Язвенный колит
Версия: Клинические рекомендации РФ 2018-2020 (Россия)
Категории МКБ:
Язвенный колит (K51)
Разделы медицины:
Гастроэнтерология, Проктология
Общая информация
Краткое описание
Разработчик клинической рекомендации
Российская Гастроэнтерологическая Ассоциация
Общероссийская общественная организация «Ассоциация колопроктологов России»
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе до 1 сентября 2021 года – с 1 января 2022 года;
– размещенные в Рубрикаторе до 1 июня 2022 года – с 1 января 2023 года;
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Язвенный колит
Год утверждения (частота пересмотра): 2020
Возрастная категория: Взрослые
Пересмотр не позднее: 2022
Дата размещения: 21.07.2020
ID: 193
Определение заболевания или состояния (группы заболеваний или состояний)
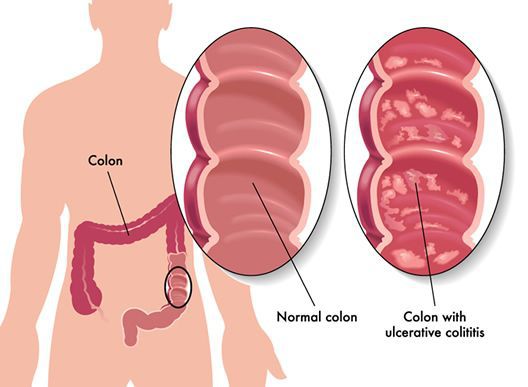
Язвенный колит (ЯК) – хроническое заболевание толстой кишки, характеризующееся иммунным воспалением ее слизистой оболочки.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
K51.0 – Язвенный (хронический) энтероколит
K51.1 – Язвенный (хронический) илеоколит
K51.2 – Язвенный (хронический) проктит
K51.3 – Язвенный (хронический) ректосигмоидит
K51.4 – Псевдополипоз ободочной кишки
K51.5 – Мукозный проктоколит
K51.8 – Другие язвенные колиты
K51.9 – Язвенный колит неуточненный
Облачная МИС «МедЭлемент»
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Надлежащая классификация ЯК по протяженности поражения, характеру течения, тяжести атаки и наличию осложнений определяет вид и форму введения лекарственных препаратов, а также периодичность скрининга на колоректальный рак [5].
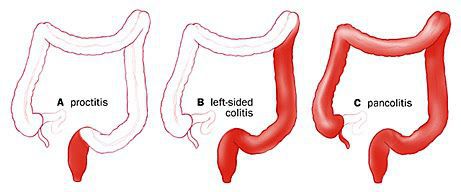
Для описания протяженности поражения применяется Монреальская классификация (табл. 1), оценивающая протяженность макроскопических изменений при эндоскопическом исследовании толстой кишки.
Таблица 1. Монреальская классификация ЯК по протяженности поражения [6].
По характеру течения выделяют:
1. Острое течение (менее 6 месяцев от дебюта заболевания):
2. Хроническое непрерывное течение (длительность ремиссии менее 6 мес на фоне адекватной терапии).
3. Хроническое рецидивирующее течение (длительность ремиссии более 6 мес).
Для правильного формулирования диагноза и определения тактики лечения следует оценивать тяжесть текущего обострения (атаки), для чего используются простые критерии Truelove-Witts, как правило, применяемые в повседневной клинической практике, и индекс активности ЯК (индекс Мейо; DAI), как правило, применяемый в клинических испытаниях. Однако, для определения социального статуса пациента, получения инвалидности, льготного лекарственного обеспечения, бесплатного санаторно-курортного лечения и других социальных льгот необходимо учитывать тяжесть заболевания в целом, что определяется тяжестью текущей атаки, наличием внекишечных проявлений и осложнений, рефрактерностью к лечению, в частности, развитием гормональной зависимости и резистентности. Выделяют легкую, среднетяжелую и тяжелую атаки ЯК (табл. 2 и 3).
Таблица 2. Тяжесть атаки ЯК согласно критериям Truelove-Witts [7].
В клинической практике нередко встречается так называемая «сверхтяжелая или крайне тяжелая атака» ЯК, характеризующаяся диареей более 10-15 раз в сутки, нарастающим падением гемоглобина, лихорадкой выше 38°С, тяжелой гипопротеинемией и электролитными сдвигами, высоким уровнем С-реактивного белка (СРБ) [8,9]. Подходы к лечению такого колита отличаются от обычных. В англоязычной литературе такое состояние называется «острый тяжелый ЯК» (acute severe UC) [10].
Таблица 3. Тяжесть атаки согласно индексу активности ЯК (индекс Мейо).
Тяжесть атаки язвенного колита устанавливается по сумме баллов: 0–2 — ремиссия (при этом оценка параметров ректального кровотечения и эндоскопического состояния слизистой = 0 баллов); 3–5 — легкая атака ЯК; 6–9 — среднетяжелая атака ЯК; 10–12 — тяжелая атака ЯК.
Парциальный индекс (или неполная шакала Мейо) без данных эндоскопии: 0–1 балл –клиническая ремиссия (при этом параметр «ректальное кровотечение» = 0 баллов; 1–2 балла –легкая атака; 3–5 баллов – среднетяжелая атака; ≥ 6 баллов – тяжелая атака ЯК.
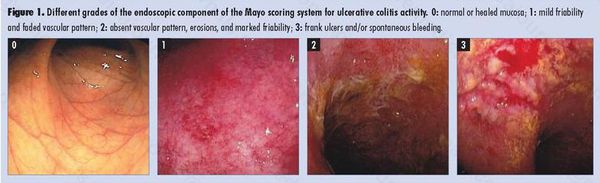
Используемая в индексе Мейо шкала оценки состояния слизистой оболочки по Schroeder приведена в Таблице 4. и применяется для оценки эндоскопической активности ЯК.
Таблица 4. Классификация ЯК в зависимости от эндоскопической активности (по Schroeder)[11].
Классификация ЯК в зависимости от ответа на гормональную терапию облегчает выбор рациональной лечебной тактики, поскольку целью консервативного лечения является достижение стойкой ремиссии с прекращением терапии глюкокортикостероидами (ГКС). Для этих целей выделяются:
1. Гормональная резистентность:
- В случае тяжелой атаки – отсутствие положительной динамики со стороны клинических и лабораторных показателей, несмотря на применение системных ГКС в дозе, эквивалентной 2мг/кг массы тела преднизолона** в сутки, в течение более чем 7 дней;
- В случае среднетяжелой атаки – сохранение активности заболевания при пероральном приеме ГКС в дозе, эквивалентной 1 мг/кг массы тела преднизолона**, в течение 2 недель.
2. Гормональная зависимость:
- Увеличение активности болезни, возникшее при уменьшении дозы ГКС после достижения исходного улучшения в течение 3 месяцев от начала лечения;
- Возникновение рецидива болезни в течение 3 месяцев после окончания лечения ГКС.
При формулировании диагноза следует отразить характер течения заболевания, протяженность поражения, тяжесть текущей атаки или наличие ремиссии, наличие гормональной зависимости или резистентности, а также наличие внекишечных или кишечных осложнений ЯК. Ниже приведены примеры формулировок диагноза:
1. «Язвенный колит, хроническое рецидивирующее течение, проктит, среднетяжелая атака».
2. «Язвенный колит, хроническое непрерывное течение, левостороннее поражение, среднетяжелая атака. Гормональная зависимость. Внекишечные проявления (периферическая артропатия)».
3. «Язвенный колит, хроническое рецидивирующее течение, тотальное поражение, тяжелая атака. Гормональная резистентность. Токсический мегаколон».
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
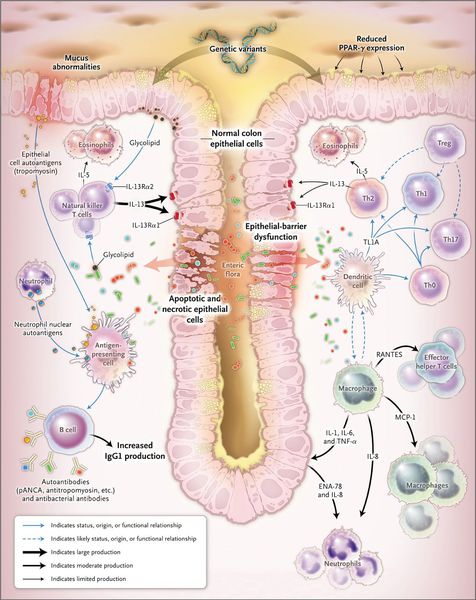
Этиология воспалительных заболеваний кишечника (ВЗК), в том числе ЯК, не установлена. Заболевание развивается в результате сочетания нескольких факторов, включающих генетическую предрасположенность, дефекты врожденного и приобретенного иммунитета, нарушения кишечной микрофлоры и влияние факторов окружающей среды. Описано около 100 генетических полиморфизмов, ассоциированных с ЯК. Генетическая детерминированность приводит к изменениям врожденного иммунного ответа, аутофагии, нарушению механизмов распознавания микроорганизмов, нарушению эпителиального барьера и, как результат, извращению адаптивного иммунитета. Ключевым дефектом, предрасполагающим к развитию ВЗК является нарушения распознавания бактериальных молекулярных маркеров (паттернов) дендритными клетками, что приводит к гиперактивации сигнальных провоспалительных путей.Также при ВЗК отмечается уменьшение разнообразия кишечной микрофлоры за счет снижения доли анаэробных бактерий, преимущественно Bacteroidetes и Firmicutes. На этом фоне развитие ВЗК происходит под действием пусковых факторов, к которым относят курение, нервный стресс, дефицит витамина D, питание с пониженным содержанием пищевых волокон и повышенным содержанием животного белка, кишечные инфекции, особенно, инфекция Clostridioides difficile.
Результатом взаимного влияния факторов риска является активация лимфоцитов-Т-хелперов 2 типа, гиперэкспрессия провоспалительных цитокинов, в первую очередь, фактора некроза опухоли-альфа и молекул клеточной адгезии. Вследствие этих нарушений формируется воспалительная лимфоплазмоцитарная инфильтрация и деструкция слизистой оболочки толстой кишки с характерными макроскопическими изменениями и развивается клиническая картина ЯК.
При ЯК поражается только толстая кишка (за исключением ретроградного илеита), в процесс обязательно вовлекается прямая кишка, воспаление чаще всего ограничивается слизистой оболочкой (за исключением острого тяжелого колита) и носит диффузный характер.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Согласно зарубежным данным, заболеваемость ЯК составляет от 0,6 до 24,3 на 100 000 человек, распространенность достигает 505 на 100 000 человек [3]. Данные о распространенности ЯК в Российской Федерации ограничены [4]. Распространенность ЯК выше в северных широтах и в западных регионах. Заболеваемость и распространенность ЯК в Азии ниже, однако, в настоящее время увеличивается. Европеоиды страдают заболеванием чаще, чем представители негроидной и монголоидной рас. Пик заболеваемости отмечается между 20 и 30 годами жизни, а второй пик заболеваемости описан в возрасте 60-70 лет. Заболеваемость приблизительно одинакова у мужчин и женщин.
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
ЯК включает четыре клинических синдрома:
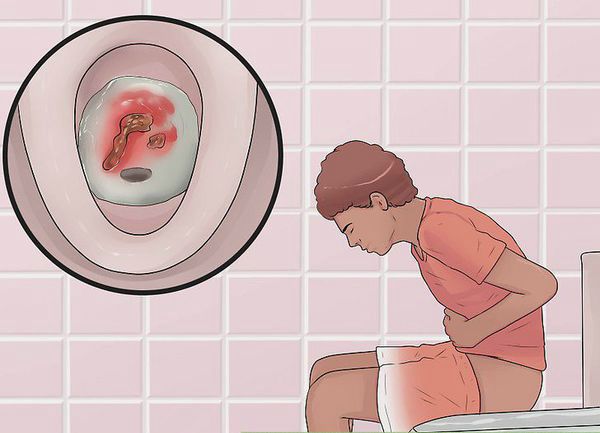
Кишечный синдром. Типичные кишечные симптомы включают диарею, преимущественно в ночное время (65 % случаев), кровь в стуле (95-100% случаев), тенезмы (чаще при проктитах и проктосигмоидитах), иногда тенезмы в сочетании с запором при дистальном ограниченном поражении. При проктитах и проктосигмоидитах диарея может отсутствовать, в клинической картине преобладают тенезмы. Для ЯК, в отличие от БК, боль в животе не характерна. Может быть умеренно выраженный болевой абдоминальный синдром спастического характера, чаще перед стулом.
Эндотоксемия — признаки системного воспаления, обусловленные высокой активностью воспалительного процесса в толстой кишке. Эндотоксемия в разной степени сопутствует среднетяжелым и тяжелым формам ЯК. Основные симптомы – общая интоксикация, лихорадка, тахикардия, анемия, увеличение СОЭ, лейкоцитоз, тромбоцитоз, повышение уровня острофазных белков: СРБ, фибриногена.
Метаболические расстройства являются следствием диареи, токсемии, избыточной потери белка с калом вследствие экссудации и нарушением всасывания воды и электролитов. Клинические симптомы типичны: потеря массы тела (иногда до степени истощения), обезвоживание, гипопротеинемия, гипоальбуминемия с развитием отечного синдрома, гипокалиемия и другие электролитные нарушения, гиповитаминоз
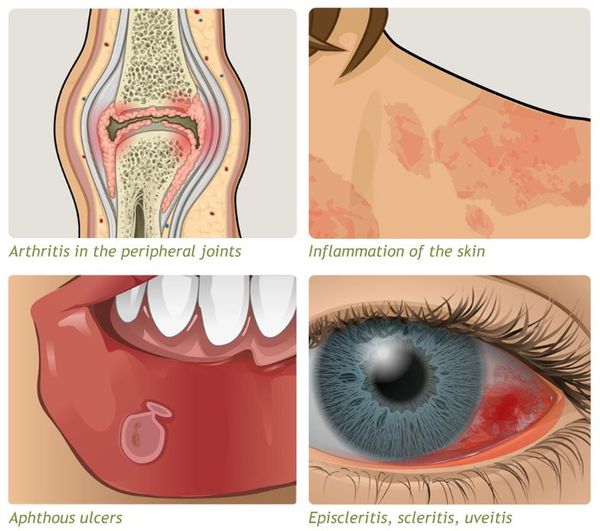
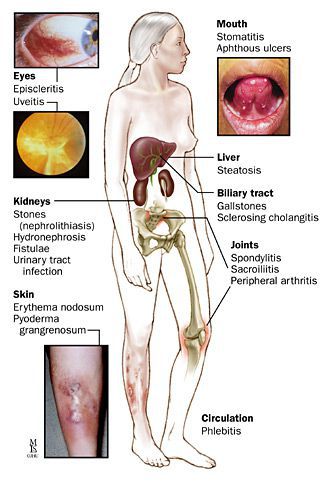
Внекишечные системные проявления (ВКП) встречаются в 20-25% случаев ЯК и обычно сопровождают тяжелые формы болезни [12] (табл. 5).
Таблица 5. Основные внекишечные (системные) проявления язвенного колита.
Аутоиммунные проявления, связанные с активностью воспалительного процесса, появляются вместе с основными кишечными симптомами обострения и исчезают вместе с ними на фоне лечения. Аутоиммунные проявления, не связанные с активностью процесса (в англоязычной литературе их часто называют «сопутствующими аутоиммунными заболеваниями»), имеют тенденцию к прогрессированию независимо от фазы основного заболевания (обострение или ремиссия) и часто определяют негативный прогноз болезни.
Кишечные осложнения ЯК включают кишечное кровотечение, токсическую дилатацию и перфорацию толстой кишки, а также колоректальный рак. Поскольку эти осложнения в большей степени требуют хирургического лечения, подробно они рассматриваются в Разделе 3.2 «Хирургическое лечение».
Диагностика
Диагностика
Критерии установления диагноза/состояния на основании патогномоничных данных:
1) анамнестических данных,
2) физикального обследования,
3) лабораторных исследований,
4) инструментального обследования.
Однозначных диагностических критериев ЯК не существует. Диагноз выставляется на основании сочетания данных анамнеза, клинической картины и типичных эндоскопических и гистологических изменений.
Жалобы и анамнез
- У всех пациентов при подозрении на ЯК рекомендуется сбор анамнеза и жалоб для верификации диагноза [13-16].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- В том числе при сборе анамнеза рекомендуется уточнить наличие факта курения для сужения круга диагностического поиска и верификации диагноза [17].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2)
Комментарий: обращается внимание на частоту и характер стула, длительность данных симптомов, наличие примеси крови, характер болей в животе; поездки в южные страны; принимаемые лекарства (в частности, антибиотики и нестероидные противовоспалительные средства (НПВП)); курение; наличие воспалительных и злокачественных заболеваний кишечника у родственников [18,19].
Физикальное обследование
- У всех пациентов с подозрением на ЯК в обязательном порядке рекомендуется физикальное обследование с целью сужения круга диагностического поиска и верификации диагноза:
— осмотр перианальной области;
— пальцевое исследование прямой кишки (трансректальное пальцевое исследование) [20, 197].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий: при физикальном осмотре могут быть обнаружены различные проявления ЯК, включая лихорадку, периферические отеки, дефицит питания, наличие признаков перфорации или токсической дилатации толстой кишки, а также внекишечных проявлений.
Лабораторные диагностические исследования
- Рекомендуется всем пациентам при подозрении на ЯК развернутый общий (клинический) анализ крови для диагностики анемии, сопутствующей патологии, а также определения степени активности ЯК [21-26].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарий: при общем (клиническом) анализе крови могут быть диагностированы анемии (железодефицитная, анемия хронического заболевания), лейкоцитоз (на фоне хронического воспаления или на фоне стероидной терапии), тромбоцитоз.
- Рекомендуется всем пациентам при подозрении на ЯК анализ крови биохимический общетерапевтический (общий белок, альбумин, АЛТ, АСТ, общий билирубин, гамма-ГТ,ЛДГ, К+, Na+, Сl—, С-реактивный белок, щелочная фосфатаза, фибриноген) для диагностики сопутствующей патологии [23,26-30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарий: биохимическое исследование позволяет выявить электролитные нарушения, гипопротеинемию (в частности, гипоальбуминемию), а также повышение щелочной фосфатазы, что является возможным проявлением ассоциированного с ЯК первичного склерозирующего холангита.
- Рекомендуется пациентам с острым течением ЯК (первой атаке заболевания) проводить дифференциальную диагностику с острой кишечной инфекцией [188].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- Рекомендуется пациентам с обострением ЯК выполнить иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile) исключения клостридиальной инфекции [31-34].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- Рекомендуется всем пациентам при подозрении на ЯК, среднетяжелой и тяжелой атаках ЯК, гормональной резистентности или резистентности к биологической терапии молекулярно-биологическое исследование биоптатов и пунктатов из очагов поражения (толстой кишки) органов и тканей на цитомегаловирус (Cytomegalovirus) [37,38].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Инструментальные диагностические исследования
- Рекомендуется всем пациентам с легкой и умеренной активностью ЯК проведение колоноскопии для верификации диагноза. Пациентам с выраженной активностью ЯК рекомендуется проведение ректосигмоидоскопии [u1] [19,39].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
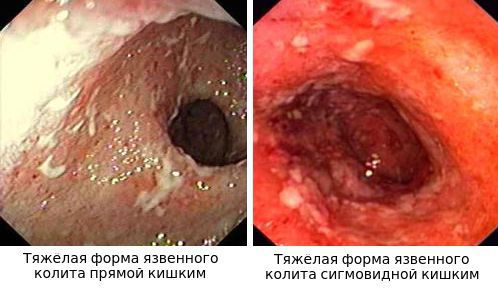
Комментарий: колоноскопия обязательна для установления диагноза ЯК, а также для решения вопроса о колэктомии. Эндоскопическое исследование толстой кишки является основным методом диагностики ЯК, однако, специфичные эндоскопические признаки отсутствуют. Наиболее характерными являются непрерывное воспаление, ограниченное слизистой оболочкой, начинающееся в прямой кишке и распространяющееся проксимальнее, с четкой границей воспаления. Эндоскопическую активность ЯК наилучшим образом отражают контактная ранимость (выделение крови при контакте с эндоскопом), отсутствие сосудистого рисунка и наличие эрозий и изъязвлений. Обнаружение стойкого сужения кишки на фоне ЯК требует обязательного исключения колоректального рака.
- Рекомендуется пациентам с тяжелой атакой ЯК обзорная рентгенография органов брюшной полости для исключения:
— перфорации толстой кишки [40];
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
— токсической дилатации толстой кишки [19].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Всем пациентам с подозрением на ЯК при первичной постановке диагноза, при сомнениях в правильности ранее выставленного диагноза, рекомендуется выполнение биопсии толстой кишки с целью верификации диагноза [42,43].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: при длительном анамнезе ЯК (более 7-10 лет) – хромоэндоскопия с прицельной биопсией или ступенчатая биопсия (из каждого отдела толстой кишки) для исключения дисплазии эпителия. Рекомендуемым стандартом биопсии при постановке диагноза является взятие биоптатов слизистой оболочки прямой кишки и не менее чем из 4 других участков толстой кишки, а также слизистой оболочки подвздошной кишки.
К микроскопическим признакам ЯК относятся деформация крипт (разветвленность, разнонаправленность, появление крипт разного диаметра, уменьшение плотности крипт, «укорочение крипт», крипты не достигают подлежащего слоя мышечной пластинки слизистой оболочки), «неровная» поверхность слизистой в биоптате слизистой оболочки, уменьшение числа бокаловидных клеток, базальный плазмоцитоз, инфильтрация собственной пластинки слизистой оболочки, наличие крипт-абсцессов и базальных лимфоидных скоплений. Степень воспалительной инфильтрации обычно уменьшается по мере удаления от прямой кишки.
- Рекомендуется всем пациентам с подозрением на ЯК при первичной постановке диагноза, при сомнениях в правильности ранее выставленного диагноза, при длительном анамнезе ЯК, при подозрении на осложнения ЯК, а также для исключения патологии других органов брюшной полости — ультразвуковое исследование органов брюшной полости, забрюшинного пространства, малого таза [44-45].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2)
- Рекомендуется всем пациентам с подозрением на ЯК при необходимости дифференциальной диагностики или при невозможности проведения полноценной илеоколоноскопии одно из следующих визуализирующих методов исследования:
— магнитно-резонансная томография (МРТ) органов брюшной полости [47];
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
— компьютерная томография (КТ) органов брюшной полости с контрастированием кишечника (в случае недоступности экспертной оценки или невозможности выполнения МРТ) [48,49].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
- Рекомендуется пациентам с подозрением на ЯК при необходимости дифференциальной диагностики или при невозможности проведения полноценной колоноскопии, МРТ и КТ проведение ирригоскопии с двойным контрастированием для оценки протяженности поражения в толстой кишке, уточнения наличия образований, стриктур и др. [20,50,189].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Комментарий: пациентам с подозрением на ЯК также возможно выполнение дополнительных исследований в зависимости от клинической ситуации.
Иная диагностика
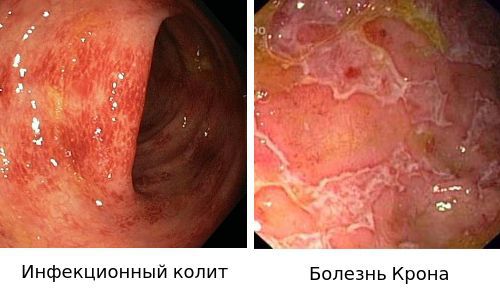
Дополнительные инструментальные и лабораторные исследования выполняются преимущественно с целью проведения дифференциальной диагностики с рядом заболеваний. Это инфекционные, сосудистые, медикаментозные, токсические и радиационные поражения, а также дивертикулит и др. На следующем этапе дифференциальной диагностики проводится верификация клинических диагнозов ЯК и БК, относящихся к группе ВЗК. Таким образом, дифференциальный диагноз ЯК проводится с болезнью Крона толстой кишки, острыми кишечными инфекциями (дизентерия, сальмонеллез, кампилобактериоз, иерсиниоз, амебиаз), паразитозами, антибиотико-ассоциированными поражениями кишечника (псевдомембранозный колит, вызываемый C.Difficile) [52], туберкулезом кишечника, системными васкулитами, раком толстой кишки, дивертикулитом, микроскопическими колитами (коллагеновым и лимфоцитарным) [52], радиационным проктитом.
С целью дифференциальной диагностики и подбора терапии при внекишечных проявлениях ЯК и сопутствующих состояниях может потребоваться консультация:
- врача-психотерапевта или медицинского психолога (невроз, планируемая операция с наличием стомы и т.п.);
- врача-эндокринолога (стероидный сахарный диабет, надпочечниковая недостаточность у пациентов на длительной гормональной терапии);
- врача-дерматовенеролога (дифференциальный диагноз узловатой эритемы, пиодермии ит.п.);
- врача-ревматолога (артропатии, сакроилеит и т.п.);
- врача-акушера-гинеколога (беременность).
Лечение
Лечение
1. Консервативное лечение
Лечебные мероприятия при ЯК включают в себя назначение лекарственных препаратов, хирургическое лечение, психосоциальную поддержку и диетические рекомендации.
Выбор вида консервативного или хирургического лечения определяется тяжестью атаки, протяженностью поражения толстой кишки, наличием внекишечных проявлений, длительностью анамнеза, эффективностью и безопасностью ранее проводившейся терапии, а также риском развития осложнений ЯК [53, 54].
Целью терапии является достижение и поддержание бесстероидной ремиссии (прекращение приема ГКС в течение 12 недель после начала терапии) [55], профилактика осложнений ЯК, предупреждение операции, а при прогрессировании процесса, и/или развитии опасных для жизни осложнений – своевременное назначение хирургического лечения. Поскольку полное излечение пациентов ЯК достигается только путем удаления толстой кишки (колпроктэктомии), при достижении ремиссии неоперированный пациент должен оставаться на постоянной поддерживающей (противорецидивной) терапии.
Следует особо отметить, что ГКС не могут применяться в качестве поддерживающей терапии.
Ниже представлены рекомендации по выбору препаратов для индукции и поддержания ремиссии в зависимости от протяженности поражения и тяжести атаки [20].
1.2 Проктит. Легкая и среднетяжелая атака
- Данной группе пациентов рекомендовано местное лечение [198].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5)
Комментарий: в данной ситуации целесообразно назначение суппозиториев с #месалазином**(1 г/сут, при необходимости дозу можно увеличить до 2 г/сутки) или ректальной пены #месалазина (1 г 1 раз/сутки, при необходимости дозу можно увеличить до 2 раз/сутки) [20, 56,57,199]. Оценка терапевтического ответа проводится через 2 недели [56] при положительном ответе на лечение в указанных дозах пролонгируется до 6-8 недель.
- Рекомендуется пациентам при неэффективности лечения ректальными формами месалазина** назначение ректальных форм ГКС [20,58,59].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 2).
Комментарий: в данной ситуации целесообразно назначение будесонида в форме ректальной пены 2 мг в сутки, суппозитории с преднизолоном 10 мг (ex tempore) х 2 раза в сутки с оценкой ответа через 2 недели для достижения ремиссии [20,58,59].
- Рекомендуется пациентам при достижении ремиссии поддерживающая терапия –ректальное введение #месалазина** в свечах 1 г х 3 раза в неделю в виде монотерапии для поддержания ремиссии [20,64, 201].
Уровень убедительности рекомендации В (уровень достоверности доказательств – 2).
Комментарий: также может использоваться #месалазин в виде ректальной пены в том же режиме дозирования. Лечение целесообразно продолжать не менее 2 лет [202].
- Рекомендуется пациентам при неэффективности местного лечения подключить пероральные формы месалазина** в терапевтической дозе согласно инструкции по применению препаратов для достижения ремиссии [60].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2).
- Рекомендуется пациентам при отсутствии эффекта от пероральных форм месалазина назначение ГКС для достижения ремиссии. [20,59].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарий: Доза преднизолона** в данной клинической ситуации эквивалентной 0,5-0,75 мг/кг массы тела преднизолона в таблетках в сутки для достижения ремиссии.
- Рекомендуется пациентам в случае рецидива, требующего повторного назначения ГКС, комбинация ГКС с азатиоприном** (АЗА) или #меркаптопурином** (МП) для достижения ремиссии [20,61].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1).
Комментарий: АЗА** назначается по 2,5 мг/кг, а #МП по 1,5 мг/кг [61, 203]. Местная терапия (ректальная пена будесонида 2 мг в сутки, суппозитории с преднизолоном 10 мг (ex tempore) х1-2 раза в сутки) может быть продолжена.
- Рекомендуется пациентам при достижении ремиссии, индуцированной ГКС, поддерживающая терапия АЗА** 2-2,5 мг/кг (или #МП 1,5 мг/кг) не менее 2 лет для поддержания ремиссии [60,61,203].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1)
- Рекомендуется пациентам, у которых обнаружено ДНК цитомегаловируса при молекулярно-биологическом исследовании биоптатов из толстой кишки терапия ганцикловиром** в дозе 5мг/кг 2 раза в сутки в течение 14-21 дня для элиминации возбудителя [20, 62].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4)
1.3 Проктит. Тяжёлое течение (развивается крайне редко)
- Рекомендуется пациентам при тяжелом язвенном проктите внутривенное ГКС в дозе, эквивалентной преднизолону** 1-2 мг/кг массы тела в сутки в комбинации с местной терапией месалазином** (суппозитории, ректальная пена) или ГКС (ректальная пена будесонида 2 мг в сутки, суппозитории с преднизолоном 10 мг (ex tempore) 10 мг х 2 раза всутки) для достижения ремиссии [20,59].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
- Рекомендуется пациентам в случае первой атаки поддерживающая терапия при достижении ремиссии проводится местными формами препаратов #месалазина** в форме суппозиториев или месалазина в форме ректальной пены) 1 г х 3 раза в неделю в виде монотерапии или в комбинации с пероральным месалазином в дозе 2-2,4 г – не менее 2 лет для поддержания ремиссии [20,57,60,63-66].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1).
- Рекомендуется пациентам при рецидиве, требующем повторного назначения ГКС (системных или топических), одновременно с ГКС назначить АЗА** 2-2,5 мг/кг (или #МП1,5 мг/кг) и затем продолжение поддерживающей терапии иммунодепрессантами (АЗА или #МП) не менее 2 лет для достижения ремиссии [61].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
- Рекомендуется пациентам, у которых обнаружено ДНК цитомегаловируса при молекулярно-биологическом исследовании биоптатов из толстой кишки терапия ганцикловиром** в дозе 5мг/кг 2 раза в сутки в течение 14-21 дня для элиминации возбудителя [20, 62].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4)
1.4 Левосторонний и тотальный язвенный колит. Легкая атака
- Рекомендуется пациентам при первой атаке или рецидиве назначение месалазина** внутрь в максимальных терапевтических дозах в соответствие с инструкциями по применению в комбинации с месалазином** суспензия ректальная 4 г/сут для достижения ремиссии [20, 64,67-68].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: терапевтический ответ оценивается через 2 недели. При положительном ответе терапия продолжается до 6-8 недель.
- Рекомендуется пациентам при отсутствии эффекта от комбинированной терапии препаратами #аминосалициловой кислоты** (5-АСК) (аминосалициловая кислота и аналогичные препараты) назначение ректальных форм ГКС [68,69].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
Комментарий: целесообразно назначение ректальной пены будесонида 2 мг в сутки или суспензии #гидрокортизон 125-250 мг 1 раз в сутки в виде клизм или ректального капельного введения для достижения ремиссии [213-214].
- Рекомендуется пациентам при достижении ремиссии проводить поддерживающую терапию пероральным месалазином** 2-2,4 г/сут. для поддержания ремиссии [70].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1)
Комментарий: дополнительное введение #месалазина** ректально по 2 г х 2 раза в неделю («терапия выходного дня») увеличивает вероятность долгосрочной ремиссии [215].
- Рекомендуется пациентам при отсутствии ответа на терапию пероральными препаратами #АСК** (аминосалициловая кислота и аналогичные препараты) в сочетании с любым местным вариантом лечения назначение топических ГКС (будесонид**, таблетки кишечнорастворимые с пролонгированным высвобождением, покрытые пленочной оболочкой) или системных ГКС (см. раздел 3.1.4) для достижения терапевтического эффекта [71].
Уровень убедительности рекомендации В (уровень достоверности доказательств – 3)
- Рекомендуется пациентам, у которых обнаружено ДНК цитомегаловируса при молекулярно-биологическом исследовании биоптатов из толстой кишки терапия ганцикловиром** в дозе 5мг/кг 2 раза в сутки в течение 14-21 дня для элиминации возбудителя [20, 62].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4)
1.5 Левосторонний и тотальный язвенный колит. Среднетяжелая атака
- Рекомендуется пациентам при первой атаке или рецидиве назначение перорального месалазина** в максимальной терапевтической дозе в соответствии с инструкциями к препаратам в комбинации с месалазином** в клизмах 4 г/сут для достижения ремиссии [20,65,66,72].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1).
Комментарий: терапевтический ответ оценивается через 2 недели. При улучшении клинической симптоматики и положительной лабораторной динамике терапия продолжается до 6-8 недель.
- Рекомендуется пациентам при достижении ремиссии поддерживающая терапия препарата мимесалазина** 2,0-2,4 г/сут внутрь + месалазин** суспензия ректальная по 4 г х 2 раза в неделю для поддержания ремиссии [64,66,67,73,190].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1).
Комментарий. Допустимо назначение #сульфасалазина** 2 г/сут вместо месалазина** [210].
- Рекомендуется пациентам при неэффективности АСК** и отсутствии системных признаков воспаления назначение топических ГКС (будесонид**, таблетки кишечнорастворимые с пролонгированным высвобождением, покрытые пленочной оболочкой) [191-193]
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
Комментарии. Топические ГКС назначают в дозе 9 мг/сут. После 10-недельного приема будесонида, снижение дозы проводится через день в течение 1-2 недель до полной отмены.
- Рекомендуется пациентам при неэффективности АСК** и при наличии системного воспаления рекомендуется назначение системных ГКС для достижения терапевтического эффекта [71,74-76].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1)
Комментарии. Системные ГКС назначают в дозе, эквивалентной преднизолону** 1 мг/кг массы тела. Снижение дозы системных ГКС производится по 5 мг в 5-7 дней до полной отмены.
- Рекомендуется пациентам в случае непереносимости препаратов АСК** или при необходимости повторного назначения ГКС в течение года и менее комбинировать ГКС с АЗА** 2,0-2,5 мг/кг или #МП** 1,5 мг/кг для достижения терапевтического эффекта [61,77].
Уровень убедительности рекомендации A (уровень достоверности доказательств – 2)
- Рекомендуется пациентам при достижении ремиссии продолжение поддерживающей терапии АЗА** 2,0-2,5 мг/кг/сут или #МП** 1,5 мг/кг не менее 2 лет для поддержания ремиссии [61,77].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
- Рекомендуется пациентам при отсутствии эффекта от ГКС в течение 2 недель проведение биологической терапии для достижения ремиссии (инфликсимаб**, адалимумаб**, голимумаб**, ведолизумаб**, тофацитиниб** или устекинумаб**), начиная с индукционного курса, в дозах, соответствующих инструкции по применению [78-82].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
Комментарий: Все указанные препараты могут применяться как в первой, так и во второй линии терапии [20]
- Рекомендуется пациентам, получающим инфликсимаб**, комбинировать его с АЗА** 2,0-2,5мг/кг для повышения эффективности лечения [61,83,84].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
Комментарии. Допустимо применение #МП 1,5 мг/кг [211] вместо АЗА** в связи с тем, что МП является метаболитом АЗА**. Для других биологических лекарственных препаратов эффективность комбинации с иммунодепрессантами не доказана. Совместное применение АЗА** и тофацитиниба противопоказано [85,86].
- Рекомендуется пациентам при эффективности индукционного курса биологическими лекарственными препаратами проводить поддерживающую терапию ими же в соответствии с инструкцией по применению в течение, как минимум, 2 лет для поддержания ремиссии [87-91].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
- Рекомендуется пациентам при первичной неэффективности ингибитора фактора некроза опухоли альфа (анти-ФНО) смена терапии на ведолизумаб**, тофацитиниб** или устекинумаб** для достижения ремиссии [91, 92, 194].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарий: тофацитиниб**, ведолизумаб** и устекинумаб** могут быть назначены в качестве 1-ой и последующих линий терапии в комбинации с ГКС или без них.
- Рекомендуется пациентам при потере ответа на терапию анти-ФНО (рецидив ЯК на фоне ранее достигнутой ремиссии) оптимизация терапии в виде увеличения дозы препарата (10мг/кг инфликсимаба** каждые 8 недель, 100 мг голимумаба** каждые 4 недели, 80 мг адалимумаба каждые 2 недели) или сокращения интервалов между введениями(инфликсимаб** до 4-6 недель, адалимумаб** каждую неделю) или назначение препаратов другого механизма действия: ведолизумаба**, тофацитиниба** или устекинумаба** длядостижения терапевтического эффекта [87-91,194,195].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
Комментарий: смена на другой анти-ФНО возможна, но ее эффективность ниже, чем при переходе на препараты других классов (ведолизумаб**, тофацитиниб** или устекинумаб**).
- Рекомендуется пациентам при потере ответа на ведолизумаб** в стандартной дозе 300 мг каждые 8 недель оптимизация терапии в виде сокращения интервалов между введениями до 4 недель или смена на биологический лекарственный препарат другого класса [93].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4)
- Рекомендуется пациентам при потере ответа на тофацитиниб** в стандартной дозе 10 мг в день оптимизация терапии до 20 мг в день [94].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарий: Учитывая недавнее появление тофацитиниба**, в том числе в России, доказательная база о возможности перехода с тофацитиниба** на биологические лекарственные препараты недостаточна. Смена препаратов возможна и остается на усмотрение лечащего врача.
Длительность биологической терапии определяется лечащим врачом. Также возможна смена на биологический лекарственный препарат другого класса для достижения ремиссии. В большинстве стран лечение проводят в течение многих лет. Ранняя отмена препаратов, как правило, приводит к рецидиву ЯК в короткие сроки. При невозможности пролонгированного использования биологических лекарственных препаратов, поддерживающая терапия проводится только иммунодепрессантами (АЗА**, МП**). В случае непереносимости аналогов пурина — монотерапия биологическими лекарственными препаратами.
- Рекомендуется пациентам при снижении дозы ГКС до эквивалентной 35-45 мг преднизолона**, назначить дополнительно месалазин** per os в максимальной терапевтической дозе в соответствии с инструкциями к препаратам) для поддержания терапевтического эффекта (в том случае, если пациент не получает иммунодепрессантов, в том числе биологической терапии) [67]
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарий: дальнейшее снижение ГКС следует проводить на фоне месалазина** с последующим переходом на поддерживающую терапию месалазином**
per os 2,0-2,4 г в сутки.
- Рекомендуется пациентам при рецидиве, возникшем на фоне поддерживающей терапии аналогами пурина, назначение биологической терапии (инфликсимаб**, адалимумаб**, голимумаб**, ведолизумаб** или устекинумаб**), а также тофацитиниба** (с отменой аналогов пурина согласно инструкции по медицинскому применению) [87-91,194].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
Комментарий: Любой из указанных препаратов может назначаться в качестве первой линии терапии
- Рекомендуется пациентам, у которых обнаружено ДНК цитомегаловируса терапия ганцикловиром** в дозе 5мг/кг 2 раза в сутки в течение 14-21 дня для элиминации возбудителя [20, 62].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4)
1.6 Левосторонний и тотальный язвенный колит. Тяжелая атака
- Рекомендуется пациентам в качестве первой линии терапии внутривенная терапия ГКС для достижения ремиссии [20,96].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1).
Комментарий: применение ГКС целесообразно в дозе, эквивалентной преднизолону** 2 мг/кг массы тела (при высокой массе тела возможно назначение 1,5мг/кг) в течение 7 дней или применение гидрокортизона** в эквивалентной дозе. Эквивалентность доз и длительности действия ГКС приведена в таблице 6. Ответ оценивается в интервале от 3 до 7 дней. Если в течение трех дней состояние стабильно, то терапию продолжают до 7 дней. Если состояние больного в течение трех дней ухудшается ставится вопрос о «терапии спасения» или околэктомии. Если через 7 дней отмечено клиническое улучшение, то терапию ГКС можно продолжить до стабильного улучшения и затем переходить на пероральный прием препаратов и медленно снижать дозу по 5 мг в 5-7 дней.
В случае отсутствия значимого клинического улучшения через 7 дней состояние расценивается как стероидорезистентность.
- Рекомендуется пациентам дополнительно назначить местную терапию клизмами с месалазином** 4 г в сутки или #гидрокортизон 125-250 мг х 1 раз в сутки в виде клизм или ректального капельного введения для достижения ремиссии [68,69, 213-214].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5)
- Рекомендуется пациентам при наличии метаболических нарушений инфузионная терапия с целью регидратации, коррекции белково-электролитных нарушений [55].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5)
Комментарий: гипокалиемия и гипомагниемия повышают риск токсической дилатации ободочной кишки.
- Рекомендуется пациентам при уровне гемоглобина ниже 80 г/л для коррекции анемии в виде гемотрансфузии (эритромасса), при уровне гемоглобина от 80 до 100 г/л – терапия препаратами железа парентерально (железа (III) гидроксид сахарозный комплекс**, железа(III) гидроксид декстран, железа (III) гидроксид олигоизомальтозат**, железа карбоксимальтозат**) [97].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
- Рекомендуется у пациентов с дефицитом массы тела (ИМТ менее 18) назначение дополнительного энтерального, в том числе зондового, питания для улучшения трофологического статуса [98].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 2)
Комментарий: полностью парентеральное питание и/или временное ограничение приема пищи внутрь нецелесообразно.
- При развитии признаков системного воспаления у пациентов рекомендуется назначение антибиотиков с целью профилактики септических осложнений:
— 1 линия – #метронидазол** + фторхинолоны (ципрофлоксацин**, офлоксацин**) [100];
— 2 линия — цефалоспорины [99,101,102].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1)
Таблица 6. Сравнительная характеристика ГКС
- Рекомендуется пациентам при клиническом ответе на ГКС через 7 дней перевод на пероральный прием преднизолона** с последующим снижением до полной отмены по 5-10 мг преднизолона** в 5-7 дней для поддержания ремиссии [55].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарий: Схема перехода с внутривенных ГКС на пероральные формы рассматривается индивидуально лечащим врачом в зависимости от скорости достижения эффекта и выраженности терапевтического ответа. При развитии стероидорезистентности, если нет непосредственной угрозы жизни или тяжелых осложнений, требующих немедленного оперативного вмешательства, активизация консервативного лечения, которая проводится биологическими лекарственными препаратами или циклоспорином. «Терапия спасения» проводится двумя основными препаратами на фоне сохраняющегося лечения ГКС: инфликсимабом** (в дозе 5 мг/кг в рамках индукционного курса на 0, 2 и 6 неделе) или #циклоспорином**В/в (2-4 мг/кг в течение 7 дней [204-206] с мониторированием показателей функции почек и определением концентрации препарата в крови). Клинический результат такой терапии оценивается через 7 дней. Исследования показали, что эффективность обеих схем на 8 день лечения идентична, поэтому в настоящее время в зарубежной практике используется в основном инфликсимаб**, как более безопасный и не требующий трудоемкого и дорогостоящего определения концентрации. При отсутствии эффекта через 7-8 дней рассматриваются варианты хирургического лечения. При невозможности назначения инфликсимаба** допустимо назначение тофацитиниба** с учетом скорости достижения эффекта в соответствии с инструкцией к применению.
- Рекомендуется пациентам при достижении ремиссии на инфликсимабе** продолжить поддерживающую противорецидивную терапию этим же препаратом по стандартной схеме вкомбинации с АЗА** 2 мг/кг (или #МП 1,5 мг/кг) или без него [84,108,109].
Уровень убедительности рекомендации B (уровень достоверности доказательств – 3)
- Рекомендуется пациентам при положительном ответе на в/в #циклоспорин** через 7 дней перейти на пероральный прием препарата в дозе 2 мг/кг веса с дополнительным назначением АЗА** 2 мг/кг (на фоне терапевтической дозы стероидов) с постепенной отменой стероидов в течение 12 недель до момента достижения терапевтической концентрации и начала действия АЗА** для увеличения продолжительности ремиссии у пациента. При достижении ремиссии можно отменять пероральный циклоспорин, оставив пациента на поддерживающей терапии АЗА** не менее 2 лет [61,77,110,111, 205].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 2).
1.7 Сверхтяжелый язвенный колит любой протяженности
В такой форме может протекать как первая атака ЯК, так любое из последующих обострений (характеристику см. в разделе «классификация ЯК»). Пациент должен быть госпитализирован в многопрофильный (специализированный) стационар для консервативного лечения с последующим обязательным наблюдением врачом-гастроэнтерологом и врачом-колопроктологом (врачом-хирургом) для решения вопроса о целесообразности выполнения хирургического вмешательства в течение 24 часов.
- Рекомендуется пациентам при сверхтяжелой атаке ЯК назначение в/в ГКС в дозе, эквивалентной преднизолону** 2 мг/кг массы тела для достижения терапевтического эффекта [95].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4)
Комментарий: эффективность консервативной терапии при сверхтяжелой атаке ЯК не превышает 50%. При этом производят оценку клинической картины и лабораторных параметров каждые 24 часа, а при необходимости – чаще. При ухудшении клинической картины и лабораторных показателей единственным путем спасения жизни пациента при сверхтяжелой атаке ЯК является колэктомия.
При существенной положительной динамике со стороны клинической картины и лабораторных показателей с достаточной степенью осторожности можно продолжить в/в терапию ГКС до 14 дней. Если в течение 3 дней положительная динамика отсутствует, то это состояние расценивается как стероидорезистентность.
- В случае стероидорезистентности и непосредственной угрозы жизни пациента или развитиятяжелых осложнений, требующих немедленного оперативного вмешательства, данной группе пациентов рекомендуется назначение терапии «второй линии» (в англоязычной литературе «терапии спасения»), которая включает следующие варианты лечения:
— инфликсимаб** 5 мг/кг (введения в рамках индукционного курса на 0, 2 и 6 неделе) [103,104] или
— #циклоспорин** (лучше в/в) 2-4 мг/кг в течение 7 дней с мониторированием показателей функции почек [105,106].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 2)
Комментарий: другие биологические лекарственные препараты и тофацитиниб** в качестве «терапии спасения» не используются. Данной группе пациентов при отрицательной динамике или при отсутствии ответа на 7 день терапии инфликсимабом** или циклоспорином**показано хирургическое лечение [107].
- Рекомендуется пациентам при достижении ремиссии на инфликсимабе** продолжить поддерживающую противорецидивную терапию этим же препаратом по стандартной схеме вкомбинации с АЗА** 2 мг/кг (или #МП 1,5 мг/кг) или без него [84,108,109].
Уровень убедительности рекомендации B (уровень достоверности доказательств – 3)
- Рекомендуется пациентам при положительном ответе на в/в #циклоспорин** через 7 дней перейти на пероральный прием препарата в дозе 2 мг/кг веса с дополнительным назначением АЗА** 2 мг/кг (на фоне терапевтической дозы стероидов) с постепенной отменой стероидов в течение 12 недель до момента достижения терапевтической концентрации и начала действия АЗА** для увеличения продолжительности ремиссии у пациента. При достижении ремиссии можно отменять пероральный циклоспорин, оставив пациента на поддерживающей терапии АЗА** не менее 2 лет [61,77,110,111, 205].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 2).
2. Хирургическое лечение
2.1 Показания к хирургическому лечению ЯК: неэффективность или невозможностьпродолжения консервативной терапии.
Показаниями к хирургическому лечению ЯК служат неэффективность консервативной терапии (гормональная резистентность, неэффективность биологической терапии) или невозможность ее продолжения (гормональная зависимость, непереносимость или противопоказания для проведения консервативной терапии), кишечные осложнения ЯК (токсическая дилатация, перфорация кишки, кишечное кровотечение), а также рак толстой кишки или высокий риск его возникновения.
О неэффективности консервативной терапии свидетельствуют (см. раздел 1.5):
- гормональная резистентность;
- гормональная зависимость.
Гормональную зависимость удается эффективно преодолеть при помощи иммунодепрессантов (биологические лекарственные препараты, АЗА**, МП**) в 40-55% случаев [67, 111], а при гормональной резистентности назначение #циклоспорина** или биологической терапии позволяет индуцировать ремиссию в 43-80% случаев [105]. Однако, участи пациентов с высоким риском осложнений и неэффективностью консервативной терапии при развитии гормональной резистентности или зависимости возможно проведение хирургического лечения без попытки применения биологической терапии, АЗА**, МП**.
2.2 Показания к хирургическому лечению ЯК: кишечные осложнения ЯК
- Рекомендуется пациентам с осложнением ЯК в виде кишечного кровотечения; перфорации толстой кишки при выявлении угрожающих симптомов (симптомы раздражения брюшины, свободный газ в брюшной полости и т.д.); токсической дилатации на фоне адекватной интенсивной терапии, экстренная операция в объеме субтотальной колэктомии или тотальной колэктомии (колпроктэктомии – при выраженной активности в прямой кишке) для увеличения продолжительности жизни пациента [113,114, 125].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4).
Комментарий: токсическая дилатация ободочной кишки (токсический мегаколон), представляет собой не связанное с обструкцией расширение ободочной кишки 6 см и более сявлениями интоксикации. К факторам риска токсической дилатации относятся гипокалиемия, гипомагниемия, подготовка кишки к колоноскопии при помощи осмотических слабительных и прием антидиарейных препаратов. Косвенно о развитии токсической дилатации свидетельствует внезапное сокращение частоты стула на фоне имевшейся диареи, вздутие живота, а также внезапное уменьшение или исчезновение болевого синдрома и нарастание симптомов интоксикации (нарастание тахикардии, снижение АД).
Перфорация толстойкишки является наиболее опасным осложнением ЯК с почти 50% смертностью.
2.3 Показания к хирургическому лечению ЯК: колоректальный рак
У пациентов с длительным анамнезом ЯК существенно повышен риск колоректального рака,что обусловливает необходимость регулярного обследования для выявления дисплазии эпителия толстой кишки. На вероятность развития рака влияют следующие факторы:
а) длительность анамнеза ЯК: риск колоректального рака составляет 2% при 10-летнем, 8% -при 20-летнем и 18% — при 30-летнем анамнезе [126];
б) начало заболевания в детском и подростковом возрасте, хотя этот фактор может лишь отражать длительность анамнеза и не являться независимым предиктором колоректального рака [127];
в) протяженность поражения: риск наиболее повышен у пациентов с тотальным ЯК, в товремя как у пациентов с проктитом риск не отличается от среднего в популяции;
г) наличие первичного склерозирующего холангита [128];
д) семейный анамнез колоректального рака;
е) тяжелые обострения ЯК в анамнезе или непрерывное течение ЯК. Последствием высокой активности ЯК может являться воспалительный полипоз, также являющийся фактором риска развития колоректального рака [129].
Контрольная колоноскопия должна проводиться в условиях хорошей подготовки кишки и, желательно, в период ремиссии, поскольку активное воспаление затрудняет выявление дисплазии.
Для скрининга неопластических изменений слизистой оболочки используются два подхода:
1. Хромоэндоскопия с прицельной биопсией участков, подозрительных на неоплазию.
2. Биопсия слизистой оболочки по 4 фрагмента из каждых 10 см ободочной и прямой кишки (при эндоскопии в белом свете). Такой подход не исключает обязательной биопсии всех подозрительных образований.
Результаты скрининговой биопсии влияют на тактику дальнейшего лечения и наблюдения.
- Рекомендуется пациентам с ЯК при обнаружении дисплазии высокой степени при биопсии в неизмененной слизистой оболочке (т.е. не в приподнятых образованиях), хирургическое лечение в объеме тотальной колэктомии [126, 207].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарий: Возможно выполнение колпроктэктомии с формированием постоянной концевой илеостомы или тотальной колэктомии с формированием резервуара (колпроктэктомия с одномоментным формированием тонкокишечного резервуара подприкрытием петлевой илеостомы).
Наличие дисплазии должно быть подтверждено вторым независимым патоморфологом. Объем хирургического лечения обсуждается совместно спациентом, тем самым учитывается желание пациента в отношении сохранения анальной дефекации или формирования постоянной илеостомы.
- Рекомендуется пациентам с ЯК при обнаружении дисплазии легкой степени в неизмененной слизистой оболочке (не в приподнятых образованиях) принимать решение индивидуально совместно с пациентом: необходимо обсудить два варианта – тотальная колэктомия (колпроктэктомия) с формированием постоянной концевой илеостомы и формированием резервуара (колпроктэктомия с одномоментным формированием тонкокишечного резервуара под прикрытием петлевой илеостомы) для улучшения качества жизни пациента, но приемлемым может быть продолжение регулярного эндоскопического скрининга с сокращением интервала между исследованиями 6-12 месяцев [126, 208, 209].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарий: объем хирургического лечения обсуждается совместно с пациентом, тем самым учитывается желание пациента в отношении сохранения анальной дефекации или формирования постоянной илеостомы. Пациент вправе воздержаться от оперативного лечения, в таком случае предлагается эндоскопический скрининг.
- Рекомендуется пациентам с ремиссией ЯК, при подтверждении наличия аденоматозного полипа (эндоскопически и по результатам патоморфологического исследования), выполнение стандартной полипэктомии для улучшения качества жизни пациента [128].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
- Не рекомендуется колэктомия пациентам с ЯК при наличии полипа с дисплазией в участке толстой кишки, пораженной ЯК, если гистологическое строение полипа соответствует аденоме и признаки дисплазии отсутствуют в окружающей неизменной слизистой оболочке или где-либо в кишке, а также в краях удаленного полипа [128].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
2.4 Виды хирургических вмешательств
У большинства пациентов ЯК современная консервативная терапия позволяет контролировать течение воспалительного процесса, однако у 10-30% пациентов в связи с неэффективностью медикаментозного лечения приходится прибегать к хирургическому вмешательству, направленному на удаление толстой кишки [114]. До начала 1980-х годов стандартом хирургического лечения являлась колпроктэктомия с концевой илеостомией, несмотря на эпизодическое формирование илеоректального анастомоза. За последние 20 лет новым золотым стандартом стала восстановительно-пластическая операция – тотальная колэктомия сформированием резервуара (колпроктэктомия с илеоанальным резервуарным анастомозом (ИАРА)) [130,131] (Табл.8). При успешном выполнении данная операция обеспечивает возможность контролируемой дефекации через задний проход с удовлетворительным качеством жизни [132]: средняя частота дефекации после формирования ИАРА составляет от 4 до 8 раз всутки [133-135], а суточный объем полуоформленного/жидкого стула составляет около 700 мл в сутки (в сравнении с 200 мл/сутки у здорового человека).
Таблица 8. Методы хирургического лечения ЯК
2.5 Выбор вида хирургического лечения
Проведение реконструктивно-пластической операции с формированием ИАРА, несмотря на очевидную привлекательность для пациента, возможно не во всех случаях, поскольку ряд факторов ухудшают функциональный исход операции и увеличивают риск осложнений, приводя к необходимости удаления резервуара у 3,5-10% пациентов [136-138].
У пациентов с ЯК, несмотря на более высокую частоту сопутствующих заболеваний после 65 лет, само хирургическое вмешательство с формированием тонкокишечного резервуара у лиц старших возрастных групп безопасно и эффективно [139].
Функция анального держания, играющая ключевую роль для нормального функционирования ИАРА, очевидно, ухудшается в старших возрастных группах [140]. Кроме того, у пациентов старше 60 лет чаще развиваются осложнения, в частности резервуарит и стриктуры анастомоза [141,142]. В то же время, какой-либо определенный возрастной порог для отказа от формирования ИАРА не определен.
Формирование тонкокишечного резервуара (ИАРА) на 30-70% [143-147] повышает риск бесплодия у женщин детородного возраста с ЯК.
Риск бесплодия связан со спаечным процессом, вовлекающим маточные трубы. Планируемая беременность и молодой возраст женщины не являются противопоказаниями к формированию ИАРА, однако, пациентка должна быть предупреждена о потенциальном риске бесплодия. В отдельных случаях возможно рассмотреть вопрос о формировании илеоректального анастомоза в качестве промежуточного этапа хирургического лечения (см.ниже).
У всех пациенток с ЯК, при возникновении показаний к операции, использование лапароскопических технологий снижает риск развития бесплодия на 90% [143-147].
У приблизительно 10% пациентов с колитом даже при изучении операционного материала, полученного при колэктомии, не удается провести дифференциальный диагноз между БК и ЯК, в связи с чем им выставляется диагноз неуточненного язвенного колита. Решение оформировании ИАРА в таких случаях принимается индивидуально, при этом пациент должен быть предупрежден о рисках неэффективности реконструктивно-пластической операции и иных осложнениях, связанных с БК.
Пациентам с ЯК при наличии таких сопутствующих заболеваний, как рак прямой кишки и выраженное анальное недержание (2 или 3 степень) формирование тонкокишечного резервуара (ИАРА) нецелесообразно.
- Рекомендуется пациентам с тяжелой атакой ЯК, не ответивших на консервативное лечение; а также пациентам с ЯК, у которых к моменту выставления показаний к операции, была проведена гормональная терапия преднизолоном** в дозе не менее 20 мг в сутки в течение более чем 6 недель- трехэтапное хирургическое лечение (с колэктомией на первом этапе, формированием тонкокишечного резервуара и петлевой илеостомы — на втором, и закрытие петлевой илеостомы — на третьем этапе) для увеличения продолжительности жизни пациентов [149-151].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарий: колэктомия с концевой илеостомией купирует интоксикацию, обусловленную колитом, что позволяет улучшить общее состояние пациента, восстановить метаболизм, а изучение операционного препарата также позволяет уточнить диагноз и исключить БК. Колэктомия является относительно безопасным вмешательством даже у пациентов в критическом состоянии [149-151], при этом, при достаточной квалификации хирурга безопасным является также выполнение минимально инвазивных или лапароскопических операций [152, 153].
Илеоректальный анастомоз [154-156]: формирование илеоректального анастомоза неприводит к излечению пациента и не исключает возможность рецидива воспаления в прямой кишке и развития рака. Данная операция при ЯК может выполняться только в исключительных случаях у женщин, планирующих беременность. Обязательным условием является наличие ремиссии в прямой кишке и согласие пациентки на регулярное обследование прямой кишки с биопсией слизистой оболочки [148,157].
2.6 Особенности хирургического вмешательства при формировании тонкокишечногорезервуара (ИАРА)
Пациентам с ЯК, которым выполнена колэктомия, реконструктивно-пластические операции с формированием тонкокишечного резервуара (ИАРА) выполняются в специализированных стационарах, поскольку частота осложнений и функциональный исход таких операций существенно зависит от квалификации хирурга (в частности, от числа проведенных аналогичных вмешательств) [148].
Длина сохраняемой прямой и/или сигмовидной кишки.
Пациентам с ЯК при выполнении колэктомии по срочным показаниям при язвенном колите, которым в дальнейшем планируется формирование тонкокишечного резервуара (ИАРА), целесообразно сохранить всю прямую кишку и нижние брыжеечные сосуды для улучшения качества жизни пациентов. Прямую кишку целесообразно пересекать на уровне мыса крестца (т.е. на уровне «ректосигмоидного перехода») или дополнительно сохранять дистальный отдел сигмовидной кишки (решение принимается оперирующим хирургом). При сохранении дистального отдела сигмовидной кишки она выводится на переднюю брюшную стенку в виде концевой сигмостомы. Последний вариант является наиболее безопасным, поскольку при этом в брюшной полости не остается культи кишки. При пересечении прямой кишки на уровне мыса в течение нескольких дней рекомендуется дренирование культи через задний проход для профилактики несостоятельности швов в связи с накоплением в культе слизи. В случае сохранения отключённой прямой или прямой и сигмовидной кишки, возможно развитие вторичных воспалительных изменений слизистой оболочки по типу колита отключеннойкишки. Контролируемые испытания лекарственных средств у пациентов после колэктомии не проводились. Эмпирическое лечение заключается в применении местного месалазина [158], преднизолона, промывании отключенной прямой кишки растворами антисептиков.
Наложение анастомоза при формировании ИАРА.
Пациентам с ЯК, которым планируется хирургическое лечение с формированием тонкокишечного резервуара (ИАРА), сохранять слизистую оболочку между зубчатой линией и анастомозом не более 2 см длиной и проводить под прикрытием петлевой илеостомы для улучшения качества жизни пациентов. Сохранение протяженного участка прямой кишки (более 2 см над зубчатой линией) при использовании сшивающего аппарата для формирования ИАРА может быть причиной хронического воспаления в ней с дисфункцией резервуара, а также способствует сохранению риска дисплазии и (очень редко) рака [154]. При невозможности сформировать анастомоз при помощи сшивающего аппарата следует выполнить брюшно-анальную резекцию прямой кишки и наложить ручной илеоанальный анастомоз.
У пациентов ЯК, перенесших хирургическое лечение с формированием тонкокишечного резервуара (ИАРА), несмотря на то, что при использовании сшивающего аппарата сохраняется небольшой фрагмент слизистой оболочки, риск рака невысок и соответствует таковому при формировании ручного анастомоза [154].
Морфологические изменения эпителиальной выстилки резервуара обычно развиваются через 12-18 месяцев после закрытия илеостомы и характеризуются уплощением и сокращением числа ворсинок, приводящими к их атрофии («толстокишечная метаплазия») [159,160], что потенциально связано с риском развития злокачественной трансформации слизистой оболочки резервуара. Кроме того, при наложении аппаратного ИАРА сохраняется небольшой участок слизистой оболочки прямой кишки («манжетка»). Риск развития рака резервуара повышен у пациентов, оперированных по поводу рака или дисплазии на фоне ЯК (и при обнаружении дисплазии в операционном материале), а также у пациентов с первичным склерозирующим холангитом (ПСХ). Научное обоснование частоты контрольных обследований пациентов сИАРА не выполнялось, однако, у пациентов с наличием вышеуказанных факторов риска целесообразно проведение контрольных эндоскопических исследований (резервуароскопии) с биопсией слизистой оболочки не реже одного раза в 2 года.
2.7 Медикаментозная терапия в период хирургического лечения.
Влияние лекарственной терапии на риск хирургических вмешательств.
- Рекомендуется с осторожностью проводить медикаментозную терапию (гормональную, иммунодепрессивную, терапию с использованием моноклональных антител) в период хирургического лечения для профилактики послеоперационных осложнений [161-166].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарий: прием преднизолона** в дозе более 20 мг в течение более чем 6 недель увеличивает частоту хирургических осложнений [161,162]. Предоперационный прием АЗА иМП не ухудшает исход хирургического лечения [163], в то время как введение инфликсимаба** и циклоспорина**# незадолго до операции может увеличивать частоту послеоперационных осложнений [164,165], хотя данные по инфликсимабу** остаются противоречивыми [166].
Резкое прекращение терапии ГКС может вызвать синдром отмены (острую недостаточность коры надпочечников, т.н. Аддисонический криз), что обусловливает необходимость временного продолжения гормональной терапии после операции до полной отмены.
На настоящий момент отсутствует надежная научная база для обоснования какой-либо схемы прекращения гормональной терапии после колэктомии по поводу ЯК. Доза ГКС для дальнейшего перорального приема в период отмены гормональной терапии определяется длительностью предшествовавшей терапии и величиной использованных доз. Согласно рекомендациям Европейского общества по изучению ЯК и БК (ECCO) [20], в случае, если гормональная терапия перед операцией проводилась не более месяца, сразу после операции возможно прекращение приема ГКС.
Если перед операцией пациент более месяца получал ГКС, после хирургического вмешательства целесообразно перейти с вышеописанной высокой парентеральной дозы ГКС на пероральный прием ГКС внутрь в дозе не ниже верхней границы суточной стрессовой продукции кортизола, то есть не ниже 20 мг преднизолона**.
2.8 Резервуарит и другие осложнения хирургического лечения при формировании тонкокишечного резервуара
Резервуарит представляет собой неспецифическое воспаление тонкокишечного резервуара и наиболее частое осложнение ИАРА. Частота его возникновения колеблется в широком диапазоне от 15 до 50% в течение 10 лет после формирования ИАРА в крупных специализированных центрах [167-169]. Такие различия могут быть обусловлены существенно большим риском резервуарита при ЯК, превышающим частоту этого осложнения при формировании ИАРА по поводу других заболеваний (в частности, семейного аденоматоза толстой кишки) [170,171].
Осложнения резервуарита включают абсцессы, свищи, стеноз резервуаро-анального анастомоза и аденокарциному резервуара. Последнее осложнение встречается исключительно редко и почти всегда – при выявленной дисплазии или раке в операционном препарате, полученном при выполнении колэктомии.
Дифференциальный диагноз при подозрении на резервуарит проводится с синдромом раздраженного резервуара (СРР), ишемическими поражениями, БК и другими редкими причинами дисфункции резервуара, такими как коллагенозный, цитомегаловирусный и Clostridioides difficile-ассоциированный резервуарит. Следует учитывать возможность развития неспецифического илеита, вызываемого приемом НПВП и синдрома избыточного бактериального роста.
Основными препаратами, применяемыми для лечения резервуарита, остаются антибиотики,что позволяет классифицировать резервуарит как антибиотикочувствительный, антибиотикозависимый и антибиотикорезистентный.
- Рекомендуется пациентам с резервуаритом первая линия терапии, включающая 14-дневный курс перорального метронидазола** (15-20 мг/кг/сутки) или ципрофлоксацина** (1000 мг/сут) для достижения терапевтического эффекта [172].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарий: нежелательные явления значительно чаще отмечаются при приеме метронидазола. В случаях антибиотико-резистентного резервуарита возможно назначение перорального будесонида (9 мг) в течение 8 недель.
- Рекомендуется пациентам с резервуаритом при отсутствии эффекта или при развитии зависимости от приема указанных препаратов назначение резервных препаратов –#рифаксимина (2000 мг/сут) и тинидазола (1000–1500 мг/сут), в том числе в комбинации с ципрофлоксацином** (1000 мг/сут), ректальных ГКС, ректальных препаратов месалазина**, АЗА** для достижения терапевтического эффекта [172].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Воспаление слизистой оболочки сохраненного участка прямой кишки и синдром раздраженного резервуара.
Другим потенциальным осложнением ИАРА является воспаление слизистой оболочки прямой кишки, сохраняемой при наложении аппаратного анастомоза.
- Рекомендуется пациентам с проктитом после формирования тонкокишечного резервуара, лечение проводить свечами месалазина** 500 мг 2 раза в сутки и/или ректальными ГКС для достижения терапевтического эффекта [58].
Уровень убедительности рекомендации A (уровень достоверности доказательств – 1).
2.9 Дисфункция илеостомы после хирургического лечения ЯК.
Под дисфункцией илеостомы понимается увеличение объема кишечного отделяемого по илеостоме более 1000 мл в сутки. Данное состояние также сопровождается быстро прогрессирующими метаболическими и водно-электролитными нарушениями [174,186].
- Рекомендуется пациентам с дисфункцией илеостомы для лабораторной диагностики Clostridioides difficile – ассоциированной диареи использовать алгоритм, включающий молекулярно-биологическое исследование фекалий на возбудителя диффициального клостридиоза (Clostridium difficile) или иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile) или иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile)[174,175].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарий: помимо обильного жидкого отделяемого по стоме, в клинической картине также отмечается повышение температуры тела до 39 С, метеоризм, редко жалобы на тошноту, рвоту, боли в животе спастического характера. При лабораторных исследованиях: анемия, гипопротеинемия, гипоальбуминемия, гипокалиемия, повышение уровня СРБ, редко увеличение концентрации креатинина.
- Рекомендуется пациентам с лёгкой дисфункцией илеостомы диетотерапия, спазмолитики и препараты, замедляющие пассаж по ЖКТ, для достижения терапевтического эффекта и улучшения качества жизни пациента [174,175,186].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам со среднетяжёлой формой дисфункции илеостомы метронидазол** в дозе 500 мг внутрь три раза в день в течение 10 дней. При отсутствии клинического эффекта от метронидазола** через 5-7 дней производят смену препарата на ванкомицин** в дозе 1000 мг в день per os в течение 10 дней для достижения терапевтического эффекта и улучшения качества жизни пациента [174,176,178,186].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарий: если в лабораторных показателях отмечается увеличение уровня лейкоцитов в крови более 15×109/л, креатинина в сыворотке крови выше 115 мкмоль/л, подъём температуры тела выше 38°C и снижении уровня альбумина менее 25 г/л, пациенты должны получать лечение в условиях круглосуточного стационара. Этим пациентам изначально показано назначение ванкомицина** в дозе 1000 мг внутрь в день в течение 10 дней.
- Рекомендуется пациентам с тяжелой формой дисфункции илеостомы изначально наряду с инфузионной терапией назначить ванкомицин** внутрь в дозе 500 мг 4 раза в день в сочетании с метронидазолом** в дозе 500 мг 3 раза в день внутривенно [179,186].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: при невозможности введения препарата через рот ванкомицин** назначается ректально. При этом препарат в дозе 500 мг разводится в 500 мл 0,9% раствора хлорида натрия и вводится в виде клизм четыре раза в день. Ухудшение состояния пациента с возникновением гипотонии, гипертермия выше 38,5 °C, задержка стула, выраженное вздутие живота, изменение сознания, лейкоцитоз свыше 15 × 109 или лейкопении ниже 2 × 109, повышение уровня лактата в сыворотке крови выше 2,2 ммоль/л, развитие синдрома полиорганной недостаточности требует его перевода в отделение интенсивной терапии для дальнейшего лечения.
Медицинская реабилитация
Реабилитация
Специфические меры реабилитации пациентов с ЯК отсутствуют. Меры медицинской реабилитации направлены на профилактику колоректального рака.
Поскольку в ряде случаев терапия ЯК сопряжена с применением иммунодепрессантов, основным способом реабилитации пациентов является профилактика оппортунистических инфекций, описанная в разделе 5 (Профилактика).
У пациентов, которым потребовалось хирургическое лечение язвенного колита, возможна реабилитация в три этапа.
1-й этап – ранняя реабилитация, осуществляется непосредственно после хирургического лечения со 2-х по 14-е сутки. Основной задачей 1 этапа реабилитации является восстановление нормального функционирования желудочно-кишечного тракта после хирургического вмешательства. Именно на этом этапе чаще всего выявляются и должны быть корригированы нарушения мочеиспускания. Важная роль отводится также контролю гомеостаза, мероприятиям, направленным на заживление послеоперационных ран, купированию послеоперационного болевого синдрома, активизации пациента. В данный период проводится контроль общего анализа крови, биохимического анализа крови, коагулограммы крови, общего анализа мочи.
2-й этап реабилитации начинается после 15 суток и продолжается по мере необходимости в последующем. Направлен на окончательное заживление послеоперационных ран с контролем за деятельностью желудочно-кишечного тракта и других систем организма. Данный этап возможно осуществлять как амбулаторно, так и в условиях стационара дневного или круглосуточного пребывания.
3-й этап реабилитации осуществляется в поздний реабилитационный период у пациентов как с постоянной илеостомой, так и перед реконструктивно-восстановительной операцией. Основной задачей на данном этапе является компенсация функции желудочно-кишечного тракта, мероприятия, направленные на выявление и коррекцию функции запирательного аппарата прямой кишки.
Недостаточность анального сфинктера
Реабилитация возможна на 2 и 3 этапах. У ряда пациентов, у которых оперативное вмешательство по поводу ЯК завершилось формированием тонкокишечного резервуара, отмечается снижение функции держания.
Пациентам с ЯК с недостаточностью анального сфинктера перед реконструктивно-восстановительным лечением целесообразно выполнение исследования функций сфинктерного (запирательного) аппарата прямой кишки (сфинктерометрия, профилометрия, исследование проводимости по срамному нерву) с последующей консультаций врача функциональной диагностики для планирования оперативного вмешательства [180].
Пациентам с ЯК при выявлении недостаточности анального сфинктера 2-3 степени, целесообразно провести 10-дневный цикл электростимуляции с использованием биологической обратной связи (БОС-терапия и тибиальная ней ромодуляция) в условиях дневного или круглосуточного стационара для проведения реабилитационного лечения, улучшения качества жизни пациентов [180, 181].
В реабилитации пациентов с недостаточностью анального сфинктера по данным литературы, широкое применение нашел метод лечения биологической обратной связью (БОС), направленный на улучшение сократительной способности мышц наружного сфинктера и тазового дна за счет увеличения как силы, так и длительности произвольного сжатия [180,181]. Данный неинвазивный метод вовлекает в процесс реабилитации собственные ресурсы организма с выработкой правильных навыков на уровне создания новых условно-рефлекторных связей. Так же эффективным является метод тибиальной нейромодуляции. Нейромодуляция — это процесс, при котором электрический ток по одним нервным путям модулирует существовавшую ранее активность в других нервных путях или центрах.Чрескожная электростимуляция заднего большеберцового нерва применяется при функциональных заболеваниях органов малого таза, так как в составе заднего большеберцового нерва проходят волокна из II и III крестцовых сегментов спинного мозга, играющие значительную роль в иннервации прямой кишки, мочевого пузыря и их сфинктеров.Доказано, что мышечные структуры отключенного запирательного аппарата могут реагировать на терапию биологической обратной связью и проведение тибиальной ней ромодуляции, увеличивая как тонус, так и силу волевых сокращений [180,181]. Стимуляцию тибиального нерва проводят с помощью накожного стимулирующего электрода, что позволяет пациенту после курса предварительного обучения продолжить курс лечения самостоятельно в домашних условиях. В таком случае курс лечения с ежедневными сеансами стимуляции может продлеваться до 1-3 месяцев. Контроль эффективности БОС-терапии производится перед началом и по окончании каждого курса процедур путем комплексного физиологического исследования функции запирательного аппарата прямой кишки (сфинктерометрия + физиологическое исследование резервуарной функции низведенной кишки). При улучшении показателей тонуса и сократительной способности анальных сфинктеров, можно ставить вопрос о выполнении реконструктивно-восстановительной операции, направленной на возобновление естественного пассажа по желудочно-кишечному тракту.
Прогноз
Дополнительная информация, влияющая на течение и исход заболевания
Риск тяжелого обострения ЯК в течение жизни составляет 15%, при этом вероятность тяжелой атаки выше у пациентов с тотальным поражением толстой кишки. При проведении адекватной противорецидивной терапии в течение 5 лет обострений удается избежать у половины пациентов, а в течение 10 лет — у 20% пациентов. В течение первого года после постановки диагноза вероятность колэктомии составляет 4-9% (при тяжелой атаке — около 50%), в дальнейшем с каждым годом заболевания риск колэктомии увеличивается на 1%. Факторами риска агрессивного течения ЯК являются прогрессирование поражения от дистального (проктита) к тотальному, первичный склерозирующий холангит, а также детский и подростковый возраст на момент начала заболевания. Планирование беременности необходимо осуществлять в период ремиссии ВЗК, что позволяет улучшать исходы беременности. Применение беременными большинства препаратов для лечения ВЗК сопряжено с низким риском неблагоприятного воздействия на плод, за исключением метотрексата и препаратов 5-АСК, содержащих дибутилфталат. Отмена анти-ФНО или переход на монотерапию возможны лишь у ограниченного числа пациенток с низким риском реактивации ВЗК. Лечение генно-инженерными биологическими лекарственными препаратами, не противопоказанными при беременности (см. инструкцию по применению), может быть продолжено, если польза для матери превышает потенциальные риски для плода.
Уменьшение рисков, связанных с назначением ГКО, достигается строгим соблюдением принципов гормональной терапии. ГКС не могут применяться в качестве поддерживающей терапии.
При назначении гормональной терапии необходимо учитывать следующее:
- постепенное снижение дозы стероидов до полной отмены — строго обязательно;
- суммарная продолжительность гормональной терапии не должна превышать 12 недель;
- обязательным является сопутствующий прием препаратов кальция, витамина D;
- в период лечение необходим регулярный контроль уровня глюкозы в крови.
Пациентам, которым в результате хирургического лечения была сформирована кишечная стома, может потребоваться консультация и наблюдение специалистом по реабилитации стомированных пациентов.
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 47 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядками оказания помощи по профилям «гастроэнтерология», «колопроктология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь больным ЯК оказывается врачом-гастроэнтерологом, врачом-колопроктологом и иными врачами-специалистами в медицинских организациях, имеющих лицензию на оказание соответствующих видов медицинской деятельности.
При подозрении или выявлении язвенного колита у пациента врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в медицинскую организацию, имеющую в своем составе кабинет врача-гастроэнтеролога, врача-колопроктолога, и/или амбулаторный гастроэнтерологический центр (отделение), и/или амбулаторный колопроктологический центр (отделение), и/или центр диагностики и лечения воспалительных заболеваний кишечника (при наличии в субъекте, организуется на функциональной основе) для оказания ему первичной специализированной медико-санитарной помощи. Консультация в указанных структурных подразделениях медицинской организации должна быть проведена не позднее 15 рабочих дней с даты выдачи направления на консультацию, а в случаях тяжелой формы язвенного колита не позднее 3 рабочих дней с даты выдачи направления на консультацию.
Врач-гастроэнтеролог, врач-колопроктолог медицинской организации, имеющей в своем составе кабинет врача-гастроэнтеролога, врача-колопроктолога, амбулаторный гастроэнтерологический центр (отделение), амбулаторный колопроктологический центр (отделение), центр диагностики и лечения воспалительных заболеваний кишечника, организует своевременное квалифицированное обследование и лечение пациента, включая определение степени выраженности воспалительного процесса, протяженности поражения, наличия кишечных и внекишечных проявлений, в том числе взятие биопсийного материала.
При необходимости лечения и углубленного обследования в стационарных условиях, пациентна правляется лечащим врачом в гастроэнтерологическое отделение, колопроктологическое отделение, центр диагностики и лечения воспалительных заболеваний кишечника или иную медицинскую организацию, оказывающую медицинскую помощь в стационарных условиях пациентов по профилю «гастроэнтерология», «колопроктология».
При подозрении и (или) выявлении язвенного колита у пациента в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь по профилю «гастроэнтерология», «колопроктология» для определения тактики ведения и необходимости применения дополнительно других методов специализированного лечения, включая проведение таргетной биологической терапии.
Врач-гастроэнтеролог, врач-колопроктолог медицинской организации, имеющей в своем составе кабинет врача-гастроэнтеролога, врача-колопроктолога, амбулаторный гастроэнтерологический центр (отделение), амбулаторный колопроктологический центр (отделение), центр диагностики и лечения воспалительных заболеваний кишечника направляет пациента в медицинские организации, имеющие для оказания медицинской помощи в стационарных условиях в своем составе гастроэнтерологическое отделение и/или колопроктологическое отделение, и/или центр диагностики и лечения воспалительных заболеваний кишечника для уточнения диагноза (в случае невозможности установления диагноза при оказании первичной специализированной медико-санитарной помощи) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи. Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи определяется по решению комиссии по отбору пациентов для госпитализации в зависимости от тяжести язвенного колита, характера течения, распространённости воспалительного процесса, срок не должен превышать 30 календарных дней с даты выдачи направления на госпитализацию.
Специализированная, в том числе высокотехнологичная, медицинская помощь при язвенном колите оказывается врачами-гастроэнтерологами, врачами-колопроктологами в медицинских организациях, имеющих в своем составе гастроэнтерологическое отделение и/или колопроктологическое отделение, и/или центр диагностики и лечения воспалительных заболеваний кишечника, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение язвенного колита, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь при язвенном колите определяются врачом-гастроэнтерологом и/или врачом-колопроктологом с проведением при необходимости мультидисциплинарного консилиума.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
1) наличии осложнений язвенного колита, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, биологическая терапия, гормональная и цитостатическая терапия и т.д.) язвенного колита.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному лечению язвенного колита (хирургическое вмешательство, гормональная и цитостатическая терапия, биологическая и таргетная терапия), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
1) завершение курса лечения, или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей лечение язвенного колита при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
Профилактика
Профилактика
Язвенный колит характеризуется хроническим рецидивирующим течением. Диспансерное наблюдение при ЯК проводится пожизненно. Целью диспансерного наблюдения является, в первую очередь, профилактика колоректального рака. У большинства пациентов в стадии клинической ремиссии колоноскопия должна выполняться не реже, чем каждые 3 года. У части пациентов периодичность диспансерного наблюдения с проведением колоноскопии может быть иной. К особенностям наблюдения за пациентами, получающими иммунодепрессанты (АЗА**, МП**, МТ** и/или биологические лекарственные препараты), относится профилактика оппортунистических инфекции. К факторам риска развития оппортунистических инфекций относят: прием преднизолона** 20 мг в сутки и более в течение 2 недель, прием иммунодепрессантов (АЗА**, МП**, МТ** и биологические лекарственные препараты), возраст старше 50 лет, сопутствующие заболевания (хронические заболевания легких, алкоголизм, органические заболевания головного мозга, сахарный диабет).
Пациентам следует разъяснить необходимость постоянного приема лекарственных препаратов, поскольку соблюдение предписаний по терапии существенно (в 2-2,5 раза) снижает частоту обострений, а сама терапия является методом химиопрофилактики колоректального рака.
- Рекомендуется всем пациентам обязательная вакцинопрофилактика в соответствии с Европейским консенсусом по профилактике, диагностике и лечению оппортунистических инфекций при ВЗК для профилактики инфекций. Необходимым минимумом вакцинопрофилактики является [187]:
— Вакцина для профилактики вирусного гепатита В
— Вакцина для профилактики пневмококковых инфекций
— Вакцина для профилактики гриппа [инактивированная]
— Для женщин до 26 лет, при отсутствии вируса на момент скрининга рекомендуется вакцинация от вируса папилломы человека.
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарий. Пациентам в период терапии ГКС необходим мониторинг уровня гликемии (исследование уровня глюкозы в крови) для профилактики побочного действия глюкокортикоидов. Также необходим пациентам в период терапии иммунодепрессантами ежемесячный контроль уровня лейкоцитов (общий анализ крови) и печёночных ферментов (АЛТ, АСТ, билирубин, щелочная фосфатаза, ГГТ) в начале лечения раз в две недели, далее раз в месяц в течение первых 6 месяцев терапии, далее раз в три месяца для профилактики побочных эффектов от терапии.
- Рекомендуется пациентам перед проведением биологической терапии (ГИБП + малые молекулы (тофацитиниб**) и далее каждые 6 месяцев консультация врача-фтизиатра и скрининг на туберкулез (квантифероновый тест, а при невозможности, проведение внутрикожной пробы с туберкулезным аллергеном – проба Манту, диаскин-тест) для диагностики туберкулеза [182].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам до назначения иммуносупрессивной терапии, включая ГИБП и на фоне лечения проводить скрининг для диагностики сопутствующих заболеваний в соответствии с профессиональными клиническими рекомендациями:
1. на наличие маркеров вирусных гепатитов (Определение антител к вирусу гепатита C (Hepatitis C virus) в крови; Определение антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови) [187]
2. на иммунодефицит человека (Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови; Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови) [187].
3. на сифилис (Определение антител к бледной трепонеме (Treponema pallidum) в нетрепонемных тестах (RPR, РМП) (качественное и полуколичественное исследование) в сыворотке крови) [212].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарий: Недопустимы перерывы в лечении без медицинских показаний.
- Не рекомендуется всем пациентам смена оригинального препарата на биоаналог или наоборот более одного раза [196].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарий: в настоящее время зарегистрированы биосимиляры (биоаналоги) анти-ФНО, схожие с оригинальными биологическими лекарственными препаратами по эффективности и безопасности, однако их взаимозаменяемость с оригинальными препаратами в настоящее время не доказана. С учетом отсутствия клинических испытаний у пациентов с ВЗК, доказавших безопасность и эффективность чередования или полного переключения с оригинального препарата на биоаналоги и наоборот, подобный терапевтический подход не рекомендован [196].
- Рекомендуется всем пациентам каждые 6 месяцев выполнять исследование уровня кальпротектина в калеи/или ректороманоскопию с целью оценки эффективности проводимой терапии[39,41,42,183-185].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарий: с точки зрения долгосрочного прогноза течения ЯК целесообразно регулярно оценивать наличие эндоскопической ремиссии (заживления слизистой оболочки).
Информация
Источники и литература
-
Клинические рекомендации Российской гастроэнтерологической ассоциации
- 1.
Travis SP, Dinesen L. Remission in trials of ulcerative colitis: what does it mean?
PractGastroenterol.
2010;30:17–20.
2.
D»Haens G, et al. A review of activity indices and efficacy end points for clinical trials of medicaltherapy in adults with ulcerative colitis.
Gastroenterology
. 2007;132:763–86.
3.
Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Epidemiology and natural history ofinflammatory bowel diseases.
Gastroenterology
. 2011;140:1785–94.
4.
Белоусова Е.А., Абдулганиева Д.И., Алексеева О.П., Алексеенко С.А. и соавт. Социально-демографическая характеристика, особенности течения и варианты лечениявоспалительных заболеваний кишечника в России. Результаты двух многоцентровыхисследований.
Альманах клинической медицины.
2018;46(5):445-463.
https://doi.org/10.18786/2072-0505-2018-46-5-445-463.
5.
Katsanos KH, Vermeire S, Christodoulou DK, Riis L, et al. Dysplasia and cancer in inflammatorybowel disease 10 years after diagnosis: results of a population-based European collaborativefollow-up study.
Digestion
. 2007;75: 113–21.
6.
Silverberg MS, et al. Toward an integrated clinical, molecular and serological classification ofinflammatory bowel disease: report of a working party of the 2005 Montreal World Congress ofGastroenterology.
Can J Gastroenterol
. 2005;19(Suppl A):5–36.
7.
Truelove SC et al. Cortisone in ulcerative colitis; final report on a therapeutic trial.
Br Med J
.1955;2:1041–8.
8.
Seah D, De Cruz P. Review article: the practical management of acute severe ulcerative colitis.
Aliment Pharmacol
Ther
. 2016 Feb;43(4):482-513.
9.
Hindryckx P, Jairath V, D»Haens G. Acute severe ulcerative colitis: from pathophysiology toclinical management.
Nat Rev Gastroenterol Hepatol.
2016 Sep 1.
10.
Chen JH, Andrews JM, Kariyawasam V, Moran N. IBD Sydney Organisation and the AustralianInflammatory Bowel Diseases Consensus Working Group. Review article: acute severe ulcerativecolitis — evidence-based consensus statements.
Aliment Pharmacol
Ther.
2016 Jul;44(2):127-44.
11.
Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly tomoderately active ulcerative colitis. A randomized study.
N Engl J Med
. 1987;317:1625–9.
12.
Григорьева Г.А., Мешалкина Н.Ю. О проблеме системных проявлений воспалительныхзаболеваний кишечника.
Фарматека
. 2011; № 15, с. 44-49.
13.
Sands BE. From symptom to diagnosis: clinical distinctions among various forms of intestinalinflammation. Gastroenterology. 2004;126:1518–32.
14.
Perler B, Ungaro R, Baird G, Malette M. et al. Presenting symptoms in inflammatory boweldisease: descriptive analysis of a community-based inceptive cohort.
BMC Gastroenterol
. 2019;19:47.
15.
Fine KD, Schiller LR. AGA technical review on the evaluation and management of chronicdiarrhea. Gastroenterology. 1999;116:1464–86.
16.
Forrest K, Symmons D, Foster P. Systematic review: is ingestion of paracetamol or non-steroidalanti-inflammatory drugs associated with exacerbations of inflammatory bowel disease? AlimentPharmacol Ther. 2004;20:1035–43.
17.
Mahid SS, Minor KS, Soto RE, et al. Smoking and inflammatory bowel disease: a meta-analysis.Mayo Clin Proc. 2006;81:1462–71.
18.
Vermeire S. Review article: genetic susceptibility and application of genetic testing in clinicalmanagement of inflammatory bowel disease. Aliment Pharmacol Ther. 2006;24:2–10.
19.
Carter MJ, Lobo AJ, Travis SP; IBD Section, British Society of Gastroenterology. Guidelines forthe management of inflammatory bowel disease in adults. Gut. 2004;53:V1–16.
20.
Harbord M, Eliakim R, Bettenworth D, Karmiris K, Katsanos K, Kopylov U, Kucharzik T, MolnárT, Raine T, Sebastian S, de Sousa HT, Dignass A, Carbonnel F; European Crohn’s and ColitisOrganisation [ECCO]. Third European Evidence-based Consensus on Diagnosis and Managementof Ulcerative Colitis. Part 2: Current Management. J Crohns Colitis. 2017 Jan 28;11(7):769-84.doi: 10.1093/ecco-jcc/jjx009.
21.
Travis SP, Jewell DP. Ulcerative colitis: clinical presentation and diagnosis. In: Satsangi J,Sutherland LR, editors. Inflammatory Bowel Diseases. London: Churchill Livingstone. 2003:169–81.
22.
Lucendo AJ,
Arias Á,
Roncero Ó,
Hervías D, et al. Anemia at the time of diagnosis ofinflammatory bowel disease: Prevalence and associated factors in adolescent and adult patients.
Sao Paulo Med J.
2014;132(3):140-6.
23.
Irwin JR,
Ferguson E,
Simms LA,
Hanigan K, et al. Detectable Laboratory Abnormality Is Presentup to 12 Months Prior to Diagnosis in Patients with Crohn»s Disease.
Dig Dis Sci
. 2019Feb;64(2):503-517.
24.
Cherfane CE,
Gessel L,
Cirillo D,
Zimmerman MB,
Polyak S. Monocytosis and a LowLymphocyte to Monocyte Ratio Are Effective Biomarkers of Ulcerative Colitis Disease Activity.
Inflamm Bowel Dis.
2015 Aug;21(8):1769-75.
25.
Feng JR,
Qiu X,
Wang F,
Chen PF, et al. Diagnostic Value of Neutrophil-to-Lymphocyte Ratio andPlatelet-to-Lymphocyte Ratio in Crohn»s Disease.
Gastroenterol Res Pract
. 2017;2017:3526460.doi: 10.1155/2017/3526460.
26.
Yoon JY,
Park SJ,
Hong SP,
Kim TI, et al. Correlations of C-reactive protein levels and erythrocytesedimentation rates with endoscopic activity indices in patients with ulcerative colitis.
Dig Dis Sci.
2014 Apr;59(4):829-37.
27.
Yamamoto-Furusho JK,
Sánchez-Osorio M,
Uribe M. Prevalence and factors associated with thepresence of abnormal function liver tests in patients with ulcerative colitis
.
Ann Hepatol.
2010Oct-Dec;9(4):397-401
28.
Archampong EQ,
Harris J,
Clark CG. The absorption and secretion of water and electrolytesacross the healthy and the diseased human colonic mucosa measured in vitro.
Gut
. 1972Nov;13(11):880-6.
29.
Maharshak N,
Arbel Y,
Gal-Oz A,
Rogowski O, et al. Comparative analysis of Bayer wide-rangeC-reactive protein (wr-CRP) and the Dade-Behring high sensitivity C-reactive protein (hs-CRP) inpatients with inflammatory bowel disease.
J Dig Dis.
2008 Aug;9(3):140-3.
30.
Weber P,
Husemann S,
Vielhaber H,
Zimmer KP,
Nowak-Göttl U. Coagulation and fibrinolysis inchildren, adolescents, and young adults with inflammatory bowel disease.
J Pediatr GastroenterolNutr.
1999 Apr;28(4):418-22.
31.
Issa M, Vikayapal A, Gracham MB et al. Impact of Clostridium difficile in inflammatory boweldisease patients.
Clin Gastroenterol Hepatol.
2007; 5: 345-351.
- 1.
Информация
Список сокращений
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
5-АСК – аминосалициловая кислота**
АЗА – азатиоприн**
Анти-ФНО – ингибиторы фактора некроза опухоли альфа (ФНО-альфа)
БК – болезнь Крона
БОС – биологическая обратная связь
ВЗК – воспалительные заболевания кишечника
гамма-ГТ – гамма-глютамилтранспептидаза
ГИБП – генно-инженерный биологический лекарственный препарат
ГКС – глюкокортикостероиды
ДИ – доверительный интервал
ЖКТ – желудочно-кишечный тракт
ИАРА – илеоанальный резервуарный анастомоз
ИМТ – индекс массы тела
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МП – меркаптопурин**
МРТ – магнитно-резонансная томография
НПВП – нестероидные противовоспалительные препараты
РКИ – рандомизированное контролируемое испытание
СОЭ – скорость оседания эритроцитов
СРБ – С-реактивный белок
ФНО-альфа – фактор некроза опухоли-альфа
ЯК – язвенный колит
UC – ulcerative colitis – язвенный колит
Термины и определения
Язвенный колит (ЯК) – хроническое заболевание толстой кишки, характеризующееся иммунным воспалением ее слизистой оболочки.
Обострение (рецидив, атака) ЯК – появление типичных симптомов заболевания у больных ЯК в стадии клинической ремиссии, спонтанной или медикаментозно поддерживаемой. На практике признаками клинического обострения являются увеличение частоты дефекаций с выделением крови и/или характерные изменения, обнаруживаемые при эндоскопическом исследовании толстой кишки.
Ремиссия ЯК – исчезновение основных клинических симптомов заболевания [1] и заживление слизистой оболочки толстой кишки («глубокая ремиссия») [2].
Ремиссия ЯК, клиническая – отсутствие примеси крови в стуле, отсутствие императивных/ложных позывов при частоте дефекаций не более 3 раз в сутки.
Ремиссия ЯК, эндоскопическая – отсутствие видимых макроскопических признаков воспаления при эндоскопическом исследовании толстой кишки.
Ремиссия ЯК, гистологическая – отсутствие микроскопических признаков воспаления.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы
Конфликты интересов у всех перечисленных авторов отсутствуют.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. Врачи -гастроэнтерологи
2. Врачи -колопроктологи
3. Врачи -хирурги
4. Врачи -терапевты
5. Врачи общей практики (семейные врачи)
6. Врачи -эндоскописты
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УРР) для методов профилактики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР (клинических рекомендации) но не чаще 1 раз в 6 месяцев.
Приложение А3. Связанные документы
Данные клинические рекомендации разработаны с учетом следующих нормативных актов: порядка оказания медицинской помощи населению по профилю «гастроэнтерология»(утвержден приказом Министерства здравоохранения Российской Федерации № 906н от 12ноября 2012 г), порядка оказания медицинской помощи населению с заболеваниями толстой кишки, анального канала и промежности колопроктологического профиля (утвержден приказом Министерства здравоохранения Российской Федерации № 206н от 02 апреля 2010 г)
Приложение Б. Алгоритмы ведения пациента
Рисунок 1. Алгоритм диагностической и лечебной тактики при язвенном колите
Язвенный колит
Приложение В. Информация для пациентов
Язвенный колит (ЯК) – хроническое воспалительное заболевание, характеризующееся повторяющимися острыми обострениями, после которых следуют периоды ремиссии. Многочисленные исследования показывают, что без лечения у пациентов с ЯК существенно повышается риск колоректального рака и смертность. Несвоевременное и недостаточное лечение может привести к прогрессированию заболевания и не только нарастанию симптомов (диареи с кровью, болей в животе), но и к системным проявлениям: снижению массы тела, лихорадке, анемии. Тяжелое обострение язвенного колита представляет угрозу для жизни из-за риска перфорации (прободения) кишки и развития перитонита. Самое главное, что даже при слабо выраженных симптомах или их отсутствии в кишке может сохраняться воспаление. При неполноценном лечении это постоянное воспаление приводит к развитию колоректального рака, который при ЯК протекает особенно агрессивно. Только постоянная противовоспалительная терапия может уменьшить вероятность развития опухоли.
Язвенный колит – достаточно редкое заболевание, человек с этой болезнью должен по возможности наблюдаться у врача, специализирующегося на лечении именно данной патологии, и строго следовать его рекомендациям по длительной, нередко, пожизненной, лекарственной терапии. Ни уровень физической нагрузки, ни прием конкретных продуктов питания, не влияют на риск обострения язвенного колита так, как влияет на него нерегулярный прием лекарств и несвоевременное обращение к специалисту.
Приложение Г.
Название на русском языке: индекс активности язвенного колита (индекс Мейо)
Оригинальное название: Mayo Score / Disease Activity Index (DAI) for Ulcerative Colitis
Источник: Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy formildly to moderately active ulcerative colitis. A randomized study. N Engl J Med. 1987;317:1625–9[11].
Тип: шкала оценки
Назначение: оценка тяжести атаки ЯК
Содержание (шаблон):
Ключ: тяжесть атаки ЯК устанавливается по сумме баллов: 0–2 — ремиссия (при этом оценка параметров ректального кровотечения и эндоскопического состояния слизистой = 0 баллов); 3–5 — легкая атака ЯК; 6–9 — среднетяжелая атака ЯК; 10–12 — тяжелая атака ЯК.
Парциальный индекс (или неполная шакала Мейо) без данных эндоскопии: 0–1 балл –клиническая ремиссия (при этом параметр «ректальное кровотечение» = 0 баллов; 1–2 балла –легкая атака; 3–5 баллов – среднетяжелая атака; ≥ 6 баллов – тяжелая атака ЯК.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Неспецифический язвенный колит (или просто язвенный колит) — хроническое воспаление толстой кишки аутоиммунного характера. Данное заболевание относится к группе воспалительных заболеваний толстого кишечника.
Эпидемиология
Заболевание преобладает в развитых странах Европы и Северной Америки. Язвенный колит встречается в 20-260 случаев на 100 000 человек. С каждым годом число заболевших увеличивается.[2]
Чаще всего болеют лица в возрасте от 21 до 42 лет, а также пациенты после 54 лет. Самые опасные периоды в развитии язвенного колита — это первый год болезни (из-за быстрого развития воспаления при фульминантном течении появляются осложнения, опасные для жизни) и десятый год (за этот период развиваются злокачественные новообразования).
Факторы риска до сих пор до конца не изучены. Существует следующая закономерность:
- Взаимосвязь курения и язвенного колита. По статистическим данным курящие люди реже болеют язвенным колитом.
- Аппендэктомия (удаление аппендицита) в анамнезе снижает заболеваемость язвенным колитом.
- Снижение количества пищевых волокон способствует появлению болезни.
- Лица, чаще болеющие детскими инфекциями, имеют склонность к появлению данного заболевания.
Этиология
Происхождение язвенного колита на сегодняшний день неизвестно. Существуют следующие теории развития заболевания:
- Язвенный колит возникает под действием определённых экзогенных (внешних) факторов, которые не известны. Предположительной причиной является инфекция.
- Заболевание имеет аутоиммунный характер. Существует наследственная предрасположенность к развитию болезни. Под воздействием определённых факторов запускаются иммунные реакции, вырабатываются антитела, направленные на клетки толстого кишечника.
- Язвенный колит развивается вследствие реакции организма на определённые продукты питания, при этом воспаляется кишечная стенка.
Первые признаки заболевания: кровь и слизь в стуле, диарея, боли в животе, повышение температуры тела.
Основными симптомами неспецифического язвенного колита кишечника являются:
- кишечные кровотечения;
- диарея;
- запор;
- боль в животе;
- тенезмы (ощущение постоянных режущих, тянущих, жгучих болей в толстой кишке — позывов к дефекации, однако при этом выделение кала не происходит);
- лихорадка;
- снижение массы тела;
- тошнота, рвота;
- слабость;
- внекишечные симптомы (артрит, узловатая эритема, увеит и другие).
Заболевание хроническое — симптомы возникают только при обострении, при ремиссии их может не быть.
Характер преобладающей симптоматики зависит от тяжести заболевания и вовлечённого в воспалительный процесс отдела толстого кишечника. Например, при тотальном поражении наблюдается частый жидкий стул с большим количеством крови в кале, боли в животе спастического характера. При тяжёлом течении присоединяются симптомы общей интоксикации (лихорадка, тошнота, рвота, слабость).
При поражении дистальных отделов толстого кишечника (проктит) чаще возникает запор, ложные позывы на дефекацию, тенезмы, в кале обнаруживаются следы алой крови, слизи или гноя. Для оценки тяжести язвенного колита предложены критерии Truelove и Witts.
При язвенном колите происходит каскад воспалительных реакций. В результате воздействия триггерного (инициирующего) фактора стимулируются Т- и В-лимфоциты, что, в свою очередь, приводит к образованию иммуноглобулинов М и G. Дефицит Т-супрессоров усиливает аутоиммунный ответ. Образование иммуноглобулинов М и G приводит к появлению иммунных комплексов и активации сиcтемы комплемента, который обладает цитотоксическим действием. В очаг воспаления проникают нейтрофилы и фагоциты, при этом высвобождаются медиаторы воспаления.
Одним из механизмов патогенеза язвенного колита является нарушение барьерной функции слизистой оболочки толстой кишки и регенераторной функции.
Реакция организма на стресс с патологическим нейрогуморальным ответом приводит к активизации аутоиммунного процесса. Часто больные язвенным колитом имеют эмоциональную нестабильность.
По распространённости процесса различают:
- проктит (с вовлечением прямой кишки);
- левосторонний колит (поражение прямой сигмовидной и нисходящей ободочной кишки);
- тотальный колит (поражение всех отделов толстого кишечника).
По степени тяжести течения:[3]
- лёгкое течение;
- среднетяжёлое течение;
- тяжёлое течение.
По характеру течения:
- острое течение (менее 6 месяцев от начала болезни);
- фульминантное (быстро развивающееся);
- постепенное;
- хронический язвенный колит непрерывного течения (периоды ремиссии (ослабления симптомов) менее 6 месяцев при правильном лечении);
- хронический язвенный колит рецидивирующего течения (периоды ремиссии более 6 месяцев): редко рецидивирующее (один раз в год или меньше) или часто рецидивирующее (более 2 раз в год).
Язвенный колит — это хроническое заболевание, при котором бывают периоды, когда возникает обострение и периоды, когда симптомы затухают или не выявляются — стадия ремиссии. Язвенный колит может обостряться без явной причины, однако чаще это происходит под воздействием стресса, неправильного питания и приёме некоторых лекарств.
Местные осложнения
К местным осложнениям относятся:
- перфорация;
- токсическая дилатация (расширение) толстого кишечника;
- обильное кишечное кровотечение;
- колоректальный рак.
Системные осложнения
Проявляются внекишечными симптомами, причина которых до сих пор не изучена. Чаще поражаются ротовая полость, кожа, суставы.
К системным осложнениям относятся:
- узловатая эритема (поражение кожи и подкожной клетчатки);
- гангренозная пиодермия (поражение кожи крупными болезненными язвами);
- эписклерит (поражение эписклеральной ткани глаза);
- артропатия (поражение суставов);
- анкилозирующий спондилит (воспаление суставов позвоночника);
- поражения печени (повышение трансаминаз крови, гепатомегалия);
- первичный склерозирующий холангит (сужение просвета желчных протоков в результате воспаления).
При диагностике в первую очередь оценивается клиника заболевания, анамнез, производится осмотр с обязательным пальцевым исследованием прямой кишки.
Наиболее важными в диагностике язвенного колита являются эндоскопические методы исследования: ректороманоскопия, колоноскопия с биопсией. Так же для уточнения диагноза применяются ирригоскопия, МСКТ-колоноскопия.
По эндоскопической картине можно определить степень воспаления толстого кишечника. Существуют четыре степени воспаления кишечника:
- При I степени наблюдается отёчность слизистой оболочки, гиперемия, сглаженность или отсутствие сосудистого рисунка, определяются точечные кровоизлияния, слизистая ранима, контактно кровоточит.
- При II степени добавляется зернистость, могут присутствовать эрозии, фиброзный налёт на стенках кишки.
- При III степени эрозии сливаются между собой, образуются язвы, в просвете кишки гной и кровь.
- При IV степени, помимо вышесказанного, появляются псевдополипы, состоящие из грануляционной ткани.
Язвы не проникают глубже подслизистого слоя.
При рентгенологическом исследовании определяется:
- отсутствие гаустр (мешкообразных выпячиваний стенки толстой кишки);
- сглаженность контуров;
- изъязвления, отёк, зубчатость, двойной контур;
- утолщение слизистой и подслизистой оболочек;
- преимущественно продольные и грубые поперечные складки;
- воспалительные полипы.
Ирригоскопия помогает не только в диагносте язвенного колита, но и в выявлении серьёзных осложнений, таких как токсическая дилатация (чрезмерное расширение просвета толстой кишки).
Дифференциальный диагноз:
- Для подтверждения диагноза «Инфекционный колит» используют бактериологическое исследование.
- Диагноз «Болезнью Крона» ставится на основании эндоскопической картины и гистологического исследования биоптата слизистой.
- Ишемический колит.
Тактика зависит от локализации поражения и тяжести течения. При дистальных формах заболевания течение обычно лёгкое, поэтому больные могут лечиться в амбулаторных условиях. Тотальное или левостороннее поражение чаще имеет тяжёлое течение, поэтому требует госпитализации и лечения в условиях стационара.
Диета
Назначаются диеты № 4, 4Б, 4В по Певзнеру. Цель диеты — уменьшить воспаление, бродильные и гнилостные процессы в кишечнике, нормализовать функции кишечника и других органов пищеварения. Блюда жидкие, полужидкие, протёртые, сваренные в воде или на пару. Исключены очень горячие и холодные блюда.
Разрешённые при язвенном колите продукты:
- сухари, супы слизистой консистенции, сваренные на обезжиренном мясном, рыбном бульоне или овощном отваре, с хорошо проваренными крупами, лапшой или вермишелью, допускается добавление фрикаделек;
- нежирное мясо и рыба;
- тщательно проваренные каши;
- фруктовые пюре;
- свежий протёртый творог;
- сахар в маленьких дозах;
- желе и кисели из черники, кизила, черемухи, айвы, груш;
- крепкий черный чай, можно с лимоном, отвар из шиповника, черной смородины, черники и черемухи;
- паровой омлет, яйца, сваренные вкрутую; сливочное масло.
Запрещенные при язвенном колите продукты:
- сдоба и кондитерские изделия;
- чёрный хлеб;
- мясные и рыбные жирные бульоны;
- колбасы, солёная и копчёная рыба, консервы;
- алкоголь;
- кофе;
- молоко;
- газированные сладкие напитки;
- свежие овощи и фрукты;
- перловая и пшеничная каши, бобовые.
Консервативная терапия
К консервативной терапии относятся:
- аминосалицилаты, препараты 5-аминосалициловой кислоты (5-АСК, месалазин);
- кортикостероиды;
- иммунодепрессанты;
- билогическая терапия.
Аминосалицилаты являются препаратами первой линии и применяются в первую очередь. Для купирования атаки язвенного колита обычно требуется 3-6 недель терапии по 1-2 г/кг в сутки. После этого проводится противорецидивное лечение сульфасалазином (3 г/сут) или месалазином (2 г/сут).
При дистальном поражении (проктит) отдаётся предпочтение формам препарата в виде свечей. При левостороннем поражении — препаратам в форме пены для ректального применения. При тотальном поражении используют таблетированные формы препаратов.
При лечении данными препаратами ремиссия достигается в 74-81 % случаев.
Наиболее выраженным и эффективным противовоспалительным средством являются глюкокортикоиды.
Основными показаниями для лечения глюкокортикоидами являются:
- острое течение тяжёлой и среднетяжёлой степени;
- тяжёлое или среднетяжёлое левостороннее и тотальное поражение при наличии III степени воспаления по данным эндоскопического исследования;
- неэффективность или недостаточная эффективность лечения аминосалицилатами при хроническом течении заболевания.
При остром тяжёлом течении назначают внутривенное введение глюкокортикоидов (преднизолона не менее 120 мг/сут) 4-6 раз в день. Обязательно проводится коррекция водно-электролитного баланса, переливание компонентов крови, гемосорбция. Через неделю после внутривенного введения переходят на приём преднизолона внутрь. За это время проводится гастроскопия для исключения язвенной болезни желудка и двенадцатиперстной кишки.
При среднетяжёлой форме можно ограничиться пероральным приёмом преднизолона. Обычно преднизолон назначается в дозе 1,5-2 мг/кг массы тела в сутки. Максимальная доза 100 мг (у лиц пожилого возраста 60 мг).
Если отсутствуют побочные эффекты, то приём продолжают ещё 10-14 дней, затем снижают дозу на 10 мг каждые 10 дней. С 30-40 мг переходят на однократный приём преднизолона. С 30 мг дозу снижают по 5 мг в неделю. Обычно курс гормональной терапии составляет от 8 до 12 недель. Параллельно с гормонотерапией применяют аминосалицилаты до полной отмены гормонов.
При проктите применяются глюкокортикоиды ректально в микроклизмах. Обычно для этого используют гидрокортизон, применяют после дефекации 2 раза в день.
Побочные эффекты гормонотерапии:
- отёки;
- артериальная гипертензия;
- остеопороз;
- различные вегетативные расстройства;
- может способствовать развитию язвы желудка, а, как следствие, может возникнуть желудочно-кишечное кровотечение.
Современным глюкокортикоидом является буденофальк (содержащий будесонид). Суточная доза составляет 3 мг будесонида (1 капсула) 4-6 раз в сутки.
При лечении глюкокортикоидами может возникнуть гормональная зависимость или даже гормонорезистентность, которая формируется у 20-35 % больных тяжёлым язвенным колитом. Гормональная зависимость — это ответ организма на лечение глюкокортикоидами, при котором возобновляется воспалительный процесс после снижения дозировки.
При отсутствии эффекта от гормональной терапии назначают препараты, обладающие иммуносупрессивным действием, а также биологическую терапию. Основными из них являются 6-меркаптопурин и азатиоприн — это препараты первой линии. Они помогают уменьшить дозу гормонов и отменить их в 62-71 % случаев. Лечение обычно начинают вместе с гормонотерапией. Максимальная суточная доза — 150 мг. Незначительное количество побочных эффектов, по сравнению с глюкокортикоидами, позволяет применять препарат на протяжении многих лет.
Также существует аналогичный препарат — метотрексат, который применяется при непереносимости азатиоприна или для ускорения лечебного эффекта. Внутрь или внутримышечно по 30 мг в неделю. Эффект наступает через 2-4 недели
Если отсутствует эффект от азатиоприна и 6-меркаптопурина, применяют препараты второй линии — это инфликсимаб и циклоспорин А.
При отсутствии эффекта от второго введения инфликсимаба и 7-дневного курса циклоспорина А показано хирургическое лечение.
Противорецидивное лечение
После купирования острых воспалительных процессов, назначают противорецидивную терапию аминосалицилатами на срок до 6 месяцев. В случае успешного лечения и отсутствии клинических и эндоскопических признаков заболевания, терапию отменяют.
В случае нестабильного эффекта от противорецидивного лечения терапию продлевают дополнительно сроком на 6 месяцев.
При неэффективности монотерапии аминосалицилатами добовляют к лечению иммуносупрессоры (азатиоприн или 6-меркаптопурин) и гормоны.
Пациентам с язвенным колитом, получающих консервативную терапию, необходимо постоянное наблюдение врача, регулярное эндоскопическое исследование с биопсией.
Хирургическое лечение
По статистике хирургическое лечение показано больным в 11-22 % случаев. Единственным способом радикального хирургического лечения язвенного колита является колпроктэктомия, то есть удаление всей толстой кишки. Основными показаниями к хирургическому лечению являются:
- отсутствие эффекта от консервативного лечения;
- развитие осложнений язвенного колита (кровотечение, перфорация, рак, токсическая дилатация толстого кишечника).
Послеоперационные осложнения
Возникают у ослабленных пациентов на фоне тяжёлого течения заболевания:
- эвентрация (выпадение кишечника через дефект в брюшной стенке );
- несостоятельность швов кишечных стом;
- серозный перитонит (воспаление брюшины);
- полисерозит;
- абсцессы брюшной полости;
- пневмония.
Особенности лечения в зависимости от формы и течения
Левосторонний колит или проктит низкой активности: свечи и пена салофальк.
Колит умеренной активности или распространённый: салофальк в таблетках, глюкокортикоиды.
Тяжёлое течение: салофальк в таблетках, глюкокортикоиды, инфузионная терапия, препараты железа, переливание плазмы и эритроцитарной массы, колпроктэктомия (удаление всей толстой кишки с формированием постоянной илеостомы — отверстия в брюшной полости, к которому прикрепляют калоприёмник).
Фульминантный колит: лечение такое же как и при тяжёлом течении.
При несвоевременном хирургическом лечении в послеоперационном периоде присоединяются другие осложнения в 59-81 % случаев, а летальность составляет от 11 до 49 %. При хирургическом лечении до возникновения тяжёлых кишечных осложнений (перфорация, токсическая дилатация и т. д.) эти цифры снижаются до 8-12 % и 0,5-1,5 % соответственно.
Таким образом, правильная диагностика, рациональная консервативная терапия и своевременное хирургическое лечение помогают добиться хороших результатов. В таком случае прогноз благоприятный. Но, в связи с длительным периодом нетрудоспособности, многие пациенты нуждаются в медико-социальной экспертизе и оформлении инвалидности.
Язвенный колит (2021)
Опубликовано 21/07/2020 в категории «Клинические рекомендации».
Содержание
- Министерство здравоохранения Российской Федерации Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: К51 Год утверждения (частота пересмотра): 202…
- Список сокращений
- Термины и определения
- 1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
-
- 1.1 Определение заболевания или состояния (группы заболеваний или состояний)
- 1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
- 1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
- 1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
- 1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
- 1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
- 2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
-
- 2.1 Жалобы и анамнез
- 2.2 Физикальное обследование
- 2.3 Лабораторные диагностические исследования
- 2.4 Инструментальные диагностические исследования
- 2.5 Иные диагностические исследования
- 3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
-
- 3.1. Консервативное лечение
-
- 3.1.1 Диетотерапия
- 3.1.2 Медикаментозная терапия
-
- 3.1.2.1 Терапия пероральными и ректальными препаратами аминосалициловой кислоты и аналогичными препаратами (5-АСК))
- 3.1.2.2 Кортикостероиды системного действия
- 3.1.2.3 Адьювантная терапия
- 3.1.2.4 Иммунодепрессанты и антиметаболиты (азатиоприн**, #меркаптопурин** и #циклоспорин**, такролимус**)
- 3.1.2.5 Инфликсимаб**, адалимумаб**, #голимумаб**, #ведолизумаб** (Ингибиторы фактора некроза опухоли альфа (ФНО-альфа) и селективные иммунодепрессанты)
-
- 3.1.2.5.1 Немедицинское переключение
- 3.1.2.6 Консервативная терапия кишечного кровотечения
- 3.1.2.7 Консервативная терапия токсического мегаколона
- 3.1.2.8 Консервативная терапия тяжелой/сверхтяжелой атаки ЯК
- 3.2 Хирургическое лечение
-
- 3.2.1. Хирургическое лечение при ургентных хирургических осложнениях
-
- 3.2.1.1. Хирургическое лечение при кишечном кровотечении
- 3.2.1.2 Хирургическое лечение при перфорации толстой кишки
- 3.2.1.3. Хирургическое лечение при развитии токсической дилатации ободочной кишки (токсический мегаколон).
- 3.2.2 Хирургическое лечение при неэффективности консервативной терапии ЯК (Плановое хирургическое лечение)
- 3.2.4 Терапия осложнений колэктомии (осложнения после реконструктивных операций)
- 4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- 5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
- 5.1. Профилактика
- 5.2. Диспансерное наблюдение
- 6. Организация оказания медицинской помощи
- 7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- Критерии оценки качества медицинской помощи
-
- Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Приложение А2. Методология разработки клинических рекомендаций
- Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препар…
- Приложение Б. Алгоритмы действий врача
- Приложение В. Информация для пациента
- Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
-
- Приложение Г1. Педиатрический индекс активности язвенного колита
- Приложение Г2. Эндоскопический индекс активности язвенного колита (UCEIS ) 42
- Приложение Г3. Эндоскопический индекс активности язвенного колита Mayo ES (с оценкой состояния слизистой оболочки по Schroeder) 43
- Приложение Г4. Основные заболевания, с которыми следует проводить дифференциальную диагностику ЯК у детей
- Приложение Г5. Алгоритм диагностики и лечения детей с ЯК
- Приложение Г6 Расшифровка примечаний
- Список литературы
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Язвенный колит (ЯК) – хроническое рецидивирующее воспалительное заболевание толстой кишки с распространением поражения непрерывно от прямой кишки в проксимальном направлении.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология воспалительных заболеваний кишечника (ВЗК), в том числе ЯК, не установлена: заболевание развивается в результате сочетания нескольких факторов, включающих генетическую предрасположенность, дефекты врожденного и приобретенного иммунитета, кишечную микрофлору и различные факторы окружающей среды. Генетический фон предрасполагает к изменениям врожденного иммунного ответа, аутофагии, механизмов распознавания микроорганизмов, эндоплазматического ретикулоцитарного стресса, функций эпителиального барьера и адаптивного иммунного ответа. Ключевым дефектом иммунитета, приводящим к развитию ВЗК, является нарушение распознавания бактериальных молекулярных маркеров дендритными клетками, что приводит к гиперактивации сигнальных провоспалительных путей. Также при ВЗК отмечается снижение разнообразия кишечной микробиоты за счет снижения доли анаэробных бактерий, преимущественно Bacteroidetes и Firmicutes и увеличение агрессивных типов (Proteobacteria, Fusobacteria). При наличии указанных микробиологических и иммунологических изменений ВЗК под действием пусковых факторов, к которым относят курение, нервный стресс, дефицит витамина D, антибиотикотерапия, питание с пониженным содержанием пищевых волокон и повышенным содержанием животного белка, развиваются кишечные инфекции, особенно инфекция C.difficile 2.
Результатом взаимного влияния данных факторов риска является активация Th2-клеток, гиперэкспрессия провоспалительных цитокинов, в первую очередь, фактора некроза опухоли-альфа и молекул клеточной адгезии. Недостаточность иммунной регуляции приводит к неконтролируемым ответам на повреждение ткани и развитию локального воспаления. Результатом этих реакций становится лимфоплазмоцитарная инфильтрация слизистой оболочки толстой кишки с развитием характерных макроскопических изменений и симптомов ЯК.
При ЯК поражается только толстая кишка (за исключением ретроградного илеита), в процесс обязательно вовлекается прямая кишка, воспаление чаще всего ограничивается слизистой оболочкой (за исключением острого тяжелого колита) и носит диффузный характер.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Заболеваемость ЯК у детей колеблется от 1 до 4 случаев на 100 000 жителей в Северной Америке и Европе 3, 4, 5, что составляет приблизительно 15-20% от больных ЯК всех возрастов. Данные о распространенности ЯК в Российской Федерации ограничены. Распространенность ЯК выше в северных широтах и на Западе. Заболеваемость и распространенность ЯК в Азии ниже, однако, увеличивается. Европеоиды страдают заболеванием чаще, чем представители негроидной и монголоидной рас. Пик заболеваемости отмечается между 20 и 30 годами жизни, а второй пик заболеваемости описан в возрасте 60-70 лет. Заболеваемость приблизительно одинакова у мужчин и женщин.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
К51.0 – Язвенный (хронический) энтероколит
К51.1 – Язвенный (хронический) илеоколит
К51.2 – Язвенный (хронический) проктит
К51.3 – Язвенный (хронический) ректосигмоидит
K51.4 – Псевдополипоз ободочной кишки
K51.5 – Мукозный проктоколит
K51.8 – Другие язвенные колиты
K51.9 – Язвенный колит неуточненный
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Для классификации ЯК по локализации поражения и фенотипическим вариантам течения заболевания рекомендуется использовать международную классификацию, принятую в 2010 г. в Париже (табл.1 6) и обновленные Порто-критерии ESPGHAN 7.
Таблица 1. Парижская классификация язвенного колита 6.
Сейчас выделяют также ВЗК с очень ранним началом (ОРН ВЗК) – до 6 лет, а также младенческие ВЗК – с началом в первые 2 года жизни 2, 8.
По характеру течения выделяют:
-
Острое течение (менее 6 месяцев от дебюта заболевания);
-
Хроническое непрерывное течение (отсутствие более чем 6-месячных периодов ремиссии на фоне адекватной терапии);
-
Хроническое рецидивирующее течение (наличие более чем 6-месячных периодовремиссии).
В зависимости от ответа на гормональную терапию выделяют:
-
стероидорезистентность (сохранение активности заболевания несмотря на пероральный прием адекватной дозы кортикостероидов системного действия в течение 7-14 дней).
-
стероидозависимость (определяется при достижении клинической ремиссии на фоне терапии кортикостероидами системного действия и возобновлении симптомов при снижении дозы или в течение 3 месяцев после полной отмены, а также в случаях, если терапию кортикостероидами системного действия не удается прекратить в течение 14-16 недель).
Для определения тяжести текущего обострения (атаки) используют педиатрический индекс активности ЯК Pediatric Ulcerative Colitis Activity Index (PUCAI). Выделяют легкую, среднетяжелую и тяжелую атаки ЯК (Приложение Г1) 9.
Фазы течения заболевания:
Клиническая ремиссия – отсутствие клинических симптомов заболевания и воспалительной активности по результатам лабораторных исследований крови (PUCAI <10 баллов).
Клинико-эндоскопическая (или полная) ремиссия – наличие клинической ремиссии и полное заживление слизистой оболочки по данным эндоскопии.
Обострение
Появление типичных симптомов заболевания у больных ЯК в стадии клинической ремиссии, спонтанной или медикаментозно поддерживаемой.
Фенотип заболевания и риск колэктомии определяются: протяженностью и топографией воспалительных изменений, тяжестью текущего обострения, наличием тяжелой атаки в анамнезе, развитием гормональной зависимости, резистентностью к лечению, наличием внекишечных проявлений и осложнений 10, 11, 12, 13.
Согласно обновленным Порто-критериям ESPGHAN 7, ЯК у детей может быть представлен типичным и атипичным фенотипами.
Типичный фенотип характеризуется непрерывным хроническим активным воспалением без гранулем, которое начинается в прямой кишке и может распространяться в проксимальном направлении до слепой кишки, не поражая тонкую кишку. В случае тотального колита (E4) с вовлечением в воспалительный процесс слепой кишки в структуре типичного ЯК может иметь место возвратный илеит (эритема и отек в дистальной части подвздошной кишки в отсутствии афт, эрозий и язв).
Атипичный ЯК может быть представлен 5 вариантами:
-
типичное поражение проксимальных отделов толстой кишки при отсутствии воспалительных изменений в прямой кишке;
-
воспалительные изменения могут быть фокальными при отсутствии морфологических признаков хронического воспаления (у детей с недавним дебютом симптомов);
-
левосторонний ЯК со скачкообразным поражением слепой кишки;
-
наличие диффузного или фокального гастрита (без линейных и серпигинозных язв);
-
тяжелый колит с трансмуральным воспалением или глубокими язвами 7.
Особым фенотипом является неклассифицированное ВЗК. Диагноз ставят в том случае, если при изолированном поражении толстой кишки на основании результатов обследования не представляется возможным дифференцировать ЯК и болезнь Крона 7, 14.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Кишечные проявления болезни:
-
хроническая (≥4 недель) или рецидивирующая (≥2 эпизодов в течение 6 месяцев) диарея с кровью, преимущественно в ночное время (65 % случаев);
-
кровь в стуле;
-
тенезмы, иногда в сочетании с запором (при дистальном поражении), не более, чем у 15% больных, только при остром начале у 86% детей ночной стул);
-
боли в животе спастического характера;
-
лихорадка.
-
общая слабость;
-
потеря массы тела;
-
задержка роста и/или пубертатного развития;
-
внекишечные симптомы (поражение кожи, слизистых, суставов, глаз, первичный склерозирующий холангит и др.);
Внекишечные проявления болезни (ВКП)
ВКП наблюдаются у 30% педиатрических пациентов с ЯК. При ВЗК возможны поражения любых органов, но наиболее часто встречаются поражения суставов, печени, глаз и кожи. Некоторые из ВКП четко связаны с активностью заболевания кишечника (узловатая эритема, периферические артриты), в то время как другие происходят независимо друг от друга (гангренозная пиодермия, увеит, анкилозирующий спондилит и первичный склерозирующий холангит (ПСХ) 15. Данные 2-х детских реестров в США 16, 17 и Европе 15 показывают, что >1 ВКП присутствуют на момент постановки диагноза у 6% — 17% педиатрических пациентов с ЯК, особенно у детей в возрасте старше 5 лет, с ростом почти на 50% с эволюцией болезни 18, 19, 20, 21. ВКП более вероятны у больных с распространенным колитом 17.
Первичный склерозирующий холангит (ПСХ) в 3 раза чаще встречаются при ЯК, чем при БК 17, и ассоциируется с детьми более старшего возраста 17. ПСХ может предшествовать появлению симптомов ВЗК на много лет, но может также развиваться у больных с ЯК после колэктомии. Кумулятивная частота ПСХ при ВЗК у детей увеличивается на 1,6% в течение 10 лет после установления диагноза 16. Хотя внекишечные проявления язвенного колита, как правило, связаны с более тяжелым течением заболевания, это не верно для ПСХ 17. В связи с тем, что ЭРХПГ трудно выполнить, особенно маленьким детям, магнито-резонансная РХПГ может показать характерную картину нерегулярных желчных протоков, с зонами сужения и дилатации 22. ПСХ может прогрессировать в цирроз печени, и, в конечном счете, потребовать пересадки печени. У пациентов с ПСХ и ЯК имеется больший риск развития злокачественных опухолей, таких как колоректальный рак и холангиокарцинома (8%-30% пациентов с ЯК и длительным течением ПСХ) 23, 24. Пациенты, у которых диагноз ПСХ был установлен в детском возрасте, могут иметь более тяжелое течение болезни 24. Сообщается, что у взрослых с ПСХ, урсодезоксихолевая кислота** улучшает нарушенные функциональные пробы печени 25 и может улучшить исход. Исследования по лечению ПСХ у детей отсутствуют. Магнитно-резонансная холангиография является исследованием первой линии для ПСХ у детей, но интерпретация у маленьких детей может быть затруднена.
Кишечные осложнения ЯК включают кишечное кровотечение, токсическую дилатацию и перфорацию толстой кишки, а также колоректальный рак.
Токсическая дилатация ободочной кишки (токсический мегаколон) является редким осложнением у детей и представляет собой не связанное с обструкцией расширение кишки (диаметр поперечно-ободочной кишки у подростков и взрослых — более 60мм, у детей младше 10 лет — более 40мм, старше 11 лет — более 55мм) на фоне симптомов интоксикации. К факторам риска развития токсической дилатации относятся гипокалиемия, гипомагниемия, прием противодиарейных, кишечных противовоспалительных и противомикробных препаратов (лоперамид**) и антихолинергических средств, опиоидов и антидепрессантов, а также цитомегаловирусная и клостридиальная инфекция 3, 8. О развитии токсической дилатации свидетельствует внезапное сокращение частоты стула на фоне имевшейся диареи, вздутие живота, а также внезапное уменьшение или исчезновение болевого синдрома и нарастание симптомов интоксикации (включая тахикардию и снижение артериального давления).
В клинической практике может встречаться так называемая «сверхтяжелая или крайне тяжелая атака» ЯК («острый тяжелый колит» в англоязычной литературе), характеризующаяся диареей более 10-15 раз в сутки, прогрессирующим снижением уровня гемоглобина, лихорадкой выше 38°С, тяжелой гипопротеинемией и электролитными сдвигами, высоким уровнем СРБ. Подходы к лечению такого колита отличаются от обычных.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз ЯК у детей должен устанавливаться на основании сочетания данных анамнеза, физикального осмотра и илеоколоноскопии с множественной биопсией.
Единого критерия для постановки диагноза ЯК не существует. Как правило, диагноз ЯК следует подозревать у ребенка с хронической (≥4 недель) или повторяющейся (≥2 эпизодов в течение 6 мес) диареей с кровью, тенезмами, болями в животе после исключения инфекционных и других причин, а в тяжелых случаях – с потерей массы тела, общей слабостью и рвотой. Особенно настораживающими данными в отношении ВЗК у ребенка являются сопутствующая задержка роста и/или пубертатного развития, наличие ВЗК в семье, повышение маркеров воспаления или наличие анемии.
Язвенный колит, дебютирующий в детском возрасте, оказывается тотальным в 60-80% всех случаев, то есть в два раза чаще, чем у взрослых 26. Поскольку доказано, что протяженность поражения коррелирует с большей активностью заболевания, в детском возрасте при первой атаке течение болезни становится более тяжелым, приводя к колэктомии у 30-40% детей в течение 10 лет, по сравнению с 20% у взрослых 26, 27.
Кроме того, при лечении детей приходится учитывать возрастные особенности, такие как рост, половое развитие, питание и прирост минеральной плотности костной ткани (МПК) в подростковом возрасте, возрастные ограничения к применению препаратов, а также особенности психосоциального поведения и развития 28, 29, 30.
Для формулирования диагноза и определения тактики лечения следует определять тяжесть текущего обострения (атаки), для чего применяют педиатрический индекс активности ЯК (PUCAI) (Приложение Г1). Выделяют легкую, среднетяжелую и тяжелую атаки ЯК 9.
2.1 Жалобы и анамнез
При сборе жалоб и анамнеза следует оценить типичные клинические симптомы болезни: частота и характер стула, боли в животе, примеси крови в стуле (см. клиническую картину).
2.2 Физикальное обследование
При физикальном осмотре могут быть обнаружены различные проявления ЯК, включая лихорадку, периферические отеки, дефицит питания, отставание в росте и половом развитии, наличие признаков перфорации или токсической дилатации толстой кишки, а также внекишечных проявлений.
При проведении физикального обследования следует провести осмотр перианальной области, пальцевое исследование прямой кишки (Трансректальное пальцевое исследование) 29, 30, 31.
Для уточнения локализации и объема поражения следует обратить внимание на следующую симптоматику:
- О наличии проктита, проктосигмоидита свидетельствуют:
-
стул ежедневный 1-2 раза в день, может быть нормальным оформленным или спастического характера, кровь располагается на каловых массах в виде ректального «плевка» или мазка, учащение ночных дефекаций, частые тенезмы;
-
боли в животе локализуются в левой половине живота, предшествуют акту дефекации
-
дефицит массы тела развивается редко.
- О наличии левостороннего колита, тотального колита свидетельствуют:
-
стул учащенный до 20-50 раз в сутки, примесь крови в большом количестве и перемешана с каловыми массами;
-
боли в животе локализуются по всему животу, предшествуют акту дефекации;
-
ночные позывы;
-
дефицит массы тела 29, 30, 31.
2.3 Лабораторные диагностические исследования
- Всем пациентам при первичной диагностике и далее при динамическом наблюдении рекомендовано проводить общий (клинический) анализ крови развернутый (гематокрит, скорость оседания эритроцитов (СОЭ)) с целью оценки воспалительной реакции, выявления анемии и/или контроля терапии 29, 30, 32, 33. (УУР – С УДД – 5)
Комментарии: По клиническому анализу крови могут быть диагностированы анемия (железодефицитная, анемии хронического заболевания), лейкоцитоз (на фоне хронического воспаления или на фоне стероидной терапии), тромбоцитоз.
Частота контроля исследований в динамическом наблюдении зависит от клинической необходимости, в среднем, не реже 1 раза в год, по показаниям – чаще (при иммуносупрессивной терапии – в среднем, каждые 3 месяца, при терапии тиопуринами (аналогами пурина) – каждые 1-2 нед. в первый месяц лечения, затем ежемесячно до 3 месяца терапии, далее – каждые 3 месяца)
- Рекомендовано всем пациентам при первичной диагностике и далее при динамическом наблюдении исследование уровня С-реактивного белка в сыворотке крови, анализ крови биохимический общетерапевтический (общий белок, альбумин, печеночные пробы (определение активности аланинаминотрансферазы, аспартатаминотрансферазы, гамма-глютамилтрансферазы, щелочной фосфатазы), электролиты (натрий, калий, хлор)), с целью оценки воспалительной реакции, определения наличия электролитных нарушений 29, 30, 32, 33. (УУР – С УДД – 5 )
Комментарии: Лабораторные проявления ЯК носят неспецифический характер. Биохимический анализ крови общетерапевтический позволяет выявить электролитные нарушения, гипопротеинемию (в частности, гипоальбуминемию), а также повышение щелочной фосфатазы, что является возможным проявлением ассоциированного с ЯК первичного склерозирующего холангита.
Уровень маркеров воспаления у детей с активным колитом может быть нормальным, особенно при слабой активности заболевания
Частота контроля исследований в динамическом наблюдении зависит от клинической необходимости, в среднем, не реже 1-2 раза в год, по показаниям – чаще (на фоне иммуносупрессивной терапии, в среднем, каждые 3 месяца).
- Рекомендуется исследование коагулограммы (ориентировочное исследование системы гемостаза) (исследование уровня фибриногена в крови) при первичной диагностике и далее в динамическом наблюдении для оценки риска нарушений коагуляции и в комплексной оценке активности воспаления 34. (УУР – С УДД – 5)
Комментарий: Частота контроля исследований в динамическом наблюдении зависит от клинической необходимости, в среднем, не реже 1-2 раза в год
- Всем пациентам с ЯК рекомендуется оценить обмен железа (Исследование уровня железа сыворотки крови, Исследование уровня трансферрина сыворотки крови, Исследование уровня ферритина в крови) с целью оценки воспалительной реакции, дефицита железа 35. (УУР – С УДД – 5)
Комментарий: исследование проводится при диагностике и далее в процессе динамического наблюдения по необходимости в зависимости от тяжести течения заболевания и клинических проявлений.
- Пациентам с подозрением на ЯК в сомнительных случаях рекомендовано использовать серологические маркеры (антинейтрофильные цитоплазматические антитела) (Определение маркеров ANCA-ассоциированных васкулитов: PR3 (c-ANCA), МПО (p-ANCA)) для дифференциальной диагностики между ЯК, БК и другими заболеваниями. 30, 31 (УУР – С УДД – 5 )
Комментарии: отсутствие серологических маркеров, особенно у детей раннего возраста, не является основанием для исключения или пересмотра диагноза ЯК.
Серологические маркеры используются в качестве дополнительного метода дифференциальной диагностики в сомнительных случаях.
- При остром течении ЯК (первой атаке заболевания) рекомендовано выполнить бактериологическое и микроскопическое исследование кала (Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудителя дизентерии (Shigella spp.), Микробиологическое (культуральное) исследование фекалий на возбудители брюшного тифа и паратифов (Salmonella typhi), Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудитель иерсиниоза (Yersinia enterocolitica), Микробиологическое (культуральное) исследование фекалий/ректального мазка на патогенные кампилобактерии (Campylobacter jejuni/coli) с определением чувствительности к антибактериальным препаратам, ), Микроскопическое исследование кала на яйца и личинки гельминтов, Микроскопическое исследование кала на гельминты с применением методов обогащения, Микроскопическое исследование кала на простейшие (Strongyloides, Trichuris trichiura (власоглав)) (Amoeba (по эпид. показаниям)), Микроскопическое исследование кала на простейшие с применением методов обогащения, Исследование биологических объектов, обнаруженных в фекалиях, с целью определения их биологического вида) для исключения острой кишечной инфекции. Как при дебюте заболевания, так и при обострениях, рекомендуется исследование кала на наличие токсина клостридии диффициле (Clostridium difficile), Иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile). Наиболее высокой чувствительностью и специфичностью обладает ПЦР (особенно, при недавно проведенном курсе антибиотикотерапии или пребывании в стационаре). Данное исследование также рекомендуется выполнять при тяжелом течении и развитии резистентности к проводимой терапии 32, 33, 36. (УУР – С УДД – 5)
Комментарии: Препаратом выбора для лечения колита, ассоциированного с C.difficile при язвенном колите является ванкомицин** (перорально) 32.
Лечение колита, вызванного другими возбудителями, проводят согласно соответствующим клиническим рекомендациям.
- Рекомендовано проведение исследования уровня кальпротектина в кале всем пациентам с подозрением на ЯК с целью дифференциальной диагностики колита с диареей невоспалительной природы и далее регулярно в динамическом наблюдении с целью неинвазивного динамического контроля воспаления. 30, 31, 32, 33. (УУР – С УДД – 5)
Комментарии: На момент дебюта концентрация маркеров воспаления оказывается выше при БК, чем при ЯК 37, 38. При впервые выявленном ЯК у 54% пациентов с легкой атакой результаты анализа 4 наиболее часто используемых маркеров (гемоглобина, альбумина, тромбоцитов и СОЭ) могут находиться в пределах нормы, в то время как при легкой атаке БК доля нормальных результатов составляет 21% 37. В международном консенсусе 2018 года по язвенному колиту у детей фекальному кальпротектину придается большее значение, чем в более ранних документах. При повышении уровня кальпротектина в кале (фекального кальпротектина) более чем в 5 раз (212 мг/г либо выше, в зависимости от возраста) ребенок должен быть направлен в гастроэнтерологическое отделение для углубленного обследования 39, 40.
Для повышения чувствительности фекального кальпротектина в мониторинге активности заболевания, рекомендовано также дополнительно определение СРБ и клинического индекса активности ЯК PUCAI 41.
- Пациентам с ЯК в активной фазе заболевания и при терапии кортикостероидами системного действия необходимо исследование уровня общего кальция, исследование уровня ионизированного кальция в крови и витамина D (Исследование уровня 25-ОН витамина Д в крови) с целью профилактики остеопороза и своевременной диагностики недостаточности витамина D и кальция 35. (УУР – С УДД – 5)
Комментарий: диагностика, динамическое наблюдение и терапия остеопороза осуществляется в соответствии с соответствующими клиническими рекомендациями
2.4 Инструментальные диагностические исследования
Диагностика ЯК преимущественно основана на инструментальных методах исследования. Для подтверждения диагноза необходимы следующие мероприятия.
- Рекомендовано проведение колоноскопии с илеоскопией. Данные исследования являются обязательной процедурой для установления диагноза ЯК, а также для решения вопроса о колэктомии. Для интерпретации результатов исследования применяются эндоскопический индекс активности язвенного колита (UCEIS) (Приложение Г2) 42 и эндоскопический индекс активности язвенного колита Mayo ES (с оценкой состояния слизистой оболочки по Schroeder) (Приложение Г3) 43. Визуализация тонкой кишки рекомендована для исключения болезни Крона (БК), особенно у пациентов с нетипичной клинической симптоматикой 29, 30, 31, 32, 33. (УУР – С УДД – 5)
Комментарии: эндоскопическое исследование толстой кишки является основным методом диагностики ЯК, однако, специфичные эндоскопические признаки отсутствуют. Наиболее характерными являются непрерывное воспаление, ограниченное слизистой оболочкой, начинающееся в прямой кишке и распространяющееся проксимальнее, с четкой границей воспаления. Эндоскопическую активность ЯК наилучшим образом отражают наличие или отсутствие эрозий и язв, контактная ранимость (выделение крови при контакте с эндоскопом), отсутствие сосудистого рисунка.
Эндоскопическую оценку следует проводить для постановки диагноза, при существенных изменениях схемы лечения и затруднениях в оценке клинических симптомов. Эндоскопическое исследование у детей не следует проводить рутинно при нетяжелых обострениях или в период ремиссии, при отсутствии подозрений на развитие колоректального рака 44.
У пациентов с острым тяжелым колитом, диагностическая сигмоидоскопия может использоваться в качестве первого исследования для оценки состояния, однако, в дальнейшем следует провести контрольную колоноскопию.
- Рекомендовано пациентам с подозрением на ЯК проведение эзофагогастродуоденоскопии и илеоскопии с колоноскопией (илеококолоноскопией) для проведения дифференциальной диагностики с болезнью Крона 30, 45, 46. (УУР – С УДД –5)
Комментарий: Поскольку различные обнаруживаемые проявления в отдельности могут не соответствовать ЯК, при диагностике ВЗК у детей важно выполнить полную илеоколоноскопию и эндоскопическое исследование верхних отделов ЖКТ (эзофагогастродуоденоскопии) с серийной биопсией.
-
Рекомендовано проводить ректосигмоидоскопию при левостороннем колите для контроля эффективности проводимой терапии 30, 31. (УУР – С; УДД – 5)
-
Пациентам рекомендуется выполнение биопсии толстой кишки:
-
при первичной постановке диагноза;
-
при сомнениях в правильности ранее выставленного диагноза
-
при длительном анамнезе язвенного колита (более 7-10 лет) для исключения дисплазии эпителия 28, 30, 47. (УУР – С; УДД – 5)
-
Рекомендовано при проведении биопсии (Биопсия тонкой кишки эндоскопическая, Биопсия ободочной кишки эндоскопическая, Биопсия сигмовидной кишки с помощью видеоэндоскопических технологий, Биопсия прямой кишки с помощью видеоэндоскопических технологий) при постановке диагноза язвенного колита взятие биоптатов слизистой оболочки прямой кишки и не менее чем из 4 других участков толстой кишки, а также слизистой оболочки подвздошной кишки с гистологическим исследованием биоптатов (Патолого-анатомическое исследование биопсийного (операционного) материала тонкой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала толстой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки) 7, 31 (УУР – C; УДД – 5)
Комментарии:
Биоптаты нужно брать, как из измененных, так и из эндоскопически не измененных участков, размещая биоптаты в отдельные контейнеры с соответствующей маркировкой 48.
Гистологическая диагностика язвенного колита состоит из следующих этапов 45, 49, 50:
-
Подтверждение наличия воспалительного заболевания кишечника: выявление признаков хронического воспаления (базальный плазмоцитоз и нарушение архитектоники (разветвленность и разнонаправленность крипт, появление крипт разного диаметра, диффузная атрофия крипт), наличие клеток Панета в левых отделах толстой кишки).
-
Дифференциальный диагноз с болезнью Крона: для язвенного колита характерно наличие однотипных изменений в биоптатах, взятых из разных участков толстой кишки с эндоскопическими признаками воспаления, неровная поверхность слизистой, уменьшение числа бокаловидных клеток и муцина, отсутствие гранулем.
-
Оценка активности воспаления: наличие криптитов (внедрение нейтрофилов в эпителий крипт) и крипт-абсцессов (скопление нейтрофилов в просвете крипт). Для острых инфекционных колитов характерно наличие активности воспаления при отсутствии признаков хронического воспаления.
Согласно клиническим рекомендациям при ЯК для взрослых — при длительном анамнезе ЯК (более 7-10 лет) – хромоэндоскопия с прицельной биопсией или ступенчатая биопсия (из каждого отдела толстой кишки) для исключения дисплазии эпителия.
32.
- Рекомендовано провести ректосигмоидоскопию с гистологическим, иммуногистохимическим и/или молекулярно-биологическим исследованием биоптата слизистой оболочки (Патолого-анатомическое исследование биопсийного (операционного) материала толстой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки) для исключения/ подтверждения цитомегаловирусной этиологии колита детям, не отвечающим на терапию внутривенными кортикостероидами системного действия в течение 3 дней и при обострении язвенного колита 32. (УУР – C; УДД – 5)
Комментарии: исследование биоптата проводится с помощью окраски гематоксилин-эозином (Патолого-анатомическое исследование биопсийного (операционного) материала толстой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки, ), иммуногистохимического исследования (Патолого-анатомическое исследование биопсийного (операционного) материала толстой кишки с применением иммуногистохимических методов, Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки с применением иммуногистохимических методов).
Положительный результат ПЦР-тестирования (Определение ДНК цитомегаловируса (Cytomegalovirus) в биоптатах и пунктатах из очагов поражения органов и тканей методом ПЦР, качественное исследование, Определение ДНК цитомегаловируса (Cytomegalovirus) в биоптатах и пунктатах из очагов поражения органов и тканей методом ПЦР, количественное исследование) в отсутствие включений или позитивного мазка не является информативным.
- Рекомендовано при длительном анамнезе ЯК (более 7-10 лет) проведение хромоэндоскопии с прицельной биопсией или ступенчатой биопсии (из каждого отдела толстой кишки) для исключения дисплазии эпителия 7, 51. (УУР – С; УДД – 5 )
Комментарий: интактность прямой кишки (ректальный спаринг), очаговые макроскопические изменения, а также нормальная или минимально измененная архитектоника крипт на момент дебюта заболевания чаще встречается у детей младшего возраста 52, 53. Подобные особенности характерны для детей в возрасте 10 лет и младше 54. Легкий неэрозивный илеит при наличии тяжелого панколита может быть следствием ретроградного илеита, ассоциированного с ЯК, и микроскопически может проявляться атрофией ворсинок, повышением содержания мононуклеарных клеток и несгруппированными крипт-абсцессами 55. У 1 из 13 пациентов с колитом, диагноз БК может быть установлен на основании изменений, найденных при эндоскопии верхних отделов ЖКТ 53.
-
При обнаружении стойкого сужения кишки на фоне ЯК рекомендовано обязательно исключить колоректальный рак с целью своевременной его диагностики и старта терапии 51, 56. (УУР – С; УДД – 5)
-
Рекомендовано проведение ультразвукового исследования органов брюшной полости, забрюшинного пространства, малого таза с целью уточнения диагноза, скринига на наличие свищей и/или абсцессов, при постановке диагноза и далее при динамическом наблюдении 30, 31, 47. (УУР – С; УДД – 5)
-
Рекомендовано проведение обзорной рентгенографии органов брюшной полости (при тяжелой атаке) для исключения токсической дилатации и перфорации толстой кишки 31. (УУР — С УДД — 5)
Комментарии:
Критерии, при наличии которых может предполагаться токсический мегаколон 57:
А) Диаметр поперечно-ободочной кишки более 40 мм у детей младше 10 лет и более 56 мм у детей старше 10 лет (по данным обзорной рентгенографии) +
Б) симптомы интоксикации (температура тела >38,8 С, тахикардия (ЧСС>2 стандартных отклонений по возрасту), обезвоживание, электролитные расстройства, нарушение сознания или кома, гипотония или шок
-
При необходимости дифференциальной диагностики или при невозможности проведения полноценной интестиноскопии и колоноскопи (илеоколоноскопии) рекомендовано проведение уточняющих методов визуализации:
-
Магнитно-резонансная томография тонкой кишки с контрастированием, Магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием (предпочтительно) или
-
Компьютерная томография тонкой кишки с контрастированием, Компьютерная томография толстой кишки с двойным контрастированием, Компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием 30, 31, 47.
(УУР – С; УДД – 5)
Комментарий: по показаниям проводится наркоз
- При невозможности выполнения МРТ (Магнитно-резонансная томография тонкой кишки с контрастированием) или КТ (Компьютерная томография тонкой кишки с контрастированием) рекомендовано проведение ирригоскопии с двойным контрастированием (для оценки протяженности поражения в толстой кишке, уточнения наличия образований, стриктур и др.) 58. (УУР – В; УДД – 2)
2.5 Иные диагностические исследования
- При неясности клинической картины рекомендовано рассмотреть возможность проведения дополнительных исследований 30, 31, 47. (УУР – С; УДД – 5)
Комментарии: в зависимости от клинической картины и лабораторно-инструментальных данных могут проводиться:
-
Трансабдоминальное ультразвуковое сканирование тонкой и ободочной кишки с целью выявления изменений со стороны тонкой кишки;
-
Ультразвуковое исследование прямой кишки трансректальное с целью оценки активности процесса и обнаружения/исключения параректальных абсцессов;
-
Эзофагогастродуоденоскопия с целью выявления изменений верхних отделов пищеварительного тракта;
-
Видеокапсульная эндоскопия (Тонкокишечная эндоскопия видеокапсульная, Толстокишечная эндоскопия видеокапсульная) (при отсутствии стриктур кишечника) и/или одно- или двухбаллонная энтероскопия с целью постановки альтернативного диагноза, если язвенный колит исключен или мало вероятен;
-
При сверхтяжелом ЯК, возникающем как первая атака или как рецидив заболевания на фоне поддерживающей терапии, рекомендовано проведение следующих диагностических мероприятий: обзорной рентгенографии брюшной полости (для исключения токсической дилатации или перфорации толстой кишки); эндоскопического исследования дистального отдела толстой кишки (Ректосигмоидоскопия (при отсутствии стриктур кишечника)) (с целью оценки объема необходимого консервативного лечения). 31, 46. (УУР – С; УДД – 5)
Комментарии: понятие «сверхтяжелая или крайне тяжелая атака» ЯК см.в разделе «Клиническая картина»
Дополнительные инструментальные и лабораторные исследования выполняются преимущественно с целью проведения дифференциальной диагностики с рядом заболеваний. Это инфекционные, сосудистые, медикаментозные, токсические и радиационные поражения, а также дивертикулит и др. На следующем этапе дифференциальной диагностики проводится верификация клинических диагнозов ЯК и БК, относящихся к группе ВЗК. Таким образом, дифференциальный диагноз ЯК проводится с болезнью Крона толстой кишки, острыми кишечными инфекциями (дизентерия, сальмонеллез, кампилобактериоз, иерсиниоз, амебиаз), паразитозами, антибиотикоассоциированными поражениями кишечника (псевдомембранозный колит, вызываемый C.difficile) 59, туберкулезом кишечника, системными васкулитами, раком толстой кишки, дивертикулитом, микроскопическими колитами (коллагеновым и лимфоцитарным) 60, радиационным проктитом. В приложении Г4 указаны основные заболевания, с которыми следует проводить дифференциальную диагностику ЯК у детей.
-
С целью дифференциальной диагностики и подбора терапии при внекишечных проявлениях ЯК и сопутствующих состояниях рекомендовано провести, при необходимости, консультации:
-
врача-психотерапевта (прием, осмотр, консультация врача-психотерапевта первичный) и/или медицинского психолога (прием (тестирование, консультация) медицинского психолога первичный) (невроз, планируемая операция с наличием стомы и т.п.);
-
прием врача-эндокринолога/врача детского эндокринолога первичный (стероидный сахарный диабет, надпочечниковая недостаточность у больных на длительной гормональной терапии);
-
прием врача-дерматовенеролога первичный (дифференциальный диагноз узловатой эритемы, пиодермии и т.п.);
-
прием врача-ревматолога первичный (артропатии и т.п.) 30, 31.
(УУР – С; УДД – 5)
- У детей младше 2 лет при клинических признаках ЯК рекомендовано рассмотреть проведение иммунологического исследования в целях исключения колита, связанного с первичным иммунодефицитом 30, 32, 33. (УУР – С; УДД – 5)
Комментарии: иммунологическое исследование включает исследование популяций лимфоцитов (фенотипирование лимфоцитов (Т, В, NK, NK-T клетки)), исследование уровня иммуноглобулинов A,M,G,E в крови,, а также, при необходимости, функциональные анализы ответа лимфоцитов на антигены/митогены и нейтрофилы, включая анализ на хроническую гранулематозную болезнь (ХГБ) (Определение активности системы пероксидаза-пероксид водорода нейтрофилов периферической крови, Тест восстановления нитросинего тетразолия (НСТ-тест)) и другие, в зависимости от клинической ситуации.
- При клинических признаках ЯК у детей младше 2 лет рекомендовано аллергологическое обследование для исключения/подтверждения колита аллергической этиологии. (УУР – С; УДД – 5)
Комментарии: Воспаление толстой кишки у детей до 2лет (особенно младше 1 года) может являться проявлением аллергического колита или иммунодефицита, даже если это единственный симптом. В данном случае для исключения/подтверждения диагноза аллергического колита ребенку следует провести аллергологическое обследование (Исследование уровня общего иммуноглобулина Е в крови, Исследование уровня антител к антигенам растительного, животного и химического происхождения в крови и/или диагностическая элиминационная диета (исключение определенных продуктов питания) 61. При развитии симптоматики в раннем детском возрасте, следует исключить классические или скрытые иммунодефицитные состояния 62, 63, 64.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Лечебные мероприятия при ЯК включают в себя назначение лекарственных препаратов, хирургическое лечение, психосоциальную поддержку и диетические рекомендации.
Выбор вида консервативного или хирургического лечения определяется тяжестью атаки, протяженностью поражения толстой кишки, наличием внекишечных проявлений, длительностью анамнеза, эффективностью и безопасностью ранее проводившейся терапии, а также риском развития осложнений ЯК 65, 66.
Целью терапии является достижение клинической, эндоскопической и (в идеале) гистологической ремиссии 50, 67. При достижении ремиссии неоперированный пациент должен оставаться на постоянной поддерживающей (противорецидивной) терапии.
3.1. Консервативное лечение
3.1.1 Диетотерапия
- Нутритивный статус и рост детей с ЯК рекомендуется регулярно оценивать; при необходимости рекомендовано применять нутритивную поддержку с целью поддержания адекватного нутритивного статуса 30. (УУР – С; УДД – 5)
Комментарий: частота оценки роста и веса детей с ЯК – проводится при каждом поступлении в стационар или при каждом амбулаторном приеме
-
Рекомендован у пациентов с ЯК прием обычной пищи, при невозможности – отдавать предпочтение энтеральному питанию (питательные смеси или жидкости). Парентеральное питание применять при полной невозможности энтерального питания 30, 35. (УУР – С; УДД – 5)
-
Специальная диета или пищевые добавки неэффективны и не рекомендованы к использованию для индукции и поддержания ремиссии при ЯК у детей, а в некоторых случаях могут способствовать дефициту питательных веществ 30. (УУР – С; УДД – 5)
-
Рекомендовано назначение препаратов витамина D и его аналогов и препаратов кальция (кальция глюконат**, кальция глицерофосфат или комбинированные препараты, например, кальция карбонат+колекальциферол) пациентам в активной фазе болезни и получающим глюкокортикоиды на основании результатов Исследования уровня 25-ОН витамина Д в крови с целью коррекции дефицита витамина D и кальция 35, 68, 69, 70. (УУР – С; УДД – 5)
Комментарии: Возможно рассмотреть различные стратегии назначения препаратов витамина D и аналогов, например, ежедневный прием (>2000 МЕ/день) или 50 000 МЕ #колекальциферола** перорально один раз в неделю на протяжении 2-3 месяцев. Имеется публикация об эффективности и безопасности применения однократной высокой дозы #колекальциферола** 300 000 — 500 000 МЕ 33.
Терапия остеопении и остеопороза осуществляется согласно соответствующим клиническим рекомендациям
3.1.2 Медикаментозная терапия
3.1.2.1 Терапия пероральными и ректальными препаратами аминосалициловой кислоты и аналогичными препаратами (5-АСК))
- Пероральное назначение препаратов аминосалициловой кислоты и аналогичных препаратов (употребляемые наименования: аминосалицилаты, 5-АСК) (месалазин** и сульфасалазин**(не разрешен по инструкции детям до 10 лет, применяется в более младшем возрасте по решению врачебной комиссии — #сульфасалазин**) рекомендовано в качестве терапии первой линии для индукции и поддержания ремиссии у детей при легкой и среднетяжелой активности язвенного колита 8, 71. (УУР – С; УДД – 5)
Комментарии: пероральный месалазин** назначается в дозе от 60 до 75мг/кг (не более 4 г/сутки) и #75 до 80 мг/кг в сутки (не более 4,8 г/сутки) в 2 приема (по инструкции с 6 лет у детей).
Доза для поддерживающей терапии подбирается индивидуально. Неоправданно низкая доза – одна из частых причин «недостаточной эффективности» препаратов аминосалициловой кислоты и аналогичных препаратов 72.
Сульфасалазин** применяется в доступной в РФ форме согласно инструкции. Максимальная доза пероральных и ректальных препаратов обычно не превосходит стандартную дозу для перорального приема более чем на 50% или 6,4 г/сутки у взрослых. Постепенное увеличение дозы сульфасалазина** в течение 7-14 дней может снизить риск дозозависимых нежелательных явлений, таких как головные боли и расстройства желудочно-кишечного тракта (ЖКТ).
Возможен однократный прием препаратов аминосалициловой кислоты и аналогичных препаратов, о чем сообщается в ряде исследований, свидетельствующих о равной эффективности однократного и двукратного применения дозы.
Острая непереносимость препаратов аминосалициловой кислоты и аналогичных препаратов может имитировать картину обострения колита. Улучшение состояния после их отмены и появление симптомов после повторного назначения позволяет верифицировать причину состояния и является противопоказанием к назначению любых препаратов препаратов аминосалициловой кислоты и аналогичных препаратов.
При необходимости назначения препаратов по жизненным показаниям детям более младшего возраста необходимо решение врачебной комиссии медицинской организации и получение информированного согласия родителей/законных представителей.
- Рекомендовано комбинированное назначение пероральных и местных (ректальных) препаратов аминосалициловой кислоты и аналогичных препаратов (5-АСК) пациентам без противопоказаний, так как данная стратегия более эффективна, чем применение каждого препарата отдельно 30, 32, 33. (УУР – С; УДД – 5)
Комментарии: ректальные препараты аминосалициловой кислоты и аналогичных препаратов (#месалазин**) назначаются в дозе 25 мг/кг (до 1 г/сутки) 8.
- Рекомендовано отдавать предпочтение ректальному назначению препаратов аминосалициловой кислоты и аналогичных препаратов (#месалазин**) пациентам с легким течением ЯК по сравнению с ректальным назначением глюкокортикоидов в связи с большей эффективностью 71. (УУР – С; УДД – 5)
Комментарии: детям следует попытаться назначить ректальную терапию, однако не нужно на ней настаивать. Однократное введение ректальных форм может улучшить приверженность к лечению, не снижая клинической эффективности терапии.
Для эффективного местного лечения необходимо обеспечить оптимальную приверженность к лечению, что требует поддержки ребенка и родителей, их обучения, убеждения и разъяснения тревожащих их вопросов.
#Месалазин** форме суппозиториев по инструкции противопоказан детям до 18 лет, в форме пены ректальной противопоказание для детей до 12 лет, назначение в более раннем возрасте – по решению врачебной комиссии с получением информированного согласия родителей/законных представителей ребенка.
-
Пациентам с легким течением ЯК при условии хорошей переносимости поддерживающую терапию препаратами аминосалициловой кислоты и аналогичных препаратов (5-АСК) рекомендовано проводить неограниченно долго. Поддерживающая доза должна равняться дозе, использованной для индукции ремиссии, хотя возможно применение меньшей дозы (не менее 40 мг/кг или 2,4 г/ сутки; минимальная эффективная доза у взрослых составляет 1,2 г/сутки) после достижения устойчивой ремиссии 30, 47, 73. (УУР – С; УДД – 5)
-
При отсутствии ответа на пероральный прием месалазина** в течение 2 недель рекомендовано назначение альтернативного лечения, например, подключение местной терапии (если еще не проводится) или назначение кортикостероидов системного действия (пероральные формы) 30, 47, 73. (УУР – С; УДД – 5)
3.1.2.2 Кортикостероиды системного действия
-
Кортикостероиды системного действия (перорально) рекомендовано использовать для индукции ремиссии, но не для ее поддержания при язвенном колите у детей 30, 71. (УУР – С; УДД – 5)
-
Кортикостероиды системного действия рекомендовано применять при среднетяжелой атаке с системными проявлениями и у отдельных пациентов детского возраста с тяжелой атакой без системных проявлений или у пациентов, не достигших ремиссии на фоне терапии оптимальной дозой препаратами аминосалициловой кислоты и аналогичными препаратами (5-АСК). При тяжелой атаке проводится внутривенная стероидная терапия 30. (УУР – С; УДД – 5)
-
Доза преднизолона** составляет 1 мг/кг и превышать ее не рекомендовано; у большинства детей она составляет 40 мг в сутки однократно 30 (УУР – С; УДД – 5)
Комментарии: с целью уменьшения потенциального риска подавления роста рекомендуется однократный прием всей дозы утром. Ориентировочная схема применения кортикостероидов системного действия у детей представлена в Таблице 1.
Таблица 1 — Схема снижения дозы преднизолона** детям с язвенным колитом (в мг/ сутки)
Первые 2-3 недели: начало терапии преднизолоном** в дозе 1 мг/кг (до 60 мг) однократно в сутки (*для купирования атаки тяжелого язвенного колита может применяться доза до 60 мг/сутки перорально, а также внутривенно до 3-5 мг/кг). При отсутствии значимого клинического улучшения у пациентов со среднетяжелым и тяжелым колитом (снижение PUCAI на <20 баллов) после 7-14 дней терапии или при увеличении PUCAI на ≥20 баллов на любом этапе лечения следует рассмотреть возможность усиления терапии после исключения других причин стероидорезистентного течения болезни.
После первых 2-3 недель терапии: при PUCAI от 15 до 30 продолжить прием преднизолона** в той же дозе (увеличение общей продолжительности приема на 1 неделю); PUCAI >35: увеличение дозы до использовавшейся на 1-2 этапах лечения, в течение недели, затем начать снижение дозы с меньшей скоростью; PUCAI >60 или повышение PUCAI не менее чем на 20 баллов на любом этапе лечения: рассмотреть возможность усиления терапии. В любой ситуации следует избегать гормональной зависимости путем усиления поддерживающей терапии.
Риск обострения меньше при использовании дозы преднизолона**>20 мг, однако, частота нежелательных явлений при использовании высокой дозы увеличивается. Снижение дозы в связи с этим следует начать как можно раньше и в начале курса кортикостероидов системного действия снижать дозу более интенсивно, замедлив скорость уменьшения дозы в дальнейшем. В некоторых случаях возможно сокращение каждого этапа терапии с 7 до 5 дней. По достижению малой дозы для снижения риска нежелательных явлений возможен прием препарата через день. Следует помнить о возможности надпочечниковой недостаточности даже спустя много месяцев после отмены стероидов.
Заживление слизистой оболочки на фоне приема стероидов при ЯК достигается чаще, чем при БК, однако отстает от клинического улучшения 44. У детей особенно важно оценить ответ на максимально раннем этапе для быстрого начала снижения дозы и уменьшения продолжительности лечения. Обязательным является сокращение необоснованного приема стероидов для минимизации задержки роста и других, связанных с приемом кортикостероидов системного действия, нежелательных явлений. Гормональная терапия может снижать концентрацию кальпротектина по мере ослабления активности заболевания, однако нормализация его уровня отмечается нечасто 74. Повышенный уровень кальпротектина не требует продолжения гормональной терапии, если пациент находится в состоянии клинической ремиссии.
Разделение суточной дозы на несколько приемов по эффективности не превышает однократный прием 75. У детей, страдающих ЯК, по сравнению с взрослыми, частота осложнений стероидной терапии, включая остеопороз, глаукому и катаракту, может быть выше даже при назначении дозы, рассчитанной по массе тела 76. В большинстве случаев, при отсутствии клинической симптоматики применение антацидов не требуется. Их следует назначить при поражении верхних отделов ЖКТ или при приеме нестероидных противовоспалительных препаратов.
Способы профилактики гормональной зависимости включают оптимизацию дозы препаратов аминосалициловой кислоты и аналогичных препаратов (5-АСК), сопутствующую терапию клизмами и усиление базисной терапии с подключением ингибиторов фактора некроза опухоли альфа (ФНО-альфа) и других иммунодепрессантов (тиопуринов) или инфликсимаба**. Следует убедиться в соблюдении медицинских назначений, особенно подростками. При невозможности преодолеть гормональную зависимость консервативными средствами следует рассмотреть возможность колэктомии.
3.1.2.3 Адьювантная терапия
- Антибактериальные препараты системного действия при ЯК у детей не рекомендованы к применению для индукции или поддержания ремиссии в амбулаторной практике в связи с неэффективностью 30. (УУР – С; УДД – 5)
Комментарии: антибактериальная терапия применяется в случае развития осложнений или в качестве дополнения к стандартной терапии в острый период.
3.1.2.4 Иммунодепрессанты и антиметаболиты (азатиоприн**, #меркаптопурин** и #циклоспорин**, такролимус**)
- Иммунодепрессант (азатиоприн**) или антиметаболит (#меркаптопурин**) (традиционное наименование — тиопурины (по АТХ-классификации — другие иммунодепрессанты, аналоги пурина)) рекомендовано назначать для поддержания ремиссии у детей с непереносимостью препаратов аминосалициловой кислоты и аналогичных препаратов или у пациентов с часто рецидивирующим течением (2-3 обострения в год) или развитием гормонозависимой формы заболевания на фоне проведения терапии препаратами аминосалициловой кислоты и аналогичными препаратами в максимальных дозах 30, 32, 33. (УУР – С; УДД – 5)
Комментарии: терапевтический эффект тиопуринов (другие иммунодепрессанты, аналоги пурина) достигается через 10-14 недель от начала лечения. Доза может корректироваться приблизительно до 2,5 мг/кг для азатиоприна** или 1-1,5 мг/кг для #меркаптопурина** и приниматься однократно 30.
Азатиоприн** превосходит плацебо для поддержания ремиссии ЯК 30, обладая приблизительно 60% эффективностью 77, 78. Ретроспективные исследования у детей подтвердили эффективность тиопуринов (другие иммунодепрессанты, аналоги пурина) в поддержании ремиссии и преодолении стероидной зависимости 79, 80, 81. Средний период времени до достижения стабильного уровня тиопуринов (других иммунодепрессантов, аналогов пурина) в сыворотке крови составляет 55 сут 82.
С учетом эффективности и безопасности препаратов аминосалициловой кислоты и аналогичных препаратов для поддержания ремиссии, применение тиопуринов (другие иммунодепрессанты, аналоги пурина) ограничивается следующими показаниями: непереносимость препаратов аминосалициловой кислоты и аналогичных препаратов и тяжелая атака ЯК у детей, т. е. в случае повышенного риска агрессивного течения заболевания. Учитывая хороший профиль безопасности и высокую эффективность препаратов аминосалициловой кислоты и аналогичных препаратов, в т. ч. и для профилактики колоректального рака, нельзя исключить целесообразность сочетанного применения препаратов аминосалициловой кислоты и аналогичных препаратов с тиопуринами (другие иммунодепрессанты, аналоги пурина). В то же время увеличение числа принимаемых таблеток может снизить приверженность детей к лечению.
Не зависящие от дозы побочные эффекты тиопуринов (другие иммунодепрессанты, аналоги пурина) включают лихорадку, панкреатит, артралгию, тошноту, рвоту и диарею, дозозависимые токсические реакции (лейкопению, тромбоцитопению, инфекции и гепатит) 83. Панкреатит — наиболее часто обнаруживаемая реакция гиперчувствительности, отмечаемая у 3–4% пациентов и практически всегда развивающаяся в течение первых нескольких недель лечения. Наибольший риск для детей, принимающих иммунодепрессанты (другие иммунодепрессанты, аналоги пурина), представляют инфекции 84, 85, хотя тяжелые инфекции развиваются редко.
- Тиопурины (аналоги пурина) рекомендуются для поддерживающей терапии при остром тяжелом колите после индукции ремиссии при помощи кортикостероидов системного действия 29. (УУР – С; УДД – 5)
Комментарии: терапию тиопуринами (другие иммунодепрессанты, аналоги пурина) рекомендовано прекратить при клинически значимой миелосупрессии или панкреатите. Назначать тиопурины (другие иммунодепрессанты, аналоги пурина) повторно после лейкопении следует в меньшей дозе, после тщательной оценки риска и пользы от лечения. Переход с азатиоприна** на #меркаптопурин** 1-1,5 мг/кг/день, максимальная доза 2,5 мг/кг/день 86 может быть эффективен при острых гриппоподобных и желудочнокишечных побочных эффектах.
Продолжение терапии препаратами аминосалициловой кислоты и аналогичными препаратами после назначения тиопуринов (другие иммунодепрессанты, аналоги пурина) может иметь ряд преимуществ.
- Терапию #циклоспорином**, назначенную при острой тяжелой атаке язвенного колита рекомендовано прекратить спустя 4 месяца с переходом на прием тиопуринов (другие иммунодепрессанты, аналоги пурина) 29. (УУР – С; УДД – 5)
Комментарий: обычно назначается в стартовой дозе 2 мг/кг/сут 32 (или 2-4 мг/сут) 87 (в виде продолжительной внутривенной инфузии) Целевая концентрация уровня #циклоспорина** в крови во время индукции — 150-300 нг/мл и 100-200 нг/мл при достижении ремиссии 32.
- Рутинное применение #метотрексата** при ЯК у детей в настоящее время не рекомендуется, препарат назначается только в случае непереносимости тиопуринов (другие иммунодепрессанты, аналоги пурина) при невозможности проведения альтернативного лечения 32, 33. (УУР – С; УДД – 5)
Комментарии: дозы #метотрексата** у детей с язвенным колитом изучались только в когортных исследованиях. Препарат может применяться в дозе 15мг/м2 поверхности тела 88. Применение #метотрексата** должно сопровождаться приемом #фолиевой кислоты** 1 мг/сут. или 5 мг/неделю 89.
3.1.2.5 Инфликсимаб**, адалимумаб**, #голимумаб**, #ведолизумаб** (Ингибиторы фактора некроза опухоли альфа (ФНО-альфа) и селективные иммунодепрессанты)
- У пациентов с хроническим непрерывным или гормонозависимым течением ЯК, не контролируемым Аминосалициловой кислотой и аналогичными препаратами и тиопуринами (иммунодепрессантами (аналоги пурина), рекомендовано рассмотреть возможность назначения инфликсимаба** 33. (УУР – С; УДД – 5)
Комментарии: у детей с ЯК в настоящее время рекомендовано назначать Ингибиторы фактора некроза опухоли альфа (ФНО-альфа) (Инфликсимаб**) в качестве препарата первой линии биологической терапии в дозе 5 мг/кг (3 индукционных на 0, 2 и 6 неделях с последующим введением по 5 мг/кг каждые 8 недель в качестве поддерживающей терапии). Может потребоваться индивидуальный подбор дозы. Препарат по инструкции разрешен детям с 6 лет, при необходимости назначения в более младшем возрасте — по решению врачебной комиссии с подписанием информированного согласия законными представителями ребенка)
Отсутствуют надежные данные о необходимости комбинации Ингибиторов фактора некроза опухоли альфа (ФНО-альфа) (инфликсимаба**) с тиопуринами (другие иммунодепрессанты) у детей с ЯК, не ответивших на терапию только тиопуринами (другие иммунодепрессанты, аналоги пурина). Возможно, однако, применение биологических препаратов (Ингибиторы фактора некроза опухоли альфа (ФНО-альфа) ) в сочетании с тиопуринами (другие иммунодепрессанты, аналоги пурина) в течение 4-8 месяцев терапии, даже если ребенок не ответил на ранее проводившуюся терапию тиопуринами (другие иммунодепрессанты, аналоги пурина). Необходима при комбинированном лечении дальнейшая тщательная оценка соотношения польза/риск.
Учитывая потенциальное благоприятное действие (включая возможную профилактику колоректального рака) и высокую безопасность Аминосалициловой кислотой и аналогичных препаратов, представляется рациональным проведение их комбинированного лечения с биологическими препаратами (Ингибиторы фактора некроза опухоли альфа (ФНО-альфа)).
Показано, что инфликсимаб** эффективен в индукции клинической ремиссии, обеспечивает заживление слизистой оболочки и снижает потребность в проведении колэктомии у больных с активным ЯК, не ответивших на стандартную терапию 90, 91. Согласно данным рандомизированных двойных слепых плацебо-контролируемых исследований АСТ-1 и АСТ-2, инфликсимаб** эффективен для индукции и поддержания ремиссии у взрослых пациентов со среднетяжелым и тяжелым ЯК 92. Сопоставимые результаты были получены и в ходе проведенного у детей РКИ Т-72: через 8 недель лечения инфликсимабом** (5 мг/кг внутривенно на 0-й, 2-й и 6-й нед) 73% пациентов ответили и 40% достигли клинической ремиссии; у 68% пациентов отмечалось заживление слизистой оболочки по данным эндоскопического исследования. При продолжении терапии в течение года в режиме регулярных инфузий по 5 мг/кг каждые 8 недель стойкая клиническая ремиссия без применения ГК наблюдалась практически у 40% пациентов 93, 94, 95. Имеются результаты и других педиатрических исследований, подтверждающие целесообразность применения инфликсимаба** у детей с ЯК. Мета-анализ показал, что накопленная долгосрочная эффективность инфликсимаба** при остром тяжелом колите составляет 64% 90. Избежать колэктомии в течение 2 лет удалось у 61% больных.
- Инфликсимаб** (по инструкции разрешен детям с 6 лет) рекомендовано назначить при гормонорезистетной форме заболевания (устойчивости как к пероральному, так и внутривенному введению). Если инфликсимаб** был назначен при острой атаке у пациента, ранее не получавшего тиопурины (другие иммунодепрессанты), биологическая терапия может использоваться как вспомогательная для перехода на терапию тиопуринами (другие иммунодепрессанты, аналоги пурина). В этом случае, терапию инфликсимабом** можно прекратить через 4-8 месяцев 32, 33. (УУР – С;УДД – 5)
Комментарии: В исследовании SUCCESS 96, проведенном у взрослых пациентов с ЯК, установлено, что комбинация инфликсимаба** с азатиоприном** превосходит по эффективности монотерапию каждым из препаратов по отдельности. Назначение комбинированной терапии следует проводить с учетом риска развития возможных нежелательных явлений, включая риск лимфомы, а также принимая во внимание тот факт, что эффективность комбинации препаратов при неэффективности тиопуринов (другие иммунодепрессанты, аналоги пурина) пока надежно не доказана. Несмотря на то, что тиопурины (другие иммунодепрессанты, аналоги пурина) снижают частоту инфузионных реакций и иммуногенность инфликсимаба**, они не влияют на клинический исход терапии и его фармакокинетику 97. Аналогичные результаты, свидетельствующие об отсутствии преимущества в проведении комбинированной терапии, были получены и в ходе исследования эффективности инфликсимаба** у детей (Т-72) 93. Вероятность колэктомии при долгосрочном наблюдении 52 детей с ЯК, получавших инфликсимаб**, не различалась в группах монотерапии и комбинированного лечения 95. У детей с гормональной резистентностью, ранее не получавших тиопурины (другие иммунодепрессанты, аналоги пурина), инфликсимаб** может быть использован для перехода на терапию тиопуринами (другие иммунодепрессанты, аналоги пурина). В этом случае комбинированная терапия обычно продолжается в течение 4–8 мес 29.
Пациентам с потерей ответа во время поддерживающего лечения может потребоваться оптимизация дозы (#увеличение дозы инфликсимаба** до 10 мг/кг или сокращение интервалов между введениями до 4–6 нед) 93, 98. По данным большинства клинических исследований, наиболее существенным является риск инфузионных и аллергических реакций, тогда как вероятность развития других побочных эффектов невелика.
- Адалимумаб** (разрешен по инструкции пациентам с ЯК с 5 лет) рекомендовано применять только у пациентов с потерей ответа на инфликсимаб** или с непереносимостью инфликсимаба** 32, 33, 99. (УУР – С; УДД – 5)
Комментарии: терапию адалимумабом** показано проводить по схеме: индукционная доза на 0 и 2 неделе 160 мг и 80 мг при массе тела ≥40 кг или 80 мг и 40 мг при массе тела <40 кг, затем поддерживающая терапия для пациентов с массой тела ≥40 кг 80 мг 1р в 2 недели или 40 мг 1р в неделю, для детей с массой тела <40 кг 40 мг 1р в 2 недели или 20 мг 1р в неделю 100. Препарат вводится подкожно. Может потребоваться индивидуальный подбор дозы.
Еще одним препаратом данной фармакотерапевтической группы ГИБП (Ингибиторы фактора некроза опухоли альфа (ФНО-альфа)) является #голимумаб**, однако его назначение детям после проведенной неэффективной терапии инфликсимабом** и адалимумабом** нецелесообразно.
- Рекомендовано рассмотреть (при возможности) измерение уровней Ингибиторов фактора некроза опухоли альфа (ФНО-альфа) в крови (Исследование уровня лекарственных препаратов в крови) и антител к данным препаратам после периода, достаточного для индукции ремиссии (например, на 14 неделе от начала для инфликсимаба** и на 8–10 неделе для адалимумаба**) у пациентов с недостаточным эффектом от проводимой терапии с целью оптимизации лечения 33.
Комментарий: Как правило, ответ на лечение Ингибиторами фактора некроза опухоли альфа (ФНО-альфа) может проявляться уже через 1-4 недели и достигает пика к 12–16 неделе лечения.
Во время индукции минимальный уровень >15 мкг/мл на 6 неделе лучше всего предсказывал вероятность в ближайшее время заживления слизистой оболочки.
Рекомендуемые оптимальные уровни во время поддерживающей терапии для улучшения клинических исходов до настоящего времени дискутируются: например, в ряде исследований для инфликсимаба** >4 мкг/мл, для адалимумаба** >5 мкг/мл. Американская гастроэнтерологическая ассоциация рекомендует использовать пороговые значения >5 мкг/мл для инфликсимаба** и >7,5 мкг/мл для адалимумаба**.
- Измерение уровней Ингибиторов фактора некроза опухоли альфа (ФНО-альфа) в крови (Исследование уровня лекарственных препаратов в крови) рекомендовано рассмотреть (при возможности) у пациентов с неудовлетворительным ответом на ингибиторы фактора некроза опухоли альфа (ФНО-альфа) для решения вопроса о повышении дозы или перехода на другой биологический препарат 33.
Комментарий: К факторам, являющимся предикторами более низких уровней препарата (и, таким образом, возможно, диктующим более высокую дозировку) относятся более высокий индекс массы тела, низкая масса тела <30 кг, мужской пол, высокая воспалительная нагрузка (степень и тяжесть заболевания), гипоальбуминемия, наличие антител против лекарств и отсутствие терапии иммунодепрессантом.
Сохраняющиеся симптомы, несмотря на адекватные уровни лекарств, указывают на необходимость переключения терапии на другой класс биологических препаратов. Высокий титр антител указывает на неэффективность увеличения дозы.
#Ведолизумаб** рекомендовано применять только у пациентов с потерей ответа или непереносимостью препаратов Ингибиторов фактора некроза опухоли альфа (ФНО-альфа) (инфликсимаба**, адалимумаба**) 73, 101, 102. (УУР – С; УДД – 5)
Комментарии: дозы #ведолизумаба** у детей окончательно не определены, лечение проводится по схеме: в начальной дозе 5 мг/кг (далее обычно используются дозы 6-10 мг/ кг) 32, 87, до 300 мг на 0,2,6 неделе, затем каждые 8 недель (более короткие интервалы (4 недели) могут понадобиться при неполном эффекте) (детям <30кг требуются более высокие дозы).
Может быть более предпочтителен расчет на площадь поверхности тела -177 мг/м2. 8, 32, 103.
применение #ведолизумаба** у детей с ЯК — off label – вне зарегистрированных в инструкции лекарственного средства показаний, по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии) и подписанного информированного согласия родителей (законного представителя) и ребенка в возрасте старше 15 лет)
3.1.2.5.1 Немедицинское переключение
В настоящее время зарегистрированы биоаналоги (биосимиляры) Ингибиторов фактора некроза опухоли альфа (ФНО-альфа) анти-ФНО препаратов, которые эквивалентны им по строению, часть из которых в клинических испытаниях показали схожую с оригинальными препаратами эффективность 104, однако не для всех биоаналогов проведены такие исследования.
- Переход с оригинального препарата на биосимиляр рекомендовано рассмотреть только после достижения ремиссии (не ранее, чем после введения 3-х доз оригинального инфликсимаба**) и после обсуждения перехода с пациентом и/или законным представителем с целью достижения максимального эффекта терапии и возможности точной оценки ее результативности 104. (УУР – С; УДД – 5)
Комментарии:
При применении как оригинальных препаратов, так и биосимиляров, необходим тщательный контроль со своевременной подачей сведений в систему Мониторинга эффективности и безопасности лекарственных препаратов Росздравнадзора (https://roszdravnadzor.gov.ru/drugs/monitpringlp).
Общероссийская общественная организация «Ассоциация колопроктологов России» и «Всероссийское общество по изучению воспалительных заболеваний кишечника» по вопросу немедицинского переключения биологической терапии при воспалительных заболеваниях кишечника в рамках Национального саммита по лечению воспалительных заболеваний кишечника 22 июня 2019 г вынесли следующую резолюцию:
Биосимиляр может быть назначен пациентам, не получавшим ранее Ингибиторы фактора некроза опухоли альфа (ФНО-альфа), при наличии соответствующих показаний и в том случае, если его стоимость ниже, чем оригинального Ингибитора фактора некроза опухоли альфа (ФНО-альфа), и поддерживается совместным решением пациента и врача.
Решение о возможности замены оригинального Ингибитора фактора некроза опухоли альфа (ФНО-альфа) на его биосимиляр должно приниматься врачом исходя из индивидуальных особенностей течения ВЗК, а также с учетом отнесения пациента к особым популяциям (дети, беременные, пожилые и др.) и должно быть согласовано с пациентом в соответствии с мировыми практиками.
Не допустима автоматическая замена оригинального препарата на биосимиляр и/или переключение с одного биосимиляра на другой ввиду отсутствия в настоящий момент достаточных данных об их безопасности и эффективности 105.
- Не рекомендуются множественные переключения (более одного переключения) между различными биоаналогами (биосимилярами) или между биосимиляром и оригинальным препаратом пациентам с ВЗК так как становится сложным отслеживание лекарственного препарата в случае потери эффективности и/или сигналов безопасности 104, 106, 107. (УУР – С; УДД – 5)
3.1.2.6 Консервативная терапия кишечного кровотечения
- Рекомендовано при кишечном кровотечении в случае отсутствия массивной кровопотери в течение 24-48 часов проведение интенсивной гемостатической терапии и назначение заместительных гемотрансфузий эритроцитарной массы 108. (УУР – С; УДД – 5)
Комментарии: при отсутствии эффекта в течение 24-48 часов и массивной кровопотере – необходимо экстренное хирургическое вмешательство (косвенно о продолжающемся кишечном кровотечении свидетельствует прогрессирующее снижение уровня гемоглобина на фоне интенсивной терапии).
3.1.2.7 Консервативная терапия токсического мегаколона
- В случае диагностирования токсического мегаколона рекомендовано начать интенсивную инфузионную и антибактериальную терапию, противовоспалительное лечение (кортикостероиды системного действия), применять декомпрессию кишечника (абдоминальная декомпрессия) (с назогастральной и ректальной интубацией) 108, 109. (УУР – С; УДД – 5)
Комментарий: При неэффективности консервативных мероприятий в течение 24-72 часов показано проведение экстренной операции.
3.1.2.8 Консервативная терапия тяжелой/сверхтяжелой атаки ЯК
- Рекомендовано детей с тяжелой/сверхтяжелой атакой ЯК госпитализировать в многопрофильный стационар в гастроэнтерологическое (при наличии), педиатрическое или хирургическое отделение. 32, 33. (УУР – С; УДД – 5)
Комментарий: Следует придерживаться алгоритма, принятого ESPGHAN в 2018 г. Ключевым критериями, определяющими тактику лечения, являются PUCAI и уровень маркеров воспаления, определяемых при поступлении, на 3 и 5 дни лечения тяжелой атаки 12, 13, 110.
При поступлении необходимо подсчитать PUCAI, исключить инфекционные причины тяжелой атаки (посев кала на патогенные бактерии, вирусы, токсины C. Difficile (A, B)) ((Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудителя дизентерии (Shigella spp.), Микробиологическое (культуральное) исследование фекалий на возбудители брюшного тифа и паратифов (Salmonella typhi), Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудитель иерсиниоза (Yersinia enterocolitica), Микробиологическое (культуральное) исследование фекалий/ректального мазка на патогенные кампилобактерии (Campylobacter jejuni/coli) с определением чувствительности к антибактериальным препаратам, Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудитель диффициального клостридиоза (Clostridium difficile)), оценить общий (клинический) анализ крови, СОЭ, анализ крови биохимический общетерапевтический (уровень электролитов и альбумина, АЛТ, АСТ, СРБ), сделать посев крови (микробиологическое (культуральное) исследование крови на стерильность, при необходимости: определение чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам) (при наличии фебрильной лихорадки). При наличии симптомов интоксикации, выраженного болевого синдрома, вздутия живота и болезненности при пальпации следует сделать обзорный рентгеновский снимок брюшной полости для исключения токсического мегаколона 32.
-
Рекомендуется при тяжелой/сверхтяжелой атаке ЯК отменить, как пероральные, так и ректальные формы Аминосалициловой кислоты и аналогичных препаратов, так как в 2-10% случаев обострение ЯК может быть связано с непереносимостью месалазина** 111. (УУР – В; УДД – 2)
-
После исключения инфекции рекомендуется начать внутривенное введение кортикостероидов системного действия (ГКС). Оптимальным является введение метилпреднизолона** в суточной дозе 1 мг/кг 1 раз в день (до 40 мг/сут). При сверхтяжелой атаке возможно введение метилпреднизолона** в суточной дозе 1,5 мг/кг, разделив ее на 2 введения. При отсутствии метилпреднизолона** возможно в/ в введение эквивалентной дозы преднизолона** (1 мг метилпреднизолона** соответствует 1,25 мг преднизолона**) 38, 108. (УУР – С; УДД – 5)
Комментарии: Снижение PUCAI до 45 баллов и ниже на 3й день лечения свидетельствует о хорошем ответе на в/в кортикостероиды системного действия (ГКС). В этом случае нужно продолжить терапию в течение еще 2 дней. Попытка перехода на пероральные формы кортикостероиды системного действия (ГКС) может быть сделана, если PUCAI будет менее 35 баллов 32.
Если на 3й день лечения в/в кортикостероидами системного действия PUCAI >45 баллов, в течение следующих 3-5 дней нужно начать планировать терапию 2й линии. Подготовка к терапии 2й линии включает проведение сигмоидоскопии (для взятия биопсии с целью исключения CMV-инфекции, наличия гранулем и оценки тяжести воспаления), консультацию врача-хирурга, скрининг на туберкулез, гепатиты В и С. На 3 и 5 сутки необходимо повторить следующие анализы: общий (клинический) анализ крови с СОЭ, анализ крови биохимический общетерапевтический (СРБ, альбумин, электролиты) 12, 32.
Если на 5й день лечения в/в кортикостероидами системного действия PUCAI будет 35-65 баллов, нужно продолжить в/в введение кортикостероидов системного действия еще в течение 2-5 дней и затем следовать алгоритму в зависимости от PUCAI 32.
Если на 5й день лечения в/в кортикостероидами системного действия PUCAI >65 баллов, следует либо начать терапию 2й линии (EL2), либо сделать колэктомию.
-
Рекомендовано при отсутствии непосредственной угрозы жизни или развития тяжелых осложнений, требующих немедленного оперативного вмешательства, пациентам с тяжелой/сверхтяжелой атакой ЯК назначение терапии «второй линии» (биологической или иммуносупрессивной терапии) 8. (УУР – С; УДД – 5)
-
Рекомендуется в качестве терапии 2й линии назначение инфликсимаба**. Альтернативой являются #такролимус** 0,2 мг/кг/день в два приема или #циклоспорин** (обычно назначается в стартовой дозе 2 мг/кг/сут 32 (или 2-4 мг/ сут) 87 (в виде продолжительной внутривенной инфузии) Целевая концентрация уровня циклоспорина А в крови во время индукции — 150-300 нг/мл и 100-200 нг/мл при достижении ремиссии 32. (УУР – С; УДД – 5)
Комментарии: перед началом терапии #циклоспорином** следует провести: Исследование уровня креатинина в крови, Исследование уровня глюкозы в крови, исследование уровня электролитов в крови (Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня общего магния в сыворотке крови), Исследование уровня холестерина в крови.
В процессе терапии #циклоспорином** или #такролимусом** следует проводить контрольные: Исследование уровня креатинина в крови, Исследование уровня глюкозы в крови, исследование уровня электролитов в крови (Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня общего магния в сыворотке крови, Исследование уровня триглицеридов в крови, измерениа артериального давления на периферических артериях, профилактика пневмонии, вызванной P.jirovec 32.
-
В связи с повышенным клиренсом инфликсимаба** у детей с тяжелой атакой ЯК, рекомендуется #увеличить дозу препарата до 10 мг/кг и сократить интервалы между введением (например, 0-1-4 (5) недели) 12, 32, 90. (УУР – С; УДД – 5)
-
Рекомендуется для оценки эффективности терапии 2й линии ежедневно оценивать PUCAI, проводить исследования уровня СРБ и альбумина в крови. При хорошем ответе на 4-7 день лечения PUCAI должен снизиться по меньшей мере на 20 баллов 12, 32, 33. (УУР – С; УДД – 5)
-
При отсутствии четкой положительной динамки всем пациентам рекомендовано провести консультацию врача-детского хирурга для решения вопроса о проведении колэктомии 112. (УУР – С; УДД – 5)
-
С целью предотвращения иммуносупрессии при назначении терапии 2й линии, а также перед колэктомией рекомендуется начать снижение дозы кортикостероидов системного действия 32, 33. (УУР – С; УДД – 5)
-
При снижении уровня гемоглобина ниже 80 г/л рекомендуется переливание крови (эритроцитарной массы) с целью коррекции анемии 32. (УУР – С; УДД – 5)
-
Подросткам с риском тромбоэмболических осложнений (курение, прием гормональных пероральных контрацептивов, полное обездвиживание, наличие центрального катетера, ожирение, сопутствующая тяжелая инфекция, наличие тромбозов и тромбоэмболии в анамнезе, отягощенная наследственность) рекомендуется назначение антитромботических средств (EL5) 113. (УУР – С; УДД – 5)
Комментарий: С этой целью используют группу гепарина (низкомолекулярные гепарины), например, #эноксапарин натрия** в дозе 1 мг/кг подкожно 1 раз в день 114, 115.
- Детям с тяжелым ЯК при поступлении в стационар антибактериальные препараты системного действия, как правило, не рекомендуются 32. (УУР – С; УДД – 5)
Комментарий: при наличии высокой вероятности инфекции (включая C. difficile), до получения результатов анализов кала возможно проведение эмпирической антибактериальной терапии 32.
Алгоритм диагностики и лечения тяжелой атаки язвенного колита
3.2 Хирургическое лечение
3.2.1. Хирургическое лечение при ургентных хирургических осложнениях
Экстренное хирургическое вмешательство у пациентов с ЯК рекомендовано при развитии следующих осложнений основного заболевания: продолжающееся (некупируемое) кишечное кровотечение, перфорация стенки толстой кишки, токсическая дилатация ободочной кишки. Операцию рекомендуется проводить в объеме тотальной/субтотальной колэктомии с формированием терминальной илеостомы по Бруку. 116. (УУР – С; УДД – 5)
Комментарии: при выполнении экстренной колэктомии нет необходимости выполнять низкую резекцию прямой кишки, поскольку это усложняет ход операции и удлиняет время хирургического вмешательства у тяжелых пациентов. Прямая кишка пересекается на уровне мыса крестца (ректо-сигмоидный переход) с формированием культи. Предпочтительным является аппаратное (применение линейных сшивающих аппаратов) формирование культи прямой кишки. Использование сшивающих аппаратов позволяет сократить время операции и снизить риск развития несостоятельности швов культи прямой кишки в раннем послеоперационном периоде 117. Также, в течение 3 – 5 дней после колэктомии рекомендуется санировать культю прямой кишки с помощью ПХВ катетера (катетер Нелатона, мочевой катетер), введенного через анальное отверстие, для профилактики несостоятельности швов в связи с накоплением в прямой кишке слизи и крови 118. Выполненная колэктомия с илеостомией купирует явления интоксикации, обусловленные течением тяжелого колита, улучшает общее состояние пациента, а патолого-анатомическое (гистологическое) исследование операционного (макропрепарата) препарата позволяет уточнить диагноз и исключить болезнь Крона толстой кишки, которая у детей может протекать фенотипически как ЯК (Крон-колит) 119
- Реконструктивный этап хирургического лечения после колэктомии, выполненной по экстренным показаниям, рекомендуется проводить через 6-12 месяцев после отмены противовоспалительной терапии (гормональной и/или биологической) и нормализации нутритивного статуса пациента 120. (УУР – С; УДД – 5)
Комментарии: реконструктивный этап включает в себя резекцию прямой кишки с формированием резервуарного наданального илеоректального / илеоанального анастомоза. Также у детей (особенно у пациентов младшего возраста) допускается формирование прямого илеоректального (илеоанального) кишечного анастомоза 121.
Операция завершается формированием превентивной петлевой илеостомы по Торнболлу.
Третий этап хирургического лечения — закрытие превентивной илеостомы возможно выполнить в случаях адекватно сформированного тонкокишечного резервуара, отсутствии явлений стеноза и воспалительных изменений слизистой оболочки кишки в зоне резервуарного анастомоза. Реконструктивно-восстановительная операция по восстановлению проходимости ЖКТ возможна через 1-2 месяца после основноего реконструктивного этапа 118.
3.2.1.1. Хирургическое лечение при кишечном кровотечении
- Рекомендовано экстренное хирургическое вмешательство при кишечном кровотечении в случае массивной кровопотери, возникшей на фоне проведения адекватной медикаментозной терапии ЯК, при ухудшении состояния или отсутствии положительной динамики от консервативной терапии (переливание компонентов крови – СЗП, эритроцитарная масса) 108. (УУР – С; УДД – 5)
Комментарии: косвенно о продолжающемся кишечном кровотечении свидетельствует прогрессирующее снижение уровня гемоглобина на фоне интенсивной терапии.
Объективными критериями (на фоне комплексного адекватного консервативного лечения) для решения вопроса в пользу экстренного хирургического лечения являются:
-
склонность к гипотонии на фоне адекватной инфузионной терапии
-
явления гемической гипоксии
-
изменение показателей коагулограммы (признаки ДВС синдрома, нарастающая гипокоагуляция),
-
прогрессирующая анемия
Длительность консервативной терапии до принятия решения об экстренном хирургическом вмешательстве четко не определена и устанавливается индивидуально 112.
3.2.1.2 Хирургическое лечение при перфорации толстой кишки
Пациенты со сверхтяжелым / тяжелым ЯК должны быть госпитализированы в стационар для проведения комплексного обследования и консервативного лечения, а также суточного мониторинга в условиях ОРИТ. Этой группе пациентов необходимо провести рентгенологическое (проведение обзорной рентгенографии органов брюшной полости) и эндоскопическое исследование толстой кишки с целью исключения ургентных хирургических осложнений (перфорация толстой кишки, токсическая дилатация ободочной кишки) с обязательным динамическим наблюдением детского хирурга. В основе оценки тяжести состояния и эффективности терапии может использоваться педиатрическая бальная шкала активности ЯК (PUCAI) 116. (УРР-С; УДД-5)
При выявлении перитонеальных симптомов (симптомов раздражения брюшины), рентгенологических признаках свободного газа в брюшной полости по данным обзорной рентгенографии (проведение обзорной рентгенографии органов брюшной полости) рекомендована экстренная субтотальная колэктомия с формированием терминальной илеостомы по Бруку 122. (УУР – С; УДД – 5)
Комментарии: Перфорация толстой кишки в свободную брюшную полость при остром сверхтяжелом / тяжелом ЯК может быть первым проявлением заболевания и является наиболее опасным осложнением с почти 50% летальностью.
3.2.1.3. Хирургическое лечение при развитии токсической дилатации ободочной кишки (токсический мегаколон).
Токсическая дилатация толстой кишки (токсический мегаколон) – это не связанное с обструкцией расширение ободочной кишки с явлениями интоксикации. Причинами, провоцирующими это грозное осложнение, могут быть электролитные нарушения, оппортунистические инфекции (цитомегаловирусная, клостридиальная и др.), прием противодиарейных, кишечных противовоспалительных и противомикробных препаратов, опиоидов и антидепрессантов 123.
- Для установки диагноза «токсический мегаколон» рекомендовано учесть клинические данные (уменьшение / купирование болевого абдоминального синдрома, увеличение объема живота, уменьшение частоты дефекаций, нарастание явлений интоксикации) и данные рентгенографии (проведение обзорной рентгенографии органов брюшной полости). Выполнение обзорной рентгенографии органов брюшной полости в вертикальном положении является достоверным подтверждением диагноза 90. (УУР – С; УДД – 5)
Комментарий: токсическая дилатация толстой кишки становится очевидной при расширении диаметра поперечно ободочной кишки до 40 мм и более – у детей до 10 лет; старше 11 лет – 55 мм и более; подростки и взрослые пациенты – 60 мм и более.
-
В случае неэффективности консервативных мероприятий по поводу токсического мегаколона в течение 24-72 часов рекомендовано проведение экстренной операции. Объем хирургического вмешательства – субтотальная / тотальная колэктомия с формирование терминальной илеостомы 108. (УУР – С; УДД – 5)
-
Рекомендовано рассмотреть возможность применения лапароскопического доступа при проведении хирургического лечения детям с ЯК как минимально инвазивного вмешательства, с хорошим косметическим результатом, более ранним восстановлением в послеоперационном периоде и коротким пребыванием в стационаре 124, 125. (УУР – С; УДД – 4)
Комментарий: при хорошей оснащенности стационара и высокой квалификации опытного специалиста колэктомия с применением лапароскопической методики является относительно безопасной хирургической опцией даже у тяжелых пациентов с ЯК, оперируемых по экстренным показаниям.
3.2.2 Хирургическое лечение при неэффективности консервативной терапии ЯК (Плановое хирургическое лечение)
- В случае неэффективности консервативной терапии ЯК рекомендовано рассмотреть возможность проведения хирургического этапа лечения. Объем оперативного вмешательства заключается в выполнении колпроктэктомии с формированием наданального илеоректального / илеоанального резервуарного анастомоза (ИАРА) (Тотальная колэктомия, Субтотальная колэктомия, Колэктомия с формированием илеоректального анастомоза, Формирование тонкокишечного анастомоза, Лапароскопически-ассистированная, колэктомия с брюшно-анальной резекцией прямой кишки, Лапароскопическая колэктомия с брюшно-анальной резекцией прямой кишки, Колэктомия с брюшно-анальной резекцией прямой кишки, Лапароскопически-ассистированная колэктомия с формированием илеоректального анастомоза, Лапароскопическая колэктомия с формированием илеоректального анастомоза) с целью улучшения состояния пациента 31, 118. Хирургическое лечение может быть выполнено в 1 или 3 этапа. (УУР – С; УДД – 5)
Комментарии: Неэффективность консервативной терапии включает развитие гормональной резистентности и/или гормональной зависимости, задержку физического развития, а также отсутствие ответа на адекватную терапию (биологическую или иммуносупрессивную) – отсутствие стойкой клинико-лабораторной и эндоскопической ремиссии. Также хирургическое лечение может быть показано при выявлении дисплазии слизистой оболочки толстой кишки высокой степени.
- Пациентам с ЯК при выявлении дисплазии высокой степени (в биоптатах неизмененной слизистой оболочки) рекомендовано проведение хирургического этапа лечения 112, 126. (УУР-C; УДД -2)
Комментарий: При выявлении дисплазии легкой степени у пациентов с ЯК (в биоптатах неизмененной слизистой оболочки) решение о проведении хирургического лечения принимается коллегиально с привлечением пациента и/или родителей пациента.
- Динамическое наблюдение с регулярным гистологическим исследованием биоптатов слизистой толстой кишки (Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки, Патолого-анатомическое исследование биопсийного (операционного) материала прямой кишки с применением гистохимических методов) (1 раз в 3 мес.) может рассматриваться в качестве альтернативы ранней хирургии 127. (УУР-C; УДД — 5)
Коммментарий: Вопрос о необходимости проведения хирургического вмешательства решается коллегиально с участием врача-гастроэнтеролога, врача-детского хирурга, врача лабораторной диагностики/врача патологоанатома, с соблюдением междисциплинарного подхода 126. Хотя медикаментозная терапия во многих случаях оказывается эффективной, имеются данные, указывающие, что задержка в проведении необходимого оперативного лечения пагубно сказывается на исходе лечения пациента, в частности, увеличивая риск операционных осложнений 128. Риск колэктомии повышается в 5-9 раз при наличии гипоальбуминемии и лихорадки, а также при отсутствии более чем 40% уменьшения частоты стула за 5 дней внутривенной гормональной терапии при тяжелой атаке 129.
При тяжелой/сверхтяжелой атаке ЯК ключевым условием безопасного ведения пациента является совместное наблюдение пациента опытным врачом-гастроэнтерологом и врачом-детским хирургом (колопроктологом) с целью своевременного принятия решения о неэффективности консервативного лечения и проведении хирургического вмешательства 118.
При успешном выполнении данная операция обеспечивает возможность контролируемой дефекации через задний проход с удовлетворительным качеством жизни. В раннем послеоперационном периоде частота стула достигает 15-20 раз в сутки, с тенденцией к уменьшению на фоне диеты и симптоматической терапии (до 6-8 раз в сутки). Ночное недержание кала регистрируется в 8-19% случаев.
- При высоком риске осложнений детям с ЯК, (как и взрослым) при необходимости выполнения хирургического лечения в случае неэффективности консервативной терапии рекомендовано трехэтапное лечение: 1 этап — колэктомия с формированием терминальной илеостомы; 2 этап — ИАРА (формирование илеоанального / наданального илеоректального резервуарного анастомоза) с превентивной петлевой илеостомией проксимальнее анастомоза (дистальная петля подвздошной кишки); 3 этап — закрытие превентивной илеостомы 130. (УУР – B; УДД – 3)
Комментарий: В стационарах, где оперируют менее 10 пациентов в год (с формированием тонкокишечных резервуаров), допускается выполнение операции в объеме колэктомии с резекцией слизистой прямой кишки, низведением подвздошной кишки через серозно-мышечный цилиндр и формированием прямого илео-анального анастомоза по типу операции Соаве 120, 121, 131.
Плановое хирургическое вмешательство у детей с ЯК технически возможно выполнить в два этапа – с выполнением колэктомии, формированием илеоанального анастомоза и превентивной илеостомией, и последующим закрытием илеостомы, либо в один этап – без наложения илеостомы 132.
У пациентов с ранним дебютом ЯК (с моногенными формами ВЗК/первичным иммунодефицитом) хирургический этап лечения рассматривается как единственная возможность для достижения стабилизации состояния 133, 134.
3.2.4 Терапия осложнений колэктомии (осложнения после реконструктивных операций)
- В случае развития резервуарита у детей с ЯК рекомендовано назначение консервативной терапии — антибактериальные препараты системного действия курсом до 14 дней (препараты первой линии #метронидазол** 20-30 мг/кг/день в три приема (максимальная доза 500 мг) и #ципрофлоксацин** 30 мг/кг/день в 2 приема (максимальная доза 1 г), а также глюкокортикоиды для местного применения: #будесонид** (гранулы кишечнорастворимые) 9 мг в день с целью купирования воспаления 30, 135. (УУР — С; УДД — 5)
Комментарии: Наиболее частым осложнением колэктомии с формированием тонкокишечного резервуара является неспецифическое воспаление резервуара (резервуарит, «паучит» — от анг. pouch – мешок, резервуар), которое может возникнуть после операции в течение 10 лет, и даже в крупных специализированных центрах частота резервуарита колеблется от 15 до 75% 11. К симптомам резервуарита относятся учащение дефекаций, спастические боли в животе, тенезмы 136.
-
При рецидивирующем резервуарите и неэффективности терапии, включая биологическую и иммуносупрессивную, либо при выявлении болезни Крона подвздошной кишки, рекомендовано выполнить удаление резервуара 2, 30. (УУР — С; УДД — 5)
-
Рекомендовано при сохранении воспаления в оставшемся участке слизистой оболочке прямой кишки, оставляемой при наложении анастомоза (т.н. «каффите» от англ. cuff — манжетка) назначение местного лечения и антимикробной терапии (Другие бета-лактамные антибактериальные препараты (цефалоспорины второго или третьего поколения), фторхинолоны, метронидазол**, ректальных препаратов аминосалициловой кислоты и аналогичных препаратов (5-АСК) #месалазина** – 60 до 80 мг/кг в сутки (не более 4,8 г/сутки) в 2 приема или глюкокортикоиды для местного применения #будесонид** (гранулы кишечнорастворимые) по 9 мг в день) 30, 135, 137, 138. (УУР — С; УДД — 4)
Комментарии: «каффит» может быть причиной появления примеси крови в стуле или учащения стула.
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Специфические меры реабилитации пациентов с ЯК отсутствуют. Меры медицинской реабилитации направлены на профилактику осложнений консервативной терапии
-
Рекомендуется проведение психосоциальной поддержки (консультации медицинского психолога (Прием (тестирование, консультация) медицинского психолога первичный и повторный), мероприятия, способствующие повышению приверженности к терапии) с целью повышения качества жизни, облегчения адаптации к заболеванию и профилактики депрессии 32, 33. (УУР – С; УДД – 5)
-
У детей и подростков, особенно при нестабильном течении заболевания, рекомендовано учитывать возможное несоблюдение медицинских предписаний 139. (УУР – С; УДД – 4)
Комментарии: Отсутствие приверженности терапии ВЗК является важной и частой проблемой, и отмечается у 50%-66% детей 139, 140, особенно в подростковом возрасте. Отсутствие приверженности связано с повышенной активностью заболевания у подростков 140. Индивидуальные исследования среди подростков с ВЗК сообщили о наличие проблем, идентичные тем, которые существуют среди взрослых, а также собственно педиатрических конкретных проблем: страх побочных эффектов лекарств, убеждение, что болезнь является неактивной, убеждение, что лечение не работает, >1 ежедневного лекарства 139), забывчивость, вмешательство других видов деятельности, трудности при глотании таблеток 141, отсутствие мотивации, а также конфликты между родителями и ребенком 142.
Приверженность может быть оценена с помощью интервью подростка и родителей, мониторинга лекарственных средств (например, определения уровня метаболита тиопурина).
Приверженность к терапии может быть улучшена путем предоставления всеобъемлющей информации, касающейся предписанных лекарств, сохранения лекарственной нагрузки как можно ниже, а также однократного приема, когда это возможно, суточной дозы препаратов.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1. Профилактика
Язвенный колит характеризуется хроническим рецидивирующим течением. Целью диспансерного наблюдения является, в первую очередь, раннее выявление рецидивов заболевания, а также профилактика колоректального рака. Особенности наблюдения за пациентами, получающими иммуносупрессивную терапию и/или биологические препараты описаны в разделе 5.2. Пациенту следует разъяснить необходимость постоянного приема лекарственных препаратов, поскольку соблюдение предписаний по терапии существенно (в 2-2,5) раза снижает частоту обострений, а сама терапия является методом химиопрофилактики колоректального рака.
Воспалительные заболевания кишечника – состояния, которые характеризуются повышенным риском присоединения различных инфекций. Стратегиями по нивелированию рисков для пациента признаны своевременная диагностика инфекций, вакцинация и химиопрофилактика.
- Рекомендовано всем пациентам с БК перед началом терапии оценить статус иммунизации и, при наличии возможности, провести вакцинацию до старта иммуносупрессивной терапии с целью формирования защитного титра антител к вакциноуправляемым инфекциям 143. (УУР – С, УДД -4).
Комментарии: В ином случае, иммунизация может быть продолжена при установлении контроля над заболеванием, при необходимости его поддержания – на фоне назначения базисной терапии, строгого соблюдения диетологических и других рекомендаций гастроэнтеролога. Вакцинацию живыми вакцинами следует проводить не позднее, чем за 6 недель до начала приема иммуносупрессивной терапии (Иммунодепрессанты), однако, проведение вакцинации не должно приводить к задержке в назначении препаратов, необходимых для контроля заболевания.
- Рекомендована вакцинация согласно национальному календарю профилактических прививок 144. Пациентам на фоне иммуносупрессивной терапии противопоказаны живые аттенуированные вакцины 143. (УУР – С , УДД -4).
Комментарии: желательно проведение вакцинации также против пневмококковой, гемофильной инфекции типа b, гриппа, ветряной оспы, папилломавирусной и ротавирусной инфекции в чётком соответствии с возрастными ограничениями назначения иммунобиологических препаратов. Согласно МУ «Мед.противопоказания к проведению профилактических прививок». «Дозой кортикостероидов системного действия, вызывающей иммуносупрессию, является для преднизолона** 2 мг/кг/сут (или 20 мг/сут для детей с весом более 10 кг), принимаемой в течение 14 дней и более; введение живых вакцин этим детям допускается через 1 месяц и более после окончания терапии. Использование такой дозы в течение менее 2 недель или меньших доз в течение более длительного периода не ведет к развитию выраженной иммуносупрессии, так что введение живых вакцин возможно сразу по окончании курса лечения. Использование поддерживающих доз кортикостероидов системного действия, а также ингаляционное, местное или внутрисуставное их применение не является противопоказанием к введению любых вакцин».
Таким образом, временным противопоказанием к проведению вакцинации является применение высоких доз кортикостероидов системного действия.
Инактивированные вакцины могут быть назначены сразу после окончания приема высоких доз кортикостероидов системного действия, вызывающих состояние иммунологической супрессии (преднизолона** 2 мг/кг/сут (или 20 мг/сут для детей с весом более 10 кг, принимаемых в течение 14 дней и более).
Назначение аттенуированных вакцин возможно через месяц после окончания гормональной терапии в высоких дозах.
5.2. Диспансерное наблюдение
Мониторинг пациентов, получающих иммуносупресивную терапию.
- При назначении иммуносупрессивной и биологической терапии рекомендовано предварительное обследование на туберкулезную инфекцию, строгое соблюдение доз и графика введения препарата и регулярный контроль 31. (УУР – С; УДД – 5)
Комментарии:
-
Перед началом биологической терапии консультация врача-фтизиатра (Прием (осмотр, консультация) врача-фтизиатра первичный) – скрининг на туберкулез (см. соответствующие рекомендации);
-
Биологическая терапия требует строгого соблюдения доз и графика введения (нерегулярное введение повышает риск инфузионных реакций и неэффективности);
-
На фоне терапии Иммунодепрессантами обязательным является контроль уровня лейкоцитов (общий (клинический) анализ крови развернутый ежемесячно).
- С целью уменьшения рисков, связанных с назначением кортикостероидов системного действия, рекомендовано строгое соблюдение принципов гормональной терапии при ВЗК 30. (УУР – С; УДД – 5)
Комментарии: кортикостероиды системного действия не могут применяться в качестве поддерживающей терапии. При назначении гормональной терапии необходимо учитывать следующее:
-
Постепенное снижение дозы кортикостероидов системного действия до полной отмены – строго обязательно;
-
Суммарная продолжительность гормональной терапии не должна превышать 12 недель;
-
Обязательным является сопутствующий прием препаратов кальция, витамина D и его аналогов, ингибиторов протонного насоса;
-
В период лечения необходим регулярный контроль уровня глюкозы в крови.
6. Организация оказания медицинской помощи
Помощь пациентам с язвенным колитом оказывается во всех предусмотренных условиях: амбулаторно-поликлинических, дневного стационара, круглосуточного стационара, вне медицинской организации (в т.ч., скорая медицинская помощь).
Диагностику и динамическое наблюдение с подбором и коррекцией терапии осуществляет врач-гастроэнтеролог (врач-педиатр с опытом оказания медицинской помощи таким пациентам), также на всех этапах может быть необходимо участие врача-педиатра, врача общей практики (семейного врача), врача-инфекциониста, врача-ревматолога, врача-аллерголога-иммунолога, медицинского психолога и других (по клинической необходимости)
Показания для экстренной или неотложной госпитализации в медицинскую организацию:
1) наличие осложнений язвенного колита, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме.
2) наличие осложнений лечения (хирургическое вмешательство, биологическая терапия, гормональная и цитостатическая терапия и т.д.) язвенного колита.
Показания для плановой госпитализации в медицинскую организацию:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному лечению язвенного колита (хирургическое вмешательство, гормональная и цитостатическая терапия, биологическая и таргетная терапия), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показания к выписке пациента из медицинской организации:
1) завершение курса лечения, или одного из этапов оказания специализированной, втом числе высокотехнологичной медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в томчисле высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей лечение язвенного колита при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Риск тяжелого обострения ЯК в течение жизни составляет 15%, при этом вероятность тяжелой атаки выше у больных с тотальным поражением толстой кишки. При проведении адекватной противорецидивной терапии в течение 5 лет обострений удается избежать у половины пациентов, а в течение 10 лет – у 20% больных. В течение первого года после постановки диагноза вероятность колэктомии составляет 4-9% (при тяжелой атаке — около 50%), в дальнейшем с каждым годом заболевания риск колэктомии увеличивается на 1%. Факторами риска агрессивного течения ЯК являются детский и подростковый возраст на момент начала заболевания, прогрессирование поражения от дистального (проктита) к тотальному и первичный склерозирующий холангит.
К хроническим кишечным осложнениям ЯК относят дисплазию эпителия высокой степени и колоректальный рак. У больных с длительным анамнезом ЯК существенно повышен риск колоректального рака, что обусловливает необходимость регулярного обследования для выявления дисплазии эпителия толстой кишки. На вероятность развития рака влияют следующие факторы:
1) длительность анамнеза ЯК: риск колоректального рака составляет 2% при 10-летнем,8% — при 20-летнем и 18% — при 30-летнем анамнезе 126;
2) начало заболевания в детском и подростковом возрасте, хотя этот фактор может лишь отражать длительность анамнеза и не являться независимым предиктором колоректального рака 145;
3) наличие первичного склерозирующего холангита 146,
4) семейный анамнез колоректального рака,
5) тяжелые обострения ЯК в анамнезе или непрерывное течение ЯК. Последствиемвысокой активности ЯК может являться «воспалительный полипоз», также являющийся фактором риска развития колоректального рака 147.
Послеоперационные осложнения
В послеоперационном периоде возможны как общехирургические осложнения гнойно-септические инфекции, спаечная кишечная непроходимость 148, так и осложнения, связанные с особенностью течения иммунного заболевания — резервуарит и каффит 149, 150. В послеоперационном периоде возможны осложнения, обусловленные техникой формирования резервуара — несостоятельность резервуарно-анального анастомоза или резервуара, либо формирование стриктур или свищей, а также бесплодие у женщин, как результат спаечного процесса в малом тазу 151.
К факторам высокого риска послеоперационных осложнений, обусловливающих выбор объема операции, относится лечение кортикостероидами системного действия в высоких дозах, острый тяжелый колит, тяжелый дефицит веса и недифференцированный колит, не позволяющий исключить болезнь Крона толстой кишки 132. Отмечено влияние лекарственной терапии на частоту осложнений хирургических вмешательств. Так, прием преднизолона** в дозе более 20 мг в течение более чем 6 недель повышает риск хирургических осложнений 152. Предоперационный прием азатиоприна** не ухудшает исход хирургического лечения 153, 154, в то время как введение инфликсимаба** (разрешен детям с 6 лет) и #циклоспорина** незадолго до операции может увеличивать частоту послеоперационных осложнений, хотя данные по инфликсимабу** остаются противоречивыми 155, 156. Гипоальбуминемия, потеря веса в предоперационном периоде, так же, как и терапия кортикостероидами системного действия, увеличивают риск послеоперационных осложнений 157, 158.
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень достоверности доказательств | Уровень убедительности рекомендаций |
|---|---|---|---|
| 1. | Выполнено эндоскопическое исследование (колоноскопия с илеоскопией) в течение госпитализации | УУР — С | УДД — 5 |
| 2. | Выполнена биопсия слизистой оболочки толстой кишки (Биопсия тонкой кишки оперативная , Биопсия ободочной кишки эндоскопическая, Биопсия сигмовидной кишки с помощью видеоэндоскопических технологий, Биопсия прямой кишки с помощью видеоэндоскопических технологий) (при установлении диагноза) | УУР — С | УДД — 5 |
| 3. | Выполнено пальцевое исследование прямой кишки при первичной диагностике (Трансректальное пальцевое исследование ). | УУР — С | УДД — 5 |
| 4. | Проведено бактериологическое исследование кала на патогенные энтеробактерии и паразитологическое исследование кала (патологибактериологическое и микроскопическое исследование кала (Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудителя дизентерии (Shigella spp.), Микробиологическое (культуральное) исследование фекалий на возбудители брюшного тифа и паратифов (Salmonella typhi), Микробиологическое (культуральное) исследование фекалий/ректального мазка на возбудитель иерсиниоза (Yersinia enterocolitica), Микробиологическое (культуральное) исследование фекалий/ректального мазка на патогенные кампилобактерии (Campylobacter jejuni/coli) с определением чувствительности к антибактериальным препаратам, Микробиологическое (культуральное) исследование кала на аэробные и факультативноанаэробные микроорганизмы (Salmonella, Shigella, Yersinia, Campylobacter, Aeromonas, энтерогеморрагическую E. Coli), на яйца и личинки гельминтов) (при остром течении язвенного колита и/ или наличии подозрений на данную патологию. | УУР — С | УДД — 5 |
| 5. | Выполнено исследование кала на токсины Clostridium difficile (исследование кала на наличие токсина клостридии диффициле (Clostridium difficile), Иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile)проведение копрологического исследования для обнаружения токсигенных штаммов (тест амплификации нуклеиновых кислот – ПЦР) и/или токсинов A и B (ИФА) Clostridioides difficile)) (при наличии показаний) | УУР — С | УДД — 5 |
| 6. | Проведено назначение пероральных препаратов аминосалициловой кислоты и аналогичных препаратов в качестве терапии первой линии для индукции и поддержания ремиссии у детей при легкой и среднетяжелой активности язвенного колита | УУР — С | УДД — 5 |
| 7. | Проведена терапия кортикостероидами системного действия или инфликсимабом** или #циклоспорином** (при тяжелой атаке язвенного колита и при отсутствии медицинских противопоказаний) | УУР — С | УДД — 5 |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Баранов А.А., акад. РАН, профессор, д.м.н.; почетный президент Союза педиатровРоссии, советник руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, главный внештатный специалист педиатр Минздрава России
-
Намазова-Баранова Л. С., акад. РАН, профессор, д.м.н., президент Союза педиатровРоссии; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей ЦКБ РАН, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России
-
Разумовский А.Ю. — член-корр. РАН, д.м.н., проф., заведующий кафедрой детскойхирургии ФГАОУ ВО РНИМУ имени Н.И. Пирогова Минздрава России, Президент Российской ассоциации детских хирургов
-
Хавкин А.И., д.м.н., профессор, главный научный сотрудник отдела гастроэнтерологии НИКИ педиатрии им. академика Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Председатель Общества детских гастроэнтерологов, гепатологов и нутрициологов
-
Бельмер С.В., д.м.н., профессор, член Союз педиатров России (участие в исходной версии документа)
-
Боровик Т.Э., доктор медицинских наук, профессор, заведующая лабораторией питания здорового и больного ребенка Национального медицинского исследовательского центра здоровья детей Министерства здравоохранения Российской Федерации; профессор кафедры педиатрии и детской ревматологии Первого Московского государственного медицинского университета им. И.М.Сеченова (Сеченовский Университет), член Союза педиатров России
-
Волынец Г.В., д.м.н., главный научный сотрудник отдела гастроэнтерологии НИКИпедиатрии им. академика Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
-
Габрусская Т. В., к.м.н., член Союза педиатров России (участие в исходной версии документа)
-
Горелов А.В. член-корр. РАН, профессор, заместитель директора по научной работеФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора д.м.н., профессор кафедры детских болезней ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
-
Горячева О.А. к.м.н., педиатр, гастроэнтеролог, ГБУЗ «Морозовская детская городская клиническая больница ДЗМ», кафедры пропедевтики детских болезней педиатрического факультета РНИМУ имени Н.И. Пирогова
-
Гундобина О.С. кандидат медицинских наук, в.н.с., врач-гастроэнтеролог НИИ педиатрии и охраны здоровья детей ЦКБ РАН член Союза педиатров России
-
Гурова М.М., доктор медицинских наук, доцент, ведущий научный сотрудник лаборатории медико-социальных проблем в педиатрии НИЦ Санкт-Петербургского государственного педиатрического медицинского университета
-
Захарова И.Н., д.м.н., профессор, член Союза педиатров России (участие в исходной версии документа)
-
Зокиров Н.З., д.м.н., заведующий кафедрой Академии последипломного образования ФГБУ ФНКЦ ФМБА России, ФГБУ «ФНКЦ детей и подростков ФМБА России», член Союза педиатров России
-
Камалова А. А., д.м.н., доцент, член Союза педиатров России (участие в исходнойверсии документа)
-
Кайтукова Е.В. кандидат медицинских наук, главный врач НИИ педиатрии и охраны здоровья детей ЦКБ РАН, доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России член Союза педиатров России
-
Комарова Е.В. доктор медицинских наук, заместитель руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, врач-гастроэнтеролог, член Союза педиатров России
-
Корниенко Е. А., д.м.н., профессор, заведующая кафедрой гастроэнтерологии ФП иДПО (Факультета послевузовского и дополнительного профессионального образования) Санкт-Петербургского государственного педиатрического медицинского университета (СПбГПМУ), главный детский гастроэнтеролог и эндоскопист Санкт-Петербурга
-
Лохматов М. М., д.м.н., заведующий отделением эндоскопических исследований ФГАУ «НМИЦ здоровья детей» Минздрава России, профессор кафедры детской хирургии, урологии и уроандрологии Первого Московского государственного медицинского университета имени И.М. Сеченова, член Союза педиатров России
-
Новикова В.П., доктор медицинских наук, профессор, заведующая кафедрой пропедевтики детских болезней, заведующая лабораторией медико-социальных проблем в педиатрии НИЦ Санкт-Петербургского государственного педиатрического медицинского университета
-
Панфилова В. Н., д.м.н., доцент, член Союза педиатров России (участие в исходной версии документа)
-
Петряйкина Е. Е, д.м.н., директор РДКБ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, профессор кафедры факультетской педиатрии педиатрического факультета РНИМУ имени Н.И. Пирогова, профессор кафедры доказательной медицины медицинского института РУДН, Главный внештатный специалист детский эндокринолог Департамента здравоохранения города Москвы
-
Печкуров Д. В., д.м.н., профессор, член Союза педиатров России (участие в исходной версии документа)
-
Поддубный И.В. (д.м.н., проф., заведующий кафедрой детской хирургии, Московский государственный медико-стоматологический университет им. А.И.Евдокимова),
-
Подкаменев А.В. д.м.н., Санкт-Петербургский государственный педиатрический медицинский университет, доцент/проф. кафедры хирургических болезней детского возраста им. академика Г.А. Баирова),
-
Потапов А. С., д.м.н., профессор, главный научный сотрудник лабораторииразработки новых технологий диагностики и лечения болезней детского возраста ФГАУ «НМИЦ здоровья детей» Минздрава России; профессор кафедры педиатрии и детской ревматологии Первого Московского государственного медицинского университета им. И.М.Сеченова, член Союза педиатров России
-
Ревнова М. О., д.м.н., профессор, член Союза педиатров России
-
Рославцева Е.А., к.м.н., старший научный сотрудник лаборатории питания здорового и больного ребенка ФГАУ «НМИЦ здоровья детей» Минздрава России
-
Ситникова Е. П., д.м.н., профессор, член Союза педиатров России
-
Сичинава И.В., доктор медицинских наук, доцент по кафедре, профессор кафедрыдетских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), член Союза педиатров России
-
Скворцова Т.А., к.м.н., Главный внештатный детский специалист гастроэнтерологДепартамента здравоохранения г. Москва, руководитель Центра детской гастроэнтерологии и Центра ВЗК, заведующая отделением гастроэнтерологии ГБУЗ «Морозовская детская городская клиническая больница ДЗМ»
-
Сурков А.Н.,.к.м.н., заведующий гастроэнтерологическим отделением с гепатологической группой ФГАУ «НМИЦ здоровья детей» Минздрава России, член Союза педиатров России
-
Ткаченко М.А., к.м.н., педиатр, гастроэнтеролог, главный внештатный гастроэнтеролог Комитета по Здравоохранению Ленинградской области, доцент кафедры поликлинической педиатрии имени академика А.Ф. Тура СанктПетербургского государственного педиатрического медицинского университета.
-
Филиппов Д.В. к.м.н., Санкт-Петербургский государственный педиатрический медицинский университет, доцент кафедры хирургических болезней детского возраста им. академика Г.А. Баирова)
-
Федосеенко М.В., к.м.н., заведующая отделом разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, ведущий научный сотрудник, врач-педиатр НИИ педиатрии и охраны здоровья детей ЦКБ РАН Министерства науки и высшего образования Российской Федерации, доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза педиатров России
-
Федулова Э.Н., д.м.н., профессор, член Союза педиатров России (участие в исходной версии документа)
-
Цимбалова Е.Г., к.м.н., внештатный специалист МЗ МО-главный детский гастроэнтеролог МО, член Союза педиатров России, член детской группы Российского общества по изучению ВЗК
-
Шумилов П.В., д.м.н., профессор, член Союза педиатров России (участие в исходной версии документа)
-
Щербакова О.В., к.м.н., заведующая хирургическим отделением №1 РДКБ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член Российской Ассоциации детских хирургов член Союза педиатров России
-
Щиголева Н.Е., к.м.н., член Союза педиатров России (участие в исходной версии документа)
-
Яблокова Е.А. кандидат медицинских наук, доцент кафедры детских болезней ФГАОУВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет) член Союза педиатров России
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Врачи-педиатры
-
Врачи-гастроэнтерологи
-
Врачи-детские хирурги
-
Врачи-эндоскописты
-
Врачи-рентгенологи
-
Врачи-патологоанатомы
-
Врачи общей практики (семейные врачи)
-
Врачи-инфекционисты
-
Врачи-аллергологи-иммунологи
-
Студенты медицинских ВУЗов, обучающиеся в ординатуре и аспирантуре
Данные рекомендации составлены на основании данных литературы, Европейского доказательного консенсуса по диагностике и лечению ЯК, представленного Европейским обществом по изучению язвенного колита и болезни Крона.
Клинические рекомендации отражают мнение экспертов по ключевым вопросам. В клинической практике могут возникать ситуации, выходящие за рамки представленных рекомендаций, поэтому окончательное решение о тактике ведения каждого пациента должен принимать лечащий врач, на котором лежит ответственность за его лечение.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД)для методов диагностики (диагностических вмешательств)
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
-
Стандарт специализированной медицинской помощи детям при язвенном (хроническом) илеоколите (неспецифическом язвенном колите) (Приказ Минздрава России от 07.11.2012 N 649н).
-
Об утверждении порядка оказания педиатрической помощи (Приказ Министерстваздравоохранения Российской Федерации N 366н от 16 апреля 2012 г.).
-
Информация о лекарственных препаратах: https://grls.rosminzdrav.ru/.
Основные нормативно-правовые акты, регулирующие оказание паллиативной медицинской помощи
-
Федеральный закон «О внесении изменений в Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам оказания паллиативной медицинской помощи» от 06.03.2019 № 18-ФЗ.
-
Приказ Минздрава России № 345н, Минтруда России от 31.05.2019 № 372н «Обутверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
-
Приказ Минздрава России № 348н от 31 мая 2019 года «Об утверждении перечнямедицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому».
-
Приказ Минздрава России № 505н от 10 июля 2019 года «Об утверждении Порядкапередачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи».
-
Приказ МЗ РФ № 831 от 3 октября 2019 года «Об утверждении ведомственной целевой программы «Развитие системы оказания паллиативной медицинской помощи».
Прочие нормативно-правовые документы, с учетом которых разработаны клинические рекомендации:
-
Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровьяграждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011 г., № 48, ст. 6724);
-
Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ – 10);
-
Приказ МЗ РФ от 20 декабря 2012г. № 1183н Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников.
-
Приказ МЗ РФ от 23 июля 2010 г. № 541н. Единый квалификационный справочникдолжностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
-
Федеральный закон от 25.12.2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций».
-
Приказ Минздрава России № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
-
Приказ Минздрава России от 13.10.2017 N 804н «Об утверждении номенклатуры медицинских услуг».
-
Приказ Министерства труда и социальной защиты РФ от 27 августа 2019 г. n 585н «Оклассификациях и критериях, используемых при осуществлении медикосоциальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы» (вступает в силу с 1 января 2020 года);
-
Приказ Министерства здравоохранения РФ от 14 января 2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения»
-
Приказ Министерство здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. № 494
-
Информационное письмо Минздрава России по возможности закупки лекарственного препарата по торговому наименованию (https://www.rosminzdrav.ru/news/2019/12/18/13043-minzdrav-podgotovil-informatsionnoe-pismo-po-vozmozhnosti-zakupki-lekarstvennogo-preparata-po-torgovomu-naimenovaniyu);
Примеры формулировок диагноза:
-
Язвенный колит, проктит (E1), легкая атака (PUCAI — 30 баллов). Отсутствие тяжелой атаки в анамнезе (S0).
-
Язвенный колит, левостороннее поражение (E2), среднетяжелая атака (PUCAI – 50 баллов). Наличие тяжелой атаки в анамнезе (S1). Обострение. Внекишечные проявления (первичный склерозирующий холангит).
-
Язвенный колит, левостороннее поражение (E2), атипичный фенотип (скачкообразное поражение слепой кишки), среднетяжелая атака (PUCAI – 50 баллов), отсутствие тяжелой атаки в анамнезе (S0).
-
Язвенный колит, панколит (E4), тяжелая атака (PUCAI – 80 баллов) (S1). Гормональная резистентность. Токсический мегаколон.
-
Неклассифицированное воспалительное заболевание кишечника, тяжелая атака (PUCAI – 80 баллов) (S1). Гормональная резистентность.
-
Язвенный колит, панколит (E4). Отсутствие тяжелой атаки в анамнезе (S0). Клинико-эндоскопическая ремиссия.
Приложение В. Информация для пациента
Язвенный колит (ЯК) – хроническое воспалительное заболевание, характеризующееся повторяющимися острыми обострениями, после которых следуют периоды ремиссии. Многочисленные исследования показывают, что без лечения у больных ЯК существенно снижается качество жизни, повышается риск развития колоректального рака и смертность. Несвоевременное и недостаточное лечение может привести к прогрессированию заболевания и не только нарастанию симптомов (диареи с кровью, болей в животе), но и к системным проявлениям: снижению массы тела, лихорадке, анемии. Тяжелое обострение язвенного колита представляет угрозу для жизни из-за риска перфорации (прободения) кишки и развития перитонита. Самое главное, что даже при слабо выраженных симптомах или их отсутствии в кишке может сохраняться воспаление. При неполноценном лечении э постоянное воспаление приводит к развитию колоректального рака, который при ЯК протекает особенно агрессивно. Только регулярная противовоспалительная терапия может уменьшить вероятность развития опухоли.
Язвенный колит – достаточно редкое заболевание, человек с этой болезнью должен по возможности наблюдаться у врача, специализирующегося на лечении именно данной патологии, и строго следовать его рекомендациям по длительной, нередко, пожизненной, лекарственной терапии. Ни уровень физической нагрузки, ни прием конкретных продуктов питания, не влияют на риск обострения язвенного колита так, как влияет на него нерегулярный прием лекарств и несвоевременное обращение к специалисту.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Педиатрический индекс активности язвенного колита
Оригинальное название: Pediatric Ulcerative Colitis Activity Index: PUCAI
Источник: 32
Тип: шкала оценки
Назначение: оценка активности язвенного колита
Содержание (шаблон):
Ключ (интерпретация):
Критерии PUCAI:
-
Ремиссия — до 10 баллов (чувствительность 89%, специфичность 89%)
-
Минимальная активность (легкая атака) — 10-34 балла (чувствительность 95%, специфичность 95%)
-
Умеренная активность (среднетяжелая атака) — 35-64 балла (чувствительность 92%, специфичность 94%)
-
Высокая активность (тяжелая атака) — более 65 баллов
-
Клинически значимый ответ соответствует снижению PUCAI не менее, чем на 20 баллов.
Приложение Г2. Эндоскопический индекс активности язвенного колита (UCEIS ) 42
Оригинальное название: Ulcerative Colitis Endoscopic Index of Severity (UCEIS)
Источник: 42
Тип: шкала оценки
Назначение: эндоскопическая оценка активности язвенного колита
Ключ (интерпретация): ремиссия – 0-1 баллов, минимальная активность – 2-4 балла, умеренная активность – 5-6 баллов, 7-8 баллов – высокая активность.
Приложение Г3. Эндоскопический индекс активности язвенного колита Mayo ES (с оценкой состояния слизистой оболочки по Schroeder) 43
Оригинальное название: Mayo Endoscopy Score (MES)
Источник: 43
Тип: шкала оценки
Назначение: эндоскопическая оценка активности язвенного колита
Ключ (интерпретация): отсутствие активности (0 баллов), легкая степень активности (1 балл), умеренная степень активности (2 балла) и тяжелая (высокая) степень активности (3 балла).
Приложение Г4. Основные заболевания, с которыми следует проводить дифференциальную диагностику ЯК у детей
| Дифференциальный диагноз | Клиническая картина | Исследования |
|---|---|---|
| Инфекционный колит (часто) | Острое начало, часто с лихорадкой и рвотой. Редко продолжается более 3 недель | Анализ кала для микробиологических исследований, включая Clostridium difficile и паразитов, возбудителей туберкулеза и Yersinia при наличии показаний |
| Аллергический колит (часто у младенцев) | Экзема, аллергия на молочный белок в анамнезе, отягощенная наследственность по атопии | Уровень специфического/общего IgE, кожные тестирование (с 3 лет), биопсия толстой кишки (эозинофильная инфильтрация, лимфофолликулярная гиперплазия), диагностическая элиминационная диета с исключением белков коровьего молока и других аллергенов |
| Васкулит (редко) | Сопутствующие внекишечные проявления (поражения кожи, суставов и глаз) | Анализ HLA-B5, биопсия кожи, серологические маркеры |
| Иммунодефицитные состояния (редко) | Развитие колита в первые месяцы жизни, часто с вовлечением перианальной зоны; воспаление волосяных фолликулов или экзема; другие грибковые или бактериальные инфекции | Консультация врача-аллергологаиммунолога во всех случаях колита с ранним развитием |
Приложение Г5. Алгоритм диагностики и лечения детей с ЯК
Примечания: Медикаментозные средства лечения ЯК следует разделить на препараты для индукции ремиссии (Аминосалициловая кислота и аналогичные препараты [5-АСК], кортикостероиды системного действия, Ингибиторы фактора некроза опухоли альфа [иФНО], ингибиторы кальциневрина) и для поддержания ремиссии (Аминосалициловая кислота и аналогичные препараты (5-АСК), тиопурины (другие иммунодепрессанты), Ингибиторы фактора некроза опухоли альфа).
1При любой тяжести активного заболевания следует исключить следующие состояния: инфекционный колит (включая цитомегаловирусный (ЦМВ) и Cl.difficile), 5-АСК-ассоциированный колит, непереносимость лактозы, синдром раздраженного кишечника, ошибочный диагноз, целиакия и схожие состояния.
2В отличие от взрослых, эндоскопическая оценка слизистой оболочки прямой кишки у детей представляется более инвазивной для рутинного мониторирования активности заболевания и ответа на терапию. В связи с этим, оценивать статус заболевания предпочтительнее на основании неинвазивных косвенных маркеров активности колита.
3 Аминосалициловая кислота и аналогичные препараты (5-АСК) назначаются в дозе 60-80 мг/кг/сутки до 4,8 г/сутки. Последние данные свидетельствуют, что однократный прием 3 г Аминосалициловая кислота и аналогичные препараты (5-АСК) не менее эффективен, чем назначение этой дозы на 2 приема.
4Клизмы с Аминосалициловая кислота и аналогичные препараты (5-АСК)(25 мг/кг, до 1 г) более эффективны, чем клизмы с кортикостероидами системного действия.
5При отсутствии улучшения (т.е. при снижении PUCAI менее чем на 20 пунктов) после 7-10 дней или при увеличении PUCAI на ≥20 пунктов на любом этапе лечения следует рассмотреть применения внутривенных кортикостероидов системного действия или назначение Ингибиторов фактора некроза опухоли альфа (реже – #такролимус**). При гормональной зависимости следует усилить поддерживающую терапию.
6. Turner D et al 2011 29.
7Ответ определяется как снижение PUCAI не менее чем на 20 пунктов; в то же время, целью индукционной терапии является достижение полной клинической ремиссии (PUCAI <10).
8Если инфликсимаб** назначался пациенту, ранее не получавшему тиопурины (Другие иммунодепрессанты), после достижения полной ремиссии возможно их подключение к терапии и последующая отмена инфликсимаба** через 4-8 месяцев. В отдельных случаях после длительной устойчивой ремиссии возможен постепенный переход на терапию Аминосалициловая кислота и аналогичные препараты (5-АСК), если ранее не отмечалась неэффективность Аминосалициловая кислота и аналогичные препараты (5-АСК).
9На настоящий момент отсутствуют данные, позволяющие рекомендовать подключение тиопуринов (Другие иммунодепрессанты) к терапии инфликсимабом** у детей, у которых тиопурины (Другие иммунодепрессанты) ранее оказались неэффективны. Показано прекращение терапии тиопуринами (Другие иммунодепрессанты) после 4-8 месяцев комбинированной терапии, особенно для мальчиков.
Приложение Г6 Расшифровка примечаний
** – лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2021 год (Распоряжение Правительства РФ от 12.10.2019 № 2406-р, от 23 ноября 2020 г. № 3073-р)
# — применение off-label – вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет
Резюме. В статье рассмотрены современные подходы к лечению язвенного колита. Указывается, что для выбора тактики и алгоритма лечения важное значение имеют протяженность поражения, а также степень тяжести текущего обострения, классифицируемая как легкая, средняя и тяжелая. Критерии полезны для оценки необходимости госпитализации, но не учитывают такие важные признаки, как ночные симптомы, внекишечные проявления, эндоскопическая активность. Степень тяжести обострения заболевания характеризует его тяжесть в данный момент, но может не отражать долгосрочное совокупное бремя болезни. Протяженность поражения, в свою очередь, может влиять на выбор способа введения препарата. Выделяют проктит (распространение воспаления до ректосигмоидного угла), левостороннее (воспаление ограничено селезеночным изгибом) и распространенное поражение (воспаление распространяется проксимальнее селезеночного изгиба, включая панколит). Для достижения целей терапии определен временной период от начала лечения до ожидаемого клинического ответа, ремиссии и эндоскопического заживления. Непосредственными и краткосрочными целями названы клинический ответ и ремиссия, а также нормализация уровня С-реактивного белка. В качестве официальной промежуточной цели лечения рекомендовано снижение фекального кальпротектина до оптимального диапазона. Степень повышения концентрации фекального кальпротектина коррелирует с тяжестью воспаления, и при легкой степени заболевания ее значения могут быть нормальными или пограничными. В этой ситуации повторный контроль фекального кальпротектина с течением времени может прояснить клиническую картину. Это было продемонстрировано в недавнем проспективном когортном исследовании, где последовательное определение фекального кальпротектина с интервалом в 1 месяц являлось наилучшим предиктором обострения до появления клинических симптомов. Наряду с эндоскопическим заживлением слизистой оболочки, долгосрочной целью названо восстановление качества жизни и отсутствие инвалидности. В статье рассмотрено применение для лечения язвенного колита препаратов группы месалазина, топических и системных стероидов, а также рассматриваются подходы к мониторингу заболевания и долгосрочному ведению пациентов.
«Лечащий врач» осваивает новые пространства и форматы. Вся актуальная информация (и даже больше) – в нашем телеграм канале. Подписывайтесь!
Язвенный колит (ЯК) – хроническое воспалительное заболевание толстой кишки, характеризующееся периодами ремиссии и обострений, с возрастающей частотой и распространенностью во всем мире [1, 2]. Заболевание носит прогрессирующий характер, с риском развития дисплазии, колоректального рака, потребности в колэктомии [1]. С течением времени возможно проксимальное распространение воспаления [3], у 12,5-48% пациентов возможно формирование псевдополипоза [4]. Исходом длительного неконтролируемого хронического воспаления может быть нарушение моторики толстой кишки, формирование симптома «водопроводной трубы», для которого характерна хроническая водянистая диарея [5] и аноректальная дисфункция с императивностью позывов [6]. В настоящее время конечной целью лечения ЯК является поддержание связанного со здоровьем качества жизни (QOL) и предотвращение инвалидности [7]. Для реализации данной цели важно достичь клинической ремиссии и эндоскопического заживления слизистой, что связано с улучшением долгосрочных исходов [8-10]. Препараты 5-аминосалициловой кислоты (5-АСК) являются базисным средством для лечения язвенного колита легкой и средней степени тяжести. Местные или системные стероиды могут быть назначены только для купирования обострения. При средней и тяжелой степени язвенного колита в случае неэффективности стероидов и иммуносупрессоров рекомендованы биологические препараты и малые молекулы. До 15% пациентов с ЯК подвергаются хирургическому лечению [11].
Общие подходы к ведению ЯК
Для выбора тактики и алгоритма лечения важное значение имеет протяженность поражения, а также степень тяжести текущего обострения, оцениваемая с помощью критериев Truelove и Witts [12] и классифицируемая как легкая, средняя и тяжелая. Критерии полезны для оценки необходимости госпитализации, но не учитывают такие важные признаки, как ночные симптомы, внекишечные проявления, эндоскопическая активность.
Важно понимать, что степень тяжести обострения заболевания характеризует его тяжесть в данный момент, но может не отражать долгосрочное совокупное бремя болезни.
Протяженность поражения, в свою очередь, может влиять на выбор способа введения препарата. Согласно Монреальской классификации [13] выделяют проктит (распространение воспаления до ректосигмоидного угла), левостороннее (воспаление ограничено селезеночным изгибом) и распространенное поражение (воспаление распространяется проксимальнее селезеночного изгиба, включая панколит). Важно, что с течением времени болезнь может прогрессировать [14, 15] и являться негативным прогностическим маркером.
Данные определения протяженности поражения несколько произвольны. Поскольку при проктосигмоидите (ЯК, распространенность которого ограничена прямой кишкой и частью сигмовидной кишки) часто применяют местные методы лечения, для описания этой локализации поражения используется термин «дистальный колит».
Естественное течение ЯК
При постановке диагноза у большинства пациентов имеет место левостороннее поражение (40%) легкой и средней степени тяжести [16]. В течение первых 10 лет клиническое течение ЯК чаще бывает хроническим ремиттирующим и рецидивирующим, с риском клинического обострения в 70-80% случаев [2, 17]. Вероятность прогрессирования болезни в проксимальном направлении у пациентов с ЯК через 5 лет составляет 10-19%, а через 10 лет – до 28% [11]. При обострении ЯК в данных условиях увеличивается потребность в назначении иммуносупрессоров, биологических препаратов, малых молекул или хирургическом вмешательстве [18, 19]. Возраст начала болезни, по-видимому, влияет на течение ЯК, поскольку пациенты с дебютом заболевания до 40 лет, как правило, имеют более агрессивное его течение, высокую потребность в назначении иммуносупрессивной терапии и хирургическом вмешательстве по сравнению с дебютом заболевания в более старшем возрасте [20]. У пациентов с ЯК более высокий риск развития колоректального рака, особенно в определенных клинических ситуациях, например, при длительном течении заболевания, первичном склерозирующем холангите и неконтролируемом воспалении [21, 22]. В последние десятилетия снизился риск хирургического вмешательства при ЯК, однако он все еще остается значимым: через 5 лет вероятность хирургического вмешательства составляет 11,6%, а через 10 лет — 15,6% [23].
Предикторы плохого прогноза ЯК
Комплексная оценка тяжести ЯК включает наличие предикторов агрессивного течения заболевания, необходимость колэктомии и ответ на терапию.
Пациенты с предшествующей госпитализацией по поводу ЯК подвергались более высокому риску последующей колэктомии. Данным пациентам может быть полезна более агрессивная начальная терапия. Например, больной, удовлетворяющий критериям ЯК легкой – средней степени тяжести, но с предыдущей госпитализацией и стероидной зависимостью, должен рассматриваться в качестве кандидата на лечение, обычно рекомендуемого больным со средней – тяжелой степенью тяжести, поскольку стероидозависимость и предыдущая госпитализация влияют на исходы заболевания.
Цели терапии
Руководство STRIDE II под эгидой Всемирной организации по изучению воспалительных заболеваний кишечника (ВЗК) обновило рекомендации, опубликованные в 2015 г., и разработало 13 рекомендаций по лечению ВЗК [7]. В зависимости от препарата для достижения целей терапии определен временной период от начала лечения до ожидаемого клинического ответа, ремиссии и эндоскопического заживления. Непосредственными и краткосрочными целями названы клинический ответ и ремиссия, а также нормализация уровня С-реактивного белка (СРБ). В качестве официальной промежуточной цели лечения рекомендовано снижение фекального кальпротектина (ФК) до оптимального диапазона. Наряду с эндоскопическим заживлением слизистой оболочки, долгосрочной целью названо восстановление качества жизни и отсутствие инвалидности. Гистологическое заживление признано важным аспектом при ЯК, однако официально оно пока не одобрено в качестве новой цели лечения.
Достижение комбинированной клинической и эндоскопической ремиссии у пациентов с впервые выявленным ЯК, по сравнению с разрешением только симптомов, связано со снижением частоты клинического обострения, госпитализации и колэктомии после 5 лет наблюдения [24].
Определение клинической ремиссии
Клиническая ремиссия – это разрешение ректального кровотечения, нормализация частоты и характера стула, что является независимым предиктором выживаемости без обострения и колэктомии, а также положительных долгосрочных исходов [25].
Как правило, в клинических исследованиях для оценки активности ЯК и ответа на терапию используется индекс Мейо, который включает клинические и эндоскопические параметры: частоту стула, ректальное кровотечение, признаки эндоскопической активности и общую врачебную оценку [26].
Стандартом для оценки симптомов у взрослых больных ЯК стал опросник по результатам, сообщаемым пациентом (PRO2), который состоит из двух субъективных пунктов оценки Мейо, а именно – частоты/характера стула и ректального кровотечения, и используется в сочетании с эндоскопической оценкой воспаления [27, 28]. Причем отсутствие ректального кровотечения демонстрирует большую чувствительность, чем нормализация стула [28].
Несмотря на достижение клинической ремиссии, пациенты с ЯК нередко имеют остаточные эндоскопические и/или гистологические признаки активности заболевания [29, 30].
Определение эндоскопического заживления слизистой
Эндоскопической ремиссией считается эндоскопическая оценка по шкале Мейо 0 или 1, однако новые данные демонстрируют, что оценка 0 связана с более низким риском клинического обострения в последующем по сравнению с оценкой 1 [31, 32].
Клиническое обострение может произойти у пациентов, у которых была достигнута эндоскопическая ремиссия, так как в отсутствие эндоскопических признаков активности заболевания может сохраняться гистологическое воспаление.
Роль гистологической ремиссии: современный взгляд
Гистологическая активность стала рациональной терапевтической целью в профилактике долгосрочных осложнений [33]. Действительно, при ЯК достижение гистологической ремиссии, по сравнению только с эндоскопической, было ассоциировано с более низкими показателями клинического обострения, применения кортикостероидов, госпитализации и развития неоплазии [34, 35]. Возможно, в будущем гистологическая ремиссия будет представлять собой отдельную цель лечения ЯК.
На сегодняшний день пациентам с ЯК, достигшим клинической и эндоскопической ремиссии, но с сохраняющимся гистологическим воспалением, не рекомендована эскалация лечения. Однако персистирующая гистологическая активность, возможно, должна насторожить в отношении любой деэскалации лечения.
Качество жизни: новая долгосрочная цель
Оба типа ВЗК являются хроническим прогрессирующим заболеванием и часто приводят к ухудшению качества жизни и инвалидности. ВЗК негативно влияют на многие аспекты жизни и на общее благополучие по сравнению с контрольной группой здоровых субъектов [36-38]. От 19% до 22% пациентов с ВЗК являются функционально неполноценными и прекращают активно участвовать в социальной или трудовой деятельности [39].
Группа Всемирной организации по изучению ВЗК – Delphi проголосовала за включение восстановления качества жизни и снижения инвалидности в качестве официальных долгосрочных целей лечения, независимо от других объективных показателей воспаления [7]. Поскольку заживление слизистой также является целью лечения, совместное принятие решений с пациентом имеет первостепенное значение для достижения баланса между различными целями, так как не всегда все цели могут быть достигнуты. Тем не менее качество жизни (в том числе связанное с питанием), инвалидность, усталость, депрессия, беспокойство, сексуальная дисфункция и внешний вид – все это должно в значительной степени регулярно учитываться при оценке состояния пациентов с ВЗК.
В одной из работ определялась взаимосвязь между ФК и связанным со здоровьем качеством жизни [40]. Поддерживая концепцию, что «пациент находится в центре внимания», необходимо независимо от объективных маркеров воспаления регулярно оценивать качество жизни, даже если оно не рассматривается как формальная цель.
Дополнительные методы оценки активности ЯК
Ввиду высокой достоверности, простоты и доступности растет интерес к проведению ультразвукового исследования для оценки активности ЯК. С эндоскопической активностью по шкале Мейо хорошо ассоциировалось утолщение стенки толстой кишки, усиление допплеровского кровотока, гипо-эхогенность стенки и наличие лимфатических узлов [41]. Хотя данное исследование не является методом оценки ремиссии, его доступность у постели больного делает этот инструмент ценным исследованием для интуитивной оценки воспаления кишечника при ЯК.
Препараты группы 5-АСК
Препараты группы месалазина (5-аминосалицилат; 5-АСК) являются первой линией терапии у пациентов с ЯК легкой и средней степени тяжести как для индукции, так и для поддержания ремиссии, вне зависимости от протяженности поражения [29]. Более 90% пациентов получают 5-AСК в течение первого года после постановки диагноза, при этом от 60% до 90% продолжают прием препарата до 15 лет [16]. В течение более чем 30 лет месалазин является эффективным препаратом с хорошим профилем безопасности [42, 42], обладающим противовоспалительной активностью в просвете толстой кишки с минимальной системной биодоступностью [43].
Примечательно, что, несмотря на обсуждение различий в распределении разных препаратов месалазина в толстой кишке, в сравнительных исследованиях не наблюдалось существенных различий в их эффективности [42]. По этой причине пациенты с умеренно активным ЯК, которым не удается достичь ремиссии с помощью адекватной дозы пероральной формы 5-АСК, вряд ли достигнут ремиссии при переходе на альтернативную пероральную форму 5-АСК.
В отличие от других пероральных форм месалазина, Пентаса состоит из микрогранул, покрытых этилцеллюлозой, которые обеспечивают уникальный механизм pH-независимого пролонгированного высвобождения, с доступностью более высоких доз препарата для упрощенного дозирования один раз в день [44]. Было проанализировано 12 исследований, в которых 3674 пациента получали лечение Пентасой, из них 1154 участвовали в рандомизированных клинических исследованиях (РКИ) [45]. Была доказана эффективность и безопасность перорального препарата как в индукции, так и поддержании ремиссии ЯК. Пентаса 2-4 г в день превосходила плацебо в индукции (разница абсолютного риска [ARD] через 8 недель – 0,14, 95% ДИ 0,07-0,21; p < 0,001) и поддержании (ARD 6-12 месяцев 0,18, 95% ДИ 0,04 ± 0,33; p < 0,05) ремиссии. Согласно данным РКИ, по сравнению с другими 5-AСК Пентаса имела аналогичную эффективность в индукции (ARD < 0,001, 95% ДИ −0,05-0,05) и поддержании (ARD – 0,01, 95% ДИ −0,07-0,08) ремиссии.
В одном из исследований показана связь между приемом Пентасы и улучшением качества жизни пациентов с ЯК. Hanauer и соавт. [46] показали, что пероральный прием месалазина с пролонгированным высвобождением (2 или 4 г/день) значительно превосходит плацебо в улучшении каждого из 12 оцененных функциональных параметров качества жизни (p < 0,05) [47].
Другие преимущества приема Пентасы обусловлены наличием препарата в различных дозах и формах выпуска, включая гранулы 2 г и 4 г, с возможностью приема ежедневной дозы один раз в сутки для повышения приверженности пациента [48]. В исследовании MOTUS [49] было показано, что однократный прием суточной дозы гранул не уступал двукратному приему той же суточной дозы 4 г в индукции ремиссии при ЯК легкой – средней степени тяжести. Аналогичным образом исследование PODIUM [50] показало, что однократный режим приема гранул Пентаса 2 г не уступает и даже превосходит режим приема по 1 г два раза в день в поддержании клинической ремиссии у пациентов с ЯК (p = 0,024).
Пациентам с легким или средней степени тяжести ЯК для индукции ремиссии рекомендован прием 5-АСК в дозе ≥ 2 г/день [51].
Недавний Кокрейновский метаанализ 54 РКИ при участии пациентов с ЯК, получавших 5-AСК для индукции ремиссии [42], продемонстрировал превосходство 5-AСК в индукции ремиссии по сравнению с плацебо. Клиническая ремиссия не наступила у 71% (1107/1550) больных, получавших 5-АСК, по сравнению с 83% (695/837) пациентов, принимавших плацебо (ОР – 0,86; 95% ДИ от 0,82 до 0,89; 2387 участников, 11 исследований; высокий уровень). В этом исследовании также наблюдалась связь частоты достижения ремиссии с дозой 5-АСК.
Американская гастроэнтерологическая ассоциация рекомендует распространенный ЯК легкой и средней степени тяжести лечить стандартными дозами перорального месалазина (от 2 г до 3 г/сут) [52]. Эти рекомендации были сделаны на основе эквивалентности, с точки зрения эффективности и безопасности, между пероральными дозами 5-АСК от 2 г до 2,4 г/сут и более высокими дозами 4,8 г/сут.
Учитывая отсутствие дозозависимой токсичности и потенциальные риски недостаточного контроля заболевания на более низких дозах перорального месалазина, на основании недавнего метаанализа по оценке эффективности пероральных, топических препаратов 5-АСК и их комбинации в лечении ЯК [53], следует отдавать предпочтение дозам перорального месалазина 4 г/сут или выше, особенно у пациентов с высоким риском неудачи лечения стандартными дозами. Американская гастроэнтерологическая ассоциация рекомендует высокодозную терапию 5-АСК (> 3,0 г/сут) группе пациентов со средней степенью тяжести ЯК, наивных к 5-АСК, с недостаточным ответом на стандартную дозу месалазина, с потребностью в системных стероидах [52].
У пациентов с проктитом в первую очередь для индукции ремиссии рекомендуют топические (ректальные) формы 5-AСК в дозе ≥ 1 г/сут. При дистальном колите показаны пероральные 5-AСК (≥ 2 г/сут) в сочетании с местными (ректальными) формами 5-AСК [51].
Топические стероиды
Пациентов, которые не реагируют или не достигают ремиссии на препаратах 5-АСК, можно лечить кортикостероидами. Ректальные кортикостероиды можно попробовать в качестве дополнительной терапии второй линии для индукции ремиссии при проктите или дистальном колите. Существуют ограниченные доказательства преимущества назначения в некоторых клинических ситуациях комбинации ректального 5-АСК с ректальными формами кортикостероидов. Возможно, это актуально для пациентов, которые не реагируют на начальную ректальную терапию 5-АСК [54].
Пациентам с активным ЯК легкой и средней степени тяжести с непереносимостью и/или неэффективностью 5-АСК рекомендуется назначать кортикостероиды с высвобождением в толстой кишке для индукции ремиссии [51]. Эффективность лечения таким кортикостероидом будесонидом MMX в дозе 9 мг один раз в день для индукции ремиссии у взрослых пациентов с активным ЯК легкой и средней степени тяжести была изучена в трех исследованиях [55-57]. Было проанализировано 542 пациента, получавших будесонид ММХ в течение 8 недель. Кортикостероиды с высвобождением в толстой кишке превосходили плацебо в индукции клинической ремиссии и клинического ответа (RR 2,86; 95% ДИ 1,62-5,04 и RR 1,46; 95% ДИ 1,11-1,93 соответственно).
В двух исследованиях [55, 56] с наблюдением 510 пациентов в течение 8 недель эндоскопический ответ с большей вероятностью был достигнут с помощью будесонида ММХ по сравнению с плацебо (ОР 1,43; 95% ДИ 1,10-1,84). Во всех трех исследованиях показатели серьезных НЯ и любых НЯ не различались между будесонид ММХ и плацебо (RR 0,88; 95% ДИ 0,33-2,41 и RR 1,04; 95% ДИ 0,79-1,37 соответственно).
Объединенный анализ данных обоих исследований третьей фазы показал комбинированную клиническую и эндоскопическую частоту ремиссии 17,7% для будесонида MMX 9 мг/сут против 6,2% для плацебо (отношение шансов [OR] 3,3; 95% ДИ 1,7-6,4). В отличие от других методов лечения, включая 5-АСК, не существует данных о роли будесонида MMX в качестве поддерживающей терапии. Это говорит о том, что наиболее подходящее применение будесонида MMX может быть у пациентов с легким – средней степени тяжести ЯК, которые не реагируют или не переносят оптимизированную терапию 5-AСК.
В РКИ, сравнивающем будесонид MMX 9 мг/сут с плацебо у пациентов с легким или средней степени тяжести ЯК, несмотря на пероральную терапию 5-AСК, выявили значительное улучшение первичной конечной точки комбинированной клинической и эндоскопической ремиссии (13% против 7,5%; р = 0,049), а также гистологическое заживление в группе будесонида ММХ (27% против 17,5%; р = 0,016).
Системные стероиды
Метаанализ показал, что системные кортикостероиды эффективнее плацебо в индукции ремиссии (RR 0,65; 95% ДИ 0,45-0,93) [58]. Типичные стартовые дозы перорального преднизолона составляют 40-60 мг в день, обычно в разовой дозе. Не наблюдалось никаких преимуществ при начальной дозе, превышающей 60 мг/сут [59]. Клинический ответ ожидается в течение 5-7 дней после начала лечения, а затем доза стероидов должна быть постепенно снижена [59, 60]. Общий подход заключается в снижении на 5-10 мг в неделю до достижения 20 мг, а затем в снижении на 2,5-5 мг в неделю до завершения курса лечения и отмены препарата. Кортикостероиды не следует использовать для поддержания ремиссии из-за отсутствия долгосрочной эффективности и риска побочных эффектов [61, 62].
Если ремиссия достигается с помощью кортикостероидов, для поддерживающей терапии у пациентов, которые до обострения не получали 5-АСК или являются вновь диагностированными, обычно используют препараты 5-АСК. Пациентам с плохими прогностическими факторами (молодой возраст начала заболевания, распространенный колит, глубокие язвы), которым требуются два или более курса системных стероидов в год или у которых невозможно эффективное снижение дозы стероидов (т. е. имеет место стероидозависимость), следует оптимизировать терапию назначением тиопуринов, биологических препаратов или малых молекул [63].
Мониторинг заболевания и долгосрочное ведение
Стратегия лечения ЯК превратилась в подход «лечение до цели», при котором пациенты регулярно обследуются, чтобы убедиться, что они достигают строгих целей, касающихся контроля активности заболевания. Пациенты должны наблюдаться регулярно, как минимум каждые 3 месяца, до разрешения симптомов заболевания, а затем по крайней мере каждые 6-12 месяцев с целью контроля за воспалением [64].
Простота и низкая стоимость неинвазивных биомаркеров, таких как СРБ и ФК, позволяют использовать их в качестве мониторинга до достижения ремиссии и последующей регулярной оценки на протяжении всего течения заболевания.
СРБ, СОЭ и ФК коррелируют с эндоскопической активностью, хотя ФК значительно более чувствителен, чем СРБ или СОЭ [64-66]. Высокая корреляция ФК с клинической активностью заболевания, эндоскопическими и гистологическими показателями была описана у детей и взрослых [67-72]. Поэтому ФК был предложен в качестве инструмента мониторинга для оценки ответа на терапию и субклинического обострения [73].
Степень повышения концентрации ФК коррелирует с тяжестью воспаления, и при легкой степени заболевания ее значения могут быть нормальными или пограничными. В этой ситуации повторный контроль ФК с течением времени может прояснить клиническую картину. Это было продемонстрировано в недавнем проспективном когортном исследовании, где последовательное определение ФК с интервалом в 1 месяц являлось наилучшим предиктором обострения до появления клинических симптомов [74].
Показано, что уровень концентрации ФК также коррелирует с гистологической активностью заболевания [75].
Дальнейшие исследования в области оптимальных значений концентрации ФК будут оказывать непосредственное влияние на принятие клинических решений в будущем, однако на сегодняшний день имеющиеся данные рекомендуют его в качестве неинвазивного маркера для оценки и мониторинга воспаления слизистой оболочки.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
- Kobayashi T., Siegmund B., LeBerre C., et al. Ulcerative colitis // Nat Rev Dis Prim. 2020; 6: 74.
- Solberg I. C., Lygren I., Jahnsen J., et al. Clinical course during the first 10 years of ulcerative colitis: results from a population-based inception cohort (IBSEN study) // Scand J Gastroenterol. 2009; 44 (4): 431-440.
- Farmer R. G., Easley K. A., Rankin G. B. Clinical patterns, natural history, and progression of ulcerative colitis. A long-term follow-up of 1116 patients // Dig. Dis. Sci. 1993; 38: 1137-1146.
- Esaki M., Matsumoto T., Fuyuno Y. et al. Giant inflammatory polyposis of the cecum with repeated intussusception in ulcerative colitis: report of a case // Am. J. Gastroenterol. 2009; 104: 2873-2874.
- Snape W. J. Jr. The role of a colonic motility disturbance in ulcerative colitis // Keio J. Med. 1991; 40: 6-8.
- Peyrin-Biroulet L., Cieza A., Sandborn W. J. et al. for ulcerative colitis // N. Engl. J. Med. 2005; 353: 2462-2476.
- Turner D., Ricciuto A., Lewis A., D’Amico F., Dhaliwal J., Griffiths A. M., et al. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD // Gastroenterology 2021. DOI: 10.1053/j.gastro.2020.12.031.
- Leung C. M., Tang W., Kyaw M., Niamul G., Aniwan S., Limsrivilai J., et al. Endoscopic and histological mucosal healing in ulcerative colitis in the first year of diagnosis: Results from a population-based inception cohort from Six Countries in Asia // J Crohn’s Colitis 2017. DOI: 10.1093/ecco-jcc/jjx103.
- Laharie D., Filippi J., Roblin X., Nancey S., Chevaux J. B., Hébuterne X., et al. Impact of mucosal healing on long-term outcomes in ulcerative colitis treated with infliximab: A multicenter experience // Aliment Pharmacol Ther. 2013. DOI: 10.1111/apt.12289.
- Theede K., Kiszka-Kanowitz M., Nordgaard-Lassen I., Nielsen A. M. The impact of endoscopic inflammation and mucosal healing on health-related quality of life in ulcerative colitis patients // J Crohn’s Colitis. 2015. DOI: 10.1093/ecco-jcc/jjv081.
- Magro F., Rodrigues A., Vieira A. I., et al. Review of the disease course among adult ulcerative colitis population-based longitudinal cohorts // Inflamm Bowel Dis. 2012; 18: 573-83. [PubMed] [Google Scholar].
- Truelove S. C., Witts L. J. Cortisone in ulcerative colitis; final report on a therapeutic trial // Br Med J. 1955; 2: 1041-1048.
- Silverberg M. S., Satsangi J., Ahmad T., Arnott I. D. R., Bernstein C. N., Brant S. R., et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology // Can J Gastroenterol. 2005. DOI: 10.1155/2005/269076.
- Burisch J., Katsanos K. H., Christodoulou D. K., Barros L., Magro F., Pedersen N., et al. Natural Disease Course of Ulcerative Colitis during the First Five Years of Follow-up in a European Population-based Inception Cohort – An Epi-IBD Study // J Crohn’s Colitis 2019. DOI: 10.1093/ecco-jcc/jjy154.
- Lee H. S., Park S. H., Yang S. K., Lee J., Soh J. S., Lee S., et al. Long-term prognosis of ulcerative colitis and its temporal change between 1977 and 2013: A hospital-based cohort study from Korea // J Crohn’s Colitis. 2015. DOI: 10.1093/ecco-jcc/jju017.
- Fumery M., Singh S., Dulai P. S., Gower-Rousseau C., Peyrin-Biroulet L., Sandborn W.J. Natural History of Adult Ulcerative Colitis in Population-based Cohorts: A Systematic Review // Clin Gastroenterol Hepatol. 2018; 16 (3): 343-356.
- Sjöberg D., Holmström T., Larsson M., Nielsen A. L., Holmquist L., Ekbom A., et al. Incidence and clinical course of Crohn’s disease during the first year – results from the IBD Cohort of the Uppsala Region (ICURE) of Sweden 2005-2009 // Crohn’s Colitis. 2014; 8 (3): 215-222.
- Reinisch W., Reinink A. R., Higgins P. D. R. Factors associated with poor outcomes in adults with newly diagnosed ulcerative colitis // Clin Gastroenterol Hepatol. 2015; 13: 635–642. [PubMed] [Google Scholar].
- Etchevers M. J., Aceituno M., García-Bosch O., et al. Risk factors and characteristics of extent progression in ulcerative colitis // Inflamm Bowel Dis. 2009; 15: 1320-1325. [PubMed] [Google Scholar].
- Barreiro-de Acosta M., Magro F., Carpio D., et al. Ulcerative colitis in Northern Portugal and Galicia in Spain // Inflamm Bowel Dis. 2010; 16: 1227-1238.
- Choi C. H. R., Rutter M. D., Askari A., et al. Forty-year analysis of colonoscopic surveillance program for neoplasia in ulcerative colitis: an updated overview // Am J Gastroenterol. 2015; 110: 1022-1034. [PMC free article] [PubMed] [Google Scholar].
- Beaugerie L., Itzkowitz S. H. Cancers complicating inflammatory bowel disease // N Engl J Med. 2015; 372: 1441-1452. [PubMed] [Google Scholar].
- Frolkis A. D., Dykeman J., Negrón M. E., et al. Risk of surgery for inflammatory bowel diseases has decreased over time: a systematic review and meta-analysis of population-based studies // Gastroenterology. 2013; 145: 996-1006. [PubMed] [Google Scholar].
- Ardizzone S., Cassinotti A., Duca P., et al. Mucosal healing predicts late outcomes after the first course of corticosteroids for newly diagnosed ulcerative colitis // Clin Gastroenterol Hepatol. 2011; 9: 483-489.
- Arias M. T., VandeCasteele N., Vermeire S., et al. A panel to predict long-term outcome of infliximab therapy for patients with ulcerative colitis // Clin Gastroenterol Hepatol. 2015; 13: 531-538.
- Schroeder K. W., Tremaine W. J., Ilstrup D. M. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study // N. Engl. J. Med. 1987; 26 (317): 1625-1629.
- Colombel J.-F., Keir M. E., Scherl A., et al. Discrepancies between patient-reported outcomes, and endoscopic and histological appearance in UC // Gut. 2017; 66: 2063-2068.
- Restellini S., Chao C. Y., Martel M., et al. Clinical parameters correlate with endoscopic activity of ulcerative colitis: a systematic review // Clin Gastroenterol Hepatol. 2019; 17: 1265-1275.
- Harbord M., Eliakim R., Bettenworth D., et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 2: current management // J Crohns Colitis. 2017; 11 (7): 769-784.
- Ko C. W., Singh S., Feuerstein J. D., et al. AGA clinical practice guidelines on the management of mild-to-moderate ulcerative colitis // Gastroenterology. 2019; 156 (3): 748-764.
- Barreiro-de Acosta M., Vallejo N., de la Iglesia D., Uribarri L., Bastón I., Ferreiro-Iglesias R., Lorenzo A, Domínguez-Muñoz JE. Evaluation of the Risk of Relapse in Ulcerative Colitis According to the Degree of Mucosal Healing (Mayo 0 vs 1): A Longitudinal Cohort Study // J Crohns Colitis. 2016; 10: 13-19. PMID: 26351390. DOI: 10.1093/ecco-jcc/jjv158.
- Boal Carvalho P., Dias de Castro F., Rosa B., Moreira M. J., Cotter J. Mucosal Healing in Ulcerative Colitis — When Zero is Better // J Crohns Colitis. 2016; 10: 20-25. PMID: 26438714. DOI: 10.1093/ecco-jcc/jjv180.
- Mojtahed A., Khanna R., Sandborn W. J., et al. Assessment of histologic disease activity in Crohn’s disease: a systematic review // Inflamm Bowel Dis. 2014; 20: 2092-2103.
- Bryant R. V., Burger D. C., Delo J., et al. Beyond endoscopic mucosal healing in UC: histological remission better predicts corticosteroid use and hospitalisation over 6 years of follow-up // Gut. 2016; 65: 408-414.
- Zenlea T., Yee E. U., Rosenberg L., et al. Histology grade is independently associated with relapse risk in patients with ulcerative colitis in clinical remission: a prospective study // Am J Gastroenterol. 2016; 111: 685-690.
- Devlen J., Beusterien K., Yen L., et al. The burden of inflammatory bowel disease: a patient-reported qualitative analysis and development of a conceptual model // Inflamm Bowel Dis. 2014; 20: 545-552.
- Drossman D. A., Patrick D. L., Mitchell C. M., et al. Health-related quality of life in inflammatory bowel disease. Functional status and patient worries and concerns // Dig Dis Sci. 1989; 34: 1379-1386.
- Kappelman M. D., Long M. D., Martin C., et al. Evaluation of the patient-reported outcomes measurement information system in a large cohort of patients with inflammatory bowel diseases // Clin Gastroenterol Hepatol. 2014; 12: 1315-1323.
- Büsch K., Sonnenberg A., Bansback N. Impact of inflammatory bowel disease on disability // Curr Gastroenterol Rep. 2014; 16: 414.
- Gauss A., Geib T., Hinz U., et al. Quality of life is related to fecal calprotectin concentrations in colonic crohn disease and ulcerative colitis, but not in ileal Crohn disease // Medicine (Baltimore). 2016; 95: e3477.
- Allocca M., Fiorino G., Bonovas S., et al. Accuracy of humanitas ultrasound criteria in assessing disease activity and severity in ulcerative colitis: a prospective study // J Crohns Colitis. 2018; 12: 1385-1391.
- Murray A., Nguyen T. M., Parker C. E., et al. Oral 5-aminosalicylic acid for induction of remission in ulcerative colitis // Cochrane Database Syst Rev. 2020; 8: CD000543.
- Ham M., Moss A. C. Mesalamine in the treatment and maintenance of remission of ulcerative colitis // Expert Rev Clin Pharmacol. 2012; 5 (2): 113-123.
- Ye B. Mesalazine preparations for the treatment of ulcerative colitis: are all created equal? // World J Gastrointest Pharmacol Ther. 2015; 6 (4): 137.
- Paridaens K., Fullarton J. R., Travis S. P. L. Efficacy and safety of oral Pentasa (prolonged-release mesalazine) in mild-to-moderate ulcerative colitis: a systematic review and meta-analysis. Pages 1891-1900. Received 24 Jul 2021, Accepted 12 Aug 2021, Accepted author version posted online: 18 Aug 2021, Published online: 01 Sep 2021.
- Hanauer S., Schwartz J., Robinson M., et al. Mesalamine capsules for treatment of active ulcerative colitis: results of a controlled trial. Pentasa Study Group // Am J Gastroenterol. 1993; 88: 1188-1197.
- Robinson M., Hanauer S., Hoop R., et al. Mesalamine capsules enhance the quality of life for patients with ulcerative colitis // Aliment PharmacolTher. 2007; 8 (1): 27-34.
- Kane S. V. Systematic review: adherence issues in the treatment of ulcerative colitis // Aliment Pharmacol Ther. 2006; 23 (5): 577-585.
- Flourie B., Hagege H., Tucat G., et al. Randomised clinical trial: once- vs. twice-daily prolonged-release mesalazine for active ulcerative colitis // Aliment Pharmacol Ther. 2013; 37 (8): 767-775.
- Dignass A. U., Bokemeyer B., Adamek H., et al. Mesalamine once daily is more effective than twice daily in patients with quiescent ulcerative colitis // Clin Gastroenterol Hepatol. 2009; 7 (7): 762-769.
- Raine T., Bonovas S., Burisch J. et al. ECCO Guidelines on Therapeutics in Ulcerative Colitis: Medical Treatment // Journal of Crohn’s and Colitis, 2021, 1-16. https: //doi.org/10.1093/ecco-jcc/jjab178 Advance Access publication October 12, 2021 ECCO Guideline/Consensus Paper.
- Singh S., Feuerstein J. D., Binion D. G., Tremaine W. J. AGA technical review on the management of mild-to-moderate ulcerative colitis // Gastroenterology. 2019; 156: 769-808.
- Barberio B., Segal J. P., Quraishi M. N., Black C. J., Savarinoa E. V., Ford A. C. Efficacy of Oral, Topical, or Combined Oral and Topical 5-Aminosalicylates, in Ulcerative Colitis: Systematic Review and Network Meta-analysis // Journal of Crohn’s and Colitis. 2021, 1184-1196. DOI: 10.1093/ecco-jcc/jjab010.
- Hartmann F., Stein J.; BudMesa-Study Group. Clinical trial: controlled, open, randomized multicentre study comparing the effects of treatment on quality of life, safety and efficacy of budesonide or mesalazine enemas in active left-sided ulcerative colitis // Aliment Pharmacol Ther. 2010; 32: 368-376.
- Sandborn W. J., Travis S., Moro L., Jones R., Gautille T., Bagin R., et al. Once-daily budesonide MMX® extended-release tablets induce remission in patients with mild to moderate ulcerative colitis: Results from the CORE i study // Gastroenterology. 2012. DOI: 10.1053/j.gastro.2012.08.003.
- Travis S. P. L., Danese S., Kupcinskas L., Alexeeva O., D’Haens G., Gibson P. R., et al. Once-daily budesonide MMX in active, mild-to-moderate ulcerative colitis: Results from the randomised CORE II study // Gut. 2014. DOI: 10.1136/gutjnl-2012-304258.
- Therapeutic Goods Administration. Extract from the Clinical Evaluation Report for budesonide. Available at https://www.tga.gov.au/sites/default/files/auspar-budesonide 160111-cer.pdf.
- Ford A. C., Bernstein C. N., Khan K. J., et al. Glucocorticosteroid therapy in inflammatory bowel disease: Systematic review and meta-analysis // Am J Gastroenterol. 2011; 106: 590-599; quiz 600.
- Turner D., Walsh C. M., Steinhart A. H., et al. Response to corticosteroids in severe ulcerative colitis: A systematic review of the literature and a metaregression // Clin Gastroenterol Hepatol. 2007; 5 (1): 103-110. DOI: 10.1016/j.cgh.2006.09.033.
- Rubin D. T., Ananthakrishnan A. N., Siegel C. A., Sauer B. G., Long M. D. ACG Clinical Guideline: Ulcerative Colitis in Adults // Am J Gastroenterol. 2019; 114 (3): 384-413. DOI: 10.14309/ajg.0000000000000152.
- Kornbluth A., Sachar D. B. Practice Parameters Committee of the American College of Gastroenterology Ulcerative colitis practice guidelines in adults: American College Of Gastroenterology, Practice Parameters Committee // Am J Gastroenterol. 2010; 105: 501-523. [PubMed] [Google Scholar].
- Gower-Rousseau C., Sarter H., Savoye G., et al. the International Programme to Develop New Indexes for Crohn’s Disease (IPNIC) group, International Programme to Develop New Indexes for Crohn’s Disease IPNIC group Validation of the Inflammatory Bowel Disease Disability Index in a population-based cohort // Gut. 2015. Published online Dec 8. DOI: 10.1136/gutjnl-2015-310151. [PubMed] [CrossRef] [Google Scholar].
- Bressler B., Marshall J. K., Bernstein C. N., et al. Clinical practice guidelines for the medical management of nonhospitalized ulcerative colitis: the Toronto consensus // Gastroenterology. 2015; 148: 1035–58. [PubMed] [Google Scholar].
- Peyrin-Biroulet L., Panes J., Sandborn W. J., et al. Defining disease severity in inflammatory bowel diseases: Current and future directions // Clin Gastroenterol Hepatol. 2015; 14: 348-354.
- Sands B. E. Biomarkers of inflammation in inflammatory bowel disease // Gastroenterology. 2015; 149: 1275-1285.
- Stragier E., Van Assche G. The use of fecal calprotectin and lactoferrin in patients with IBD. Review // Acta GastroEnterologica Belgica. 2013; 76: 322-328.
- Canani R. B., Terrin G., Rapacciuolo L., et al. Faecal calprotectin as reliable non-invasive marker to assess the severity of mucosal inflammation in children with inflammatory bowel disease // Dig Liver Dis. 2008; 40: 547-553.
- Schoepfer A. M., Beglinger C., Straumann A., et al. Ulcerative colitis: correlation of the Rachmilewitz endoscopic activity index with fecal calprotectin, clinical activity, Creactive protein, and blood leukocytes // Inflamm Bowel Dis. 2009; 15: 1851-1858.
- Tibble J. A., Sigthorsson G., Bridger S., et al. Surrogate markers of intestinal inflammation are predictive of relapse in patients with inflammatory bowel disease // Gastroenterology. 2000; 119: 15-22.
- Roszak D., Galecka M., Cichy W., et al. Determination of faecal inflammatory marker concentration as a noninvasive method of evaluation of pathological activity in April 2021 STRIDE-II 1581 CLINICAL AT children with inflammatory bowel diseases // Adv Med Sci. 2015; 60: 246-252.
- Komraus M., Wos H., Wiecek S., et al. Usefulness of faecal calprotectin measurement in children with various types of inflammatory bowel disease // Mediators Inflamm. 2012; 2012: 608249.
- Ashorn S., Honkanen T., Kolho K. L., et al. Fecal calprotectin levels and serological responses to microbial antigens among children and adolescents with inflammatory bowel disease // Inflamm Bowel Dis. 2009; 15: 199-205.
- De Vos M., Dewit O., D’Haens G., et al. Fast and sharp decrease in calprotectin predicts remission by infliximab in anti-TNF naive patients with ulcerative colitis // J Crohns Colitis. 2012; 6: 557-562.
- Ferreiro-Iglesias R., Barreiro-de Acosta M., Lorenzo Gonzalez A., et al. Accuracy of consecutive fecal calprotectin measurements to predict relapse in inflammatory bowel disease patients under maintenance with anti-TNF therapy: a prospective longitudinal cohort study // J Clin Gastroenterol. 2018; 52: 229-234.
- Mak W. Y., Buisson A., Andersen M. J. Jr., et al. Fecal calprotectin in assessing endoscopic and histological remission in patients with ulcerative colitis // Dig Dis Sci. 2018; 63: 1294-1301.
А. М. Харитидис1, ORCID: 0000-0001-6047-3895, akharitidis@gmail.com
О. Б. Щукина1, 2, ORCID: 0000-0001-8402-0743, burmao@gmail.com
1 Городской центр диагностики и лечения воспалительных заболеваний кишечника, Санкт-Петербургское государственное бюджетное учреждение здравоохранения Городская клиническая больница № 31; 197110, Россия, Санкт-Петербург, пр. Динамо, 3
2 Федеральное государственное бюджетное образовательное учреждение высшего образования Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова Министерства здравоохранения Российской Федерации; 197022, Россия, Санкт-Петербург, ул. Льва Толстого, 6-8
Сведения об авторах:
Харитидис Александра Михайловна, гастроэнтеролог, Городской центр диагностики и лечения воспалительных заболеваний кишечника, Санкт-Петербургское государственное бюджетное учреждение здравоохранения Городская клиническая больница № 31; 197110, Россия, Санкт-Петербург, пр. Динамо, 3; akharitidis@gmail.com
Щукина Оксана Борисовна, д.м.н., заведующая кабинетом ВЗК поликлиники c КДЦ, профессор, доцент кафедры общей врачебной практики, Федеральное государственное бюджетное образовательное учреждение высшего образования Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова Министерства здравоохранения Российской Федерации; 197022, Россия, Санкт-Петербург, ул. Льва Толстого, 6-8; руководитель Городского центра диагностики и лечения воспалительных заболеваний кишечника, Санкт-Петербургское государственное бюджетное учреждение здравоохранения Городская клиническая больница № 31; 197110, Россия, Санкт-Петербург, пр. Динамо, 3; burmao@gmail.com
Information about the authors:
Aleksandra M. Kharitidis, gastroenterologist, City Center for Diagnosis and Treatment of Inflammatory Bowel Diseases, St. Petersburg City Clinical Hospital No. 31; 13 Dynamo Ave., St. Petersburg, 97110, Russia; akharitidis@gmail.com
Oksana B. Shchukina, Dr. of Sci. (Med.), Head of the office of inflammatory bowel diseases of the polyclinic with consultative and diagnostic center, Professor, Associate Professor of Department of General Medical Practice at the Federal State Budgetary Educational Institution of Higher Education Pavlov First Saint Petersburg State Medical University of the Ministry of Health of the Russian Federation; 6-8 Lev Tolstoy str., St. Petersburg, 197022, Russia; Head of City Center for Diagnosis and Treatment of Inflammatory Bowel Diseases, St. Petersburg City Clinical; 13 Dynamo Ave., St. Petersburg, 97110, Russia; burmao@gmail.com
Современный взгляд на ведение пациентов с язвенным колитом легкой и средней степени тяжести в амбулаторной практике/ А. М. Харитидис, О. Б. Щукина
Для цитирования: Харитидис А. М., Щукина О. Б. Современный взгляд на ведение пациентов с язвенным колитом легкой и средней степени тяжести в амбулаторной практике // Лечащий Врач. 2022; 2 (25): 25-31. DOI: 10.51793/OS.2022.25.2.004
Теги: кишечник, толстая кишка, воспаление, качество жизни
-
Travis SP, Dinesen L. Remission in trials of ulcerative colitis:
what does it mean? Pract Gastroenterol 2010;30:17–20. -
D»Haens G, et al. A review of activity indices and efficacy end
points for clinical trials of medical therapy in adults with ulcerative
colitis. Gastroenterology 2007;132:763–86 -
Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Epidemiology and
natural history of infl ammatory bowel diseases. Gastroenterology.
2011;140:1785–94. -
Katsanos KH, Vermeire S, Christodoulou DK, Riis L, Wolters F, Odes
S, et al. Dysplasia and cancer in inflammatory bowel disease 10 years
after diagnosis: results of a population-based European collaborative
follow-up study. Digestion 2007;75: 113–21. -
Silverberg MS, et al. Toward an integrated clinical, molecular and
serological classification of inflammatory bowel disease: report of |
working party of the 2005 Montreal World Congress of Gastroenterology.
Can J Gastroenterol 2005;19(Suppl A):5–36. -
Truelove SC et al. Cortisone in ulcerative colitis; final report on
a therapeutic trial. Br Med J 1955;2:1041–8. -
Seah D, De Cruz P. Review article: the practical management of acute
severe ulcerative colitis. Aliment Pharmacol Ther. 2016
Feb;43(4):482-513. -
Hindryckx P, Jairath V, D»Haens G. Acute severe ulcerative colitis:
from pathophysiology to clinical management. Nat Rev Gastroenterol
Hepatol. 2016 Sep 1. -
Chen JH, Andrews JM, Kariyawasam V, Moran N, IBD Sydney Organisation
and the Australian Inflammatory Bowel Diseases Consensus Working Group.
Review article: acute severe ulcerative colitis — evidence-based
consensus statements. Aliment Pharmacol Ther. 2016 Jul;44(2):127-44. -
Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic
acid therapy for mildly to moderately active ulcerative colitis. A
randomized study. N Engl J Med 1987;317:1625–9. -
Григорьева Г.А., Мешалкина Н.Ю. О проблеме системных проявлений
воспалительных заболеваний кишечника. Фарматека. 2011. № 15. С. 44-49 -
Issa M, Vikayapal A, Gracham MB et al. Impact of Clostridium
difficile in inflammatory bowel disease patients. Clin Gastroenterol
Hepatol 2007; 5: 345-351 -
Rodeman JF, Dubberke ER, Reske KA et al. Incidence of Clostridium
difficile in inflammatory bowel disease. Clin Gastroenterol Hepatol.
2007; 5: 339-344 -
Issa M, Ananthakrishnan AN, Binion DG. Clostridium difficile and
inflammatory bowel disease. Inflamm Bowel Dis. 2008; 14:1432-42 -
Nguyen GC, Kaplan GG, Harris ML et al. A national survey of the
prevalence and impact of Clostridium difficile infection among
hospitalized inflammatory bowel disease patients. Am J Gastroenterol.
2008; 103: 1443-50 -
Mindenmark M, Larsson A. Rulling out IBD estimation of the possible
economic effects of pre-endoscopic screening with F-calprotectin. Clin
Biochem 2012; 45: 552-5 -
Costa F, Mumolo MG, Bellini M, Romano MR, Ceccarelli L, Arpe P, et
al. Role of faecal calprotectin as non-invasive marker of intestinal
inflammation. Dig Liver Dis 2003;35:642–7. -
Корнеева О.И., Ивашкин В.Т. Антибиотикоассоциированный колит:
патоморфология, клиника, лечение. Российский журнал гастроэнтерологии,
гепатологии, колопроктологии. 2007. Т. 17. № 3. С. 65-71 -
Ивашкин В.Т., Шептулин А.А., Шифрин О. С., Галимова С.Ф., Юрманова
Е.Н. Vикроскопический колит: клинические формы, диагностика, лечение.
Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2006.
Т.16, №6. С. 56-60 -
Белоусова Е.А., Никитина Н.В., Цодикова О.М.. Лечение язвенного
колита легкого и среднетяжелого течения. Фарматека. 2013. № 2. С. 42-46 -
Халиф И.Л. Лечебная тактика при язвенном колите. Российский журнал
гастроэнтерологии, гепатологии, колопроктологии, 2006. Т16. №3. С. 58-62 -
Dignass A, et al, Second EUROPEAN evidence-based Consensus on the
diagnosis and management of ulcerative colitis: Current management,
Journal of Crohn»s and Colitis (2012). -
Халиф И.Л. Принципы лечения язвенного колита (рекомендации
российской группы по изучению воспалительных заболеваний кишечника).
Колопроктология, 2006(2): с.31-33 -
Su C, Lewis JD, Goldberg B, Brensinger C, Lichtenstein GR. A
meta-analysis of the placebo rates of remission and response in clinical
trials of active ulcerative colitis. Gastroenterology 2007;132:516–26. -
Marshall JK, Thabane M, Steinhart AH, Newman JR, Anand A, Irvine EJ.
Rectal 5-aminosalicylic acid for induction of remission in ulcerative
colitis. Cochrane Database Syst Rev 2010 [CD004115-CD004115]. -
Marshall JK, Irvine EJ. Rectal corticosteroids versus alternative
treatments in ulcerative colitis: a meta-analysis. Gut 1997;40: 775–81. -
Lamet M. A multicenter, randomized study to evaluate the efficacy
and safety of mesalamine suppositories 1 g at bedtime and 500 mg twice
daily in patients with active mild-to-moderate ulcerative proctitis. Dig
Dis Sci 2011;56:513–22 -
Safdi M, DeMicco M, Sninsky C, Banks P, Wruble L, Deren J, et al. A
double-blind comparison of oral versus rectal mesalamine versus
combination therapy in the treatment of distal ulcerative colitis. Am J
Gastroenterol 1997;92:1867–71. -
Sutherland L, Macdonald JK. Oral 5-aminosalicylic acid for induction
of remission in ulcerative colitis. Cochrane Database Syst Rev
2006:CD000543. -
Regueiro M, Loftus Jr EV, Steinhart AH, Cohen RD. Medical management
of left-sided ulcerative colitis and ulcerative proctitis: critical
evaluation of therapeutic trials. Inflamm Bowel Dis 2006;12:979–94. -
Ford AC, Achkar J-P, Khan KJ, Kane SV, Talley NJ, Marshall JK, et
al. Efficacy of 5-aminosalicylates in ulcerative colitis: systematic
review and meta-analysis. Am J Gastroenterol 2011;106:601–16. -
Kane SV, Bjorkman DJ. The efficacy of oral 5-ASAs in the treatment
of active ulcerative colitis: a systematic review. Rev Gastroenterol
Disord 2003;3:210–8. -
Ford AC, Achkar J-P, Khan KJ, Kane SV, Talley NJ, Marshall JK, et
al. Efficacy of 5-aminosalicylates in ulcerative colitis: systematic
review and meta-analysis. Am J Gastroenterol 2011;106:601–16. -
Kane SV, Bjorkman DJ. The efficacy of oral 5-ASAs in the reatment of
active ulcerative colitis: a systematic review. Rev Gastroenterol Disord
2003;3:210–8. -
Sutherland L, Macdonald JK. Oral 5-aminosalicylic acid for induction
of remission in ulcerative colitis. Cochrane Database Syst Rev
2006:CD000543. -
Lichtenstein GR. Budesonide Multi-matrix for the Treatment of
Patients with Ulcerative Colitis. Dig Dis Sci. 2016 Feb;61(2):358-70. -
Sherlock ME, MacDonald JK, Griffiths AM, Steinhart AH, Seow CH. Oral
budesonide for induction of remission in ulcerative colitis. Cochrane
Database Syst Rev. 2015 Oct 26;(10):CD007698. -
Danese S, Siegel CA, Peyrin-Biroulet L. Review article: integrating
budesonide-MMX into treatment algorithms for mild-to-moderate ulcerative
colitis. Aliment Pharmacol Ther. 2014 May;39(10):1095-103. -
Gisbert JP, Linares PM, McNicholl AG, Mate J, Gomollon F.
Meta-analysis: the efficacy of azathioprine and mercaptopurine in
ulcerative colitis. Aliment Pharmacol Ther 2009;30:126–37. -
Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A,
Rachmilewitz D, et al. Infliximab, azathioprine, or combination therapy
for Crohn’s disease. N Engl J Med. 2010;362(15): 1383–95. -
Yarur AJ, Rubin DT. Therapeutic Drug Monitoring of Anti-tumor
Necrosis Factor Agents in Patients with Inflammatory Bowel Diseases.
Inflamm Bowel Dis. 2015 Jul;21(7):1709-18. -
Steenholdt C, Bendtzen K, Brynskov J, Ainsworth MA. Optimizing
Treatment with TNF Inhibitors in Inflammatory Bowel Disease by
Monitoring Drug Levels and Antidrug Antibodies. Inflamm Bowel Dis. 2016
Aug;22(8):1999-2015. -
Panaccione R, Ghosh S, Middleton S, et al. Infliximab, azathioprine
or infliximab + azathioprine for treatment of moderate to severe
ulcerative colitis. The UC SUCCESS trial. J Crohns Colitis 2011;5:13. -
Gonzalez-Huix F, Fernandez-Banares F, Esteve-Comas M, Abad-Lacruz A,
Cabre E, Acero D, et al. Enteral versus parenteral nutrition as adjunct
therapy in acute ulcerative colitis. Am J Gastroenterol 1993;88:227–32 -
Khan KJ, Ullman TA, Ford AC, Abreu MT, Abadir A, Abadir A, et al.
Antibiotic therapy in inflammatory bowel disease: a systematic review
and meta-analysis. Am J Gastroenterol 2011;106:661–73. -
Ohkusa T, Kato K, Terao S, Chiba T, Mabe K, Murakami K, et al. Newly
developed antibiotic combination therapy for ulcerative colitis: |
double-blind placebo-controlled multicenter trial. Am J Gastroenterol
2010;105:1820–9. -
Gionchetti P, Rizzello F, Ferrieri A, Venturi A, Brignola C,
Ferretti M, Peruzzo S, Miglioli M, Campieri M. Rifaximin in patients
with moderate or severe ulcerative colitis refractory to
steroid-treatment: a double-blind, placebo-controlled trial. Dig Dis
Sci. 1999 Jun;44(6):1220-1. -
Frey BM, Frey FJ. Clinical pharmacokinetics of prednisone and
prednisolone. Clin Pharmacokinet. 1990 Aug;19(2):126-46. -
Turner D. Response to corticosteroids in severe ulcerative colitis:
a systematic review of the literature and a meta-regression. Clin
Gastroenterol Hepatol. 2007 Jan;5(1):103-10. -
Järnerot G, Hertervig E, Friis-Liby I, Blomquist L, Karlen P, Granno
C, et al. Infliximab as rescue therapy in severe to moderately severe
ulcerative colitis: a randomized, placebo-controlled study.
Gastroenterology 2005;128:1805–11. -
Lees CW, Heys D, Ho GT, Noble CL, Shand AG, Mowat C, et al. A
retrospective analysis of the efficacy and safety of infliximab as
rescue therapy in acute severe ulcerative colitis. Aliment Pharmacol
Ther 2007;26:411–9. -
Van Assche G, D»Haens G, Noman M, Vermeire S, Hiele M, Asnong K, et
al. Randomized, double-blind comparison of 4 mg/kg versus 2 mg/kg
intravenous cyclosporine in severe ulcerative colitis. Gastroenterology
2003;125:1025–31. -
Sjoberg M, Walch A, Meshkat M, Gustavsson A, Jarnerot G, Vogelsang
H, et al. Infliximab or cyclosporine as rescue therapy in hospitalized
patients with steroid-refractory ulcerative colitis: a retrospective
observational study. Inflamm Bowel Dis 2012; 18(2), p.212-8. -
Sokol H, Seksik P, Carrat F, Nion-Larmurier I, Vienne A, Beaugerie
L, et al. Usefulness of co-treatment with immunomodulators in patients
with inflammatory bowel disease treated with scheduled infliximab
maintenance therapy. Gut 2010;59:1363–8. -
Reinisch W, Sandborn WJ, Rutgeerts P, Feagan BG, Rachmilewitz D,
Hanauer SB, et al. Long-term infliximab maintenance therapy for
ulcerative colitis: the ACT-1 and -2 extension studies. Inflamm Bowel
Dis 2012;18:201–11. -
Chebli LA, LDdM Chaves, Pimentel FF, Guerra DM, RMdF Barros, Gaburri
PD, et al. Azathioprine maintains long-term steroid-free remission
through 3 years in patients with steroid-dependent ulcerative colitis.
Inflamm Bowel Dis 2010;16:613–9. -
Randall JSB, Warren BF, Travis SP, Mortensen NJ, George BD. Delayed
surgery for acute severe colitis is associated with increased risk of
postoperative complications. Br J Surg 2010;97: 404–9 -
Lennard-Jones JE, Ritchie JK, Hilder W, Spicer CC. Assessment of
severity in colitis: a preliminary study. Gut 1975;16:579–84 -
Travis SP, Farrant JM, Ricketts C, Nolan DJ, Mortensen NM,
Kettlewell MG, et al. Predicting outcome in severe ulcerative colitis.
Gut 1996;38:905–10 -
Lindgren SC, Flood LM, Kilander AF, Lofberg R, Persson TB, Sjodahl
RI. Early predictors of glucocorticosteroid treatment failure in severe
and moderately severe attacks of ulcerative colitis. Eur J Gastroenterol
Hepatol 1998;10:831–5 -
Benazzato L, D»Inca R, Grigoletto F, Perissinotto E, Medici V,
Angriman I, et al. Prognosis of severe attacks in ulcerative colitis:
effect of intensive medical treatment. Dig Liver Dis 2004;36:461–6 -
Almer S, Bodemar G, Franzen L, Lindstrom E, Nystrom P, Strom M. Use
of air enema radiography to assess depth of ulceration during acute
attacks of ulcerative colitis. Lancet 1996;347: 1731–5. -
Carbonnel F, Lavergne A, Lemann M, Bitoun A, Valleur P, Hautefeuille
P, et al. Colonoscopy of acute colitis. A safe and reliable tool for
assessment of severity. Dig Dis Sci 1994;39: 1550–7. -
Ferrante M, Vermeire S, Katsanos KH. Predictors of early response to
infliximab in patients with ulcerative colitis. Inflamm Bowel Dis. 2007
Feb;13(2):123-8. -
Gonzalez-Lama Y, Fernandez-Blanco I, Lopez-SanRoman A. Open-label
infliximab therapy in ulcerative colitis: a multicenter survey of
results and predictors of response. Hepatogastroenterology. 2008
Sep-Oct;55(86-87):1609-14. -
Fasanmade AA, Adedokun OJ, Olson A, Strauss R, Davis HM. Serum
albumin concentration: a predictive factor of infliximab
pharmacokinetics and clinical response in patients with ulcerative
colitis. Int J Clin Pharmacol Ther. 2010 May;48(5):297-308. -
Oussalah A, Evesque L, Laharie D, Roblin X. A multicenter experience
with infliximab for ulcerative colitis: outcomes and predictors of
response, optimization, colectomy, and hospitalization. Am J
Gastroenterol. 2010 Dec;105(12):2617-25 -
А.О. Головенко, И.Л. Халиф, О.В. Головенко, В.В. Веселов. Предикторы
эффективности инфликсимаба у больных с тяжелой атакой язвенного колита.
Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2013.3. -
Cacheux W. Am J Gastroenterol 2008; 103: 637–42;
-
Monterubbianesi R. J Crohns Colitis 2014; 8: 852–8
-
Ardizzone S, Maconi G, Russo A, Imbesi V, Colombo E, Bianchi PG.
Randomised controlled trial of azathioprine and 5-aminosalicylic acid
for treatment of steroid dependent ulcerative colitis. Gut 2006;55:47–53 -
Panaccione R, Ghosh S, Middleton S, et al. Infliximab, azathioprine
or infliximab + azathioprine for treatment of moderate to severe
ulcerative colitis. The UC SUCCESS trial. J Crohns Colitis 2011;5:13. -
Van Assche G, D»Haens G, Noman M, Vermeire S, Hiele M, Asnong K, et
al. Randomized, double-blind comparison of 4 mg/kg versus 2 mg/kg
intravenous cyclosporine in severe ulcerative colitis. Gastroenterology
2003;125:1025–31. -
Van Assche G, D»Haens G, Noman M, Vermeire S, Hiele M, Asnong K, et
al. Randomized, double-blind comparison of 4 mg/kg versus 2 mg/kg
intravenous cyclosporine in severe ulcerative colitis. Gastroenterology
2003;125:1025–31. -
Gan S.I., Beck P.L. A new look at toxic megacolon: an update and
review of incidence, etiology, pathogenesis, and management. Am J
Gastroenterol 2003;98:2363-2371 -
Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in
ulcerative colitis: a meta-analysis. Gut 2001;48:526–35 -
Jess T, Loftus Jr EV, Velayos FS, Harmsen WS, Zinsmeister AR, Smyrk
TC, et al. Risk of intestinal cancer in inflammatory bowel disease: |
population-based study from olmsted county, Minnesota. Gastroenterology
2006;130:1039–46 -
Bergeron V, Vienne A, Sokol H, Seksik P, Nion-Larmurier I,
Ruskone-Fourmestraux A, et al. Risk factors for neoplasia in
inflammatory bowel disease patients with pancolitis. Am J Gastroenterol
2010, [advance online publication, 15 June 2010] -
Rutter M, Saunders B, Wilkinson K, Rumbles S, Schofield G, Kamm M,
et al. Severity of inflammation is a risk factor for colorectal
neoplasia in ulcerative colitis. Gastroenterology 2004;126:451–9 -
Справочник по колопроктологии под редакцией проф. Ю.А. Шелыгина,
проф Л.А. Благодарного: 2012. «Литтерра», с.460-522. -
Travis SPL, Farrant JM, Ricketts C, et al. Predicting outcome in
severe ulcerative colitis // Gut 1996;38:905—10. -
Richards DM, Hughes SA, Irving MH, Scott NA. Patient quality of life
after successful restorative proctocolectomy is normal. Colorectal Dis
2001;3:223–6. -
McLaughlin SD, Clark SK, Thomas-Gibson S, Tekkis P, Ciclitira PJ,
Nicholls RJ. Guide to endoscopy of the ileo-anal pouch following
restorative proctocolectomy with ileal pouch-anal anastomosis;
indications, technique, and management of common findings. Inflamm Bowel
Dis 2009;15:1256–63. -
Berndtsson I, Oresland T. Quality of life before and after
proctocolectomy and IPAA in patients with ulcerative proctocolitis—|
prospective study. Colorectal Dis 2003;5:173–9 -
Marcello PW, Roberts PL, Schoetz Jr DJ, Coller JA, Murray JJ,
Veidenheimer MC. Long-term results of the ileoanal pouch procedure. Arch
Surg 1993;128:500–3 [discussion 503–4] -
Sagar PM, Pemberton JH. Ileo-anal pouch function and dysfunction.
Dig Dis 1997;15:172–88. -
Meagher AP, Farouk R, Dozois RR, Kelly KA, Pemberton JH. J ileal
pouch-anal anastomosis for chronic ulcerative colitis: complications and
long-term outcome in 1310 patients. Br J Surg 1998;85:800–3. -
Setti-Carraro P, Ritchie JK, Wilkinson KH, et al. The first 10
years’ experience of restorative proctocolectomy for ulcerative colitis.
Gut. 1994;35:1070–1075 -
Fazio VW, Ziv Y, Church JM, et al. Ileal pouch-anal anastomoses
complications and function in 1005 patients. Ann Surg. 1995;222:120–127 -
Belliveau P, Trudel J, Vasilevsky CA, et al. Ileoanal anastomosis
with reservoirs: complications and long-term results. Can J Surg.
1999;42: 345–352 -
Pinto RA, Canedo J, Murad-Regadas S, Regadas SF, Weiss EG, Wexner
SD. Ileal pouch-anal anastomosis in elderly patients: is there |
difference in morbidity compared with younger patients? Colorectal Dis
2011;13:177–83 -
Church JM. Functional outcome and quality of life in an elderly
patient with an ileal pouch-anal anastomosis: a 10-year follow up. Aust
N Z J Surg 2000;70:906–7 -
Chapman JR, Larson DW, Wolff BG, Dozois EJ, Cima RR, Pemberton JH,
et al. Ileal pouch-anal anastomosis: does age at the timeof surgery
affect outcome? Arch Surg 2005;140:534–40 -
Delaney CP, Dadvand B, Remzi FH, Church JM, Fazio VW. Functional
outcome, quality of life, and complications after ileal pouch-anal
anastomosis in selected septuagenarians. Dis Colon Rectum 2002;45:890–4. -
Olsen KO, Joelsson M, Laurberg S, Oresland T. Fertility after ileal
pouch-anal anastomosis in women with ulcerative colitis. Br J Surg
1999;86:493–5. -
Ording OK, Juul S, Berndtsson I, Oresland T, Laurberg S. Ulcerative
colitis: female fecundity before diagnosis, during disease, and after
surgery compared with a population sample. Gastroenterology
2002;122:15–9. -
Gorgun E, Remzi FH, Goldberg JM, Thornton J, Bast J, Hull TL, et al.
Fertility is reduced after restorative proctocolectomy with ileal pouch
anal anastomosis: a study of 300 patients. Surgery 2004;136:795–803. -
Johnson P, Richard C, Ravid A, Spencer L, Pinto E, Hanna M, et al.
Female infertility after ileal pouch-anal anastomosis for ulcerative
colitis. Dis Colon Rectum 2004;47:1119–26. -
Oresland T, Palmblad S, Ellstrom M, Berndtsson I, Crona N, Hulten L.
Gynaecological and sexual function related to anatomical changes in the
female pelvis after restorative proctocolectomy. Int J Colorectal Dis
1994;9:77–81. -
Alves A, Panis Y, Bouhnik Y, Maylin V, Lavergne-Slove A, Valleur P.
Subtotal colectomy for severe acute colitis: a 20-year experience of |
tertiary care center with an aggressive and early surgical policy. J Am
Coll Surg 2003;197:379–85 -
Berg DF, Bahadursingh AM, Kaminski DL, Longo WE. Acute surgical
emergencies in inflammatory bowel disease. Am J Surg 2002;184:45–51. -
Hyman NH, Cataldo P, Osler T. Urgent subtotal colectomy for severe
inflammatory bowel disease. Dis Colon Rectum 2005;48: 70–3. -
Holubar SD, Larson DW, Dozois EJ, Pattana-Arun J, Pemberton JH,
Cima RR. Minimally invasive subtotal colectomy and ileal pouch-anal
anastomosis for fulminant ulcerative colitis: a reasonable approach? Dis
Colon Rectum 2009;52:187–92. -
Marceau C, Alves A, Ouaissi M, Bouhnik Y, Valleur P, Panis Y.
Laparoscopic subtotal colectomy for acute or severe colitis complicating
inflammatory bowel disease: a case-matched study in 88 patients. Surgery
2007;141:640 -
Annibali R, Oresland T, Hulten L. Does the level of stapled
ileoanal anastomosis influence physiologic and functional outcome? Dis
Colon Rectum 1994;37:321–9. -
Burns EM, Bottle A, Aylin P, Clark SK, Tekkis P, Darzi A, et al.
Volume analysis of outcome following restorative proctocolectomy. Br J
Surg 2011;98:408–17. -
Tekkis PP, Fazio VW, Lavery IC, Remzi FH, Senagore AJ, Wu JS, et
al. Evaluation of the learning curve in ileal pouch-anal anastomosis
surgery. Ann Surg 2005;241:262–8. -
Lepisto A, J. JH.. Fate of the rectum after colectomy with
ileorectal anastomosis in ulcerative colitis. Scand J Surg 2005;94:40–2 -
Burns EM, Bottle A, Aylin P, Clark SK, Tekkis P, Darzi A, et al.
Volume analysis of outcome following restorative proctocolectomy. Br J
Surg 2011;98:408–17. -
Burns EM, Bottle A, Aylin P, Clark SK, Tekkis P, Darzi A, et al.
Volume analysis of outcome following restorative proctocolectomy. Br J
Surg 2011;98:408–17 -
Edwards, C.M., B. George, and B.F. Warren, Diversion colitis: new
light through old windows. Histopathology, 1999. 35(1): p. 86-7. -
Annibali R, Oresland T, Hulten L. Does the level of stapled
ileoanal anastomosis influence physiologic and functional outcome? Dis
Colon Rectum 1994;37:321–9 -
Shepherd NA, Jass JR, Duval I, Moskowitz RL, Nicholls RJ, Morson
BC. Restorative proctocolectomy with ileal reservoir: pathological and
histochemical study of mucosal biopsy specimens. J Clin Pathol
1987;40:601–7. -
Setti Carraro PG, Talbot IC, Nicholls JR. Patterns of distribution
of endoscopic and histological changes in the ileal reservoir after
restorative proctocolectomy for ulcerative colitis. A long-term
follow-up study. Int J Colorectal Dis 1998;13:103–7. -
Ferrante M, D»Hoore A, Vermeire S, et al. Corticosteroids but not
infliximab increase short-term postoperative infectious complications in
patients with ulcerative colitis. Inflamm Bowel Dis 2009;15:1062–70. -
Lake JP, Firoozmand E, Kang JC, Vassiliu P, Chan LS, Vukasin P, et
al. Effect of high-dose steroids on anastomotic complications after
proctocolectomy with ileal pouch-anal anastomosis. J Gastrointest Surg
2004;8:547–51. -
Mahadevan U, Loftus Jr EV, TremaineWJ, Pemberton JH, Harmsen WS,
Schleck CD, et al. Azathioprine or 6-mercaptopurine before colectomy for
ulcerative colitis is not associated with increased postoperative
complications. Inflamm Bowel Dis 2002;8:311–6. -
Pugliese D, Armuzzi A, Rizzo G, et al. Effect of anti-TNF-alph|
treatment on short-term post-operative complications in patients with
inflammatory bowel disease. Gut 2010;59(Suppl III):A13 -
Subramanian V, Pollok RC, Kang JY, Kumar D. Systematic review of
postoperative complications in patients with inflammatory bowel disease
treated with immunomodulators. Br J Surg 2006;93:793–9 -
Meta-analysis: effect of preoperative infliximab use on early
postoperative complications in patients with ulcerative colitis
undergoing abdominal surgery. Yang Z, Wu Q, Wang F, Wu K, Fan D. Aliment
Pharmacol Ther. 2012 Nov;36(10):922-8. doi: 10.1111/apt.12060. Epub 2012
Sep 24. -
Dignass, A., et al., Second European evidence-based consensus on
the diagnosis and management of ulcerative colitis part 2: current
management. J Crohns Colitis, 2012. 6(10): p. 991-1030. -
Meagher AP, Farouk R, Dozois RR, Kelly KA, Pemberton JH. J ileal
pouch-anal anastomosis for chronic ulcerative colitis: complications and
long-term outcome in 1310 patients. Br J Surg 1998;85:800–3. -
Simchuk EJ, Thirlby RC. Risk factors and true incidence of
pouchitis in patients after ileal pouch-anal anastomoses. World J Surg
2000;24:851–6 -
Stahlberg D, Gullberg K, Liljeqvist L, Hellers G, Lofberg R.
Pouchitis following pelvic pouch operation for ulcerative colitis.
Incidence, cumulative risk, and risk factors. Dis Colon Rectum
1996;39:1012–8. -
Penna C, Tiret E, Kartheuser A, Hannoun L, Nordlinger B, Parc R.
Function of ileal J pouch-anal anastomosis in patients with familial
adenomatous polyposis. Br J Surg 1993;80:765–7 -
Tjandra JJ, Fazio VW, Church JM, Oakley JR, Milsom JW, Lavery IC.
Similar functional results after restorative proctocolectomy in patients
with familial adenomatous polyposis and mucosal ulcerative colitis. Am J
Surg 1993;165:322–5 -
Shen B, Achkar JP, Lashner BA. Irritable pouch syndrome: a new
category of diagnosis for symptomatic patients with ileal pouch-anal
anastomosis. Am J Gastroenterol. 2002 Apr;97(4):972-7. -
American Thoracic Society/Centers for Disease Control and
Prevention/Infectious Diseases Society of America: controlling
tuberculosis in the United States. Am J Respir Crit Care Med, 2005.
172(9): p. 1169-227. -
OCEBM Levels of Evidence Working Group. «The Oxford 2011 Levels of
Evidence». Oxford Centre for Evidence-Based Medicine.
http://www.cebm.net/ocebm-levels-of-evidence