Воспалительные заболевания кишечника
Воспалительные заболевания кишечника – это хронические иммунопатологические болезни неизвестной этиологии, которые поражают разные отделы ЖКТ. Они возникают на фоне генетической предрасположенности, нарушения микробиоты тонкой и толстой кишки, действия экзогенных факторов. Патология вызывает кишечные симптомы (боли в животе, расстройства стула, появление слизи и крови в кале), сопровождающиеся разнообразными внекишечными проявлениями. Для диагностики используют данные УЗИ, рентгенографии и КТ органов живота, эндоскопии (ЭФГДС, колоноскопия), лабораторных анализов. Лечение консервативное, при осложнениях требуется хирургическое вмешательство.
Общие сведения
Группу воспалительных заболеваний кишечника (ВЗК) составляют две основные нозологические единицы: язвенный колит (ЯК) и болезнь Крона (БК). Суммарная частота встречаемости патологий составляет 60-300 случаев на 100 тыс. населения. Некоторые исследователи выделяют третью форму ВЗК – недифференцированный неспецифический колит. Несмотря на относительно низкую распространенность, воспалительные заболевания кишечника имеют высокую медико-социальную значимость, не теряют актуальности в практической гастроэнтерологии.
Воспалительные заболевания кишечника
Причины
Этиологические факторы воспалительных заболеваний пока точно не установлены. Большое значение уделяется генетическим изменениям. Описан полиморфизм Ala893 – гена множественной лекарственной резистентности (MDR1), полигенные мутации главного комплекса гистосовместимости, мутации IBD5 и CARD15 (NOD2) на 16-ой хромосоме. Гены участвуют в формировании эпителиального защитного барьера, регулируют иммунный ответ. Другие возможные причины ВЗК:
- Дисбиоз кишечника. Патология возникает при снижении числа полезных бифидобактерий, возрастании количества болезнетворных энтеробактерий и анаэробных микроорганизмов. Дисбаланс микрофлоры оказывает токсическое и аллергизирующее действие, нарушает естественную иммунную защиту в кишечнике.
- Внешние факторы. Риск развития заболевания повышают вирусы (герпесвирус, возбудитель кори), бактерии (хламидии, листерии, микобактерии). Определенную роль в формировании ВЗК играет хронический стресс, проживание в регионе с плохой экологией, употребление рафинированных продуктов и пищи с большим количеством консервантов.
Патогенез
Под действием генетических факторов и внешних агентов развиваются повреждения кишечной стенки и сопутствующие нарушения иммунного ответа. Эпителиальный барьер кишечника становится проницаемым для антигенов, в ответ на которые в организме активно формируются антитела. Постепенно у 60-75% пациентов образуются противотолстокишечные аутоантитела, реже встречаются антинейтрофильные аутоантитела (ANSA).
При болезни Крона иммунные комплексы атакуют любые отделы ЖКТ – от ротовой полости до ануса, вызывая характерное гранулематозное воспаление с трансмуральным поражением стенки пищеварительного канала. При неспецифическом язвенном колите наблюдается поверхностное воспаление толстой кишки без отдельных гранулем. При ВЗК нарушается всасывательная, секреторная и эвакуаторная функция кишечника, с чем связаны различные гастроэнтерологические симптомы.
Большое значение в патогенезе воспалительных заболеваний имеют провоспалительные цитокины, которые синтезируются макрофагами, Т-лимфоцитами и эндотелиальными клетками. К ним относят фактор некроза опухолей, интерлейкины 1 и 6, гамма-интерферон. Со временем в крови появляются иммунные комплексы, которые поражают другие органы и ткани: кожу, орган зрения опорно-двигательный аппарат, систему кроветворения.
Боль в животе при ВЗК
Симптомы
Манифестация воспалительных заболеваний кишечника чаще всего происходит в возрасте 20-40 лет. При ВЗК развиваются типичные признаки поражения ЖКТ: хроническая диарея, боли в животе различной локализации, примеси крови и слизи в каловых массах. Для язвенного колита характерны ложные позывы на дефекацию (тенезмы), выделение малых объемов кала («ректальный плевок»). У 25-35% пациентов наблюдаются трещины и свищи в перианальной зоне, которые более характерны для БК.
Вторую группу симптомов ВЗК составляют внекишечные проявления, вызванные системным действием иммунопатологических механизмов. Они в 3 раза чаще встречаются при язвенном колите и болезни Крона с поражением толстого кишечника, чем при изолированном терминальном илеите, типичном для БК. Внекишечные признаки отягощают течение воспалительного заболевания, снижают качество жизни и могут стать причиной инвалидизации.
Поражение опорно-двигательной системы представлено артритом крупных суставов, остеопорозом, сакроилеитом и анкилозирующим спондилитом (болезнью Бехтерева). Нарушения зрения возникают в результате эписклерита и увеита. Вовлечение в процесс кожи и слизистых оболочек проявляется узловатой эритемой, афтозным стоматитом, гангренозной пиодермией.
У 3-5% больных с ВЗК возникают патологии гепатобилиарной системы: первичный склерозирующий холангит, аутоиммунный гепатит, желчнокаменная болезнь. При длительном существовании заболевания и значительном поражении кишечника развивается синдром мальабсорбции, который сопровождается железодефицитной или В12-дефицитной анемией, полигиповитаминозами, признаками недостатка микроэлементов.
Осложнения
Вероятность тяжелого обострения ВЗК составляет 15% на протяжении жизни. При проведении адекватного лечения рецидивы возникают у 50% пациентов в первые 5 лет от начала терапии, у 80% больных – в течение 10 лет. Серьезной проблемой остается зависимость от системных стероидов, которые применяются для купирования обострений – в организме снижается синтез собственных гормонов, поэтому после отмены лекарств возможна надпочечниковая недостаточность.
К жизнеугрожающим последствиям воспалительных заболеваний относят токсическую дилатацию кишечника, перфорацию стенки с массивным кровотечением. Для БК характерно образование свищей, которые открываются в перианальной области. При заживлении язв зачастую формируются рубцовые стриктуры, которые нарушают пассаж каловых масс и со временем приводят к острой кишечной непроходимости.
ВЗК относят к факультативным предраковым заболеваниям. Риск развития колоректального рака возрастает в 20 раз по сравнению со среднепопуляционным значением. От манифестации воспалительного заболевания кишечника до формирования злокачественной опухоли проходит более 10 лет. Если человек болеет дольше 30 лет, вероятность развития рака составляет свыше 18%.
Диагностика
При подозрении на ВЗК пациенту необходима консультация врача-гастроэнтеролога. Первый этап диагностики – уточнение жалоб и детальный сбор анамнеза, чтобы уточнить время и очередность появления симптомов, количество внекишечных проявлений, результативность проводимого ранее лечения. Второй этап – физикальное обследование с пальпацией живота и осмотром перианальной зоны. На третьем этапе назначаются такие методы исследования:
- Неинвазивные методы визуализации. Базовое обследование при гастроэнтерологических жалобах включает УЗИ и обзорную рентгенографию органов брюшной полости, рентгенологическое исследование с контрастированием. В спорных случаях для уточнения диагноза назначают КТ или МРТ органов живота.
- Эндоскопическая диагностика. При синдроме колита проводится колоноскопия, чтобы оценить степень и распространенность поражения стенки кишечника, выполнить биопсию пораженных участков для гистологического анализа. При болезни Крона с вовлечением в процесс верхних отделов ЖКТ потребуется ЭФГДС, по показаниям назначают капсульную эндоскопию.
- Биопсия стенки кишечника. К патогномоничным признакам воспалительных заболеваний кишечника относят поверхностные (при НЯК) или глубокие щелевидные язвы (при БК), лимфоплазмоцитарную инфильтрацию, структурные изменения ворсин. При язвенном колите определяются нарушения секреции слизи и крипт-абсцессы.
- Лабораторные исследования. В стандартный комплекс входит клинический и биохимический анализ крови, определение острофазовых показателей, коагулограмма. Также проводится копрограмма, бактериологический посев кала, анализ каловых масс на яйца гельминтов.
Дифференциальная диагностика
При постановке диагноза исключают более распространенные причины абдоминальных болей и диспепсических нарушений. ВЗК дифференцируют с инфекционными болезнями (сальмонеллез, дизентерия, амебиаз, паразитозы), антибиотик-ассоциированной диареей, туберкулезом кишечника, ишемическим колитом. Выделение крови с калом требует дифференциальной диагностики с геморроем, анальной трещиной, колоректальным раком.
Эндоскопическое исследование ЖКТ
Лечение воспалительных заболеваний кишечника
Консервативная терапия
При болезни Крона и язвенном колите требуется комплексное медикаментозное лечение для индукции и длительного поддержания ремиссии, профилактики осложнений. Терапевтическая программа подбирается с учетом степени тяжести заболевания, выраженности клинических проявлений, наличия внекишечной симптоматики. Используемые препараты подразделяются на 3 категории:
- Средства для индукции ремиссии. В первую линию терапии входят системные глюкокортикостероиды и иммуносупрессоры, по показаниям их дополняют антибиотиками и салицилатами. Высокую эффективность показывают генно-инженерные препараты – моноклональные антитела к провоспалительным цитокинам.
- Противорецидивные средства. После ликвидации острых проявлений назначаются поддерживающие курсы иммуносупрессоров, препаратов 5-аминосалициловой кислоты и моноклональных антител. Основная задача этого этапа – стойкий контроль симптомов без применения гормонов.
- Вспомогательные медикаменты. Используется фармакотерапия для коррекции осложнений ВЗК: препараты железа при анемии, средства с кальцием при остеопорозе, парентеральные растворы для устранения белково-электролитных нарушений.
Хирургическое лечение
Операцию назначают при осложненной форме воспалительного заболевания, отсутствии эффекта от консервативной терапии. По возможности ограничиваются минимально травматичными вмешательствами: стриктуропластикой, дилатацией стриктур, эндоскопической остановкой кровотечения, чтобы сохранить целостность кишечника. Глубокое поражение стенки кишки требует резекции отдельных участков с наложением анастомозов или выведением стомы.
Прогноз и профилактика
Правильно подобранное лечение позволяет контролировать симптоматику воспалительных заболеваний кишечника и поддерживать удовлетворительное качество жизни пациента. При развитии осложнений и потребности в радикальных операциях прогноз сомнительный. Поскольку причины и факторы риска точно не определены, эффективные превентивные меры отсутствуют. Вторичная профилактика заключается в ранней диагностике и своевременном начале терапии.
|
Литература 1. Клинические рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению язвенного колита. – 2020. 2. Воспалительные заболевания кишечника. Клиническое руководство/ под ред. И.П. Халифа. – 2018. 3. Воспалительная болезнь кишечника. Глобальные практические рекомендации Всемирной гастроэнтерологической ассоциации. – 2015. 4. Воспалительные заболевания кишечника/ И.П. Павлова и соавт. – 2014. |
Код МКБ-10 К50-К52 |
Воспалительные заболевания кишечника — лечение в Москве
Воспалительные заболевания кишечника (ВЗК) являются многофакторными заболеваниями неясной этиологии с доказанным влиянием окружающей среды на генетическую предрасположенность [1]. Выявленные генетические ассоциации ВЗК, нетипичная реакция иммунной системы организма на определенные виды микроорганизмов кишечника, триггерная роль вирусной инфекции, стрессов, этническая принадлежность, курение, особенности питания являются предметом пристального изучения, влияющего на развитие ВЗК. Сегодня большинство исследователей понимают, что воздействие на один или несколько из этих компонентов сложного механизма ВЗК не может удовлетворить потребности врача и пациента в излечении заболевания. Несомненно, возможности современных фармакологических препаратов значительно улучшают качество жизни пациентов, даже изменяют естественное течение болезни, однако совершенно очевидно, что требуются дальнейшие серьезные разработки для эффективного контроля над течением ВЗК.
Распространенность язвенного колита (ЯК) в мире составляет 21,0–505,0 случаев на 100 тыс. населения, болезни Крона (БК) — 9,0–322,0 случая на 100 тыс. населения. Заболеваемость ЯК регистрируется в диапазоне 0–24,3 случая, а БК — 0–20,2 случая на 100 тыс. населения, в зависимости от географического расположения [2, 3]. В последние десятилетия в России, как и во всем мире, отмечается неуклонный рост заболеваемости ВЗК. По данным Министерства здравоохранения РФ прирост ЯК с 2012 по 2015 гг. составил 31,7%, а БК — 20,4%. По данным отдельных эпидемиологических исследований распространенность ВЗК в России составляет 19,3–29,8 на 100 тыс. населения для ЯК и 3,0–4,5 на 100 тыс. населения для БК. Однако, по данным региональных регистров, распространенность ВЗК в РФ гораздо выше. В Московской области, например, этот показатель составляет 58,0 случаев на 100 тысяч населения; 40,0 случаев в Республике Татарстан, 49,0 — на 100 тысяч в Новосибирской области [4]; по данным регистра Иркутской области, распространенность ВЗК составила 74,9 случая на 100 тысяч населения. В следующие десятилетия ряд авторов прогнозируют рост первичной заболеваемости ВЗК в странах Восточной Европы, в том числе в России, и в Азии [3, 4].
Лечебные мероприятия при ВЗК включают в себя назначение лекарственных препаратов, хирургическое лечение, психосоциальную поддержку и диетические рекомендации. Выбор вида консервативного или хирургического лечения определяется тяжестью атаки, протяженностью поражения толстой кишки, наличием внекишечных проявлений, длительностью анамнеза, эффективностью и безопасностью ранее проводившейся терапии, а также риском развития осложнений ВЗК.
Лекарственная (консервативная) терапия ЯК и БК проводится не только для того, чтобы устранить симптомы заболевания, с которыми человек обратился к врачу. Цель лечения — сократить частоту и тяжесть обострений, предотвратить развитие осложнений, поскольку они могут потребовать серьезной хирургической операции, достижение бесстероидной ремиссии. Зачастую пациентам требуется применение комбинации нескольких препаратов. Основные группы препаратов для лечения ВЗК:
- моноклональные антитела (инфликсимаб, адалимумаб, цертолизумаб, голимумаб, ведолизумаб);
- рекомбинантные цитокины;
- малые молекулы (такролимус и др.);
- ингибиторы киназ (тофацитиниб);
- иммуносупрессоры, цитостатики — азатиоприн, 6-меркаптопурин, метотрексат, циклоспорин;
- глюкокортикостероиды — системные (преднизолон, гидрокортизон), топические (будесонид);
- 5-аминосалициловая кислота — месалазин, сульфасалазин;
- энтеро- и колосептики, антибиотики — метронидазол, ципрофлоксацин, рифаксимин.
Одним из препаратов в лечении ВЗК является месалазин, противовоспалительный эффект которого обусловливается нейтрализацией свободных радикалов, угнетением хемотаксиса лейкоцитов, уменьшением продукции цитокинов и лейкотриенов в воспаленной слизистой оболочке кишечника. Рассмотрим данные клинических исследований препарата Пентаса. Это препарат для перорального применения, с контролируемым высвобождением аминосалицилатного компонента, химически представляющего собой 5-амино-2-гидроксибензойную кислоту. Эффективность изучена в течение нескольких десятилетий в ряде серьезных рандомизированных, мультицентровых плацебо-контролируемых исследований. Согласно инструкции, Пентаса назначается для лечения легких и умеренных форм ВЗК, а также широко используется в качестве поддерживающей терапии для снижения риска повторных рецидивов. Таблетки Пентаса (250 мг, 500 мг и 1 г) одобрены для лечения ВЗК в более чем 100 странах, а гранулы Пентаса (250 мг, 500 мг, 1 г, 2 г и 4 г) — более чем в 80 странах мира. Пероральная форма препарата Пентаса имеет состав с пролонгированным высвобождением активного месалазина по всей длине кишечника от двенадцатиперстной кишки до прямой. Лекарственные формы для местного применения (суппозитории и клизмы) предназначены для введения через прямую кишку, что позволяет добиваться высокой концентрации и длительной экспозиции (несколько часов) лекарственного средства в дистальной части толстой кишки.
P. Miner и соавт. в 12-месячном двойном слепом плацебо-контролируемом исследовании рандомизировали 205 пациентов с ЯК в ремиссии на плацебо или месалазин с контролируемым высвобождением (Пентаса) в дозе 4 г/сут в течение 12 месяцев. Поддержание ремиссии определялось по следующим показателям: эндоскопический индекс < 5, менее пяти дефекаций в день и отсутствие ректального кровотечения. Значительно большее число пациентов сохраняли ремиссию при приеме месалазина 4 г/сут по сравнению с плацебо при каждом из пяти посещений исследования после первого посещения в течение одного месяца (p < 0,05). 12-месячные показатели ремиссии для группы месалазина составили 64% и 38% для плацебо (p = 0,0004). Побочные эффекты, связанные с лечением, были редкими. Месалазин с контролируемым высвобождением был признан безопасным и эффективным средством для поддержания ремиссии ЯК [5].
M. Vecchi и соавт. в 15 исследовательских центрах сравнивали эффективность перорального приема месалазина (Пентаса) в сравнении с комбинированным пероральным и местным приемом месалазина (Пентаса) при легком и умеренно активном ЯК. В результате частота клинической ремиссии составила 82% для перорального лечения и 87% для комбинированного лечения (p = 0,56); среднее время до ремиссии 22,2 и 20,2 дня соответственно (р = 0,29); частота клинической ремиссии/улучшения и частота эндоскопической ремиссии составляли 85% и 91% (p = 0,503) и 58% и 71% (p = 0,21) соответственно. Таким образом, у пациентов с легким активным ЯК месалазин 4 г перорально или 2 г перорально плюс 2 г в клизме были одинаково эффективны в индукции ремиссии заболевания [6].
Основная цель 12-месячного многоцентрового рандомизированного слепого контролируемого исследования PODIUM заключалась в том, чтобы продемонстрировать одинаковую эффективность одного 2-граммового саше месалазина, принимаемого один раз в день, по сравнению с двумя отдельными 1-граммовыми саше в день. Однако из 362 пациентов с ЯК в стадии ремиссии, которые рецидивировали в течение предыдущего года, 73,8% пациентов, принимавших саше один раз в день, находились в клинической и эндоскопической ремиссии по сравнению с 63,6% в группе, принимавших саше два раза в день (p = 0,024). Впервые режим дозирования месалазина (гранул Пентаса) один раз в день оказался статистически превосходящим дозирование два раза в день для эффективного поддержания ремиссии у пациентов, страдающих ЯК легкой и средней степени тяжести [7].
B. Flourié и соавт. изучали эффективность и безопасность однократного применения против двукратного ежедневного приема пролонгированного высвобождения месалазина (Пентаса) при активном легком или умеренном течении ЯК. Все пациенты (n = 206) были рандомизированы на 8 недель приема месалазина (4 г/сут), либо однократно два саше по 2 г месалазиновых гранул утром (n = 102), либо двукратно по одному саше 2 г утром и вечером (n = 104). Пациенты также получали в течение 4 недель клизмы с месалазином по 1 г/сут. Активность заболевания оценивали через 4, 8 и 12 недель, используя индекс активности ЯК (UC-DAI). Клиническая и эндоскопическая ремиссия (первичная конечная точка) была оценена через 8 недель. Пациенты регистрировали частоту стула и ректальных кровотечений в ежедневном дневнике. В сочетании с клизмами, месалазин пролонгированного действия 4 г один раз в день столь же эффективен и хорошо переносился, как 2 г два раза в день, для индукции ремиссии у пациентов с легким или умеренно активным ЯК [8].
В европейском многоцентровом рандомизированном исследовании PINCE авторы сравнивали терапию комбинированным пероральным (4 г/сут) месалазином (Пентаса) с ректальной суспензией (1 г/сут) и пероральным месалазином (Пентаса) (4 г/сут) плюс плацебо-суспензия у пациентов с обширным умеренно активным ЯК. Частота ремиссии, основанная на клинических и эндоскопических критериях, была выше в группе комбинированной терапии месалазином, чем в группе пероральной терапии на 4-й и 8-й неделе; значительно чаще ремиссия констатирована на 8-й неделе — 64% при комбинированном лечении по сравнению с пероральным приемом месалазина — 43% (р = 0,030) [9].
Японские ученые исследовали 180 пациентов с активным ЯК, а затем 115 пациентов, у которых имелось клиническое улучшение или была достигнута клиническая ремиссия после лечения месалазином (Пентаса) в дозе 4,0 г/сут. Все пациенты были разделены на две подгруппы в соответствии с медианой продолжительности лечения: группа краткосрочного лечения (≤ 105 дней, n = 58) и группа длительного лечения (> 105 дней, n = 57). В целом у 45 (39,1%) пациентов случился рецидив: у 28 (48,3%) в группе краткосрочного лечения и у 17 (29,8%) в группе длительного лечения (р < 0,05). Частота рецидивов в группе долгосрочного лечения оказалась значимо меньше, чем в группе краткосрочного лечения (р < 0,05). Среднее время ремиссии в группе длительного лечения также было значительно дольше, чем в группе краткосрочного лечения (425,6 ± 243,8 дня против 277,4 ± 224,5 дня; р < 0,05). Длительное непрерывное лечение месалазином в высоких дозах (4,0 г/сут) было более эффективным, чем краткосрочное лечение для поддержания ремиссии у пациентов с ЯК [10].
В японском исследовании OPTIMUM авторы изучали несколько вариантов применения пероральных месалазинов разных коммерческих наименований, в том числе и препарат Пентаса; оценивали эффективность лечения пациентов с легкой и умеренной тяжестью течения язвенного колита. Препарат Пентаса по 4 г/сут в 2 приема вводили 480 (21,0%) пациентам с ремиссией и 341 (46,6%) пациенту в активной стадии ЯК. Показатель поддержания ремиссии на 52-й неделе на фоне приема препарата Пентаса 4 г/сут в 2 приема составил 76,5%, этот показатель не отличался достоверно от результатов лечения другими препаратами месалазинов [11].
В еще одном японском исследовании авторы проспективно проанализировали 2 группы пациентов, страдающих ЯК. Пациенты в каждой группе принимали 4 г таблетированного препарата или гранул месалазина с длительным высвобождением (Пентаса) в течение 6–9 недель, а затем переходили на 4 г другой формы препарата в течение еще 6–9 недель. Эффективность лечения оценивали с помощью опросников, а приверженность — с использованием визуальной аналоговой шкалы. Значительно больше пациентов обнаружили, что таблетки менее приемлемы, чем гранулы (76% против 33%, p = 0,0005). Гранулы оказались предпочтительнее таблеток, когда сравнивали 2 препарата непосредственно (73% против 21%, p = 0,004) по их переносимости, размеру и количеству таблеток. Уровень приверженности был немного выше среди пациентов, принимавших гранулы (94% против 91%) в течение периода наблюдения, но разница не была статистически значимой (p = 0,139). Таким образом, гранулы препарата Пентаса продемонстрировали более высокую приемлемость, чем таблетки, и, следовательно, могут быть лучшим вариантом для длительного лечения [12].
Большое количество клинических исследований посвящено применению месалазина при ЯК. Известно, что применение месалазинов при БК носит ограниченный характер. S. B. Hanauer и U. Strömberg представили метаанализ трех крупных двойных слепых рандомизированных исследований по лечению активной БК и подтвердили, что Пентаса в дозе 4 г/сут превосходила плацебо в снижении индекса активности БК (CDAI) [13]. Пероральная форма препарата Пентаса достигает всех участков воспаления благодаря ее уникальной системе высвобождения, которая обеспечивает прогнозируемое и надежное пролонгированное воздействие месалазина от двенадцатиперстной до прямой кишки. О. Б. Щукина и соавт. провели 5-летнее проспективное наблюдение 210 пациентов с БК, получающих базисную терапию. Ответ на лечение определяли в условиях реальной жизни, согласно рекомендациям Европейского общества по изучению БК и ЯК (European Crohn’s Colitis Organisation, ЕCCO). Оценивали благоприятные и неблагоприятные исходы, а также влияние на них различных видов медикаментозного лечения. Авторы считают, что поддерживающая терапия месалазином возможна только у больных с воспалительной формой БК без системной активности под динамическим контролем лечащего врача [14]. Согласно третьему европейскому консенсусу ЕССО 2016 г. [15], препараты 5-аминосалициловой кислоты (5-АСК) не рекомендуются в качестве поддерживающей терапии, хотя результаты некоторых метаанализов представляют доказательную базу об эффективности месалазина как у пациентов с легким течением БК, так и в профилактике послеоперационного рецидива и отдаленной ремиссии. Так, например, в 1995 г. в журнале Gastroenterology опубликованы данные двойного слепого, плацебо-контролируемого многоцентрового исследования С. Brignola и соавт., об эффективности месалазина для снижения вероятности эндоскопического рецидива БК после хирургического вмешательства (резекции кишки) по поводу БК [16]. Наблюдали группу пациентов, получающих препарат Пентаса по 1 г три раза в день (n = 44), вторая группа пациентов с плацебо (n = 43) в течение 12 месяцев. Оценивали результаты через 1 месяц после хирургического вмешательства и по истечении 12 месяцев исследования. Состояние клинической ремиссии сохранил 31 (70%) пациент в группе приема препарата Пентаса и 29 пациентов (67%) в группе приема плацебо. Из общего числа пациентов частота тяжелых эндоскопических рецидивов (оценка 3–4 балла) через 1 год составила 14% в группе препарата Пентаса и 50% в группе плацебо. Общая частота тяжелых рецидивов через 1 год составила 24% в группе препарата Пентаса и 56% в группе плацебо. Лечение, получаемое во время исследования, было единственным фактором, который оказывал достоверный эффект на общую частоту рецидивов (отношение шансов [ОШ] 4,1; 95% ДИ 2,7–6,3), и частота рецидивов была выше у пациентов, которые в прошлом подвергались более чем одному хирургическому вмешательству (ОШ 4,1; нет данных). Среди всех пациентов, которые подвергались более чем 1 операции, у 3 из 11 пациентов, получавших препарат Пентаса, по сравнению с 6 из 7 пациентов, получавших плацебо, произошел рецидив, по данным эндоскопического исследования (ОШ 16; 95% ДИ 13,4–19,0; χ2: 5,5; p < 0,05). Среди пациентов, которые подвергались только одной операции, эндоскопические рецидивы были зафиксированы у 5 из 25 пациентов, принимавших препарат Пентаса, по сравнению с 16 из 31 пациента, получавшего плацебо (ОШ 4,2; 95% ДИ 2,3–7,7χ2: 5,9; p < 0,05). Исследование показало, что Пентаса в дозе 3 г/день эффективно снижает частоту и тяжесть эндоскопических рецидивов у пациентов с БК подвздошной или подвздошной и ободочной кишки после хирургического вмешательства.
Рекомендации Американской гастроэнтерологической ассоциации (American Gastroenterological Association, AGA) не рассматривают прием 5-АСК, месалазина у пациентов с хирургически индуцированной ремиссией БК в силу низкого уровня доказательности [17]. Проведенный Jin-Shan Feng и соавт. метаанализ 14 рандомизированных клинических исследований, включающий 877 пациентов, показал, что месалазины в любых дозах неэффективны для профилактики раннего послеоперационного рецидива БК [18]. Необходимо отметить, что проведенные исследования демонстрировали относительную безопасность препарата Пентаса — во всех одобренных дозах побочные эффекты препарата сопоставимы с таковыми в группах плацебо [19.
Выбор тактики ведения пациентов с БК в послеоперационном периоде представляет серьезную проблему как для гастроэнтеролога, так и для колопроктолога не только в силу тяжести самого заболевания, но и в связи с достаточно часто встречающейся коморбидностью или развитием нежелательных явлений на прием базисных препаратов. Несмотря на противоречивые данные о применении месалазина в поддерживающей терапии БК, в реальной клинической практике препарат занимает свою определенную нишу, что демонстрирует следующий пример.
Пациент К., 1986 г. р., поступил в хирургическое отделение по экстренным показаниям с клиникой перитонита. 28.10.2006 г. выполнена лапаротомия, разобщение тонко-толстокишечных свищей, ушивание перфорации терминального отдела подвздошной кишки, наложение илеотрансверзоанастомоза. 31.10.2006 г. — релапаротомия, резекция терминального отдела тонкой кишки, правосторонняя гемиколэктомия. По гистологическому заключению исследования резецированного материала выявлена БК. 11.02.2011 г. — диагностирован абсцесс брюшной полости, выполнена лапаротомия, иссечение участка брыжейки тонкой кишки, содержащего лигатуру и гнойник. В январе 2012 г. по экстренным показаниям вновь госпитализирован в хирургическое отделение с нарушением кишечного пассажа. 08.01.2012 г. — лапаротомия, энтеролиз, вскрытие абсцесса брюшной полости, резекция тонкой кишки (объем неизвестен), энтеростомия. На 12-е сутки после операции развилась клиника острой кишечной непроходимости. Выполнена релапаротомия, с техническими трудностями проведен энтеролиз, резекция тонкокишечного конгломерата, вскрытие и дренирование межкишечных абсцессов, формирование петлевой энтеростомы. Из-за выраженного рубцового изменения брыжейки тонкой кишки и ограниченной мобильности кишки энтеростома наложена в нижнем углу лапаротомной раны. На фоне проводимой терапии выписан с положительной динамикой и направлен для восстановительной операции в клинику ФГБУ НЦРВХ г. Иркутска. При поступлении состояние пациента средней тяжести, рост 178 см, вес 48 кг, ИМТ = 15, бледный кожный покров с желтушным оттенком, ангулярный стоматит. В верхнем правом квадранте живота под реберной дугой — трубчатый кишечный свищ с минимальным отделяемым. В нижней трети послеоперационной раны — тонкокишечный свищ. Слизистая оболочка стомированной кишки ярко-багрового цвета, плотная, кишечное отделяемое жидкое. При приеме через рот контрастное вещество поступает через 20 минут в калоприемник. Слизистая оболочка прямой кишки отечная, ранимая, на высоте пальца пальпируется болезненный инфильтрат. Ректороманоскопия (осмотр до 18 см): слизистая оболочка розовая, отечная, от ануса до 10 см без сосудистого рисунка, выше — слизистая оболочка обычной окраски, сосудистый рисунок четко прослеживается. Продолжение осмотра невозможно из-за выраженного болевого синдрома. Диагноз при поступлении: «Болезнь Крона, илеоколит, тяжелое непрерывное течение, свищевая форма, осложненная инфильтратом и абсцессами брюшной полости. Энтеростома. Сформированный тонкокишечный свищ. Ангулярный стоматит. Сопутствующий диагноз: невралгия седалищного нерва справа. Трофические нарушения, умеренный болевой синдром с нейропатическим компонентом». Проведена инфузионно-корригирующая терапия, преднизолон в стартовой дозе 150 мг внутривенно (в/в) (из расчета 2,5 мг на 1 кг веса), далее по снижающей схеме. Начат индукционный курс биологической терапии — инфликсимабом (Ремикейд) в дозе 300 мг в/в по стандартной схеме. По данным МСКТ-энтерографии — обнаружен высокий сформированный тонкокишечный свищ (в 40 см от дуоденоеюнального перехода), утолщение стенок всей тонкой кишки от 4 до 10 мм. Выполнена резекция 20 см тонкой кишки, включая энтеростомальный сегмент, наложен илеотрансверзоанастомоз по типу «конец в бок» однорядным непрерывным внеслизистым швом. Гистологическое заключение: резецированная тонкая кишка с картиной хронического продуктивного гранулематозного воспаления.
В послеоперационном периоде — серия релапаротомий в связи с перфорациями тонкой кишки, развитием диффузного фибринозного перитонита. Через три месяца пациент выписан в удовлетворительном состоянии, вес 55 кг, ИМТ 17, с восстановлением пассажа по желудочно-кишечному тракту, количество дефекаций уменьшилось с 7–8 раз до 3 эпизодов в сутки, каловые массы кашицеобразной консистенции, без видимых патологических примесей. Назначен азатиоприн 100 мг (2 мг/кг веса в сутки), продолжен инфликсимаб 5 мг/кг. Перед 4-й инфузией инфликсимаба 18.05.2012 г. развилась лихорадка. Дополнительное обследование выявило диссеминированный туберкулез легких, инфликсимаб отменен. Назначена полихимиотерапия из 6 противотуберкулезных препаратов. В декабре 2012 г. развилась панцитопения — азатиоприн отменен, назначен препарат с учетом локализации поражения — месалазин с контролируемым высвобождением (Пентаса) 3,0 г/сут. Стационарное лечение в противотуберкулезном диспансере с мая 2012 по апрель 2013 г. Выписан в удовлетворительном состоянии. В мае 2013 г. — гемоглобин снизился до 46 г/л, сывороточное железо — 1,2 мкг/л, панцитопения тяжелой степени. Госпитализирован в тяжелом состоянии в отделение реанимации по месту жительства. Лечение: гемотрансфузии, препарат железа внутривенно в течение нескольких недель. Противотуберкулезные средства отменены. С июня 2013 г. по настоящее время: получает 2 г месалазина с контролируемым высвобождением (Пентаса), состояние удовлетворительное, стул 2–3 раза в сутки, кал кашицеобразный, без крови и слизи. Кальпротектин в пределах 12–37 мкг/г (норма: до 50 мкг/г). По МРТ-энтерографии органов брюшной полости (один раз в 1–2 года) — признаков активности БК нет. МСКТ органов грудной клетки — активного специфического процесса нет, заключение фтизиатра: «Излечение». На визите 09.01.2019 г. — пациент чувствует себя хорошо, вес 78 кг, повторно женился, родился второй ребенок, работает.
Приведенный клинический случай [20] представляет типичный пример естественного прогрессирующего течения БК с развитием хирургических осложнений. Дебют болезни у пациента произошел в возрасте 13 лет, когда возникали немотивированные подъемы температуры тела до фебрильных цифр, слабость. Пациент лечился у невролога с диагнозом «аутоиммунный энцефаломиелополирадикулоневрит» с нарушением фагоцитарного звена. Позднее с учета снят. В 2004 г. в возрасте 17 лет вновь отметил повышение температуры тела до фебрильной, тогда же появились боли в животе. В ноябре 2006 г. впервые появился частый стул с примесью крови и появилось разжижение каловых масс.
К сожалению, от момента первых проявлений БК до постановки диагноза прошло 6 лет, когда пациент поступил в хирургический стационар уже с осложненным течением болезни. Однако базисной терапии назначено не было, несмотря на патоморфологическое и интраоперационное подтверждение диагноза. Доказано, что резекция пораженных отделов пищеварительной трубки в пределах здоровых тканей не означает излечения БК и предполагает обязательное продолжение медикаментозной терапии ввиду высокого риска рецидивов [18]. Назначенная в феврале 2012 г. биологическая терапия блокаторами ФНО-α позволила стабилизировать состояние больного, однако, несмотря на предварительно проведенное обследование у фтизиатра, у пациента после индукционного курса инфликсимаба развилась туберкулезная инфекция, в связи с чем антицитокиновую терапию прекратили. Азатиоприн также отменили в связи с тяжелой анемией и панцитопений. Что в такой ситуации назначать пациенту, учитывая агрессивное течение болезни, многократные оперативные вмешательства и резекции кишечника? Несмотря на существующее мнение многих исследователей о неэффективности месалазина для поддерживающей терапии в случае тяжелого осложненного течения БК, у данного пациента применение монотерапии месалазином в течение нескольких лет позволяет удерживать стабильное состояние пациента в ремиссии. Подобные клинические ситуации встречаются в практике специалистов, занимающихся ВЗК, нередко выходя за рамки клинических рекомендаций, стандартов и данных рандомизированных исследований, когда месалазины оказываются единственными препаратами, возможными для назначения даже в случаях тяжелого течения болезни [18].
Второй препарат для лечения ВЗК — Кортимент (Cortiment) MMX. Показан взрослым пациентам для индукции ремиссии при активном язвенном колите с легкой и умеренной активностью, когда лечение препаратами 5-ASA (аминосалицилатом) недостаточно. Кортимент MMX содержит будесонид, локально действующий глюкокортикостероид, запатентованный оральный препарат в виде таблеток с использованием технологии мультиматриксной доставки (MMX), которая предназначена для контролируемого высвобождения и распределения будесонида по всей длине толстой кишки.
Будесонид является кортикостероидом второго поколения, который обладает минимальной системной активностью благодаря метаболизму печени первого прохода. В настоящее время доступны две композиции будесонида: композиция с зависимым от рН высвобождением и таблетка с пролонгированным высвобождением, в которой используется MMX для доставки в толстую кишку. Многочисленные рандомизированные клинические исследования на сегодняшний день продемонстрировали, что 3–9 мг будесонида MMX хорошо переносятся, вызывают значительное улучшение у пациентов по сравнению с плацебо и имеют профиль безопасности, аналогичный плацебо, связанный с кортикостероидами [21].
Композиция MMX была разработана для перорально вводимых лекарств с таргетным воздействием на дистальный отдел толстой кишки [22]. Эта система доставки использует внешнее pH-зависимое покрытие, состоящее из гидрофильной и инертной полимерной матрицы, которая позволяет проходить активное лекарственное средство через желудочно-кишечный тракт в подвздошную кишку, где внешний слой капсулы начинает растворяться при pH > 7,0. Таким образом, активное лекарственное средство доставляется равномерно по всей длине ободочной кишки, что сводит к минимуму системную абсорбцию, в отличие от обычной абсорбции кортикостероидов (рис. 1) [23]. В фармакокинетических исследованиях с будесонидом MMX 9 мг средняя относительная абсорбция будесонида в области между восходящей ободочной кишкой и нисходящей/сигмовидной ободочной кишкой составила 95,9%, обнаруженным между 4 и > 24 часами после введения лекарственного средства (рис. 2) [24].
Два спонсируемых производителем многоцентровых двойных слепых плацебо-контролируемых рандомизированных исследования: CORE I (n = 510) и CORE II (n = 512) оценивали эффективность и безопасность применения препарата Кортимент (будесонид) MMX 9 мг у взрослых пациентов с активным легким и умеренным ЯК. Исследование CORE I также включало группу лечения месалазином (Асакол 2,400 мг), в то время как исследование CORE II включало группу лечения будесонидом (Энтокорт EC 9 мг). Хотя в исследованиях не было возможности сравнить эти препараты с плацебо или препаратом Кортимент, они были включены в качестве контрольного сравнения. Авторы исследования представили сетевой метаанализ сравнения препарата Кортимент 9 мг с другими лекарственными средствами для индукции полной клинической ремиссии у пациентов с активным ЯК от легкой до умеренной степени тяжести. Кортимент был связан со статистически значимым улучшением в индукции полной клинической ремиссии по сравнению с плацебо и высокими дозами месалазина [25, 26].
В 2015 г. опубликованы данные пяти клинических исследований, в том числе двойных слепых, рандомизированных и открытых исследований, которые показали, что частота побочных эффектов была одинаковой для будесонида MMX (Кортимент) 9 мг и 6 мг (54,5% и 60,6% соответственно) и плацебо (50,5%) у пациентов с легким и умеренным течением ЯК. Кроме того, открытые исследования показали меньшую частоту побочных эффектов с будесонидом MMX (3 мг или 9 мг) по сравнению с плацебо. Наиболее частыми побочными эффектами в этих исследованиях регистрировали головную боль, тошноту и инфекции мочевыводящих путей, демонстрирующие, что топические кортикостероиды второго поколения не только имеют меньше побочных эффектов, но и эти эффекты менее серьезны по сравнению с побочными эффектами системных глюкокортикостероидов [27].
M. E. Sherlock и соавт. провели поиск в MEDLINE, EMBASE, CENTRAL и в специализированном регистре Cochrane IBD Group с момента его создания до апреля 2015 г. и выбрали шесть исследований с участием 1808 человек, страдающих ЯК. В четырех исследованиях сравнивался будесонид MMX (Кортимент) с плацебо, в одном небольшом пилотном исследовании изучалась клиническая ремиссия на четвертой неделе, а затем следовали три крупных исследования, в которых оценивались комбинированная клиническая и эндоскопическая ремиссия на восьмой неделе. Данные исследования подтвердили использование перорального приема будесонида MMX в дневной дозе 9 мг для индукции ремиссии при активном ЯК, особенно у пациентов с левосторонним колитом. Будесонид MMX 9 мг в день был эффективен для индукции ремиссии при наличии или отсутствии одновременной терапии 5-АСК. Кроме того, будесонид MMX был безопасным и не приводил к значительному ухудшению функции надпочечников по сравнению с плацебо [28].
В нескольких исследованиях оценивалось использование пероральных составов будесонида MMX в качестве поддерживающей терапии у пациентов с БК, и он обеспечил поддержку долгосрочной (≥ 1 года) ремиссии заболевания. Будесонид MMX (Кортимент) может также предложить фармакоэкономические преимущества, потенциально повышая приверженность к лечению с помощью дозирования один раз в день и снижая риск возникновения побочных эффектов по сравнению с обычными оральными кортикостероидами [29].
Обзор W. J. Sandborn, S. Travis с соавт. (2014 г.) плацебо-контролируемого исследования показал, что более высокая доля пациентов с ЯК легкой и умеренной активности, получавших будесонид MMX (Кортимент) (9 мг), достигла клинической ремиссии и разрешения симптомов по сравнению с плацебо. Напротив, более низкие дозы будесонида MMX (6 мг) и месалазина (2,4 г/сут) не улучшили существенно ни один из параметров заболевания. Кроме того, более высокая доза будесонида MMX была эффективной в индукции ремиссии у пациентов с легкой и умеренной формами ЯК, которые не достигли ремиссии при лечении месалазином или сульфасалазином [30]. В настоящее время врачи назначают будесонид MMX пациентам с ЯК, которые не реагируют на традиционную поддерживающую терапию до лечения азатиоприном/6-меркаптопурином [31].
D. T. Rubin и соавт. (2017) провели рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое исследование, в котором оценили эффективность и безопасность будесонида MMX (Кортимент) для индукции ремиссии ЯК (индекс активности ЯК ≥ 4 и ≤ 10) у 510 взрослых пациентов, которые принимали будесонид MMX 9 мг один раз в день или плацебо в течение 8 недель. Пациенты продолжали базовое лечение пероральным месалазином ≥ 2,4 г/день. Будесонид MMX оказался безопасным и эффективным для индукции клинической и эндоскопической ремиссии при ЯК легкой и средней степени, резистентном к пероральной терапии месалазином [32].
Мы в своей повседневной практике широко применяем Кортимент как у пациентов с болезнью Крона толстой кишки, так и у пациентов, страдающих язвенным колитом. Относительная безопасность препарата позволяет назначать его в ситуациях, когда, несмотря на потребность в стероидах, системные глюкокортикостероидные препараты крайне нежелательны. Представляем вниманию тактику ведения пациента 1983 г. р., социально благополучного, без вредных привычек молодого человека с высшим образованием. Из анамнеза болезни известно, что в 2014 г. выставлен диагноз сахарного диабета 1 типа, инсулинозависимый, средней степени тяжести. В 2015 г. — дебют язвенного колита с тотальным поражением толстой кишки, потребовавшего госпитализации и назначения внутривенного преднизолона. Поддерживающая терапия — месалазин таблетированный 3,0 г/сут и ректально два раза в неделю по 4,0 г. В течение следующих 10 месяцев наблюдалась клинико-эндоскопическая ремиссия, однако в течение этого периода выявили трудно корригируемые уровни глюкозы крови. Через 10 месяцев обострение ЯК — 8 баллов по индексу Мейо. Учитывая сопутствующую патологию, риск развития инсулинорезистентности при назначении системных стероидов, решено назначить Кортимент 9 мг/сут, согласно инструкции, с постепенной отменой и азатиоприн в дозе 2 мг/кг. Препараты месалазина пациент продолжал принимать в прежних дозах. Получен положительный ответ на лечение, клинико-эндоскопическая ремиссия в течение 8,5 месяцев, стабилизация состояния по течению диабета. Однако весной 2018 г. случилось очередное обострение, расцененное как 8 баллов по индексу Мейо. К лечению назначен Кортимент 9 мг/сут и начат индукционный курс биологической терапии (Ремикейд) с выраженным положительным ответом. В настоящее время пациент чувствует себя хорошо, уровень глюкозы крови нормализовался, со слов пациента — снизилась дозировка инсулина. В приведенном случае, с нашей точки зрения, назначение топического стероидного препарата позволило минимизировать риски применения системных стероидов у пациента с сопутствующей тяжелой патологией. Назначение препарата Кортимент перед биологической терапией и в период индукционного курса послужило своеобразным «мостиком» для достижения ремиссии.
Таким образом, при выборе лечения пациентов с воспалительными заболеваниями кишечника лечащий врач принимает во внимание клинические симптомы, течение и тяжесть заболевания, а также наличие и характер осложнений. ВЗК — хронические заболевания, контроль которых в большинстве случаев возможен. Препараты Пентаса и Кортимент оказывают доказанную эффективность для достижения ремиссии и ее поддержания у пациентов с ВЗК в реальной клинической практике.
Литература
- Shanahan F. The gut microbiota — a clinical perspective on lessons learned // Nat. Rev. Gastroenterol. Hepatol. 2012; 9: 609–614.
- Molodecky N. A., Soon I. S., Rabi D. M., Ghali W. A., Ferris M., Chernoff G., Benchimol E. I., Panaccione R., Ghosh S., Barkema H. W., Kaplan G. G. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review // Gastroenterology. 2012; 142 (1): 46–54. e42; quiz e30.
- Burisch J., Pedersen N., Cukovic-Cavka S. et al. East–West gradient in the incidence of inflammatory bowel disease in Europe: the ECCO-EpiCom inception cohort // Gut. 2013; 0: 1–10. DOI: 10.1136/gutjnl-2013–304636.
- Князев О. В., Шкурко Т. В., Фадеева Н. А., Бакулин И. Г., Бордин Д. С. Эпидемиология хронических воспалительных заболеваний кишечника. Вчера, сегодня, завтра // Экспериментальная и клиническая гастроэнтерология. 2017; 3: 4–12.
- Miner P., Hanauer S., Robinson M., Schwartz J., Arora S. Safety and efficacy of controlled-release mesalamine for maintenance of remission in ulcerative colitis. Pentasa UC Maintenance Study Group // Dig Dis Sci. 1995; 40 (2): 296–304.
- Vecchi M., Meucci G., Gionchetti P., Beltrami M., Di Maurizio P., Beretta L., Ganio E., Usai P., Campieri M., Fornaciari G., DeFranchis R. Oral versus combination mesalazine therapy in active ulcerative colitis: a double-blind, double-dummy, randomized multicentre study // Alimentary Pharmacology & Therapeutics. 2001; 15 (2): 251–256.
- Bokemeyer B., Hommes D., Gill I., Broberg P., Dignass A. Mesalazine in left-sided ulcerative colitis: efficacy analyses from the PODIUM trial on maintenance of remission and mucosal healing // J Crohns Colitis. 2012; 6 (4): 476–482.
- Flourié, Hagège B., Tucat H., Maetz G., Hébuterne D., Dewit X., Olivier [UCL], Aoucheta D. et al. Randomised clinical trial: once- vs. twice-daily prolonged-release mesalazine for active ulcerative colitis // Alimentary Pharmacologyand Therapeutics. 2013; 37 (8): 767–775.
- Proberta C. S. J., Dignass A. U., Lindgren S., Pool M. O., Marteau P. Combined oral and rectal mesalazine for the treatment of mild-to-moderately active ulcerative colitis: Rapid symptom resolution and improvements in quality of life. Author links openoverlay panel // Journal of Crohn’sand Colitis. 2014; 8 (3): 200–207.
- Takeshima F., Matsumura M., Makiyama K. et al. Efficacy of long-term 4.0 g/day mesalazine (Pentasa) for maintenance therapy in ulcerative colitis // Med Sci Monit. 2014; 20: 1314–1318.
- Nagahori M., Kochi S., Hanai H., Yamamoto, Nakamura S., Omuro S., Watanabe M., Hibi T. Real life results in using 5-ASA-for maintaining mild to moderate UC patients in Japan, amulti-center study, OPTIMUM Study // BMC Gastroenterol. 2017; 17: 47.
- Yagisawa K., Kobayashi T., Ozaki R., Okabayashi S., Toyonaga T., Miura M., Hayashida M., Saito E., Nakano M., Matsubara H., Hisamatsu T., Hibi T. Randomized, crossover questionnaire survey of acceptabilityes of controlled-release mesalazine tablets and granules in ulcerative colitis patients // Intest Res. 2018. Dec 14. DOI: 10.5217/ir.2018.00078.
- Hanauer S. B., Strömberg U. Oral Pentasa in the treatment of active Crohn’s disease: A meta-analysis of double-blind, placebo-controll edtrials // Clin Gastroenterol Hepatol. 2004; 2 (5): 379–388.
- Щукина О. Б., Кондрашина Э. А., Вепрева Е. Г., Харитонов А. Г., Барановский А. Ю. Влияние базисной терапии на клинические исходы болезни Крона // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016; 26 (2): 112–119.
- Gomollón F., Dignass A., Annese V., Tilg H., van Assche G., J. O. Lindsay, Peyrin-Biroulet L., Garret J., Daperno M., Kucharzik T. et al. // Journal of Crohn’s and Colitis. 2017, 1 January, vol. 11, Issue 1, p. 3–25. https://doi. org/10.1093/ecco-jcc/jjw168.
- Corrado Brignola et al., Mesalamine in the Prevention of Endoscopic Recurrence After Intestinal Resectionfor Crohn’s Disease / Gastroenterology 1995; 108: 345–349.
- Ngyuen G. C. et al. Summary of Recommendations of the AGA. Clinical Guidelines for the Management of Crohn’s Disease After Surgical Resection AGA // Gastroenterology. 2017; 152: 271–275.
- Головенко А. О., Халиф И. Л., Головенко О. В. Профилактика послеоперационных рецидивов болезни Крона // Колопроктология. 2012; 4: 40–48.
- Ardizzone S, et al. Azathioprine and mesalamine for prevention of relapse after conservative surgery for Crohn’s Disease / Gastroenterology 2004; 127(3): 730–740.
- Григорьев Е. Г., Чашкова Е. Ю., Капорский В. И., Гельфанд С. А., Шедоева Л. Р., Чхенкели Л. Г. Многоэтапное хирургическое лечение пациента с осложненной формой болезни Крона // Колопроктология. 2014; № 1 (47): 37–42.
- Weisshof R., Jurdi K. E., Zmeter N., Rubin D. T. Emerging Therapies for Inflammatory Bowel Disease // Adv Ther. 2018; 35 (11): 1746–1762.
- Prantera C., Viscido A., Biancone L., Francavilla A., Giglio L., Campieri M. A new oral delivery system for 5-ASA: preliminary clinical findings for MMx // Inflamm Bowel Dis. 2005; 11: 421–427.
- Fiorino G., Fries W., de La Rue S. A., Malesci A. C., Repici A., Danese S. New drug delivery systems in inflammatory bowel disease: MMX™ and tailored delivery to the gut // Curr Med Chem. 2010; 17: 1851–1857.
- Brunner M., Ziegler S., Di Stefano A. F. et al. Gastrointestinal transit, release and plasma pharmacokinetics of a new oral budesonide formulation // Br J Clin Pharmacol. 2006; 61: 31–38.
- Lichtenstein G. R. Budesonide multi-matrix for the treatment of patients with Ul cerative Colitis // Dig Dis Sci. 2016; 61: 358–370.
- Huang M., Yeung P., Ballard E. D. Once-daily budesonide MMX® extended-release tablets induce remission in patients with mild to moderate ulcerative colitis: results from the CORE I study // Gastroenterology. 2012; 143: 1218–1226.
- Travis S. P. L., Danese S., Kupcinskas L., Alexeeva O., D’Haens G., Gibson P. R., Moro L., Jones R., Ballard E. D., Masure J., Rossini M., Sandborn W. J. Once-daily budesonide MMX in active, mild-to-moderate ulcerative colitis: results from the randomised CORE II study // Gut. 2014, Mar; 63 (3): 433–441.
- Lichtenstein G. R., Travis S., Danese S., D’Haens G., Moro L., Jones R., Huang M., Ballard E. D., Bagin R., Hardiman Y. et al. Budesonide MMX for the Induction of Remission of Mild to Moderate Ulcerative Colitis: A Pooled Safety Analysis // J Crohns Colitis. 2015; 9: 738–746.
- Sherlock M. E., MacDonald J. K., Griffiths A. M., Steinhart A. H., Seow C. H. Oral budesonide for induction of remission in ulcerative colitis // Cochrane Database Syst Rev. 2015, Oct 26; (10): CD007698.
- Sandborn W. J., Travis S., Moro L., Jones R., Gautille T., Bagin R., Danese S., Siegel C. A., Peyrin-Biroulet L. Review article: integrating budesonide-MMX into treatment algorithms for mild-to-moderate ulcerative colitis // Aliment Pharmacol Ther. 2014; 39: 1095–1103.
- Dubois-Camacho K., Ottum P. A., Franco-Muñoz D., De la Fuente M., Torres-Riquelme A., Díaz-Jiménez D., Olivares-Morales M., Astudillo G., Quera R., Hermoso M. A. Glucocorticosteroid therapy in inflammatory bowel diseases: From clinical practice to molecular biology // World J Gastroenterol. 2017, Sep 28; 23 (36): 6628–6638.
- Rubin D. T., Cohen R. D., Sandborn W. J., Lichtenstein G. R., Axler J., Riddell R. H., Zhu C., Barrett A. C., Bortey E., Forbes W. P. Budesonide Multimatrix Is Efficacious for Mesalamine-refractory, Mild to Moderate Ulcerative Colitis: A Randomised, Placebo-controlled Trial // J Crohns Colitis. 2017 Jul; 11 (7): 785–791.
Е. Ю. Плотникова*, 1, доктор медицинских наук, профессор
Е. Ю. Чашкова**, кандидат медицинских наук
* ГБОУ ВПО КемГМУ Минздрава России, Кемерово
** ФГБНУ ИНЦХТ, Иркутск
1 Контактная информация: eka-pl@rambler.ru
DOI: 10.26295/OS.2019.62.53.002
Некоторые аспекты лечения воспалительных заболеваний кишечника/ Е. Ю. Плотникова, Е. Ю. Чашкова
Для цитирования: Лечащий врач № 8/2019; Номера страниц в выпуске: 14-21
Теги: желудочно-кишечный тракт, воспаление, осложнения
| Inflammatory bowel diseases | |
|---|---|
 |
|
| Micrograph showing inflammation of the large bowel in a case of inflammatory bowel disease. Colonic biopsy. H&E stain. | |
| Specialty | Gastroenterology |
| Differential diagnosis | Gastroenteritis, irritable bowel syndrome, celiac disease |
| Frequency | 11.2 million worldwide (2015)[1] |
| Deaths | 47,400 worldwide (2015)[2] |
Inflammatory bowel disease (IBD) is a group of inflammatory conditions of the colon and small intestine, Crohn’s disease and ulcerative colitis (UC) being the principal types.[3] Crohn’s disease affects the small intestine and large intestine, as well as the mouth, esophagus, stomach and the anus, whereas ulcerative colitis primarily affects the colon and the rectum.[4][5][6]
Signs and symptoms[edit]
| Crohn’s disease | Ulcerative colitis | |
|---|---|---|
| Defecation | Often porridge-like,[7] sometimes steatorrhea |
Often mucus-like and with blood[7] |
| Tenesmus | Less common[7] | More common[7] |
| Fever | Common[7] | Indicates severe disease[7] |
| Fistulae | Common[8] | Seldom |
| Weight loss | Often | More seldom |
In spite of Crohn’s and UC being very different diseases, both may present with any of the following symptoms: abdominal pain, diarrhea, rectal bleeding, severe internal cramps/muscle spasms in the region of the pelvis and weight loss. Anemia is the most prevalent extraintestinal complication of inflammatory bowel disease.[9][10] Associated complaints or diseases include arthritis, pyoderma gangrenosum, primary sclerosing cholangitis, and non-thyroidal illness syndrome (NTIS).[11] Associations with deep vein thrombosis (DVT)[12] and bronchiolitis obliterans organizing pneumonia (BOOP) have also been reported.[13] Diagnosis is generally by assessment of inflammatory markers in stool followed by colonoscopy with biopsy of pathological lesions.[14]
| Crohn’s disease | Ulcerative colitis | |
|---|---|---|
| Terminal ileum involvement | Commonly | Seldom |
| Colon involvement | Usually | Always |
| Rectum involvement | Seldom | Usually (95%)[15] |
| Involvement around the anus |
Common[16] | Seldom |
| Bile duct involvement | No increase in rate of primary sclerosing cholangitis | Higher rate[17] |
| Distribution of disease | Patchy areas of inflammation (skip lesions) | Continuous area of inflammation[15] |
| Endoscopy | Deep geographic and serpiginous (snake-like) ulcers | Continuous ulcer |
| Depth of inflammation | May be transmural, deep into tissues[16][5] | Shallow, mucosal |
| Stenosis | Common | Seldom |
| Granulomas on biopsy | May have non-necrotizing non-peri-intestinal crypt granulomas[16][18][19] | Non-peri-intestinal crypt granulomas not seen[20] |
Causes[edit]
| Crohn’s disease | Ulcerative colitis | |
|---|---|---|
| Cytokine response | Associated with Th17[21] | Vaguely associated with Th2 |
IBD is a complex disease which arises as a result of the interaction of environmental and genetic factors leading to immunological responses and inflammation in the intestine.[4]
Diet[edit]
People living with IBD are very interested in diet, but little is known about the impact of diet on these patients. Recent reviews underlined the important role of nutritional counselling in IBD patients. Patients should be encouraged to adopt diets that are best supported by evidence and involve monitoring for the objective resolution of inflammation.[22][23]
A 2022 study found that diets with increased intake of fruits and vegetables, reduction of processed meats and refined carbohydrates, and preference of water for hydration were associated with lower risk of active symptoms with IBD, although increased intake of fruits and vegetables alone did not reduce risk of symptoms with Crohn’s disease.[24]
Dietary patterns are associated with a risk for ulcerative colitis. In particular, subjects who were in the highest tertile of the healthy dietary pattern had a 79% lower risk of ulcerative colitis.[25]
Gluten sensitivity is common in IBD and associated with having flareups. Gluten sensitivity was reported in 23.6% and 27.3% of Crohn’s disease and ulcerative colitis patients, respectively.[26]
A diet high in protein, particularly animal protein, and/or high in sugar may be associated with increased risk of inflammatory bowel disease and relapses.[27][28]
Bile acids[edit]
Emerging evidence indicates that bile acids are important etiological agents in IBD pathogenesis.[29] IBD patients have a consistent pattern of an increased abundance of primary bile acids such as cholic acid and chenodeoxycholic acid (and their conjugated forms), and a decreased abundance of secondary bile acids such as lithocholic acid and deoxycholic acid.[29]
Microbiota[edit]
As a result of microbial symbiosis and immunity, alterations in the gut microbiome may contribute to inflammatory gut diseases.[30] IBD-affected individuals have been found to have 30–50 percent reduced biodiversity of commensal bacteria, such as decreases in Bacillota (namely Lachnospiraceae) and Bacteroidota. Further evidence of the role of gut flora in the cause of inflammatory bowel disease is that IBD-affected individuals are more likely to have been prescribed antibiotics in the 2–5 year period before their diagnosis than unaffected individuals.[31] The enteral bacteria can be altered by environmental factors, such as concentrated milk fats (a common ingredient of processed foods and confectionery) or oral medications such as antibiotics and oral iron preparations.[32] The mucosal microbiota in the large intestine of IBD patients with active inflammation was found to be associated with pro-inflammatory changes to the host epigenome.[33] However, large international studies have failed to identify a single microbial biomarker of IBD indicating it’s not driven by any single micro-organism.[34]
Breach of intestinal barrier[edit]
Loss of integrity of the intestinal epithelium plays a key pathogenic role in IBD.[35] Dysfunction of the innate immune system as a result of abnormal signaling through immune receptors called toll-like receptors (TLRs)—which activates an immune response to molecules that are broadly shared by multiple pathogens—contributes to acute and chronic inflammatory processes in IBD colitis and associated cancer.[36] Changes in the composition of the intestinal microbiota are an important environmental factor in the development of IBD. Detrimental changes in the intestinal microbiota induce an inappropriate (uncontrolled) immune response that results in damage to the intestinal epithelium. Breaches in this critical barrier (the intestinal epithelium) allow further infiltration of microbiota that, in turn, elicit further immune responses. IBD is a multifactorial disease that is nonetheless driven in part by an exaggerated immune response to gut microbiota that causes defects in epithelial barrier function.[37]
Oxidative stress and DNA damage[edit]
Pereira et al.[38] reviewed evidence from numerous studies indicating that oxidative stress and DNA damage likely have a role in the pathophysiology of IBD. Oxidative DNA damage as measured by 8-OHdG levels was found to be significantly increased in patients with IBD compared to control patients, and in inflamed mucosa compared with non-inflamed mucosa.[38]
Genetics[edit]
A genetic component to IBD has been recognized for over a century.[39] The genes associated with IBS are also more likely to be associated with anxiety, neuroticism and depression.[40]
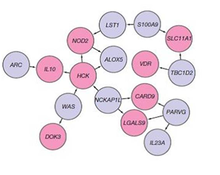
Research that has contributed to understanding of the genetics include studies of ethnic groups (e.g., Ashkenazi Jews, Irish), familial clustering, epidemiological studies, and twin studies. With the advent of molecular genetics, understanding of the genetic basis has expanded considerably, particularly in the past decade.[41] The first gene linked to IBD was NOD2 in 2001.
Genome-wide association studies have since added to understanding of the genomics and pathogenesis of the disease. More than 200 single nucleotide polymorphisms (SNPs or «snips») are now known to be associated with susceptibility to IBD.[42] One of the largest genetic studies of IBD was published in 2012.[43] The analysis explained more of the variance in Crohn’s disease and ulcerative colitis than previously reported.[41] The results suggested that commensal microbiota are altered in such a way that they act as pathogens in inflammatory bowel diseases. Other studies show that mutations in IBD-associated genes might interfere with the cellular activity and interactions with the microbiome that promote normal immune responses.[44] Many studies identified that microRNAs dysregulation involved in IBD and to promote colorectal cancer.[45] By 2020, single-cell RNA sequencing analysis was launched by a small consortium using IBD patient biopsy material in a search for therapeutic targets.[46]
Diagnosis[edit]
The diagnosis is usually confirmed by biopsies on colonoscopy. Fecal calprotectin is useful as an initial investigation, which may suggest the possibility of IBD, as this test is sensitive but not specific for IBD.[47][48]
Differential diagnosis[edit]
Other diseases may cause an increased excretion of fecal calprotectin, such as infectious diarrhea, untreated celiac disease, necrotizing enterocolitis, intestinal cystic fibrosis and neoplastic pediatric tumor cells.[49]
Conditions with similar symptoms as Crohn’s disease includes intestinal tuberculosis, Behçet’s disease, ulcerative colitis, nonsteroidal anti-inflammatory drug enteropathy, irritable bowel syndrome and coeliac disease.[50]
Conditions with similar symptoms as ulcerative colitis includes acute self-limiting colitis, amebic colitis, schistosomiasis, Crohn’s disease, colon cancer, irritable bowel syndrome, intestinal tuberculosis and nonsteroidal anti-inflammatory drug enteropathy.[50]
Liver function tests are often elevated in inflammatory bowel disease, and are often mild and generally return spontaneously to normal levels.[51] The most relevant mechanisms of elevated liver functions tests in IBD are drug-induced hepatotoxicity and fatty liver.[51]
Classification[edit]
The chief types of inflammatory bowel disease are Crohn’s disease and ulcerative colitis (UC). Inflammatory bowel diseases fall into the class of autoimmune diseases, in which the body’s own immune system attacks elements of the digestive system.[52]
Accounting for fewer cases are other forms of IBD, which are not always classified as typical IBD:[53]
- Microscopic colitis subdivided into collagenous colitis and lymphocytic colitis
- Diversion colitis
- Behçet’s disease
- Early Onset IBD[54]
- Indeterminate colitis
No disease specific markers are currently known in the blood, enabling the reliable separation of Crohn’s disease and ulcerative colitis patients.[55] The way doctors can tell the difference between Crohn’s disease and UC is the location and nature of the inflammatory changes. Crohn’s can affect any part of the gastrointestinal tract, from mouth to anus (skip lesions), although a majority of the cases start in the terminal ileum. Ulcerative colitis, in contrast, is restricted to the colon and the rectum.[56] Microscopically, ulcerative colitis is restricted to the mucosa (epithelial lining of the gut), while Crohn’s disease affects the full thickness of the bowel wall («transmural lesions»). Lastly, Crohn’s disease and ulcerative colitis present with extra-intestinal manifestations (such as liver problems, arthritis, skin manifestations and eye problems) in different proportions.[57]
In 10–15% of cases,[58] a definitive diagnosis neither of Crohn’s disease nor of ulcerative colitis can be made because of idiosyncrasies in the presentation. In this case, a diagnosis of indeterminate colitis may be made. Although a recognised definition, not all centres refer to this.[59]
Treatment[edit]
| Crohn’s disease | Ulcerative colitis | |
|---|---|---|
| Mesalazine | Less useful[60] | More useful[60] |
| Antibiotics | Effective in long-term[61] | Generally not useful[62] |
| Surgery | Often returns following removal of affected part |
Usually cured by removal of colon |
Surgery[edit]
CD and UC are chronic inflammatory diseases, and are not medically curable.[63] However, Ulcerative Colitis can in most cases be cured by proctocolectomy, although this may not eliminate extra-intestinal symptoms. An ileostomy will collect feces in a bag. Alternatively, a pouch can be created from the small intestine; this serves as the rectum and prevents the need for a permanent ileostomy. Between one-quarter and one-half of patients with ileo-anal pouches do have to manage occasional or chronic pouchitis.[64]
Surgery cannot cure Crohn’s disease but may be needed to treat complications such as abscesses, strictures or fistulae.[65] Severe cases may require surgery, such as bowel resection, strictureplasty or a temporary or permanent colostomy or ileostomy. In Crohn’s disease, surgery involves removing the worst inflamed segments of the intestine and connecting the healthy regions, but unfortunately, it does not cure Crohn’s or eliminate the disease. At some point after the first surgery, Crohn’s disease can recur in the healthy parts of the intestine, usually at the resection site.[66] (For example, if a patient with Crohn’s disease has an ileocecal anastomosis, in which the caecum and terminal ileum are removed and the ileum is joined to the ascending colon, their Crohn’s will nearly always flare-up near the anastomosis or in the rest of the ascending colon).[67]
Medical therapies[edit]
Medical treatment of IBD is individualised to each patient.[63] The choice of which drugs to use and by which route to administer them (oral, rectal, injection, infusion) depends on factors including the type, distribution, and severity of the patient’s disease, as well as other historical and biochemical prognostic factors, and patient preferences. For example, mesalazine is more useful in ulcerative colitis than in Crohn’s disease.[60] Generally, depending on the level of severity, IBD may require immunosuppression to control the symptoms, with drugs such as prednisone, tumor necrosis factor inhibitors (TNF inhibitors), azathioprine, methotrexate, or 6-mercaptopurine.[68]
Steroids, such as the glucocorticoid prednisone, are frequently used to control disease flares and were once acceptable as a maintenance drug. Biological therapy for inflammatory bowel disease, especially the TNF inhibitors, are used in people with more severe or resistant Crohn’s disease and sometimes in ulcerative colitis.[69]
Treatment is usually started by administering drugs with high anti-inflammatory effects, such as prednisone. Once the inflammation is successfully controlled, another drug to keep the disease in remission, such as mesalazine in UC, is the main treatment. If further treatment is required, a combination of an immunosuppressive drug (such as azathioprine) with mesalazine (which may also have an anti-inflammatory effect) may be needed, depending on the patient. Controlled release budesonide is used for mild ileal Crohn’s disease.[63]
Nutritional and dietetic therapies[edit]
Exclusive enteral nutrition is a first-line therapy in pediatric Crohn’s disease with weaker data in adults.[70]: 331 [71] Evidence supporting exclusive enteral nutrition in ulcerative colitis is lacking.[70]: 333
Nutritional deficiencies play a prominent role in IBD. Malabsorption, diarrhea, and GI blood loss are common features of IBD. Deficiencies of B vitamins, fat-soluble vitamins, essential fatty acids, and key minerals such as magnesium, zinc, and selenium are extremely common and benefit from replacement therapy. Dietary interventions, including certain exclusion diets like the specific carbohydrate diet (SCD) can be beneficial for symptom management.[72] Dietary fiber interventions, such as psyillium supplementation (a mixture of soluble and insoluble fibers), may relieve symptoms as well as induce/maintain remission by altering the microbiome composition of the GI tract, thereby improving regulation of immune function, reducing inflammation, and helping to restore the intestinal mucosal lining.[73]
Anaemia is commonly present in both ulcerative colitis and Crohn’s disease. Due to raised levels of inflammatory cytokines which lead to the increased expression of hepcidin, parenteral iron is the preferred treatment option as it bypasses the gastrointestinal system, has lower incidence of adverse events and enables quicker treatment. Hepcidin itself is also an anti-inflammatory agent. In the murine model very low levels of iron restrict hepcidin synthesis, worsening the inflammation that is present.[74] Enteral nutrition has been found to be efficient to improve hemoglobin level in patients with inflammatory bowel disease, especially combined with erythropoietin.[75]
Gastrointestinal bleeding, occurring especially during ulcerative colitis relapse, can contribute to anaemia when chronic, and may be life-threatening when acute. To limit the possible risk of dietary intake disturbing hemostasis in acute gastrointestinal bleeding, temporary fasting is often considered necessary in hospital settings.[76] The effectiveness of this approach is unknown; a Cochrane review in 2016 found no published clinical trials including children.[77]
Microbiome[edit]
There is preliminary evidence of an infectious contribution to inflammatory bowel disease in some patients that may benefit from antibiotic therapy, such as with rifaximin.[78] The evidence for a benefit of rifaximin is mostly limited to Crohn’s disease with less convincing evidence supporting use in ulcerative colitis.[79][80]
The use of oral probiotic supplements to modify the composition and behaviour of the microbiome has been considered as a possible therapy for both induction and maintenance of remission in people with Crohn’s disease and ulcerative colitis. A Cochrane review in 2020 did not find clear evidence of improved remission likelihood, nor lower adverse events, in people with Crohn’s disease, following probiotic treatment.[81]
For ulcerative colitis, there is low-certainty evidence that probiotic supplements may increase the probability of clinical remission.[82] People receiving probiotics were 73% more likely to experience disease remission and over 2x as likely to report improvement in symptoms compared to those receiving a placebo, with no clear difference in minor or serious adverse effects.[82] Although there was no clear evidence of greater remission when probiotic supplements were compared with 5‐aminosalicylic acid treatment as a monotherapy, the likelihood of remission was 22% higher if probiotics were used in combination with 5-aminosalicylic acid therapy.[82] Whereas in people who are already in remission, it is unclear whether probiotics help to prevent future relapse, either as a monotherapy or combination therapy.[83]
Fecal microbiota transplant is a relatively new treatment option for IBD which has attracted attention since 2010.[84][85] Some preliminary studies have suggested benefits similar to those in Clostridium difficile infection but a review of use in IBD shows that FMT is safe, but of variable efficacy. A 2014 review stated that more randomized controlled trials were needed.[85]
Alternative medicine[edit]
Complementary and alternative medicine approaches have been used in inflammatory bowel disorders.[86] Evidence from controlled studies of these therapies has been reviewed; risk of bias was quite heterogeneous. The best supportive evidence was found for herbal therapy, with Plantago ovata and curcumin in UC maintenance therapy, wormwood in CD, mind/body therapy and self-intervention in UC, and acupuncture in UC and CD.[87]
Novel approaches[edit]
Stem cell therapy is undergoing research as a possible treatment for IBD. A review of studies suggests a promising role, although there are substantial challenges, including cost and characterization of effects, which limit the current use in clinical practice.[88]
Psychological interventions[edit]
Currently, there is no evidence to recommend psychological treatment, such as psychotherapy, stress management and patient’s education, to all adults with IBD in general.[89] These treatments had no effect on quality of life, emotional well-being and disease activity.[89] The need for these approaches should be individually assessed and further researched to identify subgroups and determine type of therapy that may benefit individuals with IBD.[89] In adolescents population such treatments may be beneficial on quality of life and depression, although only short-term effects have been found, which also imposes the need for further research.[89]
Treatment standards[edit]
Crohn’s and Colitis Australia, the peak body for IBD in Australia, where prevalence is one of the highest in the world, reviewed the quality of care for patients admitted to Australian hospitals. They found that only one hospital met accepted standards for multidisciplinary care, but that care was improved with the availability of even minimal specialised services.[90]
Prognosis[edit]
| Crohn’s disease |
Ulcerative colitis |
||
|---|---|---|---|
| Nutrient deficiency | Higher risk | ||
| Colon cancer risk | Slight | Considerable | |
| Prevalence of extraintestinal complications[91][92][93] | |||
| Iritis/uveitis | Females | 2.2% | 3.2% |
| Males | 1.3% | 0.9% | |
| Primary sclerosing cholangitis |
Females | 0.3% | 1% |
| Males | 0.4% | 3% | |
| Ankylosing spondylitis |
Females | 0.7% | 0.8% |
| Males | 2.7% | 1.5% | |
| Pyoderma gangrenosum |
Females | 1.2% | 0.8% |
| Males | 1.3% | 0.7% | |
| Erythema nodosum | Females | 1.9% | 2% |
| Males | 0.6% | 0.7% |
While IBD can limit quality of life because of pain, vomiting, and diarrhea, it is rarely fatal on its own. Fatalities due to complications such as toxic megacolon, bowel perforation and surgical complications are also rare.[94] Fatigue is a common symptom of IBD and can be a burden.[95]
Around one-third of individuals with IBD experience persistent gastrointestinal symptoms similar to irritable bowel syndrome (IBS) in the absence of objective evidence of disease activity.[96] Despite enduring the side-effects of long-term therapies, this cohort has a quality of life that is not significantly different to that of individuals with uncontrolled, objectively active disease, and escalation of therapy to biological agents is typically ineffective in resolving their symptoms.[97] The cause of these IBS-like symptoms is unclear, but it has been suggested that changes in the gut-brain axis, epithelial barrier dysfunction, and the gut flora may be partially responsible.[98][needs update]
While patients of IBD do have an increased risk of colorectal cancer, this is usually caught much earlier than the general population in routine surveillance of the colon by colonoscopy, and therefore patients are much more likely to survive.[99]
New evidence suggests that patients with IBD may have an elevated risk of endothelial dysfunction and coronary artery disease.[100][101]
The goal of treatment is toward achieving remission, after which the patient is usually switched to a lighter drug with fewer potential side effects. Every so often, an acute resurgence of the original symptoms may appear; this is known as a «flare-up». Depending on the circumstances, it may go away on its own or require medication. The time between flare-ups may be anywhere from weeks to years, and varies wildly between patients – a few have never experienced a flare-up.[102]
Life with IBD can be challenging; however, many with the condition lead relatively normal lives. IBD carries a psychological burden due to stigmatization of being diagnosed, leading to high levels of anxiety, depression, and a general reduction in the quality of life.[103][104] Although living with IBD can be difficult, there are numerous resources available to help families navigate the ins and out of IBD, such as the Crohn’s and Colitis Foundation of America (CCFA).
Epidemiology[edit]
IBD resulted in a global total of 51,000 deaths in 2013 and 55,000 deaths in 1990.[105] The increased incidence of IBD since World War II has been correlated to the increase in meat consumption worldwide, supporting the claim that animal protein intake is associated with IBD.[106] However, there are many environmental risk factors that have been linked to the increased and decreased risk of IBD, such as smoking, air pollution and greenspace, urbanization and Westernization.[107] Inflammatory bowel diseases are increasing in Europe.[108] Incidence and prevalence of IBD has risen steadily for the last decades in Asia, which could be related changes in diet and other environmental factors.[109]
Around 0.8% of people in the UK have IBD.[110] Similarly, around 270,000 (0.7%) of people in Canada have IBD,[111] with that number expected to rise to 400,000 (1%) by 2030.[112]
Research[edit]
The following treatment strategies are not used routinely, but appear promising in some forms of inflammatory bowel disease.
Initial reports[113] suggest that «helminthic therapy» may not only prevent but even control IBD: a drink with roughly 2,500 ova of the Trichuris suis helminth taken twice monthly decreased symptoms markedly in many patients. It is even speculated that an effective «immunization» procedure could be developed—by ingesting the cocktail at an early age.[114]
Prebiotics and probiotics are focusing increasing interest as treatments for IBD. Currently, there is evidence to support the use of certain probiotics in addition to standard treatments in people with ulcerative colitis but there is no sufficient data to recommend probiotics in people with Crohn’s disease. Both single strain and multi-strain probiotics have been researched for mild to moderate cases of ulcerative colitis. The most clinically researched multi-strain probiotic with over 70 human trials is the De Simone Formulation.[115] Further research is required to identify specific probiotic strains or their combinations and prebiotic substances for therapies of intestinal inflammation.[116]
Currently, the probiotic strain, frequency, dose and duration of the probiotic therapy are not established.[117] In severely ill people with IBD there is a risk of the passage of viable bacteria from the gastrointestinal tract to the internal organs (bacterial translocation) and subsequent bacteremia, which can cause serious adverse health consequences.[117] Live bacteria might not be essential because of beneficial effects of probiotics seems to be mediated by their DNA and by secreted soluble factors, and their therapeutic effects may be obtained by systemic administration rather than oral administration.[117][118]
In 2005 New Scientist published a joint study by Bristol University and the University of Bath on the apparent healing power of cannabis on IBD. Reports that cannabis eased IBD symptoms indicated the possible existence of cannabinoid receptors in the intestinal lining, which respond to molecules in the plant-derived chemicals. CB1 cannabinoid receptors – which are known to be present in the brain – exist in the endothelial cells which line the gut, it is thought that they are involved in repairing the lining of the gut when damaged.[119]
The team deliberately damaged the cells to cause inflammation of the gut lining and then added synthetically produced cannabinoids; the result was that gut started to heal: the broken cells were repaired and brought back closer together to mend the tears. It is believed that in a healthy gut, natural endogenous cannabinoids are released from endothelial cells when they are injured, which then bind to the CB1 receptors. The process appears to set off a wound-healing reaction, and when people use cannabis, the cannabinoids bind to these receptors in the same way.[119]
Previous studies have shown that CB1 receptors located on the nerve cells in the gut respond to cannabinoids by slowing gut motility, therefore reducing the painful muscle contractions associated with diarrhea. CB2, another cannabinoid receptor predominantly expressed by immune cells, was detected in the gut of people with IBD at a higher concentration. These receptors, which also respond to chemicals in cannabis, appear to be associated with apoptosis – programmed cell death – and may have a role in suppressing the overactive immune system and reducing inflammation by mopping up excess cells.[119]
Activation of the endocannabinoid system was found efficient in ameliorating colitis and increasing the survival rate of mice, and reducing remote organ changes induced by colitis, further suggest that modulation of this system is a potential therapeutic approach for IBDs and the associated remote organ lesions.[120]
Alicaforsen is a first generation antisense oligodeoxynucleotide designed to bind specifically to the human ICAM-1 messenger RNA through Watson-Crick base pair interactions in order to subdue expression of ICAM-1.[121] ICAM-1 propagates an inflammatory response promoting the extravasation and activation of leukocytes (white blood cells) into inflamed tissue.[121] Increased expression of ICAM-1 has been observed within the inflamed intestinal mucosa of people with ulcerative colitis, pouchitis and Crohn’s, where ICAM-1 over production correlated with disease activity.[122] This suggests that ICAM-1 is a potential therapeutic target in the treatment of these diseases.[123][124]
Cannabinoid CB2 receptor agonists are found to decrease the induction of ICAM-1 and VCAM-1 surface expression in human brain tissues and primary human brain endothelial cells (BMVEC) exposed to various pro-inflammatory mediators.[125]
In 2014, an alliance among the Broad Institute, Amgen and Massachusetts General Hospital formed with the intention to «collect and analyze patient DNA samples to identify and further validate genetic targets.»[126]
In 2015, a meta-analysis on 938 IBD patients and 953 controls, IBD was significantly associated with having higher odds of vitamin D deficiency.[127]
Gram-positive bacteria present in the lumen could be associated with extending the time of relapse for ulcerative colitis.[128]
Bidirectional pathways between depression and IBD have been suggested [129] and psychological processes have been demonstrated to influence self-perceived physical and psychological health over time.[130] IBD-disease activity may impact quality of life and over time may significantly affect individual’s mental well-being, which may be related to the increased risk to develop anxiety and/or depression.[129][131][132] On the other hand, psychological distress may also influence IBD activity.[133]
Higher rates of anxiety and depression are observed among those with IBD compared to healthy individuals, which correlated with disease severity.[131][133] Part of this phenotypic correlation is due to a shared genetic overlap between IBD and psychiatric comorbidities.[134] Moreover, anxiety and depression rates increase during active disease compared with inactive phases.[133]
In other Species[edit]
IBD also occurs in dogs and is thought to arise from a combination of host genetics, intestinal microenvironment, environmental components and the immune system. There is an ongoing discussion, however, that the term «chronic enteropathy» might be better to use than «inflammatory bowel disease» in dogs because it differs from IBD in humans in how the dogs respond to treatment. For example, many dogs respond to only dietary changes compared to humans with IBD, who often need immunosuppressive treatment. Some dogs may also need immunosuppressant or antibiotic treatment when dietary changes are not enough. After having excluded other diseases that can lead to vomiting, diarrhea, and abdominal pain in dogs, intestinal biopsies are often performed to investigate what kind of inflammation is occurring (lymphoplasmacytic, eosinophilic, or granulomatous). In dogs, low levels of cobalamin in the blood have been shown to be a risk factor for negative outcome.[135][136][137]
See also[edit]
- Inflammatory bowel disease-22
- World Inflammatory Bowel Disease Day
References[edit]
- ^ GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (October 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (October 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1459–1544. doi:10.1016/S0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ Talley N (2018). Clinical examination: A systematic guide to physical diagnosis. Chatswood, N.S.W: Elsevier Australia. p. 227. ISBN 978-0-7295-4259-3. OCLC 988941211.
- ^ a b Baumgart DC, Carding SR (May 2007). «Inflammatory bowel disease: cause and immunobiology». Lancet. 369 (9573): 1627–40. doi:10.1016/S0140-6736(07)60750-8. PMID 17499605. S2CID 13544348.
- ^ a b Baumgart DC, Sandborn WJ (May 2007). «Inflammatory bowel disease: clinical aspects and established and evolving therapies». Lancet. 369 (9573): 1641–57. doi:10.1016/S0140-6736(07)60751-X. PMID 17499606. S2CID 35264387.
- ^ Xavier RJ, Podolsky DK (July 2007). «Unravelling the pathogenesis of inflammatory bowel disease». Nature. 448 (7152): 427–34. Bibcode:2007Natur.448..427X. doi:10.1038/nature06005. PMID 17653185. S2CID 4337332.
- ^ a b c d e f internetmedicin.se > Inflammatorisk tarmsjukdom, kronisk, IBD By Robert Löfberg. Retrieved Oct 2010 Translate.
- ^ Hanauer SB, Sandborn W (March 2001). «Management of Crohn’s disease in adults». The American Journal of Gastroenterology. 96 (3): 635–43. doi:10.1111/j.1572-0241.2001.3671_c.x (inactive 1 August 2023). PMID 11280528. S2CID 31219115.
{{cite journal}}: CS1 maint: DOI inactive as of August 2023 (link) - ^ Wang GF, Ren JA, Liu S, Chen J, Gu GS, Wang XB, et al. (July 2012). «Clinical characteristics of non-perianal fistulating Crohn’s disease in China: a single-center experience of 184 cases». Chinese Medical Journal. 125 (14): 2405–10. PMID 22882911.
- ^ Stein J, Hartmann F, Dignass AU (November 2010). «Diagnosis and management of iron deficiency anemia in patients with IBD». Nature Reviews. Gastroenterology & Hepatology. 7 (11): 599–610. doi:10.1038/nrgastro.2010.151. PMID 20924367. S2CID 25341683.
- ^ Liu S, Ren J, Zhao Y, Han G, Hong Z, Yan D, et al. (February 2013). «Nonthyroidal illness syndrome: is it far away from Crohn’s disease?». Journal of Clinical Gastroenterology. 47 (2): 153–9. doi:10.1097/MCG.0b013e318254ea8a. PMID 22874844. S2CID 35344744.
- ^ Warner J (February 22, 2011). Martin LJ (ed.). «Inflammatory Bowel Disease Health Center». WebMD. Retrieved 14 October 2014.
- ^ Lu DG, Ji XQ, Liu X, Li HJ, Zhang CQ (January 2014). «Pulmonary manifestations of Crohn’s disease». World Journal of Gastroenterology. 20 (1): 133–41. doi:10.3748/wjg.v20.i1.133. PMC 3886002. PMID 24415866.
- ^ Aydoğdu, Müge; Gürsel, Gül; Özyilmaz, Ezgi; Akyürek, Nalan; Memış, Leyla (2012). «A case of ulcerative colitis complicated with bronchiolitis obliterans organizing pneumonia (BOOP) and air leak syndrome». The Turkish Journal of Gastroenterology. 23 (5): 590–595. doi:10.4318/tjg.2012.0428. ISSN 2148-5607. PMID 23161307.
- ^ a b Rubin DT, Ananthakrishnan AN, Siegel CA, Sauer BG, Long MD (March 2019). «ACG Clinical Guideline: Ulcerative Colitis in Adults». The American Journal of Gastroenterology. 114 (3): 384–413. doi:10.14309/ajg.0000000000000152. PMID 30840605. S2CID 73473272.
- ^ a b c Hanauer SB, Sandborn W (March 2001). «Management of Crohn’s disease in adults». The American Journal of Gastroenterology. 96 (3): 635–43. doi:10.1111/j.1572-0241.2001.3671_c.x (inactive 1 August 2023). PMID 11280528. S2CID 31219115.
{{cite journal}}: CS1 maint: DOI inactive as of August 2023 (link) - ^ Broomé U, Bergquist A (February 2006). «Primary sclerosing cholangitis, inflammatory bowel disease, and colon cancer». Seminars in Liver Disease. 26 (1): 31–41. doi:10.1055/s-2006-933561. PMID 16496231.
- ^ Shepherd NA (August 2002). «Granulomas in the diagnosis of intestinal Crohn’s disease: a myth exploded?». Histopathology. 41 (2): 166–8. doi:10.1046/j.1365-2559.2002.01441.x. PMID 12147095. S2CID 36907992.
- ^ Mahadeva U, Martin JP, Patel NK, Price AB (July 2002). «Granulomatous ulcerative colitis: a re-appraisal of the mucosal granuloma in the distinction of Crohn’s disease from ulcerative colitis». Histopathology. 41 (1): 50–5. doi:10.1046/j.1365-2559.2002.01416.x. PMID 12121237. S2CID 29476514.
- ^ DeRoche TC, Xiao SY, Liu X (August 2014). «Histological evaluation in ulcerative colitis». Gastroenterology Report. 2 (3): 178–92. doi:10.1093/gastro/gou031. PMC 4124271. PMID 24942757.
- ^ Elson CO, Cong Y, Weaver CT, Schoeb TR, McClanahan TK, Fick RB, Kastelein RA (2007). «Monoclonal anti-interleukin 23 reverses active colitis in a T cell-mediated model in mice». Gastroenterology. 132 (7): 2359–70. doi:10.1053/j.gastro.2007.03.104. PMID 17570211.
- ^ Ananthakrishnan AN, Kaplan GG, Bernstein CN, Burke KE, Lochhead PJ, Sasson AN, Agrawal M, Tiong JHT, Steinberg J, Kruis W, Steinwurz F, Ahuja V, Ng SC, Rubin DT, Colombel JF, Gearry R; International Organization for Study of Inflammatory Bowel Diseases. Lifestyle, behaviour, and environmental modification for the management of patients with inflammatory bowel diseases: an International Organization for Study of Inflammatory Bowel Diseases consensus. Lancet Gastroenterol Hepatol. 2022 Apr 26:S2468-1253(22)00021-8.
- ^ Roncoroni L, Gori R, Elli L, Tontini GE, Doneda L, Norsa L, Cuomo M, Lombardo V, Scricciolo A, Caprioli F, Costantino A, Scaramella L, Vecchi M. Nutrition in Patients with Inflammatory Bowel Diseases: A Narrative Review. Nutrients. 2022 Feb 10;14(4):751.
- ^ Limketkai, Berkeley N.; Hamideh, Mohamed; Shah, Rishabh; Sauk, Jenny S.; Jaffe, Nancee (2022-01-29). «Dietary Patterns and Their Association With Symptoms Activity in Inflammatory Bowel Diseases». Inflammatory Bowel Diseases. 28 (11): 1627–1636. doi:10.1093/ibd/izab335. ISSN 1536-4844. PMID 35092268.
- ^ Rashvand S, Behrooz M, Samsamikor M, Jacobson K, Hekmatdoost A (June 2018). «Dietary patterns and risk of ulcerative colitis: a case-control study». Journal of Human Nutrition and Dietetics. 31 (3): 408–412. doi:10.1111/jhn.12544. PMID 29468761. S2CID 3452004.
- ^ Limketkai BN, Sepulveda R, Hing T, Shah ND, Choe M, Limsui D, Shah S (February 2018). «Prevalence and factors associated with gluten sensitivity in inflammatory bowel disease». Scandinavian Journal of Gastroenterology. 53 (2): 147–151. doi:10.1080/00365521.2017.1409364. PMID 29216767. S2CID 4119392.
- ^ Andersen V, Olsen A, Carbonnel F, Tjønneland A, Vogel U (March 2012). «Diet and risk of inflammatory bowel disease». Digestive and Liver Disease. 44 (3): 185–94. doi:10.1016/j.dld.2011.10.001. PMID 22055893.
- ^ Barron M (2021-01-11). «Sugar may trigger inflammatory bowel disease by breaking down gut mucus». Massive Science. Retrieved 2021-01-15.
{{cite web}}: CS1 maint: url-status (link) - ^ a b Thomas JP, Modos D, Rushbrook SM, Powell N, Korcsmaros T. The Emerging Role of Bile Acids in the Pathogenesis of Inflammatory Bowel Disease. Front Immunol. 2022 Feb 3;13:829525. doi: 10.3389/fimmu.2022.829525. PMID 35185922; PMCID: PMC8850271
- ^ Mukhopadhya I, Hansen R, El-Omar EM, Hold GL (February 2012). «IBD-what role do Proteobacteria play?». Nature Reviews. Gastroenterology & Hepatology. 9 (4): 219–30. doi:10.1038/nrgastro.2012.14. PMID 22349170. S2CID 24538712.
- ^ Aroniadis OC, Brandt LJ (January 2013). «Fecal microbiota transplantation: past, present and future». Current Opinion in Gastroenterology. 29 (1): 79–84. doi:10.1097/MOG.0b013e32835a4b3e. PMID 23041678. S2CID 39943619.
- ^ Kotanko P, Carter M, Levin NW (August 2006). «Intestinal bacterial microflora—a potential source of chronic inflammation in patients with chronic kidney disease». Nephrology, Dialysis, Transplantation. 21 (8): 2057–60. doi:10.1093/ndt/gfl281. PMID 16762961.
- ^ Ryan, F. J.; Ahern, A. M.; Fitzgerald, R. S.; Laserna-Mendieta, E. J.; Power, E. M.; Clooney, A. G.; O’Donoghue, K. W.; McMurdie, P. J.; Iwai, S.; Crits-Christoph, A.; Sheehan, D. (2020-03-23). «Colonic microbiota is associated with inflammation and host epigenomic alterations in inflammatory bowel disease». Nature Communications. 11 (1): 1512. Bibcode:2020NatCo..11.1512R. doi:10.1038/s41467-020-15342-5. ISSN 2041-1723. PMC 7089947. PMID 32251296.
- ^ Clooney, Adam G.; Eckenberger, Julia; Laserna-Mendieta, Emilio; Sexton, Kathryn A.; Bernstein, Matthew T.; Vagianos, Kathy; Sargent, Michael; Ryan, Feargal J.; Moran, Carthage; Sheehan, Donal; Sleator, Roy D. (March 2021). «Ranking microbiome variance in inflammatory bowel disease: a large longitudinal intercontinental study». Gut. 70 (3): 499–510. doi:10.1136/gutjnl-2020-321106. ISSN 1468-3288. PMC 7873428. PMID 32536605.
- ^ Maloy KJ, Powrie F (June 2011). «Intestinal homeostasis and its breakdown in inflammatory bowel disease». Nature. 474 (7351): 298–306. doi:10.1038/nature10208. PMID 21677746. S2CID 205225483. Archived from the original on 2019-10-29. Retrieved 2019-10-29.
- ^ Cario E (September 2010). «Toll-like receptors in inflammatory bowel diseases: a decade later». Inflammatory Bowel Diseases. 16 (9): 1583–97. doi:10.1002/ibd.21282. PMC 2958454. PMID 20803699.
- ^ Coskun M (2014-08-25). «Intestinal epithelium in inflammatory bowel disease». Frontiers in Medicine. 1: 24. doi:10.3389/fmed.2014.00024. PMC 4292184. PMID 25593900.
- ^ a b Pereira, Cristiana; Grácio, Daniela; Teixeira, João P.; Magro, Fernando (October 2015). «Oxidative Stress and DNA Damage: Implications in Inflammatory Bowel Disease». Inflammatory Bowel Diseases. 21 (10): 2403–2417. doi:10.1097/MIB.0000000000000506. PMID 26193347. S2CID 8068289.
- ^ Ek WE, D’Amato M, Halfvarson J (2014). «The history of genetics in inflammatory bowel disease». Annals of Gastroenterology. 27 (4): 294–303. PMC 4188925. PMID 25331623.
- ^ Eijsbouts, Chris; Zheng, Tenghao; Kennedy, Nicholas A.; et al. (November 2021). «Genome-wide analysis of 53,400 people with irritable bowel syndrome highlights shared genetic pathways with mood and anxiety disorders». Nature Genetics. 53 (11): 1543–1552. doi:10.1038/s41588-021-00950-8. ISSN 1546-1718. PMC 8571093. PMID 34741163.
- ^ a b Liu TC, Stappenbeck TS (May 2016). «Genetics and Pathogenesis of Inflammatory Bowel Disease». Annual Review of Pathology. 11: 127–48. doi:10.1146/annurev-pathol-012615-044152. PMC 3204665. PMID 26907531.
- ^ Ye BD, McGovern DP (October 2016). «Genetic variation in IBD: progress, clues to pathogenesis and possible clinical utility». Expert Review of Clinical Immunology. 12 (10): 1091–107. doi:10.1080/1744666X.2016.1184972. PMC 5083126. PMID 27156530.
- ^ Jostins L, Ripke S, Weersma RK, Duerr RH, McGovern DP, Hui KY, et al. (November 2012). «Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease». Nature. 491 (7422): 119–24. Bibcode:2012Natur.491..119.. doi:10.1038/nature11582. PMC 3491803. PMID 23128233.
- ^ Chu H, Khosravi A, Kusumawardhani IP, Kwon AH, Vasconcelos AC, Cunha LD, et al. (May 2016). «Gene-microbiota interactions contribute to the pathogenesis of inflammatory bowel disease». Science. 352 (6289): 1116–20. Bibcode:2016Sci…352.1116C. doi:10.1126/science.aad9948. PMC 4996125. PMID 27230380.
- ^ Bocchetti M, Ferraro MG, Ricciardiello F, Ottaiano A, Luce A, Cossu AM, et al. (April 2021). «The Role of microRNAs in Development of Colitis-Associated Colorectal Cancer». International Journal of Molecular Sciences. 22 (8): 3967. doi:10.3390/ijms22083967. PMC 8068787. PMID 33921348.
- ^ Staff (1 July 2020). «Celsius Therapeutics Teams With Oxford, Cleveland Clinic, LMU on Single-Cell IBD Research». genomeweb. New York City: Crain Communications. Retrieved 1 July 2020.
- ^ Henderson P, Anderson NH, Wilson DC (May 2014). «The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease: a systematic review and meta-analysis». The American Journal of Gastroenterology. 109 (5): 637–45. doi:10.1038/ajg.2013.131. PMID 23670113. S2CID 30604736.
- ^ Waugh N, Cummins E, Royle P, Kandala NB, Shyangdan D, Arasaradnam R, et al. (November 2013). «Faecal calprotectin testing for differentiating amongst inflammatory and non-inflammatory bowel diseases: systematic review and economic evaluation». Health Technology Assessment. 17 (55): xv–xix, 1–211. doi:10.3310/hta17550. PMC 4781415. PMID 24286461.
- ^ Vaos G, Kostakis ID, Zavras N, Chatzemichael A (2013). «The role of calprotectin in pediatric disease». BioMed Research International (Review). 2013: 542363. doi:10.1155/2013/542363. PMC 3794633. PMID 24175291.
- ^ a b «Inflammatory Bowel Disease» (PDF). World Gastroenterology Organization. August 2015. Retrieved Mar 13, 2016.
- ^ a b Cappello M, Randazzo C, Bravatà I, Licata A, Peralta S, Craxì A, Almasio PL (2014). «Liver Function Test Abnormalities in Patients with Inflammatory Bowel Diseases: A Hospital-based Survey». Clinical Medicine Insights. Gastroenterology. 7: 25–31. doi:10.4137/CGast.S13125. PMC 4069044. PMID 24966712.
- ^ «IBD Facts». Archived from the original on 2013-02-12. Retrieved 2013-02-13.
- ^ Levine, Jonathan S.; Burakoff, Robert (2011). «Extraintestinal Manifestations of Inflammatory Bowel Disease». Gastroenterology & Hepatology. 7 (4): 235–241. ISSN 1554-7914. PMC 3127025. PMID 21857821.
- ^ Glocker EO, Kotlarz D, Boztug K, Gertz EM, Schäffer AA, Noyan F, et al. (November 2009). «Inflammatory bowel disease and mutations affecting the interleukin-10 receptor». The New England Journal of Medicine. 361 (21): 2033–2045. doi:10.1056/NEJMoa0907206. PMC 2787406. PMID 19890111.
- ^ Bennike, Tue; Birkelund, Svend; Stensballe, Allan; Andersen, Vibeke (2014-03-28). «Biomarkers in inflammatory bowel diseases: Current status and proteomics identification strategies». World Journal of Gastroenterology. 20 (12): 3231–3244. doi:10.3748/wjg.v20.i12.3231. ISSN 1007-9327. PMC 3964395. PMID 24696607.
- ^ «Crohn’s & Colitis Foundation of America».
- ^ Yamamoto-Furusho, J. K.; Bosques-Padilla, F.; de-Paula, J.; Galiano, M. T.; Ibañez, P.; Juliao, F.; Kotze, P. G.; Rocha, J. L.; Steinwurz, F.; Veitia, G.; Zaltman, C. (2017-01-01). «Diagnosis and treatment of inflammatory bowel disease: First Latin American Consensus of the Pan American Crohn’s and Colitis Organisation». Revista de Gastroenterología de México (English Edition). 82 (1): 46–84. doi:10.1016/j.rgmxen.2016.07.003. ISSN 2255-534X. PMID 27979414.
- ^ Guindi M, Riddell RH (December 2004). «Indeterminate colitis». Journal of Clinical Pathology. 57 (12): 1233–44. doi:10.1136/jcp.2003.015214. PMC 1770507. PMID 15563659.
- ^ Guindi, M; Riddell, R H (2004). «Indeterminate colitis». Journal of Clinical Pathology. 57 (12): 1233–1244. doi:10.1136/jcp.2003.015214. ISSN 0021-9746. PMC 1770507. PMID 15563659.
- ^ a b c Agabegi ED, Agabegi SS (2008). «Inflammatory bowel disease (IBD)». Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 152–156. ISBN 0-7817-7153-6.
- ^ Feller M, Huwiler K, Schoepfer A, Shang A, Furrer H, Egger M (February 2010). «Long-term antibiotic treatment for Crohn’s disease: systematic review and meta-analysis of placebo-controlled trials». Clinical Infectious Diseases. 50 (4): 473–80. doi:10.1086/649923. PMID 20067425.
- ^ Prantera C, Scribano ML (July 2009). «Antibiotics and probiotics in inflammatory bowel disease: why, when, and how». Current Opinion in Gastroenterology. 25 (4): 329–33. doi:10.1097/MOG.0b013e32832b20bf. PMID 19444096.
- ^ a b c Mowat C, Cole A, Windsor A, Ahmad T, Arnott I, Driscoll R, et al. (May 2011). «Guidelines for the management of inflammatory bowel disease in adults». Gut. 60 (5): 571–607. doi:10.1136/gut.2010.224154. PMID 21464096. S2CID 8269837.
- ^ «Pouchitis: Symptoms & Causes». Mayo Clinic. 21 December 2018.
- ^ Karimuddin A, Gilles G. «Surgery for Abdominal/Intestinal Crohn’s Disease». Trusted Therapies. Retrieved 19 May 2015.
- ^ «Inflammatory Bowel Disease». Mayo Clinic. Retrieved November 18, 2022.
- ^ DiLauro, Steven; Crum-Cianflone, Nancy F. (2010). «Ileitis: When It Is Not Crohn’s Disease». Current Gastroenterology Reports. 12 (4): 249–258. doi:10.1007/s11894-010-0112-5. ISSN 1522-8037. PMC 2914216. PMID 20532706.
- ^ Cohen, Benjamin L.; Torres, Joana; déric Colombel, Jean-Fré (2012). «Immunosuppression in inflammatory bowel disease: how much is too much?». Current Opinion in Gastroenterology. 28 (4): 341–348. doi:10.1097/MOG.0b013e328354567f. ISSN 0267-1379. PMC 6681654. PMID 22573191.
- ^ D’Haens GR, Panaccione R, Higgins PD, Vermeire S, Gassull M, Chowers Y, et al. (February 2011). «The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohn’s and Colitis Organization: when to start, when to stop, which drug to choose, and how to predict response?». The American Journal of Gastroenterology. 106 (2): 199–212, quiz 213. doi:10.1038/ajg.2010.392. PMID 21045814. S2CID 24401720.
- ^ a b Forbes A, Escher J, Hébuterne X, Kłęk S, Krznaric Z, Schneider S, et al. (April 2017). «ESPEN guideline: Clinical nutrition in inflammatory bowel disease». Clinical Nutrition. 36 (2): 321–347. doi:10.1016/j.clnu.2016.12.027. PMID 28131521.
- ^ Ashton JJ, Gavin J, Beattie RM (February 2019). «Exclusive enteral nutrition in Crohn’s disease: Evidence and practicalities». Clinical Nutrition. 38 (1): 80–89. doi:10.1016/j.clnu.2018.01.020. PMID 29398336. S2CID 25135919.
- ^ Charlebois A, Rosenfeld G, Bressler B (June 2016). «The Impact of Dietary Interventions on the Symptoms of Inflammatory Bowel Disease: A Systematic Review». Critical Reviews in Food Science and Nutrition. 56 (8): 1370–8. doi:10.1080/10408398.2012.760515. PMID 25569442. S2CID 267557.
- ^ Wong C, Harris PJ, Ferguson LR (June 2016). «Potential Benefits of Dietary Fibre Intervention in Inflammatory Bowel Disease». International Journal of Molecular Sciences. 17 (6): 919. doi:10.3390/ijms17060919. PMC 4926452. PMID 27314323.
- ^ Pagani A, Nai A, Corna G, Bosurgi L, Rovere-Querini P, Camaschella C, Silvestri L (July 2011). «Low hepcidin accounts for the proinflammatory status associated with iron deficiency». Blood. 118 (3): 736–46. doi:10.1182/blood-2011-02-337212. PMID 21628413. S2CID 27452694.
- ^ Liu S, Ren J, Hong Z, Yan D, Gu G, Han G, et al. (February 2013). «Efficacy of erythropoietin combined with enteral nutrition for the treatment of anemia in Crohn’s disease: a prospective cohort study». Nutrition in Clinical Practice. 28 (1): 120–7. doi:10.1177/0884533612462744. PMID 23064018.
- ^ Hébuterne, Xavier; Vanbiervliet, Geoffroy (2011). «Feeding the patients with upper gastrointestinal bleeding». Current Opinion in Clinical Nutrition and Metabolic Care. 14 (2): 197–201. doi:10.1097/MCO.0b013e3283436dc5. ISSN 1363-1950. PMID 21252654. S2CID 39937720.
- ^ Luo, Shuang-Hong; Guo, Qin; Liu, Guan J; Wan, Chaomin (2016-05-19). Cochrane Gut Group (ed.). «Fasting for haemostasis in children with gastrointestinal bleeding». Cochrane Database of Systematic Reviews. 2021 (7): CD010714. doi:10.1002/14651858.CD010714.pub2. PMC 7066502. PMID 27197069.
- ^ Lopetuso LR, Napoli M, Rizzatti G, Gasbarrini A (June 2018). «The intriguing role of Rifaximin in gut barrier chronic inflammation and in the treatment of Crohn’s disease». Expert Opinion on Investigational Drugs. 27 (6): 543–551. doi:10.1080/13543784.2018.1483333. PMID 29865875. S2CID 46928303.
- ^ Scribano ML (2015). «Role of Rifaximin in Inflammatory Bowel Disease Treatment». Mini Reviews in Medicinal Chemistry. 16 (3): 225–9. doi:10.2174/1389557515666150722104230. PMID 26202194.
- ^ Sartor RB (January 2016). «Review article: the potential mechanisms of action of rifaximin in the management of inflammatory bowel diseases». Alimentary Pharmacology & Therapeutics. 43 (Suppl 1): 27–36. doi:10.1111/apt.13436. PMID 26618923. S2CID 26119818.
- ^ Limketkai, Berkeley N; Akobeng, Anthony K; Gordon, Morris; Adepoju, Akinlolu Adedayo (2020-07-17). Cochrane Gut Group (ed.). «Probiotics for induction of remission in Crohn’s disease». Cochrane Database of Systematic Reviews. 2020 (7): CD006634. doi:10.1002/14651858.CD006634.pub3. PMC 7389339. PMID 32678465.
- ^ a b c Kaur, Lakhbir; Gordon, Morris; Baines, Patricia Anne; Iheozor-Ejiofor, Zipporah; Sinopoulou, Vasiliki; Akobeng, Anthony K (2020-03-04). Cochrane IBD Group (ed.). «Probiotics for induction of remission in ulcerative colitis». Cochrane Database of Systematic Reviews. 3 (3): CD005573. doi:10.1002/14651858.CD005573.pub3. PMC 7059959. PMID 32128795.
- ^ Iheozor-Ejiofor, Zipporah; Kaur, Lakhbir; Gordon, Morris; Baines, Patricia Anne; Sinopoulou, Vasiliki; Akobeng, Anthony K (2020-03-04). Cochrane IBD Group (ed.). «Probiotics for maintenance of remission in ulcerative colitis». Cochrane Database of Systematic Reviews. 3 (3): CD007443. doi:10.1002/14651858.CD007443.pub3. PMC 7059960. PMID 32128794.
- ^ Sunkara T, Rawla P, Ofosu A, Gaduputi V (2018). «Fecal microbiota transplant — a new frontier in inflammatory bowel disease». Journal of Inflammation Research. 11: 321–328. doi:10.2147/JIR.S176190. PMC 6124474. PMID 30214266.
- ^ a b Colman RJ, Rubin DT (December 2014). «Fecal microbiota transplantation as therapy for inflammatory bowel disease: a systematic review and meta-analysis». Journal of Crohn’s & Colitis. 8 (12): 1569–81. doi:10.1016/j.crohns.2014.08.006. PMC 4296742. PMID 25223604.
- ^ Gilardi D, Fiorino G, Genua M, Allocca M, Danese S (September 2014). «Complementary and alternative medicine in inflammatory bowel diseases: what is the future in the field of herbal medicine?». Expert Review of Gastroenterology & Hepatology. 8 (7): 835–46. doi:10.1586/17474124.2014.917954. PMID 24813226. S2CID 207205293.
- ^ Langhorst J, Wulfert H, Lauche R, Klose P, Cramer H, Dobos GJ, Korzenik J (January 2015). «Systematic review of complementary and alternative medicine treatments in inflammatory bowel diseases». Journal of Crohn’s & Colitis. 9 (1): 86–106. doi:10.1093/ecco-jcc/jju007. PMID 25518050.
- ^ Dave M, Mehta K, Luther J, Baruah A, Dietz AB, Faubion WA (November 2015). «Mesenchymal Stem Cell Therapy for Inflammatory Bowel Disease: A Systematic Review and Meta-analysis». Inflammatory Bowel Diseases. 21 (11): 2696–707. doi:10.1097/MIB.0000000000000543. PMC 4615553. PMID 26230863.
- ^ a b c d Timmer, Antje; Preiss, Jan C; Motschall, Edith; Rücker, Gerta; Jantschek, Günther; Moser, Gabriele (2011-02-15). Cochrane IBD Group (ed.). «Psychological interventions for treatment of inflammatory bowel disease». Cochrane Database of Systematic Reviews (2): CD006913. doi:10.1002/14651858.CD006913.pub2. PMID 21328288.
- ^ Massuger, Wayne; Moore, Gregory T. C.; et al. (2019). «Crohn’s & Colitis Australia inflammatory bowel disease audit: measuring the quality of care in Australia» (PDF). Internal Medicine Journal. Wiley. 49 (7): 859–866. doi:10.1111/imj.14187. hdl:11343/286098. ISSN 1444-0903. PMID 30525299. S2CID 54564573.
- ^ Greenstein AJ, Janowitz HD, Sachar DB (September 1976). «The extra-intestinal complications of Crohn’s disease and ulcerative colitis: a study of 700 patients». Medicine. 55 (5): 401–412. doi:10.1097/00005792-197609000-00004. PMID 957999.
- ^ Bernstein CN, Blanchard JF, Rawsthorne P, Yu N (April 2001). «The prevalence of extraintestinal diseases in inflammatory bowel disease: a population-based study». The American Journal of Gastroenterology. 96 (4): 1116–1122. doi:10.1111/j.1572-0241.2001.03756.x. PMID 11316157.
- ^ Harbord M, Annese V, Vavricka SR, Allez M, Barreiro-de Acosta M, Boberg KM, et al. (March 2016). «The First European Evidence-based Consensus on Extra-intestinal Manifestations in Inflammatory Bowel Disease». Journal of Crohn’s & Colitis. 10 (3): 239–254. doi:10.1093/ecco-jcc/jjv213. PMID 26614685.
- ^ Greenstein, A. J.; Aufses, A. H. (1985). «Differences in pathogenesis, incidence and outcome of perforation in inflammatory bowel disease». Surgery, Gynecology & Obstetrics. 160 (1): 63–69. ISSN 0039-6087. PMID 3871126.
- ^ Farrell D, Artom M, Czuber-Dochan W, Jelsness-Jørgensen LP, Norton C, Savage E (April 2020). «Interventions for fatigue in inflammatory bowel disease». The Cochrane Database of Systematic Reviews. 2020 (4): CD012005. doi:10.1002/14651858.CD012005.pub2. PMC 7161727. PMID 32297974.
- ^ Halpin SJ, Ford AC (October 2012). «Prevalence of symptoms meeting criteria for irritable bowel syndrome in inflammatory bowel disease: systematic review and meta-analysis». The American Journal of Gastroenterology. 107 (10): 1474–82. doi:10.1038/ajg.2012.260. PMID 22929759. S2CID 11007309.
- ^ Gracie DJ, Williams CJ, Sood R, Mumtaz S, Bholah MH, Hamlin PJ, Ford AC (March 2017). «Negative Effects on Psychological Health and Quality of Life of Genuine Irritable Bowel Syndrome-type Symptoms in Patients With Inflammatory Bowel Disease». Clinical Gastroenterology and Hepatology. 15 (3): 376–384.e5. doi:10.1016/j.cgh.2016.05.012. PMID 27189912.
- ^ Abdul Rani R, Raja Ali RA, Lee YY (October 2016). «Irritable bowel syndrome and inflammatory bowel disease overlap syndrome: pieces of the puzzle are falling into place». Intestinal Research. 14 (4): 297–304. doi:10.5217/ir.2016.14.4.297. PMC 5083258. PMID 27799880.
- ^ Guagnozzi, Danila; Lucendo, Alfredo J (2012-04-16). «Colorectal cancer surveillance in patients with inflammatory bowel disease: What is new?». World Journal of Gastrointestinal Endoscopy. 4 (4): 108–116. doi:10.4253/wjge.v4.i4.108. ISSN 1948-5190. PMC 3329610. PMID 22523611.
- ^ Gandhi S, Narula N, Marshall JK, Farkouh M (October 2012). «Are patients with inflammatory bowel disease at increased risk of coronary artery disease?». The American Journal of Medicine. 125 (10): 956–62. doi:10.1016/j.amjmed.2012.03.015. PMID 22840916.
- ^ Roifman I, Sun YC, Fedwick JP, Panaccione R, Buret AG, Liu H, et al. (February 2009). «Evidence of endothelial dysfunction in patients with inflammatory bowel disease». Clinical Gastroenterology and Hepatology. 7 (2): 175–82. doi:10.1016/j.cgh.2008.10.021. PMID 19121648.
- ^ «Inflammatory bowel disease». nhs.uk. 2017-10-18. Retrieved 2022-11-29.
- ^ Kemp K, Griffiths J, Lovell K. Understanding the health and social care needs ofpeople living with IBD: a meta-synthesis of the evidence. World J Gastroenterol2012;18:6240–9.
- ^ Borghi L., Poli S., Furfaro F., Allocca M., Vegni E.A.M. Psychological Challenges for Patients with Inflammatory Bowel Disease during the COVID-19 Pandemic. Psychosom. Med.. 2021;83(4):397-398. doi:10.1097/PSY.0000000000000888
- ^ GBD 2013 Mortality Causes of Death Collaborators (January 2015). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013». Lancet. 385 (9963): 117–71. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ^ Jantchou P, Morois S, Clavel-Chapelon F, Boutron-Ruault MC, Carbonnel F (October 2010). «Animal protein intake and risk of inflammatory bowel disease: The E3N prospective study». The American Journal of Gastroenterology. 105 (10): 2195–201. doi:10.1038/ajg.2010.192. PMID 20461067. S2CID 13160121.
- ^ Kaplan GG, Bernstein CN, Coward S, Bitton A, Murthy SK, Nguyen GC, Lee K, Cooke-Lauder J, Benchimol EI (November 2018). «The Impact of Inflammatory Bowel Disease in Canada 2018: Epidemiology». Journal of the Canadian Association of Gastroenterology. 2 (Suppl 1): S6–S16. doi:10.1093/jcag/gwy054. PMC 6512243. PMID 31294381.
- ^ Burisch J, Jess T, Martinato M, Lakatos PL (May 2013). «The burden of inflammatory bowel disease in Europe». Journal of Crohn’s & Colitis. 7 (4): 322–37. doi:10.1016/j.crohns.2013.01.010. PMID 23395397.
- ^ Park J, Cheon JH (February 2021). «Incidence and Prevalence of Inflammatory Bowel Disease across Asia». Yonsei Medical Journal. 62 (2): 99–108. doi:10.3349/ymj.2021.62.2.99. PMC 7859683. PMID 33527789.
- ^ British Society of Gastroenterology https://www.bsg.org.uk/covid-19-advice/bsg-advice-for-management-of-inflammatory-bowel-diseases-during-the-covid-19-pandemic/
- ^ Crohn’s and Colitis Canada 2018 Impact of IBD in Canada Report. https://crohnsandcolitis.ca/About-Us/Resources-Publications/Impact-of-IBD-Report/
- ^ Coward S, Clement F, Benchimol EI, Bernstein CN, Avina-Zubieta JA, Bitton A, Carroll MW, Hazlewood G, Jacobson K, Jelinski S, Deardon R, Jones JL, Kuenzig ME, Leddin D, McBrien KA, Murthy SK, Nguyen GC, Otley AR, Panaccione R, Rezaie A, Rosenfeld G, Peña-Sánchez JN, Singh H, Targownik LE, Kaplan GG (May 2019). «Past and Future Burden of Inflammatory Bowel Diseases Based on Modeling of Population-Based Data». Gastroenterology. 156 (5): 1345–1353.e4. doi:10.1053/j.gastro.2019.01.002. PMID 30639677.
- ^ Summers RW, Elliott DE, Qadir K, Urban JF, Thompson R, Weinstock JV (September 2003). «Trichuris suis seems to be safe and possibly effective in the treatment of inflammatory bowel disease». The American Journal of Gastroenterology. 98 (9): 2034–41. CiteSeerX 10.1.1.457.8633. doi:10.1111/j.1572-0241.2003.07660.x. PMID 14499784. S2CID 2605979.
- ^ Weinstock, Joel V; Elliott, David E. (2013). «Translatability of helminth therapy in inflammatory bowel diseases». International Journal for Parasitology. 43 (3–4): 245–251. doi:10.1016/j.ijpara.2012.10.016. ISSN 0020-7519. PMC 3683647. PMID 23178819.
- ^ Tursi, A.; Brandimarte, G.; Papa, A.; Giglio, A.; Elisei, W.; Giorgetti, G. M.; Forti, G.; Morini, S.; Hassan, C.; Pistoia, M. A.; Modeo, M. E.; Rodino’, S.; d’Amico, T.; Sebkova, L.; Sacca’, N.; Di Giulio, E.; Luzza, F.; Imeneo, M.; Larussa, T.; Di Rosa, S.; Annese, V.; Danese, S.; Gasbarrini, A. (2010). «Treatment of Relapsing Mild-to-Moderate Ulcerative Colitis with the Probiotic VSL#3 as Adjunctive to a Standard Pharmaceutical Treatment: A Double-Blind, Randomized, Placebo-Controlled Study». The American Journal of Gastroenterology. 105 (10): 2218–2227. doi:10.1038/ajg.2010.218. PMC 3180711. PMID 20517305.
- ^ Ghouri YA, Richards DM, Rahimi EF, Krill JT, Jelinek KA, DuPont AW (Dec 9, 2014). «Systematic review of randomized controlled trials of probiotics, prebiotics, and synbiotics in inflammatory bowel disease». Clinical and Experimental Gastroenterology (Review). 7: 473–87. doi:10.2147/CEG.S27530. PMC 4266241. PMID 25525379.
- ^ a b c Durchschein F, Petritsch W, Hammer HF (February 2016). «Diet therapy for inflammatory bowel diseases: The established and the new». World Journal of Gastroenterology (Review). 22 (7): 2179–94. doi:10.3748/wjg.v22.i7.2179. PMC 4734995. PMID 26900283.
- ^ Dotan I, Rachmilewitz D (July 2005). «Probiotics in inflammatory bowel disease: possible mechanisms of action». Current Opinion in Gastroenterology (Review). 21 (4): 426–30. PMID 15930982.
- ^ a b c Wright K, Rooney N, Feeney M, Tate J, Robertson D, Welham M, Ward S (August 2005). «Differential expression of cannabinoid receptors in the human colon: cannabinoids promote epithelial wound healing». Gastroenterology. 129 (2): 437–53. doi:10.1053/j.gastro.2005.05.026. PMID 16083701.
- ^ Zhao X, Liang P, Liu J, Jiang H, Fan X, Chen G, Zhou C (December 2017). «Elevation of arachidonoylethanolamide levels by activation of the endocannabinoid system protects against colitis and ameliorates remote organ lesions in mice». Experimental and Therapeutic Medicine. 14 (6): 5664–5670. doi:10.3892/etm.2017.5222. PMC 5740744. PMID 29285108.
- ^ a b Bennett CF, Condon TP, Grimm S, Chan H, Chiang MY (April 1994). «Inhibition of endothelial cell adhesion molecule expression with antisense oligonucleotides». Journal of Immunology. 152 (7): 3530–40. doi:10.4049/jimmunol.152.7.3530. PMID 7511650. S2CID 34563008.
- ^ Jones SC, Banks RE, Haidar A, Gearing AJ, Hemingway IK, Ibbotson SH, et al. (May 1995). «Adhesion molecules in inflammatory bowel disease». Gut. 36 (5): 724–30. doi:10.1136/gut.36.5.724. PMC 1382677. PMID 7541009.
- ^ van Deventer SJ, Wedel MK, Baker BF, Xia S, Chuang E, Miner PB (May 2006). «A phase II dose ranging, double-blind, placebo-controlled study of alicaforsen enema in subjects with acute exacerbation of mild to moderate left-sided ulcerative colitis». Alimentary Pharmacology & Therapeutics. 23 (10): 1415–25. doi:10.1111/j.1365-2036.2006.02910.x. PMID 16669956. S2CID 31495688.
- ^ Thomas S, Baumgart DC (February 2012). «Targeting leukocyte migration and adhesion in Crohn’s disease and ulcerative colitis». Inflammopharmacology. 20 (1): 1–18. doi:10.1007/s10787-011-0104-6. PMID 22205271. S2CID 11663330.
- ^ Ramirez SH, Haskó J, Skuba A, Fan S, Dykstra H, McCormick R, et al. (March 2012). «Activation of cannabinoid receptor 2 attenuates leukocyte-endothelial cell interactions and blood-brain barrier dysfunction under inflammatory conditions». The Journal of Neuroscience. 32 (12): 4004–16. doi:10.1523/JNEUROSCI.4628-11.2012. PMC 3325902. PMID 22442067.
- ^ «Amgen, MGH, Broad form IBD Therapeutics Initiative». News: Discovery & Development. Gen. Eng. Biotechnol. News (paper). Vol. 34, no. 4. p. 14.
- ^ Del Pinto R, Pietropaoli D, Chandar AK, Ferri C, Cominelli F (November 2015). «Association Between Inflammatory Bowel Disease and Vitamin D Deficiency: A Systematic Review and Meta-analysis». Inflammatory Bowel Diseases. 21 (11): 2708–17. doi:10.1097/MIB.0000000000000546. PMC 4615394. PMID 26348447.
- ^ Ghouri YA, Richards DM, Rahimi EF, Krill JT, Jelinek KA, DuPont AW (9 December 2014). «Systematic review of randomized controlled trials of probiotics, prebiotics, and synbiotics in inflammatory bowel disease». Clinical and Experimental Gastroenterology. 7: 473–87. doi:10.2147/CEG.S27530. PMC 4266241. PMID 25525379.
- ^ a b Keefer L, Kane SV (2017). «Considering the Bidirectional Pathways Between Depression and IBD: Recommendations for Comprehensive IBD Care». Gastroenterology & Hepatology. 13 (3): 164–169. PMC 5439135. PMID 28539843.
- ^ Trindade IA, Ferreira C, Pinto-Gouveia J (February 2018). «The longitudinal effects of emotion regulation on physical and psychological health: A latent growth analysis exploring the role of cognitive fusion in inflammatory bowel disease». British Journal of Health Psychology. 23 (1): 171–185. doi:10.1111/bjhp.12280. hdl:10316/46833. PMID 28980414. S2CID 3375968.
- ^ a b Gao, Xin; Tang, Yu; Lei, Na; Luo, Ying; Chen, Pingrun; Liang, Chang; Duan, Shihao; Zhang, Yan (2021-01-14). «Symptoms of anxiety/depression is associated with more aggressive inflammatory bowel disease». Scientific Reports. 11 (1): 1440. Bibcode:2021NatSR..11.1440G. doi:10.1038/s41598-021-81213-8. ISSN 2045-2322. PMC 7809475. PMID 33446900.
- ^ Choi, Kookhwan; Chun, Jaeyoung; Han, Kyungdo; Park, Seona; Soh, Hosim; Kim, Jihye; Lee, Jooyoung; Lee, Hyun Jung; Im, Jong Pil; Kim, Joo Sung (2019-05-10). «Risk of Anxiety and Depression in Patients with Inflammatory Bowel Disease: A Nationwide, Population-Based Study». Journal of Clinical Medicine. 8 (5): 654. doi:10.3390/jcm8050654. ISSN 2077-0383. PMC 6572298. PMID 31083476.
- ^ a b c Mikocka-Walus, Antonina; Knowles, Simon R.; Keefer, Laurie; Graff, Lesley (March 2016). «Controversies Revisited: A Systematic Review of the Comorbidity of Depression and Anxiety with Inflammatory Bowel Diseases». Inflammatory Bowel Diseases. 22 (3): 752–762. doi:10.1097/MIB.0000000000000620. hdl:10536/DRO/DU:30088625. ISSN 1536-4844. PMID 26841224. S2CID 6315815.
- ^ Li, Yao; Bernstein, Charles N.; Xu, Wei; Hu, Pingzhao (2022-01-27). «Polygenic risk and causal inference of psychiatric comorbidity in inflammatory bowel disease among patients with European ancestry». Journal of Translational Medicine. 20 (1): 43. doi:10.1186/s12967-022-03242-9. ISSN 1479-5876. PMC 8793227. PMID 35086532.
- ^ Dandrieux JR (November 2016). «Inflammatory bowel disease versus chronic enteropathy in dogs: are they one and the same?». The Journal of Small Animal Practice. 57 (11): 589–599. doi:10.1111/jsap.12588. hdl:11343/291847. PMID 27747868.
- ^ Allenspach K, Wieland B, Gröne A, Gaschen F (July 2007). «Chronic enteropathies in dogs: evaluation of risk factors for negative outcome». Journal of Veterinary Internal Medicine. 21 (4): 700–8. doi:10.1111/j.1939-1676.2007.tb03011.x. PMID 17708389.
- ^ Simpson KW, Jergens AE (March 2011). «Pitfalls and progress in the diagnosis and management of canine inflammatory bowel disease». The Veterinary Clinics of North America. Small Animal Practice. Chronic Intestinal Diseases of Dogs and Cats. 41 (2): 381–98. doi:10.1016/j.cvsm.2011.02.003. PMID 21486642.
External links[edit]
- Inflammatory bowel disease at Curlie
Воспалительные заболевания кишечника.
Проблемы дифференциальной диагностики и лечения
-
1
-
Рачкова Н.С.
,
1
ОСП «Научно-исследовательский клинический институт педиатрии имени академика Ю.Е. Вельтищева» ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва, Россия
Для цитирования: Хавкин А.И., Рачкова Н.С. Воспалительные заболевания кишечника.
Проблемы дифференциальной диагностики и лечения. РМЖ. 2006;3:154.
В группу ВЗК объединены два заболевания – болезнь Крона и неспецифический язвенный колит (НЯК). Для этих заболеваний характерны различная распространенность патологического процесса в ЖКТ, разная глубина поражения слизистой оболочки кишки, определенные морфологические признаки, а также различное течение и прогноз. Несмотря на это некоторые сходные особенности, такие как общность патогенетических механизмов развития этих заболеваний, и вследствие этого единые подходы к лечению, а также сходные клинические проявления позволяют объединять эти два заболевания в одну группу.
Эпидемиология НЯК и болезни Крона очень схожи. При обоих заболеваниях наиболее низкая распространенность наблюдается в африканских и азиатских странах. Частота язвенного колита в России составляет 20 на100 000 населения (из них около 10% – дети), а болезни Крона 3,5 на 100 000 (20-25% дети). В США распространенность НЯК у детей в возрасте 10 – 19 лет составляет 2 на 100 000 населения. Распространенность в Великобритании и Швеции возросла вдвое, достигнув 16,6 на 100 000.
Этиология и патогенез ВЗК до настоящего времени до конца не определены. При ВЗК возникает иммунопатологический процесс в слизистой оболочке ЖКТ, при БК в любом его отделе и при неспецифическом язвенном колите только в толстой кишке. В качестве триггеров обсуждается роль некоторых вирусов, бактерий. В настоящее время доказана роль CARD15/NOD2 гена в предрасположенности к развитию БК. При этом показано, что активизация CARD15, возникающая под воздействием компонентов бактериальной стенки, вызывает активацию провоспалительных молекул.
Диагностика ВЗК очень сложна. В среднем на установление диагноза уходит около 5 лет. Диагноз ВЗК основывается на клинических данных и данных обязательных обследований, включающих рентгенологическое, эндоскопическое и гистологическое исследования.
Одним из важных этапов дифференциальной диагностики является исключение кишечных инфекций, паразитов. Обычные кишечные инфекции могут вызывать сходные клинические симптомы (диарея, боли в животе, кровь в стуле), внекишечные проявления (реактивный артрит, узловатая эритема), а также в ряде случаев сходные эндоскопические и гистологические изменения (отек и воспаление слизистой, крипт абсцессы, крипт язвы).
Наиболее часто ВЗК приходится дифференцировать с иерсиниозами, вызываемыми Yersinia Enterocolitica и Yersinia pseudotuberculosis. Иерсиниозы протекают с болями в животе, диарейным синдромом, в ряде случаев наблюдается артралгии, нодозная эритема. У некоторых больных боли в животе локализуются в правой подвздошной области, и наблюдается аппендицитоподобный синдром, обусловленный терминальным илеитом, мезаденитом. При эндоскопическом исследовании выявляются афтоидные и продольные язвы в терминальном отделе подвздошной кишки, слепой и восходящей ободочной кишке. В некоторых случаях иерсиниоз приобретает хроническое течение, имитируя развитие ВЗК. При дифференциальной диагностике используют бактериологический и серологический методы. Возбудитель иерсиниоза выделяется из кала, мочи, крови, гноя, операционного материала. Решающее значение в диагностике имеет нарастание титра антител.
Кампилобатерная инфекция вызывается Campylobacter jejuni и Campylobacter fetus. При кампилобактерной инфекции часто развивается энтерит, энтероколит, сопровождающийся диареей, болями в животе, повышением температуры тела, рвотой. Стул часто с прожилками крови, иногда содержит свежую кровь. Возможно развитие реактивного артрита. Эндоскопическая картина слизистой оболочки прямой и сигмовидной кишки, при кампилобактерной диарее может быть практически такой же, как и при неспецифическом язвенном колите и при болезни Крона.
Диагностика основана на выделении кампилобактеров из фекалий больного, а также на определении в крови специфических антител в диагностических титрах.
Salmonella обладает выраженной инвазивностью и цитотоксичностью к эпителию кишечника, но может проникать и внутрь эпителиоцитов в собственную пластинку слизистой оболочки. Нередко отмечаются глубокие воспалительные изменения, доходящие до подслизистого слоя. Эндоскопические изменения при сальмонеллезном колите трудно отличить от таковых при НЯК, но при сальмонеллезе часто наблюдается терминальный илеит. В диагностике помогает выделение сальмонеллы из кала, мочи, желчи и нарастание титра антител в крови.
Шигеллез. Симптомами шигеллеза являются, боли в животе, лихорадка, диарея, тенезмы с выделением слизи, крови. При эндоскопическом исследовании больных шигеллезом выявляются выраженное поражение ректосигмоидного отдела толстой кишки и различное по интенсивности поражение проксимальных отделов толстой кишки. Эндоскопическая картина приблизительно в 15% случаев при инфицировании Shigella поражается вся толстая кишка. В некоторых случаях, как правило, у ослабленных детей инфицирование Shigella вызывает затяжное течение заболевания. Шигеллез иногда развивается как суперинфекция при БК.
Escherichia coli. Взаимоотношения E.coli и БК сложные. Кишечную инфекцию, вызываемую штаммом O157:H7 E.coli, крайне трудно отличить клинически и эндоскопически от БК. Дифференциальная диагностика проводится с помощью бактерилогического метода. Однако при иммуногистохимическом исследовании биоптатов кишечника больных с БК на поверхности эпителия, в язвах, крипт абсцессах, в собственной пластинке слизистой в макрофагах часто обнаруживаются E.coli. E.coli часто выделяется из операционного материала от больных БК, кроме того, у больных БК часто выявляются высокие титры антител к различным штаммам E.coli (скорее всего, это связано с развитием суперинфекции).
К более редким патогенам, вызывающим сходную картину заболевания, относятся Entamoeba histolytica, Chlamidia trahomatis, Aeromonas hydrophilia, Blastocystis hominis, Mycobacterium avium intracellulare.
Entamoeba histolytica может вызывать острый амебный колит, напоминающий БК. Однако в ряде случаев у больных БК может происходить суперинфицирование дизентерийной амебой. При этом исследование стула и биоптатов, а также серологические методы могут быть отрицательными. У больных, получающих стероидную терапию, возможно развитие фульминантного колита, связанного с суперинфекцией. В связи с этим некоторыми исследователями считается целесообразным назначать больным БК, получающим стероидную терапию, антибактериальные препараты (например, метранидазол).
Aeromonas hydrophila может вызывать развитие диареи с примесью крови в стуле. Последняя в тяжелых случаях может продолжаться до нескольких недель. При этом во время эндоскопического исследования выявляется хронический сегментарный колит, напоминающий БК. Дифференциальная терапия проводится с помощью бактериологического метода.
Blastocystis hominis в ряде случаев может вызывать терминальный илеит. Основными клиническими проявлениеми бластоцистоза являются диарея и боли в животе. Заболевание развивается как по типу простого энтерита, так и в виде энтероколита или колита.
БК нужно также дифференцировать с абдоминальной формой туберкулеза, такими заболеваниями, как гистоплазмоз, криптококкоз, актиномикоз, базидиоболомикоз.
Цитомегаловирусная инфекция (ЦМВ) у иммунокомпрометированных больных может вызывать поражения кишечника, напоминающие ВЗК. Поражения кишечника часто наблюдаются при врожденной ЦМВ инфекции. Однако чаще ЦМВ наблюдается как оппортунистическая инфекция у больных с НЯК и БК, причем при НЯК цитомегаловирус выявляется чаще, чем при БК.
Большие сложности возникают при дифференцировании БК и неспецифического язвенного колита. Известно, что при БК поражается любой отдел пищеварительного тракта, при НЯК только толстая кишка. Для НЯК характерно поражение прямой кишки. Перианальные поражения, свищи, стриктуры характерны для БК. Рецидив после удаления пораженного сегмента толстой кишки при НЯК встречается крайне редко, тогда как при БК процесс прогрессирует, часто наблюдается рецидив заболевания. Однако основными критериями диагностики являются гистологические изменения. При БК воспалительный процесс начинается в подслизистом слое и распространяется на все слои кишечной стенки, (в отличие от НЯК, при котором воспалительные изменения ограничиваются только слизистой оболочкой). Специфическим гистологическим признаком при БК является формирование эпителиоидных гранулем, состоящих из эпителиоидных и гигантских многоядерных клеток. Однако гранулемы встречаются только в 40-60% случаев. Для ВЗК характерна лимфоплазмоцитарная инфильтрация. Присоединяющееся изъязвление эпителия сопровождается инфильтрацией нейтрофилами. Неравномерная плотность инфильтрата собственной пластинки слизистой оболочки также является характерной для БК. Лимфоидные фолликулы нагнаиваются и изъязвляются. При БК язвы чаще бывают глубокие и узкие, могут проникать до субсерозного слоя и окружающей клетчатки, с формированием свищей и спаек с соседними органами.
В последние годы были выявлены специфические маркеры ВЗК. У больных с НЯК в 70% случаев в крови определяются антинейтрофильные цитоплазматические антитела (рANCA). У больных БК – антитела к грибам Saccharomyces cerevisiae (ASCA).
Неясность этиологии ВЗК обусловливает отсутствие этиотропной терапии. Поэтому в настоящее время проводится патогенетическая и симптоматическая терапия этих заболеваний. Основными целями лечения служат достижение и продление ремиссии заболевания, снижение риска развития осложнений, а также улучшение качества жизни пациентов, страдающих ВЗК.
На сегодняшний день основными классами препаратов, использующимися при лечении ВЗК, являются препараты 5-аминосалициловой кислоты (5-АСК), глюкокортикоиды и цитостатики. В последние годы активно разрабатывается молекулярная терапия, включающая препараты, содержащие антитела к ФНО-a, рекомбинантные гуманизированные антитела к а4-интегрину, антиCD3 моноклональные антитела, ИЛ-10, ИЛ-11. Однако многие из этих препаратов пока ограничены в применении, в связи с тем, что некоторые из них до настоящего времени находятся на стадии клинических испытаний, другие имеют высокую стоимость.
При низкой активности заболевания и для поддержания ремиссии применяют препараты, содержащие месалазин (5-АСК). С чем связана эффективность месалазина, до конца не изучено. Однако установлено, что месалазин способен ингибировать циклооксигеназу и подавлять таким образом продукцию простагландинов. Установлено также, что месалазин подавляет липооксигеназный путь метаболизма арахидоновой кислоты активированных нейтрофилов, ингибирует образование цитокинов (ИЛ-1, ИЛ-6), подавляет рецепторы ИЛ-2. Кроме того, показано, что месалазин стимулирует апоптоз клеток колоректального рака, подавляет митоген-активированную протеинкиназу и уменьшает пролиферацию колоректальной слизистой оболочки у больных со спорадическими полипами. Первым препаратом этой группы был сульфасалазин. Сульфасалазин состоит из двух компонентов – сульфапиридина и месалазина. Сульфапиридин играет роль транспортного агента для месалазина. Расщепление сульфасалазина с высвобождением месалазина происходит только в толстой кишке под действием микрофлоры. Рекомендуемая доза сульфасалазина у детей – 50 мг/кг массы тела, ее можно повысить до 80 мг/кг. Неактивный сульфапиридин не обладает терапевтической активностью, а напротив вызывает ряд побочных эффектов, поэтому предпочтительнее использовать препараты, содержащие только месалазин.
Первый чистый препарат месалазина (Салофальк) был создан в 1984 году, в форме ректальных свечей. В настоящее время Салофальк производится в таблетках, гранулах, свечах, клизмах. Таблетки и гранулы, содержащие месалазин, покрыты кишечнорастворимой оболочкой, которая препятствует высвобождению препарата при рН менее 6,0. В отличие от таблеток, гранулы имеют несколько слоев. Внешняя оболочка, содержащая скользящее вещество (любрикант), облегчает проглатывание и транзит гранул. Кишечнорастворимая пленочная оболочка из эудрагита L обеспечивает высвобождение месалазина в дистальных отделах тонкой кишки. Внутреннее ядро на основе полимерной матрицы обеспечивает пролонгированное высвобождение действующего вещества. Салофальк в таблетках выпускается в дозе 250мг и 500мг, салофальк в гранулах – 500мг и 1000 мг. Рекомендуемая доза у взрослых при активных формах НЯК – 1,5-3 г в сутки, при активной форме БК – 3-4,5 г в сутки. Для профилактики рецидивов ВЗК Салофальк назначается в дозе 1,5 г в сутки. У детей рекомендованная доза Салофалька при активной форме ВЗК – 20 мг на 1 кг массы тела, при необходимости доза может быть повышена до 50 мг/кг. Наличие гранул Салофалька в 1000 мг уменьшает общее число приемов препарата. Преимущество гранул Салофалька перед таблетками состоит также в том, что маленькие размеры гранул не позволяют им задерживаться в желудке, гранулы могут приниматься независимо от приема пищи.
При дистальном колите месалазин (Салофальк) можно применять местно через прямую кишку в свечах (1–2 г/сут) и в виде клизм (2 г ежедневно или 4 г через день).
У больных ВЗК при относительно легком течении и для поддержания ремиссии возможна монотерапия препаратами 5-АСК. При тяжелых и распространенных формах заболевания, при недостаточной эффективности от лечения месалазином следует дополнять кортикостероиды. У пациентов БК, имеющих длительный анамнез заболевания с продолжительной кортикостероидной терапией при предыдущих обострениях, лечение 5-АСК неэффективно.
До настоящего времени кортикостероидная терапия является наиболее эффективным методом лечения острых форм БК. Глюкокортикоиды эффективны при любой локализации процесса. Преднизолон назначают в стандартной дозе 1-2 мг/кг в сутки с постепенным уменьшением и отменой в течение 3-4 месяцев. Пероральный прием глюкокортикоидов приводит к развитию таких побочных эффектов, как диабет, гипертензия, остеопороз и повышенная восприимчивость к инфекциям, а также косметические дефекты. В настоящее время широко используется топический кортикостероид – будесонид (Буденофальк). Буденофальк обладает в пять раз большей активностью, чем преднизолон, а 90% всосавшегося Буденофалька быстро инактивируется в печени, благодаря чему побочные глюкокортикоидные эффекты сводятся к минимуму. Доза будесонида для перорального применения составляет 9 мг в сутки, для поддерживающей терапии 3 и 6 мг через день. В индукции ремиссии Будесонид (буденофальк) лишь на 13% менее эффективен, чем системные кортикостероиды, при этом не вызывает характерных для стероидов побочных эффектов. При тяжелом поражении дистальных отделов толстой кишки применяются традиционные глюкокортикоиды в виде клизм или пены, будесонид в клизмах. Отмена будесонида, как и традиционных форм глюкокортикоидов должна проводиться постепенно. Исследования показали, что применение будесонида (буденофальк) при БК, как и других кортикостероидов в качестве поддерживающей терапии во время ремиссии, удлиняет ремиссию, но не предотвращает появление рецидива.
В случае если длительная кортикостероидная терапия не приводит к ремиссии или в случае возникновения резистентности или непереносимости, в терапии используют иммуносупрессанты. Механизм их действия включает супрессию функции лимфоцитов (преимущественно Т-клеток). При ВЗК используются азатиоприн или его метаболит 6-меркаптопурин. Суточная доза у взрослых составляет 2-3 мг /кг, у детей 1-2 мг/кг. У детей поддерживающая доза назначается в течение 2 лет после последнего рецидива. При НЯК, рефрактерном к лечению кортикостероидами, применяют метотрексат, циклоспорин. Метотрексат обладает выраженной гепатотоксичностью. Применение метортрексата возможно только с подросткового возраста в дозе 25 мг внутримышечно один раз в неделю или перорально 5 мг через день. При стероидорезистентных формах НЯК применяют также циклоспорин в дозе 2 мг/кг. Эффективность циклоспорина при БК очень низкая. В случае развития бактериальных инфекций применяют антибактериальные препараты – ципрофлоксацин, метронидазол. При отсутствии эффекта от консервативного лечения, а также при возникновении осложнений проводится хирургическое лечение.
Имеются данные о повышенном риске развития рака толстой кишки в случае возникновения НЯК в детском и юношеском возрасте, при тотальном колите, а также при продолжительности заболевания более 10 лет. Клинические исследования показали, что регулярный прием месалазина (Салофалька) снижает риск развития рака у больных НЯК.
Все статьи номера