Вифенд лиофилизат — Фармация и Апджон — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
П N015539/01
Торговое наименование препарата
Вифенд®
Международное непатентованное наименование
Вориконазол
Лекарственная форма
лиофилизат для приготовления раствора для инфузий
Состав
В 1 флаконе содержится:
Активное вещество: вориконазол — 200 мг4
Вспомогательное вещество: бетадекса сульфобутилат натрия — 3200 мг/
Описание
Лиофилизированный порошок белого цвета.
Восстановленный раствор: прозрачная, бесцветная жидкость.
Фармакотерапевтическая группа
Противогрибковое средство
Код АТХ
J02AC03
Фармакодинамика:
Механизм действия
Вориконазол — противогрибковый препарат широкого спектра действия из группы триазолов. Механизм действия вориконазола связан с ингибированием грибкового цитохрома Р450, что является ключевым этапом биосинтеза эргостерола. Накопление 14α-метилстерола коррелирует с последующей потерей эргостерола в грибковых клеточных мембранах, что обуславливает противогрибковую активность вориконазола. Было установлено, что вориконазол более селективен в отношении изоферментов цитохрома Р450 грибков, чем в отношении различных ферментных систем цитохрома P450 млекопитающих.
Положительной связи между средними, максимальными и минимальными значениями концентрации вориконазола в плазме крови и эффективностью препарата в терапевтических исследованиях не выявлено и эта взаимосвязь в профилактических исследованиях не изучалась.
Фармакодинамический и фармакокинетический анализ данных клинических исследований выявил положительную связь между концентрацией вориконазола в плазме крови и отклонением от нормы биохимических показателей функции печени, а также зрительными нарушениями.
In vitro вориконазол обладает широким спектром противогрибкового действия: активен в отношении Candida spp. (включая штаммы С. кrusei, устойчивые к флуконазолу, и резистентные штаммы С. glabrata и С. albicans), а также проявляет фунгицидный эффект в отношении всех изученных штаммов Aspergillus spp. и патогенных грибов, ставших актуальными в последнее время, включая Scedosporium spp. или Fusarium spp., которые ограниченно чувствительны к существующим противогрибковым средствам.
Клиническая эффективность (с частичным или полным ответом) вориконазола была продемонстрирована при инфекциях, вызванных Aspergillus spp., включая A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans, Candida spp., включая С. albicans, С. glabrata, С. krusei, С. parapsilosis и С. tropicalis, а также в отношении ограниченного числа штаммов С. dubliniensis, С. inconspicua, и С. guilliermondii, Scedosporium spp., включая S. apiospenmun,S. proliftcans и Fusarium spp.
Другие грибковые инфекции, при которых применялся вориконазол (иногда с частичным или полным ответом), включали в себя отдельные случаи инфекций, вызванных Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitaus, Cladosporium spp., Coccidioides immitis, Conidiobolus coronatus. Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp., включая P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis и Trichosporon spp., включая T. beigelii.
Продемонстрирована активность вориконазола in vitro в отношении клинических штаммов Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp., Histoplasma capsulatum. Рост большинства штаммов подавлялся при концентрациях вориконазола от 0,05 мкг/мл до 2 мкг/мл.
Выявлена также активность вориконазолa in vitro в отношении Curvularia spp. и Sporothrix spp., однако клиническое значение данного эффекта неизвестно.
Фармакокинетика:
Общая характеристика
Фармакокинетические параметры вориконазола характеризуются значительной межиндивидуальной вариабельностью.
Фармакокинетика вориконазола является нелинейной за счет насыщения его метаболизма. При повышении дозы наблюдается непропорциональное (более выраженное) увеличение площади под кривой «концентрация-время» (AUCτ). Увеличение пероральной дозы с 200 мг 2 раза в сутки до 300 мг 2 раза в сутки приводит к увеличению AUCτ в среднем в 2,5 раза. Воздействие вориконазола при приеме внутрь поддерживающей дозы 200 мг (или 100 мг для пациентов с массой тела менее 40 кг) соответствует воздействию вориконазола при применении внутривенно в дозе 3 мг/кг. При приеме внутрь поддерживающей дозы 300 мг (или 150 мг для пациентов с массой тела менее 40 кг) воздействие соответствует воздействию вориконазола при внутривенном применении в дозе 4 мг/кг.
При внутривенном введении или приеме внутрь насыщающих доз вориконазола равновесная концентрация достигается в течение первых 24 ч. Если препарат назначают 2 раза в сутки в средних (по не в насыщающих) дозах, то происходит кумуляция вориконазола, а равновесные концентрации достигаются к 6-му дню у большинства пациентов.
Всасывание и распределение
Вориконазол быстро и практически полностью всасывается после приема внутрь: максимальная концентрация в плазме крови (Сmах) достигается через 1-2 ч после приема. Биодоступность вориконазола при приеме внутрь составляет 96%. При повторном приеме с пищей с большим содержанием жиров Сmах и AUCτ снижаются на 34% и 24%, соответственно. Всасывание вориконазола не зависит от pH желудочного сока.
Средний объем распределения вориконазола в равновесном состоянии составляет около 4,6 л/кг, что указывает на активное распределение вориконазола в ткани. Связывание с белками плазмы крови составляет 58%.
Вориконазол проникает через гематоэнцефалический барьер (ГЭБ) и определяется в спинномозговой жидкостью.
Метаболизм
Согласно данным исследований in vitro вориконазол метаболизируется под действием изоферментов CYP2C19, CYP2C9, CYP3A4. Важную роль в метаболизме вориконазола играет изофермент CYP2CI9, проявляющий выраженный генетический полиморфизм, в связи с чем пониженный метаболизм вориконазола возможен у 15-20% представителей азиатского происхождения и у 3-5% представителей европеоидной и негроидной рас. Установлено, что у пациентов с пониженным метаболизмом AUCτ вориконазола в среднем в 4 раза выше, чем у гомозиготных пациентов с высоким метаболизмом. У гетерозиготных пациентов с высоким метаболизмом AUCτ вориконазола в среднем в 2 раза выше, чем у гомозиготных.
Основным метаболитом вориконазола является N-оксид, доля которого составляет около 72% от общего количества циркулирующих в плазме крови метаболитов с радиоактивной меткой. Этот метаболит обладает минимальной противогрибковой активностью и нс вносит вклад в клинический эффект вориконазола.
Выведение
Вориконазол выводится в виде метаболитов после биотрансформации в печени; в неизмененном виде почками выводится менее 2% от введенной дозы препарата.
После многократного приема вориконазола внутрь или внутривенного введения в моче обнаруживается около 83% и 80% дозы препарата, соответственно, большая часть (> 94%) общей дозы выводится в течение первых 96 ч после приема внутрь и внутривенного введения. Период полувыведения (Т1/2) вориконазола зависит от дозы и составляет примерно 6 ч при приеме препарата внутрь в дозе 200 мг. В связи с нелинейностью фармакокинетики величина Т1/2 не позволяет предсказать кумуляцию или выведение вориконазола.
Фармакокинетика в особых группах
Пол
При многократном приеме вориконазола внутрь Сmaх и AUCτ у здоровых молодых женщин были на 83% и 113% соответственно выше, чем у здоровых молодых мужчин (18-45 лет). Значимых различий Сmах и AUCτ у здоровых пожилых мужчин и здоровых пожилых женщин (≥65 лет) нет. Равновесная концентрация вориконазола в плазме крови у женщин была на 100% и 91% выше, чем у мужчин после приема препарата в виде таблеток или суспензии, соответственно. Необходимости коррекции дозы вориконазола в зависимости от пола ист. Концентрации в плазме крови у мужчин и женщин сходны.
Возраст
При многократном приеме вориконазола в виде таблеток внутрь Сmax и AUCτ у здоровых пожилых мужчин (≥ 65 лет) на 61% и 86% соответственно выше, чем у здоровых молодых мужчин (18-45 лет). Значимых различий Сmах и AUCτ у здоровых пожилых женщин (≥ 65 лет) и здоровых молодых женщин (18-45 лет) нет.
Профиль безопасности вориконазола у молодых и пожилых пациентов не отличается. Необходимости коррекции дозы вориконазола в зависимости от возраста нет.
Дети
У детей отмечается большая внутрииндивидуальная вариабельность, чем у взрослых. Сравнение детской и взрослой популяций показало, что предполагаемая AUCτ у детей после введения насыщающей дозы 9 мг/кг была сравнима с таковой у взрослых после введения насыщающей дозы 6 мг/кг. Предполагаемая общая концентрация у детей после введения поддерживающей дозы 4 мг/кг и 8 мг/кг два раза в сутки была также сравнима с таковой у взрослых после введения поддерживающей дозы 3 мг/кг и 4 мг/кг два раза в сутки. Концентрация вориконазола при внутривенном введении в дозе 8 мг/кг в два раза выше, чем при приеме внутрь в дозе 9 мг/кг. Биодоступность вориконазола при приеме внутрь у детей может ограничиваться нарушением всасывания и достаточно низкой массой тела в этом возрасте и в этом случае может быть показано внутривенное введение.
Полученные данные свидетельствуют о более высокой элиминации вориконазола у детей по сравнению со взрослыми в связи с большим соотношением массы печени и массы тела.
У большинства подростков концентрация вориконазола в плазме крови соответствует этому показателю у взрослых пациентов. Тем не менее отмечались меньшие значения концентрации вориконазола в плазме крови у некоторых подростков с низкой массой тела по сравнению с взрослыми и были ближе к значениям того же показателя у детей. Основываясь на популяционном фармакокинетическом анализе, подростки в возрасте от 12 до 14 лете массой тела менее 50 кг должны получать дозу вориконазола. рекомендованную для приема у детей.
Нарушение функции почек
Связывание с белками плазмы сходно у больных с различной степенью почечной недостаточности. У пациентов со средней или тяжелой степенью нарушения функции почек (концентрация креатинина в сыворотке ≥ 220 мкмоль/л или 2,5 мг/дл) наблюдается кумуляция вспомогательного вещества — бетадекса сульфобутилата натрия, входящего в состав лиофилизата для приготовления раствора для инфузий.
Нарушение функции печени
Нарушение функции печени не влияет на связывание вориконазола с белками плазмы крови. Сведений о фармакокинетике вориконазола у пациентов с тяжелым циррозом печени (класс С по классификации Чайлд-Пью) нет.
Показания:
— Инвазивный аспергиллез.
— Кандидемия у пациентов без нейтропении.
— Тяжелые инвазивные кандидозные инфекции (включая С. krusei).
— Кандидоз пищевода.
— Тяжелые грибковые инфекции, вызванные Scedosporium spp. и Fusarium spp.
— Другие тяжелые инвазивные грибковые инфекции при непереносимости или рефрактерное к другим лекарственным средствам.
— Профилактика «прорывных» грибковых инфекций у пациентов со сниженной функцией иммунной системы, лихорадкой и нейтропенией, из групп высокого риска (реципиенты трансплантации гемопоэтических стволовых клеток, больные с рецидивом лейкоза).
— Профилактика инвазивных грибковых инфекций у пациентов (взрослых и детей старше 12 лет) группы высокого риска, таких как реципиенты трансплантации гемопоэтических стволовых клеток.
Противопоказания:
— Препарат Вифенд® противопоказан больным с гиперчувствительностью к вориконазолу или любому другому компоненту препарата.
— Противопоказано одновременное применение Вифенда® и следующих препаратов (см. раздел «Взаимодействие с другими лекарственными средствами»): субстраты изофермента CYP3A4 — терфенадин, астемизол, цизаприд, пимозид или хинидин; сиролимус; рифамиицин, карбамазепин и длительно действующие барбитураты (фенобарбитал); рифабутин; эфавиренз в дозах 400 мг и выше один раз в сутки (с вориконазолом в стандартных дозах); ритонавир в высоких дозах (400 мг и выше два раза в сутки); алкалоиды спорыньи (эрготамин, дигидроэрготамин), являющиеся субстратами изофермента CYP3A4; зверобой продырявленный (индуктор цитохрома Р450 и Р-гликопротеина).
— Препарат Вифенд® противопоказан детям в возрасте младше 2 лет.
С осторожностью:
— Повышенная чувствительность к другим препаратам — производным азолов.
— Тяжелая степень недостаточности функции печени, тяжелая степень недостаточности функции почек.
— Вориконазол следует применять с осторожностью у пациентов с проаритмическими состояниями: врожденное или приобретенное увеличение интервала QT, кардиомиопатия, в особенности с сердечной недостаточностью, синусовая брадикардия, наличие симптоматической аритмии, одновременный прием препаратов, вызывающих удлинение интервала QT (см. раздел «Особые указания»).
— Также следует соблюдать осторожность при применении препарата Вифенд® у пациентов с электролитными нарушениями, такими как: гипокалиемия, гииомагниемия и гипокальциемия.
Беременность и лактация:
Достаточной информации о применении вориконазола у беременных женщин нет.
В исследованиях на животных установлено, что препарат оказывает токсическое действие на репродуктивную функцию. Возможный риск для человека неизвестен. Вориконазол не следует применять у беременных женщин за исключением тех случаев, когда ожидаемая польза для матери явно превышает возможный риск для плода.
Выведение вориконазола с грудным молоком не изучалось. На время применения препарата грудное вскармливание следует прекратить.
Женщины репродуктивного возраста при применении препарата Вифенд® должны использовать надежные методы контрацепции.
Способ применения и дозы:
Препарат Вифенд® не рекомендуется вводить в виде болюсных инъекций (струйно). Скорость инфузии не должна превышать 3 мг/кг/ч в течение 1-3 ч.
Перед началом терапии необходимо откорректировать такие электролитные нарушения, как гипокалиемия, гипомагниемия и гипокальциемия (см. раздел «Побочное действие»).
Взрослые пациенты
Назначение препарата Вифенд® следует начинать с внутривенного введения в рекомендуемой насыщающей дозе, чтобы уже в первый день добиться адекватной концентрации в плазме крови. Внутривенное введение следует продолжать как минимум 7 дней, после чего возможен переход на пероральный прием препарата, при условии, что пациент способен принимать лекарственные средства для приема внутрь. Учитывая высокую биодоступность препарата при приеме внутрь, достигающую 96% (см. раздел «Фармакокинетика»), при наличии клинических показаний можно переходить с внутривенного на пероральное применение препарата без коррекции дозы.
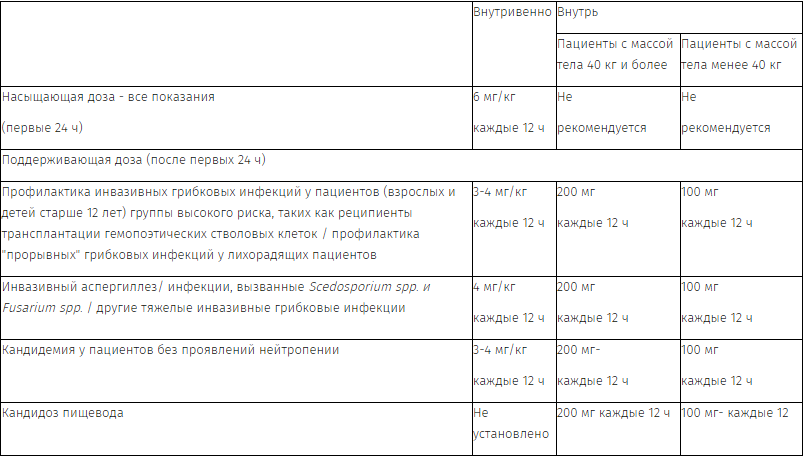
В таблице приведена подробная информация по дозированию препарата Вифенд®:
|
Внутривенно |
Внутрь |
||
|
Пациенты с массой тела 40 кг и более |
Пациенты с массой тела менее 40 кг |
||
|
Насыщающая доза — все показания (первые 24 ч) |
6 мг/кг каждые 12 ч |
Не рекомендуется |
Не рекомендуется |
|
Поддерживающая доза (после первых 24 ч) |
|||
|
Профилактика инвазивных грибковых инфекций у пациентов (взрослых и детей старше 12 лет) группы высокого риска, таких как реципиенты трансплантации гемопоэтических стволовых клеток / профилактика «прорывных» грибковых инфекций у лихорадящих больных |
3-4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
|
Инвазивный аспергиллез/ инфекции, вызванные Scedosporium spp. и Fusarium spp. / другие тяжелые инвазивные грибковые инфекции |
4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
|
Кандидемия у пациентов без проявлений нейтропении |
3-4 мг/кг каждые 12 ч |
200 мг- каждые 12 ч |
100 мг каждые 12 ч |
|
Кандидоз пищевода |
Не установлено |
200 мг каждые 12 ч |
100 мг- каждые 12 |
Подбор дозы для внутривенного введения
При недостаточной эффективности лечения поддерживающая доза препарата Вифенд® для внутривенного введения может быть увеличена до 4 мг/кг каждые 12 ч. Если пациент не переносит препарат в высокой дозе, ее снижают до 3 мг/кг каждые 12 ч.
Длительность лечения должна быть как можно короче в зависимости от клинического эффекта и результатов микологического исследования. Длительность лечения не должна превышать 180 дней.
Профилактика у взрослых и детей
Профилактическое применение препарата следует начинать в день трансплантации и можно продолжать до 100 дней. Продлить профилактику до 180 дней после трансплантации можно только в случае продолжения иммуносупрессивной терапии или развития реакции «трансплантат против хозяина» (ТПХ). Безопасность и эффективность вориконазола при применении более 180 дней в клинических исследованиях надлежащим образом не изучались. Режим дозирования с целью профилактики такой же, как и с целью лечения в соответствующих возрастных группах.
Нарушение функции почек
У больных со средней или тяжелой степенью почечной недостаточностью (клиренс креатинина < 50 мл/мин) наблюдается кумуляция вспомогательного компонента препарата бетадекса сульфобутилата натрия. Таким больным препарат Вифенд® следует назначать внутрь за исключением тех случаев, когда предполагаемая польза внутривенного введения превышает потенциальный риск. В подобных ситуациях необходимо регулярно контролировать концентрацию креатинина и в случае его повышения следует обсудить возможность перехода на прием вориконазола внутрь.
Вориконазол выводится в ходе гемодиализа с клиренсом 121 мл/мин. 4-часовой сеанс гемодиализа не приводит к удалению значительной части дозы вориконазола и не требует ее коррекции. Бетадекса сульфобутилат натрия выводится в ходе гемодиализа с клиренсом 55 мл/мин.
Нарушение функции печени
При остром повреждении печени, проявляющемся повышением активности «печеночных» трансаминаз: аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT), коррекция дозы не требуется, но рекомендуется продолжать контроль показателей функции печени. Больным с легкими или среднетяжелыми нарушениями функции печени (классы А и В по классификации Чайлд-Пью) следует назначать стандартную насыщающую дозу препарата Вифенд®, а поддерживающую дозу снижать в 2 раза. Больным с тяжелой степенью нарушения функции печени (класс С по классификации Чайлд-Пью) препарат Вифенд® следует назначать только в тех случаях, когда ожидаемая польза превышает возможный риск, и под постоянным контролем с целью выявления признаков токсического действия препарата.
Пожилые пациенты
Коррекции дозы у пожилых людей не требуется.
Применение у детей
Безопасность и эффективность вориконазола у детей младше 2 лет не установлены.
Режим дозирования вориконазола у детей (в возрасте от 2 до 12 лет) и подростков в возрасте от 12 до 14 лет и массой тела менее 50 кг:
|
Внутривенно |
Внутрь |
|
|
Насыщающая доза (первые 24 ч) |
9 мг/кг каждые 12 ч |
Не рекомендуется |
|
Поддерживающая доза (после первых 24 ч) |
8 мг/кг 2 раза в сутки |
9 мг/кг два раза в сутки (максимальная доза 350 мг два раза в сутки) |
Терапию рекомендуется начинать с внутривенного введения препарата, а возможность перорального приема препарата Вифенд® следует рассматривать только после клинического улучшения и возможности пациента принимать пероральные лекарственные средства.
Следует принимать во внимание, что воздействие препарата при внутривенном введении в дозе 8 мг/кг приблизительно в два раза выше, чем при применении внутрь в дозе 9 мг/кг. Применение вориконазола у детей в возрасте от 2 до 12 лет с нарушениями функции печени или почек не изучалось.
У подростков (в возрасте от 12 до 14 лет с массой тела 50 кг или более; от 15 до 18 лет вне зависимости от массы тела) вориконазол дозируется так же, как для взрослых.
Коррекция дозы
При неадекватном клиническом ответе пациента, доза может быть увеличена с шагом 1 мг/кг (или 50 мг в случае, если изначально применяли максимальную пероральную дозу 350 мг). В случае, если ребенок не переносит лечение, можно снизить дозу вориконазола с шагом 1 мг/мл (или 50 мг в случае, если изначально применяли максимальную пероральную дозу 350 мг).
Инструкция по приготовлению раствора для инфузий
Препарат Вифенд® выпускается во флаконах для однократного применения. Содержимое флакона восстанавливают, растворяя в 19 мл воды для инъекции, и получают 20 мл прозрачного концентрата, содержащего вориконазол в концентрации 10 мг/мл. Если растворитель не поступает во флакон под действием вакуума, то флакон использовать нельзя. Перед применением необходимый объем концентрата (см. таблицу) прибавляют к рекомендуемому совместимому раствору для инфузии (см. ниже) и получают раствор, содержащий вориконазол в концентрациях от 0,5 мг/мл до 5 мг/мл.
Необходимые объемы концентрата препарата Вифенд® 10 мг/мл:
|
Масса тела (кг) |
Объемы концентрата препарата Вифенд® (10 мг/мл), необходимые для приготовления: |
|||||
|
Доза 3 мг/кг (число флаконов) |
Доза 4 мг/кг (число флаконов) |
Доза 6 мг/кг (число флаконов) |
Доза 8 мг/кг (число флаконов) |
Доза 9 мг/кг (число флаконов) |
||
|
10 |
— |
4,0 мл (1) |
— |
8,0 мл (1) |
9,0 мл (1) |
|
|
15 |
— |
6,0 мл (1) |
— |
12,0 мл (1) |
13,5 мл (1) |
|
|
20 |
— |
8,0 мл (1) |
— |
16,0 мл (1) |
18,0 мл (1) |
|
|
25 |
— |
10,0 мл (1) |
— |
20,0 мл (1) |
22,5 мл (2) |
|
|
30 |
9,0 мл (1) |
12,0 мл (1) |
18,0 мл (1) |
24,0 мл (2) |
27,0 мл (2) |
|
|
35 |
10,5 мл (1) |
14,0 мл (1) |
21,0 мл (2) |
28,0 мл (2) |
31,5 мл (2) |
|
|
40 |
12,0 мл (1) |
16,0 мл (1) |
24,0 мл (2) |
32,0 мл (2) |
36,0 мл (2) |
|
|
45 |
13,5 мл (1) |
18,0 мл (1) |
27,0 мл (2) |
36,0 мл (2) |
40,5 мл (3) |
|
|
50 |
15,0 мл (1) |
20,0 мл (1) |
30,0 мл (2) |
40,0 мл (2) |
45,0 мл (3) |
|
|
55 |
16,5 мл (1) |
22,0 мл (2) |
33,0 мл (2) |
44,0 мл (3) |
49,5 мл (3) |
|
|
60 |
18,0 мл (1) |
24,0 мл (2) |
36,0 мл (2) |
48,0 мл (3) |
54,0 мл (3) |
|
|
65 |
19,5 мл (1) |
26,0 мл (2) |
39,0 мл (2) |
52,0 мл (3) |
58,5 мл (3) |
|
|
70 |
21,0 мл (2) |
28,0 мл (2) |
42,0 мл (3) |
— |
— |
|
|
75 |
22,5 мл (2) |
30,0 мл (2) |
45,0 мл (3) |
— |
— |
|
|
80 |
24,0 мл (2) |
32,0 мл (2) |
48,0 мл (3) |
— |
— |
|
|
85 |
25,5 мл (2) |
34,0 мл (2) |
51,0 мл (3) |
— |
— |
|
|
90 |
27,0 мл (2) |
36,0 мл (2) |
54,0 мл (3) |
— |
— |
|
|
95 |
28,5 мл (2) |
38,0 мл (2) |
57,0 мл (3) |
— |
— |
|
|
100 |
30,0 мл (2) |
40,0 мл (2) |
60,0 мл (3) |
— |
— |
Препарат Вифенд® лиофилизат для приготовления раствора для инфузий представляет собой стерильный лиофилизат без консерванта, предназначенный для однократного применения. С микробиологической точки зрения препарат следует вводить немедленно. Восстановленный раствор (концентрат) можно хранить не более 24 ч при температуре от 2 до 8 °С в том случае, если он был приготовлен в контролируемых асептических условиях.
Концентрат можно далее разводить следующими растворами:
— 0,9% раствор натрия хлорида для внутривенного введения;
— раствор Рингера лактата для внутривенного введения;
— 5% раствор декстрозы и раствор Рингера лактата для внутривенного введения;
— 5% раствор декстрозы и 0,45% раствор натрия хлорида для внутривенного введения;
— 5% раствор декстрозы для внутривенного введения;
— 5% раствор декстрозы и 0,15% раствор калия хлорида для внутривенного введения;
— 0,45% раствор натрия хлорида для внутривенного введения;
— 5% раствор декстрозы и 0,9% раствор натрия хлорида для внутривенного введения.
Совместимость вориконазола с другими растворами, помимо указанных выше неизвестна.
Побочные эффекты:
Данные о безопасности вориконазола основаны на результатах исследования более чем 2000 человек (1655 пациентов, применяющих вориконазол в лечебных целях и 279 с профилактической целью), представленных гетерогенной популяцией (пациенты со злокачественными новообразованиями крови, ВИЧ-инфицированные больные с кандидозом пищевода и рефрактерными грибковыми инфекциями, пациенты без нейтропении с кандидемией или аспергиллезом, а также здоровые добровольцы).
Наиболее распространенными нежелательными реакциями являются нарушения со стороны органа зрения, отклонение от нормы результатов функциональных проб печени, лихорадка, сыпь, рвота, тошнота, диарея, головная боль, периферические отеки, боль в животе и угнетение дыхания. Нежелательные реакции обычно были легко или умеренно выражены. Клинически значимой зависимости безопасности препарата от возраста, расы или пола не выявлено.
Критерии оценки частоты: очень часто ≥ 10%; часто ≥1% и < 10%; нечасто ≥ 0,1% и < 1%; редко ≥ 0,01% и < 0,1%; очень редко < 0,01%; частота неизвестна — невозможно определить частоту на основании имеющихся данных.
Со стороны сердца: часто наджелудочковая аритмия, тахикардия, брадикардия; нечасто — фибрилляция желудочков, желудочковая экстрасистолия, наджелудочковая тахикардия, желудочковая тахикардия; редко — аритмия по типу «пируэт», полная атриовентрикулярная блокада, блокада ножки пучка Гиса, узловые аритмии.
Со стороны сосудов: часто — артериальная гипотензия, флебит; нечасто тромбофлебит.
Со стороны системы кроветворения и лимфатической системы: часто — агранулоцитоз (включая фебрильную нейтропению и нейтропению), панцитопения, тромбоцитопения (включая иммунную тромбоцитопеническую пурпуру), анемия; нечасто — депрессия костного мозга, лейкопения, лимфаденопатия, эозинофилия, синдром диссеминированного внутрисосудистого свертывания.
Со стороны нервной системы: очень часто — головная боль; часто — синкопа, тремор, парестезия, сонливость, головокружение, судороги, нистагм; нечасто — отек головного мозга, энцефалопатия, экстрапирамидное расстройство, периферическая нейропатия, атаксия, гипестезия, дисгевзия (нарушение вкусового восприятия); редко — печеночная энцефалопатия, синдром Гийена-Барре.
Со стороны органа зрения: очень часто — нарушение со стороны органа зрения (в том числе нечеткость зрения, затуманенное зрение, фотофобия, хлоропсия. хроматопсия, светобоязнь, цветовая слепота, цианопсия, наличие в поле зрения радужных кругов вокруг источников света, ночная слепота, осциллопсия, фотопсия, мерцательная скотома, снижение остроты зрения, зрительная яркость, дефект полей зрения, плавающие помутнения стекловидного тела и ксантопсия); часто — кровоизлияние в сетчатую оболочку глаза; нечасто — неврит зрительного нерва, отек соска зрительного нерва, окулогирный криз, диплопия, склерит, блефарит; редко — атрофия зрительного нерва, помутнение роговицы.
Со стороны органа слуха и вестибулярного аппарата: нечасто — вертиго, гипоакузия, шум в ушах.
Со стороны дыхательной системы, грудной клетки и средостения: очень часто — угнетение дыхания; часто — отек легких, острый респираторный дистресс- синдром.
Со стороны желудочно-кишечного тракта: очень часто — тошнота, рвота, диарея, боль в животе; часто — хейлит, диспепсия, запор; нечасто — дуоденит, глоссит, панкреатит, отек языка.
Со стороны почек и мочевыделительной системы: часто — острая почечная недостаточность, гематурия; нечасто некроз почечных канальцев, протеинурия, нефрит.
Со стороны кожи и подкожных тканей: очень часто — сыпь; частое эксфолиативный дерматит, алопеция, кожный зуд, макулопапулезная сыпь, эритема; нечасто — синдром Стивенса-Джонсона, фотосенсибилизация, крапивница, экзема, токсический эпидермальный некролиз, ангионевротический отек, мультиформная эритема, псориаз, аллергический дерматит, пурпура, папулезная сыпь, макулярная сыпь; редко — псевдопорфирия, стойкая лекарственная эритема; частота неизвестна кожная форма системной красной волчанки.
Со стороны опорно-двигательного аппарата и соединительной ткани: часто — боль в спине; нечасто — артрит; частота неизвестна — периостит.
Со стороны эндокринной системы: нечасто — недостаточность коры надпочечников, гипотиреоз; редко гипертиреоз.
Нарушения метаболизма и питания: очень часто — периферические отеки; часто гипокалиемия, гипогликемия, гипонатриемия (выявлено в пострегистрационных исследованиях).
Инфекции и инвазии: часто — синусит, гастроэнтерит, гингивит; нечасто псевдомембранозный колит, лимфангит, перитонит.
Общие расстройства и нарушения в месте введения: очень часто — лихорадка; часто — озноб, астения, боль в грудной клетке, гриппоподобное заболевание, отек лица (включая периорбитальный отек, отек губ и отек рта); нечасто реакция/воспаление на месте инъекции.
Со стороны иммунной системы: нечасто — аллергические реакции; редко анафилактоидные реакции.
Со стороны гепатобилиарной системы: очень часто — отклонения от нормы результатов функциональных печеночных тестов (повышение активности аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы, гамма-глутамилтрансферазы, лактатдегидрогеназы, гипербилирубинемия); часто — желтуха, холестатическая желтуха, гепатит; нечасто — печеночная недостаточность, холецистит, холелитиаз, увеличение печени.
Психические расстройства: часто галлюцинации, спутанность сознания, депрессия, тревога, бессоница, ажитация.
Новообразования доброкачественные, злокачественные и неуточненные (включая кисты и полипы): частота неизвестна — плоскоклеточный рак кожи.
Исследования: часто — повышение концентрации креатинина в крови; нечасто — удлинение интервала QT на электрокардиограмме, повышение концентрации мочевины в крови, повышение концентрации холестерина в крови.
Побочное действие при применении у детей: было установлено, что нежелательные эффекты препарата у детей в возрасте от 2 до 12 лет аналогичны таковым у взрослых. У детей наблюдалась более высокая частота повышения активности печеночных ферментов. В ходе пострегистрационных исследований выявлено развитие панкреатита у детей на фоне терапии вориконазолом, а также более частое возникновение кожных реакций.
Передозировка:
Известно о трех случаях случайной передозировки. Все упомянутые случаи произошли у детей, которым внутривенно была введена доза вориконазола, в пять раз превышающая рекомендованную.
Имеется сообщение о единичном случае фотофобии, продолжительностью 10 минут.
Антидот вориконазола неизвестен. В случае передозировки показана симптоматическая и поддерживающая терапия.
Вориконазол выводится в ходе гемодиализа с клиренсом 121 мл/мин. бетадекса сульфобутилат натрия — с клиренсом 55 мл/мин. 13 случае передозировки гемодиализ может способствовать выведению вориконазола и бетадекса сульфобутилата натрия из организма.
Взаимодействие:
Ингибиторы или индукторы изоферментов цитохрома P450 (CYP2C19, CYP2C9 и CYP3A4) могут вызвать, соответственно, повышение или снижение концентрации вориконазола в плазме крови.
Вориконазол ингибирует активность изоферментов цитохрома P450 — CYP2C19, CYP2C9 и CYP3A4, — и может повышать плазменные концентрации веществ, которые метаболизируются с участием изоферментов цитохрома Р450.
Взаимодействие вориконазола с другими лекарственными средствами и рекомендации при одновременном применении представлены в таблице ниже:
|
Лекарственное средство (механизм взаимодействия) |
Взаимодействие: изменения фармакокинетических параметров (%) |
Рекомендации при одновременном применении |
|
Астемизол, цизаприд, пимозид, хинидин и терфенадин [субстраты изофермента CYP3A4] |
Взаимодействие не изучалось, однако существует высокая вероятность, что повышенные концентрации данных лекарственных средств могут привести к удлинению интервала QTc и в редких случаях возникновению желудочковой тахикардии по типу «пируэт» |
Противопоказано |
|
Карбамазепин и длительно действующие барбитураты (например, фенобарбитал, мефобарбитал) [мощные индукторы цитохрома Р450] |
Взаимодействие не изучалось, однако карбамазепин и длительно действующие барбитураты, вероятно, могут значительно снижать плазменные концентрации вориконазола |
Противопоказано |
|
Эфавиренз (ненуклеозидный ингибитор обратной транскриптазы) [индуктор цитохрома Р450; ингибитор и субстрат изофермента СYP3A4] |
||
|
Одновременное применение эфавиренза в дозе 400 мг один раз в сутки и вориконазола в дозе 200 мг два раза в сутки * |
Сmax эфавиренза ↑ 38% AUCτ эфавиренза ↑ 44% Сmax вориконазола ↓61% AUCτ вориконазола ↓77% |
Применение стандартных доз вориконазола и эфавиренза в дозе 400 мг одни раз в сутки противопоказано. |
|
В сравнении с эфавирензом 600 мг один раз в сутки: |
Одновременное применение возможно, если |
|
|
Одновременное применение 300 мг эфавиренза один раз в сутки и вориконазола 400 мг два раза в сутки* |
Сmax эфавиренза ↔ AUCτ эфавиренза ↑ 17% |
поддерживающая доза вориконазола будет повышена до 400 мг два раза в сутки, а доза эфавиренза снижена до 300 мг один раз в сутки. При отмене терапии вориконазолом начальная доза эфавиренза должна быть восстановлена. |
|
В сравнении с вориконазолом 200 мг два раза в сутки: Сmax вориконазола ↑23% AUCτ вориконазола ↓ 7% |
||
|
Алкалоиды спорыньи (например, эрготамин и дигидроэрготамин) [субстраты изофермента СYР3А4] |
Взаимодействие вориконазола с алкалоидами спорыньи (эрготамином и дигидроэрготамином) не изучалось, однако существует высокая вероятность, что вориконазол может вызывать повышение концентрации данных препаратов в плазме крови и приводить к эрготизму. |
Противопоказано |
|
Рифабутин [мощный индуктор цитохрома Р450] |
||
|
300 мг один раз в сутки |
Сmax вориконазола ↓69% AUCτ вориконазола ↓78% Сmax рифабутина ↑195% AUCτ рифабутина ↑331% |
Противопоказано |
|
300 мг один раз в сутки (при одновременном применении с вориконазолом 400 мг два раза в сутки)* |
В сравнении с вориконазолом 200 мг два раза в сутки: Сmax вориконазола ↑ 104% AUCτ вориконазола ↑ 87% |
|
|
Рифампицин (600 мг один раз в сутки) [мощный индуктор цитохрома Р450] |
Сmax вориконазола ↓93 % AUCτ вориконазола ↓ 96% |
Противопоказано |
|
Ритонавир (ингибитор протеаз) [мощный индуктор цитохрома Р450;ингибитор и субстрат изофермента СYР3А4] |
||
|
Высокие дозы (400 мг два раза в сутки) |
Сmax и AUCτ ритонавира ↔ Сmax вориконазола ↓ 66% AUCτ вориконазола ↓82% |
Одновременное применение вориконазола н высоких доз ритонавира (400 мг и выше два раза в сутки) противопоказано. |
|
Низкие дозы (100 мг два раза в сутки)* |
Сmax pитонавира ↓ 25 % AUCτ ритонавира ↓13% Сmax вориконазола ↓24% AUCτ вориконазола ↓39% |
Применять одновременно вориконазол и ритонавира низких дозах (100 мг 2 раза в сутки) следует лишь в том случае, если ожидаемая польза от приема вориконазола значительно превышает риск от их совместного применения. |
|
Зверобой продырявленный [индуктор цитохрома Р450 и Р-гликопротеина] 300 мг три раза в сутки (одновременное применение с однократной дозой вориконазола 400 мг) |
Согласно данным независимого исследования: AUC0-∞ вориконазола ↓ 59% |
Противопоказано |
|
Эверолимус [субстрат изофермента CYP3A4 и Р-гликопротеина] |
Взаимодействие не изучалось, однако вориконазол, вероятно, может значительно повышать плазменные концентрации эверолимуса. |
Одновременное применение не рекомендуется, так как ожидается, что вориконазол значительно повышает концентрацию эверолимуса в плазме крови. На данный момент не имеется достаточной информации для рекомендации по коррекции режима дозирования. |
|
Флуконазол (200 мг один раз в сутки) [ингибитор изоферментов CYP2C9, СYР2С19 и CYP3A4] |
Сmax вориконазола ↑ 57% AUCτ вориконазола ↑ 79% Изменения Сmax и AUCτ, флуконазола не установлены |
Подходящий режим коррекции дозы и/или частоты приема вориконазола и флуконазола не установлен. В том случае, если вориконазол применяется после флуконазола, рекомендуется проводить тщательный контроль нежелательных реакций, связанных с приемом вориконазола. |
|
Фенитоин [субстрат изофермента CYP2C9 и мощный индуктор цитохрома Р450] |
||
|
300 мг один раз в сутки |
Сmax вориконазола ↓ 49% AUCτ вориконазола ↓ 69% |
Следует избегать одновременного приема вориконазола и фенитоина, за исключением случаев, когда польза для пациента превышает риск. Рекомендуется контролировать плазменные концентрации фенитоина. |
|
300 мг один раз в сутки (одновременное применение с вориконазолом в дозе 400 мг два раза в сутки)* |
Сmax фенитоина ↑ 67% AUCτ фенитопна↑81% В сравнении с вориконазолом 200 мг два раза в сутки, Сmax вориконазола ↑34% AUCτ вориконазола ↑ 39% |
Одновременное применение возможно только в случае, если поддерживающая доза вориконазола будет увеличена до 5 мг/кг внутривенно или с 200 мг до 400 мг внутрь два раза в сутки (у пациентов с массой зела менее 40 кг со 100 мг до 200 мг внутрь два раза в сутки). |
|
Антикоагулянты |
Если больным, получающим препараты кумарина, назначают вориконазол. необходимо с короткими интервалами контролировать протромбинового время исоответствующим образом подбирать дозы антикоагулянтов. |
|
|
Варфарин (30 мг однократно одновременно с вориконазолом 300 мг два раза в сутки) [субстрат профермента CYP2C9] |
Увеличение максимального протромбинового времени было приблизительно в два раза. |
|
|
Другие пероральные антикоагулянты, например, фенпрокумон, аценокумарол [субстраты проферментов CYP2C9 и CYP3A4] |
Предполагается, что вориконазол может увеличивать плазменные концентрации кумаринов, что может приводить к повышению про тромбинового времени. |
|
|
Бензодиазепины (например, мидазолам, триазолам, алпразолам) [субстраты профермента CYP3A4] |
Invitro вориконазол может вызывать повышение плазменных концентрации бензодиазепинов, которые метаболизируются под действием изофермента CYP3A4, и вызывать развитие пролонгированного седативного эффекта. |
Рекомендуется оценить целесообразность коррекции дозы бензодиазепинов. |
|
Иммуносупрессанты [субстраты изофермента CYP3A4] |
||
|
Сиролимус (2 мг однократно) |
Согласно данным независимого исследования: Сmax сиролимуса ↑ в 6,6 раз AUC0-∞ сиролимуса ↑ в 11 раз |
Одновременное применение вориконазола и сиролимуса противопоказано. |
|
Циклоспорин (у пациентов, перенесших трансплантацию почки и находящихся в стабильном состоянии) |
Сmax циклоспорина ↑ 13% AUCτ циклоспорина ↑ 70% |
При назначении вориконазола больным, получающим циклоспорин, рекомендуется уменьшить дозу циклоспорина вдвое и контролировать его концентрацию в плазме крови. Повышение концентрации циклоспорина сопровождается нефротоксичностью. После отмены вориконазола необходимо контролировать концентрацию циклоспорина и при необходимости увеличить его дозу. |
|
Такролимус (0,1 мг/кг однократно) |
Сmax такролимуса ↑ 117% AUCτ такролимуса ↑ 221% |
При назначении вориконазола больным, получающим такролимус. рекомендуется уменьшить дозу последнего до одной трети и контролировать его концентрацию в плазме крови. Повышение концентрации такролимуса сопровождается нефротоксичностью. После отмены вориконазола необходимо контролировать концентрацию такролимуса и при необходимости увеличить его дозу. |
|
Длительно действующие опиаты [субстраты изофермента CYP3A4] |
||
|
Оксикодон (10 мг однократно) |
Согласно данным независимого исследования: Сmax оксикодона ↑ в 1,7 раз AUC0-∞ оксикодона ↑ в 3,6 раз |
Следует оценить возможность снижения дозы оксикодона и других длительно действующих опиатов, метаболизируемых изоферментом CYP3A4 (например, гидрокодона). Может понадобиться контроль состояния пациента с короткими интервалами на предмет развития нежелательных реакции связанных с опиатами. |
|
Метадон (32-100 мг один раз в сутки) [субстрат изофермента CYP3A4] |
Сmax R-метадона (активного метаболита) ↑ 31% AUCτ R-метадона (активного метаболита) ↑ 47% Сmax S-метадона ↑ 65% AUCτ S-метадона ↑103% |
Повышение концентрации метадона в плазме крови приводит к проявлению токсических эффектов, включая удлинение интервала QT. Рекомендуется частый контроль состояния пациента на предмет развития нежелательных реакции и токсичности (в том числе, удлинение интервала QT), связанных с метадоном. Возможно, понадобится снижение дозы метадона. |
|
Нестероидные противовоспалительные препараты (HПBП) [субстраты изофермента CYP2C9] |
Больных следует наблюдать с целью выявления возможных токсических эффектов и при необходимости корректировать дозу НПВП. |
|
|
Ибупрофен (400 мг однократно) |
Сmax S-ибупрофена ↑ 20% AUC0-∞ S-ибупрофена ↑ 100% |
|
|
Диклофенак (50 мг однократно) |
Сmax диклофенака ↑ 114% AUC0-∞ диклофенака ↑ 78% |
|
|
Омепразол (40 мг один раз в сутки)* [ингибитор изофермента CYP2C19; субстрат изоферментов CYP2C19 и CYP3A4] |
Сmax омепразола ↑ 116% AUCτ омепразола ↑ 280% Сmax вориконазола ↑ 15% AUCτ вориконазола ↑ 41%. Вориконазол также может угнетать действие других ингибиторов прогонной помпы, которые являются субстратами изофермента CYP2C19. что может приводить к повышению плазменных концентраций этих лекарственных средств. |
Коррекция дозы вориконазола не требуется. При начале приема вориконазола у пациентов, уже получающих терапию омепразолом в дозах 40 мг или выше, рекомендуется снижение дозы омепразола в два раза. |
|
Пероральные контрацептивы * [субстраты изофермента CYP3A4; ингибиторы изофермента СYР2С19] Норэтистерон/этинилэстрадиол (1 мг/0,35 мг один раз в сутки) |
Сmax этинилэстрадиола ↑ 36 % AUCτ этинилэстрадиола ↑ 61% Сmax норэтистерона ↑ 15% AUCτ норэтистерона ↑ 53% Сmax вориконазола ↑ 14% AUCτ вориконазола ↑ 46% |
Рекомендуется контроль состояния пациента на предмет развития нежелательных реакций, связанных с применением пероральных контрацептивов и вориконазола. |
|
Наркотические анальгетики короткого действия [субстраты изофермента CYP3A4] |
Следует оценить возможность снижения дозы алфентанила. фентанила и других наркотических анальгетиков короткого действия, имеющих схожую с алфентанилом химическую структуру и метаболизируемых изоферментом CYP3A4 (например, суфентанила). Пациенты должны находиться под постоянным наблюдением для предотвращения угнетения функции дыхания или других побочных эффектов, связанных с приемом наркотических анальгетиков короткого действия, и при необходимости их доза должна быть снижена. |
|
|
Алфентанил (однократная доза 20 мкг/кг с одновременным применением налоксона) |
Согласно данным независимого исследования: AUC0-∞ алфентанила ↑ в 6 раз |
|
|
Фентанил (однократная доза 5 мкг/кг) |
Согласно данным независимого исследования: AUC0-∞ фентанила ↑ в 1,34 раза |
|
|
Статины (например, ловастатин) [субстраты изофермента CYP3A4] |
Взаимодействие не изучалось, однако, вероятно, вориконазол может увеличивать плазменные концентрации статинов, которые метаболизируются изоферментом CYP3A4 и может приводить к рабдомиолизу. |
Следует оценить возможность снижения дозы статинов. |
|
Производные сульфонилмочевины (например, толбутамид, глипизид, глибенкламид) [субстраты изофермента CYP2C9] |
Взаимодействие не изучалось, однако, вероятно, вориконазол может увеличивать плазменные концентрации производных сульфонилмочевины и являться причиной гипогликемии. |
Необходимо тщательно контролировать концентрацию глюкозы в плазме крови. |
|
Алкалоиды барвинка (например, винкристин и винбластин) [субстраты изофермента CYP3A4] |
Вориконазол может повышать содержание алкалоидов барвинка (винкристина и винбластина) в плазме крови и вызывать нейротоксичность. |
Рекомендуется оценить целесообразность коррекции дозы алкалоидов барвинка. |
|
Другие ингибиторы протеазы (ИП) ВИЧ (например, саквинавир, ампренавир и нелфинавир)* [ингибиторы и субстраты изофермента CYP3A4] |
Исследования in vitroсвидетельствуют о том, что вориконазол может ингибировать метаболизм ингибиторов протеазы ВИЧ: саквинавира, ампренавира и нелфинавира. В свою очередь, ингибиторы протеазы ВИЧ могут подавлять метаболизм вориконазола. |
Рекомендуется тщательный контроль состояния пациента на предмет развития любых проявлений лекарственной токсичности и/или недостаточности действия. Возможно, понадобится коррекция дозы препаратов. |
|
Другие ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ) (например, делавирдин, невирапин)* [ингибиторы или индукторы цитохрома Р450 и субстраты изофермента CYP3A4] |
Исследования in vitro показали, что метаболизм вориконазола может угнетаться под действием ННИОТ, а вориконазол в свою очередь может угнетать метаболизм ННИОТ. На основании полученных результатов исследования эффекта эфавиренза на вориконазол, можно предположить, что ННИОТ могут усиливать метаболизм вориконазола. |
Рекомендуется тщательный контроль состояния пациента на предмет развития лекарственной токсичности и/или недостаточности действия. Возможно, потребуется коррекция дозы препаратов. |
|
Циметидин (400 мг два раза в сутки) [неспецифически ингибирует цитохром Р450 и повышает уровень pH желудочного сока] |
Сmax вориконазола ↑18% AUCτ вориконазола ↑ 23% |
Коррекции дозы не требуется |
|
Дигоксин (0,25 мг один раз в сутки) |
Сmax дигоксина ↔ AUCτ дигоксина ↔ |
Коррекции дозы не требуется |
|
Индинавир (800 мг три раза в сутки) [ингибитор и субстрат изофермента CYP3A4] |
Сmax индинавира ↔ AUCτ индинавира ↔ Сmax вориконазола ↔ AUCτ вориконазола ↔ |
Коррекции дозы не требуется |
|
Антибиотики группы макролидов |
Коррекции дозы не требуется |
|
|
Эритромицин (1 г два раза в сутки) [ингибитор изофермента CYP3A4] |
Сmax и AUCτ вориконазола ↔ |
|
|
Азитромицин (500 мг один раз в сутки) |
Сmax и AUCτ , вориконазола ↔ Влияние вориконазола на метаболизм эритромицина или азитромицина неизвестно. |
|
|
Микофеноловая кислота (1 г однократно) [субстрат уридин-5′-дифосфат- глюкуронилтрансферазы] |
Сmax микофеноловой КИСЛОТЫ ↔ AUCτ микофеноловой кислоты ↔ |
Коррекции дозы не требуется |
|
Преднизолон (60 мг однократно) [субстрат изофермента CYP3A4] |
Сmax преднизолона ↑11% AUC0-∞ преднизолона ↑ 34% |
Коррекции дозы не требуется |
|
Ранитидин (150 мг два раза в сутки) [повышает pH желудочного сока] |
Сmax и AUCτ вориконазола |
Коррекции дозы не требуется |
Фармакокинетический параметр, основанный на 90% доверительном интервале среднего геометрического значения находится внутри (↔), выше (↑) или ниже (↓) интервала 80%-125%.
* Взаимное воздействие.
AUCτ, AUCt, AUC0-∞ — площадь под кривой «концентрация-время» в период дозирования, от момента введения препарата до видимой концентрации в плазме крови, от момента введения препарата до бесконечности, соответственно.
Фармацевтическая несовместимость
Вориконазол несовместим с 4,2% раствором натрия гидрокарбоната, поэтому его не рекомендуется использовать в качестве растворителя. Совместимость с другими концентрациями натрия гидрокарбоната неизвестна.
Препарат Вифенд® нельзя вводить одновременно с препаратами крови или растворами электролитов высокой концентрации, даже если для инфузий используются отдельные катетеры.
Инфузию препарата Вифенд® не следует проводить через один катетер или канюлю с другими лекарственными средствами, включая препараты для парентерального питания (Аминофузин 10% Плюс). Однако препарат может вводиться одновременно с полным парентеральным питанием и с растворами электролитов невысокой концентрации через отдельные катетеры или отдельный вход многоканального катетера.
Препарат Вифенд® не следует смешивать с другими лекарственными средствами, за исключением перечисленных в разделе «Инструкция по приготовлению раствора для инфузий».
Особые указания:
Взятие материала для посева и других лабораторных исследований (серология, гистопатология) с целью выделения и идентификации возбудителей следует производить до начала лечения. Лечение можно начать до получения результатов лабораторных исследований. Однако после получения этих результатов необходимо скорректировать противогрибковую терапию.
К видам, наиболее часто вызывающим инфекции у человека, относятся С. albicans, С. parapsilosis, С. tropicalis, С. glabratа и С. krusei, при этом для всех них минимальная подавляющая концентрация (МПК) вориконазола обычно составляет менее 1 мг/мл.
Однако in vitro активность вориконазола против грибов разных видов Candida не одинакова. В частности, МПК вориконазола для устойчивых к флуконазолу изолятов С. glabrata пропорционально выше, чем МПК для изолятов, чувствительных к флуконазолу. В связи с этим, грибки рода Candida следует во всех возможных случаях идентифицировать до уровня вида. При возможности определения чувствительности грибов к противогрибковым препаратам полученные значения МПК следует интерпретировать с использованием пороговых критериев.
Выделены клинические штаммы микроорганизмов, обладающие пониженной чувствительностью к вориконазолу. Однако повышенные минимальные подавляющие концентрации (МПК) не всегда позволяют предсказать клиническую неэффективность: известны случаи, когда вориконазол был эффективен у больных, инфицированных микроорганизмами, устойчивыми к другим азолам.
Оценить корреляцию между активностью вориконазола в условиях in vitro и клиническими результатами лечения трудно, учитывая сложность больных, которых включали в клинические исследования. Пограничные концентрации вориконазола, позволяющие оценивать чувствительность к этому препарату, не установлены.
Нежелательные явления со стороны сердечно-сосудистой системы
Применение вориконазола связано с удлинением интервала QT на электрокардиограмме, что сопровождается редкими случаями мерцания/трепетания желудочков у тяжелобольных пациентов с множественными факторами риска, такими как кардиотоксическая химиотерапия, кардиомиопатия, гипокалиемия и сопутствующая терапия, которые могли способствовать развитию данного осложнения.
Вориконазол следует с осторожностью применять у пациентов со следующими потенциально проаритмическими состояниями:
— врожденное или приобретенное удлинение интервала QT;
— кардиомиопатия, особенно в сочетании с сердечной недостаточностью;
— синусовая брадикардия;
— существующие аритмии с клиническими проявлениями;
— одновременное применение лекарственных препаратов, удлиняющих интервал QT (см. раздел «Взаимодействие с другими лекарственными средствами»).
Электролитные нарушения, например гипокалиемию, гипомагниемию и гипокальциемию, при необходимости, следует контролировать и устранять до начала и во время терапии вориконазолом. При исследовании на здоровых добровольцах влияния вориконазола на интервал QT на ЭКГ при применении однократных доз, превышающих обычную дневную дозу не более, чем в 4 раза, было установлено, что ни у одного из испытуемых не наблюдалось повышения интервала QT на 60 или более мсек от нормы. Также ни у одного из испытуемых не наблюдалось превышения интервала выше клинически значимого порога в 500 мсек.
Гепатотоксичностъ
Частота клинически значимого повышения активности «печеночных» трансаминаз у больных, получающих вориконазол, составляет 13,4%. В большинстве случаев показатели функции печени нормализуются как при продолжении лечения без изменения дозы или после ее коррекции, так и после прекращения терапии. При применении вориконазола нечасто наблюдались случаи тяжелой гепатотоксичности (желтуха, гепатит и печеночно-клеточная недостаточность, приводящая к смерти) у больных с серьезными основными заболеваниями.
Нежелательные явления со стороны печени наблюдаются, в основном, у больных с серьезными заболеваниями, главным образом, злокачественными опухолями крови. У больных без каких-либо факторов риска наблюдаются преходящие реакции со стороны печени, включая гепатит и желтуху. Нарушения функции печени обычно обратимы и проходят после прекращения лечения.
Мониторинг функции печени
Во время лечения вориконазолом рекомендуется постоянно контролировать функцию печени у детей и взрослых. Клиническое ведение таких пациентов должно включать лабораторную оценку функции печени (в частности, определение активности ACT и АЛТ) в начале лечения вориконазолом и не реже одного раза в неделю в течение первого месяца терапии. В случае продолжения лечения при отсутствии изменений со стороны биохимических показателей функции печени частота лабораторного обследования может быть уменьшена до одного раза в месяц. При выраженном повышении биохимических показателей функции печени вориконазол следует отменить, если только соотношение пользы и риска терапии согласно медицинской оценке не оправдывает ее дальнейшее применение.
Зрительные нарушения
При лечении вориконазолом примерно у 21% больных наблюдается нарушение зрительного восприятия: затуманивание зрения, изменение цветового зрения или фотофобия. Нарушения зрения являются преходящими и полностью обратимыми; в большинстве случаев они самопроизвольно исчезают в течение 60 мин. При повторном применении вориконазола отмечается ослабление их выраженности. Зрительные нарушения обычно легко выражены, редко требуют прекращения лечения и не приводят к каким-либо отдаленным последствиям.
Механизм развития зрительных нарушений неизвестен. Установлено, что вориконазол снижает амплитуду волн на электроретинограмме (ЭРГ) у здоровых добровольцев. Данные изменения ЭРГ не нарастали при продолжении лечения в течение 29 дней и полностью исчезали после отмены вориконазола.
Длительная терапия вориконазолом (в среднем в течение 169 дней) у пациентов с паракокцидиоидозом не оказывала клинически значимого эффекта на зрительную функцию, что подтвердили результаты тестов на остроту зрения, зрительных полей, цветовосприятия и контрастной чувствительности.
По данным постмаркетинговых исследований сообщается о развитии случаев зрительных нарушений, сохраняющихся продолжительное время, в частности, возникновение «пелены» перед глазами, неврит зрительного нерва и отек диска зрительного нерва. Следует отметить, что данные нарушения развиваются чаще всего у тяжелобольных пациентов и/или получающих сопутствующую терапию, которая может вызывать подобные нежелательные явления.
Нежелательные явления со стороны почек
У тяжелобольных пациентов, получающих вориконазол, отмечались случаи развития острой почечной недостаточности, что, вероятно, было связано с терапией основного или сопутствующих заболеваний нефротоксичными лекарственными средствами.
Мониторинг функции почек
Больных следует наблюдать с целью выявления признаков нарушения функции почек. Для этого необходимо проводить лабораторные исследования, в частности определять концентрацию креатинина в сыворотке крови (см. раздел «Способ применения и дозы»).
Мониторинг функции поджелудочной железы
Взрослые и дети, имеющие факторы риска развития острого панкреатита (недавняя химиотерапия, трансплантация гемопоэтических стволовых клеток) должны пройти обследование (определение активности амилазы и липазы в сыворотке крови) для решения вопроса о терапии вориконазолом.
Нежелательные явления со стороны кожи
При терапии вориконазолом часто развиваются кожные реакции, в основном, у пациентов с серьезными основными заболеваниями, одновременно принимающих другие лекарственные средства. В большинстве случаев отмечалась легко или умеренно выраженная кожная сыпь.
Во время лечения вориконазолом у пациентов наблюдались случаи эксфолиативных кожных реакций, таких как синдром Стивенса-Джонсона.
Если у пациента развиваются эксфолиативные кожные реакции, то вориконазол следует отменить.
Так как во время терапии вориконазолом возможно развитие фотосенсибилизации, то во время лечения больным (в том числе и детям) рекомендуется избегать воздействия прямых солнечных лучей и принимать защитные меры, такие как ношение одежды и применение солнцезащитных средств с высоким коэффициентом защиты от ультрафиолетового излучения (SPF).
Длительное лечение
У пациентов с кожными реакциями фоточувствительности и дополнительными факторами риска сообщается о развитии плоскоклеточного рака кожи и меланомы на фоне продолжительной терапии. При возникновении у пациента фототоксических реакций он должен быть проконсультирован соответствующими специалистами и направлен к дерматологу. Следует рассмотреть возможность отмены вориконазола. При продолжении терапии вориконазолом, несмотря на возникновение фототоксических поражений кожи, пациент должен регулярно проходить дерматологическое обследование с целью раннего выявления и лечения предраковых заболеваний кожи. Если у пациента развиваются поражения кожи, связанные с предраковыми заболеваниями кожи, плоскоклеточным раком кожи или меланомой, то следует рассмотреть вопрос о прекращении терапии вориконазолом.
Неинфекционный периостит
Имеются сообщения о случаях развития периостита у пациентов после трансплантации, получающих длительную терапию вориконазолом. Терапию вориконазолом следует отменить в случае, если у пациента имеется боль в костях и на рентгенограмме отмечаются изменения, характерные для периостита.
Применение у детей
Эффективность и безопасность применения вориконазола у детей в возрасте до 2 лет не изучались. Вориконазол показан для применения у детей в возрасте от 2 лет и старше при постоянном контроле функции печени. У детей наблюдалась более высокая частота повышения активности печеночных ферментов по сравнению со взрослыми. Биодоступность вориконазола при приеме внутрь у детей в возрасте от 2 до 12 лет может быть снижена за счет нарушения всасывания или за счет пониженной массы тела. В таких случаях показано внутривенное введение вориконазола. Частота фототоксических реакций у детей выше. В связи с тем, что фототоксические поражения могут перерождаться в плоскоклеточную карциному (ПКК), у детей необходимо применять строгие меры по защите кожи от ультрафиолетового излучения. Детям с признаками фотостарения кожи, например лентиго или веснушки, рекомендуется избегать солнца и обследоваться у дерматолога даже после прекращения лечения.
Наркотические анальгетики короткого действия (субстраты изофермента CYP3A4)
Поскольку период полувыведения алфентанила при его одновременном введении с вориконазолом увеличивается в 4 раза, необходим тщательный мониторинг нежелательных явлений, связанных с применением наркотических анальгетиков, включая более продолжительный мониторинг функции дыхания.
Наркотические анальгетики длительного действия (субстраты изофермента CYP3A4)
Следует предусмотреть возможность снижения дозы оксикодона и других наркотических анальгетиков продолжительного действия, которые метаболизируются изоферментом CYP3A4 (гидрокодон) при одновременном применении с вориконазолом. Необходимо проводить тщательный мониторинг нежелательных явлений, связанных с применением наркотических анальгетиков (см. раздел «Взаимодействие с другими лекарственными средствами»).
Фенитоин (мощный индуктор цитохрома Р450 и субстрат изофермента CYP2C9)
При одновременном применении фенитоина и вориконазола рекомендуется осуществлять постоянный контроль концентрации фенитоина. По возможности следует избегать одновременного применения вориконазола и фенитоина за исключением тех случаев, когда ожидаемая польза превышает возможный риск (см. раздел «Взаимодействие с другими лекарственными средствами»).
Эфавиренз (ненуклеозидный ингибитор обратной транскриптазы, индуктор цитохрома Р450, ингибитор и субстрат изофермента CYP3A4)
В случае одновременного применения вориконазола и эфавиренза дозу вориконазола следует увеличить до 400 мг 2 раза в сутки, а доза эфавиренза должна быть снижена до 300 мг каждые 24 ч (см. раздел «Взаимодействие с другими лекарственными средствами»).
Рифабутин
Одновременное применение вориконазола и рифабутина противопоказано, так как рифабутин значительно снижают концетрацию вориконазола в плазме крови.
Ритонавир (мощный индуктор цитохрома Р450, ингибитор и субстрат изофермента CYP3A4)
Применять одновременно вориконазол и ритонавир в низких дозах (100 мг 2 раза в сутки) следует лишь в том случае, если ожидаемая польза от приема вориконазола значительно превышает риск от их совместного применения (см. разделы «Противопоказания» и «Взаимодействие с другими лекарственными средствами»).
Эверолимус (субстрат изофермента CYP3A4 и Р-гликопротеина)
Одновременное применение вориконазола и эверолимуса не рекомендуется, так как ожидается, что вориконазол значительно повышает концентрацию эверолимуса в плазме крови. На данный момент не имеется достаточной информации для рекомендации по коррекции режима дозирования.
Метадон (субстрат изофермента CYP3A4)
Повышение концентрации метадона в плазме крови приводит к проявлению токсических эффектов, включая удлинение интервала QT. При одновременном применении вориконазола и метадона необходимо внимательно следить за проявлением нежелательных и токсических эффектов. При необходимости доза метадона может быть снижена (см. раздел «Взаимодействие с другими лекарственными средствами»).
Флуконазол (ингибитор изоферментов CYP2C9, CYP2C19 и CYP3A4)
Одновременное применение вориконазола и флуконазола внутрь у здоровых добровольцев приводит к значительному повышению Сmах и AUCτ вориконазола. Подходящий режим коррекции дозы и/или частоты приема вориконазола и флуконазола не установлен. В том случае, если вориконазол применяется после флуконазола, рекомендуется проводить тщательный контроль нежелательных реакций, связанных с приемом вориконазола.
Содержание натрия
Каждый флакон препарата содержит 217,6мг натрия, это необходимо учитывать при применении препарата у пациентов, которые придерживаются диеты с пониженным содержанием натрия.
Реакции, связанные с введением
При внутривенном введении вориконазола наблюдаются связанные с инфузией реакции, в частности, «приливы» крови к коже лица и тошнота. Если эти симптомы выражены, то следует обсудить целесообразность прекращения лечения (см. раздел «Побочное действие»).
Влияние на способность управлять транспортными средствами и механизмами:
Вориконазол может вызвать преходящие и обратимые нарушения зрения, включая возникновение «пелены» перед глазами, нарушение/усиление зрительного восприятия и/или фотофобию. При наличии таких симптомов пациенты должны избегать выполнения потенциально опасных действий, в частности управления автомобилем или использования сложной техники. При приеме вориконазола пациенты не должны водить автомобиль по ночам.
Форма выпуска/дозировка:
Лиофилизат для приготовления раствора для инфузий, 200 мг.
Упаковка:
3,4 г лиофилизата во флакон прозрачного бесцветного стекла (тип I), укупоренный резиновой пробкой и герметичным алюминиевым колпачком с пластиковой крышкой типа «флип-офф».
1 флакон в картонную пачку вместе с инструкцией по применению.
Условия хранения:
Лиофилизат — при температуре не выше 30 °С.
Восстановленный раствор — при температуре от 2 до 8 °С.
Хранить в местах, недоступных для детей.
Срок годности:
Лиофилизат — 3 года.
Восстановленный раствор — не более 24 часов.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
По рецепту
Производитель
Фармация и Апджон Кампани, 7000 Portage Road, Kalamazoo, MI 49001, USA, США
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Пфайзер Инк
Купить Вифенд лиофилизат — Фармация и Апджон в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Вифенд® (лиофилизат для приготовления раствора для инфузий, 200 мг)
МНН: Вориконазол
Производитель: Фармация и Апджон Кампани
Анатомо-терапевтическо-химическая классификация: Voriconazole
Номер регистрации в РК:
№ РК-ЛС-5№014469
Информация о регистрации в РК:
20.08.2019 — бессрочно
- Скачать инструкцию медикамента
Торговое название
Вифенд®
Международное непатентованное название
Вориконазол
Лекарственная форма
Лиофилизат для приготовления раствора для инфузий, 200 мг
Состав
Один флакон содержит
активное вещество — вориконазол 200 мг,
вспомогательные вещества: натриевая соль сульфобутилового эфира β — циклодекстрина
Описание
Лиофилизат белого цвета
Фармакотерапевтическая группа
Противогрибковые препараты для системного использования.
Триазола производные. Вориконазол.
Код АТХ J02АС03
Фармакологические свойства
Фармакокинетика
Фармакокинетика вориконазола имеет нелинейный характер за счет насыщения метаболических путей его превращений. При увеличении дозы наблюдается выраженное повышение уровня его воздействия.
При внутривенном применении рекомендуемых насыщающих доз, концентрации вориконазола в плазме крови, близкие к равновесным, достигаются в течение первых 24 часов после введения препарата. Без применения насыщающей дозы при многократном приеме два раза в сутки наблюдается накопление препарата с достижением равновесной концентрации вориконазола в плазме крови у большинства пациентов к 6 — ому дню.
Распределение
Объем распределения вориконазола в равновесном состоянии составляет 4,6 л/кг, что указывает на широкое распределение препарата в тканях. Связывание с белками плазмы составляет 58 %.
Вориконазол в концентрациях, поддающихся определению, обнаруживается в спинно — мозговой жидкости.
Биотрансформация
Исследования in vitro показали, что вориконазол метаболизируется печеночными изоферментами цитохрома P — 450 — CYP2C19, CYP2C9 и CYP3A4.
Для фармакокинетики вориконазола характерна значительная индивидуальная вариабельность.
Исследования in vivo свидетельствуют о том, что CYP2C19 играет важную роль в метаболизме вориконазола. Для этого фермента характерен генетический полиморфизм. Например, низкой активности метаболизирующих вориконазол ферментов можно ожидать у 15 — 20 % представителей азиатской расы. Среди представителей европеоидной и негроидной рас распространенность лиц с низкой метаболизирующей активностью ферментов составляет 3 — 5 %. Исследования у здоровых представителей европеоидной расы и японцев показали, что у пациентов с низкой метаболизирующей активностью ферментов экспозиции (AUCτ) препарата в среднем в 4 раза выше, чем у гомозиготных участников с высокой метаболизирующей активностью. У гетерозиготных участников с высокой метаболизирующей активностью ферментов воздействие вориконазола в среднем в 2 раза выше, чем у гомозиготных участников с высокой метаболизирующей активностью ферментов.
Основным метаболитом вориконазола является N — оксид, доля которого составляет 72 % от циркулирующих меченных радиоактивной меткой метаболитов в плазме крови. Этот метаболит обладает минимальной противогрибковой активностью и не влияет на общую эффективность вориконазола.
Выведение
Вориконазол элиминируется посредством метаболизма в печени, при этом в неизмененном виде с мочой выделяется менее 2 % дозы препарата.
После многократного внутривенного введения меченного радиоактивной меткой вориконазола в моче обнаруживают примерно 80 % радиоактивной метки. После внутривенного введения основная часть (> 94 %) радиоактивной метки выводится в течение первых 96 часов.
Продолжительность терминального периода полувыведения вориконазола зависит от дозы. В связи с нелинейностью фармакокинетики терминальный период полувыведения не позволяет прогнозировать параметры накопления или элиминации вориконазола.
Фармакокинетика у особых групп пациентов
Пол
В ходе клинических исследований коррекция дозы в зависимости от пола не осуществлялась. Профиль безопасности и концентрации препарата в плазме крови у женщин и мужчин были схожими. Таким образом, коррекция дозы препарата в зависимости от пола не требуется.
Пожилые пациенты
В терапевтических исследованиях коррекция дозы в зависимости от возраста не осуществлялась. Однако была установлена взаимосвязь между концентрациями препарата в плазме крови и возрастом пациентов. Профиль безопасность вориконазола у пациентов молодого и пожилого возраста был схож, поэтому необходимость в коррекции дозы у лиц пожилого возраста отсутствует.
Пациенты детского возраста
Дозы препарата, рекомендуемые к применению у детей и подростков, определены по результатам популяционного фармакокинетического анализа объединенных данных у детей с ослабленным иммунитетом в возрасте от 2 до 12 лет и подростков с ослабленным иммунитетом в возрасте от 12 до 17 лет.
Многократные дозы вориконазола 3, 4, 6, 7 и 8 мг/кг при внутривенном введении два раза в сутки наблюдались в исследованиях по оценке фармакокинетики вориконазола у пациентов детского возраста.
Насыщающие дозы 6 мг/кг при внутривенном введении два раза в сутки на 1 — й день с последующим введением дозы 4 мг/кг два раза в сутки наблюдались в исследованиях фармакокинетического профиля применения препарата у подростков. У детей отмечалась более выраженная индивидуальная вариабельность, чем у взрослых.
При сравнении данных по фармакокинетике препарата у детей и взрослых было установлено, что прогнозируемое общее воздействие (AUC) у детей после внутривенного введения насыщающей дозы 9 мг/кг было сопоставимо с воздействием у взрослых после внутривенного введения насыщающей дозы 6 мг/кг. Прогнозируемый суммарный уровень воздействия у детей после внутривенного введения поддерживающих доз 4 и 8 мг/кг два раза в сутки был сопоставим с таковым у взрослых после внутривенного введения препарата в дозах 3 и 4 мг/кг два раза в сутки соответственно.
Поддерживающая доза для внутривенного введения у детей выше, чем у взрослых, в связи с наличием у детей более выраженной способности к элиминации препарата, обусловленной более высоким соотношением массы печени к массе тела.
Уровни воздействия вориконазола у большинства подростков были сопоставимы с таковыми у взрослых пациентов, получавших препарат по такой же схеме лечения. Однако у некоторых пациентов раннего подросткового возраста с низкой массой тела наблюдался более низкий уровень воздействия вориконазола, чем у взрослых. Вполне вероятно, что у этих пациентов метаболизм вориконазола более схож с метаболизмом у детей, чем у подростков/взрослых. Исходя из результатов популяционного фармакокинетического анализа, подростки в возрасте от 12 до 14 лет с массой тела менее 50 кг должны получать детские дозы препарата.
Нарушение функции почек
У пациентов с умеренным или тяжелым нарушением функции почек (уровнями креатинина в сыворотке > 2,5 мг/дл) наблюдается накопление вспомогательного вещества лекарственной формы для внутривенного введения — сульфобутилового эфира бета — циклодекстрина натрия (SBECD).
Фармакодинамика
Вифенд® — противогрибковый препарат широкого спектра действия, который принадлежит к группе соединений триазольной структуры.
Механизм действия
Основной механизм действия вориконазола заключается в ингибировании опосредованной грибковым цитохромом Р — 450 реакции деметилирования 14 — альфа — ланостерола, являющейся ключевым этапом биосинтеза эргостерола в грибах. Накопление 14 — альфа — метилстеролов коррелирует с последующей потерей эргостерола, входящего в состав клеточной мембраны грибов; этот процесс, возможно, лежит в основе противогрибкового действия вориконазола. Показано, что вориконазол более селективен по отношению к ферментам семейства цитохрома Р — 450 грибов, чем по отношению к различным ферментам семейства цитохрома P — 450 млекопитающих.
Зависимость параметров фармакокинетики и фармакодинамики
В 10 терапевтических исследованиях медиана средней и максимальной концентрации препарата в плазме крови у отдельных пациентов во всех исследованиях равнялась 2425 нг/мл (межквартильный размах от 1193 до 4380 нг/мл) и 3742 нг/мл (межквартильный размах от 2027 до 6302 нг/мл) соответственно. Положительной связи между средними, максимальными и минимальными значениями концентрации вориконазола в плазме крови и эффективностью препарата в исследованиях с его применением в терапевтических целях не выявлено; в исследованиях с применением вориконазола в профилактических целях такая связь не изучалась.
В результате анализа данных по фармакокинетике и фармакодинамике, полученных в клинических исследованиях, была выявлена положительная связь между концентрациями вориконазола в плазме и отклонениями от нормы биохимических показателей функции печени и зрительными нарушениями. Коррекция дозы в исследованиях с применением вориконазола в профилактических целях не изучалась.
Клиническая эффективность и безопасность
В условиях in vitro вориконазол обладает широким спектром противогрибкового действия и активен против грибов рода Candida (включая устойчивые к флуконазолу штаммы C. krusei, а также устойчивые штаммы C. glabrata и C. albicans) и фунгицидным действием относительно всех исследованных грибов рода Aspergillus. Кроме того, в условиях in vitro вориконазол обладает фунгицидным действием против новых патогенных грибов, в том числе грибов рода Scedosporium или Fusarium, имеющих ограниченную чувствительность к существующим противогрибковым средствам.
Клиническая эффективность, определяемая как частичный или полный ответ, была показана относительно грибов рода Aspergillus, в том числе A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans; грибов рода Candida, включая C. albicans, C. glabrata, C. krusei, C. parapsilosis и C. tropicalis; а также против ограниченного количества грибов C. dubliniensis, C. inconspicua, и видов C. guilliermondii, Scedosporium, в том числе S. apiospermum, S. prolificans;
кроме того, грибов рода Fusarium.
Другие грибковые инфекции, при которых применялся вориконазол (часто с частичным или полным ответом), включали в себя отдельные случаи инфекций, вызванных грибами рода Alternaria, Blastomyces dermatitidis, Blastoschizomyces capitatus, рода Cladosporium, Coccidioides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, рода Penicillium, включая P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis и рода Trichosporon, включая T. beigelii.
Активность препарата в условиях in vitro по отношению к клиническим штаммам наблюдалась для грибов рода Acremonium, рода Alternaria, рода Bipolaris, рода Cladophialophora и Histoplasma capsulatum, причем рост большинства штаммов подавлялся при концентрациях вориконазола от 0,05 мкг/мл до 2 мкг/мл.
В условиях in vitro выявлена активность вориконазола в отношении грибов рода Curvularia и рода Sporothrix, но клиническая достоверность неизвестна.
Пограничные значения
К видам, которые чаще всего служат причиной грибковых инфекций у человека, относятся C. albicans, C. parapsilosis, C. tropicalis, C. glabrata и C. krusei, причем для всех этих видов минимальная ингибирующая концентрация (МИК) вориконазола составляет менее 1 мг/л.
Однако активность вориконазола in vitro в отношении различных видов грибов рода Candida неодинакова. В частности, МИК вориконазола для резистентных к флуконазолу изолятов C. glabrata пропорционально выше, чем для изолятов, чувствительных к флуконазолу. В связи с этим грибы рода Candida необходимо идентифицировать до уровня вида. При возможности выполнения исследования по определению чувствительности грибов к противогрибковым препаратам полученные значения МИК могут интерпретироваться с использованием критериев границ чувствительности Европейского комитета по определению чувствительности микроорганизмов к антибактериальным средствам (EUCAST).
Границы чувствительности согласно EUCAST
|
Виды Candida |
Пограничные значения МИК (мг/л) |
|
|
≤ Ч (чувствительные) |
> У (устойчивые) |
|
|
Candida albicans1 |
0,125 |
0,125 |
|
Candida tropicalis1 |
0,125 |
0,125 |
|
Candida parapsilosis1 |
0,125 |
0,125 |
|
Candida glabrata2 |
Данных недостаточно |
|
|
Candida krusei3 |
Данных недостаточно |
|
|
Другие виды Candida4 |
Данных недостаточно |
1 Штаммы с величинами МИК выше пограничного значения чувствительности (Ч) выявлялись редко или не выявлялись вообще. Идентификацию любого из таких изолятов и исследование его чувствительности к противогрибковым средствам необходимо выполнить повторно и в случае подтверждения полученного результата изолят следует направить в поверочную лабораторию.
2 В клинических исследованиях у пациентов с инфекциями, вызванными C. glabrata, ответ на терапию вориконазолом был на 21 % ниже, чем у пациентов с инфекциями, вызванными C. albicans, C. parapsilosis и C. tropicalis. Однако этот сниженный ответ не коррелировал с повышенными значениями МИК.
3 В клинических исследованиях у пациентов с инфекциями, вызванными C. krusei, ответ на терапию вориконазолом был сопоставим с ответом на терапию у пациентов с инфекциями, вызванными C. albicans, C. parapsilosis и C. tropicalis. Однако поскольку для анализа по критериям EUCAST было доступно лишь 9 случаев инфекции, на данный момент доказательных данных для установления клинических пограничных значений для C. krusei недостаточно.
4 EUCAST не установил не зависящих от вида возбудителя пограничных значений для вориконазола.
Опыт клинического применения
В рамках данного раздела положительный результат применения препарата определяется как полный или частичный ответ на лечение.
Инфекции, вызванные Aspergillus: эффективность у пациентов с аспергиллезом и неблагоприятным прогнозом
В условиях in vitro вориконазол проявляет противогрибковое действие против разных видов Aspergillus. Эффективность вориконазола и его положительное влияние на выживаемость в сравнении со стандартной терапией амфотерицином B при первичном лечении острого инвазивного аспергиллеза были показаны в открытом, рандомизированном, многоцентровом исследовании с участием 277 пациентов с ослабленным иммунитетом, получавших лечение в течение 12 недель. Вориконазол вводили внутривенно в виде насыщающей дозы 6 мг/кг каждые 12 часов в течение первых 24 часов, а затем в виде поддерживающей дозы 4 мг/кг каждые 12 часов в течение не менее 7 дней. Далее можно было перейти к получению препарата перорально в дозе 200 мг каждые 12 часов. Медианная продолжительность в/в терапии вориконазолом составляла 10 дней (диапазон 2 — 85 дней). Медианная продолжительность пероральной терапии вориконазолом после в/в терапии составляла 76 дней (диапазон 2 — 232 дня).
Удовлетворительный общий ответ (полное или частичное исчезновение всех ассоциированных признаков, симптомов и рентгенографических/бронхоскопических изменений, имевшихся на исходном уровне) наблюдался у 53 % пациентов, получавших вориконазол, по сравнению с 31 % пациентов, получавших препарат сравнения. Выживаемость пациентов на протяжении 84 — дневного периода на фоне применения вориконазола была статистически значимо выше, чем на фоне применения препарата сравнения, при этом были продемонстрированы клинически и статистически значимые преимущества вориконазола как в плане продолжительности периода до наступления смерти, так и в плане продолжительности периода до отмены препарата в связи с его токсичностью.
Это исследование подтвердило результаты предыдущего проспективного исследования, в котором был получен положительный результат у пациентов с факторами риска неблагоприятного прогноза, включая реакцию «трансплантат против хозяина» и, особенно, церебральные инфекции (обычно сопровождающиеся почти 100 % — ой летальностью).
Эти исследования включали случаи аспергиллеза головного мозга, придаточных пазух носа, легких и диссеминированной инфекции у пациентов после трансплантации костного мозга и органов, у пациентов с гемобластозами, другими злокачественными опухолями и СПИДом.
Кандидемия у пациентов без нейтропении
Эффективность вориконазола в сравнении с амфотерицином В с последующим применением флуконазола в качестве первичной терапии кандидемии была продемонстрирована в открытом сравнительном исследовании. В исследовании участвовали 370 пациентов без нейтропении (старше 12 лет) с подтвержденной кандидемией, из которых 248 получали вориконазол. Девять пациентов в группе вориконазола и 5 пациентов в группе амфотерицина В с последующим применением флуконазола также имели грибковую инфекцию глубоких тканей, подтвержденную микологическим исследованием. Пациенты с почечной недостаточностью в это исследование не включались. Медианная продолжительность лечения составляла 15 дней в обеих группах лечения. В соответствии с проведенной Комитетом по анализу данных (КАД) оценкой результатов, которые были маскированы в отношении исследовавшегося лекарственного препарата, при первичном анализе благоприятный ответ определялся как исчезновение или ослабление всех клинических признаков и симптомов инфекции с отсутствием грибов рода Candida в крови и в инфицированных участках глубоких тканей через 12 недель после окончания терапии (ОТ). Пациенты, не прошедшие оценку через 12 недель после ОТ, рассматривались как не ответившие на лечение. В этом анализе благоприятный ответ наблюдался у 41 % пациентов в обеих группах лечения.
При вторичном анализе, в котором использовались результаты оценки ответа КАД в самой последней временной точке (при ОТ или через 2, 6 или 12 недель после ОТ), частота благоприятного ответа на терапию вориконазолом и амфотерицином В с последующим применением флуконазола составляла 65 % и 71 % соответственно.
Результаты оценки исследователем удачного исхода лечения в каждой из названных временных точек приводятся в следующей таблице.
|
Временная точка |
Вориконазол (N = 248) |
Амфотерицин B → флуконазол (N = 122) |
|
ОТ |
178 (72 %) |
88 (72 %) |
|
2 недели после ОТ |
125 (50 %) |
62 (51 %) |
|
6 недель после ОТ |
104 (42 %) |
55 (45 %) |
|
12 недель после ОТ |
104 (42 %) |
51 (42 %) |
Серьезные рефрактерные инфекции, вызванные грибами рода Candida
В клиническом исследовании приняли участие 55 пациентов с серьезными рефрактерными системными инфекциями, вызванными грибами рода Candida (включая кандидемию, диссеминированный кандидоз и другие формы инвазивного кандидоза), у которых предыдущая противогрибковая терапия, в частности флуконазолом, была неэффективной. Благоприятный ответ на лечение вориконазолом наблюдался у 24 пациентов (у 15 пациентов полный ответ, у 9 пациентов частичный ответ). У пациентов, инфицированных резистентными к флуконазолу штаммами, не принадлежащими к виду albicans, благоприятный ответ на лечение наблюдался у 3 из 3 пациентов, инфицированных C. krusei (полный ответ), и у 6 из 8 пациентов, инфицированных C. glabrata (у 5 — полный ответ, у 1 -частичный ответ). Данные о клинической эффективности подтверждались немногочисленными результатами определения чувствительности возбудителей к препарату.
Инфекции, вызванные грибами рода Scedosporium и Fusarium
Была продемонстрирована эффективность вориконазола против следующих редких патогенных грибов.
Грибы рода Scedosporium. Благоприятный ответ на терапию вориконазолом наблюдался у 16 (у 6 пациентов полный ответ и у 10 пациентов частичный ответ) из 28 пациентов с инфекцией, вызванной S. apiospermum, и у 2 (в обоих случаях частичный ответ) из 7 пациентов с инфекцией, вызванной S. prolificans. Помимо этого, благоприятный ответ наблюдался у 1 из 3 пациентов с инфекциями, вызванными более чем одним микроорганизмом, включая грибы рода Scedosporium.
Грибы рода Fusarium. Семь (3 пациента с полным ответом и 4 пациента с частичным) из 17 пациентов были успешно пролечены вориконазолом. У 3 из этих 7 пациентов наблюдалась инфекция глаз, у 1 — инфекция придаточных пазух носа и у 3 пациентов — диссеминированная инфекция. Еще 4 пациента с фузариозом были инфицированы несколькими возбудителями; у 2 из этих пациентов исход лечения был удачным.
У большинства пациентов, получавших вориконазол для лечения вышеуказанных редких инфекций, наблюдалась непереносимость применявшейся ранее противогрибковой терапии или устойчивость к ней.
Первичная профилактика инвазивных грибковых инфекций (ИГИ) — эффективность при применении у реципиентов ТГСК (трансплантации гемопоэтических стволовых клеток), ранее не инфицированных подтвержденной или подозреваемой ИГИ
Вориконазол сравнивали с итраконазолом при применении в качестве первичной профилактики в ходе открытого, сравнительного, многоцентрового исследования с участием взрослых и подростков, реципиентов аллогенных ТГСК, ранее не инфицированных подтвержденной или подозреваемой ИГИ. Благоприятным результатом лечения считалась возможность продолжать профилактическое применение исследуемого препарата на протяжении 100 дней после трансплантации КСК (без перерыва длительностью > 14 дней) и выживаемость без подтвержденной или подозреваемой ИГИ на протяжении 180 дней после трансплантации КСК. В модифицированной в соответствии с назначенным лечением (MITT) группе насчитывалось 465 реципиентов аллогенных ТГСК, причем у 45 % пациентов был острый миелоидный лейкоз (ОМЛ). Среди всех пациентов 58 % лиц предстояло миелоаблативное кондиционирование. Профилактическое применение исследуемого препарата начинали непосредственно после трансплантации КСК: 224 пациента получали вориконазол, и 241 пациент получал итраконазол. Медиана продолжительности профилактического применения исследуемого препарата в популяции MITT составила 96 дней для вориконазола и 68 дней для итраконазола.
Показатели эффективности и другие вторичные конечные точки представлены в таблице ниже.
|
Конечные точки исследования |
Вориконазол N = 224 |
Итраконазол N = 241 |
Разность процентных долей и 95 % доверительный интервал (ДИ) |
P — значение |
|
Эффективность лечения на 180* день |
109 (48,7 %) |
80 (33,2 %) |
16,4 % (7,7 %, 25,1 %)** |
0,0002** |
|
Эффективность лечения на 100 день |
121 (54,0 %) |
96 (39,8 %) |
15,4 % (6,6 %, 24,2 %)** |
0,0006** |
|
Количество пациентов, получавших исследуемый препарат с профилактической целью в течение как минимум 100 дней |
120 (53,6 %) |
94 (39,0 %) |
14,6 % (5,6 %, 23,5 %) |
0,0015 |
|
Количество выживших пациентов к 180 дню |
184 (82,1 %) |
197 (81,7 %) |
0,4 % (-6,6 %, 7,4 %) |
0,9107 |
|
Количество пациентов с доказанной или вероятной ИГИ, развившейся к 180 дню |
3 (1,3 %) |
5 (2,1 %) |
-0,7 % (-3,1 %, 1,6 %) |
0,5390 |
|
Количество пациентов с доказанной или вероятной ИГИ, развившейся к 100 дню |
2 (0,9 %) |
4 (1,7 %) |
-0,8 % (-2,8 %, 1,3 %) |
0,4589 |
|
Количество пациентов с доказанной или вероятной ИГИ, развившейся при приеме исследуемого препарата |
3 (1,2 %) |
-1,2 % (-2,6 %, 0,2 %) |
0,0813 |
* Первичная конечная точка исследования
** Разность отношений, 95 % ДИ и p — значение, полученные после поправки на рандомизацию.
Частота случаев заражения ИГИ после лечения ко Дню 180 и первичная конечная точка исследования, определяемая как успешное лечение по данным на 180 — й день, у пациентов с ОМЛ и миелоаблативным кондиционированием соответственно представлены в таблице ниже.
ОМЛ
|
Конечные точки исследования |
Вориконазол (N = 98) |
Итраконазол (N = 109) |
Разность процентных долей и 95 % доверительный интервал (ДИ) |
|
Частота случаев заражения ИГИ после лечения — 180 день |
1 (1,0 %) |
2 (1,8 %) |
— 0,8 % (- 4,0 %; 2,4 %)** |
|
Эффективность лечения на 180* день |
55 (56,1 %) |
45 (41,3 %) |
14,7 % (1,7 %; 27,7 %)*** |
* Первичная конечная точка исследования.
** При запасе 5 % была показана не меньшая эффективность.
*** Разность отношений, 95 % ДИ, полученная после поправки на рандомизацию.
Схема миелоаблативного кондиционирования
|
Конечные точки исследования |
Вориконазол (N = 125) |
Итраконазол (N = 143) |
Разность процентных долей и 95 % доверительный интервал (ДИ) |
|
Частота случаев заражения ИГИ после лечения — 180 день |
2 (1,6 %) |
3 (2,1 %) |
— 0,5 % (- 3,7 %; 2,7 %)** |
|
Эффективность лечения на 180* день |
70 (56,0 %) |
53 (37,1 %) |
20,1 % (8,5 %; 31,7 %)*** |
* Первичная конечная точка исследования.
** При запасе 5 % была показана не меньшая эффективность.
*** Разность отношений, 95 % ДИ, полученная после поправки на рандомизацию.
Вторичная профилактика ИГИ — эффективность при применении у ТГСК реципиентов, ранее инфицированных подтвержденной или подозреваемой ИГИ
Применение вориконазола в качестве вторичной профилактики изучалось в ходе открытого, несравнительного, многоцентрового исследования с участием взрослых пациентов, реципиентов аллогенных КСК, ранее инфицированных подтвержденной или подозреваемой ИГИ. В качестве первичной конечной точки использовали частоту инфицирования подтвержденной или подозреваемой ИГИ на протяжении первого года после трансплантации КСК. Популяция MITT состояла из 40 пациентов, ранее инфицированных ИГИ, включая 31 пациента с аспергиллезом, 5 пациентов с кандидозом и 4 пациента с другими ИГИ. Медиана продолжительности профилактического применения исследуемого препарата в популяции MITT составила 95,5 дня.
Подтвержденные или подозреваемые ИГИ развились у 7,5 % (3/40) пациентов в течение первого года после трансплантации КСК, включая один случай кандидемии, один случай сцедоспориоза (обе инфекции как рецидив имевшейся ранее ИГИ) и один случай зигомикоза. Выживаемость на 180 — й день составила 80,0 % (32/40), а через 1 год — 70,0 % (28/40).
Продолжительность терапии
В клинических исследованиях 705 пациент получал вориконазол более 12 недель, причем 164 из них получали вориконазол более 6 месяцев.
Пациенты детского возраста
Вориконазол применялся для лечения 61 ребенка в возрасте от 9 месяцев до 15 лет с подтвержденными или подозреваемыми инвазивными грибковыми инфекциями. В состав этой группы входило 34 пациента в возрасте от 2 до < 12 лет и 20 пациентов в возрасте от 12 до 15 лет.
У большинства пациентов (57 из 61) предыдущая противогрибковая терапия была неэффективной. В терапевтических исследованиях участвовали пять пациентов в возрасте от 12 до 15 лет; остальные получали вориконазол в рамках программ применения незарегистрированного препарата при неэффективности других методов лечения. Основными заболеваниями у этих пациентов являлись гемобластозы (27 пациентов) и хронический гранулематоз (14 пациентов). Наиболее распространенным грибковым заболеванием, по поводу которого пациенты получали лечение, являлся аспергиллез (43 из 61; 70 %).
Клинические исследования по оценке интервала QTc
Для оценки влияния трех пероральных доз вориконазола и кетоконазола на интервал QTc было проведено плацебо — контролируемое, рандомизированное, перекрестное исследование с однократным приемом препарата здоровыми добровольцами. Скорректированное относительно плацебо среднее максимальное удлинение интервала QTc по сравнению с исходным уровнем составляло 5,1 мсек, 4,8 мсек и 8,2 мсек после применения 800 мг, 1200 мг и 1600 мг вориконазола, соответственно, и 7,0 мсек после применения кетоконазола в дозе 800 мг. Ни у одного участника исследования удлинение интервала QTc не составляло ≥ 60 мсек по сравнению с исходным уровнем. Случаи удлинения интервала выше потенциально клинически значимого порогового значения 500 мсек отсутствовали.
Показания к применению
Вифенд® следует применять, главным образом, у пациентов с прогрессирующими и потенциально жизнеугрожающими инфекциями:
— лечение инвазивного аспергиллеза — лечение кандидемии у пациентов без нейтропении — лечение устойчивых к флуконазолу серьезных инвазивных инфекций, вызванных грибами рода Candida (в том числе C. krusei) — лечение тяжелых грибковых инфекций, вызванных грибами рода Scedosporium и Fusarium
— профилактика инвазивных грибковых инфекций у пациентов, которым была выполнена аллогенная трансплантация гемопоэтических стволовых клеток (ТГСК) с высоким риском развития этих инфекций.
Способ применения и дозы
Перед началом терапии необходимо получить образцы грибковой культуры и провести другие надлежащие лабораторные исследования (серологические, гистопатологические) для выделения и идентификации патогенных микроорганизмов — возбудителей инфекции. Терапия может быть начата до получения результатов культурального и других лабораторных исследований, однако, после получения этих результатов противоинфекционное лечение должно быть скорректировано соответствующим образом.
Перед внутривенной инфузией порошок Вифенда® следует растворить и затем дополнительно развести.
Раствор для инфузий не предназначен для болюсного введения.
Вифенд® нельзя вводить одновременно с другими препаратами для внутривенного введения через одну и ту же инфузионную систему или канюлю. После окончания инфузии Вифенда® инфузионную систему можно использовать для введения других препаратов для внутривенного применения.
Вифенд® не должен вводиться одновременно с препаратами крови и концентрированными растворами электролитов, вводимыми путем быстрой инфузии, даже если две инфузии вводятся через разные внутривенные катетеры.
Электролитные нарушения, такие как гипокалиемия, гипомагниемия и гипокальциемия должны быть откорректированы до начала терапии Вифендом.®
Полное парентеральное питание (ППП)
Полное парентеральное питание (ППП) не следует прекращать при назначении Вифенда®, однако раствор питательных веществ следует вводить через отдельную инфузионную систему. Если используется многоканальный катетер, ППП и Вифенд® должны вводиться через разные входы.
Вифенд® нельзя разводить 4,2 % раствором натрия бикарбоната для внутривенных инфузий. Совместимость с раствором натрия бикарбоната в других концентрациях неизвестна.
Инструкции по приготовлению раствора для инфузий
Вифенд® растворяется либо 19 мл воды для инъекций, либо 19 мл раствора натрия хлорида 9 мг/мл (0,9 %) для внутривенных инфузий для получения прозрачного концентрата объемом 20 мл, содержащего 10 мг/мл вориконазола. Если растворитель не всасывается во флакон под силой вакуума, Вифенд® не используют. Для извлечения точного объема (19,0 мл) воды для инъекций или раствора натрия хлорида 9 мг/мл (0,9 %) для внутривенных инфузий рекомендуется использовать стандартный (неавтоматический) шприц объемом 20 мл. Приготовленный раствор Вифенда® предназначен только для однократного использования, и весь неиспользованный раствор должен быть утилизирован. Можно использовать только прозрачный раствор без видимых частиц.
Для внутривенного введения необходимый объем полученного после растворения концентрата добавляют к совместимому с препаратом рекомендованному раствору для инфузий (см. таблицу ниже) для получения готового раствора вориконазола, содержащего 0,5 — 5 мг/мл действующего вещества.
Необходимые объемы концентрата Вифенда® 10 мг/мл
|
Масса тела (кг) |
Объемы концентрата Вифенда® (10 мг/мл), необходимые для приготовления: |
||||
|
Доза 3мг/кг (количество флаконов) |
Доза 4мг/кг (количество флаконов) |
Доза 6мг/кг (количество флаконов) |
Доза 8мг/кг (количество флаконов) |
Доза 9мг/кг (количество флаконов) |
|
|
10 |
— |
4.0 мл (1) |
— |
8.0 мл (1) |
9.0 мл (1) |
|
15 |
— |
6.0 мл (1) |
— |
12.0 мл (1) |
13.5 мл (1) |
|
20 |
— |
8.0 мл (1) |
— |
16.0 мл (1) |
18.0 мл (1) |
|
25 |
— |
10.0 мл (1) |
— |
20.0 мл (1) |
22.5 мл (2) |
|
30 |
9.0 мл (1) |
12.0 мл (1) |
18.0 мл (1) |
24.0 мл (2) |
27,0 мл (2) |
|
35 |
10.5 мл (1) |
14.0 мл (1) |
21.0 мл (2) |
28.0 мл (2) |
31.5 мл (2) |
|
40 |
12.0 мл (1) |
16.0 мл (1) |
24.0 мл (2) |
32.0 мл (2) |
36.0 мл (2) |
|
45 |
13.5 мл (1) |
18.0 мл (1) |
27.0 мл (2) |
36.0 мл (2) |
40.5 мл (3) |
|
50 |
15.0 мл (1) |
20.0 мл (1) |
30.0 мл (2) |
40.0 мл (2) |
45.0 мл (3) |
|
55 |
16.5 мл (1) |
22.0 мл (2) |
33.0 мл (2) |
44.0 мл (3) |
49.5 мл (3) |
|
60 |
18.0 мл (1) |
24.0 мл (2) |
36.0 мл (2) |
48.0 мл (3) |
54.0 мл (3) |
|
65 |
19.5 мл (1) |
26.0 мл (2) |
39.0 мл (2) |
52.0 мл (3) |
58.5 мл (3) |
|
70 |
21.0 мл (2) |
28.0 мл (2) |
42.0 мл (3) |
— |
— |
|
75 |
22.5 мл (2) |
30.0 мл (2) |
45.0 мл (3) |
— |
— |
|
80 |
24.0 мл (2) |
32.0 мл (2) |
48.0 мл (3) |
— |
— |
|
85 |
25.5 мл (2) |
34.0 мл (2) |
51.0 мл (3) |
— |
— |
|
90 |
27.0 мл (2) |
36.0 мл (2) |
54.0 мл (3) |
— |
— |
|
95 |
28.5 мл (2) |
38.0 мл (2) |
57.0 мл (3) |
— |
— |
|
100 |
30.0 мл (2) |
40.0 мл (2) |
60.0 мл (3) |
— |
— |
Препарат следует вводить немедленно после приготовления раствора. Его можно хранить не более 24 ч при температуре от 2°C до 8°C в том случае, когда раствор был приготовлен в контролируемых асептических условиях.
Концентрат можно разводить следующими растворами:
— 0,9 % раствор хлорида натрия для внутривенного введения
— сложный раствор натрия лактата для внутривенного введения
— 5 % раствор глюкозы и сложный раствор натрия лактата для внутривенного введения
— 5 % раствор глюкозы и 0,45 % раствор натрия хлорида для внутривенного введения
— 5 % раствор глюкозы для внутривенного введения
— 5% раствор глюкозы в 20 мэкв раствора хлорида калия для внутривенного введения
— 0,45 % раствор хлорида натрия для внутривенного введения
— 5 % раствор глюкозы и 0,9 % раствор натрия хлорида для внутривенного введения.
Совместимость Вифенда® с другими растворами помимо указанных выше неизвестна.
Применение у взрослых
Назначение Вифенда® внутривенно следует начинать с установленной насыщающей дозы, чтобы уже в первый день добиться концентрации вориконазола в плазме крови, близкой к равновесной концентрации.
Учитывая высокую биодоступность при приеме внутрь, при наличии клинических показаний можно переходить с внутривенного на пероральное применение препарата и наоборот.
Режим дозирования у взрослых
Насыщающая доза Вифенда® при всех показаниях (первые 24 часа) составляет 6 мг/кг каждые 12 часов.
Поддерживающая доза Вифенда® (через 24 часа после начала лечения) составляет 4 мг/кг два раза в сутки.
Вифенд® рекомендуется вводить со скоростью не более 3 мг/кг/ч в течение
1 — 3 ч.
Продолжительность лечения
Длительность лечения должна быть максимально короткой в зависимости от клинического и микологического ответа пациента. Продолжительное лечение вориконазолом более 180 дней (6 месяцев) требует тщательной оценки соотношения пользы и риска применения препарата.
Коррекция дозы у взрослых
Если больные не могут переносить Вифенд® в дозе 4 мг/кг внутривенно два раза в сутки, необходимо уменьшить дозу до 3 мг/кг два раза в сутки.
В случае применения в целях профилактики
Применение у детей (от 2 до < 12 лет) и подростков младшего возраста с низкой массой тела (от 12 до 14 лет с массой тела < 50 кг)
Назначается в таких же дозах, как и у детей, поскольку у подростков младшего возраста метаболизм вориконазола более схож с метаболизмом у детей, чем у взрослых.
Рекомендуемый режим дозирования следующий:
|
Схема с насыщающей дозой (первые 24 часа) |
9 мг/кг каждые 12 часов |
|
Поддерживающая доза (через 24 часа после начала лечения) |
8 мг/кг два раза в сутки |
Примечание. По результатам популяционного фармакокинетического анализа данных детей с ослабленным иммунитетом в возрасте от 2 до < 12 лет и подростков с ослабленным иммунитетом в возрасте от 12 до < 17 лет.
Рекомендуется начинать терапию с внутривенного введения препарата; возможность перорального приема следует рассматривать только после значительного клинического улучшения. Следует отметить, что воздействие вориконазола при внутривенном введении в дозе 8 мг/кг примерно в два раза выше, чем при пероральном приеме в дозе 9 мг/кг.
Все остальные подростки (от 12 до 14 лет и с массой тела ≥ 50 кг; от 15 до 17 лет, независимо от массы тела)
Вориконазол следует применять как у взрослых.
Коррекция дозы у детей (дети (от 2 до < 12 лет) и подростков младшего возраста с низкой массой тела (от 12 до 14 лет с массой тела < 50 кг))
Если ответ пациента на терапию недостаточен, внутривенная доза может быть увеличена поэтапно на 1 мг/кг. Если пациент не переносит терапию, внутривенную дозу снижают поэтапно на 1 мг/кг.
Применение у детей в возрасте менее 2 — х лет
Безопасность и эффективность Вифенда® у детей в возрасте менее 2 — х лет не установлены. В связи с этим Вифенд® не рекомендуется назначать детям младше 2 — х лет.
Применение препарата у детей в возрасте от 2 до 12 лет с печеночной или почечной недостаточностью не изучалось.
Профилактика у взрослых и детей
Профилактику начинают в день выполнения трансплантации. Ее продолжительность может составлять до 100 дней. Профилактика должна быть как можно более короткой и подбираться в зависимости от оценки риска развития инвазивной грибковой инфекции (ИГИ), о возникновении которой сигнализирует нейтропения или иммуносупрессия. Профилактика может длиться только до 180 дней после трансплантации в случае продолжительной иммуносупрессии или возникновения болезни «трансплантат против хозяина».
Дозировка
Рекомендуемый режим дозирования препарата в целях профилактики аналогичен таковому в целях лечения у соответствующих возрастных групп. Продолжительность профилактики
Безопасность и эффективность вориконазола при применении в течение периода времени, превышающего 180 дней, не были достаточным образом изучены в клинических исследованиях.
В случае применения вориконазола в течение периода времени, превышающего 180 дней (6 месяцев), требуется тщательная оценка соотношения пользы и риска.
В случае применения лечения и профилактики
Коррекция дозы
Если препарат применяется в целях профилактики, то в случае недостаточной эффективности или развития связанных с терапией нежелательных явлений коррекция дозы не рекомендуется. При развитии связанных с терапией нежелательных явлений вориконазол отменяют и назначают альтернативные противогрибковые препараты.
Коррекция дозы в случае одновременного применения с другими лекарственными препаратами
Если поддерживающая доза вориконазола повышена до 5 мг/кг внутривенно два раза в сутки, совместно с ним могут быть назначены рифабутин или фенитоин.
Если поддерживающая доза вориконазола увеличена до 400 мг каждые 12 часов, а доза эфавиренза снижена на 50 %, то есть до 300 мг один раз в сутки, совместно с вориконазолом может быть назначен эфавиренз. После отмены терапии вориконазолом прием эфавиренза возобновляют в начальной дозе.
Применение у пожилых людей
Коррекция дозы у пожилых пациентов не требуется.
Применение у больных с нарушением функции почек
У больных с умеренным или тяжелым нарушением функции почек (клиренс креатинина < 50 мл/мин) происходит накопление вспомогательного компонента препарата — сульфобутилового эфира бета — циклодекстрина (SBECD). Таким больным Вифенд® следует назначать перорально, за исключением тех случаев, когда соотношение риска и пользы оправдывает его внутривенное введение. В подобных ситуациях необходимо регулярно контролировать уровни креатинина в сыворотке крови; в случае его повышения следует обсудить возможность перехода к пероральному приему Вифенда®.
Вориконазол выводится в ходе гемодиализа с клиренсом 121 мл/мин.
Четырехчасовой сеанс гемодиализа не приводит к выведению значительной части дозы вориконазола и не требует ее коррекции. Вспомогательное вещество Вифенда® для внутривенного введения SBECD выводится в ходе гемодиализа с клиренсом 55 мл/мин.
Применение у больных с нарушением функции печени
У больных с легким или умеренным циррозом печени (класс А и В по классификации Чайлда — Пью) рекомендуется назначать cтандартную насыщающую дозу Вифенда®, а поддерживающую дозу снижать в 2 раза.
Вифенд® не изучался у пациентов с тяжелым хроническим циррозом печени (класс С по классификации Чайлда — Пью).
Данные по безопасности Вифенда® у пациентов с отклонением от нормы биохимических показателей функции печени (уровнями аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ) или общего билирубина более чем в 5 раз превосходящими верхнюю границу нормы) представлены в ограниченном объеме.
Применение Вифенда® сопровождалось повышением биохимических показателей функции печени и клиническими признаками поражения печени, например, желтухой, и поэтому больным с выраженным нарушением функции печени Вифенд® следует назначать только в тех случаях, когда ожидаемая польза превышает возможный риск.
У больных с тяжелым нарушением функции печени лечение необходимо проводить под постоянным контролем с целью выявления признаков токсичности препарата.
Побочные действия
При применении Вифенда® зарегистрированы нежелательные эффекты, которые были классифицированы по частоте их проявления следующим образом: очень часто ( 1/10), часто (от ≥ 1/100 до < 1/10), нечасто (от ≥ 1/1000 до < 1/100), редко (от ≥ 1/10 000 до < 1/1000) и неизвестно (невозможно определить по имеющимся данным).
Очень часто
— нарушения зрения (включая нечеткость зрения, хроматопсию и светобоязнь)
— респираторный дистресс
— сыпь
— абдоминальная боль, тошнота, рвота, диарея
— головная боль
— периферический отек
— пирексия
— отклонение от нормы биохимических показателей функции печени (включая АСТ, АЛТ, щелочную фосфатазу, гамма — глутамилтранспептидазу (ГГТ), лактатдегидрогеназу (ЛДГ), билирубин)
Часто
— гастроэнтерит, синусит, гингивит
— агранулоцитоз, тромбоцитопения, анемия, панцитопения
— гиперчувствительность
— судороги, головокружение, тремор, парестезия, гипертонус, сонливость, обморок
— гипогликемия, гипокалиемия, гипонатриемия
— галлюцинации, спутанность сознания, депрессия, возбуждение, тревожность, бессоница
— артериальная гипотензия, флебит
— острый респираторный дистресс — синдром, отек легких
— зуд, макулопапулезная сыпь, алопеция, эксфолиативный дерматит, эритема
— боль в спине
— боль в груди, отек лица,общая слабость, озноб, гриппоподобное заболевание
— повышение уровня креатинина в крови
— кровоизлияние в сетчатку
— брадикардия, тахикардия, наджелудочковая аритмия
— диспепсия, запор, воспалительные процессы в области губ
— желтуха, холестатическая желтуха, гепатит
— острая почечная недостаточность, гематурия
Нечасто
— псевдомембранозный колит, лимфангит
— диссеминированное внутрисосудистое свертывание крови, недостаточность красного костного мозга, лимфаденопатия, эозинофилия, лейкопения
— анафилактоидная реакция
— недостаточность коры надпочечников, гипотиреоз
— отек головного мозга, энцефалопатия, экстрапирамидное расстройство, периферическая нейропатия, атаксия, гипоэстезия, дисгевзия, нистагм
— окулогирный криз, поражение зрительного нерва (включая неврит зрительного нерва), отек диска зрительного нерва, склерит, блефарит, диплопия
— тугоухость, вертиго, шум/звон в ушах
— фибрилляция желудочков, желудочковая экстрасистолия, наджелудочковая тахикардия, желудочковая тахикардия
— тромбофлебит
— панкреатит, дуоденит, глоссит, припухлость языка
— печеночная недостаточность, гепатомегалия, холецистит, холелитиаз
— токсический эпидермальный некролиз, синдром Стивенса — Джонсона, полиморфная эритема, ангионевротический отек, псориаз, крапивница, аллергический дерматит, фототоксичность, макулезная сыпь, папулезная сыпь, пурпура, экзема
— артрит
— некроз почечных канальцев, протеинурия, нефрит
— реакция в месте инъекции
— удлинение интервала QTс на электрокардиограмме, повышение уровня мочевины в крови, повышение уровня холестерина в крови
Редко
— гипертиреоз
— синдром Гийена — Барре, печеночная энцефалопатия
— помутнение роговицы, атрофия зрительного нерва
— полная атриовентрикулярная блокада, блокада ножки пучка Гиса,
многоформная желудочковая пароксизмальная тахикардия типа “пируэт”, узловой ритм
— псевдопорфирия, локальная лекарственная сыпь
Неизвестно
— кожная красная волчанка*
— плоскоклеточная карцинома*
— периостит*
* Нежелательные эффекты, выявленные во время пострегистрационного применения.
Сообщение о подозреваемых нежелательных эффектах
Сообщение сведений о подозреваемых нежелательных эффектах, выявленных после регистрации лекарственного средства, имеет большое значение. Это позволяет продолжать мониторинг соотношения пользы и риска лекарственного средства. Медицинских работников просят сообщать о любых предполагаемых нежелательных реакциях.
Описание отдельных нежелательных реакций
Нарушения зрения
В рамках клинических исследований очень частыми нежелательными явлениями, связанными с вориконазолом, были нарушения зрения. В рамках терапевтических исследований очень частыми нежелательными явлениями, связанными с вориконазолом, были нарушения зрения. В этих исследованиях как при кратковременном, так и при длительном лечении примерно у 21 % пациентов наблюдалось изменение/повышение зрительного восприятия, нечеткое зрение, изменение цветовосприятия или светобоязнь. Эти зрительные нарушения имели преходящий характер и были полностью обратимы, самостоятельно разрешались в большинстве случаев в течение 60 минут и не оставляли после себя каких — либо клинических значимых последствий в отдаленном периоде. При повторном применении вориконазола отмечалось ослабление их выраженности. Нарушения зрения, как правило, были легко выражены, редко требовали прекращения лечения и не приводили к каким — либо последствиям в отдаленном периоде. Нарушения зрения могут быть обусловлены более высокими концентрациями препарата в плазме крови и/или более высокими дозами.
Механизм развития зрительных нарушений неизвестен, хотя, вероятнее всего, их возникновение связано с действием препарата на сетчатку. При изучении влияния вориконазола на функцию сетчатки в исследовании с участием здоровых добровольцев было выявлено снижение амплитуды волн на электроретинограмме (ЭРГ) под действием вориконазола. С помощью ЭРГ измеряют электрический ток в сетчатке. Изменения на ЭРГ не прогрессировали при продолжении терапии в течение 29 дней и полностью исчезали после отмены вориконазола.
В период пострегистрационного применения сообщалось о случаях продолжительных нежелательных явлений со стороны органа зрения.
Кожные реакции
У пациентов, получавших вориконазол в клинических исследованиях, часто отмечались кожные реакции, однако эти пациенты имели серьезные основные заболевания и одновременно принимали другие лекарственные средства. В большинстве случаев сыпь имела легкую или умеренную выраженность. В редких случаях при лечении Вифендом® развивались серьезные кожные реакции, включая синдром Стивенса — Джонсона, токсический эпидермальный некролиз и многоформную эритему.
При появлении сыпи за пациентом следует вести тщательное наблюдение и отменить Вифенд® при прогрессировании поражения кожи. Сообщалось о реакциях светочувствительности, особенно при длительной терапии.
Сообщалось о случаях плоскоклеточного рака кожи у пациентов, получавших Вифенд® в течение длительного времени; механизм возникновения опухоли неизвестен.
Биохимические показатели функции печени
Клинически значимые отклонения от нормы уровней трансаминаз в программе клинического изучения вориконазола наблюдались в общем у 13,5% (258 из 1918) получавших препарат пациентов. Отклонения от нормы биохимических показателей функции печени могут быть связаны с более высокими концентрациями препарата в плазме крови и/или более высокими дозами. В большинстве случаев биохимические показатели функции печени нормализовывались либо при продолжении лечения без изменения дозы, либо после коррекции дозы, в том числе после прекращения терапии. При применении вориконазола имели место нечастые случаи серьезной гепатотоксичности у пациентов с другими серьезными основными заболеваниями. Гепатотоксичность проявлялась в виде желтухи, а также редко в форме гепатита и печеночной недостаточности со смертельным исходом.
Реакции на инфузию
При внутривенном введении вориконазола здоровым добровольцам во время инфузии наблюдались анафилактоидные реакции, включая приливы, лихорадку, потливость, тахикардию, чувство стеснения в груди, одышку, обморочное состояние, тошноту, кожный зуд и сыпь. Эти симптомы появлялись сразу после начала инфузии.
Профилактика побочных эффектов
В ходе открытого сравнительного многоцентрового исследования для сравнения вориконазола и итраконазола как средств первичной профилактики у взрослых и подростков, реципиентов аллогенных ТГСК, ранее не инфицированных подтвержденной или подозреваемой ИГИ, окончательная отмена препарата по причине побочных эффектов была зарегистрирована у 39,3 % пациентов в группе вориконазола по сравнению с 39,6 % пациентов в группе итраконазола. Нежелательные явления со стороны печени, возникшие после начала лечения и требовавшие окончательной отмены препарата исследования, наблюдались у 50 пациентов (21,4 %), получавших вориконазол, и у 18 пациентов (7,1 %), получавших итраконазол.
Пациенты детского возраста
Безопасность вориконазола изучалась у 285 детей в возрасте от 2 до < 12 лет, получавших вориконазол в исследованиях по изучению фармакокинетики (127 детей) и в программах применения незарегистрированного препарата при неэффективности других методов лечения (158 детей). Профиль нежелательных реакций у этих 285 пациентов детского возраста соответствовал профилю нежелательных реакций у взрослых. Данные пострегистрационного наблюдения указывают на то, что у детей кожные реакции (особенно эритема) могут встречаться чаще, чем у взрослых. У 22 пациентов младше 2 лет, получавших вориконазол в программе применения незарегистрированного препарата при неэффективности других методов лечения, наблюдались следующие нежелательные реакции (для которых не может быть исключена связь с вориконазолом): реакция светочувствительности (1), аритмия (1), панкреатит (1), повышение уровня билирубина в крови (1), повышение уровня печеночных ферментов (1), сыпь (1) и отек диска зрительного нерва (1). В пострегистрационном периоде сообщалось о случаях панкреатита у детей.
Противопоказания
— гиперчувствительность к вориконазолу или любым компонентам
препарата
— одновременное применение с субстратами CYP3A4 (терфенадин, астемизол, цизаприда, пимозид или хинидин)
— одновременное применение с сиролимусом
— одновременное применение с рифампицином, карбамазепином и фенобарбиталом
— одновременное применение с эфавирензом в дозах 400 мг или выше один раз в сутки
— одновременное применение с высокими дозами ритонавира в дозах 400 мг и выше два раза в день
— одновременное применение с алкалоидами спорыньи, являющимися субстратами CYP3A4 (эрготамин, дигидроэрготамин)
— одновременное применение с препаратами зверобоя
— детский возраст до 2 — х лет
Лекарственные взаимодействия
Вориконазол метаболизируется под действием изоферментов цитохрома Р — 450 (CYP2C19, CYP2C9 и CYP3A4) и ингибирует их активность. Ингибиторы или индукторы этих изоферментов могут вызвать, соответственно, повышение или снижение концентраций вориконазола в плазме крови, а также существует вероятность повышения вориконазолом плазменных концентраций веществ, метаболизируемых этими изоферментами цитохрома Р — 450.
Вориконазол следует с осторожностью применять с лекарственными средствами, способными удлинять интервал QTс, так как в редких случаях это может приводить к возникновению многоформной желудочковой пароксизмальной тахикардии. Также противопоказано применение вориконазола вместе с веществами, метаболизируемыми изоферментом CYP3A4 (куда относятся некоторые антигистаминные препараты, хинидин, цизаприд, пимозид), концентрации которых в плазме крови он может увеличивать.
Астемизол, цизаприд, пимозид, хинидин и терфенадин (субстраты CYP3A4)
Cоответствующие исследования не проводились. Но повышенные концентрации данных лекарственных средств в плазме крови могут привести к удлинению интервала QTс и, в редких случаях, к возникновению многоформной желудочковой пароксизмальной тахикардии типа “пируэт”. Одновременное их применение противопоказано.
Карбамазепин и барбитураты длительного действия (например, фенобарбитал, мефобарбитал) (мощные индукторы CYP450)
Cоответствующие исследования не проводились. Но карбамазепин и барбитураты длительного действия значительно снижают концентрации вориконазола в плазме крови. Одновременное их применение противопоказано.
Эфавиренз (ингибитор ненуклеозидной обратной транскриптазы (индуктор CYP450; ингибитор и субстрат CYP3A4))
Одновременное применение стандартных доз вориконазола с эфавирензом (400 мг один раз в сутки или выше) противопоказано, поскольку в этих дозах эфавиренз значительно снижает концентрации вориконазола в плазме крови у здоровых пациентов. Вориконазол также значительно повышает концентрации эфавиренза в плазме крови. У здоровых лиц эфавиренз (400 мг один раз в сутки) снижает Cmax и площадь под фармакокинетической кривой на протяжении интервала времени между введением двух доз (AUC) вориконазола (200 мг два раза в сутки*) на 61 % и 77 % соответственно. Вифенд® (200 мг два раза в сутки*) повышает Cmax и AUC эфавиренза (400 мг один раз в сутки) на 38 % и 44 %, соответственно у тех же лиц.
После одновременного назначения Вифенда® (400 мг два раза в сутки*) с эфавирензом (300 мг один раз в сутки) у здоровых лиц AUC вориконазола снижается на 7 % и Cmax повышается на 23 %, по сравнению с терапией Вифендом® 200 мг два раза в сутки. AUC эфавиренза повышается на 17 % и Cmax эквивалентна при сравнении с терапией эфавирензом 600 мг один раз в сутки.
Вифенд® может применяться совместно с эфавирензом, если поддерживающая доза вориконазола повышена до 400 мг два раза в сутки, а доза эфавиренза снижена до 300 мг один раз в сутки. После прекращения терапии вориконазолом возвращаются к применению эфавиренза в начальной дозе.
Алкалоиды спорыньи (например, эрготамин и дигидроэрготамин) (субстраты CYP3A4)
Cоответствующие исследования не проводились. Однако вориконазол может приводить к повышению концентраций алкалоидов спорыньи в плазме крови и, как следствие, к эрготизму. Одновременное их применение противопоказано.
Рифабутин (сильный индуктор CYP450)
Рифабутин (300 мг один раз в сутки) снижает Cmax и AUC вориконазола (200 мг два раза в сутки) на 69 % и 78 % соответственно. При одновременном применении рифабутина (300 мг один раз в сутки) с вориконазолом (350 мг два раза в сутки*) Cmax и AUC вориконазола снижается на 4 % и 32 % соответственно по сравнению с вориконазолом в дозе 200 мг два раза в сутки.
При применении Вифенда® в дозе 400 мг два раза в сутки* и рифабутина в дозе 300 мг один раз в сутки Cmax и AUC вориконазола, соответственно, на 104 % и 87 % выше, чем при терапии Вифендом® в дозе 200 мг два раза в сутки. Вифенд® в дозе 400 мг два раза в сутки* повышает Cmax и AUC рифабутина на 195 % и 331 % соответственно. Если ожидаемая польза от лечения перевешивает риск, рифабутин можно применять одновременно с Вифендом®. Поддерживающая доза вориконазола может быть увеличена до 5 мг/кг внутривенно два раза в сутки.
При одновременном применении рифабутина и вориконазола рекомендуется тщательный контроль показателей общего анализа крови и нежелательных реакций на рифабутин (например, увеита).
Рифампицин (мощный индуктор CYP450)
Рифампицин (600 мг один раз в сутки) снижает Cmax и AUC вориконазола на 93 % и 96 % соответственно. Одновременное применение вориконазола и рифампицина противопоказано.
Ритонавир (ингибитор протеазы) (мощный индуктор CYP450; ингибитор и субстрат CYP3A4)
Ритонавир в дозе 400 мг два раза в сутки снижает Cmax и AUC вориконазола на 66 % и 82 % соответственно, Cmax и AUC ритонавира при этом не меняется. Одновременное применение вориконазола и высоких доз ритонавира (400 мг и выше два раза в сутки) противопоказано.
Ритонавир в дозе 100 мг два раза в сутки* снижает Cmax и AUC вориконазола на 24 % и 39 % соответственно, а Cmax и AUC ритонавира снижается на 25 % и 13 %. Одновременного применения вориконазола и ритонавира в низких дозах (100 мг два раза в сутки) следует избегать, за исключением тех случаев, когда соотношение пользы и риска оправдывает применение вориконазола.
Препараты зверобоя (индукторы CYP450; индукторы P — гликопротеина)
По данным одного независимого исследования при применении препаратов зверобоя (300 мг три раза в сутки) и вориконазола (однократно 400 мг) AUC0- вориконазола снижается на 59 %. Одновременное их применение противопоказано.
Эверолимус (субстрат CYP3A4, субстрат P — гликопротеина)
Несмотря на то, что соответствующие исследования не проводились, вориконазол, вероятно, может существенно увеличивать концентрации эверолимуса в плазме крови. Одновременное применение эверолимуса и вориконазола не рекомендуется, так как вориконазол значительно повышает концентрации эверолимуса.
Флуконазол (ингибитор CYP2C9, CYP2C19 и CYP3A4)
При применении флуконазола (200 мг один раз в сутки) Cmax и AUC вориконазола повышается на 57 % и 79 %, а данные Cmax и AUC флуконазола не установлены. Неизвестно, какое снижение дозы и/или частоты применения вориконазола и флуконазола привело бы к исчезновению данного эффекта. Рекомендуется провести мониторинг нежелательных явлений, связанных с применением Вифенда®, если вориконазол используется непосредственно после флуконазола.
Фенитоин (субстрат CYP2C9 и мощный индуктор CYP450)
Одновременного применения Вифенда® и фенитоина следует избегать за исключением тех случаев, когда ожидаемая польза превышает возможный риск. Рекомендуется тщательный контроль уровня фенитоина в плазме крови.
Фенитоин (300 мг один раз в сутки) снижает Cmax и AUC вориконазола на 49 % и 69 % соответственно. При одновременном применении фенитоина (300 мг один раз в сутки) и Вифенда® (400 мг два раза в сутки*) Cmax и AUC фенитоина повышается на 67 % и 81 % соответственно, Cmax и AUC вориконазола при этом повышается на 34 % и 39 %.
Фенитоин можно применять совместно с Вифендом®, если поддерживающая доза последнего увеличена до 5 мг/кг внутривенно два раза в сутки.
Антикоагулянты
Варфарин (субстрат CYP2C9)
Одновременное применение Вифенда® (300 мг 2 раза в сутки) с варфарином (30 мг однократно) сопровождалось максимальным увеличением протромбинового времени (приблизительно в 2 раза).
Другие пероральные кумарины (например, фенпрокумон, аценокумарол) (субстраты CYP2C9 и CYP3A4)
Cоответствующие исследования не проводились. Однако Вифенд® может вызвать повышение концентраций кумаринов в плазме крови, что может привести к увеличению протромбинового времени.
Рекомендуется тщательный мониторинг протромбинового времени или других соответствующих показателей коагуляции; также необходимо соответствующим образом подбирать дозы антикоагулянтов.
Бензодиазепины (субстраты CYP3A4) (например, мидазолам, триазолам, алпразолам)
Cоответствующие исследования не проводились. Но вориконазол, вероятно, повышает плазменные концентрации бензодиазепинов, метаболизируемых CYP3A4, что, в свою очередь, может привести к длительному седативному эффекту. При одновременном применении этих препаратов рекомендуется обсудить целесообразность снижения дозы бензодиазепинов.
Иммунодепрессанты (субстраты CYP3A4)
Сиролимус
По данным одного независимого исследования при применении сиролимуса в разовой дозе 2 мг Cmax и площадь под фармакокинетической кривой с момента времени 0 до бесконечности (AUC0-) сиролимуса выше в 6,6 раз и 11 раз, соответственно. Одновременное их применение противопоказано.
Циклоспорин
Циклоспорин, у реципиентов со стабильной функцией почечного трансплантата, получающих циклоспорин на протяжении длительного времени повышает Cmax и AUC циклоспорина на 13 % и 70 % соответственно. При назначении Вифенда® пациентам, получающим циклоспорин, рекомендуется уменьшить дозу циклоспорина вдвое и контролировать его уровни в плазме крови. Повышение уровней циклоспорина сопровождается нефротоксичностью. После отмены Вифенда® необходимо контролировать уровни циклоспорина и при необходимости увеличить его дозу.
Такролимус
Вориконазол повышает Cmax и площадь под фармакокинетической кривой с момента времени 0 до первой определяемой концентрации (AUCt) такролимуса (0,1 мг/кг однократно) на 117 % и 221 % соответственно. При назначении Вифенда® больным, получающим такролимус, рекомендуется уменьшить дозу последнего на две трети и контролировать его уровни в плазме крови. Повышение уровня такролимуса сопровождается нефротоксичностью. После отмены Вифенда® необходимо контролировать уровни такролимуса и при необходимости увеличить его дозу.
Опиаты длительного действия (субстраты CYP3A4)
Оксикодон
По данным одного независимого исследования при применении оксикодона в разовой дозе 10 мг Cmax и AUC0- оксикодона выше в 1,7 раза и 3,6 раза, соответственно. Следует рассмотреть возможность снижения дозы оксикодона и других опиатов длительного действия, метаболизируемых CYP3A4 (например, гидрокодона). Может потребоваться частый контроль нежелательных явлений, возникающих при применении опиатов.
Метадон (субстрат CYP3A4)
При применении метадона (32 — 100 мг один раз в сутки) Cmax и AUC R — метадона (активного) выше на 31 % и 47 %, Cmax и AUC S — метадона выше на 65 % и 103 %. Рекомендуется частый контроль нежелательных явлений и выявление признаков токсичности метадона, включая удлинение интервала QTс. Может потребоваться снижение дозы метадона.
Нестероидные противовоспалительные средства (НПВС) (субстраты CYP2C9)
Ибупрофен
При применении ибупрофена (400 мг однократно) Cmax и AUC0- S — ибупрофена выше на 20% и 100%, соответственно.
Диклофенак
При применении диклофенака (50 мг однократно) Cmax и AUC0- диклофенака выше на 114% и 78%, соответственно.
Рекомендуется проведение частого мониторинга нежелательных явлений и признаков токсичности, вызванных НПВС. Может потребоваться снижение дозы НПВС.
Омепразол (ингибитор CYP2C19; субстрат CYP2C19 и CYP3A4)
Омепразол (40 мг один раз в сутки*) повышает Cmax и AUC вориконазола на 15 % и 41 % соответственно и повышает Cmax и AUC омепразола на 116 % и 280 %, соответственно. Коррекция дозы Вифенда® не рекомендуется. При назначении Вифенда® больным, получающим омепразол в дозах 40 мг или выше, дозу последнего рекомендуется снизить вдвое. Вифенд® может также ингибировать метаболизм других ингибиторов протонного насоса, которые являются субстратами CYP2C19, что может привести к повышению концентраций этих лекарственных средств в плазме крови.
Пероральные контрацептивы* (субстраты CYP3A4; ингибиторы CYP2C19)
Норэтистерон и этинилэстрадиол
Одновременное назначение Вифенда® и орального контрацептива (1 мг норэтистерона и 0,035 мг этинилэстрадиола один раз в сутки) у здоровых женщин приводит к повышению Cmax и AUC этинилэстрадиола (36 % и 61 % соответственно), норэтистерона (15 % и 53 % соответственно) и вориконазола (14 % и 46 % соответственно). Необходим мониторинг нежелательных явлений, связанных с применением вориконазола и оральных контрацептивов.
Опиаты короткого действия (субстраты CYP3A4)
Альфетанил
По данным одного независимого исследования одновременное применение Вифенда® и альфетанила (20 мкг/кг однократно при одновременном применении с налоксоном) повышает AUC0- альфетанила в 6 раз.
Фентанил
По данным одного независимого исследования при применении фентанила в разовой дозе 5 мкг/кг AUC0- фентанила выше в 1,34 раза.
Следует рассмотреть возможность снижения дозы альфентанила, фентанила и других опиатов короткого действия, подобных по структуре альфентанилу и метаболизируемых CYP3A4 (например, суфентанила). Рекомендуется проводить расширенный и частый контроль с целью выявления признаков угнетения дыхательной функции и других нежелательных явлений, связанных с применением опиатов.
Статины (субстраты CYP3A4)
Ловастатин
Cоответствующие клинические исследования не проводились. Вориконазол, вероятно, повышает плазменные концентрации статинов, метаболизируемых CYP3A4, что, в свою очередь, может привести к рабдомиолизу. Следует рассмотреть необходимость снижения дозы статинов.
Препараты сульфонилмочевины (субстраты CYP2C9) (например, толбутамид, глипизид и глибурид)
Cоответствующие клинические исследования не проводились. Вориконазол, вероятно, повышает концентрации препаратов сульфонилмочевины в плазме крови и вызывает гипогликемию. При одновременном их применении необходимо тщательно контролировать уровни глюкозы в крови, а также следует рассмотреть необходимость снижения дозы препаратов сульфонилмочевины.
Алкалоиды барвинка (субстраты CYP3A4) (например, винкристин и винбластин)
Cоответствующие исследования не проводились. Вориконазол, вероятно, повышает концентрации алкалоидов барвинка в плазме крови и вызывает нейротоксичность. Рекомендуется обсудить целесообразность снижения дозы алкалоидов барвинка.
Другие ингибиторы ВИЧ протеазы (субстраты и ингибиторы CYP3A4) (например, саквинавир, ампренавир и нелфинавир)*
Cоответствующие клинические исследования не проводились. Результаты исследований in vitro указывают на то, что вориконазол может ингибировать метаболизм ингибиторов ВИЧ протеазы, а ингибиторы ВИЧ протеазы, в свою очередь, могут ингибировать метаболизм вориконазола. Может потребоваться тщательное наблюдение с целью выявления признаков лекарственной токсичности и/или отсутствия эффективности препарата, а также коррекция дозы.
Другие ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ) (субстраты CYP3A4, ингибиторы или индукторы CYP450) (например, делавирдин, невирапин)*
Cоответствующие клинические исследования не проводились. Результаты исследований in vitro указывают на то, что ННИОТ могут ингибировать метаболизм вориконазола, а вориконазол может ингибировать метаболизм ННИОТ.
Данные о влиянии эфавиренза на вориконазол позволяют сделать вывод о том, что метаболизм вориконазола может усиливаться под действием ННИОТ. Может потребоваться тщательное наблюдение с целью выявления признаков лекарственной токсичности и/или отсутствия эффективности препарата, а также коррекция дозы.
Циметидин (неспецифический ингибитор CYP450, повышает pH желудочного содержимого)
Циметидин в дозе 400 мг два раза в сутки повышает Cmax и AUC вориконазола на 18 % и 23 %, соответственно. При этом коррекция дозы не требуется.
Дигоксин (субстрат P — гликопротеина)
Вифенд® не оказывает существенного влияния на Cmax и AUC дигоксина (0,25 мг один раз в сутки). Коррекция дозы не требуется.
Индинавир (ингибитор и субстрат CYP3A4)
Индинавир (800 мг три раза в сутки) не оказывает существенного влияния на Cmax и AUC вориконазола. Вифенд® существенно не влияет на Cmax и AUC индинавира (800 мг 3 раза в сутки). Коррекция дозы не требуется.
Макролидные антибиотики
Эритромицин (ингибитор CYP3A4)
Эритромицин (1 г два раза в сутки) и азитромицин (500 мг один раз в сутки) не оказывают существенного влияния на Cmax и AUC вориконазола. Воздействие вориконазола на эритромицин или азитромицин неизвестно. Коррекция дозы не требуется.
Микофеноловая кислота (субстрат УДФ — глюкуронилтрансферазы)
Вифенд® не оказывает влияния на Cmax и AUCt микофеноловой кислоты (1 г однократно). Коррекция дозы не требуется.
Преднизолон (субстрат CYP3A4)
Вифенд® повышает Cmax и AUC0- преднизолона (60 мг однократно) на 11 % и 34 % соответственно. Коррекция дозы не рекомендуется.
Ранитидин (повышает pH желудочного содержимого)
Ранитидин (150 мг два раза в сутки) не оказывает влияния на Cmax и AUC вориконазола. Коррекция дозы не рекомендуется.
* указывает на двустороннее взаимодействие
Особые указания
Гиперчувствительность
Вифенд® с осторожностью должен назначаться больным с гиперчувствительностью к другим азольным препаратам.
Продолжительность терапии
Длительность лечения Вифенда® для внутривенного введения не должна превышать 6 месяцев.
Сердечно — сосудистые нарушения
Применение Вифенда® связано с удлинением интервала QTс на электрокардиограмме, что сопровождается редкими случаями многоформной желудочковой пароксизмальной тахикардии типа “пируэт” у пациентов с факторами риска, такими как кардиотоксическая химиотерапия в анамнезе, кардиомиопатия, гипокалиемия и сопутствующая терапия препаратами, которые могли способствовать развитию данного осложнения.
Пациентам со следующими потенциально проаритмическими состояниями Вифенд® должен назначаться с осторожностью:
— врожденное или приобретенное удлинение интервала QTс
— кардиомиопатия, в особенности при наличии сердечной недостаточности
— синусовая брадикардия
— существующие аритмии с клиническими симптомами
— одновременное применение лекарственных средств с установленной способностью удлинять интервал QTс. При необходимости до начала и во время терапии вориконазолом следует выявлять и корректировать такие электролитные нарушения как гипокалиемия, гипомагниемия, гипокальциемия.
Было проведено исследование с участием здоровых добровольцев, в котором оценивали влияние на длительность интервала QTc однократных доз вориконазола вплоть до доз, в 4 раза превышающих стандартные суточные дозы. Случаев удлинения интервала выше потенциально клинически значимого порогового значения 500 мсек выявлено не было.
Реакции на инфузию
При применении Вифенда® наблюдались реакции на инфузию, главным образом приливы и тошнота. С учетом степени тяжести симптомов следует рассмотреть возможность прекращения лечения.
Гепатотоксичность
При лечении Вифендом® наблюдаются нечастые случаи серьезных реакций со стороны печени (включая клинически проявляющийся гепатит, холестаз и фульминантную печеночную недостаточность, в том числе с летальным исходом). Нежелательные явления со стороны печени в основном наблюдаются у пациентов с серьезными основными заболеваниями (главным образом, гемобластозами). У пациентов, не имеющих других выявленных факторов риска, наблюдаются преходящие реакции со стороны печени, включая гепатит и желтуху. Функция печени обычно восстанавливается после прекращения терапии.
Мониторинг функции печени
За пациентами, получающими Вифенд®, следует вести тщательное наблюдение с целью выявления признаков гепатотоксичности. Клиническое наблюдение должно включать лабораторную оценку функции печени (в частности, определение уровня АСТ и АЛТ) в начале лечения Вифендом® и по меньшей мере еженедельно в течение первого месяца терапии. Длительность лечения должна быть максимально короткой, однако, если после оценки пользы и риска терапия продолжается, при отсутствии изменений биохимических показателей функции печени частота обследования может быть уменьшена до одного раза в месяц.
При существенном повышении биохимических показателей функции печени Вифенд® следует отменить, если только по заключению врача соотношение риска и пользы лечения у пациента не оправдывает продолжение его приема.
Мониторинг функции печени следует осуществлять как у детей, так и у взрослых.
Нежелательные явления со стороны зрения
Сообщалось о случаях длительно сохранявшихся нежелательных реакций со стороны органа зрения, включая нечеткое зрение, неврит зрительного нерва и отек диска зрительного нерва.
Нежелательные явления со стороны почек
У тяжелых больных, получающих Вифенд®, наблюдали случаи развития острой почечной недостаточности. Пациенты, получающие вориконазол, могут принимать и другие нефротоксичные лекарственные средства и иметь сопутствующие заболевания, что может приводить к снижению функции почек.
Мониторинг функции почек
Пациентов следует наблюдать с целью выявления признаков нарушения функции почек. Для этого необходимо проводить лабораторные исследования, в частности, определять сывороточный уровень креатинина.
Мониторинг функции поджелудочной железы
За пациентами, особенно детского возраста, с факторами риска острого панкреатита (например, химиотерапия в недавнем прошлом, трансплантация гемопоэтических стволовых клеток (ТГСК)) при терапии Вифендом® следует вести тщательное наблюдение. В такой клинической ситуации может рассматриваться возможность контроля уровня сывороточной амилазы или липазы.
Нежелательные явления со стороны кожи
У пациентов на фоне лечения Вифендом® редко развивались эксфолиативные кожные реакции, такие как синдром Стивенса — Джонсона. При появлении сыпи за пациентом следует вести тщательное наблюдение и отменить Вифенд® при прогрессировании поражения кожи.
Кроме того, применение Вифенда® сопровождалось развитием фототоксических реакций и псевдопорфирии. При терапии Вифендом® всем пациентам, включая детей, рекомендуется избегать воздействия прямых солнечных лучей и применять защитные меры в виде ношения защитной одежды и использования солнцезащитных средств с высоким коэффициентом защиты от солнечных лучей (SPF).
Длительное лечение
При длительном применении Вифенда® (в целях терапии или профилактики) в течение более 180 дней (6 месяцев) необходимо тщательно оценивать соотношение риска и пользы. В связи с этим, врачам следует рассмотреть целесообразность ограничения продолжительности применения препарата. При длительной терапии Вифендом® сообщалось о развитии следующих тяжелых нежелательных явлений:
Плоскоклеточный рак кожи (ПРК)
Сообщалось о развитии у пациентов ПРК, при этом у некоторых из них в анамнезе наблюдались фототоксические реакции. В случае развития фототоксических реакций следует обратиться за консультацией к врачам других специальностей и направить пациента к дерматологу. Терапию Вифендом® отменяют и назначают альтернативные противогрибковые препараты. Во всех случаях продолжения терапии Вифендом®, несмотря на возникновение поражений, обусловленных фототоксическими реакциями, следует регулярно проводить дерматологическое обследование для раннего выявления и лечения предраковых заболеваний кожи. При выявлении предраковых заболеваний или плоскоклеточного рака кожи Вифенд® следует отменить.
Неинфекционный периостит с повышением уровня фтористых соединений и щелочной фосфатазы
У пациентов, перенесших трансплантацию, сообщалось о развитии неинфекционного периостита с повышением уровня фтористых соединений и щелочной фосфатазы. Если у пациента развивается боли в костях и рентгенологические признаки периостита после консультации с врачами другого профиля, терапию Вифендом® прекращают.
Пациенты детского возраста
Безопасность и эффективность препарата у детей младше 2 — х лет не установлена. Вориконазол назначают детям в возрасте от двух лет и старше. Следует контролировать функцию печени у детей также как и у взрослых. При пероральном применении биодоступность препарата у детей в возрасте от 2 до < 12 лет с мальабсорбцией и очень низкой относительно возрастной нормы массой тела может быть снижена. В таких случаях рекомендуется внутривенное введение вориконазола.
Частота развития реакций фототоксичности у детей выше. Учитывая возможность развития ПРК, в этой популяции пациентов оправдано применение строгих мер по защите от воздействия ультрафиолетового облучения. При развитии у детей явлений, связанных с фотостарением кожи, таких как лентигиноз или веснушки, даже после прекращения терапии рекомендуется избегать воздействия ультрафиолетового облучения и продолжать последующее дерматологическое наблюдение.
Профилактика побочных эффектов
При возникновении связанных с применением Вифенда® нежелательных явлений (гепатотоксичность, тяжелые кожные реакции, включая фототоксичность и ПРК, тяжелые или длительные нарушения зрения и периостит) следует рассмотреть целесообразность отмены вориконазола и применения альтернативных противогрибковых препаратов.
Содержание натрия
В каждом флаконе Вифенда® содержится 217,6 мг натрия. Это следует учитывать при назначении препарата пациентам, соблюдающим диету с ограничением употребления натрия.
Беременность и период лактации
Адекватной информации о применении Вифенда® у беременных женщин нет. Вифенд® не следует применять у беременных женщин за исключением тех случаев, когда ожидаемая польза для матери явно перевешивает возможный риск для плода. Выведение Вифенда® с грудным молоком не изучалось.
В начале лечения Вифендом® кормление грудью необходимо прекратить.
Женщины репродуктивного возраста во время лечения должны постоянно пользоваться эффективными методами контрацепции.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Вифенд® может вызвать преходящие и обратимые нарушения зрения, включая нечеткость зрения, нарушение/усиление зрительного восприятия и/или светобоязнь. При наличии таких симптомов пациенты должны избегать выполнения потенциально опасных действий как, например, управления автотранспортными средствами или работы с механизмами.
Передозировка
Симптомы: усиление побочных реакций.
Лечение: антидот Вифенда® неизвестен. В случае передозировки показана симптоматическая и поддерживающая терапия.
Вифенд® выводится при гемодиализе с клиренсом 121 мл/мин. Сульфобутиловый эфир бета — циклодекстрина натрия (SBECD) также диализируется с клиренсом 55 мл/мин. В случае передозировки гемодиализ может способствовать выведению вориконазола и SBECD из организма.
Есть сообщения о трех случаях неумышленной передозировки в ходе клинических исследований. Все случаи наблюдались у детей, получивших вориконазол внутривенно в дозе, в пять раз превышавшей рекомендованную. Единственной нежелательной реакцией была светобоязнь длительностью 10 минут.
Форма выпуска и упаковка
Препарат помещают во флаконы из прозрачного бесцветного стекла типа I по ЕФ* вместимостью 30 мл, укупоренные серыми силиконизированными полимерными хлорбутилизопреновыми пробками, обжатые алюминиевыми уплотнительными кольцами с дисками из полипропилена типа «flip — off».
По 1 флакону вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Условия хранения
Хранить при температуре не выше 25 ºС. Приготовленный раствор хранят при температуре от 2 до 8 ºC не более 24 часов.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не использовать после истечения срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Фармация и Апджон Кампани
7000 Портейдж Роуд
Каламазу, МИ 49001
США
Упаковщик
Фарева Амбуаз
Зона Индустриале, 29 роут дес Индастриес
37530 Поце Сур Циссе
Франция
Владелец регистрационного удостоверения
Пфайзер Эйч Си Пи Корпорэйшн, США
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара):
Представительство компании «Пфайзер Эйч Си Пи Корпорэйшн» (США) г.Алматы, пр. Абылай хана, 141
тел. (727) 272 — 27 — 01, 250 — 09 — 16
факс (727) 272 — 04 — 06
| 013637451477976668_ru.doc | 310 кб |
| 221280661477977823_kz.doc | 342 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Вифенд® (Vifend®)
💊 Состав препарата Вифенд®
✅ Применение препарата Вифенд®
Описание активных компонентов препарата
Вифенд®
(Vifend®)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.11.16
Владелец регистрационного удостоверения:
Код ATX:
J02AC03
(Вориконазол)
Лекарственная форма
| Вифенд® |
Лиофилизат д/пригот. р-ра д/инф. 200 мг/3.4 г: фл. 1 шт. рег. №: П N015539/01 |
Форма выпуска, упаковка и состав
препарата Вифенд®
Лиофилизат для приготовления раствора для инфузий белого цвета; .
Вспомогательные вещества: натриевая соль сульфобутилового эфира бета-циклодекстрина (SBECD).
3.4 г — флаконы бесцветного стекла (1) — пачки картонные.
Фармакологическое действие
Противогрибковое средство, производное триазола. Механизм действия связан с ингибированием деметилирования 14α-стерола, опосредованного грибковым цитохромом P450, эта реакция является ключевым этапом биосинтеза эргостерола.
In vitro вориконазол обладает широким спектром противогрибкового действия, активен в отношении Candida spp. (включая штаммы Candida krusei, устойчивые к флуконазолу, и резистентные штаммы Candida glabrata и Candida albicans) и обладает фунгицидным эффектом в отношении всех изученных штаммов Aspergillus spp., а также патогенных грибов, ставших актуальными в последнее время, включая Scedosporium или Fusarium, которые в ограниченной степени чувствительны к противогрибковым средствам.
Клиническая эффективность вориконазола была продемонстрирована при инфекциях, вызванных Aspergillus spp. (включая Aspergillus flavus, Aspergillus fumigatus, Aspergillus terreus, Aspergillus niger, Aspergillus nidulans), Candida spp. (включая штаммы Candida albicans, Candida dubliniensis, Candida glabrata, Candida inconspicua, Candida krusei, Candida parapsilosis, Candida tropicalis и Candida guillermondii), Scedosporium spp. (включая Scedosporium apiospermum /Pseudoallescheria boydii/, Scedosporium prolifecans) и Fusarium spp.
Другие грибковые инфекции, при которых наблюдался частичный или полный противогрибковый эффект, включали отдельные случаи инфекций, вызванных Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidoides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp. (включая Penicillium marneffei), Philaphora richardsiae, Scopulariopsis brevicaulis и Trychosporon spp. (включая Trychosporon beigelii).
In vitro продемонстрирована активность вориконазола в отношении клинических штаммов Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp., Histoplasma capsulatum. Рост большинства штаммов подавлялся при концентрациях вориконазола от 0.05 до 2 мкг/мл.
In vitro выявлена активность вориконазола в отношении Curvularia spp. и Sporothrix spp., однако клиническое значение ее неизвестно.
Фармакокинетика
Фармакокинетические параметры вориконазола характеризуются значительной межиндивидуальной вариабельностью.
Фармакокинетика вориконазола является нелинейной за счет насыщения его метаболизма. При повышении дозы наблюдается непропорциональное (более выраженное) увеличение AUC. Увеличение дозы с 200 мг 2 раза/сут до 300 мг 2 раза/сут приводит к увеличению AUC в среднем в 2.5 раза. При в/в введении или приеме внутрь ударных доз концентрации в плазме приближаются к равновесным в течение первых 24 ч. При кратности применения 2 раза/сут в средних (не в ударных) дозах происходит кумуляция активного вещества, а Css достигаются в большинстве случаев к 6 дню.
Вориконазол быстро и практически полностью всасывается после приема внутрь; Cmax в плазме крови достигается через 1-2 ч после приема. Биодоступность вориконазола при приеме внутрь составляет 96%, при повторном приеме с пищей с большим содержанием жиров Cmax и AUC снижаются на 34% и 24% соответственно. Всасывание вориконазола не зависит от рН желудочного сока.
Расчетный Vd вориконазола в равновесном состоянии составляет 4.6 л/кг, что указывает на активное распределение вориконазола в ткани. Связывание с белками плазмы составляет 58%.
Вориконазол проникает через ГЭБ и определяется в спинномозговой жидкости.
По данным исследований in vitro установлено, что вориконазол метаболизируется при участии печеночных изоферментов CYP2C19, CYP2C9, CYP3A4, при этом CYP2C19 играет важную роль в метаболизме вориконазола. Этот фермент проявляет выраженный генетический полиморфизм, в связи с чем сниженный метаболизм вориконазола возможен у 15-20% пациентов азиатского происхождения и у 3-5% европейцев и чернокожих. Исследования у представителей европеоидной расы и японцев показали, что у пациентов с пониженным метаболизмом AUC вориконазола в среднем в 4 раза выше, чем у гомозиготных пациентов с высоким метаболизмом. У гетерозиготных пациентов с активным метаболизмом AUC вориконазола в среднем в 2 раза выше, чем у гомозиготных.
Основным метаболитом вориконазола является N-оксид (72% среди циркулирующих в плазме метаболитов, меченных радиоактивной меткой). Этот метаболит обладает минимальной противогрибковой активностью.
В неизмененном виде с мочой выводится менее 2%.
После повторного приема внутрь или в/в введения в моче обнаруживается примерно 83% и 80% дозы (меченной радиоактивной меткой) соответственно. Большая часть (>94%) общей дозы выводится в течение первых 96 ч после приема внутрь и в/в введения.
T1/2 вориконазола в терминальной фазе зависит от дозы и составляет примерно 6 ч при приеме препарата внутрь в дозе 200 мг. В связи с нелинейностью фармакокинетики величина T1/2 не позволяет предсказать кумуляцию или выведение вориконазола.
Фармакокинетика в особых клинических случаях
При повторном приеме внутрь Cmax и AUC у здоровых молодых женщин были на 83% и 113% соответственно выше, чем у здоровых молодых мужчин (18-45 лет). Значимых различий Cmax и AUC у здоровых пожилых мужчин и здоровых пожилых женщин (≥ 65 лет) нет.
При повторном приеме вориконазола внутрь Cmax и AUC у здоровых пожилых мужчин (≥ 65 лет) на 61% и 86% соответственно выше, чем у здоровых молодых мужчин (18-45 лет).
Средние Css в плазме у детей, получающих вориконазол в дозе 4 мг/кг каждые 12 ч, сопоставимы с таковыми у взрослых, получающих вориконазол в дозе 3 мг/кг каждые 12 ч. Средняя концентрация была 1186 нг/мл у детей и 1155 нг/мл у взрослых. В связи с этим рекомендуемая поддерживающая доза у детей в возрасте от 2 до 12 лет составляет 4 мг/кг каждые 12 ч.
При однократном приеме вориконазола внутрь в дозе 200 мг у пациентов с нормальной функцией почек и пациентов от легких (КК 41-60 мл/мин) до тяжелых (КК менее 20 мл/мин) нарушений функции почек фармакокинетика вориконазола существенно не зависит от степени нарушений. Связывание с белками плазмы сходно у больных с различной степенью почечной недостаточности.
После однократного приема внутрь в дозе 200 мг AUC вориконазола у пациентов с легкой или умеренно выраженной степенью тяжести цирроза печени (классы А и В по шкале Чайлд-Пью) на 233% выше, чем у пациентов с нормальной функцией печени. Нарушение функции печени не влияет на связывание вориконазола с белками плазмы.
При повторном приеме внутрь AUC вориконазола сопоставима у больных с умеренно выраженным циррозом печени (класс В по шкале Чайлд-Пью), получавших поддерживающую дозу 100 мг 2 раза/сут, и у пациентов с нормальной функцией печени, получавших вориконазол в дозе 200 мг 2 раза/сут.
Показания активных веществ препарата
Вифенд®
Инвазивный аспергиллез; тяжелые инвазивные формы кандидозных инфекций (включая Candida krusei); кандидоз пищевода; тяжелые грибковые инфекции, вызванные Scedosporium spp. и Fusarium spp.; тяжелые грибковые инфекции при непереносимости или рефрактерности к другим лекарственным средствам; профилактика прорывных грибковых инфекций у пациентов с лихорадкой из групп высокого риска (реципиенты аллогенного костного мозга, больные с рецидивом лейкоза).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Применяют внутрь или парентерально в виде инфузии.
Дозу устанавливают индивидуально, в зависимости от показаний, возраста и массы тела пациента, схемы лечения.
Побочное действие
Со стороны организма в целом: очень часто – лихорадка, периферические отеки; часто – ознобы, астения, боль в груди, реакции и воспаление в месте инъекции, гриппоподобный синдром.
Со стороны сердечно-сосудистой системы: часто – снижение АД, тромбофлебит, флебит; редко – предсердные аритмии, брадикардия, тахикардия, желудочковые аритмии; очень редко – наджелудочковая тахикардия, полная AV-блокада, блокада ножки пучка Гиса, узловые аритмии, желудочковая тахикардия (включая трепетание желудочков), удлинение интервала QT, фибрилляция желудочков.
Со стороны пищеварительной системы: очень часто – тошнота, рвота, диарея, боли в животе; часто – повышение активности АЛТ, АСТ, ЩФ, ЛДГ, ГГТ и уровня билирубина в плазме крови, желтуха, хейлит, холестаз; редко – холецистит, холелитиаз, запор, дуоденит, диспепсия, увеличение печени, гингивит, глоссит, гепатит, печеночная недостаточность, панкреатит, отек языка, перитонит; очень редко – псевдомембранозный колит, печеночная кома. У пациентов с серьезными основными заболеваниями (злокачественные гематологические заболевания) на фоне применения вориконазола редко отмечались случаи тяжелой гепатотоксичности (случаи желтухи, гепатита, гепатоцеллюлярной недостаточности, приводящей к смерти).
Со стороны эндокринной системы: редко – недостаточность коры надпочечников; очень редко – гипертиреоз, гипотиреоз.
Аллергические реакции: редко – токсический эпидермальный некролиз, синдром Стивенса-Джонсона, крапивница; очень редко – ангионевротический отек, многоформная эритема. При в/в инфузии описаны анафилактоидные реакции, включающие приливы, лихорадку, потливость, тахикардию, чувство стеснения в груди, одышку, обморочные состояния, зуд, сыпь.
Со стороны системы кроветворения: часто – тромбоцитопения, анемия (в т.ч. макроцитарная, микроцитарная, нормоцитарная, мегалобластная, апластическая), лейкопения, панцитопения; редко – лимфаденопатия, агранулоцитоз, эозинофилия, синдром диссеминированного внутрисосудистого свертывания, угнетение костномозгового кроветворения; очень редко – лимфангит.
Со стороны обмена веществ: часто – гипокалиемия, гипогликемия; редко – гипохолестеринемия.
Со стороны костно-мышечной системы: часто — боль в спине; редко – артрит.
Со стороны ЦНС и периферической нервной системы: очень часто – головная боль; часто – головокружение, галлюцинации, спутанность сознания, депрессия, тревога, тремор, ажитация, парестезии; редко – атаксия, отек головного мозга, внутричерепная гипертензия, гипестезия, нистагм, головокружение, обморок; очень редко – синдром Гийена-Барре, окуломоторный криз, эсктрапирамидный синдром.
Со стороны дыхательной системы: часто – респираторный дистресс-синдром, отек легких, синусит.
Дерматологические реакции: очень часто – сыпь; часто – зуд, макуло-папулезная сыпь, фотосенсибилизация, алопеция, эксфолиативный дерматит, отек лица, пурпура; редко – псориаз; очень редко – дискоидная красная волчанка.
Со стороны органов чувств: часто — зрительные нарушения (включая нарушение/усиление зрительного восприятия, туман перед глазами, изменение цветового восприятия, фотофобия); редко – блефарит, неврит зрительного нерва, отек соска зрительного нерва, склерит, нарушение вкусового восприятия, диплопия; очень редко – кровоизлияние в сетчатку, помутнение роговицы, атрофия зрительного нерва.
Со стороны мочевыделительной системы: часто – повышение уровня креатинина в сыворотке крови, острая почечная недостаточность, гематурия; редко – повышение остаточного азота мочевины, альбуминурия, нефрит; очень редко – некроз почечных канальцев.
Противопоказания к применению
Одновременный прием лекарственных средств – субстратов CYP3A4 – терфенадина, астемизола, цизаприда, пимозида и хинидина; одновременный прием сиролимуса; одновременный прием рифампицина, карбамазепина и длительно действующих барбитуратов; одновременный прием ритонавира; одновременный прием эфавиренза; одновременный прием алкалоидов спорыньи (эрготамина, дигидроэрготамина); повышенная чувствительность к вориконазолу.
Применение при беременности и кормлении грудью
Адекватных и строго контролируемых исследований по безопасности применения вориконазола при беременности не проводилось. В экспериментальных исследованиях на животных установлено, что вориконазол в высоких дозах оказывает токсическое действие на репродуктивную функцию. Возможный риск для человека не известен.
Выведение вориконазола с грудным молоком не изучалось.
Вориконазол не следует применять при беременности и в период лактации, за исключением тех случаев, когда ожидаемая польза для матери превышает потенциальный риск для плода или грудного ребенка.
В период лечения женщины репродуктивного возраста должны пользоваться надежными методами контрацепции.
Применение при нарушениях функции печени
С осторожностью применять у пациентов с тяжелой печеночной недостаточностью. В период лечения следует регулярно контролировать функцию печени (при появлении клинических признаков заболевания печени следует обсудить целесообразность прекращения терапии).
Применение при нарушениях функции почек
С осторожностью применять у пациентов с тяжелой почечной недостаточностью (при парентеральном введении). В период лечения следует регулярно контролировать функцию почек (в т.ч. уровень креатинина в сыворотке крови).
Применение у детей
Безопасность и эффективность применения вориконазола у детей младше 2 лет не установлены.
Особые указания
С осторожностью применять у пациентов с тяжелой печеночной недостаточностью, с тяжелой почечной недостаточностью (при парентеральном введении), а также при повышенной чувствительности к другим лекарственным средствам – производным азолов.
Перед началом лечения требуется коррекция электролитных нарушений (гипокалиемии, гипомагниемии и гипокальциемии).
Забор проб для культурального и других лабораторных исследований (серологических, гистопатологических) с целью выделения и идентификации возбудителей следует производить до начала лечения. Терапию можно начать до получения результатов лабораторных исследований, а затем, при необходимости, скорректировать.
Применение вориконазола может приводить к удлинению интервала QT на ЭКГ, что сопровождается редкими случаями мерцания-трепетания желудочков у пациентов со множественными факторами риска (кардиотоксическая химиотерапия, кардиомиопатия, гипокалиемия и сопутствующая терапия, которая могла способствовать развитию нежелательных явлений со стороны сердечно-сосудистой системы). У пациентов с данными потенциально проаритмическими состояниями вориконазол следует применять с осторожностью.
В период лечения следует регулярно контролировать функцию печени (при появлении клинических признаков заболевания печени следует обсудить целесообразность прекращения терапии), функцию почек (в т.ч. уровень креатинина в сыворотке крови).
При прогрессировании дерматологических реакций препарат следует отменить.
В период лечения пациенты, получающие вориконазол, должны избегать пребывания на солнце и УФ-облучения.
При одновременном применении вориконазола у пациентов, получающих циклоспорин и такролимус, следует провести коррекцию дозы последних и контролировать их концентрацию в плазме. После отмены вориконазола следует оценить концентрацию циклоспорина и такролимуса в плазме и при необходимости повысить их дозу.
При необходимости совместного применения вориконазола и фенитоина следует тщательно оценить предполагаемую пользу и потенциальный риск комбинированной терапии и постоянно мониторировать уровень фенитоина.
При необходимости совместного применения вориконазола и рифабутина следует тщательно оценить предполагаемую пользу и потенциальный риск от комбинированной терапии и проводить ее под контролем картины периферической крови, а также других возможных нежелательных эффектов рифабутина.
Безопасность и эффективность применения вориконазола у детей младше 2 лет не установлены.
Влияние на способность к управлению транспортными средствами и механизмами
Поскольку вориконазол может вызвать преходящие нарушения зрения, включая затуманивание зрения, нарушение/усиление зрительного восприятия и/или фотофобию, то при появлении таких реакций пациенты не должны заниматься потенциально опасными видами деятельности, такими как, например, управление автомобилем или использование сложной техники. На фоне применения вориконазола пациенты не должны водить автомобиль в темное время суток.
Лекарственное взаимодействие
Вориконазол метаболизируется при участии изоферментов CYP2C19, CYP2C9 и CYP3A4. Ингибиторы или индукторы этих изоферментов могут вызвать, соответственно, повышение или снижение концентраций вориконазола в плазме.
При одновременном применении с рифампицином (индуктор изоферментов CYP) в дозе 600 мг/сут Cmax и AUC вориконазола снижаются на 93% и 96% соответственно (комбинация противопоказана).
При одновременном применении с вориконазолом, ритонавир (индуктор изоферментов CYP, ингибитор и субстрат CYP3A4) в дозе 400 мг каждые 12 ч снижал Cmax в равновесном состоянии и AUC вориконазола, принимаемого внутрь, в среднем на 66% и 82% соответственно. Эффект более низких доз ритонавира на концентрации вориконазола пока не известен. Установлено, что повторное применение вориконазола внутрь не оказывает выраженного эффекта на Cmax в равновесном состоянии и AUC ритонавира, также принимаемого повторно (одновременное применение вориконазола и ритонавира в дозе 400 мг каждые 12 ч противопоказано).
При совместном применении с мощными индукторами изоферментов CYP карбамазепином или длительно действующими барбитуратами (фенобарбиталом) возможно значительное снижение Cmax вориконазола в плазме, хотя их взаимодействие не изучалось. Такая комбинация противопоказана.
При совместном применении с циметидином (неспецифический ингибитор изоферментов изоферментов CYP) в дозе 400 мг 2 раза/сут Cmax и AUC вориконазола повышаются на 18% и 23% соответственно (коррекции дозы вориконазола не требуется).
Вориконазол ингибирует активность CYP2C19, CYP2C9, CYP3A4, поэтому возможно повышение концентраций в плазме лекарственных средств, которые метаболизируются этими изоферментами.
При одновременном применении вориконазола с терфенадином, астемизолом, цизапридом, пимозидом и хинидином возможно значительное повышение их концентрации в плазме, что может привести к удлинению интервала QT и в редких случаях к развитию мерцания/трепетания желудочков (комбинация противопоказана).
При совместном применении вориконазол повышает Cmax и AUC сиролимуса (2 мг однократно) на 556% и 1014% соответственно (комбинация противопоказана).
При одновременном применении вориконазол может вызывать повышение концентрации алкалоидов спорыньи (эрготамина и дигидроэрготамина) в плазме и развитие эрготизма (такая комбинация противопоказана).
При совместном применении у пациентов, перенесших трансплантацию почки и находящихся в стабильном состоянии, вориконазол повышает Cmax и AUC циклоспорина, по крайней мере, на 13% и 70% соответственно, что сопровождается повышением риска развития нефротоксических реакций. При применении вориконазола у пациентов, получающих циклоспорин, рекомендуется уменьшить дозу циклоспорина в 2 раза и контролировать его уровни в плазме. После отмены вориконазола необходимо контролировать уровни циклоспорина и при необходимости увеличить его дозу.
При совместном применении вориконазол повышает Cmax и AUC такролимуса (применяемого в дозе 0.1 мг/кг однократно) на 117% и 221% соответственно, что может сопровождаться нефротоксическими реакциями. При применении вориконазола у пациентов, получающих такролимус, рекомендуется уменьшить дозу последнего до 1/3 и контролировать его уровни в плазме. После отмены вориконазола необходимо контролировать концентрацию такролимуса и при необходимости увеличить его дозу.
Одновременное применение вориконазола (в дозе 300 мг 2 раза/сут) и варфарина (30 мг 1 раз/сут) сопровождалось увеличением максимального протромбинового времени до 93%. При одновременном назначении варфарина и вориконазола рекомендуется контролировать протромбиновое время.
Вориконазол при совместном применении может вызывать повышение концентрации в плазме фенпрокумона, аценокумарола (субстраты CYP2C9, CYP3A4) и протромбинового времени. При применении вориконазола у пациентов, получающих препараты кумарина, необходимо контролировать протромбиновое время с короткими интервалами и соответствующим образом подбирать дозы антикоагулянтов.
При совместном применении вориконазол может вызывать повышение концентрации производных сульфонилмочевины (субстраты CYP2C9) — толбутамида, глипизида и глибенкламида в плазме и вызвать гипогликемию. При одновременном их применении необходимо тщательно контролировать уровни глюкозы в крови.
In vitro вориконазол ингибирует метаболизм ловастатина (субстрат CYP3A4). При совместном применении возможно повышение концентрации в плазме статинов, метаболизирующихся под действием CYP3A4, что может увеличить риск развития рабдомиолиза. При одновременном их применении рекомендуется оценить целесообразность коррекции дозы статина.
In vitro вориконазол ингибирует метаболизм мидазолама (субстрат CYP3A4). При совместном применении возможно повышение концентрации в плазме метаболизирующихся под действием CYP3A4 бензодиазепинов (мидазолама, триазолама, алпразолама) и развитие пролонгированного седативного эффекта. При одновременном применении этих препаратов рекомендуется обсудить целесообразность коррекции дозы бензодиазепина.
При совместном применении вориконазол может повысить содержание алкалоидов барвинка (субстраты CYP3A4) — винкристина, винбластина в плазме и привести к развитию нейротоксических реакций. Рекомендуется обсудить целесообразность коррекции дозы алкалоидов барвинка.
Вориконазол повышает Cmax и AUC преднизолона (субстрат CYP3A4), применяемого в дозе 60 мг однократно на 11% и 34% соответственно. Коррекция дозы не рекомендуется.
При одновременном применении с вориконазолом, эфавиренз (субстрат CYP3A4, по данным ряда исследований в зависимости от дозы — ингибитор или индуктор CYP3A4), применяемый в дозе 400 мг 1 раз/сут в равновесном состоянии снижает Cmax и AUC вориконазола в среднем на 61% и 77% соответственно. Вориконазол в равновесном состоянии (400 мг внутрь каждые 12 ч в первый день, затем 200 мг внутрь каждые 12 ч в течение 8 дней) повышает равновесную Cmax и AUC эфавиренза в среднем на 38% и 44% соответственно (такая комбинация противопоказана).
При совместном применении фенитоин (субстрат CYP2C9 и мощный индуктор изоферментов цитохрома P450), применяемый в дозе 300 мг 1 раз/сут, снижает Cmax и AUC вориконазола на 49% и 69% соответственно; а вориконазол (400 мг 2 раза/сут) повышает Cmax и AUC фенитоина на 67% и 81% соответственно (при необходимости совместного применения следует тщательно оценить соотношение предполагаемой пользы и потенциального риска комбинированной терапии, а также тщательно мониторировать уровни фенитоина в плазме).
При совместном применении рифабутин (индуктор цитохрома P450), применяемый в дозе 300 мг 1 раз/сут снижает Cmax и AUC вориконазола (200 мг 1 раз/сут) на 69% и 78% соответственно. При совместном применении с рифабутином Cmax и AUC вориконазола (350 мг 2 раза/сут) составляет соответственно 96% и 68% от показателей при монотерапии вориконазолом (200 мг 2 раза/сут). При применении вориконазола в дозе 400 мг 2 раза/сут Сmax и AUC соответственно на 104% и 87% выше, чем при монотерапии вориконазолом в дозе 200 мг 2 раза/сут. Вориконазол в дозе 400 мг 2 раза/сут повышает Cmax и AUC рифабутина на 195% и 331% соответственно. При одновременном лечении рифабутином и вориконазолом рекомендуется регулярно проводить развернутый анализ картины периферической крови и контролировать нежелательные эффекты рифабутина (например, увеит).
При совместном применении в дозе 40 мг 1 раз/сут омепразол (ингибитор CYP2C19; субстрат CYP2C19 и CYP3A4) повышает Cmax и AUC вориконазола на 15% и 41% соответственно, а вориконазол повышает Cmax и AUC омепразола на 116% и 280% соответственно (следовательно, коррекции дозы вориконазола не требуется, а дозу омепразола следует уменьшить в 2 раза). Следует учесть возможность лекарственного взаимодействия вориконазола с другими ингибиторами Н+-К+-АТФ-азы, которые являются субстратами CYP2C19.
При одновременном применении с другими ингибиторами протеазы ВИЧ (субстраты и ингибиторы CYP3A4) следует тщательно контролировать состояние пациента с целью возможных токсических эффектов, т.к. исследования in vitro показали, что вориконазол и ингибиторы протеазы ВИЧ (саквинавир, ампренавир, нелфинавир) могут взаимно ингибировать метаболизм друг друга.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
активное вещество — вориконазол 200 мг;
вспомогательные вещества: натриевая соль сульфобутиловогоэфира бета-циклодекстрина (SBECD).
Лиофилизат для приготовления раствора для инфузий -лиофилизат белого цвета.
Вифенд® – это противогрибковый препарат широкого спектрадействия, который принадлежит к группе антибиотиков триазольной структуры.
Механизм действия Вифенда® связан с ингибированиемдеметилирования 14α-стерола, опосредованного грибковым цитохромом Р450; этареакция является ключевым этапом биосинтеза эргостерола. Вифенд® обладаетшироким спектром противогрибковой активности и активен в отношении Candida spр.(включая штаммы C. krusei, устойчивые к флуконазолу, и резистентные штаммы C.glabrataи C.albicans), обладает фунгицидным эффектом в отношении всех изученных штаммовАspergillus spp., а также патогенных грибов, ставших актуальными в последнеевремя, включая Scedosporium или Fusarium, которые ограниченно чувствительны ксуществующим противогрибковым средствам.
Клиническая эффективность была продемонстрирована при инфекциях,вызванных Aspergillus spp., включая A. flavus, A. fumigatus, A. terreus, A.niger,A. nidulans, Candida spp., включая C.albicans, C.dubliniensis, C.glabrata, C.inconspicua, C. krusei, C. parapsilosis, C. tropicalis и C. guilliermondii, Scedosporiumspp., включая S. apiospermum, S. prolificans и Fusarium spp.
Другие грибковые инфекции, при которых применялся препарат(часто с частичным или полным ответом), включали в себя отдельные случаиинфекций, вызванных Alternaria spp., Blastomyces dermatitidis, Blastoschizomycescapitatus, Cladosporium spp., Coccidioides immitis, Conidiobolus coronatus, Cryptococcusneoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurellamycetomatis, Paecilomyces lilacinus, Penicillium spp., включая P.marneffei, Phialophorarichardsiae, Scopulariopsis brevicaulis и Trichosporon spp., включая T.beigelii.
Продемонстрирована активность Вифенда® в отношенииклинических штаммов Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophoraspp., Histoplasma capsulatum. Рост большинства штаммов подавлялся приконцентрациях Вифенда® от 0,05 до 2 мкг/мл.
Выявлена активность Вифенда® в отношении Curvularia spp. и Sporothrixspp., однако клиническое ее значение неизвестно.
При внутривенном или пероральном применении ударных дозконцентрации в плазме приближаются к равновесным в течение первых 24 ч. Еслибольной не получает ударную дозу, то при повторном применении вориконазола 2раза в сутки происходит кумуляция препарата, а равновесные концентрации вплазме достигаются к 6-му дню у большинства пациентов. Вориконазол быстро ипрактически полностью всасывается после приема внутрь; максимальныеконцентрации в плазме (Cmax) достигаются через 1 – 2 ч после приема.Биодоступность вориконазола при приеме внутрь составляет 96%. При повторномприеме вориконазола с жирной пищей Cmax и AUC (площадь под кривой«концентрация-время») снижаются на 34% и 24% соответственно. Всасываниевориконазола не зависит от рН желудочного сока.
Объем распределения вориконазола в равновесном состояниисоставляет 4,6 л/кг, что указывает на активное распределение препарата в ткани.Связывание с белками плазмы составляет 58%. Вориконазол определяется вспинномозговой жидкости.
Вориконазол метаболизируется под действием печеночныхизоферментов цитохрома Р450 – CYP2C19, CYP2C9 и CYP3A4. Основным метаболитомвориконазола является N-оксид, доля которого составляет 72% среди циркулирующихмеченных метаболитов в плазме. Этот метаболит обладает минимальнойпротивогрибковой активностью и не вносит вклад в эффект вориконазола. Внеизмененном виде с мочой выводится менее 2% дозы препарата. После повторноговнутривенного и перорального применения меченного вориконазола примерно 80% и83% радиоактивной дозы соответственно обнаруживают в моче. Большая часть (>94%) общей дозы выводится в течение первых 96 ч после перорального ивнутривенного применения. Терминальный период полувыведения вориконазолазависит от дозы и составляет примерно 6 ч при приеме препарата внутрь в дозе200 мг. В связи с нелинейностью фармакокинетики терминальный периодполувыведения не позволяет предсказать кумуляцию или выведение вориконазола.
инвазивный аспергиллез
— тяжелые инвазивные формы кандидозных инфекций (включая C.krusei),устойчивые к флуконазолу
— кандидемия у пациентов без нейтропении
— кандидоз пищевода, вызванный C. albicans, у больных симмунодефицитом
— тяжелые грибковые инфекции, вызванные Scedosporium spp и Fusariumspp.
— тяжелые грибковые инфекции при непереносимости илирефрактерности к другим лекарственным средствам
— профилактика “прорывных” грибковых инфекций у лихорадящихбольных группы высокого риска (реципиентов аллогенного костного мозга, больныхс рецидивом лейкоза).
— гиперчувствительность к вориконазолу или любым компонентампрепарата
— одновременное применение Вифенда® и субстратов CYP3A4 –терфенадина, астемизола, цизаприда, пимозида или хинидина
— одновременное применение Вифенда® и сиролимуса
— одновременное применение Вифенда® с рифампицином,карбамазепином и длительно действующими барбитуратами (например,фенобарбиталом)
— одновременное применение Вифенда® с высокими дозамиритонавира (400мг и выше два раза в день)
— одновременное применение алкалоидов спорыньи (эрготамина,дигидроэрготамина), являющихся субстратами CYP3A4.
— одновременное применение Вифенда® и зверобоя
— детский возраст до 2-х лет (безопасность и эффективность удетей в возрасте менее 2 лет не установлены).
С ОСТОРОЖНОСТЬЮ
Тяжелая печеночная недостаточность, тяжелая хроническаяпочечная недостаточность (при парентеральном введении).
Повышенная чувствительность к другим препаратам –производным азолов.
Адекватной информации о применении Вифенда® у беременныхженщин нет. Вифенд® не следует применять у беременных женщин за исключением техслучаев, когда ожидаемая польза для матери явно перевешивает возможный риск дляплода. Выведение Вифенда® с грудным молоком не изучалось.
Вифенд® не следует применять у женщин, кормящих грудью, заисключением тех случаев, когда ожидаемая польза явно перевешивает риск.
Женщины репродуктивного возраста во время лечения должныпостоянно пользоваться эффективными методами контрацепции.
Особенности влияния лекарственного средства на способностьуправлять транспортным средством или потенциально опасными механизмами
Вифенд® может вызвать преходящие и обратимые нарушениязрения, включая туман перед глазами, нарушение/усиление зрительного восприятияи/или фотофобию. При наличии таких симптомов пациенты должны избегатьвыполнения потенциально опасных действий как, например, управления автомобилемили использования сложной техники.
При приеме Вифенда® пациенты не должны водить автомобиль поночам.
Лиофилизат для приготовления раствора для инфузий
Перед внутривенной инфузией порошок Вифенда® следуетрастворить и развести (см. раздел Инструкции по применению).
Раствор для инфузий не рекомендуется для болюсного введения.
Вифенд® рекомендуется вводить со скоростью не более 3мг/кг/ч в течение 1 – 2 ч.
Перед началом терапии необходимо скоррегировать такиеэлектролитные нарушения, как гипокалиемия, гипомагниемия и гипокальциемия.
Применение у взрослых
Назначение Вифенда® внутривенно или внутрь следует начинатьс рекомендуемой насыщающей дозы, чтобы уже в первый день добиться концентрациив сыворотке, близкой к равновесной. Учитывая высокую биодоступность при приемевнутрь, при наличии клинических показаний можно переходить с внутривенного напероральное применение препарата.
В таблице приведена подробная информация по дозированиюпрепарата:
|
Внутривенно |
Внутрь |
||
|
Пациенты с массой тела 40 кг и более |
Пациенты с массой тела менее 40 кг |
||
|
Насыщающая доза – все показания (первые 24 ч) |
6 мг/кг каждые 12 ч (в течение первых 24 ч) |
400 мг каждые 12 ч (в течение первых 24 ч) |
200 мг каждые 12 ч (в течение первых 24 ч) |
|
Поддерживающая доза (после первых 24 ч) Профилактика прорывных инфекций |
3 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
|
Тяжелые инвазивные кандидозные инфекции, устойчивые к флуконазолу, инвазивный аспергиллез, инфекции, вызванные Scedosporium и Fusarium, другие серьезные плесневые инфекции |
4 мг/кг каждые 12 ч |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
|
Кандидемия у пациентов без нейтропении |
3-4мг/кг каждые 12 часов |
200мг каждые 12 часов |
100мг каждые 12 часов |
|
Кандидоз пищевода, вызванный C. albicans, у больных с иммунодефицитом |
Нет рекомендаций |
200 мг каждые 12 ч |
100 мг каждые 12 ч |
Подбор дозы
Таблетки, покрытые оболочкой
При недостаточной эффективности лечения поддерживающая дозаможет быть увеличена до 300 мг каждые 12 ч внутрь. У больных с массой теламенее 40 кгдоза может быть увеличена до 150 мг каждые 12 ч внутрь.
Если пациент не переносит препарат в высокой дозе, то ееснижают ступенями по 50 мг до 200 мг каждые 12 ч внутрь (или 100 мг каждые 12 чу больных с массой тела менее 40 кг).
Фенитоин можно применять с Вифендом®, если поддерживающуюдозу последнего увеличивают с 200 до 400 мг каждые 12 ч внутрь (со 100 до 200мг каждые 12 ч внутрь у пациентов с массой тела менее 40 кг).
Рифабутин можно применять с Вифендом®, если поддерживающуюдозу последнего увеличивают с 200 до 350 мг каждые 12 ч внутрь (со 100 до 200мг каждые 12 ч внутрь у больных с массой тела менее 40 кг).
Если Вифенд® применяется вместе с эфавиренцом, топоддерживающая доза Вифенда ® должна быть увеличена до 400мг каждые 12 часов.
Длительность лечения зависит от клинического эффекта ирезультатов микологического анализа.
Лиофилизат для приготовления раствора для инфузий
При недостаточной эффективности лечения поддерживающая дозаможет быть увеличена до 4 мг/кг каждые 12 ч внутривенно. Если пациенты непереносят препарат в этой более высокой дозе, то внутривенную дозу снижают до 3мг/кг каждые 12 ч.
Рифабутин и фенитоин можно применять одновременно с Вифендом®,если поддерживающая доза последнего увеличена до 5 мг/кг каждые 12 ч.
Длительность лечения зависит от клинического эффекта ирезультатов микологического анализа.
Применение у пожилых людей
Коррекция дозы у пожилых людей не требуется.
Применение у больных с нарушением функции почек
Таблетки, покрытые оболочкой
Нарушение функции почек не влияет на фармакокинетику Вифенда®при приеме внутрь. В связи с этим коррекция дозы Вифенда® для приема внутрь убольных с легким, умеренным или выраженным нарушением функции почек нетребуется.
Лиофилизат для приготовления раствора для инфузий
У больных с умеренным или выраженным нарушением функциипочек (клиренс креатинина менее 50 мл/мин) происходит накоплениевспомогательного компонента препарата – сульфобутилового эфирабета-циклодекстрина (SBECD). Таким больным Вифенд® следует назначать внутрь заисключением тех случаев, когда соотношение риска и пользы оправдывает еговнутривенное введение. В подобных ситуациях необходимо регулярно контролироватьуровни креатинина; в случае его повышения следует обсудить возможность переходана прием Вифенда® внутрь.
Вифенд® выводится в ходе гемодиализа с клиренсом 121 мл/мин.
Четырехчасовой сеанс гемодиализа не приводит к удалениюзначительной части дозы Вифенда® и не требует ее коррекции. SBECD выводится входе гемодиализа с клиренсом 55 мл/мин.
Применение у больных с нарушением функции печени
При остром повреждении печени, проявляющемся повышениемактивности “печеночных” трансаминаз (АЛТ, АСТ), коррекция дозы не требуется. Втаких случаях рекомендуется продолжить контроль за показателями функции печенис целью выявления их дальнейшего повышения.
У больных с легким или среднетяжелым циррозом печени(Child-Pugh А и В) рекомендуется назначать cтандартную ударную дозу Вифенда®, аподдерживающую дозу снижать в 2 раза.
Больным с выраженным нарушением функции печени Вифенд®следует назначать только в тех случаях, когда ожидаемая польза перевешиваетвозможный риск. У больных с тяжелым нарушением функции печени лечениенеобходимо проводить под постоянным контролем с целью выявления признаковтоксичности препарата.
Применение у детей
Безопасность и эффективность Вифенда® у детей в возрастеменее 2 лет не установлены. В связи с этим Вифенд® не рекомендуется назначатьдетям младше 2 лет.
Если ребенок не переносит препарат в дозе 7мг/кг два раза вдень внутривенно, то дозу можно снизить до 4мг/кг два раза в день.
Если ребенок может глотать таблетки, то дозу округляют доближайшей дозы в мг/кг, кратной 50 мг, и назначают в виде целых таблеток.
Фармакокинетика и переносимость более высоких доз у детей неизучены.
Подростки в возрасте от 12 до 16 лет: препарат дозируют также, как у взрослых.
Инструкции по приготовлению раствора для инфузий
Вифенд® выпускается во флаконах для однократного применения.Содержимое флакона растворяют в 19 мл воды для инъекций. В результате получают20 мл прозрачного концентрата, содержащего 10мг/мл Вифенда®. Если растворительне поступает во флакон под действием вакуума, то флакон использовать нельзя.Перед применением необходимый объем концентрата (см. таблицу) добавляют крекомендуемому совместимому раствору для инфузии (см. ниже). В конечном итогеполучают раствор Вифенда®, содержащий 0,5 – 5 мг/мл.
Вифенд® представляет собой стерильный лиофилизат безконсерванта, предназначенный для однократного применения. С микробиологическойточки зрения препарат следует вводить немедленно. Его можно хранить не более 24ч
при температуре от 2°C до 8°C в том случае, когда растворбыл приготовлен в контролируемых асептических условиях.
Концентрат можно разводить следующими растворами:
0,9% раствор хлорида натрия для внутривенного введения
Сложный раствор натрия лактата для внутривенного введения
5 % раствор глюкозы и сложный раствор натрия лактата длявнутривенного введения
5 % раствор глюкозы и 0,45% раствор натрия хлорида длявнутривенного введения
5 % раствор глюкозы для внутривенного введения
5% раствор глюкозы в 20 мэкв раствора хлорида калия для внутривенноговведения
0,45 % раствор хлорида натрия для внутривенного введения
5 % раствор глюкозы и 0,9% раствор натрия хлорида длявнутривенного введения.
Совместимость Вифенда® с другими растворами помимо указанныхвыше не известна.
— лихорадка, периферические отеки
— ознобы, астения, боль в груди, реакции/воспаление в местевведения, гриппоподобный синдром
— снижение АД, тромбофлебит, флебит
— предсердные аритмии, брадикардия, тахикардия, желудочковаяаритмия
— наджелудочковая тахикардия, полная атрио-вентрикулярнаяблокада, блокада ножки пучка Гиса, узловые аритмии, желудочковая тахикардия(включая трепетание желудочков), удлинение интервала QT, фибрилляция желудочков
— тошнота, рвота, диарея, боль в животе, запор
— повышение показателей функции печени (включая АСТ, АЛТ,щелочную фосфатазу, гамма-ГТ, ЛДГ, билирубин), желтуха, хейлит, холестаз
— холецистит, холелитиаз, дуоденит, диспепсия, увеличениепечени, гингивит, глоссит, гепатит, печеночная недостаточность, панкреатит,отек языка, перитонит
— псевдомембранозный колит, печеночная кома
— недостаточность коры надпочечников
— гипертиреоз, гипотиреоз
— тромбоцитопения, анемия (в том числе макроцитарная,микроцитарная, нормоцитарная, мегалобластная, апластическая), лейкопения,панцитопения
— лимфаденопатия, агранулоцитоз, эозинофилия, синдромдиссеминированного внутрисосудистого свертывания, угнетение костномозговогокроветворения
— лимфангиит
— гипокалиемия, гипогликемия
— гиперхолестеринемия
— боль в спине
— артрит
— головная боль, головокружение, галлюцинации, спутанность,депрессия, тревога, тремор, ажитация, парестезии
— атаксия, отек головного мозга, гипертония, гипостезия,нистагм, головокружение, обморок
— синдром Гиенна-Барре, глазодвигательный криз,экстрапирамидный синдром, бессонница, энцефалопатия, сонливость во времяинфузии
— респираторный дистресс синдром, отек легких, синусит
— аллергические реакции, анафилактоидные реакции, сыпь, зуд,макулопапулезная сыпь, кожные реакции фоточувствительности, алопеция,эксфолиативный дерматит, отек лица, пурпура, токсический эпидермальныйнекролиз, экзема, псориаз, синдром Стивенса-Джонсона, крапивница, ангионевротическийотек, дискоидная красная волчанка, многоформная эритема, псевдопорфирия
— зрительные нарушения (включая нарушение/усилениезрительного восприятия, туман перед глазами, изменение цветного зрения,фотофобия)
— блефарит, неврит зрительного нерва, отек соска зрительногонерва, склерит, нарушение вкусового восприятия, диплопия
— снижение слуха, звон в ушах
— кровоизлияние в сетчатку, помутнение роговицы, атрофиязрительного нерва
— повышение креатинина, острая почечная недостаточность,гематурия
— повышение остаточного азота мочевины, альбуминурия, нефрит
— некроз канальцев почек
Симптомы: усиление побочных реакций.
Лечение: антидот Вифенда® не известен. В случае передозировкипоказана симптоматическая терапия. Возможное проведение промывания желудка.
Вифенд® удаляется при гемодиализе с клиренсом 121 мл/мин.Сульфобутиловый эфир бета-циклодекстрина (SBECD) также диализируется склиренсом 55 мл/мин. В случае передозировки гемодиализ может способствоватьвыведению Вифенда® и SBECD из организма.
Влияние других препаратов на фармакокинетику Вифенда®
Вифенд® метаболизируется под действием изоферментовцитохрома Р450 – CYP2C19, CYP2C9 и CYP3A4. Ингибиторы или индукторы этихизоферментов могут вызвать, соответственно, повышение или снижение концентрацийВифенда® в плазме.
Уровни Вифенда® в плазме значительно снижаются приодновременном применении со следующими препаратами:
Рифампицин (600 мг один раз в сутки) снижает Cmax(максимальную концентрацию в плазме) и AUC Вифенда® на 93% и 96%соответственно. Одновременное применение Вифенда® и рифампицинапротивопоказано.
Карбамазепин и длительно действующие барбитураты (например,фенобарбитал), вероятно, значительно снижают концентрации Вифенда® в плазме,хотя их взаимодействие не изучалось. Одновременное применение Вифенда® скарбамазепином и длительно действующими барбитуратами противопоказано.
Учитывая небольшое фармакокинетическое взаимодействие илиотсутствие значимого взаимодействия, коррекция доз следующих препаратов нетребуется: циметидин, ранитидин, антибиотики группы макролидов (эритромицин иазитромицин).
Действие Вифенда® на другие препараты
Вифенд ингибирует активность изоферментов цитохрома Р450 –CYP2C19, CYP2C9 и CYP3A4. В связи с этим Вифенд® может повысить плазменныеконцентрации веществ, которые метаболизируются этими изоферментами CYP450.
Взаимодействие с Вифендом® может привести к повышениюконцентрации в крови следующих препаратов, перечисленных ниже. В связи с этимпри их одновременном применении необходимы постоянное наблюдение и/иликоррекция доз.
Циклоспорин (субстрат CYP3A4): у пациентов, перенесшихтрансплантацию почки и находящихся в стабильном состоянии, Вифенд® повышаетCmax и AUC циклоспорина по крайней мере на 13% и 70% соответственно. Приназначении Вифенда® больным, получающим циклоспорин, рекомендуется уменьшитьдозу циклоспорина вдвое и контролировать его уровни в плазме. Повышениеконцентрации циклоспорина сопровождается нефротоксичностью. После отмены Вифенда®необходимо контролировать уровни циклоспорина и при необходимости увеличить егодозу.
Такролимус (субстрат CYP3A4): Вифенд® повышает Cmax и AUC (площадьпод кривой концентрация-время до последнего количественного измерения)такролимуса (0,1 мг/кг однократно) на 117 % и 221 % соответственно. При назначенииВифенда® больным, получающим такролимус, рекомендуется уменьшить дозупоследнего до одной трети и контролировать его уровни в плазме. Повышениеуровней такролимуса сопровождается нефротоксичностью. После отмены Вифенда®необходимо контролировать концентрацию такролимуса и при необходимостиувеличить его дозу.
Метадон (субстрат CYP3A4): Повторный прием Вифенда® внутрь (400мг каждые 12 часов в течение 1 дня, затем 200 мг каждые 12 часов в течение 4дней) повышал Cmax и AUC фармакологически активного R-метадона на 31% (90% ДИ:22%, 40%) и 47% (90% ДИ: 38%, 57%), соответственно, у лиц, получающихподдерживающую дозу метадона (30-100 мг однократно в сутки).
Опиаты короткого действия (субстраты CYP3A4): одновременноеприменение Вифенда® и альфетанила повышало AUC однократно введенногоальфетанила в 6 раз. При одновременном назначении с Вифендом® необходимо решитьвопрос о снижении дозы альфетанила и других опиатов короткого действия сосходным с альфетанилом строением и метаболизирующихся CYP3A4 (например, суфентанил).
Фентанил (субстрат CYP3A4): одновременное применение Вифенда®(400 мг каждые 12 часов в 1-й день, затем 200 мг каждые 12 часов на 2-й день) свнутривенным фентанилом (5 µг/кг) приводило к повышению средней AUC0-∞фентанила в 1.4 раза (в пределах 1.12-1.60 раз). При одновременномназначении Вифенда® и фентанила рекомендуется расширенный и частый контрольпациентов на предмет подавления дыхательной функции и других побочных эффектов,связанных с фентанилом, при необходимости доза фентанила должна быть снижена.
Оксикодон (субстрат CYP3A4): одновременное назначениенескольких доз Вифенда® внутрь (400 мг каждые 12 часов на 1 день с последующимипятью приемами 200 мг каждые 12 часов на 2-4 дни) с однократным приемом 10 мгорального оксикодона на 3 день приводило к повышению средней Cмакс и AUC0–∞оксикодона в 1.7 раз (в пределах 1.4- 2.2 раз) и в 3.6 раза (в пределах 2.7-5.6 раза), соответственно. Средний период полувыведения оксикодона такжеповышался в 2 раза (в пределах 1.4-2.5 раза). Снижение дозы оксикодона можетпотребоваться при терапии Вифендом® во избежание побочных эффектов, связанных сопиоидами. Рекомендуется расширенный и частый контроль на предмет побочныхэффектов, связанных с оксикодоном и другими опиатами длительного действия, метаболизирующихсяCYP3A4.
Варфарин (субстрат CYP2C9): одновременное применение Вифенда®(300 мг 2 раза в сутки) с варфарином (30 мг однократно) сопровождалосьувеличением максимального протромбинового времени до 93%. При одновременномназначении варфарина и Вифенда® рекомендуется контролировать протромбиновоевремя.
Другие пероральные антикоагулянты, например, фенпрокумон,аценокумарол (субстраты CYP2C9, CYP3A4): Вифенд® может вызвать повышениеконцентраций кумаринов в плазме и протромбинового времени. Если больным,получающим препараты кумарина, назначают Вифенд®, необходимо контролироватьпротромбиновое время с короткими интервалами и соответствующим образомподбирать дозы антикоагулянтов.
Производные сульфонилмочевины (субстраты CYP2C9): Вифенд®может повысить концентрации производных сульфонилмочевины (например,толбутамида, глипизида и глибенкламида) в плазме и вызвать гипогликемию. Приодновременном их применении необходимо тщательно контролировать уровни глюкозыв крови.
Статины (субстраты CYP3A4): Вифенд® ингибирует метаболизмловастатина (в микросомах печени человека). В связи с этим Вифенд® можетвызвать повышение плазменных концентраций статинов, метаболизирующихся поддействием CYP3A4. При одновременном их применении рекомендуется оценитьцелесообразность коррекции дозы статина. Повышение уровня статинов иногдасопровождалось развитием рабдомиолиза.
Бензодиазепины (субстраты CYP3A4): хотя в клиническихисследованиях взаимодействие не изучалось, Вифенд® ингибирует метаболизммидазолама (микросомы печени человека). В связи с этим Вифенд® может вызватьповышение плазменных уровней бензодиазепинов, которые метаболизируются поддействием CYP3A4 (мидазолама, триазолама, алпразолама), и развитиепролонгированного седативного эффекта.
При одновременном применении этих препаратов рекомендуетсяобсудить целесообразность коррекции дозы бензодиазепина.
Алкалоиды барвинка (субстраты CYP3A4): Вифенд® можетповысить содержание алкалоидов барвинка в плазме (например, винкристина ивинбластина) и вызвать нейротоксичность. Рекомендуется обсудитьцелесообразность коррекции дозы алкалоидов барвинка.
Нестероидные противовоспалительные препараты (НПВП): Вифенд®повышал Cmax и AUC ибупрофена (400 мг однократно) на 20% и 100%,соответственно. Вифенд® повышал Cмакс иAUC диклофенака (50 мг однократно) на 114% и 78%, соответственно.
Рекомендуется частый контроль на побочные явления итоксичность, связанные с НПВП. Может потребоваться коррекция дозы НПВП.
Одновременное применение Вифенда® со следующими препаратамипротивопоказано:
одновременное применение Вифенда® с субстратами CYP3A4:терфенадином, астемизолом, цизапридом, пимозидом или хинидином противопоказано,так как повышение их концентрации в плазме может привести к удлинению интервалаQT и в редких случаях к развитию мерцания/трепетания желудочков.
Сиролимус (субстрат CYP3A4): Вифенд® повышает Cmax и AUC сиролимуса(2 мг однократно) на 556 % и 1014 % соответственно. Одновременное применение Вифенда®и сиролимуса противопоказано.
Алкалоиды спорыньи (субстраты CYP3A4): Вифенд® может вызватьповышение концентраций алкалоидов спорыньи (эрготамина и дигидроэрготамина) вплазме и развитие эрготизма. Одновременное применение алкалоидов спорыньи с Вифендом®противопоказано.
При одновременном применении Вифенда® со следующими препаратамизначимого фармакокинетического взаимодействия не выявлено, поэтому коррекция ихдозы не требуется.
Преднизолон (субстрат CYP3A4): Вифенд® повышает Cmax и AUC преднизолона(60 мг однократно) на 11 % и 34 % соответственно. Коррекция дозы не рекомендуется.
Дигоксин (транспорт, опосредованный Р-гликопротеином): Вифенд®не оказывает существенного влияния на Cmax и AUC дигоксина (0,25 мг один раз всутки).
Микофеноловая кислота (субстрат УДФ-глюкуронилтрансферазы): Вифенд®не оказывает влияния на Cmax и AUC микофеноловой кислоты (1 г однократно).
Эфавиренц (ингибитор ненуклеозидной обратной транскриптазы[индуктор CYP450; ингибитор и субстрат CYP3A4]): Стандартные дозы Вифенда® истандартные дозы эфавиренца не должны назначаться одновременно. У здоровых лицэфавиренц (400 мг орально однократно в сутки) снижал стабильные Cmax и AUC Вифенда® в среднем на 61% и 77%соответственно. Вифенд® в стабильном состоянии (400 мг орально каждые 12 часов1 день, затем 200 мг орально каждые 12 часов в течение 8 дней) снижалстабильные Cmax и AUC эфавиренца всреднем на 38% и 44%, соответственно у тех же лиц.
Прием Вифенда® в дозе 300 мг дважды в сутки в сочетаниис низкой дозой эфавиренца (300 мгоднократно в сутки) не приводил к достаточному воздействию Вифенда®.
После одновременного назначения Вифенда® 400 мг дважды всутки с эфавиренцом 300 мг орально однократно в сутки у здоровых лиц AUC Вифенда®снижалась на 7 % и Cmax повышалась на 23 %, по сравнению с монотерапией Вифендом®200 мг дважды в сутки. AUC эфавиренца повышалась на 17 % и Cmax былаэквивалентна при сравнении с монотерапией эфавиренцом 600 мг однократно всутки. Эти различия не считаются клинически значимыми.
При одновременном назначении Вифенда® с эфавиренцомподдерживающая доза Вифенда® должна быть повышена до 400 мг дважды в сутки, адоза эфавиренца должна быть снижена на 50%, например, до 300 мг однократно всутки. При прекращении лечения Вифендом® необходимо вернуться к исходной дозеэфавиренца.
Фенитоин (субстрат CYP2C9 и мощный индуктор CYP450):одновременного применения Вифенда® и фенитоина следует избегать за исключениемтех случаев, когда ожидаемая польза перевешивает возможный риск.
Фенитоин (300 мг один раз в сутки) снижает Cmax и AUCт Вифенда®на 49% и 69% соответственно. Вифенд® (400 мг два раза в сутки) повышает Cmax иAUC фенитоина (300 мг один раз в сутки) на 67% и 81% соответственно. Приодновременном применении фенитоина с Вифендом® рекомендуется тщательноемониторирование уровней фенитоина в плазме. Фенитоин можно применять совместнос Вифендом®, если поддерживающая доза последнего увеличена до 5 мг/кг каждые 12ч внутривенно или с 200 до 400 мг каждые 12 ч внутрь (со 100 до 200 мг каждые12 ч внутрь у пациентов с массой тела менее 40 кг).
Рифабутин (индуктор CYP450): рифабутин (300 мг один раз всутки) снижает Cmax и AUC Вифенда® (200 мг два раза в сутки) на 69% и 78%соответственно. При одновременном назначении рифабутина Cmax и AUC Вифенда вдозе 350 мг 2 раза в сутки составляют 96% и 68% от показателей при применении Вифенда®по отдельности в дозе 200 мг 2 раза в сутки. При применении Вифенда® в дозе 400мг два раза в сутки Cmax и AUC, соответственно, на 104% и 87% выше, чем примонотерапии Вифендом® в дозе 200 мг 2 раза в сутки. Вифенд® в дозе 400 мг 2раза в сутки повышает Cmax и AUC рифабутина на 195% и 331% соответственно. Еслиожидаемая польза от лечения перевешивает риск, рифабутин можно применятьодновременно с Вифендом®. В этом случае поддерживающую дозу Вифенда® следуетповысить до 5 мг/кг каждые 12 ч внутривенно или с 200 до 350 мг каждые 12 чвнутрь (со 100 до 200 мг каждые 12 ч внутрь у больных с массой тела менее 40 кг). При одновременномлечении рифабутином и Вифендом® рекомендуется регулярно проводить развернутыйанализ крови и контролировать нежелательные эффекты рифабутина (например,увеит).
Омепразол (ингибитор CYP2C19; субстрат CYP2C19 и CYP3A4):омепразол (40 мг один раз в сутки) повышает Cmax и AUC Вифенда® на 15% и 41%соответственно. Коррекция дозы Вифенда® не рекомендуется. Вифенд® повышает Cmaxи AUCт омепразола на 116% и 280%, соответственно. При назначении Вифенда®больным, получающим омепразол, дозу последнего рекомендуется уменьшить вдвое. Вифенд®может также ингибировать метаболизм других блокаторов протонного насоса,которые являются субстратами CYP2C19.
Оральные контрацептивы (субстраты CYP3A4): Одновременноеназначение Вифенда® и орального контрацептива (1 мг норэтистерона и 0.035 мгэтинилэстрадиола однократно в сутки) у здоровых женщин приводило к повышению Cmaxи AUC этинилэстрадиола (36% и 61% соответственно) и норэтистерона (15% и 53%соответственно). Cмакс и AUC Вифенда®повышалась на 14% и 46% соответственно. Другие дозы оральных контрацептивов, нежели 1 мг норэтистерона и 0.035мг этинилэстрадиола, не изучены. Так как соотношение между норэтистероном иэтинилэстрадиолом остается аналогичным при взаимодействии с Вифендом®, ихконтрацептивная активность возможно не меняется. Рекомендуется контрольпобочных явлений, связанных с оральными контрацептивами при одновременномназначении.
Индинавир (ингибитор и субстрат CYP3A4): индинавир (800 мгтри раза в сутки) не оказывает существенного влияния на Cmax и AUC Вифенда®. Вифенд®существенно не влияет на Cmax, Сmin и AUCт индинавира (800 мг 3 раза в сутки).
Другие ингибиторы протеазы ВИЧ (субстраты и ингибиторыCYP3A4): Вифенд® может ингибировать метаболизм ингибиторов протеазы ВИЧ(например, саквинавира, ампренавира и нелфинавира). Ингибиторы протеазы ВИЧмогут подавлять метаболизм Вифенда®. В случае одновременного применения Вифенда®с ингибиторами протеазы ВИЧ больных следует наблюдать с целью выявлениявозможных токсических эффектов.
Другие ненуклеозидные ингибиторы обратной транскриптазы(НИОТ) (субстраты, ингибиторы CYP3A4 или CYP450): метаболизм Вифенда® можетингибироваться делавирдином. Метаболизм Вифенда® может индуцироватьсяневипарином. Вифенд® может также ингибировать метаболизм НИОТ. Пациенты должнытщательно контролироваться а предмет токсичности препаратов при одновременномназначении Вифенда® и НИОТ.
Фармацевтическая несовместимость
Лиофилизат для приготовления раствора для инфузий:
Инфузию Вифенда® не следует проводить через один катетер иликанюлю с другими лекарственными веществами, включая препараты дляпарентерального питания (например, Аминофузином 10 % Плюс). Однако, Вифенд®может вводиться одновременно с полным парентеральным питанием через отдельный входмногоканального катетера.
4.2 % раствор натрия бикарбоната для внутривенной инфузии несовместим с Вифендом®, поэтому его не рекомендуется использовать в качестверастворителя. Совместимость с другими концентрациями не известна.
Данный препарат не следует смешивать с другимилекарственными средствами за исключением перечисленных в разделе Инструкции поприготовлению раствора для инъекций.
Одновременно с введением Вифенда® не следует проводитьинфузии препаратов крови и растворов электролитов.
Применение Вифенда® связано с удлинением интервала QT наэлектрокардиограмме, что сопровождается редкими случаями мерцания-трепетанияжелудочков у пациентов, получающих терапию Вифендом® (у тяжелобольных пациентовс множественными факторами риска, как кардиотоксическая химиотерапия,кардиомиопатия, гипокалиемия и сопутствующая терапия, которые моглиспособствовать развитию данного осложнения). Пациентам с данными потенциально проаритмическимисостояниями Вифенд® должен назначаться с осторожностью.
Гепатотоксичность. При лечении Вифендом® наблюдаютсянечастые (0,1 – 1%) случаи серьезных реакций со стороны печени (включаяпроявляющийся клинически гепатит, холестаз и печеночноклеточнуюнедостаточность, в том числе с летальным исходом). Нежелательные явления состороны печени в основном наблюдаются у больных с серьезными заболеваниями(главным образом злокачественными опухолями крови). У больных без каких-либофакторов риска наблюдаются преходящие реакции со стороны печени, включаягепатит и желтуху. Нарушения функции печени обычно обратимы и проходят послепрекращения лечения.
Мониторирование функции печени. Во время лечения Вифендом®рекомендуется регулярно контролировать функцию печени, особенно печеночныепробы и билирубин. При появлении клинических признаков болезни печени, которыемогут быть связаны с Вифендом®, необходимо обсудить целесообразностьпрекращения терапии.
Нежелательные явления со стороны почек. У тяжелых больных, получающихВифенд®, наблюдали случаи развития острой почечной недостаточности.
Мониторирование функции почек. Больных следует наблюдать сцелью выявления признаков нарушения функции почек. Для этого необходимопроводить лабораторные исследования, в частности определять сывороточныйуровень креатинина.
Инфузионные реакции. При внутривенном введении Вифенда®наблюдаются инфузионные реакции, в основном “приливы крови к лицу” и тошнота.Если эти симптомы выражены, то следует обсудить целесообразность прекращениялечения.
Нежелательные явления со стороны зрения: Имеютсяпост-маркетинговые сообщения о длительных побочных явлениях со стороны зрения,включая неврит зрительного нерва и отек соска зрительного нерва. Эти явлениявозникали прежде всего у пациентов с тяжелыми заболеваниями с подлежащимисостояниями и/или одновременно назначенными препаратами, которые могут вызватьили участвовать в возникновении этих явлений.
Контроль функции поджелудочной железы: У взрослых и детей сналичием факторов риска по развитию острого панкреатита (например, недавнополученная химиотерапия, трансплантация гематопоэтических стволовых клеток[ТГСК]) на фоне лечения Вифендом® необходим контроль на предмет развитияпанкреатита.
Нежелательные явления со стороны кожи: У пациентов на фонелечения Вифендом® редко развивались эксфолиативные кожные реакции, такие каксиндром Стивенса-Джонсона. При развитии у пациента эксфолиативной кожнойреакции лечение Вифендом® должно быть прекращено. Кроме того, лечение Вифендом®было связано с кожными реакциями фоточувствительности. Рекомендуется избегатьинтенсивного или длительного воздействия солнечных лучей на фоне терапии Вифендом®.У пациентов с кожными реакциями фоточувствительности и дополнительнымифакторами риска на фоне длительной терапии наблюдалось развитияплоскоклеточного рака кожи и меланомы. Если у пациента развиваются кожныеповреждения, характерные для плоскоклеточного рака или меланомы, необходиморешение вопроса об отмене препарата.
Применение у детей: Безопасность и эффективность у детеймладше двух лет не установлена. Вифенд® показан у детей в возрасте два года истарше. Как у детей, так и у взрослых, должны контролироваться функции печени.У детей от 2 до 12 лет может бытьограничена оральная биодоступность при наличии и нарушенного всасывания и оченьнизкой массы тела по возрасту. В таком случае рекомендуется внутривенноевведение Вифенда®.
Лиофилизат для приготовления раствора для инфузий 200мг:
По 3,4 гпорошка во флаконы прозрачного бесцветного стекла, с резиновыми крышками иалюминиевыми герметичными колпачками с пластиковой вставкой.
По 1 флакону вместе с инструкцией по применению в картоннойпачке. Флаконы предназначены для однократного применения.
Лиофилизат для приготовления раствора для инфузий хранитьпри температуре не выше 25°С
Приготовленный раствор: при температуре от 2°C до 8°C.
Хранить в недоступном для детей месте!
Лиофилизат для приготовления раствора для инфузий — 3 года.
Приготовленный раствор – не более 24 ч.
Не использовать после истечения срока годности.
Состав
Действующее вещество:
вориконазол 200 мг,
Вспомогательные вещества:
натриевая соль сульфобутилового эфира бета-циклодекстрина (SBECD).
Фармакокинетика
Фармакокинетику вориконазола изучали у здоровых людей, представителей особых групп и больных.
Фармакокинетика вориконазола является нелинейной за счет насыщения его метаболизма. При увеличении дозы наблюдается непропорциональное (более выраженное) повышение AUC (площадь под кривой «концентрация-время»). По расчетам, увеличение пероральной дозы с 200 мг 2 раза в сутки до 300 мг 2 раза в сутки приводит к увеличению AUCτ в среднем в 2,5 раза. При внутривенном или пероральном применении ударных доз концентрации в плазме приближаются к равновесным в течение первых 24 ч. Если больной не получает ударную дозу, то при повторном применении вориконазола 2 раза в сутки происходит кумуляция препарата, а равновесные концентрации в плазме достигаются к 6-му дню у большинства пациентов.
Вориконазол быстро и практически полностью всасывается после приема внутрь; максимальные концентрации в плазме (Сmах) достигаются через 1-2 ч после приема. Биодоступность вориконазола при приеме внутрь составляет 96%. При повторном приеме вориконазола с жирной пищей Сmах и AUCτ снижаются на 34% и 24% соответственно.
Всасывание вориконазола не зависит от рН желудочного сока.
Расчетный объем распределения вориконазола в равновесном состоянии составляет 4,6 л/кг, что указывает на активное распределение препарата в ткани. Связывание с белками плазмы составляет 58%.
Вориконазол определяется в спиномозговой жидкости.
Фармакокинетика вориконазола характеризуется высокой межиндивидуальной вариабельностью.
Исследования in vitro показали, что вориконазол метаболизируется под действием печеночных изоферментов цитохрома Р450 — CYP2C19, CYP2C9 и CYP3A4.
Исследования in vivo также свидетельствуют о том, что CYP2C19 играет важную роль в метаболизме вориконазола. Этот фермент проявляет генетический полиморфизм. Например, пониженного метаболизма вориконазола можно ожидать у 15-20% азиатов и 3-5% белых и черных. Исследования у представителей белой расы и японцев показали, что у пациентов с пониженным метаболизмом AUCτ вориконазола в среднем в 4 раза выше, чем у гомозиготных пациентов с высоким метаболизмом. У гетерозиготных пациентов с активным метаболизмом AUCτ вориконазола в среднем в 2 раза выше, чем у гомозиготных.
Основным метаболитом вориконазола является N-оксид, доля которого составляет 72% среди циркулирующих меченных метаболитов в плазме. Этот метаболит обладает минимальной противогрибковой активностью и не вносит вклад в эффект вориконазола.
В неизмененном виде с мочой выводится менее 2% дозы препарата.
После повторного внутривенного и перорального применения меченного вориконазола примерно 80% и 83% радиоактивной дозы соответственно обнаруживают в моче. Большая часть (>94%) общей дозы выводится в течение первых 96 ч после перорального и внутривенного применения.
Терминальный период полувыведения вориконазола зависит от дозы и составляет примерно 6 ч при приеме препарата внутрь в дозе 200 мг. В связи с нелинейностью фармакокинетики терминальный период полувыведения не позволяет предсказать кумуляцию или выведение вориконазола.
Фармакокинетика в особых группах
Пол
При пероральном повторном применении Сmах и AUCτ у здоровых молодых женщин были на 83% и 113% соответственно выше, чем у молодых здоровых мужчин (18-45 лет). Значимых различий Сmах и AUCτ у здоровых пожилых мужчин и здоровых пожилых женщин (>65 лет) нет.
Необходимости коррекции дозы в зависимости от пола не отмечается. Концентрация в плазме у мужчин и женщин сходны.
Возраст
При повторном пероральном применении Сmах и AUCτ у здоровых пожилых мужчин (>65 лет) на 61%) и 86%о соответственно выше, чем у здоровых молодых мужчин (18-45 лет). Значимых различий Сmах и AUCτ у здоровых пожилых женщин (>65 лет) и здоровых молодых женщин (18-45 лет) нет. Безопасность вориконазола у молодых и пожилых пациентов одинакова, в связи с чем коррекция дозы в пожилом возрасте не требуется.
Средние равновесные концентрации препарата в плазме у детей, получающих препарат в дозе 4 мг/кг каждые 12 ч, сопоставима с таковыми у взрослых, получающих вориконазол в дозе 3 мг/кг каждые 12 ч. Средняя концентрация была — 1186 нг/мл у детей и 1155 нг/мл у взрослых. В связи с этим рекомендуемая поддерживающая доза у детей в возрасте от 2 до
Нарушение функции почек
При однократном приеме вориконазола внутрь в дозе 200 мг у пациентов с нормальной функцией почек и больных от легкого (клиренс креатинина 41-60 мл/мин) до тяжелого (клиренс креатинина У больных с умеренным или выраженным нарушением функции почек (сывороточные уровни креатинина >220 мкмоль/л, или 2,5 мг/дл) наблюдается кумуляция вспомогательного вещества, входящего в состав лиофилизата для приготовления раствора для инъекций — SBECD.
Нарушение функции печени
После однократного приема внутрь (200 мг) AUC вориконазола у больных с легким или умеренно тяжелым циррозом печени (Child-Pugh А и В) на 233% выше, чем у пациентов с нормальной функцией печени. Нарушение функции печени не влияет на связь вориконазола с белками плазмы.
При повторном пероральном применении AUCX вориконазола сопоставима у больных с умеренно выраженным циррозом печени (Child-Pugh В), получавших препарат в поддерживающей дозе 100 мг 2 раза в сутки, и пациентов с нормальной функцией печени, получающих вориконазол в дозе 200 мг 2 раза в сутки. Сведений о фармакокинетике у больных тяжелым циррозом печени (Child-Pugh С) нет.
Показания к применению
-
Инвазивный аспергиллез.
-
Кандидемия у пациентов без нейтропении.
-
Тяжелые инвазивные кандидозные инфекции (включая С. krusei).
-
Кандидоз пищевода.
-
Тяжелые грибковые инфекции вызванные Scedosporium spp. и Fusarium spp.
-
Другие тяжелые инвазивные грибковые инфекции при непереносимости или рефрактерное к другим лекарственным средствам.
-
Профилактика «прорывных» грибковых инфекций у пациентов со сниженной функцией иммунной системы лихорадкой и нейтропенией из групп высокого риска (реципиенты трансплантации гемопоэтических стволовых клеток больные с рецидивом лейкоза).
-
Профилактика инвазивных грибковых инфекций у пациентов (взрослых и детей старше 12 лет) группы высокого риска таких как реципиенты трансплантации гемопоэтических стволовых клеток.
Противопоказания
- Препарат Вифенд® противопоказан больным с гиперчувствительностью к вориконазолу или любому другому компоненту препарата.
-
Противопоказано одновременное применение Вифенда® и следующих препаратов: субстраты изофермента CYP3A4 — терфенадин астемизол цизаприд пимозид или хинидин; сиролимус; рифамиицин карбамазепин и длительно действующие барбитураты (фенобарбитал); рифабутин; эфавиренз в дозах 400 мг и выше один раз в сутки (с вориконазолом в стандартных дозах); ритонавир в высоких дозах (400 мг и выше два раза в сутки); алкалоиды спорыньи (эрготамин дигидроэрготамин) являющиеся субстратами изофермента CYP3A4; зверобой продырявленный (индуктор цитохрома Р450 и Р-гликопротеина).
-
Препарат Вифенд® противопоказан детям в возрасте младше 2 лет.
С осторожностью:
-
Повышенная чувствительность к другим препаратам — производным азолов.
-
Тяжелая степень недостаточности функции печени тяжелая степень недостаточности функции почек.
-
Вориконазол следует применять с осторожностью у пациентов с проаритмическими состояниями: врожденное или приобретенное увеличение интервала QT кардиомиопатия в особенности с сердечной недостаточностью синусовая брадикардия наличие симптоматической аритмии одновременный прием препаратов вызывающих удлинение интервала QT (см. раздел «Особые указания»).
-
Также следует соблюдать осторожность при применении препарата Вифенд® у пациентов с электролитными нарушениями такими как: гипокалиемия гииомагниемия и гипокальциемия.
Способ применения и дозы
Препарат Вифенд® не рекомендуется вводить в виде болюсных инъекций (струйно). Скорость инфузии не должна превышать 3 мг/кг/ч в течение 1-3 ч.
Перед началом терапии необходимо откорректировать такие электролитные нарушения как гипокалиемия гипомагниемия и гипокальциемия (см. раздел «Побочное действие»).
Взрослые пациенты
Назначение препарата Вифенд® следует начинать с внутривенного введения в рекомендуемой насыщающей дозе чтобы уже в первый день добиться адекватной концентрации в плазме крови. Внутривенное введение следует продолжать как минимум 7 дней после чего возможен переход на пероральный прием препарата при условии что пациент способен принимать лекарственные средства для приема внутрь. Учитывая высокую биодоступность препарата при приеме внутрь достигающую 96% (см. раздел «Фармакокинетика») при наличии клинических показаний можно переходить с внутривенного на пероральное применение препарата без коррекции дозы.
В таблице приведена подробная информация по дозированию препарата Вифенд®:
Подбор дозы для внутривенного введения
При недостаточной эффективности лечения поддерживающая доза препарата Вифенд® для внутривенного введения может быть увеличена до 4 мг/кг каждые 12 ч. Если пациент не переносит препарат в высокой дозе ее снижают до 3 мг/кг каждые 12 ч.
Длительность лечения должна быть как можно короче в зависимости от клинического эффекта и результатов микологического исследования. Длительность лечения не должна превышать 180 дней.
Профилактика у взрослых и детей
Профилактическое применение препарата следует начинать в день трансплантации и можно продолжать до 100 дней. Продлить профилактику до 180 дней после трансплантации можно только в случае продолжения иммуносупрессивной терапии или развития реакции «трансплантат против хозяина» (ТПХ). Безопасность и эффективность вориконазола при применении более 180 дней в клинических исследованиях надлежащим образом не изучались. Режим дозирования с целью профилактики такой же как и с целью лечения в соответствующих возрастных группах.
Нарушение функции почек
У больных со средней или тяжелой степенью почечной недостаточностью (клиренс креатинина < 50 мл/мин) наблюдается кумуляция вспомогательного компонента препарата бетадекса сульфобутилата натрия. Таким больным препарат Вифенд® следует назначать внутрь за исключением тех случаев когда предполагаемая польза внутривенного введения превышает потенциальный риск. В подобных ситуациях необходимо регулярно контролировать концентрацию креатинина и в случае его повышения следует обсудить возможность перехода на прием вориконазола внутрь.
Вориконазол выводится в ходе гемодиализа с клиренсом 121 мл/мин. 4-часовой сеанс гемодиализа не приводит к удалению значительной части дозы вориконазола и не требует ее коррекции. Бетадекса сульфобутилат натрия выводится в ходе гемодиализа с клиренсом 55 мл/мин.
Нарушение функции печени
При остром повреждении печени проявляющемся повышением активности «печеночных» трансаминаз: аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT) коррекция дозы не требуется но рекомендуется продолжать контроль показателей функции печени. Больным с легкими или среднетяжелыми нарушениями функции печени (классы А и В по классификации Чайлд-Пью) следует назначать стандартную насыщающую дозу препарата Вифенд® а поддерживающую дозу снижать в 2 раза. Больным с тяжелой степенью нарушения функции печени (класс С по классификации Чайлд-Пью) препарат Вифенд® следует назначать только в тех случаях когда ожидаемая польза превышает возможный риск и под постоянным контролем с целью выявления признаков токсического действия препарата.
Пожилые пациенты
Коррекции дозы у пожилых людей не требуется.
Применение у детей
Безопасность и эффективность вориконазола у детей младше 2 лет не установлены.
Режим дозирования вориконазола у детей (в возрасте от 2 до 12 лет) и подростков в возрасте от 12 до 14 лет и массой тела менее 50 кг:
|
|
|
|
|
|
|
|
|
|
|
|
Терапию рекомендуется начинать с внутривенного введения препарата а возможность перорального приема препарата Вифенд® следует рассматривать только после клинического улучшения и возможности пациента принимать пероральные лекарственные средства.
Следует принимать во внимание что воздействие препарата при внутривенном введении в дозе 8 мг/кг приблизительно в два раза выше чем при применении внутрь в дозе 9 мг/кг. Применение вориконазола у детей в возрасте от 2 до 12 лет с нарушениями функции печени или почек не изучалось.
У подростков (в возрасте от 12 до 14 лет с массой тела 50 кг или более; от 15 до 18 лет вне зависимости от массы тела) вориконазол дозируется так же как для взрослых.
Коррекция дозы
При неадекватном клиническом ответе пациента доза может быть увеличена с шагом 1 мг/кг (или 50 мг в случае если изначально применяли максимальную пероральную дозу 350 мг). В случае если ребенок не переносит лечение можно снизить дозу вориконазола с шагом 1 мг/мл (или 50 мг в случае если изначально применяли максимальную пероральную дозу 350 мг).
Инструкция по приготовлению раствора для инфузий
Препарат Вифенд® выпускается во флаконах для однократного применения. Содержимое флакона восстанавливают растворяя в 19 мл воды для инъекции и получают 20 мл прозрачного концентрата содержащего вориконазол в концентрации 10 мг/мл. Если растворитель не поступает во флакон под действием вакуума то флакон использовать нельзя. Перед применением необходимый объем концентрата (см. таблицу) прибавляют к рекомендуемому совместимому раствору для инфузии (см. ниже) и получают раствор содержащий вориконазол в концентрациях от 05 мг/мл до 5 мг/мл.
Препарат Вифенд® лиофилизат для приготовления раствора для инфузий представляет собой стерильный лиофилизат без консерванта предназначенный для однократного применения. С микробиологической точки зрения препарат следует вводить немедленно. Восстановленный раствор (концентрат) можно хранить не более 24 ч при температуре от 2 до 8 °С в том случае если он был приготовлен в контролируемых асептических условиях.
Концентрат можно далее разводить следующими растворами:
-
0,9% раствор натрия хлорида для внутривенного введения;
-
раствор Рингера лактата для внутривенного введения;
-
5% раствор декстрозы и раствор Рингера лактата для внутривенного введения;
-
5% раствор декстрозы и 0,45% раствор натрия хлорида для внутривенного введения;
-
5% раствор декстрозы для внутривенного введения;
-
5% раствор декстрозы и 0,15% раствор калия хлорида для внутривенного введения;
-
0,45% раствор натрия хлорида для внутривенного введения;
-
5% раствор декстрозы и 0,9% раствор натрия хлорида для внутривенного введения.
Совместимость вориконазола с другими растворами помимо указанных выше неизвестна.
Условия хранения
Лиофилизат для приготовления раствора для инфузий: при температуре не выше 30°С
Растворенный концентрат: при температуре от 2°С до 8°С .
Срок годности
2 года. Восстановленный раствор — не более 24 часов.
Особые указания
Забор проб для культурального и других лабораторных исследований (серология, гистопатология) с целью выделения и идентификации возбудителей следует производить до начала лечения. Терапия может быть начата до получения результатов культурального и других лабораторных исследований, однако при их наличии лечение следует соответствующим образом скорректировать.
Выделены клинические штаммы, обладающие сниженной чувствительностью к вориконазолу.
Однако повышенные минимальные подавляющие концентрации (МПК) не всегда позволяют предсказать клиническую неэффективность; известны случаи, когда вориконазол был эффективен у больных, инфицированных микроорганизмами, устойчивыми к другим азолам. Оценить корреляцию между активностью in vitro и клиническими результатами лечения трудно, учитывая сложность больных, которых включали в клинические исследования; значения пограничных концентраций вориконазола, позволяющих оценивать чувствительность к этому препарату, не установлены.
Гиперчувствительность: Больным с повышенной чувствительностью к другим азолам вориконазол следует назначать с осторожностью
Нежелательные явления со стороны сердечно-сосудистой системы: применение вориконазола связано с удлинением интервала QT на электрокардиограмме, что сопровождается редкими случаями мерцания-трепетания желудочков у пациентов, получающих терапию вориконазолом (у тяжелобольных пациентов с множественными факторами риска, как кардиотоксическая химиотерапия, кардиомиопатия, гипокалиемия и сопутствующая терапия, которые могли способствовать развитию данного осложнения). Пациентам с данными потенциально проаритмическими состояниями вориконазол должен назначаться с осторожностью.
Гепатотоксичность: При лечении вориконазолом наблюдаются нечастые (0,1-1%%) случаи серьезных реакций со стороны печени (включая проявляющийся клинически гепатит, холестаз и печеночноклеточную недостаточность, в том числе с летальным исходом). Нежелательные явления со стороны печени в основном наблюдаются у больных с серьезными заболеваниями (главным образом злокачественными опухолями крови). У больных без каких-либо факторов риска наблюдаются преходящие реакции со стороны печени, включая гепатит и желтуху. Нарушения функции печени обычно обратимы и проходят после прекращения лечения.
Мониторирование функции печени: Во время лечения вориконазолом рекомендуется регулярно контролировать функцию печени, особенно печеночные пробы и билирубин. При появлении клинических признаков болезни печени, которые могут быть связаны с вориконазолом, необходимо обсудить целесообразность прекращения терапии.
Нежелательные явления со стороны почек: У тяжелых больных, получающих вориконазол, наблюдаются случаи развития острой почечной недостаточности.
Мониторирование функции почек: Больных следует наблюдать с целью выявления признаков нарушения функции почек. Для этого необходимо проводить лабораторные исследования, в частности определять сывороточный уровень креатинина.
Инфузионные реакции: При внутривенном введении вориконазола наблюдаются инфузионные реакции, в основном «приливы крови к лицу» и тошнота. Если эти симптомы выражены, то следует обсудить целесообразность прекращения лечения.
Кожные реакции: В редких случаях при лечении вориконазолом у больных развиваются эксфолиативные кожные реакции, такие как синдром Стивенса-Джонсона. При появления сыпи больных следует наблюдать. При прогрессировании кожных поражений вориконазол целесообразно отменить.
Кроме того, применение вориконазола сопровождалось кожными реакциями фоточувствительности, особенно при длительном лечении. Во время лечения больным рекомендуется избегать интенсивного или длительного облучения прямым солнечным светом.
Циклоспорин и такролимус (субстраты CYP3A4): У больных, получающих циклоспорин или такролимус, может наблюдаться клинически значимое их взаимодействие с вориконазолом (см. Раздел Взаимодействие с другими препаратами и другие формы взаимодействия).
Фенитоин (субстрат CYP2C9 и мощный индуктор CYP450): при одновременном применении фенитоина с вориконазолом рекомендуется постоянное мониторирование уровней фенитоина. По возможности следует избегать одновременного применения вориконазола и фенитоина за исключением тех случаев, когда ожидаемая польза перевешивает возможный риск.
Рифабутин (индуктор CYP450): При одновременном применении рифабутина с вориконазолом рекомендуется проводить клинический анализ крови и контролировать нежелательные эффекты рифабутина (например, увеит). Одновременного назначения вориконазола и рифабутина следует избегать за исключением тех случаев, когда ожидаемая польза перевешивает возможный риск.
Описание
Противогрибковое средство.
Фармакодинамика
Вориконазол — это противогрибковый препарат широкого спектра действия, который принадлежит к группе антибиотиков триазольной структуры.
Механизм действия вориконазола связан с ингибированием деметилирования 14α-стерола, опосредованного грибковым цитохромом Р450; эта реакция является ключевым этапом биосинтеза эргостерола.
In vitro вориконазол обладает широким спектром противогрибковой активности и активен в отношении Candida spp. (включая штаммы С. krusei, устойчивые к флуконазолу, и резистентные штаммы С. glabrata и С. albicans), и обладает фунгицидным эффектом в отношении всех изученных штаммов Aspergillus sp. а также патогенных грибов, ставших актуальными в последнее время, включая Scedosporium или Fusarium, которые ограниченно чувствительны к существующим противогрибковым средствам.
Клиническая эффективность была продемонстрирована при инфекциях, вызванных Aspergillus spp., включая A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans, Candida spp., включая С. albicans, С. dubliniensis, С. glabrata, С. inconspicua, С. krusei, С. parapsilosis, С. tropicalis и С. guilliermondii, Scedosporium spp., включая S. apiospermum, S. prolificans и Fusarium spp.
Другие грибковые инфекции, при которых применялся препарат (часто с частичным или полным ответом), включали в себя отдельные случаи инфекций, вызванных Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidioides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp., включая P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis и Trichosporon spp., включая Т. beigelii.
In vitro продемонстрирована активность вориконазола в отношении клинических штаммов Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp., Histoplasma capsulatum. Рост большинства штаммов подавлялся при концентрациях вориконазола от 0,05 до 2 мкг/мл.
In vitro выявлена активность вориконазола в отношении Curvularia spp. и Sporothrix spp., однако клиническое ее значение неизвестно.
Побочные действия
Наиболее распространенными нежелательными реакциями являются зрительные нарушения, лихорадка, сыпь, рвота, тошнота, диарея, головная боль, периферические отеки и боль в животе. Нежелательные реакции обычно были легко или умеренно выражены.
Общие: лихорадка, периферические отеки (очень часто); ознобы, астения, боль в груди, реакции/воспаление в месте введения, гриппоподобный синдром (часто).
Сердечно-сосудистая система: снижение АД, тромбофлебит, флебит (часто); предсердные аритмии, брадикардия, тахикардия, желудочковая аритмия, наджелудочковая тахикардия, удлинение интервала QT, фибрилляция желудочков (редко); полная атрио-вентрикулярная блокада, блокада ножки пучка Гиса, узловые аритмии, желудочковая тахикардия (включая трепетание желудочков) (очень редко).
Пищеварительная система: тошнота, рвота, диарея, боль в животе (очень часто); повышение показателей функции печени (включая ACT, АЛТ, щелочную фосфатазу, гамма-ГТ, ЛДГ, билирубин), желтуха, хейлит, гастроэнтерит, холестатическая желтуха (часто); холецистит, холелитиаз, запор, дуоденит, диспепсия, увеличение печени, гингивит, глоссит, гепатит, печеночная недостаточность, панкреатит, отек языка, перитонит (редко); псевдомембранозный колит, печеночная кома (очень редко).
Эндокринная система: недостаточность коры надпочечников (редко); гипертиреоз, гипотиреоз (очень редко). Иммунная система: аллергические реакции, анафилактоидные реакции (редко).
Кровь и лимфатическая система: тромбоцитопения, анемия (в том числе макроцитарная, микроцитарная, нормоцитарная, мегалобластная, апластическая), лейкопения, панцитопения (часто); лимфаденопатия, агранулоцитоз, эозинофилия, синдром диссеминированного внутрисосудистого свертывания, угнетение костномозгового кроветворения (редко); лимфангит (очень редко).
Метаболизм и питание: гипокалиемия, гипогликемия (часто); гиперхолестеринемия (редко).
Скелетно-мышечная система: боль в спине (часто); артрит (редко).
Нервная система: головная боль (очень часто); головокружение, галлюцинации, спутанность, депрессия, тревога, тремор, ажитация, парестезии (часто); Атаксия, отек головного мозга, гипертония, гипостезия, нистагм, обморок (редко); Синдром Гиенна-Барре, глазодвигательный криз, экстрапирамидный синдром, бессонница, энцефалопатия, сонливость во время инфузии (очень редко).
Дыхательная система: респираторный дистресс синдром, отек легких, синусит (часто).
Кожа и подкожные ткани: сыпь (очень часто); зуд, макулопапулезная сыпь, кожные реакции фоточувствительности, алопеция, эксфолиативный дерматит, отек лица, пурпура (часто); фиксированная лекарственная сыпь, экзема, псориаз, синдром Стивенса-Джонсона, крапивница (редко); ангионевротический отек, дискоидная красная волчанка, многоформная эритема, токсический эпидермальный некролиз (очень редко).
Органы чувств: зрительные нарушения (включая нарушение/усиление зрительного восприятия, туман перед глазами, изменение цветного зрения, фотофобия) (очень часто); блефарит, неврит зрительного нерва, склерит, нарушение вкусового восприятия, диплопия (редко); кровоизлияние в сетчатку, помутнение роговицы, атрофия зрительного нерва, гипоакузия, звон в ушах (очень редко).
Мочеполовая система: повышение креатинина, острая почечная недостаточность, гематурия (часто); повышение остаточного азота мочевины, альбуминурия, нефрит (редко); некроз канальцев почек (очень редко).
Применение при беременности и кормлении грудью
Адекватной информации о применении вориконазола у беременных женщин нет.
Исследования на животных показали, что препарат в высоких дозах оказывает токсическое действие на репродуктивную функцию. Возможный риск для человека неизвестен.
Вориконазол не следует применять у беременных женщин за исключением тех случаев, когда ожидаемая польза для матери явно перевешивает возможный риск для плода.
Выведение вориконазола с грудным молоком не изучалось. Вориконазол не следует применять у женщин, кормящих грудью, за исключением тех случаев, когда ожидаемая польза явно перевешивает риск.
Взаимодействие
Вориконазол метаболизируется под действием изоферментов цитохрома Р450 — CYP2C19, CYP2C9 и CYP3A4. Ингибиторы или индукторы этих изоферментов могут вызвать, соответственно, повышение или снижение концентраций вориконазола в плазме.
При одновременном применении с рифампицином (индуктор CYP P450) в дозе 600 мг/сут Cmax и AUC вориконазола снижаются на 93% и 96% соответственно (такая комбинация противопоказана).
При одновременном применении с Вифендом, ритонавир (индуктор CYP P450, ингибитор и субстрат CYP3A4) в дозе 400 мг каждые 12 ч снижал Cmax в равновесном состоянии и AUC вориконазола, принимаемого внутрь, в среднем на 66% и 82% соответственно. Эффект более низких доз ритонавира на концентрации вориконазола пока не известен. Установлено, что повторное применение вориконазола внутрь не оказывает выраженного эффекта на Cmax в равновесном состоянии и AUC ритонавира, также принимаемого повторно (одновременное применение вориконазола и ритонавира в дозе 400 мг каждые 12 ч противопоказано).
При совместном применении с мощными индукторами CYP P450 карбамазепином или длительно действующими барбитуратами (фенобарбиталом) возможно значительное снижение Cmax вориконазола в плазме, хотя их взаимодействие не изучалось. Такая комбинация противопоказана.
При совместном применении с циметидином (неспецифический ингибитор CYP P450) в дозе 400 мг 2 раза/сут Cmax и AUC вориконазола повышаются на 18% и 23% соответственно (коррекции дозы Вифенда не требуется).
Ранитидин в дозе 150 мг 2 раза/сут при совместном применении не оказывает существенного влияния на Cmax и AUC вориконазола.
Эритромицин (ингибитор CYP3A4) при применении в дозе 1 г 2 раза/сут и азитромицин в дозе 500 мг 1 раз/сут не оказывают существенного влияния на Cmax и AUC вориконазола.
Вориконазол ингибирует активность изоферментов цитохрома P450 — CYP2C19, CYP2C9, CYP3A4, поэтому возможно повышение концентраций в плазме лекарственных средств, которые метаболизируются этими изоферментами.
При одновременном применении вориконазола с терфенадином, астемизолом, цизапридом, пимозидом и хинидином возможно значительное повышение их концентрации в плазме, что может привести к удлинению интервала QT и в редких случаях к развитию мерцания/трепетания желудочков (такая комбинация противопоказана).
При совместном применении вориконазол повышает Cmax и AUC сиролимуса (2 мг однократно) на 556% и 1014% соответственно (такая комбинация противопоказана).
При одновременном применении вориконазол может вызывать повышение концентрации алкалоидов спорыньи (эрготамина и дигидроэрготамина) в плазме и развитие эрготизма (такая комбинация противопоказана).
При совместном применении у пациентов, перенесших трансплантацию почки и находящихся в стабильном состоянии, вориконазол повышает Cmax и AUC циклоспорина, по крайней мере, на 13% и 70% соответственно, что сопровождается повышением риска развития нефротоксических реакций. При назначении вориконазола больным, получающим циклоспорин, рекомендуется уменьшить дозу циклоспорина вдвое и контролировать его уровни в плазме. После отмены вориконазола необходимо контролировать уровни циклоспорина и при необходимости увеличить его дозу.
При совместном применении вориконазол повышает Cmax и AUC такролимуса (применяемого в дозе 0.1 мг/кг однократно) на 117% и 221% соответственно, что может сопровождаться нефротоксическими реакциями. При назначении вориконазола больным, получающим такролимус, рекомендуется уменьшить дозу последнего до 1/3 и контролировать его уровни в плазме. После отмены вориконазола необходимо контролировать концентрацию такролимуса и при необходимости увеличить его дозу.
Одновременное применение вориконазола (в дозе 300 мг 2 раза/сут) и варфарина (30 мг 1 раз/сут) сопровождалось увеличением максимального протромбинового времени до 93%. При одновременном назначении варфарина и вориконазола рекомендуется контролировать протромбиновое время.
Вориконазол при совместном применении может вызывать повышение концентрации в плазме фенпрокумона, аценокумарола (субстраты CYP2C9, CYP3A4) и протромбинового времени. Если больным, получающим препараты кумарина, назначают вориконазол, необходимо контролировать протромбиновое время с короткими интервалами и соответствующим образом подбирать дозы антикоагулянтов.
При совместном применении вориконазол может вызывать повышение концентрации производных сульфонилмочевины (субстраты CYP2C9) — толбутамида, глипизида и глибенкламида в плазме и вызвать гипогликемию. При одновременном их применении необходимо тщательно контролировать уровни глюкозы в крови.
In vitro вориконазол ингибирует метаболизм ловастатина (субстрат CYP3A4). При совместном применении возможно повышение концентрации в плазме статинов, метаболизирующихся под действием CYP3A4, что может увеличить риск развития рабдомиолиза. При одновременном их применении рекомендуется оценить целесообразность коррекции дозы статина.
In vitro вориконазол ингибирует метаболизм мидазолама (субстрат CYP3A4). При совместном применении возможно повышение концентрации в плазме метаболизирующихся под действием CYP3A4 бензодиазепинов (мидазолама, триазолама, алпразолама) и развитие пролонгированного седативного эффекта. При одновременном применении этих препаратов рекомендуется обсудить целесообразность коррекции дозы бензодиазепина.
При совместном применении вориконазол может повысить содержание алкалоидов барвинка (субстраты CYP3A4) — винкристина, винбластина в плазме и привести к развитию нейротоксических реакций. Рекомендуется обсудить целесообразность коррекции дозы алкалоидов барвинка.
Вориконазол повышает Cmax и AUC преднизолона (субстрат CYP3A4), применяемого в дозе 60 мг однократно на 11% и 34% соответственно. Коррекция дозы не рекомендуется.
При одновременном применении вориконазол не оказывает существенного влияния на Cmax и AUC дигоксина, назначаемого в дозе 0.25 мг 1 раз/сут.
При совместном применении вориконазол не оказывает влияния на Cmax и AUC микофеноловой кислоты, назначаемой в дозе 1 г.
При одновременном применении с Вифендом, эфавиренз (индуктор CYP P450, ингибитор и субстрат CYP3A4), применяемый в дозе 400 мг 1 раз/сут в равновесном состоянии снижает Cmax и AUC вориконазола в среднем на 61% и 77% соответственно. Вориконазол в равновесном состоянии (400 мг внутрь каждые 12 ч в первый день, затем 200 мг внутрь каждые 12 ч в течение 8 дней) повышает равновесную Cmax и AUC эфавиренза в среднем на 38% и 44% соответственно (такая комбинация противопоказана).
При совместном применении фенитоин (субстрат CYP2С9 и мощный индуктор цитохрома P450), применяемый в дозе 300 мг 1 раз/сут, снижает Cmax и AUC вориконазола на 49% и 69% соответственно; а вориконазол (400 мг 2 раза/сут) повышает Cmax и AUC фенитоина на 67% и 81% соответственно (при необходимости совместного применения следует тщательно оценить соотношение предполагаемой пользы и потенциального риска комбинированной терапии, а также тщательно мониторировать уровни фенитоина в плазме).
При совместном применении рифабутин (индуктор цитохрома P450), применяемый в дозе 300 мг 1 раз/сут снижает Cmax и AUC вориконазола (200 мг 1 раз/сут) на 69% и 78% соответственно. При совместном применении с рифабутином Cmax и AUC вориконазола (350 мг 2 раза/сут) составляет соответственно 96% и 68% от показателей при монотерапии вориконазолом (200 мг 2 раза/сут). При применении вориконазола в дозе 400 мг 2 раза/сут Сmax и AUC соответственно на 104% и 87% выше, чем при монотерапии вориконазолом в дозе 200 мг 2 раза/сут. Вориконазол в дозе 400 мг 2 раза/сут повышает Cmax и AUC рифабутина на 195% и 331% соответственно. При одновременном лечении рифабутином и вориконазолом рекомендуется регулярно проводить развернутый анализ картины периферической крови и контролировать нежелательные эффекты рифабутина (например, увеит).
При совместном применении в дозе 40 мг 1 раз/сут омепразол (ингибитор CYP2C19; субстрат CYP2C19 и CYP3A4) повышает Cmax и AUC вориконазола на 15% и 41% соответственно, а вориконазол повышает Cmax и AUC омепразола на 116% и 280% соответственно (следовательно, коррекции дозы вориконазола не требуется, а дозу омепразола следует уменьшить вдвое). Следует учесть возможность лекарственного взаимодействия вориконазола с другими ингибиторами Н+-К+-АТФ-азы, которые являются субстратами CYP2C19.
Индинавир (ингибитор и субстрат CYP3A4), применяемый в дозе 800 мг 3 раза/сут не оказывает существенного влияния на величину Cmax и AUC вориконазола, а вориконазол не влияет на Cmax и AUC индинавира.
При одновременном применении с другими ингибиторами протеазы ВИЧ (субстраты и ингибиторы CYP3A4) следует тщательно контролировать состояние пациента с целью возможных токсических эффектов, т.к. исследования in vitro показали, что вориконазол и ингибиторы протеазы ВИЧ (саквинавир, ампренавир, нелфинавир) могут взаимно ингибировать метаболизм друг друга.
При совместном применении вориконазола с ненуклеозидными ингибиторами обратной транскриптазы (субстраты CYP3A4, ингибиторы или индукторы цитохрома P450) следует учитывать, что эфавиренз и невирапин могут индуцировать метаболизм вориконазола, а делавердин и эфавиренз — ингибировать его; вориконазол, в свою очередь, может подавлять метаболизм ингибиторов обратной транскриптазы. При одновременном применении вориконазола с ненуклеозидными ингибиторами обратной транскриптазы больных следует наблюдать с целью выявления возможных токсических эффектов.
Передозировка
Известно о трех случаях случайной передозировки. Все упомянутые случаи произошли у детей которым внутривенно была введена доза вориконазола в пять раз превышающая рекомендованную.
Имеется сообщение о единичном случае фотофобии продолжительностью 10 минут.
Антидот вориконазола неизвестен. В случае передозировки показана симптоматическая и поддерживающая терапия.
Вориконазол выводится в ходе гемодиализа с клиренсом 121 мл/мин. бетадекса сульфобутилат натрия — с клиренсом 55 мл/мин. 13 случае передозировки гемодиализ может способствовать выведению вориконазола и бетадекса сульфобутилата натрия из организма.
Влияние на способность к вождению автотранспорта и управлению механизмами
Вориконазол может вызвать преходящие и обратимые нарушения зрения, включая туман перед глазами, нарушение/усиление зрительного восприятия и/или фотофобию. При наличии таких симптомов пациенты должны избегать выполнения потенциально опасных действий как, например, управления автомобилем или использования сложной техники. При приеме вориконазола пациенты не должны водить автомобиль по ночам.