Federal law restricts this drug to use by or on the order of a licensed veterinarian.
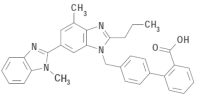
SEMINTRA (telmisartan oral solution) is a clear, colorless to yellowish viscous solution containing 10 mg/mL telmisartan. Telmisartan is an orally active, non-peptide, selective angiotensin II subtype 1 (AT1) receptor blocker. The chemical name of telmisartan is 4’ — [(1,4’ — dimethyl — 2’propyl[2,6’ — bi — 1H — benzimidazol] — 1’ — yl)methyl] — [1,1’ — biphenyl] — 2 — carboxylic acid. Its empirical formula is C33H30N4O2, its molecular weight is 514.63, and its structural formula is:
Indication: SEMINTRA is indicated for the control of systemic hypertension in cats.
Dosage and Administration
Always provide the Client Information Sheet with each prescription.
The initial dose of SEMINTRA is 1.5 mg/kg (0.68 mg/lb) orally twice daily for 14 days, followed by 2 mg/kg (0.91 mg/lb) orally once daily. The dose may be reduced by 0.5 mg/kg (0.23 mg/lb) increments to a minimum of 0.5 mg/kg (0.23 mg/lb) orally once daily to manage SEMINTRA-induced hypotension. SEMINTRA can be administered directly into the mouth, or next to or on top of a small amount of food. Do not mix into food.
SEMINTRA should be administered using the dosing syringe provided in the package. The dosing syringe fits onto the bottle and has 0.1 mL incremental marks. The dose should be rounded to the nearest 0.1 mL. After administration close the bottle tightly with the cap. Rinse the dosing syringe with water and let air dry.
If the cat vomits within 30 minutes of dosing, the cat may be re-dosed.
Information for Cat Owners
Always provide the Client Information Sheet with each prescription and review it with the cat owner. Advise cat owners that adverse reactions can occur with use of SEMINTRA. The most common adverse reactions reported during the field studies included vomiting, diarrhea, lethargy, weight loss, anemia and dehydration.
Contraindications
Do not use in cats with a hypersensitivity to telmisartan.
Human Warnings: Not for human use. Keep out of reach of children.
SEMINTRA is an angiotensin II antagonist/angiotensin receptor blocker (ARB). Pregnant women should avoid contact with SEMINTRA because substances that act on the renin-angiotensin-aldosterone system (RAAS) such as angiotensin receptor blockers (ARBs) can cause fetal and neonatal morbidity and death during pregnancy in humans.
Precautions
SEMINTRA has not been evaluated in cats with systolic blood pressure >200 mm Hg.
SEMINTRA can cause mild anemia or non-regenerative anemia. Cats should be monitored for anemia when initiating treatment with SEMINTRA.
SEMINTRA may cause inappetence and weight loss in some cats. Cats should be monitored for weight loss when initiating treatment with SEMINTRA. Use with caution in cats with a history of vomiting, inappetence or weight loss.
The safe use of SEMINTRA in cats with hepatic disease has not been evaluated. SEMINTRA is metabolized by the liver.
The safe use of SEMINTRA has not been evaluated in cats less than 9 months of age.
The safe use of SEMINTRA has not been evaluated in cats that are pregnant, lactating, or intended for breeding. See Human Warnings.
The safe use with other anti-hypertensive medications has not been evaluated.
Adverse Reactions
28-day Field Effectiveness Study
Safety was evaluated in a 28-day field study in 288 cats (192 SEMINTRA group cats, 96 control group cats) that received at least one dose of study drug. The control product was a vehicle control without telmisartan. Cats enrolled in the study had a median age of 14 years (7-20 years), and weighed 1.93-11.4 kg. SEMINTRA was administered orally at 1.5 mg/kg twice daily for 14 days, then 2 mg/kg once daily until study end; the control was administered at a volume equivalent to SEMINTRA. One hundred fourteen (59.4%) SEMINTRA group cats and 42 (43.8%) control group cats had at least one adverse reaction. Adverse reactions that occurred in at least 5% of either treatment group are presented in Table 1 below.
Table 1 Adverse Reactions in the 28-Day Field Study a
|
Clinical Sign |
SEMINTRA |
Control |
|
Vomiting |
46 (24.0%) |
14 (14.6%) |
|
Diarrhea |
18 (9.4%) |
4 (4.2%) |
|
Lethargy |
13 (6.8%) |
3 (3.1%) |
|
Weight loss |
13 (6.8%) |
5 (5.2%) |
|
Decreased appetite/inappetence |
13 (6.8%) |
7 (7.3%) |
|
Non-regenerative anemia |
11 (5.7%) |
2 (2.1%) |
|
Dehydration |
10 (5.2%) |
4 (4.2%) |
|
Retinal lesions (target organ damage) |
4 (2.1%) |
6 (6.3%) |
Additional adverse reactions that occurred in <5% of the SEMINTRA group included (in order of decreasing frequency): anorexia, gagging, arrhythmia, cough, heart murmur, and regenerative anemia. Additional adverse reactions representing 2-5% of the control group included azotemia, not drinking and renal failure.
Seven cats (five SEMINTRA and two control) either died or were euthanized during the study. None of the SEMINTRA group deaths were considered related to treatment.
5-month Field Effectiveness And Safety Study
The long-term safety of SEMINTRA was evaluated in an open label, 5 month field effectiveness and safety study in 107 cats that received at least one dose of SEMINTRA. Cats enrolled in the study had a mean age of 14.1 years (7-20 years) and weighed 1.92-11.4 kg. SEMINTRA was administered orally at 2 mg/kg once daily. Ninety-four cats (87.9%) had at least one adverse reaction during the study. Adverse reactions that occurred in at least 5% of cats are presented in Table 2 below.
Table 2 Adverse Reactions in the 5-Month Studya
|
Clinical Sign |
SEMINTRA |
|
Weight loss |
37 (34.6%) |
|
Vomiting |
32 (29.9%) |
|
Dehydration |
18 (16.8%) |
|
Non-regenerative anemia |
17 (15.8%) |
|
Anorexia |
14 (13.1%) |
|
Diarrhea |
12 (11.2%) |
|
Lethargy |
12 (11.2%) |
|
Decreased appetite/inappetence |
11 (10.3%) |
|
Heart murmur |
10 (9.3%) |
|
Death, Euthanasia, Found dead |
9 (8.4%) |
|
Cough |
8 (7.5%) |
|
Retinal lesions (target organ damage) |
6 (5.6%) |
Adverse reactions representing <5% of the study population were (in order of decreasing frequency): elevated liver enzymes, renal failure, tachycardia, arrhythmia, azotemia, depression, loose stool, constipation, gagging, hypotension, regenerative anemia, renal insufficiency, and vocalization.
Nine cats died or were euthanized during the study. Three cats had progressive chronic kidney disease that may have been affected by telmisartan treatment, concurrent disease, or inadequate control of hypertension. The other six cats died of causes unrelated to treatment (e.g. neoplasia).
To report suspected adverse drug events, for technical assistance, or to obtain a copy of the Safety Data Sheet (SDS), contact Boehringer Ingelheim Vetmedica, Inc. at 888-637-4251. For additional information about adverse drug experience reporting for animal drugs, contact FDA at 1-888-FDA-VETS or at http://www.fda.gov/reportanimalae.
Clinical Pharmacology
Telmisartan is a selective angiotensin II subtype AT1 receptor blocker, with no relevant affinity for other receptors in general receptor-binding assays. Telmisartan is metabolized to the 1-0-acylglucuronide of telmisartan, which, in cats treated for 6 days at 1 mg/kg, was shown to be present in the plasma at levels approximately 21% of that of unchanged parent compound.
Following an oral dose of 1 mg/kg telmisartan once daily for five days, the time to reach mean peak plasma concentration (Tmax) was 21 minutes and 32 minutes for fasted and fed cats, respectively. There was a higher systemic exposure to telmisartan in the fasted cats based on the maximum concentration (Cmax) and area under the concentration vs time curve (AUC). The mean terminal elimination half-life was approximately 8 hours. The mean systemic exposure of telmisartan (Cmax and AUC) was approximately 60% lower for female cats compared to male cats. However, dose adjustment for female cats is not necessary. An increase in dose from 1 to 5 mg/kg once daily resulted in a greater than proportional increase in telmisartan exposure. There could be low to moderate accumulation of drug upon repeated once daily or twice daily administrations of 1.5-2 mg/kg.
Effectiveness
Effectiveness was demonstrated in a 28-day multi-center, controlled, randomized and masked field study in client-owned cats with hypertension, and in an open-label 5-month field study.
28-day Field Study
In the 28-day study, 288 cats with hypertension (systolic blood pressure [SBP] 160-200 mmHg) were enrolled in the study and randomized to treatment with SEMINTRA (telmisartan oral solution) (n=192) or vehicle control (n=96).
The study population included cats with hypertension associated with chronic kidney disease or controlled hyperthyroidism, or idiopathic hypertension. The per protocol population for effectiveness was 141 SEMINTRA treated cats and 79 control cats. SEMINTRA was administered orally at 1.5 mg/kg twice daily for 14 days, then 2 mg/kg once daily until study end; the vehicle control was administered at a mL/kg volume equivalent to SEMINTRA. The two primary variables for effectiveness were comparison of the SEMINTRA and control group mean SBP (mSBP) from baseline to Day 14, and a decrease in mSBP >20 mmHg in the SEMINTRA group from baseline to Day 28. Cats with SBP >180 mmHg at Days 14 or 28 were rescued and removed from the study. There was a statistically significant difference between the mSBP for the SEMINTRA group compared to the control group at Day 14 (p=0.0005). At Day 14 the SEMINTRA group mSBP decreased by 23.2 mmHg, and the control group mSBP decreased by 7.3 mmHg. At Day 28, the SEMINTRA group mSBP decreased 23.9 mmHg compared to baseline.
5-month Field Study
One hundred-seven cats from the SEMINTRA group that had successfully completed the 28-day study were enrolled in a 5-month open label study. At the beginning of the 5-month study most cats were administered SEMINTRA at 2 mg/kg once daily. Cats that experienced hypotension (defined as SBP <120 mmHg) at 2 mg/kg once daily could have the SEMINTRA dose reduced to 1 mg/kg once daily. Cats that experienced hypotension at 1 mg/kg once daily could have the SEMINTRA dose reduced again to 0.5 mg/kg once daily. Cats were evaluated for SBP, target organ damage (TOD; primarily assessed by retinal photographs), clinical pathology and adverse reactions. SBP was measured on Days 28, 56, 98, 140 and 182 and retinal photographs and clinical pathology were collected on Days 28, 98 and 182. Seventy-three (68.2%) cats completed the study (Day 182), 8 cats were removed for hypertension (SBP >180 mmHg), 2 cats were removed for hypotension, 10 cats were removed by the owner or for owner noncompliance, 8 cats were removed for new or worsening TOD, and 6 cats were removed for adverse reactions unrelated to TOD. Twenty-six cats had dose reductions to 1 mg/kg once daily to manage hypotension. Of these 26 cats, 10 had an additional dose reduction to 0.5 mg/kg once daily.
Table 3 Distribution of Cats by SBP Range and Study Day in the 5-Month Studya
|
SBP Range (mm Hg) |
Basline |
Day 28 |
Day 56 |
Day 98 |
Day 140 |
Day 182 |
|
≤ 150 |
0 (0%) |
58 (54.2%) |
55 (53.9%) |
61 (67%) |
44 (55%) |
41 (59.4%) |
|
>150-160 |
4 (3.7%) |
19 (17.8%) |
19 (18.6%) |
17 (18.7%) |
21 (26.2%) |
16 (23.2%) |
|
>160-170 |
38 (35.5%) |
18 (16.8%) |
14 (13.7%) |
10 (11%) |
12 (15%) |
7 (10.1%) |
|
>170-180 |
28 (26.2%) |
12 (11.2%) |
10 (9.8%) |
2 (2.2%) |
3 (3.8%) |
4 (5.8%) |
|
> 180 |
37(34.6%) |
0 (0%) |
4 (3.9%) |
1 (1.1%) |
0 (0%) |
1 (1.5%) |
a SBP obtained at unscheduled visits are not represented. Cats that were removed for missing >3 doses prior to SBP measurement are not included.
The most commonly used concomitant treatments during the 5-month study included (in order of frequency) antibiotics, anesthesia/sedatives/analgesia, nutritional supplements, vaccines, prescription diets, antiparasitics, thyroid treatment, antiemetics and fluid therapy.
Animal Safety: In a six-month target animal safety study, healthy cats 9 to 13 months old were administered telmisartan orally, once daily at 0, 1, 3, or 5 mg/kg body weight.
Control cats (0 mg/kg) received saline at a volume equal to the 5 mg/kg dose. There were eight cats per group (4 males, 4 females).
All cats survived the study, and there were no telmisartan-related effects on clinical observations, physical examination, body weight, ophthalmic examination, coagulation parameters, urinalysis, and gross necropsy.
Blood pressure was lower in the groups administered telmisartan compared to the control group. Blood pressure was lower starting at week 4 in the 1 mg/kg group, at week 2 in the 3 mg/kg group, and during the first week in the 5 mg/kg group. This is an expected pharmacologic effect of telmisartan. Food consumption in the 3 and 5 mg/kg group cats was lower than that of the control group.
Telmisartan-related effects on hematology parameters included lower red blood cell count, hemoglobin, hematocrit, and reticulocytes in the 3 and 5 mg/kg group cats. One 5 mg/kg group cat also had mild generalized depletion of the hematopoietic cells on bone marrow histology. In some 5 mg/kg group cats, decreases in red blood cell precursors on bone marrow cytology were considered telmisartan-related.
Blood urea nitrogen (BUN) was statistically significantly higher for the 3 mg/kg group at weeks 12 and 16, and for the 5 mg/kg group at weeks 2, 4, 7, 12, 16, 20, and 25, when compared to the control group. There were no clinical signs associated with the changes in BUN.
There was a telmisartan-related effect on lower heart weight in the 3 and 5 mg/kg groups compared to the control group, but the histopathology was normal in all treated cats. On kidney histology, there was minimal to mild hypertrophy of the juxtaglomerular apparatus in the 1, 3, and 5 mg/kg group cats. Kidney histology was normal in control group cats.
Storage Conditions: Store at or below 25°C (77°F) with excursions permitted up to 40°C (104°F). Once the bottle is opened, use the contents within six months.
How Supplied
SEMINTRA (telmisartan oral solution), 10 mg/mL, 35 mL fill volume, is supplied in a 45 mL plastic bottle with a dosing syringe.
NDC 0010-4492-01
Approved by FDA under NADA # 141-501
Manufactured for: Boehringer Ingelheim Animal Health USA Inc., Duluth, GA 30096
Made in Spain
SEMINTRA is a registered trademark of Boehringer Ingelheim Vetmedica GmbH, used under license.
© 2019 Boehringer Ingelheim Animal Health USA Inc.
All Rights Reserved.
Revised 11/2019
159591-002
449201-01
CPN: 1028316.2
Роман-А. Леонард,
к.в.н., практикующий ветеринарный врач, президент Российской научно-практической ассоциации ветеринарных нефрологов и урологов (НАВНУ, www.vetnefro.ru)
Введение
Последние десятилетия ознаменовались катастрофическим ростом числа кошек, страдающих от хронических асептических нефропатий (ХАН), прежде всего гломерулярного ряда в дебюте заболевания. Значительно усугубилась тяжесть первичного поражения, а также скорость течения воспалительных реакций в почечной паренхиме и неизбежность их итога — процессов ренальной деструкции (фатальной репарации, склерозирования и т. д.). Также следует отметить, что эта группа заболеваний существенно «помолодела». И значительное число кошек, особенно породистых, имеют те или иные клинические проявления хронической почечной недостаточности (ХПН) уже в молодом возрасте, а то и вовсе погибают от её последствий.
Неизбежным исходом всех ХАН у кошек и собак, вне зависимости от того, какие структуры нефрона были поражены первоначально, является хроническая болезнь почек (ХБП). Кроме прочего, эта патология характеризуется поражением подавляющего большинства как форменных элементов почки, так и — в последующем — стромы этого органа с финалом в виде тотального нефросклероза. (Поскольку форменный элемент почки — структура и физиологически, и анатомически замкнутая, то вне зависимости от того, какой тропизм имеет первоначальное повреждение, в патологические процессы неизбежно вовлекаются и все остальные участки нефрона).
В течении ХБП выделяют два основных этапа: доклинический и клинический. Принципиальное различие этих двух этапов почечного континуума не только в отсутствии или наличии, соответственно, очевидных изменений в общем состоянии пациента, напрямую связанных с масштабом почечной деструкции (снижения скорости клубочковой фильтрации (СКФ) и исчерпанием компенсаторного резерва этого органа. Для клинициста значимым отличием является также возможность/рациональность проведения различных видов терапии, её эффективность и прогноз заболевания (качество жизни и время дожития пациента).
На доклиническом этапе в арсенале врача имеются прежде всего различные средства нефропротективной (т. е. этиопатогенетической) терапии и время для её подбора каждому конкретному пациенту. А вот лавинообразно нарастающие клинические проявления ХБП свидетельствуют о том, что возможность лечения заболевания всё больше и больше будет скатываться к симптоматической и заместительной терапии (эффективность которой уже по определению не может быть высока). Кроме того, катастрофически сужается круг препаратов, которые могут быть назначены пациенту. Последнее связано прежде всего с тем, что подавляющее большинство лекарственных средств метаболизируются и/или экскретируются почками, что при патологии последних делает их фармакодинамику, фармакокинетику и терапевтические эффекты плохо предсказуемыми. Мало того, многие препараты, на доклиническом этапе ХБП проявляющие те или иные нефропротективные свойства, на клиническом обычно приобретают ряд значимых нефротоксичных эффектов.
Поэтому, о каком бы этапе ХБП ни шла бы речь, важными факторами являются как нефропротективные свойства препарата, так и минимальный уровень его нефротоксичности. Очевидно, что на клиническом этапе почечного континуума последняя характеристика для применяемых лекарственных средств является даже более значимой, поскольку принцип «не навреди» в этом случае как нельзя актуален.
Данная статья посвящена механизмам нефро- и кардиопротективного действия, терапевтической эффективности, фармакодинамики и фармакокинетики блокатора рецепторов первого типа к ангиотензину II (блокатор рецепторов ангиотензина — БРА) — телмисартана. Рассмотрена возможность и целесообразность его использования на различных этапах ХАН как монотерапии, так и в комбинации с иными нефро- и кардиопротективными средствами.
РААС1 и её роль в патогенезе хронических асептических нефропатий
Общепризнано, что поражение фильтрационного барьера в частности и гломерулярного аппарата почки в целом (неотъемлемая часть всех хронических асептических нефропатий) всегда сопряжено с компенсаторным повышением активности РААС. И если при ХАН у врача нет веских оснований считать, что у пациента РААС не гиперактивирована, то он обязательно должен считать её гиперактивированной.
Увеличение выработки одного из важнейших компонентов РААС, октапептидного гормона ангиотензина II (АТ II), прямо (например, через вазоконстрикцию) или косвенно (например, через участие в процессах пролиферации, неспецифического воспаления и инициации выработки других нейрогуморальных субстанций) активирует целый ряд патогенетических механизмов в гломерулах и тубулоинтерстиции. В результате порочный круг заболевания охватывает весь нефрон целиком.
РААС глубоко вовлекается в патофизиологию ХАН и ХБП вне зависимости от уровня системного артериального давления. Связано это с тем, что интраренальная РААС способна активно функционировать как на клеточном, так и на молекулярном уровне в автономном режиме.
Кроме того, в патогенез ХБП рано или поздно вовлекаются и другие системы организма, прежде всего сердечно-сосудистая. Во-первых, сердце и эндотелий сосудов являются мишенью для системной гипертензии любого генеза (так же, как глазное дно и сами почки), в том числе и ренального. Во-вторых, патогенезы нефро- и кардиопатий имеют много общих черт (например, выраженная эндотелиальная дисфункция2), что стремительно приводит к формированию рено-кардиального/кардио-ренального континуумов и к замыканию патогенезов заболеваний в единый порочный круг. В том числе и поэтому многие препараты, традиционно относимые к гипотензивным средствам и кардиопротекторам, проявляют выраженные нефропротективные свойства (хотя об этом, правду сказать, в аннотациях указывается далеко не всегда3).
Так, например, на заключительных этапах почечного континуума вследствие совместно прогрессирующей почечной и кардиальной дисфункции часто происходит патологическое перераспределение жидкости в организме (прежде всего гидроторакс и гидроперикард, часто регистрируемый на фоне гиповолемии организма пациента в целом) и гибель животных от тяжёлой дыхательной и сердечной недостаточности. Такой сценарий развития событий на клиническом этапе ХБП особенно характерен для кошачьих. Причём в этом случае у пациента необязательно может быть формально диагностирована терминальная (IV по классификации IRIS4) стадия ХБП.
Но следует учитывать, что РААС имеет не только вазоконстрикционное/гипертензивное (пролиферативное или антидиуретическое), но и вазодилатирующее/гипотензивное (антипролиферативное или диуретическое) звено. Поэтому неселективное воздействие на высокие отделы РААС (например, использованием ингибиторов ангиотензинпревращающего фермента (иАПФ)) может быть недостаточно эффективным или даже иметь целый ряд негативных последствий для пациента (например, усугубление тяжести нефротоксической протеинурии, гипостенурии, клинических проявлений нефропатии и т. д.).
Фатальная репарация
Нарушение целостности капиллярных петель клубочка запускает процессы репарации (инициатором или по крайней мере важным участником которых является фенестрированный эндотелий), идентичные для любых других сосудов в организме. Но следует учитывать, что механизмы восстановления целостности, характерные для сосудистой системы в целом и призванные купировать кровопотерю, в петлях клубочка не только приводят к исключению части фильтрационного барьера из процессов мочеобразования, но и инициируют деструкцию рядом расположенных участков. Причём патогенез этого процесса очень скоро входит в режим порочного круга. И если поражение, что почти всегда бывает при гломерулонефритах, имеет массивный характер, то и репарация капиллярных петель начинает приобретать для почки в целом фатальный характер.
Строение и функции РААС
РААС — это система ферментов и гормонов, принимающая участие в регулировании артериального (в т. ч. и внутриклубочкового) давления и водно-электролитного баланса у млекопитающих. При различных кардио- и нефропатиях доказана значимая роль РААС в процессах:
— клеточной пролиферации и гипертрофии (на почечном уровне это проявляется такими значащими и необратимыми патологическими изменениями, как гиперклеточность и гипертрофия клубочков);
— склерозирования (в т. ч. гломеруло- и нефросклероза);
— воспалительных (в т. ч. аутоиммунных) реакциях на местном и системном уровнях.
Деятельность РААС регулируется симпатической и ЦНС и тесно связана с работой других вазоактивных систем, таких как симпато-адреналовая и калликреин-кининовая.
Одним из самых значимых нейрогормонов в организме животных и человека считается ангиотензин II (АТ II), представляющий собой центральное звено РААС и являющийся одним из самых сильных вазопрессорных веществ в организме5. В норме выработка АТ II в почечной паренхиме зависит от режима её кровоснабжения и функциональной активности.
Также АТ II прямо (воздействуя на тубулярный эпителий) или косвенно (стимулируя секрецию альдостерона) способен эффективно регулировать избирательную реабсорбцию Na+, К+ и Н2О в канальцах, оказывая этим значительное влияние на водно-солевой гомеостаз.
В упрощённом виде каскад выработки БАВ РААС можно представить следующим образом. Ангиотензиноген, вырабатываемый клетками печени под воздействием ренина, продуцируемого юкстагломерулярным аппаратом почек, превращается в АТ I, который, в свою очередь, расщепляется АПФ (кининазой II) и трансформируется в АТ II, который затем стимулирует синтез и секрецию минералокортикоида альдостерона (схема 1).
Продолжительное время существовало представление о том, что вовлечение почек в патогенез гипертонической болезни в целом и нефрогенной гипертензии в частности связано прежде всего с нарушением внутрипочечного кровообращения и снижением СКФ. Однако в ряде исследований почечного кровотока при гипертонической болезни и хронической асептической нефропатии не было выявлено прямой зависимости между объёмом внутрипочечного кровотока и уровнем кровяного давления. Таким образом, прямое патогенетическое значение ишемии первичной микрокапиллярной сети почек не может считаться установленным фактом не только для гипертонической болезни в целом, но даже и для нефрогенной гипертензии в частности. Подтверждением этого может служить и то, что у животных с ХБП нет прямой связи между степенью ХПН и уровнем системной гипертензии. Так, например, у пациентов, находящихся на финальных стадиях почечного континуума, может и не регистрироваться стойкое повышение кровяного давления.
Выделяют плазменный (циркуляторный) и тканевый (местный) компоненты РААС, работа которых осуществляется независимо друг от друга.
Плазменный компонент реализует свои эффекты в течение нескольких секунд после поступления активирующих его стимулов (компоненты РААС, вырабатываемые эндотелием сосудов при повреждении, принимают активное участие в процессах гемостаза), но сохраняет своё действие непродолжительное время. Тканевый, напротив, в полном объёме вступает в работу в течение нескольких часов, но реализует свои эффекты продолжительное время.
Осуществление тех или иных эффектов гормонов (и нейрогормоны РААС не являются в данном случае исключением) возможно только при воздействии их на свои рецепторы, находящиеся на поверхности клеток различных тканей.
Длительное время считалось, что АТ II имеет только рецепторы одного, первого типа (АТ1), через которые и реализуются его вазоконстрикционные, пролиферативные и антидиуретические эффекты. А цепочка превращений ангиотензиногена печени заканчивается на АТ II. Но исследования последних десятилетий выявили рецепторы к АТ II второго (АТ2), а затем третьего и четвёртого типов. Также на сегодняшний день открыты АТ III–XII, и это, по всей видимости, далеко не предел.
Неожиданностью для исследователей стало и то, что воздействие на свои рецепторы второго типа АТ II приводит к диаметрально противоположным эффектам — тем, которые возникали при взаимодействии с рецепторами первого (схема 1). А АТ IV, например, в малых концентрациях воздействовал только на свои рецепторы и вызывал эндотелийзависимую дилатацию сосудов, а в высоких — уже на рецепторы первого типа к АТ II и обусловливал вазопрессорные явления.
Установлено, что как АТ1, так и АТ2-рецепторы широко представлены во многих тканях организма. Однако число АТ2 резко возрастает (иногда даже превышая количество рецепторов первого типа) в повреждённых тканях и при необходимости репарационных процессов (в т. ч. в при нарушении целостности фильтрационного барьера почки тем или иным иммунным или неиммунным механизмом, при процессах фатальной репарации и т. д.).
При ХБП гиперактивация тканевого, а затем и плазменного компонентов РААС приобретает не только хронический характер, но и начинает работать в режиме порочного круга. При этом не только повышается количество активных молекул РААС, прежде всего АТ II и альдостерона, но и многократно усиливаются эффекты, которые они производят, воздействуя на свои рецепторы различного типа (схема 1).
Схема 1. РААС, CAC и KKC у собак и кошек
Роль РААС в патогенезе хронической асептической нефропатии и ХБП
Среди «неиммунных» механизмов прогрессирования поражения почечной паренхимы при хронических гломерулонефритах (ХГН) ведущая роль принадлежит следующим процессам:
— гемодинамическим нарушениям в первичной микрокапиллярной сети почек, приводящим к внутриклубочковой гипертензии и гиперфильтрации из-за вазоконстрикции приносящих и в ещё большей степени выносящих артериол клубочка;
— пролиферации и/или гипертрофии большинства резидентных клеток клубочка;
— протеинурии, имеющей прямое токсическое воздействие на канальцевый аппарат.
Все эти процессы прямо или косвенно связаны с гиперактивацией РААС и прежде всего с увеличением уровня и активности АТ II, а итогом их является инициация и поддержание процессов фатальной репарации в микрокапиллярных петлях клубочка и гломеруло- и нефросклероз.
При хронической асептической нефропатии и ХБП патологическое повышение уровня АТ II в почечной паренхиме и увеличение интенсивности его воздействия на АТ1 также приводит к:
— выраженной эндотелиальной дисфункции первичной микрокапиллярной сети почек (что не только усугубляет вазоконстрикцию, но и стремительно приводит к её хронизации);
— ремоделированию почечных артерий;
— интенсификации оксидантного стресса и дефициту мощнейшего вазодилататора оксида азота;
— асептическому воспалению (в котором активное участие принимают агранулоциты, «руководимые» провоспалительными цитокинами).
Важнейшая роль принадлежит АТ II в необратимых процессах гломеруло- и нефросклероза ещё и потому, что он является ключевым трофическим фактором пролиферации гладкомышечных клеток сосудов и близких к ним мезангиальных клеток почечных клубочков (что является одной из причин гиперклеточности клубочка, сдавливания его капиллярных петель и нарушения гломерулярной гемодинамики) и через TNG-β (трансформирующий фактор роста β) способствует повышению синтеза соединительной ткани и накоплению коллагенового матрикса. Также АТ II индуцирует синтез остеопонтина клетками канальцев, способствуя этим развитию тубулоинтерстициального фиброза (склероза).
Установлена способность АТ II индуцировать выработку IL-1β, TNF-α, IL-8 лейкоцитами и таким образом активировать неспецифические воспалительные реакции как на местном (в т. ч. и интраренальном), так и системном уровнях.
Кроме того, АТ II активизирует и многие внутриклеточные процессы (например, путём активации внутриклеточных сигнальных систем (multiple intracellular signaling cascades) и различных факторов транскрипции), что дополнительно усугубляет тяжесть ренальных склеротических изменений и увеличивает скорость их течения.
Альдостерон, одним из инициаторов синтеза и секреции которого является АТ II, не только обладает антидиуретическим и антинатрийурическим действием, но также в условиях патологии активно участвует в процессах нефросклероза.
Поскольку АПФ, или кининаза II, имеет бифункциональное действие (участие в синтезе АТ II и в разрушении брадикинина), то угнетение её образования (например, при использовании иАПФ) приводит к гиперактивации калликреин-кининовой системы (ККС). Одним из ключевых пептидов ККС является брадикинин, который, воздействуя на свои рецепторы различных видов, не только вызывает дилатацию периферических сосудов (что может быть расценено как положительный эффект иАПФ), но и участвует в широком спектре других физиологических и патофизиологических механизмов и в первую очередь в развитии и поддержании воспалительных реакций в тканях.
Последние свойства брадикинина имеют отрицательное влияние на состояние почечной паренхимы при хронической асептической нефропатии и ХБП и связаны с его способностью индуцировать высвобождение гистамина тучными клетками, а также стимулировать синтез и секрецию провоспалительных цитокинов, в т. ч. и TNF-α (фактор некроза опухолей, кахектин).
С потенцированием ККС при длительном использовании иАПФ может быть связано и развитие ангионевротических отёков и т. н. брадикининового кашля.
Альбуминурия, а при усугублении процесса и глобулинурия (неселективная нефротоксическая протеинурия), являющиеся следствием поражения фильтрационного барьера и ассоциированной с АТ II гиперфильтрации в гломерулах (прямо, через вазоконстрикцию, или, косвенно, например, через пролиферацию клеток мезангия), приводят к поражению тубулярного эпителия и утолщению канальцевой базальной мембраны. Связано это с тем, что одной из основных функций канальцев является реабсорбция белков, попавших в первичную мочу. Этот процесс происходит с большой затратой энергии и кислорода и при длительной протеинурии, превышающей физиологические возможности, приводит к истощению энергетических запасов тубулярного эпителия (гистоморфологически этот процесс описывается как «высокий воспалительный статус эпителия канальцев»).
Поэтому длительная протеинурия способна привести к дистрофии, а в последующем и к атрофии канальцевого эпителия. А нужно принять во внимание, что клетки эпителия канальцев, так же как подоциты6 и клетки нервной системы, относительно плохо способны к регенерации.
Поэтому формирование тубулярного, а затем и тубулоинтерстициального компонентов является неотъемлемой частью патогенеза любых ХАН. Причём на определённом этапе течения ХАН гломерулярного ряда тубулоинтерстициальный компонент начинает вносить даже более значимый вклад в усугубление степени хронической почечной недостаточности, чем собственно гломерулярный.
При острых и хронических ТИН, прежде всего из-за расширения канальцев и отёка интерстиция, происходит механическое сдавливание гломерул и нарушаются процессы микроциркуляции в них. Это достаточно быстро приводит к гиперактивации по крайней мере интраренальной РААС (схема 2).
Схема 2. Роль РААС в развитии различных хронических асептических нефропатий
Альтернативные пути образования АТ II
АТ II образуется в организме человека и животных не только с участием АПФ. Этот пептид может синтезироваться непосредственно из ангиотензиногена или из АТ I под воздействием тонина, тканевого активатора плазминогена, катепсина G, сериновых протеаз и т. д. Причём в тканях (миокардиальный интерстиций, адвентиции и медии сосудов и т. д.) даже в норме преобладают альтернативные пути образования АТ II, и лишь плазме крови — АПФ-зависимые (схема 1).
В почечной паренхиме у здоровых животных благодаря колоссальному кровоснабжению и большой массе т. н. «эндотелиального дерева» микрокапиллярных сетей (в эндотелии сосудов во всём организме синтез АТ II осуществляется сбалансированно различными путями) значимыми могут считаться оба пути образования АТ II. Однако при использовании иАПФ, и особенно при их передозировке7, начинают преобладать альтернативные пути, а также в разы возрастает синтез АТ II тубулярным эпителием.
Этим обстоятельством, помимо прочего, могут быть объяснены относительно невысокие нефропротективные свойства иАПФ по сравнению с блокаторами АТ1 (блокаторы рецепторов ангиотензина). Последние не только эффективно и точечно подавляют именно вазоконстрикционный и пролиферативный компонент РААС, но и обладают стимулирующим действием на вазодилатирующий и антипролиферативный благодаря способности усиливать воздействие АТ II на АТ2 (схема 1).
Перечисленные выше особенности работы РААС в норме и при различных нефропатиях делают именно БРА препаратами первого выбора для их профилактики и лечения.
Режим дозирования телмисартана при хронической асептической нефропатии и ХБП
Важными свойствами телмисартана являются его широкий терапевтический индекс и нейтральный метаболический профиль8, что вкупе с 99%-ной внепочечной элиминацией из организма значительно облегчает подбор дозы каждому конкретному пациенту даже с тяжёлыми степенями ХБП. (Иными словами, навредить этим БРА пациенту довольно сложно.) Плюс к этому период полувыведения телмисартана таков (по крайней мере у человека; разумеется, для кошек и собак необходимо проведение исследований, уточняющих эту особенность его фармакокинетики), что позволяет рекомендовать использование содержащих его препаратов по крайней мере 1 раз в 24–36 часов (что, например, для такого «капризного» пациента, как кошка, весьма и весьма актуально).
Автор статьи, основываясь на собственном более чем семилетнем опыте работы с телмисартаном, считает возможным/целесообразным применение следующего диапазона терапевтических доз этого БРА (табл. 1). И именно это лекарственное средство может быть названо препаратом первого выбора для лечения пациентов с хронической асептической нефропатией и ХБП на любом этапе ренального континуума. Причём коррекции дозы (её уменьшения вплоть до полной отмены, как для большинства иных нефро- и кардиопротекторов) пациентам с тяжёлыми степенями ХБП не требуется, поскольку элиминация телмисартана осуществляется на 99% внепочечными путями.
Продолжительность терапии телмисартаном, учитывая характер патогенеза ХАН, может быть определена как длительная/пожизненная. При этом следует также учитывать, что у БРА в целом и у телмисартана в частности относительно редко развивается феномен «ускользания эффекта».
Кроме того, телмисартан может с успехом использоваться и в комбинации с другими нефро- и кардиопротекторами, а также с мочегонными и антипаратиреоидными препаратами, антиагрегантами, антикоагулянтами, фосфат-байндерами, средствами симптоматической и заместительной терапии и т. д.
Таблица 1. Режим дозирования телмисартана при хронической асептической нефропатии
| Действующее вещество | Форма выпуска | Дозы (собаки/кошки) |
| Телмисартан | таблетки 40 и 80 мг |
Внутрь: 1,0–5,0 мг/кг один раз в 24–36 ч. |
Заключение
Гиперактивация РААС является неотъемлемой частью патогенеза всех хронических асептических нефропатий на клиническом и доклиническом этапах (в т. ч. самых ранних) почечного континуума и обязательно требует назначения соответствующего лечения.
Нефропротективные свойства телмисартана имеют высокий доказательный уровень как в медицине человека, так и в ветеринарии, учитывая особенности фармакокинетики и фармакодинамики этого БРА (одним из наиболее ценных в этом отношении свойств является его сугубо внепочечная элиминация, широкий терапевтический индекс и нейтральный метаболический профиль) и напрямую связанные с этим самые низкие нефротоксичные эффекты среди препаратов, контролирующих гиперактивность РААС. Поэтому телмисартан может быть назван лекарственным средством первого выбора в терапии ХАН и ХБП на любом этапе ренального континуума (в т. ч. и у пациентов на терминальных стадиях) как в монотерапии, так и в случае необходимости — в комбинации с иными средствами, использующимися для лечения заболеваний почек и ССС.
Примечания
1 Ренин-ангиотензин-альдостероновая система.
2 Эндотелий сосудов — это не только крайне чувствительная и «агрессивная» железа внутренней секреции, при нефропатиях часто подверженная плохо прогнозируемому биполярному расстройству, но ещё и весьма тяжёлое образование. В целом в теле взрослого человека, например, её суммарный вес может превышать 2 кг.
3 Необходимую информацию о фармакотерапии нефропротективными препаратами можно почерпнуть из специализированной литературы (например, в учебном пособии «Рациональная фармакотерапия в нефрологии» и целом ряде научных публикаций как на русском, так и иностранных языках, а также на занятиях «Школы ветеринарной нефрологии и урологии Романа Леонарда».
4 www.iris-kidney.com.
5 Хотя вазоконстрикционные свойства АТ II не идут ни в какое сравнение с эффектами эндотелиина I. Сосудосуживающие свойства этого пептида, выделяемого, как понятно из названия, эндотелием (прежде всего повреждённым) сосудов, более чем в 10 раз сильнее, чем у АТ II. В том числе и этим объясняется недостаточная эффективность (или даже полное её отсутствие) у некоторых пациентов двух-, трёх- четырёхкомпонентного и т. д. гипотензивного лечения. Лекарственные средства, блокирующие выработку или силу рецепторных взаимодействий эндотелиина I, на данный момент находятся пока только на стадии разработки.
6 Подоциты образуют последний, контактирующий с мочевым пространством слой фильтрационного барьера гломерулы.
7 Следует учитывать, что все иАПФ, в отличие от БРА, имеют узкий терапевтический индекс.
8 Те молекулы телмисартана, которые не связываются с рецепторами АТ1, не оказывают какого-либо влияния на организм пациента.
Литература
- Aoki A., Ogawa T., Sumino H., et al. Long-term effects of telmisartan on blood pressure, the renin-angiotensinaldosterone system, and lipids in hypertensive patients. Heart Vessels 2010; 25:195–202.
- Bugbee A.C., Coleman A.E., Wang A., Woolcock A.D., Brown S.A. Telmisartan Treatment of Refractory Proteinuria in a Dog. J Vet Intern Med 2014; 28:1871–1874.
- Chan D.P, Sandok E.K., Aarhus L.L., et al. Renal-specific actions of angiotensin II receptor antagonism in the anesthetized dog. Am J Hypertens 1992; 5:354–360.
- Danyel L.A., Schmerler P., Paulis L., et al. Impact of AT2-receptor stimulation on vascular biology, kidney function, and blood pressure. Integr Blood Press Control 2013; 6:153–161.
- Ebner T., Weber W., Sent U., Elliott J. et al. In vitro glucuronidation of the angiotensin II receptor antagonist telmisartan in the cat: a comparison with other species. J. vet. Pharmacol. Therap. 36, 154–160.
- Finco D.R. Association of systemic hypertension with renal injury in dogs with induced renal failure. J Vet Intern Med 2004; 18:289–294.
- Grauer G.F., Greco D.S., Getzy D.M., et al. Effects of enalapril versus placebo as a treatment for canine idiopathic glomerulonephritis. J Vet Intern Med 2000; 14:526–533.
- Fukami K., Yamagishi S.I., Kaifu K., et al. Telmisartan inhibits AGE-induced podocyte damage and detachment. Microvasc Res 2013; 88:79–83.
- Goyache-Goni B., Aranda-Lara P., Reyes-Engels A., et al. The influence of renin-angiotensin system genotypes on the antiproteinuric response to high doses of olmesartan in non-diabetic proteinuric nephropathies. Nefrologia 2013;33:771–778.
- Jenkins T.L., Coleman A.E., Schmiedt C.W., Brown S.A. Attenuation of the pressor response to exogenous angiotensin by angiotensin receptor blockers and benazepril hydrochloride in clinically normal cats. Am J Vet Res 2015; 76(9):807–813.
- Lees G.E., Brown S.A., Elliott J., et al. Assessment and management of proteinuria in dogs and cats: 2004 ACVIM Forum Consensus Statement (small animal). J Vet Intern Med 2005;19:377–385.
- Makino H., Haneda M., Babazono T., et al. Microalbuminuria reduction with telmisartan in normotensive and hypertensive Japanese patients with type 2 diabetes: A post-hoc analysis of The Incipient to Overt: Angiotensin II Blocker, Telmisartan, Investigation on Type 2 Diabetic Nephropathy (INNOVATION) study. Hypertens Res 2008; 31:657–664.
- Michel M.C., Foster C., Brunner H.R., Liu L. A systematic comparison of the properties of clinically used angiotensin II type 1 receptor antagonists. Pharmacol Rev 2013; 65:809–848.
- Padia S.H., Carey R.M. AT2 receptors: Beneficial counterregulatory role in cardiovascular and renal function. Pflugers Arch 2013; 465:99–110.
- Ruester C., Wolf G. Renin-angiotensin-aldosterone system and progression of renal disease. J Am Soc Nephrol 2006; 17:2985–2991.
- Schierok H., Pairet M., Hauel N., et al. Effects of telmisartan on renal excretory function in conscious dogs. J Int Med Res 2001; 29:131–139.
- Sent U., Gossl R., Elliott J., et al. Comparison of efficacy of long-term oral treatment with telmisartan and benazepril in cats with chronic kidney disease. J Vet Intern Med 2015; 29:1479-1487.
- Siragy H.M., Carey R.M. Role of the intrarenal renin-angiotensin-aldosterone system in chronic kidney disease. Am J Nephrol 2010; 31:541–550.
- Syme H.M., Markwell P.J., Pfeiffer D., Elliott J. Survival of cats with naturally occurring chronic renal failure is related to severity of proteinuria. J Vet Intern Med 2006; 20(3):528–535.
- Ucciferri C., Falasca K., Mancino P., et al. Microalbuminuria and hypertension in HIV-infected patients: A preliminary study of telmisartan. Eur Rev Med Pharmacol Sci 2012; 16:491–498
СВМ № 1/2018
Подпишитесь
на наш телеграм-канал
и получайте важные отраслевые новости в удобном для вас формате.
Оценить материал
Нравится
Нравится
Поздравляю
Сочувствую
Возмутительно
Смешно
Задумался
Нет слов
141
Телмисартан — Озон — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-004442
Торговое наименование препарата
Телмисартан
Международное непатентованное наименование
Телмисартан
Лекарственная форма
таблетки
Состав
Состав на одну таблетку 40 мг:
Действующее вещество: телмисартан — 40.00 мг.
Вспомогательные вещества: лактозы моногидрат (сахар молочный) — 296.85 мг, кроскармеллоза натрия -12,00 мг, повидон-К25 — 12,00 мг, меглюмин — 12,00 мг, натрия гидроксид — 3,35 мг, магния стеарат — 3,80 мг.
Состав на одну таблетку 80 мг:
Действующее вещество: телмисартан — 80,00 мг.
Вспомогательные вещества: лактозы моногидрат (сахар молочный) — 474,90 мг, кроскармеллоза натрия — 24,00 мг, повидон-К25 — 24,00 мг, меглюмин — 24,00 мг, натрия гидроксид — 6,70 мг, магния стеарат — 6,40 мг.
Описание
Круглые плоскоцилиндрические таблетки белого или белого с желтоватым оттенком цвета с фаской и риской.
Фармакотерапевтическая группа
Ангиотензина II рецепторов антагонист
Код АТХ
C09CA07
Фармакодинамика:
Телмисартан — специфический антагонист рецептора ангиотензина II (АРА II) (тип AT1), обладает высоким сродством к подтипу АТ1 рецепторов ангиотензина II, через которые реализуется действие ангиотензина II. Вытесняет ангиотензин II из связи с рецептором, не обладая действием агониста в отношении этого рецептора.
Телмисартан связывается только с подтипом AT1 рецепторов ангиотензина II.
Связь носит длительный характер. Не обладает сродством к другим рецепторам, в том числе к АТ2 рецепторам и другим, менее изученным рецепторам ангиотензина. Функциональное значение этих рецепторов, а также эффект их возможной избыточной стимуляции ангиотензином II, концентрация которого увеличивается под действием телмисартана, не изучены. Телмисартан снижает концентрацию альдостерона в плазме крови, не снижает активность ренина в плазме крови и не блокирует ионные каналы. Телмисартан не ингибирует ангиотензинпревращающий фермент (АПФ, кининазу II), который также катализирует деградацию брадикинина. Это позволяет избежать побочных эффектов, связанных с действием брадикинина (например, сухой кашель).
Артериальная гипертензия
Телмисартан в дозе 80 мг полностью блокирует у пациентов гипертензивный эффект ангиотензина II. Начало антигипертензивного действия отмечается в течение 3-х часов после первого приема телмисартана. Действие препарата сохраняется в течение 24 часов и остается значимым до 48 часов. Выраженный антигипертензивный эффект обычно развивается через 4-8 недель регулярного применения телмисартана.
У пациентов с артериальной гипертензией телмисартан снижает как систолическое, так и диастолическое артериальное давление (АД), не оказывая влияния на частоту сердечных сокращений (ЧСС).
В случае резкой отмены телмисартана АД постепенно (в течение нескольких дней) возвращается к исходным значениям без развития синдрома «отмены».
В сравнительных клинических исследованиях было показано, что антигипертензивное действие телмисартана сопоставимо с антигипертензивным действием препаратов других классов (амлодипином, атенололом, эналаприлом, гидрохлоротиазидом и лизиноприлом). Частота возникновения «сухого» кашля была значительно ниже у пациентов, получавших телмисартан, по сравнению с теми, кто получал ингибиторы АПФ.
Профилактика сердечно-сосудистых заболеваний
У пациентов в возрасте 55 лет и старше с ишемической болезнью сердца, инсультом, транзиторной ишемической атакой, поражением периферических артерий или с осложнениями сахарного диабета 2 типа (например, ретинопатией, гипертрофией левого желудочка, макро- или микроальбуминурией) в анамнезе, подверженных риску возникновения сердечно-сосудистых осложнений. Телмисартан оказывал действие, подобное эффекту рамиприла в снижении первичной комбинированной конечной точки: сердечно-сосудистая смертность, нефатальный инфаркт миокарда, нефатальный инсульт или госпитализация в связи с хронической сердечной недостаточностью.
Телмисартан был также эффективен, как и рамиприл в отношении снижения частоты вторичных точек: сердечно-сосудистой смертности, инфаркта миокарда без смертельного исхода или инсульта без смертельного исхода.
Эффективность снижения риска сердечно-сосудистой смертности дозами телмисартана менее 80 мг не изучена.
Сухой кашель и ангионевротический отек реже были описаны на фоне приема телмисартана в отличие от рамиприла, при этом артериальная гипотензия чаще возникала на фоне приема телмисартана.
Пациенты детского и подросткового возраста
Безопасность и эффективность телмисартана у детей и подростков младше 18 лет не установлены.
Фармакокинетика:
Всасывание
После приёма внутрь телмисартан быстро всасывается из желудочно-кишечного тракта. Биодоступность составляет около 50%. При приёме телмисартана одновременно с пищей снижение площади под кривой «концентрация — время» (AUC) для телмисартана варьирует от 6% (при дозе 40 мг) до 19% (при дозе 160 мг). Через 3 часа после приёма внутрь концентрация телмисартана в плазме крови выравнивается независимо от времени приёма пищи.
Линейность/нелинейность
Не предполагается, что небольшое уменьшение AUC может вызывать снижение терапевтической эффективности. Линейная зависимость между дозой и концентрацией препарата в плазме крови отсутствует. При дозах более 40 мг максимальная концентрация в плазме крови (Сmах) и, в меньшей степени. AUC увеличиваются непропорционально.
Распределение
Телмисартан активно связывается с белками плазмы крови (более чем на 99,5%), главным образом с альбумином и альфа-1 кислым гликопротеином. Среднее значение кажущегося объема распределения в равновесном состоянии составляет примерно 500 л.
Метаболизм
Телмисартан метаболизируется посредством конъюгации исходного вещества с глюкуронидом. Конъюгат не обладает фармакологической активностью.
Выведение
Телмисартан характеризуется фармакокинетикой биэкспоненциального распада с конечным периодом полувыведения более 20 часов. Сmах и, в меньшей степени, AUC увеличиваются с дозой непропорционально. Нет данных о том, что накопление телмисартана при приёме в рекомендуемых дозах имеет клиническую значимость.
После введения препарата внутрь (и внутривенно) телмисартан выводится практически только через кишечник, в основном в неизмененном виде. Общее количество, выводимое почками, составляет менее 1% от дозы. Общий плазменный клиренс высокий (порядка 1000 мл/мин) по сравнению с печеночным кровотоком (около 1500 мл/мин).
Фармакокинетика у особых групп пациентов
Гендерные различия
Концентрации в плазме крови были выше у женщин по сравнению с мужчинами. Наблюдались отличия концентрации в плазме крови Сmах и AUC у женщин по сравнению с мужчинами, они были примерно в 3 и 2 раза выше, соответственно, однако соответствующего влияния на эффективность отмечено не было.
Пациенты пожилого возраста
Фармакокинетика телмисартана у пациентов пожилого возраста и пациентов моложе 65 лет не отличается.
Пациенты с почечной недостаточностью
Изменение дозы у пациентов с почечной недостаточностью не требуется, включая пациентов, находящихся на гемодиализе. Пациентам с тяжелой почечной недостаточностью и пациентам, находящимся на гемодиализе, рекомендована более низкая начальная доза — 20 мг в сутки (см. раздел «Особые указания»). Телмисартан активно связывается с белками плазмы крови у пациентов с почечной недостаточностью и не выводится при диализе.
Пациенты с печёночной недостаточностью
Фармакокинетические исследования с участием пациентов с печёночной недостаточностью выявили повышение абсолютной биодоступности практически до 100%. Период полувыведения у пациентов с печёночной недостаточностью не меняется.
Показания:
— Артериальная гипертензия;
— снижение сердечно-сосудистой заболеваемости и смертности у пациентов в возрасте 55 лет и старше с высоким риском сердечно-сосудистых заболеваний.
Противопоказания:
— Повышенная чувствительность к действующему веществу или к вспомогательным компонентам препарата;
— беременность и период грудного вскармливания;
— обструктивные заболевания желчевыводящих путей;
— тяжёлые нарушения функции печени (класс С по классификации Чайлд-Пью);
— одновременное применение с алискиреном или алискиренсодержащими препаратами у пациентов с сахарным диабетом и/или умеренным или тяжелым нарушением функции ночек (скорость клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2 площади поверхности тела);
— одновременное применение с ингибиторами ангиотензинпревращающего фермента у пациентов с диабетической нефропатией;
— дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция;
— возраст до 18 лет (эффективность и безопасность не установлены).
С осторожностью:
Двусторонний стеноз почечных артерий, стеноз артерии единственной почки, легкие и умеренные нарушения функции почек и/или печени, состояние после трансплантации почки (опыт применения отсутствует); снижение объёма циркулирующей крови (ОЦК) вследствие предшествующей диуретической терапии, ограничения приёма поваренной соли, диареи или рвоты; гипонатриемия, гиперкалиемия, хроническая сердечная недостаточность (ХСН), стеноз аортального и/или митрального клапана, гипертрофическая обструктивная кардиомиопатия (ГОКМП), первичный гиперальдостеронизм (эффективность и безопасность не установлены), применение у пациентов негроидной расы.
Беременность и лактация:
Применение препарата Телмисартан при беременности и в период грудного вскармливания противопоказано.
Беременность
В настоящее время достоверная информация по безопасности применения телмисартана у беременных женщин отсутствует. В исследованиях на животных была выявлена репродуктивная токсичность препарата.
При подтверждении факта беременности применение препарата Телмисартан следует немедленно прекратить. При необходимости должна быть назначена альтернативная гипотензивная терапия (другие классы гипотензивных препаратов, которые разрешены к применению при беременности).
Как показали результаты клинических наблюдений, применение АРАII в ходе второго и третьего триместров беременности оказывает токсическое действие на плод (ухудшение почечной функции, олигогидрамнион, задержка окостенения черепа) и новорожденного (почечная недостаточность, артериальная гипотензия и гиперкалиемия). При применении АРАII в течение второго триместра беременности рекомендовано ультразвуковое исследование почек и черепа плода.
Новорожденные, чьи матери принимали препарат АРА IIво время беременности, должны находиться под наблюдением, так как возможно развитие артериальной гипотензии у новорожденного.
Период грудного вскармливания
Отсутствуют сведения о том, выделяется ли телмисартан в грудное молоко. Исследования на животных свидетельствуют о проникновении телмисартана в молоко лактирующих животных.
Применение препарата Телмисартан противопоказано в период грудного вскармливания. При необходимости применения препарата Телмисартан в период лактации, грудное вскармливание необходимо прекратить.
Способ применения и дозы:
Внутрь, вне зависимости от времени приёма пищи.
Артериальная гипертензия
Начальная рекомендованная доза составляет 1 таблетка (40 мг) препарата Телмисартан один раз в сутки. У некоторых пациентов может быть эффективным прием 20 мг телмисартана в сутки. Дозу 20 мг можно получить путем разделения таблетки 40 мг пополам по риске. В случаях, когда терапевтический эффект не достигается, максимальная рекомендованная доза препарата Телмисартан может быть увеличена до 80 мг один раз в сутки. 13 качестве альтернативы препарат можно принимать в сочетании с тиазидными диуретиками, например, гидрохлоротиазидом, который при совместном применении с телмисартаном оказывал дополнительное антигипертензивное действие. При необходимости увеличения дозы следует учитывать, что максимальный антигипертензивный эффект обычно развивается через 4-8 недель после начала лечения (см. раздел «Фармакодинамика»).
Снижение сердечно-сосудистой заболеваемости и смертности
Рекомендуемая доза — 1 таблетка препарата Телмисартан 80 мг один раз в сутки.
Рекомендуется регулярный контроль АД и, в случае необходимости, корректировка дозы препаратов, снижающих АД.
Особые группы пациентов
Почечная недостаточность
Для пациентов с легким и умеренным нарушением функции почек коррекции дозы не требуется. Опыт применения телмисартана у пациентов с тяжелой почечной недостаточностью или пациентов, находящихся на гемодиализе, ограничен. Данным пациентам рекомендована более низкая начальная доза — 20 мг в сутки (см. раздел «Особые указания»).
Печёночная недостаточность
У пациентов с легкими и умеренными нарушениями функции печени (класс А и В по классификации Чайлд-Пью, соответственно) суточная доза препарата Телмисартан не должна превышать 40 мг. У пациентов с тяжелыми нарушениями функции печени (класс С по классификации Чайлд-Пью) применение препарата противопоказано (см. раздел «Противопоказания»).
Пациенты пожилого возраста
Для пациентов пожилого возраста коррекции дозы не требуется.
Побочные эффекты:
В целом, частота возникновения нежелательных явлений, отмеченная для телмисартана (41,4%), сопоставима с аналогичной для плацебо (43,9%). Частота возникновения нежелательных явлений не зависела от дозы и не коррелировала с полом, возрастом или расовой принадлежностью пациентов.
Неблагоприятные побочные реакции представлены в соответствии с частотой возникновения: очень часто (≥ 1/10); часто (от ≥ 1/100 до < 1/10); нечасто (от≥ 1/1000 до < 1/100); редко (от ≥ 1/10000 до < 1/1000); очень редко (< 1/10000), неизвестной частоты (на основании имеющихся данных невозможно провести оценку).
Инфекции и инвазии: нечасто — инфекция верхних дыхательных путей, в том числе фарингит и синусит; инфекция мочевыводящих путей, в том числе цистит; неизвестной частоты: сепсис, в том числе с летальным исходом.
Нарушения со стороны крови и лимфатической системы: нечасто — анемия; редко — тромбоцитопения; неизвестной частоты — эозинофилия.
Нарушения со стороны иммунной системы: редко — гиперчувствительность; неизвестной частоты — анафилактические реакции.
Нарушения питания и обмена веществ: нечасто — гиперкалиемия.
Психические нарушения: нечасто — депрессия, бессонница; редко — тревога.
Нарушения со стороны нервной системы: нечасто — синкопе.
Нарушения со стороны органа зрения: редко — нарушение зрения.
Нарушения со стороны органа слуха и равновесия: нечасто — вертиго.
Нарушения со стороны сердечно-сосудистой системы: нечасто — брадикардия, выраженное снижение артериального давления*, ортостатическая гипотензия; редко — тахикардия.
* Часто наблюдалось у пациентов с контролируемым артериальным давлением, которые получали лечение телмисартаном с целью снижения риска сердечно-сосудистой смертности в дополнение к стандартному лечению.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: нечасто — одышка; очень редко — интерстициальная болезнь легких (по результатам постмаркетингового применения; причинно-следственная связь не установлена).
Нарушения со стороны пищеварительной системы: нечасто — боль в животе, диарея, диспепсия, метеоризм, рвота; редко — расстройство желудка, дискомфорт, сухость слизистой оболочки полости рта, дисгевзия.
Нарушения со стороны гепатобилиарной системы: редко — нарушение функции печени/заболевание печени (по результатам постмаркетинговых наблюдений, в большинстве случаев нарушение функции печени/заболевания печени были выявлены у жителей Японии).
Нарушения со стороны кожи, подкожной клетчатки: нечасто — гипергидроз, кожный зуд, кожная сыпь; редко — эритема, ангионевротический отек (в т.ч. с летальным исходом), лекарственная сыпь, токсическая кожная сыпь, экзема; неизвестной частоты — крапивница.
Нарушения со стороны скелетно-мышечной системы и соединительной ткани: нечасто — миалгия, боль в спине (например, ишиас), мышечные спазмы; редко — артралгия, боль в конечностях; неизвестной частоты — боль в области сухожилий (тендинитоподобные симптомы).
Нарушения со стороны мочевыделительной системы: нечасто — почечная недостаточность, в том числе острая почечная недостаточность.
Общие расстройства и нарушения в месте введения: нечасто — боль в груди, астения (слабость); редко — гриппоподобное состояние.
Лабораторные показатели: нечасто — повышение концентрации креатинина в крови; редко — повышение концентрации мочевой кислоты в крови, повышение активности «печеночных» ферментов, повышение активности креатинфосфокиназы в сыворотке крови; снижение гемоглобина; гипогликемия (у пациентов с сахарным диабетом).
Передозировка:
Случаи передозировки не выявлены.
Симптомы: выраженное снижение АД и тахикардия: также может наблюдаться брадикардия, головокружение, повышение концентрации креатинина в сыворотке крови и острая почечная недостаточность.
Лечение: телмисартан не выводится путем гемодиализа. Следует тщательно контролировать состояние пациентов и осуществлять симптоматическое, а также поддерживающее лечение. Подход к лечению зависит от времени, прошедшего после приема препарата, и выраженности симптомов. Рекомендуемые мероприятия включают в себя провоцирование рвоты и/или промывание желудка, целесообразен прием активированного угля. Следует регулярно контролировать содержание электролитов и креатинина в плазме крови. При возникновении выраженного снижения АД пациенту следует принять горизонтальное положение с приподнятыми ногами, при этом необходимо быстро восполнить объем циркулирующей крови и электролитов.
Взаимодействие:
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС)
Результаты клинических исследований показали, что двойная блокада РААС вследствие комбинированного применения ингибиторов АПФ, АРА II или алискирена связана с повышенной частотой нежелательных явлений, таких как артериальная гипотензия, гиперкалиемия и нарушение функции почек (включая острую почечную недостаточность) в сравнении с применением только одного лекарственного средства, действующего на РААС.
Сопутствующее применение телмисартана с алискиреном противопоказано пациентам с сахарным диабетом или почечной недостаточностью (СКФ менее 60 мл/мин/1,73 м2 площади поверхности тела) и не рекомендуется другим пациентам.
Одновременное применение телмисартана и ингибиторов АПФ противопоказано у пациентов с диабетической нефропатией (см. раздел «Противопоказания»).
Препараты, способные вызвать гиперкалиемию
Как и другие лекарственные средства, действующие на РААС, телмисартан может провоцировать риск развития гиперкалиемии. Риск может быть увеличен в случае одновременного применения с другими лекарственными средствами, которые могут вызывать гиперкалиемию (заменители соли, содержащие калий, калийсберегающие диуретики (спиронолактон, эплеренон, триамтерен или амилорид), ингибиторы АПФ, АРА II, НПВП, включая селективные ингибиторы ЦОГ-2), гепарин, иммунодепрессанты (циклоспорин или такролимус) и триметоприм). Необходимо соблюдать осторожность при одновременном применении и периодически контролировать содержание калия в плазме крови при одновременном применении.
Дигоксин
При совместном применении телмисартана с дигоксином было отмечено среднее повышение Сmах дигоксина в плазме крови на 49% и минимальной концентрации на 20%. В начале лечения, при подборе дозы и прекращении лечения телмисартаном следует тщательно контролировать концентрацию дигоксина в плазме крови для поддержания ее в рамках терапевтического диапазона.
Калийсберегающие диуретики или калийсодержащие пищевые добавки
АРА II, такие как телмисартан, снижают вызываемую диуретиком потерю калия. Калийсберегающие диуретики, например, спиронолактон, эплеренон, триамтерен или амилорид, калийсодержащие пищевые добавки или заменители соли могут привести к значимому повышению содержания калия в плазме крови. Если сопутствующее применение показано, поскольку имеется документально подтвержденная гипокалиемия, их следует применять с осторожностью и на фоне регулярного контроля содержания калия в плазме крови.
Препараты лития
При совместном приеме препаратов лития с ингибиторами АПФ и АРА II, включая телмисартан, возникало обратимое повышение концентраций лития в плазме крови и его токсическое действие. При необходимости применения данной комбинации препаратов рекомендуется тщательно контролировать концентрации лития в плазме крови.
Нестероидные противовоспалительные препараты (НПВП)
Лечение нестероидными противовоспалительными препаратами (НПВП), включая ацетилсалициловую кислоту в дозах 3 г в сутки и более, ингибиторы циклооксигеназы-2 (ЦОГ-2) и неселективные НПВП, могут ослаблять антигипертензивное действие АРА II (посредством ингибирования сосудорасширяющего эффекта простагландинов). У некоторых пациентов с нарушением почечной функции (например, у пациентов с обезвоживанием, пожилых пациентов с нарушением функции почек) совместное применение АРА II и препаратов, угнетающих ЦОГ-2, может приводить к дальнейшему ухудшению почечной функции, включая развитие острой почечной недостаточности, которая, как правило, является обратимой. Поэтому совместное применение препаратов следует осуществлять с осторожностью, особенно пожилым пациентам. Следует обеспечить надлежащее поступление жидкости, кроме того, в начале совместного применения и периодически в дальнейшем следует контролировать показатели функции почек.
Диуретики (тиазидные или «петлевые»)
Предыдущее лечение высокими дозами диуретиков, такими как фуросемид («петлевой» диуретик) и гидрохлоротиазид (тиазидный диуретик), может привести к гиповолемии и риску развития артериальной гипотензии в начале лечения телмисартаном.
Рамиприл
При одновременном применении телмисартана и рамиприла наблюдалось увеличение показателей АUC0-24 и Сmах рамиприла и рамиприлата в 2,5 раза. Клиническая значимость этого явления не установлена.
Прочие гипотензивные препараты
Телмисартан может увеличивать антигипертензивный эффект других гипотензивных лекарственных средств.
На основании фармакологических свойств баклофена и амифостина можно предположить, что они будут усиливать терапевтический эффект всех гипотензивных средств, включая телмисартан. Кроме того, ортостатическая гипотензия может усиливаться на фоне приема алкоголя, барбитуратов, наркотических средств или антидепрессантов.
Кортикостероиды (для системного применения)
Глюкокортикостероиды ослабляют антигипертензивное действие телмисартана.
Особые указания:
Перед началом и во время лечения препаратом Телмисартан необходим контроль артериального давления, функции почек, содержания калия в сыворотке крови. Транзиторная артериальная гипотензия не является противопоказанием для дальнейшего лечения препаратом Телмисартан после стабилизации АД. В случае повторного возникновения выраженной артериальной гипотензии следует уменьшить дозу или отменить препарат. При наличии почечной недостаточности лечение проводят с осторожностью под контролем концентрации креатинина в сыворотке крови.
Печёночная недостаточность
Телмисартан не должен применяться у пациентов с холестазом, непроходимостью желчных путей или тяжелым нарушением функции печени (класс С по классификации Чайлд-Пью) (см. раздел «Противопоказания»), поскольку телмисартан, главным образом, выводится с желчью. Предполагается, что у таких пациентов снижен печеночный клиренс телмисартана. Телмисартан должен применяться с особой осторожностью у пациентов с лёгкой или умеренной печёночной недостаточностью (класс А и В по классификации Чайлд-Пью).
Реноваскулярная гипертензия
При лечении лекарственными средствами, действующими на РААС, у пациентов с двусторонним стенозом почечной артерии и стенозом артерии единственной почки возрастает риск возникновения тяжёлой артериальной гипотензии и почечной недостаточности.
Почечная недостаточность и трансплантация почки
При применении препарата Телмисартан у пациентов с нарушенной функцией почек рекомендуется периодический контроль содержания калия и концентрации креатинина в сыворотке крови. Клинический опыт применения препарата Телмисартан у пациентов, которым недавно была проведена трансплантация почки, отсутствует.
Снижение объёма циркулирующей крови (ОЦК)
У пациентов со снижением ОЦК и/или содержания натрия вследствие предшествующей диуретической терапии, ограничения приёма поваренной соли, диареи или рвоты может возникать симптоматическая артериальная гипотензия, особенно после первого приёма препарата Телмисартан. Дефицит жидкости и/или натрия должен быть устранен до начала приёма препарата Телмисартан.
Двойная блокада ренин-ангиотензин-альдостероновой системы (РААС)
Как последствия ингибирования РААС были отмечены: возникновение артериальной гипотензии, обморока, гиперкалиемии и нарушение почечной функции (в том числе острая почечная недостаточность) у предрасположенных к этому пациентов, особенно при применении в комбинации с лекарственными средствами, также действующими на эту систему. Двойная блокада РААС, например, при добавлении ингибитора АПФ к АРА II, не рекомендуется для пациентов с уже контролируемым АД и должна ограничиваться отдельными случаями при усиленном контроле функции почек (в том числе периодический контроль содержания калия и концентрации креатинина в плазме крови).
Другие заболевания, характеризующиеся активацией РААС
У пациентов, сосудистый тонус и почечная функция которых зависят преимущественно от активности РААС (например, пациенты с хронической сердечной недостаточностью или болезнью почек, в том числе стенозом почечной артерии), применение лекарственных средств, действующих на эту систему, таких как телмисартан, было ассоциировано с возникновением острой артериальной гипотензии, гиперазотемии, олигурии или редко — с острой почечной недостаточностью (см. раздел «Побочное действие»).
Первичный гиперальдостеронизм
Пациенты с первичным гиперальдостеронизмом, как правило, не отвечают на лечение гипотензивными средствами, действие которых проявляется ингибированием РААС. В связи с этим применение препарата Телмисартан в этих случаях не рекомендуется.
Стеноз аортального и митрального клапана, гипертрофическая обструктивная кардиомиопатия (ГОКМП)
Как и в отношении других сосудорасширяющих средств, для пациентов с аортальным и митральным стенозом или ГОКМП показано соблюдение особых мер предосторожности.
Гиперкалиемия
Применение лекарственных средств, действующих на РААС, может вызывать гиперкалиемию.
Для пациентов пожилого возраста, пациентов с почечной недостаточностью, пациентов с сахарным диабетом и также с артериальной гипертензией и ишемической болезнью сердца (ИБС), пациентов, получающих сопутствующую терапию лекарственными средствами, которые могут вызывать повышение содержания калия, и/или пациентов с сопутствующим заболеванием, гиперкалиемия может привести к летальному исходу. Перед рассмотрением возможности сопутствующего применения лекарственных средств, действующих на РААС, необходимо оценить соотношение «польза-риск».
Основными факторами риска, которые следует учитывать, являются:
— Сахарный диабет, почечная недостаточность, возраст (пациенты старше 70 лет).
— Комбинация с одним или более лекарственным средством, действующим на РААС и/или повышение содержания калия в сыворотке крови. Лекарственными средствами или терапевтическими классами лекарственных средств, которые могут вызывать гиперкалиемию, являются заменители соли, содержащие калий, калийсберегающие диуретики, ингибиторы АПФ, АРА II, НПВП, в том числе селективные ингибиторы ЦОГ-2, гепарин, иммунодепрессанты (циклоспорин или такролимус) и триметоприм.
— Интеркуррентные заболевания, в особенности дегидратация, острая сердечная недостаточность, метаболический ацидоз, нарушение почечной функции, резкое ухудшение состояния почек (например, инфекционные заболевания), синдром цитолиза (например, острая ишемия конечностей, рабдомиолиз, тяжёлая травма).
Для пациентов группы риска рекомендован регулярный контроль содержания калия в сыворотке крови (см. раздел «Взаимодействие с другими лекарственными средствами»).
У пациентов с сахарным диабетом и дополнительным сердечно-сосудистым риском, например, у пациентов с сахарным диабетом и ИБС в случае применения гипотензивных средств, таких как АРА II или ингибиторы АПФ, может повышаться риск фатального инфаркта миокарда и внезапной сердечно-сосудистой смерти.
У пациентов с сахарным диабетом ИБС может протекать бессимптомно, и поэтому может быть не диагностирована. У пациентов с сахарным диабетом перед началом применения препарата Телмисартан для выявления и лечения ИБС следует проводить соответствующие диагностические исследования, в том числе пробу с физической нагрузкой.
В качестве альтернативы препарат Телмисартан может применяться в комбинации с тиазидными диуретиками, такими как гидрохлоротиазид, которые дополнительно оказывают антигипертензивный эффект.
Расовые отличия
Как отмечено для ингибиторов АПФ, телмисартан и другие АРА II, по-видимому, менее эффективно снижают АД у пациентов негроидной расы, чем у представителей других рас, возможно, вследствие большей предрасположенности к снижению активности ренина в популяции пациентов негроидной расы, пациентов с сахарным диабетом и также с артериальной гипертензией и ИБС.
Прочее
Как и при применении других гипотензивных средств, чрезмерное снижение уровня артериального давления у пациентов с ишемической кардиомиопатией или ишемической болезнью сердца может приводить к развитию инфаркта миокарда или инсульта.
Влияние на способность управлять транспортными средствами и механизмами:
Специальных исследований влияния препарата на способность управления автотранспортом и на работу с техникой не проводилось. Необходимо соблюдать осторожность при управлении транспортными средствами, а также при работе с техникой (риск развития головокружения и сонливости).
Форма выпуска/дозировка:
Таблетки 40 мг и 80 мг.
Упаковка:
По 5, 7, 10 или 20 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 10, 20, 28, 30, 40, 50 или 100 таблеток в банки из полиэтилентерефталата для лекарственных средств, укупоренные крышками навинчиваемыми с контролем первого вскрытия или системой «нажать-повернуть» из полипропилена или полиэтилена или банки полипропиленовые для лекарственных средств, укупоренные крышками натягиваемыми с контролем первого вскрытия из полиэтилена или банки полипропиленовые для лекарственных средств, укупоренные крышками натягиваемыми с контролем первого вскрытия из полиэтилена высокого давления.
Одну банку или 1, 2, 3, 4, 5, 8 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную упаковку (пачку).
Условия хранения:
При температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности:
3 года. Не применять после истечения срока годности.
Условия отпуска
По рецепту
Производитель
Общество с ограниченной ответственностью «Озон» (ООО «Озон»), 445351, Самарская обл., г. Жигулёвск, ул. Гидростроителей, д. 6, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
ООО «Атолл»
Купить Телмисартан — Озон в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Семинтра® инструкция по применению
📜 Инструкция по применению Семинтра®
💊 Состав препарата Семинтра®
✅ Применение препарата Семинтра®
📅 Условия хранения Семинтра®
⏳ Срок годности Семинтра®
Описание лекарственного препарата ветеринарного назначения Семинтра®
Основано на данных Государственного реестра лекарственных средств для ветеринарного применения и сделано в 2018 году
Дата обновления: 2018.04.02
Лекарственная форма
|
|
Семинтра® |
Раствор для перорального применения 4 мг рег. 276-3-12.17-3906№ПВИ-3-12.17/05101 |
Форма выпуска, состав и упаковка
Международное непатентованное или химическое наименование:
телмисартан
Держатель регистрационного удостоверения:
«Boehringer Ingelheim Vetmedica GmbH», Binger Strasse 173, D-55216 Ingelheim/Rhein, Германия
Разработчик:
«Boehringer Ingelheim Vetmedica GmbH», Binger Strasse 173, D-55216 Ingelheim/Rhein, Германия
Производитель:
«Boehringer Ingelheim Promeco, S.A. de C.V», Calle Maiz 49, Barrio Xaltocan, Del. Xochimilco, C.P. 16090 Mexico City, D.F., Мексика
«Boehringer Ingelheim Vetmedica GmbH», Binger Strasse 173, D-55216 Ingelheim/Rhein, Германия
Лекарственная форма:
раствор для перорального применения
Качественный состав и количественный состав действующих веществ и качественный состав вспомогательных веществ:
в 1 мл в качестве действующего вещества 4 мг
телмисартана, а в качестве вспомогательных веществ: бензалкония хлорид, гидроксиэтилцеллюлозу, гидроксид натрия и соляную кислоту (для регулирования уровня pH), малтитол и очищенную воду
Дозировка:
4 мг
Показания к применению препарата СЕМИНТРА®
Для снижения уровня протеинурии при хронической болезни почек у кошек
Побочные эффекты
В отдельных случаях у животных может наблюдаться лёгкая и/или периодическая отрыжка, рвота, диарея или разжиженный стул, гипотония и понижение количества эритроцитов в крови, повышение уровня печеночных ферментов
Противопоказания к применению препарата СЕМИНТРА®
Препарат не предназначен для применения продуктивным животным
Условия хранения Семинтра®
Хранят в закрытой упаковке производителя отдельно от продуктов питания и кормов в защищенном от света месте при температуре от 10 °С до 25 °С
Условия отпуска
Без рецепта
Семинтра® отзывы
Помогите другим с выбором, оставьте отзыв об Семинтра®
Оставить отзыв
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код