Функциональная диспепсия (ФД) имеет много форм, включающих различные симптомы, связанные с верхними отделами желудочно–кишечного тракта (ЖКТ). Диагноз ФД основывается на отсутствии изменений при гастроскопии, а также других отклонений, выявленных при применении стандартных методов обследования [1,2]. Исследования показывают, что 15–20% населения ежегодно отмечают симптомы, характерные для диспепсии [3,4]. ФД, хотя и является хроническим состоянием, не повышает риска развития серьезных осложнений, однако она снижает качество жизни пациентов и ложится тяжелым бременем на систему здравоохранения [3,5–7].
В последние годы появились научные факты, позволившие расширить представления о патофизиологических механизмах развития ФД, включая нарушение расслабления проксимального отдела желудка при приеме пищи, инфицирование Helicobacter pylori (H. pylori), желудочную дизритмию, нарушение антродуоденальной моторики и замедление опорожнения желудка, нарушение чувствительности двенадцатиперстной кишки к жирам или уровню кислотности, дисрегуляцию вегетативной или центральной нервной системы, психосоциальные факторы и постинфекционное повреждение слизистой. Предполагается, что эти факторы во многих случаях могут сочетаться [2,4,8,9].
В связи с многообразием симптомов и отсутствием единой цели для медикаментозного воздействия функциональные нарушения продолжают оставаться сложными для лечения. Существующие лечебные подходы нацелены на различные предполагаемые механизмы, включая повышенную чувствительность к уровню кислотности, нарушение опорожнения желудка и повышенную чувствительность желудочно–кишечного тракта. В клинической практике, как правило, применяют ингибиторы кислотной секреции, среди которых наиболее эффективными являются ингибиторы протонной помпы [10], прокинетики [11,12], препараты, нацеленные на эрадикацию H. pylori [13,14], антидепрессанты и психотерапия [15].
Экстракт растительного происхождения STW 5 был недавно одобрен для применения при ФД [16–18], а также других функциональных нарушениях [19].
Экстракт STW 5 состоит из комбинации экстрактов различных трав. Среди них наиболее выраженным действием на ЖКТ обладает экстракт Iberis amara (иберийки горькой), активность которого подтверждена в исследованиях на животных [20–22].
Также описано действие экстракта STW 5 на двигательную функцию и гиперчувствительность желудка [23,24]. Другие эффекты данной субстанции включают противовоспалительное, антиоксидантное, гастропротективное действие, а также угнетение секреции кислоты [25–29].
Целью настоящего исследования является подтверждение эффективности и переносимости экстракта STW 5 по сравнению с плацебо в клиническом исследовании продолжительностью 8 нед.
Методы
Пациенты
После 7–дневного периода, в течение которого пациенты не получали какого–либо лечения, 315 пациентов в возрасте от 18 до 80 лет с диагнозом ФД, установленным согласно Римским критериями II [3], были рандомизированы на прием плацебо или экстракта STW 5. В данном многоцентровом плацебо–контролируемом двойном слепом исследовании принимали участие в общей сложности 39 гастроэнтерологов, терапевтов и врачей общей практики. Руководство исследованием осуществляла кафедра внутренних болезней Университета Otto–von–Guericke, расположенного в г. Магдебурге (Германия).
Основным критерием включения было наличие как минимум трех симптомов, входящих в шкалу оценки желудочно–кишечных симптомов (Gastrointestinal Symptom Rating Scale, GSRS), со степенью тяжести не ниже средней. Ощущение боли или чувство дискомфорта в эпигастрии должны были иметь место постоянно или периодически в течение 12 нед. до первого обследования. Во всех случаях гастроскопия и другие стандартные исследования не выявляли каких–либо клинически значимых нарушений. Также облегчение симптомов не достигалось только дефекацией, что могло бы указывать на наличие синдрома раздраженной кишки.
Во всех случаях проводили исследование с целью выявления H. рylori. Наличие данной инфекции не являлось критерием исключения из исследования.
Исследование было проведено согласно стандартам, включая Хельсинскую декларацию и рекомендации Международного комитета по гармонизации и под контролем местного этического комитета (Университет Otto–von Guericke, Магдебург).
Дизайн исследования
После проведения первоначального обследования пациенты в течение 7 дней (±2 дня) не получали никаких препаратов, действующих на ЖКТ. Если после этого периода сохранялись не менее трех симптомов не менее чем средней степени тяжести, пациентов включали в исследование. В дальнейшем они получали 3 раза/сут. по 20 капель STW 5 или плацебо в течение 8 нед., прием других препаратов в это время был запрещен. Дозировка соответствовала инструкции по медицинскому применению. Последующее обследование проводили через 6 мес. В таблице 1 представлены данные о составе исследовавшегося препарата. В период лечения контрольные обследования выполняли через 14, 28 и 56 дней после его начала.
Основные оценивавшиеся показатели
Основной целью данного исследования являлось подтверждение превосходства экстракта STW 5 перед плацебо в лечении ФД. Данный препарат впервые был изучен в рамках исследования продолжительностью 8 нед. Подобный период лечения и последующие обследования соответствуют рекомендациям для проведения исследований в области нарушений функции ЖКТ [30]. Основным показателем эффективности было изменение суммы баллов по GSRS [31], фиксируемое исследователями. GSRS включает следующие симптомы: боль в эпигастрии, спазмы в животе, чувство тяжести в животе, раннее насыщение, потерю аппетита, подташнивание, тошноту, рвоту, дискомфорт за грудиной и изжогу. Выраженность каждого симптома оценивают по шкале Likert: 0 – отсутствует, 1 – легкая, 2 – умеренная, 3 – тяжелая, 4 – очень тяжелая. Максимальная сумма баллов составляет 40. Вторичные показатели включали оценки общей эффективности и переносимости лечения в течение 8 нед., которые определяли пациенты и врачи по шкале от 1 (очень хорошая) до 6 (очень плохая). Также было рассчитано число пациентов, у которых лечение было эффективным; пациентов, у которых какие–либо симптомы полностью отсутствовали, а также количество людей, не завершивших исследование. Лечение считали эффективным в случае увеличения суммы баллов GSRS на 40% и более, а в качестве полного избавления от симптомов рассматривали снижение GSRS до 0 или 1 балла на момент завершения лечения. Также учитывали действие курса лечения на дальнейшее течение заболевания, число рецидивов и побочных эффектов.
Расчет размеров группы и рандомизация
пациентов
Основной гипотезой, которую предстояло оценить, было наличие большей клинической эффективности у STW 5 по сравнению с плацебо, которое устанавливали при достижении уровня достоверности 5%. В результате 8–недельного периода лечения GSRS должна была улучшиться на 3 пункта по сравнению с плацебо. Стандартное отклонение по данным ранее проведенных исследований и с учетом числа пациентов в данной работе должно было составить показатель, равный 7. При таких показателях и статистической значимости исследования 90% необходимо было иметь не менее 116 пациентов в каждой группе. С учетом того, что 25% пациентов могли выбыть из исследования, мы набрали 310 пациентов, которые были рандомизированы с применением программы IDVRANCODE. В качестве плацебо использовали специально изготовленный спиртовой раствор, неотличимый по своим характеристикам от того, который содержал действующее вещество. При первом обследовании (за 7 дней до начала исследования) каждому пациенту присваивался четырехзначный номер, включавший данные о центре, в котором пациент проходил лечение. Общий контроль над рандомизацией осуществлял центр клинических исследований Harrison, расположенный в Мюнхене.
Статистический анализ
Основным исследовавшимся показателем было изменение суммы баллов по GSRS с момента начала исследования до 56–го дня (конец исследования). Мы применяли следующие методики:
1. Дисперсионный анализ, включавший данные о получаемом лечении и месте его проведения.
2. В случае выявления достоверных различий между центрами анализ повторяли, включая в него фактор взаимодействия между лечением и центром.
3. Наряду с дисперсионным анализом мы также провели смешанный анализ случайных эффектов, в котором лечение было постоянным фактором, а центр – случайным. Результаты подобного анализа позволяют оценить достоверность результатов.
4. Для выявления эффекта лечения мы рассчитали средние значения по методу наименьших квадратов, используя данные дисперсионного анализа.
При анализе вторичных показателей лечения мы применяли те же статистические методики, что и при анализе основных показателей. Изменения суммы баллов GSRS, а также отдельно симптомов диспепсии представлены в графической форме. Количество пациентов с различными результатами лечения в разных группах сравнивали с применением теста Фишера.
Общую тяжесть диспепсических симптомов в течение последней недели лечения сравнивали между группами, а также с показателями, полученными до начала лечения, с применением тестов Вилкоксона и Манн – Уитни.
Результаты
Исследование было начато 15 декабря 2000 г. и завершено 10 июня 2003 г. В общей сложности были обследованы 326 пациентов. Одиннадцать пациентов (n=11) были исключены из исследования, вследствие чего анализ безопасности лечения основывается на 315 пациентах. Из них 158 получали STW 5 и 157 – плацебо. Данные об эффективности лечения были доступны для 308 пациентов, которые начали лечение и прошли как минимум одно повторное обследование (рис. 1). Полный курс лечения прошли 199 пациентов (98 получали STW 5, 101 – плацебо). Анализ причин выбывания из исследования не обнаружил существенных различий между группами. Число пациентов, отказавшихся от продолжения лечения вследствие развития побочных эффектов, было одинаковым в обеих группах (8 человек).
Демографические данные
Основные показатели были схожими в обеих группах (табл. 2), что указывает на адекватную рандомизацию. Средний возраст пациентов составил 49±16 лет и варьировал от 18 до 80 лет. Все пациенты относились к белой расе, две трети группы составили женщины. Средняя длительность заболевания составляла 63 мес., причем данный показатель колебался в широком интервале и был в среднем на 6 мес. длиннее у тех, кто получал плацебо. Около 55% пациентов отмечали диспепсию двигательного типа (характерную для нарушений моторики ЖКТ), 24% – неспецифическую диспепсию и 21% – язвенноподобную диспепсию.
Методы лечения, применявшиеся пациентами до начала исследования, были весьма разнообразными. Слабительные или препараты, содержащие клетчатку, прием которых может указывать на наличие синдрома раздраженной кишки, получали лишь два пациента – по одному в каждой группе. Факт наличия H. pylori считался подтвержденным, если хотя бы один из методов обследования (биопсия или быстрый тест) показывал положительный результат, при этом 30% получавших препарат STW 5 и 27% получавших плацебо были инфицированы данным микроорганизмом. У 79% пациентов были выявлены гистологические признаки гастрита, причем в большинстве случаев (80%) выявляли хроническую, неатрофическую форму. Количество пациентов, находящихся под действием психологического стресса, было схожим в обеих группах. Исходная сумма баллов GSRS составила 11,0±3,4 среди получавших экстракт STW 5 и 11,2±4,0 – среди получавших плацебо. Эти значения соответствовали нарушениям средней степени тяжести, что в целом совпадало с оценками пациентов. Средний показатель, полученный с применением опросника для оценки качества жизни (КЖ), составил 38,5% из 100%, что было несколько выше по сравнению с GSRS.
Изменения суммы баллов GSRS
В обеих группах сумма баллов GSRS прогрессивно улучшалась на фоне лечения: среди применявших STW 5 прирост составил 6,9±4,8 балла к 56 дню, а среди получавших плацебо – 5,9±4,3 балла. Различие между группами было статистически достоверным (р=0,0407) (рис. 2). Анализ данных, полученных у пациентов, прошедших полный курс лечения, показал более выраженное улучшение, а также более существенное превосходство STW 5 (р=0,0022). Среди пациентов, получавших данный препарат, после 2 нед. лечения терапевтический эффект был достигнут на 57%, а после 4 нед. – на 86% от итогового. Предположительно в результате параллельного приема других препаратов среди получавших плацебо средние значения GSRS в этот период достигли схожего уровня. В период наблюдения средние значения GSRS не опускались ниже 3,9. Различие между группами стало достоверным на 28 день лечения, и среди прошедших полный курс оно сохранялось через 8 мес.
Были также выявлены достоверные различия между центрами (р=0,0011 среди начавших лечение и р=0,0074 среди прошедших полный курс). Отдельный анализ данных, полученных в этом центре, продемонстрировал достоверное различие между STW 5 и плацебо, аналогичное таковому в общей группе. Фактическое различие превышало 1 балл или минимальное изменение, которое пациент может заметить, что указывает на клиническое значение выявленного преимущества STW 5.
Различные результаты лечения
В общей сложности 72,2% и 78,3% пациентов, получавших плацебо и экстракт STW 5 соответственно, отметили улучшение. Число полностью излеченных пациентов было выше в группе, получавшей STW 5, по сравнению с получавшими плацебо (98 (62,4%) и 80 (53,0%)) пациентов соответственно, различие не достоверно). По 14 пациентов из каждой группы сообщили о развитии рецидива в период наблюдения. Для лечения рецидива разрешалось принимать другие препараты.
Данные об эффективности лечения, основанные на записях пациентов, и общая оценка
эффективности
Средняя интенсивность симптомов согласно записям пациентов достоверно снижалась в обеих группах на фоне лечения (р<0,0001 для обеих групп). Достоверных различий в степени снижения между группами не было. Как исследователи, так и пациенты оценивали общую эффективность экстракта STW 5 выше по сравнению с плацебо, при этом р составил 0,0207 для пациентов, начавших лечение, и 0,0399 для тех, кто прошел его полный курс. Количество исследователей, оценивавших эффективность STW 5 как «очень высокую», было почти в два раза выше по сравнению с плацебо (20,6% по сравнению с 10,8%). Оценки пациентов в целом соответствовали таковым у исследователей (очень хорошая эффективность – 17,7% для STW 5 и 10,8% – для плацебо).
Безопасность и переносимость лечения
В общей сложности было отмечено 253 побочных эффекта, число которых было практически схожим в обеих группах (123 среди получавших STW 5 и 130 среди получавших плацебо). 47,3% пациентов сообщали о как минимум одном побочном эффекте, данный показатель также не различался между группами (74 пациента из группы, получавшей STW 5, и 75 пациентов из группы, получавшей плацебо).
Большинство побочных эффектов были низкой степени тяжести (95,1% в группе, получавшей STW 5, и 92,3% в группе, получавшей плацебо) и разрешались до окончания исследования (78% в группе, получавшей STW 5, и 77,7% в группе, получавшей плацебо). В обеих группах отмечено по 6 случаев побочных эффектов, ставших причиной госпитализации и классифицированных как тяжелые. Ни один из этих эпизодов не был непосредственно связан с приемом препаратов.
В общей сложности 13 из 253 эпизодов побочных эффектов (5,1%) могли быть вызваны приемом исследовавшихся препаратов. Ни один из этих эффектов не был тяжелым. Различий между группами выявлено не было. Эти побочные эффекты имели место у 11 пациентов (5 из группы, получавшей STW 5, и 6 из группы, получавшей плацебо). Эти побочные эффекты имели 16 различных описаний, так как в некоторых случаях для одного эффекта было недостаточно одного описания. Среди получавших STW 5 были отмечены следующие побочные эффекты: неопределенная боль в животе у пациента с хроническим панкреатитом, облысение, боль в горле, кожный зуд, гиперчувствительность неопределенного характера, гипотензия и боль желудочно–кишечного характера. Пациенты, получавшие плацебо, отметили следующие побочные эффекты: головная боль, диспепсия, боль в эпигастрии, тошнота, боль в области печени, диарея, боль в животе и гастроэнтерит.
Ни лабораторные показатели (глюкоза крови натощак, мочевина, креатинин, билирубин, АСТ, АЛТ, ≥–ГТ, щелочная фосфатаза, общий белок, натрий, калий, тромбопластиновое время, СОЭ, амилаза, мочевая кислота), ни общие показатели (температура тела, данные общего осмотра, артериальное давление, частота сердечных сокращений) не изменялись в значимой степени в ходе лечения.
Пациенты оценивали переносимость плацебо выше по сравнению с STW 5, это различие достигло уровня статистической значимости (р=0,0048), при этом 92,1% и 84,4% пациентов оценивали переносимость плацебо и экстракта STW 5 соответственно как очень хорошую. Оценки исследователей также были более высокими в случае плацебо, однако различие не было достоверным.
Обсуждение
Наше многоцентровое рандомизированное двойное слепое плацебо–контролируемое исследование показало, что экстракт STW 5 эффективен в лечении пациентов с ФД. Данный препарат также характеризуется хорошей переносимостью. Исследование продемонстрировало достоверное превосходство STW 5 по сравнению с плацебо в отношении действия на симптомы диспепсии после 4 и 8 нед. лечения.
Эффективность экстракта STW 5 в отношении ФД в целом и ее отдельных проявлений ранее была показана в исследовании, продолжавшемся 4 нед. [16–19]. Два мета–анализа, оценивавших действие STW 5 по сравнению с плацебо в облегчении симптомов, входящих в состав основных синдромов и ФД, выявили достоверное преимущество STW 5 при лечении в течение 4 нед. [32,33]. В одном исследовании эффективность STW 5 сравнивали с таковой у цизаприда [17] при лечении в течение 4 нед. Данная работа продемонстрировала схожий уровень эффективности для обоих препаратов. В нашем исследовании наблюдение продолжалось более 8 нед., при этом было выявлено достоверное благоприятное действие на симптомы диспепсии в этот период. Основываясь на результатах более ранних работ [17,19,33], мы предположили, что изменение GSRS на 3 балла можно считать клинически значимым. Различие в эффекте между STW 5 и плацебо было меньше, чем ожидалось. Это стало следствием высокой эффективности плацебо в нашей работе (43% после 4 нед. и 53% после 8 нед.), что, впрочем, в целом соответствует результатам других исследований лечения ФД [34].
Наиболее вероятной причиной столь выраженного эффекта плацебо в нашем исследовании стало участие в нем значительного числа гастроэнтерологов. Пациенты доверяют специалистам больше, чем врачам общего профиля. Схожее объяснение было предложено авторами крупного двойного слепого рандомизированного и плацебо–контролируемого исследования эффективности ингибиторов протонного насоса в лечении ФД [10]. Значение изменения GSRS подтверждается его выраженной корреляцией с общей оценкой пациентов (17,7% получавших STW 5 оценивали лечение как очень хорошее по сравнению с 10,8% для плацебо). При этом необходимо отметить, что после окончания приема препарата его действие не сохраняется, и число рецидивов в течение последующих 6 мес. не снижается.
Вследствие высокой эффективности плацебо преимущество STW 5 оказалось небольшим, но достоверным.
Несколько препаратов были изучены в качестве метода лечения ФД [9–12,35–40], однако даже самые эффективные средства, снижающие кислотность, такие как ингибиторы протонного насоса, оказывают лишь небольшой положительный эффект [36,41]. Результаты устранения H. pylori противоречивы [13,14,37], однако в целом определенный благоприятный эффект данного фактора обеспечивает в подгруппе пациентов с симптомами диспепсии [41]. Цизаприд является эффективным препаратом для лечения диспепсии, однако его производство и продажа были остановлены после сообщений о развитии серьезных побочных эффектов [42,43].
Одним из преимуществ препаратов растительного происхождения в качестве метода лечения ФД является то, что они содержат большое количество различных действующих веществ. Поэтому сочетание разных экстрактов может оказывать действие на целый ряд различных механизмов. Среди различных растений, входящих в состав STW 5, Iberis amara вероятнее всего обладает наиболее выраженным действием на моторику ЖКТ [20–23], однако комбинация 9 растительных компонентов способна оказывать более многообразное действие [23,27,29,44]. Другие эффекты данного препарата включают противовоспалительное, антиоксидантное, антисекреторное, а также гастропротективное действие, угнетение секреции кислоты [25–29]. Все эти характеристики делают STW 5 подходящим кандидатом для применения в лечении столь многообразного заболевания, как ФД.
Препарат характеризуется хорошей переносимостью и не вызывает серьезных побочных эффектов. Существуют некоторые опасения в отношении возможности наличия гепатотоксических свойств у Chelidonium majus – алкалоида, содержащегося в чистотеле [45,46]. STW 5 содержит небольшое количество Chelidonium majus. Впрочем, доза чистотела, применявшаяся в этом исследовании, составляла 0,35 мг в сутки, что значительно меньше тех доз, при которых было отмечено токсическое действие. STW 5 содержит небольшие концентрации 9 различных растений, что обеспечивает хорошую переносимость. Так же как и в предыдущих исследованиях, прием STW 5 не приводил к развитию серьезных побочных эффектов [16–19]. Побочные эффекты, отмеченные среди получавших данный препарат, в большинстве случаев не были связаны с лечением и были сопоставимыми с таковыми в группе, получавшей плацебо. Все лабораторные показатели оставались в пределах нормы, и мы не отмечали каких–либо системных побочных эффектов.
В клинической практике ФД характеризуется непостоянством и неспецифичностью проявлений. Нередким является сходство между ФД и синдромом раздраженной толстой кишки. В плацебо–контролируемом исследовании, включавшем пациентов с синдромом раздраженной толстой кишки, STW 5 продемонстрировал эффективность [19]. Эти факты указывают на то, что STW 5 является хорошим альтернативным методом лечения нарушений функции ЖКТ [44].
На фоне отсутствия более эффективных и специфичных методов лечения ФД экстракт STW 5, в отношении которого накоплен значительный клинический опыт и высокая безопасность которого хорошо подтверждена, может являться ценной составляющей лечения.
Реферат подготовлен к.м.н. В.В. Иремашвили по материалам статьи
U. von Arnim, U. Peitz, B. Vinson, et al. «STW 5,
a Phytopharmacon for Patients
With Functional Dyspepsia: Results
of a Multicenter, Placebo–Controlled Double–Blind Study» Am J Gastroenterol 2007; 102: 1268–1275
Литература
1. Talley NJ, Stanghellini V, Heading RC, et al. Functional gastroduodenal disorders. Gut 1999;45(Suppl 2):II37–42.
2. Haag S, Talley NJ, Holtmann G. Symptom patterns in functional dyspepsia and irritable bowel syndrome: Relationship to disturbances in gastric emptying and response to
a nutrient challenge in consulters and non–consulters. Gut 2004;53:1445–51.
3. Drossman DA, Li Z, Andruzzi E, et al. U.S. householder survey of functional gastrointestinal disorders. Prevalence, sociodemography, and health impact. Dig Dis Sci 1993;38:1569–80.
4. Lee KJ, Kindt S, Tack J. Pathophysiology of functional dyspepsia. Best Pract Res Clin Gastroenterol 2004;18:707–16.
5. Jones MP, Sharp LK, Crowell MD. Psychosocial correlates of symptoms in functional dyspepsia. Clin Gastroenterol Hepatol 2005;3:521–8.
6. Nyren O, Lindberg G, Lindstrom E, et al. Economic costs of functional dyspepsia. Pharmacoeconomics 1992;1:312–24.
7. Talley NJ,Weaver AL, Zinsmeister AR. Impact of functional dyspepsia on quality of life. Dig Dis Sci 1995;40:584–9.
8. SmithML.Functional dyspepsia pathogenesis and therapeutic options—implications for management. Dig Liver Dis 2005;37:547–58.
9. Tack J, Bisschops R, Sarnelli G. Pathophysiology and treatment of functional dyspepsia. Gastroenterology 2004;127:1239–55.
10. Talley NJ, Meineche–Schmidt V, Pare P, et al. Efficacy of omeprazole in functional dyspepsia: Double–blind, randomized, placebo–controlled trials (the Bond and Opera studies). Aliment Pharmacol Ther 1998;12:1055–65.
11. Holtmann G, Gschossmann J, Mayr P, et al. A randomized placebo–controlled trial of simethicone and cisapride for the treatment of patients with functional dyspepsia. Aliment Pharmacol Ther 2002;16:1641–8.
12. Van OutryveM,De Nutte N,VanEeghem P, et al. Efficacy of cisapride in functional dyspepsia resistant to domperidone or metoclopramide: A double–blind, placebo–controlled study. Scand J Gastroenterol Suppl 1993;195:47–52.
13. Froehlich F, Gonvers JJ, Wietlisbach V, et al. Helicobacter pylori eradication treatment does not benefit patients with nonulcer dyspepsia. Am J Gastroenterol 2001;96:2329–36.
14. Talley NJ, Vakil N, Ballard ED, et al. Absence of benefit of eradicating Helicobacter pylori in patients with nonulcer dyspepsia. N Engl J Med 1999;341:1106–11.
15. Hamilton J, Guthrie E, Creed F, et al. A randomized controlled trial of psychotherapy in patients with chronic functional dyspepsia. Gastroenterology 2000;119:661–9.
16. BuchertD.Wirkung einer fixenKombination bei gesicherter Non–ulcer–Dyspepsie. Z Phytother 1994;15:24–5.
17. Madisch A, Melderis H, Mayr G, et al.Aplant extract and its modified preparation in functional dyspepsia. Results of a double–blind placebo controlled comparative study. Z Gastroenterol 2001;39:511–7.
18. Rosch W, Vinson B, Sassin I. A randomised clinical trial comparing the efficacy of a herbal preparation STW 5 with the prokinetic drug cisapride in patients with dysmotility type of functional dyspepsia. Z Gastroenterol 2002;40: 401–8.
19. Madisch A, Holtmann G, Plein K, et al. Treatment of irritable bowel syndrome with herbal preparations: Results of a double–blind, randomized, placebo–controlled, multi–centre trial. Aliment Pharmacol Ther 2004;19:271–9.
20. Okpanyi SN. Evaluations of the effects of Iberogast, STW 5–II, Iberis amara and some herbal extracts on different intestinal regions of the rat – in vitro. Research report 01/90. Darmstadt, Germany: Steigerwald Arzneimittelwerk GmbH, 1990.
21. Okpanyi SN. Evaluations of the effect of Iberogast (STW 5) and Iberogast N–II (STW 22. 5–II) on the histamin–induced contraction of the ileum of the guinea pig. Forschungsbericht
11/91. Darmstadt, Germany: Steigerwald Arzneimittelwerk GmbH, 1991.
22. Okpanyi SN, Mark M, Wahl MA. Gastrointestinal motility modulation with Iberogast. Acta Horticulturae 1993;332:227–35.
23. Heinle H, Hagelauer D, Pascht U, et al. Intestinal spasmolytic effects of STW 5 (Iberogast((R)) and its components. Phytomedicine 2006; 13 (Suppl 1): 75–9.
24. Storr M, Sibaev A, Weiser D, et al. Herbal extracts modulate the amplitude and frequency of slow waves in circular smooth muscle of mouse small intestine. Digestion 2004;70:257–64.
25. Hohenester B, Ruhl A, Kelber O, et al. The herbal preparation STW5 (lberogast) has potent and region–specific effects on gastric motility. Neurogastroenterol Motil 2004;16:765–73.
26. Khayyal MT, el Ghazaly MA, Kenawy SA, et al. Antiulcerogenic effect of some gastrointestinally acting plant extracts and their combination. Arzneimittelforschung 2001;51:545–53.
27. Khayyal MT, Schemann M, El–Ghazaly M. Effect of the phytomedicinal combination (STW 5) on gastric hyperacidity and motility. Clin Exp Pharmacol Physiol 2004;31(Suppl):A164.
28. Schempp H,Toth A,Weiser D, et al. Antioxidative properties of Iberis amara extracts in biochemical model reactions. Arzneimittelforschung 2003;53:568–77.
29. Schempp H, Hippeli S, Weiser D, et al. Comparison of the inhibition of myeloperoxidase–catalyzed hypochlorite formation in vitro and inwhole blood by different plant extracts contained in a phytopharmacon treating functional dyspepsia. Arzneimittelforschung 2004;54:389–95.
30. Veldhuyzen van Zanten SJ, Talley NJ, Bytzer P, et al. Design of treatment trials for functional gastrointestinal disorders. Gut 1999;45(Suppl 2):II69–77.
31. Adam B, Liebregts T, Saadat–Gilani K, et al. Validation of the gastrointestinal symptom score for the assessment of symptoms in patients with functional dyspepsia. Aliment Pharmacol Ther 2005;22:357–63.
32. Gundermann KJ, Godehardt E, Ulbrich M. Efficacy of a herbal preparation in patients with functional dyspepsia: A meta–analysis of double–blind, randomized, clinical trials.
Adv Ther 2003;20:43–9.
33. Melzer J, Rosch W, Reichling J, et al. Meta–analysis: Phytotherapy of functional dyspepsia with STW 5 (Iberogast). Aliment Pharmacol Ther 2004;20:1–9.
34. Dobrilla G, Scarpignato C. Placebo and placebo effect: Their impact on the evaluation of drug response in patients. Dig Dis 1994;12:368–77.
35. Talley NJ, Phillips SF. Non–ulcer dyspepsia: Potential causes and pathophysiology. Ann Intern Med 1988;108:865–79.
36. Moayyedi P, Delaney BC, Vakil N, et al. The efficacy of proton pump inhibitors in nonulcer dyspepsia: A systematic review and economic analysis. Gastroenterology 2004;127:1329–37.
37. Soo S, Moayyedi P, Deeks J, et al. Pharmacological interventions for non–ulcer dyspepsia. Cochrane Database Syst Rev 2000;CD001960.
38. Laine L, Schoenfeld P, Fennerty MB. Therapy for Helicobacter pylori in patients with nonulcer dyspepsia.Ametaanalysis of randomized, controlled trials. Ann Intern Med 2001;134:361–9.
39. Veldhuyzen van Zanten SJ, Jones MJ, Verlinden M, et al. Efficacy of cisapride and domperidone in functional (nonulcer) dyspepsia: A meta–analysis. Am J Gastroenterol 2001;96:689–96.
40. Dobrilla G, Comberlato M, Steele A, et al. Drug treatment of functional dyspepsia. A meta–analysis of randomized controlled clinical trials. J Clin Gastroenterol 1989;11:169–77.
41. Talley NJ, Lauritsen K. The potential role of acid suppression in functional dyspepsia: The BOND, OPERA, PILOT, and ENCORE studies. Gut 2002;50(Suppl IV):iv36–41.
42. Malfertheiner P, Mossner J, Fischbach W, et al. Helicobacter pylori eradication is beneficial in the treatment of functional dyspepsia. Aliment Pharmacol Ther 2003;18:615–25.
43. Glessner MR, Heller DA. Changes in related drug class utilization after market withdrawal of cisapride. Am J Manag Care 2002;8:243–50.
44. Layton D, Key C, Shakir SA. Prolongation of the QT interval and cardiac arrhythmias associated with cisapride: Limitations of the pharmacoepidemiological studies conducted and proposals for the future. Pharmacoepidemiol Drug Saf 2003;12:31–40.
45. Benninger J, Schneider HT, Schuppan D, et al. Acute hepatitis induced by greater celandine (Chelidonium majus). Gastroenterology 1999;117:1234–7.
46. Greving I, Meister V, Monnerjahn C, et al. Chelidonium majus: A rare reason for severe hepatotoxic reaction. Pharmacoepidemiol Drug Saf 1998;7(Suppl 1):S66–9.
Авторы: Мельцер Й. (Отделение внутренних болезней Университетской клиники, Цюрих, Швейцария), Рош В. (Клиника Северо-запада, Франкфурт-на-Майне, Германия), Рейхлинг Й. (Институт фармакологии и молекулярных биотехнологий Университета Гейдельберга, Германия), Бригноли Р. (Tradyser GmbH, Рюшликон, Швейцария), Саллер Р. (Отделение внутренних болезней Университетской клиники, Цюрих, Швейцария)
Для цитирования: Мельцер Й., Рош В., Рейхлинг Й., Бригноли Р., Саллер Р. Метаанализ: применение фитопрепарата STW 5 (Иберогаст®) при функциональной диспепсии // РМЖ. 2016. №17. С. 1130-1137
В статье приведен метаанализ, посвященный применению фитопрепарата STW 5 (Иберогаст®) при функциональной диспепсии
Введение
Функциональная диспепсия (ФД) является клиническим синдромом, характеризующимся хроническими или рецидивирующими симптомами со стороны верхних отделов желудочно-кишечного тракта (ЖКТ) [1]. Для дифференциальной диагностики между органической диспепсией и более распространенной ФД (также называемой неязвенной диспепсией (НЯД) или «раздраженным желудком») происхождение и тяжесть клинической симптоматики имеют ограниченное значение [2]. Как показало исследование, длившееся 3 мес., от симптомов диспепсии страдает приблизительно 1/4 взрослого населения, и эти симптомы являются причинами около 5% всех обращений за медицинской помощью [3, 4] и другими медицинскими услугами [5]. Диагноз ФД ставится путем исключения других возможных причин симптомов. Этиология данного заболевания, по всей видимости, имеет полиморфный характер, описаны различные потенциальные патогенетические механизмы, лежащие в основе заболевания, например: замедленное опорожнение желудка, желудочная гиперсекреция, гиперчувствительность к растяжению или нарушение распределения пищи внутри желудка. Кроме того, по результатам эпидемиологических исследований, была выявлена связь между возникновением диспепсии и недавними событиями в жизни пациента – психосоциальный фактор [6].
Для лечения ФД были предложены различные диагностические и терапевтические методики, каждая из которых имеет свои преимущества и недостатки [7, 8]. Лечение этого заболевания остается зачастую спорным вопросом, и, вероятно, «подходящая всем» терапия отсутствует. По результатам Кохрановского анализа [9], было сделано заключение, что применение прокинетиков, антагонистов Н2-рецепторов и ингибиторов протонной помпы (ИПП) приводит к значимому снижению относительного риска по сравнению с таковым при применении плацебо: на 48, 22 и 14% соответственно.
Однако прокинетики, несмотря на наличие некоторых положительных эффектов, обладают и рядом недостатков: воздействие на центральную нервную систему (метоклопрамид) или ряд побочных эффектов со стороны сердечно-сосудистой системы (цизаприд) [10]. Препараты солей висмута, антациды и сукральфат продемонстрировали ограниченный эффект или полное его отсутствие, Helicobacter pylori-эрадикационная терапия обладает небольшим, но статистически значимым эффектом в отношении H. pylori-положительной НЯД [11]. Применение растительных препаратов при лечении диспепсических жалоб имеет долгую историю. Они используются либо самостоятельно, либо в сочетании с другими растительными препаратами, т. к. содержат эфирные масла, которые известны своими спазмолитическими эффектами, ветрогонным и местным анестезирующим действием. Механизмы действия данных препаратов до конца не изучены. Однако результаты исследований позволяют предположить, что они регулируют активность гладкой мускулатуры пищеварительного тракта [12]. Оценке эффективности растительных лекарственных препаратов при лечении больных с диспепсическими симптомами раньше уделялось недостаточно внимания [13]. Растительный лекарственный препарат STW 5 (Иберогаст® «Штайгервальд», Дармштадт, Германия) представляет собой фиксированную комбинацию 9 растительных экстрактов (табл. 1), каждый из которых (за исключением иберийки горькой [14]) содержится в очень низкой концентрации по сравнению с дозировками, используемыми в монопрепаратах из травы чистотела, корня солодки, цветков ромашки, цветков мелиссы, листьев перечной мяты [15] или плодов расторопши пятнистой [16] и корня дягиля лекарственного [17]. Клиническая эффективность этого препарата считается высокой [18]. В представленной работе проанализированы клинические данные, касающиеся лечения ФД.
Материал и методы
Стратегия поиска
Для проведения настоящего метаанализа были использованы следующие базы данных: TOXLINE, MEDLINE, HealthSTAR, AIDSLINE и CANCERLIT, Embase, AMED и Cochrane Collaboration, которые анализировались со дня их формирования до декабря 2003 г. Условия поиска были следующими: STW 5, Иберогаст, растительные препараты, диспепсия, диспепсические и желудочно-кишечные расстройства, фитотерапия. Кроме того, были тщательно изучены ссылки на источники литературы из соответствующих статей, обзоров и книг, были установлены контакты со специалистами в данной области и производителем растительного препарата. В случае наличия дублирующихся публикаций в анализ включалась более поздняя или та, что была опубликована в рецензируемом журнале. Поскольку опубликованные данные были немногочисленны, в анализ также были включены неопубликованные данные и результаты отчетов, представленных для регистрации препарата в органы здравоохранения Германии (в Федеральный институт лекарственных средств и изделий медицинского назначения (BfArM)). Использование разносторонних данных способствовало снижению количества ошибок и отклонений анализа [19]. Для более точной уверенности в достоверности и сравнимости первичных данных была проведена перепроверка всех необработанных данных РКИ.
Критерий отбора
Для формирования обзора изначально были взяты все статьи с упоминанием о STW 5. Затем статьи были разделены в соответствии с тематикой или особенностями отбора пациентов и качеством методологии публикации (использованные методы, участники исследования, получаемая терапия и оценка результатов). Статьи о комбинированных лекарственных препаратах, опубликованные до 1992 г., не были включены в анализ, поскольку они не соответствуют современным стандартам надлежащей клинической практики (GCP), а также современным диагностическим критериям (Римские критерии). Для включения в данный анализ исследования должны были быть двойными слепыми рандомизированными плацебо-контролируемыми, с включением пациентов с ФД, кроме того, исследования должны были соответствовать стандартам GCP и использовать адекватные статистические методы. Исследования, которые не отвечали данным критериям, были исключены из нашего метаанализа. В своем анализе мы также следовали принципам, предусмотренным Кохрановским сообществом [20].
Статистические методы
После отбора исследований соответствующие исходные данные были перепроверены с использованием метода на основе пациентов, начавших получать лечение (ITT), и переноса вперед данных последнего наблюдения (метод замены пропущенных данных последним значением) (LOCF). Анализ отобранных исследований с учетом диагностических критериев и характеристик пациентов проводили в соответствии с Римскими критериями II [21]. Эти критерии классифицируют функциональные желудочно-кишечные расстройства как ФД, аэрофагию и функциональную рвоту. ФД подразделяется на 3 группы симптомов: «язвенного типа», «нарушения моторики» и «неспецифические» симптомы. Кроме того, был проведен анализ в соответствии с наиболее часто встречающимися симптомами, т. е. симптомами, получившими наиболее высокий балл у пациента. Анализ отобранных исследований продемонстрировал, что у 1/3 пациентов с ФД дополнительно присутствуют симптомы гастроэзофагеального рефлюкса (ГЭР) или синдрома раздраженного кишечника [22]. Таким образом, были отобраны все исследования, где изучали ФД, т. е. жалобы, которые не сопровождались нарушениями по данным эзофагогастродуоденоскопии, УЗИ или стандартных лабораторных показателей.
Полученные данные были сведены в таблицу для работы в соответствующей компьютерной программе [23]. Изучаемые исследования были преобразованы в «стандартное исследование» для возможности адекватного сопоставления первичных данных: вводный период – 7 дней, рандомизация при поступлении (включении), лечение после консультаций 3 и 5 нед. Полученные результаты были обобщены в таблицах и статистически проанализированы: в случае наличия дихотомических данных были определены отношение шансов и различия рисков по критериям Пето, Мантеля – Гензеля. У непрерывных данных было приведено среднее взвешенное по разности обратной дисперсией. При наличии значимости полученных результатов проводился анализ чувствительности. Уровень значимости был рассчитан с использованием двусторонних тестов, порог значимости был определен как p≤0,05, а незначимый результат соответствовал p>0,1; значения между р >0,05 и р<0,1 были определены как тенденции. Для оценки степени выраженности симптомов была использована шкала 10 наиболее часто встречающихся гастроинтестинальных симптомов (ГИС): от резко выраженных до мягких (с использованием 5-балльной шкалы Лайкерта: симптом резко выраженный, выраженный, умеренно выраженный, незначительно выраженный, симптом отсутствует).
Результаты
В электронных базах данных STW 5 и Иберогаст® были идентифицированы в 5 статьях. Также в анализ были включены 2 дополнительных клинических исследования. Так как основной целью настоящего метаанализа явилась оценка эффективности STW 5 с клинической точки зрения, особое внимание было обращено на клинически значимые конечные точки. Из 7 отобранных исследований 4 не соответствовали критериям включения (различная структура исследования и повторная публикация [24, 25], наблюдательное исследование [26], использован простой слепой метод [27]), в связи с чем в метаанализ были включены 3 исследования [28–30]. Четвертое исследование [31] было взято для анализа безопасности. Клинико-диагностические характеристики пациентов, включенных в исследования, достоверно не различались (табл. 2).
Плацебо-контролируемые исследования STW 5 (Иберогаст®): отдельные исследования
Все 3 рандомизированных исследования STW 5 были многоцентровыми, двойными слепыми плацебо-контролируемыми. В каждом исследовании пациенты получали STW 5 по 20 капель (20 капель = 1 мл) 3 р./сут в течение 4-х нед., за этот период было 4 визита (табл. 3). Анамнез пациентов был сопоставим, но длительность симптомов была весьма разнородна, что, вероятно, могло быть связано с различными способами запроса для определения продолжительности симптомов. В каждом исследовании было проанализировано улучшение симптомов у пациентов, начавших получать лечение. Помимо STW 5 в каждом из исследований изучался и другой дополнительный препарат, схожий с STW 5, но не содержащий всех 9 его растительных компонентов. Последние были отмечены в таблице 2 как STW 5-S, STW 6, STW 5-II.
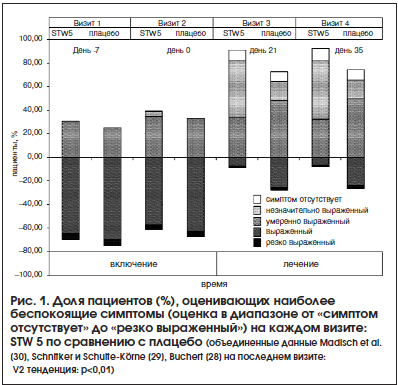
1. В небольшом РКИ, опубликованном Madisch et al. [30], было рандомизировано 60 пациентов, получавших STW 5 (n=20), STW 5-S (n=20) или плацебо (n=20). На последнем визите 15 из 20 пациентов, получавших STW 5, сообщили о том, что наиболее часто встречающиеся симптомы идентифицировались как «незначительно выраженный» или «симптом отсутствует», по сравнению с отсутствием таковых у пациентов из группы, получавшей плацебо. Исследователями также был сделан вывод о более высокой эффективности STW 5 по сравнению с плацебо (р<0,05).
2. Второе РКИ, проведенное Schnitker и Schulte-Körne [29], не было опубликовано. Оно основано на данных о 118 пациентах, получавших STW 5 (n=35), STW 6 (n=38), плацебо (n=35); 10 пациентов были исключены из анализа, т. к. не была известна информация о получаемой ими терапии. В общей сложности 91 пациент побывал на всех 4-х контрольных визитах. На последнем визите 16 из 35 пациентов, получавших STW 5, сообщили о том, что наиболее часто встречающиеся симптомы идентифицировались как «незначительно выраженный» или «симптом отсутствует», в то время как 7 из 35 идентифицировали симптомы как «выраженный» или «резко выраженный». Мнение о симптоматике и пациентов, и исследователей было отрицательным – не удалось показать существенную разницу между STW 5 и плацебо (визит 4, χ2 тенденция: статистически недостоверно).
3. Третье РКИ – это абстракт, опубликованный Buchert [28]. Было набрано 247 пациентов, 243 из них были включены в исследование. О 4-х исключенных пациентах нет данных. Пациенты были разделены на 3 группы, получавшие STW 5 (n=83), STW 5-II (n=80), плацебо (n=80). На последнем визите 52 из 83 пациентов, получавших STW 5, сообщили о том, что наиболее часто встречающиеся симптомы идентифицировались как «незначительно выраженный» или «симптом отсутствует», по сравнению с 14 из 80, получавших плацебо (χ2 тенденция: p<0,01). Анализ отдельных симптомов на последнем визите продемонстрировал значимые различия между STW 5 и плацебо в пользу препарата исследования для всех симптомов, за исключением спастических болей в животе.
Плацебо-контролируемые исследования препарата STW 5 (Иберогаст®): объединенные исследования
В настоящем метаанализе были использованы данные пациентов, участвующих в 3-х РКИ (первичные данные были сопоставимы по общим клинико-диагностическим, анамнестическим характеристикам и проводимой терапии): STW 5 (138 пациентов) и плацебо (135 пациентов). У большинства пациентов среди симптомов преобладала отрыжка кислым (n=124), остальных в основном беспокоила боль в эпигастральной области (n=101), преобладали симптомы расстройства моторики (n=30) или функциональной рвоты (n=18). На заключительном визите 83 из 138 пациентов, получавших препарат исследования, сообщили о том, что наиболее часто встречающиеся симптомы идентифицировались как «незначительно выраженный» или «симптом отсутствует» по сравнению с 33 из 135 пациентов в группе плацебо (V2 тенденция: p<0,01 (рис. 1).
Был выполнен пошаговый регрессионный анализ, в качестве независимых переменных использовались данные, полученные при включении (лечение, возраст, пол, рост, курение, ИМТ, наиболее часто встречающиеся симптомы: максимальное количество баллов при поступлении) и исходы (наиболее часто встречающиеся симптомы: максимальное количество баллов на последнем визите). В качестве зависимой переменной были использованы только лечение (p<0,001) и оценка наиболее часто встречающихся симптомов при включении (p=0,013), которые коррелировали с исходами. В конце периода лечения наиболее часто встречавшиеся симптомы идентифицировались как «выраженный» и «резко выраженный» у 26% пациентов в группе плацебо и только у 7% в группе STW 5. Различие между плацебо и STW 5 составляет 19% (р<0,001; отношение шансов 0,22; 95% ДИ: 0,11–0,47) (рис. 2).
На финальных визитах результаты индивидуальной оценки симптомов были получены в пользу препарата исследования (STW 5) – это касалось боли в эпигастральной области, отрыжки кислым и дискомфорта за грудиной (не было оценено у Schnitker и Schulte-Körne [29]). Пошаговый регрессионный анализ данных при включении в исследование и финальном визите продемонстрировал, что лечение было в значительной степени связано с исходом (p<0,001) для 6 из 10 симптомов (спастические боли в животе, боли в эпигастральной области, тошнота, отрыжка кислым, дискомфорт за грудиной, рвота), не было выявлено значимой корреляции для оставшихся 4-х симптомов: отсутствие аппетита, ощущение «переполнения», рвотные позывы и раннее насыщение.
Контролируемое исследование STW 5 с использованием эталонного препарата
Представлено многоцентровое контролируемое исследование по сравнению STW 5 с эталонным препаратом – прокинетиком цизапридом [31]. В общей сложности в это исследование было включено 193 пациента с ФД с нарушением моторики, 186 были рандомизированы, а 183 были проанализированы как начавшие получать лечение. 137 пациентов участвовали в протоколе исследования. В настоящем метаанализе были перепроверены первичные данные всех рандомизированных пациентов, получавших STW 5 (n=61), STW 5-II (n=62), цизаприд (n=463) (всего: n=186). При включении пациенты были сопоставимы по общим клинико-диагностическим характеристикам, продолжительности симптомов, результатам эндоскопических исследований и частоте встречаемости симптомов – от незначительных до резко выраженных (кроме рвотных позывов, для которых была отмечена тенденция к преобладанию в группе цизаприда (от незначительных до выраженных, p<0,1)).
Как показано на рисунке 3, баллы наиболее часто встречающегося симптома значительно сдвинуты в сторону STW 5 и цизаприда по сравнению с плацебо: от «преимущественно выраженный»/«резко выраженный» до «симптом отсутствует»/«незначительно выраженный».
Тем не менее сравнительный анализ 2-х групп, получавших препарат исследования, в отношении индивидуальных оценок симптомов в конце лечения продемонстрировал значительно меньшее количество таких симптомов, как отсутствие аппетита (p<0,01) и тенденцию к меньшему количеству симптомов раннего насыщения в группе STW 5 (р<0,1). Кроме того, общая оценка эффективности и переносимости исследуемых препаратов не продемонстрировала каких-либо существенных различий, хотя по данным опроса пациентов была тенденция к лучшей переносимости STW 5 по сравнению с цизапридом (р<0,1).
Безопасность
STW 5, как правило, хорошо переносится, при этом частота встречаемости НЯ значительно варьирует среди проведенных исследований, что может быть связано с более активным или пассивным сбором информации о НЯ. В анализируемых исследованиях регистрировались следующие процентные отношения частоты НЯ на фоне приема STW 5 или плацебо, соответственно: Buchert [28] 3,6% против 1,3%, Schnitker и Schulte-Körne [29] 22,9% против 25,7%, Madisch et al. [30] 5% против 10 % и Rösch et al. [31] 24,6% против 34,9% у цизаприда. Классификация НЯ, зарегистрированных в исследованиях в соответствии с системой (табл. 4), показала аналогичное число НЯ на фоне приема STW 5, плацебо или цизаприда. В действительности для любого препарата серьезных побочных эффектов в этих исследованиях зарегистрировано не было, а также не было обнаружено отклонений от соответствующих стандартных биохимических показателей. В одном наблюдательном исследовании (постмаркетинговые наблюдения), проведенном производителем STW 5 и включавшем 2267 пациентов, было выявлено единственное серьезное НЯ, которое не могло быть связано с лечением, – хирургическое вмешательство по поводу рака толстой кишки через 4 дня после завершения исследования [18, 26]. В течение 14 лет среди сообщений о НЯ было зарегистрировано 7 случаев экзантематозной кожной реакции (1 – с отеком Квинке и 1 – с рассеянным нейродермитом), 6 случаев непереносимости и 1 случай аллергической астмы. На фоне приема STW 5 побочные эффекты со стороны центральной нервной или сердечно-сосудистой системы зарегистрированы не были.
Обсуждение
273 пациента с ФД, получавших STW 5 (Иберогаст®) и плацебо в нескольких РКИ, – это довольно ограниченное, но все же достаточно большое количество наблюдений, необходимых для четкого представления о кратковременной клинической эффективности лекарственного препарата. Представленный анализ позволяет избежать проблем, часто встречающихся в метаанализах и анализах объединенных данных [32, 33]: (I) в анализ были включены все исследования, которые удовлетворяли текущим нормативам и стандартам, (II) дизайн исследования и схемы оценки симптомов были идентичны во всех исследованиях, и (III) все исследования проводились в одной социально-культурной среде. В отличие от ранее проведенного анализа тех же данных [29] мы избежали использования суммы баллов и провели повторный анализ всех первичных данных пациентов, начавших получать лечение, и метода переноса вперед данных последнего наблюдения (метод замены пропущенных данных последним значением).
Этот подход характеризуется некоторой потерей чувствительности, однако полученные результаты фактически подтвердили результаты, опубликованные или представленные в отдельных исследованиях с использованием оценки различных ГИС в качестве критерия эффективности. Хотя используемые в исследовании STW 5 профили ГИС не сильно различаются, всех их объединяет проблема многих других методов оценки клинических симптомов – они недостаточно апробированы для оценки ФД. Метод определения баллов наиболее часто встречающихся симптомов ранее уже использовался с целью разработки классификации [4] и определения эффективности другой группы лекарственных препаратов, используемых для лечения ФД (например, ИПП омепразола) [34]. Для обеспечения сопоставимости демографических и клинико-диагностических характеристик пациентов был предпринят повторный анализ первичных данных опубликованных и неопубликованных исследований, что помогло свести к минимуму различные отклонения. Применение метода для пациентов, начавших получать лечение, ко всем данным, увеличило надежность использованных в этом анализе данных. Хотя включение неопубликованных данных в метаанализ по-прежнему является предметом дискуссий, существуют указания, свидетельствующие о том, что это возможно, например, в случае скудности опубликованных данных. При этом неопубликованные данные могут быть подвергнуты такому же пристальному анализу, как и опубликованные [19].
Результаты объединенных исследований продемонстрировали, что STW 5 с точки зрения симптоматической помощи пациентам с ФД является более эффективным, чем плацебо. При сочетании с ГЭР или при преобладании боли в эпигастральной области такое различие имеет еще более высокую степень значимости. Однако данные результаты должны быть подтверждены в более крупных исследованиях.
С учетом данных, полученных в ходе клинических и наблюдательных исследований, а также того факта, что препарат применяется на немецком фармацевтическом рынке около 40 лет, профиль безопасности STW 5 является благоприятным. Хорошая переносимость препарата может быть связана с низкими концентрациями его отдельных компонентов. Вероятно, существует синергизм терапевтических эффектов, например, спазмолитического, ветрогонного, противовоспалительного и местного обезболивающего, и при этом без присоединения токсических эффектов. По данным ряда работ, только на фоне приема чистотела в составе других препаратов и в более высокой концентрации регистрировались редкие случаи холестатического гепатита [35, 36]. Данный факт объясняет отсутствие таких явлений на фоне приема STW 5 [18]. Исследования, проведенные в течение 4-х нед. в отношении других фиксированных комбинаций, таких как перечная мята и масло тмина [37, 38] или масло перечной мяты и экстракт имбиря [39], продемонстрировали улучшение течения ФД или НЯД по сравнению с результатами при применении плацебо или цизаприда, что сопоставимо с результатами на фоне приема STW 5. Результаты, касающиеся безопасности и эффективности лечения, обнадеживающие, однако необходимы дальнейшие исследования безопасности препарата при длительном применении, а также возможных взаимодействий растительных препаратов [13].
Таким образом, с точки зрения эффективности и профиля безопасности препарат STW 5 (Иберогаст®) может быть рекомендован в качестве перспективного препарата первой линии терапии ФД для пациентов, нуждающихся в комплексном медицинском подходе. Для подтверждения полученных данных необходимо дальнейшее проведение крупномасштабных исследований.
Перевод с английского выполнен к.м.н. Ю.Е. Ефремовой
источник: http://www.rmj.ru/
1. Stanghellini V., Chan F.K.L., Hasler W.L., Malagelada J.R., Suzuki H., Tack J., Talley N.J. Gastroduodenal disorders. Gastroenterology. 2016; 150 (6): 1380–92. DOI: 10.1053/j.gastro.2016.02.011
2. Lacy B.E., Mearin F., Chang L., Chey W.D., Lembo A.J., Simren M., Spiller R. Bowel disorders. Gastroenterology. 2016;150(6):1393–407. DOI: 10.1053/j.gastro.2016.02.031
3. Шептулин А.А., Кардашева С.С., Курбатова А.А. Сочетание функциональной диспепсии и синдрома раздраженного кишечника: случайная комбинация или закономерная связь? Клиническая медицина. 2020;98(4):251–5. DOI: 10.30629/0023-2149-2020-98-4-251-255
4. Allescher H.-D., Burgell R., Malfertheiner P., Mearin F. Multi-target treatment for irritable bowel syndrtome with STW 5: pharmacological modes of action. J Gastrointestin Liver Dis. 2020;29(2):227–33. DOI: 10.15403/jgld-814
5. Allescher H.-D., Abdel-Aziz H. Mechanism of action of STW5 in functional dyspepsia and IBS: the origin of multi-target. Dig Dis. 2017;35(suppl. 1):18–24. DOI: 10.1159/000485456
6. Malfertheiner P. STW5 (Iberogast) therapy in gastrointestinal functional disorders. Dig Dis. 2017;35(suppl. 1):25–9. DOI: 10.1159/000485410
7. Simmen U., Kelber O., Okpanyi S.N., et al. Bimding of STW 5 (Iberogast® ) and its components to intestinal 5-HT, muscarinic M3, and opioid receptors Phytomedicine. 2006;13(suppl. 5):51–5. DOI: 10.1016/j.phymed.2006.03.012
8. Khayyal M.T., El-Ghazaly M.A., Kenawy S., Seif-ElNasr M., Mahran L.G. Fafafi Y.A., et al. Antiulcerogenic effect of some gastrointestinally acting plant extracts and their combination. Arzneim Forsch Drug Res. 2001;51(7):545–53. DOI: 10.1055/s-0031-1300078
9. Hohenester B., Rühl A., Kelber O., Schemann M. The herbal preparation STW5 (Iberogast® ) has potent and region-specific effects on gastric motility. Neurogastroenterol Motil. 2004;16(6):765–73. DOI: 10.1111/j.1365-2982.2004.00648.x
10. Schemann M., Michel K., Zeller F., Hohenester B., Rühl A. Region-specific effects of STW 5 (Iberogast® ) and its components in gastric fundus, corpus and antrum. Phytomedicine. 2006;13(suppl. 5):90–9. DOI: 10.1016/j.phymed.2006.03.020
11. Pilichiewicz A.N., Horowitz M., Russo A., Maddox A., Jones K.L., Schemann M., et al. Effects of Iberogast® on proximal gastric volume, antropyloroduodenal motility and gastric emptying in healthy men. Amer J Gastroenterol. 2007;102(6):1276–83. DOI: 10.1111/j.1572-0241.2007.01142.x
12. Madisch A., Vinson B. Abdel-Aziz H., Kelber O., Nieber K., Kraft K., Storr M. Modulation of gastrointestinal motility beyond metoclopramide and domperidone: Pharmacological and clinical evidence for phytotherapy in functional gastrointestinal disorders. Wien Med Wochenschr. 2017;167(7–8):160–8. DOI: 10.1007/s10354-017-0557-3
13. Ammon H.P.T., Lelber O., Okpanyi S.N. Spasmolytic and tonic effect of Iberogast (STW 5) in intestinal smooth muscle. Phytomedicine. 2006;13(suppl. 5):67–74. DOI: 10.1016/j.phymed.2006.08.004
14. Liu C.-Y., Müller M.H., Glatzle J., Weiser D., Kelber O., Enck P., et al. The herbal preparation STW5 (Iberogast) desensitizes intestinal afferents in the rat small intestine. Neurogastroenterol Motil. 2004;16(6):759–64. DOI: 10.1111/j.1365-2982-2004.00576.x
15. Michael S., Kelber O., Нauschildt S., Spanel-Borowski K., Nieber K. Inhibition of inflammation-induced alterations in rat small intestine by the herbal preparations STW5 and STW6. Phytomedicine. 2009;16:161–71. DOI: 10.1016/j.phymed.2008.10.011
16. Wadie W., Abdel-Aziz H., Zaki H.F., Kelber O., Weiser D., Khayyal T. STW5 is effective in dextran sulfate sodium-induced colitis in rats. Int J Colorectal Dis. 2012;27(11):1445–53. DOI: 10.1007/s00384-012-1473-z
17. Von Arnim U., Peitz U., Vinson B., Gundermann KJ, Malfertheiner P. STW 5, a phytopharmacon for patients with functional dyspepsia: results of a multicenter, placebo-controlled double-blind study. Am J Gastroenterol. 2007;102(6):1268– 75. DOI: 10.1111/j.1572-0241.2006.01183.x
18. Braden B., Caspary W., Bȍrner N., Vinson B., Schneider A.R. Clinical effects of STW 5 Iberogast® are not based on acceleration of gastric emptying in patients with functional dyspepsia and gastroparesis. Neurogastroenterol Motil. 2009;21(6):632–9. DOI: 10.1111/j.1365-2982.2008.01249.x
19. Buchert D. Wirksamkeit und Verträglichkeit von Iberogast® bei Patienten mit gesicherter Non Ulkus Dyspepsie. Z Phytotherapie. 1994;15:45–6.
20. Madisch A., Melderis H., Mayr G., Sassin I., Hotz J. Ein Phytotherapeutikum und seine modifizierte Rezeptur bei funktioneller Dyspepsie. Z Gastroenterologie. 2001;39(7):1–8. DOI: 10.1055/s-2001-1614
21. Gundermann K.-J., Godehardt E., Ulbrich M. Efficacy of a herbal preparation in patients with functional dyspepsia: a meta-analysis of double-blind, randomized clinical trials. Adv Ther. 2003;20(1):1–7. DOI: 10.10077/BF02850118
22. Holtmann G., Nandurkar S., Talley N.J. Herbal medicine for the treatment of functional dyspepsia: a systematic review of the literature and meta-analysis. Gastroenterology. 2007;132(suppl. 2):Abstract W1204.
23. Melzer J., Rȍsch W., Reichling J., Brignoli R., Saller R. Meta-analysis: phytotherapy of functional dyspepsia with the herbal drug preparation STW 5 (Iberogast® ). Aliment Pharmacol Ther. 2004;20(11–12):1279–87. DOI: 10.1111/j.1365-2036.2004.02275
24. Raedsch R., Hanisch J., Bock P., Sibaev A., Vinson B., Gunderman K.J. Wirksamkeit und Unbedenklichkeit des Phytopharmacons STW 5 versus Metoclopramid bei Funktioneller Dyspepsie unter Praxisbedingungen — eine retrolektive Kohortenstudie. Z Gastroenterol. 2007;45(10):1041–8. DOI: 10.1055/s-20070963357
25. Madisch A., Holtmann G., Plein K., Hotz J. Treatment of irritable bowel syndrome with herbal preparations: results of a double-blind, randomized, placebo-controlled, multicentre trial. Alement Pharmacol Ther. 2004;19(3):271–9. DOI: 10.1111/j.1365-2036.2004/01859
26. Sassin I., Buchert D. Efficacy and tolerability of the herbal preparation Iberogast in the therapy of functional dyspepsia. Phytomedicine. 2000;7(suppl. 2):91–2.
27. Klein-Galczinsky C., Sassin I. Anwendungsbeobachtung zur Wirksamkeit und Verträglichkeitvon Iberogast in der Therapie des Colon irritable. Phytotherapie an der Schwelle zun neuen Jahrtausend. 1999;125:Abstract P25.
28. Abdel-Aziz H., Kelber O., Lorkowski G., Storr M. Evaluating the multitarget effects of combinations through multistep clustering of pharmacological data: the example of the commercial preparation Iberogast. Planta Medica. 2017;83(14–15):1130–46. DOI: 10.1055/s-0043-116852
29. Layer P., Andresen V., Pehl C., Allescher H., Bischoff S.C., Classen M., et al. Irritable bowel syndrome: German consensus guidelines on definition, pathophysiology and management. Joint guideline of the German Society for digestive and metabolic diseases (DGVS) and the German Society for Neurgastroenterology and Motility (DGNM). Z Gastroenterol. 2011;49(2):237–93.
30. Lapina T.L., Trukhmanov A.S. Herbal preparation STW 5 for functional gastrointestinal disorders: clinical experience in everyday practice. Dig Dis. 2017;35(suppl. 1):30– 5. DOI: 10.1159/000485411
31. Gundermann K.-J., Vinson B., Hänicke S. Die funktionelle Dyspepsie bei Kindern — eine retrospective Studie mit einem Phytopharmakon. Pädiatrie. 2004;10:1–6.
32. Vinson B.R., Radke M. The herbal preparation STW 5 for the treatment of functional gastrointestinal diseases in children aged 3–14 years — a prospective non interventional study Digestive Disease Week, Chicago. 2011:Abstract #523. Gastroenterology. 2011;140(5):S102. DOI: 10.1016/S0016-5085(11)60415-0
33. Ottilinger B., Storr M., Malfertheiner P., Allescher H.-D. STW 5 (Iberogast) — a safe and effective standart in the treatment of functional gastrointestinal disorders. Wien Med Wochenschr. 2013;163(3–4):65–72. DOI: 10.1007/s10354-012-0169-x
ГЛАВНЫЕ ТЕЗИСЫ
В ходе периода исследования продолжительностью 8 недель установлена эффективность STW 5-II при применении в качестве терапевтического средства в лечении пациентов с функциональной диспепсией, соответствовавших Римским критериям IV.
Аннотация
Предпосылки к проведению исследования
Целью вторичного анализа в ходе исследования продолжительностью 8 недель была повторная оценка эффективности применения STW 5-II у пациентов с функциональной диспепсией (ФД), соответствовавших последней версии Римских критериев IV.
Методология
Из 272 пациентов с ФД, соответствовавших Римским критериям II, 266 (97,8 %) соответствовали Римским критериям IV, так как имели хотя бы 1 ключевой симптом умеренной степени тяжести (а именно «чувство переполнения», «раннее насыщение» или «боль в верхней части живота/эпигастрии») на исходном уровне и прошли хотя бы одну оценку эффективности после начала исследования. Степень тяжести симптомов со стороны ЖКТ определяли с помощью валидированной шкалы оценки выраженности симптомов со стороны ЖКТ (GIS).
Долю пациентов, ответивших на лечение, рассчитывали на основании улучшения GIS на 50 % хотя бы в 3 из 4 оценок в качестве критерия ответа. В дополнительном исследовании использовали изменение суммы результатов оценки симптомов между исходным уровнем и 8-й неделей в качестве конечной точки для оценки эффективности по четырем различным кластерам симптомов.
Результаты
Демографические характеристики и степень тяжести симптомов на исходном уровне в двух группах лечения были сопоставимы (STW 5-II: n = 134, плацебо: n = 132). Результаты вторичной оценки подтвердили первоначальные результаты исследования (частота ответа составляла 61,2 % по сравнению с 45,1 %) и свидетельствовали о том, что STW-II превосходил плацебо в отношении частоты ответа (65 % по сравнению с 48,7 %). При сравнении группы применения STW 5-II с группой плацебо была отмечена разность средних 0,6 по таким симптомам, связанным с приемом пищи, как раннее насыщение, чувство переполнения и потеря аппетита.
Заключение
При применении у пациентов с функциональной диспепсией STW-II превосходил плацебо по эффективности в отношении доли пациентов, ответивших на лечение. Кроме того, применение STW-II сопровождалось более выраженным улучшением кластеров симптомов, связанных с приемом пищи.
Оригинальное название статьи
Efficacy and safety of STW 5-II in patients with functional dyspepsia according Rome IV criteria: Results from a post-hoc analysis of a double-blind, randomized, placebo-controlled, 8-week multicenter trial
Авторы
функциональная диспепсия
Иберогаст® (Iberogast®) инструкция по применению
📜 Инструкция по применению Иберогаст®
💊 Состав препарата Иберогаст®
✅ Применение препарата Иберогаст®
📅 Условия хранения Иберогаст®
⏳ Срок годности Иберогаст®
Описание лекарственного препарата
Иберогаст®
(Iberogast®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2018 года.
Дата обновления: 2017.12.14
Владелец регистрационного удостоверения:
Контакты для обращений:
БАЙЕР АГ
(Германия)
Код ATX:
V30
(Не присвоен)
Лекарственная форма
| Иберогаст® |
Капли д/приема внутрь: фл. 50 мл или 100 мл с капельницей рег. №: ЛП-000094 |
Форма выпуска, упаковка и состав
препарата Иберогаст®
Капли для приема внутрь от прозрачной до немного мутной жидкости темно-коричневого цвета; в процессе хранения допускается образование незначительного осадка.
* Экстрагент: этанол 50%.
** Экстрагент: этанол 30%.
Вспомогательные вещества: этанол — около 31% (в объемном отношении).
50 мл — флаконы темного стекла с капельницей (1) — пачки картонные.
100 мл — флаконы темного стекла с капельницей (1) — пачки картонные.
Фармакологическое действие
Препарат обладает выраженным противовоспалительным действием, а также нормализует тонус гладкой мускулатуры ЖКТ: способствует устранению спазма без влияния на нормальную перистальтику, а при пониженном тонусе и моторике оказывает тонизирующее, прокинетическое действие. В эксперименте in vitro ингибирует рост 6 подвидов Helicobacter pylori. Иберогаст® снижает интенсивность изъязвления слизистой оболочки желудка, секреции соляной кислоты, уменьшает концентрацию лейкотриенов, усиливает продукцию муцинов, повышает концентрацию мукопротективного простагландина Е2 в слизистой оболочке желудка.
Фармакокинетика
Данные о фармакокинетике препарата отсутствуют.
Показания препарата
Иберогаст®
- для лечения функциональных расстройств ЖКТ (в т.ч. синдрома раздраженного кишечника), проявляющихся тяжестью в эпигастральной области, спазмами желудка или кишечника, отрыжкой, тошнотой, метеоризмом, запором, диареей или их чередованием;
- в составе комплексной терапии гастрита, язвенной болезни желудка и двенадцатиперстной кишки.
Режим дозирования
Препарат принимают внутрь, по 20 капель 3 раза/сут, перед или во время еды, с небольшим количеством воды.
Длительность терапии составляет 4 недели.
Увеличение продолжительности и проведение повторных курсов лечения возможно по рекомендации врача.
Побочное действие
Со стороны пищеварительной системы: тошнота, рвота, диарея.
Аллергические реакции: кожные проявления, одышка.
При появлении побочных реакций необходимо отменить препарат и обратиться к врачу.
Противопоказания к применению
- калькулезный холецистит;
- детский и подростковый возраст до 12 лет (из-за недостаточности клинических данных);
- повышенная чувствительность к компонентам препарата.
С осторожностью следует назначать препарат при заболеваниях печени, алкоголизме, черепно-мозговой травме, заболеваниях головного мозга — из-за содержания этанола в препарате.
Применение при беременности и кормлении грудью
Препарат не следует применять при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
С осторожностью: заболевания печени (из-за содержания этанола в препарате).
Применение у детей
Противопоказан детям в возрасте до 18 лет из-за недостаточности клинических данных.
Особые указания
Если выраженность заболевания не уменьшается в течение 14 дней применения препарата, или отмечается усугубление симптомов, или возникают новые жалобы, пациенту необходимо обратиться к врачу.
Содержание в составе препарата этанола составляет от 29.5 до 32.6% (по объему). При приеме 1 разовой дозы (20 капель) пациент получает до 0.24 г абсолютного этилового спирта. В максимальной суточной дозе препарата (60 капель) содержится до 0.72 г абсолютного этилового спирта, что ниже содержания этанола в 200 мл яблочного сока или 75 мл кефира.
Перед применением содержимое флакона следует взбалтывать.
В процессе хранения возможно легкое помутнение или выпадение незначительного осадка, что не оказывает влияния на терапевтическую эффективность препарата.
Влияние на способность к управлению транспортными средствами и механизмами
При применении препарата следует соблюдать осторожность при выполнении потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций (в т.ч. управление транспортными средствами, работа с движущимися механизмами, работа диспетчера и оператора).
Передозировка
До настоящего времени о случаях передозировки препарата не сообщалось.
Лекарственное взаимодействие
Взаимодействие с другими лекарственными средствами на настоящий момент неизвестно.
Следует учитывать возможность взаимодействия с лекарственными средствами, метаболизм которых осуществляется с участием системы цитохрома Р450 (корни солодки, плоды расторопши, цветки ромашки могут оказывать ингибирующее действие на ряд изоферментов цитохрома Р450). При этом данные эффекты носят дозозависимый характер и описаны при применении отдельных компонентов в концентрациях, многократно превышающих рекомендуемые дозы препарата Иберогаст®.
Условия хранения препарата Иберогаст®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Иберогаст®
Условия реализации
Препарат отпускается без рецепта.
Контакты для обращений
БАЙЕР АГ
(Германия)

|
|
Организация, принимающая |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код