The following serious adverse reactions are discussed in greater detail in other sections of the labeling:
- CNS-depressant effects and next-day impairment
- Serious anaphylactic and anaphylactoid reactions
- Abnormal thinking and behavior changes, and complex behaviors
- Withdrawal effects
Clinical Trials Experience
Associated With Discontinuation Of Treatment
Approximately 4% of 1,701 patients who received zolpidem tartrate at all doses (1.25 to 90 mg) in U.S. premarketing clinical trials discontinued treatment because of an adverse reaction. Reactions most commonly associated with discontinuation from U.S. trials were daytime drowsiness (0.5%), dizziness (0.4%), headache (0.5%), nausea (0.6%), and vomiting (0.5%).
Approximately 4% of 1,959 patients who received zolpidem tartrate at all doses (1 to 50 mg) in similar foreign trials discontinued treatment because of an adverse reaction. Reactions most commonly associated with discontinuation from these trials were daytime drowsiness (1.1%), dizziness/vertigo (0.8%), amnesia (0.5%), nausea (0.5%), headache (0.4%), and falls (0.4%).
Data from a clinical study in which selective serotonin reuptake inhibitor (SSRI)-treated patients were given zolpidem tartrate revealed that four of the seven discontinuations during double-blind treatment with zolpidem (n=95) were associated with impaired concentration, continuing or aggravated depression, and manic reaction; one patient treated with placebo (n=97) was discontinued after an attempted suicide.
Most Commonly Observed Adverse Reactions In Controlled Trials
During short-term treatment (up to 10 nights) with zolpidem tartrate at doses up to 10 mg, the most commonly observed adverse reactions associated with the use of zolpidem and seen at statistically significant differences from placebo-treated patients were drowsiness (reported by 2% of zolpidem patients), dizziness (1%), and diarrhea (1%). During longer-term treatment (28 to 35 nights) with zolpidem tartrate at doses up to 10 mg, the most commonly observed adverse reactions associated with the use of zolpidem and seen at statistically significant differences from placebo-treated patients were dizziness (5%) and drugged feelings (3%).
Adverse Reactions Observed At An Incidence Of = 1% In Controlled Trials
The following tables enumerate treatment-emergent adverse event frequencies that were observed at an incidence equal to 1% or greater among patients with insomnia who received zolpidem tartrate and at a greater incidence than placebo in U.S. placebo-controlled trials. Events reported by investigators were classified utilizing a modified World Health Organization (WHO) dictionary of preferred terms for the purpose of establishing event frequencies. The prescriber should be aware that these figures cannot be used to predict the incidence of side effects in the course of usual medical practice, in which patient characteristics and other factors differ from those that prevailed in these clinical trials. Similarly, the cited frequencies cannot be compared with figures obtained from other clinical investigators involving related drug products and uses, since each group of drug trials is conducted under a different set of conditions. However, the cited figures provide the physician with a basis for estimating the relative contribution of drug and nondrug factors to the incidence of side effects in the population studied.
The following table was derived from a pool of 11 placebo-controlled short-term U.S. efficacy trials involving zolpidem in doses ranging from 1.25 to 20 mg. The table is limited to data from doses up to and including 10 mg, the highest dose recommended for use.
TABLE 1: Incidence of Treatment-Emergent Adverse Experiences in Placebo-Controlled Clinical Trials with zolpidem tartrate lasting up to 10 nights (Percentage of patients reporting)
| Body System/ Adverse Event* | Zolpidem tartrate ( ≤ 10 mg) (N=685) |
Placebo (N=473) |
| Central and Peripheral Nervous System | ||
| Headache | 7 | 6 |
| Drowsiness | 2 | — |
| Dizziness | 1 | — |
| Gastrointestinal System | ||
| Diarrhea | 1 | — |
| *Reactions reported by at least 1 % of patients treated with oral zolpidem and at a greater frequency than placebo. |
The following table was derived from a pool of three placebo-controlled long-term efficacy trials involving oral zolpidem. These trials involved patients with chronic insomnia who were treated for 28 to 35 nights with zolpidem at doses of 5, 10, or 15 mg. The table is limited to data from doses up to and including 10 mg, the highest dose recommended for use. The table includes only adverse events occurring at an incidence of at least 1% for zolpidem patients.
TABLE 2: Incidence of Treatment-Emergent Adverse Experiences in Placebo-Controlled Clinical Trials with zolpidem tartrate lasting up to 35 nights (Percentage of patients reporting)
| Body System/ Adverse Event* | Zolpidem tartrate ( ≤ 10 mg) (N=152) | Placebo (N=161) |
| Autonomic Nervous System Dry mouth | 3 | 1 |
| Body as a Whole | ||
| Allergy | 4 | 1 |
| Back Pain | 3 | 2 |
| Influenza-like symptoms | 2 | — |
| Chest pain | 1 | — |
| Cardiovascular System | ||
| Palpitation | 2 | — |
| Central and Peripheral Nervous System | ||
| Drowsiness | 8 | 5 |
| Dizziness | 5 | 1 |
| Lethargy | 3 | 1 |
| Drugged feeling | 3 | — |
| Lightheadedness | 2 | 1 |
| Depression | 2 | 1 |
| Abnormal dreams | 1 | — |
| Amnesia | 1 | — |
| Sleep disorder | 1 | — |
| Gastrointestinal System | ||
| Diarrhea | 3 | 2 |
| Abdominal pain | 2 | 2 |
| Constipation | 2 | 1 |
| Respiratory System | ||
| Sinusitis | 4 | 2 |
| Pharyngitis | 3 | 1 |
| Skin and Appendages | ||
| Rash | 2 | 1 |
| *Reactions reported by at least 1% of patients treated with oral zolpidem and at a greater frequency than placebo. |
Dose Relationship For Adverse Reactions Associated With Oral Zolpidem
There is evidence from dose comparison trials suggesting a dose relationship for many of the adverse reactions associated with oral zolpidem use, particularly for certain CNS and gastrointestinal adverse events.
Oral Tissue-Related Adverse Reactions To Stilnox
The effect of chronic daily administration of Stilnox on oral tissue was evaluated in a 60-day open-label study in 60 insomniac patients. One patient developed transient sublingual erythema, and another transient paresthesia of the tongue.
Adverse Event Incidence Across The Entire Preapproval Oral Zolpidem Database
Zolpidem was administered to 3,660 subjects in clinical trials throughout the U.S., Canada, and Europe. Treatment-emergent adverse events associated with clinical trial participation were recorded by clinical investigators using terminology of their own choosing. To provide a meaningful estimate of the proportion of individuals experiencing treatment-emergent adverse events, similar types of untoward events were grouped into a smaller number of standardized event categories and classified utilizing a modified World Health Organization (WHO) dictionary of preferred terms.
The frequencies presented, therefore, represent the proportions of the 3,660 individuals exposed to zolpidem, at all doses, who experienced an event of the type cited on at least one occasion while receiving zolpidem. All reported treatment-emergent adverse events are included, except those already listed in the table above of adverse events in placebo-controlled studies, those coding terms that are so general as to be uninformative, and those events where a drug cause was remote. It is important to emphasize that, although the events reported did occur during treatment with zolpidem, they were not necessarily caused by it.
Adverse events are further classified within body system categories and enumerated in order of decreasing frequency using the following definitions: frequent adverse events are defined as those occurring in greater than 1/100 subjects; infrequent adverse events are those occurring in 1/100 to 1/1,000 patients; rare events are those occurring in less than 1/1,000 patients.
Autonomic nervous system: Infrequent: increased sweating, pallor, postural hypotension, syncope. Rare: abnormal accommodation, altered saliva, flushing, glaucoma, hypotension, impotence, increased saliva, tenesmus.
Body as a whole: Frequent: asthenia. Infrequent: edema, falling, fever, malaise, trauma.
Rare: allergic reaction, allergy aggravated, anaphylactic shock, face edema, hot flashes, increased ESR, pain, restless legs, rigors, tolerance increased, weight decrease.
Cardiovascular system: Infrequent: cerebrovascular disorder, hypertension, tachycardia.
Rare: angina pectoris, arrhythmia, arteritis, circulatory failure, extrasystoles, hypertension aggravated, myocardial infarction, phlebitis, pulmonary embolism, pulmonary edema, varicose veins, ventricular tachycardia.
Central and peripheral nervous system: Frequent: ataxia, confusion, euphoria, headache, insomnia, vertigo. Infrequent: agitation, anxiety, decreased cognition, detached, difficulty concentrating, dysarthria, emotional lability, hallucination, hypoesthesia, illusion, leg cramps, migraine, nervousness, paresthesia, sleeping (after daytime dosing), speech disorder, stupor, tremor. Rare: abnormal gait, abnormal thinking, aggressive reaction, apathy, appetite increased, decreased libido, delusion, dementia, depersonalization, dysphasia, feeling strange, hypokinesia, hypotonia, hysteria, intoxicated feeling, manic reaction, neuralgia, neuritis, neuropathy, neurosis, panic attacks, paresis, personality disorder, somnambulism, suicide attempts, tetany, yawning.
Gastrointestinal system: Frequent: dyspepsia, hiccup, nausea. Infrequent: anorexia, constipation, dysphagia, flatulence, gastroenteritis, vomiting. Rare: enteritis, eructation, esophagospasm, gastritis, hemorrhoids, intestinal obstruction, rectal hemorrhage, tooth caries.
Hematologic and lymphatic system: Rare: anemia, hyperhemoglobinemia, leukopenia, lymphadenopathy, macrocytic anemia, purpura, thrombosis.
Immunologic system: Infrequent: infection. Rare: abscess herpes simplex herpes zoster, otitis externa, otitis media.
Liver and biliary system: Infrequent: abnormal hepatic function, increased SGPT. Rare: bilirubinemia, increased SGOT.
Metabolic and nutritional: Infrequent: hyperglycemia, thirst. Rare: gout, hypercholesteremia, hyperlipidemia, increased alkaline phosphatase, increased BUN, periorbital edema.
Musculoskeletal system: Frequent: arthralgia, myalgia. Infrequent: arthritis. Rare: arthrosis, muscle weakness, sciatica, tendinitis.
Reproductive system: Infrequent: menstrual disorder, vaginitis. Rare: breast fibroadenosis, breast neoplasm, breast pain.
Respiratory system: Frequent: upper respiratory infection. Infrequent: bronchitis, coughing, dyspnea, rhinitis. Rare: bronchospasm, epistaxis, hypoxia, laryngitis, pneumonia.
Skin and appendages: Infrequent: pruritus. Rare: acne, bullous eruption, dermatitis, furunculosis, injection-site inflammation, photosensitivity reaction, urticaria.
Special senses: Frequent: diplopia, vision abnormal. Infrequent: eye irritation, eye pain, scleritis, taste perversion, tinnitus. Rare: conjunctivitis, corneal ulceration, lacrimation abnormal, parosmia, photopsia.
Urogenital system: Frequent: urinary tract infection. Infrequent: cystitis, urinary incontinence. Rare: acute renal failure, dysuria, micturition frequency, nocturia, polyuria, pyelonephritis, renal pain, urinary retention.
These effects seem to be related with individual sensitivity and to appear more often within the hour following the drug intake if the patient does not go to bed or does not sleep immediately.
The adverse drug reactions are stated in the table below using the following convention:
Very common (>1/10); common (>1/100; <1/10); uncommon (>1/1,000; <1/100); rare (>1/10,000; <1/1,000); very rare (<1/10,000) including isolated reports; not known (cannot be estimated from available data).
There is evidence for a dose connection for reactions associated with use of Stilnox, especially certain CNS reactions and gastrointestinal events. Theoretically they should be less if Stilnox is taken immediately before bedtime. They occur most frequently in elderly patients.
|
SOC |
Frequency |
|||
|
Common |
Uncommon |
Rare |
Not known |
|
|
Infections and infestations |
Upper respiratory tract infection, lower respiratory tract infection |
|||
|
Immune system disorders |
Angioneurotic oedema |
|||
|
Psychiatric disorders |
Hallucination, agitation, nightmare, numbed emotions |
Irritability, confusion |
Restlessness, aggression, delusion, anger, psychosis, abnormal behaviour, sleep walking , dependence (withdrawal symptoms, or rebound effects may occur after treatment discontinuation), depression, decreased libido |
|
|
Nervous system disorders |
Somnolence, headache, dizziness, increased insomnia, cognitive disorders such as anterograde amnesia: (amnestic effects may be associated with inappropriate behaviour), drowsiness during the following day, reduced alertness |
Ataxia |
Depressed level of consciousness |
|
|
Eye disorders |
Double vision |
|||
|
Ear and labyrinth disorders |
Vertigo |
|||
|
Respiratory, thoracic and mediastinal disorders |
Respiratory depression |
|||
|
Gastrointestinal disorders |
Diarrhoea, nausea, vomiting, abdominal pain |
|||
|
Hepatobiliary disorders |
Elevated liver enzymes, hepatocellular, cholestatic or mixed liver injury |
|||
|
Skin and subcutaneous tissue disorders |
Skin reactions |
Rash, pruritus, urticaria, hyperhidrosis |
||
|
Musculoskeletal and connective tissue disorders |
Back pain |
Muscle weakness |
||
|
General disorders and administration site conditions |
Fatigue |
Paradoxical reactions |
Gait disturbance, drug tolerance, falls (predominantly in elderly patients and when Stilnox was not taken in accordance with prescribing recommendation) |
These phenomena occur predominantly at the start of the therapy or in elderly patients and usually disappear with repeated administration.
Amnesia
Anterograde amnesia may occur during therapeutic dosages, the risk increasing at higher dosages. In order to reduce the risk, patients should ensure that they will be able to have an uninterrupted sleep of 8 hours. Amnestic effects may be associated with inappropriate behaviour.
Depression
Pre-existing depression may become manifest during use of benzodiazepines or benzodiazepine-like agents.
Psychiatric and “paradoxical†reactions
Reactions like restlessness, agitation, irritability, aggressiveness, delusions, rage, nightmares, increased insomnia, hallucinations, psychoses, inappropriate behaviour and other adverse behavioural effects may occur when using benzodiazepines and benzodiazepine-like agents. Such reactions are more likely to occur in the elderly.
Dependence
Use (even at therapeutic dosages) may lead to physical dependence: discontinuation of the therapy may result in withdrawal or rebound phenomena.
Psychological dependence may occur. Abuse has been reported in polydrug abusers.
Reporting of suspected adverse reactions
Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Healthcare professionals are asked to report any suspected adverse reactions via the Yellow Card Scheme at: www.mhra.gov.uk/yellowcard.
The following CIOMS frequency rating is used, when applicable:
Very common > 10%
Common > 1 and < 10%
Uncommon > 0.1 and < 1%
Rare > 0.01 and < 0.1%
Very rare < 0.01%
Not known: cannot be estimated based on available data.
There is evidence of a dose-relationship for adverse effects associated with zolpidem use, particularly for certain CNS and gastrointestinal events. They occur most frequently in elderly patients.
Immune system disorders
Not known: angioneurotic oedema
Psychiatric disorders
Common: hallucination, agitation, nightmare, depression
Uncommon: confusional state, irritability, restlessness, aggression, somnambulism , euphoric mood
Rare: libido disorder
Very rare: delusion, dependence (withdrawal symptoms, or rebound effects may occur after treatment discontinuation)
Not known: anger, psychosis, abnormal behaviour
Most of these psychiatric undesirable effects are related to paradoxical reactions.
Nervous system disorders
Common: somnolence, headache, dizziness, exacerbated insomnia, cognitive disorders such as anterograde amnesia (amnestic effects may be associated with inappropriate behaviour)
Uncommon: paraesthesia, tremor, disturbance in attention, speech disorder
Rare: depressed level of consciousness
Eye disorders
Uncommon: diplopia, vision blurred
Very rare: visual impairment
Respiratory, thoracic and mediastinal disorders
Very rare: respiratory depression
Gastro-intestinal disorders
Common: diarrhoea, nausea, vomiting, abdominal pain
Hepatobiliary disorders
Uncommon: liver enzymes elevated
Rare: hepatocellular, cholestatic or mixed liver injury
Metabolism and nutrition disorders
Uncommon: appetite disorder
Skin and subcutaneous tissue disorders
Uncommon: rash, pruritus, hyperhidrosis
Rare: urticaria
Musculoskeletal and connective tissue disorders
Common: back pain
Uncommon: myalgia, muscle spasms, muscular weakness
Infections and infestations
Common: upper respiratory tract infection, lower respiratory tract infection
General disorders and administration site conditions
Common: fatigue
Rare: gait disturbance, fall (predominantly in elderly patients and when zolpidem was not taken in accordance with prescribing recommendation)
Not known: drug tolerance
Reporting of suspected adverse reactions
Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Healthcare professionals are asked to report any suspected adverse reactions via the Yellow Card Scheme at: www.mhra.gov.uk/yellowcard or search for MHRA Yellow Card in the Google Play or Apple App Store.
The following serious adverse reactions are discussed in greater detail in other sections of the labeling:
- CNS-depressant effects and next-day impairment
- Serious anaphylactic and anaphylactoid reactions
- Abnormal thinking and behavior changes, and complex behaviors
- Withdrawal effects
Clinical Trials Experience
Associated With Discontinuation Of Treatment
In 3-week clinical trials in adults and elderly patients ( > 65 years), 3.5% (7/201) patients receiving Stilnox 6.25 or 12.5 mg discontinued treatment due to an adverse reaction as compared to 0.9% (2/216) of patients on placebo. The reaction most commonly associated with discontinuation in patients treated with Stilnox was somnolence (1%).
In a 6-month study in adult patients (18-64 years of age), 8.5% (57/669) of patients receiving Stilnox 12.5 mg as compared to 4.6% on placebo (16/349) discontinued treatment due to an adverse reaction. Reactions most commonly associated with discontinuation of Stilnox included anxiety (anxiety, restlessness or agitation) reported in 1.5% (10/669) of patients as compared to 0.3% (1/349) of patients on placebo, and depression (depression, major depression or depressed mood) reported in 1.5% (10/669) of patients as compared to 0.3% (1/349) of patients on placebo.
Data from a clinical study in which selective serotonin reuptake inhibitor-(SSRI-) treated patients were given zolpidem revealed that four of the seven discontinuations during double-blind treatment with zolpidem (n=95) were associated with impaired concentration, continuing or aggravated depression, and manic reaction; one patient treated with placebo (n =97) was discontinued after an attempted suicide.
Most Commonly Observed Adverse Reactions In Controlled Trials
During treatment with Stilnox in adults and elderly at daily doses of 12.5 mg and 6.25 mg, respectively, each for three weeks, the most commonly observed adverse reactions associated with the use of Stilnox were headache, next-day somnolence, and dizziness.
In the 6-month trial evaluating Stilnox 12.5 mg, the adverse reaction profile was consistent with that reported in short-term trials, except for a higher incidence of anxiety (6.3% for Stilnox versus 2.6% for placebo).
Adverse Reactions Observed At An Incidence Of ≥ 1% In Controlled Trials
The following tables enumerate treatment-emergent adverse reaction frequencies that were observed at an incidence equal to 1% or greater among patients with insomnia who received Stilnox in placebo-controlled trials. Events reported by investigators were classified utilizing the MedDRA dictionary for the purpose of establishing event frequencies. The prescriber should be aware that these figures cannot be used to predict the incidence of side effects in the course of usual medical practice, in which patient characteristics and other factors differ from those that prevailed in these clinical trials. Similarly, the cited frequencies cannot be compared with figures obtained from other clinical investigators involving related drug products and uses, since each group of drug trials is conducted under a different set of conditions. However, the cited figures provide the physician with a basis for estimating the relative contribution of drug and nondrug factors to the incidence of side effects in the population studied.
The following tables were derived from results of two placebo-controlled efficacy trials involving Stilnox. These trials involved patients with primary insomnia who were treated for 3 weeks with Stilnox at doses of 12.5 mg (Table 1) or 6.25 mg (Table 2), respectively. The tables include only adverse reactions occurring at an incidence of at least 1% for Stilnox patients and with an incidence greater than that seen in the placebo patients.
Table 1: Incidences of Treatment-Emergent Adverse Reactions in a 3-Week Placebo-Controlled Clinical Trial in Adults (percentage of patients reporting)
| Body System/ Adverse Reaction * |
Stilnox 12.5 mg (N = 102) |
Placebo (N = 110) |
| Infections and infestations | ||
| Influenza | 3 | 0 |
| Gastroenteritis | 1 | 0 |
| Labyrinthitis | 1 | 0 |
| Metabolism and nutrition disorders | ||
| Appetite disorder | 1 | 0 |
| Psychiatric disorders | ||
| Hallucinations ** | 4 | 0 |
| Disorientation | 3 | 2 |
| Anxiety | 2 | 0 |
| Depression | 2 | 0 |
| Psychomotor retardation | 2 | 0 |
| Binge eating | 1 | 0 |
| Depersonalization | 1 | 0 |
| Disinhibition | 1 | 0 |
| Euphoric mood | 1 | 0 |
| Mood swings | 1 | 0 |
| Stress symptoms | 1 | 0 |
| Nervous system disorders | ||
| Headache | 19 | 16 |
| Somnolence | 15 | 2 |
| Dizziness | 12 | 5 |
| Memory disorders *** | 3 | 0 |
| Balance disorder | 2 | 0 |
| Disturbance in attention | 2 | 0 |
| Hypoesthesia | 2 | 1 |
| Ataxia | 1 | 0 |
| Paresthesia | 1 | 0 |
| Eye disorders | ||
| Visual disturbance | 3 | 0 |
| Eye redness | 2 | 0 |
| Vision blurred | 2 | 1 |
| Altered visual depth perception | 1 | 0 |
| Asthenopia | 1 | 0 |
| Ear and labyrinth disorders | ||
| Vertigo | 2 | 0 |
| Tinnitus | 1 | 0 |
| Respiratory, thoracic and mediastinal disorders | ||
| Throat irritation | 1 | 0 |
| Gastrointestinal disorders | ||
| Nausea | 7 | 4 |
| Constipation | 2 | 0 |
| Abdominal discomfort | 1 | 0 |
| Abdominal tenderness | 1 | 0 |
| Frequent bowel movements | 1 | 0 |
| Gastroesophageal reflux disease | 1 | 0 |
| Vomiting | 1 | 0 |
| Skin and subcutaneous tissue disorders | ||
| Rash | 1 | 0 |
| Skin wrinkling | 1 | 0 |
| Urticaria | 1 | 0 |
| Musculoskeletal and connective tissue disorders | ||
| Back pain | 4 | 3 |
| Myalgia | 4 | 0 |
| Neck pain | 1 | 0 |
| Reproductive system and breast disorders | ||
| Menorrhagia | 1 | 0 |
| General disorders and administration site conditions | ||
| Fatigue | 3 | 2 |
| Asthenia | 1 | 0 |
| Chest discomfort | 1 | 0 |
| Investigations | ||
| Blood pressure increased | 1 | 0 |
| Body temperature increased | 1 | 0 |
| Injury, poisoning and procedural complications | ||
| Contusion | 1 | 0 |
| Social circumstances | ||
| Exposure to poisonous plant | 1 | 0 |
| *Reactions reported by at least 1% of patients treated with Stilnox and at greater frequency than in the placebo group. **Hallucinations included hallucinations NOS as well as visual and hypnogogic hallucinations. ***Memory disorders include: memory impairment, amnesia, anterograde amnesia. |
Table 2: Incidences of Treatment-Emergent Adverse Reactions in a 3-Week Placebo-Controlled Clinical Trial in Elderly (percentage of patients reporting)
| Body System/ Adverse Reaction * |
Stilnox 6.25 mg (N=99) |
Placebo (N=106) |
| Infections and infestations | ||
| Nasopharyngitis | 6 | 4 |
| Lower respiratory tract infection | 1 | 0 |
| Otitis externa | 1 | 0 |
| Upper respiratory tract infection | 1 | 0 |
| Psychiatric disorders | ||
| Anxiety | 3 | 2 |
| Psychomotor retardation | 2 | 0 |
| Apathy | 1 | 0 |
| Depressed mood | 1 | 0 |
| Nervous system disorders | ||
| Headache | 14 | 11 |
| Dizziness | 8 | 3 |
| Somnolence | 6 | 5 |
| Burning sensation | 1 | 0 |
| Dizziness postural | 1 | 0 |
| Memory disorders ** | 1 | 0 |
| Muscle contractions involuntary | 1 | 0 |
| Paresthesia | 1 | 0 |
| Tremor | 1 | 0 |
| Cardiac disorders | ||
| Palpitations | 2 | 0 |
| Respiratory, thoracic and mediastinal disorders | ||
| Dry throat | 1 | 0 |
| Gastrointestinal disorders | ||
| Flatulence | 1 | 0 |
| Vomiting | 1 | 0 |
| Skin and subcutaneous tissue disorders | ||
| Rash | 1 | 0 |
| Urticaria | 1 | 0 |
| Musculoskeletal and connective tissue disorders | ||
| Arthralgia | 2 | 0 |
| Muscle cramp | 2 | 1 |
| Neck pain | 2 | 0 |
| Renal and urinary disorders | ||
| Dysuria | 1 | 0 |
| Reproductive system and breast disorders | ||
| Vulvovaginal dryness | 1 | 0 |
| General disorders and administration site conditions | ||
| Influenza like illness | 1 | 0 |
| Pyrexia | 1 | 0 |
| Injury, poisoning and procedural complications | ||
| Neck injury | 1 | 0 |
| *Reactions reported by at least 1% of patients treated with Stilnox and at greater frequency than in the placebo group. **Memory disorders include: memory impairment, amnesia, anterograde amnesia. |
Dose Relationship For Adverse Reactions
There is evidence from dose comparison trials suggesting a dose relationship for many of the adverse reactions associated with zolpidem use, particularly for certain CNS and gastrointestinal adverse events.
Other Adverse Reactions Observed During The Premarketing Evaluation Of Stilnox
Other treatment-emergent adverse reactions associated with participation in Stilnox studies (those reported at frequencies of < 1%) were not different in nature or frequency to those seen in studies with immediate-release zolpidem tartrate, which are listed below.
Adverse Events Observed During The Premarketing Evaluation Of Immediate-Release Zolpidem Tartrate
Immediate-release zolpidem tartrate was administered to 3,660 subjects in clinical trials throughout the U.S., Canada, and Europe. Treatment-emergent adverse events associated with clinical trial participation were recorded by clinical investigators using terminology of their own choosing. To provide a meaningful estimate of the proportion of individuals experiencing treatment-emergent adverse events, similar types of untoward events were grouped into a smaller number of standardized event categories and classified utilizing a modified World Health Organization (WHO) dictionary of preferred terms.
The frequencies presented, therefore, represent the proportions of the 3,660 individuals exposed to zolpidem, at all doses, who experienced an event of the type cited on at least one occasion while receiving zolpidem. All reported treatment-emergent adverse events are included, except those already listed in the table above of adverse events in placebo-controlled studies, those coding terms that are so general as to be uninformative, and those events where a drug cause was remote. It is important to emphasize that, although the events reported did occur during treatment with AMBIEN, they were not necessarily caused by it.
Adverse events are further classified within body system categories and enumerated in order of decreasing frequency using the following definitions: frequent adverse events are defined as those occurring in greater than 1/100 subjects; infrequent adverse events are those occurring in 1/100 to 1/1,000 patients; rare events are those occurring in less than 1/1,000 patients.
Autonomic nervous system: Frequent: dry mouth. Infrequent: increased sweating, pallor, postural hypotension, syncope. Rare: abnormal accommodation, altered saliva, flushing, glaucoma, hypotension, impotence, increased saliva, tenesmus.
Body as a whole: Frequent: asthenia. Infrequent: chest pain, edema, falling, fever, malaise, trauma. Rare: allergic reaction, allergy aggravated, anaphylactic shock, face edema, hot flashes, increased ESR, pain, restless legs, rigors, tolerance increased, weight decrease.
Cardiovascular system: Infrequent: cerebrovascular disorder, hypertension, tachycardia. Rare: angina pectoris, arrhythmia, arteritis, circulatory failure, extrasystoles, hypertension aggravated, myocardial infarction, phlebitis, pulmonary embolism, pulmonary edema, varicose veins, ventricular tachycardia.
Central and peripheral nervous system: Frequent: ataxia, confusion, drowsiness, drugged feeling, euphoria, insomnia, lethargy, lightheadedness, vertigo. Infrequent: agitation, decreased cognition, detached, difficulty concentrating, dysarthria, emotional lability, hallucination, hypoesthesia, illusion, leg cramps, migraine, nervousness, paresthesia, sleeping (after daytime dosing), speech disorder, stupor, tremor. Rare: abnormal gait, abnormal thinking, aggressive reaction, apathy, appetite increased, decreased libido, delusion, dementia, depersonalization, dysphasia, feeling strange, hypokinesia, hypotonia, hysteria, intoxicated feeling, manic reaction, neuralgia, neuritis, neuropathy, neurosis, panic attacks, paresis, personality disorder, somnambulism, suicide attempts, tetany, yawning.
Gastrointestinal system: Frequent: diarrhea, dyspepsia, hiccup. Infrequent: anorexia, constipation, dysphagia, flatulence, gastroenteritis. Rare: enteritis, eructation, esophagospasm, gastritis, hemorrhoids, intestinal obstruction, rectal hemorrhage, tooth caries.
Hematologic and lymphatic system: Rare: anemia, hyperhemoglobinemia, leukopenia, lymphadenopathy, macrocytic anemia, purpura, thrombosis.
Immunologic system: Infrequent: infection. Rare: abscess herpes simplex herpes zoster, otitis externa, otitis media.
Liver and biliary system: Infrequent: abnormal hepatic function, increased SGPT. Rare: bilirubinemia, increased SGOT.
Metabolic and nutritional: Infrequent: hyperglycemia, thirst. Rare: gout, hypercholesteremia, hyperlipidemia, increased alkaline phosphatase, increased BUN, periorbital edema.
Musculoskeletal system: Infrequent: arthritis. Rare: arthrosis, muscle weakness, sciatica, tendinitis.
Reproductive system: Infrequent: menstrual disorder, vaginitis. Rare: breast fibroadenosis, breast neoplasm, breast pain.
Respiratory system: Frequent: sinusitis. Infrequent: bronchitis, coughing, dyspnea. Rare: bronchospasm, respiratory depression, epistaxis, hypoxia, laryngitis, pneumonia.
Skin and appendages: Infrequent: pruritus. Rare: acne, bullous eruption, dermatitis, furunculosis, injection-site inflammation, photosensitivity reaction, urticaria.
Special senses: Frequent: diplopia, vision abnormal. Infrequent: eye irritation, eye pain, scleritis, taste perversion, tinnitus. Rare: conjunctivitis, corneal ulceration, lacrimation abnormal, parosmia, photopsia.
Urogenital system: Frequent: urinary tract infection. Infrequent: cystitis, urinary incontinence. Rare: acute renal failure, dysuria, micturition frequency, nocturia, polyuria, pyelonephritis, renal pain, urinary retention.
Postmarketing Experience
The following adverse reactions have been identified during post-approval use of Stilnox. Because these reactions are reported voluntarily from a population of uncertain size, it is not always possible to reliably estimate their frequency or establish a causal relationship to drug exposure.
Liver and biliary system: acute hepatocellular, cholestatic or mixed liver injury with or without jaundice (i.e., bilirubin > 2x ULN, alkaline phosphatase ≥ 2x ULN, transaminase ≥ 5x ULN).
The following serious adverse reactions are discussed in greater detail in other sections of the labeling:
- Serious anaphylactic and anaphylactoid reactions.
- Abnormal thinking, behavior changes, and complex behaviors.
- Withdrawal effects.
- CNS-depressant effects.
Clinical trials experience
Because clinical trials are conducted under widely varying conditions, adverse reaction rates observed in the clinical trials of a drug cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice. The adverse reaction information from clinical trials does, however, provide a basis for identifying the adverse events that appear to be related to drug use and for approximating incidence rates.
Associated with discontinuation of treatment
Approximately 4% of 1,701 patients who received zolpidem tartrate at all doses (1.25 to 90 mg) in U.S. premarketing clinical trials discontinued treatment because of an adverse reaction. Reactions most commonly associated with discontinuation from U.S. trials were daytime drowsiness (0.5%), dizziness (0.4%), headache (0.5%), nausea (0.6%), and vomiting (0.5%).
Approximately 4% of 1,959 patients who received zolpidem at all doses (1 to 50 mg) in similar foreign trials discontinued treatment because of an adverse reaction. Reactions most commonly associated with discontinuation from these trials were daytime drowsiness (1.1%), dizziness/vertigo (0.8%), amnesia (0.5%), nausea (0.5%), headache (0.4%), and falls (0.4%).
Data from a clinical study in which selective serotonin reuptake inhibitor (SSRI)-treated patients were given zolpidem revealed that four of the seven discontinuations during double-blind treatment with zolpidem (n=95) were associated with impaired concentration, continuing or aggravated depression, and manic reaction; one patient treated with placebo (n=97) was discontinued after an attempted suicide.
Most commonly observed adverse reactions in controlled trials
During short-term treatment (up to 10 nights) with zolpidem tartrate at doses up to 10 mg, the most commonly observed adverse reactions associated with the use of zolpidem and seen at statistically significant differences from placebo-treated patients were drowsiness (reported by 2% of zolpidem patients), dizziness (1%), and diarrhea (1%). During longer-term treatment (28 to 35 nights) with zolpidem tartrate at doses up to 10 mg, the most commonly observed adverse reactions associated with the use of zolpidem and seen at statistically significant differences from placebo-treated patients were dizziness (5%) and drugged feelings (3%).
Adverse reactions observed at an incidence of ≥ 1% in controlled trials
The following tables enumerate treatment-emergent adverse reactions frequencies that were observed at an incidence equal to 1% or greater among patients with insomnia who received zolpidem tartrate and at a greater incidence than placebo in U.S. placebo-controlled trials. Events reported by investigators were classified utilizing a modified World Health Organization (WHO) dictionary of preferred terms for the purpose of establishing event frequencies. The prescriber should be aware that these figures cannot be used to predict the incidence of side effects in the course of usual medical practice, in which patient characteristics and other factors differ from those that prevailed in these clinical trials. Similarly, the cited frequencies cannot be compared with figures obtained from other clinical investigators involving related drug products and uses, since each group of drug trials is conducted under a different set of conditions. However, the cited figures provide the physician with a basis for estimating the relative contribution of drug and nondrug factors to the incidence of side effects in the population studied.
The following table was derived from results of 11 placebo-controlled short-term U.S. efficacy trials involving zolpidem in doses ranging from 1.25 to 20 mg. The table is limited to data from doses up to and including 10 mg, the highest dose recommended for use.
Incidence of Treatment-Emergent Adverse Reactions in Placebo-Controlled Clinical Trials Lasting up to 10 Nights (Percentage of patients reporting)
| Body System/Adverse Reaction* | Zolpidem ( ≤ 10mg) (n=685) |
Placebo (n=473) |
| Central and Peripheral Nervous System | ||
| Headache | 7 | 6 |
| Drowsiness | 2 | – |
| Dizziness | 1 | – |
| Gastrointestinal System | ||
| Diarrhea | 1 | – |
| *Reactions reported by at least 1% of patients treated with zolpidem tartrate and at a greater frequency than placebo. |
The following table was derived from results of three placebo-controlled long-term efficacy trials involving zolpidem tartrate. These trials involved patients with chronic insomnia who were treated for 28 to 35 nights with zolpidem tartrate at doses of 5, 10, or 15 mg. The table is limited to data from doses up to and including 10 mg, the highest dose recommended for use. The table includes only adverse reactions occurring at an incidence of at least 1% for zolpidem tartrate patients.
Incidence of Treatment-Emergent Adverse Reactions in Placebo-Controlled Clinical Trials Lasting up to 35 Nights (Percentage of patients reporting)
| Body System/Adverse Reaction* | Zolpidem ( ≤ 10mg) (n=152) |
Placebo (n=161) |
| Autonomic Nervous System | ||
| Dry mouth | 3 | 1 |
| Body as a Whole | ||
| Allergy | 4 | 1 |
| Back pain | 3 | 2 |
| Influenza-like symptoms | 2 | — |
| Chest pain | 1 | — |
| Cardiovascular System | ||
| Palpitation | 2 | — |
| Central and Peripheral Nervous System | ||
| Drowsiness | 8 | 5 |
| Dizziness | 5 | 1 |
| Lethargy | 3 | 1 |
| Drugged feeling | 3 | — |
| Lightheadedness | 2 | 1 |
| Depression | 2 | 1 |
| Abnormal dreams | 1 | — |
| Amnesia | 1 | — |
| Sleep disorder | 1 | — |
| Gastrointestinal System | ||
| Diarrhea | 3 | 2 |
| Abdominal pain | 2 | 2 |
| Constipation | 2 | 1 |
| Respiratory System | ||
| Sinusitis | 4 | 2 |
| Pharyngitis | 3 | 1 |
| Skin and Appendages | ||
| Rash | 2 | 1 |
| *Reactions reported by at least 1% of patients treated with zolpidem tartrate and at a greater frequency than placebo. |
Dose relationship for adverse reactions
There is evidence from dose comparison trials suggesting a dose relationship for many of the adverse reactions associated with zolpidem tartrate use, particularly for certain CNS and gastrointestinal adverse reactions.
Oral tissue-related adverse reactions in Stilnox (zolpidem tartrate oral spray) pharmacokinetics studies
The effect of chronic daily administrations of Stilnox (zolpidem tartrate oral spray) on oral tissue has not been evaluated. In pharmacokinetic studies conducted with Stilnox (zolpidem tartrate oral spray) in healthy subjects, an oral soft tissue exam was performed and no signs of oral irritation were noted following administration of single doses of Stilnox (zolpidem tartrate oral spray).
Adverse event incidence across the entire preapproval database
Zolpidem tartrate was administered to 3,660 subjects in clinical trials throughout the United States, Canada, and Europe. Treatment-emergent adverse event associated with clinical trial participation were recorded by clinical investigators using terminology of their own choosing. To provide a meaningful estimate of the proportion of individuals experiencing treatment-emergent adverse events, similar types of untoward events were grouped into a smaller number of standardized event categories and classified utilizing a modified WHO dictionary of preferred terms.
The frequencies presented, therefore, represent the proportions of the 3,660 individuals exposed to zolpidem tartrate, at all doses, who experienced an event of the type cited on at least one occasion while receiving zolpidem tartrate. All reported treatment-emergent adverse events are included, except those already listed in the table above of adverse events in placebo-controlled studies, those coding terms that are so general as to be uninformative, and those events where a drug cause was remote. It is important to emphasize that, although the events reported did occur during treatment with zolpidem tartrate, they were not necessarily caused by it.
Adverse events are further classified within body system categories and enumerated in order of decreasing frequency using the following definitions: frequent adverse events are defined as those occurring in greater than 1/100 subjects; infrequent adverse events are those occurring in 1/100 to 1/1,000 patients; rare events are those occurring in less than 1/1,000 patients.
Autonomic nervous system: Infrequent: increased sweating, pallor, postural hypotension, syncope. Rare: abnormal accommodation, altered saliva, flushing, glaucoma, hypotension, impotence, increased saliva, tenesmus.
Body as a whole: Frequent: asthenia. Infrequent: edema, falling, fatigue, fever, malaise, trauma. Rare: allergic reaction, allergy aggravated, anaphylactic shock, face edema, hot flashes, increased ESR, pain, restless legs, rigors, tolerance increased, weight decrease.
Cardiovascular system: Infrequent: cerebrovascular disorder, hypertension, tachycardia. Rare: angina pectoris, arrhythmia, arteritis, circulatory failure, extrasystoles, hypertension aggravated, myocardial infarction, phlebitis, pulmonary embolism, pulmonary edema, varicose veins, ventricular tachycardia.
Central and peripheral nervous system: Frequent: ataxia, confusion, euphoria, headache, insomnia, vertigo. Infrequent: agitation, anxiety, decreased cognition, detached, difficulty concentrating, dysarthria, emotional lability, hallucination, hypoesthesia, illusion, leg cramps, migraine, nervousness, paresthesia, sleeping (after daytime dosing), speech disorder, stupor, tremor. Rare: abnormal gait, abnormal thinking, aggressive reaction, apathy, appetite increased, decreased libido, delusion, dementia, depersonalization, dysphasia, feeling strange, hypokinesia, hypotonia, hysteria, intoxicated feeling, manic reaction, neuralgia, neuritis, neuropathy, neurosis, panic attacks, paresis, personality disorder, somnambulism, suicide attempts, tetany, yawning.
Gastrointestinal system: Frequent: dyspepsia, hiccup, nausea. Infrequent: anorexia, constipation, dysphagia, flatulence, gastroenteritis, vomiting. Rare: enteritis, eructation, esophagospasm, gastritis, hemorrhoids, intestinal obstruction, rectal hemorrhage, tooth caries.
Hematologic and lymphatic system: Rare: anemia, hyperhemoglobinemia, leukopenia, lymphadenopathy, macrocytic anemia, purpura, thrombosis.
Immunologic system: Infrequent: infection. Rare: abscess, herpes simplex, herpes zoster, otitis externa, otitis media.
Liver and biliary system: Infrequent: abnormal hepatic function, increased SGPT. Rare: bilirubinemia, increased SGOT.
Metabolic and nutritional: Infrequent: hyperglycemia, thirst. Rare: gout, hypercholesteremia, hyperlipidemia, increased alkaline phosphatase, increased BUN, periorbital edema.
Musculoskeletal system: Frequent: arthralgia, myalgia. Infrequent: arthritis. Rare: arthrosis, muscle weakness, sciatica, tendonitis.
Reproductive system: Infrequent: menstrual disorder, vaginitis. Rare: breast fibroadenosis, breast neoplasm, breast pain.
Respiratory system: Frequent: upper respiratory infection. Infrequent: bronchitis, coughing, dyspnea, rhinitis. Rare: bronchospasm, epistaxis, hypoxia, laryngitis, pneumonia.
Skin and appendages:Infrequent: pruritus. Rare: acne, bullous eruption, dermatitis, furunculosis, injection-site inflammation, photosensitivity reaction, urticaria.
Special senses: Frequent: diplopia, vision abnormal. Infrequent: eye irritation, eye pain, scleritis, taste perversion, tinnitus. Rare: conjunctivitis, corneal ulceration, lacrimation abnormal, parosmia, photopsia.
Urogenital system: Frequent: urinary tract infection. Infrequent: cystitis, urinary incontinence. Rare: acute renal failure, dysuria, micturition frequency, nocturia, polyuria, pyelonephritis, renal pain, urinary retention.
Инструкция по применению Стилнокса
Стилнокс – это препарат, действие которого направлено на борьбу с бессонницей. Вызывает привыкание, имеет много противопоказаний, вследствие чего отпускается строго по рецепту врача. В статье будет подробно описана инструкция по применению Стилнокса, показания и негативные последствия приема.
Содержание статьи
- 1 Состав Стилнокса и форма выпуска
- 2 Кому показан Стилнокс и как он действует
- 3 Инструкция по применению Стилнокса
- 4 Противопоказания
- 5 Негативные последствия приема Стилнокса
- 6 Передозировка
- 7 Взаимодействие Стилнокса с другими лекарствами и алкоголем
- 8 Синдром отмены
- 9 Особые указания
Состав Стилнокса и форма выпуска
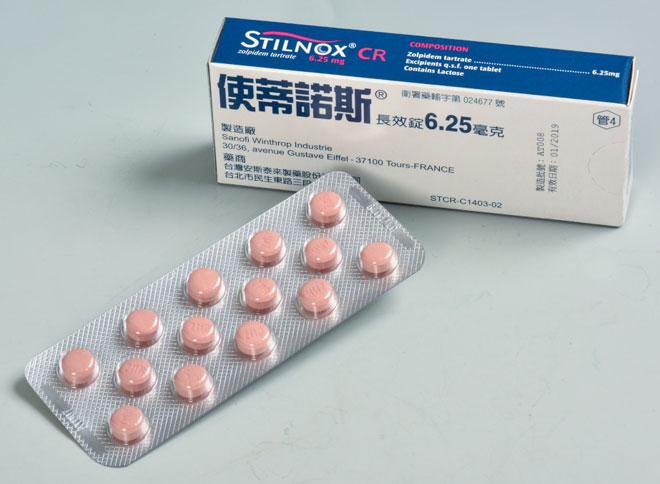
Основное действующее вещество – золпидем тартрат (10 мг). Выпускается в виде белых таблеток продолговатой формы по 10 или 20 штук в блистере. Производитель – французская фармацевтическая компания Sanofi Aventis.
Кому показан Стилнокс и как он действует
Назначаются таблетки при бессоннице, раннем подъеме, частых ночных пробуждениях. Оказывают седативное действие, улучшают качество сна, увеличивают его продолжительность, укорачивают время засыпания.
Быстро всасывается в кровь. Пик концентрации действующего вещества достигается через несколько часов. Метаболизируется в печени, выводится с мочой и калом. Период полувыведения короткий – от 1 часа до 3,5 часов. У пациентов с нарушениями работы печени биодоступность золпидема повышается, а период полувыведения увеличивается до 10 часов.
Инструкция по применению Стилнокса
Принимать таблетки необходимо перед сном. Стандартная дозировка для пациентов до 65 лет – 10 мг, не более. Людям старшего возраста, а также тем, кто страдает печеночной недостаточностью, назначают по 5 мг препарата в сутки (1/2 таблетки). В крайнем случае, дозировка может быть увеличена врачом. Самостоятельно это делать категорически запрещено.
Принимать Stilnox можно не более месяца. Лечебный курс зависит от тяжести состояния:
- в случае транзиторной бессонницы, длительность лечения составляет 2-3 недели;
- при эпизодической бессоннице – 2-5 суток.
Если препарат принимался в течение нескольких дней, по окончании лечения его можно сразу отменить. При терапевтическом курсе более 7 дней, отменять прием таблеток сразу нельзя, чтобы не было негативных эффектов. Дозировка снижается постепенно.
Противопоказания
Стилнокс нельзя принимать в следующих случаях:
- женщинам в период беременности и лактации;
- если у пациента происходит ночное апноэ;
- в детском возрасте до 18 лет;
- при дыхательной недостаточности острого характера;
- если имеется аллергия на золпидем или прочие бензодиазепины;
- когда пациент не переносит лактозу;
- людям, у которых диагностированы тяжелые заболевания почек и печени.
Особую осторожность следует соблюдать пациентам, страдающим от депрессии, при алкоголизме и наркомании.
Негативные последствия приема Стилнокса
При правильно подобранной дозировке и в случае отсутствия противопоказаний, лекарство редко вызывает побочные эффекты. Они могут проявляться:
- головными болями, сонливостью, кошмарными снами, чрезмерным возбуждением, парадоксальной бессонницей;
- головокружением, антероградной амнезией;
- рвотой, тошнотой, поносом, болями в желудке;
- снижением сексуальной активности, атаксией, привыканием;
- кожными высыпаниями, отеком Квинке, зудом, гипергидрозом;
- спутанностью сознания, совнамбулизмом, агрессией;
- мышечной слабостью, увеличением количества ферментов, проблемами в функционировании печени;
- дисфорией, раздражительностью, необычным поведением.
При возникновении данных негативных реакций необходимо срочно обратиться к врачу. При длительном приеме препарата нельзя его отменять самостоятельно, чтобы не возникло синдрома отмены.
Передозировка
Стилнокс – серьезный препарат, при злоупотреблении которого возникает:
- спутанность сознания;
- атаксия;
- понижение артериального давления;
- заторможенность;
- трудности с дыханием;
- кома.
При передозировке необходимо в течение часа вызвать рвоту, принять Активированный уголь или другие энтеросорбенты. Если пострадавший без сознания, необходимо вызвать скорую помощь. В больнице ему промоют желудок через зонд и проведут симптоматическую терапию. У Стинокса имеется антидот – флумазенил, однако его прием опасен для больных эпилепсией (возможны судороги).
Взаимодействие Стилнокса с другими лекарствами и алкоголем
Запрещен совместный прием Стилнокса с Кетоконазолом, так как последний в несколько раз увеличивает время полувыведения действующего вещества. Также есть риск угнетения ЦНС.
Пить алкогольные напитки при лечении препаратом категорически нельзя, поскольку может случиться передозировка и усилиться седативный эффект.
Из-за одновременного приема Рифампицина повышается метаболизм, вследствие чего эффективность и концентрация активного вещества снизится. С осторожностью назначают Stilnox при совместном приеме следующих лекарств:
- барбитуратов, противоэпилептических медикаментов, наркотических анальгетиков, анксиолитиков;
- нейролептиков, противокашлевых, снотворных средств, антидепрессантов;
- Талидомида, Пизотифена, Баклофена;
- средств, предназначенных для проведения общей анестезии;
- антигистаминных веществ, обладающих седативным эффектом.
Синдром отмены
Стилнокс необходимо принимать строго в соответствии с инструкцией по применению. Длительный прием вызывает привыкание, что требует дополнительного лечения. Наличие зависимости определяется потребностью увеличить дозировку, чтобы получить необходимый эффект.
После повторного или непреодолимого приема таблетки есть риск развития наркотической зависимости от препарата. Возможно проявление синдрома отмены с такой симптоматикой:
- беспокойством;
- возникновением галлюцинаций;
- психозом;
- конвульсиями, судорогами;
- паническим страхом;
- тремором конечностей, дрожью;
- раздражительным состоянием;
- чрезмерной сонливостью;
- усиленным потоотделением;
- спазмами мышц и желудка.
Лечение зависимости осуществляется в специализированном медицинском центре, где обеспечена безопасность пациента. Для этого дозировка постепенно сокращается либо назначаются схожие лекарства (диазепам или хлордиазепоксид).
Особые указания
Если Стилнокс принимать в течение 20-30 дней, разовьется психическая либо физическая зависимость от действующего вещества. Больше всего подвержены привыканию люди с прочими видами зависимости (от алкоголя, наркотиков и т.д.). Такие пациенты должны находиться под наблюдением врача, который будет оценивать их психическое и физическое состояние.
Если сочетать Стилнокс с бензодиазепинами, риск развития привыкания возрастает.
После приема таблетки необходимо лечь в постель и проспать в течение как минимум 7-8 часов. В противном случае может проявиться антероградная амнезия.
Если по истечении 2-х недель приема бессонница продолжается, необходимо обратиться к доктору. Скорее всего, у пациента имеются первичные психические расстройства.
При лечении Стилноксом следует отказаться от управления транспортными средствами и выполнения действий, которые требуют высокой концентрации.
Если у больного имеются проблемы с печенью, активное вещество может скапливаться в организме, что приведет к негативным последствиям.
Пожилые люди должны с осторожностью пить данное средство, поскольку есть риск развития седативного и миорелаксирующего действия на организм, вследствие чего человек может упасть и получить травму.
Золпидем (Zolpidem) инструкция по применению
📜 Инструкция по применению Золпидем
💊 Состав препарата Золпидем
✅ Применение препарата Золпидем
📅 Условия хранения Золпидем
⏳ Срок годности Золпидем
Описание лекарственного препарата
Золпидем
(Zolpidem)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2010 года, дата обновления: 2011.07.15
Владелец регистрационного удостоверения:
Лекарственная форма
| Золпидем |
Таб., покр. оболочкой, 10 мг: 15 или 30 шт. рег. №: ЛСР-006936/10 |
Форма выпуска, упаковка и состав
препарата Золпидем
15 шт. — упаковки ячейковые контурные (1) — пачки картонные.
15 шт. — упаковки ячейковые контурные (2) — пачки картонные.
Фармакологическое действие
Золпидем представляет собой снотворное средство, относящееся к группе имидазопиридинов, и является селективным агонистом подкласса омега1-бензодиазепиновых рецепторов. Оказывает седативное действие, при этом при применении в обычных дозах не оказывает анксиолитического, центрального миорелаксирующего и противосудорожного действия. Возбуждает бензодиазепиновые рецепторы (омега) в альфа-субъединице ГАМК-рецепторных комплексов, локализованных в области IV пластинки сенсорно-моторных зон коры, ретикулярных отделов черной субстанции, зрительных бугров вентрального таламического комплекса, моста, бледного шара и др. Взаимодействие с омега-рецепторами приводит к открытию нейрональных ионоформных каналов для ионов хлора.
Укорачивает время засыпания, уменьшает число ночных пробуждений, увеличивает общую продолжительность сна и улучшает его качество. Удлиняет II стадию сна и стадии глубокого сна (III и IV). Не вызывает сонливости в течение дня.
Фармакокинетика
Золпидем быстро абсорбируется из ЖКТ. Время достижения Cmax в плазме крови после приема внутрь составляет 0.5-3 ч. Биодоступность — 70%, связывание с белками плазмы — 92%. Существует линейная зависимость между величиной дозы препарата и его концентрациями в плазме. Метаболизируется в печени с образованием трех неактивных метаболитов, которые выводятся почками (56%) и через кишечник (37%). Средний T1/2 составляет 2.4 ч. Vd — 0.5±0.02 л/кг. Не индуцирует ферменты печени. У лиц пожилого возраста клиренс в плазме крови может снижаться без существенного увеличения T1/2 (в среднем 3 ч), при этом Cmax увеличивается на 50%. У больных с выраженными нарушениями функции почек клиренс увеличивается незначительно. У больных с нарушениями функции печени биодоступность увеличивается, T1/2 возрастает до 10 ч. Выделяется в небольших количествах с грудным молоком.
Показания препарата
Золпидем
- нарушения сна: затрудненное засыпание, ранние и ночные пробуждения.
Режим дозирования
Внутрь (непосредственно перед сном) в разовой дозе 10 мг.
У пожилых или ослабленных пациентов, при нарушении функции печени лечение начинают с дозы 5 мг. При необходимости (недостаточный клинический эффект) и хорошей переносимости препарата доза может быть увеличена до 10 мг. Максимальная суточная доза — 10 мг. Курс лечения не должен превышать 4 недели. При преходящей бессоннице рекомендуемый курс лечения — 2-5 дней, при ситуационной — 2-3 нед.
Очень короткие периоды лечения не требуют постепенной отмены препарата. В случае длительного приема препарата для снижения возможности развития рикошетной бессонницы отмена золпидема должна проводиться постепенно (сначала снижение суточной дозы и затем отмена препарата).
Побочное действие
Золпидем обычно хорошо переносится.
Частота возникновения нежелательных реакций: очень часто — более 10%, часто -более 1% и менее 10%, нечасто — более 0.1% и менее 1%), редко — более 0.01% и менее 0.1%, очень редко — менее 0.01% (включая отдельные случаи), частота неизвестна (на основании доступных данных установление частоты возникновения невозможно).
Со стороны нервной системы: часто — сонливость, ощущение опьянения, головная боль, головокружение, усиление бессонницы, антероградная амнезия (эффекты амнезии могут ассоциироваться с поведенческими реакциями), риск развития которой увеличивается пропорционально дозе, галлюцинации, возбуждение, кошмарные сновидения; нечасто — спутанность сознания, раздражительность; частота неизвестна — нарушение сознания, дисфория, агрессивность, зрительные и слуховые галлюцинации, повышенная возбудимость, поведенческие реакции, сомнамбулизм, лекарственная зависимость (может развиваться даже при использовании терапевтических доз), при отмене препарата — синдром отмены или рикошетная бессонница, снижение либидо, нарушение походки, атаксия, падения (главным образом у пациентов пожилого возраста), привыкание к препарату (снижение седативного и снотворного действия при применении в течение нескольких недель). Большинство побочных эффектов со стороны психики являются парадоксальными реакциям.
Со стороны пищеварительной системы: часто — диарея, тошнота, рвота, абдоминальная боль; частота неизвестна — повышение активности печеночных ферментов.
Со стороны костно-мышечной системы: частота неизвестна — мышечная слабость.
Со стороны кожных покровов: частота неизвестна — сыпь, зуд, крапивница, гипергидроз.
Аллергические реакции: частота неизвестна — ангионевротический отек.
Прочие: часто — чувство усталости; нечасто — диплопия.
Противопоказания к применению
- острая и/или тяжелая дыхательная недостаточность;
- тяжелая острая или хроническая печеночная недостаточность;
- ночное апноэ (в т.ч. предполагаемое);
- в связи с наличием в составе лактозы: наследственная непереносимость лактозы, дефицит лактазы или синдром мальабсорбции глюкозы-галактозы;
- беременность;
- период лактации;
- детский возраст (до 18 лет);
- повышенная чувствительность к золпидему или другому компоненту препарата.
С осторожностью: тяжелая миастения, дыхательная недостаточность, печеночная недостаточность легкой и средней степени тяжести, депрессия, алкоголизм, наркомания и другие виды зависимости.
Применение при беременности и кормлении грудью
Препарат противопоказан при беременности и в период лактации.
Применение при нарушениях функции печени
Противопоказан при острой или хронической печеночной недостаточности.
С осторожностью: печеночная недостаточность легкой и средней степени тяжести.
При нарушении функции печени лечение начинают с дозы 5 мг. При необходимости (недостаточный клинический эффект) и хорошей переносимости препарата доза может быть увеличена до 10 мг. Максимальная суточная доза — 10 мг. Курс лечения не должен превышать 4 недели. При преходящей бессоннице рекомендуемый курс лечения — 2-5 дней, при ситуационной — 2-3 нед.
Применение у детей
Противопоказан детям до 18 лет.
Применение у пожилых пациентов
У пожилых пациентов лечение начинают с дозы 5 мг. При необходимости (недостаточный клинический эффект) и хорошей переносимости препарата доза может быть увеличена до 10 мг. Максимальная суточная доза — 10 мг. Курс лечения не должен превышать 4 недели. При преходящей бессоннице рекомендуемый курс лечения — 2-5 дней, при ситуационной — 2-3 нед.
У пожилых пациентов могут возникать психические и поведенческие (в т.ч. парадоксальные) реакции. При возникновении таких реакций прием золпидема должен быть прекращен
У пожилых пациентов или с нарушением функции печени возможно значительное увеличение T1/2 золпидема, что может приводить к кумуляции препарата при его повторном приеме.
При применении золпидема у лиц пожилого возраста необходимо соблюдать осторожность, в связи с риском развития выраженного седативного и/или миорелаксирующего эффектов.
Особые указания
Сохранение бессонницы в течение 7-14 дней лечения указывает на наличие первичных психических расстройств и/или нарушений со стороны нервной системы. Поэтому для выявления этих нарушений необходимо регулярно проводить переоценку состояния пациента.
Для снижения риска развития антероградной амнезии пациенты должны иметь условия для непрерывного 7-8-часового сна.
При применении золпидема могут возникать психические и поведенческие (в т.ч. парадоксальные) реакции (риск развития выше у пожилых пациентов). При возникновении таких реакций прием золпидема должен быть прекращен. После курсового приема в течение нескольких недель возможно некоторое снижение седативного и снотворного эффектов золпидема.
Применение золпидема (особенно продолжительное) может вести к формированию физической и/или психической зависимости, риск возникновения которой повышается при увеличении дозы и продолжительности лечения, а также у пациентов с наличием в анамнезе злоупотребления алкоголем или другими лекарственными средствами и нелекарственными веществами. Такие пациенты в период лечения должны находиться под тщательным наблюдением. Тем не менее, зависимость (крайне редко) может возникать и при применении терапевтических доз и/или у пациентов без индивидуальных факторов риска.
Комбинация золпидема с бензодиазепинами повышает риск развития лекарственной зависимости.
У пожилых пациентов или с нарушением функции печени возможно значительное увеличение T1/2 золпидема, что может приводить к кумуляции препарата при его повторном приеме. Исходя из особенностей фармакокинетики золпидема, при ХПН кумуляции препарата не ожидается.
При применении золпидема у лиц пожилого возраста необходимо соблюдать осторожность, в связи с риском развития выраженного седативного и/или миорелаксирующего эффектов.
Влияние на способность к управлению транспортными средствами и механизмами
В период лечения следует воздерживаться от занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания (вождение автомобиля, работа с механизмами) и быстроты психомоторных реакций.
Передозировка
Симптомы: нарушение сознания (от спутанности сознания и заторможенности до комы), атаксия, снижение артериального давления, угнетение дыхания.
Лечение: индукция рвоты в течение 1 ч после передозировки, активированный уголь, если после передозировки прошло более 1 ч (при сохраненном сознании -внутрь, при бессознательном — через зонд), промывание желудка, симптоматическая терапия. В качестве антидота рекомендуется флумазенил (антагонист бензодиазепиновых рецепторов), однако следует помнить, что антагонизм с бензодиазепиновыми рецепторами может приводить к развитию судорог, особенно у пациентов с эпилепсией. Диализ малоэффективен.
Лекарственное взаимодействие
Не рекомендуемые комбинации: этанол усиливает седативное действие золпидема.
Комбинации, требующие осторожности при применении:
- препараты, угнетающие ЦНС (нейролептики, барбитураты, другие снотворные, анксиолитики/седативные, антидепрессанты с седативным действием, наркотические анальгетики, противокашлевые центрального действия), противоэпилептические, препараты для общей анестезии, антигистаминные с седативным эффектом, гипотензивные центрального действия; баклофен; талидомид; пизотифен — усиление угнетающего действия на ЦНС и риск угнетения дыхания;
- бупренорфин — риск угнетения дыхания;
- кетоконазол (мощный ингибитор CYP3A4) в дозе 200 мг 2 раза/сут увеличивает T1/2, AUC и снижает клиренс золпидема (возможно усиление седативного действия золпидема);
- итраконазол (ингибитор CYP3A4) — незначительное, клинически незначимое изменение фармакокинетики и фармакодинамики золпидема.
Взаимодействия, которые следует принимать во внимание:
- рифампицин (индуктор CYP3A4) — ускоряет метаболизм, снижает концентрацию и, как следствие, эффективность золпидема.
Условия хранения препарата Золпидем
Препарат хранить в сухом, защищенном от света месте, при температуре не выше 25°С. Хранить в недоступном для детей месте.
Срок годности препарата Золпидем
Срок годности — 3 года.
Не использовать препарат после истечения срока годности.
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
- Психолептики
- Снотворные и седативные средства
- Бензодиазепиноподобные средства
- Золпидем
- Бензодиазепиноподобные средства
- Снотворные и седативные средства
-
DDD[*1] (Среднестатистическая поддерживающая суточная доза лекарства, применяющаяся по его основному показанию у взрослых): [10mg Adm.R:O] Список сокращений
Внимание! Материалы, представленные здесь, служат лишь для ознакомления и не могут являться руководством для самостоятельного лечения. Сайт ни в коем случае не ответственен за приведенные описания препаратов. Вы используете или не используете их на свой собственный риск!
# На 2023-Sep-24
ориентировочно, Вы можете купить «STILNOX (ZOLPIDEM) TBL 10MG N20 N14» в городе Рига, Латвия по следующей цене:
-
11.33€ 12.06$ 9.83£ 1308руб. 134.6SEK 52PLN 45.93₪
| Mакcимально допустимая государством цена в Латвии (от сайта ZVA) Euro: | Перепроверить |
Reģ. Nr.: 99-1021
Фирма производитель: Sanofi Winthrop.
Лекарство отпускается по рецепту (℞)
| Cписок лекарств, продуктов c таким же или со схожим наименованием * | ||
|---|---|---|
| Название товара / лекарства | Цены | Аптечная сеть |
STILNOX KATTEGA TBL 10MG N14 |
3.99€, Sep.2023 |
|
STILNOX KATTEGA TBL 10MG N14 |
3.99€, Sep.2023 |
|
STILNOX KATTEGA TBL 10MG N14 |
3.99€, Sep.2023 |
|
STILNOX 10MG APV.TABL.N14 Rx (Elpis) |
6.93€
, May.2023 |
|
STILNOX 10MG APV.TABL.N14 Rx (Sanofi Aventis) |
7.29€, May.2023 |
|
* Данная таблица была скомпонована полностью автоматически, независимым от позиции рекламодателей способом, напрямую и без модификаций, ретранслируя открытые предложения доступные на указанные даты.Согласно нормативным актам, в Латвии, через интернет разрешается распространение только безрецептурных лекарств.
(Cтилнокс) Наименование: Ивадал (Ivadal).
Ивадал является снотворным препаратом имидазопиридиновой структуры с быстро наступающим эффектом. В отличие от бензодиазепинов, золпидем (действующее вещество ивадала) является селективным агонистом подкласса омега1-бензодиазепиновых рецепторов.
Этим может объясняться относительное отсутствие миорелаксирующего и противосудорожного эффектов и сохранение стадии глубокого сна при приеме ивадала. Показано, что ивадал укорачивает время засыпания, уменьшает латентную фазу сна, продлевает общее время сна, предотвращает раннее пробуждение и снижает чиcло и продолжительность ночных пробуждений.
Ивадал не оказывает седативного действия днем.
Ивадал не вызывает привыкания.
Фармакокинетика:
Эффект ивадала наступает быстро. Пики концентраций в плазме действующего вещества достигаются в среднем через 2.2 (0.5-3.0) часа поcле приема внутрь.
Биодоступность золпидема составляет около 70%. Характеризуется высокой степенью связывания с белками плазмы – 92%. Концентрации в плазме являются дозозависимыми. Метаболизируется в печени, не индуцируя ферментов печени. Золпидем метаболизируется до трех неактивных метаболитов, которые выводятся преимущественно почками (57%) и кишечником (37%). Период полувыведения короткий, варьирует от 0.7 до 3.5 часов (в среднем 2.4 часа).
У пациентов старшего возраста клиренс золпидема в плазме может снижаться, без существенного изменения периода полувыведения (до 3 часов), при этом максимальная концентрация в плазме может увеличиваться на 50%, поэтому необходимо проводить коррекцию дозы у пожилых пациентов.
У пациентов с нарушениями функции печени биодоступность золпидема увеличивается, период полувыведения увеличивается до 10 часов, необходима коррекция режима дозирования.
Ситуационные или длительные расстройства сна:
— затрудненное засыпание;
— ночные и ранние пробуждения.
Взрослым в возрасте до 65 лет назначают препарат по 10 мг (1 таблетка) в сутки.
Лицам старше 65 лет или пациентам с печеночной недостаточностью препарат назначают в дозе 5 мг (1/2 таблетки) в сутки. Увеличивать дозу до 10 мг (1 таблетка) у этой категории больных можно только в крайнем случае.
Максимальная суточная доза — 10 мг.
Курс лечения должен быть как можно более коротким — от нескольких суток до 4 недель (максимально).
При эпизодической бессоннице продолжительность лечения составляет от 2 до 5 суток; при транзиторной — 2-3 недели.
Если необходимо продлить терапию на срок более 4 недель, следует повторно проконсультировать больного.
Препарат следует принимать непосредственно перед сном.
Со стороны пищеварительной системы: в отдельных случаях — боли в животе, тошнота, рвота, диарея.
Со стороны центральной нервной системы: в зависимости от дозы и индивидуальной восприимчивости (особенно у пожилых пациентов) — головокружение, нарушение равновесия, атаксия, головная боль, дневная сонливость, рассеивание внимания, мышечная слабость, диплопия, антероградная амнезия, парадоксальные или психопатологические реакции.
Аллергические реакции: кожная сыпь, зуд.
Прочие: редко — нарушения полового влечения; развитие привыкания, формирование психической и физической зависимости (при применении препарата в течение нескольких недель); рикошетная бессонница (при применении препарата в высоких дозах или при длительном применении).
– тяжелая дыхательная недостаточность;
– ночное апноэ;
– тяжелая печеночная недостаточность;
– детский и подростковый возраст до 15 лет;
– повышенная чувствительность к компонентам препарата.
Препарат не рекомендуют применять при миастении и одновременном употреблении алкоголя.
Беременность и лактация:
Ивадал противопоказан к применению в I триместре беременности.
В III триместре беременности препарат можно применять в минимальных дозах, так как при применении бензодиазепинов и сходных с ними препаратов в высоких дозах в конце беременности возможно возникновение артериальной гипотензии, гипотермии и респираторного дистресс-синдрома новорожденных, а через несколько дней после рождения развитие синдрома отмены у ребенка.
Концентрация золпидема в грудном молоке невелика, однако при необходимости применения Ивадала в период лактации следует решить вопрос о прекращении грудного вскармливания.
В экспериментальных исследованиях не было выявлено тератогенного действия препарата.
Передозировка:
Симптомы: угнетение центральной нервной системы. В легких случаях — оглушенность, сонливость; в более тяжелых — атаксия, гипотония, гипотензия, угнетение дыхания, реже кома. Если исключено отравление несколькими лекарственными средствами, то прогноз благоприятный, даже при дозе золпидема 400 мг.
Лечение: промывание желудка, искусственная рвота, прием активированного угля. При необходимости — симптоматическая терапия в отделении интенсивной терапии.
Лекарственное взаимодействие:
При одновременном применении с Ивадалом опиоидных анальгетиков, противокашлевых препаратов, барбитуратов, антидепрессантов, седативных средств, антигистаминных препаратов, бензодиазепинов, клонидина, нейролептиков, этанола возможно развитие симптомов угнетения центральной нервной системы и дыхательного центра.
При одновременном применении Ивадала с клозапином повышается риск коллапса, остановки кровообращения и дыхания.
Таблетки по 7 или 10 штук, в ячейковых контурных упаковках, в картонных пачках.
Препарат следует хранить при комнатной температуре.
Срок годности — 4 года.
Условия отпуска из аптек — по рецепту.
Золпидем (Zolpidem), Санвал (Sanval), Амбиен (Ambien),(Cтилнокс).
Одна таблетка содержит: золпидема тартрат — 10 мг, прочие ингредиенты ( лактоза, микрокристаллическая целлюлоза, метилгидроксипропилцеллюлоза, карбоксиметилкрахмал, магния стеарат).
Производители:
Ивадал (Ivadal) — Synthelabo Groupe, Франция;
Золпидем (Zolpidem) — Pharmacia Corporation;
Амбиен (Ambien) — Sanofi-Synthelabo.
Перед применением препарата Ивадал вы должны проконсультироваться с врачом. Данная инструкция приведена в свободном переводе и предназначена исключительно для ознакомления. Для получения более полной информации просим обращаться к аннотации производителя.
Источник аннотации, инструкции по применению препарата(лекарства): Сайт «Piluli — Медицина от А до Я»
Состав
В 1 таблетке активного компонента декскетопрофена трометамола 36,9 мг, что составляет 25 мг декскетопрофена. Дополнительные индифферентные компоненты: МКЦ, крахмал кукурузный, стеарат магния, гликолят натрия крахмала, аэросил.
В 1 ампуле 2 мл активного компонента декскетопрофена трометамола 73,8 мг, что составляет 50 мг декскетопрофена. Дополнительные индифферентные компоненты: хлорид натрия, этанол 95%, раствор гидроксида натрия, вода для инъекций.
Форма выпуска
Имеет 2 формы выпуска: в виде таблеток и раствор в ампулах для инъекций.
Таблетки по форме круглые, двояковыпуклые, с риской по центру, белые в разрезе. Пленочная оболочка белая или почти белая. Расфасованы по 10 шт. в контурную ячейковую пластину и картонную коробочку.
Раствор для инъекций прозрачный, с выраженным спиртовым запахом. Выпускается в ампулах из затемненного стекла объемом 2 мл. Количество ампул в упаковке: 5 штук.
Фармакологическое действие
Лекарственное средство с обезболивающим, противовоспалительным и жаропонижающим действием.
Фармакодинамика и фармакокинетика
Принцип работы активного вещества декскетопрофена заключается в подавлении синтеза простагландинов на уровне циклооксигеназ — ЦОГ-1 и ЦОГ-2.
Максимальный пик действующего вещества в крови после применения таблетки составляет около получаса, обезболивающее действие сохраняется от 4 до 6 часов. После в/м и в/в инъекции максимальная концентрация в сыворотке появляется через 20 минут, длительность обезболивания до 8 часов.
Для действующего вещества специфично соединение с белками плазмы на 99%. Не кумулируется в организме, в основном выводится через почки с мочой. Время полувыведения при инъекционной форме около 1-2,7 часов, при таблетированной — 1,65 часов. У пожилых людей старше 65 лет дольше почти на 50%.
Показания к применению
Применяется для устранения острой и хронической боли в мышцах, суставах, связках, сухожилиях. Снимает симптоматику в момент применения.
От чего помогают таблетки Дексонала: от зубной и головной боли, болезненных менструаций, любой внезапной боли. Снимает болевую симптоматику при ревматоидном артрите, остеохондрозе, артрозе.
От чего помогают уколы Дексонала: от сильной боли после операций, в пояснице и суставах, при межпозвоночной грыже, почечной колике.
Противопоказания
Препарат противопоказан в следующих случаях:
- Чувствительность к декскетопрофену, веществам, входящим в состав препарата;
- Язвенные поражения ЖКТ, болезнь Крона в острой стадии, активные кровотечения;
- Людям с хронической диспепсией и сильным обезвоживанием;
- Печеночная недостаточность в тяжелой форме;
- Гиперкалиемия, прогрессирующие патологии почек;
- Сердечная недостаточность, до и после операции по шунтированию сердца;
- При склонности к кровотечениям;
- Дети и подростки до 18 лет, беременные и кормящие женщины.
Препарат можно применять, но под наблюдением врача:
- При эзофагите, гастрите;
- Людям, проходящим лечение ГКС, антикоагулянтами, антиагрегантами, диуретиками, СИОЗС.
- Больным с повышенным АД, ишемической болезнью сердца, нарушениями мозгового кровообращения, сахарным диабетом.
- При патологиях гемопоэза, системной красной волчанке.
- Людям пожилого и преклонного возраста.
Побочные действия
Наиболее часто побочные реакции наблюдаются со стороны ЖКТ. Особенно это выражено у людей старшего возраста. Самые вероятные проявления — резь в животе, изжога, поташнивание и нарушения стула. Совсем редко обострение язвенного колита, гастрита.
Остальные побочные эффекты отмечаются редко:
- Нервная система и органы чувств: головокружение, вялость, неспокойный сон, парестезии, тревожность, двоение в глазах;
- Сердечно-сосудистая система и кровь: чувство сердцебиения и жара, повышение АД, нарушение показателей крови;
- Мочеполовая система: нарушение функции почек;
- Репродуктивная система: у женщин сбой менструального цикла, у мужчин — работы простаты, в основном при длительном приеме;
- Аллергические проявления: сыпь, крапивница, бронхоспазм, фотосенсибилизация;
- Со стороны обмена веществ: редкие случаи анорексии.
Инструкция по применению Дексонала (Способ и дозировка)
Рассчитан на краткосрочный прием. Таблетки принимают не более 5 дней, в виде инъекций — не больше 2 дней.
Таблетки Дексонал, инструкция по применению
Во время приема пищи, внутрь, запивая водой.
При внезапной боли лучше принять перед едой, за 30 мин. Анальгетический эффект наступит быстрее.
При слабой боли достаточно 1/2 таблетки, минимальный промежуток между приемами 4-6 часов.
При умеренной боли — 1 таблетка с интервалом в 8 часов.
Максимально в сутки можно принять — 75 мг. Людям старшего возраста, больным с проблемами почек и печени не стоит превышать дозу 50 мг.
Уколы Дексонала, инструкция по применению
При внутримышечном введении 2 мл препарата вводят в мышцу не торопясь, в течение 15 секунд. Если было введено не все содержимое, оставшийся раствор утилизируют. Внутривенное вливание может осуществляться струйно и инфузионно.
При струйной инъекции введение в вену препарата также медленное.
Для внутривенной инфузии 2 мл препарата разводят в 30-100 мл физраствора, раствора глюкозы или Рингера. Далее вводят путем внутривенной капельницы в течение 10-30 минут.
Оптимальная дозировка — 50 мг с интервалом 8-12 ч. Максимально в сутки — 150 мг. При сильной послеоперационной боли можно сочетать Дексонал с опиоидными лекарствами. Пожилым пациентам уменьшать суточную дозировку нет необходимости.
Передозировка
Случаи передозировок практически не наблюдаются. Дексонал хорошо переносится. При сильно завышенной дозе возможны: рвота, боль в животе, бессонница, вертиго и помутнение сознания. В таком случае необходим прием адсорбентов и промывание желудка.
Взаимодействие
Усиливает действие других анальгезирующих противовоспалительных лекарств и ГСК;
Повышает эффект антикоагулянтов, типа Варфарина и гепарина, что увеличивает возможность кровотечений;
Не дружит с препаратами, содержащими Li и метотрексат, препятствуя их выведению;
Усиливает побочные эффекты фенитоина и сульфонамидов;
Ослабляет действие мочегонных и понижающих давление средств;
Прием с пентоксифеллином, тромболитиками, СИОЗС провоцирует развитие кровотечений из ЖКТ;
Усиливает действие пероральных сахароснижающих лекарств;
Прием препарата на фоне терапии зидовудином грозит развитием тяжелой анемии;
Снижает эффективность β-адреноблокаторов;
Прием с сердечными гликозидами повышает их концентрацию в крови, что может вызывать нарушение ритма сердца;
При применении с хинолонами в увеличенных дозах возможны судороги.
Условия продажи
Таблетки являются безрецептурными, ампулы с рецептурным отпуском.
Условия хранения
Хранить следует при комнатной температуре до 25°C, без доступа прямых солнечных лучей.
Срок годности
С указанной даты выпуска препарат в таблетках хранится 3 года, в ампулах — 2 года.
Особые указания
Чтобы сократить нежелательное побочное воздействие при приеме лекарства, можно уменьшить его дозировку и длительность терапии.
Пациентам, имеющим в анамнезе язву ЖКТ и аллергию, принимающим ацетилсалициловую кислоту в малых дозах, пожилым людям, следует начинать лечение с наименьшей дозировки. Рекомендовано дополнительное применение мизопростола или блокаторов протонной помпы. В случае кровотечений в ЖКТ и открытия язвы прекратить прием препарата.
У пациентов, принимающих антикоагулянты и антиагреганты, ГСК также повышается вероятность кровотечений в ЖКТ.
Препарат может повышать концентрацию креатина и азота в плазме, что неблагоприятно для мочевыводящей системы. При одновременном приеме с диуретиками есть риск нефротоксичности.
Дексонал может вызывать нарушение водного обмена, что нежелательно для пациентов с повышенным давлением, почечной и сердечной недостаточностью. В случае ухудшения состояния прием лекарства прекращают. Аналогичный подход людям с заболеваниями: сахарный диабет, ИБС, патологии мозгового кровообращения, курение.
В связи с возможностью головокружений и сонливости сразу после приема лучше избегать поездок за рулем, работы, требующей повышенной сосредоточенности.
Аналоги Дексонала
Совпадения по коду АТХ 4-го уровня:
В аптеках можно подобрать полные аналоги таблеток и уколов Дексонала на возможную замену: Велдексал, Дексалгин, Декскетопрофен-Белмед, Дексиакс, Кетодексал, Фламадекс, Риклинг, Морсадекс, Максалгин, Декскетопрофен-Эво, Декскетопрофен (Велфарм, Керн Фарма, Эллара, Биохимик, Биоком, Лекас, Органика, Северная звезда, Курская биофабрика), Дексолитин, Инфен-25.
В среднем цена аналогов Дексонала колеблется от 102 руб. за таблетки №10 российского производства до 600 руб. за раствор для в/в и в/м введ. №10 импортных фармпроизводителей.
Детям
Безопасность применения Дексонала у детей и подростков до 18 лет не установлена.
С алкоголем
При приеме Дексонала следует воздержаться от употребления алкоголя. Спиртные напитки усиливают раздражающее действие препарата на желудок, нервную систему и работу сердца. Острые реакции выражаются в виде сильной боли в животе, расстройства кишечника, рвоты, головокружения, скачков давления и учащенного сердцебиения.
При беременности и лактации
Беременным и кормящим женщинам прием Дексонала в любой форме выпуска противопоказан.
Отзывы о Дексонале
Отзывы пациентов о таблетках Дексонал с положительными рекомендациями. Отмечен быстрый обезболивающий эффект и пролонгированное действие. Чаще всего таблетки применяют от зубной боли, острой суставной и поясничной боли, при болезненных менструациях. Удобно принимать, 1 таблетки хватает до 8 часов.
Врачи-хирурги, вертебрологи и стоматологи также высоко оценивают обезболивающие таблетки и уколы Дексонал. Помогают снять выраженную боль и воспаление в краткие сроки без значительного урона ЖКТ.
Цена Дексонала, где купить
Цена на таблетки Дексонал №10 в российских аптеках составляет около 370 руб. Средняя стоимость раствора Дексонал для в/в и в/м введ. №5 -240 руб.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Дексонал таблетки п/о плен. 25мг 10штАО Алиум
Аптека Диалог
-
Дексонал (таб.п.пл/об.25мг №10)АО «АЛИУМ»
-
Дексонал таблетки 25мг №10Оболенское фармпред.
-
Дексонал таблетки 25мг №10Оболенское фармпред.
Ригла
-
Дексонал р-р для в/в и в/м введ. 25мг/мл 2мл амп. №5Биннофарм/Алиум АО
-
Дексонал таб.п/о плен. 25мг №10Алиум АО
показать еще