Регистрационное удостоверение: DV/X № 03875/12/17;
Утверждено: Государственный Центр Экспертизы и Стандартизации лекарственных средств, изделий медицинского назначения и медицинского оборудования Министерства Здравоохранения Республики Узбекистан
ИНСТРУКЦИЯ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ
СПИЛОТТА
Торговое название препарата: Спилотта
Действующие вещества (МНН): ситаглиптин + метформин
Лекарственная форма: таблетки, покрытые пленочной оболочкой с пролонгированным действием
Состав:
Одна таблетка Спилотта 500 мг/50 мг содержит:
активные вещества: метформина гидрохлорид 500 мг, ситаглиптина фосфат моногидрат (ситаглиптин) 50 мг;
вспомогательные вещества: повидон К90, гипромеллоза, лаковый краситель зеленое яблоко, магния стеарат;
пленочное покрытие: гидроксипропил метилцеллюлоза 15 cps, гидроксипропил метилцеллюлоза 5 cps, полиэтиленгликоль 6000, очищенный тальк, этилцеллюлоза 20 cps, титана диоксид, лаковый краситель зеленое яблоко, полисорбат 80, метиловый спирт, метиленхлорид.
Одна таблетка Спилотта 1000 мг/50 мг содержит:
активные вещества: метформина гидрохлорид 1000 мг, ситаглиптина фосфат моногидрат (ситаглиптин) 50 мг;
вспомогательные вещества: повидон К90, гипромеллоза, железа оксид желтый, магния стеарат;
пленочное покрытие: гидроксипропил метилцеллюлоза 15 cps, гидроксипропил метилцеллюлоза 5 cps, полиэтиленгликоль 6000, очищенный тальк, этилцеллюлоза 20 cps, титана диоксид, железа оксид желтый, полисорбат 80, метиловый спирт, метиленхлорид.
Описание:
Таблетки 500 мг/50 мг: таблетки в форме каплет, покрытые пленочной оболочкой светло-зеленого цвета, с риской на одной стороне.
Таблетки 1000 мг/50 мг: таблетки в форме каплет, покрытые пленочной оболочкой светло-желтого цвета
Фармакотерапевтическая группа: противодиабетическое средство (пероральное).
Код АТХ: A10B
Фармакологические свойства
Комбинированный пероральный гипогликемический препарат.
Ситаглиптин – высокоселективный ингибитор дипептидилпептидазы 4 (ДПП-4). Ситаглиптин отличается по химической структуре и фармакологическому действию от аналогов глюкагоноподобного пептида-1 (ГПП-1), инсулина, производных сульфонилмочевины, бигуанидов, агонистов γ-рецепторов, активируемых пролифератором пероксисом (PPAR-γ), ингибиторов альфа-гликозидазы, аналогов амилина. Ингибируя ДПП-4, ситаглиптин повышает концентрацию 2 известных гормонов семейства инкретинов: ГПП-1 и глюкозо-зависимого инсулинотропного пептида (ГИП). Гормоны семейства инкретинов секретируются в кишечнике в течение суток, их уровень повышается в ответ на прием пищи. Инкретины являются частью внутренней физиологической системы регуляции гомеостаза глюкозы.
Метформина гидрохлорид – тормозит глюконеогенез в печени, уменьшает абсорбцию глюкозы из кишечника, усиливает периферическую утилизацию глюкозы, а также повышает чувствительность тканей к инсулину. При этом не оказывает действия на секрецию инсулина бета-клетками поджелудочной железы, не вызывает гипогликемических реакций. Снижает содержание общего холестерина, триглицеридов и липопротеинов низкой плотности в крови.
Фармакокинетика
Ситаглиптин
После приема внутрь быстро абсорбируется в желудочно-кишечном тракте. Cmax. достигается через 1-4 ч. Абсолютная биодоступность составляет приблизительно 87%.
Связывание ситаглиптина с белками плазмы составляет 38%. Метаболизируется лишь незначительная часть поступившего в организм препарата.
Приблизительно 79% ситаглиптина выводится в неизмененном виде с мочой.
T1/2 выведения ситаглиптина при приеме внутрь в дозе 100 мг составляет приблизительно 12,4 ч. Почечный клиренс составляет приблизительно 350 мл/мин.
Метформина гидрохлорид
После приема внутрь метформин абсорбируется из желудочно-кишечного тракта. Биодоступность составляет 50-60 %. Максимальная концентрация в плазме крови (Сmax) достигается через 2,5 ч после приема внутрь. Прием пищи снижает Сmax на 40 % и замедляет ее достижение на 35 минут. Метформин быстро распределяется в тканях, практически не связывается с белками плазмы. Подвергается метаболизму в очень слабой степени и выводится почками. Клиренс метформина у здоровых субъектов составляет 400 мл/мин (в 4 раза выше, чем клиренс креатинина), что свидетельствует о наличии активной канальцевой секреции. Период полувыведения составляет 6,5 часов.
При нарушении функции почек возможна кумуляция препарата.
Показания к применению
- сахарный диабет 2 типа;
- показан как дополнение к диете и режиму физических нагрузок для улучшения контроля над гликемией у пациентов, у которых не достигнуто адекватного контроля на фоне монотерапии метформином в максимально переносимой дозе;
- показан в комбинации с производными сульфонилмочевины как дополнение к диете и режиму физических нагрузок у пациентов, которые не достигли адекватного контроля при терапии метформином в максимально переносимых дозах и сульфонилмочевиной;
- показан в комбинации с инсулином (комбинация трех препаратов) как дополнение к диете и режиму физических нагрузок для улучшения контроля над гликемией у пациентов, у которых инсулин в стабильной дозе и метформин не обеспечивают адекватного контроля над гликемией.
Способ применения и дозы
Препарат принимают внутрь, независимо от приема пищи.
Рекомендуемая доза препарата – одна таблетка 2 раза в сутки.
С целью обеспечения разных доз метформина препарат Спилотта выпускается в дозировках 50 мг ситаглиптина в комбинации с 500 или 1000 мг метформина гидрохлорида.
Все пациенты должны продолжать придерживаться диеты с адекватным распределением приема углеводов в течение дня. Пациенты с избыточной массой тела должны продолжать придерживаться низкокалорийной диеты.
Побочные действия
Со стороны системы органов пищеварения: тошнота, рвота, «металлический» привкус во рту, отсутствие аппетита, диарея, метеоризм, боли в животе.
Эти симптомы встречаются особенно часто в начале лечения и, как правило, проходят самостоятельно. Данные симптомы можно уменьшить назначением антацидов, м-холиноблокаторов или спазмолитиков. В редких случаях наблюдается повышение активности «печеночных» трансаминаз или гепатит, исчезающие после отмены препарата.
Со стороны обмена веществ: в редких случаях – лактоацидоз (требует прекращения лечения); при длительном лечении – гиповитаминоз В12 (нарушение его всасывания).
Со стороны органов кроветворения: в отдельных случаях – мегалобластная анемия.
Со стороны эндокринной системы: гипогликемия.
Аллергические реакции: кожная сыпь, зуд.
Противопоказания
- повышенная чувствительность к препарату;
- диабетический кетоацидоз, диабетическая прекома, кома;
- нарушение функции почек (клиренс креатинина менее 60 мл/мин);
- острые заболевания, протекающие с риском развития нарушения функции почек: дегидратация (при диарее, рвоте), лихорадка, тяжелые инфекционные заболевания, состояния гипоксии (шок, сепсис, почечные инфекции, бронхо-легочные заболевания);
- клинически выраженные проявления острых и хронических заболеваний, которые могут приводить к развитию тканевой гипоксии (сердечная или дыхательная недостаточность, острый инфаркт миокарда и т.д.);
- серьезные хирургические операции и травмы (на фоне которых показано проведение инсулинотерапии);
- нарушение функции печени;
- хронический алкоголизм, острое отравление алкоголем;
- беременность, период грудного вскармливания;
- лактоацидоз (в т.ч. в анамнезе);
- применение в течение не менее 2-х дней до и в течение 2-х дней после проведения радиоизотопных или рентгенологических исследований с введением йодсодержащего контрастного вещества;
- соблюдение гипокалорийной диеты (менее 1000 ккал/сут).
Не рекомендуется применять препарат у лиц старше 60 лет, выполняющих тяжелую физическую работу, что связано с повышенным риском развития у них лактоацидоза.
Лекарственные взаимодействия
Ситаглиптин
В исследованиях взаимодействия с другими лекарственными средствами, ситаглиптин не оказывал клинически значимого действия на фармакокинетику следующих препаратов: метформина, розиглитазона, глибенкламида, симвастатина, варфарина, пероральных контрацептивов.
Было отмечено небольшое увеличение AUC (11%), а также средней Сmax (18%) дигоксина при совместном применении с ситаглиптином. Это увеличение не считается клинически значимым. Не рекомендуется изменение дозы ни дигоксина, ни препарата при их одновременном применении. Было отмечено увеличение AUC и Сmax ситаглиптина на 29% и 68% соответственно у пациентов при совместном применении Спилотта в разовой дозе 100 мг и циклоспорина (мощного ингибитора р-гликопротеина) в разовой дозе
600 мг. Данные изменения фармакокинетических параметров ситаглиптина не считаются клинически значимыми. Не рекомендуется изменение дозы препарата при совместном применении с циклоспорином и другими ингибиторами р-гликопротеина (например, кетоконазолом).
Метформина гидрохлорид
Не рекомендуемые комбинации: одновременный прием даназола во избежание гипергликемического действия последнего. При необходимости лечения даназолом и после прекращения приема последнего требуется коррекция дозы метформина под контролем уровня гликемии.
Комбинации, требующие особой осторожности: хлорпромазин – при приеме в больших дозах (100 мг в день) повышает концентрацию глюкозы в крови, снижая высвобождение инсулина. При лечении нейролептиками и после прекращения приема последних требуется коррекция дозы метформина под контролем концентрации глюкозы крови.
При одновременном применении с производными сульфонилмочевины, салицилатами, акарбозой, инсулином, нестероидными противовоспалительными препаратами, ингибиторами моноаминооксидазы, окситетрациклином, ингибиторами ангиотензинпревращающего фермента, производными фиброевой кислоты, циклофосфамидом, β-адреноблокаторами возможно усиление гипогликемического действия метформина. При одновременном применении с глюкокортикостероидами, пероральными контрацептивами, эпинефрином, симпатомиметиками, глюкагоном, препаратами йодсодержащих гормонов щитовидной железы, тиазидными и «петлевыми» диуретиками, производными фенотиазина, производными никотиновой кислоты возможно уменьшение гипогликемического действия метформина.
Нифедипин повышает абсорбцию, Сmax, замедляет выведение метформина.
Циметидин замедляет выведение метформина, вследствие чего увеличивается риск развития лактоацидоза.
Катионные лекарственные средства (аминохинидин, дигоксин, хинин, ранитидин, триамтерен и ванкомицин), выводящиеся почечными канальцами, конкурируют за канальцевые транспортные системы и при длительной терапии могут увеличить Сmax на 60%.
Метформин может ослабитьдействие непрямых антикоагулянтов (производных кумарина).
Риск развития лактоацидоза усиливается при острой алкогольной интоксикации, особенно в случае голодания, соблюдения низкокалорийной диеты или печеночной недостаточности. Во время лечения следует воздерживаться от приема алкоголя и лекарственных препаратов, содержащих этанол. Возможна кумуляция метформина и развитие лактоацидоза при внутрисосудистом введении йодсодержащих контрастных препаратов.
Особые указания
В период лечения необходимо не реже 2 раз в год, а также при появлении миалгии определять содержание лактата в плазме.
Кроме того, 1 раз в 6 месяцев необходим контроль содержания креатинина в сыворотке крови (особенно у больных пожилого возраста), а также особенно тщательный контроль концентрации глюкозы в крови.
При появлении бронхо-легочной инфекции или инфекционного заболевания мочеполовых органов пациенту следует немедленно сообщить об этом лечащему врачу.
Применение в период беременности и кормления грудью
Спилотту не следует применять в период беременности. Неизвестно, выделяется ли ситаглиптин с молоком у человека. По этой причине препарат Спилотту не следует применять у женщин, кормящих грудью.
Влияние на способность управлять автотранспортом и работу с механизмами
Препарат Спилотта не оказывает влияния на способность управлять автотранспортом и механизмами.
Передозировка
В случае передозировки следует применять стандартные поддерживающие меры, например, удаление неабсорбированного материала из желудочно-кишечного тракта, назначить поддерживающую терапию, если необходимо.
Форма выпуска
По 6 таблеток в блистере из алюминиевой фольги. 3 блистера вместе с инструкцией по применению в картонной коробке.
Условия хранения
Хранить при температуре ниже 30ºС.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не следует применять по истечении срока годности.
Условия отпуска из аптек
По рецепту.
Производитель
INCEPTA PHARMACEUTICALS LTD
Наименование и адрес организации, принимающей претензии (предложения) по качеству лекарственных средств на территории Республики Узбекистан:
100179, г. Ташкент, Алмазарский р-н, Массив Чимбай 5 А,
Тел.: +99871 229 27 09.
— сахарный диабет 2 типа;
— показан как дополнение к диете и режиму физических нагрузок для улучшения контроля над гликемией у пациентов, у которых не достигнуто адекватного контроля на фоне монотерапии метформином в максимально переносимой дозе;
— показан в комбинации с производными сульфонилмочевины как дополнение к диете и режиму физических нагрузок у пациентов, которые не достигли адекватного контроля при терапии метформином в максимально переносимых дозах и сульфонилмочевиной;
— показан в комбинации с инсулином (комбинация трех препаратов) как дополнение к диете и режиму физических нагрузок для улучшения контроля над гликемией у пациентов, у которых инсулин в стабильной дозе и метформин не обеспечивают адекватного контроля над гликемией.
Одна таблетка Спилотта 500 мг/50 мг содержит:
активные вещества: метформина гидрохлорид 500 мг, ситаглиптина фосфат моногидрат
(ситаглиптин) 50 мг;
вспомогательные вещества: повидон К90, гипромеллоза, лаковый краситель зеленое яблоко,
магния стеарат; `
пленочное покрытие: гидроксипропил метилцеллюлоза 15 cps, гидроксипропил метилцеллюлоза 5 сps, полиэтиленгликоль 6000, очищенный тальк, этилцеллюлоза: 20 cps, титана диоксид, лаковый краситель зеленое яблоко, полисорбат 80, метиловый спирт, метиленхлорид.
Одна таблетка Спилотта 1000 мг/50 мг содержит:
активные вещества: метформина гидрохлорид 1000 мг, ситаглиптина фосфат моногидрат (ситаглиптин) 50 мг;
вспомогательные вещества: повидон К90, гипромеллоза, железа оксид желтый, магния стеарат;
пленочное покрытие: гидроксипропил метилцеллюлоза 15 срз, гидроксипропил метилцеллюлоза 5 cps, полиэтиленгликоль 6000, очищенный тальк, этилцеллюлоза 20 cps, титана диоксид, железа оксид желтый, полисорбат 80, метиловый спирт, метиленхлорид.
Препарат принимают внутрь, независимо от приема пищи.
Рекомендуемая доза препарата — одна таблетка 2 раза в сутки.
С целью обеспечения разных доз метформина препарат Спилотта выпускается в дозировках 50 мг ситаглиптина в комбинации с 500 или 1000 мг метформина гидрохлорида:
Все пациенты должны продолжать придерживаться диеты с адекватным распределением приема углеводов в течение дня. Пациенты с избыточной массой тела должны продолжать придерживаться низкокалорийной диеты.
Со стороны системы органов пищеварения: тошнота, рвота, «металлический» привкус во рту, отсутствие аппетита, диарея, метеоризм, боли в животе.
Эти симптомы встречаются особенно часто в начале лечения и, как правило, проходят самостоятельно. Данные симптомы можно уменьшить назначением антацидов, м-холиноблокаторов или спазмолитиков. В редких случаях наблюдается повышение активности «печеночных» трансаминаз или гепатит, исчезающие после отмены препарата.
Со стороны обмена веществ: в редких случаях — лактоацидоз (требует прекращения лечения);
при длительном лечении — гиповитаминоз В12 (нарушение его всасывания).
Со стороны органов кроветворения: в отдельных случаях — мегалобластная анемия.
Со стороны эндокринной системы: гипогликемия.
‘Аллергические реакции: кожная сыпь, зуд.
— повышенная чувствительность к компонентам препарата.
— серьезные хирургические операции и травмы (на фоне’ которых показано проведение инсулинотерапии);
— нарушение функции печени;
— хронический алкоголизм, острое отравление алкоголем;
— беременность, период грудного вскармливания;
— лактоацидоз (в т.ч. в анамнезе);
— применение в течение не менее 2-х дней до и в течение 2-х дней после проведения радиоизотопных или рентгенологических исследований с введением йодсодержащего контрастного вещества;
— соблюдение гипокалорийной диеты (менее 1000 ккал/сут).
— не рекомендуется применять препарат у лиц старше 60 лет, выполняющих тяжелую физическую работу, что связано с повышенным риском развития у них лактоацидоза.
Срок годности и условия хранения указаны на упаковке.
Идентификационный номер сертификата
9359
Регистрационный номер
DV/X 03875/12/17
Дата выдачи сертификата
19.12.2017
Фармакотерапевтическая группа
Страна-производитель
Фирма-производитель
Держатель сертификата
Международный непатентованный название
Название лекарственного препарата
СПИЛОТТА Таблетки, покрытые пленочной оболочкой пролонгированного действия 500 мг + 50 мг
Торговое наименование
СПИЛОТТА
Название atx
Метформин и ситаглиптин
Способ введения
Внутрь
В составе лекарственного препарата имеется растительное вещество?
Нет
В составе лекарственного препарата имеется наркотический, психотропный, прекурсор?
Нет
Если у Вас имеются жалобы на цены лекарств,
позвоните по номеру 📞1159 или @consumeruz
Последняя обновления:17.06.2023
28
Спиолто® Респимат® (Spiolto® Respimat®) инструкция по применению
📜 Инструкция по применению Спиолто® Респимат®
💊 Состав препарата Спиолто® Респимат®
✅ Применение препарата Спиолто® Респимат®
📅 Условия хранения Спиолто® Респимат®
⏳ Срок годности Спиолто® Респимат®
Описание лекарственного препарата
Спиолто® Респимат®
(Spiolto® Respimat®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2018 года.
Дата обновления: 2018.12.26
Код ATX:
R03AL06
(Олодатерол и тиотропия бромид)
Лекарственная форма
| Спиолто® Респимат® |
Р-р д/ингаляций дозированный 2.5 мкг+2.5 мкг/1 ингаляционная доза: картридж 4.5 мл (60 доз) в компл. с ингалятором Респимат® рег. №: ЛП-003164 |
Форма выпуска, упаковка и состав
препарата Спиолто® Респимат®
Раствор для ингаляций дозированный прозрачный, бесцветный или почти бесцветный.
Вспомогательные вещества: бензалкония хлорида раствор — 2.2 мкг (соответственно бензалкония хлорида — 1.1 мкг), динатрия эдетат — 1.1 мкг, хлористоводородная кислота 1М — до pH 2.9, вода очищенная — до 11.05 мг.
60 доз ингаляционных (30 терапевтических доз) — картриджи (1) вместимостью 4.5 мл, помещенные в алюминиевый цилиндр, в комплекте с ингалятором Респимат® — пачки картонные.
Фармакологическое действие
Комбинированный бронхолитический препарат. Олодатерол — бета2-адреномиметик длительного действия и тиотропия бромид — м-холиноблокатор обеспечивают взаимодополняющую бронходилатацию, в результате различного механизма действия активных веществ и различной локализации целевых рецепторов в легких.
Олодатерол обладает высоким сродством и селективностью к β2-адренорецепторам. Активация β2-адренорецепторов в дыхательных путях приводит к стимуляции внутриклеточной аденилатциклазы, которая участвует в синтезе циклического 3.5-аденозинмонофосфата (цАМФ). Повышение уровня цАМФ вызывает бронходилатацию, расслабляя гладкомышечные клетки дыхательных путей. Олодатерол является селективным агонистом β2-адренорецепторов длительного действия с быстрым началом действия и длительным (не менее 24 ч) сохранением эффекта. β2-адренорецепторы присутствуют не только в гладкомышечных клетках, но и во многих других клетках, в т.ч. в эпителиальных и эндотелиальных клетках легких и сердца. Точная функция β2-рецепторов в сердце до конца не изучена, но их присутствие указывает на возможность влияний на сердце даже высокоселективных бета2-адренергических агонистов.
Тиотропия бромид — м-холиноблокатор длительного действия. Препарат обладает одинаковым сродством к M1-М5 подтипам мускариновых рецепторов. Результатом ингибирования М3-холинорецепторов в дыхательных путях является расслабление гладкой мускулатуры. Бронходилатирующий эффект зависит от дозы и сохраняется в течение не менее 24 ч. Значительная продолжительность действия связана, вероятно, с очень медленной диссоциацией препарата от М3-холинорецепторов: период полудиссоциации существенно более длительный, чем у ипратропия бромида. При ингаляционном способе введения тиотропия бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывая системных м-холиноблокирующих побочных эффектов. Диссоциация от М2-холинорецепторов происходит быстрее, чем от М3-холинорецепторов, что свидетельствует о преобладании селективности в отношении М3 подтипа холинорецепторов над М2-холинорецепторами. Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с ХОБЛ.
Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием.
В ходе клинических исследований установлено, что препарат Спиолто® Респимат®, применявшийся 1 раз/сут, утром, приводил к быстрому (в течение 5 мин после первой дозы) улучшению функции легких. Эффект препарата Спиолто® Респимат® превосходил эффект тиотропия бромида в дозе 5 мкг и олодатерола в дозе 5 мкг, применявшихся в качестве монотерапии (ОФВ1 при приеме Спиолто® Респимат® на 0.137 л: при приеме тиотропия бромида на 0.058 л; при приеме олодатерола — на 0.125 л).
При применении препарата Спиолто® Респимат® по сравнению с применением тиотропия бромида и олодатерола в качестве монотерапии достигался более значительный бронходилатирующий эффект, а также увеличивалась пиковая объемная скорость выдоха в утренние и вечерние часы.
Применение препарата Спиолто® Респимат® приводило к снижению риска обострений ХОБЛ по сравнению с плацебо.
Препарат Спиолто® Респимат® значительно улучшал емкость вдоха по сравнению с тиотропия бромидом, олодатеролом или плацебо, применявшимися в виде монотерапии.
Спиолто® Респимат® по сравнению с плацебо значительно улучшал время переносимости физической нагрузки.
Фармакокинетика
Фармакокинетика комбинированного препарата Спиолто® Респимат® эквивалентна фармакокинетике отдельно применяемым олодатеролу и тиотропия бромиду.
Олодатеролу и тиотропия бромиду свойственна линейная фармакокинетика.
Устойчивое состояние фармакокинетики олодатерола достигалось через 8 дней при применении 1 раз/сут, а степень воздействия увеличивалась по сравнению с применением однократной дозы в 1.8 раза. Устойчивое состояние фармакокинетики тиотропия бромида при применении 1 раз/сут достигалось через 7 дней.
Всасывание
Олодатерол быстро всасывается, после ингаляции препарата Cmax в плазме обычно достигается в течение 10-20 мин. У здоровых добровольцев после ингаляции препарата абсолютная биодоступность олодатерола составляла около 30%, тогда как абсолютная биодоступность олодатерола после приема препарата внутрь в виде раствора была ниже 1%. Таким образом, системное воздействие олодатерола после ингаляционного применения в основном реализуется путем всасывания в легких, а вклад проглатываемой части дозы в системное воздействие незначителен.
После ингаляции раствора тиотропия бромида в системный кровоток поступает около 33% от величины ингаляционной дозы. Абсолютная биодоступность при приеме внутрь составляет 2-3%. Cmax в плазме наблюдается через 5-7 мин после ингаляции.
Распределение
Связывание олодатерола с белками плазмы составляет примерно 60%, а Vd — 1110 л.
Связывание тиотропия бромида с белками плазмы составляет 72%: Vd — 32 л/кг. Доклинические исследования показали, что тиотропия бромид не проникает через ГЭБ.
Метаболизм
Олодатерол в значительной степени метаболизируется путем непосредственной глюкуронизации и O-деметилирования с последующей конъюгацией. Из 6 идентифицированных метаболитов с β2-адренорецепторами связывается только 1 неконъюгированное деметилированное производное (SOM 1522), однако этот метаболит не обнаруживается в плазме после длительного ингаляционного применения препарата в рекомендуемой терапевтической дозе или в дозах, превышающих терапевтическую в 4 раза. В O-деметилировании олодатерола участвует цитохром Р450 (изоферментов CYP2C9, CYP2C8 и в незначительной степени CYP3A4). В образовании глюкуронидов олодатерола участвуют изоформы уридиндифосфатгликозил трансферазы, UGT2B7, UGT1A1, 1А7 и 1А9.
Степень биотрансформации тиотропия бромида незначительна. Это подтверждается тем, что после в/в введения тиотропия бромида молодым здоровым добровольцам 74% тиотропия бромида выводится почками в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-N-метилскопин и дитиенилгликолевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro показано, что некоторая часть препарата (<20% от дозы после в/в введения) метаболизируется путем окисления цитохромом Р450 (CYP2D6 и 3А4) с последующей конъюгацией с глутатионом и образованием различных метаболитов.
Выведение
Общий клиренс олодатерола у здоровых добровольцев составляет 872 мл/мин, а почечный клиренс 173 мл/мин. Конечный T1/2 после в/в применения олодатерола составляет 22 ч, тогда как конечный T1/2 после ингаляционного применения — примерно 45 ч. Из этого следует, что в последнем случае выведение в большей степени зависит от всасывания.
Общая меченая изотопом доза олодатерола, выделявшаяся почками (включая исходное соединение и все метаболиты), составляла после в/в введения 38%, после приема внутрь — 9%. Общая меченая изотопом доза, выделявшаяся почками, неизмененного олодатерола составляла, после в/в введения 19%. Общая меченая изотопом доза, выделявшаяся через кишечник, составляла после в/в введения 53% и 84% после приема внутрь.
Более 90% дозы препарата выводилось после в/в введения в течение 5 дней и после приема внутрь в течение 6 дней. После ингаляционного применения препарата экскреция неизмененного олодатерола почками на протяжении интервала дозирования составляла у здоровых добровольцев в период устойчивого состояния фармакокинетики 5-7% от величины дозы.
Тиотропия бромид после в/в введения в основном выводится почками в неизмененном виде (74%). Общий клиренс после в/в введения тиотропия бромида молодым здоровым добровольцам составляет 880 мл/мин. После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18.6% (0.93 мкг), оставшаяся неабсорбировавшаяся часть выводится через кишечник. Почечный клиренс тиотропия бромида превышает КК, что свидетельствует о его канальцевой секреции. Терминальный T1/2 тиотропия бромида после ингаляции составляет от 27 до 45 ч.
Фармакокинетика в особых клинических случаях
Клинические исследования показали: несмотря на влияние возраста, пола и массы тела на системное воздействие олодатерола коррекции дозы не требуется.
У пациентов пожилого возраста отмечается снижение почечного клиренса тиотропия (347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ старше 65 лет). Однако это не приводило к увеличению значения AUC0-6,ss и Cmax,ss.
Раса. Сравнение фармакокинетических данных, полученных в клинических исследованиях олодатерола, выявило тенденцию к более высокому системному воздействию олодатерола у пациентов из Японии и других пациентов монголоидной расы по сравнению с пациентами европеоидной расы. В клинических исследованиях олодатерола, применявшегося в дозах, которые превышали рекомендуемую терапевтическую дозу в 2 раза, у пациентов европеоидной и монголоидной расы каких-либо опасений в отношении безопасности установлено не было.
У пациентов с почечной недостаточностью тяжелой степени тяжести (КК <30 мл/мин) системное воздействие олодатерола увеличивалось в среднем в 1.4 раза. Такое повышение воздействия не вызывает опасении в отношении безопасности, учитывая опыт, полученный в ходе применения олодатерола в клинических исследованиях. После ингаляционного применения тиотропия 1 раз/сут в период равновесного состояния у пациентов с ХОБЛ и почечной недостаточностью легкой степени тяжести (КК 50-80 мл/мин) отмечалось небольшое увеличение величин AUC0-6,ss на 1.8-30% и Cmax,ss по сравнению с пациентами с нормальной функцией почек (КК >80 мл/мин). У пациентов с ХОБЛ и почечной недостаточностью средней и тяжелой степени тяжести (КК <50 мл/мин) в/в применение тиотропия бромида приводило к двукратному увеличению общего воздействия тиотропия бромида (значение AUC0-4 увеличивалось на 82%, а величина Cmax увеличилась на 52%) по сравнению с пациентами с нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
У пациентов с печеночной недостаточностью легкой и средней степени тяжести системное воздействие олодатерола не изменялось. Системное воздействие олодатерола у пациентов с печеночной недостаточностью тяжелой степени тяжести не изучалось. Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия бромида, т.к. тиотропия бромид преимущественно выводится почками и с помощью неферментативного расщепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
Показания препарата
Спиолто® Респимат®
- длительная поддерживающая терапия у пациентов с ХОБЛ, хроническим бронхитом, эмфиземой легких;
- для уменьшения обструкции дыхательных путей и сопутствующей одышки;
- для уменьшения частоты обострений; улучшения переносимости физических нагрузок и качества жизни.
Режим дозирования
Рекомендуемая терапевтическая доза составляет 2 ингаляции спрея из ингалятора Респимат® (5 мкг/терапевтическая доза тиотропия бромида и 5 мкг/терапевтическая доза олодатерола) 1 раз/сут, в одно и то же время суток.
У пациентов пожилого возраста можно использовать препарат Спиолто® Респимат® в рекомендуемой дозе.
У пациентов с печеночной недостаточностью легкой и средней степени тяжести можно использовать Спиолто® Респимат® в рекомендуемой дозе. Данных о применении олодатерола у пациентов с печеночной недостаточностью тяжелой степени не имеется.
У пациентов с нарушениями функции почек можно использовать препарат Спиолто® Респимат® в рекомендуемой дозе.
Пациенты с почечной недостаточностью средней и тяжелой степени, применяющие препарат Спиолто® Респимат®, должны находиться под тщательным наблюдением врача.
Правила применения ингалятора Спиолто® Респимат®
Перед началом использования препарата следует изучить правила применения ингалятора Спиолто® Респимат®.
Ингалятор предназначен для использования 1 раз/сут. Каждый раз при его применении следует делать 2 ингаляции.
Как хранить ингалятор Спиолто® Респимат®
Хранить Спиолто® Респимат® в недоступном для детей месте.
Не замораживать Спиолто® Респимат®.
Если ингалятор Спиолто® Респимат® не использовался более 7 дней, следует направить его перед применением вниз и нажать один раз на кнопку подачи дозы.
Если ингалятор Спиолто® Респимат® не использовался более 21 дня, следует повторить шаги 4-6 из раздела «Подготовка к первому использованию» до появления облачка аэрозоля. Затем повторить шаги 4-6 еще три раза.
Не использовать ингалятор Спиолто® Респимат® после окончания срока годности.
Не трогать прокалывающий элемент внутри прозрачной гильзы.
Уход за ингалятором Спиолто® Респимат®
Мундштук, включая металлическую часть внутри мундштука, следует очищать влажной тряпочкой или тканью, как минимум, 1 раз в неделю.
Любое незначительное изменение цвета мундштука не влияет на работу ингалятора Спиолто® Респимат®.
Определение момента, когда нужно начать пользоваться новым ингалятором
Ингалятор Спиолто® Респимат® содержит 60 ингаляционных доз (т.е. 30 терапевтических доз) при условии применения в соответствии с режимом дозирования (2 ингаляционные дозы 1 раз/сут).
Индикатор доз показывает, сколько примерно доз еще осталось. Когда индикатор покажет на красную область шкалы, это означает, что лекарства осталось примерно на 7 дней (14 ингаляционных доз).
Когда индикатор доз ингалятора достигнет конца красной области шкалы, ингалятор Спиолто® Респимат® автоматически заблокируется — больше не может быть получено ни одной ингаляционной дозы (поворот прозрачной гильзы будет невозможен).
Через 3 месяца после первого использования ингалятор Спиолто® Респимат® следует выбросить, даже если он полностью не использован.
Подготовка к перовому использованию
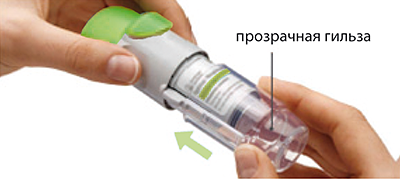
1. Снять прозрачную гильзу
- Держать колпачок закрытым.
- Нажать стопорную кнопку и сильно потянуть при этом другой рукой за прозрачную гильзу.
2. Вставить картридж
- Вставить картридж узким концом в ингалятор.
- Поставить ингалятор дном картриджа на твердую поверхность и сильно нажать на него, пока картридж не встанет на место со щелчком.
3. Установить на место прозрачную гильзу
- Установить прозрачную гильзу на место до щелчка.
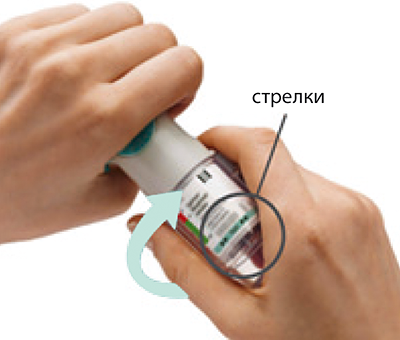
4. Повернуть
- Держать колпачок закрытым.
- Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (пол-оборота).
5. Открыть
- Открыть колпачок до упора.
6. Нажать
- Направить ингалятор вниз.
- Нажать кнопку подачи дозы.
- Закрыть колпачок.
- Повторить шаги 4-6 до появления облачка аэрозоля.
- После появления облачка аэрозоля повторить шаги 4-6 еще 3 раза.
Ежедневное применение
Повернуть
- Держать колпачок закрытым.
- Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, до щелчка (пол-оборота).
Открыть
- Открыть колпачок до упора.
Нажать
Сделать медленный полный выдох.
Обхватить мундштук губами, не перекрывая воздухозаборники.
Делая медленный, глубокий вдох через рот, нажать кнопку подачи дозы и продолжать делать вдох.
Задержать дыхание примерно на 10 сек или так долго, как возможно.
Для получения второй ингаляционной дозы повторить операции: Повернуть, Открыть, Нажать.
Ответы на часто задаваемые вопросы
1. Сложно установить картридж на необходимую глубину
Вы случайно повернули прозрачную гильзу до установки картриджа? Откройте колпачок, нажмите на кнопку подачи дозы, затем вставьте картридж.
Вы вставляете картридж широким концом? Вставьте картридж узким концом в ингалятор.
2. Невозможно нажать на кнопку подачи дозы
Повернули ли Вы прозрачную гильзу? Если нет, поверните прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль? Ингалятор Спиолто® Респимат® блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спиолто® Респимат®.
3. Невозможно повернуть прозрачную гильзу
Вы уже повернули прозрачную гильзу? Если прозрачная гильза уже повернута, следуйте по шагам «Открыть» и «Нажать» в разделе «Ежедневное применение» для получения ингаляционной дозы.
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль? Ингалятор Спиолто® Респимат® блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спиолто® Респимат®.
4. Индикатор доз ингалятора Спиолто® Респимат® достигает нуля слишком быстро
Использовали ли Вы Спиолто® Респимат® в соответствии с Режимом дозирования (две ингаляционные дозы 1 раз/сут)? Препарата Спиолто® Респимат® хватает на 30 дней при использовании двух ингаляций 1 раз/сут.
Поворачивали ли Вы прозрачную гильзу до установки картриджа? Индикатор доз считает каждый поворот прозрачной гильзы вне зависимости от того, установлен картридж или нет.
Выпускали ли Вы ингаляционные дозы в воздух для проверки работы Спиолто® Респимат®. После подготовки ингалятора к использованию не требуется ежедневной проверки ингаляции.
Вы установили картридж в использованный ингалятор Спиолто® Респимат®?
Всегда устанавливайте новый картридж в новый ингалятор Спиолто® Респимат®.
5. Ингалятор Спиолто® Респимат® выпускает ингаляционные дозы автоматически
Был ли открыт колпачок, когда Вы поворачивали прозрачную гильзу? Закройте колпачок, затем поверните прозрачную гильзу.
Нажимали ли Вы кнопку подачи дозы во время поворота прозрачной гильзы? Закройте колпачок так, чтобы кнопка подачи дозы была закрыта, затем поверните прозрачную гильзу.
Останавливались ли Вы во время поворота прозрачной гильзы, до звука щелчка? Поверните прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
6. Ингалятор Спиолто® Респимат® не выпускает ингаляционную дозу
Установили ли Вы картридж? Если нет, установите картридж.
Вы повторили шаги «Повернуть», «Открыть», «Нажать» менее трех раз после установки картриджа? Повторите шаги «Повернуть», «Открыть», «Нажать» три раза после установки картриджа, как описано в разделе «Подготовка к первому использованию», шаги 4-6.
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль? Если индикатор доз указывает на ноль, значит ингалятор пуст и заблокирован.
Не снимайте прозрачную гильзу и не вынимайте картридж после подготовки ингалятора к использованию. Всегда устанавливайте новый картридж в новый ингалятор Спиолто® Респимат®.
Побочное действие
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований препарата Спиолто® Респимат®.
Определений категорий частоты побочных реакций: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (от ≥1/1000, <1/100), редко (≥1/10 000, <1/1000), очень редко (<1/10 000), частота неизвестна* (частота не может быть оценена на основании имеющихся данных).
Инфекционные и паразитарные заболевания: редко — назофарингит.
Со стороны обмена веществ: частота неизвестна — дегидратация.
Со стороны нервной системы: нечасто — головокружение, бессонница.
Со стороны органа зрения: редко — нечеткое зрение; частота неизвестна — повышение внутриглазного давления, глаукома.
Со стороны сердечно-сосудистой системы: нечасто — мерцательная аритмия, ощущение сердцебиения, тахикардия, повышение АД; редко — наджелудочковая тахикардия.
Со стороны дыхательной системы: нечасто — кашель, дисфония; редко — ларингит, фарингит, носовое кровотечение; частота неизвестна — бронхоспазм, синусит.
Со стороны пищеварительной системы: часто — сухость во рту (обычно незначительная); нечасто — запор; редко — кандидоз полости рта, гингивит; частота неизвестна — кишечная непроходимость, включая паралитическую кишечную непроходимость, гастроэзофагеальный рефлюкс, дисфагия, глоссит, стоматит.
Со стороны кожи и подкожных тканей: частота неизвестна — кожные инфекции и язвы на коже, сухость кожи.
Аллергические реакции: редко — гиперчувствительность (включая реакции немедленного типа) ангионевротический отек, крапивница, зуд; частота неизвестна — сыпь.
Со стороны костно-мышечной системы: редко — артралгия, боль в спине**; частота неизвестна — отечность в области суставов.
Со стороны почек и мочевыделительной системы: редко — дизурия, задержка мочи (чаще у мужчин с наличием предрасполагающих факторов), инфекция мочевыводящих путей.
* Данные побочные реакции не были выявлены в ходе клинических исследований препарата. С вероятностью 95% частота этих побочных реакций не превышает категорию «нечасто».
**Нежелательный эффект, относящейся к препарату Спиолто® Респимат®, а не к его компонентам.
Многие из перечисленных нежелательных эффектов относятся к антихолинергическим свойствам тиотропия бромида или к бета-адреномиметическим свойствам олодатерола. Поэтому следует принимать во внимание возможность возникновения нежелательных эффектов, характерных для всего класса бета-адреномиметиков, таких как: аритмия, ишемия миокарда, стенокардия, артериальная гипотензия, тремор, головная боль, нервозность, тошнота, мышечные спазмы, усталость, недомогание, гипокалиемия, гипергликемия и метаболический ацидоз.
Противопоказания к применению
- повышенная чувствительность к олодатеролу, тиотропию бромиду или к любому компоненту препарата;
- повышенная чувствительность к атропину или его производным, в т.ч. к ипратропию и окситропию;
- не рекомендуется к применению у детей до 18 лет (ввиду отсутствия данных по эффективности и безопасности).
С осторожностью следует применять препарат у пациентов с закрытоугольной глаукомой, гиперплазией предстательной железы и обструкцией шейки мочевого пузыря; у пациентов с сердечно-сосудистыми заболеваниями, в т.ч. коронарной недостаточностью, нарушениями сердечного ритма, удлинением интервала QT, гипертрофической обструктивной кардиомиопатией, артериальной гипертензией, тиреотоксикозом, судорогами; у пациентов в анамнезе которых отмечались такие заболевания как инфаркт миокарда или госпитализация по поводу сердечной недостаточности (в течение предшествующего года), жизнеугрожающая аритмия, пароксизмальная тахикардия с ЧСС >100 уд./мин; у пациентов с необычными реакциями на симпатомиметические амины.
Применение при беременности и кормлении грудью
Клинических данных о влиянии олодатерола/тиотропия бромида на беременность нет. В доклинических исследованиях при использовании высоких доз олодатерола, в несколько раз превышавших терапевтические дозы, установлены влияния типичные для бета2-адреномиметиков. Следует учитывать ингибирующее влияние олодатерола на сократительную способность матки. Препарат Спиолто® Респимат® не следует применять у беременных женщин, если только потенциальная польза для матери не превышает потенциальный риск для плода.
Клинических данных о применении олодатерола/тиотропия бромида у женщин, кормящих грудью, нет. Препарат Спиолто® Респимат® не следует применять у кормящих грудью женщин, если только потенциальная польза для матери не превышает потенциальный риск для ребенка. На период применения препарата необходимо прекратить грудное вскармливание.
Применение при нарушениях функции печени
Пациентам с печеночной недостаточностью легкой и средней степени тяжести можно использовать Спиолто Респимат в рекомендуемой дозе.
Данных о применении олодатерола у пациентов с печеночной недостаточностью тяжелой степени тяжести не имеется.
Применение при нарушениях функции почек
Пациентам с нарушениями функции почек можно использовать препарат Спиолто Респимат в рекомендуемой дозе.
Пациенты с почечной недостаточностью средней и тяжелой степени тяжести, применяющие препарат Спиолто Респимат, должны находиться под тщательным наблюдением врача.
Применение у детей
Противопоказано применение препарата детям и подросткам в возрасте до 18 лет (ввиду отсутствия данных по эффективности и безопасности).
Применение у пожилых пациентов
У пожилых пациентов можно использовать препарат Спиолто Респимат в рекомендуемой дозе.
Особые указания
Препарат Спиолто® Респимат® не следует использовать при бронхиальной астме. Эффективность и безопасность препарата Спиолто® Респимат® при бронхиальной астме не изучались.
Острый бронхоспазм
Препарат Спиолто® Респимат® не показан для лечения острых эпизодов бронхоспазма, т.е. в качестве средства скорой помощи.
Гиперчувствительность
После применения препарата Спиолто® Респимат® возможно развитие реакций гиперчувствительности немедленного типа.
Парадоксальный бронхоспазм
Применение препарата Спиолто® Респимат®, как и других ингаляционных лекарственных средств, может привести к парадоксальному бронхоспазму, иногда угрожающему жизни. В случае развития парадоксального бронхоспазма применение препарата Спиолто® Респимат® должно быть немедленно прекращено и назначена альтернативная терапия.
Пациенты с нарушениями функции почек
Т.к. тиотропия бромид выводится преимущественно почками, пациенты с почечной недостаточностью средней и тяжелой степени тяжести (КК <50 мл/мин), применяющие препарат Спиолто® Респимат®, должны находиться под тщательным наблюдением врача.
Нарушения со стороны органа зрения
Пациенты должны быть ознакомлены о правильном применении препарата Спиолто® Респимат®. Не следует допускать попадания раствора или аэрозоля в глаза. Боль или дискомфорт в глазах, нечеткое зрение, зрительные ореолы вокруг источников света в сочетании с покраснением глаз, вызванным отеком конъюнктивы и роговицы могут быть симптомами острой закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Глазные капли, обладающие миотическим действием, не считаются эффективным лечением.
Сердечно-сосудистые эффекты
Олодатерол, как и другие бета2-адреномиметики, может оказывать клинически существенное влияние на сердечно-сосудистую систему у некоторых пациентов (учащение пульса, повышение АД и/или появление соответствующих симптомов). В случае возникновения таких симптомов может потребоваться прекращение лечения. Кроме того, сообщалось, что бета2-адреномиметики приводили к таким изменениям ЭКГ, как уплощение зубца Т и депрессия сегмента ST, хотя клиническое значение этих изменений неизвестно.
Гипокалиемия
Бета2-адреномиметики у некоторых пациентов могут приводить к развитию гипокалиемии, создающей предпосылки для возникновения нежелательных влиянии на сердечно-сосудистую систему. Снижение концентрации калия в сыворотке крови обычно кратковременно и не требует его восполнения. У пациентов с тяжелой ХОБЛ гипокалиемия может усиливаться из-за гипоксии и сопутствующего лечения и увеличивать риск развития аритмий.
Гипергликемия
Ингаляционное применение больших доз бета2-адреномиметиков может привести к увеличению концентрации глюкозы в плазме крови.
Спиолто® Респимат® не следует применять в комбинации с каким-либо другим лекарственным препаратом, содержащим бета2-адреномиметики длительного действия.
Пациентов, часто применяющих ингаляционные бета2-адреномиметики короткого действия (например, 4 раза/сут), необходимо проинструктировать о том, что эти препараты используются только для облегчения острых симптомов бронхоспазма.
Спиолто® Респимат® предназначен для поддерживающего лечения больных ХОБЛ. В связи с тем обстоятельством, что в общей популяции ХОБЛ существенно преобладают больные в возрасте старше 40 лет, при назначении препарата пациентам моложе 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Влияние препарата на способность управлять транспортными средствами и механизмами
Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деятельности, т.к. возможно развитие головокружения или нечеткости зрения.
Передозировка
Симптомы: передозировка олодатерола может привести к выраженным эффектам, типичным для бета2-адреномиметиков, например, к ишемии миокарда, повышению или снижению АД, тахикардии, аритмиям, ощущению сердцебиения, головокружению, нервозности, бессоннице, беспокойству, головной боли, тремору, сухости во рту, спазму мышц, тошноте, усталости, недомоганию, гипокалиемии, гипергликемии и метаболическому ацидозу.
При применении высоких доз тиотропия бромида возможны проявления м-холиноблокирующего действия. После 14-дневного ингаляционного применения тиотропия бромида в дозах, достигавших 40 мкг, у здоровых лиц не наблюдалось значимых неблагоприятных явлений, кроме чувства сухости слизистых оболочек носа и ротоглотки, частота которых зависела от величины дозы (10-40 мкг/сут). Исключение составляло отчетливое снижение саливации, начиная с 7 дня применения препарата.
Лечение: прием препарата Спиолто® Респимат® следует прекратить. Показано поддерживающее и симптоматическое лечение. В тяжелых случаях необходима госпитализация. Может рекомендоваться применение бета1-адреноблокаторов, но только при соблюдении особой осторожности, т.к. использование этих препаратов может вызвать бронхоспазм.
Лекарственное взаимодействие
Хотя специальных исследований лекарственного взаимодействия не проводилось, тиотропия бромид применяли совместно с другими препаратами, для лечения ХОБЛ, включая метилксантины, стероиды для приема внутрь и ингаляционного применения, при этом клинических признаков лекарственного взаимодействия не отмечалось.
Длительное совместное применение тиотропия бромида с другими м-холиноблокирующими препаратами не изучалось. Поэтому долгосрочное совместное применение препарата Спиолто® Респимат® с другими м-холиноблокирующими препаратами не рекомендуется.
Одновременное применение других адренергических препаратов может усиливать нежелательные эффекты препарата Спиолто® Респимат®.
Одновременное применение ксантиновых производных, стероидов или диуретиков (не относящихся к группе калийсберегающих) может усиливать гипокалиемический эффект адреномиметиков.
Бета-адреноблокаторы могут ослаблять эффект олодатерола или противодействовать этому эффекту. В этом случае предпочтительно применение бета1-адреноблокаторов, хотя и их следует применять с осторожностью.
Ингибиторы МАО, трициклические антидепрессанты или другие препараты, способные удлинять интервал QTc, могут усиливать действие препарата Спиолто® Респимат® на сердечно-сосудистую систему.
Совместное применение олодатерола с кетоконазолом приводило к увеличению системного воздействия олодатерола в 1.7 раза. Однако это не влияло на безопасность. Изменения дозы не требуется.
Условия хранения препарата Спиолто® Респимат®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С. Не замораживать.
Срок годности препарата Спиолто® Респимат®
Срок годности — 3 года. Использовать в течение 3 мес после первой ингаляции.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЕШНЛ ГМБХ
(Германия)
|
|
ООО «Берингер Ингельхайм» |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
МНН: Метформина гидрохлорид, Ситаглиптина фосфата моногидрата (эквивалентно ситаглиптину)
Производитель: Аджанта Фарма Лимитед
Анатомо-терапевтическо-химическая классификация: Метформин в комбинации с ситаглиптином
Номер регистрации в РК:
№ РК-ЛС-5№025857
Информация о регистрации в РК:
30.05.2022 — 30.05.2027
- Скачать инструкцию медикамента
Торговое наименование
СИТАПРИЛ
М 50/500
Международное непатентованное название
Нет
Лекарственная
форма, дозировка
Таблетки,
покрытые пленочной оболочкой, 50
мг/500 мг
Фармакотерапевтическая группа
Пищеварительный
тракт и обмен веществ. Лекарственные препараты, применяемые при
диабете. Препараты, снижающие уровень глюкозы в крови, исключая
инсулины. Комбинация пероральных препаратов для снижения уровня
глюкозы в крови. Метформин и ситаглиптин.
Код
АТХ А10ВD07
Показания к применению
Для
лечения
сахарного диабета 2 типа:
-
В
дополнение к диете и режиму физических нагрузок для улучшения
контроля уровня
гликемии у пациентов с недостаточной эффективностью монотерапии
метформином в максимально переносимой дозе, а также у пациентов,
которые ранее получали лечение комбинацией ситаглиптина и
метформина. -
В
комбинации с производными сульфонилмочевины (комбинация трех
препаратов) как дополнение к диете и режиму физических нагрузок у
пациентов, которые не достигли адекватного контроля гликемии при
лечении препаратами производными сульфонилмочевины и метформином в
максимально переносимых дозах. -
В
комбинации с агонистами гамма-рецепторов, активируемыми
пролифератором пероксисом (PPAR-γ) (например,
тиазолидиндионом) (комбинация
трех препаратов) как дополнение к диете и режиму физических нагрузок
у пациентов с недостаточной эффективностью терапии метформином и
агонистом PPAR-γ в максимально переносимых дозах. -
В
комбинации с инсулином (комбинация трех препаратов) как дополнение к
диете и режиму
физических нагрузок для улучшения контроля уровня гликемии у
пациентов с недостаточной эффективностью терапии инсулином и
метформином.
Перечень
сведений, необходимых до начала применения
Противопоказания
-
гиперчувствительность
к действующим веществам или любому из вспомогательных веществ -
любой
тип острого метаболического ацидоза (например, лактоацидоз,
диабетический кетоацидоз -
диабетическая
прекома -
тяжелая
почечная недостаточность (СКФ
<30 мл/мин) -
острые
состояния, влияющие на функцию почек (дегидратация, тяжелая
инфекция, шок, внутрисосудистое введение йодсодержащих контрастных
веществ) -
острые
и хронические заболевания, которые могут приводить к тканевой
гипоксии (сердечная или дыхательная недостаточность, недавно
перенесенный инфаркт миокарда, шок) -
печеночная
недостаточность -
острая
алкогольная интоксикация, алкоголизм -
беременность
и период лактации -
детский
и подростковый возраст до 18 лет (ввиду отсутствия клинических
данных)
Необходимые
меры предосторожности при применении
Общие
указания
СИТАПРИЛ
М 50/500 не
следует применять пациентам с сахарным диабетом 1 типа, а также для
лечения диабетического кетоацидоза.
Острый
панкреатит
Применение
ингибиторов дипептидилпептидазы-4 (ДПП-4) ассоциировано с риском
развития острого панкреатита. Пациентам следует сообщать о
характерных симптомах острого панкреатита: персистирующая,
интенсивная абдоминальная боль. Разрешение панкреатита наблюдалось
после отмены ситаглиптина (с/без проведения поддерживающего лечения),
очень редко сообщалось о случаях некротизирующего или
геморрагического панкреатита и/или смерти. При подозрении на
панкреатит, препарат СИТАПРИЛ
М 50/500 и
другие потенциально опасные препараты следует отменить; если
подтвержден острый панкреатит, не следует возобновлять применение
препарата СИТАПРИЛ М 50/500. Следует с осторожностью применять
препарат у пациентов с панкреатитом в анамнезе.
Лактацидоз
Лактацидоз
является очень редким, но серьезным метаболическим осложнением,
возникающим вследствие кумуляции метформина. Чаще всего о развитии
лактацидоза сообщалось в случаях выраженной почечной недостаточности,
кардиореспираторных заболеваниях или сепсисе. При резком ухудшении
функции почек происходит накопление метформина и увеличивается риск
развития лактоацидоза.
В
случае дегидратации (тяжелая рвота, диарея, лихорадка или уменьшение
потребления жидкости) следует временно прекратить прием метформина и
рекомендуется обратиться к врачу.
Лекарственные
препараты, которые могут резко ухудшить функцию почек (такие как
гипотензивные препараты, диуретики и НПВП), следует назначать с
осторожностью пациентам, принимающим метформин. Другими факторами
риска развития лактацидоза являются чрезмерное потребление алкоголя,
нарушение функции печени, недостаточно контролируемый диабет, кетоз,
длительное голодание, любые состояния, связанные с гипоксией, а также
одновременный прием лекарственных препаратов, которые могут приводить
к развитию лактацидоза.
Пациенты
и/или лица, осуществляющие уход, должны быть проинформированы о риске
развития лактацидоза. Лактацидоз характеризуется ацидозным диспноэ,
болью в животе, мышечными спазмами, астенией, гипотермией с
последующей комой. В случае появления подозреваемых симптомов пациент
должен прекратить прием метформина и немедленно обратиться за
медицинской помощью. Диагностические лабораторные показатели включают
снижение pH крови (< 7,35), повышение уровня лактата в плазме
крови (> 5 ммоль/л) и повышение анионного интервала и соотношения
лактат/пируват.
Функция
почек
Скорость
клубочковой фильтрации (СКФ)
следует определять до начала лечения и регулярно в дальнейшем.
Препарат СИТАПРИЛ М 50/500 противопоказан пациентам с СКФ < 30
мл/мин и должен быть временно отменен при состояниях, которые
потенциально могут повлиять на функцию почек.
Гипогликемия
У
пациентов, получающих СИТАПРИЛ
М 50/500 в
комбинации с сульфонилмочевиной или инсулином, существует риск
возникновения гипогликемии. Поэтому может понадобиться снижение дозы
сульфонилмочевины или инсулина.
Введение йодсодержащих
контрастных препаратов
Внутрисосудистое введение
йодсодержащих контрастных веществ может приводить к
контраст-индуцированной нефропатии, сопровождающейся накоплением
метформина и повышением риска развития лактацидоза. Прием препарата
СИТАПРИЛ М 50/500 следует прекратить до или во время процедуры
визуализации, и возобновлять не ранее, чем через 48 часов, при
условии, что функция почек была повторно оценена и признана
стабильной.
Реакции
гиперчувствительности
В
пострегистрационном периоде были получены сообщения о серьезных
реакциях гиперчувствительности у пациентов, принимавших ситаглиптин.
Реакции гиперчувствительности, такие как анафилаксия,
ангионевротический отек и эксфолиативные заболевания кожи, включая
синдром Стивенса-Джонсона, возникали в течение первых 3 месяцев после
начала лечения ситаглиптином, а в некоторых случаях – после
приема первой дозы. При подозрении на реакцию гиперчувствительности
СИТАПРИЛ
М 50/500 следует
немедленно отменить, оценить другие возможные причины их
возникновения и назначить альтернативное лечение диабета.
Изменение
клинического статуса пациентов с ранее контролируемым сахарным
диабетом 2 типа
При
появлении лабораторных отклонений или клинических проявлений
(особенно неясных и стертых клинических симптомов), у пациентов с
сахарным диабетом 2 типа необходимо провести срочное обследование на
предмет кетоацидоза и лактацидоза. Обследование должно включать
определение электролитов и кетонов в сыворотке крови, глюкозы крови,
рН крови, лактата, пирувата и уровня метформина. При ацидозе любой
формы применение препарата СИТАПРИЛ
М 50/500 следует
немедленно прекратить и провести соответствующую симптоматическую
терапию.
Буллезный
пемфигоид
В
пострегистрационном периоде были получены сообщения о буллезном
пемфигоиде у пациентов, принимавших ингибиторы дипептидилпептидазы-4
(ДПП-4), включая ситаглиптин. При подозрении на буллезный пемфигоид,
следует прекратить применение препарата СИТАПРИЛ
М 50/500 и
направить пациента к дерматологу для диагностики и получения
соответствующего лечения.
Хирургические
вмешательства
Применение
препарата СИТАПРИЛ
М 50/500
следует прекратить на время хирургического вмешательства, которое
проводится под общей, спинальной или эпидуральной анестезией. Терапию
можно возобновить не раньше, чем через 48 часов после проведения
хирургического вмешательства или возобновления перорального питания,
при условии, что функция почек является стабильной.
Взаимодействия
с другими лекарственными препаратами
Одновременное
применение нескольких доз ситаглиптина (50 мг два раза в сутки) и
метформина (1000 мг два раза в сутки) не оказывало существенного
влияния на фармакокинетику ситаглиптина или метформина у пациентов с
диабетом 2 типа.
Исследования
фармакокинетических взаимодействий других препаратов с препаратом
СИТАПРИЛ М 50/500 не проводились; однако такие исследования были
проведены отдельно для каждого из действующих веществ, входящих в
состав препарата СИТАПРИЛ М 50/500 (ситаглиптина и метформина).
Одновременное
применение не рекомендовано
Алкоголь
Следует
исключить употребление алкоголя и лекарственных препаратов,
содержащих спирт, вследствие высокого риска развития лактацидоза
(особенно в случае голодания, недостаточного питания или нарушения
функции печени).
Йодсодержащие
контрастные вещества
Внутрисосудистое
введение йодсодержащих контрастных веществ при радиологических
обследованиях может приводить к развитию почечной недостаточности и,
следовательно, к кумуляции метформина и риску развития лактацидоза.
СИТАПРИЛ
М 50/500 следует
отменить перед или во время обследования и возобновлять прием только
через 48 часов после
повторной
оценки функции почек и признания ее стабильной.
Комбинации,
которые следует применять c
осторожностью
Некоторые
лекарственные средства могут отрицательно влиять на функцию почек,
что может повышать риск развития лактацидоза (например, НПВП, включая
селективные ингибиторы циклооксигеназы 2 (ЦОГ-2), ингибиторы АКФ,
антагонисты рецепторов ангиотензина II и диуретики, особенно петлевые
диуретики). В начале и в ходе применения таких препаратов
одновременно с метформином следует тщательно контролировать функцию
почек.
Одновременное
применение лекарственных средств, влияющих на общие транспортные
системы почечных канальцев,
участвующих в элиминации метформина через почки (например, ингибиторы
органических
катионных переносчиков-2 [ОСТ2]/белок
множественной резистентности и выведения токсинов
[MATE], таких как ранолазин, вандетаниб, долутегравир и циметидин),
может увеличить системное воздействие метформина и риск возникновения
лактацидоза.
При
совместном применении
таких препаратов следует проводить тщательный мониторинг
гликемического контроля, корректировать дозу в пределах рекомендуемой
дозировки и изменить лечение при диабете.
Глюкокортикостероиды
для системного и местного применения, β-2-агонисты и диуретики
обладают
гипергликемической активностью. Следует информировать об этом
пациентов и тщательней контролировать уровень глюкозы крови, особенно
в начале лечения такими препаратами. Дозу препарата СИТАПРИЛ
М 50/500 следует
корректировать в ходе лечения перечисленными препаратами
и
при их отмене.
Ингибиторы
АКФ
могут снижать уровень глюкозы в крови. При необходимости, дозу
препарата СИТАПРИЛ
М 50/500 следует
корректировать при лечении ингибиторами АКФ и при их отмене.
Влияние
других препаратов на ситаглиптин
Данные
in
vitro и
клинические данные, представленные ниже, указывают на низкий риск
возникновения клинически значимых взаимодействий при одновременном
применении с другими препаратами.
Исследования
in
vitro
показали, что основным ферментом, отвечающим за ограниченный
метаболизм ситаглиптина, является CYP3A4, с участием CYP2C8. У
пациентов с нормальной функцией почек метаболизм, включая посредством
CYP3A4, играет незначительную роль в клиренсе ситаглиптина.
Метаболизм может играть более существенную роль в выведении
ситаглиптина при тяжелой почечной недостаточности или терминальной
стадии заболевания почек (ТПН). По этой причине не исключено, что
мощные ингибиторы CYP3A4 (например, кетоконазол, итраконазол,
ритонавир, кларитромицин) могут влиять на фармакокинетику
ситаглиптина у пациентов с тяжелой почечной недостаточностью или ТПН.
Эффекты мощных ингибиторов CYP3A4 при почечной недостаточности в
клинических исследованиях не изучались.
Исследования
транспорта in
vitro показали,
что ситаглиптин является субстратом р-гликопротеина и переносчика
органических анионов-3 (ОАП-3). ОАП-3 опосредованный транспорт
ситаглиптина ингибировался пробенецидом
in vitro,
хотя риск возникновения клинически значимых взаимодействий считается
низким. Одновременное применение ингибиторов ОАП-3 in
vivo
не изучалось.
Циклоспорин
Проводилось
исследование для оценки влияния циклоспорина, мощного ингибитора
р-гликопротеина, на фармакокинетику ситаглиптина. Одновременное
пероральное применение ситаглиптина в разовой дозе 100 мг и
циклоспорина в разовой дозе 600 мг увеличивало AUC и Cmax
ситаглиптина приблизительно на 29 и 68 % соответственно. Эти
изменения в фармакокинетике ситаглиптина не считались как клинически
значимые. Почечный клиренс ситаглиптина существенно не изменился.
Следовательно, значимые взаимодействия с другими ингибиторами
р-гликопротеина не ожидаются.
Влияние
ситаглиптина на другие препараты
Дигоксин
Ситаглиптин
незначительно влияет на концентрацию дигоксина в плазме крови. После
применения 0,25 мг дигоксина одновременно с 100 мг ситаглиптина
ежедневно на протяжении 10 дней значения AUC дигоксина в плазме крови
повышались, в среднем, на 11 %, а Cmax в плазме крови – в
среднем на 18 %. Коррекция дозы дигоксина не требуется. Однако при
одновременном применении ситаглиптина и дигоксина следует наблюдать
пациентов относительно токсичности дигоксина.
Данные
in
vitro
позволяют предположить, что ситаглиптин не ингибирует и не индуцирует
изоферменты CYP450. В клинических исследованиях ситаглиптин не
оказывал значительного влияния на фармакокинетику метформина,
глибурида, симвастатина, розиглитазона, варфарина или пероральных
контрацептивов, что in
vivo
свидетельствует о низкой склонности к взаимодействиям с субстратами
CYP3A4, CYP2C8, CYP2C9 и переносчиком органических катионов.
Ситаглиптин может быть слабым ингибитором р-гликопротеина in
vivo.
Специальные
предупреждения
Применение
в педиатрии
СИТАПРИЛ
М 50/500 не
рекомендуется применять детям и подросткам в возрасте до 18 лет по
причине отсутствия данных о безопасности и эффективности применения в
этой популяции.
Во
время беременности или лактации
СИТАПРИЛ
М 50/500 не
следует применять в период беременности. Если пациентка планирует
беременность или забеременела после начала лечения, то препарат
СИТАПРИЛ
М 50/500 следует
отменить и назначить инсулин как можно раньше.
Учитывая,
что метформин выделяется с грудным молоком в небольших количествах, а
данных о ситаглиптине недостаточно, СИТАПРИЛ
М 50/500 не
рекомендовано применять в период грудного вскармливания.
Натрий
СИТАПРИЛ
М 50/500 содержит натрий. Препарат содержит менее 1 ммоль (23 мг)
натрия в разовой дозе, т.е. практически не содержит натрия.
Особенности
влияния препарата на способность управлять транспортным средством или
потенциально опасными механизмами
Препарат
СИТАПРИЛ
М 50/500 не
оказывает влияния на способность управлять автотранспортом и сложными
механизмами. Однако следует принимать во внимание головокружение и
сонливость, возможные при применении ситаглиптина. Следует
предупредить пациентов о риске возникновения гипогликемии, если
препарат СИТАПРИЛ
М 50/500 применяется
в комбинации с производными сульфонилмочевины или с инсулином.
Рекомендации
по применению
Режим
дозирования
Дозу
препарата СИТАПРИЛ
М 50/500 следует
подбирать индивидуально с учетом текущей схемы лечения, эффективности
и переносимости у пациента, не превышая максимально рекомендованную
суточную дозу ситаглиптина — 100 мг.
Взрослые
пациенты с нормальной функцией почек (скорость клубочковой фильтрации
(CКФ)
≥90 мл/мин)
Для
пациентов, у которых не достигнут адекватный контроль гликемии при
монотерапии метформином в максимальной переносимой дозе
Начальная
рекомендованная доза препарата СИТАПРИЛ
М 50/500 для пациентов, у которых не достигнут адекватный контроль
гликемии при монотерапии метформином, должна
включать дозу ситаглиптина 50 мг 2 раза в сутки (общая суточная доза
100 мг) и текущую дозу метформина.
Для
пациентов, переходящих с комбинированного лечения ситаглиптином и
метформином
в
виде монопрепаратов
Пациентам,
переходящим с одновременного приема ситаглиптина и метформина,
начальная доза препарата СИТАПРИЛ
М 50/500 должна
быть эквивалентной применявшимся дозам ситаглиптина и метформина.
Для
пациентов, у которых не достигнут адекватный контроль гликемии при
применении комбинированной терапии метформином в максимально
переносимой дозе и сульфонилмочевины
Доза
препарата СИТАПРИЛ
М 50/500 должна
включать дозу ситаглиптина 50 мг 2 раза в сутки (общая суточная доза
100 мг) и текущую дозу метформина. Если СИТАПРИЛ
М 50/500 применяют
в комбинации с сульфонилмочевиной, целесообразно снизить текущую дозу
сульфонилмочевины для снижения риска возникновения гипогликемии.
Для
пациентов, у которых не достигнут адекватный контроль гликемии
при
применении комбинированной терапии метформином в максимально
переносимой дозе и агонистом PPARγ
Доза
препарата СИТАПРИЛ
М 50/500 должна
включать дозу ситаглиптина 50 мг 2 раза в сутки (общая суточная доза
100 мг) и текущую дозу метформина.
Для
пациентов, у которых не достигнут адекватный контроль гликемии
при
применении комбинированной терапии двумя препаратами –
инсулином и метформином в максимально переносимой дозе
Доза
препарата СИТАПРИЛ
М 50/500 должна
включать дозу ситаглиптина 50 мг 2 раза в сутки (общая суточная доза
100 мг) и текущую дозу метформина. При применении препарата СИТАПРИЛ
М 50/500 в
комбинации с инсулином может понадобиться снизить дозу инсулина для
предотвращения риска гипогликемии.
Для
удобства дозирования препарат СИТАПРИЛ
М выпускается
в двух дозировках 50 мг ситаглиптина плюс 500 или 1000 мг
метформина гидрохлорида.
Все
пациенты должны придерживаться диеты с адекватным распределением
приема углеводов в течение дня. Пациенты с избыточной массой тела
должны придерживаться низкокалорийной диеты.
Особые
группы пациентов
Пациенты
с почечной недостаточностью
Коррекция
дозы у пациентов с легкой почечной недостаточностью (СКФ ≥ 60
мл/мин) не требуется. СКФ должна оцениваться до начала лечения
метформин содержащими препаратами и минимум один раз в год в
дальнейшем. У пациентов с повышенным риском дальнейшего
прогрессирования почечной недостаточности и у пожилых пациентов
функцию почек следует оценивать чаще, например, один раз в 3-6
месяцев.
Максимальную
суточную дозу метформина предпочтительнее делить на 2-3 приема. До
рассмотрения начала курса лечения метформином у пациентов с СКФ<60
мл/мин. следует провести анализ факторов, способствующих повышению
риска развития лактацидоза (см. Особые указания).
В
случае отсутствия подходящих дозировок препарата СИТАПРИЛ
М,
необходимо применять отдельные монокомпоненты вместо комбинированного
препарата с фиксированной дозировкой.
СИТАПРИЛ
М 50/500 противопоказан
пациентам с СКФ <30 мл/мин.
СИТАПРИЛ
М 50/500 не
рекомендуется пациентам с СКФ ≥ 30 мл/мин и <45 мл/мин , потому
что эти пациенты нуждаются в более низкой дозировке ситаглиптина, чем
в препарате СИТАПРИЛ
М 50/500 с
фиксированной комбинацией.
|
СКФ |
Метформин |
Ситаглиптин |
|
60-89 |
Максимальная
При |
Максимальная |
|
45-59 |
Максимальная
Начальная |
Максимальная |
|
30-44 |
Максимальная
Начальная |
Максимальная |
|
< |
Метформин |
Максимальная |
Пациенты
с печеночной недостаточностью
СИТАПРИЛ
М 50/500 не
рекомендован пациентам с печеночной недостаточностью.
Пациенты
пожилого возраста
Поскольку
метформин и ситаглиптин выводятся через почки, пожилым пациентам
препарат следует применять с осторожностью. Для предупреждения
лактацидоза, вызываемого метформином, необходимо проводить мониторинг
функции почек, особенно у пожилых пациентов.
Дети
СИТАПРИЛ
М 50/500 не следует применять у
детей и подростков в возрасте младше 18 лет
в
связи с недостаточностью данных по безопасности и эффективности
препарата.
Способ
применения
Для
приема внутрь.
СИТАПРИЛ
М 50/500 следует
применять 2 раза в сутки во время приема пищи, с целью снижения риска
возникновения побочных реакций со стороны пищеварительной системы,
связанных с метформином.
Меры,
которые необходимо принять в случае передозировки
Если
пациент принял дозу препарата больше, чем было предписано, следует
немедленно сообщить врачу. Если появились такие симптомы лактацидоза,
как чувство холода или дискомфорта, сильная тошнота или рвота, боль в
животе, необъяснимая потеря веса, мышечные спазмы или учащенное
дыхание, следует немедленно обратиться в поликлинику.
В
ходе контролируемых клинических исследований с участием здоровых
добровольцев, ситаглиптин вводили в разовой дозе до 800 мг.
Минимальное
увеличение интервала QTc, не считающееся клинически значимым,
наблюдалось в одном исследовании при приеме ситаглиптина в дозе 800
мг. В клинических исследованиях отсутствует опыт применения доз выше
800 мг. В исследованиях I фазы с применением многократных доз не
наблюдалось дозозависимых клинических побочных реакций при применении
ситаглиптина в дозах до 600 мг/сут в течение периода до 10 дней и 400
мг/сут в течение периода до 28 дней.
Большая
передозировка метформина (или сопутствующие риски развития
лактацидоза) может привести к развитию лактацидоза, что является
неотложным состоянием и требует госпитализации. Наиболее эффективным
методом выведения из организма лактата и метформина является
гемодиализ.
В
клинических исследованиях приблизительно 13.5% дозы выводилось на
протяжении 3-4 часового сеанса гемодиализа. В случае клинической
необходимости назначают пролонгированный диализ. Неизвестно,
выводится ли ситаглиптин из организма при проведении перитонеального
диализа.
В
случае передозировки следует применять стандартные поддерживающие
меры, например, удаление неабсорбированного препарата из
желудочно-кишечного тракта, проведение клинического мониторинга
(включая ЭКГ), а также назначение поддерживающей терапии, при
необходимости.
Рекомендации
по обращению за консультацией к медицинскому работнику для
разъяснения способа применения лекарственного препарата
При
возникновении дополнительных вопросов по применению данного
лекарственного препарата следует обратиться за консультацией к врачу
или фармацевту.
Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае
Как
и все лекарственные средства, этот препарат может вызывать побочные
эффекты, хотя это происходит не у всех пациентов. Необходимо
прекратить прием препарата СИТАПРИЛ
М 50/500 и
немедленно сообщить врачу, если имеются один из следующих серьезных
побочных эффектов:
сильная
и постоянная боль в животе (область желудка), которая может доходить
до спины, с тошнотой и рвотой или без, поскольку это может быть
признаком острого воспаления поджелудочной железы (панкреатит).
СИТАПРИЛ
М 50/500 может
вызвать очень
редкий,
но очень серьезный побочный эффект, называемый лактацидозом
(см.раздел “Специальные
предупреждения”).
В таких случаях, пациент должен немедленно
прекратить
прием
препарата СИТАПРИЛ
М 50/500
и
обратиться к своему врачу или пойти в ближайшую поликлинику,
так как лактацидоз может повлечь за собой кому.
Если
появилась серьезная аллергическая реакция, включая сыпь, крапивницу,
волдыри на коже / шелушение кожи и отек лица, губ, языка и горла,
которые могут вызвать затруднение дыхания или глотания (частота
встречаемости в общей популяции не установлена), следует прекратить
прием этого препарата и сразу же позвонить своему врачу. Лечащий врач
может назначить лекарство от аллергии и другой препарат от диабета.
У
некоторых пациентов, принимающих метформин, были отмечены следующие
побочные эффекты, после того, как они начали принимать ситаглиптин:
Часто:
гипогликемия, тошнота, метеоризм, рвота
Нечасто:
боль в животе, диарея, запор, сонливость
У
некоторых пациентов наблюдались диарея, тошнота, метеоризм, запор,
боль в животе или рвота после того, как они начали принимать
комбинацию препаратов ситаглиптина и метформина (общая частота).
У
некоторых пациентов были отмечены следующие побочные эффекты при
приеме препарата СИТАПРИЛ
М 50/500 в
комбинации с глимепиридом:
Очень
часто:
гипогликемия
Часто:
запор
У
некоторых пациентов были отмечены следующие побочные эффекты при
приеме препарата СИТАПРИЛ
М 50/500 в
комбинации с пиоглитазоном:
Часто:
отечность рук или ног
У
некоторых пациентов были отмечены следующие побочные эффекты при
приеме препарата СИТАПРИЛ
М 50/500 в
комбинации с инсулином:
Очень
часто:
гипогликемия
Нечасто:
сухость во рту, головная боль
При
проведении клинических исследований ситаглиптина (одного из
компонентов препарата СИТАПРИЛ
М 50/500),
в пострегистрационный период применения препарата СИТАПРИЛ
М 50/500 или
только ситаглиптина или в комбинации с другими препаратами для
лечения диабета были отмечены следующие побочные эффекты:
Часто:
гипогликемия, головная боль, инфекция верхних дыхательных путей,
заложенность носа, слизисто-водянистые выделения из носа, боль в
горле, остеоартрит, боли в конечностях
Нечасто:
головокружение, запор, зуд
Редко:
тромбоцитопения
Частота
неизвестна:
нарушение функции почек (иногда требующие диализа), рвота, боль в
суставах, мышечная боль, боль в пояснице, интерстициальные
заболевания легких, буллёзный пемфигоид (в виде волдырей на коже)
У
некоторых пациентов были отмечены следующие побочные эффекты при
приеме метформина в виде монопрепарата
Очень
часто:
тошнота, рвота, диарея, боль в животе, снижение аппетита. Эти
симптомы могут появиться, когда пациент только начинает принимать
метформин, и обычно они сходят на нет
Часто:
металлический привкус во рту
Очень
редко:
снижение уровня витамина B12,
гепатит, крапивница, покраснение кожи (сыпь) или зуд
При
возникновении нежелательных лекарственных реакций обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов
РГП
на ПХВ «Национальный Центр экспертизы лекарственных средств и
медицинских изделий» Комитет
медицинского
и фармацевтического контроля Министерства
здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведения
Состав
лекарственного препарата
Одна
таблетка содержит
активные
вещества:
cитаглиптина
фосфата моногидрат 64.25 мг
(эквивалентно ситаглиптина 50.00 мг), метформина гидрохлорид
500.00 мг
вспомогательные вещества:
целлюлоза
микрокристаллическая, кальция гидрофосфат безводный, повидон
(Коллидон 30), натрия кроскармеллоза, натрия стеарилфумарат,
пленочная
оболочка:
Опадрай 03B84681 розовый: гипромеллоза, полиэтиленгликоль, титана
диоксид (Е 171), железа оксид желтый (Е 172), железа оксид красный (Е
172).
Описание
внешнего вида, запаха, вкуса
Таблетки
в форме капсулы, покрытые пленочной оболочкой светло-розового цвета,
с гравировкой «SM1» на одной стороне и гладкие с другой.
Форма выпуска и упаковка
По
10 таблеток помещают в контурную ячейковую упаковку из алюминиевой
фольги.
По
3 контурные
ячейковые
упаковки
вместе с инструкцией по медицинскому применению на
казахском и русском языках помещают в
картонную коробку.
Срок хранения
2
года.
Не
применять по истечении срока годности.
Условия хранения
при температуре не выше 30 ºС.
Хранить
в недоступном для детей месте!
Условия отпуска из аптек
По
рецепту
Сведения
о производителе
Аджанта
Фарма Лимитед
Аджанта
Хаус, Чаркоп, Кандивли (З),
Мумбай
400067, Индия
Телефон:
(0091) 22-
2868 3625
Факс:
(0091) 22-2868 3930/2868 2848
E—mail:
info@ajantapharma.com
Держатель
регистрационного удостоверения
Аджанта
Фарма Лимитед
Аджанта
Хаус, Чаркоп, Кандивли (З),
Мумбай
400067, Индия
Телефон:
(91-2431) 232123, 232009, 232077, 233393
E—mail:
info@ajantapharma.com
Наименование
и адрес организации на территории Республики Казахстан принимающей
претензии (предложения) по качеству лекарственных средств от
потребителей
Филиал
Аджанта Фарма Лимитед в
Республике
Казахстан,
050062,
г. Алматы, Микрорайон
3,
дом
43А, кабинеты №3, №4, №7, №8
E—mail:
info@ajantapharma.com
Наименование
и адрес организации на территории Республики Казахстан ответственной
за пострегистрационное наблюдение за безопасностью лекарственного
средства
ТОО
ConsultAsia
г.
Алматы,
ул.
Шевченко,
165 Б, офис 204-206
Тел.:
+77051708825/+77051708876
(24-х часовая доступность)
Факс:
+727-379-42-58
Е-mail:
pv@consultingasia.kz
info@consultingasia.kz
| СИТАПРИЛ_М_50_500_табл_ЛВ_28_04_2022.docx | 0.06 кб |
| СИТАПРИЛ_М_50_500___ЛВ_каз___28_04_2022.docx | 0.05 кб |