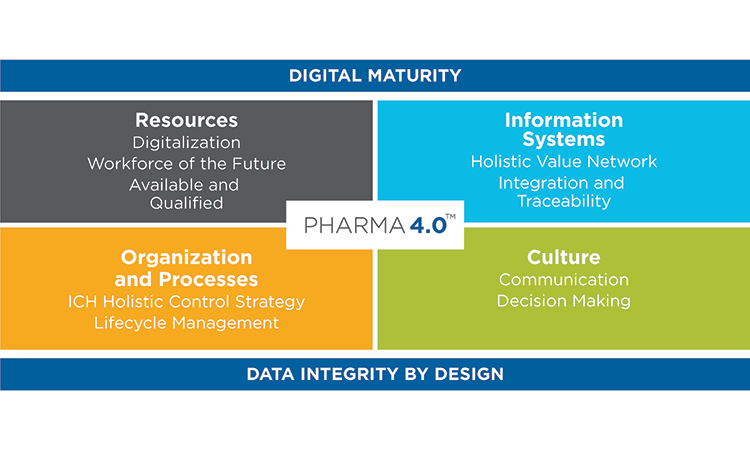
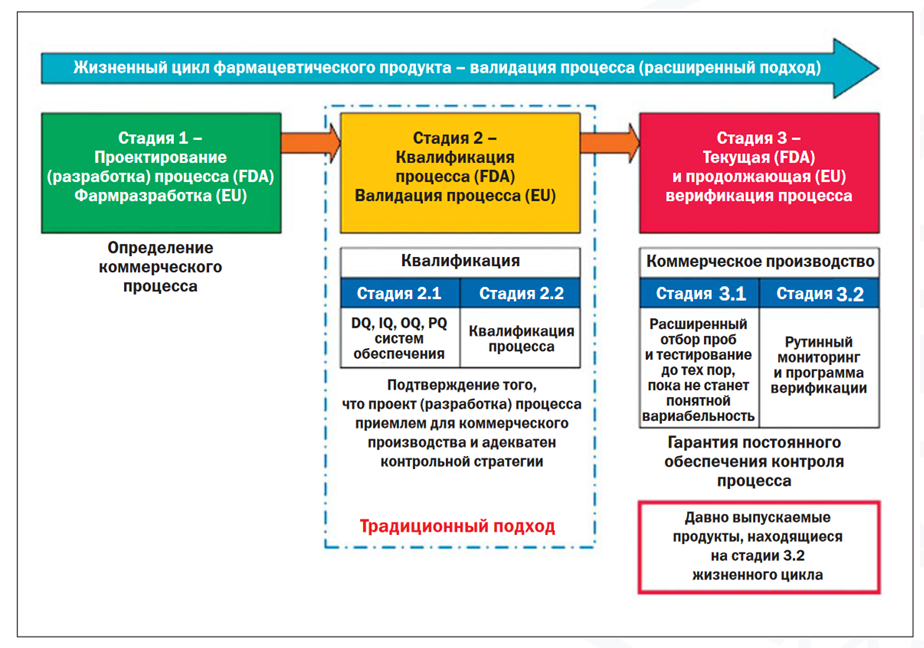
О Руководстве по валидации процесса производства лекарственных препаратов для медицинского применения
Коллегия Евразийской экономической комиссии в соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая 2014 года, пунктом 3 статьи 3 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года,
в целях гармонизации требований, предъявляемых к валидации процессов фармацевтического производства, установленных законодательством государств – членов Евразийского экономического союза, РЕКОМЕНДУЕТ
государствам – членам Евразийского экономического союза по истечении 6 месяцев с даты опубликования настоящей Рекомендации на официальном сайте Евразийского экономического союза при производстве лекарственных средств для медицинского применения, подготовке регистрационных досье лекарственных препаратов для их регистрации в соответствии с Правилами регистрации и экспертизы лекарственных средств для медицинского применения, утвержденными Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78, приведении регистрационного досье лекарственных препаратов в соответствие с указанными Правилами и инспектировании производственных площадок на соответствие Правилам надлежащей производственной практики Евразийского экономического союза, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 77, применять Руководство по валидации процесса производства лекарственных препаратов для медицинского применения согласно приложению.
Председатель Коллегии
Евразийской экономической комиссии
Т.Саркисян
Приложение
к Рекомендации Коллегии
Евразийской экономической комиссии
от 26 сентября 2017 г. N 19
РУКОВОДСТВО
ПО ВАЛИДАЦИИ ПРОЦЕССА ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
I. Введение
1. Настоящее Руководство является правилами по документальному оформлению результатов подтверждения того, что процесс производства, выполняемый в пределах установленных параметров, эффективно и воспроизводимо обеспечивает получение лекарственного препарата, соответствующего установленным спецификациям и показателям качества, для их представления в регистрационном досье лекарственного препарата.
2. Введением непрерывной верификации процесса определен альтернативный подход к валидации процесса на основе непрерывного мониторинга процесса производства. Этот подход основан на знании продукта и процесса, полученном при их разработке и (или) на опыте предыдущего производства. Непрерывная верификация процесса может применяться как при традиционном, таки при расширенном подходе к фармацевтической разработке. Для оценки процесса могут использоваться методы непрерывного мониторинга и (или) контроля. Предполагается, что совокупность положений, приведенных в руководствах по фармацевтической разработке, принимаемых Евразийской экономической комиссией, и в настоящем Руководстве, охватывает все критические стадии технологического процесса, подлежащие включению в регистрационное досье лекарственного препарата для медицинского применения, согласно приложению N 1 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78 (далее соответственно – регистрационное досье, Правила регистрации и экспертизы).
3. Валидация процессов не должна рассматриваться как разовое событие. Подход к валидации на основе жизненного цикла процесса включает в себя разработку продукта и процесса, валидацию производственного процесса промышленного масштаба и поддержание процесса в контролируемом состоянии в ходе рутинного промышленного производства.
II. Область применения
4. Настоящее Руководство определяет состав информации о валидации процесса, подлежащей представлению при регистрации лекарственного препарата химической природы для медицинского применения. Общие принципы, касающиеся валидации, применимы также к активным фармацевтическим субстанциям. Представлять информацию о валидации процесса производства нестерильных фармацевтических субстанций в регистрационном досье, как правило, не требуется. Требования к валидации производства активных фармацевтических субстанций более подробно изложены в руководстве Международного совета по гармонизации технических требований к регистрации лекарственных препаратов для медицинского применения «Разработка и производство фармацевтических субстанций (химических веществ и биотехнологических (биологических) соединений)» (ICHQ11).
Приведенные в настоящем Руководстве принципы применимы к биологическим лекарственным препаратам. В связи с присущей биологической субстанции сложности и изменчивости валидация процесса производства таких лекарственных препаратов должна быть рассмотрена в индивидуальном порядке.
5. Необходимая в соответствии с настоящим Руководством информация представляется в регистрационном досье на момент подачи заявления о регистрации лекарственного препарата в уполномоченный орган государства – члена Евразийского экономического союза в сфере обращения лекарственных средств (далее соответственно – уполномоченный орган, государство-член).
6. Валидация производственного процесса в соответствии с настоящим Руководством рассматривается как второй этап жизненного цикла процесса. Первый этап (разработка процесса) рассматривается в руководствах по фармацевтической разработке, третий этап (текущая верификация процесса) рассматривается в приложении N 15 к Правилам надлежащей производственной практики Евразийского экономического союза, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 77 (далее – Правила надлежащей производственной практики).
7. Для целей настоящего Руководства используются понятия, которые означают следующее:
«валидация процесса» (process validation) – документально оформленное подтверждение того, что процесс производства, выполняемый в пределах установленных параметров, эффективно и воспроизводимо обеспечивает получение лекарственного препарата, соответствующего заранее установленным спецификациям и показателям качества;
«жизненный цикл продукта» (product lifecycle) – все стадии жизни продукта от начальной разработки, пребывания в обороте и до прекращения существования продукта;
«исследование крайних вариантов (брекетинг)» (bracketing) – изложенный в плане валидации процесса научный и основанный на оценке рисков подход, обосновывающий возможность при валидации процесса испытывать только серии с крайними значениями некоторых факторов, например, с определенной дозировкой, размером серии и (или) вместимостью упаковки. Такой подход предполагает, что валидация каких-либо промежуточных значений факторов представлена валидацией крайних значений. Исследование крайних вариантов может быть применимо для ряда дозировок, подлежащих валидации, если такие дозировки совпадают или очень близки по составу, например, для таблеток, полученных с различным усилием прессования из аналогичного гранулята, или для ряда капсул с разной вместимостью, заполняемых одинаковым составом содержимого. Исследование крайних вариантов может применяться в отношении контейнеров с различной вместимостью или разным объемом наполнения одной и той же системы «контейнер-укупорка»;
«критический параметр процесса» (critical process parameter; СРР) – параметр процесса, изменчивость которого влияет на критические показатели качества и который, следовательно, подлежит мониторингу или контролю для обеспечения требуемого качества в результате осуществления процесса;
«критический показатель качества» (critical quality attribute; CQA) – физическое, химическое, биологическое или микробиологическое свойство или характеристика, которые для обеспечения необходимого качества продукта должны находиться в соответствующих пределах и диапазоне или иметь соответствующее распределение;
«метод «в потоке» (in-line) – метод измерения, при котором образец анализируется непосредственно в технологическом потоке и не отбирается из него;
«метод «вне потока» (on-line) – метод измерения, при котором образец отбирается из технологического потока с возможным возвращением в технологический поток;
«метод «у потока» (at-line) – метод измерения, при котором образец отбирается из технологического потока, изолируется от него и анализируется в непосредственной близости от потока;
«непрерывная верификация процесса» (сontinuous process verification) – альтернативный подход к валидации процесса, при котором производственный процесс постоянно контролируется и оценивается;
«проектное поле» (design space) – многомерная комбинация и взаимодействие входных переменных (например, показателей качества материалов) и параметров процесса, подтвердившие способность обеспечивать качество продукта. Работа в пределах проектного поля не рассматривается как изменение. Выход за пределы проектного поля считается изменением и обычно требует утверждения изменений после их согласования с уполномоченным органом. Проектное поле предлагается лицом, которое подает заявление на регистрацию лекарственного препарата, и подлежит оценке и утверждению уполномоченным органом;
«расширенный подход» (enhanced approach) – подход к разработке процесса на основе использования научных знаний, результатов исследований и оценки рисков для выявления и понимания характеристик материалов и параметров процесса, влияющих на критические показатели качества продукта;
«стратегия контроля» (control strategy) – планируемый комплекс элементов контроля, разработанный на основании существующего понимания продукта и процесса, который обеспечивает пригодность процесса и качество продукта. Элементы контроля могут включать в себя параметры и характеристики, связанные с активными фармацевтическими субстанциями и лекарственными препаратами, материалами и компонентами, условиями эксплуатации помещений и оборудования, внутрипроизводственным контролем, спецификациями на готовый продукт, методиками и периодичностью мониторинга и контроля;
«традиционный подход» (traditional approach) – подход к разработке продукта, при котором устанавливаются заданные значения и рабочие диапазоны параметров процесса для обеспечения воспроизводимости;
«фармацевтическая система качества» (pharmaceutical quality system; PQS) – система управления для направления и контроля фармацевтической компании в отношении качества.
IV. Общие положения
8. Независимо от используемого при разработке лекарственного препарата подхода, традиционного или расширенного, до начала реализации лекарственного препарата на рынке необходимо валидировать процесс его производства. В исключительных случаях (при особо благоприятном соотношении «польза – риск» для пациента) допускается проведение сопутствующей валидации.
9. Валидация процесса должна подтвердить, что процесс в рамках разработанной стратегии контроля способен обеспечивать качество продукта. Валидация должна охватывать все предназначенные для реализации дозировки и все производственные участки, используемые для производства товарного продукта. Для различных дозировок, размеров серии и вместимости упаковки может быть приемлемо исследование крайних вариантов, тем не менее валидация должна выполняться на всех предлагаемых производственных участках. Данные о валидации процесса должны подтверждать пригодность процесса для всех продуктов и на каждом производственном участке. Валидация должна проводиться в соответствии с требованиями Правил надлежащей производственной практики, полученные данные должны храниться по месту производства и быть доступны для инспекции, если представление их в регистрационном досье не требуется (в соответствии с разделом VIII настоящего Руководства).
10. Независимо от подхода, принятого при разработке процесса, его валидация может выполняться традиционным способом. Допускается возможность использования непрерывной верификации процесса, если его разработка выполнена с использованием расширенного подхода или если на основании ретроспективных данных и производственного опыта получен значительный объем знаний о продукте и процессе. Можно использовать сочетание традиционной валидации и непрерывной верификации процесса. Применение при мониторинге методов«в потоке», «у потока» и «вне потока», часто используемых при непрерывной верификации процесса (в соответствии с подразделом 2 раздела V настоящего Руководства), обеспечивает получение значительно большей информации и знаний о процессе и может способствовать улучшению процесса.
V. Валидация процесса
1. Традиционная валидация процесса
11. Традиционная валидация процесса, как правило, выполняется по завершении фармацевтической разработки и (или) разработки процесса после масштабирования производственного процесса и до начала реализации готового продукта. В рамках жизненного цикла продукта некоторые исследования по валидации процесса производства могут быть выполнены на опытно-промышленных сериях до масштабирования процесса. Следует отметить, что размер опытно-промышленной серии должен соответствовать как минимум10% от размера серии промышленного масштаба (то есть коэффициент масштабирования должен быть не более 10). Для твердых пероральных лекарственных форм размер опытно-промышленной серии, как правило, должен составлять не менее 10 % от максимального размера серии промышленного масштаба или 100 000 единиц в зависимости от того, какое количество больше.
Если предполагаемый размер промышленной серии менее 100 000 единиц, прогностическое значение результатов валидации, полученных на опытно-промышленных сериях, может быть ограничено, и использование такого подхода должно быть обосновано. Для других лекарственных форм размер опытно-промышленной серии должен быть обоснован с учетом риска для пациента, обусловленного несоответствием качества для данной лекарственной формы.
12. Проведение полных валидационных исследований на опытно-промышленных сериях в целом считается нецелесообразным, поэтому для каждого лекарственного препарата должен быть разработан план валидации процесса (в соответствии с требованиями согласно приложению N 1) для последующего выполнения валидации на сериях промышленного масштаба, а также может быть применено исследование крайних вариантов. План валидации процесса должен быть включен в регистрационное досье. В план валидации процесса включаются описание производственного процесса, перечень выполняемых испытаний и критерии приемлемости, описание дополнительных элементов контроля в процессе, а также данные, которые должны быть получены. Обоснование плана валидации процесса должно быть представлено в подразделе 2.3 («Общее резюме по качеству») модуля 2 регистрационного досье. Сведения по валидации процесса на момент подачи заявления о регистрации лекарственного препарата представляются для производственного процесса в промышленном масштабе для нестандартных продуктов(например, для биологических (биотехнологических) продуктов)или в случае, если предлагается нестандартный метод производства (в соответствии с разделом VIII настоящего Руководства и согласно приложению N 2).
В таких случаях данные на ряд последовательных серий промышленного масштаба должны быть представлены в уполномоченный орган (экспертную организацию) референтного государства, определяемого в соответствии с Правилами регистрации и экспертизы, в срок не более 14 рабочих дней после получения заключения по модулю 3 регистрационного досье. Количество серий должно быть обосновано исходя из изменчивости процесса, сложности процесса (продукта), знаний о процессе, полученных в ходе разработки, подтверждающих данных, полученных в промышленном масштабе при переносе (трансфере) технологий и общего опыта производителя. Должны быть представлены данные по валидации как минимум 3 серий промышленного масштаба, если не обосновано иное число серий. Данных по одной или двум сериям промышленного масштаба может быть достаточно при наличии данных по опытно-промышленным сериями соответствующего обоснования (как изложено выше).
13. Валидационные исследования должны включать в себя критические стадии процесса, в том числе проведение дополнительных испытаний (при необходимости).
2. Непрерывная верификация процесса
14. В качестве альтернативы традиционной валидации процесса может использоваться непрерывная верификация процесса, при которой процесс постоянно контролируется и оценивается. Непрерывная верификация процесса может быть использована дополнительно к традиционной валидации процесса или заменять ее.
Непрерывная верификация процесса является научным и основанным на оценке рисков подходом для проверки и подтверждения в режиме реального времени того, что процесс, реализуемый в рамках установленных параметров по утвержденной документации, постоянно обеспечивает получение продукта, соответствующего всем критическим показателям качества и требованиям стратегии контроля.
15. Применение непрерывной верификации процесса для производителя (заявителя) означает проведение обширного мониторинга процесса методами «в потоке», «вне потока» или «у потока»и контроля качества продукта и пригодности процесса для каждой серии. Необходимо получить соответствующие данные по показателям качества исходных материалов или компонентов, промежуточных продуктов и готового продукта. Также данные должны включать в себя верификацию и оценку критических показателей качества (CQA) и критических параметров процесса (СРР), в том числе оценку тенденций. В качестве инструментов для практической реализации непрерывной верификации процесса могут быть использованы такие процессно-аналитические технологии (PAT), как спектроскопия в ближней инфракрасной области спектра (например, для определения однородности при смешивании, площади поверхности гранул, однородности содержания для выборок большого размера) и многомерный статистический контроль процессов (SPC).
16. Масштаб и степень применения непрерывной верификации процесса зависят от ряда факторов, включая следующие:
а) наличие предварительных знаний о разработке и производстве аналогичных продуктов и (или) процессах;
б) степень понимания процесса (детализация и подробная документальная характеристика), полученного в ходе исследований при его разработке и в результате опыта производства промышленного масштаба;
в) сложность продукта и (или) производственного процесса;
г) уровень автоматизации процессов и используемых процессно-аналитических технологий (РАТ);
д) сведения, основанные на жизненном цикле продукта, устойчивости процесса и опыте производства в промышленном масштабе для существующих продуктов (при необходимости).
17. Обоснование пригодности и целесообразности непрерывной верификации процесса необходимо включить в подраздел 3.2.P.2. («Фармацевтическая разработка») модуля 3 регистрационного досье и подтвердить данными лабораторных или опытно-промышленных серий. Описание системы непрерывной верификации процесса, включая подлежащие контролю параметры процесса и показатели материалов, применяемые для контроля аналитические методики, должно быть включено в регистрационное досье с перекрестной ссылкой на раздел «Валидация» (в соответствии с приложением N 1 к настоящему Руководству). Фактические данные, получаемые в ходе непрерывной верификации процесса производства промышленного масштаба, должны быть доступны при проведении инспекции производственного участка. Заявитель должен определить и обосновать выбор критических стадий процесса и завершить валидационные исследования до начала реализации продукта. Должно быть представлено обоснование числа серий продукта, которые будут использованы для валидации процесса в зависимости от сложности и ожидаемой изменчивости процесса и имеющегося опыта производства. Непрерывная верификация процесса считается наиболее подходящим методом валидации непрерывных процессов.
18. Непрерывная верификация процесса может быть введена на любом этапе жизненного цикла продукта. Этот подход может быть использован в следующих случаях: при первоначальном производстве промышленного масштаба, для проверки валидированных процессов как часть процедуры управления изменениями и в поддержку процесса постоянного улучшения.
19. Выполнение непрерывной верификации процесса осуществляется с соблюдением принципов и требований Правил надлежащей производственной практики. Фармацевтические системы качества (PQS) могут дополнять требования Правил надлежащей производственной практики. Тем не менее вопросы, относящиеся к самой процедуре соблюдения Правил надлежащей производственной практики и фармацевтических систем качества, не должны включаться в регистрационное досье, поскольку оценка данных вопросов выполняется при инспектировании производства лекарственных препаратов на соответствие требованиям Правил надлежащей производственной практики.
3. Комбинированный подход
20. Допускается использование комбинированного подхода, заключающегося в применении традиционного подхода к валидации и непрерывной верификации процесса для различных стадий производства. В регистрационном досье должно быть четко определено, какой подход к валидации использован на различных стадиях производственного процесса. Число серий и размер серий, требуемых для валидации, будут зависеть от степени использования непрерывной верификации процесса. Если для критических операций нестандартных процессов (указанных в разделе VIII настоящего Руководства) не используется непрерывная верификация процесса, к ним должны применяться требования к валидации процесса в соответствии с подразделом 1 раздела V настоящего Руководства при отсутствии другого обоснования.
4. Верификация проектного поля
21. Проектное поле обычно разрабатывается на основе лабораторных или опытно-промышленных серий. При масштабировании промышленный процесс, как правило, осуществляется и валидируется в соответствующей области проектного поля, которая определена как целевой интервал или нормальный рабочий диапазон. В течение жизненного цикла продукта изменение параметров и характеристик процесса в пределах проектного поля (то есть в пределах рабочих диапазонов процесса и показателей качества материалов)может привести к появлению более высоких или не выявленных при разработке рисков. По этой причине, а также в зависимости от того, как изначально определено проектное поле и валидирован процесс, может понадобиться подтверждение пригодности новой области в рамках проектного поля (путем предоставления доказательств того, что все показатели качества продукта соответствуют установленным критериям), то есть верификация проектного поля.
22. Если не было показано, что параметры, изученные при разработке проектного поля, масштабируются независимо от масштаба производства, а процесс был валидирован с использованием традиционного подхода, потребуются верификация проектного поля и включение в регистрационное досье протокола такой верификации. Применение непрерывной верификации процесса может способствовать подтверждению пригодности проектного поля в течение жизненного цикла продукта. В этом случае верификация проектного поля должна рассматриваться как часть системы непрерывной верификации процесса.
23. В зависимости от изменчивости параметров и характеристик процесса и их перемещения по проектному полю(то есть колебаний в пределах оптимальных рабочих параметров (валидированных диапазонов) или в новой области проектного поля с появлением более высокого или неизвестного риска) план верификации может включать в себя показатели качества (QA) и параметры процессов (PP’s), не включенные в систему рутинного контроля процесса (например, мониторинг или испытания QA и PP’s, которые могут зависеть от масштаба производства и (если применимо) от оборудования). Нет необходимости верифицировать все области проектного поля или допустимые пределы проектного поля.
24. Должно быть верифицировано более одной области проектного поля, но поэтапный подход для корректировки утвержденного проектного поля в течение жизненного цикла продукта также является приемлемым.
VI. Масштабирование
25. Во избежание повторения длительных и дорогостоящих испытаний необходимо должным образом организовать сбор информации и данных о ходе исследований при разработке, оптимизации и масштабировании процесса. Данную информацию представляют для обоснования того, что масштабирование процесса может быть достигнуто без потери качества при проведении промышленного производственного процесса. В подразделе 3.2.P.2 («Фармацевтическая разработка»)модуля 3 регистрационного досье необходимо обозначить элементы процесса, которые окажутся критичными при масштабировании, в подразделе 3.2.P.3 («Процесс производства лекарственного препарата») модуля 3 регистрационного досье их необходимо охарактеризовать.
26. Если размеры серий предлагаются в определенных диапазонах, следует привести обоснование того, что изменение размера серии не окажет отрицательного влияния на критические показатели качества (CQA) готового продукта. Параметры, изложенные в плане валидации процесса (в соответствии с приложением N 1 к настоящему Руководству), при изменении размера серии должны быть проверены повторно, если не предоставлены доказательства того, что процесс независим от масштаба, или если не используется непрерывная верификация процесса.
VII. Пострегистрационный контроль изменений
27. Необходимо установить четкие процедуры для управления изменениями, предлагаемыми для производственного процесса. Такие процедуры являются частью требований Правил надлежащей производственной практики и в регистрационном досье обычно не указываются. Процедуры контроля изменений должны обеспечивать получение достаточного количества данных, собранных с помощью утвержденной стратегии контроля, для подтверждения того, что измененный процесс позволяет получать продукт требуемого качества и обеспечивать полное и подробное документальное оформление и утверждение всех элементов, связанных с изменением, включая оценку необходимости внесения изменений в регистрационное досье.
Подробная информация об изменениях, которые необходимо вносить в регистрационное досье, приведена в приложениях N 19 и 20 к Правилам регистрации и экспертизы.
VIII. Стандартные и нестандартные процессы производства
28. Положения настоящего раздела применяются только к процессам, которые были валидированы с использованием традиционного подхода, а не к процессам, где используется непрерывная верификация процесса (в соответствии с подразделами 1 и 2 раздела V настоящего Руководства). В соответствии с подразделом 1 раздела V настоящего Руководства данные при масштабировании производства должны предоставляться в регистрационное досье для нестандартных продуктов или нестандартных процессов, валидированных с использованием традиционного подхода. Заявителем может быть дано обоснование, что процесс производства продукта является стандартным для конкретного производства (производственного участка) с учетом риска для пациента, обусловленного несоответствием качества лекарственного препарата или процесса. Оценка таких обоснований выполняется в каждом конкретном случае, но информация, предоставленная заявителем (для каждого производственного участка), должна включать в себя:
а) опыт работы с тем же или подобным продуктом или процессом (перечень продуктов, зарегистрированных (реализуемых) на территориях государств-членов, и число произведенных серий (включая размер));
б) наименование продуктов (число регистрационных удостоверений) в соответствующем государстве-члене;
в) объем знаний, накопленный при разработке продукта (число и размер серий, произведенных на каждом производственном участке);
г) ретроспективные данные о соответствии производственных участков требованиям Правил надлежащей производственной практики для этого типа процесса.
29. В заявлении на регистрацию заявитель должен указать в подразделе 3.2.P.3.5 («Валидация производственного процесса и (или) его оценка») модуля 3 регистрационного досье категорию производственного процесса (стандартный или нестандартный процесс) и обосновать выбор указанной категории.
Дополнительная информация о продуктах (процессах), рассматриваемых как нестандартные, приведена в приложении N 2 к настоящему Руководству.
Приложение N 1
к Руководству по валидации
процесса производства
лекарственных препаратов
для медицинского применения
ТРЕБОВАНИЯ
К ПЛАНУ ВАЛИДАЦИИ ПРОЦЕССА
I. Традиционная валидация процесса
1. Если предполагается традиционная валидация процесса в соответствии с подразделом 1 раздела V Руководства по валидации процесса производства лекарственных препаратов для медицинского применения (далее – Руководство) при недостаточности данных, полученных на сериях промышленного масштаба, то заявителем представляется в уполномоченный орган государства – члена Евразийского экономического союза в сфере обращения лекарственных средств (далее – уполномоченный орган)план валидации процесса. В нем указываются объем и порядок выполнения валидационных исследований, которые будут проводиться на сериях промышленного масштаба (число серий для валидации будет зависеть от изменчивости процесса, сложности процесса и продукта, а также от опыта производителя, но, как правило, составляет не менее 3 последовательных серий). Информация по этим исследованиям должна быть доступна уполномоченным органам для пострегистрационной инспекции.
План валидации процесса включается в регистрационное досье, предусмотренное приложением N 1 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78 , и содержит в том числе:
а) краткое описание процесса с указанием критических стадий производства или критических параметров процесса, подлежащих контролю при проведении валидации;
б) спецификацию на выпуск готового продукта (ссылки на соответствующий раздел регистрационного досье);
в) подробные сведения об аналитических методиках (ссылки на соответствующие методики, указанные в регистрационном досье);
г) сведения о внутрипроизводственном контроле и критерии приемлемости;
д) сведения о предлагаемых дополнительных испытаниях (с критериями приемлемости и валидацией аналитических методик (при необходимости));
е) план отбора проб (с указанием места, времени и способа отбора проб);
ж) методы учета и оценки результатов;
з) предлагаемый график выполнения исследований.
2. Результаты выполнения валидации оформляются документально, подписываются уполномоченным на это лицом и должны быть доступны для проверки.
3. Отчет по результатам выполнения валидации должен содержать следующие данные:
а) результаты испытания серий продукта;
б) сертификаты анализа продукта;
в) протоколы производства серий продукта;
г) сведения о полученных неожиданных результатах, отклонениях или внесенных изменениях (с обоснованиями);
д) выводы.
4. При получении значительных отклонений от ожидаемых результатов заявитель незамедлительно информирует об этом уполномоченные органы с указанием корректирующих действий. Все предлагаемые изменения в производственном процессе должны получить одобрение путем внесения изменений в регистрационное досье.
II. Непрерывная верификация процесса
5. Если предполагается использование непрерывной верификации процесса (в соответствии с подразделом 2 раздела V Руководства), заявителем представляется план непрерывной верификации процесса, включающий в себя описание мониторинга промышленных серий. Представленная информация должна быть доступна уполномоченным органам для пострегистрационной проверки.
6. План непрерывной верификации процесса включается в регистрационное досье и содержит(при необходимости) следующую информацию:
а) подробное описание использования мониторинга для контроля параметров процесса методом «в потоке» («у потока» и«вне потока») (в том числе периодичность мониторинга, число и размеры проверяемых образцов);
б) сведения об аналитических методиках (ссылки на соответствующие методики, указанные в регистрационном досье);
в) критерии приемлемости;
г) информация, включающая в себя в соответствующих случаях обоснование способности непрерывной верификации поддерживать контроль воспроизводимости процесса при производстве продукта в промышленном масштабе, а также сведения о применяемых статистических методах обработки данных;
д) обоснование того, каким образом мониторинг будет способствовать верификации проектного поля (при разработке проектного поля).
Приложение N 2
к Руководству по валидации
процесса производства
лекарственных препаратов
для медицинского применения
УКАЗАНИЯ
ПО ОПРЕДЕЛЕНИЮ СТАНДАРТНЫХ И НЕСТАНДАРТНЫХ ПРОЦЕССОВ
I. Общие положения
1. Отнесение процесса к стандартному или нестандартному определяется на основе оценки природы фармацевтической субстанции, природы готового продукта, процесса производства и опыта производителя.
Все биологические продукты рассматриваются как нестандартные.
2. Продуктами или процессами, которые могут рассматриваться в качестве нестандартных и для которых в регистрационном досье приводятся данные о валидации серий промышленного масштаба (при отсутствии другого обоснования), являются в том числе:
а) производство специализированных лекарственных форм;
б) включение в обычный процесс некоторых новых технологий;
в) специализированные процессы с использованием новых технологий или сложные процессы, требующие особой осторожности;
г) нестандартные методы стерилизации.
3. Технологические операции в процессе производства лекарственных препаратов, ранее не применявшиеся в рамках Евразийского экономического союза, как правило, рассматриваются в качестве нестандартных.
II. Специализированные лекарственные формы
4. К видам продуктов, которые рассматриваются в качестве специализированных, относятся:
а) лекарственные препараты для дозированного введения в легкие (например, аэрозольные дозирующие ингаляторы и сухие порошковые ингаляторы);
б) стерильные суспензии, эмульсии или другие диспергированные стерильные жидкости;
в) лекарственные препараты с модифицированным высвобождением;
г) однодозовые лекарственные препараты с низким содержанием действующего вещества (≤ 2 % от состава);
д) иные специализированные лекарственные формы (например, парентеральные депо на основе биоразлагаемых полимеров, липосом, мицелл, наночастиц).
III. Рутинные фармацевтические процессы,
включающие в себя новые технологии
5. Надлежащим образом разработанные и утвержденные рутинные фармацевтические процессы могут, например, включать в себя стадию таблетирования с использованием влажной грануляции. Вместе с тем введение в обычный процесс новой технологической операции (например, новой технологии сушки), обычно не используемой в фармацевтической промышленности, может привести к необходимости проведения всесторонней валидации на основе данных, полученных при разработке процесса и продукта.
IV. Специализированные или комплексные процессы
6. К специализированным или комплексным процессам относятся:
а) процессы, включающие в себя такие критические стадии, как лиофилизация, микрокапсулирование;
б) процессы, в которых физико-химические свойства активной фармацевтической субстанции или ключевого вспомогательного вещества (например, лубрикантов, агентов для нанесения оболочки) могут привести к трудностям при обработке или масштабировании производства либо проблемам, связанным с обеспечением стабильности при проведении процесса в промышленном масштабе;
в) асептические процессы.
V. Нестандартные способы стерилизации
7. К нестандартным способам стерилизации относятся:
а) конечная стерилизация влажным теплом с использованием нефармакопейных режимов стерилизации;
б) конечная стерилизация ионизирующим излучением при величине поглощенной дозы менее 25 кГр.
КОЛЛЕГИЯ ЕВРАЗИЙСКОЙ ЭКОНОМИЧЕСКОЙ КОМИССИИ
РЕКОМЕНДАЦИЯ
от 26 сентября 2017 г. N 19
О РУКОВОДСТВЕ
ПО ВАЛИДАЦИИ ПРОЦЕССА ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
Коллегия Евразийской экономической комиссии в соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая 2014 года, пунктом 3 статьи 3 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года,
в целях гармонизации требований, предъявляемых к валидации процессов фармацевтического производства, установленных законодательством государств — членов Евразийского экономического союза,
рекомендует государствам членам Евразийского экономического союза по истечении 6 месяцев с даты опубликования настоящей Рекомендации на официальном сайте Евразийского экономического союза при производстве лекарственных средств для медицинского применения, подготовке регистрационных досье лекарственных препаратов для их регистрации в соответствии с Правилами регистрации и экспертизы лекарственных средств для медицинского применения, утвержденными Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78, приведении регистрационного досье лекарственных препаратов в соответствие с указанными Правилами и инспектировании производственных площадок на соответствие Правилам надлежащей производственной практики Евразийского экономического союза, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 77, применять Руководство по валидации процесса производства лекарственных препаратов для медицинского применения согласно приложению.
Председатель Коллегии
Евразийской экономической комиссии
Т.САРКИСЯН
1. Настоящее Руководство является правилами по документальному оформлению результатов подтверждения того, что процесс производства, выполняемый в пределах установленных параметров, эффективно и воспроизводимо обеспечивает получение лекарственного препарата, соответствующего установленным спецификациям и показателям качества, для их представления в регистрационном досье лекарственного препарата.
2. Введением непрерывной верификации процесса определен альтернативный подход к валидации процесса на основе непрерывного мониторинга процесса производства. Этот подход основан на знании продукта и процесса, полученном при их разработке и (или) на опыте предыдущего производства. Непрерывная верификация процесса может применяться как при традиционном, так и при расширенном подходе к фармацевтической разработке. Для оценки процесса могут использоваться методы непрерывного мониторинга и (или) контроля. Предполагается, что совокупность положений, приведенных в руководствах по фармацевтической разработке, принимаемых Евразийской экономической комиссией, и в настоящем Руководстве, охватывает все критические стадии технологического процесса, подлежащие включению в регистрационное досье лекарственного препарата для медицинского применения, согласно приложению N 1 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78 (далее соответственно — регистрационное досье, Правила регистрации и экспертизы).
3. Валидация процессов не должна рассматриваться как разовое событие. Подход к валидации на основе жизненного цикла процесса включает в себя разработку продукта и процесса, валидацию производственного процесса промышленного масштаба и поддержание процесса в контролируемом состоянии в ходе рутинного промышленного производства.
4. Настоящее Руководство определяет состав информации о валидации процесса, подлежащей представлению при регистрации лекарственного препарата химической природы для медицинского применения. Общие принципы, касающиеся валидации, применимы также к активным фармацевтическим субстанциям. Представлять информацию о валидации процесса производства нестерильных фармацевтических субстанций в регистрационном досье, как правило, не требуется. Требования к валидации производства активных фармацевтических субстанций более подробно изложены в руководстве Международного совета по гармонизации технических требований к регистрации лекарственных препаратов для медицинского применения «Разработка и производство фармацевтических субстанций (химических веществ и биотехнологических (биологических) соединений)» (ICH Q11).
Приведенные в настоящем Руководстве принципы применимы к биологическим лекарственным препаратам. В связи с присущей биологической субстанции сложности и изменчивости валидация процесса производства таких лекарственных препаратов должна быть рассмотрена в индивидуальном порядке.
5. Необходимая в соответствии с настоящим Руководством информация представляется в регистрационном досье на момент подачи заявления о регистрации лекарственного препарата в уполномоченный орган государства — члена Евразийского экономического союза в сфере обращения лекарственных средств (далее соответственно — уполномоченный орган, государство-член).
6. Валидация производственного процесса в соответствии с настоящим Руководством рассматривается как второй этап жизненного цикла процесса. Первый этап (разработка процесса) рассматривается в руководствах по фармацевтической разработке, третий этап (текущая верификация процесса) рассматривается в приложении N 15 к Правилам надлежащей производственной практики Евразийского экономического союза, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 77 (далее — Правила надлежащей производственной практики).
7. Для целей настоящего Руководства используются понятия, которые означают следующее:
«валидация процесса» (process validation) — документально оформленное подтверждение того, что процесс производства, выполняемый в пределах установленных параметров, эффективно и воспроизводимо обеспечивает получение лекарственного препарата, соответствующего заранее установленным спецификациям и показателям качества;
«жизненный цикл продукта» (product lifecycle) — все стадии жизни продукта от начальной разработки, пребывания в обороте и до прекращения существования продукта;
«исследование крайних вариантов (брекетинг)» (bracketing) изложенный в плане валидации процесса научный и основанный на оценке рисков подход, обосновывающий возможность при валидации процесса испытывать только серии с крайними значениями некоторых факторов, например, с определенной дозировкой, размером серии и (или) вместимостью упаковки. Такой подход предполагает, что валидация каких-либо промежуточных значений факторов представлена валидацией крайних значений. Исследование крайних вариантов может быть применимо для ряда дозировок, подлежащих валидации, если такие дозировки совпадают или очень близки по составу, например, для таблеток, полученных с различным усилием прессования из аналогичного гранулята, или для ряда капсул с разной вместимостью, заполняемых одинаковым составом содержимого. Исследование крайних вариантов может применяться в отношении контейнеров с различной вместимостью или разным объемом наполнения одной и той же системы «контейнер-укупорка»;
«критический параметр процесса» (critical process parameter; CPP) — параметр процесса, изменчивость которого влияет на критические показатели качества и который, следовательно, подлежит мониторингу или контролю для обеспечения требуемого качества в результате осуществления процесса;
«критический показатель качества» (critical quality attribute; CQA) — физическое, химическое, биологическое или микробиологическое свойство или характеристика, которые для обеспечения необходимого качества продукта должны находиться в соответствующих пределах и диапазоне или иметь соответствующее распределение;
«метод «в потоке» (in-line) — метод измерения, при котором образец анализируется непосредственно в технологическом потоке и не отбирается из него;
«метод «вне потока» (on-line) — метод измерения, при котором образец отбирается из технологического потока с возможным возвращением в технологический поток;
«метод «у потока» (at-line) — метод измерения, при котором образец отбирается из технологического потока, изолируется от него и анализируется в непосредственной близости от потока;
«непрерывная верификация процесса» (continuous process verification) — альтернативный подход к валидации процесса, при котором производственный процесс постоянно контролируется и оценивается;
«проектное поле» (design space) — многомерная комбинация и взаимодействие входных переменных (например, показателей качества материалов) и параметров процесса, подтвердившие способность обеспечивать качество продукта. Работа в пределах проектного поля не рассматривается как изменение. Выход за пределы проектного поля считается изменением и обычно требует утверждения изменений после их согласования с уполномоченным органом. Проектное поле предлагается лицом, которое подает заявление на регистрацию лекарственного препарата, и подлежит оценке и утверждению уполномоченным органом;
«расширенный подход» (enhanced approach) — подход к разработке процесса на основе использования научных знаний, результатов исследований и оценки рисков для выявления и понимания характеристик материалов и параметров процесса, влияющих на критические показатели качества продукта;
«стратегия контроля» (control strategy) — планируемый комплекс элементов контроля, разработанный на основании существующего понимания продукта и процесса, который обеспечивает пригодность процесса и качество продукта. Элементы контроля могут включать в себя параметры и характеристики, связанные с активными фармацевтическими субстанциями и лекарственными препаратами, материалами и компонентами, условиями эксплуатации помещений и оборудования, внутрипроизводственным контролем, спецификациями на готовый продукт, методиками и периодичностью мониторинга и контроля;
«традиционный подход» (traditional approach) — подход к разработке продукта, при котором устанавливаются заданные значения и рабочие диапазоны параметров процесса для обеспечения воспроизводимости;
«фармацевтическая система качества» (pharmaceutical quality system; PQS) — система управления для направления и контроля фармацевтической компании в отношении качества.
8. Независимо от используемого при разработке лекарственного препарата подхода, традиционного или расширенного, до начала реализации лекарственного препарата на рынке необходимо валидировать процесс его производства. В исключительных случаях (при особо благоприятном соотношении «польза — риск» для пациента) допускается проведение сопутствующей валидации.
9. Валидация процесса должна подтвердить, что процесс в рамках разработанной стратегии контроля способен обеспечивать качество продукта. Валидация должна охватывать все предназначенные для реализации дозировки и все производственные участки, используемые для производства товарного продукта. Для различных дозировок, размеров серии и вместимости упаковки может быть приемлемо исследование крайних вариантов, тем не менее валидация должна выполняться на всех предлагаемых производственных участках. Данные о валидации процесса должны подтверждать пригодность процесса для всех продуктов и на каждом производственном участке. Валидация должна проводиться в соответствии с требованиями Правил надлежащей производственной практики, полученные данные должны храниться по месту производства и быть доступны для инспекции, если представление их в регистрационном досье не требуется (в соответствии с разделом VIII настоящего Руководства).
10. Независимо от подхода, принятого при разработке процесса, его валидация может выполняться традиционным способом. Допускается возможность использования непрерывной верификации процесса, если его разработка выполнена с использованием расширенного подхода или если на основании ретроспективных данных и производственного опыта получен значительный объем знаний о продукте и процессе. Можно использовать сочетание традиционной валидации и непрерывной верификации процесса. Применение при мониторинге методов «в потоке», «у потока» и «вне потока», часто используемых при непрерывной верификации процесса (в соответствии с подразделом 2 раздела V настоящего Руководства), обеспечивает получение значительно большей информации и знаний о процессе и может способствовать улучшению процесса.
1. Традиционная валидация процесса
11. Традиционная валидация процесса, как правило, выполняется по завершении фармацевтической разработки и (или) разработки процесса после масштабирования производственного процесса и до начала реализации готового продукта. В рамках жизненного цикла продукта некоторые исследования по валидации процесса производства могут быть выполнены на опытно-промышленных сериях до масштабирования процесса. Следует отметить, что размер опытно-промышленной серии должен соответствовать как минимум 10% от размера серии промышленного масштаба (то есть коэффициент масштабирования должен быть не более 10). Для твердых пероральных лекарственных форм размер опытно-промышленной серии, как правило, должен составлять не менее 10% от максимального размера серии промышленного масштаба или 100 000 единиц в зависимости от того, какое количество больше.
Если предполагаемый размер промышленной серии менее 100 000 единиц, прогностическое значение результатов валидации, полученных на опытно-промышленных сериях, может быть ограничено, и использование такого подхода должно быть обосновано. Для других лекарственных форм размер опытно-промышленной серии должен быть обоснован с учетом риска для пациента, обусловленного несоответствием качества для данной лекарственной формы.
12. Проведение полных валидационных исследований на опытно-промышленных сериях в целом считается нецелесообразным, поэтому для каждого лекарственного препарата должен быть разработан план валидации процесса (в соответствии с требованиями согласно приложению N 1) для последующего выполнения валидации на сериях промышленного масштаба, а также может быть применено исследование крайних вариантов. План валидации процесса должен быть включен в регистрационное досье. В план валидации процесса включаются описание производственного процесса, перечень выполняемых испытаний и критерии приемлемости, описание дополнительных элементов контроля в процессе, а также данные, которые должны быть получены. Обоснование плана валидации процесса должно быть представлено в подразделе 2.3 («Общее резюме по качеству») модуля 2 регистрационного досье. Сведения по валидации процесса на момент подачи заявления о регистрации лекарственного препарата представляются для производственного процесса в промышленном масштабе для нестандартных продуктов (например, для биологических (биотехнологических) продуктов) или в случае, если предлагается нестандартный метод производства (в соответствии с разделом VIII настоящего Руководства и согласно приложению N 2).
В таких случаях данные на ряд последовательных серий промышленного масштаба должны быть представлены в уполномоченный орган (экспертную организацию) референтного государства, определяемого в соответствии с Правилами регистрации и экспертизы, в срок не более 14 рабочих дней после получения заключения по модулю 3 регистрационного досье. Количество серий должно быть обосновано исходя из изменчивости процесса, сложности процесса (продукта), знаний о процессе, полученных в ходе разработки, подтверждающих данных, полученных в промышленном масштабе при переносе (трансфере) технологий и общего опыта производителя. Должны быть представлены данные по валидации как минимум 3 серий промышленного масштаба, если не обосновано иное число серий. Данных по одной или двум сериям промышленного масштаба может быть достаточно при наличии данных по опытно-промышленным сериям и соответствующего обоснования (как изложено выше).
13. Валидационные исследования должны включать в себя критические стадии процесса, в том числе проведение дополнительных испытаний (при необходимости).
2. Непрерывная верификация процесса
14. В качестве альтернативы традиционной валидации процесса может использоваться непрерывная верификация процесса, при которой процесс постоянно контролируется и оценивается. Непрерывная верификация процесса может быть использована дополнительно к традиционной валидации процесса или заменять ее.
Непрерывная верификация процесса является научным и основанным на оценке рисков подходом для проверки и подтверждения в режиме реального времени того, что процесс, реализуемый в рамках установленных параметров по утвержденной документации, постоянно обеспечивает получение продукта, соответствующего всем критическим показателям качества и требованиям стратегии контроля.
15. Применение непрерывной верификации процесса для производителя (заявителя) означает проведение обширного мониторинга процесса методами «в потоке», «вне потока» или «у потока» и контроля качества продукта и пригодности процесса для каждой серии. Необходимо получить соответствующие данные по показателям качества исходных материалов или компонентов, промежуточных продуктов и готового продукта. Также данные должны включать в себя верификацию и оценку критических показателей качества (CQA) и критических параметров процесса (CPP), в том числе оценку тенденций. В качестве инструментов для практической реализации непрерывной верификации процесса могут быть использованы такие процессно-аналитические технологии (PAT), как спектроскопия в ближней инфракрасной области спектра (например, для определения однородности при смешивании, площади поверхности гранул, однородности содержания для выборок большого размера) и многомерный статистический контроль процессов (SPC).
16. Масштаб и степень применения непрерывной верификации процесса зависят от ряда факторов, включая следующие:
а) наличие предварительных знаний о разработке и производстве аналогичных продуктов и (или) процессах;
б) степень понимания процесса (детализация и подробная документальная характеристика), полученного в ходе исследований при его разработке и в результате опыта производства промышленного масштаба;
в) сложность продукта и (или) производственного процесса;
г) уровень автоматизации процессов и используемых процессно-аналитических технологий (PAT);
д) сведения, основанные на жизненном цикле продукта, устойчивости процесса и опыте производства в промышленном масштабе для существующих продуктов (при необходимости).
17. Обоснование пригодности и целесообразности непрерывной верификации процесса необходимо включить в подраздел 3.2.Р.2 («Фармацевтическая разработка») модуля 3 регистрационного досье и подтвердить данными лабораторных или опытно-промышленных серий. Описание системы непрерывной верификации процесса, включая подлежащие контролю параметры процесса и показатели материалов, применяемые для контроля аналитические методики, должно быть включено в регистрационное досье с перекрестной ссылкой на раздел «Валидация» (в соответствии с приложением N 1 к настоящему Руководству). Фактические данные, получаемые в ходе непрерывной верификации процесса производства промышленного масштаба, должны быть доступны при проведении инспекции производственного участка. Заявитель должен определить и обосновать выбор критических стадий процесса и завершить валидационные исследования до начала реализации продукта. Должно быть представлено обоснование числа серий продукта, которые будут использованы для валидации процесса в зависимости от сложности и ожидаемой изменчивости процесса и имеющегося опыта производства. Непрерывная верификация процесса считается наиболее подходящим методом валидации непрерывных процессов.
18. Непрерывная верификация процесса может быть введена на любом этапе жизненного цикла продукта. Этот подход может быть использован в следующих случаях: при первоначальном производстве промышленного масштаба, для проверки валидированных процессов как часть процедуры управления изменениями и в поддержку процесса постоянного улучшения.
19. Выполнение непрерывной верификации процесса осуществляется с соблюдением принципов и требований Правил надлежащей производственной практики. Фармацевтические системы качества (PQS) могут дополнять требования Правил надлежащей производственной практики. Тем не менее вопросы, относящиеся к самой процедуре соблюдения Правил надлежащей производственной практики и фармацевтических систем качества, не должны включаться в регистрационное досье, поскольку оценка данных вопросов выполняется при инспектировании производства лекарственных препаратов на соответствие требованиям Правил надлежащей производственной практики.
3. Комбинированный подход
20. Допускается использование комбинированного подхода, заключающегося в применении традиционного подхода к валидации и непрерывной верификации процесса для различных стадий производства. В регистрационном досье должно быть четко определено, какой подход к валидации использован на различных стадиях производственного процесса. Число серий и размер серий, требуемых для валидации, будут зависеть от степени использования непрерывной верификации процесса. Если для критических операций нестандартных процессов (указанных в разделе VIII настоящего Руководства) не используется непрерывная верификация процесса, к ним должны применяться требования к валидации процесса в соответствии с подразделом 1 раздела V настоящего Руководства при отсутствии другого обоснования.
4. Верификация проектного поля
21. Проектное поле обычно разрабатывается на основе лабораторных или опытно-промышленных серий. При масштабировании промышленный процесс, как правило, осуществляется и валидируется в соответствующей области проектного поля, которая определена как целевой интервал или нормальный рабочий диапазон. В течение жизненного цикла продукта изменение параметров и характеристик процесса в пределах проектного поля (то есть в пределах рабочих диапазонов процесса и показателей качества материалов) может привести к появлению более высоких или не выявленных при разработке рисков. По этой причине, а также в зависимости от того, как изначально определено проектное поле и валидирован процесс, может понадобиться подтверждение пригодности новой области в рамках проектного поля (путем предоставления доказательств того, что все показатели качества продукта соответствуют установленным критериям), то есть верификация проектного поля.
22. Если не было показано, что параметры, изученные при разработке проектного поля, масштабируются независимо от масштаба производства, а процесс был валидирован с использованием традиционного подхода, потребуются верификация проектного поля и включение в регистрационное досье протокола такой верификации. Применение непрерывной верификации процесса может способствовать подтверждению пригодности проектного поля в течение жизненного цикла продукта. В этом случае верификация проектного поля должна рассматриваться как часть системы непрерывной верификации процесса.
23. В зависимости от изменчивости параметров и характеристик процесса и их перемещения по проектному полю (то есть колебаний в пределах оптимальных рабочих параметров (валидированных диапазонов) или в новой области проектного поля с появлением более высокого или неизвестного риска) план верификации может включать в себя показатели качества (QA) и параметры процессов (PP’s), не включенные в систему рутинного контроля процесса (например, мониторинг или испытания QA и PP’s, которые могут зависеть от масштаба производства и (если применимо) от оборудования). Нет необходимости верифицировать все области проектного поля или допустимые пределы проектного поля.
24. Должно быть верифицировано более одной области проектного поля, но поэтапный подход для корректировки утвержденного проектного поля в течение жизненного цикла продукта также является приемлемым.
25. Во избежание повторения длительных и дорогостоящих испытаний необходимо должным образом организовать сбор информации и данных о ходе исследований при разработке, оптимизации и масштабировании процесса. Данную информацию представляют для обоснования того, что масштабирование процесса может быть достигнуто без потери качества при проведении промышленного производственного процесса. В подразделе 3.2.Р.2 («Фармацевтическая разработка») модуля 3 регистрационного досье необходимо обозначить элементы процесса, которые окажутся критичными при масштабировании, в подразделе 3.2.Р.3 («Процесс производства лекарственного препарата») модуля 3 регистрационного досье их необходимо охарактеризовать.
26. Если размеры серий предлагаются в определенных диапазонах, следует привести обоснование того, что изменение размера серии не окажет отрицательного влияния на критические показатели качества (CQA) готового продукта. Параметры, изложенные в плане валидации процесса (в соответствии с приложением N 1 к настоящему Руководству), при изменении размера серии должны быть проверены повторно, если не предоставлены доказательства того, что процесс независим от масштаба, или если не используется непрерывная верификация процесса.
27. Необходимо установить четкие процедуры для управления изменениями, предлагаемыми для производственного процесса. Такие процедуры являются частью требований Правил надлежащей производственной практики и в регистрационном досье обычно не указываются. Процедуры контроля изменений должны обеспечивать получение достаточного количества данных, собранных с помощью утвержденной стратегии контроля, для подтверждения того, что измененный процесс позволяет получать продукт требуемого качества и обеспечивать полное и подробное документальное оформление и утверждение всех элементов, связанных с изменением, включая оценку необходимости внесения изменений в регистрационное досье.
Подробная информация об изменениях, которые необходимо вносить в регистрационное досье, приведена в приложениях N 19 и 20 к Правилам регистрации и экспертизы.
28. Положения настоящего раздела применяются только к процессам, которые были валидированы с использованием традиционного подхода, а не к процессам, где используется непрерывная верификация процесса (в соответствии с подразделами 1 и 2 раздела V настоящего Руководства). В соответствии с подразделом 1 раздела V настоящего Руководства данные при масштабировании производства должны предоставляться в регистрационное досье для нестандартных продуктов или нестандартных процессов, валидированных с использованием традиционного подхода. Заявителем может быть дано обоснование, что процесс производства продукта является стандартным для конкретного производства (производственного участка) с учетом риска для пациента, обусловленного несоответствием качества лекарственного препарата или процесса. Оценка таких обоснований выполняется в каждом конкретном случае, но информация, предоставленная заявителем (для каждого производственного участка), должна включать в себя:
а) опыт работы с тем же или подобным продуктом или процессом (перечень продуктов, зарегистрированных (реализуемых) на территориях государств-членов, и число произведенных серий (включая размер));
б) наименование продуктов (число регистрационных удостоверений) в соответствующем государстве-члене;
в) объем знаний, накопленный при разработке продукта (число и размер серий, произведенных на каждом производственном участке);
г) ретроспективные данные о соответствии производственных участков требованиям Правил надлежащей производственной практики для этого типа процесса.
29. В заявлении на регистрацию заявитель должен указать в подразделе 3.2.Р.3.5 («Валидация производственного процесса и (или) его оценка») модуля 3 регистрационного досье категорию производственного процесса (стандартный или нестандартный процесс) и обосновать выбор указанной категории.
Дополнительная информация о продуктах (процессах), рассматриваемых как нестандартные, приведена в приложении N 2 к настоящему Руководству.
1. Если предполагается традиционная валидация процесса в соответствии с подразделом 1 раздела V Руководства по валидации процесса производства лекарственных препаратов для медицинского применения (далее — Руководство) при недостаточности данных, полученных на сериях промышленного масштаба, то заявителем представляется в уполномоченный орган государства — члена Евразийского экономического союза в сфере обращения лекарственных средств (далее — уполномоченный орган) план валидации процесса. В нем указываются объем и порядок выполнения валидационных исследований, которые будут проводиться на сериях промышленного масштаба (число серий для валидации будет зависеть от изменчивости процесса, сложности процесса и продукта, а также от опыта производителя, но, как правило, составляет не менее 3 последовательных серий). Информация по этим исследованиям должна быть доступна уполномоченным органам для пострегистрационной инспекции.
План валидации процесса включается в регистрационное досье, предусмотренное приложением N 1 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78, и содержит в том числе:
а) краткое описание процесса с указанием критических стадий производства или критических параметров процесса, подлежащих контролю при проведении валидации;
б) спецификацию на выпуск готового продукта (ссылки на соответствующий раздел регистрационного досье);
в) подробные сведения об аналитических методиках (ссылки на соответствующие методики, указанные в регистрационном досье);
г) сведения о внутрипроизводственном контроле и критерии приемлемости;
д) сведения о предлагаемых дополнительных испытаниях (с критериями приемлемости и валидацией аналитических методик (при необходимости));
е) план отбора проб (с указанием места, времени и способа отбора проб);
ж) методы учета и оценки результатов;
з) предлагаемый график выполнения исследований.
2. Результаты выполнения валидации оформляются документально, подписываются уполномоченным на это лицом и должны быть доступны для проверки.
3. Отчет по результатам выполнения валидации должен содержать следующие данные:
а) результаты испытания серий продукта;
б) сертификаты анализа продукта;
в) протоколы производства серий продукта;
г) сведения о полученных неожиданных результатах, отклонениях или внесенных изменениях (с обоснованиями);
д) выводы.
4. При получении значительных отклонений от ожидаемых результатов заявитель незамедлительно информирует об этом уполномоченные органы с указанием корректирующих действий. Все предлагаемые изменения в производственном процессе должны получить одобрение путем внесения изменений в регистрационное досье.
5. Если предполагается использование непрерывной верификации процесса (в соответствии с подразделом 2 раздела V Руководства), заявителем представляется план непрерывной верификации процесса, включающий в себя описание мониторинга промышленных серий. Представленная информация должна быть доступна уполномоченным органам для пострегистрационной проверки.
6. План непрерывной верификации процесса включается в регистрационное досье и содержит (при необходимости) следующую информацию:
а) подробное описание использования мониторинга для контроля параметров процесса методом «в потоке» («у потока» и «вне потока») (в том числе периодичность мониторинга, число и размеры проверяемых образцов);
б) сведения об аналитических методиках (ссылки на соответствующие методики, указанные в регистрационном досье);
в) критерии приемлемости;
г) информация, включающая в себя в соответствующих случаях обоснование способности непрерывной верификации поддерживать контроль воспроизводимости процесса при производстве продукта в промышленном масштабе, а также сведения о применяемых статистических методах обработки данных;
д) обоснование того, каким образом мониторинг будет способствовать верификации проектного поля (при разработке проектного поля).
1. Отнесение процесса к стандартному или нестандартному определяется на основе оценки природы фармацевтической субстанции, природы готового продукта, процесса производства и опыта производителя.
Все биологические продукты рассматриваются как нестандартные.
2. Продуктами или процессами, которые могут рассматриваться в качестве нестандартных и для которых в регистрационном досье приводятся данные о валидации серий промышленного масштаба (при отсутствии другого обоснования), являются в том числе:
а) производство специализированных лекарственных форм;
б) включение в обычный процесс некоторых новых технологий;
в) специализированные процессы с использованием новых технологий или сложные процессы, требующие особой осторожности;
г) нестандартные методы стерилизации.
3. Технологические операции в процессе производства лекарственных препаратов, ранее не применявшиеся в рамках Евразийского экономического союза, как правило, рассматриваются в качестве нестандартных.
4. К видам продуктов, которые рассматриваются в качестве специализированных, относятся:
а) лекарственные препараты для дозированного введения в легкие (например, аэрозольные дозирующие ингаляторы и сухие порошковые ингаляторы);
б) стерильные суспензии, эмульсии или другие диспергированные стерильные жидкости;
в) лекарственные препараты с модифицированным высвобождением;
г) однодозовые лекарственные препараты с низким содержанием действующего вещества (< 2% от состава);
д) иные специализированные лекарственные формы (например, парентеральные депо на основе биоразлагаемых полимеров, липосом, мицелл, наночастиц).
5. Надлежащим образом разработанные и утвержденные рутинные фармацевтические процессы могут, например, включать в себя стадию таблетирования с использованием влажной грануляции. Вместе с тем введение в обычный процесс новой технологической операции (например, новой технологии сушки), обычно не используемой в фармацевтической промышленности, может привести к необходимости проведения всесторонней валидации на основе данных, полученных при разработке процесса и продукта.
6. К специализированным или комплексным процессам относятся:
а) процессы, включающие в себя такие критические стадии, как лиофилизация, микрокапсулирование;
б) процессы, в которых физико-химические свойства активной фармацевтической субстанции или ключевого вспомогательного вещества (например, лубрикантов, агентов для нанесения оболочки) могут привести к трудностям при обработке или масштабировании производства либо проблемам, связанным с обеспечением стабильности при проведении процесса в промышленном масштабе;
в) асептические процессы.
7. К нестандартным способам стерилизации относятся:
а) конечная стерилизация влажным теплом с использованием нефармакопейных режимов стерилизации;
б) конечная стерилизация ионизирующим излучением при величине поглощенной дозы менее 25 кГр.
По истечении 6 месяцев с даты опубликования документа членам ЕАЭС рекомендуется применять данное Руководство при производстве лекарств, подготовке регистрационных досье лекарственных препаратов для их регистрации и при инспектировании производственных площадок на соответствие Правилам GMP ЕАЭС, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 77.
В Руководстве содержатся рекомендации по документальному оформлению результатов подтверждения того, что процесс производства, выполняемый в пределах установленных параметров, эффективно и воспроизводимо обеспечивает получение лекарственного препарата, соответствующего установленным спецификациям и показателям качества, для их представления в регистрационном досье лекарственного препарата.
Руководство определяет состав информации о валидации процесса, подлежащей представлению при регистрации лекарственного препарата химической природы для медицинского применения . Общие принципы, касающиеся валидации, применимы также к активным фармацевтическим субстанциям. Приведенные в Руководстве принципы применимы к биологическим лекарственным препаратам. В связи с присущей биологической субстанции сложности и изменчивости валидация процесса производства таких лекарственных препаратов должна быть рассмотрена в индивидуальном порядке.
Необходимая в соответствии с Руководством информация представляется в регистрационном досье на момент подачи заявле ния о регистрации лекарственного препарата в уполномоченный орган rocyдарства — члена Евразийского экономического союза в сфере обращения лекарственных средств (далее соответственно уполномоченный орган, государство-член).
Источник: gmpnews.ru.

Данная статья подготовлена при участии Евразийского отделения ISPE
В рамках развития образовательного направления ISPE ЕАЭС и углубления сотрудничества с «Евразийской Академией надлежащих практик» при участии экспертов PQE Group в феврале 2022 года состоялся вебинар для фармпроизводителей ЕАЭС «Валидация технологического процесса – подход на основании жизненного цикла продукта. Концепция Quality by Design – качество через дизайн». В вебинаре приняли участие: Владимир Орлов, директор Евразийского отделения ISPE, Юрий Сандлер, генеральный директор PQE CIS, Александр Белинский, Главный консультант PQE CIS.
Юрий Сандлер, Генеральный директор PQE CIS
Александр Белинский, Главный консультант PQE CIS
В программе были освещены такие вопросы, как:
- Концепция Quality by Design – качество посредством проектирования. Обзор руководств ISPE и практические аспекты их применения, включая руководство о жизненном цикле валидации процесса (ISPE Good Practice Guide: Practical Implementation of the Lifecycle Approach to Process Validation), которое было представлено на Ежегодной конференции ISPE ЕАЭС в ноябре 2021 г.
- Что необходимо выполнить в ходе фармацевтической разработки. Необходимо установить критические показатели качества (CQA) и определяемые ими критические параметры процесса (СPP), критические характеристики материалов (CMA). Рекомендуется (как удобная опция) определять пространство проектных параметров (Design Space).
- Что делать производителю с уже производимой лекарственной продукцией для рынка ЕАЭС? Ведь даже при наличии валидации процесса по традиционному подходу для них обязательной становится продолжающаяся верификация процесса в ходе жизненного цикла.
- Современные подходы к валидации технологических процессов. В данной статье приводится краткое содержание вебинара, которое раскрывает читателям подход и мнение экспертов ISPE и PQE по данной тематике.
Quality by Design – есть у валидации начало, нет у валидации конца.
Слоган выше, характеризующий валидацию, зачастую на различных конференциях произносят по-философски с некоторым налётом грусти. До недавнего времени – без «диковинного» словосочетания «Quality by Design» – «качество через дизайн». Но в связи с вступлением силу обновленного Приложения 15 GMP ЕАЭС (в форме Решения Совета Евразийской экономической комиссии от 14 июля 2021 г. № 65 «О внесении изменений в Правила надлежащей производственной практики Евразийского экономического союза») к этим тяжким раздумьям добавилось и новое понятие, хотя новизной является только его официально закрепленная возможность применения. Вместе с тем, если пойти немного вглубь, то в рамках ЕАЭС концепция «качество через дизайн» впервые прозвучала в тексте Рекомендации Коллегии Евразийской экономической комиссии от 26 сентября 2017 г. № 19 «О Руководстве по валидации процесса производства лекарственных препаратов для медицинского применения». Не говоря уже о том, что и Решение № 65 (соответствующее в целом приложению 1 5 GMP EU) и Рекомендация № 19 (соответствующее в целом Руководству ЕМА по валидации процесса) всего лишь актуализируют достаточно давно прорабатываемый концепт, сменяющий подход «Quality by Testing», как неприемлемый в виду запредельной контрпродуктивности. Делая акцент на тестирование готовой продукции, мы пытались компенсировать отсутствие знаний о продукте и процессе, что приводило к значительному риску производства некачественного продукта и убыткам для компании.
Что же скрывается за словосочетанием «качество через дизайн» (Quality by Design), которое теперь предложено к рассмотрению? Оттолкнемся от определения, данного по текстам Решения 65 и Рекомендации № 19 – это системный подход, предусматривающий определение целей перед началом разработки продукции, точную оценку продукции и процесса ее производства, а также контроль процесса производства на основе научных данных и принципов управления рисками для качества.
Звучит это всё как «пугающее наукообразие». Мало того, что валидация процесса на современном этапе перестает быть разовым событием – уже исключен вариант произвести «коекак» три валидационные серии и «забыть» о валидации на какое-то время – так вдобавок ещё и предлагается осуществлять контроль процесса производства на основе научных подходов. Таким образом, наукоемкость и ресурсоемкость процесса очевидно возрастают. При этом не следует забывать, что если подход «качество через дизайн» является в настоящее время допустимой альтернативой, то продолжающаяся верификация процесса в ходе жизненного цикла становится безальтернативным обязательством.
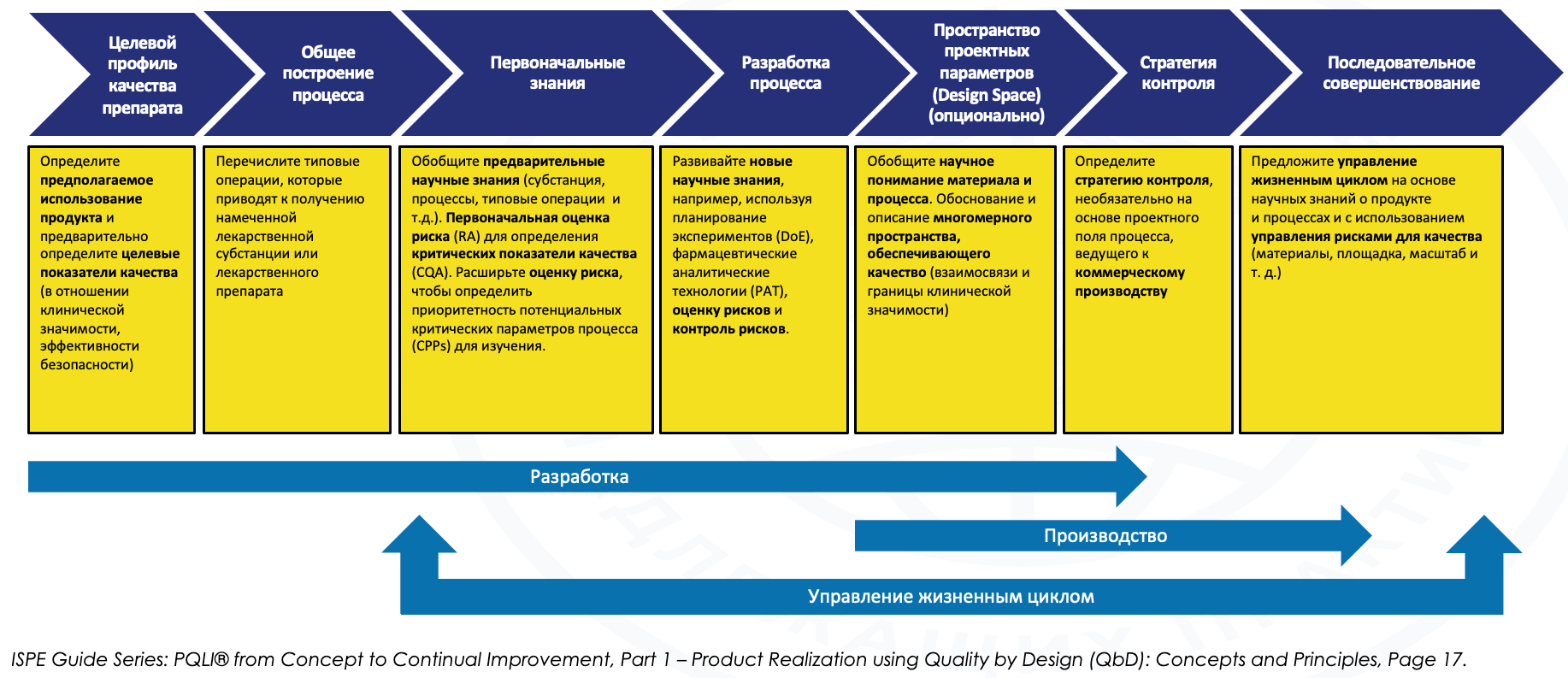
Казалось бы, эти нововведения могут восприниматься как очередной «регуляторный прессинг», «гиря на ногах бизнеса». Однако при более детальном рассмотрении выясняется, что как раз реализация концепта «качество через дизайн» способна сократить затраты по выведению на рынок новых лекарственных препаратов вплоть до 25%. За счет чего может быть достигнут такой эффект? По сравнению с традиционным подходом (когда этап фарм– разработки выполнялся без должного статистического обоснования, во многом эмпирическим путем, «по наитию»), больший фокус внимания уделяется именно этапу фармацевтической разработки – именно там формируется целевой профиль продукта, а также связанные с ним CQA (критические показатели качества), CPP (критические параметры процесса), как возможная опция – пространство проектных параметров (Design Space) и стратегия контроля. Считается, что реализация такого концепта не принесёт какой-то значимой экономии на этапе фармразработки, однако обеспечит статистически обоснованные знания о продукте и процессе, что заметно упростит масштабирование, трансфер и производство последующих коммерческих серий, поскольку процесс будет заведомо в состоянии статистического контроля (см. рис. 1).
Рис. 1. Обзор концепта «качество через дизайн»
Далее следует краткое описание главных этапов процесса при разработке лекарственных средств согласно ICH Q8 и руководствам PQLI от ISPE от ранней разработки до производства коммерческих серий.
Этапы расположены в логическом и хронологическом порядке:
•Определение целевого профиля качества препарата (Quality Target Product Profile, QTPP) – Задача данного этапа обеспечить понимание того, что будет гарантировать качество, безопасность и эффективность конкретного продукта для пациента.
QTPP описывает критерии проекта для продукта, формирует основу для разработки CQA, CPP и стратегии контроля.
Аспекты целевого профиля качества продукта могут включать, но не ограничиваются следующим:
Предполагаемое применение в клинической практике, способ введения, лекарственная форма, системы доставки;
◦Дозировка (–и);
◦Система упаковки/укупорки;
◦Высвобождение или доставка лекарственного вещества и свойства, влияющие на фармакокинетические характеристики (например, растворение, всасывание и т. д.), которые соответствуют разрабатываемой лекарственной форме препарата;
◦Критерии качества лекарственного препарата (например, стерильность, чистота, стабильность и высвобождение лекарственного вещества), которые соответствуют предполагаемому продукту для реализации на рынке.
•Определение критических показателей качества (CQA) можно рассматривать как количественное представление QTPP. В руководстве Q8 (R2) определение CQA гласит: «Физическое, химическое, биологическое или микробиологическое свойство, или характеристика, которые должны соответствовать установленным нормам, диапазону или распределению для обеспечения желаемого качества продукта».
Описание их выведения по результатам работ по разработке приведено в руководстве Q8 (R2).
CQA обычно связаны со следующим:
•Фармацевтическая субстанция
•Вспомогательные вещества
•Полупродукты (внутрипроизводственные материалы)
•Лекарственный препарат
Выявление критических показателей носит итеративный характер и требует как можно более раннего обращения внимания в ходе выполнения работ на то, чтобы вывести из QTPP первоначальный перечень потенциальных CQA для продукта и перейти к изучению предложенного перечня критических характеристик качества продукта, устанавливая критерии приемлемости для тех показателей, которые признаны критическими. Соответствующие CQA могут быть выявлены с помощью итеративного процесса управления рисками для качества (QRM, который является неотъемлемой частью ФСК и экспериментов, оценивающих степень, в которой их изменчивость может повлиять на качество лекарственного препарата).
•Критические характеристики материала (CMA) и параметры процесса (CPP) – определяются как «материал или процесс, вариабельность которых влияет на критический показатель качества, поэтому следует проводить их мониторинг или контролировать для обеспечения желаемого качества лекарственного препарата». Критические показатели качества (CQA) лекарственного препарата и их QTPP учитываются при выборе вспомогательных веществ и параметров процесса.
А именно:
◦«Материал» означает сырье, исходные материалы, реактивы, растворители, вспомогательные вещества, промежуточные продукты и т. д., а «Характеристика» означает физическое, химическое, биологическое или микробиологическое свойство, или характеристики данного материала, которые можно измерить. Это может быть морфология частиц, концентрация и тип ингредиентов, соотношение ингредиентов, растворимость в воде, pH и т. д. Характеристика материала имеет критическое значение, когда с большой долей вероятности может повлиять на CQA.
◦Критические параметры процесса (CPP) – это еще одна категория факторов риска, связанных с производственными переменными.
Управление рисками качества обычно используется для выявления областей разработки с риском для CQA, однако недостаточно выявить только CPP и CMA. Общая оценка рисков указывает на отдельные операции с риском, а более детальная оценка – выявляет потенциальные факторы, которые могут повлиять на CQA. При этом одной только оценки рисков недостаточно для выявления и контроля CPP. Она может быть основана только на измерении того, как факторы непосредственно влияют на отклик*.
Иными словами, как и для определения критических показателей качества продукта, так и для определения критических параметров процесса необходим научный подход с множеством поставленных экспериментов и статистическим анализом полученных данных.
Разработка стратегии контроля — структурированный подход с участием многопрофильной группы экспертов, связывающих разработку фармацевтической продукции с производственным процессом и инженерно-техническими средствами контроля технологического оборудования. Необходимо тщательно разработать и спланировать мероприятия, чтобы получить продукт, соответствующий установленным показателям качества; поэтому важно получить как можно больше информации о действующих веществах, продукте и производственном процессе, которые подвергаются проверке. Все технологические процессы должны быть разработаны таким образом, чтобы они позволяли стабильно получать продукты, соответствующие критическим показателям качества (CQA), в основном касающимся подлинности, дозировки, качества, чистоты и активности.
По итогу данного процесса компания производитель должна получить эффективную стратегию контроля, отлично понимая, как влияют различные этапы процесса на критические параметры качества продукта, и иметь возможность это доказать. В отличие от подхода «Качество путем контроля» (Quality by Testing), эффективность стратегии заключается и в минимизации контрольных точек в процессе производства, например, если было выявлено, что определенный этап производства не влияет на pH раствора, то нет смысла тратить ресурсы на его контроль после данного этапа.
Масштабирование процесса (Process Scale-Up) – переход от лабораторных / пилотных серий к полномасштабным (коммерческим) сериям. На данном этапе уже должно быть полное понимание процесса и его влияние на качество продукта. В ходе масштабирования проверяются и верифицируются критические параметры процесса. За исключением редких случаев, серии масштабирования являются крайними из немаркетируемых серий. В данных сериях стоит максимально усилить контроль для выявления возможного влияния масштабирования на критические показатели качества продукта (CQAs) и увеличить исследования стабильности препарата для получения максимального количества данных и статистически более обоснованных результатов.
Валидация процесса – данный этап можно по праву назвать самым легким, менее важным и менее трудозатратным в этом списке, ведь доказать, что процесс разработан правильно – легче, чем по факту его разработать. Когда компания использовала при разработке ЛС подход QbD, она досконально изучила свой продукт и процесс его производства. В ходе выполненных экспериментов было получено статистически значимое количество данных по каждому этапу и параметру процесса, а сам процесс имеет высокий индекс воспроизводимости (Process Capability Index).
В данном случае производителю далее следует использовать непрерывную верификацию процесса.
Если первоначальная разработка продукта велась по стандартному подходу, тогда возможно применение гибридного подхода (условно «среднее» между традиционной валидацией и непрерывной верификацией процесса). В данном подходе, основываясь на статистическом анализе данных, которые производитель сумел получить, определяется количество дополнительных серий, которые требуется произвести для увеличения индекса воспроизводимости процесса. Эти дополнительные серии будут считаться «валидационными» и могут стать коммерческими. Количество данных серий напрямую зависит от вариабельности показателей качества продукта и индекса воспроизводимости процесса. Количество валидационных серий продукции на сегодняшний день уже не имеет строгого регулирования в руководящих документах, поэтому общепринятой практикой является определение их числа каждым производителем самостоятельно, применяя риск-ориентированный подход с использованием данных статистического анализа.
Следующие темы заслуживают отдельного внимания:
ПРОСТРАНСТВО ПРОЕКТНЫХ ПАРАМЕТРОВ
В соответствии с ICH Q8 пространство проектных параметров описывает взаимосвязь между «входами» процесса (характеристики сырья и параметры процесса) и критическими показателями качества (CQA).
На практике пространство проектных параметров процесса – это наибольший возможный объем, в пределах которого можно варьировать важные факторы процесса без риска нарушения спецификаций. За пределами этого операционного окна могут возникнуть проблемы с одним или несколькими показателями качества продукта.
Хотя наличие проектного поля не является обязательным, его использование дает ряд несомненных преимуществ:
•Подтверждает высокий уровень понимания процесса
•Демонстрирует и поддерживает гибкость процесса
•Обеспечивает понимание для поддержки предлагаемой стратегии контроля
•Обосновывает меньшее количество испытаний готовой продукции
•Обеспечивает обоснование критериев валидации процесса
•Обеспечивает основу для постоянного совершенствования
Согласно требованиям GMP ЕАЭС, использование данного подхода должно быть зафиксировано в регистрационном досье продукта согласно Рекомендации Коллегии Евразийской экономической комиссии от 26 сентября 2017 г. № 19 «О Руководстве по валидации процесса производства лекарственных препаратов для медицинского применения».
Проектирование экспериментов (Design of Experiments, DoE). Концепция проектирования экспериментов может применяться как на уровне этапа разработки, так и на гораздо более продвинутом этапе в целях улучшения уже существующего процесса. Это означает, что данный инструмент полезен не только на начальных этапах разработки процесса, но также может быть с пользой применен к процессам, уже реализуемым в полноценной GMP-среде.
Концепция DoE полезна в следующем:
•Определение факторов, которые в наибольшей степени влияют на отклик (и)
•Определение тех факторов, которые вместе воздействуют на конкретный отклик – они известны как «взаимодействия»
•Определение оптимальных значений факторов для удовлетворения ряда требуемых откликов.
АНАЛИЗ РИСКОВ
Принципы управления рисками эффективно используются во многих областях фармацевтической отрасли и на разных этапах разработки продуктов, процессов и внедрения в производство и являются ценным компонентом эффективной системы качества.
Деятельность по управлению рисками обычно осуществляется междисциплинарными группами.
Мероприятия управления рисками обычно выполняются на ранних этапах процесса фармацевтической разработки для выявления и ранжирования параметров (например, процесса, оборудования, материалов), которые могут иметь потенциальное влияние на качество продукта. После определения значимых параметров их можно дополнительно изучить для достижения более высокого уровня понимания процесса.
Рис. 2. Стадии жизненного цикла продукта (ISPE GPG: Process validation, стр. 7).
Использование утвержденного подхода к управлению рисками для качества обеспечивает конкретные инструменты для выявления, анализа, оценивания и информирования о рисках на основе знания продукта и развития понимания процесса. Результат управления рисками для качества указывает, где требуется контроль критических параметров и как поддерживать состояние контроля.
При реализации концепта «качество через дизайн» и, соответственно, выработке стратегии контроля ещё на этапе фармразработки, далее речь идёт о верификации этой самой стратегии. В Приложении № 15 GMP ЕАЭС это сформулировано как непрерывная верификация процесса, переходящая в продолжающуюся верификацию процесса в ходе жизненного цикла. Опциональное применение проектного поля (Design Space) имеет ещё одну существенную выгоду – варьирование параметров в рамках определенного проектного поля может не рассматриваться как изменение. Это, в конечном итоге, минимизирует затраты ресурсов как при рассмотрении таких вариаций в рамках процедур управления изменений на предприятии, так и с точки зрения внесения потенциальных изменений в регистрационное досье на препарат – а это уже заметное преимущество. Перерегистрация и внесение изменений в регистрационное досье – процесс, как известно, не быстрый.
В целом жизненный цикл продукта условно разбивается на три стадии (см. рис. 2).
Ввиду того, что валидация процесса перестает быть разовым событием, возрастает важность четко определённых CQA, CPP и верно выработанной стратегии контроля, отражающей особенности процесса. Ведь если это не так, то постоянная фиксация межсерийной вариабельности будет во всех смыслах обременением, влекущим за собой производственные и регуляторные риски, перегруженность лабораторий контроля качества дорогостоящим подтверждением вариабельности по непродуманным стратегиям контроля с риском последующих итераций. Поэтому единственный разумный вариант – прекратить «строить дом с крыши» и с самого начала продумать процесс, так сказать, с «фундамента».
Вместе с тем, руководства ISPE, в частности, рассматривают и случаи, когда продукт уже находится в коммерческой реализации – т. н. Legacy Products. В этом случае продукция начинает свой жизненный цикл с этапа 3.2 (см. рис. 2). Это особенно важный аспект в свете того, что новая версия Приложения № 15 в ЕАЭС вступила в силу только с февраля 2022 года, а до этого момента, безусловно, в коммерческой реализации находилось большое количество зарегистрированных лекарственных препаратов, чья первичная валидация уже была проведена до этого. Для таких препаратов необходимо реализовать продолжающуюся верификацию процесса в ходе жизненного цикла, первично отталкиваясь от данных производства, устанавливая CQA, CPP (если этого не было сделано ранее) и в дальнейшем, при необходимости, внося изменения и/или дополнения в планы отбора проб с целью статистического контроля процесса производства.
Из рациональных предложений в этом плане можно выделить то, что такая деятельность станет частью привычных регулярных обзоров качества продукции с акцентом на обеспечение фиксации событий в режиме реального времени (а не ретроспективно), что позволит при необходимости реализовывать своевременные САРА. Разумеется, в ходе ежегодных обзоров качества исчезнет необходимость дублировать эту деятельность, можно будет просто сослаться на уже построенные тренды и их анализ.
В ходе такой продолжающейся верификации процесса будет возрастать знание в отношении самого процесса, а также будут установлены источники возможной вариабельности. При необходимости, могут быть реализованы изменения, возвращающие процесс как на стадию 2 (повторную валидацию при внесении изменений), так и на стадию 1 (повторную фармразработку).
Для новых лекарственных продуктов настоятельно рекомендуется использовать подход «качество через дизайн», который призван значительно снизить вероятность таких «возвратов» на стадию 1 и стадию 2, что, несомненно, является прямой потерей времени и ресурсов. И пусть фармсообщество не вводит в заблуждение тот факт, что этот подход – «всего лишь» альтернатива «традиционному подходу». Метод проб и ошибок – достаточно дорогостоящий. Именно исключение таких непроизводительных затрат времени и ресурсов является ключевым выходом и ключевой выгодой при следовании подходу «качество через дизайн». Ведь вся суть такого подхода – это статистически значимая «заявка на успех» ещё на этапе фармразработки.
Орлов Владимир Александрович, Директор Евразийского отделения ISPE: «Одной из ключевых задач ISPE на глобальном уровне является развитие и продвижение современных технических решений и организационных мер, направленных на совершенствование процессов промышленного производства лекарственных средств. Как известно, валидация в целом (как система) и валидация процессов (как ключевой элемент указанной системы) являются базисами построения и поддержания фармацевтической системы качества, позволяющими с определённым уровнем «уверенности» гарантировать качество производимой лекарственной продукции в ходе её жизненного цикла. Однако, безусловно, необходимо поэтапно совершенствовать и обновлять в т. ч. сами подходы и методологию валидации процессов – и здесь важно также придерживаться принципов международной гармонизации в части нормативно-технических требований к производству лекарственных средств. Следуя указанным принципам, при разработке и организации образовательных мероприятий с участием ISPE ЕАЭС особый фокус внимания уделяется тому, чтобы участникам и слушателям были представлены современные, актуальные и востребованные материалы, подготавливаемые ведущими отечественными и зарубежными экспертами».
Пряничникова Оксана Михайловна, Заместитель директора Евразийского отделения ISPE, Директор по развитию PQE CIS: «PQE много лет сотрудничает с ISPE на глобальном уровне, так как верит в роль ISPE в объединении отраслевых знаний и развитии стандартов качества на основе вклада каждого из членов крупнейшей фармацевтической Ассоциации в мире. PQE активно делится своим опытом и активно участвует в международных форумах и конференциях ISPE. Если говорить о локальном опыте, то в качестве примера, эксперт PQE Group из Италии принял участие в 1й Конференции Евразийского отделения ISPE в 2020 году c докладом о целостности данных, а специалисты Евразийского отделения PQE Group Юрий Сандлер и Александр Белинский, не только принимают участие в образовательных программах Академии надлежащих практик, но также являются членами ISPE и активными участниками рабочей группы Евразийского отделения ISPE».
Юрий Сандлер, Генеральный директор PQE CIS
Александр Белинский, Главный консультант PQE CIS
Данная статья подготовлена при участии Евразийского отделения ISPE
В рамках развития образовательного направления ISPE ЕАЭС и углубления сотрудничества с «Евразийской Академией надлежащих практик» при участии экспертов PQE Group в феврале 2022 года состоялся вебинар для фармпроизводителей ЕАЭС «Валидация технологического процесса – подход на основании жизненного цикла продукта. Концепция Quality by Design – качество через дизайн». В вебинаре приняли участие: Владимир Орлов, директор Евразийского отделения ISPE, Юрий Сандлер, генеральный директор PQE CIS, Александр Белинский, Главный консультант PQE CIS. В программе были освещены такие вопросы, как:
- Концепция Quality by Design – качество посредством проектирования. Обзор руководств ISPE и практические аспекты их применения, включая руководство о жизненном цикле валидации процесса (ISPE Good Practice Guide: Practical Implementation of the Lifecycle Approach to Process Validation), которое было представлено на Ежегодной конференции ISPE ЕАЭС в ноябре 2021 г.
- Что необходимо выполнить в ходе фармацевтической разработки. Необходимо установить критические показатели качества (CQA) и определяемые ими критические параметры процесса (СPP), критические характеристики материалов (CMA). Рекомендуется (как удобная опция) определять пространство проектных параметров (Design Space).
- Что делать производителю с уже производимой лекарственной продукцией для рынка ЕАЭС? Ведь даже при наличии валидации процесса по традиционному подходу для них обязательной становится продолжающаяся верификация процесса в ходе жизненного цикла.
- Современные подходы к валидации технологических процессов. В данной статье приводится краткое содержание вебинара, которое раскрывает читателям подход и мнение экспертов ISPE и PQE по данной тематике.
Quality by Design – есть у валидации начало, нет у валидации конца.
Слоган выше, характеризующий валидацию, зачастую на различных конференциях произносят по-философски с некоторым налётом грусти. До недавнего времени – без «диковинного» словосочетания «Quality by Design» – «качество через дизайн». Но в связи с вступлением силу обновленного Приложения 15 GMP ЕАЭС (в форме Решения Совета Евразийской экономической комиссии от 14 июля 2021 г. № 65 «О внесении изменений в Правила надлежащей производственной практики Евразийского экономического союза») к этим тяжким раздумьям добавилось и новое понятие, хотя новизной является только его официально закрепленная возможность применения. Вместе с тем, если пойти немного вглубь, то в рамках ЕАЭС концепция «качество через дизайн» впервые прозвучала в тексте Рекомендации Коллегии Евразийской экономической комиссии от 26 сентября 2017 г. № 19 «О Руководстве по валидации процесса производства лекарственных препаратов для медицинского применения». Не говоря уже о том, что и Решение № 65 (соответствующее в целом приложению 1 5 GMP EU) и Рекомендация № 19 (соответствующее в целом Руководству ЕМА по валидации процесса) всего лишь актуализируют достаточно давно прорабатываемый концепт, сменяющий подход «Quality by Testing», как неприемлемый в виду запредельной контрпродуктивности. Делая акцент на тестирование готовой продукции, мы пытались компенсировать отсутствие знаний о продукте и процессе, что приводило к значительному риску производства некачественного продукта и убыткам для компании.
Что же скрывается за словосочетанием «качество через дизайн» (Quality by Design), которое теперь предложено к рассмотрению? Оттолкнемся от определения, данного по текстам Решения 65 и Рекомендации № 19 – это системный подход, предусматривающий определение целей перед началом разработки продукции, точную оценку продукции и процесса ее производства, а также контроль процесса производства на основе научных данных и принципов управления рисками для качества.
Звучит это всё как «пугающее наукообразие». Мало того, что валидация процесса на современном этапе перестает быть разовым событием – уже исключен вариант произвести «коекак» три валидационные серии и «забыть» о валидации на какое-то время – так вдобавок ещё и предлагается осуществлять контроль процесса производства на основе научных подходов. Таким образом, наукоемкость и ресурсоемкость процесса очевидно возрастают. При этом не следует забывать, что если подход «качество через дизайн» является в настоящее время допустимой альтернативой, то продолжающаяся верификация процесса в ходе жизненного цикла становится безальтернативным обязательством.
Казалось бы, эти нововведения могут восприниматься как очередной «регуляторный прессинг», «гиря на ногах бизнеса». Однако при более детальном рассмотрении выясняется, что как раз реализация концепта «качество через дизайн» способна сократить затраты по выведению на рынок новых лекарственных препаратов вплоть до 25%. За счет чего может быть достигнут такой эффект? По сравнению с традиционным подходом (когда этап фарм– разработки выполнялся без должного статистического обоснования, во многом эмпирическим путем, «по наитию»), больший фокус внимания уделяется именно этапу фармацевтической разработки – именно там формируется целевой профиль продукта, а также связанные с ним CQA (критические показатели качества), CPP (критические параметры процесса), как возможная опция – пространство проектных параметров (Design Space) и стратегия контроля. Считается, что реализация такого концепта не принесёт какой-то значимой экономии на этапе фармразработки, однако обеспечит статистически обоснованные знания о продукте и процессе, что заметно упростит масштабирование, трансфер и производство последующих коммерческих серий, поскольку процесс будет заведомо в состоянии статистического контроля (см. рис. 1).
Рис. 1. Обзор концепта «качество через дизайн»
Далее следует краткое описание главных этапов процесса при разработке лекарственных средств согласно ICH Q8 и руководствам PQLI от ISPE от ранней разработки до производства коммерческих серий.
Этапы расположены в логическом и хронологическом порядке:
- Определение целевого профиля качества препарата (Quality Target Product Profile, QTPP) – Задача данного этапа обеспечить понимание того, что будет гарантировать качество, безопасность и эффективность конкретного продукта для пациента.
QTPP описывает критерии проекта для продукта, формирует основу для разработки CQA, CPP и стратегии контроля.
Аспекты целевого профиля качества продукта могут включать, но не ограничиваются следующим:
Предполагаемое применение в клинической практике, способ введения, лекарственная форма, системы доставки;
- Дозировка (–и);
- Система упаковки/укупорки;
- Высвобождение или доставка лекарственного вещества и свойства, влияющие на фармакокинетические характеристики (например, растворение, всасывание и т. д.), которые соответствуют разрабатываемой лекарственной форме препарата;
- Критерии качества лекарственного препарата (например, стерильность, чистота, стабильность и высвобождение лекарственного вещества), которые соответствуют предполагаемому продукту для реализации на рынке.
- Определение критических показателей качества (CQA) можно рассматривать как количественное представление QTPP. В руководстве Q8 (R2) определение CQA гласит: «Физическое, химическое, биологическое или микробиологическое свойство, или характеристика, которые должны соответствовать установленным нормам, диапазону или распределению для обеспечения желаемого качества продукта».
Описание их выведения по результатам работ по разработке приведено в руководстве Q8 (R2).
CQA обычно связаны со следующим:
- Фармацевтическая субстанция
- Вспомогательные вещества
- Полупродукты (внутрипроизводственные материалы)
- Лекарственный препарат
Выявление критических показателей носит итеративный характер и требует как можно более раннего обращения внимания в ходе выполнения работ на то, чтобы вывести из QTPP первоначальный перечень потенциальных CQA для продукта и перейти к изучению предложенного перечня критических характеристик качества продукта, устанавливая критерии приемлемости для тех показателей, которые признаны критическими. Соответствующие CQA могут быть выявлены с помощью итеративного процесса управления рисками для качества (QRM, который является неотъемлемой частью ФСК и экспериментов, оценивающих степень, в которой их изменчивость может повлиять на качество лекарственного препарата).
- Критические характеристики материала (CMA) и параметры процесса (CPP) – определяются как «материал или процесс, вариабельность которых влияет на критический показатель качества, поэтому следует проводить их мониторинг или контролировать для обеспечения желаемого качества лекарственного препарата». Критические показатели качества (CQA) лекарственного препарата и их QTPP учитываются при выборе вспомогательных веществ и параметров процесса.
А именно:
- «Материал» означает сырье, исходные материалы, реактивы, растворители, вспомогательные вещества, промежуточные продукты и т. д., а «Характеристика» означает физическое, химическое, биологическое или микробиологическое свойство, или характеристики данного материала, которые можно измерить. Это может быть морфология частиц, концентрация и тип ингредиентов, соотношение ингредиентов, растворимость в воде, pH и т. д. Характеристика материала имеет критическое значение, когда с большой долей вероятности может повлиять на CQA.
- Критические параметры процесса (CPP) – это еще одна категория факторов риска, связанных с производственными переменными.
Управление рисками качества обычно используется для выявления областей разработки с риском для CQA, однако недостаточно выявить только CPP и CMA. Общая оценка рисков указывает на отдельные операции с риском, а более детальная оценка – выявляет потенциальные факторы, которые могут повлиять на CQA. При этом одной только оценки рисков недостаточно для выявления и контроля CPP. Она может быть основана только на измерении того, как факторы непосредственно влияют на отклик*.
Иными словами, как и для определения критических показателей качества продукта, так и для определения критических параметров процесса необходим научный подход с множеством поставленных экспериментов и статистическим анализом полученных данных.
Разработка стратегии контроля — структурированный подход с участием многопрофильной группы экспертов, связывающих разработку фармацевтической продукции с производственным процессом и инженерно-техническими средствами контроля технологического оборудования. Необходимо тщательно разработать и спланировать мероприятия, чтобы получить продукт, соответствующий установленным показателям качества; поэтому важно получить как можно больше информации о действующих веществах, продукте и производственном процессе, которые подвергаются проверке. Все технологические процессы должны быть разработаны таким образом, чтобы они позволяли стабильно получать продукты, соответствующие критическим показателям качества (CQA), в основном касающимся подлинности, дозировки, качества, чистоты и активности.
По итогу данного процесса компания производитель должна получить эффективную стратегию контроля, отлично понимая, как влияют различные этапы процесса на критические параметры качества продукта, и иметь возможность это доказать. В отличие от подхода «Качество путем контроля» (Quality by Testing), эффективность стратегии заключается и в минимизации контрольных точек в процессе производства, например, если было выявлено, что определенный этап производства не влияет на pH раствора, то нет смысла тратить ресурсы на его контроль после данного этапа.
Масштабирование процесса (Process Scale-Up) – переход от лабораторных / пилотных серий к полномасштабным (коммерческим) сериям. На данном этапе уже должно быть полное понимание процесса и его влияние на качество продукта. В ходе масштабирования проверяются и верифицируются критические параметры процесса. За исключением редких случаев, серии масштабирования являются крайними из немаркетируемых серий. В данных сериях стоит максимально усилить контроль для выявления возможного влияния масштабирования на критические показатели качества продукта (CQAs) и увеличить исследования стабильности препарата для получения максимального количества данных и статистически более обоснованных результатов.
Валидация процесса – данный этап можно по праву назвать самым легким, менее важным и менее трудозатратным в этом списке, ведь доказать, что процесс разработан правильно – легче, чем по факту его разработать. Когда компания использовала при разработке ЛС подход QbD, она досконально изучила свой продукт и процесс его производства. В ходе выполненных экспериментов было получено статистически значимое количество данных по каждому этапу и параметру процесса, а сам процесс имеет высокий индекс воспроизводимости (Process Capability Index).
В данном случае производителю далее следует использовать непрерывную верификацию процесса.
Если первоначальная разработка продукта велась по стандартному подходу, тогда возможно применение гибридного подхода (условно «среднее» между традиционной валидацией и непрерывной верификацией процесса). В данном подходе, основываясь на статистическом анализе данных, которые производитель сумел получить, определяется количество дополнительных серий, которые требуется произвести для увеличения индекса воспроизводимости процесса. Эти дополнительные серии будут считаться «валидационными» и могут стать коммерческими. Количество данных серий напрямую зависит от вариабельности показателей качества продукта и индекса воспроизводимости процесса. Количество валидационных серий продукции на сегодняшний день уже не имеет строгого регулирования в руководящих документах, поэтому общепринятой практикой является определение их числа каждым производителем самостоятельно, применяя риск-ориентированный подход с использованием данных статистического анализа.
Следующие темы заслуживают отдельного внимания:
ПРОСТРАНСТВО ПРОЕКТНЫХ ПАРАМЕТРОВ
В соответствии с ICH Q8 пространство проектных параметров описывает взаимосвязь между «входами» процесса (характеристики сырья и параметры процесса) и критическими показателями качества (CQA).
На практике пространство проектных параметров процесса – это наибольший возможный объем, в пределах которого можно варьировать важные факторы процесса без риска нарушения спецификаций. За пределами этого операционного окна могут возникнуть проблемы с одним или несколькими показателями качества продукта.
Хотя наличие проектного поля не является обязательным, его использование дает ряд несомненных преимуществ:
- Подтверждает высокий уровень понимания процесса
- Демонстрирует и поддерживает гибкость процесса
- Обеспечивает понимание для поддержки предлагаемой стратегии контроля
- Обосновывает меньшее количество испытаний готовой продукции
- Обеспечивает обоснование критериев валидации процесса
- Обеспечивает основу для постоянного совершенствования
Согласно требованиям GMP ЕАЭС, использование данного подхода должно быть зафиксировано в регистрационном досье продукта согласно Рекомендации Коллегии Евразийской экономической комиссии от 26 сентября 2017 г. № 19 «О Руководстве по валидации процесса производства лекарственных препаратов для медицинского применения».
Проектирование экспериментов (Design of Experiments, DoE). Концепция проектирования экспериментов может применяться как на уровне этапа разработки, так и на гораздо более продвинутом этапе в целях улучшения уже существующего процесса. Это означает, что данный инструмент полезен не только на начальных этапах разработки процесса, но также может быть с пользой применен к процессам, уже реализуемым в полноценной GMP-среде.
Концепция DoE полезна в следующем:
- Определение факторов, которые в наибольшей степени влияют на отклик (и)
- Определение тех факторов, которые вместе воздействуют на конкретный отклик – они известны как «взаимодействия»
- Определение оптимальных значений факторов для удовлетворения ряда требуемых откликов.
АНАЛИЗ РИСКОВ
Принципы управления рисками эффективно используются во многих областях фармацевтической отрасли и на разных этапах разработки продуктов, процессов и внедрения в производство и являются ценным компонентом эффективной системы качества.
Деятельность по управлению рисками обычно осуществляется междисциплинарными группами.
Мероприятия управления рисками обычно выполняются на ранних этапах процесса фармацевтической разработки для выявления и ранжирования параметров (например, процесса, оборудования, материалов), которые могут иметь потенциальное влияние на качество продукта. После определения значимых параметров их можно дополнительно изучить для достижения более высокого уровня понимания процесса.
Рис. 2. Стадии жизненного цикла продукта (ISPE GPG: Process validation, стр. 7).
Использование утвержденного подхода к управлению рисками для качества обеспечивает конкретные инструменты для выявления, анализа, оценивания и информирования о рисках на основе знания продукта и развития понимания процесса. Результат управления рисками для качества указывает, где требуется контроль критических параметров и как поддерживать состояние контроля.
При реализации концепта «качество через дизайн» и, соответственно, выработке стратегии контроля ещё на этапе фармразработки, далее речь идёт о верификации этой самой стратегии. В Приложении № 15 GMP ЕАЭС это сформулировано как непрерывная верификация процесса, переходящая в продолжающуюся верификацию процесса в ходе жизненного цикла. Опциональное применение проектного поля (Design Space) имеет ещё одну существенную выгоду – варьирование параметров в рамках определенного проектного поля может не рассматриваться как изменение. Это, в конечном итоге, минимизирует затраты ресурсов как при рассмотрении таких вариаций в рамках процедур управления изменений на предприятии, так и с точки зрения внесения потенциальных изменений в регистрационное досье на препарат – а это уже заметное преимущество. Перерегистрация и внесение изменений в регистрационное досье – процесс, как известно, не быстрый.
В целом жизненный цикл продукта условно разбивается на три стадии (см. рис. 2).
Ввиду того, что валидация процесса перестает быть разовым событием, возрастает важность четко определённых CQA, CPP и верно выработанной стратегии контроля, отражающей особенности процесса. Ведь если это не так, то постоянная фиксация межсерийной вариабельности будет во всех смыслах обременением, влекущим за собой производственные и регуляторные риски, перегруженность лабораторий контроля качества дорогостоящим подтверждением вариабельности по непродуманным стратегиям контроля с риском последующих итераций. Поэтому единственный разумный вариант – прекратить «строить дом с крыши» и с самого начала продумать процесс, так сказать, с «фундамента».
Вместе с тем, руководства ISPE, в частности, рассматривают и случаи, когда продукт уже находится в коммерческой реализации – т. н. Legacy Products. В этом случае продукция начинает свой жизненный цикл с этапа 3.2 (см. рис. 2). Это особенно важный аспект в свете того, что новая версия Приложения № 15 в ЕАЭС вступила в силу только с февраля 2022 года, а до этого момента, безусловно, в коммерческой реализации находилось большое количество зарегистрированных лекарственных препаратов, чья первичная валидация уже была проведена до этого. Для таких препаратов необходимо реализовать продолжающуюся верификацию процесса в ходе жизненного цикла, первично отталкиваясь от данных производства, устанавливая CQA, CPP (если этого не было сделано ранее) и в дальнейшем, при необходимости, внося изменения и/или дополнения в планы отбора проб с целью статистического контроля процесса производства.
Из рациональных предложений в этом плане можно выделить то, что такая деятельность станет частью привычных регулярных обзоров качества продукции с акцентом на обеспечение фиксации событий в режиме реального времени (а не ретроспективно), что позволит при необходимости реализовывать своевременные САРА. Разумеется, в ходе ежегодных обзоров качества исчезнет необходимость дублировать эту деятельность, можно будет просто сослаться на уже построенные тренды и их анализ.
В ходе такой продолжающейся верификации процесса будет возрастать знание в отношении самого процесса, а также будут установлены источники возможной вариабельности. При необходимости, могут быть реализованы изменения, возвращающие процесс как на стадию 2 (повторную валидацию при внесении изменений), так и на стадию 1 (повторную фармразработку).
Для новых лекарственных продуктов настоятельно рекомендуется использовать подход «качество через дизайн», который призван значительно снизить вероятность таких «возвратов» на стадию 1 и стадию 2, что, несомненно, является прямой потерей времени и ресурсов. И пусть фармсообщество не вводит в заблуждение тот факт, что этот подход – «всего лишь» альтернатива «традиционному подходу». Метод проб и ошибок – достаточно дорогостоящий. Именно исключение таких непроизводительных затрат времени и ресурсов является ключевым выходом и ключевой выгодой при следовании подходу «качество через дизайн». Ведь вся суть такого подхода – это статистически значимая «заявка на успех» ещё на этапе фармразработки.

Пряничникова Оксана Михайловна, Заместитель директора Евразийского отделения ISPE, Директор по развитию PQE CIS: «PQE много лет сотрудничает с ISPE на глобальном уровне, так как верит в роль ISPE в объединении отраслевых знаний и развитии стандартов качества на основе вклада каждого из членов крупнейшей фармацевтической Ассоциации в мире. PQE активно делится своим опытом и активно участвует в международных форумах и конференциях ISPE. Если говорить о локальном опыте, то в качестве примера, эксперт PQE Group из Италии принял участие в 1й Конференции Евразийского отделения ISPE в 2020 году c докладом о целостности данных, а специалисты Евразийского отделения PQE Group Юрий Сандлер и Александр Белинский, не только принимают участие в образовательных программах Академии надлежащих практик, но также являются членами ISPE и активными участниками рабочей группы Евразийского отделения ISPE».
СПРАВОЧНАЯ ИНФОРМАЦИЯ:
Евразийское отделение ISPE – локальное отделение ISPE в Евразийском экономическом союзе, существующее в виде НКО (некоммерческой организации), открытое на базе МАФИ ЕАЭС. Ассоциация создана группой инициативных лиц из фармотрасли, которые объединены идеей продвижения наиболее актуальных и востребованных технологий и идей в области фармацевтического производства, базирующееся на современных аспектах регуляторных требований, технических решений и научных знаний применительно ко всему жизненному циклу лекарственного средства.
PQE Group – международная консалтинговая Группа компаний, офисы представлены в 34 странах мира, Штаб-квартира находится в Италии. Более 20 лет PQE оказывает поддержку мировым производителям лекарственных средств и медицинских изделий в области обеспечения качества.
В странах СНГ PQE работает с 2011 года, за время работы на территории России и ЕАЭС PQE было реализовано более 100 проектов для большинства крупнейших предприятий фарминдустрии. Важным аспектом деятельности PQE является сотрудничество с локальными и международными Ассоциациями и Регуляторами.

Чтобы узнать больше, свяжитесь с представителем PQE CIS в России по электронной почте ru.info@pqegroup.com
ООО «ПИКЬЮИ СИАЙЭС»
127015, г.Москва ул. Новодмитровская д.2, к.2 БЦ Савеловский Сити, башня Davis.
Тел.: +7 (495) 133 — 98 — 36