-
Главная -
Новости -
Всё о НОД
-
Структура НОД
-
Президиум НОД -
Исполнительная дирекция -
Члены НОД
-
-
Членство в НОД
-
Как вступить в НОД -
Преимущества членства в НОД -
Положение о членстве в НОД -
Членские взносы
-
-
Система СДСД
-
Что такое СДСД -
Положение о СДСД -
О структурных органах -
Порядок проведения -
Документы для прохождения СДСД -
Положение о Знаке соответствия -
Организации, прошедшие СДСД
-
-
Деятельность НОД
-
Издания НОД -
Сотрудничество -
Решения коллегиальных органов
-
-
Номинации и поощрения
-
О поощрении членов НОД -
Почётный член НОД -
Грант им. Г.И. Останина -
Премия им. В.И. Вашкова -
Номинации членов НОД
-
-
Совет производителей
-
Положение о Совете -
Состав -
Этический кодекс
-
-
Информация для населения
-
-
Журнал «ДезДело» -
Документы
-
Общие вопросы -
Дезинфекция -
Дезинсекция -
Дератизация -
Стерилизация -
Эпидемиология -
Медицинские отходы
-
-
Контакты -
Реклама
-
Главная -
Новости -
Всё о НОД
-
Структура НОД
-
Президиум НОД -
Исполнительная дирекция -
Члены НОД
-
-
Членство в НОД
-
Как вступить в НОД -
Преимущества членства в НОД -
Положение о членстве в НОД -
Членские взносы
-
-
Система СДСД
-
Что такое СДСД -
Положение о СДСД -
О структурных органах -
Порядок проведения -
Документы для прохождения СДСД -
Положение о Знаке соответствия -
Организации, прошедшие СДСД
-
-
Деятельность НОД
-
Издания НОД -
Сотрудничество -
Решения коллегиальных органов
-
-
Номинации и поощрения
-
О поощрении членов НОД -
Почётный член НОД -
Грант им. Г.И. Останина -
Премия им. В.И. Вашкова -
Номинации членов НОД
-
-
Совет производителей
-
Положение о Совете -
Состав -
Этический кодекс
-
-
Информация для населения
-
-
Журнал «ДезДело» -
Документы
-
Общие вопросы -
Дезинфекция -
Дезинсекция -
Дератизация -
Стерилизация -
Эпидемиология -
Медицинские отходы
-
-
Контакты -
Реклама
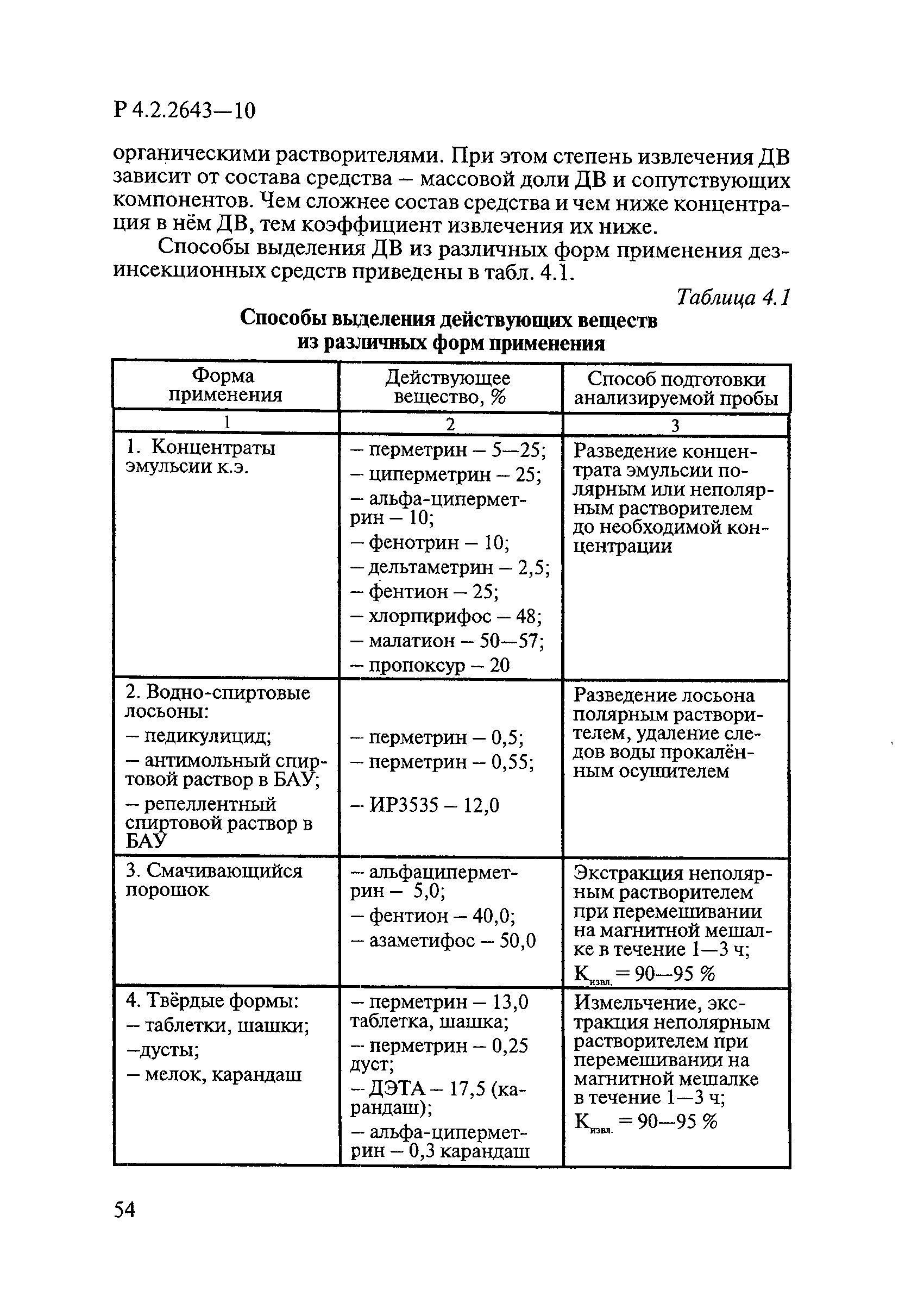
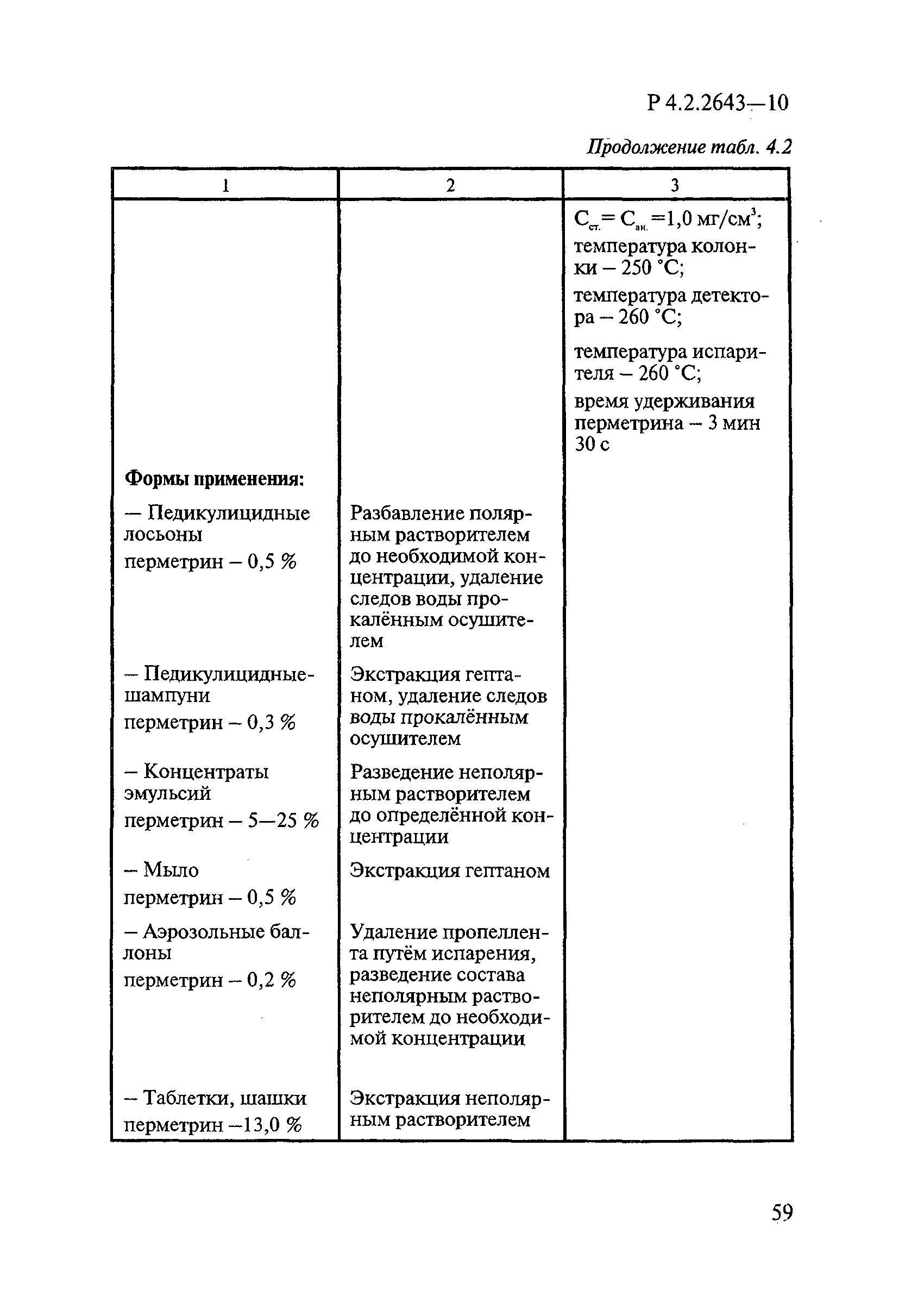
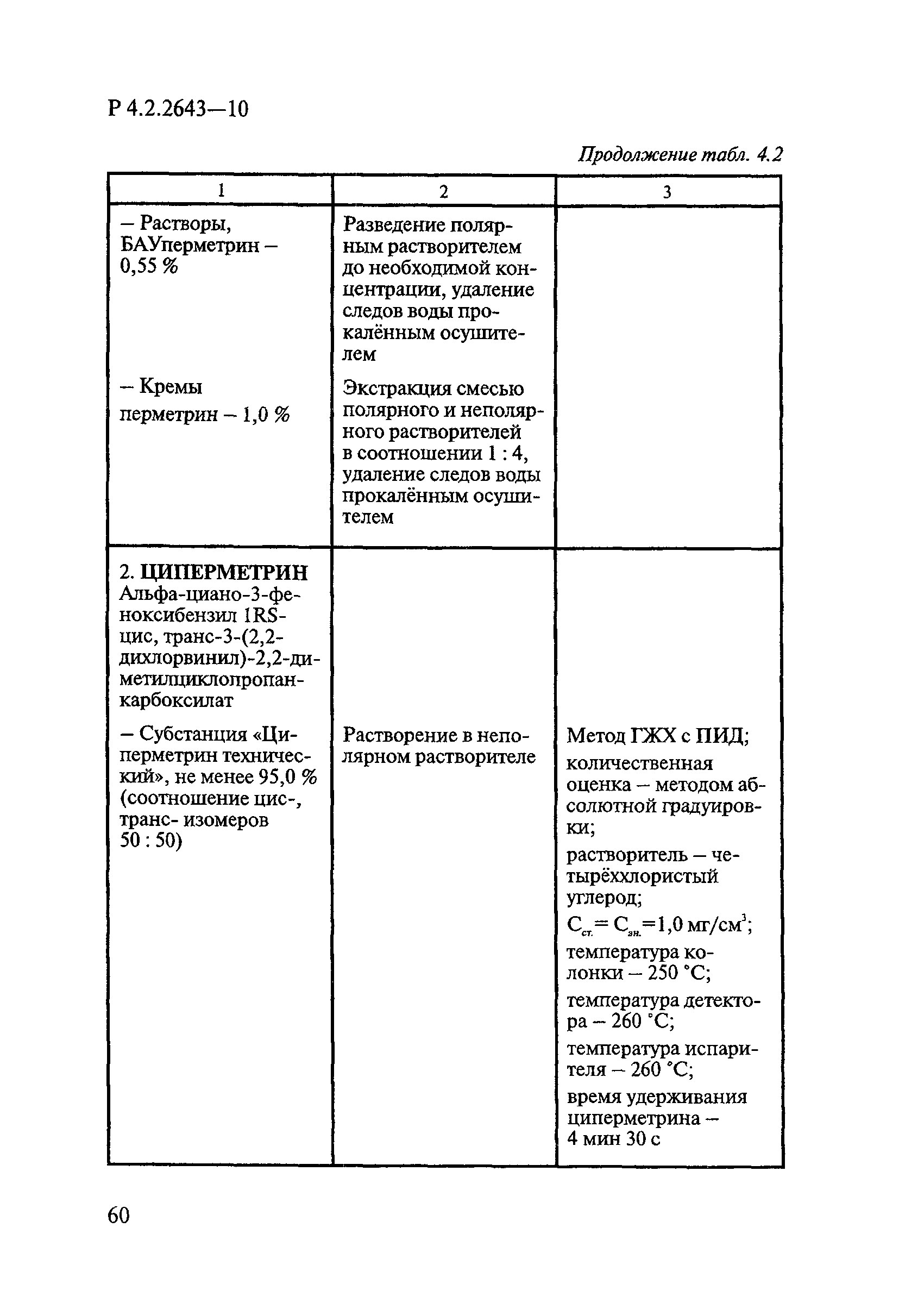
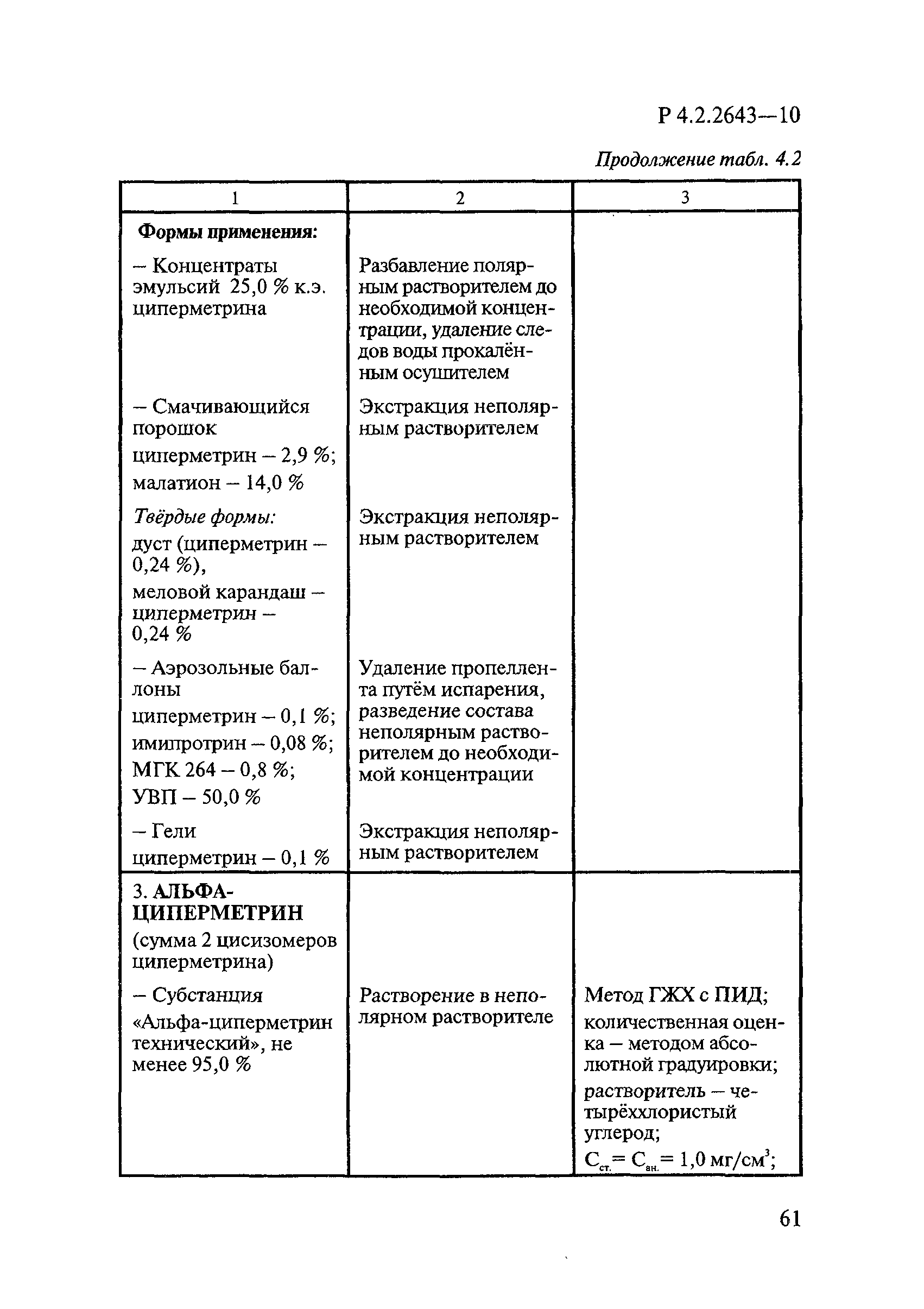
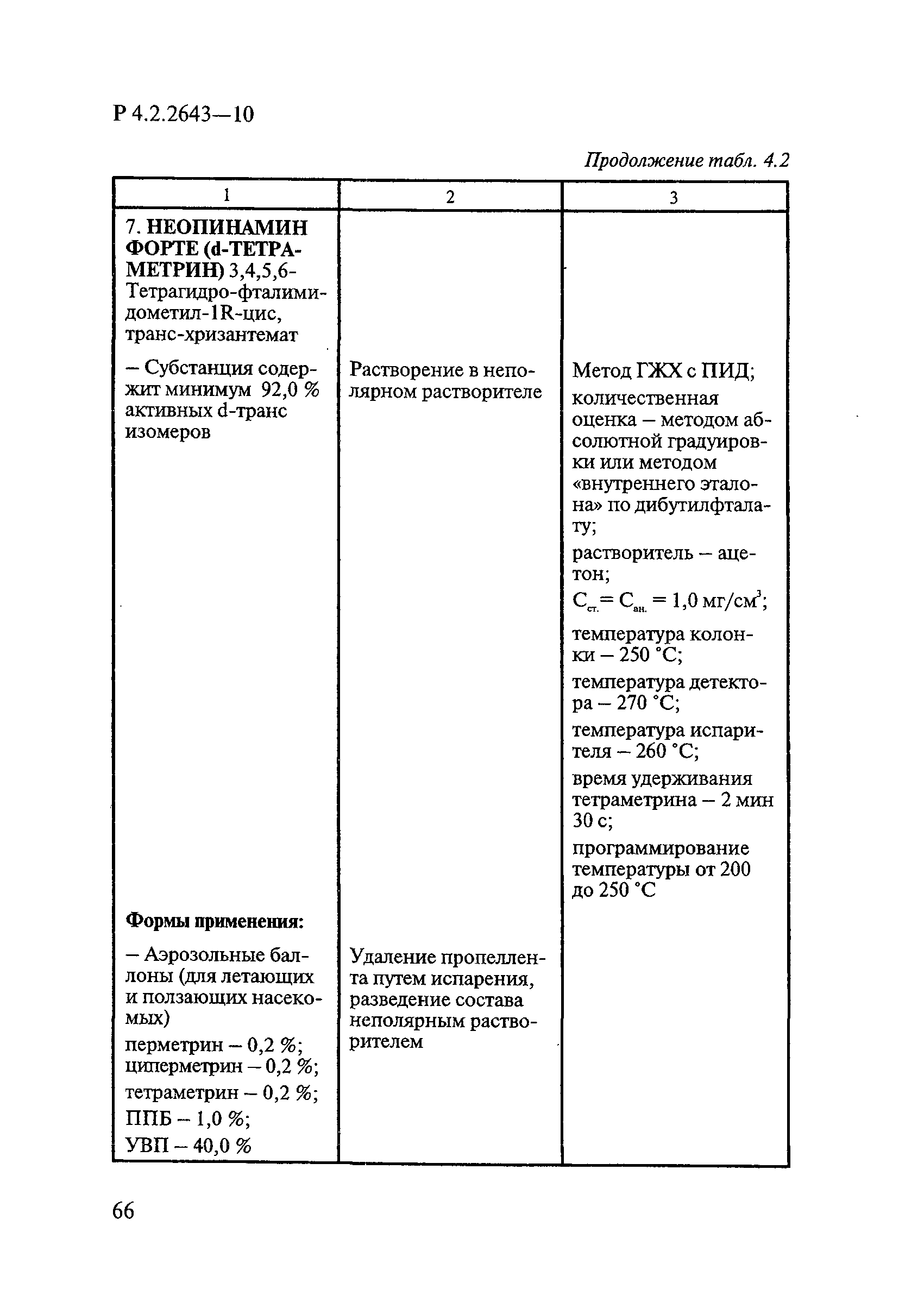
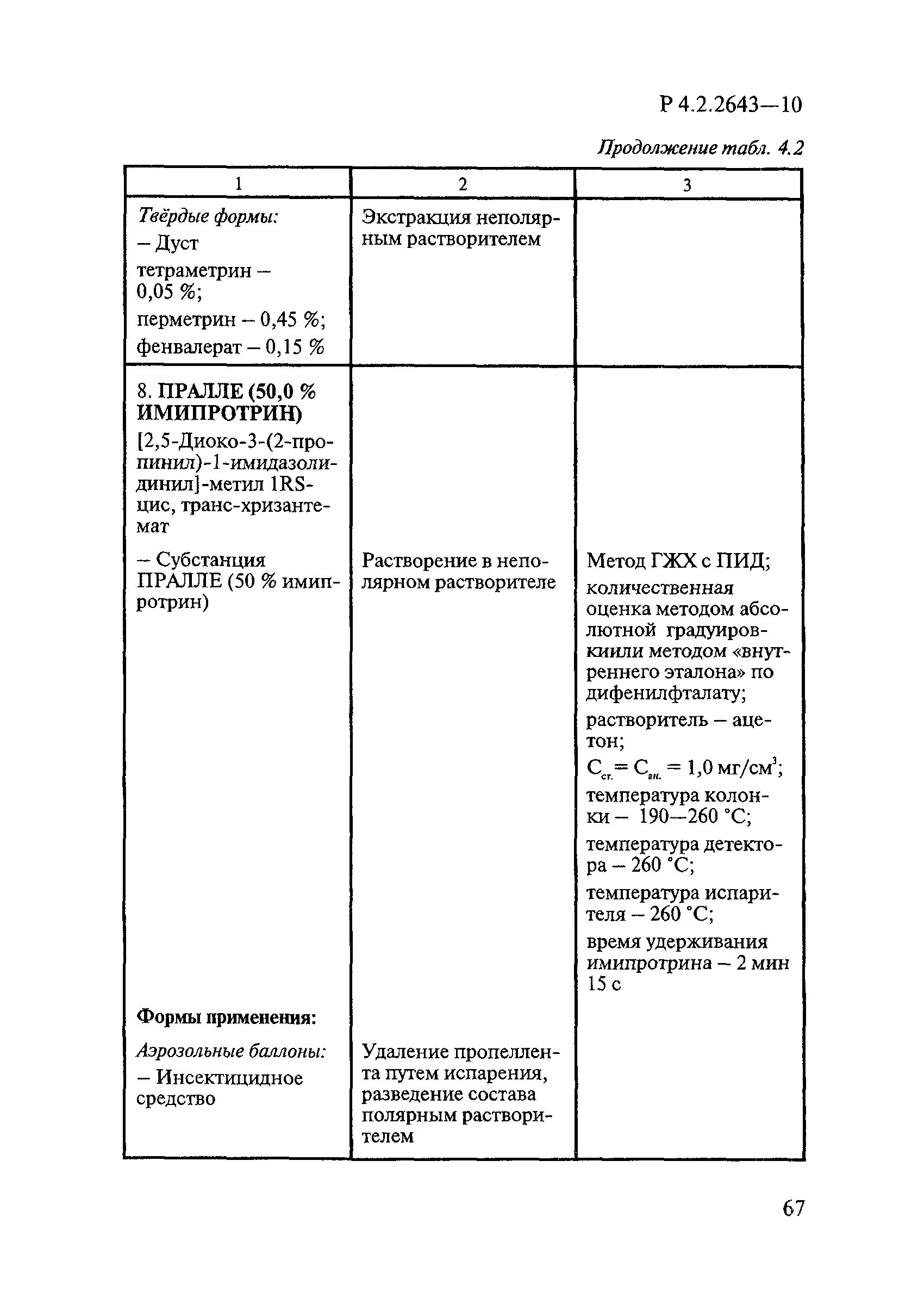
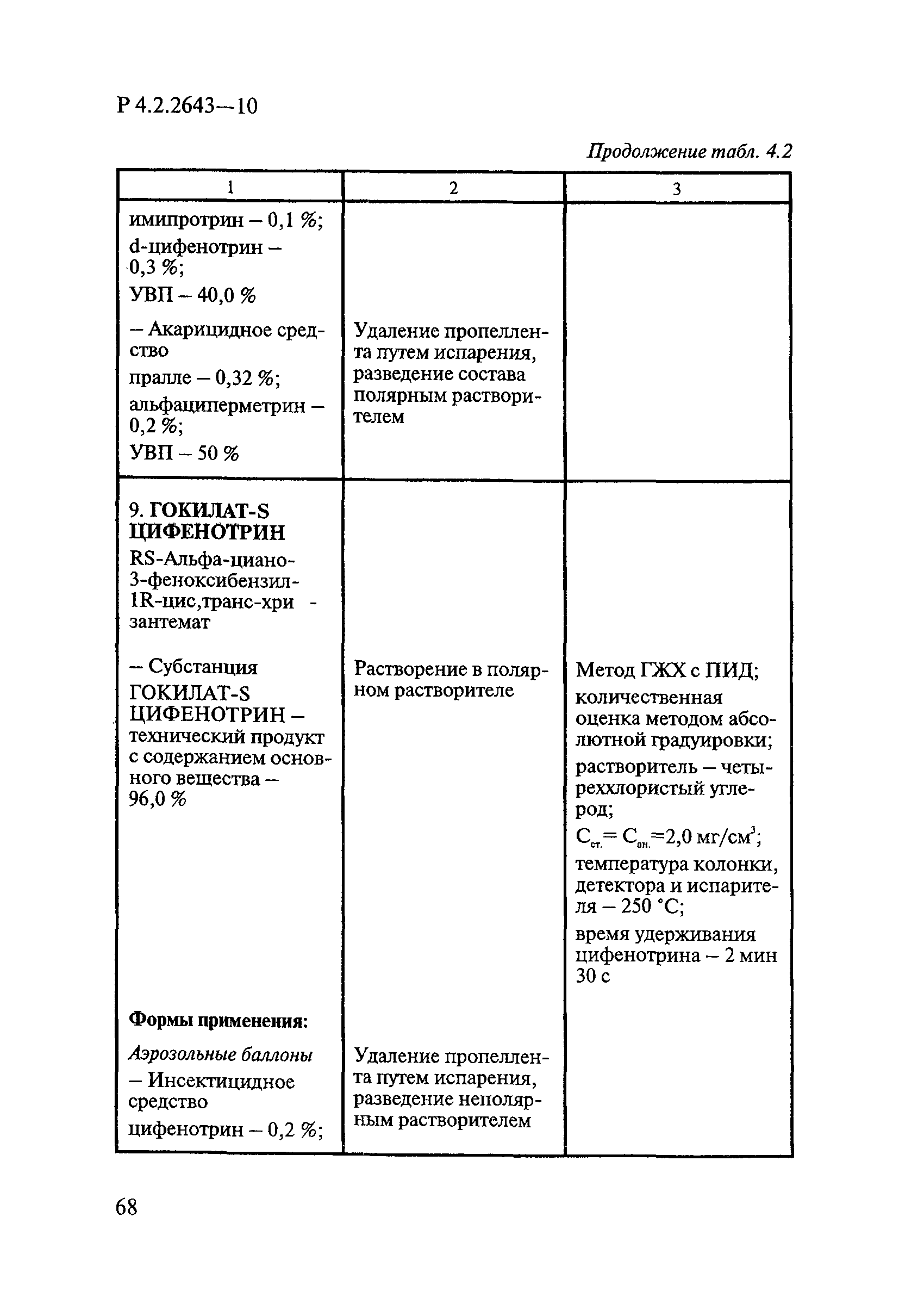
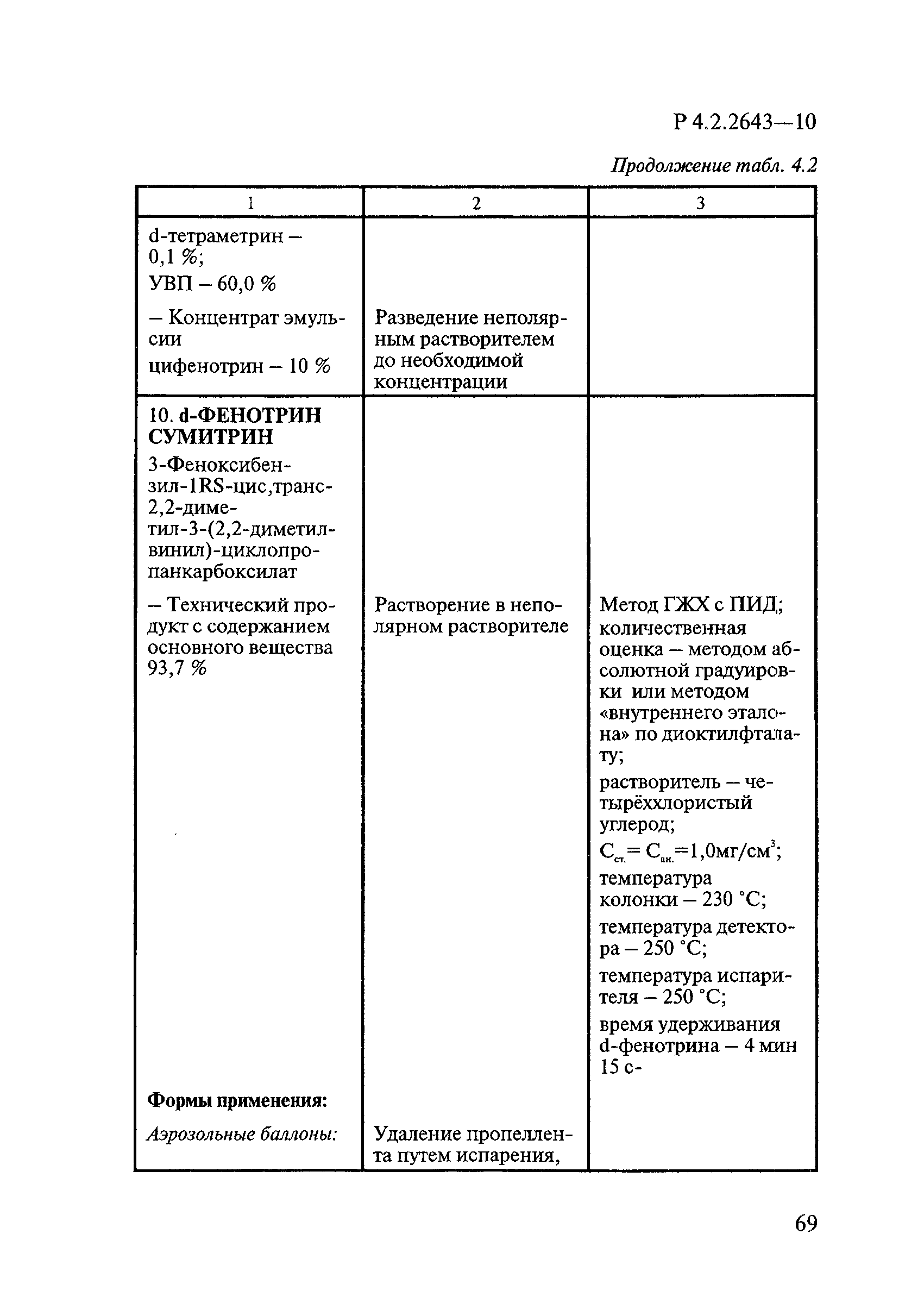
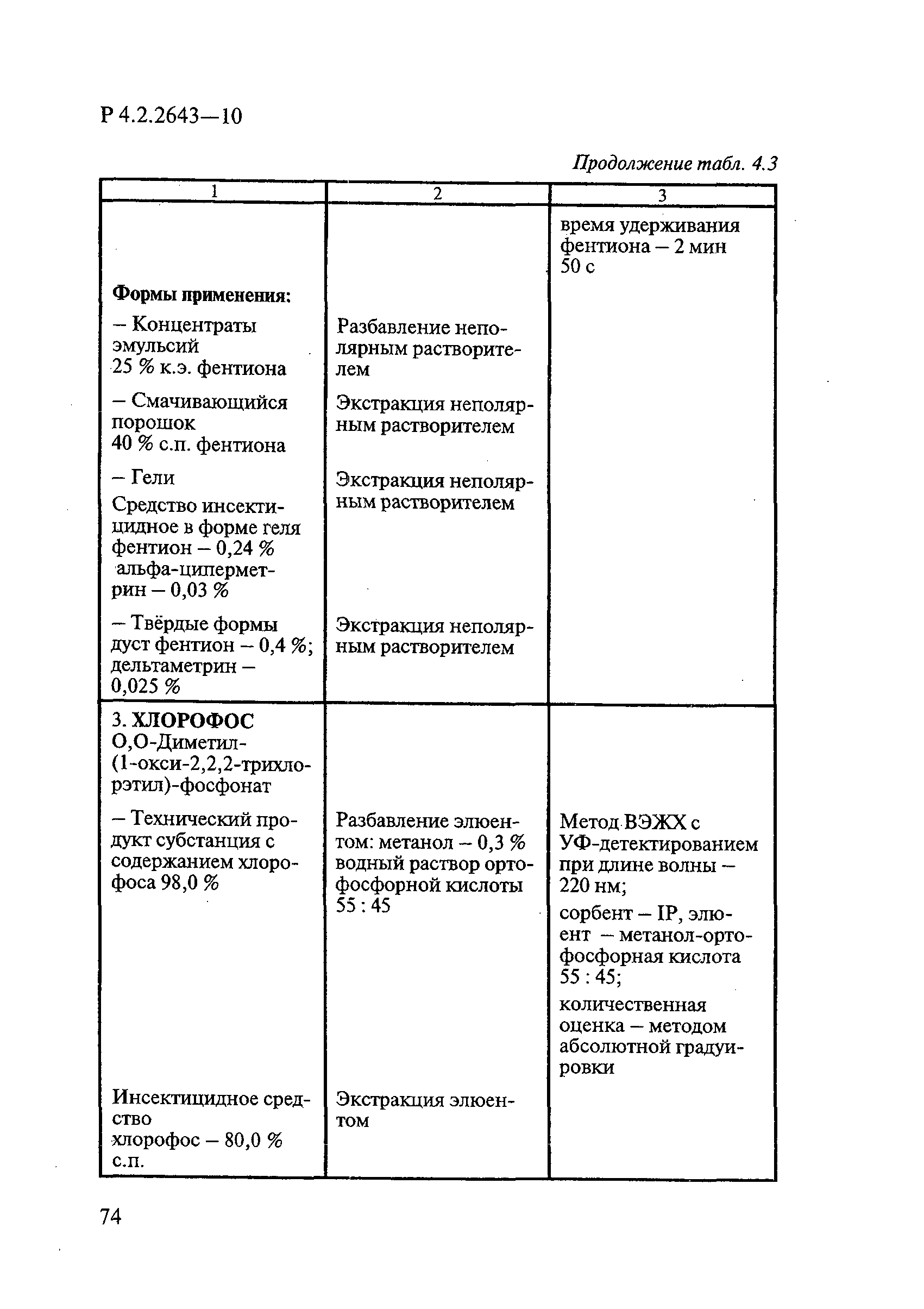
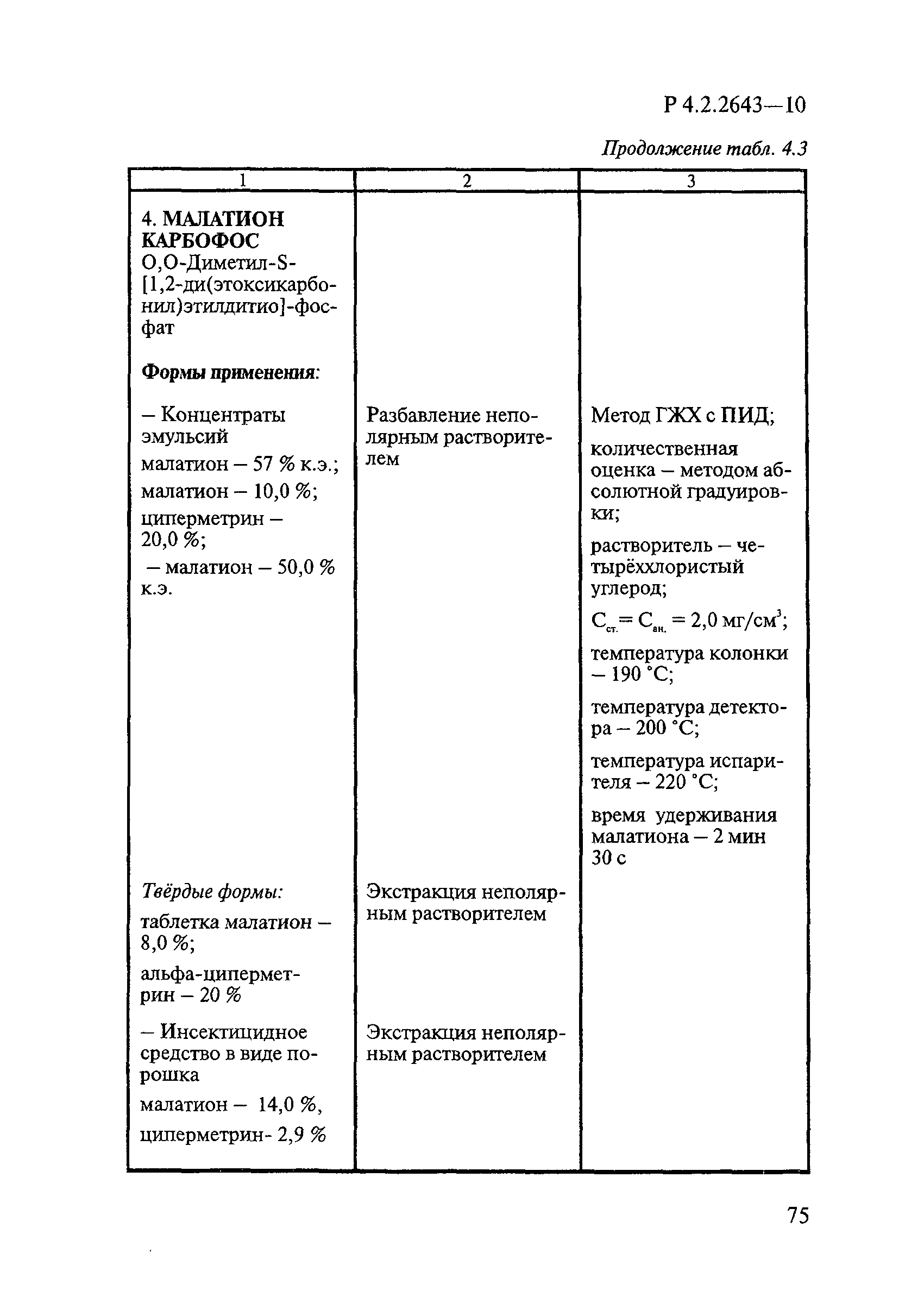
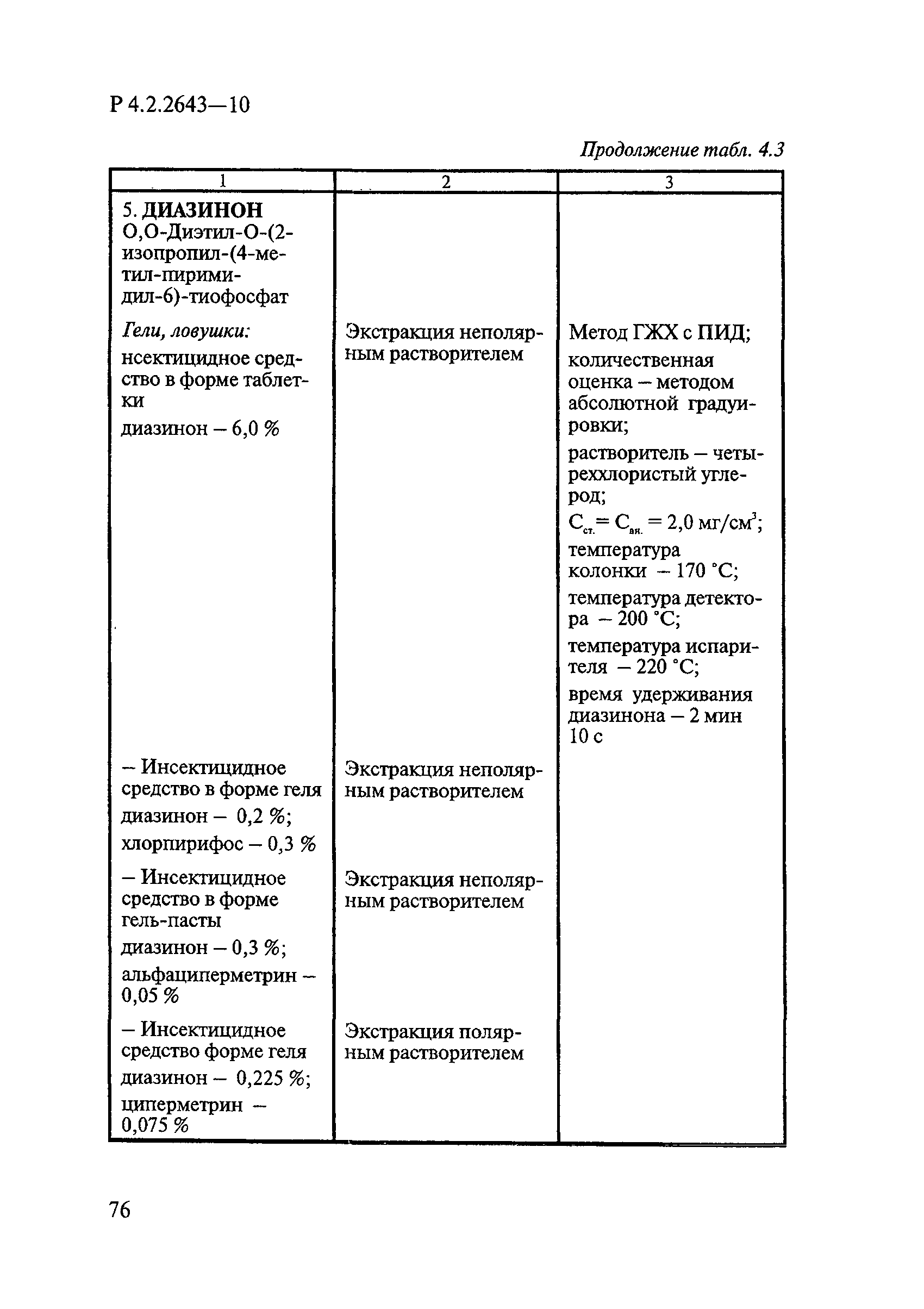
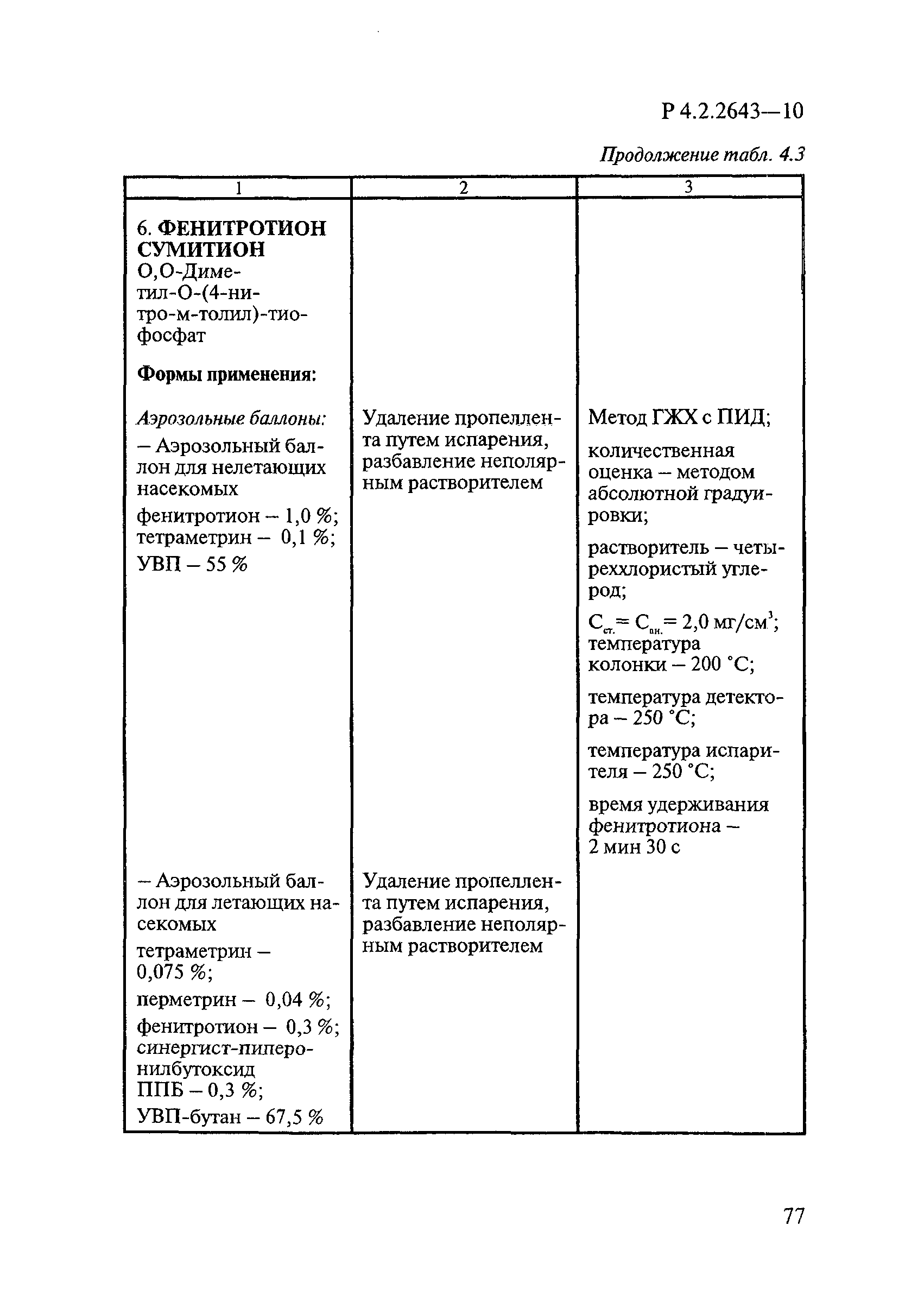
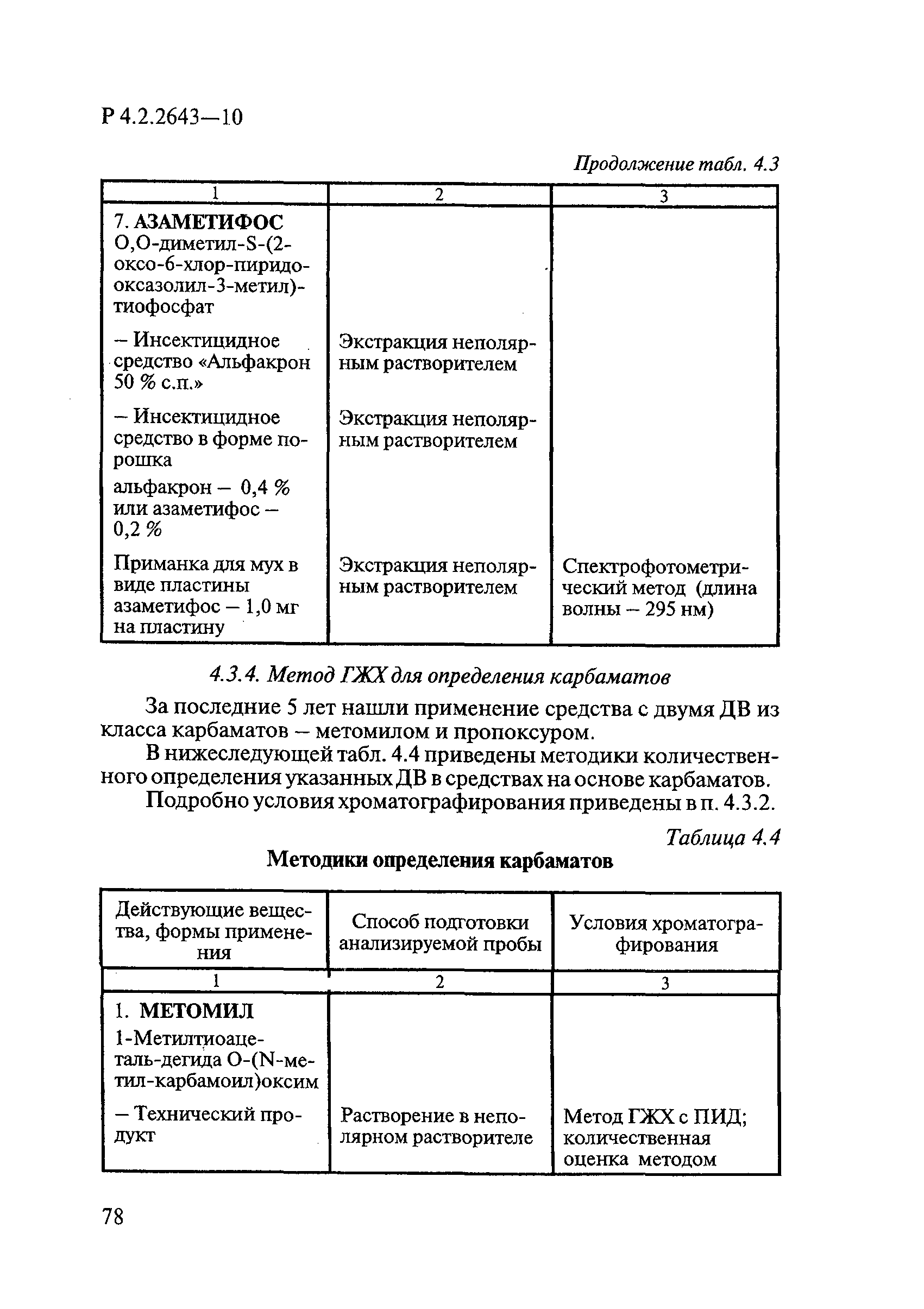
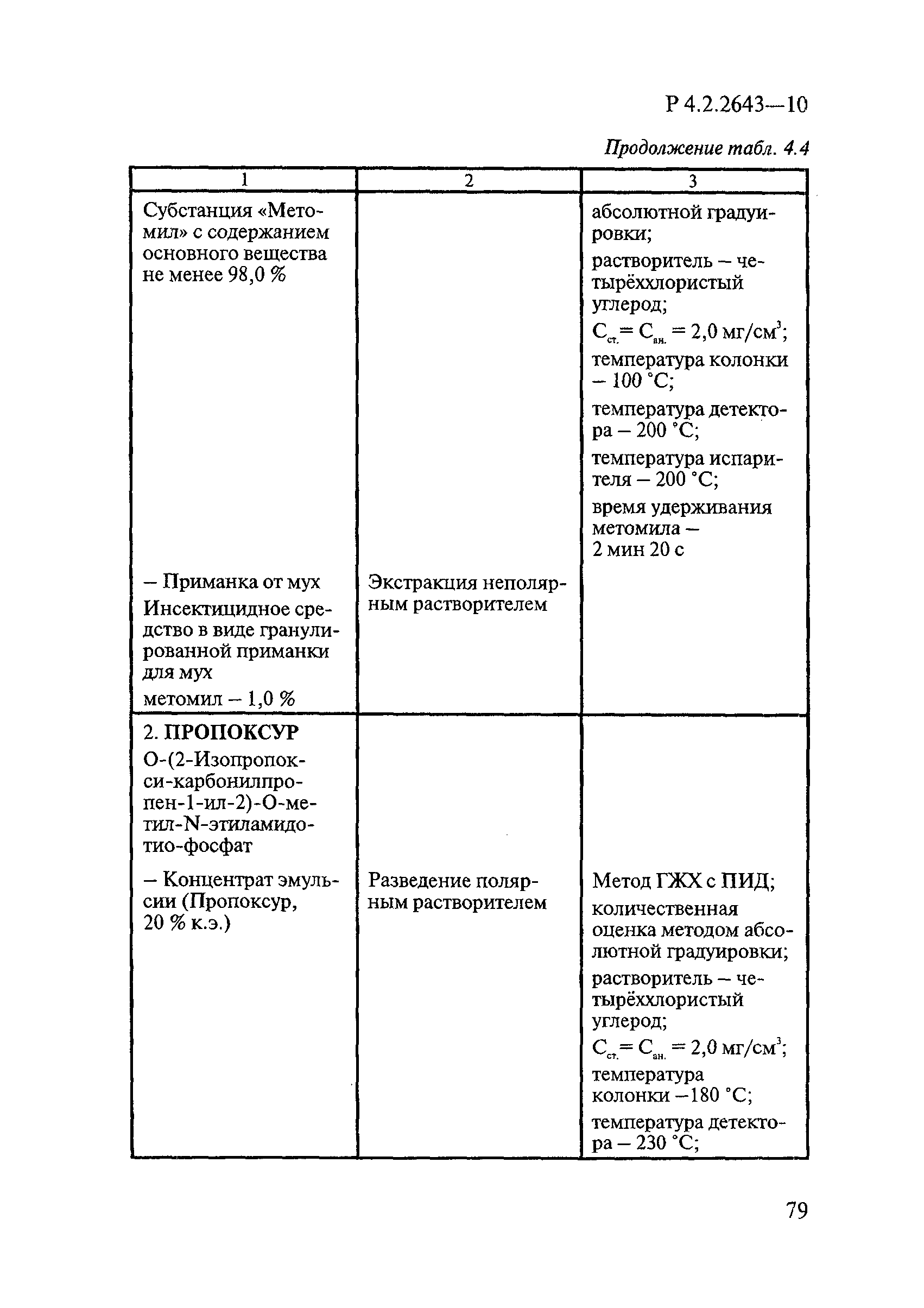
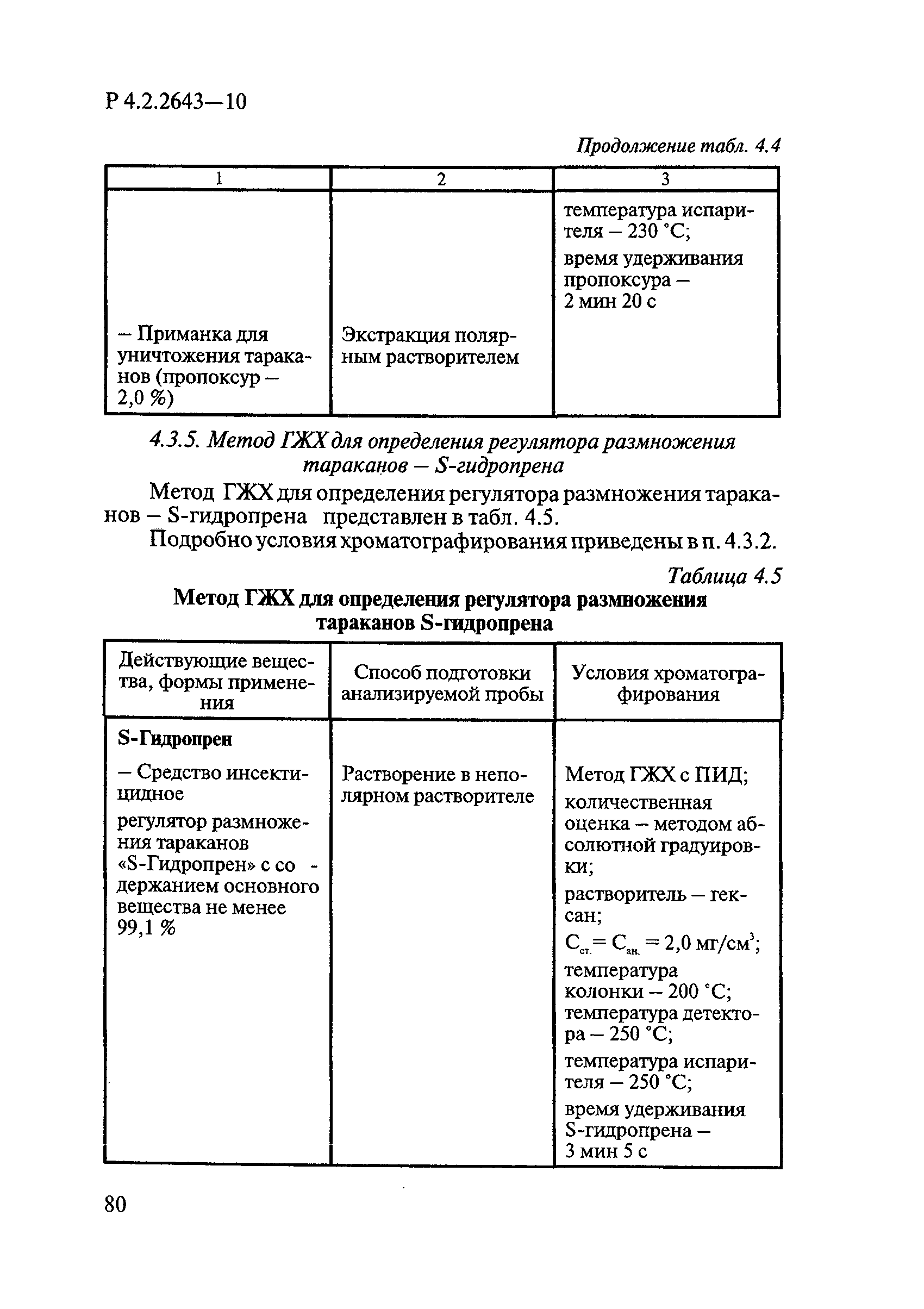
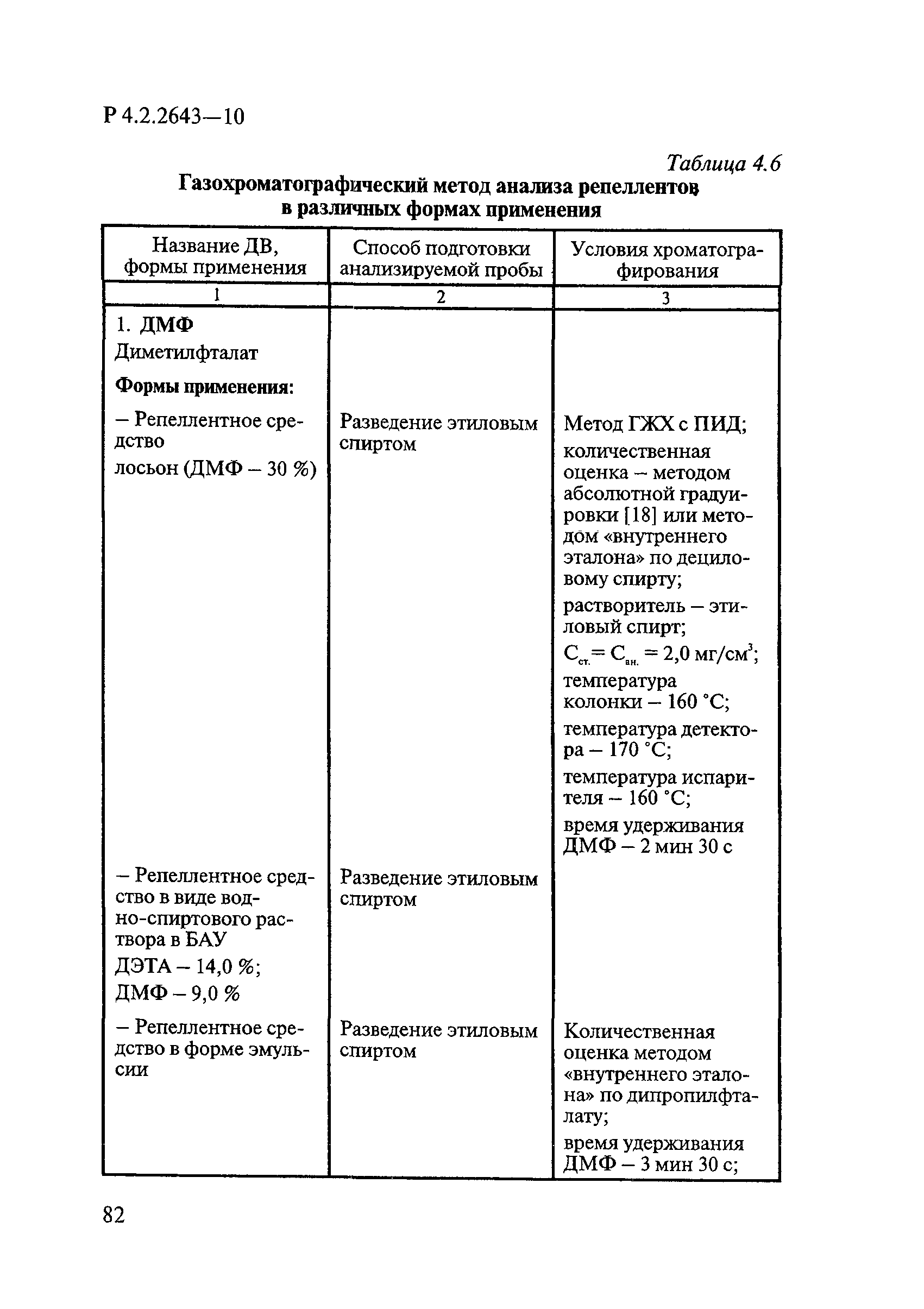
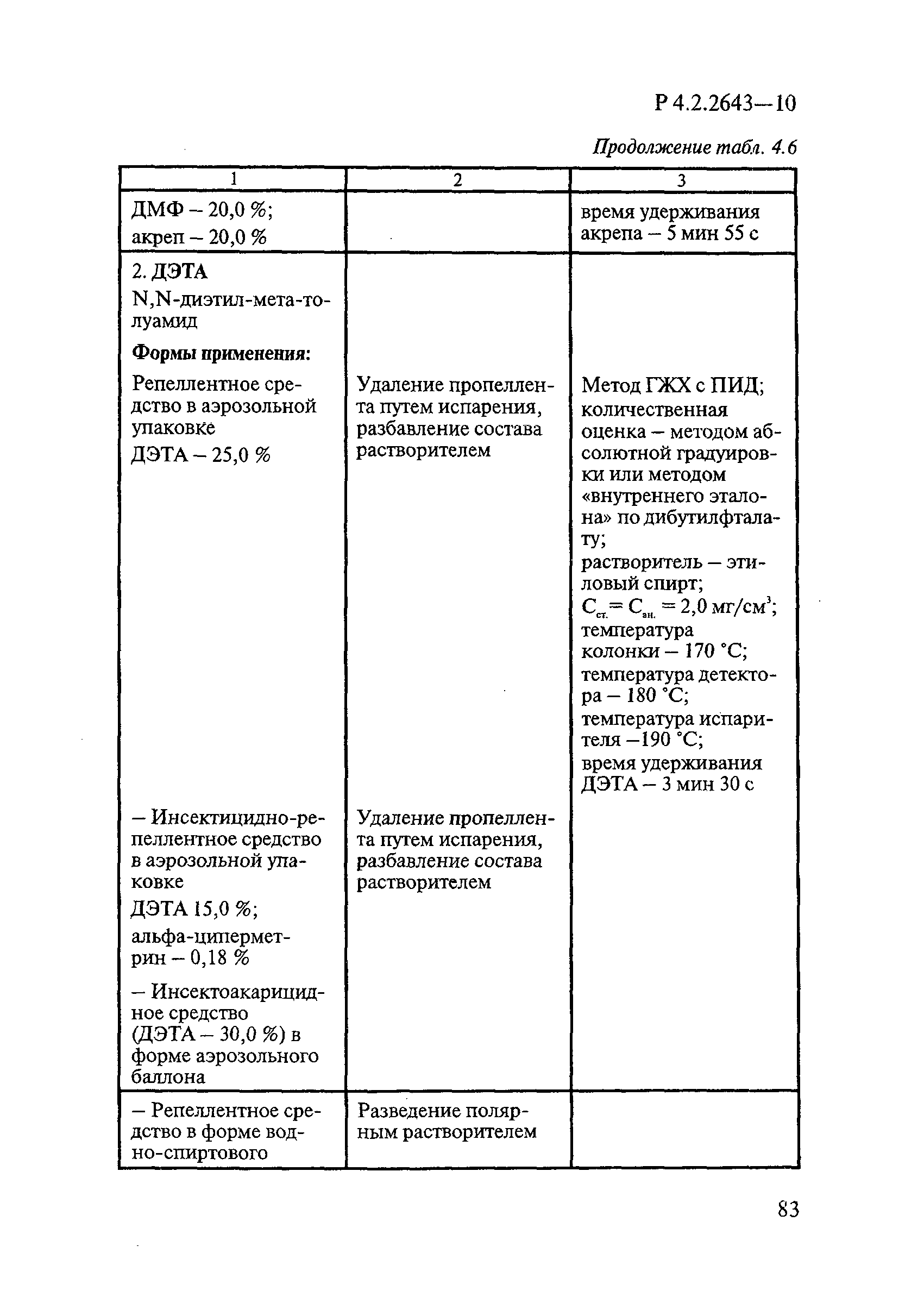
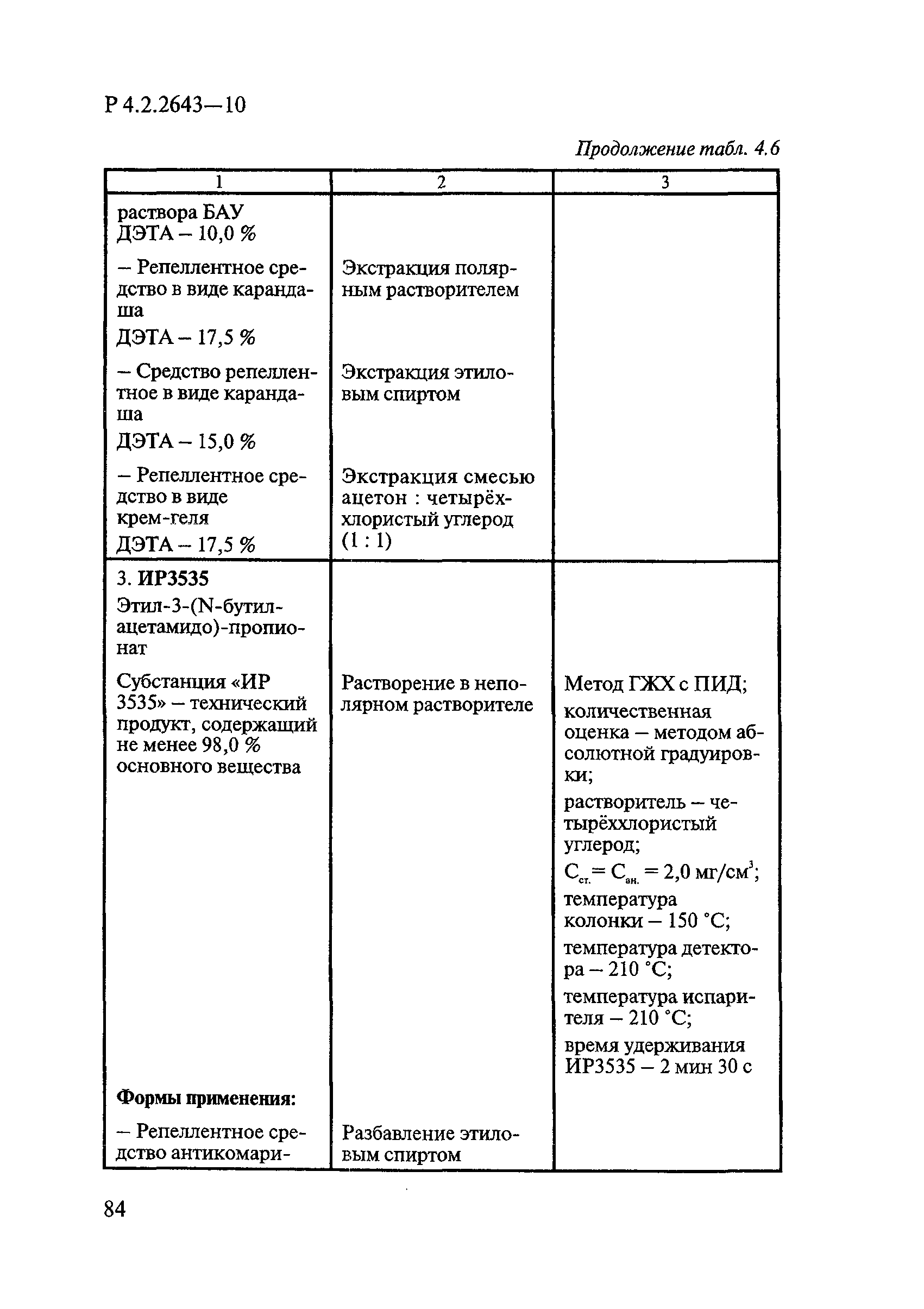
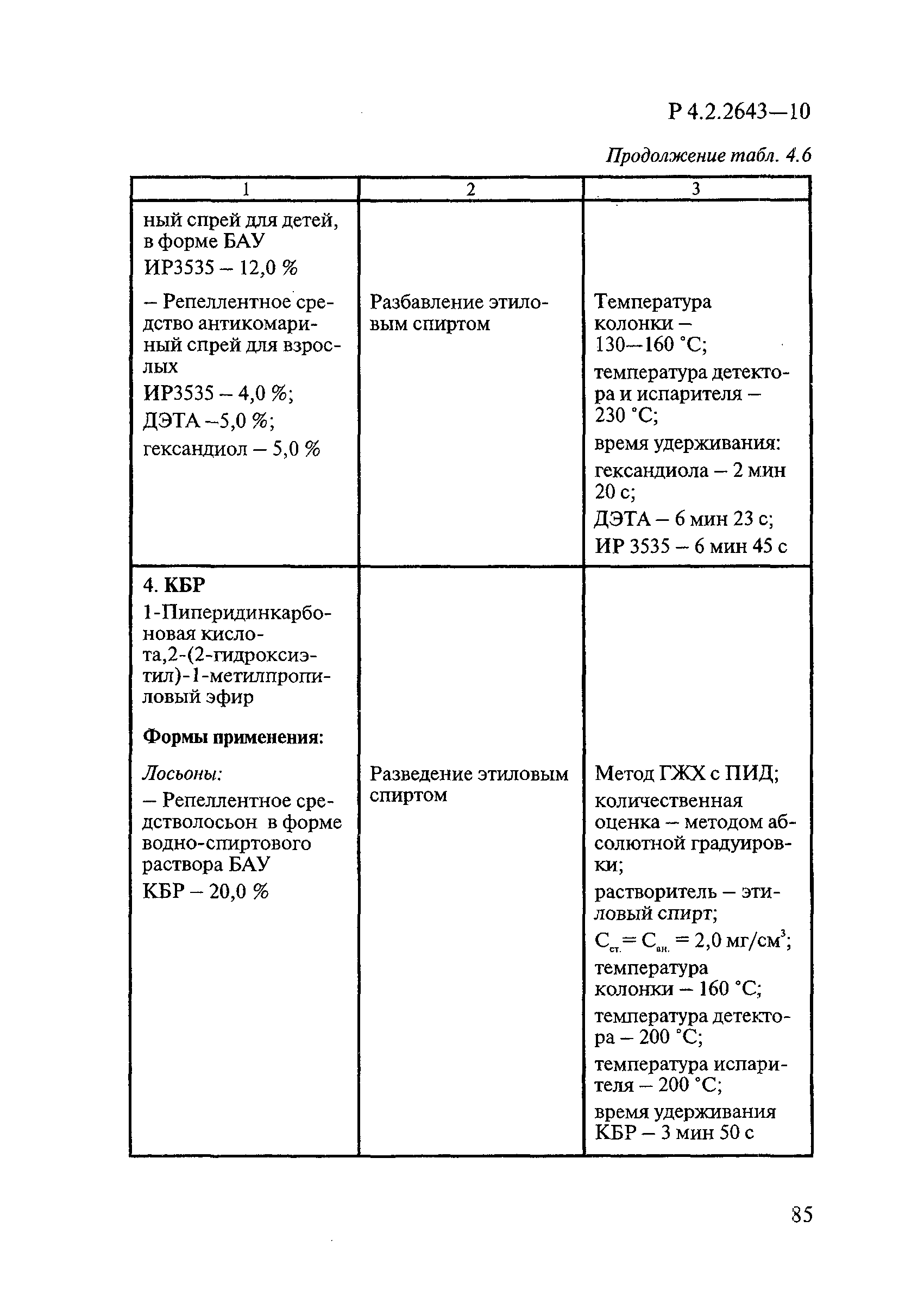
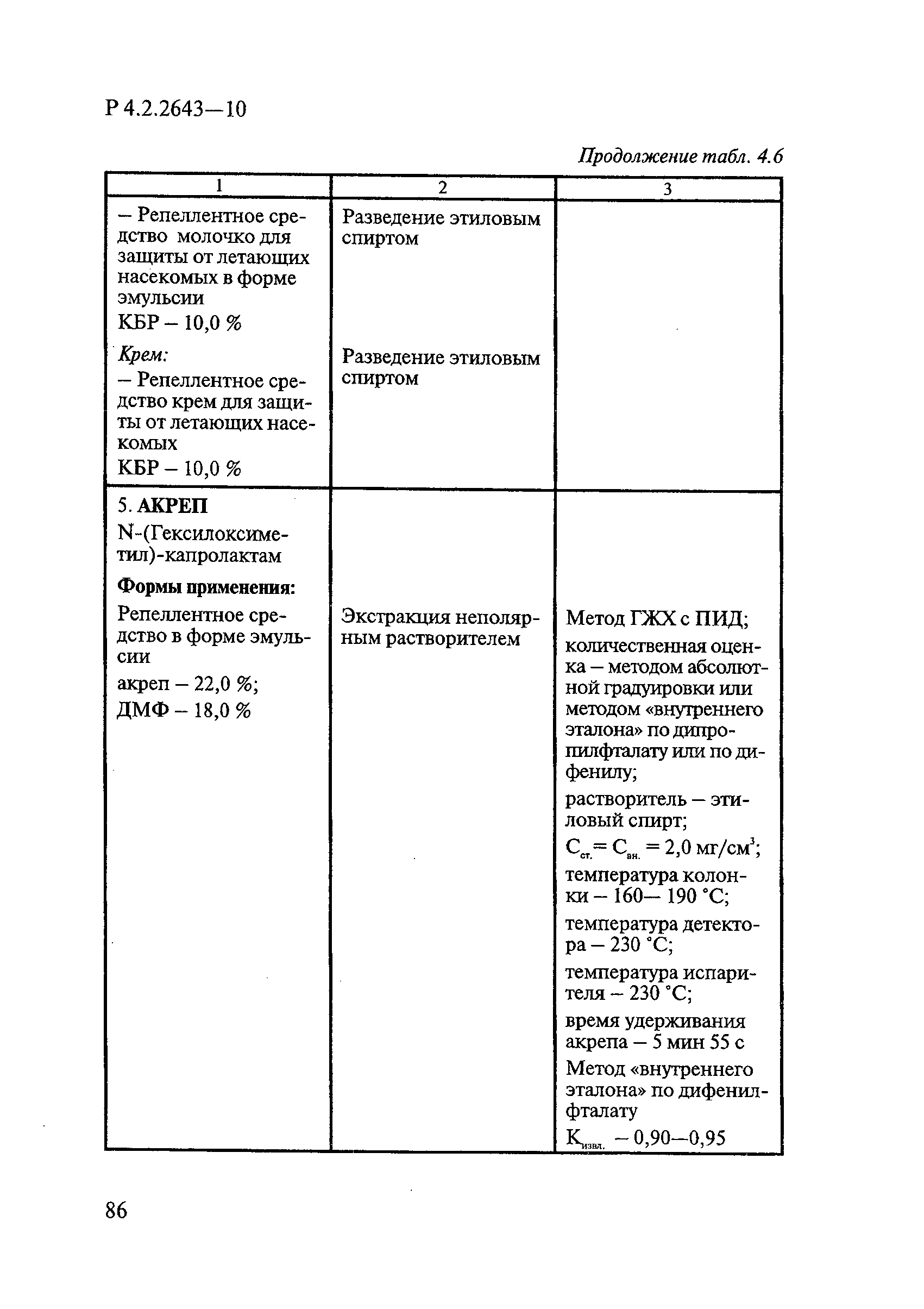
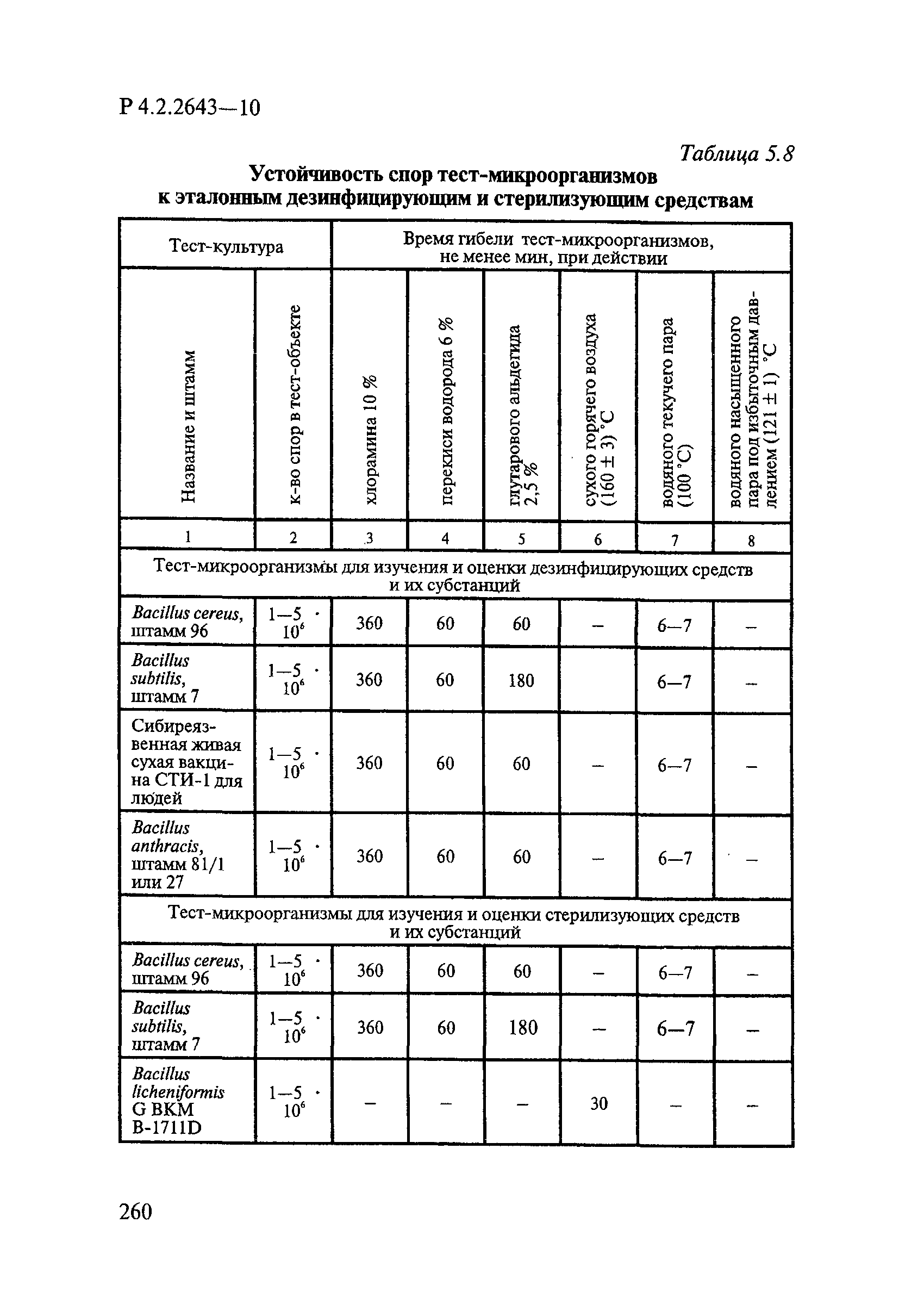
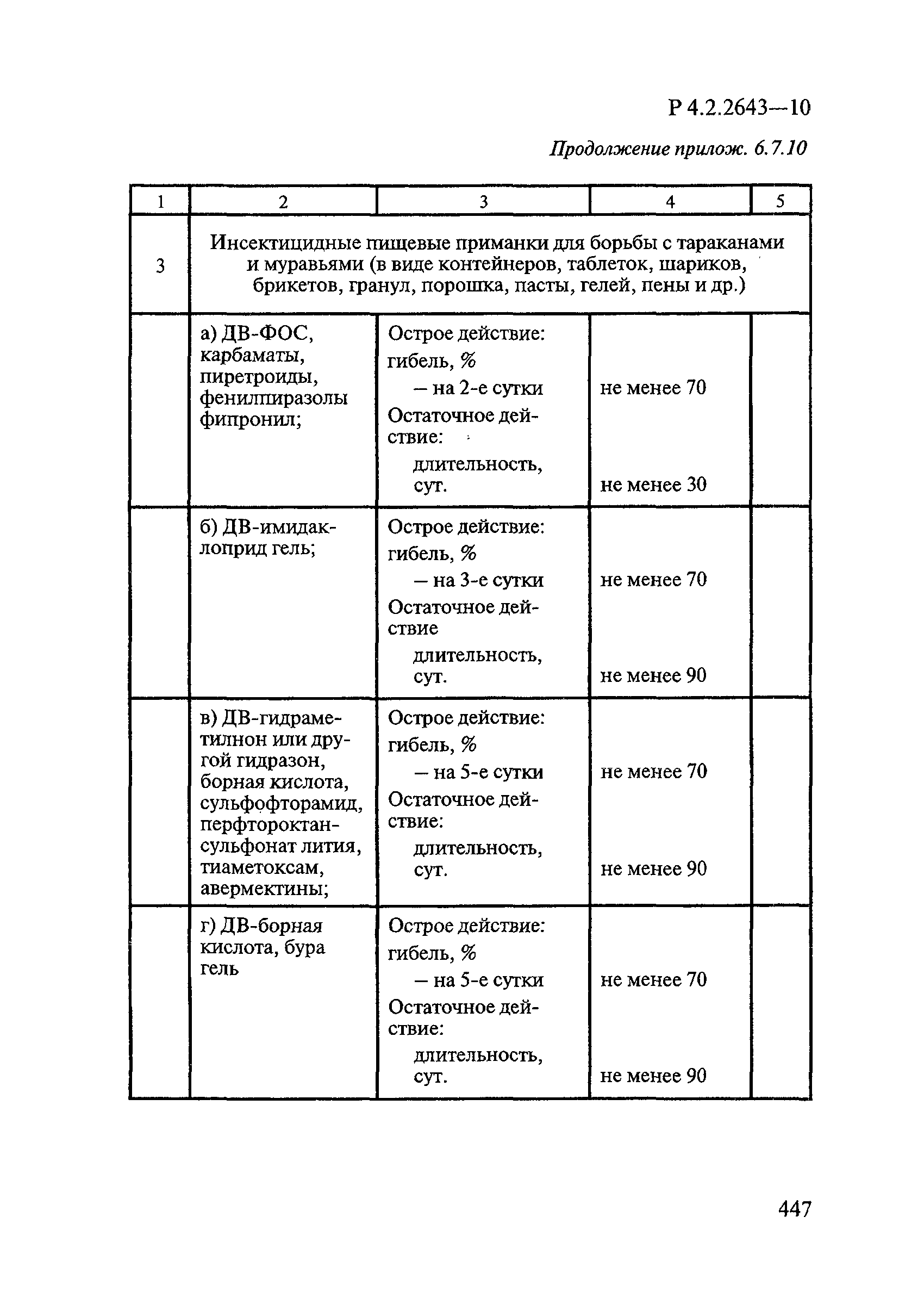
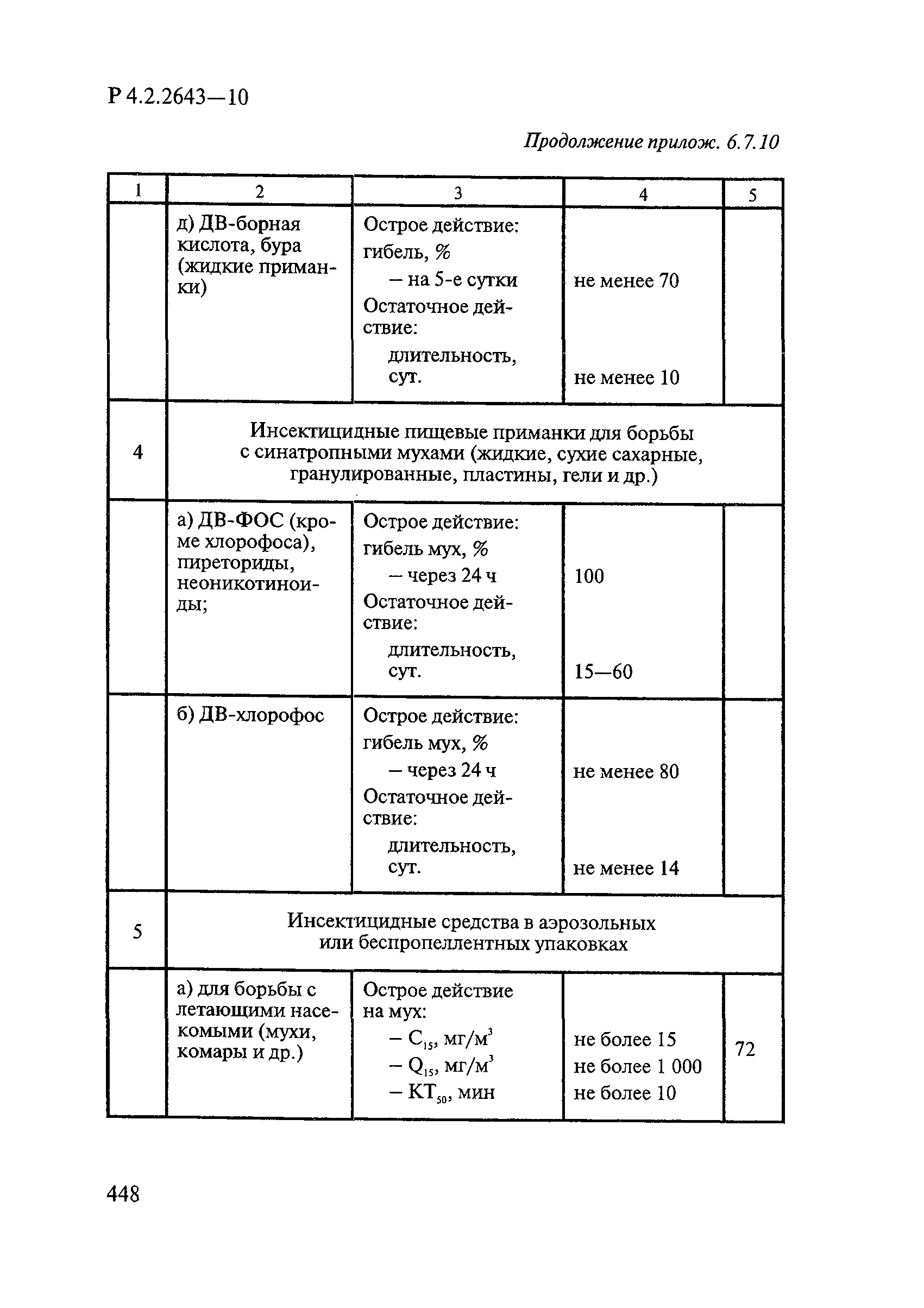
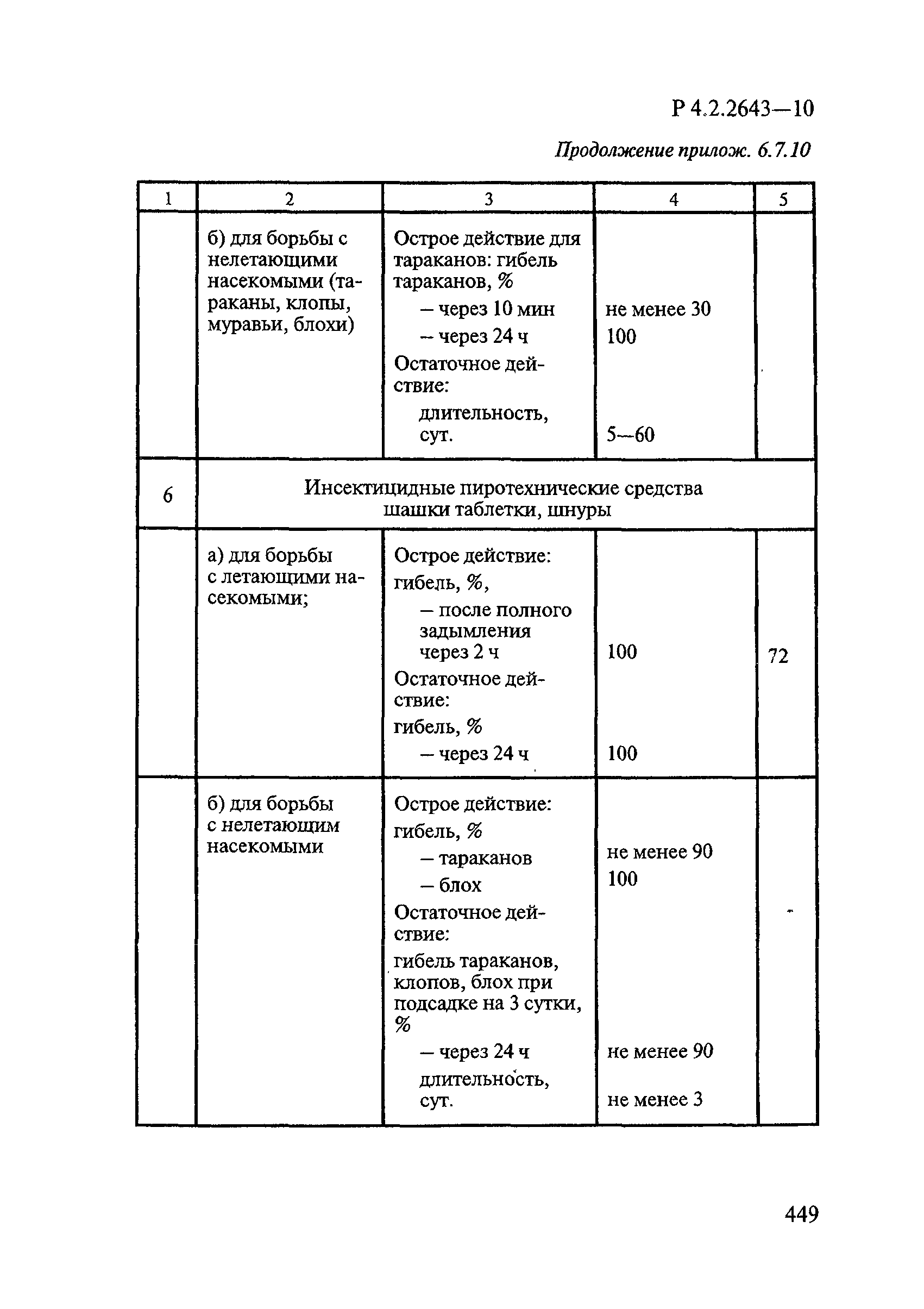
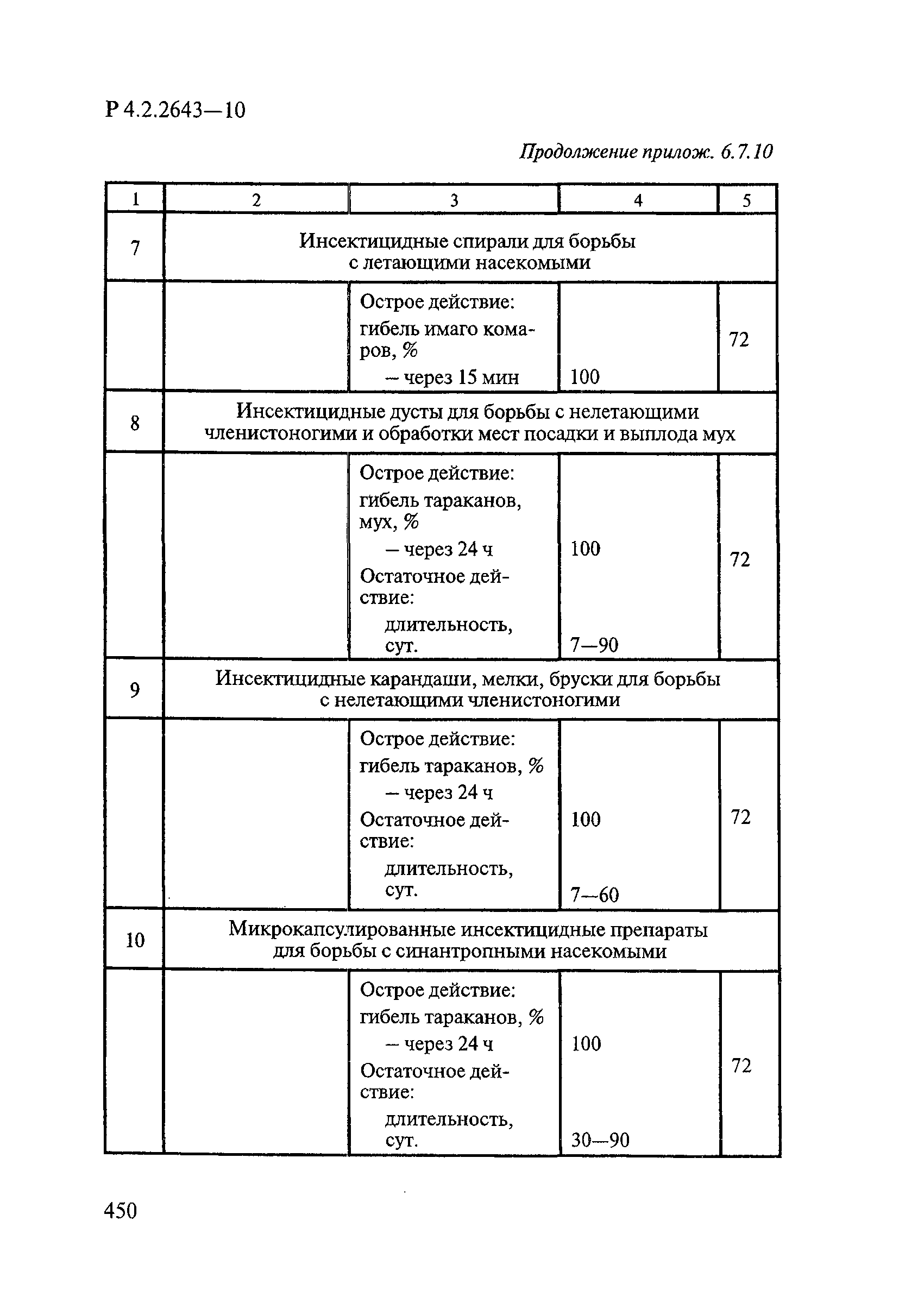
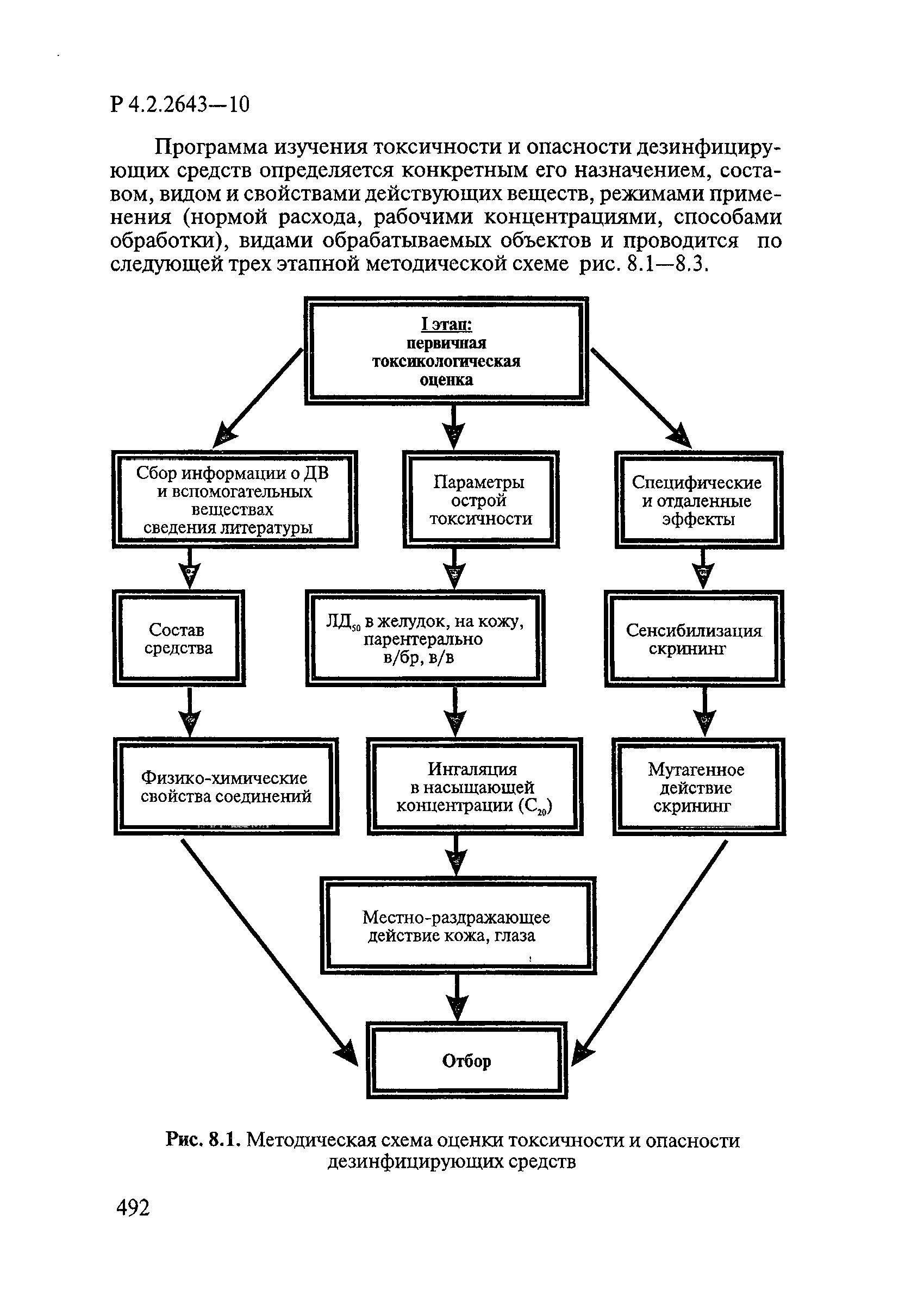
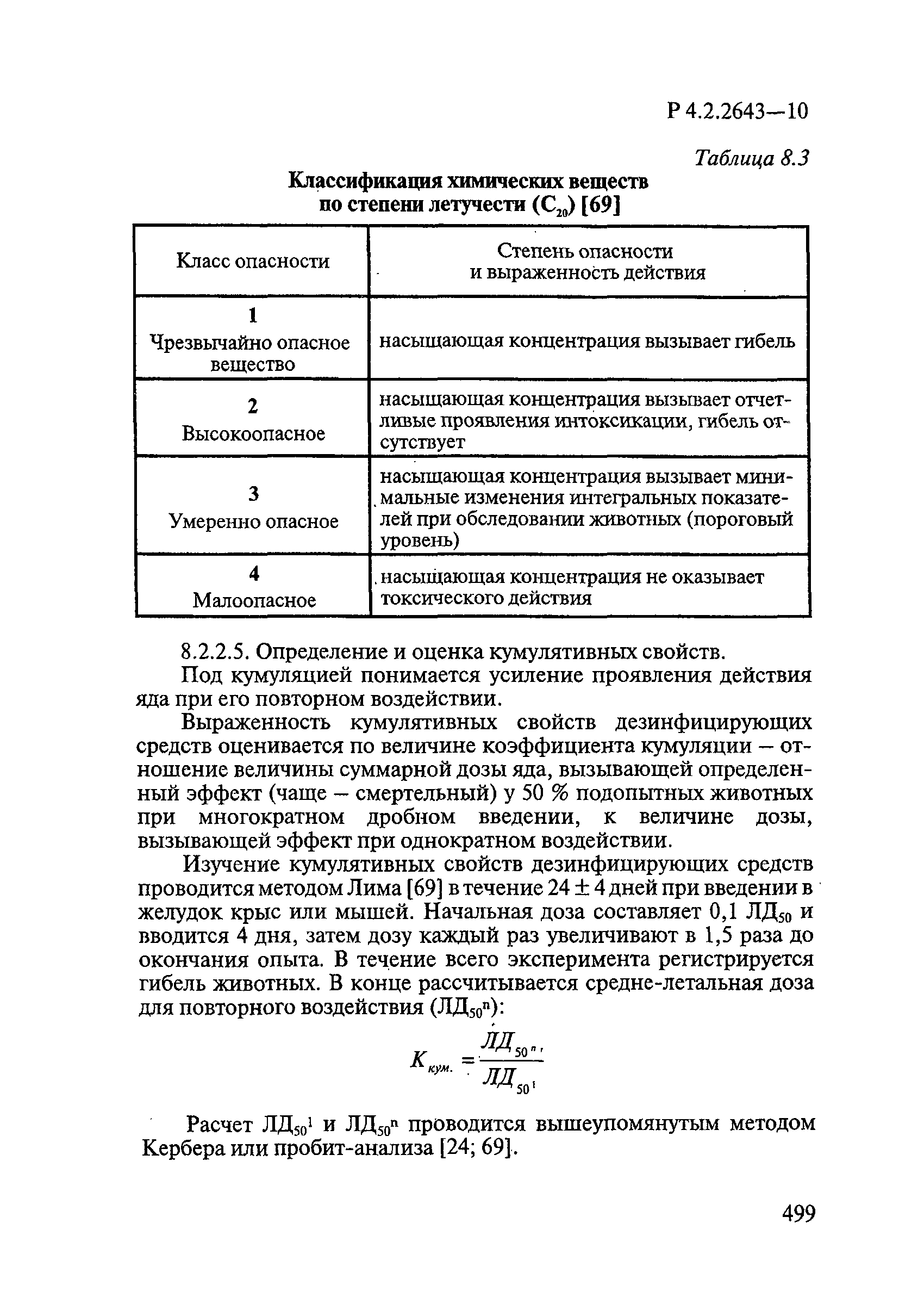
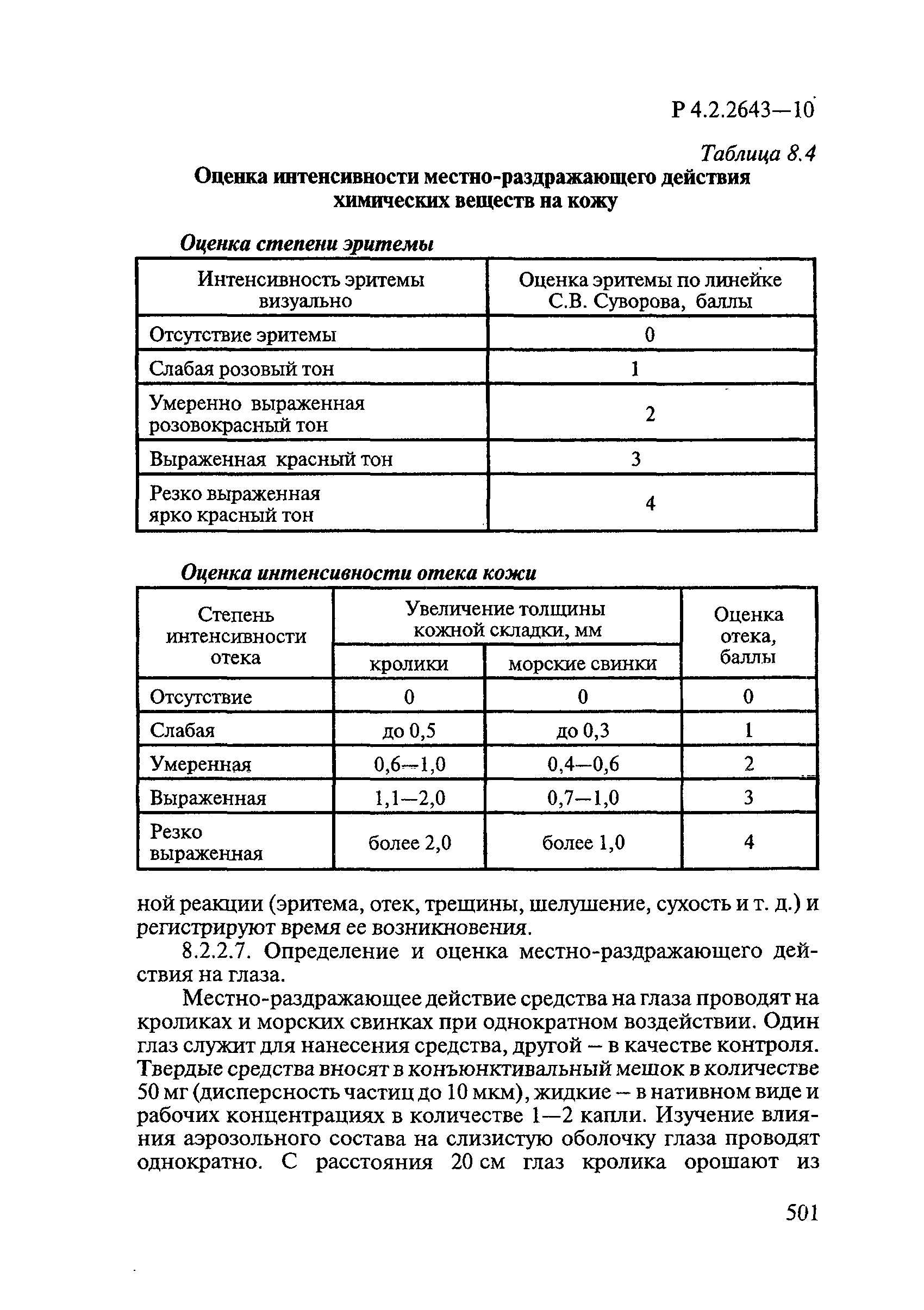
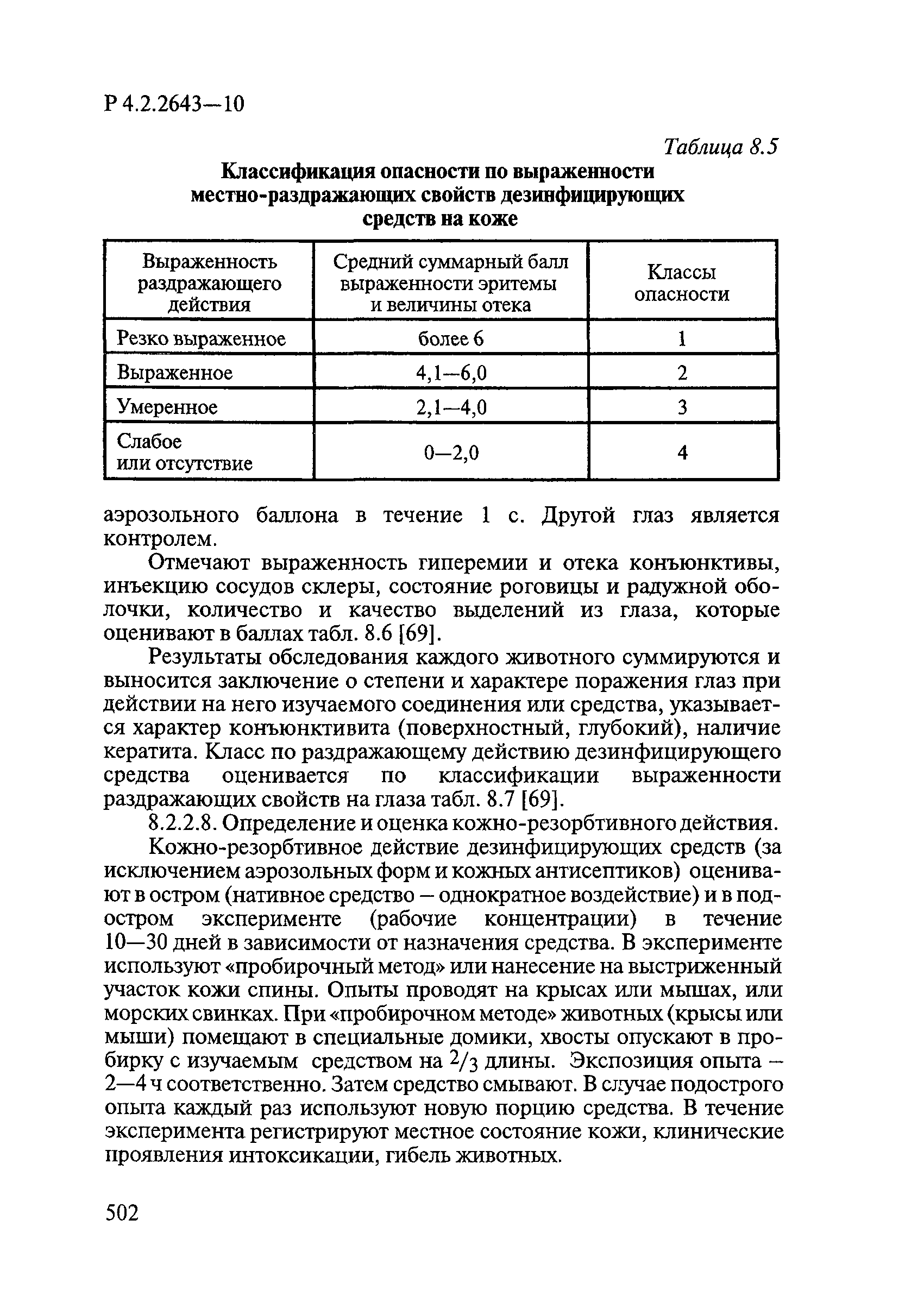
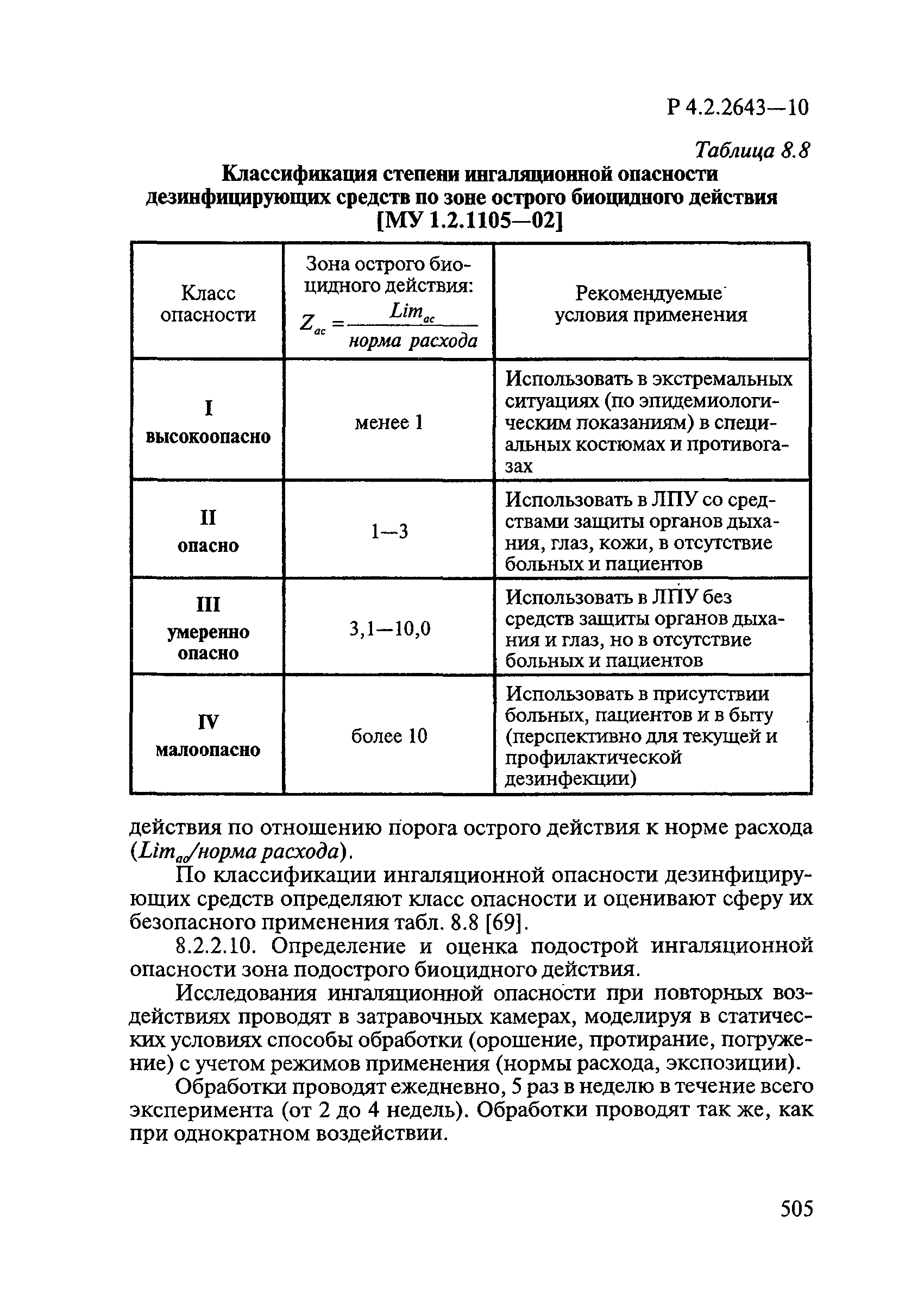
Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности
| Обозначение: |  Р 4.2.2643-10 Р 4.2.2643-10 |
| Обозначение англ: |  R 4.2.2643-10 R 4.2.2643-10 |
| Статус: | действует |
| Название рус.: | Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 02.06.2010 |
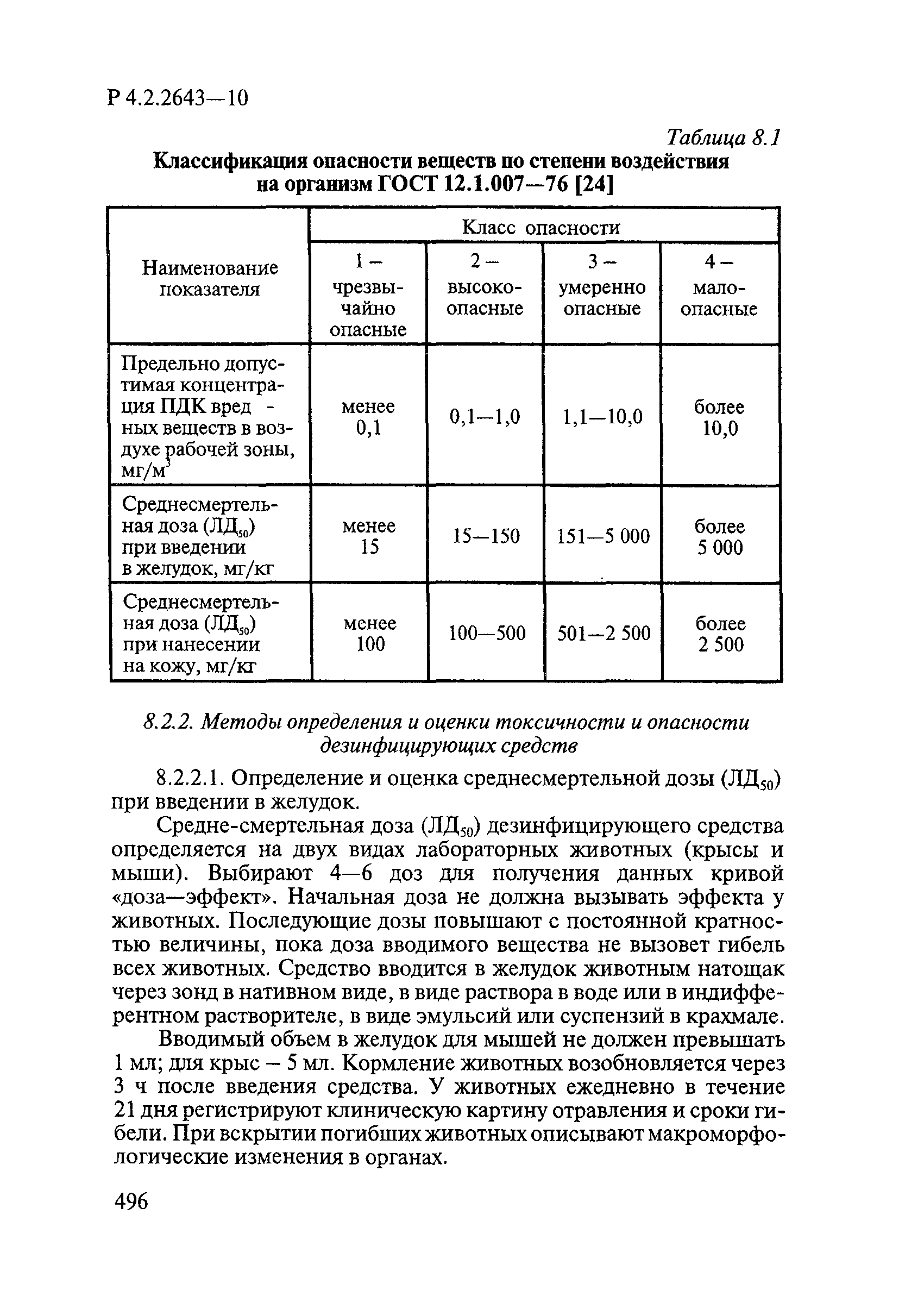
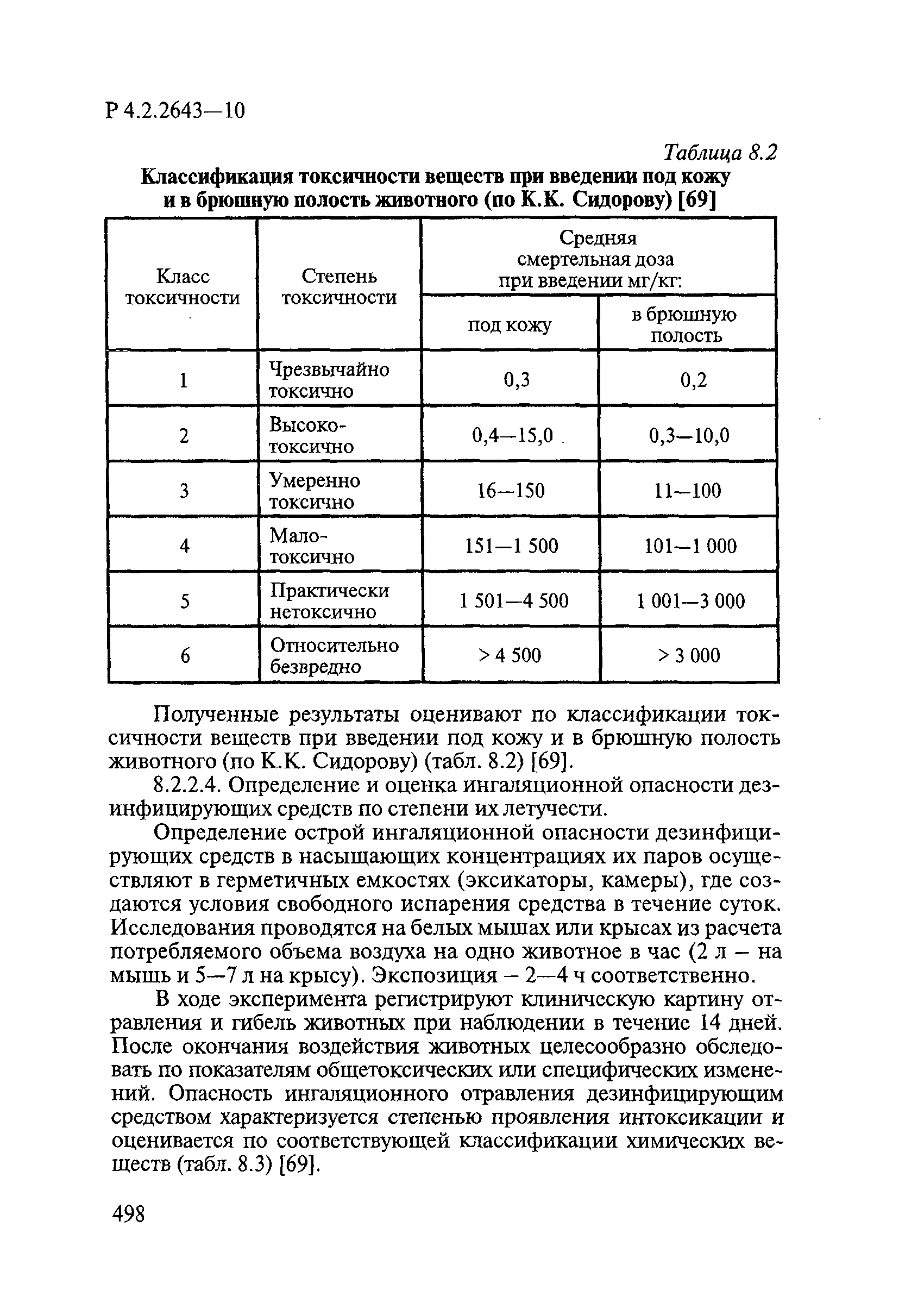
| Область применения: | Руководство устанавливает единые методы лабораторных исследований и испытаний дезинфекционных средств для оценки их антимикробной, инсектицидной, акарицидной, репеллентной и родентицидной активности, эффективности и безопасности при применении в быту, в лечебно-профилактических организациях и на других объектах для обеспечения безопасности жизни и здоровья людей, животных и неповреждения объектов внешней среды. Руководство предназначено для организаций, учреждений, предприятий, аккредитованных испытательных центров лабораторий, органов по сертификации дезинфекционных средств, аккредитованных в системе аккредитации ГОСТ Р, специалистов, осуществляющих исследования дезинфицирующих, стерилизующих, дезинсекционных, дератизационных средств, а также их субстанций (действующих веществ) в процессе их разработки, производства, применения, регистрационных и сертификационных испытаний, производственного контроля и надзора. |
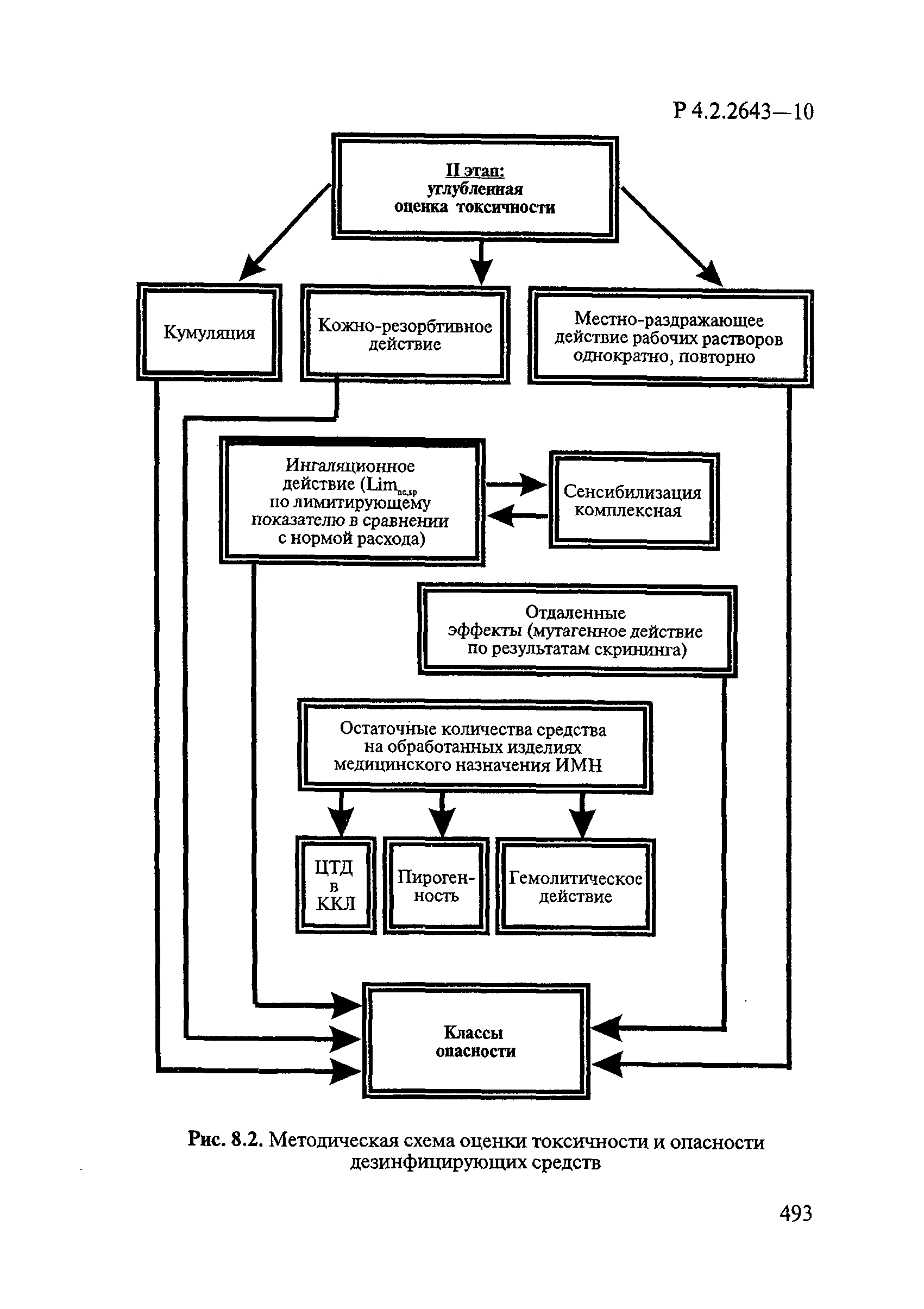
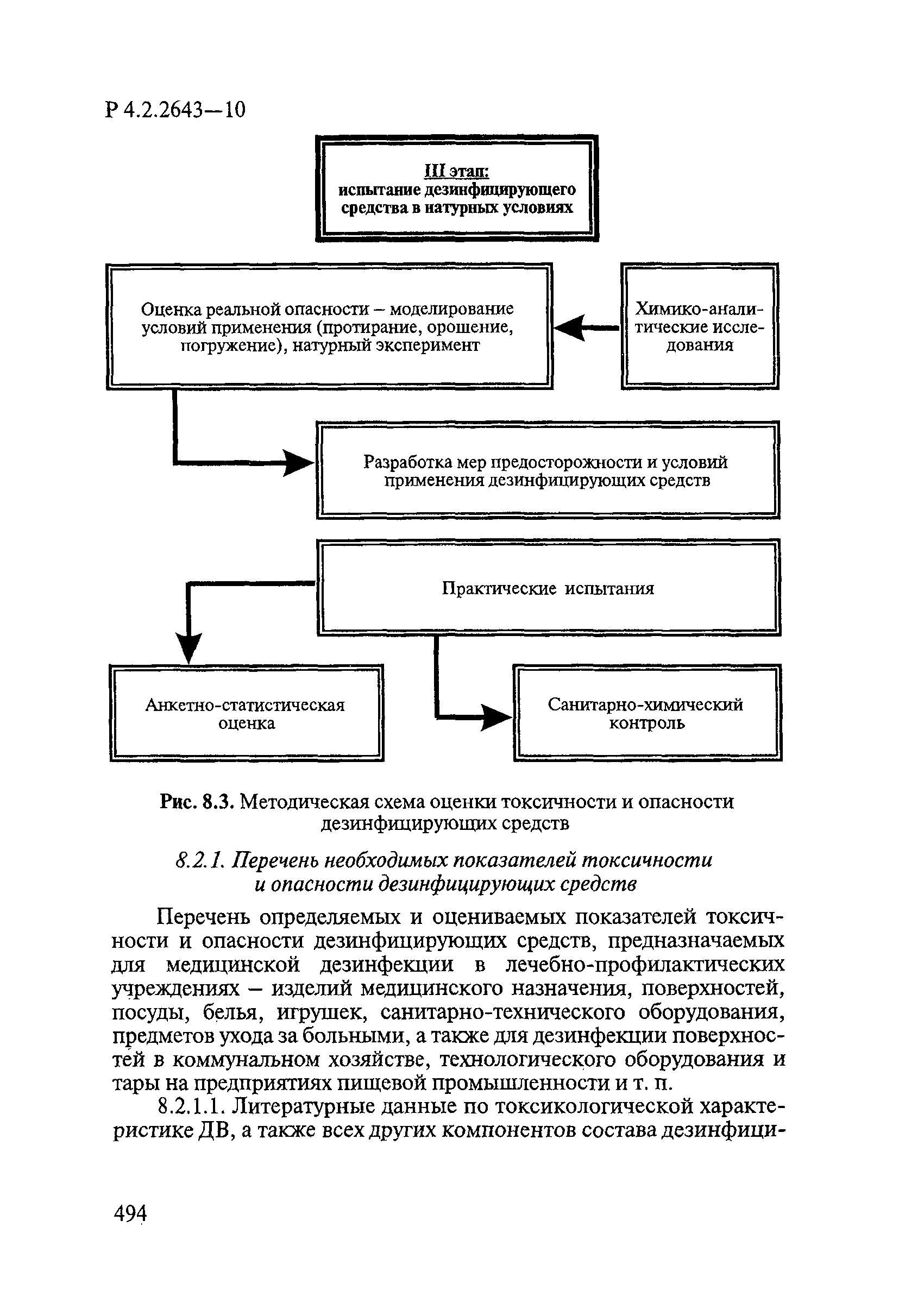
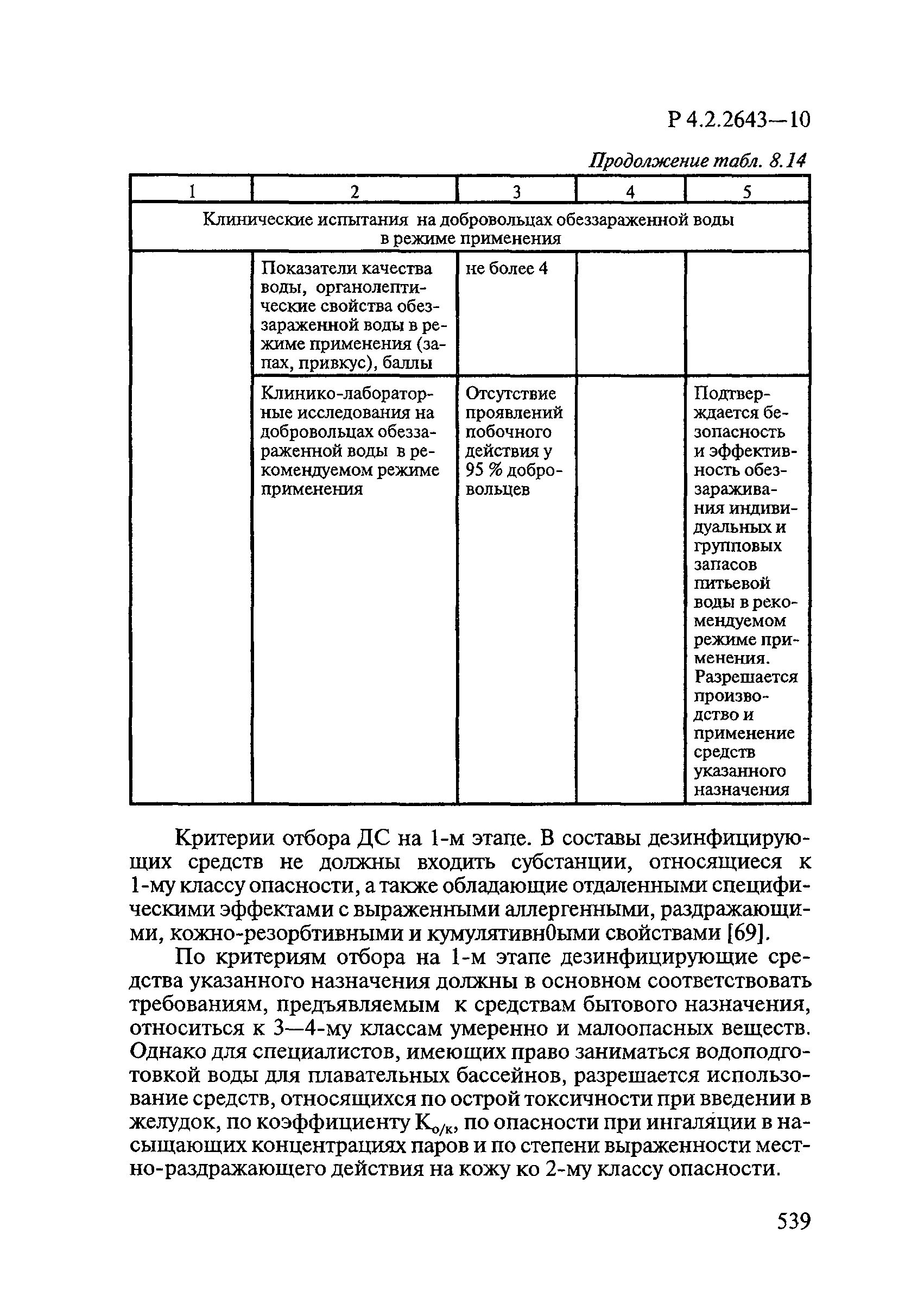
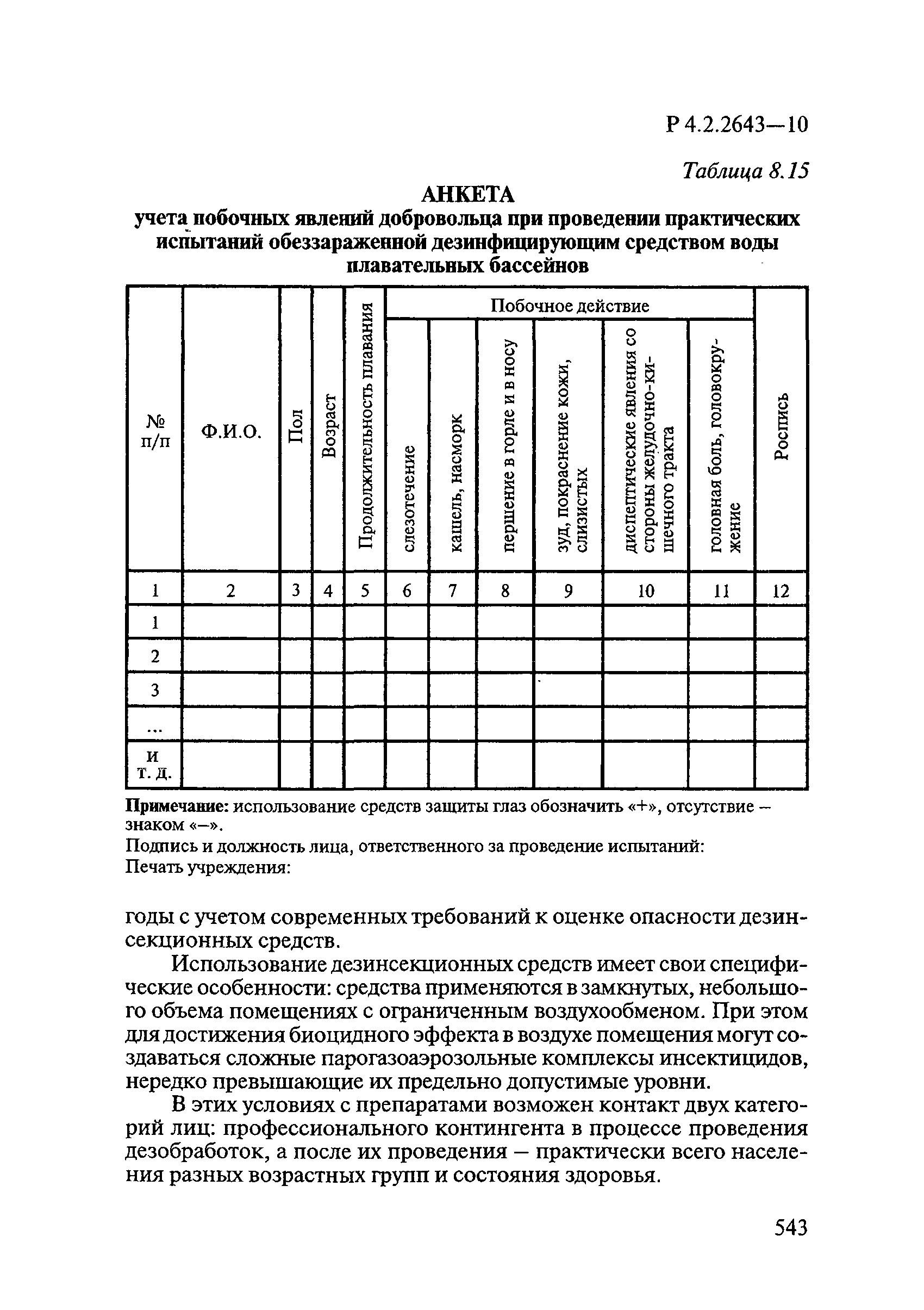
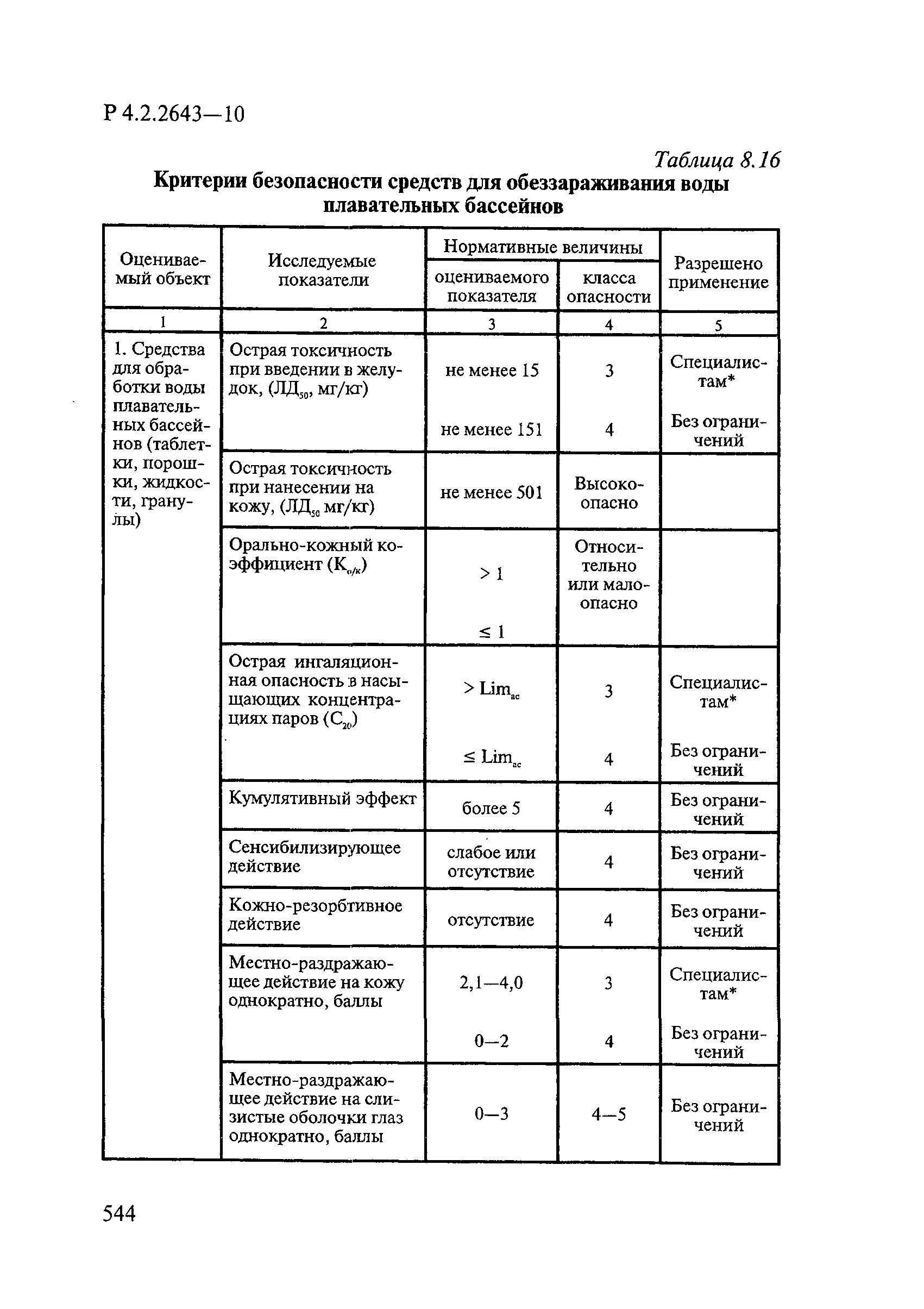
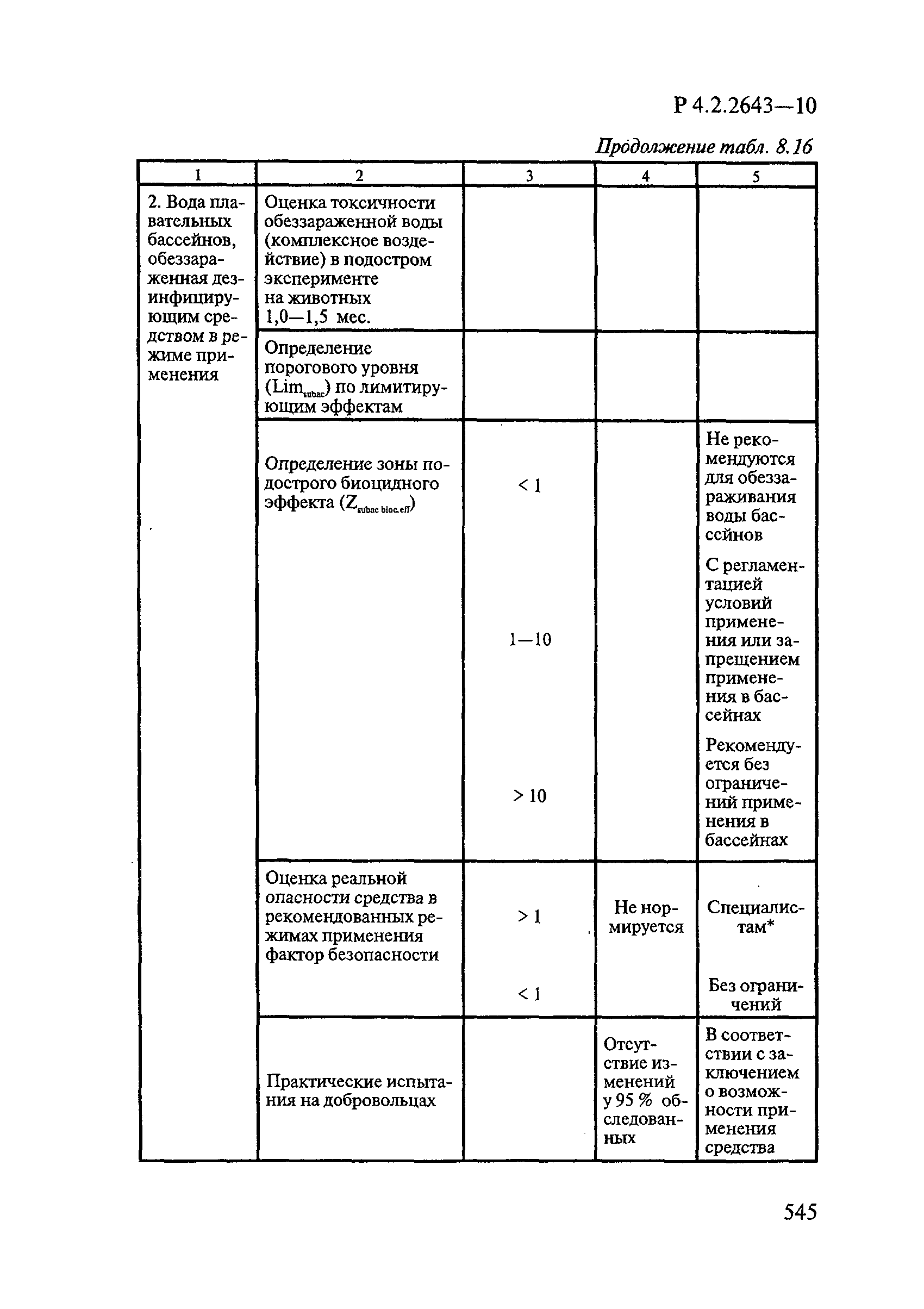
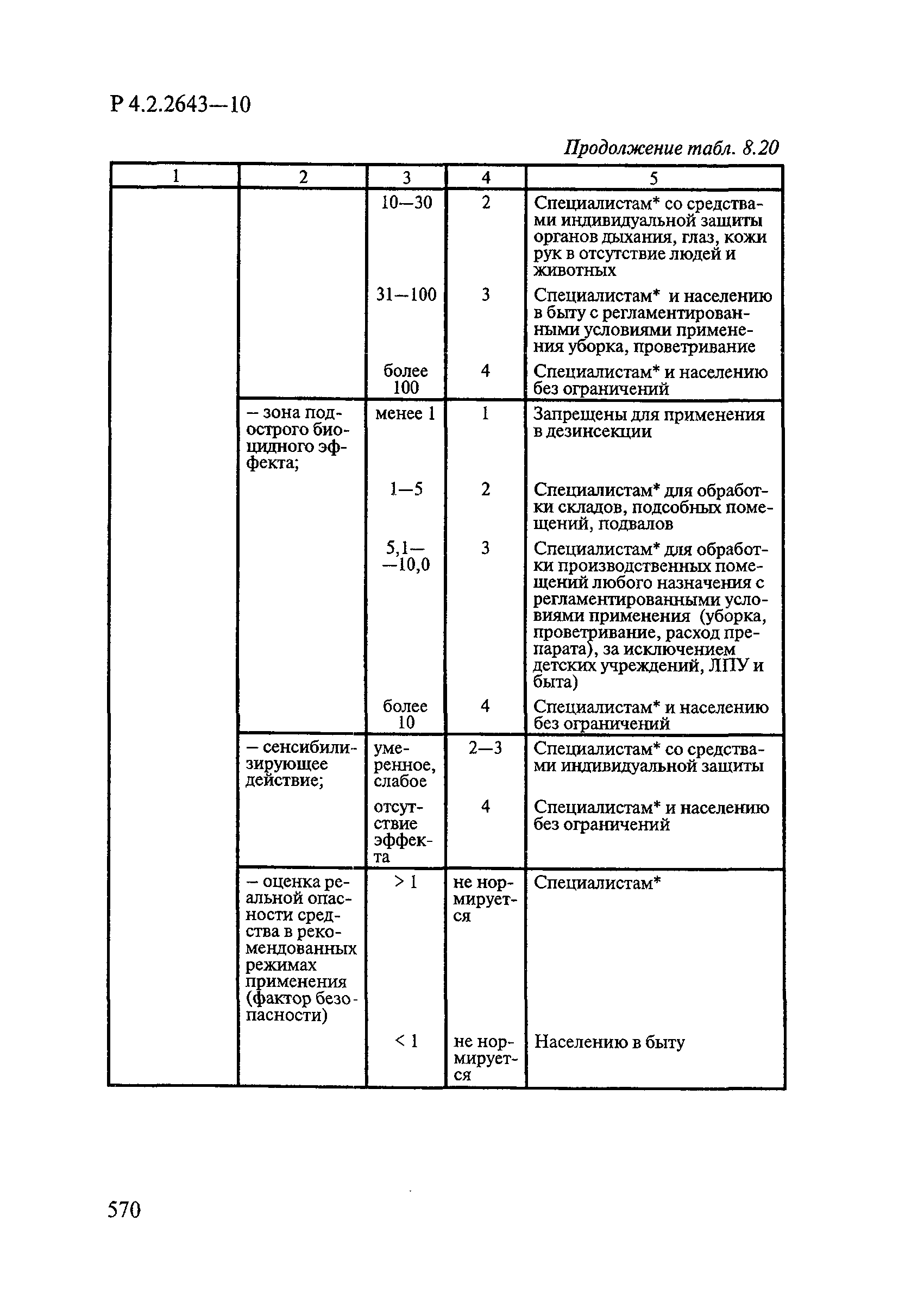
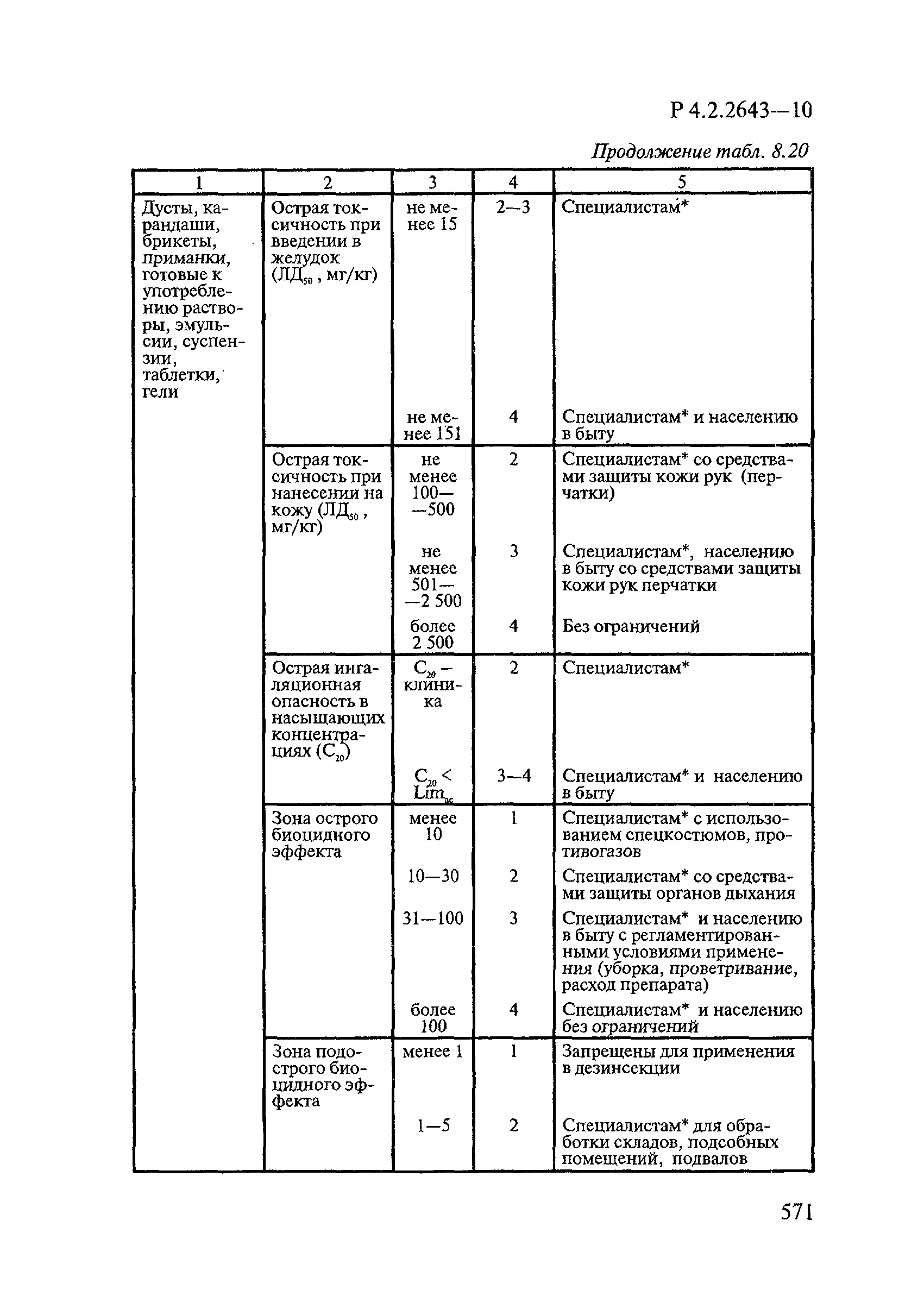
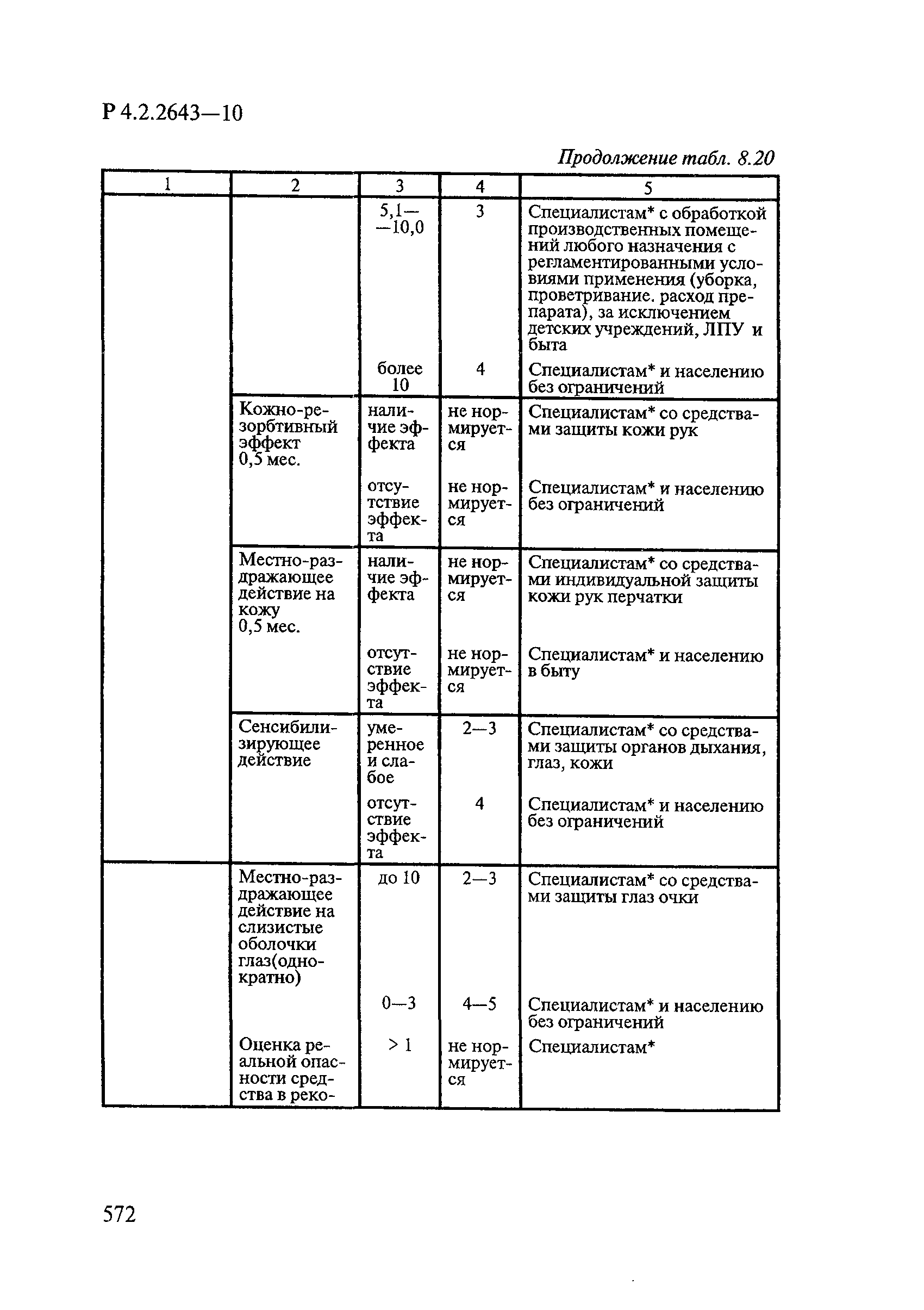
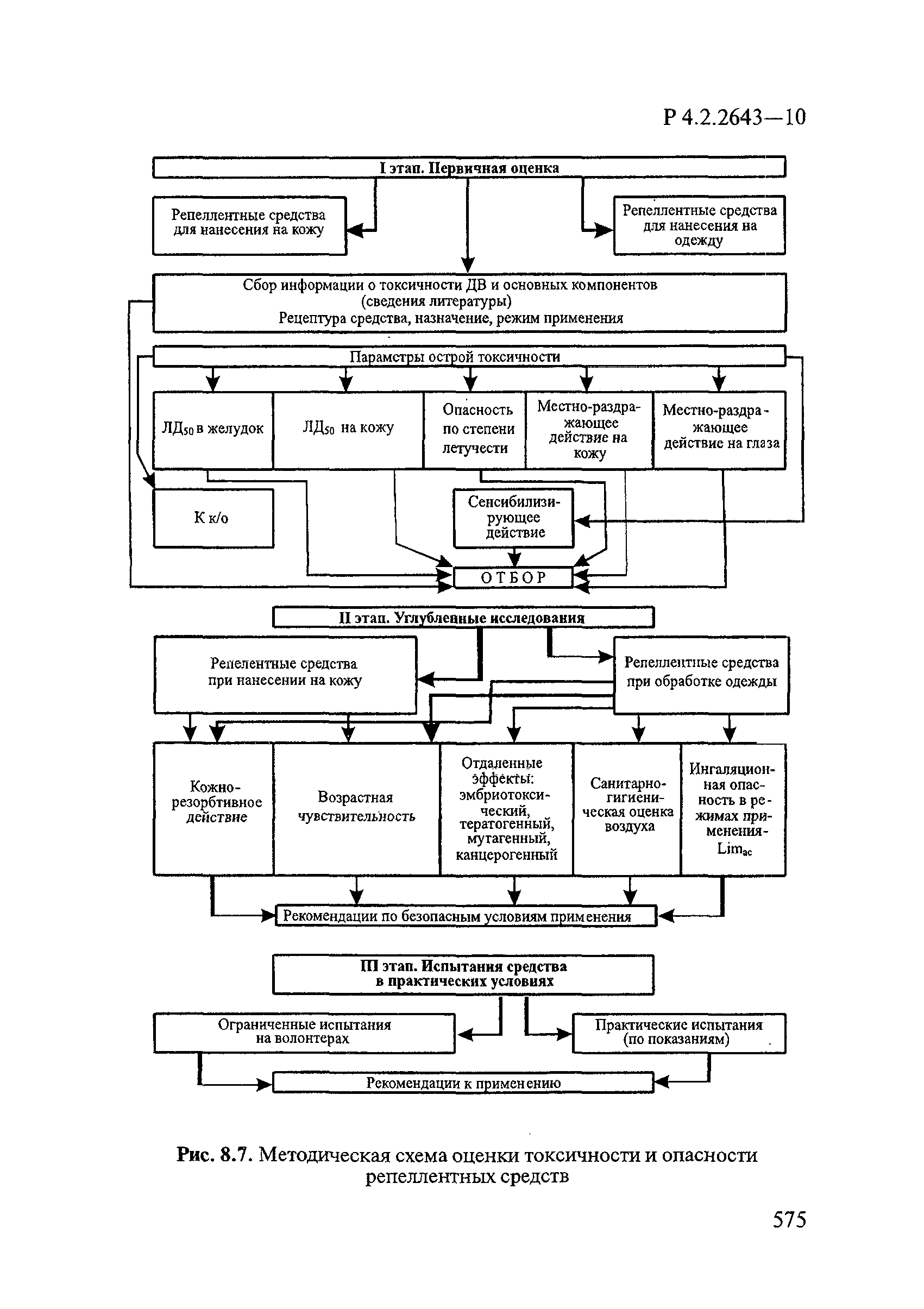
| Оглавление: | 1. Область применения 2. Нормативные ссылки 3. Общие положения 4. Химико-аналитические методы исследований дезинфекционных средств 4.1. Общие положения 4.2. Методы количественного определения действующих веществ в дезинфицирующих, стерилизующих средствах и средствах для предстерилизационной очистки 4.3. Методы исследования дезинсекционных средств 4.4. Методы исследований дератизационных средств 4.5. Библиографические данные 5. Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих и стерилизующих средств 5.1. Методы изучения и оценки бактерицидной активности дезинфицирующих средств и их субстанций 5.2. Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств 5.3. Методы изучения и оценки фунгицидной активности дезинфицирующих средств 5.4. Методы определения активности антимикробных материалов тканей, лакокрасочных покрытий 5.5. Методы определения эффективности кожных антисептиков 5.6. Методы определения эффективности ДС и кожных антисептиков в практических условиях 5.7. Методы изучения и оценки вирулицидной активности дезинфицирующих средств 5.8. Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств 5.9. Методы исследований и критерии оценки эффективности средств для предстерилизационной очистки ИМН 6. Энтомологические методы исследований и критерии оценки эффективности дезинсекционных средств 6.1. Общие положения. Организация экспериментов 6.2. Методы определения активности действующих веществ субстанций дезинсекционных средств 6.3. Методы определения активности инсектицидных средств 6.4. Методы изучения активности акарицидных и инсекто-акарицидных средств 6.5. Методы определения активности инсекто- и акарорепеллентных средств 6.6. Методы определения активности средств на основе регуляторов развития насекомых и аттрактантов феромонов 6.7. Методы определения эффективности инсектицидных, акарицидных и репеллентных средств в натурных условиях 7. Родентологические методы исследований и критерии оценки эффективности дератизационных средств 7.1. Общие положения. Требования к экспериментальным животным и условиям их содержания 7.2. Методы исследований эффективности химических родентицидных средств 7.3. Методы исследования эффективности репеллентов 7.4. Методы исследований эффективности механических дератизационных средств 7.5. Методы исследований эффективности химических родентицидных средств в условиях группового содержания грызунов 7.6. Методы оценки эффективности дератизационных средств в естественных местообитаниях грызунов в натурных условиях 7.7. Библиографические данные 8. Методы исследования и критерии оценки токсичности и опасности дезинфекционных средств 8.1. Общие требования к организации и проведению токсикологических исследований дезинфекционных средств 8.2. Методы изучения токсичности и опасности микробоцидных дезинфицирующих средств 8.3. Методы изучения токсичности и опасности средств для стерилизации и предстерилизационной очистки изделий медицинского назначения ИМН 8.4. Методы изучения токсичности и опасности кожных антисептиков 8.5. Методы изучения токсичности и опасности средств для обеззараживания питьевой воды при нецентрализованном водоснабжении 8.6. Методы изучения токсичности и опасности средств для обеззараживания воды плавательных бассейнов 8.7. Методы изучения токсичности и опасности дезинсекционных средств 8.8. Методы изучения токсичности и опасности репеллентных средств 8.9. Методы изучения токсичности и опасности педикулицидных средств 8.10. Методы изучения токсичности и опасности дератизационных средств 8.11. Библиографические данные |
| Разработан: | НИИ дезинфектологии Институт медицинской паразитологии и тропической медицины им. Е.И. Марциновского МЗ РФ ГУ Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова ФГУН 48 НИИМ МО РФ |
| Утверждён: | 01.06.2010 Главный государственный санитарный врач Российской Федерации |
| Издан: | Федеральный центр гигиены и эпидемиологии Роспотребнадзора (2011 г. ) |
| Расположен в: | Техническая документация Экология ЗДРАВООХРАНЕНИЕ Стерилизация и дезинфекция Стерилизация и дезинфекция, прочие аспекты |
| Заменяет собой: |
|
| Нормативные ссылки: |
|
ГОСТ Р 58151.4-2018
Группа Т58
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СРЕДСТВА ДЕЗИНФИЦИРУЮЩИЕ
Методы определения показателей эффективности
Disinfectants. Methods for determining efficiency factor
ОКС 11.080.20*
________________
* Поправка (ИУС N 8-2018)
Дата введения 2019-01-01
Предисловие
1 РАЗРАБОТАН Федеральным бюджетным учреждением науки «Научно-исследовательский институт дезинфектологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 339 «Безопасность сырья, материалов и веществ»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 5 июня 2018 г. N 317-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
ВНЕСЕНА поправка, опубликованная в ИУС N 8, 2018 год
Поправка внесена изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на химические дезинфицирующие средства (далее ДС) и устанавливает методы исследования дезинфицирующих средств для разработки эффективных режимов дезинфекции, обеспечивающих эпидемиологическую безопасность жизни и здоровья населения, охрану окружающей среды и предупреждение действий, вводящих в заблуждение потребителей путем предоставления недостоверной информации о средствах.
Настоящий стандарт распространяется на методы исследований эффективности дезинфицирующих средств, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств; белья и других изделий из текстильных материалов; посуды столовой, лабораторной и др., контаминированных бактериями (включая микобактерии), грибами и вирусами, с целью разработки режимов их дезинфекции.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ 11683 Пиросульфит натрия технический. Технические условия
ГОСТ 27068 Реактивы. Натрий серноватистокислый (натрия тиосульфат) 5-водный. Технические условия
ГОСТ 32770 Добавки пищевые. Эмульгаторы пищевых продуктов. Термины и определения
ГОСТ Р 56990 Химические дезинфицирующие средства и антисептики. Дезинфицирующие средства. Критерии и показатели эффективности
ГОСТ Р 56994 Дезинфектология и дезинфекционная деятельность. Термины и определения
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячно издаваемого информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р 56994.
4 Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих средств
4.1 Общие положения
Объем микробиологических исследований определяют в соответствии с предполагаемой сферой применения дезинфицирующих средств (ДС).
Микробиологические исследования начинают только после получения результатов химико-аналитических исследований, подтверждающих соответствие средства требованиям нормативно-технической документации (НТД): технических условий — на отечественные средства, спецификации — на зарубежные.
Критерии эффективности ДС установлены в ГОСТ Р 56990.
4.2 Приготовление рабочих растворов ДС и их субстанций
Рабочие растворы ДС и их субстанций готовят непосредственно перед проведением исследований, за исключением изучения стабильности рабочих растворов в процессе хранения.
При изучении ДС, производимых в форме гранул, порошков, таблеток и др., рабочие растворы используют только после полного растворения действующих веществ (ДВ) ДС, если не указано на возможность выпадения осадка.
Для оценки антимикробного действия субстанций и ДС в лабораторных условиях и исследования эффективности ДС, предназначенных для обеззараживания различных объектов, растворы готовят на стерильной питьевой воде.
Для приготовления раствора определенной концентрации и нужного объема необходимое количество сухого ДС или жидкого концентрата вносят в пробирку (колбу) соответствующего или превосходящего объема и добавляют расчетное количество воды, тщательно размешивают и закрывают пробкой.
Пример — Для приготовления 1% раствора 1 г средства растворяют в 100 мл воды.
Отмечают время полного растворения и внешний вид приготовленного рабочего раствора.
Температура растворов ДС должна быть в пределах 20±2°С (если по условиям эксперимента не рекомендована другая температура) независимо от температуры окружающей среды. Для поддержания требуемой температуры используют водяную баню.
При испытании ДС в практических условиях рабочие растворы готовят на нестерильной питьевой воде комнатной температуры (20±2°С) или умеренно повышенной температуры (45-50°С).
Для приготовления раствора необходимой концентрации навеску средства или отмеренное количество жидкого концентрата вносят в соответствующую емкость, добавляют воду, размешивают и закрывают крышкой. Работу с раствором начинают после полного растворения ДВ. Рабочие растворы из ДС в форме таблеток готовят путем добавления в отмеренный объем воды определенного числа таблеток
Пример — 1 таблетка на 10 л воды.
Рабочие растворы субстанций и ДС готовят с соблюдением мер предосторожности. Если ДВ относится к летучим веществам и представляет опасность при ингаляционном воздействии, растворы готовят в вытяжном шкафу или в отдельном помещении, оборудованном приточно-вытяжной вентиляцией, в респираторе РУ 60М или РПГ-67, кожу рук защищают резиновыми перчатками, глаза — защитными очками.
Исследуемые ДС (перед, во время и после исследований) хранят в соответствии с требованиями технических условий или спецификации; при отсутствии таковых — в соответствии с нормативными документами.
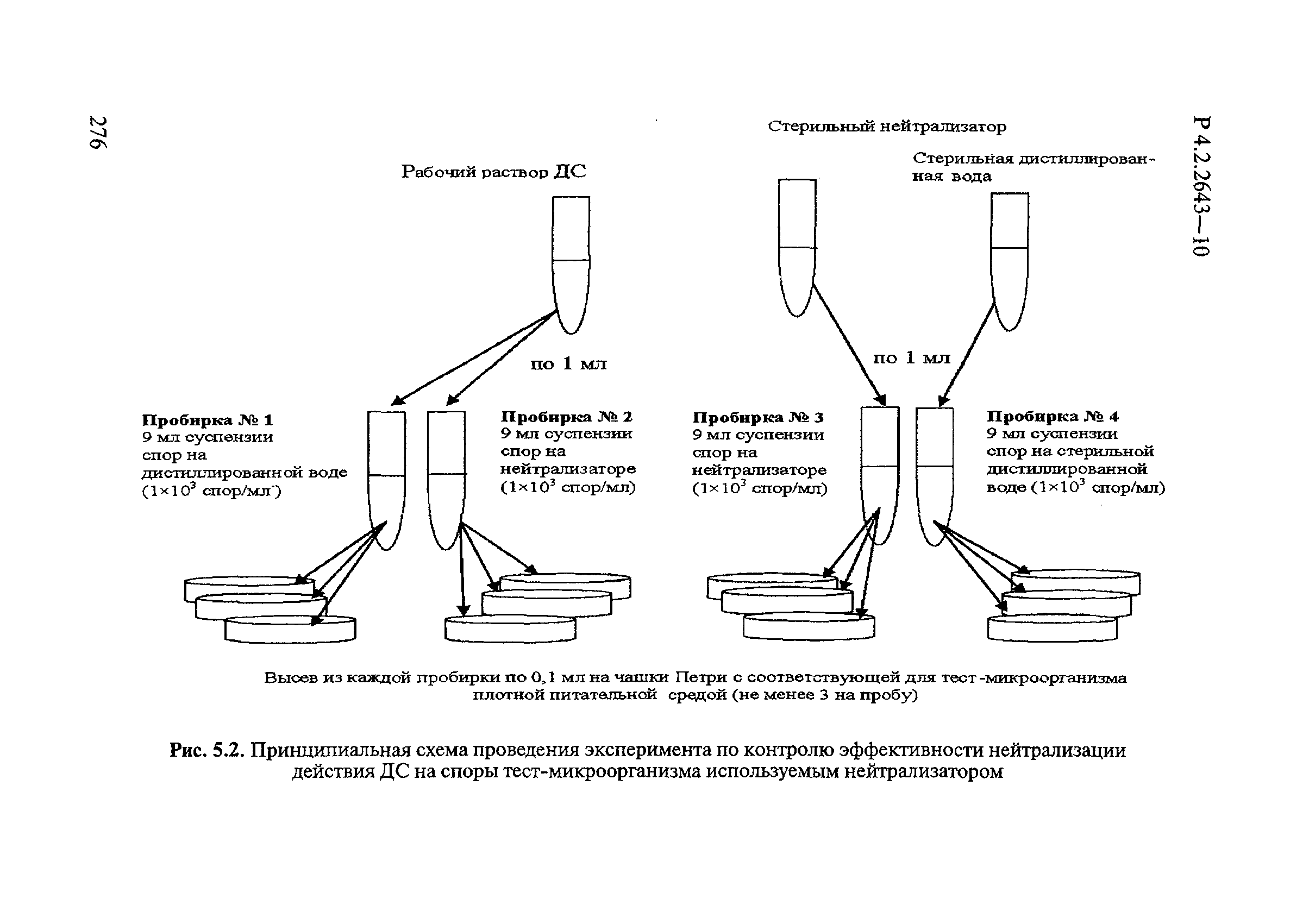
4.3 Применение нейтрализаторов действующих веществ
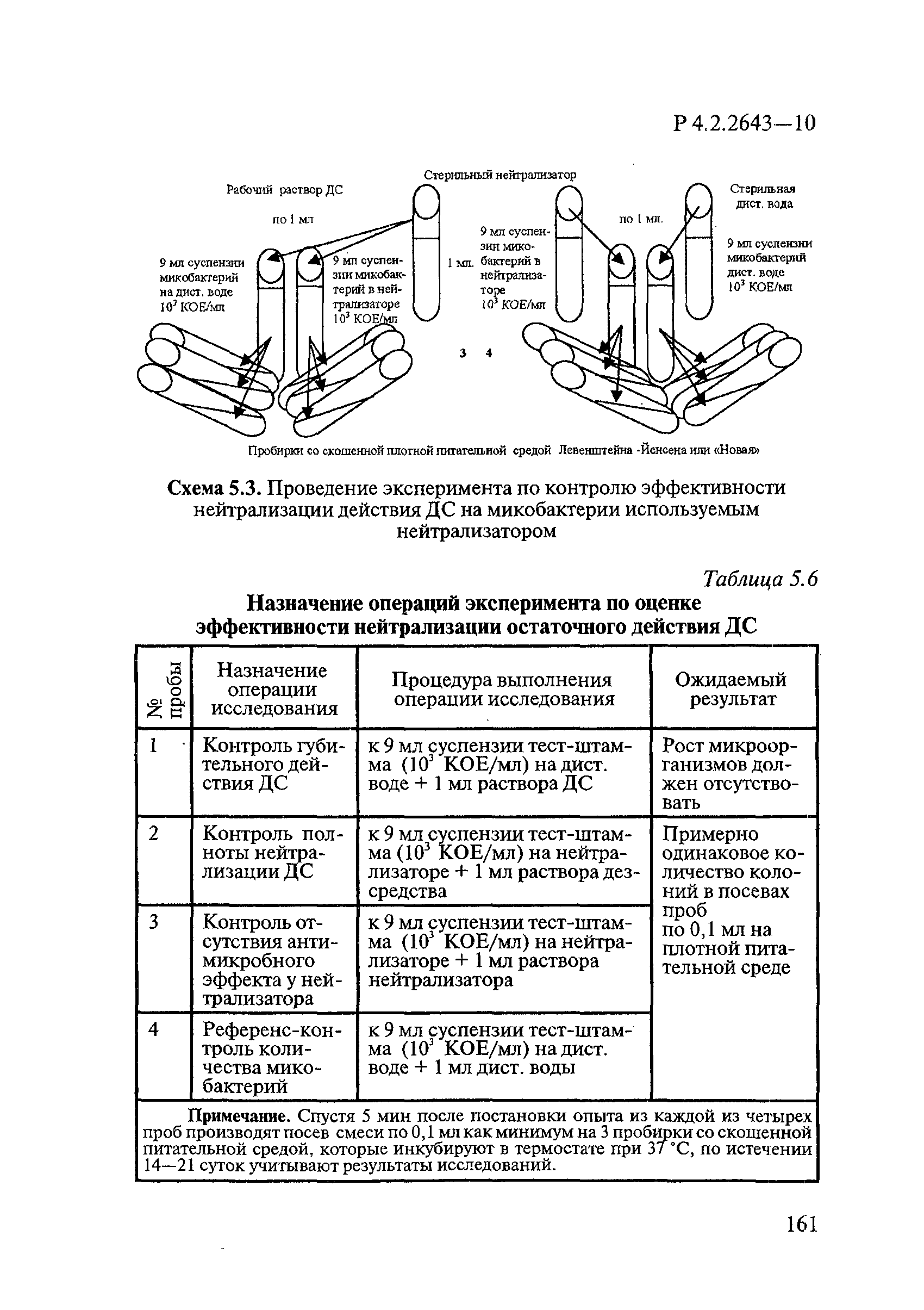
Для разграничения биоцидного и биостатического действий ДС при определении антимикробной активности и эффективности применяют нейтрализаторы, исключающие остаточное атимикробное действие.
Для нейтрализации антимикробного действия ДС из различных химических групп применяют следующие нейтрализаторы:
— для галоидактивных (хлор-, бром- и йодактивные) и кислородактивных (перекись водорода, ее комплексы с солями, надуксусная кислота, озон) — 0,1-1,0% растворы тиосульфата натрия по ГОСТ 27068;
— для четвертичных аммониевых солей (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и др.), производных гуанидина (полигексаметиленгуанидин гидрохлорид, хлоргексидин биглюконат и др.) — 0,1-1,0% растворы лаурилсульфата натрия (сульфонол) [1]), растворы лаурилсульфата натрия с 10% обезжиренного молока или универсальный нейтрализатор;
— для альдегидов (глутаровый альдегид, глиоксаль, формальдегид, ортофталевый альдегид) — 1,0% раствор пиросульфита (метабисульфита) натрия по ГОСТ 11683 или универсальный нейтрализатор;
— для кислот — щелочи в эквивалентном количестве;
— для щелочей — кислоты в эквивалентном количестве;
— для спиртов — разведение в воде до недействующей концентрации;
— для композиционных средств — универсальный нейтрализатор, содержащий Твин 80 по ГОСТ 32770 3%, сапонин 0,3-3%, гистидин — 0,1%, цистеин — 0,1%.
Если в состав композиции входят окислители, в нейтрализатор дополнительно вводят тиосульфат натрия по ГОСТ 27068.
В качестве универсального нейтрализатора при изучении туберкулоцидного действия используют нейтрализующий бульон по Ди-Ингли.
Растворы нейтрализаторов готовят в асептических условиях, применяя для этого стерильную дистиллированную воду по ГОСТ 6709.
При невозможности соблюдения асептических условий приготовления нейтрализаторов допускают стерилизацию готовых растворов автоклавированием при 1,1 атм. (121°С) в течение 15 мин.
Температура растворов нейтрализаторов должна быть 20°С, независимо от температуры окружающей среды.
Готовые растворы должны использоваться в день приготовления. Допускается хранение готовых растворов при температуре 4°С в течение 48 ч.
Исследование эффективности ДС проводят в зависимости от концентрации ДВ, времени воздействия, нормы расхода, характера объекта, вида его загрязнения, температуры, способа и кратности обработки по [2].
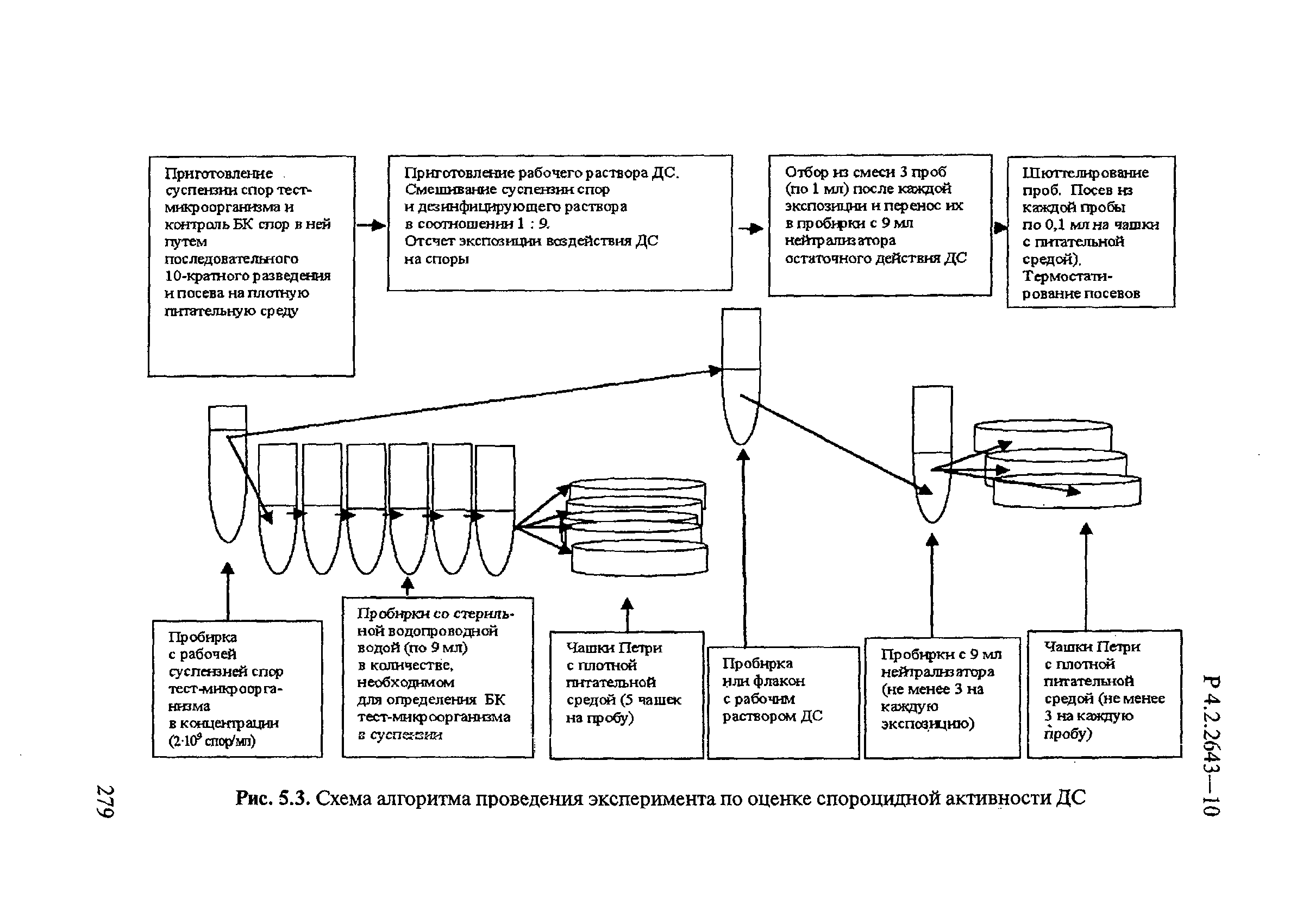
5 Методы изучения и оценки бактерицидной активности дезинфицирующих средств
5.1 Требования к тест-микроорганизмам
При изучении бактерицидной активности дезинфицирующих субстанций и ДС в качестве тест-микроорганизмов используют:
— Escherichia coli (штамм 1257);
— Pseudomonas aeruginosa (штамм АТСС 27853);
— Salmonella typhimurium (штамм 00074 NCTC=13311 АТСС) — для оценки бактерицидной активности в отношении грамотрицательных бактерий;
— Staphylococcus aureus (штамм 906) — для оценки бактерицидной активности в отношении грамположительных бактерий.
Или другие микроорганизмы, обладающие аналогичной устойчивостью к ДС.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные, культуральные и ферментативные свойства, присущие данному виду, и обладать стандартной устойчивостью к эталонным ДС.
Музейные культуры микроорганизмов хранят при температуре 3-10°С в ампулах (после лиофильной сушки) или на плотных питательных средах (посев уколом) под слоем стерильного вазелинового масла с толщиной слоя 1,5-3 мм, рабочие культуры — на скошенном агаре или в бульоне.
Проверку устойчивости тест-микроорганизмов проводят не реже 1 раза в месяц по [2]. При снижении резистентности культур делают их пересевы на обогащенные питательные среды до восстановления устойчивости.
Тест-микроорганизмы культивируют при температуре 37°С в течение 18-24 ч на следующих питательных средах:
— казеиновом бульоне;
— мясо-пептонном бульоне;
— агаре Эндо;
— казеиновом агаре;
— мясо-пептонном агаре.
5.2 Методы приготовления суспензии тест-микроорганизмов. Определение биологической концентрации тест-микроорганизмов в бактериальной суспензии
Перед изучением бактерицидной активности ДС культуры тест-микроорганизмов подвергают контролю их качества. Перед использованием тест-культур для исследовательских целей проверяют отсутствие среди тест-микроорганизмов, выросших на питательной среде, посторонней микрофлоры. Для оценки роста тест-микроорганизмов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших тест-микроорганизмов, окрашенных по Граму.
Рабочую суспензию тест-микроорганизмов готовят из культуры данного тест-штамма, выращенного на плотной питательной среде (МПА или казеиновый агар) при температуре (37±1)°С в течение 18-24 ч. Для приготовления бактериальной взвеси культуру смывают с агара стерильной питьевой водой. Полученную взвесь тест-микроорганизмов фильтруют через ватно-марлевый фильтр и разводят стерильной питьевой водой до концентрации 2×109 клеток в 1 мл, соответствующей по мутности 20 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (20 ME) или 6 единицам Мак-Фарланда, определяемых с помощью денситометра.
В связи с тем, что суспензия может содержать наряду с живыми мертвые микроорганизмы, необходимо определять биологическую концентрацию фактического количества живых клеток в приготовленной суспензии для корректировки и обеспечения требуемых уровней контаминации тест-объектов жизнеспособными микроорганизмами.
Определение биологической концентрации тест-микроорганизмов выполняют методом последовательных десятикратных разведений суспензии тест-микроорганизма в стерильной питьевой воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (казеиновый агар, агар Эндо, МПА). После определенного времени инкубации при соответствующей температуре проводят подсчет выросших колониеобразующих единиц (КОЕ) и определяют количество жизнеспособных бактерий в 1 мл суспензии.
5.3 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Исследования проводят в зависимости от вида поверхностей, их положения (горизонтальное, вертикальное), способа и кратности обработки.
В качестве тест-поверхностей используют поверхности размером 10×10 см из различных материалов:
— гладкие;
— шероховатые;
— впитывающие;
— не впитывающие.
Пример — Деревянные, оштукатуренные, окрашенные масляной, силикатной, водоэмульсионной или клеевой краской; оклеенные обоями, поверхности из линолеумных покрытий, окрашенного или неокрашенного металла — нержавеющая хром-никелевая кислотостойкая сталь, из пластика, стекла, искусственной или натуральной кожи, облицовочной плитки — кафельной и метлахской, фаянса.
Для исследования используют не менее 5 видов поверхностей. Набор тест-поверхностей для исследований определяют по назначению средства.
В качестве тест-микроорганизмов используют S.aureus и E.coli, при необходимости дополнительно используют S.typhimurium, P.aeruginosa или другие виды бактерий.
Перед контаминацией тест-микроорганизмами поверхности подвергают механической очистке — моют водой с мылом и щеткой (за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской). Последние протирают несколько раз стерильной салфеткой, увлажненной стерильной питьевой водой.
Высушенные поверхности располагают горизонтально и на них пипеткой наносят взвесь тест-микроорганизмов из расчета 0,5 мл 2-миллиардной микробной взвеси на площадь в 100 см и равномерно распределяют ее по поверхности стеклянным шпателем. Поверхности подсушивают (до полного высыхания) при температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
При изучении эффективности обеззараживания горизонтально располагают:
— линолеум;
— плитку метлахскую;
— искусственную кожу;
— натуральную кожу.
Вертикально располагают:
— дерево, окрашенное масляной или другими видами красок;
— поверхности, оклеенные обоями;
— пластик;
— кафельную плитку;
— фаянсовую плитку;
— стекло.
Для имитации загрязнения поверхностей используют белковое или фекальное загрязнение: 40% инактивированной сыворотки, 40% фекальной эмульсии (при разработке режимов обеззараживания санитарно-технического оборудования).
Обработку поверхностей проводят способами протирания или орошения (крупнокапельное и аэрозольное).
Для определения нормы расхода при однократной обработке дезинфицирующий раствор наносят с помощью пипетки на поверхность размером 10х10 см при применении способа протирания в количестве 1,0, 1,5 или 2,0 мл, а при крупнокапельном орошении наносят с помощью дозатора 1,5-3,0 мл. При аэрозольном методе обработки изучают эффективность обеззараживания при норме расхода 1-100 мл/м (в зависимости от вида аэрозольного генератора и применяемой аэрозольной насадки). Многократное протирание или орошение проводят с интервалом между обработками 5-15-30 мин.
Время обеззараживания поверхностей определяют в интервале от 5 до 120 мин. Выбор экспозиции зависит от назначения и рекомендуемых условий применения ДС.
Контрольные поверхности обрабатывают стерильной водопроводной водой так же и из того же расчета, что и опытные.
Исследования проводят при температуре 18-20°С. При необходимости оценивают эффективность обеззараживания поверхностей при повышенной до 50°С или пониженной до минус 30°С температуре (исследования проводят в термо- или холодильной камере).
Контроль эффективности обеззараживания тест-поверхностей проводят следующим образом: марлевой салфеткой (размером 5×5 см), смоченной в растворе соответствующего для данного дезинфицирующего средства нейтрализатора, тщательно протирают тест-поверхность, затем ее погружают в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. Отмывную жидкость сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды.
Допустимо проводить исследования с использованием тест-поверхностей размером 5х5 см из тех же материалов, что и тест-поверхности 10х10 см. Этот метод можно использовать при оценке чувствительности к ДС микроорганизмов, выделенных с объектов окружающей среды.
Тест-поверхности помещают на дно стерильной чашки Петри и пипеткой наносят на них 0,1 мл 2-миллиардной микробной взвеси (площадь поверхности 25 см), равномерно распределяют ее по поверхности стерильным шпателем, не допуская отекания суспензии за пределы тест-объекта, затем подсушивают, приоткрыв чашку Петри (до полного высыхания) при температуре плюс 18-22°С и относительной влажности 40-60%, после чего обрабатывают раствором ДС так же, как указано выше. После окончания экспозиции чашки с тест-объектами заливают 10 мл раствора нейтрализатора, соответствующего данному ДС, и делают несколько круговых движений чашкой для лучшего смачивания тест-объекта. Через несколько минут стерильным пинцетом переворачивают тест-объект и повторяют круговые движения. После контакта нейтрализатора с тест-объектом в течение 10 мин снова делают несколько круговых движений чашкой, затем стерильным пинцетом удаляют тест-объект из чашки и сбрасывают его в емкость с дезинфицирующим раствором с целью дальнейшего обеззараживания. Если тест-объект обработан способом погружения в дезинфицирующий раствор, то по завершении экспозиции его переносят в чашку Петри с 10 мл раствора нейтрализатора на 10 мин, после чего извлекают и сбрасывают в емкость с дезинфицирующим раствором для обеззараживания.
Нейтрализатор из чашки Петри сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды либо заливают чашку с нейтрализатором растопленным и остуженным до 45°С агаром.
Посевы помещают для выращивания в термостате при температуре (37±1)°С. Учет результатов проводят в течение 1-2 суток путем подсчета количества выросших колоний, затем рассчитывают плотность контаминации 100 см поверхности и процент обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100%.
Критерий эффективности обеззараживания поверхностей — не менее 99,99% гибели тест-микроорганизмов.
Таблица 1 — Показатели эффективности ДС при обработке поверхностей
|
Показатель |
Значение показателя |
|
Критерий эффективности |
99,99% гибель тест-культуры |
|
Время гибели S.aureus, E.coli, S.typhimurium, Paeruginosa |
Не более 120 мин |
5.4 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания белья
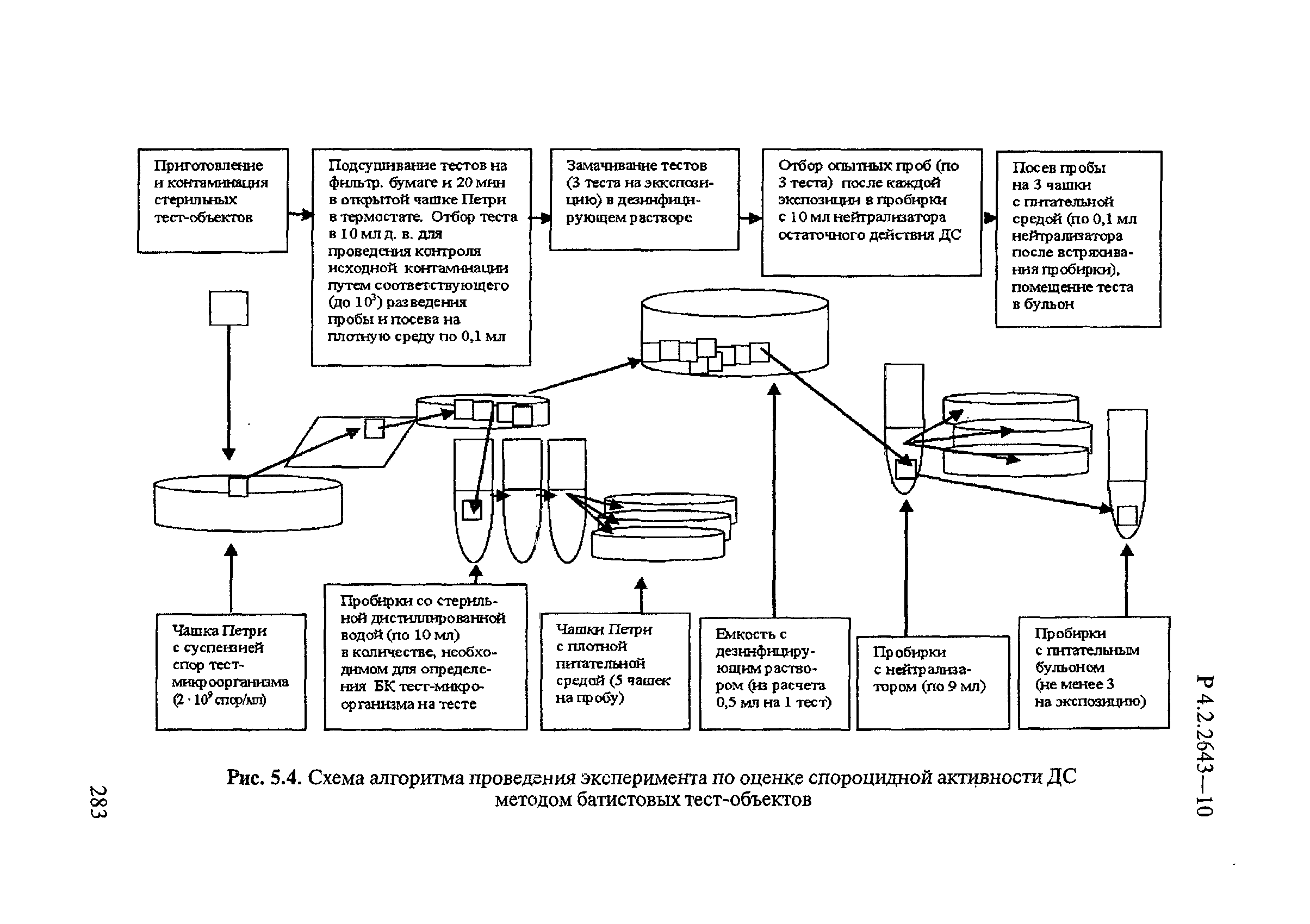
Эффективность обеззараживания белья ДС определяют с помощью тест-объектов, представляющих собой кусочки ткани из бязи размером 2х2 см. В качестве тест-культур используют S.aureus и E.coli.
При разработке режима обеззараживания загрязненного белья к суспензии микроорганизмов перед контаминацией тест-объектов добавляют 40% инактивированной сыворотки (6 мл 2-миллиардной взвеси тест-культуры смешивают с 4 мл инактивированной сыворотки) или 40% фекальной эмульсии (6 мл 2-миллиардной взвеси тест-культуры смешивают с 4 мл фекальной эмульсии). Для приготовления фекальной эмульсии 8 г фекалий растирают в ступке с 20 мл воды. Контаминированные тест-объекты подсушивают в термостате при 37°С в течение 20-25 мин или 1,5-2 ч при комнатной температуре до полного высыхания.
Стерильные тест-объекты пропитывают 2-миллиардной взвесью тест-микроорганизмов из расчета 20 мл на 10 тест-объектов и подсушивают в термостате. Далее контаминированные тест-объекты помещают в стерильные бязевые мешочки размером 5х8 см по 2 штуки в каждый.
При разработке режимов обеззараживания белья, не загрязненного выделениями, белье погружают в емкость с дезинфицирующим раствором из расчета 4 л раствора на 1 кг сухого белья.
При разработке режимов обеззараживания белья, загрязненного выделениями, белье погружают в емкость с дезинфицирующим раствором из расчета 5 л раствора на 1 кг сухого белья.
Белье погружают в раствор последовательно, без воздушных полостей между вещами, препятствующих процессу дезинфекции. Мешочки с контаминированными тест-объектами распределяют между слоями белья (сверху, в середине, внизу). Через заданное время воздействия ДС извлекают по 1 мешочку с каждого уровня, стерильным пинцетом вынимают тест-объекты, переносят их в раствор нейтрализатора на 5 мин, промывают 5 мин в стерильной питьевой воде и помещают в жидкие питательные среды. В контрольных опытах вместо дезинфицирующего раствора используют стерильную питьевую воду.
Показатели эффективности обеззараживания белья приведены в таблице 2.
Таблица 2 — Критерии эффективности обеззараживания белья
|
Показатель |
Значение показателя |
|
Критерий эффективности |
100% гибель тест-культуры |
|
Время обеззараживания белья без видимых загрязнений, контаминированного S.aureus, E.coli |
Не более 120 мин |
|
Время обеззараживания белья, загрязненного выделениями и контаминированного S.aureus, E.coli |
Не более 240 мин |
5.5 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания посуды
В зависимости от назначения ДС исследования проводят при обеззараживании посуды столовой и кухонной, лабораторной и из-под выделений.
В качестве тест-объектов при разработке режимов обеззараживания столовой и кухонной посуды используют:
— тарелки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— стаканы из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— кружки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— столовые приборы — ножи, вилки, ложки из различных материалов (нержавеющая сталь, алюминий, пластик);
— лабораторную посуду — предметные и покровные стекла, пипетки, пробирки, чашки Петри, планшеты для иммунологического анализа и др.;
— посуду из-под выделений — подкладные судна, мочеприемники, горшки, плевательницы и др. или тест-объекты их имитирующие.
В качестве тест-микроорганизмов при контаминации столовой посуды используют S.aureus, E.coli.
Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя добавляют 1 мл 2-миллиардной микробной взвеси), лабораторной посуды — 40% инактивированной сыворотки, посуды из-под выделений — 40% фекальную эмульсию или мокроту, контаминированные тест-микроорганизмами (на 10 мл — 1 мл 2х млрд. взвеси).
Перед контаминацией микроорганизмами посуду и столовые приборы подвергают механической очистке — моют водой с мылом и щеткой. Посуду располагают горизонтально, наносят пипеткой взвесь тест-микроорганизмов из расчета 0,5 мл 2 млрд. взвеси на площадь в 100 см и равномерно распределяют ее по поверхности посуды стеклянным шпателем. Столовые приборы для контаминации погружают в бактериальную суспензию на 1-2 мин, оставляя незараженными их ручки.
Посуду подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
Для разработки режимов обеззараживания посуды с остатками пищи до ее контаминации микробную взвесь смешивают с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной микробной взвеси).
Обработку столовой, чайной, лабораторной посуды и столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18-20°С. При необходимости изучают эффективность растворов, имеющих температуру 50°С.
Контролем служит аналогично контаминированная посуда, которую погружают в такой же объем стерильной питьевой воды.
Дезинфицирующий раствор должен полностью и с избытком покрыть всю посуду и приборы (из расчета не менее 2 л на 1 комплект).
Через определенные интервалы времени извлекают из дезинфицирующего раствора по одному предмету и стерильной марлевой салфеткой (размер 5×5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС; тщательно протирают зараженную часть каждого предмета, погружают салфетку в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. После отмыва марлевую салфетку погружают в соответствующую жидкую питательную среду. Отмывную жидкость сеют на 2-3 чашки по 0,2-0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 37°С и учитывают через 2 суток.
Время обеззараживания посуды определяют в интервале от 15 до 240 мин в зависимости от вида тест-микроорганизма и наличия загрязнения.
Критерий эффективности обеззараживания — не менее 100%.
Таблица 3 — Показатели эффективности обеззараживания посуды
|
Микроорганизм |
Объекты обеззараживания |
Эффективность (%) — время обеззараживания (мин) |
|
S.aureus, E.coli |
Столовая посуда без остатков пищи |
100% — не более 60 мин |
|
S.aureus, E.coli, S.typhimurium |
Столовая посуда с остатками пищи |
100% — не более 120 мин |
|
S.aureus, E.coli |
Лабораторная посуда |
100% — не более 120 мин |
|
E.coli, S.typhimurium |
Посуда из-под выделений |
100% — не более 240 мин |
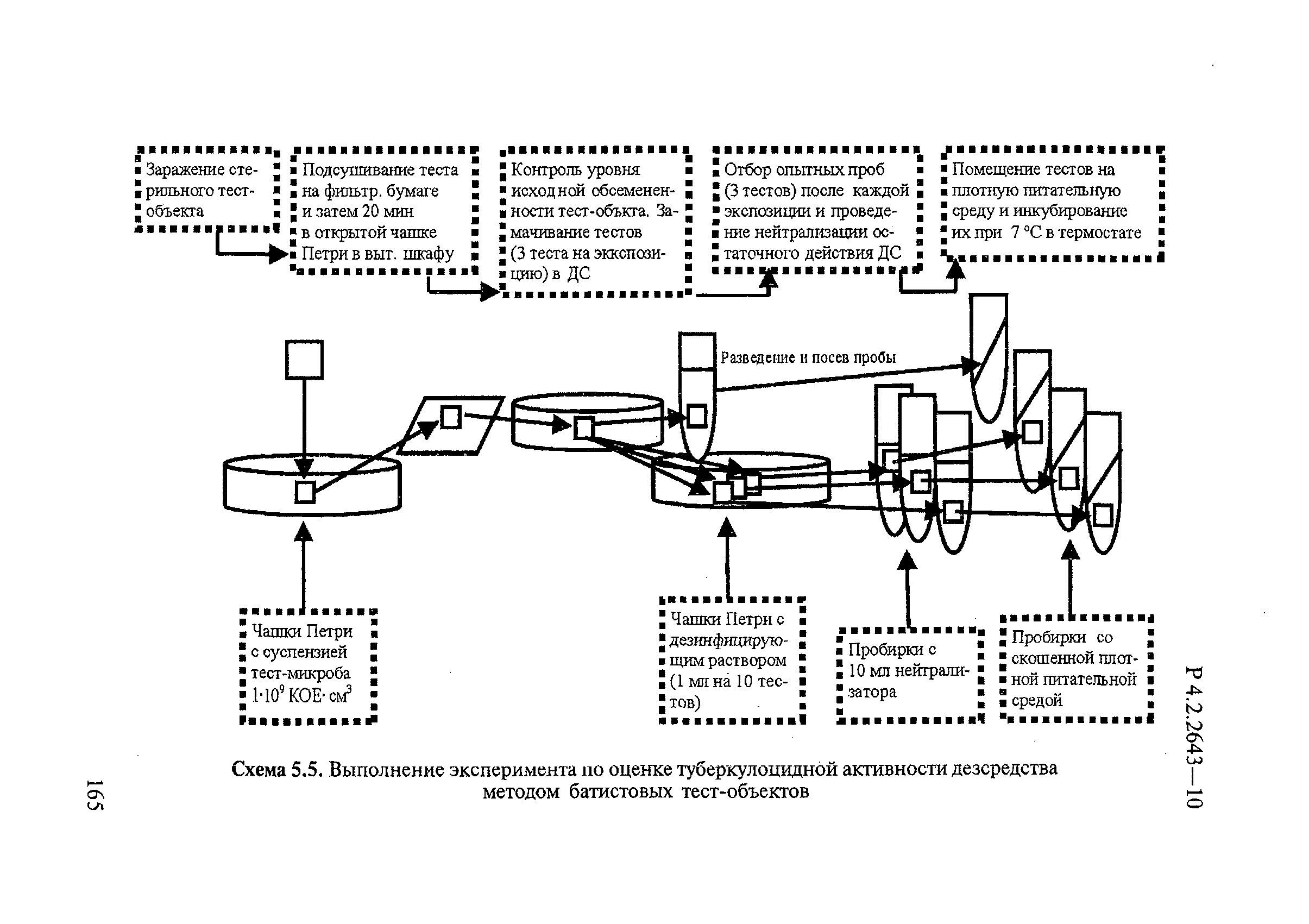
6 Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств
6.1 Требования к тест-микроорганизмам
Исследование и оценку туберкулоцидной и микобактерицидной (в отношении непатогенных микобактерий) активности ДС проводят, используя в качестве тест-микроорганизмов следующие:
— агаровую культуру Mycobacterium terrae для оценки активности ДС и разработки режимов их применения при обеззараживании объектов в отношении возбудителя туберкулеза и микобактериозов;
— агаровую культуру Mycobacterium tuberculosis для подтверждения эффективности разработанных режимов применения ДС в отношении возбудителей туберкулеза и микобактериозов в практических условиях.
Тест-микобактерии должны иметь типичные морфологические, культуральные, биохимические, тинкториальные и ферментативные свойства, присущие данному штамму, и обладать стандартной устойчивостью к эталонным ДС и температуре.
6.2 Методика приготовления суспензии тест-микроорганизмов. Определение биологической концентрации тест-микроорганизмов в суспензии
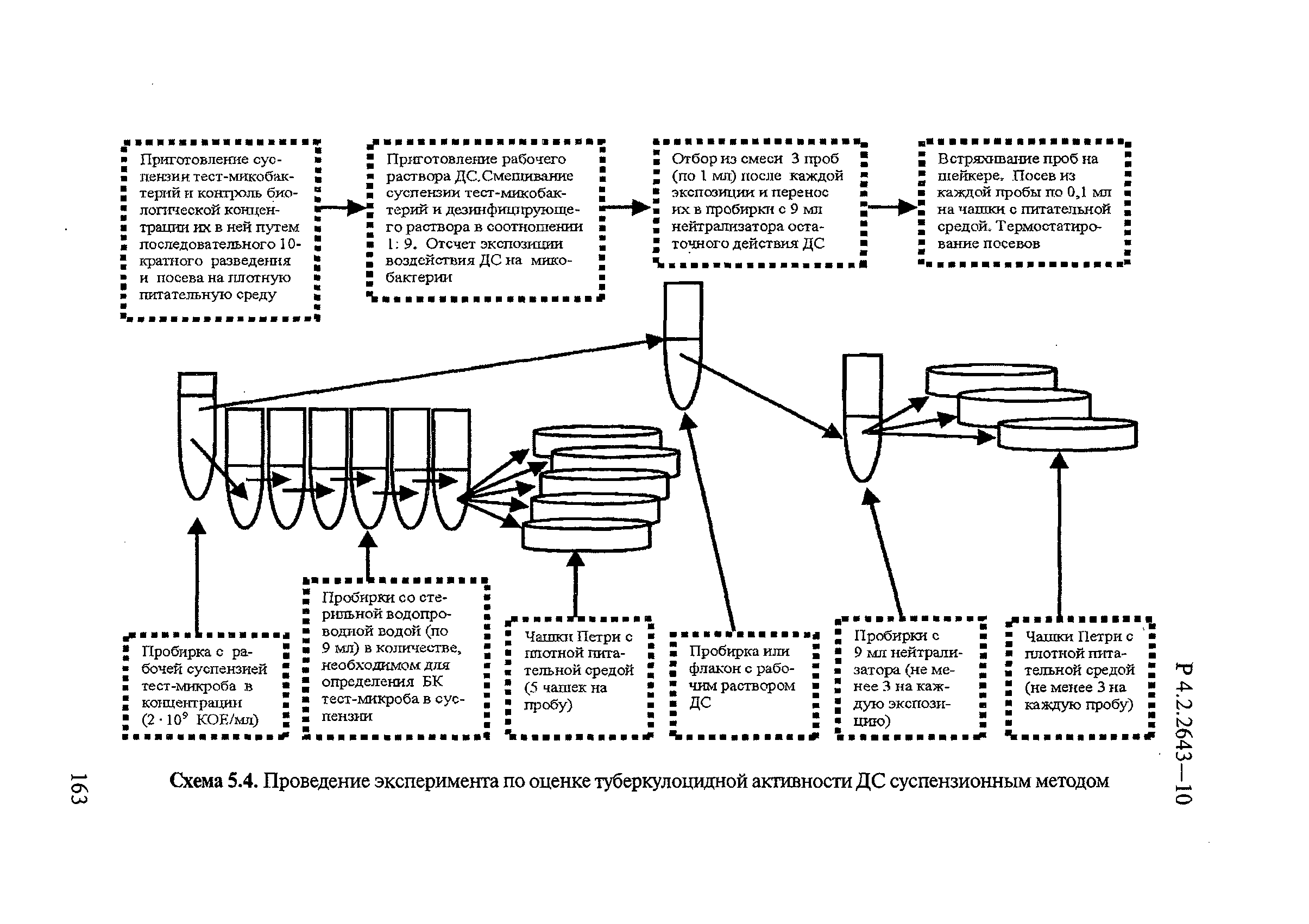
Для получения первого пассажа культуры тест-штамма микобактерий, используемой при оценке эффективности ДС, необходимое для исследования количество хранящихся при температуре минус 70°С или минус 20°С микропробирок (2 штуки на 1 исследование) с данным штаммом микобактерий размораживают при комнатной температуре, переносят по 0,1 мл содержимого в пробирки со скошенной питательной средой Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий, и инкубируют в термостате при плюс (37±1)°С в течение 10-21 суток. Выросшую на плотной питательной среде в пробирках культуру используют для приготовления рабочей суспензии тест-микобактерий данного штамма.
Одну или несколько пробирок используют для получения второго пассажа культуры тест-микобактерий этого штамма. Для этого культуру первого пассажа в пробирке снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды, помещают в толстостенную стеклянную пробирку и тщательно растирают, постепенно добавляя по каплям стерильную дистиллированную воду. Полученную суспензию рассевают на плотную питательную среду тем же способом, который используют для получения первого пассажа.
Культуры тест-микобактерий подвергают контролю их качества. Непосредственно перед использованием культур для исследовательских целей проверяют, что тест-микобактерии, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста тест-микобактерий визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших культур методом окраски по Циль-Нильсену
Пример — М.terrae представляют собой короткие прямые палочки малиново-красного цвета, располагающиеся в мазке параллельно друг другу наподобие частокола. Размер клеток микобактерий 0,2-0,6х1-10 мкм.
Рабочую суспензию тест-микобактерий готовят из тест-штамма первого и/или второго пассажей, выросших на плотной питательной среде. Дальнейшее субкультивирование недопустимо.
Для приготовления рабочей суспензии культуру микобактерий снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды и помещают в толстостенную стеклянную пробирку. Микробную биомассу тщательно гомогенизируют, постепенно добавляя по каплям стерильную дистиллированную воду. Густую исходную бактериальную суспензию оставляют на 15 минут для осаждения негомогенизированных конгломератов и частиц. Полученную надосадочную жидкость отбирают пастеровской пипеткой, переносят в стерильную пробирку и, добавляя стерильную дистиллированную воду, доводят до концентрации 1×109 клеток в 1 мл, соответствующей по мутности 10 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (10 ME) или 3 единицам Мак-Фарланда, определяемых с помощью денситометра.
Контроль над содержанием живых микроорганизмов осуществляют посредством бактериологического контроля фактического их количества в приготовленной суспензии.
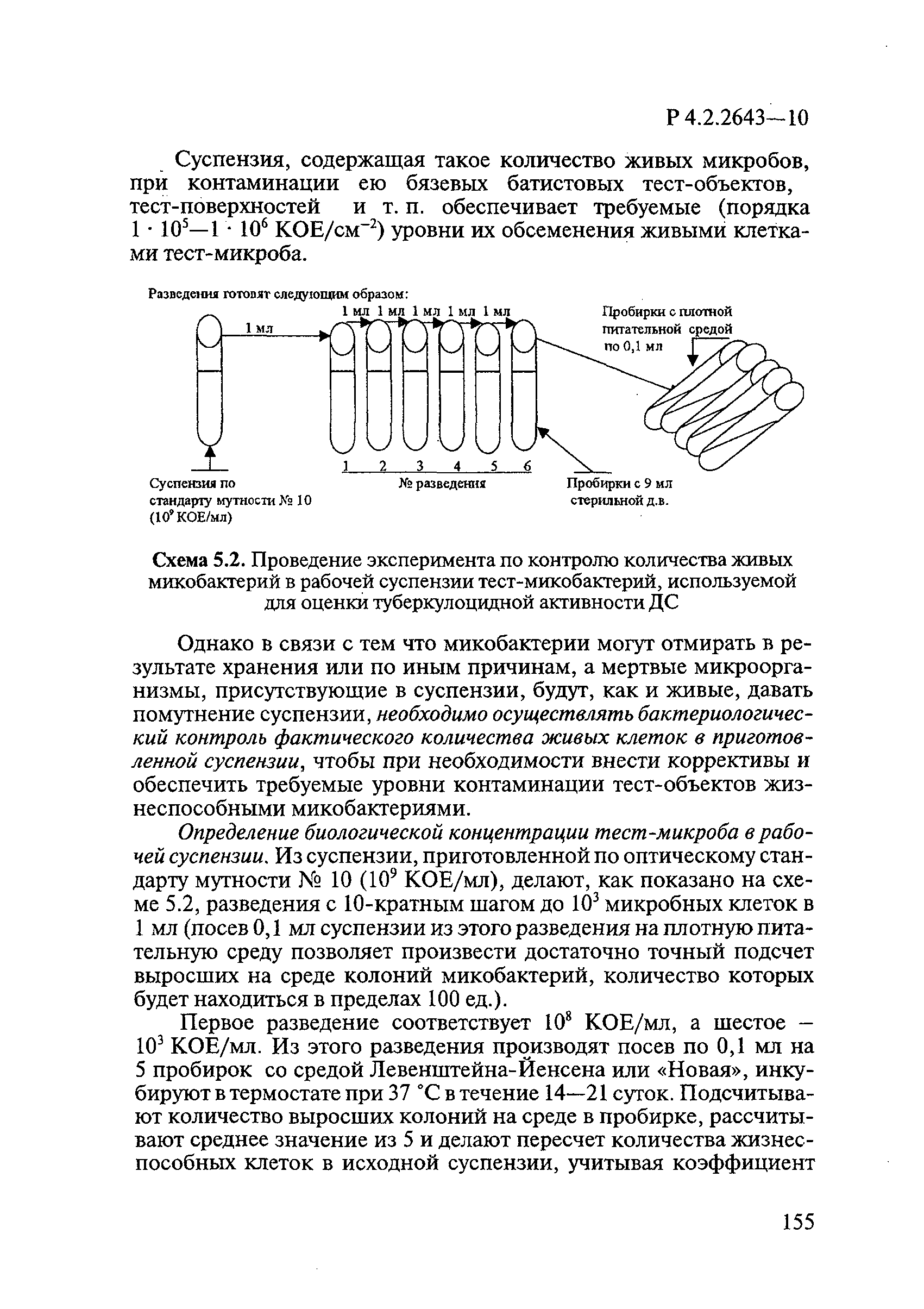
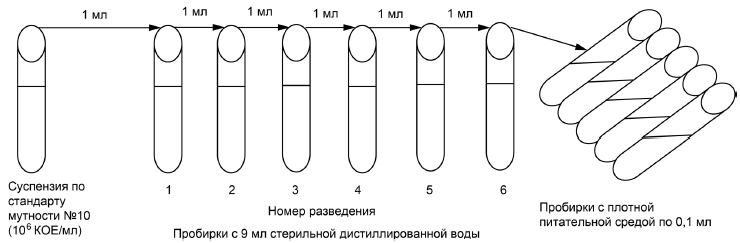
Из приготовленной суспензии делают, как показано на рисунке 1, разведения с 10-кратным шагом до 10 микробных клеток в 1 мл (посев 0,1 мл суспензии из этого разведения на плотную питательную среду позволяет произвести достаточно точный подсчет выросших на среде колоний микобактерий, количество которых будет находиться в пределах 100 единиц).
|
|
Рисунок 1 — Процесс разведения
Посевы инкубируют в термостате при плюс (37±1)°С в течение 10-21 суток. Подсчитывают количество выросших колоний на среде в пробирке, рассчитывают среднее значение из 5 и делают пересчет количества жизнеспособных клеток в исходной суспензии, учитывая коэффициент разведения. Количество жизнеспособных клеток в рабочей суспензии должно быть КОЕ/мл.
6.3 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Подготовка тест-поверхностей и технология проведения эксперимента изложены в п.5.3.
Для контроля эффективности обеззараживания через определенные промежутки времени (15-30-60 и т.д. до 120 мин) с обработанных раствором ДС тест-поверхностей делают смывы путем тщательного протирания поверхности стерильной марлевой салфеткой (5×5 см), увлажненной нейтрализатором. После протирания на тест-поверхности не должно оставаться излишней влаги. Салфетки погружают на 5 минут в пробирки (емкости) с соответствующим нейтрализатором (10 мл), а затем в стерильную питьевую воду с бусами и встряхивают на шейкере в течение 10 мин. Полученную смывную жидкость вносят по 0,1 мл в 3-5 пробирок со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая» или аналогичную питательную среду, предназначенную для культивирования микобактерий, тщательно распределяя ее по всей поверхности. Посевы инкубируют в термостате при температуре 37±1°С в течение 10-21 суток.
В контрольных опытах для обработки аналогично контаминированных тест-поверхностей вместо раствора ДС используют стерильную питьевую воду из того же расчета, что и опытные. Жидкость, в которую помещают стерильную марлевую салфетку после взятия смыва с контрольных поверхностей, перед посевом разводят в 100 раз и вносят по 0,1 мл на скошенную поверхность плотной питательной среды Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий 3-5 пробирок. Посевы инкубируют в термостате при температуре плюс (37±1)°С. Результаты учитывают через 10-21 суток.
Оценку результатов проводят по посеву того разведения, в котором число колоний на чашке Петри или в пробирке составляет от 30 до 300.
Допускается проводить исследования с использованием тест-поверхностей размером 5х5 см (5.3). После выдерживания посевов в термостате подсчитывают число колоний на чашках или пробирках с плотной питательной средой, рассчитывают остаточную плотность контаминации на 100 см тест-поверхности и высчитывают эффективность обеззараживания, принимая количество тест-микроорганизмов, снятых с контрольных тест-объектов (тест-поверхностей), за 100%.
Критерий эффективности ДС при обеззараживании тест-поверхностей из различных материалов, контаминированных тест-микроорганизмом, должен составлять не менее 99,99%.
6.4 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания белья
Исследования с ДС проводят в целях оценки эффективности его для обеззараживания белья и других объектов из ткани, чистых и загрязненных кровью или выделениями (фекалии, моча, мокрота).
Оценку эффективности ДС для обеззараживания белья, одежды, спецодежды и других объектов из ткани осуществляют в соответствии с п.5.4 После обработки раствором ДС тест-объекты вынимают из мешочка стерильным пинцетом, помещают на 5 мин в емкость с раствором соответствующего нейтрализатора, затем переносят в стерильную питьевую воду и высевают на питательный агар. Посевы инкубируют при (37±1)°С. Предварительный учет результатов проводят через 10-14 суток, а окончательный — через 21 сутки. В контрольных опытах белье погружают в стерильную питьевую воду. Мешочки с тестами закладывают так же, как и в опыте. При получении 100%-ной гибели тест-микроорганизма в опытах по обеззараживанию белья без белковых загрязнений переходят к опытам по обеззараживанию белья, загрязненного выделениями.
Для определения эффективности ДС при обеззараживании белья, одежды, спецодежды и других объектов из ткани, загрязненных кровью, выделениями (фекалии, мокрота, моча и др.), в лабораторных условиях используют бязевые тест-объекты, которые контаминируют суспензией тест-микобактерий с добавлением 40% инактивированной сыворотки (6 мл суспензии, содержащей 2х109 КОЕ/мл тест-микроорганизма, смешивают с 4 мл инактивированной сыворотки) или 40% фекальной эмульсии (6 мл суспензии тест-микроорганизма смешивают с 4 мл 40% фекальной эмульсии) исходя из расчета 30 мл суспензии на 10 тест-объектов. Для приготовления фекальной эмульсии 8 г фекалий растирают в ступке с 20 мл воды. Количество суспензии тест-микроорганизма, содержащей сыворотку или фекалии, готовят из расчета 30 мл на 10 тест-объектов. При изучении эффективности обеззараживания изделий из синтетических тканей (капрон, ацетат, лавсан и др.) используют тест-объекты из этих тканей размером 5×5 см. Контаминированные тест-объекты подсушивают в термостате при (37±1)°С в течение 20-25 мин или 1,5-2 ч при комнатной температуре до полного высыхания.
Критерием эффективности ДС при обеззараживании белья, одежды, спецодежды и других объектов из тканей является 100%-ная гибель тест-микроорганизмов на тест-объектах.
6.5 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания посуды
Для определения туберкулоцидной активности ДС, предназначенных для обеззараживания посуды (столовой, лабораторной и из-под выделений), используют в качестве тест-объектов, указанные в 5.5.
Обработку контаминированной столовой, чайной, лабораторной посуды, столовых приборов проводят способом погружения в дезинфицирующий раствор, аналогично изложенным в 5.5.
Время обеззараживания посуды — от 15 до 240 мин, в зависимости от вида ДС и наличия загрязнения.
Через определенные интервалы времени (15, 30, 60 минут и т.д.) извлекают по одному предмету разных наименований (тарелка, стакан, предметное стекло, нож и т.д.) из дезинфицирующего раствора стерильной марлевой салфеткой (5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС, тщательно протирают зараженную часть каждого предмета и погружают в 10 мл этого же нейтрализатора на 5 мин, затем салфетку переносят в пробирку со стерильной питьевой водой и бусами. Время отмыва марлевой салфетки — 10 мин при постоянном встряхивании на шейкере. После отмыва смывную жидкость по 0,1 мл высевают в 3-5 пробирки со скошенной поверхностью плотной питательной среды Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий (по 0,1 мл в каждую). Посевы помещают в термостат при температуре 37°С. Предварительный учет результатов проводят через 10-14 суток, окончательный — через 21 сутки.
Контролем служит аналогично контаминированная посуда, которая погружается не в дезинфицирующий раствор, а в такой же объем стерильной питьевой воды.
Критерий эффективности обеззараживания посуды: гибель тест-микроорганизма не менее 100%.
7 Методы изучения и оценки фунгицидной активности дезинфицирующих средств
7.1 Требования к тест-микроорганизмам
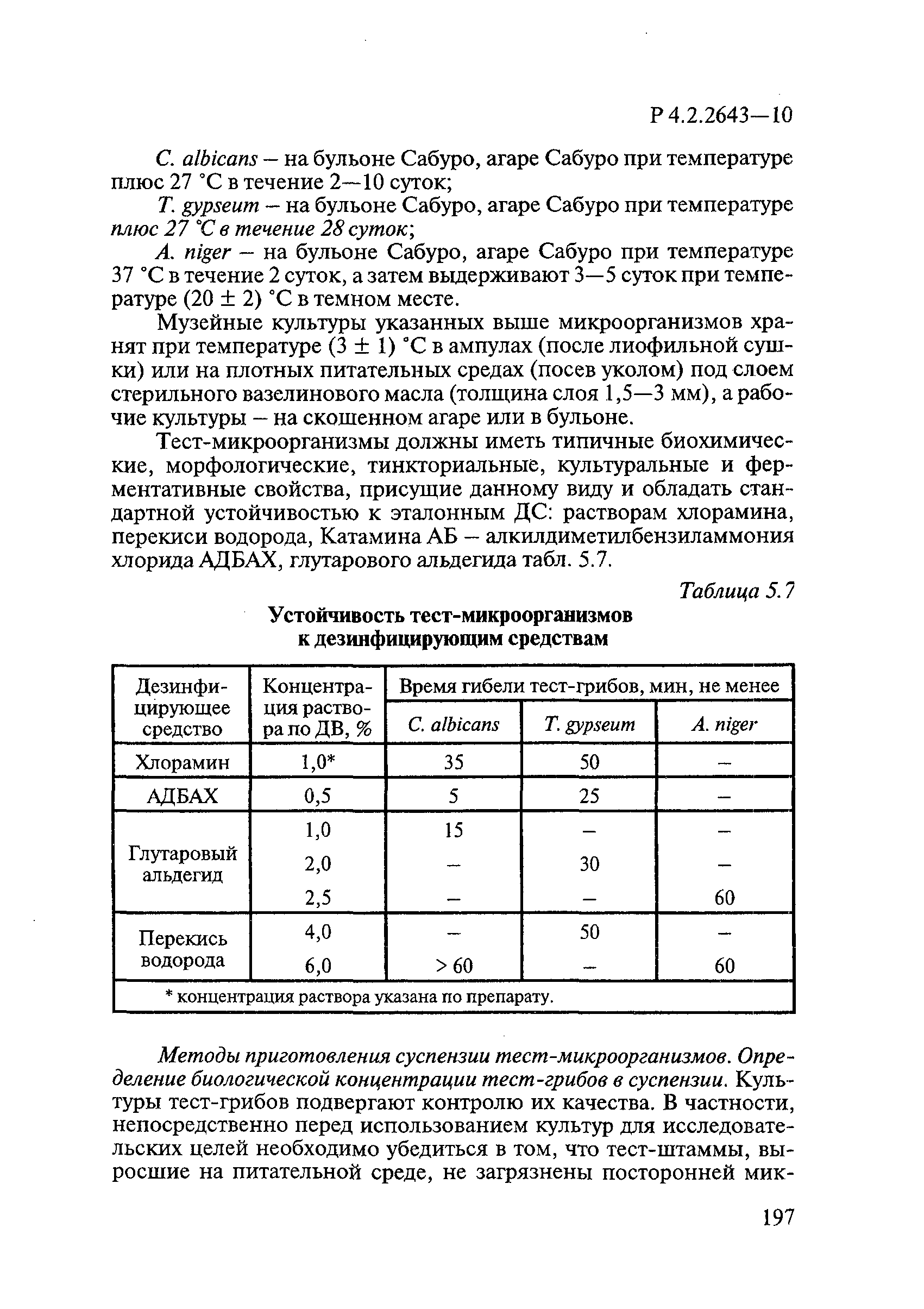
При изучении фунгицидной активности ДС и их субстанций в качестве тест-микроорганизмов используют:
— Candida albicans (штамм 15 или шт. ВКПМ Y 3108 (АТСС 10231) — для оценки фунгицидной активности в отношении возбудителей кандидозов;
— Trichophyton gypseum (муз.штамм НИИД) — для оценки фунгицидной активности в отношении возбудителей дерматофитий;
— Aspergillus niger (муз.штамм НИИД) или Aspergillus brasiliensis (штамм NCPF2275/ATCC 16404) для оценки фунгицидной активности в отношении плесневых грибов.
При сертификационных испытаниях и экспертной оценке ранее зарегистрированных ДС набор тест-микроорганизмов ограничивают наиболее устойчивыми представителями каждой группы.
Тест-микроорганизмы культивируют на следующих питательных средах:
— С.albicans — на бульоне Сабуро, агаре Сабуро при температуре (27±1)°С в течение 2-10 суток;
— Т.gypseum — на бульоне Сабуро, агаре Сабуро при температуре (27±1)°С в течение 28 суток;
— A.niger и A.brasiliensis — на бульоне Сабуро, агаре Сабуро при температуре (37±1)°С в течение 2 суток, затем выдерживают 3-5 суток при температуре (20±2)°С в темном месте.
Музейные культуры микроорганизмов хранят при температуре (3±1)°С в ампулах (после лиофильной сушки) или на плотных питательных средах (посев уколом) под слоем стерильного вазелинового масла (толщина слоя 1,5-3 мм), а рабочие культуры — на скошенном агаре или в бульоне.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные, культуральные и ферментативные свойства, присущие данному виду, и обладать стандартной устойчивостью к эталонным ДС.
7.2 Методы приготовления суспензии тест-микроорганизмов
Непосредственно перед использованием культур для исследовательских целей получают подтверждение, что тест-микроорганизмы, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста культур тест-грибов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды.
Рабочие суспензии тест-микроорганизмов готовят из культуры тест-грибов, выращенных на питательной среде.
Культуру Т.gypseum, выращенную на бульоне Сабуро при температуре (27±1)°С в течение 28 суток, извлекают петлей из пробирки, помещают в фарфоровую ступку и растирают с небольшим количеством стерильного физиологического раствора до гомогенной взвеси с минимальным размером частиц. Полученную суспензию фильтруют через стерильный ватно-марлевый фильтр и доводят с помощью физиологического раствора до концентрации 2х клеток в 1 мл, соответствующей по мутности 20 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (20 ME) или 6 единицам Мак-Фарланда, определяемых с помощью денситометра.
Культуру С.albicans выращивают на агаре Сабуро в течение 2 суток при температуре (27±1)°С в течение 48 часов. Затем смывают с питательной среды небольшим количеством стерильного физиологического раствора и тщательно перемешивают. Полученную суспензию фильтруют и разводят так же, как и культуру Т.gypseum.
Культуру A.niger, выращенную на бульоне Сабуро в течение 2 суток и выдержанную в течение 3-5 суток в темном месте, извлекают петлей из пробирки, помещают в фарфоровую ступку и растирают с небольшим количеством стерильного физиологического раствора до гомогенной суспензии с минимальным размером частиц. Полученную взвесь фильтруют и разводят также, как и культуру Т.gypseum.
В связи с тем, что суспензия содержит наряду с живыми мертвые микроорганизмы, определяют биологическую концентрацию тест-грибов. Для этого проводят десятикратные разведения суспензии тест-микроорганизама в стерильной дистиллированной воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (агар Сабуро). После определенного времени инкубации при соответствующей температуре подсчитывают количество выросших колониеобразующих единиц (КОЕ) и определяют количество жизнеспособных клеток в одном мл суспензии, которое должно быть не менее .
Проверку устойчивости проводят не реже 1 раза в 6 месяцев. При снижении устойчивости культур делают их пересевы на обогащенные питательные среды до восстановления устойчивости.
7.3 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Исследования проводят в зависимости от вида поверхностей, их положения (горизонтальное, вертикальное), способа и кратности обработки.
При разработке режимов обеззараживания поверхностей используют поверхности размером 10х10 см из различных материалов:
— гладкие;
— шероховатые;
— впитывающие;
— не впитывающие.
Пример — Деревянные, оштукатуренные, окрашенные масляной, силикатной, водоэмульсионной или клеевой краской; оклеенные обоями, поверхности из линолеумных покрытий, окрашенного или неокрашенного металла — нержавеющая хром — никелевая кислотостойкая сталь, из пластика, стекла, искусственной или натуральной кожи, облицовочной плитки — кафельной и метлахской, фаянса.
Для исследования используют не менее 5 видов поверхностей.
В качестве тест-культур С.albicans, Т.gypseum; A.niger или A.brasiliensis используют для разработки режимов обеззараживания поверхностей с целью профилактики и борьбы с плесенью.
Для имитации загрязнения поверхностей санитарно-технического оборудования при контаминации С.albicans, Т.gypseum используют белковое загрязнение в виде 40% инактивированной лошадиной сыворотки.
Для имитации загрязнения поверхностей унитазов при контаминации С.albicans используют загрязнение в виде 40% фекальной эмульсии. Для этого перед контаминацией объектов к суспензии грибов С.albicans, Т.gypseum добавляют необходимое количество сыворотки и к суспензии С.albicans — необходимое количество фекальной эмульсии.
Перед контаминацией тест-микрорганизамами поверхности подвергают механической очистке — моют водой с мылом и щеткой (за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской), затем протирают несколько раз стерильной салфеткой, увлажненной стерильной водопроводной водой.
Высушенные поверхности располагают горизонтально и на них пипеткой наносят взвесь тест-грибов из расчета 0,5 мл 2-миллиардной микробной взвеси на площадь в 100 см. Культуру равномерно распределяют по поверхности стеклянным шпателем. Поверхности подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
При изучении эффективности обеззараживания горизонтально располагают:
— линолеум;
— плитку метлахскую;
— искусственную кожу; натуральную кожу;
— стекло.
Вертикально располагают:
— дерево, окрашенное масляной краской;
— дерево, окрашенное силикатной краской;
— дерево, окрашенное водоэмульсионной краской;
— дерево, окрашенное клеевой краской;
— поверхности, оклеенные обоями;
— пластик;
— кафельную плитку; фаянсовую плитку.
Обработку поверхностей проводят способами протирания или орошения (крупнокапельное и аэрозольное).
Для определения нормы расхода при однократной обработке дезинфицирующий раствор наносят с помощью пипетки на поверхность размером 10×10 см при применении способа протирания в количестве 1,0, 1,5 или 2,0 мл, а при крупнокапельном орошении наносят с помощью дозатора 1,5-3,0 мл. При аэрозольном методе обработки изучают эффективность обеззараживания при норме расхода 30-50-100 мл/м (в зависимости от вида аэрозольного генератора и применяемой аэрозольной насадки). Многократное протирание или орошение проводят с интервалом между обработками 5-15-30 мин.
Время обеззараживания поверхностей определяют в интервале от 5 до 120 мин. Выбор экспозиции зависит от назначения и рекомендуемых условий применения средства.
Контрольные поверхности обрабатывают стерильной питьевой водой также и из того же расчета, что и опытные.
Исследования проводят при комнатной температуре. При необходимости оценивают эффективность обеззараживания поверхностей при повышенной до 50°С или пониженной до минус 30°С температуре (исследования проводят в термо- или холодильной камере).
Для контроля эффективности обеззараживания тест-поверхностей марлевой салфеткой (размером 5×5 см), смоченной в растворе соответствующего для данного дезинфицирующего средства нейтрализатора, тщательно протирают тест-поверхность, затем ее погружают в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки — 10 мин при постоянном встряхивании. Отмывную жидкость сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды.
Допускается проводить исследования с использованием тест-поверхностей размером 5х5 см из тех же материалов, что и тест-поверхности 10х10 см. Метод можно применяют для оценки чувствительности к ДС микроорганизмов, выделенных с объектов окружающей среды. Тест-поверхности помещают на дно стерильной чашки Петри и располагают на лабораторном столе в микробиологическом боксе или боксах биологической безопасности II класса на поддонах с салфетками, смоченными дезинфицирующим раствором.
Пипеткой наносят на них 0,1 мл 2-миллиардной микробной взвеси (площадь поверхности 25 см), равномерно распределяют ее по поверхности стерильным шпателем, не допуская отекания суспензии за пределы тест-объекта, затем подсушивают, приоткрыв чашку Петри (до полного высыхания) при температуре 18-22°С и относительной влажности 40-60%, после чего обрабатывают раствором ДС так же, как указано выше.
После окончания экспозиции чашки с тест-объектами заливают 10 мл раствора нейтрализатора, соответствующего данному ДС, и делают несколько круговых движений чашкой для лучшего смачивания тест-объекта. Через несколько минут стерильным пинцетом переворачивают тест-объект и повторяют круговые движения. После контакта нейтрализатора с тест-объектом в течение 10 мин снова делают несколько круговых движений чашкой, затем стерильным пинцетом удаляют тест-объект из чашки и сбрасывают его в емкость с дезинфицирующим раствором с целью дальнейшего обеззараживания. Нейтрализатор из чашки Петри сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды либо заливают чашку с нейтрализатором растопленным и остуженным до 45°С агаром.
Посевы выращивают в термостате при температуре плюс (28±1)°С. Учет результатов проводят в течение 2-7 суток (С.albicans, A.niger) и 21-28 суток (Т.gypseum) путем подсчета количества выросших колоний, затем рассчитывают плотность контаминации 100 см поверхности и процент обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100%.
Критерий эффективности обеззараживания поверхностей — не менее 99,99% гибели тест-микроорганизмов
Таблица 4 — Показатели эффективности обеззараживания поверхностей
|
Микроорганизм |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans, Т.gypseum |
99,99 |
Не более 240 |
|
A.niger, A.brasiliensis |
99,99 |
Не более 360 |
7.4 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания белья
Эффективность обеззараживания белья ДС определяют в соответствии с изложенным в 5.4. Мешочки с контаминированными тест-объектами распределяют между слоями белья (сверху, в середине, внизу). Через заданное время воздействия дезинфектанта (например, 15, 30, 60 мин) извлекают по 1 мешочку с каждого уровня, стерильным пинцетом вынимают тест-объекты, переносят их в раствор нейтрализатора на 5 мин, затем промывают 5 мин в стерильной питьевой воде, затем помещают в жидкие питательные среды. В контрольных опытах вместо дезинфицирующего раствора используют стерильную питьевую воду.
Критерий эффективности — 100% гибель тест-микроорганизмов.
Таблица 5 — Показатели эффективности обеззараживания белья
|
Микроорганизм |
Объект обеззараживания |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans, Т.gypseum |
Белье без видимых загрязнений |
100 |
Не более 240 |
|
С.albicans, Т.gypseum |
Белье, загрязненное выделениями |
100 |
Не более 240 |
7.5 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания посуды
В зависимости от назначения ДС исследования проводят при обеззараживании посуды столовой и кухонной, лабораторной и из-под выделений.
В качестве тест-объектов при разработке режимов обеззараживания столовой и кухонной посуды используют:
— тарелки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— стаканы из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— кружки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— столовые приборы — ножи, вилки, ложки из различных материалов (нержавеющая сталь, алюминий, пластик);
— лабораторную посуду — предметные и покровные стекла, пипетки, чашки Петри, планшеты для иммунологического анализа и др.;
— посуду из-под выделений — подкладные судна, мочеприемники, горшки, плевательницы и др. или тест-объекты их имитирующие.
В качестве тест-микроорганизмов при контаминации столовой посуды используют С.albicans, лабораторной — С.albicans, Т.gypseum.
При разработке режимов обеззараживания посуды с остатками пищи суспензию С.albicans смешивают с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной микробной взвеси).
Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя добавляют 1 мл 2-миллиардной суспензии С.albicans), лабораторной посуды — 40% инактивированной сыворотки (6 мл 2-миллиардной суспензии С.albicans или Т.gypseum смешивают с 4 мл инактивированной сыворотки), а посуды из-под выделений — 40% фекальную эмульсию, контаминированную С.albicans (на 10 мл — 1 мл 2х109 суспензии).
Перед контаминацией тест-грибами посуду (столовую и лабораторную) и столовые приборы подвергают механической очистке — моют водой с мылом и щеткой. Посуду располагают горизонтально и на нее пипеткой наносят взвесь тест-грибов из расчета 0,5 мл 2-миллиардной суспензии на площадь в 100 см. Культуру равномерно распределяют по поверхности посуды стеклянным шпателем. Столовые приборы для контаминации погружают в бактериальную суспензию на 1-2 мин, оставляя незараженными их ручки.
Посуду подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
Обработку столовой, чайной, лабораторной посуды и столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18-20°С. При необходимости изучают эффективность растворов, имеющих температуру 50°С.
Контролем служит аналогично контаминированная посуда, которую погружают в такой же объем стерильной питьевой воды.
Дезинфицирующий раствор должен полностью и с избытком покрыть всю посуду (столовую и лабораторную) и столовые приборы (из расчета не менее 2 л на 1 комплект).
Через определенные интервалы времени извлекают из дезинфицирующего раствора по одному предмету и стерильной марлевой салфеткой (размер 5×5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС; тщательно протирают контаминированную часть каждого предмета, погружают салфетку в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. После отмыва марлевую салфетку погружают в соответствующую жидкую питательную среду. Отмывную жидкость сеют на 2-3 чашки по 0,2-0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 28°С и учитывают результат через 2-7 суток (С.albicans) и 21-28 суток (Т.gypseum).
Время обеззараживания посуды определяют в интервале от 15 до 240 мин в зависимости от вида тест-микроорганизма и наличия загрязнения.
Критерий эффективности обеззараживания — не менее 100%-ной гибели тест-микроорганизмы.
Таблица 6 — Показатели эффективности обеззараживания посуды
|
Микроорганизм |
Объект обеззараживания |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans |
Столовая посуда без остатков пищи |
100 |
Не более 60 |
|
Столовая посуда с остатками пищи |
100 |
Не более 120 |
|
|
С.albicans, Т.gypseum |
Лабораторная посуда |
100 |
Не более 120 |
|
С.albicans |
Посуда из-под выделений |
100 |
Не более 240 |
8 Методы изучения и оценки вирулицидной активности дезинфицирующих средств
8.1 Требования к тест-вирусам
Тест-вирусы получают из национальных или из международных коллекций вирусов. При исследованиях вирулицидной активности ДС необходимо использовать как РНК-, так и ДНК-содержащие тест-вирусы, поэтому обязательным для испытания вирулицидного действия всех ДС используют как минимум два тест-вируса:
— вирус полиомиелита 1 типа — вакцинный штамм Sabin (LSc-2ab), далее «полиовирус», РНК-содержащий вирус, не имеющий оболочки, из семейства пикорнавирусов;
— аденовирус тип 5, штамм Аденоид 75 (АТСС VR-5), далее «аденовирус» ДНК-содержащий вирус, не имеющий оболочки, из семейства аденовирусов.
Перечень вирусов может быть расширен при необходимости более детального изучения вирулицидного действия ДС или его эффективности в отношении вируса определенной инфекции за счет следующих вирусов:
— бычий парвовирус, штамм Хаден (АТСС VR-767);
— вирус гепатита А, штамм HAS-15, РНК-содержащий вирус, не имеющий оболочки, из семейства пикорнавирусов;
— вирус гепатита В уток (ВГВУ), штамм УФА-04, ДНК-содержащий, из семейства гепаднавирусов;
— вирус гепатита С человека, штамм Д1;
— вирус бычьей диареи (ВД-БС), РНК — содержащий вирус диареи — болезни слизистых оболочек крупного рогатого скота, из семейства пестивирусов, штамм ВК-1В1-N 28.
Средство, показавшее способность инактивировать полиовирус и аденовирус, включают в группу ДС с вирулицидной активностью. ДС с вирулицидной активностью используют для дезинфекции при любой вирусной (включая особо опасные) инфекции, имеющей значение в инфекционной патологии человека.
Для ДС, применяемых при повышенной (до 60°С) температуре растворов, кроме указанных двух основных вирусов в качестве тест-вируса используют бычий парвовирус (штамм Хаден).
Для изучения и оценки активности ДС в отношении вируса гепатита А используют вирус гепатита А человека (штамм HAS-15). ДС, инактивирующие вирус гепатита А, входит в группу средств с вирулицидной активностью.
Для изучения вирулицидной активности ДС в отношении вируса гепатита В применяют суррогатный вирус — вирус гепатита В уток (ВГВУ), в отношении вируса гепатита С — суррогатный вирус — вирус диарреи — болезни слизистых оболочек крупного рогатого скота ВД-БС (штамм ВК-1В1-N 28) или вирус гепатита С человека (штамм Д1).
Исходный вирус, полученный из референс центров (из национальных или международных коллекций вирусов), размноженный в объемах, достаточных для длительной работы сданным пассажем, хранят в малых объемах при минус 20°-минус 70°С или в жидком азоте.
Исходный вирус размножают в чувствительных клетках (лабораторных животных, утках и др.), продуцирующих вирус в высоких титрах. Клеточный детрит удаляют цетрифугированием* при низких оборотах (1000 об/5 мин), получая вирусную суспензию (ВС).
________________
* Текст соответствует оригиналу. — .
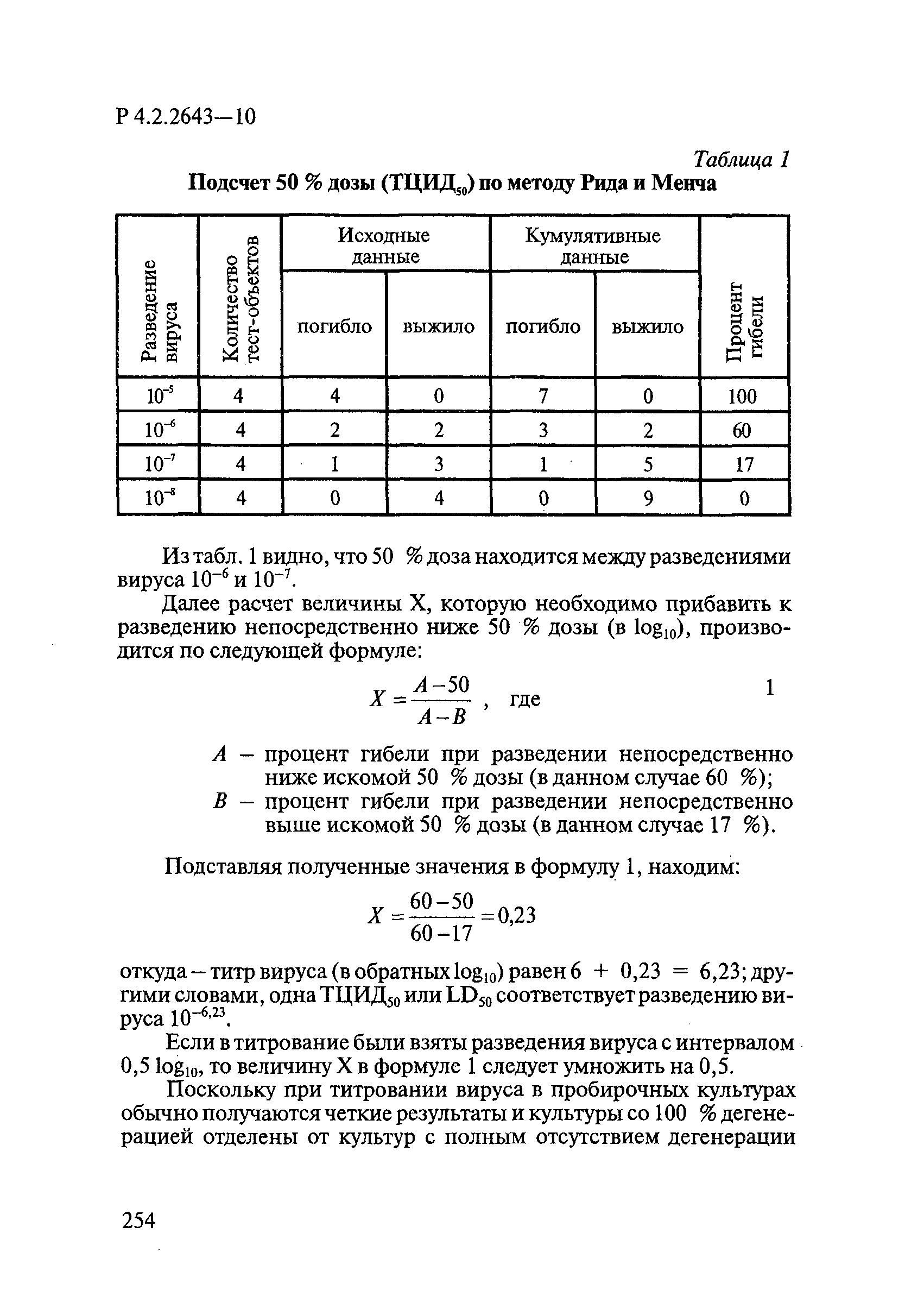
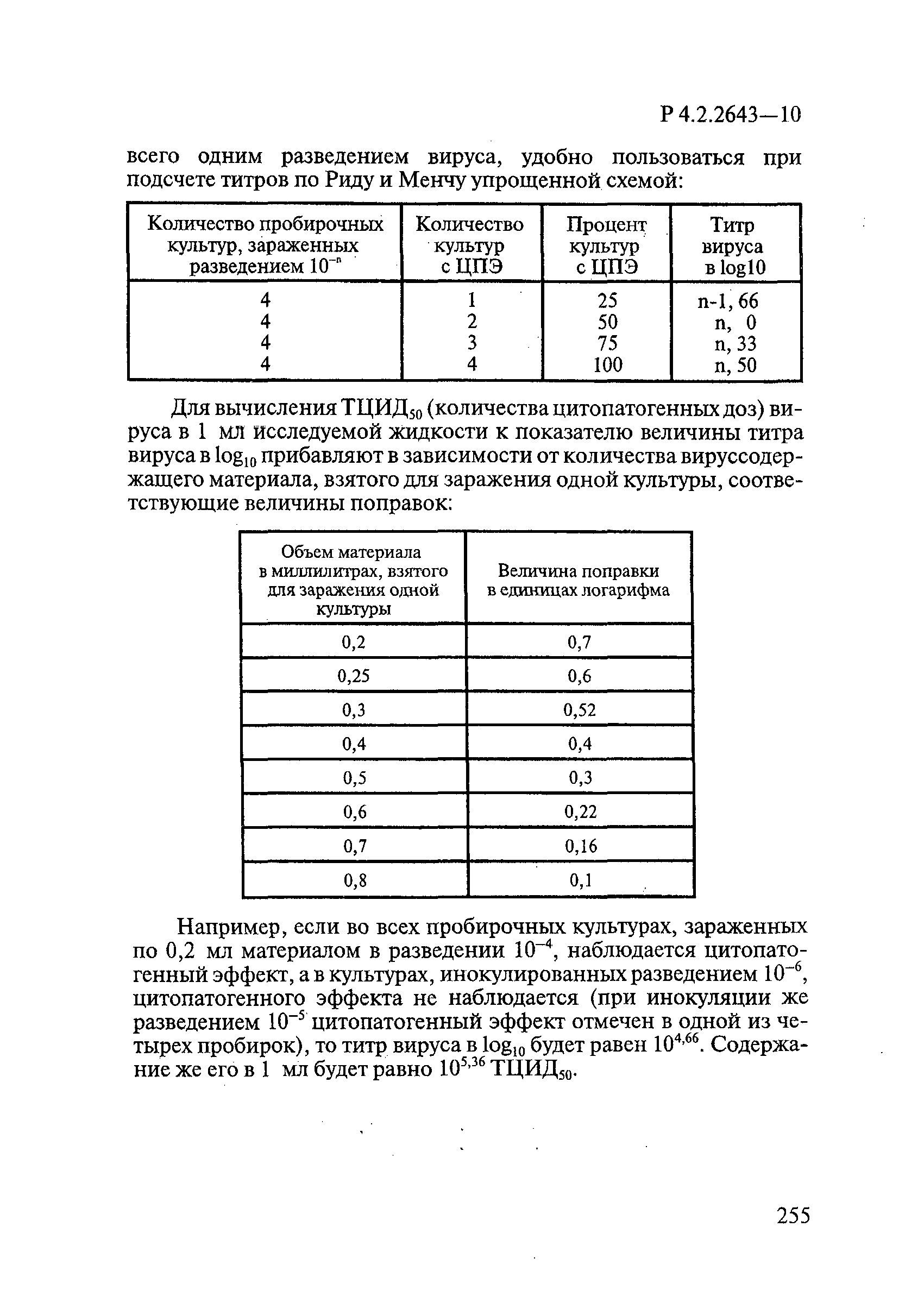
Титр ВС должен быть достаточно высоким, чтобы можно было получить снижение титра на 4,0 log10. Минимальный титр ВС должен составлять 106,5 ТЦИД/мл. Для подсчета ТЦИД или LD применяют метод полных кумулятивов Рида и Менча и метод определения «центральной величины» Кербера по [2].
Полиовирус размножают в перевиваемой культуре клеток RD и НЕр-2 или в других чувствительных клеточных культурах (4647, Vero и т.д.). Для получения ВС культуру клеток, инфицированную вирусом полиомиелита на стадии 100% поражения монослоя, вызванного цитопатическим действием вируса, трехкратно замораживают и оттаивают. После удаления разрушенных клеток центрифугированием полученную ВС используют в экспериментах.
Аденовирус размножают в перевиваемой клеточной культуре НЕр-2, 4647 и в других чувствительных клеточных культурах. Методика получения ВС аналогична методике получения вирусной суспензии для полиовируса, за исключением того, что перед процедурой разрушения клеток методом замораживания-оттаивания проводят замену культуральной среды на не содержащую сыворотки и добавляют ее в меньшем объеме.
Вирулицидное ДС (субстанция) должно подавлять инфекционность обязательных для испытаний тест-вирусов — полиовируса и аденовируса на исследуемых объектах не менее, чем на 4log10 ТЦИД (то есть степень инактивации должна быть не менее 99,99%).
Критерием вирулицидной активности ДС (субстанций) для других тест-вирусов (включая вирусы — возбудители особо опасных инфекций) является отсутствие инфекционности, определяемое современными методами индикации.
Степень инактивации тест-вируса определяют в чувствительных модельных системах по подавлению инфекционной, цитопатической или бляшкообразующей активности вируса в культуре клеток, или по отсутствию маркеров инфицирования, или по специфической гибели лабораторных животных. Для получения более точных результатов тест-вирус следует использовать с максимальным титром.
Показателем вирулицидной активности ДС (субстанций) является скорость инактивации, которая представляет собой соотношение концентрации тест-вируса, выраженное в десятичных логарифмах, до и после воздействия ДС за определенный промежуток времени (экспозиция). Степень снижения вирусной инфекционности вычисляется в десятичных логарифмах по разнице титров вируса до и после обработки ДС.
При отсутствии цитопатического эффекта пробы подвергают необходимой обработке с целью проведения второго, а при необходимости и третьего слепого пассажа для определения полноты ингибирования тест-вируса. Эксперименты сопровождают всеми необходимыми контролями, в том числе контролем полноты нейтрализации дезинфектанта, жизнеспособности тест-вируса, контаминации тест-объекта тест-вирусом, культуры клеток или лабораторных животных (мыши), утки и др.
Для нейтрализации ДС используют нейтрализатор, подобранный к конкретному ДС (или дезинфицирующей субстанции), останавливающий действие ДС (характеристика нейтрализаторов указана в 4.3).
Комплексный нейтрализатор обладает выраженным цитотоксическим действием на клеточные культуры. Если не удается подобрать какой-либо химический нейтрализатор, так как его действие проявляется в неспецифической дегенерации культуры клеток (или гибели мышей, уток), то используют 60%-80% сыворотки (без консерванта) крупного рогатого скота (СКРС), инактивированной при 56°С. В течение 30 мин СКРС нейтрализует большой перечень ДВ и по своему действию наиболее близка к комплексному нейтрализатору.
При невозможности нейтрализовать токсическое действие ДС следует применять дополнительные методы удаления ДС — диализ смеси вирус-дезинфектант, например, с использованием сефадекса LH-20, G-75; осаждения вируса методом высокоскоростного центрифугирования или фильтрацией через мембранные фильтры.
8.2 Определение вирулицидной активности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Определение вирулицидной активности ДС при обеззараживании тест-поверхностей проводят двумя способами: способом протирания (одно- или двукратного) или способом орошения.
На поверхности, подготовленные и расположенные, как указано в 5.3, наносят ВС из расчета — 0,5 мл с добавлением 5% инактивированной СКРС на площадь в 100 см, равномерно распределяют по поверхности стеклянным шпателем. Контаминированные вирусом поверхности подсушивают до полного высыхания при температуре 20°С±2°С и относительной влажности воздуха 50-60%, затем обрабатывают раствором ДС.
Для имитации органического загрязнения используют 40% инактивированной сыворотки при разработке режимов обеззараживания раковин, ванн, унитазов — 80%. Возможно использование вируссодержащей фекальной эмульсии, которую наносят на поверхности из кафеля или фаянса в экспериментах с вирусами, выделяющимися из организма с фекалиями.
Контроль эффективности обеззараживания осуществляют через 15-30-60 минут. Пробы отбирают путем тщательного протирания обработанных раствором ДС поверхностей слегка увлажненной нейтрализатором в физиологическом растворе или растворе Хенкса с антибиотиками стерильной марлевой салфеткой (5×5 см), а затем сухой. Салфетки помещают в широкогорлые пробирки с бусами с 5 мл нейтрализатора.
Оптимальное время обеззараживания поверхностей — не более 60 мин.
В контроле вируса контаминированные ВС поверхности протирают или орошают стерильной водопроводной водой при той же норме расхода воды, что и ДС в опыте. Забор проб и их обработку проводят аналогично опытным. Для определения плотности контаминации проводят титрование смывов с поверхностей.
8.3 Определение вирулицидной активности ДС, предназначенных для обеззараживания белья
Изучение вирулицидной активности ДС проводят при обеззараживании белья без видимых загрязнений и белья, загрязненного выделениями. Для этого в емкость с раствором ДС помещают бязевое белье (1 кг на 4 л раствора). Контаминированные ВС бязевые тест-объекты подсушивают, закладывают в бязевые стерильные мешочки, которые размещают между слоями белья (верх, середина, низ).
Через определенные промежутки времени (15 и более мин) мешочки с тестами извлекают одновременно из трех слоев.
Тесты вынимают из мешочка стерильным пинцетом, погружают в широкогорлые пробирки с нейтрализатором и бусами, отмывают в шуттель-аппарате в течение 10 мин. Смывной жидкостью заражают культуру клеток (или другой биологический объект). Культуру клеток, отмытую от ростовой среды, оставляют на контакт на 30-60 мин для адсорбции вируса. Затем клетки промывают раствором Хенкса и заливают поддерживающей средой с сывороткой. Клетки инкубируют в термостате при оптимальной для конкретного вируса температуре.
Для изучения эффективности ДС при обеззараживании белья, загрязненного кровью (имитация в виде 40% сыворотки), медицинских отходов из тканей, марли, ваты (одноразовое хирургическое белье и акушерские комплекты, перевязочный материал, марлевые салфетки, ватные тампоны и др.) к 6 мл вируссодержащей жидкости добавляют 4 мл инактивированной СКРС, смешивают и заливают тесты, подсушивают их и используют в опыте.
Оптимальное время обеззараживания белья — не более 120 мин, медицинских отходов — не более 240 мин.
Для имитации загрязнения белья и медицинских отходов из тканей и др. фекалиями в экспериментах с тест-вирусом используют фекальную эмульсию. Фекальную эмульсию готовят следующим образом: к 6 мл 10% ВС добавляют 4 мл 40%-ной эмульсии фекалий. Для этого 8 г простерилизованных фекалий (1,5 атм в течение 30 мин) растирают в ступке с 20 мл стерильной воды. В качестве органической нагрузки также используют 80% инактивированной СКРС из расчета: 8 мл сыворотки и 2 мл ВС тщательно перемешивают и этой смесью заливают тесты. Избыток жидкости через 15 мин удаляют с помощью пипетки, тесты подсушивают при комнатной температуре. Далее эксперимент проводят по схеме — как с бельем, незагрязненным выделениями.
Время обеззараживания белья и медицинских отходов, загрязненных фекалиями — не более 240 мин.
8.4 Определение вирулицидной активности ДС, предназначенных для обеззараживания посуды
Исследования ДС проводят с использованием посуды без остатков пищи, а также без других видимых загрязнений и посуды с остатками пищи или другими загрязнениями.
При обеззараживании посуды без остатков пищи в качестве тест-объектов используют:
— тарелки;
— стаканы;
— эмалированные кружки;
— столовые приборы — ножи, вилки, ложки;
— лабораторную посуду — пипетки, в т.ч. микропипетки, наконечники к ним, предметные стекла, пробирки.
Чистую посуду контаминируют вирусной суспензией (ВС), которую наносят пипеткой из расчета 0,5 мл на 100 см и равномерно распределяют по поверхности стерильным стеклянным шпателем. Вилки, ложки и ножи погружают в ВС на 10-15 мин (за исключением ручек), каналы пипеток контаминируют вирусом.
Посуду, столовые приборы подсушивают при комнатной температуре. После полного высыхания погружают в раствор ДС, полностью их покрывая раствором (расход раствора составляет примерно 2 л на комплект посуды: чашка, блюдце, 2 тарелки, ложка, вилка, нож).
Через определенные интервалы времени (15, 30, 60, 90, 120 минут) посуду извлекают из раствора ДС. Для оценки эффективности обеззараживания стерильными марлевыми салфетками размером 5х5 см (вначале увлажненной нейтрализатором, затем сухой) тщательно протирают контаминированные вирусом части каждого предмета. Салфетки помещают в стерильную широкую пробирку с бусами и с 5 мл стерильного нейтрализатора.
Оптимальное время обеззараживания — не более 60 мин.
В качестве контроля используют аналогичным способом контаминированную вирусом посуду, погруженную на максимальную экспозицию в стерильную или прокипяченную водопроводную воду.
Для изучения эффективности ДС при обеззараживании посуды с остатками пищи, загрязненной лабораторной посуды многократного использования и однократного применения (перед утилизацией) к ВС добавляют 80% инактивированной СКРС из расчета: 20% ВС и 80% сыворотки, смесь наносят равномерно на посуду, подсушивают.
Оптимальное время обеззараживания — не более 120 мин для посуды многократного использования и не более 240 мин — для посуды однократного применения (перед утилизацией).
Библиография
|
[1] |
Технические условия ТУ 2481-135-07510508-07 |
Сульфонол порошок |
|
[2] |
Руководство Р 4.2.2643-10 |
Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности |
|
УДК 615.478.74:006.354 |
ОКС 11.080.20 |
Т58 |
||
|
Ключевые слова: средства дезинфицирующие, методы определения, показатели эффективности, бактерии, вирусы, грибы, нейтрализатор |
(Поправка. ИУС N 8-2018).
Редакция документа с учетом
изменений и дополнений подготовлена
ГОСТ Р 57473-2017
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ДЕЗИНФЕКТОЛОГИЯ И ДЕЗИНФЕКЦИОННАЯ ДЕЯТЕЛЬНОСТЬ
Правила проведения испытаний дезинфекционных средств на добровольцах
Disinfectology and disinfection activities. Rules for testing disinfectants on volunteers
ОКС 11.080
Дата введения 2018-01-01
Предисловие
1 РАЗРАБОТАН Федеральным бюджетным учреждением науки «Научно-исследовательский институт дезинфектологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН НИИ дезинфектологии Роспотребнадзора)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 339 «Безопасность сырья, материалов и веществ»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ
Приказом Федерального агентства по техническому регулированию и метрологии от 26 мая 2017 г. N 442-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в
статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской Федерации» . Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Испытания на добровольцах необходимо проводить для изучения эффективности и безопасности кожных антисептиков, дезинфекционных, педикулицидных, инсектоакарицидных, акарицидных, репеллентных средств, дезинфектантов для обеззараживания питьевой воды и воды плавательных бассейнов, выявления возможных побочных реакций при их применении, особенно в тех случаях, когда иными методами получить объективные данные невозможно. Настоящий стандарт разработан с целью проведения необходимых испытаний дезинфекционных средств на добровольцах в соответствии с существующим законодательством. Проведена регламентация различных этапов и условий проведения практических испытаний дезинфекционных средств с участием добровольцев (см. приложение А) в соответствии с национальными и международными актами, определяющими проведение экспериментов на людях
[1] —
[5] .
1 Область применения
Настоящий стандарт распространяется на условия проведения практических испытаний дезинфекционных средств и обеспечивает гарантии соблюдения прав, безопасности и благополучия добровольцев, привлекаемых к испытаниям дезинфекционных средств.
Настоящий стандарт применяют при проведении испытаний дезинфекционных средств на добровольцах.
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий стандарт:
ГОСТ Р 52379 Надлежащая клиническая практика
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 аудит (независимая оценка соответствия): Проверка деятельности и документации для подтверждения соответствия протоколу, стандартным операционным процедурам, надлежащей клинической практике по
ГОСТ Р 52379 и нормативным требованиям. Для ее проведения заказчик назначает независимых проверяющих (третьих лиц), не заинтересованных в результатах исследования.
3.2 заказчик (разработчик): Инициатор исследования, юридическое лицо, обратившееся для проведения исследования и несущее ответственность за его финансирование.
3.3 заключение: Принятое комиссией по этике заключение, подтверждающее проведение экспертизы запланированного исследования и служащее разрешением на его проведение в организации.
3.4 идентификационный код испытуемого: Код, присваиваемый исследователем каждому субъекту исследования для обеспечения конфиденциальности его личных данных и используемый вместо имени испытуемого в отчетах, относящихся к исследованию.
3.5 индивидуальная регистрационная карта; ИРК: Документ на бумажном, электронном или оптическом носителе для внесения всей предусмотренной протоколом информации по каждому испытуемому.
3.6 информированное согласие: Добровольное подтверждение субъектом своего согласия на участие (см. приложение А) в исследовании после получения информации обо всех значимых аспектах исследования. Оно оформляется подписанием Формы информированного согласия (см. приложение Б).
3.7 испытуемый (субъект исследования): Лицо, участвующее в исследовании в составе опытной или контрольной группы.
3.8 исследователь: Лицо, несущее ответственность за проведение исследования в исследовательском центре.
3.9 исследовательский центр (организация): Любое учреждение вне зависимости от его организационно-правовой формы, где проводят исследование, фактическое место проведения исследования.
3.10 исследуемое средство: Форма средства, изучаемая или используемая для контроля в исследовании.
3.11 испытание/исследование: Любое исследование, проводимое с участием человека в качестве субъекта.
3.12 комиссия по этике; ЭК: Независимый орган (экспертный совет, комитет, действующий на уровне организации), который состоит из специалистов и обеспечивает защиту прав, безопасности и благополучия субъектов исследования.
3.13 конфиденциальность: Неразглашение информации, принадлежащей заказчику или позволяющей идентифицировать субъект исследования.
3.14 многоцентровое исследование: Исследование, проводимое по единому протоколу более чем в одном исследовательском центре и соответственно более чем одним исследователем.
3.15 мониторинг (наблюдение): Контроль хода исследования, обеспечение его проведения, сбор данных и представление результатов в соответствии с протоколом, стандартными операционными процедурами, стандартами GCP и нормативными требованиями. Может проводиться как представителями заказчика (внешний), так и Испытательного лабораторного центра организации (внутренний).
3.16 надлежащая клиническая практика; (good clinical practice; GCP): Стандарт планирования, организации, проведения, мониторинга, аудита, документирования исследований, анализа и представления их результатов, служащий гарантией достоверности и точности полученных данных и представленных результатов, обеспечивающий защиту прав, здоровья и конфиденциальности субъектов исследования.
3.17 нежелательная реакция; HP: Все негативные реакции, связанные с применением средства в любой дозе или концентрации при минимальной возможности наличия причинно-следственной связи между применением средства и нежелательным явлением.
3.18 нежелательное явление; НЯ: Любое выявленное у субъекта исследования после применения средства неблагоприятное с медицинской точки зрения событие, которое может и не иметь причинно-следственной связи с его применением. НЯ может представлять любой неблагоприятный симптом, жалобу или заболевание, время возникновения которого не исключает причинно-следственной связи с применением исследуемого продукта вне зависимости от наличия или отсутствия такой связи.
3.19 первичные данные: Вся информация, содержащаяся в оригинальных записях и их заверенных копиях, описывающая результаты наблюдений, обследований и другой деятельности, позволяющая воссоздать ход исследования и оценить его. Первичные данные содержатся в первичной документации (подлинниках или их заверенных копиях).
3.20 препарат сравнения: Исследуемый эталонный или зарегистрированный продукт (активный контроль) или плацебо, используемый(ое) в качестве контроля в исследовании.
3.21 протокол (программа) исследования: Документ, описывающий цели, структуру, методологию, статистические аспекты и организацию исследования; обычно содержит полученные ранее данные и обоснование исследования (см. приложение В).
3.22 прямой доступ: Разрешение на изучение, анализ, проверку и копирование любых записей и отчетов, необходимых для оценки исследования. Лица, имеющие право такого доступа, должны соблюдать условие конфиденциальности полученной информации.
3.23 рандомизация: Распределение субъектов исследования по группам случайным образом, позволяющее свести к минимуму субъективность.
3.24 серьезное нежелательное явление; СНЯ и/или серьезная нежелательная реакция; СНР: Любое неблагоприятное медицинское событие, которое вне зависимости от дозы:
— требует госпитализации;
— привело к стойкой или значительной нетрудоспособности или инвалидности;
— представляет угрозу для жизни.
3.25 слепой метод/маскировка: Метод проведения испытаний, когда одной или нескольким участвующим в исследовании сторонам неизвестно, какое средство дают испытуемым. Простой слепой метод предусматривает неосведомленность об используемом средстве субъектов исследования, двойной слепой метод подразумевает неосведомленность испытуемых, исследователей и, в некоторых случаях, лиц, выполняющих статистическую обработку данных.
3.26 уязвимые субъекты исследования: Лица, на чье желание участвовать в исследовании может оказать влияние ожидание тех или иных преимуществ, связанных с участием в нем, или санкции вышестоящих лиц в случае отказа от участия. Ими могут быть учащиеся высших и средних учебных заведений, младший персонал лабораторий, военнослужащие и заключенные. К уязвимым также относятся больные с неизлечимыми заболеваниями, лица, находящиеся в домах по уходу, нищие и безработные, представители национальных меньшинств, бездомные, кочевники, беженцы, несовершеннолетние и лица, находящиеся под опекой или попечительством, а также неспособные дать согласие.
4 Комиссия по этике организации
Независимая комиссия по этике (ЭК) является постоянно действующим органом, она призвана защищать права, безопасность и благополучие всех субъектов исследования (испытуемых).
4.1 Состав, функции и порядок работы
4.1.1 В составе ЭК должны быть лица, обладающие необходимым опытом и квалификацией для оценки научных, санитарно-гигиенических и этических аспектов предлагаемого исследования. Рекомендуется, чтобы в ЭК входили не менее пяти и не более одиннадцати членов; из них — не менее одного, чьи интересы лежат вне сферы науки, и не менее одного, не зависящего от организации/исследовательского центра.
4.1.2 Кандидатуры в состав ЭК предлагают представители подразделений и члены Ученого совета организации.
4.1.3 Состав ЭК, включая председателя, утверждает приказом директор организации сроком на 3 года.
4.1.4 ЭК самостоятельно разрабатывает и соблюдает регламент своей работы, определяющий порядок назначения заседаний, порядок рассмотрения документации по планируемому исследованию и внесения изменений в ранее одобренную документацию, порядок контроля соответствия проведения исследования согласно утвержденному протоколу.
Примечание — Недопустимо внесение поправок или изменений в протокол испытаний без предварительного утверждения/одобрения их ЭК, кроме случаев, когда необходимо устранить непосредственную угрозу испытуемым либо изменения касаются административных или технических аспектов исследования (изменение адреса, номера телефона и др.).
4.1.5 ЭК документирует свою работу, ведет протоколы заседаний. Все документы (списки членов, представленные на рассмотрение материалы, протоколы заседаний, переписку и др.) ЭК сохраняет не менее 3 лет после завершения исследования и предоставляет их по запросу уполномоченных органов.
4.1.6 ЭК принимает решения при наличии кворума, установленного принятым регламентом. Решение принимается открытым голосованием простым большинством голосов членов ЭК, лично присутствующих на заседании. В случае равенства голосов принятым считается решение, за которое проголосовал председательствующий на заседании.
4.1.7 Исследователь может предоставлять информацию ЭК по любым аспектам исследования, но не имеет права участвовать в прениях или голосовании.
4.1.8 ЭК может обращаться за помощью к экспертам, не входящим в ее состав.
4.2 Обязанности
4.2.1 ЭК получает от исследователя и рассматривает следующие документы:
— протокол исследования и поправки к нему, включая индивидуальные регистрационные карты;
— информацию для испытуемых и форму информированного согласия;
— описание действий для привлечения испытуемых к участию в исследовании (например, рекламные объявления);
— информацию о выплатах и компенсациях испытуемым, если таковые предусмотрены.
Примечание — Размер выплат определяют заранее в договоре с испытуемыми либо в другой письменно предоставляемой форме, он не зависит от того, завершил субъект исследование полностью или нет;
— любые дополнительные материалы, которые могут потребоваться ЭК для принятия решения.
4.2.2 ЭК оценивает квалификацию исследователя на основании его научной биографии или другой запрошенной документации.
4.2.3 ЭК может потребовать внесения изменений/дополнений в представленные документы, если они необходимы для оценки планируемого исследования или повысят защиту прав, безопасность и/или благополучие испытуемых.
4.2.4 ЭК выносит и документально оформляет свое решение в виде:
— утверждения;
— внесения изменений для получения утверждения;
— отрицательного заключения;
— отмены/приостановления данного ранее утверждения.
4.2.5 ЭК незамедлительно письменно сообщает исследователю:
а) о своих решениях/заключениях, касающихся исследования;
б) о причинах принятия решений;
в) о порядке обжалования его решений/заключений.
5 Права и обязанности заказчика (разработчика) испытаний
5.1 Заказчик выбирает исследователя или организацию, при многоцентровых испытаниях может создать координационный центр либо назначить координатора, отвечающего за согласование деятельности всех исследователей.
5.2 До подписания договора (см. приложение А) заказчик должен заранее представить протокол исследования в текущей редакции (см. приложение В).
5.3 Заказчик может поручить разработку протокола и другой сопутствующей документации исследователю и/или исследовательскому центру с последующим его утверждением. Такое поручение оформляется отдельным пунктом в рамках договора либо отдельным соглашением с организацией.
5.4 Заказчик представляет документацию на исследуемое средство, включая препараты сравнения и плацебо, с подробным указанием его состава, инструкции по правилам получения, учета и хранения. При необходимости применения «слепого» метода проводит кодирование и маркировку в соответствии с действующими нормативными требованиями.
5.5 В рамках «слепого» метода кодирование должно включать и механизм, позволяющий идентифицировать средство в случае неотложных состояний, но не допускающий возможности незаметного раскрытия кода.
5.6 Заказчик при необходимости может привлечь независимых консультантов, проводить независимую оценку исследования (аудит), в том числе по вопросам продолжения, изменения или прекращения исследования, для контроля хода испытаний и данных по безопасности и эффективности исследуемого средства.
5.7 Заказчик (или по его поручению исследователь) обеспечивает получение письменного согласия всех сторон на предоставление прямого доступа во все участвующие в испытании исследовательские центры и ко всем первичным данным/документам и отчетам для их мониторинга и независимой оценки соответствия, а также государственного контроля.
5.8 До начала испытаний в организации при необходимости проводится оценка соответствия средства нормативным документам с документальным оформлением результатов анализов.
5.9 Договоры между заказчиком и организацией или любой другой участвующей в исследовании стороной, где оговариваются финансовые аспекты исследования, должны быть оформлены в письменной форме.
5.10 Заказчик (или по его поручению исследователь) обеспечивает страхование испытуемых. Порядок возмещения вреда, причиненного жизни и здоровью испытуемого, определяется в соответствии с законодательством.
5.11 При преждевременном прекращении исследований заказчик ставит в известность исследователей и организацию. При этом зафиксированные в договоре обязательства выполняются заказчиком в полном объеме.
6 Подготовка и организация исследования, сбор данных и ведение записей. Обеспечение качества исследования
6.1 Необходимым документом для принятия решения о возможности проведения испытаний на добровольцах является протокол исследования дезинфекционного средства (см. приложение В).
6.2 Информация в нем излагается в лаконичной, доступной, объективной форме, позволяющей потенциальному исследователю сформировать собственное непредвзятое мнение о целесообразности планируемого исследования. Характер и объем информации зависят от стадии разработки изучаемого средства. Если его свойства хорошо известны, информация может быть менее подробной.
6.3 Каждый из исследователей должен быть ознакомлен с результатами экспериментальных исследований и имеет право на получение любой дополнительной информации, относящийся к средству.
6.4 После заключения договора с заказчиком (см. приложение А) директор организации утверждает программу исследования и назначает ответственного исследователя.
6.5 Ответственный исследователь должен ознакомить персонал, принимающий участие в исследовании, со своими функциями и обязанностями, с протоколом и информацией о средстве.
6.6 Ответственный исследователь должен иметь достаточное число квалифицированных сотрудников и соответствующую материально-техническую базу для качественного проведения исследования.
6.7 Ответственный исследователь готовит основные документы (см. 4.2.1) для передачи в ЭК. Они позволяют оценить планируемое исследование и качество полученных данных и служат доказательством соблюдения исследователем и заказчиком стандартов GCP и нормативных требований.
6.8 После получения согласия ЭК проходит набор испытуемых, которые могут быть привлечены к участию в исследованиях.
6.9 Ответственный исследователь объясняет правила применения исследуемого дезинфекционного средства всем испытуемым и проверяет их соблюдение.
6.10 Для идентификации конкретного испытуемого должен использоваться индивидуальный код.
6.11 Ответственный исследователь соблюдает процедуру рандомизации, если таковая предусмотрена, и следит, чтобы раскрытие кода происходило только в соответствии с протоколом.
6.12 Данные в картах испытуемых должны соответствовать первичной документации. Любые дополнения или исправления (в бумажной или электронной карте) должны позволять прочесть первоначальную запись, быть подписаны, датированы и, при необходимости, объяснены.
6.13 Учет средства, его расход, возврат заказчику, утилизация неиспользованного препарата проводятся исследовательским центром. В журнале учета указывают даты, количество, номера партий (серий), сроки хранения и коды исследуемого средства и испытуемого. Исследователи ведут записи о получении его испытуемыми в предусмотренных протоколом количествах.
6.14 Ответственный исследователь проводит испытания в соответствии с протоколом, одобренным ЭК, согласованным с заказчиком и разрешительными органами, и не должен отклоняться от него или вносить изменения без согласия заказчика и ЭК.
6.15 Испытания проводят в специально оборудованных помещениях, где должны быть необходимый набор медикаментов и приборов для оказания первой помощи.
6.16 Исследователи должны обеспечить полноту и достоверность сбора данных, иметь стандартные процедуры их использования, иметь систему их защиты от несанкционированного доступа, сохранять кодирование при вводе и обработке данных.
6.17 Информация о допущенных отклонениях или изменениях, их причины и предлагаемая поправка к протоколу должны быть незамедлительно представлены ЭК для рассмотрения и утверждения, заказчику, разрешительным органам — для согласования.
6.18 Ответственный исследователь может принять решение о прекращении исследования дезинфекционного средства, если обнаружена опасность для здоровья испытуемых.
6.19 При преждевременном прекращении (приостановке) исследования ответственный исследователь и/или организация должны сообщить об этом испытуемым, письменно информировать ЭК и заказчика о решении с объяснением причин.
6.20 Исследователи не должны препятствовать проведению контроля исследования (мониторингу), а также независимой оценке соответствия исследования требованиям законодательства, проводимой с целью подтверждения самого факта исследования, либо государственного контроля.
6.21 После окончания испытаний ответственный исследователь совместно с сотрудниками проводит анализ полученных результатов и составляет отчет (см. раздел 12).
6.22 Основные документы должны храниться в исследовательском центре не менее 3 лет после официального прекращения исследования. Они могут храниться и более длительный срок, если это предусмотрено действующими нормативными требованиями или договором с заказчиком.
7 Обеспечение прав, безопасности и охраны здоровья испытуемых
7.1 Лицо, на котором исследуют средство или препарат сравнения (испытуемый), дает письменное согласие на участие в исследовании. Участие испытуемых является добровольным.
7.2 Исследователь должен дать испытуемому достаточно времени для принятия решения об участии в исследовании и предоставить подробную информацию об испытании.
7.3 Испытуемый должен быть информирован:
— о самом средстве и сущности его исследования;
— о его ожидаемой эффективности, безопасности, степени риска;
— о собственных действиях в случае влияния средства на состояние его здоровья;
— об условиях страхования своего здоровья.
7.4 Информацию об исследовании излагают доступно и понятно, с минимальным количеством специальных терминов. В ней не должно быть формулировок, вынуждающих испытуемого отказаться от своих законных прав; заявлений, ограничивающих ответственность исследователя, организации, заказчика (разработчика).
7.5 Ответственный исследователь и его сотрудники не должны оказывать давление на испытуемого или вызывать у него необоснованную заинтересованность в участии или продолжении участия в исследовании.
7.6 Испытуемый имеет право отказаться от участия в исследовании средства на любой стадии его проведения.
7.7 Не допускаются исследования на несовершеннолетних, беременных женщинах, военнослужащих, лицах, отбывающих наказание в местах лишения свободы, а также находящихся под стражей в следственных изоляторах.
Исключения из этого правила допускаются лишь в том случае, если необходимая информация может быть получена только при исследованиях на определенных группах лиц и невозможно создать необходимые для испытаний дезинфекционных средств сходные условия.
7.8 Форма информированного согласия и иные материалы могут пересматриваться по ходу исследования, если они способны повлиять на согласие испытуемого. Их новая редакция обязательно проходит одобрение ЭК, а сообщение испытуемому должно быть подтверждено документально.
8 Оценка эффективности дезинфекционных средств
Изучение эффективности проводят в соответствии с руководством
[6] и
[7] . Также могут быть использованы вновь разработанные методики, утвержденные в установленном порядке.
8.1 Определение эффективности кожных антисептиков
8.1.1 Изучение возможности использования дезинфицирующего средства в качестве кожного антисептика проводят на добровольцах с целью:
— разработки эффективных режимов обеззараживания в зависимости от концентрации активно действующих веществ, времени воздействия, а также способа и кратности обработки согласно назначению средства (рук хирургов, операционного и инъекционного полей, локтевых сгибов доноров, гигиенической обработки) и форм его применения (готовый раствор, гели, салфетки);
— выявления длительности действия;
— оценки установленных режимов обеззараживания средствами с разрешенными к применению действующего вещества (ДВ);
— подготовки рекомендаций и предложений в проекты инструкции по применению средства и этикетки (тарной, бытовой).
8.1.2 Кожные антисептики исследуют на добровольцах в режиме применения:
— для обработки рук лиц, проводящих оперативные вмешательства в лечебно-профилактических организациях (в том числе стоматологических, в родильных домах и др.);
— для обработки локтевых сгибов у доноров; операционного поля при оперативных вмешательствах; кожи пациентов перед инъекциями;
— для гигиенической обработки рук.
8.1.3 Испытания проводят на практически здоровых людях не моложе 18 лет (не менее 10 человек) со здоровой кожей рук без порезов или потертостей, с короткими и чистыми ногтями. Не менее чем за 2 недели до начала исследования испытуемые должны прекратить использование веществ с противомикробными свойствами. Общее состояние испытуемых на момент испытания должно быть удовлетворительным, при отсутствии предрасположенности к заболеваниям кожи.
8.1.4 Исследование эффективности антисептика для гигиенической обработки рук проводят с привлечением группы испытуемых с учетом требований, изложенных в 8.1.3.
8.2 Исследование эффективности инсектицидных, акарицидных, репеллентных, педикулицидных средств
8.2.1 Оценку защитного действия репеллентных средств, предназначенных для нанесения на кожу или одежду, проводят испытатели в лаборатории или в природных биотопах.
8.2.2 Испытание каждого репеллентного средства проводят не менее 9 раз при различных условиях (3 испытуемых в 3 повторностях).
8.2.3 Оценку защитного действия инсектоакарицидных средств, предназначенных для нанесения на одежду, проводят только в природных биотопах. Испытания проводят не менее 9 раз при различных условиях (3 испытуемых в 3 повторностях).
8.2.4 Изучение длительности педикулицидного действия при ношении импрегнированного белья, предназначенного для профилактики платяного педикулеза (импрегнация тканей, нательного и постельного белья), проводят не менее чем на 10 добровольцах.
9 Оценка безопасности и переносимости дезинфекционных средств
9.1 Испытания безопасности и переносимости проводят для дезинфекционных средств, непосредственно контактирующих с человеком.
9.2 Основная цель испытаний на добровольцах — выявление местно-раздражающих и сенсибилизирующих свойств, а также общетоксического действия.
9.3 До начала исследований проводят общий медицинский осмотр и оценивают состояние здоровья по заранее установленным критериям включения/невключения предполагаемых испытуемых с обязательным учетом наличия в анамнезе кожных и аллергических заболеваний.
9.4 Всех испытуемых, включенных в исследование, инструктируют о режиме применения изучаемого препарата, возможных субъективных ощущениях, необходимости при появлении побочных реакций немедленного обращения к медицинскому персоналу.
9.5 Испытания проводят на рандомизированных по полу, возрасту, образу жизни и привычкам, а также степени физической нагрузки группах здоровых добровольцев.
9.6 Численность опытной и контрольной групп испытуемых зависит от целей испытания.
9.7 Продолжительность исследования определяется целями, задачами испытаний, а также назначением и режимом применения средства. При исследованиях длительностью более одного дня устанавливают периодичность, частоту и объем обследования испытуемых.
9.8 Кожные антисептики исследуют в режиме применения: при нанесении средства от 2 до 10 раз в сутки в течение 2-4 недель.
9.9 Исследование безопасности и переносимости инсектоакарицидных, акарицидных и репеллентных средств, используемых для нанесения на кожу или одежду, проводят согласно разработанной инструкции в максимально возможных дозах.
9.10 Сроки испытаний педикулицидных средств (в т.ч. импрегнированного белья) определяются условиями их практического использования.
9.11 Испытания обеззараженной питьевой воды и воды плавательных бассейнов в режиме применения проводят в соответствии с руководством
[6] , пункты 8.5.4, 8.6.3.
9.12 По ходу испытаний проводят анкетный опрос испытуемых для учета субъективных ощущений и возможных жалоб. К проведению испытаний, связанных с изучением состояния кожных покровов, привлекается дерматолог, в других случаях при необходимости — врачи соответствующих специальностей.
9.13 При оценке переносимости и безопасности средства регулярно измеряют частоту сердечных сокращений (ЧСС), частоту дыхания (ЧД) и уровень артериального давления (АД). Также проводят анализ морфологического состава периферической крови, биохимический анализ крови, общий клинический анализ мочи.
9.14 При выборе клинических и лабораторных показателей для оценки результатов исследования необходимо учитывать различные способы применения препаратов, пути их поступления, патогенетическую направленность действия на организм человека.
9.15 При испытаниях средств, используемых для нанесения на кожу или одежду, особое внимание уделяют состоянию кожных покровов для оценки местно-раздражающих и сенсибилизирующих свойств. При необходимости проводят на испытуемых «провокационные» пробы для выявления возможных аллергенных свойств.
9.16 Положительным результатом испытаний безопасности и переносимости любого дезинфекционного средства считается отсутствие нежелательных явлений у испытуемых в течение всего срока исследования и после его окончания. Допускается колебание клинических и лабораторных показателей в границах физиологической нормы.
9.17 Наличие субъективных и объективных реакций на воздействие средства, изменения в физиологических и биохимических показателях у опытной группы по сравнению с контрольной служит основанием для отрицательного заключения о безопасности и переносимости средства.
9.18 По результатам проведенных исследований разрабатывают рекомендации по наиболее безопасному использованию средства, мерам предосторожности при работе с ним, которые включают в текст этикетки (тарной, бытовой) и инструкцию по его применению.
10 Медицинская помощь испытуемым
10.1 До начала испытаний исследователь совместно с медицинским персоналом должен провести предварительный осмотр: измерить частоту сердечных сокращений и дыхания, уровень артериального давления, оценить внешний вид и состояние кожных покровов испытуемого, а также при необходимости провести дополнительные лабораторные исследования.
10.2 Во время испытаний исследователь (совместно с медицинским персоналом) тщательно следит за состоянием здоровья испытуемых. При развитии признаков ухудшения самочувствия, появлении жалоб испытуемого выводят из исследования.
10.3 В ходе исследования и после его окончания организация, проводящая испытания, обеспечивает испытуемому необходимую медицинскую помощь при любых выявленных негативных состояниях, включая изменения лабораторных показателей.
10.4 Исследователь и/или организация обязаны сообщить испытуемому о необходимости лечения заболеваний, выявленных в ходе испытания.
10.5 В случае решения испытуемого досрочно прекратить участие в исследовании исследователь должен попытаться установить причину отказа, при этом учитывая, что испытуемый не обязан сообщать об этом.
11 Мониторинг и независимая оценка соответствия (аудит)
11.1 Мониторинг проводят для обеспечения прав, безопасности и охраны здоровья испытуемых; подтверждения точности и полноты полученных данных; подтверждения соответствия проводимого исследования настоящему стандарту, действующим нормативным требованиям и утвержденному протоколу исследования.
11.2 Лицо, осуществляющее мониторинг (наблюдатель), имеет соответствующую подготовку, обладает знаниями, необходимыми для выполнения своих функций. Необходимо документальное подтверждение квалификации наблюдателя.
11.3 Наблюдатель должен быть хорошо знаком со свойствами исследуемого средства, протоколом исследования, формой письменного согласия и предоставляемыми испытуемому материалами, настоящим стандартом и действующими нормативными требованиями.
11.4 Объем и особенности мониторинга зависят от целей, задач, методов, сложности и вида исследования, количества испытуемых и характера измеряемых показателей.
11.5 Наблюдатель контролирует соответствующую квалификацию, опыт исследователя и персонала, участвующего в испытаниях, наличие условий для проведения исследования, в том числе помещений, лаборатории и оборудования.
11.6 Наблюдатель соблюдает установленные процедуры, указывает исследователю на нарушения протокола, стандартных процедур, настоящего стандарта, действующих нормативных требований, а также обеспечивает принятие надлежащих мер во избежание повторения обнаруженных нарушений.
11.7 Независимая оценка соответствия (аудит) — самостоятельная процедура, не связанная с мониторингом и контролем качества. Ее задача — проведение заказчиком всесторонней проверки соответствия исследования настоящему стандарту, действующему законодательству, стандартным процедурам и протоколу исследования.
11.8 Аудит проводят по выбору заказчика независимые проверяющие, не заинтересованные в результатах исследования, обладающие соответствующей подготовкой, квалификацией и опытом для проведения оценки. Их квалификация должна быть документально подтверждена.
11.9 План проведения мониторинга и процедура оценки — в соответствии с 11.3-11.6.
11.10 Результаты мониторинга и независимой оценки соответствия оформляют отчетом с указанием даты, названия исследовательского центра, фамилий наблюдателя, исследователя или другого лица, участвующего в переговорах/переписке, с кратким описанием объектов проверки, полученных результатов, выявленных недостатков и нарушений, с выводами, предпринятыми или планируемыми мерами и/или рекомендациями по устранению нарушений.
12 Отчет об испытании
12.1 Отчет о результатах исследований составляет руководитель программы исследований (ответственный исследователь).
12.2 Окончательный отчет об исследовании дезинфекционного средства должен включать:
1) основания для проведения исследований;
2) дату начала и завершения исследований;
3) цель, задачи и вид исследования;
4) критерии включения и исключения испытуемых;
5) характеристику отобранной группы испытуемых;
6) схему проведения испытаний;
7) описание критериев оценки эффективности, переносимости, безопасности и методов статистической обработки результатов.
12.3 Отчет должен содержать раздел, посвященный обсуждению полученных результатов, и заканчиваться выводами с рекомендациями о целесообразности применения и регистрации дезинфекционного средства.
12.4 Исследователь указывает все факторы, оказывающие влияние на проведение исследования и/или увеличивающие риск для испытуемых, все нежелательные явления.
12.5 Серьезное нежелательное явление подробно описывается в отчете, где испытуемые идентифицируются по индивидуальным кодам, а не по данным, позволяющим установить его личность.
12.6 К отчету прилагается документация по учету и расходу исследуемого средства. Отчет подписывается руководителем организации, скрепляется печатью и направляется заказчику.
Приложение А
(рекомендуемое)
ДОГОВОР ОБ УЧАСТИИ В ИСПЫТАНИЯХ ДЕЗИНФЕКЦИОННОГО СРЕДСТВА
|
г.Москва |
» |
» |
20 |
г. |
|||||||||||
|
Исследовательский центр организации, именуемый в дальнейшем Исследователь, в лице |
|||||||||||||||
|
директора |
, действующего на основании Устава, с одной стороны, и |
||||||||||||||
|
, именуемый в дальнейшем Испытуемый, с другой |
|||||||||||||||
|
(фамилия, имя, отчество, год рождения и адрес) |
|||||||||||||||
|
стороны, заключили настоящий договор о нижеследующем: |
|||||||||||||||
|
1 Предмет договора |
|||||||||||||||
|
Проведение испытаний средства: |
|||||||||||||||
|
(наименование средства) |
|||||||||||||||
|
Срок проведения испытания: с |
по |
20 |
г. |
||||||||||||
|
Испытания проводятся в порядке, определяемом Исследователем. |
|||||||||||||||
|
Результаты, полученные в ходе испытаний дезинфекционного средства, принадлежат Исследователю и могут быть в дальнейшем использованы любым возможным способом. |
|||||||||||||||
|
2 Обязанности и права сторон |
|||||||||||||||
|
Исследователь обязан: |
|||||||||||||||
|
2.1 Ознакомить Испытуемого с сущностью проводимых испытаний дезинфекционного средства и ответить на все возникшие вопросы. |
|||||||||||||||
|
2.2 Обеспечить наблюдение за состоянием здоровья Испытуемого врачом в период подготовки и фактического проведения испытания, а также в течение 30 (тридцати) календарных дней после проведения испытания, который обязан оказать первую медицинскую помощь либо дать рекомендации по обращению к иным врачам-специалистам. |
|||||||||||||||
|
2.3 Исследователь может компенсировать по требованию Испытуемого документально подтвержденные расходы, возникшие в результате проведения испытания в связи с причинением вреда жизни или здоровью Испытуемого при наличии Заключения врача о возникновении причинно-следственной связи между проводимым испытанием и возникшими последствиями, повлекшими нанесение вреда жизни или здоровью Испытуемого, а также назначении лечения, соответствующего расходам, в сумме не более ______ (_______) рублей РФ. Расходы, убытки, компенсации и пр., предусмотренные Законом в большем размере, компенсирует Заказчик проведения испытания (Наименование, фактический и юридический адрес, ИНН) на основании Договора N ___ от __________ 20 ___ г., заключенного с Исследователем. Указанные в настоящем пункте расходы, убытки, компенсации и пр. не выплачиваются Испытуемому в случае нарушения им одного из условий настоящего Договора, приложений к нему, рекомендаций врача и Исследователя. |
|||||||||||||||
|
Испытуемый обязан: |
|||||||||||||||
|
2.4 Строго выполнять условия проведения испытания, оговоренные Договором, а также рекомендации врача и Исследователя. |
|||||||||||||||
|
2.5 Подписание настоящего Договора и Формы информированного согласия является согласием Испытуемого на участие в исследованиях на условиях, указанных в «Информации для испытуемого», а также согласием с наступлением каких-либо, в том числе неблагоприятных, последствий. Риски наступления неблагоприятных последствий Испытуемый несет самостоятельно и не вправе требовать от Исследователя каких-либо компенсаций, расходов, убытков и пр., связанных с проведением испытаний и последствиями, возникшими после его проведения. |
|||||||||||||||
|
2.6 В день подписания настоящего Договора заполнить анкету Исследователя полно и достоверно. |
|||||||||||||||
|
Испытуемый имеет право: |
|||||||||||||||
|
2.7 На ознакомление с результатами исследований состояния его здоровья до начала, во время и после завершения испытания. |
|||||||||||||||
|
2.8 На отказ от участия в исследовании в любое время. |
|||||||||||||||
|
3 Материальная компенсация |
|||||||||||||||
|
3.1 В течение 10 (десяти) рабочих дней с даты окончания испытания путем перечисления денежных средств на счет Испытуемого выплачивается материальная компенсация в общей сумме ______________ (______) рублей. Материальная компенсация включает в себя все риски и компенсации, связанные с проведением испытания и его последствиями, расходы Испытуемого на страхование жизни и здоровья, а также иные расходы, связанные с исполнением настоящего Договора. |
|||||||||||||||
|
3.2 Исследователь удерживает из материальной компенсации Испытуемого сумму налога на доходы физических лиц (НДФЛ) в размере и в порядке, предусмотренными НК РФ , и перечисляет сумму налога в соответствующий бюджет. Исследователь также вычисляет и уплачивает иные предусмотренные законодательством РФ налоги и сборы, связанные с выплатой Испытуемому материальной компенсации. |
|||||||||||||||
|
3.3 В случае досрочного окончания испытания по инициативе Исследователя материальная компенсация Испытуемому выплачивается в полном размере, за исключением случаев нарушения Испытуемым условий настоящего договора, приложений к нему, рекомендаций врача-дерматолога и Исследователя. |
|||||||||||||||
|
3.4 В случае досрочного окончания испытания в связи с получением Испытуемым Заключения врача-дерматолога о нанесении ущерба здоровью Испытуемого в ходе испытания материальная компенсация Испытуемому выплачивается в полном размере. |
|||||||||||||||
|
3.5 В случае прерывания испытания по инициативе Испытуемого материальная компенсация ему не выплачивается. |
|||||||||||||||
|
4 Расторжение договора |
|||||||||||||||
|
4.1 Договор может быть расторгнут Исследователем в одностороннем порядке в случае невыполнения Испытуемым условий проведения испытаний. |
|||||||||||||||
|
4.2 Договор может быть расторгнут Испытуемым в одностороннем порядке в случае ухудшения состояния самочувствия на основании заключения врача, осуществляющего наблюдение состояния здоровья Испытуемого, а также без объяснения причины. |
|||||||||||||||
|
Договор составлен в двух экземплярах, каждый из которых имеет одинаковую юридическую силу. |
|||||||||||||||
|
5 Реквизиты и подписи сторон: |
|
Испытуемый: |
Исследователь: |
|||||||||
|
ФИО, дата рождения |
Наименование, фактический и юридический адрес, ИНН |
|||||||||
|
Паспорт серия |
номер |
|||||||||
|
выдан |
||||||||||
|
Зарегистрирован |
Директор организации |
|||||||||
|
Банковские реквизиты |
||||||||||
Приложение Б
(рекомендуемое)
ФОРМА ИНФОРМИРОВАННОГО СОГЛАСИЯ
по теме исследования:
|
Я, (ФИО испытуемого) |
получил всю информацию о предстоящем |
|||||||||||||||||||||||
|
исследовании. Я также получил удовлетворительные ответы на все вопросы. Мне выдан экземпляр |
||||||||||||||||||||||||
|
информации для испытуемого с информированным согласием на |
листах, что и подтверждаю |
|||||||||||||||||||||||
|
своей подписью. |
||||||||||||||||||||||||
|
Подпись испытуемого |
Дата: » |
» |
201 |
г. |
||||||||||||||||||||
|
(опекуна или юридически уполномоченного лица) |
||||||||||||||||||||||||
|
Я, |
(ФИО исследователя) подтверждаю, что полученные испытуемым |
|||||||||||||||||||||||
|
письменные материалы соответствуют предоставленным заказчиком исследования. |
||||||||||||||||||||||||
|
(подпись исследователя либо другого лица, заключающего |
||||||||||||||||||||||||
|
с испытуемым договор об участии в испытании) |
||||||||||||||||||||||||
|
» |
» |
201 |
г. (дата) |
|||||||||||||||||||||
|
Я, (испытуемый), даю добровольное согласие участвовать в данном исследовании. |
||||||||||||||||||||||||
|
» |
» |
201 |
г. (дата) |
|||||||||||||||||||||
|
(подпись испытуемого, родственника, опекуна или юридически уполномоченного лица). |
||||||||||||||||||||||||
|
Подпись испытуемого (его законного представителя) подтверждаю. |
||||||||||||||||||||||||
|
(ФИО исследователя) |
||||||||||||||||||||||||
|
(подпись исследователя) » |
» |
201 |
г. (дата) |
|||||||||||||||||||||
|
(либо другого лица, заключающего с испытуемым договор об участии в исследовании). |
Приложение В
(рекомендуемое)
ПРОТОКОЛ ИССЛЕДОВАНИЯ ДЕЗИНФЕКЦИОННОГО СРЕДСТВА И ПОПРАВКИ К ПРОТОКОЛУ
Общая информация. Наименование протокола, идентификационный номер и дата. Наименование/имя и адрес заказчика. Имена и должности лиц, уполномоченных от имени заказчика подписывать протокол и поправки к нему. Имена и должности исследователей, отвечающих за проведение испытаний, а также адреса и номера телефонов исследовательских центров. Наименования и адреса лабораторий и других служб и/или организаций, вовлеченных в исследование.
Обоснование исследования. Наименование и описание исследуемых продуктов. Сводное изложение потенциально имеющих значимость результатов экспериментальных и практических исследований, а также значимых для данного испытания. Краткое описание известных и потенциальных рисков и пользы для субъектов исследования, если таковые имеются. Описание и обоснование способа использования, дозировки, режима дозирования и длительности применения. Указание, что исследование будет проводиться в соответствии с Протоколом, GCP и нормативными требованиями. Описание исследуемой популяции. Ссылки на литературные источники и существенные данные, представляющие обоснование данного исследования.
Цели и задачи исследования. Порядок исследования. Указание основных и дополнительных параметров, оцениваемых в ходе исследования. Описание типа проводимого исследования (двойное слепое, плацебо-контролируемое, параллельное) и графическая схема исследования, его процедур и этапов. Меры, направленные на минимизацию/исключение субъективности, в том числе: рандомизация; слепой метод/маскировка и др. Используемые дозировки и схемы применения исследуемых средств, их формы, упаковка и маркировка. Продолжительность участия субъектов в исследовании, последовательность и продолжительность всех периодов исследования, включая последующее наблюдение, если таковое предусмотрено. Описание правил остановки или критериев исключения для отдельных субъектов, частей исследования или исследования в целом. Процедуры учета исследуемых продуктов, включая, при наличии, плацебо и препараты сравнения. Хранение идентификационных кодов и процедуры их раскрытия. Перечень данных, регистрируемых непосредственно в ИРК (т.е. без предварительной записи в письменном или электронном виде) и рассматриваемых в качестве первичных данных.
Отбор и исключение субъектов. Критерии включения субъектов. Критерии невключения субъектов. Критерии исключения субъектов (т.е. основания для прекращения применения исследуемого продукта), а также процедуры, определяющие: а) когда и как субъекты исключать из исследования; б) какие данные и в какие сроки должны быть собраны по исключенным пациентам; в) заменены ли и каким образом выбывшие субъекты; г) последующее наблюдение за субъектами, исключенными из исследования.
Оценка эффективности. Перечень параметров эффективности. Методы и сроки оценки, регистрации и анализа параметров эффективности. Методы контроля соблюдения процедур испытуемыми.
Оценка безопасности. Перечень параметров безопасности. Методы и сроки оценки, регистрации и анализа параметров безопасности. Требования к отчетам, процедуры по регистрации и сообщениям о нежелательных явлениях и заболеваниях. Метод и продолжительность наблюдения за испытуемыми после возникновения нежелательных явлений.
Статистика. Описание используемых статистических методов. Планируемое число субъектов. При многоцентровых исследованиях — количество испытуемых в каждом центре. Обоснование размера выборки. Критерии прекращения исследования. Процедуры учета отсутствующих, не подлежащих анализу и сомнительных данных. Процедуры сообщения о любых отклонениях от первоначального статистического плана (все отклонения должны быть описаны и обоснованы в протоколе и/или финальном отчете об исследовании). Отбор субъектов для анализа (например, все рандомизированные субъекты, все получившие хотя бы одну дозу средства, все соответствующие критериям отбора субъекты, данные которых пригодны для оценки).
Прямой доступ к первичным данным/документации.
Контроль качества и обеспечение качества.
Этика (описание этических аспектов исследования).
Работа с данными и ведение записей.
Финансирование и страхование (если не описаны в отдельном договоре).
Публикации (политика в отношении публикаций, если не описана в отдельном договоре).
Приложения.
Библиография
|
[1] |
Федеральный закон от 21 ноября 2011 г. N 323-ФЗ |
Об основах охраны здоровья граждан в Российской Федерации |
|
[2] |
Федеральный закон от 30 марта 1999 г. N 52-ФЗ |
О санитарно-эпидемиологическом благополучии населения |
|
[3] |
Постановление Правительства Российской Федерации от 28 августа 2012 г. N 866 |
О федеральном органе исполнительной власти, уполномоченном осуществлять государственную регистрацию товаров, и признании утратившими силу некоторых актов Правительства Российской Федерации по вопросам государственной регистрации отдельных видов продукции |
|
[4] |
Постановление Правительства Российской Федерации от 24 июля 2000 г. N 554 |
Об утверждении Положения о Государственной санитарно-эпидемиологической службе Российской Федерации и Положения о государственном санитарно-эпидемиологическом нормировании |
|
[5] |
Приказ Минздрава РСФСР от 25 августа 1992 г. N 235 |
Об организации отделений клинических испытаний лекарственных препаратов на здоровых добровольцах |
|
[6] |
Руководство Р 4.2.2643-10 . М., 2011 |
Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности |
|
[7] |
Нормативные показатели 01-12/75-97 |
Нормативные показатели безопасности и эффективности дезинфекционных средств, подлежащих контролю при проведении обязательной сертификации |
|
УДК 637.132.4:715.478:658.513:006.354 |
ОКС 11.080 |
|
Ключевые слова: дезинфектология, дезинфекционная деятельность, дезинфекционные средства, правила проведения испытаний на добровольцах, добровольцы, комиссия по этике, обеспечение качества исследования, права, безопасность испытуемых, эффективность, безопасность, переносимость дезинфекционных средств |

 МР 1119-73 «Методические рекомендации по определению вирулицидной активности препаратов»
МР 1119-73 «Методические рекомендации по определению вирулицидной активности препаратов»