Деятельность инспектируемого органа изучается и оценивается в соответствии с требованиями приказа УМВД России по Оренбургской области от 12.07.2013 № 450 «Об организации ведомственного контроля» и методик оценки территориальных органов МВД России на районном уровне, подчиненных УМВД по области, разработанными структурными подразделениями УМВД по области.
Инспектирование (инспекторская проверка) – форма ведомственного контроля, включающая комплекс мер по установлению фактического положения дел, изучению, проверке состояния и оценке результатов деятельности территориального органа.
Цели инспектирования:
1. Изучение и оценка фактического положения дел в инспектируемом органе с последующим информированием начальника УМВД области.
2. Совершенствование организации и повышение эффективности деятельности инспектируемого органа.
3. Формирование экспертной оценки для выведения комплексной оценки деятельности территориального органа за год.
Задачи инспектирования:
1. Определение и оценка соответствия организации деятельности инспектируемого органа требованиям законодательных и иных нормативных правовых актов Российской Федерации, ведомственных нормативных правовых актов, директивных, распорядительных и планирующих документов МВД России, УМВД области, поставленным задачам и оперативной обстановке.
2. Оценка организации и эффективности деятельности инспектируемого органа по выполнению возложенных на него задач, степени влияния на подчиненные подразделения, а также соответствия статистической и иной ведомственной отчетности, представляемой в УМВД области, фактическому положению дел.
3. Определение и оценка роли руководителей инспектируемого органа в управлении имеющимися силами и средствами, адекватности принимаемых ими мер оперативной обстановке, складывающейся на обслуживаемой территории.
4. Выявление проблемных вопросов в деятельности инспектируемого органа, а также причин и условий, способствующих возникновению нарушении и недостатков.
5. Выработка мер и рекомендаций по приведению организации деятельности инспектируемого органа в соответствие с установленными требованиями, а также повышению ее эффективности.
6. Оказание организационно-методической и практической помощи инспектируемому органу.
7. Изучение, обобщение и распространение новых положительных форм и методов работы.
Предмет инспекторской проверки – все направления деятельности территориального органа в соответствии с реализуемыми полномочиями.
Плановое инспектирование территориального органа осуществляется один раз в шесть лет, а его продолжительность составляет срок не более двадцати пяти дней. В случае необходимости, срок инспектирования может быть продлен начальником УМВД по области.
Деятельность инспектируемого органа оценивается по состоянию на текущий период. В случае проведения инспектирования до истечения первых трех месяцев года изучается и оценивается деятельность инспектируемого органа за прошлый год.
Данные за предыдущие три года и более анализируются и учитываются в той степени, в которой они способствуют изучению положения дел в инспектируемом органе и тенденций в его развитии.
При инспектировании изучению и оценке подлежат деятельность инспектируемого органа в целом и по отдельным направлениям деятельности.
Оценки проверяемым структурным подразделениям инспектируемого органа не выставляются.
Оценочные показатели не имеют численного выражения. По результатам проверки каждого направления деятельности и деятельности инспектируемого органа она определяется как удовлетворительная или неудовлетворительная.
С момента принятия решения о проведении инспекторской проверки территориального органа и до ее окончания:
— иные служебные командировки в территориальный орган запрещены, за исключением случаев, требующих неотложного реагирования, а также выездов, осуществляемых по решению начальника УМВД по области;
— назначение на другую должность, перевод в другое подразделение и направление в длительную (более месяца) командировку руководителя территориального органа не осуществляются.
По итогам инспекторской проверки выставляются итоговые результаты деятельности инспектируемого органа в целом в следующем порядке:
1. Изучаются и оцениваются направления деятельности инспектируемого органа.
2. На основе оценок, полученных при проверке направлений деятельности, выводится расчетная оценка деятельности инспектируемого органа.
3. Итоговые результаты деятельности проинспектированного органа определяются на основе расчетной оценки органа и в зависимости от наличия (отсутствия) системы укрытия заявлений (сообщений) о преступлениях от регистрации и (или) многочисленных фактов искажения статистических данных (манипуляции статистическими данными) о результатах его оперативно-служебной деятельности.
При изучении и оценке отдельного направления деятельности и деятельности инспектируемого органа в целом руководитель комиссии УМВД области вправе применить метод экспертной оценки.
Порядок изучения и оценки направления деятельности:
Изучаются и оцениваются организация, законность, полнота и результативность осуществления 18 основных направлений деятельности (см. приложение №1):
1. Охрана общественного порядка и обеспечение общественной безопасности.
2. Предупреждение преступлений и административных правонарушений.
3. Выявление и раскрытие преступлений.
4. Осуществление оперативно-розыскной деятельности.
5. Розыск лиц и похищенного имущества.
6. Осуществление дознания.
7. Производство предварительного следствия.
8. Выявление, предупреждение и пресечение экстремистской деятельности.
9. Противодействие терроризму, обеспечение антитеррористической защищенности зданий, сооружений, помещений и иных объектов инспектируемого органа.
10. Противодействие коррупции.
11. Экспертно-криминалистическая деятельность.
12. Контроль в сфере миграции.
13. Обеспечение безопасности дорожного движения.
14. Контроль за оборотом наркотических средств, психотропных веществ и их прекурсоров.
15. Исполнение административного законодательства.
16. Содержание задержанных, заключенных, арестованных, их охрана и конвоирование.
17. Предоставление государственных услуг населению (осуществление государственных функций).
18. Прием граждан, работа с обращениями граждан.
Изучается организация и эффективность обеспечения деятельности проинспектированного органа, его структурных подразделений, в том числе:
1. Анализ и прогноз состояния преступности, выработка мер по укреплению правопорядка.
2. Планирование деятельности.
3. Внесение предложений по совершенствованию борьбы с преступностью.
4. Правовая работа, в том числе внесение предложений по совершенствованию законодательства.
5. Работа со средствами массовой информации. Осуществление мониторинга общественного мнения о деятельности проинспектированного органа.
6. Информирование населения, государственных органов и общественных организаций о деятельности проинспектированного органа.
7. Информационное обеспечение, в том числе деятельность по формированию и использованию централизованных оперативно-справочных, розыскных и криминалистических учетов.
8. Кадровое обеспечение.
9. Служебная дисциплина и законность.
10. Обеспечение защиты сведений, составляющих государственную тайну и иную охраняемую законом тайну.
11. Материально-техническое обеспечение.
12. Состояние мобилизационной подготовки, гражданской обороны.
13. Готовность к действиям при чрезвычайных обстоятельствах.
14. Осуществление функций получателя и распорядителя бюджетных ассигнований.
Оценивается управленческая деятельность руководства проинспектированного органа и состояние учетно-регистрационной дисциплины и статистической работы.
Состояние учетно-регистрационной дисциплины и статистической работы, служебная дисциплина и законность, обеспечение защиты сведений, составляющих государственную тайну и иную охраняемую законом тайну, управленческая деятельность руководства структурного подразделения инспектируемого органа изучаются и оцениваются при проверке всех структурных подразделений инспектируемого органа.
Выводы о результатах проверяемых направлений деятельности определяются на основе:
результатов изучения в ходе выезда документов, характеризующих деятельность инспектируемого органа, подчиненных подразделений;
результатов учений, тренировок, тестирований, проверок фактического состояния служебной деятельности, проведенных в ходе выезда в соответствии с требованиями нормативных правовых актов МВД России;
информации органов государственной власти, прокуратуры, ФСБ, судов, характеризующей деятельность инспектируемого органа и отвечающей требованиям полноты, объективности и достоверности;
результатов функционирования Временной приемной УМВД области, приема граждан, встреч с представителями органов государственной власти, иных правоохранительных органов и общественных организаций.
В зависимости от полученных результатов каждому проверяемому направлению деятельности проинспектированного органа выставляется одна из оценок – «удовлетворительно» или «неудовлетворительно».
Основными документами, в которых фиксируются информация о результатах проверки и оценки направления (направлений) деятельности инспектируемого органа, являются справки членов комиссии УМВД области, прилагаемые к ним оценочные показатели, составленные по действующей методике оценки, сводная оценочная ведомость по результатам инспектирования.
Результаты проверки основных направлений деятельности проинспектированного органа определяются по специальным методикам.
Руководитель комиссии УМВД области, исходя из совокупности оценок, полученных разными подразделениями по оцениваемому направлению деятельности, определяет итоговую оценку направления деятельности инспектируемого органа:
1. Неудовлетворительно оценивается направление деятельности инспектируемого органа, если в ходе его проверки выявлены признаки системы нарушений учетно-регистрационной дисциплины или статистической отчетности. Определения признаков системы нарушений статистической отчетности по направлениям деятельности включаются в специальные методики или отдельные нормативные правовые акты МВД России, УМВД области. При отсутствии определений признаков нарушений статистической отчетности в специальных методиках в связи с согласованным со штабом УМВД области решением о нецелесообразности включения в них соответствующих положений вывод о наличии (отсутствии) системы нарушений статистической отчетности по направлениям деятельности формируется руководителем, членами комиссии УМВД области методом экспертной оценки.
2. Если при изучении структурных подразделений инспектируемого органа проверяемое направление деятельности оценено одинаково, при этом руководитель и члены комиссии УМВД области не видят оснований для ее пересмотра, итоговая оценка направления деятельности имеет то же значение. При наличии оснований для пересмотра итоговая оценка направления деятельности может быть определена методом экспертной оценки.
3. Если при проверке структурных подразделений инспектируемого органа получены различные оценки направления деятельности или формализованные показатели направления деятельности не определены, руководитель комиссии УМВД области определяет итоговую оценку направления деятельности проинспектированного органа методом экспертной оценки.
Обеспечивающие направления деятельности изучаются по специальным методикам в профильном и остальных проверяемых структурных подразделениях инспектируемого органа. Обеспечивающее направление оценивается неудовлетворительно, если в ходе его проверки выявлены признаки системы нарушений статистической отчетности.
Управленческая деятельность руководителя инспектируемого органа, его заместителей, заместителей начальника полиции, а также руководителей структурных подразделений инспектируемого органа изучается и оценивается, членами комиссии по специальной методике.
Расчетная оценка деятельности проинспектированного органа определяется и в следующем порядке:
1. На основании изучения организации, законности, полноты и результативности основных направлений деятельности проинспектированного органа выводится расчетная оценка органа:
«удовлетворительно» — если число неудовлетворительных расчетных оценок по основным направлениям деятельности не превышает пяти;
«неудовлетворительно» — если число неудовлетворительных расчетных оценок по основным направлениям деятельности равно шести или превышает шесть.
Расчетная оценка может быть скорректирована с учетом дополнительных факторов:
оценок организации и эффективности осуществления обеспечивающих направлений деятельности проинспектированного органа;
оценки управленческой деятельности руководства инспектируемого органа; При получении неудовлетворительной предварительной оценки управленческая деятельность руководства инспектируемого органа, как правило, также оценивается «неудовлетворительно».
общественного мнения о деятельности инспектируемого органа на обслуживаемой территории и объектах, которое изучается в порядке, предусмотренном нормативными правовыми актами МВД России.
Отрицательное или положительное влияние указанных факторов на эффективность и предварительную оценку деятельности инспектируемого органа определяется экспертным путем и отражается в итоговых документах по результатам инспекторской проверки.
Решение об учете дополнительных факторов при определении расчетной оценки органа принимает руководитель комиссии с учетом мнения членов комиссии, выраженного в итоговых справках.
Итоговые результаты деятельности органа:
Состояние учетно-регистрационной дисциплины и статистической работы оценивается неудовлетворительно при получении указанной оценки по специальной методике и (или) при выявлении системы укрытия заявлений (сообщений) о преступлениях от регистрации и (или) установлении многочисленных фактов искажения статистических данных (манипуляции статистическими данными) о результатах оперативно-служебной деятельности.
Под системой укрытия заявлений (сообщений) о преступлениях от регистрации понимается выявление в ходе проверки деятельности инспектируемого органа сотрудниками подразделений УМВД области за проверяемый период двух и более фактов укрытия заявлений (сообщений) о преступлениях от регистрации.
Под многочисленными фактами искажения статистических данных (манипуляции статистическими данными) о результатах оперативно — служебной деятельности понимается допущенное по вине сотрудников органов внутренних дел завышение раскрываемости тяжких и особо тяжких преступлений на 1% и более и (или) искажение трех и более показателей, включенных в ведомственную оценку на 1% и более (каждого), и (или) искажение более чем на 10% одного показателя, включенного в ведомственную оценку, повлекшее завышение оценочного показателя.
Деятельность проинспектированного органа в целом оценивается удовлетворительно при удовлетворительной расчетной оценке органа и отсутствии системы укрытия заявлений (сообщений) о преступлениях от регистрации и (или) многочисленных фактов искажения статистических данных (манипуляции статистическими данными) о результатах его оперативно-служебной деятельности.
Деятельность проинспектированного органа в целом оценивается неудовлетворительно:
1. При выявлении системы укрытия заявлений (сообщений) о преступлениях от регистрации и (или) многочисленных фактов искажения статистических данных (манипуляции статистическими данными) о результатах его оперативно-служебной деятельности.
2. При неудовлетворительной расчетной оценке деятельности проинспектированного органа.
При наличии оснований для пересмотра итоговых результатов деятельности органа применяется метод экспертной оценки.
Итоговые результаты деятельности проинспектированного органа признаются окончательными после утверждения результатов инспекторской проверки начальником УМВД области.
План реализации предложений по устранению нарушений и недостатков, выявленных при инспектировании разрабатывается штабом инспектируемого органа с участием членов комиссии УМВД области, подписывается его руководителем, согласовывается с руководителем комиссии УМВД области и утверждается начальником УМВД области.
Результаты инспектирования рассматриваются на совещании руководящего состава проинспектированного органа.
В ходе совещания ведутся аудио-, видеозапись и стенографирование, организация которых возлагается на руководителя проинспектированного органа.
О результатах инспектирования в установленном порядке информируются средства массовой информации. По решению начальника УМВД области по результатам инспектирования руководителями комиссии УМВД области и проинспектированного органа проводится брифинг с представителями средств массовой информации.
Окончательное решение по оценке деятельности проинспектированного органа принимает начальник УМВД области.
При подготовке к инспектированию необходимо использовать информационно-аналитические материалы УМВД России по Оренбургской области, в том числе обзоры об основных недостатках, выявленных в ходе инспекторских, контрольных и целевых проверок территориальных органов МВД России на районном уровне, подчиненных УМВД России по Оренбургской области, за отчетные периоды, а также информационные материалы о проблемных вопросах, выявляемых в ходе проверок территориальных органов МВД России на районном уровне
Инспекция УМВД России по Оренбургской области
Show simple item record
| dc.contributor.author | Всемирная организация здравоохранения | en_US |
| dc.coverage.spatial | Копенгаген | en_US |
| dc.date.accessioned | 2021-08-31T09:17:39Z | |
| dc.date.available | 2021-08-31T09:17:39Z | |
| dc.date.issued | 2014 | |
| dc.identifier.isbn | 9789289050180 | |
| dc.identifier.uri | https://iris.who.int/handle/10665/344590 | |
| dc.description | 176 c. | en_US |
| dc.description.abstract | Руководство содержит основные принципы подготовки и проведения инспекций судов, заполнения санитарных свидетельств и осуществления медико-санитарных мероприятий, предусмотренных ММСП (2005 г.). Оно предназначено для использования в качестве справочного материала санитарными службами портов, судовыми операторами и другими уполномоченными органами, ответственными за обеспечение санитарно-эпидемиологического благополучия на судах. | en_US |
| dc.language.iso | ru | en_US |
| dc.publisher | Всемирная организация здравоохранения. Европейское региональное бюро | en_US |
| dc.subject.mesh | Legislation as Topic | en_US |
| dc.subject.mesh | Communicable Disease Control | en_US |
| dc.subject.mesh | Ships | en_US |
| dc.subject.mesh | Sanitation | en_US |
| dc.subject.mesh | Disease Outbreaks | en_US |
| dc.subject.mesh | Disease Transmission, Infectious | en_US |
| dc.subject.mesh | Handbook | |
| dc.subject.mesh | International Health Regulations | |
| dc.title | Руководство по инспектированию судов и выдаче судовых санитарных свидетельств | en_US |
| dc.type | Publications | en_US |
| dc.subject.meshqualifier | legislation and jurisprudence | en_US |
| dc.subject.meshqualifier | prevention and control | |
| who.relation.languageVersion | 10665/44594 | English |
| who.relation.languageVersion | 10665/44835 | español |
| who.relation.languageVersion | 10665/44834 | français |
Files in this item

- Name:
- 9789289050180-rus.pdf
- Size:
- 2.218Mb
- Format:
This item appears in the following Collection(s)
-
Publications
Show simple item record
2. Формами реализации мероприятий по инспектированию проверяемых органов <6> в зависимости от проверяемого органа являются:
———————————
<6> Далее — «инспектирование».
выездное инспектирование — проводится в отношении представительства МВД России или временной группы по месту их нахождения (функционирования);
документарное инспектирование — проводится в отношении дипломатического представительства по месту нахождения МИД России.
3. Инспектирование осуществляется на плановой основе <1>:
———————————
<1> Пункт 6.1 Положения об организации работы с соотечественниками.
3.1. Выездное инспектирование — должностными лицами Главного управления по вопросам миграции Министерства внутренних дел Российской Федерации <2> и Департамента по работе с соотечественниками за рубежом Министерства иностранных дел Российской Федерации <3>.
———————————
<2> Далее — «ГУВМ МВД России».
<3> Далее — «ДРС МИД России».
К проведению инспектирования при необходимости могут привлекаться сотрудники и (или) федеральные государственные гражданские служащие Управления международного сотрудничества Министерства внутренних дел Российской Федерации, Главного управления собственной безопасности Министерства внутренних дел Российской Федерации, иных заинтересованных подразделений центрального аппарата МВД России, Валютно-финансового департамента Министерства иностранных дел Российской Федерации <4>, а также должностные лица других заинтересованных федеральных органов исполнительной власти (по согласованию).
———————————
<4> Далее — «ВФД МИД России».
3.2. Документарное инспектирование — должностными лицами ДРС МИД России, при необходимости с привлечением представителей ВФД МИД России.
4. Предложения о проведении выездного инспектирования подготавливаются ГУВМ МВД России, согласовываются с ДРС МИД России и включаются в документы планирования, касающиеся вопросов выездов специалистов МВД России, МИД России за пределы территории Российской Федерации.
5. Инспектирование проводится не чаще одного раза в 3 года.
6. Решение о проведении инспектирования принимается:
6.1. Заместителем Министра внутренних дел Российской Федерации, ответственным за деятельность ГУВМ МВД России (в случае проведения выездного инспектирования).
6.2. Заместителем Министра иностранных дел Российской Федерации, ответственным за деятельность ДРС МИД России (в случае проведения документарного инспектирования).
7. Инспектирование проводится комиссией, формируемой из должностных лиц подразделений МВД России и (или) МИД России, других заинтересованных федеральных органов исполнительной власти (по согласованию), указанных в пункте 3 настоящего Порядка, в зависимости от формы реализации мероприятий по инспектированию <1>.
———————————
<1> Далее — «комиссия».
Общее количество членов комиссии не должно превышать 6 человек (включая руководителя комиссии).
8. Руководитель комиссии определяется:
8.1. При проведении выездного инспектирования — МВД России по согласованию с МИД России.
8.2. При проведении документарного инспектирования — МИД России.
9. Персональный состав комиссии и план-задание инспектирования и оказания организационно-методической помощи <2> (рекомендуемый образец приведен в приложении N 1 к настоящему Порядку) утверждаются не позднее чем за 10 календарных дней до начала инспектирования:
———————————
<2> Далее — «план-задание».
9.1. При проведении выездного инспектирования — заместителем Министра внутренних дел Российской Федерации, ответственным за деятельность ГУВМ МВД России.
9.2. При проведении документарного инспектирования — заместителем Министра иностранных дел Российской Федерации, ответственным за деятельность ДРС МИД России.
10. Замена лиц, включенных в состав комиссии, производится по решению заместителя Министра внутренних дел Российской Федерации, ответственного за деятельность ГУВМ МВД России, либо заместителя Министра иностранных дел Российской Федерации, ответственного за деятельность ДРС МИД России.
11. Срок проведения инспектирования устанавливается с учетом сложности поставленных задач, при этом срок проведения выездного инспектирования не должен превышать 5 рабочих дней, документарного инспектирования — 15 рабочих дней.
12. ГУВМ МВД России при подготовке выездного инспектирования не позднее чем за 20 календарных дней до его начала направляет в ДРС МИД России, а также в подразделения центрального аппарата МВД России и заинтересованные федеральные органы исполнительной власти, в случае включения их представителей в состав комиссии, проект плана-задания с указанием направлений деятельности, проверяемых членами комиссии, статистические данные о реализации представительством МВД России, временной группой Государственной программы.
13. ДРС МИД России, подразделения центрального аппарата МВД России, заинтересованные федеральные органы исполнительной власти не позднее 5 календарных дней со дня поступления проекта плана-задания согласовывают его или направляют замечания и предложения по его доработке. В случае если в указанный срок в ГУВМ МВД России не поступил ответ, проект плана-задания считается согласованным.
14. Инструктивное совещание с членами комиссии проводится не позднее чем за 3 рабочих дня до начала инспектирования:
14.1. При проведении выездного инспектирования — заместителем начальника ГУВМ МВД России, ответственным за деятельность по реализации Государственной программы.
14.2. При проведении документарного инспектирования — заместителем директора ДРС МИД России, ответственным за деятельность по реализации Государственной программы.
15. Руководитель комиссии:
15.1. В случае проведения выездного инспектирования обеспечивает решение вопросов, связанных с командированием членов комиссии.
15.2. Осуществляет непосредственное руководство деятельностью комиссии до окончания срока инспектирования.
15.3. Проводит совещание по вопросам организации и проведения инспектирования с руководителем проверяемого органа, знакомит его с планом-заданием.
15.4. В случае проведения выездного инспектирования в целях обеспечения объективного подхода к оценке организации и эффективности работы с соотечественниками проводит рабочую встречу с руководителем дипломатического представительства, курирующим деятельность по реализации Государственной программы <1>, в ходе которой информирует его о целях, сроках и порядке проведения инспектирования, выясняет его мнение об эффективности деятельности представительства МВД России (временной группы).
———————————
<1> Далее — «руководитель дипломатического представительства».
15.5. Дает поручения руководителю проверяемого органа о подготовке и предоставлении необходимых документов и материалов.
15.6. Несет персональную ответственность за подготовку, организацию и качество инспектирования.
16. Члены комиссии:
16.1. Согласовывают с руководителем комиссии порядок своей работы.
16.2. Изучают работу проверяемого органа по соответствующим направлениям деятельности, в том числе по приему соотечественников, по вопросам, отнесенным к компетенции комиссии, анализируют служебные документы.
16.3. Проверяют соблюдение порядка предоставления государственной услуги по оформлению, выдаче и замене свидетельства участника Государственной программы, принятия решений должностными лицами проверяемого органа, а также ход и результаты выполнения проверяемым органом требований нормативных правовых актов, указанных в подпункте 1.2 настоящего Порядка.
16.4. Проверяют на соответствие фактическим данным имеющиеся у комиссии статистические данные и данные, представленные проверяемым органом.
16.5. Выявляют и оценивают новые направления, формы и методы работы проверяемого органа, изучают ход внедрения положительного опыта.
16.6. Оказывают организационно-методическую помощь проверяемому органу в разработке и реализации мероприятий, направленных на повышение результативности его деятельности, в том числе на более эффективное использование личного состава.
16.7. Осуществляют подготовку и представляют в сроки, установленные руководителем комиссии, справки, в которых отражаются:
16.7.1. Принимаемые проверяемым органом меры по решению стоящих перед ним задач, совершенствованию организации работы.
16.7.2. Результаты деятельности проверяемого органа.
16.7.3. Выявленные недостатки в работе проверяемого органа, которые в том числе повлекли либо могут повлечь нарушение требований нормативных правовых актов, указанных в подпункте 1.2 настоящего Порядка.
16.7.4. Выявленные факты предоставления проверяемым органом недостоверных данных (статистических, учетных, информационных, установочных).
16.7.5. Предложения по устранению выявленных недостатков с указанием сроков.
17. Руководитель и члены комиссии обязаны:
17.1. Исполнять обязанности по инспектированию в соответствии с планом-заданием, оценивать результаты деятельности проверяемого органа, давать разъяснения по вопросам, относящимся к предмету инспектирования.
17.2. Вносить предложения по совершенствованию деятельности проверяемого органа.
Примечание: Данный документ является справочным материалом для инспекторов и других сотрудников FDA (Управления по контролю за пищевыми продуктами и лекарственными средствами, США). Документ не налагает на FDA никаких обязательств и не дает кому-либо каких бы то ни было прав, привилегий и льгот
Эти руководящие указания рассматривают оценку и анализ систем высокочистой воды, используемых в производстве лекарственных препаратов и субстанций, главным образом с точки зрения микробиологических аспектов. Также, руководящие указания включают обзор различных типов систем, используемых в практике, и проблем, присущих каждой из них. Как и другие руководящие указания, они не являются исчерпывающими, а содержат основу и методологические принципы проверки и оценки систем высокочистой воды. Дополнительные рекомендации можно найти в руководящих указаниях по инспектированию фармацевтических лабораторий контроля качества (май 1993 г.).
Проектирование системы
Одним из основных факторов, оказывающих влияние на проектирование системы получения высокочистой воды, является тип продукта, который будет производиться. Например, для парентеральных препаратов, где основной проблемой является пирогенность, используется только вода для инъекций (ВДИ). Она применяется как для приготовления лекарственных препаратов, так и для финального ополаскивания компонентов первичной упаковки и оборудования, используемых при их производстве. Единственными разрешенными Фармакопеей США методами получения ВДИ являются дистилляция и обратный осмос. Однако при производстве фармацевтических и биотехнологических продуктов в форме in bulk, а также в некоторых зарубежных компаниях, для минимизации содержания эндотоксинов в лекарственных субстанциях, вводимых парентерально, допускается использование ультрафильтрации.
При приготовлении некоторых офтальмологических продуктов, таких как офтальмологические растворы для ирригаций, и некоторых других ингаляционных продуктов, таких как стерильная вода для ингаляций, должна использоваться вода для инъекций. Однако при приготовлении большинства ингаляционных и офтальмологических препаратов на практике используется вода очищенная. Это также относится к производству местнодействующих, косметических и пероральных препаратов.
Другим, не менее важным параметром, который необходимо учитывать при проектировании систем, является температура воды. Системы хранения и распределения воды для фармацевтических целей в горячем состоянии (65–80°С) считаются самосанирующимися. Хотя стоимость других систем для предприятия может оказаться гораздо ниже по сравнению с данным типом исполнения, в конечном счете, затраты на обслуживание, проведение анализов и потенциальных проблем могут превысить стоимость сэкономленной энергии. Также важно, является ли система циркуляционной или однонаправленной. Очевидно, что в постоянно движущейся воде сильное загрязнение менее вероятно. В то время как однонаправленная система в принципе является тупиковой.
И наконец, возможно, самым важным аспектом проектирования систем высокочистой воды является оценка риска или уровень качества продукта, который необходимо получить. Следует понимать, что для различных продуктов нужна вода разного качества. Для парентеральных препаратов нужна очень чистая вода без эндотоксинов. Для местнодействующих и пероральных препаратов требуется вода более низкого качества, для них отсутствуют требования по содержанию эндотоксинов. Даже в случае местнодействующих и пероральных препаратов есть факторы, которые определяют выбор воды различного качества. Например, консерванты в антацидных препаратах имеют минимальную эффективность, поэтому для таких препаратов необходимы более жесткие требования по микробиологической чистоте. В данном случае Отделу контроля качества (ОКК) следует проверять каждый продукт, производимый с испольованием воды из системы, и определить для нее так называемый «Порог корректирующих действий» (Action limit) по показателю «Микробиологическая чистота», исходя из наиболее микробиологически чувствительного продукта. Вместо жестких пределов корректирующего действия, установленных к качеству воды, предприятие может включить в процесс производства чувствительных продукта(-ов) стадии снижения микробиологической нагрузки.
Валидация системы
Основным документом, который используется для валидации систем высокочистой воды, является Технический Отчет PDA (Parenteral Drug Association – Ассоциация парентеральных препаратов) № 4 «Проектные концепции для валидации систем получения воды для инъекций».
Во введении к этому документу приводятся методические рекомендации и указывается, что «Валидация часто предполагает применение метода контрольного загрязнения и проведение соответствующих испытаний. В этой ситуации было бы нежелательно привносить микроорганизмы в работающую систему, поэтому остается рассчитывать на периодический микробиологический контроль и установку оборудования для мониторинга в определенных контрольных точках, чтобы убедиться в том, что вся система работает надлежащим образом и постоянно выполняет предусмотренную функцию».
При рассмотрении валидационного отчета или при валидации системы высокочистой воды следует обращать внимание на ряд аспектов. Документация должна включать описание системы и ее схему. На чертеже должны быть показаны все входящие в систему единицы оборудования от точки подачи исходной воды до точек ее потребления. Здесь же следует указать и все точки отбора проб с их обозначениями. Отсутствие схемы системы водоподготовки обычно считается неприемлемым. При этом размышляют так: «Если нет схемы системы, как можно ее валидировать? Как работник ОКК или микробиолог узнает, где отбирать пробы?» На предприятиях, с отсутствующими актуальными схемами, были выявлены серьезные проблемы. Чертежи должны быть скорректированы с реально существующей схемой для подтверждения ее правильности и актуальности, выявления незарегистрированных изменений и подтверждения зарегистрированных изменений.
Убедившись, что все оборудование и трубопроводы смонтированы надлежащим образом и работают в соответствии с заданными параметрами, можно приступать к начальной фазе валидации системы высокочистой воды. На этом этапе определяются эксплуатационные параметры системы, а также процедуры и периодичность очистки/дезинфекции.
В течение двух–четырех недель следует ежедневно отбирать пробы после каждого этапа процесса очистки и в каждой точке потребления. Процедура отбора пробы в точке потребления должна быть выполнена в полном соответствии тому, как отбирается вода в этой конкретной точке, т.е., если обычно в работе используется шланг, пробу нужно брать из конца шланга. Если в соответствии со стандартной операционной процедурой (СОП) перед использованием воды из данной точки требуется промывка линии сильной струей, пробу отбирают после такой промывки. К концу этих двух–четырех недель предприятие должно разработать комплект СОП по эксплуатации системы высокочистой воды.
Вторая фаза валидации системы заключается в подтверждении того, что при эксплуатации в соответствии с СОП система способна стабильно производить воду надлежащего качества. На этом этапе пробы отбирают так же, как и на начальной фазе валидации. По завершении данной фазы полученные данные должны демонстрировать, что система будет стабильно производить воду требуемого качества.
Третья фаза валидации призвана продемонстрировать, что при длительной эксплуатации системы высокочистой воды в соответствии с утвержденными СОП она стабильно позволяет получать воду требуемого качества. На этой фазе валидации выявляются любые изменения качества исходной воды, которые могут повлиять на работу системы и, в конечном итоге, непосредственно на качество воды. Отбор проб проводится по обычным процедурам и графику. Для систем подготовки воды для инъекций пробы следует отбирать ежедневно минимум из одной точки потребления и еженедельно контролировать все точки потребления. Валидация системы высокочистой воды считается завершенной после того, как предприятие накопит данные за календарный год.
Хотя приведенная выше схема влидации системы высокочистой воды не является единственно возможной, она включает необходимые элементы валидации системы водоподготовки. Во-первых, схема валидации должна включать данные, обосновывающие СОП. Во-вторых, она должна содержать данные, демонстрирующие, что все СОП эффективны и система в состоянии стабильно производит воду с показателями, установленными спецификацией. И, наконец, в схеме валидации должны быть представлены данные, которые демонстрируют, что сезонные изменения качества исходной воды не оказывают отрицательного влияния на работу системы высокочистой воды и на ее качество.
Последней частью валидации является представление собранных данных с заключениями в итоговом отчете. Итоговый валидационный отчет должен быть подписан лицами, отвечающими за эксплуатацию и обеспечение качества системы высокочистой воды.
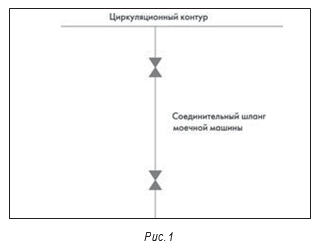
Типичная проблема, которая встречается на практике, – нарушение мероприятий по предотвращению загрязнения системы нестерильным воздухом, оставшимся в трубе после слива. На фрагменте системы, представленной на рис. 1, данная проблема возникает тогда, когда моечную машину или соединительный шланг промывают струей, а потом сливают воду после работы. После слива клапан (второй от системы) закрывают. Если на следующий день или при следующем включении открывают первый от циркуляционной системы высокочистой воды клапан, то оставшийся в трубе после слива нестерильный воздух загрязняет систему. Решение заключается в том, чтобы предусмотреть в СОП открывание второго клапана раньше первого для промывки системы перед использованием.
Еще одним важным моментом при валидации систем высокочистой воды являются критерии приемлемости. Стабильные результаты на всех участках системы высокочистой воды за весь период валидации являются первостепенными.
Уровни микробиологического загрязнения
Системы воды для инъекций
Согласно результатам микробиологического анализа воды для инъекций (ВДИ), предполагается, что она будет практически стерильной. Поскольку отбор проб часто производят в нестерильных зонах и не вполне асептическими методами, иногда возможен незначительный рост микроорганизмов в результате неправильного отбора проб. FDA считает уровень 10 КОЕ/100 мл приемлемым уровнем корректирующих действий. Ни один из уровней, устанавливаемых для оценки качества воды по данному показателю, не относится к типу «Соответствует/Не соответствует». Все они являются уровнями корректирующих действий. При превышении уровней корректирующих действий предприятие должно установить причину проблемы, предпринять действия по ее устранению, оценить влияние микробиологического загрязнения на произведенную с использованием этой воды продукцию и задокументировать результаты расследования.
Предпочтительный объем пробы для ВДИ по показателю «Микробиологическая чистота» составляет 100–300 мл. Пробы объемом менее 100 мл неприемлемы.
Реальную проблему для систем ВДИ представляют эндотоксины. Поскольку ВДИ может пройти ЛАЛ-тест на эндотоксины при превышении уровня корректирующего действия по микробиологической чистоте, важно осуществлять постоянный мониторинг систем ВДИ на содержание как эндотоксинов, так и микроорганизмов.
Системы воды очищенной
Требования по микробиологической чистоте для систем получения воды очищенной не столь очевидны. Требования Фармакопеи США (на момент подготовки этих руководящих указаний действующей является USP XXII), которые согласуются с требованиями федерального Управления по охране окружающей среды (Environmental Protection Agency – ЕРА) к питьевой воде, считаются минимальными. Некоторыми организациями предпринимались попытки установить более строгие требования для воды очищенной. Так, Ассоциация производителей косметических средств, туалетных принадлежностей и парфюмерии (CFTA,Cosmetic, Toiletry, and Fragrance Association) предложила установить требование – не более 500 микроорганизмов на миллилитр, а по Фармакопее США порог корректирующего действия составляет не более 100 микроорганизмов на один миллилитр». Хотя требования к микробиологической чистоте воды активно обсуждались, они так и не были введены в действие (за исключением стандартов ЕРА). Непосредственно FDA считает установление порога корректирующего действия выше 100 КОЕ/мл неприемлемым для системы воды очищенной.
Цель установления какого-либо предела или порога действия состоит в том, чтобы гарантировать, что система водоподготовки находится под контролем. Любой устанавливаемый порог корректирующего действия должен зависеть от системы воды очищенной в целом, дальнейшей технологии получения готовой продукции и ее применения. Например, в воде очищенной для производства лекарственных препаратов с помощью холодных технологий нежелательные микроорганизмы должны отсутствовать. Мы определяем термин «нежелательные микроорганизмы» как любые микроорганизмы, которые могут привести к инфицированию при применении лекарственного препарата в соответствии с инструкцией, или любой микроорганизм, способный к росту в лекарственном препарате. Как отмечено в руководящих указаниях по инспектированию микробиологических фармацевтических лабораторий контроля качества большее значение, как правило, имеет конкретный вид загрязнения, а не его уровень.
В системе воды очищенной микроорганизмы существуют во взвешенном состоянии или удерживаются на стенках труб и емкостей. Удерживаемые на стенках загрязнения такого типа образуют биопленки, от которых постоянно отделяются микроорганизмы. Таким образом, загрязнение распределено по системе неравномерно, и проба не обязательно отражает тип и уровень загрязнения. Вполне возможна ситуация, когда одна проба содержит 10 КОЕ/мл, а следующая 100 или даже 1000 КОЕ/мл.
Таким образом, при определении уровня загрязнения, допустимого в системе воды очищенной, используемой в производстве нестерильных препаратов, требуется понимание применения получаемого препарата, его состава (системы консервации) и технологии производства. Например, для изготовления антацидных препаратов, не содержащих эффективных консервантов, требуется порог корректирующих действий не более 100 КОЕ/мл.
Фармакопея США (USP) приводит некоторые рекомендации в фармакопейной монографии по микробиологическим показателям нестерильных препаратов. Там указывается, что «значимость микроорганизмов в нестерильных фармацевтических препаратах следует оценивать с точки зрения применения препарата, его природы и потенциального вреда для потребителя». Таким образом, проблему представляют не просто индикаторные микроорганизмы, указанные в конкретных фармакопейных статьях. Каждый производитель сам должен оценить свой продукт и технологию его производства, и на основании производимого с использованием этой воды препарата, представляющего наивысший риск, установить для своей системы воды очищенной допустимый порог корректирующего действия по микробиологическому загрязнению, не превышающий установленный максимум.
Системы воды для инъекций
При оценке и анализе систем воды для инъекций есть несколько аспектов, требующих особого внимания.
Предварительная очистка питающей (исходной) воды рекомендуется большинством производителей дистилляционного оборудования и, безусловно, она необходима для установок обратного осмоса. В течение срока эксплуатации системы водоподготовки качество поступающей исходной воды может меняться в зависимости от сезонных колебаний и иных внешних факторов, не зависящих от деятельности фармацевтического предприятия. Например, весной отмечено увеличение грамотрицательных микроорганизмов в воде. Новое строительство или пожары могут приводить к истощению запасов воды в старых водопроводных сетях, что может вызывать приток сильно загрязненной воды с различной флорой.
Конструкция системы воды для инъекций должна быть рассчитана на работу в таких прогнозируемых экстремальных условиях и ситуациях. Очевидно, единственный способ выявить такие экстремальные условия и ситуации – проводить периодический мониторинг исходной воды. Если питающая вода поступает из городского водопровода, вместо собственного анализа параметров качества могут использоваться данные подразделений муниципального контроля.
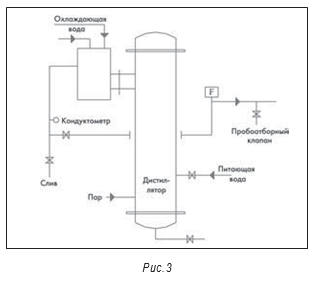
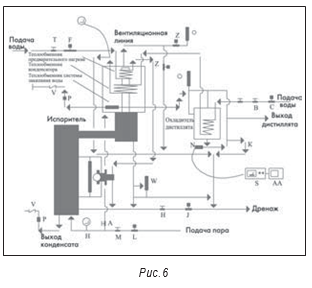
Дистиллятор
На рис. 3–5 показана типичная принципиальная схема системы ВДИ. В большинстве новых систем сейчас используются многоколоночные дистилляторы. На некоторых предприятиях отмечено загрязнение получаемой ВДИ эндотоксинами. В одной системе это произошло из-за неполадок в работе клапана питающей воды и контроля уровня воды в дистилляторе, что привело к попаданию капелек питающей воды в дистиллят.
В другом случае было отмечено, что при включении дистиллятора в конденсаторе уже было около 50 литров ВДИ. Поскольку вода могла находиться там не один день, например, в течение выходных, то это и явилось причиной недопустимого содержания эндотоксинов в получаемой ВДИ.
Однако чаще проблема заключается в том, что предварительная очистка исходной воды не обеспечивает необходимого снижения уровня эндотоксинов. Многие производители дистилляторов гарантируют снижение содержания эндотоксинов только на 2,5–3 log. Поэтому неудивительно, что в системах, где в исходной воде иногда бывают скачки до 250 МЕ/мл, в дистилляте (ВДИ) иногда отмечается недопустимый уровень эндотоксинов. Например, в трех новых дистилляторах, в том числе двух многоколоночных, недавно было выявлено периодическое повышение эндотоксинов в ВДИ выше 0,25 МЕ/мл. Системы предварительной очистки для этих дистилляторов включали только системы деионизации без ультрафильтрации, обратного осмоса или дистилляции. При отсутствии необходимой системы предварительной подготовки воды компании будет очень трудно доказать, что система ВДИ валидирована.
Приведенные выше примеры проблем с дистилляционными установками, используемыми для получения ВДИ, указывают на проблемы с обслуживанием оборудования или ненадлежащую его работу, что свидетельствует о том, что система не была должным образом валидирована, или что проведенная валидация уже не действительна. При обнаружении проблем такого рода следует очень тщательно проанализировать конструктивное решение системы, любые внесенные в систему изменения, валидационный отчет и данные регулярных испытаний и тестов, чтобы определить, что эксплуатация системы находится под контролем.
Обычно для мониторинга качества воды по химическим показателям в системах водоподготовки используются кондуктометры. Но они не дают информации о микробиологической чистоте.
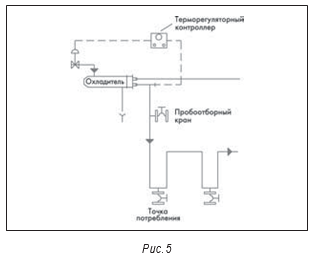
На рис. 3–5 также показаны маленькие пробоотборные вентили между отдельными единицами оборудования, например, после дистиллятора и перед баком-накопителем. Они разделяют основные единицы оборудования. Это необходимо для квалификации оборудования и для изучения любых проблем, которые могут возникнуть.
Дистиллятор
Одним из основных компонентов дистиллятора является теплообменник. Из-за схожего ионного состава дистиллированной и деионизованной воды кондуктометры не могут использоваться для мониторинга ее микробиологической чистоты. Для предотвращения возможного загрязнения дистиллята питающей водой в имеющем течи теплообменнике следует использовать избыточное давление, как в случае применения термокомпрессионных дистилляторов или дистилляторов с «классической» двойной трубной решеткой «double tubesheet».
В техническом руководстве для инспекторов FDA «Теплообменники для предотвращения загрязнения» обсуждается конструкция теплообменников и возможные проблемы, связанные с использованием такого оборудования. В руководстве указывается, что есть два метода предотвращения загрязнения в результате течей. Первый заключается в установке манометров для постоянного мониторинга перепадов давления, чтобы более высокое давление всегда было с «чистой» стороны, а второй – в использовании теплообменников с двойными трубными решетками.
В некоторых системах теплообменники используются для охлаждения воды в точках потребления. Как правило, когда потребления воды нет, охлаждающая вода в них не циркулирует. Отмечено несколько случаев образования в трубах микроотверстий после того, как из них была слита охлаждающая вода, и они не использовались. Было установлено, что небольшое количество оставшейся в трубах влаги в сочетании с воздухом привело к коррозии труб из нержавеющей стали со стороны охлаждающей воды. Поэтому рекомендуется не сливать охлаждающую воду из теплообменников, когда они не используются.
Емкости для хранения
В системах «горячего» хранения воды температура обычно поддерживается подачей тепла в рубашку накопительной емкости или установкой в линии циркуляции воды теплообменника перед возвратом в накопительную емкость с теплоизоляцией.
Элементом накопительной емкости, вызывающим больше всего вопросов, является фильтр дыхания. Для контроля работы существует программа проверки целостности фильтров дыхания, подтверждающая его исправность. В настоящее время фильтры обычно снабжают рубашкой, чтобы конденсат или вода не закупоривали гидрофобный фильтр. Если это происходит (фильтр закупоривается), возможно нарушение целостности фильтра или бака. Существуют методы проверки целостности фильтров дыхания без демонтажа (in situ).
Поэтому необходимо помнить, что расположение фильтра дыхания на накопительной емкости должно обеспечивать легкий доступ к нему.
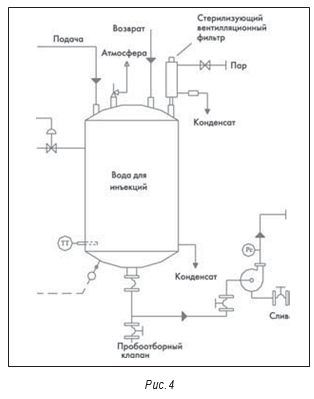
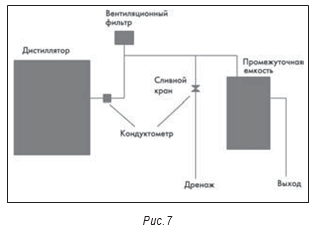
Сама по себе относительная новизна установки получения ВДИ и применение дистилляции как метода получения ВДИ не означают отсутствия проблем. При инспекции производителя парентеральных препаратов внимание привлекла установка 1984 года изготовления (см. рис. 6). При кажущейся сложности системы она оказалась относительно простой. На рис. 7 приведена схема установки. Среди замечаний по итогам инспекции было отмечено следующее: «Стандартные операционные процедуры по эксплуатации установки получения воды для инъекций (СОП) не обеспечивают периодической полной промывки или полного дренирования/опорожнения. Установка также контактирует с атмосферой и воздухом помещения. Оборудование для приготовления растворов лекарственных средств представляет собой негерметичные, открытые емкости с крышками. Накопительная емкость воды для инъекций также негерметична, из нее никогда не брали пробы на содержание бактериальных эндотоксинов». Из-за этих и других замечаний предприятие было вынуждено отозвать несколько препаратов и остановить производство.
Насосы
Насосы могут сгорать, а детали – изнашиваться. Кроме того, в случае не используемого постоянно насоса для создания статического давления накопительная емкость является застойной зоной. Например, в ходе инспекции было отмечено, что предприятию пришлось установить слив в нижней точке корпуса насоса. В системе хранения и распределения воды периодически обнаруживалось загрязнение Pseudomonas sp., что было отчасти отнесено на счет насоса, который эксплуатировался только периодически.
Трубопроводы
Трубопроводы систем ВДИ обычно изготавливаются из зеркально полированной стали. В некоторых случаях производители начали использовать трубы из поливинилиденфторида (ПВДФ). Считается, что при высокой температуре такие трубы не выделяют экстрагируемых веществ. Существенной проблемой при использовании трубопроводов из ПВДФ является необходимость обеспечения соответствующей поддержки трубопроводов за счет достаточно частого расположения опор для крепления. При нагреве трубы из ПВДФ она провисает, и в месте соединения может возникнуть напряжение, приводящее к протечке и/или разрыву. Кроме того, по меньшей мере в первоначальный период эксплуатации таких полимерных систем отмечается высокий уровень фторидов в воде. Такие трубы хороши в системах подачи продукта, когда незначительное загрязнение металлами может ускорять разложение лекарственного препарата, например, на биотехнологических производствах.
Распространенной проблемой с трубопроводами являются тупиковые зоны (dead legs). В предложенных Правилах производства парентеральных растворов больших объемов (LVP, Large volume parenterals) тупиковые зоны определяются как имеющие неиспользуемый участок длиной более шести диаметров неиспользуемой трубы при измерении от оси используемой трубы. Следует отметить, что это касается горячих (75–80°С) циркуляционных систем. В более холодных (65–75°С) системах в любых опусках или неиспользуемых участках трубы любой длины может образовываться биопленка, поэтому их следует по возможности исключить или предусмотреть специальные процедуры дезинфекции. В системах получения, хранения и распределения воды для фармацевтических целей недопустимо использование резьбовых соединений. Для соединений труб должны использоваться только санитарные разъемы или сварка встык. Санитарные разъемы обычно используются в местах соединения трубопроводов с клапанами, емкостями и иным оборудованием, которое необходимо демонтировать для обслуживания или замены. Поэтому во время инспекции следует проверять и оценивать процедуры санитарной обработки (дезинфекции) и сами трубопроводы.
Обратный осмос
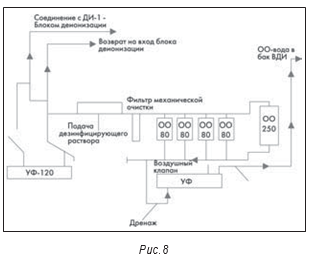
Другим допустимым методом получения ВДИ является обратный осмос (ОО). Однако, поскольку эти системы относятся к холодным, а ОО-мембраны не являются абсолютными, нередки случаи микробиологического загрязнения. На рис. 8 показана система, работавшая несколько лет назад. Система включает пять соединенных параллельно установок обратного осмоса. Поскольку ОО-мембраны не абсолютны, их производители рекомендовали последовательно устанавливать не менее двух мембран. На рисунке также показан ультрафиолетовый (УФ) облучатель, установленный в системе ниже установок обратного осмоса. Он потребовался для контроля снижения микробиологического загрязнения получаемой воды.
В системе также есть шаровые краны. Эти краны не считаются санитарными, потому что в середине крана есть полость и при его закрывании там может оставаться вода. Эта застойная зона, в которой могут присутствовать микроорганизмы, может инициировать начало образования биопленки.
Дополнительно следует отметить, что, понимая микробиологические проблемы в системах обратного осмоса, некоторые производители устанавливают сразу после ОО-фильтров теплообменники, нагревающие воду до 75-80°С для минимизации микробиологического загрязнения.
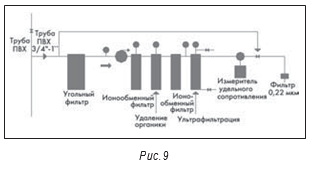
С появлением биотехнологических препаратов множество небольших предприятий стали использовать для получения высокочистой воды комбинированные системы обратного осмоса и ультрафильтрации. Например, на рис. 9 показана настенная система, запитываемая от одноступенчатой установки обратного осмоса.
Как и на рисунке 9, в большинстве подобных систем используются трубы из ПВХ или другого пластика. Так как эти системы обычно «холодные», их многочисленные соединения также являются потенциальным источником загрязнений. Другой, не менее серьезной проблемой при использовании пластиков являются экстрагируемые, в частности из ПВХ труб, вещества. Рассмотрение возможности соответствия системы ВДИ, выполненной из такого материала, на соответствие требованиям USP без какого-либо подтверждения отсутствия экстрагируемых веществ просто неприемлемо.
В точках отбора ВДИ в системах ее распределения установлены фильтры 0,2 микрона, которые могут скрывать истинную картину уровня микробиологического загрязнения системы. Известно, что главной опасностью в таких системах водоподготовки являются эндотоксины; при этом стерилизующий фильтр снижает микробиологическое загрязнение, но не обязательно удаляет эндотоксины. Если в системах распределения воды для фармацевтических целей используются фильтры, то для каждого фильтра должно быть указано его назначение, т.е. либо удаление механических примесей, либо снижение микробиологического загрязнения, а также должна быть в СОП, в которой указывается периодичность замены фильтра, основанная на данных, полученных при валидации системы.
Как говорилось выше, из-за объема реально анализируемой воды (0,1 мл при определении эндотоксинов по сравнению со 100 мл при анализе общего микробного числа ВДИ) микробиологический анализ дает хорошее представление об уровне загрязнения системы. Поэтому проведение микробиологического анализа не имеет особого смысла, если проба воды отбирается перед конечным фильтром 0,2 микрона
При повторной инспекции этого биотехнологического производства было отмечено, что для устранения недостатков системы ВДИ были выполнены работы по монтажу трубопроводов системы распределения из нержавеющей стали, в которые вода поступала из четырех последовательно смонтированных установок обратного осмоса. Поскольку этому производителю не требовалось для нужд производства много воды (общая производительность системы составляла около 115 литров), они попытались отключить систему примерно на сутки. На рис. 9 показано, что в точке отсчета (в 9 часов третьего октября) микроорганизмы и эндотоксины в обнаруживаемых количествах отсутствовали. Через день было выявлено загрязнение этой статичной системы, вода в которой не циркулировала. Четыре пробы, взятые с интервалом в один час, также иллюстрируют вариабельность полученных результатов отобранных из системы проб. После отбора последней пробы в 12 часов систему повторно продезинфицировали 0,5%-ным раствором перекиси водорода, промыли, включили рециркуляцию и отобрали повторные пробы. После повторного включения системы микробиологическое загрязнение в ежедневных пробах отсутствовало. По этой причине FDA рекомендовало ежедневно сливать воду из нерециркулирующих/ тупиковых систем, а не оставлять ее в системе.
Системы воды очищенной
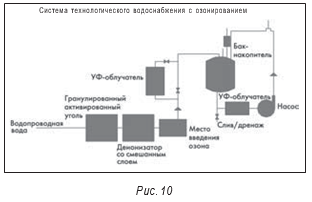
Многие комментарии в отношении оборудования для систем получения воды для инъекций применимы и к системам воды очищенной. В одном типе систем, используемых для контроля микробиологического загрязнения, используется озон. На рис. 10 показана стандартная система с использованием озонирования. Хотя эта система считается относительно недорогой, с ней связан ряд проблем. Для оптимальной эффективности требуется, чтобы в системе оставался растворенный остаточный озон. В результате возникают проблемы как с безопасностью персонала, так и с использованием воды при приготовлении препаратов.
Опубликованные данные производственной компании Vicks в г. Гринсборо, Северная Каролина, показали, что их система оказалась повторно загрязненной через два–три дня после выключения генератора озона. При инспектировании другого производителя была отмечена проблема с загрязнением Peudomonas sp. Из-за возможных проблем с безопасностью персонала перед подачей воды в рециркуляционную систему из нее удаляли озон. Имеются сообщения, что растворенный озон в концентрации 0,45 мг/л остается в системе не более пяти–шести часов.
Еще один производитель в рамках ежедневной санитарной обработки снимает все опуски озонированной воды и дезинфицирует их в 70%-ном изопропиловом спирте, прошедшем стерилизующую фильтрацию. В отчетах у этого производителя великолепные результаты по микробиологии. Однако пробы отбирают только сразу после дезинфекции, а не в конце работы. Поэтому результаты не вполне показательны.
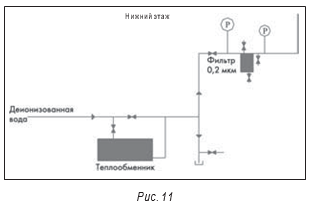
На рисунках 11 и 12 представлена еще одна система воды очищенной, в которой были отмечены проблемы. В отличие от большинства других вышеописанных систем эта система не рециркуляционная, а тупиковая. Для еженедельной дезинфекции системы путем нагрева воды и используется теплообменник. Фактически, вся эта система является тупиковой.
На рис. 11 показан установленный в линии фильтр 0,2 микрона, используемый для ежедневной дезинфекции очищенной воды. Помимо того, что корпус фильтра – хорошая среда для микробиологического загрязнения, типичной проблемой является гидравлический удар, который приводит к «раздуванию» фильтра. Если расположенный ниже фильтра кран закрыть слишком быстро, обратное давление воды может привести именно к таким проблемам. Типичным видимым признаком высокого обратного давления является вибрация трубы, но действительная проблема заключается в попадании находившихся выше стерилизующего фильтра загрязнений на лицевую сторону фильтра. Эта система также имеет несколько вертикальных отводов к точкам потребления. Во время дезинфекции важно приоткрывать оконечные краны, чтобы все колена и изгибы трубопроводов наполнились водой и таким образом полностью подверглись воздействию дезинфицирующего средства.
Следует отметить, что эта система не является неадекватной только из-за того, что она тупиковая. При хорошо отработанных и написанных стандартных операционных процедурах, основанных на данных валидации, и регулярных обработках горячей водой, эта система может быть приемлемой. Соответствующей требованиям была сочтена даже очень длинная (более 180 метров) система с более чем 50 точками потребления. Все опуски этой системы ежедневно промывали водой, нагретой до 80°С.
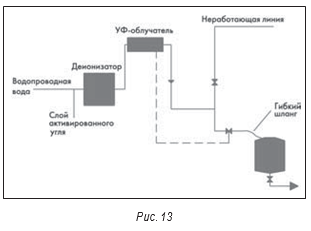
Последняя система воды очищенной, рассматриваемая ниже, была признана несоответствующей требованиям. Обнаруженная в системе (после анализа, проведенного FDA) Pseudomonas sp. была найдена и в местнодействующем стероидном препарате (после анализа, проведенного FDA). В результате продукция была отозвана из продажи, и FDA выпустило письмо-предупреждение. Эта система (рис. 13) тоже тупиковая с использованием УФ-облучателя для контроля микробиологического загрязнения. Облучатель включают, только когда нужна вода.
Таким образом, бывают периоды, когда вода остается в системе трубопроводов и застаивается. Гибкий шланг, который также используется в данной схеме, очень трудно продезинфицировать. Чтобы УФ-облучатели работали, их нужно правильно обслуживать. Стеклянные кожухи вокруг ламп(-ы) должны быть чистыми, иначе их эффективность снижается. В установках с несколькими лампами должна быть система, позволяющая определить, что все лампы работают. Нужно помнить, что УФ-облучение убивает не более 90% поступающих в установку организмов.
Технологическая вода
В настоящее время Фармакопея США (USP) на стр. 4 в разделе общих замечаний разрешает производство лекарственных субстанций из питьевой воды. В то же время там указывается, что любые готовые формы должны производиться из воды очищенной, воды для инъекций или одной из форм стерильной воды. В этих утверждениях есть определенная непоследовательность, потому что для гранулирования таблеточной смеси нужно использовать воду очищенную, однако для финальной очистки лекарственной субстанции допускается использование и питьевой воды.
В Руководстве FDA по инспектированию фармацевтических ингредиентов ангро выражается озабоченность качеством воды, используемой для производства лекарственных субстанций, особенно лекарственных субстанций для парентеральных препаратов. Отмечаются случаи повышенного микробиологического и/или эндотоксинового загрязнения лекарственных субстанций, источником которых является используемая при очистке вода. В настоящее время на финишных этапах синтеза/очистки лекарственных субстанций для парентерального применения не обязательно использовать воду для инъекций. Однако те системы воды, которые используются или планируются к использованию на финишных стадиях производства лекарственных субстанций для парентерального применения, для гарантии обеспечения минимального эндотоксинового/микробиологического загрязнения следует валидировать.
На производствах лекарственных субстанций, особенно для производства парентеральных лекарственных средств, для получения воды распространены системы ультрафильтрации и обратного осмоса (ОО). Хотя ультрафильтрация не вполне эффективно снижает общий уровень пирогенов, но зато снижает содержание в воде эндотоксинов с высокой молекулярной массой. Как и ОО, ультрафильтрация не является «абсолютным» процессом, но гарантировано улучшает показатели на порядки. Кроме того, как говорилось раньше о других холодных системах, для поддержания их работоспособности требуется постоянное техническое обслуживание и существенные эксплуатационные затраты.
При производстве лекарственных субстанций не для парентерального применения все равно существуют вопросы микробиологической чистоты, хотя и в меньшей степени, чем для лекарственных субстанций для парентерального применения. В некоторых регионах мира питьевая (хлорированная) вода может не представлять проблемы с точки зрения микробиологии. Однако могут возникнуть другие вопросы. Например, использование хлорированной воды обычно приводит к повышению содержания хлоридов, содержание которых в воде для фармацевтических целей регламентируется и которые влияют на удельную электропроводность воды. В некоторых регионах вода для нужд технологии может быть получена непосредственно из источника водоснабжения.
В рамках проведения одной из инспекций производителя, получавшего воду для технологических нужд из реки в сельскохозяйственном районе, было выявлено, что в какой-то момент у них возникла проблема с повышенным содержанием пестицидов, попадавших в воду из расположенных рядом ферм. Процесс производства и методы анализа не были рассчитаны на удаление и идентификацию следовых загрязнений пестицидами. Поэтому очевидно, что использование такой схемы технологической воды для очистки лекарственных субстанций недопустимо.
Технологическая вода
Обычно у производителей бывают периодические записи (журналы, распечатки или таблицы) с результатами данных по системам водоподготовки. Эти данные должны быть проанализированы. Кроме того, следует проанализировать отчеты о расследованиях случаев превышения установленных пределов.
Поскольку результаты микробиологических анализов воды из системы водоподготовки не могут быть получены сразу после изготовления лекарственного препарата, результаты превышения установленных пределов следует рассматривать с учетом того, что продукт произведен с использованием воды такого качества. Решение о дальнейшей переработке или выпуске такого продукта зависит от вида загрязнения, технологии и конечного использования продукта. Такие ситуации обычно рассматриваются для каждого конкретного случая. В таких ситуациях правильно прилагать к отчету компании отчет о расследовании таких случаев с обоснованием выпуска/забраковки. Результаты микробиологического анализа конечного продукта, хотя и дают определенную информацию, не должны служить единственным основанием для выпуска лекарственного препарата. Следует учитывать ограничения при отборе проб и микробиологического анализа (объемы проб, время и пр.).
У производителей также должны быть записи или журналы обслуживания оборудования, например, дистилляторов. Эти журналы также следует анализировать, чтобы можно было оценить проблемы с системой и оборудованием.
Помимо рассмотрения результатов анализа, сводных данных, отчетов о расследованиях и иных данных при проведении физической инспекции следует рассматривать и схемы системы водоподготовки (P&ID). Как указывалось выше, чтобы продемонстрировать, что система валидирована, нужны правильное ее описание и достоверная схема.
Редакция выражает глубокую признательность Генеральному директору ООО «Фармсистемы» Приходько Александру за помощь в подготовке текста статьи к опубликованию
Коллегия Евразийской экономической комиссии в соответствии со статьей 31 Договора о Евразийском экономическом союзе от 29 мая 2014 года и статьей 3 Соглашения о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники) в рамках Евразийского экономического союза от 23 декабря 2014 года, а также в целях обеспечения единообразных подходов к инспектированию производства медицинских изделий РЕКОМЕНДУЕТ
государствам–членам Евразийского экономического союза с даты опубликования настоящей Рекомендации на официальном сайте Евразийского экономического союза применять Руководство по оценке и наделению организаций государств – членов Евразийского экономического союза полномочиями по проведению инспектирования производства медицинских изделий согласно приложению.
РУКОВОДСТВО
ПО ОЦЕНКЕ И НАДЕЛЕНИЮ ОРГАНИЗАЦИЙ ГОСУДАРСТВ – ЧЛЕНОВ ЕВРАЗИЙСКОГО
ЭКОНОМИЧЕСКОГО СОЮЗА ПОЛНОМОЧИЯМИ ПО ПРОВЕДЕНИЮ ИНСПЕКТИРОВАНИЯ
ПРОИЗВОДСТВА МЕДИЦИНСКИХ ИЗДЕЛИЙ
I. Общие положения
1. Настоящее Руководство определяет подходы к проведению оценки и наделению организаций государств – членов Евразийского экономического союза (далее соответственно – государства-члены, Союз) полномочиями по проведению инспектирования производства медицинских изделий на соответствие Требованиям к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения, утвержденным Решением Совета Евразийской экономической комиссии от 10 ноября 2017 г. N 106 (далее – Требования к системе менеджмента качества).
2. Для целей применения настоящего Руководства под уполномоченным органом понимается орган государственной власти государства-члена, уполномоченный на осуществление и (или) координацию деятельности в сфере обращения медицинских изделий на территории этого государства.
Иные понятия, используемые в настоящем Руководстве, применяются в значениях, определенных актами в сфере обращения медицинских изделий, входящими в право Союза.
II. Деятельность уполномоченного органа по оценке
и уполномочиванию инспектирующих организаций
3. В случае если инспектирующей организацией является уполномоченный орган, оценка и наделение этого органа полномочиями осуществляются в соответствии с законодательством государства-члена.
4. Уполномоченный орган осуществляет уполномочивание организаций, претендующих на проведение инспектирования производства (далее – заявители), на основании их заявок по каждой подгруппе медицинских изделий по перечню, предусмотренному приложением N 2 к Требованиям к системе менеджмента качества, по итогам проведения оценки их соответствия указанным Требованиям, а также требованиям к организациям государств-членов для наделения их полномочиями по проведению инспектирования производства медицинских изделий, утверждаемым Евразийской экономической комиссией (далее – требования к инспектирующим организациям).
5. Уполномоченный орган осуществляет следующие функции:
а) рассмотрение заявок и документов, поступивших от заявителей;
б) обеспечение проведения в соответствии с законодательством государства-члена проверок с целью уполномочивания заявителей;
в) уполномочивание заявителей и ведение перечня инспектирующих организаций;
г) наблюдение за проведением инспектирующими организациями инспектирования производства;
д) планирование и проведение периодических и проведение внеплановых проверок инспектирующих организаций;
е) отзыв полномочий или сокращение области уполномочивания инспектирующей организации.
6. До принятия решения о проведении проверки с целью уполномочивания заявителя уполномоченный орган рассматривает заявку в течение 15 рабочих дней со дня ее поступления.
К заявке прилагаются документы, содержащие следующую информацию:
предполагаемая область уполномочивания (по подгруппам медицинских изделий);
местонахождение и основной вид деятельности заявителя, его филиалов (при наличии) и лиц, входящих с ним в одну группу (с указанием оснований, по которым такие лица входят в эту группу, в соответствии с требованиями к инспектирующим организациям);
действующая система менеджмента качества заявителя и ее соответствие требованиям к инспектирующим организациям.
При отрицательном результате рассмотрения заявки в течение 3 рабочих дней после принятия уполномоченным органом решения в адрес заявителя направляется письменное уведомление с указанием причин отказа (несоответствие заявки и прилагаемых документов положениям настоящего пункта или основание, предусмотренное пунктом 18 Требований к системе менеджмента качества) в электронном виде и заказным почтовым отправлением с уведомлением о вручении или передается иным способом, позволяющим подтвердить факт его получения. Проверка с целью уполномочивания заявителя в таком случае не проводится.
7. При положительном результате рассмотрения заявки уполномоченным органом в срок, не превышающий 30 рабочих дней со дня поступления заявки, обеспечивается проведение проверки с целью уполномочивания заявителя.
Задачами проверки с целью уполномочивания являются:
оценка соответствия процессов и процедур системы менеджмента качества заявителя требованиям к инспектирующим организациям;
анализ доказательств соблюдения заявителем процедур и целей, установленных его системой менеджмента качества, с учетом планируемого уполномочивания;
анализ оперативного управления процессами системы менеджмента качества заявителя;
подтверждение компетенции заявителя для выполнения обязательств в области уполномочивания и наличия необходимых ресурсов.
Проверка филиаловзаявителя (при наличии) по месту их нахождения дополнительно включает в себя:
анализ взаимосвязи заявителя и его филиалов, а также методов контроля деятельности филиалов, связанной с областью уполномочивания;
оценку систем менеджмента качества филиалов и их соответствие требованиям заявителя;
оценку соответствия деятельности филиалов, связанной с областью уполномочивания, требованиям системы менеджмента качества инспектирующей организации, а также настоящего Руководства.
8. По итогам проведения проверки заявителя уполномоченным органом принимается решение об уполномочивании (расширении области уполномочивания) заявителя или об отказе в уполномочивании (расширении области уполномочивания), которое оформляется приказом (распоряжением) уполномоченного органа (с указанием причин отказа).
Уполномоченному органу в течение 3 рабочих дней со дня принятия соответствующего решения следует уведомлять заявителя о принятом решении любым способом, позволяющим подтвердить факт его получения.
Если по итогам проведения проверки заявителя уполномоченным органом принято решение об отказе в уполномочивании, заявитель вправе повторно подать заявку в соответствии с настоящим Руководством не ранее чем по истечении 90 календарных дней.
Уполномоченный орган в течение 3 рабочих дней со дня принятия решения об уполномочивании (расширении области уполномочивания) заявителя размещает информацию об этом на своем официальном сайте в информационно-телекоммуникационной сети «Интернет» и вносит сведения о заявителе в перечень инспектирующих организаций.
9. В рамках проведения периодической или внеплановой проверки инспектирующей организации уполномоченный орган вправе за свой счет направить своих представителей для наблюдения за проведением инспектирующей организацией инспектирования производства.
Наблюдение за проведением инспектирующей организацией инспектирования производства осуществляется уполномоченным органом в целях оценки работы инспектирующей организации в части:
соответствия инспектирования производства Требованиям к системе менеджмента качества;
способности инспектирующей организации:
определить, соблюдает ли производитель медицинских изделий законодательство государств-членов в сфере обращения медицинских изделий;
достоверно сообщить о результатах инспектирования производства, в том числе о выявленных нарушениях;
формировать группы инспекторов из сотрудников, обладающих необходимой компетенцией.
10. Инспектирующей организации следует уведомлять уполномоченный орган о дате предстоящего инспектирования производства не позднее, чем за 30 рабочих дней до дня его проведения.
11. Уполномоченный орган уведомляет инспектирующую организацию и инспектируемого производителя медицинского изделия о предстоящем наблюдении за проведением инспектирующей организацией инспектирования производства не позднее чем за 5 рабочих дней до дня его проведения.
12. При выборе инспектирования производства для наблюдения уполномоченным органом учитываются следующие факторы:
а) класс потенциального риска применения производимых медицинских изделий;
б) форма проводимого инспектирования производства (первичное, периодическое (плановое) или внеплановое);
в) местонахождение объекта инспектирования производства;
г) личные данные участников инспекционной группы;
д) используемые производственные процессы и технологии;
е) выявленные по результатам мониторинга безопасности, качества и эффективности медицинских изделий проблемы, связанные с инспектируемым производителем или его продукцией.
13. До проведения инспектирования производства с участием представителей уполномоченного органа инспектирующей организации следует представить уполномоченному органу по его запросу следующие документы и сведения:
а) контактная информация производителя медицинских изделий;
б) руководство по качеству производителя медицинских изделий;
в) запланированный объем инспектирования производства;
г) отчеты о предыдущих инспектированиях производства (при наличии);
д) информация о нарушениях, обнаруженных в ходе предыдущих инспектирований производства (при наличии);
е) состав инспекционной группы, а также обоснование выбора членов группы;
ж) копии документов, представленных инспектирующей организацией инспекционной группе для планирования инспектирования производства;
з) программа инспектирования производства;
и) другие запрошенные сведения.
14. Во время инспектирования производства представитель уполномоченного органа не вправе вмешиваться и влиять на ход и результат инспектирования производства. Взаимодействие между представителем уполномоченного органа и инспекционной группой осуществляется только после завершения инспектирования производства.
15. Отчет представителя уполномоченного органа об оценке работы инспектирующей организации по результатам наблюдения за проведением инспектирующей организацией инспектирования производства оформляется в письменном виде и передается в уполномоченный орган и инспектирующую организацию.
16. Уполномоченный орган не реже 1 раза в 2 года обеспечивает проведение периодической проверки инспектирующей организации для оценки соблюдения инспектирующей организацией Требований к системе менеджмента качества и требований к инспектирующим организациям. Периодическая проверка проводится по месту нахождения инспектирующей организации.
Задачами периодической проверки являются:
оценка результативности системы менеджмента качества инспектирующей организации;
подтверждение того, что инспектирующая организация соответствует Требованиям к системе менеджмента качества и требованиям к инспектирующим организациям;
оценка деятельности инспектирующей организации, связанной с первоначальным определением компетенций и последующим непрерывным совершенствованием профессиональных знаний и навыков сотрудников, участвующих в инспектировании производства;
оценка работы по рассмотрению апелляций и работы с обращениями;
оценка отчетов о результатах инспектирования производства;
подтверждение того, что инспектирующая организация проводит внутренние проверки и анализ системы менеджмента качества;
оценка всех изменений, произошедших в инспектирующей организации со дня проведения уполномоченным органом последней проверки.
17. Основаниями для проведения внеплановой проверки инспектирующей организации являются:
а) заявка инспектирующей организации об изменении области уполномочивания;
б) уведомление инспектирующей организации об изменениях, влияющих на ее полномочия, в соответствии с требованиями к инспектирующим организациям. Необходимость проведения внеплановой проверки инспектирующей организации по указанному основанию определяется уполномоченным органом с учетом степени влияния произошедших изменений на результат предыдущей проверки в каждом конкретном случае самостоятельно;
в) решение уполномоченного органа, принятое на основании информации о возможных нарушениях в деятельности инспектирующей организации, в том числе на основании отчета представителя уполномоченного органа об оценке работы инспектирующей организации по результатам наблюдения за проведением инспектирующей организацией инспектирования производства;
г) оценка результативности мер, принятых для устранения нарушений, обнаруженных в ходе предыдущей проверки.
18. Если по результатам проведения периодической или внеплановой проверки инспектирующей организации выявлены нарушения Требований к системе менеджмента качества и требований к инспектирующим организациям, уполномоченному органу следует уведомить инспектирующую организацию о необходимости устранения выявленных нарушений и установить срок для их устранения, который должен позволять инспектирующей организации устранить все выявленные нарушения и который не должен превышать 90 календарных дней.
До устранения нарушений инспектирующая организация может проводить инспектирование производства, за исключением случаев несоответствия профессионального уровня сотрудников, ответственных за проведение инспектирования производства, и лиц, привлекаемых инспектирующей организацией к проведению инспектирования производства, области уполномочивания инспектирующей организации.
III. Порядок оценки инспектирующей организации
19. В рамках проведения проверок с целью уполномочивания заявителей, а также периодических и внеплановых проверок инспектирующих организаций следует осуществлять оценку соответствия инспектирующей организации Требованиям к системе менеджмента качества и требованиям к инспектирующим организациям, которая включает в себя анализ и оценку следующих процессов:
«Управление»;
«Привлечение внешних экспертов»;
«Измерения, анализ и улучшения»;
«Управление компетенциями сотрудников»;
«Инспектирование производства и принятие решений по его результатам»;
«Управление информацией и документацией».
Указанные процессы оцениваются вне зависимости от того, как инспектирующая организация организует свою деятельность и систему менеджмента качества.
Проверка с целью уполномочивания заявителей содержит оценку всех 6 процессов. Периодическая проверка содержит оценку 5 процессов, при этом исключается процесс «Управление».
20. Задачей оценки процесса «Управление» является подтверждение того, что высшее руководство инспектирующей организации обеспечило внедрение и функционирование эффективной системы менеджмента качества для обеспечения контроля действий, относящихся к инспектированию производства и принятию решений по результатам инспектирования производства.
В результате оценки процесса «Управление» следует подтвердить, что инспектирующей организации удалось:
организовать осуществление процессов, необходимых для системы менеджмента качества, их применение на каждом уровне, а также обеспечить их последовательность и взаимосвязь;
создать систему менеджмента качества, способствующую эффективному проведению инспектирования производства и принятию обоснованных решений по результатам инспектирования производства, соблюдению установленных в рамках Союза требований в сфере обращения медицинских изделий и договорных обязательств;
установить цели в области качества, которые согласуются с политикой в области качества инспектирующей организации и периодически обновляются для обеспечения соответствия инспектирующей организации установленным в рамках Союза требованиям в сфере обращения медицинских изделий;
обеспечить наличие необходимых ресурсов и компетентных сотрудников;
наделить сотрудников полномочиями и распределить обязанности, а также определить организационную структуру;
разработать, документально оформить и внедрить процедуры управления беспристрастностью, защиты конфиденциальной информации, прозрачности проведения инспектирования производства и принятия решений;
обеспечить эффективность системы менеджмента качества и ее процессов.
В рамках оценки процесса «Управление» необходимо:
проверить и подтвердить, что руководство по качеству и необходимая документация, связанная с системой менеджмента качества, разработаны и оформлены должным образом;
проверить и подтвердить, что в организации определена политика и установлены цели в области качества, что цели в области качества измеримы и согласуются с политикой в области качества и для их достижения приняты меры;
проверить организационную структуру инспектирующей организации и связанные с ней документы, подтвердить, что в них включены положения о должностных обязанностях и полномочиях, в том числе определена ответственность, связанная с деятельностью по инспектированию производства и своевременным обменом информацией с уполномоченными органами, а также с обеспечением выполнения требований системы менеджмента качества инспектирующей организации;
подтвердить, что компетенция инспекторов инспектирующей организации соответствует области ее деятельности и количество инспекторов достаточно для выполнения объема работ по инспектированию, в том числе с учетом количества привлекаемых внешних экспертов;
подтвердить, что инспектирующая организация разработала и внедрила процедуры управления беспристрастностью;
подтвердить, что анализ системы менеджмента качества осуществляется с запланированной периодичностью.
21. Задачей оценки процесса «Привлечение внешних экспертов» является подтверждение того, что действия, совершаемые по поручению инспектирующей организации внешними экспертами, контролируются инспектирующей организацией.
В результате оценки процесса «Привлечение внешних экспертов» следует подтвердить, что инспектирующей организации удалось:
разработать, задокументировать и внедрить процедуры, необходимые для контроля деятельности внешних экспертов, в том числе для контроля профессионального уровня, соблюдения конфиденциальности и управления беспристрастностью;
оформить договоренности с внешними экспертами в письменном виде, включая их обязательства соблюдать требования инспектирующей организации в части конфиденциальности и беспристрастности;
подтвердить, что она обладает компетентностью, позволяющей анализировать результаты деятельности внешних экспертов.
В рамках оценки процесса «Привлечение внешних экспертов» необходимо:
установить, что при использовании услуг внешних экспертов инспектирующая организация контролирует соблюдение ими установленных в рамках Союза требований в сфере обращения медицинских изделий, в том числе в части, касающейся профессионального уровня, беспристрастности, конфиденциальности и конфликта интересов;
подтвердить, что взаимоотношения инспектирующей организации с внешними экспертами оформлены в виде договора таким образом, чтобы обеспечить возможность проведения уполномоченным органом проверок и наблюдений за действиями внешних экспертов. Эти договоренности должны включать в себя обязательства внешних экспертов соблюдать требования инспектирующей организации, обеспечивающие контроль беспристрастности и конфиденциальности;
подтвердить, что инспектирующая организация обладает компетентностью, позволяющей оценивать деятельность внешних экспертов, а также подтвердить пригодность представляемых ими объективных свидетельств для принятия решений.
22. Задачей оценки процесса «Измерения, анализ и улучшения» является подтверждение того, что:
информация, касающаяся инспектирования производства, профессионального уровня инспекторов, решений о соблюдении установленных в рамках Союза требований в сфере обращения медицинских изделий и системы менеджмента качества инспектирующей организации, была собрана и проанализирована на предмет выявления фактических и потенциальных нарушений;
фактические и потенциальные нарушения изучены;
при необходимости приняты эффективные меры по исправлению, устранению и предотвращению нарушений.
В результате оценки процесса «Измерения, анализ и улучшения» следует подтвердить, что инспектирующей организации удалось:
разработать, задокументировать и внедрить процедуры измерения, анализа и улучшения, которые соответствуют требованиям к инспектирующим организациям;
установить и проанализировать источники данных о качестве, включая внутренние проверки, внешнюю оценку, а также апелляции, с целью выявления фактических и потенциальных нарушений;
изучить фактические и потенциальные нарушения;
принять эффективные меры по исправлению, устранению и предотвращению нарушений (при необходимости);
проверить эффективность таких мер (при наличии).
В рамках оценки процесса «Измерения, анализ и улучшения» необходимо:
подтвердить, что инспектирующая организация разработала и внедрила процедуру измерения, контроля, анализа и улучшения в отношении эффективности своей системы менеджмента качества, а также ее соответствия требованиям к инспектирующим организациям;
определить, как инспектирующая организация может отслеживать источники данных о качестве и процессах, с помощью которых можно было выявить фактические и потенциальные нарушения. Такими источниками данных о качестве являются, в том числе результаты внутренних и внешних проверок, привлечение внешних экспертов, а также апелляции. Подтвердить, что действия по измерению и контролю охватывают профессиональный уровень инспекторов, эффективность инспектирования производства, принятие решений о соблюдении требований по результатам инспектирования производства и соблюдение кодекса деловой этики в области медицинских изделий в процессах «Управление компетенциями сотрудников» и «Инспектирование производства и принятие решений по его результатам»;
определить, как проводятся расследования для установления причин выявленных нарушений, подтвердить, что при необходимости были приняты меры по исправлению, устранению или предотвращению нарушений, что эти меры были эффективны и не сказались отрицательно на проведении инспектирования производства и принятых решениях, а также установить, что меры по исправлению и предотвращению нарушений соответствуют рискам, которые несут в себе обнаруженные фактические или потенциальные нарушения;
определить, требовалось ли сообщить в уполномоченный орган о каких-либо корректирующих действиях инспектирующей организации, которые могут затрагивать полномочия инспектирующей организации;
подтвердить, что разработаны мероприятия по контролю, позволяющие выявлять случаи инспектирования производства, не соответствующие требованиям к инспектирующим организациям, и принятые решения по результатам такого инспектирования о соблюдении установленных в рамках Союза требований в сфере обращения медицинских изделий учитывают эту информацию. Подтвердить, что соответствующие решения были приняты, обоснованы и документально оформлены;
подтвердить, что в случае выявления нарушений требований при инспектировании производства были приняты меры, соответствующие рискам нарушений, и что в уполномоченный орган отправлено соответствующее уведомление;
подтвердить, что внутренние проверки проводятся в соответствии с документированными процедурами и позволяют удостовериться, что система менеджмента качества соответствует требованиям к инспектирующим организациям.
23. Задачей оценки процесса «Управление компетенциями сотрудников» является подтверждение того, что инспекторы, специалисты по заключительной оценке и внешние эксперты имеют профессиональный уровень, соответствующий требованиям к инспектирующим организациям.
В результате оценки процесса «Управление компетенциями сотрудников» следует подтвердить, что инспектирующей организации удалось:
определить необходимые компетенции сотрудников для эффективной работы в области инспектирования производства;
разработать, задокументировать и внедрить процедуры, необходимые для оценки и контроля профессионального уровня инспекторов, специалистов по заключительной оценке и внешних экспертов;
определить потребности в обучении и предоставить доступ к обучению инспекторам и специалистам по заключительной оценке;
поддерживать в актуальном состоянии записи, подтверждающие эффективную реализацию процесса «Управление компетенциями сотрудников»;
подтвердить эффективность методов управления компетенциями сотрудников.
В рамках оценки процесса «Управление компетенциями сотрудников» необходимо:
подтвердить, что инспектирующая организация определила необходимые компетенции сотрудников для эффективной работы в области инспектирования производства и что инспектирующая организация имеет доступ к техническим знаниям, необходимым для принятия решений о соблюдении производителем законодательства государств-членов в сфере обращения медицинских изделий;
подтвердить, что инспектирующая организация разработала, задокументировала и внедрила процедуры для первоначальной оценки профессионального уровня инспекторов, специалистов по заключительной оценке и внешних экспертов;
подтвердить, что инспектирующая организация регистрирует сведения об области профессиональной компетентности инспекторов, специалистов по заключительной оценке и внешних экспертов, которые согласно оценке их профессионального уровня могут выполнять обязанности, связанные с инспектированием производства. Подтвердить, что записи об области профессиональной компетентности поддерживаются в актуальном состоянии;
подтвердить, что инспектирующая организация определила потребность в обучении, предоставила доступ к такому обучению и проследила за тем, чтобы такое обучение прошли инспекторы и специалисты по заключительной оценке в соответствии с требованиями к инспектирующим организациям;
подтвердить, что инспектирующая организация разработала, задокументировала и внедрила процедуры контроля профессионального уровня и результатов работы сотрудников, участвующих в деятельности по инспектированию производства. Подтвердить, что в случае, если профессиональный уровень какого-либо сотрудника перестает соответствовать требованиям к инспектирующим организациям, его статус пересматривается;
подтвердить, что процесс оценки профессионального уровня, обучения, исполнения обязательств по конфиденциальности и беспристрастности, соблюдения кодекса деловой этики инспекторами, специалистами по заключительной оценке и внешними экспертами реализован и документально подтвержден.
24. Задачей оценки процесса «Инспектирование производства и принятие решений по его результатам» является подтверждение того, что инспектирующей организацией обеспечивается контроль за организацией работы с заявками об инспектировании производства. Этот процесс включает в себя рассмотрение заявки об инспектировании производства, определение программы инспектирования производства, планирование и проведение инспектирования производства и оформление отчета по его результатам.
В результате оценки процесса «Инспектирование производства и принятие решений по его результатам» следует подтвердить, что инспектирующей организации удалось:
разработать, задокументировать и внедрить процедуры, необходимые для контроля процесса «Инспектирование производства и принятие решений по его результатам»;
разработать и реализовать программу инспектирования для каждого конкретного случая инспектирования производства;
запланировать и провести инспектирование производства в соответствии с программой инспектирования производства, включая назначение компетентной группы инспекторов;
рассмотреть меры по устранению нарушений, принятые производителем по результатам инспектирования производства;
принять обоснованные решения по результатам инспектирования производства и анализа апелляций производителей;
проконтролировать корректирующие действия производителей в соответствии с принятыми решениями по результатам инспектирования производства;
провести эффективную работу по апелляциям;
поддерживать в актуальном состоянии записи, подтверждающие эффективность реализации процесса «Инспектирование производства и принятие решений по его результатам».
В рамках оценки процесса «Инспектирование производства и принятие решений по его результатам» необходимо:
подтвердить, что инспектирующая организация документально оформила процедуры по проведению инспектирования производства;
подтвердить, что инспектирующая организация может обеспечить инспектирование производства в соответствии с программой инспектирования производства, включающей в себя выбор критических поставщиков с учетом особенностей конкретного производителя медицинских изделий и определение продолжительности инспектирования производства согласно Требованиям к системе менеджмента качества;
подтвердить, что инспектирующая организация включает в группы инспектирования сотрудников с необходимыми компетенциями. Подтвердить, что инспектирующая организация распределила обязанности внутри инспекционной группы и проинформировала производителя медицинских изделий о составе инспекционной группы и программе инспектирования производства;
подтвердить, что инспектирующая организация проводила инспектирование производства согласно программе инспектирования производства и Требованиям к системе менеджмента качества и что были выполнены требования к оформлению отчетов по результатам инспектирования, включая оценку нарушений (при наличии);
подтвердить, что инспектирующая организация контролирует процесс принятия решений по результатам инспектирования производства, включая мониторинг корректирующих действий производителя, и при необходимости проводит внеплановое инспектирование производства;
подтвердить, что инспектирующая организация принимает обоснованные решения по результатам инспектирования производства;
подтвердить, что инспектирующая организация оценивает и принимает обоснованные решения по апелляциям и что апелляции учитываются в процессе «Измерения, анализ и улучшения»;
подтвердить, что инспектирующая организация поддерживает записи о действиях, касающихся инспектирования производства и принятия решений по его результатам, в актуальном состоянии.
25. Задачей оценки процесса «Управление информацией и документацией» является подтверждение того, что обеспечивается эффективный документооборот и обмен информацией между инспектирующей организацией, производителями медицинских изделий и уполномоченными органами.
В результате оценки процесса «Управление информацией и документацией» следует подтвердить, что инспектирующей организации удалось:
внедрить эффективный процесс контроля документооборота;
сделать доступной для уполномоченных органов и производителей медицинских изделий информацию о своей деятельности;
надлежащим образом организовать работу по заключению с производителями медицинских изделий договоров о проведении инспектирования производства;
принять необходимые меры для обеспечения конфиденциальности.
В рамках оценки процесса «Управление информацией и документацией» необходимо:
подтвердить, что были разработаны, задокументированы и внедрены процедуры контроля документооборота, предусмотренные системой менеджмента качества инспектирующей организации и требованиями к инспектирующим организациям;
подтвердить, что инспектирующая организация обеспечила доступ для производителей медицинских изделий к информации о своей деятельности по инспектированию производства, включая сведения о процессах инспектирования производства и принятия решения по его результатам, о порядке рассмотрения апелляций, стоимости и порядке оплаты инспектирования производства;
подтвердить, что инспектирующая организация надлежащим образом оформляет договорные отношения с производителями медицинских изделий с определением обязанностей каждой из сторон. Проверить, что по условиям договоров уполномоченный орган имеет право наблюдать за инспектированием производства, проводимым инспектирующей организацией, и оценивать его;
подтвердить, что инспектирующая организация внедрила систему контроля предоставления уполномоченному органу отчетов об инспектировании производства и иной запрашиваемой информации;
подтвердить, что инспектирующая организация разработала, задокументировала и внедрила процедуры, гарантирующие сохранение конфиденциальной информации.
IV. Отзыв полномочий или сокращение области уполномочивания
инспектирующей организации
26. Уполномоченный орган принимает решение об отзыве у инспектирующей организации полномочий на проведение инспектирования производства или об исключении подгрупп медицинских изделий из области ее уполномочивания (о сокращении области уполномочивания) в следующих случаях:
неустранение в установленный срок выявленных нарушений и (или) непредставление документов и (или) сведений по запросу;
предоставление уполномоченному органу недостоверных сведений.
Решение об отзыве полномочий у инспектирующей организации или о сокращении области уполномочивания следует оформлять приказом (распоряжением) уполномоченного органа.
27. Уполномоченному органу в течение 3 рабочих дней со дня принятия решения об отзыве полномочий или о сокращении области уполномочивания следует уведомить инспектирующую организацию о принятом решении любым способом, позволяющим подтвердить факт его получения. В случае если инспектирующая организация не согласна с решением уполномоченного органа, она вправе обжаловать его в суд по месту нахождения уполномоченного органа.
28. С даты получения уведомления об отзыве полномочий инспектирующей организации не следует:
а) принимать новые заявки о проведении инспектирования производства;
б) проводить инспектирование производства у производителей, заявки которых уже были приняты.
29. С даты получения уведомления о сокращении области уполномочивания инспектирующей организации не следует:
а) принимать новые заявки о проведении инспектирования производства подгрупп медицинских изделий, исключенных из области ее уполномочивания;
б) проводить инспектирование производства подгрупп медицинских изделий, исключенных из области ее уполномочивания, у производителей, заявки которых уже были приняты.
30. Исключение сведений из перечня инспектирующих организаций может осуществляться уполномоченным органом в следующих случаях:
а) подача заявления об исключении из перечня инспектирующих организаций, подписанного руководителем инспектирующей организации;
б) принятие уполномоченным органом решения об отзыве полномочий у инспектирующей организации.
31. Внесение соответствующих изменений в перечень инспектирующих организаций и размещение на официальном сайте в информационно-телекоммуникационной сети «Интернет» графика проведения проверок осуществляются уполномоченным органом в порядке и сроки, которые установлены Требованиями к системе менеджмента качества.