РУКОВОДСТВО ПО ГЛАЗНОЙ ХИРУРГИИ
Под редакцией
яроф. М. Л. КРАСНОВА и проф. В. С. БЕЛЯЕВА
Издание второе, переработанное и дополненное
эдшее м ИЗОТОВ, жной рохи-1ьшое (ракт, з;овые епри-гии и сет-льно-
астие е над Крас-Ката-рохи-таза»
Ц1ХСЯ ча — [ания :торы зкро-пол-зреи-
зут с
СНОВ IEB
Москва • «Медицина» 1988
ББК 56.7
Р85
УДК 617.7-089 (035)
А вторы:
М. Л. Краснов, проф.; В. С. Беляев, проф.;
Э. С. Аветисов, проф.; В. И. Барашков, доцент, канд. мед. наук;
В. Г. Белоглазов, докт. мед. наук; А. Ф. Бровкина, проф.;
В. В. Волков, проф.; Р. А. Гундорова, проф.;
М. В. Зайкова, проф.; М. М. Краснов, акад. АМН СССР;
Р. Л. Трояновский, канд. мед. наук; В. В. Шмелева, проф.
Руководство по глазной хирургии/М. Л. Краснов, В. С. Бе-Р85 ляев и др. Под ред. М. Л. Краснова, В. С. Беляева. — 2-е изд., перераб. и доп. — М.: Медицина, 1988. — 624 с.: ил.
ISBN 5-225-00054-1
Во втором издании руководства (первое вышло в 1976 г.) отражены результаты бурного развития микрохирургии и лазерной хирургии глауком, рефракционных разделов хирургии роговицы (кератофакия, кератотомия, клинопластика и др.). Описаны значительно усовершенствованные операции на склере, используемые при лечении прогрессирующей миопии (различные варианты склеропластики). Приведены новые данные по хирургии катаракт, лечению отслоек сетчатки, офтальмоонкологии, лечению травм и ожогов глаз, описаны новые приборы и инструменты для микрохирургии, новые методы исследования и основные современные способы лечения, применяемые в офтальмохирургии.
Руководство рассчитано на офтальмохирургов.
4120000000—238 039(01)-88
163-88
ББК 56.7
ISBN 5-225-00054—1
© Издательство «Медицина», Москва, 1976
© Издательство «Медицина», Москва, 1988, с изменениями
Предисловие ко второму изданию
Первое издание «Руководства по глазной хирургии», вышедшее в 1976 г., было с интересом встречено читателями. Во втором издании учтены критические замечания и пожелания рецензентов, обобщены новейшие достижения отечественной и зарубежной офтальмохирургии. Внедрение новых рефракционных микрохирургических вмешательств позволило реабилитировать большое число больных с миопией и афакией, после удаления катаракт, в связи с чем отечественная микрохирургия заняла передовые позиции в мировой офтальмохирургии. Несомненны и общепри-знаны успехи отечественных офтальмологов в микрохирургии и лазерной хирургии глауком, хирургии катаракт, отслойки сетчатки и др. Это нашло отражение в изменении последовательности изложения материала во втором издании руководства.
В подготовке второго издания руководства принимали участие ведущие офтальмологи нашей страны. Кроме того, в работе над руководством использованы материалы монографий М. М. Краснова «Микрохирургия глауком» (1980), В. В. Шмелевой «Катаракта» (1981), А. И. Горбаня и О. А. Джадиашвили «Микрохирургия глаза» (1983), Р. А. Гундоровой и соавт. «Травмы глаза» (1986) и др.
Руководство не может претендовать на охват всех имеющихся в настоящее время сведений по офтальмохирургии. Его задача — отразить основы глазной хирургии и дополнить наши знания по микрохирургии, которые постоянно обновляются. Редакторы приносят извинения, если какие-то данные по хирургии и микрохирургии глаза были упущены или отражены недостаточно полно. В библиографии представлены только основные работы преимущественно последнего времени.
Все замечания и пожелания авторы и редакторы примут с благодарностью
Заслуженный деятель науки РСФСР
проф. М. Л. КРАСНОВ проф. В. С. БЕЛЯЕВ
Предисловие к первому изданию
Целесообразность выпуска данного отечественного руководства по глазной хирургии обусловлена несколькими соображениями. Основным из них является то, что в связи с бурным развитием пауки и техники в офтальмологии начали применять новые аппараты и приборы, а также методы диагностики и лечения. В частности, разработан ряд операций нового типа (операции под микроскопом, с использованием квантовой оптики — лазеров и др.). Разработай и создан новый хирургический инструментарий. Открылась возможность получить более точные данные о патогенезе некоторых заболеваний глаза и, следовательно, патогенетически направленно осуществлять некоторые глазные операции.
Последнее отечественное руководство по глазной хирургии вышло 15 лет назад, оно давно разошлось и не содержит тех сведений, которые необходимы современному офтальмохирургу.
Именно эта идея — ознакомить практических глазных хирургов, число которых из года в год быстро увеличивается, с современными достижениями офтальмохирургии — и легла в основу предлагаемого руководства. Поскольку речь идет о руководстве, в нем наряду с современными описаны и старые, традиционные, методы, но лишь в той мере, в какой без них невозможно было обойтись. Интересующиеся этими методами могут ознакомиться с ними в различных ранее изданных отечественных и зарубежных руководствах.
Создание современного руководства по глазной хирургии едва ли под силу одному автору, даже весьма эрудированному в вопросах офтальмохирургии. В подготовке настоящего руководства приняли участие ведущие офтальмологи по принципу компетентности каждого из них в том или ипом разделе глазной хирургии, что, конечно, является основным преимуществом такого коллективного руководства. Вместе с тем участие нескольких авторов повлекло за собой отсутствие единого стиля изложения, но зато позволило каждому автору представить свой материал с известной степенью оригинальности и учетом личного опыта. Читатель обратит внимание и на то, что разные главы имеют разный объем и удельный вес. Это зависит не только от практической значимости того или иного раздела, но и от основной целевой установки руководства — уделить основное внимание тем разделам, в которых за последнее время произошли наиболее значительные изменения (глаукома, катаракта, операции на роговице, сосудистом тракте, при отслойке сетчатки).
Авторы надеются, что настоящее руководство поможет офтальмохирургам, а также офтальмологам, готовящимся к хирургической деятельности, приобрести необходимые знания. Все замечания по данной работе будут приняты с благодарностью.
Заслуженный деятель науки РСФСР
проф. М. Л. КРАСНОВ проф. В. С. БЕЛЯЕВ
Глава 1
Общие сведения о хирургии глаза
Операции на глазном яблоке и его придатках характеризуются рядом особенностей. Их выполняют па небольшом пространстве, применяя особую технику и специальные хирургические инструменты. Многие операции на глазном яблоке в настоящее время производят под микроскопом, поэтому соответствующим образом изменились применяемые с этой целью инструменты, оборудование, иглы и шовный материал. При любом вмешательстве хирург должен стремиться к тому, чтобы операционная травма была минимальной и по возможности сохранились анатомо-физиологические соотношения. В глазной хирургии это особенно важно в связи с небольшими размерами органа и его легкой ранимостью.
Организация работы операционного блока в глазной хирургии имеет свои особенности. В его состав входят операционная и вспомогательные помещения. Операционный блок необходимо организовать таким образом, чтобы исключить возможность занесения инфекции в операционную рану. Он должен быть изолирован от палат, кухни, столовой, туалетных комнат. Спокойная обстановка во время операции имеет большое значение для психологического состояния хирурга и больного.
Для того чтобы было легче поддерживать чистоту, стены операционной покрывают кафельной плиткой, дверные коробки, оконные рамы, арматуру водопровода и отопления окрашивают масляной краской. На стенах не должно быть выступов, а соединения их с потолком рекомендуется делать закругленными.
При выполнении операций под офтальмоскопическим контролем (при отслойке сетчатки и др.) необходимо временно затемнять помещение. Для этого на окнах, лучше между рамами, устанавливают автоматически опускающиеся шторы. Однако они затрудняют мытье окон, поэтому целесообразнее или закрашивать стекла вторых рам темной краской, или использовать специальные плотные щиты и ставни.
Операционный блок состоит не менее чем из трех — четырех смежных комнат: операционной, предоперационной, автоклавной и стерилизационной. При увеличении объема хирургических вмешательств и их специализации могут понадобиться дополнительные помещения, в частности комната для проведения фото- и лазеркоагуляции.
5
Вспомогательные помещения операционного блока включают комнаты для больного, доставленного на операцию, и персонала, участвующего в операции, помещения для хранения инструментов и перевязочного материала. Кроме того, при операционном блоке желательно иметь помещение для переодевания хирургов и медицинского персонала, а также душевую. Предоперационная предусмотрена во всех операционных блоках независимо от объема их работы. Она располагается перед входом в операционную и используется для обработки рук хирургов и операционных сестер, а в некоторых случаях и для стерилизации инструментов, однако это нежелательно.
В больших операционных блоках выделяют комнату для старшей операционной сестры, в которой находятся медикаменты, материальные ценности и документация. В современных операционных блоках следует иметь специальные комнаты для инструментария и приборов. Хранить инструменты в операционной и предоперационной, где обычно повышена влажность воздуха, не следует, поскольку это может привести к их порче. Инструменты раскладывают в стеклянных шкафах в разобранном виде, смазывают вазелиновым маслом и обогревают вмонтированными в шкафах электрическими лампочками. Для выполнения операции на современном уровне необходима сложная аппаратура, а также баллоны с кислородом, закисью азота, углекислотой, жидким азотом и др., которые используют для проведения наркоза и криохирургии. Аппаратура и баллоны с газами должны находиться в специальном помещении и доставляться в операционную по мере надобности.
Необходима автоклавная для стерилизации белья, перевязочного материала и инструментов. Она располагается рядом в операционной и соединяется с ней окном, через которое подают стерильные инструменты.
Асептические операции с вскрытием глазного яблока необходимо производить в специально оборудованной операционной. В связи с этим в операционных блоках должны быть предусмотрены две операционные.
Большинство глазных отделений располагается на базе многопрофильных больниц. В этих случаях используют общий операционный блок, в котором должно быть специальное оборудование, необходимое для выполнения глазных хирургических операций.
В глазной операционной необходимо постоянно поддерживать чистоту, придерживаясь правил, разработанных для общехирургических операционных и изложенных в руководствах по общей хирургии. Общее наблюдение за состоянием операционного блока возлагается на старшую операционную сестру.
В условиях поликлиники операционный блок обычно состоит из операционной и предоперационной. При небольшом объеме работы можно производить амбулаторные операции в перевязочной. Для того чтобы предотвратить бактериальное загрязнение, в операционные дни, когда предстоит выполнить большое
6
количество операций, сначала необходимо произвести все «чистые» операции, а после их окончания оперировать больных с воспалительными процессами.
В больших поликлиниках для осуществления офтальмохирургических вмешательств может быть использован и общий операционный блок. При оборудовании операционной необходимо подобрать удобный операционный стол и лампу искусственного освещения. Операции под микроскопом хирургу удобнее выполнять сидя, при этом руки его должны быть фиксированы на подлокотниках. С этой целью в настоящее время используют специальные столы. Достаточное освещение во время глазных операций создают с помощью светильников, применяемых в общей хирургии. Широко распространен светильник хирургический стационарный с шестью рефлекторами (с регулируемым освещением и аварийным питанием) — СРСЛ-6. Для обеспечения требующегося в некоторых случаях локального освещения применяют специальные осветители типа автомобильной фары, установленной на кронштейне, или инструменты с волоконной оптикой.
Хирургические инструменты и аппараты
В последние два десятилетия существенно изменились глазной инструментарий и основное оборудование операционной, в первую очередь операционный стол и кресла. В настоящее время используют операционные столы, изготовленные из нержавеющих материалов в виде каталки, которые устанавливают на стандартные гидравлические стопорные устройства. Хирург производит операцию, сидя в специальном кресле с подлокотниками. В нашей стране применяют различные модификации операционного стола типа журнального столика с подставкой для рук в виде подковы, укрепленной па кронштейне около головы больного (рис. 1, авт. гнид. № 17ЯО4(>). Высоту этого столика можно регулировать специальным пиитом, изменяя ее н зависимости от размеров и положения головы больного.
Операционные микроскопы за последние годы значительно усовершенствованы. Изменения внесены как в оптическую систему и механизм смены увеличения, так и в регулирование освещения. В настоящее время используют микроскопы, крепящиеся к потолку (рис. 2) или стене, но наибольшее распространение получили микроскопы с напольным штативом и ножным управлением (рис. 3) '. Эти приборы снабжены массивным моторизированным штативом с педалью управления, с помощью которой осуществляют перемещение оптических головок по вертикали и изменяют увеличение в микроскопе, предназначенном для хирурга (второй микроскоп — для ассистента). Подвеска микроскопа фиксируется стопором с помощью электромагнита.
Горбань А. И., Джалиашвили О. А. Микрохирургия глаза. Л.: Медицина, 1982.
7
Ml
1. Операционный стол Федорова—Бедилы для глазных микрохирургических вмешательств, операционный микроскоп модель 310 (фирма Karl Zeiss-Jena, ГДР).
Обе оптические головки свободно вращаются вокруг вертикально расположенного осветителя, снабженного мощной галогеновой лампой и щелевой диафрагмой. Откидывающаяся призматическая система осветителя позволяет направлять свет на операционное поле достаточно наклонно и с любой стороны. Достоинствами микроскопа являются не только хорошее освещение операционного поля и возможность получить оптический срез с прозрачных сред оперируемого глаза, но и удовлетворительная согласованность породного фокуса микроскопа при всех имеющихся увеличениях.
Болео сложное строение имеет глазной операционный микроскоп фирмы «Ор1он» (ФРГ), который обеспечивает все виды освещения (боковое, диффузное, щелевое, аксиальное и диафаноскопическое) , в том число с использованием волоконной оптики. В этой модели очень удобна также система плавной регулировки увеличения обоих микроскопов с помощью универсальной ножной педали, которая смонтирована па кресле хирурга. Представ-
8
2. Операционный микроскоп, крепящийся к потолку.
3. Операционный микроскоп (фирма «Opton», ФРГ)
i. Отечественный операционный микроскоп, крепящийся на голове хирурга.
ляют интерес увеличительные системы, крепящиеся на голове хирурга (рис. 4).
Любой глазной операции предшествуют подготовительные этапы, для выполнения которых не требуется операционный микроскоп (введение больного в наркоз, обработка операционного поля, век и т. д.), поэтому в помещении должно быть предусмотрено и обычное, потолочное освещение операционного поля. Многие глазные операционные оборудованы универсальными бестеневыми светильниками с семью рефлекторами. Фокус этой лампы находится на расстоянии примерно 1 м от ее нижней поверхности, и лампу нередко крепят к потолку с учетом именно этого расстояния и высоты универсального операционного стола, применяемого в общехирургической практике. При использовании низких операционных столов, приспособленных для выполнения микрохирургических операций сидя, бестеневой светильник нужно перефокусировать, иначе яркое световое пятно на операционном поле распадется на семь менее ярких бликов. При юстировке светильника его освобождают от колпака и шесть периферических плафонов максимально разводят в стороны, вращая центрирующие винты: расположенные более центрально до упора вывинчивают, а наружные — до упора ввертывают. Окончательную юстировку осуществляют с помощью этих же винтов, следя за формой светового пятна на экране, расположенном на более значительном расстоянии от лампы.
За последние два десятилетия значительно усовершенствованы инструменты, используемые в глазной хирургии. Имеются
10
стандартные наборы инструментов для операций при катаракте, глаукоме, отслойке сетчатки, удаления инородных тел из глазного яблока, амбулаторных вмешательств. Особое место занимает набор инструментов, который необходим для проведения хирургических вмешательств на глазном яблоке под микроскопом. Инструменты, входящие в этот набор, могут быть использованы и при операциях, осуществляемых обычным способом, при этом повышается качество операции и меньше травмируются ткани глаза.
Подробные сведения о всех инструментах, используемых при микрохирургических операциях, можно получить из каталогов, мы же остановимся лишь па основных группах инструментов. Любое оперативное вмешательство включает основные действия: рассечение, захват, перемещение и фиксация тканей с помо-щью разнообразных швов.
Инструменты для рассечения тканей — так называемые катарактальпые (ножи Грефе; рис. 5, а) и копьевидные (рис. 5,6), ножи, скарификаторы (склеротомы; рис. 5, в, г, д), ножи для расслоения роговицы и склеры, лезвиедержатели с кусочками бритвенных лезвий, трепаны и ножницы.
В настоящее время в качестве режущего инструмента чаще всего используют кусочки бритвенного лезвия, которые закрепляют в специальном инструменте — прямом или изогнутом лезвие-держателе. Предпочтение отдают лезвиям «Нева» или «Спутник», имеющим толщину 0,1 мм. Они изготовлены из хорошо закаленной стали, которая легко ломается в избранном направлении, а острие образующихся осколков достаточно острое и не отогнуто в бок (рис. 6).
Лезвия из нержавеющей стали могут быть использованы после выкраивания из них осколков необходимой формы и величины с помощью прочных ножниц с последующей их стерилизацией. Ножницы для глазной микрохирургии могут быть пружинные (рис. 7, а, б, в) для роговицы и склеры и шарнирные (рис. 7, г) для радужной оболочки.
Инструменты для захвата и удерживания тканей — пинцеты — необходимы для выполнения почти всех глазных операций. Основные варианты формы рабочих концов пинцетов представлены на рис. 8. Они могут быть гладкими — остроконечными (1), тупоконечными (2), либо несимметричными (3), иметь слабую поперечную накатку (анатомический пинцет — 4) или же зубцы. Пинцет, на одной бранше которого имеется один зубец, а на второй — два зубца, называется хирургическим. В этом пинцете зубцы прямоугольные (5) или же скошены под острым углом (6). Зубцов на пинцете может быть множество (7). Особое положение занимают пинцеты, концы которых представляют собой как бы две лопатки, обращенные вогнутыми поверхностями друг к другу (8). Эти пинцеты сочетают в себе атравматичность пинцетов без зубцов и прочность захвата, свойственную пинцетам с зубцами.
5./
Форма лезвий ножей основных Уипов. Объяснение в тексте.
Инструменты и материалы для соединения тканей — иглы, иглодержатели и шовный материал — за последние два десятилетия претерпели значительные изменения: они стали более миниатюрными в связи с тем, что глазные операции выполняют под микроскопом.
Для наложения раз
личных швов при микрохирургических операциях на глазу используют либо иглы с ушком (рис. 9), либо так называемые атравматические иглы с укрепленной на их конце нитью. Отечественной медицинской промышленностью налажено производство обоих вариантов глазных микроигл. Выпускают иглы с ушком длиной 5, 7,5 и 9 мм, а также атравматические иглы с наименьшим размером 4—5 мм при толщине синтетической нити 8:0, 9:0. Кроме того, применяют импортные микрохирургические иглы: атравматические с шелко-
6. Обламывание кусочка лезвия и способы его фиксации в изогнутом (а, б, д) и прямом (в, г, е) лезвиедержателе.
12
1.
Пружинные (а, б, в) и шарнирные (г) ножницы для глазных микрохирургических операций.
вой или синтетической нитью, с ушком, многократного пользования. Иглы фирм S&T (ФРГ) и «Et-hicon» (Англия) длиной 7 и 9 мм имеют нарезное ушко, плоское тело и обратную трехграпную заточку. Недостатком их является то, что форма иглы отклоняется от дугообразной, конечная часть у острия недостаточно изогнута, поэтому крутой выкол из ткани затруднителен. Однако металл, из которого изготовлены иглы, позволяет придать им необходимый изгиб. Особо тонкие иглы длиной 4 и 5 мм, выпускаемые этой фирмой, предназначены .для кератопластики.
Используют также микроиглы фирмы «И. Gohder» (ФРГ), которые имеют ромбическую заточку острия. Их изготовляют из прочного нержавеющего и немагнитного металла; эти иглы могут служить долго, в случае необходимости их можно подвергнуть повторным заточкам. У данных игл относительно большое нераз-резное ушко, сквозь которое легко проходит не только микро-
s. Различная форма рабочих концов пинцетов.
л — вид о торца; б — вид с боку. Объяснение в тексте.
13
9.
Игла для глазных микрохирургических операций.
шовный материал, но и шелк 3 :0, а также аналогичная нить иэ капрона. Длина их от 3 до 10 мм, но обычно используют иглы длиной 5, 7 и 9 мм.
Шовный материал может быть шелковым, синтетическим (лавсан, нейлон) и биологическим (кетгут, биошвы и др.). Используют нити различной толщины.
Средний диаметр,
№ нити мм
1:0 0,45
2:0 0,35
3:0 0,25
4:0 0,2
5:0 0,15
6:0 0,1
7:0 0,06
8:0 0,045
9:0 0,03
10:0 0,015
При операциях на глазном яблоке чаще применяют нити 2 : 0—3 : 0. Очень тонкий микрохирургический шелк изготавливают, соединяя нити в пучки по 3—7 волокон специальным биологическим клеем. Такой шелк 8:0—10:0 черного или синего цвета (шелк Барракара или верджинский шелк) имеется во многих клиниках. В настоящее время налажено
производство отечественного шелка для микрохирургии глаза. Предложен шовный материал из коконных нитей дубового шелкопряда [Гапурова Г. Н., 1982, 1985], обладающий высокой прочностью (номера нитей 7:0, 8:0, 9:0, 10 : 0).
От структуры шовного материала зависит, насколько легко нить проходит сквозь ткани. Идеально скользят в проколе цельные гладкие нити (моноволокно — как синтетическое, так и биологической природы). Мало отличается от них некрученый микрохирургический шелк. Значительно уступает этим материалам плетеный лавсан, еще менее удачен шовный материал из крученых питей. В то же время чем более неровную поверхность имеет нить, тем прочнее узел, поэтому в тех случаях, когда сближение тканей осуществляется со значительным натяжением (укорочение склеры при отслойке и др.), лучше использовать плетеный материал, например прочную лавсановую нить. Менее удобны для стягивания тканей крученые нити.
При завязывании узла, для того чтобы он не расходился, на первом этапе его обычно приходится вязать с двойным перехлестом концов (рис. 10, И), усложнение узла обязательно при ис-
14
13
УО. Простой узел.
11. Узел с двойным перехлестом.
12. Узел с тройным перехлестом.
13. Второй и третий этапы завязывания узлов. Объяснение в тексте.
-пользовании гладких материалов — кетгута, биошвов, микрохирургического шелка. Максимальным скольжением в узле обладает синтетическое моноволокно, поэтому при его использовании -на первом этапе рекомендуется завязывать узел даже не с двойным, а с тройным перехлестом (рис. 12).
Шелковую нить (2:0—6:0) достаточно завязать двухэтапным, но правильно выполненным узлом (рис. 13, а) —так называемым морским. Если узел завязывают неверно, вопреки есте-«ственному направлению петель (рис. 13,6), — так называемый женский, то он хуже затягивается и может развязаться. Более тонкий шелк, а также синтетические нити и биошвы лучше завязывать узлом в три этапа (рис. 13,в). При этом верхние этапы узлов можно вязать уже с одним, но правильно выполненным «морским» перехлестом. Такие швы следует накладывать автоматически после упорных тренировок на тренажере при освоении -приемов микрохирургии (см. рис. 20) [Гмыря А. И., 1985]. Более -плотному связыванию швов способствует просушивание области узла непосредственно перед стягиванием нити.
Для отрезания избытка нити используют различные инструменты в зависимости не столько от ее толщины и материала, сколько от того, на какую ткань наложен шов. Если шов наложен на роговицу или склеру и концы нити можно натянуть, то целесообразнее использовать осколок бритвенного лезвия. .JI. X. Шоттер, для того чтобы добиться равномерного подрезания узловых швов на роговице и склере, использует ножницы для «конъюнктивы, нижняя бранша которых утолщена соответственно ^размеру оставленных кончиков на 1—2 мм. Если же шов нало-
15
14. Иглодержатели для микрохирургических вмешательств на глазу. Объяснение в тексте [Шмелева В. В., 1981].
жеп па конъюнктиву или радужку, то следует применять пружинные либо шарнирные остроконечные ножницы. Толстые капроновые пити лучше отжигать термокаутером, для того чтобы образовались закрученные и менее травмирующие глаз концы. Острые концы даже тончайших капроновых нитей нельзя оставлять непогруженными в глубь фиброзной капсулы, так как они легко перфорируют покровные ткани, раздражают веки и глазное яблоко. Однако в связи с полной ареактивностью этих нитей при нахождении их в толще роговицы, склеры и радужки они незаменимы в тех случаях, когда удаление швов не планируется.
Иглодержатели применяют для точного проведения иглы сквозь ткани глаза. Вследствие того что глазные иглы имеют различные размер, кривизну и толщину, используют целый набор этих инструментов. Менее удобны иглодержатели, которые имеют короткие рукоятки при относительно длинных рабочих концах.
Иглодержатели для роговичных и склеральных игл изготовляют с большим соотношением размеров рукояток и рабочих концов (рис. 14). Для того чтобы лучше фиксировать иглы, часть иглодержателей имеют замки. В последние годы отечественная промышленность выпускает иглодержатели с плазменным напылением твердых металлов на браншах, удерживающих иглу, в связи с чем значительно увеличивается срок службы инструментов.
В глазной микрохирургии иглодержатель используют также дли завязывания лигатур. Захватить конец нити иглодержателем легче, если ассистент приподнимет нить остроконечным мик-ропипцотом. Однако нетрудно взять нить, лежащую на роговице, конъюнктиве или на хорошо очищенной склере, и иглодержателем, если концы его губок хорошо соприкасаются. Методика завязывания микрошвов показана на рис. 15.
Мы по ставили перед собой цель перечислить все микрохирургические инструменты, тем более что часть из них будет пока-
16
15. Проведение иглы и завязывание швов при глазных микрохирургических операциях (схема).
зана в- главах, посвященных микрохирургии роговицы, глауком и др. Однако необходимо назвать инструменты, используемые-для коагуляции мелких кровоточащих сосудов, которая имеет очень важное значение при операциях, производимых под микроскопом. С этой целью целесообразно применять современные микрокаутеры (рис. 16), питающиеся от батарей, находящихся в ручке инструмента; используют также миниатюрные аккумуляторы,, которые можно многократно подзаряжать.
Из специальных аппаратов, используемых в последние годы для микрохирургических операций на глазу, следует отметить факоэмульсификатор фирмы «Cavitron-Kelman» (США) (рис. 17) и приборы для криоэкстракции катаракты (рис. 19); криоэкстрактор, выпускаемый объединением «Красногвардеец»; отечественный аппарат «Криотерм» и модель конструкции Amoils (фирма «КШег», Англия). Методика факоэмульсификации катаракты показана на рис. 18.
Широко применяют также факофрагментатор УЗХ-Ф-04-01 Коссовского. Более подробные сведения об этих приборах будут приведены в соответствующих главах («Хирургия катаракты», «Операции на стекловидном теле»).
Аппарат ДК-3 — диатермокоагулятор — предназначен для коагуляции тканей при глазных операциях. В комплект прибора входят шариковые электроды диаметром 1,3 и 3 мм, пуговчатые электроды диаметром 1,2 и 2 мм, иглы с ограничителем — прямая и изогнутая, тонкая игла, электронож, электроды Сафара с шестью иглами — круглый с прямым стеблем и такой же с изогнутым стеблем. Индифферентный электрод прибинтовывают к верх-
2 Руководство по глазной хирургии
17
16. Микрокаутер с питанием от батареек.
17. Факоэмульсификатор фирмы «Cavitron-Kelman» (США).
18. Факоэмульсификация катаракты.
19. Приборы для криоэкстракции катаракты.
а — модель объединения «Крясногпардпец»; б — аппарат «Криотерм»; в — модель конструкции ЛпюНя (фирма «Keeler», Англия).
ней трети предплечья больного, под электрод подкладывают сложенную вчетверо марлю, смоченную изотопическим раствором хлорида натрия. Для остановки кровотечения используют шариковый электрод диаметром 1,3 мм, которым после тщательного осушения раны коагулируют непосредственно кровоточащий сосуд.
Освоение микрохирургической техники
В последние годы в офтальмохирургии все шире используют приемы и методы микрохирургии. При выполнении операции под микроскопом значительно повышается точность движений инструментами. В первую очередь необходимо адаптироваться к изменению привычных пространственных соотношений. Дистанция рука — зона операции остается такой же, как при операциях, выполняемых обычным способом, дистанция глаз хирурга — зона операции резко изменяется. Требуется навык и для того, чтобы точно вносить инструмент в поле зрения. При зашивании ран на первых порах могут наблюдаться запутывание нитей, выскальзывание их из ушка иглы. Перед тем как перейти к применению операционного микроскопа, необходимо накопить опыт извлечения инородных тел роговицы и удаления швов под контролем щелевой лампы.
Следующая стадия подготовки — проведение иглы с нитью и завязывание узлов. Обычно шов фиксируют двойным узлом (первый из нескольких витков нити). При использовании нити из полимеров иногда целесообразно завязывать третий узел. Методика проведения иглы и завязывания узла в глазной микрохирургии представлена на рис. 15. Необходимо уделять большое
2*
19
.внимание натяжению шва. Слишком /лабо завязанный узел в ’Сущности теряет свое значение, слищХом тугой ведет к прорезыванию нити, некрозу ткани, деформации области разреза. В связи «с этим некоторые авторы рекомендуют завязывать не «морской», а простой узел, натяжение которого можно в какой-то степени регулировать. Узел, завязанный на роговице или лимбе, может вызывать раздражение глазет и неприятные ощущения, поэтому многие хирурги погружаю?/его в канал, сделанный иглой, или завязывают в глубине раны.
Относительно быстро приобретается навык работы с «одноконечными» инструментами, такими как режущее лезвие, игла, крючок, несколько труднее — с «двухконечными» инструментами — ножницами и пинцетами, при этом более выражен физиологический тремор. Очень помогает, особенно в первое время, дополнительная фиксация рук, необходимость в которой увеличивается в тех случаях, если операцию производят при сильном увеличении. В любом случае офтальмохирург обычно находит подходящую точку опоры для рук (например, касается головы больного). Можно также упереться кончиком мизинца в скуловую кость, в то время как остальные пальцы той же руки манипулируют инструментом. Это позволяет в случае необходимости слегка смещать голову больного в нужную сторону.
При осуществлении микрохирургических вмешательств довольно важное значение имеет положение тела хирурга. Операции под микроскопом следует производить сидя, поскольку общая нагрузка на мышцы и сосудистую систему при этом меньше, а устойчивость больше. Такое положение офтальмохирурга предполагает использование низких операционных столов в комбинации с сиденьем.
Обычно указывают на известные дополнительные трудности, возникающие в связи с необходимостью проводить фокусировку микроскопа и фиксировать голову больного. На наш взгляд, в практической работе это не представляет особой проблемы. Чаще приходится оперировать под 10-кратным увеличением, в этом • случае и глубина резкости, и поле зрения достаточно велики для полноты обзора.
Для отработки техники микрохирургических операций на глазу обучающийся должен работать на тренажере. Удачный вариант такого устройства описан А. И. Гмырей и соавт. (1985) (авт. свид.№ 930347).
Тренажер (рис. 20) состоит из фиксатора глаза, выполненного в виде бруска пенопласта с углублением для энуклеированного глаза человека или животного, и приспособления для создания физиологического или повышенного внутриглазного давления. Это приспособление представляет собой прижимное кольцо с четырьмя тягами, которые одним концом закреплены по периметру кольца, а другим — на бруске и снабжены устройством для регулировки степени натяжения, например посредством винтовой пары, и отсчетной шкалой. Глаз, зафиксированный в тренаже-
20
20.
Устройство (тренажер) для обучения микрооперациям на глазу по Гмыре.
1 — брусок пенопласта; 2— углубление для трупного глаза; 3 — глаз человека или животного; 4 — при--жимное кольцо; 5 — тяги; 6 — шкала для определения степени натяжения тяг.
5 6
ре, помещают под операционный микроскоп. Устройство трена-atepa позволяет создавать необходимое внутриглазное давление в энуклеированном глазу, контролируемое тонометром Маклакова, и тем самым создавать условия для выполнения учебной операции, приближающиеся к естественным. Для обучения технике проведения микроопераций на глазу используют прижимные кольца диаметром от 12 до 24 мм. Выбор кольца зависит от размеров использованного глаза, а также области глазного яблока, необходимой для отработки определенной методики оперативного вмешательства. На стороне прижимного кольца, обращенного к энуклеированному глазу, имеются шипики, обеспечивающие его лучшую иммобилизацию.
Стерилизация инструментов, шовного и перевязочного материала
Стерилизацию инструментов, шовного и перевязочного материала для глазных операций проводят по общим правилам, существующим в хирургии.
Стерилизация инструментов. В стерилизатор наливают воду и добавляют в нее двууглекислый натрий до получения 2% раствора. После того как раствор закипит, в стерилизатор опускают инструменты, уложенные на сетку, и кипятят в течение 20— 30 мин. Началом стерилизации считается момент вторичного закипания жидкости. Загрязненные патогенными микробами инструменты нужно кипятить в течение 45 мин. При подозрении на анаэробную инфекцию инструменты стерилизуют в течение 2 ч, применяя дробное кипячение. Режущие инструменты кипятят в течение 3 мин в воде без соды, а затем закладывают на 2—3 ч в 96% этиловый спирт. По окончании стерилизации сетку с инструментами вынимают из стерилизатора и, когда стечет вода, раскладывают их на инструментальном столике и покрывают стерильной простыней.
21
Использованные инструменты промывают щеткой под краном, затем в течение 5—10 мин кипятят, замки их смазывают вазелиновым маслом. После этого инструменты помещают в инструментальный шкаф. Готовые наборы инструментов можно стерилизовать в автоклаве при 1,5 атм влечение 40 мин.
В Московском научно-исследовательском институте глазных болезней им. Гельмгольца в течение многих лет практикуется стерилизация инструментов в растворе диоцида — бактерицидного препарата широкого спектра действия, хорошо растворяющегося в спирте и горячей воде. Раствор диоцида бесцветен, не имеет запаха, пенится при взбалтывании, обладает высокой бактерицидной активностью в отношении различных бактерий и спор, а также фунгистатической активностью в концентрации 1:8000—1:128 000. Активность раствора диоцида не изменяется при комнатной температуре в течение 5 мес.
Инструменты закладывают на 3 мин в раствор диоцида 1: 2000, в который добавляют антикоррозирующее средство НДА. Затем их прополаскивают в кипящей дистиллированной воде и раскладывают на инструментальном столике. Многочисленные исследования инструментов на стерильность, проведенные после обработки их раствором диоцида, показали, что такой метод стерилизации имеет преимущество перед другими способами, заключающиеся в значительной экономии времени. В офтальмологической практике применяют также метод стерилизации инструментов по Баккалу.
Стерилизация перевязочного материала и белья. Перевязочный материал и белье в офтальмохирургии стерилизуют так же, как и в общей хирургии. В качестве перевязочного материала используют марлю (салфетки) и вату, из которой делают тампоны и шарики. Бинты, обычно применяемые в офтальмологии для повязок, должны иметь 6—8 см в ширину и 3—5 м в длину. Из марли и ваты заготавливают кружки, которые удобно накладывать на глаз при перевязках.
Перевязочный материал, находящийся в операционной, должен быть подвергнут стерилизации независимо от того, накладывают его непосредственно на оперированный глаз или нет. Стерилизацию перевязочного материала производят в автоклаве водяным паром. В зависимости от конструкции автоклава стерилизацию осуществляют текущим паром при температуре 100 °C или одновременно используют повышенное давление (2 атм и более), в результате чего температура в автоклаве повышается до 140 °C. При стерилизации текущим паром не всегда удается добиться полной стерильности, так как температура 100 °C оказывается недостаточной для уничтожения спороносных бактерий (возбудители столбняка, сибирской язвы и др.).
Шовный материал и его стерилизация. В офтальмохирургии в качестве шовного материала применяют шелк, кетгут, нитки из искусственного волокна, биологические швы, конский и женский волос.
22
Шелк (крученый или плетеный). Существуют различные номера шелка в зависимости от его толщины. Отечественная промышленность выпускает шелк от 1 : 0 до 10:0. Наибольшее распространение получили следующие методы стерилизации шелка.
1. После промывания шелка в теплой воде с мылом и высушивания для обезжиривания его опускают в эфир на 12—24 ч. Затем шелк переносят в 70% спирт и выдерживают в нем в течение такого же времени, после чего его кипятят в растворе дихлорида ртути (сулема) 1 : 1000 в течение 10 мин. Хранят шелк в герметически закрытой банке с чистым спиртом.
2. Мотки шелка моют в мыльной воде, прополаскивают, высушивают в стерильном полотенце и наматывают на предметные стекла. Г.се это производят в стерильных условиях. Затем мотки шелка закладывают на сутки в эфир. После этого шелк перекладывают в стерильную эмалированную кастрюлю и держат там сутки. Далее его кипятят в растворе дихлорида ртути 1 : 1000 в течение 10—20 мин и оставляют в той же кастрюле, предварительно слив раствор. Через сутки делают посев на стерильность и помещают шелк в стерильный сосуд с 96% спиртом. Спирт меняют через каждые 10 дней и одновременно повторно осуществляют проверку шелка на стерильность.
Стерилизацию шелка в автоклаве производить не рекомендуют, так как под влиянием высокой температуры уменьшается его прочность. Микрохирургический шелк (8 : 0, 10 : 0) стерилизуют в абсолютном спирте в течение 3 сут.
Кетгут. Стерилизацию кетгута следует производить с особой тщательностью, так как не исключена возможность значительного бактериального загрязнения сухого кетгута. Стерилизовать кетгут можно различными способами.
1. Сухой способ стерилизации по методу Ситковского: кетгут закладывают в эфир на 12—24 ч, затем протирают тампоном, смоченным раствором дихлорида ртути, опускают в 2% водный раствор йодида калия на 30 с — 1 мин в зависимости от толщины нити. Смотанный в колечки кетгут подвешивают в стерильной стеклянной банке на расстоянии 60—70 мм от ее дна, на которое помещают сухой йод из расчета 40 г на 3-литровую банку и 66 г на 5-литровую. Кетгут стерилен через 3—5 сут.
2. Стерилизация в спиртовом растворе Люголя: нити кетгута заливают эфиром на 12—24 ч, затем помещают на 8—10 сут в раствор Люголя (96% спирт— 100 мл, йодид калия— 10 г, чистый йод—10 г). Через каждые 8—10 сут нити кетгута заливают свежим раствором Люголя. На 16-е сутки от начала стерилизации проводят бактериологический контроль, после чего кетгут готов к употреблению. Его хранят в растворе Люголя, который меняют через каждые 7—10 сут. Существуют и другие способы стерилизации кетгута.
Нити из искусственно го волокна. Ряд офтальмохирургов используют для наложения швов тонкие капроновые и нейлоновые супрамидные нити. Достоинствами этих швов являют
23
»
ся высокая прочность и хорошая переносимость тканями, недостатком — повышенная упругость нити, в связи с чем существует опасность развязывания узлов. Стерилизация нитей из искусственного волокна проста — кипячение в течение 20 мин.
Рекомендуются следующие методы стерилизации синтетических нитей, используемых в микрохирургии: 1) 3% раствор перекиси водорода (ГОСТ 177—71; температура 18°C, время выдержки образцов 80 мин); 2) дезоксон-1 — 0,1% раствор надуксусной кислоты (температура 18°С, время выдержки 30 мин); 3) 6% раствор перекиси водорода (ОСТ 42—2—2—77; температура 18 °C, время выдержки 6 ч); 4) дезоксон-3— 1 % раствор надуксусной кислоты, 2% раствор перекиси водорода (температура 18 °C, время выдержки 30 мин). Менее желательно, но допустимо проводить стерилизацию паром при давлении 1—2 атм (температура 120±2°С, время выдержки 45 мин).
Волос. Как шовный материал волос давно получил признание офтальмохирургов; его используют при пластических операциях на веках и коже, окружающей глаз. Стерилизация конского-волоса должна быть тщательной, так как в кишечнике лошади может сапрофитировать столбнячная палочка. Волос несколько-раз моют щеткой с зеленым мылом, после просушивания обезжиривают бензином или эфиром в течение 7 сут. Затем его кипятят в дистиллированной воде ежедневно в течение 5 дней: в первый день 40 мин, в последующие — по 20 мин. Хранят волос в сухом виде. Перед операцией его кипятят в течение 15 мин, что-придает ему мягкость и эластичность.
Биологические швы обладают большой прочностью: при среднем диаметре 0,1—0,2 мм выдерживают нагрузку от 600 до 2500 г. Основное достоинство биологических швов — их самопроизвольное рассасывание. Методика приготовления и стерилизации биологических швов следующая.
У только что убитой взрослой белой крысы или нутрии отрезают хвост у основания. Если это не удается сделать сразу после-забоя, то материал следует брать не позже чем через 24 ч. Хвост тщательно моют щеткой с мылом в теплой воде. Кожу надрезают вдоль хвоста и снимают, после чего одним пинцетом зажимают хвост посредине, а другим захватывают дистальный конец последнего позвонка, обламывают его и вместе с ним вытягивают из хвоста прикрепленные к позвонку сухожилия. Можно обломить еще три-четыре следующих позвонка и извлечь с ними сухожилия, пока они еще достаточно длинные.
Сухожилия погружают в сосуд со спиртом на 10—15 мин, где-их обезвоживают и фиксируют. После этого жесткой щеткой сухожилия разделяют на стекле на тонкие нити. Полученные нити отрезают от позвонков, скручивают в небольшие моточки по 10— 15 нитей в каждом и стерилизуют. С этой целью нити помещают на 24 ч в раствор, содержащий 70% спирт и 45% раствор суль-фацил-натрия, затем их переносят на 6 сут в 96% этиловый спирт, насыщенный метиленовым синим, и дважды меняют этот раствор.
24
после чего выдерживают нити 24 ч в абсолютном спирте. Далее моточки помещают в стерильные ампулы с абсолютным спиртом и запаивают их. По прохождении бактериологического контроля нити могут быть использованы для наложения швов во время операции. Срок хранения их неограничен [Пучковская Н. А., Никулина Н. Б., 1963; Никулина Н. Б., 1964]. Для стерилизации шовного материала предложен также гамма-лучевой метод.
Обработка рук хирурга
Главное в подготовке хирурга и операционной сестры к операции — это дезинфекция рук, которую с помощью всех существующих методов проводят в два этапа: сначала смывают бактерии и уничтожают их на поверхности кожи антисептиками, а затем осуществляют дубление кожи с целью закрыть поры, для того чтобы создать препятствие выходу бактерий во время операции. Рекомендуется мыть сначала ладонную, потом тыльную поверхность каждого пальца, а после этого межпальцевые промежутки и ногтевые ложа. Затем моют кисти и предплечья.
Мы не будем останавливаться на общеизвестных методах Фюр-брингера, Спасокукоцкого — Кочергина, Баккала, описанных в руководствах по глазной хирургии. Приведем лишь наиболее часто применяемые способы.
Обработка рук диоцидом. Сравнительные бактериологические исследования кожи рук, обработанной по Спасокукоцкому — Кочергину и раствором диоцида [Капысь С. И., 1959], показали, что первый метод обеспечивал стерильность в 81% случаев, второй — в 86%. Установлены следующие преимущества диоцида: он обладает высокой антисептической активностью; с его помощью достигается надежная и длительно сохраняющаяся стерильность, раствор не вызывает раздражения кожи рук, лишь в некоторых случаях отмечается сухость кожи; его можно использовать длительно — не менее 1 мес.
Вымыв руки, их погружают в раствор диоцида 1 : 5000 на 3 мин, затем осушают стерильной салфеткой и протирают спиртом. Неоднократные бактериологические исследования, проведенные после такой обработки, показали стерильность кожи рук хирурга и раствора. Метод апробирован на тысячах офтальмохирургических операций.
В Одесском научно-исследовательском институте глазных болезней и тканевой терапии им. Филатова обработку рук производят по методу Филатова — Баккала. Опыт применения этого метода показал, что обработка бриллиантовым зеленым приводит к гибели не только вегетативных форм бактерий, но и спор.
Простым методом, обеспечивающим стерильность, является обработка рук муравьиной кислотой и пергидролем. Раствор готовят следующим образом: в 10 л дистиллированной воды добавляют 69 г 100% раствора муравьиной кис
25
лоты и 171 г 30% раствора пергидроля. Обработку рук в тазу производят в течение 1 мин, перед этим их моют с мылом бея щеток.
Дезинфекцию рук, обработку операционного поля и инструментов можно проводить 0,5% водно-спиртовым раствором хлоргексидина.
Готовый раствор содержит 20% раствор хлоргексидина и 70% этиловый спирт в соотношении 1 :40 (на 1 л раствора 700 мл 70% спирта, 275 мл дистиллированной воды и 25 мл 20% раствора хлоргексидина).
После обычного гигиенического мытья рук теплой проточной водой с мылом (без щеток) руки ополаскивают до полного удаления мыла и насухо вытирают. Затем в течение 3 мин их моют салфеткой в тазике 0,5% спиртовым или 1% водным раствором хлоргексидина либо обтирают кожу рук дважды с интервалом в 2 мин салфеткой, смоченной 0,5% спиртовым раствором хлоргексидина. Для быстрой стерилизации инструмента его обрабатывают тем же раствором в течение 2 мин.
После повторной обработки рук указанными выше способами кожа их становится сухой и часто трескается. Для ее смягчения можно использовать спиртово-глицериновую смесь:
Rp.: Glycerini
Spiritus vini 90%
Liquor ammonii caustici aa 50,0 MDS. Наруяшое
Если в общей хирургии очень широко пользуются резиновыми перчатками, то в офтальмохирургии их применяют редко. Для того чтобы защитить операционную от пыли, перед тем как войти в нее, на ноги надевают бахилы (полотняные или из поливиниловой пленки).
Подготовка больного к операции
Перед операцией, особенно проводящейся со вскрытием глазного яблока, необходимо получить квалифицированное заключение о состоянии сердечно-сосудистой и дыхательной систем, а также желудочно-кишечного тракта больного. Повышенное артериальное давление должно быть по возможности нормализовано. Следует также выполнить электрокардиографическое исследование. Поскольку хронический бронхит и астма могут вызвать кровоизлияния и расхождение краев раны, естественно, в период подготовки к операции необходимо провести соответствующее лечение таких больных.
До операции очень важно добиться регулярной деятельности желудочно-кишечного тракта. Необходимо также ликвидировать имеющиеся воспалительные очаги, которые в послеоперационном периоде могут вызвать эндогенную (одонтогенная и отогенная) инфекцию глаза.
26
Аллергические состояния, а также факторы, которые могут привести к аллергизации организма больного, назначенного на Операцию, не должны выпадать из поля зрения офтальмохирурга. Особенно важно до операции установить переносимость больным новокаина, дикаина и наиболее часто применяемых антибиотиков.
В дооперационном периоде необходимо произвести анализы крови и мочи больного. Обязательно определяют время свертывания крови, количество тромбоцитов, а у пожилых людей — протромбиновый индекс, поскольку кровотечение, возникающее во время операции и связанное с гипокоагуляцией крови, а тем более гемофилией, весьма опасно. Кроме того, нужно знать состояние свертывающей системы крови для решения вопроса о срочном применении антикоагулянтов.
Кровь и мочу на сахар исследуют для исключения у больного диабета, который предрасполагает к инфицированию и кровоизлияниям. Благодаря хорошо налаженному контролю за содержанием сахара в крови больных сахарным диабетом в предоперационном и послеоперационном периодах, а также применению антибиотиков у них реже, чем раньше, возникают осложнения после экстракции катаракт и антиглаукоматозных операций.
Естественно, нельзя оперировать больных, у которых наблюдаются такие гнойные воспалительные процессы, как фурункулы и карбункулы. Их необходимо ликвидировать до операции.
Психогенные реакции больного, усиливающиеся к моменту операции, создают неблагоприятный фон для хирургического вмешательства и увеличивают опасность развития осложнений. Большинство оперируемых больных испытывают беспокойство и страх, в связи с чем у них возникают такие вегетативные реакции, как повышение артериального и внутриглазного давления, учащение пульса, а иногда и повышение температуры тела. Особенно выражены эти реакции у больных глаукомой, у которых вообще отмечается повышенная возбудимость. В связи с этим в офтальмохирургии начали применять методы премедикации, уже оправдавшие себя в общей хирургии.
Основными задачами премедикации являются улучшение общего состояния больного перед операцией, достижение выраженного аналгезирующего эффекта, седативное влияние на нервную систему, снижение артериального и внутриглазного давления. С этой целью применяют нейроплегические средства, вызывающие состояние гибернации (от франц, hibernation — зимняя спячка), характеризующаяся функциональной перестройкой в организме человека, напоминающей таковую при зимней спячке животных и ограждающую больного от разнообразных вредных влияний, включая операционную травму. Гибернация может быть достигнута при введении симпатолитических, парасимпатолитических, антигистаминных и седативных препаратов. Комбинация этих препаратов получила название литического коктейля. Изменяя дозировки препаратов, можно получить как глубокую гибернацию,
27
при которой угнетаются все физиологические реакции, так и поверхностную. Первая не получила распространения в хирургии,, вторую применяют в сочетании с местной анестезией и наркозом.
В общей хирургии распространена следующая методика потенцированного обезболивания, которую можно применять и в офтальмохирургии. Накануне операции на ночь больные получают снотворное — 0,1 г фенобарбитала или 0,1 г барбамила (эти препараты могут быть заменены ноксироном), 0,025 г аминазина и 0,025 г этизина, что обеспечивает спокойный, ровный сон. За 30—45 мин до операции внутримышечно вводят смесь следующего состава: 2 мл 2,5% раствора аминазина, 2 мл 2,5% раствора дипразина и 2 мл 5% раствора лидола или 1—1,5 мл 2% раствора промедола. При внутривенном вливании комбинацию препаратов разводят в 20 мл 5% раствора глюкозы и вводят медленно, в течение 15—18 мин. В связи с тем что артериальное давление под действием литических коктейлей снижается, нужно соблюдать осторожность при введении их больным с нормальным артериальным давлением, а при гипотонии, когда не исключена возможность коллапса, их лучше не применять.
Для премедикации широко используют такие препараты, как промедол, димедрол и дипразин. Промедол является основным компонентом премедикации. Обычно его вводят подкожно в количестве 0,02—0,03 г (1—1,5 мл 2% раствора). Промедол усиливает аналгезию. Он имеет преимущества по сравнению с такими анальгетиками, как морфин и пантопон, так как он слабо действует на дыхательный и рвотный центры. Больные хорошо переносят препарат, лишь в редких случаях отмечается тошнота или головокружение. Промедол противопоказан при угнетении дыхания.
Димедрол наряду с противогистаминным действием оказывает также седативное, тормозит проведение нервного возбуждения в вегетативных ганглиях, обладает противовоспалительными свойствами. Препарат назначают внутрь по 0,03—0,05 г, внутримышечно вводят в виде 1 % раствора, внутривенно — капельным способом — 0,02—0,05 г димедрола в 75—100 мл изотонического раствора хлорида натрия.
Дипразин (пипольфен) — препарат с высокой противогиста-минной активностью. Он оказывает выраженное седативное действие, усиливает эффективность местноанестезирующих и анал-гезирующих препаратов. Препарат назначают внутрь (после еды), а также вводят внутримышечно и внутривенно. В хирургической практике его используют как один из основных компонентов литических коктейлей. Средняя однократная доза дипразина для взрослых 0,025 г. Внутримышечно вводят 1—2 мл 2,5% раствора. Препарат нужно применять с осторожностью у лиц с нарушением функции печени и почек. Для премедикации целесообразно использовать комбинацию промедола с одним из противогиста-минных препаратов.
В последние годы начали проводить клинические и экспериментальные исследования по применению гиперосмотических
28
препаратов для предоперационной подготовки больных с катарактой и глаукомой. В ряде отечественных и зарубежных клиник для снижения внутриглазного давления назначают такие препараты, как мочевина, маннитол, глицерол. Благоприятные условия проведения операции со вскрытием глазного яблока при сниженном внутриглазном давлении очевидны: во-первых, уменьшается опасность возникновения кровоизлияния и отслойки сосудистой оболочки при очень большом перепаде внутриглазного давления, наблюдающемся при антиглаукоматозных операциях; во-вторых,, можно производить экстракцию катаракты без выпадения стекловидного тела, если внутриглазное давление у больного на операционном столе будет равно 12—14 мм рт. ст.
При применении раствора мочевины возникают осложнения,, вследствие чего значительно снизился интерес к этому препарату. Ранними осложнениями являются тошнота, рвота, головная-боль, сухость во рту, боли по ходу вен, к поздним относятся ограниченные флебиты, тромбоз поверхностных и глубоких вен, гипертермия, дезориентация и даже острый отек легких. В связи с этим был определен довольно широкий круг противопоказаний к назначению мочевины.
Относительно недавно [Weiss Т., 1962] в офтальмологии начали применять еще одно гипотензивное средство осмотического действия — маннитол, представляющий собой шестиатомный, спирт (гексит). Препарат вводят внутривенно медленно в виде 20% раствора в дозе 2—2,5 мл на 1 кг массы тела. Максимальное снижение внутриглазного давления отмечается через 45— 120 мин после введения препарата. Однако и при введении ман-нитола развиваются серьезные осложнения. Наблюдались случаи возникновения шока с одышкой и цианозом, a S. Goldberg (1963) описал молниеносную декомпенсацию сердечной деятельности при быстром введении препарата. G. Bietti и Т. Bucei (1962) провели исследования, в которых была установлена высокая эффективность и безвредность приема внутрь глицерола из-расчета 1—1,5 г па 1 кг массы тела. Л. А. Кацнельсоном и Н. С. Ярцевой (1965), а затем И. Г. Ершковичем (1965) была показана целесообразность применения 50% раствора глицерина у больных с глаукомой и катарактой в предоперационном периоде. Значительное снижение внутриглазного давления наступало через 45 мин после введения препарата, при этом не отмечалось осложнений, которые развивались при введении мочевины и ман-нитола. Однако в последующих наблюдениях был выявлен ряд недостатков глицерина — вкусовая непереносимость и др. В связи, с этим Л. А. Кацнельсон и соавт. предложили глицероаскорбат, состоящий из смеси глицерина (1,5 г на 1 кг массы тела), аскорбиновой кислоты (0,1 г на 1 кг массы тела) и фруктового сиропа-(20—25 г). Максимальное снижение внутриглазного давления отмечалось примерно через 3 ч после введения глицероаскорбата,. т. е. значительно позже, чем после введения глицерола; следовательно, гипотензивное действие последнего может быть пролон
2»
гировано с помощью аскорбиновой кислоты. Неприятные вкусовые ощущения значительно уменьшались вследствие добавления фруктового сиропа и при охлаждении раствора глицероаскорбата опущенным в стакан кусочком льда. Чрезвычайно редко возникали осложнения — скоропроходящая тошнота или чувство тяжести в области желудка.
Выраженный гипотензивный эффект дает ацетазоламид, который назначают перед оперативным вмешательством внутрь, внутримышечно или внутривенно.
В механизме действия гиперосмотических средств основное значение имеет повышение осмотического давления крови, что вызывает дегидратацию тканей глаза, а также облегчает отток водянистой влаги.
Все изложенное выше свидетельствует о необходимости включения гиперосмотических препаратов в комплекс средств, используемых для подготовки больных к антиглаукоматозным операциям, экстракции катаракты и другим вмешательствам со вскрытием глазного яблока.
В последнее время появились сообщения о капельном внутривенном введении комбинации 30% раствора глицерина и 20% раствора аскорбиновой кислоты. Вливание производят со скоро--стью 80—100 капель в минуту. Обычно при этом у больных не возникают неприятные ощущения и в то же время быстро достигается высокая концентрация глицерина в крови, обусловливающая снижение внутриглазного давления на 20 мм рт. ст. и более при глаукоме и на 6—8 мм рт. ст. при нормальном давлении. Добавление аскорбиновой кислоты считают обязательным, так как чистый глицерин при внутривенном введении вызывает кровоизлияние в почечных канальцах, тогда как при одновременном введении аскорбиновой кислоты этого не происходит. При экстракции катаракты с помощью описанной методики можно быстро создать гипотонию глаза, что позволяет свободно маневрировать с хрусталиком, не боясь выпадения стекловидного тела.
Анестезия1
Местная анестезия является методом выбора при проведении микрохирургических операций на глазу. Однако существует ряд ситуаций, когда необходимо использовать общую анестезию или по крайней мере некоторые из ее компонентов. В первую очередь это относится к операциям, выполняемым детям, а также взрослым, у которых местная анестезия либо нежелательна, либо неэффективна.
При подготовке больных к любой плановой глазной операции требуется расширенное заключение терапевта о возможности
1 Рекомендации в отношении общей анестезии даны на основании опыта заведующего анестезиологической службой Всесоюзного научно-исследовательского института глазных болезней Министерства здравоохранения СССР С. С. Хадышьяна.
30
проведения оперативного вмешательства с приложением анализа крови, мочи, ЭКГ и т. д.
Актуальным является вопрос рациональной премедикации, особенно при проведении местной анестезии. В настоящее время оптимальным способом премедикации как при местной, так в при общей анестезии следует считать сочетание нейролептика (дроперидол 2,5—5 мг), наркотического анальгетика (промедол 10 мг) и транквилизатора (седуксен 5—10 мг). Необходим индивидуальный подход к премедикации, особенно у пожилых больных. Необходимо учесть, что чем старше больной, тем должно быть меньше количество вводимых препаратов. М-холинолитики в премедикацию не включают. Препараты вводят внутримышечно на 30—45 мин до операции. В операционную больных доставляют на каталке.
Из существующих методов общего обезболивания при выполг-нении операций на глазах у взрослых больных предпочтение отдают сбалансированной анестезии препаратами, используемыми для нейролептаналгезии (дроперидол и фентанил), в сочетании с седуксеном. Возможность проведения операции в условиях самостоятельного дыхания, при стабильных показателях гемодинамики и умеренном снижении внутриглазного давления, а также отсутствие рвоты и возбуждения в послеоперационном периоде обусловливают целесообразность применения этого метода обезболивания в глазной клинике.
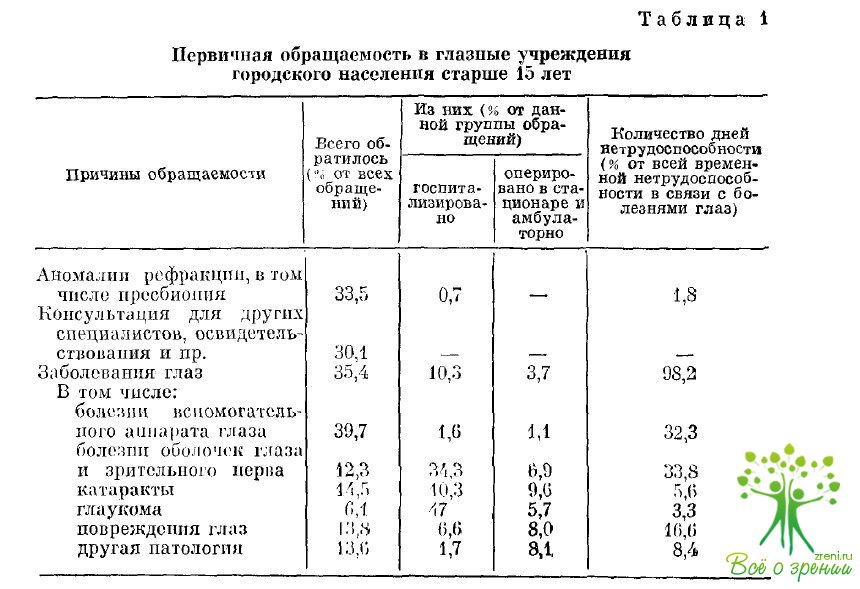
Методика сбалансированногой анестезии заключается в следующем. Индукцию осуществляют последовательным медленным внутривенным введением дроперидола по 0,08—0,15 мг/кг (2— 4 мл), фентанила по 0,0008—0,0016 мг/кг (1—2 мл) и седуксен» по 0,08—0,15 мг/кг (1—2 мл). При расчете доз вводимых препаратов необходимо учитывать как массу тела, так и возраст больных (табл. 1).
Таблица 1
Ориентировочные дозы дроперидола, фентанила и седуксена, применяемые для индукции в различных возрастных группах
Возраст, годы Дроперидол, мг/кг Фентанил, МГ/КГ Седуксен, мг/кг
21—40 0,15 0,0016 0,15
41—60 о,и 0,0012 0,1
61 и старше 0,08 0,0008 0,08
Анестезию поддерживают путем дробного внутривенного введения фентанила и седуксена. Повторно препараты вводят строго индивидуально, ориентируясь на эффект обезболивания: седуксен каждые 15—20 мин в дозе 5—10 мг, фентанил через 20— 25 мин в количестве 0,05—1 мг. Показанием к их повторному" введению служит появление клинических признаков ослабления
31
анестезии (учащение пульса, немотивированные движения и т. п.). При выполнении операции средней продолжительности •больным старше 60 лет ограничиваются однократным введением •фентанила, а поддерживают обезболивание седуксеном.
При проведении сбалансированной анестезии у больных отмечается амнезия на период от внутривенного введения препаратов до перевода в отделение. Наблюдение за больными в ближайшем послеоперационном периоде не требуется. Есть им разрешают через 4—6 ч после операции, вставать — в течение первых суток.
Осложнения, как правило, связаны с нарушением техники проведения обезболивания (быстрое введение препаратов, увеличение рекомендуемых доз и т. п.). Наиболее часто у больных пожилого и старческого возраста отмечается кратковременная задержка дыхания, связанная с релаксацией мышц диафрагмы рта и западением нижней челюсти. Иногда у больных с сопутствующей артериальной гипертензией после введения препаратов отмечается значительное снижение артериального давления, не требующее коррекции.
Таким образом, показаниями к проведению сбалансированной анестезии препаратами, используемыми для нейролептаналгезии, и седуксеном при глазных операциях служат: 1) сопутствующие заболевания сердечно-сосудистой системы (гипертоническая болезнь, артериальная гипертензия, ишемическая болезнь сердца, нарушения ритма сердца и др.); 2) неврологические нарушения (остаточные явления перенесенного нарушения мозгового кровообращения, болезнь Паркинсона); 3) сопутствующие психические расстройства (эпилепсия, сенильные психозы); 4) психоэмоциональная неустойчивость; 5) затруднения при контакте с больными (тугоухость, глухонемота); 6) непереносимость местных анестетиков. К абсолютным показаниям к проведению сбалансированной анестезии следует отнести операции на глазном яблоке при высоком исходном внутриглазном давлении, а также хирургические вмешательства на единственном глазу, особенно в тех случаях, когда второй глаз погиб вследствие экспульсивного кровотечения.
Противопоказания к проведению сбалансированной анестезии обусловлены фармакологическим действием применяемых препаратов: бронхиальная астма (фентанил вызывает бронхоконстрик-щию) и миастения (седуксен является релаксантом центрального .действия).
Обезболивание в педиатрической практике. Большинство оперативных вмешательств на глазном яблоке у детей производят в условиях общей анестезии. Более того, при подозрении на глаукому у больных грудного возраста обследование также осуществляют под наркозом. При этом следует учесть, что различные анестетики по-разному влияют на внутриглазное давление. Целесообразно выполнять исследования, используя один и тот же способ обезболивания.
32
Как для проведения исследований, так и при выполнении операций в педиатрической практике наиболее часто применяют масочный, или назофарингеальный, фторотанозакисный наркоз либо кетаминовую анестезию. Указанные способы мало отличаются от используемых в педиатрической общехирургической практике. Следует подчеркнуть необходимость включения в премедикацию и-холинолитиков (атропин или метацин).
Из особенностей проведения обезболивания при операциях на глазах следует отметить возможность возникновения глазосердечного рефлекса в момент наложения уздечного шва на верхнюю прямую мышцу. Для купирования глазосердечного рефлекса бра-диаритмической формы, если он не исчез после прекращения тракции, необходимо внутривенно ввести адекватные дозы 0,1% раствора атропина, при тахиаритмической форме вводят обзидан внутривенно (!).
В педиатрической практике применяют также анестезию кетамином (кеталар, калипсол). Для премедикации вводят препараты, блокирующие м-холинореактивные структуры (0,1% раствор атропина или метацина по 0,1 мл па год жизни, но не более 1 мл), в сочетании с седуксеном (0,5% раствор по 0,1—0,2 мл на год жизни).
Кетамин вводят внутримышечно в среднем по 6—10 мг/кг. При расчете дозы следует учесть, что чем моложе ребенок, тем больше должно быть относительное количество вводимого препарата. Продолжительность действия разовой дозы 30—35 мин. Для поддержания анестезии кетамин вводят внутримышечно в дозе 3 мг/кг. В отличие от большинства известных наркотических препаратов кетамин не угнетает дыхания, в связи с чем возможно проведение анестезии в условиях сохранившегося самостоятельного дыхания. Внутриглазное давление под действием кетамина несколько повышается. По мнению некоторых авторов, внутриглазное давление при кетаминовой анестезии более точно отражает его величину в состоянии бодрствования, чем при обычных способах наркоза. Пробуждение наступает через 30—40 мин после последнего введения препарата. В послеоперационном периоде отмечается выраженная аналгезия, сохраняющаяся в течение 10— 12 ч.
Местное обезболивание
Методы обезболивания подробно описаны в монографии М. Л. Краснова «Анестезия в офтальмологии» (1959). Остановимся на основных моментах, необходимых в практике офтальмохирурга. Следует обратить внимание практических врачей на комплекс внешних условий и той обстановки, которая окружает хирургического больного в палате, перевязочной, операционной.
Имеется в виду удобная постель, всегда спокойный тон всего медицинского персонала в разговорах с больным, недопустимость какой-либо спешки при осуществлении любой процедуры, внима-
Я Руководство по глазной хирургии
33
тельность и точность в выполнении врачебных назначений. Особенно следует указать на необходимость тихой, спокойной обстановки в самой операционной, где абсолютно недопустимы какие-либо разговоры персонала на посторонние темы, резкие звуки, где должны быть сведены к минимуму даже реплики хирурга в ходе операции помогающему ему персоналу. Все это потому, что глазные операции обычно проводятся под местной анестезией, когда сознание больного не только не выключено, а, наоборот, чрезвычайно обострено и напряжено. Пациент невольно реагирует не только на слова, но даже на интонацию голоса хирурга и окружающих.
Особое значение имеет спокойный и уверенный голос хирурга, когда он во время операции обращается к пациенту или персоналу. Совершенно недопустимы реплики, которые могут быть истолкованы больным как свидетельство какой-то неудачи или осложнения в процессе операции. Это требует, конечно, от хирурга и персонала известной выдержки, дисциплины, но зато чрезвычайно благоприятно действует на психику больного.
Следует учитывать и такой момент, как необходимость предупреждения больного перед впусканием ему капель в глаза, в частности в предоперационной и на операционном столе. Эти инстилляции капель не должны быть неожиданностью для больного, иначе он отрицательно отреагирует на эту безобидную процедуру. Впускать капли надо осторожно, чтобы больной в каждом даже мелком акте подготовки к операции чувствовал внимание к себе. Точно такого же словесного предупреждения требует и первая инъекция (а иногда и последующие) анестезирующего раствора, когда пациент уже лежит на операционном столе, особенно если это укол через кожу.
Обработку операционного поля перед анестезией в различных лечебных учреждениях производят по-разному. В ряде клиник при обработке кожи предпочитают смазывать ее 2 раза 2,5—5% спиртовым раствором йода с глицерином в соотношении 2 : 1 (без предварительного обмывания кожи водой с мылом). При повышенной чувствительности больных к препаратам йода следует обрабатывать кожу, а также края век 1 % спиртовым раствором бриллиантового зеленого.
Обработку конъюнктивального мешка в ряде клиник производят путем инстилляции 3% раствора колларгола с последующим промыванием его изотоническим раствором хлорида натрия. В некоторых случаях тщательно промывают конъюнктивальный мешок стерильным изотоническим раствором хлорида натрия, после чего инстиллируют 30% раствор сульфацил-натрия.
Местная анестезия занимает доминирующее положение в офтальмохирургии, поскольку она безопасна, при ее применении почти никогда не возникают осложнения и отсутствуют смертельные исходы, связанные с обезболиванием. Относительными противопоказаниями к осуществлению местной анестезии служат некоторые психические заболевания, сильное нервное возбуждение,
34
а также ранний детский возраст. В глазной хирургии применяют инстилляционную, инфильтрационную и проводниковую (регионарная) местную анестезию.
Поверхностная, или инстилляционная, анестезия. Для поверхностной анестезии глазного яблока, как правило, применяют 0,5—1% раствор дикаина. Повторного закапывания его в глаз, чаще троекратного с небольшими (около 1 мин) интервалами, достаточно для того, чтобы добиться анестезии конъюнктивы и роговицы, позволяющей выполнять манипуляции, мало травмирующие ткань. В последнее время дикаин полностью вытеснил из офтальмологической практики раствор кокаина. Единственным противопоказанием к применению дикаина для инстил-ляционной анестезии является его непереносимость. В таких случаях дикаин можно заменить 0,5—1% раствором триме-каина.
Инфильтрационная анестезия. Различают прямую и непрямую инфильтрационную анестезию. В первом случае анестезирующим раствором пропитывают все ткани в той области, где будет проведена операция, во втором его вводят в один участок операционного поля, и оттуда раствор постепенно путем диффузии вследствие разницы осмотического давления переходит на остальные участки. При непрямом способе анестезия наступает медленнее, а обезболивающий эффект ее менее выраженный. Инфильтрационную анестезию кожи век и окружающих частей глаза необходимо проводить по правилам, применяемым в общей хирургии: снаружи внутрь послойно. Сначала тонкой иглой в кожу вводят небольшое количество анестезирующего раствора (при этом образуется поверхностный инфильтрат), затем из этой точки последовательно анестезируют глубжележащие слои. Тщательно и последовательно проведенная инфильтрация тканей анестезирующим раствором обеспечивает полную анестезию той области, где будет проведена операция. Анестезию конъюнктивы осуществляют путем прокола ее тонкой иглой, через которую вводят нужное количество анестезирующего раствора. При этом конъюнктива выбухает в виде подушки и происходит постепенное пропитывание глубжележащих слоев.
В офтальмологии, так же как и в общей хирургии, основным анестезирующим веществом является новокаин. Поскольку при глазных операциях для анестезии требуется небольшое количество раствора новокаина, не оказывающее токсического действия, как правило, применяют 2% раствор.
Новокаин хорошо растворяется в воде и не разлагается при повторном кипячении. Общетоксическое действие его в 7—10 раз слабее, чем кокаина. Отмечено бактерицидное действие новокаина, усиливающееся по мере повышения его концентрации.
Сначала под действием новокаина сосуды расширяются, а затем суживаются. Препарат не обладает кумулятивными свойствами, поэтому .его можно вводить повторно. Растворы новокаина готовят на 0,75% растворе хлорида натрия. Токсическое действие
3*
35
новокаина может проявиться только при введении больших количеств его и выражается в кратковременной сонливости, эйфории, а иногда и небольшой дезориентации. Фармакопейным комитетом разрешено вводить за каждый час операции 2 г новокаина (400 мл 0,5% раствора). Такие количества новокаина в офтальмохирургии не применяют, поэтому токсическое действие его при глазных операциях не отмечено.
В офтальмохирургии в качестве местноанестезирующего вещества может быть использован тримекаин. Он оказывает более сильное и продолжительное действие, чем новокаин, относительно малотоксичен и не раздражает ткани. В связи с тем что для местного обезболивания в офтальмологической практике требуются относительно небольшие количества анестетика, целесообразно использовать 1—2% водный раствор тримекаина. Для усиления и увеличения продолжительности анестезирующего действия раствора тримекаина к нему можно добавить раствор адреналина в соотношении 1 : 1000.
Регионарная, или проводниковая, анестезия. Для того чтобы правильно провести регионарную анестезию, необходимо знать зоны чувствительной иннервации (рис. 21). Мет»' ды выполнения регионарной анестезии при различных операциях описаны в соответствующих главах руководства.
При некоторых вмешательствах на глазном яблоке, таких как экстракция катаракты, антиглаукоматозные операции и др., не’ обходимо по возможности выключить действие круговой мышцы глаза, иннервируемой лицевым нервом, иначе нельзя избежать сжатия век во время операции, что может вызвать при вскрытом глазном яблоке тяжелые осложнения, в частности выпадение стекловидного тела при экстракции катаракты. С этой целью про’ водят акинезию — блокаду анестезирующим раствором ветвей лицевого нерва, идущих к круговой мышце глаза (рис. 22). Акинезию по Ван-Линту осуществляют следующим образом.
Первый вкол иглы делают в точке, образующейся при пересечении двух линий: горизонтальной, отстоящей на 0,5 см от нижнего края глазницы, и вертикальной, проведенной на 0,5 см снаружи от наружного края глазницы, и проводят иглу до кости. Вводят небольшое количество новокаина (примерно 0,5 мл 2% раствора), затем иглу несколько выдвигают и направляют горизонтально примерно на 0,5 см под костный край глазницы. По ходу движения иглы ткани постепенно инфильтрируются новокаином. Иглу проводят до внутренней трети нижнего века, при этом нужно все время ощущать иглой кость. Затем иглу выдвигают обратно до точки первого вкола и поворачивают (не вынимая) кверху; новокаин вводят по вертикальной линии, отстоящей на 0,5 см от наружного края глазницы. После этого иглу вынимают. Затем вводят новокаин подкожно вверх по направлению к наружному краю брови. Через 10—15 мин наступает акинезия. Общее количество введенного 2% раствора новокаина составляет 3 мл.
36
21.
Чувствительная иннервация око-леглазной области.
а — зоны кожной чувствительной иннервации; б — чувствительные нервы глаза; в — чувствительные нервы глаза и его придатков: 1 — глазничная часть V черепного нерва, 2— носоресничный; 3 — лобный, 4 — слезный, 5 — чувствительная ветвь ресничного узла, 6 — ресничный узел, 7 — длинный ресничный нерв, 8 — короткий ресничный, 9 — носовой, 10 — надглазничный, 11 — надблоковый, 12—подбпоковый, 13—нижнечелюстной. 14—тройничный узел, 15 — верхнечелюстной нерв, 16—скуловой нерв, — височная и лицевая ветви. 17—двигательная ветвь ресничного узла, 18 — нерв нижней косой мышцы, 19 — подглазничный нерв.
а
в
Менее распространен метод акинезии по Вийеру — Террьену. Иглу вкалывают у наружного конца брови, проводят в толще мышцы примерно до наружной части нижнего края глазницы. Второй вкол иглы делают в точке, где закончили первую инъекцию. Иглу проводят горизонтально к носу по нижнему краю глазницы. Вводят 4 мл 1 % раствора новокаина. Для усиления акинезии некоторые авторы предлагают производить третью инъекцию. На расстоянии 1—2 см от наружной спайки век делают инъекции новокаина по горизонтальной линии к уху и затем, не извлекая иглу полностью, проводят ее под углом 30° ниже места первой инъекции.
37
22.
Акинезия круговой мышцы.
а — по О’Брайну; б — по Ванл Линту; в — по Аткинсону; г — конъюнктивальным путем; i— 4 — порядок инъекций.
А. А. Колен (1947) отмети что при акинезии по Ван-Линту возникает отек век. Он предложил вводить новокаин по вертикальной линии на расстоянии 1,5 см от наружного края глазницы. Иглу проводят снизу вверх, вкол делают на 1,5 см ниже нижнего края глазницы, инъекции заканчивают на 1,5 см выше
38
23.
Акинезия круговой мышцы век по несколько видоизмененному методу Ван-Линта. 1 — лицевой нерв; 2 — место вкола иглы; пунктирная линия — направление продвижения иглы.
2
ее верхнего края. При этой технике акинезии блокируются все нервные веточки, подходящие к круговой мышце глаза (рис. 23).
М. Л. Краснов производит акинезию 2% раствором новокаина (\ мл) таким образом, чтобы создать инфильтрационный вал в виде подковы по наружному и пижиенаружному краю глазницы. Вводят 4 мл 2% раствора новокаина. Иглу 5-граммового шприца вкалывают па 1 см латеральное костного наружного края глазницы па уровне глазной щели и продвигают кверху кнутри по верхненаружному краю глазницы, затем иглу выдвигают назад, по не до конца и проводят книзу кнутри по нижненаружному краю глазницы. Во избежание отека иглу не следует опускать в толщу век. Методика проведения акинезии по Краснову представлена на рис. 24.
24.
Акинезия по Краснову.
39
25.
Регионарная, или проводниковая, анестезия. Стрелками указано направление продвижения иглы.
а — слезный и лобный нервы; б — подблоковый; в — подглазничный: г — подглазничный и скуловой; д — скуловой — лицевая ветвь; е — надглазничный; 1, 2 — порядок инъекций.
Целесообразность проведения акинезии перед многими глазными операциями не вызывает сомнения. Все предложенные методы достаточно надежны в отношении временного ослабления функции круговой мышцы, и после накопления небольшого опыта выполнения их может применять офтальмохирург.
При хирургических вмешательствах на глазном яблоке выполняют ретробульбарную анестезию. С этой целью используют 2% раствор новокаина. Иглу длиной 4—4,5 см вводят через кожу нижнего века в области наружного угла глаза непосредственно над нижним краем глазницы. Больного просят смотреть кверху и кнутри, для того чтобы отвести глазное яблоко от зоны введения иглы. Иглу проводят слегка кнутри и кверху по направлению к вершине глазницы на глубину около 4 см к области ресничного узла. После того как поршень шприца слегка отодвигают назад, для того чтобы убедиться в том, что конец иглы не проколол сосуд, медленно вводят 2—3 мл 2% раствора новокаина. Можно проводить ретробульбарную анестезию с вколом иглы не через кожу века, а через конъюнктиву в области наружной части нижнего свода. При непереносимости новокаина используют 2% раствор лидокаина в той же дозе. Вариант регионарной, или проводниковой, анестезии представлен на рис. 25.
Для обездвиживания глазного яблока обычно приходится накладывать шов на верхнюю прямую кишку; инъекции 2% раствора новокаина (0,5—1 мл) обычно вполне достаточно для проведения этой операции. Лучший вариант обезболивания, предло
40
женный Н. Н. Бохоном (1970), заключается в прикладывании ватного тампона на стеклянной палочке, смоченного 2—4% раствором дикаина, к поверхности глаза в месте будущего проведения уздечного шва.
Общий и местный гемостаз
Сильное кровотечение во время глазной операции наблюдается очень редко. Оно может возникнуть у больных, страдающих гемофилией, гипокоагуляцией крови или выраженным атеросклерозом. Если до операции у больного выявлено снижение активности свертывающей системы крови, то ему необходимо назначить препараты, повышающие коагуляционные свойства крови и уменьшающие проницаемость сосудистой стенки.
Кровотечения из мелких конъюнктивальных и эписклеральных сосудов, возникающие при проведении разрезов на глазном яблоке, обычно легко останавливаются после прижатия кровоточащего учпсткп пптпым или марлевым тампоном. С этой целью часто применяют кусочек губки из поролона, зажатый в пинцете.
Весьма эффективно при кровотечении локальное прижигание эписклеральных сосудов концом нагретого па спиртовой горелке пуговчатого зонда. С этой целью используют специально сконструированные электротермокаутеры. Достоинство их состоит в том, что при включении прибора петля из проволоки нагревается, при выключении прибора сразу же охлаждается.
С введением в практику термокаутеризации кровоточащих сосудов почти отпала необходимость в применении тампончиков с адреналином, которые не всегда давали желаемый гемостатический эффект и, кроме того, могли вызвать нежелательное у больных с гипертонической болезнью повышение артериального давления. Удобно останавливать поверхностное кровотечение гемостатической губкой.
Значительно труднее предупредить кровоизлияние в переднюю камеру, которое нередко наблюдается при иридэктомии и экстракции катаракты, особенно у лиц с атеросклеротическими изменениями сосудов, прорастанием сосудов в угол передней камеры и др. В таких случаях необходимо попытаться вывести кровь из передней камеры по шпателю, введенному в рану, одновременно производя очень легкий массаж роговицы ложечкой Давиэля. Для того чтобы удалить кровь из передней камеры, ее промывают изотоническим раствором хлорида натрия, а также удаляют сгустки пинцетом.
Если не удается вывести кровь из передней камеры во время операции, то необходимо принять меры к быстрому рассасыванию ее в послеоперационном периоде. Это не всегда возможно, и оставшаяся в передней камере кровь может привести к вторичной глаукоме. В некоторых случаях приходится даже прибегать к повторному хирургическому вмешательству — парацентезу, с тем чтобы выпустить кровь из передней камеры. Важно не
41
допустить частичного свертывания гифемы, поэтому на 2-й день после операции можно осторожно провести легкий массаж глазного яблока. Для быстрого рассасывания гифемы можно применять гиперосмотический раствор глицерола (в приведенной выше дозе) в течение 3—4 дней. При больших гифемах эффективно внутривенное капельное вливание раствора глицерина с аскорбиновой кислотой.
При гиперкоагуляции крови разжижению гифемы и ее рассасыванию могут способствовать субконъюнктивальные инъекции гепарина с фибринолизином, однако их не следует делать в раннем послеоперационном периоде, поскольку иногда возникает аллергическая реакция на фибринолизин.
Наиболее тяжелые последствия отмечаются при экспульсив-ном кровотечении, возникающем после экстракции катаракты или антпглаукоматозной операции. Для остановки кровотечения при операциях па веках, слезных органах, глазнице применяют те же методы, что и в общей хирургии: механические, химические и биологические. Механический метод заключается в закручивании сосуда, захваченного кровоостанавливающим пинцетом. В офтальмологической практике такой метод наиболее приемлем, так как кровотечение происходит из мелких сосудов, наложить лигатуры на которые технически сложно. Для остановки кровотечения из артериальных и венозных сосудов, лежащих в глубине, применяют временное тампонирование полоской марли.
Иногда приходится оставлять тампоны в полости на длительное время, тогда марлю следует смочить раствором антисептического вещества. Тампон оставляют на длительный срок только в самых крайних случаях, так как удаление его через продолжительное время нарушает процессы заживления раны.
Из биологических средств, используемых для остановки кровотечения в общей хирургии, заслуживают внимания производные сыворотки животных (гемостол, вивикол, тромбин), обладающие способностью останавливать кровотечение при местном применении путем повышения свертываемости крови. Кровоточащую поверхность орошают раствором тромбина и затем покрывают марлевыми салфетками, смоченными в этом растворе.
При кровотечении из костных сосудов (при риностомии и др.) показано механическое сдавление (например, легкий удар молоточком по долоту, установленному на кость в соответствующем месте).
Для уменьшения кровотечения при офтальмохирургических вмешательствах в настоящее время используют дицинон. Препарат нетоксичен, противопоказаний к его применению нет. Наиболее эффективно внутривенное введение 2 мл дицинона за 30 мин до операции. Действие дицинона связано с усилением формирования тромбопластина и значительным уменьшением проницаемости сосудистой стенки.
Повязки. Как правило, на оперированный глаз, а иногда и на оба глаза накладывают повязку. В настоящее время во многих
42
случаях вместо повязки применяют различные «заклеики» глаза. Они легче переносятся и легко снимаются. Кружок из марли накладывают на глаз и фиксируют к коже лба и щеки перекрестно наклеенными полосками липкого пластыря. Для прочности сверху можно провести один косой ход бинта.
Многие офтальмохирурги используют металлические сетки, которые накладывают поверх марлевого кружка. Они имеют вид чашечек овальной формы с отверстиями, которые фиксируют полосками липкого пластыря.
Разновидностью повязок являются занавески. Обычно их накладывают на глаз на 2—3-й день после операции (в тех случаях, когда не требуется длительная иммобилизация глаза), для того чтобы оградить его от воздействия света и пыли.
Ведение послеоперационного периода
Норным этапом послеоперационного периода является транс-пор тнропкп больного в палату. Естественно, после операций на исках и вспомогательных органах глаза, если их производили не под наркозом, больные могут передвигаться самостоятельно. В тех случаях, когда вскрывают глазное яблоко, хирург должен решать, может ли больной сам идти в палату или его надо туда доставить.
За последние десятилетия техника операций значительно усовершенствована. Она стала более щадящей, операционную рану, как правило, герметизируют швами. Изменились также и представления о процессе заживления раны. Многим больным после экстракции катаракты и антиглаукоматозных операций можно разрешить самим подняться (с помощью обслуживающего персонала) с операционного стола и дойти до палаты. Исключение составляют оперированные под наркозом с применением премедикации, а также больные, резко ослабленные после операции, чаще старческого возраста.
После операции со вскрытием глазного яблока больной должен лежать на спине в течение 1—2 дней. Первую перевязку чаще всего делают на следующий день после операции. Последующие перевязки в зависимости от состояния глаза и необходимости в инстилляциях производят либо по нескольку раз в день, либо через сутки. При спокойном течении послеоперационного периода на 2-й день больному разрешают сесть, а на 3-й — встать.
Необходимо наблюдать за мочеиспусканием больного. У лиц преклонного возраста возможна задержка мочеиспускания, иногда связанная с гипертрофией предстательной железы. В таких случаях рекомендуется изменить положение больного в кровати, иногда ему разрешают опустить ноги, поставить грелку на область мочевого пузыря. Если это не помогает, то производят катетеризацию.
Важное значение имеет создание спокойной обстановки в послеоперационной палате.
Глава 2
Операции на веках
Дефекты и деформации век чрезвычайно многообразны как по этиологии, так и по клиническим проявлениям. Различают следующие дефекты и деформации век.
А. По этиологии.
1. Дефекты и деформации после травмы: а) неогнестрельных ранений; б) огнестрельных ранений; в) ожогов (термические, химические, лучевые и др.); г) комбинированные поражения (механические, термические, химические, радиационные и другие факторы в различных сочетаниях).
2. Врожденные дефекты и деформации.
3. Дефекты и деформации после заболеваний (воспалительные процессы, новообразования и др.).
Б. По анатомо-топографическому признаку.
1. Несочетанные дефекты и деформации: а) частичный или полный выворот век (верхнего, нижнего, обоих); б) частичный или полный сквозной дефект века (верхнего, нижнего, обоих); в) неправильное положение век (эпикантус, птоз верхнего века, лагофтальм, смещение, деформация и т. д.); г) дефект или деформация брови.
2. Сочетанные дефекты век: а) деформация век и брови; б) деформация век и конъюнктивальной полости; в) дефект века и деформация конъюнктивальной полости; г) деформация век и лица; д) сквозной дефект век; е) деформация век и дефект стенки или стенок глазницы; ж) обширный дефект век, конъюнктивальной полости, глазницы и приглазничной области.
Особенности сложных и многообразных реконструктивных операций в области век (блефаропластика) наиболее полно отражены в классификации методов блефаропластики, предложенной Е. В. Королевой (1982) и дополненной нами (табл. 2). В ней учтена терминология военно-полевой и пластической хирургии.
Первичная блефаропластика — это пластическая операция, выполняемая в первые сутки после ранения во время первичной хирургической обработки ран или производимая одномоментно с удалением опухоли; первично-отсроченная — выполняемая через сутки после ранения или ожога, но до появления грануляций; вторичная ранняя — производимая после появления грануляций, но до начала рубцевания; вторичная поздняя — сделанная при наличии рубцов. Под несочетанной блефаропластикой подра-
44
Таблица 2
Классификация методов блефаропластики
По времени операции По глубине дефекта По площади По используемым тканям По основному методу
Первичная Первично-отсроченная Вторичная Поверхностная Сквозная Несочетанная Сочетанная Иекомбиниро-ванная Лоскутом кожи на ножке Свободная кожная пластика Острый стебель Круглый стебель Местными тканями Комбинированная: а) одномоментная (одноэтапная) б) последовательная (многоэтапная)
зумсвают пластику, производимую только в области века, под сочетанной — в области век и глазницы, в области век и смежных областей лица.
К некомбинированпой блефаропластике относят пластические операции, выполняемые с использованием только одного метода аутопластики. Под комбинированной подразумевают сочетание методов блефаропластики между собой и с пересадкой аллотрансплантатов. При одномоментной (одноэтапной) пластике несколько операций производят в один этап, при многоэтапной — на нескольких этапах пластики.
Существуют показания и противопоказания к применению каждого метода блефаропластики (табл. 3).
К противопоказаниям также относят общие острые и хронические заболевания, заболевания почек, тяжелые сердечно-сосудистые расстройства, злокачественные опухоли других органов, кариес зубов, гнойные процессы в области лица (дакриоцистит, синусит и др.). Операции па веках производят в любом возрасте.
Подготовка к реконструктивным операциям. От общего состояния организма во многом зависят исходы реконструктивных операций. В связи с этим перед операцией, помимо всестороннего обследования, проводят общеукрепляющее лечение. Для успешного и спокойного выполнения всех, нередко многочисленных, этапов операций необходимо установить с больным добрые доверительные отношения. В период подготовки больного к операции ликвидируют все очаги гнойной инфекции (дакриоцистит, синусит и др.).
Обезболивание. Выбор метода обезболивания зависит от возраста и состояния больного. Большинство операций на веках производят под местной инфильтрационной анестезией 0,5—1% раствором новокаина или тримекаина. У детей применяют наркоз.
Методы блефаропластики. Для устранения деформаций и дефектов век и глазничной области применяют все классические
45
Таблица 3
Показания и противопоказания к применению основных методов блефаропластики
Метод Показания Проп-вопоказания
Пластика местными тканями Ограниченные деформации, дефекты век и брови Значительные деформации и дефекты век в сочетании с дефектами стенок глазницы
Свободная кожная пластика Рубцовая деформация век различной величины и локализации. Умеренно выраженное смещение век. Частичный и полный выворот век Сквозной дефект век. Дефект век в сочетании с дефектом стенки глазницы
Пластика лоскутом кожи на ножке Полный рубцовый выворот век (ранее оперированный). Значительное смещение век. Выраженная рубцовая деформация век. Сквозной дефект век. Сочетанные дефекты век, конъюнктивальной полости и глазницы. Дефект век и брови. Дефект век и стенки глазницы Наличие рубцов кожи в области основания выкраиваемого лоскута
Острый микростебель, образованный в области кожного покрова век Рубцовый выворот, деформация или укорочение одного века. Незначительное смещение половины века. Частичный или полный дефект века. Дефект края века Наличие рубцов на противоположном веке. Дефект стенки глазницы
Острый стебель, образованный в области виска Обширный рубцовый выворот обоих век. Полный сквозной, дефект века. Полный дефект века и одной из стенок глазницы. Дефект брови Наличие глубоких кожных и подкожных рубцов в области виска
Круглый стебель Филатова Обширный дефект век и одной из стенок глазницы. Обширный дефект век и нескольких стенок глазницы. Обширный дефект век, нескольких стенок глазницы и приглазничной области. Обширный рубцовый выворот обоих век, ранее оперированный при наличии грубых рубцов окружающей кожи лица. Резко выраженное смещение век (ранее безрезультатно оперированное) Нет
46
методы пластики [Волков В. В., Шиляев В. Г., 1976; Зайкова м. В., 1980, и др.]. Благоприятные результаты реконструктивный операций в области век и глазницы во многом зависят не только от правильного планирования операций, но и от тщательного выполнения всех ее этапов.
Направление разрезов кожи по возможности должно соответствовать расположению естественных складок кожи век. Разрез необходимо делать перпендикулярно поверхности кожи хорошо отточенным скальпелем, а отсепаровку его краев — строго в одной плоскости. Ответственным моментом любой операции на веках является наложение кожных швов. С этой целью наиболее часто применяют шелк, кетгут, капрон, конский волос.
Большинство операций на веках производят с использованием бинокулярной лупы, тонкие манипуляции (операции в области ннутренпего угла и др.) —под операционным микроскопом. Микрохирургическая техника позволяет более экономно иссекать кожные и подкожные рубцы, более точно дозировать глубину p11.1pe.41, иы к рпи нить нутотрансплаптаты кожи и слизистой обо-точки в одном слое, более точно накладывать швы.
II |«14(<стно дополнительного пластического материала широко применяют аллотканн (твердая мозговая оболочка, хрящ, кость и др.), ксопоткани (хрящ) и пластмассы.
Блофаропластика местными тканями. Основой пластики местными тканями является перераспределение тканей, устранение деформации века с помощью неизмененной окружающей кожи.
Способы блефаропластики местными тканями многочисленны. Ю. К. Шимановский (1865) систематизировал местнопластические операции в зависимости от формы дефектов (в виде треугольника, четырехугольника, эллипса и круга). Наиболее распространенными способами местнопластических операций в области век являются боковое смещение кожи и пластика встречными треугольными лоскутами по Лимбергу.
Важный момент пластики местными тканями — нанесение точных линейных разрезов. Отсепаровка кожи увеличивает подвижность краев раны и лоскутов кожи, перемещаемых на дефект. Тонкая и подвижная кожа век позволяет выкраивать лоскуты различной формы и величины.
Элементы бокового смещения кожи («скользящий» лоскут) используют при многих местнопластических операциях. Например, наиболее распространенным способом устранения старческого выворота век является операция Кунта — Шимановского (рис. 26).
Основой пластики встречными треугольными лоскутами по Лимбергу является выкраивание двух лоскутов треугольной формы с помощью трех равных по длине разрезов, чаще всего под углом 30—90°, которые взаимно перемещают. Выкраивают симметричные и несимметричные, т. е. под разными углами (рис. 27), встречные треугольные лоскуты.
47
26. Некомбинированная пластика местными тканями по Кунту — Шимановскому (схема).
а — пдтсрмаргинальный разрез иссечение треугольных лоскутов из коньюнктивально-хрящевой пластинки нижнего века (1) и кожи на уровне наружной спайки век (2); б, в — наложение швов.
27. Устранение эпикантуса по Лимбергу (схема).
а — фигура встречных треугольных лоскутов кожи (1, 2) с углами 30° и 90°; б — те же лоскуты после перемещения (первый вариант); в — сочетание двух фигур (1,2) с углами 45° и 90° (второй вариант); г — те же лоскуты кожи после перемещения.
2
28. Комбинированная одномоментная сквозная пластика нижнего века лоскутом кожи на ножке, выкроенным в области виска, и аутотрансплантатом оболочки (схема).
а — к краям дефекта конъюнктивально-хрящевой пластинки подшит аутотрансплантат слизистой оболочки (1); б — в области виска выкроен лоскут кожи на ножке (2); в — лоскут кожи на ножке подшит к краям дефекта кожи века.
Б л е ф а р о п л а с т и к а лоскутом кожи на ножке. Ввиду многообразия дефектов век выкраивают лоскуты разной величины на различных участках кожи в области противоположного века, виска, лба, носогубной складки и щеки. Лоскут выкраивают, продолжая одну из сторон дефекта века. Периферическую часть лоскута перемещают на область дефекта века. Чаще всего применяют однослойный лоскут, состоящий из кожи и слоя подкожной жировой клетчатки. Длина лоскута не должна превышать утроенной ширины его ножки. Оптимальным углом поворота лоскута является угол менее 90°. При сквозных дефектах века и наличии глаза блефаропластику лоскутом кожи на ножке комбинируют с пересадкой аутотрансплантатов слизистой оболочки полости рта (рис. 28).
4 Руководство по глазной хирургии 49
"29. Образование круглого стебля (схема) [Зайкова М. В., 1980].
.а — кожно-жировая лента с треугольными лоскутами на концах; б — шелковые швы (В—В, и Г—Г,); в, г — перемещение треугольных лоскутов (А, Б); д, е — фиксирующая повязка.
Хороший косметический эффект дает пластика лоскутом кожи на скрытой ножке. В лоскут включают кожу и подкожную жировую клетчатку, а с ножки лоскута кожу срезают. Лоскут проводят по подкожному туннелю к дефекту века и подшивают к его краям. Приживление такого лоскута улучшается, если в него включают крупные сосуды (артериолизированный лоскут).
Блефаропластика круглым стеблем. Пластику круглым стеблем, которая предложена В. П. Филатовым (1917), производят в несколько этапов. Первый этап — образование круглого стебля (в области виска, шеи, груди, на внутренней поверхности плеча): выкраивают ленту кожи с подкожной жировой клетчаткой, например по способу Къяндского, с треугольными лоскутами кожи на концах основных разрезов (рис. 29). Края ленты сшивают — формируют стебель. Второй этап — пересадка одной ножки стебля в область дефекта. На последующих этапах круглым стеблем замещают обширные сочетанные дефекты век, глазницы и приглазничной области.
В височной области формируют микростебель по Колену, который, как правило, приживает даже при наличии глубоких рубцов, спаянных с краями дефекта стенки глазницы.
Остростебельчатая блефаропластика. Пластику острым стеблем относят к ускоренным методам замещения дефектов. Остростебельчатая блефаропластика позволяет заместить сложные дефекты век в два этапа. Различают два основных способа остростебельчатой блефаропластики: 1) острым микростеблем; 2) острым стеблем.
Блефаропластику острым микростеблем производят следующим образом. Первый этап: в области главным образом верхнего /30
30. Комбинированная сквозная пластика нижнего века острым микростебле» на двух ножках (схема).
а — выкраивание острого микростебля на двух ножках; б — подшивание средней части микростебля к краям дефекта кожи нижнего века, трансплантата слизистой оболочки (указано пунктиром) к краям дефекта конъюнктивы; в, г — иссечение ножек, микростсбля и введение в толщу века пластинки хряща.
века выкраивают лоскут кожи на одной ножке длиной 2,5—4,5 см, шириной 1—1,5 см и дополнительный лоскут треугольной формы (первый вариант). Большой устойчивостью обладает острый микростебель на двух ножках (второй вариант). В области верхнего' века выкраивают кожно-мышечную ленту длиной 4—4,5 см, шириной 1—1,5 см также с дополнительными треугольными лоскутами. Края ножки лоскута сшивают. Лоскут на одной круглой ножке или среднюю часть острого микростебля на двух ножках подшивают к краям дефекта века, т. е. производят поверхностную или сквозную блефаропластику (рис. 30). Второй этап — иссечение ножек микростебля — выполняют через 2—4 нед.
Блефаропластику острым стеблем также осуществляют в два этапа. Первый: в области виска выкраивают лоскут кожи на ножке длиной 10—12 см, шириной 3,5—4 см. Ножку лоскута у основания сшивают в трубочку, а сам лоскут подшивают к краям дефекта кожи века. При сквозном дефекте века к краю дефекта конъюнктивы подшивают аутотрансплантат слизистой оболочки. На втором этапе, который выполняют через 2—3 нед, иссекают ножку стебля.
Пересадка аутотр ансплантата кожи. Аутотрансплантаты целесообразно выкраивать на верхнем веке, задней поверхности ушной раковины и внутренней поверхности плеча. На
4*
51
блюдения показывают, что наилучшие результаты получают при применении расщепленных трансплантатов кожи. Расщепленный лоскут выкраивают в средних слоях кожи пилящими движения^ ми скальпеля, располагающегося параллельно ее поверхности. При обширных сочетанных ожогах век весьма перспективна дерматомная техника выкраивания трансплантатов кожи.
Пересадка аутотрансплантата слизистой оболочки. Трансплантаты, как правило, выкраивают в области губ и век. В лоскут не включают подслизистый слой. Свободную пересадку слизистой оболочки применяют для замещения дефекта конъюнктивы при рубцовом завороте века, трихиазе (операция Миллингена — Сапежко), а также для замещения дефекта внутренней пластинки века при сквозной блефаропластике.
Пересадка аутотрансплантата тканей. В качестве опорных тканей при операциях на веках применяют алло-хрящ, консервированный тем или иным методом (фиксированный в спирте, консервированный в 0,2 % водном растворе тимола, путем глубокого охлаждения и др.). Используют также реберный хрящ трупов взрослых доноров, эпифизарные хрящи длинных трубчатых костей мертворожденных плодов. Пластинки хряща вводят в толщу века, трансплантаты хряща различной величины — в дефект подкожных тканей или костной стенки глазницы.
В качестве аллопластического материала при блефаропластике применяют аллотрансплантаты твердой мозговой оболочки, взятые от трупов взрослых и мертворожденных плодов. Аллотрансплантаты выкраивают в виде полосок различной длины и ширины. Их помещают под края дефекта кожи, натягивают в продольном направлении и подшивают концы к подкожным тканям [Королева Е. В., 1982].
Перед операцией аллотрансплантаты обрабатывают антибиотиками, после операции больным назначают внутримышечные инъекции антибиотиков. Применение опорных аллотканей улучшает отдаленные исходы блефаропластики.
Ведение послеоперационного периода. Осложнения. Уход за пересаженными тканями начинают на операционном столе. Для более равномерного прилегания аутотрансплантатов кожи их растягивают длинными нитями швов, связанными в пучки и приклеенными лейкопластырем к окружающей коже. При пластике лоскутом кожи на ножке и острым микростеблем во время наложения повязки нужно следить за тем, чтобы шарики или салфетки не сместились и не сдавили ножку лоскута.
После свободной пересадки кожи накладывают давящую повязку. Первую перевязку производят на 4—5-й день после операции, последующие — через день. При пластике лоскутом кожи на ножке и круглым стеблем первую перевязку выполняют на следующий день, все последующие — через день. Если на следующий день лоскут на ножке имеет синеватый оттенок и подушкообразно выступает над окружающей кожей, то это указывает на развитие послеоперационной гематомы. В таких случаях снимают
один шов, вводят зонд между краями раны и удаляют скопившуюся под лоскутом кровь.
Краевой некроз характеризуется потемнением ткани лоскута по линии швов. Через несколько дней под корочкой обнаруживают ровную эпителизировавшуюся поверхность. Если весь лоскут имеет темный, почти черный цвет и не выступает над поверхностью века, то это свидетельствует о развитии полного некроза лоскута. В таких случаях лоскут постепенно превращается в сухой струп. При угрозе развития некроза лоскута больному назначают полный покой, местную гипотермию. Швы в области виска снимают на 10—12-й день после операции, в области век — на 6—7-й день.
Жизнеспособность круглого стебля зависит от правильного ухода за ним в послеоперационном периоде. В течение первой педели после образования стебля больному назначают постельный режим, он должен находиться в положении, обеспечивающем хороши в при ток кропи к стеблю и отток крови от него. Нельзя допуски и, иерокру'iiinniiini, провисания стебля и сдавления его попликой. Для того чтобы предотвратить развитие послеоперационных осложнений в порш,io 2 сут, на повязку около стебля укладывают пузырь со льдом (по 30—40 мин с перерывами на Г/г-2 ч).
При выраженном затруднении венозного оттока стебель набухает, становится синюшным и плотным, покрывается пузырями, наполненными серозной жидкостью. Пузыри рекомендуется вскрыть после обработки кожи спиртом. Посинение стебля указывает на развитие гематомы. Для того чтобы ее ликвидировать, со стебля снимают один—два шва и удаляют скопившуюся кровь.
При расхождении швов на стебле образуются мокнущие, вяло гранулирующие очаги. Во время перевязок их обрабатывают спиртом, назначают местное кварцевое облучение, стебель укла-зывают на сухие марлевые салфетки. Сдавление ножек стебля, в том числе на этапах пластики, приводит к полному некрозу всего стебля или его пересаженной части.
К снятию швов при пластике круглым стеблем подходят индивидуально: швы на стебле снимают на 8—12-й день, на донорской почве — на 12—16-й день в несколько приемов. В послеоперационном периоде при всех методах блефаропластики проводят общеукрепляющее лечение.
Операции при деформациях век
При деформациях век, которые чрезвычайно многообразны по величине и форме, в большинстве случаев выполняют местнопластические операции. При узкой глазной щели, например, ее расширяют, производят разрез в сторону виска с отсепаровкой краев раны. На края разреза конъюнктивы и кожи накладывают швы. При широкой глазной щели разрез ведут по интермаргинальному пространству. Вначале сшивают края раны конъюнк
53
тивы, затем — кожи, добиваясь тем самым укорочения глазной щели.
В основу операций, которые выполняют при спастическом завороте, положен принцип закрытия треугольных и эллиптических дефектов, описанных Ю. К. Шимановским (1865). Например, при спастическом завороте нижнего века иссекают полоску кожи овальной формы с волокнами круговой мышцы, края раны отсе-паровывают и рану зашивают. Для устранения спастического заворота века иногда достаточно провести разрез кожи с широкой отсепаровкой его краев и ввести под кожу века тонкую пластинку аллохряща.
При рубцовом и врожденном эпикантусе применяют пластику двумя треугольными лоскутами кожи, которые выкраивают под углом 30—90° и взаимно перемещают.
Для устранения паралитического лагофтальма производят наружную или внутреннюю кантопластику: под кожу верхнего века вводят аллотрансплантаты хряща. Рубцовый лагофтальм ликвидируют с помощью свободной кожной пластики.
Грубые рубцы окружающих тканей вызывают вторичную деформацию и смещение век. Для их устранения в ряде случаев достаточно иссечь рубец кожи век по возможности до неизмененных подкожных тканей, широко отсепаровать края раны и сместить на этот участок неизмененную кожу. Нередко при грубых рубцах часть века отекает вследствие блокады путей лимфооттока и увеличивается в размерах, в результате чего усиливается деформация века. В таких случаях после иссечения сквозного рубца века края раны конъюнктивы и кожи широко отсепаровы-вают. Каждый слой века сшивают в отдельности и в разных плоскостях, с тем чтобы линия швов конъюнктивы не совпадала со швами мышечного слоя и кожи. При этом широко используют резерв кожи век, всегда довольно подвижный. При соблюдении этих условий деформация и отек века после операции исчезают. Небольшое смещение наружной половины век или брови устраняют с помощью пластики встречными треугольными лоскутами по Лимбергу.
Деформация и смещение век нередко сопровождаются чрезмерным расширением или удлинением глазной щели. В таких случаях производят внутреннюю либо наружную кантопластику как самостоятельную операцию или в сочетании со свободной пересадкой кожи либо другим методом местной пластики. Если одновременно с деформацией и смещением имеется укорочение век, то осуществляют пластику лоскутом кожи на ножке, выкроенным в области век, виска, щеки или носогубной складки, а также пластику острым микростеблем. Для дополнительной фиксации в толщу век вводят аллотрансплантаты, например твердой мозговой оболочки, выкроенные в виде полосок. При очень сложных и обширных деформациях век применяют способы комбинированной блефаропластики. Резко выраженное смещение век в сочетании с грубыми деформирующими рубцами смежных отде
54
лов лица устраняют с помощью пластики круглым стеблем Филатова.
Операции при рубцовом вывороте век после травмы. Клинические проявления рубцового выворота век чрезвычайно разнообразны и во многом зависят от этиологии повреждения (огнестрельные и неогнестрельные ранения, ожоги, и т. д.). При выполнении операции учитывают локализацию рубцов и их глубину. Для устранения стягивающих рубцов используют пластику встречными треугольными лоскутами по Лимбергу, при этом срединный разрез проводят в направлении укорочения века. После встречного перемещения лоскутов устраняют выворот века. Полулунными лоскутами, вырезанными по Имре, в сочетании с треугольным лоскутом, сформированным по Бурову, устраняют выворот наружной или внутренней половины века. Лучшие результаты отмечаются при выполнении клиновидной резекции растянутого края вока в сочетании с пересадкой аллотрансплантатов в виде полосок.
Для устранения рубцового выворота широко используют кожу противоположного века, если она пе изменена. Лоскут кожи на пожко, выкроенный в области верхнего или нижнего века, подшивают к краям дефекта кожи и устраняют рубцовый выворот. Острый микростебель, сформированный в области верхнего века, более устойчив к нарушениям кровоснабжения воспринимающего ложа и не создает «раневой» дорожки на уровне соответствующего угла глазной щели.
Устранение рубцового выворота века после ожога представляет собой особую трудность: использовать пластику местными тканями невозможно, так как окружающая кожа рубцово изменена. В таких случаях производят свободную пересадку кожи, которую при расширенной глазной щели сочетают с кантопла-стикой, а при растяжении края века дополняют сквозной частичной клиновидной резекцией века. Для предупреждения рецидива выполняют комбинированную свободную кожную пластику: в толщу века вводят тонкую пластинку аллохряща или под кожу у края век — полоски аллотрансплантатов твердой мозговой оболочки (рис. 31).
При сочетанном рубцовом вывороте, образующемся после огнестрельного ранения, веко грубыми рубцами подтягивается к дефекту края или стенки глазницы. В таких случаях производят комбинированную пластику лоскутом кожи на ножке: грубые рубцы иссекают, веко перемещают в правильное положение, к краям дефекта подшивают лоскут кожи на ножке, выкраиваемый чаще всего в области виска. Между освеженными краями дефекта костной стенки глазницы помещают аллотрансплантат хряща или кости. Для предупреждения вторичной деформации век на уровне их наружной спайки применяют комбинированную пластику острым стеблем, выкроенным в области виска (рис. 32). При наличии рубцов в области виска производят пластику круглым стеблем.
55
31. Комбинированная свободная кожная пластика век с пересадкой аллотрансплантатов твердой мозговой оболочки при рубцовом вывороте век (схема).
а — разрез кожи у края века (1) с отсепаровкой; б — полоски твердой мозговой оболочки (.3) уложены под край дефекта век (2); в — к краям дефекта кожи век подшиты аутотрансплантаты кожи (4).
Операции при завороте века. Многочисленные операции, производимые при спастическом (старческом) завороте нижнего века, возникающем вследствие ослабления тургора кожи и тонуса главным образом нижней части круговой мышцы века, сводятся к выкраиванию полоски кожи и круговой мышцы с отсепаровкой окружающей кожи.
Для исправления спастического (старческого) заворота нижнего века умеренной с т е п е и и Л. X. Шот-тер (1960) разработал простой способ подкожной диатермокоагуляции. С этой целью используют глазной диатермокоагуляци-онный аппарат (сила тока 60—100 мА). Активным электродом служит специально изготовленная игла длиной 40 мм и толщиной до 1 мм, покрытая изоляцией на всем протяжении, кроме самого острия (рис. 33). Пассивный электрод укрепляют на руке больного. Иглу вкалывают на расстоянии 5 мм к виску и книзу от наружного угла глазной щели и проводят в ткани нижнего века параллельно ресничному краю на расстоянии 4—5 мм от него до уровня слезной точки. При движении иглы туда и обратно осуществляют коагуляцию, интенсивность которой проверяют пальцем через кожу. Вследствие сжатия тканей, а в дальнейшем в результате рубцевания веко принимает правильное положение.
В случае выраженного спастического (старческого) заворота нижнего века Л. X. Шоттер (1960) предложил производить операцию с перемещением волокон круговой мышцы века. Параллельно краю нижнего века делают кожный разрез на расстоянии 3—4 мм от ресниц. Края кожной раны отсепаровывают, обнажающиеся волокна круговой мышцы следует щадить.
С помощью пинцета и сомкнутых ножниц волокна круговой мышцы тщательно отделяют от хряща и верхней части тарзоор-битальной фасции. Начинают сепарацию сверху, от самых ресниц, и, спускаясь вниз, распространяют ее во всю ширину кожной раны так, что обнажаются вся передняя поверхность хряща и верхняя часть фасции.
56
32. Комбинированная пластика нижнего века острым стеблем при сочетанном рубцовом вывороте и дефекте стенки глазницы (схема).
а — разрез кожи у края века АБ с отсепаровкой, выкраивание лоскута кожи на ножке в области виска и треугольного лоскута над ушной раковиной; б — формирование ножки стебля, введение в дефект стенки глазницы аллотрансплантата хряща или кости (2 б); в — подшивание острого стебля А к краям дефекта кожи века (первый этап); г. д — иссечение ножки стебля (второй этап).
33. Исправление спастического (старческого) заворота нижнего века с помощью подкожной диатермокоагуляции по Шоттеру (схема).
34. Исправление спастического заворота нижнего века дислокацией мышечных волокон по Шоттеру (схема).
Выделенную часть круговой мышцы века сдвигают вниз за выпуклый край хряща, образуя мышечный валик (рис. 34). Накладывают пять швов в вертикальном направлении по Году. От-сепарованные и смещенные книзу мышечные волокна остаются на уровне нижнего края хряща.
Операции при морщинах век. С возрастом вследствие потери эластичности кожи появляются морщины кожи век. Деформация в виде выбухания век возникает при выпадении жира в толщу век даже у молодых людей. Морщины кожи век удаляют путем иссечения избытка кожи. Ширину лоскута, подлежащего иссечению, определяют, захватывая кожу пинцетом. Один разрез кожи проводят, отступя от ресничного края век на 3—4 мм, другому придают дугообразную форму. Кожу тщательно отсепа-ровывают от волокон круговой мышцы. При выпадении жира производят его иссечение, отверстия в тарзоорбитальной фасции зашивают тонким шелком или капроном. На нижнем веке у наружного угла производят клиновидное иссечение кожи. На края раны кожи накладывают швы.
58
Операции при дефектах век и бровей
Операции при поверхностных дефектах век. При ранениях с образованием дефекта тканей век, как правило, в последующем развиваются деформации век. Для того чтобы предупредить их возникновение, производят одномоментное замещение дефектов кожи век с первичной хирургической обработкой ран. В зависимости от величины дефекта применяют пластику местными тканями или свободную кожную пластику в комбинации с пересадкой аллотрансплантатов хряща и твердой мозговой оболочки.
Дефекты кожи век, возникающие после иссечения опухолей, подлежат одномоментному замещению с использованием одного из методов блефаропластики в зависимости от величины дефекта. Первичная блефаропластика во всех случаях повышает эффективность хирургического лечения как ранений век, так и опухолей.
Операции при сквозных дефектах век. Замещение сквозных дефектов вок представляет собой большие трудности. При ранениях с образованием сквозного дефекта века выбирают наиболее оптимальный способ одпоэтаппой первичной блефаропластики (местными тканями, свободную кожную пластику и др.).
Сквозные дефекты век, являющиеся последствием травм, характеризуются наличием глубоких рубцов в тканях, окружающих дефект. Во время операции рубцы в области краев дефекта век иссекают, а края раны широко отсепаровывают. При этом выявляются истинные размеры дефекта века. Внутреннюю пластинку века при наличии глазного яблока, восстанавливают с помощью аутотрансплантата слизистой оболочки, при анофтальме используют опрокидывающийся лоскут кожи, выкроенный из окружающих тканей, а также свободный лоскут кожи. Для восстановления наружной пластинки века применяют один из методов блефаропластики.
Для устранения частичного сквозного дефекта век при ранениях и их последствиях широко используют здоровые ткани, избегая их натяжения, так как при натяжении швы после операции расходятся и возникает вторичный, еще более обезображивающий дефект. В том случае, если простым сближением краев раны устранить небольшие сквозные дефекты век не удается, производят пластику лоскутом кожи на ножке. При сквозном дефекте средней трети века выполняют частичную сквозную комбинированную пластику острым микростеблем и аутотрансплантатом слизистой оболочки. Этот способ позволяет предупредить вторичную послеоперационную деформацию век на уровне их спаек.
Дефект внутренней пластинки века устраняют простым сближением краев раны, а чаще пересадкой аутотрансплантата слизистой оболочки (рис. 35).
59
35. Частичная сквозная комбинированная пластика нижнего века острым микростеблем (схема).
а — разрез по краю дефекта нижнего века, выкраивание на верхнем веке острого-микростебля; б — формирование ножки стебля, устранение дефекта конъюнктивально-хрящевой пластинки методом бокового смещения (первый вариант); в — подшивание аутотрансплантата слизистой оболочки к краям дефекта кожи (второй вариант); г — подшивание острого микростебля к краям дефекта кожи нижнего века (первый этап); д, е — иссечение ножки стебля (второй этап).
Для замещения полного сквозного дефекта века применяют полную комбинированную пластику века лоскутом кожи на ножке или острым микростеблем (лучше на двух ножках), формируемым в области верхнего века. Дополнительный треугольный лоскут кожи, выкраиваемый на верхнем веке, предупреждает деформацию века, аллотрансплантат твердой мозговой оболочки
60
36. Комбинированная одномоментная полная сквозная пластика нижнего века лоскутом кожи на ножке (схема).
а — разрез по краю дефекта (1) с отсепаровкой краев; б —к краям дефекта внутренней пластинки век подшит аутотрансплантат слизистой оболочки (2), на верхнем веке выкроен лоскут кожи на ножке (3) с дополнительным треугольным лоскутом кожи (4); в, г — полоска твердой мозговой оболочки (5) уложена между кожей и мышечным слоем; д — лоскут кожи подшит к краям дефекта века, аллотрансплантат хряща с отверстиями (6) уложен в дефект края глазницы.
стойко фиксирует веко в правильном положении, а аллотрансплантат хряща выравнивает рельеф века при дефекте края глазницы (рис. 36). При сочетанном полном сквозном дефекте века и стенки глазницы, особенно если он является последствием огнестрельного ранения, эффективна пластика лоскутом кожи на ножке, выкроенном в области виска, с одномоментной пересадкой аллотрансплантатов кожи или кости.
Большой жизнеспособностью обладает лоскут кожи на скрытой ножке, формируемый в области виска. В лоскут включают крупные сосуды, поверхностные слои с его ножки срезают. Лоскут проводят через подкожный тоннель к дефекту века и подшивают к его краям.
При обширных сочетанных полных дефектах обоих век благоприятные результаты дает комбинированная пластика острым стеблем, выкроенным в лобно-височной области, с пересадкой опорных аллотканей. Такие дефекты обоих век с разрушением стенок глазницы и окологлазничной области замещают круглым стеблем. Сложную блефаропластику круглым стеблем осуществляют в несколько этапов. К подготовительным этапам относят
61
формирование стебля и пересадку его ножек, к основным — вое-'Становление век и глазничной области. Этот метод позволяет восстановить веки и одновременно произвести замещение обширных дефектов стенок глазницы и прилежащих отделов лица при последствиях огнестрельных ранений, обширных злокачественных опухолей, врожденных дефектах. При анофтальме и наличии грубых рубцов, сращенных с дефектом стенок глазницы, а также последствиях огнестрельного ранения, когда полностью отсутствует жировая клетчатка глазницы, пластика круглым стеблем незаменима. Из вживленного стебля удается сформировать оба века и «конъюнктивальную» полость, т. е. создать условия для глазного протезирования. Одновременно замещают дефект краев и стенок глазницы, выравнивают благодаря толстому слою подкожной жировой клетчатки рельеф всей глазничной области (рис. 37).
При иссечении всего века по поводу, например, раковой опухоли хорошие результаты получают при одномоментной сквозной первичной комбинированной пластике век по Томашевской. Сразу же после полной резекции века к краям дефекта кожи подшивают лоскут кожи на ножке, выкроенной в области виска, лба или носогубной складки. Дефект внутренней пластинки замещают аутотрансплантатом слизистой оболочки.
Врожденные сквозные дефекты век и дефекты, образующиеся после заболеваний, устраняют одним из указанных методов блефаропластики с учетом величины и локализации дефекта.
Операции при дефектах ресниц. Восстановление ресниц представляет очень большие трудности, так как волосяные луковицы при пересадке чаще всего гибнут. Предложена свободная пересадка отдельных ресниц, по она малоэффективна. Свободные трансплантаты кожи выкраивают в области брови и пересаживают на участок дефекта ресничного края. Установлено, что аутотрансплантат кожи приживает, но происходит его стойкое облысение. Лучшие результаты, на наш взгляд, дает пластика краев век и ресниц лоскутом кожи на ножке, выкроенным в области брови. В области нижней половины брови выкраивают лоскут кожи на ножке, а в области краев век — два опрокидывающихся лоскута кожи, которые сшивают. Лоскут кожи на ножке подшивают к краям дефекта краев век (первый этап операции). Через 2—3 нед раскрывают глазную щель и ножку лоскута возвращают в область брови (второй этап).
Операции при дефектах бровей. Дефекты и деформации бровей в большинстве случаев бывают сочетанными. Деформации бровей устраняют пластикой местными тканями: взаимным перемещением двух треугольных лоскутов кожи или способом бокового смещения. Дефект брови замещают свободным лоскутом кожи, выкроенным в волосистой части головы. Аутотрансплантат кожи, как правило, приживает, но большинство волосяных луковиц гибнет. Большей устойчивостью обладают лоскуты кожи на ножке, выкроенные на волосистой части головы. Однако
62
37. Сквозная пластика обоих век и глазничной области круглым стеблем Филатова (схема).
а — ножка круглого стебля пересажена в область виска, вторая ножка отсечена, разрез в области дефекта век АДБ и ВЕГ; б — ножка стебля (1) распластана, выкроено два лоскута АДЕВ и ДБгЕ; в — ножка стебля (1) подшита к краям дефекта век; г — ножка (2) отсечена, разрезана и уложена в дефект тканей области виска, проведено два разреза по линии вживленной в глазничную область ножки с широкой отсепаровкой разрезов ИКЛП и ИМнО; д — наружная и внутренняя кантопласти-ка; е — часть стебля (3) рассечена и уложена в дефект наружной стенки глазницы, вставлен глазной протез.
этот метод имеет существенный недостаток: на уровне ножки лоскута остается рубцовая «дорожка». Пластика лоскутом кожи на» скрытой сосудистой ножке, сформированном в области виска, не* дает «дорожки» и позволяет восстановить бровь в один этап, если отсутствуют рубцы в области виска.
631
Дефекты обеих бровей в основном образуются после обширных ожогов лица. Обе брови восстанавливают пластикой острым микростеблем, выкроенным в области виска. Хорошее кровоснабжение острого стебля обеспечивает приживление кожи с волосяными луковицами на рубцовом ложе.
При последствиях обширных ожогов лица, когда кожа в области висков рубцово изменена, применяют пластику бровей, круглым стеблем, выкроенным в области волосистой части головы над ушной раковиной. Одновременно с выполнением пластики бровей устраняют рубцовое укорочение верхних век путем отсепаровки во время операции кожи до края века.
Операции при блефароптозе
Способы устранения врожденного и паралитического птоза (опущения) верхнего века многообразны.
Операции, усиливающие функцию мышцы, поднимающей верхнее веко, путем ее укорочения. Резекцию мышцы осуществляют через кожу или конъюнктиву, проще производить ее через кожу по способу Джонсона в модификации Азнабаева (рис. 38).
Л. X. Шоттер и А. В. Герасимова (1963) в течение многих лет применяют упрощенный метод операции усиления мышцы, поднимающей верхнее веко, проводят разрез через кожу и обнажают переднюю поверхность тарзуса и мышцы, поднимающей веко. Вдоль верхнего края тарзуса, отступя от него на 2—3 мм, делают сквозной разрез (рис. 39). Через край тарзуса и сухожилие мышцы, поднимающей веко, захватывая конъюнктиву, проводят пять нитей из расчета, что для поднятия века на 1 мм необходимо укоротить мышцу на 2—3 мм, после чего часть мышцы, поднимающей верхнее веко, с полоской тарзуса иссекают. Нити швов завязывают одним узлом, после оценки полученного эффекта концы их выводят на кожу и завязывают окончательно. Между основными швами накладывают тонкие швы на кожу. При травматических птозах одномоментно устраняют внутренний или наружный эпикантус и производят пластику местными тканями.
Л. X. Шоттер (1978) предложил метод расходящихся треугольников для устранения эпикантуса. Первый дугообразный разрез проводят в вертикальном направлении несколько медиальнее носовой границы эпикантуса, второй — латеральное его наружной границы. Верхние и нижние концы разрезов веерообразно расходятся. Третьим, косым, разрезом оба первые соединяют между собой так, что получают два треугольника, соприкасающиеся между собой (рис. 40). После отсепаровки обоих треугольников почти до их основания оба лоскута кожи раздвигают (один кверху, другой книзу) настолько, чтобы полностью устранить имевшееся ранее натяжение кожи в вертикальном направлении. На края разрезов накладывают швы, захватывая отчасти и подлежащие ткани. Имевшийся избыток кожи в горизонтальном направ-
-64
88, Резекция мышцы, поднимающей верхнее веко, через кожу (схема).
к -• разрез кожи и круговой мышцы; б — швы — держалки; в — П-образныс швы, наложенные на апоневроз мышцы, поднимающей верхнее веко; г — П-образные швы. наложенные на мышцу, поднимающую верхнее веко на расстоянии 2 мм от линии предполагаемой резекции или выше; д — проведение концов П-образных швов 'lopoa хрящ; е — завязывание концов нитей узловатым швом, наложение кожных ШкОВ.
лопни па ан расхождения треугольников также устраняется. При значительной ширине складки аникаптуса производят добавочную эксцизию кожи для сужения лоскутов. Благодаря более естественному направлению разрезов по сравнению с другими методами перемежающихся треугольников после данной операции остается менее заметный след (авт. свид. № 704613).
Операции усиления мышцы, поднимающей веко, действием лобной мышцы. Мышечная аутопластика по способу Робертса в модификации Колена и Фукса основана на выкраивании из лобной мышцы двух или трех лоскутов на ножке и подведении их через тоннель к верхнему краю хряща верхнего века.
В последнее десятилетие для устранения блефароптоза применяют аллоткани (склеру, твердую мозговую оболочку, фасцию). Операцию подвешивания верхнего века к лобной мышце алло-фасцией по способу Азнабаева производят следующим образом: на 4 мм выше ресничного края проводят разрез кожи и отсепа-ровывают верхний край хряща. По верхнему краю брови делают три кожных разреза длиной 7 мм. Создают три подкожных тон-
5 Руководство по глазной хирургии
65
39. Модификация операции исправления блефароптоза путем усиления мышцы, поднимающей веко, по Шоттеру (схема).
ноля, соединяющие верхние разрезы кожи с разрезом у ресничного края. По тоннелям проводят лоскуты алло-фасции шириной 3 мм. Нижние концы их подшивают кетгутом к верхнему краю хряща, верхние — к лобной мышце после установления
ресничного края верхнего века на уровне верхнего сектора лимба.
В случаях полного отсутствия действия мышцы, поднимающей верхнее веко, Л. X. Шоттер и А. В. Герасимова (1965) для перенесения на веко действия лобной мышцы имплантируют в подкожный карман три ленты из капроновой ткани (рис. 41). Нижний конец лент подшивают к тарзусу (посредине), концы нитей выводят на кожу века и завязывают на марлевом валике, в результате чего образуется кожная складка. Верхние концы лент крепят нитями, которые выводят на кожу лба и завязывают бантиком, что позволяет в течение нескольких дней изменять величину подъема верхнего века.
В. С. Беляев (1970) с этой целью использует петлеобразный трансплантат из широкой фасции бедра.
При врожденном птозе верхнее веко подтягивают к лобной мышце с помощью погружных швов. Методика одного из вариантов операции состоит в следующем. У верхнего края брови проводят два небольших разреза кожи до надкостницы: один на расстоянии 5 мм от ее медиального конца, второй — 3 см кнаружи от первого. Еще два разреза кожи делают в 2 мм от края верхнего века на расстоянии 2 мм один от другого. Шелковую нить изогнутой иглой проводят через верхний медиальный разрез сквозь основание лобной мышцы и выводят через верхний латеральный разрез. Затем нить проводят под круговой мышцей с выколем через разрезы на веке. Нить выводят в верхний медиальный разрез, веко подтягивают и нить завязывают.
40. Операция устранения эпикантуса методом расходящихся треугольников по Шоттеру (схема).
66
41. Исправление птоза с перенесением действия лобной мышцы на веко по Шоттеру (схема).
При врожденном птозе, кроме того, устраняют внутренний эпикантус пластикой местными тканями по Лимбергу и удлиняют глазную щель, т. е. производят реконструктивные операции в несколько этапов.
Операции усиления мышцы, поднимающей веко, действием круговой мышцы глаза. Операции ос-11111111111.1 па усилении леватора действием орбитальной части круговой мышцы глаза |Хпцукоп Л. Л,, 1977]. Методика операции состоит в следующем: в сродней части брови проводят разрез кожи длиной 2—3 см и отсенаровывают ее книзу. Из орбитальной части круговой мышцы выкраивают полоску шириной 0,5—0,7 см и длиной 2—2,5 см в горизонтальном направлении. Полоску отсекают у внутреннего (первый вариант) или наружного (второй вариант) угла раны. Конец мышечного лоскута разрезают на две—три ножки. Второй разрез проводят, отступя 2—3 мм от края верхнего века до средней трети. Обе раны соединяют подкожными тоннелями, через них проводят мышечный лоскут и подвешивают соответственно к хрящу, отступя на 2—3 мм от его свободного края. Третий вариант — выкраивают мышечную полоску, средняя часть которой соединена с надкостницей и орбитальной мышцей. Оба конца полоски отсекают. Одну из образовавшихся ножек разрезают по длине. Три мышечные ножки проводят через тоннели и подшивают к хрящу.
Эти операции рекомендуют применять при врожденном и паралитическом птозе верхнего века.
5*
Глава 3
Операции на конъюнктиве и хряще
При выполнении операций на конъюнктиве необходимо помнить о некоторых особенностях этой оболочки, обусловленных ее анатомическим строением, неодинаковым в разных отделах конъюнктивального мешка. Вследствие богатой васкуляризации века при операциях на конъюнктиве и хряще могут возникнуть значительные кровотечения.
Следует учитывать также основное распространение нервных веточек. Известно, что денервация ведет к «растормаживанию» ткани [Беляев В. С., 1968]. В конъюнктиве это выражается в образовании конъюнктивальных полипов, значительных разрастаний конъюнктивы с последующим рубцеванием ее на месте неполного смывания краев разрезов и ран, особенно циркулярных. Наименее выраженные реакции (тканевой рост и рубцевание), так же как и в роговице, наблюдаются при радиальных разрезах, при которых травма нервной сети минимальна.
На конъюнктиве производят различные манипуляции — от легких (инъекции различных препаратов под конъюнктиву) вплоть до таких тяжелых, как пластические операции, при которых осуществляют полную или почти полную замену слизистой оболочки (после тяжелых химических и термических ожогов).
Анатомические особенности слизистой оболочки глаза и ее переходной складки (рыхлое соединение со склерой, подвижность) создают благоприятные условия для подконъюнктивального введения различных лекарственных средств. Подконъюнктивальные инъекции всегда делают после эпибульбарной анестезии дву-, трехкратными инстилляциями 0,5—1% раствора дикаина или закладывания в конъюнктивальную полость на 1—2 мин ватного тампона, смоченного 0,5—1% раствором дикаина.
После анестезии нижнее веко оттягивают книзу, больной при этом смотрит вверх. Пинцетом захватывают конъюнктиву в складку, оттягивают ее от склеры и прокалывают иглой. Место вкола выбирают в зависимости от цели инъекции. Следует избегать ранения сосудов, особенно при вколе у переходной складки. Под конъюнктиву вводят растворы антибиотиков, новокаина, хлорида натрия, ферментов и др.
В отличие от слизистой оболочки склеры и переходной складки конъюнктива хряща плотно спаяна с подлежащими тканями, поэтому при операциях на хряще для получения обезболиваю
68
щего эффекта анестезирующее вещество вводят через кожу века И дополнительно в переходную складку, в случае необходимости осуществляют также проводниковую анестезию.
Скарификации (насечки) иногда наносят на выпавшую-из глазной щели отечную конъюнктиву верхней и нижней переходных складок при ее резко выраженном отеке (хемоз). Обычно делают пять—шесть параллельных насечек и производят инстилляции дезинфицирующих растворов (20—30% раствор сульфа-цил-натрия и др.).
Наложение швов на слизистую оболочку производят при ее разрывах и после рассечения при различных операциях. Применяют узловатые или, чаще, непрерывные швы из тонкого шелка, кетгута или аллопластических нитей (нейлон, супрамид). Во избежание образования пролежней нужно следить, чтобы концы швов не лежали на роговице.
Удаление множественных мелких инородных тел из конъюнктивального мешка осуществляют струей теплого дезинфицирующего раствора. Инородные тела, оставшиеся на конъюнктиве, удаляют влажным тампоном, а лежащие в ее тол-чio с помощью пинцета, иглы для инородных тел или инструмента Поттера. Перед удалением проводят эпибульбарную ане-: езию.
Операция при мейбомиевом блефароконъюнк-т и в и т е по Филатову. После инстилляции 1 % раствора дикаина в конъюнктивальный мешок и инъекции 2% раствора новокаина подкожно и по краю века под него со стороны слизистой оболочки подводят пластинку Егера. Ножом Грефе или острым узким скальпелем разрезают хрящ в интермаргинальном пространстве пс линии выводных протоков желез хряща века (иейбониевы железы) до его края. Если разрез проводят правильно, то видна поверхность краев рапы желтовато белого цвета; если же разрез хряща прошел мимо желез п они не вскрыты, то следует положить нож Грефе плашмя па хрящ и срезать с него пластины, вскрывая, таким образом, железы. Когда веко расщеплено, острой ложечкой соскабливают с обеих поверхностей все железы, соблюдая особую осторожность у корней ресниц. При правильно сделанном разрезе соскабливание идет легко; если же расщепление произведено неудачно, то железы не столько выскабливаются, сколько отдавливаются. После остановки кровотечения тщательно сшивают края пластин расщепленного хряща пятью — шестью тонкими швами, которые снимают на 4-й день; повязку снимают на 5-й день.
Удаление халазиона осуществляют тремя способами: через кожу века, через конъюнктиву хряща и через межреберное пространство. Халазион больших размеров, расположенный ближе к коже века, можно удалить со стороны кожи. После инстилляции 2 капель 1% раствора дикаина и инъекции 1—1,5 мл 1% раствора новокаина под кожу века под него со стороны слизистой оболочки подводят пластинку, а со стороны кожи — окон-
69
матую браншу зажима Демарра для халазиона так, чтобы отверстие бранши оказалось над халазионом. Бранши смыкают и в таком положении фиксируют винтом. Проводят горизонтальный разрез кожи параллельно краю века. После отсепаровки халазиона его удаляют вместе с сумкой, рану смазывают 5% спиртовым раствором йода. Накладывают кожный погружной шелковый шов: иглу вкалывают не через кожу, а через раневую поверхность у края разреза и проводят ее внутрикожно, не выводя наружу, через обе губы раны попеременно («змейка»), последний выкол делают на поверхность кожи (рис. 42). Потянув за концы шва, сближают края раны. Через 5 дней нить вытягивают. Нежный рубчик вскоре теряется между складками кожи века.
Если халазион находится в толще хряща и большая его часть выступает в сторону конъюнктивы, то его удаляют со стороны слизистой оболочки. Кроме описанной выше анестезии, желательно сделать две инъекции в края века в местах прижатия их зажимом, который накладывают окончатой браншей со стороны конъюнктивы над халазионом. Веко плотно зажимают бранша-ми и фиксируют их стопорным винтом. Вывернув веко, делают разрез через слизистую оболочку над халазионом перпендикулярно к краю века. Халазион вылущивают в сумке. Если сумка вскрывается, то халазион удаляют частями, вычищая ложе его острой ложечкой. Швы обычно не накладывают, но если кровотечение не останавливается прижатием века, то приходится наложить один или два шва. Концы швов (на двух иглах) можно вывести на кожу и завязать над марлевыми валиками. Через сутки их снимают.
В тех случаях, когда халазион расположен вблизи ресничного края века, разрез делают в межреберном пространстве. Халазион вскрывают и выскабливают ложечкой. При множественных халазионах приходится иссекать большое количество ткани. Фиброзная ткань хряща обычно восстанавливается, благодаря чему форма века не изменяется.
Если халазион расположен вблизи слезного канала, то операцию следует выполнять с большой осторожностью, поскольку его можно повредить при удалении гранулематозной ткани. Во избежание этого в слезный канал для его защиты вводят зонд. Захватив окончатым зажимом Демарра область халазиона и канала с введенным в него зондом или канюлей для промывания, пользуясь ножницами и пинцетом, осторожно удаляют халазион. Для того чтобы предотвратить возникновение рецидива, после операции следует проводить массаж желез, заложенных в хряще, и в течение 2 нед по вечерам втирать в веки мазь с сульфаниламидными препаратами или антибиотиками. Иногда ограничиваются инцизией халазиона с последующим выскабливанием острой ложечкой.
О. А. Джалиашвили и соавт. (1983), Д. С. Лупан и соавт. (1985), L. Pizzarello и соавт. (1978) сообщили об успешном лечении халазиона введением стероидных препаратов непосредствен-
70
42. Внутрикожный шов «змейкой» (схема).
43. Пинцеты для выдавливания зерен при трахоме.
а—Кнаппа; б—Кунта; в—Донберга; г — Беллярминона; д — Пренса; е — Павлова.
но в очаг поражения. Авторы вводили внутрь халазиона суспензию триамцинолона ацетонида (кеналог) по 0,05—0,3 мл однократно и только в отдельных случаях повторно. Халазион полностью рассасывался в течение 2 нед.
Операции при трахоме
В Советском Союзе трахома ликвидирована, но отечественные офтальмологи производят операции при этом заболевании в развивающихся странах, где трахома широко распространена.
Выдавливание трахоматозных зерен производят специальными пинцетами (рис. 43). В. П. Филатов (1931) предложил метод повторных выдавливаний, при проведении которых не только механически разрушают фолликулы, но и оказывают целебное раздражающее действие. Курс лечения состоит из 4—» 6 сеансов. Длительность курса лечения 3—5 мес. При отсутствии рецидива в течение 6 мес после последнего сеанса больного можно считать выздоровевшим.
Выдавливание трахоматозных зерен по Филатову осуществляют следующим образом. Производят местную анестезию инстилляцией 1% раствора дикаина и инъекцией 1 % раствора новокаина (лучше через кожу) у наружного угла вывернутого века;
71
"игла должна обязательно пройти через тарзоорбиталыаую фасцию к внутреннему углу, чтобы раствор пропитал область слезного мясца. Выдавливание на верхнем веке значительно облегчается, если вывернуть его с помощью векоподъемника Демарра. Лучше всего пользоваться пинцетом Пренса с кольцевидными брашнами, который позволяет производить более нежное сдавливание, чем при использовании других пинцетов, и не рвать конъюнктиву. Вначале осуществляют умеренное выдавливание, без излишнего травмирования конъюнктивы, при проведении последующих сеансов действуют более энергично. После выдавливания больному рекомендуют делать холодные примочки в течение 1—2 дней. При наличии паннуса одновременно назначают курс аутогемотерапии по 10 мл через 2—3 дня, всего 6—8 инъекций.
Сторонники активного выдавливания предлагают использовать пинцеты с широкими браншами, чтобы оказывать действие не только на поверхностно расположенные фолликулы, но и на тарзальную ткань: чем сильнее раздражение, тем выраженное ответная реакция. С помощью пинцетов Биллярминова, Донберга, Пренса, Павлова можно воздействовать на ткань путем сдавливания и растяжения, т. е. осуществлять одновременно массаж и выдавливание. После выдавливания наблюдаются гиперемия конъюнктивы, отек и обострение процесса, которые обычно исчезают через несколько дней.
В настоящее время разработаны щадящие методы лечения трахомы, поэтому достаточно производить однократную экспрессию. , Серьезным осложнением является обострение трахоматозного кератита. Иногда образуется язва роговицы. Во избежание развития этого осложнения необходимо проводить соответствующую терапию до и после экспрессии.
Удаление хряща, комбинированная эксцизия хряща и конъюнктивы переходной складки. Удаление хряща — одна из так называемых тарзопластических операций. Показания к ней следующие: искривление и утолщение хряща, заворот века, три-хиаз, паннус, инфильтраты и изъязвления роговицы, не поддающиеся консервативному лечению. Комбинированную эксцизию хряща и переходной складки осуществляют при тяжелом обширном поражении конъюнктивы и хряща с резким трахоматозным кератитом, который может привести к слепоте.
Удаление хряща по Кунту обычно производят только на верхнем веке (рис. 44). Анестезия капельная и инфильтрационная: под слизистую оболочку переходной складки вводят 1,5—2 мл 1% или 2% раствора новокаина. Верхнее веко выворачивают и фиксируют на пластинке Егера, подведенной со стороны кожи. Ресничный край века удерживают с помощью двух уздечных швов, предварительно наложенных на край века. Отступя от края века 2—3 мм, проводят параллельно ему разрез слизистой оболочки и хряща. Отсепаровывают слизистую оболочку от хряща, что можно сделать, лишь оставив на ней тонкие пластинки последнего. Слизистую оболочку отделяют до верхнего края хряща или немного
72
hb. Комбинированная эксцизия переходной складки по Кунту (схема).
а — разрез конъюнктивы; б — наложение швов после удаления хряща; в — выведение швов на кожу.
дальше. На край слизистой оболочки накладывают три шва, каждый па двух иглах, так, чтобы нити лежали со стороны слизистой оболочки — способ Штрауба (рис. 45). Концы нитей не завязы-вывают и помещают сбоку на влажной салфетке. Затем со стороны кожи тщательно и осторожно отсепаровывают хрящ от клетчатки и волокон круговой мышцы. Хрящ отрезают ножницами у верхнего края, стараясь не повредить места прикрепления мышцы, поднимающей веко, и удаляют. Заготовленные швы проводят у нижнего края раны, иглы выводят на кожу века над ресницами, нити завязывают на марлевых валиках. Швы снимают на 4—5-й день.
Комбинированную эксцизию хряща и слизистой оболочки переходной складки производят только на верхнем веке. Анестезия — эпибульбарная инстилляция в комбинации с инфильтрационной. После выворачивания верхнего века делают разрез конъюнктивы у границы переходной складки и слизистой оболочки склеры. На края разреза слизистой оболочки склеры предварительно накладывают три шва на двух иглах каждый. Делают разрез слизистой оболочки хряща параллельно краю века
73
45.
Проведение швов по Штраубу (а) и положение края века (б) после затягивания швов (схема).
на расстоянии 2—3 мм от него. Хрящ, а затем и слизистую оболочку переходной складки тщательно отсепаровывают от клетчатки и мышечных волокон и после проведения добавочных разрезов иссекают. Таким образом удаляют хрящ с покрывающей его слизистой оболочкой и слизистую оболочку переходной складки, после чего зашивают рану. Нити выводят на кожу выше ресниц и завязывают над марлевыми валиками. После этой операции конъюнктивальный мешок значительно уменьшается. Из осложнений необходимо отметить также ксероз. Для того чтобы избежать отрицательных последствий операции, пытаются восполнить дефект конъюнктивы пересаженной слизистой оболочкой, а хрящ удаляют лишь частично. Существуют и другие модификации этой операции.
Операция при трахоматозном паннусе. В основу всех операций, предложенных для лечения трахоматозного паннуса, положен принцип местного воздействия на ткани. В частности производят перерезку новообразованных сосудов в роговице, формируют прочный рубец на пути их проникновения в лимб, создают барьер между роговицей и конъюнктивой, субконъюнктивальной и эписклеральной тканями, образуют валик, который, приподнимая верхнее веко, уменьшает раздражение роговицы.
Перитомия, пер и эктомия и ли м борафи я. Одной из первых операций, которую начали применять при паннусе, была перитомия. R. Graefe предложил перерезать конъюнктиву глазного яблока вокруг лимба, в результате чего склера обнажается на 1—2 мм. Позднее была предложена периэктомия: после кругового разреза конъюнктивы глазного яблока срезают полоску шириной до 2—3 мм и соскабливают эписклеру. В первые дни после перитомии и периэктомии возникает гиперемия паннозно-измененной роговицы; в ней появляются новые сосуды, усиливается инфильтрация. После периода первичного раздражения про
74
цесс затихает и происходит обратное развитие трахоматозного кератита.
В. П. Филатов (1931) предложил производить подконъюнктивальную перитомию повторно. Методика данной операции такова: надрезают конъюнктиву глазного яблока у экватора по вертикальному меридиану и отсепаровывают подконъюнктивальную ткань до лимба между 11 и 1 часом. Дальнейшие надрезы делают по мере необходимости на меридианах 2 и 4 часа с отсепаровкой на участках между 1 и 3; 3 и 5 часами и т. д. Всего делают 4—6 разрезов. Предложено отсепаровывать конъюнктиву глазного яблока вокруг лимба до мест прикрепления мышц; внутреннюю поверхность конъюнктивы и обнаженную часть склеры тщательно» очищают острой ложкой [Хавин О. А., 1935].
Для получения полного рубца в конъюнктиве в области распространения паннуса предложена лимборафия— прошивание конъюнктивы и эписклеры топким кетгутом между меридианами 1 и 3 часа. Позднее рекомендована перирафия, при которой производят обшивание шелковой нитью вокруг всего лимба. Ежедневно лигатуру слегка смещают. Некоторые авторы предлагают оставлять лигатуру на 30—60 дней и не производить ежедневных смещений.
Пересадка слизистой оболочки по Денигу. Операция заключается в перилимбальной эктомии конъюнктивы и пересаживании лоскута слизистой оболочки губы на обнаженную поверхность склеры. При выраженном паннусе производят пересадку вокруг всего лимба или в той его части, которая поражена паннусом. Лоскут слизистой оболочки губы должен полностью закрыть обнаженную часть склеры. Его тщательно освобождают ножницами от подслизистой ткани. Трансплантат шириной 5— 6 мм пришивают к конъюнктиве, а если он круговой, то сшивают его концы. Трансплантат не должен находить на роговицу. В ряде случаев R. Denig пересаживал пе конъюнктиву, а полоску кожи, выкроенную за ушной раковиной.
Недостатком операции Денига является образование косметического дефекта: слизистая оболочка долгое время сохраняет темно-розовый цвет, особенно если пересажен лоскут с остатком подслизистой ткани. Во избежание этого можно выкраивать лоскут слизистой оболочки по способу Филатова. Конъюнктиву разрезают перилимбально между 1 и 3 часами и иссекают полоску конъюнктивы с подконъюнктивальной и эписклеральной тканями. Берут лоскут слизистой оболочки с губы трупа (срок консервации 1—6 дней) и укладывают вокруг лимба. Слизистую оболочку рекомендуется пришивать кетгутом к сухожилиям прямых мышц, в результате чего уменьшается продолжительность операции. Слизистая оболочка рассасывается, поэтому в отношении получения косметического эффекта предложенная модификация, по мнению автора, лучше операции Денига.
Пересадка хряща из уха по Гольдфедеру. Производят эпибуль-барную анестезию 0,5% раствором дикаина и анестезию ушной
75
раковины подкожной инъекцией 1 — 1,5 мл 2°/о раствора новокаина. Веки удерживают векоподъемниками Демарра. Выполняют периэктомию слизистой оболочки, оставляя при частичном паннусе два—три, а при круговом — четыре конъюнктивальных мостика. В области концов горизонтального и вертикального меридианов делают подконъюнктивальные карманы шириной 1— 1,5 мм и длиной 3—4 мм. В этом месте конъюнктиву срезают косо книзу или кверху. Острой ложкой тщательно выскабливают подконъюнктивальную и эписклеральную ткани. На передней поверхности закругленного завитка ушной раковины на расстоянии 2—3 мм внутрь от его свободного кожного края делают дугообразный разрез кожи до хряща длиной 2,5—3 см. Разрез производят параллельно свободному краю завитка. Кожу отсепаровы-вают тупыми ножницами на протяжении 2—3 см. Вырезают дугообразный лоскут хряща шириной до 2—3 мм и достаточной длины. Концы его заостряют. Лоскут истончают и укладывают на склеру под конъюнктивальные мостики, которые его удерживают.
Операции при опухолях конъюнктивы
Хирургическое вмешательство выбирают в зависимости от вида опухоли. При злокачественных опухолях, проросших в глазное яблоко, необходима энуклеация или даже экзентерация глазницы. Для удаления подконъюнктивальных липом и липодермоидов разрезают конъюнктиву склеры на высоте опухоли параллельно своду. Опухоль отделяют от склеры тупым путем. Приближаясь при отсепаровке к экватору глазного яблока, необходимо соблюдать особую осторожность, чтобы не вскрыть орбитальную клетчатку. Удалив опухоль, следует убедиться в том, что она не проросла склеру и не продолжается в глазницу. После тщательной диатермокоагуляции ложа опухоли и гемостаза на конъюнктиву накладывают швы. При удалении кист конъюнктивы необходимо быть осторожным, чтобы не прорвать их стенки. Это особенно важно, если «киста» окажется цистицерком. В случае прорыва во время операции стенки кисты хирург захватывает ее пинцетом, а ассистент удерживает края рассеченной конъюнктивы пинцетом или крючком. Если киста уходит далеко в глазницу, удалять ее нужно с большой осторожностью, чтобы не прорезать влагалище глазного яблока (тенонова капсула) или не пересечь сухожилие мышцы. Ангиомы конъюнктивы чаще являются продолжением ангиом век. Они, как правило, не осумкованы и имеют тонкие стенки в отличие от ангиофибром, которые носят кавернозный характер и просвечивают под конъюнктивой синеватым цветом. Ангиомы часто рецидивируют. Небольшие ангиомы лучше выжигать диатермокоагулятором. Липомы, папилломы и другие мелкие опухоли конъюнктивы обычно удаляют, отделяя их ножом. Ткани под их основанием прижигают гальвано- или диатермокоагулятором.
76
К подконъюнктивальным разрастаниям можно отнести амилоид конъюнктивы. Разрезав конъюнктиву над амилоидным разрастанием, его отсепаровывают и тщательно отделяют от склеры. Если это трудно сделать, то нужно удалить образование вместе с частью конъюнктивы. Дефект в таких случаях можно закрыть лоскутом слизистой оболочки, взятым с губы. Для того чтобы установить границы распространения злокачественных новообра-вований, необходимо провести тщательное исследование (офтальмоскопия, диафаноскопия, ультразвуковая радиоизотопная диагностика). Можно ограничиться удалением опухоли, если она не проросла склеру и т. д. При этом необходимо удалить 0,5—1 см окружающей непораженной конъюнктивы и обязательно часть склеры под основанием опухоли. Склеру тщательно выскабливают скальпелем и прижигают диатермокоагулятором, прикасаясь к ней (экспозиция 2—3 с). Дефект покрывают отсепарованным соседним лоскутом конъюнктивы или производят пластическое закрытие слизистой оболочкой губы.
Эпителиальные неоплазмы. Отграниченное новообразование иссекают. Поскольку передняя пограничная пластинка (боуменова оболочка) оказывает сопротивление росту новообразования, оно может распространиться на роговицу, не вовлекая в процесс строму, в связи с чем иссечение его возможно даже при далеко зашедших процессах. Если новообразование захватывает склеру, то дополнительно можно применить 0-лучи или контактную радиотерапию. При рецидивах показана энуклеация.
Внутриэпителиальная эпителиома (болезнь Бо-вэна). При локализации новообразования только на роговице и лимбе его можно соскоблить с передней пограничной пластинки, причем роговица остается прозрачной. Возможна и ламеллярная резекция в пораженной зоне. Если новообразование диффузно распространяется по конъюнктиве, то для полного излечения может возникнуть необходимость в энуклеации, а при распространении его па конъюнктиву века — удаление последнего. Иногда можно ограничиться иссечением конъюнктивы с соответствующей пластикой для предотвращения образования симблефарона. При рецидивах показана энуклеация.
Новообразования слезного мясца. Новообразования слезного мясца могут быть различной природы, поскольку в их структуру входят все элементы кожи, включая волосяные фолликулы, сальные и потовые железы. Приводим описание методики удаления обезображивающего новообразования слезного мясца по Эплбау-му. После инфильтрации полулунной складки и области медиальной спайки 2% раствором новокаина на треугольник, образуемый слезными точками и медиальной связкой, накладывают три оттягивающих пгва. Их проводят поверхностно через конъюнктиву немного медиальное свободного края этого участка века; верхний шов — немного кнутри от слезной точки, нижний — в соответствующем месте нижнего века, средний — в области медиальной спайки. Концы каждого шва захватывают кровоостанавливающим пин-
77
детом. Ассистент натягивает швы, вследствие чего слезное мясцо становится более доступным для проведения на нем манипуляций. Через основание опухоли проводят шов и во избежание соскальзывания его завязывают. Опухоль иссекают вместе с кольцом окружающей его здоровой конъюнктивы. Образовавшийся дефект закрывают путем наложения тонкого кисетного шва. Внутреннюю поверхность смазывают спиртовым раствором йода. После затягивания кисетного шва снимают швы-держалки.
Операции при симблефароне
Операции при симблефароне заключаются в пересадке тканей на раневую поверхность глазного яблока и поверхность век после рассечения сращений и отделения век от глаза. Для пересадки используют различные ткани (кожа, слизистая оболочка губы, трупная конъюнктива).
Впервые наиболее полно вопрос о пересадке слизистой оболочки при глазных операциях был изучен К. М. Сапежко (1892). Оперативное лечение обширных и полных симблефаронов по методу, предложенному Н. А. Пучковской, проводят в два этапа.
Первый этап. Кожу век смазывают 1 % раствором бриллиантового зеленого, производят ретробульбарную и инфильтрационную анестезию. Скальпелем и ножницами рассекают спайки между веками и глазным яблоком. Рубцовую ткань иссекают. Не следует удалять рубцовую ткань до самой склеры, так как при этом может нарушиться кровообращение глаза. У лимба временно оставляют участок рубцовой ткани для фиксации и поворота глазного яблока во время операции. При устранении обширных симблефаронов обоих век иногда делают кантотомию.
В местах наложения эписклеральных швов производят меридиональный разрез- влагалища глазного яблока до склеры по бокам прямых мышц. Шелковые швы проводят через эписклеру и передние слои склеры тонкой режущей иглой, но можно применить и круглую иглу для наложения роговичных швов. Удобнее пользоваться иглами с простым ушком, так как они легче проходят через склеральную ткань. Швы накладывают на расстоянии 12—13 мм от лимба. Для удобства наложения швов глазное яблоко фиксируют и поворачивают в нужном направлении за «культю» рубцовой ткани, оставленной у лимба.
При операциях по поводу полного симблефарона одного века, например нижнего, достаточно наложить четыре эписклеральных шва: один возле внутренней прямой мышцы, два — по бокам нижней прямой мышцы и один — возле наружной прямой мышцы. Если производят операции по поводу полного симблефарона обоих век, то накладывают восемь эписклеральных швов — по два по бокам каждой прямой мышцы.
Слизистую оболочку берут тонкой пластинкой по способу Филатова—Цыкуленко. Ассистент выворачивает верхнюю или нижнюю губу больного с помощью марлевой салфетки. В подслизи
78
стый слой вводят значительное количество 0,25% раствора новокаина до тех пор, пока не будет достигнута высокая плотность Губы. С помощью брюшистого скальпеля или бритвы выкраивают лоскут на 2 мм больше дефекта ткани, так как после выкраива-вия лоскута отмечается некоторое уменьшение его размеров. (Сли-вистую оболочку удобнее всего срезать брюшистым скальпелем с закругленным концом.) При выкраивании лоскута скальпелем производят пилящие движения параллельно поверхности слизистой оболочки. Лоскут выкраивают без подслизистого слоя. Рану губы не зашивают, а тампонируют стерильными марлевыми салфетками, которые удаляют через 2—3 ч. После операции больным рекомендуют полоскать рот слабым раствором перманганата калия. До переноса на глаз лоскут слизистой оболочки помещают в стерильную чашку Петри, на дне которой имеется небольшое количество изотонического раствора хлорида натрия.
Слизистую оболочку укрепляют на глазном яблоке и задней поверхности век следующим образом. Один лоскут слизистой оболочки укладывают на лишенную конъюнктивы поверхность глазного яблока и укрепляют предварительно наложенными эписклеральными швами (рис. 46). Швы после этого не отрезают, так как к ним в дальнейшем прикрепляют лоскут слизистой оболочки, покрывающей заднюю поверхность века. При завязывании швов глаз поворачивают в нужном направлении за «культю» рубцовой ткани. Дополнительные эписклеральные швы накладывают у лимба и по бокам лоскута так, чтобы слизистая оболочка плотно и без складок прилегала к склере. Если одного лоскута слизистой оболочки недостаточно для того, чтобы закрыть раневую поверхность глазного яблока, то можно покрыть ее двумя и даже тремя лоскутами.
В местах соединения лоскутов слизистой оболочки накладывают дополнительные швы. Во время операции устранения симблефарона лучше не удалять рубцовую ткань, покрывающую область роговицы: в послеоперационном периоде могут наступить заворот и укорочение век, и в этом случае лучше, если роговица закрыта рубцовой тканью. Только после того, как полностью закончены операции по поводу симблефарона, можно приступить к хирургическому вмешательству на роговице.
Второй лоскут слизистой оболочки нужного размера укладывают на заднюю раневую поверхность века и в глубине свода укрепляют теми же эписклеральными швами, которыми фиксирована слизистая оболочка, покрывающая глазное яблоко. После этого швы отрезают так, чтобы остались концы длиной не менее 1 см. Другой край лоскута пришивают матрацными швами к свободному краю века (рис. 47). Если производят операцию по поводу симблефарона обоих век, то еще один лоскут слизистой оболочки укрепляют на другое веко таким же способом.
У части больных, у которых имеется обширный симблефарон с резким укорочением сводов, но неполным сращением века с •глазным яблоком, для закрытия раневой поверхности века можно
79
46. Укладывание лоскута слизистой оболочки на раневую поверхность глазного яблока и укрепление его эписклеральными швами (схема) [Пулковская Н. А., 1960].
47. Укладывание лоскута слизистой оболочки на заднюю поверхность века и фиксация его эписклеральными швами к основанию и П-образными швами к свободному краю века (схема).
использовать конъюнктиву глазного яблока и века. С этой целью конъюнктиву в области симблефарона отрезают у лимба> отсепа-ровывают до свободного края века, заворачивают на заднюю поверхность века и фиксируют несколькими погружными П-образными швами, которые выводят на кожу века. Их назначение — удерживать конъюнктиву в нужном положении в первые дни после операции. Швы снимают рано — через 4—5 дней, чтобы по их ходу не успели образоваться рубцы. По окончании операции слизистую оболочку припудривают порошком сульфацил-нат-рия или в конъюнктивальный мешок закладывают 2% стрептоци-довую мазь и накладывают повязку. После этой операции у всех больных восстанавливались своды достаточной глубины.
При симблефароне, занимающем '/з—2/з площади века, одной операции обычно достаточно для достижения нужного эффекта; восстанавливается свод, достигается правильное положение века и полное смыкание глазной щели (рис. 48). Иногда остается небольшой заворот, который устраняют с помощью операции Са-пежко.
Если операцию с целью устранить симблефарон делают по поводу полного сращения одного или особенно обоих век, то через 8—12 дней после нее развиваются заворот век и лагофтальм. Незначительный заворот век, образовавшийся после первой операции, устраняют с помощью операции Сапежко или типа Лоти-на—Попова. При операции Сапежко для пересадки в интермаргинальное пространство лучше использовать не тонкие лоскуты слизистой оболочки, как это обычно делают, а толстые лоскуты с
80
48. Сагиттальный разрез глаза и век. Лоскуты слизистой оболочки губы пересажены на склеру (1) и заднюю поверхность лека (2) (схема) [Пучков-ская Н. А., 1960].
49. Сагиттальный разрез глаза и век (схема). После расщепления век на переднюю и заднюю пластинки веки приняли правильное положение, а рубцово-измененная слизистая оболочка сократилась и отошла к сводам.
подслизистым слоем, имеющие форму призмы или клина. Наблюдения показали, что пересадка этих лоскутов дает больший эффект.
Операцию Лотина—Попова производят в тех случаях, когда заворот и укорочение имеются только па одном веке и незначительно выражены, так как с помощью этой операции удается добиться удлинения века не более чем на 1—1,5 см. Веко расщепляют по интермаргинальному пространству, слизистая оболочка уходит к своду, а на дефект, образовавшийся на задней поверхности века, укладывают лоскут слизистой оболочки с губы и укрепляют его швами.
При значительно выраженных завороте и укорочении одного или обоих век, сопровождающихся их несмыканием, Н. А. Пулковская предложила через 3 нед после первого выполнять второй этап — удаление пластинок век с пересадкой слизистой оболочки губы и сшиванием век. Кожу век смазывают 1% раствором бриллиантового зеленого и осуществляют местную инфильтрационную анестезию 1% раствором новокаина. В случае необходимости производят кантотомию. Разрезом по краю века расщепляют его на переднюю (кожа, мышцы, хрящ) и заднюю (слизистая оболочка) пластинки (рис. 49).
6 Руководство по глазной хирургии 81
50. Подшивание лоскута слизистой оболочки губы к задним пластинкам верхнего и нижнего век (схема) [Пучковская Н. А., 1960].
51. Сшивание края век (схема) [Пучковская Н. А., 1960].
Выкраивают лоскут слизистой оболочки необходимого размера по описанному выше способу. Слизистую оболочку можно брать повторно в тех местах, где и в первый раз, если после этого прошло 5—6 мес. Лоскут слизистой оболочки укладывают эпителиальной стороной на глазное яблоко и пришивают кетгутовыми швами к краю задней пластинки верхнего и нижнего век (рис. 50). После этого его необходимо равномерно, но не слишком туго натянуть между задними пластинками верхнего и нижнего век. Освежают края обоих век. На лоскуте слизистой оболочки бриллиантовым зеленым отмечают линию смыкания век и, отступя 1,5—2 мм книзу и кверху от нее, через всю толщу слизистой оболочки проводят по 2—3 шелковых шва на двух иглах. Затем оба конца каждого шва выводят через кожу соответствующего века, но не завязывают. На освеженные края век накладывают 8—10 швов, которые проводят через край вначале одного, а затем другого века. Вкол делают у заднего ребра свободного края века и иглу выводят через кожу у основания ресниц. Швы завязывают хирургическим узлом (рис. 51). У наружного и внутреннего углов необходимо оставить отверстия для выхода слезы и отделяемого. Далее завязывают фиксирующие швы. В конъюнктивальный мешок вводят 20—30% мазь сульфацил-натрия и накладывают бинокулярную повязку.
При значительном повреждении кожи и свободного края век, т. е. в тех случаях, когда имеется их действительная недостаточность, одновременно с удлинением задних пластинок производят свободную пересадку кожи на одном или обоих веках. После этой операции больного отпускают домой на 3—4 мес, по истечении этого срока производят операцию раскрытия глазной щели. Такой длительный срок необходим для того, чтобы закончились процессы рубцевания после операции. Опыт показал, что при раскрытии
82
главной щели в более ранние сроки могут вновь возникнуть заворот и укорочение век.
Методика операции раскрытия глазной щели проста. Под местной инфильтрационной анестезией делают разрез век по линии сшивания. При этом разрезают и слизистую оболочку, пересаженную на заднюю поверхность век во время предыдущей операции. Иногда после раскрытия глазной щели сохраняется небольшой заворот одного века, который легко устраняют с помощью операции Сапежко.
Таким образом, оперативное лечение обширных и полных симблефаронов по Пучковской заключается в проведении одной или двух основных операций в зависимости от исходного состояния оперируемого глаза. При обширных симблефаронах одного века можно ограничиться одной операцией — устранением симбле-фарона с пересадкой слизистой оболочки губы и наложением эписклеральных швов (первый этап). При полных симблефаронах одного века, обширных и полных симблефаронах обоих век производят вторую операцию — удлинение задних пластинок со сшиванием век (второй этап). Кроме этих основных операций, осуществляют еще такие мелкие оперативные вмешательства, как раскрытие глазной щели и операция Сапежко.
6*
Глава 4
Операции на роговице и склере
Хирургические операции на роговице и склере занимают значительное место в практике офтальмолога. Прежде чем перейти к описанию методов выполнения этих операций, необходимо остановиться на иннервации роговицы и отметить особенности ее реакции на оперативное или травматическое воздействие.
Нервные ветви проникают в роговицу в радиальном направлении в виде многочисленных стволиков, которые затем дают разветвления, располагающиеся в основном в ее поверхностных слоях. Глубокие слои роговицы иннервированы значительно слабее. Тканевые сдвиги (тканевая динамика) в роговице происходят в результате частичной или почти полной денервации и выражаются в снижении степени дифференцировки ее ткани (омоложение и усиление роста роговичных клеток и покровного эпителия) .[Беляев В. С., 1964—1984]. При хирургическом вмешательстве на роговице меридиональный разрез обусловливает наименьший сдвиг в структуре ткани, циркулярный разрез, пересекающий большее количество нервов, вызывает значительные отклонения в тканевой динамике. Имеет значение и острота инструмента или ранящего предмета. При разрезе острым ножом отмечаются меньшие сдвиги в денервированных участках, чем при ущемлении или размозжении тканей роговицы и ее нервов. По-видимому, это необходимо учитывать как при разработке новых подходов в хирургии роговицы и склеры, так и при объяснении механизма воздействия на уже поврежденную роговицу.
Репарационная функция тканей при заполнении дефектов и ран роговицы улучшается в результате ее денервации; это следует иметь в виду при выполнении вмешательств на роговице и склере, а также выборе метода хирургического лечения при их повреждении. Однако просветление ткани роговицы и созревание (восстановление функции ткани) склеры связаны с их реиннервацией. Аналогичный процесс часто наблюдается при тяжелых проникающих травмах роговицы, особенно повторных хирургических вмешательствах. В этих случаях роговица теряет эластичность и, полипозно изменяясь, некоторое время может оставаться в таком отечном состоянии, напоминая культуру ткани. Однако иссекать ее не следует, поскольку в дальнейшем после реиннервации и дифференцировки из подобной культуры ткани могут восстановиться участки роговицы с характерными для нее структурой й функцией.
•84
Описанные выше закономерности помогают офтальмохирургам ориентироваться при выполнении кератопластики. Необходимо учитывать состояние ткани роговицы, окружающей трансплантат, и влияние дополнительных раздражений (швы, повторные манипуляции и т. д.). Каждое повреждение, вызывающее раздражение нервов, приводит к обратному сдвигу в состоянии тканей, отеку и помутнению роговицы, в этом случае отмечается замедление созревания и просветления ткани роговицы после ее пересадки. Однако и значительное уменьшение влияния травмирующего фактора не всегда благоприятно отражается на процессах регенерации и заживления роговичной раны. Например, при использовании в качестве режущего инструмента острого лезвия бритвы, а также тонких швов (супрамид 10:0 — 12 : 0) замедляется пролиферативный процесс регенерации и для заживления раны роговицы требуется более продолжительное время (до l'/г— 3 мес).
Необходимо обратить внимание на тканевую динамику при межслойных (интерламеллярных) пересадках роговицы, которые в последние годы вызвали повышенный интерес у офтальмохирургов. Как правило, при межслойных пересадках отмечается наименьшее повреждение нервной сети роговицы; так, при расслоении стромы повреждаются в основном мелкие анастомозы, что обеспечивает наиболее прозрачное приживление. Сохраненная иннервация роговицы не позволит поверхностному эпителию врастать между слоями стромы и имплантата. Врастание же эпителия при рефракционных и оптических кератопластиках всегда представляет собой значительную опасность, так как утрачивается оптический эффект роговицы вследствие создания непрозрачного слоя и потери ее основного светопреломляющего свойства.
Офтальмохирург должен сориентироваться на предварительных этапах операции: проведении надреза роговицы и приготовлении межслойного кармана, где повреждение должно быть минимальным. Это позволит добиться желаемого результата и предотвратить врастание поверхностного эпителия между стромой роговицы реципиента и имплантата. Как подтвердили результаты наших опытов, врастание эпителия возможно только при неполноценной нервной сети роговичной стромы или ее повреждениях, особенно неоднократных. При реиннервации и повышении дифференцировки стромы роговицы реципиента происходят вытеснение и деструкция эпителиальных межслойных врастаний.
Не следует забывать, что при неинтенсивных помутнениях роговицы, которые могут быть расценены как ателеплазирован-ные участки (с недодифференцированной стромой роговицы) вследствие неполноценной реиннервации, возможно улучшение тканевой структуры роговицы в результате воздействия раздражающих процедур, в частности местного применения тканевой терапии в виде инъекций под конъюнктиву.
Использование раздражающих веществ (дионин, мази, частички сахарной пудры и др.) дает благоприятные результаты. В дан
85
ном случае, по-видимому, эффект обусловлен стимуляцией дополнительной регенерации нервных окончаний, что ведет к повышению степени дифференцировки ткани роговицы с восстановлением ее полноценной чувствительности и прозрачности. Это имеет значение при лечении неинтенсивных помутнений (бельм) роговицы как обоснование терапевтических воздействий торфота, повышающих ее прозрачность [Галацка Я. С., 1980].
С помощью дополнительных раздражений (острая травма в пределах здоровых тканей, пластика сосудисто-нервным лоскутом, введение сыворотки, тканевая терапия и т. д.) можно добиться возобновления процесса регенерации нервных окончаний, которые могут задержать рост ателеплазированных участков тканей. Однако это возможно лишь при условии полноценного функционального состояния всей нервной системы, иначе повторная травма может не оказать необходимого воздействия. Есть, основания предполагать, что воздействием на организм и его нервную систему в направлении усиления ее функциональных и регенеративных свойств и местным смещением сосудисто-нервных, лоскутов можно добиться замедления роста ателеплазированных участков, а также повышения дифференцировки этих участков и-соседних с ними тканей.
В связи с этим следует коротко остановиться на патогенезе миопии высокой степени, при которой наблюдается тенденция к. усиленному растяжению наружной оболочки глаза — склеры с резким осевым удлинением глаза спереди назад, что приводит не только к снижению зрения, но и к тяжелым повреждениям светочувствительной оболочки глаза (сетчатки) вплоть до ее отслойки, С точки зрения тканевой динамики осевое удлинение глаза можно представить как процесс, зависящий от состояния иннерваци-онных аппаратов наружных оболочек глаза при общем уменьшении зрелости тканей всего организма при акселерации на фоне общей гиподинамии. По-видимому, раздражение и местные воздействия на нервы могут отражаться на степени дифференцировки тканей склеры и роговицы, влияя на их стойкость и растяжимость, а значит, и на размеры переднезадней оси как основного» показателя прогрессирования миопии.
По всей вероятности, склеропластика (укрепление заднего полюса глаза), которая будет описана ниже, снимая излишние напряжения, способствует уменьшению раздражения нервного аппарата глаза и через него благоприятно влияет на степень зрелости тканей, обеспечивая функциональную полноценность его оболочек. Не исключено и местное воздействие на ткани за счет реиннервации и реваскуляризации новообразованными нервами и сосудами вокруг трансплантата в зоне заднего полюса глаза. Этому же, вероятно, способствует и более подвижный образ жизни подобных больных после этой операции, укрепляющей глаз [Беляев В. С., 1975].
Описанные выше закономерности могут быть использованы для объяснения механизма местных лечебных мероприятий в офталь
86
мологии, таких, как прижигание термокоагулятором, лазерные воздействия и криоаппликации, трепанация вокруг эрозии роговицы для стимуляции регенеративного процесса, В этом случае локальная денервация «растормаживает» рост ткани в пролиферативной стадии регенерации, значительно ускоряя заживление дефектов роговицы, склеры и конъюнктивы. Последующая реиннервация этих участков способствует созреванию тканей и восстановлению их полноценной функции.
Лечение, по-видимому, должно быть направлено в основном на улучшение иннервации и питания тканей, участки ателепла-зии с недостаточной иннервацией необходимо заменить нормально функционирующими тканями. Это может быть осуществлено с помощью или общего, или местного воздействия: пластического смещения сосудисто-нервных лоскутов на место удаленных участков ателеплазированных тканей или по соседству с ними, как это делают при кожной пластике [Блохин Н. Н., 1955], склеропласти-ке при прогрессирующей миопии, реваскуляризации при различных видах дистрофических процессов в офтальмологии. В последнее время этот метод применяют при лечении пигментной дистрофии [Дмитриев М. А., 1963; Волошиной Д. Б., 1968; Шлопак Т. В., 1970; Базарный В. Ф., 1978; Беляев В. С., Ли Т. В., 1972, 1976; Индейкин Е. Н., 1980; Шпак Н. И., 1978; Agarwal L., 1963, и др.], можно использовать его также при дистрофии сетчатки (возрастной и врожденной).
Есть основания идею склеропластики и реваскуляризации распространить на лечение дистрофических процессов в сетчатке и системе зрительного нерва (при глаукоме, нарушениях питания и поражениях другой этиологии).
Операции на роговице
Роговица и склера, являющиеся наружными оболочками глаза, наиболее подвержены различным внешним воздействиям, травмам, ожогам, заболеваниям. Хирургические операции на роговице и склере занимают значительное место в практике офтальмолога. Методы воздействия на роговицу и склеру претерпели значительные изменения особенно за последние два десятилетия, в связи с рядом технических новшеств в хирургической методике, инструментарии и оборудовании.
Коротко остановимся на иннервации роговицы и особенностях ее реакции на операционное или травматическое повреждение. Нервные ветви проникают в роговицу в радиальном направлении в виде многочисленных стволиков, которые затем дают разветвления, располагающиеся в основном в поверхностных слоях роговицы. Глубокие слои ее иннервированы значительно слабее [Егоров И. Г., 1940; Левкоева Э. Ф., 1953, и др.]. В роговице могут происходить тканевые сдвиги (тканевая динамика) в результате частичной или полной денервации, которая выражается в уменьшении дифференцировки тканей — в «омоложении» и усилении
87
роста роговичных клеток и покровного эпителия [Беляев В. С.» 1964—1984]. Это зависит от направления разреза и степени повреждения нервов. По-видимому, это свойство следует учитывать как при разработке новых методов хирургических вмешательств на роговице и склере, так и при объяснении механизма различных воздействий на поврежденную роговицу. Например, в объяснении действия прижигания, термо-, лазер-, либо криовоздействия на рану или фистулу с вялой регенерацией можно думать об определенном «растормаживании» и перестройке краев раны с большей регенерационной способностью к заполнению дефекта тканей в этом состоянии. Этим же можно объяснить ускорение заживления герпетических поражений поверхности роговицы после окружения их кольцом поверхностной трепанации.
Иными словами, репарационная регенерация тканей роговицы, улучшается за счет ее денервации. Степень же созревания, прозрачность роговицы и ее механическая стойкость находятся в прямой зависимости от возможности и скорости реиннервации поврежденных участков. Сказанное выше следует учитывать при вмешательствах на роговице и склере и выборе хирургической тактики при повреждениях роговицы.
В последнее время при оказании помощи при ранениях роговицы широко применяют роговичные швы (шелковые, капроновые, супрамидные, биологические и др.). Однако в ряде случаев приходится осуществлять конъюнктивальную пластику по Кунту или использовать целлулоидные колпачки, как рекомендует С. П. Петруня при звездчатых ранениях роговицы.
В последние годы усовершенствованы также методы сближения краев роговичных ран. Отмечается тенденция к осуществлению микрохирургической обработки с использованием микроигл и соответствующего (8:0 — 10:0) синтетического, шелкового или биологического шовного материала, а также предпринимаются попытки применить клеевые основы для укрепления краев раны или комбинации клея со швами на края роговичных ран. В качестве клеевых основ используют лиофилизированную плазму [Гольдфельд Н. Г., 1970; Степанов В. К., 1972] или циакриновые основы (МК-2 и др.), которые наносят па края роговичных ран в виде мелких капель.
Сквозные разрезы роговицы и склеры производят копьевидным, линейным, круглым ножом, трепаном, роговичными ножницами и лезвием бритвы. В одних случаях назначение разрезов — только вскрытие и опорожнение передней камеры для воздействия на тот или иной патологический процесс в роговице — парацентез. В других они служат для удаления или прорезания отдельных участков роговицы, т. е. выполняют функцию пластики.
При парацентезе роговицы копьевидным ножом конъюнктиву глазного яблока захватывают фиксационным пинцетом, конец ножа вкалывают или в роговицу у лимба, или после отсепаровы-
88
вания конъюнктивы лимбально, или в склеру у лимба. Нож проводят в переднюю камеру так, чтобы его плоскость была параллельна плоскости радужки, и продвигают его вперед до тех пор, пока не будет достигнута желаемая ширина разреза (3—5 мм). При извлечении нож должен находиться в той же плоскости. Водянистая влага при правильном выведении ножа почти не вытекает, ее выпускают, разводя края разреза шпателем.
Аналогичным образом поступают при парацентезе роговицы линейным ножом, который после фиксации глазного яблока вкалывают в роговицу, лимб или склеру около лимба и проводят в переднюю камеру параллельно плоскости радужки на глубину 3—4 мм. При выведении ножа нажимают лезвием на один конец разреза с целью увеличить его. Круглый нож и скарификатор Грефе (нож типа клюшки) используют для вскрытия роговицы при мелкой передней камере, чтобы избежать повреждения радужки и капсулы хрусталика.
Проведение разрезов трепанами является самостоятельным вмешательством при гнойных язвах роговицы. Их используют также для извлечения из передней камеры инородных тел диаметром 1,5—2 мм и при трепанации склеры с различной целью. Трепаны больших диаметров (4—12 мм) обычно применяют для выполнения пластических операций на роговице и склере.
Конъюнктивальная пластика роговицы введена в широкую практику Н. Kuhnt (1898). Для покрытия дефектов и ран роговицы используют, как правило, поверхностный слой конъюнктивы склеры. При обширных и глубоких дефектах вместе с конъюнктивой можно переносить ткань эпи-склеры.
Для получения эффекта необходимо, чтобы раневая поверхность конъюнктивального лоскута плотно соприкасалась с роговицей, лишенной эпителия и передней пограничной пластинки. Дефект или рапу покрывают свободным лоскутом конъюнктивы или лоскутом на одной либо двух ножках (рис. 52, а), надвигают на всю роговицу конъюнктиву, отсепарованную почти до экватора глаза, или, наконец, закрывают всю роговицу конъюнктивой, от-сепаровав ее до экватора вокруг всего глаза и сблизив края узловым или кисетным швом (рис. 52, б).
Операции при фистулах роговицы производят с целью добиться заживления дефекта роговицы, возникшего после сквозных язв или повреждений. Наиболее эффективное средство лечения фистулы — оперативное вмешательство. При этом применяют электрокоагуляцию или криоаппликацию краев фистулы, дав возможность образоваться новому молодому тканевому про-лиферату на месте дефекта поврежденных тканей. При сохранении передней камеры кончиком слабо нагретой петли электрокоагулятора прижигают вначале ткани, окружающие фистулу, а аатем ее вход. При отсутствии передней камеры эту процедуру следует проводить с большой осторожностью, чтобы не повредить радужку и хрусталик.
89
52. Конъюнктивальная пластика по Кунту (схема).
а — лоскутом на двух ножках; б — двумя перекрещивающимися лоскутами.
Описанную манипуляцию можно объединить с конъюнктивальной пластикой области прижигания по Кунту. Вначале следует приготовить конъюнктивальный лоскут и, наложив провизорные швы, проверить, покрывает ли он зону фистулы, а затем провести электрокоагуляцию или криоаппликацию краев и входа фистулы.
В трудных, упорных случаях закрытие фистулы осуществляют после несквозной трепанации ее краев трепаном соответствующего диаметра. Образовавшийся дефект закрывают диском из донорской роговицы, взятым на соответствующую глубину, который укрепляют лоскутом конъюнктивы по Кунту или микрошвами. Можно произвести межслойную пересадку роговицы, расслоив 90
строму вокруг фистулы в средних слоях и перекрыв ход фистулы трансплантатом из роговицы.
Нами [Беляев В. С. и др., 1985] применяется интерламеллярная пластика фистулы или раны роговицы диском диаметром до 6 мм, а в случаях повреждения хрусталика — плосковыпуклой биолинзой из аллороговицы с целью коррекции афакии. Роговицу больного расслаивают па глубине 0,3 мм через надрез длиной 4 мм, отступя 2 мм от лимба, вначале по периферии, а затем в зоне фистулы или раны от периферии к краям фистулы. Затем в роговичный карман вставляют ранее приготовленный имплантат, который и перекрывает раневой канал. Имплантат удерживается между слоями роговицы обычно без дополнительной фиксации.
Пересадка роговицы
Возвращение зрения людям, ослепшим вследствие образования бельма, издавна было одной из основных проблем офтальмологии. Исследовательский поиск проводился по многим направлениям. Попытка пересадить роговицу кролика была сделана еще в 1824 г. F. Riesinger, однако подлинный успех пришел значительно позже. В 1906 г. Е. Zirm описал случай приживления у человека роговичного трансплантата, длительное время сохранявшего прозрачность. Этому предшествовало два важных события. Во-первых, было предложено использовать для кератопластики роговицу, взятую не от животных, а от другого человека [Power Н., 1872]. Во-вторых, A. Hippel (1877) разработал технику частичной сквозной пересадки роговицы с помощью изобретенного им трепана. Вслед за Е. Zirm прозрачного приживления трансплантата у некоторых больных добились А. Ф. Шимановский (1912), W. Lohlein (1910), М. Magitot (1911, 1912), О. Plange (1912). Более широкое применение пересадки роговицы в клинике связано с именем чешского офтальмолога A. Elschnig. С 1908 по 1913 г. в Пражской клинике были произведены 203 операции пересадки роговицы, приживление трансплантата с сохранением его прозрачности отмечено у 31 больного.
В середине 30-х годов мировой центр изучения пересадки роговицы переместился в Одессу благодаря выдающимся работам В. П. Филатова и представителей его школы. В. П. Филатов детально разработал основной метод кератопластики — частичную сквозную пересадку роговицы — и решил целый ряд принципиально важных вопросов этой проблемы. Была значительно усовершенствована техника операции, предложены новые инструменты для иссечения роговицы донора и формирования отверстия в бельме (трепаны ФМ-I, ФМ-Ш и др.), разработан способ укрепления трансплантата конъюнктивальной лентой. Огромное значение имело внедрение в широкую практику использования роговицы глаз трупов в качестве трансплантационного материала. Была предложена классификация бельм [Филатов В. II., Бушмич Д. Г.,
91
1947], установлены показания и противопоказания к различным видам пересадки роговицы, разработаны и опробованы разнообразные методы фиксации трансплантата с помощью швов, контактных чашечек Петруни и т. д.
Пересадку роговицы в Советском Союзе выполняют в глазных стационарах многих городов, она действительно стала массовой операцией. Таким образом, отечественная офтальмология заняла ведущее место в разработке этой проблемы [Пулковская Н. А., 1950-1970].
В 1967 г. в Вене на Международном симпозиуме трансплантологов была принята новая терминология [Коваленко П. П., 1975}. «Пластика» — термин для обозначения трансплантации без сшивания кровеносных сосудов, т. е. пересадки тканей. Термин «аутокератопластика» применяют в тех случаях, когда имеется возможность взять роговицу одного, как правило, слепого глаза и пересадить на другой глаз того же больного. Ксенотрансплантация («гетеропластика» по старой классификации)—пересадка тканей между организмами разных видов. Аллопластика (гемопластика) роговицы (от греч. alios — другой) представляет собой пересадку материала от другой особи того же вида, но иного генетического происхождения. Эксплантация (аллотрансптант?-ция) — пересадка небиологического субстрата.
В зависимости от поставленной цели различают оптическую (удаление бельма, улучшение зрения), рефракционную (исправление аномалий рефракции), тектоническую (ликвидация стафиломы или закрытие дефекта), профилактическую (предотвращение перфорации при истончении роговицы), терапевтическую (лечение некоторых заболеваний роговицы), мелиоративную (обогащение бельма роговичными элементами), и косметическую пересадку роговицы.
По технике пересадки роговицы различают полную (тотальная) и почти полную сквозную кератопластику — удаляют всю мутную роговицу и замещают дефект роговицей донора; полную и почти полную послойную пересадку производят только при наличии не слишком эктазированных бельм с оптической целью или для мелиорации почвы роговицы. Частичная сквозная пересадка роговицы — наиболее разработанная и результативная операция в отношении восстановления зрения. Частичную послойную пересадку центральных передних слоев роговицы применяют при небольших и несквозных бельмах. Трансплантат можно фиксировать лентой конъюнктивы по Филатову, швом край в край или с помощью биологического клея.
При послойной периферической пересадке по Пучковской удаляют поверхностное бельмо, а трансплантат представляет собой только подковку из поверхностных слоев роговицы донора, которая преграждает путь новообразованным сосудам из конъюнктивы. Центральная часть роговицы реципиента восстанавливается вследствие регенерации оставшихся глубоких слоев стромы.
Межслойная пересадка (интерламеллярная) — наименее раз
92
работанная операция, ее используют с рефракционной и оптической, а также лечебной и косметической целями [В. В. Войпо-Ясенецкий, В. С. Беляев, И. В. Моржат].
Кроме того, производят полную сквозную пересадку с широкой каймой склеры и даже пересадку переднего отрезка глаза. В нашей стране первым применил этот вид пересадки А. Ф. Шимановский (1912). В настоящее время пересадку роговицы с каймой склеры производят Н. А. Пучковская, 3. Д. Титаренко и А. И. Гмыря. Они получили обнадеживающие результаты и при пересадке переднего отдела глаза.
Не имея возможности подробно описать все виды пересадок, остановимся на классической частичной сквозной пересадке роговицы по Филатову и некоторых видах пересадок, получивших развитие в последние годы.
Техника частичной сквозной пересадки роговицы по Филатову. После обработки операционного поля 1% раствором бриллиантового зеленого (на 70% этиловом спирте) производят эпибульбарную анестезию (трехкратная инстилляция в конъюнктивальный мешок 0,5% раствора дикаина).
Акинезия век по способу Ван-Линта в модификации Виллара предшествует ретробульбарной анестезии, которую осуществляют путем введения через кожу век в нижненаружном квадранте 2 мл 1% раствора новокаина. На лоб и лицо больного накладывают диадему Филатова—Кальфа, к которой швами фиксируют веки: два на верхнее веко и один на нижнее. (Мы в нашей практике используем диадему Романико с модифицированными векоподъем-никами.) Под конъюнктиву верхней и нижней части глазного яблока вводят по 0,5—1 мл 1% раствора новокаина.
Сверху на месте переходной складки делают разрез конъюнктивы длиной 8—10 мм и отсепаровывают ее от склеры до лимба. Длина ленты должна быть 10—12 мм. В средней части ленту выкраивают без подслизистого слоя. У нижнего края роговицы производят разрез конъюнктивы длиной 8—10 мм и отсепаровывают ее от подлежащей склеры до места прикрепления сухожилия нижней прямой мышцы. На верхнюю и нижнюю прямые мышцы глаза накладывают уздечные швы, на свободный конец ленты конъюнктивы у ее углов — провизорные швы (по одному на двух иглах каждый); иглы проводят под отсепарованную внизу конъюнктиву, концы швов не завязывают. Через середину свободного конца ленты проводят третий шов на одной игле, которую ведут сзади наперед сквозь край отсепарованной внизу конъюнктивы (рис. 53). Еще лучше накладывать и этот шов на двух иглах. Убедившись с помощью потягивания швов в том, что лента хорошо покрывает бельмо, отодвигают конъюнктиву и швы в стороны. Следует стремиться к тому, чтобы лента равномерно облегала поверхность роговицы, не была бы свободной и после завязывания швов хорошо фиксировала трансплантат.
Затем приступают к иссечению трансплантата из глаза донора трепаном ФМ-IV, который состоит из стального цилиндра с режу-
93
53. Частичная сквозная пересадка роговицы по Филатову (схема).
а — наложение швов на конъюнктивальную ленту; б — положение конъюнктивальной ленты и швов перед трепанацией бельма.
щей коронкой диаметром 4—5 или 6 мм. Внутрь цилиндра входит тщательно пришлифованный поршень. Перед трепанацией глаза трупа поршень вытягивают из трепана до совпадения имеющейся на нем метки с верхним краем трепана. Глаз донора предварительно тщательно обмывают свежим водным раствором бриллиантового зеленого (1 :2000). Трансплантат иссекают из центральной части роговицы. Трепан с иссеченным диском кладут под колпак чашки Петри. Специальным отметчиком определяют центр роговицы: кружок отметчика, смазанный метиленовым синим или бриллиантовым зеленым, при соприкосновении с поверхностью бельма оставляет кольцевидный след, по которому и производят трепанацию. Ассистент фиксирует глаз уздечными швами. Хирург, удерживая глаз у лимба фиксационным пинцетом, устанавливает коронку трепана ФМ-Ш диаметром 4,05, 5,05, 6,05 мм в пределах намеченного отметчиком кольца (рис. 54, а).
Трепан ФМ-Ш состоит из стального цилиндра, канал которого имеет горизонтальную перегородку на расстоянии 7,5 мм от режущего края. Цилиндрическая режущая коронка трепана имеет длину 1 мм, а затем конусообразно утолщается, для того чтобы создать герметизацию при сквозной трепанации бельм (рис. 54, б). Когда лезвие трепана, после того как прорежет бельмо, пройдет в переднюю камеру, иссеченный диск и водянистая влага смогут проникнуть в канал лишь на очень небольшую глубину вследствие сопротивления воздуха в канале трепана. Даже при самой мелкой передней камере трудно повредить хрусталик, потому что сохранившаяся в камере влага препятствует этому. Камера опорожняется только в момент снятия трепана. После ревизии очищают трепанационное отверстие от сгустков крови и сращений бельма с радужкой, в трепанационное отверстие вводят одну кап-
94
а б
54. Трепанация бельма (схема).
а — положение трепана ФМ-Ш во время трепанации бельма; б — трепан ФМ-Ш на разрезе.
лю 1% раствора атропина и укладывают диск трансплантата, выталкивая его движением поршня из режущей коронки трепана ФМ-IV.
Трансплантат покрывают заготовленной конъюнктивальной лентой, завязывают сначала средний шов, а затем боковые. Удаляют уздечные швы, затем швы, удерживающие веки. В конъюнктивальный мешок инсталлируют одну каплю 1% раствора атропина, субконъюнктивально — 75 000 ЕД пенициллина. Накладывают бинокулярную повязку. Производят ежедневный туалет. Швы обычно снимают на 10-е сутки, одновременно отсекают конъюнктиву у ее основания. Эту процедуру выпол
няют на операционном столе. Основным противопоказанием к кератопластике является вторичная глаукома.
В последние годы разработаны модификации частичной сквозной пересадки роговицы. Для фиксации трансплантата используют целлулоидные колпачки [Петруня С. П., 1960] и так называемые каркасные диски [Абрамов В. Г., 1971]. Они представляют собой кольца из нержавеющей стали толщиной 0,3 мм с внутренним диаметром 10—13 мм. Кольцо запаивают между двумя прозрачными полиэтиленовыми пленками путем воздействия на них высокой температуры. Затем трепаном диаметром 1—1,5 мм в пленке высверливают 20—25 отверстий. Это придает ей дополнительную эластичность и способствует лучшему омыванию трансплантата слезой. Диски, подшитые четырьмя швами за стальное кольцо к эписклере, прочно удерживают трансплантат в коже. На следующий день больным разрешают недолго сидеть в постели, на 4—7-е сутки — вставать. Опыт показал, что этот способ позволяет фиксировать пересаженные роговичные диски диаметром 4— 8 мм, избежать их проминирования и контролировать состояние переднего отрезка глаза в послеоперационном периоде. Г. А. Уль-дановым (1960, 1961) проведены пересадки роговицы в условиях жаркого климата, когда, по его словам, особенно остро возникает проблема донорского материала.
Как бы хорошо не укреплялся трансплантат бесшовными способами, будущее все-таки принадлежит тончайшим швам из различных материалов, которые накладывают миниатюрными иглами под микроскопом. Уже в настоящее время такие способы с применением шелка или супрамида (10 : 0 — 12 : 0) получают все более широкое распространение при кератопластике. Подобные швы лучше укрепляют трансплантат, не вызывают или почти не вызы-
95
вают помутнения в местах проколов и могут оставаться в глазу в течение длительного времени — до полного завершения процесса сращения тканей роговицы.
Частичная послойная пересадка роговицы. Операция разработана В. П. Филатовым в 1939 г. Описано несколько ее модификаций. Суть операции заключается в срезапии мутных слоев роговицы на участке диаметром 4, 5 или 6 мм и замене их роговичным трансплантатом соответствующего размера, представляющим собой передние слои роговицы глаза донора.
После подготовки операционного поля, обработки кожи век и окружающих тканей спиртовым раствором бриллиантового зеленого производят акинезию, эпибульбарную и ретробульбарную анестезию. На верхнюю прямую мышцу накладывают уздечный шов. Для фиксации век можно использовать обычный векорас-ширитель.
Для укрепления трансплантата при частичной послойной пересадке чаще всего применяют перекидные швы по Элыпнигу или комбинируют их с яичной пленкой (по предложению В. П. Филатова), которая предохраняет трансплантат от повреждения нитями швов. Для наложения перекидных швов используют конъюнктивальный шелк, в настоящее время с этой целью применяют рассасывающиеся материалы [Горгиладзе Т. У., 1979, 1983]. Иглой проводят шов в эписклере на меридиане 12 часов параллельно лимбу. Один конец этого шва проводят таким же образом на ^-часовом меридиане. Так же накладывают второй шов, который проводят на 3- и 9-часовом меридиане. Швы завязывают один раз. При правильном наложении завязанные швы располагаются под прямым углом, образуя фигуру двухконтурного креста. После проверки швы разводят. Из пленки яйца, сваренного вкрутую, вырезают кружок диаметром 10—11 мм. По краям его делают несколько насечек длиной 1,5—2 мм, для того чтобы пленка лучше прилегала к поверхности роговицы. Подготовленную пленку хранят в изотоническом растворе хлорида натрия.
Трансплантат из глаза донора выкраивают трепаном ФМ-V диаметром 5 мм. С помощью этого трепана можно устанавливать режущую коронку на определенную глубину, так как поршень трепана по винтовой нарезке может уходить внутрь на различную глубину соответственно градуировке на шкале трепана.
После того как диск трансплантата частично прорезан, обычно на глубину 0,3—0,4 мм, с помощью круглого ножа его отслаивают от подлежащих слоев стромы роговицы донора. Этим же трепаном прорезают поверхностные слои бельма. Затем круглым ножом отделяют передние слои роговицы (бельмо) на глубине трепанационного надреза. Можно производить расслаивание слоев стромы после прорезывания ее на строго дозированную глубину (0,3— ‘0,4 мм) с последующей трепанацией поверхностных слоев бельма или стромы донора. Трансплантат переносят на дефект роговицы оперируемого глаза и тщательно расправляют шпателем. На 96
тра нс и л и птат и окружающую роговицу кладут кружок ив яичной пленки и расправляют предварительно наложенные перекидные швы, которые после этого завязывают, оставляя узел в области л и мбн. Производят инстилляции 1 % раствора атропина и 20% рнсгпора сульфацил-натрия. Накладывают бинокулярную поникну.
Для укрепления трансплантата можно использовать или конъюнктивальную ленту по методике, которую применяют при частичной сквозной пересадке, или швы край в край. Для удобства мы накладываем пгвы на край трансплантата после его трепанации и отслаивания по окружности разреза круглым ножом.
I После наложения четырех швов окончательно отделяют центральный участок трансплантата от подлежащей ткани стромы и на швах с иглами переносят его на дефект глаза реципиента, укрепляя к краю трепанационного разреза. Дополнительные швы накладывают после завязывания четырех основных в промежутки между ними.
Почти полная и полная послойные пересадки технически отличаются только размером трансплантата и количеством швов, накладываемых для его укрепления. Несколько обособленно стоит периферическая послойная пересадка роговицы, предложенная и разработанная II. Л. Пучковской (1954—1957). Основной принцип операции совершенно иной. Получение оптического эффекта основано па использовании и стимуляции регенеративных свойств тканей роговицы оперируемого глаза, а не на замене мутного бельма трансплантатом из прозрачной роговицы, как при других видах пересадок. Основная цель этой пересадки — с помощью подковообразного трансплантата, пришитого перилимбально, преградить путь распространению рубцовой ткани из окружающих ; участков па роговицу. В этом случае центральные участки, не , закрытые трансплантатом стромы, регенерируют прозрачно за 1 счет сохранившихся глубоких слоев роговицы.
Полная сквозная кератопластика с широкой каймой склеры и пластика переднего отрезка глазного яблока (рис. 55). Операции подробно разработаны и описаны А. И. Гмырей (1960—1969). Их применяют при тяжелых повреждениях глазного яблока (гнойное расплавление / всей роговицы, некроз роговицы и переднего отрезка глазного яблока).
Предоперационная подготовка больных обычная: акинезия, инъекция 1 мл 2% раствора новокаина в толщу век, для того чтобы обеспечить безболезненное проведение швов-держалок. Слизистую оболочку отрезают у места прикрепления на всем протяжении и отсепаровывают вглубь над стафиломой и на 2—3 мм над нормальной склерой. Накладывают четыре шва-держалки на > эписклеру на 2—3 мм, дальше заднего края стафиломы. У самого д края стафиломы, полностью сохраняя склеральную ткань, даже ее f истонченные поверхностные слои, косо кзади производят надрез склеры на 2/з ее толщины скребцом, который ставят под углом
7 Руководство по глазной хирургии
97
55.
Полная сквозная кератопластика е каймой склеры и пересадка переднего отрезка глазного яблока по Гмыре (схема), а — скошенные разрезы.
примерно 30° к поверхности склеры. Этот косой надрез позволяет сохранить поверхностные истонченные слои склеры глаза больного. При дальнейшем выкраивании измененных тканей, сохраняя косое направление разреза в глубине, продолжают его до толстых слоев склеры. Применяя такой прием, получают отверстие меньшего диаметра. После завершения кругового надреза измеряют его диаметр с помощью циркуля.
Сохраняя такой же диаметр и центральное расположение роговицы, намечают место кругового надреза
склеры на глазу, взятом от трупа. Скребцом, установленным под таким же углом, как и при надрезе склеры глаза реципиента, производят надрез склеры глаза донора на 2/з его толщины. На внутреннюю губу образовавшейся склеральной раны накладывают четыре шва соответственно 12; 3; 6 и 9 часам, при этом склеру прокалывают на ‘А ее толщины. Глаз донора вскрывают скребцом по ранее произведенному надрезу склеры. В разрез вводят изогнутые маленькие ножницы с тонкими браншами. Установив плоскости бранш соответственно наклону скребца, делают круговой разрез склеры. При таком положении ножниц скошенность разреза склеры сохраняется. Трансплантат провизорно пришивают к наружной губе склерального надреза у края стафиломы на 12-, 2-, 6- и 9-часовом меридианах и откладывают в сторону.
Глаз реципиента вскрывают и удаляют стафилому скошенным разрезом, как при выкраивании трансплантата. Стафилому чаще удаляют вместе с измененным хрусталиком. Затем осторожно затягивают и завязывают диаметрально противоположные швы. В промежутках накладывают по три несквозных склеральных шва аналогично предварительно наложенным. Заканчивают операцию наложением обвивного шва на слизистую оболочку на расстоянии 1,5 мм от ее края, который стягивают до тех пор, пока роговица не будет покрыта конъюнктивой на 1—1,5 мм. При таком натяжении обвивного шва край конъюнктивы паходится у лимба трансплантата, где он и прирастает.
Обычно в переднюю камеру вводят пузырек стерильного воздуха. Это особенно показано при выпадении стекловидного тела. Под конъюнктиву вводят 40 000—50 000 ЕД пенициллина в 0,5 мл
98
изотонического раствора хлорида натрия для профилактики послеоперационного нагноения. Производят инстилляции 1% раствора сульфата атропина. Накладывают бинокулярную повязку. Больной в течение 10 дней соблюдает постельный режим. Ежедневно дважды делают перевязку. Применяют 30% раствор суль-фацил-натрия и 1 % раствор атропина в каплях, внутримышечно вводят пенициллин в течение 3—4 дней.
В первые дни после операции возникает отек роговичной части трансплантата, уменьшающийся через 4—6 дней и исчезающий к 8—9-му дню. Через 13—20 дней в центре пересаженной роговицы появляется эрозия эпителия, исчезающая через 1—2 нед. К исходу 5—6-й недели обычно не наблюдается признаков раздражения глаза и больного выписывают на амбулаторное лечение.
Методика операции пересадки переднего отрезка глазного яблока аналогична описанной выше. Отличие заключается в том, что трансплантат выкраивают с радужкой и отростчатой частью ресничного тела, а на глазу реципиента удаляют ткани переднего отрезка глазного яблока, чаще вместе с хрусталиком.
Пересадку переднего отрезка глазного яблока производят больным, у которых имеются его односторонние обширные и глубокие изменения. Одновременно исправляют и косметический дефект. В случае приживления трансплантата и достаточной прозрачности роговицы заметно улучшается внешний вид, так как радужку трансплантата подбирают под цвет второго глаза реципиента. Схема лечения в послеоперационном периоде аналогична описанной 'выше.
Оперативное лечение рубцового ксероза. Операция предложена В. Е. Шевалевым и В. П. Филатовым (1951). Опа представляет собой перемещение протока околоушной желе-иы (стенопов проток) к глазу с целью возместить недостаток слепы слюной. После выполнении анестезии (рис. 56) щеку оття-1ИНВЮТ шнпми, нродпаритольно наложенными па верхнюю и нижнюю губы больного, том самым открывая доступ к месту операции. Найдя отверстие протока околоушной железы, который открывается в полость рта у второго коренного зуба под небольшим бугорком слизистой оболочки, в него вставляют зонд и проводят его до места выхода протока из околоушной железы. Произведя инъекцию 0,5% раствора новокаина, вокруг отверстия протока вырезают кружок слизистой оболочки диаметром 1 см. На кружок накладывают четыре шва. Удерживая рукой швы и зонд, orcoiinpoiibiiiiiKiT проток с кружком слизистой оболочки от окружающих тканой. После этого надрезают слизистую оболочку гла-па у пижпоппружпого угла глазной щели и по пальцу, вставленному в рану, находящуюся во рту, проводят навстречу ему ножницы. Затем в этот канал проводят зонд с ушком и, привязав к аопду швы, ранее наложенные на кружок слизистой оболочки вокруг отверстия протока, вытягивают обратно зонд и таким образом перемещают проток к глазу (рис. 57). Кружок слизистой
7»
99
56. Проведение анестезии при операции перемещения протока околоушной железы к глазу по Шевалеву.
1 и 2 — точки первой и второй инъекций. Стрелками указано направление иглы при введении 0,25% раствора новокаина.
57. Перемещение протока околоушной железы к глазу (схема).
оболочки рта прикрепляют швами к слизистой оболочке конъюнктивального мешка. Рану на внутренней поверхности щек зашивают.
В последние годы в методику этой операции внесено ценное дополнение [Нурмамедов Н. Н., 1971]: с помощью трубки, образованной из слизистой оболочки щеки, удлиняют проток околоушной железы. Это позволяет получать более стойкие послеоперационные результаты.
Г. А. Ульданов (1961, 1965) в условиях жаркого климата произвел пересадки протока околушной железы в конъюнктивальные полости обоих глаз с интервалом между вмешательствами в 1 год, и даже при двусторонней операции не наблюдал каких-либо нарушений пищеварения.
Трансплантационный материал. Для кератопластики используют аутопластический, аллопластический (гомопластический) и брефопластический трансплантационный материал. Аутопластический материал применяют относительно редко. Наиболее широко используют аллопластические ткани.
В последнее время установлена возможность использования роговиц плодов человека и умерших новорожденных [Беляев В. С., 1954—1972; Блаватская Е. Д., 1963; Юшко Н. А., 1971, и др.]. В настоящее время в основном применяют трупный материал. Согласно постановлениям СНК СССР от 15.09.37 г. и Наркомздра-ва СССР от 21.01.38 г., разрешено изъятие глаз у трупов без согласия родственников.
По приказу Министерства здравоохранения СССР № 86 от 16.02.54 г. «О широком внедрении в практику окулистов пересадки
100
роговицы» использовать глаза умерших людей для выполнения кератопластики больным с бельмами разрешается окулистам, работающим в клиниках и больницах, оснащенных оборудованием для глазных операций. Согласно утвержденной инструкции, врач может производить изъятие глаз из трупов, доставленных в морг, без согласия родственников, обязательно соблюдая при этом условие — максимально щадить лицо умершего. Этого достигают введением в полость глазницы после энуклеации ватного шарика либо протеза или наложением швов на веки. Изъятие глаз у умерших может быть произведено через 2 ч после смерти до получения результатов патологоанатомического исследования, но глаза могут быть использованы только после получения этих данных. Для изъятия глаз из трупов необходимо согласие заведующего моргом, а если труп подлежит судебно-медицинскому исследованию, то и согласие судебно-медицинского эксперта. Об изъятии глаза составляют акт, который подписывают врач, производивший энуклеацию, и представитель учреждения, где находится труп. В том случае, если заведующий моргом не разрешает использовать глаза трупа для кератопластики, он должен мотивировать свой отказ в письменной форме.
Противопоказаниями к использованию глаз для кератопластики являются:
1) инфекционные заболевания, приведшие к смерти, а также острые инфекционные заболевания, которые не были причиной смерти, ио имелись перед смертью;
2) злокачественные новообразования (рак, саркома и др.);
3) туберкулез или наличие туберкулезных очагов, обнаруженных на вскрытии;
4) отравление ядами, способными вызвать гемолиз;
Г>) сифилис;
<>)• набухание роговицы глаза утопленников.
Отравлении ядовитыми веществами, быстро действующими на жизненно важные центры, например цианидами, угарным газом, алкоголем и др., п'’ являются противопоказанием к использованию глаз трупа для пересадки роговицы. Преклонный возраст донора также не является противопоказанием к применению роговицы для кератопластики.
Перед извлечением глаза кожу век и носа трупа обрабатывают тампоном, смоченным в 70% этиловом спирте. Руки врача, производящего энуклеацию, должны быть стерильными или же необходимо надеть стерильные перчатки. Инструменты для энуклеации следует просторилизовать. Перед операцией в конъюнктивальный мешок вводят 2 — 3 капли 30% раствора сульфацил-патрия.
Извлеченный глаз помещают в стеклянную баночку (бюкс) с плотно закрывающейся крышкой роговицей вверх, на баночку наклеивают этикетку с паспортными данными и номером трупа. Глаза в баночках консервируют при температуре +2-1-4 °C (по
Филатову). Необходимо следить, чтобы температура не опуска-
101
лась ниже О °C. Оптимальным для консервации глаз трупа является срок 2—3 сут, но опыт показал, что можно использовать глаза и после 4—5-суточной консервации.
Одновременно с энуклеацией глаз у трупа берут кровь из сердца. Шприц и игла должны быть сухими или промыты изотоническим раствором хлорида натрия. Вкол иглы производят в третье межреберье, немного отступя от грудины влево. Иглу направляют кнутри и книзу. Для анализа достаточно взять 4— 5 мл крови. Рекомендуется выполнять реакцию Вассермана в модификации Вайнштейна—Резниковой. Ответ получают в течение 30 мин.
Кроме описанного выше способа консервации глаза во влажной камере (по методу Филатова), используют также консервацию роговицы глубоким замораживанием и лиофилизацией, однако эти методы сложны для практического применения, для их применения требуются специальный персонал и дорогостоящая аппаратура. При кератопластике, особенно в срочных случаях (например, при ожогах), используют также роговицы, консервированные обезвоживанием силикагелем или алюмогелем [Попов Г. П., 1965; Гольдфельд Н. Г., 1967, и др.].
В настоящее время в связи с резко расширившимися показаниями к проведению пересадки роговицы как с оптической, так и особенно с лечебной целью нельзя полностью удовлетворить все возрастающие потребности офтальмохирургов в пластическом материале только с помощью описанных выше методов консервации. Это обстоятельство является постоянным стимулом к разработке методов долговременной консервации и заготовки донорского материала. В течение последнего десятилетия в нашей стране интенсивно проводились исследования по совершенствованию уже известных методов консервации роговицы — криогенный, силиковысушивание, лиофилизация, формалинизация и т. д. — и предложены новые методы — консервация в сбалансированных растворах типа синтетической питательной среды 199 с добавками, в гамма-глобулине, раздельносредный способ, консервация в барокамере, мумификация под защитой антиоксидантов и др. [Гундорова Р. А. и др., 1972—1980; Савушкина Н. М., 1973; Линник Л. Ф., Подопригора Б. Н., 1976; Христофоров В. С., Багров С. Н., 1977; Бочкарева А. А., Темиров Н. Э., 1978; Брошевский Т. И., Протасов А. И., 1978; Стукалов С. Е., Болдырев В.П., 1978; Попова 3. С. и др., 1978; Гольдфельд Н. Г., 1978; Каминская Н. Н. и др., 1980, и дрД.
Разработаны также новые методы определения жизнеспособности донорской роговицы — кератохемилюминесценция [Травкин А. Г., Бордюгова Г. Г., 1974], кератоимпедансометрия [Трин-чук В. В., 1976, 1978] и кератопенефлюорометрия [Попова 3. С. и др., 1979]. В Куйбышеве по инициативе Т. И. Брошевского создан первый отечественный глазной банк, в котором в качестве основной методики используют консервацию роговицы в противо-коревом гамма-глобулине [Брошевский Т. И., Яхина Н. М., 1972— 102
19781. Многолетние исследования авторов свидетельствуют о том, что изолированную донорскую роговицу, консервированную по данной методике, можно применять в течение I’/a лет для послойной и 3 мес для сквозной кератопластики.
Из различных криогенных методов наибольшего внимания васлуживает программированная низкотемпературная (—196°С) консервация роговиц с использованием криопротектора — диметилсульфоксида. Этот метод позволяет создать долгосрочный запас донорского материала для сквозной кератопластики [Capel-la A. et al., 1972; Polack С., 1978].
В нашей стране аналогичные методы разработаны в Институте криобиологии АН СССР [Юрченко Т. Н., Шарлай Т. М., 1977], а также во Всесоюзном научно-исследовательском институте глазных болезней (ВНИИ глазных болезней) и Центральном научно-исследовательском институте гематологии и переливания крови [Попова 3. С. и др., 1978, 1979]. Авторами использованы оригинальные криопротекторы — 10% раствор ПЭО-400 и 10% раствор диметилацетамида (ДМАА), который, по данным А. Ю. Ярославцева и соавт. (1977), превосходит по своим свойствам диметилсульфоксид. Опыт клинического использования криоконсервиро-ванной роговицы при послойной кератопластике показал, что она имеет преимущества перед роговицей, высушенной силикагелем, и примерно одинаковые трансплантационные свойства с роговицей, консервированной во влажной камере [Непомящая В. М. и др., 11)78; Каспаров А. А. и др., 1979]. В. В. Волков и М. М. Дронов (1981), использовавшие роговицу, криоконсервированную под защитой ДЭО-400, хранившуюся в течение нескольких месяцев в банке при низкой температуре, отметили положительные результаты у всех 23 больных, которым с ургентной целью была произведена сквозная кератопластика. С помощью метода авторадиографии 'Г. II. Юрченко и соавт. (1981) продемонстрировали сохранность андотолиальных клеток донорского лоскута криокон-серпировапной роговицы при прозрачном ее приживлении у реципиента.
Следует отметить, что именно при наличии достаточного запаса донорских роговиц и крови, хранящихся в банке при низкой температуре, возможно проведение тканевого типирования (HLA-антигены и др.). В нашей стране первые исследования по подбору донора и реципиента по HLA-системе, проведенные в Одесском научно-исследовательском институте глазных болезней им. В. И. Филатова, способствовали улучшению прогноза пересадки роговицы при постожоговых сосудистых бельмах [Игнатов Р. К. и др., 1977].
Применение в клинической практике нового метода исследования роговицы — зеркальной микроскопии — позволяет прижизненно дать количественную и качественную оценку изменений эндотелия при различных состояниях роговицы и глаза [Краснов М. М. и др., 1982]. Этот метод имеет большое значение' при отборе качественного донорского материала, так как состояние
103
эндотелия, устанавливаемое с его помощью, в значительной степени определяет жизнеспособность роговицы донора и ее выживаемость при сквозной кератопластике. Исследования, проведенные в отделении патологии роговицы ВНИИ глазных болезней [Каспаров А. А., Ермаков Н. В., 1962], свидетельствуют о большей информативности зеркальной микроскопии эндотелия по сравнению с биомикроскопией при отборе неконсервированной роговицы донора непосредственно перед операцией и о наличии корреляционной связи между состоянием эндотелия и исходом сквозной кератопластики.
Хирургическое лечение кератоконуса. Известно несколько типов спонтанного растяжения роговицы, которые различаются по площади и месту ее поражения: кератоконус, кератоторус и кератоглобус. В начальном периоде основным методом лечения таких эктазий являются контактные линзы. Однако твердо установленных данных о том, что они способны приостановить развитие болезни, не существует. По данным G. Gorfy (1964), 14% больных не переносят подобные линзы, 6% не могут их долго носить, а при длительной контактной коррекции некоторых больных наблюдается генерализация истончения.
При выраженной деформации и помутнении роговицы производят хирургическое вмешательство — сквозную кератопластику [Пучковская Н. А., Титаренко 3. Д., 1978]. Частота успешно проведенных операций колеблется от 62,2% [Owens W., 1948] до 100% [Копаева В. Г., 1982; Moore Т., 1971]. Однако у молодых больных даже спустя 10—15 лет может возникнуть рецидив [Alberth В., 1971].
Основную группу больных с хроническими кератоэктазиями составляют лица, у которых трудно подобрать контактную коррекцию, а производить сквозную пересадку роговицы еще преждевременно. Для лечения этих больных Э. Л. Сапегина и А. И. Горбань (1984), основываясь на положительном опыте гемопломбировки острого кератоконуса, предложили способ, смысл которого состоит в пломбировке щелевидных пространств измененной стромы аутоплазмой или аутокровью, которую вводят интракорне-ально. После эпибульбарной капельной анестезии на неистончен-ном участке роговицы осколком лезвия производят насечку на 2/з ее толщины (рис. 58, а). Из надреза примерно до вершины эктазии специальным микрошпателем или роговичным ножом формируют глубокий и узкий тоннель (рис. 58, б), в который через микроканюлю вводят аутоплазму или аутокровь, заполняющую внутристромальные пустоты (рис. 58,в). Вводить жидкость следует осторожно, небольшими порциями, так как под ее давлением задняя пограничная пластинка (десцементова мембрана) прогибается кзади, в результате чего повышается тургор глаза. При значительном истончении роговицы следует опасаться также микроперфораций этой пластинки концом шпателя. В наиболее опасных зонах желательно слегка отклонять его кверху. Этим приемом в зоне кератоэктазии создается массивная биопломба, 104
58. Интракорнеальная пломбировка аутоплазмой крови.
а, б, в — объяснение в тексте; 1 — зона кератоконуса, 2 — лезвиедержа-тель, 3 — микрошпатель, 4 — канюля, 5 — строма роговицы, пропитанная плазмой.
которая рассасывается довольно быстро, но, по-видимому, не полностью. Только ее частичной организацией можно объяснить наблюдающееся после вмешательства утолщение оптического среза роговицы и уменьшение выпячивания кератоконуса. В результате выполнения вмешательства у большинства больных повышается острота зрения. Пломбировка роговицы может предотвратить переход заболевания в острую фазу.
Нами [Беляев В. С., Душин Н. В., 1985] получены обнадеживающие результаты использования при кератотонусе межслойной кератопластики. Роговичным ножом производят расслоение средних слоев роговицы после ее перелимбального разреза. Расслаивание ведут от периферии к центру, где необходимо соблюдать особую осторожность, учитывая истончение стромы на этом участке. В образовавшийся карман помещают послойный имплантат из роговицы донора диаметром 7—9 мм, толщиной 0,2—0,3 мм. Имплантат прочно удерживается между слоями стромы реципиента и не нуждается в дополнительной фиксации. Прозрачное приживление имплантата создает благоприятные условия для повышения остроты зрения и уплощения поверхности роговицы.
При остром керагоконусе Н. А. Пучковская и 3. Д. Титаренко (1977) применяют биологическое покрытие — лечебную поверхностную послойную кератопластику. Наложенный на роговицу после ее деэпителизации и парацентеза послойный роговичный трансплантат со склеральными язычками, которые прикрепляют к склере глаза больного, плотно удерживает ее. В результате рубцевания трещин в задней пограничной пластинке уменьшается выпячивание роговицы, постепенно исчезает отек стромы и восстанавливается толщина роговицы. Через 3—4 нед после операции биологическое покрытие начинает рассасываться, а затем рассасывается полностью. В течение этого времени восстанавливаются толщина, кривизна и в значительной степени прозрачность роговицы, повышается острота зрения (в отдельных случаях до 0,5). А. А. Каспаров и Ю. Б. Слонимский (1979)
105
при остром и прогрессирующем кератоконусе применяли бандажное укрепление роговицы и термокератопластику. Н. Е. Kaufman и Т. Р. Werblin (1982) сообщили о лечении кератоконуса с помощью «эпикератофакии», которая представляет собой послойную пересадку роговицы — своего рода биологическое покрытие кератоконуса.
Сквозную кератопластику при кератоконусе применяют при наличии истонченной, выпяченной роговицы с помутнением вершины конуса. При диаметре трансплантата 5—6 мм для его фиксации накладывали четыре шва край в край, фибринную пленку и перекидные биологические швы [Горгиладзе Т. У., Титаренко 3. Д., 1976]. При большом диаметре трансплантата (7— 8 мм) обычно используют непрерывный шов (чаще супрамид 10:0). Швы рекомендуется удалять через 2—3 мес после операции, а некоторые авторы советуют оставлять их до 6—8 мес. У некоторых больных после удаления швов отмечается выстоя-ние трансплантата на отдельном участке, что может привести к астигматизму. Кроме того, после кератопластики наблюдается, хотя и редко, прогрессирование кератоконуса.
Брефопластика роговицы
В литературе, посвященной пересадкам органов и тканей, имеется ряд высказываний о рациональности применения молодых и эмбриональных тканей. Такие пересадки получили название «брефопластичесцих» (от греч. brephos — плод, plastic — формирую). Указанные ткани имеют более низкую степень дифференцировки, обладают выраженной способностью к росту и высокой пластичностью, кроме того, они антигенпо менее активны, чем ткани взрослых, поэтому при пересадке этих тканей отмечается менее выраженная реакция тканевой несовместимости.
Результаты экспериментально-клинических исследований по брефопластике роговицы [Беляев В. С., 1954—1984; Юшко Н. А., 1962, 1971; Блаватская Е. Д., 1963—1970; Овсепян Т. Л., 1963— 1971; Маркарян В. X., 1964—1967; Лазаренко Л. Ф., 1965; Зайкова М. В., 1968; Веретенникова В. В., 1970; Ионова Т. А., 1975, и др.] позволяют считать, что преимущества брефопластики роговицы перед другими методами пересадки неоспоримы. Главное из них — менее выраженная тканевая несовместимость, позволяющая добиваться лучших клинических результатов. Привлекает возможность получать материал для пересадок из акушерских учреждений, что доступно в большинстве стран мира. Роговица плодов 20—32-недельного возраста (после абортов по медицинским показаниям) хорошо приживает при послойной, частичной сквозной и интерламеллярной пересадках.
Число сторонников данного метода увеличивается по мере накопления клинического материала. Количество произведенных пересадок роговиц плодов исчисляется сотнями. Если вначале брефопластику роговицы в виде послойной и частичной сквозной
106
пересадки использовали для лечения больных с бельмами, то теперь ее успешно применяют для лечения птеригиума [Овсе-пян Т. Л., 1963; Зайкова М. В., 1968], для рефракционной [Беляев В. С. и др., 1970; Краснов М. М., 1970] и послойной сквозной [Юшко Н. А., 1971] пересадки, укрепления роговичного трансплантата [Каленич Л. А., 1970].
Остановимся на некоторых особенностях этого метода. Материалом для брефопластики служат роговицы глаз плодов человека различных возрастов (18—40 нед). Плоды получают в акушерских и гинекологических учреждениях после малого или влагалищного кесарева сечения либо после возбуждения родовой деятельности по Миронову по медицинским показаниям (сердечно-сосудистая недостаточность, диабет, очень молодой возраст роженицы и др.).
Возраст плода определяют с учетом анамнеза, акушерских данных и размеров плода по таблице Гаазе. Энуклеацию глаз производят стерильно не позднее чем через 6 ч после извлечения плодов, которые хранили при пониженной температуре. Размеры глаз плодов и новорожденных приведены в табл. 4.
Размеры глаз плодов и новорожденных 1
Таблица 4
Возраст плода, нед
Длина продольной оси глаза, мм
Диаметр роговицы, мм
Толщина роговицы, ' мм
16 6 5 0,57
18 6 5 0,54
19 7 6x5,2 0,55
20 7 6x6 0,57
21 7 6,2X6,3 0,64
22 8 6,5x6,5 0,60
23 И 8x8 0,66
24 И 8,3x8,3 0,87
28 12 8x8 1,06
32 12 8x8 1,20
40 16,1 9,4x9,6 0,85—1,12
Глаз взрослого 24,4 11,5x11,7 0,60—0,90
в центре, 1,01—1,10 по краям
1 Приведены средние размеры 120 глаз плодов и новорожденных, использованных для брефопластики [Веретенникова В. В., 1972].
Консервирование глаз производят во влажной камере по методу Филатова при температуре +2----|-4°С в течение 2—5 сут.
В Ереване разработаны и внедрены несколько способов долгосрочного консервирования эмбриональной роговицы: глубокое замораживание, лиофилизация и хранение в гамма-глобулине [Блаватская Е. Д. и др., 1978; Галстян Л. А., 1982]. Согласно данным исследований, трансплантационные свойства эмбриональ-
107
ной роговицы могут сохраняться при ее хранении в состоянии глубокого замораживания в течение 7 мес, при лиофилизации 7 мес и более и в гамма-глобулине до 2 мес.
Как показали результаты наших исследований [Беляев В. С. и др., 1959—1984], брефопластику можно использовать при различных видах пересадки: частичной сквозной, частичной и периферической послойной, межслойной, которые производят с рефракционной, оптической и лечебной целью. При частичной сквозной пересадке роговицы у больных с бельмами применяют роговицу плодов, начиная с 28—32-й недели беременности и до рождения. Пересадка роговицы новорожденных, умерших от асфиксии во время или вскоре после родов, также дает неплохие результаты. Операции проводят по Филатову, однако в большинстве случаев для фиксации трансплантата при сквозной и частичной послойной пересадке применяют целлулоидные колпачки по Петруне.
Колпачок представляет собой контактную линзу толщиной 0,05 мм, по форме соответствующую переднему отрезку глаза. Существуют целлулоидные колпачки трех размеров в зависимости от степени кривизны роговицы. Перед операцией подбирают такой колпачок, который плотно прилегает к поверхности бельма, присасываясь к нему без образования воздушного пузыря. В ходе операции колпачок хранят в 20% растворе сульфацил-натрия. После перенесения трансплантата в отверстие в бельме колпачок накладывают на передний отрезок глаза, где он присасывается к поверхности окружающей роговицы и трансплантата. Подобная фиксация более прочна, чем фиксация конъюнктивальной лентой, и позволяет визуально контролировать состояние трансплантата в послеоперационном периоде. В настоящее время с этой целью используют мягкие контактные линзы [Каспаров А. А., 1978].
При частичной послойной пересадке трансплантат из роговицы плода (начиная с 24-й недели развития) фиксируют с помощью конъюнктивальной ленты по Филатову или швов. Сначала целесообразнее наложить четыре шва на трансплантат до его полного отделения от подлежащих глубоких слоев роговицы донора.
Для послойной трепанации используют трепан ФМ-V, который устанавливают на глубину режущей коронки 0,4—0,6 мм. После поверхностной трепанации круглым ножом производят отслаивание трансплантата по периферии на глубине прорези так, чтобы оставить перемычку шириной 1—2 мм под центром трансплантата между ним и глубокими слоями стромы. В этот момент на свободные края трансплантата накладывают четыре шелковых шва, а затем после полного отслоения трансплантат на швах переносят на дефект в роговице реципиента и пришивают край в край.
Послойную брефопластику с успехом применяют для лечения рецидивирующих птеригиумов и частичных рубцовых симблефаронов. После освобождения роговицы на участке поражения от мутных слоев из глаза донора выкраивают лоскут 108
59.
Инструменты для проведения межслойной пересадки роговицы по Беляеву.
а — ступенчатое лекало; 5 — нож для расслоения роговицы; в — микрошпатель; г — лезвиедержатель; Д — микро-пинцент.
в виде подковки из перилим-больных слоев роговицы с участком прилежащей конъюнктивы. После пересадки на место дефекта его прикрепляют швами к лимбальной части и узловыми швами к конъюнктиве.
Роговицу плода используют также для лечения фистул. С этой целью копьевидным и круглым ножами делают ход под поверхностные слои роговицы в области фистулы. В образовавшийся карман помещают послойный трансплантат, выкроенный из роговицы плода после скарификации поверхностного эпителия. Обычно берут диск из ткани стромы роговицы плода диаметром 5 мм при толщине 0,4—0,5 мм. Введенный в
карман под поверхностными слоями роговицы реципиента диск имплантата перекрывает ход фистулы. Дополнительной фиксации его, как правило, не требуется, иногда накладывают один — два шелковых шва на края разреза у входа в роговичный карман.
Межслойную пересадку роговицы плода применяют при поверхностных бельмах с рефракционной (об этом подробнее будет сказано ниже) и оптической целью. Этот вид пересадки технически прост и надежен. Межслойные пересадки изучали в эксперименте В. В. Войно-Ясенецкий (1955) и в клинике И. В. Морхат (1964). Наши первые экспериментальные исследования с использованием тканей плода относятся к 1954— 1957 гг.
И п т е р л а м е л л я р ну ю брефопластику с оптической целью выполняют в два этапа. На первом этапе после акинезии и эпибульбарной анестезии осколком лезвия бритвы, укрепленным в лезвиедержателе на точно дозированную высоту (рис. 59), производят надрез роговицы в верхненаружном квадранте длиной 5 мм на глубину 0,4—0,6 мм в зависимости от расположения бельма. Глубину прорези дозируют по высоте осколка лезвия, который устанавливают на лекале — пластинке со ступен-
109
3
2
1
60. Межслойная оптическая брефопластика по Беляеву.
I — вид роговицы спереди; II — срез роговицы после первого этапа операции — трансплантат под слоями бельма; III — после трепанации бельма; I — разрез по» верхностных слоев роговицы; 2 — карман между глубокими слоями роговицы; 3 -трансплантат из роговицы плода с сохраненным эпителием; 4 — бельмо.
чатыми выступами высотой 0,2—0,7 мм, расстояние между которыми 0,1 мм. В глубине разреза с помощью тонкого, слегка заостренного шпателя, круглого ножа или ножа для расслоения роговицы качательными движениями отслаивают поверхностные слои роговицы под бельмом. Готовят своеобразный карман между слоями роговицы (под бельмом) в ее центре диаметром 7 мм и входом в него размером 5—6 мм. В карман вводят диск, вырезанный из поверхностных слоев роговицы плода человека (рис. 60).
После обычной обработки глаза в водном растворе (1:2000) бриллиантового зеленого делают надрез роговицы лезвием бритвы, установленным по лекалу на такую же глубину (0,4—0,6 мм), как и при выполнении первого этапа операции. Из надреза производят расслаивание стромы роговицы ножом или шпателем с последующей трепанацией поверхностных слоев трепаном ФМ-V (диаметр 5 мм). Выделенный диск трансплантата после обмывания в 20 % растворе сульфацил-натрия и изотоническом растворе хлорида натрия с помощью двух шпателей помещают в карман под поверхностные слои бельма роговицы реципиента. Трансплантат прочно удерживается в кармане под бельмом и в дополнительной фиксации не нуждается. Под конъюнктиву вводят пенициллин. Накладывают монокулярную повязку. Больному назначают постельный режим на 2 дня, затем разрешают сидеть и ходить.
При этом виде брефопластики поверхностные слои роговицы (бельма) служат для фиксации, плотно прижимая слои стромы трансплантата к глубоким слоям стромы реципиента и тем самым способствуя их тесному смыканию. Срастанию трансплантата с поверхностными слоями препятствует эпителиальный слой на
ПО
диске трансплантата. Процесс срастания трансплантата длится 10—15 дней. Соответственно через этот период времени и выполняют второй этап операции — трепанацию и удаление поверхности ново бельма. '
После акинезии и дистилляции 1% раствора дикаина (у беспокойных больных после ретробульбарной инъекции 1 мл 2% раствора новокаина производят поверхностную трепанацию бельма над трансплантатом трёпаном ФМ-V (диаметр 5 мм) на глубину 0,4—0,6 мм. При этом края трепанационного отверстия должны совпадать с краями трансплантата. Если бельмо не удается сразу прорезать трепаном, то концом копьевидного ножа или лезвия бритвы осторожно просекают его вглубь до трансплантата. Для того чтобы точно определить глубину надреза, в роговичную рану (до начала расслаивания) можно ввести микрошпатель и с его помощью контролировать глубину трепанации. В разрез вводят тонкий шпатель и осторожно проводят его над трансплантатом, отслаивая поверхностные слои кармана (бельма). Затем по линии трепанации острым концом копьевидного ножа или осколка лезвия бритвы либо роговичными микроножницами прорезают оставшиеся слои бельма и удаляют его диск. Прорезание производят по линии трепанации того же диаметра, что и диаметр ранее вставленного трансплантата; при таком условии оставшиеся слои передней стенки кармана после оседания плотно окружают диск трансплантата. Трансплантат после прорезания бельма как бы вставляется в трепанационное отверстие, выходя своей эпителиальной стороной наружу, и располагается на уровне поверхности окружающей роговицы.
В послеоперационном периоде, после выполнения второго этапа, глаза 2 дня находятся под бинокулярной повязкой, а больной — на строгом постельном режиме. На 3-й день накладывают монокулярную повязку и разрешают больному сидеть.
Из осложнений, которые могут возникнуть во время операции, следует назвать прободение инструментами (круглый нож, шпатель) поверхностного слоя кармана или глубоких слоев роговицы и проникновение в переднюю камеру. Оба осложнения не служат противопоказанием к завершению первого этапа операции. Даже после вскрытия передней камеры удается закончить приготовление кармана между слоями роговицы. Трансплантат, вставленный в карман, как правило, самопроизвольно блокирует дефект в задней стенке кармана и восстаналивает переднюю камеру.
При выполнении второго этапа операции после трепанации бельма шпатель может проникнуть под трансплантат и вызвать его частичное или полное отслоение, поэтому эта процедура требует особого внимания. В случае смещения трансплантата его следует укрепить швами край в край. Однако отслоение и потеря трансплантата наблюдаются крайне редко. Как правило, на 12— 14-й день трансплантат бывает прочно спаян своим основанием с глубокими слоями роговицы и не требует дополнительной фик-
111
сации. Окружающие его участки поверхности-7 роговицы после трепанации и удаления центра бельма над трансплантатом несколько возвышаются над ним. Затем проиоходит выравнивание поверхностей трансплантата и граничащей & ним роговицы. Некоторое время (до 2 нед) на месте их соприкосновения по линии трепанации видна кольцевидная эпителидльная бороздка, которая постепенно заменяется еле заметным пограничным кольцом. При межслойных пересадках роговицы отвечается воздействие трансплантата на граничащие с ним слои^оверхностного бельма, возникает своеобразное кольцо просветления на границе с линией трепанации. Заметно влияние трансплантата и на остаточные помутнения в глубоких слоях роговицы, расположенных под трансплантатом, он наблюдается в течение длительного времени (до 6—12 мес) с момента операции. Более подробные сведения об этом приведены в работах А. А. Абдулла (1977).
Межслойная рефракционная брефопластика представляет собой пересадку роговицы плода в прозрачную роговицу реципиента с целью изменения ее рефракции. Наше первое сообщение [Беляев В. С., 1964] и последующие экспериментально-клинические исследования [Беляев В. С., 1965—1984; Веретенникова В. В., 1970, 1971] подтвердили, что диск имплантата, постепенно превращаясь под влиянием стенок роговичного кармана в линзу с истонченными краями, обусловливает длительно наблюдающиеся рефракционные сдвиги в роговице.
Операцию выполняют в два этапа; мы производили ее по следующей методике. На первом этапе после инстилляции в конъюнктивальный мешок 1 % раствора дикаина (у беспокойных больных после ретробульбарной инъекции 1—2 мл 2% раствора новокаина) в верхненаружном квадранте роговицы на расстоянии 2 мм от лимба осколком бритвенного лезвия, зажатого в лезвиедержа-теле, производили надрез поверхностных слоев роговицы длиной 5—6 мм на глубину 0,2 мм. Тонким шпателем или ножом для расслоения роговицы, введенным в надрез, проникали между слоями роговичной стромы качательными движениями как при циклодиализе, образуя карман диаметром 9 мм (рис. 61). В качестве трансплантационного материала при интерламеллярных пересадках использовали роговицу плодов 22—40-недельного возраста,, которых получали из родильных домов после малого кесарева или влагалищного сечения либо возбуждения родовой деятельности по Миронову, производившихся по медицинским показаниям. Глаза консервировали во влажной камере (по Филатову) при температуре +2-----Н4°С в течение 2—5 сут. Глаз донора после
консервации обрабатывали в двух порциях водного раствора (1:2000) бриллиантового зеленого и в 30 °/орастворе сульфацил-натрия.
Для приготовления диска имплантата после скарификации эпителия роговицы производили надрез поверхностных слоев роговицы лезвием бритвы, установленным в лезвиедержателе с помощью ступенчатого лекала на строго заданную глубину (0,3— 112
IV
61.
Межслойная рефракционная брефопластика по Беляеву.
а — схема операции: I — вид роговицы спереди; II — срез роговицы после пер-вого этапа операции — диск имплантата в межслойном кармане; III — формирование биолинзы в кармане; IV — срез роговицы после трепанации поверхностного листка; 1 — разрез поверхностных слоев роговицы; 2 — карман между глубокими слоями роговицы; 3 — имплантат; 4 — поверхностный листок роговицы; 5 — линия трепанации; б — формирование кармана между глубокими слоями роговицы.
Ill
0,7 мм) в зависимости от степени исправляемой гиперметро-
• пии (от +6,0 до +14,0 дптр). На глубине прорези ножом для расслоения роговицы или тонким шпателем расслаивали рого
вицу донора, а из поверхностных слоев стромы трепаном ФМ-V (диаметр 5 мм) иссекали диск имплантата. Определенная толщина имплантата является основным условием дозирования рефракционных сдвигов, так как остальные параметры (диаметр диска, размеры кармана и др.) остаются относительно постоянными. Полученный имплантат с помощью двух шпателей или шпателя и микропинцета помещали в роговичный карман реципиента, устанавливая его против зрачка. Имплантат прочно удерживается под поверхностными слоями роговицы без дополнительной фиксации. Швы на края раны роговицы не накладывали.
В 1-е сутки накладывали бинокулярную повязку, больные соблюдали строгий постельный режим. Затем им разрешали сидеть. С 3-го дня больные начинали ходить. Просветление имплантата начиналось через 1—2 нед, полностью прозрачными роговица и имплантат становились через 1 — IV2 мес с момента операции.
8 Руководство по глазной хирургии
113
62. /
Роговица после трепанации поверхностного листка в сйете щелевой лампы (в центре — имшгантат).
Во вр^мя операции иногда наблюдалась перфорация передней ct6hki/ роговичного кармана. Это осложнение не влияло на исход операции: происходило полноценное приживление имплантата с восстановлением прозрачности пересаженного диска роговицы. Однако возможности межслойного способа изменения рефракции недостаточно велики, вследствие того что поверхностные слои роговицы больного устойчивы к растяжению, а глубокие наиболее податливы и легче прогибаются в сторону передней камеры, в ре
зультате чего уменьшается рефракционный эффект.
Второй этап операции заключается в трепанации поверхностного слоя кармана трепаном большего диаметра, чем имплантат (авт. свид. № 825067). Его выполняли спустя 6—8 нед после первого, После акинезии и эпибульбарной анестезии осуществляли сквозную трепанацию поверхностного слоя роговичного кармана трепаном ФМ-Ш (диаметр 7—8 мм) концентрически на расстоянии 1 мм от края имплантата. На отдельных участках не полностью трепанированный слой роговицы прорезали острым концом лезвия бритвы, роговичными микроножницами или ножницами Ваннаса. После рассечения переднего листка кармана уменьшается его давление на имплантат, который сдвигается вперед, приподнимая поверхностный слой роговицы и образуя круговую эрозию шириной 0,1—0,2 мм по линии трепанации. Поверхностный листок кармана удерживается в центре на месте спаяния с имплантатом, дополнительная фиксация не требуется (у беспокойных больных можно наложить четыре—пять узловых швов без натяжения). Замещение эрозии производят роговичной тканью. Имплантат и роговица сохраняют прозрачность. Биомикроскопически роговица вместе с имплантатом напоминала биологическую •контактную линзу, изменяющую рефракцию центра роговицы (рис. 62). Полученные рефракционные показатели в пределах срока наблюдения (свыше 3 лет) существенно не изменились.
Операции при птеригиуме
Все операции по удалению птеригиума производят в два этапа: сначала отделяют птеригиум от поверхности глазного яблока
414
(роговицы, лимба, склеры), затем осуществляют резекцию или перемещение отсепарованного птеригиума, а иногда и закрытие дефекта конъюнктивы склеры. Птеригиум может быть отделен от поверхности глазного яблока несколькими способами, которые обычно не характеризуют сам метод операции, предложенный тем или иным автором. Различные способы операции при птеригиуме отличаются преимущественно вмешательствами на конъюнктиве. Только в отдельных случаях автор операции подчеркивает отделение птеригиума как ее характерный и неотъемлемый момент. Различают несколько типов отделения птеригиума от глазного яблока.
Отсенаровку птеригиума от вершины к основанию производят под местной анестезией (инстилляции 1% раствора дикаина и инъекции 2% раствора новокаина). Птеригиум захватывают зубчатым пинцетом или поперек шейки (на лимбе), или у самой вершины, а затем оттягивают от роговицы и, начиная от верхушки, подрезают все связки, соединяющие его с роговицей. Это делают очень тщательно копьевидным ножом, линейным ножом Грефе, скальпелем и круглым ножом так, чтобы при отсепаровке на роговице не осталось обрезков ткани птеригиума. Желательно, чтобы хирург срезал именно поверхностные слои роговицы. Оттягивая птеригиум от роговицы, отсепаровы-вают его до лимба, затем продолжают на протяжении 5—8 мм отсенаровку его от склеры, полностью освобождая ее от эписклеры; область отсепаровки в поперечном к длиннику птеригиума направлении обычно выходит за его пределы.
Отсепаровка птеригиума от периферии к вершине может быть произведена при использовании способов, связанных с резекцией тела птеригиума. После отделения от склеры и лимба тела птеригиума его оттягивают от поверхности глазного яблока и обрезают связки, соединяющие птеригиум с роговицей, постепенно подходя к вершине. Этот метод менее удобен из за кровотечения, при его применении верхушку удается отделить с меньшей точностью.
Отрывание птеригиума от роговицы рекомендовано И. И. Казасом. Шпатель проводят под шейку птеригиума и отслаивают его от роговицы, остатки счищают острой ложечкой.
Отделение птеригиума с послойной резекцией роговицы производят линейным ножом Грефе. Захватив птеригиум на 1 мм сзади лимба и приподняв его, прокалывают складку птеригиума ножом у ее основания впереди пинцета так, чтобы лезвие было направлено к роговице. Пилящими движениями выкраивают лоскут из поверхностных слоев роговицы, края которого должны совпадать с краями птеригиума, а вершина — находиться на краю головки птеригиума. Таким образом, птеригиум удаляют вместе со слоем роговицы. При правильном выполнении манипуляции получается чистая, гладкая, легко эпителизи-рующаяся поверхность.
11S
81
<53. Удаление птеригиума по Чермаку (схема).
После того как с помощью одного иа/описанных методов птеригиум отделен от поверхности /глазного яблока, острой ложечкой тщательно соскабливают все его остатки с /роговицы, начиная от верхушки по направлению к лимбу и за его пределы. Чем лучше очищена роговица, тем скорее она эпителизируется и тем прозрачнее в области птеригиума. Некоторые хирурги, для того чтобы наиболее полно очистить роговицу и лимб от остатков птеригиума, прижигают термокаутером все подозрительные места или просто рану поперек, по внутреннему краю лимба и его поверхности. При
всех методах отделения птеригиума и очистки роговицы самым главным является тщательное удаление его остатков. Удаление птеригиума производят несколькими способами.
Способ Чермака. Головку птеригиума отделяют от роговицы, конъюнктиву шейки и тела отсепаровывают. Захватив птеригиум за головку, оттягивают его от края роговицы по направлению к слезному мясцу. Края образовавшейся треугольной раны конъюнктивы сшивают двумя—тремя швами (рис. 63), вследствие чего у носового конца раны образуется возвышение (за счет головки и тела птеригиума), которое сглаживается в ближайшие дни после операции. Достоинство способа в том, что не удаляют конъюнктиву.
Способ М а к-Р ейнольдса целесообразнее использовать при удалении большого птеригиума. Головку птеригиума захватывают фиксационным пинцетом и тщательно отделяют от роговицы, тело его отсепаровывают. Затем ножницами надрезают конъюнктиву глазного яблока и отсепаровывают ее книзу до нижнего свода. На головку птеригиума накладывают П-образный шов на двух иглах (рис. 64). Головку птеригиума подворачивают в образованный конъюктивальный карман, при этом оба конца шовной нити проводят через дно кармана, выводят на слизистую оболочку и завязывают. Пересаживаемый лоскут должен быть выкроен с таким расчетом, чтобы его края прилегали к обнаженному лимбу, не покрывая роговицу и не оставляя обнаженной широкую полосу склеры. Если лоскут не укладывается должным образом, то нужно переложить шов так, чтобы лоскут лег, как это требуется.
В случае необходимости накладывают один или два дополни-
116
€4. Пересадка птеригиума по Мак-Рейнольдсу (схема), а — в — этапы операции.
тельных шва, укрепляющих лоскут на эписклере, и разглаживают прилегающие части конъюнктивы. Если, учитывая харак-I тер птеригиума, можно опасаться рецидива или он уже возник на другом глазу, то подвертывают прилегающий к лимбу край конъюнктивы и закрепляют его в этом положении.
Способ Терсо па отличается тем, что линия шва после удаления птеригиума проходит под верхним веком, а против глазной щели располагается здоровая конъюнктива. Для того чтобы заранее наметить границы иссечения тела птеригиума, на необходимом расстоянии от слезного мясца конъюнктиву берут в склад-it ку и надсекают прямыми ножницами. На концах этого разреза
| делают два горизонтальных разреза конъюнктивы до роговицы:
I верхний — на уровне верхней четверти роговицы, нижний — в зависимости от ширины птеригиума. Головку птеригиума тщательно отделяют от роговицы, отсепаровывают очерченный указанными разрезами четырехугольник и иссекают его. Если необходимо, то выскабливают роговицу и прижигают гальванокаутером подозрительные места. Прямыми ножницами разрезают конъюнктиву склеры в двух местах от концов нижнего края дефекта; один разрез идет от роговичного конца дефекта косо книзу, параллельно лимбу, другой — параллельно ему от начального конца книзу. Лоскут, очерченный этими разрезами, отсепаровывают. Край лоскута сшивают с верхним краем четырехугольного дефекта; при этом шов непременно должен захватывать и поверхностные слои склеры, для того чтобы линия швов не опустилась вниз. Основная цель операции — переместить на место птеригиума здоровую конъюнктиву.
Способ Головина заключается в свободной аутотрансплантации птеригиума. Птеригиум срезают с роговицы и иссекают до полулунной складки. Повернув иссеченный птеригиум на 180°, пришивают его несколькими швами. Отделяя птеригиум со всех сторон от склеры, можно оставить его на узеньком пучке подконъюнктивальной ткани, что не помешает повернуть его. Этот способ основан на предположении, что при изменении направления головки птеригиума прекратится его рост.
Способ Канкрова состоит во встречном вертикальном смещении квадратных лоскутов слизистой оболочки после иссече-
117
65. Пересадка птеригиума по Канкрову.
а, б — этапы операции; 1, 2 — перемещаемые лоскуты конъюнктивы.
ния птеригиума. Было предложено также перемещение двух треугольных лоскутов, при котором треугольник конъюнктивы склеры смещают к краю роговицы вместо птеригиума, который передвигают назально (рис. 65).
При упорно рецидивирующих формах птеригиума предпочтение отдают так называемому барьерному методу; путем перемещения или пересадки на глазное яблоко различных тканей создают барьер, препятствующий росту птеригиума. Для создания такого барьера применяли пересадку конъюнктивы наружной половины глазного яблока [Elschnig А., 1930] или верхней переходной складки [Каллахан А., 1963], слизистую оболочку губы, аллопластику роговично-конъюнктивальным лоскутом [Филатов В. П., 1934], периферическую пересадку роговицы [Пучковская И. А., 1960; Кукса В. Д., 1962], пластику роговично-склерально-конъюнктивального лоскута [Нурмаме-дов Н. Н., 1973] и др. Однако лечение упорно рецидивирующего птеригиума всегда представляет значительные трудности. При этом неоднократные хирургические вмешательства приводят к обширному грубому рубцовому перерождению конъюнктивы, иногда с образованием симблефарона или бельма роговицы.
Аллопластика (гомопластика) роговичноконъюнктивального лоскута (по Филатову) при рецидивирующем птеригиуме дает удовлетворительные результаты. Срезав головку птеригиума с поверхностным слоем роговицы, от-сепаровывают его до полулунной складки и иссекают. Отделяют конъюнктиву склеры по краям дефекта. С глаза трупа, сохранявшегося в течение 2—3 дней при температуре +2—}~4ОС, срезают участок поверхностных слоев роговицы с лоскутом конъюнктивы склеры.
Роговично-конъюнктивальный трансплантат по размерам и форме должен соответствовать дефектам. Трансплантат укладывают на дефект и тщательно пришивают тонкими швами конъюнктиву трансплантата к краям конъюнктивального дефекта;
118
В результате роговица приживает и хорошо закрывает роговичный .дефект, препятствуя рецидиву птеригиума.
Оценивая описанные способы, можно отметить, что в первый раз предпочитают производить операцию по поводу птеригиума до способу Чермака и Терсона. Многие окулисты выполняют операцию Мак-Рейнольдса. При рецидиве можно осуществить пересадку лоскута слизистой оболочки, взятой с губы, который укладывают на дефект, что дает стойкий результат. Косметический дефект можно уменьшить, срезав впоследствии большую часть лоскута и оставив от него только узкую полоску у лимба. При повторных рецидивах можно применить послойную пересадку ро-говично-кон'ыонктивального трансплантата.
А. Каллахан предлагает при рецидивирующих птеригиумах после повторного иссечения покрывать образовавшийся дефект лоскутом конъюнктивы верхней переходной складки. При этом широко иссекают головку и тело птеригиума вместе с прилегающим участком конъюнктивы кнутри от роговицы. Размер обнаженной поверхности склеры 6X6 мм, иногда больше. Для выкраивания конъюнктивального лоскута непосредственно над кожной складкой верхнего века со стороны кожи инъецируют 1 — 2 мм 1 % раствора новокаина. Раствор отсенаровывает слизистую оболочку от окружающих тканей; если вывернуть веко, то слизистая оболочка выйдет из верхнего свода. Затем на конъюнктиве намечают участок соответствующих размеров и на его углы накладывают швы. Иглы вкалывают со стороны эпителиальной поверхности, проводят через субконъюнктивальные ткани и выводят через надрез. Такое положение швов помогает отличить эпителиальную поверхность лоскута на последующих этапах операции. Когда лоскут уложен на новое место, швы проводят через край дефекта.
Края дефекта конъюнктивы свода после взятия лоскута плотно соединять не следует; для сближения краев на них накладывают несколько топких рассасывающих швов (кетгут) таким образом, чтобы после завязывания узлы оказались под конъюнктивой. Пересаживаемый лоскут укрепляют узловыми швами. На обращенном к лимбу краю лоскута швы, прежде чем захватить ими эписклеру, дважды проводят через край лоскута. При подвертывании края лоскута конъюнктивы после завязывания швов уменьшается угроза нового рецидива. В этом случае обнаженная поверхность роговицы скорее покрывается собственным эпителием. Для предупреждения васкуляризации применяют инстилляции кортизона или раствора Тио ТЭФ (1: -2000).
Г. В. Легеза и соавт. (1983) предложили для устранения неоднократно оперированного и упорно рецидивирующего птеригиума использовать методику операции, которая заключается в радиальном иссечении птеригиума и рубцовой конъюнктивы глазного яблока у внутреннего утла глазной щели с одновременным покрытием образовавшегося дефекта конъюнктивы слизистой с губы и периферической пересадкой роговицы по Пучковской. Одномоментную пересадку слизистой и периферического рогович-
119
ного трансплантата при устранении частичного симблефарона века и частичного бельма применили Е. И. Клюцевая и В. Ф. Макух (1972).
Операцию на ложном птеригиуме, т. е. нарастании на роговицу складки конъюнктивы при ожогах, ранах, язвах и т. д., производят с косметической целью, для улучшения зрения (если закрыта область зрачка) и улучшения почвы для пересадки роговицы. Птеригиум следует удалять после устранения симблефарона, если он имеется, или одновременно с ним. Техника срезания ложного птеригиума сходна с таковой при удалении настоящего птеригиума. Определенных способов здесь указать нельзя,, можно лишь наметить основные принципы. При необходимости удалить вместе с ложным птеригиумом участок конъюнктивы ее дефект следует закрыть здоровой конъюнктивой (из верхнего, свода) или слизистой оболочкой губы. При срезании птеригиума надо помнить о возможности истончения роговицы и не прорезать ее. Целесообразно срезанные передние слои роговицы или бельма замещать (особенно если речь идет о подготовке глаза к кератопластике) пластинами роговицы, взятой из глаза донора.
Микрохирургические операции на роговице
В последние годы в офтальмологии наметилось новое направление — так называемая микрохирургия. На первых порах это направление разрабатывали немногие специалисты [Краснов М. М.т 1969; Harms Н., McKensen G., 1966; Berraqyuer J., 1966, и др.], затем его развитие значительно ускорилось. В настоящее время микрохирургия все настойчивее проникает в различные разделы офтальмологии. Для этих операций используют микрохирургические установки фирмы «Keeler», операционный микроскоп модель 310 фирмы «Karl-Zeiss Jena» и др.
Микрохирургия позволила добиться недоступного ранее уровня техники выполнения кератопластики. При послойной кератопластике возможен точный контроль за глубиной расслоения роговицы с точностью до долей миллиметра (особенно с использованием оптического среза). При сквозной пересадке трепанационное отверстие в роговице донора и реципиента может быть сделано с большей точностью и с очень ровными краями. Микрохирургическая техника фиксации трансплантата непрерывным швом (10 : 0—12 : 0) имеет ряд достоинств и получает все большее распространение.
Существенное практическое значение имеет операционный и послеоперационный контроль за репозицией краев трансплантата и роговицы реципиента. Несомненную пользу может принести при всех прочих условиях микроскопический контроль за состоянием эндотелия роговицы глаза донора.
Поскольку прозрачное приживление во многом зависит от качества формирования и фиксации трансплантата, микрохирургическую технику необходимо использовать при кератопластике. 120
66. Круговой непрерывный шов, используемый при пересадке роговицы, а — асимметричный; б — симметричный.
\ При кератомилезе (стромэктомия) для коррекции миопии осто-I рожность и точность манипуляций должны быть особенно вели-(ки. При аллопластике роговицы применение микроскопа позволяет ввести интерламеллярный имплантат вплотную к задним слоям роговицы, что имеет важное значение для обеспечения успеха операции.
| Микрохирургия глаза, созданная в нашей стране как метод хирургического лечения глаукомы [Краснов М. М., 1964], быстро нашла применение и в хирургии роговицы. Ее средства и методы способствовали повышению эффективности и надежности традиционных операций па роговице, включая кератопластику, и значительному расширению показаний к ее проведению. Разработаны также новые операции, которые невозможно выполнить без операционного микроскопа, микроигл и современного шовного материала.
Микрохирургическая техника сквозной пересадки роговицы предполагает использование для фиксации трансплантата супра-мидных (нейлоновых) швов 9:0—10:0 (рис. 66, 67), наложение и наличие которых сопряжено с травмой, однако обеспечивает надежность фиксации трансплантата, а также способствует устранению ряда возникавших ранее осложнений (невосстановление передней камеры, вторичная глаукома, фистулизация и т. д.) и резкому уменьшению продолжительности пребывания больного на постельном режиме (с 8—10 до 1—3 дней).
М. М. Краснов (1983) предложил два новых варианта более надежного непрерывного шва для кератопластики и экстракции катаракты: нить через глубокие слои разреза прошивают дваж-
121
67. Глубина проведения нити через края роговицы (оптимальная на 2/3).
ды. В результате в области каждого стежка образуется полная петля, соединяющая края раны подобно узловому шву.
В настоящее время сквозную кератопластику производят в сочетании с рядом реконструктивных операций, включая иридо-пластику, витрэктомию и одновременную подсадку интраокулярной линзы [Краснов М. М. и др.г 19/9; Федоров С. Н. и др.„ 1982], Значительным материалом по сквозной кератопластике трансплантатами больших размеро» располагает О. М. Романи-ко (1978).
Для наиболее распространенного вида пересадки-роговицы — послойной кератопластики, наоборот,
характерно использование бесшовных методов фиксации трансплантата с помощью биоклея [Гольдфельд Н. Г., 1976], целлулоидных чашечек [Петруия М. С., 1977], фибринной пленки [Горги-ладзе Т. У., 1978] и мягких контактных линз [Каспаров А. А., 1978; Краснов М. М. и др., 1979]. В настоящее время гидрогелевые-и силиконовые [Джарулла-Заде Ч. Д., 1978] контактные линзы разработаны во ВНИИ глазных болезней и выпускаются нашей промышленностью.
В Московском научно-исследовательском институте глазных болезней им. Гельмгольца Р. А. Гундоровой и соавт. (1982) разработан новый вид хондрокератопластики, показанием к применению которого являются сосудистые постожоговые бельма. Согласно первым наблюдениям авторов (27 больных), прозрачное и полупрозрачное приживление трансплантата наблюдалось в 2 раза чаще, чем у больных контрольной группы, оперированных без аутохряща.
Лечебная кератопластика становится в настоящее время самым необходимым видом пересадки роговицы. Согласно последним данным [Горгиладзе Т. У., 1978—1983, и др.], наиболее часто кератопластику производят при герпетическом кератите и буллезной кератопатии (эндотелиально-эпителиальная дистрофия роговицы).
Н. А. Пучковской (1968—1978) предложен метод лечебной поверхностной послойной пересадки роговицы (биологическое-
122
покрытие) и установлены показания к ее применению. Поело тотального расслоения стромы глаза донора на глубину 0,3— 0,4 мм выкраивают лоскут роговицы с двумя склеральными выступами. На глазу реципиента отсепаровывают конъюнктиву и на поверхность роговицы укладывают трансплантат, который укрепляют за склеральные выступы к склере реципиента. В случае необходимости накладывают дополнительные роговичные швы. Склеральные выступы и лимб роговицы покрывают отсепарован-ной ранее конъюнктивой. Эту операцию широко используют при различных тяжелых патологических процессах в роговице, при которых другие методы лечения неэффективны.
Во ВНИИ глазных болезней разработана методика ранней щадящей послойной кератопластики, сочетающая в себе приемы микрохирургической и противовирусной операций и адаптированная к лечению вирусных кератитов. Она предполагает укрепление трансплантата биоклеем и мягкой контактной линзой после тщательного иссечения очага воспаления [Каспаров А. А., 1976; Каспаров А. А., Маложен С. А., 1980]. Биоклей (гамма-глобулин и интерферон) по адгезивным свойствам более чем в 3 раза превосходит биоклей из плазмы доноров и обладает также лечебными свойствами. Произведены 102 операции больным с центральной и парацентральной локализацией патологического герпесвирусного процесса через 1—3 мес после безуспешного медикаментозного лечения. Купирование процесса достигнуто у 92% больных, прозрачное приживление трансплантата отмечено у 85%, полупрозрачное — у 12%, мутное — у 3% больных. Повышение остроты зрения с 0,2 до 1,0 отмечено у 65% больных (срок наблюдений до 6 лет). Проведенное после операции противорецидивное лечение (противогерпетическая поливакцина) позволило снизить частоту рецидивов у этих больных в 2’/г раза по сравнению с больными контрольной группы. Хорошие результаты ранней лечебной кератопластики при активных воспалительных заболеваниях роговицы были получены Н. Г. Гольдфельд (1976), Т. У. Горгиладзе (1978), Н. Н. Нурмамедовым и Ш. Амансахато-зым (1975, 1978), 3. М. Скрипниченко и Н. Н. Бушуевой (1978), Р. А. Гундоровой и соавт. (1979).
Трудной задачей является лечение больных с хронической •отечной буллезной кератопатией, развивающейся чаще всего на яфакичных глазах. С помощью медикаментозных средств излечить это заболевание, в основе которого лежат прогрессирующее поражение эндотелия и отек роговицы, невозможно. Стабилизирующий эффект при этом заболевании дают мягкие лечебные гидрогелевые линзы [Краснов М. М. и др., 1975, 1979; Огане-сянц В. А., 1981], однако и с их помощью невозможно добиться полного выздоровления.
Разрабатываемые способы кератопластики преследуют цель .заменить пораженный эндотелий больного полноценным эндотелием роговицы донора. Этой задаче отвечает задняя послойная кератопластика, предложенная В. В. Волковым (1975), а также
123
послойно-сквозная кератопластика в модификации «обратный гриб» [Волков В. В., Дронов М. М., 1978; Горгиладзе Т. У., 1978].
Во ВНИИ глазных болезней по предложению М. М. Краснова был разработан новый способ лечения хронической буллезной кератопатии, основанный на интерламеллярной трансплантации в роговицу капсулы хрусталика [Краснов М. М. и др., 1981]. В отдаленные сроки после операции (100 операций с преимущественным использованием капсулы катарактального хрусталика) от 4 мес до 3 лет у 88% больных отмечен противоотечный эффект и ликвидированы болевые ощущения, у 2/з из них острота зрения повысилась в пределах от 0,02 до 0,6. В III—IV стадии заболевания при отсутствии у больных выраженных признаков поражения макулярной зоны сетчатки осуществляли второй этап лечения — сквозную кератопластику, часто в сочетании с реконструкцией переднего отдела глаза (иридопластика, ликвидация спаек, передняя витрэктомия, имплантация интраокулярной линзы). Интерламеллярная аллопластика роговицы капсулой хрусталика по Краснову выполнима в условиях любого глазного отделения, где проводят операции под микроскопом.
Нет сомнений, что уже в ближайшие годы глазная микрохирургия будет развиваться по мере совершенствования техники и расширения сферы использования этих методов. Тем большего внимания со стороны офтальмологов заслуживает эта проблема в настоящее время [Краснов М. М., 1969].
Изменение кривизны роговицы с помощью рефракционной кератопластики. Преломляющая способность роговицы зависит в основном от радиуса кривизны ее передней поверхности в центральной (оптической) зоне. Теоретически возможны два пути ее изменения хирургическим путем: воздействие на кривизну всех слоев роговицы (без изменения ее толщины) и только на кривизну передней поверхности роговицы, что связано с изменением ее толщины в том или ином месте.
Для изменения кривизны всех слоев роговицы были предложены методы нанесения задних и передних роговичных надрезов [Краснов М. М., Пурескин Н. П., 1966; Sato Т., 1953, и др.]. Кривизну передней поверхности можно изменить с помощью методов интерламеллярной подсадки аллопластических и брефопластиче-ских имплантатов [Беляев В. С., 1964], которые играют роль линз. Изменить переднюю кривизну роговицы можно также с помощью ламеллярной стромэктомии: в центре — для уплощения, на периферии оптической зоны — для увеличения кривизны [Barraquer J., 1949; Krwawicz Т., 1964].
Исправление гиперметропии с помощью диатермокоагуляции периферической части роговицы в 1953 г. произвел Л. X. Шоттер (1965). В результате 10 коагулянтов, расположенных в области срединной окружности роговицы, рефракция увеличивалась на 7—10 дптр, отдаленный эффект процедуры равнялся в среднем 2,5 дптр. Метод может быть применен также для исправления астигматизма.
124
Используют и методы аутопластики [Barraquer J., 1949] — так называемый кератомилез (для уплощения роговицы) и кератофа-кию (для утолщения центра). Принцип этих операций состоит в резекции передних слоев стромы роговицы, обработке аутотрансплантата до получения нужной степени кривизны и реимплантации его в роговицу. Вначале выкраивают послойный трансплантат из передних слоев центральной оптической зоны роговицы. Затем моделируют его до получения нужной кривизны методом горизонтального сечения [Морхат И. В., 1964; Краснов М. М.т 1970; Груша О. В. и др., 1971]. Этот метод заключается в том, что с трансплантата на специальном замораживающем микротоме либо с помощью точного токарного станка срезают периферическую часть для создания выпуклой биолинзы или центр для ее истончения при коррекции миопии [Федоров С. Н., Захаров В. Д., 1971; Barraquer J., 1949, и др.]. Полученные подобным образом биолинзы (аутотрансплантаты) фиксируют в роговичном ложе с помощью микрошвов или комбинации швов с биологическими клеевыми основами.
Межслойная рефракционная кератопластика при афакии, гиперметропии и миопии
Межслойная (интерламеллярная) пересадка роговицы технически проста и надежна. Этот вид пересадки изучили в эксперименте В. В. Войно-Ясенецкий (1955) и в клинике И. В. Морхат (1964). Нами экспериментальные исследования по межслойной кератопластике с использованием роговицы плода начаты в 1954 г.
Межслойная рефракционная кератопластика представляет собой пересадку роговицы донора между слоями прозрачной роговицы для изменения ее рефракции. По вопросам рефракционной хирургии роговицы имеется ряд сообщений отечественных и зарубежных исследователей [Морхат И. В., 1964, 1975; Беляев В. С., 1964; Блаватская Е. Д., 1964; Беляев В. С., Веретенникова В. В., 1970; Животовский Д. С., 1970; Краснов М. М., 1970; Груша О. В.,. Мустаев И. А., 1971; Федоров С. Н., Захаров В. Д., 1971; Пучковская Н. А. и др., 1973; Луэнго В. М., 1979; Беляев В. С. и др.,. 1980; Barraquer J., 1949, 1965; Krwawicz Т., 1964, и ДР-]-Однако возможности ранее описанных вариантов межслойной кератопластики недостаточно велики, вследствие того что поверхностные слои роговицы больного устойчивы к растяжению, а глубокие наиболее податливы и легче прогибаются в сторону передней камеры, но дают менее выраженный рефракционный эффект. Это не позволяло добиться желаемых рефракционных изменений роговицы глаза.
В проведенных нами за последние 10 лет экспериментальных и клинических исследованиях получен желаемый рефракционный эффект за счет ослабления натяжения передних слоев роговицы реципиента. Результаты экспериментов показали, что трансплантат приобретает и длительно сохраняет форму плюсовой линзы,
125<
вследствие чего значительно изменяется кривизна передней поверхности роговицы при коррекции афакии. В многочисленных экспериментах [Беляев В. С., 1957—1965] установлено, что для устранения основной опасности рефракционных пересадок — врастания эпителия — необходимо сохранить чувствительность и иннервацию роговицы до полного приживления стромы роговицы реципиента и имплантата (биолинза в кармане). Эксперименты, в которых при миопии для межслойных пересадок использовали роговичные кольца с параллельными и скошенными краями и отрицательные биолинзы, показали преимущество биолинз перед кольцевыми имплантатами.
Было доказано, что при подсадке между слоями роговицы отрицательной биолинзы достигается стойкое ослабление рефракции за счет увеличения радиуса кривизны передней поверхности роговицы реципиента без истончения ее центральной части. Предложено устройство для приготовления роговичного имплантата, используемого при коррекции афакии и миопии, которое фиксируют на столике гистологического санного микротома. Это устройство позволяет приготовить биолинзу без замораживания роговицы донора (рис. 68)1 по принципу параллельных сечений Мор-хата.
Способ выплавления свинцовых моделирующих основ. Мы в работе использовали моделирующие основы из свинца, который легко обработать без специальных станков, что позволяет с минимальными затратами изготовить основы необходимого диаметра. Для выплавления свинцовых моделирующих основ предварительно делали формочки определенного диаметра из гипса. Тщательно размешанную гипсовую кашицу заливали слоем толщиной до 3 см в ванночку размером 20X30 см. Затем в нее погружали до половины диаметра отшлифованные шарики необходимого диаметра и оставляли на 2—3 ч до полного затвердевания гипса. Шарики предварительно смазывали вазелиновым маслом, для того чтобы их было легче выделить из гипсовой формочки. Свинец расплавляли на газовой горелке и заливали в приготовленные формочки. После остывания свинца моделирующие основы обтачивали с боков до диаметра, соответствующего диаметру отверстия на фиксирующей пластинке устройства для срезания имплантата.
Имплантат в виде плосковыпуклой биолинзы готовили из када-верной роговицы, консервированной по Филатову во влажной камере при температуре +2-------|-4оС в течение 2—24 ч, однако
старались использовать свежеэнуклеированные глаза. Преломляющую силу роговичной линзы (D) в воздухе определяли по формуле:
711 — П П1 -- П
D =------=--------- (1)
Г1 г2
1 Удостоверение па рационализаторское предложение № 0066 от 06.06.79 г., выданное Университетом дружбы народов им. П. Лумумбы.
-126
где ni — показатель преломления роговицы, равный 1,376; п — показатель преломления воздуха, равный 1; и и гг — радиусы кривизны поверхностей линзы, мм. Расчеты показали, что преломляющая сила роговицы схематичного глаза человека с радиусом кривизны передней поверхности 7,7 мм, а задней 6,8 мм в воздухе должна составлять — 6,47 дптр, т. е. изолированная роговица человека имеет свойства минусовой линзы, а не +42,0—50,0 дптр,. как это принято считать на основании определения только кривизны ее передней поверхности (табл. 5). Преломляющую силу плосковыпуклой линзы из роговичной ткани в воздухе рассчитывают по формуле:
П1 — п
=-------. (2>
г
В наших наблюдениях после трепанации поверхностного листка кармана для определения преломляющей силы трансплантата может быть использована формула (2), так как поверхностный листок карманов роговицы повторяет наружную кривизну имплантата.
В литературе имеется ряд работ, посвященных расчетным основам рефракционной хирургии роговицы [Блаватская Е. Д., 1969, 1973; Слонимский Ю. Б., 1973; Морхат И. В., 1974; Barraquer I., • ; :
1964, 1970, и др.]. В расчетах заднюю поверхность роговицы не 5
68.
Устройство для иссечения имплантата на свинцовой моделирующей основе (а) и гистологически санный микротом с устройством для срезания имплантата в рабочем состоянии (б).
127
Таблица 5
Зависимость диаметра линз от их толщины и радиуса кривизны передней поверхности [Мор хат И. В., 7Р80]
Диаметр моделирующего шарика, мм Радиус кривизны линзы, мм Диаметр линзы (мм) при толщине линзы
0,5 мм 0,4 мм 0,3 мм 0,2 мм 0,1 мм
7 4* 3,87 3,49 3,04 2,46 1,78
8 4,5 4,13 3,72 3,23 2,65 1,89
9 5 4,36 3,92 3,41 2,8 1,99
10 5,5 4,58 4,12 3,58 2,94 2,09
11 6 4,8 4,31 3,75 3,07 2,18
12 6,5 5,0 4,49 3,9 3,2 2,27
13 7 5,2 4,66 4,05 3,32 2,36
14 7,5 5,39 4,83 4,2 3,44 2,44
15 8 5,57 4,96 4,33 3,55 2,52
16 8,5 5,74 5,15 4,43 3,67 2,6
17 9 5,91 5,31 4,6 3,8 2,67
18 9,5 6,08 5,42 4,74 3,88 2,75
19 10 6,24 5,6 4,86 3,98 2,82
20 10,5 6,4 5,75 5,0 4,08 2,89
* Радиус кривизны срезаемой биолинзы больше радиуса моделирующего шарика на толщину роговицы (0,5 мм).
принимают во внимание, так как при вмешательствах на роговице она не подвергается изменениям. При постоянном радиусе кривизны задней поверхности рефракция глаза в целом изменяется настолько, насколько изменяется кривизна передней поверхности за счет утолщения роговицы в центре после пересадки биолинзы.
А. А. Карамян (1985) предлагает простой метод расчета параметров биолинзы и радиуса кривизны передней поверхности роговицы реципиента после введения биолинзы. Радиус кривизны моделирующей основы (7?i), на которой должна выкраиваться биолинза для уменьшения радиуса кривизны передней поверхности роговицы (7?) до необходимого размера (г), можно определить по формуле:
Z-2 + ft?
Ri
(3)
2/ц моделирующей основы; L — */2 диа-известная) ; hi — толщина биолинзы
где Ri — радиус кривизны метра биолинзы (величина (рассчитывают на основании известных R и г).
Эту же формулу используют для определения радиуса кривизны передней поверхности роговицы после введения биолинзы (г) •при известных толщине биолинзы (hi) и радиусе кривизны передней поверхности роговицы (R) до введения био линзы:
Р +Я2
2Н
(4)
928
Н — высота сегмента роговицы после введения биолинзы (рассчитывают на основании известных h\ и R).
Стойкость клинических результатов рефракционной межслойной пересадки имплантатов, произведенной 7 больным, подтверждена длительными наблюдениями (свыше 14 лет). Трансплантаты, взятые из роговиц глаза трупа и плода, сохраняли форму, рефракционные свойства и прозрачность на протяжении всего срока наблюдения [Беляев В. С., Веретенникова В. В., 1970,1972, 19791.
Обобщая данные 25-летних исследований по проблеме межслойной кератопластики, следует отметить возможность изменения рефракционных показателей и улучшения остроты зрения после хирургической коррекции афакии, гиперметропии и миопии за счет увеличения или уменьшения кривизны передней поверхности центральной зоны роговицы над имплантатом при сохранении кривизны задней поверхности роговицы реципиента. Указанной цели достигают, помещая иссеченный имплантат (плюсовая или минусовая биолинза) из роговицы глаза трупа в карман между слоями стромы роговицы и после приживления его к глубоким слоям роговицы, производя трепанацию поверхностного слоя кармана трепаном большего диаметра, чем имплантат. Это нововведение в виде трепанации или насечки снижает сопротивляемость поверхностного слоя кармана, позволяет изменить оптическую кривизну передней поверхности центра роговицы над имплантатом, не меняя кривизны ее задней поверхности, значительно повышает рефракционный эффект операции (авт. свид. № 825067).
Техника хирургической коррекции афакии и гиперметропии. После инстилляции в конъюнктивальную полость 1 % раствора дикаина (у беспокойных больных после акинезии и ретробульбарного введения 2 мл 2% раствора новокаина) в верхпенаружном квадранте роговицы, отступя 2 мм от лимба, осколком лезвия бритвы, установленным по лекалу на 0,2 мм в лезвиедержателе, производят разрез длиной 5—6 мм на глубину 0,2 мм. Специальным изогнутым по кривизне роговицы ножом для ее расслоения на глубине надреза, проникают между слоями стромы, образуя карман диаметром 7—8 мм (рис. 69).
Глаз донора обрабатывают в двух порциях водного раствора бриллиантового зеленого (1: 2000) и 30% раствор сульфацил-нат-рия. Скарификатором тщательно удаляют эпителий с роговицы. С помощью ножа Грефе и ножниц отделяют роговицу с ободком склеры шириной до 5 мм и укладывают на моделирующую свинцовую основу, имеющую необходимый радиус кривизны. Моделирующую основу с роговицей помещают на специальный столик, сверху прижимают фиксирующей пластиной с отверстиями для моделирующей основы и винтов, после чего зажимают винтами до появления легкой опалесценции роговицы. Затем данное устройство укрепляют на санном микротоме на уровне ножа и микровинтом поднимают столик на необходимую высоту. Плавным движением срезают биолинзу толщиной в центре 0,3—0,5 мм.
9 Руководство по глазной хирургии
129
69. Кератофакия по Беляеву — Душину (схема).
I — вид роговицы спереди; II — поперечный срез роговицы после первого этапа операции — имплантат в межслойном кармане; III — после трепанации поверхностного листка; 1 — разрез роговицы; 2 — межслойный карман; 3 — имплантат; 4—• поверхностный листок роговицы; 5 — линия трепанации.
В некоторых случаях биолинза повисает на «хвостике» шириной менее 1 мм, который отсекают осколком бритвенного лезвия. Под микроскопом контролировали форму и толщину биолинзы. Затем ее обрабатывают 30% раствором сульфацил-натрия и опускают в водный раствор бриллиантового зеленого (1:2000). Имплантат принимает голубоватую окраску, что значительно облегчает его расправление и установление в роговичном кармане. Имплантат обесцвечивается на следующий день.
После обмывания в 30% растворе сульфацил-натрия имплантат с помощью микропинцета и шпателя вводят в карман роговицы и устанавливают в центре ее против зрачка. Имплантат удерживается поверхностными слоями роговицы без дополнительной фиксации. Швы на роговичный надрез не накладывают. Передние слои роговицы плохо растягиваются, поэтому имплантат отжимает глубокие слои роговицы в сторону передней камеры. В; течение первых суток применяют бинокулярную повязку при соблюдении больным строгого постельного режима, со 2-го дня накладывают монокулярную повязку, а больному разрешают двигаться.
Второй этап операции производят спустя 3—4 нед с целью ослабить давление поверхностных слоев роговицы на трансплантат. После акинезии и эпибульбарной анестезии осуществляют сквозную трепанацию поверхностного слоя роговичного кармана трепаном ФМ-Ш (диаметр 7—8 мм) концентрически на расстоянии 1 мм от края имплантата. На отдельных участках не полностью трепанированный слой роговицы прорезают острым кончиком осколка лезвия бритвы, роговичными микроножницами или ножницами Ваннаса. После просечения переднего листка кармана уменьшается его давление на имплантат и он сдвигается вперед,
130
70. Роговица после кератофакии в свете щелевой лампы (в центре — имплантат).
а — до трепанации; б — после трепанации поверхностного листка кармана.
приподнимая поверхностный слой роговицы, в результате чего образуется круговая эрозия шириной 0,1—0,2 мм по линии трепанации. Поверхностный листок кармана удерживается в центре па месте спаялия с имплантатом, дополнительная фиксация не требуется (у беспокойных больных можно наложить четыре— пять узловых швов без натяжения). Заживление эрозии происходит роговичной тканью. Имплантат и роговица сохраняют прозрачность. Биомикроскопически роговица вместе с имплантатом напоминают биологическую контактную линзу, меняющую рефракцию центра роговицы (рис. 70). Для иллюстрации приводим выписку из истории болезни оперированной нами больной.
Больная К., 66 лет. Поступила в глазное отделение Московской городской клинической больницы № 1 15.10.79 г. с диагнозом: зрелая старческая катаракта правого глаза. Миопия слабой степени обоих глаз. Острота зрения правого глаза — светоощущение с правильной проекцией света, острота зрения левого глаза 0,2, с — 3,0 дптр 0,9. Поле зрения обоих глаз в норме. Механофосфен, аутофтальмоскопия обоих глаз положительны.
16.10 больной произведена интракапсулярная криоэкстракция катаракты •с базальной иридэктомией и межслойная рефракционная кератопластика с целью усиления рефракции правого глаза. В карман роговицы диаметром 8 мм и глубиной 0,2 мм, приготовленный до экстракции катаракты, после ее
131
удаления помещен аллоимплантат. Имплантат срезан на санном микротоме (свинцовая моделирующая основа диаметром 19 мм), толщина его в центре 0,44 мм, диаметр 5,6 мм. Операция прошла без осложнений. Течение послеоперационного периода спокойное.
На 15-й день глаз спокоен. Роговица и имплантат прозрачные, отмечается легкий десцеметит в виде складок под имплантатом. Биомикроскопически наблюдается изменение кривизны задней стенки кармана под имплантатом, передняя поверхность роговицы не изменена. Острота зрения 0,2, с +8,0 дптр 0,6.
02.11 произведена трепанация передней стенки роговичного кармана на глубину 0,2 мм трепаном диаметром 7 мм и наложены шесть направляющих узловых швов (шелк 10:0). В послеоперационном периоде наблюдались светобоязнь и слезотечение, которые уменьшились по мере заживления эрозии, образовавшейся на месте насечки.
При выписке 24.11 правый глаз спокоен. Роговица и имплантат прозрачные. Биомикроскопически задняя поверхность роговицы имеет свойственную ей кривизну, наблюдается отчетливое изменение передней поверхности роговицы над имплантатом. Острота зрения 0,1, с—3,0 дптр=0,3.
При осмотре 0.7.04.82 г. правый глаз спокоен, роговица и имплантат прозрачные. Острота зрения 3,0, с — 3,0 дптр = 0,6. Скиаскопически выявляется миопия —3,0—4,0 дптр. Читает вблизи шрифт № 7 без коррекции.
Техника хирургической коррекции миопии. Осуществляют инстилляцию в конъюнктивальную полость 1 % раствора дикаина, акинезию и ретробульбарную инъекцию 2 мл 2% раствора новокаина. Осколком лезвия бритвы перилимбально производят надрез роговицы длиной 5 мм на глубину 0,2 мм.
Специальным ножом для расслоения роговицы на глубине надреза проникают между слоями роговичной стромы качательны-ми движениями, образуя карман диаметром 7—8 мм. Имплантат готовили из роговицы глаза трупа. Глаза консервируют во влажной камере по Филатову при температуре +2+ 4 °C в течение 2— 5 сут. Глаз донора после консервирования обрабатывают в двух порциях водного раствора (1:2000) бриллиантового зеленого и 30% раствора сульфацил-натрия. Для приготовления имплантата после скарификации эпителия делают перилимбальный надрез роговицы осколком лезвия бритвы, установленным в лезвиедер-жатель с помощью ступенчатого лекала на заданную глубину (0,3—0,5 мм) в зависимости от степени миопии. На глубине разреза роговичным ножом расслаивают роговицу донора. Расслоенную роговицу вместе со склеральным ободком шириной 3—4 мм зажимают пластиной с отверстием на свинцовой полусфере диаметром 9,6 мм и ножом санного микротома срезают выступающую на сфере часть роговицы толщиной 0,3—0,5 мм. Затем трепаном ФМ-III (диаметр 5 мм) иссекают имплантат, который представляет собой мениск диаметром 5 мм с истончением в центре, или имплантат в виде мениска с отверстием диаметром 1,5—2 мм в центре.
После обработки в 30% растворе сульфацил-натрия и споласкивания в изотоническом растворе хлорида натрия имплантат микропинцетом и шпателем вводят в карман роговицы реципиента и устанавливают в центре роговицы напротив зрачка. Имплантат прочно удерживается под поверхностными слоями роговицы без дополнительной фиксации. Швы на края роговичной раны не на-132
71. Межслойная рефракционная кератопластика при миопии по Беляеву — Луэнго (схема).
I — вид роговицы спереди; II — Срез роговицы после первого втапа операции — имплантат в кармане; III — после трепанации поверхностного листка кармана; 1— разрез роговицы, 2 — межслойный карман, 3 — имплантат, 4 — поверхностный листок роговицы, 5 — линия трепанации.
кладывают (рис. 71). В течение первых суток глаза остаются под бинокулярной повязкой при соблюдении больным строгого постельного режима, со 2-го дня накладывают монокулярную повязку, больной начинает ходить. Биомикроскопически имплантат в виде отрицательной линзы виден в оптическом срезе роговицы, причем его утолщенные края отжимают задние слои роговицы реципиента в сторону передней камеры.
Второй этап операции выполняют спустя 3—4 нед после первого с целью создать условия для смещения имплантата вперед после трепанации поверхностных слоев роговицы. После акинезии и эпибульбарной анестезии производят сквозную трепанацию поверхностного слоя роговичного кармана трепаном ФМ-И1 (диаметр 7 мм). На отдельных участках не полностью трепанированный слой роговицы вскрывают кончиком осколка бритвенного лезвия, роговичными микроножницами или ножницами Ваннаса. После трепанации по линии разреза образуется круговая эрозия шириной 0,1—0,2 мм. В результате ослабления поверхностного слоя кармана утолщенные края имплантата смещаются вперед, вызывая уплощение поверхности центрального участка роговицы реципиента. Если трепанацию производят через 4 нед после первого этапа, то дополнительная фиксация не требуется. При осуществлении трепанации в более ранний период (5—7-й день) поверхностный листок роговицы следует укрепить четырьмя— шестью шелковыми швами (10:0) край в край без натяжения для предотвращения смещения лоскута и имплантата.
133
Заживление эрозии и ее последующее заполнение происходят за счет слоев роговичной ткани. Имплантат и роговица реципиента сохраняют прозрачность. Для иллюстрации приводим выписку из истории болезни наблюдавшегося нами больного.
Больной Г., 18 лет. Поступил 30.10.78 г. в глазное отделение Московской городской клинической больницы № 1 с диагнозом: прогрессирующая осложненная миопия высокой степени; амблиопия левого глаза; миопия средней степени правого глаза; анизометропия.
Острота зрения правого глаза 0,06, с —6,0 дптр и цилиндром —1,0 дптр (ось 180°) 0,8, левого глаза 0,01, с —23,0 дптр 0,09. Скиаскопически миопия правого глаза 6,5 дптр/5,0 дптр, левого глаза 24,0 дптр/22,0 дптр. Поле зрения обоих глаз в норме. Эхобиометрически переднезадняя ось правого глаза 27,1 мм, левого 31,8 мм.
01.09.78 г. произведена склеропластика левого глаза. Операция и послеоперационный период без осложнений. При выписке 11.09: острота зрения левого глаза 0,01, с —22,0 дптр 0,1, скиаскопически миопия 23,0 дптр/21,0 дптр, переднезадняя ось 30,9 мм, поле зрения в норме.
Таким образом, у больного после склеропластики левого глаза миопия снизилась на 1,0 дптр, острота зрения улучшилась с коррекцией на 0,01.
09.11 больной поступил для выполнения межслойной рефракционной кератопластики левого глаза. При поступлении: острота зрения правого глава 0,1, с —6,0 дптр и цилиндром —1,0 (ось 180°) 0,8, левого глаза 0,02, с —23,0 дптр 0,1, скиаскопически правый глаз — миопия 6,5 дптр/5,0 дптр, левый — 23,0 дптр/21,0 дптр. Эхобиометрия правого глаза 27,1 мм, левого 31 мм. Офтальмометрия левого глаза: 165°—41,0 дптр, 8,1 мм, 75° —42,25 дптр, 7,85 мм, поле зрения обоих глаз в норме. Чувствительность роговицы по Добромыслову — Ромашевскому 100%.
13.11 произведена межслойная рефракционная кератопластика левого глаза с целью уменьшения рефракции. В карман роговицы глубиной 0,2 мм и диаметром 8 мм помещен имплантат (диаметр 5 мм, толщина 0,4 мм по периферии и 0,1 мм в центре), который приготовлен на свинцовой моделирующей основе диаметром 9,6 мм. Операция и послеоперационный период без осложнений. На 5-й день глаз спокоен, роговица прозрачная, имплантат слегка опалесцирует. Скиаскопически степень миопии не изменилась. Биомикроскопически не наблюдается уплощения передней поверхности роговицы, но под имплантатом заметна деформация задней стенки кармана (рис. 72, а).
18.12 произведена концентрическая трепанация передней стенки кармана роговицы над имплантатом на глубину 0,2 мм трепаном диаметром 7 мм и наложены пять направляющих узловых швов. В послеоперационном периоде наблюдались светобоязнь и слезотечение, которые постепенно уменьшились по мере заживления эрозии от насечки.
При выписке 18.01.79 г. левый глаз спокоен. Роговица и имплантат прозрачные. Биомикроскопически задняя поверхность роговицы имеет свойственную ей кривизну, наблюдается отчетливое уплощение передней поверхности роговицы над имплантатом (рис. 72, б). Острота зрения левого глаза 0,1 без коррекции. Скиаскопически эмметропия левого глаза. Чувствительность роговицы в центре отсутствует, по периферии сохранена.
При осмотре 29.05 глаз спокоен. В роговице над имплантатом появились нежные облаковидные опалесценции. Острота зрения левого глаза 0,06, с —5,0 дптр = 0,1. Скиаскопически отмечается некоторое уменьшение первоначального эффекта операции, миопия 7,0 дптр. Назначено лечение — инстилляции раствора дионина в возрастающей концентрации.
При осмотре 15.07 левый глаз спокоен, имплантат и роговица прозрачные. Острота зрения 0,08, с —5,0 дптр 0,1. Скиаскопически — миопия 7,0 дптр. Чувствительность роговицы восстановилась до 100%.
На 40-м месяце наблюдения 11.03.82 г. имплантат и роговица прозрачные. Острота зрения левого глаза 0,08, с —5,0 дптр 0,3. Скиаскопически — миопия 7,0 дптр.
<34
72. Роговица после межслойной рефракционной кератопластики при миопии, а — имплантат, отжимающий задние слои роговицы; б — уплощение передней поверхности роговицы после трепанации поверхностного листка.
Таким образом, у больного после комбинированного хирургического лечения миопии левого глаза острота зрения на амблио-пичном глазу увеличилась на 0,07 без коррекции и на 0,21 с коррекцией, а степень миопии уменьшилась на 17,0 дптр/15,0 дптр.
* * *
При использовании описанных ранее способов межслойной пересадки имплантат, помещенный между слоями роговицы, вызывал в основном прогибание задней поверхности роговицы без достаточных изменений ее рефракции. Настоящий способ дает возможность, применив простую и безопасную методику, добиться изменения кривизны передней поверхности роговицы. Это позволяет корригировать афакию, гиперметропию и значительно выраженную миопию (10—20 дптр) с высокой точностью, которая при свободном заживлении после трепанации поверхностного листка роговицы зависит в основном от параметров имплантата (биолинзы), чего не удавалось достичь с помощью применявшегося ранее способа.
Имплантат, помещенный в карман под поверхностные слои роговицы с сохраненной иннервацией, прочно фиксируется, срастаясь с соседними слоями роговицы, что обеспечивает лучшее питание и ускоряет его приживление, устраняя главную опасность этих операций — врастание эпителия с потерей прозрачности роговицы.
Прорезание поверхностного слоя кармана для формирования передней поверхности, меняющей рефракцию глаза, в отличие от кератомилеза производят после срастания поверхностей стромы
135
имплантата со слоями роговицы реципиента, когда врастание эпителия уже невозможно. При использовании описанного способа не происходит истончение роговицы больного, которое отрицательно влияет на отдаленные результаты кератомилеза. Ткань имплантата обрабатывают без воздействия холода, исключается замораживание и размораживание аутотрансплантата, применяемое при кератомилезе. В результате этого меньше травмируется ткань роговицы и не требуется сложная замораживающая аппаратура. Наконец, отсутствуют многочисленные роговичные швы, неизбежные при использовании ранее существовавших методик. Имплантат и поверхностный слой роговицы удерживаются за счет приживления, наступающего во время фиксации имплантата в кармане до момента прорезания поверхностного листка роговицы.
Таким образом, предложенный способ характеризуется тем, что используется упрощенная техника операции, устраняется основная опасность — врастание эпителия с потерей прозрачности роговицы больного, отсутствует повреждающее действие холода, нет необходимости применять сложное оборудование для обработки имплантата и накладывать множественные швы, повреждающие трансплантат при его фиксации, при длительном наблюдении и в клинике (более 14 лет) отмечаются благоприятные результаты операции.
Все отмеченное выше позволяет сделать заключение, что поставленная цель — коррекция афакии, гиперметропии и миопии, может быть достигнута с помощью простого, менее опасного и доступного способа. В связи с этим открываются возможности широкого применения рефракционной кератопластики для исправления аномалий рефракции в условиях клиники.
Мы располагаем результатами длительных наблюдений за больными: 7 больных — более 14 лет, 86 больных — от 2 до 6 лет. Роговица и имплантат остаются прозрачными, рефракционный эффект не ослабевает, биолинза не рассасывается, чувствительность роговицы сохраняется, максимальная острота зрения до 0,8—1,0 без коррекции с восстановлением бинокулярного зрения. Двум из этих больных кератофакия произведена на обоих глазах [Беляев В. С. и др., 1984].
В настоящее время под нашим наблюдением находится больной, которому кератофакия была произведена после реклинации, выполненной 9 лет назад. Бинокулярное зрение у него восстановилось после реклинации катаракты и межслойной имплантации биолинзы, исправляющей афакию. Хотелось бы верить, что в будущем удастся объединить реклинацию с кератофакией и эта наиболее легко выполнимая перспективная комбинированная операция при лечении больных с катарактами, привлечет внимание окулистов.
Методика межслойных пересадок получила одобрение и в работах зарубежных авторов. R. С. Troutman и соавт. (1981) приводят данные об изменении рефракции глаза путем внедрения между пластинками стромы роговицы аллотрансплантата в форме 136
диска; 29 вмешательств были первичными (кератофакию осуществляли одновременно с экстракцией катаракты), 3 — вторичными на афакичных глазах. В первой серии операций не было скор-ригировано 28,5 % гиперметропий, во второй — 6,5 %.
Авторы считают, что дальнейшее совершенствование технического оснащения операции и математических расчетов приведет к широкому распространению рефракционной кератопластики. По их мнению, вторичная кератофакия предпочтительнее вторичной имплантации внутриглазной линзы, так как не требует вскрытия глазного яблока. Она является операцией выбора у молодых людей с катарактой и у всех лиц, которым не показано введение искусственного хрусталика. В описываемых авторами наблюдениях, несмотря на увеличившуюся толщину роговицы, среды оставались полностью прозрачными и глазное дно офтальмоскопирова-лось вплоть до крайней периферии. По их мнению, рефракционная кератопластика — это новое перспективное направление в офтальмомикрохирургии.
Зарубежные авторы [Kaufman Н. Е., 1980; Werblin Т. Р. et al., 1981] описывают метод эпикератофакии (живой контактной линзы): аллотрансплантат пришивают к деэпитализированной поверхности роговицы донора. Метод заслуживает внимания. Недостатком его является наложение множественных швов на роговицу, в связи с чем существует опасность возникновения неправильного астигматизма и врастания эпителия.
Имплантация искусственной роговицы
Кератопротезирование, или эксплантацию роговицы, пересадку искусственной роговицы, начали производить еще в прошлом веке [Nussbaum J. N., 1853, и др.]. Идея операции состояла в использовании искусственных прозрачных материалов для образования «окна» в бельме.
В Советском Союзе первая эксплантация бельма произведена В. П. Филатовым в 1936 г. В качестве материала для пересадки использовали хрусталь, стекло, различные пластмассы. Эти операции, как правило, оканчивались отторжением имплантата.
Произведенное за последние два десятилетия техническое усовершенствование оперативной техники позволило несколько снизить частоту отторжения [Краснов М. М., 1967; Пучковская Н. А., Якименко С. А., 1968—1985; Бедило В. Я., 1968; Федоров С. Н., 1970, 1982, и др.]. В связи с этим вновь возрос интерес к керато-протезированию роговицы.
Эксплантацию выполняют при грубых бельмах, особенно после ожогов. Основным показанием в ее применении служит безуспешность кератопластики, которая, безусловно, более физиологична, чем эксплантация, поэтому ее следует производить в первую очередь [Пучковская Н. А., 1973].
Различают сквозную и межслойную (интерламеллярную) эксплантацию. Принцип сквозной эксплантации заключается в том, что в центре мутной роговицы (бельма) производят ее сквозную
137
73. Кератопротез.
1 — оптический цилиндр; 2 — основа не-ратопротеза.
трепанацию и в образовавшееся отверстие вставляют прозрачный цилиндр — кератопротез (рис. 73). Для кератопротезиро-вания лучше использовать полиметилметакрилат. Опорная часть кератопротеза, которую укрепляют между слоями роговицы или бельма, изготовляют из того же материала или инертных металлов — титана, тантала, платины или пластмассы (рис. 74).
При тяжелых бельмах рого-
вицы, когда восстановить ее прозрачность с помощью кератопластики невозможно, применяют кератопротезы, выполняющие роль прозрачного «окна» в рубцовой ткани. Основой кератопротеза этого типа является тонкий диск, располагающийся интерламеллярно; в центре его помещается оптическая часть в виде цилиндра из метилметакрилата, не-
74. Кератопротезирование (схема).
а — расслоение бельма; б — имплантация основы кератопротеза; в — трепанация поверхностного листка бельма; г, д — установка оптического цилиндра протеза; е — передний отдел глаза с кератопротезом.
138
75.
Укрепление кератопротеза под хрящевым диском.
а — схема операции; б — глаз после операции.
сколько выступающего в переднюю камеру [Cordona Н., 1962, и др.]. Образующийся «уступ» затрудняет разрастание соединительной ткани по задней поверхности имплантата. Разновидностью кератопротеза данного типа является имплантат Стрампелли, укрепленный па пластипке, вышлифованной из зуба реципиента. Н. Cordona (1969) сообщил о применении грибовидного кератопротеза («болт-гайка»). При этом для фиксации имплантата используют всю толщу бельма. Кератопротезы позволяют одновременно корригировать аномалии рефракции [Бедило В. Ф., 1969].
Основным осложнением при эксплантации является отторжение кератопротеза, опасность возникновения которого больше при ожоговых бельмах и несколько меньше при неожоговых [Пулковская Н. А., Якименко С. А., 1970; Castroviejo R. et al., 1969]. Конъюнктивальная пластика, как правило, не в состоянии предотвратить начавшееся отторжение. На практике с этой целью чаще используют тектоническую пересадку трупной роговицы и склеры. Для предотвращения отторжения кератопротеза применяют аутосклеру, надкостницу и хрящ из уха, взятые у больного. Надкостница недостаточно плотная, более перспективна аутогенная хрящевая ткань [Войно-Ясенецкий В. В., 1960, 1965; Краснов М. М., Удинцов Б. Е., 1975]. Хрящ из уха достаточно плотный как основа для кератопротеза и эластичный, чтобы его можно было использовать для вживления в ткань роговицы.
139
Формируют широкий интерламеллярный карман между слоями бельма, в который помещают хрящевой диск, взятый из уха больного. Для лучшей адаптации край хрящевого диска делают более тонким. После приживления хрящевого диска (рис. 75, а) под него помещают плоскую основу кератопротеза. В центральной части бельма трепанируют отверстие нужного диаметра (3— 4,5 мм) для введения оптического цилиндра кератопротеза. Получены обнадеживающие результаты; острота зрения до 1,0 при сроке наблюдения до 2 лет (рис. 75,6).
В последнее время кератопротезирование начали применять в клинике (М. М. Краснов, Н. А. Пучковская, С. А. Якименко, В. Я. Бедило, С. Н. Федоров, В. К. Зуев, А. И. Гмыря и др.).
Благодаря использованию новых моделей кератопротезов и методик эксплантации достигнут определенный успех в керато-протезировании. Отечественными и зарубежными офтальмологами произведены операции свыше 500 больным, отдаленные результаты вполне обнадеживающие.
Хирургическая реконструкция переднего сегмента глаза аутотрансплантатом из заднего отдела другого глаза. Восстановление зрения после тяжелых ожогов глаз остается во многом нерешенной проблемой. Пересадка роговицы чаще всего малоперспективна: пересаженная ткань быстро подвергается перерождению и неоваскуляризации. Кератопротезирование может дать хороший непосредственный эффект, однако имплантат часто отторгается (при неожоговых бельмах результаты намного лучше). Наиболее хорошие результаты дает аутопластика. Техника подобного оперативного вмешательства описана М. М. Красновым (1975). Указанная идея была апробирована в случае, когда, по-видимому, не было других реальных возможностей в борьбе за зрение.
Хирургическая коррекция миопии и астигматизма
Решение проблемы хирургической коррекции миопии и астигматизма связано с достижениями офтальмохирургии в области удаления хрусталика, укорочения и укрепления склеры, кератопластики. Идея удаления прозрачного хрусталика из глаза при высокой степени миопии была высказана A. Desmonceaux (1775). Однако более 100 лет операция не находила применения из-за часто возникавшего осложнения — гнойной инфекции.
V. Fukala (1889) и L. Vacher (1890) на практике показали, что удаление прозрачного хрусталика при высокой степени миопии дает положительные результаты. В последующие 10 лет операция завоевала признание. Однако при изучении отдаленных результатов операции было установлено, что после нее нередко происходит отслойка сетчатки. По данным С. Норпег (1909), это осложнение возникло в 11% случаев (на 338 операций). Л. Г. Беллярминов и А. И. Мерц (1930) указывали, что более чем у 50% оперированных рано или поздно происходит отслойка сетчатки. Это заста
140
вило офтальмохирургов отказаться от операции, и в 20—30-х годах XX века она была оставлена.
В последующие десятилетия достижения в хирургическом лечении катаракты позволили ряду офтальмологов [Elschnig А., 1934; Gilbert W., 1950; Gomes Е. et al., 1953; Valerio M., 1957; Hervonet F., 1961, и др.] применить этот метод при высокой миопии. М. Valerio (1960), обобщив результаты 200 интракапсулярных экстракций, рекомендовал применять этот метод в показанных случаях для лечения миопии у больных старше 20 лет. F. Hervonet привел статистические данные о 391 интракапсулярной экстракции прозрачного хрусталика: хороший результат получен в 70% случаев, удовлетворительный — в 20%, отслойка сетчатки возникла в 6%, острота зрения снизилась в 4% случаев. Необходимо отметить, что показания к этой операции ограничены миопией высокой степени.
W. Gilbert считает, что лучше всего оперировать при миопии 18,0—20,0 дптр, так как в этом случае можно рассчитывать на улучшение остроты зрения вдаль без очков, и при прогрессирующей миопии 16,0 дптр. Об этом свидетельствует всем известная формула для определения рефракции афакичного глаза:
«2 = 10- — , (5)
где 7?i — рефракция до операции. Из данной формулы видно, что после удаления хрусталика разовьется эметропия, если до операции была миопия 20,0 дптр.
Большинство офтальмохирургов рекомендуют два метода удаления хрусталика: у больных с миопией в возрасте до 20—25 лет дисцизию капсулы хрусталика с последующим выпусканием или отсасыванием масс, а у больных старше 25 лет — первичную интракапсулярную экстракцию прозрачного хрусталика. Противопоказаниями к операции являются миопия ниже 16,0 дптр и наличие отслойки сетчатки или ее выраженной дегенерации.
Таким образом, хотя удаление прозрачного хрусталика и производят при миопии для уменьшения рефракции, каждый офтальмохирург представляет, какие трудности могут возникнуть вовремя операции. В послеоперационном периоде возможны отслойка сетчатки и вторичная глаукома.
Мы используем этот метод в основном при помутнении хрусталика (катаракта) у больных с миопией высокой степени; в этом случае имеется больше показаний к выполнению такой операции и она более оправдана.
При прогрессирующей миопии в глазу происходят серьезные изменения, что приводит к значительной потере зрения. Развивающаяся в таких глазах осложненная катаракта резко снижает остаточные зрительные функции, лишая больных трудоспособности. Достижения в хирургии катаракты и прогрессирующей миопии позволили нам выработать наиболее оптимальную тактику ле-
141
чеиия этой смешанной патологии. Мы производили комбинированную операцию — склеропластику [Беляев В. С., Ильина Т. С., 1972] и удаление хрусталика при миопии высокой степени. Выполняя склеропластику как первый этап хирургического вмешательства по поводу осложненной прогрессирующей миопии, мы стремились не только остановить прогрессирование заболевания, но и с помощью наступающей при этом реваскуляризации тканей добиться лечебно-профилактического эффекта при миопическом хориоретините.
Под наблюдением в отдаленные сроки после операции (до 10 лет) находились 59 больных, из них 43 женщины и 16 мужчин в возрасте 25—77 лет, которым произведена 151 операция (97 скле-ропластик, 40 экстракций катаракты и 14 удалений прозрачных хрусталиков) при прогрессирующей миопии высокой степени. Срок наблюдения после склеропластики составил от 6 мес до 10 лет, после экстракции катаракты — от 2 мес до 10 лет [Матту И. К.„ 1984].
У одного больного во время экстракции катаракты отмечалось выпадение стекловидного тела. В послеоперационном периоде ни после склеропластики, ни после экстракции катаракты осложнений не наблюдалось. Степень миопии у больных была от 16,0 до 30,0 дптр.
При эхобиометрическом исследовании выявлено максимальное удлинение переднезадней оси глаза до 39,9 мм. После экстракции катаракты получено увеличение остроты зрения от светоощу-щения с правильной проекцией света до 0,1—0,8 без очковой коррекции. У 2 больных понадобилась дополнительная коррекция— 3,0 дптр и 4-2,25 дптр. У остальных больных острота зрения выше,, чем была с полной коррекцией до развития катаракты. Для иллюстрации приводим собственное наблюдение.
Больная Б., 52 лет. Диагноз: прогрессирующая миопия высокой степени;, начальная катаракта обоих глаз.
При поступлении острота зрения правого глаза 0,01, с — 18,0 дптр 0,1,. левого — 0,01, с —18,0 дптр 0,2.
23.06.71 г. выполнен первый этап комбинированный операции — скле-ропластика аллосклероп заднего полюса правого, хуже видящего глаза,. 4.01.79 г. — второй этап — интракапсулярная криоэкстракция катаракты правого глаза.
18.03.79 г. произведена интракапсулярная криоэкстракция катаракты без: предварительной склеропластики левого глаза. Операция и послеоперационный период без осложнений.
При выписке острота зрения правого глаза 0,5, левого 0,7. В отдаленном периоде (10.11.84 г.) острота зрения правого глаза 0,8, с—1,0 дптр 1,0, левого 0,4, с —0,5 дптр 0,6.
У данной больной в отдаленные сроки после операции (через 5 лет) отчетливо прослеживались стабилизация миопии и повышение остроты зрения не хуже видящем глазу, на котором была произведена склеропластика с удалением катаракты. В то же время на другом глазу, на котором склеропластику не выполняли,, острота зрения в отдаленные сроки понизилась.
142
Таким образом, для реабилитации больных с прогрессирующей миопией, осложненной катарактой, показана склеропластика как предварительное вмешательство перед экстракцией осложненной катаракты, что значительно снижает число операционных и послеоперационных осложнений. С помощью укрепления заднего полюса глаза удается остановить прогрессирование миопии и снизить опасность возникновения отслойки сетчатки, при этом улучшается питание тканей глаза, что позволяет получить лучший визуальный эффект.
Уменьшение преломляющей силы роговицы. Возможность уменьшения общей рефракции глаза при миопии за счет уменьшения преломляющей силы роговицы в последние годы привлекает внимание многих исследователей. В литературе приводятся описания операций на роговице, которые производят с целью снизить степень миопии [Морхат И. В., 1961, 1963, 1966, 1975; Блаватская Е. Д., 1966, 1968, 1973; Пурескин Н. IL, 1966, 1967; Пурескин Н. П., Богуславская Э. С., 1967; Краснов М. М., 1970; Груша О. В., Мустаев И. А., 1971, 1973; Федоров С. Н., Захаров В. Д., 1971; Пучковская Н. А. и др., 1973, 1974; Беляев В. С. и др., 1974; Беляев В. С., 1975; Маунг Кио Тин, 1976, 1979; Илиа А. Н., 1977; Беляев В. С., Луэнго В. М., 1978; Сергиенко Н. М., 1978; Уткин В. Ф., 1979; Еналиев Ф. С., 1979, 1980; Беляев В. С. а др., 1980; Аветисов С. Э., 1980; Вайсблат А. С., Еникеева Т. И., 1981; Sato Т., 1950, 1953, 1955, 1956; Barraquer J. I., 1949, 1965; Sato Т. et al., 1953; Krwawicz T., 1960, 1964; Martinez M., Kat-xin H., 1963; Ainslie D., 1969; Krachmer J. H., Fenzl R. E., 1980, и др.]. Изучение этих вопросов продолжается.
Т. Sato (1950, 1953) предложил оригинальный метод хирургической коррекции миопии. С помощью задних, а позднее и передних периферических радиальных надрезов роговицы он добился увеличения радиуса кривизны пад зрачковой зоной и тем самым уменьшения ее преломляющей силы.
Техника операции. После достаточной местной анестезии ретробульбарно вводят 3 мл 2% раствора новокаина, в результате этого создается легкий экзофтальм и облегчается проведение операции. Под сухожилие верхней и нижней прямых мышц накладывают шелковые швы-держалки, что позволяет глазному яблоку вращаться вокруг переднезадней оси. Веки удерживают ве-корасширителем. На роговицу накладывают кольцо из стерильного волоса для ограничения зрачковой зоны (6 мм).
Роговичный нож Сато вводят в переднюю камеру у верхнего лимба и делают 5—9 насечек в нижней части роговицы. Нож вводят в корнеосклеральной переходной зоне, ближе к склере, и достигают передней камеры, пройдя 2 мм по касательной в строме роговицы. Нож проводят через переднюю камеру до противоположной лимбальной зоны и делают насечку такой длины, чтобы оставить нетронутой зрачковую зону диаметром 6 мм. Затем нож извлекают и вновь вводят в переднюю камеру у нижнего лимба, такие же насечки (4—9) наносят в верхней части роговицы.
143
а б
76. Нанесение задних насечек по Сато (а) и нож Сато (б) (схема). Стрелкой указано направление силы тяги за прямые мышцы.
Насечки в наружной части роговицы производят из прокола с носовой стороны, во внутренней — с височной стороны (рис. 76, а). Насечку делают через эндотелий, заднюю пограничную пластинку (десцеметова оболочка) и 2/з стромы роговицы. Особенно внимательно необходимо следить за сохранением равномерной глубины и длины насечки. Обычно в начале и конце насечки мельче, чем в середине. Этого следует избегать: короткие и мелкие насечки менее эффективны.
Для выполнения операции требуется острый нож, поэтому должно быть не менее двух ножей. Лезвие ножа Сато серповидное шириной 0,4, длиной 2,5 мм, расположено над углом 160° к тонкой ножке диаметром 0,3 мм, которая на расстоянии 12 мм от лезвия загнута на 10° от направления рукоятки (рис. 76,6).
Радиальные насечки на передней поверхности Т. Sato производил трахомным ножом Окамуры, который не позволяет делать разрез глубже намеченного (рис. 77). Производят около 40 насечек от зрачковой зоны до лимбальной склеры почти на всю глубину роговицы. После окончания операции роговица с насечками напоминает бамбуковую основу японского зонтика (рис. 78).
При сложном миопическом астигматизме Т. Sato в меридиане с сильной рефракцией делал насечки глубже, длиннее и чаще, чем в квадрантах менее преломляющего меридиана (см. рис. 84). По данным Т. Sato (1953), передние и задние насечки роговицы позволили уменьшить миопию с 1,5 до 7,0 дптр (в среднем на 3,0 дптр). По меридиану наибольшей кривизны роговицы при астигматизме рефракция уменьшилась в среднем на 3,9 дптр. «Мы уверены, — пишет Т. Sato — что операция, если она тщательно выпол-
ни
77. Нанесение передних насечек по Сато (а) и нож Окамуры (б) (схема).
йена, может излечивать миопию до 4,0 дптр и давать значительное улучшение при близорукости 5,0—6,0 дптр». Рефракцию и остроту зрения Т. Sato определял через 4 нед после операции. Спустя 2 мес рефракция, по его словам, становится постоянной, радиальные линии от насечек на роговице можно увидеть только при сильном фокальном освещении в темной комнате, при обычном освещении они не заметны. В работах Т. Sato приведены ближайшие результаты операций, а также полученные при наблюдении в течение 5—10 мес.
Выявлению возможности уменьшить степень миопии и миопического астигматизма посвящены экспериментальные работы Н. П. Пурескина (1966, 1967), Н. П. Пурескина и Э. С. Богуславской (1967), выполненные под руководством проф. М. М. Краснова, которые послужили основанием для дальнейшего изучения этого вопроса в клинике [Беляев В. С., и др., 1974; Маунг Кио Тин, 1976, 1979; Илиа А. Н., 1977; Беляев В. С., Маунг Кио Тин, 1978; Уткин В. Ф., 1979; Енали-ев Ф. С., 1979; Федоров С. Н., Дурнев В. В., 1979; Аветисов С. Э., 1980, и др.].
Ф. С. Еналиев с 1969 по 1977 г. у 231 больного в основном со слабой и средней степенью миопии произвел 426 операций по нанесению наружных радиальных периферических надрезов роговицы по Сато. С этой целью он вначале использовал хрусталиковый ци-стотом, заточенный на глубину разреза 0,5 мм, а в дальнейшем — осколок лезвия, установленный в
78. Роговица после нанесения передних насечек по Сато (схема).
10 Руководство по глазной хирургии
145
81. Нанесение передних насечек на роговицу (схема), а — 4 насечки; б — 32 насечки; в — участок роговицы после нанесения насечек.
От треугольного осколка, отделенного от угла безопасной бритвы, отламывают наиболее остроугольный конец. Оставшийся трапециевидный осколок устанавливают в лезвиедержателе под небольшим углом к его скошенному концу. В этом случае лезвие, скользя под небольшим углом (до 30° и меньше) к поверхности роговицы, легко ее режет, а не царапает, как коготь, что наблюдается при увеличении угла. Лучи разрезов получаются прямолинейными, имеют одинаковую, заранее установленную по лекалу (0,6 мм) глубину. При таких форме и угле установления лезвия снижается опасность сквозного прободения глубоких слоев роговицы.
Вначале делают 4 насечки, затем — 8 и 16, всего 32 насечки (рис. 81), оставляя неповрежденной центральную (значковую) зону роговицы диаметром 5—6 мм. Для того чтобы лучше ориентироваться, насечки во время операции несколько раз окрашивали 1% раствором флюоресцеина (после нанесения 4; 8 и 16 насечек). Под конъюнктиву вводили пенициллин (50 000 ЕД), местно применяли мидриатики в каплях и 5% ксероформную мазь. Накладывали монокулярную повязку. Больным разрешали ходить сразу же после операции. Перевязки делали на следующий день. В глаз инстиллировали 30% раствор сульфацил-натрия, витамины, 0,2% раствор скополамина и закладывали 5% ксероформную мазь утром и 1 % тиаминовую мазь на ночь.
Как правило, в первый день наблюдались умеренное раздражение глаз и гиперемия конъюнктивы. При биомикроскопии переднего отрезка глаза отмечались легкий отек роговицы и следы передних несквозных насечек с легкими явлениями инфильтрации. Оптическая зона роговицы была прозрачной.
К 5—6-му дню после операции глаз постепенно успокаивался, и больных выписывали домой на 6—7-й день; в течение 10—15 дней они продолжали инстилляции в глаз тех же капель и мази, которые получали в стационаре. Контрольную проверку функционирования оперированных глаз производили на 6—7-й день перед выпиской из стационара.
Подобная рефракционная операция может быть применена для коррекции стойкой миопии (особенно при односторонней или разной степени) либо вторым этапом, как в наших случаях, после ста-148
билизации прогрессирующей миопии с помощью склеропластики. Эта комбинированная операция названа нами склерокератопла-стикой.
Ниже приведены результаты операции после выполнения двух ее этапов.
Непосредственно после двухэтапной склерокератопластики (всего 63 операции у 49 больных) острота зрения без коррекции улучшилась в 54 глазах (85,7 %) в среднем на 0,05 и с коррекцией — в 36 глазах (57,14%) в среднем на 0,14. После склерокератопластики степень миопии снизилась в 63 глазах (100%) в среднем на 3,87 дптр (табл. 6) и максимальная корригирующая сила стекла уменьшилась в 62 глазах (98,41%) в среднем на 4,35 дптр. До и
Таблица 6
Динамика снижения степени миопии в результате склерокератопластики
Снижение степени миопии (скиаскопически), дптр
Не снизилась
На 0,5
» 1,0
» 2,0
» 3,0
» 4,0
» 5,0
» 6,0
» 7,0
» 8,0
Более 8,0
Количество глаз
3
6 16 20 11
3 4
после склерокератопластики с помощью офтальмометра ОФ-3 выявляли увеличение радиуса кривизны роговицы глаза соответственно снижению степени миопии после операции. В отдаленном периоде не отмечалось повышения внутриглазного давления, нарушения чувствительности роговицы и появления астигматизма в оперированных глазах.
Во время выполнения комбинированных операций (63) осложнений не возникло. В послеоперационном периоде у одного больного отмечался единичный новообразованный сосуд по ходу насечки и у 7 появились мелкие эпителиальные кисты в строме по ходу насечек, вероятно, вследствие заноса эпителиальных клеток в глубокие слои роговицы по ходу насечек при использовании не очень острого осколка бритвы. Образование нового сосуда по ходу насечки, вероятно, связано с продолжением насечек , др области перикорнеальных сосудов. Однако ни новообразованный сосуд, ни эпителиальные кисты не влияли на остроту зрения. В отдаленном периоде они постепенно самостоятельно исчезли.
149
li
I; При проведении 63 операций нанесения передних насечек на
j роговицу не отмечено каких-либо осложнений, влияющих на исход
операции. Проведенные клинические исследования показали, что комбинированная склерокератопластика технически проста и позволяет добиться не только стабилизации, но и снижения степени миопии. При тщательном соблюдении технических особенностей она дает меньше осложнений, чем описанные в литературе методы.
' Ближайшие и отдаленные результаты операции вполне удовлет-
11 ворительны. Все названные факты позволяют рекомендовать даль-
нейшее изучение склерокератопластики в условиях клиники.
Отдаленные результаты прослежены на 37 (32 больных) из 63 j: (49 больных) оперированных глаз в сроки от 6 мес до 2 7г лет.
При этом острота зрения без коррекции улучшилась на 26 глазах | в среднем на 0,02 и с коррекцией — на 0,09. В отдаленном периоде ' степень миопии снизилась в 37 глазах в среднем на 2,78 дптр. В более отдаленные сроки (3 года 10 мес — 3 года 11 мес) отмечено уменьшение силы рефракции роговицы частично вследствие нанесения передних периферических насечек. Необходимо отметить, что дальнейшее уменьшение силы рефракции роговицы после нанесения передних насечек было более выражено при высокой сте-ч пени миопии. При более низкой степени миопии отмечено минимальное уменьшение силы рефракции роговицы в отдаленном периоде [Маунг Кио Тин, 1979].
А. Н. Илиа (1977) наблюдал 19 больных с миопией от 6,0 ДО' । 32,0 дптр и сложным миопическим астигматизмом. Оперированы
19 больных (21 глаз), из них 8 по поводу сложного миопического астигматизма по модифицированной методике Т. Sato. Степень астигматизма от 2,0 до 4,0 дптр. В послеоперационном периоде миопия стабилизировалась у всех больных. Степень астигматизма J удалось изменить у 8 больных (8 глаз), рефракция у них снизи-
1 лась на 1,0—7,0 дптр. У этих больных наблюдались осложнения.*
у одной больной одна насечка оказалась сквозной и вызвала подпаивание радужки с изменением формы зрачка. В дальнейшем | после пункции роговицы микрошпателем удалось отслоить синехию и восстановить форму зрачка. У второй больной в отдаленном периоде после нанесения радикальных пасечек на оперированном глазу развился дисковидный кератит, вызвавший врастание ново-| образованных сосудов по ходу насечек, в результате чего возникло ' стойкое центральное помутнение роговицы. Больная обратилась вновь через 6 лет. В центре роговицы осталось поверхностное не-1 интенсивное помутнение, по периферии видны следы 21 насечки, Г в некоторых из них видны новообразованные полузапустевшие со-I суды, чувствительность роговицы снижена. Глаз амблиопичен, от-
| веден кнаружи (острота зрения 0,01 не корригируется). Хотя в
' этом случае нельзя установить прямую зависимость вирусного дис-i ковидного кератита с проведенной ранее операцией, все же ке-i ратит развился именно на оперированном глазу.
; На основании результатов наблюдений над больными (71 глаз),
которым были нанесены наружные периферические радиальные 150
насечки, можно отметить, что в большинстве случаев удается получить определенный эффект от первой серии насечек. Повторные надрезы, как правило, неэффективны. Степень снижения рефракции, по-видимому, наибольшая (до 6,0—7,0 дптр) на роговицах с меньшим радиусом кривизны, более плоские роговицы дают минимальный рефракционный сдвиг. Дальнейшие исследования в этом направлении, возможно, помогут ответить на оставшиеся не выясненными вопросы. .
На кафедре глазных болезней Университета дружбы народов им. П. Лумумбы разработан и используется комбинированный способ хирургического лечения прогрессирующей миопии [Луэн-го В. М., 1979; Беляев В. С. и др., 1980]. Вначале укрепляют задний полюс глаза с помощью склеропластики для стабилизации миопии. Для того чтобы снизить степень миопии, лучше произвести межслойную рефракционную пересадку роговицы — технически простой и надежный метод. В межслойный карман помещают имплантат в виде отрицательной биолинзы из роговицы донора, а затем после его приживления производят трепанацию поверхностного листка кармана над имплантатом трепаном большего диаметра. В результате уплощается центральный участок роговицы и значительно (на 10,0—17,0 дптр) снижается степень миопии. Полученные результаты сохраняются и в отдаленные сроки наблюдения. Это открывает возможности широко применять рефракционную кератопластику для исправления миопии в условиях клиники.
М. М. Краснов, О. В. Груша, С. Э. Аветисов, В. Р. Мамиконян, А. А. Холмский на основании результатов ортокератологии, изучения механизма уплощения роговицы при нанесении на нее передних неперфорирующих надрезов и клинико-экспериментальных исследований разработали новую модификацию метода Сато по хирургической коррекции миопии — переднюю «компрессионную» кератотомию, или ортокератотомию. Отличительная особенность операции — уплощающая компрессия на роговицу с ослабленной надрезами ригидностью. Степень миопии после операции снизилась в среднем на 4,25 дптр.
В последнем варианте операции авторы делали четыре неперфорирующих надреза, оставляя свободной только центральную зону роговицы против зрачка диаметром (ДЦЗ) 3 мм. На веки в течение первых 2 сут после операции накладывали мениск из пластмассы эллипсоидной формы с радиусом кривизны задней поверхности от И до 23 мм, однако на практике, как правило, использовали мениски с радиусом больше 20 мм. Главным достоинством метода является то, что компрессия через веки позволяет исключить прямой контакт устройства с роговицей и проявление каких-либо осложнений со стороны последней. Авторами произведено 48 операций 31 больному с миопией от 3,0 до 21,0 дптр. Во всех случаях на роговицу наносили только четыре надреза при ДЦЗ 3 мм. Средний рефракционный эффект операций к моменту стабилизации составил 4Д5± 0,0345 дптр.
151
С. Н. Федоров и В. В. Дурнев (1979) приводят данные о 60 операциях (на 60 глазах) у 30 больных с миопией от 0,75 до 3,0 дптр. В основе метода лежит идея Т. Sato, однако авторы в отличие от него (Т. Sato, как известно, оставлял свободной от надрезов» центральную зрачковую зону диаметром 6 мм) сузили центральную зону роговицы до 4,5 и даже 3 мм. В среднем по группам получены следующие изменения рефракции: при диаметре центральной зоны 4,5 мм — 1,25 дптр, при 4 мм — 1,84 дптр, при 3,5 мм — 2,37, при 3,2 мм — 2,4—2,65 дптр; 17 больных находились под наблюдением от 1 года до 2 лет, 13 — от 2 до 3 лет.
Авторами было проведено еще 675 вмешательств. Получены следующие результаты: в группе А 130 больных (миопия 0,75— 3,0 дптр), из них у 101 (77,7%) аметропия, у 13 гиперметропия (0,25—0,75 дптр) и у 16 — миопия (0,25—0,75 дптр); в группе В 546 больных (миопия 3,25—6,0 дптр), из них у 114 (20,8%) аметропия, у 25 (44%) гиперметропия и у 408 осталась миопия: у 193 от 0,25 до 0,75 дптр, у 173 от 1,00 до 1,75 дптр и у 42 от 2,00 до 3,00 дптр.
С. Н. Федоров и соавт. (1983) приводят сведения об инструментах, которые они используют для кератотомии. Основным инструментом является лезвиедержатель с микрометрической подачей лезвия, сделанный по типу трепана Филатова ФМ-5. Осколок бритвы устанавливают в лезвиедержателе под углом 90° к поверхности роговицы. Прежде чем приступить к нанесению надрезов, готовят два лезвиедержателя с выстоянием режущей части лезвия, рассчитанным с учетом толщины роговицы данного больного в центре и на периферии. Первым паносят надрез меньшей глубины движением от периферии к центру. Разрез па периферии углубляют вторым лезвиедержателем, отступя от центра 2,5—3,5 мм, причем лезвие направляют от центра к периферии. Разрезы промывают изотоническим раствором хлорида натрия. Авторы произвели операции 5500 больным. Они отмечают, что у ряда больных результаты операции неудовлетворительные и возникает вопрос о повторном хирургическом вмешательстве [Федоров С. Н., Саркизо-ва М. Б, 1981, 1985].
С. Н. Федоров (1984) приводит отдаленные результаты 10719 кератотомий. Автор считает, что рефракционный эффект стабилизируется к концу первого года после операции. Высокое зрение без коррекции (0,6—1,0) получено при слабой степени миопии у 100% больных, при средней степени также у 100% и при высокой степени миопии у 82,2%. У 2 больных возникли осложнения: у одного развился ирит, у другого возник герпетический кератит.
Р. Binder (1984) анализирует опыт применения кератотомии по методике Федорова в 9 центрах США, начиная с 1978 г. По данным американских офтальмологов, с помощью радиальной кератотомии можно исправить миопию до 4,0 дптр, производя 16 надрезов глубиной 90—95% от толщины роговицы и при диаметре оптической зоны 3 мм. Авторов не удовлетворяет тот факт, что ре-152
зультат регенерации роговицы при насечках не предсказуем и трудно заранее определить, насколько изменится рефракция глаза.
Не следует забывать об отдаленных результатах операций Сато, о которых пишет A. Nakajima (1979): «...этим методом в Японии было прооперировано двадцать лет назад около 280 глаз. В более чем 60 из них в настоящее время развилась буллезная кератопатия, не поддающаяся кератопластике (клинические и гистологические данные). Главным проявлением буллезной кератопатии после такой операции является уменьшение количества роговичного эндотелия. Крайне медленное развитие эндотелиальной дистрофии после нанесения надрезов, видимо, связано с биологическими свойствами роговицы».
Будем надеяться, что дальнейшее серьезное изучение вопроса, •особенно отдаленных результатов операций, поможет офтальмологам прийти к верному решению. В научных исследованиях недопустима поспешность с выводами.
Хирургическая коррекция астигматизма. Воп-прос о хирургической коррекции астигматизма не нов. Еще в 1869 г. Snellen, исходя из возможности возникновения астигматизма после экстракции катаракты, рекомендовал производить катаракталь-•ный разрез с учетом астигматизма. В литературе имеются описания хирургических вмешательств, которые были произведены офтальмохирургами для исправления роговицы при астигматизме в эксперименте и клинике [Silex Р., 1906; Winselman G., 1909; Levinson G., 1911, и др.].
Наибольший интерес вызвали работы Т. Sato (1950, 1953), который предложил оригинальный метод хирургического исправления астигматизма. С помощью задних надрезов — радиального, тангенциального и их комбинации — изменяли кривизну роговицы в нужном меридиане (рис. 82). Кроме того, применяли сочетание методов — расслоения средних слоев роговицы с задними насечками (рис. 83).
Радиальный метод позволяет уменьшить рефракционную силу роговичного меридиана, вдоль которого сделана насечка. У животных эффект от применения этого метода достигал 4,0 дптр и сохранялся от нескольких месяцев до года. У больных эффект в пределах не более 2,0 дптр был более длительным. Метод радиальных насечек целесообразно применять при средней степени миопического астигматизма. При прямом астигматизме вертикальную насечку лучше сделать в верхней части над зрачком так, чтобы легкое помутнение было скрыто под верхним веком. Если астигматизм небольшой, то этот метод более эффективен, чем нанесение тангенциальной насечки.
Тангенциальный метод позволяет уменьшить рефракционную силу меридиана, который пересекает насечку, и увеличить силу меридиана, параллельно насечке. Стандартная длина этой насечки около 4 мм. Однако в опытах установлено, что чем длиннее насечка, тем больше минусовый эффект, и чем глубже насечка, иногда
153
82. Нанесение задних насечек на роговицу по Сато при кератоконусе (а, б) и астигматизме (в, ж) (схема).
до перфорации роговицы, тем больше плюсовой эффект. При прямом миопическом астигматизме насечку нужно делать вверху над зрачком.
В 1950 г. Т. Sato сообщил о 19 операциях, произведенных на глазах людей, а в 1953 г. — еще о 15. Применение задних надрезов роговицы и их комбинации с расслоением роговицы позволило' уменьшить астигматизм с 1,0 до 4,75 дптр. Сроки наблюдения до 10 мес.
Показанием к операции Сато является астигматизм более 2,0 дптр. и астигматизм, который не может быть исправлен с помощью стекол, сильный астигматизм с косыми осями.
Заслуживает внимания комбинированный метод лечения астигматизма, предложенный Т. Sato, — расслаивание роговицы в верхнем секторе и рассечение ее глубоких слоев перпендикулярно меридиану с наибольшей рефракцией. Для иллюстрации приводим собственное наблюдение.
Больной Б. Диагноз: простой миопический астигматизм с косыми осями. Острота зрения правого глаза 0,5, с цилиндром—3,0 дптр (ось 98°) 08, левого глаза 0,5, с цилиндром —3,0 дптр (ось 78°) 0,7.
83. Нанесение насечек на роговицу по Сато при астигматизме (схема).
а — тангенциальная насечка: б —радиальные; в, г — расслоение роговицы и нанесение задней тангенциальной насечки.
154
Произведена комбинированная операция на левом глазу. После местной и ретробульбарной анестезии 2% раствором новокаина осколком лезвия, установленным по лекалу в лезвиедержате-ле на глубину 0,6 мм, прорезаны поверхностные слои роговицы у лимба перпендикулярно оси наибольшего преломления. Из надреза длиной 5—4 мм ножом для расслоения приготовлен межслойный карман, занимающий сектор с нижней границей на уровне верхнего края зрачка. Затем перилимбально
84. Нанесение насечек на роговицу по Сато при сложном миопическом астигматизме (схема).
произведено расширение разреза на всю поверхность кармана от 10 до 14 часов. Оставшиеся глубокие слои роговицы со стороны передней камеры перпендикулярно меридиану наибольшего
преломления прорезаны ножом Сато на длину 5 мм. После появления влаги передней камеры на края перилимбального роговичного разреза наложены узловые микрошвы без натяжения лоскута.
При осмотре на 2-й день острота зрения левого глаза равна 1,0, при повторном осмотре через 3 мес — 0,9.
А. Н. Илиа (1977) приводит результаты комбинированного хирургического лечения больных по поводу сложного миопического астигматизма. Сначала была произведена склеропластика лентой гомосклеры по методу Беляева — Ильиной, а затем нанесены наружные радиальные насечки с увеличением их числа в меридиане с наибольшей рефракцией по модифицированной методике Сато. При сложном миопическом астигматизме Сато делал насечки глубже, длиннее и чаще в меридиане с сильной рефракцией, чем в квадрантах меридиана с наименьшей рефракцией (рис. 84). Степень астигматизма составляла от 2,0 до 4,0 дптр. После операции миопия стабилизировалась у всех больных, степень астигматизма снизилась у 8 больных (8 глаз) с 1,0 до 7,0 дптр.
В. Уткин (1979) применил периферические радиальные наружные насечки роговицы па глубину 0,5—0,6 мм на 24 глаза с миопическим астигматизмом. В секторах, прилегающих к более сильному в оптическом отношении меридиану, производили на 2— 3 надреза больше, чем в других. Сферический компонент миопии снизился на 1,8 дптр на рефрактометре и на 0’8 дптр на офтальмометре. Уменьшение астигматизма оказалось равным 0,7 дптр при рефрактометрии и 0,4 дптр при офтальмометрии. В. Ф. Уткин разработал и предложил набор инструментов и оригинальную модификацию оперативного лечения асферической миопии.
В. Ф. Уткин (1982) приводит результаты хирургической коррекции астигматизма. Для проведения операции им сконструирован комплект инструментов, состоящий из ножа-циркуля, маркировочного кольца и лекала. С помощью отметчика центра из набора Филатова красящим веществом отмечают оптический центр роговицы. На глазное яблоко помещают маркировочное кольцо, а в специальное отверстие, имеющееся в нем, вставляют опорную
155
ножку ножа-циркуля. В секторе более сильно преломляющегося меридиана осколком бритвенного лезвия, закрепленным в цангу другой ножки циркуля, производят по два или три несквозных концентрических надреза в каждом из противолежащих секторов, чаще на расстоянии 3; 4 и 5 мм от центра роговицы. Длина надрезов, которую определяют по шкале маркировочного кольца, составляет 110—120°. Глубину надрезов дозируют, предварительно установив лезвие в цанговом зажиме циркуля с помощью лекала. По мнению автора, первый от центра надрез лучше производить на глубину 0,4 мм, последующие — 0,5 и 0,6 мм.
Автор приводит результаты 110 операций, произведенных у 63 человек в возрасте от 6 до 35 лет, чаще с асферической миопией. Исходная степень астигматизма колебалась от 2,0 до 10,0 дптр. У 47 человек операцию производили одномоментно на двух и у 16 — на одном глазу. Результаты операции, как правило, стабилизировались через 3 мес. Острота зрения повысилась у всех больных. До операции 75 глаз имели остроту зрения с коррекцией 0,2, 30—до 0,6 и 5—выше 0,7. После операции только на 5 глазах с амблиопией острота зрения осталась равной 0,2, на 42 глазах она достигла 0,3—0,6 и на 63 глазах — 0,7—1,5. Степень коррекции астигматизма у больных была от 1,0 до 6,0 дптр. Среднее уменьшение асферичности в результате 76 операций с четырьмя надрезами оказалось равным 2,4 дптр рефрактометрически и 2,1 дптр офтальмометрически. На 34 глазах, на которых произведено по шесть надрезов, общий астигматизм уменьшился на 2,9 дптр, а астигматизм роговицы — на 2,5 дптр. Из осложнений наблюдалась микроперфорация роговицы (у 4 больных), которая развивалась в тех случаях, когда надрезы наименьшего радиуса проводили на глубину до 0,5 мм. Следствием этого был послеоперационный гиперэффект до 2,0 дптр, который в последующем у 2 больных исчез и у 2 уменьшился до 1,0 дптр.
В зарубежной литературе появился ряд публикаций по хирургической коррекции астигматизма. Наибольших успехов добился R. С. Troutman (1977, 1979), который, для того чтобы предотвратить развитие высокого роговичного астигматизма, предложил использовать клиновидную резекцию роговицы, позволяющую увеличить кривизну уплощенного меридиана роговицы, и релаксирующие насечки, обеспечивающие уплощение более выпуклого меридиана.
I. Н. Krachmer и R. Е. Fensl (1980) провели ретроспективный сравнительный анализ эффективности двух этих методик у больных с высоким роговичным астигматизмом, возникшим после сквозной кератопластики. Выраженным нейтрализующим астигматизм эффектом характеризовалась клиновидная резекция роговицы: в среднем степень астигматизма снижалась на 6,50 дптр, при релаксирующих насечках — на 4,25 дптр. Стабильность эффекта, однако, была выше в последнем случае (приблизительно 75%). Таким образом, клиновидную резекцию роговицы целесообразно производить только в тех случаях, когда невозможно нанести ре-
156
85. Нанесение насечек на роговицу по Федорову — Дурневу при сложном миопическом астигматизме (схема).
лаксирующие насечки (выполнить их хирургу значительно легчег и они лучше переносятся больными).
С. Н. Федоров и В. В. Дурнев (1979) приводят результаты лечения сложного миопического астигматизма с помощью передних надрезов (рис. 85). Операции произведены 18 больным (21 глаз) со сложным миопическим астигматизмом. Через 6 мес рефракция уменьшилась на 5 глазах (метод А) в среднем на 1,6 дптр в одном меридиане и на 0,85 дптр в другом и на 16 глазах (метод Б) в среднем на 3,32 дптр в меридиане с сильной рефракцией и на 1,52 дптр — со слабой.
Таким образом, операцию Сато, по-видимому, можно применять только для коррекции стойкой миопии слабой степени и астигматизма. Что касается хирургического лечения и коррекции миопии средней и высокой степени, особенно прогрессирующей, то в отдаленные сроки после кератомилеза с истончением центра роговицы отмечались деформации и растяжение оставшихся слоев роговицы, снижение аффекта операции, рецидив миопии.
Мы отдаем предпочтение комбинации склеропластики с не-сквозпой меридиональной рефракционной кератопластикой (клинопластика), которую разрабатывают Л. Л. Шоттер и М. X. Кабир. Этот способ позволяет стабилизировать миопию и понизить ее степень с 1,0 до 10,0 дптр при сроках наблюдения до 4 лет. Если при насечках по Сато результаты рубцевания трудно предвидеть, то при клинопластике можно заранее определить эффект операции: пересадка в меридиональную насечку аллотрансплантата шириной 0,3 мм позволяет уменьшить степень миопии на 0,98+0,08 дптр. Максимальный эффект был получен при 12 аллотрансплантатах в 10,0 дптр.
Меридиональная рефракционная кератопластика (клинопластика) для исправления миопии. Операцию выполняют следующим образом (рис. 86). После обычной локальной анестезии проводятся меридиональные несквозные разрезы роговицы, оставляя свободной зону диаметром 4 мм напротив зрачка. В разрезы помещают ланцетовидные роговичные аллотрансплантаты с клиновидным сечением, длина кото-
157
ft
86.
Несквозная меридиональная Кератопластика (клинопластика) (схема).
1 — роговица нормальной кривизны; 2 — радужка; 3 — лимб; 4 — срединная окружность роговицы; 5 — проекция зрачка; 6 — трансплантаты; 7 — выбухание периферической части роговицы; 8 — уплощение центральной части роговицы.
рых 3,5 мм, ширина 0,3 мм, а толщина равна глубине надрезов. Трансплантаты фиксируются силиконовой линзой.
Опыт, накопленный на кафедре офтальмологии Тартусского университета [Шоттер Л. X. и др., 1984] и кафедре глазных болезней Университета дружбы народов им. П. Лумумбы [Беляев В. С. и др., 1984], показывает, что с помощью одного аллотрансплантата удается уменьшить рефракцию глаза в данном меридиане в среднем на 0,98 дптр (отдаленный результат). Дозирование рефракционного эффекта осуществляют, изменяя число трансплантатов (авт. свид. № 1066591).
В настоящее время накоплен определенный опыт выполнения
клинопластики и модифицирована ее техника [Беляев В. С., Кабир М. X., 1984]. После акинезии, эпибульбарной и ретробульбарной анестезии центроотметчиком (рис. 87, 1) наносят кольцевидный отпечаток в центре роговицы диаметром 4 мм. По лимбу про-
изводят точечные отметки 1% спиртовым раствором бриллиантового зеленого соответственно числу будущих меридиональных надрезов (из расчета 1 на каждую диоптрию).
Лезвием бритвы, установленным в иглодержателе по лекалу, производят надрезы роговицы длиной 3—3,5 мм на глубину, соответствующую 90% ее толщины с последующим их углублением до задней пограничной пластинки. Специальным Т-образным ножом (рис. 87, 2) отслаивают глубокие слои стромы роговицы от задней пограничной пластинки на 0,2 мм в стороны от насечки. Аллотрансплантаты (клинья) готовят из трупной роговицы, которую после расслоения ее стромы на глубину 0,4 мм укрепляют в зажиме на свинцовой основе (см. рис. 87, 6). Трансплантаты вырезают или кусачками Шнаудигеля (для склеротомии при анти-глаукомных операциях) шириной 0,3 мм при длине 2,5 мм, или специальным инструментом-пробойником, состоящим из двух выгнутых осколков лезвия бритвы с металлической распоркой между
458
a
87. Набор инструментов для клинопластики (а) и их действующие части (б).
1 — центроотметчик Шоттера; 2 — Т-образный нож; 3 — микропинцет о истонченными плоскими браншами для вставления трансплантата; 4 — нож для расслоения, роговицы; 5 — клинотом с фиксированными в браншах осколками лезвия, 6 — устройство со свинцовой основой для фиксации роговицы донора.
ними шириной 0,3 мм (рис. 87, 5). В первом случае получают трансплантат в виде параллелепипеда размером 0,3 X 0,4X 2,5 мм,, во втором — ланцетовидный размером 0,4X2,5 мм при максимальной ширине в центре 0,3 мм. В последнее время мы отдаем предпочтение ланцетовидным трансплантатам. После разведения специальным пинцетом краев разреза роговицы трансплантат помещают основанием на заднюю пограничную пластинку, при этом-он удерживается за счет сжатия краями роговичного надреза.
После помещения всех трансплантатов (от 4 до 12 в зависимости от величины исправляемой рефракции) на роговицу укла-
159-
88. Кератограммы глаза больных с миопией.
*, в — до операции; б, г — через 2 мес после операции. Стрелками указано расположение трансплантатов. Увеличение центральных кружков свидетельствует об уплощении центра роговицы.
дывают мягкую гидрогелиевую лечебную контактную линзу, которая удерживает трансплантаты от смещения. В конъюнктивальный мешок вводят 30% раствор сульфацил-натрия, накладывают бинокулярную повязку на сутки, которую затем заменяют монокулярной повязкой.
Контактную линзу снимают на 12—14-й день. Больные находятся под наблюдением до 3 мес.
Нами произведены 62 подобные операции. Пересадка в меридиональную насечку аллотрансплантата шириной 0,3 мм позволяет уменьшить степень миопии на 0,98±0,08 дптр в отдаленные сроки наблюдения (до 4 лет). Максимальный эффект в 10,0 дптр получен при использовании 12 аллотрансплантатов. Кератограммы, сделанные на дисковом кератографе, подтвердили изменение сферичности роговицы с сохранением правильного рельефа ее в центральной зоне (рис. 88). Метод позволяет дозированно исправлять миопию до 10,0 дптр.
В тех случаях, когда до операции острота зрения с полной коррекцией равнялась 1,0 и аметропия полностью устранялась, острота зрения без коррекции после операции равнялась 1,0. Если же аметропию не удавалось полностью устранить, то острота зрения равнялась 1,0 с дополнительной коррекцией. Когда вследствие умеренной амблиопии или изменений на глазном дне острота зрения при максимальной коррекции была неполной, после операции она оставалась такой же.
160
Тяжелых осложнений, повлиявших на остроту зрения, нами не отмечено. Несквозная меридиональная рефракционная кератопластика — малотравматичный, дозированный и сильнодействующий по сравнению с насечками по Сато метод, при применении которого в отдаленные сроки отмечаются стойкие обнадеживающие результаты.
В настоящее время после экспериментальных исследований в клиническую практику введена межслойная тоннельная меридиональная рефракционная кератопластика, основным достоинством которой является отсутствие разрезов в оптической зоне роговицы. Имплантаты вставляют в меридиональные ходы, приготовленные между слоями стромы из перилимбальных надрезов роговицы. При этом не возникает реакции глаза на вмешательство и сохраняются остальные преимущества клинопластики перед насечками по Сато [Беляев В. С., Гончар П. А. и др., 1986].
Операции на склере
Оперативные вмешательства на склере производят с различными целями. В одних случаях их используют для лечения патологических процессов или состояний самой склеры (опухоли, травмы и др.), в других вмешательство является лишь одним из этапов операции на глазном яблоке (удаление инородного тела, опухоли ресничного тела, цистицерка и др.), в третьих операции на склере применяют как составную часть комплексного лечения различных заболеваний глаз (глаукома, отслойка сетчатки и др.).
Хирургическое воздействие на склеру осуществляют при многих заболеваниях. При высокой прогрессирующей миопии применяют различные методы укрепления склеры. В случае упорного склерита можно произвести скарификацию и выскабливание очага воспаления острой ложечкой но Кунту, при этом предварительно отсонаровывают конъюнктиву. При метастатическом гнойном эписклерито можно вскрыть фокусы скальпелем, для того чтобы из них вышел гной. Стафиломы склеры подлежат хирургическому лечению, если они прогрессируют. С этой целью используют различные способы.
Операция Камо. Сущность операции заключается в иссечении из стафиломы звездообразного куска. С оставшихся лучей соскабливают эпителий на передней и задней поверхности, сшивают их друг с другом кетгутовыми швами и покрывают сверху конъюнктивой склеры.
Операция Диану. При этой операции не удаляют стафилому, а превращают ее с помощью термокаутеризации в более плоский и плотный рубец. По направлению от периферии стафиломы делают глубокие, но не сквозные прожоги гальванокаутером в виде полос (8—10), сходящихся наподобие лучей звезды к центру стафиломы, где выжигают сквозное округлое отверстие, стараясь не поранить хрусталик. В течение 1—2 нед происходит отток
11 Руководство по глазной хирургии
161
водянистой влаги через отверстие и лучистые- ожоги- рубцуются при условии, если давление будет сниженным. Операцию необходимо повторять 2—3 раза. При благоприятном исходе операции происходит уплощение стафиломы и образуется плотный рубец,, который может быть татуирован.
Пластическая операция Кунта. Принцип ее заключается в том, что после удаления стафиломы закрывают большое отверстие трансплантатом из фасции или сухожилия, т. е. и® таких тканей, которые не имеют склонности к сморщиванию. Отсе-паровывают конъюнктиву склеры вокруг роговицы от лимба по» направлению к экватору за пределы прикрепления прямых мышц, особенно далеко кверху и книзу. Проводят четыре шва через склеру (по горизонтальному меридиану изнутри и снаружи, по вертикальному сверху и снизу) на расстоянии 3 ми от края роговицы. Игла должна проходить по крайней мере на глубине, равной половине толщины склеры. Для фиксации склеры целесообразно использовать пинцет Элыпнига с острым клювом. Если на периферии имеются остатки роговицы, то при последующем срезании стафиломы их нужно сохранить, а на данном этапе операции и эти остатки, и лимб следует хорошо очистить от эпителия острой ложкой. На бедре делают разрез кожи до широкой фасции (или до сухожилия наружной бедренной мышцы) и иссекают из нее кусок такой величины, чтобы из него можно было выкроить диск диаметром 25—26 мм, который помещают в изотонический раствор хлорида натрия. Срезают всю стафилому, сохраняя остатки роговичной ткани, при этом держат нож как можно ближе к плоскости стафиломы, чтобы образовалась широкая поверхность среза ее краев для создания лучших условий для приживления фасции.
Хрусталик удаляют, стекловидное тело оставляют. Через фасцию, которую кладут на отверстие и края которой выходят за его пределы, сначала проводят и завязывают внутренний и наружный швы, потом — верхний и нижний. Фасцию накрывают сверху или внизу конъюнктивой склеры и делают на ней освобождающие разрезы. Накладывают повязки на оба глаза на 3—4 дня, шов удаляют на 6-й день. Заживление происходит через 14—16 дней.
При недостатке конъюнктивы трансплантат фасции можно покрыть слизистой оболочкой, взятой с губы (одномоментно). Можно использовать фасцию и для закрытия дефектов при резекции частичных стафилом; в этих случаях трансплантат следует покрывать лентой конъюнктивы на двух ножках.
Операция Койанаги. Операция заключается в инъецировании в полость стекловидного тела 10% раствора хлорида натрия. Под местной анестезией производят прокол склеры с помощью довольно толстой иглы (или иглы Цур-Неддена), надетой на ре-кордовский шприц вместимостью ,5 мл. Делают прокол на расстоянии 1—1,5 см от лимба и отсасывают 0,5—3 мл обычно разжиженного стекловидного тела. Взамен тотчас же, не вынимая иглы, вводят такое же количество или немного меньше 10% раствора
162
хлорида натрия. Обычно через сутки после инъекции наступает снижение внутриглазного давления, а через несколько дней — уплощение стафиломы. Глаз постепенно сморщивается и становится возможным носить протез. Если давление через несколько дней опять повышается, то следует повторить вмешательство. Инъекции повторяют 2—3 раза и более до тех пор, пока гипотония не станет постоянной. Никаких осложнений при данной операции не описано.
Резекция стафиломы. Операцию производят после отсепаровки конъюнктивы над стафиломой, ее захватывают пинцетом И через основание проводят несколько игл с лигатурами. Иглы остаются все время на месте, а стафилому срезают впереди них. Затем иглы быстро подтягивают и швы завязывают. На конъюнктиву накладывают швы.
Ауто- и аллопластическое укрепление стафи-ломы. Вмешательство выполняют после отсепаровки широкой лепты конъюнктивы на двух ножках. Делают склеротомию, чтобы вызвать спадение стафиломы. На нее помещают лоскут широкой фасции бедра, гомосклеры или твердой мозговой оболочки и пришивают к склере. Сверху накладывают конъюнктивальный лоскут, который тщательно фиксируют швами.
При больших и круговых интерколярных стафиломах Л. И. Гмыря (1969) предлагает применять следующую методику операции. У заднего края стафиломы на всем ее протяжении скребцом косо кзади производят надрез на 2/з ее толщины. Скребец ставят под углом 45° к поверхности склеры. После такого же кругового надреза бельма или измененной роговицы по переднему краю иптерколярвой стафиломы радиально накладывают 16—20 провизорных капроновых швов, перед завязыванием которых глазков яблоко в любом меридиане переднего надреза вскрывают скребцом пн протяжении 1,5—2 мм. После частичного оттока водяни-с rott влаги ранее наложенные швы свободно завязываются. По мора уменьшения глазного яблока в результате завязывания швов «лишняя» жидкость постепенно выходит через разрез и остальные швы завязывают без значительного натяжения.
Для того чтобы предотвратить развитие рецидива вследствие нозможпого прорезывания швов, область, где раньше была стафилома, покрывают корнеосклеральным кольцевидным трансплантатом, BiiniHM из глаза трупа. Трансплантат подобно кольцу протеза К'имПер|н I in mu па покрывает место ушитой стафиломы; его крепят Н U! iHiiiiMi) кии.ко па склеральный край к эписклере гла-яп репппианin (рис НИ) lllnpiiita склерального ободка трансплантат >> I) мм, potотитного 2 мм. Операцию закапчивают наложением па 1(о|г1.юц|11пну обвивного шип, после затягивания которого елилис।ии оболочки покрывает трансплантат.
Фистулы склеры и кистозные рубцы образуются после ранений и фистулизирующих операций при глаукоме. Хирургическое вмешательство требуется только в том случае, если фистулы и рубцы вызывают слишком большую гипотонию. Вмеша-
II
163
89. Аллопластическое укрепление стафиломы по Гмыре.
t — стафилома после ушивания; 2 — корнеосклеральный кольцевидный трансплантат;
3 — швы на краях стафиломы; 4 — края отсепарированной конъюнктивы.
тельство заключается в отсепаров-ке конъюнктивы склеры около фистулы, термокаутеризации фистулезного хода и зашивании конъюнктивальной раны. Иногда целесообразно покрыть фистулы небольшим лоскутом консервированной твердой мозговой оболочки, взятой у трупа, или склеральным аллотрансплантатом, который крепят швами к склере реципиента, а сверху закрывают конъюнктивальным лоскутом.
Кисты склеры, обычно травматические и реже врожден
ные, имеют вид полупросвечивающих бобовидных возвышений в переднем отделе склеры, окаймляющих вогнутым краем лимб; конъюнктива склеры над ними обычно подвижна. Операция заключается в разрезании и отсепаровке конъюнктивы и иссечении передней стенки кисты, состоящей из склеральной ткани.
Фистулезный ход, идущий внутрь глаза, который нередко имеется на дне кисты, можно не прижигать. На конъюнктиву накладывают швы. При наличии значительного склерального отверстия его можно закрыть аллосклерой или твердой мозговой оболочкой трупа, при этом трансплантат фиксируют швами к склере реципи
ента с последующим конъюнктивальным покрытием.
Опухоли склеры удаляют вместе с поверхностными слоями склеры и проводят термокаутеризацию. При сквозных иссечениях можно произвести склеропластику с укреплением аллотрансплантата швами край в край или закрытием дефекта кольцевидным трансплантатом по Гмыре. Аллосклеральный трансплантат следует тщательно закрыть конъюнктивой склеры, фиксируя ее узловы
ми или кисетными швами.
Укорочение и укрепление склеры при прогрессирующей миопии
Идея хирургического лечения прогрессирующей миопии путем укрепления ослабленной склеры широкой фасцией бедра возникла в нашей стране. М. М. Шевелев (1930) в экспериментах на глазах, взятых от трупов, разработал оригинальную методику укрепления
164
1
склеры заднего полюса с помощью ленты из широкой фасции бедра. Хотя методика операции была описана в руководстве по глазной хирургии, на практике в те годы ее не применяли. В литературе после статьи М. М. Шевелева об успешном использовании операции укрепления склеры при лечении прогрессирующей миопии сообщили А. П. Нестеров и Н. Б. Либенсон (1967), М. В. Зайкова и В. И. Негода (1968, 1970), Т. И. Брошевский и Н. И. Панфилов (1970), В. С. Беляев и Т. С. Ильина (1972), В. С. Беляев и соавт. (1974), Маунг Кио Тин (1976), А. Н. Илиа (1976), Н. Н. Пивоваров и Ю. К. Ширшиков (1976), В. С. Беляев и В. М. Луэнго (1978), Н. Н. Нурмамедов и Г. К. Атамередова (1978, 1981), В. Е. Луэнго (1979, 1980), В. И. Савиных (1980), М. С. Ремизов и А. И. Грязнов (1981), Э. С. Аветисов и Е. П. Тарутта (1981), В. J. Curtin (1960, 1961), W. Miller и W. Е. Borley (1964), W. Starkiewicz (1965), W. Starkiewicz и E. Markiewicz-Jablonska (1967), W. Andrzejewska (1972), A. A. Snyder и F. B. Thompson (1972), F. B. Thompson (1978) и др. Все авторы использовали для укрепления склеры широкую фасцию бедра и аллосклеру.
Конечная цель применения различных методик, описанных авторами, укрепление истонченной склеры с помощью X- или Y-o6pa;ini.iх лент широкой фасции или Y-образной полосы гемо-склеры, получаемой после спиралевидного выкраивания ее из глааа донора (В. С. Беляев, Т. С. Ильина). Эти методики позволяют наложить с...'образный бандаж из фасции или склеры на зад-
ниц, па1|Г|о.иоо истонченный отрезок глаза в окружности выхода :|рптелы1ого нерва и тем самым предотвратить дальнейшее растяжение глаза и прогрессирование миопии.
Операции с использованием полных или частичных трансплантатов склеры (М. В. Зайкова, В. И. Негода) и межслойным введением склеральных трансплантатов (Т. И. Брошевский, Н. И. Панфилов) позволяют добиться положительных результатов за счет укрепления экваториальной зоны склеры миопичного глаза. М. В. Зайковой (1968) предложена операция укрепления склеры при прогрессирующей миопии цельными трансплантатами алло-склеры. В последующих сообщениях М. В. Зайкова и В. И. Негода (1970) приводят результаты склеропластики, произведенной в нескольких вариантах: секторальный, с временным отсечением наружной прямой мышцы, укрепление склеры пересадкой почти полных трансплантатов аллосклеры и склеропластика полными трансплантатами аллосклеры. Прослежены отдаленные результаты всех 48 операций в сроки до 2 лет. Острота зрения повысилась в 19 глазах на 0,1—0,2, в 6 — на 0,3—0,4 и не изменилась в 23 глазах.
Большой интерес представляют сообщения М. В. Зайковой и соавт. (1979) об исходах склеропластики при высокой степени миопии у детей и подростков. Авторы произвели 101 операцию у 29 детей и 61 подростка. Отдаленные результаты проверены у всех больных в сроки от 6 мес до 5 лет. Острота зрения в отдаленные сроки повысилась или не изменилась без коррекции в 93% и с
165
90. Субтотальная аллопластика по Зайковой (схема).
а — форма и размеры трансплантатов: I — лентовидный, II — фигурный, III — в виде полоски и бочкообразный; б — этапы операции: I — аллотрансплантат уложен под прямые мышцы глаза, II — аллотрансплантат фиксирован к эписклере двумя бпошвами, 1 — трансплантат, 2 — полный трансплантат склеры.
коррекцией в 90% оперированных глаз. Переднезадняя ось при ультразвуковой биометрии уменьшилась в среднем на 1 мм. У детей миопия в среднем уменьшилась на 1,32 дптр, у подростков — на 1,67 дптр. Авторы считают целесообразным производить склеро-пластику в раннем возрасте при наличии явных признаков быстрого прогрессирования высокой миопии.
Несомненно, заслуживает внимания сообщение М. В. Зайковой и Е. Н. Маркова (1982) о результатах тимоловой экстрасклераль-ной аллопластики при высокой прогрессирующей миопии. Тимол {2-изопропил-5-метилфенол) — кристаллический порошок с резким запахом. Консервирование аллосклеры производят в водном С,2 % растворе тимола, который растворяют в подогретой воде. Раствор меняют на следующий день, а затем через каждые 10— 15 дней. Срок использования склеры, консервированной в растворе тимола, — до 10—12 мес. Авторы приводят результаты пересадки аллотрансплантатов склеры, прослеженные у 250 больных. Применяли аллотрансплантаты склеры различной формы и величины (рис. 90,а). Описаны показания и противопоказания к операции, подходы к склере, техника операций (рис. 90, б). Проведен анализ 166
1
91, Склеропластика по Нестерову-Либенсон (схема).
« - Х-обраэиый (1) и У-образный (2) трансплантаты; б — крючок проведен позади главного яблока через разрез конъюнктивы в верхневнутреннем сегменте; в, г — 1ки1ОН(ецие Х-образного и У-образного трансплантатов после операции: 1 — вид спе-|нии; 2 — пиД сзади.
попосредстпенных результатов. Отдаленные исходы проверены в сроки от 6 мес до 7 лет. Острота зрения без коррекции повысилась или по изменилась у 84% больных, с коррекцией — у 95%.
Л. II. Нестеров и И. Б. Либенсон (1967) предложили свой ме-тод склоронластики при прогрессирующей миопии (рис. 91).
Т. И. Еропкчк’кий и И. И. Панфилов (1971, 1977) разработали н внедрили и практику инторламеллярную склеропластику. Из склеры глаза трупа после удаления его содержимого готовят по-лоску шириной 6—7 мм и длиной 9—10 см, которую завертывают в стерильную целлофановую пленку и помещают в эксикатор с силикагелем. В высушенном состоянии склера сохраняется в течение месяца. Перед операцией высушенную полоску склеры погружают на 15 мин в изотонический раствор хлорида натрия.
После разрезания конъюнктивы и влагалища глазного яблока обнажается склера глаза донора. Произведя ее надрезы на половину толщины готовят меридиональные тоннели в средних слоях склеры, в которые с помощью пинцета и шпателя вводят ленты из укрепляющей ткани (полоска склеры или широкой аутофасции бедра). Постоянный визуальный и офтальмологический контроль позволяет избежать повреждения вортикозных вен. Операция интерламеллярной склеропластики в 94% случаев позволяет приостановить биомеханическое растяжение склеры. Анализируя отдаленные результаты интерламеллярной склеропластики, Т. И. Брошевский и соавт. (1982) приводят данные о 44 больных (69 операций)
167'
92. Склеропластика по Снайдеру — Томпсону (схема).
1 — прямые мышцы глаза; 2 — нижняя косая мышца; 3 — зрительный нерв; 4 — верх* ияя косая мышца; 5 — склеральный лоскут.
с прогрессирующей миопией. У 55% из них в отдаленные сроки (4—12 лет) зрительные функции сохранились, миопия стабилизировалась.
A. A. Snyder и F. В. Thompson (1972), F. В. Thompson (1978) предложили упрощенную методику склерального укрепления заднего полюса глаза при миопии. Предварительно готовят роговично-склеральный аллотрансплантат из глаза донора в виде полоски. После анесте
зии трансплантат проводят к заднему полюсу глаза и укладывают на склеру между местом прикрепления нижней косой мышцы и зрительным нервом. Концы трансплантата фиксируют швами к склере кнутри от места прикрепления верхней и нижней прямых мышц. Таким образом, трансплантат, проходя сверху вниз под глазными мышцами, своей средней
частью закрывает место проекции на склеру желтого пятна (рис. 92).
Н. Н. Пивоваров и Ю. К. Ширшиков (1976), Э. Ф. Приставко (1980) описывают упрощенный хирургический метод профилактики прогрессирования миопии. Показанием к операции является миопия 6,0 дптр и более при прогрессировании на 1,0 дптр и больше в год. Для трансплантации используют аллосклеру глаза трупа, консервированную во влажной камере при -|-2---(-4°С в течение
1—3 сут по Филатову или высушенную на силикагеле. Трансплантаты выкраивают из склерального бокала в меридиональном направлении. Ширина основания трансплантата 5—6 мм, длина его 22—25 мм.
Производят акинезию 2% раствором новокаина и инстилляции 0,5% раствора дикаина. Делают разрезы конъюнктивы и влагалища глазного яблока в четырех квадрантах длиной 8—9 мм параллельно лимбу, отступя от него 5—6 мм. Тонким шпателем от склеры отслаивают влагалище глазного яблока в виде тоннеля до заднего полюса глаза в меридианах 10 часов 30 мин, 1 час 30 мин, 4 часа 30 мин, 7 часов 30 мин. Склеральные трансплантаты погружают под влагалище глазного яблока до заднего полюса глаза и фиксируют одним швом (8: 0) за периферический конец к склере на расстоянии 10—12 мм от лимба (рис. 93). Накладывают непрерывный шелковый шов (8 : 0) на разрезы конъюнктивы, вводят раствор антибиотика под конъюнктиву, накладывают монокулярную повязку.
168
1
93. Склеропластика по Пивоварову (схема).
94. Склеропластика по Аветисову.
1,2 — верхняя и нижняя прямые мышцы; 3 и 4 — наружная и внутренняя прямые Мышцы; 5 — нижняя косая мышца; 6 — зрительный нерв.
В. И. Савиных (1980) приводит данные о склеропластической реконструкции глаз с миопией высокой степени. Автор применил комбиннцик» рифления склеры в четырех квадрантах с пломбиро-ihhiik'M диском реберного хряща диаметром 8 мм и толщиной 1 3 мм и зависимости от степени миопии. Пломбу прижимают к склере глаза с помощью крестообразных лент, выкроенных из широкой фасции, концы которых проводят в склеральные тоннели и фиксируют к склере двумя швами с таким расчетом, чтобы хряще-iiiiH пломба легла па участок склеры, соответствующий желтому нагну. Несмотря па кажущуюся сложность, операция выполняется, по словим автора, за 1 i '/й ч и сочетает в себе укрепление склеры с укорочением глаза, рифлопиом и задним пломбированием.
Операция выполнена 80 больным (85 глаз). В результате степень миопии снизилась в среднем на 8,25 дптр. Укорочение зрительной оси составило в среднем 2,2 мм (от 1,2 до 5,2 мм). Отдаленные результаты в сроки от 6 мес до 5 лет прослежены у G7 больных. Полученное ослабление рефракции и улучшение зрения при длительном наблюдении осталось стабильным.
Э. С. Аветисов и Е. П. Тарутта (1981) описали операцию склеропластики для укрепления задненаружного сегмента глазного яблока. Непосредственно перед операцией из целого донорского глаза, консервированного во влажной камере по Филатову и обработанного в водном растворе (1:2000) бриллиантового зеленого, после предварительного нанесения контуров выкраивают трансплантат в виде полоски от верхней прямой мышцы через задний полюс до нижней прямой мышцы (рис. 94). Ширина верхней части лоскута равна 7—8 мм, в средней части он расширяется до 12 мм и суживается книзу до 5 мм, что облегчает его проведение под нижнюю косую мышцу. ’Выкроенный трансплантат очищают)
169
от эписклеры и внутренних оболочек и помещают в 30% раствор сульфацил-натрия.
Производят разрез конъюнктивы длиной 10—12 мм над наружной прямой мышцей параллельно лимбу на расстоянии 12 мм от него. С помощью крючка выделяют наружную прямую мышцу. После наложения двух швов, отступя 2—3 мм от места ее прикрепления, мышцу отсекают от склеры, на культю мышцы накладывают уздечный шов. Разрез конъюнктивы влагалища глазного яблока продолжают кверху и книзу параллельно лимбу до наружных краев верхней и нижней прямых мышц. Склеру на всем протяжении освобождают тупым путем. Нижнюю косую мышцу выделяют с помощью крючков и под нее сверху вниз проводят узкую часть трансплантата. Нижний конец трансплантата укрепляют эписклеральным швом под сухожилием нижней прямой мышцы. Глазное яблоко поворачивают кнутри, трансплантат пинцетом продвигают кзади и фиксируют его передний край эписклеральным швом на заданном расстоянии от лимба. Верхний конец трансплантата укрепляют швом к склере под сухожилием верхней прямой мышцы. Наружную прямую мышцу подшивают на место. Накладывают швы на влагалище глазного яблока и конъюнктиву.
Операция произведена 86 больным в возрасте 8—45 лет с миопией от 6,5 до 44,0 дптр. Степень миопии после операции не изменилась у 12 больных, у остальных 74 отмечено уменьшение миопии на 0,5—4,5 дптр. Срок наблюдения до l'/г лет.
Следует отметить методику укрепляющей склеропластики, предложенную Н. А. Пучковской и соавт. (1984) для профилактики прогрессирующей миопии у детей и подростков. Трансплантат из аллосклеры представляет собой Х-образную ленту, которая предотвращает сдавление вортикозных вен.
М. С. Ремизовым и А. И. Грязновым (1981) разработан оригинальный способ хирургического лечения прогрессирующей миопии. После акинезии и ретробульбарной анестезии новокаином в меридианах между прямыми мышцами, отступя 7—8 мм от лимба, делают четыре разреза конъюнктивы и влагалища глазного яблока. Под него вводят изогнутую по кривизне глазного яблока тупую иглу с широким просветом от системы переливания крови на шприце и продвигают ее в теноновом пространстве к заднему полюсу глаза на 15—20 мм, не доводя до сосудисто-нервного пучка.
Сильно надавливая на поршень, вводят 0,3—0,4 мм взвеси измельченной склеры в изотоническом растворе хлорида натрия за глазное яблоко в теноново пространство, а затем в остальных трех меридианах (всего 1,2—1,6 мм взвеси). После наложения швов па влагалище глазного яблока и конъюнктиву производят массаж глазного яблока через веки для более равномерного распределения взвеси ткани в теноновом пространстве. Взвесь ткани приготавливают непосредственно перед введением, используя высушенную и измельченную в шаровой мельнице или высокооборотной кофемолке ткань, например аллосклеру или аллохрящ, сохраняемую в стерильных бюксах над силикагелем, из расчета 0,2—0,3 г сухого
170
S5.
Инструменты для хондропластики — изогнутая игла и напильник из нержавеющей стали или титана.
* sA
В
порошка на 1 мл изотонического раствора хлорида натрия. Способ применен 36 больным (70 глаз) в возрасте 7—40 лет. В отдаленные сроки (6 мес — 2'/г года) степень миопии соответствовала исходной, прогрессирование ее прекратилось у 95% больных.
Используя метод, предложенный М. С. Ремизовым и А. И. Грязновым, мы готовим взвесь, натирая трупный хрящ или хрящ плодов на стерильном напильнике из нержавеющей стали или титана (рис. 95) над чашкой Петри, стерилизуем хрящ в водном растворе (1 : 2000) бриллиантового зеленого и консервируем во влажной камере по Филатову. Приготовленные хрящевые опилки смешиваем с изотоническим раствором хлорида натрия в пропорции 0;6 г на 1 мл и в виде гомо-гоппой пасты вводим по 0,3—0,4 мл в четыре квадранта между влагалищем глазного ябло- < ка и склерой в область желтого пятна и во- ' круг зрительного нерва. Эхографически после I операции отмечается уменьшение длины не- к реднезадней оси от 0,2 до 0,4 мм. Слабовы- к раженные явления тенонита обычно прохо- Ь дят к 4—6-му дню после вмешательства. Методика (авт. спид. № 1219079) заслуживает одобрения, особенно при прогрессирующей миопии 6,0—10.0 дптр | Беляев В. С., Кравчинипа В. В., Амирбегишвили М. М., 1984].
Н. П. Нурмамедов и Г. К. Атамередова (1981) описали результаты однолоскутной склеропластики с использованием трансплантата из твердой мозговой оболочки. Трупную твердую мозговую оболочку, взятую в стерильных условиях в течение 24 ч после клинической смерти, промывают в растворе фурацилина (1:5000), меняя его 3 раза, а также в растворе пенициллина со стрептомицином (100 000 ЕД). Затем оболочку помещают на сутки в 3% раствор борной кислоты и хранят в холодильнике при температуре +2—(-4°С. Через 24 ч в лаборатории проверяют ее стерильность.
Из стерильной твердой мозговой оболочки выкраивают лоскут длиной 46—48 мм и шириной 9—10 мм. На одном конце трансплантата делают дубликат в виде кармана длиной 10 мм, боковые края которого сшивают биологическими швами (рис. 96). Приготовленный лоскут помещают на 5—7 мин в 30% раствор сульфацил-натрия. После обработки операционного ноля обычным способом, ретробульбарно, а также Между верхней и наружной прямыми
171
96. Однолоскутная склеропластика по Нурмамедову.
97. Приготовления лентовидного трансплантата (1) из склеры донора (2) по Беляеву — Ильиной.
мышцами под конъюнктиву вводят 2% раствор новокаина. Отступя от лимба 6 мм, конъюнктиву и влагалище глазного яблока разрезают между указанными мышцами на 6—7 мм. Шпателем отделяют влагалище глазного яблока от склеры на ширину трансплантата (10 мм) глубоко до заднего полюса глаза. Затем в карман на шпателе вставляют трансплантат и лоскут проводят по склере по направлению к проекции желтого пятна так, чтобы дуб-ликатура трансплантата оказалась за глазом. При этом гладкая поверхность лоскута должна прилежать к склере. Передний конец лоскута фиксируют в эписклере двумя биологическими швами, отступя 7 мм от лимба. Конъюнктивальный разрез герметизируют непрерывным шелковым швом. Под конъюнктиву вводят 0,002 мг дексаметазона. На сутки накладывают бинокулярную повязку. Больных выписывают из стационара на 7—10-е сутки после операции.
Авторы проанализировали результаты 30 операций, произведенных у 30 больных с высокой степенью миопии (6,0—26,0 дптр). В отдаленные сроки (3—20 мес) у всех больных отмечена стабилизация процесса прогрессирования миопии. У 11 больных степень миопии снизилась на 1,0—3,0 дптр. Переднезадняя ось стала короче на 0,2—0,5 мм. Острота зрения повысилась на 0,01—0,07 без коррекции у 10 больных и на 0,07—0,2 с коррекцией у 8.
На кафедре глазных болезней Университета дружбы народов им. П. Лумумбы ведутся исследования по разработке методов хирургического лечения прогрессирующей миопии. Первоначальной целью исследований была разработка технически простой склеропластической операции, которая позволила бы предотвратить прогрессирование миопии. Этому посвящены работы В. С. Беляева и Т. С. Ильиной (1975). Затем был поставлен вопрос о возможности применения склерокератопластики, т. е. комбинированной рефракционной операции, для стабилизации прогрессирования близоруко-
)72
81И и снижения степени миопии [Беляев В. С. и др., 1974; Маунг Кио Тин, 1976] и астигматизма [Илиа А. Н., 1976]. В настоящее время ведется разработка комбинированного способа воздействия Н* склеру и роговицу для профилактики прогрессирования миопии вначительного снижения ее степени посредством изменения кривизны парацентральных участков роговицы [Луэнго В. М., 1979, 1880; Беляев В. С., 1980; Шоттер Л. Л., Кабир М. X., 1984]. Изучаются также возможности применения комбинации склеропластики с удалением мутного или прозрачного хрусталика [Матту И. К., 1982].
Склеропластика
Для укрепления заднего отрезка глаза использовали аллоскле-ру, полученную из глаз трупа, консервированных во влажной каморе по Филатову при температуре +2—4 °C в течение 1—8 сут. После эвисцерации и обработки в водном растворе бриллиантового аеленого (1 : 2000)1 склеру разрезали по спирали и получали ленту шириной около 8 мм и длиной 120 мм (рис. 97). В настоящее время с этой целью используют ножницы с ограничителем, предложенные С. Я. Миминошвили, которые позволяют добиться одинаковой ширины склерального трансплантата. С одного конца (лучик* выкроенного из переднего отрезка глаза) трансплантат рштекалп ив две полоски длиной 60 мм и шириной 3 мм. Таким образом получали Y-образную склеральную ленту. Длину обеих ножек уравнивали и концы их заостряли. После этого с помощью острого скальпеля делали небольшие насечки на ножках на одинаковом расстоянии (около 30 мм) от места бифуркации ленты, для того чтобы контролировать их расположение на глазу реципиента. В последнее время по предложению Л. П. Флик и Р. Ю. Волкола-Konoii ив склеральной лепте и место ее раздвоопия специальным пробойником или трепаном диаметром 2 3 мм делают отверстие опальной (каплеобразной) формы размером 3X4 мм, которое, как считают авторы, предотвращает касание ножек трансплантата к зрительному нерву (рис. 98). Ширина ленты на этом участке 8—
98. Выкройка трансплантата для склеропластики по Беляеву (схема).
1 — надрезы на лентах; 2 — полукруг, образованный при трепанации в месте бифуркации.
1 В литературе [Когермазова Н. X., 1978] есть указания об использовании для обработки трансплантата ристомицина.
173
99.
Крючок для ретробульбарного проведения трансплантата.
| 9 мм. Затем помещали склеральную»
S ленту в 30% раствор сульфацил-натрия
до начала операции. G этой целью мож-но использовать и антибиотики (пени-•' циллинидр.).
В технике операции за основу принят метод, предложенный А. II. Нестеровым (1967) и модифицированный В. С. Беляевым и Т. С. Ильиной (1972), используемый для лечения прогрессирующей миопии высокой степени. Для ретробульбарного проведения приготовленного трансплантата к заднему отрезку глазного яблока применяли спе-, циальный крючок, который состоит из.
1 4 плоской и изогнутой по форме глазного
яблока пружинной части и твердой более утолщенной ручки с накаткой на ее поверхности. На конце-изогнутой части имеется овальное отверстие размером 2 X 3 мм для вставления ножки трансплантата.
В процессе работы крючок неоднократно усовершенствовался. Последнюю модель крючка от предшествующих отличает то, что он пружинистый и уплощен в виде шпателя, конец которого затуплен и слегка разогнут. Это облегчает начальный этап заведения » при более легком и менее травматичном проведении обеспечивает неплотное прилегание конца крючка к глазному яблоку, уменьшая возможность повреждения его концом инструмента (рис. 99).
Осуществляли акинезию, ретробульбарно и под конъюнктиву вводили 2% раствор новокаина. Выполняли наружную кантото-мию. Веки фиксировали пружинным векорасширителем. Делали разрезы конъюнктивы и влагалища глазного яблока в трех местах,, отступя от лимба 6—8 мм: выше и ниже внутренней прямой мышцы и над наружной прямой мышцей. Тупым путем с помощью шпателя тщательно отсепаровывали конъюнктиву и влагалище глазного яблока от склеры глазного яблока в местах разрезов для проведения ножек трансплантата. Наружную прямую мышцу прошивали двумя кетгутовыми швами и временно отсекали, на культю сухожилия накладывали крепкий шелковый шов, для того чтобы было удобно фиксировать глазное яблоко. Сначала вставляли крючок в разрез конъюнктивы выше внутренней прямой мышцы и осторожно тупым путем проводили ретробульбарно над зрительным нервом, пока конец крючка не показывался между сухожилиями нижней косой и наружной прямой мышц.
При ретробульбарном проведении крючка следует учитывать анатомические особенности заднего полюса глазного яблока. Крю-174
Wok должен пройти в непосредственной близости от зрительного «(рва, между ним и вортикозными венами. При отклонении крюч-«а .кверху его конец может попасть под то место, где прикрепляется сухожилие блоковой мышцы. Это значительно затруднит прохождение крючка, поэтому при проведении над зрительным нервом его следует направлять в промежуток над местом прикрепления Наружной прямой мышцы. При проведении крючка ниже зрительного нерва и, обойдя его, сразу же поднять конец крючка вверх, чтобы миновать место прикрепления нижней косой мышцы склере глаза. Выйти крючок должен также над местом прикрепления наружной прямой мышцы, иначе при более низком его выведении крючок может проникнуть под или через сухожилие ниж-вей косой мышцы. При этом лента трансплантата «сядет» на сухожилие мышцы, а не пройдет, как необходимо, в виде развилки до зрительного нерва.
Для того чтобы овладеть навыками проведения крючка, требуется предварительная тренировка, и наиболее легко удается осуществить его в непосредственной близости (в 1—2 мм) от зрительного нерва, обойдя сверху сухожилие блоковой мышцы, а снизу сухожилие нижней косой мышцы (рис. 100). Вставленную в ушко крючка одну из ножек аллотрансплантата склеры обратным движением осторожно проводили ретробульбарно над зрительным •норном (рис. 101). Вторую ножку трансплантата проводили таким же образом нитке зрительного нерва.
Делая перекроет, постепенно подтягивали на себя оба конца трансплантата, для того чтобы развилка трансплантата «села» на зрительный нерв. В этот момент контролировали насечки на нож-•ках трансплантата: они должны быть друг против друга на одина-«овом расстоянии. После этого каждую ножку трансплантата прикрепляли двумя биошвами к склере глаза больного выше и ниже ппутреипой прямой мышцы па уровне ее сухожилия. Широкую часть трансплантата нодтигппали па себя, для того чтобы одновременно получить необходимое натяжение трансплантата и освободить зрительный нерв из его развилки, затем подшивали трансплантат двумя биошвами на 4—5 мм кзади о-т места прикрепления наружной прямой мышцы (рис. 102). Величину натяжения склерального трансплантата регулировали в месте его укрепления биошвами; она составляет 2—4 мм в зависимости от размеров глазного яблока. Мышцу фиксировали к месту ее прикрепления.
Накладывали три — четыре узловых биошва на вагалище глазного яблока снаружи и непрерывный шов на конъюнктиву. Вводили пенициллин (5000 ЕД) и 0,5% раствор гидрокортизона (0,2 мл) или дексазона (0,002 мг) под конъюнктиву. Применяли монокулярную повязку.
С 1-го дня больным разрешали сидеть, со 2-го — ходить. Перевязки производили ежедневно с инстилляцией в глаз 30% раствора сульфацил-натрия, витаминов и 0,25% раствора скополамина. Е пе.рвые дни при перевязках обязательно проверяли остроту зре-
175
100.
Ретробульбарное проведение крючка (схема).
101.
Ретробульбарное проведение трансплантата (схема).
102,
Укрепление заднего полюса глаза при миопии (схема). 1 — прямые мышцы глаза: 2— нижняя косая мышца: 3 — зрительный нерв; 4 — верхняя косая мышца: 5 — склеральный лоскут. Пунктирной линией отмечены отрезаемые участки.
иия без коррекции, поле зрения контрольным способом, внутриглазное давление и производили офтальмоскопию.
Как правило, в первые дни после операции отмечались реактивный отек век, легкий хемоз конъюнктивы, иногда ограничение? подвижности глазного яблока, у ряда больных наблюдались явления легкого тенонита, которые проходили через неделю. Швы с конъюнктивы снимали на 8—10-й день. После склеропластики’ больных обычно выписывали из стационара на 10—12-й день, а иногородних больных отправляли в загородное отделение на 2 нед: для отдыха и наблюдения. Срок временной нетрудоспособности в среднем 28—30 дней.
Остановимся на некоторых особенностях склеропластики у детей с выраженным прогрессированием миопии. По нашим данным, основным показанием к склеро пластике у детей служит быстрое-прогрессирование миопии высокой степени с выраженными миопическими изменениями на глазном дне.
Среди наблюдавшихся нами больных были дети старшего возраста (13—14 лет), операция у них была произведена под местной анестезией с предварительной общепринятой премедикацией.. При выполнении операции у детей более раннего возраста (8 лет) приходится применять наркоз, особенно на начальном этапе операции. Для иллюстрации приводим собственное наблюдение.
Больной Б., 8 лет. Диагноз: прогрессирующая миопия высокой степени,, синдром Марфана. Заключение кардиолога: выраженный кардиальный синдром, который является компонентом болезни Марфана (грубый систолический шум на верхушке); на особенности изменения сердца оказывает влияние резкая деформация грудной клетки; нарушение кровообращения отсутствует.
Острота зрения правого глаза 0,02, не корригируется, левого глаза 0,02,. с —12,0 дптр 0,05. Дислокация хрусталиков. На глазном дне миопические стафиломы, перераспределение пигмента. Показанием к укреплению заднего полюса правого глаза гомосклерой послужило прогрессирование миопии с резким снижением остроты зрения. Попытка провести склеропластику под местным обелболнеанием с внутривенным введением седуксена не удалась.
17.09.70 г. проведена склеропластика правого глаза гомосклерой под внутривенным виадриловым наркозом. Премедикация: растворы атропина (0,5 мл), промедола (0,5 мл) и супрастина (1 мл). В конце операции возник-ларингоспазм, купированный с помощью искусственной вентиляции легких. Операция прошла без осложнений.
При выписке на 11-й день: острота зрения правого глаза 0,02, не корригируется, левого глаза 0,02, с — 12,0 дптр 0,05.
Таким образом, у детей можно производить склеропластику даже при наличии серьезных нарушений общего статуса. Как правило, укрепление заднего полюса глаза в детском возрасте ведет к стабилизации миопии, предотвращая дальнейшие серьезные изменения глазного дна.
С целью контроля за укорочением переднезадней оси глаза производили ультразвуковую биометрию до и после склеропластики. Отмечено укорочение переднезадней оси на 0,2—2,3 мм (в среднем на 0,8 мм). Степень миопии снизилась на 0,5—5,0 дптр (в среднем на 2,1 дптр). В послеоперационном периоде (болен
12 Руководство по глазной хирургии 177
:1000 операций) наблюдались следующие осложнения: секторальное выпадение поля зрения — у 3 больных (у одного из них на 2-й .день удален трансплантат, у 2 других ослаблено натяжение транс-плаптата); прижатие вортикозной вены с экссудатом в передней жамере — у 1 больной (после лечения экссудат лизировался и восстановилась исходная острота зрения); другие осложнения — расхождение конъюнктивального шва у 8 больных, краевая инфильтрация роговицы у 5, на исход операции не повлияли.
За последнее десятилетие накоплен достаточный клинический материал, позволяющий сделать выводы об отдаленных результатах операции укрепления склеры. По данным А. П. Нестерова и соавт. (1976), после 184 операций с использованием аутотрансплантата фасции отдаленные результаты (в сроки от 1 года до 7 лет) прослежены на 105 глазах, прогрессирование миопии отмечено в 5% случаев. Анализ результатов 116 операций, проведенных М. В. Зайковой и соавт. (1975), показал благоприятные результаты, острота зрения в отдаленные сроки повысилась или не изменилась: без коррекции — на 87,9% оперированных глаз, с коррекцией — на 97,4%. По данным В. С. Беляева и соавт. (1980), аа 511 операций склеропластики в отдаленные сроки (до 8 лет) отмечено прогрессирование миопии на 22 (4,4%) оперированных глазах. При исследовании вторых, неоперированных, глаз в 51,5% •случаев отмечалось прогрессирование с повышением степени миопии на 0,5—4,0 дптр (в среднем на 1,7 дптр) и в 54,2% —повышение переносимой коррекции (в среднем на 2,2 дптр).
Таким образом, оперативное лечение, направленное на укрепление склеры миопичных глаз, позволяет, по данным большинства •отечественных и зарубежных авторов, добиться стабилизации миопии на оперированных глазах.
Склеропластика при прогрессирующей миопии высокой степени получает все большее признание среди офтальмологов как метод профилактики ее прогрессирования и лечения осложнений. Об ©том свидетельствует возросшее за последние годы количество публикаций по этой проблеме.
В начале применения хирургического лечения основанием для выполнения склеропластики служили тяжелые случаи с серьезными осложнениями и бурным прогрессированием миопии. Операции носили лечебно-профилактический характер. Применяли в основном способы, направленные на укрепление заднего полюса (фасциальными или склеральными лентами с одновременным укорочением переднезадней оси.
В настоящее время операции производят в основном с профилактической целью, применяя упрощенные методики, направленные на реваскуляризацию склеры (М. В. Зайкова, М. С. Ремизов, Н. Н. Пивоваров, Н. Н. Нурмамедов; В. С. Беляев, Ж. X. Госсон и др.). В тех случаях, когда происходит неуклонное прогрессирование миопии, необходимо выполнять склеропластику независимо от возраста. Показана склеропластика даже в раннем детском возрасте (М. В. Зайкова и В. П. Маценко). На повестку дня встает <78
опрос о том, чтобы склеропластику, особенно ее облегченные варианты, в том числе предложенный нами комбинированный способ, использовали для профилактики в возможно более раннем возрасте и в начале прогрессирования миопии с 6,0 дптр и выше, т. е, до появления дегенеративных изменений на глазном дне. Применение этих методик оправдано даже в случаях умеренного прогрессирования миопии у детей и подростков. При резком же перерастя-жении глаза с выраженными явлениями дегенерации в центре а< на периферии сетчатки лучший эффект дают бандажирующне склероукрепляющие операции (А. П. Нестеров, Т. И. Брошевский, В. С. Беляев, В. И. Савиных и др.), которые позволяют добиться^ стабилизации и улучшения функций даже в тяжелых случаях прогрессирующей миопии.
Схема хирургической профилактики прогрессирования и коррекции миопии. За последние годы в-нашей клинике сложилась система оказания лечебной помощи больным с миопией, включающая не только хирургическую профилактику ее прогрессирования, по и исправления миопии в довольно (нирокич иродолач.
При миопии слабой степени для стабилизации и исправления рефракции мы используем хопдрннла( тику, которая позволяет добиться снижения степени миопии па 1,5 2,0 дптр в зависимости от дозы введенной к заднему полюсу глаза пасты из брефохряща. При миопии средней степени применяем брефохондропластику в комбинации с меридиональной рефракционной кератопластикой' (клинопластика) для стабилизации и исправления миопии из расчета по одному трансплантату шириной 0,3 мм на каждую диоптрию рефракции. При миопии 8,0—12,0 дптр используем бандажи-рующую склеропластику Y-образным трансплантатом, которая наиболее эффективна и, по нашим данным, приводит к стабилизации процесса в 95,6% и улучшени юзрительных функций в 51%, случаев. К этому добавляем меридиональную рефракционную кератопластику (клипопластика), которая позволяет снизить степень, миопии па 10,0 дптр при использовании 12 трансплантатов.
В последние годы применяем тоннельную кератопластику.
При миопии от 12,0 до 16,0 дптр после бандажирующей склеропластики Y-образным трансплантатом используем межслойную рефракционную кератопластику с отрицательной (вогнутой) биолинзой. При очень высокой степени миопии—16,0—25,0 дптр — делаем бандажирующую склеропластику Y-образным склеральным трансплантатом и удаляем хрусталик при любом состоянии его прозрачности.
Таким образом, можно отметить, что получившие широкое развитие в нашей стране хирургические методы укрепления заднего полюса глаза при миопии в комбинации с корригирующими операциями дают обнадеживающие отдаленные результаты. Что касается осложнений, при использовании этих методов, то они не идут ни в какое сравнение с теми тяжелыми последствиями, к которым ведет прогрессирование миопии, особенно высокой степени.
12* 17»
103. Трансплантат (1) с пришитой пломбой (2) (схема).
Склеропластика с пломбированием при тяжелых отслойках сетчатки с макулярными и парамакулярными разрывами при прогрессирующей миопии
При прогрессирующей миопии особо тяжелыми бывают отслойки сетчатки с центральными разрывами в макулярной и парама-кулярпой зонах. Тяжесть заболевания определяется не только давностью существования отслойки, недостаточным прилеганием сетчатки после назначения постельного режима, но и трудностью ’блокирования ретинальных разрывов с помощью методов, описанных в литературе.
В тех случаях, когда сетчатка не прилегала после соблюдения постельного режима, производили укрепление заднего полюса глаза аллотрансплантатом склеры с пломбированием силиконовой резиной или хрящом. Операция заключалась в том, что к склеральному трансплантату Y-образной формы, приготовленному по казней методике, подшивали силиконовую пломбу в области бифуркации (рис. 103). Затем проводили склеропластику с натяжением за край трансплантата, что вызывало вдавление оболочек в области разрыва (рис. 104).
По описанной методике в течение 1972—1980 гг. проведено хирургическое лечение 10 больных с тяжелыми отслойками сетчатки и наличием макулярного и парамакулярного разрывов. Возраст больных от 22 до 69 лет. Степень осложненной прогресси-результатов операций показал, что у 6 больных получено улучшение: сетчатка прилегла, разрыв блокирован, острота зрения повысилась от светоощу-щения с правильной проекцией света до 0,1—0,2 с коррекцией, поле зре-
рующеи миопии до zb,О дптр.
104. Укрепление склеры с пломбировкой заднего полюса при макулярных разрывах.
1 — прямые мышцы глаза; 2 — нижняя косая мышца; 3 — зрительный нерв: 4 — верхняя косая мышца; 5 — склеральный лоскут;
6 — пломба.
180
ния расширилось почти до нормы. У одного больного функции не изменились, хотя разрыв был блокирован, но сетчатка прилегла не полностью. У 3 больных отмечено ухудшение: разрыв блокирован не полностью, поле зрения сузилось, острота зрения осталась низкой. Для иллюстрации приводим выписку из истории болезни больного, находившегося под нашим наблюдением.
Больной М., 43 года, поступил 20.09.73 г. в глазное отделение Московской городской клинической больницы № 1 с диагнозом: отслойка сетчатки с центральным разрывом, миопия высокой степени правого глаза, амавроз, перезрелая катаракта левого глаза.
Резкое ухудшение зрения больной отметил 28.08. Острота зрения правого глаза — светоощущение с правильной проекцией света, левого глаза 0. Миопия с детства. Поле зрения сужено до 7° с височной стороны, механофос-фен отрицательный в нижненаружном и нижневнутреннем квадрантах. Офтальмоскопически: диск зрительного нерва бледный, границы несколько стушеваны. Тотальная, плоская отслойка сетчатки с центральным дырчатым разрывом.
27.09 произведено укрепление заднего полюса правого глаза аллотрансплантатом склеры с вдавлением силиконовой пломбой и циркляжем силиконовой лентой. При выписке острота зрения правого глаза 0,02, с —10,0 дптр 0,1. Поле зрения расширилось с височной стороны до 70° и с носовой стороны до 40°.
Таким образом, применение комбинации склеропластики заднего полюса глазного яблока с пломбированием центральных разрывов сетчатки при миопии высокой степени позволяет добиться эффекта при обширных отслойках сетчатки.
Комбинированная склеропластика с реваскуляризацией
Длительные наблюдения за больными с прогрессирующей миопией после склеропластики при выраженных дистрофических процессах на глазном дне позволили прийти к выводу о благоприятном влиянии вмешательств па функции органа зрения. Подобные факты навели па мысль о целесообразности выполнения подобных вмешательств при врожденных и возрастных дистрофиях сетчатки и атрофиях зрительного нерва. В этих случаях используют комбинированную методику, позволяющую одновременно произвести реваскуляризацию за счет конъюнктивально-эписклерального лоскута, который направляют к заднему полюсу и фиксируют там с помощью склеропластики.
В литературе, посвященной хирургическому лечению дистрофий, за последние годы появился ряд интересных сообщений [Дмитриев М. А., 1963; Волошинов Д. Б., 1968; Шлопак Т. В., 1970; Базарный В. Ф., 1973; Беляев В. С., Ли Т. В., 1976; Шпак Н. И., 1978; Индейкин Е. Н., 1980; Беляев В. С., 1981; Джа-лиашвили О. А., Бойков Г. С., 1981; Галимова В. У., Мулда-шев Э. Р., 1981; Госсен Ж. X., 1982; Agarwal L., 1963, и др.]. Это послужило основанием для дальнейшего изучения возможностей комбинированного метода реваскуляризации с пластикой склеры при ряде дистрофических процессов оболочек глаза и зрительного нерва.
181
105. Реваскуляризация с упрощенной склеропластикой.
1 — прямые мышцы глаза; 2 — нижняя косая мышца: 3 — зрительный нерв; 4— верхняя косая мышца; 5 — лоскут влагалища глазного яблока, повернутый к зрительному нерву; 6 — зона непроникающих диатермокоагуляций склеры (обозначена точками); 7 — склеральный лоскут с подвернутым концом.
Предложенный нами комбинированный метод хирургического лечения дистрофий оболочек и зрительного нерва основан на упрощенной склеропла-стике в комбинации с микродиа-термокоагуляцией и реваскуляризацией субконъюнктивальными тканями, которые заводят к заднему полюсу глаза, с подключением питания из системы ветвей наружной сонной артерии в помощь к веточкам глазничной артерии. При этом руководствовались тем, что артериальная система, снабжающая кровью веки и конъюнктиву, является обособленной группой. Она образуется обильными анастомозами между конечными ветвями внутренней и наружной сонных артерий. От внут
ренней сонной артерии эти анастомозы дают ветви — глазную, слезную и верхнюю орбитальную артерии, артерии век, лобную артерию и артерию спинки носа. Из ветвей, отходящих от наружной сонной артерии, здесь иг-
рают роль те, которые отдают концы к векам, т. е. главным образом наружная, верхнечелюстная и височная артерии [Авербах М. И., 1949].
Техника операции. Предварительно готовят склеральный аллотрансплантат линейной формы (6x40 мм) из глаза донора с подвернутым и подшитым концом размером 6X7 мм (по Нурма-медову), который до операции хранят в 20% растворе сульфацил-натрия. После акинезии и ретробульбарной анестезии 2% раствором новокаина разрезают конъюнктиву, отступя 4—5 мм от лимба. После тщательной отсепаровки конъюнктивы от подлежащих субконъюнктивальных тканей и отделения тупым путем влагалища глазного яблока с эписклерой от склеры из них выкраивают лоскут длиной 20 мм и шириной 10 мм. В этом же квадранте (между верхней и наружной прямыми мышцами, на которые накладывают шелковые держалки) тупым путем готовят тоннель между склерой и субконъюнктивальными тканями по направлению к зрительному нерву. На освобожденный при этом участок: склеры наносят 10—12 непроникающих микродиатермокоагуля-ций. Затем лоскут влагалища глазного яблока вместе с аллотрансплантатом склеры заводят по склере глаза реципиента к области зрительного нерва (рис. 105). Периферический конец склерального трансплантата фиксируют двумя биошвами к склере реципиента. Конъюнктивальный разрез закрывают непрерывным шелковым
182
шпом. Накладывают монокулярную повязку (авт. свид. № 1017325) [Беляев В. С., Госсен Ж. X., 1983].
По указанной методике выполнено 140 операций (у 106 больших). Возраст больных от 14 до 90 лет. Большинство из них поступили с диагнозами: врожденная и старческая дистрофия сетчатки, Пигментная абиотрофия, компенсированная глаукома. В отдаленные сроки наблюдения (от 6 мес до 3 лет) у больных отмечено улучшение зрительных функций, повышение остроты зрения от Светоощущения с неправильной проекцией света до 0,3 перед операцией до 0,01—0,7 в отдаленный период наблюдения. Зафиксировано расширение поля зрения на 5—20° на каждом из 8 меридианов, уменьшение абсолютных и относительных скотом. Для иллюстрации приводим истории болезней больных, находившихся под нашим наблюдением.
Больной С., 42 года, находился в глазном отделении с 26.11 по 03.12.81 г. Диагноз: макулодистрофия обоих глаз. При поступлении: на глазном дне обоих глаз (больше на левом) имеются старые очаги хориоретинита белого цнета. Острота зрения правого глаза 0,9—1,0, левого глаза 0,3—0,4, с — 2.0 дптр и цилиндром —1,5 дптр (ось 125°) (субъективное улучшение).
27.11 произведена реваскуляризация на левом глазу по нашей методике. Операция и послеоперационный период без осложнений. Острота зрения правого глаза 1,0, пе корригируется, левого глаза 0,3—0,4, с — 2,0 дптр и цилиндром — 1,5 дптр (ось 125°) 0,5.
При осмотре 12.02.82 г.: оперированный глаз в хорошем состоянии. Острота зрения правого глаза 1,0, левого глаза 0,3 — 0,4, с —2,0 дптр и цилиндром —1,5 дптр (ось 125°) 0,6—0,7. Поле зрения в норме.
Больная С., 65 лет, находилась в глазном отделении с 24.02 по 17.03.81 г. Диагноз: глаукома открытоугольная ЗА и атрофия зрительного нерва правого глаза, абсолютная глаукома левого глаза.
При поступлении: на глазном дне правого глаза имеется глаукоматозная экскавация; острота зрения 0,1, +1,5 дптр 0,2, внутриглазное давление 22 мм рт. ст.; поле зрения сужено до точки фиксации с носовой стороны.
09.(13.81 г. произведена реваскуляризация на правом глазу. Операция и «кх'леоперпционпый период без осложнений.
При осмотре 27.10.81 г.: острога пропин правого глаза 0,1, с +1,5 дптр 0,2- 0,3, поле зрении с носовой стороны расширилось па 10°.
Результаты произведенной нами пересадки сосудисто-нервных стеблей эписклеры с поворотом и заведением ее переднего участка к области зрительного нерва, подключением питания системы ветвей наружной сонной артерии в помощь веточкам глазничной артерии, одновременно упрощенной аллосклеропластикой и непро-«шкающей диатермокоагуляцией свидетельствуют о том, что без вскрытия оболочек глаза можно добиться хорошего результата •при возрастной и врожденной дистрофиях сетчатки, пигментной абиотрофии, атрофии зрительного нерва при глаукоме. Операция проста по технике выполнения, не требует сложного оборудования, «что может способствовать ее внедрению в клиническую практику.
Глава 5
Микрохирургия глауком
В будущем о современной хирургии глауком будут по всей вероятности говорить, как о своего рода переходном периоде. Традиционная хирургия глауком оформилась в начале XX века. Многие офтальмохирурги до сих пор производят «классические» операции, чаще всего фистулизирующие.
Между тем учение о глаукоме продвинулось вперед, особенно за два последних десятилетия. Механизм повышения внутриглазного давления стал во многом более понятным. Соответственно этому появились и новые задачи хирургического воздействия. Микрохирургическая техника позволила подойти практически к решению этих задач. В результате появилась патогенетически ориентированная микрохирургия глаукомы. Ее преимущества перед традиционной хирургией заключаются в патогенетической направленности операции, малой травматичности, максимальном щажении глаза, отсутствии фистулизации. Однако для выполнения микрохирургических операций при глаукоме требуется высокая квалификация офтальмохирурга и специальное техническое оснащение.
Что же рекомендовать офтальмохирургу для повседневной работы? Традиционная хирургия — это уже вчерашний день, микрохирургия — завтрашний. Есть ли третий путь в реальных условие ях клинической практики сегодняшнего дня? В известной мере, да.
В отечественной и зарубежной офтальмологии описан ряд новых операций, которые вполне выполнимы технически и в то же время представляют несомненный шаг в сторону микрохирургии от старых фистулизирующих вмешательств. Указанные операции и составляют содержание центрального раздела настоящей главы. Совокупность этих методов можно обозначить понятием «дифференцированная хирургия глаукомы».
Переход от традиционной хирургии глаукомы к новым методам неразрывно связан с необходимостью выделить группы глауком, различающиеся по патогенезу глазной гипертензии. Без этого новые способы, особенно микрохирургические, бессмысленны, поскольку главное в них — это стремление воздействовать на непосредственные причины повышения внутриглазного давления (которые различны при разных формах болезни). В максимально упрощенном виде такое деление сводится хотя бы к дифференциа
184
ции глаукомы на формы с узким и широким углом передней камеры.
Таким образом, «дифференцированная хирургия глаукомы» занимает как бы промежуточное положение между традиционными методами и патогенетически ориентированной микрохирургией. Эти методы можно рассматривать как наиболее подходящие для конкретных условий современной широкой клинической практики. Вместе с тем в настоящем руководстве нельзя ограничиться только ими. Перспектива окончательного перехода к микрохирургии требует хотя бы сжатой характеристики соответствующих (еще более специфически ориентированных) операций. Все описанные ниже методы были апробированы в клинической практике.
Принципиальные основы современной хирургии глауком. В течение многих лет слабым местом теории нарушения циркуляции внутриглазной жидкости было отсутствие выраженной клинической симптоматики ее гиперпродукции или задержки оттока. В конце 20-х — начале 50-х годов сведения об этом были получены. Флюориметрия и топография позволили получить веские доказательства задержки оттока внутриглазной жидкости у большинства больных глаукомой. Наличие изменений в путях оттока камерной влаги было подтверждено гистохимичоски и с помощью методов обычной патогистологии.
В 50—60-х годах продолжали господствовать принципы «классической» антиглаукоматозной хирургии. Главенствующее положение заняли фистулизирующие методы и ириденклейзис. За предшествующие десятилетия были предложены бесчисленные технические модификации первоначальных способов. К методам, заслужившим широкое признание, можно отнести, например, операцию Лагранжа — Хольта — Филатова (1933), иридэктомию с истончением склеры по Покровскому (1942), так называемую фильтрующую иридэктомию по Шейе. Эти способы в известной мере вытеснили корнеосклеральную трепанацию по Эллиоту, некогда очень популярную.
Область использования циклодиализа, несмотря на ряд остроумных вариаций его техники, постепенно суживалась в связи с непостоянством и нестойкостью получаемых результатов. Методы коагуляции ресничного тела или снабжающих его артерий, например способы Архангельского, практически никогда не рассматривались как основные в хирургии глаукомы. В связи с явной нефи-зиологичностью ириденклейзиса предпринимались многочисленные попытки ущемления в операционном разрезе других тканей — склеры (склероклейзис), артерий и вен (венеклейзис), конъюнктивы, мышечных «мостиков».
Тем временем теоретический базис учения о глаукоме значительно пополнился. Совокупность накопившихся сведений свидетельствует о существовании нескольких непосредственных причин повышения внутриглазного давления. Очевидно, что не может быть одинаков, например, патогенез нарушения оттока и увеличения продукции внутриглазной жидкости. Ясно, что механизмы
185
глазной гипертензии различны при открытом и закрытом угле передней камеры. Не исключено, что и «высшие» механизмы патогенеза глаукомы, стоящие за «местными», также различны, хотя это и нуждается в дополнительных доказательствах. В современной научной литературе все чаще стали применять термин «глаукомы» вместо «глаукома».
С признанием полипатогенетичности повышения внутриглазного давления при глаукоме непосредственно связано новое направление в хирургии глаукомы. Его главная цель — найти для каждой формы глаукомы свою операцию, которая имела бы патогенетическое обоснование.
Все эти данные явились теоретическим обоснованием для разработки (М. М. Краснов) системы патогенетически-ориентирован-ных операций при глаукоме соответственно различным формам болезни: ангулярной (с блокадой угла передней камеры), претра-бекулярной (с блокадой входа в каналы оттока), трабекулярной (с поражением трабекулярной сети), интрасклеральной (с поражением коллекторной сети между венозным синусом склеры и ресничными венами) и «гиперсекреторной».
Патогенез глазной гипертензии. Общая схема патогенетически ориентированного лечения
Понятия «патогенез глаукомы» и «патогенез повышения внутриглазного давления» нередко смешивают между собой. Безусловно, между ними много общего, но понятие «патогенез глаукомы» намного шире. Так, оно включает не только патологические механизмы, предшествующие глазной гипертензии (например, изменения в путях циркуляции внутриглазной жидкости), но и ее последствия (изменения в зрительно-нервном аппарате). Совершенно не оправданно противопоставлять «общие» и «местные» факторы либо теории, подчеркивающие роль тех или других. В настоящее время показано, что в большинстве случаев (до 80%) гипертензия вообще является доброкачественным состоянием и не требует хирургического лечения. Более того, причиной изменений в зрительно-нервном аппарате может быть не только повышение внутриглазного давления.
Задачей операции, естественно, является только снижение внутриглазного давления. В связи с этим всегда необходимо отдавать себе отчет в том, что, во-первых, операция может принести пользу только в тех случаях, когда повышенное внутриглазное давление угрожает состоянию зрительных функций; во-вторых, от операции можно ждать эффекта только постольку, поскольку она снижает внутриглазное давление; значение операции уменьшается если имеются еще и другие причины снижения зрительных функций (сосудистая патология зрительного нерва, его прогрессирующая атрофия ит. д.).
186
Повышение внутриглазного давления, как правило, обусловлено изменениями в путях оттока внутриглазной жидкости, которые В свою очередь связаны с более «высокими» расстройствами, на-йример сосудистого, обменного или нервного характера. Результаты генетических исследований с достоверностью свидетельствуют О роли наследственного фактора в патогенезе глаукомы.
Прямое отношение к современной хирургии глауком имеют Патологические изменения в больном глазу. В настоящее время установлено, что колебания кровенаполнения глаза не могут привести к развитию постоянной гипертензии, хотя могут играть, на-дример, роль «спускового крючка» при остром приступе глаукомы. Основной фактор, определяющий клиническую картину стойкого Повышения внутриглазного давления, — это нарушение циркуляции внутриглазной жидкости.
Возможность развития стойкой гипертензии глаза вследствие увеличения продукции внутриглазной жидкости до сих пор подвергается сомнению. Если даже «гиперсекреторная» глаукома существует, то лишь у небольшой части больных. Как правило, причина повышения внутриглазного давления — это затруднение оттока внутриглазной жидкости, которое может возникать в разных местах.
Хорошо известно, что заращение области зрачка или приращение его к хрусталику, например в результате воспалительного процесса, приводит к резкой гипертензии при картине бомбажа радужки. Некоторое затруднение перехода жидкости из задней камеры в переднюю отмечается и при так называемом относительном зрачковом блоке. В происхождении его могут играть роль несколько факторов, например резкий миоз. Затруднять переход жидкости через область зрачка может и слишком плотный контакт между хрусталиком и радужкой. Обычно это происходит вследствие «прижимания» хрусталика к радужке сзади из-за некоторого смещения его вперед. Причины этого изучены не до конца; значительную роль, по-видимому, играют некоторые индивидуальные особенности строения глазного яблока (небольшой объем переднего сегмента глаза, сравнительно большой хрусталик и т. д.).
Следствием относительного зрачкового блока является выбухание прикорневой части радужки, что приводит к сужению угла передней камеры. Иногда наблюдается также картина «циклохрусталикового блока». При этом хрусталик как бы ущемляется в кольце отростков ресничного тела и внутриглазная жидкость оказывается запертой в заднем отрезке глаза. Методы диагностики и лечения этого состояния будут описаны ниже.
Различают две категории основных причин повышения внутриглазного давления: блокирование доступа к путям оттока внутриглазной жидкости и нарушения в самих путях оттока. Наиболее часто встречающимся видом блокирования доступа к фильтрующей зоне является блокада угла передней камеры корнем радужки (ангулярная глаукома). Обычно вначале блок функциональный (оппозиционный), однако если радужка продолжает
187
5Й О № £0 Я PS
К
Я в
Примерное соотношение с традиционной терминологией ойная» глаукома ая и хроническая ы) «Простая открытоугольная» глаукома
Я со &< Я ->t5<
S Й S я о И а эр ня ра-(иридэк- 1 г трабе-! 1 !Н03Н0Г0 трабе-грабеку- теммова )ти ресничных
Направленность хируршческс воздействия Ликвидация зрачкового блока хиальной блокады угла передн< ры; оттеснение хрусталика и к< дужки от фильтрующей зоны томия и иридоциклоретракция) Удаление чужеродной ткани О' кулярной зоны (гониотомия) 1 Вскрытие внутренней стенки вс ! синуса склеры (трабекулотомия кулэктомия, трабекулостомия, i । лоциклостомия) о Вскрытие наружной стенки ш. канала (синусотомия) Уменьшение продукции жидко< ничным телом (коагуляция рес артерий) Комбинированные воздействия
Патогенетические формы глазной гипертензии Ангулярная форма: функциональная (апози-ционный блок); органическая (синехиальный блок, переднее прикре- пление корня радужки) Претрабекулярная । 1 Трабекулярная Интрасклеральная «Гиперсекреторная» глаукома Наиболее частые сочета- ния: ангулярная + трабекулярная, трабекулярная + интрасклераль- ная
Причина глазной гипертензии Блокирование доступа к путям оттока внутриглазной жидкости корнем радужки или чужеродной тканью Блокада путей оттока внутриглазной жидкости в фильтру- 1 ющей зоне склеры (включая 1 коллапс венозного синуса склеры) Гиперпродукция внутриглазной жидкости Комбинированные формы
188
примыкать к фильтрующей зоне, то очень быстро развиваются гониосинехии и блокада угла становится органической. Возможна также пристеночная блокада входа в пути оттока чужеродной-тканью при нормальном положении корня радужки (например,, при «капсулярной» глаукоме с эксфолиативным синдромом, «пигментной» глаукоме1, некоторых видах врожденной глаукомы и др.). Этот вид ретенции можно обозначить термином «претрабекулярная». В этом случае угол передней камеры как таковой не изменен: положение корня радужки по отношению к роговице может быть нормальным. Речь идет не о сужении угла, а о его. «закупорке».
Поражение интрамуральных путей оттока (при открытом углепередней камеры) может локализоваться в разных отделах. Так, например, известно, что развитие глаукомы после введения химотрипсина в переднюю камеру (обычно в ходе экстракции катаракты) объясняется «засорением» межтрабекулярных пространств отшелушившимися клетками. Многие авторы считают, что трабекулярная локализация поражения отмечается и в большинство случаев простой глаукомы с открытым углом передней камеры.
В то же время имеются данные о возможности блокирования путей оттока в средних слоях фильтрующей зоны, т. е. в интра-склеральных коллекторах («интрасклеральная» глаукома).. В пользу этого свидетельствуют, например, проба с ретроградным заполнением венозного синуса склеры кровью. Существуют веские доводы, подтверждающие существование и такого патогенетического фактора, как функциональная блокада венозного синуса* склеры («коллапс» синуса по Нестерову). В этом случае нарушается функция как афферентных (трабекулярная зона), так и эфферентных (интрасклеральные коллекторы) путей.
Изложенное выше позволяет предложить следующее схематическое деление патогенетических вариантов глазной гипертензии, а также методов хирургического воздействия для их устранения (табл. 7).
В какой-то мере вторая группа причин глазной гипертензии соответствует той форме болезни, которая обозначается классическим термином «простая открытоугольная глаукома». В целом, однако, описательные классификации глаукомы, в частности деление на «простую» и «застойную» формы, практически ничего не дают для выбора метода лечения. Дифференциальная диагностика между трабекулярной и интрасклеральными формами глаукомы на практике может представлять существенные трудности; нередко поражения этих зон сочетаются между собой (в том числе при коллапсе венозного синуса склеры канала). С точки зрения хирургического лечения очень важно, что непосредственные причины глазной гипертензии при первичной и вторичной глаукоме одни и те же. Одинаковы и принципы операций.
1 В настоящее время существование «пигментной» глаукомы многие исследователи подвергают сомнению.
189
Таблица 8
Выделение форм глаукомы при упрощенном дифференцированном подходе к выбору метода операции
Форма болезни Характер блокады Хирургическое лечение
Глаукома с узким или закры--тым углом породней камеры (апгулярная глаукома) Глаукома с широким углом пе-,редкой камеры (внеангуляр-ная глаукома, включающая претрабекулярную, трабекулярную, интрасклеральную формы) Функциональная блокада Органическая блокада Иридэктомия, в том числе при остром приступе глаукомы или повторных атаках с нормальным внутриглазным давлением между ними Иридоциклоретракция Трабекулэктомия или синусо-трабекулэктомия, трабекуло-стомия, трабекулоциклостомия
Примечание. Метод хирургического лечения особых форм глаукомы, имею-щих специфическую клинику (врожденная, гиперсекреторная и т. д.), определяют индивидуально.
Вряд ли можно сомневаться в том, что с накоплением наших знаний указанная схема будет расширяться и усложняться. Однако для широкой клинической практики она должна быть, наоборот, максимально упрощенной и ясной.
Применительно к задачам упрощенного дифференцированного подхода к хирургии глауком в условиях широкой клинической практики схема имеет следующий вид (табл. 8).
Техническое оснащение современной микрохирургии глауком
При выполнении современных антиглаукоматозных операций на микроструктурах глаза особенно важны микроиглы, иглодержатели, микропинцеты (хирургические — типа «колибри» и анатомические, которые служат также и шовными). В настоящее время вместо режущих инструментов обычного вида широко применяют 'бритвенные лезвия. Начинают использовать алмазные, рубиновые и подобные им режущие инструменты, которые не требуют заточки и позволяют получить идеально гладкую поверхность разреза. Отечественная промышленность выпускает наборы для проведения микрохирургических операций на глазах, которые вполне удовлетворяют современным требованиям. Конструкция современных гониотомов в основных чертах такая же, как инструмента, предложенного первоначально О. Barkan (1948). Существуют • канюлированные гониотомы, которые позволяют оперировать при заполнении передней камеры жидкостью.
U90
106. Оптическая часть операционного микроскопа (модель 310, фирма «КагЬ Zeiss-Jena», ГДР).
|Для проведения операций на венозном синусе склеры созданы специальные зонды, с помощью которых вскрывают его внутреннюю стенку при трабекулотомии. При выполнении циклодиализа и иридоциклоретракции используют специальные шпатели, иногда с миллиметровыми делениями; имеются также канюлированные шпатели для одновременного введения жидкости или воздуха в лереднюю камеру.
Применительно к потребностям глазной микрохирургии предложены разнообразные конструкции операционных микроскопов. Лучшие из них имеют ножное управление (фокусировка, степень увеличения, установка высоты), фокальное, щелевое и коаксиальное освещение, а также обеспечивают возможность одновременной фото- и киносъемки, телевизионной трансляции.
Микроскопы, используемые для операций на внутреннем ухе (в частности, отечественный микроскоп), неудобны для выполнения микрохирургических вмешательств при глаукоме, так как (применяющееся в них коаксиальное освещение способствует образованию большого количества рефлексов от роговицы и влажной-поверхности глазного яблока, что затрудняет оценку глубины : резкости. Добавление достаточно мощного бокового осветителя к
таким микроскопам позволяет использовать их для микрохирурги-• ческих операций на глазах. В отечественной практике нашли широкое применение операционные микроскопы, изготовляемые народным предприятием «Karl Zeiss-Jena», ГДР (например, модель 310, рис. 106).
191.»
Для выполнения большинства антиглаукоматозных операций достаточно фокального бокового освещения (мощность лампы не менее 30 Вт). Как правило, увеличение может быть не более 10-кратного. Препаровка же венозного синуса склеры требует, как правило, большего увеличения — в 20—40 раз.
Существенное значение при микрохирургических операциях имеет безукоризненная фиксация головы больного. Ее можно фиксировать в специальном углублении на подголовнике, сделанном, например, из пенопласта.
При выполнении хирургических операций под микроскопом хирург и ассистент находятся в положении сидя, поэтому необходимо применять низкие операционные столы. Поскольку поза больного при глазных операциях, как правило, одна и та же, вместо столов с успехом могут быть использованы операционные каталки современных конструкций (с устройством для изменения высоты и торможения каталки). При этом отпадает необходимость в перекладывании больного с операционного стола на каталку.
Анестезия. Местная анестезия в микрохирургии глауком считается методом выбора при обезболивании. Однако существует .ряд ситуаций, когда необходимо применение общей анестезии (или по крайней мере некоторых ее компонентов), в первую очередь в педиатрической практике (хирургическое лечение врожденных глауком), а также у взрослых, у которых местная анестезия либо нежелательна, либо неэффективна. Подготовку больных к анти-тлаукоматозной операции осуществляют по тем же правилам, как -и к любой плановой глазной операции.
Показания к операции при глаукоме, возможные осложнения
Статистика показывает, что при выполнении антиглаукоматоз-пой операции в ранние сроки получают хорошие ближайшие и отдаленные результаты, в большинстве случаев отмечается стабилизация зрительных функций. Преимущества ранних операций перед произведенными в поздние сроки аргументировал В. П. Филатов. Эта позиция нашла свое отражение и в официальном документе — решении Всесоюзной конференции по глаукоме (1952 г.).
При традиционных, особенно фистулизирующих, операциях процент осложнений сравнительно высок. Выдающемуся советскому клиницисту акад. М. И. Авербаху принадлежат известные слова о том, что оперировать глаукому, может быть, и плохо, но не оперировать — еще хуже. Относительная опасность операции была основным, если не единственным, возражением против ее применения.
При использовании новых, в частности микрохирургических, методов риск осложнений намного меньше. Вместе с тем 392
результаты многих исследований, произведенных в последние годы, позволили с высокой степенью достоверности утверждать, что только у 15—20% больных с глазной гипертензией, которым не производят операцию, развиваются патологические нарушения зрительных функций в связи с атрофическими изменениями в зрительном нерве. Возникшая в связи с этим проблема дифференциальной диагностики между глаукомой и глазной гипертензией — одна из наиболее важных и актуальных, однако применительно к клинической практике она еще далеко не решена. Так называемая толерантность зрительного нерва или индивидуальная норма внутриглазного давления в сущности разные названия одной и той же проблемы. Она осложняется еще и тем, что изменения в зрительном нерве могут просто сопутствовать глазной гипертензии как самостоятельное заболевание.
В идеале операцию надо делать тогда, когда появляются первые признаки нарушения питания зрительного нерва, несмотря на проведение оптимальной консервативной терапии (медикаментозная, лазерная). Однако па практике диагностика этих признаков, иинил/киш*, например, с помощью компьютерной периметрии, киантптатианой периметрии, в связи с определением микроскотом и т. д., не всегда возможна. Вследствие этого до настоящего времени для решения вопроса о том, нужна ли операция, приходится пользоваться весьма условными среднестатистическими показателями внутриглазного давления.
Нормой «тонометрического» внутриглазного давления принято считать величины до 26 мм рт. ст. при измерении его с помощью грузика массой 10 г. Для тонометра Гольдмана нормальным считают значения до 22 мм рт. ст., которые близки к так называемому истинному внутриглазному давлению. Вообще при использовании топометрии (даже апплапациоппой) и величины «тонометрического» внутриглазного давления, безусловно, возникают ошибки. Давно известно, что па величину «тонометрического» давления в большой степени влияет ригидность оболочек глаза, а значение этого фактора не всегда можно учесть с достаточной полнотой. Так, например, при миопии, некоторых заболеваниях щитовидной железы и т. д. «тонометрическое» давление может быть нормальным, в то время как истинное давление повышено и отмечается типичное для глаукомы нарушение зрительных функций.
Нет сомнения, что переход к измерению истинного (или близкого к нему) внутриглазного давления вместо «тонометрического» скажется положительно на диагностике и контроле за динамикой течения болезни. Это бУДет также шагом вперед к пониманию так называемой нормы внутриглазного давления. В то же время, например, при так называемой гиперсекреторной глаукоме (существование которой многие исследователи отвергают, но клиническая картина ее достаточно специфична) зрительные функции, как правило, очень долго стабилизированы. В связи с этим установление диагноза гиперсекреторной глаукомы большей частью позволяет избежать хирургического лечения.
|3 Руководство по глазной хирургии
193
Вопрос о целесообразности операции при далеко зашедшей глаукоме неоднократно вызывал острые споры. Мы склонны считать, что оперировать надо, учитывая серьезность прогноза; как правило, необходима интенсивная терапия, направленная на стабилизацию состояния зрительного нерва.
Несколько особняком стоит вопрос о показаниях к операции при глаукоме, протекающей по типу острых рецидивирующих атак. При этой форме болезни не редки случаи, когда больной отмечает рецидивирующие приступы затуманивания, образование радужных кругов и т. д., в то время как внутриглазное давление у него оказывается нормальным. Если систематическое закапывание миотиков не предотвращает возникновение атак, хотя бы чисто субъективно, то необходима операция (обычно базальная иридэктомия, при наличии соответствующего технического оснащения лучше лазерная иридэктомия).
При остром приступе глаукомы мы не считаем целесообразным выжидать более 48 ч из-за опасности развития органических нарушений в зрительно-нервном аппарате и в углу передней камеры (синехиальная облитерация).
В какой-то мере близок к этому и вопрос о так называемой профилактической иридэктомии на втором глазу, если на первом был острый приступ. Естественно, что предложение производить операцию на практически здоровом глазу психологически трудно как для больного, так и для хирурга. Однако статистические данные, как отечественые, так и зарубежные, с несомненностью показывают склонность к возникновению приступа и на другом глазу. Преимущества же операции, произведенной вне приступа, на спокойном глазу, не вызывают сомнений. В связи с этим мы широко пользуемся «профилактической» иридэктомией в том случае, если угол передней камеры на втором глазу резко сужен, и считаем ее оправданной. Еще более широкие возможности при практическом отсутствии риска осложнений дает лазерная иридэктомия или другие лазерные вмешательства.
Современные хирургические вмешательства при глаукоме намного безопаснее традиционных. Например, при использовании современных методов практически может быть исключено такое осложнение, как поздняя инфекция. Однако возможность некоторых отрицательных последствий все же остается, даже если операция прошла без осложнений. После вмешательства нередко изменяется рефракция. Слишком широкая или неправильно расположенная колобома, появляющаяся после иридэктомии, может вызвать светорассеяние. Антиглаукоматозное вмешательство часто ускоряет созревание катаракты у пожилых людей, у которых имеются изменения в хрусталике, особенно операции, сопровождающиеся фистулизацией или манипуляциями на ресничном теле (циклокоагуляция, циклодиализ и т. д.).
Все это необходимо учитывать, устанавливая показания к операции и выбирая оптимальный вариант ее выполнения.
194
Обследование и подготовка больного к операции
Топографоанатомическая характеристика зон антиглаукома-тозной хирургии. Антиглаукоматозные операции всех основных видов выполняют в области утла передней камеры, реже — в зоне ресничного тела. К углу передней камеры относится область между корнем радужки и внутренней поверхностью склеры до области лимба. Корень радужки чаще всего прикрепляется на расстоянии 1,5—1,75 мм от лимба.
Понятие о широком и узком угле передней камеры связано главным образом с величиной расстояния между прикорневой частью радужки и внутренней поверхностью стенки глазного яблока непосредственно за областью лимба (рис. 107). При смещении вперед радужно-хрусталиковой диафрагмы именно здесь воз и и кает блокада угла передней камеры, ведущая к нарушению оттока, Естественно, что ширина угла передней камеры обычно (инн и по всегда) тесно связана с глубиной передней камеры. < 1ц1'1111111П1 1 дубину передней каморы при биомикроскопии, напри игр срвнпшшя ее с толщиной оптического среза роговицы, можно ориентировочно судить о ширине угла даже без гониоско-П1П1
При блокаде угла передней камеры развиваются гониосинехии шип hi уже через 24 ч. Они соединяют прикорневую часть радужки с трабекулярной зоной или даже с областью кольца Швальбе. Распространенные гониосинехии могут в конце концов привести к полной облитерации угла передней камеры. Разделять плотные синехии в ходе операции, например иридоциклоретракции, следует очень осторожно, чтобы ио вызнать излишней травмы.
107. Угол передней камеры (схема). Объяснение в тексте.
13*
193
Во внутриутробном периоде развития угол передней камеры ваполнен рыхлой эмбриональной тканью, которая обычно рассасывается к моменту рождения. Нерассосавшаяся ткань может вызвать задержку оттока внутриглазной жидкости и врожденную глаукому, к этому же могут привести и другие аномалии, развивающиеся в эмбриональном периоде.
У корня радужки проходит кольцевая артерия. При отрыве радужки от ресничного тела возникает сильное кровотечение. Особую опасность представляет кровотечение при рубеозе радужки, развивающемся, например, на почве диабета или тромбоза центральной вены сетчатки.
Ресничное тело прикрепляется к склере в области склеральной шпоры, тотчас кзади от зоны фильтрации. Далее кзади имеется только очень рыхлая связь. Отделение ресничного тела от склеры позади склеральной шпоры (циклодиализ, иридоцикло-ретракция) не представляет труда.
Положение хрусталика также имеет значение для антиглау-коматозной операции. После иридэктомии и опорожнения передней и задней камер экватор хрусталика очень близко подходит к лимбу. Любое вхождение инструментом в переднюю камеру в зтих условиях очень опасно и может привести к повреждению хрусталика и развитию катаракты.
В норме между экватором хрусталика и отростками ресничного тела имеется узкая щель. При ряде обстоятельств (относительно большой хрусталик, отек отростков ресничного тела и т. д.) эта щель может закрыться, в результате чего возникает циклохрусталиковый блок, не всегда правильно диагностируемый.
Путь оттока жидкости из глаза начинается с трабекулярной зоны. При разработке операций на венозном синусе склеры необходимы знания топографии этой области. Венозный синус склеры расположен довольно глубоко. Слои склеры, остающиеся между ним и передней камерой, практически прозрачны, что иногда может вводить в заблуждение хирурга (впечатление вскрытия передней камеры!). Сам синус имеет вид щели, переднезадний разрез которой составляет около 0,25 мм; расстояние между внутренней и наружной стенками настолько мало (особенно, спереди), что при некоторых обстоятельствах они могут соприкасаться («коллапс» венозного синуса склеры). Положение венозного си-* нуса склеры по отношению к лимбу может варьировать в довольно широких пределах (переднее и заднее положение синуса). В связи с этим наиболее трудный и важный этап операции нэ венозном синусе склеры — точное определение локализации его просвета.
Предоперационное обследование. Выбор метода операции. Основная задача — определение места и характера ретенции. Как уже отмечалось, возможны два основных варианта: ангулярная ретенция (блокада угла передней камеры корнем радужки) и внутристеночная ретенция в путях оттока водянистой жидкости при открытом угле передней камеры. Значительно реже встреча
196
ется претрабекулярная ретенция — блокада доступа к путям оттока посторонней тканью. При достаточной квалификации врача он проводит дальнейшую дифференцировку в пределах каждой из этих групп. При ангулярной гипертензии — это дифференцировка между функциональной и синехиальной блокадой угла передней камеры, при претрабекулярной — выяснение характера ткани, закрывающей доступ к путям оттока, при внутристеночной гипертензии — решение вопроса о локализации поражения (трабекулярная, интрасклеральная, их комбинация).
Основные методы исследования при выборе способа операции — гониоскопия и определение суточных колебаний внутриглазного давления, меньшее значение имеет топография. Ведущее место в дифференциальной диагностике занимает гониоскопия. Во всех случаях ее необходимо проводить с максимальной тщательностью. От результатов гониоскопии в значительной мере зависит план дальнейшего обследования.
Так, при широком угле передней камеры существенное значение в диагностике гиперсекреторной глаукомы может иметь топографии. Как уже указывалось, существование гиперсекреторной глаукомы многие авторы подвергают сомнению. Речь идет о тех больных, у которых при повышенном внутриглазном давлении данные топографии (коэффициент С) по указывают на затруднение оттока. Справедливо отмечено, что такие показатели могут быть просто результатом ошибки самого метода тонографии. Как бы то ни было, при хороших тонографических показателях глаукоматозный процесс часто протекает своеобразно. Зрительные функции имеют склонность к стабилизации. Экскавация обычно долго не развивается. Если даже в действительности при этом и нет гиперпродукции внутриглазной жидкости, то специфика клинического течения этой формы болезни не вызывает сомнений. Таких больных часто можно и не оперировать. Этим определяется роль тонографии в выборе метода операции. Важную роль играет топография и в контроле за результатом хирургического вмешательства.
Значительные колебания величин тонографических показателей от одного исследования к другому позволяют думать о существенной роли функционального компонента в механизме ретенции. При узком угле передней камеры сушественное значение при выборе метода операции имеет решение вопроса о том, какой компонент является ведущим в блокаде угла передней камеры: функциональный или органический. Установить это позволяют гониоскопическая проба с корнеокомпрессией (проба Форбса) и определение характера суточных колебаний внутриглазного давления. Такова общая схема обследования при выборе оптимального метода операции. Ниже приведено краткое описание методик обследования и основных показателей.
Гониоскопия. Этот метод известен давно [Trantas S., 1898; Коерре Т., 1922]. Однако повсеместное распространение он получил только после того, как Goldmann Н. (1938) предложил ис-
197
108. Гониоскоп Ван-Бой-нингена (схема).
пользовать зеркальный гониоскоп. Гониоскопию стали проводить в процессе обычного исследования с помощью щелевой лампы. В настоящее время известно большое количество моделей гониоскопов. В Советском Союзе довольно широко применяется четырехзеркальный гониоскоп Ван-Бойнингена (рис. 108). Отечественной промышленностью серийно выпускается гониоскоп М. М. Краснова (рис. 109).
Техника гониоскопии с помощью современного зеркального гониоскопа проста. Контактную поверхность прибора приводят в соприкосновение с роговицей исследуемого глаза. В этой позиции гониоскоп удерживают рукой на протяжении всего исследования; наблюдение ведут через щелевую лампу.
Наш многолетний опыт свидетельствует об удобстве гониоскопов без гаптической части (вставляемой за веки). Пользование ими требует большого навыка, но он приобретается быстро. Гониоскопы такого типа часто описывают под названием «гониопризма». Удобна гониопризма автора, позволяющая видеть в од-
109. Гониоскоп Краснова.
193
ИО. Гопиопрпзма Краснова с двойным полем наблюдения.
И оГипий nu t. ii схема хода лучей.
пом поле зрении дни противоположных сектора угла передней камеры (см. рис. ПО).
Го11иос1со11ическио ориентиры и соответствующие им структуры угли передней камеры глаза представлены на рис. 107: корень радужки (4), передняя поверхность ресничного тела, склеральная шпора (3), трабекулярная зона (2) (с зоной венозного синуса склеры и ее пределах), так называемая вырезка, переднее кольцо Шпнльбе (1).
Угол может быть различным по ширине и профилю. Существует несколько систем для определения ширины угла. Всем им свойственна известная степень условности. На рис. 111 представлены основные варианты угла передней камеры по Ван-Бойнин-гену.
Угол широкий — видны все указанные выше образования.
Угол сродной ширины — видны указанные выше образования без передней части ресничного тела и склеральной шпоры, большая часть трабекулярной зоны открыта.
Угол узкий — большая часть трабекулярной зоны закрыта корнем радужки, но часть его доступна наблюдению.
Угол закрыт — корень радужки доходит до уровня переднего пограничного кольца Швальбе.
Закрытый угол передней камеры — всегда патология. Вместе с тем узкий угол передней камеры вполне может встречаться в норме.
Ширина угла передней камеры в какой-то мере конституционально обусловлена и зависит, например, от размера переднего отрезка глаза и величины хрусталика. Сам по себе узкий угол не обязательно свидетельствует о глаукоме, но его существование в значительной мере отражается на специфике и особенностях течения болезни. В то же время сужение угла может быть следствием патологического процесса («глаукома узкого угла»).
199
ill.
Варианты (а, б) ширины угла передней камеры (па Ван-Бойнингену).
Таким образом, без симптома глазной гипертензии, с помощью одной гониоскопии не всегда можно ответить на вопрос, является ли узкий угол передней камеры вариантом нормы, т. е. конституциональной особенностью, или симптомом болезни. В этих случаях надо обращать внимание в первую очередь на асимметрию ширины и профиля угла передней камеры на обоих глазах (конституциональный вариант строения обычно более или менее одинаков с той и с другой стороны). Необходимо всегда сравнивать между собой только одинаково расположенные участки угла (например, верхний с верхним и т. д.), так как, например, угол передней камеры вверху, как правило, уже, чем внизу.
Симптом пигментации угла передней камеры также имеет как диагностическое, так и патогенетическое значение. Однако бывает трудно определить грань между «нормальной» и «патологической» пигментацией, поскольку в норме степень ее выраженности варьирует в широчайших пределах. Асимметричность пигментации является определенным ориентиром. Склонность к блокаде угла передней камеры иногда удается выявить с помощью пробы Хейм-са. Измеряют внутриглазное давление одним из обычных методов. Затем больного укладывают на кушетку вниз лицом на 40— 45 мин, после чего снова проводят тонометрию. Повышение внут
200
риглазного давления более чем на 5 мм рт. ст. свидетельствует о склонности к блокаде угла передней каеры, т. е. в пользу диагноза узкоугольной глаукомы.
Важным признаком ангулярной глаукомы является наличие гониосинехий. Они имеют вид тончайших нитевидных перемычек между корнем радужки и трабекулярной зоной или даже кольцом Швальбе. Иногда о наличии синехий можно скорее догадываться по бугоркам на прикорневой части радужки и неровностям ее рельефа. Грубые спайки, особенно с отложениями пигмента,, характерны для вторичной глаукомы и чаще являются следствием воспалительного процесса. Начинающий офтальмолог иногда принимает за гониосинехии отростки радужки. Однако известное сходство между ними касается только их расположения. Даже поверхностное исследование структуры самих перемычек (ткань того же типа, как радужка) позволит избежать ошибки.
Гониоскопия также незаменима в диагностике пристеночной (претрабекулярной) ретенции. В некоторых случаях чужеродная ткань, закрывающая доступ к фильтрующей зоне, видна в гониоскоп. Зто могут быть частицы пигмента, эксфолиации передней капсулы хрусталика, новообразованные сосуды и мембраны при посттромботической глаукоме и рубеозе радужки. Претрабекуляр-ная гипертензия характерна (хотя и не всегда обязательна) для врожденной глаукомы, при которой доступ внутриглазной жидкости к путям оттока преграждается резидуальной тканью (рис. 112). Гониоскопически, однако, сама эта ткань может быть плохо различима, будучи тесно связана с радужкой. На первый план в этих случаях выступает симптом так называемого переднего прикрепления радужки, когда корень ее представляется резко выдвинутым вперед и закрывающим трабекулярную зону роговицы. Однако в отличие от ангулярной глаукомы радужнохрусталиковая диафрагма вперед по выбухает, профиль угла тупой. Более того, в связи с растяжением переднего отрезка отмечается противоположное явление — почти перпендикулярное отхождение радужки от стенки глаза.
Гониоскопическая проба с корнеокомпрессией (проба Форбса)' может быть проведена в рамках обычной гониоскопии. Необходим гониоскоп без гаптической части, например четырехгранная призма гониоскопа Ван-Бойнингена, гониопризма М. М. Краснова. Наблюдая за утлом передней камеры (обычно за верхним его сектором), довольно сильно надавливают гониоскопом на роговицу (рис. 113). Появляющиеся складки задней пограничной пластинки при еще более сильном давлении несколько разглаживаются и наблюдение за углом передней камеры становится возможным". Жидкость передней камеры при этом оттесняется к периферии и отдавливает прикорневую часть радужки назад. Если спайки выражены нерезко, то при отхождении корня радужки назад открывается большая часть фильтрующей зоны; если же спайки обширные, то экскурсия корня незначительна или отсутствует.
201
112. Угол передней камеры при врожденной глаукоме, а — гистологический срев; б — гониоскопическая картина.
Мы широко применяем пробу в клинической практике, и она овевалась весьма полезной.
Топография. Существуют различные методики тонографического исследования, отличающиеся как по используемому техническому оснащению, так и по способу расчета соответствующих показателей.
В настоящей главе будут описаны две наиболее широко применяемые методики: одна — с использованием электронного тонографа, вторая — так называемая упрощенная топография аппла-
113. Проба Форбса (схема). Объяснение в тексте.
национным тонометром Маклакова. Принцип методик одинаков (рис. 114).
Тонометр, поставленный на глаз, чисто механически вызывает повышение внутриглазного давления. В связи с этим начинается компенсаторный ускоренный отток внутриглазной жидкости и внутриглазное давление начинает постепенно снижаться (тонометр все это время находится на глазу).
Тонографическая формула расчета сопротивляемости оттоку камерной влаги (коэффициент С) имеет следующий вид:
V / мм3 \ •
(Ptcp — Ро—1,25)./ у мм рт. ст.-мин )’ (
где V — объем жидкости, вытесненной из глаза за время исследования (соответствует разнице между величиной внутриглазного давления в начале и в конце топографии и определяется по специальной таблице); Ptc₽ — тонометрическое давление, среднее между максимальным и минимальным в процессе топографии (в начале и в конце исследования); Ро — «истинное» внутриглазное давление (берут из соответствующих таблиц или вычисляют по
данным измерения внутриглазного давления тонометрами разной
массы); t — время исследования.
На практике, для того чтобы получить представление о способности к оттоку, используют также коэффициент Беккера:
Ро
КБ = —. (7)
В. норме его величина не превышает 100.
114. Методика расчета топографических показателей. Объяснение в тексте.
Внутриглазное давление, мм рт.ст.
203
По величине С и Ро легко рассчитать минутный объем внутриглазной жидкости: F (минутный объем) = С(Р0—Р), где Р — величина давления крови в эписклеральных венах; обычно его принимают равным 10 мм рт. ст. Эти же показатели позволяют судить и об уровне продукции внутриглазной жидкости. В самом деле, если в данный момент давление в глазу постоянно (не находится в процессе повышения или понижения), то величина притока должна быть равна величине оттока. Иными словами, F=C(P0—10). Нормальными считают значения F до 4— 4,5 мм3/мин.
Методика расчета тонографических показателей при так называемой упрощенной тонографии аналогична.
Исследование проводят следующим образом. Измеряют внутриглазное давление с помощью гирьки тонометра Маклакова массой 10—15 г; при наличии соответствующих таблиц можно выполнить одно измерение для обычной тонометрии, затем гирьку ставят второй (неокрашенно) площадкой вертикально на роговицу исследуемого глаза. Через 4 мин гирьку снимают, переворачивают и вновь измеряют внутриглазное давление.
Истинное внутриглазное давление может быть рассчитано графически (проводят прямую через точки, соответствующие результатам измерения с помощью 10—15-граммовых гирек) или по таблице.
Диагностическое значение тонографии, особенно для раннего выявления глаукомы, в прошлом нередко преувеличивали. В то же время эффективность ее использования при выборе метода лечения и для контроля за течением болезни иногда недооценивают. При тонографии, несомненно допускаются принципиальные погрешности; так, например, ткань роговицы в окружности зоны контакта с инструментом как бы оттесняется в стороны, в результате чего может произойти сдавление путей оттока внутриглазной жидкости. Автором [Краснов М. М., 1982] разработан метод так называемой конвекс-тонографии, позволяющий избежать этой ошибки измерения. Дальнейшие исследования, по-видимому, позволят сделать способ еще более точным.
। Исследование суточной кривой внутриглазного давления может иметь очень важное значение в выборе метода операции. При узком угле передней камеры приходится выбирать между операцией по устранению функциональной блокады (иридэктомия) и операцией, направленной на ликвидацию синехиальной блокады (иридоциклоретракция). Первая менее травматична, и при прочих равных условиях ей следует отдавать предпочтение.
Смысл исследования суточной кривой в данном случае состоит в том, чтобы выявлять минимальные значения величин внутриглазного давления за все время проведения контроля. Если они находятся на уровне нормальных, то можно рассчитывать на удовлетворительный эффект иридэктомии; если же эти значения выше 26—28 мм рт. ст., то можно думать о выраженном органическом (синехиальном) компоненте в механизме блокады угла
204
вередней камеры. В этом случае выполнения иридэктомии обычно недостаточно; методом выбора является иридоциклоретракция. • Подготовка больного к операции. Принципы подготовки больных к антиглаукоматозной операции в общем не отличаются от обычных; в ряде отношений они менее строги, чем, например, при экстракции катаракты.
Обследование включает проведение обычных анализов, терапевтический контроль, чтобы исключить общие противопоказания, санацию полости рта; в ряде случаев целесообразна рентгенография корней зубов для исключения прикорневых гранулем.
Постельный режим после антиглаукоматозных операций может быть не очень строгим: больному, как правило, разрешают подниматься с кровати в день проведения операции.
Цель общей медикаментозной терапии в рамках подготовки к вмешательству—прежде всего уменьшить нервно-психический стресс, связанный с операцией. Важно обеспечить хороший сон перед операцией, если необходимо, с помощью снотворных. За 7-10 дней до операции следует отменить все антихолинэстераз-П14П многими (физостигмин, прозерин, фосфакол и т. д.); на их фоно склонность к иридоциклитам выражена значительно больше. Следует также учитывать, что кортикостероиды, назначаемые местно (особенно такие, как дексаметазон, преднизолон) могут привести к повышению внутриглазного давления, особенно в послеоперационном периоде при нефистулизирующих вмешательствах.
Большинство описанных ниже операций не требует широкого вскрытия глазного яблока, не сопровождается опорожнением передней камеры, манипуляции в передней камере при некоторых из пих минимальны. В связи с этим для бактериологического контроля достаточно мазка с конъюнктивы. По возможности следует сделать посев, поскольку это позволяет при обнаружении патологической флоры определить ее чувствительность и выбрать иаиболее активный препарат для последующего лечения.
Патогенность бактериальной флоры оценивают по результатам посева. Если высеяна особо вирулентная флора (пневмококк и др.), то необходимо получить два чистых посева. Непосредственно перед операцией конъюнктивальную полость несколько раз промывают изотоническим раствором хлорида натрия и закапывают в нее раствор антисептического средства.
В связи с тем что большинство новых антиглаукоматозных операций выполняют без опорожнения передней камеры, в глубоком потенцировании нет необходимости. Примерную схему медикаментозной подготовки см. в разделе «Анестезия» (глава 1). Целесообразно принять внутрь глицерин (из расчета 1,5 г на 1 кг массы), разбавленный равным количеством фруктового сока. Кожу век и соответствующей половины лица обрабатывают йод-слицерином (3%). При отсутствии каких-либо специальных показаний антибиотики не назначают ни накануне операции, ни в «день ев выполнения.
205
После большинства операций следует стремиться к тому, чтобы зрачок был несколько расширен (до 5—6 мм). Более конкретно соответствующие рекомендации изложены при описании отдельных операций.
Система дифференцированной хирургии глауком
Выбор метода при упрощенной системе дифференцированной хирургии глауком основывается на одном основном показателе — величине угла передней камеры (широкий — средней ширины или узкий — закрытый). Из дифференциально-диагностических методик применяют гониоскопию, топографию, при узком угле — гониоскопическую пробу с корнеокомпрессией (проба Форбса) определение суточной кривой внутриглазного давления. Выбор метода при узком угле передней камеры зависит главным образом от степени выраженности синехиального компонента.
Преобладание функционального характера блокады определяет выбор иридэктомии, органического — иридоциклоретракции. Для их дифференциации очень полезна гониоскопическая проба с корнеокомпрессией (проба Форбса). Если внутриглазное давление хотя бы периодически снижается до нормальных цифр (даже в условиях лечения миотиками), то имеются основания рассчитывать на удовлетворительный эффект иридэктомии.
При глаукоме с функциональной блокадой угла передней камеры показана базальная иридэктомия (рис. 115), с синехиальной
115. Иридэктомия.
а — До операции; б — после операции — устранение относительного зрачкового блока. Стрелками указано направление тока внутриглазной жидкости.
206
блокадой угла передней камеры — иридоциклоретракция (возможно, в комбинации с иридэктомией), при сопутствующем поражении трабекулярной зоны — комбинация иридэктомии (одномоментная или последовательная) с трабекулотомией или трабекул-вктомией.
Б момент острого приступа обычно трудно провести указанные пробы. В этом случае назначают необходимую медикаментозную терапию (миотики, ингибиторы угольной ангидразы, глицерол и отвлекающие методы и т. д.). При отсутствии положительной динамики в течение 48 ч показана базальная иридэктомия. С ее помощью, как правило, удается купировать приступ. В случае рецидива гипертензии (обычно, из-за синехиальной блокады угла) производят операцию второго этапа; выбор ее определяется рассмотренными выше установками.
При угле передней камеры средней ширины или широком в настоящее время большинство хирургов предпочитают трабекул-эктомию или схожие методы (трабекулостомия, трабекулоцикло-стомия); можно произвести несколько более сложную по технике синусотрабекулотомию.
При широком угле передней камеры желательно выполнить топографию для исключения «гиперсекреторной» глаукомы. Выявление этой редко встречающейся формы обычно позволяет обойтись без операции. При узком угле передней камеры тонографические показатели практически мало влияют на выбор метода. Гиперсекреция в этом случае выявляется редко и может быть просто ошибкой метода, так как при функциональной блокаде угла передней камеры способность к оттоку нередко изменяется в широких пределах. Наибольшие трудности вызывает дифференциальная диагностика «трабекулярной» и «интрасклеральной» ретенции, тем более что они, по-видимому, часто встречаются в сочетании (в частности, при так называемом коллапсе венозного синуса склеры). Па практике при открытом угле передней камеры большинство офтальмологов не идут дальше диагноза «простая открытоугольпая глаукома». В этом случае предпочтение следует отдавать комбинированной трабекулярно-интрасклераль-ной хирургии (трабекулэктомия и схожие методы).
Практически почти все современные операции (синусотомия, трабекулотомия, трабекулэктомия) улучшают отток как через внутреннюю, так и через наружную стенку венозного синуса склеры, это было убедительно показано, например, в исследованиях W. М. Gijant.
В таком виде система вполне доступна рядовому специалисту. Освоив технику только двух новых операций (иридоциклоретракция и трабекулэктомия), хирург получает реальную возможность осуществлять патогенетически ориентированное воздействие (хотя бы в приближенном варианте) у большинства больных глаукомой (более 90%). При этом необходим минимум диагностических навыков.
Такой подход имеет принципиальные преимущества перед ме
207
тодами традиционной хирургии. При выполнении вмешательства все-таки учитывают (пусть не совсем полно) главные особенности патогенеза глазной гипертензии. Глазу наносится значительно меньшая хирургическая травма, меньше риск развития осложнений и лучше послеоперационная гидродинамика.
Кроме того, использование даже упрощенной («приближеннодифференцированной») системы хирургического лечения глаукомы подготовит почву для дальнейшего перехода к более детализированной, полной системе патогенетически ориентированной хирургии.
Следует отметить, что у некоторых больных, несмотря на достаточно широкий угол передней камеры, в нем имеются элементы синехизации. В этих случаях целесообразнее производить трабекулостомию и трабекулоциклостомию, которые можно назвать вариантами трабекулэктомии с внутренним транспонированием склеральной ножки.
Патогенетически ориентированная
микрохирургия глауком
Основные требования к выбору патогенетически ориентированной операции при глаукоме суммированы в соответствующей таблице (см. табл. 6). Дополнения к упрощенной системе дифференцированной хирургии состоят в: выделении претрабекулярной формы; разграничении интрасклеральной и трабекулярной форм при глаукоме с широким углом передней камеры; обособлении в отдельную категорию комбинированных форм глазной гипертензии (подлежащих комбинированным операциям). Каждой из этих категорий соответствуют определенные операции (гониотомия, трабекулотомия, синусотомия и т. д.), не входящие в систему дифференцированной хирургии.
Принципы патогенетически ориентированной микрохирургии глаукомы, характеризующиеся стремлением направить хирургическое воздействие на конкретное звено в цепи нарушений, ведущих к повышению внутриглазного давления, изложены в начальных разделах настоящей главы.
Операции при ангулярной гипертензии
Иридэктомия. Выбор метода. Классическим местом для выполнения иридэктомии считают меридиан 12 часов. В настоящее время область 12 часов часто оставляют для сопутствующих операций, необходимость в которых может возникнуть позже.
Мы обычно производим антиглаукоматозную иридэктомию в. верхневнутреннем квадранте (соответственно l’/г и Ю'/г часам для правого и левого глаза); это место удобно также и с точки зрения минимального светорассеяния в будущем.
208
Иридэктомия относится к малотравматичным операциям, для ее осуществления не требуется какая-либо специальная обща» подготовка, помимо указанной выше. Внутрь назначают глицерин, чтобы уменьшить вероятность возникновения гипертензии после вскрытия передней камеры или по крайней мере уменьшить-степень ее выраженности. Надо помнить об общих противопоказаниях к применению глицерина (диабет, заболевания почек,, внутричерепные спайки и т. д.).
Для иммобилизации глазного яблока обычно приходится накладывать шов на верхнюю прямую мышцу. Сопутствующей этому инъекции 2% раствора новокаина или 1—2% раствора лидокаина (0,5—1 мл) обычно вполне достаточно для проведения всей операции. При обратном выведении инъекционной иглы несколько капель анестезирующего раствора вводят под конъюнктиву; это целесообразно делать в тех случаях, когда планируется образование конъюнктивального лоскута. Перед отсечением радужки можно капнуть на нее одну каплю 0,5% или 1% раствора дикаина.
У спокойных больных мы иногда производим иридэктомию просто под инстилляционной анестезией дикаином. Лучший вариант этого метода [Бохон Н. Н., 1970] заключается в прикладывании ватного тампона, смоченного 2—4% раствором дикаина, к поверхности глаза в местах будущего разреза (не на роговицу!) и проведении уздечного шва.
Техника иридэктомии может варьировать в зависимости от: 1) проведения разреза ad interno или ab extemo; 2) характера режущего инструмента; 3) метода отсечения радужки.
Разрез ad interno с помощью ножа Грефе производят в принципе так же, как и при экстракции катаракты, но на небольшом протяжении (3—4 мм). Он может быть произведен с конъюнктивальным лоскутом или беи пего. В связи с его сложностью по сравнению с методами ab oxterno способ в настоящее время практически оставлен.
Методы ab extemo характеризуются постепенным углублением разреза от поверхностных слоев до вскрытия передней камеры; в дальнейшем разрез расширяют, начиная с этой точки ткани роговицы.
В хирургии прошлых лет для проведения разреза ab externo широко использовали обычный нож Грефе, поставленный касательно к поверхности глазного яблока. Его движения подобны движению смычка. После того как вскрывали переднюю камеру (обычно в центре), разрез расширяли в ту или другую сторону концом того же ножа, но уже изнутри кнаружи (спинка обращена к передней камере). «Пилящий» характер движений, их последовательное «наслаивание» способствовали образованию сравнительно рыхлого фильтрующего рубца, поэтому с точки зрения патогенетической направленности воздействия (когда хирург умышленно стремится избежать фистулизации) метод малоцелесообразен.
14 Руководство по глазной хирургии 20^
Разрез ab externo концом копьевидного ножа популяризировал Elschnig. Конец инструмента ставят перпендикулярно к поверхности склеры и производят движения им, как ножом Грефе. Достоинство способа в том, что наружный размер раны получается почти таким же, как внутренний.
Копьевидный нож можно использовать также для проведения «косого» разреза (параллельно плоскости радужки), как при экстракции катаракты. Края разреза при этом гладкие, но его наружный размер значительно больше, чем вход в переднюю камеру.
В современной хирургии заслуженное распространение получило вскрытие передней камеры концом осколка бритвенного лезвия. Его техника в сущности аналогична таковой при способе Злыпнига. Расширить разрез от места вскрытия передней камеры можно либо тем же осколком, перевернутым режущей кромкой кнаружи, либо тонкими роговичными ножницами с затупленными концами. Усовершенствованием того же метода является использование инструментов с алмазным или рубиновым лезвием.
В прошлом подчеркивалась целесообразность выполнения как можно более широкой иридэктомии. В связи с этим популярной была иридэктомия в два приема, когда отсечение производили при последовательном вытягивании радужки сначала в один, затем в другой угол разреза. Больший гипотензивный эффект мог быть связан с большей величиной разреза в стенке глаза. С точки зрения современных представлений, в применении такого метода нет необходимости. Позиция ирис-ножниц в момент отсечения радужки имеет значение в отношении формы последующей колобомы. Положение бранш параллельно лимбу способствует образованию более широкого дефекта, перпендикулярное положение — более узкому.
В настоящее время многие хирурги практикуют роговичный разрез, к достоинствам которого относится отсутствие кровотечения. Мы, как правило, делаем операцию с конъюнктивальным лоскутом, принимая во внимание лучшее заживление разреза.
Рекомендуемая техника операции. Делают разрез конъюнктивы длиной 5 мм в верхневнутреннем квадранте на расстоянии 3 мм от лимба. Отсепаровывают конъюнктиву от лимба. Нами был апробирован также радиальный разрез конъюнктивы (для уменьшения тенденции к рубцеванию), однако заметной разницы в течении послеоперационного периода и исходах не отмечено.
Закономерно стремление найти способ определения позиции корня радужки в каждом конкретном случае. Практическое значение имеет методика подсвечивания. Конец диафаноскопа приставляют к нижней части лимба (в некоторых вариантах к середине роговицы). В результате рассеивания света в передней камере вокруг роговицы появляется розовый поясок просвечивающей склеры. Он особенно хорошо заметен под операционным микроскопом. Граница этой просвечивающей зоны соответствует положению корня радужки.
210
116. Разрез ab externo при иридэктомии лезвием ножа или осколком бритвенного лезвия (схема).
Как показывает опыт, метод имеет известную практическую ценность, но, к сожалению, граница между просвечивающей и темной зоной несколько расплывчата. Па практике положение корня радужки чаще всего определяют па глаз.
Разрез должен находиться па расстоянии 0,5 мм кпереди от этой воображаемой границы. Лезвие располагают перпендикулярно к поверхности глаза. Движения должны быть параллельны лимбу с постепенным углублением (рис. 116). До вхождения в переднюю камеру целесообразно провести окончательный гемостаз с помощью поверхностной каутеризации. О вхождении в переднюю камеру свидетельствует истечение камерной влаги; из точки вкола рану расширяют до 3 мм движениями лезвия к себе. При точном положении разреза в этот момент обычно выпадает радужка. Если этого не происходит, то выпадение обычно легко спровоцировать давлением на склеральную губу раны. Если радужка все же не выпадает, то приходится извлекать ее пинцетом. Это необходимо сделать с максимальной осторожностью во избежание травмирования хрусталика. Известно оригинальное предложение об извлечении радужки с помощью шприца с тупоконечной канюлей, которую вводят в разрез. Аспирация шприцем ведет к «присасыванию» радужки к концу канюли.
Выпавшую радужку захватывают пинцетом по возможности ближе к задней губе разреза. Если выпала слишком большая часть радужки, можно умышленно выпустить небольшое количество камерной влаги. Радужку обычно отсекают параллельно лимбу: бранши роговичных ножниц должны быть плотно прижаты к склере.
Сравнительно часто тотчас после иридэктомии отмечается состояние гипертензии глазного яблока. Пытаться форсированно заправить радужку на место в этот момент нерационально. Гипертензия чаще всего объясняется тем, что смещенная к месту
14*
211!
разреза радужка тампонирует рану и угол передней камеры, в результате чего жидкость скапливается в задней камере, как в «западне». Необходимо слегка надавить на склеральную губу разреза, что ведет к истечению внутриглазной жидкости. В состоянии гипотонии радужка вправляется самостоятельно или при легком поглаживании по роговице. Состояние гипотонии может быть скоропроходящим, и с репозицией радужки медлить не следует. Если снова возникла гипертензия, то необходимо давлением на склеральную губу опять выпустить часть камерной влаги, добиваясь гипотонии.
В то же время надо помнить, что неоднократное (и особенно -неделикатное) выполнение этого маневра может привести к отеку отростков ресничного тела и появлению признаков хрусталикового блока. Это легко распознать по тому, что гипертензию не удается снять нажимом на склеральную губу и жидкость из глаза не выходит.
Часто можно наблюдать, что после заправления радужки передняя камера углубляется, несмотря на существование разреза в стенке глазного яблока; это — самое верное свидетельство устранения зрачкового блока.
В большинстве случаев необходимости в наложении корнеосклерального шва нет; если камера опорожнилась и не восстанавливается, то конъюнктиву зашивают непрерывным швом. В конъюнктивальный мешок закапывают 30% раствор сульфацил-натрия. Введение антибиотика под конъюнктиву не обязательно, но часто практикуется. Накладывают монокулярную повязку.
Осложнения. Серьезные осложнения в ходе выполнения иридэктомии и после нее возникают редко. При проведении разреза копьевидным ножом может быть выбрано ошибочное направление вкола, что приводит к серьезным последствиям (ранение ресничного тела, хрусталика). При возникновении кровотечения сразу после иссечения радужки надо надавить на глазное яблоко ватным тампоном, стараясь одновременно «вымассировать» кровь через рану. Наружная компрессия вызывает повышение давления в полости глаза, что является довольно эффективным способом остановки кровотечений из радужки и ресничного тела (разумеется, при небольшом разрезе в стенке глаза). Давление на глаз необходимо осуществлять в течение минуты. Целесообразно попытаться ввести воздух в переднюю камеру для вытеснения из нее крови (конец инъекционной канюли не должен заходить в область колобомы радужки). Если кровь вывести не удалось и в передней камере образовались свертки, то не следует пытаться их извлечь. В течение ближайших несколько суток кровь разжижается, и тогда становится ясна дальнейшая тактика: консервативное лечение или дополнительное выведение крови.
Упорная гипертензия по завершении иридэктомии при мелкой передней камере (иногда невозможно заправить радужку) свидетельствует о возможности образования циклохрусталикового блока. При исследовании под операционным микроскопом или с по
212
мощью щелевой лампы этот диагноз может быть подтвержден: через колобому видно, что экватор хрусталика прилегает к ресничным отросткам. В этом случае лучше начать с введения глицерина и мочевины внутрь, местно — капли атропина.
Необходимо отметить, что перечисленные осложнения способствуют образованию гониосинехий, что может свести на нет эффект, полученный от иридэктомии. Именно поэтому — с целью предотвратить развитие осложнений — даже такую несложную операцию, как иридэктомия, необходимо производить деликатно и предпочтительно под операционным микроскопом.
Воспалительные и тем более инфекционные процессы после иридэктомии развиваются редко, раздражение глаза, как правило, умеренное и быстро устраняется с помощью обычной терапии.
Ведение послеоперационного периода. Больной может подниматься с постели на следующий день после операции. Необходимо остерегаться неосторожных прикосновений к глазу, особенно в течение первых 2 нед. Шов с конъюнктивы удаляют на 7—10-й день. Если был наложен корнеосклеральный <пов, то его лучше снять не позже 7-го дня.
Целесообразно избегать назначения как мидриатиков, так и миотиков, особенно антихолинэстеразного профиля (физостигмин, врозерпн, фосфакол и т. д.). Воспалительные явления обычно легко купируются с помощью применяемых местно стероидных препаратов (кортизон, гидрокортизон, преднизолон и др.). При подозрении на развитие задних синехий попеременное расширение и сужение зрачка целесообразнее постоянного назначения мидриатиков.
В случае образования плохо рассасывающейся гифемы, особен-no если она достигает области зрачка, целесообразно удалить ее из передней камеры. Для этого обычно вполне достаточно слегка раздпинуть края операционного разреза.
Иридоциклоретракция. Практически невозможно отделить корень радужки от стенки глазного яблока без отделения также передней части ресничного тела. Оно очень слабо связано с внутренней поверхностью склеральной капсулы и, за исключением области склеральной шпоры, легко от нее отделяется шпателем, как например, при циклодиализе. Отделение склеральной Шпоры следует производить с осторожностью. При травматизации увеальной ткани или отрыве корня радужки нередко возникает сильное кровотечение.
Постоянное оттеснение корня радужки от фильтрующей зоны В каком-то секторе утла передней камеры требует введения по крайней мере двух имплантатов по краям этого сектора — так называемая двухточечная иридоциклоретракция (рис. 117).
При резко выраженном смещении радужно-хрусталиковой диафрагмы (обычно из-за передней позиции хрусталика) иногда необходимо ввести третий имплантат в середине — «трехточечная» иридоциклоретракция (рис. 118). Как правило, операцию производят в верхнем секторе глаза. Выполнять ее в нижнем секторе
213
117. Иридоциклоретракция (схема).
Черные полосы — верхняя прямая мышца, линии, параллельные лимбу, — зона от» крытого доступа к углу передней камеры.
118. Трехточечная иридоциклоретракция (схема).
менее целесообразно, так как кровь, скапливаясь внизу, способствует облитерации образованной щели. Противопоказаны также манипуляции в горизонтальных меридианах из-за опасности повреждения проходящих здесь крупных сосудистых стволов.
Подготовка к операции. Анестезия. Отделение ресничного тела может быть болезненной процедурой; в связи с этим показано введение 1% раствора димедрола (1 мл) и 2% раствора промедола (1 мл) перед операцией. Не исключена возможность возникновения кровотечения в переднюю камеру в ходе операции, поэтому целесообразно вводить дицинон с профилактической целью, начиная со дня, предшествующего операции. Инъекция дицинона может быть эффективной даже в ходе операции и способствовать остановке начавшегося кровотечения. Местная анестезия — инъекция 4 мл 2% раствора новокаина: ретробуль-барно — 2 мл, под верхнюю прямую мышцу — 1,5 мл и под конъюнктиву в секторе, где делают операцию, — 0,5 мл.
Основные варианты хирургической техники. В качестве распорок в углу передней камеры служат лоскутные имплантаты из поверхностных слоев склеры.
Имплантируемые в угол передней камеры язычки из поверхностных слоев склеры могут быть направлены как в сторону лимба, так и в сторону экватора; основание ножек в том и другом случае находится на расстоянии 3—4 мм от лимба. Мы больший-
214
119. Обозначения те же, что и на рис. 118. Техника иридоциклоретракции. Объяснение в тексте.
ство операций выполнили вторым способом, первый способ особенно удобен при сочетании с трабекулотомией.
Отделение ресничного тела и корня радужки от склеры шпателем можно производить в направлении от экватора к лимбу (как при циклодиализе по Блашковичу) и в обратном направлении (как при циклодиализе пе Гейне). Второй способ, по нашим данным, предпочтительнее.
Рекомендуемая техника. Этапы операции представлены па рис. 119. Разрез конъюнктивы производят концентрично лимбу на расстоянии 7—8 мм от него, обычно сверху (на 11 — 1 часу). Верхнюю прямую мышцу можно захватить зажимом Пеана, что способствует уменьшению притока крови по мышечным артериальным веточкам к зоне выполнения операции.
По обе стороны от мышцы вплотную к ее краям в склере намечают несквозными разрезами (на 2/з толщины) два участка в форме буквы П с перекладиной, обращенной в сторону экватора. Расстояние между продольными надрезами 2 мм, длина их 3,5— 4 мм, концы разрезов отстоят от лимба на 3—4 мм. Надрезы хорошо делать по контуру специального шпателя с миллиметровыми делениями, прижатого к склере. Если операцию планируется производить где-либо между мышцами, то основания язычков должны отстоять друг от друга не более чем на 5 мм. Ограниченные таким образом язычки отсепаровывают расслоением склеры, начиная сзади, как при послойной пересадке роговицы.
По передней границе расслоения (у основания язычков) делают сквозные разрезы через остающиеся слои склеры, т. е. в 3—4 мм от лимба параллельно ему. Производят тщательный
215
120. Х-образная иридоциклоретракция по Шныревой.
121. Y-образная иридэктомия по Шмыревой.
гемостаз. При обратном направлении язычков их концы «смотрят» вперед, выкраивание следует осуществлять от лимба к экватору на длину 3,5—4 мм.
Ряд технических модификаций иридоциклоретракции предложен В. Ф. Шмыревой (рис. 120, 121) и успешно апробирован на большом клиническом материале (1975—1984 гг.). Ей же описаны рациональные варианты техники комбинированных операций иридоциклоретракции с трабекулотомией и трабекулэкто-мией.
Шпатель проводят поочередно через разрезы вперед до появления его конца в передней камере. Обычно хорошо ощущается некоторое препятствие при отслоении в области склеральной шпоры и гониосинехий. Форсировать продвижение шпателя вперед в этот момент не следует, лучше делать это легкими покачивающими движениями. Шпатель должен быть все время прижат к склере изнутри, но чрезмерное усилие может привести к повреждению эндотелия или даже отслоению задней пограничной пластинки (как это может быть и при циклодиализе).
После введения шпателя в переднюю камеру ресничное тело в зоне между язычками отслаивают движениями от зрачка. Мы предпочитаем делать это дважды в той же зоне — сначала из одного, потом из другого разреза. Кнаружи от язычков ресничное тело не отслаивают. Особое внимание необходимо уделить предотвращению кровотечения в переднюю камеру, особенно в момент отслоения ресничного тела (и в первый, и во второй раз) и тотчас после него. Это достигается давлением на глазное яблоко в течение 1 мин с помощью ватного тампона (до состояния выраженной гипертензии глаза) сразу после извлечения шпателя. Как правило, этого бывает достаточно. Если кровь все же начинает появляться в передней камере, то целесообразно быстро вытеснить ее воздухом; применяемый с этой целью шприц с тупоконечной канюлей должен быть наготове. Промывание дает в этот момент худшие результаты.
216
Самым ответственным этапом операции является заправление склеральных язычков в угол передней камеры. Наилучшим является следующий способ. Тонкую круглую хирургическую иглу зажимают В иглодержатель. Конец иглы распрямляют на расстоянии 5—7 мм. Иглой слегка накалывают склеральный язычок у его конца и проводят в склерохориоидальное пространство к углу передней камеры. При осторожном извлечении иглы конец ее выскальзывает из ткани имплантата, который остается на месте. Склеральные
122. Комбинация иридоциклоретракции с иридэктомией (схема).
ножки легко подправить тонким шпателем. Их концы должны выступать за корень радужки (практически доходить до лимба). После этого удаляют зажим с
Верхней прямой мышцы.
В заключение операции переднюю камеру заполняют воздухом, который во избежание воздушного блока не должен полностью закрывать область зрачка. Разрез конъюнктивы зашивают непрерывным швом. Делают инъекцию раствора антибиотиков под конъюнктиву глазного яблока. Накладывают монокулярную
повязку.
Как уже упоминалось, в отдельных случаях показана иридо-циклоретракция с тремя имплантатами («трехточечный» вариант). Ход операции при этом не меняется. Третью ножку формируют между двумя первыми. Обычно ее задняя граница (перекладина буквы П) приходится как раз на место прикрепления мышцы.
Иридоциклоретракцию можно также комбинировать с иридэктомией. В этих случаях последнюю лучше делать за пределами зоны ретракции (обычно медиальпее). При этом сохраняется действие сфинктера зрачка на прикорневую часть радужки, оттягивающее ее от фильтрационной зоны (рис. 122). Гониоскопическая картина после успешной иридоциклоретракции представлена на рис. 123 и 124.
Осложнения. При иридоциклоретракции могут развиваться примерно такие же осложнения, что и при циклодиализе. Ряд из них (отрыв корня радужки, перфорация ресничного тела, отслоение задней пограничной пластинки) является следствием грубого нарушения хирургической техники, что определяет пути их профилактики.
На двух осложнениях — иридоциклитах и кровоизлияниях — следует остановиться подробнее. Иридоциклиты, возникающие после иридоциклоретракции (как и после циклодиализа), обычно протекают легко, но субклинические признаки воспаления (в частности, появление спаек) иногда отмечаются в течение долгого времени (месяцы). Лечение этого осложнения не представляет
217
123. Гониоскопическая картина после иридоциклоретракции (схема).
особых трудностей, однако обязательным условием является своевременное его проведение.
Необходим систематический биомикроскопический контроль для распознавания тенденции к образованию задних спаек. Их, как правило, удается легко разорвать, однако необходимо помнить, что мидриаз может привести к закрытию созданной щели в углу передней камеры. В связи с этим предпочтительнее гибкий (ситуационный) медикаментозный режим; после разрыва спаек целесообразно восстановить величину зрачка около 5—6 мм.
Кровоизлияние в переднюю камеру при иридоциклоретракции весьма нежелательно, поскольку оно способствует развитию слипчивых процессов как в углу передней камеры, так и в области зрачка (вплоть до образования на передней поверхности хрусталика тонкой фибринной пленки). Наиболее эффективной мерой профилактики кровотечения является сохранение достаточно высокого внутриглазного давления на протяжении всей операции. Если же кровь все же остается в передней камере к концу операции или появляется после нее, то этому следует уделить самое пристальное внимание.
Hl
124.
Угол передней камеры после иридоциклоретракции.
218
Необходимо также иметь в виду, что если в хрусталике имеется катарактальные изменения, то после иридоциклоретракции (как и после циклодиализа) они могут прогрессировать.
Ведение послеоперационного периода. В связи <С известной склонностью к возникновению гифем после иридоциклоретракции целесообразно соблюдать ограниченный постель-ный режим; в течение первых дней больной получает соответствующую «профилактическую» терапию (аскорбиновая кислота, дицинон и т. д.). Шов с конъюнктивы удаляют на 7—10-й день. При появлении гифемы применяют активную рассасывающую терапию (химотрипсин, лекозим, папаин, кислород под конъюнктиву, лидаза внутримышечно и под конъюнктиву, аутогемотерапия и др.). При больших гифемах без признаков положительной динамики показана эвакуация крови через парацентез роговицы примерно на 7—10-й день после операции.
Для того чтобы свести к минимуму воспалительную реакцию, целесообразно в ранние сроки после операции (начиная со дня ее выполнения) назначать стероидные гормоны (кортизон, гидрокортизон, преднизолон, дексаметазон) местно (3—4 раза в день до стихания явлений воспаления). В случае недостаточной эффективности стероидных препаратов их назначают внутрь. Могут быть показаны и неспецифические противовоспалительные средства (ацетилсалициловая кислота, бутадион, индометацин), которые способны в той или иной мере ингибировать синтез простагландинов. В литературе появились первые сообщения об успешном использовании препаратов такого рода местно (капли, мази). При наличии тенденции к формированию задних спаек следует проводить местную терапию стероидными препаратами в небольших дозах в течение продолжительного времени — до нескольких месяцев.
В заключении раздела о хирургии узкоугольной глаукомы следует еще раз указать, что иридоциклоретракция является уникальным (по сути дела, единственным известным) методом оперативного лечения синехиальной облитерации угла передней камеры. Вместе с тем при одновременном поражении других зон фильтрации необходимо использовать рациональное сочетание ее с другими методами. Противопоказанием к иридоциклоретракции является образование спаек угла передней камеры на фоне увеального воспалительного процесса.
Операции при Претрабекулярной гипертензии
Гониотомия. Группа глауком с претрабекулярной гипертензией не столь многочисленна, как остальные патогенетические группы, рассмотренные в данной главе. Границы этой группы также менее четко очерчены, так как в нее входят нозологические формы, совершенно различные по происхождению: некоторые виды врожденной глаукомы, глаукома, развивающаяся после введения химотрипсина в переднюю камеру, так называемые пигментная
219
и капсулярная глаукомы, глаукома, возникающая после тромбоза центральной вены сетчатки, глаукома при неоваекуляризации радужки и угла передней камеры и т. д. Прогноз при этих заболеваниях различен: тяжелый при диабетическом рубеозе и после тромбоза центральной вены, удовлетворительный при большинстве других форм.
Тем не менее выделение этой группы вполне обоснованно, так как все входящие в нее формы имеют одну общую и очень важную патогенетическую особенность — пристеночное (претрабеку-лярное) препятствие прохождению внутриглазной жидкости к путям оттока. Положение радужно-хрусталиковой диафрагмы и профиль угла передней камеры при этом, как правило, нормальные. Это и определяет общий основной принцип патогенетически ориентированного хирургического воздействия — удаление посторонней ткани из утла передней камеры.
Значительную часть поражений претрабекулярной локализации составляет врожденная глаукома (хотя и не все ее формы имеют этот патогенез). Резидуальная ткань в углу передней камеры не только препятствует прохождению внутриглазной жидкости к путям ее оттока, но и обрекают эти пути на бездействие. Помимо этого, в них происходят патологические изменения в связи с растяжением глазного яблока. Таким образом, в этих случаях показана возможно ранняя операция, предпочтительно в течение первого года жизни, пока в путях оттока не произошли необратимые изменения. В этих случаях гониотомия дает очень хороший эффект (до 80% успеха и более).
В большинстве руководств по офтальмологии наряду с гониотомией описывают также гониопунктуру. По механизму своего действия гониопунктура является фистулизирующей операцией. Однако по технике и главное области клинического использования она близка к гониотомии. Ряд авторов предлагают комбинировать эти два метода в рамках одного вмешательства. Учитывая все это, мы даем описание гониопунктуры непосредственно за гониотомией.
Подготовка к операции. Анестезия. Значительная часть больных с претрабекулярной формой ретенции — дети с врожденной глаукомой. Операции им проводят, как правило, под общей анестезией. В остальном предоперационная подготовка не отличается от обычной.
Основные варианты операционной техники. Исключительно важное значение при транскорнеальном подходе к углу передней камеры имеет прозрачность роговицы. У взрослых она обычно сохранена. У детей же (при буфтальме) роговица может быть резко помутневшей из-за отека. В этих случаях может помочь введение глицерина в конъюнктивальный мешок (менее эффективен 40% раствор глюкозы). Неплохие результаты иногда дает соскабливание эпителия, который, будучи отечным, отходит сравнительно легко. Это можно сделать с помощью тугого ватного тампона или специальным скариофикатором.
220
Если операцию производят под местной анестезией, то надо» помнить, что при случайном повреждении корня радужки отмечается резкая болезненность, поэтому целесообразно ввести 2%> раствор новокаина в ретробульбарное пространство. Важное значение имеет иммобилизация глаза; лигатурами должны быть фиксированы по крайней мере две мышцы (обычно верхняя и нижняя). По ходу этих мышц на глубину около 3 см следует ввести; 1—2% раствор новокаина, который можно инъецировать и в ретробульбарное пространство. При применении некоторых видов» гониолинз может потребоваться кантотомия, если глазная щель-недостаточно широка.
Важное значение имеет также хорошее освещение операционного поля. При использовании современных операционных микроскопов с мощными фокальными осветителями эта проблема разрешается сама собой. При применении традиционной техники обычно нужен дополнительный источник света. Один из возможных вариантов — использование фокального осветителя, который ассистент держит за плечом хирурга.
На ассистента, помимо прочего, возлагаются две важные задачи: фиксация гониолинзы на глазу и контроль за тем, чтобы была, хорошо наполнена передняя камера. Наполнять ее можно черев отдельный вкол в переднюю камеру с помощью обычного шприца. Другой вариант — наполнение передней камеры с помощью стандартной системы для переливания крови, заполненной изотоническим (или сбалансированным) раствором хлорида натрия; высота, на которой расположен сосуд, определяет необходимую степень гидростатического давления. Перед операцией производят обычные инъекции и в глаз закапывают миотики (лучше холиномиметические, например, пилокарпин, карбохолин и т. д.) для» освобождения корня радужки. Целесообразно ввести гипотензивные средства (диакарб, глицерин, мочевина).
Варианты гониотомии принципиально не отличаются друг от? друга, хотя различия в технических деталях могут быть существенными. В значительной мере это связано с характером используемых инструментов, в первую очередь гониотома и операционной гониолинзы. По конструкции существующие гониотомы сходны. Они имеют короткую изогнутую режущую кромку, переходящую в слегка коническую шейку, которая играет роль пробки,, препятствующей истечению жидкостц передней камеры через вкол. Важной особенностью некоторых конструкций является наличиеканюлированной ручки, что позволяет одновременно производить, заполнение передней камеры жидкостью и хирургические манипуляции, используя один вкол.
Операционная техника гониотомии варьирует незначительно* (рис. 125). Вкол гониотома производят, как правило, в точке,, находящейся на стороне, противоположной сектору разреза (чаще всего снаружи для большей свободы маневра). В настоящее время» операцию производят, как правило, под операционным микроскопом и с прямым гониоскопическим контролем. Гониотомию бен
22В
125. Гониотомия (схема).
гониоскопии выполняют как исключение в тех случаях, когда из-за прозрачности роговицы гониоскопия невозможна; результат при этом значительно хуже.
Верхнюю и нижнюю прямые мышцы фиксируют уздечным швом или фиксационными пинцетами с замком. В последнем случае удобнее оперировать без векорасширителя. При использовании гониолинзы Баркана иногда приходится производить кантотомию, при применении гониолинзы Краснова потребности в кантотомии не возникает.
Голову больного поворачивают под углом 45° от хирурга. Левая рука хирурга удерживает гониолинзу в контакте с глазным яблоком; ее сдвигают слегка эксцентрично, чтобы освободить место для вкола гониотома. Наиболее це-
лесообразно применять 10-кратное увеличение операционного микроскопа. Фокусировка — на трабекулярную зону, место вкола ножа при этом находится не в фокусе. Вкол делают роговично на расстоянии 1—2 мм от лимба.
Ассистент удерживает глаз (пинцетом или за швы) так, чтобы плоскость радужки была точно параллельна направлению ножа, проходящего через переднюю камеру. Лезвие проводят через переднюю камеру над зрачком по возможности быстро, чтобы коническая шейка ножа закрыла место вкола и не позволила истечь влаге передней камеры. Если хирург использует канюлированный гониотом и камера может быть в любой момент углублена, то в быстром выполнении этой манипуляции нет необходимости. Тот же результат может быть достигнут, если для заполнения передней камеры применяют канюлю, для введения которой делают отдельный вкол.
Кончик ножа должен войти в трабекулярную зону непосредственно за линией Швальбе. Разрез не следует делать слишком глубоким. По крайней мере на 3Д лезвие гониотома должно остаться свободным для наблюдения, и это является хорошим ориентиром. Иногда приходится слегка вращать нож вокруг продольной оси, чтобы продвинуть его точно на нужную глубину.
После этого дугообразным движением ножа рассекают фильтрующую зону (см. рис. 125) примерно на 60°. Затем лезвие пере-
ворачивают и делают второе рассечение в противоположном направлении также на 60°. Разрез кпереди от указанной позиции бесполезен, разрез кзади от нее может привести к кровоизлиянию, иногда с тяжелыми последствиями. Нож следует удалять быстро, чтобы не повредить хрусталик. Спинка лезвия при этом должна
.222
б
126. Гониопунктура (схема).
а. б — этапы операции.
быть прижата к роговице во избежание расширения раневого канала.
Для того чтобы предупредить возникновение блокады области зрачка, лучше заполнять переднюю камеру воздухом не более чем на 2/з, остальную часть заполняют изотоническим раствором хлорида натрия. Под конъюнктиву вводят раствор антибиотика. В точение 12 ч после операции, если это возможно, лучше держать голову больного повернутой в ту сторону, где был произведен вкол в роговицу. Назначают 2% раствор пилокарпина Зраза в день.
Гониопунктура является фистулизирующим методом. С точки зрения техники, операция похожа на гониотомию, за исключением последнего момента. Нож, проведенный через переднюю камеру, выкалывают через все слои фильтрующей зоны склеры так, чтобы конец его показался под конъюнктивой (рис. 126); во избежание ее перфорации под конъюнктиву вводят 0,2—0,3 мл изотонического раствора хлорида натрия. Нож извлекают, в переднюю камеру вводят пузырек воздуха, который не должен закрывать область зрачка. В случае успеха в этой зоне формируется нежная фильтрационная подушка.
Осложнения. Наиболее частое встречающееся осложнение — кровоизлияние в переднюю камеру. Чаще всего оно является следствием повреждения корня радужки и проходящих здесь кровеносных сосудов. Необходимо как можно быстрее промыть переднюю камеру во избежание образования свертков крови. В последнее время для промывания передней камеры с успехом применяют раствор урокиназы (стрептокиназа). Введение воздуха в переднюю камеру также помогает эвакуировать кровь, особенно из области зрачка. Повышение внутриглазного давления при инъекциях в полость глаза является наиболее эффективной мерой предупреждения дальнейшего кровотечения,
22»
Перфорация стенки глаза в ходе гониотомии обычно является следствием неправильной хирургической техники. В большинстве «случаев не требуется принимать какие-либо меры для ликвидации этого осложнения, но необходимо следить, чтобы к концу операции передняя камера была полностью заполнена.
Иногда отмечается склонность к спаиванию радужки с роговичным разрезом или углом передней камеры. Основной профилактической мерой является тщательный туалет операционной раны и полноценное заполнение передней камеры к концу операции.
Ведение послеоперационного периода. До рассасывания воздуха в передней камере показан постельный режим (не менее суток); голова больного должна находиться в таком положении, чтобы воздух в передней камере располагался в секторе, в котором производили вмешательство (где была удалена претрабекулярная ткань). Зрачок должен быть сужен (антихо-линэстеразные препараты нежелательны) по крайней мере в течение первых 4—5 дней; в дальнейшем мидриаз также нежелателен, если к нему нет прямых показаний. Стероидные гормоны, применяемые местно, в некоторой мере препятствуют избыточному рубцеванию. Воспалительная реакция после неосложненной •гониотомии обычно слабая. Если не было тяжелого кровотечения, кровь обычно рассасывается самостоятельно в течение 3—4 дней.
Хирургическое лечение трабекулярной гипертензии (трабекулотомия)
Знание топографии венозного синуса склеры необходимо для хирургического лечения трабекулярной гипертензии, особенно при трабекул отомни. Расстояние его от края роговицы составляет •величину порядка 1,5 мм; в боковых отделах он расположен ближе к лимбу, чем сверху и снизу. Просвет имеет вытянутую форму с наибольшим размером около 0,25 мм. Он выстлан эндотелием, иногда в нем имеются частицы пигмента. Благодаря этой пигментации или заполнению кровью канал иногда бывает виден при гониоскопии.
Внутренняя стенка венозного синуса склеры, ограничивающая •его вместе с трабекулярной зоной от передней камеры, очень тонка (0,1 мм) и полупрозрачна. При операциях на вскрытом венозном синусе склеры, особенно без помощи операционного микроскопа, иногда нелегко определить, сохранена ли его внутренняя стенка, так как сквозь нее хорошо видна прикорневая часть радужки. В нашей практике, особенно на первых порах, случалось, что только безуспешные попытки захватить корень радужки пинцетом убеждали в существовании неповрежденной стенки канала.
Правильная локализация просвета венозного синуса в слоях склеры представляет одну из главных задач операции; от этого во многом зависит ее успех. Отстояние его от лимба варьирует 224
настолько, что возникла необходимость в методах его индивидуальной локализации уже в процессе операции. Наиболее практичен способ, при котором тонкую микрохирургическую иглу (5 мм) проводят достаточно глубоко через наружные и средние слои склеры примерно в области венозного синуса (в 0,5—1 мм от задней границы лимба) параллельно ему.
При гониоскопии тело иглы хорошо заметно по металлическому блеску, просвечивающему через глубокие слои стенки глазного яблока. Позиция этой иглы по отношению к позиции венозного синуса склеры дает ясное представление о том, где найти его просвет. Если сам синус при гониоскопии не виден (в нем нет пигмента или крови), то можно предполагать, что положение примерно соответствует границе между средней и задней третью трабекулярной зоны.
Вокруг венозного синуса склеры в стенке глазного яблока заложено богатое сосудистое сплетение; при разрезах ab externo в этой зоне хирург должен быть готов к обильному кровотечению, не представляющему опасности, но затягивающему ход операции.
Подгото ait а, анестезия. Операции на венозном синусе склеры являются микрохирургическими вмешательствами. Они требуют обычной подготовки, в частности хорошей иммобилизации головы больного, достаточной фиксации глаза, рук хирурга, соот-iiotctbj ющегп освещения. Операции малоболезнепны: вполне достаточно 111ci.< Kiр।и новокаина (1,5 мл 2% раствора) под верхнюю прямую мышцу во время проведения уздечного шва; при введении иглы несколько капель анестетика вводят и под конъюнктиву. Подготовка операционного поля обычная. Доза седативных препаратов для премедикации, как правило, небольшая.
Просвет венозного синуса склеры может быть вскрыт радиальным надрезом [Smith J., 1960; Allen J., 1962, и др.] или с образованней небольшого склерального лоскута [Harms Н., Dann-hoini К., 1968|. Поиски просвета синуса в коротком радиальном разрезе представляют более трудную задачу, и с этой точки зрения метод Хармса более практичен и надежен.
Известны различные конструкции зондов для трабекулотомии. Такого рода трабекулотом включен и в отечественный набор для хирургии глаукомы. Принципиальной разницы в пользовании ими нет.
Рекомендуемая техника. Формируют небольшой конъюнктивальный' лоскут с основанием у лимба. Под ним несквозными надрезами склеры намечают П-образный участок размером примерно 3X2 мм (больший размер соответствует перекладине буквы П, свободные концы обращены к лимбу). В пределах очерченного участка склеру расслаивают. На дне расслоенной зоны определяют и вскрывают венозный синус. Опытному офтальмохирургу вполне доступно вскрытие просвета коротким (2—3 мм) радиальным разрезом перпендикулярно к лимбу. По ходу канала сначала в одну, затем в другую сторону проводят зонд-трабекулотом (примерно на ’/б окружности лимба). Удобен
15 Руководство по глазной хирургии
225
127. Трабекулотомия (схема), а, б — этапы операции.
двойной трабекулотом Хармса (рис. 127); вторая его ножка (идентичная по размерам и изгибу первой) ложится снаружи, точно показывая расположение внутренней ножки.
Вращательным движением к зрачку (место введения зонда используют как точку вращения) разрывают внутреннюю стенку венозного синуса. Склеральный лоскут укладывают на место и пришивают несколькими швами, нити из шелка или полимера должны быть выведены наружу и удалены через 7 дней; биологические швы могут быть погружными. Накладывают непрерывный шов на конъюнктиву. Воздух не должен закрывать область зрачка (опасность зрачкового блока).
Осложнения. После трабекулотомии часто отмечается небольшая гифема, которая, как правило, не требует каких-либо мер, кроме обычной медикаментозной терапии.
Манипуляции при трабекулотомии могут иногда приводить к отслоению задней пограничной пластинки. При этом биомикроскопически на задней поверхности роговицы видна нежная мембрана, завернутая в сторону передней камеры. Отслойка задней пограничной пластинки (несмотря на то что она регенерирует) нежелательна; это может способствовать отеку роговицы в соответствующей зоне. Большей частью, однако, при трабекулотомии она невелика и не вызывает сколько-нибудь серьезных последствий.
Ведение послеоперационного периода. После трабекулотомии обычно достаточно одних суток постельного режима. Целесообразен умеренный мидриаз (диаметр зрачка 5— 6 мм); этим определяется и необходимое количество закапываний того или иного мидриатика.
Перед выпиской обязательна гониоскопия для контроля за состоянием области вмешательства.
226
Хирургическое лечение интрасклеральной гипертензии (синусотомия)
Возможно несколько вариантов подхода для вскрытия наружной стенки венозного синуса склеры: прямо по линии его проекции на поверхность глаза, сзади (от экватора) и спереди (от роговицы). Второй и третий варианты требуют ламеллярного расслоения стенки глаза сзади или спереди от канала. Каждый из втих путей имеет свои достоинства и недостатки. Опыт показал, что в клинической практике выбор метода обычно диктуется техническим оснащением и навыками хирурга. Хирург должен помнить, что в области венозного синуса заложен интрасклеральный артериальный круг, и должен быть готов к неопасному, но мешающему кровотечению. Важнейшим и принципиальным досто-И11СТ1ЮМ способа является то, что он не требует вскрытия полости глазного яблока. Операция не только улучшает отток от венозного синуса склеры, по и влияет благоприятно на проходимость в ооласги ину 1 poiinoii его стенки (в частности, за счет устранения кол л linen синуса).
Подготовка, анестезия. Вскрытие наружной стенки попонного синуса склеры не требует вхождения в переднюю камеру. Будучи не полостной, операция малотравматична и малоболез-IICHIIII. Достаточно инъекции 2% раствора новокаина (2 мл) под верхнюю прямую мышцу; при выведении иглы несколько капель раствора вводят и под конъюнктиву. Уздечный шов обеспечивает достаточную фиксацию. Чтобы уменьшить опасность повреждения или разрыва тонкой внутренней стенки венозного синуса, целесообразно максимально снизить давление перед операцией (применение гиперосмотических средств, диакарба и т. д.). Для той же цели следует максимально ослабить давление на глазное яблоко в ходе операции, используя современные блефаростаты с упорами на спинку поса и скуловую дугу и т. д. В медикаментозном миозе или мидриазе необходимости нет.
Рекомендуемая техника. Формируют большой (8мм) конъюнктивальный лоскут с основанием у лимба. Определяют локализацию венозного синуса склеры и намечают его позицию на склере, например раствором бриллиантового зеленого (рис. 128).
Проводят два несквозных надреза склеры между меридианами на 101/г—l'/г часах: один кпереди от позиции венозного синуса, второй кзади. Если специальной локализации венозного синуса пе производили, первый разрез проводят у задней границы лимба, второй — в 1,5 мм за первым. Делают тщательный гемостаз поверхностной коагуляцией. С одного из концов очерченной таким образом полоски склеры начинают ее ламеллярную резекцию.
Мы обычно пользуемся для этой цели осколком бритвенного лезвия, хотя копьевидный нож тоже вполне применим. На протяжении первых миллиметров резекции глубину расслоения постепенно увеличивают, пока на дне не определится венозный синус
15*
227
склеры в виде темноватой канавки. Ширина его просвета варьирует в широких пределах — от почти неразличимого до растянутого; иногда в просвете хорошо заметны частицы пигмента. В этой стадии лучше пользоваться большим увеличением микроскопа (до 20—30-кратного) и максимально ярким освещением.
Вскрытие просвета венозного синуса склеры — наиболее ответственный момент операции. Если из него начинает поступать жидкость передней камеры (канал «плачет»), операция может быть продолжена и закончена как синусотомия. Начиная от этой точки, острый конец инструмента вводят в синус и движениями лезвия к поверхности склеры (от передней камеры) просвет его вскрывают по всей длине; эта стадия операции трудностей не представляет.
В итоге резецируют полоску
склеры над венозным синусом склеры шириной около 1 мм. Иногда над ним остаются мостики склеральной ткани, которые также рассекают над зондом. Целесообразно оставлять мостик склеральной ткани в центре зоны резекции, т. е. обычно на 12 часах; перекидываясь над вскрытым венозным синусом склеры, он консолидирует зону
128.
Синусотомия по Краснову (схема), а — профильный срез лимба; б — этапы операции.
228
120. Переход от синусотомии к синусотрабекулотомии (схема).
130. Ножницы иопд Шотторп для синусотомии.
операции и и известной мере препятствует разрыву внутренней стенки синуса при случайном давлении на глаз после операции.
Следует особенно тщательно зашивать конъюнктивальную рапу нопрорыпным швом. Это необходимо, чтобы ввести воздух под лоскут и отслоить его от склеры, предотвратив возможное спаяпие со склерой.
«Сухой» синус свидетельствует о нарушении трабекулярной проходимости и, следовательно, о необходимости дополнительного вмешательства на трабекулярной зоне. В этом случае синусотомия превращается в сипусотрабекулотомию. Естественно, что места «интернализации» и «экстерпализации» не должны совпадать, так как это сделало бы операцию фистулизирующей.
Мы обычно вводим топкий мапдрен в просвет синуса и продвигаем его до противоположного конца отграниченной надрезами зоны; с этого конца полоску склеры также несколько отслаивают от глубоких слоев, давая возможность концу зонда выйти наружу. Изгибая мандрен за концы, легко добиться того, чтобы его середина пошла в переднюю камеру, разрушив, таким образом, трабекулярную зону (рис. 129). С этой целью можно использовать специальные ножницы-зонд (рис. 130), предложенные Л. X. Шотте-ром (1968).
По мере совершенствования общего уровня глазной микрохирургии встает вопрос и о возможностях усовершенствования техники синусотомии; первоначально предложенный (и описанный выше) вариант в наши дни представляется уже недостаточно щадящим (необходимость резекции значительного участка склеры). В связи с этим нами были апробированы модификации с продольным и поперечным разрезами венозного синуса склеры без резекции склеры, в частности так называемые тоннельная и я
радиальная синусотомия. Особый интерес представляет «радиаль- )
229
ная» синусотомия. Сразу за лимбом над венозным синусом склеры проводят от 4 до 32 глубоких надрезов через фильтрующую зону. Цель операции — не только улучшить отток от венозного синуса склеры; она способствует также растяжению всей ретролимбаль-ной зоны склеры, что улучшает проницаемость трабекулярного аппарата и противодействует коллапсу венозного синуса склеры. Метод практически совершенно безопасен и может выполняться амбулаторно. Вместе с тем описывать подробно указанные варианты в руководстве, ориентированном на повседневную практику, представляется нецелесообразным. Исследования в этой области продолжаются.
В любом случае операция заканчивается введением раствора антибиотика под конъюнктиву и наложением слегка давящей повязки.
Осложнения. Операционные и послеоперационные осложнения при синусотомии наблюдаются редко. Могут возникнуть трудности при нахождении венозного синуса в слоях склеры; если хирург оказывается не в состоянии их преодолеть, то в качестве крайней меры может быть произведена иридэктомия через разрез в «ложе» резекции. В итоге состояние глаза будет сходно с тем, которое отмечается после операции Покровского или так называемой фильтрующей иридэктомии по Шейе. Мы неоднократно имели возможность убедиться в том, что формирование фильтрационных каналов происходит особенно благоприятно в тех случаях, когда вкол в переднюю камеру приходится на трабекулярную зону, как это и получается, если он сделан в области венозного синуса склеры, даже если он не обнаружен. Разумеется, что в этом случае вмешательство является фистулизирующим, хотя и в сравнительно выгодном варианте, и не имеет какой-либо патогенетической ориентации.
В наибольшей мере следует опасаться выпадения радужки при случайном повреждении внутренней стенки венозного синуса склеры или разрыве ее в первые дни после операции вследствие неосторожного движения или давления на глаз. Чаще всего это осложнение возникает, если операцию производит неопытный хирург. Как уже упоминалось, внутренняя стенка венозного синуса склеры практически прозрачна, а определить, цела она или повреждена, без соответствующего навыка нелегко. Само выпадение радужки не представляет опасности, но в этом случае необходимо произвести иридотомию или иридэктомию; в результате операция обычно превращается в фистулизирующую.
Гифема, обычно очень небольшая, нередко определяется на 2—3-й день после синусотомии, даже если к концу операции крови в передней камере не было. Обычно гифема рассасывается самостоятельно. Замедленное восстановление передней камеры и отслойка хориоидеи после «чистой» синусотомии, как правило, не наблюдаются.
При иссечении слишком широкой полоски может возникнуть роговичный астигматизм (мы наблюдали 3 таких случая). Сте-230
ень астигматизма с течением времени обычно снижается. Дели* Ватная хирургическая техника, внимание к деталям служат на* Важной мерой профилактики указанных осложнений.
Воспалительная реакция после правильно выполненной синусотомии обычно слабая, так как операция не полостная. В нескольких случаях мы отмечали длительную послеоперационную Гипотонию. Назначение мидриатиков в небольших дозах (0,5% раствор платифиллина или 0,125% раствор атропина) во всех случаях устраняло беспокоившие больного явления.
Ведение послеоперационного периода. Следует избегать резких движений или случайного давления на оперированный глаз, особенно в течение первых 2 нед. Зрачок поддерживают в состоянии легкого мидриаза (5—6 мм). Кортикостероидные препараты местно показаны не только для купирования воспалительной реакции, но и для уменьшения тенденции к рубцеванию.
В первые месяцы после успешно произведенной синусотомии обычно отмечается выраженная фильтрация под конъюнктиву. Однако в дальнейшем фильтрационный валик часто уменьшается и в конце концов становится почти незаметным, в то время как внутриглазное давление остается нормальным.
Хирургическое лечение «гиперсекреторной» глаукомы (циклокоагуляция, циклоанемизация)
Внутриглазная жидкость продуцируется отростками ресничного тела. Проекция этой зоны на склеру соответствует примерно 3—5 мм от лимба. Стойкость эффекта операций зависит не столько от непосредственной коагуляционной травмы, сколько от выраженности последующего рубцевания, поэтому воздействие должно быть по возможности глубоким. В наибольшей мере это свойственно диатермокоагуляции, особенно перфорирующей. Мепее выражен эффект пеперфорирующей диатермокоагуляции. Еще слабее влияние низких температур; как известно, после криокоагуляции кровообращение в крупных сосудистых стволах быстро восстанавливается (в противоположность диатермокоагуляции).
Те же исходные положения действительны и для так называемой циклоанемизации, при которой воздействие направлено на сосуды, питающие ресничное тело. С помощью холода практически невозможно добиться их облитерации. Диатермокоагуляция здесь должна быть по возможности глубокой. Ресничное тело получает кровь как от длинных задних, так и от передних цилиарных артерий. Имеются предложения воздействовать как на те, так и на другие.
Указывалось, что коагуляция обеих длинных цилиарных артерий может быть опасной из-за слишком сильного сокращения притока крови; в клинической практике, однако (в том числе и в нашей), это не подтверждается, если вмешательство не сопровождается чрезмерной ожоговой травмой. Гипотензивный эффект от
231
выключения только одной цилиарной артерии обычно недостаточен. Недостаточная стойкость гипотензивного эффекта свойственна всем коагуляционным методам и вместе с тем при некоторых обстоятельствах они могут быть незаменимы (глаукома или неоваскуляризация радужки и угла передней камеры, далеко зашедшая глаукома и т. д.).
При рекомендуемой нами технике циклоанемизация является легким вмешательством. Надобности в очищении кишечника и строгом соблюдении предосторожностей, принятых при полостных операциях на глазу, нет. Однако, поскольку в заключение вмешательства обычно приходится делать парацентез (в связи с гипертензией, обычно проявляющейся в этот момент), исследование конъюнктивальной флоры необходимо. Умеренная премедикация целесоообразна, так как тракция за глазные мышцы может быть болезненной. Анестезия — инъекция 2 мл 2°/о раствора новокаина вдоль мышц, по возможности глубже. Несколько капель анестетика вводят и под конъюнктиву у места ее разреза, и в зоне будущего парацентеза.
Основные варианты операционной техники. Проникающую (трансконъюнктивальную, или подконъюнктивальную) циклодиатермокоагуляцию [Vogt А., 1936] производят игольчатым электродом в 10—20 точках над зоной отростков ресничного тела. Неперфорирующую коагуляцию [Архангельский В. Н., 1957] осуществляют в той же зоне, обычно после отсепаровки конъюнктивального лоскута; наносят около 15 коагуляций (в два ряда).
Криокоагуляция ресничного тела требует весьма низких температур (—70° и ниже); остальные стадии операции примерно такие же, как при диатермическом воздействии. При так называемой ретроцилиарной диатермокоагуляции прижигания наносят соответственно плоской части ресничного тела [Wecker Н., 1954].
При криокоагуляции обычно пользуются установками, обеспечивающими охлаждение на рабочем конце порядка —70° (например, аппарат Амойлз); экспозиция 15—25 с. Обычно наносят 8— 10 аппликаций соответственно одной половине ресничного тела; через 2—3 нед можно таким же образом коагулировать вторую половину. Криокоагуляцию можно осуществлять и трансконъюнк-тивально, и в этих случаях экспозиция должна быть продолжительнее. В трансконъюнктивальном варианте криокоагуляция ресничного тела является легко переносимой процедурой, которую вполне можно выполнить амбулаторно.
Воздействие на передние цилиарные артерии обычно связано с перерезкой или перевязкой одной или двух прямых мышц глаза, по которым проходят эти веточки; существенного распространения в клинической практике эти способы не получили.
Воздействие на длинные задние цилиарные артерии является основным видом циклоанемизации. Наши результаты заставляют отдать им предпочтение перед диатермокоагуляцией ресничного
232
тела. Ниже описываются многократ-
|О апробированные нами и рекомен- у'' дуемые варианты операционной тех-
ики. X.
Рекомендуемая техника.
Производят разрез конъюнктивы Ц ]
длиной 5—7 мм у места прикрепле- Ц I
иия наружной и внутренней прямых га J
Мышц глаза (как при косоглазии). Jr
Из соображений косметики разрез /
под внутренней прямой мышцей еле- \_____________
дует вести под полулунной складкой, снаружи — на расстоянии 8—9 мм от 1
лимба, чтобы он оказался за предела- 131. Коагуляция длинных рес-МИ глазной щели. личных артерий — циклоане-
Мышцы отсепаровывают от окру- мизация (схема), жающих тканей на расстоянии
около 1 см и отодвигают в сторону. Сквозь склеру под мышцей нередко просвечивает длинная цилиарная артерия, являющаяся целью воздействия.
Коагуляцию делают «полуперфорирующим» игольчатым электродом; прижигания располагают под мышцей в три ряда (по три прижигания), начиная от места ее прикрепления, на протяжении 6—7 мм (рис. 131). То же самое повторяют под второй мышцей глаза. Как правило, непосредственно после коагуляции внутриглазное давление повышается. В связи с этим обычно целесообразен парацентез. Конъюнктиву отсепаровывают до лимба, копьевидный нож вкалывают в переднюю камеру через лимб; разрез должен быть по возможности косым во избежание выпадения радужки. Отодвигание шпателем задней губы разреза облегчает выхождение жидкости из передней камеры.
Операцию закапчивают наложением непрерывного шва на разрезы конъюнктивы. Делают монокулярную наклейку на сутки.
Осложнения. Вмешательство является сравнительно легким. В исключительных случаях отмечается выпадение радужки через лимбальный разрез. Практически это всегда бывает следствием неправильной хирургической техники; необходима хирур-
гическая репозиция радужки после иридэктомии или иридотомии. При слишком глубоких прижиганиях возможно кровотечение в стекловидное тело; как правило, оно быстро рассасывается. При всем том никогда не следует упускать из вида, что циклокоагуляция (хотя и очень редко) может вести к атрофии глазного яблока, в связи с этим надо всячески избегать передозировки.
Ведение послеоперационного периода. Реакция глаза на вмешательство, как правило, незначительная. Местная терапия кортикостероидами в течение недели обычно приводит к стиханию воспалительных явлений. На крайней периферии глазного дна в зоне операции часто бывают видны изменения, типичные для коагуляции (как после операции по поводу отслойки сет
233
чатки); этому нередко соответствует небольшое сужение поля зрения с наружной и внутренней сторон.
Необходим тщательный контроль за внутриглазным давлением. При гиперсекреторной глаукоме эффект от вмешательства обычно хороший. При других формах глаукомы результат, по нашим данным, часто оказывается недостаточно стойким; через 1—2 года примерно у половины больных давление снова начинает повышаться за пределы нормальных цифр; особенно характерен слабый эффект (или даже его отсутствие) при узком угле передней камеры.
Операции с комбинированным воздействием на различные участки фильтрующей зоны
Ведущая роль трабекулэктомии в недифференцированной и приближенно-дифференцированной хирургии «простой открытоугольной глаукомы», уже упоминалась выше. Дифференциальная диагностика трабекулярной и интрасклеральной ретенции далеко не всегда возможна; более того, эти нарушения часто сочетаются. В какой-то мере это находит отражение в широком распространении операций с комбинированным воздействием на внутреннюю и наружную стенку венозного синуса склеры. Одним из этих методов является синусотрабекулотомии (см. выше). Но гораздо более широкое признание и распространение получила так называемая трабекулэктомия, предложенная Cairns в 1968 г. (рис. 132). Идея автора заключалась в том, чтобы иссечь под лоскутом поверхностных слоев склеры блок тканей в окружности венозного синуса и тем самым открыть вход в его просвет как бы «с торца», в обход блокированной трабекулярной зоны. Более поздние исследования показали, что в действительности этого не
132. Секторная синусэктомия — трабекулэктомия (схема).
234
Происходит: просвет синуса в зоне операции быстро облитерируется. Ведущим в механизме гипотензивного эффекта трабекулэктомии является обычная фильтрация по ходу сделанных разрезов, воответственно метод предлагали называть «субсклеральная Оклерэктомия», «трабекулоканалэктомия», «секторная синусэктомия» и т. д.
А. П. Нестеров, Н. В. Федорова, Ю. Е. Батманов (1971) описали аналогичную операцию, назвав ее «синусотрабекулэктомия». Однако независимо от научных исследований метод получил Повсеместное признание клиницистов-практиков, и название «трабекулэктомия» вошло в офтальмологический лексикон независимо от того, отражает он принцип действия метода или нет. На практике именно трабекулэктомия вытеснила фистулизирующие операции традиционного типа, такие, как склерэктомия, трепанация по Эллиоту, ириденклейзис, фильтрующая иридэктомия и др. И действительно, трабекулэктомия имеет перед ним существенные преимущества, прежде всего с точки зрения сравнительной безопасности и меньшего риска осложнений. Большей частью метод применяется без какой-либо ориентации в определении места ретенции, и показанием к нему является так называемая простая открытоугольная глаукома. За последнее десятилетие был предложен целый ряд технических вариантов трабекулэктомии. Так, автором (М. М. Краснов) было предложено формировать склеральный лоскут треугольной формы, что нашло широкое признание, в том числе за рубежом. В современной офтальмохирургии наметилась тенденция к иссечению довольно большого участка глубоких слоев склеры (т. е. участка собственно «трабекулэктомии», включающего и венозный синус склеры): 3X3 мм и даже 4X5 мм. Иными словами, в процессе такой операции обнажается на довольно широком протяжении поверхность ресничного тела. Это в какой-то мере положило начало операциям обнажения ресничного тела, при которых полоску склеры с венозным синусом склеры вообще не иссекают. Близко к этой группе методов стоит и так называемая склерангулореконструкция [Пучков С. Г. и др., 1972]; формируют два склеральных лоскута: из поверхностных и глубоких слоев склеры, после этого их меняют местами (наружный лоскут становится глубоким, а глубокий — поверхностным). Среди возможных механизмов действия склеран-гулореконструкции авторы выделяют отток жидкости передней камеры непосредственно в сосуды поверхностных слоев склеры. Вместе с тем представляется вероятным, что и здесь играет важную роль фильтрация по ходу сделанных разрезов точно так же, как при классической трабекулэктомии. Хорошо выполненная трабекулэктомия дает в 83—85% случаев стойкую нормализацию внутриглазного давления.
Подготовка, анестезия. Такая же, как для иридэктомии.
Рекомендуемая техника. Формируют широкий (8 мм) конъюнктивальный лоскут с основанием у лимба. Не
235
сквозными надрезами (2/з толщины склеры) очерчивают треугольную зону с основанием (5 мм шириной, 4 мм высотой) у лимба; соответственно этому производят ламеллярное расслоение склеры. На дне расслоенной зоны обычно хорошо заметно положение склеральной шпоры (по переходу от прозрачных слоев лимба к непрозрачным); чуть кзади от нее располагается венозный синус склеры. Соответственно позиции синуса высекают полоску глубоких слоев склеры (1,5 мм шириной, 4 мм длиной) концентрично лимбу. Мы предпочитаем выполнять этот этап операции с помощью кусачек Шнаудигеля: образующееся «окно» при этом имеет правильную форму с гладкими краями (без «выступающего козырька» десцеметовой оболочки), меньше опасность кровотечения из иптрасклеральных сосудов. Обычная (и более распространенная на практике) техника заключается в иссечении глубоких слоев склеры концом режущего инструмента (например, осколка бритвенного лезвия), при этом лучше сначала провести два разреза, параллельно лимбу. Большей частью в рану выпадает радужка.
Базальная иридэктомия. Склеральный лоскут репо-нируют и подшивают обратно к ложу. В зависимости от полноценности адаптации лоскута к краям его ложа накладывают от одного (на вершину лоскута) до 3 швов; мы предпочитаем нити из современных рассасывающихся материалов (дексон, виргакрил и др.), но практически можно пользоваться любым видом шовного материала (при нерассасывающихся нитях предпочтительнее выводить концы на поверхность конъюнктивы и удалять швы на 7—10-й день с целью уменьшить процессы реактивного фиброза). Шов на конъюнктиву (обычно, виржинский шелк) должен быть наложен очень тщательно; полноценная адаптация краев разреза способствует лучшему формированию фильтрационных путей. В переднюю камеру из-под склерального лоскута можно ввести небольшой пузырек воздуха (не закрывая области зрачка, во избежание зрачкового блока).
Осложнения. Синдром мелкой передней камеры с отслойкой хориоидеи. По характеру течения послеоперационного периода трабекулэктомия в известной мере напоминает фистулизирующие операции, хотя типичные для них осложнения обычно протекают легче. Нередко отмечается синдром мелкой передней камеры, который большей частью сочетается с отслойкой собственно сосудистой оболочки. Если передняя камера, хотя бы и очень мелкая, все же имеется, можно придерживаться консервативной тактики (слегка давящая повязка с валиком над областью фильтрации, обильное питье, мидриатики вплоть др атропина и т. д.). Нами предложен метод лечения отслоек сосудистой оболочки инъекциями кофеина (0,5 мл 5% раствора) под конъюнктиву. Явный и быстрый положительный эффект отмечается более, чем в половине случаев. Способ совершенно безопасен. В тех случаях, когда радужка прилежит к роговице на всем протяжении, имеется опасность синехизации
236
угла передней камеры, а также возможность повреждения эндотелия с последующим развитием отека роговицы; длительно существующая цилиохориоидальная отслойка, как правило, сопровождается иридоциклитом (хотя симптоматика его может быть слабовыраженной) и наклонностью к формированию задних спаек. Поэтому в случаях полного отсутствия передней камеры и признаков положительной динамики в течение 3 сут целесообразна хирургическая процедура для эвакуации супрахориоидального транссудата.
С нашей точки зрения, для этого вполне достаточно короткого разреза склеры (или пункции игольчатым электродом диатермокоагулятора) на расстоянии 6—7 мм от лимба соответственно участку наибольшей проминенции отслойки (обычно в наружном или внутреннем секторе глазного яблока, хотя пункции в горизонтальных меридианах на 3 или 9 часах следует избегать из-за риска повреждения цилиарных артерий). Вскрывать склеру дальше кзади нерационально, поскольку не исключена возможность повреждения сетчатки, а отслойка хориоидеи практически всегда распространяется и на плоскую часть ресничного тела. Заднюю склеротомию часто сочетают с введением воздуха в переднюю камеру; для этого удобно использовать тот же разрез склеры, проводя через него в переднюю камеру канюлю над ресничным телом.
Ведение послеоперационного периода. Как правило, назначают мидриатики, например 1 % раствор гоматропина 4 раза в день, местно — кортикостероиды до купирования явлений послеоперационного ирита. Иногда полезен массаж глазного яблока для лучшего формирования фильтрующих путей.
В отдаленные сроки после трабекулэктомии (как и после многих других аптиглаукоматозных операций) отмечается ускоренное прогрессирование катаракталышх изменений хрусталика; о возможности этого больной должен быть в некоторых случаях заблаговременно поставлен н известность.
Модификации трабекулэктомии с наружным и внутренним транспортированием склеральной ножки. В тех случаях, когда отдаленные результаты трабекулэктомии оказываются неудовлетворительными, причина этого обычно заключается в рубцевании сформированных путей фильтрации. Это может происходить как «снаружи» (склеральный лоскут плотно срастается с подлежащей тканью), так и «изнутри» (вход в зону трабекулэктомии закрывается корнем радужки или другой тканью), поэтому были предложены способы, имеющие целью поддерживать каналы фильтрации в открытом состоянии. Осуществляется это путем транспонирования склеральных аутоимплантатов, подобных тем, которые были впервые предложены для операции иридоциклоретракции (М. М. Краснов). Технически для этого очень удобно использовать полоску той самой склеральной ткани, которая резецируется при классической трабекулэктомии; в описываемых методах она не удаляется, а используется в качестве своего рода «распорок»,
237
133. Модификация секторной синусэктомии (трабекулэктомия) по Краснову (схема).
а, б — этапы операции.
поддерживающих сформированные каналы фильтрации в открытом состоянии.
Так, в течение многих лет мы используем транспонирование склеральной ножки под склеральный лоскут. Операцию производят так же, как стандартную трабекулэктомию. Резецируемый участок глубоких слоев склеры у одного из его узких концов не отрезают. Другой, свободный, конец склеральной ножки свободно укладывается в ложе ламеллярного расслоения склеры и после репонирования склерального лоскута остается лежать между ним и глубокими слоями склеры (рис. 133). Такой прием в известной мере препятствует заращению щелевидного пространства между поверхностными и глубокими слоями склеры.
Ранее (1977) нами была разработана трабекулэктомия с «внутренним» транспонированием склеральной ножки в переднюю камеру и супрахориои-дальное пространство. Операция описана под названием «трабекулоциклостомия» (рис. 134). Резецируемую полоску глубоких слоев склеры не отрезают у одного конца. Из об-
134.
Трабекулоциклостомия по Краснову (схема).
238
разованного окошка в переднюю камеру по направлению к экватору ресничное тело отделяют от склеральной шпоры шпателем. В образованную таким образом щель циклодиализа вводят Конец склеральной ножки. Таким образом корень радужки и рес-Вичное тело оттесняются от входа в зону фильтрации; создается дополнительный дренажный канал в супрахориоидальное пространство по ходу транспонированной склеральной полоски.
О. В. Груша и Г. А. Соколовский предложили метод, при котором склеральный аутоимплантат не заправляют в супрахориоидальное пространство. Через глубокие слои склерального ложа проводят два продольных разреза (4 мм длиной, как при стандартной трабекулэктомии); отграниченная таким образо.м полоска 0 обеих концов остается связанной с короткими сторонами трабе-кулэктомического «окна» (см. рис. 135). После пересечения полоски в центре образуются две склеральные ножки, концы которых заправляют в переднюю камеру. Благодаря этому корень радужки оттесняется от угла передней камеры. Для указанного метода (представляющего собой в сущности сочетание трабекул-вктомии с иридоретракцией) было предложено название «трабе-кулостомия».
Вполне логичным и целесообразным представляется сочетание внутреннего и наружного транспонирования склеральных ножек при трабекулэктомии с целью воспрепятствовать блокаде путей оттока как со стороны передней камеры, так и со стороны наружных слоев склеры; к настоящему моменту, однако, мы не располагаем достаточным опытом клинической апробации такого варианта операции.
Суммируя изложенное в настоящем разделе, необходимо констатировать, что трабекулэктомия и усовершенствованные ее варианты занимают очень важное место в современной хирургии глаукомы. Среди современных методов эти операции ближе всего подходят к идеалу «универсальной аптпглаукоматозпой операции», который импонирует н импонировал многим офтальмохирургам на протяжении всей истории глазной хирургии XX века. Есть все основания считать, что дальнейшее развитие пойдет по пути дифференциации, т. е. поиска специфической операции для каждой из.патогенетических форм глаукомы. И тем не менее необходимо считаться с реальностью сегодняшнего дня: для тех офтальмологов (а их большинство), которые ограничиваются диагнозом «простая открытоугольная глаукома» (без дифференциального подразделения различных ее форм) трабекулэктомия и сходные с ней операции должны считаться методом выбора.
Иридоциклоретракции с трабекулотомией. Сочетание синехиальной блокады с трабекулярным поражением не всегда легко диагностировать. Достаточно уверенно о нем можно говорить только тогда, когда удалось ликвидировать, блокаду угла передней камеры, а гипертензия глаза остается.
Как было сказано выше, операцией выбора при синехиальной блокаде утла передней камеры является иридоциклоретракция.
239
разрез конъюнктивы на Ю’/г—1 ’/:
135.
Трабекулэктомия с иридоциклоре-тракцией по Груше — Соколовскому. Объяснение в тексте.
Опыт показал, что примерно у 15—20% больных внутриглазное давление не нормализуется полностью, несмотря на открытие угла передней камеры между аутоимплантатами. Причину этого надо обычно искать в изменениях трабекулярной зоны. В этих случаях показана комбинированная операция иридоциклоретракции с трабекулотомией (рис. 135).
В целях анестезии ретро-бульбарно и под верхнюю прямую мышцу вводят около 4 мл 2% раствора новокаина. Делают часах в 8 мм от лимба и отсепа-
ровывают ее до лимба. Верхнюю прямую мышцу берут на зажим Пеана для уменьшения притока крови к переднему отрезку глаза. Склеральные язычки для заправления в супрахориоидальное пространство и угол передней камеры формируют, как и при обычной иридоциклоретракции, размер их тот же (2X4 мм). Однако при одновременной трабекулотомии их целесообразно формировать свободным концом к лимбу. Разрез через «дно» резецированной зоны производят у основания язычков, т. е. в 4 мм от лимба. Отделение ресничного тела и прикорневой части радужки производят так же, как было описано выше. Аутоимплантаты заправляют по направлению к углу передней камеры; их концы располагают примерно у лимба.
После этого в переднем отделе истонченных участков склеры находят просвет венозного синуса склеры, вводят в него тонкий металлический мандрен до появления конца его в зоне второго язычка. Изгибая мандрен за концы, добиваются прорезывания центральной его части в переднюю камеру через трабекулярную зону. Накладывают непрерывный шов на конъюнктиву. Для случаев особенно тяжелой синехиальной облитерации угла передней камеры с грубым фиброзом трабекулярной зоны трабекулотомии может быть недостаточно. В этих случаях более эффективна комбинация иридоциклоретракции с трабекулэктомией. Резекция
полоски при этом также производится на открытом участке утла передней камеры между склеральными имплантатами. Техника ее была описана выше.
Синусотрабекулотомия. Дооперационная диагностика комбинированной интрасклерально-трабекулярной ретенции может пред-
240
ставить известные трудности. Как уже упоминалось, надежным ориентиром является характер тока жидкости из просвета венозного синуса склеры, вскрытого в ходе операции. Выраженный ток Жидкости из него свидетельствует против трабекулярной ретенции. Однако «сухой» синус, указывая на плохую трабекулярную Проходимость, вместе с тем не исключает возможности сопутствующей интрасклеральной ретенции.
Таким образом, при современных возможностях труднее всего диагностировать те формы комбинированной гипертензии, компонентом которых является интрасклеральное нарушение оттока (в сочетании, например, с трабекулярной или ангулярной ретенцией). Техника синусотрабекулотомии описана выше.
Хирургия глаукомы в особых осложненных ситуациях
Врожденная и юношеская глаукома. О врожденной глаукоме уже упоминалось выше в подразделе, посвященном претрабекулярной гипертензии. Причиной гипертензии глаза при врожденной глаукоме обычно являются дефекты формирования угла передней камеры (резидуальная ткань, переднее прикрепление Корпя радужки). В связи с податливостью тканей в этом возрасте глаз обычно растянут (буфгальм), передняя камера глубокая. Гониосконпчесьая картина в полыни истце случаев достаточно характерна (см. рис. 112).
В противоположность этому при юношеской глаукоме нет определенных диагностических ориентиров, кроме возраста. В одних случаях это, по-видимому, поздно проявившаяся врожденная глаукома, в других — обычная глаукома, развившаяся сравнительно рано. В клинической картине юношеской глаукомы, как правило, можно найти симптомы, позволяющие отнести ее к той или иной категории. Соответственно этому планируют и выбор метода лечения.
Операцией выбора при врожденной глаукоме является гониотомия. Будучи правильно и своевременно (рано) произведена, операция дает хорошие результаты в 80% случаев. При выполнении ее в возрасте старше 1—2 лет гониотомия гораздо реже бывает успешной, что в какой-то мере, вероятно, объясняется облитерацией бездействующих интрасклеральных путей.
В этой ситуации иногда, но далеко не всегда приносит успех гониопунктура, которую производят как самостоятельную операцию или в сочетании с гониотомией. За последнее десятилетие традиционная гониотомия по Баркану в известной мере уступила место трабекулотомии ab externo по Хармсу, в возрасте после года она часто оказывается более эффективной. При юношеской глаукоме метод операции выбирают так же, как при обычной глаукоме. У этих больных сравнительно часто отмечается трабекулярная локализация ретенции.
Глаукома в сочетании с катарактой. Сочетание глаукомы с катарактой — явление настолько частое и типичное, что в лите-
16 Руководство по глазной хирургии
241
ратуре уже неоднократно поднимался вопрос о патогенетическом родстве этих заболеваний. В некоторых случаях гипертензия глаза, безусловно, является следствием процесса в хрусталике (набухающая катаракта, так называемая факолитическая глаукома и т. д.). Диагностика этих форм лежит за пределами задач настоящей главы; она, как правило, нетрудна. В этих ситуациях экстракция катаракты одновременно является и антиглаукоматозной операцией, так как устраняет источник гипертензии глаза.
Не вполне ясна, хотя, возможно, и существует, причинно-следственная связь между глаукомой и катарактой при так называемом эксфолиативном синдроме. На радужке, передней поверхности хрусталика, задней поверхности роговицы видны множественные мелкие белые отложения («снежинки»), зрачковый край обычно депигментирован. Нередко синдром бывает односторонним. Глаукома часто плохо поддается медикаментозной терапии, и обычно требуется хирургическое лечение ее в виде трабекулэктомии или подобных методов.
Чаще какой-либо непосредственной связи между катаракталь-ным и глаукоматозным процессом, по крайней мере клинически, не определяется. Если в этих случаях внутриглазное давление компенсируется медикаментозными средствами, то возникает вопрос, что делать сначала: экстракцию катаракты или антиглау-коматозную операцию. Бесспорно, сама по себе экстракция катаракты часто дает также гипотензивный эффект. Вместе с тем в течение многих лет второй путь считался более целесообразным. Эту точку зрения, в частности, аргументировал В. П. Филатов. Он исходил из того несомненного факта, что выполнение антиглаукоматозной операции на афакичном глазу часто затруднено, а ее гипотензивный аффект неудовлетворительный или скоропреходящий. Ряд авторитетных зарубежных специалистов (А. Е. Ман-шепее и др.) считают даже, что созданные хирургическим путем каналы фильтрации на афакичном глазу практически почти всегда рубцуются. С этой точки зрения, целесообразно в первую очередь добиться компенсации внутриглазного давления.
Другая возможная тактика, которая в последние годы постепенно становится более популярной, — производство комбинированных операций. Преимущества, в частности психологические, одноэтапного вмешательства перед двухэтапным очевидны. Ком-•бинированная операция, однако, более травматична для глаза. При двухэтапном лечении выбор антиглаукоматозной операции определяется теми же моментами, о которых шла речь в предыдущих разделах главы. Техника операции также принципиально не отличается от описанной. Необходимо, однако, заранее выбрать место для катарактального разреза.
Разрез в нижней части роговицы может вызвать помутнение роговицы или образование передних спаек в пределах глазной щели, что невыгодно косметически ч может отражаться на зрении. В случае подтягивания радужки к ране смещение зрачка •книзу ухудшает зрение. Противолежащее расположение двух 542
разрезов (например, катарактального — сверху, а для выполнения •нтиглаукоматозной операции — снизу) чаще влечет за собой Дистрофию роговицы. В связи с этим как антиглаукоматозную Операцию, так и экстракцию катаракты мы производим в верхней Половине глазного яблока. При этом возможны два технических варианта: 1) область, где будет выполнена одна операция (обычно антиглаукоматозная), смещают кнутри, область осуществления другой — кнаружи; 2) разрез для экстракции катаракты производится роговично, перед областью, где будет произведена антиглаукоматозная операция. По бокам от зоны фильтрации катаракталь-ная рана может быть покрыта конъюнктивой.
В любом случае одним из основных условий успешного выполнения операции является тщательное закрытие катарактального разреза (минимум 7—8 узловатыми швами). Без этого вероятность развития передних спаек в области разреза во много раз возрастает, а это обычно сводит на нет результаты антиглаукоматозной операции.
Из комбинированных операций, которые применяют при сочетании глаукомы с катарактой, хорошо зарекомендовали себя два метода: экстракция катаракты с одновременным циклодиализом (или иридоциклоретракцией) и экстракция катаракты с трабе-кулэктомией.
Уже давно замечено, что циклодиализ может давать хорошие результаты на афакичных глазах. Это и понятно, поскольку именно при предлежании хрусталик в значительной мере способствует закрытию циклодиализной щели, смещая вперед корень радужки и ресничное тело. Циклодиализ обычно производят сверху, еще до проведения катарактального ^разреза. После этого операцию продолжают и заканчивают как обычно. Иридоциклоретракция в такой же ситуации дает более выраженный и стабильный гипотензивный эффект, но увеличивается травматичность экстракции катаракты.
При сочетании экстракции катаракты с трабекулэктомией сначала формируют склеральный лоскут (мы предложили применять лоскут треугольной формы). После этого делают катарактальный разрез обычным способом. Он проходит под склеральным лоскутом, который, таким образом, остается связанным с роговичной губой разреза. Из задней губы разреза в части, соответствующей склеральному лоскуту, иссекают полоску ткани размером 4X1 мм, содержащей трабекулярную зону (рис. 136). Экстракцию катаракты производят обычным путем. В дополнение к обычным корнеосклеральным швам накладывают швы на основание склерального лоскута и его вершину (или углы, если лоскут прямоугольный). А. И. Луфталла (1976) использует склеральный лоскут полукруглой формы (рис. 137), который фиксируют тремя микрошвами у вершины.
Как уже отмечалось при экстракции катаракты на глазу, на котором необходимо произвести также антиглаукоматозную операцию, принцип патогенетически направленного воздействия
16*
243
I
J
!l ,1 I
136. Экстракция катаракты с трабекулэктомией с треугольным лоскутом по Краснову (схема).
137. Одномоментная экстракция катаракты с трабекулэктомией (схема).
осуществить практически труднее из-за склонности каналов оттока к рубцеванию. В связи с этим неоднократно предлагалось не производить полную герметизацию катарактального разреза и тем самым способствовать фильтрации внутриглазной жидкости через него. Мы предлагаем с этой целью ущемлять между краями раны небольшой лоскут капсулы хрусталика, удаленного у того же больного, который играет роль своего рода «фитиля». Этот метод очень прост и удобен.
Глаукома хрусталикового блока. Некоторые виды декомпрессионных («злокачественных») глауком. Уже давно были известны случаи, когда вскрытие передней камеры (момент декомпрессии глаза) в ходе антиглаукоматозной операции приводит лишь к кратковременному снижению внутриглазного давления, за которым тотчас следует его резкое повышение. Это чаще происходит при наличии мелкой передней камеры и узкого камерного угла. Иногда повышение давления спонтанно проходит. В других случаях оно оказывается стойким и приводит к гибели глаза, поэтому в ряде руководств эту форму глаукомы описывают как «злокачественную».
За последние 15—20 лет оформилась концепция так называемого хрусталикового блока, позволяющая объяснить механизм развития гипертензии глаза в некоторых из описанных случаев. Речь идет об ущемлении хрусталика в кольце отростков ресничного тела (рис. 138). В прошлом многие авторы рекомендовали удалять хрусталик в качестве единственной эффективной меры борьбы со «злокачественной» глаукомой. Хотя это и согласуется с современной концепцией о хрусталиковом блоке, но представляется неоправданно тяжелой и травматичной мерой.
Иногда хорошие результаты дает закапывание раствора атропина или закладывание порошка атропина в конъюнктивальный мешок. Это ведет к некоторому уменьшению объема ресничных отростков. Указанное лечение необходимо проводить на фоне ак-244
138.
Циклохрусталиковый блок (схема).
1 — внутриглазная жидкость: 2 —
стекловидное тело.
тивной осмотерапии (глицерол, мочевина). Миотики, как правило, противопоказаны, нередко они лишь отягощают течение глаукомы хрусталикового блока.
Описан метод давления (концом мышечного крючка для косоглазия) на область ресничного тела. Это может вызвать искажение формы кольца отростков ресничного тела и, таким образом, разорвать блок на каком-то участ
ке. Метод не наносит травму глазу и уже с этой точки зрения за
служивает внимания.
Наконец, возможна пункция заднего отрезка глаза через плоскую часть ресничного тела с выпусканием скопившейся там водянистой влаги, а также некоторого количества жидкого стекловидного тела. В результате всех этих мер на нашем материале последних 20 лет ни разу не пришлось прибегать к экстракции хрусталика.
Не исключено, что механизм хрусталикового блока (хотя бы относительного) играет известную роль и при, казалось бы, обычных формах узкоугольной глаукомы. А. П. Нестеров и Г. А. Киселев (1973) предложили оригинальную пробу с задней кольцевой компрессией, которая, по-видимому, позволяет более реально ставить вопрос о своевременной клинической диагностике ука
занного состояния.
Иногда сходная картина повышения внутриглазного давления, следующая непосредственно вслед за хирургической декомпрессией глаза, может быть следствием субхориоидального кровоизлияния. Это состояние по своему патогенезу в принципе сходно с состоянием экспульсивной геморрагии, но дело обычно не доходит до отторжения всех оболочек, как, например, при экстракции катаракты, из-за небольшой величины разреза. Следует немедленно зашить операционную рану одним—двумя прочными швами, после чего произвести офтальмоскопию. Бугор проминирующих оболочек бывает хорошо заметен и соответственно его расположения производят заднюю склеротомию и заднюю трепанацию склеры. Обильное количество крови в супрахориоидальном (субсклеральном) пространстве подтверждает диагноз. Мы имели возможность наблюдать указанное осложнение дважды при глаукоме в
245
сочетании c naevus flameus. Эва-куацию крови из супрахориои-\ дального пространства можно / \ Ч, отложить на несколько дней (к
I I этому времени кровь разжижа-
I I ется), но не следует оставлять
\ / ее в глазу надолго, так как это
/ \ / может привести к развитию ге-
\ ' мосидероза оболочек.
Похожее, но патогенетически совершенно различное состо-139. Супрацилиарная склеротомия. яние может дать обильная транссудация жидкости из сосудов ресничного тела в момент декомпрессии глаза. Чаще это наблюдается при далеко зашедшей глаукоме или при сочетании ее с выраженной сосудистой патологией. Некоторые исследования показывают, что в этих случаях речь идет о проходе жидкости через сосудистую стенку; кроме этого, паретичные сосуды резко расширяются, и ресничное тело, подобно набухающей губке, резко увеличивается в объеме. Повышение внутриглазного давления также отмечается сразу после вскрытия глазного яблока, но при офтальмоскопии не определяется проминирующий бугор внутренних оболочек. В этих случаях склеротомию (или трепанацию склеры) следует производить под ресничным телом (в 4 мм от лимба). Отхождение транссудативной жидкости (которая иногда имеет желтоватую окраску) ставит диагноз вне сомнений. Мы обычно предпочитаем в этих случаях V-образную склеротомию, которая не требует специальных инструментов и позволяет добиться такого же эффекта дренирования как традиционная трепанация (рис. 139).
Картина «злокачественной гипертензии» в ходе операции может отмечаться при любой операции, сопровождающейся вскрытием глазного яблока. Поэтому сказанное выше относится в полной мере например, к иридэктомии, трабекулэктомии и ряду других хирургических вмешательств, описанных выше.
Глаукома на афакичном глазу. Во многих случаях глаукома, возникающая после экстракции катаракты, является вторичной. Чаще всего это так называемая глаукома зрачкового блока (при окклюзии области зрачка стекловидным телом или секундарной мембраной, при круговых спайках края зрачка с передней пограничной мембраной стекловидного тела и т. д.). Характерный симптом — наличие мелкой передней камеры или ее отсутствие.
Хирургическое лечение сводится к базальной иридэктомии или рассечению мембраны, блокирующей переход внутриглазной жидкости из задней камеры в переднюю.
Внешне в известной мере сходную, но що существу гораздо более тяжелую картину представляет глаукома витреоцилиарного блока (рис. 140). В принципе ее патогенез в какой-то мере сходен с патогенезом глаукомы циклохрусталикового блока (см. выше), 246
140.
Глаукома витреоцилиарно-Го блока. Объяснение в тексте.
но конкретный механизм заболевания менее ясен. Так или иначе, в том и другом случае внутриглазная жидкость, продуцируемая ресничным телом, оказывается как бы замкнутой в стекловидном теле или в ретровитре-альном пространстве. Консервативные меры или операции на перед
нем отрезке глаза при
витреоцилиарном блоке обычно неэффективны, поэтому состояние
нередко относят в уже упомянутую разнородную группу «злока-
чественных» глауком.
Необходимо исследовать гипотензивный эффект мидриатиков холинолитического ряда (вплоть до атропина) и при отсутствии положительного эффекта прибегнуть к глубокому рассечению
стекловидного тела в надежде установить трансвитреальное сообщение между задним и передним отрезками глаза для свободного оттока внутриглазной жидкости (рис. 141). Узкий нож Грефе вкалывают через область лимба и зрач ка глубоко в полость стекловидного тела с расчетом рассечь ее заднюю пограничную мембрану (при афакии она обычно смещена вперед, довольно далеко от сетчатки). В случае успеха передняя камера углубляется немедленно на операционном столе. Она заполняется внутриглазной жидкостью, оформленное стекловидное тело отходит кзади.
Возможна синехиальная облитерация угла передней камеры (особенно после выраженных циклитов), а также блокада его стекловидным телом (при
141. Пункция стекловидного тела при глаукоме витреоцилиарного блока. Объяснение в тексте.
247
выпадении); то и другое обычно дополнительно требует иридоциклоретракции.
Ферментативный зонулолизис (химиотрипсином, а-химотрипси-ном) иногда также сопровождается гипертензией глаза. Причина ее заключается в «засорении» межтрабекулярного пространства отшелушившимися клеточными конгломератами. Как правило, «трипсинная глаукома» исчезает самостоятельно через 2—4 нед.
Интенсивная местная стероидная терапия, столь распространенная в наши дни, также может (и не редко) привести к гипертензии глаза. Патогенез ее не может пока считаться полностью выясненным. Правильный диагноз определяет и правильную лечебную тактику, которая сводится к отмене лечения стероидами. Если это сделано своевременно, то «стероидная гипертензия» исчезает самостоятельно.
Вместе с тем глаукома на афакичном глазу может быть и первичной. Заболевание может впервые проявить себя уже после экстракции катаракты.
Согласно нашему опыту, наилучшие результаты у этих больных дает иридоциклоретракция. Однако если и иридоциклоретракция не привела к успеху и угол передней камеры остается закрытым, то показана повторная попытка его открытия. Производят циклодиализ в зоне бывшей иридоциклоретракции. Затем между двумя ранее введенными имплантатами вводят третью склеральную ножку, аналогично первым двум («трехточечная» иридоциклоретракция) . Мы имели возможность убедиться в эффективности этого метода, когда все другие оказывались безуспешными. Если угол передней камеры в зоне иридоциклоретракции открыт, а гипертензия держится, то показана трабекулэктомия между имплантатами.
Абсолютная болящая глаукома. Абсолютную болящую глаукому многие офтальмохирурги считают показанием к энуклеации. В пользу этой точки зрения имеется ряд доводов. Один из них — возможность существования опухоли в слепом глазу.
Вместе с тем глаз, даже слепой, представляет собой большую косметическую ценность. Существует несколько путей устранения болевых ощущений при сохранении глаза. К ним, естественно, следует прибегать при наличии уверенности в отсутствии внутриглазной опухоли (новые возможности для этого дает, в частности, ультразвуковая эхография) и при удовлетворительном внешнем виде глаза.
Неплохие результаты часто могут быть достигнуты алкоголизацией ресничного узла. Производят ретробульбарную инъекцию новокаина (2 мл 2% раствора). Иглу не извлекают. Через 5 мин через нее другим шприцем вводят 1,5—2 мл абсолютного 96% этилового спирта (некоторые авторы рекомендуют пользоваться 50% растворами). Эффект обычно наступает немедленно. Продолжительность его различна: от нескольких недель до года и дольше. Часто после такой процедуры в течение 10—14 дней держится умеренный отек век; больной должен быть об этом пре-248
дупрежден. При рецидиве болей процедуру можно повторять неоднократно.
Более радикальной мерой является оптикоцилиарная невр-эктомия. Операцию обычно производят под местной анестезией (как при энуклеации). Делают разрез конъюнктивы в наружной половине глазного яблока от 6 до 12 часов на расстоянии 7 мм от лимба. Производят тенотомию наружной прямой мышцы. Накладывают зажим Пеана на зрительный нерв. После 5—10 мин ожидания рассекают зрительный нерв ножницами перед зажимом. Глазное яблоко вывихивают задним отделом вперед; склеру заднего полюса тщательно очищают от примыкающей ткани (в которой проходят и цилиарные нервы). Снимают зажим с культи зрительного нерва.
При отсутствии кровотечения глазное яблоко репонируют. Конъюнктиву зашивают непрерывным швом. Шов на мышцы не нужен и даже нецелесообразен (большая склонность к появлению косоглазия). Накладывают давящую повязку.
В некоторых случаях косметический вид глаза с абсолютной глаукомой может быть неудовлетворителен также в связи с дистрофическими изменениями роговицы. Весьма удовлетворительные результаты (с точки зрения внешнего вида) может дать в таких случаях подбор косметических контактных линз (жестких или мягких).
Повторные операции. Если антиглаукоматозная операция не нормализовала внутриглазное давление, то необходимо в первую очередь решить, удалось ли достичь запланированных структурных сдвигов в глазу или нет. Так, например, при недостаточном эффекте от иридоциклоретракции необходимо прежде всего определить, удалось ли открыть угол между аутоимплаптатами. Дальнейшая тактика полностью зависит от этого. Если угол открыт, то налицо хирургический успех, непосредственная задача иридоциклоретракции выполнена, и, следовательно, необходимо вмешательство совершенно иного рода (например, трабекулэктомия). Если же угол между имплантатами закрыт, то ситуация остается в принципе прежней и требуется повторная операция того же типа (например, повторная иридоциклоретракция в третьей точке).
Последующее изложение и рекомендации касаются основных из описанных выше операций: иридэктомии, иридоциклоретракции, трабекулотомии, синусотомии. По отношению к каждой из этих операций рассмотрены две ситуации: а) намеченный анатомический результат не достигнут, ситуация остается принципиально прежней; б) намеченный анатомический результат достигнут (хирургический успех); сложилась новая ситуация, улучшающая прогноз.
Иридэктомия, а) Намеченный анатомический результат не достигнут — угол передней камеры остается закрытым. Возможные причины: не иссечен пигментный листок радужки, обширные гониосинехии, хрусталиковый блок.
249
При остающемся пигментном листке радужки — повторная иридэктомия. Обширная синехиальная блокада требует иридоциклоретракции. В случае хрусталикового блока показана комплексная медикаментозная терапия, в критических ситуациях — опера-ция.
б) Намеченный анатомический результат достигнут — угол передней камеры открыт. Необходима операция на интрамуральных путях (чаще всего трабекулэктомия).
Иридоциклоретракция. а) Намеченный анатомический результат не достигнут — угол передней камеры между имплантатами закрыт. Возможные причины: ведущая роль хрусталикового фактора в развитии блокады угла. Производят иридоциклоретрак-цию с введением добавочного третьего аутоимплантата в середине между двумя («трехточечная» иридоциклоретракция).
б) Намеченный анатомический результат достигнут — угол передней камеры между аутоимплантатами открыт. Требуется операция на интрамуральных путях оттока внутриглазной жидкости (чаще всего трабекулэктомия).
Трабекулотомии и трабекулэктомия. а) Намеченный анатомический результат не достигнут — при гониоскопии не видно щели в трабекулярной зоне или в этом месте имеется спаяние с корнем радужки, отростками ресничного тела, экватором хрусталика. Возможные причины: недостаточно широкий угол передней камеры в зоне операции, неправильное положение резецированной полоски при трабекулэктомии (кпереди или кзади от трабекулярной зоны), неточная локализация венозного синуса склеры при трабекулотомии.
При слишком узком угле передней камеры и спаянии зоны вмешательства с корнем радужки, отростками ресничного тела или хрусталиком попытка разделить сращения обычно безуспешна. Целесообразно повторное вмешательство в другом секторе. При отсутствии сращений в зоне вмешательства возможна повторная операция в том же секторе (синусотрабекулотомия или трабекулэктомия).
б) Намеченный анатомический результат достигнут — при гониоскопи видно место операции; сращений в этой области нет.
Необходима операция на интрасклеральных путях, обычно синусотомия, в том же смежном секторе.
Синусотомия, а) Намеченный анатомический результат не достигнут. При гониоскопии видно, что синус не вскрыт — фильтрации под конъюнктиву не было с первых дней операции. В некоторых случаях есть признаки вскрытия синуса, но отмечается приращение корня радужки к зоне вмешательства. Необходима повторная синусотомия в той же зоне с тщательной локализацией венозного синуса склеры.
б) Намеченный анатомический результат достигнут — при гониоскопии видно, что синус вскрыт. Сращения зоны вмешательства с корнем радужки. Скорее всего имеется сопутствующая трабекулярная недостаточность. Показана операция на трабекуляр-
250
вой эоне (при спаяниях с корнем радужки лучше выбирать место в стороне).
Если повторная синусотомия не приводит к успеху, то представляется возможным использовать то обстоятельство, что стенка глаза в области синусотомии истончена за счет наружных слоев, имеющих большой регенерационный потенциал. Внутренние слои склеры имеют гораздо меньшую склонность к пролиферации. Поскольку истончение уже было сделано ранее (при вскрытии наружной стенки синуса), появляется возможность произвести вмешательство без формирования конъюнктивального лоскута и препаровки субконъюнктивальной рубцовой ткани. Таким образом, в некоторой мере устраняется еще один важный и активный источник рубцевания.
Метод, основанный на этих предпосылках, был разработан нами и описан под названием «дисцизия угла передней камеры». Операция малотравматична, и нам приходилось выполнять ее под инстилляционной анестезией (троекратное закапывание 1% раствора дикаина). Однако при отсутствии достаточного опыта ее лучше производить после обычной подготовки. Достаточно произвести анестезию под верхнюю прямую мышцу (перед наложением уздечного шва) и инъекцию новокаина под конъюнктиву в области бывшей синусотомии.
Конъюнктива должна быть хорошо отделена слоем новокаина от подлежащей склеры («ложе» бывшей синусотомии). Если это не удается сделать инъекцией, следует ввести под конъюнктиву лезвие ножа Грефе (вкол сбоку в 6—7 мм от лимба) и его движениями добиться полного разъединения всех сращений и свободной смещаемости конъюнктивы по поверхности глазного яблока. Большое неудобство в этот момент может представить субконъюнктивальное кровоизлияние, поэтому для субконъюнктивальной инъекции следует добавлять в повокаин также раствор адреналина (10—15 капель па 10 мл 2% раствора новокаина). Если кровоизлияние все же произошло и вымыть кровь из-под конъюнктивы не удалось, целесообразно отложить операцию до рассасывания кровоизлияния.
После отделения конъюнктивы от склеры производят основной этап вмешательства. Нож Грефе (с возможно узким лезвием) вкалывают в переднюю камеру косо через роговицу у лимба, обычно снаружи, в меридиане, образующем примерно 90° с областью дисцизии (если область дисцизии как обычно находится сверху, нож вводят в горизонтальном меридиане). Затем конец ножа проводят через переднюю камеру к ее углу в зоне бывшей синусотомии (чаще всего к области 11—1 часа). Конец ножа выкалывают сквозь склеру в намеченной области так, чтобы он оказался под конъюнктивой (не перфорируя ее!). Одним движением лезвия расширяют разрез до 4—5 мм, причем место вкола служит как бы точкой вращений. Все вмешательство следует выполнять достаточно быстро во избежание опорожнения передней камеры. После дисцизии в переднюю камеру вводят пузырек
251
воздуха; при отсутствии колобомы радужки надо следить, чтобы он не закрывал область зрачка (опасность зрачкового блока!).
Течение послеоперационного периода, как правило, гладкое. При благоприятном исходе в области дисцизии формируется хорошая фильтрационная подушечка. Операцию можно повторять. Как правило, это позволяет обойтись без более травматичных традиционных операций.
Лазерное лечение глаукомы
При всех несомненных успехах микрохирургии глаза становится очевидным, что как бы ни были велики достижения в технике микроманипуляций, как бы ни было мало по размерам режущее лезвие, все же даже максимальный потенциал его возможностей несоизмерим с задачей исправления патологии микроструктур тончайшей по строению фильтрующей зоны глаза. В связи с этим неизбежно встает вопрос о поисках путей «безножевой» микрохирургии.
Уникальные возможности для этого представляет лазерный луч, с помощью которого можно производить операции на оболочках глаза или внутри глаза, не вскрывая его полость, т. е. без разреза стенки. Луч лазера может быть сфокусирован в точечное световое пятно, которое как бы играет роль «лазерной иглы» или «лазерного ножа». Возможность такой точной фокусировки выгодно отличает лазерный луч от обычного светового луча, фокусировке которого мешает хроматическая аберрация (лазерный луч монохроматичен). Наши исследования в области лазерного лечения глаукомы начаты в 1970 г. Применение лазеров в общей хирургии, дерматологии, оториноларингологии известно уже сравнительно давно. В офтальмологии лазерные методы также применяются уже в течение многих лет, главным образом при патологии глазного дна (отслойка сетчатки, диабетическая ретинопатия и т. д.). Конкретные цели и задачи использования энергии лазера для лечения глаукомы требуют, однако, разработки специальных методик, а в ряде случаев и нового технического оснащения, которое во многих случаях должно радикально отличаться от применявшегося ранее при патологии глазного дна.
В офтальмологии до последнего времени использовался главным образом тепловой эффект лазерного излучения, т. е. так называемая лазеркоагуляция. В какой-то мере она может быть использована и при глаукоме. Однако ожог тканей в области фильтрующей зоны может быть весьма неблагоприятным сопутствующим фактором. Реактивное воспаление, вызванное им, способствует облитерации созданных каналов, фильтрации внутриглазной жидкости, развитию спаек и т. д. Между тем, с теоретической точки зрения, биологическое действие лазерного излучения далеко не ограничивается термическим эффектом. Комплекс реакций, возникающих в зоне лазерного облучения, обобщен в известной схеме, разработанной A. Bruma. В несколько модифи-252
Схема. Эффект лазерного излучения
цированном и упрощенном нами варианте она выглядит следую-щи.м образом (схема).
В зависимости от типа лазерного излучения и его дозы на первый план в общем эффекте выступает та или иная группа компонентов. В физике их делят на две основные группы, обозначаемые терминами «тепловые» и «нетеплавые» эффекты.
Нами впервые поставлен вопрос об использовании нетепловых эффектов лазерного излучения для лечения глаукомы. Теоретическая обоснованность этой идеи была подтверждена лауреатом Нобелевской премии акад. А. М. Прохоровым, к которому мы обратились за консультацией: он же наметил основные пути реализации этой идеи на практике. Для того чтобы уменьшить тепловое (коагулирующее) воздействие и вывести на первый план нетепловые (механические) компоненты, необходимо сделать лазерный импульс насколько возможно коротким. При импульсах порядка 10-6 с (миллионные доли секунды) и короче нетепловые эффекты составляют около 1% в общем результате [Goldman Н.,
253
•ЛЗысотэ импульса.мм
Время, мс
442. Различия в структуре модулированного (1) и немодулированного (2) лазерного импульса.
Rokwell S., 1971]; это позволяет практически избежать теплового ожога ткани. Упрощая, можно сказать, что за время столь короткого лазерного импульса ткань не успевает нагреться настолько, чтобы тепло передалось на окружающие зоны. В точке же воздействия, т. е. в фокальном пятне лазерного пучка, ткань «испаряется», причем образуется облачко ионизированной плазмы. Этот конечный эффект можно сравнить с «микровзрывом» и «микро-пупкцией>1, которые играют роль своего рода световой иглы, пунктирующей тот или иной участок ткани на пути оттока внутриглазной жидкости. Короткие импульсы такого рода могут быть получены на практике с помощью так называемых модулированных лазеров.
Импульс обычного, немодулированного (10-3 с) лазера (например, в отечественных установках ОК-1 и О К-2) фактически состоит из множества мелких пиков (рис. 142). В модулированных лазерах энергия выделяется в виде одного пика (его иногда называют гигантским). Различие в действии обычного («теплового») и модулированного («холодного») лазерного импульса может быть наглядно продемонстрировано на обычной спичке. Ее легко зажечь обычным импульсом. С помощью модулированного импульса можно разрушить головку спички, не воспламеняя ее (рис. 143), используя модулированную лазерную установку «Ятаган» на основе рубинового кристалла (рис. 144); попытки создать подобные установки предпринимаются в настоящее время также за рубежом (например, на основе неодимовых лазеров). Так или иначе, все эти разработки означают признание обоснованности поиска путей разработки лазеров с короткими импульсами, которые уже получили название «холодные». Следует еще раз подчеркнуть, что именно модулированный импульс, а не излучающая субстанция лазера (будь то рубин, неодим и т. д.) обусловливает «холодный» характер биологического эффекта.
254
143, Различия в действии модулированного (а) и немодулированного (б) ла-верного импульса.
Одна из нелегких технических задач, которые приходится решать при создании офтальмологических лазерных установок — адаптации лазера к щелевой лампе или операционному микроскопу. Уникальный путь решения этой задачи был реализован в пос-
144. Отечественная лазерная установка «Ятаган-2» для лечения глаукомы модулированными лазерными импульсами.
255
педней из модулированных лазерных установок, созданных под руководством А. М. Прохорова (прибор «Двина»). Лазерная головка помещена в ней полностью в корпусе стандартной щелевой лампы, в связи с чем вообще нет необходимости в использовании световодов, соединяющих источник лазерной энергии с офтальмологической аппаратурой, т. е. обычно со щелевой лампой. Для выполнения некоторых лазерных процедур на углу передней камеры (лазерная гониопунктура) требуются контактные линзы. Количество энергии, сконцентрированное в одном модулированном импульсе, настолько велико, что гониолинза, особенно ее контактная поверхность, может быть повреждена (кратерообразные дефекты, трещины и т. п.). При использовании гониопризм или зеркальных гониоскопов (по типу гониоскопа Гольдмана), как правило, повреждается покрытие на отражающей поверхности. '
В связи с этим в повседневной практике мы используем главным образом гониолинзы «прямого» наблюдения, схожие с операционной гониолинзой М. М. Краснова. Однако и в этом случае необходимо следить, чтобы фокальное пятно лазерного пучка не располагалось слишком близко от контактной поверхности гониолинзы, что может вызвать ее разрушение, а также повреждение поверхности роговицы мелкими осколками стекла. Поиски более совершенных гониолинз остаются одним из наиболее важных аспектов проводимых нами в настоящее время исследований по лазеротерапии глаукомы. В последнее время лазеропрочные гониолинзы были разработаны В. С. Акопяном и соавт. (1984).
Наши клинические исследования в области лазерного лечения глаукомы касались в основном разработки следующих конкретных методов: лазерной иридэктомии (термическая и модулированная) при узкоугольной глаукоме, лазерной гониопластики, лазерного фотомидриаза (лазерная эукория), лазерной гониопунктуры (термическая и модулированная) при широкоугольной глаукоме, лазерного циклогониоспазиса (в сравнении с лазерной трабекуло-пластикой по Визу).
В настоящее время установлены достаточно определенные показания к клиническому применению этих методов. В процессе изучения находятся такие методы, как лазерная гониотомия при врожденной глаукоме, а также лазерный циклодиализ, однако делать вывод об их клинической значимости в настоящее время преждевременно. Перспективной представляется возможность комбинированного использования различных типов лазеров на одном и том же глазу.
Общая цель всех наших исследований определялась задачей ограничить сферу применения антиглаукоматозных операций, заменив их амбулаторными лазерными процедурами.
Лазерная иридэктомия. Возможности лазерной иридэктомии были изучены в ряде исследований [Ведмеденко Л. А., 1969; Линник Л. А. и др., 1972; Краснов М. М. и др., 1974; Дроздова Н. М., 1977; Perkins Е. S., Brown N. А. Р., 1975, и др.]. С по-
256
мощью лазеров обычного типа (тепловые) лазерная иридэктомия может быть произведена двумя способами: методом множественных коагуляций слабой или средней интенсивности и методом одномоментной интенсивной коагуляции.
Цель применения метода множественных коагуляций — постепенное углубление дефекта радужки в зоне, намеченной для выполнения иридэктомии, до получения сквозного отверстия. Эту процедуру необходимо повторять 2—3 раза, иногда больше. Используя немодулированный импульсный лазер, Е. Perkins и A. Brown добились успеха в 80% случаев. В нашей практике (М. М. Краснов, В. С. Акопян, Г. М. Никольская, Н. М. Дроздова) с этой целью использовали стандартный аргоновый лазер (фирма «Koherent Radieshn», модель 800). Интенсивность каждого импульса составляла 200—400 мВ, экспозиция 0,1—0,2 с, диаметр фокального пятна 50—100 мкм. Как и другие виды излучений, лазерный луч действует только в тех точках, где» он поглощается. Фотоабсорбентами в теле человека являются преимущественно частицы меланина, в радужке лазерная энергия поглощается главным образом в слое пигментного эпителия и в меньшей мере частицами меланина, рассыпанными в строме. Именно в этих точках поглощение лазерного излучения сопровождается выделением тепловой энергии, коагулирующей стромальные слои.
При использовании метода множественных коагуляций важно предотвратить разрушение заднего пигментного листка до послед-ной стадии лечения. Если в результате передозировки он перфорирован преждевременно, до того как коагулированы передние стромальные слои, то дальнейшие манипуляции в этой зоне успеха по приносят. Хотя при трансиллюминации удается получить яркий рефлекс с глазного дна и зоне лазерных аппликаций, ток жидкости ил задней камеры а переднюю не восстанавливается. В этих случаях необходимо почать процедуру где-то в другом мосте. Как правило, удобными точками являются лакуны радужки, где слой стромы относительно тонкий.
Технику одномоментной (в один сеанс) лазерной иридэктомии с помощью интенсивных термических импульсов разработал R. К. Abrahams (1976). Необходима ретробульбарная анестезия. Первую лазерную коагуляцию обычно производят в одном из горизонтальных меридианов (интенсивность 0,5—1 Вт, экспозиция около 0,2—0,5 с, фокальное пятно 100— 200 мкм). В результате коагуляции ткани по обе стороны от точки лазерной аппликации образуются выбухания; в этих зонах радужка отходит вперед от хрусталика. Следующий импульс направляют на вершину образовавшегося куполообразного выбухания радужки. Он должен быть достаточно сильным, чтобы «прожечь» ее насквозь; обычно для этого требуется экспозиция порядка 1—1,5 с при интенсивности излучения до 1—1,5 Вт.
Можно было предположить, что термальная лазерная иридэктомия будет более успешной на коричневых радужках, которые
17 Руководство по глазной хирургии
257
содержат больше меланина. Однако это в значительной мере нейтрализуется тем, что строма в голубых и серых радужках тоньше. В результате вероятность успеха в том и другом случае достигает примерно 80—85%; при выполнении операции опытным офтальмохирургом она еще выше.
В процессе термальной лазерной иридэктомии весьма часто образуются локальные зоны ожога роговицы или передней капсулы хрусталика. Коагуляция роговицы на пути хода лазерного луча проявляется, как правило, в ее задних слоях (в виде белого пятнышка); признаки коагуляции обычно исчезают в течение 1—2 дней. Ожог капсулы хрусталика в зоне термальной лазерной иридэктомии также выглядит как круглое беловатое пятно; оно не рассасывается, но помутнение не прогрессирует и, оставаясь вне зрачка, не представляет угрозы для зрения.
Использование модулированных лазеров (М. М. Краснов, В. С. Акопян, А. Клатт, Г. М. Никольская, П. И. Сапрыкин) открыло новые возможности для применения лазерной иридэктомии. С их помощью нередко удается получить сквозное отверстие даже в полностью депигментированной строме радужки.
Опыт показал, что единственного модулированного импульса нередко бывает достаточно, чтобы добиться полной иридэктомии. Сходные результаты получили Е. S. Perkins и С. В. Wheeler (1977) с помощью лазера на красителях. С той же целью начали использовать YAG-лазеры.
Вполне оправдывает себя на практике техника двухэтапной иридэктомии с использованием двух лазеров. На первом этапе применяют стандартный (тепловой) лазер, с помощью которого коагулируется строма радужки в зоне, намеченной для иридэктомии (10—20 импульсов с энергией 200—400 мВ, экспозицией 0,1—0,2 с, фокальным пятном 50 мкм). Примерно через l’/г— 2 нед в этом месте образуется очаг атрофии, иногда распространяющийся почти до уровня пигментного листка (рис. 145). На этом этапе единственного импульса модулированного лазера обычно достаточно, чтобы превратить отверстие в радужке из несквозного в сквозное. Умелое использование лазерной техники, как показал наш опыт, позволяет произвести лазерную иридэктомию практически в 100% случаев. В некоторых случаях, однако, мы не добились компенсации внутриглазного давления, поскольку в углу передней камеры уже развились выраженные органические (синехиальные) изменения.
В некоторых случаях пролиферация пигментного эпителия закрывает образованную колобому радужки; для повторной иридэктомии, как правило, бывает достаточно единственного лазерного импульса. Точно таким же образом легко добиться сквозной иридэктомии в тех случаях, когда при хирургической иридэктомии не был удален пигментный листок.
Хотя теоретически гипотензивное действие хирургической и лазерной иридэктомий основано на одном и том же принципе, а именно устранении зрачкового блока, на практике эффект может 258
Н5. Образование атрофического очага радужки в месте ее локальной термокоагуляции лазером.
быть не совсем идентичным, поскольку при хирургической иридэктомии нередко имеет значение дополнительный фактор — филы рация через рану. В связи с этим лазерную иридэктомию « ледуот делать как можно раньше, до образования синехиального блока угла передней камеры.
'Гаким образом, с научной точки зрения, проблема лазерной иридэктомии решена (рис. 146), и перспектива замены ею хирур-
146. Лазерная иридэктомия.
17*
259
гической иридэктомии вполне реальна. Лазерная иридэктомия позволяет также в сущности впервые поставить вопрос об истинной профилактике узкоугольной глаукомы, вернее той ее формы, которая протекает в виде повторных острых приступов. Как известно, вероятность возникновения острого приступа глаукомы на другом глазу, если он ранее возникал на одном, составляет 15—20%. Мы производим профилактическую лазерную иридэктомию всем таким больным, и ни у одного из них заболевание не развилось на другом глазу.
Лазерная гониопластика. Н. Hager и независимо от него нами в клиническую практику была введена процедура коагуляции радужки в прикорневой зоне, что вызывает немедленную ретракцию ее ткани и тем самым способствует освобождению угла передней камеры. Н. Hager (1973) назвал указанную процедуру «тангенциальная коагуляция радужки». Термин «лазерная гониопластика» представляется нам [Краснов М. М. и др., 1974] более удачным; кроме того, он подчеркивает целевую направленность процедуры. Лазерную гониопластику производят с помощью «тепловых» лазеров обычного типа. Коагуляция может быть осуществлена по всей окружности концентрично лимбу, предпочтительно в два приема для уменьшения ожоговой травмы. Стандартные параметры: интенсивность 200—400 мВ (в зависимости от цвета радужки), экспозиция 0,2 с, фокальное пятно 200 мкм. Лазерная гониопластика оказалась эффективной при узкоугольной глаукоме, в том числе при предприступных состояниях. Обычно она является вспомогательной мерой, поскольку действие ее, как правило, временное. Освобождение доступа к углу передней камеры может облегчить осуществление лазерной гониопунктуры в качестве второго этапа лечения. Коагуляция радужки при лазерной гониопластике способствует ускоренному рассасыванию гифем.
Лазерный фотомидриаз (лазерная эукория). При узкоугольной глаукоме нередко встречается такое состояние, когда слишком сильный миоз препятствует назначению более интенсивной мистической терапии: чрезмерное сужение зрачка ведет к еще большему затруднению перехода внутриглазной жидкости из задней камеры в переднюю, а это в свою очередь вызывает усиление явлений относительного зрачкового блока. В этих случаях может быть весьма полезен лазерный мидриаз (возможно, эту процедуру правильнее было бы назвать лазерной эукорией, так как ее цель — восстановление нормального размера зрачка). Лазерные коагуляты (обычно около 15—16) наносят концентрично области зрачка, отступя 1 —1,5 мм от края, обычно в два ряда. Это вызывает его немедленное расширение.
Доза излучения примерно такая же, как при лазерной гонио-пластике. Помимо того что лазерный мидриаз позволяет проводить более интенсивную медикаментозную терапию, он нередко способствует некоторому улучшению остроты зрения и расширению поля зрения, поскольку в хрусталике больных глаукомой часто имеются возрастные изменения и расширение зрачка позво
260
Ляет использовать для зрения более широкую часть оптической юны.
Лазерная гониопунктура при «простой» (широкоугольной) глаукоме. Исследования возможностей лазерного лечения широкоугольной глаукомы представляют собой интерес. Первые шаги в втом направлении были сделаны также с помощью обычных «тепловых» лазеров: немодулированного рубинового и аргонового [Краснов М. М., 1973; Hager Н., 1973; Worthen D М., 1974, и др.]. Проблема также изучена в экспериментах на глазах обезьян и других животных [Краснов М. М. и др., 1974;]. Даже эти первые попытки показали возможность улучшения оттока внутриглазной жидкости в результате лазерной трабекулопунктуры.
При использовании стандартного аргонового лазера можно наблюдать гониоскопически процесс «выжигания» отверстия в трабекулярной зоне. В то же время ожог фильтрационной области склеры сопровождается развитием воспалительного процесса, который приводит к рубцовым изменениям и в конечном итоге к облитерации созданных каналов [Spitznas М., 1977, и др.], поэтому гипотензивный эффект аргоновой лазерной трабекулопункту-|>ы обычно оказывается скоропреходящим. Нами (М. М. Краснов, В. С. Акопян, Г. С. Полунин) проведены исследования с целью определить возможность подавления названных облитерирующих процессов протеолитическими и другими ферментами. Получены оГ)Ц(|дошивающие результаты, свидетельствующие о том, что данный метод может быть использован в клинической практике, особенно в тех клиниках, которые располагают только лазерами с термическим эффектом действия.
Основное внимание в наших исследованиях уделялось использованию принципиально новых путей лазерной гопиопунктуры с помощью модул и роив и п их («холодных») лазеров. Возможности модулированной лазерной гопиопунктуры были изучены предварительно в опытах пн глвзвх обезьян. Результаты патологических исследований показали, что можно добиться разрушения трабекулярной зоны и вскрытия венозного синуса склеры лазерным лучом (рис. 147); в зоне действия импульса часто образуется небольшой циклодиализ (на глазах человека этого отмечено не было). Модулированная лазерная гониопунктура представляет собой несложную процедуру, выполняемую амбулаторно.
Как уже отмечалось, в клинике облучение угла передней камеры производят с помощью контактной линзы «прямого» наблюдения. Необходима только поверхностная анестезия (например, 1—2 капли 0,5% раствора дикаина). Больной смотрит в сторону того сектора угла передней камеры, где планируется сделать го-ниопунктуру (чаще всего книзу, реже в стороны). Лазерный пучок фокусируют на поверхности трабекулярной зоны. Около 20—25 импульсов распределяют примерно на протяжении ’А окружности камерного угла. Энергия каждого импульса составляет около 0,1 Дж, но дозу следует изменять в зависимости от картины, наблюдаемой при облучении. В момент выхода лазер-
261
147. Угол передней камеры (глаз обезьяны).
а — в норме; б — после модулированной лазерной гониопунктуры.
ного импульса в точке прицеливания отмечается яркая вспышка («облачко» плазменного поля), после которой оставляется пузырек газа (испаряющаяся жидкость ткани трабекулярной зоны). Иногда в точках облучения образуются щелевидные или кратерообразные дефекты. Как правило, после первых импульсов отмечается некоторое помутнение (тиндализация) камерной влаги. Иногда появляется кровь из вскрытого венозного синуса склеры. В некоторых случаях в ходе процедуры следует постепенно увеличивать интенсивность лазерного импульса, чтобы поддерживать тот же самый видимый эффект действия от каждого импульса. Точка фокусирования лазерного импульса не должна располагаться слишком близко к ресничному телу, так как это может вызвать кровотечение. Если оно все же возникло, то необходимо слегка надавить на глазное яблоко с целью «тампонировать» кровоточащий сосуд повышенным внутриглазным давлением. Голову больного следует повернуть таким образом, чтобы кровь переместилась в сторону от зоны облучения.
После модулированной лазерной гониопунктуры обычно в течение 2—3 дней отмечается легкое раздражение глаза, которое легко поддается местному лечению с помощью инстилляции стероидных препаратов. В течение первых часов после процедуры нередко наблюдается некоторое повышение внутриглазного давления. В течение последующих дней оно снижается, чаще ниже исходного уровня. По нашим данным, средний гипотензивный эффект одной процедуры модулированной лазерной гониопункту-
262
ры составляет около 10 мм рт. ст. (в более ранних сообщениях мы приводили цифру 8,3 мм рт. ст., но с того времени метод был усовершенствован). Согласно результатам тонографии, отток внутриглазной жидкости после модулированной лазерной гониопунктуры закономерно улучшается: в среднем С составляет 0,08—0,18 до процедуры и 0,16—0,25 через 2 года после лечения [Литвинова Г. Г., 1978].
Для практики особенно важен вопрос о том, как долго сохраняется нормальное внутриглазное давление. В некоторых из наших наблюдений состояние компенсации держалось до 2 лет и дольше. Мы считаем целесообразным продолжать курсы лазерного лечения, если состояние компенсации сохраняется по крайней мере 4—6 мес; если же эффект менее длительный, то обычно следует рекомендовать хирургическое лечение. В связи с этим необходимо упомянуть важный факт: лазерное лечение мы проводили только больным, которым было назначено хирургическое лечение; таким образом, модулированная лазерная гониопунктура была для них последним шансом избежать операции.
В конце 70-х годов F. Wise был разработан метод так называемой лазерной трабекулопластики (ЛТП). Используют обычный (например, аргоновый) лазер с термическим эффектом действия. Прижигания (около 100) производят непосредственно в трабекулярной зоне; применяют излучение довольно высокой интенсивности (до 1 Вт) при короткой экспозиции (до 0,1 с). Эффективность метода отмечают многие авторы. Его гипотензивный эффект объясняют тем, что сокращение (ретракция) трабекулярной ткани в точке коагуляции приводит к натяжению и распределению соседних участков фильтрующей поверхности; вероятно также, что лазерная трабекулопластика может препятствовать развитию коллапса венозного синуса склеры.
В течение последних 8 лет мы с успехом применяем лазер-кон гуляцию в зоне угла передней камеры с той же целью, но при этом удастся избежать прямого повреждения трабекулярной зоны. Как известно, передняя часть ресничного тела тесно связана с трабекулярным поясом. Тракция ресничной мышцы оказывает прямое влияние на способность к оттоку внутриглазной жидкости. По всей вероятности, именно этим объясняется гипотензивное действие мистических средств. Данная процедура получила название «лазерный циклотрабекулоспазис» (рис. 148).
Технически метод очень прост. Применяют стандартный (тепловой) лазер обычного типа. Переднюю поверхность ресничного тела коагулируют в 20—25 точках вплотную к склеральной шпоре. Доза и экспозиция во многом зависят от степени пигментации ресничного тела; эффект можно определить по появлению характерного очага коагуляции на передней поверхности ресничного тела. После процедуры следует принять необходимые меры для подавления воспалительной реакции (кортикостероидные препараты местно, ингибиторы синтеза простагландинов внутрь). Лазерная коагуляция передней части ресничного тела, доступная при
263
148. Лазерный гониоспазис (схема).
достаточно широком угле передней камеры, вызывает немедленное сокращение, а впоследствии и рубцевание его ткани. Образующиеся при этом тракционные силы действуют на трабекулярную зону, улучшая ее проходимость для внутриглазной жидкости. Так же как и при лазерной трабекулопластике, не исключено, что передняя циклокоагуляция и вызываемые ею тракционные силы в известной мере могут противодействовать тенденции к коллапсу венозного синуса склеры.
Гипотензивный эффект иногда отмечается уже в первые дни после процедуры, но на этой стадии он может быть связан с воспалительной реакцией; тракционные силы как следствие рубцевания развиваются через 2—3 нед. В то же время в течение первой недели, так же как и после лазерной трабекуло-пластики, могут наблюдаться эпизоды временной, преходящей гипертензии.
Осложнений после лазерного гониоспазиса не наблюдали. Результаты топографии, как правило, свидетельствовали об улучшении оттока внутриглазной жидкости. Тщательная статистическая проверка клинической эффективности лазерной трабекуло-пластики по Визу и лазерного трабекулоспазиса по М. М. Краснову была проведена Е. Л. Казаковой (1984). Процедуры оказались почти равноценными в отношении как выраженности гипотензивного действия (в среднем 10—12 мм рт. ст.), так и продолжительности сохранения полученных результатов (до нескольких лет и больше).
Очень возможно, однако, что оценка эффективности различных лазерных методов лечения первичной глаукомы пойдет по тому же пути, по которому уже проводили оценку способов хирургического лечения глаукомы. В настоящее время почти нет сомнений в том, что будут выделены формы болезни со специфической симптоматикой, благоприятствующей использованию той или другой методики, а в некоторых случаях — их комбинации. Подобные исследования уже проводятся нами.
Подводя итоги, следует констатировать, что каково бы ни было современное состояние лазерного лечения глаукомы, описанные методы открыли качественно новую область как в научных исследованиях, так и в клинической практике. До настоящего времени были известны два пути лечения глаукомы: медикаментозный и хирургический. С применением лазеров впервые в истории офтальмологии появился третий путь, возможности которого только начинают раскрываться. Насколько можно судить по уже
264
ЖМеющимся в настоящее время данным, своевременное использование лазерных методов позволяет избежать хирургического вмешательства у большинства больных глаукомой, у которых оно Представлялось бы неизбежным всего 10—15 лет назад.
Очень важно, что потенциально лазерное лечение имеет известные преимущества и перед медикаментозной терапией, в частности потому, что гипотензивный эффект не зависит от продолжительности промежутка между закапываниями; что, как Известно, особенно важно в ночное время.
Настоящее руководство предназначено прежде всего для оф-тальмохирургов-практиков, поэтому в настоящем разделе главное внимание уделено известным методам, хорошо зарекомендовавшим себя в клинике, и умышленно не упоминаются некоторые поисковые работы, представляющие пока в основном научный интерес. Вместе с тем любой врач должен видеть перспективу развития той области, в которой он работает, в данном случае — хирургии глаукомы. Вряд ли могут быть сомнения в том, что ее развитие пойдет по пути разработки более специфично ориентированных операций с направленностью воздействия на патогенетические звенья процесса гипертензии для каждой формы болезни. Повсеместный отход от традиционной фистулизирующей хирургии глаукомы очевиден. Соответственно этому в первом издании настоящего руководства еще имелся подраздел, посвященный традиционным операциям, в настоящем издании он уже представляется излишним. По мере развития патогенетически ориентированной микрохирургии глаукомы операции будут становиться все более щадящими и микромасштабными. В свое время Э. Фукс говорил, что достаточно «пощекотать» фильтрующую зону, чтобы она ответила улучшением оттока. Пока еще не решена окончательно проблема, как это сделать на практике. Однако задача осознана, и это главная предпосылка того, что она (будет решена.
Глава 6
Хирургия катаракты
За последние десятилетия в хирургическом лечении катаракты произошли очень большие перемены. Огромную роль в этом сыграло внедрение микрохирургических методов. Во многом изменилась техника операции, значительно расширились показания к ее выполнению. Соответственно возросли требования к исходам операции. Большие успехи достигнуты в борьбе с операционными и послеоперационными осложнениями. Можно без преувеличения сказать, что современная экстракция катаракты, оставаясь одной из самых серьезных полостных операций, становится все более безопасной. Получили широкое распространение такие виды коррекции афакии, как мягкие контактные и интраокулярные линзы кератофакия.
В настоящей главе освещается вопрос об основах современной микрохирургии катаракты и дается описание тех методов, которые зарекомендовали себя как наилучшие за последние годы.
Общая характеристика современной микрохирургии катаракты
Экстракапсулярный и интракапсулярный методы экстракции катаракты. Экстракапсулярный метод экстракции катаракты, исторически более ранний, занимал господствующее положение в течение более полутора веков. Первые предложения удалять катаракту в капсуле с помощью пинцета или выдавливания были сделаны еще во второй половине прошлого века. Постепенно интракапсулярный метод находил все больше сторонников. Однако даже хирургам, виртуозно владеющим техникой, удавалось произвести не более чем у 70% больных интракапсулярное извлечение катаракты с помощью пинцета. При использовании прямой (механической) зонулотомии повышались возможности извлечения хрусталика в капсуле, но это было связано с большим риском потерять стекловидное тело.
Эризофакия создавала большие возможности для извлечения катаракты в капсуле по сравнению с пинцетным способом. Этот метод внедрялся в клиническую практику очень медленно, а в ряде стран, в частности в Советском Союзе, так и не получил широкого распространения. Криофакия (или криоэкстракция), раз-266
работанная в 1961 г. Т. Krwawicz, устранила технические трудности интракапсулярного метода.
Однако экстракапсулярный метод экстракции катаракты не является пройденным этапом в офтальмологии. Более того, он получает все более широкое развитие. Это объясняется его существенными достоинствами, главными из которых являются сохранение задней капсулы, отграничивающей стекловидное тело, и меньшее травмирование оболочек глаза в момент выведения хрусталика.
В настоящее время становится возможным избежать наиболее серьезных недостатков экстракапсулярного метода, особенно развития вторичной катаракты, поэтому он постепенно занимает ведущее положение в микрохирургии катаракты. За рубежом экстракцию катаракты производят преимущественно экстракапсу-лярно.
В течение многих десятилетий хирургическое извлечение хрусталика, как правило, сопровождалось полной иридэктомией. Распространение интракапсулярного метода создало гораздо большие возможности для сохранения круглого зрачка. Это обеспечило хороший внешний вид глаза после операции и более высокие функциональные исходы. В современной офтальмологии экстракция катаракты с круглым зрачком получила почти повсеместное распространение и противопоказаний к ее выполнению практически нет, кроме ригидного узкого зрачка в глаукоматозных глазах.
Ферментативный зонулолизис, его место в современной хирургии катаракты. В 1958 г. J. Barraguer открыл лизирующее действие а-химотрипсина на ресничный поясок (циннова связка). В последующем появились сообщения о том, что для ферментативного зонулолизиса могут быть использованы также обычный химотрипсин и трипсин.
После периода увлечения ферментативным зонулолизисом стали появляться высказывания о необходимости ограничить применение этого метода. Зонулолизис считали показанным в случаях резистентного ресничного пояска, т. е. прежде всего при катаракте в молодом возрасте. Вскоре, однако, было установлено, что интракапсулярная экстракция в детском и юношеском возрасте даже после растворения ресничного пояска может быть опасной. Стекловидное тело в этом возрасте вязкое по консистенции, нередко спаяно с хрусталиком, и выпадение его представляет больше опасности, чем при старческой катаракте. Кроме того, на основании ряда экспериментальных работ было установлено вредное действие протеолитических ферментов на различные оболочки глаза, включая сетчатку. В связи с этим в настоящее время противопоказано использование ферментативного зонулолизиса у больных, не достигших возраста 20 лет. Препарат используют для лечения больных возрастной группы от 25 до 55 лет.
Микрохирургия, в частности при экстракции катаракты, уже в настоящее время дает качественно иные возможности и обеспечивает более высокий уровень всей глазной хирургии.
267
Факоэмульсификация. В 1967 г. С. Kelman предложил принципиально новый способ удаления катаракты с помощью ультразвуковой энергии. Для этой цели был сконструирован специальный прибор.
Принцип метода состоит в том, что через маленький (2—Змм) разрез стенки глазного яблока в переднюю камеру вводят наконечник ультразвукового прибора, в котором заключены носитель низкочастотной ультразвуковой энергии и система ирригации — аспирации, через которую в переднюю камеру подается и отводится сбалансированный солевой раствор. Под действием ультразвуковых колебаний происходит дробление хрусталика до состояния эмульсии; ирригационный раствор, подающийся по системе трубок, вымывает образовавшуюся эмульсию из глаза. Важнейшим компонентом прибора, используемого при проведении операции, является специальная, весьма чувствительная компьютерная система, регулирующая подачу и выведение ирригационного раствора, поддерживая относительно постоянное внутриглазное давление. При так называемых мягких катарактах нет необходимости включать ультразвук, поэтому операция по существу состоит из ирригации — аспирации хрусталиковых масс.
Первым этапом операции после разреза глазного яблока является вскрытие передней капсулы хрусталика. В первоначальном варианте автор предусматривал вывихивание ядра хрусталика в переднюю камеру. Позднее другие хирурги стали производить дробление ядра в задней камере, что имеет большое значение, поскольку при этом меньше травмируется эндотелий роговицы. В настоящее время данный метод занял ведущее положение.
Этот способ имеет ряд достоинств. Благодаря небольшому (2— 3 мм) операционному разрезу послеоперационный период протекает гладко, в связи с чем продолжительность лечения больных в стационаре составляет всего 1—3 дня.
В результате успешного выполнения факоэмульсификация достигается состояние, аналогичное тому, которое получается после экстракапсулярной экстракции катаракты. Однако благодаря полному удалению вещества хрусталика вероятность развития вторичной катаракты и факогенных воспалительных процессов значительно уменьшается.
Сохранение задней капсулы хрусталика имеет свои преимущества: меньшая вероятность развития осложнений со стороны стекловидного тела и сетчатки, лучшие перспективы последующих операций по поводу глаукомы или кератопластики. В связи с этим экстракапсулярная методика экстракции катаракты занимает все более прочное место в микрохирургии катаракты. Отсутствие астигматизма создает особенно благоприятные условия для подбора контактных линз. Факоэмульсификация может заканчиваться введением интраокулярной линзы, особенно в случае монокулярной афакии. Не исключено, что факоэмульсификацию можно использовать для удаления катаракты в поликлинике.
268
В нашей стране метод получил широкое распространение. Однако необходимо знать о существовании показаний и противопоказаний к его применению.
Факоэмульсификация показана при: 1) возрастных зрелых и незрелых катарактах без резко выраженного склероза ядра; 2) врожденных катарактах; 3) травматических катарактах; 4) в некоторых случаях подвывиха и вывиха хрусталика.
Метод может быть применен наряду с криоэкстракцией.
Противопоказаниями к выполнению факоэмульсификации являются: 1) пленчатые катаракты; 2) сопутствующая глаукома с узким и закрытым углом передней камеры; 3) бурая катаракта у больных старше 60 лет; 4) наличие признаков эпителиальноэндотелиальной дистрофии роговицы; 5) небольшое количество эндотелиальных клеток (менее 1500 в 1 мм2).
Обследование больного с катарактой
На протяжении почти всей истории хирургии катаракты п о-казанием к операции считалась так называемая зрелость катаракты. Это обусловлено том, что полноценное удаление хрусталиковых масс, необходимое как для лучшего визуального исхода операции, так и для профилактики факогенных воспалительных процессов, было возможно только при полной зрелости катаракты. В последние десятилетия в связи с повсеместным распространением интракапсулярного метода операции, а также разработкой принципиально новых видов экстракапсулярного метода вопрос о показаниях к данной операции пересмотрен. В связи с возможностью удалять хрусталик в капсуле или выводить хрусталиковые массы экстракапсулярпым методом степень зрелости катаракты утрачивает свое значение.
Н современной хирургии катаракты показания к операции целесообразно условно разделить па медицинские и профессионально-бытовые.
К медицинским показаниям относят:
1) перезрелую катаракту, особенно при наличии симптомов факолитической глаукомы;
2) набухающую катаракту, особенно при мелкой передней камере и узком или почти закрытом угле передней камеры, в связи с чем существует опасность возникновения острого приступа глаукомы;
3) вывих, а в некоторых случаях и подвывих хрусталика;
4) аномальные формы хрусталика;
5) факогенетическую глаукому (понимая под этим термином факотоксическую, факолитическую, анафилактическую и другие виды глауком);
6) циклолентикулярный блок, не поддающийся лечению медикаментозными средствами;
7) необходимость исследования глазного дна при сопутствующих заболеваниях, требующих лечения под контролем офтальмо
269
скопии или с помощью лазерных методов (диабетическая ретинопатия, отслойка сетчатки и др.);
8) необходимость осуществления витреофагии при непрозрачном хрусталике.
Профессионально-бытовые показания определяются главным образом остротой зрения, полем зрения и степенью бинокулярного зрения, которое необходимо больному в привычной для него деятельности (на работе и в быту). Таким образом, в каждом конкретном случае прямые показания к экстракции катаракты могут быть различными в зависимости от профессии больного (например, водители транспортных средств, хирурги, научные работники и др.). На практике не так уже редко стали производить экстракцию катаракты при остроте зрения 0,4—0,5, В то же время, если больной не должен читать и выполнять тонкую работу на близком расстоянии, то вполне можно выжидать снижения остроты зрения до 0,2—0,1.
К профессионально-бытовым показаниям можно также отнести и косметические, когда операцию производят, например, для того, чтобы зрачок приобрел нормальный черный цвет. Однако в этих случаях необходимо особенно строго предупредить больного о риске, связанном с операцией, а также заранее решить вопрос об оптической коррекции афакии в послеоперационном периоде.
Вопрос о наличии одно- или двусторонней катаракты чрезвычайно важен при выборе времени выполнения оперативного вмешательства. При этом, несомненно, в первую очередь необходимо учитывать профессиональную потребность в качестве зрения (его острота, поле зрения, бинокулярное зрение). Профессиональная потребность в бинокулярном зрении является прямым показанием к операции при односторонней катаракте. В этом случае сразу должен быть решен вопрос и о коррекции односторонней афакии (контактные или интраокулярные линзы).
Безусловным показанием к операции при односторонней катаракте является ее набухание, сопровождающееся повышением внутриглазного давления. Подобная ситуация возможна и при перезрелой катаракте. Относительным показанием к операции могут служить косметические соображения.
Операция при двусторонней катаракте показана в том случае, если больной не может выполнять привычную работу.
В настоящее время имеются широкие возможности коррекции афакии. Однако когда решается вопрос о профессиональной деятельности, способ коррекции афакии должен быть выбран да от рации [очки (обычные и изейконические), кератофакия, контактные линзы, интраокулярные линзы].
Важное значение при выборе метода хирургического лечения имеет возможность определить свойства хрусталика до операции. Каждый способ удаления катаракты (интра- или экстракапсу-лярный) может быть более целесообразным и эффективным при одних свойствах хрусталика и малоподходящим—при других. Так, например, для использования пинцетного способа необхо-
270
дико, чтобы капсула захватывалась в складку, т. е. не была туго натянута. Даже в отношении криофакии — в значительной мере «универсального» способа, получившего в современной хирургии катаракты наибольшее распространение, — существуют обстоятельства, облегчающие или затрудняющие ее выполнение. В связи с этим важно, чтобы хирург, планируя операцию, имел представление о свойствах хрусталика и мог бы на этом основании выбрать наиболее оптимальный метод в каждом конкретном случае.
Определение свойств хрусталика перед операцией осуществляют главным образом с помощью биомикроскопии. Для того чтобы выбрать наиболее целесообразный способ извлечения хрусталика, хирургу необходимо иметь представление о следующих его свойствах: состоянии передней капсулы (толщина и натянутость), величине ядра, состоянии задней капсулы и ресничного пояска (прочность). Последнее не относится прямо к свойствам хрусталика, но влияет на ход операции.
«Шагрень» передней капсулы хрусталика, рассматриваемая как мелкая складчатость, свидетельствует о ее слабом натяжении. В этом случае можно планировать захват капсулы в складку «, следовательно, в случае необходимости применить для извлечения хрусталика пинцетный способ (со слабым натяжением капсулы нередко сочетается наличие субкапсулярных вакуолей). II рп этом важно учитывать разную толщину капсулы на различных участках: следует захватывать ее пинцетом ближе к экватору, где толщина капсулы составляет 15—25 мкм.
Наличие перламутрового блеска помутневшего хрусталика и водяных щелей, как известно, свидетельствует о набухании вещества хрусталика. В подобных случаях капсула натянута, что обычно сопровождается отсутствием «шагрени». Попытка захватить капсулу пинцетом приводит, как правило, к ее разрыву. Таким образом, признаки набухания являются противопоказанием к использованию пипцотпого способа экстракции катаракты.
О дряблости и непрочности капсулы можно судить по состоянию ядра хрусталика: при большом буром возрастном ядре хрусталика капсула, как правило, дряблая и легко рвется при контакте с инструментом. В подобных ситуациях наиболее эффективна криоэкстракция.
Расположение помутнения под задней капсулой хрусталика, характерное для осложненных помутнений, нередко отмечается при обычных старческих катарактах, хотя это клинически не так заметно из-за сопутствующих помутнений в возрастном ядре. Диагностировать помутнение под задней капсулой хрусталика при обычной старческой катаракте можно только при хорошей технике биомикроскопии и, естественно, при том условии, что лежащие впереди слои еще не полностью помутнели. Если заднюю капсулу на глазу, на котором предстоит произвести операцию, нельзя исследовать с помощью щелевой лампы, то о состоянии ее с большой степенью достоверности можно судить по второму глазу, так как характер помутнения с обеих сторон, как правило,
271
одинаков. В любом случае наличие помутнений под задней капсулой является прямым показанием к интракапсулярной экстракции катаракты, так как остающаяся после применения экстра-капсулярного метода задняя капсула не будет достаточно прозрачной для того, чтобы обеспечить удовлетворительную остроту зрения. При использовании же экстракапсулярного метода в подобной ситуации необходимо планировать специальную «обработку» задней капсулы хрусталика.
Иридо- и факоденез, которые лучше определять с помощью щелевой лампы, обычно свидетельствуют о слабости ресничного пояска; появление этих симптомов может указывать также па разжижение стекловидного тела. При наличии иридо- и факоде-неза хрусталик обычно извлекается легко. Признаки, позволяющие установить расположенность к выпадению стекловидного тела в ходе операции, недостаточно достоверны. Однако создается впечатление, что подобная тенденция (отсутствие коллапса после разреза, выбухание радужки в рану и т. д.) несколько чаще отмечается при узком угле передней камеры.
Таким образом, по результатам биомикроскопического исследования можно с большой степенью достоверности судить о ряде свойств хрусталика, которые во многом определяют выбор наиболее оптимального подхода к извлечению хрусталика из глаза.
При современном развитии совершенных технических средств для экстракции катаракты необходимость тонкой ориентировки в свойствах оперируемого хрусталика не утрачивает своего значения. Для тех хирургов, кто вследствие тех или иных обстоятельств использует традиционные методы, предоперационное определение особенностей катаракты, подлежащей удалению, имеет первостепенное значение. Для хирургов, полностью перешедших на современные методы операции с использованием новейших технических средств, определение свойств хрусталика перед операцией также играет определенную роль, поскольку в настоящее время, как уже отмечалось, наблюдается определенная тенденция к возрождению экстракапсулярной экстракции катаракты на новом техническом уровне. Таким образом, необходимо ставить вопрос не о том, какой способ операции наилучший, а о том, какой из них наиболее показан данному больному. При этом незаменимой является биомикроскопия.
Прогноз операции целесообразно рассматривать с двух позиций: как хирургический, и как функциональный. Под хирургическим прогнозом подразумевают ход операции и ее исход. Об этом в значительной степени можно судить в предоперационном периоде по свойствам хрусталика, радужки, ресничного пояска и т. д. (этот вопрос освещен выше). Что же касается функционального прогноза, то он во многом зависит от сопутствующих заболеваний, которые могут повлиять на состояние сетчатки или зрительно-нервных путей. В связи с этим установление визуального прогноза зависит от результатов исследования нервно-рецепторной части зрительного анализатора в условиях мутных 272
вред. Классическим, хотя и примитивным, способом установления визуального прогноза является определение проекции света. Вместе с тем значение этого симптома не следует преувеличивать. Так, например, светопроекция может быть правильной при отслойке сетчатки (при исследовании с ярким объектом), центральных скотомах, даже больших, и т. д. В то же время светопроекция может быть неправильной при резко выраженном склерозе ядра хрусталика, суженном поле зрения, слишком узком зрачкег перезрелой катаракте, у недостаточно контактного больного' и т. д.
Практически, если глазное дно недоступно офтальмоскопии из-за наличия катаракты, но больной различает направление движения ладони врача (вправо, влево, вверх, вниз), даже при неспособности считать пальцы, визуальный прогноз, как правило, удовлетворительный.
Исследование поля зрения дает гораздо большие возможности, чем определение проекции света. Однако этот метод не лишен недостатков. Мы уже упоминали об отслойке сетчатки. Мелкие скотомы обычно определить нс удается, а более выраженные, наоборот, выглядят крупнее, чем на самом деле. Кроме того, трудно судить о положении скотом, в частности являются ли они действительно Центральными, что, с практической точки зрения,, чрезвычайно важно. В связи с этим важное значение могут иметь, нннримор, такие методы, как исследование феномена Гайдинге-ра, аутоофтальмоскопия, механофосфены, проба на цветоощущение. Умелое использование их часто позволяет довольно уверенно прогнозировать степень остроты зрения после операции (с точностью до ±0,1).
Техническое оснащение микрохирургии катаракты
За всю историю развития экстракции катаракты было предложено очень много разновидностей инструментов. Ниже приведены самые основные из них — режущие инструменты, иглы, пинцеты и инструменты для извлечения хрусталика.
Режущие инструменты. Соответственно двум типам разреза, используемым при экстракции катаракты, наибольшее распространение получили линейный нож, копьевидный нож и роговичные ножницы. В последние годы, как правило, применяют инструменты со сменной режущей частью, например в виде осколков бритвенных лезвий.
Ряд изменений внесен в конструкцию ножниц для расширения корнеосклерального разреза. Во многих современных типах ножниц совершенно изменена конструкция части, находящейся в руке хирурга. Рабочая часть изогнута соответственно форме катарактального разреза, бранша, вводимая внутрь глаза, несколько длиннее, с притупленным концом. Ножницы изготовляют в двух вариантах — для проведения разреза в левую и правую стороны
18 Руководство по глазной хирургии 273*
149. Роговичные ножницы (правые, левые).
(рис. 149). Благодаря применению модифицированных ножниц процедура проведения разреза с помощью ножниц стала более щадящей и удобной. Некоторые хирурги вскрывают переднюю камеру на 2 часах, а разрез ножницами производят полностью в левую сторону.
Наряду с классическим разрезом заслуживает внимания так называемый разрез с обратным профилем (субсклеральный), предложенный М. М. Красновым (1968, 1978). Ход разреза в слоях стенки глазного яблока соответствует положению лимба; несильно надавливая и производя вращательные движения трепаном, делают разрез ткани (рис. 150). Глубокие слои разрезают ножницами. Разрез такого типа можно произвести также бритвенным лезвием.
Иглы. Благодаря разработке новых типов игл появилась возможность осуществлять хорошую герме
тизацию ран и разрезов, которая раньше была невозможной из-за травмы, наносившейся при этом
глазному яблоку. Основным в конструкции этих игл является их форма. Края иглы, начинающиеся от кончика, должны •быть обязательно режущими. Трехгранное сечение иглы (как это делалось раньше) нецелесообразно, так как способствует прорезанию иглы через ткань. Заслуженное признание получили иглы •с плоским сечением (по типу удлиненного шестигранника). Такую форму имеет только передняя треть иглы — до места, где
заканчивается ее постепенное утолщение; на остальном протяжении режущие края нецелесообразны. Ушко современных типов игл (если они не атравматические), как правило, делают неразрезным; в краях его имеются специальные бороздки, в которые ложится нить, что уменьшает общий диаметр заднего конца иглы. Наиболее удобная длина иглы, применяемой для обычной офтальмо хирургии, 7—9 мм.
В связи с появлением микрохирургической техники возникла необходимость использовать иглы длиной 4—5 мм. Это в свою очередь повлекло за собой создание специальных иглодержателей (рис. 151).
Пинцеты. Пинцеты используют на всех этапах экстракции катаракты с различными целями. Из наиболее общих современных тенденций следует отметить: 1) широкое применение полукруглых ручек или бранш с отверстиями, обеспечивающих более удоб-
274
4
150. Трепан для разреза с «обратным» профилем (а), схематическое изобра-t жение различных видов разреза (б).
Ц 1 — разрез, произведенный трепаном; 2 — ножом Грефе; 3 — ножницами. Стрел-Ж ни — направление движения лезвия.
ное положение инструмента в руке хирурга; 2) разработку хирургических пинцетов с исключительно тонкой рабочей частью и мелкими зубцами (рис. 152).
Инструменты и приборы для извлечения хрусталика (пинцеты, эризифаки, криофаки). Пинцеты для интракапсулярной экстракции катаракты сравнительно мало изменились по сравнению с первоначальными конструкциями. Наиболее часто применяют пинцеты с ложкообразными губками. В некоторых конструкциях используют перекрещенные бранши, что обеспечивает постоянную силу захвата капсулы хрусталика в складку.
Многочисленные варианты эриэифаков различаются главным образом конструкцией присасывающей чашечки и разрежающего вакуумного устройства. В клинической практике используют преимущественно простые конструкции эризофаков с резиновым или силиконовым баллоном. Из различных вариантов чашечек эризифака наибольшее распространение получила конструкция с бортиком на внутренней поверхности края, который
181
275
151. Иглодержатель.
прикладывают к хрусталику. Бортик препятствует блокированию отверстия соединительной трубки.
Первый в России эризифак был создан Д. Л. Глинским (1908). Он был изготовлен из серебра, позволял производить экстракцию катаракты в капсуле, без иридэктомии. Однако этот эризифак был незаслуженно забыт.
Б. С. Парадня (1973) сконструировал и применил на практике эризифак оригинальной конструкции (рис. 153; авт. свид. № 316447). Новизна его заключается в том, что в головку штуцера эризифака вмонтирована на стойке пластинка из нержавеющей стали, которая предохраняет от закупорки отверстие впаянной в головку иглы, соединяющей ее с вакуумным резиновым баллончиком. Кроме того, эта пластинка образует со
•стенкой головки круговую щель, в которую всасывается капсула хрусталика, в результате чего формируется складка по типу зам'
152. Пинцеты для микрохирургических операций.
а — калибри; б — хирургический; в — для снятия швов.
153.
IIpii3n<ji,iк Парадпп.
a — схема: 1 — головка штуцера, 2 — ядро. 3 — хрусталик, б — набор штуцеров.
б
ка, обеспечивая надежный захват и удержание хрусталика в период его выведения. Для удобства пользования инструмент состоит из набора штуцеров, которые имеют разный диаметр головки — от 2,4 до 5 мм, а также разную ширину между пластинкой и стенкой головки штуцера — от 0,5 до 1,5 мм. Инструмент имеет явные преимущества перед описанными ранее эризифаками, что подтверждает опыт выполнения более 400 операций.
Что касается криофаков (криоэкстракторы), то, как известно, для достаточно прочного примораживания хрусталика к концу рабочей части инструмента резкое охлаждение нерационально, так как кристаллы льда, образующиеся в месте контакта, слишком мелкие. Большинство исследователей считают оптимальной температуру —30 —50 °C.
В большинстве простых конструкций криофаков, начиная с первого из них, предложенного Т. Krwawicz (1961), в качестве
277
охлаждающего агента использовали конденсированную углекислоту — так называемый сухой лед. В некоторых конструкциях применяют снег или спрессованный из него цилиндр — «криопилюлю».
Основу простых конструкций в криофаках составляет металлический (обычно медный) стержень, заключенный в оболочку, предохраняющую руку хирурга от резкого охлаждения. Существуют также простые конструкции криофаков, основой которых служит шприц с баллоном, наполненным охлаждающим агентом. Реже, чем углекислота, для охлаждения криофаков используют такие агенты, как хлорэтил, дихлордифлуорометан, жидкий азот.
В Советском Союзе И. X. Полтинниковым и Е. Коленко (1964) разработан полупроводниковый криоэкстрактор, в настоящее время применяется более совершенный прибор «Криотерм». Н. Э. Темиров и А. А. Бочкарева (1982) предложили оригинальный метод гидромониторной факофрагментации и витрэктомии^ который, несомненно, займет достойное место в хирургии катаракт.
Подготовка больного к операции
Обработка операционного поля. В конъюнктивальный мешок инсталлируют 3% раствор колларгола и 30% раствор сульфацил-натрия, а затем промывают его изотоническим раствором хлорида натрия из шприца или ундинки.
Кожу век соответствующей половины лица (до ушной раковины) обрабатывают 70% этиловым спиртом, а затем 3% спиртовым раствором йода с глицерином. Коротко подстриженные бровь и ресницы, а также интермаргинальное пространство смазывают-1% спиртовым раствором бриллиантового зеленого. Операционное поле изолируют стерильной тканью.
В случае необходимости расширить зрачок следует выбирать, такие средства, эффект от действия которых легко снимается после извлечения хрусталика. В связи с этим использовать препараты типа атропина и сколамина нецелесообразно.
Мы предпочитаем оперировать без перчаток. Руки обрабатывают по способу Спасокукоцкого — Кочергина. Обычное положение хирурга при экстракции катаракты (если разрез производят сверху) — за головой больного.
Акинезия. Широко используют метод М. М. Краснова, представляющий собой комбинацию способа Аткинсона с некоторыми элементами способа Ван-Линта. В этом методе сочетаются достоинства воздействия на верхнюю ветвь лицевого нерва по проводниковому типу с блокированием его окончаний в орбикулярной мышце.
Анестезия. Для получения удовлетворительного обезболивающего эффекта при экстракции катаракты может быть достаточно инсталляционной анестезии. Однако целесообразно также производить инъекцию раствора новокаина в глазницу, поскольку при 278
•том понижается тонус прямых мышц и уменьшается их давление на глазное яблоко. Принятая нами методика анестезии в целом соответствует установкам, изложенным в руководстве М. Л. Краснова «Анестезия в офтальмологии». Метод общего обезболивания описан в главе 1.
Поверхностную анестезию осуществляют троекратным закапыванием 1% раствора дикаина. Для ретробульбарной инъекции необходимо применять достаточно длинную иглу. Больного просят посмотреть максимально вверх. Вкол иглы производят в нижненаружном углу глазницы, в непосредственной близости от ее костного края. Отсюда иглу проводят по направлению к вершине глазницы, положение которой хирург должен хорошо представлять, на глубину 4 см. После того как игла прошла первые 2—2,5 см, продолжая продвигать ее дальше, одновременно вводят новокаин. Это в известной мере помогает избежать ранения со-судистйх стволов. Обычно рекомендуется после введения иглы на необходимую глубину потянуть за поршень и убедиться, не находится ли она в просвете сосуда. Всего за глаз вводят 2 мл 2% раствора новокаина.
Анестезию в области верхней прямой мышцы обычно сочетают с проведением через нее уздечного шва. Мышцу целесообразно захватывать на расстоянии 7—8 мм от лимба, т. е. в области сухожилия.
Для обезболивания сухожилия верхней прямой мышцы целесообразно использовать локальную аппликацию этой зоны 2% раствором дикаина с помощью ватного тампона, намотанного на конец стеклянной палочки. Процедуру проводят после ретробульбарной инъекции.
После завершения анестезии надавливают пальцем на глазное яблоко для снижения офтальмотонуса, для того чтобы предотвратить выпадение стекловидного тела.
Иммобилизация век и глазного яблока. Неподвижность век и глазного яблока во время хирургических манипуляций имеет большое значение в обеспечении успешного исхода экстракции катаракты. Существующие методы иммобилизации век делят на две основные группы: с использованием швов-лигатур и векорас-ширителей-блефаростатов.
Раздвигание и удержание век с помощью швов до сих пор довольно часто применяют в клинической практике. Однако с помощью одних лигатур не удается полностью устранить давление век на глазное яблоко, что является серьезным недочетом в отношении профилактики выпадения стекловидного тела. Вследствие этого в настоящее время широко применяют векорасшири-тели. Основное требование, которое предъявляют к ним, — устранить давление на глазное яблоко со стороны век или самим инструментом.
Наибольшее распространение получил векорасширитель Арруга с упором на спинку носа и скуловую дугу. Его усовершенствованной модификацией является отечественная модель веко-
279
154.
Векорасширитель.
расширителя-блефаростата. В отличие от векорасширителя Арруга он имеет съемный упор иа спинку носа, что позволяет использовать один инструмент для выполнения операций на обоих глазах (рис. 154). Использование данной модели векорасширителя позволяет полностью устранить давление на глазное яблоко.
После расширения глазной щели уздечный шов фиксируют пеаном к ткани, покрывающей голову больного, с необходимой степенью натяжения.
Регулируют положение блефаростата по высоте до полного устранения контакта век с глазным яблоком с помощью трех упоров. Далее в случае необходимости делают кантотомию. Целесообразно применять методику Аткинсона: па наружную спайку век (после инъекции 0,5 мл 2% раствора новокаина) накладывают зажим Пеана. Через 1—2 мин его снимают и в этом месте наружную спайку век рассекают одним движением прямых ножниц. Рана не кровоточит, наложения швов не требуется. Заживление гладкое.
Техника экстракции катаракты
Одним из наиболее ответственных этапов операции по поводу катаракты является проведение разреза стенки глазного яблока. На протяжении всей истории развития хирургии предлагались различные варианты разрезов как по их положению, так и по профилю.
Положение разреза может быть склеральным (примыкающим к задней части лимба), лимбальным (в передней или задней части лимба) и роговичным (в пределах бессосудистой ткани).
При склеральном разрезе легче извлечь хрусталик, однако в этих случаях значительно чаще развиваются осложнения в виде кровотечения и послеоперационных отслоек сосудистой оболочки (вероятно, в связи с повреждением склеральной шпоры). Разрез
280
в бессосудистой ткани (роговичный) характеризуется медленной консолидацией раневых краев, извлечение хрусталика по сравнению со склеральным положением разреза вызывает большие трудности. Лимбальный разрез лишен всех перечисленных недостатков, поэтому он нашел наиболее широкое распространение в хирургии катаракты.
По профилю разреза, т. е. по расположению его плоскости по отношению к плоскости радужки, можно выделить четыре типа: 1) косой (ножом Грефе, копьевидным ножом и т. д.); 2) перпендикулярный (ножницами, некоторыми специальными инструментами, например вакуумным алмазным ножом и др.); 3) разрез с так называемым обратным профилем (трепаном, режущим лезвием, специальными инструментами); 4) смешанный (например, копьевидным ножом и ножницами, бритвенным лезвием и ножницами и т. д.).
Плоскость косого разреза параллельна плоскости радужки. Классический вариант этого разреза — полный разрез ножом Грефе. Косой профиль получается также при разрезе копьевидным ножом; если этот нож двойной, то операционная рана практически получается такой же, как при использовании ножа Грефе. Этот вид разреза был популярен в те времена, когда особенно важное значение имела быстрота выполнения операции. Главным недостатком этого вида сечения является то, что края раны могут относительно легко смещаться (как бы скользить один по другому) в плоскости разреза.
Перпендикулярный разрез лишен этих недостатков. Его достоинством является также техническая простота; при разрезе ножницами, которые сдавливают кровеносные сосуды, отмечается и менее выраженная наклонность к кровотечению, чем при ножевых разрезах. Разрез с «обратным» профилем стали широко применять сравнительно недавно [Краснов М. М., 1968, 1978]. Плоскость сечения при этом разрезе параллельна границе перехода роговичной ткани в склеральную, т. с. параллельна профилю лимба. Таким образом, в глубоких слоях роговичный край разреза как бы заходит под его склеральную губу (наподобие крепления часового стекла). К достоинствам разреза этого типа относится то, что внутриглазное давление в известной мере прижимает роговичную губу разреза к склеральной, обеспечивая тем самым и более плотный контакт. Сечение проходит полностью в бессосудистой ткани. Подход к хрусталику широкий (в противоположность косому и даже перпендикулярному разрезу).
Раньше считали, что если сечение располагается в склере или слишком близко от нее, то при этом более выражен послеоперационный астигматизм. При современной технике зашивания разреза это положение практически теряет свою силу. Кроме того, контроль за величиной астигматизма уже на операционном столе и в послеоперационном периоде вплоть до снятия швов позволяет решить проблему борьбы с послеоперационным астигматизмом при любом профиле катарактального разреза.
281
Большинство офтальмохирургов признают, что операционную рану необходимо покрывать конъюнктивальным лоскутом. Его роль усматривается в ускорении заживления операционной раны и в предупреждении врастания эпителия в переднюю камеру. Исследования глаз кроликов и человека, удаленных после экстракции катаракты (через несколько дней после операции), показали, что конъюнктивальный лоскут быстро приклеивается к подлежащей ткани и его сосуды, врастая в раневой канал, способствуют быстрому склеиванию раны.
Длина разреза варьирует от 10 до 15 мм в зависимости от вида катаракты (катаракта у лиц молодого возраста, старческая катаракта) и от метода ее экстракции. При инкапсулярной методике длина разреза достигает 15 мм, при экстракапсулярной экстракции достаточно провести разрез длиной 10 мм (чтобы вывести ядро).
Удаление хрусталика — основной этап операции, от которого во многом зависит ее исход. Как уже отмечалось, известны два принципиально отличающихся друг от друга способа экстракции катаракты: экстракапсулярный и интракапсулярный. Первый был разработан основоположником экстракции катаракты Давиэлем. В дальнейшем способ модифицировался, однако в основе своей он мало изменился до последнего времени.
При использовании экстракапсулярной методики требуется относительно небольшой разрез глазного яблока (примерно 10 мм), через который можно удалить ядро. До извлечения ядра «вырывают» переднюю капсулу хрусталика, затем методом выдавливания извлекают ядро и в последнюю очередь удаляют (различными способами) хрусталиковые массы. Основным принципом этого метода является то, что в глазу оставляют заднюю капсулу хрусталика. Таким образом, передний отрезок глаза как в процессе операции, так и после ее завершения отделен от заднего. Кроме того, операция менее травматична, поскольку известно, что задняя капсула хрусталика тесно спаяна с плоскостью ресничного тела силой капиллярного сцепления, а также волокнами ресничного пояска и ее удаление является дополнительной травмой.
Вместе с тем остающиеся в глазу хрусталиковые массы нередко вызывают факогенные иридоциклиты, а уплотняющаяся задняя капсула и разрастающийся эпителий способствуют развитию так называемой вторичной катаракты. Именно эти осложнения были причиной поиска более совершенного метода удаления хрусталика. В результате был разработан метод интракапсулярной экстракции катаракты — удаление хрусталика в неповрежденной капсуле. Этот метод по сравнению с первым имеет то преимущество, что при нем исключается развитие осложнений, характерных для экстракапсулярной методики: нет причин для развития факогенных воспалений и вторичных катаракт.
Однако при использовании интракапсулярного метода не-
282
^обходимо знать теоретические основы техники разрыва ресничного пояска, удерживающего хрусталик.
! Строение зонулярной пластинки изучали многие исследова-' толи, однако до конца этот вопрос не решен и единого мнения ! Со этому поводу не существует. Одна из теорий ее происхождения ; С строения сводится к следующему: зонулярная пластинка воз-I Сикает из зрительного нерва у плода в 3-недельном возрасте.
I К 4 мес волокна ее дорастают до хрусталика и спаиваются с ним, г разделяясь на переднюю и заднюю порции. Часть волокон зонулярной пластинки прикрепляется к отросткам ресничного тела. Волокна зонулярной пластинки как бы погружены в вязкое вещество. Она состоит из трех порций, которые отходят от: 1) зубчатой линии; 2) плоской части ресничного тела; 3) отростков ресничного тела. Таким образом, зонулярная пластинка прикрепляется к сетчатке, стекловидному телу и гиалоидной мембране.
На хрусталике эти порции делятся на переднюю (прикрепляются на расстояние 2 мм от экватора), заднюю (в 1 мм от экватора) и экваториальную. Зонулярная пластинка плотно спаяна как с хрусталиком, так и с ресничным телом. Отмечено, что после удаления хрусталика на его капсуле не остается следов от ресничного пояска. Это свидетельствует, по-видимому, о том, что поясок не отрывается, а «отклеивается» от капсулы. Кроме того, доказано, что поясок никогда не «отклеивается» сразу целиком: «начала «отклеивается» небольшая порция, в результате чего образуется отверстие, а затем постепенно происходит его отрыв по всей окружности. Капсула хрусталика имеет различную толщину (передняя наиболее прочна на расстоянии 3 мм от переднего полюса, задняя — на 1 мм ближе к экватору). Кроме того, капсула независимо от ее анатомических свойств рвется у различных людей по-разному. Сетчатка в зоне прикрепления к ней ресничного пояска истончена, поэтому резкое натяжение может привести к ее разрывам.
Разработаны четыре варианта отделения хрусталика в капсуле от ресничного пояска: 1) выдавливание; 2) вытягивание; 3) комбинация выдавливания и вытягивания; 4) непосредственное разрушение пояска.
Способ выдавливания был разработан и пропагандировался R. Smith (1926). Однако все изложенное выше с несомненностью убеждает в травматичности и опасности этого способа. Чистое вытягивание также является слишком грубым, поскольку при резком натяжении ресничный поясок отрывается от отростков ресничного тела и сетчатки, что может привести к крайне нежелательным последствиям (разрывы сетчатки, потеря стекловидного тела, иридоциклиты).
Наиболее целесообразным следует признать сочетание двух способов — выдавливания и вытягивания. Вопрос о преобладании выдавливания или вытягивания решают в зависимости от того, какой способ извлечения хрусталика используется — скользящий (без переворота) или с переворотом. Принято считать, что при
283
применении способа с переворотом должно преобладать выталки вание (95%), а «тяга» должна быть незначительной (5%). В связи с тем что при использовании способа с переворотом хрусталика часто рвется наиболее тонкая задняя капсула, большинство' офтальмохирургов предпочитают применять скользящую методику интракапсулярной экстракции катаракты.
По мнению ряда хирургов, нужно захватить капсулу хрусталика сверху, а инструментом в левой руке подталкивать ее снизу. При освобождении хрусталика они рекомендуют надавить на роговицу, чтобы предупредить выпадение стекловидного тела. D. Kirby (1949) предлагает иную тактику: захватить капсулу хрусталика сверху и слегка покачивать хрусталик до образования отверстия в зонулярной пластинке. После этого хрусталик раскачивают сильнее и дефект зонулярной пластинки увеличивается по окружности до полного освобождения хрусталика. Если связки крепкие, то можно прибегнуть к их механическому разрушению. Извлекать хрусталик из глаза следует только после' полного разрыва ресничного пояска. Таким образом, при скользящей методике вытягивание преобладает над выдавливанием.
Существует большое количество технических вариантов операции по поводу катаракты. Невозможно не только описать все, но и даже перечислить. Необходимо руководствоваться какими-то общими теоретическими принципами, чтобы из этого множества выбрать те, которые представляются наиболее рациональными.
Производя любую операцию, в том числе и экстракцию катаракты, хирург должен зпать механизмы заживления операционной раны, чтобы иметь возможность влиять на этот процесс как в ходе вмешательства, так и в послеоперационном периоде. Доказано, что кортизон задерживает пролиферацию и васкуляризацию. Однако малые дозы его не оказывают особого влияния на заживление.
Наибольшее распространение и признание получил лимбаль-ный разрез, особенно с вынесением его максимально вперед, в пределы роговичной ткани. Одним из преимуществ этого разреза перед роговичным является возможность использовать конъюнктивальный лоскут.
Новые возможности выполнения катарактального разреза дает микрохирургическая техника. В частности, шире используется роговичный разрез, поскольку микроскоп позволяет накладывать большое количество корнеосклеральных швов на продолжительный период (3 мес) до полной консолидации раны, исключаются кровотечения в ходе операции.
Таким образом, единственным надежным способом достижения более быстрого и правильного заживления операционной раны в настоящее время является хорошая герметизация ее с помощью швов. При этом необходимо правильно сопоставить края разреза. Однако необходимо помнить, что почти все швы вызывают реакцию глаза как инородное тело. Разные шовные материалы вызывают реакцию различной степени выраженности. Ре-284
акция на шелк развивается с 8-го до 12-го дня, когда наиболее Выражена инфильтрация. Исходя из этого, шелковые швы следует снимать рано (на 8—9-й день). Поскольку по шелковым нитям быстро врастает эпителий, нецелесообразно делать эти швы сквозными. Кетгут вызывает резкую лейкоцитарную реакцию. К 8-му дню швы в значительной мере рассасываются, а рана еще не консолидирована. В современной хирургии катаракты кетгут практически не используют. Наименьшую реакцию ткани вызывают применяющиеся в настоящее время виргинский шелк, суп-рамид и моноволокпо — нейлон.
Существует множество способов наложения швов на катарак-тальную рану. Прежде всего принципиально различаются оппозиционные (проводящиеся через плоскость разреза) и неоппозиционные (проходящие над раной) швы. Неоппозиционные швы на современном этапе хирургии катаракты утратили свое значение.
Очень существенным моментом при наложении швов является глубина проведения нити. Оптимальная глубина проведения нити во многом зависит от вида шовного материала и его толщины. Не следует проводить нить слишком поверхностно, так как это не предотвращает зияния задних (глубоких) слоев раны. Швы не должны быть сквозными, особенно если они шелковые, так как это может способствовать фистулизации. В первую очередь необходимо учитывать эластичность и растяжимость шовного материала, что, естественно, зависит не только от химического состава, но и от толщины нити. В первые дни после операции края раны набухают. Если нить недостаточно эластичная,, то происходит ее прорезывание из-за некроза, развивающегося вследствие чрезмерного давления петли, которая как бы не может охватить увеличивающуюся в объеме ткань. Это относится почти i; любому шовному материалу, если пить достаточно толстая.
Очень важным достоинством современных шовных питой из сунрамида или нейлонового моноволокпа является их растяжимость. С набуханием раневых краев петли шва растягиваются, а при уменьшении отека сокращаются, удерживая таким образом края разреза в контакте с примерно одинаковой силой. В то же время эти нити настолько тонкие, что оказываемое ими давление-неспособно вызвать некроз. Они также практически не вызывают инфильтрации, будучи биологически инертными. Именно поэтому такие швы надо накладывать как можно глубже для смыкания раневых краев в самых глубоких слоях.
Современные методы зашивания разреза. С середины прошлого века до настоящего времени было предложено множество способов и вариантов зашивания корнеосклерального разреза. Однако только начиная с 40-х годов XX столетия зашивание операционной раны после экстракции катаракты стало быстро приобретать все большее число сторонников.
В настоящее время после внедрения в офтальмологию микрохирургической техники корнеосклеральные и корнеальные швы
285-
во многом усовершенствованы и модифицированы. Оппозиционные швы могут быть узловыми, матрацными, непрерывными. Узловые швы накладывают в количестве не менее десяти.
С технической точки зрения, корнеосклеральные швы делят на две основные группы в зависимости от того, когда их накладывают — до или после разреза глазного яблока. В последние годы наиболее широкое признание получили швы, накладываемые на вскрытом глазном яблоке. Их распространение объясняется прежде всего тем, что созданы специальные иглы, легко проникающие в очень плотную ткань роговицы и склеры. Их изготавливают из мягких сортов стали, поэтому они скорее гнутся, чем ломаются. Отличительной особенностью игл является форма передней части с режущими краями. Конец иглы подобен концу копья. Имеется несколько вариантов игл, различающихся по длине, толщине, кривизне. В так называемых атравматических иглах очень важно место крепления иглы с нитью: надо, чтобы оно не было утолщено и вместе с тем было прочным. Диаметр атравматических игл 0,2 мм. Кривизна иглы определяет глубину ее проведения в ткань.
Лучшим шовным материалом в настоящее время считают нейлон (моноволокно). Нити бывают различной толщины. Фирма «Eticon» выпускает четыре вида нитей: 9:0 (38 мкм), 10:0 (22 мкм), 12:0 (16—18 мкм) и 14:0 (13—15 мкм). Нейлоновая нить имеет гладкую поверхность, равномерную толщину и эластичность. Узел из этой нити быстро покрывается эпителием. В микрохирургической практике используют также шелк, кетгут, полиэстеры, полиамиды, металлы (в частности, титан).
Зашивание операционного разреза, как уже отмечалось, является чрезвычайно ответственным этапом операции. Срастание краев раны во всю толщину без рубцов и фиброза обусловливает не только его прочность, но и оптическую конфигурацию разреза. Он должен быть чистым, гладким с минимальным разрастанием ткани и закрыт на всю глубину. Послеоперационный период следует вести так, чтобы раздражение глаза было минимальным.
Чтобы удовлетворить перечисленные требования, важно знать элементы техники наложения корнеосклеральных швов. Они состоят в следующем. Конец иглы ставят вертикально по отношению к поверхности роговицы, для этого иглодержатель поворачивают против часовой стрелки. После того как игла вошла в ткань роговицы, рукоятку иглодержателя поворачивают по ходу часовой стрелки и в таком положении иглу ведут до выкола кончика ее в глубоких слоях разреза (у задней пограничной пластинки). Иглодержателем иглу перехватывают ближе к ушку и в горизонтальном положении вкалывают в противоположную губу раны; сразу после этого рукоятку иглодержателя опять поворачивают по часовой стрелке. При выведении иглы нужно надавить на ткань, чтобы она не тянулась за иглой. Глубина проведения иглы 0,75 мм. Вкол и выкол производят на расстоянии 1 мм от края разреза (рис. 155).
I ,55'
В Проведение иглы через ка-р Тарактальный разрез (exes' ма).
Техника завязывания нити шва состоит в следующем: первый узел делают тройным, второй — в один оборот. Обрезают нить вплотную к узлу, лучше бритвенным лезвием.
Оригинальные непрерывные швы предложены М. М. Красновым (1983), они совмещают надежность узловых швов с быстротой наложения непрерывных (рис. 156). А. Г. Травкин (1984) предложил накладывать шов на края роговичной раны с образованием петли, которая служит для удержания роговицы во время выведения катаракты.
Роль конъюнктивального лоскута. Конъюнктивальное покрытие катарактального разреза в самых разнообразных вариантах применяли очень давно. Раньше это делали прежде всего для того, чтобы защитить рану от инфекции. Особенности конъюнктивального покрытия раны определяются в основном двумя показателями; положением основания лоскута и шириной покрытия.
В настоящее время преимущества катарактального разреза а конъюнктивальным лоскутом общепризнаны. Главные из них — более быстрое и надежное заживление раны и предотвращение
156. Наложение петлевого непрерывного шва по Краснову, а — варианты швов; б — этапы проведения швов.
2»7
врастания эпителия в переднюю камеру. Оба эти преимущества мало зависят от размера конъюнктивального лоскута; важно, что-•бы разрез в конъюнктиве не совпадал с разрезом в стенке глазного яблока. Именно с этой точки зрения лоскут, расположенный основанием к лимбу, имеет преимущество перед конъюнктивальным покрытием от экватора. Лоскут, обращенный основанием к нкватору, несколько облегчает проведение склерального разреза, наложение швов и извлечение хрусталика. По-видимому, учитывая эти преимущества, некоторые офтальмохирурги предпочитают применять данный метод [Абрамов В. Г., 1968; Post N., 1963].
Наш опыт позволяет высказаться в пользу конъюнктивального лоскута с основанием у лимба: при его применении рана лучше защищена и быстрее консолидируется. В условиях закрытия раны корнеосклеральными швами наиболее часто используют лоскут шириной 3—4 мм. Более широкий лоскут практически не имеет никаких преимуществ, но менее удобен для хирургических манипуляций. В то же время более узкий конъюнктивальный лоскут (1—2 мм) с основанием у лимба более удобен с технической точки зрения: доступнее операционное поле, корнеосклеральные айвы могут быть использованы для закрытия разреза в конъюнктиве (нет необходимости в наложении отдельного конъюнктивального шва). В связи с этим конъюнктивальный лоскут указанного типа получил в настоящее время широкое распространение.
Потребность в более широком конъюнктивальном лоскуте может возникнуть, например, при комбинированной хирургии, в случае сочетания глаукомы с катарактой; существует мнение, что он может быть показан также при предрасположении к дистрофии роговицы. Более широкий лоскут целесообразнее применять при использовании погружных корнеосклеральных швов в частности непрерывных. Если в будущем перейдут к рассасывающимся швам новых типов (коллаген, дексон, виргакрил и др.), то можно ожидать, что сравнительно широкий конъюнктивальный лоскут снова получит широкое распространение.
Наиболее рациональной техникой образования конъюнктивального лоскута мы считаем следующую: на расстоянии 2—4 мм от лимба (в зависимости от желаемой ширины лоскута) делают ножницами небольшой разрез конъюнктивы на 12 часах. Через этот разрез шпателем производят отсепаровку конъюнктивы на нужном протяжении. Именно поэтому важно при первом разрезе дойти до склеры. Затем отсепарованную тупым путем конъюнктиву разрезают в обе стороны ножницами. Область лимба очищают концами сомкнутых ножниц. Эта методика является более щадящей для конъюнктивы и с ее помощью можно быстрее получить конъюнктивальный лоскут.
Манипуляции на радужке. Экстракция катаракты с круглым зрачком заняла господствующее положение в клинической практике. Извлечение хрусталика через ригидный зрачок, не поддаю-:288
щяйся расширению (например, после длительного Печения миотиками при ревко выраженной атрофии радужки), может и в •Стоящее время представлять технические трудности. Стремлением избежать их объясняются не-
157. Ирис-ретрактор Шоттера.
которые оригинальные
предложения производить
акстракцию катаракты с
предшествующим иридодиализом [Родштейн С. Д., 1933; Шмелева В. В., 1969]. D. Bithaem (1957) предлагал делать радиальную Кридотомию с последующим наложением швов на радужку.
Создан ряд ирис-ретракторов для оттягивания зрачкового края радужки кверху. Предложенный Л. X. Шоттером (1968) ирис-ретрактор, который можно легко ввести боковыми движениями и в нерасширенный зрачок, захватывает, отводит, надежно удерживает радужку и предохраняет ее от примораживания (рис. 157).
При экстракции катаракты с круглым зрачком большинство хирургов считают целесообразным производить вмешательство на радужке базальную иридотомию или иридэктомию (одну или iiocKo.ui.Ko). Выполнять полную иридэктомию вряд ли имеет смысл. В тех случаях, когда экстракция катаракты с круглым мрачном по тем или иным соображениям нецелесообразна (сопутствующая отслойка сетчатки или подозрение на нее, резко ригидный зрачок, слабо расширенный зрачок), мы производим операцию с. радиальной иридотомией. Обладая всеми достоинствами полной придэкюмип, она вызывает менее выраженное светорас-
сеяние в но. .пооперационном периодо.
1*ад1П1Ч|.шщ ирндоюмпя в зависимости от показаний может быть очень различной но воличпно. Операционную рапу открывают с том, чтобы обеспечить свободный доступ к радужке, которую захватывают у зрачкового края и несколько приподнимают. Одну браншу ирис-ножниц вводят под радужку, после чего ее рассекают в радиальном направлении от зрачка.
Базальную иридотомию следует производить возможно ближе к корню радужки; при этом важно не повредить капсулу, хрусталика у экватора. В связи с этим режущая часть ирис-нож-ниц должна располагаться под прямым углом к поверхности глазного яблока. Радужку захватывают в складку ирис-пинцетом у склеральной губы разреза и несколько оттягивают книзу. При рассечении ее бранши ножниц располагаются вплотную к склеральной губе и концы их могут даже заходить под радужку.
Чаще всего мы производим две базальные иридотомии в промежутках между корнеосклеральными швами. Если выполняют одну иридотомию, то она должна быть несколько шире (около 3 мм). Базальная иридэктомия имеет большое число сторонников.
19 Руководство по глазной хирургии
289
При операциях со вскрытием передней камеры возникает необходимость репонировать выпадающую радужку, корригирован форму зрачка. Для этой цели Л. X. Шоттером и А. В. Пановым сконструирован специальный инструмент — ирис-шпатель с мик рошипом. Микрошип легко захватывает поверхностный слой ра дужки, плечи же инструмента не дают ему углубиться в ее ткань (авт. свид. № 1017326).
Извлечение хрусталика. Методы извлечения хрусталика с по мощью пинцета, эризифака, криофака и сорбционным способом имеют много различий. Большинство офтальмологов, особенно за рубежом, основное значение придают силам выталкивания. Это относится главным образом к пинцету, поскольку он не в состоянии обеспечить достаточную силу тракции. Исследования последних лет показали, однако, что извлечение хрусталика за счет силы тракции имеет ряд преимуществ, к которым, в частности, относится меньшая вероятность выпадения стекловидного тела, меньшая травматизация глаза и т. д. Оказалось, что, применяя рациональную технику, можно значительно расширить даже возможности пинцетного способа.
Важным является также вопрос о целесообразности извлечения хрусталика методом переворота. Как известно, после работ A. Elschnig извлечение хрусталика с переворотом заняло господствующее положение. Однако в связи с появлением новых способов экстракции катаракты значительно расширились возможности извлечения хрусталика из глаза. Обоснованы преимущества так называемого скользящего метода [Kirby D., 1938, 1949]. При криофакии и сорбционном методе применить способ переворота вообще невозможно. Мы пользуемся исключительно скользящим методом. Поскольку основным ограничением для выполнения криофакии является ригидный нерасширенный зрачок, мы в этих случаях нередко комбинируем скользящий метод с эризифа-кией.
При использовании пинцетного способа, как правило, применяют инструменты типа пинцетов Блашковича и Эльшнига. Для экстракции вакуумным способом чаще используют простой эри-зифак отечественного производства с толстостенным резиновым баллоном. Рациональная конструкция присасывающей чашечки с бортиком на ее внутренней кромке позволяет создать достаточную силу присасывания. Криофакию производят с помощью криофаков (криоэкстракторы) различных конструкций: от простых с охлаждением углекислотой до сложных типа выпускаемых фирмой «Amoils».
Извлечение хрусталика в капсуле пинцетом (скользящий метод). Роговичный лоскут оттягивают книзу за лигатуру, проведенную через конъюнктиву. Верхний край зрачка смещают шпателем к области разреза. Пинцетом захватывают складку как можно ближе к экваториальной зоне (рис. 158). Давление на поверхность хрусталика при захвате капсулы должно быть минимальным. Бранши пинцета разводят примерно на 290
.1 4 мм «I |>i< M'i« > и и tt .nix ни i it 11, Chui i.uiy io понерхность капсулы МИННИ |>|1И1НН1И II IHI pit IJII.iny,
< >Ч1НИ, IlHIhlHi ||11ГЛНД|>||||'| HJI 1,110 выполнять движения, для того чтобы oCiw.tiu'tmi, иосгвпоиный разрыв волокон ресничного пояска, до итого но следует предпринимать попыток к извлечению хрусталика. Первое движение направлено к нижнему лимбу, чтобы вывести верхний экватор хрусталика из-за склеральной губы разреза перед открытой раной. Следующее движение направлено прямо кверху (по направлению зрительной оси), оно должно разрушить верхнюю часть волокон ресничного пояска. Затем производят качательные движения для разрушения его остальных волокон.
Приступать к извлечению хрусталика следует только тогда, когда смещения его станут совершенно свободными. Верхний экватор хрусталика переводят в область зрачка. После этого радужку сдвигают шпателем в обе стороны от места захвата капсулы до тех пор, пока экватор не пройдет через зрачок. Даже в этот момент не следует торопиться с извлечением хрусталика, потому что самая нижняя часть волокон ресничного пояска может разорвать капсулу хрусталика. Выведение надо производить постепенно, медленно смещая пинцет от одного угла разреза к другому.
Извлечение хрусталика в капсуле эризифа-ком (скользящий метод). Роговичный лоскут оттягивают книзу. Присасывающую чашечку с помощью шпателя проводят к передней поверхности хрусталика; ее следует расположить по возможности ближе к верхнему экватору хрусталика без перекоса. В момент введения эризифака резиновый баллон должен быть сжат.
1-9*
291
159. Интракапсулярное извлечение хрусталика с помощью эризифака.
Ослабляя давление на баллон, добиваются присасывания чашечки к хрусталику. Если под край чашечки попадает радужка, то присасывание необходимо повторить. В дальнейшем последовательность движений точно такая же, как при использовании пинцета; необходимо, однако, помнить, что плоскость чашечки все время должна располагаться параллельно передней поверхности хрусталика. Приподнимание какого-либо края чашечки часто приводит к нарушению вакуума.
В случае нарушения вакуума и отклеивания чашечки необходимо обратить внимание на состояние передней поверхности хрусталика. Если на ней остается выраженное выбухание, то повторная попытка наложить эризифак, как правило, не удается; если же выбухание невелико или отсутствует, то наложение чашечки можно производить неоднократно (рис. 159).
Извлечение хрусталика в капсуле криофаком. Роговичный лоскут оттягивают книзу, поскольку криофав должен иметь свободный доступ к хрусталику, иначе он может примерзнуть к окружающим тканям. Обязательным условием выполнения криофакии является умеренное расширение зрачка (не менее 4—5 мм).
Верхний край зрачка смещают шпателем к области разреза. Как уже отмечалось, при криофакии показана исключитель-н о скользящая методика.
Кончик криофака, предварительно очищенный от инея, приводят в соприкосновение с передней поверхностью хрусталика перед верхней экваториальной зоной. Как только установится прочный контакт инструмента с хрусталиком, хирург последовательно производит все необходимые движения, для того чтобы обеспечить
292
IвО. Ивнлпчевие хрусталика криоэкстрактором (схема).
1в1. Криопнстрактор-дипамометр Шоттера.
болоо щпдпщий риарып подокон ресничного пояски, и медленно выводит хрусталик на глаза (рис. 160).
С целью онрпдол он и и но время операции силы, потребовавшейся для криоэкстракции катаракты, а также и для тренировки начинающих офтальмохирургов Л. X. Шоттер (1977) сконструировал специальный криоэкстрактор-динамометр (рис. 161). Сила сцепления при примораживании хрусталика к криоэкстрактору достигает 150—410 г, в то время как прочность ресничного пояска равна в среднем 18 г. Если же предварительными качатель-пыми движениями в течение 5—8 с разрывать зонулу по частям, то хрусталик удается извлечь с силой не более 2—4 г.
Объективными причинами повышения сопротивления при криоэкстракции могут быть: недостаточная для данного хрусталика величина разреза оболочек, повышенная ригидность радужки, прочный ресничный поясок, спайки хрусталика с радужкой или со стекловидным телом. В этих случаях следует остановить тракцию и после устранения причины повышения сопротивления закончить операцию с небольшой, не превышающей 5 г, тракцией. В противном случае показана экстракапсулярная экстракция.
293
Однако самой частой причиной повышенной тракции является недостаточное освобождение хрусталика от зонулы вследствие чрезмерной поспешности хирурга, что может привести к развитию непосредственных или поздних осложнений при криоэкстракции.
В отличие от других методов при криофакии легко извлечь хрусталик одним движением, приподняв его кверху, так как сила фиксации его к инструменту очень большая (40—55 г). Однако этого не следует делать, так как очень легко можно повредить переднюю пограничную мембрану стекловидного тела и вызвать его выпадение.
При выведении хрусталика следует освобождать его от покрывающей радужки шпателем. Необходимо предупреждать примо-раживание криофака к окружающим тканям (максимально открыть рану, страховать роговицу шпателем и т. д.). Если же оно все-таки произошло, то следует немедленно начать орошение места примораживания теплым изотоническим раствором хлорида натрия.
В тех случаях, когда инструмент с первого раза не приморо-зился к хрусталику, это бывает при чрезмерно или недостаточно низкой температуре, прикосновение нужно повторить: в первом случае тем же криофаком, во втором — другим.
Ферментативный зонулолизис. В 1958 г. J. Barraquer открыл лизирующее действие химотрипсина на ресничный поясок. В связи с этим ои предложил способ «ферментативного зонулолизиса» при экстракции катаракты, который вначале получил довольно широкое распространение. а-Химотрипсин, предложенный J. Barraquer, является одной из фракций химотрипсина— профермента трипсина. Он может быть получен в кристаллическом виде, его добывают из поджелудочной железы крупного рогатого скота. В дальнейшем появились сообщения, что для ферментативного зонулолизиса могут быть с равным успехом использованы и обычный химотрипсин, и даже трипсин.
С самого начала основным показанием к осуществлению зонулолизиса считали резистентность ресничного пояска, т. е. прежде всего катаракту в молодом возрасте. Позднее, однако, было установлено, что на практике интракапсулярная экстракция катаракты в детском и юношеском возрасте даже с применением зонулолизиса может быть опасной. Стекловидное тело примерно до 25 лет нередко спаяно с хрусталиком и имеет вязкую консистенцию, поэтому выпадение его (к чему в связи с эластичностью склеральной оболочки имеется повышенная склонность) представляет большую опасность, чем при старческой катаракте.
Ряд авторов [Scheil D., 1960, и др.] установили вредное действие протеолитических ферментов на различные оболочки глаза, включая сетчатку. Некоторые клинические наблюдения свидетельствуют о более частом формировании грыж стекловидного тела и медленном заживлении операционной раны [Barraquer J., 1961]. Кроме того, в послеоперационном периоде может развиться вто-
294
*'-r
1(12 Пинцет петля Горбаня.
рмчпня глаукома вследствие блокады отверстий корнеосклераль-I Hl.ix трабекул обрывками волокон ресничного пояска [Kirsch М., 1UH4], В связи с этим в настоящее время использование ферментативного зонулолизиса у больных до 20 лет считается противо-покипапным [Пучковская Н. А., 1966; Girard L., 1962, и др.].
Что касается применения химотрипсина при обычной возраст-Пий катаракте, то клиницисты по-разному оценивают степень Вредности упомянутого выше побочного действия. В связи с этим диапазон применения ферментативного зонулолизиса варьирует а широких пределах. В ряде клиник его производят у всех без Исключения больных. Однако, по-видимому, более обоснованна Точка зрения, согласно которой без прямых показаний не следует |(ПК>Л ыювать протеолитические ферменты для растворения ресничного пояска. Какова бы ни была степень выраженности повреждающего действия их на оболочки глаза, оно, несомненно, •ущнстнуот; необходимо с этим считаться и отказываться от фер-М<’Н1КТИ1шого зонулолизиса, если операция может быть успешно BMiinjilioiia без него. Большинство офтальмохирургов считают, Что использование ферментативного зонулолизиса оправдано (при омродолпнпых показаниях) только при лечении больных в возраста от 25 до 50 лет.
О. М. Романико (1980) использует для извлечения катаракты а капсуле микрокрючок с тонким «жалом» на конце, которое, протыкая капсулу, вонзается в ядро хрусталика. Чтобы не вызнать пошел птельного смещения катаракты рнн. голдпюг противоупор микрошпателем.
Г Д Жпбппдоа (1978) применяет для удаления катаракты миitpoiii ।опор, спираль которого, вкрученная жинпот китарпкту при ее выведении. Автор назвал этот способ Гелиоэкстракцней катаракты. А. И. Горбань (1983) с этой целью Применяет пинцет (рис. 162), одна из ножек которого имеет вид петли.
ЭК1 трпкпнсуляриая экстракция катаракты. Как уже отмечалось, экстракппсулирный метод удаления катаракты имеет важное ироимущес । по перед интракапсулярным: задняя капсула остистей нопопрсжденион. Зто обеспечивает полное отграничение заднего отдела глаза от переднего, и стекловидное тело остается
в момент вкола ост-
в ядро, прочно удер-
295
в замкнутой полости. Таким образом, устраняется опасность возникновения грыж стекловидного тела и связанных с этим патологических состояний роговицы и афакических макулопатий. При необходимости произвести операцию на афакичных глазах (по поводу глаукомы, отслойки сетчатки и др.) наличие задней капсулы также предохраняет от возможных осложнений. Если какую-либо операцию планируют осуществить после экстракции катаракты (на афакичном глазу), то в этих случаях показана экстракапсулярная методика. При планирующей подсадке интраокулярной линзы наличие задней капсулы хрусталика очень выгодно [Федоров С. Н., Захаров В. Д., 1974; Краснов М. М., 1975; Алексеев Б. Н., 1976, и др.].
Вопрос о недооценке экстракапсулярного метода экстракции катаракты и перспективе возвращения к нему неоднократно поднимался авторитетнейшими офтальмологами [Пучковская Н. А., 1966; Краснов М. М., 1977, и др.]. Тот факт, что экстракапсуляр-ный метод еще не получил широкого распространения, объясняется тем, что при его применении трудно полностью удалить хрусталиковые массы, в связи с чем возникают осложнения, в частности факогенные увеиты и вторичные катаракты. Только устранение этих недостатков может помочь внедрению метода в широкую клиническую практику.
В современных условиях полностью удалить хрусталиковые массы можно с помощью технических средств, используемых для ультразвуковой факоэмульсификации. Однако ее не везде применяют и, кроме того, показания к использованию этого метода ограничены. Вместе с тем факоэмульсификации явилась стимулом для усовершенствования методики экстракапсулярной экстракции катаракты с использованием некоторых технических приемов и приспособлений, применяемых при факоэмульсификации. Таким образом, появилась возможность разработать новую методику экстракапсулярной экстракции катаракты, технически более совершенную, причем для этого не требуется сложной, дорогостоящей аппаратуры и нет необходимости в ультразвуковом дроблении ядра хрусталика. Однако обязательным условием является использование микрохирургической техники, которая открыла новые возможности выполнения хирургических вмешательств на глазу, в частности при катаракте [Краснов М. М., 1969; Шмелева В. В., 1969; Harms Н., Mackensen G., 1966, и др.].
Таким образом, в настоящее время сложились условия для разработки усовершенствованной методики экстракапсулярной экстракции катаракты на качественно новом уровне. Хотя интракапсулярная методика технически более проста, в настоящее время решающее значение приобретает качественная сторона исхода операции — уменьшение риска послеоперационных осложнений.
Разработке качественно нового способа экстракапсулярной экстракции катаракты способствовали некоторые технические предпосылки. Очень важной из них является возможность про-
296
Мдения таких этапов операции, как вскрытие передней капсулы выведение ядра хрусталика в неопорожненную переднюю камеру. Вскрытие передней капсулы при сохранной камере осуществляют более широко и полно (циркулярное рассечение), чем при обычной методике. Для выведения ядра хрусталика используют катаральный разрез меньших размеров (8—9 мм). Хрусталиковые массы полностью удаляются аспирационно-ирригационным методом — с помощью сбалансированного притока и оттока промывной жидкости. Для предупреждения развития вторичных катаракт производят «отскабливание» клеток задней камеры, разрастание которых приводит к развитию этого осложнения.
Все перечисленные элементы операционной техники уже разработаны и используются в клинике [Краснов М. М., 1977]. Таким образом, стоит вопрос об их усовершенствовании и более широком внедрении в клиническую практику. Все эти элементы операционной техники качественно могут быть осуществлены только под микроскопическим контролем. Именно глазная микрохирургия явилась одной из главных предпосылок для разработки нового метода экстракапсулярной экстракции катаракты. Детально псе перечисленные этапы операции разработаны и освещены в офтальмологической печати М. М. Красновым (1977). Они состоят п следующем.
Проведение операции при полной камере. Проведение операции (дяшв отдельных ее этапов) при неопорожненной передней кнмере деляет оо значительно менее травматичной для эндотелия рипшицы, радужки и передней пограничной мембраны стекловидного тела. Важно и то, что полость глазного яблока вскрывают иа меньшем протяжении. Полный разрез нужен только для выведения ядра хрусталика. Предшествующие этому этапы операции Могут быть пынолнены при поонорожиоппой передней камере.
Согласно разработанному М. М Красновым методу, для вскрытия породней каморы необходимы нож Сато или нож-игла. Конец ножа икодят н переднюю камору на 12 часах (лимбально). Кончиком ножа производят ряд пункций капсулы хрусталика соответственно краю расширенного зрачка. Затем рассекают перемычки между пункционными отверстиями. Таким образом оказывается резецированной большая часть передней капсулы хрусталика. После резекции капсулы тем же инструментом выводят ядро хрусталика из задней камеры в переднюю. Иссеченный участок капсулы впоследствии вымывается из глаза вместе с хрусталиковыми массами.
Выведение ядра. Как уже отмечалось, длина операционного разреза при предварительном выведении ядра в переднюю камеру может быть значительно меньше, чем при традиционной экстракапсулярной экстракции катаракты, а тем более при интракапсулярном методе. Техника «хирургического вывиха» ядра в переднюю камеру может быть различной [Бочаров В. Е., 1977]. Наиболее рациональным способом является следующий. После циркулярной резекции передней капсулы хрусталика ножом Са-
297
163.
Извлечение ядра хрусталика ножом Сато (а) и с помощью двух игл (б).
то, по выводя его из передней камеры, приступают к маневру «вывиха». Конец ножа проводят к нижнему краю зрачка примерно к 5 часам, вкалывают в ядро хрусталика и надавливают на него таким образом, чтобы противоположная часть ядра переместилась вперед над плоскостью радужки. Как только этот маневр удался, ядро начинают поворачивать против часовой стрелки. Это приводит к постепенному, а затем полному «вывиху» ядра в переднюю камеру (рис. 163, а).
Если полностью вывести ядро не удается, можно шпателем «заправить» радужку под него. Обязательным условием выполнения этих манипуляций является наличие неопорожненной передней камеры. Если в ходе вмешательства камера опорожнилась, то ее нужно заполнить сбалансированным раствором или другими специальными средами [Груша О. В., Мустаев И. А., 1970] и только после этого продолжать манипуляции. При наличии оснащения для факоэмульсификации можно использовать канюлированный цистотом. Переведенное в переднюю камеру
298
Ядро можно вывести из нее через относительно небольшой разрез (примерно 8 мм).
При традиционной экстракапсулярной экстракции катаракты Ядро хрусталика выводится из глаза за счет выдавливания (экспрессия). Хорошо известно, что при давлении на вскрытый глаз Могут возникнуть осложнения: выпадение стекловидного тела, смещение ядра в стекловидное тело и др. Узкий ригидный зрачок вообще может явиться непреодолимым препятствием для выведения ядра. В подобных случаях экстракцию катаракты производят или в сочетании со сфинктеротомией, или экстрапупилляр-ио [Родштейн С. Д., 1933; Шмелева В. В., 1969; Алексеев Б. Н., 1973]. Экспрессия может быть заменена усовершенствованным методом «двух игл» [Краснов М. М., 1973]. В этом случае используют преимущественно тракционные силы. Для этого применяют обычные инъекционные иглы. Одну из них помещают касательно боковой стороны на зону нижнего лимба и используют в качестве экспрессора для давления на глаз. Роговичную губу операционного разреза при этом приподнимает ассистент. Когда верхний полюс ядра приподнимается и смещается к области разреза, второй иглой с него сдвигают радужку и конец этой иглы вкалывают в экватор хрусталика (ближе к задней его поверхности) соответственно 12 часам. С помощью этой иглы хрусталик слпчцлют поочередно вправо и влево. Первой иглой оказывают ди иле и по па лимб, поддерживающее необходимое положение верхнего экватора в ране. В результате боковых движений ядро выводится из раны в сторону. Давление на лимб производят до тех пор, пока экватор ядра не пройдет через зрачок. В этот момент первую иглу вкалывают в верхнюю часть ядра в предэква-ториальиую зону передней поверхности. Ядро оказывается фиксированным между двумя иглами, что позволяет легко извлечь его из глаза силами тракции (рис. 16.3,6).
Описанный метод может ni.ru. применен повсеместно, так как но требует каких либо специальных приспособлений. Одпако он не исключает выдавливания. Именно поэтому способ извлечения ядра хрусталика при экстракапсулярной методе нуждается в дальнейшем усовершенствовании. В перспективе не исключена возможность использования идеи D. Jess (1932) и G. Lasarrere (1933), предлагавших в свое время электродиафакию. Несомненно, метод нуждается в упрощении и усовершенствовании.
В последнее время для выведения ядра в переднюю камеру предложен способ с использованием ирригационного раствора: после вскрытия глазного яблока и удаления передней капсулы тупую иглу вводят под радужку на 12 часах и надавливанием на поршень шприца под ядро хрусталика вводят жидкость (при заполненной камере), в результате чего он выходит из-под радужки в переднюю камеру. После этого ядро выводят из глаза. Методом аспирации — ирригации вымывают хрусталиковые массы.
Новые возможности эвакуации хрусталиковых масс. Удаление хрусталиковых масс с помощью аспирации — ирригации успешно
299
применяют при так называемых мягких катарактах. Эту манипу ляцию также следует производить при полной камере. Для этого после выведения ядра хрусталика рану зашивают и оставляю! только 3-миллиметровое отверстие между центральными швами. При отсутствии аспирационно-ирригационного устройства от фа коэмульсификатора с этой целью можно использовать двухка мерный шприц Фукса. Упрощенным и более доступным вариантом техники является применение двух канюль (в виде полиэти леновых трубок), которые вводят в переднюю камеру между швами. Канюли могут быть соединены в одно целое или раздельны (вводят в разных отделах операционной раны). Могут быть использованы и металлические канюли; каждая из них соединяется с отдельным шприцем. Через одну канюлю ассистент нагнетает жидкость в переднюю камеру, через другую, находящуюся в руках хирурга, происходит аспирация. Особое внимание нужно уделять очищению экваториальной зоны, где находится наибольшая часть хрусталиковых масс (особенно на 12 часах), поэтому аспирационную канюлю нужно заводить далеко под радужку. Эта манипуляция без постоянного заполнения передней камеры может быть рискованной в связи с опасностью выпадения стекловидного тела. Роль промывной жидкости состоит в заполнении передней камеры, оттеснении кзади стекловидного тела и максимальной эвакуации хрусталиковых масс. Для того чтобы правильно определить, насколько полно они удалены, необходим визуальный контроль в проходящем свете. С этой целью используют коаксиальный осветитель операционного микроскопа (например, модель 310, народное предприятие «Karl Zeiss-Jena»), а также источники ультрафиолетового света, вызывающего флюоресценцию хрусталиковых масс.
Профилактическая чистка задней капсулы. Хорошо известно, что вторичные катаракты формируются как за счет хрусталиковых масс, так и клеточной пролиферации на задней капсуле. «Отскабливание» передних слоев задней капсулы позволяет в достаточной мере удалить те элементы, которые впоследствии подвергаются перерождению. По данным некоторых авторов, вероятность образования вторичных катаракт уменьшается после этой процедуры почти в 10 раз, поэтому обработка задней капсулы необходима для предупреждения развития вторичных катаракт. Метод профилактической обработки задней капсулы внедрен в офтальмохирургическую практику также одновременно с факоэмульсификацией. Однако он с успехом может быть использован при экстракапсулярной экстракции катаракты. Инструментом для обработки задней капсулы может служить круглый шпатель, конец которого загнут под прямым углом, а поверхность в этой зоне должна быть шероховатой (напоминая напильник). Шероховатой поверхностью инструмента капсулу «протирают» несколько раз. «Отскобленные» клетки вымывают промывной жидкостью.
В этом случае безопасность манипуляции обеспечивается так-
300
Ute полной камерой. Это создает равенство давления впереди и Позади тгапсулы, что очень важно для предупреждения разрыва Капсулы и выпадения стекловидного тела. Заполнение передней Хамеры производят по описанной выше методике. Контроль за глубиной этой камеры осуществляет ассистент. После обработки видней капсулы накладывают дополнительные корнеосклеральные швы для полноценной герметизации операционной раны.
Несомненно, экстра капсул яркую экстракцию катаракты в настоящее время необходимо производить на уровне всех современных достижений глазной микрохирургии. Это касается всех этапов операции: метода разреза, количества и техники наложения швов, манипуляций на радужке и др.
В заключение следует отметить, что по мере того как экстра-капсулярная экстракция катаракты становится все более надежной, безопасной и простой операцией, значение этого обстоятельства становится все более существенным и в итоге может ока-виться решающим, так как технической простоте интракапсулярного метода противопоставляется большая стабильность афа-кичяого глаза после экстракапсулярной экстракции.
Преимущества микрохирургической техники экстракции катаракты. Преимущества микрохирургии перед другими методами очевидны. Приведем некоторые из них:
1) гораздо большая точность и деликатность проводимых мани-нулицвй, меньшая травматизация тканей глаза;
2) при рпирознх па глазном яблоке намного точнее оценивается их глубина;
3) гемостаз можно осуществлять гораздо более прицельно, ограничиваясь только кровоточащими сосудами. С этой целью можпо применять микрокоагулятор, питающийся от электрических батарей. Менее удобен микрокаутер с питанием от сети переменного токи;
4) при наложении корнеосклеральных union обеспечивается поз-можпосгь нропвдеиия иглы пн нужной глубине и в точно противолежащих участках разреза;
5) можно завязать швы, точно дозируя степень их натяжения;
6) при скользящем методе экстракции хорошо видны волокна цинновой связки, что очень облегчает их отделение. При криофакии меньше вероятность случайного примораживания инструмента к краям разреза или радужке. При экстракапсулярной экстракции катаракты или разрыве ее капсулы намного облегчаются выведение масс и удаление остатков капсулы;
7) возможно своевременное определение выхождения стекловидного тела в переднюю камеру или ущемления его волокон в ране. Некоторые авторы [Barraquer J., 1968, и др.] используют с этой целью оптический срез. Однако соответствующие устройства предусмотрены только в наиболее совершенных микроскопах. При репозиции стекловидного тела под микроскопическим контролем гораздо больше уверенность в тщательном удалении волокон стекловидного тела из раны;
301
8) обеспечивается бывший ранее совершенно недоступный туи лет операционной раны (удаление пигмента, свертков крови, ворсинок шовного материала и т. д.). /
Микрохирургическая техника намного повышает возможности и качество зашивания дефектов радужки и иридодиализа. При зашивании колобомы радужки швы не удаляют. Зашивая иридо диализ, длинную петлю шва выводят через рану под конъюнк тиву и извлекают через 3—4 дня, потягивая за один конец нити шва.
Наш опыт микрохирургии катаракты позволяет рекомендовать сравнительно небольшие степени увеличения — до 10-кратного Как известно, степень увеличения микроскопа обратно пропорциональна величине поля зрения. При экстракции катаракты, особенно при накладывании и завязывании корнеосклеральных швов, желательно иметь возможно более широкое поле зрения, так как за его пределами нить легко запутывается и может выскользнуть из ушка иглы.
В общих чертах техника экстракции катаракты при микрохирургии напоминает описанную выше. Главное отличие касается методики зашивания раны. Большинство авторов, использующих микрохирургическую технику экстракции катаракты, производят зашивание на вскрытом глазном яблоке [Barraquer J., 1968; Troutman В. С., 1968]. Одним из достоинств этого способа является сравнительная простота процедуры. Однако до выведения хрусталика необходимо наложить центральный шов, что способствует более правильному (точному) сопоставлению раневых поверхностей при последующем зашивании.
Достоинства микрохирургии катаракты настолько очевидны, техника ее настолько доступна, что ее следует внедрять в широкую клиническую практику во всех учреждениях, оснащенных соответствующим оборудованием.
Незаменимым инструментом для микрохирургии катаракты являются иглы. Вполне удовлетворительным шовным материалом служат капроновые нити. Снимать эти швы необходимо также под контролем щелевой лампы или операционного микроскопа. Однако швы можно не извлекать в течение продолжительного времени, во всяком случае до момента консолидации раны. Мы предпочитаем все же их удалять, хотя большинство зарубежных офтальмохирургов считают это ненужным.
Завершение операции. Как отмечалось выше, при завязывании нитей швов следует проверить, не зияет ли рана под швом и не образовались ли складки на роговице. Желательно после завязывания нитей шва сместить его таким образом, чтобы узел и концы нити не лежали на роговице.
После завязывания нитей швов необходимо еще раз осмотреть область разреза и убедиться, что в нем не ущемлены частицы пигмента, свертки крови, радужка, капсула хрусталика, хрусталиковые массы, стекловидное тело и т. д. Все посторонние ткани должны быть удалены.
302
Радужку заправляют с целью отделить ее от области разреза В восстановить правильное положение радужки с центральной Ювицией зрачка. При интракапсулярной экстракции с этой це-|^к> прежде^ всего вводят миотики в переднюю камеру.
Наиболее действенным миотиком является ацетилхолин в рас-fiope 1:100—1:1000. Он быстро вызывает выраженный миоз, ©Стягивающий радужку от разреза, ограничивающий стекловидное тело в задней камере и смещающий зрачок к центру. Для по-дучения такого эффекта достаточно ввести несколько капель раствора. Необходимо, однако, помнить, что раствор ацетилхолина нестойкий и его следует изготавливать ex tempore непосредственно перед операцией. Хорошие результаты дает также введение в переднюю камеру 4—6% раствора пилокарпина.
После интракапсулярной экстракции катаракты для репозиции радужки обычно достаточно хорошего медикаментозного миоза. Если желаемого эффекта добиться не удалось, то это чаще всего свидетельствует о наличии механических препятствий. После экстракапсулярной экстракции введение миотиков в переднюю Камеру противопоказано. В этих случаях необходима механическая репозиция. Шпатель вводят в переднюю камеру через один из углов разреза параллельно ему. Движениями шпателя стремятся оттеснить радужку книзу, разъединяя ее с областью раз-роаа. Признаком успешной репозиции является восстановление цинтрильпого положения зрачка; желательно сместить его даже нисколько ниже.
Иногда механическая репозиция удается лучше после заполнения передней камеры воздухом. Если и это не приводит к желаемому эффекту, то чаще всего это свидетельствует о смещении радужки стекловидным телом, которое не обязательно сопровождается его выпадением.
Конъюнктивальную рану можно зашить как узловатыми швами, гак и непрерывными.
Для инъекции под конъюнктиву лучше всего применять тот антибиотик, действенность которого была определена ранее при исследовании чувствительности конъюнктивальной флоры. При отсутствии этих данных чаще всего используют пенициллин, стрептомицин или их смесь в разведении 100 000 ЕД антибиотика на 1 мл растворителя.
Раствор антибиотика в дозе 0,5—1 мл обычно вводят в нижнюю переходную складку. Поскольку в момент инъекции не исключено некоторое давление на глазное яблоко, ее лучше выполнять до введения воздуха в переднюю камеру.
Введение воздуха в переднюю камеру производят тупоконечной канюлей. Воздух набирают в шприц через раскаленную докрасна (над пламенем спиртовки) иглу, которую затем снимают и заменяют канюлей. Основная цель заполнения передней камеры воздухом — разделение поверхностей радужки и роговицы. Канюлю осторожно проводят под конъюнктивальным лоскутом через корнеосклеральный разрез в переднюю камеру. Важно не
303
оказывать никакого давления канюлей на края разреза; /место ее прохождения через корнеосклеральную рану рекомендуется слегка придавить ватным тампоном. 7
Канюлей не следует попадать в область зрачка иди колобомы во избежание повреждения передней пограничной пластинки стекловидного тела.. Самым тяжелым осложнением при введении воздуха является его полный или частичный переход в заднюю камеру. В этом положении воздух не только придавливает радужку к роговице, но и очень легко вызывает так называемый зрачковый блок.
Воздух следует вводить над радужкой возможно дальше от зрачкового края, лучше в нижней части передней камеры. Желательно заполнять камеру сразу одним большим пузырьком воздуха. При образовании в передней камере нескольких пузырьков опасность прохождения воздуха в заднюю камеру возрастает. Следует ввести конец канюли в самый крупный из пузырьков и продолжать введение воздуха. Нет необходимости в углублении передней камеры более чем до нормальной величины.
Если повторные попытки заполнить переднюю камеру воздухом оказываются безрезультативными, то может возникнуть вопрос о наложении дополнительных швов на рану. У спокойных больных перед введением воздуха лучше снять уздечный шов.
Извлечение блефаростата начинают с освобождения нижнего века. Давление на глаз при этом нежелательно, так как оно может привести, в частности, к выхождению воздуха из передней камеры.
После интракапсулярной экстракции с круглым зрачком рекомендуется вводить 1—6% раствор пилокарпина или ацетилхолина; после интракапсулярной экстракции с радиарной иридото-мией или полной иридэктомией обычно нет необходимости в мио-тиках или мидриатиках; после экстракапсулярной экстракции вводят 1% раствор атропина или 0,25% раствор скополамина.
Всем больным обычно закапывают какие-либо дезинфицирующие растворы (30% раствор сульфацила-натрия, 0,3% раствор синтомицина); при выборе препарата надо руководствоваться чувствительностью конъюнктивальной флоры.
Повязку накладывают на оба глаза. Она имеет преимущества перед бинокулярной наклейкой, поскольку умеренное давление на глаз полезно для адаптации корнеосклеральной раны; кроме того, повязка в большей мере защищает глаз от случайных или неосторожных прикосновений.
Ведение послеоперационного периода. Больной находится на строгом постельном режиме в течение нескольких часов — суток после операции. Затем больному разрешают вставать с постели. При благоприятном течении послеоперационного периода выписывают из стационара на 5—7-й день после операции. Швы, как отмечалось выше, оставляют и снимают их через 3 мес.
Важное значение имеет контроль за состоянием области зрачка. В течение первых 3 дней после операции желательно поддер-
304
живать зрачок умеренно расширенным (до 5—6 мм). Слишком; выраженный мидриаз способствует образованию спаек радужки; в прикорневой зоне, а недостаточный мидриаз — возникновению» задних спаек и зрачкового блока.
Начиная с 4-го дня желательно поддерживать более выраженный мидриаз в связи с начинающимися к этому времени явлениями послеоперационного иридоциклита. С этого же дня целесообразно местно применять стероидные гормоны; 0,5—1% суспензию кортизона или гидрокортизона, 0,5% гидрокортизоновую мазь и др.
В случае смещения зрачка кверху не следует назначать мистические средства, особенно антихолинэстеразного профиля. Этопрактически никогда не приводит к желаемому результату, но-способствует обострению воспалительного процесса.
При первых признаках формирования задних спаек необходимо провести интенсивную мидриатическую терапию (вплоть до-аппликаций с адреналином или его подконъюнктивальных инъекций), назначить кокаин с атропином, электрофорез с атропином и др. При резко выраженном послеоперационном иридоциклите применяют весь комплекс противовоспалительных средств.
Иридоциклиты после экстракции катаракты, как правило, не инфекционные. Однако назначение умеренных доз антибиотиков может быть полезно для воздействия на сопутствующую инфекцию.
Как отмечалось выше, шелковые корнеосклеральные швы надо удалять не позднее 8-го дня во избежание развития инфильтрации вокруг нитей (что способствует развитию иридоциклита). Погружные швы из виргинского шелка или супрамида остаются под конъюнктивальным лоскутом, их не удаляют. Супрамидные швы целесообразно не снимать в течение 3 мес; это способствует плотной адаптации раневых краев и является мерой профилактики астигматизма. Больные сравнительно рано могут быть выписаны под наблюдение врача поликлиники.
Конъюнктивальные швы, как правило, снимают не ранее 7-го дня. Корнеосклеральные швы следует удалять под контролем микроскопа или щелевой лампы. В глаз дважды инсталлируют 1% раствор дикаина. Веки разводят пальцами. Предварительно с концов шва надо снять покрывающую их слизь. Нить захватывают пинцетом и несколько приподнимают, с тем чтобы в петлю шва можно было войти режущим инструментом (осколком бритвенного лезвия, зажатого в иглодержателе). Петлю следует разрезать изнутри кнаружи и не задеть при этом узел (рис. 164).
Для удаления непрерывного корнеосклерального шва и узловатых швов осколком бритвенного лезвия рассекают часть нити, проходящей через роговицу. Протягивая за узел или его концы, удаляют весь шов. Непрерывный конъюнктивальный шов снимают потягиванием за центральную часть нити. После удаления корнеосклеральных швов в глаз закапывают 30% раствор суль-фацил-натрия и 0,3% раствор синтомицина.
20 Руководство по глазной хирургии
305
ЦII Коррекция афакии у
IlJ Вопрос о коррекции афакий решают, / как правило, до операции. В Современной \ / офтальмологии используют четыре вида
коррекции афакии: очковую, интраокуляр-££ ными линзами (искусственные хрустали лТЯ " ки), с помощью кератофакии и контактны-ми линзами. При выборе метода учитыва-\ ют возраст больного, наличие сопутствую-\ щих заболеваний (глаукома, диабетичес-/г / кая ретинопатия, макулярная патология,
патология сетчатки), отношение больного //^ / к тому или иному виду коррекции.
/ Прямым показанием к интраокулярной
// х / коррекции является монокулярная афа-
/ кия при полноценном зрении на втором
глазу и необходимости в бинокулярном 164. Удаление роговично- зрении в профессиональной деятельности го шва (схема). больного.
Вопрос об очковой коррекции не нуждается в подробном обсуждении, поскольку за последние десятилетия в этой области не произошло каких-либо изменений.
Применяют также интраокулярную коррекцию (искусственные хрусталики). Для изготовления искусственных хрусталиков (ИОЛ) используют два вида материала: для оптической части — высоко очищенный полиметилметакрилат, для части, укрепляющей линзу, — различные инертные полимеры и, реже, металлы.
При разработке различных видов ИОЛ большое внимание уделяют способам крепления линзы в глазу. Известны различные способы крепления: с опорой на угол передней камеры, на радужку в области зрачка (ирис-клипс-линзы), на радужку вне области зрачка (экстрапупиллярные ирис-линзы), к капсуле хрусталика, с иридокапсулярной фиксацией (в пространстве между радужкой и капсулой, как правило, в иридокапсулярных спайках), с опорой па ресничную борозду.
Как наименее травматичные и отличающиеся меньшей возможностью осложнений зарекомендовали себя способы крепления на радужке вне области зрачка (экстрапупиллярные ирис-линзы) и к капсуле хрусталика с иридокапсулярной фиксацией.
Отдаленные результаты показали, что заднекамерные линзы, не будучи фиксированными, имеют тенденцию к смещению в
стекловидное тело, что сопровождается тяжелыми воспалительными процессами,- Интерес к интраокулярной коррекции афакии вновь возник в связи с изобретением переднекамерных линз. Фиксация этих имплантатов достигалась за счет упора в область угла передней камеры.
Воспалительная реакция, развивающаяся при использовании имплантата данного типа, обычно не представляет серьезной опас-
306
Юсти. Однако в отдаленные сроки после операции в глазу довольно часто возникают трофические расстройства, в первую оче-^дь дистрофия роговицы с отеком всех ее слоев. Несовершенство 1ксации линзы с упором в область угла передней камеры по-
ВЛужило стимулом к разработке еще одного типа искусственного хрусталика — ирис-клипс-линзы, укрепляющейся в области прачка: соответствующие упоры фиксируют ее к радужке, предохраняя от смещения. Однако американские офтальмологи разработали усовершенствованные модели переднекамерных линз и до Сих пор около 30% имплантаций ИОЛ выполняют, применяя эти линзы.
На протяжении последнего десятилетия ведущее положение нанимали модели ирис-клипс-линз, однако за последние голы наметился явный отход от использования этого типа крепления ИОЛ. Это связано со значительным процентом дислокаций данных линз, особенно в случаях мидриаза по медицинским показаниям. Менее широко стали применять также иридокапсулярную-фиксацию, хотя она имеет целый ряд достоинств (физиологичное положение линзы, хорошая ее фиксация за счет иридокапсуляр-пых спаек), однако трудность удаления линзы в случае необходимости и изменение ее положения при слишком интенсивном рубцевании значительно снизило интерес к этому виду ИОЛ.
I! настоящее время наибольшее распространение в мировом масштабе волу вила фиксация ИОЛ в ресничной борозде. Ее преимущества достаточно прочная опора далеко от «опасных» зон. Кроме того, немалое значение имеет то обстоятельство, что при атом способе фиксации хрусталик занимает положение, более близкое к естественному.
В Советском Союзе в клинической практике применяют экс-трапуниллярные линзы М. М. Краснова и М. М. Краснова — Пивоварова, интракапсулярную линзу Алексеева, ирис клинс-липзы Федорова Захарова (рис. 1(>.г»), Экстрапупиллярные и интракап -
165. Модели интраокулярных линз (схема).
а — М. М. Краснова; б — Двали (1978), в— Федоровой-Захарова.
20
307?
сулярные линзы лишены недостатков, характерных для ирис клипс-линз. '
Одной из важнейших проблем подсадки ИОЛ явлдется проб лема щажения эндотелия в ходе и после операции. С этой целью перед операцией проводят электронную микроскопию эндотелия, при небольшом количестве эндотелиальных клеток (менее 1500 в 1 мм2) применение ИОЛ противопоказано. Важно избегать лю бых прикосновений к задней поверхности роговицы в ходе операции; в последнее время появились протекторы эндотелия (хилон и др.), хорошо себя зарекомендовавшие. По возможности следует проводить все манипуляции с ИОЛ при полной передней камере, т. е. после зашивания операционной раны. Важными проблемами являются также предупреждение дислокации, псевдофакоденеза, контакта опорных элементов с роговицей, полноценной герметизации операционной раны.
Одной из важнейших задач при имплантации ИОЛ является борьба с операционным астигматизмом; хирургическая профилактика обеспечивается правильным положением и техникой разреза, особенностями различных шовных материалов и соответственно типом корнеосклеральных швов. В зависимости от типа шовного материала определяют сроки снятия швов; в частности, супрамид может и должен оставаться длительное время (не менее 3 мес), что, безусловно, обеспечивает лучшую консолидацию раны при стабильном четком сопоставлении раневых краев, и это является одним из элементов профилактики астигматизма. Важно в этом смысле наложение в первую очередь центрального шва еще до проведения окончательного операционного разреза (как при узловых швах, так и при непрерывном шве).
Хирургическое исправление послеоперационного астигматизма осуществляют методами кератотомии или клиновидной резекции (операции Сато, Тротмана, Федорова, Аветисова). Как уже отмечалось, вопрос о методе коррекции афакии необходимо решать до операции. В настоящее время большинство больных стремятся к современной коррекции афакии: ИОЛ или контактной коррекции. Выбор между этими видами не всегда прост. Каждый метод имеет свои «за» и «против». Коррекция ИОЛ сопряжена со значительно большим риском, в то время как при контактной коррекции требуется сложный уход за линзами.
Опыт показывает, что больные старше 55 лет часто с большим трудом осваивают технику надевания линз и ухода за ними. Таким образом, одним из критериев выбора является возраст больного.
К послеоперационным осложнениям, возникающим при подсадке ИОЛ, и характерным наиболее тяжелым последствиям следует отнести эпителиально-эндотелиальную дистрофию и отек желтого пятна. Частота каждого из этих осложнений достигает 2 %. В этих случаях очень важна своевременная диагностика этих осложнений, которая позволит избежать тяжелых последствий. Для диагностики отека области желтого пятна имеют значение
308
раннее исследовние поля зрения (центральные скотомы) и флюоресцентная ангиография.
Дислокации ИОЛ при хорошей технике имплантации можно, как правило, избежать. Если же она возникает, то своевременное Вмешательство позволяет добиться благоприятных результатов.
Нередко приходится решать вопрос о «вторичной» имплантации ИОЛ на афакичном глазу. В этих случаях необходимо знать, что такая операция очень сложна и после нее могут развиться тяжелые осложнения, поэтому, если у хирурга нет опыта выполнения таких операций, их лучше избежать.
В послеоперационном периоде после подсадки ИОЛ длительно применяют кортикостероиды, назначают простагландины, стремятся не допустить возникновения синдрома мелкой камеры, правильно и своевременно снимают швы (косо наложенные швы надо удалять как можно раньше во избежание развития астигматизма) .
Имплантация биологических линз в роговицу (кератофакия). Операция имплантации искусственного хрусталика при ряде достоинств обладает основным недостатком — внутрь глаза вводят инородное тело.
Первые попытки изменить рефракцию, изменяя кривизну роговицы, относятся еще ко второй половине прошлого века. Возрождение этой идеи в наше время связано с резко возросшими то х п ическими возможностями.
В настоящее время успешно развивается новое направление рефракционной хирургии афакии, в основе которого заложены работы ряда исследователей [Морхат И. В., 1964, 1975; Беляев В. С., 1964; Краснов М. М., 1970; Беляев В. С., Веретенникова В. В., 1970; Груша О. В., Мустаев И. А., 1971; Barraquer I., 1949, 1965, и др.). В последние годы получены обнадеживающие результаты можслойной рефракционной кератопластики [Беляев В. С., Душин 11. В., 1980—1 983], удалось добиться точной коррекции афакии при высокой остроте зрения (до 0,8—1,0) в послеоперационном периоде. Методика межслойных пересадок получила одобрение и в работах зарубежных авторов [Troutman R. С. et al., 1981, и др.].
Представляют интерес сообщения Н. Е. Kaufman (1980), Т. Werblin и соавт. (1981) об эпикератофакии — своеобразной живой контактной линзе. В этом случае трансплантат в виде линзы из роговицы укрепляют швами на поверхности роговицы афакпч-ного глаза. По их мнению, вторичная кератофакия предпочтительнее вторичной имплантации внутриглазной линзы. Авторы считают, что рефракционная кератопластика — это новое перспективное направление в офтальмохирургии. Детальные сведения о рефракционной кератопластике при афакии приведены в главе 4 «Операции на роговице и склере».
Контактная коррекция афакии. С точки зрения хирургии, важно, чтобы зона, на которую будет надеваться линза, не была искажена в ходе операции. В связи с этим следует принимать
309
все возможные меры для профилактики послеоперационного ас тигматизма. Область раны также должна быть гладкой. В связи с этим более целесообразно применить лимбальный разрез с конь юнктивальным лоскутом. Жесткие контактные линзы ощущаются как инородное тело, .хотя именно после экстракции катаракты они переносятся сравнительно лучше, поскольку чувствительность роговицы долгое время после операции остается сниженной (перерезаются роговичные нервы).
Острота зрения в жестких линзах, как правило, выше, чем в мягких контактных линзах, по двум причинам: во-первых, материал, из которого они сделаны, более прозрачен; во-вторых, жесткие линзы нейтрализуют роговичный астигматизм. Несмотря на это, в последние десятилетия мягкие контактные линзы в значительной мере вытеснили жесткие, поскольку они обеспечивают больший комфорт: при хорошей подгонке они практически не ощущаются в глазу. За последние годы с помощью мягких контактных линз удалось добиться так называемого постоянного (длительного) ношения без удаления линзы с глаза (2 нед и дольше). Для хорошей переносимости и тем более «постоянного» ношения мягких контактных линз необходимо обеспечивать высокую проницаемость кислорода. На практике это означает, что для изготовления современных моделей афакических мягких контактных линз необходимо использовать гидрофильные материалы с высоким содержанием воды (70—80%). Стандартные мягкие контактные линзы из материалов «ХЕМА» (38,9% гидрофильности) для коррекции афакии с «постоянным» ношением подходят мало.
Так называемая афакическая линза должна быть толстой, следовательно, она плохо пропускает кислород. В противоположность этому линзы с низкой гидрофильностью иногда могут быть использованы для постоянного ношения при миопии именно из-за их тонкости, особенно в центральной части.
Хорошо подобранная мягкая контактная линза на глазу не должна сидеть ни слишком свободно, ни слишком плотно: при моргании линза должна совершать экскурсии около 0,5—1,0 мм. Правильность посадки линзы иногда бывает трудно определить сразу, и только через несколько часов или даже дней она принимает окончательную форму соответственно осмотическому давлению слезной жидкости, ширине глазной щели, смыканию век и т. д.
Значительный опыт подбора мягких контактных линз при афакии позволили выявить одно, практически очень важное, препятствие к их ношению: многие больные старше 55 лет не могут преодолеть «психологический барьер» и приобрести навык надевания линзы на глаз. Это необходимо обязательно учитывать при выборе оптимального метода оптической коррекции афакии (очки, жесткие контактные линзы, мягкие контактные линзы, кератофа-кия, ИОЛ) еще до операции.
310
Операционные и послеоперационные осложнения
Выпадение стекловидного тела. Выпадение стекловидного тела было и остается одним из самых распространенных осложнений при экстракции катаракты (7—11%). Оно является более серьезным, чем считали раньше [Vali D., 1965]. Было установлено, что хотя у большинства больных, у которых произошло выпадение стекловидного тела, послеоперационный период, казалось бы, протекает гладко, впоследствии (через 1—2 года) у них развиваются тяжелые осложнения. В итоге около 7з глаз после выпадения стекловидного тела через 2—3 года после операции утрачивают функциональное значение. Анализ осложнений при криоэкстракции катаракты приведен в работе Т. Ф. Субботиной и А. Ф. Шураева (1970).
Следует помнить, что возможен и спонтанный разрыв передней пограничной пластинки стекловидного тела через какое-то время после операции (иногда через много месяцев). В этом случае лечебные воздействия такие же, как при обычном выпадении стекловидного тела.
Наиболее частыми осложнениями после выпадения стекловидного тела являются дистрофия роговицы, дегенерация желтого пятна, отслойка сетчатки, хронические увеальные воспалительные процессы, развитие шварт и обширных спаек в области операционного разреза. Эти состояния (за исключением дистрофии роговицы) во многом связаны с тракционным действием фибрилл стекловидного тела. Когда стекловидное тело фиксировано к области раны и, следовательно, с этой стороны неподвижно, вся сила тракции приходится на «противолежащие» оболочки — сетчатку и увеальный тракт, что приводит к развитию дегенеративных и воспалительных процессов, а ташке отслойке сетчатки, которая имеет особенно тяжелый nporiioa именно в этом случае.
Положенно еще больше осложняется, если хрусталик удален с круглым зрачком. Фибриллы стекловидного тела, перекидывающиеся через верхний край зрачка к ране, постепенно втягивают его кверху, так что иногда зрачок полностью исчезает за областью верхнего лимба. Продолжающееся сокращение зрачкового сфинктера еще более усугубляет воспалительный процесс в радужке.
В последнее время уделяют большое внимание профилактике выпадения стекловидного тела и лечебным (хирургическим) воздействиям в случаях, когда оно произошло. Предотвратить выпадение стекловидного тела помогают меры, принятые непосредственно перед операцией — акинезия, анестезия, иммобилизация век. Эти меры позволили снизить частоту выпадения стекловидного тела примерно до 2,8%. К приемам хирургической профилактики относится исключение давления на глазное яблоко в ходе операции: нейтрализация давления век с помощью блефаро-стата, давления наружной спайки век с помощью кантотомии,
311
ослабление давления прямых мышц на глазное яблоко с помощью ретробульбарной анестезии и т. д.
Обычно производимое отсечение выпавшей части стекловидного тела способствует смыканию раневых краев (особенно при корнеосклеральных швах), но не предупреждает спаяния его волокон с областью разреза. В связи с этим характер хирургического вмешательства зависит в первую очередь от консистенции стекловидного тела. Если оно разжижено и, следовательно, его фибриллярная структура практически отсутствует, то опасность, развития упомянутых выше ретракционных осложнений невелика; в этих случаях обычно не требуется дополнительных манипуляций, за исключением полноценного закрытия операционной раны. Однако намного чаще стекловидное тело оказывается оформленным, в связи с чем требуются специальные воздействия для отделения его от области операционного разреза и предупреждения тракционных воздействий на сосудистую оболочку и сетчатку.
Если эти специальные воздействия не осуществляют, то необходимо по крайней мере произвести иридэктомию, так как сокращающееся стекловидное тело обязательно подтянет верхнюю часть радужки к ране. Многие зарубежные авторы [Paton R. et al., 1957, и др.] считают, что обычно иридэктомии недостаточно, так как ножки колобомы все равно спаиваются с областью разреза и сокращение сфинктера зрачка постоянно поддерживает состояние хронического раздражения радужки. Учитывая это, ряд авторов в настоящее время широко практикуют осуществление после выпадения стекловидного тела нижней сфинктеротомии в дополнение к обычной сфинктеротомии сверху.
Несомненно, шагом вперед явился метод так называемой репозиции стекловидного тела. Сущность его заключается в следующем. Операционную рану следует плотно закрыть, чтобы полностью исключить выхождение стекловидного тела наружу в» время манипуляций; в случае необходимости накладывают дополнительные корнеосклеральные швы. Затем через один из углов разреза в переднюю камеру вводят шпатель (1), который продвигают (вплотную к радужке) вдоль внутренней поверхности раны до противоположного ее конца (2) (рис. 166). Вслед за этим шпатель перемещают сверху вниз в передней камере (3, 4), причем место его введения в рану служит как бы точкой вращения.
При удачном выполнении этой манипуляции удается отделить все волокна стекловидного тела от области разреза. Мы предложили выполнять репозицию после заполнения передней камеры воздухом; это технически сложнее, но зато визуально позволяет контролировать, насколько полно удалось отделить стекловидное тело. Заслуживает внимания дополнительный прием, позволяющий диагностировать ущемление хотя бы отдельных волоков стекловидного тела в разрезе. По зашитой ране слегка поглаживают ватным тампоном в направлении от роговицы к склере.
312
166. Репозиция стекловидного тела ^схема). Объяснение в тексте, а. б — этапы операции.
Если при этом наблюдаются хотя бы легкие движения зрачка или искажения его формы, репозицию нужно продолжить, добиваясь полного эффекта.
В последнее время заслуженно широкое распространение получила так называемая передняя витрэктомия. Отсечение выпадающего стекловидного тела производят до тех пор, пока оно полностью не уйдет за радужку. В некоторых случаях показано отсасывание стекловидного тела.
В настоящее время трудно дать сравнительную оценку всех этих способов. В их основе лежит стремление к полному освобождению передней камеры, области зрачка и операционного разреза от элементов стекловидного тела.
Обычное выпадение стекловидного тела в операционную рану распознается легко. Значительно трудное диагностировать выхож-депие стекловидного тола н переднюю камору через какое-то время поело извлечения хрусталика.
О выхождении стекловидного тола в переднюю камеру могут свидетельствовать следующие признаки:
1) углубление передней камеры в первые же минуты после извлечения хрусталика;
2) смещение зрачка (чаще всего кверху) или изменение его формы;
3) ..образование многих пузырьков при введении воздуха в переднюю камеру;
4) тенденция зрачка к расширению, которая не устраняется даже при введении пилокарпина в переднюю камеру.
Своевременное распознавание выхождения стекловидного тела в переднюю камеру имеет важное практическое значение, так как возможностей предпринять необходимые меры в этом случае больше, чем при выпадении стекловидного тела за пределы камеры. Главной целью лечебных воздействий и в этом случае остается отделение стекловидного тела от области разреза, а в случае возможности отграничение его за диафрагмой радужки.
313
Следует иметь в виду, что введение миотиков в переднюю ка меру не ведет к восстановлению правильной формы и положения зрачка, особенно в послеоперационном периоде. Сокращение сфинктера не в состоянии преодолеть механического препятствия со стороны стекловидного тела. Однако на практике хирурги не редко ограничиваются одной миотической терапией, которая не только бесполезна, но и вредна, поскольку вызывает раздражение цилиарного тела, образование зрачкового блока и т. д.
Хирургические воздействия при выхождении стекловидного тела в переднюю камеру следует начинать с безукоризненного закрытия операционной раны (в случае необходимости дополнительными швами). Затем необходимо ввести воздух в переднюю камеру, что в этих условиях часто является непростой манипуляцией. Дело в том, что если конец канюли попадает в массу стекловидного тела, то вводимый воздух часто поступает не в переднюю, а в заднюю камеру; это ухудшает положение и, в частности, может привести к дальнейшему выпадению стекловидного тела. Необходимо вводить воздух в переднюю камеру за пределами выбухающего в нее стекловидного тела; конец канюли следует помещать возможно дальше от зрачка, лучше всего в нижней части передней камеры.
При попадании воздуха за радужку необходимо либо отсосать его, либо переместить в переднюю камеру легким давлением на верхнюю часть радужки. Если удалось заполнить переднюю камеру одним большим пузырьком воздуха и зрачок не смещается в сторону, то следует стремиться к миозу и «изоляции» стекловидного тела за радужкой.
Необходимо учитывать, что при отсутствии эффекта от указанных манипуляций необходимо использовать описанные выше хирургические воздействия, показанные при выпадении стекловидного тела в рану (репозиция стекловидного тела и т. д.). В противном случае неизбежно спаяние стекловидного тела с раной со всеми вытекающими отсюда последствиями.
Экспульсивное кровотечение. Экспульсивное кровотечение является одним из самых тяжелых осложнений экстракции катаракты; оно возникает примерно в 0,2% случаев. Кровотечение может начаться тотчас по окончании проведения роговичного разреза; в этих случаях хрусталик самостоятельно выталкивается через раневое отверстие, за ним выходит стекловидное тело и появляется кровь. Однако значительно чаще начавшееся на операционном столе экспульсивное кровотечение возникает только в конце операции.
Одним из первых его признаков могут быть смещение зрачка и тенденция радужки к выпадению в рану. Попытки заправить радужку в этих случаях безуспешны. Вторым признаком кровотечения является выпадение стекловидного тела в раневое отверстие. Окончательным подтверждением наличия экспульсивного кровотечения является нарастающая гипертензия глаза. Нередко в области зрачка становятся видимыми смещающиеся оболочки.
314
Все эти симптомы иногда сопровождаются головной болью, болями в глазу, тошнотой и рвотой. При наличии всех указанных признаков хирург должен принимать немедленные меры для ликвидации этого грозного осложнения.
Известны также случаи позднего кровотечения, когда только на 2—5-й день после гладко протекавшей операции появляются боли в глазу, тошнота, рвота, повязка пропитывается кровью. Обнаруживается легкий отек век, из глазной щели сочится кровь, область операционной раны прикрыта свертком крови, в передней камере также видна кровь.
Возможности лечения этого тяжелого осложнения крайне ограничены. Первой попыткой борьбы с его последствиями была произведенная в 1915 г. F. Verhoeff фистулизация склеры в заднем отделе глазного яблока. В. П. Филатов (1934) и М. И. Авербах (1936) предложили производить заднюю трепанацию склеры в качестве профилактической меры перед операциями, сопровождающимися вскрытием глазного яблока. По-видимому, эта мера недостаточно эффективна, так же как и другие.
При лечении экспульсивного кровотечения нужно стремиться по возможности максимально вывести кровь, скапливающуюся в супрахориоидальном пространстве. Именно эта идея лежит в основе фистулизации склеры, разработанной М. М. Красновым (1959). Автор считает, что для эвакуации крови из супрахорио-идального пространства недостаточно только создать канал для ее оттока наружу и что для этого нужна какая-то дополнительная активная сила. Исходя из этого, он предложил метод так называемой форсированной эвакуации крови из супрахориоидаль-ного пространства. Метод заключается в том, что в дополнение к обычной фистулизации склеры в .заднем отделе глаза в стекловидное тело вводят воздух. Сила его давления способствует расправлению оболочек и эвакуации крови ил супрахориоидальпого пространства при условии хорошей герметизации рапы (в случае необходимости дополи игольными корнеосклеральными швами).
При появлении признаков экспульсивного кровотечения хирург, произведя отсенаровку конъюнктивы (в случае быстро нарастающих явлений этого можно не делать), должен произвести перфорацию склеры с помощью ножа Грефе в двух нижних квадрантах, расположенных близко от горизонтальных меридианов. Если через эти отверстия кровь не поступает или поступает в незначительном количестве, фистулизацию можно произвести и в верхних квадрантах. Для решения вопроса о том, с какого квадранта надо начинать фистулизацию, следует исходить из того, с какой стороны начинают смещаться оболочки. Это нередко хорошо видно через область зрачка. Как только кровь начала поступать через отверстия в склере, необходимо наложить дополнительные корнеосклеральные швы, если герметизация раны недостаточна. Наконец, после тщательного закрытия раны следует вводить воздух в стекловидное тело. При выполнении операции
315
167. Эвакуация крови при экспульсивной геморрагии (схема).
надо все время контролировать, не закрылись ли отверстия в склере, и приоткрывать их с помощью шпателя. Затем зашивают конъюнктивальную рану (рис. 167).
В том случае, если в последующие дни при исследовании с помощью щелевой лампы вновь обнаруживают отхождение оболочек к центру глаза, введение воздуха и эвакуацию скопившейся крови следует повторить. Если осложнение обнаружено в самой начальной стадии, когда еще не началось активное выхожде-ние стекловидного тела и крови в рану, можно обойтись тщательной герметизацией раны швами и созданием тем самым резкой гипертензии глаза.
Выпадение радужки. Разнообразные причины выпадения радужки в послеоперационном периоде можно объединить в три группы: плохая герметизация раны, давление на глазное яблоко извне, например, в результате рвоты, травматизации глаза самим больным и т. д., и давление изнутри глазного яблока, вызванное стекловидным телом при вскрытии его пограничной мембраны или экспульсивным кровотечением.
Различают профилактические и лечебные меры борьбы с этим осложнением. К первым относят правильное проведение операционного разреза, тщательное наложение корнеосклеральных швов и достаточное их количество (не менее шести), а также введение воздуха в переднюю камеру. Единственный способ лечения выпадения радужки — хирургический.
В тех наиболее часто наблюдающихся случаях, когда выпадение радужки обусловлено плохой герметизацией раны или давлением на глазное яблоко извне, следует либо отсечь выпавшую радужку, либо (при стремлении к сохранению круглого зрачка) заправить ее в рану, сделав предварительную базальную иридо-томию. Операцию заканчивают наложением одного или двух (дополнительных) корнеосклеральных швов.
Если ущемление радужки в ране вызвано давлением со стороны стекловидного тела изнутри глазного яблока, то заправле-ние радужки представляет нелегкую задачу. Давление со стороны стекловидного тела может быть устранено только уменьшением его количества в глазу, поэтому повторные попытки заправить радужку ни к чему не приведут. Надо сделать либо полную иридэктомию, либо (при стремлении сохранить круглый зрачок) отсосать жидкую часть стекловидного тела.
Во избежание подтягивания зрачкового края и спаяния его с областью разреза следует дать выход стекловидному телу путем
316
осуществления базальной иридотомии или иридэктомии. Если же выпадение радужки является симптомом начавшейся экспульсивной геморрагии, то следует произвести операцию — форсированную эвакуацию крови из супрахориоидального пространства.
Отслойка сосудистой оболочки. Отслойка сосудистой оболочки — одно из часто встречающихся осложнений после хирургических вмешательств, связанных с вскрытием глазного яблока, в том числе по поводу катаракты. В ряде случаев могут наблюдаться очень тяжелые последствия отслойки, такие, как дистрофия роговицы, сращения в углу передней камеры и в области эрачка, вторичная глаукома вследствие зрачкового блока и т. д. Указанные состояния могут привести не только к ухудшению’ зрения, но и к потере глаза, а лечение их часто представляет большие трудности. Гораздо рациональнее предупредить их своевременным вмешательством по поводу отслойки сосудистой оболочки. С этой целью были предложены диатермокоагуляция склеры [Краснов М. М., Шульпина Н. Б., 1956], задняя склерэктомия [Филатов В. П., Кальфа С. Ф., 1953], введение воздуха в переднюю камеру [Фрадкин М. Я., Могилевская Ф. Я., 1961] и даже-цилиарная трепанация склеры [Еремина А. И., 1965].
В литературе имеются указания на существование зависимости между особенностями техники операции (но поводу катаракты) и частотой но.'шикпово11ия отслойки собственно сосудистой оболочки в послеоперационном периоде. Основными причинами ее отслойки являются: длительная гипотония, обычно вследствие* фильтрации внутриглазной жидкости через плохо закрытую операционную рану; «склеральное» положение разреза в стенке глазного яблока, при котором, по-видимому, повреждается область-склеральной шпоры. Значение обоих этих факторов подтверждается нашими клиническими наблюдениями. Установлено, что осложнение отмечалось почти в 2 раза чаще при разрезе в задней-части лимба или еще более склерально. Средняя частота отслойки собственно сосудистой оболочки при экстракции катаракты, по нашим данным, составляет 2,7%.
Наиболее серьезные осложнения после отслойки собственно сосудистой оболочки чаще всего связаны с исчезновением передней камеры. Величина и продолжительность существования отслойки сами по себе не являются показанием к активному вмешательству. Мы производили его только при отсутствии передней камеры в течение 5 дней.
Предпочтительнее в этих случаях делать разрез склеры (не трепанацию) так же, как при цикло диализе, т. е. на расстоянии 5—6 мм от лимба. Этого, как правило, достаточно для выпускания жидкости из супрахориоидального пространства; через этот же разрез в переднюю камеру между склерой и ресничным телом проводят шпатель и по этому каналу заполняют воздухом переднюю камеру. Если при биомикроскопии удается констатировать, хотя бы очень мелкую переднюю камеру, то можно, как правило, не производить операцию.
3!Р
Кровоизлияние в переднюю камеру и стекловидное тело. Диагноз внутриглазного кровоизлияния в послеоперационном периоде не представляет трудностей. Необходимо, однако, четко разграничить кровоизлияние в стекловидное тело и кровоизлияние в переднюю камеру. С этой целью целесообразно проводить исследование с реградиентным освещением (осветитель ставят почти параллельно оси наблюдения): если кровоизлияние ограничивается передней камерой, то всегда можно увидеть равномерный, хотя и тусклый, рефлекс глазного дна, если, конечно, гифема не занимает всю область зрачка. Кроме того, отмечается резко выраженная «тиндализация».
При правильной хирургической технике послеоперационные кровоизлияния в стекловидное тело встречаются сравнительно редко. Они возникают либо после выпадения стекловидного тела, либо при сопутствующих общих заболеваниях (диабет, гипертоническая болезнь и др.).
Самым лучшим методом борьбы с кровоизлиянием в переднюю камеру является его профилактика. Это осложнение может быть обусловлено недостаточным гемостазом конъюнктивальных и склеральных сосудов или кровотечением из сосудов радужки при ее разрезе или отрыве у корня. В этих случаях необходимо использовать все возможные средства для удаления крови из камеры, поскольку она является помехой при выполнении операции и серьезной опасностью в послеоперационном периоде (образование спаек, имбибиция задних слоев роговицы гемосидерином).
Наиболее распространенным способом удаления крови из передней камеры является ирригация — орошение жидкостью из шприца. Эту манипуляцию следует производить при неполностью зашитой ране, чтобы жидкость с кровью имела свободный выход из камеры. В противном случае легко спровоцировать выпадение стекловидного тела.
В том случае, если образовались свертки крови, то их можно удалить пинцетом с гладкими браншами. Нужно стремиться в первую очередь удалить кровь из области зрачка. С этой целью нередко с успехом применяют введение пузырька воздуха в переднюю камеру.
При попадании крови в стекловидное тело следует опасаться швартообразования в полости глаза. Симптомом начинающегося швартообразования являются видимые (особенно при биомикроскопии) тяжи в стекловидном теле, чаще всего имеющие вертикальное направление и малоподвижные. При первых признаках такого рода изменений необходимо поставить вопрос о хирургическом вмешательстве: отсасывании стекловидного тела с последующим замещением его трупным стекловидным телом или вит-реофагии.
Зрачковый блок. Вторичная глаукома после экстракции катаракты является одним из самых опасных осложнений. Причины этого серьезного осложнения различны: ущемление радужки в операционном рубце, заращение угла передней камеры, врастание
.318
•пителия в переднюю камеру и т. д. Однако наряду с перечислен-Выми формами вторичной глаукомы встречается так называемая глаукома зрачкового блока. Частота этого осложнения возросла в связи с широким внедрением в практику экстракции катаракты с круглым зрачком.
Возникновение глаукомы зрачкового блока обусловлено срастанием или плотным смыканием задней части зрачкового пояса радужки, а также края колобомы, если таковая имеется, с остатками капсулы хрусталика (при экстракапсулярной экстракции катаракты) или с передней пограничной пластинкой стекловидного тела (после интракапсулярной экстракции катаракты). В том и другом случае это приводит к возникновению препятствия на пути тока внутриглазной жидкости из задней камеры в переднюю, что и вызывает повышение внутриглазного давления. Камерная влага, скапливаясь за радужкой, смещает ее вперед, причем в отличие от картины iris bombee околозрачковая область, не будучи фиксированной к хрусталику, также может участвовать в этом смещении. Достаточное внимание этому виду глаукомы и особенно ее лечению стали уделять сравнительно недавно [Краснов М. М., Шмелева В. В., 1962, 1968; Chandler Р„ 1953, 1957, 1962; Irvine S., 1957].
Возникновению зрачкового блока способствует послеоперационный иридоциклит. Зрачковый блок, по нашим наблюдениям, чаще развивается после операций, протекавших без повреждения передней пограничной пластинки и без выпадения стекловидного тела.
Выпадение стекловидного тела может привести к развитию вторичной глаукомы, но зрачкового блока при этом обычно не бывает.
Глаукома зрачкового блока чаще возникает через 2—3 нед, реже в первые 1—2 мое после экстракции катаракты. Больные предъявляют жалобы, характерные для закрытоугольной глаукомы. В выраженных случаях могут наблюдаться отек эпителия роговицы и повышение внутриглазного давления до очень высоких цифр (50—60 мм рт. ст.).
Диагноз устанавливают на основании трех основных симптомов, возникающих в первые 2—3 нед после экстракции катаракты: повышения внутриглазного давления, наличия мелкой передней камеры и пленки в области зрачка.
Надо обращать внимание на выбухание вперед напряженной передней пограничной пластинки стекловидного тела. В тех случаях, когда классические признаки недостаточно определенны, большое значение для диагностики имеет симптом выбухания радужки (иногда до контакта с задней поверхностью роговицы) в периферических ее отделах по всей окружности или на ограниченном участке.
Своевременная диагностика и лечение глаукомы зрачкового блока совершенно необходимы, поскольку промедление приводит к образованию кольцевых периферических спаек, а это в свою
319-'
очередь — к более тяжелой вторичной глаукоме, очень плохо поддающейся воздействию.
Проводя консервативное лечение, прежде всего надо стремиться к максимальному мидриазу. С помощью мидриатиков можно разорвать сращения у зрачкового края и восстановить яормальное сообщение между задней и передней камерами.
Если консервативное лечение не дало должного эффекта, то -следует произвести хирургическое вмешательство с целью восстановить свободное сообщение между передней и задней камерами. Рекомендуется выполнить базальную иридэктомию, которая обычно позволяет восстановить эти сообщения в достаточной мере.
Важным вопросом является профилактика зрачкового блока. Ее следует производить в трех направлениях: 1) предупреждение или максимальное ослабление послеоперационного иридоциклита; 2) профилактика отслойки собственно сосудистой оболочки; 3) своевременный мидриаз.
Неполноценная адаптация краев операционной раны. Явно недостаточное смыкание краев раны определяют при биомикроскопии. В подобных случаях необходимо своевременно наложить корнеосклеральные швы во избежание присоединения еще более тяжелых осложнений (врастание эпителия или соединительной ткани в переднюю камеру и др.). Чаще, однако, неполноценная герметизация определяется по тем или иным признакам фильтрации, которыми, в частности, являются отек конъюнктивального лоскута и его резкое побледнение. Наконец, при подозрении на фильтрацию целесообразно провести пробу Зайделя. При хорошем освещении и широко раздвинутых веках на область послеоперационной раны закапывают 1% раствор флюоресцеина, в результате чего создается равномерный фон желто-коричневой окраски. При функционирующей фистуле на этом фоне появляется зеленое расплывающееся пятно, свидетельствующее о размазывании флюоресцеина вытекающей камерной влагой. Таким образом можно определить не только существование фистулы, но и ее точную локализацию.
Одним из признаков фильтрации является гипотония, особенно возникающая периодически; этот симптом характерен также для хронической фистулы, сформировавшейся после длительного расхождения краев раны.
Лечение описываемого осложнения, как правило, хирургическое; если участок фильтрации невелик, то можно осуществить его каутеризацию (поверх конъюнктивы). При отсутствии эффекта, а также при наличии более обширного участка расхождения раневых краев необходимо наложить дополнительные корнеосклеральные швы. В случаях существования хронической фистулы обычно производят пластику конъюнктивой, смещенной от экватора.
Дистрофия роговицы. Развитию дистрофических изменений способствуют передние спайки или контакт задней поверхности
320
роговицы с радужкой либо стекловидным телом. По-видимому, существует предрасположение к дистрофии роговицы, которое возникает под влиянием операционной травмы.
Наибольшее внимание должно быть уделено изменениям роговицы, связанным с нарушением барьерной функции эндотелия (заднего эпителия) в результате технических погрешностей или послеоперационных осложнений. Эти состояния встречаются после экстракции катаракты чаще всего и могут быть охарактеризованы как «дистрофический отек». Известно, что в норме эндотелий роговицы играет роль барьера, не пропускающего влагу передней камеры. При нарушении этой функции создается отечное пропитывание стромы, в результате чего роговица мутнеет; поступающая в нее влага отслаивает эпителий, буллезные изменения которого вызывают светобоязнь и состояние постоянного раздражения. В более поздних стадиях в роговицу начинают врастать поверхностные и глубокие сосуды, что в еще большей мере способствует снижению ее прозрачности. /
Вероятность механического травмирования эндотелия особенно велика, если в переднюю камеру вводят инструменты большого размера (например, чашечка эризифака). В подобных случаях необходимо откидывать роговицу книзу, как можно шире открывая рану; достоинства этой техники открытого неба в настоящее время общепризнанны.
Прилегание стекловидного тела к задней поверхности роговицы наблюдается в двух основных формах; речь идет о грыжах стекловидного тела с повреждением передней пограничной пластинки и о заполнении передней камеры стекловидным телом при нарушении целости передней пограничной пластинки. Попытки отделить стекловидное тело от роговицы (например, введение воздуха а переднюю камеру), как правило, безрезультатны.
В последние годы появились сообщения о том, что при небольших спайках стекловидного тела с задней поверхностью рогови-, цы эффект может дать криокоагуляция наружной поверхности I роговицы соответственно месту спаяния [Drysdale D., Shea F., I 1966]. Причины разрушения спаек при этом до сих пор неясны. ' Однако способ абсолютно безопасен, очень прост технически, поэтому должен быть апробирован.
• Приводятся данные о благоприятных результатах сквозной • кератопластики, но прозрачного приживления удается добиться > далеко не всегда. В последние годы появились сообщения [Краснов М. М., Орлова Е. М., 1968; Краснов М. М. и др., 1968; Brown I., Dohlman D., 1965] о возможности получить удовлетворительные результаты при лечении методами аллопластической хирургии. Целью операции такого рода является создание искусственного барьера (своего рода искусственного эндотелия) на пути проникновения влаги передней камеры в роговичную строму.
Известен, например, вариант этой операции, когда тончайшую пленку из прозрачной пластмассы укрепляют прямо к задней по-
21 Руководство по глазной хирургии
321
верхности роговицы [Dohlman D., 1966]. Предложен также метод наклеивания на роговицу пластмассовых имплантатов по типу контактной линзы — так называемых эпикератопротезов [Dolil man D., 1969]. Эпителий при этом соскабливают. Процедура не позволяет ликвидировать отек стромы, однако при ее проведении в значительной мере уменьшаются болезненные ощущения (за щищая нервные окончания субэпителиального сплетения) и вое станавливается правильная сферическая граница между рогови цей и воздухом, вследствие чего улучшается зрение. Однако наибольшее распространение получили способы с интраламеллярной имплантацией тонких пластмассовых дисков диаметром 5—6 мм. Очень важно, чтобы имплантат был введен как можно ближе к задней поверхности роговицы. В этом состоит техническая сложность операции.
Часто происходит рубцовое перерождение слоев, находящихся позади имплантата. В связи с этим М. М. Краснов (1967) предложил производить рассечение задних слоев роговицы через 2—3 мес после введения имплантата. Перфорирующее кератопротезирование дает лучший визуальный исход, но борьба с его отторжением представляет трудности.
К дистрофии роговицы предрасположены больные с небольшим количеством эндотелиальных клеток, которое определяют с помощью эндотелиальной микроскопии. Нормальное количество эндотелиальных клеток — от 2 до 3 тыс. в 1 мм2.
Врастание эпителия и соединительной ткани в переднюю камеру. Диагноз врастания эпителия в переднюю камеру обычно ставят при биомикроскопическом исследовании: по внутренней поверхности роговицы стелется нежная серая пленка. Врастание эпителия необходимо отличать от пролиферации соединительной ткани. В этом случае мембрана обычно пронизана сосудами, растет медленно. По-видимому, отдельные сообщения об успешном лечении врастания эпителия относятся к врастанию соединительной ткани.
Лечение этого осложнения малоэффективно. Применяют рентгенотерапию. Имеются отдельные сообщения о хороших исходах таких операций, как удаление вросшего эпителия и сквозная кератопластика.
Послеоперационная инфекция. Лечение этого тяжелого осложнения должно быть интенсивным и проводить его необходимо как можно раньше. Следует обязательно взять материал из области раны для посева, исследовать патогенную флору на чувствительность к антибиотикам. До получения результатов микробиологического исследования необходимо начать интенсивную общую терапию антибиотиками широкого спектра действия, например гентамицином, который следует вводить внутриартериально или парабульбарно.
При лечении обычными антибиотиками, которые с трудом проходят через гематоофтальмический барьер, во многих случаях приходится назначать медикаменты, повышающие его проницае-
322
Кость, например уротропин (5 мл 40% раствора внутривенно че-реп 10 мин после инъекции антибиотика).
К внутриглазной инфекции полностью применим один из основных принципов общей медицины: ubi pus ibi evacua (где гной. Там опорожни). В связи с этим при отсутствии положительной динамики после проведения медикаментозной терапии в течение 3—4 дней следует эвакуировать гнойный экссудат из полости глаза. При повторном появлении экссудата в передней камере парацентез можно производить многократно (до 10 раз и более). Эвакуация гнойного экссудата из заднего отдела глаза представляет гораздо более трудную задачу. Экссудат в стекловидном теле, как правило, очень густой и не отсасывается даже с помощью игл большого диаметра. Тем не менее такую попытку стоит предпринять, используя иглу и для введения антибиотика в стекловидное тело. Короткий (1—2 мм) разрез для введения иглы делают в плоской части ресничного тела (на расстоянии 5—7 мм от лимба). Процедуру можно повторить, но не столько раз, как парацентез роговицы.
Прогноз при послеоперационной внутриглазной инфекции всегда сомнителен.
Замедленное восстановление передней камеры. Замедленное восстановление передней камеры или исчезновение ее через несколько дней после операции может быть обусловлено фильтрацией операционной раны, отслойкой сосудистой оболочки, зрачковым блоком, угнетением продукции внутриглазной жидкости. Нередко встречается и комбинация указанных причин, отягчающая исход.
Для установления той или иной степени фильтрации необходимо тщательно исследовать области операционного разреза. С этой целью используют биомикроскопию и пробу Зайделя. Отслойку сосудистой оболочки выявляют с помощью тщательной офтальмоскопии, и в сомнительных случаях — биомикроскопии глазного дна.
Если породили камера не восстанавливается в течение очень длительного периода (несколько дней), то, исключив все указанные причины, можно предположить недостаточность продукции внутриглазной жидкости вследствие угнетения секреции ресничного тела.
Лечение синдрома мелкой камеры следует начинать после установления вызвавшей его причины. Если невосстановление передней камеры вызвано фильтрацией, то все меры должны быть направлены на ее ликвидацию: повязка с валиком на верхнее веко, каутеризация зоны фильтрации, наложение дополнительных швов, пластика. Лечебные мероприятия при отслойке сосудистой оболочки и зрачковом блоке описаны выше.
В заключение следует отметить, что какая бы из названных причин не лежала в основе синдрома мелкой камеры, его появлению в очень большой мере способствует недостаточная адаптация краев операционного разреза. В связи с этим правильная
21
323
техника проведения разреза и полноценная герметизация рапы корнеосклеральными швами имеют первостепенное значение и профилактике синдрома замедленного восстановления передней камеры после экстракции катаракты.
Экстракция катаракты в детском
и юношеском возрасте
Выбор времени для выполнения оперативного вмешательства по поводу катаракты в детском возрасте представляет известные трудности. С одной стороны, необходимость применения наркоза у маленьких детей и связанные с этим осложнения, а также трудности ведения послеоперационного периода часто побуждают хирурга отсрочить операцию насколько возможно. С другой стороны, вероятность развития амблиопии вследствие бездействия представляет реальную п очень грозную опасность. В связи С этим данный вопрос необходимо решать индивидуально.
Особенности хирургии катаракты в детском и юношеском возрасте определяются морфологической и функциональной спецификой глаз этого возрастного периода: отсутствие ядра в хрусталике до начала или середины третьего десятилетия жизни, прочный ресничный поясок, очень тесная связь стекловидного тела с задней капсулой хрусталика или даже спаяние с ней. В связи с этим инкапсулярная экстракция катаракты нецелесообразна и, как правило, невыполнима.
Методом выбора при экстракции катаракты в детском и юношеском возрасте является экстракапсулярный способ. Чаще всего применяют так называемую линеарную экстракцию и методы, схожие с ней.
При врожденных катарактах значительная или даже большая часть вещества хрусталика прозрачна (ядерная, зонулярная катаракта и т. д.). Удаление этих прозрачных масс при линеарной экстракции часто затруднено как из-за их вязкости, так и в связи с отсутствием визуального контроля за полнотой их эвакуации.
Известную помощь на этом этапе может оказать использование источников ультрафиолетового излучения, в свете которых хрусталиковые массы становятся видимыми [Хватова А. В., 1967, 1982]. Однако это не всегда решает проблему, так как часть масс скрывается за радужкой и вследствие их вязкости с трудом удаляется. В связи с этим получили распространение двухэтапные операции при катарактах в детском и юношеском возрасте. При использовании факоэмульсифпкации возможно и одноэтапное удаление катаракты.
Предложен ряд вариантов техники при катарактах в детском и юношеском возрасте. Смысл всех этих предложений сводится к следующему. На первом этапе широко вскрывают переднюю капсулу хрусталика несколькими широкими, глубокими разрезами с помощью дисцизионной иглы или ножа Сато. При этом надо
324
Следить, чтобы задняя капсула хрусталика осталась неповрежден-ЙОЙ. Через 7—8 дней после рассечения передней капсулы вещество хрусталика полностью мутнеет и в значительной мере разрыхляется. И то, и другое благоприятствует его эвакуации при Мором этапе операции. В этой стадии производят парацентез роговицы или небольшой разрез (3—4 мм) в лимбе под конъюнктивальным лоскутом. Наилучшие результаты получают при вымывании хрусталиковых масс изотоническим раствором хлорида Яатрия, при этом надо предусмотреть его свободный выход из глаза (достаточная величина разреза, приоткрывание его части и Т. Д-).
В последние годы широкое распространение получил метод отсасывания (аспирации) хрусталиковых масс с помощью шприца. Для этого требуется очень небольшой разрез роговицы у лимба, чтобы ввести в переднюю камеру иглу от шприца с внутренним диаметром около 1,5 мм. Иглу, надетую на шприц, вводят в переднюю камеру так, чтобы она была обращена косым срезом к роговице. Когда конец иглы достигает середины зрачка, ее поворачивают на 180° вокруг продольной оси. Оттягивая поршень шприца, постепенно отсасывают хрусталиковые массы. Конец иглы поочередно перемещают к тому месту, где остаются скопления хрусталиковых масс.
Основное преимущество отсасывания перед вымыванием за-клк)'1 потея в меньшой опасности выпадения стекловидного тела, а также в отсутствии необходимости введения в переднюю камеру чужеродной жидкости (известно, что изотонический раствор хлорида натрия оказывает неблагоприятное влияние на эндотелий роговицы и способствует возникновению иридоциклита).
Эти процедуры необходимо проводить под контролем микроскопа, который позволяет подводить конец канюли к разным участкам хрусталиковых масс, а также избежать повреждения задней капсулы, чего следует опасаться как при промывании, так и при отсасывании. Данное осложнение, как правило, влечет за собой выхождение густого стекловидного тела в переднюю камеру, вследствие чего обычно невозможна дальнейшая эвакуация хрусталиковых масс.
Медикаментозное лечение в послеоперационном периоде проводится по обычным принципам. В большинстве случаев необходим максимальный мидриаз.
Двухэтапные операции по поводу катаракт в детском и юношеском возрасте сравнительно малотравматичны и обычно дают прекрасные результаты. В некоторых случаях рассасывание идет настолько быстро, что необходимость в эвакуации хрусталика на втором этапе отпадает и хирургическое вмешательство ограничивают рассечением капсулы хрусталика.
В последнее время был разработан лазерный метод лечения мягких катаракт [Краснов М. М., Акопян В. С., 1975, 1976]. Использование лазеров с «гигантским» импульсом для дисцизии передней капсулы хрусталика позволило поставить вопрос о воз-
325
можности лечения мягких катаракт на качественно новой хирургической основе. Процедура получила название «лазерная капсу-лофакопунктура». Ее применение устраняет ряд серьезных проблем, связанных с вскрытием глазного яблока при традиционном вмешательстве (операционные и послеоперационные осложнения) и особенностями хирургии детского возраста (необходимость общего наркоза и
трудность ведения послеоперационного периода).
Лазерная капсулофакопунктура (рис. 168) обеспечивает довольно обширное вскрытие передней капсулы хрусталика. Длительность набухания хрусталикового вещества и его рассасывания может варьировать от 3 мес до 17г лет. Примерно у 50% больных происходит полное рассасывание хрусталиковых масс. У некоторых больных наступает организация и кальцификация нерассо-савшихся остатков содержимого хрусталика. В подобной ситуации хирургическое вмешательство неизбежно.
Таким образом, лазерную капсулофакопунктуру можно применять как самостоятельный метод лечения мягких катаракт, а также в качестве первого этапа (вскрытие передней капсулы хрусталика), что делает хирургическое вмешательство однократным (аспирация).
Вторичная катаракта
В связи с распространением интракапсулярных методов вторичная катаракта стала встречаться редко, развиваясь главным образом в тех случаях, когда капсула рвется в ходе операции, которую приходится, таким образом, заканчивать экстракапсу-лярно (примерно в 2—4% случаев).
Вместе с тем выведение хрусталика в капсуле позволило обратить внимание на так называемую ложную вторичную катаракту. Если при вторичной катаракте обычного типа соединительнотканная пленка в области зрачка формируется из остатков капсулы и хрусталиковых масс, то во втором случае речь идет об уплотнении слоев стекловидного тела.
Показания к хирургическому вмешательству по поводу вторичной катаракты такие же, как при старческой катаракте.
Истинная вторичная катаракта. При вторичной катаракте од
326
ни офтальмологи отдают предпочтение дисцизии, другие — уда-лению пленки или по крайней мере большого ее участка.
Основным преимуществом удаления мембраны является меньшая вероятность рецидива, дисцизия же характеризуется малой травматичностью и значительно меньшим риском развития осложнений. По нашему мнению, современная техника дисцизии позволяет резко сократить вероятность рецидива вторичной катаракты; кроме того, в случае необходимости она может быть повторена. Наконец, дисцизию можно дополнить удалением пленки. Мы всегда отдаем предпочтение дисцизии, хотя технику ее необходимо в значительной мере индивидуализировать. Показания к удалению пленки являются скорее исключением, чем правилом.
При вторичной катаракте без обширных спаек и без подтянутого кверху зрачка достаточно произвести вертикальную дисцизию. Если плепка состоит не только из уплотнившейся капсулы, по и из остатков хрусталиковых масс, то необходимо подождать до окончания процоссв их рассасывания или организации.
При наличии подтянутого к области разреза зрачка, как правило, необходимо сочетать дисцизию вторичной катаракты с дис-цизией радужки. Нередко наилучшио результаты получают при рассечении перпендикулярно по отношению к силам, действующим на радужку, чаще всего при разрезе у верхнего лимба горизонтально. В этих случаях сокращение ткани сверху и снизу от области дисцизии обусловливает хорошее зияние отверстия, которое часто имитирует круглый зрачок. При тяжелом швартообра-зовании с обширным вовлечением радужки в сращения показана иридокапсулотомия по Эльшнигу.
Экстракцию пленки вторичной катаракты мы считаем показанной при пеосложпенпых формах (без спаяний с радужкой и без втянутого зрачка), если края дисцизионного разреза не расходятся достаточно широко. Чаще всего это бывает при тонких пленках. Нередко их можно удалить через вкол, сделанный для дисцизии; по этому каналу в переднюю камеру вводят острый крючок для радужки, с помощью которого часто удается извлечь либо всю пленку (навернув ее на крючок), либо большую ее часть.
В нашей практике наилучшим образом зарекомендовала себя техника рассечения пленки по Уилеру. Тонкий нож Грефе вкалывают в роговицу почти перпендикулярно к лимбу на расстоянии 1—2 мм от него. Нож проводят через переднюю камеру несколько ниже края зрачка и здесь вкалывают в пленку вторичной катаракты или в радужку, если она подтянута кверху. После этого ручку ножа поднимают кверху, в этот момент лезвие рассекает мембрану в вертикальном направлении. Место вкола ножа служит при этом как бы точкой вращения (рис. 169). Необходимо следить за тем, чтобы в момент дисцизии не оказать давления режущей кромкой ножа на роговицу и не расширить роговичную рану. Лезвие ножа при правильной технике операции плотно
327
169. Рассечение вторичной катаракты (схема).
закрывает сделанный им роговичный разрез, что предохраняет переднюю камеру от опорожнения. Роговичный шов, как правило, не нужен, поскольку края раны обычно хорошо адаптируются. В том случае, если края разреза не разошлись, операция может быть дополнена удалением пленки с помощью крючка.
Опыт показывает, что у большинства больных такая дисци-зия может быть выполнена под инстилляционной анестезией 1% раствором дикаипа и без уздечного шва. Вмешательство, как правило, переносится легко. В послеоперационном периоде показана интенсивная терапия мидриатиками.
Если показана дисцизия в горизонтальном направлении, то вкол ножа делают на 9 или 3 часах; в остальном техника операции такая же. Мы, однако, предпочитаем и в этих случаях делать роговичный разрез у верхнего лимба.
Л. X; Шоттер (1957, 1960) предложил действенную и малотравматичную операцию рассечения вторичных катаракт, пленок и радужки с помощью двух дисцизионных ножичков. Оба ножичка вводят одновременно в переднюю камеру навстречу друг другу через проколы у лимба на концах одного и того же меридиана (рис. 170, а). Один ножичек проводят через прокол у края пленки на ее заднюю поверхность, другой располагается на ее передней поверхности (рис. 172,6). Ножички поворачивают лезвиями друг к другу, нижний поднимают, верхний несколько опускают (рис. 172, в,г). Таким образом ножички действуют как бранши ножниц и без травмирования тканей легко рассекают любую пленку, шварту, радужку (рис. 172, д,е). Для того чтобы отверстие лучше зияло, разрез следует проводить поперек натяжения пленки, спаек, дилататора зрачка. В случае необходимости можно добавить разрез в другом направлении. Поскольку разрез удобнее производить в направлении глазной щели, глаз поворачивают двумя уздечными швами в соответствующем направлении. Ножички при плотном проведении лезвия по лезвию тупятся и пос-
328
170. 1 ’иссечение вторичной катаракты по Шоттеру (схема). Объяснение в тексте.
ле операции их необходимо шлифовать. В связи с тем что эта манипуляция необычная, желательно для освоения метода предва-рительпо упражняться в резании бумаги двумя столовыми пожами.
При всех видах дисцизии разрез роговицы настолько мал, что стекловидное тело либо по выпадает совсем, либо теряется очень незначительная его часть. Если стекловидное тело ущемляется в рапе, то его необходимо отсечь; желательно наложить один — два роговичных шва.
Для удаления пленки вторичной катаракты большинство хирургов захватывают ее с помощью пинцета. Вероятность выпадения стекловидного тела при этом значительно больше, чем при дисцизии, поскольку для манипуляции пинцетом необходим разрез длиной по крайней мере 3—4 мм. Его можно делать как в роговице, так и в лимбе под конъюнктивальным лоскутом; в том и другом случае целесообразно наложить роговичные швы. Для иридокаисулэктомии лучше использовать технику Эльш-нига.
В. С. Беляев (1962) применяет предложенный им нож-пинцет (рис. 171), которым проникают через клапанный прокол роговицы длиной 1 мм в переднюю камеру, острыми концами бранши надрезают пленчатую катаракту и, сомкнув бранши пинцета, вы-
329
171.
Нож-пинцет Беляева для удаления вторичных катаракт.
а — общий вид; б — бранши: 1 — неподвижная, 2 — подвижная.
тягивают пленку в рану, иссекая ее роговичными ножницами. Зашивать рану не требуется. Метод особенно удобен для выполнения операции у детей. В большинстве случаев удается удалить вторичную катаракту почти без потери влаги передней камеры.
Ложная вторичная катаракта. Диагностика так называемых ложных вторичных катаракт может вызывать известные трудности [Шуль-пина Н. Б., 1966, и др.]. Нередко они плохо различимы невооруженным глазом и только при биомикроскопии отмечается зона резкого увеличения оптической плотности в месте перехода от влаги передней камеры к стекловидному телу.
Лечение ложных вторичных ката
ракт очень сложное. Дисцизия пленки, как правило, не приводит к существенному расхождению краев отверстия. В том и другом
случае имеется тенденция к повторному уплотнению передних
слоев стекловидного тела.
Весьма перспективно использование лазерного излучения в лечении как истинных, так и ложных вторичных катаракт [Вед-меденко Л. А., 1969, 1974; Краснов М. М., 1973]. Оптимальным для лазерной корепраксии является сочетание непрерывного излучения аргонового и импульсного рубинового лазерных источников [Акопян В. С., 1975].
Реклинация катаракты
Сведений о реклинации катаракты, дошедших до нашего времени, чрезвычайно мало. В большинстве современных руководств по глазной хирургии о ней даже не упоминается, а у офтальмологов сложилось негативное отношение к этой операции. Чтобы объяснить такое отношение к этому методу лечения, необходимо было бы проследить всю эволюцию хирургического лечения катаракты, но объем данного руководства и его цели не позволяют это сделать, поэтому назовем лишь основные причины, повлиявшие на развитие реклинации.
330
Прежде всего следует отметить, что вплоть до настоящего вре-|Мопи подобная операция не всегда безуспешно применяется представителями народной медицины в некоторых странах Юго-Вос-Точлой Азии [Ekamabram R., 1910; Rambo V. С., 1955;
Sood N. N., Ratnaraj A., 1968, и др.]. Согласно сведениям, дошедшим до нас [Васильев Е. В., 1900, 1901], главной причиной Дискредитации реклинации катаракты было то, что в течение многих веков ее производили главным образом люди, далекие от медицины. Так называемые странствующие хирурги не заботились об исходах операции. Получив вознаграждение, они немедленно исче-вали. Пострадавшие больные были вынуждены обращаться за помощью к врачам, а у последних, встречавшихся большей частью с осложнениями, постепенно формировалось отрицательное отношение к этой операции и они отказывались от ее применения.
A. Magnus (1876, цит. по Е. В. Васильеву, 1900) пишет буквально следующее: «Теперешнему поколению врачей трудно понять, каким образом в течение 16 столетий операция, которая так глубоко влияет на счастье семьи, равно как и на благосостояние страны, могла быть предоставлена необразованным проходимцам и шарлатанам».
Анализируя различные методы смещения катаракты в стекловидное тело, применявшиеся в прошлом, а именно с предварительным раздроблением хрусталика, смещением его сверху вниз во фронтальной плоскости — так называемое низдавление и другие методы, предусматривающие использование остроконечных инструментов, которые в основном вводили через склеру, т. е. практически вслепую, можно предположить, что наиболее вероятной причиной осложнений при этих операциях была глаукома факогенного происхождения. Не в мепыпей степени осложнения могли быть обусловлены внутриглазной инфекцией, гемофтальмом, отслойкой сетчатки. Надо полагать, что именно эти тяжелые осложнения, которые наблюдали врачи, побуждали их к поискам других методов лечения катаракты.
Французский окулист Жак Давиэль в 1745 г. впервые произвел экстракцию катаракты, и несмотря на то что из первых 206 операций, произведенных им, в 24 случаях глаза погибли, метод продолжал совершенствоваться и находил все более широкое распространение.
В то же время совершенствовалась операция смещения катаракты в стекловидное тело. Так, Willburg М. в 1785 г., т. е. через 40 лет после изобретения экстракции, вновь пробудил интерес к операции, которую выполняли с помощью иглы. Он ввел изменение, которое состояло в том, что хрусталик не просто смещался под зрачок в переднюю часть стекловидного тела, а отклонялся в его заднюю часть. Именно тогда эта операция и получила название «реклинация» (reclinatio) — «отклонение катаракты назад» [Васильев Е. В., 1900].
Последующее время было ознаменовано борьбой за первенство между реклинацией и экстракцией, в результате чего совершенст
331
вовались обе операции. Вплоть до конца XIX века в литературе приводилось много сообщений об успешно произведенных операциях смещения катаракты в стекловидное тело [Andrew Н., 1882; Rampoldi R., 1886, и др.]. Вполне понятно, что экстракция катаракты, технически более сложная операция и поэтому применяемая только врачами, непрерывно совершенствуясь, получила большую известность.
Кроме перечисленных выше причин, повлиявших на судьбу реклинации, необходимо отметить и то, что у многих современных офтальмологов негативное отношение к реклинации поддерживается неправильным пониманием роли хрусталика в развитии осложнений в глазу после его травматического вывиха в стекловидное тело. Имеются в виду случаи без повреждения капсулы хрусталика. Известно, что при этом часто развивается вторичная глаукома, которую из-за явных изменений в положении хрусталика определяют как факотопическую, хотя имеются многочисленные убедительные данные, указывающие на ретенционный характер гипертензии, обусловленной посттравматическими изменениями в системе оттока внутриглазной жидкости. В пользу этого свидетельствует и то, что удаление хрусталика не приводит к нормализации офтальмотонуса, а эффективным является антиглаукомное хирургическое и консервативное лечение. Необходимо отметить, что не существует убедительных данных, доказывающих гиперсекреторный характер глаукомы при травматических. вывихах линзы в стекловидное тело. Большинство авторов, признавая полипатогене-тичность вторичной посттравматической глаукомы, считают, что при ней страдает как секреция внутриглазной жидкости, так и, в большей степени, ее отток, что и обусловливает нарушение гидродинамики. .
Таким образом, не извлекая люксированный хрусталик, что является непростой и часто опасной для глаза операцией, а применяя хирургические и консервативные методы лечения глаукомы, можно добиться нормализации офтальмотонуса. Данные литературы [Быков С. С., 1927; Ершкович А. И., 1962; Шмелева В. В., 1970; Беляев В. С., Барашков В. И., 1975, и др.] и собственные наблюдения доказывают возможность длительного (в наших наблюдениях до 50 лет) безреактивного пребывания хрусталика с неповрежденной капсулой в стекловидном теле с сохранением зрительных функций. В качестве примера можно привести следующий случай из нашей практики.
Больной С., 49 лет, поступил в клинику с диагнозом: травматический вывих хрусталика в стекловидное тело, вторичная глаукома. При обследовании было установлено отсутствие факолитических признаков, прозрачный хрусталик располагался в передненижнем отделе стекловидного тела и не перекрывал область зрачка, в передней камере — грыжа стекловидного тела. Консервативное лечение оказалось неэффективным. В результате хирургического лечения, состоявшего из дважды произведенной трабекулэктомии с базальной иридэктомией и пункции стекловидного тела, офтальмотонус нормализовался, функции глаза стабилизировались. В дальнейшем из-за непереносимости контактной коррекции была произведена кератофакия. В на-
332
ямояшев время острота зрения у больного 0,4 без коррекции. Срок наблюде-Мввя 15 лет. Все это время мутный хрусталик находился в передненижнем Рутделе стекловидного тела.
I А Многовековая история развития реклинации и многочисленные I Современные наблюдения, свидетельствующие о возможности дли-I Свльного безреактивного пребывания хрусталика в стекловидном | теле, побудили к пересмотру возможностей этого метода на совре-I менном научном уровне.
[ Реклинация катаракты с дозированным диализом ресничного f пояска. На кафедре глазных болезней Университета дружбы на' t родов им. П. Лумумбы произведен анализ причин развития ослож-, Пений в глазах после реклинации катаракты и разработан метод, позволяющий уменьшить до минимума опасность их возникнове-вия. Этот метод, получивший название «реклинация катаракты с дозированным диализом ресничного пояска и предварительным формированием канала в стекловидном теле», успешно применяют в клинике в течение 15 лет. За это время произведено 104 операции.
Реклинацию производилп только на одном глазу, при этом старались сохранить ресничный поясок (циннову связку) в нижней части хрусталика, чтобы удержать его в нижнем отделе глазного яблока и избежать дальнейшего смещения его в стекловидное тело. Операции производили только таким больным, у которых производить экстракцию катаракты было опасно или она была ма-лоперспективна. Бескровность, герметичность разреза, отсутствие резкого перепада внутриглазного давления во время вмешательства позволили произвести операцию больным, у которых на другом глазу во время экстракции катаракты произошла экспульсивная геморрагия вследствие болезни крови, тяжелых форм гипертонической болезни, сахарного диабета. Небольшой прокол роговицы (2 — 3 мм) в меньшей степени нарушает ее трофику, поэтому исход операции был благоприятным у больных, у которых была утрачена чувствительность роговицы и у которых на другом глазу после экстракции катаракты развился нейропаралитический кератит.
Небольшая продолжительность хирургического вмешательства (около 5 мин), отсутствие ограничений в послеоперационном периоде позволили оперировать больных с частыми эпилептическими припадками, с тяжелыми формами бронхиальной астмы, с психическими расстройствами. Среди оперированных были такие больные, которым по заключению терапевта или других специалистов экстракция катаракты была противопоказана в связи с возможностью декомпенсации глубоких возрастных изменений, что могло угрожать их жизни.
Подготовка к операции должна проводиться в том же объеме, как и при экстракции катаракты. Особое внимание необходимо уделить гидродинамике глаз, так как большинство больных лишены систематического наблюдения в поликлинических условиях из-за тяжелого общего состояния.
333
При наличии тяжелой общей патологии характер премедикации согласовывают с терапевтом или анестезиологом. В особо тяжелых случаях необходимо их присутствие во время операции. Больные с психическими заболеваниями нуждаются в специальной медикаментозной подготовке, которую назначает психиатр.
Во всех случаях целесообразно провести с больным беседу с целью разъяснить особенности операции, т. е. ее безболезненность и краткость, что способствует упорядоченному поведению больного во время операции, а это в свою очередь в значительной мере определяет ее успех.
Операцию целесообразно производить в положении больного сидя. С этой целью можно использовать кресло с подголовником типа зубоврачебного или любое удобное, устойчивое кресло. При отсутствии подголовника можно воспользоваться помощью ассистента, стоящего сзади кресла и фиксирующего голову больного. При выполнении операции у беспокойных больных и тех, поведение которых трудно предвидеть, необходимо участие второго помощника, готового предупредить импульсивные движения пациента.
Обработку операционного поля производят с помощью последовательных инстилляций 3% раствора колларгола, 30% раствора сульфацила-натрия, 0,3% раствора синтомицина или другого антибиотика широкого спектра действия. Затем конъюнктивальный мешок промывают изотоническим раствором хлорида натрия. Соответствующую половину лица, включая кожу век, обрабатывают 70% этиловым спиртом, а затем 3% спиртовым раствором йода с глицерином. Заранее постриженные ресницы и брови обрабатывают 1% спиртовым раствором бриллиантового зеленого. Операционное поле покрывают стерильной маской с отверстием для оперируемого глаза.
Анестезия. Как показала практика, для проведения операции достаточно дву-, троекратной инстилляции 1% раствора дикаина. У беспокойных больных показана акинезия и ретробульбарная анестезия.
Веки фиксируют с помощью блефаростата. Предпочтение следует отдавать наиболее легким векорасширителям, так как они лучше удерживают веки при положении больного сидя. Для проведения операции предложены специальные инструменты.
Иммобилизации глазного яблока добиваются фиксацией анатомическим пинцетом за конъюнктиву в непосредственной близости от лимба/ на меридиане 5 или 7 часов. Роговичный разрез проводят при фиксации глазного яблока при взгляде вверх. Используют обоюдоострый мечевидный нож или осколок бритвенного лезвия (рис. 173, а, б). Роговичный разрез, подобный парацентезу, делают на меридиане, близком к 6 часам, отступя от лимба 1 мм. Длина разреза не превышает 2,5—3 мм, и в то же время она должна быть достаточной для последующего свободного, без усилия введения инструментов в рану. Внутрироговичная протяженность разреза не более 2 мм. Соблюдение этих условий, с одной стороны,
334
172. Реклинация катаракты по Беляеву — Барашкову (схема). Объяснение в тексте.
позволяет беспрепятственно ввести инструменты в рану и свобод-но манипулировать ими, с другой — обеспечивает клапанный характер разреза и, следовательно, его высокую герметичность. При правильно произведенном разрезе после извлечения ножа глубина передней камеры практически не изменяется (рис. 172, а).
Следующим этапом операции является введение в рану инструмента для диализа ресничного пояска (173,в). Для того чтобы успешно выполнить этот этап, желательно предварительно умеренно расширить зрачок (до 4—5 мм). Инструмент плавно вводят в переднюю камеру, боковым скользящим движением по передней капсуле хрусталика заводят под зрачковый край радужки и продвигают к ресничному пояску. При выполнении операции на правом глазу вначале производят диализ па меридиапе от 1 часа до 5 часов, а затем переводят инструмент в наружный отдел и разрушают связку па меридиане от 11 до 7 часов (рис. 172,6). Во время последнего движения рабочий конец инструмента ориентируют параллельно сагиттальной плоскости глаза, с тем чтобы за хрусталиком разрушить переднюю гиалоидную мембрану в ее нижней части и образовать канал в стекловидном теле (рис. 172, в).
Выведя обратным движением рабочую часть инструмента в переднюю камеру, завершают диализ ресничного пояска на меридиане от И до 1 часа (рис. 172,г). Участок ресничного пояска от 5 до 7 часов остается неповрежденным. Инструмент выводят из раны.
Следующий этап (рис. 172, д) — введение соответствующего (правого или левого) реклинатора (рис. 173, г, д). Расположив рабочую часть реклинатора по возможности точно по вертикальному диаметру хрусталика, вращательным движением рукоятки производят очень плавное надавливание на переднюю капсулу. Если при этом хрусталик пытается выскользнуть из-под инструмента, то надавливание прекращают и перемещают инструмент по передней поверхности хрусталика в ту сторону, в которую он выскальзывает, как бы находя точку равновесия, и затем возобновляют его
335
173. ' .
Инструменты для реклинации катаракты.
а — мечевидный нож; б — осколок бритвенного лезвия; в— инструмент для диализа ресничного пояска: г — реклина-тор для левого глаза; д — ре-клинатор Для бравого глаза.
плавное опрокидывание в стекловидное тело. Как правило, при отклонении от первоначального положения до 90° катаракта оттесняет гиалоидную мембрану, скользя по ней (при этом ощущается заметное сопротивление), а затем довольно легко проваливается в канал, предварительно образованный в нижней части стекловидного тела.
На этом этапе инструмент также может соскальзывать с передней
поверхности хрусталика и даже оказаться сзади него. Как на этом, так и на всех других этапах операции следует избегать резких, форсированных движений инструмента. Чтобы вновь правильно расположить инструмент, необходимо почти полностью вывести его из раны, а затем, после уточнения расположения хрусталика, продолжить его опрокидывание. Сместив катаракту в передненижний отдел стекловидного тела, удерживают ее там в течение 20—30 с, для того чтобы стекловидное тело успело полностью занять то место, где раньше располагался хрусталик (рис. 172, е). Реклинатор выводят из раны следующим образом. Вначале рабочий конец инструмента плавно возвращают до положения параллельного переднезадней оси и только после этого извлекают полностью (рис. 172, ж, з).
Во избежание повреждения внутренних оболочек глаза хирург должен отчетливо представлять себе, где на каждом этапе операции находится конец рабочей части инструмента. Особенно важно это на последнем этапе, на котором визуальный контроль практически невозможен.
Контроль за положением реклинированного хрусталика производят с помощью офтальмоскопии или в проходящем свете. Офтальмоскопический контроль может быть затруднен из-за резкого сужения зрачка, которое часто наблюдается в конце операции. В этом случае оценить степень смещения хрусталика можно.
336
. проверив зрение вблизи и с помощью контрольного метода исследования поля зрения. При наличии предметного зрения и сужения поля зрения сверху или сверху изнутри не более чем на 30° от точки фиксации результат следует признать удовлетворительным. Оптимальным положением реклинированного хрусталика является передненижненаружный отдел стекловидного тела (рис. 172, з). В этой позиции возможность сужения поля зрения за счет перекрытия мутным хрусталиком периферических отделов сетчатки наименьшая.
В заключение проверяют наличие волокон (фибрилл) стекло-> видного тела между краями роговичного разреза, которые могут приклеиваться к инструментам при извлечении их из раны. Ь С этой целью область разреза промокают губкой или плотно свернутым ватным тампоном. Если при этом отмечается смещение врачкового края радужки в сторону разреза, а за тампоном тянется нить стекловидного тела, то ее отсекают вплотную у поверхно-• сти роговицы. В случае необходимости манипуляцию повторяют неоднократно^ Убедившись в хорошей адаптации краев роговичного разреза, операцию заканчивают.
Если к концу операции передняя камера полностью отсутствует, что бывает крайне редко, то нет необходимости в каких-либо мероприятиях по ее формированию, так как в течение 5—10 мин происходит ее самопроизвольное восстановление.
При правильном выполнении операции ее продолжительность не более 5—7 мин. Под конъюнктиву вводят 50000 ЕД пенициллина и 0,5 мл 0,4% раствора дексаметазона.
Ведение послеоперационного периода. В течение первых часов после операции больному рекомендуется сидеть или лежать с высоко приподнятым изголовьем. Это положение желательно сохранять и в первую ночь после операции. В это же время запрещаются резкие наклоны головы и длительное нахождение лицом впиз.
В течение 2—3 нед после операции применяют дезинфицирующие препараты и витамины в каплях. В первые 3—5 дней целесообразно назначать инстилляции мидриатиков слабого действия (3% раствора эфедрина) и кортикостероидов.
При гладком течении послеоперационного периода больного можно выписать под наблюдение врача поликлиники на 4—5-й день. При выписке можно назначить постоянные очки. Как показал опыт, рефракция в таких глазах со временем практически не । изменяется, что, по-видимому, объясняется небольшой вероят-f ностью развития послеоперационного роговичного астигматизма, поэтому у больных уже в первые дни выявляется высокая острота зрения со сферической коррекцией. В дальнейшем проводят контрольные осмотры больных через 2 нед, затем через месяц и далее 2—3 раза в год. Применение этой методики позволило получить хорошие результаты у большинства из 104 больных. Большей части из этих больных в хирургическом лечении катаракты было отказано из-за тяжелого общего состояния или сопутствующей глаз-
22 Руководство по глазной хирургии 337
ной патологии, в связи с чем традиционное хирургическое лечений катаракты было малоперспективным. Результаты реклинаций катаракты представлены в табл. 9.
Таблица 9
Острота зрения, полученная в результате реклинации катаракты (отдаленные результаты)
Острота зрения
Число глаз
Средняя острота зрения по группам
С выраженной сопутствующей глазной патологией
,01—0,04
,05-0,1 0,2
0,3-0,5
0,24
Вез выраженной сопутствующей глазной патологии
0,6—0,7
0,8—0,9 1,0
0,89
У большинства больных, у которых не было сопутствующей глазной патологии, влияющей на зрительные функции, острота зрения равнялась 0,8—1,0 (рис. 174). Сроки наблюдения до 12 лет.
Ошибки и осложнения во время операции. Наиболее вероятным осложнением является повреждение капсулы хрусталика. Оно может произойти как при проведении роговичного разреза, так и во время введения в рану инструментов. При проведении роговичного разреза необходимо избегать форсированного продвижения режущего инструмента в переднюю камеру, что может привести к повреждению радужки и передней капсулы хру-
174.
Передний отрезок глаза после реклинации катаракты. В нижней части виден сектор реклиниро-ванной катаракты. Мидриаз вследствие инстилляции раствора атропина.
338
Ьталика. Причиной этого осложнения могут быть как применение недостаточно острого ножа, так и ненадежная фиксация головы или глаза больного. Если появилось подозрение на повреждение Передней капсулы хрусталика, то операцию следует прервать, а больного оставить под наблюдением на 2—3 нед. В нашей практике наблюдались два подобных случая, когда к концу 2-й недели в области зрачка появлялись хрусталиковые массы и повышалось внутриглазное давление. Тяжелое соматическое состояние больных не позволяло произвести неотложные хирургические вмешательства. После тщательной подготовки больных удалось произвести экстракцию ядра хрусталика в сочетании с передней витрэктомией. Острота зрения после операции в одном случае равнялась 0,6, в другом — 0,4 с коррекцией, офтальмотонус нормализовался.
Повреждение капсулы хрусталика может произойти как при введении инструмента в переднюю камеру, так и при дальнейшем его продвижении под радужку. Причинами повреждения в этом случае могут быть его форсированное введение в рану из-за несоответствия размеров роговичного разреза и инструмента, а также недостаточная отшлифованность его поверхностей, перезревшая катаракта, дегенеративные изменения передней капсулы, наличие задних спаек.
Возникновению осложнений может способствовать и неправильно произведенный разрез роговицы. Имеется в виду его слишком косой, а потому длинный ход в слоях. В этом случае при движении инструментами будет ощущаться значительное сопротивление-со стороны краев роговичного разреза, что приводит к деформации роговицы, затрудняющей визуальный контроль во время операции и, что еще хуже, может вызвать надрывы краев раны и тем самым способствовать неожиданным, форсированным продвижениям инструмента. В том случае, если разрез слишком косо проходит через слои роговицы, а передняя камера не опорожнилась, лучше сделать рядом новый разрез, чем пытаться исправить старый.
Первостепенное значение в предупреждении осложнений имеют особенности применяемых при этой операции инструментов. Для них характерны отсутствие острых граней, качественная шлифовка поверхностей, анатомическая соразмерность, особая конфигурация рабочей части и ее расположение под прямым углом к рукоятке. Все это значительно уменьшает вероятность повреждения капсулы хрусталика и оболочек глаза. С этой же целью целесообразно использовать бинокулярную лупу. Применение операционного микроскопа при выполнении вмешательства в положении больного сидя вызывает определенные трудности.
Послеоперационные осложнения. По нашим данным, у 15% больных после операции реклинации катаракты отмечалось повышение внутриглазного давления от умеренного до 40—50 мм рт. ст. Сроки появления гипертензии колебались от нескольких часов до 3 дней после хирургического вмешательства. Эти случаи рассматривались нами как реактивная гипертензия в ответ на операционную травму. Согласно данным литературы
22*
33»
{Сидоренко Е. И., 1975], реактивная гипертензия после экстракции катаракты встречалась в 84% случаев, но внутриглазное дав-* ление, равное 50 мм рт. ст., наблюдалось только в одном случае. Таким образом сравнительная оценка показывает, что реактивная гипертензия после реклинации катаракты развивается реже, чем после ее экстракции, но достигает более высокой степени. Это обстоятельство, вероятно, можно объяснить, с одной стороны, меньшей травматичностью, а с другой — большей герметичностью операционного разреза при реклинации. Не исключено, что частота реактивной гипертензии может зависеть от степени и продолжительности разгерметизации глаза, которые при реклинации минимальны.
Для нормализации внутриглазного давления в большинстве случаев было достаточным назначение гипотензивной терапии (глицерол, диакарб). В случаях гипертензии, когда по истечении одних суток офтальмотонус оставался повышенным, стойкий гипотензивный эффект давала эвакуация нескольких капель переднекамерной влаги, которая достигалась разведением краев роговичного разреза микрошпателем под контролем щелевой лампы или операционного микроскопа.
В связи с возможностью реактивной гипертензии после реклинации катаракты не следует забывать, что под этим повышением офтальмотонуса может скрываться недиагностированная первичная глаукома. О важности исследования гидродинамики глаза перед операцией Говорилось выше.
По данным ряда авторов [Чемоданова Л. Е., 1968; Шмелева В. В., 1970; Соколова П. Д., 1974], вторичная глаукома после экстракции катаракты встречается в 0,6—3% случаев.
Основной причиной глаукомы на афакичных глазах П. Д. Соколова считает имевшуюся до операции открытоугольную первичную глаукому. Автор отмечает, что >у больных первичной глаукомой после экстракции катаракты наблюдается усиление степени расстройств компенсации внутриглазного давления.
В наших наблюдениях было 14 случаев, где до операции реклинации катаракты имелись различные формы и стадии компенсированной глаукомы.
Среди них у 6 компенсация была достигнута хирургическим путем, а у 8 — консервативным. Ни в одном из этих случаев после операции реклинации не отмечено расстройств компенсации внутриглазного давления, на основании чего можно предположить, что в результате реклинации происходят меньшие, чем при экстракции катаракты, изменения, способствующие срыву компенсации ВГД, но это не значит, что он исключается.
Недостаточная степень смещения катаракты, выявляемая в послеоперационном периоде, наблюдалась в 28%. случаев. Хрусталик в большей или меньшей степени перекрывал область зрачка. Большинство этих случаев падало на период освоения и совершенствования операции и объяснялось недостаточным диализом цинковой связки. В этих случаях на следующий день производилась
340
полнительная реклинация катаракты. Вначале производили волнительный диализ цинновой связки и, если уже после этого хрусталик не занимал надлежащего положения, его повторно рек-линировали.
Причиной подъема хрусталика служит главным образом недостаточный диализ цинновой связки в ее нижнебоковых отделах. Нужно учитывать, что при ее диализе тупым инструментом ниж-пие отделы связки могут лишь растягиваться, а не разрываться, Как известно, ее прочность подвержена индивидуальным колебаниям, а также зависит от возраста и степени зрелости катаракты, что необходимо учитывать.
Противопоказания к реклинации катаракты. Реклинация катаракты противопоказана в следующих случаях:
1) при миопии высокой степени; 2) при морганиевой катаракте или наличии признаков ее перезревания; при выраженных дегенеративных изменениях передней капсулы хрусталика; 3) при сочетании катаракты с отслойкой сетчатки; 4) в случаях сочетания катаракты с нестабилизпрованной глаукомой.
Повышенная подвижность реклинированной катаракты и ее стремление вернуться на прежнее место зависят также от состояния стекловидного тела. По этой причине при миопии высокой степени, когда стекловидное тело, как правило, разжижено, мутный хрусталик может периодически, особенно прп резком наклоне головы, почти полностью перекрывать область зрачка.
Производить реклинацпю при перезревшей катаракте также нежелательно. При этом велика опасность повреждения капсулы хрусталика и трудно предвидеть «поведение» перезревшей катаракты в стекловидном теле.
При сочетании катаракты с отслойкой сетчатки реклинация не показана из-за невозможности в последующем исследовать периферию глазного дна в его нижних отделах.
Противопоказания со стороны общего состояния для проведения реклинации практически отсутствуют и ограничиваются двигательным возбуждением у психически больных.
В заключение необходимо отметить, что ни один известный метод хирургического лечения катаракты не является универсальным, так как каждый имеет свои особенности и показания к применению. Об этом свидетельствуют непрекращающаяся дискуссия о преимуществах того или иного метода и непрерывные поиски новых способов лечения.
Мы далеки от мысли рекомендовать реклпнацию для массового применения, но опыт показал, что эта операция может дать положительный результат даже в тех случаях, когда традиционные операции малоперспективны. Мы хотели бы обратить внимание коллег на эту проверенную веками и, на наш взгляд, незаслуженно оставленную без внимания операцию, при дальнейшем совершенствовании которой на уровне современной офтальмохирургической техники могут открыться неожиданные возможности применения ее в хирургии катаракты.
Глава 7
Операции на стекловидном теле
В настоящее время происходит бурное развитие хирургии стекловидного тела. Предлагаются десятки новых оперативных приемов и оригинальных автоматизированных инструментов. Техническая возможность осуществления вмешательств даже на уровне прере-тинальной части стекловидного тела при прямом визуальном контроле за взаимодействием инструмента и тканей не вызывает сомнений. Одни офтальмохирурги предпочитают использовать подход к стекловидному телу через зрачок. Для этого приходится удалять хрусталик, зачастую сохраняющий прозрачность, и широко вскрывать переднюю камеру, в том числе и путем временного иссечения роговицы. Другие производят обширное — на половину окружности — вскрытие глазного яблока разрезом через плоскую часть ресничного тела. Наряду с этим используют и специально разработанную методику «закрытых» операций, при которых необходимые инструменты, волоконные осветители, наконечники ирригационно-аспирационных и режущих систем вводят в глаз всего лишь сквозь один—два прокола оболочек. Взаимоотношение тканей в ходе таких вмешательств оценивают под микроскопом через специальные контактные линзы, нередко в оптическом срезе коаксиального щелевого осветителя.
Несмотря на примеры непосредственного успеха таких операций, их отдаленные исходы, особенно функциональные, не вполне ясны. Вызывает сомнение реальность внедрения столь сложных вмешательств в широкую офтальмохирургическую практику. Подробное описание метода закрытой витрэктомии и витрэктомии с широким доступом (типа открытого неба) дано в главе «Операции при заболеваниях сетчатки».
Приведем лишь схематическую реконструкцию основной идеи этих вмешательств (рис. 175, 176), а также схемы устройства вит-реофагов нескольких типов (рис. 177, 178)1.
Техника операций на стекловидном теле
Остановимся более подробно на технике выполнения тех, зачастую вынужденных, манипуляций со стекловидным телом, которые вполне доступны практическому офтальмохирургу, располагающе-
1 В главе приведены основные сведения и рисунки из монографии А. И. Горбаня и О. А. Джалиашвили «Микрохирургия глаза». — Л.: Медицина, 1982.
342
175. Передняя витрэктомия аппаратом «Ocutome» (США).
а — после удаления катаракты; б — после факоэмульспфикации; в — после трабекулэктомии; г — после сквозной кератопластики; д — после введения инстраокулярной линзы.
176. Витреофагия через плоскую часть ресничного тела.
а — удаление субретинальной жидкости; б — рассечение преретинальной мембраны.
9
177. Аппарат для витреофагпп фпрмы «Optikon» (Италия).
а — общий вид; б — основные варианты устройства рабочих концов головки: 1 — режущая головка, вибрирующая вдоль оси; 2 — вращающаяся [Горбань, 1982].
му стандартным микрохирургическим инструментарием и оснащением операционного блока.
Аспирация жидкой части стекловидного тела.- Перед экстракцией катаракты выполняют аспирацию либо с йрофилактической целью, когда к началу операции недостаточно снижен тургор' глаза, либо когда это удается сделать, но после вскрытия, полости глаза радужно-хрусталиковая диафрагма резко смещается к ране, что свидетельствует об опасности выпадения хрусталика и стекловидного тела. Наконец, этот прием можно применить и после того, как оформленное стекловидное тело выпало в рану, для того чтобы об
178. Аппарат и инструменты для витреофагии «Ocutome».
а — общий вид аппарата; б — режущая головка, вибрирующая вдоль оси; в — режущая часть.
344
179. Отсасывание стекловидного тела.
а — игла Цур-Неддена; б — введение иглы в стекловидное тело.
легчить его репозицию в арачок.
Яг. После удаления жид-|Я кой части стекловидного |Я тела, не содержащего опорной коллагеновой тка-' Яр ни, не наблюдается неже-дательных последствий,
^Я так как объем его быстро Я| восполняется за счет про-дукции внутриглазной
Я| Жидкости, причем это в Яр равной мере справедливо и для содержимого внутри-
Я| витреальных полостей Я| (рис. 179, 180), и для В| «ретровитреальной» жид-Я кости, заполняющей при Я отслойке стекловидноготе-Я ла пространство между V сетчаткой и задней гиало-
Ш иди ой мембраной. Более вязкой, но все же поддающейся ас- пирации частью содержимого глаза является ретроленталь-К ная порция стекловидного тела, заполняющая просвет гиало-Ш идного тракта. Для успешного проведения процедуры важно вы-Ш брать иглу минимального сечения и попасть ее острием сквозь колобому радужки в нужную часть гиалопдной полости. Лучше В использовать пглу, предназначенную для подкожных инъекций. Ш К сожалению, через нее проходит лишь жидкость стекловидного В тела малой вязкости, поэтому необходимо иметь наготове и более В толстую иглу — но тину тех, которые используются для ротро-В бульбарных или внутривенных инъекций.
В Предпочтение1 следует отдавать плавно изогнутыми пальцами (примерно под углом 120—135°) иглам, длина концевой части • которых не превышает 15 мм. Полезно иметь в наборе также иглы ж с более короткими концами — длиной 5 и 10 мм. Изгиб иглы не-|* обходим, поскольку он, во-первых, является стопором, который
180. Аспирация жидкого стекловидного тела сквозь колобому радужки (схема). Объяснение в тексте.
345
препятствует погружению иглы в глаз на чрезмерную глубину, во-вторых, открывает для наблюдения через микроскоп при малом увеличении одновременно и место вкола иглы в глаз, и конец шприца с делениями. Цифры и риски шкалы при надевании изогнутой иглы нужно ориентировать так, чтобы они были видны сверху, со стороны микроскопа.
Попасть в эндовитреальную полость помогает предварительно проведенная биомикроскопия. При непрозрачном хрусталике исследуют второй глаз. Поскольку часто состояние стекловидного тела обоих глаз бывает одинаковым, можно с большой долей вероятности установить, какую жидкость предстоит аспирировать и где искать ее скопления — в каком квадранте и на каком удалении от лимба. Когда больной лежит на спине, просвет осевого гиалоидного тракта может быть найден на расстоянии 5—15 мм за центром хрусталика. Внутривитреальные полости чаще локализуются в верхнеэкваториальной зоне, а до «ретровитреальной» полости проще дойти, если продвигать иглу от места входа у лимба перпендикулярно радужке на глубине 14—15 мм, но не более, поскольку на глубине 19—20 мм при нормальных размерах глаза здесь уже находится сетчатка.
Для того чтобы попасть концом иглы в одну из гиалоидных полостей, нередко требуется выполнить «веером» несколько повторных проколов передней гиалоидной мембраны и геля стекловидного тела, не извлекая полностью конец иглы из раны и колобомы. При погружении конца иглы через каждые 3—5 мм делают пробную попытку произвести аспирацию. Как только в шприц начнет поступать жидкость, необходимо прекратить любые перемещения иглы в глазу, поэтому при выполнении этой манипуляции шприц нужно удерживать двумя руками. Функции обеих рук хирурга четко разграничены. Левая рука, которая плотно прижата тыльной поверхностью ко лбу больного, служит для удерживания шприца и страховки от внезапных движений глаза (прижатием уздечного шва). Правой рукой в нужные моменты хирург осуществляет движения поршнем, а в случае необходимости обеими руками синхронно и медленно перемещает иглу в полости глаза. Пальцы обеих рук должны быть плотно прижаты друг к другу, как бы соединяя кисти в единое целое (это в какой-то мере предупреждает опасную несогласованность их действий).
Аспирацию следует производить медленно, чтобы игла не закупорилась оформленным гелем. Необходимо контролировать поступление в шприц жидкости. Хирург или ассистент должен следить за тем, заполнился ли шприц до планируемой отметки, не пошли ли в шприц пузырьки воздуха, что свидетельствует о закупорке иглы. Известную помощь оказывает хирургу и ощущение легкости перемещения поршня в шприце.
Если в ходе аспирации жидкость засасывается, но тургор глаза почти не снижается, то процедуру надо прекратить, так как компенсаторная гиперемия увеального тракта может привести в конечном счете к внутриглазному кровотечению. Аспирированную 346
витреальную жидкость нужно хранить в шприце до конца основного вмешательства, а после герметизации раны ввести обратно в Гиалоидную полость для восстановления нормального тургора гла-Йа. С этой целью применяют самую тонкую иглу, которая свободно входит в глаз даже между близко расположенными лимбальными швами. Конец ее вводят в полость глаза наклонно через зрачок или базальную колобому.
Репозиция оформленного стекловидного тела. Если стекловидное тело в конце вмешательства вышло в переднюю камеру, то иногда удается заправить его обратно в зрачок микрошпателями при частичной герметизации операционного разреза. В этом случае применяют те же технические приемы, что и при репозиции радужки. Сохраняется основной принцип: инструмент следует вводить в переднюю камеру возможно дальше от сектора выпадения, чтобы боковыми движениями микрошпателя в сторону зрачка можно было оттянуть стромальные элементы стекловидного тела из угла передней камеры и ликвидировать их контакт с внутренними губами разреза фиброзной капсулы. Шпатель проводят вплотную к поверхности радужки, периодически отклоняя его конец от лимба.
В микроскоп хирург должен замечать малейшие сдвиги ткани радужки вдали от конца инструмента. Такие сдвиги зависят от тяги фибрилл стекловидного тела, переброшенных поверх радужки к ране. Целесообразно эти манипуляции делать после заполнения передней камеры воздухом, если он не дробится на мелкие пузырьки. Шансы на обнаружение нитей стекловидного тела в передней камере увеличиваются, потому что стенки воздушного пузыря снизу отчетливо вдавливаются натягивающимися нитями стекловидного тела. Распустив в соответствующем секторе пару стянутых лимбальных швов, иногда удается устранить ущемление стекловидного тела по только в углу передней камеры, но и на каком-либо участке разреза. Наличие поустрапенпой витреолим-бальпой связи через зрачок является прямым показанием к передней витрэктомии.
Если оформленный гель стекловидного тела, покрытый неповрежденной передней гиалоидной мембраной, не только подходит к лимбальному разрезу, но и выходит наружу, то прямая репозиция его становится невозможной. Этому препятствует временное уменьшение объема гиалоидной полости вследствие формирования складок склеры в заднем отделе глаза или резкой гиперемии увеального тракта. Прежде чем принимать решение о выполнении витрэктомии, стоит все же попытаться аспирировать из глубины глаза через зрачок или колобому некоторое количество жидкости, есди, конечно, она там находится в свободном состоянии. В результате этого тургор глаза может снизиться настолько, что оформленное стекловидное тело само уйдет обратно в переднюю камеру и даже втянется в зрачок. Помочь его продвижению можно поглаживанием мягкой акварельной кисточкой, простерилизованной в автоклаве (рис. 181). При отсутствии ее можно использовать
347
181. Передняя витрэктомия с помощью кисточки.
обычный широкий шпатель. Поскольку обе руки хирурга заняты аспиратором, то собственно вправление стекловидного тела в переднюю камеру производит ассистент, который второй рукой приоткрывает лимбальную рану. Если было наложено глазное каркасное кольцо, то, подтягивая его кверху, можно несколько увеличить объем спадающего глаза и тем самым повысить эффект аспирации.
Передняя витрэктомия. Если описанные выше приемы не дают полного эффекта, то иссекают весь вышедший через зрачок гель стекловидного тела (даже с некоторым избытком). Поскольку пришить глазное кольцо к уже вскрытому глазу трудно, то для предотвращения дальнейшего спадения склеральной капсулы на эписклеру у лимба можно наложить четыре трансконъюнктивальных шва-держалки и подтянуть за них глазное яблоко кверху, перебросив нити с оттяжками через марлевые валики. Ассистент полностью открывает рану, а хирург с помощью ножниц сначала отсекает все выпавшее оформленное стекловидное тело (рис. 182, а), а затем удаляет тот гель, который находится в передней камере (рис. 182,6). Для подтягивания его к ране можно использовать узкие тугие ватные «сигареты», обрезанные под острым утлом. К гигроскопической вате стекловидное тело приклеивается не очень сильно, но все же достаточно для отсечения малых порций геля при каждой потяжке (естественно, каждый раз берут «сигареты» новые). После иссечения всего стекловидного тела, которое тянется из передней камеры за «сигаретами», хирург вводит их концы непосредственно в зрачок, извлекая и отсекая часть невыпавшего, ретропупиллярно расположенного стекловидного тела (рис. 182,в). Манипуляции заканчивают лишь тогда, когда радужка по всему кругу провисает внутрь глаза, зрачок полностью центрируется, а на радужке у раны ничего «клейкого» не остается (рис. 182, г).
После быстрой герметизации разреза объем глазного яблока восстанавливают путем введения изотонического раствора хлорида натрия с добавлением 5000 ЕД пенициллина и 0,1 мл дексамета-348
182. Удаление стекловидного тела и передней камеры ватной «сигаретой». Объяснение в тексте.
зона; в переднюю камеру вводят пузырек воздуха. Его должно быть немного, поскольку после достаточно полной витрэктомии, когда и в зрачке, и на небольшом протяжении за ним оформленный гель стекловидного тела отсутствует, создаются условия для легкого проскальзывания газа в зрачок, после чего немедленно исчезает передняя камера. Естественно, это нежелательно из-за опасности образования зрачкового блока. В то же время свободное вхождение цельного пузырька газа в зрачок свидетельствует о полноте витрэктомии. Так что иногда полезно сначала ввести избыток воздуха, а потом уже тонкой канюлей частично отсосать его через зрачок, заместив удаленное стекловидное тело изотоническим раствором хлорида натрия с необходимыми добавками.
Описанные манипуляции следует производить быстро, но не поспешно. При широком раскрытии раны увеличивается опасность заноса микробов из воздуха; резкая гипотония создает условия для выпотевания плазмы из увеальных и ретинальных сосудов, для разрыва их стенок; при обширной травматизации роговицы инструментами может развиться эндотелиально-эпителиальная дистрофия. Всех этих нежелательных моментов должно быть как можно меньше, чтобы можно было получить не только анатомический, но и функциональный эффект от основной операции.
Для того чтобы отсечь гель, его захватывают не только заостренными ватными «сигаретами», но и пинцетами с плотно смыкающимися плоскими браншами, а в особо трудных случаях присасывают к концу баллончика или шприцевого аспиратора без канюли. Вытяжение избыточного количества стромы стекловидного тела
349
185. Передняя витреотомия при афакическом зрачковом блоке (схема), а, б — этапы операции.
вают зрачковую пленку и все, что за ней расположено, на глубину до 7—10 мм. Выполняют эту манипуляцию одним движением — вращением рукоятки микрошпателя примерно на 90° вокруг оси в пальцах (рис. 185,6). Она рассчитана на создание соустья между витреальными полостями с одной стороны, и передней камерой глаза — с другой. О выполнении поставленной задачи свидетельствуют мгновенное расширение зрачка и углубление передней камеры вследствие выхода в нее разжиженных витреальных масс. После этого через ту же колобому следует аспирировать немного жидкости из глубоких отделов стекловидного тела, а переднюю камеру частично заполнить воздухом, оттесняя тем самым оформленное стекловидное тело за плоскость зрачка.
Рассечение пленок в стекловидном теле производят также с оптической целью. При афакии после тщательной биомикроскопи-ческой оценки плотности и глубины мешающей зрению пленки можно попытаться рассечь ее через расширенный до предела зрачок узким катарактальным ножом с затупленной проксимальной частью лезвия. Вмешательство невозможно произвести без операционного микроскопа с коаксиальным освещением, которое позволяет видеть конец ножа в глазу, правда, при не очень глубоком проникновении его в стекловидное тело. При выполнении этой процедуры необходимо подстраивать фокус микроскопа, а также поддерживать тургор глаза, нагнетая изотонический раствор хлорида натрия в переднюю камеру через отдельный прокол. К сожалению, диффузное освещение ОМ-2 не позволяет видеть саму вит- / реальную пленку, поэтому момент вкола в нее ножа и эффект рас- I сечения (распиливания) можно определить только по слабому ' тактильному ощущению.
Эту процедуру можно выполнить точнее, если использовать операционный микроскоп, снабженный щелевым осветителем, который приближают к линии наблюдения под достаточно острым углом. Можно применить также ручную щелевую лампу, обеспечив ее стерильность:
352
186. Рассечение внутривитреальной пленки через плоскую часть ресничного тела (схема).
а. б — этапы операции.
При наличии прозрачного хрусталика вкол ножа производят на проекции плоской части ресничного тела в удобном для выполнения манипуляций меридиане, обычно со стороны правой руки хирурга. После надреза склеры производят гемостатическую диатермокоагуляцию ее глубоких слоев. Направление надреза оболочек должно совпадать с линией намеченного рассечения витреальной плевки: если предстоит рассечь ее в поперечном направлении, то плоскость лезвия ориентируют вдоль лимба (рис. 186, а), если же планируется продольный надрез, то плоскость ножа должна быть перпендикулярна к лимбу (рис. 186,6). При таких подходах нож следует снабдить ограничителем глубины. Для этого затупленную часть лезвия туго обматывают несколькими витками смоченной капроновой нити, концы которой связывают затем прочным узлом. Расстояние от кончика ножа до этого узла должно на 3—5 мм превышать рассчитанное расстояние от места вкола до пленки, чтобы можно было осуществлять пилящие движения лезвием. Расчет производят па основании результатов биомикроскопии, которые1 переносят на мериднонпльпук) схему Валтина — Поляка, используемую для реитсеполокализацпп инородных тел в глазу. Однако нужно помнить о возможном спадении глаза в ходе операции вследствие истечения жидких фракций стекловидного тела. Если не обращать внимания па деформацию глазного яблока и не поддерживать обычный объем глаза, вводя жидкость через отдельный прокол оболочек, рассчитанная длина лезвия ножа может оказаться избыточной, в результате чего можно повредить сосудистую оболочку и сетчатку.
Пересечение внутривитреальных тяжей. Эта процедура имеет довольно узкие показания. В частности, с ее помощью можно прекратить деформацию сетчатки швартой стекловидного тела пли ослабить витреоретинальную тракцию в зоне клапанного разрыва. Для этого удобно использовать специальные шарнирно-ползунные и цанговые ножницы. Плоскость резания в таких ножницах можно изменять, поворачивая направляющую трубку и шток-толкатель при постоянном положении рукояток (рис. 187, а) или же вращая рукоятку в пальцах (рис. 187,6—г). Это удобно, так как витре-альные тяжи располагаются в любых направлениях. Лезвия мик-
23 Руководство по глазной хирургии
353
187. Шарнирно-ползунные микроножницы для операций на стекловидном теле. Объяснение в тексте.
роножниц могут быть прямыми или изогнутыми, в связи с чем еще больше расширяются возможности их использования. Последние их модели (см. рис. 187, в, г) снабжены системой для подачи компенсирующего раствора в полость глаза через ту же направляющую трубку. Это, конечно, облегчает работу.
Подведение лезвий ножниц к неглубоко расположенной шварте и само пересечение ее хорошо контролируются под микроскопом на фоне розового рефлекса с глазного дна, так как все детали, находящиеся на небольшом расстоянии за хрусталиком, видны с дополнительным увеличением (рис. 188). По мере истечения жидкого стекловидного тела через разрез склеры и по трубке ножниц происходит медленное спадение глазного яблока. Если ножницы не снабжены системой для подачи раствора, то рядом делают второе трансцилиарное отверстие для введения тонкой канюли, по которой ассистент по команде хирурга в течение всей процедуры вводит подогретый изотонический раствор хлорида натрия.
Условия для выполнения вмешательства могут ухудшиться не только в результате спадения глазного яблока, но и вследствие сужения зрачка, поэтому необходим максимальный и по возмож-
354
188. Пересечения шварты в стекловидном теле (схема). Объяснение в тексте.
кости стойкий мидриаз. Место введения ножниц в глаз выбирают с таким расчетом, чтобы направляющая трубка ножниц находилась примерно под прямым углом к длиннику шварты. Однако и при этом условии подобными ножницами не всегда удается перерезать даже тонкие, но очень прочные или эластичные тяжи в стекловидном теле. Тяжелым осложнением такой «закрытой» швартотомии может быть повреждение задней сумки хрусталика, поэтому все время необходимо ощущать пальцами наклон внутриглазной части ножниц, пе позволяя их концу близко подходить к хрусталику.
После того как микропоясницы погружены в стекловидное тело, они становятся также инструментом фиксации глазного яблока. Перемещая их в нужную сторону, хирург может наклонять глаз и последовательно осматривать в микроскоп интересующие его участки гиалоидной полости. Левой рукой, вооруженной изогнутым микропипцотом со скошенными зубцами, хирург удерживает глаз во второй точке. Это препятствует ого вращению вокруг направляющей трубки ножниц при сильных наклонах.
Бели ппутрпглпзпые шварты особенно мощные, то таким же образом в полость стекловидного тела приходится вводить пружинные ножницы тина роговичных, но с равными по длине лезвиями. Разрез оболочек в этом случае более длинный, потеря стекловидного тела, как правило, ощутима, а визуальный контроль через зрачок возможен лишь в начале операции, пока глаз не спался. При пересечении мощных, часто васкуляризированных шварт иногда возникает внутриглазное кровотечение. В связи с этим приходится прекратить дальнейшие манипуляции в глазу, отказаться от реализации первоначально намеченного плана. Для уменьшения опасности возникновения кровотечения сосуды целесообразно заблаговременно коагулировать с помощью аргонового лазера.
К рассматриваемым здесь вмешательствам относится также извлечение из стекловидного тела немагнитных инородных тел. Некоторые пз современных инструментов, используемых с этой целью, представлены на рис. 189 и 190. Более подробные сведения по этому вопросу приведены в главе 13.
23*
355
189. Пинцеты для внутртг-витреальных манипуляций, а — в — неканюлированные; г — с системой подачи жидкости в глаз; черные стрелки — направление движения брашпи. светлая — ток жидкости.
нипуляций по Беляеву.
а — общий вид; б, в — увеличенные с раскрытыми браншами.
3
191. Офтальмофрагментатор Коссовского.
Общие принципы их использования аналогичны рассмотренным выше правилам работы витреальными ножницами, поскольку в их конструкции имеется много общего (пружинные рукоятки, направляющие трубки для подачи жидкости и т. д.). Разнообразие формы и устройства их рабочих концов обеспечивает захват немагнитных частиц практически всех видов, формы и величины (проволока, дробинки, металлические осколки, кусочки хрупких материалов и т. д.). Однако подвести инструмент к осколку, даже видимому в стекловидном теле через зрачок, — задача весьма трудная из-за подвижности инородного тела и увеличения плотности стромы стекловидного тела вблизи осколка. Еще более индивидуальным должен быть подход к извлечению таких инородных тел при потере прозрачности сред глаза и при наличии гнойника вокруг осколка. (' этими типами эндовитреальпых операций лучше всего ознакомиться по специальным руководствам по травматологии 1.таза | Нолик 11. Л., 1972; Лепехов II. И., 1974; Волков В. В., Ши-лиев В. Г., 197(1; Гундорова Р. А. и др., 198(1].
Операции на стекловидном теле с применением отечественного ультразвукового офтальмофрагментатора. Л. В. Коссовским был сконструирован и изготовлен ультразвуковой офтальмофрагментатор (УЗХ-Ф-04-0), предназначенный для фрагментации хрусталика и стекловидного тела. Основное отличие прибора от существующих образцов заключается в автоматической аспирации продуктов фрагментации за счет особой конструкции рабочей иглы-наконечника. Это позволило исключить из схемы прибора специальное отсасывающее устройство и сделало аппарат более простым и компактным. Благодаря тому, что устранена опасность возникновения блоков отводящей системы, увеличилась безопасность операции, стало легче управлять прибором.
Офтальмофрагментатор (рис. 191) состоит из четырех основных частей: ультразвукового генератора, магнитострикционного преобразователя с рабочей иглой-наконечником, ирригатора и педали управления. В ультразвуковом генераторе предусмотрена
357
регулировка мощности и частоты ультразвука, а также автоматическая подстройка резонансной частоты. Магнитострикционный преобразователь, составляющий рабочую часть прибора, изготовлен на ферритовой основе, масса его 150 г.
Рабочая игла-наконечник сделана из титанового сплава, ее наружный диаметр 0,9—1,1 мм. Педаль управления включает в работу магнитострикционный преобразователь и служит для тонкой регулировки мощности ультразвука путем изменения силы нажатия на педаль. Офтальмофрагментатор предполагает применение бимануальной методики операции с подачей замещающего раствора через отдельный ирригатор со съемной иглой. Конструкция ирригатора предусматривает пальцевую регулировку подачи раствора. Рабочую иглу-наконечник стерилизуют сухожаровым или паровым методом, магнитострикционный преобразователь и ирригатор — паровым методом (при температуре не выше 120 °C) или в парах формалина.
Предварительная настройка прибора, которую рекомендуется производить до стерилизации, заключается в выведении его на резонансную частоту вращением тумблера. Настройку осуществляют погружением рабочей иглы в воду наполовину; при правильной настройке из патрубка преобразователя жидкость должна вытекать с частотой 3—5 капель в секунду.
Техника операции. Л. В. Коссовский (1983) рекомендует производить разрезы конъюнктивы и склеры на расстоянии 3,5—4 мм от лимба на 10 и 2 часах. Через латеральный разрез длиной 2 мм в толщу хрусталика с помощью инъекционной иглы вводят 0,1 мл 1% раствора мезатона (при этом одновременно определяют плотность хрусталика), а затем проводят иглу-наконечника офтальмофрагментатора; через медиальный разрез длиной 1 мм вводят иглу ирригационной системы. Фрагментацию вещества хрусталика производят по возможности в пределах капсульной сумки с последующей фрагментацией задней капсулы. Переднюю капсулу по окончании фрагментации в большинстве случаев рассекают в центре концом ирригационной иглы или ножом Сато. Операцию завершают наложением шелковых швов на разрезы. Послеоперационный период у большинства больных протекает гладко, применения кортикостероидов не требуется.
Показания к операции. Ультразвуковую витрэктомию применяли при кровоизлияниях в стекловидное тело (при отсутствии признаков рассасывания в течение 2 нед), помутнениях стекловидного тела (без грубого швартообразования), эндофтальмите, выпадении стекловидного тела, смешивании стекловидного тела и кортикальных масс, витреальном блоке, грыже стекловидного тела с витреокорнеальным контактом, ущемлении стекловидного тела в послеоперационном рубце, свежих ранениях с образованием смеси хрусталиковых масс, крови и стекловидного тела, операционных интраокулярных геморрагиях.
Особенности конструкции аппарата предполагают введение в глаз во время операции двух игл: фрагментатора (диаметр 0,9— 358
1,1 мм), для разрушения и аспирации внутриглазных тканей и Ирригационной иглы (диаметр 0,9 мм) для подачи замещающей Жидкости (обычно изотонический раствор хлорида натрия).
При работе в глубоких отделах стекловидного тела используют Комбинированный осветитель — ирригатор (диаметр 1,2 мм). Ультразвуковую иглу вводят через разрез склеры на расстоянии 4 мм от лимба, ирригатор же в зависимости от ситуации — через лимбальный или транссклеральный разрез.
Фрагментацию производят серией коротких импульсов (по 1—2 с). Суммарное время экспозиции не превышает 2—2'/2 мин. Обычно операцию выполняют под местной анестезией.
При лечении осложнений, возникающих при экстракции катаракты, с помощью аппарата можно в считанные секунды освободить переднюю камеру от стекловидного тела или кортикальных масс. Это возможно при частичной герметизации катарактального разреза и введении иглы-наконечника и ирригационной иглы между швами в переднюю камеру с фрагментацией стекловидного тела при наполненной передней камере.
В некоторых случаях широко раскрывают катарактальный разрез и удаляют стекловидное тело, не замещая его. Дефицит объема восполняют изотоническим раствором хлорида натрия или воздухом после герметизации раны. Этот метод целесообразнее применять при выпадении в рану большого количества оформленного стекловидного тела или смешивании его с кортикальными массами. В этом случае можно контролировать полноту санации передней камеры.
При витреальном блоке целью витрэктомии является обеспечение свободного оттока внутриглазной жидкости между ретровит-реальным пространством и передней камерой.
При грыжах стекловидного тола с витреокорнеальным контактом и |П1'Н1Л1>пых явлениях буллезной кератопатии своевременное, по позднее 2 3 нед поело появления признаков кератотомии, удаление передних отделов стекловидного тела позволяет предотвратить дальнейшее развитие этого серьезного осложнения. Аналогичные данные получены А. И. Мовшович и Ю. Е. Батмановым (1983). При передней витреофиксации ультразвуковая витрэктомия имеет преимущества перед механической, так как разрезать ущемленные волокна стекловидного тела трудно, легче разрушить их ультразвуковым офтальмофрагментатором.
Хороню зарекомендовал себя аппарат Коссовского в хирургии свежей травмы при удалении смеси хрусталиковых масс со стекловидным телом и кровью. Его можно применить для удаления крови из передней камеры и стекловидного тела при внутриглазных геморрагиях во время различных операций. Во всех случаях удается быстро эвакуировать излившуюся кровь.
Тяжелая патология стекловидного тела, возникающая в результате интравитреальных кровоизлияний различной этиологии, крайне неблагоприятна в отношении восстановления зрительных функций.
359
R. Machemer и соавт. (1971, 1972) получили удовлетворительные результаты при использовании витрэктомии при лечении старых кровоизлияний в стекловидное тело при диабетической ретинопатии.
С. Н. Федоров и соавт. (1974, 1975) приводят результаты витрэктомий при различной патологии стекловидного тела (после посттравматического, диабетического, гипертонического гемоф-тальма). Практически удаляли почти все измененное стекловидное тело, за исключением его основания, которое сложно удалить, не повредив хрусталик, и замещали его изотоническим раствором хлорида натрия. Из осложнений отмечены повреждения задней капсулы хрусталика и свежие кровоизлияния в полость глаза во время операции, вызванные рассечением сосудистых пролифера-тов, обусловленных сахарным диабетом и гипертонической болезнью. Повышение внутриглазного давления путем увеличения подачи замещающей жидкости позволяет приостановить кровотечение. Улучшения остроты зрения после витрэктомии удалось добиться у больных с последствиями кровоизлияний травматической этиологии и помутнениями стекловидного тела воспалительного характера. Менее выраженный эффект отмечался при гемоф-тальмах гипертонической и диабетической этиологии.
В 1980 г. В. А. Думенеком, Л. В. Коссовским и Г. Е. Столяренко был создан первый советский оригинальный механический витреотом гильотинного действия с пружинистым прижимом режущих кромок друг к другу (авт. свпд. № 858818).
Осложнения при операциях
на стекловидном теле
Осложнения, связанные с хирургическими вмешательствами на стекловидном теле, возникают чаще и нередко протекают тяжелее, чем осложнения при других офтальмохирургических вмешательствах. Осложнения могут развиться как во время, так и после операции. Ниже приведены описания основных осложнений, способов их устранения и профилактики.
Осложнения во время операции. Диапазон осложнений со стороны стекловидного тела широк..Большинство осложнений возникает вследствие повреждения различных тканей глаза, таких, как роговица, хрусталик, сетчатка, а также возникновения внутриглазного кровотечения. Некоторые осложнения связаны с использованием ряда инструментов, например специальной канюли, применяемой для инфузии в супрахориоидальное пространство. Незавершенность действий хирурга во время операции может привести к развитию поздних осложнений вследствие продолжающегося воздействия неустраненного заболевания или повреждения глаза.
Осложнения со стороны роговицы. Отек роговицы в результате ее повреждения возникал довольно часто в начальный 360
Йериод хирургического лечения патологии стекловидного тела, в Иастоящее время это нечастое осложнение. Однако иногда Ио-прежнему встречается патология роговицы, например длительно незаживающие дефекты эпителия, отек стромы легкой или средней степени.
Послеоперационные расстройства возникают в ответ па механическое или фармакологическое повреждение эпителия и эндотелия. Ранее обычным явлением в хирургии стекловидного тела было частичное удаление эпителия роговицы для улучшения видимости во время операции, в настоящее время по возможности этого избегают, особенно при операциях на диабетических глазах. Большая часть дефектов эпителия чаще связана со случайной травмой его поверхности, чем со специальной скарификацией. Чаще их обнаруживают в глазах больных сахарным диабетом, где эпителий слабо фиксирован к передней пограничной пластинке в связи с чрезмерным накоплением экстравазатов под эпителиальным слоем.
При наличии дефекта эпителия строма роговицы отекает, в результате чего образуются складки в ее задних слоях и на задней пограничной пластинке. Эти складки углубляются с течением времени и могут искажать видимость во время операции. Отек стромы исчезает после заживления дефекта эпителия, если эндотелий не сильно пострадал. Для того чтобы не травмировать эпителий роговицы, следует уменьшить до минимума продолжительность операции, постоянно смачивать эпителий, а также избегать его механического соскабливания. Если, несмотря на эти предосторожности, эпителий роговицы мутнеет во время операции, то следует, по-видимому, удалить часть эпителия, с тем чтобы завершить операцию. Предпочтительнее убирать центрально располагающийся эпителий, оставляя интактной периферию, чтобы ускорить последующую эпнтслниацпю. Повреждение эндотелия п результате прямого воздействия нпструмептон редкость, чаще оно происходит при нснольаоваппп лимбнльпого доступа.
Повреждение хрусталика. Повреждение хрусталика во время операции может возникнуть в результате непосредственного воздействия на пего хирургическими инструментами или орошаемой жидкостью. Наиболее часто хрусталик травмируется при удалении мутного стекловидного тела из позадихрусталикового пространства или передиепериферического участка стекловидного тела на противоположной стороне глаза. Во время выполнения вмешательства в этих зонах желательно постоянно видеть заднюю капсулу хрусталика с помощью операционного микроскопа. Ориентирами могут служить помутнения капсулы хрусталика или пузырек воздуха в стекловидном теле, который выплывает к задней капсуле. Аналогичное описанным выше повреждение хрусталика возможно и при использовании фиброволоконной оптики, если ее применяют для подсвечивания переднепериферического стекловидного тела при расположении его в противоположном квадранте (по отношению к оптике). Избежать этого можно, если
361
использовать заднее подсвечивание, при котором свет отражается от заднего пигментного эпителия сетчатки.
Механическая травма хрусталика с разрывом задней капсулы и видимой несостоятельностью кортикального слоя обычно приводит к полному помутнению хрусталика в течение 6 нед. В связи с этим, если произошло серьезное повреждение хрусталика, его удаляют уже в ходе операции. При незначительном повреждении, однако, образуются локализованные участки помутнения и хрусталик можно не убирать.
По нашим данным, частота случайных травм хрусталика во время операций, когда не планировалось удалять хрусталик, составила 1 °/0 на 200 случаев, приблизительно такие же сведения приводят и другие авторы. Повреждение хрусталика может произойти также при использовании растворов для орошения глаза и внутриглазного введения. Применение большого количества орошающего раствора или раствора неправильного состава может вызвать катаракту.
Повреждения задней капсулы хрусталика во время иссечения периферически расположенного стекловидного тела с помощью разъемно-системного инструментария можно избежать, если использовать непрямое подсвечивание, при котором свет отражается от задней поверхности сетчатки. Состав раствора для орошения имеет важное значение в поддержании прозрачности хрусталика. Необходимо использовать более физиологичный раствор, а также оставлять слой нетронутого стекловидного тела в ретролентикуляр-ном пространстве как защитный барьер от вредного воздействия введенного внутривитреального раствора для орошения.
Наиболее частым осложнением во время операции является случайное вывихивание ядра или кортикального слоя в стекловидное тело в результате преждевременного разрыва задней капсулы хрусталика при удалении его через плоскую часть ресничного тела. Подобное осложнение наблюдается в 25 % случаев и особенно часто возникает при слабости задней капсулы хрусталика. Вывихнутые хрусталиковые массы трудно удалить, особенно если они плотные. Для удаления фрагментов масс необходима достаточная просасывающая сила. Это может привести к чрезмерной тракции стекловидного тела, витреоретинальному спаиванию и в результате к разрыву сетчатки или кровотечению. Помимо этого, фрагменты хрусталиковых масс могут осесть на сетчатке, в связи с чем их удаление сопряжено с риском.
Избежать преждевременного разрыва задней капсулы хрусталика можно, используя присасывающую силу ультразвукового факоэмульсификатора. Если же, несмотря на все предосторожности, хрусталиковые массы попали в глубокие слои глаза (рис. 192, а), то, отсосав передние порции стекловидного тела, непосредственно прилегающие к массам, создают пространство, заполненное жидким содержимым (рис. 192,6). Затем фрагменты хрусталика локализуют с помощью зонда для витрэктомии или ультразвуковой иглой и удаляют из наполненного жидкостью про-362
192. Удаление фрагментов хрусталика, выпавших через дефект задней капсулы, ультразвуковой иглой (схема). Объяснение в тексте.
странства (рис. 192,в). Чтобы при выполнении этой манипуляции не пострадала сетчатка, оставляют задний прилегающий к ней участок стекловидного тела в виде подушки.
Кровотечения. Возникновение кровотечения во время операции — серьезная проблема, поскольку из-за него снижается видимость и тем самым ухудшается исход вмешательства на стекловидном теле. После операции трудно увидеть сетчатку, а следовательно, трудно выявить осложнения и провести лечение, например, применить фотокоагуляцию для лечения послеоперационной пеоваскуляризации радужки. Кроме того, необходимо выполнить дополнительное хирургическое вмешательство, чтобы вымыть оставшуюся кровь.
Чаще всего возникает кровотечение из недавно травмированного глаза, а также из глаз с пролиферативными ретинопатиями. Во время операции наблюдаются кровотечения из сетчатки, )Н'ош1скулярп;1нров1111пой ткани или, реже, сосудистой оболочки. Кровотечение из сосудистой оболочки при склеротомии через плоскую часть ресничного тела встречается редко, хотя увеальные сосуды имеют радиальную направленность и поэтому часто травмируются при проведении кругового разреза в этой области. Кровотечение при склеротомии через плоскую часть ресничного тела возникает в основном в травмированных глазах, в которых, вероятно, увеальные сосуды паретичны или уже возникло кровотечение из собственно сосудистой оболочки. Однако даже в этих случаях введение инструментария для витрэктомии, как правило, позволяет остановить кровотечение, возможно вследствие местной тампонады.
Кровотечение из радужки или сосудистой зрачковой мембраны встречается чаще, поэтому в случае необходимости рассечь эти ткани нужно иметь наготове аппарат для биполярной бимануальной диатермии. К счастью, такое кровотечение останавливается спонтанно при повышении внутриглазного давления, с этой целью приподнимают сосуд с инфузируемым раствором. Для борьбы с такого рода кровотечением можно применить трансвитреальную
363
193. Двухполюсная диатермоко-муляция.
фотокоагуляцию ксеноном или специальный одноэлементный зонд, схожий по действию с биполярной диатермией. При кровотечении из прилежащих к сетчатке образований предпочтителен именно этот метод, так как он позволяет не касаться самой сетчатки.
После того как обильное кровотечение остановлено, жидкую кровь удаляют с помощью вакуумной установки, с тем чтобы оставить минимум крови после операции. Сгустки крови не стоит удалять, поскольку при этом может возобновиться кровотечение. Несмотря на успехи в со
вершенствовании хирургической техники и инструментов, кровотечение во время операции остается серьезной проблемой. Кровотечение возникает практически в каждом случае пролиферативной ретинопатии даже при использовании биполярного диатермокоагулятора и несмотря на все предосторожности при рассечении фиброзно-сосудистой ткани (рис. 193).
Повреждение сетчатки. Разрывы и отслойка сетчатки — наиболее грозное операционное осложнение в хирургии стекловидного тела. При вы полней и и склеротомии и вмешательства через плоскую часть ресничного тела возможны и другие травмы сетчатки, контузионные повреждения и ущемление сетчатки.
Разрывы сетчатки могут образоваться как при непосредственном повреждении ее хирургическими инструментами, так и при тракции шварты стекловидного тела. Разрывы локализуются: спереди в меридиане, где производят склеротомию через плоскую часть ресничного тела; спереди в других меридианах и сзади в местах витреоретинальпых соединений.
По ранее опубликованным данным, разрывы сетчатки по соседству с плоской частью ресничного тела встречаются в 11% случаев. Однако ввиду совершенствования методов нанесения разрезов и введения инструментов, а также вследствие выполнения склеротомии во время выведения инструментов и закрытия раны подобные разрывы стали встречаться реже. Разрез через плоскую часть ресничного тела производят на расстоянии 4 мм кзади от лимба на глазах с хрусталиком и 3—3,5 мм от лимба на афакичных глазах. Разрезы наносят кпереди от переднего края стекловидного тела, впереди от зубчатой линии сетчатки, поэтому частота диализа сводится к минимуму. При использовании зонда для витрэктомии необходимо, чтобы разрез увеальной ткани соответствовал диаметру зонда. При использовании одновременно с зондом троакара и
364
1ИНЮЛИ также уменьшается вероятность чрезмерной тракции при-лежащего стекловидного тела и сетчатки.
I В том случае если инструмент вводят в полость стекловидного тала, желательно видеть его кончик, чтобы он не вызвал повреждения периферии стекловидного тела. Уменьшив внутриглазное давление перед выведением инструмента, можно свести до минимума вероятность насильственного выпадения стекловидного тела, а т|акже тракционной отслойки сетчатки вдоль его края.
'Разрывы сетчатки возникают и при удалении крови из прере-тинального пространства. При попытке удалить кровь вблизи отслоившейся сетчатки она может пристать к кончику вакуумэк-страктора.
Несмотря на предосторожности, задние разрывы сетчатки встречаются часто. Число их доходит до 13% в глазах со сложной витреоретинальной патологией. При задней отслойке сетчатки стараются уменьшить ее размер и ослабить переднезаднюю и тангенциальную тракцию в этой области. После того как это сделано, большинство разрывов сетчатки можно с успехом лечить введением газового пузыря в сочетании с криовоздействием, диатермией, фотокоагуляцией, с тем чтобы вызвать хориоретинальное прилегание. В том случае, если нельзя устранить постоянную тракцию в месте разрыва сетчатки со стороны стекловидного тела или прилегающей соединительной ткани, часто используют губку, которую подшивают к склере матрацными швами в радиальном направлении.
Встречаются также другие повреждения сетчатки, такие, как, контузия сетчатки и подлежащей сосудистой оболочки хирургическими инструментами пли ущемление отслоившейся передней порции сетчатки при склеротомии через плоскую часть ресничного тела. Жидкую кровь убирают с поверхности сетчатки с помощью вакуумэкстрактора. Иглу с тупым концом выводят за пределы глаза, и отсасывание происходит за счет разницы внутриглазного давления при инфузии.
В других меридианах спереди отрывы сетчатки происходят нечасто (1—2%)- Они связаны с чрезмерной тракцией в местах витреоретинальных сращений. Эти осложнения встречаются реже, если применять не сильную тракцию и если витреотом хорошо работает.
Для устранения передних разрывов сетчатки применяют криотерапию в сочетании с локальным склеральным пломбированием силиконовой губкой или плотным силиконом. Эти методы можно комбинировать с круговым бандажем, а также с введением газового пузыря в стекловидное тело для тампонады изнутри, так как часто сетчатка не ложится на место, если было удалено прилежащее к ней стекловидное тело.
Наиболее часто разрывы сетчатки локализуются кзади от экватора и возникают от чрезмерной тракции в местах витреоретиналь-ного сращения, когда при этом повреждаются волокна стекловидного тела или соединительнотканные волокна, а также при отделе-
365
i
нии эпителиальной мембраны от сетчатки. Применяя небольшую отсасывающую силу и внимательно наблюдая за участками вит-реоретинальных сращений, можно уменьшить количество последующих отслоек. /
Помимо того, иногда можно порезать сетчатку витреотомом или внутриглазными ножницами, например при отслоившейся и подвижной сетчатке или когда трудно определить точное расположение сетчатки кзади от помутнения. I
Послеоперационные осложнения. Осложнения со стороны хрусталика. К послеоперационным осложнениям можно отнести: помутнение хрусталика, воспаление, обусловленное оставленными хрусталиковыми массами, затрудненная экстракция катаракты в позднем периоде и, по-видимому, спонтанный разрыв задней стенки капсулы хрусталика с вывихиванием ядра хрусталика в полость стекловидного тела. Катаракта может возникнуть в послеоперационном периоде в результате механического повреждения хрусталика во время операции; токсического воздействия раствора, используемого для ирригации; контакта с пузырьком газа, который вводят в стекловидное тело и, возможно, под действием других факторов. Наш опыт свидетельствует о том, что механическое повреждение может вызвать разрыв капсулы хрусталика и видимые повреждения в его прилегающем слое всегда приводят к заметному помутнению хрусталика в послеоперационном периоде.
Постоянный контакт между интравитреальным пузырем, состоящим из воздуха или сульфургексафторида (SFe), и задней частью капсулы хрусталика вызывает субкапсулярные помутнения через 12—24 ч после операции. Эти субкапсулярпые изменения обычно обратимы, если контакт хрусталика с газовым пузырем продолжается не более 36 ч. В связи с этим в послеоперационном периоде необходимо находиться в постели в определенном положении, для того чтобы ограничить контакт глаза с задней поверхностью хрусталика.
Катаракта, являющаяся причиной значительной потери зрения, возникает примерно у 15% больных диабетом, которые находились под наблюдением больше года.
Хрусталиковые массы, оставшиеся после неполного удаления хрусталика через плоскую часть ресничного тела могут вызывать различные постоперационные осложнения в зависимости от их количества и локализации. Кортикальные слои хрусталика мутнеют и отекают, в результате этого может произойти закупорка зрачкового пространства, если за радужкой оставлено большое количество хрусталиковых масс. Вещество кортикального слоя, оставшееся за радужкой или в полости стекловидного тела, обычно рассасывается в течение 4—8 нед.
Большие фрагменты вещества ядра, оставшиеся в полости стекловидного тела, обычно вызывают тяжелое, длительное интраокулярное воспаление, которое может прогрессировать вплоть до развития факоанафилактического эндоофтальмита и потери глаза. В связи с этим любой фрагмент вещества ядра, размер которого 366
ЙЬльше ’А диаметра диска, попавший в полость стекловидного Мла при удалении хрусталика, должен быть удален. Это обычно Цроизводят с помощью интравитреальной ультразвуковой эмульси-фикации после удаления прилежащей части стекловидного тела для создания пространства, наполненного жидкостью. Более мел-Кж фрагменты вещества ядра, оставшиеся в глазу незамеченными после оперативного вмешательства на стекловидном теле, по-©тв|пенно рассасываются и обычно не вызывают серьезного воспаления.
В случае развития прогрессирующего помутнения хрусталика посде хирургического вмешательства на стекловидном теле, катаракта может быть удалена позднее через лимбальный разрез или плоскую часть ресничного тела. Лимбальный разрез предпочтительнее, если в дальнейшем не требуется произвести вмешательство на стекловидном теле в связи с патологией заднего сегмента глаза.
При осуществлении экстракции катаракты через лимб после витрэктомии необходимо соблюдать предосторожности независимо от того, как удаляли хрусталик — экстра- или интракапсулярно. При проведении большого лимбального разреза к склере пришивают двойное кольцо Флиринга, потому что если жидкость из вит-реальной полости вытекает из глаза,'когда делают разрез, то это приводит к заметному коллапсу склеры. Возможно, не стоит использовать а-химотрипсин, поскольку он может свободно диффундировать в витреальную полость, так как нет витреального геля, и повредить ресничный эпителий или сетчатку. Если зонулярные нити капсулы хрусталика разорваны, то необходимо соблюдать крайнюю осторожность при экстракции катаракты, чтобы избежать соскальзывания хрусталика или его ядра в стекловидную полость. Необходимо соблюдать осторожность и для того, чтобы предотвратить разрыв задней капсулы хрусталика. Капсула в районе заднего полюса тонкая (2,5 мкм), и ее легко можно порвать при экстра- или интракапсулярном удалении хрусталика, если зонулярные нити трудно отделяются от капсулы.
Развития большинства осложнений можно избежать при соблюдении осторожности во время операции. Так, больных, перенесших витрэктомию, предупреждают о необходимости напоминать об этом врачам, если экстракцию катаракты рекомендовано выполнить в более поздние сроки.
Степень выраженности, длительность и последствия внутриглазного воспаления после вмешательств на стекловидном теле варьируют в широких пределах, хотя более или менее выраженное воспаление развивается во всех случаях. Если хрусталик сохраняют, а удаляют только измененное стекловидное тело, то послеоперационное воспаление обычно слабовыраженное и недлительное. В таких случаях во внутриглазных жидких средах обнаруживают небольшое количество клеток и белка, воспалительные явления исчезают через 2—3 нед. Однако постоперационное воспаление протекает
367
тяжелее, если операция была длительной; если удаляют хруста лик, применяют ретинальную криотерапию или вводят внутр t глаза газовый пузырек. В этих случаях может возникнуть тяжелое длительное воспаление, которое может привести к образованию фибриновой зрачковой мембраны в течение первой недели поме операции. Умеренное количество белка и клеток во внутриглазных средах может сохраняться в течение 10—16 нед. Тяжелое и средней тяжести послеоперационное воспаление лечат противовоспалительными средствами, которые применяют местно. J
Осложнение со стороны сетчатки. Наиболее тяжелыми осложнениями со стороны сетчатки, возникающими после хирургического вмешательства на стекловидном теле, являются отслойка сетчатки, обусловленная многими причинами и смещение сетчатки из-за сокращения оставшихся преретинальных мембран. Отслойка сетчатки наиболее опасна при поражении ее сосудов, так как сочетание этих двух видов патологии связано с высоким уровнем развития рубеоза радужки, особенно при диабете.
Отслойка сетчатки может быть следствием разрыва сетчатки или тракции, создаваемой остатками стекловидного геля или пре-ретинальными мембранами. Она возникает через 3—12 мес после операции. Экссудативная отслойка, вызванная ранее нераспознанным разрывом сетчатки, обычно проявляется в течение 2 нед после витрэктомии.
Послеоперационная экссудативная отслойка сетчатки может быть вызвана разрывом сетчатки у заднего края основания стекловидного тела. Неполностью удаленная задняя стекловидная пластинка, протянувшаяся между задней частью фиброваскулярной пролиферации и основанием стекловидного тела, вызывает тракцию и является причиной разрыва.
Разрывы сетчатки могут возникать в местах, не подверженных тракции, патогенез таких разрывов неизвестен. Послеоперационная экссудативная отслойка обычно быстро прогрессирует и часто характеризуется большим количеством субретинальной жидкости,, это, возможно, объясняется тем, что лишенная вязкости интравит-реальная жидкость легко проходит через отверстие.
Тракционная отслойка может персистировать или усиливаться после витрэктомии, если порции кортикальных слоев стекловидного тела в задней части остаются прикрепленными к сетчатке: кортикальные слои стекловидного тела, идущие от его основания к задним частям зоны фиброваскулярной пролиферации, другие’ витреоретинальные прикрепления, а также стекловидное тело, протянувшееся от одной задней части сетчатки к другой.
Развития прогрессирующей тракционной отслойки сетчатки можно избежать, удалив заднюю часть стекловидного тела во время первой операции, поэтому в большинстве случаев это — первоочередная задача при производстве витрэктомии. Однако послеоперационная отслойка сетчатки не всегда возникает или прогрессирует после витрэктомии, когда задние кортикальные слои стекловидного тела неполностью удалены. Послеоперационные осложне-
368
ия отсутствуют в глазах, в которых задние отделы стекловидного Ала и прилегающая сетчатка не изменены патологически, в отличие от глаз с пролиферативными изменениями, в которых фибро-ВЯскулярпая ткань уже подверглась атрофии.
(Прогрессирующее смещение задней части сетчатки без отслойки! может возникать в послеоперационном периоде вследствие тракции резидуальной неатрофировавшейся преретинальной пролиферирующей ткани. После удаления прилегающего кортикального слоя стекловидного тела остающаяся преретинальная ткань атрофируется и сокращается, иногда вызывая тангенциальную тракцию подлежащих и соседних участков сетчатки, к которой она прилегает. Отделение или сегментация преретинальной пролиферирующей ткани, которая может вызвать послеоперационную тракцию, является важной задачей при выполнении хирургического вмешательства на стекловидном теле. Повреждающее действие тангенциальной тракции обычно наблюдается в течение первых 3 мес после операции. Затем преретинальная ткань атрофируется и остается такой в дальнейшем.
Уровень послеоперационных отслоек сетчатки значительно варьирует в зависимости от показаний к хирургическому вмешательству на стекловидном теле и использованном техники. Повторная отслойка возникает в случаев, если операции на глазах произведены но поводу отслойки сетчатки в сочетании с прогрессирующей массивной преретпиальпой пролиферацией.
Л1ечеиие послеоперационной экссудативной отслойки схоже с таковым при возникновении отслойки в момент операции. Экссудативная отслойка сетчатки после витрэктомии сопровождается большим количеством субретинальной жидкости. Сетчатка может не встать на место, если сделан трансклеральный дренаж для выпуска субретинальной жидкости, так как интравитреальная жидкость свободно проходит через отверстия в сетчатке при отсутствии стекловидного тела. В связи с этим для внутренней тампонады разрыва сетчатки используют интравитреальный газовый пузырь. После удаления стекловидного тела жидкость может быть легко аспирирована из полости стекловидного тела, для того чтобы склеральная пломба вдавилась должным образом или для введения иптравитреального газового пузыря. Транссклеральный дренаж субретипальной жидкости требуется редко, и в большинстве случаев отслойку успешно лечат криотерапией в месте разрыва сетчатки и введением газового пузыря с наложением склеральной пломбы и без нее.
Если тангенциальная тракция оставшейся неатрофировапшей-ся преретинальной пролиферативной ткани вызывает смещение заднего отдела сетчатки или ее отслойку, то может понадобиться повторная операция, чтобы отделить или удалить оставшуюся пре-ретинальную ткань. При отсутствии стекловидного тела тканевые тяжи легко идентифицировать при повторной операции, что облегчает отделение преретинальной ткани с целью1 снятия тангенциальной тракции прилегающей сетчатки.
24 Руководство по глазной хирургии * 369
Рубеоз радужки и неоваскуляризационная глаукома. Неоваскуляризация (рубеоз) радужки с закрытием угла передней камеры — наиболее частое осложнение, особенно при диабете, при развитии которого ликвидируется эффект анатомически хорошо выполненной витрэктомии. Это осложнение развивается почти исключительно в тех случаях, когда до операции имелись сосудистые нарушения в сетчатке, характеризующиеся зонами нарушения капиллярной перфузии и, вероятно, гипоксией сетчатки. Механизм развития рубеоза радужки не ясен, но считают, что он связан со способным к диффузии ангиогенным фактором, вырабатывающимся тканью сетчатки в состоянии гипоксии. Полагают, что этот фактор способен вызывать неоваскуляризацию в прилегающей сетчатке и в более отдаленных местах, например таких, как зрительный нерв и радужка.
Причина повышения уровня развития рубеоза радужки после витрэктомии в глазах, в которых до операции наблюдалась гипоксия сетчатки, неизвестна. Он может быть следствием: уменьшения числа механических препятствий диффузии из заднего сегмента в передний водопролиферативных факторов после удаления стекловидного геля п (или) хрусталика; удаление биологически активных ингибиторов ангиогенеза, которые, возможно, содержатся в 'стекловидном геле и хрусталике; увеличения высвобождения вазопролиферативных факторов в сетчатке после витрэктомии в результате субклинических повреждений сетчатки или изменений внутриглазных физиологических процессов, ведущих к нарушению метаболизма сетчатки.
Рубеоз радужки вызывает глаукому (наиболее тяжелый тип) вследствие блокады угла передней камеры неоваскулярной тканью. Глаукома обычно развивается через 2—12 нед после витрэктомии, а иногда спустя месяцы или годы. В наиболее запущенных случаях, когда угол передней камеры полностью или почти полностью закрыт периферическими передними спайками или неоваскуляр-.иой тканью, такие методы лечения, как фотокоагуляция сетчатки, прямая фотокоагуляция неоваскуляризации в углу передней камеры и антиглаукомные препараты, неэффективны. В связи с этим одна из причин проведения частых послеоперационных осмотров — необходимость выявления рубеоза радужки в начале его развития, чтобы провести лечение до необратимого закрытия угла.
Диагностика послеоперационного рубеоза радужки затруднена, так как трудно дифференцировать ранний рубеоз радужки от ее гиперемии. Трудно прогнозировать течение рубеоза радужки и сочетание рубеоза с другими послеоперационными осложнениями, такими, как отслойка сетчатки.
Расширенные кровеносные сосуды вокруг зрачкового края могут наблюдаться через 72 ч после витрэктомии в некоторых глазах, •и невозможно установить, представляют ли собой эти изменения расширение нормальных сосудов радужки или ранние признаки неоваскуляризации радужки. Такие сосудистые нарушения также выявляются перед операцией у некоторых больных, страдающих
370
Лабетом, и при этом наблюдается просачивание флюоресцеина-Иви ангиографии. Однако в этих случаях рубеоз с дальнейшими, ошюжнениями развивается редко, если не производят витрэктомию.
1 Естественное течение рубеоза радужки может быть различным. Нфначительная непрогрессирующая неоваскуляризация радужки может возникать и без закрытия угла передней камеры. Однако ие всегда можно быть уверенным в том, что незначительная веоваскуляризация не является начальной стадией более быстро текущего рубеоза. В этих случаях необходимо часто проводить исследование с помощью щелевой лампы и гониоскопию для обнаружения прогрессирования неоваскуляризации радужки до развития необратимого закрытия угла.
Оценка влияния рубеоза радужки на состояние глаза после операции также осложняется при сочетании его с другими ослож-вениями, такими, как отслойка сетчатки. Тотальная отслойка сетчатки после витрэктомии в афакичных глазах с пролиферативной диабетической ретинопатией обычно сопровождается неоваскуля-ризационной глаукомой. Рубеоз сетчатки возникает как вторичное осложнение отслойки сетчатки в уже слепых глазах, в то же время отслойка увеличивает частоту рубеоза радужки как осложнения хирургического вмешательства на стекловидном теле.
Патологию сосудов радужки мы наблюдали в 42% случаев после витрэктомии по поводу осложнений пролиферативной диабетической ретинопатии. Однако высокая частота патологии сосудов включает в себя случаи возможной гиперемии радужки и неоваскуляризации, связанной с отслойкой сетчатки. Слепота, вызванная непосредственно неоваскулярной глаукомой, вероятно, наблюдается в 10% случаев после операции на стекловидном теле.
Па частоту развития рубеоза радужки после операции, по-вп-димому, также влияет тот факт, был ли удален хрусталик или пет. Рубеоз полипквот в 2 рала чаще в пфакичпых глазах, чем в глазах с хрусталиком. В результате большинство хирургов, проводящих оперативные вмешательства ив стекловидном теле в глазах с пролиферативной диабетической ретинопатией, предпочитают оставлять прозрачный хрусталик интактным, чтобы уменьшить вероятность развития в дальнейшем рубеоза радужки.
Эндофтальмит — редкое (0,2% случаев), но тяжелое осложнение, возникающее после витрэктомии. Обычно наличие инфекции очевидно на 1—2-й день после операции, наиболее важные симптомы — сильные боли в глазу и значительное снижение остроты зрения. Возможны отек века и хемоз, хотя они могут наблюдаться и при отсутствии инфекции. Важнейший признак, свидетельствующий о возможности развития эндофтальмита, — это гипопион. В случаях, подозрительных на эндофтальмит, производят немедленный парацентез с целью получить внутриглазную жидкость для микроскопического исследования и посева на культуру. Парацентез производят через плоскую часть ресничного тела в главах с хрусталиком и через лимб при афакии. После этого 0,4 мг гентамицина медленно вводят в переднюю часть стекловидной по-
24* 37Ь
лости. Проводят курс лечения антибиотиками широкого спектра действия, которые вводят внутривенно. После получения результатов посевов на культуру и определения чувствительности флоры первоначально применявшиеся антибиотики могут быть заменены. В большинстве случаев применяют также системную терапию стероидами, хотя у больных, страдающих диабетом, вместо этого можно применить повторное субконъюнктивальное введение водных растворов стероидов для снижения системных эффектов до минимума. В последние годы при эндофтальмите рекомендуют субтотальную закрытую витрэктомию [Южаков А. М. и др., 1981; Ло-гай И. М. и др., 1985, и др.].
Таким образом, послеоперационные осложнения широко варьируют по частоте и тяжести от обычного небольшого транзиторного отека роговицы до редкого, но тяжелого осложнения — симпатической офтальмии. Серьезные осложнения с вовлечением в процесс роговицы в настоящее время встречаются редко, и частоту их мож но свести до минимума или совсем избежать этих осложнений, предупреждая интраоперационную абразию эпителия роговицы и как можно меньше травмируя роговичный эпителий. Предотвращение прямой механической травмы хрусталика, использование небольших объемов изотонического раствора хлорида натрия для промывания и сокращения до минимума турбулентности потока обеспечивают минимальное повреждение эндотелия. Послеоперационное помутнение хрусталика развивается в менее чем 20% случаев, а прозрачный хрусталик по возможности всегда оставляют, для того чтобы сохранить более физиологичную оптическую .систему и снизить риск развития рубеоза радужки.
В заключение можно отметить, что частота ятрогенных и других операционных осложнений может быть снижена за счет тщательного планирования операции и ее правильного проведения, хотя сама суть операций не позволяет избежать осложнений. При выполнении опасных манипуляций необходимо оценить ожидаемый анатомический и визуальный эффект. Если осложнения возникают во время операции, то они должны быть быстро распознаны и устранены. Послеоперационные осложнения являются следствием повреждений во время операции, влияния существовавших до операции заболеваний пли травм, а также того, что не были выполнены анатомические задачи операции. Другие осложнения, такие, как неоваскуляризация радужки, могут развиться, несмотря на успешную операцию. Быстрая диагностика осложнений и лечение лекарственными препаратами или путем проведения дополнительных операций, а при необходимости применение лазера часто позволяют спасти глаз, несмотря на эти осложнения.
Дальнейшее изучение механизмов развития осложнения после витрэктомии позволит улучшить превентивные и терапевтические зиеры.
Глава 8
Операции при заболеваниях сетчатки'
Операции при отслойке сетчатки
и предотслоечных состояниях
Тракционные натяжения, формирующие складки сетчатки и угрожающие появлением в ней разрыва (отрыва), дистрофические фокусы в сетчатке, постепенно истончающиеся до дефекта ткани, и, наконец, уже образовавшаяся отслойка сетчатки ретракционного или дистрофического типа подлежат хирургическому лечению. При состояниях, угрожающих появлением отслойки сетчатки, операции имеют характер профилактических.
В диагностике отслоек сетчатки, особенно плоских, и при определении прогноза послеоперационного состояния целесообразно использовать методы энтоптических феноменов: механофос-феп, фотофосфен, аутоофтальмоскопию [Пивоваров Н. Н., 1974]. Выбор оптимального метода хирургического вмешательства в каждом конкретном случае следует осуществлять, учитывая многие моменты.
В последние десятилетия все больше в лечении отслоек сетчатки находят микрохирургические методы [Алексеев В. II., 1974, и др.]. По нашему мнении», многообразные тины предотслоечных «•остоштп к отслоек сетчатки дистрофического п ретракционного генеза целесообразно обьедппить в три группы (табл. 10).
Методы хирургического лечения предотслоечных состояний и отслоек сетчатки с ее полным самопроизвольным прилеганием
В эту группу включены состояния, при которых имеется подозрение на разрыв сетчатки, налицо изменения сетчатки, угрожающие формированпем разрыва, или он уже возник, но отслойка еще не сформировалась, а также свежая отслойка сетчатки, когда в результате соблюдения пробного постельного режима в течение 2—3 дней и применения бинокулярной повязки происходит прилегание отслоенной сетчатки по всей площади или хотя бы в области разрыва.
Коагуляция сетчатки и сосудистой оболочки через склеру без ее перфорации. Не нарушая постельного режима, больного на ка-
1 Рисунки к главе выполнены офтальмологом Б. В. Плужниченко.
373
Клинико-хирургическая характеристика (классификация) отслоек и предотслоечных состояниях в зависимости от особенностей течения
Группа Особенности отслойки сетчатки
основная характеристика дополнительные признаки
I Отслойка полностью мобильная, а также все предотслоеч-ные состояния Отверстия, разрывы в зоне, легко до ступной для хирурга. Предразрыв, участки решетчатой ди строфии, «след улитки», витреоретл нальные сращения, «пигментные группы» при наличии фотопсий п интенсивных явлений летающих му шек. Разрыв (разрывы) в области задне го отдела глаза; предразрыв в маку лярной зоне, если на втором глазу уже имеются разрыв в желтом пятне и отслойка сетчатки
II Отслойка частично мобильная, но сетчатка еще сохраняет прозрачность и эластичность Одиночные разрывы (расположенные на близком расстоянии) без признаков выраженной жесткой вит-реоретинальной фиксации и фиброза. Отслойка обычно захватывает не более одного — двух квадрантов, удовлетворительно расправляется
Одиночные и множественные разрывы, отрывы с заворотом и отстоя-пием края сетчатки до 6—7 мм. Отслойка обычно захватывает около двух квадрантов, часто субтотальная и тотальная с умеренной тяжисто-стью в стекловидном теле, плохо расправляется при соблюдении постельного режима. Разрывы в макулярной зоне
III Ригидная отслойка сетчатки, обычно уже безуспешно оперированная, отслойка после прободных ранений. В сетчатке имеются выраженные признаки дистрофии, сморщивания (помутнения, рубцы, грубые складки). Отслойка со значительными фиброзными изменениями: преретинальны-ми, интраретинальными, субретинальными или панретинальными Одиночные шварты с одиночными «сухими» складками сетчатки, обычно после контузий с гемофтальмом, ‘ воспалительных заболеваний, ранений и т. д. Шварта формируется по ходу раневого канала, в зонах рико-шетирования, удаления инородных тел. Разрывов сетчатки нет Шварты, множественные складки, отслойка сетчатки (часто разрыв не удается найти), отрывы, маскируемые рубцами
374
Таблица 10
Iчитки и схема выбора оперативных приемов при них рлсвания
Принципы лечения
общие для группы варианты предпочтительных приемов
Неперфорирующая коагуляция после соблюдения постельного режима в течение 2—3 дней Криокоагуляция, диатермокоагуляция, (электрокоагуляция), ультразвуковая коагуляция, фотокоагуляция, лазерная коагуляция
Фотокоагуляция, лазерная коагуляция
Бездренажное временное или постоянное пломбирование, ретинопексия наиболее щадящим методом Экстрасклеральное баллонирование, временное подлавливание (или пломбирование), шовная фиксация глазного яблока за наружные мышцы в сочетании с диатермо-, электро- и фотокоагуляцией, криопексией, лазерной или ультразвуковой коагуляцией Преимущественно экстрасклеральное или иптрасклеральное пломбирование с рациональной ориентацией пломбы (меридионально, экваториально, косые позиции), циркляж (круговое пломбирование) с акцептированием в избранных секторах, различные способы ретино-иоксии Задпоо пломбирование, крио- и диатермокоагуляция, по показаниям лазерная коагуляция и фотокоагуляция
Витреотомия; витрэктомия; приемы витреоретинальной хирургии; рети-нотомия и ретинэктомия для мобилизации краев отрывов-разрывов сетчатки, для освобождения сетчатки из рубцов, для доступа к субретинальным тяжам; введение жидкостей и газов в стекловидное тело; дренирование субретинальной жидкости; все виды экстрасклерального пломбирования (в том числе кругового) с учетом рельефа и объема отслойки (таким образом выполняется принцип сближения ободочек наружным поддавливанием и расправлением сетчатки изнутри).
Витреошвартотомия, витрэктомия, иногда экстрасклеральное пломбирование (для ослабления натяжения рубцовых структур в стекловидном теле и сетчатке)
Витреошвартэктомиж циркляж, пломбирование (особенно при отрывах), в том числе с погружением пломб больших объемов, дренирование субретинальной жидкости, введение газов, ретинопексия
375
Группа Особенности отслойки сетчатки
основная характеристика | дополнительные признаки
Гигантский отрыв-разрыв с заворотом и отстоянием края сетчатки более чем на 6—7 мм, с умеренными фиброзными изменениями в стекловидном теле Гигантский отрыв-разрыв с заворотом сетчатки вплоть до полного смещения ее в противоположную сторону («сложившаяся сетчатка»), выраженные фиброзные изменения в стекловидном теле Отслойка сетчатки (обычно оперированная) с грубыми фиброзными изменениями в стекловидном теле, звездчатыми рубцами, полнослойными фиксированными складками: в 1 квадранте; в 2—4 квадрантах («широкая воронка» отслойки) в 4 квадрантах, «узкая воронка» отслойки (виден диск зрительного нерва) в 4 квадрантах, «закрытая воронка» (диск зрительного нерва закрыт складками сетчатки)
талке доставляют в операционную. Способ ретинопексии выбирают в зависимости от локализации разрывов и отслойки и имеющегося в офтальмологическом учреждении оснащения. Особенно важно блокировать сам разрыв [Gonin J., 1921].
Если зона, где планируется произвести вмешательство, располагается не слишком далеко от лимба (на расстоянии 14—17 мм), то сетчатку и сосудистую оболочку чаще коагулируют со стороны склеры, приставляя к ней диатермический электрод, криоаппликатор и т. д. Современные устройства, применяемые с этой целью, представлены на рис. 194. Если же приходится воздействовать на более удаленные от лимба участки сетчатки, то предпочтение (при условии хорошей прозрачности сред глаза) нужно отдать световой
376
Продолжение
Принципы лечения
общие для группы варианты предпочтительных приемов
Все виды ретинопексии (по показаниям), в том числе ретиненклейзис и попытки проведения ретинального шва Косой акцентированный в секторе отрыва циркляж, иногда с дополнительным пломбированием, дренаж с целью ущемления (фиксации) оторванного края Введение газа, в том числе в положении больного лицом вниз, «ущемление сетчатки на пузыре газа» Те же приемы, кроме того, разглаживание сетчатки латексовым баллоном, витрэктомия (ленсвитрэкто-мия), ретинотомия, ретинэктомия, ретиненклейзис
Пломбирование, при необходимости коррекция циркляжа, как правило, дренаж субретинальпой жидкости, ретинопекспя Циркляж, пломбирование разрывов, дренаж субретинальной жидкости, уменьшение объема глаза, укорочение его переднезадней оси погружением экваториально ориентированных пломб (под лептой) или круговым пломбированием То же с, возможной питреошнартэк-гомией, ре।ниоloMiieii, введением газа То же с возможным введением силикона и набухающих заменителей стекловидного тела
коагуляции через зрачок. Развитие лазерной техники в настоящее время позволяет производить коагуляцию не только центральных, но и периферических отделов глаза (с помощью призм и специальных линз).
Коагуляцию через склеру выполняют под капельной и инфильтрационной анестезией. Новокаин вводят ретробульбарно и по ходу тех прямых мышц глаза, которые придется потягивать. Обычно это мышцы, ограничивающие зону вмешательства или оказывающиеся в ее пределах. После расширения глазной щели веко-расширителем на них накладывают уздечные швы. Криопексию, а иногда (при наличии изогнутых наконечников) и низкочастотную ультразвуковую коагуляцию в доэкваториальной зоне можно осу-
377
"ТТ’
194. Устройства для коагуляции оболочек глаза со стороны склеры.
а — диатермокоагулятор с разными наконечниками; б — жидкоазотный криоаппликатор Волкова—Трояновского; в — жидкоазотный криоаппликатор Паштаева — Аксенова; г — криокарандаш Килера—Амоилса; д — ультразвуковой волновод.
ществлять без конъюнктивотомии, т. е. трансконъюпктивалыго. Для этого под офтальмоскопическим контролем производят поэтапное подлавливание оболочек глаза наконечником инструмента и в момент, когда вдавление блокирует зону краев разрыва сетчатки,, подают холод или включают ультразвуковой прибор. Формирование коагулята происходит под зрительным контролем через офтальмоскоп любой системы, предпочтительнее бинокулярный налобный (рис. 195), либо через микроскоп с использованием призмы (рис. 196) типа призмы Гольдмана, Франклина и т. д. Оптимальными являются криокоагуляты II и III степени, т. е. такие, которые возникают уже в начале промораживания сетчатки или спустя 3 с. Коагуляты I степени (побеление только собственно сосудистой оболочки без промораживания сетчатки) приводят к формированию слабой спайки.
В тех случаях, когда конструкция криоаппликатора не позволяет осуществить непосредственный офтальмоскопический контроль, например при использовании жидкоазотного (рис. 194, б, в) криоаппликатора, ретинопексию производят подлавливанием зоны проекции разрыва по определенному временному циклу. Экспозиция составляет 5—10 с в начале аппликационного цикла и 10—15 с в конце его, т. е. через 8—10 мин от начала работы с заряженным аппликатором. При ультразвуковой аппликации в режиме 24— 44 кГц и амплитуде 25—35 мкм достаточна экспозиция 3—5 с.
378
195. Ретинопексия под контролем бинокулярного офтальмоскопа и асферической линзы +20 или +30 дптр (схема).
196. Ретинопексия под контролем микроскопа и призмы (схема).
Пунктирная линия со стрелкой — направление луча света.
Для выполнения ретинопексия в более отдаленных, постэкваториальных зонах глазного яблока производят разрез конъюнктивы и влагалища глазного яблока (до склеры) обычно на расстоянии 5—9 мм от лимба концентрично ему в пределах обычно одного — трех квадрантов глазного яблока в зависимости от размеров планируемого вмешательства. С. L. Schepens и соавт. (1974, 1983) предлагают надсекать конъюнктиву и тенонову капсулу по лимбу, расширяя подход путем нанесения на них дополнительных горизонтальных насечек. В конце операции ушивают только эти насечки. Особую осторожность следует соблюдать при рассечении конъюнктивы над местами прикрепления прямых мышц, в том числе взятых на уздечные швы. Если разрез планируют произвести в тех меридианах, где проходят прямые мышцы, то их удобнее взять на фиксационные швы после конъюнктивотомии.
Роговицу защищают регулярными инстилляциями изотонического раствора хлорида натрия или покрывая ее, например, ватным диском, смоченным в этом растворе. Обнаженную склеру освобождают в нужных направлениях от покрывающих ее тканей. Бранши изогнутых остроконечных глазных ножниц при введении их в рану должны быть сомкнуты, кривизна брапш должна повторять кривизну глазного яблока. В глубине рапы их максимально размыкают. Затем бранши вновь смыкают и выводят. По соседству с прямыми мышцами, а при наличии рубцовых изменений в конъюнктиве и на других участках глазного яблока осторожно рассекают (теми же ножницами) ткани и рубцовые перетяжки, не позволяющие
379
197. Проецирование разрыва сетчатки на склеру с помощью склерометра (схема).
хирургу тупым путем подойти к не обходимому участку склеры. Уздеч ные швы-оттяжки на края раны конъюнктивы и влагалища глазного яблока можно не накладывать, так как они создают «тканевый колодец»; целесообразнее оттягивать мягкие ткани и открывать нужную зону склеры с помощью зеркала-лопатки.
Положение проекции разрыва сетчатки на склере уточняют следующим образом. Все уздечные швы освобождают от натяжения и придают глазному яблоку срединное положение в глазной щели. Остро заточенным химическим карандашом или концом тонкого зонда, погруженного в раствор бриллиантового зеленого, отмечают на лимбе точкой искомый меридиан; в случае необходимости предварительно обозначают лимбаль-ные концы вертикального и горизонтального меридианов. Циркулем или
лучше склерометром откладывают на склере требуемое расстояние от лимба (рис. 197). Чтобы точнее сохранить направление искомого меридиана, склерометр целесообразно ориентировать одним концом на центр роговицы, а другим — па лимбальную отметку и отмерять не сразу все требующееся расстояние. Вначале на склере намечают точку, удаленную от лимбальной всего на 5—6 мм, а затем, переместив склерометр, по уже имеющимся двум точкам определяют третью точку, например на расстоянии 10—12 мм от лимба, и т. д. Последнюю отметку (в проекции разрыва) в ряде случаев можно сделать диатермическим электродом. Это не только предохранит ее от смывания в ходе операции, но и позволит воспользоваться одним из приемов уточнения локализации разрыва.
Взаиморасположение разрыва и белесого коагулята, образующегося на глазном дне почти сразу после выполнения диатермокоагуляции, можно установить с помощью обычной обратной офтальмоскопии. С этой целью целесообразно применять налобное зеркало конструкции завода «Красногвардеец», так как при этом высвобождается одна рука офтальмохирурга. В случае необходимости вносят поправку, делают отметку на новом месте и офтальмоскопически проверяют его положение. Оптимальным является нанесение коагулята непосредственно под офтальмоскопическим контролем, используя с этой целью налобный бинокулярный офтальмоскоп (см. рис. 195).
Для более точного определения проекции разрыва сетчатки на склеру можно применить диафаноофтальмоскопию. При этом один
380
из хирургов проводит офтальмоскопию области разрыва, в то время как другой просвечивает склеру клювовидным наконечником' сильного трансиллюминатора примерно в месте проекции разрыва. По команде первого хирурга второй вносит коррективы в положение «клюва» на склере до тех пор, пока световое пятно на дне глаза не совпадает с разрывом. В специальном инструменте, сконструированном Arruga, предусмотрен крючочек, впивающийся в нужном месте в эписклеру, как только диафанофтальмоскопиче-ское уточнение проекции разрыва завершено.
Иногда удается воспользоваться еще одним весьма эффективным приемом, позволяющим уточнить локализацию разрыва. С помощью металлических или стеклянных лопаточек и тупых крючков ассистент оттягивает со склеры, обнаженной в месте проекции предполагаемого ретинального разрыва, все покрывающие склеру ткани. Глазное яблоко, насколько это возможно, смещают за мышечные уздечные швы кпереди. В затемненной операционной хирург офтальмоскопирует область разрыва. Световой «зайчик» от офтальмоскопа, наведенный хирургом точно на разрыв, ассистент должен уловить со стороны обнаженной склеры и отметить его положение. Проводить офтальмоскопическое просвечивание и одновременно наблюдать за свечением поверхности склеры можно лишь при не слишком далеко расположенных разрывах и не очень глубоком положении глазного яблока в глазнице.
Однако наиболее универсальным способом определения локализации разрыва является поддавливание наружных оболочек глаза, причем его осуществляют как инструментом, которым производят коагуляцию, так и пинцетом или другими приспособлениями, Захват эписклеры пинцетом не только облегчает поддавливание, но и позволяет легко вывести глазное яблоко в позицию, удобную для офтальмоскопии. При широком использовании этого приема уменьшается необходимость в ировсденнп точного предоперационного офтальмоскопического н неленгнропашш разрыва с помощью таблицы.
Уточнив локализацию разрыва сетчатки, можно приступать к его транссклеральной коагуляции. При этом независимо от источника воздействия хирург добивается создания не слишком грубого, но и не слишком нежного очага асептического воспаления, достаточного для возникновения спайки между сетчаткой и сосудистой оболочкой. Коагуляция через склеру эффективнее в тех местах, где удается воздействовать не только на сосудистую оболочку, но и на сетчатку, а это осуществимо при наличии контакта между ними (рис. 198). Как видно на рисунке, в случае отстояния сетчатки от сосудистой оболочки добиться контакта можно, вдавливая наконечник в склеру. При этом условии оболочки окажутся связанными единым воспалительным фокусом.
Сопоставление возможностей химической, ультразвуковой, холодовой и диатермической коагуляции показало, что последняя является особенно мощной. Однако именно при диатермокоагуляции наиболее высока опасность передозировки. Режим теплового
38 )
а б в
i98. Коагуляция сетчатки через склеру (схема).
а, в — правильно; б — неправильно.
воздействия многие офтальмохирурги выбирают эмпирически, используя для оценки возможностей незнакомого диатермического аппарата кусочек сырого мяса. В работе с диатермическим аппа-.ратом важна определенная последовательность действий. После включения аппарата в сеть он должен прогреваться в течение нескольких минут. Потенциометр ставят на первое деление шкалы. Проверяют необходимую силу давления на ножную педаль пли кнопку на рукоятке, чтобы ощутить на слух щелчок. Только после этого приставляют тонкий (активный) электрод к намеченной для коагуляции ткани, при этом широкий электрод укреплен на предплечье или голени больного. Очень осторожно прибавляя число делений на потенциометре при слабых и убавляя при слишком сильных коагулятах, выбирают режим теплового воздействия. Оптимальной является сила тока 60—80 мА. В клинической практике обычно ориентируются на вид возникающих на склере коагулятов; они не должны быть слишком темными, лучше, если они беловато-сероватые.
Конечно, имеет значение не только сила тока, но и экспозиция. При очень быстром снятии электрода коагуляты могут не проявиться, а при очень длительном прижигании они оказываются излишне сильными. Такая пережженная склера при повторных операциях буквально крошится под ножом, а в отдаленные сроки практически резорбируется и имеет вид тонкой соединительнотканной перепонки, расползающейся при попытке наложить на нее швы. Для того чтобы нанести оптимальные, без перфорации склеры, коагуляты, выбрав силу тока, необходимо на намеченном (предварительно обязательно подсушенном) участке установить диатермический электрод плотно на склеру, нажать педаль, через 1—2 с отпустить и снять электрод. Визуально оценив полученный коагулят, по соседству выбирают место для нового, который наносят аналогичным образом или вносят необходимые поправки в режим коагуляции.
Чаще всего используют электрод с площадью сечения на торце около 1 мм2. Более массивные наконечники прожигают слишком
Л82
100. Нанесение коагулятов на склеру при неперфорирующей (отбаррикади-рующей) диатермокоагуляции (схема).
й — при небольшом разрыве вблизи зубчатой линии; б — при небольшом разрыве клали от зубчатой линии; в — при большом разрыве или при наличии широкой зоны. Подозрительной на разрыв.
сильно и в глубину, и по площади, игольчатый же электрод при кратковременной экспозиции вызывает лишь поверхностную коагуляцию, поэтому его целесообразно использовать для коагуляции истонченной склеры, в частности в ходе операции. Удлиняя экспозицию до 6 - 10 с, можно проводить эффективную диатермокоагуляцию сетчатки игольчатым электродом также и через нормальную по толщине склеру, особенно при условии введения его на небольшую глубину. Представляют интерес электроды в виде очень тонкой иглы с ограничителем. Ограничитель не позволяет перфорировать глубокие слои склеры; вместе с тем благодаря сближению с сосудистой оболочкой при вкалывании в склеру эти электроды обеспечивают желаемый эффект коагуляции сетчатки при минимальной силе тока. Для периодического подсушивания коагулируемого поля удобны стерильные палочки («баннички») чуть потолще спички длиной 10—15 см с туго намотанной на одном конце сухой ватой.
Диаметр возникающих на склере коагулятов обычно немного больше, чем диаметр наконечника к электроду. Расстояние между коагулятами не должно превышать диаметр одиночного коагулята. Однако располагать коагуляты слишком близко (вплотную) один к другому нерационально: диатермическое воздействие на коагулируемые ткани оказывается чрезмерным.
Расположение коагулятов и их число варьируют в зависимости от особенностей отслойки и главным образом от местоположения и размеров разрыва. Разрывы, расположенные кпереди от экватора, окаймляют двойной дугой, концы которой как бы упираются в зубчатую линию (рис. 199, а). Более удаленные разрывы окружают двойным кольцом коагулятов (рис. 199,6). При множественных разрывах и в случае необходимости отграничить значительную площадь глазного дна, где подозревают существование необнаруженных разрывов, используют методику отграничения этой зоны
38Э
диатермокоагулятами по Линднеру — Одинцову (рис. 199, в). Для коагуляции тех участков склеры, которые прикрыты мышцами, и\ оттягивают тупоконечными крючками (для операции на мышцах) пли узкой лопаточкой. Следует иметь в виду опасность контакта наконечника для термокоагулятора с металлическими инструментами: в результате этого расширится зона коагуляционного ожога. Во избежание подобных осложнений на боковых поверхностях наконечников необходимо создавать изолирующее покрытие для защиты тканей.
Химическую коагуляцию в настоящее время уже не применяют для лечения отслойки сетчатки, потому нет необходимости ее описывать. Все большее распространение получает криокоагуляция, пли криопексия по Крвавичу. Для проведения криопексии наиболее удобны аппараты с достаточно миниатюрным наконечником типа криокарандаша Килера — Амоилса (см. рис. 194,г). Один из вариантов прибора выпускается в ГДР (фирма «VEB»), в последние годы универсальная криоофтальмологическая установка УМ-14 создана в Харькове. Аппараты имеют педальное управление, позволяющее начинать охлаждение наконечника в момент поддавли-вания в зоне разрыва (блокируемого очага). Для того чтобы обеспечить более надежное функционирование аппаратов и предохранить их от поломок для охлаждения необходимо использовать баллоны с закисью азота, а не емкости с углекислотой, которая содержит много примесей, оказывающих вредное влияние на узлы аппаратов. Созданы и более простые приборы: КГ-65-20, работающий на снеге угольной кислоты, КГ-195 — на жидком азоте и другие аппликаторы, охлаждаемые в жидком азоте (рис. 194, в). Однако при использовании этих приборов, как правило, нельзя осуществлять офтальмоскопический контроль в момент криопексии. Для криопексии могут быть применены также обычные криоэкстракторы.
Охлажденный наконечник диаметром 2—3 мм прикладывают к подсушенной склере на 10 с при пользовании азотом и на 20 с в случае применения СОг, затем наконечник с усилием отрывают, отдавливая стеклянной палочкой пряморозившуюся склеру (примерзают слабо охлажденные наконечники, работающие па СОг), и устанавливают на новом месте.
В силу того что от криовоздействия склера и сосудистая оболочка страдают не так сильно, как от диатермического воздействия, криокоагуляты можно наносить вплотную один к другому. Поскольку при криопексии коагуляты выражены слабо, важно уже в ходе операции проследить с помощью офтальмоскопии за правильностью их расположения.
Силовые низкочастотные ультразвуковые установки еще не очень широко применяют для ретинопексии. Выше изложены основные приемы ультразвуковой коагуляции. В ходе выполнения процедуры следует избегать чрезмерного вдавления, чтобы не допустить перфорации склеры. При использовании изогнутого волновода можно офтальмоскопически контролировать ход коагуляции.
384
Правильное проведение манипуляции гарантирует от повреждения ослабления склеры.
В связи с развитием методов фотокоагуляции и лазерной тех-Вики значительно сужены показания к применению описанных выше приемов ретинопексии. Однако пока их используют достаточно широко и они по-прежнему являются важным элементом других противоотслоечных операций.
Световая коагуляция сетчатки и сосудистой оболочки через врачок. Первоначально воздействие светом, фокусируемым через врачок на дне глаза, было методом выбора только при коагуляции разрывов, расположенных в области заднего полюса глаза, желтом пятне и постэкваториальных отделах. Однако затем использование призм, совершенных лазерных установок и приемов подлавливания позволило расширить применение лазерной коагуляции для воздействия практически на все отделы глазного дна [Линник Л. А., 1969; Корнеев В. П., 1973; Ганиченко И. Н., Романова Н. А., 1977]. Вначале были использованы мощные ксеноновые лампы (в так называемых фотокоагуляторах), а затем — лазеры, в том числе рубиновой (в приборах ОК-1 и ОК-2), неодимовый, аргоновый (импортные типа «Coherent Radiation-900» и др. и отечественные из комплекса «Лиман» [Ганиченко И. Н., Линник Л. А., 1978; Линник Л. А. и др., 1986].
Важными условиями успешного проведения коагуляции являются хорошая видимость области разрыва при офтальмоскопии, отсутствие на местах, предназначенных для коагуляции, субретинальной жидкости и, наконец, достаточно выраженная пигментация глазного дна. Перед вмешательством больному максимально расширяют зрачок и часто производят ретробульбарную инъекцию новокаина, поскольку ожог радужки мощным световым пучком весьма болезнен. Специальным вокорасширителем с бортиками из пластмассы расширяют глазную щель. Бортики удерживают пад роговицей слой изотонического раствора хлорида натрия, который время от времени подливают на глазное яблоко из шприца для охлаждения засвечиваемых тканей, которые в момент «фотовыст-релов» сильно прогреваются. Для коррекции высокой аметропии подбирают плавающую контактную линзу. С помощью офтальмоскопической системы фотокоагулятора или лазера в затемненном помещении офтальмохирург отыскивает на глазном дне больного область разрыва и после необходимой центровки ее в поле зрения офтальмоскопа (возможно, и с помощью луча наводки) нажимает кнопку. Яркий пучок света на очень короткий срок фокусируют в избранной точке (длительность импульса в фотокоагуляторе составляет 1—1 ‘/г с, а при лазерном воздействии — всего 0,001 с). Вслед за световым «выстрелом» на глазном дне можно увидеть округлый белый с легкой голубизной фокус — коагулят. При лечении отслойки сетчатки оптимальной для рубинового лазера является энергия 0,04—0,12 Дж, для неодимового — 0,09—0,4 Дж. Применение более высокой энергии может послужить причиной кровоизлияний в сетчатку и даже в стекловидное тело, а при пере-
25 Руководство по глазной хирургии
385
200. Нанесение коагулятов на дно глаза с помощью фотолазеркоагуляции.
а — при разрыве сетчатки в области заднего полюса глаза: б — в области экватора или на периферии глазного дна; черные точки — диатермокоагуляты, белые — фотокоагуляты.
дозировке импульсного лазерного излучения не исключается, кроме того, механический (взрывной) эффект.
При фотокоагуляции по Мейеру — Швикерату, если удается хорошо расширить зрачок, ирис-диафрагму раскрывают до нулевой отметки. Режим выбирают индивидуально, начиная с минимальных энергий (режим 1, «зеленый» диапазон). Если при этом коагуляты не появляются, то переходят на режим 2 и 3 того же диапазона. Оптимальная величина коагулята (D~l мм) для центральных отделов глазного дна достигается при диафрагме поля изображения 1,5—3°, для периферических — до 4,5°.
Удобным является лазер непрерывного действия, работающий на аргоне. При мощности излучения 400 мВт длительность импульса составляет 0,1—0,2 с. По мере удаления участка воздействия от центральной зоны размер светового пятна на глазном дне варьирует от 50 до 500 мкм. Недостатком аргоновой лазеркоагуля-ции является то, что значительная доля энергии поглощается в самой сетчатке, не достигая сосудистой оболочки. Создается опасность уменьшения площади сетчатки и рецидивирования отслойки.
Рекомендуемые схемы расположения фотокоагулятов на глазном дне представлены на рис. 200. Они варьируют в зависимости от особенностей отслойки сетчатки и прежде всего от локализации разрывов и предразрывов. Макулярные разрывы окаймляют полудугой с височной стороны, оберегая папилломакулярный пучок, идущий со стороны носа [Линник Л. А., 1966]. Если же фотокоа-386
руллты нужно расположить как можно периферийнее, то рекомендуется поджимать склеру коагулируемой области миниатюрной методической лопаточкой, стеклянной палочкой или тупым крючком И Центру глаза и тем самым как бы выводить сетчатку и сосуди-втую оболочку под луч прибора.
При множественных разрывах и обширной дегенерации сетчатки (как в центре, так и на периферии глазного дна) отбаррикади-рующую коагуляцию целесообразно выполнять в несколько этапов (с интервалом между прижиганиями в разных квадрантах 2—3 дня). Кроме того, световую коагуляцию нередко требуется сочетать с диатермо (крио) коагуляцией или обычными хирургическими вмешательствами. В этом случае, помимо нанесения в шахматном порядке в два ряда изолированных коагулятов, полезна и так называемая линейная коагуляция. Линия возникает, если во время сеанса слегка смещают луч («туширование» тканей по Зиангировой); очень мелкие разрывы обычно не окружают, а «накрывают» коагулятом.
Следует заметить, что схемы расположения патологических изменений на дне глаза, составляемые в предоперационном периоде, как и схемы планируемых вмешательств, могут оказаться весьма полезными в ходе операции, поэтому целесообразно иметь их под рукой.
Методы хирургического лечения отслойки сетчатки с частичным самопроизвольным прилеганием
В эту группу включены отслойки различной давности, главным образом сравнительно свежие (до 3 мес), однако в отличие от отслоек первой группы они после пробного постельного режима с бинокулярной повязкой уплощаются и уменьшаются по площади лишь отчасти и полностью не исчезают. Чтобы убедиться в этом, вполне достаточно 3-днонпой пробы.
Плохая мобильность нестарой еще отслойки может быть обусловлена низкой способностью к всасыванию субретинальной жидкости, попаданием под отслоенную сетчатку форменных элементов стекловидного тела, наконец, тяжистостью стекловидного тола и наличием в нем шварт, удерживающих сетчатку в отслоенном состоянии.
При отслойках сетчатки рассматриваемой категории диапазон хирургических вмешательств очень широк и зависит как от давности отслойки и степени ее расправимости, так и от локализации места дефекта (отверстия, разрыва, отрыва) и точек приложения тракционных сил. Ведущая роль ротаторных движений глаз в прогрессировании отслойки, быстрое всасывание субретинальной жидкости при блокировании разрыва, успех методик без-дренажной хирургии отслойки сетчатки, наконец, отмеченное в большинстве случаев постепенное ослабление пломбажного вдав-ления создали предпосылки для развития методик щадящего манипулирования. Исходя из изложенного выше, для устранения
25*
387
отслоек данной группы рекомендованы следующие хирургические вмешательства.
Метод местной иммобилизации глазного яблока. При отслойках с незначительными тракционными воздействиями со стороны стекловидного тела, невысоком отстоянии разрыва и отсутствии явных фиброзных изменений Р. Algvere и В. Rosengren (1979) рекомендуют хирургически исключить ротаторные движения глаза, содействующие поступлению жидкости под сетчатку. Иммобилизацию создают наложением швов на нижнюю и внутреннюю прямые мышцы глаза, потягиванием за эти лигатуры поворачивают глазное яблоко в лобно-височном направлении и фиксируют его в этом положении. Другой глаз свободен от повязки или иммобилизован с помощью вертикальной стенопеической щели. Необходимость в соблюдении постельного режима отпадает. Через 1—2 сут после всасывания субретинальной жидкости в зоне разрыва производят крио-, лазер- или фотокоагуляцию.
Метод временного локального вдавления склеры. Усиления эффекта блокирования разрыва достигают иммобилизацией с экс-трасклеральным вдавлением наружными подпружиненными клипсами [Пивоваров Н. Н., Лихникевич Е. Н., 1982], шарнирно присоедиеннными к опорному кольцу (диадеме), которое надевают на голову и фиксируют. После прилегания разрыва применяют один из методов ретинопексии.
Идея производить вдавливание методом введения временных, извлекаемых за шов пломб [Лупан Д. С., 1981], наложением клипс и поддавливающих каркасов в настоящее время реализовалась в предложении об экстрасклеральпом баллопировании зон разрывов при отслойке сетчатки. Этот метод в настоящее время находит все большее распространение при лечении отслоек, не осложненных грубой ретракцией со стороны стекловидного тела. Метод может быть использован не только для лечения небольших отслоек сетчатки, но и для коррекции некоторых послеоперационных состояний, например обнаружения и закрытия дополнительного разрыва.
Технически операция простая, и почти в 7з случаев ее можно выполнять амбулаторно. Осуществляют ретробульбарную анестезию. Фиксационные швы обычно проводят через сухожилия двух прямых мышц: расположенной ближе к зоне введения баллона и противолежащей. Небольшое количество новокаина желательно инъецировать вдоль мышцы и под конъюнктиву, туда, где предполагается ввести баллон.
Пинцетным поддавливанием через конъюнктиву офтальмоскопически уточняют меридиан расположения разрыва (разрывов), а затем производят трансконъюнктивальную криопексию. На расстоянии 2—4 мм от лимба делают насечку конъюнктивы и подлежащих тканей до склеры длиной 2—3 мм. Слегка изогнутым шпателем в направлении разрыва делают тоннель (шпатель скользит по склере). Затем анатомическим пинцетом (если баллон расположен на конце катетера) вводят на тефлоновой или полиэтиле-
388
a
201. Баллонирование зоны разрыва и отслойки сетчатки (схема).
* — модель баллона Волкова—Трояновского; б — модель баллона Крейсига — Лин-иофа; в — введение баллона пинцетом или без него; г — вариант расположения баллона.
вовой трубке баллон в спавшемся состоянии (рис. 201). Если баллон имеет «классическую» конструкцию (см. рис. 201, б) и располагается на расстоянии 2—3 мм от кончика катетера, то его проводят без пинцета за счет упругости трубки. Глазное яблоко пинцетом или фиксационным швом (противолежащим зоне введения баллона) устанавливают в прямой позиции или с легким поворотом в сторону баллонирования. Это создает в момент заполнения баллона изотопическим раствором хлорида натрия лучшие условия для фиксации его во влагалище глазного яблока между ним и стенками глазницы. Обычно достаточно введения 1,5— 2,5 мл изотонического раствора. Необходимо помнить о возможности развития острой офтальмогипертензии, сопровождающейся стойкой окклюзией центральной артерии сетчатки (появление «блэк-аут»-феномена), и падения зрения до 0. В том случае, если это состояние держится более 5 мин, необходимо безотлагательно произвести парацентез передней камеры (микропрокол узким осколком лезвия) или, ослабив фиксацию поршня шприца, уменьшить объем введенной в баллон жидкости и затем нагнетать ее медленнее.
Просвет катетера в зависимости от конструкции баллона закрывают пробкой-колпачком или завязывают на два—три узла, затягиваемых москитными зажимами. Катетер фиксируется к коже периорбиты в 2—3 точках липким пластырем. На конъюнктиву иногда накладывают один шов, обвязав его вокруг катетера, но можно обойтись вообще без шва. Субретинальная жидкость в области удачно поддавленного разрыва исчезает уже через сутки.
389
Этот момент благоприятен для выполнения дополнительной лазер- или фотокоагуляции краев разрыва. Обычно баллон извлекают после формирования пигментных спаек в зоне разрывов, т. е. через 7—9 дней.
Метод постоянного локального вдавления склеры. Жесткая фиксация не только основания клапана, но и центральных краев разрыва сетчатки, небольшая подвижность ее даже при ограни-
ченных по площади пузырях свидетельствуют о выраженности тракции со стороны стекловидного тела. Это служит основанием для применения постоянных пломб. Из описанных в литературе апробированных способов в настоящее время наиболее эффективным следует признать использование пористых и литых пломб, лент, шин, жгутов (на основе силикона, полиуретана и др.) с помощью усовершенствованной методики, разработанной Е. Custodis (1949—1956), и различных приемов кругового вдавления. Отечественной промышленностью выпускаются комплекты имплантатов эластических для склеропластических операций (ИЭСО). Исполь
зование эластичного материала для экстрасклерального вдавления существенно упростило технику вмешательств и расширило рамки бездренажной хирургии отслойки сетчатки, в результате чего при-
менение дренирования ограничилось специальными показаниями.
Расположение и ориентация пломбы на склерб зависят от характера и количества разрывов. Одиночные разрывы размером до 8 мм и разрывы, расположенные близко друг от друга, целесообразно блокировать меридионально ориентированными пломбами. Крепление пломбы осуществляют перекидными матрацными швами (супрамид, мерсилен, капрон, нейлоп 3:0, 4:0, 5:0). Меридиональное ориентирование пломбы позволяет блокировать и центральный, и периферический отделы разрыва. Таким путем
уменьшают силу тракций сетчатки со стороны стекловидного тела.
Большинство разрывов размером менее 3 мм удается закрыть пломбами, имеющими диаметр 4—5 мм. Расчет для проведения
стежка (его шаг, расстояние между вколами) можно сделать, ис-
ходя из размеров пломбы. Чтобы погрузить пломбу как минимум на половину ее диаметра, расстояние между вколами (стежками) должно быть равно половине окружности пломбы, т. е. jtR, или
D 2 ’
Например, при использовании пломбы диаметром 5 мм шаг
стежка составит 8 мм. Для блокирования разрывов размером 5 мм потребуются пломбы диаметром 7,5 мм, а расстояние между стежками должно равняться 10 мм. Еще более крупные разрывы (до 8 мм) блокируют двумя параллельно сложенными пломбами диаметром 7,5 мм каждая при расстоянии между стежками матрацного шва 14 мм.
Шов должен быть прочным. Существенное значение имеет техника проведения шва через склеру: его глубина не менее */2> а лучше 2/з ее толщины, длина стежка в склере 6 мм (рис. 202). Однако проведение такого шва в экваториальном и постэкваториальном отделах, а также в зонах, прикрытых сухожилиями и мас-
390
202. Экстрасклеральное пломбирование с меридиональной ориентацией пломбы (схема).
203. Скошенное «пунктирное» (небольшие стежки) проведение шва, погружающего пломбу (схема).
сивом мышц, представляет существенные затруднения. В связи с отим склеру следует прошивать серией небольших стежков, у которых выходное отверстие предыдущего шва практически совпадает с входным отверстием следующего, иногда они могут располагаться с небольшим перекрытием по длиннику или со смещением по меридиану (рис. 203). Если при этом в момент погружения пломбы лигатура плохо протягивается в стежках, то следует поэтапно подтянуть швы.
Для усиления эффекта вдавления можно наложить дополнительные швы, а при пломбе длиной более 8 мм это необходимо сделать. Ряд офтальмологов для усиления эффекта вдавления предпочитают в момент завязывания швов растягивать пломбу, фиксируй ее за концы инструментами. Дли лучшей фиксации пломбы швами (швом) на тыльной стороне пломбы следует сделать несколько ножных (неглубоких) поперечных пасечек лезвием бритвы или ножницами. При этом обычно прорезают только корковую (наружная) непористую часть оболочки.
При большом количестве (цепочка) маленьких разрывов на периферии глазного дна и гигантских разрывах-отрывах (90° и более по периметру) пломбу целесообразно ориентировать экваториально и поэтапно погружать ее матрацными швами. Расчет ширины стежка (расстояние между двумя параллельными вколами в склеру) основывается на знании диаметра пломбы и учете планируемой глубины погружения. Центр стежка располагается соответственно центральному краю разрыва и уточняется до проведения шва офтальмоскопически с пинцетным поддавлива-нием.
В ходе погружения пломбы можно растягивать ее вдоль длин-ника. Осуществляя погружение пломбы, целесообразно уже после первого шва (лучше завязанного «на бантик» — с петлей для распускания) офтальмоскопически уточнить положение разрыва сетчатки относительно формируемого вдавления. Гипертензию,
391
возникающую в ходе погружения пломбы, снимают, поэтапно выпуская влагу в зоне парацентеза передней камеры. Завершают операцию введением антибиотика в толщу пористой пломбы и ушиванием влагалища глазного яблока и конъюнктивы.
Метод кругового механического сдавления. Возможности без-дренажного лечения отслойки сетчатки значительно расширяются при использовании кругового вдавления склеры силиконовой резиновой лентой или губкой в сочетании с эписклеральным пломбированием. Лента проста в обращении, и степень укорочения ее легко изменить. При сильном укорочении лента не просто фиксирует лежащую под ней пломбу, но и значительно повышает эффект пломбирования. Это особенно важно в тех случаях, когда вона разрывов и фиброзных изменений сетчатки не имеет тенденции к расправлению над пломбой и находится в состоянии легкого натяжения. Круговое вдавление показано при отслойке сетчатки, захватывающей два квадранта и более, множественных разрывах, разбросанных в ней на большом протяжении, наличии больших и гигантских разрывов, значительной высоте пузыря отслоенной сетчатки.
Локализацию и проекцию разрывов на склеру уточняют на операционном столе с помощью офтальмоскопии и пинцетного (инструментального) вдавления. Ленту из силиконовой резины (ширина 2—2,5 или 4 мм, толщина 0,5—0,6 мм, длина 80— 90 мм) крепят матрацными швами (супрамидные, капроновые, нейлоновые, мерсиленовые 3 : 0—5 : 0) к склере соответственно планируемому виду циркляжа (строго экваториальный, «косой») после проведения ее под мышцами. Там, где это необходимо, лента должна пройти даже сквозь сухожилие косых мышц. Целесообразно, чтобы центральный (задний) край разрыва приходился на вершину или на периферический скат вала вдавления. Следует считать ошибкой стремление хирургов сместить вал вдавления гораздо центральнее разрывов, особенно если в их зоне действуют значительные тракционные силы. При этом не происходит ни существенного уменьшения тракции, ни поджатия зоны разрывов и, следовательно, сохраняется основа для неполного прилегания сетчатки или рецидива отслойки.
Средний периметр глазного яблока (при различных вариантах проведения ленты) обычно составляет 72—76 мм, в единичных случаях — 78—80 мм. Его легко измерить, если, выбрав «слабину» ленты, из общей длины ее вычесть сумму избыточных концов скрещенной ленты. Концы ленты один навстречу другому проводят через муфту (силиконовая трубка) либо на месте перекреста связывают силиконовой нитью или другими лигатурами (не прошивать!) (рис. 204). При потягивании за концы ленты в зоне фиксации ее можно укоротить.
Криопексию выполняют до или после подшивания ленты, но предпочтительнее до ее затягивания, поскольку при этом легче достигается плотный контакт наружных оболочек в момент компрессии и промораживания.
Ь92
204. Проведение концов ленты через муфту (капилляр с внутренним просветом 0,7 мм для ленты шириной 2—2,5 мм и 0,9 мм для ленты шириной 4 мм (схема).
а, б, в — с ассистентом; г — без ассистента, в последнем случае следует ваострить концы ленты для удобства захвата и протягивания.
Необходимости в равномерном циркляжном вдавлении по всему периметру глазного яблока, как правило, нет. Преимущественное (акцентированное) вдавление оболочек производят в зоне, где имеются высокий пузырь, грубая складчатость сетчатки, разрывы, в том числе жесткая фиксация краев разрыва тяжистым стекловидным телом, либо участок гигантского разрыва (ретинодиализ), или разрыва с частичным заворото*м сетчатки. Обычно в квадрантах, где не требуется значительное вдавление, ленту из силиконовой резины укладывают на склеру вообще без натяжения и прочло фиксируют туго затянутыми матрацными швами. В соседнем квадранте или в квадранте, где планируется наибольшее укорочение, лепту скрепляют муфтой. В этих зонах ленту фиксируют к склере потуго затянутыми матрацными швами, и в момент укорочения опа сравнительно легко скользит. Акцентированное вдавление можно создать также смещением ленты в зоне швов с помощью анатомических пинцетов. В отдаленные сроки преимущественное вдавление в избранной области, как правило, сохраняется.
Расчет укорочения ленты целесообразно проводить по уже известным методикам [Пивоваров Н. Н. и др., 1979; Волков В. В., Трояновский Р. Л., 1981; Hamilton А. М., Taylor W., 1972, и др.]. Исходя из планируемой высоты вала вдавления, равнозначной уменьшению радиуса (AR), рассчитывают необходимое укорочение ленты: АС = 2л’АВ = 6,28-АВ. Так, для создания равномерного вала вдавления высотой 2 мм необходимо укоротить ленту на 12,56 мм. Если же учесть растяжимость (деформацию) ленты под влиянием нормального офтальмотонуса, то укорочение ее следует произвести с некоторым запасом, например в приведенном примере на 15—16 мм. Не столь уж редко добиваются уменьшения
393
205. Укрепление меридионально ориентированных пломб и погружения их под лентой (схема).
а — схема операции; б — силиконовая пломба с бороздками; в — эписклеральная пломба, укрепленная швами.
радиуса глаза на 3 мм, для этого в ходе оперативного вмешательства требуется укоротить ленту примерно на 20 мм. При более значительном укорочении ленты (на 22—26 мм) существует опасность развития синдрома сдавления, который проявляется значительными послеоперационными циркляжными болями, признаками ишемии переднего отдела глазного яблока, а в дальнейшем может привести к пролежням склеры.
После применения приемов бездрепажпого оперативного вмешательства, сопровождающихся созданием значительной внутриглазной гипертензии, на операционном столе необходимо произвести проверку зрительных функций (наличие светоощущения, форменного зрения) путем показа пальцев и движения рукой или офтальмоскопию, чтобы не пропустить нарушения кровообращения в центральной артерии сетчатки. При обнаружении ее пульсации, сопровождающейся снижением или утратой зрительных функций, показано немедленное пунктирование передней камеры или расслабление ленты.
Круговое вдавление обычно позволяет закрыть множественные небольшие дефекты в сетчатке. Если этого недостаточно, наличие циркляжа облегчает выполнение дополнительного пломбирования. Под силиконовую ленту в меридианах разрывов пломбу помещают эписклерально с дополнительным креплением и погружением ее швами или без них. Для предотвращения выскальзывания пломбы на ней формируют бороздку, для размещения перекидных швов следует сделать насечки. Технически шов, погружающий (фиксирующий) пломбу в меридиональном направлении под циркляжной лентой, целесообразно выполнить в виде четырех экваториально проведенных стежков с перекидыванием нити под ленту или над ней (рис. 205). При значительной длине пломбы накладывают несколько таких швов, погружающих ее. Эквато-
394
206. Погружение экваториально ориентированной пломбы под циркляжной лентой — вариант практически полного погружения (схема).
риально ориентированную пломбу погружают П-образными швами, повторяющими направление швов при проведении ленты, но с большим расстоянием между стежками (достаточное для погружения пломбы). На экваториально ориентированной пломбе для предотвращения ее выскальзывания из-под ленты делают желобок (срезают корковую часть пломбы) сверху, кроме того, на стороне, обращенной к склере, можно снять «горбушку».
Обычно даже длинная пломба после наложения двух швов хорошо фиксируется под лентой и дальнейшее погружение ее становится технически несложным. Количество и частота швов зависят от размера (длина) пломбы и необходимой глубины ее погружения; обычно расстояние между швами равно 2—3 мм (рис. 206).
Имеющиеся в наборе силиконовых имплантатов шины с желобком, в том числе армированным, моделируются хуже, чем жгуты, более жесткие, и создают некоторую аппланацию в зоне пломбирования, как бы разгружая вдавление. В связи с этим в последние годы все более широко применяют пористый материал. Проведение кругового вданлепия с помощью пористых жгутов диаметром 3,5—6 мм включает приемы циркляжа и экваториального пломбирования. Используя технику фиксации жгута П-образными швами в косых меридианах, его сразу растягивают в квадрантах на 3—5 мм с преимущественным натяжением в зоне предполагаемого максимального вдавления.
Для того чтобы облегчить дозирование, целесообразно применять стандартные (постоянного размера) жгуты (62,5—70 мм). Поскольку нашей промышленностью выпускаются жгуты длиной 125 мм, для операции следует использовать половину его (62,5 мм) или фрагмент, точно соответствующий длине планируемой круговой пломбы (обычно не короче 54—56 мм). Завершив круговое проведение жгута длиной 62,5 мм с растяжением и фиксацией его во всех четырех квадрантах, концы жгута укорачивают на 2—4 мм каждый и скрепляют П-образными или узловыми швами конец в конец. Таким образом общая длина жгута оказывается равной 54—58 мм, что будет соответствовать уменьшению периметра глазного яблока на 20—25%. Более точно степень укорочения пломбы можно рассчитать, измерив поперечный диаметр и вычислив периметр глазного яблока. Сложную формулу
395
207. Вдавливание склеры отрезком рассеченного пористого жгута путем растягивания его по склере — «апп лавирующее» пломбирование (схема).
для определения глубины вала вдавления и степени растяжения силиконовой губки предложили В. Д. Захаров и А. О. Аксенов (1982).
В случае необходимости этот вид пломбирования дополняют меридиональной пломбой, укрепляемой П-образными швами. Эту пломбу технически удобнее наложить до фиксации жгута, проводимого вокруг глазного яблока.
В ряде случаев, особенно при затруднениях в проведении П-об-разных швов, целесообразно использовать для пломбирования, в том числе и кругового, технику ап-планирующего вдавления [Пиво-воваров Н. Н. и др., 1983] путем
подшивания к склере краев
продольно рассеченного губчатого жгута (рис. 207). Губка обращена к склере своей гладкой поверхностью и растягивается при наложении каждого шва на края полуцилиндра. В случае круго
вого вдавления такого полуцилиндра сначала подшивают передний или задний край, а затем соответственно — противоположный, растягивая жгут в поперечнике па 3—4 мм. Торцевые отделы полужгута фиксируют конец в конец. Операцию завершают введением антибиотиков в толщу пломбы.
В рассматриваемой группе отслоек сетчатки перечисленные приемы пломбирования, в том числе и кругового с использованием элементов акцентированного вдавления, позволяют блокировать разрывы и отрывы сетчатки любой локализации. Опыт пока-вывает, что даже отрывы с заворотом и отстоянием края сетчатки от сосудистой оболочки до 6—7 мм удается блокировать без дренирования субретинальной жидкости. Следует только иметь в
виду, что во всех случаях, когда можно ограничиться локальным вдавлением, не следует производить обширное — круговое.
Метод локального вдавления склеры в области заднего полюса глаза. Особого внимания заслуживает блокирование разрывов в макулярной области, сопровождающихся отслойкой сетчатки. В большинстве случаев эти операции производят под наркозом. Пломбирование заднего полюса выполняют интра- и эписклераль-но. Первый вариант целесообразно применять при достаточной толщине склеры, однако каких-либо преимуществ перед эписклеральным пломбированием он не имеет. При посттравматических разрывах без миопического растяжения (стафилома) склеры в заднем полюсе глаза экстрасклерально подойти к макулярной зоне относительно несложно, так как форма глазного яблока близка к шаровидной. Труднее осуществить операцию на эллипсовид-
396
*0М миопическом глазу с истонченным задним полюсом. В связи •о сложностью доступа велика опасность развития операционных ©Оложнений, прежде всего непланируемой перфорации склеры с •Ыпадением стекловидного тела, кровоизлияниями субретинально • сетчатку и стекловидное тело. Однако риск возникновения Осложнений существенно уменьшается при соблюдении щадящих Приемов манипулирования.
Можно рекомендовать следующую технику вмешательства. Делают разрез конъюнктивы длиной около 7з ее окружности на расстоянии 6—8 мм от наружной части лимба. Учитывая, что разрыв расположен в заднем полюсе, выше или ниже горизонтальной плоскости, разрез смещают к верхней или нижней прямым мышцам. Фиксационные швы накладывают на верхнюю (или иижнюю), наружную и внутреннюю (для выведения глаза с целью офтальмоскопического контроля) прямые мышцы. Лопатку для оттягивания конъюнктивы (лопатка Арруга или подобная ей, изготовленная из нейрохирургического шпателя) вводят в разрез ниже наружной прямой мышцы и с помощью пинцета и крючка С отверстием захватывают сухожилие нижней косой мышцы в непосредственной близости от склеры. Проводят фиксационный шов. Если этот прием трудно выполнить, то сухожилие мышцы захватывают в шов поэтапно в два приема.
Проекция макулярной зоны ориентировочно находится на расстоянии 1—2 мм кзади от более удаленного края сухожилия, однако в глазах с увеличенной переднезадней осью (стафилома) это расстояние может быть и больше, достигая 4—6 мм. Первый склеральный стежок делают в 4—5 мм височнее и выше (или ниже) предполагаемой макулярной зоны, в миопическом глазу он обычно оказывается у периферического края стафиломы. Следующий стежок (супрамид, мерсилеп, капрон, пейлон 4: 0—5 : 0) делают симметрично первому в том же экваториальном (широтном) поясе, по на 4 — 5 мм ниже (или выше) горизонтальной плоскости, проходящей через зону желтого пятна (разрыва). Следующую пару стежков проводят центральпее, они имеют обратное направление. Иногда из-за тонкости стафиломатозно измененной склеры не удается добиться того, чтобы стежки находились на одинаковом расстоянии от оси симметрии (горизонтальная плоскость), и тогда стежки накладываемых швов делают несколько шире.
Предпочтительнее прошивать склеру у края стафиломы. Таким образом получается четырехточечный П-образный шов, которым погружается пломба из пористой губки диаметром 4—5 мм и длиной 8—10 мм (рис. 208). Перед погружением пломбы обычно производят транссклеральную криопексию. Для лучшей фиксации пломбы на ее тыльной стороне в корковом слое делают насечки, а на склеральной части можно снять небольшую «горбушку». Иногда для коррекции вала и лучшей фиксации пломбы накладывают дополнительную пару двух- или четырехточечных стежков.
397
а
208. Фиксация пломбы над зоной макулярного разрыва (схема).
а — подшивание пломбы; б — вариант моделирования пломбы; 1 — верхняя прямая мышца, 2 — наружная прямая, 3 — нижняя косая, 4 — нижняя прямая.
Как правило, в ходе операции не требуется пересекать ни наружную, ни верхнюю или нижнюю прямую мышцу. Все операции по погружению пористых пломб завершают введением в них антибиотиков (га-рамицин и др.).
Эписклеральное пломбирование заднего полюса глаза мож но выполнить и другими способами, в том числе с проведением лент в сочетании с пломбами, в виде подшивания растянутых пломб, упругих накладных карманов и клипс. Обширная, иногда тотальная и высокая отслойка сетчатки является поводом для выполнения ре-тинопексии в зоне макулярного отверстия (в ряде случаев
фотокоагуляции с непосредственным поддавливанием) в сочетании с круговым вдавлением или другими склеропластическими операциями и дренированием субретинальной жидкости. Последняя процедура, так же как и витрэктомия с последующим введением газа и укладыванием больного на сутки лицом вниз при макулярных разрывах с выражеппой преретинальной ретракцией в области заднего полюса [Aaberg Т. М., 1977; Machemer R., Aaberg Т. М., 1979] являются хирургическими вмешательствами, характерными для третьей группы отслоек.
Методы хирургического лечения
ригидных отслоек сетчатки
В эту группу входят преимущественно несвежая отслойка сетчатки, по поводу которой часто уже производили какую-либо операцию, но без успеха. Вначале может наблюдаться прилегание, однако затем вновь вступают в действие тракционные силы и возникает рецидив еще до выписки из стационара либо спустя несколько недель или месяцев. При таких отслойках нет тенденции к самопроизвольному прилеганию, поэтому их называют ригидными.
В происхождении ригидных отслоек важнейшее значение имеют рубцовое укорочение, сморщивание ткани самой сетчатки, потеря ею эластичности. Как бы хорошо при этом ни расправляли отслоенную сетчатку, ее не хватит, чтобы выстлать сосудистую оболочку. Существует лишь один путь устранения отслойки такого типа: сблизить оболочки путем укорочения капсулы глазного-яблока, используя различные приемы вдавления, выпускание суб
398
ретинальной жидкости, рассечение и удаление рубцов, расположенных в стекловидном теле и преретинально, наконец, расправление и поджатие отслоенных оболочек изнутри (введение газа, Силикона и т. д.). С этой целью применяют множество оператив-ных приемов, некоторые из которых являются методами выбора также при лечении вариантов отслойки сетчатки из уже рассмотренной второй группы отслоек. Речь идет о склеропластических, преимущественно экстрасклеральных, вмешательствах, которые при лечении отслойки данного вида несколько усложняются и в большинстве случаев комбинируются с другими способами лечения.
Швартотомия в стекловидном теле. Причиной формирования складок сетчатки, иногда одиночных и «сухих», фактически без выраженной ее отслойки, однако прогрессирующих и приводящих к деформации поверхности сетчатки, являются рубцы в стекловидном теле, образовавшиеся после повреждений, воспалительных процессов, различных оперативных вмешательств и т. д. Рубцы спаяны с сетчаткой и практически располагаются на ее поверхности и в ней самой. В таких случаях трудно добиться улучшения или стабилизации процесса без пересечения, а лучше и удаления витреоретинальных шварт. Расположение шварт в стекловидном теле предварительно тщательно изучают с помощью щелевой лампы и эхографически.
Наблюдение за швартами в ходе операции осуществляют через микроскоп с коаксиальным освещением, а в случае расположения их в задних отделах глазного яблока используют рассеивающие роговичные операционные контактные линзы (—25 —35 дптр), которые помещают на роговицу. Обнаружить структуры стекловидного тела помогает применение интраокулярных осветителей на тонких наконечниках, свет к которым подводится по световолокопиым жгутам. Эти осветители могут иметь просвет для введения жидкости внутрь глаза с целью поддержать тургор. Зрачок пород операцией следует максимально расширить.
Подход к стекловидному телу осуществляют в проекции плоской части ресничного тела на расстоянии 4—5 мм от лимба. Для введения инструмента лучше использовать тот квадрант, в котором инструмент будет находиться под углом 90—180° к зоне, где будут проведены наиболее ответственные манипуляции. Обычно используют иглу-ножницы или ножницы для стекловидного тела, в том числе и канюлированные (для поддержания офтальмотонуса путем введения изотонического раствора хлорида натрия). Перед введением ножниц внутрь глаза, как правило, узким ножом Грефе, осколком лезвия или троакаром прокалывают не только склеру и ресничное тело (в плоской части), но и прилегающие базисные слои стекловидного тела. При несоблюдении этого условия в ходе введения инструмента могут произойти отрыв базиса стекловидного тела и повреждение сетчатки, в том числе отрыв, у зубчатой линии. В момент прокола инструмент должен быть ориентирован к центру глаза.
399
209.
Швартотомия в стекловидном теле (схема).
а — пересечение шварт в стекловидном теле; б — канюлированные ножницы.
Бывают, однако, случаи, когда
За уздечные швы, наложенные на прямые мышцы, а также с помощью пинцетов и введенных внутрь глаза инструментов (одного или двух), опирающихся на склеру, выводят глазное яблоко в такую позицию, при которой хирургу одновременно видны и зона шварт, и кончик подведенного к ним инструмента. Раскрыв бранши, обхватывают ими шварту (рис. 209), и, нажав на рычаг, смыкают бранши. Иногда шварта сразу пересекается и ее концы, подобно резине, резко сокращаясь, расходятся в разные стороны, процедуру приходится многократ
но повторять.
В тех случаях, когда шварта ускользает, захват и пересечение ее следует выполнять бимануально. Инструментом, находящимся в другой руке (канюля, игла, крючок, пинцет, наконечник витрео-тома или фрагментатора другого типа), удерживают шварту от смещения, подают ее к ножницам и затем серией насечек разрезают.
Разрушение шварты можно осуществить биполярным или однополярным диатермокаутером. Его предпочтительнее использовать в тех случаях, когда шварты васкуляризированы. Однако во время выполнения этих манипуляций выделяются пузырьки газа, которые в последующем затрудняют обзор зоны вмешательства, так как всплывают к задней капсуле хрусталика (или к роговице при афакии).
Разделение и отделение шварт, расположенных концентрично стенкам глаза (сетчатка) и эпиретинально (эпиретинальные мембраны) , как правило, — весьма рискованная процедура, и начинать ее следует в зоне, где пленчатая структура больше всего отстоит от сетчатки, фиксированную в этом месте и слегка оттягиваемую инструментом (пинцет, крючок) пленку отслаивают от поверхности сетчатки, осуществляя осторожные боковые тракции другим инструментом, а при прочной фиксации отсекают от по
400
верхности сетчатки. При наличии грубых и протяженных шварт целесообразно после рассечения, а частично и иссечения удалить их: грубые — пинцетом, нежные— канюлей, фрагменты, по структуре близкие к стекловидному телу, — витреотомом или фрагментатором другой конструкции.
Закрытая витрэктомия. Техника витрэктомии всегда значительно проще при афакии. При сохранении прозрачного хрусталика необходимо манипулировать осторожно, во избежание травмы задней капсулы хрусталика. В зависимости от избранной техники манипулирования делают одно—два, реже три отверстия в плоской части ресничного тела, причем для введения острых (например, иглы) инструментов сквозную просечку в склере можно не делать. При введении любого инструмента следует убедиться в том, что он не тянет за собой ресничное тело, а также плотные слои стекловидного тела (отрыв базиса! ретинодиализ!).
В последние годы все шире применяют технику манипулирования с помощью двух инструментов: в одной руке инструмент для отсасывания и отсечения, в другой система для подачи жидкости, освещения или отделения (фиксация, коагуляция, пересечение) тяжей, причем жидкость часто подают с помощью канюли, введенной через третий прокол и фиксированной к склере швом. Первым следует вводить инструмент, через который подают жидкость. Для отсечения и удаления фрагментов тканей лучше (безопаснее) использовать инструменты не ротационного, а поступательного действия, в которых нож перемещается в продольном направлении. Эти инструменты меньше дергают ткани и не натягивают их.
Изменение структуры лучше удалять, начиная с центральных отделов, постоянно контролируя положение кончиков инструментов, введенных в глаз, и постепенно продвигаясь по всем направлениям. Создание полости в центральных отделах оказывается полезным в случае угрозы ущемления оболочек и при необходимости освободить инструмент от тяжистых структур. Удалить вит-реальные ткапи без грубой тяжистости можно с помощью любого витреотома, а часто и ультразвукового фрагментатора, например УЗХ-Ф-04-0, разработанного Л. В. Коссовским с соавт. Ткани попадают в окошко для аспирации вследствие активного подсасывания их за счет создания вакуума порядка 0,05—0,1 атм или самотеком в результате активной подачи жидкости из системы подачи. Ультразвуковой фрагментатор УЗХ-Ф-04-0 наряду с дроблением осуществляет отсасывание содержимого. При наличии выраженных тяжистых и мембранозных структур используют дополнительный режущий инструмент (предпочтительнее ножницы), оснащенный системой для подачи раствора. Завершая витрэктомию, необходим» позаботиться о том, чтобы в момент выведения инструментов из глаза была создана умеренная гипотония с целью предотвратить ущемление оболочек. Затем отверстия-просечки очищают от стекловидного тела и герметизируют швами 7 :0—8:0. Для поддержания тургора вводят изотониче-
26 Руководство по главной хирургии
401
ский раствор хлорида натрия или газ, в частности стерильным воздухом.
Если витрэктомию осуществляют при высокой отслойке сетчатки, то целесообразно до введения инструментов внутрь глаза произвести дренирование субретинальной жидкости, а в ходе операции при наличии разрывов — так называемое внутреннее дренирование путем наружного поддавливания оболочек в зоне разрыва с отсасыванием жидкости из этой зоны через инструмент, находящийся внутри глаза.
При выполнении витрэктомии в условиях отслойки особенно важно соответствие диаметра инструмента и размеров склеральной просечки, так как существует угроза выпадения и ущемления оболочек в зонах склеральных надрезов.
Витрэктомия — очень важный этап хирургического лечения •отслоек с гигантскими отрывами-разрывами и заворотом сетчатки. Ее производят с целью мобилизации завернутого края, в том числе и путем нанесения небольших меридиональных насечек на фиброзно-измененный край сетчатки в ходе удаления пререти-яальных мембран.
Т. М. Aaberg (1977) считает возможным использовать заднюю витрэктомию при наличии разрыва сетчатки в макулярной области. По-видимому, это оправдано только при наличии грубых ретракционных изменений в заднем полюсе, а в случае их отсутствия предпочтительнее заднее, эписклеральное, пломбирование.
Витреошвартэктомия с широким доступом (по типу открытого неба). В настоящее время имеются весьма узкие показания к применению данного метода в связи со значительным прогрессом техники витреальных вмешательств на «закрытом» глазу доступом через небольшие разрезы в проекции плоской части ресничного тела. Показанием для витрэктомии с широким разрезом является выраженное швартообразование в стекловидном теле, сопровождающееся, как правило, тотальной отслойкой сетчатки на глазу с мутной роговицей, не позволяющей осуществить осмотр через зрачок. Иногда элементы витрэктомии могут быть выполнены в том случае, когда роговица прозрачная, но удаляют плотный хрусталик, который невозможно разрушить через малые разрезы. Целесообразно осуществить витреошвартэктомию и при удалении через зрачок крупного инородного тела, находящегося внутри глаза, в том числе на глазу с отслойкой сетчатки.
Наиболее оправдан доступ через лимбальный разрез (аналогичный катарактальному или несколько шире) или путем временного иссечения диска роговицы трепаном диаметром 6—8 мм. Для стабилизации формы переднего отдела глазного яблока и •обеспечения хорошего зияния разреза в лимбосклеральной зоне предварительно подшивают кольцо Флиринга, лучше в виде двойного кольца (рис. 210) или с «отростками» в межмышечные пространства (в косых меридианах).
После удаления хрусталика под контролем микроскопа с коаксиальным освещением производят три основные манипуляции.
402
210. Швартэктомия в стекловидном теле (витрэктомия) череа> зрачок (схема).
Во-первых, удаляют гелеобразную часть стекловидного тела. Это трудная задача. В этом случае целесообразно применить витрео-фаг. При его отсутствии гель стекловидного тела фиксируют пинцетом с идеально подогнанными концевыми частями бравшей, подсасывают широкой канюлей или накручивают на тупфер из поролона, либо ватный «пальчик» и, слегка натягивая, подсекают со всех сторон пружинными ножницами. Во-вторых, отсасывают жидкую часть стекловидного тела с помощью тупоконечной канюли, насаженной на шприц (лучше через резиновый или пластмассовый переходник). В-третьих, шварты осторожно отделяют от сетчатки широким шпателем; иногда хорошо помогает опреде
лить отношения между тканями разделение их струей жидкости. Подхватив и натянув шварту пинцетом, ее отсекают миниатюрными пружинными ножницами (например, конструкции Ванна-са), бранши которых смыкают путем мягкого сдавления рукоятки между большим и указательным пальцами.
Для остановки кровотечения из сосудов сетчатки полость вскрытого глаза орошают раствором аминокапроновой кислоты. Ни в коем случае нельзя форсированно отсасывать жидкое содержимое из глаза, так как это лишь усилит кровотечение. Потягиванием в разные стороны за кольцо Флиринга создают условия для ревизии всей внутренней поверхности глазного яблока.
Если операцию на «открытом» глазу производят при наличии высокой отслойки сетчатки, то для обеспечения доступа к глубоким отделам необходимо предварительно дренировать субретинальную жидкость, так как иначе высокие пузыри отслоенной ретины сразу вставятся в зрачковую зону и создавшаяся воронка не позволит выполнить манипуляции в области экватора и заднего полюса. Даже наличие разрыва в сетчатке (в периферических отделах и в зоне экватора) только частично облегчит эвакуацию жидкости и уплощение пузырей, которые будут маскировать задние отделы глаза. Обнаруженные в сетчатке разрывы пломбируют обычным экстрасклеральным способом (чаще сочетание пломбы и кругового вдавления), однако для уточнения локализации пломбы необходимо маркировать зону склеры там, где наружным пинцетным поддавливанием (с контролем через микроскоп на «открытом» глазу) удается блокировать разрыв, т. е. уточнить проекцию разрыва.
26*
403
211. Перфорация склеры и сосудистой оболочки на участке наибольшего выстояния отслоенной сетчатки (схема).
Ушивают рану в лимбе или подшивают иссеченный диск роговицы. Полость глаза заполняют газом, изотоническим раствором хлорида натрия, лурони-том, консервированным стекловидным телом или «сбалансированным» раствором. Снимают кольцо Флиринга. В конъюнктивальный мешок вводят 1% раствор сульфата атропина, под конъюнктиву или парабульбар-но — антибиотик и кортикостероиды. Накладывают бинокулярную повязку. Если в полость глаза были введены воздух или силиконовая жидкость, то в послеоперационном периоде
больной должен периодически ложиться лицом вниз.
Перфорация глазного яблока с целью выведения субретинальной жидкости. Если меридиан наиболее высокой отслойки (обычна снизу изнутри или снизу снаружи, т. е. на 5 или 7 часу) не совпадает с локализацией области разрыва или зоной, обнаженной в ходе операции на склере, то в секторе максимально выраженного пузыря производят дополнительную насечку конъюнктивы концентрично лимбу на расстоянии 7—8 мм от него. По направлению к экватору обнажают склеру и выбирают место для ее перфорации. Оно должно располагаться в стороне от крупных вортикозных вен, избежать встречи с которыми можно использовав диафаноскопию при просвечивании через зрачок. Вокруг намеченной для перфорации точки (чаще на расстоянии 12—14 мм от лимба) можно создать венчик из пяти—шести несквозных, но интенсивных диатермокоагулятов (рис. 211), которые наносят с целью анемизации сосудистой оболочки. Таким приемом зачастую удается предотвратить кровотечение внутрь глаза из повреждаемой сосудистой оболочки.
Перфорацию склеры производят линейным ножом Грефе или лезвием, создавая меридионально послойную насечку длиной 2— 3 мм. Целость сосудистой оболочки, обозначившейся темной тканью в глубине склеральной раны, нарушают прикосновением игольчатого диатермоэлектрода, кончика ножа или микрошпателя. При выполнении перфорирующих манипуляций в склере и сосудистой оболочке следует приподнимать склеру пинцетом (или гарпунчиком), чтобы избежать ее продавливания и травмы сетчатки. Субретинальной жидкости дают возможность беспрепятственно выходить, поэтому обычно никаких швов на эту рану не накладывают (дренажный ход может функционировать и после операции, что особенно важно при введении в стекловидное тело растворов или газов). Следует иметь в виду, что создавать для
404
выпускания субретинальной жидкости трепанационное отверстие рискованно, особенно в тех случаях, когда планируется какая-либо из склеропластических операций. Дело в том, что в момент сильного укорочения склеральной капсулы, сопровождающегося повышением внутриглазного давления, в трепанационное отверстие могут выпасть внутренние оболочки и содержимое глаза.
Если предполагается собрать субретинальную жидкость (для исследования и т. д.), то склеральную насечку следует производить не на всю глубину. Глубокие слои не прорезают, а прокалывают. Для этого ассистент фиксирует глазное яблоко за уз
212. Пункция субретинального пространства и эвакуация из него жидкости.
дечные швы в нужном положе-
нии, а хирург, пинцетом разгружая и фиксирую склеру, вводит в склеральную рану конец тонкой инъекционной иглы, насаженной на «туберкулиновый» шприц вместимостью 0,5—1 мл. Срез иглы устанавливают с той стороны, где расположены деления шприца (проходимость иглы, естественно, должна быть проверена до начала всех манипуляций с ней). Иглу и шприц располагают примерно под углом 45° к поверхности глазного яблока в области вмешательства. Легкими вращательными движениями то
в одном, то в другом направлении иглу проталкивают через глубокие слои склеры и через сосудистую оболочку в субретинальное пространство так, чтобы пе повредить сетчатку. Для этого срез иглы лишь слегка погружают в оболочки, а затем разворачивают по направлению к сетчатке, ориентируясь на деления шприца (рис. 212).
Забор жидкости производят легким потягиванием за поршень шприца. Если жидкость не появляется, а подсасывается воздух, то, значит, либо игла неплотно насажена на шприц, либо срез ее еще не достиг субретинального пространства. После устранения указанных недостатков техники обычно без труда удается отсосать 1—2 мл субретинальной жидкости, бесцветной при свежих и янтарно-желтой при старых отслойках сетчатки. Капнув на кончик пальцев, можно ощутить легкие клеющие свойства этой жидкости. В случае окрашивания ее в шприце кровью манипуляцию следует немедленно прекратить. Форсированное отсасывание жидкости может привести к кровотечению. Если во время забора жидкости игла случайно вышла из раны в склере, то не стоит пытаться вводить ее обратно во избежание повреждения прибли-
405
вившейся сетчатки. С помощью контрольной офтальмоскопии можно определить, много ли еще осталось субретинальной жид кости. Часто уже в проходящем свете заметно, как «порозовел» рефлекс на участке бывшей отслойки.
При сохранении высоких пузырей на отдалении возникает вопрос о проведении дополнительных разрезов или проколов ь соответствующих местах. Если же «серый» рефлекс и складча тость сохраняются в непосредственной близи от места перфора ции, то через него иногда удается вывести всю остаточную суб ретинальную жидкость легким массажем глазного яблока. В. Е. Шевелев и Ю. Д. Бабанина (1965) предостерегают от про калывания сразу всех оболочек глаза диатермоэлектродом, так как подобная коагуляция «вслепую» может быть причиной образова ния грубых звездчатых рубцов внутри глаза, сильно стягивающих внутренние оболочки к месту прожога и оказывающихся фактически причиной новых разрывов сетчатки (на отдалении) и внутри глазного фиброза.
Для достижения временного прилегания отслоенной сетчатки после выпускания из-под нее жидкости используют другие при емы лечения. При разрывах в макулярной и парамакулярной областях, если в процессе выпускания субретинальной жидкости не помутнели преломляющие среды, следует тут же приступить к фото- или лазеркоагуляции. Сближению сетчатки и сосудистой оболочки в момент коагуляции может способствовать поддавливание склеры инструментами в проекции разрыва (при офтальмоскопическом контроле).
В тех случаях, когда судя по размерам отслойки предполагается наличие большого количества субретиналыюй жидкости, нужно позаботиться о поэтапном ее выведении по мере восполнения объема глазного яблока, например вводимым газом (или другим имплантатом) или путем погружения пломбажных конструкций. Если в зоне разрывов не производили ретипопексию, то это необходимо сделать перед погружением пломб.
Дренаж субретинальной жидкости и пломбирование в объеме отслойки. При отслойках сетчатки с признаками выраженного фиброза стекловидного тела, звездчатыми рубцами, полнослойными фиксированными складками, особенно на протяжении более одного квадранта (два—четыре), целесообразно круговое вдавле-ние и пломбирование выполнять в сочетании с дренированием субретинального пространства. Как правило, имеющаяся в этих случаях жесткая фиксация стекловидным телом высоких складок отслоенной сетчатки в нижних отделах (разрывы чаще находятся в верхних отделах, там же отмечаются и признаки отслоения стекловидного тела) не позволяет надеяться на расправление сетчатки даже при успешном блокировании разрывов. Использовать затягивание ленты для «восполнения» всего выводимого объема субретинальной жидкости невозможно, так как это привело бы к чрезмерному укорочению ленты и развитию осложнений (пролежни, прорезывание конструкции внутрь глаза и т. д.)’.
406
Объем эвакуированной субретинальной жидкости восполняют Им вдавлением пломб (из жгутов), размещенных экваториально I «од лентой, в зонах наиболее высокой отслойки и соответственно I Наиболее выраженной витреоретинальной ретракции (например, к вмву), или проведением кругового пломбирования пористым жгу-। fOM (циркляж жгутом). Если при таком размещении пломб Г рлврывы не попадают в зону вдавления, то в зоне разрывов под I ленту обычно погружают меридионально ориентированные плом-I бы. Также и при использовании круговой пломбы из пористого j Жгута, если даже при скошенной позиции она оказывается пери-I феричнее разрыва, то под жгут помещают и дополнительно погружают швами меридионально ориентированную пломбу.
Несмотря на значительный объем дренированной жидкости, описанным погружением пломб удается восполнить его потерю. Погружение экваториально ориентированной пломбы осуществляют серией матрацных швов с расстоянием между стежками, позволяющим почти полностью погрузить вдавливаемую пломбу. При использовании, например, жгута диаметром 4 мм длина переднезадней оси может уменьшиться на 2 мм, объем полости глазного яблока — более чем на 2 мл. Осуществляя погружение пломбы, необходимо избегать повреждения и прямого ущемления вортикозных вен.
Уже в ходе выполнения операции часто удается достичь расправления не только «широкой», но и «узкой» воронки отслоенной сетчатки, а в ряде случаев даже «закрытой» воронки. Эта операция часто является единственно эффективной в борьбе с «молниеносно» развивающейся тотальной отслойкой сетчатки вследствие массивной витреоретинальной ретракции после, казалось бы, успешно выполненной первой операции по поводу отслойки сетчатки («злокачественное» течение отслойки сетчатки).
Методы пломбирования стекловидного тела жидкостями (кроме силиконовой) и газами. Доступ к полости стекловидного тола наименее травматичен, если проходить через плоскую часть ресничного тела. Для этого прокол или сквозной разрез оболочек делают либо в том же квадранте глазного яблока, в котором намечается основное вмешательство, либо в другом, т. е. через дополнительную насечку конъюнктивы. На расстоянии 4—6 мм от лимба обнажают участок склеры. По одному из косых меридианов 1 в склере почти на всю ее толщину, но не до перфорации, так как гипотония осложняет выполнение операции, делают меридиональную насечку длиной 1—1,5 мм, как это показано на рис. 213, а, и коагулируют дно склеральной раны с целью анемизации подлежащего ресничного тела. При отсутствии в этой эоне выраженных склеральных сосудистых стволов коагуляцию можно не производить. В том случае, если предполагается расширить разрез в ходе операции, на-
1 При выполнении перфорации в косых меридианах уменьшается опасность повреждения передних ресничных артерий.
407
213. Перфорация склеры и плоской части ресничного тела в месте введения в стекловидное тело жидкостей или воздуха (схема).
а — меридиональная насечка склеры (3,5—5 мм от лимба); б — игла шприца в центре глаза, введение воздуха (газа).
сечку следует делать концентрично лимбу на расстоянии 4—5 мм от него.
При использовании инструментов значительного диаметра (более 0,3 мм) или в том случае, если планируется введение жидких имплантатов, целесообразно наложить провизорный шов, можно край в край при условии, что края раны склеры оберегаются от ожога при коагуляции дна. В противном случае шов может прорезаться при затягивании, в результате чего нарушится герметизация в самый ответственный момент. Разгерметизация раны и выпадение стекловидного тела или пломбирующего материала, естественно, снижают эффект операции. Чтобы этого избежать, лучше не прорезать, а прокалывать глубокие слои склеры и ресничное тело (при этом размер раны никогда не превышает размер иглы). Удобно делать это той же иглой, через которую предполагается вводить в глаз пломбирующий материал.
В 5-граммовый шприц набирают одну из стерильных жидкостей: изотонический раствор хлорида натрия, цереброспинальную или субретинальную жидкость, 0,1—0,2% раствор луронита1, гиа-лон, консервированное стекловидное тело и т. д. При желании применить воздушную (газовую) пломбу в шприц насасывают воздух над кипящей в стерилизаторе водой или через стерильный ватный фильтр из баллонов с газом. Иглу плотно надевают на шприц. Склеру фиксируют пинцетом обычно за край насечки или в непосредственной близости от него. Вставив в насечку конец иглы, вращательными движениями шприца перфорируют оболоч-
1 Луронит готовят ex tempore за 40 мин до введения; содержимое флакона (0,01 г) растворяют в 5—6 мл воды.
408
ки глаза, оставшиеся нелрорезанными. Очень важно придать игле правильное направление: она должна двигаться к центру глазного яблока (рис. 213,6). Если направить ее слишком кпереди, то пострадает хрусталик, если пристеночно, то в опасности окажется отслоенная сетчатка. В связи с этим лучше выбирать для введения пломбы в стекловидное тело квадрант, свободный от отслойки, или на периферии которого имеется наиболее плоская отслойка.
До начала введения внутрь глаза пломбирующего материала положение копчика иглы в глазу обязательно контролируют в проходящем свете. Убедившись при наблюдении в проходящем свете с помощью бинокулярного офтальмоскопа, а лучше под микроскопом с коаксиальным освещением, что срез иглы свободен от обволакивающих тканей, продвигают иглу дальше, например, в ретровитреальное пространство (рис. 214, а) в тех случаях, когда преследуют цель препарировать ткани газом или другим имплантатом.
Пломбирующий материал начинают вводить, контролируя положение иглы и оболочек через микроскоп, в проходящем свете или офтальмоскопически. Если вводят газ, то пузырьки его видны через зрачок. Стеклянной палочкой контролируют внутриглазное давление. Достигнув желаемого тургора (T+i> даже Т+2), выжидают 1—2 мин. По мере того как глаз становится мягче, определяют потребность в дополнительном введении пломбирующего материала. Если истечение субретинальной жидкости через ранее сделанное отверстие прекратилось и внутриглазное давление стабилизировалось (T+i), то введение прекращают. Ассистент заготавливает узел на провизорном шве и затягивает его в тот момент, когда хирург извлекает из раны кончик иглы.
409
Завершают операцию неперфорирующей диатермо- или крип коагуляцией склеры в местах разрывов сетчатки. При этом на верняка коагулируется и сетчатка, придавленная газовой пломбой изнутри. Затем укорачивают ленту (доводят укорочение до рас четного и погружают экстрасклеральную пломбу (рис. 214,6).
Выведение жидкости из субретинального пространства и вне дение пломбирующего материала (газ) в стекловидное тело обыч но выполняют поочередно в два—три приема, особенно при заме щении больших объемов жидкости, если она сама не вытекаеч через склеральную просечку. Эти манипуляции можно объедп нить, но из-за трудностей доступа к зоне дренирования и опас ности повреждения внутриглазных структур это редко удается.
В настоящее время введение газа в полость стекловидного тела как самостоятельную операцию с целью разделения витреорети-нальных или межретинальных спаек, расправления и фиксации сетчатки не производят. Обычно материал, пломбирующий глаз изнутри, выполняет вспомогательную роль в ходе какой-либо другой основной операции или по ее завершении. Его вводят для иммобилизации сетчатки на период нанесения коагулятов и начальной фазы их формирования, для расправления сетчатки и целях дальнейшей ее фиксации вплоть до выполнения элементов ретиненклейзиса в различных вариантах. В этих случаях газ (или другой имплантат) вводят через просечку, подготовленную и использованную для выполнения вмешательства на стекловидном теле (витреотомия, витрэктомия), и лишь изредка через отдельный прокол.
В тех случаях, когда были удалены стекловидное тело и пре-ретинальные структуры, воздух (газовая смесь, например шестифтористая сера и воздух 1: 1,5 или фреоны типа хладон С-318 и др.) используют для расправления сетчатки и восполнения объема глаза. Наличие в смеси инертного и плохо всасывающегося газа приводит к увеличению объема газовой полости в послеоперационном периоде вследствие выравнивания парциального давления газов в полости и дополнительиого выхода из тканей преимущественно азота. Это содействует резорбции остаточной субретинальной жидкости и удлиняет срок пребывания в глазу газового пузыря. Однако нельзя рассчитывать на полное формирование коагулятов за то время, пока газ находится в глазу. Успех операции в конечном итоге обеспечивается эффективностью удаления тяжей и других фиброзных структур, блокирования разрывов и зон деформации сетчатки, а также прекращения дальнейшего прогрессирования ретракции.
Обычно после завершения витрэктомии вновь выводят субретинальную жидкость через наружный прокол (прорез), уже использовавшийся, как правило, до витрэктомии или в ходе ее выполнения. Возможен и внутренний дренаж с отсасыванием жидкости в зоне разрыва. Он особенно эффективен, если поддавливать склеру в зоне отслойки, однако для этого требуется навык синхронного бимануального действия и хорошего зрительного кон-
410
фроля (лучше через микроскоп) позиции канюли (иглы, витрео-ТОма), подведенной изнутри к зоне разрыва.
По окончании или в процессе дренирования субретинальной жидкости через ушитые склеральные отверстия для витрэктомии ЫОДят газ до формирования тургора порядка Т+ь В этой ситуации для введения газа используют тонкую канюлю или иглу, Которую легко проводят между швами, герметизирующими зоны «клеротомических отверстий.
Некоторыми особенностями техники характеризуется хирургическое вмешательство, в том числе и газовая тампонада, выполняемое при гигантских отрывах сетчатки с выраженной латеро-Юрзией вплоть до смещения сетчатки в противоположную половину глазного яблока. В рассматриваемой категории больных следует выделить две группы: с относительно сохранными элементами стекловидного тела без выраженных тяжеподобных и мембранозных структур, часто с выпадением стекловидного тела за Сетчатку, и с несомненными признаками ретракции и пререти-иальной пролиферации с формированием тяжистых структур в Стекловидном теле.
У больных первой группы, как правило, нет необходимости удалять стекловидное тело. Операцию производят следующим образом. После проведения косо ориентированной циркляжной ленты (в зоне отрыва-разрыва она удалена от лимба на 14— 16 мм) и подготовки у заднего края ленты отверстия для выведения жидкости выполняют пункцию глаза через плоскую часть ресничного тела (больного при этом укладывают лицом вниз) и к заднему полюсу глаза, под «купол» сетчатки, вводят пузырь газа (рис. 215, а). Сетчатка всплывает и стекловидное тело, находящееся позади нее, занимает позицию перед сетчаткой. Если возникает пузырь газа большого объема (более 0,5—0,8 мм), то ассистент в момент введения газа должен выпустить субретинальную жидкость через зарапее подготовленное отверстие в области циркляжной ленты (см. рис. 215).
После введения газа больного укладывают на бок, противоположный зоне ретинодиализа, зрительная ось ориентируется с наклоном головы к горизонтальной плоскости на 25—30° (рис. 215,6). Непосредственно перед циркляжной лентой производят ряд сквозных насечек склеры и сосудистой оболочки (через каждые 30—40°) с целью выведения остатков субретинальной жидкости, а также получения спонтанного ретиненклейзиса (рис. 215,в). На поджатие сетчатки к зоне прореза стенки глазного яблока указывают прекращение истечения жидкости и отсутствие выхождения воздуха. Потеря газа нежелательна, так как может потребоваться дополнительное его введение в полость глава. Тургор поддерживают постепенным затягиванием циркляжной ленты (рис. 215,г). Вдоль вала вдавления наносят серию крио-коагулятов.
В случаях с выраженным витреоретинальным ретракционным синдромом необходимо произвести радикальное удаление стекло-
411
i f I
j
215.
Расправление сетчатки и блокирование зоны отрыва (схема).
а — введение газа под «купол» отслойки с од-повременным выведением субретинальной жидкости; б — расправление сетчатки при повороте головы и глаза: в — дренирование жидкости — прием «спонтанного» ретиненклейзиса; г — затягивание циркляжной ленты с наиболь-
шим продавливанием в зоне отрыва.
видного тела и мобилизацию сетчатки. При этом следует преодолеть тракции, направленные не только поперечно либо продольно, но и концентрично поверхности сетчатки. После удаления стекловидного тела для преодоления концентрично направленных тракций и ослабления натяжения «омозолелого» края сетчатки производят ретинотомию — радиальные насечки на завернутом крае сетчатки. После такой подготовки выполняют остальные этапы операции: расправление сетчатки газом (воздух либо смесь шестифтористой серы или других инертных газов с воздухом), круговое вдавление, просечки и приемы спонтанного ретиненклейзиса и криопексию, как указано выше.
При сохранении значительной ригидности оторвавшегося края сетчатки до введения газа могут потребоваться другие приемы расправления ретиненклейзиса, в этом случае последовательность этапов операции изменится, в том числе может отпасть необходимость в расправлении сетчатки и тампонировании полости глаза в положении больного лицом вниз.
Расправление сетчатки латексовым шариком (баллончиком). Тупоконечную канюлю с туго сидящим на ней латексовым чехлом вводят в стекловидное тело через прокол (разрез) в проекции плоской части ресничного тела. Путем дозированной подачи в полость латексового чехольчика изотонического раствора хлорида натрия из шприца, соединенного с канюлей гибкой тонкой трубкой, чехольчик раздувают и на конце канюли, т. е. в полости стекловидного тела, появляется мягкий шарик диаметром 5— 6 мм (рис. 216, а). Контролируя действия через микроскоп с коаксиальным освещением, шариком расправляют и проглаживают
412
816. Расправление свернувшейся сетчатки с помощью латексового (силиконового) баллончика (схема).
— начало операции; б — конец операции.
вавернувшуюся или собравшуюся в складки сетчатку до ее возможно более полного расправления (рис. 216,6).
По окончании этой весьма тонкой манипуляции жидкость из шарика выпускают, при этом он спадается, и канюлю вместе с латексовым чехлом свободно извлекают из глаза. Если сетчатка удерживается в приданной ей позиции, т. е. не обнаруживает тенденции к возвращению в состояние отслойки, в полость глаза вводят газ (изотонический раствор хлорида натрия и т. д.) и приступают к ретинопексии доступными средствами, в том числе интраокулярными. Надежнее, однако, произвести круговое вдав-ление, применив перед этим еще один специальный прием, получивший наименование «ретипопклейзис».
Ретипеиклейзис. На стороне отрыва (гигантский разрыв) в соответствующих меридианах л двух—трех местах прокалывают (с интервалохМ 30—40°, иногда и чаще) склеру и сосудистую оболочку. При хорошо расправляющейся сетчатке проколы делают вблизи от зубчатой линии, а при сморщивающейся ригидной сетчатке — в области экватора, но, как правило, у переднего края вала вдавления. Если проколы (прорезы) имеют длину более 1,5—2 мм, то на них накладывают швы. В тех случаях, когда сетчатка сохраняет пристеночное положение, обычно достаточно проколов (прорезов), чтобы к их зоне подошла (и зафиксировалась) подпираемая изнутри газом или раствором сетчатка.
При ригидной сетчатке, когда даже после витрэктомии и рети-нотомии она плохо мобилизуется, через проколы внутрь глаза вводят захватывающие инструменты (цанговые и шарнирные пинцеты, пинцет Дикуна—Барцевича, присасывающая канюля и др.). Эту процедуру часто выполняют с помощью двух инструментов: в одной руке у хирурга или латексовый баллончик, или пинцет, канюля, игла, т. е. «инструмент-вассистент», с помощью которого хирург подает край сетчатки к рабочему концу захва-
413
Il
217. Ретиненклейзис при гигантском отрыве сетчатки, а—в—этапы операции.
тывающего (присасывающего) инструмента. Под микроскопом с коаксиальным освещением (сложнее с бинокулярным налобным офтальмоскопом) край оторвавшейся сетчатки захватывают (рис. 217) и подтягивают к ране в склере. При выведении конца инструмента из раны ткань сетчатки ущемляется в ней, однако иногда при очень ригидной сетчатке для ее удержания в ране необходимо затянуть провизорный шов. За полосой участков ущемления сетчатки (ретиненклейзис), т. е. еще несколько дальше от лимба, через дополнительный прокол из-под сетчатки выводят остатки субретинальной жидкости и оставшиеся там форменные элементы стекловидного тела. Газовой пломбой изнутри, со стороны стекловидного тела, поддавливают сетчатку и завер- • шают операцию нанесением криокоагулятов, серии неперфорирующих коагуляций диатермией или ультразвуком в зоне, окружающей отрыв (разрыв).
Следует упомянуть о попытках шовной фиксации сетчатки, в том числе с подведением пломбы со стороны сетчатки под одиночные стежки сквозных швов, о предложенной R. Zivojnovic и 1 •соавт. (1982) методике наложения сквозного непрерывного шва. Авторы трансвитреально проводят полую иглу с нитью и через проколы у края дефекта ретины выводят на склеру сначала конец нити, а затем петли шва, через которые проводят нить. Эти приемы экстремальной хирургии отслойки сетчатки требуют изучения и еще далеки от совершенства, поэтому пока не могут быть внедрены в широкую практику.
Ретинотомия. Витрэктомию, которую производят с целью мо- | билизовать отслоенную сетчатку, иногда расширяют вплоть до I ретинотомии, выполняемой в различных вариантах [MachemerR., I 1981]. Уже упоминалось о радиальных насечках завернувшегося и ригидного края сетчатки, которые делают с целью преодолеть тракционные силы, направленные концентрично поверхности -сетчатки. Такую операцию выполняют с помощью ножниц или витреотома, который при этом «выедает» кусочки края оторвавшейся сетчатки.
-414
Если не удается освободить сетчатку из рубцов и зон ущемления (рубцы после ранения, операции), то в ходе ее мобилизации и отделения может сформироваться дефект размером до 180° и более [Machemer R., 1979; Kloti, 1979]. Дальнейшее блокирование такого дефекта осуществляют, используя приемы кругового вдавления, интраокулярную ретинопексию, введение газа, в том числе и в положении больного лицом вниз на вращающемся столе, ретиненклейзис.
Имеются предложения производить ретинэктомию рубцовосморщенных и перерожденных зон сетчатки с целью мобилизации и расправления оставшихся ее отделов, свободных от рубцов, и ретракции. Такое «выедание» сетчатки опасно как само по себе (кровотечение), так и в связи с необходимостью применять в последующем сложные приемы ее фиксации, поэтому пока не имеет преимуществ перед другими методами, позволяющими нейтрализовать массивную ретракцию.
Наконец, ретинотомию используют как хирургический доступ для удаления субретинальных пролифератов [MachemerR., 1981]. Применение ее оправдано в редких случаях при безнадежных ситуациях, особенно на единственном глазу. Фактически сетчатку отсекают на протяжении от одного квадранта до половины периметра, отворачивают (операционный заворот), после иссечения субретинальных рубцов укладывают на место и фиксируют, используя различные приемы ретинопексии (вплоть до клейзиса) и экстрасклерального пломбирования. Доступ к субретинальным швартам возможен также и через «окно» в склере, но он сложен, и угрожает массивным кровотечением и потерей оболочек.
Пломбирование стекловидного тела силиконовой жидкостью. Силиконовая жидкость прозрачная, бесцпетпая. Из-за ее маслянистости и довольно высокой вязкости для введения жидкости используют иглу с внутренним диаметром не менее 0,5 мм. Силикон бактерициден, и если ого храпят в стерильных флаконах, то предоперационной стерилизации не требуется. Как при заборе силикона в шприц, так и при введении его из шприца в глаз важно сохранять непрерывное поступательное движение поршня, чтобы, во-первых, в толщу силикона не засасывался воздух и, во-вторых, силиконовый пузырь в глазу не дробился на мелкие пузырьки. Даже близко лежащие один к другому пузырьки силикона, не имеющие выраженной тенденции к слиянию, значительно снижают оптический эффект операции. К тяжелым осложнениям относится попадание силикона под сетчатку. Введенный же по назначению — в ретровитреальное пространство, он довольно спокойно переносится соседними тканями. При повторном введении силикона с целью усиления уже достигнутого эффекта важно кончик иглы погружать в центр уже имеющегося пузыря и только тогда вводить новую порцию.
В клинической практике пока применяют только жидкие силиконы, плотность которых (от 0,8 до 0,98) меньше, чем плотность стекловидного тела (в среднем 1,1), хотя были получены
415-
и даже изучены в экспериментах фторсилоксаны (плотность 1,25—1,33) — вещества, более тяжелые, чем стекловидное тело.
В отдаленные сроки силиконовые пузыри дробятся, и этот процесс наступает быстрее при использовании тяжелых силиконов [Казанец Л. И., 1976]. В сетчатке, хрусталике и роговице в местах контакта с силиконом возникают дистрофические изменения, отмечена и соединительнотканная пролиферация, более выраженная при использовании тяжелых силиконов.
Легкие силиконы, занимающие верхнюю часть глазного яблока, целесообразнее применять при верхних разрывах. Важным преимуществом силикона перед другими пломбировочными материалами является то, что он практически не рассасывается, поэтому создает стойкий эффект давления на сетчатку изнутри. Однако через I’A—2 года, а при наличии выраженного фиброза в стекловидном теле и раньше наступает эмульгирование силикона и его мельчайшие пузырьки можно обнаруживать в верхних отделах передней камеры (они напоминают зеркальное изображение гипопиона).
Успехи витреоретинальной хирургии, достигнутые в последние годы, содействовали пробуждению интереса к использованию на завершающем этапе операции стойких интраокулярных пломб, дающих длительный тампонирующий и разглаживающий эффект, особенно в сочетании с витрэктомией и описанными выше приемами ретинопластики. Как самостоятельная операция при выраженном внутриглазном фиброзе введение силикона в полость глаза неэффективно. Через 4—6 мес рекомендуется удалять силикон с помощью канюли с широким просветом (1,4 мм), которую вводят в центр силиконового пузыря. Удаление силикона производят в сочетании с подачей внутрь глаза замещающего раствора. При этом с помощью витреотома желательно удалить граничащие с пузырем силикона уплотненные и пролиферативно измененные витреальные структуры, среди которых находятся мельчайшие пузырьки эмульгированного силикона.
Осложнения при операциях по поводу отслойки сетчатки
К факторам, осложняющим планирование и проведение операции по поводу отслойки сетчатки, относятся все те, которые в ходе вмешательства окажутся помехой для постоянного офтальмоскопического контроля за состоянием сетчатки, особенно в зонах ее разрыва (отрыва). Это резкий миоз, особенно у больных, длительно пользовавшихся ранее миотиками; нарушение прозрачности оптических сред глаза, в частности катаракта, помутнение стекловидного тела. Оно нередко теряет прозрачность из-за кровоизлияния, возникающего в момент образования в сетчатке разрыва, если в его зону попадает сосуд, а также из-за импрегнации стекловидного тела глыбками пигмента, происходящего из слоя пигментного эпителия длительно отслоенной сетчатки, ухудшая исход.
416
Оптимальным путем преодоления указанных дооперацион-ных осложнений было бы проведение через небольшие разрезы непосредственно перед началом основной операции вспомогательных: иридотомии, факофрагментации или витрэктомии. В том случае, если невозможно хорошо герметизировать рану после указанных предварительных действий, то основную операцию можно отложить на несколько дней.
Операционные осложнения связаны почти исключительно с дефектами хирургической техники. К ним относятся следующие.
1. Нарушение прозрачности роговицы вследствие пересыхания, механической, химической (антисептиками) или фототравмы эпителия и стромы роговицы; ожог не только роговицы, но и радужки при световой коагуляции глазного дна; чрезмерное прожигание склеры и сосудистой оболочки при диатермокоагуляции.
2. Незапланированная перфорация и даже разрыв оболочек глаза, в частности с дополнительным повреждением сетчатки (особенно на месте бывшего ранее пережога склеры), и вследствие этого непредвиденное дренирование субретинальной жидкости и стекловидного тела, резкая гипотония и миоз, затрудняющие продолжение операции.
3. Кровоизлияния внутрь глаза (под сетчатку, в стекловидное тело) вследствие повреждения и последующего тромбоза вортикозной вены либо в связи с ранением крупных артериальных стволиков собственно сосудистой оболочки или артерий; кровоизлияния по типу незавершенной экспульсивной геморрагии при форсированном отсасывании субретинальной жидкости.
4. Проникновение материала, предназначенного для пломбирования стекловидного тела (например, силикона или газа), под сетчатку через неблокированпый и пей разрыв, под конъюнктиву через рапу в склере, в переднюю камеру при афакии в случае повреждения передней пограничной пластинки стекловидного тела, в пространство между оболочками глазного яблока при неполном проколе тканей.
5. Косоглазие, симблефароп, птоз, диастаз конъюнктивальной раны при травматичном вмешательстве и неправильном сопоставлении временно пересеченных и затем сшиваемых тканей.
6. Выпадение через разрезы в склере стекловидного тела при чрезмерном стягивании циркляжной конструкции, при этом прорываются также сосудистая оболочка и сетчатка.
7. Прорезание склеральных швов, накладываемых над пломбой. Это может быть связано с наложением швов слишком поверхностно и близко к краю пломбы. В данную группу осложнений следует отнести также разрыв нитей при неправильном выборе шовного материала по толщине.
8. Эрозия эпителия роговицы, затрудняющая офтальмоскопический контроль в ходе операции и вызывающая боли в послеоперационном периоде, хотя в части случаев при отеке эпителия приходится его специально соскабливать.
27 Руководство по глазной хирургии
417
9. Острое нарушение кровообращения в центральной артерии сетчатки вследствие создания чрезмерно высокой офтальмогипертензии и в связи с этим внезапная потеря светоощущения (как правило, на короткий срок). Нельзя завершать операцию, не добившись восстановления кровообращения в центральной артерии сетчатки и способности ощущать свет.
Способы предупреждения указанных выше осложнений и тактика офтальмохирурга в случае их возникновения описаны в предыдущем разделе главы при изложении современных методик операции.
Послеоперационные осложнения, так же как и осложнения, возникающие в ходе операции, чаще всего обусловлены дефектами хирургической техники; лишь некоторые из них вызваны неправильным ведением послеоперационного периода и нарушением режима самими больными. Перечисляем эти осложнения.
1. Рецидив отслойки сетчатки вследствие недостаточно точного блокирования найденного разрыва, в том числе из-за смещения пломбы или баллона либо необнаружения всех дефектов сетчатки. Возникает необходимость в повторной операции, в части случаев удается ограничиться световой коагуляцией.
2. Рецидив отслойки сетчатки из-за неумеренного рубцевания в области вмешательства вследствие слишком сильного прижигания тканей. Новый разрыв возникает на отдалении. Требуется повторная операция.
3. Рецидив отслойки сетчатки из-за нарушения больным предписанного ему режима. Обычно офтальмохирурги склонны преувеличивать роль этого фактора, но в отдельных случаях действительно для ликвидации рецидива достаточно увеличить время соблюдения постельного режима.
4. Поздние кровоизлияния внутрь глаза в случае недостаточного тромбирования сосудов, поврежденных при операции. Продлевают срок действия ограничительного режима, сразу после возникновения кровоизлияния назначают аминокапроновую кислоту, дицинон, витамин К, в последующем — глицерин, фибрино-литики, антикоагулянты, протеолитические ферменты. При образовании внутри глаза грубых шварт может развиться рецидив отслойки.
5. Массивный преретинальный фиброз на почве выраженной послеоперационной ретракции стекловидного тела даже без существенных кровоизлияний в полость глаза. По ряду причин он может принимать упорно прогрессирующее течение и спустя несколько недель вызвать рецидив отслойки сетчатки.
6. Иридоциклит, возникающий при слишком травматичном проведении операции, особенно на глазу, на котором возникают рецидивы воспаления радужки и ресничного тела. Для профилактики иридоциклита в ходе операции, сразу по окончании ее и в послеоперационном периоде применяют мидриатики. При начавшемся воспалении добавляют кортикостероиды.
418
7. Эндофтальмит, нагноение и отторжение пломб или цирк-ляжных лент, панофтальмит. Требуется безотлагательно удалить секвестры и провести бактериологическое исследование. Назначают антибиотики и сульфаниламидные препараты. В случае необходимости производят витреопусэктомию.
8. Синдром сдавления (после наложения кругового шва). Вследствие слишком сильного стягивания хирургом циркляжной ленты или неудачного ее положения на вортикозных венах возникают выраженные застойные явления в бульбарных и эпи-бульбарных сосудах: сужение глазной щели, хемоз конъюнктивы, симптомокомплекс раздражения глаза, тусклость роговицы из-за повышения внутриглазного давления. Синдром сдавления сопровождается болями в глазу и вокруг него. Нормализовать внутриглазное давление обычно удается с помощью диакарба, глицерина, аминазина. Иногда приходится прибегать к пересечению или удалению циркляжной ленты. После этого боли, возникающие даже при умеренной офтальмогипертензии, стихают.
9. Продавливание циркляжной ленты или пломбы сквозь склеру в полость глаза — симптом бельевой веревки.
10. Сублюксация хрусталика вследствие чрезмерного стягивания циркляжной ленты, катаракта в результате механического повреждения капсулы хрусталика инструментами, вводимыми в полость глаза, неосторожного диатермического прогревания оболочек глаза, неправильного введения силиконовой жидкости, оказывающейся в конечном счете в контакте с задней капсулой хрусталика. Спешить с экстракцией такой катаракты не следует, так как производить ее необходимо экстракапсулярно, что, как известно, лучше делать при достаточной зрелости катаракты. В случае сохранения задней капсулы хрусталика вероятность рецидива отслойки сетчатки уменьшается.
11. Отслойка сосудистой оболочки. Она изредка возникает при значительной деформации оболочек глаза вдавливающими конструкциями, хрупкости и склерозировании сосудов собственно сосудистой оболочки, а также в тех случаях, когда выпускание субретинальной жидкости не сопровождается полноценным восстановлением объема глазного яблока путем интравитреального пломбирования газом или жидкостью. Обычно отслойка ликвидируется самопроизвольно либо после склеротомии.
12. Стойкое уменьшение размеров глаза вследствие слишком сильного кругового вдавления, чрезмерной по силе и по площади коагуляции склеры и сосудистого тракта. Никогда не следует коагулировать глазное яблоко замкнутым кольцом. Вообще нужно отдать предпочтение криопексии перед диатермокоагуляцией склеры.
13. Выход силиконовой жидкости в переднюю камеру или под конъюнктиву. Если при этом повышается внутриглазное давление либо возникают стойкие дистрофические изменения тканей, граничащих с силиконом, то необходимо вывести его через прокол или небольшой разрез.
27*
419
Лечение больных 'с отслойкой сетчатки в послеоперационном периоде
Избыточная подвижность жидкого содержимого глаза может привести к рецидиву отслойки сетчатки при недостаточно надежном блокировании разрывов. В связи с этим ограничение движений всего тела и особенно головы и глаз должно играть первостепенную роль в лечении больных, которым произведена операция по поводу отслойки сетчатки. Для них вполне обоснован постельный режим с бинокулярной повязкой. Больному не рекомендуют самостоятельно менять положение головы, ограничивают прием пищи. При задержке стула делают очистительную клизму. При ограничении движений очень полезна дыхательная гимнастика в постели.
Голове больного важно придать определенное положение. При наличии в стекловидном теле относительно легких пломб (газ, силикон) нужно так поместить голову больного, чтобы разрыв сетчатки занял самую высокую точку глазного яблока. При верхних разрывах он должен находиться в положении полусидя, при разрывах снизу подушку убирают, а при локализации разрыва в макулярной области — необходимо уложить больного лицом вниз. Легкая интравитреальная пломба, приняв самое высокое положение в глазу, придавливает края надорванной сетчатки вверх к сосудистой оболочке, и этим необходимо воспользоваться. При отсутствии в стекловидном теле легких пломбирующих материалов голове больного, наоборот, придают такое положение, чтобы разрыв сетчатки оказался в самой нижней точке глазного яблока (в расчете на оптимальные условия действия силы тяжести).
На постельном режиме больной находится 1—7 дней. После операций, оканчивающихся только спайкой тканей (криопексия, фотокоагуляция, диатермокоагуляция и ультразвуковая коагуляция), постельный режим целесообразно соблюдать в течение 5—7 дней, после сравнительно грубых воздействий (циркляж, постоянное пломбирование) в случае надежного блокирования разрыва — до 3—4 дней. При операциях, производимых с профилактической целью, продолжительность пребывания в постели уменьшают до суток. Профилактическую криотерапию или лазерные воздействия и даже временное баллонирование могут быть выполнены в амбулаторных условиях, правда, дома больному все равно рекомендуют соблюдать ограниченный или постельный режим. Прежде чем существенно изменить режим, нередко принято выжидать появления при офтальмоскопии в зоне коагулятов пигментных пятен. Хотя наличие таких пятен свидетельствует о врастании пигментного эпителия в сетчатку, оно отнюдь не может служить признаком достаточно высокой прочности спайки. Однако неоправданно оставлять больного в постели на более длительное время. Указанных выше сроков нередко достаточно, чтобы при условиях блокирования разрыва всосалась остаточная субретинальная жидкость и произошла необходимая спайка тканей.
420
После длительного пребывания в постели нельзя сразу переводить больного на общий режим. Ему вначале разрешают сидеть в постели, затем — на стуле, рядом с койкой, затем помогают пройти по палате. Такой палатный режим с ношением дырчатых очков необходимо соблюдать в течение 2—3 дней. Дырчатые очки больному предлагают носить и при переводе его на общий режим. Выписывают из стационара при гладком течении послеоперационного периода спустя 5—14 дней после операции. Больного необходимо освободить от работы на 1—2 мес, а если работа сопряжена со значительными физическими или зрительными нагрузками, то во избежание рецидива отслойки рекомендуют сменить профессию.
Первую перевязку производят на следующий день после операции. Частота медикаментозных инстилляций в глаз определяется необходимостью профилактики иридоциклита. При подозрении на развитие раневой инфекции, синдром сдавления, послеоперационное кровоизлияние внутрь глаза проводят соответствующие терапевтические манипуляции. Болевой синдром (циркляжные боли) снимают с помощью анальгетиков, а также 2—3% раствора новокаина, который вводят парабульбарно. Иногда полезно в новокаиновую «подушку» добавить 0,3—0,5 мл дексаметазона (гидрокортизон). Конъюнктивальные швы снимают на 7—8-й день.
После явно неудачной операции или в случае послеоперационного рецидива отслойки сетчатки никакой необходимости удерживать больного в постели нет. Уже на 2—3-й день его поднимают и при желании больного приступают к подготовке реоперации. Однако необходимо иметь в виду, что остаточная отслойка сетчатки, особенно после склеропластических операций, выполняемых без дренирования субретипа л ытой жидкости, если разрыв надежно блокирован, еще не свидетельствует о неуспехе. Если высота и площадь отслоенной сетчатки от перевязки к перевязке неуклонно уменьшаются, то прогноз благоприятен. Вообще отдаленные результаты операций укорочения склеры и циркляжа часто лучше непосредственных.
При перевязках недостаточно ограничиваться осмотром наружных отделов глаза. Прежде всего в проходящем свете оценивают состояние рефлекса с глазного дна, с помощью офтальмоскопа обязательно пытаются рассмотреть также детали глазного дна. Если преломляющие среды недостаточно прозрачны либо мешает пузырь введенного в стекловидное тело газа (он рассасывается на протяжении 5—7 дней и дольше), то все же стараются увидеть хотя бы участок пломбы или вдавления от циркляжной ленты. Обнаружив выстоящий внутрь глаза участок пломбы и обследуя офтальмоскопически ее скат, пытаются найти разрыв в сетчатке и убедиться, что он пришелся как раз на пломбу и, таким образом, блокирован.
Особое внимание уделяют состоянию сетчатки, выстилающей задний скат пломбы. Оценивают и регистрируют в истории болез-
421
ни размеры зоны, занятой еще не всосавшейся субретинальной жидкостью. При благоприятном течении к концу пребывания больного в постели и после этого 1—2 раза в неделю производят периметрию. В случае отсутствия успеха от операции для оценки перспективности повторных вмешательств необходимо провести прогностические офтальмоэлектрофизиологические исследования.
ЦЩЦШш осНЯЯВстИ^^Ял^позволяе^ооще^состояние больного, можно произвести в сравнительно ранние сроки (через 1—2 нед). Откладывать повторную операцию надолго (свыше 3 мес) обычно невыгодно из-за того, что существует опасность развития интраокулярного фиброза, но и в эти сроки реоперация возможна.
Операции при других заболеваниях сетчатки
Методы хирургического лечения сосудистых заболеваний сетчатки. Фото-и лазер коагуляцию используют для лечения диабетической ретинопатии, а также болезней Илза, Лебера, Гип-пеля—Линдау и др. Разрушение с помощью фотокоагулятора или аргонового лазера патологически измененных сосудов иногда предотвращает рецидивы кровоизлияний и грубое рубцевание.
Существуют методики фото- и лазервоздействия по площадям, или так называемая панретинальная коагуляция. При этом с помощью коагуляции выключают функционально менее значимые периферические отделы сетчатки, улучшая тем самым условия кровообращения для центральных отделов. Чем ближе к периферии сетчатки оказывают воздействие, тем больше применяемая энергия (до 500—600 мВт) и диаметр коагулята (до 1 мм). С приближением к заднему полюсу глаза диаметр очага уменьшается до 0,2—0,3 мм, а энергия — до 200—300 мВт. Длительность воздействия составляет 0,2—0,1 с.
При острых нарушениях кровообращения в сосудах сетчатки ряд авторов считают полезным пробивать аргоновым лазером мембрану Бруха и пигментный эпителий на участках в 100—150 мкм в расчете на создание путей микроциркуляции крови непосредственно между собственно сосудистой оболочкой и сетчаткой. Энергия воздействия составляет 300—400 мВт при длительности импульса 0,2 с.
Несколько более грубые воздействия требуются для разрушения аневризм, возникающих при болезни Гиппеля—Линдау. В этом случае можно использовать ксеноновую лампу, создавая на глазном дне энергию 0,2—0,3 Дж; сила тока при этом варьирует от 50 до 70 А.
Су б склеральная диатермокоагуляция. Для разрушения крупных аневризматических узлов, особенно расположенных на периферии сетчатки, световая коагуляция малопригодна. Более эффективной является криодеструкция или диатермокоагуляция. Перед указанным воздействием в области проекции аневризматического узла Гиппеля, местоположение которого уточ-422
218.
Субсклеральная диатермокоагуляция ан-гиоматозного узла при болезни Гиппеля— i Линдау (схема).
а, б — этапы операции.
няют с помощью диафаносклероско-пии, намечают прямоугольный скле ральный клапан и выкраивают его основанием к экватору (рис. 218). Склеру прорезают почти на всю толщину, клапан отсепаровывают скле-ротомом и откидывают кзади. Вновь повторяют диафаноскопию, уточняя на просвет местоположение узла, который должен полностью оказаться в проекции истонченного участка склеры. В пределах созданного «окна» подлежащие ткани проморажи-
вают криозондом или прожигают шариковым (диаметр 2 мм) диатермоэлектродом. Возвращают на место склеральный клапан и подшивают его несколькими узловатыми швами. Накладывают швы на конъюнктиву.
Введение в полость глаза через рану склеры порции прямой мышцы. Эту операцию производят иногда при пигментной дегенерации сетчатки [Волошиной Д. Б., 1968; Шлопак Т. В., 1970; Ивдейкин Е. Н., 1980; Джалиашвили О. А., Бойков Г. С., 1981, и др.]. Выделив одну из прямых мышц глаза, расщепляют ее на три полоски (рис. 219, а). Среднюю полоску пересекают у места прикрепления ее к склере (именно в средней порции мышцы проходит передняя ресничная артерия). Пересеченную полоску мышцы разворачивают кзади и отводят несколько в сторону от нормального хода. В области экватора и у конца уложенной па склере полоски мышцы трепанируют (прорезают) склеру и шпателем делают ход над сосудистой оболочкой
219. Реваскуляризация сетчатки по Шлопак и соавт. при ее пигментной аби-отрофии (схема). Объяснение в тексте.
423
(рис. 219,6). Через отверстия в склере проводят мышечную полоску и закрепляют ее одним — двумя швами (рис. 219,в). Существуют и другие варианты введения мышечно-сосудистой полоски в супрахориоидальное пространство [Шпак Н. И., 1978, и др.]. В. И. Галимова и Э. Р. Мудлашев (1981) предлагают для улучшения питания сетчатки вводить в супрахориоидальное пространство через косой разрез склеры эписклеральный лоскут с магистральным сосудом на нем.
Комбинированные операции склеропластики с реваскуляризацией, применяемые в профилактике и лечении дистрофии сетчатки и атрофии зрительного нерва, описаны В. С. Беляевым и Ж. X. Госсеном (1983) (см. главу 4).
Хирургическое лечение при опухолях сетчатки. В сетчатке встречается почти исключительно один вид опухоли — ретинобластома. Она относится к злокачественным новообразованиям, поражающим главным образом детей в возрасте 2—4 лет.
При больших размерах опухоли производят энуклеацию. Если же не утрачена надежда на сохранение глаза и его зрительной функции, то воздействуют непосредственно на опухоль. При фото-, лазер-, крио- или диатермокоагуляции опухоли используют максимально возможные дозы энергии (в режиме перегрузки).
Поскольку ретинобластома относится к радиочувствительным образованиям, применяют и лучевую терапию, в частности вводят радиоизотопы в толщу опухоли или подшивают их в виде чашечек или зерен к склере. Используют аппликаторы с радиоактивным иттрием (90Y) — чистым бета-аппликатором.
Глава 9
Операции на глазных мышцах
Операции на глазных мышцах производят при содружественном и паралитическом косоглазии, атипичных формах косоглазия и нистагме. Цель таких операций заключается в том, чтобы путем изменения мышечного баланса, т. е. относительной силы натяжения глазных мышц, добиться симметричного или близкого к нему положения глаз, улучшить подвижность глаз или уменьшить их нистагмоидные движения.
Операции при содружественном косоглазии
В настоящее время общепринятой является методика комплексного лечения содружественного косоглазия, которое складывается из оптической коррекции аметропий, мероприятий по борьбе с амблиопией (плеоптики), операций на глазных мышцах и выполнения ортоптических и диплоптических упражнений в пред-и послеоперационном периодах. Необходимость в проведении хирургического лечения косоглазия возникает в тех случаях, когда постоянное и достаточно длительное (не менее года) ношение правильно назначенных очков и ортоптические упражнения не приводят к устранению девиации.
В процесс!1 леченин iiojii.iii.ix до операции главное внимание неоо\!>дкмо .уделять пенравл14111111 зрительной фиксации и повышению остроты прении амолнопнчпого глаза, развитию способности зрительного и налпзатора сливать фовеальные изображения объектов, получению достаточной ширины фузии и подвижности глаз.
Конечной целью лечения содружественного косоглазия является восстановление бинокулярного зрения. Операция должна способствовать, а не препятствовать достижению указанной цели. В связи с этим современная тактика хирургического лечения косоглазия характеризуется отказом от выполнения форсированных вмешательств, равномерным распределением эффекта операции на несколько мышц и применением таких видов операций, при которых мышца остается в своей плоскости и сохраняет надежную связь с глазным яблоком. Целесообразность соблюдения приведенных принципов подтверждается результатами гистологических исследований, которые показывают, что на процесс регенерации большое влияние оказывает степень натяжения мышцы. Как чрезмерно сильное, так и слабое натяжение отрицательно влияет на
425
нормальный восстановительный процесс в мышце [Тетерина Т. П., 19651.
Оптимальным возрастом для выполнения операции по поводу содружественного косоглазия большинство офтальмологов считают 4—6 лет, когда уже достаточно отчетливо виден эффект оптической коррекции аномалий рефракции и когда уже можно проводить активные ортоптические упражнения в пред- и послеоперационном периодах.
Следует иметь в виду, что при возникновении косоглазия в раннем возрасте (на первом году жизни) развитие бинокулярной зрительной системы происходит неправильно, с самого начала приспосабливаясь к асимметричному положению глаз. В таких случаях ранняя и идеально дозированная операция на глазных мышцах может создать условия для формирования нормального бинокулярного зрения, если к этому нет противопоказаний со стороны сетчатки. Исходя из этих соображений, ряд авторов [Пиль-ман Н. И., 1960; Сенякина А. С., 1977, 1980—1982; Arruga Н., Fisher Е., 1968; Hiles, 1976, и др.] предлагают проводить операции по поводу косоглазия и в период раннего детства, особенно при очень большой девиации и наличии «глазного» тортиколлиса.
Выдвигаются, однако, и аргументы противоположного характера. Так, A. Bangerter (1956) не без оснований отмечает, что у детей в возрасте 1—3 лет очень трудно осуществить анализ мышечного равновесия, нельзя провести ортоптические упражнения, еще возможно самопроизвольное восстановление правильного положения глаз и развитие нормальных сенсорных связей. По его мнению, устранение девиации хирургическим путем еще не гарантирует, что произойдут быстрые изменения в сенсорной сфере, обеспечивающие правильность оптикомоторных реакций. Очевидно, вопрос о ранних операциях при косоглазии нуждается в дальнейшей научной разработке, прежде всего в направлении совершенствования методики обследования органа зрения у детей младшего возраста и обоснования показаний к таким операциям.
Следует подчеркнуть, что с помощью ортоптических упражнений больного обучают не истинному, а гаплоскопическому зрению. Помимо того, проведение этих упражнений возможно только у детей в возрасте 4—5 лет и старше, т. е. в период, когда асимметричное бинокулярное зрение уже стало более прочным.
Указанные недостатки ортоптики послужили поводом для разработки новой системы лечения содружественного косоглазия в естественных условиях — диплоптики [Аветисов Э. С., 1977]. Дип-лоптические упражнения можно проводить даже в возрасте 2— 3 лет. При назначении таких упражнений детям раннего возраста следует также производить операции на мышцах глаза.
При обследовании больных до операции необходимо получить полноценные данные об остроте зрения и о зрительной фиксации, рефракции глаз, величине угла косоглазия, характере зрения при двух открытых глазах, подвижности глаз, способности зрительного анализатора сливать фовеальные изображения объектов и фу-
426
знойных резервах под углом косоглазия. Анализ этих данных позволит уточнить показания к операции, определить рациональную тактику ее проведения и предсказать вероятный исход.
Если после активного плеоптического лечения на амблиопич-ном глазуусохраняется низкая острота зрения (менее 0,3), препятствующая формированию бинокулярных связей, то с операцией спешить йе следует. При наличии выраженной девиации (более 10°) целесообразно все же сделать ее еще до поступления ребенка в шкоду, но учитывать возможность повторной операции в случае рецидцва косоглазия. Об этом следует предупредить родителей ребенка. Такую корригирующую операцию лучше производить в возрасте 10—12 лет, когда почти прекращается развитие лицевого скелета и глазниц, которое в условиях отсутствия бинокулярного зрения может способствовать отклонению глаз.
Наличие гиперметропии пои сходящемся косоглазии и миопии при расходящемся косоглазии дает основание рассчитывать на появление после операции «частично-аккомодационных» свойств косоглазия [Смольянинова И. Л., 1957]. В таких случаях оптическая коррекция аномалий рефракции может оказать стабилизирующее влияние на положение глаз в послеоперационном периоде.
Одновременное зрение указывает на меньшую тенденцию к торможению зрительных восприятий отклоненного глаза, чем монокулярное зрение. Это создает более благоприятные условия для совместной деятельности обоих глаз. Однако первостепенное значение в указанном смысле имеет состояние фузии. Выявленная еще до операции способность зрительного анализатора сливать фонеальные изображения объектов существенно повышает эффективность послеоперационных ортонтичсских упражнений и возможность посетинонлония нормального бинокулярного зрения. За i"ii г этой способности, которая ныступает в роли надежного M oioaiiiiKn» хирурга, может быть даже устранен небольшой угол косоглазия, оставшийся после операции.
Чем постояннее угол косоглазия, тем, как правило, лучше и стабильнее результаты операции. При изменяющемся угле косоглазия в расчет следует принимать его среднюю величину. Если в процессе обследования больного девиация периодически исчезает и появляется, причем диапазон отклонения глаза бывает значительным, то производить операцию не следует.
При небольших углах косоглазия нужно особенно тщательно исследовать состояние бинокулярных функций. Способность к слиянию при нулевом положении объектов синоптофора и бинокулярное зрение, выявленное на цветовом приборе, указывают на то, что у больного имеется так называемое асимметричное бинокулярное зрение. В этих случаях, которые, правда, встречаются очень редко, операция не имеет смысла, так как после нее либо сохранится прежнее положение глаз, либо появится стойкое двоение.
427
Известное значение имеет предложение Е. М. Фишера/1958), Burian (1950) и A. Bangerter (1962) учитывать до опера/ии экскурсию глаз. При усиленной аддукции они считают целесообразным производить операцию с целью ослабить действие внутренних прямых мышц. Если же аддукция уменьшена, то /ледует выполнить операцию и на наружной прямой мышце. /
При монолатеральном косоглазии логичнее в первую очередь произвести операцию на косящем глазу, исходя из того, что на нем обычно больше выражены патологические нарушения. Такая тактика находит больше понимания у больного^ и его близких, поэтому 'оправдана и в психологическом отношении.
При альтернирующем косоглазии вопрос о /выборе глаза для выполнения операции, естественно, теряет смысл, но и в этом случае, как справедливо замечает Е. М. Фишер (1958), лучше вначале произвести операцию на том глазу, который имеет большие отклонения от нормы (например, по степени подвижности или по остроте зрения).
Исходя из физиологических соображений, следует отдать предпочтение операциям, усиливающим действие ослабленной мышцы. Нужно учитывать также ширину глазной щели, помня, что операции, усиливающие действие мышцы, несколько сужают глазную щель, а ослабляющие — несколько расширяют. Эта рекомендация относится к косоглазию без местных мышечных дефектов (фиброз, контрактура, гипертрофия, аномалии мест прикрепления), которые в ряде случаев лежат в основе врожденного косоглазия [Пильмап Н. И., Голикова Т. И., 1974; Пильмав Н. И., 1979; Сенякина А. С., 1972, 1980, 1981, и др.]. В таких случаях усиление антагониста без предварительного или одновременного освобождения такой усиленной мышцы малоэффективно.
Даже при значительных углах косоглазия не следует одновременно производить операции более чем на двух мышцах, так как при этом во много раз возрастают трудности дозирования и вероятность получения гиперэффекта.
Если после первого этапа операции сохранится остаточный угол косоглазия, то второй этап операции на другой мышце этого же глаза или на другом глазу производят через 6—8 мес. Об этом лучше всего предупредить больного или его родителей, иначе даже проведенный в соответствии с планом первый этап операции, не исправивший косоглазия полностью, может расцениваться ими как неудача.
При сочетании выраженного горизонтального отклонения глаза с вертикальным целесообразно вначале произвести операцию на горизонтальных мышцах, учитывая, что вертикальная девиация может быть не только следствием пареза мышц, но и проявлением вертикальной фории, которая в первичном положении глаза нередко исчезает. Если же вертикальное отклонение значительное и исследование глазодвигательного аппарата указывает на преимущественное поражение мышц вертикального действия, то следует произвести операцию на этих мышцах.
428
220. Расположение глазных мышц.
1 — сухожильное кольцо; 2 — верхняя косая мышца; 3 — место ее прохождения Через блок; 4 — верхняя прямая мышца; 5 — нижняя косая мышца; 6 — наружная прямая мышца; 7 — нижняя прямая мышца; 8 — внутренняя прямая мышца.
Для того чтобы произвести рациональное хирургическое вмешательство на глазных мышцах, необходимо знать их некоторые анатомо-топографические особенности. Детали топографии глазодвигателен, имеющие непосредственное отношение к технике операции, логичнее привести в соответствующем месте при их описании. Здесь же целесообразно представить данные об основных анатомо-топографических соотношениях глазных мышц (табл. 11), общую схему их расположения (рис. 220) и сочетанного действия (рис. 221).
Дли устрвпсппя косоглазия применяют операции двух типов— усиливающие и ослабляющие действие мышц. К операциям первого типа относят: 1) резекцию—укорочение мышцы посредством иссечения се участка у места прикрепления к склере и подшивания к этому месту; 2) тенорафию — укорочение путем образования складки из ее сухожилия; 3) прорафию — усиление степени натяжения мышцы в результате перемещения ее сухожилия кпереди (при вмешательствах на прямых мышцах) или кзади (при вмешательствах на косых мышцах) с образованием складки или без нее; 4) перекручивание — усиление степени натяжения мышцы с помощью винтообразного поворота ее вокруг своей оси после пересечения с последующим подшиванием к месту анатомического прикрепления.
221. Направление движений глаза при действии мышц (указано стрелками).
429
Основные анатомо-топографические соотношения глазных / мышц
Мышца Статистический показатель Место прикрепления— расстояние от лимба, мм Ширина сухожилия у , места при-7 крепления/ мм / Длина сухожилия, мм
Внутренняя М±а 5,85± 9,э4: 3,1±
прямая 0,2 0/ 0,3
Наружная М±а 7,29± 8,69+ 6,6±
прямая 0,3 1,1 1,1 5,0±
Верхняя М±а 7,4±
прямая 0,2 /0,28 0,13
Нижняя М±а 6,7± 8,9± 5,4±
прямая 0,22 0,25 0,15
Верхняя М±а 16,3+ 6,4± 26,4+
косая 1,18 1,1 4,6
Нижняя косая М+а 18,3± 0,76 7,6± 1,1 1,0
* Измерить на трупе этот угол для верхней косой мышцы не удалось. Следует полагать, что он примерно такой же, как и для нижней косой мышцы.
Ослабляют действие мышцы следующие операции: 1) свободная (или полная) тенотомия — пересечение сухожилия мышцы у места прикрепления без подшивания ее к склере; 2) тенотомия с ограничительным (предохранительным) швом — фиксация тено-томированной мышцы на некотором расстоянии от места анатомического прикрепления с помощью шва, проходящего через это место и край перепеченного сухожилия; 3) частичная тенотомия— нанесение на сухожилие мышцы с противоположных краев двух—трех неполных разрезов, несколько отстоящих друг от друга; 4) рецессия — перемещение мышцы, пересеченной у места прикрепления, кзади (при вмешательствах на прямых мышцах) или кйереди (при вмешательствах на косых мышцах) с подшиванием ее к склере; 5) пролонгация — удлинение мышцы путем полной перерезки ее сухожилия в разных направлениях и сшивания перерезанных участков; 6) фаденоперация — фиксация мышцы к склере за участком прилегания мышцы к глазному яблоку.
Для усиления действия мышц обычно производят резекцию. Тенорафию и прорафию выполняют редко, в основном при вмешательствах на косых мышцах.
Из операций, ослабляющих действие мышц, наибольшее распространение получила рецессия. Значительно реже применяют пролонгацию, тенотомию с предохранительным швом и особенно редко частичную тенотомию. Свободную тенотомию выполняют только при некоторых атипичных формах косоглазия и при операции на косых мышцах.
Способы проведения каждой из указанных операций отлича-
430
Таблица 11
[Махкам\а X. М;, 1970]
Ширина проксимальной части мышц, мм Ширина мышцы в ее средней части, мм Толщина мышцы, мм Угол между мышечной плоскостью и сагиттальной плоскостью глаза
Длина мышц, мм \ Ширина Дистальной части мышц, \ мм \
39,49± 5(3+ 8,3± 9,85± 4,2± __
3,066 од 0,37 0,27 0,15 —
46,73± 4,5б± 7,55± 9,4± 3,9± —•
4,37 0,3 \ 1,37 1,09 0,03 -—
42,35± 4.2Д 6,3± 8,1± 3,4+ 21°6'
2,8 0,27\ 0,3 0,2 0,1 2°12'
43,2± 4,57±\ 6,1± 8,37± 3,8± 20° 10'
3,47 0,24 0,3 0,22 0,1 20'
58,5± 3,0± 3,7± 5,77± 3,1± *
2,47 0,03 0,1 0,3 0,05 —
33,15+ — — 6,97± 2,9+ 60°20'
2,85 — — 0,3 0,2 6°8'
ются большим разнообразием. Однако это относится преимущественно к техническим деталям, а не к принципу самой операции. Применение многих из этих способов малооправдано: они либо не вносят в ход операции существенных изменений, либо чрезмерно усложняют ее. В связи с этим в данной главе описаны только наиболее рациональные и признанные способы хирургического вмешательства на мышцах глаза.
У детей в возрасте до 10—14 лет операции па глазных мышцах следует проводить под наркозом, отдавая предпочтение смеси лаьпсп плота и фторотапп. У взрослых и детой старшего возрос га используют местную ипфильтрациопно-проиодпиковую анестезию [Краснов М. JI., 1959]. Нужно помнить, что болевые ощущения обычно возникают при натяжении глазодвигательных мышц, имеющих богатую иннервацию. Чтобы устранить эти ощущения, необходимо вводить анестезирующее вещество в область мышечной воронки. После троекратной инстилляции в конъюнктивальный мешок 0,5—1% раствора дикаина инъецируют 1,5— 2 мл 2% раствора новокаина под оперируемую мышцу, а затем, несколько изменяя направление иглы, за глазное яблоко. Небольшое количество (0,3—0,5 мл) раствора новокаина следует ввести и под конъюнктиву в месте прикрепления мышцы.
«Вопрос вопросов» в хирургии косоглазия — это правильное дозирование эффекта операции. Некоторые авторы справедливо отмечают, что при одной и той же величине укорочения или перемещения мышцы не всегда получается одинаковый результат в смысле влияния на угол косоглазия. На этом основании они делают вывод о том, что невозможно произвести предварительные
431
расчеты дозирования эффекта операции. С таким выводо/ согласиться нельзя. 1
Установлено [Махкамова X. М., 1964; Тетерина Т. А., 1965], что между степенью укорочения или перемещения мышцы и полученной величиной изменения угла косоглазия имеется высокая прямая корреляция. Это позволяет считать, что ориентировочный предварительный план дозирования эффекта операции на глазодвигательных мышцах возможен. /
Для суждения о том, какая степень укорочения или перемещения мышц примерно потребуется для устранения данного угла косоглазия, необходимо прибегнуть к определению моды, т. е. той величины варианты, которая встречается чаще всего. Если разбить достаточно большое число операций на ^группы так, чтобы в каждой из них оказались больные, который произведена ослабляющая или усиливающая операция на мышцах одной и той же степени, то за моду следует принять угол косоглазия, чаще всего исправляющийся при данной степени дозирования.
Рассчитанная по этому статистическому принципу схема дозирования операций при сходящемся косоглазии представлена в табл. 12 [Аветисов Э. С., Махкамова X. М., 1966].
Таблица 12
Наиболее частая величина исправления угла косоглазия при той или иной степени перемещения и укорочения мышцы (в миллиметрах)
Степень рецессии внутренней прямой МЫШЦЫ Степень резекции наружной прямой мышцы этого же глаза Степень рецессии внутренней прямой мышцы другого глаза Степень резекции наружной прямой мышцы другого глаза Мода, градусы
I э т а п И этап
4 — 10
4 4 — — 10
4 5 — 10
4 6 — — 15
4 7 — 20
4 8 — — 20
4 9 — — 25
4 6 4 — 25
4 8 4 — 30
4 8 4 6 45
4 8 4 8 60
Эта таблица может служить ориентиром для предварительного определения степени рецессии и резекции при том или ином угле косоглазия. При использовании других ослабляющих и усиливающих мышцу операций статистическую обработку материала и составление таблицы проводят применительно к этим операциям. Целесообразно во время операции вносить некоторые коррективы в дозирование. Если мышца, подлежащая резекции, выглядит
432
дряблой, то степень предполагаемого ее укорочения увеличивают на 1—2\мм.
Известно, что под влиянием наркотических веществ глаза отклоняются» кверху и кнаружи, причем величина этого отклонения сильно варьирует. В связи с этим при проведении наркоза по положению глаз на операционном столе нельзя судить об эффекте вмешательства на глазных мышцах. В этих условиях принцип предварительного дозирования операции является единственно возможным. \
Пользоваться^ таблицей дозирования операции исправления косоглазия следует и в тех случаях, когда ее производят под местной анестезией. В этом случае можно оценить результат хирургического вмешательства непосредственно на операционном столе и внести некоторые коррективы в намеченную схему дозирования. Однако такая оценка затруднена из-за того, что под влиянием новокаина угол косоглазия также изменяется в довольно широких пределах. Желательно во время операции придать глазам больного положение некоторого гиперэффекта.
Для проведения операций на глазных мышцах необходимы векорасширитель, фиксационный, анатомический и хирургические пинцеты, специальные изогнутые под тупым углом ножницы, крючки для мышц, измерительное устройство (миллиметровая лппепка, циркуль и др.), иглодержатель, тупоконечные ножницы для отрезания швов, шпатель, острая ложечка для выскабливания склеры, иглы для наложения лигатуры на мышцу и швов на конъюнктиву, топкие изогнутые (лучше атравматические) иглы для наложения эписклеральных швов. Могут потребоваться также зажимы для мышц, крючок для верхней косой мышцы и пинцет для образования складки на этой мышце. Предложено много других инструментов, ио их примени ют только при некоторых модификациях операций устра пепин косоглазия, не получивших распространения.
В кичосгпе пшппого материпла при .хирургических вмешательствах па мышцах глаза используют топкий и прочный кетгут 1:0 и 2 : 0, шелк 2:0 и 3:0 для конъюнктивы, шелк 1 : 0 для прошивания мышц и шелк 3:0 и 4:0 для наложения лигатуры на мышцу. Применяют также биологические швы. Особенно удобны синтетические швы, которые после операции не нужно снимать.
Операции на мышцах горизонтального действия
При сходящемся косоглазии необходимо либо усилить действие наружных прямых, либо ослабить действие внутренних прямых мышц. При расходящемся косоглазии, наоборот, надо либо усилить действие внутренних прямых, либо ослабить действие наружных прямых мышц. В физиологическом отношении лучше сочетать усиление слабой мышцы с ослаблением ее антагониста.
Не следует перемещать внутреннюю прямую мышцу кзади больше чем на 4 мм, чтобы не нарушать акт конвергенции. На
28 Руководство по глазной хирургии 433
222. Разрез конъюнктивы и влагалища глазного яблока (схема).
i
наружной прямой мышце допустима рецессия в пределах 6 мм. Степень укорочения названных мышц, как правило, не должна превышать 8 мм. Только при очень больших углах косоглазия и резко ослабленной мышце это укорочение можно увеличить до 10 мм.
Выделение мышцы. Нужно помнить, что внутренняя и наружная прямые мышцы начинаются в глубине глазницы от сухожильного кольца и прикрепляются к склере на расстоянии соответственно 5,7—6,1 и 7—7,6 мм от лимба. Разрез конъюнктивы следует делать кпереди от места прикрепления указанных мышц, иначе можно ранить их И вызвать кровотечение, которое затруднит проведение операции.
Предлагают производить горизонтальный разрез конъюнктивы [Worst et al., 1971], отдельные несовпадающие разрезы конъюнктивы и влагалища глазного яблока [Swan К. С., 1970] или отсе-паровывать П-образный конъюнктивальный лоскут [de Decker. 1967], начиная на расстоянии 2 мм от Лимба. Преимущества таких разрезов сомнительны.
Предпочтителен вертикальный разрез конъюнктивы и влагалища глазного яблока, который делают на расстоянии 4—5 мм от лимба параллельно ему (рис. 222). Длина разреза 8—10 мм. В него вводят сомкнутые ножницы и с их помощью тупо отделяют конъюнктиву и влагалище глазного яблока от склеры. В случае необходимости увеличить разрез влагалища глазного яблока бранши ножниц при их извлечении несколько раздвигают. Крючок, обращенный концом в противоположную от мышцы сторону, проводят вдоль края мышцы, а затем поворачивают концом к склере, под мышцу, целиком захватывая ее сухожилие. Ножницами на протяжении 6—10 мм осторожно, чтобы не поранить мышцу, освобождают ее от сращения с окружающими тканями.
Операции, усиливающие действие мышцы. Операции перемещения мышцы кпереди и образование на ней складки при исправлении горизонтального косоглазия сейчас почти не применяют.
434
223. Наложение лигатурного шва на мышцу (схема).
Прорафия дает незначительный эффект. Мышцу при этом пересаживают близко к роговице, что вызывает трудности в наложении эписклеральных швов и ведет к образованию под конъюнктивой у лимба заметного валика. Необычное прикрепление натянутой мышцы иногда сопровождается появлением вертикального отклонения глаза. Пересаженный кпереди участок мышцы срастается со склерой на всем протяжении от нового до прежнего места прикрепления [Благовещенский М. Н., 1934], и прорафия по сути превращается в операцию резекции — более удобную и простую по технике.
Существенные недостатки имеет и операция образования мышечной складки. Такую складку трудно укрепить швами, которые нередко расходятся, со временем складка расправляется и эффект операции значительно снижается. После операции долгое время сохраняется узловатое утолщение под конъюнктивой. Для предупреждения последнего Кйрег (1964) рекомендует образовывать складку таким образом, чтобы опа оставались под мышцей. Однако это не устраняет другие недостатки тенорафии. Из операций, усиливающих действие мышцы, лучшей, несомненно, является резекция [Muller, 1893].
В результате многолетнего опыта в Московском научно-исследовательском институте глазных болезней им. Гельмгольца разработана экономная и рациональная техника резекции. После выделения мышцы под нее подводят два крючка. Один оставляют у места прикрепления мышцы, другой максимально отодвигают кзади. Па расстоянии 3—4 мм от места прикрепления мышцы на ее сухожилие накладывают лигатурный шов. Иглу проводят под мышцу у ее верхнего края и через мышцу на границе средней и нижней третей. Затем иглу вкалывают в мышцу на границе верхней и нижней третей и выводят у ее нижнего края. Один конец шва проводят через петлю в сторону виска, другой — в обратном направлении (рис. 223). При затягивании такого шва в узел попадает все Сухожилие.
С помощью циркуля отмеряют предполагаемое место перерезки мышцы и маркируют его бриллиантовым зеленым. В этом мес-28» 435
Наложение швов на мышцу при ее резекции (схема).
225.
Проведение швов, наложен ных на мышцу, через сухожильную ПОЛОСКУ П ЭШ1-склеру у места анатомпчо ского прикрепления мышцы (схема).
те на мышцу сверху и снизу накладывают два синтетических шва, захватывая по ’/з — ’А ширины мышцы. Нити швов завязывают двумя узлами (рис. 224).
Сухожилие мышцы у места прикрепления к склере пересекают, оставляя тонкую полоску, которую удерживают фиксационным пинцетом. Наложенные на мышцу швы проводят через сухожильную полоску у верхнего и нижнего краев, захватывая при
436
227.
Наложение шва на резецируемую мышпу по методике Фишера.
этом эписклеру (рис. 225). Ассистент подтягивает мышцу за лигатуру к месту прикрепления, а хирург в это время завязывает нити швов тремя узлами. Нити перерезают у самого узла. Оставшуюся культю мышцы отсекают (рис. 226). На конъюнктивальный разрез накладывают несколько узловатых швов или непрерывный шов из тонкого шелка. Непрерывный шов легко снимается, поэтому он особенно удобен при хирургическом вмешательстве у детей.
Погружные синтетические швы позволяют очень прочно укрепить резецируемую мышцу. При их отсутствии целесообразно наложить шов по Фишеру [Фишер Е. М., 1935, 1958]. После выделения мышцы под пее подводят крючок. Сухожилие мышцы фиксируют специальным пинцетом и рассекают у места прикрепления к склере, оставляя топкую полоску. Матрацный шелковый шов пронодн! па двух иглах па расегонппи 5 — 7 мм одна от другой, пнпчпле через задний край коньюнктивального разреза и через мышцу, а затем через сухожильную полоску у места прежнего прикрепления и через передний край конъюнктивального разреза (рис. 227). Нити шва завязывают. Захваченную пинцетом культю сухожилия отсекают. Наложения дополнительного шва на конъюнктиву обычно не требуется.
Для наложения шва по Фишеру вместо шелка лучше использовать кетгут. Это позволяет дважды провести шов через резецируемую мышцу, затянуть его в узел и тем самым сделать крепление мышцы более прочным.
Цель некоторых модификаций операции — оценить, насколько правильно была намечена величина укорочения мышцы, и в случае необходимости внести коррективы. Предлагают, например, такой способ. Предварительно образуют на мышце складку, соответствующую величине предполагаемого резецирования. Фиксируют эту складку швами [Махкамова X. М., 1964] или специальными клеммами [Аветисов Э. С., 1977], а затем проверяют
437
относительное положение глаз и вносят дополнительную поправку в величину резецируемого участка мышцы. При другом Способе у лимба предварительно проводят эписклеральный шов и/ постепенно натягивая его и наложенную на мышцу лигатуру во встречных направлениях, достигают срединного положения Косящего глаза. После этого определяют необходимую величину укорочения мышцы [Абдусаматов Г. Ш., 1964].
Следует отметить, что все эти манипуляции усложняют и удлиняют операцию. Они не имеют смысла, если операцию производят под общим наркозом. Однако и при местной анестезии определение истинного положения глаз на операционном столе затруднительно: под влиянием новокаина и хирургической травмы изменяется мышечный баланс, наступает блокада мышц, ограничиваются и нарушаются движения глаз. Видимо, по этой причине упомянутые выше, на первый взгляд, довольно заманчивые предложения дозировать эффект операции в ходе ее проведения нс-получили распространения.
Операции, ослабляющие действие мышцы. Для ослабления действия мышцы чаще всего применяют рецессию [Pflugk, 1905, Jameson, 1922, 1931]. В Московском научно-исследовательском институте глазных болезней им. Гельмгольца ее делают следующим образом. Под мышцу, выделенную обычным способом, подводят крючок. Отступя 2 мм от места прикрепления к склере, на сухожилие мышцы сверху и снизу накладывают два синтетических шва. Каждый шов захватывает */з—lli ширины мышцы (рис. 228). Нити швов завязывают. Ножницами пересекают сухожилие у места его прикрепления, оставляя на склере тонкую полоску. Захватывают последнюю фиксационным шинцетом и, удерживая с его помощью глазное яблоко, выскабливают острой ложечкой поверхностные слои склеры у места предполагаемой пересадки мышцы.
Циркулем измеряют заданную величину перемещения мышцы. Ножки циркуля устанавливают таким образом, чтобы одна из них находилась у верхнего (а затем у нижнего) края сухожильной полоски, а вторая располагалась строго в направлении мышечной плоскости (рис. 229). Конец этой ножки смазывают бриллиантовым зеленым, которым делают отчетливые отметки на склере.
Фиксационным пинцетом захватывают сухожильную полоску, чтобы прочно удержать глаз в неподвижном положении. Атравматическую иглу с синтетической нитью, ранее наложенной на мышцу, проводят через поверхностные слои склеры в месте одной из отметок в направлении, параллельном экватору глаза. Как только кончик иглы появится у поверхности склеры, ассистент подводит под него шпатель перпендикулярно направлению иглы (рис. 230). Аналогичным образом накладывают шов и у места второй отметки на склере. Нити швов завязывают тремя узлами и отсекают у самого узла. На конъюнктиву накладывают непрерывный шов. Если сухожилие мышцы при рецессии крепят к 438
228.
Наложение швов на сухожилие мышцы при рецессии (схема).
229.
Измерение величины перемещения мышцы (схема).
230.
Наложение эписклеральных швов на новом месте прикрепления мышцы (схема).
231. Операции удлинения мышцы (схемы) по Стевенсону (а), Гримждалю (б), Ландольту (в), Ганену (г) и Кунту (д).
склере с помощью шелковых швов, то их выводят поверх конъюнктивы и в последующем снимают.
Для обозначения на склере .места пересадки мышцы удобен пинцет-локализатор, предложенный Н. И. Пильмап (1964). Это обычный фиксационный пинцет, к концу одной из браншей которого припаяна маленькая измерительная дуга с (.миллиметровыми делениями. Пинцет одновременно фиксирует глазное яблоко и позволяет обозначить место на склере, к которому нужно подшить отрезанную мышцу.
Чтобы сохранить при рецессии правильное направление мышечной плоскости, предлагают отсекать мышцу только после предварительного наложения швов и на нее, и на склеру [Abrams, 1965]. Для ослабления действия мышцы применяют также операцию по ее удлинению [Stephenson К. L., 1902]. Техника наиболее распространенных модификаций этой операции схематически показана на рис. 231. При наличии узкого сухожилия операция пролонгации мышцы затруднительна.
440
232. Тенотомия с предохранительным швом (схема).
а, б — этапы операции.
Рекомендуют ослаблять мышцу и с помощью тенотомии спредохранительным швом (рис. 232), предложенной Bielschowsky (1918). К достоинствам операции относят возможность дозирования ее эффекта путем укорочения или удлинения фиксирующего Шва как на операционном столе, так и в первые дни после вмешательства. Однако достоинства эти преувеличены. О трудностях определения истинного положения глаз па операционном столе уже упоминалось при оценке аналогичного принципа проведения резекции мышцы. Что касается изменения степени натяжения предохранительного шва в первые дни после операции, то эта процедура сложна и болезненна, поэтому ее практически не применяют. Отмечено, что после тенотомии с предохранительным швом может наблюдаться грубое и неправильное приживление мышцы со смещением по вертикали.
Частичную тенотомию используют очень редко, главным образом как вспомогательное вмешательство на ранее оперированных мышцах при небольшом (5—8°) остаточном угле косоглазия [Халецкая Л. Я., 1909]. Прямыми ножницами с противоположных краев мышцы проводит два разреза, каждый из которых захватывает -’/з со ширины, г. е. обязательно заходит за середину. Перяып разрез делают на расстоянии 8 мм, второй — 4 мм от моста прикрепления мышцы к склере (рис. 233).
Для уменьшения ротационного эффекта мышцы С. Cuppers (1972) разработал так называемую фаденоперацию, заключающуюся в подшивании мышцы к склере позади участка ее прилегания к глазному яблоку.
Для обеспечения лучшего доступа к операционому полю один разрез конъюнктивы делают параллельно лимбу, а два других —
233. Частичная тенотомия (схема).
а, б — этапы операции.
441
234. Заключительный этап фаде-ноперации (схема).
ция показана прежде всего
риодическим отклонением глаз.
в радиальных направлениях. Оперируемую прямую мышцу отсекают от места прикрепления и выделяют на большом протяжении. Затем на определенном расстоянии от места прикрепления (обычно 14 мм) проводят два шва через эписклеру и брюшко мышцы. Затем мышцу вновь подшивают к месту прикрепления, а швы через эписклеру и брюшко мышцы стягивают, но не чрезмерно (рис. 234). Этим создается новое прикрепление мышцы, благодаря чему дозированно уменьшается ротационный эффект мышечного сокращения. Первичное положение глазного яблока при этом не меняется. Опера-при изменчивом угле косоглазия с пе
Операции на мышцах вертикального действия
Вертикальное косоглазие обычно связано с парезом мышц вертикального действия, нередко сопровождается «глазным» торти-коллисом; для устранения такого косоглазия, как правило, требуется хирургическое вмешательство. При наличии постоянного .вынужденного положения головы операция показана в возрасте 3—4 лет.
Небольшую вертикальную девиацию (до 5—7°) целесообразно компенсировать ношением призм, если это помогает.
Как известно, движения глаз по вертикали обеспечиваются двумя прямыми и двумя косыми мышцами. Механизм сочетанного действия этих мышц очень сложен и зависит от исходного положения глаз, поэтому в хирургии вертикального косоглазия первостепенное значение имеет правильный выбор мышцы или мышц, на которых следует произвести операцию. Следует помнить, что максимальным поднимающим и опускающим действием верхняя и нижняя прямые мышцы обладают в положении абдукции, а верхняя и нижняя косые мышцы — в положени аддукции. Эта их особенность нередко позволяет выявить пораженную мышцу уже путем упрощенного или фотографического определения поля взора в восьми направлениях. В затруднительных случаях необходимо использовать методы коордиметрии и «спровоцированной» диплопии. Возможные пути устранения девиации при поражении той или иной мышцы вертикального действия показаны в табл. 13.
442
Таблица 13
Возможные пути устранения девиации при поражении той или иной мышцы вертикального действия
Пораженная мышца Возможные пути устранения девиации
Верхняя косая Усиление пораженной верхней косой мышцы, ослабление нижней косой мышцы того же глаза, усиление верхней прямой мышцы другого глаза,
Верхняя прямая ослабление нижней прямой мышцы другого глаза Усиление пораженной верхней прямой мышцы, ослабление нижней прямой мышцы того же глаза, усиление верхней косой мышцы другого глаза, ослабление нижней косой мышцы другого глаза
Нижняя косая Усиление пораженной нижней косой мышцы, ослабление верхней косой мышцы того же глаза, усиление нижней прямой мышцы другого глаза, ослабление верхней прямой мышцы другого гла-
Нижняя прямая Усиление пораженной нижней прямой мышцы, ослабление верхней прямой мышцы того же глаза, усиление нижней косой мышцы другого глаза, ослабление верхней косой мышцы другого глаза
Общие правила выполнения операций заключаются в следующем. Устранение вертикального косоглазия следует начинать с операции, усиливающей действие паретичной мышцы. При значительной девиации (более 10°) или гиперфункции гомолатераль-ного антагониста целесообразно одновременно его ослабить. При Истинной контрактуре гомолатералыюго антагониста (исследование пасен иных днпжепий глаза а условиях наркоза) показано только ого ослабление [Adolsleiп, Cuppers С., 1964]. Если эффект хирургического вмешательства па пораженном глазу окажется недостаточным, то через G—8 мес можно произвести операцию на мышцах другого глаза: ослабление контралатерального синергиста при его избыточной активности или усиление контралатерального антагониста. С этих операций лучше начинать исправление вертикального косоглазия в тех случаях когда фиксирующим является пораженный глаз.
Верхняя и нижняя прямые мышцы начинаются в глубине глазницы от сухожильного кольца и прикрепляются к склере на расстоянии соответственно 7,2—7,6 и 6,5—6,9 мм от лимба. Плоскость этих мышц образует с сагиттальной плоскостью глаза угол 19—23°, открытый в сторону виска. Техника операций на верхней и нижней мышцах такая же, как и на горизонтальных прямых мышцах. Допустимо перемещение их кзади на 3—4 мм и укорочение на 5—7 мм. При большем их ослаблении или усилении может измениться нормальное положение век.
443
235.
Топография области прикрепления нпжней косой мышцы.
1 — наружная прямая мышца, 2 — нижняя прямая, 3 — нижняя косая, 4 — желтое пятно, 5 — сосуды ресничного тела, 6 — зрительный нерв.
В хирургии вертикального косоглазия наиболее сложными являются операции на косых мышцах глаза. Это объясняется их анатомо-топографическими особенностями. Угол между плоскостью косых мышц и сагиттальной плоскостью глаза открыт кнутри и составляет 54—66°. Верхняя косая мышца берет начало у сухожильного кольца, проходит через блок у верхневнутреннего края глазницы, превращается здесь в сухожилие, идет кзади и кнаружи и прикрепляется к склере под верхней прямой мышцей позади экватора на расстоянии 15,2—17,4 мм от лимба. Линия прикрепления верхней косой мышцы располагается косо к мышечной плоскости. Ширина сухожилия у места прикрепления варьирует от 5,3 до 7,5 мм и более.
Нижняя косая мышца, начинаясь от нижневнутреннего края глазницы, направляется кзади кнаружи, проходит под нижней прямой мышцей и прикрепляется к склере, почти не образуя сухожилия, на уровне нижнего края наружной прямой мышцы позади экватора на расстоянии 17,5—19,1 мм от лимба. Форма линии прикрепления мышцы разнообразна, ширина линии прикрепления 6,5—8,7 мм. Нижняя косая мышца соединена с нижней прямой мышцей с помощью фасциального тяжа — связки Локвуда. На степень натяжения мышцы" после ее умеренного усиления или ослабления в результате операции это не влияет. При операциях на нижней косой мышце следует иметь в виду, что близко от места ее прикрепления расположены зрительный нерв, область желтого пятна сетчатки и вортикозные вены (рис. 235).
В зависимости от величины вертикальной девиации перемещение или укорочение косых мышц производят в пределах 5—10 мм. При операциях на косых мышцах требуются специальные инструменты (рис. 236).
Операции на верхней косой мышце. Для усиления действия верхней косой мышцы обычно применяют резекцию и тенорафию [Каллахан А., 1963; Аветисов Э. С., 1969; McLean J. М., 1949;
444
236. Иструменты для операций на косых мышцах глаза.
а — остроконечный крючок; б — ограничитель для рецессии; в — пинцет для фиксации склеры (все по Финку); г — пинцеты для фиксации нижней косой мышцы и наложения на нее швов (по Ляйху); д — тупоконечный крючок; е — инструмент для образования складки (оба по Э. G. Аветисову).
Fink W. Н., 1951, 1954; Arruga Н., 1901 J. Складку на этой мышце предпочитают делать потому, что идущая от блока к глазному яблоку часть ее целиком состоит из сухожилия. Операцию образования складки на верхней косой .мышце производят следующим образом.
Параллельно верхнему краю лимба и отступя от него 5—6 мм делают разрез конъюнктивы и влагалища глазного яблока длиной 12—15 мм (рис. 237). Под верхнюю прямую мышцу подводят крючок. Ее либо пересекают, предварительно наложив по краям два шва для последующего прикрепления к прежнему месту, либо отводят в сторону и удерживают в этом положении. Конъюнктиву и влагалище глазного яблока тупым путем широко освобождают от склеры. С помощью фиксационного пинцета или шва, наложенного на сухожильную полоску, оставшуюся после пересечения верхней прямой мышцы, глазное яблоко поворачивают книзу и кнутри. Если мышцу не пересекали, то тракционный шов накладывают на эписклеру у верхнего края лимба. Остроконечным (или тупоконечным в виде буквы П) крючком, проведенным плашмя по поверхности склеры кзади на 10—12 мм от места прикрепления верхней мышцы и затем повернутым кверху, захватывают
445
237. Разрез конъюнктивы и влагалища глазного яблока при операциях на верхней косой мышце (схема).
сухожилие верхней косой мышцы. Его освобождают от прилегающих тканей и растягивают на двух крючках. На сухожилие верхней косой мышцы ближе к месту прикрепления накладывают специальный инструмент, с помощью которого образуют складку нужной величины. Про
шивают ее у основания с одного и другого края двумя синтетическими швами (рис. 238). После снятия инструмента складку уплощают (рис. 239). Если верхнюю прямую мышцу временно перерезали, то ее фиксируют швами на прежнем месте. На конъюнктиву накладывают непрерывный шов.
J. М. McLean (1949) рекомендует образовывать складку у самого места прикрепления верхней косой мышцы к склере, укла
дывать складку в височную сторону и крепить швами к эписклере (рис. 240). Таким образом осуществляют перемещение мышцы кзади с образованием складки. Более сложна по технике резекция верхней косой мышцы. Здесь очень важно прочно укрепить резецированную мышцу. При проведении этой операции верхнюю прямую мышцу лучше временно перерезать.
Сухожилие верхней косой мышцы выделяют так, как было описано выше. Вытягивают его крючком. Отмеряют величину предполагаемого укорочения и отмечают анилиновой краской место наложения швов. Проводят через это место у одного и другого края два синтетических шва, захватывая им1и по */з—'Д ширины сухожилия. Последнее пересекают латеральнее швов и у места прикрепления к склере, оставляя узкую полоску. Через нее, захватывая и поверхностные слои склеры, проводят два шва, ранее наложенных на сухожилие. Швы завязывают. Верхнюю прямую мышцу укрепляют на прежнем месте. Конъюнктиву зашивают непрерывным швом.
Резекцию верхней косой мышцы производят и другим методом. Так, Э. С. Аветисов (1969) предлагает следующий способ: образуют складку из сухожилия мышцы, прошивают ее несколько раз у основания, завязывают шов в прочный узел и часть складки поверх узла отсекают. При вертикальной девиации более 10° автор сочетает эту операцию с рецессией верхней прямой мышцы.
Из операций, ослабляющих действие верхней косой мышцы, чаще всего применяют тенотомию. Сухожилие мышцы обнажают
446
238.
Прошивание складки, образованной на верхней косой мышце, у ее основания (схема).
239.
Уплощение складки на верхней косой мышце (схема).
240.
Перемещение верхней косой мышцы кзади с образованием складки (схема).
обычным способом и оттягивают крючком. На протяжении 4—5 мм надрезают сверху в продольном направлении фасцию, покрывающую сухожилие, захватывают ее крючком и перерезают (рис. 241). При значительном отклонении глаза для получения большего эффекта иссекают 3—6 мм сухожилия. Накладывают шов на конъюнктиву.
McGuire (1953) применяет рецессию верхней косой мышцы: пересекает ее у места прикрепления, перемещает кпереди и укрепляет эписклеральны-
ми швами.
Операции на нижней косой мышце. Для усиления действия нижней косой мышцы ее чаще всего не только укорачивают, но и пересаживают кзади. Это вызвано тем, что названная мышца
имеет очень короткое сухожилие, поэтому при резецировании даже в обычных пределах захватывается и брюшко мышцы, что нежелательно. Одно только укорочение мышцы показано при небольшой девиации.
Операцию производят следующим образом. Отступя 10—12 мм от наружного края лимба, делают вертикальный разрез конъюнктивы и влагалища глазного яблока длиной 12—15 мм. Его начинают у верхнего края наружной прямой мышцы и осторожно, чтобы не поранить ее, ведут книзу. Эту мышцу освобождают и оттягивают кверху. Крючком захватывают нижнюю косую мышцу (рис. 242). Определяют величину резекции, начиная от места
448
прикрепления, и отмечают анилиновым красителем линию наложения швов. Проводят два шва: один — у верхнего, другой — у нижнего края мышцы. Нити швов прочно завязывают. Если предполагается и пересадка мышцы, то маркируют соответствующие точки дальше места ее анатомического прикрепления. Удерживая мышцу пинцетом или дополнительно наложенным швом, резецируют ее участок между местом прикрепления и предварительно наложенными швами. Последние проводят через поверхностные слои склеры у намеченных точек (рис. 243), завязывают и отрезают. Если запланировано только укорочение мышцы, то ее подшивают к месту анатомического прикрепления. Накладывают шов на конъюнктиву.
Для ослабления действия нижней косой мышцы применяют рецессию. Операционное поле обнажают тем же приемом, что и при резекции этой мышцы. Наружную прямую мышцу оттягивают кверху. Захватывают крючком нижнюю косую мышцу. На расстоянии 2—3 мм от места прикрепления на нее сверху и сливу накладывают два синтетических шва. Каждый шов захватывает Уз—’Д ширины мышцы. Ее пересекают у места прикрепления (рис. 244). Книзу и кпереди по ходу мышечной плоскости отмеряют намеченную величину перемещения мышцы и соответственно отмечают анилиновым красителем две точки на расстоянии 6—7 мм друг от друга. Нужно следить за тем, чтобы эти точки не совпали с местом выхода нижней вортикозной вены. Фиксационным пинцетом захватывают сухожильную полоску, оставшуюся после пересечения мышцы, и удерживают глаз в неподвижном положении. Ранее наложенные на мышцу швы проводят через поверхностные слои склеры у намеченных точек (рис. 245), завязывают и перерезают. Наружную прямую мышцу отпускают. Конъюнктиву зашивают.
Для ослабления действия нижней косой мышцы можно использовать также тенотомию.
Ведение послеоперационного периода
После операции в глаз инстиллируют 1—2 капли 30% раствора сульфацил-натрия или другого антисептика и накладывают повязку, как правило, бинокулярную. Перевязки делают ежедневно. Швы с конъюнктивы снимают на 4—5-й день. Если на мышцу накладывали шелковые швы, то их снимают на 6—7-й день. Ортоптические и диплоптические упражнения по показаниям начинают возможно раньше, как только позволяет состояние глаз. Эти упражнения улучшают подвижность глаз, способствуют устранению остаточной девиации и восстановлению бинокулярного зрения. Выписывают больных из стационара на 5—7-й день после операции.
Ни до, ни после операции не следует назначать медикаментозные средства, действующие на аккомодацию и опосредованно на конвергенцию, например раствор атропина. Такие препараты ока-
29 Руководство по глазной хирургии
449
244.
Отсечение нижней косой мышцы при ее рецессии (схема).
245.
Укрепление на новом месте нижней косой мышцы при ее рецессии (схема).
зывают временное влияние на положение глаз, иногда вызывают парадоксальное действие и создают дополнительные трудности при оценке эффекта операции.
Лучше воздействовать на положение глаз с помощью повязки. Если после исправления сходящегося косоглазия наблюдается гипоэффект, то целесообразно оставить бинокулярную повязку на несколько дней. Такое естественное устранение аккомодации исключает также импульс к конвергенции, обусловливая тем са-450
J
мым тенденцию к расхождению зрительных осей. При выраженном гиперэффекте целесообразно оставить монокулярную повязку для подключения аккомодации и конвергенции. После хирургического исправления расходящегося косоглазия поступают наоборот: при типоэффекте предпочитают монокулярную повязку, при гиперэффекте — бинокулярную. Другие виды «ортоптиче-ских» повязок себя не оправдывают.
Операции при некоторых атипичных формах косоглазия
В офтальмологической литературе обсуждается вопрос о тактике хирургического вмешательства при так называемых синдромах «А» (эй) и «V» (ви), суть которых состоит в изменении положения глаз при направлении взора прямо вверх и прямо вниз [Urist, 1951, 1963; Brown I. В., 1953].
При синдроме «А» и сходящемся косоглазии угол отклонения увеличивается при взгляде вверх и уменьшается при взгляде вниз; при расходящемся косоглазии девиация больше при взгляде вниз и меньше при взгляде вверх. При синдроме «V» и сходящемся косоглазии угол отклонения уменьшается при взгляде вверх и увеличивается при взгляде вниз; при расходящемся косоглазии девиация больше при взгляде вверх и меньше при взгляде вниз.
Полагают, что синдромы «А» и «V» указывают на комбинированное нарушение равновесия и горизонтальных, и вертикальных мышц. При этих синдромах рекомендуют применять симметричные операции, перемещать горизонтальные мышцы по вертикали или даже производить вмешательства на косых мышцах.
Наиболее принятая тактика хирургического вмешательства при синдромах «А» и «V» заключается в следующем. Синдром «А»: при сходящемся косоглазии рекомендуют симметричную резекцию обеих наружных прямых мышц, при расходящемся — резекцию обеих внутренних прямых мышц. Синдром «V»: при сходящемся косоглазии производят симметричную рецессию обеих внутренних прямых мышц, при расходящемся — рецессию обеих наружных прямых мышц [Пильман Н. И., 1964; Urist, 1963]. Если эффект недостаточен, то дополнительно производят несимметричную операцию, а также операции на мышцах вертикального действия.
Необходимо отметить, что трактовка механизма синдромов' «А» и «V» неубедительна. Известно, например, что и в нормальных условиях отклонение взора книзу сопровождается усиленной конвергенцией, отклонение взора кверху — усиленной дивергенцией.
Следовательно, косоглазие с синдромом «V» служит проявлением обычных физиологических отношений. Мы считаем пре-
29*
451
увеличенным мнение о практическом значении синдромов «А» и «V».
Современная тактика хирургического вмешательства при содружественном косоглазии почти исключает возможность отклонения глаза после операции в противоположную сторону, т. е. возникновения вторичного обратного косоглазия. Причиной его чаще всего служит свободная тенотомия или отхождение плохо пришитой мышцы после тенотомии с ограничительным швом и рецессии. В этих случаях показана повторная операция, главная задача которой заключается в том, чтобы найти тенотомирован-ную мышцу и подшить ее к анатомическому месту прикрепления. Если девиация значительная (более 20°) и мышца полностью сохранена, то можно дополнительно укоротить ее (на 3—5 мм) или пересадить (на 3—4 мм) ближе к лимбу. Ничего другого при этой корригирующей операции делать не следует. Через 6—8 мес оценивают ее результат и при наличии остаточной девиации производят необходимое вмешательство на другой мышце.
Для поиска тепотомированной мышцы после проведения разреза и широкой отсепаровки конъюнктивы и влагалища глазного яблока вначале используют крючок. Действовать им нужно осторожно, учитывая, что мышца нередко непрочно спаяна со склерой. Иногда она приращена к последней порциями. Если выделить тенотомированную мышцу таким способом не удается, то ее пытаются обнаружить в подконъюнктивальной ткани, захватывая эту ткань в глубине операционной раны хирургическим пинцетом. На выделенную мышцу сразу же накладывают два синтетических шва для прикрепления к склоро.
Иногда оперированную мышцу найти не удается. В этих случаях можно подшить к склере влагалище глазного яблока, выбрав на нем место для наложения швов с таким расчетом, чтобы глаз принял первичное или близкое к нему положение. Аналогичным образом поступают и в очень редких случаях врожденного отсутствия мышцы или ее повреждения.
Своеобразной формой патологии глазодвигательного аппарата является синдром ретракции глаза, или синдром Штпллипга — Тюрка — Дуэйна. Для него характерно отклонение глазного яблока кнутри, отсутствие его движений кнаружи и ограничение движений кнутри, западение глаза при таких движениях, сужение глазной щели при аддукции и расширение при попытке повернуть глаз кнаружи, иногда отклонение его по вертикали. Расстройства движений глаз при ретракционном синдроме могут быть связаны с нарушениями анатомических соотношений (врожденное недоразвитие наружной прямой мышцы, превращение ее в соедпнительнотканный тяж, неправильное место прикрепления к склере, укорочение фасциальной оболочки) или с парадоксальной иннервацией внутренней и наружной прямых мышц. При анатомических дефектах пассивные движения глаза кнутри затруднены (положительный тракционный тест).
Хирургическое вмешательство показано только при наличии
452
девиации. Целесообразна рецессия внутренней прямой мышцы. Рекомендуют также частичную трансплантацию вертикальных прямых мышц к месту прикрепления наружной прямой мышцы (Orlowski, 1963]. При отклонении глаза кверху или книзу производят соответствующие операции на мышцах вертикального действия. Если ретракция глаза обусловлена анатомическими дефектами, то после этих вмешательств она обычно уменьшается.
Нарушения движений глаза, нередко сопровождаемые его ретракцией, могут возникать и при парадоксальной иннервации других пар глазных мышц [Papst, 1962]. Возможен также синдром вертикальной ретракции глаза, связанный с фиброзными изменениями нижней прямой мышцы [Khodadoust, von Noorden, 1967J. Во всех этих случаях решающее значение при выборе метода операции имеет правильный анализ механизма этих нарушений.
От истинного пареза нижней косой мышцы нужно отличать со всевдопарез, связанный с синдромом сухожильного влагалища верхней косой мышцы [Brown J. В., 1960]. При этом синдроме выявляются следующие признаки: при аддукции — недоведение глаза, при взгляде прямо кверху — недоведение кверху и легкое отклонение кнаружи, компенсаторный поворот головы в здоровую сторону и легкий наклон в сторону поражения. Причиной возникновения синдрома Брауна являются изменения фасциальной оболочки сухожилия верхней косой мышцы, ведущие к его укорочению или затрудняющие прохождение через блок. Диагноз устанавливают на основе резкого ограничения или отсутствия пассивных движений аддуцированного глаза вверх (положительный тракционный тест). При этом синдроме рекомендуют рецессию (или тенотомию) верхней косой мышцы, резекцию нижней косой мышцы или рецессию верхней прямой мышцы другого глаза.
При косоглазии с очень большим углом отклонения тракционный тост пассивных движений глаза позволяет определить, имеется ли гиперфункция мышцы или ее контрактура. В последнем случае предпочтение следует отдать тенотомии этой мышцы в сочетании с резекцией антагониста. Во время хирургического исправления длительно существующего косоглазия с очень большим углом отклонения после приведения глаза в срединное положение может потребоваться пластика конъюнктивы из-за недостатка ее на стороне тенотомированной мышцы.
Мы наблюдали еще одну атипичную форму косоглазия, связанную, по-видимому, с двусторонним парезом мышц или с их неправильным прикреплением к склере — врожденным или приобретенным вследствие операции. Эта форма косоглазия отличается тем, что при фиксации одним глазом другой отклоняется по горизонтали, а при фиксации последним наблюдается отклонение первого глаза по вертикали. Если имеется постоянно фиксирующий глаз, то при исправлении девиации второго глаза косоглазие не будет заметно. Если этого нет, то даже при успешном выполнении операции на обоих глазах при фиксации одним из них
453
косоглазие будет появляться. В таких случаях приходится «обучать» больного постоянно использовать для фиксации один определенный глаз, что, к сожалению, не всегда удается.
Операции при паралитическом косоглазии
Как известно, паралитическое косоглазие характеризуется полным или почти полным отсутствием движений глаза в сторону пораженной мышцы. Очевидно, задача хирургического вмешательства при паралитическом косоглазии должна заключаться не только в том, чтобы привести парализованный глаз в первичное положение, но и в том, чтобы добиться хотя бы небольшой его подвижности.
Впервые успешные попытки осуществить эту главную задачу предпринял Е. Hummelsheim (1908). Смысл предложенной им при параличе отводящего нерва операции состоял в образовании сухожильно-мышечных лоскутов из верхней и нижней прямых мышц и в подшивании этих лоскутов в склере недалеко от места прикрепления наружной прямой мышцы.
R. O’Connor (1919) внес в операцию Гуммелсхейма следующее изменение: выкроенные из вертикальных прямых мышц лоскуты подшивали не к склере, а к парализованной мышце. Автор предложил два способа операций, основанных на этом принципе.
А. И. Короев (1953, 1956), модифицируя операцию О’Коннора при трансплантации мышц перерезает верхнюю и нижнюю треть парализованной мышцы не в месте перехода в нее сухожилия, а у его прикрепления к склере и сшивает их с половинками верхней и нижней прямых мышц (рис. 246).
Многочисленные модификации частичной трансплантации мышц при паралитическом косоглазии различаются малозначащими деталями, которые в сущности не меняют принципа операции *.
Опыт показывает, что операция по Гуммелсхейму — О’Коннору нередко помогает восстановить некоторую степень подвижности глаза в сторону парализованной мышцы. Механизм такого динамического эффекта операции недостаточно выяснен. Полагают, что это может быть обусловлено либо иннервацией парализованной мышцы, либо тем, что при пересадке лоскута создается новое направление плоскости мышцы. Если учесть, что легкая подвижность пораженного глаза нередко восстанавливается уже в первые дни после операции, то второе объяснение следует признать более вероятным.
При решении вопроса об операции важно установить, является ли паралич врожденным или приобретенным. В последнем случае операцию следует производить не ранее чем через 6 мес
1 Реже исправляют девиацию операциями рецессии и резекции в повышенной дозировке.
454
--Д1
246. Пластика мышц (схема).
1 — по О’Коннору, 2 — по Короеву (пунктирная линия).
после стабилизации процесса. Вместе с тем не рекомендуется откладывать ее на длительное время из-за возможного появления контрактур. При подозрении на врожденное паралитическое косоглазие у детей раннего возраста целесообразно назначить пробную окклюзию ведущего глаза для исключения псевдопаралича [Aust, 1969]. Полезно также проводить длительные домашние упражнения по развитию подвижности глаз. В результате указанных мер она может восстановиться. Уже по одной этой причине нельзя признать правильной рекомендацию ряда авторов [Francois, Taillefer, 1966, и др.] оперировать детей с паралитическим косоглазием до 6-месячного возраста. Лучше это делать в возрасте 3—4 лет.
Если при параличе отводящего нерва девиация отсутствует или угол отклонения не превышает 5—7°, то можно ограничиться пересадкой вертикальных прямых мышц. При отклонении глаза до 15—20° целесообразна также резекция наружной прямой мышцы, а при девиации более 15—20° — и рецессия внутренней прямой мышцы.
Комбинированное хирургическое вмешательство (рис. 247) лучше начинать с рецессии внутренней прямой мышцы. Затем выделяют верхнюю прямую мышцу. На наружный край ее сухожилия у места прикрепления накладывают синтетический шов. Отрезают 1/з—’/2 часть сухожилия с наложенным швом от скле-
455
247. Комбинированная операция при параличе наружной прямой мышцы (схема).
1 — внутренняя прямая мышца; 2 — лоскут верхней прямой мышцы; 3 — наружная прямая мышца; 4 — лоскут нижней прямой мышцы.
тить, что эти разрезы должны
ры и выкраивают из мышцы продольный лоскут длиной 10—12 мм. То же самое делают и на нижней прямой мышце. Выделяют наружную прямую мышцу и отмечают анилиновым красителем линию ее предполагаемой резекции. На обоих краях мышцы делают небольшие насеч ки и крепят к ним с помощью ранее наложенных швов лоскуты вертикальных прямых мышц, проведенные под конъюнктивой. Этими же швами после перерезки наружной прямой мышцы у места прикрепления подшивают ее к указанному месту. Культю мышцы отсекают. На разрезы конъюнктивы накладывают непрерывные или узловатые швы. Следует заме-быть как можно меньших
размеров.
Francois и Taillefer (1968) считают, что, чем короче пересаживаемые сухожильно-мышечные лоскуты, тем сильнее эффект операции. Они отмечают также, что при приобретенных параличах отводящего нерва результаты операции лучше, чем при врожденных параличах.
Предлагают пересаживать не наружные, а внутренние части вертикальных прямых мышц, выкраивать одновременно встречные лоскуты из наружной прямой мышцы, различные варианты наложения швов, иную последовательность операции.
Аналогичный принцип трансплантации сухожильно-мышечных лоскутов целесообразен и при параличе внутренней прямой мышцы. В случае поражения мышц вертикального действия он ненадежен. Тактика хирургического вмешательства в этом случае примерно такая же как и при парезе мышц. Тщательно продуманные, индивидуализированные и поэтапные операции следует проводить при наружной офтальмоплегии и врожденном фиброзе глазных мышц.
Отмечают, что при выполнении комбинированной операции по Гуммелсхейму — О’Коннору на всех четырех мышцах вследствие большой травматизации тканей и перерезки передних ресничных артерий могут развиться значительный отек конъюнктивы, нарушение питания роговицы, воспаление и частичная атрофия радужки. С вмешательством на вертикальных прямых мышцах связывают возможность появления легкого энофтальма, сужения
456
248. Модификация комбинированной операции при параличе наружной прямой мышцы по Аветисову (схема).
глазной щели и отклонения глаза по вертикали. Хотя все эти осложнения встречаются редко, предлагают производить операцию в два этапа: вначале делать рецессию и резекцию горизонтальных мышц, а при отсутствии подвижности глаза в сторону парализованной мышцы частичную трансплантацию вертикальных прямых мышц [Аркин I!., I'.IIhS], !)то предложение заслуживает внимания.
Э. С. Аветисов (1 !)81) с помощью биофизических расчетов определил наиболее оптимальное место прикрепления лоскутов верхней и нижней прямых мышц глаза. Исходя из этих расчетов он предложил новый способ операции при паралитическом косоглазии, отличающийся тем, что с целью увеличения амплитуды движения глаза после операции трансплантаты подшивают к склере под парализованной наружной мышцей так, что верхний лоскут фиксируют у нижнего ее края, а нижний — у верхнего (рис. 248).
Следует иметь в виду, что если натяжение лоскутов велико, то оно может повернуть глаз в сторону пораженной мышцы, т. е. исправить небольшой угол косоглазия, а в отдельных случаях даже привести к гиперэффекту или ограничению подвижности глаза кнутри. В связи с этим при небольшом угле косоглазия (до 10°) можно вообще ограничиться только частичной трансплантацией верхней и нижней прямых мышц. При более значительном отклонении глаза (до 15—20°) следует добавить к этому
457
249. Операция по Шоттеру при параличе наружной прямой мышцы (схема).
1 — парализованная наружная прямая мымц_; 2 — пересаженная назад внутренняя прямая мышца; 3, 4 — перемещенные верхняя и нижняя прямые мышцы.
резекцию парализованной наружной прямой мышцы. Дополнительную рецессию внутренней прямой мышцы целесообразно производить только при больших углах отклонения глаза. Помимо того, хирург должен оценить па операционном столе степень натяжения лоскутов верхней и пижпей прямых мышц при их пересадке. Если это натяжение чрезмерно, то следует пересаживать мышцы не крест накрест, а углом или даже оставлять между концами лоскутов некоторое расстояние. Очевидно, что в результате расщепления сухожильно-мышечного конца мышцы, отведения выкроенного лоскута в сторону и прикрепления его к склере на некотором расстоянии, действие мышцы (направление мышечной плоскости) идет в промежуточном направлении. С целью получения большего эффекта Л. X. Шоттер (1970) предложил метод лечения паралитического косоглазия с полной пересадкой дистального конца функционирующих мышц, находящихся рядом с парализованной.
После косого разреза конъюнктивы отсепаровывают конъюнктиву от места прикрепления верхней прямой до места прикрепления парализованной наружной прямой мышцы. Верхнюю прямую мышцу освобождают тупым путем по возможности кзади. Сухожилие мышцы захватывают зажимом, через края сухожилия проводят швы и отсекают его от склеры. Мышцу передвигают вниз кнаружи и пришивают к склере (рис. 249). Таким же образом перемещают нижнюю прямую мышцу. В случае большого угла косоглазия в предыдущем сеансе производят рецессию антагониста или резекцию парализованной мышцы.
458
i В
250. Состояние тонуса горизонтальных мышц при правостороннем толчкооб-В попом нистагме.
олее сильные мышцы обозначены знаком ( + ), менее сильные — знаком (—).
Операции при нистагме
Давно было замечено, что операции по поводу косоглазия у больных с нистагмом иногда приводят к уменьшению его интенсивности. Возникла заманчивая идея воздействовать на нистагм путем хирургических вмешательств на мышпах глаза. Такая операция была предложена при одной его разновидности — асимметричном эксцентричном толчкообразном нистагме [Anderson, 1953; Kestenbaum, 1953].
Этот нистагм характеризуется чередованием медленного движения глаз в одном направлении с быстрым толчкообразным движением их в противоположном направлении. Механизм таких движений объясняют неодинаковым тонусом горизонтальных мышц (рис. 250). С действием более сильных мышц связывают медленную фазу, с действием более слабых — быструю фазу нистагма. Направление нистагма (правостороннее или левостороннее) определяют по его быстрой фазе.
Больной может уравновесить действие мышц, повернув глаза в сторопу медленной фазы (рис. 251), или, чтобы смотреть прямо пород собой, повернув голову в сторопу быстрой фазы. В условиях такого вынужденного компенсаторного поворота головы, как правило, значительно уменьшается интенсивность нистагма и повышается острота зрения.
Идея операции, которую в 1953 г. независимо друг от друга предложили Anderson и Kestenbaum, состоит в том, чтобы путем
251. Позиция относительного покоя при правостороннем толчкообразном нистагме.
Равжовесже тонуса мышц обозначено знаком (-).
459
изменения тонуса мышц перенести позицию относительного по коя глаз в срединное положение. С этой целью авторы рекомендуют ослаблять более сильные мышцы на стороне медленной фазы и усиливать более слабые на стороне быстрой фазы нистагма *.
Операцию выполняют симметрично на обоих глазах в два этапа. На первом этапе делают двустороннюю рецессию мышц, связанных с медленной фазой нистагма. Например, при правостороннем нистагме производят рецессию внутренней прямой мышцы правого глаза и рецессию наружной прямой мышцы левого глаза.
Второй этап операции заключается в двусторонней резекции мышц, осуществляющих быструю фазу нистагма. Например, при правостороннем нистагме укорачивают наружную прямую мышцу правого глаза и внутреннюю прямую мышцу левого глаза. Этот этап целесообразно выполнять после того, как определится результат первой операции и нистагм приобретает устойчивый толчкообразный характер. Если после первого этапа операции нистагм устраняется или резко уменьшается, то второй этап не выполняют.
Перед операцией по периметру определяют угол смещения позиции относительного покоя глаз и используют полученную величину для дозирования операции. В зависимости от этой величины рецессию делают на 3—4 мм, а резекцию — на 4—7 мм. Прежде чем оперировать больного с нистагмом, необходимо испытать действие призм, поставленных перед обоими глазами основанием в сторону быстрой фазы [Wybar, 1969].
Разработан способ операции [Аветисов Э. С., 1978], который может быть использован при любом виде нистагма. Суть операции заключается в том, что производят резекцию не сухожилия, а переднего отрезка брюшка глазодвигательных мышц, содержащих мышечные веретена. Они встречаются только у дистальных и проксимальных концов мышц и служат датчиками длины мышцы, управляющими частотой импульсного разряда, что обусловливает повышенную амплитуду нистагма. Удаление мышечных веретен позволяет уменьшить нервно-импульсное воздействие па мышцу и соответственно амплитуду нистагма. Кроме того, при резекции глазодвигательных мышц увеличивается степень их натяжения, в результате чего также уменьшается амплитуда нистагма.
Техника операции состоит в следующем. Отступя 4—5 мм от лимба, параллельно ему производят разрез конъюнктивы и влагалища глазного яблока длиной 8—10 мм. Конъюнктиву и влагалище глазного яблока отсепаровывают от склеры. Под мышцу подводят два крючка: один оставляют у места прикрепления мышцы, другой максимально отодвигают кзади. Находят место
1 Оперативные вмешательства при сочетании толчкообразного нистагма с косоглазием описаны А. С. Сенякиной (1966, 1970).
460
252. Операция при нистагме (схема).
перехода сухожилия в мышечное брюшко и маркируют его бриллиантовым зеленым. От этого места с помощью циркуля отмеряют и также маркируют предполагаемый участок резекции.
На 2 мм ближе передней метки и на 2 мм дальше задней на мышцу сверху и снизу накладывают по два синтетических шва, захватывая по ’/3—*/4 ширины мышцы. Нити швов завязывают в прочные узлы, у каждого из узлов по одной нити отсекают. Отмеченный метками участок резецируют по передней метке, верхние и нижние швы соответственно завязывают двумя узлами (рис. 252). Отсекают мышцу по задней метке. Накладывают непрерывный шелковый шов на конъюнктиву.
Можно накладывать шов на предполагаемый участок резекции мышцы иначе. Отмеченный метками участок резекции с помощью зажима или инструмента для образования складки на верхней косой мышце собирают в складку. На 2 мм ближе передней мотки и па 2 мм дальше задней на мышцу накладывают непрерывный шов по всей ширине мышцы. Шов стягивают и нити шва завязывают двумя узлами. Лезвием или ножницами отсекают мышцу у передней и задней меток. Накладывают непрерывный шов на конъюнктиву.
При толчкообразном нистагме для перемещения «зоны покоя» в первичное положение при отсутствии косоглазия производят одинаковую резекцию переднего отрезка брюшка мышц обоих глаз на стороне быстрой фазы нистагма. Например, при правостороннем толчкообразном нистагме производят резекцию в области брюшка наружной прямой мышцы правого глаза и внутренней прямой мышцы левого глаза. Для исправления поворота головы в 20—30° достаточно произвести резекцию мышц на стороне быстрой фазы нистагма по 6 мм на каждой из оперируемых мышц, при повороте головы в 35° и более — 7—8 мм. При этом следует помнить, что полностью такой поворот не устраняется.
При сочетании избирательного положения головы с косогла-
461
зием резецируют мышцы обоих глаз на стороне быстрой фазы нистагма, причем на одном глазу делают большую резекцию, а на другом меньшую, с тем чтобы устранить или уменьшить угол косоглазия. Например, при правостороннем толчкообразном нистагме и сходящемся косоглазии производят большую резекцию на наружной прямой мышце правого глаза и меньшую на внутренней прямой мышце левого глаза. При правостороннем толчкообразном нистагме и расходящемся косоглазии производят большую резекцию на внутренней прямой мышце левого глаза и меньшую — на наружной прямой мышце правого глаза. При небольшом остаточном угле косоглазия через 6 мес производят резекцию внутренней или наружной прямой мышцы (в зависимости от вида косоглазия) на стороне медленной фазы нистагма.
При сочетании избирательного положения головы с расходящимся косоглазием дозировка такая же, как и при сходящемся косоглазии, с той только разницей, что меньшую резекцию производят на наружной прямой мышце, а большую — на внутренней.
При маятникообразном нистагме без косоглазия операцию производят лишь тем больным, у которых отмечается высокая амплитуда движений глаз. Этим больным выполняют одинаковую резекцию в области переднего отрезка брюшка мышц одного глаза на наружной и внутренней прямых мышцах по 5—6 мм. Цель операции — уменьшить амплитуду нистагмоидных движений глаз. Если после такой операции пистагм значительно уменьшается^ то второй этап (такая же операция па другом глазу) не выполняют. При недостаточном эффекте аналогичную операцию производят и на втором глазу.
При сочетании маятникообразного нистагма с косоглазием операцию производят на одном глазу, причем большую резекцию делают на мышце, противоположной отклонению глаза, а меньшую — на мышце, соответствующей отклонению глаза. При недостаточном эффекте через 6 мес производят аналогичную операцию на втором глазу.
При сочетании маятникообразного нистагма с расходящимся косоглазием дозировка операции такая же, как и при сходящемся косоглазии, с той лишь разницей, что большую резекцию производят на внутренней прямой мышце, а меньшую — на наружной прямой мышце.
Если угол косоглазия большой (более 20°), то целесообразно выполнять операцию по обычному принципу, т. е. делать рецессию и резекцию соответствующих горизонтальных мышц одного глаза, с той лишь разницей, что вместо обычной резекции мышц следует производить резекцию переднего отрезка брюшка мышцы.
Операция позволяет уменьшить амплитуду нистагма при всех его видах (толчкообразный, маятникообразный, смешанный). Наибольшего уменьшения амплитуды нистагма следует ожидать 462
при маятникообразном нистагме (двусторонняя резекция мыищ-антагонистов создает дополнительный эффект «натянутых вожжей»), После операции у больных с толчкообразным и смешанным нистагмом может повыситься острота зрения в первичном положении в среднем на 0,15—0,3. При маятникообразном нистагме это повышение может быть менее ощутимым (0,1 и меньше).
Осложнения при операциях на глазных мышцах и их предупреждение
Различают два вида осложнений при операциях на глазных мышцах: 1) непосредственно связанные с особенностями таких операций; 2) свойственные хирургическим вмешательствам на глазном яблоке вообще. К последним относятся осложнения, обусловленные грубыми хирургическими манипуляторами, инфицированием операционной раны и окружающих тканей, болезнями крови (например, гемофилия) и другими общими заболеваниями организма. Рассматривать эти осложнения в рамках данной главы вряд ли целесообразно. Здесь уместно рассмотреть осложнения, которые встречаются только при вмешательствах на глазных мышцах — либо в ходе самой операции, либо после нее.
Повреждение брюшка мышцы при разрезе конъюнктивы и влагалища глазного яблока может вызвать большее, чем обычно, кровотечение. Оно, как правило, быстро останавливается после прижатия кровоточащего участка. Для того чтобы предупредить развитие этого осложнения, нужно делать разрез конъюнктивы на расстоянии не более 5—6 мм от лимба.
При подведении крючка под мышцу следует проверить, полностью ли опа захвачена. Если при тепотомии с предохранительным швом и рецессии часть волокон сухожилия окажется пепе-ророзапной, то в результате этого может резко уменьшиться эффект операции и произойдет отклонение глаза ио вертикали.
Для того чтобы избежать повреждения склеры при тенотомии, во время перерезки сухожилия нужно пользоваться ножницами с затупленными концами. Особенно затруднительна тенотомия мышцы, находящейся в состоянии контрактуры. Сухожилие такой мышцы лучше пересекать позади крючка, а не между ним и склерой.
При пересечении пересаживаемой мышцы могут быть отрезаны один—два шва, ранее наложенные на сухожилие. Это случается обычно тогда, когда швы накладывают очень близко к месту прикрепления мышцы. В таких случаях нужно повторно наложить швы на сухожилие, сняв остатки прежних швов. При целости одного шва наложить другой нетрудно. При отсечении обоих швов мышцу находят и захватывают хирургическим пинцетом. Глаз больного в это время должен быть повернут в противоположную сторону, иначе мышца сокращается и уходит в глубину тканей.
463
При пересадке мышцы нужно следить за тем, чтобы сохрани лось прежнее направление мышечной плоскости и не возникало условий для появления вертикальной девиации.
Тонкой процедурой является наложение эписклеральных швов во время рецессии или прорафии. Чрезмерно поверхностное проведение иглы может привести к отрыву шва, чрезмерно глубо кое — к перфорации склеры. В этом случае нужно извлечь иглу и уже более осторожно произвести вкол рядом. Если игла окажется неподходящей для этой цели, то вместо запланированной рецессии лучше сделать тенотомию с предохранительным швом.
При операциях, особенно усиливающих действие мышцы, возможно ее отхождение вследствие прорезывания швов. Чтобы предупредить это серьезное осложнение, нужно до конца операции фиксировать резецируемую мышцу лигатурой или пинцетом, пользоваться достаточно прочным и не очень тонким, лучше синтетическим швом, захватывать в этот шов с обоих краев мышцы часть ее волокон и прочно завязывать. Важно также активно приближать к мышце место ее будущего прикрепления и проводить иглу не только через оставшуюся после резецирования полоску сухожилия, но и через эписклеру.
Необходимо подчеркнуть, что при современной тактике умеренного и дозированного укорочения или перемещения глазодви-гателей и поэтапного распределения вмешательства на несколько мышц почти не встречаются или бывают малозаметными такие послеоперационные осложнения, как западение слезного мясца, сужение или расширение глазной щели, птоз, энофтальм или экзофтальм, ограничение подвижности глаза, гиперэффект.
В связи с гем что операции перемещения мышцы к лимбу производят редко, в настоящее время не наблюдаются и связанные с этой операцией «пролежни» на роговице, ее воспаления и изъязвления.
Возникающее после хирургического вмешательства на глазных мышцах двоение, строго говоря, не относится к послеоперационным осложнениям. Это сложный и специальный вопрос. Заметим только, что послеоперационная диплопия появляется очень редко.
Иногда в области бывшей операционной рапы возникают кистовидные или грануляционные разрастания. Причиной их могут быть недостаточная адаптация краев раны, ущемление в ней влагалища глазного яблока или подконъюнктивальной ткани, оставление слишком длинных концов после отрезания наложенных на мышцу швов, повышенная тканевая реакция на эти швы. Если после обычного физиотерапевтического и медикаментозного лечения указанные разрастания не проходят, швы с мышцы следует снять.
В заключение необходимо подчеркнуть, что при достаточном опыте операции на глазных мышцах крайне редко сопровождаются осложнениями и, как правило, приносят чувство большого удовлетворения и врачу, и больному.
Глава 10
Операции на слезных органах
Операции на слезных органах выделены в особую главу из-за Особенностей этой пограничной с ЛОР-органами патологии, своеобразия диагностики, инструментария и хирургических приемов.
Уделяется внимание операциям на слезных точках, канальцах, Слезном мешке и слезной железе. Впервые в руководстве по глаз-Вой хирургии освещена методика эндоназальной дакриоцисторино-СТОМИИ.
Оперативные вмешательства с использованием инструментов и аппаратов позволяют добиваться восстановления слезоотведения, Создавая условия для реабилитации этой группы больных.
Операции на слезных путях
Операции на слезных точках
Подготовка операционного поля: кожу века и окружающих участков обрабатывают 70% этиловым спиртом или 1% раствором бриллиантового зеленого на 70% этиловом спирте.
Анестезия: инсталляционная (0,26—0,5% раствор дикаина) и инфильтрационная (под кожу века вводят 0,5—2 мл 2% раствора новокаина).
Увеличение нижней слезной точки по Арльту. 13 нижнюю слезную точку и каналец для их расширения вводят конический зонд. При этом большим пальцем левой руки оттягивают нижнее веко, а введенный зонд тянут слегка кверху. После этого в каналец вводят браншу маленьких остроконечных ножниц, которыми рассекают его на протяжении 2 мм. Затем этими же ножницами из внутренней (задней) стенки канальца иссекают треугольный лоскут, основание которого находится у слезной точки (рис. 253). При иссечении лоскута необходимо захватить и хрящевую часть канальца, что обеспечит хороший эффект операции. За нижнее веко закладывают какую-либо бактерицидную мазь и накладывают легкую повязку. Аналогичную операцию можно производить и на верхней слезной точке.
Увеличения нижней слезной точки по Титову. Коническим зондом расширяют нижнюю слезную точку настолько, чтобы можно было ввести браншу остроконечных ножниц. Двумя разрезами (один направлен косо в сторону слезного мясца, другой — косо в
30 Руководство по глазной хирургии
465
253.
Операция по Арльту (схема), а — введение в каналец братии ножниц; б — разрез стенки канальца; в — иссечение треугольного лоскута.
сторону виска) рассекают заднюю стенку канальца. Таким образом формируют конъюнктивальный лоскут треугольной формы, вершина которого находится в области слезной точки. Лоскут захватывают пинцетом и отсекают у основания. Последующего зондирования не требуется.
Операция при дислокации нижней слезной точки. В зависимости от характера дислокации (кпереди, кзади, кнаружи, кнутри, кпереди и кнаружи, кпереди и кнутри, кзади и кнаружи, кзади и кнутри) срезают край века на соответствующем участке, в результате чего образуется новый угол, на вершине которого должна быть расположена слезная точка (рис. 254). Лоскут срезают скальпелем или ножницами.
Операции при вывороте нижней слезной точки. Операция по Блашковичу. В нижний слезный каналец с целью предохранения его от повреждения вводят конический зонд. Ниже слезной точки и канальца иссекают эллипсоидный участок хряща и конъюнктивы. Верхний разрез делают на 3—4 мм ниже слезной точки через конъюнктиву и хрящ до круговой мышцы, а ниж-466
254. Операция при дислокации нижней слезной точки (схема).
а. б, в, г — направление разреза при различных видах дислокации.
нии — через конъюнктиву и частично через круговую мышцу. Величину иссекаемого лоскута устанавливают в зависимости от степени выворота. На края раны накладывают швы (рис. 255). Для получения лучшего эффекта при наложении швов захватывают подкожную фасцию. За веки закладывают бактерицидную мазь и накладывают повязку. Швы снимают на 7—8-й день.
Операция по Тихомирову. На край нижнего века для фиксации накладывают два уздечных шва: один — отступя от слезной точки 2—3 мм в сторону виска, другой — вблизи от наружной спайки век. Швы нужно проводить через всю толщу века как можно ближе к его краю. Нижнее веко выворачивают и фиксируют на пластинке Егера с помощью натяжения уздечных швов. Очерчивают скальпелем контуры лоскута в форме ромба с продольной полоской. Внутреннее верхнее ребро ромба располагается против слезной точки. Вершина
ромба направлена к своду, по до него не доходит. У слезной точки ромб не замыкается, а переходит п горизонтальную полоску, длина которой 1,5—2 см, ширина 2—2,5 мм. Нижний край полоски (при вывернутом веке) отстоит от края века на 1 —1,5 мм. Максимальная ширина ромба 5 мм.
С помощью ножниц и пинцета иссекают конъюнктивальный лоскут: в области продольной полоски вместе с подлежащим хрящом, а в области ромба — с подслизистой тканью (рис. 256). После иссечения лоскута накладывают швы: один, который приближает слезную точку к глазному яблоку, в углах ромба, остальные швы, сближающие края раны, проводят через конъюнктиву и хрящ. Ни
255. Операция по Блашковичу (схема).
30*
467
256. Операции по Тихомирову (а) и Похисову (б) (схема).
1 — иссечение конъюнктивально-хрящевого лоскута; 2 — наложение швов на края раны.
в коем случае нельзя выводить швы через интермаргинальное пространство, так как это может повлечь за собой развитие заворота века. Швы следует коротко обрезать. За веки закладывают бактерицидную мазь. Швы снимают на 5—6-й день.
Операция по Похисову. На вывернутом веке, фиксированном с помощью двух—трех уздечных швов, скальпелем очерчивают лоскут в форме треугольника, вершиной обращенного к своду конъюнктивы. Продолжением его является второй треугольник, расположенный вдоль века; вершина этого треугольника обращена к наружному углу глазной щели (рис. 256,6). Основание первого треугольника равно 3 мм. Выкраиваемый лоскут отстоит от края века на 2 мм, величина его зависит от степени выворота.
468
.Твк же как и при операции по Тихомирову, в области лоскута, ^Идущего вдоль края века, иссекают хрящ, а в области первого Треугольника — подслизистую ткань. Швы коротко обрезают. За реки закладывают бактерицидную мазь. Швы снимают на 5—6-й Лень.
Операция по Ли в модификации Каллахана. 8ту операцию рекомендуют производить при вывороте и латеральном смещении нижней слезной точки, вызванном рубцеванием. На расстоянии 2 мм медиально от нижней слезной точки по краю Нижнего века делают разрез до угла глазной щели; такой же разрез делают на верхнем веке до соединения с первым. Разрез по нижнему веку продолжают на 5—6 мм в косом направлении Кверху, затем проводят по переносице вертикально вниз также а 5—6 мм (рис. 257, а). Кожу и подкожные ткани отсепаровы-вают, рассекают круговую мышцу, сохраняя ее связь с кожей и Подкожными тканями. Образовавшийся лоскут подтягивают квер-
257. Операция по Ли в модификации Каллахана (схема).
а — разрезы кожи по нижнему веку; б — отсепарованный лоскут подтянут кверху; в — наложение погружных швов: г — наложение швов через кожу, подкожные ткани и мышцу.
469
258. Операция по Шарщ (схема).
а — наложение швов на края раны; б — завязывание среднего шва на валике.
ху и в сторону носа таким образом, чтобы нижняя слезная точка приняла правильное положение (рис. 257,6). Избыточную част! лоскута отсекают, накладывают два—три узловатых погружных шва из кетгута (рис. 257, в). На края раны накладывают шелко вые швы, которые внизу проводят через кожу, подкожные ткани и круговую мышцу, а вверху — через эти же ткани и дополни тельно через медиальную связку (рис. 257,г). Швы снимают па 7—8-й день.
Операция по Шарц. Скальпелем книзу от нижней слезной точки намечают треугольный лоскут па конъюнктиве (длина каждой его стороны 3—4 мм). Основание треугольника обращено к слезной точке и расположено параллельно краю века на расстоянии 1,5—2 мм от него, вершина треугольника обращена к нижнему конъюнктивальному своду. В пределах очерченного участка иссекают слизистую оболочку вместе с подслизистым слоем. На края раны накладывают швы: средний шов со единяет вершину треугольника с серединой основания, по бокам от среднего шва проводят еще два шва (рис. 258, а). Концы нити среднего шва завязывают, выводят через всю толщу века на кожу пол краем глазницы и завязывают на марлевом валике (рис. 258, б). В конъюнктивальный мешок закладывают бактерицидную мазь, кожу века смазывают раствором бриллиантового зеленого и накладывают повязку. Если при перевязке будет установлено, что выворот слезной точки исправлен недостаточно, то шов на валике подтягивают; если же, наоборот, наблюдается гиперэффект, то шов ослабляют. Снимают швы через 7—10 дней.
Операция по Алексееву. Этот метод применим только при изолированной эверсии и нормальном калибре слезной точки. Эту операцию производят с целью устранить эверсию нижней слезной точки за счет стягивания рубцом, образующимся на месте прижигания электрокаутером. Нижнее веко выворачивают и удерживают на пластинке Егера. Плоским наконечником элек-470
Т’-------------------------------
II трокаутера делают линейное прижигание конъюнктивы, отступя 1 ОТ слезной точки книзу 0,5—1 мм в направлении косо кнаружи В сторону нижнего свода. Линия прижигания образует с осью ка-альца тупой угол в 105°.
При небольшом вывороте прижигают только конъюнктиву, при волее сильном вывороте еще и хрящ.
Операции при атрезии слезной точки. На расстоянии 1—1,5 мм Кнутри от того места, где должна быть расположена слезная точка, делают поперечный надрез края века ножницами либо скальпелем или же иссекают призматический клин. Под операционным микроскопом отыскивают просвет слезного канальца и расширяют •го коническим зондом. В последующие дни зондируют каналец через вновь образованное отверстие, пока края его не эпители-вируются. В тех случаях, когда слезная точка закрыта кожной перепонкой, достаточно проколоть ее острым коническим зондом ли иссечь ножницами, а затем осуществлять зондирование в течение нескольких дней. Если атрезия слезной точки сочетается с атрезией слезного канальца, то операция неэффективна и потребуется операция пластического восстановления слезного канальца или типа лакодакриоцистостомии.
Операции на слезных канальцах
Операции на слезных канальцах, как и на слезных точках, рекомендуется производить под операционным микроскопом и с применением микроинструментов.
Подготовка операционного поля: обычная.
Анестезия: инсталляционная (0,25 мл 0,5% раствора дикаина) н инфильтрационно-проводниковая (2—3 мл 2% раствора новокаина) .
Перевязка слезных канальцев. Перевязку капальцев производят в тек случаях, когда предстоит срочная операция на глазном яблоко, а имеющееся заболевание слезных путей может привести к инфицированию операционной раны. В каждый каналец поочередно вводят зонд Боумена № 1 до входа в слезный мешок. Зонд, введенный в нижний каналец, натягивают кверху и иглой с нитью прокалывают под ним веко со стороны конъюнктивы через кожу, зонд удаляют и нить завязывают. Зонд, введенный в верхний слезный каналец, натягивают книзу и иглой с нитью ® прокалывают над ним веко со стороны конъюнктивы через кожу, зонд удаляют и нить завязывают. Через 4—5 дней, когда рана на глазном яблоке зарубцуется и опасность инфицирования исчезнет, швы снимают.
Расщепление слезных канальцев. В настоящее время показания к расщеплению канальцев резко сужены, так как разработан ряд эффективных операций по устранению выворота слезной точки. В акте слезоотведения наиболее активную роль играет нижний каналец, поэтому с ним следует обращаться особенно бережно. Расщепление показано при рецидивирующем гнойном воспа-
471
лении канальца (каналикулит), грибковых конкрементах и инородных телах канальца. После расширения канальца коническим зондом в него вводят нож Вебера лезвием в сторону конъюнктивы. Делают разрез длиной 2—3 мм или больше в зависимости от показаний. При наличии конкрементов их удаляют, выскабливая острой ложечкой.
Операция активизации верхнего слезного канальца по Ерлы-шеву. Рекомендуется при неустранимом нарушении функции нижнего канальца. Верхнюю слезную точку расширяют коническим зондом и остроконечными ножницами (можно и ножом Вебера), по границе между конъюнктивой и кожей верхнего века рассекают верхний слезный каналец, начиная от слезной точки и заканчивая на расстоянии 1—1,5 мм от внутреннего угла глазной щели. Ассистент оттягивает кверху внутреннюю часть верхнего века, чтобы рассеченный каналец зиял. Заднюю губу канальца захватывают глазным хирургическим пинцетом и иссекают по всей длине в виде полоски шириной около 2 мм. За веко закладывают бактерицидную мазь. Операцию можно выполнить одновременно на обоих глазах.
Хирургическое лечение облитераций слезных канальцев. Различают ограниченные облитерации слезных канальцев и полную облитерацию канальца на всем его протяжении. Методы их лечения различны.
Операция при ограниченной облитерации слезного канальца по Колену. В слезный каналец вводят конический зонд, которым разрывают спайки, и проводят его в слезный мешок до внутренней стенки и там оставляют. После этого производят разрез кожи длиной 1,5—2 см на 3—5 мм выше внутренней спайки век на расстояние 3—4 мм от нее в сторону носа, внизу разрез загибают кнаружи. Отсепаровывают мягкие ткани в сторону носа, находят внутреннюю спайку век, которую перерезают, если слезный мешок маленький. Затем проверяют движением зонда, находится ли он в слезном мешке, после чего через слезный каналец проводят укороченную на 2/з обычную швейную иглу с пучком конского волоса. Стенку слезного мешка прокалывают иглой (рис. 259), пучок волос выводят наружу и связывают их концы, рану зашивают. Края рапы смазывают раствором бриллиантового зеленого, за веки закладывают бактерицидную мазь и накладывают повязку. Пучок волос оставляют на 2—3 нед. Для предупреждения заращения слезного канальца пучок волос продергивают ежедневно в ту и другую сторону.
Операция при облитерации устья слезного канальца по Джонсу. В области слезного мешка делают такой же разрез мягких тканей, как и при выполнении операции по Колену. Находят внутреннюю часть нижнего слезного канальца (заросшую) и отрезают ее у места прикрепления к слезному мешку, затем из верхненаружной стенки мешка выкраивают лоскут шириной 5 мм. После этого через нижнюю слезную точку 472
259. Операция по Колену: проведение иглы с конским волосом (схема).
вводят полиэтиленовую трубку длиной 25 мм, наружный диаметр которой около 3 мм, внутренний около 2 мм. Трубку через слезный каналец продвигают в слезный мешок и далее в носослезный канал. Накладывают швы, в результате чего лоскут слезного мешка превращается в каналец, в котором помещена полиэтиленовая трубка (рис. 260). На края раны слезного мешка и кожной раны накладывают швы. Рану смазывают раствором бриллиантового зеленого и накладывают повязку. Полиэтиленовую трубку рекомендуется оставлять на месяц.
260. Операция по Джонсу (схема).
а — выкраивание лоскута из стенки слезного мешка; б — наложение швов на края раны.
473
I I
[l
261. Операция восстановления слезных канальцев по Мораксу — Вальеру — Виале (схема).
а — подковообразный разрез по внутренней спайке век; б — введение мандрена с лоскутом в слезный мешок через разрез.
I
I 5
n
Операция пластического восстановления облитерированных слезных канальцев по Морак-су—Вальеру—Виале. По краю век вокруг слезного мясца несколько позади слезного гребешка делают подковообразный разрез и вскрывают шейку слезного мешка. На внутренней стороне плеча выкраивают по Тиршу лоскут длиной 4 см, шириной 2 см и обертывают им, кожной поверхностью внутрь парафиновый мандрен или мягкий зонд толщиной около 4 мм. Лоскут сшивают по горизонтали кетгутовыми швами, после чего мандрен с лоскутом вводят в слезный мешок через разрез, сделанный в крае век (рис. 261). В конъюнктивальный мешок закладывают бактерицидную мазь и накладывают повязку. Мандрен удаляют через 6—9 дней.
Операции на слезном мешке
Операции с наружным подходом
Экстирпация слезного мешка. Подготовка операционного поля: кожу области слезного мешка и окружающих участков обрабатывают 70% этиловым спиртом или 1% раствором бриллиантового зеленого на 70% этиловом спирте.
Анестезия: инфильтрационно-проводниковая (3—8 мл 2% раствор новокаина).
Делают дугообразный разрез кожи длиной 1,5—2 см, начиная на 3—5 мм выше внутренней спайки век на расстоянии 3—4 мм от нее в сторону носа, внизу разрез загибают кнаружи (рис. 262, а). Мягкие ткани тупым путем отсепаровывают в сторону носа, в рану вводят ранорасширитель Мюллера или Финзе-на. Внутреннюю связку век выделяют и перерезают несколько кнаружи от места прикрепления ее к кости, затем вскрывают
474
262. Экстирпация слезного мешка (схема).
а — разрез мягких тканей; б — выделение слезного мешка.
фасцию, покрывающую спереди слезный мешок, который сначала отделяют с внутренней стороны кверху и книзу. Дойдя до его купола, захватывают хирургическим пинцетом и продолжают отделение наружной части, при этом натягивают купол мешка в сторону носа. После выделения наружной стенки слезного мешка перерезают слезные канальцы у места впадения их в слезный мешок (рис. 262,6), затем продолжают отделение его нижней части до входа в носослезный проток и отсекают слезный мешок в глубине канала. После этого ложечкой Аксенфельда выскабливают слизистую оболочку носослезного капала.
После экстирпации мешка тщательно осматривают рану, и если обнаружат остатки стенок слезного мешка, то их удаляют, так как в противном случае могут возникнуть рецидивы дакриоцистита. Во время операции при ранении фасции, отделяющей слезный мешок от глазницы, наступает кровотечение, в рану выпадает глазничная клетчатка. В этом случае ассистент должен отодвинуть шпателем выпавшую клетчатку и прижать ее, чтобы дать возможность хирургу закончить операцию (отсечь слезный мешок). На рану вскрытой тарзоорбитальной фасции обязательно накладывают кетгутовые швы. Для того чтобы предотвратить развитие таких осложнений, как флегмона глазницы, следует применять антибиотики. На края кожной раны накладывают три— четыре шва, средним швом следует захватить внутреннюю связку век. Рану смазывают раствором бриллиантового зеленого, в конъюнктивальный мешок закладывают бактерицидную мазь, на рану накладывают давящую повязку. Швы снимают на 6—7-й день.
Дакриоцисториностомия по Тоти в модификации Дюпюи-Дю-тана—Бурге. Конъюктивальную полость, а также слезный мешок
475
промывают каким-либо бактерицидным раствором. Кожу области слезного мешка и окружающих участков обрабатывают 70% этиловым спиртом или 1% раствором бриллиантового зеленого на 70% этиловом спирте.
Анестезия: инфильтрационно-проводниковая. Вводят 6—8 мл 2% раствора новокаина с 2—5 каплями раствора адреналина 1 : 1000. Первую инъекцию 2—3 мл раствора делают ниже внутренней связки век через кожу спипки носа, иглу вводят до надкостницы спереди от переднего слезного гребня (анестезируется ветвь подблокового нерва и отчасти подглазничного). Вторую инъекцию делают выше внутренней связки век медиальнее блока; иглу, так же как и при первой инъекции, проводят до надкостницы и вводят 1 мл раствора (анестезируется ствол подблокового нерва), затем иглу продвигают вдоль костной верхневнутренней стенки глазницы на глубину 2 см по направлению к передним решетчатым отверстиям и вводят 1 мл раствора (анестезируется одноименный нерв). Третью инъекцию (2—3 мл раствора) делают по направлению либо к подглазничному отверстию, либо к участку между подглазничным отверстием и входом в носослезный канал — анестезируется подглазничный нерв (методика М. Л. Краснова). Кроме того, в средний носовой ход вводят тампон, смоченный 5 % раствором кокаина или 1 % раствором дикаина с добавлением 1—2 капель адреналина 1 : 1000 на 1 мл анестезирующего вещества.
На 2—3 мм выше внутренней связки век скальпелем начинают разрез длиной 2—3 см, отступя 2—3 мм от места прикрепления связки. Сначала ведут разрез прямо книзу, затем несколько поворачивают кпаружи по нижнеглазиичному краю (рис. 263, а). Разрез мягких тканей делают послойно, но можно производить его сразу до кости. После этого края раны отсепаровывают и вводят ранорасширители (Мюллера, Финзена, Янсена, рис. 263, б). Если кровотечение после этого не останавливается, то на кровоточащие сосуды накладывают зажимы Пеана.
Распатором выделяют внутреннюю связку век, после чего медиальнее переднего слезного гребешка разрезают сверху вниз надкостницу на протяжении 2 см, отслаивают ее вместе со слезным мешком от кости боковой спинки носа и слезной ямки до слезноносового канала и отодвигают кнаружи. После этого слабыми ударами молотка по долоту намечают границы подлежащего удалению участка кости (слезная кость, лобный отросток верхней челюсти и носовой отросток лобной кости) величиной 1,5—2 см по вертикали и 1,2—1,5 см по горизонтали (рис. 263, в). Затем легкими ударами молотка по долоту по намеченным границам выдалбливают кость. Наиболее сильными удары должны быть в области переднего слезного гребешка, так как здесь кость особенно толстая; по внутренней же границе удары следует производить осторожно, чтобы не поранить слизистую оболочку носа, расположенную под тонкой костью.
476
263. Операция по Тот» и модпфпка ции Дюпюи-Дютапа -Вурго (схема), а, б — разрез коти и выделении елейного мешка; в — обозначение границы костного окна; г — удаление кости; д — рассечение слизистой оболочки носа и стенки слезного мешка; е — наложение швов на задние губы слизистой оболочки носа и стенки слезного мешка; ж — наложение швов на передние губы слизистой оболочки носа и стенки слезного мешка.
После удаления куска кости края костной раны подравнивают с помощью щипцов-кусачек Гайека или Цителли. Костный выступ у входа в носослезный канал также нужно удалить, чтобы здесь не скапливался гной. Из раны удаляют все кусочки кости; при предлежании клеток решетчатого лабиринта последние также удаляют. После того как образовано костное окно (рис. 263, г), из носа извлекают тампон и вводят желобоватый зонд или шпатель, которым слегка выпячивают в окно слизистую оболочку носа. Ее рассекают сверху вниз. Задняя губа должна
477
быть немного шире, чтобы легче было наложить швы. С этой же целью можно сделать еще дополнительные горизонтальные надрезы вверху и внизу. Разрезают вертикально и стенку слезного мешка с надкостницей (рис. 263, д). Через нижний слезный каналец в полость слезного мешка вводят зонд, чтобы убедиться в проходимости канальца и в том, что стенка слезного мешка рассечена. Рану промывают перекисью водорода, так как в слезном мешке может быть гной. Накладывают три шва из тонкого кетгута иглой Ома или Якоби на заднюю губу слизистой оболочки носа и заднюю губу слезного мешка (рис. 263, е). На передние губы накладывают три шелковых шва, которые после перекреста выводят через края кожной раны (рис. 263, ж). Вместо шелковых швов можно накладывать кетгутовые, но на кожу их выводить не следует. В этих случаях на края кожной раны накладывают шелковые швы.
При дряблости стенок слезного мешка или слизистой оболочки носа выполнить типичную операцию по Дюпюи-Дютану — Бурге не удается; тогда ограничиваются одним (передним) этажом швов, а если и это не удается, то производят операцию по Тоти. В этом случае медиальную часть слезного мешка вырезают, в слизистой оболочке носа тоже вырезают окно таких же размеров, как и в стенке мешка. После этого со стороны носа в костное отверстие смещают края слизистой оболочки носа с помощью тампона. Так как слизистая оболочка носа легко регенерирует, вследствие чего может закрыться образованное отверстие, рекомендуется окно в кости и отверстие в слизистой оболочке делать большого размера. Первую перевязку делают через 2 сут, тампон из носа удаляют, в конъюнктивальную полость впускают капли бактерицидного раствора. Если после удаления тампона из носа возникает кровотечение, то вставляют свежий тампон. Швы снимают через 6—7 дней.
Во время операции могут возникнуть осложнения. Кровотечение иногда затрудняет выполнение операции. С помощью рано-расширителей и зажимов Пеана, которые накладывают на кровоточащие сосуды, останавливают кровотечение из краев раны. Для остановки кровотечения из разрезанной слизистой оболочки носа, которое мешает наложению швов, применяют местно фибриновые пленки и спонгостановую губку; при кровотечении из костных сосудов следует сдавить костный край кусачками. Из послеоперационных осложнений следует отметить нагноение в швах и позднее носовое кровотечение. При носовом кровотечении производят переднюю и заднюю тампонады носа и применяют кровоостанавливающие средства (внутривенные вливания 10% раствора хлорида кальция, эпсилонаминокапроновой кислоты, гемотрансфузии, внутримышечные введения дицинона, витамина К и т. д.).
Развитие грануляций в созданном отверстии слизистой оболочки носа и мешка является послеоперационным осложнением, ведущим к рецидиву дакриоцистита. Для предупреждения непро-478
ходимости слезных путей после операции В. Н. Архангельский предложил метод, заключающийся в применении масляно-суль-фидинового тампона. После наложения швов на задние края раны слизистой оболочки носа и слезного мешка протягивают кетгу-товые швы на передние края раны, но не завязывают их и приступают к введению тампона. Полоску марли длиной 20—25 см и шириной 1,5—2 см обильно смачивают стерильным маслом (парафиновое, абрикосовое, вазелиновое), присыпают сульфаниламидным порошком и вводят через нос с помощью зонда в образованное соустье, расправляют полоску пинцетом и заполняют ею всю полость. Такая тампонада предупреждает кровотечение и одновременно дренирует сформированное отверстие. Она исключает возможность склеивания противолежащих раневых поверхностей передних и задних краев слизистой оболочки, предупреждает размножение гнилостной флоры. Кроме того, масляный тампон при выведении из носа не травмирует новообразованный эпителий. Обычно тампон удаляют через 2 сут.
Б. Ф. Черкунов считает, что марлевый тампон для данной цели мало подходит: он мешает слезооттоку, ухудшает условия заживления и формирования соустья. Автор предлагает тампонировать соустье на 6—7 сут, а после реопераций на 3—4 нед вставлять резиновый колпачок с отверстиями, изготовленным из детской соски, длиной 10—12 мм. По мнению автора, колпачок шире раскрывает соустье.
Модификации метода Дюпюи-Дютана — Бурге касаются в основном размеров и способов резекции кости, а также способов формирования соустья слезного мешка с полостью носа. Наиболее ответственным моментом наружной дакриоцисториностомии является образование костного отверстия. От его величины и правильного расположения, а также от сохранения целости слизистой оболочки носа зависят стойкость соустья и хороший функциональный исход операции. Метод трепанации кости с помощью молотка и долота имеет серьезные недостатки: это наиболее болезненный, травматичный и трудоемкий этап операции, что затрудняет ее проведение у детей. Применение этого метода противопоказано больным с гипертонической болезнью и склерозом сосудов головного мозга, перенесшим сотрясение головного мозга, а также больным миопией высокой степени и афакией из-за опасности возникновения отслойки сетчатки. Кроме того, при удалении кости долотом часто повреждается слизистая оболочка носа, что затрудняет последующее наложение швов и образование полноценного соустья. Травматичность, а также длительность операции с помощью молотка и долота ограничивает ее применение у лиц старше 60 лет.
В связи с перечисленными недостатками данной операции были предложены методы образования костного окна с помощью трепанов (Арруга, Киршман и др.), приводимых в движение электромоторчиком или бормашиной, фрезами (Л. М. Бакин и др.). Существуют многочисленные конструкции данных инструментов.
479
Получившая наибольшее распространение ручная фреза обычно диаметром 8—10 мм имеет 12—14 зубцов, приводится в движение вращением рукоятки. С ее помощью высверливают два отверстия — одно под другим, а затем края раны подравнивают костными щипцами. Существенным недостатком этих способов образования костного отверстия является частое нарушение целости слизистой оболочки носа, а также необходимость применять для окончательного образования костного окна дополнительные инструменты, включая молоток и долото. Все это оправдывает поиск новых методов. Чтобы избежать перечисленных недостатков, было предложено применять для образования костного окна стамески Воячека (Б. Л. Поляк), бор-циркуль (Ш. А. Шамхалов) и др. Однако с клинической точки зрения особый интерес представляет предложение использовать с этой целью низкочастотные ультразвуковые инструменты.
Предлагаемая методика операций с применением этих инструментов значительно облегчает работу врача, уменьшает неприятные ощущения, испытываемые больными во время и после операции, сокращает продолжительность операции и срок пребывания больного в стационаре, позволяет оперировать пожилых и ослабленных больных, обеспечивает хорошие функциональные результаты восстановления слезоотведения. Возможность избежать сотрясения головы больного, малая травматичность, гемостатическое, аналгезирующее и бактерицидное действие при использовании ультразвукового хирургического инструментария выгодно отличают метод от «классического» способа операции. Метод имеет ряд преимуществ и перед бсзмолотковыми способами. Ультразвуковым инструментом можно вырезать отверстие в кости любой формы и размера, что исключает использование дополнительных инструментов. Операцию производят под контролем зрения, что очень важно при небольшом операционном поле. Легко контролируется глубина погружения инструмента в кость, что позволяет предотвратить повреждение слизистой оболочки. В связи с применением низкочастотного ультразвука появились новые, недоступные ранее возможности для резания кости. В результате действия ультразвука на костную ткань происходит ослабление молекулярных связей и размельчение твердой среды соответственно месту прохождения инструмента по кости. Это позволяет делать отверстия в кости быстро, легко, без особых усилий, нужных размеров, с ровными и гладкими краями. Портативность аппарата, удобство работы с ним, несложность настройки также являются достоинствами этого вида трепанации.
Модификация дакриоцисториностомии с помощью низкочастотного ультразвукового аппарата «Ультразвуковой нож» по Субботиной. Подготовка операционного поля, анестезия и начало операции такие же, как при выполнении операции описанным выпи способом. Трепанацию кости производят следующим образом. На обнаженной кости ультразвуковым ножом намечают контуры трепанационного отверстия в виде костной бороздки: верхний —
480
на уровне купола слезного мешка, нижний — на уровне входа в носослезный канал, снаружи — на расстоянии 8—10 мм от переднего слезного гребешка. Костное окно вырезают только с трех сторон — верхней, нижней и наружной, так как слезная косточка, составляющая внутреннюю стенку отверстия, тонкая и легко отламывается по линии соединения латеральных концов верхней и нижней костных бороздок. Далее концом ультразвукового инструмента вырезают кость по намеченной границе.
При создании костного отверстия придерживаются определенной последовательности: начинают трепанацию с образования глубоких канавок в области верхней и нижней границы, где толщина кости наибольшая. Затем дугообразной бороздкой выпуклостью наружу соединяют медиальные концы этих канавок. После того как кость прорезана на всю толщину, выпиленный костный фрагмент легко отламывается рычагообразным движением на себя с помощью элеватора вместе с подлежащим участком слезной косточки. Затем захватывают кость пинцетом и осторожно извлекают легкими качательными движениями, предупреждая при этом повреждение слизистой оболочки носа. Размеры резецируемого костного фрагмента зависят от формы и высоты спипки носа, а также от размеров слезного мешка и варьируют по вертикали от 15 до 20 мм, по горизонтали от 12 до 15 мм. Кость должна быть резецирована по отношению к месту впадения слезных канальцев в мешок во все стороны на 7—10 мм, чтобы введенный через нижний слезный каналец зонд свободно двигался во всех направлениях. Края костного отверстия получаются ровными и гладкими. Слезную косточку удаляют только на месте слезного мешка. На трепанацию уходит 3—5 мин. Остальные этапы операции такие же, как в описанной выше методике дакриоцисторипостомпи по Дюпюи Дютапу— Бурге.
Модификация дакриоцисторпшм томим по Орлову. Подготовку операционного поля, анестезию и раароа впереди области слезного мешка осуществляют так жо, как при операции по Дюпюи-Дютапу — Бурсе. Тупым путем выделяют слезный мешок до устья канальцев. Для того чтобы лучше ориентироваться, слезный мешок наполняют 1% водным раствором метиленового синего или малахитового зеленого. С помощью распатора слезный мешок отделяют с задней и наружной стороны книзу к отверстию слезного канала. Нижний конец отделенного слезного мешка фиксируют с помощью пинцета, выводят из раны наружу и срезают в косом направлении небольшой кусок его внутренней стенки (рис. 264, а). Через наружную губу раны проводят длинную нить и отводят мешок в сторону. Полость мешка тампонируют узкой полоской марли с йодоформом так, чтобы вне мешка оставался конец длиной 15 см. После этого выдалбливают или просверливают отверстие диаметром 5 мм в середине слезной ямки так, чтобы по крайней мере 'Д его находилась в лобном отростке верхней челюсти, с тем чтобы избежать попадания инструмента в решетчатые клетки.
31 Руководство по глазной хирургии
481
264.
Модификация дакриоцистори-ностомии по Орлову (схема), а — срезание куска внутренней стенки слезного мешка; б — тампонирование слезного мешка; в — погружение слезного мешка в костное окно и фиксация его в зтом положении с помощью лигатуры, завязанной над валиком у входа в нос.
В пределах образованного окна иссекают слизистую оболочку носа и у нижнего края его, кроме того, соскабливают ее острой ложечкой. После этого в нос через трепанационное отверстие проводят зонд с ушком. В ушко зонда вдевают нить, которой предварительно прошивают свободный конец тампона с йодоформом, затем осторожно вытягивают зонд и нить и выводят часть слезного мешка с отверстием через костное окно в полость носа. Тампон обрезают на уровне ноздри (рис. 264,6). Концы лигатуры, с помощью которой слезный мешок был отведен в сторону, стягивают над валиком, закрывающим наружное отверстие носа (рис. 264, в). На края кожной раны накладывают швы, причем захватывают и внутреннюю связку век. Часть марлевого тампона срезают через 3—4 дня, а на следующий день удаляют оставшуюся часть. Лигатуру, наложенную на слезный мешок, удаляют на 6—7-й день. Кожные швы снимают как обычно.
482
265.
Модификация дакриоцист ори-ностомии по Тауми (схема), а — выделение слезного мешка (слизистая оболочка носа в костном окне удалена); б — разрез стенки слезного мешка; в — выведение лигатуры, наложенной на верхушку лоскута слезного мешка. в полость носа.
Модификация дмкриоцисторипостомии по Тауми. Подготовку операционного ноля и анестезию выполняют так же, как и при предыдущих операциях. Разрезают мягкие ткани вместе с над-I костницей вдоль переднего слезного гребешка. Слезный мешок вместе с надкостницей отслаивают от кости в области слезной । ямки. Костное отверстие делают только в области слезной ямки, что значительно легче, чем при операции по Тоти, так как кость в ’этой области наиболее тонкая. Чтобы предупредить повреждение слезного мешка, помощник прикрывает его. После образования костного окна удаляют слизистую оболочку носа в пределах этого окна (рис. 265, а). Из носа удаляют турунду с дикаином и вводят в полость носа катарактальную петлю. Иногда проведению петли мешает передний конец средней носовой раковины или клетки решетчатого лабиринта, в этом случае их надо резициро-вать.
Через нижний слезный каналец вводят зонд Боумена в слезный мешок, концом зонда выпячивают стенку мешка у верхнего
31* 483
края костного отверстия. Выпяченный участок слезного мешка с надкостницей фиксируют пинцетом, делают два разреза его стенки и надкостницы в форме треугольника, вершиной обращенного кверху (рис. 265,6). Через верхушку этого лоскута, фиксированного пинцетом, проводят шелковую лигатуру, концы которой завязывают узлом. Лигатуру с помощью катарактальной петли выводят из носа (рис. 265, в). Через операционную рану проверяют, погрузился ли лоскут слезного мешка в костное окно, после чего срезают узел и лигатуру привязывают к плотному валику, сделанному из ваты, у входа в нос. Вследствие натяжения нити лоскут опускается книзу, и отверстие в слезном мешке будет находиться в костном окне, при этом слизистая оболочка слезного мешка придет в соприкосновение со слизистой оболочкой носа. Образуется желоб, который и обеспечивает отток жидкости из слезного мешка в полость носа. Если через 2 сут лигатура сама не отойдет, то ее удаляют, разрезав у валика.
Модификация дакриоцисториностомии по Султанову с временной интубацией соустья вкладышем-фиксатором слизистых оболочек. Подготовку операционного поля и анестезию осуществляют так же, как при описанных выше операциях. В косом направлении книзу и кнаружи делают разрез длиной 1,5 см до кости, начиная на уровне внутренней связки век на расстоянии 3—4 мм от внутреннего угла глазной щели, медиальнее его, вдоль переднего слезного гребешка. Надкостницу отслаивают по обе стороны разреза, внутреннюю связку век перерезают. Слезный мешок выделяют из слезной ямки и отводят кнаружи. Ручной трепанофре-зой (диаметр 10 мм) делают круглое костное отверстие так, чтобы его нижний край соответствовал месту перехода слезной ямки в костный носослезный канал, а наружный (задний) — середине слезной ямки. Высверливают кость только в области слезного гребешка, а в пределах слезной ямки вынимают.
Слизистую оболочку носа в пределах костного отверстия не удаляют, а используют для пластики соустья. Дуговым разрезом по наружному (заднему) краю отверстия в кости (на 2/5 его окружности) и диаметральным (на всю длину) разрезом из слизистой оболочки носа выкраивают два лоскута полулунной формы и загибают на стенки костного отверстия. Из стенки слезного мешка выкраивают лоскут и опускают в полость носа (по Тауми). Стенки костного отверстия почти на всем протяжении оказываются покрытыми слизистыми оболочками. Для фиксирования их помещают вкладыш-фиксатор (рис. 266) таким образом, чтобы лоскуты слизистой оболочки носа оказались между ним и стенками костного окна, а лоскут слезного мешка приходился на перерыв в окружности вкладыша. Благодаря своей эластичности вкладыш, слегка прилегая к стенкам отверстия в кости, удерживает лоскуты слизистой оболочки носа в приданном им положении.
Нить, связывающую концы вкладыша, предварительно проводят через носовой ход и по окончании операции фиксируют к 484
266.
Модификация дакриоцисто-риностомии по Султанову (схема).
а — вкладыш-фиксатор: б — положение вкладыша-фиксатора в соустье: 1 — вкладыш-фиксатор;
2 — шелковая нить; 3 — полулунные лоскуты слизистой оболочки носа; 4 — лоскут стенки слезного мешка.
спинке носа полоской липкого пластыря. Вкладыши-фиксаторы изготавливают из мягких, эластичных и биологически инертных аллопластических материалов (тефлон, губчатый силиконовый каучук); они позволяют формировать пластическое соустье, способствуют приживлению слизистых оболочек, предотвращают гипергрануляцию. На края кожной раны накладывают непрерывный шов. Вкладыш-фиксатор удаляют на 7—10-е сутки.
Операции с внутрпносовым подходом
Подготовка операционного поля: кожу в области слезного мешка, наружного носа и верхней губы обрабатывают 70% этиловым спиртом или 1 % раствором бриллиантового зеленого на 70% этилоном спирте.
Лностозин: такая же как при операции по Тоти; кроме того, в слизистую оболочку полости носа в области проекции слезной ямки вводят 1—1,5 мл 2% раствора новокаина.
Дакриоцисториностомия по Весту в модификации Бокштейна. Для того чтобы правильно ориентироваться в положении слезного мешка, производят прокол медиальной стенки слезного мешка и слезной косточки зондом Боумена, введенным через нижний слезный каналец. Конец зонда, который будет виден в носу, соответствует задненижнему углу слезной ямки. На боковой стенке носа, впереди средней носовой раковины, выкраивают соответственно проекции слезной ямки ромбовидный лоскут слизистой оболочки носа и удаляют его. Затем кпереди делают дополнительные разрезы параллельно крыше полости носа и по краю грушевидного отверстия вниз (рис. 267). Образованный лоскут слизистой оболочки носа отсепаровывают от кости и временно откидывают вниз, что значительно облегчает последующие этапы операции. По пути к слезной ямке нередко встречаются перед-
485
267.
Выкраивание лоскута слизистой оболочки на боковой степке носа по Бокштепну (схема).
ние клетки решетчатого лабиринта или передний конец средней носовой раковины, которые необходимо удалять.
Узкое желобоватое долото или отогнутое желобоватое долото Веста сначала устанавливают на 10 мм выше и кпереди от видимого в носу конца зонда и делают горизонтальную надсечку кости. Так же делают вторую надсечку на 15 мм ниже параллельно первой. Затем кость продалбливают вертикально от верхней и до нижней надсечки. Кость целым куском (10X15 мм) удаляют с помощью костных щипцов легкими вращательными движениями. Резекцию медиальной стенки слезного мешка производят конхотомом, введенным в полость мешка после того, как он будет выпячен в полость носа надавливанием указательного пальца на внутренний угол глаза и вскрыт вертикальным разрезом. Поворачивая зонд, проведенный через нижний слезный каналец, во всех направлениях, убеждаются в том, что слезный мешок вскрыт достаточно широко. После удаления костных осколков временно откинутый лоскут слизистой оболочки носа укладывают на место и полость носа послойно тампонируют марлевыми турундами, пропитанными стерильным вазелиновым маслом. Турунды удаляют постепенно, слой за слоем, в течение 2— 4 дней. Кровотечение при операциях обычно незначительное, но иногда возникает обильное кровотечение. Для его остановки, кроме местного применения раствора адреналина 1 : 1000, лучше всего плотно тампонировать полость носа, терпеливо выжидая 5—10 мин, пока кровотечение остановится. Тяжелых кровотечений, которые требовали бы, например, задней тампонады обычно не возникает.
Модификация дакриоцисториностомии с помощью низкочастотной ультразвуковой аппаратуры по Белоглазову. Для выполнения операции применяют установку «Ультразвуковой нож» («УЗС-З») и ультразвуковой инструмент типа «ИМ-44». Все основные этапы операции на слезоотводящих путях с внутриносовым подходом производят с помощью двух ультразвуковых инструментов двуполуволновой длины: ножа-распатора и пилы (рис. 268).
486
268. Низкочастотная ультразвуковая установка «УЗС-З» с двуполуволновымп инструментами — ножом-распатором и пилой.
Подготовку операционного поля и анестезию выполняют так же, как при предыдущей операции. Снаружи через один из слезных канальцев, слезный мешок, слезную косточку и слизистую оболочку полости носа проводят специальный тупоконечный зонд-перфоратор таким образом, чтобы конец этого зонда был виден в полости носа и соответствовал задненижнему углу слезной ямки. Отогнутым концом ультразвукового ножа-распатора прорезают слизистую оболочку с надкостницей до кости в виде прямоугольника размером 10X10 мм таким образом, чтобы конец зонда находился в середине нижней стороны прямоугольника. Повернув боком лезвие пожа-распатора, входят через разрез слизистой оболочки под лоскут, отсепаронынают его вместо с надкостницей от кости и удаляют. Концом ножа-распатора разрезают слизистую оболочку и подлежащие ткани боковой стопки носа до кости, продвигая ого сзади лапород. Разрез ведут по плавной дуге кверху и кпереди, начиная у середины верхнего края образованного ранее прямоугольника и заканчивая его у края грушевидного отверстия над нижней носовой раковиной (рис. 269,а). Опять, повернув боком лезвие ножа-распатора, входят через разрез под лоскут и легкими движениями сверху вниз и кзади отделяют лоскут от кости. Выделенный лоскут откидывают книзу, открывая доступ к операционному полю.
С помощью ультразвуковой пилы выпиливают костный фрагмент из боковой стенки носа. Распил длиной 6—8 мм проводят сначала снизу кпереди на уровне нижнего края образованного в слизистой оболочке отверстия на месте проекции слезной ямки, затем наверху параллельно ему. Расстояние между этими распилами 8—10 мм. Затем передние концы распилов соединяют на наиболее толстом участке кости спереди (рис. 269,6). Далее выпиленный участок лобного отростка верхнечелюстной кости отво-
487
8
269. Эндоназальная дакриоцисториностомия с помощью ультразвуковых инструментов по Белоглазову (схема).
а — образование лоскутов на боковой стенке носа ультразвуковым ножом-распатором; б — образование костного окна ультразвуковой пилой; в — обнажение слезного мешка; г — формирование соустья слезного мешка с полостью носа; 1 — средняя носовая раковина; 2 — нижняя носовая раковина; 3 — слезный мешок; 4 — временно откидываемый лоскут боковой стенки носа; 46 — временный лоскут, смещенный вниз: 5 — носослезный канал; 6 — конец зонда, проведенного снаружи через слезную косточку; 7 — соустье слезного мешка с полостью носа; 8 — медиальная стенка слезного мешка.
рачивают кзади и легко удаляют на границе со слезной косточкой. Этот фрагмент кости, уменьшенный на ширину распилов, имеет в среднем размер 5X8 мм. Толщина его различна — от 0,5 до 8 мм в зависимости от того, чем преимущественно образована медиальная стенка слезной ямки: слезной косточкой или лобным отростком.
Концом ножа-распатора продольно рассекают слегка выпяченную изнутри зондом стенку слезного мешка вдоль его переднего края. Затем двумя поперечными разрезами рассекают стенку слезного мешка и образуют створку из его внутренней стенки. С правой стороны разрез напоминает букву «С», слева — обратное ее изображение (рис. 269, в). При отведении лоскута кзади он ложится на заранее подготовленный участок обнаженной кости кзади от слезной ямки (рис. 269, г). В этом положении лоскут фиксируют, прижимая тампоном, который вводят в общий носовой ход после возвращения на место временно откинутого с боковой стенки полости носа лоскута слизистой оболочки носа. Тампон, пропитанный 1 % линиментом синтомицина, удаляют через 24— 48 ч.
Другие способы дакриоцисториностомии. Для того чтобы обеспечить более удобный и широкий доступ к операционному полю, были предложены модификации операций на слезном мешке с различными подходами.
Способ с подходом через верхнечелюстную пазуху по фон Эйкену. После широкого вскрытия передней стенки верхнечелюстной пазухи по Кальдвеллу—Люку, удаляют костную стенку носослезного канала и обнажают носослезный проток, который резецирует до слезного мешка. Способ 488
применяют в основном при одновременном выполнении операции , на верхнечелюстной пазухе, как самостоятельную операцию не применяют.
Транссептальный способ по Гоферу. Сущность транссептального метода операции на слезном мешке заключается в том, что проделывается временное отверстие в носовой перегородке, через которое из другой половины носа проводят операцию дакриоцисториностомии, т. е., например, при операции на правом слезном мешке носовое зеркало и инструменты из левой половины носа проводят через отверстие, проделанное в носовой перегородке. Это делает более доступным и лучше обозреваемым все операционное поле и позволяет произвести операцию на слезном мешке под более крутым углом.
После обычной подготовки и местного обезболивания на границе кожи и слизистой оболочки носа или несколько кзади от нее производят сквозной разрез через всю толщу носовой перегородки, через образованную таким образом щель вводят носовое зеркало и производят операцию на слезном мешке. Этот разрез затем не зашивают, но тампонируют обе половины носа на 2— 3 сут. Разрез заживает, как правило, без образования перфорации. Обычно транссептальный способ усложняет операцию, однако он может быть полезен при очень узкой полости носа, значительном выступании края грушевидного отверстия внутрь, атрезии или сужении ноздри, а также при операциях по поводу рецидивов дакриоцистита после экстирпации слезного мешка или дакриоцисториностомии. В этих же случаях операция может быть произведена после временной мобилизации носовой перегородки или трансаппертурным способом.
Трансаппертурный способ по Клаусу. Способ заключается в том, что операцию дакриоцисториностомии производят эндоназально через край грушевидного отверстия. Для этого на боковой стенке носа выкраивают большой временно отбрасываемый вниз лоскут слизистой оболочки по Галле: узким длинным скальпелем делают разрез до кости, начиная возможно выше у свода носа, ведут его вдоль переднего края средней раковины и заканчивают несколько ниже в среднем носовом ходе. От начала первого разреза делают второй разрез, который ведут вдоль свода носа почти до края грушевидного отверстия, затем загибают вниз и назад несколько выше грушевидного отверстия и кончают в области переднего конца нижней раковины; очерченный таким образом лоскут тщательно отсепаровывают тонким элеватором до кости, откидывают назад и вниз и защищают тампоном. Выделяют край грушевидного отверстия, затем выдалбливают и удаляют костную пластинку шириной около 1,5 см, начиная от края грушевидного отверстия и до слезной ямки. После этого широко резецируют внутреннюю стенку слезного мешка. Временно смещенный лоскут слизистой оболочки носа возвращают на место, образовав в задних его отделах отверстие для отведения слезы в полость носа. Половину носа тампонируют на
489
48 ч. Операция трансаппертурным способом технически выполняется легче, чем операция Веста, но более травматична. Эффект от операции хороший. Она может быть рекомендована в тех случаях, когда сильно вогнута внутренняя поверхность лобного отростка и выступают края грушевидного отверстия в полость носа (особенно после травм), а также при особо узкой полости носа.
Операции искусственного образования слезных путей
Подготовка операционного поля. Кожу области слезного мешка и окружающих участков обрабатывают 70% этиловым спиртом или 1% раствором бриллиантового зеленого на 70% этиловом спирте, конъюнктивальную полость промывают каким-либо бактерицидным раствором.
Анестезия: инфильтрационно-проводниковая — такая же, как при экстирпации слезного мешка.
Лакодакриостомия по Сталларду. Слезный мешок отделяют ножницами от слезной кости, наружную стенку отделяют на половину его длины. Купол мешка прошивают шелковой нитью и весь мешок оттягивают книзу и кпереди от слезной ямки (рис. 270, а). После этого со стороны слезного озера по направлению к слезной ямке делают разрез обоюдоострым скальпелем длиной 5 мм. Через образованную рану пинцетом захватывают нить, которой прошит слезный мешок, и вытягивают купол его
270. Лакодакриостомия по Сталларду (схема).
а — разрез тканей со стороны слезного озера (выделенный слезный мешок оттянут книзу); б — срезание верхушки слезного мешка, выведенного через раневой канал в конъюнктивальную полость.
490
271. Лакорнпостомия по Поляку (схема).
а — разрез мягких тканей со стороны слезного мясца, рассечение слизистой оболочки носа в костном окне; б — введение в рану и фиксация канюли-протеза.
во внутренний угол глазпой щели, оттягивают кпереди и в сторону, с тем чтобы обнажить орбитальную фасцию. Фасцию рассекают вертикально, при этом в слезную ямку попадает жировая клетчатка, образуя мягкую подушку для слезного мешка в его новом положении. После вытягивания слезного мешка в рану купол его должен выстоять на 3 мм. Нижнее веко оттягивают кинзу с помощью острого крючка, введенного в нижнюю слезную точку, после чего накладывают четыре топких шелковых шва через стенку слезного мешка п конъюнктиву посредине передней и надпей губ конъюнктивальной раны. Затем срезают ножницами верхушку слезного мешка (рис. 270,6), на края кожной раны в области слезного мешка накладывают швы. Рану смазывают 1 % раствором бриллиантового зеленого и накладывают легкую повязку. Швы снимают на 6—7-й день.
Лакориностомия с постоянным ношением слезной канюли-протеза по Поляку. Подготовка операционного поля и анестезия такие же как при описанной выше операции. В области слезного мешка делают такой же разрез, как при дакриоцисториностомии. Если слезный мешок рубцово изменен, производят его экстирпацию. Выдалбливают костное окно размером 1X1 см. Слезное мясцо иссекают, так как оно может закрывать входное отверстие канюли (после операции). Затем делают вкол линейным скальпелем у основания слезного мясца, проводят его в область раны под кожу и рассекают слизистую оболочку носа. Ширина разреза во всех отделах соустья должна быть 5—7 мм (рис. 271, а). В рану со стороны конъюнктивальной полости вводят времен
491
ную (хирургическую) слезную канюлю-протез. Временную канюлю изготовляют из пластмассы АКР-7, длина ее 20—22 мм, диаметр 2—3 мм; конец, обращенный к глазному яблоку, воронкообразно расширен, а конец, обращенный к полости носа, имеет утолщение в виде оливы и оканчивается косым срезом для облегчения стока жидкости. На краях обоих концов сделаны отверстия для шелковых нитей, с помощью которых канюлю фиксируют (рис. 271,6). Просвет канюли 0,8—1 мм. Постоянная канюля отличается от временной тем, что на концах ее нет отверстий.
Верхний конец временной канюли фиксируют к внутренней спайке век с помощью шелковой нити, продетой через ушко канюли. От нижнего конца канюли также проводят нить. Конец ее выводят через ноздрю и приклеивают к щеке липким пластырем. На края кожной раны накладывают швы. Первые промывания канлюли для освобождения от слизи делают через 2—3 дня. Швы снимают через 5—6 дней. После того как пройдут все воспалительные явления, обычно через 2—3 нед, временную канюлю удаляют и заменяют постоянной. Закреплять постоянную канюлю нет необходимости, так как в тканях, где нет воспалительных явлений, она держится хорошо.
Выбор метода оперативного вмешательства при заболеваниях слезных путей
Лечение патологии слезных путей является офтальмологической и ринологической проблемой. В офтальмологической практике наиболее распространенной операцией при дакриоциститах является наружная дакриоцисториностомия, в оториноларингологии— эндоназальная дакриоцисториностомия. Оба способа обеспечивают высокий процент положительных исходов (95—98%), но имеют свои показания и ограничения. Для наружных способов операции характерен широкий доступ к операционному полю, хороший осмотр, удобство манипулирования, возможность пластического оформления соустья слезного мешка с полостью носа с помощью наложения швов на слизистые оболочки слезного мешка и полости носа и т. д. Однако наружные способы операции имеют весьма существенный недостаток, вытекающий из самой природы заболевания: дакриоциститы этиологически тесно связаны с заболеваниями полости носа и околоносовых пазух. В связи с этим перед хирургическим лечением дакриоциститов снаружи нередко необходимо провести курс оториноларингологического лечения или соответствующее хирургическое вмешательство.
Внутриносовые операции на слезном мешке также имеют характерные особенности. Так, при эндоназальном способе дакрио-цисториностомии отверстие соустья имеет наиболее совершенную для этих операций форму в виде воронки, расширяющейся в сторону полости носа, что технически не выполнимо при наружных
492
операциях. Кроме того, подход и создание соустья со слезным мешком при внутриносовых операциях осуществляют в нижнем отделе слезного мешка, без отсепаровки последнего от окружаю-щих тканей, при которой разрушаются нервно-сосудистые связи, что является более физиологичным в отношении сохранения механизма слезоотведения. Необходимо, однако, отметить, что эндоназальные методы операций на слезных путях не получили широкого распространения в ринологической практике и, представляя известные трудности для офтальмологов, не нашли применения в их хирургической деятельности. Все же многие достоинства эндоназальных операций, такие, например, как небольшая травматичность, косметичность, возможность в ходе операции выявить и устранить патологию и неблагоприятные особенности строения полости носа, которые способны привести к рецидиву заболевания, возможность выполнения одномоментных операций па слезных путях с двух сторон и успешного осуществления операций прп флегмонозном дакриоцистите, способствовали тому, что некоторые офтальмохирурги пересматривают укоренившееся предо гав.lenrie о сложности этих операций и овладевают методикой внутриносовых операций.
Получившее распространение в медицине в последние годы соблюдение щадящего принципа при проведении всех диагностических п терапевтических приемов приобретает особое значение в функциональной хирургии, к которой относятся и операции на слезных путях. Щадящий принцип должен лежать в основе действий врача, начиная с детального клинического обследования, установления точного топического диагноза, подготовки больного, проведения операции и кончая проверкой отдаленных результатов лечения. Такая хирургическая тактика (с использованием микрохирургического инструментария, операционных микроскопов, ультразвуковой хирургической аппаратуры, стекловолоконной OIIIHKH, новых синтетических материалов и т. д.) обеспечивает паилучпюе сохранен по присасывающей функции слезных канальцев и мешка и способствует наиболее физиологичному восстановлению функции слезоотведения.
Выбор метода операции с наружным или внутриносовым подходом при нарушении проходимости слезных путей в зависимости от особенностей проявления заболевания можно представить в виде рабочей схемы (табл. 14). Она касается «радикальных» методов восстановления слезоотведения в полость носа и не распространяется на случаи, требующие экстирпации слезного мешка. В настоящее время экстирпацию слезного мешка производят чрезвычайно редко. Эта «антифизиологичная» операция, обрекающая больного на постоянное слезотечение, может быть произведена только в исключительных случаях, когда у больного с дакриоциститом нельзя выполнить операцию восстановления слезоотведения в нос: при анофтальме, резкой травматической дислокации слезного мешка или его деформации с образованием дивертикулов, новообразованиях слезоотводящих путей, общетера-
493
Таблица 14
Схема выбора метода операции при нарушении проходимости слезных путей в зависимости от особенностей заболевания
Основной диагноз Сопутствующие изменения слезных путей Операции
наружные внутриносовые
Острый гнойный дакриоцистит — — Дакриоцистори-ностомия
Хронический гнойный дакриоцистит — Дакриоцистори-ностомия Дакриоцистори-ностомия
Стриктура или облитерация устья слезных канальцев Каналикулоци-стостомия с дренажем (нитями и т. п.)
То же Дакриоцистит или стриктура носослезного протока Каналикулоци-сториностомия с дренажем Каналикулоци-сториностомия с дренажем или без него
Облитерация медиальной части слезных канальцев (Уз и больше) — Лакоцистостомия
То же Дакриоцистит или стриктура носослезного протока Лакоцпсторино-стомия с временным дренажем Лакоцисторино-стомия с временным дренажем
» » Отсутствие или облитерация слезного мешка Лакориностомия с временным дренажем или постоянной интубацией Лакориностомия с временным дренажем
Отсутствие или облитерация слезного мешка Каналикулорино-стомия с временным дренажем Кап али кулорино-стомия с временным дренажем
певтических противопоказаний к дакриоцисториностомии, врожденной или приобретенной облитерации полости носа и т. д.
Операции на слезной железе
Подготовка операционного поля: кожу верхнего века и окружающих участков обрабатывают 70% этиловым спиртом или 1% раствором бриллиантового зеленого на 70% этиловом спирте.
Анестезия: инсталляционная (0,25—0,5% раствор дикаина} и проводниково-инфильтрационная'(1,5—2 мл 2% раствора новокаина) .
Удаление глазничной части слезной железы. По наружной половине брови делают разрез до кости длиной 2 см. После раздвигания краев раны крючками и гемостаза отделяют от краев кости тарзоорбитальную фасцию. Не рекомендуется проводить разрез слишком кнутри, чтобы не повредить мышцу, поднимающую верхнее веко. Слезную железу захватывают зубчатым пинцетом, выделяют тупым путем и отсекают (рис. 272) . В, случае необхо-
494
272. Удаление орбитальной части слезной железы (схема), в — разрез мягких тканей: б — отсечение слезной железы.
димости можно удалить и пальпебральную железу из этого же разреза. С этой целью железу приподнимают кверху со стороны конъюнктивального мешка и удаляют. Тарзоорбитальную фасцию сшивают кетгутом, кожную рану — шелком.
Удаление пальпебральной части слезной железы по Аксен-фельду. Больного заставляют смотреть вниз и в сторону носа. Производят двойной выворот верхнего века и захватывают его со стороны слизистой оболочки зубчатым пинцетом, железа при этом выделяется под конъюнктивой в виде дольчатого образовав
273. Удаление пальпебральной части слезной железы по Аксенфельду (схема).
а — разрез конъюнктивы по длине слезной железы; б — отсечение выделенной слез-еой железы.
495
а
ния. Разрезав конъюнктиву по длине железы, тщательно отдели ют ее сначала сверху, затем снизу. Освобожденную железу оття гивают пинцетом кпереди и подводят под нее бранши изогнутого пинцета Пеана; сжав бранши, отрезают впереди пинцета свобод' ный край железы (рис. 273). На края раны накладывают швы.
Укрепление смещенной слезной железы по Головину. Производят разрез кожи между свободным краем наружной части верхнего века и краем глазницы длиной 2—2,5 см. Послойно разре зают подкожную жировую клетчатку и тарзоорбитальную фасцию. Затем шелковой нитью с двумя иглами захватывают нижний край железы вместе с капсулой в виде петли. Железу вправляют в глазницу, обе иглы проводят через все ткани и выводят в наружной трети брови, где завязывают нити над марлевым валиком. Иссекают полоску растянутой тарзоорбитальной фасции, вырезают кожную складку и зашивают рану.
Операция по поводу кисты слезной железы (дакриопс). Делают двойной выворот верхнего века и выпячивают слезную железу. Со стороны конъюнктивы в области верхней переходной складки вырезают большую часть стенки кисты. В отдельных случаях применяют также способ образования стойкого сообщения полости кисты с конъюнктивальной полостью. Для этого через кисту проводят иглу с нитью, лучше капроновой, и оставляют нить с коротко обрезанными концами на 8—12 дней. За это время места проколов обычно эпителизируются и киста перестает быть замкнутой полостью.
Инъекция спирта в слезную железу по Таратину. Выворачивают верхнее веко и выпячивают слезную железу. Вкалывают снизу в выступающую слезную железу иглу шприца и, выводя ее, медленно инъецируют 0,75 мл 70—80% спирта. Мгновенно возникает сильная боль, которая быстро проходит. Как правило, наступает сильный отек век, а иногда и птоз, который исчезает через 10—12 дней. Слезотечение прекращается не у всех больных; иногда возникают рецидивы.
Электрокоагуляция слезной железы по Тихомирову. Индифферентный электрод малого диатермического аппарата фиксируют к руке больного. Сила тока должна быть 100—150 мА. Ассистент выворачивает верхнее веко и выпячивает слезную железу. Хирург вкалывает активный электрод в виде прямой иглы в ткань слезной железы и на секунду замыкает ток. Производят 10—15 таких вкалываний. В результате электрокоагуляции железистая ткань частично замещается рубцовой.
Глава 11
Операции на сосудистом тракте
За последнее десятилетие произошли изменения в хирургии сосудистого тракта. Благодаря большому распространению криоэкстракции катаракты резко сузились показания к препараторной иридэктомии. Фотокоагуляция, позволяющая в ряде случаев формировать отверстие в радужке, в значительной мере вытеснила оптическую иридэктомию.
За этот же период получили развитие операции на ресничном теле и собственно сосудистой оболочке (хориоидея).
Операции на радужке
Препараторная иридэктомия (рис. 274). Показаниями к этой операции являются значительное улучшение зрения при зреющей старческой катаракте после расширения зрачков (иридзктомия в данном случае является одновременно и оптической), выраженная ригидность радужки, особенно при осложненных катарактах, что заставляет предполагать наличие спаек (в этом случае препараторная иридэктомия является одновременно и эксплоратив-поп).
За веки вводят нскоранпиритель. Анестезия—инсталляционная и ретробульбарная. Уздечковый шов обычно проводят под верхней прямой мышцей. Скребцом или скальпелем, установленным перпендикулярно к роговице, намечают линию разреза у лимба и делают дугообразный надрез роговицы на 'Д—7з ее толщины длиной 3—4 мм. Выполнение разреза роговицы через ее надрез исключает интерламеллярное его проникновение; уступ, образующийся при надрезе роговицы, создает удобства для наложения роговичных швов. Ассистент фиксирует глазное яблоко уздечковым швом, хирург — фиксационным пинцетом, накладываемым на конъюнктиву у самого лимба на противоположной стороне, и производит разрез роговицы. Копьевидный нож, который удерживается тремя пальцами как карандаш, устанавливают в надрез роговицы под углом примерно 45° к поверхности роговицы. Плавным надавливанием на рукоятку ножа проводят кончик его в переднюю камеру, после чего наклоняют рукоятку, переводя лезвие в положение, параллельное поверхности радужки, и ведут кончик его по направлению к зрачку, доводя ширину разреза примерно до 4 мм.
32 Руководство по глазной хирургии
497
274. Основные этапы препараторной иридэктомии (схема).
а — надрез скребцом по лимбу; б — вкол копьевидного ножа перпендикулярно роговице; в — продолжение разреза после перевода ножа в параллельное радужке положение; г — захват радужки вблизи зрачкового края; д — отсечение радужки -ирис-ножницами; е — расправление ножек колобомы шпателем.
При выведении ножа кончик его слегка приподнимают кверху, так как оно сопровождается опорожнением передней камеры и может возникнуть опасность ранения радужки и хрусталика. Во время выведения ножа можно его боковым движением слегка расширить разрез. Глазное яблоко при этом фиксировано лишь уздечным швом. Ирис-пинцет с сомкнутыми браншами вводят через разрез в переднюю камеру и продвигают к зрачку. Радужку захватывают вблизи зрачкового края и плавно вытягивают в операционную рану; величина иссекаемого участка в значительной мере зависит от степени подтягивания извлеченной радужки. Отсечение радужки лучше производить ирис-ножницами. Если ставить их перпендикулярно к ране и слегка подтягивать радужку, получается узкая колобома; при значительном подтягивании радужки и расположении бранш ножниц параллельно операционной ране образуется широкая колобома.
Ножки колобомы радужки расправляют шпателем. Можно войти шпателем глубже и придать ножкам нужное положение. Если препараторная иридэктомия одновременно является и оптической, то эти манипуляции должны быть очень щадящими; лучше ограничиться ревизией шпателем роговичного разреза, а ножки колобомы расправить нежным поглаживанием роговицы тугим
498
Влажным ватным тампончиком. Шов на роговицу обычно не накладывают. После инстилляции в конъюнктивальный мешок 1% раствора сульфата атропина снимают векорасширитель и накладывают бинокулярную повязку.
Во время операции могут возникнуть осложнения.
1. Расслоение роговицы при проведении разреза ее наблюдается крайне редко. В этом случае необходимо извлечь копьевидный нож и вскрыть переднюю камеру по ранее сделанному надрезу скребцом, лезвие которого устанавливают перпендикулярно к плоскости роговицы; после истечения камерной влаги разрез расширяют до нужных размеров.
2. Накалывание радужки концом копьевидного ножа возможно при несоблюдении правил его продвижения. В этом случае следует осторожными качательными движениями попытаться освободить острие ножа и продолжать разрез. Если это не удается, то лучше извлечь нож и расширить разрез скребцом, скальпелем или роговичными ножницами.
3. Нерассеченным сфинктер радужки остается при неточном расчете момента отсечения радужки. Если иридэктомия преследует только препараторную цель, то следует захватить сфинктер тупым крючком для радужки, извлечь в рану и отсечь. Если предполагается получить также оптический эффект, то во избежание повреждения хрусталика лучше оставить сфинктер; он будет рассечен во время экстракции катаракты.
4. Кровотечение в переднюю камеру чаще происходит из радужки, иногда — из склеральной раны. В этом случае необходимо промывание передней камеры изотоническим раствором хлорида натрия (с добавлением нескольких капель адреналина 1 : 1000) до полной остановки кровотечения.
Оптическая иридэктомия. Глазное яблоко фиксируют уздечным швом, который процедят под сухожилием одной из прямых мышц в секторе, где планируется произвести вмешательство. Конъюнктивальный лоскут выкраивают после субконъюикти-валыюй инъекции 1% раствора новокаина. Конъюнктиву захватывают хирургическим пинцетом на расстоянии 4—5 мм от лимба и рассекают ножницами в ту или другую сторону концентрично лимбу, длина разреза 6—7 мм. Ножницами конъюнктиву от-сепаровывают к лимбу. Переднюю камеру вскрывают после определения проекции угла передней камеры на склеру путем транскорнеальной диафаноскопии. Отступя 0,5 мм кпереди, скребцом делают маркировочный надрез склеры и продолжают разрез по намеченной линии. Медленными пилящими движениями скребца (скальпеля, бритвенного лезвия) постепенно углубляются в склеру, сохраняя перпендикулярное положение лезвия. Длина надреза 4—6 мм. При этом нож попадает точно в угол передней камеры, которая вскрывается обычно на ограниченном участке. Разрез увеличивают до нужных размеров скальпелем, лезвие которого обращено вперед. Обычно при этом выпадает радужка.
Отсечение радужки можно произвести, захватив выпавшую
32’
49»
ее часть и подтянув до нужной степени. Если нужно получить колобому, то в определенном участке следует слегка заправить выпавшую часть радужки, выпуская при этом камерную влагу, после чего наложить ирис-пинцет, в нужном месте извлечь радужку из раны и отсечь ирис-ножницами, бранши которых устанавливают перпендикулярно к склеральному разрезу. Расправление ножек колобомы в пределах раны производят шпателем, после чего можно придать им нужное положение легким поглаживанием роговицы влажным тугим ватным тампончиком.
Конъюнктивальный лоскут укладывают на место и пришивают непрерывным швом. Если имеются опасность выпадения стекловидного тела, то целесообразно наложить на края склерального разреза шов или провизорно, или после вскрытия передней камеры; лучше пользоваться биологическими швами. Склеро-склеральный шов целесообразно накладывать и тогда, когда необходимо к концу операции восстановить переднюю камеру.
Осложнения во время операции наблюдаются редко. Одним из них является слишком высокое расположение склерального разреза, когда проекция его совпадает с передним отделом ресничного тела и при углублении разреза не вскрывается передняя камера, а в глубине обнаруживается ткань ресничного тела. Избежать этого можно, используя при определении места разреза диафаноскопию. Если осложнение все же возникло, то следует через разрез шпателем осторожно пройти в переднюю камеру, а затем расширить разрез тонкими ножницами, смещая его до лимба. В этом случае обязательно накладывают склеро-склеральный шов.
Другие осложнения и меры борьбы с ними освещены при описании операции препараторной иридэктомии. Послеоперационное ведение больных аналогичное.
Неполную колобому радужки формируют (сфинктерэктомия, иридэктомия «в теле» радужки с сохранением сфинктера) с целью создать оптимальные оптические условия при ограниченных помутнениях хрусталика. Оперативный подход такой же как при препараторной иридэктомии (рис. 275). Целесообразно наложить роговичный шов.
Операции при иридодиализе. Иридопексия (рис. 276) показана при иридодиализе — травматическом отрыве радужки у места перехода ее в ресничное тело. Операцию производят также при монокулярной диплопии и с косметической целью.
После наложения уздечного шва и образования конъюнктивального лоскута основанием к лимбу определяют линию разреза с помощью диафаноскопии скребцом или осколком бритвенного лезвия производят разрез и вскрывают переднюю камеру. Разрез расширяют ножницами в соответствии с величиной диализа. Накладывают два—три склеро-склеральных провизорных шва, концы которых завязывают, но затягивают лишь слегка. Тонким ирис-пинцетом, введенным между швами в переднюю камеру, захватывают радужку и в нескольких местах ущемляют в разрезе; по
500
275. Иридэктомии с образованием неполной колобомы радужки (схема).
• — разрез по лимбу копьевидным ножом; б — захват радужки в 3—4 мм от зрачкового края; в — отсечение радужки; г — вид образовавшейся колобомы.
мере извлечения и ущемления радужки затягиваются склеросклеральные швы. Для фиксации корня радужки в настоящее время более целесообразным считают наложение швов на радужку и склеральную губу.
Л. X. Шоттер (1954) предложил оригинальный метод исправления иридодиализа, явившийся прототипом закрытых пластических операций на радужке. Операция состоит в следующем.
276. Иридопексия при иридодиализе (схема).
а — образование конъюнктивального лоскута; б — вскрытие передней камеры копьевидным ножом в 1,5 мм от лимба; в — расширение разреза ножницами; г — наложение провизорных склеро-склеральных швов; д — ущемление корня радужки с поэтапным завязыванием швов; е — непрерывный шов на конъюнктиву.
501
277. Устранение иридодиализа по Шоттеру (схема).
а, б, в — этапы операции.
В склеру, отступя 1 мм от лимба, в месте, соответствующем отрыву радужки, вкалывают иглу с нитью, проводят ее в переднюю камеру и, не задевая радужки, выводят через роговицу между краем зрачка и периферией (рис. 277, а) . Затем, повернув иглу, вводят ее в обратном направлении в то же отверстие выкола в роговице и проводят по тому же каналу в камеру (рис. 277,6). Когда игла снова окажется в передней камере, ею захватывают оторвавшийся край радужки и выводят иглу из камеры, выкалывая ее рядом с местом первого вкола. Нить затягивают, причем радужка притягивается к месту своего отрыва (рис. 277, в), где и прирастает. Через 10 дней нить удаляют. При более обширном иридодиализе можно провести несколько подобных швов. В последнее время Л. X. Шоттер предложил для более удобного проведения швов инструмент по типу микродешана, который вводят в камеру через прокол роговицы.
Г. Е. Венгер (1979) с целью облегчения операции предложила специальную иглу с обоими острыми концами и отверстием для нити в середине, движения которой производят по принципу челнока.
В. Н. Лагин (1984) разработал способ устранения иридодиализа прямой иглой с ушком у острия. Подобный инструмент легко изготовить из тонкой иглы от бытовой швейной машины, отточив ее до соответствующей толщины и закрепив в ручке (рис. 278). Игла (см. рис. 278, а) выполнена в виде прямого остро заточенного стержня с отверстием на колющем острие, на проти-
502
278. Устранение иридодиализа по Лягину (схема).
а — игла: б — этапы операции: А:1 — вкол иглы без нити в область лимба, 2 — прокол оторванного края радужки, 3 — прокол в области лимба, проведение нити в ушко; Б — иглу с нитью протягивают через отверстие 3 и 2: В — прокол лимба 4 рядом с ранее сделанным проколом 3.
воположпом конце крепится ручка под тупым углом к стержню иглы.
После анестезии иглу без нити вкалывают в область лимба в меридиане, противоположном месту максимального отрыва радужки от корня, продвигают иглу в передней камере параллельно радужке, подводят к свободному краю оторванной радужки и прокалывают ее. Затем выводят иглу через лимб в месте предполагаемого подшивания оторванного края радужки. Заряжают иглу нитью и обратным движением проводят иглу с нитью через ранее сделанный прокол радужки, затем обратным движением иглы прокалывают лимб рядом с ранее сделанным проколом. Петлю нити рассекают за двойную нить, оторванную радужку подтягивают к лимбу и одну из нитей удаляют, вторую затягивают. Через один прокол накладывают необходимое количество швов, повторяя описанные выше манипуляции.
Г. Е. Венгер (1981) предложила при значительных посттравматических дефектах способ частичной трансплантации радужки путем ее пересадки на укрепляющей основе, в качестве которой могут быть применены послойный лоскут донорской роговицы, а
503
а б
279. Частичная трансплантация радужки по Венгер (схема).
а — наложение наметочного шва через края колобомы; б — швы на корневой части трансплантата.
также пленки из синтетического материала, инертного для тка-ней глаза.
Из консервированного глаза выкраивают послойный лоскут роговицы, величина которого должна превышать площадь дефекта радужки на 1—1,5 мм с каждой из боковых сторон. Из радужки консервированного глаза выкраивают трансплантат соответственно величине дефекта. Трансплантат радужки укладывают на трансплантат роговицы и расправляют шпателем. Через зрачковый край трансплантатов проводят наметочный шов, концы которого остаются свободными. Трансплантат на укрепляющей основе помещают на область дефекта радужки больного. Свободные концы нити, наложенной на зрачковый край трансплантата, проводят через радужку больного у зрачкового края и укрепляющую основу. Подтягивают шов до образования зрачка правильной формы и величины. При завязывании узел шва обращен в сторону стекловидного тела. Корневую часть трансплантата вместе с укрепляющей основой фиксируют в склере узловыми швами (рис. 279)-Способ дает возможность получить хороший оптический и косметический эффект у больных с тяжелыми травмами глаза.
Г. Е. Венгер (1982) описала способ устранения полных колобом радужки, который заключается в разрезании радужки у корня по обе стороны от колобомы (рис. 280) и последующем сшивании ее краев (авт. свид. № 929099).
Удаление кист и опухолей радужки (рис. 281). Кисты радужки должны быть удалены как можно раньше, так как они нарушают функции и гидродинамику глаза. Оперативное удаление опухоли показано при появлении признаков ее малигнизации. Техника операции удаления кист и опухолей радужки почти одинакова, отличие заключается лишь в том, что при кистах иссечение выполняют более экономно, тогда как при опухолях захва-504
280.
Способ устранения полных колобом радужки по Венгер (схема).
• — г — этапы операции.
в
тывают окружающие здоровые ткани в виде пояса шириной не менее 2,5—3 мм.
Перед операцией необходимо максимально снизить внутриглазное давление. Обезболивание комбинированное: премедикация и местная анестезия. В секторе залегания новообразования на две соседние прямые мышцы накладывают уздечные швы. Выкраивают конъюнктивальный лоскут основанием к лимбу. Скребцом производят надрез по лимбу на 'А: окружности или больше н зависимости от величины новообразования. На края надреза накладывают два -три провизорных биологических шва. Переднюю камеру вскрывают по линии надреза копьевидным ножом сбоку от новообразования, для того чтобы исключить его ранение; разрез расширяют роговичными ножницами соответственно линии надреза. Роговицу с конъюнктивальным лоскутом отводят книзу. Сбоку от новообразования в пределах здоровой ткани радужку захватывают у зрачкового края ирис-пинцетом и приподнимают над хрусталиком в виде шатра. Одну браншу ирис-ножниц (с тупым концом) заводят за радужку в радиальном направлении и продвигают в сторону к ее корню, после чего мягким сечением радужку рассекают от зрачкового края до корня. Таким же образом рассекают радужку с другой стороны опухоли, после чего несколькими сечениями радужку отсекают у корня или в прикорневой зоне, что зависит от распространения опухоли. Затягивают и завязывают провизорные корнеосклеральные швы, накладывают дополнительные швы. Конъюнктивальный лоскут укладывают на место и пришивают непрерывным швом.
Если операцию производят по поводу кисты, то возможно ее
505
281. Основные этапы удаления кисты (опухоли) радужки (схема).
а — надрез склеры в 1,5 мм от лимба после образования конъюнктивального лоскута; б — вскрытие передней камеры сбоку от новообразования копьевидным ножом; в — отведение кисты от задней поверхности шпателем; г — радиальное рассечение радужки ирис-ножницами; д — отсечение радужки у корня; е — адаптация операционных разрезов швами.
преждевременное опорожнение, что затрудняет определение ее границ, а следовательно, и иссечение в пределах здоровой ткани. При наличии кист, не соприкасающихся с роговицей, вскрытие их может быть следствием неосторожности; чаще это наблюдается при кистах, плотно соприкасающихся с роговицей. Для предупреждения этого осложнения необходимо после вскрытия передней камеры войти в нее тонким шпателем и осторожно отделить кисту от задней поверхности роговицы. Для того чтобы исключить возможные затруднения при удалении кисты в случае ее вскрытия, следует еще до операции наметить какие-либо опознавательные пункты. Во избежание повреждения хрусталика нужно при продвижении бранши под радужкой конец ее слегка отстранять от поверхности хрусталика.
Полученные во время операции ткани распластывают на пробковом блоке, прикалывают по краям булавками и в таком виде фиксируют для последующего гистологического исследования. Послеоперационный период обычно протекает довольно спокойно. Иногда наблюдаются позднее восстановление передней камеры, кровоизлияние в нее, иридоциклит при явлениях гипо-
506
Тон и и. После операции, несмотря на образование достаточно широкой колобомы радужки, нередко сохраняются относительно высокие функции глаза.
Операции при новообразованиях
сосудистого тракта
Внедрение в офтальмологическую практику микрохирургии вначительно расширило показания к операциям на сосудистом тракте. Они чаще всего являются составной частью других хирургических вмешательств, таких как экстракция катаракты, анти-глаукоматозные операции, а также этапами реконструктивных операций после травм глаза. Эти операции описаны в соответствующих главах настоящего руководства. Ниже будут рассмотрены только операции, выполняемые при внутриглазных новообразованиях.
Опухоли сосудистого тракта многообразны по морфологической структуре. В связи с отсутствием клинических признаков, позволяющих до гистологического исследования абсолютно точно определять характер их роста, вопрос о лечении этих опухолей решают, исходя из особенностей их локализации и распространения. Успехи микрохирургической техники и создание набора микрохирургических инструментов позволяют в настоящее время подходить к хирургическому лечению каждого больного с учетом индивидуальных особенностей.
Схематично весь комплекс хирургических операций, которые производят в настоящее время при новообразованиях сосудистого тракта, можно представить следующим образом.
Блокэксцпзия, в основе которой лежит удаление опухоли вместо с прилежащими тканями единым блоком, может быть выполнен;! в индо иридэктомии, иридоциклосклсрэктомии, иридоцикло-корпеосклерэктомии и иридоциклохориоидсклерэктомии.
Трансклеральное разрушение опухоли осуществляют с помощью низких температур (криодеструкция) или путем подшивания радиоактивных бета-аппликаторов. Основным условием выполнения локальной эксцизии любой опухоли, в том числе и опухоли радужки, является широкое иссечение ее в пределах здоровых тканей. Внедрение в практику микрохирургической техники значительно облегчило выполнение этого условия. Операцию выполняют в несколько этапов: 1) местная анестезия по общепринятой методике; 2) вскрытие передней камеры роговичным или лимбальным разрезом; 3) фиксация радужки вне опухоли ирис-пинцетом или криоаппликатором и выведение опухоли в рану; 4) иридэктомия в пределах здоровых тканей; 5) швы на радужку; 6) швы на рану, восстановление передней камеры с помощью пузырька воздуха или изотонического раствора хлорида натрия.
При локализации опухоли в околозрачковой зоне достаточно провести лимбальный или роговичный разрез. Распространение
507
282. Способы вскрытия глаза при удалении опухолей ирпдоцилиарной зоны.
а — трапециевидный роговичный разрез по Фриде; б — склеральный разрез по Фриде в виде прямоугольника, основанием обращенного к экватору; в— склеральный разрез по Линнику с выкраиванием двух лентовидных полос; г — склеральный разрез по Стелларду с выкраиванием двух треугольных лоскутов; д — склеральный прямоугольный разрез по Флирингеру, обращенный основанием к лимбу; е — трапециевидный склеральный разрез по Бровкиной, основанием обращенный к экватору; ж — корнеосклеральный разрез по Гундоровой. ’
опухоли к корню радужки побудило R. Friede (1953) предложить трапециевидный разрез роговицы, основание которого обращено к лимбу. Поскольку не только злокачественные опухоли, но и доброкачественные новообразования типа лейомиом имеют инфильтративный характер роста и распространяются на корень радужки, несмотря на гониоскопические данные, следует предполагать возможность поражения зон угла передней камеры. Естественно, что при таком положении разрез, предложенный R. Friede, не может обеспечить максимально широкий доступ к структурам угла передней камеры глаза. Наиболее оптимальные условия в подобных случаях обеспечивает корнеосклеральный доступ, предложенный Р. А. Гундоровой и соавт. (1966). Согласно их методике, в зоне локализации опухоли производят П-образный разрез на 2/з ее толщины, отступя 3—4 мм от наружного лимба. Склеральный лоскут отсепаровывают до лимба с частичным расслоением его и роговицы. Опухоль или кисту удаляют единым блоком с прилежащими тканями внутренних слоев роговицы и склеры.
Иридоциклосклерэктомия. Иридоцилиарные опухоли, несмотря на разнообразие клинических симптомов, имеют единую анатомотомографическую зону поражения, которая явилась определяющим моментом при разработке техники операции.
Органосохраняющие операции возможны при иридоцилиарных опухолях, распространяющихся на 7s—окружности ресничного тела. R последние годы подтвердилось положение Blatt и Ursu (1958—1959) о большой сопротивляемости склеры по отношению к инфильтративному росту опухоли. Экстрабульбарный рост при иридоцилиарных опухолях происходит через передние эмиссарии и не является признаком активизации процесса [Новикова Г. К., 1974; Ashton N., 1964]. Эти исследования позволяют расширить показания к блокэксцизии и производить органосохраняющие опе-508
283. Набор инструментов и поддерживающих каркасов для проведения блок-эксцизпп.
I рации даже при окстрабульбарпом росте опухоли. В связи с трудностью определения скорости роста опухоли при иридоцилиар-пой локализации вопрос об операции следует решать в момент установления диагноза. Описано более 10 способов вскрытия глазного яблока при удалении опухолей иридоцилиарной зоны (рис. 282) [Гундорова Р. А. и др., 1965; Линник Л. Ф., 1966, 1971; f Бровкина А. Ф., 1978; Friede R., 1956; Flieringer, 1961; Stallard Н. В., 1966; Sears М., 1968; Dyson J., 1972, и др.]. Многооб- разие предложенных разрезов обусловлено стремлением удалить ; опухоль в пределах здоровых тканей с минимальной травмой глаза.
Техника операции. Параллельно лимбу и отступя 5 мм от него в квадранте, где предполагается произвести блокэксцизию, делают разрез конъюнктивы и отсепаровывают ее от лимба. Под-1 шивают кольцо Флиринга или специальный поддерживающий I каркас (рис. 283). Под контролем диафаноскопа маркируют гра-
Ц ницы опухоли. Разрез склеры на 2/з ее толщины делают на рас-
11 стоянии 3—4 мм от видимых границ опухоли. Если имеется не-
509
284. Иридоциклосклерэктомия (схема).
а — принцип блокэксцизии; б—г — этапы операции.
большая опухоль ресничного тела, локальная или распространяющаяся в радужку, то, с нашей точки зрения, наиболее оптимальные условия для удаления опухоли создает склерокорнеальный разрез по Гундоровой. Выкраивают П-образный лоскут склеры на 2/з ее толщины, основание которого обращено к лимбу. Лоскут отсепаровывают до появления прозрачных глубоких слоев роговицы.
В случаях, когда приходится планировать и одномоментную экстракцию катаракты, мы используем предложенный нами трапециевидный склеральный разрез (рис. 284). Параллельно лимбу и отступя от него 2—3 мм производят разрез склеры на 2/3 ее толщины длиной несколько меньше V2 окружности лимба. Склеральный лоскут отсепаровывают до внутреннего края лимба. Два дополнительных разреза проводят под углом к первому по на
510
правлению к экватору глазного яблока таким образом, чтобы Каждый из них отстоял от маркированных границ опухоли не ме-Кее чем на 4 мм. Образованный трапециевидный лоскут, основа-КИе которого обращено к экватору, отсепаровывают кзади настолько, чтобы между задним краем опухоли и основанием лоскута было расстояние 4—5 мм.
Предлагаемый трапециевидной формы разрез позволяет произвести радикальную блокэксцизию с одномоментной экстракцией катаракты с меньшей травмой наружных оболочек глазаг Чем при формировании лоскута прямоугольной формы. В углах сформированного лоскута накладывают предварительные швы (супрамид 8:0). По краям склерального разреза на оставшиеся глубокие слои склеры наносят черепицеобразно один—два ряда диатбрмокоагуляторов для отграничения опухоли и профилактики кровотечения, которое может возникнуть в момент резекции ресничного тела и собственно сосудистой оболочки. С этой целью может быть использована также и криопексия.
Следующим этапом операции является вскрытие передней камеры, которое производят лезвием бритвы через прозрачные глубокие слои роговицы вне зоны расположения опухоли. Роговичный разрез расширяют ножницами. С помощью ирис-пинцета или криоаппликатора радужку подтягивают к ране и производят два радиальных разреза радужки. Дальнейшее иссечение опухоли осуществляют вместе с прилежащими участками глубоких слоев роговицы, склеры и ресничного тела по линии предварительно произведенной диатермокоагуляции. В зависимости от локализации опухоли можно рекомендовать два варианта ее иссечения. В случаях, когда опухоль ограничена ресничным телом или распространяется также па хориоидею, после вскрытия передней камеры делают сквозной разрез склеры и ресничного тела на ограниченном участке. В разрез вводят бранши ножниц Ваннаса и весь намеченный ранее участок сосудистого тракта иссекают единым блоком (глубокие слои склеры, участок ресничного тела собственно сосудистой оболочки с опухолью, периферические отделы радужки). По мере иссечения задних отделов блока стекловидное тело шпателем осторожно отделяют от прилежащей опухоли и склеральным лоскутом прикрывают образующийся дефект в стенке глазного яблока. Если визуально выявлено распространение опухоли на радужку, то предпочтительнее после вскрытия передней камеры первоначально произвести радиальную иридо-томию по обе стороны от опухоли вне зоны ее расположения, а затем приступить к циклосклерэктомии по описанной выше методике (рис. 285—290).
В случае необходимости выполнить одновременно экстракцию катаракты боковые разрезы трапециевцдного склерального лоскута закрывают швами, после чего осуществляют экстракцию катаракты по обычной методике. Важным моментом, с точки зрения профилактики возможных осложнений, следует считать тщательную герметизацию краев раны, которая может быть обеспечена
5Ц
285. Иридоцилиарная пигментированная лейомиома.
наложением швов с интервалом между ними не более 2 мм. В случае необходимости можно использовать гомопластику склерой. По окончании операции ушивают влагалище глазного яблока и конъюнктиву.
286. Выкраивание трапециевидного ный лоскут сдвинут на роговицу.
склерального лоскута, конъюнктиваль-
512
(2/3 толщины склеры) смешен на ро-
287. Выкроенный склеральный лоскут говицу. Лимб отсепарован.
288. Вскрыта передняя камера, в рану вставлена опухоль радужки.
33 Руководство по глазной хирургии
289. Сквозной разрез оставшейся склеры радужки. Опухоль, распространившаяся стично на хориоидею.
после иссечения опухолн на ресничное тело и ча-
290. Циклохориоидэктомия.
291.
Глаз после иридопласти-ки и ушивания склерального трапециевидного разреза.
Опухоль радужки и ресничного тела чаще всего локализуется в нижнем и нижненаружном квадрантах, поэтому образующаяся в процессе операции широкая базальная или полная колобома служит причиной значительного снижения зрения вследствие светорассеяния или монокулярной диплопии. В последние годы для локализации этих неприятных последствий после ушивания боковых раарепоя мы накладываем па радужку 1—2 шва и рану полностью нашиваем (рис. 291). Радужку ушивают синтетическим моповолокном 10: 0, склеру — тем же шовным материалом 8 : 0. Переднюю камеру восстанавливают с помощью пузырька воздуха или изотонического раствора хлорида натрия. Под конъюнктиву вводят антибиотики. Длительность постельного режима в послеоперационном периоде составляет 3—7 дней и зависит от объема проведенной операции. Местно больные получают мид-риатики, антибиотики, кортикостероидные препараты.
Операционные и послеоперационные осложнения такие же, как и при других внутриглазных операциях.
Выпадение стекловидного тела — наиболее распространенное осложнение при иридоциклосклерэктомии — обусловлено не только большим объемом оперативного вмешательства, но и часто спаянностью опухоли с передней пограничной пластинкой. В момент отделения мембраны шпателем целость ее нарушается, что и приводит к выпадению стекловидного тела. Важной мерой профилактики этого осложнения следует считать предварительное
33
515
подшивание кольца Флиринга или поддерживающего каркаса. Кроме тбго, вероятность выпадения стекловидного тела уменьшается при предварительном отсасывании его в противоположном квадранте после вскрытия передней камеры.
В послеоперационном периоде наиболее частым осложнением является иридоциклит, который обычно протекает подостро и хорошо поддается противовоспалительному лечению. Следует отметить возможность кровоизлияния в переднюю камеру и стекловидное тело в ближайшие 4—7 дней после операции. В связи с этим целесообразно и в послеоперационном периоде назначать гемостатические средства в течение 7—10 дней.
Отсутствие восстановления передней камеры и гипотония обычно обусловлены недостаточно хорошей адаптацией краев раны. Избежать этих осложнений позволяет тщательная герметизация краев раны.
Длительная гипотония как результат нарушения циркуляторных процессов в глазу наблюдается у больных, которым произведена резекция V2 ресничного тела [Линник Л. Ф., 1971]. Однако исследования, проведенные нами, показали, что резекция ресничного тела и радужки не более чем на ’/з окружности не оказывает заметного влияния на уровень кровоснабжения и гидродинамику в оперированных глазах. Следовательно, одной из возможных мер профилактики гипотонии как результата циркуляторных расстройств в оперированном глазу можно считать возможно раннее оперативное лечение опухолей иридоцилиар-ной зоны.
Вследствие нарушения целости ресничного пояска в зоне резекции ресничного тела в послеоперационном периоде нередко наблюдается незначительная дислокация хрусталика, приводящая к астигматизму и некоторому снижению зрения. К сожалению, при обширных оперативных вмешательствах, когда удаляют более >/3 ресничного тела, это осложнение становится фатальным и предотвратить его развитие практически невозможно.
Хориоидэктомия. Опухоли собственно сосудистой оболочки при небольших размерах в настоящее время подвергают локальному разрушению, реже их удаляют. Следует подчеркнуть, что лучшего лечебного эффекта при меланомах собственно сосудистой оболочки удается добиться при сочетании нескольких методов. Наиболее часто комбинируют транспупиллярное разрушение опухоли (лазеркоагуляция) с транссклеральным (криоразрушением или облучением с помощью фиксированных бета-аппликаторов).
Локальная эксцизия опухоли собственно сосудистой оболочки в принципе возможна. В литературе описана методика хирургического вмешательства [Волков В. В. и др., 1970; Гундорова Р. А. и др., 1974; Algan В., 1967; Peyman G. A., Apple D. J., 1974]. Однако сложность оперативной техники, опасность диссеминации меланомы в случае проведения разреза по опухолевым тканям, тяжелые послеоперационные осложнения, приводящие к гибели глаза как органа зрения, наличие других щадящих методов лече-516
Ния не позволяют в настоящее время широко рекомендовать эту операцию. Следует подчеркнуть, что все авторы, занимающиеся вопросами органосохранного лечения при внутриглазных опухолях, придерживаются единой точки зрения в отношении показаний и противопоказаний к блокэксцизии опухоли собственно сосудистой оболочки. Можно считать допустимой попытку хирургического лечения, когда размеры опухоли не превышают 10 мм в поперечнике и 3 мм по высоте и она имеет доэкваториальную или экваториальную локализацию. Хирургическая техника хорио-идэктомии основана на тех же принципах, что и операции на ресничном теле (иридоциклосклерэктомия). Используют прямоугольные, полукруглые или лентовидные склеральные разрезы.
Криодеструкция. Этот метод разрушения опухоли собственно сосудистой оболочки начали применять в последние 7—8 лет. Возможность использования низких температур для разрушения опухоли теоретически обоснована. Известно, что низкие температуры при определенных условиях губительно действуют на живую клетку, так как в процессе быстрого охлаждения происходит внутри- и внеклеточное образование кристаллов льда, что приводит к дегидратации клетки, денатурации белка, нарушению внутриклеточных биохимических процессов, разрушению клеточных мембран [Copper, 1966]. Экспериментальные исследования Н. Lincoff и соавт. (1967) показали, что не все ткани и клетки одинаково чувствительны к холоду. Так, склера, кровеносные сосуды (за исключением капилляров) устойчивы к замораживанию. В одинаковых условиях молодая, быстро растущая ткань в большей степени подвержена разрушению, чем зрелая. Гистологическое изучение изменений, наступающих в меланоме при замораживании, показало возможность разрушения ткани опухоли в золе прямого воздействия низких температур; в удалении от нее опухолевые клетки остаются неповрежденными [Бровкина А. Ф. и др 1!177|.
Т е х и и к а крио д е с т р у к ц и и. При экваториальной лока-л ипации опухоли криоаппликации наносят после разреза конъюнктивы, влагалища глазного яблока и обнажения склеры. Границы опухоли должны быть отмаркированы под контролем диафаноскопа. На расстоянии 2—2,5 мм кнаружи от видимых границ опухоли отсепаровывают круглый лоскут склеры 'А ее толщины на узкой ножке (ширина 3—4 мм). Криоаппликации наносят концентрично и черепицеобразно от периферии к центру опухоли. Экспозиция составляет 60 с. Ледяной шарик в зоне замораживания появляется через 50—60 с, что можно контролировать офтальмоскопически, и удерживается в течение 30—40 с. Время экспозиции выбирают в зависимости от размеров опухоли и ее проминенции. Каждое новое замораживание следует начинать после полного оттаивания тканей. Для криодеструкции опухоли можно использовать криоаппликатор модели КГ-195. В зависимости от локализации и размеров опухоли используют наконечники с рабочей поверхностью 2,5 и 5 мм в диаметре. Это
517
позволяет получать поля замораживания размером от 4—5 до 9—10 мм. При использовании криоаппликатора диаметром 5 мм можно ограничиться меньшим количеством аппликаций. По окончании операции склеральный лоскут фиксируют четырьмя—пятью нейлоновыми швами (8:0). На конъюнктиву и влагалище глазного яблока накладывают непрерывные швы. Под конъюнктиву вводят антибиотики и дексазон.
При парамакулярной локализации опухоли предварительно следует прошить и пересечь наружную прямую мышцу, а криоаппликации наносить через всю толщу склеры. Разумеется, эффект криодеструкции при этом может быть не столь выраженным, как при расслаивании склеры, однако локализация опухоли затрудняет выкраивание склерального лоскута. Для лучшего промораживания глубоких тканей склеру вдавливают наконечником криоаппликатора.
Криодеструкцию опухоли во всех случаях следует сочетать с лазеркоагуляцией, которую проводят за 3—5 нед до криовоздействия. В первые сутки после криодеструкции в зоне замораживания на глазном дне отмечается отек сетчатки, по краю отека — мелкие кровоизлияния. На 5—6-е сутки появляются кровоизлияния в очаге криодеструкции, слабая опалесценция задних слоев стекловидного тела.
При изучении реакции биологических тканей на воздействие низких температур было отмечено, что очаг крионекроза обладает своеобразной «биологической инертностью» и вызывает лишь самую минимальную перифокальную реакцию [Кандель Э. И. и др., 1974]. Видимо, глаз по своим апатомо-физиологическим особенностям значительно отличается от изученных биологических моделей: в ответ на замораживание и образование очага крионекроза наступает выраженная перифокальная реакция с экссудацией в сетчатку и стекловидное тело с последующими грубыми изменениями в них.
Формирование хориоретинального рубца наблюдается спустя 4—6 нед после операции. Для него характерна резко выраженная пигментация, чаще слегка проминирующая, реже плоская. Появление компактного интенсивного пигмента объясняется выраженной гиперплазией выживших клеток пигментного эпителия.
Эффективность криодеструкции зависит от ряда факторов: величины рабочего наконечника, скорости замораживания и оттаивания, четкого выведения тени опухоли на поверхность склеры, Диаметр наконечника криоаппликатора предпочтительнее выбирать максимально большим, с тем чтобы образуемая ледяная сфера при минимальном количестве аппликаций превышала по своим размерам узел опухоли. Замораживание должно быть достаточно быстрым; ледяную сферу, по нашему мнению, целесообразно удерживать в течение 1 мин и более. Это создает условия для более значительной деструкции опухолевых клеток на всем протяжении. Вместе с тем следует помнить и об опасности перемо-раживания глаза, так как оно может привести к сморщиванию
518
Намного яблока. Предпочтительнее замедленное оттаивание, ускорить его, орошая глаз изотоническим раствором хлорида нат-|iH, но следует. Только при замедленном оттаивании внутриклеточные кристаллы льда продолжают увеличиваться в размерах, Что ведет к еще большему разрушению клетки. Учитывая особую чувствительность сетчатки и стекловидного тела к замораживанию, криогенное воздействие целесообразно производить ври опухолях диаметром не более 10 мм, имеющих проминенцию До 3,5—4 мм.
Лазер- и фотокоагуляция опухолей сосудистого тракта. Первый отечественный лазерофтальмокоагулятор (ОК—1) на рубине ©конструирован в Научно-исследовательском институте глазных болезней и тканевой терапии им. В. П. Филатова совместно со ©нециалистами Московского научно-исследовательского института глазных болезней им. Гельмгольца и предприятий оптической промышленности Москвы в 1965 г.
Фотокоагуляцию внутриглазных опухолей осуществляли Н. А. Пучковская, Л. С. Терентьева, Л. А. Линник в 1966—1968 гг. Выла разработана методика фотокоагуляцип внутриглазных опухолей, установлены показания и противопоказания к применению данного метода лечения [Терентьева Л. С., 1969, 1971, 1983]. Предварительная фотокоагуляция или лазеркоагуляция позволяет не только блокировать крупные сосуды, но и создает демаркирующий хориоретинальный барьер, препятствующий распространению отека сетчатки после криовоздействия. Кроме того, применение сочетания транспупиллярного разрушения опухоли с криодеструкцией позволяет ожидать лучший лечебный эффект.
Криодеструкцию можно производить практически при любой локализации опухоли в собственно сосудистой оболочке. Исключение составляют юкстапапиллярпые опухоли сосудистой оболочки. Как показали наши наблюдения, в противоположность диатермии крионоздойстиие возможно и при опухолях, расположенных вблизи одной или двух вортикозных вен. Вовлечение в ледяную сферу вортикозной вены вплоть до превращения ее в «белый столбик» в момент замораживания не препятствует кровотоку в ней после оттаивания.
Противопоказаниями к использованию любого вида орг ан ос о-хранного лечения следует считать бугристый характер опухоли, отсутствие ее четких границ (большая вторичная отслойка сетчатки), наличие кровоизлиянии на поверхности опухоли, появление очагового помутнения сетчатки над опухолью и вокруг нее. При наличии противопоказаний к органосохраннодау лечению необходимо произвести энуклеацию. Вопрос об экзентерации глазницы возникает при обнаружении признаков прорастания опухолью склеральной оболочки. Поскольку опухолевый узел, как правило, бывает прикрыт влагалищем глазного яблока, ограничивают экзентерацию частичным иссечением мягких тканей из внутреннего хирургического пространства.
Глава 12
Хирургические вмешательства при заболеваниях глазницы
Методы диагностики
Заболевания глазницы многообразны по этиологии и патогенезу и могут быть сгруппированы следующим образом: первичные, вторичные, метастатические опухоли и орбитальные бластозы; сосудистые заболевания глазницы; воспалительные процессы; врожденные изменения; травмы; эндокринные офтальмопатии.
Вопрос о вскрытии глазницы и ее дренировании решают только после того, как установлено, что в патологический процесс не вовлечены параназальные синусы. В противном случае хирургическое вмешательство на глазнице окажется неэффективным.
Судить о морфологической сущности опухоли можно лишь на основании результатов патогпстологического исследования. Наличие же объемного процесса в глазнице, его локализация могут быть, уточнены с помощью дополнительных методов исследования.
Рентгенография — самый распространенный метод исследования, позволяющий установить правильный диагноз лишь у 42— 61% больных из-за сходства ряда рентгенологических признаков при многих заболеваниях глазницы [Бровкина А. Ф., 1980; Henderson J. W., 1980]. Выделены общие рентгенологические признаки доброкачественных и злокачественных опухолей глазницы. К первым относят затемнение пораженной глазницы, истончение или атрофию одной либо нескольких костных стенок, увеличение размеров глазницы. Указанные признаки появляются в разное время, что позволяет судить о давности заболевания. Затемнение глазницы возникает одновременно с появлением экзофтальма. Истончение костных стенок и увеличение размеров глазницы мы наблюдали через 172—3 года с момента заболевания. Наличие дополнительных теней флебитов при сосудистых опухолях и варикозном расширении вен глазницы обнаруживают нечасто (в 9—10% случаев). При невриноме глазницы могут определяться участки обызвествления, симулирующие флеболиты. При первичной менингиоме зрительного нерва и глиоме нередко наблюдается расширение костного кольца канала зрительного нерва. Этот признак свидетельствует о давности процесса. Узурирование и раз-520
В тонне костей глазницы характерны в первую очередь для •Качественных опухолей с относительно медленным ростом (Ротикулосаркома, первичный рак, опухоли слезной железы).
' Г. В. Панфилова выделила три стадии течения процесса при вмешанных опухолях и карциномах слезной железы в зависимо-STK от рентгенологической картины. Ценным приемом в диагностике I стадии заболевания является отдавливание кверху и кнаружи верхнего угла глазницы и истончение костной стенки на •ТОМ участке. Наблюдающиеся при рентгенологическом исследо-•ании признаки появляются поздно. Установить наличие опухоли, направление ее роста можно лишь при значительно развитом новообразовании.
В последние годы получили распространение специальные методы исследования, к которым относится контрастирование сосудов глазницы (венография и артериография). Венография обладает высокой диагностической информативностью как при опухолях, так и при сосудистых заболеваниях. Незаменим этот вид исследования при варикозном расширении вен глазницы [Бровкина А. Ф., 1974; Dayton G. О., 1977]. Каротидную ангиографию в последнее время применяют в офтальмологии при сосудистых заболеваниях типа каротидно-кавернозного соустья и артрериаль-пых аневризм, локализующихся в глазнице [Zimmerman R. А., Vignand J, 1977].
Ультразвуковую диагностику при заболеваниях глазницы применяют все шире в связи с доступностью аппаратуры и простотой исследования. Наряду с общепризнанной одномерной эхографией [Фридман Ф. Е. и др., 1972, 1977] используют ультразвуковое сканирование, которое позволяет оценить местоположение опухоли и ее взаимоотношение с окружающими здоровыми тканями [Coleman D. I., 1974].
Радиоизотопное сканирование глазницы, разработанное В. Н. Соколовым и соавт. (1968), используют для уточнения характера роста опухоли и распространения ее за пределы глазницы [Бровкина А. Ф. и др., 1974, 1983]. В последние годы при радионуклидном сканировании наибольшее распространение получили следующие радиоактивные препараты: 99тТс-пертехнетат и 758е-метионинмеченная аминокислота, активно участвующая в синтезе и избирательно накапливающаяся в злокачественных опухолях (рис. 292). Радиоциркулография (РЦГ) позволяет уточнить характер опухоли глазницы, следить за диагностикой патологического процесса и эффективностью проводимой терапии.
Термография — измерение записи теплового излучения от поверхности тканей. Термограммы дают двумерное изображение исследуемой области по распределению температуры. Температурные вариации оценивают как по цветовой гамме, так и по количественным показателям [Лохманов В. П., 1983; Wachmeister, 1970]. По степени гипертермии можно дифференцировать опухолевые и неопухолевые заболевания глазницы (рис. 293). Метод жидкокристаллической термографии, используемый для диффе-
34 Руководство по глазной хирургии
521
292. Сцинтиграмма. Опухоль правой глазницы. Очаг интенсивного накопления радиоактивного препарата.
293. Термограмма. Опухоль левой глазницы, над которой определяется зона гипертермии.
ренциальной диагностики новообразований глазницы, разработал А, С, Буйко (1977).
Компьютерная томография предложена в 1973 г., и с этого же времени ее начали применять с диагностической целью при заболеваниях глазницы [Ambrose et al., 1974]. Преимущества метода перед другими рентгено- и радиографическими методами исследования заключаются в том, что в мягких тканях глазницы может быть выявлен небольшой участок затемнения (участок повышенной плотности); исследуемый участок глазницы подверга
294. Компьютерная томограмма. В полости правой глазницы тень мягкотканной опухоли.
ется визуальному контролю в трех проекциях и, наконец, доза облучения обследуемого» во много раз меньше, чем при обычных рентгенографических методах исследования. Низкая плотность орбитального жира обеспечивает естественный контраст, на фоне которого мягкотканные массы более четко очерчены как более плотные участки (рис. 294).
Биопсия занимает особое место в системе диагностических исследований. Однако следует учитывать, что опухоли в глазнице нередко
522
располагаются глубоко за здоровыми тканями, поэтому при Шицизионной биопсии могут развиваться осложнения в виде Усиления отека орбитальных тканей, возможны также ретробуль-врные гематомы. Аспирационная биопсия также может осложниться реактивным отеком и ретробульбарной гематомой. Кроме Того, трудно правильно направить иглу к патологическому очагу. Точность попадания иглы в опухоль при аспирации может быть йовышена благодаря использованию контрольной компьютерной томографии.
Показания к операции при заболеваниях
глазницы
Развитие и совершенствование инструментальных методов исследования позволяют диагностировать новообразования, сосудистые заболевания и воспалительные процессы в глазнице достаточно часто.
Возможности комплексного обследования больного с новообразованием глазницы изучали Л. С. Терентьева и соавт. (1981). Благодаря совершенствованию в последние годы оперативной техники расширились показания к хирургическому лечению вольных с новообразованиями глазницы.
Хирургическое лечение необходимо проводить во всех случаях при обнаружении новообразования независимо от состояния функций глаза при условии хорошего общего состояния больного. Это обусловлено тем, что любая опухоль, даже самая доброкачественная, если она располагается ретробульбарно, в большинстве случаев ставит под угрозу зрение больного. Кроме того, многие доброкачественные опухоли являются потенциально злокачественными с морфологической точки зрения. Примером могут служить плеоморфная аденома слезной железы, невриномы и даже дермоидные кисты.
Комплексное обследование больного с заболеванием глазницы позволяет до операции определить характер заболевания (опухолевый, воспалительный, сосудистый) и зону его расположения. В связи с этим отпадает необходимость в осуществлении поэтапного оперативного вмешательства. Потеряло значение высказывание Нюэля: «Хирург, вводя нож в глазницу при ретробульбарном новообразовании, редко знает вперед, что он найдет в глубине ее». Готовя больного к операции, современный офтальмохирург обязан знать цель оперативного вмешательства: биопсия или удаление опухоли, перевязка сосуда или его коагуляция.
Показания к отдельным видам орбитальных операций следующие.
Простая орбитотомия в различных ее вариантах показана при локализации новообразования в переднем отделе глазницы или при наличии больших опухолей, сопровождающихся экзофтальмом 10—13 мм и более. При этом она является как
34!
523
лечебным, так и диагностическим мероприятием. В исключительных случаях простая орбитотомия может быть использована дли удаления опухолей из мышечной воронки, располагающихся кну три от зрительного нерва. Простая орбитотомия показана при вскрытии флегмон и абсцессов глазницы. В этих случаях нужно стараться вскрыть три основных хирургических пространства: малое и большое наружные и внутреннее.
Основными показаниями для к о с т н о-п ластической о р-битотомии являются локализация новообразования во внут рением хирургическом пространстве независимо от того, связано оно со зрительным нервом или нет; наличие венозной или артериальной аневризмы в глазнице; декомпрессия глазницы при прогрессирующем отечном экзофтальме.
Костно-пластическая орбитотомия противопоказана при выполнении биопсии и так называемой пробной орбитотомии; при подозрении на злокачественную опухоль глазницы (первичная, вторичная или метастатическая); при доброкачественных опухолях, распространяющихся в глазницу из полости черепа; при опухолях слезной железы.
Экзентерация глазницы показана в случаях подтвержденной злокачественной опухоли глазницы (первичная или вторичная) при отсутствии признаков метастазирования и разрушения верхней стенки глазницы. Иногда приходится производить экзентерацию глазницы при злокачественной опухоли III стадии развития с паллиативной целью (разрушение глазного яблока, некупирующиеся сильные боли). Если имеется хотя бы малейшая возможность, то следует ограничиться эвисцерацией глаза. Экзентерацию глазницы можно рекомендовать и для удаления очень больших доброкачественных опухолей, практически приведших к необратимым изменениям в результате сдавления глазного яблока и мышечного аппарата, однако при данной операции хирургу приходится решать вопросы психологического характера в связи с тяжелым косметическим недостатком в послеоперационном периоде.
Виды хирургических вмешательств
при заболеваниях глазницы
Прежде чем перейти к описанию методики операций на глазнице, остановимся на классификации существующих операций. Классификация, предложенная С. С. Головиным (1933), громоздка, что затрудняет ее применение в практической деятельности врача.
Данные литературы последних лет и собственный опыт послужили основой для предложения следующей рабочей схемы операций на глазнице.
Применение каждого из перечисленных видов операций определяется характером заболевания.
524
1. Простая орбитотомия
Транскутанная Транспальпербральная Трансконъюнктивальная
I |
Поднадкостичная Наднадкостничная
2. Костная орбитотомия
I I
С временной резекцией С постоянной резекцией
(костно-пластическая) наружной стенки
3. Комбинированная орбитотомия
4. Транскраниальная орбитотомия
5. Экзентерация глазницы
I I
Поднадкостничная Орбитосипуальная
Простая орбитотомия
Простую орбитотомию производят как с лечебной (вскрытие флегмоны, удаление новообразования), так и с диагностической (эксплораторная орбитотомия, биопсия) целью. Само название свидетельствует о том, что подход к содержимому глазницы осуществляется путем вскрытия только мягких тканей. Операцию предпочтительное проводить под обидим наркозом, однако можно применять и проводниковую анестезию. При подготовке к операции используют премедикацию.
Транскутанная орбитотомия. В зависимости от места проведения кожного разреза (рис. 295) различают наружную, верхнюю, внутреннюю и нижнюю транскутанную орбитотомию. Общим для них является совпадение направления кожного разреза с краем глазницы. Место кожного разреза должно определять и зону оперативного вмешательства.
Наружную орбитотомию применяют для удаления опухолей и кист, локализующихся в верхненаружном отделе глазницы. Это наиболее спокойная область для выполнения операций, так как офтальмохирург встречается здесь лишь со слезной артерией и одноименным нервом. В отношении направления кожного разреза при этом подходе существует несколько мнений. С. С. Головин (1933) и А. И. Покровский (1959) рекомендуют вести разрез по нижнему краю брови, так как при этом в послеоперационном периоде не возникает ее облысение. По нашему мнению, в косметическом отношении лучше разрез Головина. В своей практике мы многократно применяли также разрез кожи по бро-
525
2
295.
Кожные разрезы, использу емые при простой орбитото мии (схема).
1 — верхненаружная орбит» томия: 2 — верхняя; 3—вну, ренняя; 4 — нижняя; 5 -транспальпебральная по Ку рышкину; 6 — транспальпс бральная по Пахомовой -Бровкиной.
ви. После тщательного послойного ушивания края раны образуется нежный, незаметный рубчик. Ни разу мы не наблюдали облысения брови.
Верхняя орбитотомия рекомендуется для удаления новообразований, расположенных в верхнем отделе наружного хирургического пространства. Разрез кожи при этом мы предпочитаем проводить по верхнему краю брови, строго параллельно ему (см. рис. 295). Поскольку в среднем отделе верхнего края глазницы располагается наиболее мощный пучок волокон мышцы, поднимающей верхнее веко, вплетающихся в тарзоорбитальную фасцию, предпочтительнее этот подход использовать для поднадкостничной орбитотомии. Послойно проводимый разрез позволит выделить и отвести крючком в сторону надглазничный нерв и одноименную артерию. Правда, перерезка нерва не считается очень тяжелым осложнением, поскольку проводимость его восстанавливается, но спустя длительное время (6—8 мес). Чувство постоянной анестезии в течение продолжительного периода доставляет больным неприятное ощущение. J. W. Henderson (1980) при верхней орбитотомии предлагает проводить разрез на 5— 10 мм выше входа в глазницу немного ниже брови, поскольку при этом бывает менее выражено профузное кровотечение.
В последние годы при различных видах орбитотомий мы используем микрохирургическую технику. При выполнении операции под микроскопом практически не возникают профузные кровотечения, а разрез кожи по верхнему краю брови предотвращает развитие послеоперационного птоза.
Внутренняя орбитотомия (см. рис. 295) может быть использована для удаления новообразований, располагающихся в верхневнутреннем отделе глазницы, или при ревизии поднадкостничного пространства в этой области. Операционное цоле при этом подходе небольшое, хирург на каждом шагу сталкивается с труд-
526
(Остями. Здесь на небольшом участке сосредоточены сосудисто-(врппый и мышечный пучки: блок с сухожилием верхней косой |Шшцы, волокна мышцы, поднимающей верхнее веко, над- и под-(Доковый, носоресничный и лобный нервы, верхняя глазничная МНа и ее анастомозы, повреждения которых могут привести к осложнениям. При продлении кожного разреза ниже внутренней ввязки век необходимо оберегать внутреннюю связку и слезные Канальцы. Уменьшить опасность повреждения указанных анатомических образований можно путем сокращения показаний н Йрименению этого вида орбитотомии (для поднадкостничной ревизии и удаления костных секвестров, свищей, кист).
Нижняя орбитотомия (см. рис. 295) открывает большее пространство, свободное от важных анатомических образований. Однако при проведении кожного разреза необходимо помнить о месте прикрепления нижней косой мышцы и месте выхода нижнеглазничного нерва. Предварительно проводить кожный разрез параллельно наружным 2/з нижнего края глазницы; орбикулярную мышцу при этом лучше раздвигать тупым путем по Ходу мышечных волокон. Такого разреза достаточно для удаления опухоли не только из нижнего отдела наружного хирургического пространства, но также из мышечной воронки. Разрез в нижненаружном отделе глазницы наиболее благоприятен и для вскрытия флегмон и абсцессов, а также дренирования глазницы при них.
Транспальпебральная орбитотомия является разновидностью транскутанной орбитотомии, предложенной R. N. Berke (1953) и П. М. Курышкиным (1956). Авторы рекомендуют проводить разрез по серой линии интермаргинального пространства с последующим расщеплением век на две пластинки: кожно-мышечную и конъюнктивально-хрящевую. Операция направлена на расширение доступа в глазницу и уменьшение косметического недостатка, возникающего после операций на глазнице. Однако в ряде случаев и при этом подходе возможны неприятные последствия: сглаженность и истончение маргинального края, трихиаз. Если проводить разрез параллельно маргинальному краю век, отступя от него 2—2,5 мм, указанные осложнения не возникают [Пахомова А. И., 1965]. Последующие этапы не отличаются от этапов операции Курышкина — Берке. Операционную рану лучше зашивать внутрикожным швом (капрон 6:0), поскольку в этом случае послеоперационный рубец совершенно незаметен.
По отношению к надкостнице различают наднадкостничную и поднадкостничную транскутанную и транспальпебральную орбитотомии.
Наднадкостничную орбитотомию поэтапно выполняют следующим образом: 1) накладывают П-образный шов на веки (обязателен для всех видов орбитотомий при новообразованиях глазницы) ; 2) делают разрез кожи в зоне предполагаемой опухоли. Меньшая травматизация тканей достигается послойным раздвиганием подлежащих тканей острым или тупым путем. Кровоте-
527
чение останавливают с помощью диатермокоагуляции и кровоос танавливающих зажимов; 3) освобождают край орбиты и делают разрез тарзоорбитальной фасции на расстоянии 2—3 мм от края глазницы, что позволяет по завершении операции наложить не прерывный кетгутовый шов на тарзоорбитальную фасцию и тем самым восстановить ее целость. При вскрытии тарзоорбитальной фасции хирург попадает в большое наружное хирургическое про странство; 4) осуществляют ревизию глазницы в зоне, соответст вующей кожному разрезу. Для осмотра внутреннего хирургиче ского пространства необходимо тупым путем вскрыть межмышечную перегородку; 5) извлекают новообразование по возможности тупым путем. Для выделения опухоли лучше использовать тупоконечные шпатели и тупферы. При использовании инструментального метода выделения опухоли меньше травмируются как окружающие здоровые ткани, так и сама опухоль.
Инкапсулированные опухоли и кисты следует стремиться извлекать в капсуле без предварительной пункции новообразования, так как при этом создаются лучшие условия для полного удаления капсулы [Покровский А. И., 1959; Бровкина А. Ф., 1974]. Существует и другая точка зрения. A. Reese (1941) и некоторые другие авторы рекомендуют предварительно пунктировать кисту и кистозную опухоль, чтобы уменьшить напряжение капсулы в момент извлечения. По-видимому, в подобных случаях тактику необходимо выбирать в зависимости от величины и места проведения кожного разреза. Для фиксации опухоли можно использовать фиксационный глазной пинцет и наложить толстый шелковый шов через толщу опухоли. Наш опыт показывает, что шелковые лигатуры, как бы глубоко через ткань опухоли их ни проводить, легко прорезываются и вскрывают капсулу. Фиксационный пинцет достаточно крепко удерживает образование, не повреждая капсулу и ткани опухоли и не мешая извлечению ее под микроскопом. Можно рекомендовать зажимы Кохера, но они сильно травмируют ткань опухоли, что осложняет выделение и удаление опухоли, а также ее последующее гистологическое исследование.
По удалении новообразования осуществляют гемостаз с помощью гемостатической губки, тампона с гемофобином или с перекисью водорода. В полость глазницы закладывают порошок сульфацил-натрия или сухой пенициллин. При удалении эхинококка полость рекомендуется обработать 96% этиловым спиртом. После удаления дермоидной кисты желательно произвести обработку полости 5% спиртовым раствором йода.
Рану рекомендуется зашивать послойно: кетгутовый непрерывный шов на тарзоорбитальную фасцию, верхний внутрикожный шов, тугая давящая повязка.
Поднадкостничную орбитотомию с успехом применяют для удаления поднадкостничных образований (остеома, дермоидная киста, холестеатома), новообразований, лежащих непосредственно над надкостницей в наружном хирургическом про-528
296. Верхняя поднадкостничная орбитотомия: отсепаровка надкостницы (схег ма).
;||рапстве (опухоли слезай железы, невриомы, ка-Мрноиные гемангиомы и |у,), секвестров и свище-*ых ходов при воспали-|вльных процессах.
Делают разрез кожи в Юисимссти от места расположения патологическо-fO процесса; выделяют Вадкостницу преимущественно тупым путем с мак-вимальным щажением прилежащих сосудов и нервов (особенно в верхнем и Верхневнутреннем отделах Глазницы). Производят разрез надкостницы на 4— В мм выше края глазницы В параллельно ему (рис. 296). По краям разреза делают два дополнитель
ных разреза, перпендикулярных к первому. Надкостницу отсела^ ровывают до края глазницы и затем от ее верхней стенки по направлению к вершине глазницы. Делая осторожные движения, удается сохранить целость надкостницы на всем протяжении.
При локализации процесса под надкостницей операцию выполняют внеорбитально. Это особенно важно при удалении дермоидных кист, холестеатом, секвестров при остеомиелите. При выполнении поднадкостничной орбитотомии во внутреннем отделе глазницы участок кости,- к которому прикрепляется блок, скалывают вместе с блоком и надкостницей.
В случае расположения опухоли в глазнице над периостом его следует вскрывать над опухолью продольным разрезом. Опухоль извлекают тупым путем.
Осуществляют гемостаз, в раневую полость закладывают порошок сульфацил-натрия или антибиотиков. Накладывают швы на продольный разрез надкостницы (обычно удается наложить два, максимум три шва), а также непрерывный или узловатые швы на надкостницу по краю орбиты. Наложение послойных швов позволяет разделить кожу и кость, что способствует образованию нежного рубца. Желательно добиваться хорошей адаптации краев раны. Последующие этапы операции соответствуют описанным выше.
Поднадкостничная орбитотомия особенно показана при удалении опухолей слезной железы, так как еще до иссечения опухоли хирург имеет возможность определить, прорастает она надкостницу и подлежащую кость или нет и, если предположение о прорастании подтверждается, имеется возможность сразу же
529
перейти к более радикальной операции — резекции дна слезное ямки [Reese A., Jones I., 1964]. Кроме того, поднадкостничная ор битотомия позволяет сохранить целость части мышцы, подни мающей верхнее веко, прикрепляющуюся к наружной связке век.
Трансконъюнктивальная орбитотомия. С момента описания операции A. Knapp она претерпела значительные изменения, н настоящее время обязательным этапом считают временную ре зекцию двух, а иногда трех прямых мышц [Bone, 1968, и др.].
Лучшим признан разрез конъюнктивы по нижнему конъюнктивальному своду. Как и при транскутанной орбитотомии, накладывают предварительный препараторный П-образный шов на веки, не завязывая его. Выполняют наружную контотомию. Проводят разрез конъюнктивы по нижнему конъюнктивальному своду, не доходя до его внутренней трети (опасность повреждения сухожилия нижней косой мышцы). Делают разрез тарзоорбитальной фасции, нижнюю прямую мышцу захватывают на крючок и ротируют кверху.
Выделяют и извлекают опухоль и осуществляют гемостаз. Накладывают швы на тарзоорбитальную фасцию, непрерывный кетгутовый или биологический шов на конъюнктиву, шов на кожу наружного угла. П-образный шов завязывают. Накладывают давящую повязку.
Единственным недостатком данной операции можно считать относительно небольшие размеры операционного поля. Применяя этот вид орбитотомии на протяжении 18 лет, мы ни разу не наблюдали ни укорочения свода, ни воспаления в послеоперационном периоде.
Своеобразной комбинацией транскутанной и трансконъюнктивальной орбитотомии является способ, предложенный В. Smith (1966) для удаления ретробульбарных опухолей, локализующихся в среднем отделе глазницы.
Методика операции заключается в следующем. Подход к содержимому глазницы обеспечивает сквозной вертикальный разрез верхнего века, который проводят отступя 5 мм от верхней слезной точки. Края раны века берут на лигатуры. Делают вертикальный разрез конъюнктивы от свода книзу. Сосудисто-нервный пучок и верхняя косая мышца остаются вне операционного поля. Подход по Смиту с успехом может быть применен для удаления опухолей, локализующихся во внутренней половине глазницы. По окончании операции накладывают непрерывный кетгутовый (6:0) шов на конъюнктиву глазного яблока и сквозные 8-образные швы на края кожно-мышечной конъюнктивальной раны. Швы снимают на 21-й день.
Костная орбитотомия
Еще в 1933 г. С. С. Головин отмечал, что невозможно говорить об едином способе операции Кронлейна. За прошедшие годы Классическая костная орбитотомия претерпела значительные 530
Цмонения. Менялись техника Ложного разреза (рис. 297), спо-|o6bi резекции костного лоскута, Место резекции, отношение к Надкостнице. Первоначально При производстве костной орбитотомии хирурги рассекали и отсепаровывали надкостницу, Позднее появились сторонники Везекции кости с надкостницей.
i последнее время наметилась тенденция возврата к первоначальному варианту.
Техника операции сводится к следующему (рис. 298).
1. Накладывают лигатуру на наружную прямую мышцу и П-образный шов на веки.
Делают разрез кожи в наружной трети век, отступя 2— 2,5 мм от ресничного края и параллельно ему. Разрез проводят
297. Кожные разрезы, используемые при костно-пластической орбитотомии (схема).
1 — по Кроилейну; 2 — по Головину; з — по Кохеру; 4 — по Курышкину — Берке.
до наружного угла век, далее продлевают в сторону виска на 2,5—3 см.
2. Тупым путем отсепаровывают кожно-мышечные пластинки
век в виде двух треугольных лоскутов до края глазницы, тупым путем раздвигают волокна височной мышцы.
3. Перерезают латеральную связку век вместе с волокнами тарзоорбитальной фасции, не нарушая целости наружного конъ
юнктивального свода.
4. Освобождают надкостницу и делают разрез вдоль наружного края орбиты, отступя от пего 5 мм. Перпендикулярно к основному разрезу проводят два дополнительных на 3—4 мм выше и ниже места предполагаемого распила кости.
Образовавшийся П-образный лоскут надкостницы отсепаровывают до края глазницы, отсепаровывают периорбиту по направлению к вершине глазницы не глубже чем на 3 см (верхняя глазничная щель), книзу кнаружи на 1—2 см. Отделение периорбиты происходит легко. Офтальмохирургу на этом этапе операции следует помнить о том, что наружная стенка глазницы в
заднем отделе тонка и при излишнем усилии или неправильном направлении распатора может быть легко перфорирована. Содержимое глазницы вместе с надкостницей шпателем смещают ме-
диально.
5. Костный лоскут размером 2X2,5 см выкраивают с помощью ультразвуковой пилы и долота (рис. 299). Распил кости производят у основания скулового отростка лобной кости под небольшим углом к фронтальной плоскости при резекции кости треугольной формы и перпендикулярно к фронтальной плоскости при стрем-
531
298. Костно-пластическая орбитотомия (схема). Объяснение в тексте.
лении резецировать кость прямоугольной формы. Второй распил кости делают у основания лобного отростка скуловой кости параллельно нижней стенке глазницы. Третье селение кости (линия перелома) образуется в момент отворачивания костного лоскута щипцами и проходит по прямой, соединяющей концы распилов. Во избежание артериального кровотечения при распиле у основания скуловой кости желательно обойти костную артерию, находящуюся в этой зоне, либо предварительно ее коагулировать.
Иссеченный участок кости отворачивают кнаружи и кзади, закрывают салфеткой, смоченной изотоническим раствором хлорида 532
299. Ультразвуковой хирургический аппарат с набором наконечников, используемый ири костно-пластической орбитотомии.
натрия. Фиксацию и питание его на протяжении всей операции осуществляют за счет височной мышцы.
6. Топким скальпелем производят продольный разрез перп-орбиты по направлению к вершине глазницы, на края его накладывают провизорные кетгутовые швы, которые впоследствии используют для сближения краев периорбиты. Подкожную жировую клетчатку шпателем отодвигают в сторону. Производят ревизию глазницы желательно под микроскопом.
7. Вскрывают межмышечную фасциальную перегородку между нижней и наружной прямой мышцами либо между верхней и наружной прямой мышцами. Ориентиром при этом служит наружная прямая мышца, которую подтягивают с помощью лигатуры. Чтобы не повредить важные анатомические образования в воронке, вскрытие фасциальной перегородки лучше производить тупым путем.. Мы предпочитаем это делать с помощью кровоостанавливающих зажимов и мышечным крючком.
Осторожно производят ревизию мышечной воронки под микроскопом, выделяют опухоль тупым путем. Ножницы рекомендуется применять в случае неврэктомии. Вначале неврэктомию производят у глазного яблока, а затем, подтягивая фиксированный зрительный нерв, без труда выполняют ее у вершины глазницы. Важно во время неврэктомии не повредить экстраокуляр-
533
ные мышцы, поэтому бранши тупоконечных ножниц заводят > глазницу сверху снаружи, направляя их при неврэктомии у глаз ного яблока сверху снаружи и книзу кнутри. При перерезке зри тельного нерва у вершины глазницы, сохраняя то же направле ние, следует вывести бранши слегка кпереди.
8. Осуществляют гемостаз, обрабатывают полость глазницы обычным способом, завязывают швы, предварительно наложен ные на периорбиту.
9. Репонируют костный лоскут и укрепляют его кетгутовы ми швами, проведенными через надкостницу. Б. Ф. Черкунов (1967) рекомендует укреплять костный лоскут капроновыми шва ми, проведенными черед специально сделанные отверстия в кости На данном этапе операции важно фиксировать костный лоскут что позволяет сохранить неизменной форму глазницы.
Подшивают латеральную связку век к месту ее резекции, накладывают кетгутовый направляющий шов на височную, мышцу.
10. Проводят непрерывный внутрикожный шов, накладывают давящую повязку.
Опухоли, локализующиеся в глубине внутренней половины глазницы, труднодоступны при любом из описанных выше подходов. Облегчает доступ к ним комбинированная орбитотомия «латерально-медиальная», предложенная С. D. McCord (1978). Суть ее заключается в следующем. Вначале после проведения описанного выше кожного разреза резецируют наружную стенку глазницы. Во внутренней половине бульбарной конъюнктивы делают вертикальный разрез, пересекают предварительно взятую на лигатуру внутреннюю прямую мышцу у места ее прикрепления. Глазное яблоко легко смещается кнаружи, в результате чего открывается доступ к вершине глазницы. Заканчивают операцию последовательным пришиванием внутренней прямой мышцы к месту прикрепления, накладывают непрерывный шов на конъюнктиву. Затем завершают костную орбитотомию по описанным выше этапам.
Методика костной орбитотомии с постоянной резекцией наружной стенки глазницы мало чем отличается от методики описанной выше операции. Используют ее с декомпрессивной целью. В связи с этим костный лоскут удаляют целиком либо в наружной стенке резецируют широкое костное окно, сохраняя узкий костный край [Головин С. С., 1933]. Можно использовать височный подход [Knauer, 1957; Vergez, 1958]. Разрез при темпоральной костной орбитотомии делают по границе волосистой части в лобно-височной области, затем отсепаровывают височную мышцу и обнажают скуловую кость. Кость резецируют в задней трети наружной стенки глазницы. Такой подход открывает широкий доступ к вершине глазницы. Однако при манипуляциях в этой области существует опасность попадания в полость черепа во время резекции кости.
534
Трнпскраниальная орбитотомия
Трнпскраниальная орбитотомия характеризуется многообра-Пм подходов к глазнице. При классической операции [Dandy, ,922} после трепанации черепа резецируют верхнюю стенку глаз-0>Цы в форме четырехугольника, передней границей которого (Вляется задняя стенка лобной пазухи и чешуя лобной кости, Внутренней — наружная стенка решетчатого лабиринта, задней — jtpnit малого крыла основной кости, наружной — наружная стен-Йй глазницы. Максимальные размеры костного окна 30Х40Х Х10 мм, минимальные — 23X11X10 мм. Подобная вариабельность размеров костного окна обусловлена разной степенью развития лобных пазух [Жагрин А. Г., 1954]. Hamby (1964) с целью увеличения костного окна предлагает одновременно производить резекцию наружной и верхней стенок глазницы.
Транскраниальную орбитотомию выполняют в условиях нейрохирургической клиники. С точки зрения офтальмохирурга, показания к этому виду вмешательства при заболеваниях глазницы должны быть максимально сужены ввиду частого развития осложнений со стороны глаза, его нервно-мышечного аппарата. Несмотря на широкое костное окно в верхней стенке глазницы, манипулировать в ней крайне трудно, так как подойти к ретробульбарному содержимому офтальмолог может, лишь отведя в сторону подкожную жировую клетчатку, мышцу, поднимающую верхнее веко и верхнюю глазничную вену. Все это сделать непросто, если учесть, что оперировать приходится на значительной глубине. Небольшие размеры операционного поля, близость важных орбитальных образований делают работу хирурга крайне напряженной и трудной. Транскраниальную орбитотомию следует считать показанной у больных с варикозным расширением вен глазницы, иногда при аневризме глазничной вены и опухолях зрительного нерва (менингиома и глиома его орбитального отрезка с распространением в канал). В случае распространения опухоли зрительного нерва па его интракраниальную порцию оперативное лечение можно проводить в один этап (транскраниальная орбитотомия) или в два этапа (костно-пластическая орбитотомия для удаления орбитальной порции зрительного нерва, транскра-ниальиая — для удаления пораженного участка его интракраниальной порции).
Экзентерация глазницы
Экзентерация глазницы относится к радикальным операциям. В зависимости от применяемой методики различают поднадкостничную (с сохранением и без сохранения век) и орбитосинуаль-ную экзентерацию, основной целью которой является одновременное освобождение от содержимого глазницы и околоносовых пазух [Головин С. С., 1910].
535
Техника поднадкостничной экзентерации Операцию производят под общим наркозом с предварительной премедикацией. Накладывают П-образный шов на веки при рас пространении опухолевого процесса на кожу или мышцы век. 15 краю глазницы делают круговой разрез кожи и подлежащих мя> ких тканей до кости, желательно электроножом. Большим расиа тором надкостницу отсепаровывают от костных стенок глазпп цы. Особую осторожность необходимо соблюдать при отделении надкостницы от верхней стенки глазницы, так как в средней и задней части она тонкая. Внутренняя стенка также тонкая, ш при ее перфорации не возникают такие тяжелые осложнения как при повреждении верхней стенки. За лигатуру, наложенную на веки, подтягивают содержимое глазницы, ножницами Пересе кают сосудисто-нервно-мышечный пучок у ее вершины. Посколь ку единственным показанием к этому виду калечащей операция можно считать наличие злокачественной опухоли глазницы, пет надобности в остановке кровотечения пеаном. Требованиям абла стики отвечает прижигание культи гальванокаутером, доведен ным до красного каления, или большим шариковым электродом диатермокоагулятора. Полость глазницы промывают перекисью водорода, засыпают порошком пенициллина, сульфаниламидных препаратов и тампонируют марлевой турундой, обильно смоченной вазелиновым маслом. Накладывают давящую повязку.
При распространении процесса на стенки глазницы и проник новении его в околоносовые пазухи следует переходить к орбито-синуалыюй экзентерации. В этих случаях, обнажив костные стенки глазницы, необходимо произвести резекцию пораженных стенок. В решетчатом лабиринте убирают все перегородки, латеральную стенку, в носу — носовые раковины. Нижнюю стенку удаляют после гальванокаутеризации нижней глазничной щели. Обязательно осуществляют выскабливание слизистой оболочки околоносовых пазух большой ложечкой.
Экстраорбитальную экзентерацию глазницы и околоносовых пазух [Филатов В. П., 1930] рекомендуется производить при обширном распространении опухолей глазницы. Поскольку операцию выполняют экстраорбитально, рекомендуется проводить четыре разреза мягких тканей до кости: два горизонтальных—по верхнему и нижнему краям глазницы и два вертикальных: внутренний — через внутренние концы горизонтальных разрезов, начиная его на 2—3 см(!) выше верхнего горизонтального разреза и заканчивая на 2—2,5 см ниже нижнего горизонтального разреза у крыла носа, наружный — через наружные концы горизонтальных разрезов, начиная на 2—3 см выше верхнего горизонтального разреза и спускаясь на 2,5—3 см ниже нижнего. Размеры опухоли позволяют перемещать разрезы в обоих направлениях. Отсепаровывают и отодвигают в сторону от глазницы мягкие ткани наружной линии разреза. Мягкие ткани внутренней линии разреза вместе с надкостницей и содержимым глазницы отсепаровывают от костных стенок глазницы. Обязательным ус-536
рвием при планировании Бс*й операции является тща-||Льное рентгенологическое Йследование костных стенок 1ЛВ811ицы и околоносовых па-|ух, особенно лобных. После обработки полости закрывают Кожный дефект путем натя-Жения тканей. Тампон выводят через нос.
Стремление закрыть большую полость натяжением коми или путем пересадки кож-
ого лоскута объясняется 3qq Покрывание костной части глазни-Иосметическим недостатком в цы кожно-мышечными лоскутами век по. Послеоперационном периоде и Шоттеру после экзентерации (схема). Грудностью протезирования.
О. А. Каторгина (1958) предложила вариант экзентерации с одновременным протезированием глазницы. Разрез мягких тканей проводят по краю брови по всей ее длине. Предваритель-Ио круговым разрезом конъюнктивы по лимбу выделяют глазное яблоко. Глаз и содержимое глазницы удаляют через кожный разрез. Однако при таком подходе у хирурга мало возможностей для визуального контроля за состоянием костных стенок орбиты. Для покрытия костной части глазницы в случае экзентерации по поводу опухоли Л. X. Шоттер (1977) использует кожно-мышечные лоскуты век, широко перфорируя их разрезами, расположенными в шахматном порядке. Четыре лоскута, скрепленные краями и образующие пирамиду (рис. 300), можно вытянуть до вершины глазницы и фиксировать с помощью тампонады по Микуличу. В результате глазница покрывается кожей век одномоментно и полностью, в результате чего значительно облегчается лечение в послеоиерационпом периоде и уменьшается его продолжительность.
Т. Reese и I. Jones (1961) предлагают для удобства протезирования пересаживать в полость глазницы после извлечения ее содержимого височную мышцу. Делают разрез век по серой линии до края глазницы, разделяя их на две пластинки — кожно-мышечную и конъюнктивально-хрящевую. На конъюнктивально-хрящевую пластинку накладывают П-образный шелковый шов. Проводят разрез мягких тканей до кости по краю глазницы. Отсепаровывают надкостницу, удаляют содержимое глазницы обычным, способом. Обрабатывают и высушивают полость глазницы. Производят наружную кантотомию, выделяют наружную стенку глазницы. В наружной стенке резецируют костное окно для проведения предварительно подготовленного свободного верхнего конца поверхностной височной мышцы, концы которой пришивают к надкостнице края глазницы.
После любой одномоментной пластики полости глазницы
35 Руководство по глазной хирургии
537
>нет возможности осуществлять контроль за ее состоянием в послеоперационном периоде, вследствие него могут остаться незамеченными ранние признаки рецидива опухоли. Кроме того, проводимая в большинстве случаев послеоперационная лучевая терапия ухудшает условия приживления кожных или мышечных трансплантатов. При сохранении кожно-мышечных пластинок век после поднадкостничной экзентерации глазницы при локализации опухолевого процесса за тарзоорбитальной фасцией улучшаются условия грануляции раневой поверхности, уменьшаются размеры послеоперационного дефекта. Хорошо подобранный впоследст вии эктопротез дает удовлетворительные косметические результаты.
Ведение послеоперационного периода
В послеоперационном периоде для профилактики ретробульбарной гематомы необходимо соблюдать постельный режим в течение 2—3 сут в зависимости от размеров оперативного вмеша тельства. До первой перевязки больным рекомендуется назначать антибиотики, в последующие дни — по показаниям. Первую пере вязку делают на 3—4-е сутки. После первой перевязки повязку заменяют легкой наклейкой. П-образный шов с век снимают на 7—8-е сутки, внутрикожные швы — на 8—9-е сутки. Отек век после простой орбитотомии сохраняется около 5—6 дней, после костно-пластической — до 14—16 дней.
Наши наблюдения показывают, что после экзентерации глазницы менее болезненно проходит перевязка на 5—6-е сутки. Удалять тампон рекомендуется постепенно, смачивая его пере кисью водорода. Последующие перевязки производят через день. Учитывая размеры операционной раны, первые две—три перевяз ки лучше проводить в операционной с предварительной премедикацией (инъекции по 1 мл 1% раствора димедрола и 1% раствора промедола). После извлечения тампона раневую полость попеременно промывают перекисью водорода и крепким раство ром перманганата калия. При этом производят механическую очистку полости, орошение раневой поверхности атомарным кислородом. Подобные «кислородные ванночки» способствуют образованию сочных грануляций в более ранние сроки. По окончании •орошения полость обрабатывают смесью порошков сульфацил натрия и стрептоцида. Делают рыхлую тампонаду с вазелиновым маслом на 12—14 дней. В последующие дни рекомендуется производить перевязки 1—2 раза в неделю. Полость глазницы не тампонируют, лишь накладывают легкую сухую повязку.
Операционные и послеоперационные осложнения
Наиболее тяжелым осложнением после орбитотомий является гибель глаза как функционирующего органа, что происходит, как правило, в результате атрофии зрительного нерва. R. N. Ветке 538
^читает атрофию зрительного нерва неизбежной в '/з случаев Всех орбитотомий. Причинами ее развития могут быть поврежде-ВИя нерва во время операции (нарушение целости его оболочек, сдавление нерва при фиксации опухоли вслепую) или нарушение целости центральной артерии сетчатки. Основной мерой профилактики указанных осложнений следует считать использование микрохирургической техники, которую мы с успехом применяем при операциях на глазнице с 1978 г.
Быстрое выделение опухоли, особенно при небольшом кожном разрезе, может привести к спазму центральной артерии сетчатки. Поскольку никакого сильного противоспазматического и Сосудорасширяющего лечения в первые сутки после орбитотомии применять нельзя, осложнение это заканчивается стойкой атрофией зрительного нерва. Грубое механическое давление на глазное яблоко в момент извлечения опухоли может привести к отслойке сетчатки.
При образовании ретробульбарной гематомы возникает массивное кровотечение не только во время операции, но и по окончании ее, о чем свидетельствуют быстро нарастающий отек, напряжение век и экзофтальм. Возникновение подобных симптомов требует введения в глазницу резиновой турунды, дополнительного наложения швов на веки во избежание их прорезывания под повязкой. Такие больные должны особенно тщательно соблюдать строгий постельный режим: в первые 2—3 ч на область глазницы назначают лед, в течение 5—6 сут делают инъекции ди-цинопа.
Причиной наблюдающегося в послеоперационном период птоза может быть ранение мышцы, поднимающей верхнее веко либо в месте прохождения ее через тарзоорбитальную фасцию, либо у сухожильного кольца Ципна в момент неврэктомии у вершины глазницы. Часто птоз наблюдают у больных, перенесших транс-краниальную орбитотомию. Уменьшить частоту данного осложнения, а возможно, и предупредить его можно только при условии правильного выбора операционного подхода в соответствии с локализацией опухоли.
В первые недели после операции, особенно после костно-пластической орбитотомии, почти у каждого больного наблюдается ограничение движений глаза кнаружи. Однако спустя 5—6 нед функции наружной прямой мышцы восстанавливаются. Причиной нарушения движений является растяжение наружной прямой мышцы во время операции. Ускоренного восстановления мышечной функции удается добиться с помощью медикаментозного лечения (подкожные инъекции 0,5% раствор прозерина, электрофорез 1% раствора йодида калия).
Стойкое ограничение подвижности экстраокулярных мышц и косоглазие наблюдаются при ранении мышц во время операции, особенно при неврэктомии у вершины глазницы. Предупредить развитие этого осложнения можно. Для этого необходимо стремиться к созданию максимально свободного доступа к опухоли,
35*
539
-а при неврэктомии следить за правильным направлением бранш ножниц.
В практике орбитальной хирургии редко встречается какое-либо одно осложнение, чаще они сочетаются. Обычно наблюдается сочетание ограничения подвижности глазного яблока с косоглазием, птозом и атрофией зрительного нерва.
Основные меры профилактики возможных осложнений могут быть сформулированы следующим образом: четкое определение показаний к применению каждого вида операции, хорошо продуманный план ее, осторожное манипулирование во время операции. Жизненно важные для глаза анатомические образования сосредоточены в глазнице настолько компактно, что малейшее грубое движение может привести к непоправимым осложнениям. В связи с этим следует отдавать предпочтение инструментальным методам выделения и извлечения опухоли как наиболее точ-•аым и щадящим и применять микрохирургическую технику.
Глава 13
Хирургическое лечение при травмах глаза
Хирургическое лечение ранений вспомогательных органов глаза
Чаще всего встречаются резаные, рваные, колотые раны век. Поврежденными могут оказаться кожа, мышцы, хрящевая пластинка, конъюнктива в отдельности или в различных комбинациях. Наиболее сложны в плане репозиции рваные раны. Если неправильное сопоставление краев кожной раны может не вызвать неблагоприятных последствий, то неадекватное ушивание тарзальной пластинки практически всегда приводит к стойкой деформации века.
Края раны имеют тенденцию к смещению в стороны — к углам глаза и в направлении действия мышц — поднимающей верхнее веко и опускающей нижнее. В связи с этим целесообразно наложить один—два ориентировочных шва, стягивающих рану, которые затем можно срезать. Первостепенная задача хирургической обработки — создание правильного контура края века, причем не в грубом приближении, а с большой точностью. Должны быть идеально сопоставлены линия ресниц, переднее и заднее ребра века, только в этом случае можно избежать формирования косметически уродливой выемки края века.
Затем приступают к восстановлению целости остальной хрящевой пластинки. Если края раны размозжены, то предварительно необходимо их ровно срезать, создав новые параллельные, хорошо сопоставляемые раневые поверхности. Что касается последовательности наложения швов, то этот вопрос решают индивидуально в каждом конкретном случае. Обычно ушивание производят следующим образом [Beyer, 1976]. По серой линии накладывают шелковый шов 5 :0 или 6 : 0, затем по одному шву 6 : О или 8:0 на заднее и переднее ребра века. Рану хряща можно ушить двумя способами: наложением рассасывающихся швов — О : 0 на передние губы раны хряща или нерассасывающихся швов той же толщины на задние губы раны. Преимущество первого способа состоит в отсутствии контакта шовного материала с роговицей. При использовании второго способа для уменьшения риска осложнений длинные концы задних швов выводят вперед
541
301. Обработка сквозной раны века (схема).
а — нити протянуты через конъюнктивально-хрящевую часть века и выведены через кожу; б — завязаны узловые швы на коже и в интермаргинальном пространстве века (слева схема шва).
и накладывают на двойной узел переднего маргинального шва, который после этого завязывают еще дважды, удерживая концы нитей направленными кпереди. Далее в соответствии с принципом послойной обработки ушивают рану мышечно-фасциального слоя рассасывающимися швами 6 : 0.
Первоначальную адаптацию краев кожной раны производят отдельными швами в узловых точках (обычно это места изломов по ходу раны), окончательную — отдельными или 8-образными швами по Л. Д. Мицкевичу (рис. 301). Подходящим шовным материалом для кожи век является шелк или нейлон 6: 0—8 : 0. На горизонтальной ране интервал между стежками может доходить до 5 мм, на вертикальной не должен превышать 2 мм. Оптимальное расстояние между местом вкола иглы и краем раны при указанной толщине нити — 1 мм. Степень натяжения шва зависит от сшиваемого слоя: на хряще узел завязывают с большим натяжением, мышечно-фасциальный слой ушивают без особых усилий, кожный шов затягивают лишь до хорошего сопоставления краев с учетом инфильтрационной анестезии и отека тканей.
Нельзя пренебрегать таким профилактическим мероприятием, как наложение тракционных швов, назначение которых — принудительно удлинить обработанную рану с целью компенсации последующего рубцового сокращения. Не следует создавать искусственную тракцию только при краевых ранах, не выходящих за пределы хряща. Нижнее веко более податливо в отношении рубцового смещения, чем верхнее, что необходимо учитывать при хирургической обработке раны. Это обусловлено меньшими размерами нижнего века, в частности его хрящевой пластинки, а также суммированием рубцового сокращения и силы тяжести, направленных в одну сторону.
542
Если рана доходит до основания века, то наложение тракционных швов следует считать безусловно обязательным. При использовании описанной выше методики ушивания такую функцию могут взять на себя длинные концы интермаргинального и маргинальных швов, прикрепленные пластырем к щеке или надбровью [Веуег, 1976]. Если это по какой-либо причине сделать невозможно, то по обе стороны от раны в 2 мм от нее накладывают два П-образных шва таким образом, чтобы горизонтальная часть каждого из них лежала на коже (между нитью и кожей должна находиться прозрачная чашеобразная прокладка, которую можно легко вырезать из таблеточной упаковки), а концы выходили в интермаргинальное пространство — в середине его или на границе задней трети.
При применении данной методики тракции отмечается один нежелательный эффект — ресницы противолежащего века находятся под оттянутым травмированным веком. Лучшим вариантом методики является шов Фроста: концы нити, проведенной через обработанное веко, перфорируют и противолежащее веко (место входа — интермаргинальное пространство, выход — на коже в 5— 10 мм от ресниц), затем веки оттягивают и шов фиксируют к коже пластырем. Тракционные швы, так же как и кожные, снимаются на 6—7-й день после операции.
Принцип дублирования Уилера, который гласит, что швы передней и задней пластинок не должны совпадать, необходимо использовать в тех случаях, когда сближение краев раны производят с заметным напряжением и в послеоперационном периоде можно ожидать прорезания швов. Применение данной техники гарантирует прочное срастание и уменьшает риск формирования краевой выемки на веке (рис. 302).
При наличии дефекта ткани первичная хирургическая обработка раны более трудоемкая [Iliff, 1980]. При небольших дефектах края рапы сближают и фиксируют, используя технику прямого сшивания (рис. 303) или методику Уилера. Неровные или размозженные края срезают таким образом, чтобы сопоставляемые поверхности были подходящими по конфигурации.
Если дефект ткани слишком большой по горизонтали для того чтобы произвести прямое сближение, то производят канто-лизис. Техника его состоит в следующем. Делают наружную кан-тотомию, затем ножницами в вертикальном направлении пересекают верхнюю или нижнюю часть наружной связки век, не затрагивая кожу и конъюнктиву. Освобожденная от связи с глазницей часть века легко смещается в сторону раны. При значительном смещении иногда необходимо сделать послабляющие разрезы кожи. Используя кантолизис, можно ликвидировать колобомы размером до 3Д длины века [Tonzel, Stewart, 1978].
При небольшом дефекте свободного края века нет необходимости превращать его в полную по высоте колобому и ликвидировать ее одним из описанных способов. Целесообразнее закрыть этот дефект прямоугольным скользящим лоскутом, вырезанным
543
302. Упрощенный метод дублирования по Уилеру при ранах век (схема), а — расщепление губ раны века, иссечение лоскута из передней пластинки; б — иссечение лоскута из задней пластинки; в — наложение матрацного шва на переднюю и заднюю пластинки; г — матрацный шов стянут и завязан на полоске резины, наложены кожные швы.
303. Обработка раны при большом дефекте века (схема).
а — наложение направляющих швов (нити перетянуты через раны); б — наложены Матрацные швы.
304. Первичная пластика сквозного дефекта века вертикальным скользящим лоскутом задней пластинки (схема).
а — в — этапы операции.
из задней пластинки противолежащего века [Gies, Bartlett, 1975]. Краям раны придают правильную прямоугольную форму, соответственно этому месту расщепляют другое веко на две пластинки, вертикальными разрезами хряща формируют прямоугольный скользящий лоскут, ширина которого равна ши-
рине восполняемого дефекта (рис. 304). Лоскут фиксируют в нише травмированного века по краям П-образным швом, выходящим на кожу. На период заживления веки сближают двумя П-образными швами на прокладках. После рассечения хрящевого мостика веки и глазная щель приобретают правильную форму.
Первичная пластика при дефектах кожи менее травматична,
чем отсроченная, поскольку не приходится ликвидировать последствия уродующего рубцевания. Небольшие дефекты устраняют каким-либо местнопластическим приемом. При обширном повреждении требуется первичная свободная кожная пластика. Наиболее подходящим донорским местом, безусловно, следует считать верхнее веко. Несмотря на кажущуюся ограниченность площади, оно позволяет в некоторых случаях выкраивать лоскуты размером до 2X4 см, что особенно легко осуществить у пожилых больных. Преимущества такого трансплантата неоспоримы: простота выкраивания, полное соответствие по фактуре и цвету окружающей коже, прекрасная приживляемость, отсутствие рубцового сокращения лоскута в послеоперационном периоде. Если использовать веко невозможно, то выбор падает на кожу задней поверхности уха или ретроаурикулярной зоны, где можно выкраивать расщепленные и полнослойные свободные лоскуты. Если и это невоз
545
можно, то используют кожу надключичной области, а также внутренней поверхности плеча.
В определенных случаях следует применять расщепленные лоскуты (разумеется, это не касается трансплантатов кожи с века), так как в отдаленном периоде место, куда пересажен полнослойный лоскут, заметно выделяется своей толщиной и ригидностью. Однако у больных с глубоким дефектом ткани этот недостаток превращается в преимущество, которое позволяет избежать образования впадины на поверхности кожи. Тем не менее край полнослойного трансплантата должен располагаться не ближе 3 мм от линии ресниц, в противном случае формируется искусственный рубцовый эпиблефарон — нависание кожи над ресницами, который может вызвать заворот ресниц при взгляде в сторону соответствующего века.
Три основных момента оперативной техники свободной кожной пластики гарантируют полное приживление лоскута: 1) создание достаточно ровного хорошо васкуляризированного ложа; 2) тщательный гемостаз; 3) плотное прижатие трансплантата к ложу. Наиболее плотное прижатие обеспечивает наложение фиксированного давящего валика и умеренно давящей повязки поверх него. Методика несложна: скатывают марлевый валик, подобный по форме трансплантату, но немного превышающий его по площади, накладывают на лоскут, над ним с большим натяжением связывают длинные концы отдельных швов, расположенных по периметру с интервалом 1—1,5 см. Таким образом осуществляют окончательный гемостаз и предотвращают возобновление кровотечения. Трансплантат прижимается к ложу по всей площади и, кроме того, растягивается во все стороны, поэтому отпадает необходимость в тракционных швах.
В тех случаях, когда имеется сквозной дефект века, но оторванная его часть сохранена (либо она висит на тонкой ножке, либо пострадавший принес ее с собой), разумной альтернативой приведенным выше способам можно считать рефиксацию сохраненного лоскута. В литературе имеются сведения о полном приживлении и восстановлении функции рефиксированных после полного отрыва обоих век, причем операция была произведена через 24 ч после травмы [Silverman J. Р., Obear М. F., 1980]. Во время рефиксации необходимо придерживаться тех же принципов послойной обработки, однако избегать погружных швов даже из рассасывающегося материала, поскольку в этом случае фактически выполняется свободная пластика, одно из непреложных правил которой запрещает оставлять какие бы то ни было инородные тела между трансплантатом и ложем. Легче и быстрее происходит приживление, если такой свободный трансплантат из задней пластинки века прилежит к интактной передней пластинке.
Иногда целесообразно преднамеренно срезать кожу лоскута, не доходя 2 мм до ресниц, и, фиксировав хрящ, восстановить целость передней пластинки смещением неповрежденных окружаю-
546
«цих тканей. Срезанный кусочек кожи можно пересадить на то место, откуда перемещен местный кожный лоскут.
Операции при повреждениях мышцы, поднимающей верхнее веко. Локализация разрыва может быть различной: тело мышцы, апоневроз, волокна, вплетающиеся в кожу, циркулярные волокна (мышца Мюллера); направление раны может варьировать от поперечного до продольного. Наиболее неблагоприятной разновидностью является длинная косая рана с отклонением от сагиттальной оси на 10—40°, поскольку диагональное ушивание мышцы осуществить трудно.
Следствием повреждения волокон, вплетающихся в кожу, является травматический эпиблефарон и отсутствие физиологической складки верхнего века. Хирургическая тактика заключается в формировании спаек между кожей и мышцей, поднимающей верхнее веко, пли передней поверхностью хряща вдоль ее верхней границы. Если рана кожи располагается горизонтально на расстоянии 5—7 мм от ресниц, то ее ушивают отдельными швами, в глубине раны проходящими через претарзальную часть мышцы, поднимающей верхнее веко, или поверхностные слои хряща с интервалом 3—5 мм. При отсутствии такой раны по линии предполагаемой складки рассекают кожу, тупым путем отсепаровывают волокна круговой мышцы и накладывают швы, как описано выше.
Нередко встречаются частичные отрывы век. Ни в коем случае нельзя ограничиваться репозицией и ушиванием кожной раны. В крайнем случае можно даже не накладывать швы на кожу, но обязательно фиксировать край оторванного апоневроза мышцы, поднимающей верхнее веко, к хрящу, поскольку рубцовую деформацию кожи в отдаленном периоде исправить гораздо легче, чем травматический птоз.
Для обнаружения мышцы, поднимающей верхнее веко, раздвигают края раны и просят больного посмотреть вверх и вниз несколько раз. При взгляде вверх в месте выхода мышцы появляется углубление. Ткани в этом месте захватывают пинцетом. Если волокна мышцы попали между браншами, то при повторных движениях глаз хирург ощущает, а иногда и видит ее напряжение. Проксимальнее места захвата прошивают ткани швом 6 : 0: это может быть хромированный кетгут, коллаген, викрил, а также нерассасывающиеся швы, которые при длительном нахождении в тканях не вызывают значительной реакции, — нейлон, пролин, капрон. Затем нить проводят через передние слои хрящевой пластинки в горизонтальном направлении на 2 мм ниже верхнего края хряща, при этом лучше всего пользоваться шпателеобразной иглой, так как круглые и треугольные в сечении иглы прорывают ткань хряща. Таким образом равномерно накладывают три—четыре шва.
Гораздо сложнее обстоит дело с разрывом тела мышцы, особенно в ее заднем отделе. Чаще всего подобное повреждение встречается при внедрении в глазницу крупных осколков. Так-
547
тика поиска краев разрыва мыпщы, поднимающей верхнее веко, остается прежней. Эта мышца довольно широкая, но очень тонкая, и этим обусловлена специфика ее ушивания. Швы проводят и завязывают при отсутствии натяжения мышцы, т. е. после сближении краев разрыва специальными зажимами или пинцетами. Толщина нити (хромированный кетгут, коллаген, викрил) не должна превышать 6 :0. Сначала нить проводят вдоль проксимального края раны и завязывают. Затем, после сближения, прошивают другой край раны и плотно завязывают узел.
Изолированные разрывы циркулярных волокон встречаются очень редко и обычно сразу не диагностируются. Сохраняющийся небольшой птоз верхнего века устраняют в отдаленном периоде с помощью одного из методов укорочения мышцы, поднимающей верхнее веко. Для того чтобы в послеоперационном периоде исключить возможность прорезания швов, наложенных на мышцу, и создать благоприятные условия для ее рубцевания, целесообразно завершить операцию проведением шва, подтягивающего веки кверху. Этот тракционный шов снимают через 1—2 нед.
Устранение повреждений связок век. Повреждения связок век встречаются чаще всего при резаных и колотых ранах, а также при переломах соответствующих краев и стенок глазницы.
Во избежание образования операционных дефектов необходимо учитывать, что: внутренняя связка двумя ножками обходит слезный мешок спереди и сзади; место прикрепления наружной связки находится не на наиболее проминирующей части края глазницы, а в 3 мм кзади от него; кожа вблизи углов неподвижно фиксирована к связкам.
Отрыв внутренней связки, как правило, сочетается с повреждением слезных канальцев, первичная реконструкция которых невозможна без репозиции внутреннего угла. Для получения лучшего доступа обычно необходимо расширить вход раневого канала. Обнажают внутренний край глазницы, слезный мешок и места прикрепления внутренней связки век. Края разрыва связки сшивают отдельными узловыми или П-образными швами (капрон, пролин, нейлон 4:0, 5:0) так, чтобы узлы не контактировали со стенкой слезного мешка. Несколькими подкожными кетгутовыми или коллагеновыми швами сближают края раны, затем накладывают швы на кожу.
Техника рефиксации наружной связки более проста и в принципе аналогична приведенной выше. Если связка оказалась пересеченной вплотную к кости так, что не представляется возможным сшить края разрыва, применяют дополнительные технические приемы. При сохранении надкостницы в области прикрепления связки к кости П-образным разрезом формируют надкостничный лоскут, основанием обращенным кпереди. Двухигольный шов проводят через связку век, основание лоскута надкостницы, кожу у края глазницы и завязывают на прокладке. В случае отсутствия надкостницы непосредственно позади края глазницы просверливают два сквозных отверстия в кости. Концы нити, ко
548
торой прошита связка век, проводят в эти отверстия и завязывают.
При ранении может быть потеряна часть связки, что не позволяет фиксировать ее остатки к надкостнице или кости. В этой случае используют трансплантат широкой фасции или склеры в< форме полоски. Трансплантату придают Y-образную форму, надрезав его с одного конца. Раздвоенную часть прикрепляют к передней поверхности хрящевых пластинок верхнего и нижнего век, а другой конец фиксируют под надкостничным лоскутом, как описано выше, или, проведя его через просверленное в кости отверстие, а затем спереди вокруг края глазницы, формируют своеобразную петлю, пришив конец трансплантата к его середине.
Если над связкой отсутствует участок кожи, то первичную хирургическую обработку дополняют одним приемом — закрывают дефект простым сближением краев раны или с помощью местнопластической техники. При этом необходимым моментом является фиксация кожи, оказавшейся над связкой. Для этого между кожей и связкой проводят П-образный шов и завязывают на прокладке площадью примерно 5X5 мм. У внутреннего угла глаза П-образный шов проводят через надкостницу лобного отростка верхней челюсти на расстоянии в 3 мм от переднего слезного-гребешка.
При сочетании разрыва связки век с переломом костей глазницы в области прикрепления связки произвести ее рефиксацию в ближайшем периоде нельзя. Пластику связки осуществляют по окончании консолидации отломков кости, спустя несколько месяцев после травмы. В случае повреждения внутренней связки-используют либо гомолатеральную, либо контралатеральную фиксацию: проводят швы через основание носа и укрепляют их на противоположной стороне.
Операции при повреждениях слезных путей. Обычной находкой при травмах внутреннего угла глаза является повреждении нижнего, верхнего или обоих слезных канальцев, иногда оказывается поврежденным и слезный мешок. Нельзя игнорировать их повреждение, даже если травмирован только один каналец-[Adams, 1976]. Прежде чем обработать рану века, восстанавливают целость слезного канальца. Цель хирургической обработки канальцев — сопоставление просветов медиального и латерального участков разорванного канальца и создание максимальной адаптации краев разрыва его стенки, задача при ведении послеоперационного периода — предупреждение рубцовой структуры просвета канальца. Современный уровень медицинской техники позволяет решить поставленные задачи.
Сопоставление производят с помощью какого-либо из многочисленных канальцевых зондов, например, зонда Поляка> (рис. 305), выбор которого зависит от конкретных условий. Иногда бывает трудно отыскать просвет медиальной части пересеченного канальца. При безуспешных попытках непосредственного-визуального поиска в полость слезного мешка через неповрежден-
54!>
305. Хирургическая обработка раны нижнего слезного канальца.
ный слезный каналец вводят раствор метиленового синего до появления в области раны капельки краски, по локализации которой определяют местонахождение канальца. Другой способ связан с применением зонда типа поросячьего хвостика. Зонд вводят через слезную точку в неповрежденный каналец, затем через слезный мешок в травмированный каналец. Однако в некоторых случаях и этот метод не применим, например при разрыве обоих канальцев, когда невозможно визуально обнаружить их просвет. Тогда производят ретроградное зондирование: делают разрез кожи вдоль внутреннего края глазницы, вскрывают слезный мешок,
из его полости через устья слезных канальцев вводят зонды. После завершения необходимых манипуляций операционную рану послойно ушивают: сначала отдельными рассасывающимися швами 6:0, 8:0 обрабатывают стенку слезного мешка, затем накладывают швы на кожу. Внутренняя связка век при описанной манипуляции должна оставаться интактной, а разрез мешка предпочтительнее вести в области его свода, над связкой.
Адаптацию краев разрыва производят в соответствии с принципами сосудистой микрохирургии. Стенку канальца ушивают край в край на зонде отдельными швами 10:0 (шелк, нейлон).
Степень рубцовой стриктуры в послеоперационном периоде зависит от интенсивности рубцевания и ширины рубца. При очень тщательном и деликатном наложении канальцевого анастомоза образуется тонкий рубец. Однако и его достаточно для развития непроходимости слезного канальца. В связи с этим в течение всего периода заживления и рубцевания в области анастомоза должен находиться имплантат, выполняющий просвет канальца. Это может быть металлическая проволока (наподобие серебряного зонда Джонсона) или синтетическая нить. По всем предъявляемым требованиям (ареактивность, химическая стойкость, прочность, моделируемость) наиболее подходящим материалом для изготовления такого имплантата является силикон. Силиконовую трубку вводят через каналец в слезный мешок и вблизи слезной точки фиксируют к коже одним швом для предотвращения смещения. Если повреждены оба слезных канальца,
550
то трубку проводят вкруговую — через оба канальца и слезный? Мешок, и кончики ее связывают шовной нитью бок в бок. В ряде-случаев из-за анатомических особенностей круговое проведение имплантата осуществить невозможно. Тогда каждый конец трубки отдельно проводят через канальцы (один — через верхний,, другой — через нижний), слезный мешок, носослезный проток,., полость носа и выводят наружу, затем завязывают узлом и фиксируют к щеке пластырем. Для интубации используют специальные зонды, полые или с отверстием на конце, в которое вставляют трубку.
Наложение канальцевого анастомоза удобнее производить на< металлическом зонде, но при последующей интубации можно повредить место сшивания, поэтому следует либо оставить металлический зонд, либо накладывать анастомоз на силиконовой трубке. После обработки слезных путей ушивают раны век. Интубационную трубку удаляют через 3—9 нед.
Хирургические методы обработки проникающих ранении глазного яблока
В результате поисков щадящего метода хирургической обработки проникающих ран роговицы был предложен способ покрытия раны конъюнктивальным лоскутом [Kuhnt Н., 1898]. Опыт лечения проникающих ранений глаза, накопленный отечественными офтальмологами в период Великой Отечественной войны, позволил подвергнуть этот способ обоснованной критике, как чреватый осложнениями.
Показания к хирургической обработке ран роговицы зависят от характера и размеров раны, сопутствующих осложнений и др. Для герметизации ран предлагали использовать кетгут и серебряную проволоку, человеческий и конский волос, нейлоновые нити, капрон, полиамидную пластмассу, силиконированный шелк,. нейлон-эластик-450. Однако все эти материалы не нашли применения в связи с рядом недостатков, и в настоящее время наиболее распространенным материалом для наложения швов является шелк.
При обработке ран используют роговичные иглы (желательно размером 4—5 мм) и наиболее тонкий шовный материал-(шелк, биологические швы, синтетические нити). В настоящее-время благодаря развитию микрохирургической техники обработку проникающих ран, особенно роговицы, можно проводить под микроскопом (с 10-кратным увеличением) с использованием инструментария для микрохирургии. Целесообразно накладывать сквозные швы через все слои роговицы, так как при слишком поверхностном их наложении отмечается зияние задних слоев краев раны и могут развиться передние спайки и другие осложнения. Расстояние между швами не должно превышать 3 мм. Однако-шелковые швы имеют ряд недостатков: необходимость их удале-
551
306. Адаптация краев раны роговицы в зависимости от глубины проведения шва (схема).
ния, при котором не исключена возможность опорожнения передней камеры; опасность развития некроза ткани, захваченной •в петлю шва, и быстрой пролиферации эпителия по ходу шва.
При обработке ран при проникающих ранениях глаза большое значение имеет глубина наложения шва. Большинство авторов считают, что она должна быть не менее 2/з толщины роговицы, так как при прошивании на х/з или '/ц остаются зияющими нижние губы раны и только наложение шва на 2/з толщины обеспечивает наилучшую адаптацию краев раны (рис. 306). Казалось •бы, лучшими являются сквозные швы. Однако прокол задней пограничной пластинки, особенно на гипотоничном глазу, очень сложен и практически невозможен.
Г. М. Саркисян (1980) для наложения сквозных роговичных и склеральных швов предлагает использовать пинцет, на концах браншей которого имеются отверстия диаметром 0,9 мм, в связи с чем он напоминает пинцет Поляка.
Следует иметь в виду, что при плохой адаптации краев роговичной раны может наблюдаться пролиферация в переднюю камеру задней пограничной пластинки и эндотелия, которые плохо
307. Адаптация краев рапы роговицы в зависимости от шага шва (схема), а — при перпендикулярных разрезах роювицы; б — при скошенных.
S52
диагностируются с помощью биомикроскопии и могут вызвать длительные иридоциклиты [Касс А. Г., 1969].
При микрохирургической обработке раны возникает также вопрос о «шаге» шва, т. е. о расстоянии места вкола и выкола иглы от края раны. На схеме, представленной на рис. 307, а, показаны различные размеры шага шва. Если сделать шаг шва очень маленький, то даже при идеальной микрохирургической обработке может наступить прорезывание шва. При большом шаге может возникнуть инвагинация краев раны. Следовательно, необходимо выбрать такую среднюю величину, при которой не возникали бы ни прорезывание, ни инвагинация. По нашему мнению, оптимальным вариантом является наложение шва на расстоянии 1 мм от краев раны, причем, как видно на схеме, сложным является наложение шва при скошенных лимбальных ранах. В таких случаях рекомендуют использовать большой шаг при наложении шва на стороне, обращенной к лимбу, и меньший шаг шва, который идет от лимба. В этом случае происходит достаточно правильная и четкая адаптация краев раны (рис. 307,6).
Большинство офтальмологов считают, что при обработке проникающих ран глаза лучше накладывать узловатые (отдельные) швы. Это объясняется тем, что они выполняют две функции: создают лучшие условия для адаптации краев раны и выпрямляют измененную конфигурацию раны. Непрерывный шов выполняет только функцию адаптации краев раны. В связи с этим при проникающих ранах необходимо накладывать узловатые швы, причем расстояние между ними должно быть не более 1 мм, а при небольших ранах — 2 мм. При сложных скошенных ранах (см. рис. 307, б) рекомендуется применять следующую тактику: для-исправления конфигурации раны накладывают один—два узловатых шва 7 : 0, 8 : 0 в месте наибольшего нарушения адаптации краев раны, а в дальнейшем накладывают отдельные тонкие швы диаметром 10 : 0 и между ними проводят непрерывный шов. Большинство авторов считают, что непрерывный шов не обеспечивает достаточно четкой адаптации краев раны, но в то же время он обладает определенным преимуществом: при его наложении получаются только два узла в начале и в конце. Считается, что узлы-даже при использовании самого тонкого шовного материала вызывают обильную васкуляризацию и затяжное течение раневого процесса глаза зависит именно от наличия большого количества узлов.
Непрерывный шов можно использовать при скошенных ранах, его следует накладывать на раны роговицы любых размеров, так как не происходит спонтанного соединения краев раны. Для того чтобы уменьшить васкуляризацию краев раны, предлагается погружать шов в глубь раны. При наложении более тонких швов и использовании микрохирургической техники меняется и время снятия швов. До настоящего времени швы снимали на 14—16-й день, так как по данным морфологических исследований рубец формируется практически на 14-й день. При использова
553
нии микрохирургической техники шелковые швы снимают через 3—4 нед, супрамидные или другие синтетические швы — через IV2—2 мес.
Стремление хирургов найти шовный материал, который не нужно удалять, привело к использованию разновидности сухожильных нитей. Сухожильные нити из хвостов лабораторных крыс, получившие название биологических швов, широко применяют в офтальмохирургии [Пучковская Н. А., Никулина Н. Б., 1963]. Биологические швы имеют преимущества перед шелковыми: нет необходимости их удалять; они могут растягиваться благодаря своим эластическим свойствам, в связи с чем в тех случаях, когда хирург при завязывании швов несколько перетягивает их, в дальнейшем происходит растягивание швов в результате восстановления тургора глаза.
Как показали экспериментальные и клинические исследования [Малаев А. А., 1970], рассасывание биологического шва начинается на участках, расположенных на поверхности раны роговицы (в узле шва) и в передней камере. Волокна сухожильных нитей, расположенные в ткани роговицы (в канале шва), сохраняются в ней в течение довольно длительного времени (до 4 мес). Воспалительная реакция тканей глаза на присутствие биологических швов выражена слабо и длится в среднем 15—20 дней.
Однако биологические швы не лишены недостатков, в частности при их использовании происходит дополнительная трав-матизация тканей иглами. Кроме того, при обработке больших ран только биологическими швами нередко наблюдается их быстрое рассасывание, в результате чего расходятся края раны. Особые трудности возникают при выпадении стекловидного тела, так как плотное завязывание биологических швов при этом затруднено из-за их эластичности.
Таким образом, обработка ран роговицы биологическими швами может быть рекомендована при небольших ранах (до 5 мм), не осложненных выпадением стекловидного тела. В связи с трав-матизацией тканей иглами при наложении швов велись поиски бесшовных методов герметизации ран глаза. В офтальмологической литературе появилось много сообщений о применении биологического клея для герметизации ран роговицы и склеры при проникающих ранениях.
Имеются сообщения о применении биологического клея МК-6 при травмах переднего отдела глаза [Скрипниченко 3. М., Бушуева Н. Н., 1973]. Биологический клей используют для кератопластики при различных видах инфицированных поврежденш! роговицы [Скрипниченко 3. М. и др., 1978]. С этой целью создан новый клей МК-7 (канакрил) с локальным введением антибиотика пролонгированного действия, капсулированного в поливи-нилпирролидон [Бушуева Н. Н., Акимова А. Я., 1976]. Однако наряду с достоинствами биологический клей имеет ряд недостатков: недостаточна сила склеивания (адгезивные свойства), сложность приготовления.
554
Я Поиски материала, обладающего достаточными склеивающи-ми свойствами, привели к попыткам применения в общей хирур-Н гии и офтальмохирургии синтетических клеев. Основой цианакри-Н латных клеевых композиций являются сложные эфиры а-циана-Н криловой кислоты. В настоящее время в разных странах разрабо-та но большое количество модификаций цианакрилатного клея, Впереди которых следует отметить «Циакрин», «МК-2» и МК-6 Иг (СССР), «Истман-910» (США), «Цианабонд-5000» и «Арон-аль-И ба» (Япония), «Акутол» (ЧССР), «Гистоакрил» (ФРГ).
И Исследования с целью определить возможность применения И клея МК-2 при проникающих ранениях роговицы провел И А- А. Малаев (1969, 1970). Клей МК-2, синтезированный на ос-' нове этил-а-цианакрилата, содержит в своем составе 85 весовых И частей этил-2-цианакрилата и 15 весовых частей поливинилаце-И тата (пластификатор и загуститель). Этот клей представляет со- бой однородную прозрачную вязкую жидкость с легким специ- фическим запахом; выпускают его в специальных герметически И закрытых полиэтиленовых тюбиках вместимостью 1 мл. Срок хра-V нения клея при температуре 0±3°С до 6 мес. В последние го- ды группой авторов (А. Я. Акимова, А. Б. Давыдов) синтезиро-В ван клей МК-6, обладающий значительно лучшими свойствами, чем клей МК-2.
В Техника наложения цианакрилатного клея. В После стерилизации тюбика с клеем в 70% этиловом спирте «но-fl сик» прокалывают сухой стерильной хирургической иглой, после В чего выдавливают каплю клея. Края раны тщательно осушают ватным тампоном или лучше губкой. При хорошей адаптации В краев раны одну каплю клея тонким слоем наносят на рану В непосредственно из «носика» тюбика или с помощью полиэтиле-В новой иглы. Через 1—172 мин на поверхности раны образуется В эластичная пленка белого цвета, прочно удерживающая края pa-fl ны и обеспечивающая ее полную герметизацию. Переднюю каме-fl ру восстанавливают на операционном столе или в первые часы В после наложения клея.
В Клей МК-2 накладывают на поверхность плотно сведенных В краев раны. При недостаточной адаптации или зиянии раны края В сводят с помощью двух пинцетов. Адгезивные свойства клея В МК-2 обеспечивают длительное сохранение пленки на неподвиж-В ной поверхности роговицы и склеры, достаточное для заполнения В раневого канала рубцовой тканью. Нанесение цианакрилатного В клея между краями раны нецелесообразно, ввиду того что плен-fl на клея, заполняя раневой канал, замедляет и осложняет процесс fl рубцевания ран. Пленка клея МК-2 удерживается на поверхно-fl сти роговичных ран в среднем в течение 5—15 дней. Если она В сохраняется дольше (более 20 дней), то ее следует удалить пин-fl цетом.
fl Нужно иметь в виду, что при обработке роговичных ран клеем fl происходят закрепление им эпителия и быстрое разрастание эн-fl дотелия, а это важно для профилактики врастания эпителия.
555
При обширных проникающих ранениях глаза со значитель ным зиянием краев раны можно рекомендовать наложить мини мальное количество биологических швов для устранения зияния раны, а затем покрыть ее клеем. При центральном расположе нии раны биологические швы накладывают вне оптической зоны, часть раны, проходящую через оптическую зону, покрывают кле ем. В отдельных случаях при проникающих ранениях роговицы даже больших размеров адаптация краев раны бывает настолько хорошей, что удается предварительно ввести стерильный воздух в переднюю камеру через дополнительный парацентез.
Для того чтобы облегчить выполнение парацентеза, предлагается использовать специальную иглу, рабочий конец которой имеет форму копьевидного ножа и остро заточен. Благодаря небольшой площади режущей части инструмента облегчается выполнение парацентеза на гипотоничном глазу и одномоментно вводится стерильный воздух.
При наличии хорошей адаптации краев раны для обезболивания достаточно произвести троекратную инстилляцию 1% рас-твора дикаина, что делает особенно перспективным применение клея МК-2 при обработке ран при проникающих ранениях глаза у детей.
Установлены следующие показания к обработке проникающих ранений роговицы биологическими и шелковыми швами, а также биологическим клеем МК-2 и МК-6. При небольших ранах роговицы (2—5 мм) с хорошо адаптированными краями показано наложение клея МК-2 и МК-6. В случае недостаточной адаптации рекомендуют свести края раны пинцетами, а затем наложить клей. При более обширных ранах с хорошо адаптированными краями также можно применить клей.
При ранах 6—12 мм и плохой адаптации краев необходимо-использовать комбинированный метод: сначала наложить два— три биологических шва, а затем — клей. Если клея нет, то при небольших ранах (до 4—5 мм) можно наложить биологические швы.
При ранах больших размеров следует либо накладывать только шелковые швы, либо производить комбинированную обработку шелковыми и биологическими швами (через один). Клей может быть наложен на участок раны, проходящий через оптическую зону.
Следует применять клей при опорожнении передней камеры во время снятия швов, а также при точечных колотых ранах роговицы и как временная мера при послераневых фистулах рубца.
Значительные трудности возникают при обработке многолоскутной раны роговицы, особенно расположенной в ее центре, с повреждением хрусталика (рис. 308); в таких случаях перед наложением швов удаляют хрусталиковые массы. Если не удается уложить лоскуты раны и наложить клей, то можно рекомендовать обработать подобную рану способом, предложенным В. В. Мо-
556
808.
Обработка звездчатой раны роговицы с одновременной экстракцией катаракты (схема).
309.
Кератопластика при обработке раны роговицы с размножением роговичной ткани (схема).
торным (1968). Шов накладывают с помощью пинцета Поляка. Вкол делают снаружи внутрь на расстоянии 1—1,5 мм от бокового края раны; иглу проводят через все слои роговицы и выводят изнутри наружу на таком же расстоянии, но уже в другом лоскуте раны. Затем делают вкол во втором лоскуте снаружи внутрь, но уже с другой стороны второго лоскута и иглу выводят в третьем лоскуте и так далее через все лоскуты. В последний раз иглу выводят в том лоскуте, где был сделан первоначальный вкол, но только с другого его края. Наложенный таким способом
557
шов сближает не только боковые поверхности лоскутов раны, но и смещает вершины лоскутов к центру раны. При грубых прони кающих ранениях роговицы с дефектом ткани можно выполнить первичную обработку и сквозную (рис. 309) или послойную пересадку консервированной роговицы, а в особых случаях — аутопластику.
И. М. Логай и К. А. Мухтурис (1985) предлагают при обработке грубых лоскутных ранений роговицы применять укрепляющую поверхностную послойную кератопластику по Пучковской. Сущность ее заключается в том, что после удаления из раны фибрина на ее края накладывают минимальное количество швов, восстанавливают переднюю камеру с помощью раствора Рингера — Локка или пузыря воздуха, соскабливают эпителий роговицы вокруг раны и область раны покрывают послойным роговичным трансплантатом, взятым из трупного глаза, консервированного во влажной камере по методу Филатова. Форма и размеры трансплантата различны в зависимости от размеров и локализации раны роговицы. Трансплантат может иметь вид ленты со склеральными ушками на концах, небольшого сегмента или сегмента на половину и более окружности глаза. Трансплантат фиксируют с помощью эписклеральных швов, причем для этого предварительно от лимба и склеры отсепаровывают конъюнктиву, которой затем прикрывают склеральную часть трансплантата. Послойный роговичный трансплантат играет роль биологической повязки и препятствует опорожнению передней камеры. Через него можно наблюдать за состоянием зрачка и глубиной передней камеры. Кроме того, можно использовать комбинированный метод; сближение краев раны роговицы биологическими швами и одномоментную послойную пересадку роговицы.
При проникающем ранении роговицы с дефектом ткани и отсутствии консервированного материала роговицы можно рекомендовать аутопластику, которую производят следующим образом. Циркулем измеряют длину и ширину раны, после чего на неповрежденной части роговицы выкраивают лоскут таких размеров. Эпителий краев раны немного счищают и на рану, соединенную по возможности биологическими швами, накладывают трансплантат, который укрепляют перекидными швами или непрерывным швом.
В некоторых случаях можно комбинировать швы с конъюнктивальной пластикой по Кунту.
Таким образом обрабатывают неосложненные проникающие раны роговицы.
Обработка раны при проникающем ранении роговицы, осложненной выпадением радужки. При проникающем ранении роговицы с выпадением радужки раньше считалось обязательным ее отсекать. В настоящее время благодаря применению антибиотиков опасность инфекции при вправлении радужки значительно уменьшилась. В связи с этим в ряде случаев допустимо осуществлять вправление радужки шпателем через рану или через до
558
полнительный'разрез у лимба. Если вправление ригидной радужки затруднено, то делают небольшую иридотомию.
После вправления радужки и обработки раны роговицы показано введение воздуха или изотонического раствора хлорида натрия через рану или дополнительный разрез у лимба. При наличии показаний к иридэктомии выпавшую радужку захватывают ирис-пинцетом, слегка подтягивают и иссекают ирис-ножницами. Ножки колобомы заправляют шпателем. В других случаях радужку, орошенную раствором пенициллина, тщательно вправляют шпателем. На рану накладывают швы.
При наличии корнеосклеральной раны и выпадении радужки в этой области, несмотря на ее вправление, нередко все-таки образуются передние спайки. В связи с этим при обработке данной области необходимо обеспечить хорошую герметизацию раны, а во избежание образования передних спаек целесообразно перед вправлением производить иридотомию. Отмечено, что при предварительном (до обработки раны) введении в переднюю камеру воздуха он, выравнивая роговицу, способствует восстановлению передней камеры, наступает иммобилизация радужки, и на рану роговицы с успехом наносят клей. Введенный таким образом воздух препятствует попаданию клея в переднюю камеру и образованию передних спаек. В последнее время вместо воздуха в переднюю камеру рекомендуют вводить изотонический раствор хлорида натрия. Однако при проникающем ранении роговицы он вытекает через рану, поэтому предпочтительнее вводить воздух.
Вправление радужки вполне себя оправдывает, особенно в случаях без повреждения хрусталика: достигается более высокая острота зрения с сохранением хорошего вида глаза.
В тех случаях, когда радужка выпала в виде размозженной ткани и обрывков, ее следует отсечь, несколько вытянув из раны. После этого рану обрабатывают. Противопоказанием к вправлению радужки следует считать также наличие явных признаков гнойной инфекции (нагноение краев раны, гной в передней камере и конъюнктивальном мешке).
Обработка проникающих ран области лимба. При наличии в области лимба раны небольших размеров (2— 3 мм) без выпадения радужки достаточно наложить клей или один биологический шов на лимбальную область. Выпавшую радужку необходимо осторожно вправить или отсечь. При ранениях больших размеров, распространяющихся только на роговицу, помимо основного шва, наложенного на рану в области лимба, накладывают цианакрилатный клей МК-2 или МК-6 либо биологические швы. Рану больших размеров рекомендуется обрабатывать комбинированным способом с наложением биологических швов и клея или шелковых и биологических швов.
Обработка проникающей раны роговицы, осложненной ранением хрусталика. В случае небольшой раны капсулы хрусталика показана описанная выше методика обработки раны с обязательным введением воздуха или
559
изотонического раствора хлорида натрия в переднюю камер\ В тех случаях, когда характер повреждения хрусталика не остан ляет сомнений в последующем развитии травматической катара к ты с выхождением хрусталиковых масс в переднюю камерх, следует возможно полнее вымыть вещество хрусталика в при цессе первичной хирургической обработки раны и ввести в перед яюю камеру воздух или изотонический раствор хлорида натрия. При повреждении хрусталика без его набухания показана обра ботка проникающей раны роговицы без вмешательства на хру сталике. В случае набухания хрусталика и длительных нести хающих явлениях иридоциклита иногда приходится его удалить. Необходимо помнить о возможности возникновения факогенной реакции, которая может быть расценена как эндофтальмит. Уда лять набухший хрусталик следует по типу обычной экстракции катаракты, особенно у людей пожилого возраста, когда имеется выраженное ядро, с выкраиванием конъюнктивального лоскута и наложением четырх—шести корнеосклеральных швов.
В последние годы достижения инструментальной хирургии (внедрение витреотомов) позволили разработать и внедрить ряд операций «закрытого типа» при посттравматической патологии переднего отдела глаза с передним подходом через разрез роговицы или лимба, размер которого не превышает 3 мм.
Операции выполняют таким образом. Способы анестезии выбирают индивидуально. Глазное яблоко фиксируют лигатурой, наложенной на сухожилие верхней прямой мышцы. Глазное яб локо вскрывают, делая разрез роговицы у лимба или разрез лимба с образованием конъюнктивального лоскута в любом удобном меридиане. В свежих случаях предварительно производят обработку раны с наложением адаптирующих швов.
Важным моментом при проведении операции «закрытого типа» является соответствие величины разреза диаметру вводимого в глаз инструмента, только при этом условии можно сохранить нормальное внутриглазное давление в ходе вмешательства. Манипуляции рабочими наконечниками инструментов производят в передней и задней камерах, а также (в случае необходимости) в переднем отделе стекловидного тела.
При достаточно широком зрачке витрео- и ленсэктомию осуществляют транспапиллярно. При ригидном, а также заращенном зрачке инструмент вводят через базальную колобому, а затем тем же инструментом формируют зрачок необходимого диаметра. Хрусталиковые массы, кровь, экссудат, иридокорнеальные спайки и кисты радужки удаляют под визуальным контролем в максимально возможном объеме, а измененное стекловидное тело — до появления яркого рефлекса с глазного дна. В качестве замещающей жидкости применяют изотонический раствор хлорида натрия. Операции завершают наложением одного—двух микрошвов на рану и субконъюнктивальным введением антибиотиков и стероидов.
На основании результатов клинических наблюдений выделе-
560
JHbi следующие виды посттравматическцх изменении, при которых •передняя витрэктомия является методом выбора.
, 1. Проникающая рана роговицы с повреждением хрусталика
В стекловидного тела, характеризующаяся выпадением и смешиванием хрусталиковых масс и стекловидного тела. Показана обработка раны роговицы с непосредственной передней витрэктомией и факофрагментацией.
2. Тяжелая проникающая рана переднего сегмента глаза с вывихом хрусталика в стекловидное тело или «выпадением» его, когда в передней камере выявляется значительное количество стекловидного тела. Переднюю витрэктомию производят непосредственно после обработки раны, а также после наложения швов в любые сроки от момента травмы.
3. Контузионная травма глаза с вывихом хрусталика и выпадением стекловидного тела в переднюю камеру. Данная патология часто сопровождается повышением внутриглазного давления, в связи с чем бывает необходима срочная операция. Производят переднюю витрэктомию с факофрагментацией (ленсэктомия).
4. Последствия тяжелых травм переднего отдела глаза с наличием грубых корнеовитреальных сращений. Выполнение передней витрэктомии в подобных случаях представляет трудности и требуется особое внимание к эндотелию, который может вызвать серьезные осложнения.
5. Переднекамерные посттравматические кисты. Следует подчеркнуть особую эффективность передней витрэктомии (кистэкто-мия), которая дает выраженный эффект.
Особенностью операции в данном случае является тщательная скарификация витреотомом рубца, из которого исходит киста. При этом следует ввести фибрин в переднюю камеру для лечебного воздействия на эндотелий по принципу лечения осложненного кератоконуса.
6. Посттравматическое врастание эпителия, при котором можно предпринять попытку с помощью витреотома произвести скарификацию эпителия при его врастании с одновременной передней витрэктомией и последующим введением в переднюю камеру крови.
Обработка ран при проникающих ранениях склеры. Зашивать склеральную рану, если она прикрыта спаянной с ней конъюнктивой, можно только после осторожной отсепаровки последней. Иногда при этом обнаруживают рану в склере гораздо больших размеров. В связи с этим во избежание значительной потери стекловидного тела следует обнажать рану в склере постепенно, последовательно накладывая на нее шов и отсепаровывая конъюнктиву (рис. 310). При обработке проникающих ран склеры следует накладывать сквозные шелковые или биологические швы. Если ранение склеры не осложнилось выпадением стекловидного тела, то можно рекомендовать наложение биологических швов. При выпадении стекловидного тела необходимо наложить шелковые швы. Если рана расположена на расстоянии 5—6 мм от лим-
36 Руководство по глазной хирургии
561
310. Пластика склеры по Ландесбер-гу (схема).
ба, то целесообразно наложить сквозные 8-образные швы с выведением их на конъюнктиву, так как погружные шелковые склеральные швы, покрытые конъюнктивой, нередко вызывают реакцию со стороны конъюнктивы, и их приходится удалять. Обработка шелковыми швами ранений склеры, расположенных на расстоянии более 5—6 мм от лимба, возможна, но без выведения их на конъюнктиву. При небольших ранениях склеры (2—3 мм) с хорошо адаптированными краями можно наложить лишь клей МК-2.
При тяжелых проникающих ранениях склеры с дефектом ее производят пластику склерой, аллосклерой или влагалищем глазного яблока. В этих случаях для сохранения формы глазного яблока используют кольца, которые пришивают к склере на время операции (рис. 311). В клинических наблюдениях установлено, что консервированная склера глаза трупа удобна для пластики. Послеоперационный период при этом протекает почти без реакций. Некоторые авторы рекомендуют фиксировать аллопла-стические материалы клеем [Пучковская Н. А. и др., 1971; Бушуева Н. Н., Полякова А. М., 1975; Бушуева Н. Н., 1977; Скрипниченко 3. М„ Бушуева Н. Н., 1978, и др.].
Обработка ран при проникающих ранениях глаза с внедрением инородных тел. Проникающие ранения глаза нередко бывают связаны с попаданием внутрь глаза инородного тела (в 30—35%
311. Кольца для сохранения формы глазного яблока.
случаев). Удаление из глаза магнитных инородных тел — довольно хорошо разработанный раздел глазной хирургии. По многочисленным наблюдениям, опубликованным за последние 35 лет, магнитные и электромагнитные операции дают положительный результат в 75—93% случаев. Неудачные попытки удаления магнитных инородных тел обычно связаны с локализацией инородного тела в задних отделах глаза. При решении вопроса о целесообразности хирургического вмешательства при амагнитных инородных телах необходимо принимать во внимание два соображения: на
562
личие достаточных показаний к извлечению осколка и практическую осуществимость операции.
Диагностика инородных тел в глазу. При проникающем ранении глаза всегда нужно предполагать возможность внедрения инородного тела. Необходимо произвести своевременную диагностику, установить характер инородного тела (магнитное или амагнитное), а также точно определить локализацию осколка до операции и в процессе оперативного вмешательства.
Для выявления инородного тела прежде всего нужно обследовать больного с помощью фокального освещения, биомикроскопии, офтальмоскопии. Обычная биомикроскопия не всегда позволяет обнаружить осколок в углу передней камеры, с этой целью лучше применять гониоскопию. Особенно ценен данный метод при наличии в передней камере мелких осколков стекла, пластмассы и других инородных тел, которые не выявляются при рентгенологическом исследовании.
Для выявления изменений за радужкой применяют циклоскопию. Для того чтобы правильно оценить состояние глаза при подозрении на наличие инородного тела в передней камере, необходимо обратить внимание на состояние роговицы. Если глаз раздражен и имеется эндотелиально-эпителиальная дистрофия роговицы, то следует предположить наличие инородного тела, чаще всего стекла или пластмассы, в углу передней камеры, причем именно в том месте, где имеются изменения роговицы. Результаты гониоскопического исследования, как правило, подтверждают наличие осколка. Если из-за выраженного отека роговицы осуществить гониоскопию невозможно, то следует предварительно назначить ванночки с 40% раствором глюкозы или инстилляции глицерина, а также применить гиперосмотические средства. Для диагностики инородных тел может быть использовано исследование с помощью инфракрасной щелевой лампы.
В тех случаях, когда внедрение в глаз инородного тела не сопровождается значительными повреждениями глазного яблока и наличием зияющих ран, для определения его локализации следует применять проверенные многолетним опытом методики Ком-берга — Балтика и Абалихина — Пивоварова. Для установления местонахождения инородных тел в переднем отделе глазного яблока с успехом используют бесскелетную рентгенографию по Фогту. Следует учитывать, что применять эту методику можно не ранее чем через 7—10 дней после ранения.
Для выявления инородных тел у большого контингента больных с ранениями глаз рекомендуется проводить флюорографическую рентгенодиагностику инородных тел глаза. Крупнокадровая флюорография (размер кадра 100X100 мм) позволяет выявлять и локализовать внутриглазные инородные тела размером от 0,5 мм и более. Крупнокадровая флюорография дает возможность применить наиболее распространенные методики рентгенолокализации внутриглазных инородных тел. Кроме того, следует учитывать экономичность этого метода и его высокую разрешающую способ
36*
563
ность, а также возможность обследовать большое число больных в короткие сроки.
В тех случаях, когда с помощью обычной рентгенографии не удается выявить инородное тело внутри глаза, а клинические данные с несомненностью указывают на наличие такового (сидероз, халькоз), целесообразно применить рентгенографию с прямым увеличением изображения. Этот метод позволяет обнаружить мельчайшие инородные тела (менее 0,3 мм), расположенные не только в переднем, но и в заднем отделе глазного яблока. Кроме того, с помощью рентгенографии с прямым увеличением изображения можно выявить малоконтрастные инородные тела, которые плохо или совсем не видны на обычных рентгенограммах.
При обследовании больных с обширными повреждениями глазного яблока и выпадением внутриглазных оболочек, когда применение контактных методик определения локализации внутриглазных инородных тел противопоказано или трудно осуществимо, следует использовать неконтактную методику. Для установления локализации внутриглазного инородного тела в случае обширного ранения, препятствующего наложению протеза-индикатора Балтина, Л. X. Шоттер и А. В. Панов (1976) предложили вспомогательный способ рентгенолокализации с наложением протеза на здоровый глаз. Произведя четыре снимка (по 2 с каждого глаза) в двух обычных проекциях и наложив снимки друг на друга (один перевернув), ввиду имеющейся в большинстве случаев симметрии можно достаточно точно установить локализацию инородного тела.
При обследовании больных с множественными инородными телами неоценимую помощь оказывает стереорентгенограмметри-ческая методика определения их локализации. Эту методику целесообразно применять также при наличии у больных нефиксированных осколков в стекловидном теле, так как в подобных случаях положение больного при рентгенологическом исследовании и на операционном столе идентично.
Указанные выше методики позволяют выявить осколок у большинства больных. Не удается выявить лишь мельчайшие осколки стекла, локализующиеся в переднем отрезке глаза и практически разрушившиеся, а также инородные тела, находящиеся в заднем отделе глаза.
Для диагностики инородных тел рекомендуется использовать метод, основанный на принципах проекционной геометрии сферических поверхностей. Существует также метод электронной локации инородных тел, который основан на изменении индуктивности катушки контура генератора при попадании в ее поле металлического осколка. Сконструирован транзисторный прибор для бесконтактной диагностики металлических инородных тел в глазу, определения их локализации и магнитных свойств (Л. С. Урмахер).
Одним из наиболее ценных методов диагностики инородных
564
тел в глазу является ультразвуковая одномерная эхография, при исследовании излучатель неподвижен по отношению к исследуемому объекту, а регистрирующиеся на экране осциллографа эхо-сигналы могут быть засняты на фото- или кинопленку. По виду эхограммы можно определить характер патологических изменений, а также отдифференцировать каждое из этих изменений, в том числе обусловленных наличием инородного тела.
Большинство исследований по ультразвуковой диагностике инородных тел глаза выполняют с помощью специальных аппаратов. Они работают в диапазоне частот от 3 до 15 МГц, что позволяет использовать эти аппараты для диагностики патологических изменений в различных отделах глазного яблока.
Установив наличие инородного тела в глазу, важно выяснить, магнитное оно или амагнитное. Для этого существует ряд проб.
Магнитные пробы. До недавнего времени считалось целесообразным широко применять магнитные пробы во всех или почти во всех случаях проникающих ранений глаза. Однако магнитные пробы не всегда дают достоверные ответы. Кроме того, значительное перемещение осколков во время проведения магнитной пробы может вызвать повреждение тканей и дополнительные кровоизлияния. Если магнитную пробу проводят после рентгенографии, то в последующем (через 2—3 нед) показано повторное рентгенологическое исследование.
Магнитную пробу на смещение осколка ставят при локализации инородного тела как в переднем отделе глаза (под биомик-роскопическим контролем), так и в стекловидном теле и на глазном дне (под офтальмоскопическим контролем). Используют ручной электрический магнит средней мощности. После приближения магнита к роговице включают и выключают ток, а врач следит за положением оскола. При правильно и осторожно проведенной пробе магнитное инородное тело слегка поворачивается в сторону магнита. В ряде случаев применяют большой электрический магнит (проба по Гейликману). Голова больного находится в кольце соленоида, и в это время проводят офтальмоскопию. Начинают с включения тока небольшой силы, но если осколок остается неподвижным, силу тока постепенно увеличивают. При фиксации осколка, не выводя голову больного из кольца соленоида, к его виску или глазу подводят якорь электромагнита.
Проба на «прилипание» может быть использована только в процессе операции диасклерального удаления осколка при условии пристеночного его расположения. Наконечник магнита приставляют к склере в месте расположения осколка (в соответствии сданными рентгенографии). Если при этом наблюдается небольшое выпячивание склеры или «прилипание» ее к острию наконечника магнита, то пробу считают положительной. Отрицательная проба возможна при малых магнитных осколках.
Для проведения диагностической магнитной пробы под контролем офтальмоскопа можно использовать и постоянный магнит,
565
312.
Полупроводниковый металлофон Пивоварова.
1 — шуп; 2 — ручка настройки; 3 — головной телефон; 4 — защитный наконечник шупа.
применив «обратную пробу» 1 [Шоттер Л. X., 1980]. Постоянный магнит осторожно подводят с соответствующей стороны к глазу, причем медленный поворот осколка может остаться незамеченным. Затем магнит резко отводят от глаза, и происходящий при этом быстрый поворот осколка в прежнее положение хорошо заметен.
Метод с использованием ультразвуковой эхографии. Впервые данный метод был применен М. В. Кодзовым и соавт. (1970). Авторы для определения магнитных свойств металлических частиц использовали сочетание ультразвуковой эхографической локации инородного тела с переменным действием поля внутриполюсного электромагнита — соленоида, которое почти не смещает инородного тела. Эхографическую локацию осколков проводят с помощью отечественного ультразвукового диагностического аппарата «Эхоофтальмограф», работающего на частоте 10 МГц.
Определение магнитных свойств осколка с помощью электронного локатора. В 1969 г. Н. Н. Пивоваровым был сконструирован полупроводниковый металлофон с применением печатной схемы, питающийся от батареек (рис. 312). Магнитные осколки дают более высокий тон, чем основной, амаг-нитные — более низкий. Инородные тела диаметром более 2 мм по звуку различаются с большим трудом.
Прибор для определения магнитных свойств осколка, основанный на том же принципе, был создан Л. С. Урмахером и соавт. (рис. 313). С этой же целью И. М. Логай (1971) использовал феррозондовый полюсоискатель (рис. 314).
Сидероскопия. Для обнаружения железных или стальных осколков очень небольших размеров можно применять сидеро-скопию. Однако используемый с этой целью прибор обладает
1 Удостоверение на рационализаторское предложение № 1164 от 31.07.
80 г., выданное Тартусским Государственным Университетом.
566
313.
Прибор для диагностики внутриглазных инородных тел и определения их магнитных свойств по Гундоровой.
очень высокой чувствительностью, в связи с чем практическая ценность метода снижается.
В отдельных, наиболее трудных, случаях для диагностики инородного тела и уточнения его природы используют химическое исследование влаги передней камеры. Такое исследование следует проводить в самых крайних случаях, когда все другие методы не дают результата.
Все указанные выше методы диагностики инородных тел позволяют установить, имеется ли осколок в глазу. В дальнейшем при проведении операции извлечения осколка чрезвычайно важно определить проекцию его на склеру.
Методы уточнения проекции инородного тела на склеру. Общепринятые в настоящее время методики рент-генолокализации внутриглазных осколков позволяют определить следующие параметры: 1) меридиан залегания осколков; 2) расстояние его от анатомической оси глаза; 3) глубину залегания осколка по прямой от плоскости лимба. Первые два параметра без поправок используют при диасклеральной операции удаления осколка.
Измеренная на боковой рентгенограмме глубина залегания осколка от плоскости лимба по прямой всегда меньше той же дистанции, измеренной по дуге склеры. В связи с этим Б. Л. Поляк (1957) боковую схему-измеритель рентгенограмм дополнил шкалой поправок, в которой указан пересчет глубины залегания осколка, откладываемой по склере, который должен делать офтальмохирург перед операцией. Расчет этой шкалы производился по отношению к схематическому глазу диаметром 24 мм.
Все измерения по склере Б. Л. Поляк рекомендует производить сконструированным им инструментом — склеромером, который позволяет откладывать линейные величины не по хорде, а по дуге. По данным Б. Л. Поляка, при небольшом расстоянии от лимба (11—12 мм) величины отсчетов по дуге и по хорде почти
567
314. Общий вид магнитометра с феррозондовым полюсоискателем (а) и методика его применения по Логаю (б).
равны. Если же инородное тело находится на расстоянии 15 мм и больше от плоскости лимба, то при определении проекции инородного тела на склеру по хорде (для облегчения измерения этой величины во время операции) предлагается это расстояние сложить по частям, в два или три приема, каждый раз раздвигая циркуль не более чем на 10 мм. Такое «дробное» откладывание, как отмечает автор, производить значительно легче и оно более точное, чем однократное откладывание того же расстояния широко открытым циркулем.
В последние годы разработаны простые методики объективного определения индивидуальных размеров глазного яблока. Но-
568
—
которые из них применяют не только при прозрачных, но и при мутных средах. Для уточнения локализации инородного тела в глазу или за глазом С. А. Любарский (1965) предложил таблицу, основанную на определении размеров глазного яблока ультразвуковым методом.
1 В последнее время для уточнения проекции инородного тела на склеру Ф. Е. Фридманом предложен «пеленгатор» — устройство для пересчета глубины залегания осколка при различных размерах глаза. Использование этого устройства дает возможность офтальмохирургу выполнить разрез при диасклеральном удалении инородных тел на участке склеры, находящемся на кратчайшем расстоянии от осколка. Это, как известно, решающим образом влияет на исход хирургического вмешательства.
При удалении инородных тел из оболочек заднего отдела глаза и находящихся предоболочечно особые трудности возникают в момент выполнения самой операции, когда необходимо совершенно точно определить проекцию осколка на склеру. При отсчете расстояния от лимба (с помощью метчика или нити) очень легко «потерять» меридиан и часы проекции осколка. В связи с этим для уточнения проекции осколка на склеру используют ряд методов и приспособлений: определение места проекции внутриглазных инородных тел по координатам рентгеновских снимков [Боранович Ю. И., 1975], специальное металлическое кольцо [Кег-kenezov, 1964], подшивание индикаторов [Дамбите Г. Р., 1967]. Предложен также метод предварительной диагностики с помощью диатермокоагуляции склеры.
Все перечисленные методы значительно облегчают удаление инородных тел из оболочек глазного яблока. Однако из-за ряда недостатков они не всегда могут быть применены. В связи с этим большое значение может приобрести метод трансиллюминации, который заключается в следующем. Обнажив склеру и повернув глаз пинцетом или уздечным швом в нужную сторону, хирург с помощью офтальмоскопа находит осколок на глазном дне. Операцию производят в затемненной операционной. При офтальмо-{скопии на склере можно увидеть небольшое светлое пятно (оно соответствует освещенному офтальмоскопом участку склеры), в ; центре которого виден затемненный участок инородного тела.
| Данный метод очень ценен при удалении как магнитных, так и
(амагнитных инородных тел, расположенных пристеночно и в оболочках переднего и заднего отделов глаза.
В последние годы широко применяют трансиллюминацию с диафаноскопом. Этот метод дает возможность уточнить локализацию осколка в оболочках глаза и при мутном хрусталике, а также при небольших помутнениях стекловидного тела, но не при £ гемофтальме. У многих оперированных нами больных до опера-ф ции уже были предприняты одна—две попытки удалить осколки. % Только использование трансиллюминации с помощью диафаноскопа дало возможность правильно определить проекцию инородного тела на склеру и с успехом удалить его.
569
315.
Диафаноскоп со световодом.
У ряда больных для уточнения локализации инородных тел, расположенных в склере и в заднем отделе глаза, используют ретробульбарную диафаноскопию, которая была предложена С. С. Головиным (1910) для диагностики внутриглазных новообразований. Этот метод заключается в следующем. После местной анестезии и отсепаровки слизистой оболочки глазного яблока примерно определяют предполагаемую локализацию инородного тела. Для уточнения места его расположения диафаноскоп прижимают к склере и производят легкие скользящие движения. В том месте, где луч света диафаноскопа встречает препятствие в виде инородного тела, происходит затемнение светящегося красным отблеском зрачка; значит, именно в этом месте располагается инородное тело, здесь и следует производить разрез склеры. Ввиду того что диаметр тубуса диафаноскопа равен 2 мм, а инородное тело может быть значительно меньшего размера, используют насадку с диаметром отверстия 1 мм, что позволяет выявлять мелкие осколки.
Ретробульбарную диафаноскопию целесообразнее применять при расположении инородных тел в оболочках заднего отдела глаза, так как трансиллюминация в этих случаях не всегда возможна, особенно если осколок расположен с носовой стороны. Этот метод может быть рекомендован при локализации магнитных или амагнитных инородных тел пристеночно и в оболочках глазного яблока с внедрением в склеру.
Р. А. Гундоровой и соавт. (1970) разработан новый метод использования диафаноскопа на волоконной оптике (рис. 315). На этом же принципе основан диафаноскоп, предложенный Neubauer (1965). Для световодов использован осветитель — лампа типа ДР7-100 (дуговая ртутная шарообразная лампа мощностью 100 Вт) с отражателем, концентрирующим световой поток на площади 3X3 см. Как известно, при диасклеральном удалении внутриглазных инородных тел применяют трансиллюминацию. Имеющийся в распоряжении хирурга диафаноскоп, используемый для освещения полости глаза через зрачковую область, концентрирует свет, излучаемый лампой накаливания. При этом тепловой эффект передается на наконечник прибора. В результате длитель-
570
кного соприкосновения горячего наконечника диафаноскопа с роговицей в ней могут развиться патологические изменения. Кроме того, яркость освещения исследуемой области невелика, так как используется обычная лампа накаливания. Сконструирован диафаноскоп с холодным свечением наконечника. Свет в нем от лампы ДРШ-100 до наконечника передается с помощью световода. Опыты показали, что освещенность исследуемого участка склеры при трансиллюминации с использованием световода значительно больше, чем при обычной диафаноскопии.
Известно, что при удалении инородных тел из ресничного тела и при гемофтальме осуществить трансиллюминацию невозможно. Проведение трансиллюминации с помощью диафаноскопа с использованием световодов позволяет добиться такой яркости освещения, что в ряде случаев осколок контрастируется и удается выявить инородное тело как в ресничном теле, так и при гемофтальме.
Клинический опыт показывает, что при тотальном гемофтальме, грубых преретинальных швартах и преретинальных кровоизлияниях в центральной зоне стекловидного тела при исследовании с диафаноскопом получают неточные данные. В этих случаях большую помощь оказывает ультразвуковая локация инородного тела во время операции.
Методика ультразвуковой локации, разработанная Ф. Е. Фридманом и М. Б. Кодзовым (1972), сводится к следующему. Во время операции излучатель диаметром 3—5 мм, работающий на частоте 5—10 МГц, стерилизованный в 96% этиловом спирте, приводят в соприкосновение с обнаженной склерой на том участке, где предполагается наличие осколка, и ориентируют строго перпендикулярно к оболочкам глаза. Контактной средой между излучателем и глазом является смесь слезной жидкости с новокаином. Затем производят скользящие движения излучателем по склере, не отрывая его от поверхности глаза и «прощупывая», таким образом, весь подозрительный на наличие осколка участок при непрерывном визуальном контроле регистрируемой при этом эхограммы.
В момент расположения излучателя над инородным телом на эхограмме внезапно возникает относительно высокий эхосигнал, соответствующий отражению ультразвука от осколка. Положение излучателя в момент регистрации эхосигнала от осколка позволяет уточнить участок оболочки глаза, где следует сделать разрез. Кроме того, акустическое исследование глаза дает возможность уточнить некоторые детали расположения осколка, имеющие важное значение для офтальмохирурга. Имеется в виду прежде всего глубина расположения инородного тела в глазу. Отстояние осколка от поверхности глаза по кратчайшей прямой может быть достаточно точно установлено только акустическим методом по расстоянию между генераторным импульсом эхограммы и эхосигналом от инородного тела при контакте излучателя с поверхностью глазного яблока. Акустическое измерение данного
571
расстояния позволяет выяснить, залегает осколок пристеночно в стекловидном теле или он ущемлен в оболочках глаза и каких именно, так как толщина оболочек глаза в месте расположения осколка является частью измеряемой глубины его залегания.
Удаление инородных тел из глаза. При наличии инородных тел в глазу, особенно в случае старой травмы, стекловидное тело может оказаться сильно разжиженным. В связи с этим большое значение приобретает предоперационная подготовка больных: применяют средства для достижения гипотонии глаза, за неделю до операции назначают гемостатические средства.
Магниты, используемые для удаления инородных тел из глаза. В настоящее время используют: 1) постоянные магниты; 2) ручные электромагниты; 3) мощные электромагниты.
Для постоянных магнитов не требуется генератор тока, в этом их преимущество. Самым распространенным является постоянный магнит Бродского — Кальфы. В ряде случаев магнитной силы этого магнита недостаточно для того, чтобы извлечь осколки, ущемленные в оболочках глаза или окруженные соединительнотканной капсулой. Довольно большая масса магнита также создает некоторые трудности во время работы, особенно при длительных манипуляциях в области операционной раны. В связи с этим предложен ряд новых моделей постоянных магнитов. О. А. Джалиашвили (1967) и Ф. Е. Фридманом (1970) разработана модель малогабаритного постоянного магнита.
Масса ручных электромагнитов 2—2,5 кг, они имеют сменные наконечники. Самыми распространенными являются магниты Головина, Поляка, Неустроева. Ручные электромагниты обладают средней мощностью и в этом отношении значительно уступают мощным электромагнитам.
В набор инструментов для удаления инородных тел из глаза, разработанный сотрудниками Научно-исследовательского института хирургической аппаратуры и инструментов совместно со специалистами Научно-исследовательского института глазных болезней им. Гельмгольца, входит постоянный магнит со сменными наконечниками.
В настоящее время лучшим является портативный глазной постоянный магнит из редкоземельных элементов. Его сила достигает 1,5—2 тыс. эрстед при массе 180—250 г (рис. 316).
Удаление инородных тел из роговицы. Для удаления поверхностно расположенных инородных тел из роговицы, кроме широко применяемых игл, плоских и желобоватых долотец, используют различные инструменты (пинцеты и др.). Удаление магнитных инородных тел из роговицы, особенно из ее глубоких слоев, как правило, сопряжено с трудностями и не удается произвести с помощью магнита, поэтому все осколки из роговицы удаляют, как амагнитные.
Общепринятой является методика извлечения осколка из поверхностных слоев роговицы копьем. Эту операцию, как прави-
572
316. Малогабаритный глазной магнит повышенной мощности.
10, выполняют в условиях по-. шклиники. Предложен набор ликроинструментов для удаления инородных тел из роговицы, они имеют предельно малые размеры и меньше травмируют роговицу вокруг инородного тела при его удалении.
Несколько большие трудности представляет извлечение инородных тел из стромы роговицы. Под местной анестезией, лучше под операционным микроскопом или используя операционную щелевую лампу, делают надрез роговицы линейным ножом над местом расположения осколка. Надрез следует производить осторожно, чтобы не протолкнуть осколок в переднюю камеру. При наличии
магнитного осколка к ране подводят магнит. Если инородное тело не удается извлечь магнитом, то его удаляют копьем.
Для удаления инородных тел из роговицы Л. X. Шоттер (1956, 1960, 1979) предложил набор плоских долотец, набор намагниченных долотец, а также долота большего размера для удаления магнитных осколков из передней камеры и прозрачного хрусталика. Инструмент ставят на ранку перпендикулярно к поверхности роговицы и пальцами вращают несколько раз в ту и другую сторону, в результате чего края и дно ранки легко очищаются от инородного тела и окалины. Рабочая часть магнитного инструмента, предложенного Л. X. Шоттером, представляет собой отточенное долотцо с несколько закругленными краями.
И. Н. Шевелев (1957) предложил при удалении магнитных осколков из глубоких слоев роговицы делать разрез специальным ножом с массивной ручкой из мягкого железа. Операцию производят в магнитном поле соленоида, и нож притягивает осколок, не давая ему погрузиться в переднюю камеру.
Особые трудности представляет удаление осколка, который задерживается в задних слоях роговицы и частично выступает в переднюю камеру. В таких случаях можно извлечь инородное тело после предварительно произведенного парацентеза введенным под осколок шпателем. При сильно инфильтрированной ране и значительном выстоянии осколка в переднюю камеру целесообразно удалить его по методу Скрипниченко. У лимба в меридиане от 3 до 6 часов делают разрез конъюнктивы и отсепаровывают ее до лимба. Разрез по лимбу скребцом увеличивают роговичными ножницами от 3 до 9 часов. С помощью шва-держалки следует оттянуть роговицу, осмотреть ее заднюю поверх-
573
317. Удаление немагнитных осколков из роговицы при глубоком проникно^ вении их в переднюю камеру по Шоттеру (схема).
а — в — этапы операции.
ность и удалить инородное тело пинцетом. После этого завязывают предварительно наложенные корнеосклеральные швы. Если после удаления инородного тела из роговицы остается ржавчина, то рекомендуют инстилляции 10% раствора дефероксаминмели-зата.
Для удаления немагнитных осколков из роговицы в случае проникания их глубоко в переднюю камеру Л. X. Шоттер (1978) предложил следующий способ (рис. 317). После предварительного миоза, обычной местной анестезии и наложения двух уздечных швов с помощью роговичной иглы тангенциально проводят супрамидную нить (6 :0) стежком длиной в 2 мм через средние слои роговицы. Шов накладывают в области, близкой к месту залегания осколка, но' периферичнее его. Подтягивая роговицу за оба конца этого шва кверху, хирург другой рукой с помощью копьевидного ножа или бритвенного лезвия вскрывает камеру по лимбу в наиболее близком к осколку меридиане. Величина разреза должна быть достаточной для свободного введения в камеру пинцета (капсульный пинцет Элыпнига или Арруга, анатомический изогнутый пинцет и т. д.), которым осколок захватывают и удаляют (авт. свид. № 914056).
Удаление инородного тела из передней каме-р ы. Наиболее приемлемым методом удаления инородного тела из передней камеры является наружный подход по Гайе. Имеются различные модификации этого подхода, главным образом для удаления амагнитных осколков.
Мы рекомендуем следующую методику удаления инородных тел из угла передней камеры. Перед операцией для максимального сужения зрачка в течение суток больным многократно закапывают 4% раствор пилокарпина. Операцию производят под операционным микроскопом. Перед операцией тщательно изучают местоположение осколка и его подвижность с помощью гониоскопа и щелевой лампы. После акинезии и инфильтрационной анестезии с помощью операционной щелевой лампы или микроскопа уточняют локализацию осколка. В ряде случаев используют го-
574
318. Удаление инородного тела из передней камеры (схема).
а — г — этапы операции.
ниоскоп или гониолипзу. При изменении положения больного осколок может переместиться в передней камере, и в таком случае попытка удалить его, ориентируясь на предполагаемое место расположения осколка, бывает безуспешной.
В том месте, где находится осколок, отступя от лимба 5—6 мм, делают разрез конъюнктивы, которую отсепаровывают до лимба. Скребцом производят склеральный разрез, отступя от лимба 2 мм, и склеру в виде козырька на */з толщины отсепаровывают до лимба. Затем накладывают три—четыре корнеосклеральных шва. Скребцом, используя наружный подход, вскрывают переднюю камеру, разрез увеличивают роговичными ножницами на Vs окружности роговицы (рис. 318, а, б). Разрез делают большим, учитывая возможность инкапсуляции осколка и необходимость удалить его пинцетом. После отведения роговично-склерального лоскута в переднюю камеру вводят магнит и осколок удаляют (рис. 318,в). Если инородное тело не удается извлечь с помощью магнита, то его следует удалить пинцетом (рис. 318, г), иногда с иссечением радужки (если осколок замурован в ней). После извлечения осколка завязывают нити корнеосклеральных швов и накладывают непрерывный шов на конъюнктиву.
Для создания яркого локального холодного освещения при удалении инородных тел из указанных выше областей глаза сконструирован пинцет с вмонтированным в него световодом. Такая конструкция позволяет офтальмохирургу при введении пинцета в переднюю камеру и в стекловидное тело освещать непосредственно область расположения осколка и, следовательно, удаляя, хорошо его видеть. Этому в значительной мере способствует яркое
575
освещение, создаваемое лампой ДРШ-100, которую используют с этой целью. ।
Удаление инородного тела из задней камеру. При наличии в задней камере магнитного инородного тела необходимо сначала сделать попытку провести его через зрачок в переднюю камеру с помощью осторожных манипуляций магнитом. Однако если осколок неправильной формы, с заостренными углами, такие манипуляции могут вызвать травму капсулы хрусталика. В связи с этим при прозрачном хрусталике в месте расположения осколка следует произвести иридэктомию, а затем вывести осколок через колобому магнитом.
Удаление инородного тела из хрусталика. Вопрос относительно тактики офтальмохирурга при удалении инородного тела из прозрачного хрусталика дискутируется до настоящего времени. Существуют различные мнения и относительно способа удаления магнитного осколка из прозрачного хрусталика. Большинство авторов считают правильным передний доступ. При этом рекомендуют выводить осколок в переднюю камеру с помощью магнита, а затем после парацентеза удалять его. Если осколок не прорезает переднюю капсулу хрусталика, то в капсуле следует сделать надрез. В ранние сроки иногда удается вывести осколок через входное отверстие в капсуле. После извлечения осколка разрез в капсуле должен быть прикрыт радужкой, что способствует быстрому закрытию его и предупреждает дальнейшее помутнение хрусталика. Если хрусталик мутный, то инородное тело удаляют вместе с ним.
Ряд авторов рекомендуют диасклеральное удаление магнитного инородного тела из прозрачного хрусталика, но при этом существует опасность выпадения хрусталиковых масс в стекловидное тело, в результате чего создаются дополнительные условия для швартообразования в стекловидном теле и развития осложнений. Железосодержащие осколки из прозрачного хрусталика целесообразно удалять во всех случаях, за редким исключением, даже тогда, когда стекловидное тело и сетчатка длительно остаются интактными. Л. X. Шоттер (1960) с этой целью использует специальное намагниченное долото, подводя его через разрез на периферии роговицы близко к осколку (авт. свид. 107793).
В тех случаях, когда окулист не владеет техникой удаления инородного тела из прозрачного хрусталика, при отсутствии изменений в сетчатке (по данным электрофизиологического исследования) следует временно воздержаться от операции. Haik и соавт. (1970) предлагают следующую методику извлечения инородных тел из хрусталика с помощью криоэкстрактора. Делают корнеосклеральный разрез, затем секторообразную иридотомию над зоной расположения инородного тела, что обеспечивает хороший подход к ране хрусталика. Магнит помещают перпендикулярно к месту расположения инородного тела, для того чтобы попытаться извлечь его. Если инородное тело удается легко удалить, то хрусталик оставляют, если же его невозможно удалить с помо2-
576
I
шью магнита, то производят крио-Якстракцию.
При наличии железосодержащего инородного тела в мутном хрусталике мы производим экстракцию хрусталика вместе с осколком. Для одновременного удаления помутневшего хрусталика с внедрившимся в него магнитным осколком Л. X. Шоттер (1983) предложил криоэкстрактор-магнит. Одновременно примораживая хрусталик и притягивая осколок, инструмент обеспечивает более надежный успех операции.
Удаление магнитных инородных тел из ресничного тела. Обычно операцию производят диасклерально по
319. Клапанный разрез склеры с подшиванием склерального кольца (схема).
известной методике. Имеются,
однако, указания, что осколки из ресничного тела не удается извлечь при длительном пребывании их в глазу и инкапсуляции и что в таких случаях следует попытаться удалить осколок по типу операций извлечения амагпитиых инородных тел.
Для диасклерального удаления слабомагнитных и инкапсулированных „магнитных осколков предлагают делать разрезы различной формы (рис. 319). При выборе техники операции удаления инородного тела учитывают его локализацию в ресничном теле и количество предпринятых ранее попыток извлечь осколок. Если операцию производят впервые и осколок локализуется в плоской, части ресничного тела, то применяют общепринятую технику его
удаления.
При повторной операции, а также при локализации осколка в основной части ресничного тела (до 4 мм от лимба) для его удаления применяют технику извлечения амагнитного инородного тела с использованием модифицированного разреза. Под местной-анестезией 2% раствором новокаина в месте расположения инородного тела делают разрез конъюнктивы, которую затем отсепаровывают от склеры. Здесь же производят Н-образный разрез склеры до сосудистой оболочки, на который накладывают два шелковых шва или более. Этот разрез очень удобен, так как он создает более широкий доступ к осколку. Сначала отсепаровывают один клапан, в дальнейшем, если не удается удалить осколок, отсепаровывают и другой. После удаления осколка, завязав нити предварительно наложенного шва, добиваются быстрой и хорошей герметизации раны. Во время операции ассистент держит швы на весу, с тем чтобы при открытии сосудистой оболочки уменьшить выпадение стекловидного тела. К ране подводят или постоянный магнит, или наконечник соленоида и осколок удаляют, а инкапсулированный осколок извлекают пинцетом. После
37 Руководство по глазной хирургии
577’
удаления осколка завязывают нити предварительно наложенный •склеральных швов, накладывают непрерывный шов на конъюнктиву, вводят антибиотики под конъюнктиву.
В ряде случаев, когда происходит растворение осколка и не удается удалить его с помощью магнита, следует произвести циклэктомию — иссечение участка ресничного тела в месте предполагаемого расположения осколка.
Для удаления инородных тел из ресничного тела и оболочек глаза может быть рекомендована криопексия. Мы совместно с Б. А. Комаровым создали набор криоаппликаторов для удаления опухолей глаза и инородных тел. Техника криопексии заключается в следующем. После обнажения склеры и надреза ее к месту предполагаемого расположения осколка на 30 с прикладывают криоаппликатор. Этого времени достаточно для создания лучших условий для гемостаза. Затем делают Н-образный разрез склеры и извлекают осколок. Наиболее успешной криоэкстракция инородных тел бывает при экспозиции инструмента 3 с. Криоаппликатор хорошо примораживается к инкапсулированному конгломерату осколка, который подтягивают и высекают ножницами.
При удалении инородного тела из ресничного тела следует применять операционный микроскоп, так как с его помощью удается обнаружить очень мелкие инородные тела, а также определить изменение цвета ресничного тела, обусловленное местным сидерозом или халькозом.
Техника удаления инородного тела из ресничного тела с помощью операционного микроскопа такова. Под местной анестезией 1 % раствором новокаина в месте расположения осколка отсепаровывают конъюнктиву. Делают разрез склеры до сосудистой оболочки. С помощью микроскопа изучают состояние ресничного тела, которое расслаивают на участке, где изменена его окраска или имеется выбухание над осколком. При выявлении инородного тела его извлекают.
Удаление осколка из стекловидного тела. Ранее для удаления инородного тела из стекловидного тела использовали «передний путь». Если осколки небольших размеров и правильной формы нередко удается вывести в переднюю камеру без заметных повреждений хрусталика и внутренних оболочек глаза, то выводить осколки их неровной, зазубренной поверхностью несравненно труднее. В большинстве случаев такие осколки прочно внедряются в ресничное тело и в другие ткани глаза, и их не удается вывести в переднюю камеру глаза. После извлечения таких осколков «передним путем» с помощью магнита приходится энуклеировать глаза гораздо чаще, чем при диасклераль-ных операциях, визуальный исход которых значительно более благоприятный [Тихомиров П. Е., 1941].
Сущность диасклерального метода заключается в том, что осколки, расположенные в заднем отделе глаза и в ресничном теле, извлекают через разрез в склере, сделанный в соответствии 578
с) результатами рентгенолокализации (наиболее близко к месту залегания осколка, в месте проекции его на склеру). В «свежих» случаях производят меридиональный или экваториальный разрез склеры в зависимости от расположения осколка по отношению к склере.
До удаления инородного тела обязательно накладывают склеральные швы. К ране подводят магнит и после удаления осколка нити швов завязывают.
Для увеличения подвижности активного полюса гигантского электромагнита Л. X. Шоттер сконструировал специальный наконечник, состоящий из трех частей, соединенных между собою с помощью шарниров. В результате при незначительном уменьшении силы притяжения острие магнита становится подвижным (авт. свид. № 92109).
У тех больных, у которых ранее уже (были предприняты одна или две безуспешные попытки удалить осколок, либо у которых инородное тело было инкапсулировано, следует рекомендовать Н-образный разрез склеры с наложением предварительных склеральных швов (рис. 320, а). Перед удалением осколка производят трансиллюминацию. Если осколок не удается извлечь с помощью магнита (рис. 320,6), то его следует удалять пинцетом (рис. 320, в) или криоаппликатором (рис. 321).
Техника удаления инородного тела из оболочек переднего отдела глаза заключается в проведении разреза склеры над инородным телом после предварительной профилактической диатермокоагуляции склеры. К ране подводят магнит и осколок удаляют. Если инородное тело не удается вывести с помощью магнита, то его удаляют пинцетом или криоаппликатором.
Удаление осколков из оболочек заднего отрезка глаза — одна из труднейших операций. При локализации инородного тела в оболочках заднего отдела глаза, особенно в макулярной и пара-макулярной области, выведение его через склеральный разрез в месте расположения представляет большие трудности (рис. 322). Подход к заднему полюсу глаза возможен, но для этого нужно сделать либо простую орбитотомию, либю операцию типа операции Кронлейна, либо временно отвести веки после проведения дуговых разрезов в наружной трети.
Сторонники удаления внутриглазных осколков «передним путем» применяли эту оперативную методику и при локализации инородных тел у заднего полюса глаза. При мелких или инкапсулированных инородных телах успеха добивались лишь после многократных повторных тракций мощным магнитом, которые повторяли в течение месяца. При безрезультатности подобных манипуляций некоторые авторы рекомендовали производить диа-склеральную операцию с введением внутрь глаза магнитного зонда либо через стекловидное тело, либо через супрахориоидальное пространство до соприкосновения с инородным телом, Так, В. В. Волков (1967) предлагает извлекать магнитные осколки из глаза следующим образом. Под контролем офтальмоскопии через
37
579'
320. Удаление инородного тела из стекловидного тела (схема).
а — створчатый разрез склеры; б — удаление инородного тела магнитом, в — удаление его пинцетом.
разрез в плоской части ресничного тела внутрь глаза вводят удлиненный наконечник постоянного магнита и продвигают до соприкосновения с осколком. Автору удалось извлечь таким образом осколок у ряда больных. Если осколок не спаян с оболочками и сохраняет 'подвижность в задних отделах стекловидного гела, некоторые авторы рекомендуют извлекать его через разрез у зубчатой линии.
Особенно трудно извлечь осколки, внедрившиеся в диск зрительного нерва. Обычно их обнаруживают случайно, как правило, после энуклеации. А. Ф. Савченко (1965) рекомендует в подобных случаях метод Поляка с переводом инородного тела на зубчатую линию. Н. Д. Белозерова (1963) предлагает вводить ретробульбарно 5—6 мл 0,5% раствора новокаина, чтобы добиться
580
321. Диасклеральное удаление инородного тела вместе с рубцовым или экссудативным конгломератом (схема).
322. Схема удаления инородного тела из заднего полюса через плоскую часть ресничного тела при прозрачных оптических средах (схема).
максимального выпячивания глазного яблока, в результате чего создаются лучшие условия для удаления инородного тела из заднего отдела глаза.
Для удаления фиксированных пеофтальмоскопируемых магнитных осколков Л. X. Шоттер (1978) сконструировал сигнальный магнит-зопд. (авт. свид. № 820825). Инструмент работает по принципу гальванического элемента: одним полюсом является железо освобожденного от изоляции острия зонда, другим — цинковая пластинка на руке больного, электролитом — жидкости и ткани организма. Как только осколок прикоснется к острию магнита-зонда, вследствие увеличения поверхности железного электрода (конец зонда + осколок) резко увеличивается сила тока в цепи, о чем свидетельствует движение стрелки микроамперметра и возникновение высокого звука в наушнике. Таким образом можно узнать о притяжении осколка без выполнения излишних манипуляций.
У ряда больных магнитные инородные тела из оболочек заднего отдела глаза удаляются с трудом, и у них могут возникнуть такие серьезные осложнения, как отслойка сетчатки, пререти-нальные кровоизлияния, гемофтальм. В связи с этим неудаленный осколок иногда приносит меньше вреда, чем попытки извлечь его из глаза. Вот почему вопрос о выработке показаний к удалению инородных тел из труднодоступной области по-прежнему остается весьма актуальным.
581
При удалении магнитных инородных тел из оболочек заднего' отдела глаза возникают большие трудности, связанные как со сложностью подхода к осколку в процессе операции, особенно« при локализации его в макулярной и парамакулярной областях, так и с проведением профилактической диатермокоагуляции склеры. При расположении осколка на расстоянии более 20—22 мм от лимба выполнить диатермокоагуляцию практически невозможно, в связи с чем увеличивается вероятность появления, после удаления инородного тела такого грозного осложнения, как отслойка сетчатки.
До последнего времени диатермокоагуляция была единственным способом профилактики отслойки сетчатки при удалении инородных тел из макулярной и парамакулярной областей глаза. В настоящее время с этой целью применяют также фото- и лазер-коагуляцию. С помощью указанных методов можно провести профилактическую коагуляцию сетчатки при удалении как магнитных, так и амагнитных инородных тел из оболочек заднего отдела глаза. Обязательным условием, однако, является наличие прозрачных сред глаза. С целью профилактики отслойки сетчатки вокруг длительно находившегося в глазу инородного тела производят лазер- или фотокоагуляцию. Через П/2—2 нед пытаются перевести инородное тело к зубчатой линии. Если при многочисленных тракциях это не удается, то дальнейшая тактика зависит от результатов электрофизиологических исследований. При отсутствии патологических изменений сетчатки можно воздержаться от попытки удалить осколок, но при условии, если будет осуществляться постоянный контроль за состоянием переднего отдела глаза и сетчатки.
При выявлении начальных изменений сетчатки после обязательного проведения повторной фото- или лазеркоагуляции обычно производят попытку диасклерального удаления осколка, обязательно используя при этом методику уточнения проекции инородного тела на склеру, а также трансиллюминацию. При прогрессировании изменений в переднем отделе глаза и сетчатке показано удаление осколка или диасклерально, или с помощью простой орбитотомии, или по Кронлейну—Головину.
Техника предложенной операции заключается в следующем. После предварительной фото- или лазеркоагуляции производят разрез конъюнктивы в месте расположения осколка. Перерезают ближайшую мышцу, для того чтобы обеспечить хороший подход к месту проекции осколка. Производят экваториальный, меридиональный или Y-образный разрез, обращенный вершиной к роговице. Учитывая, что трудно наложить швы на разрез склеры, произведенный в заднем отделе глаза с помощью обычного иглодержателя с иглой, с этой целью следует использовать иглу с круто изогнутым концом и ушком на конце (модифицированная игла Ома). Этой иглой можно легко провести шелковый шов через склеру в глубине глазницы. Кроме того, при удалении инородных тел из заднего полюса глаза можно использовать зеркальный
582
склероскоп, созданный Ф. Е. Фридманом, или ретрактор со световодом, предложенный Р. А. Гундоровой и А. А. Малаевым, для отодвигания конъюнктивы от места разреза и создания условий для осмотра заднего отдела через зеркало склероскопа.
Для создания лучших условий при операции можно рекомендовать использовать ряд инструментов, применяемых в оториноларингологической практике. Для отодвигания конъюнктивы используют носорасширитель, для проведения разреза и отсепарэв-ки склеры — отоларингологический шпатель.
Особенности удаления из глаза амагнитных инородных тел. При удалении амагнитных тел, особенно из труднодоступных отделов глаза, следует придерживаться показаний, приведенных в предыдущей главе.
Амагнитные инородные тела из передней камеры удаляют пинцетом по описанной выше методике, используя наружный подход. Если осколок инкапсулирован и плотно спаян с радужкой, то его извлекают и одномоментно производят иридэктомию. Можно использовать также криоаппликатор. При удалении амагнитных инородных тел из угла передней камеры следует применять «писанные выше методы корнеосклеральной трепанации и микрохирургический подход.
Техника удаления амагнитного инородного тела из хрусталика общеизвестна: его извлекают вместе с хрусталиком. Лучший метод операции в подобных случаях — интракапсулярная экстракция хрусталика вместе с осколком. Если это невозможно, то рекомендуют извлекать из поврежденного хрусталика амагнитное инородное тело и хрусталиковые массы методом отсасывания с помощью иглы Дефо, насаженной на баллончик, сжимаемый пальцами [Яровой Е. А., 1965].
В. В. Волков и Г. И. Литвинов (1966) предложили оригинальный прием для удаления амагнитного осколка из задней капсулы прозрачного хрусталика. В меридиане залегания осколка концентрично лимбу делают разрез конъюнктивы, отсепаровывают ее до лимба и отводят на роговицу. Далее выкраивают эписклеральный козырек основанием к лимбу. На рану предварительно накладывают три шва. После вскрытия передней камеры в нее через рану вводят изогнутый шпатель, концом которого зрачковый край радужки оттесняют к экватору хрусталика. Шпателем разрывают ресничный полюс. Через рану по подготовленному с помощью шпателя ходу за хрусталик вводят плоскую, с тупыми краями ложечку Давиэля. Под визуальным контролем (через зрачок) ложечкой накрывают инородное тело, фиксированное на задней капсуле хрусталика. Скользящим движением с легким придавливанием ложечки к задней капсуле хрусталика инородное тело, лежащее в ложечке, выводят. Завязывают корнеосклеральные швы.
Извлечение амагнитных инородных тел из ресничного тела представляет особые трудности. Важное значение при этом имеют достаточная величина осколка, пристеночное расположение его
583
и не слишком большое расстояние до осколка от плоскости лимба [Краснов М. Л., 1944]. При диасклеральной операции проводят модифицированный нами Н-образный разрез склеры до сосудистой оболочки, предварительно на края раны накладывают два шелковых шва и более. Инородное тело извлекают пинцетом.
Удаление амагнитных осколков из стекловидного тела—одна из наиболее технически трудно выполнимых операций. Для извлечения амагнитных инородных тел из стекловидного тела предложены следующие методы: 1) различными пинцетами под контролем офтальмоскопа, рентгеноскопии с двумя экранами, диаскле-рального просвечивания; 2) с помощью специального прибора типа цистоскопа; 3) с помощью сигнализирующих приборов.
И. М. Логай (1985) предложил устройство и способ удаления металлических инородных тел из глаза, в основе которого лежит фиксация инородного тела к зонду с помощью точечной электросварки. Устройство содержит два изолированных между собой электрода, электронную схему, обеспечивающую подачу напряжения на электроды для точечной электросварки с металлическим инородным телом, и систему контроля, сигнализирующую о прикреплении инородного тела к зонду в процессе извлечения его из глаза. Способ заключается в том, что делают прокол оболочек глаза в плоской части ресничного тела, в полость глаза вводят наконечник зонда с электродами и подводят его под контролем зрения к инородному телу. При прикосновении к инородному телу двух электродов электрическая цепь замыкается и инородное тело приваривается к электродам, после чего наконечник зонда вместе с инородным телом извлекают из глаза. Лабораторно-экспериментальным путем установлено, что для прочного приваривания металлов различной природы необходимо напряжение на электродах 15—40 В.
Следует выделить две группы больных с травматическими повреждениями глаз, связанными с внедрением а магнитного осколка. Первая группа — больные, у которых ранение глаза с внедрением медьсодержащего инородного тела сопровождалось развитием явлений асептического эндофтальмита или образованием экссудата вокруг осколка. Вторая группа — больные, у которых внедрение осколка в область заднего отдела глаза не сопровождалось бурной реакцией со стороны тканей глаза, в ряде случаев инородное тело было хорошо видно офтальмоскопически и локализовалось предоболочечно или в оболочках.
В первой группе удаление осколка показано во всех случаях. У некоторых больных второй группы могут возникнуть сомнения в целесообразности удаления инородного тела, так как известно» что попытка удалить осколок может вызвать более грубые изменения в глазу (отслойка сетчатки, кровоизлияние), чем оставленное в глазу инородное тело. Критерием при установлении показаний к удалению амагнитных инородных тел являются характер металла (его химическая активность), локализация осколка, изменения переднего отдела глаза, стекловидного тела и сетчатки, 584
характерные для халькоза, и степень выраженности этих признаков.
Техника удаления амагнитного осколка из стекловидного тела заключается в следующем. В месте проекции инородного тела на склеру делают П-образный или Н-образный разрез, на который предварительно накладывают склеральные швы. Склеру отсепаровывают до сосудистой оболочки. Последнюю осторожно расслаивают шпателем, повторно проводят трансиллюминацию и пинцетом удаляют инородное тело. Если приходится вскрывать сосудистую оболочку, то для уточнения местоположения инородного тела вновь производят трансиллюминацию с помощью диафаноскопа.
После удаления осколка завязывают нити склеральных швов, накладывают непрерывный шов на конъюнктиву, вводят антибиотики под конъюнктиву.
Удаление амагнитного инородного тела можно проводить под контролем трансиллюминации и в тех случаях, когда уже произошло выпадение стекловидного тела. Использование трансиллюминации в процессе удаления амагнитного инородного тела позволяет извлечь его в большинстве случаев.
Л. X. Шоттер (1960) сконструировал новый инструмент для осмотра полости глаза и манипуляций в нем — диасклеральную или эндоскопическую лупу. Аппарат предназначен для удаления амагнитных осколков из стекловидного тела при расположении их далеко от оболочек глаза и полости лимба.
Кроме того, Л. X. Шоттером предложен инструмент, служащий для удаления инородного тела из полости глаза. Конструкция инструмента такова. Бранши пинцета находятся в трубочке диаметром около 1 мм. Трубочка, которая соединена шарниром с кольцом рукоятки, опускаясь, сжимает бранши инструмента. Бранши соединены с цилиндрическим корпусом рукоятки инструмента жестко, поэтому при движении кольца рукоятки трубочка поднимается и опускается, а бранши остаются на месте. Этим инструмент отличается от других «трубочных» пинцетов (авт. свид. 131116).
Для наблюдения в полости глазного яблока с целью удаления неофтальмоскопируемых амагнитных осколков Л. X. Шоттер и А. В. Панов предложили специальные приспособления — аппла-наторы, которые представляют собой плоскопараллельные пластинки из светопроникающего материала, снабженные рукояткой. В наборе несколько аппланаторов ланцетовидной круглой формы, отличающиеся размерами. Вставленный в разрез оболочек или в зрачок при операции «открытого неба» аппланатор значительно улучшает видимость в полости глаза вследствие уплощения поверхности стекловидного тела. Для введения захватывающих инструментов на аппланаторах имеются вырезы (авт. свид. 1017284).
Отслойка сетчатки развивается одинаково часто как при проведении профилактической коагуляции, так и без нее. При разработке мер борьбы с отслойкой при удалении инородных тел
585
необходимо учитывать имеющиеся изменения в стекловидном теле и сетчатке, возможность их возникновения в процессе операции и в послеоперационном периоде, локализацию осколка, повторность вмешательства.
Энуклеация глаза и глазное протезирование
При ранении глаза в отдельных случаях производят энуклеацию. Удаление глаза осуществляют также в связи с опухолевым процессом в нем и по другим показаниям. Эта операция влечет за собой протезирование.
Протезирование глаза имеет огромное психологическое и косметическое значение. Ношение глазного протеза имеет также лечебно-профилактическое значение. Протез защищает культю энуклеированного глаза от раздражающего действия ветра, холода, пыли. При длительном отсутствии его верхнее веко вследствие развивающейся атонии опускается. Смещение сводов и слезных точек ведет к постоянному скоплению слезы, слезотечению и раздражению век, в результате чего развивается конъюнктивит, плохо поддающийся лечению. Если после энуклеации, особенно в детском возрасте, не пользоваться протезом, полость глазницы отстает в развитии, возникает асимметрия лица, и в дальнейшем затрудняется подбор протеза.
К первичной энуклеации следует относиться, как правило, отрицательно. При любой самой тяжелой травме глаза с выпадением оболочек необходимо прежде всего произвести обработку раны. Это имеет большое психологическое значение: больной знает, что врач сделал все необходимое для сохранения глаза. Кроме того, клинический опыт показывает, что с помощью обработки казалось бы безнадежных глаз и последующего лечения в ряде случаев удается сохранить глаз и даже частично восстановить зрение. Показаниями к энуклеации глаза после проникающего ранения являются травматический иридоциклит, гипотония, све-тоощущение с неправильной проекцией света или слепота. Наличие светоощущения с правильной проекцией света служит противопоказанием К удалению глаза. Энуклеации подлежат глаза с иноперабельной опухолью, тяжелым инфекционным и послеоперационным иридоциклитом, с абсолютной болящей глаукомой.
В ряде случаев ставится вопрос об удалении атрофированного или субатрофированного глаза перед последующим протезированием. В случае желания больного носить протез удалять атрофичный или субатрофичный глаз следует лишь в случаях травмы ресничного тела в анамнезе, при наличии прозрачной роговицы и при постоянном или частом раздражении этого глаза. В других случаях от удаления глаза следует Воздержаться, так как такой глаз является хорошей опорой для протеза.
Для надлежащего протезирования необходимо, чтобы после удаления глазного яблока культя была соответствующих размеров, контуры века были нормальные, глазная полость имела 586
хорошо выраженные своды, без воспалительных процессов, без спаек, сращений век. Улучшить косметические результаты протезирования стремятся с помощью пластики конъюнктивальной или склеральной полости после энуклеации и эвисцерации. В зависимости от пересаживаемого материала различают: аутопластику, аллопластику, ксенопластику и эксплантацию.
Было предложено имплантировать в полость влагалища глазного яблока жировую клетчатку, кожу с подкожной жировой клетчаткой, полоску жировой фасции бедра, аутохрящ.
Аллопластика. Поскольку применение аутопластических методов формирования культи было сопряжено с дополнительной травмой и не всегда давало нужный косметический результат, некоторые офтальмохирурги стали производить аллопластику. Из аллотканей наибольшее распространение и признание получил хрящ. Его широко используют для пластики культи и в настоящее время. Для создания более объемной культи вместо плоско-выпуклой хрящевой пластинки Д. Г. Свердлов (1954) предложил вводить в полость влагалища глазного яблока размельченный хрящ (фарш), а Л. М. Бакин (1962) сконструировал специальный шприц для его введения. Существует много способов консервации аллохряща. Ксенопластика не нашла распространения.
Эксплантация. В последнее время в связи с развитием химии высокомолекулярных соединений для изготовления имплантатов широко применяют различные пластмассы. Имплантаты из пластмасс нередко полностью или частично покрывают металлической сеткой из стойкого и инертного металла (нержавеющая сталь, тантал, золото). В зависимости от степени погружения во влагалище глазного яблока или склеру различают две основные группы имплантатов: погружные, которые полностью покрыты тканями, и полупогружпые, или «интегрированные», частично покрытые тканями и соединенные с протезом системой штифт — канал. Для изготовления погружных вкладышей используют различные пластмассы.
Для целей восстановительной хирургии в офтальмологии широко применяют полиметил-метакрилат (плексиглас, циакрил, люцит). Низкая плотность (1,2), прочность, стойкость к действию щелочей и кислот, хорошая способность к формообразованию являются достоинствами отечественной пластмассы эгмасс-12. Плосковыпуклые перфорированные имплантаты из этой пластмассы, а также вкладыши в форме контактных линз применял для пластики культи после энуклеации Д. Г. Свердлов (1955), который впервые в нашей стране использовал пластмассовый имплантат для формирования объемной культи после энуклеации. Созданная на базе акриловых смол другая отечественная пластмасса — АКР-7 — имеет высокие качества как пластический материал. Небольшая относительная плотность, достаточно высокая механическая прочность, индифферентность пластмассы способствовали ее применению для изготовления различных видов зубных, челюстно-лицевых п глазных протезов [Ревзин И. И., 1956].
587
323. Энуклеация глазного яблока (схема).
а — разрез и отсепаропка конъюнктивы; б — перерезка сухожилия мышц; в — пересечение зрительного нерва; г — наложение кисетного шва.
Для имплантации предлагают использовать также стиракрил, силикон и др.
Некоторые авторы имплантатам из твердых пластмасс предпочитают мягкие пористые вкладыши из губчатых полимеров и синтетических нитей. Низкая относительная плотность, наличие пор, в которые врастает соединительная ткань, создают хорошие предпосылки для вживления таких имплантатов. Вкладыши из губчатых полимеров легко моделируются. Вместе с тем такого типа пластмассы подвергаются частичной или даже полной резорбции, что существенно влияет на объем послеоперационной культи и косметичность протеза.
Энуклеацию глазного яблока производят по общепринятой методике. В последние годы она несколько изменена в-связи с предположениями использовать для формирования культи после энуклеации различные аллопластические и эксплантационные материалы.
Осуществляют инфильтрационную и проводниковую (ретробульбарную) анестезию. После того как будет вставлен векорас-ширитель, захватывают конъюнктиву пинцетом на расстоянии 2— 3 мм от лимба и надрезают ее ножницами Стивенса по всей
588
окружности роговицы (рис. 323, а). При проникающей ране глазного яблока для облегчения выполнения операции ее зашивают. Техника энуклеации при размозжении глазного яблока описана ниже. Поскольку от размеров конъюнктивального мешка зависит подвижность протеза, конъюнктиву надрезают у самого лимба. Затем конъюнктиву и влагалище глазного яблока полностью отсепаровывают от склеры по всей окружности и кзади от места прикрепления сухожилий прямых мышц. Если операцию производят по поводу злокачественной опухоли, то нужно удалить всю новообразованную ткань. При старых ранениях часто имеются сращения конъюнктивы со склерой, которые необходимо иссечь. Перед отсечением мышц на сухожилия накладывают швы.
Конец мышечного крючка заводят за сухожилие внутренней прямой мышцы в месте его прикрепления к склере. Ассистент сильно натягивает сухожилие крючком, а хирург захватывает пинцетом один из краев сухожилия около склеры.
Хирург отсекает сухожилие от глазного яблока (рис. 323,6), оставив на сухожилии полоску; отсечение можно произвести ножом Бард-Паркера (лезвие № 15), остроконечными ножницами или ножом Джонсона для энуклеации. Межмышечную оболочку, которую разрезают при рецессиях, отделять от мышцы при энуклеации нет надобности. Затем мышечный крючок вводят между склерой и влагалищем глазного яблока в нижненосовом квадранте, проводят его в латеральном направлении и книзу, для того чтобы захватить сухожилие нижней прямой мышцы. Это сухожилие с полоской склеры отделяют от глазного яблока так же как и сухожилия внутренней прямой мышцы; точно такую же манипуляцию проделывают сначала с сухожилиями наружной прямой, а затем верхней прямой мышцы. Для того чтобы при отсепаровывании верхней прямой мышцы не затронуть верхнюю косую мышцу, мышечный крючок вводят с височной стороны, что позволит захватить только сухожилие прямой мышцы.
До отсечения верхней прямой мышцы от глазного яблока ее оболочка должна быть полностью отделена от фасции, соединяющей мышцу с верхней косой мышцей. Для захватывания сухожилия верхней косой мышцы мышечный крючок проводят между склерой и влагалищем глазного яблока в верхненазальном квадранте и направляют латеральнее. Сухожилие оттягивают кпереди,, отделяют его от фасции, соединенной с сухожилием верхней прямой мышцы, и Отсекают от глазного яблока. Нижнюю косую мышцу отрезают, повернув глазное яблоко в медиальном направлении, для этого мышечный крючок подводят под сухожилие и отсекают его у склеры. Глазное яблоко вытягивают кпереди, слегка сблизив щечки векорасширителя позади яблока либо потянув, яблоко универсальным пинцетом или крючком для склеры.
Для того чтобы добиться скорейшей остановки кровотечения, зрительный нерв до неврэктомии на несколько минут сдавливают изогнутым гемостатом. Затем с медиальной или латеральной стороны на глаз заводят бранши энуклеационных ножниц, нащупы-
589
324. Ножницы Миминошвили для энуклеации.
вают нерв и «сажают на нега верхом» бранши ножниц. Подтягивая глазное яблоко кпереди, бранши ножниц слегка отодвигают в глубину глазницы и пересекают нерв на расстоянии 3—4 мм кзади от яблока (рис. 323,в). Можно использовать предложенные для этой цели ножницы Миминошвили (см. рис. 324). Яблоко вытягивают и рассекают все соединительнотканные тяжи. Мероприятия по остановке кровотечения описаны выше. Если кровотечение продолжается, то нужно оказать легкое давление марлевым тампоном. Кровотечение должно быть полностью ликвидировано до зашивания влагалища глазного яблока или введения имплантата.
В полость вкладывают имплантат. Можно наложить кисетный шов (рис. 323,г). Существуют различные методы укрепления имплантата. Для более надежного вживления имплантата при энуклеации Л. X. Шоттер (1968) рекомендует после прикрепления к имплантату прямых мышц наложить трехъярусные швы: кисетный кетгутовый на влагалище глазного яблока, такой же на субконъюнктиву и шелковый горизонтальный на конъюнктиву. Лучшая подвижность протеза достигается в случае выстояния вперед плоской поверхности протеза.
Погружные имплантаты полностью закрываются влагалищем глазного яблока и конъюнктивой и непосредственно контакта с протезом не имеют. Простые погружные сферические имплантаты не имеют приспособлений для фиксации прямых мышц, поэтому сразу после энуклеации их вкладывают во влагалище глазного яблока и покрывают тканями глазницы.
Конструкция погружных подвижных имплантатов предусматривает специальные приспособления для прохождения или фиксации прямых мышц, что создает дополнительный рычаг для движения протеза. Чаще других с этой целью используют туннельный имплантат, который имеет специальные каналы для прохождения прямых мышц. Для лучшей имитации глаза за счет создания микродвижений протеза рекомендуется брать на швы и косые мышцы, а затем подшивать их к сформированной культе или имплантату.
Считают, что при выборе имплантата нужно учитывать контуры лица в области глаза. Для получения выпячивающегося или
590
экзофтальмированного глаза рекомендуется брать шарик диаметром 18 мм, среднего глаза — 17 мм, глубоко расположенного глаза — 16 мм. Диаметр вторично пересаживаемого имплантата должен составлять 14—15 мм. Лучшими являются сферические имплантаты, так как при последующем протезировании края протеза могут быть тонкими и удлиненными, благодаря чему они не видны даже при (сильном повороте протеза.
Вторичная и отсроченная имплантация а л л о-пластических материалов в глазницу. Имплантат может быть введен в полость орбиты в отдаленные сроки после энуклеации (отсроченная, или поздняя, имплантация). Введение имплантата взамен выпавшего или выталкиваемого первичного вкладыша называют вторичной имплантацией. Диаметр имплантатов, применяемых при вторичной и отсроченной имплантации, несколько меньше, чем первичных,— 12—17 мм. Аутопластические материалы для вторичной или отсроченной имплантации в глазницу при анофтальме в настоящее время не применяются. Из алло- и ксенотканей с этой целью используют лишь хрящ [Зайкова М. В., 1961, 1965; Стародубцева Е. И., 1968]. Чаще для отсроченной имплантации применяют сферические пластмассовые вкладыши из полиметилметакрилата, АКР-7 и др. Для отсроченной и вторичной имплантации в глазницу применяют различные конструкции погружных имплантатов, а также магнитные имплантаты.
При выполнении отсроченной имплантации существует три способа помещения пластического материала в полость глазницы: в мышечную воронку посредством разреза конъюнктивы и обоих листков влагалища глазного яблока; в отсепарованную полость влагалища глазного яблока; в образованный подслизистый карман.
Эвисцерация (экзентерация) глазного ябло-к а. Эвисцерацию глазного яблока производят при цанофтальми-те, буфтальме, на ослепших глазах (но не вследствие травмы). Нужно помнить, что эвисцерация’ глазного яблока при травматических иридоциклитах не предупреждает развития симпатического воспаления, поэтому производить ее в этих случаях нельзя. Эта операция противопоказана при подозрении на внутриглазную опухоль.
Производят ретробульбарную анестезию (при панофтальмите иглу вводят через кожу нижнего века). Конъюнктиву глазного яблока рассекают ножницами вокруг лимба и отсепаровывают от склеры на 1 —1,5 см. Ножом Грефе делают вкол на 1 мм кнаружи от лимба, на противоположном участке — выкол; отрезают всю верхнюю половину роговицы, затем ножницами отрезают нижнюю половину. После этого ложечкой Бунге отслаивают от склеры ткань сосудистого тракта и удаляют вместе с содержимым глазного яблока.
Края отверстия в склере надсекают в четырех косых меридианах на глубину 1 см. На конъюнктиву накладывают кисетный
591
а б
325. Создание конъюнктивальной полости по Шоттеру (схема).
а — кожный лоскут; б — глаз после операции.
шов. Если операцию производят по поводу панофталь-мита, то не следует отсепаро-вывать конъюнктиву склеры и делать насечки на склере.
В тех случаях, когда конъюнктивальная полость оказывается недостаточной для помещения протеза, показано ее увеличение. Для этого применяют пластику кожными лоскутами на ножке, а также свободными лоскутами слизистой оболочки или кожи. Можно также увеличить полость, растягивая ее
бескровным путем с помощью расширителей или с нанесением разрезов.
В случае анофтальма и полного отсутствия конъюнктивальной полости Л. X. Шоттер (1966, 1977) покрывает создаваемую новую полость свободным кожным лоскутом особой формы (рис. 325), который, складываясь, хорошо выстилает полость в соответствии о помещаемым в нее протезом.
Для некровавого увеличения равномерно недостаточной конъюнктивальной полости путем постепенного растяжения слизистой оболочки Л. X. Шоттер (1960) применяет сконструированный им расширитель. Инструмент состоит из Двух дугообразных половинок, снабженных лево- и правосторонним винтом и соединенных между собой удлиненной стяжной гайкой (рис. 326). Поворачивая гайку специальным ключом, можно постепенно увеличить длину инструмента на 10 мм, используя же в случае необходимо
326. Расширитель для бескровного увеличения конъюнктивальной полости по Шоттеру.
1 — в закрытом виде; б — в открытом; в — ключ для вращения винта.
сти добавочные приставные губки — еще на 10 мм. Расширитель помещают в конъюнктивальную полость в суженном виде (иногда вначале возникает необходимость во временном сшивании век между собой). В дальнейшем постепенно, день за днем больной сам увеличивает ширину инструмента, до тех пор пока не окажется возможным протезирова
ние.
Л. X. Шоттер и А. В. Герасимова (1975) предложили специальное приспо-
592
собленис с целью формирования недостаточной для протезирования конъюнктивальной полости путем постепенно-ступенчатого растяжения ее в сочетании с насечками, а также для выполнения операций с пересадкой лоскутов слизистой оболочки или кожи. Набор состоит из собственно расширителей в виде олив различной величины, соединенных с помощью вынесенной вперед уплощенной ножии с опорной пластиной. Повязка надежно удерживает расширители в полости. Приспособление изготовлено из оргстекла и отшлифовано. Прозрачная ножка, служащая также световодом, позволяет наблюдать за состоянием полости без удаления расширителя (авт. свид. 625760).
Л. X. Шоттер (1968) совместно с А. В. Герасимовой разработали простой и эффективный способ исправления западения верхнего века при анофтальме. Консервированный трупный хрящ, измельченный на терке, смачивают раствором пенициллина до консистенции кашицы и с помощью револьверного шприца (модель Проскурякова) вводят под кожу в области орбитопальпебральной борозды. Для равномерного выполнения борозды хрящ следует вводить в виде двух—четырех горизонтальных столбиков, разминая и формируя их пальцем через кожу.
В. А. Гречушкина и М. М. Амирбегишнили (1983) использовали пасту, приготовленную путем растирания реберного консервированного хряща трупа или плода на напильнике из титана или нержавеющей стали, вводя ее в культю после энуклеации с помощью шприца с иглой диаметром 2 мм. Метод позволяет добиться стойкого увеличения размеров культи, в результате чего улучшаются условия протезирования.
Хирургическое лечение при повреждениях глазницы
Травмы могут быть изолированными или сочетаться с повреждением головного мозга и околоносовых пазух. В связи с разнообразием механизма травмы могут возникать контузии глазницы, открытые повреждения мягких тканей глазницы, переломы костных стенок, внедрение в полость глазницы инородных тел.
Контузии глазницы не имеют тяжелых последствий. Гематома рассасывается после наложения плотной повязки и прикладывания холода на поврежденную глазницу на 3—4 ч, назначения курса гемостатической терапии. Вскрытие гематомы целесообразно при обнаружении признаков ее отграничения. Его производят вдали от плотных орбитальных структур, например, слезной железы.
Переломы глазницы — нарушение целости ее костной конструкции — могут быть разрывными (внутренние орбитальные переломы) с сохранением или нарушением целости края глазницы. Нередко ранения глазницы сопровождаются внедрением в ее полость инородных тел (рис. 327, 328).
38 Руководство по глазной хирургии
593
327. Разрывной перелом наружной стенки глазницы с нарушением целости ее края (схема).
328. Расположение деревянного инородного тела в глазнице. Входное отверстие под верхним краем глазницы во внутренней трети верхнего века (схе-ма).
а — вид спереди; б — вид сбоку.
Хирургическая обработка мягких тканей глазницы. Первичная обработка рваных мягких тканей глазницы состоит в экономном иссечении загрязненных краев раны в пределах 0,5—1 мм, иногда можно ограничиться их подравниванием. Раневой канал промы-I вают раствором фурацилина, этакридина лактата или диоксидина.
i При наличии показаний следует произвести пластику ран мест-
ными тканями.
Пластика мышцы, поднимающей верхнее веко, состоит в соединении его разорванных краев кетгутовым или биологическими швами, соединении с хрящем и конъюнктивой. Такие же швы накладывают на рану тарзоорбитальной фасции и круговой мышцы век. Выпавшую слезную железу предварительно промывают антисептическим раствором и вправляют в слезную ямку. На рану кожи накладывают шелковые швы.
Отличительным свойством колотых ран является наличие экзофтальма, офтальмоплегии и опущения верхнего века, что свидетельствует о глубоком распространении раневого канала, । поражении нервных стволов и сосудов у вершин глазницы раня-
' щим предметом. Одним из факторов, определяющих тяжесть ко-
। лотых ран, является повреждение зрительного нерва.
‘ Тактика в отношении колотых ран мягких тканей глазницы
J аналогична той, которую применяют при любых колотых ранах.
; Производят тщательную ревизию раневого канала и первичную
1 хирургическую обработку. Мягкие ткани рассекают на протяже-
ч нии 2—2,5 см, раневой канал исследуют осторожно с соблюдени-
? I ем принципа максимального щажения мышцы, поднимающей
j верхнее веко, наружных мышц глаза, сосудов, нервов.
j Исключив проникновение раневого канала в полость черепа
594
или околоносовые пазухи, а также наличие инородного Тела в глазнице, на рану накладывают швы. Раны кожи век при отсутствии явных признаков воспаления зашивают наглухо. Возможность наложения швов на ткани лица в пределах 36—46 ч после ранения доказана на опыте лечения ран в годы Великой Отечественной войны.
Хирургическая обработка при повреждении костей глазницы. Богатое кровоснабжение параорбитальной области и мягких тканей глазницы, редко встречающаяся анаэробная инфекция при ранениях челюстно-лицевой области создают благоприятные условия для раннего хирургического лечения переломов костных стенок глазницы. Восстановление целости костной стенки, так же как и замещение ее дефектов, рекомендуется производить в максимально ранние сроки — через 24—48 ч, так как в отдаленные сроки после повреждений кожных стенок глазницы развиваются грубые рубцовые изменения, приводящие к смещению глазного яблока и резкому ограничению его подвижности.
Хирургические вмешательства при повреждении глазницы желательно производить под интубационным наркозом. Положение больного — на спине, лицо полностью открыто, чтобы хирург во время операции мог следить за соответствием средней линии лица средней линии тела. Это особенно важно при восстановительных операциях.
Обработку раны глазницы начинают с ее послойного расширения и углубления, остановки кровотечения. Нежизнеспособные края раны иссекают очень экономно. Свободно лежащие костные осколки, так же как и костные осколки, вдавленные в мягкие ткани, визуально определяемые инородные тела немедленно удаляют. Для репозиции смещенных участков кости применяют поднадкостничный подход к зоне поражения. Первоначально производят попытку ронопировать кости и фиксировать осколки с помощью капроновых швов, проведенных через края неповрежденной предварительно отсепаровапной надкостницы. Острые, полу-фиксированные участки кости следует скусить кусачками.
Костные дефекты в стенке, костные края восстанавливают с помощью различных имплантатов: ксено- и алло-хряща, аллогенной или ксеногенной кости, эксплантационных материалов — стер-акрила, тефлона, полиэтилена, полиуретана, танталовой фольги или пластинки, серебряной проволоки (рис. 329). Выбор материала для имплантата зависит от места повреждения. Так, при замещении дефекта в верхней стенке глазницы лучшие результаты получены при использовании костных или стеракриловых имплантатов. Отсутствие костного края, дефект во внутренней стенке с успехом ликвидируют с помощью хрящевого имплантата. Диапазон выбора материала для восстановительных хирургических вмешательств на нижней стенке весьма широк.
Не менее важен выбор метода операции. При комбинированных переломах необходимо участие в операции офтальмолога, стоматолога и нейрохирурга. Ревизию зоны повреждения в верх-
38*
595
329. Замещения дефекта в нижней стенке глазницы аллотрансплантатом (схема).
ней стенке глазницы и восстановление ее целости может проводить как офтальмохирург (верхняя поднадкостничная орбитотомия), так и нейрохирург (транскраниальное вмешательство), особенно если участок повреждения расположен ближе к вершине глазницы. Целесообразно, чтобы восстановление целости внутренней стенки глазницы производил офтальмохирург (внутренняя поднадкостничная орбитотомия). Во время операции нужно стремиться восстановить и укрепить блок при его сохранности, произвести удаление свободно лежащих костных осколков (опасность ранения внутренней прямой и верхней косой мышц). При повреждении нижней стенки может быть использована нижняя поднад-
костничная орбитотомия или антро-томия (подход через верхнюю челюстную пазуху).
При первичной хирургической обработке открытого перелома
нижней стенки глазницы иссекают нежизнеспособные участки
краев раны и выпавшую загрязненную глазничную подкожную жировую клетчатку. Свободно лежащие костные фрагменты удаляют. На края костных фрагментов, держащихся на надкостнице, накладывают швы для сохранения формы края нижней стенки глазницы.
Тарзоорбитальную фасцию кетгутовыми швами соединяют с надкостницей нижней стенки глазницы. На конъюнктиву нижнего века и свода накладывают шелковые швы. Производят блефарорафию.
При больших (более 2 см) дефектах кости вопросы о замещении их пластическим материалом, создании соустья между верхнечелюстной пазухой и носом решают совместно со стоматологом и с оториноларингологом. Смещенный слезный мешок перемещают к слезной кости, укрепляют кетгутовыми швами, наложенными на его фасцию в верхней и средней частях надкост-
ницы.
Хирургическое лечение переломов наружной стенки находится полностью в компетенции офтальмохирурга. Основным видом хирургического вмешательства при этом является наружная поднадкостничная орбитотомия. Поскольку во время операции важно провести ревизию нижненаружного угла глазницы, можно применить либо дугообразный разрез кожи по Головину, либо транспальпебральный подход. При первичной хирургической обработке освобождают ущемленную между костными фрагментами наружную прямую мышцу.
596
Наличие признаков ранения канала зрительного нерва является показанием к срочному направлению больного в нейрохирургическое отделение, так как своевременное вмешательство — удаление костных осколков и освобождение ущемленного зрительного нерва —в большинстве случаев позволяет сохранить зрение.
Хирургическая обработка раны при размозжении глазного яблока. Размозжения глазного яблока возникают при огнестрельных ранениях глазницы в сагиттальном, сагиттально-косом и поперечном направлениях, при панесении сильного удара предметом, размеры которого близки размерам глазницы или превосходят их. В первые часы или даже сутки диагностика размозжения глаза не представляет трудностей: в складке отечной конъюнктивы обнаруживают спавшееся глазное яблоко с ущемленными обрывками его тканей. Более трудна диагностика обширных за-экваториальных ранений, возникающих при поперечно-височном направлении удара ранящего предмета. В предэкваториальной зоне при этом обращают на себя внимание форма глаза (незначительное сплющивание его по вертикали), необычная глубина передней камеры и резкая гипотония. Окончательный диагноз устанавливают на операции после отсепаровки конъюнктивы и ревизии заднего отдела глаза.
Техника хирургической обработки при размозжении глазного яблока в преэкваториаль-ной зоне. Убирают свободно лежащие обрывки оболочек глаза. Края зияющей рапы (роговица, участки лимба) прошивают шелковыми швами-держалками либо фиксируют кровоостанавливающими зажимами. Конъюнктиву и влагалище глазного яблока следует отсепаровать особенно тщательно, пересечь прямые мышцы. Перед неврэктомией культю глаза швами-держалками подтягивают кверху, а энуклеациоппые ножницы, наоборот, смещают максимально кзади. Перед энуклеацией можно восстановить форму глазного яблока, набив его марлей [Чутко М. Б., 1941] или полиэтиленовой губкой и сшив края раны.
Техника хирургической обработки при размозжении глазного яблока в заэкваториаль-ной зоне. В этом случае техника более трудна. Так же как и в предыдущем случае, необходимо тщательно отсепаровать конъюнктиву от всех участков глазного яблока. Подлежат удалению все свободные кусочки тканей глаза. Потягивая за сохранившиеся мышцы, отыскивают и берут на зажим зрительный нерв. При отрыве зрительного нерва и наличии на нем остатков склеры проводят неврэкто'мию вместе с участком склеры. Осуществляют гемостаз. Накладывать швы на конъюнктиву, так же как и вводить одновременно имплантаты, во избежание поздней инфекции не рекомендуется [Поляк Б. Л., 1951]. Однако разрывы конъюнктивы по периферии нужно ушить. По окончании указанной обработки можно переходить к обработке других тканей глазницы.
Показания и техника удаления инородных тел из глазницы. Вопросы о необходимости хирургического
597
вмешательства и о методе операции решают в зависимости от характера, размеров и локализации инородного тела.
Безотлагательно удаляют костные осколки, инородные тела, локализующиеся под верхней орбитальной стенкой и у вершины глазницы. Более безопасным при этом некоторые авторы считают транскраниальный подход. Внедрившееся глубоко в глазницу деревянное инородное тело не следует удалять через раневой ход. Такие попытки приводят, как правило, к частичному извлечению отдельных кусков инородного тела [Луцкевич Я. И., 1971]. Увеличение сроков пребывания куска дерева в глазнице может привести к тяжелым осложнениям.
Сложность проведения операции при наличии внутри глазницы деревянных инородных тел заключается, во-первых, в отсутствии в ряде случаев данных о точной локализации осколков; во-вторых, в частом расположении инородного тела в противоположном по отношению к входному отверстию квадранте глазницы, что вызывает технические трудности в проведении разреза по раневому каналу; в-третьих, в близком расположении от зрительного нерва, в результате чего возможна травматизация зрительного нерва с потерей зрения; в-четвертых, наличие нескольких мелких инородных тел, кроме основного, в связи с чем извлечение большого инородного тела не приводит к ликвидации воспалительного процесса.
Следует отметить, что ранение глазницы и внедрение инородного тела большей частью происходит через своды глазницы — инородное тело проходит по касательной к глазному яблоку через конъюнктиву в глазницу. Входное отверстие, как правило, находится в конъюнктивальном своде во внутренней или наружной его части, из которой выделяется гной, и оно часто окружено грануляциями.
Существуют различные методы удаления инородных тел из глазницы. Для уточнения места расположения инородного тела в глазнице производят орбитотомию в зоне локализации осколка; послойно разделяют ткани и осторожно подходят к инородному телу. При этом, если прощупывается конгломерат соединительной ткани, окружающий осколок, следует выделить его и удалить с капсулой одним блоком, так как при выделении инородное тело может разделиться на мелкие куски. После извлечения осколка следует произвести тщательную ревизию того места, где было выполнено вмешательство, и удалить все мелкие инородные тела.
В случае расположения инородного тела вблизи от входного отверстия проводят разрез по фистуле с предварительным введением контрастного вещества. При локализации инородного тела глубоко в глазнице у зрительного нерва может быть использован костно-пластический подход к глазнице. Следует помнить, что при продолжительном пребывании в глазнице деревянный обломок распадается на мелкие куски, что затрудняет его полное извлечение; ревизию раневого канала в этом случае следует произвести особенно тщательно. В рану засыпают порошок сульфацил-натрия.
593
На поврежденное влагалище глазного яблока накладывают кетгутовые швы, на конъюнктиву — непрерывный шов, на кожу — внутрикожный или узловые швы. В рану на 1—2 сут вводят резиновый дренаж.
Что касается металлических инородных тел глазницы, то в настоящее время общепризнанным является следующее правило: инородные тела, не вызывающие воспаления, могут быть оставлены в глазнице. Крупные осколки следует удалять, так как они создают опасность механического повреждения глазного яблока, зрительного нерва, сосудисто-мышечного пучка. Особенно это касается инородных тел с зазубренными острыми краями. Обязательно удаляют инородные тела, внедрившиеся в одну из стенок глазницы.
Нередко трудно уточнить локализацию инородного тела в глазнице, но, пожалуй, еще труднее выбрать подход к нему. Только транскраниальный подход дает возможность не только удалить инородное тело, но и произвести тщательную ревизию полости черепа в области ранения, поэтому главную роль в данной операции играет нейрохирург.
Инородные тела, проникающие частично в одну из пазух, удаляют с помощью поднадкостничной орбитотомии. Гораздо сложнее вопрос об удалении инородных тел, расположенных в ретробульбарном пространстве. В первые часы после травмы можно использовать раневой капал, вводя наконечник магнита глубоко в рану. Подобная попытка оказывается эффективной, если инородное тело небольших размеров находится в самом канале. При больших осколках подход к ним лучше осуществлять одним из методов наднадкостничной орбитотомии. При расположении инородного тела у вершины глазницы целесообразно выполнить костно-пластическую орбитотомию и подвести наконечник магнита или фиксационного пинцета к осколку.
Опыт отечественных офтальмологов в период Великой Отечественной войны свидетельствует о том, что упорные попытки извлечь инородное тело, как правило, заканчивались успехом [Страхов В. П., Бочевер Е. М., 1947; Барбель И. Э., 1951].
Хирургическое лечение травматического остеомиелита. В дифференциальной диагностике травматического остеомиелита и некроза костного осколка основными являются рентгенологические признаки. Для первого характерно наличие на рентгенограммах участка разряжения кости с нечеткими изъеденными контурами, от которого отделился секвестр, для второго — наличие некротического костного фрагмента, не связанного с основной костью. Фистулография, зондирование раны, рентгенография с зондом, упирающимся в участок пораженной кости, помогают уточнить диагноз.
Лечение травматического остеомиелита только оперативное. Выскабливание свищевого хода приводит к кратковременному эффекту. Радикальными методами являются поднадкостничный подход к зоне поражения, выскабливание острой ложечкой некрэти-
599
ческих масс до появления здоровых участков кости. При обнаружении сквозного костного дефекта в одной из пазух необходимо широко вскрыть ее, удалить слизистую оболочку, промыть полость раствором антибиотиков. Завершающим этапом операции является выскабливание или иссечение свищевого хода в мягких тканях глазницы, не исключая надкостницу, кожу или конъюнктиву (место свища). По окончании хирургической обработки в полость глазницы и субпериостально засыпают порошок сульфаниламидных препаратов, антибиотиков, вводят резиновый дренаж в рану и зашивают ее наглухо. Через дренаж раневую полость ежедневно промывают раствором антибиотиков. После заживления свища на коже или конъюнктиве дренаж удаляют. Рана в этом месте закрывается вторичным натяжением.
Хирургическое лечение ожогов глаз
Хирургическое лечение ожогов конъюнктивы и роговицы
Ожоговая болезнь глаза начинается с ожоговой травмы (термическая, химическая, термохимическая, лучевая) и характеризуется длительным течением. Выделяют четыре стадии ожогового процесса: острую, стадию выраженных трофических расстройств, стадию компенсаторной васкуляризации и терминальную, или рубцовую (А. Б. Кацнельсон). Различают четыре степени тяжести ожога (Б. Л. Поляк). В комплекс лечебных мероприятий входят и хирургические методы.
Основными задачами, которые преследуются при лечении ожоговой болезни, являются: срочное и по возможности полное удаление и нейтрализация вещества, вызвавшего ожог, профилактика сращений между веками и глазным яблоком, десенсибилизирующая терапия.
В острой стадии ожоговой болезни конъюнктивальная полость должна быть обильно промыта водой, после чего могут быть применены антидоты. В. Т. Парамей (1985) при ожогах аммиаком рекомендует в качестве антидота «Антиаммиак».
Необходимо тщательно осмотреть роговицу и конъюнктивальные своды с помощью биомикроскопии и в случае обнаружения частиц вещества, вызвавшего ожог, внедрившихся в ткани, удалить их.
При ожогах известью частицы нередко попадают в глаз под большим давлением, в результате чего они внедряются в средние, а иногда и глубокие слои роговицы. В таких случаях целесообразно применение 3—4% раствора динатриевой соли этилендиаминтет-рауксусной кислоты (Na2 ЭДТА), которая образует комплексные соединения с ионами кальция и способствует выведению их из тканей. Барьером, препятствующим проникновению Na2 ЭДТА в ткань роговицы, является ее эпителий. При свежих ожогах известью роговица лишена эпителия, поэтому применение раство
600
ров Na2 ЭДТА в виде глазных ванночек в ранние сроки является наиболее эффективным. Если этот вид лечения применяется позже, когда уже произошла эпителизация роговицы, то предварительно эпителий необходимо соскоблить с помощью острой ложечки.
Секторная конъюнктивотомии. В острой стадии ожоговой болезни рекомендуется производить секторную конъюнктивото-мию по Пассову—Поляку. Наиболее целесообразно осуществлять ее в первые 6 ч после ожога. Показаниями к этой операции служат хемоз и ишемия конъюнктивы глазного яблока, но без выраженного ее некроза. При рассечении конъюнктивы выводят всосавшееся химическое вещество и образовавшийся в результате ожога токсический транссудат.
Под местной инстилляциопной анестезией (0,5 % или 1 % раствора дикаина) ножницами делают меридиональные разрезы конъюнктивы глазного яблока в секторах, где наблюдаются хемоз и ишемия. При круговом хемозе конъюнктивотомия может быть произведена во всех четырех секторах. Разрезы длиной 3—4 мм проводят по косым меридианам во избежание повреждения прямых мышц глаза. Начинают разрезы, отступя 2 мм от лимба. Через них вводят шпатель и отсепаровывают конъюнктиву от склеры на всем протяжении, где отмечаются хемоз, ишемия или даже нерезко выраженный частичный некроз.
Целесообразно также через разрезы в конъюнктиве промыть субкопъюнктивалыюе пространство 0,5% раствором новокаина, изотоническим раствором хлорида натрия или же ввести под конъюнктиву собственную кровь больного, в которую добавляют антибиотики (1—2 мл крови и 50 000 ЕД пенициллина в 1 мл 0,5% раствора новокаина).
В результате этой операции нередко удается получить значительное улучшение: исчезает хемоз, прекращается сдавление тканей отечной жидкостью, ишемия конъюнктивы сменяется гиперемией, улучшается питание роговицы и через несколько дней может наступить ее просветление.
О. В. Груша и соавт. (1985) предлагают при ожогах роговицы проводить ламеллярную кератэктомию с биологической защитой тканевого ложа. В основе метода лечения лежит удаление инородных тел и некротизированных тканей из поврежденной роговицы с одномоментной герметизацией ее поверхности биоклеем для создания оптимальных условий, способствующих сохранению прозрачности роговицы и образования регенерата. Приготовленное ложе в роговице осушают струей кислорода и заполняют слоем биоклея так, чтобы диаметр покрытого клеем участка превышал размер дефекта в 172—2 раза. Клей готовят путем растворения лиофилизированной плазмы крови в изотоническом растворе хлорида натрия.
Операция Денига. При тяжелых и особо тяжелых ожогах глаза с обширным и глубоким некрозом конъюнктивы и роговицы производят операцию Денига по срочным показаниям, причем
®0Й
эффективность ее тем выше, чем раньше ее выполняют. Рекомендуемые сроки — не позже чем через 24—36 ч после ожога.
Механизм эффекта этой операции не вполне ясен. По-видимому, прежде всего благоприятное действие оказывает удаление нежизнеспособных, некротизированных тканей, являющихся очагом, из которого происходит всасывание токсичных продуктов распада, поддерживающих резорбтивный иридоциклит и гиперсекреторную глаукому. Богатый сосудами лоскут слизистой оболочки губы способствует улучшению кровообращения в конъюнктиве, стимулирует нервные рецепторы и тем самым благоприятно влияет на трофику тканей; кроме того, он препятствует образованию сращений между обожженными поверхностями глазного яблока и век. При глубоком некрозе не только конъюнктивы, но и склеры лоскут слизистой оболочки губы, являясь пластическим материалом, может служить и тектоническим целям.
Анестезия инсталляционная (0,5% или 1% раствор дикаина). Концентрично лимбу иссекают полоску некротизированной конъюнктивы. На обнаженный участок склеры укладывают трансплантат (слизистую оболочку губы) и пришивают к эписклере несколькими тонкими шелковыми швами. В глаз закладывают мазь, накладывают повязку (бинокулярную на первые сутки). Швы снимают на 5—6-й день.
Лоскут слизистой оболочки выкраивают после инфильтрационной анестезии (2% раствор новокаина с добавлением 5—10 капель раствора адреналина 1:1000 на 10 мл раствора). На губу накладывают специальный окончатый пинцет, благодаря чему операция проходит бескровно. Лоскут выкраивают «с запасом», так как впоследствии он значительно сокращается. Затем его максимально истончают за счет удаления остатков подкожной жировой клетчатки. Рану на губе зашивают непрерывным швом или же несколькими узловатыми швами. Косметическим недостатком операции Денига является ярко-розовый цвет пересаженного лоскута.
При ожогах ряд авторов рекомендуют соскабливать острой ложечкой пораженный нежизнеспособный эпителий роговицы, подобно тому как при операции Денига удаляют участок некротически измененной конъюнктивы. Целью этой операции является уменьшение резорбции токсичных продуктов распада тканей.
В некоторых случаях при тяжелых ожогах роговицы целесообразно произвести раннюю послойную кератопластику. Показанием к этой операции является наличие глубокого некроза роговицы. Операция заключается в удалении некротизированных слоев роговицы и замене нежизнеспособных распадающихся тканей гомопластическим роговичным трансплантатом. Целью ранней кератопластики при ожогах является стремление снабдить обожженную роговицу жизнеспособными клетками, в первую очередь эпителием.
Трепаном большого диаметра или скребцом делают несквозной Крутовой надрез роговицы по лимбу (или несколько отступя от
602
него). После этого круглым ножом снимают некротизированные слои роговицы. Таким же способом выкраивают роговичный трансплантат из консервированного на холоде донорского глаза. Трансплантат укладывают на подготовленную раневую поверхность роговицы больного и укрепляют швами.
Приживление трансплантата обычно происходит плохо вследствие резко измененной трофики роговицы реципиента, а также в результате развивающихся у больных с ожогами явлений аутоагрессии, что может привести к отторжению или расплавлению трансплантата.
Особенно неблагоприятна «почва» для кератопластики после химических ожогов. При термических ожогах исходы этой операции несколько лучше. В тех случаях, когда после кератопластики происходит расплавление трансплантата, Н. А. Пучковская (1973) рекомендует производить послойную пересадку роговицы повторно, иногда до 3 и 4 раз, укрепляя трансплантатом распадающиеся ткани роговицы больного. Чем раньше производят кератопластику, тем больше вероятность приживления трансплантата, так как иммунологические сдвиги в организе больного вскоре после ожога еще незначительны. Наиболее благоприятны результаты кератопластики, сделанной в первые 6—8 ч после ожога, хотя операцию можно производить и в течение нескольких дней после травмы'.
Л. Ф. Лазаренко (1966, 1967) рекомендует в ранние сроки после тяжелых ожогов производить лечебную кератопластику, используя в качестве трансплантата детские трупные роговицы, в комбинации с секторной конъюнктивотомией. В этих случаях послойная пересадка роговицы в сочетании с пластикой сводов по Пучковской при обширных и глубоких повреждениях конъюнктивы глазного яблока, сводов и век позволяет частично сохранить частичное зрение.
Срочной операцией, которую рекомендуют производить при тяжелых химических (главным образом щелочных) ожогах глаза, является парацентез роговицы. При ожогах щелочами их очень быстро обнаруживают во влаге передней камеры глаза (через 2—3 мин после ожога). Резкое изменение pH камерной влаги может привести к развитию так называемой химической катаракты. Раздражение и повреждение радужки и ресничного тела вызывают тяжелые иридоциклиты с упорным течением и вторичное повышение внутриглазного давления в обожженном глазу. В связи с изложенным выше следует считать полезным ранний парацентез роговицы при щелочных ожогах II, III, а иногда и I степени, который следует производить не позднее чем через несколько часов после ожога.
Однако парацентез может оказаться полезным не только в острой стадии ожоговой болезни, когда эту операцию производят
1 Более подробные сведения о хирургических методах лечения ожогов глаз даны в монографии Н. А. Пучковской и соавт. «Патогенез и лечение ожогов глаз и их последствий» (1973).
603
с целью эвакуировать из передней камеры всосавшегося химического вещества, но и в более поздних стадиях, когда в обожженном глазу развиваются явления токсического резорбционного иридоциклита и вторичной гиперсекреторной глаукомы в связи со всасыванием продуктов распада тканей.
В результате парацентеза, производимого в этой стадии ожоговой болезни, прежде всего меняется состав камерной влаги. Вместе с камерной влагой удаляют токсичные вещества. Вторичная камерная влага обычно бывает богаче белками, наступает гипотония, ослабляется напряжение в роговичных пластинках. Всеми этими факторами и объясняется положительное лечебное действие парацентеза.
Разрез роговицы должен быть небольшим (некоторые авторы рекомендуют делать прокол роговицы). Важно выбрать для парацентеза участок роговицы, не пораженный при ожоге, так как в противном случае операционная рана плохо заживает. После выпускания влаги через этот же разрез роговицы в переднюю камеру необходимо ввести стерильный воздух, чтобы предупредить образование передних спаек.
Однако наблюдения [Н. А. Пучковская и др., 1973] показали, что следует соблюдать осторожность при выборе парацентеза, поскольку лечебный эффект от него временный, а осложнения, возникающие после него, нередко тяжелые и опасные.
В. Г. Шиляев (1985), Г. Г. Бордюгова и А. Г. Травкин (1985) при особо тяжелых ожогах глаз советуют после некрэктомии и покровной кератопластики производить кровавую блефарорафию. Форсированное создание анкилосимблефарона в сочетании с тектонической корнеопластикой в отдельных случаях помогло сохранить светоощущение и субатрофичное глазное яблоко даже в случаях тотального самопроизвольного отторжения роговицы с каймой склеры.
После сшивания век трансплантаты роговицы и склеры не могут отторгнуться; они инкапсулируются или замещаются рубцовой тканью, существенно увеличивая прочность наружной капсулы глаза. Из 14 больных, у которых не было первичного поражения сетчатки и которых лечили данным методом, у 5 Н. Н. Ушаков провел кератопротезирование, в том числе и транспальпебральное, причем удалось добиться остроты зрения от 0,04 до 0,3.
Хирургическое лечение ожогов век
При ожогах век II степени с образованием пузырей на коже ее нужно протереть спиртом, осторожно проколоть пузыри и выпустить из них жидкость. Срезать над пузырями кожу не следует. Веки смазывают бактерицидной мазью и накладывают повязку.
При ожоговых повреждениях век III степени в некоторых случаях может и должна быть произведена ранняя первичная бле-фаропластика — в первые часы или дни после ожога. В других случаях целесообразнее выполнить раннюю отсроченную блефаро-604
пластику через 2—3 нед после ожога, когда исчезают воспалительные явления в тканях.
Ранняя блефаропластика, как первичная, так и отсроченная, дает удовлетворительные результаты главным образом после термических ожогов. При химической травме кожи век пластические операции лучше не Делать в течение года после ожога, так как всякое хирургическое вмешательство в этих случаях вызывает активную реакцию соединительной ткани с новым резким рубцеванием и последующим сморщиванием.
Показанием к ранней блефаропластике является прежде всего небольшая площадь поражения век. В этих случаях рекомендуется полностью иссечь некротизированный участок, превратив его тем самым в чистую рану, которую закрывают лоскутом пересаживаемой кожи. Чем раньше произвести такую операцию, тем лучше ее результаты. Оптимальными сроками для выполнения ранней первичной блефаропластики являются первые часы после ожога, хотя операция может быть произведена и позже — в течение первых суток.
Ранняя первичная блефаропластика показана также и в тех случаях тяжелых ожоговых повреждений век, когда они настолько велики, что становится невозможным полное смыкание глазной щели, вследствие чего создается угроза поражения роговицы (кератит, язва).
Дефекты и деформация век настолько разнообразны, что не могут быть устранены с помощью единой методики. Для осуществления ранней блефаропластики может быть применен метод свободной пересадки кожи.
В тех случаях, когда имеется сквозной дефект века, свободная пересадка кожи не показана. Пересаживаемый на веки кожный лоскут должен быть достаточно тонким, без подкожной жировой клетчатки, чтобы после блефаропластики сохранилась подвижность век, особенно верхнего. При пересадке грубых толстых лоскутов кожи могут возникать ограничение подвижности век и даже птоз. Для свободной пересадки на веки рекомендуется брать лоскут кожи с внутренней поверхности плеча. Тонкий лоскут кожи может быть взят также с шеи над наружной половиной ключицы или с задней поверхности ушной раковины.'
Техника операции. Место, где будет произведена пересадка, и участок кожи, откуда предполагается взять лоскут, обрабатывают спиртом или 1% спиртовым раствором бриллиантового зеленого (спиртовой раствор йода использовать не следует). При взятии лоскута рекомендуется пользоваться «выкройкой», изготовляемой из прозрачной рентгеновской пленки. «Выкройку» прикладывают к коже и обводят Г% раствором бриллиантового зеленого. По границе «выкройки» производят неглубокий надрез кожи. Затем выкраивают скальпелем тонкий лоскут. Скальпель продвигают параллельно поверхности кожи в ее средних слоях. Для того чтобы лоскут получился тонким, кожу необходимо хорошо натянуть. Если лоскут взят правильно, то на донорской поч-
605
ве появляется след в виде мелкоточечных кровоизлияний. Рану, образовавшуюся на месте вырезанного лоскута, часто не зашивают. Эпителизация ее наступает к 12—14-му дню. Если на рану накладывают швы, то кожу по краям разреза отсепаровывают для лучшего ее смещения. /
Взятый для блефаропластики лоскут кожи не следует ни обмывать изотоническим раствором хлорида /натрия, ни помещать в него, так как фибрин способствует болеб быстрому склеиванию раневых поверхностей. Не рекомендует делать на трансплантате насечки, так как на их месте иногда образуются довольно заметные рубцы. Пересаживаемый лоскут должен плотно прилегать к раневой поверхности. Для этого после тщательного гемостаза, уложив лоскут, хорошо его расправляют. Для пришивания лоскута пользуются волосяными швами. Оставляют длинные концы нитей, которые подклеивают лейкопластырем к окружающим тканям. При этом лоскут несколько растягивается.
Если позволяет состояние глаза, то целесообразно временно сшить края верхнего и нижнего века, что способствует их иммобилизации и расправлению краев дефекта века. После свободной пересадки кожи накладывают давящую повязку. Первую перевязку производят на 4—5-й день после операции, затем через день. Трансплантаты кожи смазывают бактерицидной мазью. Швы снимают на 6—7-й день.
Предметней указатель
---------
Аветисова метод резекции верхней косой мышцы 446
— операция при нистагме 460
— — склеропластики 169
Азнабаева метод устранения блефа-роптоза 65
Акинезия (блокада ветвей лицевого нерва, идущих к круговой мышце глаза) 36
Аксенфельда метод удаления части слезной железы 495
Алексеева операция 469
Аллопластика после энуклеации 587
Аллоткани для устранения блефаро-птоза 65
Аллотрансплаптация при блефаро-пластике 52
Anderson и Kastenbaum операция при нистагме 460
Анестезия местная 30, 33
----в хирургии глауком 192
— — инфильтрационная 35
— — поверхностная или инсталляционная 35
— регионарная или проводниковая 36
— ретробульбарная 40
— сбалансированная 31
Аппарат и инструменты для витрео фагии 344
— специальные для микрохирургии глаза 17
Арльта метод увеличения нижней слезной точки 465
Аспирация жидкого стекловидного тела 344
Астигматизм послеоперационный, исправление хирургическое 308 — хирургическая коррекция 153 Аткинсона метод акинезии 38 Аутотрансплантация кожи при бле-фаропластике 51
— слизистой оболочки при блефаро-пластике 52
— тканей при блефаропластике 52
Афакия и гиперметропия, коррекция хирургическая 129
— коррекция интраокулярная 306
---- контактная 309
Баллонирование экстрасклеральное при отслойке сетчатки 388
Беккера коэффициент 203
Беляева — Ильиной метод склеропластики 155
Беляева нож-пинцет 329
Биоклей 122, 123
Блашковича метод при вывороте
слезной точки 466
— — циклодиализа 215
Блефаропластика 44
— аутотрансплантация 51, 52
— интерламелярная с оптической целью 109
— круглым стеблем 50
— лоскутом 49
— местными тканями 47
— остростебельчатая 50
Блефаронтоз, устранение оперативное 64
Блефаростаты 279
Бовэна болезнь 77
Брефопластика 107
— межслойная рефракционная 112
— послойная 108
Ван — Бойпингена гониоскоп 198
Вегенер метод трансплантации ра-
дужки 504
Веки, дефекты и деформации 44
— выворот и заворот, операции 56
— дефекты поверхностные и сквозные 59
— и глазное яблоко, иммобилизация 279
Веко верхнее, эксцизия хряща комбинированная 73
— нижнее, заворот спастический, операции 56
Веста метод дакриоцисториностомии в модификации Бокштейна 485
Визу метод лазерной трабекулопла-стики 264
Вийеру — Террьену метод акинезии 37
Витреокорнеальные контакты и сращения, разделение 350
Витреотомия передняя при зрачковом блоке 352
607
Витреофагия через плоскую часть ресничного тела 343
Витреошвартэктомия с широким доступом 402
Витреоэктомия аппаратами 343, 344
— закрытая при отслойке сетчатки 401
— передняя 313, 348
Внутриветриальные пленки, тяжи 351
Внутриглазное давление, исследование суточной кривой 204
Волкова и Литвинова прием для удаления амагнитного инородного тела 583
— метод послойной кератопластики 123
Волкова — Трояновского модель баллона 389
Гейликмана проба 565
Гейне метод циклодиализа 215
Гемостаз 41
Гипернация 27
Глаукома абсолютная болящая 248
— врожденная и юношеская 241
— вторичная глаукома (зрачкового блока) после экстракции катаракты 318
— в сочетании с катарактой 241
— витреоцилиарного блока 247
— на афакичном глазу 246
— хрусталикового блока 244
Гмыри метод аллопластического укрепления стафиломы 164
— — кератопластики 97
Головина метод аутотрансплантации птеригиума 117
— — ретробульбарной диафаноско-пии 570
--укрепления слезной железы
495
Гольдфедера метод пересадки хряща из уха 75
Гониопластика лазерная 260
Гониопунктура 223
— лазерная при «простой» глаукоме 261
Гониоскопические симптомы и ориентиры, пробы 199
Гонископия 197
Гониотомия 219
Горбаня пинцет-петля 294
Гофера метод дакриоцисториносто-мии 489
Груши метод ламеллярной кератоэк-томии при ожогах роговицы 601
Груши — Соколовского метод трабекулэктомии с иридоциклоретрак-цией 239
Гуммелсхейма операция, модификация О’ Коннора 454
Гундоровой корнеосклеральный доступ 508 /
— метод диафаноскопии 123
---- хондрокератопластика 122
Дакриопс 495<
Двали линз/307
Денинга метод пересадки слизистой оболочки 75
— операция при ожогах глаза 601
Джонса операция [при облитерации слезного канальца] 472
Джонсона операция в модификации
Азнабаева при блефароптозе 64
Диану операция 161
Диатермокоагулятор 17
Диатермокоагуляция при спастическом завороте нижнего века 56 — сетчатки 381 — субсклеральная 422
Диафаноофтальмоскопия 380
Дислокация нижней слезной точки, лечение оперативное 465
Дисцезия при истинной вторичной катаракте 326
— угла передней камеры 251
Ерлышева операция слезного канальца 472
Брошевского — Панфилова метод интраламеллярной склеропластики 167
Зайковой метод субтотальной аллопластики 165
Зонулол изис ферментативный 267, 294
Иммобилизация глазного яблока местная при отслойке сетчатки 388
Имплантат (ы), использование после энуклеации глаза 587
— роговичный для коррекции афакии и миопии 126
— эластические для склеропластических операций (иэсо) 390
Имплантация аллопластических материалов в глазницу 591
— биологических линз в роговицу 309
Инородные тела [глаза], магнитные пробы Д65
— — удаление 572
ИОЛ (искусственный хрусталик) 306
— имплантация «вторичная» 309
— осложнения при подсадке 308
— фиксация в ресничной борозде 307
— экстрапулиллярной 307
Инструменты стерилизация 21
Инфекция послеоперационная 322
608
Иридопексия при иридодиализе 500
Иридотомия базальная или иридоэк-томия 279 \
Иридоциклоретракции 218, 250
— с трабекулотомиеи\239
— — тремя имплантатами 217
Иридоциклосклерэктомия 508 Иридоэктомия 208, 249 \
— базальная 236 — оптическая 499 — препараторная 497 — лазерная 256 Ирис-шпатель 290
Cairns метод трабекулотомии 234
Камо операция 161
Канкрова способ пересадки птеригиума 118
Катаракты вторичные, профилактика путем чистки задней камеры 300
Каторгиной Метод экзентерации глазницы 537
Кератоконус, лечение хирургическое 104
Кератомилез и кератофакия 125
Кератопария хроническая буллезная 123
Кератопластика лечебная 122
— межслойная при кератотоиусе 105
— — рефракционная 125
— — фракционная 309
— меридиональная рефракционная (клинопластика) 157
— поверхностная послойная при остром кератоконусе 105
— противопоказания для использования глаз трупа 101
— полная сквозная с каймой склеры и пластика переднего отрезка глазного яблока 97
— рефракционная для изменения кривизны роговицы 124
— сквозная 104
Кератопротез, отторжение 139
Кератопротезирование 137
Кератотомия передняя «компрессионная» или ортокератотомия 151
Кератофакия 309
Кератохемилюминесценция и керато-импедансометрия 102
Кератоэктазия хроническая 104
Килера — Амоилса Криокарандаш 384
Клауса метод дакриоцисториносто-мии 489
Клей цианакриловый, применение при ранах роговицы 555
Клинопластика модифицированная 158
Коагуляция множественная лазерная 257
— сетчатки и сосудистой оболочки через зрачок 385
----------------- склеру без ее перфорации 373
---- ультразвуковая 384
Койанаги операция 162
Колена операция [при облитерации слезного канальца] 478
Коллахана операция при рецидивирующем птеригиуме 119
Консервация роговицы 102
---- эмбриональной 107
— трупного глаза 101
Корева метод пластики мышц при паралитическом косоглазии 454
Коссовского офтальмофрагментатор 357
Краснова гониоскоп 198
— линза 307
— метод акинезии 39, 278
— — анестезии подглазничного нерва 476
— — иридоциклоретракции 237
— — лазерного трабекулоспазиса 264
— — лечения буллезной хронической кератопатии 124
----наложения швов па катарак-тальный разрез 287
— — конвекс-тонографии 204
----секторной синусэктомии 238
------ трабекулоциклостомии 238
— — трабекулоэктомии 235
Крвавича метод криокоагуляции, или криопексии 384
Крейсига — Липкофа модель баллона 389
Криоапнликаторы 378, 579
Криодеструкция опухоли сосудистой оболочки 517
Криокоагуляция ресничного тела 232
«Криотерм» 278
Криофаки (криоэкстракторы) 17,
277
— полупроводниковые 278
Криофакия (или криоэкстракция) 266
Кровоизлияние в переднюю камеру и стекловидное тело после экстракции катаракты 318
Кровотечение при операциях на стекловидном теле 363
— эмпульсивное после экстракции катаракты 314
Кронлейпа разрез 530
Ксероз рубцовый, лечение оперативное 99
Кунта метод конъюнктивальный пластики 90
39 Руководство по глазной хирургии
609
— — удаления хряща верхнего века 72
— операция пластическая 162
Кунта — Шимановского операция 47
Cuppers фаденоперация 441
Лагранжа — Хольта — Филатова операция при глаукоме 185
Лазерная гониопластика 260
— гониопунктура 261
— иридэктомия 256
— капсулофакопунктура 326
— коагуляция множественная 257
— трабекулопластика 262, 264
— установка «ятаган» 254
Лазерное лечение глаукомы 252
----катаракты вторичной ложной 330
— — — мягкой 325
Лазерный гониоспазис 264
— трабекулоспазис 264
— цикло! рабекулоспазис 263
— фотомидриаз 260
Лазеркоагуляция в зоне передней камеры 263
— внутриглазных опухолей 519
Ландесберга метод пластики склеры при ранениях 562
Легеза метод устранения рецидивирующего птеригиума 119
Лимберга метод пластики встречными треугольными лоскутами 47
Линдера — Одинцова методика нанесения диатермокоагулятов 384
Линзы интраокулярные, модели 307
— контактные из материалов «ХЕМА» 310
Ли операция в модификации Каллахана 469
Логая метод применения магнитомера 568
Лотина •— Попова операция при симблеофароне 81
Лягина метод устранения иридодиа-лиза 503
Майера — Швикерату метод фотокоагуляции сетчатки 386
Маклакова тонометр 203
McGuire операция при косоглазии
448
McLear операция при косоглазии 446
Мак-Рейнольда способ удаления птеригиума 116
Микролимфовенозные анастомозы
101
Микроскопы операционные 7
— — крепящиеся к голове хирурга
------- — потолку 7
— — фирмы «Opton». (ФРГ) 8
Микрохирургическая техника 18
Микрохирургия/Глаукомы, 190
— катаракты 273
Миопия и астигматизм 140
— коррекция хирургическая 132
— прогрессирующая 166
— профилактика хирургическая, прогрессирование и коррекция 179
МоракСа — Вальера — Виале операция 474
Морщины век, устранение 58
Мышца горизонтального действия, операции по поводу косоглазия 434
— косая верхняя, усиление действия оперативное 444
----операции при косоглазии 448
— ослабление действия при операциях по поводу косоглазия 438
Нестерова — Либенсон метод склеропластики 167
— метод склеропластики, модифицированный Беляевым и Ильиной 174
Новообразования слезного мясца 77
Нурмамедова метод однолоскутной склеропластики 171
Обезболивание потенцированное 28
— у детей 32
Операции антиглаукоматозпые 190, 206
— — повторные 249
— при нетипичном косоглазии (синдром «А» и «V») 451
Операционный блок 5
---- поликлиники 6
Опухоли конъюнктивы 76
— — эпителиальные 77
Орбитотомия костно-пластическая 524, 531
— надкостничная 527
— поднадкостничная 528
— простая 525
— трансконъюнктивальная 528
— транскраниальная 535
— транскутанная 525
— транспальпебральная 527
Орлова модификация дакриоцисториностомии 481
Остеомиелит травматический, лечение хирургическое 599
Офтальмофрагментатор ультразвуковой для операций на стекловидном теле 357
Парадии эризифак 276
Пассова — Поляка метод секторной конъюнктивотомии 601
6(0
Пересадка межолойная роговицы плода 109 -
— — частичная послойная 97
Перитомия, периэктойця и ламбора-фия 74
Петруне колпачки 108
Пивоварова метод склеропластики 168
Пластика роговицы интерламеллярная при фистуле 91
— — конъюнктивальная 89
Пломбирование стекловидного тела 407, 409, 415
Повязка на оперированный глаз 43
Покровского метод иридэктомии 185
Поляка метод лакориностомии 491
Похисова операция [при вывороте нижней слезной точки] 467
Премедикация 27, 31
Птеригиум 115
— ложный 120
— рецидивирующий, барьерный метод устранения 118
Пучковской метод лечебной кератопластики 122
----операции при симблефароне 78
— — послойной периферической пересадки роговицы 92
— — укрепляющей склеропластики 170
Радужка, выпадение после экстракции катаракты 316
— манипуляции [на ней] при экстракции катаракты 288
— удаление кист и опухолей 594
Рана после экстракции катаракты, неполная адаптация краев 320
Реваскуляризация склеры 178
Reese и Jones метод пересадки височной мышцы в глазницу 537
Реклинация катаракты с дозированным диализом ресничного пояска 333
Реконструкция переднего сегмента глаза, аутотрансплантатомиз заднего отдела другого глаза 140
Ремизова и Грязнова операция при прогрессирующей миопии 170
Ресницы и брови, оперативное устранение дефектов 62
Ретинеенклейзис 413
Ретинобластома, лечение хирургическое и лучевое 424
Ретинопексия 378
Ретинотомия 414
Робертса операция в модификации
Колена и Фукса при блефаропто-
Роговица, дистрофия после экстракции катаракты 321
— донора, определение жизнеспособности 102
— и склера, разрезы сквозные 88
— исследование методом зеркальной микроскопии 103
— нанесение наружных насечек 146
— уменьшение ее преломляющей, силы 143
Рубеоз радужки и неоваскуляриза-ционная глаукома при операциях на стекловидном теле 369
Руки хирурга, обработка 25
Сапежко операция при симблефароне 80
Сато метод исправления астигматизма 153
— — — миопии 143
— — модифицированный 151
Сетчатка, отслойка и предотслоечыые-состояния 374, 375
— повреждения и осложнения при операциях на стекловидном теле-364, 368
— расправление латексным шариком (баллончиком) 412
Сидероскопия 566
Симблефарон, операции двуэтапные 78
Синдром мелкой передней камеры 236, 323
Синусотомия 227, 250
— переход от нее к синусотрабеку-лотомии 229
— «радикальная» 229:
Сипусотрабекулотомия 240
Сипусотрабекулоэктомия 235
Скарификация при хемозе 69
Склера, вдавление локальное 388, 390, 396
— сдавление механическое круговое при отслойке сетчатки 392
Склерангулореконструкция 235
Склероклезис и венеклейзис 185
Склеропластика 173
— с пломбированием 180
— — реваскуляризацией комбинированная по методу авторов 181
— у детей 177
Скрипниченко метод удаления инородного тела 573
Слезные канальцы, операции перевязки, расщепление 471
Smith метод выдавливания хрусталика 283
Спайдера — Томпсона склеропластики 168
Сосудистая оболочка, отслойка после экстракции катаракты 317
Сталларда метод лакодакриостомии! 490
39
61.В
•Стафилома, резекция 162
— укрепление ауто- и аллопластиче-ское 163
•Стекловидное тело, выпадение 311, 313
— — репозиция 247, 312
Стивенсона и других авторов методы оперативного удлинения мышцы при косоглазии 440
Субботиной метод дакрионисторило-стомии с помощью ультразвукового ножа 480
Субретинальная жидкость, выведение путем перфорации глазного яблока 404
— — дренаж и пломбирование в объеме отслойки 406
Султанова модификация дакриоци-сториностомии 484
Таратина метод инъекции спирта в слезную железу 496
Тауми модификация дакриоцистори-ностомии 483
Тенмия при косоглазии 441
Термокаутеризация кровоточащих сосудов 41
Терсона способ операции при птеригиуме 117
Титова метод увеличения нижней слезной точки 465
Тихомирова метод электрокоагуляции слезной железы 496
Топография 202
Тоти метод дакриосториностомии в модификации Дюпюи-дютана —
Бура 475
Трабекулотомии 224
— и трабекулоэктомия 250
— модификации 237
Трансплантат из широкой фасции бедра по В. С. Беляеву 66
— фиксация 95
Трансплантационный материал для кератопластики 100
Трахоматозный паннус, операции 74
Тренажер для отработки микрохирургической техники 20
Уилера метод дублирования при ранах век 544
— — рассечения пленки при вторичной катаракте 327
Ультразвуковая коагуляция сетчатки 384
— факоэмульсификация 296
— Ультразвуковой офтальмофрагментатор 357
— фрагментатор 401
Уткина метод хирургической коррекции астигматизма 155
Факофрагментатот/17
Факоэмульсификатор 17
Факомульсификация 268
— ультразвуковая 296
Федорова —/Дурнева метод нанесения пас/чек при миопическом астигматизме 157
Федорова7 — Захарова линза 307
Федорова метод кератотомии 152
Филатова — Баккала метод обработки рук 25
Филатова способ аллопластики роговично-конъюнктивального лоскута 118
— — выдавливание трахиоматозных зерен 71
— — консервация трупного глаза 101, 102
— — операции при мейбомиевом блефароконъюнктивите 69
----перитомии 75
— — послойной частичной пересадки роговицы 93, 96
— стебель блефаропластики 50
Филатова — Цыкуленко способ взятия тонкой пластинки слизистой оболочки 78
Фистулы роговицы закрытые 90
— склеры и кистозные рубцы хирургическое вмешательство 163
Фишера швы при операции по поводу косоглазия 437
Форбса проба 201
Фотокоагуляция внутриглазных опухолей 519
Фотолазерокоагуляция 383
— и лазерокоагуляция при диабетической ретинопатии 422
— сетчатки 386
Фрагментатор ультразвуковой 401
Фридмана и Кодзова методика ультразвуковой локации 571
Холязион, способы удаления 69
Хармса трабекулотом 226
Хирургия антиглаукоматозная 195
Хориоидэктомия 516
Хрусталик, выдавливание и вытягивание 283
— извлечение в капсуле 290
—---------криофаком 292
----------эиризифаком 291
----ножом Сато 298
— повреждения и осложнения при операциях на стекловидном теле 351, 366
— определение свойств с помощью биомикроскопии 271
Хрусталиковые массы, эвакуация 299
612
Циклоанемизация 232
Циклодиатермокоагуляция 232
Циклокоагуляция 231
Чермака способ удаления птеригиума 116
Швартотомия в стекловидном теле 399
Шварца операция 469
Швы биологические, стерилизация 24
----волоса стерилизация 24
— корнеасклеральные 285, 286
— наложение на слизистую оболочку 69
Шевалева и Филатова операция при рубцовом ксерозе 99
Шейе метод иридэктомии 185
Шелк и кетгут стерилизация 23
Шлопак метод реваскуляризации сетчатки 423
Шмыревой методы иридоциклорет-ракции и иридэктомии 216
Шовный материал 14
----стерилизация 22
Шоттера ирис-ретрактор 289
— криоэкстрактор-динамометр 293
— метод вживления имплантата 590
— диатермокоагуляции при склеротическом завороте нижнего века 56
— — исправления гиперметропии 124
— — кожно-мышечный пластики после экзентерации 537
----удаление немагнитных осколков 574, 576
----устранения эпикантуса 64
---- операция при иридодиализе 501
—------паралитическом косоглазии
458
— — перенесения действия лобной мышцы на веко 66
----рассечения вторичной катаракты 328
— — создание конъюнктивальной полости 592
— приборы для удаления инородных тел 579, 581, 585
— проба обратная 566
Шоттера — Кабир метод клинопластики 157
Штрауба шов слизистой оболочки 73
Эйкена метод дакриоцисториносто-мии 488
Экзентерация глазницы 524, 535
---- поднадкостничная 536
Эксплантация роговицы сквозная
межслойная 137
Экстирпация слезного мешка 674
Экстракция катаракты интеркапсулярная 282
— — микрохирургическая 301
— — с предшествующим иридодиа-лизом 279
— — у детей и юношей 324
— — экстракапсулярная 282, 295
— — — метод новый 297
— пленки вторичной катаракты 327
Экстрасклеральное пломбирование при отслойке сетчатки 390, 391
Эльшинга метод иридокапсулотомии
327
Эндофтальмит после витрэктомии 371
Энуклеация глазного яблока 588
Эпикератофакия 106, 309
Эпителий и соединительная ткань, врастание в переднюю камеру 322
Эпителиома внутриэпителиальная 77
Эризифак 274
Эризофакия 266
Эукория лазерная 260
Список литературы
Авербах М. И. Офтальмологические очерки. — М.: Медгиз, 1949. — 788 с.
Аветисов Э. С. Охрана зрения у детей. — М.: Медицина, 1975. — 272 с.
Аветисов Э. С. Содружественное косоглазие. — М_; Медицина, 1977.— 312 с.
Аветисов Э. С. Диплоптика — принципиально новая система лечения содружественного косоглазия//Вестн. офтальмол, — 1977. — № 6. — С. 17—24.
Аветисов Э. С., Беляев В. С. О научных исследованиях по проблеме миопии// Вести, офтальмол. — 1977. — № 5. — С. 29—35.
Аветисов Э. С. Хирургическое лечение астигматизма//Вестн. офтальмол. — 1980. — № 3. — С. 67—69.
Азнабаев М. Т. Отдаленные результаты операции аспирации катаракты у детей//Вестн. офтальмол. — 1976. — № 3. — С. 20—22.
Акопян В. С., Дроздова Н. М. Лечебное и профилактическое значение лазерной иридэктомии в клинике первичной ангулярной глаукомы//Вестн. офтальмол. — 1977. — № 1. — С. 10—14.
Белоглазов В. Г. Внутриносовой способ операции слезоотводягцих путей ультразвуковыми инструментами//Вестн. оторинолар. — 1978. — № 5. — С. 60—69.
Беляев В. С. Склеропластика в лечении прогрессирующей миопии. — М.г 1977. — 36 с.
Беляев В. С., Барашков В. И. О возможности применения реклинации в современной хирургии катаракты//Вестн. офтальмол. — 1975. — № 2. — С. 27—31.
Беляев В. С., Барашков В. И. Катаракта и основы ее лечения. — М., 1980.— 30 с.
Беляев В. С., Веретенникова В. В., Душин Н. В., Луэнго В. М. Межслойная рефракционная кератопластика при афакии, дальнозоркости и близору-кости//Вестн. офтальмол. — 1980. — № 5. — С. 28—35.
Беляев В. С., Каспаров А. А. Трансплантология в современной офтальмоло-гии//Вестн. офтальмол. — 1982. — № 6. — С. 39—47.
Беляев В. С., Госсен Ж. X. О возможностях хирургического лечения и профилактика дистрофии сетчатой оболочки и зрительного нерва//Вестн. офтальмол. — 1983. — № 6. — С. 18—21.
Беляев В. С., Кравчинина В. В., Душин Н. В. Отдаленные результаты межслойной рефракционной кератопластики при афакии и гиперметропии высокой степени//Вестн. офтальмол. — 1933. — № 2. — С. 28—32.
Беляев В. С., Кравчинина В. В., Левит В. Н. и др. Отдаленные результаты хирургического лечения близорукости//Офтальмол. журн. 1984. — № 8.— С. 454—457.
Беляев В. С. Операции на роговой оболочке и склере. — М.: Медицина, 1984. — 144 с.
Беляев В. С., Матту И. К. Экстракция катаракты при прогрессирующей близорукости высокой степени//Вестн. офтальмол. — 1984. — № 3. — С. 25—27.
Блаватская Е. Д. Рефракционная кератопластика. — Ереван: Айастан, 1973.— 192 с.
Блохин Н. И. Кожная пластика. — М.: Медгиз, 1955. — 320 с.
Бочаров В. Е. О возможностях усовершенствования техники экстракапсулярной экстракции катаракты//Вестн. офтальмол. — 1977. — № 1. — С. 18— 20.
Бровкина А. Ф. Новообразования орбиты. — М.: Медицина, 1974. — 256 с.
614
Бровкина А. Ф., Зиангирова Г. Г., Комаров Б. А. О криоразрушепии меланом хориоидеи//Вестн. офтальмол. — 1977. — № 2. — С. 61—64.
Бровкина А. Ф., Гундорова Р. А. Органосохранное лечение при опухолях иридоцилиарной области и показания к его применению//Офтальмол. журн. — 1978. — № 6. — С. 426—431.
Бровкина А. Ф., Дубинская Л. Р., Лясс Ф. М., Лившиц В. Б. Метод радионуклидной сцинтиграфии при новообразованиях орбиты//Вестп. офтальмол. — 1983. — № 4. — С. 55—57.
Васильева С. Ф. Способ аспирации катаракт и люксированных хрусталиков у детей//Офтальмол. журн. — 1977. — № 6. — С. 448—451.
Венгер Г. Е. Новый метод частичной трансплантации радужной оболочки// Офтальмол. журн. — 1981. № 5. — С. 305—308.
Венгер Г. Е. Посттравматическая гипотопия глаза. — Офтальмол. журн. — 1984. — № 7. — С. 410—414.
Война-Ясенецкий В. В. Разрастание и изменчивость тканей глаза при его заболеваниях и травмах. — Киев: Вища школа, 1979. — 224 с.
Волков В. В., Трояновский Р. Л. Новые аспекты патогенеза, лечения и профилактики отслойки сетчатки//Актуальные проблемы офтальмологии.— М„ 1981, —С. 140—171.
Галимова В. У., Мулдашев Э. Р. Новый способ реваскуляризации хориоидеи// Офтальмол. журн. — 1981. — № 5. — С. 308—309.
Ганиченко И. Н., Романова Н. А. Световая коагуляция в лечении передних ретинальных диализов//Офтальмол. журн. — 1977. — № 5. — С. 342— 347.
Ганиченко И. Н., Линник Л. А. Рубиновая и неодимовая лазеркоагуляция при макулярных разрывах сетчатой оболочки//Офтальмол. журн. — 1978. — № 5. — С. 325—330.
Гапурова Г. II. Шовный материал для микрохирургии глаза//Вестн. офтальмол. — 1982. — № 6. — С. 68—70.
Гмыря А. И., Котлубей Г. В., Агафонова В. В. Тренажер для обучения и отработки техники микрохирургических операций на глазу//Офтальмол. жури. — 1985. — №4. —• С. 249—250.
Горбань А. И., Джалиашвили О. А. Микрохирургия глаза. — Л.: Медицина, 1982.— 248 с.
Горгиладзе Т. У. Вторичная глаукома на глазах с бельмами и после кератопластики. — Тбилиси: Сабчота сакартвела, 1979. — 168 с.
Горгиладзе Т. У. Пересадка роговицы. Батуми: Сабчота Аджара, 1983. — 120 с.
Груша О. В., Соколовский Г. А. Способ лечения узкоугольной глаукомы.// Вести, офтадьмол. — 1978. — № 4. — С. 11—14.
Гундорова Р. А., Петропавловская Г. А. Проникающие ранения и контузии глаза. — М.: Медицина, 1975. — 298 с.
Гундорова Р. А., Степанов А. В. Опыт имплантации интраокулярных линз модели М. М. Краснова (экстрапупиллярная ирис-линза) »//Вестн. офтальмол. — 1977. — № 1. — С. 20—23.
Гундорова Р. А., Бордюгова Г. Г., Травкин А. Г. Реконструктивные операции на глазном яблоке. — М.: Медицина, 1983.— 224 с.
Гуртовая Е. Е., Могилевская Ф. Я., Федорова С. М. Об экстракции катаракты после антиглаукоматозных операций//Вестн. офтальмол. — 1978. — № 3.— С. 17—20.
Давыдовский И. В. Общая патология человека. — М.: Медицина, 1969. — 612 с.
Дашевский А. И., Кривенков С. Г. О деформациях склеры при эмметропии, ложной миопии и при возникновении истинной миопии//Офтальмол. журн. — 1974. — № 8. — С. 584—588.
Еналиев Ф. С. Опыт хирургического лечения близорукости//Вестн. офтальмол. — 1979. — № 3. — С. 52—55.
Ершкович И. Г., Ионова Т. А. Первые наблюдения по применению обезвоженной силикагелем роговицы плода для лечебной послойной керато-пластики//Вестн. офтальмол. — 1975. — № 1. — С. 31—35.
615
Жабоедов Г. Д. Гелиоэкстракция катаракты//Офтальмол. журн. — 1978. — _ № 8. — С. 622—624.
Зайкова М. В., Маценко В. П., Негода В. И. Исходы упрощенной склеропластики при высокой миоптии у детей и подростков//Вестн. офтальмол,— _ 1979. № 2. — С. 24—29.
Зайкова М. В. Пластическая офтальмохирургия. — М.: Медицина, 1980. — „ 207 с-
Зайкова М. В., Лялин А. Н. Пересадка твердой мозговой оболочки плода человека при прогрессирующей близорукости//Вестн. офтальмол. — 1984. № 6. — С. 33—34.
Захаров В. Д., Аксенов А. О. Дозирование инвагинации склеры при наружном пломбировании силиконовой губкой//Трансцилиарная хирургия хрусталика и стекловидного тела. — М., 1982. — С. 196—199.
Индейкин Е. Н. Реваскуляризация хориоидеи при далеко зашедшей глаукоме// Офтальмол. журн. — 1980. — 6. — С. 379—380.
Казанец Л. И. Осложнения, возникающие при интравитреальном введении силоксанов//Вопросы этиологии, патогенеза, клиники, диагностики, профилактики и лечения отслойки сетчатой оболочки. — М., 1976. — С. 42— 45.
Каспаров А. А. Микрохирургическая техника лечебной кератопластики//Ми-крохирургия глаза/Под ред. М. М. Краснова. — М., 1976. — С. 100—108.
Клюцевая Е. И. Хирургическое лечение прогрессирующей близорукости. — Минск: Беларусь, 1984. — 142 с.
Ковалевский Е. И. Детская офтальмология. — М.: Медицина, 1970. — 312 с.
Коссовский Л. В., Коссовская И. Л. Применение отечественного ультразвукового факофрагментатора в глазной хирургии (сообщение I)//Вести, офтальмол. — 1983. — № 3. — С. 25—29.
Коссовский Л. В., Столяренко Г. Е., Коссовская И. Л. Применение отечественного ультразвукового факофрагментатора в глазной хирургии (сообщение 2) //Вести, офтальмол. — 1983. — № 3. — С. 29—33.
Краснов М. Л. Анестезия в офтальмологии. — М.: Медгиз, 1959. —138 с.
Краснов М. Л., Беляев В. С. Операции на роговой оболочке и склере//Руко-водство по глазной хирургии. — М., 1976, С. 101—129.
Краснов М. М., Акопян В. С. Использование лазерной капсулофакопупктуры при лечении «мягких» катаракт//Вестн. офтальмол. — 1976. — № 1. — С. 22—25.
Краснов М. М. Экстракапсулярная экстракция катаракты, ее перспективы// Вести, офтальмол.—1977. — № 1. — С. 3—8.
Краснов М. М. Трабекулостомия и трабекулоциклостомия при комбинированных формах глаукомы//Вестн. офтальмол. — 1978. — № 4. — С. 9—12.
Краснов М. М. Близорукость — неудобство и близорукость — болезнь//Нау-ка и жизнь. — 1978. № 6. — С. 75—78.
Краснов М. М. Микрохирургия глауком. — 2-е изд. — М.: Медицина, 1980.— 247 с.
Краснов М. М., Каспаров А. Л., Пивоваров Н. И., Мусаев П. И. Интерламеллярная кератопластика с использованием капсулы хрусталика у больных буллезной кератопластики//Вестн. офтальмол. — 1981. —№2. — С. 32—37.
Краснов М. М., Ильина Т. С., Казакова Е. Л., Акопян В. С. Лазерное лечение первичной открытоугольной глаукомы. Рандомизированные сравнительные исследования. Циклотрабекулоспазис и трабекулопластика//Вестн. офтальмол. — 1982. — №5. — С. 18—22.
Краснов М. М-, Груша О. В., Аветисов С. Э. и др. Метод ортокератотомии в хирургической коррекции близорукости//Вестн. офтальмол. — 1983. — № 2. — С. 24—28.
Краснов М. М. Новая техника непрерывного шва при кератопластике и экстракции катаракты//Вестн. офтальмол. — 1983. — № 5. — С. 67—68.
Легеза Г. В., Якименко С. А., Макух В. Ф. Хирургическое лечение упорно рецидивирующего птеригиума//Офтальмол. журн. — 1983. — № 4. — С. 246—247.
Либман Е. С., Беляев В. С., Мелкумянц Т. А., Бочкарева 3. Г. Отдаленные результаты клинико-функционального состояния глаз с высокой ослож
616
ненной близорукостью после операций склеропластики//Вестп. офтальмол. — 1980. — № 6. — С. 32—36.
Лупан Д. С. Новое в практической офтальмологии. — Кишинев: Штиипца, 1981.— 156 с.
Лупан Д. С., Беженарь В. Ф. Нехирургический способ лечения халязиопа в детской офтальмологической практике//Вестн. офтальмол. — 1985. — № 3. — С. 46—47.
Луэнго В. М. Комбинированное хирургическое лечение прогрессирующей блп-зорукости//Миопия. — Рига, 1979. — С. 98—101.
Лягин В. Н. Устранение иридодиализа иглой с ушком у острия без вскрытия передней камеры//Офтальмол. журн. — 1984. — № 8. — С. 498—500.
Марголис М. Г., Плужниченко Б. В. Хирургия слезных органов//Под ред. М. Л. Краснова. — М.: Медицина, 1965. — 120 с.
Марголис М. Г. Операции на слезных оргацах//Руководство по глазной хирургии. — М., 1976. — С. 52—70.
Маунг Кио Тин. Отдаленные результаты наблюдений за больными с высокой прогрессирующей близорукостью после склеропластики в комбинации с передними насечками роговицы//Вестн. офтальмол. — 1979.—№ 2. — С. 30-32.
Мовшович А. И., Батманов Ю. Е. Ультразвуковая передняя витрэктомия в лечении послеоперационных грыж стекловидного тела и витреофиксации в рубце//Вестн. офтальмол. — 1983. — № 5. — С. 29—32.
Морхат И. В. Интерламеллярная кератопластика. — Минск: Беларусь, 1980.— 112 с.
Нестеров А. П., Либенсон Н. Б., Свирин А. В., Воропай 0. А. Отдаленные результаты оперативного лечения высокой прогрессирующей близоруко-сти//Офгальмол. журн. — 1976. — № 5. — С. 338—339.
Нестеров А. И., Бунин А. Я. О новой классификации первичной глаукомы// Вести, офтальмол. — 1977. — № 5. — С. 38—39.
Нурмамедов Н. Н., Атамередова Г. К. Склеропластика при прогрессирующей близорукости//Вестн. офтальмол. — 1978. — № 1. — С. 33—35.
Охрименко В. Е. Эффективность склеропластики при некоторых заболеваниях глаза//Офтальмол. журн. — 1981. — №4. — С. 209—211.
Пивоваров Н. Н., Багдасарова Т. А., Приставка Э. Ф., Леонов А. А. Опыт акцентированного и динамического циркляжа//Реконструктивная офтальмохирургия. — М., 1979. — С. 128—131.
Пивоваров Н. Н., Ширшиков Ю. К., Василькова Л. С. Профилактика прогрессирования миопии с помощью модифицированной склеропластики Ремизова — Грязнова//Вестн. офтальмол. — 1985. — № 2. — С. 36—39.
Пучковская Н. А. Пересадка роговой оболочки при осложненных бельмах.— Киев: Госмедиздат УССР, 1960. — 216 с.
Пучковская Н. А., Войно-Ясенецкий В. В. Вторичные дистрофические и структурные изменения в переднем отделе глаза. — М.: Медицина, 1985. — 192 с.
Пучковская Н. А., Титаренко 3. Д. Кератоконус. — Киев: Здоров’я. 1984. — 72 с.
Ремизов М. С., Грязнов А. И. Способ хирургического лечения прогрессирующей близорукости//Вестн. офтальмол. — 1981. — № 2. — С. 26—29.
Руководство по глазной хирургии/Под ред. М. Л. Краснова. — М.: Медицина, 1976. — 360 с.
Савиных В. И. Комбинированная склеропластическая реконструкция глаз с высокой близорукостью//Офтальмол. журн. — 1980. — № 8. — С. 480— 483.
Сапегина Э. Л., Горбань А. И. Внутристромальная биологическая пломбировка как метод лечения прогрессирующих кератоэктазий//Вестн. офтальмол. — 1984. — № 3. — С. 30—35.
Свирин А. В., Антипова О. А., Серебрякова Т. В. Модификация операции введения взвеси гомоткани в теноново пространство при высокой прогрессирующей близорукости//Вестн. офтальмол. — 1984. — № 4. — С. 31—33.
Сергиенко Н. М. Новая кератопластическая операция при близорукости//Оф-тальмол, журн. — 1978. — № 5. — С. 375—378.
617
Сергиенко Н. М., Коваль Э. Б. Сочетание операций по поводу отслойки сетчатки с эписклеральной имплантацией склеральной ткани на глазах с высокой близорукостью//Вести, офтальмол.— 1984.— № 6. — С. 30—33.
Сидоренко Е. И. Транзиторная гипертензия глаза после экстракции катарак-ты//Вестн. офтальмол. — 1975. — № 3. — С. 14—16.
Смеловский А. С. Микрохирургия возрастной катаракты. — М.: Медицина. 1985. —128 с.
Темиров Н. Э. Гидромониторная факофрагментация и витреоэктомия (теоретическое, экспериментальное, клиническое обоснование)//Вести, офтальмол. — 1982. — № 2. — С. 20—25.
Травкин А. Г. Способ наложения роговичного шва//Вестн. офтальмол. — 1984. — № 5. — с. 60—62.
Уткин В. Ф. Несквозная периферическая радиарная кератотомия в лечении сферической и асферической миопии//Вестн. офтальмол. — 1979. — 2.— С. 21-24.
Федоров С. Н. Имплантация искусственного хрусталика. — М.: Медицина. 1977.—207 с.
Федоров С. Н., Дурнев В. В. Хирургическая коррекция сложного миопического астигматизма методом передней кератотомии//Офтальмол. журн.— 1979. — № 4. — С. 210-213.
Федоров С. Н., Саркизова М. Б. Влияние применения дозированного ножа на эффективность повторной кератотомии//Хирургия аномалий рефракции глаза. — М.; 1981. — С. 43—47.
Федоров С. Н., Ивашина А. И., Гудечков В. Б., Яценко И. А. Особенности-хирургической техники передней радиальной дозированной кератотомии при миопии высокой степени//Вестн. офтальмол. — 1983. — № 5. — С. 20— 22.
Федоров С. Н., Мороз 3. И., Зуев В. К. Кератопротезирование. — М.: Медицина, 1982. — 144 с.
Федоров С. Н., Ронкина Т. И. Морфологический анализ причин энуклеации глаз после экстракции катаракты с имплантацией интраокулярной лин-зы//Вестн. офтальмол. — 1984. — № 5. — С. 21—25.
Филатов В. П. Круглый стебель в офтальмологии. — М.: Медгиз, 1943. — 28 с.
Филатов В. П. Оптическая пересадка роговицы и тканевая терапия. — М.:. Медгиз, 1945. — 232 с.
Филатов В. П. Мои пути в науке. — Одесса: Обл. изд-во, 1955. — 164 с.
флик Л. П. Некоторые клинико-функциональные особенности приобретенной высокой миопии и вопросы ее клинической классификации//Миопия. — Рига, 1979. — С. 26—31.
Флик Л. П., Саулгозис Ю. Ж., Волколакова Р. Ю. Биомеханические свойства склеральных трансплантатов, используемых в оперативном лечении мио-пии//Миопия. — Рига, 1979. — С. 102—104.
Хватова А. В. Заболевания хрусталика глаза у детей. — Л.: Медицина 1982.— 200 с.
Шмелева В. В. Катаракта. — М.: Медицина, 1981. — 224 с.
Шоттер Л. Л. Применение несквозной меридиональной кератопластики для исправления близорукости//Вестн. офтальмол. — 1984. — № 5. — С. 26— 29.
Шоттер Л. X., Малаев А. А., Гундорова Р. А., Панов А. В. Удаление амагнитных и фиксированных магнитных осколков из глаза//Вести, офтальмол.— 1985. —№ 4. —С. 65—67.
Шпак И. И. Новая техника операции реваскуляризации сосудистой оболочки глаза (при пигментной дегенерации сетчатки, тромбозе и атрофии зрительного нерва)//Офтальмол. журн. — 1978. — № 3. — С. 224—227.
Шульпина Н. Б. Биомикроскопия глаза. — М.: Медицина, 1974. — 264 с.
Abraham R. К., Miller G. L. Out-patient argon laser iridectomy for angle-closure glaucoma: a two year study//Trans. Amer. Acad. Ophthal, Otolaryng. — 1975. — Vol. 79. — P. 529-537.
Abraham R. K. Procedure for put-patient argon laser iridectomies for angleclosure glaucoma//Int. Ophthal. Clin. — 1976. — Vol. 16. — P. 1—8.
618
Ainslie D. Keratoplasty refractive. — Bull. Soc. Ophthalm. — 1972. — Vol. 81. -P. 175—185.
Ainslie D., Mathalone B. Clinical experience in refractive keratoplasty//Congres of the European Society of Ophthalmology. 4th. — Budapest, 1972 — P. 69—70.
Ainslie D. The indications for refractive Keratoplasty//Trans. Ophthalm. Soc. Unit. Kingdom. — 1973. — Vol. 92. — P. 491—498.
Ainslie D. Recent Adwances in Keratoplasty//Brit. J. Ophthalm. — 1974. — Vol. 58, N 4. — P. 335-343.
Algvere P., Rosengren B. Active immobilization of the eye in the treatment of retinal detachment//Mod. Probl. Ophthal.—1977,—Vol. 18. — P. 286—291.
Andrew E. Dislocation of the lens with remarks on the old operation of cou-ching//Brit. med. J. — 1982.—Vol. 2.—P. 1292—1293.
An Atlas of ophthalmic surgery 2nd ed/Ed. J. H. King, J. A. C. Wadsworth — Philadelphia, 1970.—631 p.
Andrjewska IF. Dalsze wynidi leczeni a postepujacej krotkowzrocznosci za po-moca circumlogatio meridionalis//Klin. oczna.—1972,—Vol. 42.—P. 263— 268.
Barraquer J., Muinos A. S. Lamellar scleral resection: indications and technique. — Amer. J. Ophthal., 1936, vol. 41, p. 92—98.
Barraquer J. Enzimatic zonolulysis in lens extraction//Arch. Ophthal. — 1961.— Vol. 66. — P. 6—11.
Barraquer J. Keratophakia//Trans. Ophthalm. Soc. UK. — 1973.—Vol. 92. — P. 499—516.
Barraquer Moner J. I. Queratoplastia refractiva//Estud. Inform. Oftal. (Barcelona). — 1949. — Vol. 2. — P. 10—10.
Barraquer Moner I. I. A autokeratoplastie avec surfacage pour la correction de la myopie. (Queratomileusis)//Ann. Oculist. — 1965. — Vol. 198, N 5. — P. 401—425.
Belyaev V. S., Ilyina T. S. Late Results of Scleroplasty in Surgical Treatment of Progressive Myopia//Ear, Ear, Nose Thr. Monthly. — 1975. — Vol. 54, N 3, p. 109-113.
Belyaev V. S., Veretennikova V. V. Brephoplasty of the cornea//International conference on Keratoplasty and and Keratoprosthesis. — Odessa, 1978. — P. 112-113.
Belyaev V. S., Barachkov V. J. A modern experience with couching for cata-ract//Ann. Ophthalmol.—1982. — Vol. 14, N 8. — P. 742—745.
Binder P. The statys of radial keratotomy in 1984//Arch. Ophthal. — 1984. — Vol. 102, N 11. — P. 1601—1603.
Binkhorst C. D. Perspective der Iris-Klipp-Linse und Irido-Kapsularlinase//Klin. МЫ. Augenheilk. — 1972.-Bd 161. - S. 477—481.
Brown S. I. Peripheral corneal edema after cataract extraction//Amer. J. Ophthal. — 1970.—Vol. 70. — P. 326—328.
Cairns J. E. Surgery of adult glaucoma. Iridocycloretraction//Operative Surgery. Fundamental international techniques/Ed. S. Miller. — London, 1976.— P. 77-81. . i j.
Complications in ophthalmic surgery/Ed. Iliff Nicolas. — New-York—Edinburgh—London—Melburne: T. Churchill Livingstone, 1983. — 530 p.
Consul B. N., Chhabra H. N., Sharma D. P. Lamellar keratoplasty. A review of 40 cases//Eye, Ear, Nose Thr. Monthly. — 1970.—Vol. 49, N 7. — P. 338.
Dannheim R. Trabeculotomy//Trans. Amer. Acad. Ophthal. Otolaryng. — 1971.— Vol. 76. — P. 375—376.
Dayton L C., Hilquust C. R. Complications of phacoemulsification//Canad. J. Ophthal. - 1975. — Vol. 10. - P. 61—64.
D’Ermo F., Secchi A. G. Modified iridocycloretraction in the surgery of aphakic glaucoma. Albrect von Graefes//Arch. Klin. Ophthal. — 1975. — Vol. 197.— P. 229—231.
Dyson J. Iridocycleotomiy with lamellar scleral resection//Canad. J. Ophthal. 1972,—Vol. 7. — P. 297—301.
Eisner G. Eye Surgery. — Berlin, Heidelberg. New York: Springer—Verlag, 1980.—530 p.
619
Ekamabram R. Gouchers and their metods. — Indian Med. Gas — 1910 — Vol. 14.—P. 207—210.
Etienue M. R., Donne M. R. Microsurgery of congenital or traumatic cataracts// Arch. Ophthal.—1972.—Vol. 32. — P. 189—194.
Friedlander M. H., Werblin T. P., Kaufman H. W., Granet N. S. Clinical results of Keratophkia and Keratomileusis//Ophthalmology. — 1981. — Vol. 88, N 8. — P. 716-720.
Fukala V. Operative Behandlung der hochstgradiger Myopie dutch Aphakie// Arch. Ophthal. — 1890. — Bd 36, N 2. — S. 230—244.
Harms H., Mackensen G. Mikrochirurgie am Augen. — Stuttgart: Thieme, 1966. — 470 s.
Harms H., Mackensen G. Augenoperationen under dem Mikroscop. — Stuttgart: Thieme, 1906.—301 s.
Harms H., Dannheim R. Trabeculotomy—results and problems//Advances in ophthalmology/Ed. G. Mackensen.—Basel—New-York, 1970.—P. 121—131.
Henderson J. W. Orbital tumors. 2 ed.—New-York, 1980,—725 p.
Jaffe N. S. Cataract surgery and complications. — St. Louis: Mosby, 1976.— 361 p.
Jones L. T. Epiphora: its causes and new surgical procedures for its cure. — Amer. J. Ophthal. — 1954. — Vol. 38, N 6. — P. 824—826.
Kaufman H. E. Combined keratoplasty and cataract extraction. — Amer. J. Ophthal—1974,—Vol. 77—P. 824—829.
Kaufman H. E. The correction of aphakia. XXXVI Edward Jackson Memorial Lecture//Amer. J. Ophthal.—1980.—Vol. 89, N 1.—P. 1—10.
Kelman C. D. Phacoemulsification and aspiration of senil cataracts//Canad. J, Ophthal.—1973—Vol. 8,—P. 24—32.
Keratoplasty, Proceeding of a Symposium.—Praha, 1962.—321 p.
Kestenbaum A. Nouvelle operation du nystagmus//Bull. Soc. Ophtal. — Fr. — 1953,—Vol. 6—P. 599—602.
Krasnov M. M. Sinusotomy: foundations, results and prospects//Contemporary ophthalmology. — St. Louis, 1972.—P. Ill—118.
Krasnov M. M. Laser puncture of anterior chamber angle in glaucoma//Amer. J. Ophthal. — 1973. — Vol. 75—P. 674—678.
Krasnov M. M., Cairns J. E. Iridocycloretraction in glaucoma secondary to essential atrophy of the iris//Brit. J. Ophthal. — 1973.—Vol. 57. — P. 416— 417.
Krasnov M. M. Modified trabeculectomy//Ann. Ophthal. — 1974. — Vol. 2. — P. 178—182.
Krasnov M. M., Shmyreva V. F. Microsurgery of primary closed-angle glauco-ma//Glaucoma. — 1981.—Vol. 3, N 3. — P. 187—188.
Krasnov M. M. Laser cyclotrabeculospasis in the system of laser treatment in glaucoma//Ann. Ophthal.—1983,—Vol. 15, N 11. — P. 1001—1003.
Krwawicz T. intracorneal lamellar keratoplasty//Brit. J. Ophthal. — 1960. — Vol. 44, N 10. — P. 629—633.
Krwawicz T. New plastic operation for corresting the refractive error of aphakic eyes by changing the corneal curvature. Preliminary report//Brit. J. Ophthal. — 1961—Vol. 45, N 1,—P. 59—63.
Krwawicz T. Intracapsular extraction of intumescent cataract by application of low temperature//Brit. J. Ohpthal. — 1961.—Vol. 45. — P. 279—283.
Leigh A. G. Corneal transplantation. — Oxford: Blackwell, 1966.—342 p.
Little I., Guttle I. Outline of phacoemulsification for the ophthalmic surgeon.— London, 1974.—340 p.
McCord C. D. A combined lateral and medial orbitotomy for exposure of optie nerve abd orbital apex//Ophthal. Surg.—1978.—Vol. 9, N 3. — P. 58—66.
Machemer R. A new concept for vitreous surgery. VII Two instrument techniques in pare plana vitrectomy//Arch. Ophthal. — 1974.—Vol. 92. — P. 407— 412.
Machemer A., Aaberg T. M. Vitrectomy.—2nd ed. — New-York. 1979.—262 p.
Machemer R. Retinotomy//Amer. J. Ophthal. — 1981.—Vol. 92, N 6. — P. 768— 774
620
Martinez M., Katzin H. M. Refractive Keratoplasty//Arch. Ophthal. — 1963.— Vol. 89,—P. 837-838.
Martinez M., Katzin H. Refrective keratoplasty//World Congress on the Cornea. Ist./Ed. J. H. King.—Washington, 1965.—P. 605—616.
Maumenee A. E., Wilkinson С. P. A combined operation for glaucoma and ca-taract//Amer. J. Ophthal.—1970,—Vol. 69.—P. 360—371.
Microsurgery of cataract, vitreous and astigmatism/Ed. D. Pierse. — Basel: Kargel, 1976.—270 p.
Miller W-, Borley W. E. Surgical treatment of degenerative myopia. (Scleral reinforcement)//Amer. J. Ophthal.—1964.—Vol. 57. N 5.—P. 796—804.
Momose A. Sinusotomy in glaucoma simplex//Ophthalmology (Jpn). — 1972.— Vol. 14. — P. 365-366.
Momose A. Experience on glaucoma operations of the out flow channels//Folia, Ophthal. Jap. — 1975. — Vol. 26. — P. 267—269.
Momose Л. Surgical correction of myopia. — J. Korean Ophthal. — 1983. — Vol. 24, N 4.-P. 717—725.
Naji A. F., Uldanov G. Tumor of the Eye//J. Fac. Med. Baghdad. — 1961. — Vol. 3, N l.-P. 211-25.
Thompson F. B. A simplified scleral reinforcement technique. — Amer. J. Oph-thah—1978,—Vol. 86, N 6,—P. 782—790.
Troutman R. C. Microsurgery of the anterior segment of the eye. — St. Louis:: Mosby, 1974,—402 p.
Troutman R. C., Eva F. R. Deep suturing of corneal incision. — Amer. J. Oph-thal.-1974.-Vol. 77,—P. 16-22.
Troutman R. C., Swinger C., Goldstein M. Keratophakia update//Ophthalmolo-gy.—1981,—Vol. 88, N 1.—P. 36-38.
Tucker 1)., Barraquer J. Refractive keratoplasty clinical results 67 cases//Ann.. Ophthal.—1973,—Vol. 5/3,—P. 335—352.
Uldanov G., Zalzala Л. I. Surgical treatment of cicatrical xerosis of the Eye// J. Fac. Med. Baghdad—1961.—Vol. 3, N 4. — P. 133—139.
Sato T. Posterior incision of cornea surgical treatment for conical cornea//Amer. J. Ophthal. — 1950,—Vol. 33, N 6. — P. 943—948.
Sato T. Posterior half-incision of cornea for astigmatism//Amer. J. Ophthal.— 1953,—Vol. 36.-P. 462—466.
Sato T., Akuyama K., Shibata H. A new surgical approach to myopia//Amer. J. Ophthal. — 1953—Vol. 36. N 6. — P. 823—829.
Sato T. Die pcrative Behandlung des Astigmatismus//Klin. МЫ. Augenheilk.— 1955—Bd 126, N 1—P. 16—31.
Sato T. Cirurgia del astigmatismo. — Exc. Med. Ophthal. — 1956.—Sect. 12.— Vol. 10—P. 1367—1367.
Sato T. The causes and prevention of aquired myopia. — Tokyo, 1957. — 244 pi Schepens C. L. Retinal detachment and allied diseases. — Philadelphia: Saunders. — 1983.—2 Vol.
Snyder A. A., Thompson F. B. A Simplified technique for surgical treatment of degenerative myopia. — Amer. J. Ophthal. — 1972. — Vol. 74, N 2. — P. 273—277.
Werblin T. P., Kaufman H. E., Friedlander M. N. et al. A prospective study of the use of hyperopic epiker atophaki a grafts for the correction of aphakia in adults//Ophthalmology. — 1981. — Vol. 88, N 11. — P. 1137—1140.
Wise J. B., Witter S. L. Argon laser therapy for open-angle glaucoma. A pilot study//Arch. Ophthal. — 1979. - Vol. 97, N 2. - P. 319-322.
Worthen D. M., Wickman M. G. Argon laser trabeculotomy//Trans. Amer. Acad. Ophthal. — Otolar. — 1974.—Vol. 78.—P. 371—373.
Zivojnovic R., Mertens D. A. E., Peperkamp E. Das flussige Silikon in der Amo-tiochirurgie (II). Berricht uber 280 Falleweitere Entwicklung der Tech-nick//Klin. Mbl. Augenheilk.—1982.—Bd 181.—S. 442—452.
Оглавление
Предисловие ко второму изданию.................................. 3
Предисловие к первому изданию................................... 4
Глава 1. Общие сведения о хирургии глаза. М. Л. Краснов, В. С. Беляев..................................................5
Хирургические инструменты и аппараты......................... 7
Освоение микрохирургической техники...........................19
Стерилизация инструментов, шовного и перевязочного материала 21
Обработка рук хирурга.........................................25
Подготовка больного к операции................................26
Анестезия....................................................30
Местное обезболивание........................................33
Общий и местный гемостаз......................................41
Ведение послеоперационного периода .......... 43
Глава 2. Операции на веках. М. В. Зайкова . ... 44
Операции при деформациях век.................................53
Операции при дефектах век и бровей...........................59
Операции при блефароптозе.....................................64
Глава 3. Операции на конъюнктиве и хряще. В. С. Беляев 68
Операции при трахоме.........................................71
Операции при опухолях конъюнктивы............................76
Операции при симблефароне....................................78
Глава 4. Операции на роговице и склере. В. С. Беляев 84
Операции на роговице.........................................87
Пересадка роговицы . . 91
Брефопластики роговицы....................................106
Операции при птеригиуме...................................114
Микрохирургические операции на роговице....................120
Межслойная рефракционная кератопластика при афакии, гиперметропии и миопии.........................................125
Имплантация искусственной роговицы........................137
Хирургическая коррекция миопии и астигматизма .... 140
Операции на склере...........................................161
Укорочение и укрепление склеры при прогрессирующей миопии 164
Склеропластика ............................................ 173
Склеропластика с пломбированием при тяжелых отслойках сетчатки с макулярными и парамакулярными разрывами при прогрессирующей миопии.......................................180
Комбинированная склеропластика с реваскуляризацией . . 181
Глава 5. Микрохирургия глауком. М. М. Краснов . . 184
Патогенез глазной гипертензии. Общая схема патогенетически ориентированного лечения.......................................186
Техническое оснащение современной микрохирургии глауком . . 190
Показания к операции при глаукоме, возможные осложнения . . 192
Обследование и подготовка больного к операции...............195
Система дифференциальной хирургии глауком...................206
Патогенетически ориентированная микрохирургия глауком . . 208
Операции при ангулярной гипертензии.......................208
622
Операции при претрабекулярной гипертензии..................19
Хирургическое лечение трабекулярной гипертензии (трабскуло томил)....................................................221
Хирургическое лечение интрасклеральной гипертензии (еинуео тимин)....................................................227
Хирургическое лечение «гиперсекреторной» глаукомы (цпклоко-пгулнцил, циклоанемизация)................................231
<>иорицпи с комбинированным воздействием на различные участки фильтрующей зоны.....................................234
Хирургии глаукомы в особых осложненных ситуациях . . . 241
Лазерное лечение глаукомы....................................252
Глава (>. Хирургия катаракты. В. В. Шмелева . . . 266
Общая характеристика современной микрохирургии катаракты 266 Обследование больного с катарактой ......................... 269
Техническое оснащение микрохирургии катаракты................273
Подготовка больного к операции...............................278
Техника экстракции катаракты.................................280
Коррекция афакии.............................................306
Операционные и послеоперационные осложнения..................311
Экстракция катаракты в детском и юношеском возрасте . . . 324
Вторичная катаракта..........................................326
Реклинация катаракты. В. С. Беляев, В. И. Барашков .... 330
Глава 7. Операции на стекловидном теле. В. С. Беляев . 342
Техника операций на стекловидном теле........................342
Осложнения при операциях на стекловидном теле................360
Глава 8. Операции при заболеваниях сетчатки. В. В. Волков, Р. Л. Трояновский.......................................373
Операции при отслойке сетчатки и предотслоечных состояниях . 373
Методы хирургического лечения предотслоечных состояний и отслоек сетчатки с ее полным самопроизвольным прилеганием 373 Методы хирургического лечения отслойки сетчатки с частичным самопроизвольным прилеганием..............................387
Методы хирургического лечения ригидных отслоек сетчатки 398 Осложнения при операциях по поводу отслойки сетчатки . . 416
Лечение больных с отслойкой сетчатки в послеоперационном периоде ....................................................420
Операции при других заболеваниях сетчатки....................422
Глава 9. Операции на глазных мышцах. Э. С. Аветисов . 425
Операции при содружественном косоглазии......................425
Операции на мышцах горизонтального действия...............433
Операции на мышцах вертикального действия.................442
Ведение послеоперационного периода........................449
Операции при некоторых атипичных формах косоглазия ... 451
Операции при паралитическом косоглазии.......................454
Операции при нистагме........................................459
Осложнения при операциях на глазных мышцах и их предупреждение .......................................................463
Глава 10. Операции на слезных органах. В. Г. Белоглазов 465
Операции на слезных путях....................................465
Операции на слезных точках..............................465
Операции на слезных канальцах...........................471
Операции на слезном мешке...............................474
Операции с наружным подходом............................474
Операции с внутриносовым подходом ....... 485
Операции искусственного образования слезных путей . . . 490
623
Пр Пр
Г;
Гл
Гл
Выбор метода оперативного вмешательства при заболеваниях слезных путей..........................................'1'|?
Операции на слезной железе................................11,1
Глава 11. Операции на сосудистом тракте. А. Ф. Бровкина '1‘1,
Операции на радужке......................................45
Операции при новообразованиях сосудистого тракта..........бп
Глава 12. Хирургические вмешательства при заболеваниях глазницы. А. Ф. Бровкина...................................5'-"
Методы диагностики......................................б’.’о
Показания к операции при заболеваниях глазницы............ 5? ।
Виды хирургических вмешательств при заболеваниях глазницы . 5? I
Простая орбитотомия......................................521
Костная орбитотомия...................................530
Транскраниальная орбитотомия.........................53! >
Экзентерация глазницы.................................535
Ведение послеоперационного периода.......................538
Операционные и послеоперационные осложнения..............538
Глава 13. Хирургическое лечение при травмах глаза.
Р. А. Гундорова, М. Л. Краснов, А. Ф. Бровкина . . 541
Хирургическое лечение ранений вспомогательных органов глаза 541
Хирургические методы обработки проникающих ранений глазного яблока......................................................551
Энуклеация глаза и глазное протезирование................586
Хирургическое лечение при повреждениях глазницы .... 593
Хирургическое лечение ожогов глаз........................600
Хирургическое лечение ожогов конъюнктивы и роговицы . . 600
Хирургическое лечение ожогов век......................604
Предметный указатель........................................607
Список литературы...........................................614
Гл
Практическое руководство
Михаил Леонидович Краснов Владимир Сергеевич Беляев Эдуард Сергеевич Аветисов
Руководство по глазной хирургии
Зав. редацией А. В. Елисеева. Редактор Л. К. Мошетова.
Редактор издательства Н. В. Кирсанова, Переплет художника А. Е. Григорьева. Художественный редактор С. М. Лымина. Технический редактор 3. А. Романова. I Корректор Л. А. Кокарева
Г л| ив 4157
! Сдано в набор i8.il.87. Подписано к печати 14.03.88. Т-00338. Формат бумаги
60Х90‘/16. Бумага тип. 1. Гарнитура обыкновенная. Печать высокая. Усл. псч. л. 39,0. Усл. кр.-отт. 39,0. Уч.-изд. л. 42,98. Тираж 30 000 экз. Заказ 1460. Цена 2 р. 60 к.
Ордена Трудового Красного Знамени издательство «Медицина», 101000, Москва, Петроверигский пер., 6/8.
Московская типография К» 11 Союзполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли.
413105, Москва, Нагатинская, 1.
622!
I
I
Во втором издании книги отражены результаты развития микрохирургии и лазерной хируогии глауком, рефракционных разделов хирургии роговицы (кератофакия, кератотомия, клинопластика и др.). Описаны значительно усовершенствованные операции на склере, используемые при лечении прогрессирующей миопии (различные варианты склеропластики). Приведены новые данные по хирургии катаракт, лечению отслоек сетчатки, офтальмоонкологии, лечению травм и ожогов глаз, описаны новые приборы и инструменты для микрохирургии, новые методы исследования и основные современные способы лечения, применяемые в офтальмохирургии.
-
Краснов М. Л., Беляев В. С.
-
-
Гуманитарные науки
-
Медицина
-
Руководство по глазной хирургии. Краснов М.Л., Беляев В.С. и др. 1988 г.
Руководство по глазной хирургии. Краснов М.Л., Беляев В.С. и др. 1988 г.
- Издательство: Медицина
- Код товара: 523667
- Описание
Во втором издании руководства (первое вышло в 1976 г.) отражены результаты бурного развития микрохирургии и лазерной хирургии глауком, рефракционных разделов хирургии роговицы (кератофакия, кератотомия, клинопластика и др.). Описаны значительно усовершенствованные операции на склере, используемые при лечении прогрессирующей миопии (различные варианты склеропластики). Приведены новые данные по хирургии катаракт, лечению отслоек сетчатки, офтальмоонкологии, лечению травм и ожогов глаз, описаны новые приборы и инструменты для микрохирургии, новые методы исследования и основные современные способы лечения, применяемые в офтальмохирургии. Руководство рассчитано на офтальмохирургов.
Состояние: Отличное
2-е издание, переработанное и дополненное. Под редакцией М.Л. Краснова, В.С. Беляева.
Москва. Медицина. 1988 г.
624 с., ил. Твердый переплет. Увеличенный формат.
ISBN: 5-225-00054-1, 5225000541
Название: Руководство по глазной хирургии.











Теги: Медицина,
Книги по медицине,
Краснов,
Беляев,
Руководство по глазной хирургии
Карточка
Руководство по глазной хирургии / [М. Л. Краснов и др.]; Под ред. М. Л. Краснова, В. С. Беляева. — 2-е изд., перераб. и доп. — Москва : Медицина, 1988. — 623,[1] с. : ил.; 22 см.; ISBN 5-225-00054-1 (В пер.) : 2 р. 60 к.
Офтальмохирургия
Шифр хранения:
FB 2 88-28/59
FB 2 88-28/58
Описание
| Заглавие | Руководство по глазной хирургии |
|---|---|
| Коллекции ЕЭК РГБ | Каталог документов с 1831 по настоящее время |
| Дата поступления в ЭК | 27.02.2002 |
| Каталоги | Книги (изданные с 1831 г. по настоящее время) |
| Сведения об ответственности | [М. Л. Краснов и др.]; Под ред. М. Л. Краснова, В. С. Беляева |
| Издание | 2-е изд., перераб. и доп. |
| Выходные данные | Москва : Медицина, 1988 |
| Физическое описание | 623,[1] с. : ил.; 22 см |
| ISBN | ISBN 5-225-00054-1 (В пер.) : 2 р. 60 к. |
| Тема | Офтальмохирургия |
| Язык | Русский |
| Места хранения | FB 2 88-28/59 |
| FB 2 88-28/58 |
Х Орлов, «Руководство по глазной хирургии», стр. Нет слов, чтобы обозначить наше недоумение. Нет слов, чтобы обозначить наше недоумение. Руководство по глазной хирургии Краснов М.Л. КНИГИ для скачивания Офтальмологи вконтакте ВКонтакте Формат: Pdf Размер: 2.3 MB Загружено:. В руководстве дана характеристика терапевтической офтальмологии с оценкой ее состояния и освещением некоторых аспектов дальнейшего развития. Описаны этиология, патогенез и профилактика.
- Краснов Руководство По Глазной Хирургии Скачать
- Краснов Руководство По Глазной Хирургии
СПИСОК ОБЯЗАТЕЛЬНОЙ ЛИТЕРАТУРЫ Прочитайте:. Аветисов С.Э., Егоров Е.А., Мошетова Л.К., Нероев В.В.
Офтальмология + CD. Национальное руководство, 2008 Электронная информационно-образовательная система «Консультант врача. Офтальмология», 2008 Бочкарёва А.А.
Глазные болезни, 1989 Егоров Е.А. Рациональная фармакотерапия в офтальмологии, 2006 Ковалевский Е.И.
Глазные болезни (атлас), 1985 Мошетова Л.К., Нестерова А.П., Егорова Е.А. Клинические рекомендации.
Офтальмология, 2009 Нероев В.В. Избранные лекции по детской офтальмологии, 2009 Сидоренко Е.И. Офтальмология, 2002 Шамшинова А.М., Волков В.В. Функциональные методы исследования в офтальмологии, 1998 Шульпина Н.Б. Биомикроскопия глаза, 1974 СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Аветисов Э.С., Ковалевский Е.И., Хватова А.В., Руководство по детской офтальмологии, 1987. Аветисов Э.С. Содружественное косоглазие, 1977 Аветисов Э.С.
Оптическая коррекция зрения, 1981. Аветисов Э.С. Охрана зрения детей, 1975. Аветисов Э.С. Близорукость, 1999.
Аветисов С.Э., Егоров Е.А., Мошетова Л.К., Нероев В.В., Тахчиди Х.П. Азнабаев М.Т., Сайдашева З.И.
Ретинопатия недоношенных, 2000. Аллен к.Хо Сетчатка: атлас, 2009 Алпатов С.А., Щуко А.Г., Урнева Е.М., Малышев В.В. Возрастная макулярная дегенерация: руководство, 2010 Архангельский В.Н. Морфологические основы офтальмологии, 1962 Бадалян Л.О.
Справочник по клинической генетике, 1971. Словарь офтальмологических терминов и понятий, 2008 Беляев В.С.
Руководство по офтальмологии, 1986 Беляев В.С. Операции на роговой оболочке и склере, 1984 Белоусов А.Е., Ткаченко С.С. Микрохирургия в травматологии, 1988. Ожоги глаз, 1979.
Глаз и изображение: монография, 2004 Бржеский В.В. Принципы лечения заболеваний и повреждений зрительного нерва, 2010 Бровкина А.Ф. Болезни орбиты, 1995.
Бровкина А.Ф. Болезни орбиты, 2008 Бровкина А.Ф.
Рентгенодиагностика заболеваний слёзоотводящих путей, 1969. Бровкина А.Ф., Пачес А.И. Клиническая онкология органа зрения, 1980. Бровкина А.Ф.
Эндокринная офтальмопатия, 2008 Водовозов А.Н. Исследование глазного дна в трансформированном свете, 1986 Волков В.В., Горбань А.И., Джалиашвили О.А. Клиническое исследование глаза с помощью приборов, 1972. Волков В.В., Горбань А.И., Джалиашвили О.А. Клиническая визо- и рефрактометрия, 1972.
Волков В.В., Шиляев В.В. Комбинированное поражение глаз, 1976. Глазная симптоматика в эпонимах, 1972 Волков В.В., Сухинина Л.Б., Устинова Е.И. Глаукома, преглаукома, офтальмогипертензия, 1985 Волков В.В. Глаукома открытоугольная, 2008 Вэндер Дж.Ф.
Секреты офтальмологии. 2-е издание, 2008 Габриэль Коскас, Флоранс Коскас, Ален Зурдан Комплексная диагностика патологии глазного дна: цветной атлас, 2007 Горбань А.И., Джалиашвили О.А. Лекции по клинической офтальмологи, 1984 Гундорова Р.А., Степанов А.В.
Современная офтальмотравматология, 2007 Гундорова Р.А. Травма глаза, 2009г Гундорова Р.А., Нероев В.В., Кашникова В.В. Травмы глаза, 2009 Густов А.В., Сигрианский К.И., Столярова Ж.П. Практическая нейроофтальмология, 2000 Данилечев В.Ф.
Патология глаз. Ферменты и ингибиторы, 1996. Данилечев В.Ф. Современная офтальмология, 2000.
Дашевский А.И. Ложная близоруксть, 1972 Джозеф Фламмер Глаукома, 2008 Дуглас Дж.Ри Глаукома, 2010 Дымшиц Л.А. Основы офтальмологии детского возраста, 1970 Егоров Е.А., Алексеев В.Н., Астахов Ю.С. Рациональная фармакотерапия в офтальмологии, 2004. Егоров Е.А., Астахов Ю.С., Ставицкая Т.В.
Офтальмофармакология, 2004. Неотложная офтальмология, 2007 Егоров Е.А., Басинский С.Н. Клинические лекции по офтальмологии, 2007 Егоров Е.А., Астахов Ю.С., Ставицкая Т.В. 3-е издание, 2009 Егоров Е.А., Ставицкая Т.В., Тутаева Е.С. Офтальмологические проявления общих заболеваний, 2009 Ерошевский Т.И.
Глазные болезни, 1989 Зайцева Н.С. Трахома, 1975 Зайцева Н.С.
Увеиты, 1980 Золотарёва М. Избранные разделы клинической офтальмологии, 1973. Хирургическое лечение травматических повреждений хрусталика, 2007 Каллахан А. Хирургия глазных болезней, 1963. Клиническая офтальмология.
Систематизированный подход, 2009 Каспаров А.А Офтальмогерпес, 1994 Кацнельсон Л.А., Форофонова Т.И., Бунин А.Я. Сосудистые заболевания глаз, 1990 Кацнельсон Л.А.
Клинический атлас патологии глазного дна, 1999 Кацнельсон Л.А. Реография глаза, 1976 Кацнельсон Л.А., Лысенко В.С., Балишанская Т.И. Клинический атлас патологии глазного дна, 2008 Ковалевский Е.И. Избранные лекции, 1996 Ковалевский Е.И. Профилактика слабовидения и слепоты у детей, 1991 Ковалевский Е.И. Патология органа зрения при общих заболеваниях у детей, 1976 Коровенков Р.И. Наследственные и врожденные заболевания глаз, 2006 Котелянский Э.О.
Внутренние опухоли, 1974 Краснов М.Л. Руководство по глазной хирургии, 1988 Краснов М.Л. Микрохирургия глаза, 1976 Краснов М.Л. Терапевтическая офтальмология,1985 Краснов М.Л. Элементы анатомии в клинической практике офтальмолога, 1952 Краснов М.Л., Беляев В.С Руководство по глазной хирургии, 1988 Крачмер Дж., Пэлэй Д. Роговица: атлас, 2007 Курышева Н.И.
Глаукомная оптическая нейропатия, 2006 Лесселла Е., Дж. Ван Далена Нейроофтальмология,1983 Лихванцева В.Г., Анурова О.А.
Опухоли век: клиника, диагностика, лечение, 2007 Майчук Ю.Ф. Аллергические заболевания глаз, 1983 Майчук Ю.Ф. Антибиотики в офтальмологии, 1973 Майчук Ю.Ф. Вирусные заболевания глаз, 1981 Майчук Ю.Ф. Паразитарные заболевания глаз, 1988 Минаева М.В.
Защита зрения у детей, 2006 Морозов В.И., Яковлев А.А. Фармакотерапия глазных болезней, 1998 Нестеров А.П. Глаукома, 1995 Нестеров А.П., Бунин А.Я., Кацнельсон Л.А. Внутриглазное давление, физиология и патология, 1974 Новохватский А.С. Клиническая периметрия, 1973 Нестеров А.П., Комаров Ф.И., Марголис М.Г.
Бровкина А.Ф. Патология органа зрения при общих заболеваниях, 1982 Нестеров А.П. Глаукома, 2008 Никифоров А.С., Гусева М.Р. Нейроофтальмология, 2008 Олвер Д, Кессиди Л, под редакцией Егорова Е.А. Наглядная офтальмология, 2009 Пучковская Н.А.
Иммунология глазной патологии, 1983 Пучковская Н.А. Офтальмогериатрия, 1982 Пучковская Н.А.
Основы офтальноэндокринологии,1977 Рапутано К.Дж., Хенг В. Роговица: атлас, 2010 Роберт Б.Пенн Окулопластика, 2009 Родзиховский Б.Л.
Астигматизм человеческого глаза,1969 Розенблюм Ю.З. Оптометрия, 1996 Румянцева О.А., Егоров Е.А. Неотложное состояние в офтальмологии, 1991 Сенченко Н.Я., Щуко А.Г., Малышев В.В. Увеиты: руководство, 2010 Сидоренко Е.И. Оксигенотерапия в офтальмологии, 1995 Сидоренко Е.И.
Лечение офтальмопатологии инфразвуком,1998 Сидоров Э.Г., Мирзаянц М.Г. Врождённая глаукома и её лечение, 1991 Слонимский Ю.Б., Герасимов А.С.
Краснов Руководство По Глазной Хирургии Скачать
Рефракционная сквозная пересадка роговицы, 1992 Сомов Е.Е. Клиническая анатомия глаза, 1968 Сомов Е.Е. Глазные болезни и травмы, 2002 Сомов Е.Е. Клиническая офтальмология, 2008 Степанов А.В., Гундорова Р.А., Южаков А.М., Нероев В.В. Внутриглазная раневая инфекция, 2007 Танковский В.В.
Тромбозы вен сетчатки,2000 Тахчиди Х.П. Офтальмология в вопросах и ответах, 2009 Тейлор Д, Хойт К. Детская офтальмология, 2007 Тихомиров П.Е. Болезни слёзных органов. Руководство по глазным болезням, 1960 Трон Е.Ж. Заболевание зрительного пути, 1972 Трон Е.Ж. Глаз и нейроофтальмологическая патология, 1968 Урмахер Л.С., Айзенштадт Очковая оптика, 1982 Федоров С.Н.
Восстановительная хирургия и аллопластика в офтальмологии, 1973 Фёдоров С.Н., Егорова Э.В. Хирургическое лечение травматических катаракт с интраокулярной коррекцией, 1990 Хайман Х., Кельнер У., Ферстер М. Атлас по ангиографии глазного дна, 2008 Xanne Офтальмологический справочник практического врача, 2004 Хватова А.В. Заболевание хрусталика глаза, 1990 Хватова А.В., Катаргина Л.А. Эндогенные увеиты у детей и подростков, 2000 Ченцова О.Б. Туберкулёз глаз, 1990 Шмелёва В.З.
Катаракта, 1981 Периодические офтальмологические журналы. Методические рекомендации по изучаемой тематике.
Диссертации и авторефераты диссертаций по изучаемой литературе. Материалы симпозиумов, съездов и конференций за последние годы. ПРИЛОЖЕНИЕ 3. Дата добавления: 2015-09-27 Просмотры: 258.
Руководство по глазной хирургии Краснов М.Л. Формат: Pdf Размер:. MB Загружено: раз Накопленный опыт он обобщил в работе «Проникающие ранения глаз», опубликованной в книге «Опыт советской медицины в Великой Отечественной войне 1941—1945 гг. А вообще там обычные PDF (акробатом читать можно) Подскажите, где можно скачать книгу Тарасовой Л. Многие работы посвящены проблеме травматизма глаз мирного и военного времени, он также изучал влияние на глаза различных химиотерапевтических средств, был инициатором внедрения в офтальмологическую практику антибиотиков и сульфаниламидов.
Был оставлен в ординатуре при клинике глазных болезней, работал под руководством М. Высокую оценку у практических врачей получило «Руководство по глазной хирургии» ( Научное наследие М.
В за большие заслуги в развитии народного здравоохранения, многолетнюю плодотворную научно-педагогическую деятельность и в связи с восьмидесятилетием со дня рождения Краснову Михаилу Леонидовичу было присвоено звание Михаил Леонидович успешно разрабатывал проблему сосудистой патологии глаз. Интересная в научном и практическом отношении работа «О влиянии на глаз некоторых специальных сталей и сплавов» стала его докторской диссертацией, которую он защитил. Подскажите пожалуйста, где можно найти в электронном виде атлас по гониоскопии авторов Олвэрд Уоллес Л.
Всё перекопала — не могу найти! Где-нибудь есть в сети Нестеров ‘Глаукома’ — ну хоть какого нибудь года издания! Заранее спасибо за любую помошь! Не получается скачать,попробую залогиниться,может так получится,спасибо большое Да, я уже писал, они требуют теперь регистрации.КНИГИ для скачивания Офтальмологи вконтакте ВКонтакте19 авг 2015. Скиньте, пожалуйста, у кого есть нац. Руководство Хирургия глаза Краснова.
Нравится Показать список оценивших. Saida Dibirova 27 окт 2016 в 20:24. Очень срочно,нужна книга Краснов М.Л., ‘Элементы анатомии в клинической практике врача офтальмолога’, 1952 г. Будьте добры. Краснов, Михаил Леонидович — ВикипедияМихаил Леонидович успешно разрабатывал проблему сосудистой патологии глаз.
Им разработана методика исследования глазного дна при гипертонической болезни. Высокую оценку у практических врачей получило «Руководство по глазной хирургии» (1976), в котором М. Краснов был соавтором. Терапевтическая офтальмология Краснов М.Л.; Шульпина Н.Б.26 окт 2010.
Краснов Руководство По Глазной Хирургии
Потребность в освещении вопросов хирургического профиля была выполнена выпуском в 1971) г. Издательством «Медицина» руководства по глазной хирургии. Что касается терапевтических заболеваний органа зрения, то руководств такого типа ни в нашей стране, ни за рубежом еще не. Офтальмологические отделения (подробно) — ГВКГВ конце XIX. В связи с усилением военных действий начала развиваться военная офтальмология, которая имела отличия от глазной хирургии мирного. В период Великой Отечественной войны старшим ординатором офтальмологического отделения госпиталя работал профессор М.Л.