Специальные комитеты, ответственные за критические аспекты разработки рекомендаций:
Методологический комитет отдела ЕАУ, клиническим рекомендациям:
Проф. д-р N. Lumen, Ghent (BE) (председатель), Д-р I. Omar, Aberdeen (UK) (вице-председатель), Проф. д- р S. Canfield, Houston (TX, USA), Д-р S. MacLennan, Aberdeen (UK), Д-р L. Marconi, Coimbra (PT), Д-р A.K. Nambiar, Newcastle (UK), Д-р C. Yuhong Yuan, Hamilton (ON, CN) Проф. C. Tudur Smith, Liverpool (UK), Д-р C. Yuhong Yuan, Hamilton (ON, CN) Проф. д-р J. N’Dow, Aberdeen (UK) (член по должности), Д-р T. Van den Broeck, Leuven (BE)
Комитет отдела ЕАУ по клиническим рекомендациям по распространению:
Проф. д-р M.J. Ribal, Barcelona (ES) (председатель), Д-р N. Bhatt, Norwich (UK) Д-р V. Cucchiara, Milan (IT), Д-р S. Czarniecki, Warsaw (PL) Д-р F. Esperto, Bergamo (IT), Д-р E. Garcia Rojo, Madrid (ES) Д-р G. Giannarini, Milan (IT), Д-р B. Pradere, Paris (FR), Д-р J. Teoh, Hong Kong (PRC) Д-р I. van Oort, Nijmegen (NL)
Программа помощников в составлении рекомендаций ЕАУ:
Проф. д-р T. Knoll, Sindelfingen (DE) (председатель), Д-р I. Omar, Aberdeen (UK)
Отдел штатных сотрудников ЕАУ:
Мисс J. Darraugh, Arnhem (NL) Д-р K. Plass, Arnhem (NL), М-р R. Shepherd, Arnhem (NL) Д-р E.J. Smith, Arnhem (NL) Мисс S. Lina, Arnhem (NL) Мисс R. Seeger, Arnhem (NL)
Review
. 2023 Aug;84(2):207-222.
doi: 10.1016/j.eururo.2023.04.008.
Epub 2023 May 17.
Mauro Gacci
2
, Christian Gratzke
3
, Thomas R W Herrmann
4
, Markos Karavitakis
5
, Iason Kyriazis
6
, Sachin Malde
7
, Charalampos Mamoulakis
5
, Malte Rieken
8
, Vasileios I Sakalis
9
, Natasha Schouten
10
, Mark J Speakman
11
, Kari A O Tikkinen
12
, Jean-Nicolas Cornu
13
Affiliations
-
PMID:
37202311
-
DOI:
10.1016/j.eururo.2023.04.008
Review
Summary Paper on the 2023 European Association of Urology Guidelines on the Management of Non-neurogenic Male Lower Urinary Tract Symptoms
Stavros Gravas et al.
Eur Urol.
2023 Aug.
Abstract
Context:
Lower urinary tract symptoms (LUTS) are common, often bothersome, and have multifactorial aetiology.
Objective:
To present a summary of the 2023 version of the European Association of Urology guidelines on the management of male LUTS.
Evidence acquisition:
A structured literature search from 1966 to 2021 selected the articles with the highest certainty evidence. The Delphi technique consensus approach was used to develop the recommendations.
Evidence synthesis:
The assessment of men with LUTS should be practical. A careful medical history and physical examination are essential. Validated symptom scores, urine test, uroflowmetry, and postvoid urine residual, as well as frequency-volume charts for patients with nocturia or predominately storage symptoms should be used. Prostate-specific antigen should be ordered if a diagnosis of prostate cancer changes the treatment plan. Urodynamics should be performed for selected patients. Men with mild symptoms are candidates for watchful waiting. Behavioural modification should be offered to men with LUTS prior to, or concurrent with, treatment. The choice of medical treatment depends on the assessment findings, predominant type of symptoms, ability of the treatment to change the findings, and the expectations to be met in terms of the speed of onset, efficacy, side effects, and disease progression. Surgery is reserved for men with absolute indications, and for patients who fail or prefer not to receive medical therapy. Surgical management has been divided into five sections: resection, enucleation, vaporisation, and alternative ablative and nonablative techniques. The choice of surgical technique depends on patient’s characteristics, expectations, and preferences; surgeon’s expertise; and availability of modalities.
Conclusions:
The guidelines provide an evidence-based approach for the management of male LUTS.
Patient summary:
A clinical assessment should identify the cause(s) of symptoms and define the clinical profile and patient’s expectations. The treatment should aim to ameliorate symptoms and reduce the risk of complications.
Keywords:
Conservative management; Diagnostics; European Association of Urology guidelines; Male lower urinary tract symptoms; Patient; Pharmacological management; Surgical management; Treatment; Urinary incontinence.
Copyright © 2023 European Association of Urology. Published by Elsevier B.V. All rights reserved.
Similar articles
-
EAU Guidelines on the Assessment of Non-neurogenic Male Lower Urinary Tract Symptoms including Benign Prostatic Obstruction.
Gratzke C, Bachmann A, Descazeaud A, Drake MJ, Madersbacher S, Mamoulakis C, Oelke M, Tikkinen KAO, Gravas S.
Gratzke C, et al.
Eur Urol. 2015 Jun;67(6):1099-1109. doi: 10.1016/j.eururo.2014.12.038. Epub 2015 Jan 19.
Eur Urol. 2015.PMID: 25613154
Review.
-
EAU guidelines on the treatment and follow-up of non-neurogenic male lower urinary tract symptoms including benign prostatic obstruction.
Oelke M, Bachmann A, Descazeaud A, Emberton M, Gravas S, Michel MC, N’dow J, Nordling J, de la Rosette JJ; European Association of Urology.
Oelke M, et al.
Eur Urol. 2013 Jul;64(1):118-40. doi: 10.1016/j.eururo.2013.03.004. Epub 2013 Mar 13.
Eur Urol. 2013.PMID: 23541338
Review.
-
European Association of Urology Guidelines on the Diagnosis and Management of Female Non-neurogenic Lower Urinary Tract Symptoms. Part 1: Diagnostics, Overactive Bladder, Stress Urinary Incontinence, and Mixed Urinary Incontinence.
Nambiar AK, Arlandis S, Bø K, Cobussen-Boekhorst H, Costantini E, de Heide M, Farag F, Groen J, Karavitakis M, Lapitan MC, Manso M, Arteaga SM, Riogh ANA, O’Connor E, Omar MI, Peyronnet B, Phé V, Sakalis VI, Sihra N, Tzelves L, van Poelgeest-Pomfret ML, van den Bos TWL, van der Vaart H, Harding CK.
Nambiar AK, et al.
Eur Urol. 2022 Jul;82(1):49-59. doi: 10.1016/j.eururo.2022.01.045. Epub 2022 Feb 23.
Eur Urol. 2022.PMID: 35216856
Review.
-
Urodynamics tests for the diagnosis and management of bladder outlet obstruction in men: the UPSTREAM non-inferiority RCT.
Lewis AL, Young GJ, Selman LE, Rice C, Clement C, Ochieng CA, Abrams P, Blair PS, Chapple C, Glazener CM, Horwood J, McGrath JS, Noble S, Taylor GT, Lane JA, Drake MJ.
Lewis AL, et al.
Health Technol Assess. 2020 Sep;24(42):1-122. doi: 10.3310/hta24420.
Health Technol Assess. 2020.PMID: 32902375
Free PMC article.Clinical Trial.
-
European Association of Urology Guidelines on the Management of Female Non-neurogenic Lower Urinary Tract Symptoms. Part 2: Underactive Bladder, Bladder Outlet Obstruction, and Nocturia.
Arlandis S, Bø K, Cobussen-Boekhorst H, Costantini E, de Heide M, Farag F, Groen J, Karavitakis M, Lapitan MC, Manso M, Arteaga SM, Nambiar AK, Riogh ANA, O’Connor E, Omar MI, Peyronnet B, Phé V, Sakalis VI, Sihra N, Tzelves L, van Poelgeest-Pomfret ML, van den Bos TWL, van der Vaart H, Harding CK.
Arlandis S, et al.
Eur Urol. 2022 Jul;82(1):60-70. doi: 10.1016/j.eururo.2022.01.044. Epub 2022 Feb 16.
Eur Urol. 2022.PMID: 35181193
Review.
Cited by
-
Organ-specific off-target effects of Pim/ZIP kinase inhibitors suggest lack of contractile Pim kinase activity in prostate, bladder, and vascular smooth muscle.
Hu S, Trieb M, Huang R, Tamalunas A, Keller P, Götz M, Waidelich R, Stief CG, Hennenberg M.
Hu S, et al.
Naunyn Schmiedebergs Arch Pharmacol. 2023 Sep 1. doi: 10.1007/s00210-023-02664-6. Online ahead of print.
Naunyn Schmiedebergs Arch Pharmacol. 2023.PMID: 37658212
-
Predictors of early catheter replacement after HoLEP. Results from a high-volume laser center.
Di Maida F, Cadenar A, Grosso AA, Lambertini L, Giudici S, Paganelli D, Salamone V, Mari A, Salvi M, Minervini A, Tuccio A.
Di Maida F, et al.
Int Braz J Urol. 2023 Sep-Oct;49(5):608-618. doi: 10.1590/S1677-5538.IBJU.2023.0165.
Int Braz J Urol. 2023.PMID: 37506034
Free PMC article.
Publication types
MeSH terms
LinkOut — more resources
-
Full Text Sources
- ClinicalKey
- Elsevier Science
-
Medical
- MedlinePlus Health Information
-
Miscellaneous
- NCI CPTAC Assay Portal
Европейские КР
Все материалы «Библиотеки» доступны для просмотра и скачивания только
для зарегистрированных пользователей, имеющих статус «действующий член РОУ»
Пожалуйста, Зарегистрируйтесь, и получите доступ ко всем материалам.
Клинические рекомендации Европейской Ассоциации Урологов 2022
Клинические рекомендации Европейской Ассоциации Урологов 2021
Клинические рекомендации Европейской Ассоциации Урологов 2020
Клинические рекомендации Европейской Ассоциации Урологов 2019
Клинические рекомендации Европейской Ассоциации Урологов 2018
Клинические рекомендации Европейской Ассоциации Урологов 2017
Клинические рекомендации Европейской Ассоциации Урологов 2016
Клинические рекомендации Европейской Ассоциации Урологов 2014
Данный текст составлен на основании полнотекстового варианта рекомендаций Европейской ассоциации урологов (EAU) 2014 г.
Группой EAU были разработаны рекомендации по лечению ПКР, основанные на принципах доказательной медицины, для оказания помощи урологам в оценке подходов в терапии этой патологии и внедрения данных рекомендаций в клиническую практику. Публикации, касающиеся ПКР, в большинстве случаев носят ретроспективный характер и включают некоторые наиболее крупные многоцентровые исследования и другие качественные испытания с группой контроля. В последние годы было проведено большое количество рандомизированных исследований, в основном по медикаментозному лечению метастатического ПКР, что дало возможность сформулировать рекомендации, основанные на данных с высоким уровнем достоверности.
Там, где это было возможно, информации присваивались соответствующий уровень доказательности (УД) и степень рекомендации (СР) (табл. 1, 2).

Эпидемиология и этиология
ПКР составляет 2–3% всех опухолей с высоким уровнем заболеваемости в западных странах. В течение последних 2-х десятилетий имел место ежегодный прирост частоты возникновения ПКР в среднем на 2% как в Европе, так и во всем мире. В 2012 г. в Европейском союзе было зафиксировано 84 400 новых случаев ПКР и 34 700 смертей, связанных с этим заболеванием. В Европе вплоть до начала 1990-х гг. наблюдался рост общего уровня смертности от ПКР, затем он стабилизировался или стал снижаться.
На долю ПКР приходится около 90% всех злокачественных опухолей почек, обладающих специфическими патогистологическими и генетическими характеристиками. Частота заболеваемости среди мужчин в 1,5 раза выше, чем среди женского населения. Пик заболеваемости приходится на возрастной̆ промежуток 60–70 лет. Этиологические факторы включают курение, ожирение и повышенное давление. Наличие рака почки (РП) в анамнезе у родственников первой степени родства также ассоциируется с повышенным риском развития ПКР. Роль диеты и контакта с канцерогенами в развитии РП не доказана. Умеренное потребление алкоголя по неизвестным пока причинам может иметь профилактическое воздействие.
Широкое внедрение методов визуализации, таких как ультразвуковое исследование (УЗИ) и компьютерная томография (КТ), привело к увеличению числа случайно выявляемых опухолей, имеющих в основном меньшие размеры и более низкую стадию.
Проведенные исследования показали, что курение, ожирение и артериальная гипертензия являются подтвержденными факторами риска (УД 2а). Первичной профилактикой ПКР следует считать отказ от курения и борьбу с ожирением (СР В).
Диагностика и стадирование
Клиника
Многие образования почек остаются бессимптомными вплоть до поздних стадий заболевания. В настоящее время >50% всех случаев ПКР обнаруживаются случайно во время обследования пациентов по поводу других заболеваний органов брюшной полости (УД 3). Классическая триада клинических симптомов (боль в боку, макрогематурия и пальпируемое образование в брюшной полости) сегодня встречается редко (6–10%) и коррелирует с агрессивной гистологией и поздней стадией заболевания (УД 3). У 30% пациентов, имеющих клинические признаки ПКР, могут присутствовать паранеопластические синдромы, такие как повышенное артериальное давление, кахексия, снижение массы тела, лихорадка, нейромиопатия, амилоидоз, повышенная скорость оседания эритроцитов (СОЭ), анемия, нарушения функции печени, полицитемия и гиперкальциемия (УД 4). У некоторых больных наряду с клиническими признаками проявляются также симптомы метастатического заболевания, такие как боль в костях или постоянный кашель (УД 3).
При наличии пальпируемой опухоли в брюшной полости, пальпируемых шейных лимфатических узлах, постоянного варикоцеле и двустороннего отека нижних конечностей больным показано более детальное лучевое обследование.
Лабораторная диагностика
К наиболее часто определяемым лабораторным параметрам относят уровень сывороточного креатинина, скорость клубочковой фильтрации (СКФ), общий анализ крови, СОЭ, исследования функции печени, уровень щелочной фосфатазы, лактатдегидрогеназы (ЛДГ) и сывороточного кальция с поправкой, коагулограмму и анализ мочи (УД 4). При наличии центральных почечных масс, прилегающих или открывающихся в просвет собирательной системы почки, необходимо проводить цитологическое исследование мочи и, возможно, эндоскопическое исследование верхних мочевых путей с целью исключения уротелиального рака (УД 4).
Отдельно двустороннюю функцию почек необходимо оценивать при помощи нефросцинтиграфии в следующих ситуациях (УД 2b): при нарушении функции почек, о чем свидетельствуют повышение концентрации креатинина в сыворотке крови или значительно сниженная СКФ; при наличии риска значительного снижения почечной функции в процессе лечения (опухоль единственной почки, опухолевое поражение обеих почек при наследственных формах рака).
Нефросцинтиграфия также важна у пациентов, имеющих риск снижения функции почек в будущем по причине наличия сопутствующих заболеваний, таких как сахарный диабет, тяжелая артериальная гипертензия, хронический пиелонефрит, реноваскулярная болезнь, почечнокаменная болезнь или поликистоз почек.
Лучевая диагностика
Большую часть опухолей почек выявляют при УЗИ или КТ, выполняемых по другому поводу (УД 3). Визуализация может использоваться для разделения образований почек на солидные и кистозные. Для солидных образований в почках важнейшим дифференциальным критерием злокачественных новообразований является наличие контрастирования (УД 3). Традиционно для выявления и характеристики образований почек используют УЗИ, КТ или магнитно-резонансную томографию (МРТ). УЗИ с контрастированием может быть полезным у пациентов с хронической почечной недостаточностью и относительными противопоказаниями к использованию контрастных веществ, со сложными кистозными опухолями, а также для дифференциальной диагностики сосудистых заболеваний на периферии почки, таких как инфаркт и некроз коркового слоя почки (УД 3).
Визуализация с помощью КТ или МРТ
КТ или МРТ используют для определения характера новообразований почки, причем получать изображения нужно как до, так и после внутривенного введения контрастного вещества, чтобы обнаружить контрастирование. На снимках КТ контрастирование в новообразованиях почек определяется путем сравнения контрастности по шкале Хаусфилда (в единицах шкалы HU) до и после введения контраста. Изменение контрастности на 15 единиц HU является убедительным доказательством контрастирования (УД 3). При КТ или МРТ бывает крайне затруднительно отличить онкоцитому и безжировую ангиомиолипому (АМЛ) от злокачественных новообразований (УД 3).
КТ органов брюшной полости позволяет диагностировать ПКР и получить информацию о строении и функции контралатеральной почки (УД 3), распространении первичной опухоли с выходом за пределы почки, вовлечении венозной системы, увеличении регионарных лимфатических узлов и состоянии надпочечников и печени (УД 3). КТ–ангиография сосудов брюшной полости с контрастированием применяется для оценки кровоснабжения почек (особенно при планировании резекции почки).
В случае если данные КТ неопределенные, можно прибегнуть к выполнению МРТ и получить дополнительную информацию относительно выявления контрастирования, местного распространения злокачественного образования и степени поражения венозной системы (УД 3). МРТ также показана пациентам с аллергией на контрастный препарат и беременным без нарушения функции почек (УД 3).
Почечная артериография и кавография имеют ограниченные показания и используются в качестве дополнительных средств диагностики у отдельных пациентов с ПКР (УД 3). У больных с малейшими признаками снижения функции почек следует рассмотреть вопрос о проведении изотопной ренографии и полной оценки почечной функции (УД 2а). В настоящее время позитронно-эмиссионная томография (ПЭТ) не является стандартным методом исследования (УД 3).
КТ органов грудной клетки – наиболее точный метод выявления метастазов в легких (УД 3). При недоступности КТ для обнаружения легочных метастазов следует выполнить рентгенографию органов грудной клетки. Большая часть метастазов в кости и головной мозг имеют те или иные клинические проявления к моменту постановки диагноза, поэтому рутинное выполнение сканирования костей скелета и КТ головного мозга обычно не показаны (УД 3).
Классификация кистозных новообразований в почках по Босняку
Классификация по Босняку используется для оценки кистозных новообразований в почках на основании их вида на КТ-изображениях с целью прогнозирования риска возникновения злокачественного образования (табл. 3) (УД 3).
Биопсия почек
Чрескожная биопсия опухолей почек чаще применяется для гистологического подтверждения рентгенологически неопределенных опухолей почек, отбора пациентов с целью динамического наблюдения, верификации диагноза до проведения аблативных методов лечения, а также проведения системной терапии пациентам с метастазирующим РП (УД 3). Чрескожная биопсия опухоли почки может быть выполнена либо путем пункционной биопсии, либо с помощью тонкоигольной биопсии. В связи с высоким процентом выявления опухоли почки по данным КТ или МРТ (при условии накопления контрастного вещества) дооперационная биопсия почки не показана пациентам с высокой ожидаемой продолжительностью жизни (УД 4).
В большинстве случаев биопсия опухоли почки выполняется под местной анестезией (УД 3). В зависимости от расположения опухоли биопсия выполняется под контролем УЗИ или КТ (УД 2b). Для биопсии применяют иглу калибра 18G, позволяющую предоставить достаточный объем материала для гистологического исследования (УД 2b). С целью профилактики диссеминации клеток опухоли при биопсии последнюю следует проводить через специальную канюлю (коаксиальный метод биопсии) (УД 3). Должны быть получены по крайней мере 2 фрагмента ткани (полноценные, >10 мм в длину). Также следует избегать получения некротических тканей, чтобы увеличить диагностическую ценность метода (УД 4), для этого биопсию следует проводить из периферической зоны (УД 2b).
Чрескожная биопсия опухоли почки имеет низкую морбидность. Наиболее частые осложнения – гематурия и субкапсулярная или параренальная гематомы. В целом кровотечение не является клинически значимым (0,0–1,4%) и чаше всего ограничивается почкой. Пункционная биопсия опухоли почки имеет большее диагностическое значение, т. к. позволяет определить ее гистологическое строение и степень злокачественности по сравнению с тонкоигольной биопсией (УД 2b). Большой размер опухоли и солидный компонент являются предикторами пункционной биопсии (УД 2b). Диагностическая ценность биопсии почки составляет 78–97%, специфичность – 98–100%, чувствительность – 86–100% (УД 2b). При отрицательной биопсии, но при подозрении на наличие злокачественной опухоли по данным рентгенологических методов исследования стоит рассмотреть вариант проведения повторной биопсии или хирургического вмешательства (УД 4). Оценка степени дифференцировки опухоли по данным биопсии является сложной задачей. Классификация Фурмана ограничена (43–75%), но может быть улучшена при использовании упрощенной двухуровневой системы (высокая степень против низкой степени) (УД 2b). Биопсия имеет низкую диагностическую ценность для кистозных опухолей почек и не может быть рекомендована в этих случаях при отсутствии участков с твердым компонентом (классификация кист по Босняку – IV) (УД 2b). Комбинация тонкоигольной и пункционной биопсии целесообразна при сложных кистозных образованиях (УД 3).
Гистологическая диагностика
Новообразования почек включают широкий спектр гистологических форм, описанных в 2004 г. ВОЗ и модифицированных The International Society of Urological Pathology (ISUP) Vancouver Classification. С клинической точки зрения важны 3 основных гистологических подтипа ПКР: cветлоклеточный, папиллярный (типы I и II) и хромофобный (табл. 4).
Во всех гистологических подтипах ПКР прогноз ухудшается в зависимости от стадии и гистологической степени (табл. 5, 6).
Улучшение показателя 5-летней общей выживаемости (ОВ) для каждого гистологического подтипа ПКР, составляющего 49%, произошло с 2006 г., что, по-видимому, связано с ранним обнаружением ПКР и введением ингибиторов тирозинкиназы. Саркомоподобные изменения характерны для всех гистологических подтипов ПКР и эквивалентны высокой степени злокачественности и агрессивности опухоли.
Светлоклеточный ПКР
Макроскопически капсула обычно отсутствует. Большая по размеру опухоль может быть с инфильтративным ростом. Поверхность разреза золотисто-желтого цвета с кровоизлияниями и некрозом. Обычно используется классификация Фурмана. Определяется специфической делецией хромосомы 3р и мутацией в гене фон Хиппеля-Линдау (VHL), расположенном в хромосоме 3р25. Пациенты со светлоклеточным ПКР имеют худший прогноз по сравнению пациентами с папиллярным и хромофобным ПКР. Пятилетняя раково-специфическаявыживаемость (РСВ) составляет 91, 74, 67 и 32% для пациентов с клинической стадией T1, T2, T3 и T4 соответственно (пациенты, пролеченные в период с 1987 по 1998 гг.). Вялотекущий вариант светлоклеточного ПКР имеет многоячеистую кистозную структуру и составляет 4% всех светлоклеточных вариантов ПКР.
Папиллярный ПКР
Папиллярный ПКР макроскопически состоит из псевдокапсул желтого или коричневого цвета с мягкой структурой. Наиболее устойчивые генетические изменения – трисомия по хромосомам 7 и 17 и потеря Y-хромосомы. Папиллярный ПКР неоднороден и состоит из 3 подтипов: 2 основных (1 и 2) и третий – онкоцитарная карцинома. По сравнению со светлоклеточным папиллярный ПКР имеет более высокий уровень опухолей, ограниченных органом, – клиническую стадию pT1-2N0M0 (74,9% против 62,9%) и высокий уровень 5-летней РСВ (85,1% против 76,9%). Прогноз папиллярного ПКР 2-го типа хуже, чем 1-го типа (2,16 против 3,28). Экзофитный рост, псевдонекротические изменения и псевдокапсулы – типичные признаки папиллярного ПКР 1-го типа. Псевдокапсулы и обширные некротические изменения приводят к возникновению опухоли сферической формы в экстраренальном отделе. Опухоли с массивными некрозами хрупки и уязвимы в отношении спонтанных разрывов и разрывов при минимальных травмах с последующим развитием забрюшинного кровотечения. Хорошо развитая псевдокапсула папиллярного ПКР 1-го типа не приводит к разрывам, несмотря на наличие некроза. На постконтрастных снимках КТ очаги некрозов выглядят эхонегативными в центральной части опухоли, окруженной ее тканью, накапливающей контрастный препарат на КТ.
Хромофобный ПКР
Макроскопически хромофобный ПКР – бледно-коричневая, относительно однородная и жесткая, ограниченная масса, лишенная капсулы. В 2010 г. вместо классификации Фурмана была предложена система патогистологической оценки G.P. Paner et al. Генетически характеризуется потерей 2, 10, 13, 17 и 21-й хромосом. Для данного типа ПКР характерен относительно благоприятный прогноз, 5–летняя безрецидивная выживаемость (БРВ) (89,3%) и РСВ (93,0%), а также 10-летняя РСВ (88,9%).
Заключение
Многие пациенты с ПКР по-прежнему имеют клинические симптомы, такие как наличие пальпируемых образований, гематурия, паранеопластический и метастатический синдромы (УД 3). Точное стадирование ПКР с помощью КТ или МРТ органов брюшной и грудной полостей является обязательным (УД 3). КТ – наиболее чувствительный метод, применяющийся для определения метастазов в легкие. При отсутствии КТ необходимо выполнить рентгенографию органов грудной клетки. Сканирование костей скелета и проведение КТ головного мозга при отсутствии специфических клинических показаний не являются оправданными.
Все чаще в постановке диагноза применяется чрескожная биопсия опухоли почки: для гистологического подтверждения рентгенологически неопределенных опухолей почек, при отборе пациентов для динамического наблюдения и аблативных методов лечения, для системной терапии пациентов с метастазирующим ПКР (мПКР).
Рекомендации
КТ и МРТ брюшной полости с контрастированием рекомендуются для наблюдения за пациентами с ПКР и являются равнозначными методами для стадирования и постановки диагноза (СР B). КТ и МРТ брюшной полости с контрастированием – наиболее подходящие методы визуализации для определения характеристики РП и стадирования перед операцией (СР C). КТ грудной клетки рекомендована для определения вовлеченности в процесс легких и средостения (СР C). Остеосцинтиграфия обычно не рекомендуется (СР C). Биопсия почки рекомендована перед аблативными методами лечения и системной терапией у пациентов без сопутствующей патологии (СР C). Чрескожная биопсия почки рекомендована пациентам, которым показано активное наблюдение (СР C), она должна быть выполнена коаксиальным методом (СР C).
Классификация и прогностические факторы
Классификация
Общепринятой системой стадирования ПКР является классификация TNM, рекомендованная для использования в клинической и научной работе. Последняя классификация TNM была опубликована в 2010 г. (табл. 7). Прогностическое значение классификации TNM подтверждено одно- и мультицентровыми исследованиями. Тем не менее некоторые неопределенности остаются: в подразделе опухолей, относящихся к стадии T1, резецирование (4 см) не может быть оптимальным методом при локализованном раке; значение размера опухолей клинической стадии T2 было поставлено под сомнение; версия классификации TNM от 2002 г. относила опухоли с инвазией в клетчатку почечного синуса к клинической стадии рТ3а. Однако с учетом накопленных данных можно предположить, что при инвазии опухоли в почечный синус прогноз хуже, чем при инвазии в паранефральную жировую клетчатку, и, следовательно, такие опухоли не следует включать в группу стадирования рТ3а (УД 3); некоторые подразделы классификации TNM (pT2b, pT3a, pT3c and pT4) могут пересекаться; точность подраздела N1–N2 была поставлена под сомнение (УД 3); для определения категории М у больных РП должно выполняться тщательное дооперационное инструментальное обследование, включающее выполнение КТ грудной и брюшной полостей (УД 4).
К прогностическим факторам можно отнести анатомические, гистологические, клинические и молекулярные факторы.
Анатомические факторы включают размер опухоли, венозную инвазию, инвазию капсулы почки, вовлечение в процесс надпочечника, лимфатических узлов, а также наличие отдаленных метастазов. Данные факторы объединены в общепринятой классификации TNM (табл. 7, 8).
Использование анатомической системы классификации опухолей почек позволяет объективно прогнозировать потенциальную морбидность органосохраняющих операций (ОСО) и аблативных методов лечения, предоставляет информацию о планировании хода лечения, для консультирования пациентов и надлежащего сравнения резекции опухоли и аблативных методов лечения. Тем не менее при выборе наилучшего метода лечения анатомические особенности всегда должны рассматриваться в сочетании с особенностями пациента и опытом хирурга.
К гистологическим факторам относятся степень клеточной дифференцировки по Фурману, подтип ПКР, признаки саркоматоидного характера, инвазия в мелкие сосуды, некроз опухоли и инвазия в собирательную систему. Степень дифференцировки по Фурману является общепринятой системой гистологической классификации в случае ПКР. Недавно было выдвинуто предположение о том, что упрощенная 2- или 3-уровневая классификация по Фурману может быть такой же точной, как и классическая 4-уровневая схема (УД 3).
Согласно классификации ВОЗ выделяют 3 основных гистологических подтипа ПКР, подтвержденных на молекулярном уровне с помощью генетических и цитогенетических исследований (УД 2b): светлоклеточный – 80–90%; папиллярный – 10–15%; хромофобный – 4–5%.
Как показывают результаты однофакторного анализа, имеет место тенденция к получению более благоприятного прогноза у пациентов с хромофобным раком по сравнению с таковым у больных папиллярным или светлоклеточным ПКР (УД 3).
Среди пациентов с папиллярным раком было выделено 2 прогностически различных группы: тип 1 – опухоль с низким злокачественным потенциалом, клетки с хромофильной цитоплазмой, благоприятный прогноз и тип 2 – опухоль высокого злокачественного потенциала, клетки с эозинофильной цитоплазмой, высокая предрасположенность к метастазированию (УД 3). РП, связанный с транслокацией 11,2 Xp, ассоциирован с плохим прогнозом. При низкой частоте встречаемости данный вид рака следует подозревать у молодых пациентов.
Клинические факторы включают общее состояние пациента, местные симптомы, степень кахексии, выраженность анемии и число тромбоцитов (УД 3).
В настоящее время проводят исследования большого количества молекулярных маркеров, включая карбонангидразу IX (CaIX), сосудистый эндотелиальный фактор роста (VEGF), фактор, индуцируемый гипоксией (HIF), Ki 67 (пролиферация), p53, PNEN (гомолог фосфатазы и тензина), E-кадгерин, C-реактивный белок (CRP), остеопонтин и CD 44 (клеточная адгезия) (УД 3). До сегодняшнего дня ни один из этих маркеров не смог продемонстрировать улучшения точности предсказаний нынешних прогностических систем, поэтому в регулярной практике их использование не рекомендуется.
В последние годы были разработаны и прошли испытания на больных из других медицинских центров послеоперационные прогностические системы и номограммы, включающие комбинации независимых прогностических факторов. Эти системы могут быть более точными, чем классификация TNM или градация по Фурману в отдельности для прогнозирования выживаемости (УД 3). Важным преимуществом номограмм является их способность измерять точность прогноза, что позволяет объективно оценить все новые прогностические параметры. Разработано несколько новых дооперационных номограмм, обладающих высокой точностью прогноза. Наиболее распространенные прогностические системы приведены в таблице 9.
Заключение
У пациентов с ПКР должны быть определены следующие параметры, дающие прогностически важную информацию: стадия по классификации TNM, степень дифференцировки по Фурману и гистологический подтип согласно классификации ВОЗ (2004) (УД 2).
Рекомендации
Рекомендуется использовать современную классификацию TNM (CР В), а также деление ПКР на гистологические варианты (СР В). При метастатическом ПКР рекомендуется использовать прогностические системы (СР В). Применение интегрированных прогностических систем или номограмм при локализованной форме заболевания не рекомендуется, хотя эти системы могут быть полезными при включении больных в клинические исследования (СР С). Не рекомендуется использование в повседневной практике молекулярных прогностических маркеров (СР С).
Прочие опухоли почек
На основании результатов подробных морфологических исследований была создана нынешняя классификация новообразований в почечном эпителии, изложенная в монографии, подготовленной ВОЗ в 2004 г. Пересмотренная патогистологическая классификация была опубликована в 2013 г. ISUP Ванкуверовской классификацией новообразований почек. Эта классификация, по-видимому, составляет новую классификацию ВОЗ. Приблизительно 85–90% всех злокачественных новообразований почек приходятся на распространенный светлоклеточный, папиллярный и хромофобный типы рака. Остальные 10–15% опухолей почек включают разнообразные редкие спорадические и семейные карциномы и группу неклассифицированных карцином.
Карцинома собирательной системы Беллини – очень редкий тип ПКР, часто выявляемый на поздней стадии развития болезни. До 40% пациентов имеют метастазы при первом обращении, и большинство из них умирает в течение 1–3 лет с момента постановки первоначального диагноза. Отношение рисков РСВ по сравнению со светлоклеточным ПКР составляет 4,49. В настоящее время на примере наибольшей серии показано, что метастазы в регионарных лимфатических узлах на момент постановки диагноза присутствовали у 44% пациентов, а отдаленные метастазы были обнаружены у 32%. Показатель выживаемости составил 48% за 5 лет и 14% – за 10 лет. Медиана выживаемости составила 30%, ответ на таргетную терапию был неудовлетворителен.
Медуллярная карцинома почки – разрушительное злокачественное образование, в первую очередь поражающее молодых чернокожих людей, гетерозиготных по серповидно-клеточной анемии. Тем не менее в последнее время появились случаи обнаружения данного заболевания у белых пациентов, а также у испаноговорящих. Заболевание является подтипом карциномы собирательной системы, встречается очень редко и составляет примерно 2% всех первичных опухолей почек у молодых людей в возрасте от 10 до 20 лет. У 95% пациентов на момент обращения наблюдается наличие метастазов. Медиана выживаемости составляет 5 мес. Однократного хирургического вмешательства недостаточно, системная терапия не определена, используются различные режимы химиотерапии, опухоль рентгеночувствительна.
Саркоматоидный ПКР – это ПКР разного типа, трансформировавшийся в рак высокой степени дифференцировки, однако сам по себе он не выделен в отдельную гистологическую разновидность. При наличии саркоматоидных изменений ПКР прогноз ухудшается. Метастазы саркоматоидного ПКР ассоциированы с плохим ответом на системную терапию. Лечение сунитинибом привело к незначительному числу положительных ответов на лечение. Комбинация гемцитабина и доксорубицина может быть одним из вариантов лечения (УД 3, СР С).
Неклассифицированный ПКР – это диагностическая категория, используемая для определения такого вида ПКР, который не может быть отнесен к каким-либо другим категориям, характерным для карцином ПКР-типа.
Мультилокулярный кистозный ПКР – хорошо дифференцированный светлоклеточный ПКР, на который приходится до 4% опухолей почек, удаляемых хирургическим путем. До настоящего времени не дано описания метастазов для данной опухоли. Согласно классификации по Босняку мультилокулярный светлоклеточный ПКР представляет собой кистозные новообразования II или III типа. Однако такие же типы новообразований по Босняку характерны для смешанной эпителиально-стромальной опухоли почки, кистозной нефромы или мультилокулярной кисты (все они относятся к доброкачественным опухолям). Во многих случаях выполнение предоперационной биопсии и интраоперационное исследование замороженных срезов не дают возможности установить правильный диагноз. К счастью, для всех этих опухолей существует одна и та же стратегия оперативного органосохраняющего лечения (УД 3, СР В).
Гибридная онкоцитома (хромофобный ПКР) имеет смесь клеток хромофобного ПКР почечной онкоцитомы. Может произойти в 3-х различных клинико-патологических ситуациях: спорадической, ассоциированной с почечным онкоцитозом или онкоцитоматозом, или у пациентов с синдромом Бёрта–Хогга–Дюбе (характеризуется наличием гематом на коже и несколькими опухолями почки). Данных за злокачественность получено не было. Тем не менее пациентам необходимо наблюдаться так же, как при хромофобном ПКР.
Транслокационные карциномы почек – редкие опухоли, встречающиеся у молодых людей и лишь у 25% в возрасте более 40 лет. Данный вид опухоли состоит из 2-х подгрупп с участием хромосомы 6p21 или Xp11.2. Оба типа имеют высокий злокачественный потенциал. Некоторые VEGF-таргетные препараты продемонстрировали эффективность в клинической практике в отношении 2-х подгрупп транслокационной карциномы.
Тубулокистозный ПКР характерен для мужчин в любом возрасте. Существует возможная связь с папиллярным ПКР, что часто приводит к развитию кистозного компонента (Босняк III или IV). Опухоль обладает опеределенным потенциалом злокачественности, однако в большинстве случаев (90%) имеет вялотекущий характер.
Муцинозная тубулярная и веретеноклеточная карциномы ассоциированы с петлей Генле. Большинство муцинозных тубулярных и веретеноклеточных карцином ведут себя так же, как и опухоли с низкой степенью дифференцировки.
Карцинома, ассоциированная с терминальной стадией заболевания почек и приобретенной кистозной болезнью, ассоциированной с ПКР. Дегенеративные кистозные изменения (приобретенные кисты почек) и более высокая частота развития ПКР являются типичными чертами терминальной стадии заболеваний почек. Приобретенные кисты почек встречаются почти в 50% случаев у пациентов, проходящих диализ, но частота встречаемости зависит также от продолжительности диализа, пола (у мужчин – в 3 раза чаще) и диагностических критериев, принятых в методике оценки состояния. В случае наличия терминальных стадий заболеваний собственных почек ПКР обнаруживается у 4% пациентов. Риск развития ПКР в течение жизни для таких больных по меньшей мере в 10 раз выше, чем в популяции в целом. По сравнению со спорадическим ПКР рак, ассоциированный с терминальной стадией заболевания почек и приобретенным кистозом почек, характеризуется мультицентричностью, билатеральностью и меньшей агрессивностью и встречается у более молодых пациентов (чаще мужчин). ПКР, развивающийся у больных, перенесших трансплантацию, проявляется более благоприятными клиническими, патологическими и функциональными результатами, чем у больных, проходящих диализ. Несмотря на то, что гистологический спектр опухолей в рамках приобретенных кист почек подобен таковому при спорадическом ПКР, в большинстве своем среди этих случаев рака преобладает папиллярная форма: в опухолях, развитие которых связано с приобретенными кистами, она составляет 41–71%, тогда как при спорадическом раке – 10%. Остальные опухоли представлены в основном светлоклеточным раком. ПКР, ассоциированный с терминальной стадией заболевания почек и приобретенными кистами, был описан под названием кистозной болезни, связанной с ПКР. Пациентам с терминальной стадией заболевания почек необходимо проходить ежегодную оценку состояния почек. Таким больным может быть выполнена радикальная нефрэктомия (РНЭ).
Светлоклеточный (тубуло) папиллярный ПКР, почечная ангиомиоматозная опухоль. Данный вид опухоли встречается у пациентов с терминальной стадией почечной недостаточности. Однако большинство описанных случаев были спорадическими. Опубликованные данные свидетельствуют о вялотекущем процессе. Ни одного случая метастазирования отмечено не было. Опухоль аналогичной морфологии и иммунофенотипа, но с видимой стромой гладких мышц была обозначена термином «ангиомиоматозная опухоль почки».
ПКР, связанный с наличием нейробластомы, – редкий вид опухоли, возникающий у людей, перенесших в детстве нейробластому. Данная группа пациентов имеет 329-кратный риск заболевания РП. Опухоль гетерогенна и характеризуется онкоцитоидными особенностями. Ее развитие возможно у детей обоих полов.
Папиллярные аденомы – опухоли папиллярного или тубулярного строения с низкой степенью дифференцировки и диаметром ≤5 мм. Из-за мелкого размера их обычно обнаруживают случайно в срезах почечной ткани при выполнении нефрэктомии.
Метанефральные опухоли подразделяют на метанефральную аденому, аденофиброму и метанефральные стромальные опухоли. Это редкие доброкачественные опухоли, подлежащие хирургическому удалению.
Эпителиальные и стромальные опухоли почек – это 2 вида доброкачественных смешанных мезенхимальных и эпителиальных опухолей (объединенные согласно новой концепции): кистозная нефрома и смешанные эпителиально-стромальные опухоли. Визуализация показывает, что большая часть кистозных новообразований, представляющих данный тип опухолей, может быть классифицирована по Босняку как относящиеся к III, реже – ко II или IV классам. Оба вида новообразований в целом считаются доброкачественными и подлежат удалению.
Онкоцитомы почек – доброкачественные опухоли, составляющие от 3 до 7% всех опухолей почек. Стандартным методом диагностики служит гистопатологическое исследование. Несмотря на то, что дооперационный диагноз можно поставить только с помощью выполнения чрескожной биопсии, этот метод не является специфичным для онкоцитомы, т. к. ее клетки также обнаруживаются в светлоклеточном ПКР, гранулярно-клеточном варианте ПКР, эозинофильном и онкоцитарном вариантах папиллярного ПКР (тип 2). В отдельных случаях можно прибегнуть к выжидательной тактике наблюдения. Альтернативными методами являются резекция почки и минимально инвазивные методы лечения (УД 3, СР С).
Наследственные опухоли почек могут встречаться при синдроме фон Хиппеля–Линдау, наследственном папиллярном ПКР, синдроме Бёрта–Хогга–Дюбе, врожденных лейомиоматозах и ПКР, туберозном склерозе, внутриутробной мутации сукцинатдегидрогеназы, неполипозном колоректальном раковом синдроме, гиперпаратиреозе, конституциональной транслокации 3-й хромосомы и семейном бессиндромном светлоклеточном ПКР. Почечная медуллярная карцинома также может быть включена в этот перечень из-за своей связи с наследственной гемоглобинопатией.
К мезенхимальным опухолям относят различные типы сарком. За исключением АМЛ они встречаются относительно редко.
АМЛ – доброкачественная мезенхимальная опухоль, состоящая в различной степени из жировой ткани, веретенообразных и эпителиоидных гладкомышечных клеток, а также включающая кровеносные сосуды с аномально утолщенными стенками. Такие опухоли могут возникать спорадически, причем у женщин это случается в 4 раза чаще. Также они встречаются при туберозном склерозе и в этом случае имеют множественный характер, более крупный размер, билатеральны и могут вызывать обильные кровотечения. АМЛ составляют около 1% опухолей, удаляемых хирургическим путем. Диагностируется часто при проведении УЗИ, КТ или МРТ благодаря наличию жировой ткани. Выполнение биопсии редко оказывается результативным. До операции нередко бывает сложно провести различие между АМЛ и опухолями, содержащими в основном клетки гладкой мускулатуры, а также между АМЛ и эпителиальными опухолями. АМЛ может быть обнаружена в лимфатических узлах при туберозном склерозе, однако это не считается метастазом. АМЛ свойственен сосудистый рост с вовлечением НПВ и почечной вены. АМЛ с вовлечением лимфатических узлов и опухолевого тромба является доброкачественной. Эпителиоидные АМЛ представляют потенциально злокачественный вариант данной опухоли. АМЛ свойственны медленный и постепенный рост (0,088 см/год) и низкая морбидность. Основное осложнение АМЛ – ретроперитонеальное кровотечение или кровотечение в собирательную систему почек, которое может представлять угрозу для жизни больного. Кровоточивость связана с присутствием в опухоли ангиогенного компонента, характеризующегося неравномерно растущими и аневризматическими кровеносными сосудами. Основные факторы риска развития кровотечений – это размер опухоли, степень выраженности ангиогенного компонента в ней и наличие у больного туберозного склероза. Первоочередными показаниями к выполнению вмешательства являются такие симптомы, как боль, кровотечение или подозрение на злокачественный характер опухоли.
В основном АМЛ могут быть вылечены с помощью применения органосохраняющих подходов, но в некоторых ситуациях может потребоваться полное удаление почки (УД 3). Также могут быть использованы селективная артериальная эмболизация (САЭ) и радиочастотная аблация (РЧА). Несмотря на то, что САЭ эффективна для остановки кровотечения в остром случае, для долгосрочного решения проблемы АМЛ ее пригодность ограничена. Клинические испытания ингибиторов mTOR, а также сиролимуса в сочетании с отложенной операцией продолжаются.
Дальнейшие исследования требуются для того, чтобы определить характер и течение новых гистологических разновидностей опухолей: редкой тироидоподобной фолликулярной опухоли, имитирующей фолликулярный рак щитовидной железы; ПКР, связанного с мутацией сукцинатдегидрогеназы В; ПКР, связанного с транслокацией анапластической лимфомы киназы.
Обзор прочих опухолей почек с указанием возможности озлокачествления и рекомендаций по проведению лечения представлен в таблице 10.
Заключение
За исключением АМЛ большую часть этих менее часто встречающихся опухолей почек на основании результатов лучевой диагностики невозможно отличить от ПКР, поэтому их лечение должно быть таким же, как и в случае ПКР (УД 3). При доказанной онкоцитоме предпочтительно наблюдение (УД 3). Стандартизированного подхода к лечению редких видов ПКР не существует (УД 3).
Рекомендации
Кисты с типом по Босняку >III следует рассматривать как вариант ПКР и лечить их соответствующим образом (СР С). В случае выявления АМЛ хирургическое вмешательство, термоаблация и САЭ могут быть рассмотрены в том случае, если: опухоль большая по размеру (ранее рекомендованный порог >(3) 4 см оспаривается); опухоль имеет место у женщины детородного возраста; наблюдение недостаточно у данного пациента. Предпочтительна ОСО (СР С).
Лечение локализованного ПКР
Хирургическое лечение. Органосохраняющая операция и нефрэктомия
Проведенные исследования показали, что показатели РСВ открытой резекции почки и открытой нефрэктомии сопоставимы. Так, например, при медиане наблюдения 9,3 года выживаемость в группе больных, перенесших РНЭ, составила 72,5%, а в группе больных, перенесших резекцию почки, – 64,4%. Местный рецидив зафиксирован у 1 пациента, перенесшего РНЭ, и у 6 пациентов, перенесших резекцию почки.
Ряд исследований показал, что РНЭ ассоциирована с высокой смертностью. Различий между резекцией почки и РНЭ у пациентов с ПКР 4–7 см отмечено не было. Также не было отмечено различий в ОВ, РСВ и БРВ у пациентов, перенесших лапароскопическую резекцию почки и лапароскопческую нефрэктомию при РП >4 см. Различий в продолжительности госпитализации, средней кровопотере и частоте переливания крови не отмечено. Качество жизни у больных, перенесших резекцию почки, было лучше, чем у пациентов, перенесших РНЭ. При сравнении РЧА, РНЭ и резекции почки РСВ в каждом из 3-х методов лечения составила 100%.
Выполнение ОСО при локализованном ПКР предпочтительно, тем не менее у части больных локализованным ПКР осуществление ОСО по ряду причин не представляется возможным. К этим причинам относят: местно-распространенный рост опухоли; невозможность выполнения резекции из-за неблагоприятного расположения опухоли; значительное ухудшение общего состояния пациента. В этих ситуациях единственным методом лечения остается выполнение РНЭ, являющейся «золотым стандартом» лечения.
Различий в 5- и 10-летней ОВ у больных, которым была выполнена адреналэктомия, и у тех, кому она не проводилась, отмечено не было. Проведение адреналэктомии оправданно при наличии рентгенологических и интраоперационных данных, подтверждающих целесообразность ее выполнения.
КТ и МРТ не позволяют обнаружить метастазы в лимфоузлах нормального размера. Расширенная диссекция лимфатических узлов – основной метод оценки их состояния. Ретроспективные исследования показывают, что проведение лимфодиссекции оправданно у пациентов высокого риска (размер опухоли >10 см, клиническая стадия T3-4, высокая степень дифференцировки по Фурману, наличие саркомоподобных особенностей или коагуляционный некроз опухоли). Выживаемость выше у пациентов с меньшим количеством положительных лимфоузлов (<4) и отсутствием экстранодального расширения. Была предложена предоперационная номограмма оценки степени поражения лимфоузлов.
Отсутствуют какие-либо преимущества выполнения эмболизации перед проведением обычной нефрэктомии. Пациентам, которые не могут перенести операцию, а также с болями вследствие метастазов выполнение эмболизации позволяет уменьшить выраженность симптомов, например, таких как гематурия, боль в боку или костях. Осуществление эмболизации до начала проведения резекции гиперваскулярных метастазов в кости или позвоночник способствует уменьшению кровопотери в ходе операции.
Заключение
Онкологические результаты резекции почки сопоставимы с таковыми при РНЭ (УД 1b). Ипсилатеральная адреналэктомия во время радикальной резекции почки не увеличивает ОВ (УД 3). Проведение РНЭ в сочетании с лимфодиссекцией у пациентов с локализованным РП и отсутствием клинических признаков метастазирования в лимфатические узлы не увеличивает выживаемость (УД 1b). Выполнение лимфодиссекции у пациентов с локализованным РП и увеличенными лимфатическими узлами может быть проведено с целью стадирования (УД 3). Эмболизация может быть применена в качестве паллиативного метода лечения у определенных пациентов (УД 3).
Рекомендации
Пациентам с локализованным РП должно быть рекомендовано хирургическое лечение (СР В). Выполнение ОСО рекомендовано пациентам с клинической стадией T1a (CР А). У пациентов с клинической стадией T1b и при наличии технической возможности должна выполняться ОСО (СР В). Выполнение адреналэктомии не рекомендовано при отсутствии клинических признаков поражения надпочечников (СР В). Выполнение лимфодиссекции не рекомендовано при отсутствии клинических признаков поражения лимфоузлов (СР А). У пациентов с увеличенными лимфоузлами по данным исследований лимфодиссекция может быть проведена с целью стадирования и местного контроля (СР С).
Радикальная нефрэктомия
Онкологические результаты лапароскопической и открытой РНЭ схожи. Тем не менее лапароскопическая нефрэктомия ассоциирована с меньшей кровопотерей, меньшим сроком госпитализации и коротким периодом выздоровления. Различий в частоте переливания компонентов крови и развитии осложнений не отмечено. Длительность операции была короче при открытой РНЭ. Онкологические результаты при трансабдоминальном и забрюшинном доступах сопоставимы. Также не было отмечено различий в 5-летней выживаемости, РСВ и БРВ в группах больных, перенесших стандартную лапароскопическую нефрэктомию и лапароскопическую нефрэктомию по методике hand-assisted. Продолжительность операции была значительно короче во 2-й группе, тогда как время пребывания в стационаре было меньше в группе больных, перенесших стандартную лапароскопическую нефрэктомию. Сравнение роботической нефрэктомии и лапароскоспической нефрэктомии проведено в 1 проспективном когортном исследовании. При медиане наблюдения менее 1 года различий в возникновении местных рецидивов и отдаленных метастазов отмечено не было.
Резекция почки
Различий между БРВ, ОВ и послеоперационной смертности в группе больных, перенесших лапароскопическую и открытую резекцию почки, не отмечено. Средний объем кровопотери был меньше, а продолжительность операции была больше при лапароскопической резекции почки. СКФ была больше при лапароскопической резекции почки. Аналогичные данные были получены при сравнении трансабдоминального и забрюшинного доступов при лапароскопической резекции почки. В настоящее время нет ни одного исследования, сравнивающего роботическую и лапароскопическую резекцию почки. Показано, что при роботической резекции почки объем кровопотери был меньше, а период ишемии – короче.
Заключение
Лапароскопическая РНЭ имеет низкую морбидность по сравнению с открытой операцией (УД 1b). Онкологические результаты при лечении больных с клинической стадией T1-2 сопоставимы при открытой и лапароскопической РНЭ (УД 2а). Резекция почки может быть выполнена открытым, лапароскопическим или роботическими доступами (УД 2b).
Рекомендации
Пациентам с клинической стадией Т2 и тем пациентам, которым невозможно выполнить ОСО, рекомендовано проведение лапароскопической РНЭ (СР В). Пациентам с клинической стадией Т1, которым показана резекция почки, не рекомендуется проводить лапароскопическую РНЭ (СР А).
Терапевтические подходы как альтернатива хирургическому лечению
Исследования, оценивающие возможность активного наблюдения, показали, что ПКР с медленным ростом и метастазированием наблюдается у ограниченного числа пациентов (1–2%). Кратко- и среднесрочные онкологические результаты свидетельствуют о том, что эта стратегия является подходящей для осуществления начального мониторинга малых новообразований в почках, которые могут затем быть подвергнуты лечению при прогрессировании. Активное наблюдение предусматривает выполнение МРТ, КТ или УЗИ с контрастированием; наиболее показано пожилым и соматически отягощенным пациентам, с низкой ожидаемой продолжительностью жизни и пациентам высокого риска.
К альтернативным методам лечения относят РЧА, криоаблацию, микроволновую терапию и терапию высокоинтенсивным фокусированным ультразвуком (ВИФУ). Значительные преимущества данных методов: низкая морбидность, возможность амбулаторного лечения, а также лечения пациентов высокого риска, у которых нельзя провести стандартное хирургическое лечение. Также возможно проведение данных вмешательств у пожилых и соматически отягощенных пациентов.
Среди имеющихся аблационных методов РЧА и криоаблация наиболее полно исследованы в отношении практичности их использования, частоты возникновения осложнений и онкологической безопасности. Однако исследования показывают, что частота рецидивов в данных группах выше по сравнению с частотой после ОСО.
Криоаблация, как и РЧА, может быть выполнена чрескожным или лапароскопическим доступами. Существенных различий в частоте осложнений, ОВ, РСВ и БРВ при сравнении данных методов лечения нет. Продолжительность пребывания в стационаре при выполнении чрескожной криоаблации составила 2,1 дня, при лапароскопической криоаблации – 3,5 дня (р<0,01). При сравнении лапароскопической криоаблации и лапароскопической резекции почки также не было отмечено различий в частоте осложнений, последующем восстановлении и послеоперационном уровне креатинина сыворотки крови. Лапароскопическая резекция почки была больше ассоциирована с кровопотерей. Ни в одной из групп не было отмечено местных рецидивов или метастазирования. При сравнении роботической резекции почки и лапароскопической криоаблации обнаружены существенные различия в местном рецидивировании (0% против 11%) и метастазировании (0,5% против 5,6%). Осложнения после РЧА определяются как незначительные и составляют около 29%. При сравнении РЧА и резекции почки различий в ОВ и РСВ отмечено не было (медиана наблюдения составила 6,3 года). Тем не менее резекция почки была ассоциирована с большим числом осложнений и частотой переливания крови. При сравнении РЧА и РНЭ РСВ в обеих группах составила 100%, тогда как ОВ в группе больных, перенесших РЧА, была ниже (75% против 100%).
Малоинвазивные методы лечения ПКР, такие как ВИФУ, микроволновая и лазерная аблация, в настоящее время считаются экспериментальными.
Заключение
Показатели смертности пациентов, получавших хирургическое лечение, ниже по сравнению с показателями у пациентов без хирургического лечения. Однако анализ показателей у пожилых пациентов (>75 лет) не выявил данной закономерности (УД 3). Рост небольших опухолей почек медленный, а прогрессирование болезни – редкое (УД 3). Имеющиеся данные не позволяют делать окончательные выводы относительно морбидности и онкологических результатов криоаблации и РЧА (УД 3). При применении малоинвазивных методов лечения отмечена более высокая частота местных рецидивов, чем при резекции почки (УД 3).
Рекомендации
Малое количество имеющихся данных не позволяет дать рекомендации в отношении криоаблации и РЧА (СР С). Пожилым, соматически отягощенным пациентам и пациентам с ограниченной продолжительностью жизни могут быть рекомендованы активное наблюдение, криоаблация и РЧА (СР С).
Лечение ПКР с опухолевыми тромбами
Формирование тромба в НПВ у пациентов с ПКР является неблагоприятным прогностическим фактором. Пациентам с неметастатическим ПКР показано удаление (резекция) почки и опухолевого тромба (УД 3, СР С). Также существует стратегия: дооперационная установка фильтра или эмболизация, эффективность которых в настоящее время не определена (УД 3). Хирургический подход зависит от уровня расположения тромба и степени окклюзии НПВ. Доказано, что уровень расположения опухолевого тромба не отражает степень распространения опухоли на лимфатические узлы, инвазию параренальной клетчатки или наличие отдаленных метастазов.
Существующие данные свидетельствуют о том, что осуществление адъювантной вакцинации антигенами собственной опухоли может способствовать снижению риска возникновения рецидива после выполнения нефрэктомии в подгруппе больных РП стадии Т3, однако необходимо проведение дальнейших исследований влияния данной терапии на ОВ (УД 1b). III фаза клинических исследований по эффективности сунитиниба, сорафениба, пазопаниба и эверолимуса продолжается в настоящее время, таким образом, нет никаких доказательств комплексного использования с ингибиторами VEGF-R или мишени рапамицина млекопитающих (mTOR). Следовательно, вне рамок клинических исследований проведение адъювантной терапии после осуществления радикального хирургического лечения РП не показано (СР А).
Хирургическое лечение мПКР (паллиативная нефрэктомия)
Хирургическое лечение приводит к излечению лишь при условии удаления всех определяемых опухолевых очагов. У большинства пациентов с метастазами ПКР нефрэктомия носит паллиативный характер, поэтому им необходимо дальнейшее системное лечение. Анализ показал, что у больных, перенесших удаление пораженной опухолью почки, выживаемость на длительных сроках была лучше. В настоящее время имеются лишь ограниченные данные относительно ценности использования циторедуктивной нефрэктомии в сочетании с таргетной терапией (сунитиниб и сорафениб).
Заключение
Проведение нефрэктомии в сочетании с назначением интерферона-α (ИФН-α) способствует повышению показателей выживаемости у больных метастатическим ПКР, находящихся в удовлетворительном общем состоянии (УД 1а). Проведение паллиативной нефрэктомии может улучшить ОВ и отсрочить системную терапию (УД 3).
Анализ литературы показал, что полное удаление почки или проведение лучевой терапии при наличии метастазов ПКР (в легких, поджелудочной железе, печени, головном мозге и др.) приводит к увеличению ОВ и РСВ по сравнению с медикаментозной терапией. Лучевая терапия при метастатическом РП может применяться у отдельных пациентов с нерезектабельными симптоматическими поражениями головного мозга или костей, не отвечающими на проведение системной терапии.
Полное удаление метастазов, за исключением головного мозга и костей, является наиболее подходящим видом лечения (УД 3), позволяет увеличить ОВ, РСВ и отсрочить системную терапию (УД 3). Лучевая терапия при метастазировании в головной мозг и кости позволяет уменьшить проявление болевых симптомов (УД 3).
Рекомендации
Решение по поводу удаления метастазов должно приниматься в каждом индивидуальном случае (СР С). В отдельных случаях при метастазировании в головной мозг и кости для облегчения болевых симптомов могут быть применены стереотаксическая лучевая терапия и стереотаксическая лучевая хирургия (СР С).
Использование системной терапии при мПКР
Химиотерапия
В связи с тем, что ПКР развивается из проксимальных канальцев собирательной системы, в клетках данной опухоли наблюдается высокий уровень экспрессии гликопротеина P, что является причиной резистентности к большинству химиопрепаратов. Единственная умеренно эффективная схема терапии – комбинация фторурацила с иммунопрепаратами. Однако в перспективном рандомизированном исследовании ИФН-α показана одинаковая эффективность комбинации ИФН-α, интерлейкина (ИЛ) -2 и фторурацила. Таким образом, комбинация фторурацила с иммунопрепаратами эквивалентна по эффективности монотерапии ИФН-α (УД 1b). У пациентов со светлоклеточным мПКР химиотерапия в качестве монотерапии не является эффективной (СР В).
Иммунотерапия
В ходе проведения рандомизированных исследований при мПКР отмечена более высокая эффективность использования ИФН-α, чем гормональной терапии. Частота ответов на лечение ИФН-α составила 6–15%, с 25% снижением риска прогрессирования и небольшим улучшением специфической выживаемости на 3–5 мес. по сравнению с данными показателями, полученными при использовании плацебо. Достижение положительного эффекта лечения ИФН-α имеет большое значение для пациентов с метастазирующим светлоклеточным раком, низкими критериями риска по Мотцеру (табл. 11) и наличием только легочных метастазов. В проведенном недавно исследовании продемонстрировано, что применение ИФН-α в сочетании с бевацизумабом в первой линии способствует увеличению частоты достижения ответов и времени до прогрессирования по сравнению с показателями, полученными при проведении монотерапии ИФН-α. Во всех проведенных недавно рандомизированных испытаниях таргетных препаратов (сунитиниб, ИФН-α в сочетании с бевацизумабом, темсиролимус), использующихся в качестве терапии первой линии, продемонстрировано их преимущество по сравнению с монотерапией ИФН-α.
ИЛ-2 используют для лечения мПКР с 1985 г., частота получения ответов при его применении варьирует от 7 до 27%. Оптимальная схема лечения ИЛ-2 на сегодняшний день пока не установлена, однако использование высоких доз препарата в болюсном режиме способствует достижению длительных (≥10 лет) полных ответов у некоторых больных метастатическим РП (УД 1b). Ответ на иммунотерапию наблюдается только у пациентов со светлоклеточным ПКР. Исследования по поводу вакцинации продолжаются. Вакцинация опухолевого антигена 5T4 не показала увеличения показателей выживаемости по сравнению со стандартной терапией первой линии (УД 1b).
Заключение
Монотерапия ИФН-α уступает таргетной терапии метастатического ПКР (УД 1b). Монотерапия ИЛ-2 может применяться в отдельных случаях (светлоклеточный ПКР, метастазы в легкие) (УД 2). Побочные эффекты при терапии ИЛ-2 значительно более выражены, чем при лечении ИФН-α (УД 2-3). Сочетание бевацизумаба и ИФН-α является более эффективным, чем ИФН-α в лечении пациентов низкого и промежуточного риска (УД 1b). Комбинация цитокинов с или без дополнительной химиотерапии не улучшает ОВ по сравнению с монотерапией (УД 1b). Монотерапия ИФН-α или высокие дозы ИЛ-2 не должны быть рекомендованы в качестве терапии первой линии при метастатическом ПКР (СР А).
Ингибиторы ангиогенеза
Последние достижения в области молекулярной биологии привели к созданию нескольких новых препаратов, используемых для лечения мПКР (табл. 12). В процессе канцерогенеза при спорадическом ПКР происходит аккумуляция HIF вследствие инактивации гена VHL, приводящая к гиперэкспрессии VEGF и PDGF (тромбоцитарный фактор роста), каждый из которых участвует в стимуляции неоангиогенеза. Данный процесс играет важную роль в развитии и прогрессировании ПКР. На сегодняшний день как в США, так и в Европе для лечения метастатического ПКР разрешены к применению следующие таргетные препараты: сорафениб, сунитиниб, бевацизумаб в комбинации с ИФН-α, пазопаниб, темсиролимус, эверолимус, акситиниб. Продолжаются исследования эффективности и других новых антиангиогенных препаратов, а также сочетаний их друг с другом и с цитокинами. Тивозаниб и довитиниб проходят исследования III фазы и в настоящее время не одобрены.
Сорафениб – пероральный мультикиназный ингибитор, угнетающий активность серин/треониновой киназы Raf-1, B-Raf, рецепторов VEGF-2 (VEGFR-2) и PDGF (PDGFR), FMS-подобной тирозинкиназы-3 (FLT-3) и c-KIT.
Сунитиниб – пероральный ингибитор тирозинкиназ. Данный препарат селективно подавляет PDGFR, VEGFR, с-KIT и FLT-3 и обладает противоопухолевой и антиангиогенной активностью.
Пазопаниб – пероральный ингибитор ангиогенеза, оказывающий целенаправленное воздействие на VEGFR, PDGFR и c-KIT.
Акситиниб – пероральный селективный ингибитор 2-го поколения, оказывающий целенаправленное воздействие на VEGFR-1, -2 и -3, c минимальным влиянием на прочие мишени.
На данный момент другие ингибиторы тирозинкиназы (тивозаниб и довитиниб) не одобрены для лечения метастатического РП.
Бевацизумаб представляет собой гуманизированные антитела, связывающие изоформы VEGF-A. Применение бевацизумаба в режиме 10 мг/кг каждые 2 нед. у больных, рефрактерных к иммунотерапии, способствовало увеличению общего числа ответов (10%) и показателей БРВ по сравнению с таковыми при использовании плацебо. Применение бевацизумаба в режиме 10 мг/кг каждые 2 нед. у больных + ИФН-α в режиме 9 млн единиц подкожно 3 р./нед. способствовало увеличению показателей БРВ по сравнению с монотерпией ИФН-α в режиме 9 млн единиц подкожно 3 р./нед.
Темсиролимус – специфический ингибитор mTOR. В одном из исследований пациенты с метастатическим ПКР высокой категории риска были рандомизированы на 3 группы в зависимости от принимаемого препарата: темсиролимуса, ИФН-α или их комбинации. В группе больных, получавших темсиролимус, ОВ составила 10,9 мес. по сравнению с 7,3 мес. в группе ИФН-α (p<0,0069). У пациентов, получавших темсиролимус в сочетании с ИФН-α, существенного увеличения ОВ не зарегистрировано. Темсиролимус не рекомендуется пациентам, имеющим устойчивость к рецепторам VEFG TKI.
Эверолимус – пероральный ингибитор киназы mTOR, применяемый при устойчивости к рецепторам VEFG TKI. Медиана выживаемости без прогрессирования составила 4 мес. в группе эверолимуса и 1,9 мес. в группе плацебо (p<0,001).
Клинические исследования III фазы продемонстрировали, что сунитиниб и бевацизумаб в комбинации с ИФН-α показаны в качестве терапии первой линии у нелеченных пациентов со светлоклеточным метастатическим ПКР и с низким и промежуточным риском. Исследование COMPARZ показало, что пазопаниб также может быть рекомендован в качестве терапии первой линии. Акситиниб и тивозаниб не одобрены для терапии нелеченных пациентов с метастатическим ПКР.
Заключение
Ингибиторы тирозинкиназы увеличивают выживаемость без прогрессирования заболевания и/или ОВ в качестве терапии первой или второй линии при светлоклеточном ПКР (УД 1b). Доказана эффективность акситиниба в плане выживаемости без прогрессирования заболевания в качестве терапии второй линии после лечения цитокинами и VEGF-таргетной терапии по сравнению с сорафенибом (УД 1b). Сунитиниб – более эффективный препарат, чем ИФН-α у нелеченных пациентов (УД 1b). Сочетание бевацизумаба и ИФН-α является более эффективным, чем ИФН-α у нелеченных пациентов с низким и промежуточным риском (УД 1b). Пазопаниб превосходит плацебо у пациентов с метастатическим ПКР и после терапии цитокинами (УД 1b). Пазопаниб не уступает сунитинибу у пациентов со светлоклеточным мПКР (УД 1b). Монотерапия темсиролимусом продлевает ОВ по сравнению с терапией ИФН-α у пациентов с мПКР высокого риска (УД 1b). Эверолимус продлевает выживаемость без прогрессирования у пациентов после неэффективного лечения или непереносимости ингибиторов VEGF. Сорафениб рекомендован у пациентов со светлоклеточным ПКР после терапии цитокинами или таргетной терапии (УД 4). Ингибиторы mTOR (эверолимус и темсиролимус) и VEFG-таргетная терапия (сунитиниб или сорафениб) могут быть использованы при несветлоклеточном ПКР (УД 3). Эффективность комбинирования препаратов по сравнению с эффективностью монотерапии не доказана (УД 1а).
Рекомендации
Системная терапия пациентов с мПКР должна основываться на применении таргетных препаратов (СР А). Сунитиниб и пазопаниб рекомендуются в качестве терапии первой линии светлоклеточного распространенного/мПКР (СР А). Бевацизумаб + ИФН-α рекомендуются в качестве терапии первой линии светлоклеточного распространенного/мПКР у пациентов низкого или промежуточного риска (СР А). Темсиролимус рекомендуется в качестве терапии первой линии у пациентов с ПКР высокого риска (СР А). Акситиниб рекомендуется в качестве терапии второй линии для мПКР после предшествующей терапии VEGFR или цитокинами (СР А). Эверолимус рекомендуется для пациентов со светлоклеточным ПКР после таргетной терапии ингибиторами VEGF (СР А). Пазопаниб и сорафениб рекомендуются после неэффективной терапии цитокинами в качестве альтернативы акситинибу (СР В). Рекомендуется последовательное применение таргетных препаратов (СР А).
Динамическое наблюдение после нефрэктомии, резекции почки или аблативной терапии ПКР
Динамическое наблюдение после хирургического лечения позволяет оценить послеоперационные осложнения, функцию почек, выявить наличие местных рецидивов после резекции почки или аблативного лечения, рецидивов в контралатеральной или ипсилатеральной почке, а также проанализировать возможность появления отдаленных метастазов, что имеет большое значение при проведении криотерапии или РЧА.
В настоящее время нет единого мнения о необходимости динамического наблюдения за пациентами после их лечения по поводу ПКР. Оценку послеоперационных осложнений и выделительной функции почек проводят на основании анамнеза, физикального обследования и определения уровня сывороточного креатинина и СКФ. Осуществление регулярного контроля уровня EGFR в течение длительного времени позволяет увидеть, ухудшилась ли функция почек после выполнения оперативного вмешательства или ее ухудшение имело место еще до операции. Функцию почек и выживаемость без признаков рака можно оптимизировать путем выполнения ОСО (УД 3). Частота развития местных рецидивов невысока (2,9%). Рецидив в контралатеральной почке также встречается редко (1,2%). Несмотря на то, что частота возникновения местных рецидивов при применении аблационных методов выше, чем при обычном хирургическом вмешательстве, пациент все же может быть излечен путем повторного проведения аблационной терапии или нефрэктомии (УД 3). Ранняя диагностика рецидива может способствовать повышению эффективности системной терапии, в т. ч. в рамках клинических исследований.
Интенсивное лучевое обследование не является необходимым для всех пациентов. В зависимости от риска рецидивирования и метастазирования целесообразно осуществлять дифференцированный режим наблюдения. Результаты исследований прогностических факторов с большим сроком наблюдения больных позволяют сделать некоторые выводы: рентгенография грудной клетки малочувствительна к небольшим метастазам, а УЗИ имеет ограничения; при опухолях низкого риска должны быть определены интервалы проведения КТ, учитывая побочное действие облучения (в данном случае может быть рекомендована МРТ); при среднем или высоком риске возникновения рецидива методом выбора является КТ органов грудной клетки и брюшной полости; наблюдение также должно включать клиническую оценку функции почек и кардиоваскулярные риски; ПЭТ, ПЭТ-КТ и остеосцинтиграфия не являются стандартными методами динамического контроля, учитывая ограниченную специфичность и чувствительность; в зависимости от наличия новых эффективных методов лечения может потребоваться применение более жестких схем послеоперационного контроля и наблюдения (УД 4).
Некоторыми авторами были разработаны системы баллов и номограммы для количественного определения вероятности возникновения рецидива, метастазов и последующей смерти пациента. Эти системы сравнивались и проходили валидацию (УД 2). Совсем недавно была опубликована и прошла валидацию дооперационная прогностическая модель, основанная на возрасте, симптомах и стадировании по TNM (УД 3). Алгоритм динамического наблюдения, в котором учитывается риск развития рецидива или появления метастазов, а также эффективность проведенного лечения представлены в таблице 13.
Заключение
Целью наблюдения является обнаружение местного рецидива или метастазирования на той стадии, когда пациента можно излечить путем выполнения хирургического вмешательства. Почечная функция должна быть оценена (УД 4). Стратификация риска должна основываться на существующих системах классификации (УД 4).
Рекомендации
Наблюдение за пациентом должно проводиться с учетом факторов риска и вида проведенного лечения (СР С). Для низкого риска может быть использована КТ/МРТ (СР С). В группе промежуточного риска последующее наблюдение включает выполнение КТ/МРТ через регулярные промежутки времени в соответствии со стратификацией рисков по данным номограмм (СР С). У пациентов с высоким риском последующее наблюдение должно включать КТ/МРТ (СР С). Наблюдение за пациентами, которым выполнена ОСО по поводу РП большого размера (>7 см), должно быть усилено (СР С).
Поделиться ссылкой:
В 2006 году были опубликованы «Практические рекомендации Европейской ассоциации урологов по лечению инфекций мочевыводящих путей». В настоящих рекомендациях приводятся данные по классификации, диагностике, этиологии, антибактериальной терапии и профилактике осложненных и неосложненных инфекций мочевыводящих путей различной локализации (острый цистит, пиелонефрит, уретрит, простатит, эпидидимит и орхит). Также обсуждаются вопросы тактики лечения инфекций мочевыводящих путей у детей, пациентов с почечной недостаточностью, иммуносупрессией, постоянным мочевым катетером, при уросепсисе, применения антибиотиков для периоперационной профилактики.
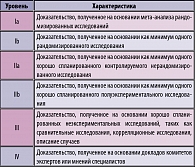
Таблица 1. Уровень доказательности данных в «Практических рекомендациях»

Таблица 2. Категории доказательности рекомендаций
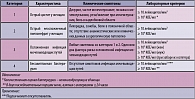
Таблица 3. Клинические и лабораторные критерии диагноза инфекций мочевыводящих путей
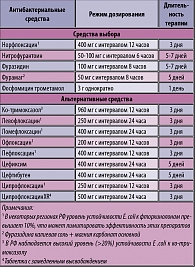
Таблица 4. Рекомендации по режимам антибактериальной терапии острого неосложненного цистита у небеременных женщин с учетом локальных данных антибиотикорезистентности
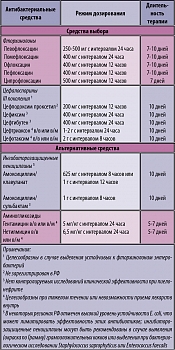
Таблица 5. Рекомендации по антибактериальной терапии пиелонефрита у небеременных женщин (в модификации)
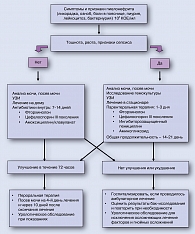
Схема. Алгоритм ведения пациентов с острым пиелонефритом
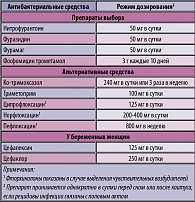
Таблица 6. Рекомендованные режимы профилактики рецидивирующих неосложненных инфекций мочевыводящих путей у женщин ( в модификации с учетом национальных особенностей)
В качестве основы для разработки рекомендаций были использованы материалы первой версии Европейских рекомендаций (2), а также практические рекомендации общества инфекционных заболеваний США (IDSA) по диагностике и лечению острого цистита и пиелонефрита у женщин (3).
В настоящей работе будут обсуждены рекомендации по антибактериальной терапии и профилактике острых и рецидивирующих неосложненных инфекций мочевыводящих путей у женщин, а также острых осложненных мочевых инфекций у мужчин с акцентом на возможность практического применения этих рекомендаций в нашей стране, учитывая локальные особенности этиологической структуры заболеваний и уровень антибиотикорезистентности возбудителей. Учитывая методологию медицины, основанную на доказательствах, все рекомендации и источники определены в соответствии с их уровнем и категорией доказательности (таблицы 1-2).
Эпидемиология
Инфекции мочевыводящих путей относятся к наиболее частым инфекционным заболеваниям человека. В США регистрируется свыше 7 млн обращений к врачу ежегодно по поводу инфекций мочевыводящих путей, из них 2 млн случаев приходится на острый цистит. Эти инфекции являются причиной свыше 100 000 госпитализаций ежегодно, большинство случаев связано с пиелонефритом. Примерно у 25-35% женщин в возрасте от 20 до 40 лет наблюдается острый цистит, из них у 1/3 заболевание приобретает рецидивирующее течение.
Классификация
Инфекции мочевыводящих путей могут быть классифицированы в соответствии с их локализацией – цистит, пиелонефрит, простатит, уретрит, эпидидимит, орхит. Однако следует учитывать, что изолированные инфекции указанных локализаций встречаются редко, чаще возбудители могут обнаруживаться в разных отделах урогенитального тракта. С практических позиций антимикробной химиотерапии целесообразно выделять следующие типы инфекций:
- неосложненные инфекции нижних отделов мочевых путей (цистит):
- острые
- рецидивирующие;
- неосложненный пиелонефрит;
- осложненные инфекции мочевыводящих путей (пиелонефрит и без вовлечения почек);
- уросепсис;
- уретрит;
- особые формы: простатит, эпидидимит, орхит.
С клинических позиций важно дифференцировать неосложненные и осложненные инфекции мочевыводящих путей, так как они различаются по прогнозу и тактике антибактериальной терапии. При неосложненных инфекциях клинический эффект и эрадикация возбудителя достигаются как правило при коротких курсах антибактериальной терапии. Кроме того, при неосложненных инфекциях не требуется рутинно проводить микробиологическую диагностику и лабораторный контроль излечения. Осложненные инфекции мочевыводящих путей ассоциируются с наличием факторов, предрасполагающих к их развитию, длительному сохранению симптомов, возникновению осложнений и неуспеху антибактериальной терапии. К факторам, ассоциированным с осложненными инфекциями мочевыводящих путей, относятся:
- принадлежность к мужскому полу;
- пожилой возраст;
- инфекция, развившаяся в стационаре;
- беременность;
- наличие мочевого катетера;
- недавно перенесенная операция на органах мочеполовой системы;
- функциональные или анатомические нарушения мочевых путей;
- недавнее применение антибиотиков;
- сохранение симптомов более 7 дней;
- сахарный диабет;
- иммуносупрессия.
Также целесообразно выделять бессимптомную бактериурию, которая часто выявляется у определенных категорий пациентов (пожилые, беременные женщины, наличие постоянного мочевого катетера, больные сахарным диабетом) и требует решения вопроса о целесообразности проведения антибактериальной терапии. Бессимптомная бактериурия редко ассоциируется с неблагоприятными последствиями и неназначение антибиотиков не сопровождается повышенным риском развития инфекций у большинства пациентов.
Диагностика
Острый цистит обычно сопровождается такими симптомами, как дизурия, рези и боли при мочеиспускании, учащенное мочеиспускание, позывы на мочеиспускание, боли в надлобковой области. Примерно у 40% женщин с острым циститом наблюдается гематурия, которая не является признаком осложненной инфекции. Остро возникшая дизурия у женщин требует исключения других симптомосходных заболеваний – острый уретрит, вызванный Chlamydia trachomatis, Neisseria gonorrhoeae или вирусом простого герпеса, или вагинит, вызванный Candida spp. или Trichomonas vaginalis. При остром цистите в общем анализе мочи всегда выявляется пиурия и бактериурия (таблица 3). Отсутствие пиурии свидетельствует в пользу другого диагноза.
Традиционный количественный критерий диагноза острой инфекции мочевыводящих путей ≥ 105 колониеобразующих единиц (КОЕ) микроорганизмов в средней порции мочи в последние годы пересмотрен. Было показано, что примерно у 1/3 женщин с документированным диагнозом острого цистита выявлена бактериурия
< 105 КОЕ/мл (II). Для диагностики острого цистита рекомендуется учитывать бактериурию >102 КОЕ/мл. Проведение бактериологического исследования мочи (выделение чистой культуры возбудителя и определение чувствительности к антибиотикам) у небеременных женщин с острым циститом не рекомендуется, так как этиология заболевания и антибиотикочувствительность возбудителей хорошо прогнозируются.
Рецидивирующая неосложненная инфекция мочевыводящих путей определяется как три и более эпизодов острой инфекции в последние 12 месяцев или два и более эпизода в последние 6 месяцев.
В отличие от острого цистита, острый пиелонефрит характеризуется симптомами генерализованной инфекции (гектическая лихорадка, ознобы) и интоксикации (головная боль, тошнота, рвота); также обычно наблюдаются боли в поясничной области. При этом симптомы цистита могут присутствовать или отсутствовать. В анализе мочи всегда наблюдается пиурия. Клинически значимой бактериурией считается >103 КОЕ/мл. Дополнительное обследование при пиелонефрите целесообразно для выявления обструкции мочевыводящих путей, уролитиаза (УЗИ, КТ). При отсутствии эффекта от адекватной антибактериальной терапии в течение 72 часов необходимо дальнейшее обследование для исключения возможных осложняющих факторов (уролитиаз, абсцесс).
Диагностически значимым уровнем бактериурии для постановки диагноза бессимптомная бактериурия следует считать > 104 КОЕ/мл микроорганизмов в двух порциях мочи, собранных с интервалом ≥ 24 часа.
Этиология
Этиологический спектр возбудителей острых неосложненных инфекций верхних (цистит) и нижних отделов (пиелонефрит) мочевыводящих путей сходен. Доминирующим возбудителем является Escherichia coli, на долю которого приходится 70-95% случаев заболеваний. В 5-19% выделяются коагулазонегативные стафилококки (главным образом Staphylococcus saprophyticus). В остальных случаях возбудителями могут быть другие энтеробактерии (Proteus mirabilis, Klebsiella spp.) и энтерококки (Enterococcus faecalis).
Российские данные1. Следует выделить некоторые национальные особенности в спектре возбудителей острых инфекций мочевыводящих путей. При анализе 1000 штаммов микроорганизмов, полученных от амбулаторных пациентов с острыми мочевыми инфекциями в Москве в 2004-2005 гг., было установлено, что наиболее частыми возбудителями были микроорганизмы семейства Enterobacteriaceae (73,8%), среди которых преобладала E. coli – 59,9%
(4, 17). В то же время выявлен высокий удельный вес энтерококков 18,7%, самый частый из которых – Enterococcus faecalis – 15%. Высокая этиологическая значимость энтерококков, вероятно, связана с тем, что около ¼ штаммов микроорганизмов было получено от мужчин, среди которых естественно преобладают осложненные инфекции мочевыводящих путей. В то же время в другом исследовании, проведенном в 3 городах РФ, в этиологической структуре острого неосложненного цистита у женщин также отмечен высокий удельный вес грамположительной микрофлоры: E. coli – 67%, другие грамотрицательные – 11%, S. saprophyticus – 13%, E. faecalis – 9% [5]. Таким образом, отечественные данные свидетельствуют о несколько меньшем удельном весе E. coli в этиологической структуре острых инфекций мочевыводящих путей за счет возрастания роли грамположительных микроорганизмов – E. faecalis и S. saprophyticus.
Антибиотикорезистентность уропатогенов
В настоящих рекомендациях вопросы состояния антибиотикорезистентности в европейских странах практически не обсуждаются. Отмечено только, что повсеместно наблюдается высокий уровень устойчивости E. coli к ампициллину и ко-тримоксазолу, а также наблюдаются тревожные тенденции роста устойчивости к фторхинолонам. В то же время хорошая чувствительность сохраняется к цефалоспоринам III поколения, фосфомицину и нитрофуранам.
В последние годы, по данным зарубежных исследований, наблюдаются отчетливые тенденции к росту устойчивости уропатогенных штаммов E. coli к антибактериальным препаратам, которые традиционно широко назначаются при внебольничных инфекциях мочевыводящих путей, прежде всего к ампициллину (устойчивость >30%) и ко-тримоксазолу (20-30%), нефторированным хинолонам (5-27%) (6-9). Неблагоприятной тенденцией является повышение устойчивости также к амоксициллину/клавуланату и фторированным хинолонам (ципрофлоксацину, норфлоксацину и др.), в некоторых странах Европы до 9 и 15% соответственно (10). Наименьший уровень устойчивости E. coli в Европе наблюдался к цефалоспоринам III поколения (цефадроксилу, мециллинаму), гентамицину, фосфомицину и нитрофурантоину. Стабильно высокая чувствительность уропатогенов к фосфомицину и нитрофурантоину на протяжении многих лет отмечена также в другом исследовании (11).
Российские данные. Исследование антибиотикочувствительности возбудителей острых внебольничных мочевых инфекций в г. Москве также показало высокий уровень устойчивости E. coli к ампициллину (43,5%), ампициллину/сульбактаму (28,5%), ко-тримоксазолу (31%), налидиксовой кислоте (21%) и фторхинолонам – ципрофлоксацину (15,5%) и левофлоксацину (15%) (4). На этом фоне сохраняется низкий уровень устойчивости
E. coli к цефалоспоринам III поколения и нитрофуранам (в пределах 5%). Среди нитрофуранов самым активным препаратом в отношении E. coli и других Enterobacteriaceae был фуразидин К (калиевая соль фуразидина), процент чувствительных штаммов к нему был выше, чем к фуразидину и нитрофурантоину. Среди стафилококков все штаммы сохраняли чувствительность к нитрофуранам, невысокая устойчивость отмечена к ко-тримоксазолу и гентамицину (7%), более высокая – к левофлоксацину (11%) и ципрофлоксацину (14%). Энтерококки характеризовались хорошей чувствительностью к ампициллину и нитрофуранам (нет устойчивых штаммов), левофлоксацину (6%); устойчивость к ципрофлоксацину и гентамицину была выше
(11 и 30%).
В другом многоцентровом исследовании, проведенном в различных регионах РФ, высокий уровень устойчивости E. coli также отмечен к ампициллину (37%), ко-тримоксазолу (21%); к другим антибактериальным препаратам устойчивость была не высокой: норфлоксацину, ципрофлоксацину – 4%, амоксициллину/клавуланату – 3%, цефуроксиму – 2%, нитрофурантоину – 1% (12).
В нашем исследовании (5) низкий уровень устойчивости внебольничных штаммов E. coli отмечен к гентамицину, цефотаксиму, фуразидину К (препарат фурамаг), ципрофлоксацину (соответственно 7,7%, 8,5%, 13% и 14,9%), более высокий уровень – к амоксициллину/клавуланату (19,1%), ко-тримоксазолу (23,4%), налидиксовой кислоте (33,3%), цефазолину (34,6%), ампициллину (46,7%). Чувствительность других энтеробактерий к антибиотикам была закономерно хуже, меньшее количество устойчивых штаммов наблюдалось к цефотаксиму. S. saprophyticus проявлял хорошую чувствительность к фуразидину К, амоксициллин/клавуланату, ципрофлоксацину; устойчивость была высокой к цефотаксиму. Чувствительность E. faecalis была высокой к ампициллину, амоксициллину/клавуланату, фуразидину К и низкой к ципрофлоксацину и ко-тримоксазолу.
Таким образом, на основании отечественных данных по антибиотикорезистентности внебольничных штаммов уропатогенов для лечения острых неосложненных инфекций мочевыводящих путей могут быть рекомендованы нитрофураны, цефалоспорины III поколения, гентамицин, фторхинолоны, последние – с оговоркой про неблагоприятные тенденции к росту устойчивости. Среди указанных препаратов следует отметить, что цефалоспорины лишены активности против энтерококков, на долю которых в РФ приходится около 15% острых мочевых инфекций, а ципрофлоксацин обладает слабой активностью против этого возбудителя. Для лечения острых неосложненных мочевых инфекций в РФ не следует использовать ко-тримоксазол, ингибиторозащищенные аминопенициллины, ампициллин и амоксициллин, нефторированные хинолоны (налидиксовая кислота, пипемидиевая кислота), у которых отмечается высокий уровень резистентности E. coli.
Антибактериальные средства
Для лечения острых внебольничных инфекций мочевыводящих путей традиционно используются бета-лактамы, фторхинолоны, нефторированные хинолоны, нитрофураны, ко-тримоксазол, фосфомицин трометамол.
Фторхинолоны
Фторхинолоны обладают высокой природной активностью против кишечной палочки и других энтеробактерий. Их активность против грамположительных уропатогенов (энтерококков, стафилококков) ниже. В этом отношении новые фторхинолоны (левофлоксацин, моксифлоксацин, гатифлоксацин) превосходят ранние.
Контролируемые клинические исследования эффективности имеются для многих представителей этой группы (ципрофлоксацин, норфлоксацин, офлоксацин, пефлоксацин, левофлоксацин, моксифлоксацин, гатифлоксацин), причем различий между разными препаратами не установлено. Для всех указанных препаратов показана эффективность коротких 3-дневных курсов терапии острого неосложненного цистита (IbA2), эффективность более коротких курсов (1 день) уступает 3-дневным. Во всех исследованиях показана равная эффективность фторхинолонов и ко-тримоксазола. Лечение фторхинолонами острых неосложненных мочевых инфекций сопровождается высоким уровнем эрадикации возбудителей (более 90%).
Для ципрофлоксацина (IbA), гатифлоксацина (IbA), левофлоксацина (IbA), ломефлоксацина (IbB), офлоксацина (IbB) имеются данные контролируемых клинических исследований высокой эффективности при неосложненном пиелонефрите.
Фторхинолоны в течение многих лет традиционно рассматривались как препараты выбора при лечении неосложненных инфекций мочевыводящих путей. Специалистами давно высказывалось опасение, что широкое использование фторхинолонов для лечения неосложненных мочевых инфекций может способствовать селекции резистентных штаммов в популяции. Подтверждений этим данным к настоящему времени не получено, по крайней мере, при использовании коротких курсов терапии (III). В то же время, учитывая эти опасения, для лечения неосложненных мочевых инфекций (цистит) более предпочтительно использование не «системных» фторхинолонов, а норфлоксацина, фармакокинетика которого характеризуется высокими концентрациями в моче и низкими в тканях. Для лечения пиелонефрита норфлоксацин не должен применяться, как раз из-за низких тканевых концентраций, в этом случае предпочтительны другие фторхинолоны.
Учитывая высокий удельный вес грамположительных бактерий в этиологической структуре острых внебольничных инфекций мочевыводящих путей в России, новые фторхинолоны (левофлоксацин, моксифлоксацин, гатифлоксацин) возможно более предпочтительны, чем ранние, однако клинического подтверждения этого нет.
Следует отметить, что уровень устойчивости в России основного возбудителя острых неосложненных мочевых инфекций – E. coli – во многих регионах превышает 10%, что может ограничивать эффективность всех фторхинолонов.
Нефторированные хинолоны
Налидиксовая кислота и пипемидиевая кислота около 50 лет применяются для лечения острых неосложненных инфекций мочевыводящих путей, так как препараты обладают высокой природной активностью против кишечной палочки. В то же время нефторированные хинолоны не активны против грамположительных бактерий. В нашей стране значение этих препаратов для лечения урогенитальных инфекций не высоко, с одной стороны, из-за высокого уровня устойчивости
E. coli (21-33%), с другой стороны, из-за высокой доли энтрококков и стафилококков в этиологической структуре острых внебольничных инфекций мочевыводящих путей (22-26%, по данным исследований (4-5)).
Бета-лактамные антибиотики
В общем, бета-лактамные антибиотики немного уступают по эффективности фторхинолонам при лечении острых неосложненных мочевых инфекций (III). В отличие от фторхинолонов и ко-тримоксазола, бета-лактамы эффективны при более длительных курсах лечения острого цистита (5 дней) и пиелонефрита (10-14 дней); при коротких курсах увеличивается частота ранних рецидивов инфекции (Ib).
Клинических данных о различиях в эффективности между разными бета-лактамами нет. Препараты I и II поколения цефалоспоринов обычно не рекомендуются для лечения острого цистита (IbA) и пиелонефрита из-за более низкой природной активности против Enterobacteriaceae по сравнению с препаратами III поколения. Наиболее хорошая доказательная база при лечении неосложненных мочевых инфекций имеется для двух препаратов – пивмециллинама и цефподоксим проксетила, которые, однако, не зарегистрированы в России. Из других пероральных цефалоспоринов III поколения, которые зарегистрированы в России, можно упомянуть цефиксим и цефтибутен, однако рандомизированных исследований их эффективности при мочевых инфекциях нет. Из парентеральных цефалоспоринов возможно использование цефтриаксона при пиелонефрите в амбулаторной практике, так как препарат вводится 1 раз в день.
Среди бета-лактамных антибиотиков при мочевых инфекциях не следует использовать ампициллин и амоксициллин из-за высокой резистентности уропатогенов, по той же причине цефалоспорины III поколения предпочтительнее ингибиторозащищенных аминопенициллинов.
Аминогликозиды
В настоящее время уровень устойчивости внебольничных мочевых штаммов E. coli к аминогликозидам не высокий. В тоже время эти антибиотики проявляют меньшую активность против грамположительных микроорганизмов. Более высокая токсичность аминогликозидов по сравнению с другими антибиотиками также ограничивает их назначение при неосложненных инфекциях мочевыводящих путей. Назначение гентамицина рационально при пиелонефрите в случае устойчивости возбудителя к цефалоспоринам и фторхинолонам.
Ко-тримоксазол
Этот препарат является наиболее хорошо изученным средством при неосложненных инфекциях мочевыводящих путей (30 исследований). Показана эффективность 3-дневных курсов лечения ко-тримоксазолом острого цистита (эффективность выше, чем при однодневном курсе), сравнимого с эффективностью фторхинолонов (IaA). Имеется тесная корреляция между выявлением устойчивых к ко-тримоксазолу штаммов
E. coli и клиническим неуспехом терапии (Ib). В этой связи подчеркивается, что в странах с уровнем устойчивости E. coli к ко-тримоксазолу выше 20% препарат не может рассматриваться как средство выбора при лечении неосложненных мочевых инфекций. В РФ устойчивости кишечной палочки к ко-тримоксазолу составляет
21-31% (4-5, 12), поэтому надежнее использовать другие антибиотики.
Фосфомицин
В отдельных клинических исследованиях и в мета-анализе показано, что фосфомицин трометамол эффективен при терапии острого неосложненного цистита в однократной дозе 3 г (IaA). Несмотря на 20-летнее применение, устойчивость E. coli к фосфомицину остается на низком уровне – в пределах 3%, причем отсутствует перекрестная устойчивость с другими группами антимикробных средств (IIb). В то же время устойчивость других энтеробактерий к фосфомицину высокая – в среднем 16%, а для Klebsiella spp. – 57% (10).
Фосфомицин используется только для лечения острого неосложненного цистита у женщин, при других уроинфекциях (пиелонефрит, уретрит и т. д.) препарат не применяется. Фосфомицин обычно хорошо переносится, однако имеются данные, что частота нежелательных явлений несколько выше по сравнению с норфлоксацином.
Показана эффективность фосфомицина при длительном применении для профилактики рецидивов цистита (IaB). Фосфомицин может назначаться для лечения острого цистита у беременных женщин (IIaB).
Нитрофураны
Представлены тремя препаратами – нитрофурантоином, фуразидином и фуразидином К (калиевая соль фуразидина). В контролируемых клинических исследованиях установлена высокая клиническая эффективность нитрофурантоина при лечении острого неосложненного цистита (IIaB). Рекомендованный курс терапии острого цистита нитрофурантоином составляет 5-7 дней, при более коротких курсах эффективность препарата ниже (IIaB). Показана эффективность нитрофурантоина при длительном профилактическом применении (IIaB). Для других нитрофуранов рандомизированных исследований нет, имеются отдельные клинические нерандомизированные исследования и наблюдения (III).
В Европейских Практических рекомендациях среди нитрофуранов представлен только один препарат – нитрофурантоин, который, однако, практически не используется в РФ. В нашей стране традиционно используется фуразидин (фурагин) и фуразидин К, в последние годы применяется препарат фурамаг, представляющий собой сочетание калиевой соли фуразидина и магния карбоната основным. Данная лекарственная форма обеспечивает лучшую биодоступность фуразидина, благодаря чему в моче достигаются концентрации фуразидина в 1,5-2 раза более высокие, чем после приема таблеток фурагина. В проведенном сравнительном клиническом исследовании (5) показана высокая клиническая и бактериологическая эффективность 5-дневного курса лечения фурамагом острого цистита у женщин.
Несмотря на длительное использование нитрофуранов в медицине, устойчивость E. coli и грамположительных уропатогенов к нитрофуранам в Европе и Америке не высока (IIb), также низкий уровень устойчивости основных уропатогенов к нитрофуранам наблюдается в России. Более низкая природная активность нитрофуранов проявляется в отношении Klebsiella spp. и P. mirabilis. При сравнении антимикробной активности различных нитрофуранов наиболее высокий уровень активности в отношении E.coli и других энтеробактерий отмечен у фуразидина калиевой соли, наименьший – у нитрофурантоина (4). Таким образом, как по антимикробной активности, так и более пролонгированной фармакокинетике фуразидин имеет определенные преимущества по сравнению с нитрофурантоином.
В литературе описаны серьезные побочные эффекты при применении нитрофурантоина, в частности, острая и хроническая легочная токсичность в виде кашля, одышки и пневмонита. Однако тщательное наблюдение за пациентами, длительно принимающих нитрофураны с целью профилактики (до 1 года), позволило установить, что риск развития острой и хронической легочной токсичности при применении нитрофуранов незначительный и подобных осложнений не развивалось у девочек и женщин молодого и среднего возраста (III) (13-14).
Нитрофураны являются препаратами выбора при остром цистите у женщин, рецидивирующем цистите, а также для лечения бессимтомной бактериурии при наличии показаний. При пиелонефрите нитрофураны назначаться не могут из-за низких тканевых концентраций. Нитрофураны могут назначаться беременным женщинам для лечения и профилактики цистита (IVC), отсутствие у фуразидина и нитрофурантоина тератогенных или эмбриотоксических свойств подтверждено в больших популяционных исследованиях (15-16).
Рекомендации по антибактериальной терапии внебольничных инфекций мочевыводящих путей
Острый неосложненный цистит у небеременных женщин
Хотя острый цистит характеризуется благоприятным прогнозом и высоким уровнем спонтанного выздоровления, в контролируемых исследованиях показано преимущество антибиотиков по сравнению с плацебо, как по клинической, так и бактериологической эффективности и быстроте прекращения симптомов заболевания (Ib).
Эффективность лечения острого цистита показана для многих антибактериальных средств в контролируемых клинических исследованиях: триметоприм, ко-тримоксазол, фторхинолоны (ципрофлоксацин, эноксацин, флероксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, пефлоксацин, руфлоксацин), бета-лактамы (амоксициллин, ампициллин, амоксициллин/клавуланат, цефадроксил, цефуроксим аксетил, цефподоксим проксетил, цефтибутен, пивмециллинам, ритипенем аксетил, цефиксим), фосфомицин трометамол, нитрофураны (нитрофурантоин, фуразидин). Подчеркивается, что сложно предоставить единые рекомендации по выбору режима антибактериальной терапии острого цистита для всех стран из-за региональных особенностей распространения антибиотикорезистентности.
В нашей стране невысокий уровень устойчивости урогенитальных внебольничных штаммов кишечной палочки отмечен к цефалоспоринам III поколения, фосфомицину и нитрофуранам. Устойчивость кишечной палочки к фторхинолонам в настоящее время превышает 10%, что может ограничивать их эффективность. Высокий уровень устойчивости наблюдается к нефторированным хинолонам, аминопенициллинам и защищенным пенициллинам, ко-тримоксазолу.
Рекомендации по режимам антибактериальной терапии острого неосложненного цистита с учетом локальных данных по антибиотикорезистентности уропатогенов представлены в таблице 4.
Короткие курсы терапии имеют преимущества в плане лучшей переносимости и снижения стоимости лечения и могут быть применены у небеременных женщин до менопаузы при назначении фторхинолонов и ко-тримоксазола (3 дня), фосфомицина (1 день). Бета-лактамы и нитрофураны целесообразно применять в течение 5-7 дней.
При назначении антибиотиков пациентам следует объяснить, что даже при эффективном лечении симптомы заболевания могут сохраняться в течение 2-3 дней. При выраженных симптомах возможно назначение анальгетиков, таких как феназопиридин в дозе 200 мг с интервалом 8 часов. Целесообразны также рекомендации по увеличению количества принимаемой жидкости, однако убедительных доказательств в пользу этого утверждения нет.
Острый неосложненный пиелонефрит у небеременных женщин
Несмотря на несколько сотен клинических исследований антибиотиков при пиелонефрите, только 5 из них могут быть отнесены к проспективным, рандомизированным, контролируемым. Резюме по этим исследованиям и еще 4 хорошо спланированным исследованиям представлено ниже.
- Ко-тримоксазол превосходит ампициллин при остром пиелонефрите (IbA).
- 2-недельный курс лечения ко-тримоксазолом острого неосложненного пиелонефрита является адекватным и достаточным у большинства женщин (IbA). В некоторых исследованиях показана эффективность других антибиотиков в более коротких курсах (7-10 дней), а аминогликозидов даже при 5-7-дневной терапии, однако доказательная сила этих данных не очень высокая (IIIB).
- В регионах, где уровень устойчивости E. coli к ко-тримоксазолу превышает 10% (в России >20%), фторхинолоны должны расцениваться как средства выбора. Показано преимущество 7-дневного курса ципрофлоксацином по сравнению с 14-дневным курсом ко-тримоксазолом по уровню эрадикации возбудителей (IbA). Одинаковая эффективность с ципрофлоксацином в дозе 500 мг с интервалом 12 часов показана для других фторхинолонов: ципрофлоксацин с замедленным высвобождением (1 г с интервалом 24 часа), гатифлоксацин (400 мг с интервалом 24 часа), левофлоксацин (250 мг с интервалом 12 часов), ломефлоксацин (400 мг с интервалом 24 часа) (IbA).
- Возможность применения ингибиторозащищенных пенициллинов (амоксициллин/клавуланат) и пероральных цефалоспоринов II-III поколения при остром пиелонефрите не подтверждена в рандомизированных сравнительных исследованиях с фторхинолонами или ко-тримоксазолом. В единственном контролируемом исследовании бета-лактамов показана одинаковая эффективность 10-дневной терапии цефподоксим проксетилом (200 мг с интервалом 12 часов) и ципрофлоксацина в дозе 500 мг с интервалом 12 часов (IbA).
- В регионах с уровнем устойчивости E. coli к фторхинолонам >10% (в России по данным трех исследований устойчивость составляла 15, 4 и 15%) или в тех ситуациях, когда фторхинолоны противопоказаны (беременные, период лактации, дети и подростки), препаратами выбора могут считаться ингибиторозащищенные аминопенициллины или цефалоспорины III поколения (IIIB). В нашей стране предпочтительнее пероральные (цефиксим, цефтибутен) или парентеральные (цефтриаксон, цефотаксим) цефалоспорины III поколения, учитывая более высокий уровень устойчивости уропатогенных штаммов
E. coli к амоксициллину/клавуланату и ампициллину/сульбактаму.
Резюме по результатам контролируемых, рандомизированных, проспективных исследований антибактериальных средств при пиелонефрите, обладающих высоким уровнем доказательности, представлены ниже.
- Ципрофлоксацин внутрь 500 мг с интервалом 12 часов в течение 7 дней более эффективен и лучше переносится, чем ступенчатая терапия цефтриаксоном и ко-тримоксазолом (IbA).
- Ципрофлоксацин в лекарственной форме с замедленным высвобождением (XR) в дозе 1000 мг с интервалом 24 часа в течение 7-10 дней эквивалентен по эффективности и переносимости ципрофлоксацину в обычной лекарственной форме (IbA).
- Цефподоксим проксетил в дозе 200 мг с интервалом 12 часов в течение 10 дней эквивалентен ципрофлоксацину в дозе 500 мг с интервалом 12 часов (IbB).
- Гатифлоксацин в дозе 400 мг с интервалом 24 часа в течение 10 дней эквивалентен ципрофлоксацину в стандартной дозе (IbA).
- Левофлоксацин в дозе 250 мг с интервалом 12 часов в течение 10 дней эквивалентен ципрофлоксацину в стандартной дозе (IbA).
- Ломефлоксацин в дозе 400 мг с интервалом 24 часа в течение 10 дней эквивалентен ципрофлоксацину, однако количество пациентов было недостаточно для выводов о статистической значимости результатов (IbB).
- Ко-тримоксазол в дозе 960 мг с интервалом 12 часов в течение 14 дней эквивалентен ципрофлоксацину в стандартной дозе в течение 7 дней только в случае, если возбудитель был чувствителен к триметоприму (IbB).
Таким образом, в случаях нетяжелого течения пиелонефрита целесообразен 7-дневный курс лечения пероральным фторхинолоном (кроме норфлоксацина). В случаях невозможности применения фторхинолонов (см. выше) оправдано назначение перорального цефалоспорина III поколения – цефиксима или цефтибутена (В). Назначение амоксициллина/клавуланата целесообразно при выявлении при окраски по Грамму грамположительных бактерий (В). По усмотрению врача пациенты могут получать также парентеральную антибиотикотерапию на дому, в этом случае предпочтительнее назначение цефтриаксона (1-2 г с интервалом 24 часа) (С).
Рекомендованные режимы антибактериальной терапии острого неосложненного пиелонефрита с учетом локальных данных по антибиотикорезистентности представлены в таблице 5.
При тяжелом течении пиелонефрита пациента следует госпитализировать и лечение проводить парентеральным антибиотиком – фторхинолоном или цефалоспорином III поколения или аминогликозидом. При улучшении состояния долечивание пациента (до полного курса, 1-2 недели) может осуществляться пероральным антибиотиком (ступенчатая терапия) (В).
Около 12% госпитализированных пациентов с пиелонефритом имеют бактериемию, однако нет данных по прогностическому значению этого феномена. У всех госпитализированных пациентов, наряду с бактериологическим исследованием мочи, взятой до начала антибиотикотерапии, целесообразно исследование гемокультуры.
После окончания терапии и отсутствия симптомов заболевания нет необходимости проводить повторное исследование мочи. В случае если симптомы заболевания сохраняются свыше 3 дней на фоне адекватной антибиотикотерапии, или если наблюдается рецидив инфекции в течение 2 недель после окончания терапии, необходимо проведение бактериологического исследования мочи и определение чувствительности возбудителя к антибиотикам, а также надлежащее инструментальное обследование (УЗИ. КТ). При отсутствии урологической патологии в этих ситуациях необходим повторный 2-недельный курс терапии другим антибиотиком с учетом данных чувствительности. В случае если рецидив был вызван тем же штаммом возбудителя, что и первичная инфекция, то необходим более длительный, 6-недельный, курс антибиотикотерапии.
Рецидивирующая (неосложненная) инфекция мочевыводящих путей у женщин
Рецидивирующая неосложненная инфекция мочевыводящих путей определяется как три и более эпизодов острой инфекции в последние 12 месяцев или два и более эпизода в последние 6 месяцев.
При рецидивирующих неосложненных инфекциях мочевыводящих путей предложены различные методы профилактики, включающие антибиотикопрофилактику, опорожнение мочевого пузыря после полового акта, прием клюквенного сока.
В отношении антибиотикопрофилактики не установлены оптимальная продолжительность применения антибиотиков и наиболее эффективные схемы профилактики. В настоящее время большинство специалистов считает наиболее адекватным способом профилактики регулярный прием антибиотика перед сном (Ib) или после полового акта (Ib). В Кокрэновском обзоре (Ia) проанализированы 108 исследований антибиотикопрофилактики. В плацебоконтролируемых исследованиях было показано, что частота рецидивов на фоне антибиотиков составила от 0 до 0,9 пациентов/год и была достоверно ниже, чем на фоне плацебо (от 0,8 до 3,6). Относительный риск рецидива инфекции составил 0,21 (95%, доверительный интервал – 0,13-0,34) в пользу антибиотиков, но риск нежелательных явлений при применении антибиотиков достоверно выше – 1,78 (95%, ДИ – 1,06-3,00), наиболее частыми были кандидоз полости рта или влагалища, желудочно-кишечные симптомы. Таким образом, частота рецидивов на фоне антибиотикопрофилактики снижается в 8 раз по сравнению с периодом до профилактики и в 5 раз по сравнению с плацебо. Период профилактического применения антибиотиков составлял от 6 до 12 месяцев. Однако после окончания профилактического приема антибиотиков примерно у 60% женщин в течение 3-4 месяцев наблюдался рецидив инфекции.
Клиническая эффективность профилактического применения антибиотиков показана в контролируемых исследованиях для фторхинолонов (норфлоксацин, ципрофлоксацин, пефлоксацин, циноксацин), нитрофурантоина, ко-тримоксазола, цефалексина, цефаклора, триметоприма.
Рекомендованные режимы профилактики рецидивирующего цистита с учетом национальных особенностей антибиотикорезистентности и антибиотикотерапии представлены в таблице 6.
Оптимальная продолжительность профилактики не установлена, но обычно не менее 6-12 месяцев.
Другие меры профилактики включают применение иммуноактивных фракций кишечной палочки ОМ-89 (уроваксом), клюквенный сок, вагинальную аппликацию лактобацилл, однако единого мнения по их эффективности в настоящее время нет.
Инфекции мочевыводящих путей у беременных
У беременных женщин не проводятся короткие 3-дневные курсы антибиотикотерапии острого цистита из-за высокого риска рецидивов инфекции. Обычно рекомендуются 7-дневные курсы терапии пероральным цефалоспорином III поколения (цефиксим, цефтибутен) или нитрофураном (фуразидин или фурамаг); фосфомицин трометамол может назначаться в однократной дозе 3 г. До начала терапии и после окончания целесообразно проводить бактериологическое исследование мочи.
Для лечения острого пиелонефрита следует использовать цефалоспорины III поколения или ингибиторозащищенные пенициллины или аминогликозиды. Оптимальная продолжительность терапии не установлена.
У беременных женщин противопоказаны фторхинолоны, тетрациклины и ко-тримоксазол.
Инфекции мочевыводящих путей у женщин в постменопаузе
Подходы к антибактериальной терапии сходные, как у женщин до менопаузы. При остром цистите короткие курсы антибиотикотерапии поддерживаются не всеми специалистами. В то же время есть исследования, подтверждающие возможность использования фторхинолонов (ципрофлоксацин, офлоксацин) в 3-дневном режиме. При возникновении острого цистита у женщины в постменопаузе рекомендуется проведение гинекологического обследования.
Бессимптомная бактериурия
Бессимптомная бактериурия диагностируется при выделении в двух последовательных анализах мочи бактерий в количестве ≥ 105 КОЕ/мл. Бессимптомная бактериурия часто выявляется у определенных категорий пациентов (пожилые, беременные женщины, наличие постоянного мочевого катетера, больные сахарным диабетом) и требует решения вопроса о целесообразности проведения антибактериальной терапии.
Бессимптомная бактериурия редко ассоциируется с неблагоприятными последствиями, и неназначение антибиотиков не сопровождается повышенным риском развития инфекций у большинства пациентов. Не рекомендуется дальнейшее обследование и антибиотикотерапия при бессимптомной бактериурии у следующих категорий пациентов:
- небеременные женщины до менопаузы (IbA);
- женщины с сахарным диабетом (IbA);
- лица пожилого возраста, живущие дома (IIB);
- лица пожилого возраста в домах престарелых (IIaB);
- пациенты с повреждениями спинного мозга (IIaB);
- пациенты с постоянным мочевым катетером (IbA).
Скрининг на наличие бактериурии и антибактериальная терапия рекомендуются только в трех ситуациях:
- беременные женщины (IbA);
- перед трансуретральной резекцией предстательной железы (IbA);
- перед другими травматическими урологическими вмешательствами (IIIB).
В двух последних случаях антибиотики следует назначить незадолго до операции (IIIb) (обычно за 1-3 дня). Возможно применение фторхинолонов или нитрофуранов.
У беременных женщин в случае выявления бессимптомной бактериурии применяется 5-7-дневный курс терапии (IIIB) одним из следующих антибактериальных препаратов: цефиксим (400 мг в сутки), цефтибутен (400 мг в сутки), фуразидин (300 мг в сутки), фурамаг (150 мг в сутки). Контрольное бактериологическое исследование мочи следует проводить через 1-4 недели после лечения и еще раз перед родами (IIIB).
Комментарии автора:
- Курсивом выделены комментарии автора.
- В скобках уровни и категории доказательности (см. таблицу 1-2).










