Инфекции и инвазии: очень часто — назофарингит; часто — грипп.
Со стороны системы кроветворения: часто — анемия.
Со стороны психики: часто — тревога.
Со стороны ЦНС: очень часто — головная боль; иногда — инсульт.
Со стороны органа зрения: очень часто — интраокулярное воспаление, воспаление стекловидного тела, отслойка стекловидного тела, ретинальные кровоизлияния, зрительные нарушения, боль в глазах, помутнения в стекловидном теле, повышение внутриглазного давления, конъюнктивальные кровоизлияния, раздражение глаз, ощущение инородного тела в глазу, слезотечение, блефарит, синдром сухого глаза, покраснение глаз, чувство зуда в глазах; часто — дегенеративные изменения сетчатки, поражение сетчатки, отслойка сетчатки, разрывы сетчатки, отслойка пигментного эпителия сетчатки, разрыв пигментного эпителия, снижение остроты зрения, кровоизлияния в стекловидное тело, поражение стекловидного тела, увеит, ирит, иридоциклит, катаракта, субкапсулярная катаракта, помутнение задней капсулы хрусталика, точечный кератит, эрозии роговицы, клеточная опалесценция в передней камере глаза, нечеткость зрения, кровоизлияние в месте инъекции, глазные кровоизлияния, конъюнктивит, аллергический конъюнктивит, выделения из глаз, фотопсия, светобоязнь, чувство дискомфорта в глазах, отек век, болезненность век, гиперемия конъюнктивы; иногда — слепота, эндофтальмит, гипопион, гифема, кератопатия, спайки радужки, отложения в роговице, отек роговицы, стрии роговицы, боль и раздражение в месте инъекции, атипичные ощущения в глазу и раздражение век.
Со стороны дыхательной системы: часто — кашель.
Со стороны пищеварительной системы: часто — тошнота.
Аллергические реакции: часто — сыпь, крапивница, зуд.
Со стороны костно-мышечной системы: очень часто — артралгии.
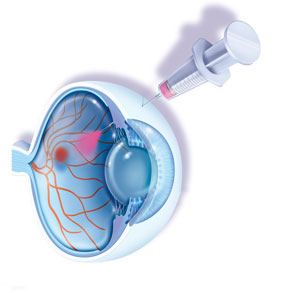
Луцентис представляет собой препарат для внутриглазного введения. Он является ингибитором неоангиогенеза, то есть подавляет рост новых сосудов в сетчатке. Применяется препарат при лечении возрастной дегенерации макулы, при макулярном отеке вследствие диабетической ангиопатии или тромбоза вен сетчатки.
Состав и форма выпуска
Действующим веществом препарата Луцентис является ранибизумаб, которого в 1 мл раствора содержится 10 мг. Вспомогательные компоненты: вода для инъекций, полисорбат, L-гистидина гидрохлорида моногидрат, L-гистидин, α-трегалозы дигидрат.
Выпускается препарат в стеклянных бесцветных флаконах для внутриглазного введения объемом 0,23 мл (10 мг/мл). Сверху размещается резиновая крышка и алюминиевый колпачок с прорезью. В комплект входит шприц и две иглы (с фильтром для забора препарата из флакона и игла для инъекции). Сам раствор прозрачный или несколько опалесцирующий, бесцветный или неинтенсивно окрашенный.
Механизм действия
Ранибизумаб – фрагмент человеческих моноклональных антител к эндотелиальному фактору роста А. Он производится с использованием рекомбинантного штамма кишечной палочки.
Луцентис обладает антиангиогенным эффектом за счет связывания с эндотелиальным фактором роста сосудов. Это препятствует взаимодействию последнего с рецепторами на поверхности эндотелия и подавляет пролиферацию сосудов и неоваскуляризацию.
За счет того, что замедляется неоангиогенез в области сетчатки, препарат препятствует патологическим изменениям при экссудативно-геморрагической форме возрастной макулярной дегенерации и отеке макулы на фоне сахарного диабета и тромбоза вен сетчатки.
Показания к применению
Луцентис используют для:
• Лечения возрастной макулярной дегенерации взрослых (неоваскулярной, или влажной, формы)
• Лечения потери остроты зрения, обусловленного диабетической ангиопатией и отеком макулы. Использование препарата может быть самостоятельным либо проводится в сочетании или после лазерной коагуляцией.
• Лечение снижения зрения, связанного с отеком макулы из-за окклюзии вен сетчатки.
Способ применения и дозы
Луцентис применяют для внутриглазного введения, то есть интравитреально (непосредственно в стекловидное тело). Стандартной дозой для инъекций считают 0,5 мг, или 0,05 мл. Введение обычно проводят 1 раз в месяц. При этом необходима ежемесячная оптометрия для контроля остроты зрения.
При лечении возрастной макулярной дегенерации выполняют ежемесячную инъекцию препарата вплоть до стабилизации остроты зрения на максимальных величинах. Ее выявляют при оптометрии в течение трех месяцев на фоне назначения Луцентиса.
Если острота зрения вновь снижается на 1 и более строк, то есть составляет более 5 букв, то терапию препаратом возобновляют. При этом обязательно наличие возрастной макулярной дегенерации, выявляемой при мониторинге. Лечение продолжают до стабилизации остроты зрения.
Если снижение зрения вызвано диабетическим отеком макулы, то терапия Луцентисом продолжается до достижения стабильного результата оптометрии в течение трех месяцев. Возобновлять лечение следует при снижении остроты зрения, обусловленным диабетическим отеком макулы. Терапию также прекращают при достижении стабильного результата оптометрии.
Назначение препарата Луцентис можно комбинировать с использованием лазерной коагуляции или применять после нее (у пациентов с диабетическим отеком макулы). Если эти манипуляции приходятся на один день, то время между внутриглазным введением препарата и лазерной коагуляцией должно быть более получаса.
Пациентам с окклюзией вен сетчатки и снижением зрения препарат вводят один раз в месяц и продолжают до стабилизации показателей оптометрии в течение трех месяцев. После этого необходима ежемесячная диспансеризация и при снижении остроты зрения вновь возобновляют терапию. Лечение пациентов с окклюзией вен сетчатки можно комбинировать с лазерной коагуляцией, либо применять после нее. При этом следует учитывать, что выполнять внутриглазную инъекцию следует не ранее чем через полчаса после завершения сеанса лазерной коагуляции.
Непосредственно перед выполнением укола следует изучить полученный раствор (наличие осадка, цвет). Раствор нельзя использовать при появлении осадка в виде нерастворимых частиц или изменении цвета.
При проведении манипуляции следует тщательно соблюдать правила асептики и антисептики, в том числе правильно обрабатывать руки, применять только стерильные одноразовые перчатки, салфетки и векорасширители, а также инструменты для парацентеза.
Непосредственно перед внутриглазным введением препарата необходимо выполнить дезинфекцию кожи вокруг глаз и в области век. Затем обработать конъюнктиву анестетиком и антибиотиком с широким спектром действия. Курс антибиотикотерапии должен состоять из 6 дней (3 дня до и 3 дня после внутриглазного укола).
Техника введения Луцентиса заключается в том, что кончик иглы должен располагаться в стекловидном теле на 3,5-4 мм кзади от лимба. При этом следует избегать меридиана и направлять иглу к центру глаза. Объем введенного раствора составляет 0,05 мл. Следующее введение препарата необходимо проводить в другую половину склеры глаза.
В связи с тем, что в течение часа после инъекции Луцентиса может наблюдаться внутриглазная гипертензия, необходимо контролировать давление в глазном яблоке и перфузию диска зрительного нерва. В случае необходимости следует назначить лечение. Внутриглазное давление после применения Луцентиса может также стойко увеличиваться.
За один сеанс препарат можно ввести только в один глаз. Коррекции дозы препарата пациентам старше 64 лет не требуется.
Противопоказания
Использовать препарат Луцентис опасно в следующих случаях:
• Повышенная индивидуальная восприимчивость к ранибизумабу или любому компоненту лекарственного средства.
• Наличие инфекционного процесса в области глазного яблока или в периокулярном сегменте.
• Воспалительные заболевания глаза.
• Период беременности или лактации.
• Несовершеннолетний возраст (до 18 лет).
Осторожности применение Луцентиса требует при наличии следующих состояний:
• Факторы риска развития острого нарушения мозгового кровообращения.
• Присутствие реакции гиперчувствительности в анамнезе.
• Одновременное назначение лекарственных средств, влияющих на эндотелиальный фактор роста сосудов.
В этих случаях перед использованием препарата Луцентис требуется консультация специалиста и тщательная оценка соотношения вред/польза в каждой конкретной ситуации.
Если на фоне назначения ранибизумаба развилось одно из ниже перечисленных клинических состояний, терапию необходимо прекратить и не возобновлять:
• повышение внутриглазного давления более 30 мм рт.ст.;
• снижение остроты зрения более чем на 29 букв по сравнению с последней оптометрией;
• разрыв сетчатки;
• массивные субретинальные кровоизлияния, которые занимают более половины площади или затрагивают центральную ямку;
• послеоперационный и предоперационный (28 дней) периоды интраокулярной хирургической манипуляции.
Выполнять инъекцию Луцентиса необходимо с соблюдением всех правил асептики и антисептики. Это условие является очень важным, так как напрямую влияет на вероятность развития таких патологических состояний, как разрыв сетчатки, эндофтальмит, ятрогенная травматическая катаракта.
Пациентам с высоким риском развития регматогенной отслойки сетчатки препарат следует назначать с особой осторожностью. Если в процессе лечения произошла регматогенная отслойка сетчатки, а также разрыв макулы 3 или 4 стадии, терапию Луцентисом следует немедленно прекратить.
Объективных данных об использовании ранибизумаба у пациентов с ишемической окклюзией центральной вены сетчатки или ее ветвей, а также с окклюзией вен сетчатки, в настоящий момент нет. Однако у таких пациентов применять препарат не рекомендуется, если имеются симптомы необратимой ишемии и потери зрительной функции.
Не рекомендуется назначать препарат и в период вынашивания и грудного вскармливания ребенка. Несмотря на то, что при внутриглазном введении действие препарата на организм минимальное, Луцентис рассматривается как потенциально опасное вещество. При этом учитывается механизм его действия, тератогенный и эбриотоксический эффекты. В этой связи женщинам, находящимся в репродуктивном возрасте, во время применения препарата стоит применять надежные методы контрацепции. Рекомендуемый интервал между окончанием терапии Луцентисом и возможным зачатием должен быть не менее трех месяцев.
Побочные действия
Самыми серьезными и опасными побочными эффектами, которые связаны с внутриглазным введением лекарственного средства, включают:
• эндофтальмит;
• ятрогенную травматическую катаракту;
• регматогенную отслойку сетчатки.
Другие значимые патологические изменения со стороны оптического аппарата, которые встречались при назначении Луцентиса, объединяют повышение внутриглазного давления и интраокулярный воспалительный процесс.
Далее представлены эффекты, которые отмечались у пациентов на фоне назначения препарата Луцентис (доза 0,5 мг). Частота их не превышала 2% случаев по сравнению с группой контроля (плацебо или фотодинамическая терапия).
Частота оценивалась по стандартной схеме (очень часто – 10%, часто 1-10%, нечасто 0,1-1%, редко 0,01-0,1%).
Инфекционные процессы: очень часто встречался назофарингит, часто развивался грипп и инфекция мочеполовой системы.
Со стороны кроветворения часто возникала анемия.
Среди психических нарушений у пациентов часто развивалась тревога.
Поражение центральной нервной системы очень часто сопровождалось головной болью, а нечасто – инсультом.
Орган зрения был задействован в большом проценте случаев:
• очень часто развивалось интраокулярное воспаление, отслойка, помутнение и воспаление стекловидного тела, зрительные нарушения, ретинальные и конъюнктивальные кровоизлияния, боль и ощущение инородного тела в глазах, их покраснение и чувство зуда, повышение внутриглазного давления, повышенное слезотечение или наоборот синдром сухого глаза, блефарит;
• часто возникали дегенеративные трансформации сетчатки, ее отслойка и разрывы, разрыв и отслойка пигментного эпителия сетчатой оболочки, поражение и кровоизлияние в область стекловидного тела, снижение остроты зрения, воспалительные изменения (ирит, увеит, иридоциклит), помутнение задней капсулы хрусталика, катаракта, в том числе субкапсулярная, эрозивные язвы роговицы, точечный кератит, нечеткость зрения, глазные кровоизлияния, в том числе в место инъекции препарата, клеточная опалесценция, фотопсия, конъюнктивит, в частности аллергической природы, светобоязнь, покраснение конъюнктивы, выделения из глаз, болезненность и отек век;
• нечасто развивалась полная потеря зрения (слепота), эндофтальмит, отек, стрии, отложения в роговице, болезненность и раздражение в месте введения препарата, гипопион, гифема, спайки радужки, непривычные ощущения в глазном яблоке, раздражение век.
Побочные эффекты со стороны дыхательной системы часто проявлялись кашлем, а со стороны пищеварительной системы – тошнотой.
На коже часто возникали аллергические проявления (эритема и зуд, сыпь и крапивница).
Костно-мышечная система очень часто отвечала на прием Луцентиса артралгиями.
Если на фоне применения препарата любые из указанных побочных явлений начинают прогрессировать, либо появляются не описанные состояния, следует незамедлительно поставить лечащего врача в известность.
Передозировка
В некоторых исследованиях были установлены случаи передозировки препаратом Луцентис. Чаще всего непреднамеренное превышение дозы сопровождалось повышением внутриглазного давления и болью в области глазного яблока.
В случае передозировки пациенту желательно находится под наблюдением врача, который будет контролировать давление внутри глаза.
Лекарственное взаимодействие
В связи с тем, что взаимодействие Луцентиса с другими лекарственными препаратами изучено не достаточно, не стоит смешивать его с любыми растворами или медикаментами.
Особые указания и меры предосторожности
Выполнять введение препарата может только офтальмолог, который владеет навыком внутриглазных инъекций. В процессе процедуры необходимо соблюдать правила асептики и антисептики. Чтобы вовремя распознать возможное развитие локального инфекционного процесса и назначить необходимое лечение, необходимо наблюдать за пациентом в течение недели после инъекции. Очень важно, чтобы пациент знал о возможности инфицирования и своевременно сообщал лечащему врачу обо всех тревожных симптомах, сопутствующих эндофтальмиту.
Луцентис обладает иммуногенными свойствами. В связи с тем, что при наличии у пациента диабетического отека макулы несколько возрастает риск общего действия препарата, риск развития гиперчувствительности и аллергии у них также выше.
Всех пациентов следует информировать о признаках интраокулярного воспаления, так как это может сопутствовать внутриглазному формированию антител к Луцентису.
В связи с тем, что при введении ингибиторов эндотелиального фактора роста А, к которым и относится ранибизумаб, возможно развитие тромбоэмболических осложнений, существует вероятность развития ишемического инсульта. Риск развития данного осложнения выше у тех пациентов, которые в анамнезе перенесли ишемические события в мозговых артериях.
У пациентов в течение часа после введения препарата повышалось давление внутри глазного яблока. Также были выявлены случай устойчивого повышения внутриглазного давления. Поэтому рекомендуется в течение этого периода контролировать давление внутри глазного яблока и перфузию диска зрительного нерва.
Не рекомендуется одновременное выполнение инъекции Луцентиса в оба глаза, так как такой способ введения подробно не изучался. Не исключено, что такое введение может усилить системное действие препарата и привести к высокому риску развития нежелательных эффектов.
Нет достаточно данных о применении Луцентиса у пациентов
• диабетическим отеком макулы на фоне сахарного диабета 1 типа;
• системным активным инфекционным процессом;
• проведенным лечением при помощи внутриглазного введения других препаратов;
• пролиферативной диабетической ретинопатией;
• неинфекционными сопутствующими патологиями глаз (отслойка сетчатки, в частности в области макулы).
Отсутствует опыт назначения препарата пациентам с тяжелым сахарным диабетом (уровень гликированного гемоглобина более 12%), а также неконтролируемым повышением системного артериального давления.
Всем женщинам детородного возраста необходимо применять хорошие и надежные контрацептивы.
Так как после внутриглазного введения Луцентиса возможно временное ухудшение остроты зрения, то в течение курса терапии не следует разрешать пациенту управлять автотранспортом или работать со сложными механизмами. Запрет должен действовать до момента полного исчезновения зрительных нарушений.
Содержимое флакона с Луцентисом можно использовать только для одного внутриглазного введения. В комплект препарата входит игла с фильтром, необходимая для извлечения раствора из флакона, шприц и желтая игла, которой нужно выполнять инъекцию.
Готовить раствор для введения необходимо по следующей методике:
1. Перед вскрытием флакона поверхность пробки следует обработать антисептиком.
2. Очень осторожно соединить шприц объемом 1 мл с иглой для забора раствора из флакона. Далее иглу с фильтром ввести во флакон через центр пробки таким образом, чтобы она коснулась дна флакона.
3. Весь раствор из флакона переместить в шприц.
4. После удаления иглы из флакона следует немного потянуть поршень шприца назад (до отметки 0,9 мл), чтобы в него поступил весь раствор, находящийся в полости иглы.
5. Далее извлечь иглу и утилизировать ее. Очень важно помнить, что иглу с фильтром нельзя использовать для выполнения внутриглазной инъекции.
6. Шприц с раствором аккуратно соединить с желтой иглой для инъекции.
7. Снять с иглы защитный колпачок. При этом нельзя касаться иглы руками или другими предметами.
8. Удалить лишний воздух из шприца и поместить поршень на отметку 0,05 мл. После этого перемещать поршень назад уже нельзя.
9. Выполнить введение раствора в стекловидное тело глаза.
Если во флаконе остался некоторый объем раствора Луцентиса, его необходимо утилизировать, так как повторное его использование недопустимо.
Хранить препарат необходимо в темном месте при температуре 2-8 градусов по Цельсию.
Цена препарата Луцентис
Стоимость препарата в аптеках Москвы и России от 52 000 руб. (10 мг/мл 0,23 мл фл.). Сюда не входит цена интравитриального введения. Пациент может купить лекарство в аптеке самостоятельно, а может воспользоваться имеющимся в распоряжении глазных клиник препаратом (что может быть намного выгоднее, т.к. один флакон может быть использован для введения нескольким пациентам.
Цена интравитриального введения Луцентиса (без стоимости препарата) в «Московской Глазной Клинике» составляет 19 000 руб. Само лекарство оплачивается отдельно (50 000 руб.) Уточнить актуальность приведенных данных Вы можете в разделе «Цены»
Аналоги

При этом Авастин отличается более низкой ценой, что может быть одним из факторов в его пользу. Луцентис разработан исключительно для применения в офтальмологии, Авастин используется и в онкологии.
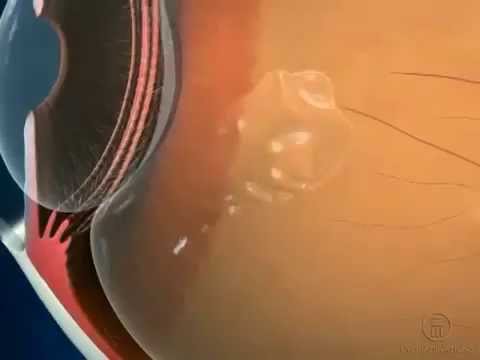
Видео интравитриального введения Луцентиса:
Обратившись в «Московскую Глазную Клинику», Вы сможете пройти обследование на самом современном диагностическом оборудовании, а по его результатам – получить индивидуальные рекомендации ведущих специалистов по лечению выявленных патологий.
Клиника работает семь дней в неделю без выходных, с 9 до 21 ч. Записаться на прием и задать специалистам все интересующие Вас вопросы можно по телефонам 8 (495) 505-70-10 и 8 (495) 505-70-15 или онлайн, воспользовавшись соответствующей формой на сайте.

Запишитесь на прием к врачу офтальмологу
Заполните форму и получите скидку 15 % на диагностику!
Луцентис — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛСР-004567/08
Торговое наименование:
Луцентис®
Международное непатентованное наименование (МНН):
ранибизумаб
Лекарственная форма:
раствор для внутриглазного введения
Состав:
1 мл раствора для внутриглазного введения/флакон/предварительно заполненный шприц содержит:
действующее вещество: ранибизумаб — 10/2,3/1,65 мг;
вспомогательные вещества: а,а-трегалозы дигидрат 100/23/16,5 мг, гистидина гидрохлорида моногидрат 1,662/0,382/0,274 мг, гистидин 0,321/0,074/0,053 мг, полисорбат 20 0,1/0,023/0,0165 мг, вода для инъекций до 1 мл/до 0,23/до 0,165 мл.
Описание:
прозрачный или слегка опалесцирующий, бесцветный или очень слабо окрашенный раствор.
Фармакотерапевтическая группа:
средства, препятствующие новообразованию сосудов.
Код ATX:
S01LA04
Фармакологические свойства
Механизм действия
Ранибизумаб является фрагментом гуманизированного антитела к эндотелиальному фактору роста сосудов A (VEGF-A) и экспрессируется рекомбинантным штаммом Escherichia coli. Он избирательно связывается с VEGF-A (VEGF110, VEGF121, VEGF165) и предотвращает его взаимодействие с рецепторами на поверхности клеток эндотелия (VEGFR1 и VEGFR2), что приводит к подавлению неоваскуляризации и пролиферации эндотелиальных клеток.
Фармакодинамика
Подавляя пролиферацию эндотелиальных клеток, рост новообразованных сосудов хориоидеи и экссудацию из них, ранибизумаб останавливает прогрессирование неоваскулярной (влажной) формы возрастной макулярной дегенерации (нВМД), развитие хориоидальной неоваскуляризации (ХНВ), включая ХНВ вследствие патологической миопии (ПМ), и уменьшает макулярный отек (МО) вследствие диабетической ретинопатии (ДР) или окклюзии (тромбоза) вен сетчатки (ОВС), сопровождающийся снижением остроты зрения (03).
Неоваскулярная (влажная) форма возрастной макулярной дегенерации
Безопасность и эффективность применения ранибизумаба при нВМД оценивалась в трех исследованиях: MARINA, PIER и ANCHOR.
Ключевые данные оценки эффективности отображены в таблице 1 и рисунке 1.
Таблица 1.
Обобщенные ключевые результаты к 12 и 24 месяцам исследований MARINA и ANCHOR (ар <0,01)

Рисунок 1. Среднее изменение 03 к 24 месяцу в исследованиях MARINA и ANCHOR.
По данным обоих исследований продолжение терапии ранибизумабом оказывало положительный эффект у пациентов с потерей ≥15 букв от максимальной корригированной остроты зрения (МКОЗ) на протяжении первого года лечения.
В исследовании PIER в среднем пациентам было проведено по 10 инъекций.
После изначального повышения 03 на фоне ежемесячного введения ранибизумаба, на фоне применения препарата 1 раз в 3 месяца 03 снижалась вплоть до первоначального уровня к 12 месяцу терапии. Ограниченные данные применения ранибизумаба у пациентов, которым изначально проводили имитацию инъекции, предположительно указывают на то, что раннее начало лечения обеспечивает лучший результат по 03.
Снижение остроты зрения, связанное с диабетическим макулярным отеком
Безопасность и эффективность применения ранибизумаба при ДМО оценивалась в трех исследованиях (RESTORE, RESTORE Extension и RETAIN).
Ключевые данные оценки эффективности в исследованиях RESTORE и RESTORE Extension отображены в таблице 2 и рисунке 2.
Таблица 2.
Оценка эффективности к 12 месяцу (RESTORE) и к 36 месяцу (RESTORE Extension). ар<0,0001

Рисунок 2. Среднее изменение 03 в исследовании RESTORE.
Ключевые данные оценки эффективности в исследовании RETAIN отображены в таблице 3.
Таблица 3.
Оценка эффективности в исследовании RETAIN.а р<0,0001
Снижение остроты зрения, вызванного макулярным отеком вследствие окклюзии вен сетчатки
Безопасность и эффективность применения ранибизумаба при МО вследствие ОВС оценивалась в исследованиях BRAVO (МО при окклюзии ветви центральной вены сетчатки, ОВЦВС), и CRUISE (МО при окклюзии центральной вены сетчатки, ОЦВС).
Ключевые данные оценки эффективности в исследованиях BRAVO и CRUISE отображены в таблице 4 и рисунках За, 3б.
Таблица 4.
Оценка эффективности на 6 и 12 месяцах (BRAVO и CRUISE).а р<0,0001

Рисунок За. Среднее изменение МКОЗ в исследовании BRAVO.
Рисунок 3б. Среднее изменение МКОЗ в исследовании CRUISE.
Отдаленные результаты безопасности и эффективности применения ранибизумаба оценивались в исследованиях BRIGHTER (МО при ОВЦВС) и CRYSTAL (МО при ОЦВС).
Ключевые данные оценки эффективности в исследованиях BRIGHTER и CRYSTAL отображены в таблице 5.
Таблица 5.
Оценка эффективности к 6 и 24 месяцам (BRIGHTER и CRYSTAL).а р<0,0001

Снижение остроты зрения, вызванное хориоидальной неоваскуляризацией
Безопасность и эффективность применения ранибизумаба при ХНВ, не обусловленной вВМД и/или ПМ, оценивалась в исследовании MINERVA.
Ключевые данные оценки эффективности в исследовании MINERVA отображены в таблицах 6, 7 и рисунке 4.
Таблица 6.
Оценка эффективности на 2 месяце (MINERVA).а р<0,001
|
Ранибизумаб 0,5 мг |
Имитация инъекции |
|
|
Среднее изменение МКОЗ ко 2 месяцу (букв) (предел среднего)a |
+9,5 |
-0,4 |
|
Прибавление ≥10 букв или МКОЗ ≥84 букв (%) |
42,4% |
14,0% |
|
Отсутствие потери ≥ 10 букв ко 2 месяцу (%) |
99,2% |
91,2% |
|
Уменьшение толщины центральной зоны сетчатки ко 2 месяцу (предел среднего)a |
77 мкм |
-9,8 мкм |
Таблица 7.
Общий эффект терапии и эффект терапии в зависимости от этиологии ко 2 месяцу (MINERVA).
|
Эффект лечения по сравнению с плацебо (букв) |
Количество пациентов (в обеих группах сравнения) |
|
|
Все подгруппы |
9,9 |
175* |
|
Ангиоидные полосы |
14,6 |
27 |
|
Поствоспалительная хориоретинопатия |
6,5 |
27 |
|
Центральная серозная хориоретинопатия |
5,0 |
23 |
|
Идиопатическая хориоретинопатия |
11,4 |
62 |
|
Другие патологии |
10,6 |
36 |
Рисунок 4. Среднее изменение МКОЗ за 12 месяцев (MINERVA).
Имеются ограниченные данные по безопасности применения препарата у подростков 12-17 лет со снижением зрения, вызванным ХНВ. В исследовании применения ранибизумаба в дозе 0,5 мг по индивидуальной схеме, основанной на оценке активности заболевания (снижение ОЗ, наличие интра-/суб-ретинальной жидкости, геморрагия или экссудация), у 5 пациентов в возрасте от 12 до 17 лет со снижением 03 вследствие ХНВ улучшение МКОЗ составило от 5 до 38 букв (в среднем 16,6 букв) по таблице ETDRS. Улучшение зрения сопровождалось стабилизацией или уменьшением толщины центральной зоны сетчатки на протяжении 12 месяцев. В среднем за время исследования потребовалось проведение 3 интравитреальных инъекций в каждый глаз.
Снижение остроты зрения, вызванное хориоидальной неоваскуляризацией, обусловленной патологической миопией
Безопасность и эффективность применения ранибизумаба при ХНВ вследствие ПМ оценивалась в исследовании RADIANCE.
Ключевые данные оценки эффективности исследовании RADIANCE отображены в таблице 8 и на рисунке 5.
Таблица 8.
Оценка эффективности за 3 и 12 месяцев (RADIANCE). а р<0,00001 по сравнению с группой 3.

Рисунок 5. Среднее изменение МКОЗ за 12 месяцев (RADIANCE).
Фармакокинетика
Всасывание
При интравитреальном введении препарата (1 раз в месяц) у пациентов с нВМД максимальная концентрация ранибизумаба (Cmax) в плазме крови была низкой и недостаточной для ингибирования биологической активности VEGF-A (т.е. на 50% ниже необходимой, 11-27нг/мл по данным исследований клеточной пролиферации in vitro). При интравитреальном введении ранибизумаба в диапазоне доз от 0,05 мг до 1,0 мг Cmax в плазме крови была пропорциональна дозе. Ожидается, что при интравитреальном введении 1 раз в месяц Сmахранибизумаба, которая достигается через сутки после введения, будет в основном находиться в диапазоне 0.79-2,90 нг/мл, минимальная концентрация — в диапазоне 0,07-0,49 нг/мл. Сывороточная концентрация ранибизумаба у пациентов с ДМО и ОВС схожа с таковой у пациентов с нВМД.
Распределение и выведение
Но данным фармакокинетического анализа и, учитывая выведение ранибизумаба из плазмы крови, средний период полувыведения (доза 0.5 мг) из стекловидного тела в среднем составлял около 9 дней.
Концентрация ранибизумаба в плазме крови приблизительно в 90000 раз ниже таковой в стекловидном теле.
Особые группы пациентов
Пациенты с нарушением функции почек
У пациентов с нарушением функции почек специальные фармакокинетические исследования применения ранибизумаба не проводились. У 68% (136/200) пациентов с нВМД. включенных в фармакокинетический анализ, имелись нарушения функции почек (46,5% — легкой степени тяжести, 20% — средней степени тяжести и 1,5% — тяжелой степени). У 48,2% (253/525) пациентов с ОВС имелись нарушения функции почек (36,4% — легкой степени тяжести, 9,5% — средней степени тяжести и 2,3% — тяжелой степени). На фоне лечения препаратом у пациентов с нарушением функции почек отмечалось минимальное снижение клиренса ранибизумаба, не имеющее клинического значения.
Пациенты с нарушением функции печени
У пациентов с нарушением функции печени специальные фармакокинетические исследования применения ранибизумаба не проводились.
Показания к применению
- Лечение неоваскулярной (влажной) формы возрастной макулярной дегенерации (нВМД).
- Лечение снижения остроты зрения, вызванного хориоидальной неоваскуляризацией (ХНВ).
- Лечение снижения остроты зрения, связанного с диабетическим макулярным отеком (ДМО).
- Лечение снижения остроты зрения, вызванного макулярным отеком (МО) вследствие окклюзии вен сетчатки (ОВС, центральной вены сетчатки или ее ветвей).
Противопоказания
- Повышенная чувствительность к ранибизумабу или любому другому компоненту препарата.
- Подтвержденные или предполагаемые инфекции глаза или инфекционные процессы периокулярной локализации.
- Активный интраокулярный воспалительный процесс.
- Детский возраст до 18 лет (эффективность и безопасность применения препарата у данной категории пациентов не изучены).
- Беременность и период грудного вскармливания.
С осторожностью:
- при наличии в анамнезе инсульта или преходящей ишемии головного мозга в связи с риском развития тромбоэмболических явлений;
- у пациентов с гиперчувствительностью в анамнезе;
- у пациентов с нВМД и выявленной обширной и/или высокой отслойкой пигментного эпителия сетчатки;
- у пациентов с риском развития регматогенной отслойки сетчатки.
Применение при беременности и в период грудного вскармливания
Применение при беременности и в период грудного вскармливания противопоказано. Системное воздействие ранибизумаба после его интраокулярного введения низкое, но, принимая во внимание механизм действия препарата, ранибизумаб должен рассматриваться как потенциально тератогенное и эмбрио-/фетотоксичное лекарственное средство. Женщинам детородного возраста при применении ранибизумаба следует применять надежные методы контрацепции. Интервал между окончанием лечения и зачатием должен быть не менее 3 месяцев.
Не известно выделяется ли ранибизумаб в грудное молоко у человека. Применение ранибизумаба в период грудного вскармливания противопоказано.
Способ применения и дозы
Вводить препарат должен только офтальмолог, имеющий опыт выполнения интравитреальных инъекций, с соблюдением правил асептики.
Рекомендуемая доза препарата Луцентис® составляет 0,5 мг, что соответствует 0,05 мл раствора, в виде интравитреальной инъекции. Между введениями препарата в один глаз следует соблюдать интервал не менее 4 недель.
Лечение нВМД; снижения остроты зрения, связанного с ДМО; снижения остроты зрения, вызванного МО вследствие ОВС; снижения остроты зрения, вызванного ХНВ
Лечение препаратом Луцентис® начинают с одной инъекции в месяц и продолжают до достижения максимальной 03 или до исчезновения признаков активности заболевания, т.е. отсутствия изменения 03 и других признаков и симптомов активности заболевания на фоне продолжающегося лечения. Стабилизация заболевания определяется как отсутствие улучшения 03 и/или анатомических параметров сетчатки в течение одного месяца после последней ежемесячной инъекции.
У пациентов с нВМД, снижением 03, связанным с ДМО и снижением 03, вызванным МО вследствие ОВС изначально может потребоваться 3 или более последовательные ежемесячные инъекции препарата Луцентис®.
После достижения стабилизации заболевания на фоне ежемесячного введения препарата периодичность контрольных осмотров и временной интервал между инъекциями устанавливает врач в зависимости от активности заболевания, оцениваемой по 03 или анатомическим параметрам.
В случае если, по мнению врача, основанном на оценке 03 и анатомических параметров сетчатки, нет улучшения от проводимого лечения, терапию препаратом Луцентис® следует прекратить. При лечении нВМД и ПМ предупреждение снижения 03 даже при отсутствии ее улучшения следует считать положительной динамикой, по сравнению с естественным течением заболевания.
Контроль активности заболевания осуществляется путем оценки клинических данных, данных функциональных тестов, а также специальных методов визуализации (оптической когерентной томографии (ОКТ) или флуоресцентной ангиографии (ФАГ)). Оценка эффективности лечения может основываться на показателях 03 или анатомических параметрах (активность заболевания определяется как снижение 03 и/или ухудшение анатомических параметров сетчатки; отсутствие активности заболевания определяется как отсутствие изменения 03 или анатомических параметров сетчатки в течение одного месяца после последней инъекции).
При использовании режима «лечение и продление» после достижения максимальной 03 и/или при отсутствии признаков активности заболевания возможно поэтапное увеличение интервалов между введением препарата до повторного снижения 03 или возникновения признаков активности заболевания. Каждый интервал между инъекциями следует увеличивать не более чем на 2 недели при лечении нВМД и не более чем на 1 месяц при лечении снижения 03, связанного с ДМО. При лечении снижения 03, вызванного МО вследствие ОВС (центральной вены сетчатки или ее ветвей) возможно поэтапное увеличение интервалов, однако на данный момент недостаточно данных для определения величины интервалов. При реактивации заболевания интервалы следует укорачивать соответственно.
Режим лечения при снижении 03, вызванном ХНВ подбирают индивидуально для каждого пациента, основываясь на активности заболевания. Некоторым пациентам может потребоваться только одна инъекция в течение первого года лечения, другим же могут потребоваться более частые инъекции, вплоть до ежемесячных.
Для лечения снижения 03, вызванного ХНВ, обусловленной ПМ, многим пациентам может понадобиться одна или две инъекции в течение первого года лечения.
Терапия препаратом Луцентис® в сочетании с ЛК сетчатки при ДМО и ОВЦВС
В клинических исследованиях терапия препаратом Луцентис® сочеталась с применением ЛК у пациентов с ДМО и пациентов с ОВЦВС (в том числе у пациентов с предшествующей ЛК). При применении обоих методов терапии в течение одного дня, препарат Луцентис® следует вводить спустя как минимум 30 минут после ЛК.
Нет опыта одновременного применения препарата Луцентис® с вертепорфином.
Особые группы пациентов
Пациенты с нарушением функции печени
Применение препарата у пациентов с нарушением функции печени не изучалось. Учитывая незначительную концентрацию ранибизумаба в плазме крови, изменения режима дозирования препарата не требуется.
Пациенты с нарушением функции почек
Пациентам с нарушением функции почек не требуется коррекции дозы препарата.
Пациенты младше 18 лет
Применение препарата Луцентис® у пациентов младше 18 лет противопоказано в связи с недостаточностью данных по безопасности у пациентов данной группы. Имеющиеся данные для подростков в возрасте от 12 до 17 лет со снижением 03, вызванным ХНВ. представлены в разделе «Фармакодинамика».
Пациенты в возрасте 65 лет и старше
Пациентам в возрасте 65 лет и старше не требуется коррекции дозы препарата.
Способ применения
Флакон и предварительно заполненный шприц предназначены для однократного применения.
Поскольку объем раствора во флаконе (0,23 мл) превышает рекомендованную дозу (0,05 мл), часть раствора, содержащегося во флаконе, следует утилизировать до проведения инъекции. Проведение более одной инъекции с использованием одного флакона может привести к контаминации раствора и последующему развитию внутриглазной инфекции.
Препарат Луцентис® применяют только в виде интравитреальных инъекций.
Перед введением препарата Луцентис® следует проконтролировать качество растворения и цвет раствора. Препарат нельзя применять при изменении цвета раствора и появлении нерастворившихся видимых частиц.
Интравитреальную инъекцию препарата следует проводить в асептических условиях, включающих хирургическую обработку рук медицинских работников, использование стерильных перчаток, простыней, векорасширителя (или его аналога). В качестве меры предосторожности следует подготовить стерильный набор инструментов для парацентеза. Перед проведением процедуры следует обязательно провести сбор аллергологического анамнеза. Перед проведением интравитреальной инъекции необходимо обеспечить адекватную анестезию, провести дезинфекцию кожи век. области вокруг глаз и глазной поверхности с использованием местных бактерицидных средств широкого спектра действия.
Препарат Луцентис® следует вводить в стекловидную камеру глаза на 3,5-4 мм кзади от лимба, избегая горизонтального меридиана и направляя иглу к центру глазного яблока. Объем инъекции составляет 0,05 мл. Следующую инъекцию препарата следует производить в другой участок склеры.
За одну процедуру введение препарата Луцентис® проводят только в один глаз.
Контроль состояния пациента в период до и после проведения процедуры должен включать следующие этапы:
— перед проведением процедуры и в течение 30 минут после инъекции препарата Луцентис® следует контролировать внутриглазное давление (ВГД);
— непосредственно после проведения инъекции следует оценить перфузию диска зрительного нерва;
— на 2-7 день после проведения инъекции следует провести биомикроскопию и офтальмоскопию с целью раннего выявления возможного инфекционного процесса.
Побочное действие
Сводная характеристика безопасности препарата
Большинство нежелательных реакций (HP), отмеченных при применении препарата, связаны с процедурой интравитреальной инъекции.
Наиболее часто после введения препарата отмечались: боль в глазу, покраснение глаза, повышение ВГД, воспаление стекловидного тела, отслойка стекловидного тела, ретинальное кровоизлияние, зрительные нарушения, помутнение стекловидного тела, конъюнктивальное кровоизлияние, раздражение глаза, чувство «инородного тела» в глазу, слезотечение, блефарит, синдром «сухого» глаза, чувство зуда в глазу. Наиболее частыми HP, не связанными с органом зрения, являются: головная боль, назофарингит и артралгия. Более серьезными, но менее частыми являются: эндофтальмит, слепота, отслойка сетчатки, разрыв сетчатки и ятрогенная травматическая катаракта.
К HP отнесены нежелательные явления, которые встречались чаще (как минимум на 2%) в группе применения ранибизумаба по сравнению с группой контроля (имитация инъекции или применение вФДТ). HP, отмеченные в клинических исследованиях, сгруппированы в соответствии с классификацией органов и систем органов MedDRA. В пределах каждой группы органов и систем органов HP перечислены в порядке уменьшения частоты встречаемости. В пределах каждой группы частоты встречаемости HP указаны в порядке уменьшения их тяжести.
Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (≥1/100; <1/10); нечасто (≥1/1000; <1/100); редко (≥1/10000; <1/1000); очень редко (<1/10000).
Инфекционные и паразитарные заболевания: очень часто — назофарингит; часто — грипп, инфекции мочевыводящих путей*.
Нарушения со стороны крови и лимфатической системы: часто — анемия.
Нарушения со стороны иммунной системы: часто — реакция гиперчувствительности.
Нарушения психики: часто — тревога.
Нарушения со стороны нервной системы: очень часто — головная боль; нечасто -инсульт.
Нарушения со стороны органа зрения: очень часто — интраокулярное воспаление, воспаление стекловидного тела. отслойка стекловидного тела, ретинальное кровоизлияние, зрительные нарушения, боль в глазу, помутнение стекловидного тела, конъюнктивальное кровоизлияние, раздражение глаза, чувство «инородного тела» в глазу, слезотечение, блефарит, синдром «сухого» глаза, покраснение глаза, чувство зуда в глазу; часто — дегенеративные изменения сетчатки, поражение сетчатки, отслойка сетчатки, разрыв сетчатки, отслойка пигментного эпителия сетчатки, разрыв пигментного эпителия сетчатки, снижение 03, кровоизлияние в стекловидное тело, поражение стекловидного тела, увеит, ирит, иридоциклит, катаракта, субкапсулярная катаракта, помутнение задней капсулы хрусталика, точечный кератит, эрозия роговицы, клеточная опалесценция в передней камере глаза, нечеткость зрения, кровоизлияние в месте инъекции, кровоизлияние в глаз, конъюнктивит, аллергический конъюнктивит, выделения из глаза, фотопсия, светобоязнь, чувство дискомфорта в глазу, отек века, болезненность века, гиперемия конъюнктивы; нечасто — слепота, эндофтальмит, гипопион, гифема, кератопатия, синехии радужки, отложения в роговице, отек роговицы, стрии роговицы, боль в месте инъекции, раздражение в месте инъекции, атипичные ощущения в глазу, раздражение век.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто — кашель.
Нарушения со стороны желудочно-кишечного тракта: часто — тошнота.
Нарушения со стороны кожи и подкожных тканей: часто — аллергические реакции (сыпь, крапивница, зуд, эритема).
Нарушения со стороны скелетно-мышечной и соединительной ткани: очень часто артралгия.
Лабораторные показатели: очень часто — повышение внутриглазного давления.
* — наблюдались только у пациентов с ДМО.
Нарушения со стороны сердечно-сосудистой системы
В исследованиях у пациентов с нВМД общая частота неофтальмологических кровоизлияний (нежелательного явления, которое может быть связано с системным подавлением активности VEGF) у пациентов, получавших ранибизумаб, была несколько повышена. Однако какой-либо четкой прослеживающейся закономерности кровоизлияний разного типа выявить не удалось.
По данным рабочей группы исследователей антитромбоцитарных препаратов (1994 г) существует связь между развитием артериальных тромбоэмболических осложнений (в т.ч. смертельные исходы в связи с сосудистыми причинами, инфаркт миокарда без летального исхода, геморрагический или ишемический инсульт без летального исхода) и системной биодоступностью высокоактивных ингибиторов VEGF. Частота развития тромбоэмболических осложнений в течение первого года лечения в группе пациентов, получавших препарат Луцентис® в дозах 0,3 мг и 0,5 мг, составила 2,3% по сравнению с 1,3% в контрольной группе. В одном из исследований данный показатель составил 3,0% по сравнению с 3,2% в контрольной группе в течение второго года лечения препаратом.
Иммуногенность
Как и при применении других терапевтических препаратов белкового происхождения у пациентов, получающих лечение препаратом Луцентис®, существует риск развития иммунных реакций. Данные, отражающие количество пациентов, у которых с использованием различных иммунологических диагностических тестов выявлены антитела к ранибизумабу, существенно зависят от специфичности и чувствительности указанных тестов.
В исследованиях лечения нВМД у взрослых частота развития иммунных реакций на введение препарата Луцентис® на этапе предварительного лечения составляла 0-3% во всех группах. После ежемесячного введения препарата на протяжении 12-24 месяцев антитела к ранибизумабу были обнаружены примерно у 1-8% пациентов с нВМД.
В исследованиях лечения снижения 03, связанного с ДМО, частота развития иммунных реакций на введение препарата Луцентис® на этапе предварительного лечения составляла 0-2% во всех группах. После ежемесячного введения препарата на протяжении 12 месяцев антитела к ранибизумабу были обнаружены примерно у 2-4% пациентов с ДМО. В исследованиях лечения снижения 03, вызванного МО вследствие ОВС, частота развития иммунных реакций на введение препарата Луцентис® на этапе предварительного лечения составляла 2-3% во всех группах. После ежемесячного введения препарата на протяжении 12 месяцев антитела к ранибизумабу были обнаружены примерно у 4-5% всех пациентов с МО вследствие ОВС.
Клиническая значимость иммунореактивности к препарату на данный момент остается невыясненной.
Мета-анализ совокупных данных по безопасности выявил, что при применении ранибизумаба в дозе 0,5 мг у пациентов с ДМО, частота случаев инфицирования/воспаления неглазных ран, не относящихся к серьезным, была выше, чем в группе контроля (1.85/100 пациенто/лет против 0,27/100 пациенто/лет). Взаимосвязь с ранибизумабом неясна.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты не указанные в инструкции, сообщите об этом врачу.
Передозировка
В клинических исследованиях и при применении препарата в клинической практике отмечались случаи непреднамеренной передозировки препаратом (введение большей дозы, чем рекомендованной — 0,05 мл). В указанных случаях при передозировке ранибизумабом наиболее часто отмечались повышение внутриглазного давления, преходящая слепота, снижение 03, отек роговицы, боль в роговице и боль в глазу. В случае передозировки препаратом следует обязательно контролировать ВГД; при необходимости пациент должен находиться под наблюдением врача.
В клинических исследованиях доза ранибизумаба у пациентов с нВМД и снижением 03, связанным с ДМО, достигала 2 мг в виде интравитреальной инъекции объемом 0,05 мл и 0,10 мл. Частота возникновения и характер местных и системных побочных эффектов соответствовали таковым при применении 0,5 мг ранибизумаба в виде интравитреальной инъекции объемом 0,05 мл.
Взаимодействие с другими лекарственными средствами
Взаимодействие препарата Луцентис® с другими лекарственными препаратами не изучалось.
В клинических исследованиях одновременное применение ранибизумаба для лечения снижения 03, связанного с ДМО, с производными тиазолидиндиона не оказывало влияния на результат лечения в отношении 03 и толщины центральной зоны сетчатки.
Препарат не следует смешивать с какими-либо другими лекарственными препаратами или растворителями.
Отсутствуют данные по применению ранибизумаба одновременно с вФДТ у пациентов со снижением 03, вызванным ХНВ при ПМ.
Особые указания
Проводить лечение препаратом должен только офтальмолог, имеющий опыт выполнения интравитреальных инъекций.
Реакции, связанные с интравитреальной инъекцией
При проведении интравитреальных инъекций возможно развитие эндофтальмита, внутриглазного воспаления, регматогенной отслойки сетчатки, разрыва сетчатки и ятрогенной травматической катаракты. Введение препарата Луцентис® следует всегда проводить в асептических условиях. Кроме того, в течение 1 недели после инъекции препарата необходимо наблюдать пациента с целью раннего выявления возможного местного инфекционного процесса и проведения своевременной терапии. Следует информировать пациента о необходимости незамедлительно сообщать врачу обо всех симптомах, которые могут свидетельствовать о развитии эндофтальмита, или любых вышеперечисленных явлениях.
Артериальная тромбоэмболия
При интравитреальной инъекции ингибиторов VEGF-A возможно развитие артериальных тромбоэмболических осложнений. В клиническом исследовании у пациентов с нВМД частота артериальной тромбоэмболии при применении ранибизумаба была сопоставима с контрольной группой.
Частота инсультов была выше в группе применения ранибизумаба в дозе 0,5 мг, по сравнению с таковой в группе применения ранибизумаба 0,3 мг или группе плацебо, однако это различие статистически не значимо. Риск развития инсульта может быть выше при наличии факторов риска, включая перенесенный ранее инсульт или транзиторные нарушения мозгового кровообращения в анамнезе. Лечащему врачу следует тщательно оценить соотношение польза/риск у пациентов данной группы.
Иммуногенность
Препарат обладает иммуногенными свойствами. Так как у пациентов с ДМО существует более высокий риск системного воздействия препарата, необходимо помнить и о более высоком риске развития реакций гиперчувствительности у пациентов данной категории. Следует предупредить пациента о необходимости сообщать врачу о признаках, свидетельствующих о развитии интраокулярного воспаления, что может указывать на интраокулярное формирование антител к препарату.
Одновременное применение препарата Луцентис® с другими лекарственными препаратами, оказывающими ингибирующее влияние на VEGF (для местного или системного применения)
Одновременное применение препарата Луцентис® с другими лекарственными препаратами, оказывающими ингибирующее влияние на VEGF (для местного или системного применения), недопустимо.
Приостановление терапии препаратом Луцентис®
Очередную инъекцию препарата Луцентис® следует отменить и не производить до следующей инъекции по расписанию в следующих случаях:
- снижение МКОЗ на ≥30 букв по сравнению с последним определением;
- ВГД ≥30 мм рт. ст.;
- разрыв сетчатки;
- субретинальные кровоизлияния, затрагивающие центральную часть фовеа, или площадь кровоизлияния составляет ≥50% площади поражения;
- в течение 28 дней до или после интраокулярного хирургического вмешательства.
Разрыв пигментного эпителия сетчатки
Следует соблюдать осторожность при применении препарата у пациентов с нВМД и выявленной обширной и/или высокой отслойкой пигментного эпителия сетчатки, так как у пациентов данной категории повышен риск развития разрывов пигментного эпителия.
Регматогенная отслойка сетчатки или макулярное отверстие
Препарат следует применять с осторожностью у пациентов с риском развития регматогенной отслойки сетчатки. У пациентов с регматогенной отслойкой сетчатки или макулярным отверстием 3, 4 стадии лечение препаратом Луцентис® должно быть прекращено.
Повышение внутриглазного давления
У пациентов после введения препарата Луцентис® отмечалось временное (в течение 60 мин после инъекции) повышение ВГД. Также отмечались случаи устойчивого повышения ВГД. На фоне применения препарата Луцентис® рекомендуется контролировать ВГД и перфузию диска зрительного нерва и при необходимости проводить надлежащее лечение.
Билатеральное применение
Из ограниченных данных по инъекциям препарата Луцентис® в оба глаза (включая инъекции в один день) не следует, что риск системных нежелательных явлений при этом выше, чем в случае инъекций в один глаз.
Лазерная коагуляция сетчатки
Возможно применение препарата Луцентис® как в монотерапии, так и в сочетании с предшествующей ЛК. При применении обоих методов терапии в течение одного дня, препарат Луцентис® следует вводить спустя как минимум 30 минут после ЛК.
Ограниченные данные
Опыт применения препарата Луцентис® ограничен у пациентов с ДМО вследствие сахарного диабета (СД) 1 типа; у пациентов, ранее получавших лечение препаратами для интраокулярного введения; у пациентов с активными системными инфекциями; с пролиферативной ДР; у пациентов с сопутствующими неинфекционными заболеваниями глаз, такими как отслойка сетчатки или макулярное отверстие. Отсутствует опыт применения препарата Луцентис® у пациентов с СД с концентрацией гликированного гемоглобина (HbAlc) более 12% и неконтролируемой артериальной гипертензией.
Опыт применения препарата Луцентис® ограничен у пациентов с ИМ, ранее безуспешно подвергавшихся вФДТ. Несмотря на то, что у пациентов с субфовеальной и юкстафовеальной локализацией поражения отмечался сходный эффект, недостаточно данных для выводов относительно эффективности применения препарата Луцентис® у пациентов с ПМ с экстрафовеальной локализацией поражения.
Женщины с сохраненным репродуктивным потенциалом
При проведении терапии препаратом Луцентис® женщинам с сохраненным репродуктивным потенциалом следует применять надежные методы контрацепции.
Влияние на способность управлять транспортными средствами и механизмами
На фоне применения ранибизумаба возможно развитие временных нарушений зрения, отрицательно влияющих на способность управлять транспортными средствами и механизмами. При возникновении таких симптомов пациентам не следует управлять транспортными средствами или механизмами до снижения выраженности временных зрительных нарушений.
Форма выпуска
Раствор для внутриглазного введения, 10 мг/мл.
I. По 0,23 мл во флакон из бесцветного стекла, укупоренный резиновой пробкой, обкатанной алюминиевым колпачком с отщелкивающейся крышкой.
По одному флакону вместе с инструкцией по медицинскому применению в картонную пачку или по одному флакону в комплекте с иглой, снабженной фильтром, для извлечения препарата из флакона, вместе с инструкцией по медицинскому применению в картонную пачку или по одному флакону в комплекте с иглой, снабженной фильтром, для извлечения препарата из флакона, шприцем, иглой для инъекций вместе с инструкцией по медицинскому применению в картонную пачку.
II. По 0,165 мл препарата в предварительно заполненном шприце из стекла, укупоренном резиновой пробкой с белой полипропиленовой крышкой контроля первого вскрытия.
По одному предварительно заполненному шприцу в блистере, снабженном этикеткой, вместе с инструкцией по медицинскому применению в картонную пачку.
Условия хранения
В защищенном от света месте при температуре от 2 до 8°С. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять после истечения срока годности.
Условия отпуска
Отпускают по рецепту.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Новартис Фарма АГ, Лихтштрассе 35, 4056 Базель, Швейцария / Novartis Pharma AG, Lichtstrasse 35, 4056 Basel, Switzerland.
Производитель
Производство готовой лекарственной формы и первичная упаковка
Флаконы:
Новартис Фарма Штейн АГ, Шаффхаузерштрассе, 4332 Штейн, Швейцария/ Novartis Pharma Stein AG, Schaffhauserstrasse, 4332 Stein, Switzerland.
Предварительно заполненные шприцы:
Веттер Фарма- Фертигунг ГмбХ & Ко., Айзенбанштр. 2-4, 88085 Лангенарген, Германия/
Vetter Pharma-Fertigung GmbH & Со. KG, Eisenbahnstr. 2-4, 88085 Langenargen. Germany.
Вторичная/потребительская упаковка и выпускающий контроль качества
Новартис Фарма Штейн АГ, Шаффхаузерштрассе, 4332 Штейн, Швейцария/ Novartis Pharma Stein AG, Schaffhauserstrasse, 4332 Stein, Switzerland.
Получить дополнительную информацию о препарате, а также направить претензии и информацию о нежелательных явлениях можно по следующему адресу в России
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 72, корпус 3.
Указания по применению
Флакон
Невскрытый флакон можно хранить при температуре 25°С не более 24 часов.
Флакон предназначен для однократного применения. После проведения инъекции неиспользованный препарат следует утилизировать в соответствии с принятыми нормами. Флакон стерилен. Не использовать флакон при повреждении упаковки. Стерильность флакона не может быть гарантирована в случае, если упаковка повреждена. Не использовать флакон, если изменен цвет раствора, если раствор мутный или содержит нерастворенные частицы.
Для подготовки к интравитреальной инъекции потребуются следующие одноразовые медицинские изделия:
- игла, снабженная фильтром 18G (размер пор 5 мкм),
- шприц вместимостью 1 мл,
- игла для инъекций 30G х 1,2.
Перечисленные медицинские изделия не входят в состав упаковки, содержащей только флакон.
В комплект упаковки, содержащей флакон и иглу, снабженную фильтром, для извлечения содержимого из флакона, не входит стерильный шприц, вместимостью 1 мл и инъекционная игла.
Приготовление раствора препарата для интравитреальной инъекции следует проводить следующим образом:
|
A. |
1. Перед вскрытием флакона с препаратом поверхность резиновой пробки следует продезинфицировать. |
|
Б. |
4. После извлечения препарата из флакона поршень шприца следует отодвинуть назад (до отметки 0,8-0,9 мл) для полного перехода раствора из иглы, снабженной фильтром, в шприц. |
B. |
6. В асептических условиях шприц плотно соединяют с иглой для инъекции (30G х 1,2). |
Г. |
8. Аккуратно удаляют воздух из шприца и устанавливают поршень на отметке 0,05 мл. Только после этого можно вводить препарат в стекловидную камеру глаза. |
Инъекционная игла вводится в стекловидную камеру глаза на 3,5-4 мм кзади от лимба, избегая горизонтального меридиана и направляя иглу к центру глазного яблока. Объем инъекции составляет 0,05 мл, следующая инъекция выполняется в другой участок склеры.
Предварительно заполненный шприц
Невскрытую упаковку с предварительно заполненным шприцом можно хранить при температуре 25°С не более 24 часов.
Предварительно заполненный шприц предназначен для одноразового применения.
Предварительно заполненный шприц стерилен. Не использовать предварительно заполненный шприц при повреждении упаковки. Стерильность гарантирована только при отсутствии повреждений блистера. Не применять в случае изменения цвета, помутнения раствора или появления включений/осадка.
Приготовление раствора препарата для интравитреальной инъекции следует проводить следующим образом:
| Внимательно прочитайте эту инструкцию перед тем, как начать применение препарата. Необходимо соблюдение правил асептики при проведении инъекций препарата. ! Внимание: Необходимо установить поршень на отметке 0,05 мл. |
||
| Описание предварительно заполненного шприца | 
|
|
| Подготовка | 1. Раскройте упаковку шприца, удалив с нее пленочную крышку. 2. Осторожно извлеките предварительно заполненный шприц из блистера, соблюдая правила асептики. |
|
|
Проверьте шприц |
3. Убедитесь, что: |
|
|
Удалите колпачок для наконечника шприца |
5. Отломите (не поворачивая и не откручивая) колпачок для наконечника шприца (см. рис. 1). |
 Рис.1.  Рис.2. |
|
Присоедините иглу |
7. Присоедините иглу для инъекции к предварительно заполненному шприцу, плотно прикрутив к наконечнику типа «Луер-Лок» (см. рис. 3). |
 Рис.3.  Рис.4. |
|
Удалите из шприца пузырьки воздуха |
9. Удерживайте шприц в вертикальном положении. |
 Рис.5. Рис.5. |
|
Отмерьте дозу |
11. Удерживая шприц на уровне глаз, осторожно надавите на поршень до тех пор, пока нижний край купола резинового ограничителя хода поршня не сравняется с линией отметки 0,05 мл (см. рис. 6). |
 Рис.6. Рис.6. |
|
Выполните интравитреальную инъекцию |
12. Препарат Луцентис® следует вводить в стекловидную камеру глаза на 3,5-4 мм кзади от лимба, избегая горизонтального меридиана и направляя иглу к центру глазного яблока. |
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Луцентис®
МНН: Ранибизумаб
Производитель: Новартис Фарма Штейн АГ
Анатомо-терапевтическо-химическая классификация: Ranibizumab
Номер регистрации в РК:
№ РК-ЛС-5№016259
Информация о регистрации в РК:
24.06.2020 — бессрочно
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
237 905.1 KZT
- Скачать инструкцию медикамента
Торговое название
Луцентис®
Международное непатентованное название
Ранибизумаб
Лекарственная форма
Раствор для инъекций, 10 мг/мл
Состав
Один мл раствора содержит
активное вещество — ранибизумаб 10 мг,
вспомогательные вещества: α,α-трегалозы дигидрат, L-гистидина гидрохлоридa моногидрат, L-гистидин, полисорбат 20, вода для инъекций.
Описание
Прозрачный или слегка опалесцирующий бесцветный раствор.
Фармакотерапевтическая группа
Препараты для лечения заболеваний глаз. Средства для лечения сосудистых расстройств окологлазного пространства. Антинеоваскулярные средства. Ранибизумаб
Код АТХ S01LA04
Фармакологические свойства
Фармакокинетика
Абсорбция
После ежемесячного интравитреального применения препарата Луцентис® у пациентов с неоваскулярной возрастной макулярной дегенерацией (ВМД) концентрация ранибизумаба в сыворотке крови, как правило, низкая, с максимальным уровнем (Cmax) ниже концентрации, необходимой для ингибирования биологической активности сосудистого эндотелиального фактора роста (VEGF) на 50 % (11‑27 нг/мл, как определено в исследовании клеточной пролиферации in vitro), Cmax пропорциональна дозе 0,05–1,0 мг/глаз.
При ежемесячном интравитреальном введении препарата Луцентис® в дозе 0,5 мг в глаз, максимальная концентрация ранибизумаба в сыворотке наблюдается приблизительно через день после введения препарата и составляет 0,79–2,90 нг/мл, Cmin может составлять 0,07–0,49 нг/мл. Сывороточные концентрации у пациентов с диабетическим макулярным отеком и окклюзией вены сетчатки были аналогичны концентрациям у пациентов с неоваскулярной (экссудативной формы) возрастной макулярной дегенерации.
Распределение/Выведение
При введении препарата в дозе 0,5 мг, среднее значение периода полувыведения ранибизумаба из стекловидного тела составляет приблизительно 9 дней. Экспозиция ранибизумаба в сыворотке крови приблизительно в 90 000 раз ниже, чем в стекловидном теле.
Фармакокинетика в особых группах пациентов.
Пациенты с нарушением функции почек.
Не проводились исследования фармакокинетики препарата у больных с нарушением функции почек. При изучении фармакокинетики в популяции пациентов с неоваскулярной формой ВМД 68% (136 из 200) пациентов имели нарушения функции почек (46,5% — незначительные [50-80 мл / мин], 20% — умеренные [30-50 мл / мин], 1,5% — тяжелые [менее 30 мл / мин]). Уровень системного клиренса был несколько ниже, но клинически незначительным.
Пациенты с нарушением функции печени.
Не проводились исследования фармакокинетики препарата у больных с нарушением функции печени.
Фармакодинамика
Ранибизумаб — фрагмент рекомбинантного гуманизированного моноклонального антитела против человеческого сосудистого эндотелиального фактора роста А (VEGF-A). Он связывает с высокой аффинностью изоформы VEGF-A (например, VEGF110, VEGF121 и VEGF165) и, таким образом, предотвращает прикрепление VEGF-A к его рецепторам VEGFR-1 и VEGFR-2. Прикрепление VEGF-A к его рецепторам приводит к пролиферации эндотелиальных клеток и неоваскуляризации, а также проницаемости сосудов, что, содействует развитию неоваскулярной формы возрастной макулярной дегенерации (ВМД) или патологической миопии, а также макулярного отека, ведущего к нарушению зрения при диабете или окклюзии вен сетчатки.
Препарат Луцентис эффективно улучшает зрение у пациентов при экссудативной ВМД с классическим компонентом хориоидальной неоваскуляризации (ХНВ) или без него. Рост остроты зрения и уменьшение толщины сетчатки может достигать максимума уже после трех последовательных ежемесячных инъекций — фаза стабилизации (у некоторых больных может проявиться уже в течение первой недели, после первой инъекции препарата Луцентис®), и поддерживается на фоне терапии на протяжении 24 месяцев.
Показания к применению
— неоваскулярная (экссудативная) возрастная макулярная дегенерация (ВМД)
— коррекция зрения при диабетическом макулярном отеке (ДМО)
— нарушение зрения вследствие макулярного отека в результате окклюзии ретинальных вен (ОРВ)
— лечение нарушения зрения при хориоидальной неоваскуляризации вследствие патологической миопии
Способ применения и дозы
Дозировка
Препарат Луцентис® применяется только для интравитреального введения. Применение более одной инъекций из одного флакона может привести к загрязнению и последующей инфекции.
Введение препарата Луцентис® должен выполнять только квалифицированный врач-офтальмолог, имеющий опыт проведения интравитреальных инъекций.
{The recommended dose for Lucentis is 0.5 mg given as a single intravitreal injection.|Рекомендуемая доза препарата Луцентис® составляет 0,5 мг в виде однократной интравитреальной инъекции. Это составляет 0,05 мл. Интервал между двумя дозами, вводимыми в один и тот же глаз, должен составлять не менее одного месяца.
Лечение экссудативной ВМД, нарушений зрения вследствие ДМО, нарушений зрения вследствие макулярного отека в результате ОРВ, нарушения зрения при хориоидальной неоваскуляризации вследствие патологической миопии }
Лечение начинают с одной инъекции в месяц до достижения максимальной остроты зрения и/или отсутствия признаков прогрессирования болезни. После этого, интервалы мониторинга и лечения должны определяться врачом и должны быть основаны на прогрессировании заболевания по оценке остроты зрения и /или анатомических параметров.
Мониторинг прогрессирования заболевания может включать в себя клиническое обследование, функциональное тестирование или методы визуализации (например, оптической когерентной томографии или флуоресцентной ангиографии).
Если пациенты проходят лечение в соответствии с режимом лечить-и-продлевать, то интервалы лечения могут быть продлены ступенчато до признаков прогрессирования заболевания или повторения нарушений зрения. Интервал лечения может быть продлен на две недели при влажной форме ВМД и окклюзии центральной вены сетчатки, или на один месяц при ДМО и окклюзии ветки вены сетчатки. Если прогрессирование заболевания повторяется, интервал лечения должен быть сокращен соответственно.При лечении нарушений зрения по причине хориоидальной неоваскуляризации на фоне патологической миопии многим пациентам, возможно, потребуется только одна или две инъекции в течение первого года, в то время как некоторые пациенты могут нуждаться в более частом лечении.
{Lucentis and laser photocoagulation in DME 
{Lucentis can be safely administered concomitantly with laser photocoagulation as well as in patients who have received previous laser photocoagulation.|Применение препарата Луцентис® может сопутствовать лазерной фотокоагуляции, а также назначаться пациентам, которые уже получали лазерную фотокоагуляцию. }{When given on the same day, Lucentis should be administered at least 30 minutes after laser photocoagulation [25,26].|В случае назначения препарата Луцентис® в тот же день, его необходимо вводить как минимум через 30 минут после процедуры фотокоагуляции.
{Additional information on special populations|Дополнительная информация для особых групп пациентов}
{Hepatic impairment|Печеночная недостаточность}
{Lucentis has not been studied in patients with hepatic impairment.|Применение препарата Луцентис® у больных с нарушением функции печени не изучалось. }{However, as systemic exposure is negligible, no special measures are considered necessary in this population [16].|Тем не менее, поскольку системное воздействие незначительно, особые указания для данной группы пациентов отсутствуют.}
{Renal impairment|Почечная недостаточность}
{Dose adjustment is not needed in patients with renal impairment (see section 5.2 Pharmacokinetic properties).|Пациентам с нарушением функции почек не требуются коррекции дозы препарата.}
{Children and adolescents (below 18 years of age)|Дети и подростки (до 18 лет)}
{Lucentis is not recommended for use in children and adolescents due to a lack of data on safety and efficacy in these sub-populations.|Препарат Луцентис® не рекомендуется применять детям и подросткам, поскольку отсутствует достаточная информация о безопасности и эффективности данного препарата для этой подгруппы пациентов.}
{Elderly (65 years of age and above)|Пожилые люди (от 65 лет)}
{No dose adjustment is required in the elderly.|Коррекции дозы препарата не требуются для лиц пожилого возраста.
Информация по введению и применению
Как и все препараты для парентерального введения, раствор перед применением нужно визуально проверить на наличие механических частиц или изменение цвета.
Введение препарата проводят в стерильных условиях, которые включают: дезинфекцию рук как при хирургическом вмешательстве, стерильные перчатки и салфетки, стерильный векорасширитель (или эквивалент), стерильный инструмент для парацентеза (если нужно). Следует внимательно пересмотреть аллергологический анамнез пациента перед выполнением интравитреальной инъекции. Необходимо продезинфицировать кожу вокруг глаза, веко и поверхность глаза. Соответствующая анестезия и бактерицидное средство широкого спектра действия должны быть определены до проведения инъекции.
Иглу для инъекций нужно ввести на 3,5–4 мм позади от лимба, в полость стекловидного тела, отклоняясь от горизонтального меридиана и направляя иглу по направлению к центру глазного яблока. Затем ввести 0,05 мл раствора; место прокола склеры нужно менять при последующих инъекциях.
Флакон препарата предназначен только для одноразового использования.
Флакон стерилен. Не используйте флакон, если упаковка имеет повреждения. Стерильность флакона гарантируется только в случае наличия неповрежденной упаковочной пломбы. Не используйте флакон, если раствор изменил цвет, замутнен или содержит механические частицы.
Для приготовления раствора Луцентис® для интравитреального введения следует придерживаться нижеследующей инструкции:
| 479992381477976373_ru.doc | 172 кб |
| 216131141477977569_kz.doc | 154 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Препарат Луцентис
Луцентис (ранибизумаб) – лекарственный препарат, останавливающий прогрессирование экссудативно-геморрагической формы ВМД, макулярного отека при сахарном диабете и окклюзии (тромбозе) вен сетчатки.
Уникальная возможность для пациентов из Вологодской области! Бесплатное введение препарата Луцентис по полису ОМС!
Многоканальный телефон для записи +7(499)110-4302.
Люди старшего поколения нередко сталкиваются с частичной или полной потерей зрения. Макулярная дегенерация возрастного характера является хроническим заболеванием глаз, связанным с прогрессирующим ухудшением центрального зрения. Введение Луцентиса, по мнению большинства офтальмологов, – наилучший способ лечения этой проблемы. Результаты многочисленных исследований доказали эффективность лекарственного средства.
- Что такое Луцентис
- Состав и форма выпуска
- Показания к применению Луцентиса
- Механизм действия
- Противопоказания
- Способ применения и дозы
- Как проходит процедура введения Луцентиса в глаз
- Эффективен ли препарат
- Аналоги
- Результаты и отзывы пациентов
- Стоимость введения Луцентиса
Что такое Луцентис
С 2006 года препарат Луцентис был признан FDA, а впоследствии и утвержден как уникальное лекарство, которое может использоваться в терапевтических целях. Его активно используют в офтальмологии с целью терапии возрастного макулярного разрушения глазной сетчатки. Данная патология считается прогрессирующей, поэтому требует незамедлительного лечения.
Сложность лечения макулодистрофии заключается в том, что цель терапии – обеспечение предотвращения роста аномальных кровеносных сосудов и вероятности возникновения кровотечения. И если ранее добиться этого офтальмологам удавалось крайне редко, сейчас блокирование активного роста новых сосудов возможно, если сделать укол Луцентиса.
Состав и форма выпуска
В составе раствора для инъекции имеется активное вещество Ранибизумаб в количестве 10/2,3 мг. Этот компонент является фрагментом рекомбинантного гуманизированного моноклональноо антитела. Действие его направлено против сосудистого эндотелиального фактора роста А. То есть его воздействие приводит к изменению проницаемости сосудов. Также в составе лекарственного средства имеются вспомогательные компоненты:
- полисорбат;
- вода д/и;
- α,α-трегалозы дигидрат;
- L9гистидина гидрохлорида моногидрат.
Луцентис производится в форме раствора для инъекций. Для удобства применения препарат выпускается во флаконе объемом 0,23 мл в комплекте с иглой и шприцом для одноразового введения.
Показания к применению Луцентиса
Так как основным направлением воздействия активных компонентов препарата является блокирование роста патогенных кровеносных сосудов в сетчатке глаза, лечение Луцентисом назначается при таких показаниях:
- неоваскулярная форма возрастной макулярной дегенерации у пациентов старшей возрастной группы;
- ухудшение зрения, связанное с диабетическим отеком макулы;
- в сочетании с лазерной коагуляцией может использоваться для терапии потери зрения;
- снижение остроты зрения, связанное с хориодальной неоваскуляризацией, вызванной патологической миопией;
- нарушение зрения, обусловленное макулярным отеком, вызванным тромбозом вен сетчатки.
В других случаях целесообразность применения препарата определяется лечащим врачом по результатам обследования и особенности заболевания.
Механизм действия
Активное вещество препарата – Ренибизумаб, попадая в область воздействия, избирательно связывается с изофорами эндотелиального фактора роста сосудов. Также этот компонент предотвращает взаимодействие VEGF-А с его рецепторами, расположенными на поверхности клеток эндотелия. Данный процесс способствует снижению неоваскуляризации и полиферации сосудов. Таким образом, происходит подавление активного роста сосудов хориоидеи в сетчатку.
Противопоказания
Применение Луцентиса не рекомендуется в следующих случаях:
- у пациента имеется повышенная чувствительность к активным компонентам лекарственного средства;
- ранее диагностированы любые инфекционные заболевания глаз;
- у пациента обнаружено интраокулярное воспаление.
Не рекомендуется использовать данный раствор для лечения снижения зрения детям младше 18 лет, а также женщинам в период беременности и лактации.
С осторожностью назначается терапия Луцентисом больным при ранее зафиксированной аллергической реакции и при возникновении вероятности возникновения инсульта. В этих случаях должно осуществляться врачебное наблюдение за состоянием пациента во время и после процедуры.
Способ применения и дозы
Препарат применяют только в виде инъекций в стекловидное тело, что оговорено в инструкции Луцентиса. Содержимое одного флакона предназначено для одного укола в один глаз. Осуществление манипуляции допустимо только в амбулаторных условиях профильным специалистом.
Дозировка и длительность лечения определяется офтальмологом, учитывая диагноз и стадию заболевания:
- Терапия влажной формы ВМД: инъекции с применением лекарства выполняются каждый месяц. Курс терапии продолжается до тех пор, пока не будет достигнута максимальная стабильность остроты зрения.
- Инъекция Луцентиса при ДМО выполняется один раз в месяц, курс, как правило, достигает трех месяцев. Терапия может возобновляться в случае снижения зрения у пациента.
- При терапии потери зрения, вызванной отеком макулы, пациенту необходимо ежемесячно вводить инъекцию препарата до достижения максимальной остроты зрения.
- Однократная инъекция Луцентиса может быть назначена пациентам в качестве терапии снижения остроты зрения, вызванного ХНВ.
В зависимости от длительности лечения, определяется и стоимость курса инъекций Луцентиса.
Как проходит процедура введения Луцентиса в глаз
Процедура может проводится как амбулаторно, так и в стационаре. Это зависит от сопутствующих заболеваний и состояния пациента. Как правило, пребывания в стационаре не требуется, а сама процедура занимает 10-15 минут.
Как и при применении прочих препаратов для парентерального введения, перед процедурой инъекции, флакон с раствором Луцентис визуально проверяется врачом на предмет наличия механических частиц или изменения оттенка лекарственного средства.
Процедура проводится в асептических условиях. После применения местной анестезии в виде капель, препарат в дозировке 0,5 мг (или 0,05 мл) вводится в стекловидное тело. Иглу для инъекции вводят на 3-4 мм позади лимба в пустоту стекловидного тела. При следующей инъекции место прокола склеры меняется, чтобы избежать появления рубцов.
Эффективен ли препарат
Как показывает врачебная практика, с применением препарата Луцентис, толщина сетчатки нормализуется, останавливается ухудшение зрения, в некоторых случаях острота зрения восстанавливается. Активные компоненты проникают во все слои сетчатки. Эффективность терапии этим препаратом подтверждается спустя некоторое время после процедуры, стабилизация зрения наступает после курса лечения.
Аналоги
Луцентис – первый препарат, который был произведен для терапии возрастной макулярной дегенерации. Именно он считается настоящим прорывом в офтальмологии, с 2006 года он считался уникальным в своей линии. Но медицина не стоит на месте, и по сегодняшний день проводятся разработки аналогов и препаратов, которые будут обладать более пролонгированным сроком действия.
В 2011 году ученым в США удалось разработать новый препарат, который предназначен для терапии влажной формы возрастной макулярной дегенерации сетчатки глаза. В начале 2016 года препарат Эйлеа официально зарегистрирован в России и сегодня также активно используется в офтальмологии.
Результаты и отзывы пациентов
Как показывают отзывы, Луцентис считается действенным в лечении главных причин возрастной малукодистрофии. При применении препарата в течение 2 лет, у пациентов с ВМД и субфовеальной хориодальной неоваскуляризацией в 90% случаев заметно уменьшается риск снижения остроты зрения, а более, чем у 30% больных наблюдается улучшение зрения.
Стоимость введения Луцентиса
Стоимость инъекции Луцентиса в глаз определяется с учетом стоимости препарата.
| Интравитреальное введение препарата Луцентис (стоимость одной инъекции) | 32 900 руб. |
В центре «Реалайз» возможно бесплатное интравитреальное введение препарата Луцентис за счет финансирования по программе обязательного медицинского страхования (по полису ОМС) для пациентов из Вологодской области.
Количество операций по полису зависит от объемов финансирования по линии ОМС. Подробности уточняйте по телефону.
Записаться на консультацию >>>