Дифференцированный рак щитовидной железы
Версия: Клинические рекомендации РФ 2018-2020 (Россия)
Категории МКБ:
Злокачественное новообразование щитовидной железы (C73)
Разделы медицины:
Онкология, Эндокринология
Общая информация
Краткое описание
Министерство здравоохранения Российской Федерации
Общероссийский национальный союз «Ассоциация онкологов России»
Общероссийская общественная организация «Российское общество специалистов по опухолям головы и шеи»
Ассоциация эндокринных хирургов
Общественная организация «Российская Ассоциация Эндокринологов»
Клинические рекомендации: Дифференцированный рак щитовидной железы
Год утверждения (частота пересмотра): 2020
ID:329
Определение заболевания или состояния (группы заболеваний или состояний)
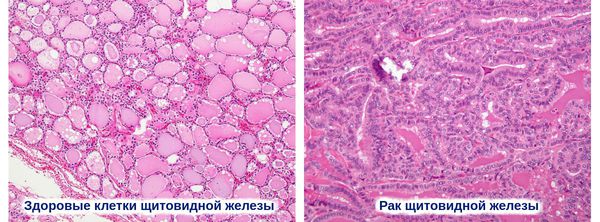
Дифференцированный РЩЖ (РЩЖ) – злокачественная опухоль из фолликулярных клеток щитовидной железы (ЩЖ), сохраняющих присущие им признаки дифференцировки.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Код по Международной классификации болезней 10-го пересмотра (МКБ-10) – С73 Злокачественное новообразование щитовидной железы.
Несмотря на единое кодирование по МКБ-10, дифференцированные формы РЩЖ и медуллярный РЩЖ – различные нозологии. Диффузную закладку С-клеток в ЩЖ по происхождению и функции можно считать самостоятельным органом, например, таким же, как околощитовидные железы. Это объясняет несколько иные свойства С-клеточных опухолей. С опухолями ЩЖ из А- и В-клеток медуллярный РЩЖ объединяет лишь локализация, но на этом их сходство заканчивается. Нейроэндокринная природа медуллярного РЩЖ является причиной принципиального иных подходов к диагностике, лечению и наблюдению. В связи с этим принято решение о разделении клинических рекомендаций по лечению РЩЖ на 2 отдельных документа: клинические рекомендации по диагностике и лечению дифференцированного РЩЖ и клинические рекомендации по диагностике и лечению медуллярного РЩЖ.
Облачная МИС «МедЭлемент»
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Международная гистологическая классификация опухолей ЩЖ (классификация Всемирной организации здравоохранения, 4-е издание, 2010 г.):
- 8330/0 Фолликулярная аденома;
- 8336/1 Гиалинизирующая трабекулярная опухоль
- 8335/1 Фолликулярная опухоль неясного злокачественного потенциала;
- 8348/1 Высокодифференцированная опухоль с неясным злокачественным потенциалом;
- 8349/1 Неинвазивная фолликулярная неоплазма с папилляроподобными ядерными изменениями;
- 8260/3 Папиллярная аденокарцинома, без дополнительного уточнения;
- 8340/3 Папиллярный рак, фолликулярный вариант;
- 8343/3 Папиллярный рак, инкапсулированный;
- 8341/3 Папиллярная микрокарцинома;
- 8344/3 Папиллярный рак, цилиндроклеточный;
- 8342/3 Папиллярный рак, из оксифильных клеток;
- 8330/3 Фолликулярная аденокарцинома, без дополнительного уточнения;
- 8335/3 Фолликулярный рак, минимально инвазивный;
- 8339/3 Фолликулярный рак, инкапсулированный, с сосудистой инвазией;
- 8330/3 Фолликулярная аденокарцинома, без дополнительного уточнения;
- 8290/0 Оксифильная аденома;
- 8290/3 Оксифильная аденокарцинома;
- 8337/3 Рак, недифференцированный, без дополнительного уточнения;
- 8020/3 Анапластический рак;
- 8070/3 Плоскоклеточный рак, без дополнительного уточнения.
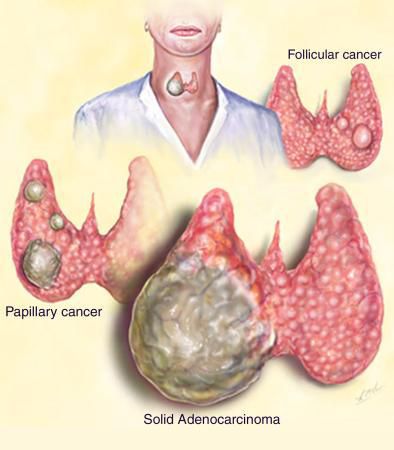
Гистологическая классификация РЩЖ
Существует 6 гистологических типов РШЖ:
1. папиллярный;
2. фолликулярный;
3. медуллярный;
4. гюртлеклеточный;
5. низкодифференцированный;
6. анапластический [3].
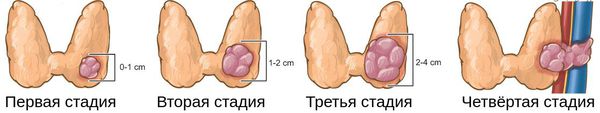
Стадии дифференцированного и анапластического РЩЖ (Американский объединенный комитет по раку (AJCC), 8-е издание, 2017 г.).
Категория Т включает следующие градации:
- T – первичная опухоль;
- Tx – недостаточно данных для оценки первичной опухоли;
- T0 – первичная опухоль не определяется;
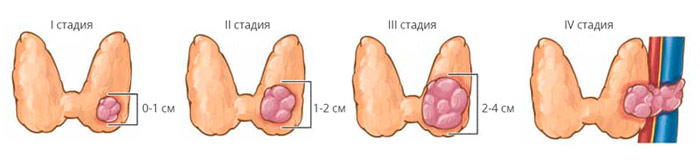
- T1 – опухоль размером до 2 см в наибольшем измерении, ограниченная тканью ЩЖ;
- T1a – опухоль размером <1 см, ограниченная тканью ЩЖ;
- T1b – опухоль размером более 1, но менее 2 см в диаметре, ограниченная тканью ЩЖ;
- Т2 – опухоль размером более 2, но не более 4 см в наибольшем измерении, ограниченная тканью ЩЖ;
- Т3 – опухоль размером >4 см в наибольшем измерении, ограниченная тканью ЩЖ, или любая опухоль с минимальным распространением за пределы капсулы (в m. sternothyroid или мягкие ткани около ЩЖ);
- Т3а – опухоль размером >4 см, ограниченная тканью ЩЖ;
- Т3b – любого размера опухоль с макроскопическим распространением за пределы капсулы ЩЖ с инвазией только в подподъязычные мышцы (грудиноподъязычную, грудинощитовидную, щитоподъязычную или лопаточно-подъязычную);
- Т4 – массивное распространение опухоли за пределы капсулы ЩЖ;
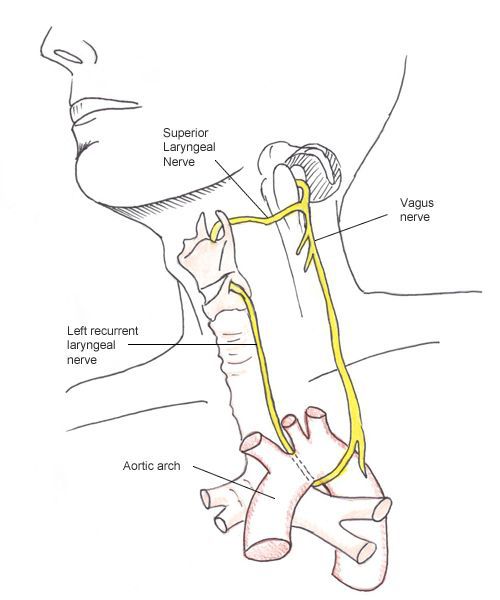
- Т4а – опухоль прорастает в капсулу ЩЖ и распространяется на любую из следующих структур: подкожные мягкие ткани, гортань, трахею, пищевод, возвратный нерв;
- Т4b – опухоль распространяется на предпозвоночную фасцию, сосуды средостения или оболочку сонной артерии.
Категория N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах:
- Nx – недостаточно данных для оценки регионарных лимфатических узлов;
- N0 – нет признаков метастатического поражения регионарных лимфатических узлов;
- N0a – один или несколько лимфатических узлов с цитологическим или гистологическим подтверждением отсутствия опухоли;
- N0b – отсутствие радиологических или клинических признаков метастатического поражения регионарных лимфатических узлов;
- N1 – имеется поражение регионарных лимфатических узлов метастазами;
- N1a – метастазы в лимфатических узлах VI или VII уровней (пре- и паратрахеальные, преларингеальные или верхние средостенные). Как одностороннее, так и двустороннее поражение;
- N1b – метастазы в шейных лимфатических узлах на одной стороне или с обеих сторон, или на противоположной стороне (I, II, III, IV или V), или в заглоточных лимфатических узлах.
Категория М характеризует наличие или отсутствие метастазов:
- М0 – нет признаков отдаленных метастазов;
- М1 – имеются отдаленные метастазы.
Группировка по стадиям
| До 55 лет | |||
| Стадия I | Т любая | N любая | М0 |
| Стадия II | Т любая | N любая | Ml |
| 55 лет и старше | |||
| Стадия I |
T1 T2 |
N0/Nx N0 |
M0 M0 |
| Стадия II |
T1 T2 T3a/b |
N1 N1 N любая |
M0 M0 M0 |
| Стадия III | T4a | N любая | M0 |
| Стадия IVА | Т4b | N любая | M0 |
| Стадия IVВ | Т4b | N любая | M1 |
| Анапластический рак | |||
| Стадия IVa | Т1–3a | N0/Nx | M0 |
| Стадия IVВ |
Т1–3a T3b T4b |
N1 N любая N любая |
M0 M0 M0 |
| Стадия IVc | T любая | N любая | M1 |
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
На сегодняшний день выделяют ряд основных факторов развития РЩЖ: мутации генов BRAF, PTEN, APC, DICER1, MNG, NRAS, KRAS, TERT и др., воздействие ионизирующего излучения, наследственные синдромы (Гарднера, Каудена, множественной эндокринной неоплазии 2А и 2B типа и др.) [1].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В 2017 г. в структуре заболеваемости злокачественными новообразованиями РЩЖ составил 2 % случаев. Средний возраст пациентов – 54 года. Стандартизированная заболеваемость РЩЖ в РФ в 2017 г. составила 6 случаев на 100 тыс. населения (среди мужчин — 2,25; среди женщин — 9,16), смертность от РЩЖ – 0,38 случая на 100 тыс. населения (0,35 – среди мужчин; 0,39 – среди женщин) [1, 2].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Дифференцированный РЩЖ не имеет специфической клинической картины и, как правило, проявляет себя как узловой зоб. Анапластический РЩЖ проявляет себя быстро растущим опухолевидным образованием на передней поверхности шеи. На более поздних стадиях присоединяются нарушения дыхания и глотания, увеличение регионарных лимфатических узлов [4, 5].
Диагностика
Критерии установления диагноза/состояния: на дооперационном этапе – результаты цитологического исследования пунктатов ЩЖ, на послеоперационном этапе – плановое патологоанатомическое исследование операционного материала (при необходимости –с иммуногистохимическим типированием) [1, 6–9].
Жалобы и анамнез
Введение: Подавляющее большинство случаев дифференцированного РЩЖ выявляют при обследовании пациентов по поводу узлового зоба. Меньшая часть случаев диагностируется в связи с отягощенным личным или семейным анамнезом, изменением голоса, обнаружением увеличенных шейных лимфатических узлов или отдаленных метастазов [6].
В качестве методов первичной диагностики узлового зоба рекомендуется пальпация ЩЖ и регионарных лимфатических узлов, предварительная оценка голосовой функции, сбор анамнеза для исключения факторов риска принадлежности к группе риска развития агрессивных форм РЩЖ [1, 6–10].
- При сборе жалоб и анамнеза среди пациентов, обратившихся на первичный прием по поводу узлового зоба, рекомендуется обращать внимание на следующие факторы с целью не пропустить РЩЖ высокого риска:
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Рекомендуется при физикальном обследовании обращать внимание на изменение контуров шеи, наличие узлового образования в ЩЖ и увеличение регионарных лимфатических узлов, изменение голоса [5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Лабораторные диагностические исследования
- При выявлении у пациента узлового образования ЩЖ рекомендовано исследование уровня кальцитонина в крови с целью исключения или подтверждения медуллярного рака щитовидной железы. [3].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
- При выявлении у пациента узлового образования ЩЖ рекомендовано исследование уровня тиреотропного гормона (ТТГ) в крови с целью оценки гормонального статуса [11].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
Комментарии: Оценка базальной концентрации кальцитонина в крови значительно превосходит тонкоигольную аспирационную биопсию (ТАБ) в диагностике медуллярного РЩЖ. Это исследование может повлиять на показания к ТАБ, поэтому должно проводиться на первичном этапе обследования.
- Уровень (концентрацию) кальцитонина в крови рекомендуется оценивать с учетом гендерных различий верхней границы референсных значений с целью адекватной интерпретации результатов [3].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
Комментарий: Повышение уровня базального кальцитонина >100 пг/мл крайне подозрительно в отношении медуллярного РЩЖ.
- Дооперационное исследование уровня тиреоглобулина (ТГ) в крови у первичных пациентов с узловыми образованиями в ЩЖ не рекомендовано, так как на этом этапе показатель не является маркером РЩЖ [12].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
Инструментальные диагностические исследования
Ультразвуковое исследование
Введение: Несмотря на высокую разрешающую способность, ультразвуковое исследование (УЗИ) не следует использовать в популяции в качестве метода скрининга РЩЖ в связи с низкой эффективностью как с клинической, так и с финансовой позиции: метод выявляет большое число случаев узлового коллоидного зоба, который, как правило, не имеет клинического значения и не требует какого-либо лечения.
Раннее выявление папиллярных микрокарцином (опухоли размером <1 см) не оказывает влияния на прогноз общей и безрецидивной выживаемости больных.
Основная роль УЗИ при РЩЖ – уточнение показаний к ТАБ, навигация при ее выполнении, оценка местной распространенности процесса и состояния лимфатических узлов для определения оптимального объема оперативного вмешательства [13, 14].
- УЗИ щитовидной железы и лимфатических узлов шеи рекомендовано пациентам с подозрением на опухоль ЩЖ в следующих случаях с целью оценки распространенности процесса, состояния лимфатических узлов и оценки объема предстоящего хирургического лечения:
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Протокол УЗИ ЩЖ включает определение размеров, локализации, ультразвуковых характеристик опухоли. Подозрительными признаками являются (оценивают только в солидных узлах или в солидных участках узлов) [1, 6, 8, 13]:
гипоэхогенная солидная структура; неровный, нечеткий или полициклический контур; точечные гиперэхогенные включения (микрокальцинаты); преобладание переднезаднего размера узла над шириной («выше/чем/шире»).
- Для ультразвуковой оценки вероятности злокачественности опухоли ЩЖ и определения показаний к ТАБ рекомендуется использовать систему EU-TIRADS (European Thyroid Imaging Reporting and Data System) [15].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3)
Комментарии:
— EU-TIRADS 1 – отсутствие узлов в ЩЖ при УЗИ;
— EU-TIRADS 2 – доброкачественное образование. Риск злокачественности – 0 %. Включает 2 категории узлов: анэхогенные (кисты) и губчатые узлы. Если в кистозных узлах есть пристеночный солидный компонент, они переквалифицируются в категорию низкого риска. ТАБ не показана, но может быть выполнена в лечебных целях;
— EU-TIRADS 3 – образование низкого риска злокачественности. Риск злокачественности – 2–4 %. Образования изо- и гиперхогенные, округлой и овальной формы, с четкими контурами, при отсутствии любых подозрительных признаков. ТАБ показана при узлах размером ≥1 см;
— EU-TIRADS 4 – образование среднего риска злокачественности. Риск злокачественности – 6–17 %. Образования умеренно гипоэхогенные, округлой и овальной формы, с четкими контурами, при отсутствии любых подозрительных признаков. Основное различие между низким и средним риском заключается в эхогенности солидных участков узла. В случае гетерогенности узла наличие любого гипоэхогенного участка будет относить узел к группе среднего риска. ТАБ показана при узлах размером ≥1 см;
— EU-TIRADS 5 – образование высокого риска злокачественности. Риск злокачественности – 26–87 %. Образование хотя бы с 1 признаком злокачественности: гипоэхогенный узел, неправильная форма, нечеткие контуры, микрокальцинаты (точечные гиперэхогенные включения), переднезадний размер узла больше его ширины («выше, чем шире»). ТАБ показана при узлах размером ≥1 см. При первичном доброкачественном результате ТАБ необходимо повторить в ближайшее время для исключения ложноотрицательного результата. Если узел размером <1 см и нет изменений со стороны регионарных лимфатических узлов, рекомендуется динамическое наблюдение с регулярными УЗИ каждые 6 мес.
Протокол УЗИ регионарных лимфатических узлов должен включать оценку следующих параметров [8, 13, 16]:
размер (необходимо оценивать диаметр или переднезадний размер, а не длину. Для всех шейных лимфатических узлов, кроме II уровня фасциально- клетчаточного пространства шеи (поднижнечелюстная зона), наибольший размер составляет не более 0,6 см, для II уровня – не более 0,8 см); соотношение длинной и короткой осей; наличие/отсутствие ворот; кистозные изменения; точечные гиперэхогенные включения (микрокальцинаты); характер васкуляризации (ворота или весь лимфатический узел); повышение эхогенности лимфатического узла (сходство с нормальной тканью ЩЖ).
Наиболее специфичными признаками, позволяющими заподозрить метастатическое поражение лимфатического узла, являются микрокальцинаты, кистозный компонент, периферическая васкуляризация, сходство ткани лимфатического узла с тканью ЩЖ, менее специфичными – увеличение размеров, закругленность контуров, отсутствие ворот.
- При наличии подозрительных ультразвуковых признаков в узловом образовании ЩЖ рекомендуется ультразвуковая оценка подвижности голосовых складок с целью исключения инвазии опухоли в гортань и/или пареза голосовой складки вследствие вовлечения в процесс возвратного гортанного нерва (зависит от анатомического строения гортани) [1, 6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При РЩЖ или подозрении на него независимо от субъективной оценки голосовой функции всем пациентам на дооперационном этапе рекомендуется проведение видеоларингоскопии с целью объективной оценки подвижности голосовых связок [1, 6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
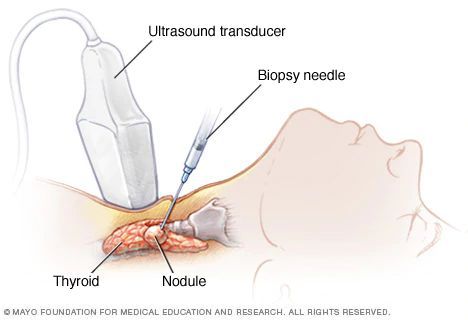
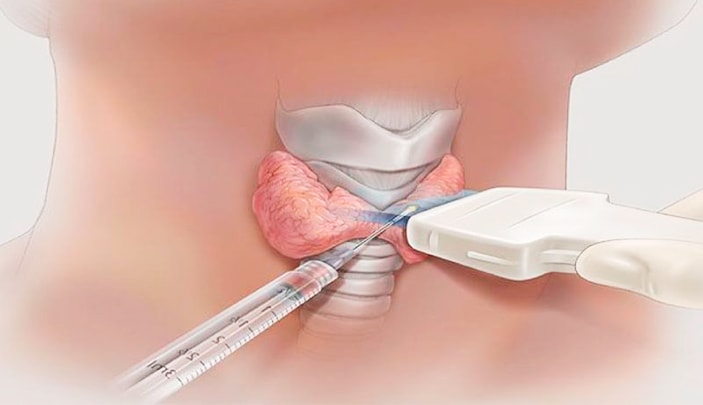
Тонкоигольная аспирационная биопсия
- Тонкоигольная аспирационная биопсия рекомендуется всем пациентам с подозрением на РЩЖ в качестве основного метода дифференциальной диагностики доброкачественных и злокачественных поражений ЩЖ и лимфатических узлов [17].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4)
- Тонкоигольную аспирационную биопсию рекомендуется проводить под ультразвуковым контролем с целью повышения диагностической точности исследования [18].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Комментарии: ТАБ может выполнять врач любой специальности, владеющий методикой ее проведения (эндокринолог, эндокринный хирург, онколог, врач лучевой диагностики).
Показания к проведению ТАБ [1, 8, 17]:
узловые образования ЩЖ, равные или превышающие 1 см в диаметре; узловые образования размером <1 см, если пациент относится к группе риска наличия агрессивных форм РЩЖ, при наличии следующих факторов:
— концентрация базального или стимулированного кальцитонина >100 пг/мл;
— наличие увеличенных регионарных лимфатических узлов;
— облучение головы и шеи в анамнезе;
— семейный анамнез РЩЖ;
— паралич голосовой складки;
-узловые образования ЩЖ, случайно выявленные при позитронно-эмиссионной томографии;
— пациенты моложе 20 лет;
— изменение ультразвуковой структуры доброкачественных узлов ЩЖ в процессе динамического наблюдения.
При образованиях размером <1 см, если пациент не относится к группе риска наличия агрессивных форм РЩЖ, проведение ТАБ нецелесообразно независимо от ультразвуковых характеристик новообразования [10].
- При получении доброкачественного цитологического заключения из узла с явными подозрительными ультразвуковыми признаками ТАБ рекомендуется повторить в ближайшее время с целью своевременной постановки диагноза злокачественного новообразования [10].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При обнаружении измененных регионарных лимфатических узлов всем пациентам с РЩЖ рекомендована их прицельная ТАБ с целью морфологической верификации с проведением цитологического исследования биопсийного материала [19].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий: Диагностическая точность ТАБ из лимфатических узлов повышается при исследовании смыва из иглы на ТГ или кальцитонин в зависимости от предполагаемой морфологической формы РЩЖ
Цитологическое исследование
- Рекомендуется использование 6 стандартных категорий заключений современной международной цитологической классификации (Bethesda Thyroid Classification, 2009, 2017) при изучении пунктатов из узловых образований ЩЖ с целью повышения диагностической точности исследования [20].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Международная цитологическая классификация пунктатов из узловых образований ЩЖ включает в себя 6 категорий:
I категория – неинформативная пункция; II категория – доброкачественное образование (коллоидные и аденоматозные узлы, хронический аутоиммунный тиреоидит, подострый тиреоидит); III категория – атипия неопределенного значения (сложная для интерпретации пункция с подозрением на опухолевое поражение); IV категория – фолликулярная неоплазия или подозрение на фолликулярную неоплазию; V категория – подозрение на злокачественную опухоль (подозрение на папиллярный рак, медуллярный рак, метастатическую карциному, лимфому); VI категория – злокачественная опухоль (папиллярный, низкодифференцированный, медуллярный, анапластический рак).
Заключения, содержащие только описательную часть, а также заключения без конкретного цитологического диагноза неинформативны. В этих ситуациях необходимо проконсультировать готовые цитологические препараты у опытного морфолога или повторить ТАБ в специализированном лечебном учреждении
Компьютерная томография
Компьютерная томография (КТ) шеи и грудной клетки с контрастированием рекомендована при неподвижной опухоли, симптомах экстратиреоидного распространения, размере опухоли T3-4, подозрении на экстратиреоидное распространение или наличие изменненых регионарных лимфатических узлов по данным УЗИ с целью уточнения распространенности опухоли [1, 8, 10]:
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Магнитно-резонансную томографию и позитронно-эмиссионную томографию применяют для диагностики метастазов по индивидуальным показаниям. При шейно-грудной локализации метастатического процесса эти методы значительно уступают диагностическому комплексу УЗИ + ТАБ + КТ [26].
Иные диагностические исследования
Молекулярно-генетическое исследование
- Для дифференциальной диагностики опухолей ЩЖ в рамках цитологического заключения III, IV и V групп по Bethesda Thyroid Classification, 2009, 2017 рекомендовано молекулярно-генетическое исследование мутаций в гене BRAF и иных мутаций (RAS, RET/PTC, PAX8/PPAR-ỵ, TERT и т. д.) [21–25].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3)
Лечение
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Хирургическое лечение
Введение: Лечение и наблюдение пациентов с высокодифференцированным РЩЖ (ВДРЩЖ) должно проводиться в специализированных медицинских учреждениях, обладающих полноценным арсеналом средств диагностики и опытом лечения ВДРЩЖ [1, 6, 8].
- При IV, V и VI категории цитологического заключения по современной международной цитологической классификации (Bethesda Thyroid Classification, 2009) рекомендовано хирургическое лечение с целью повышения выживаемости пациентов. [6, 20].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: При III категории (атипия неясного значения) необходима повторная пункция, по результатам которой уточняются степень риска злокачественности узла и показания к оперативному лечению. Показания к оперативному лечению при III и IV категориях цитологического заключения могут обсуждаться в индивидуальном порядке с пациентом в рамках применения молекулярно-генетических панелей, дающих дополнительную информацию о риске ВДРЩЖ. Тем не менее в связи с крайне ограниченным опытом таких исследований в России группа экспертов на момент публикации этого документа не высказывает мнения ни «за», ни «против» [1, 6]. Первичный объем оперативного лечения при заключениях, в разной степени подозрительных в отношении ВДРЩЖ (III–V категории), зависит от тактики, принятой в конкретном специализированном учреждении. Основополагающим является окончательный объем оперативного лечения по результатам планового гистологического исследования. Применение срочного интраоперационного морфологического исследования при III и IV категории цитологического заключения не является обязательным, так как обладает низкой чувствительностью в диагностике ВДРЩЖ, а при V и VI категории не показано. Современные технологии позволяют получить результаты планового исследования в сроки, когда повторное вмешательство может быть осуществлено вне формирования рубцового процесса [27–29].
- При опухоли размером >4 см или при опухоли с выраженной экстратиреоидной инвазией (клинически T4), клинически выраженными метастазами (сN1) или отдаленными метастазами (M1) в качестве первичного лечения рекомендуется тиреоидэктомия с максимальной хирургической аблацией опухолевой ткани в пределах возможных противопоказаний с целью повышения выживаемости пациентов [10, 30].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
- Гемитиреоидэктомия рекомендована пациентам с папиллярным РЩЖ группы низкого риска (без семейного анамнеза РЩЖ и облучения головы и шеи) с целью снижения хирургической травмы и повышения качества жизни [28, 31, 32].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Комментарии: Возможный выбор тиреоидэктомии связан с решением о послеоперационной радиойодтерапии (РЙТ) и упрощенном наблюдении или с предпочтениями пациента. При опухоли размером от 1 до 4 cм без экстратиреоидной инвазии (определяемой клинически или по данным УЗИ) и/или метастатических лимфатических узлов (cN0) возможна как тиреоидэктомия, так и гемитиреоидэктомия [10, 30, 33].
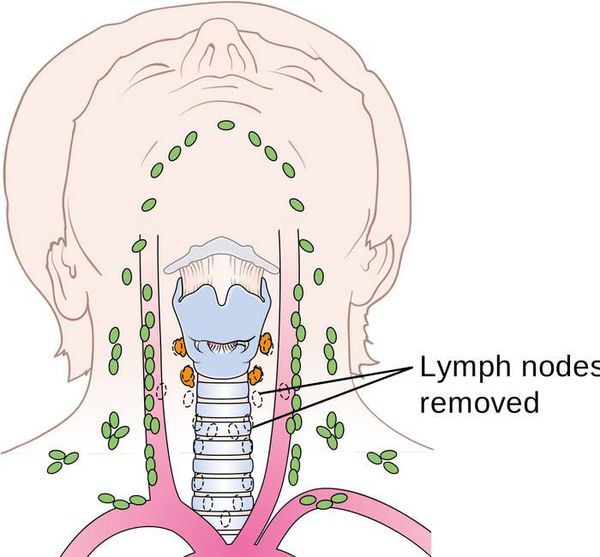
Хирургическое вмешательство на лимфатических узлах шеи
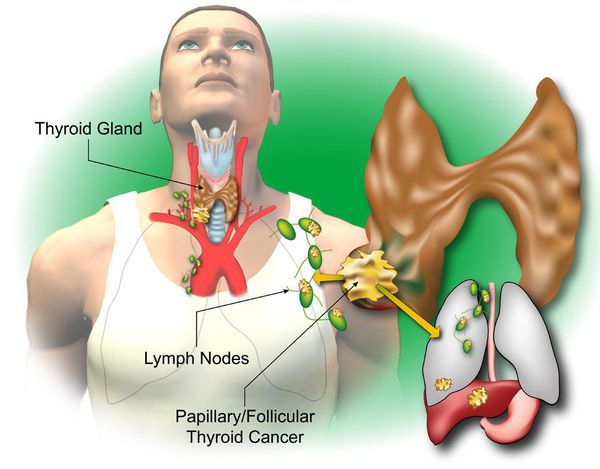
- Удаление лимфатических узлов центральной зоны (VI уровень) с целью повышения выживаемости пациентов рекомендовано, если по данным дооперационного обследования есть подозрение на наличие метастазов в этой зоне (cN1) или эти метастазы выявлены интраоперационно [6].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
- Профилактическая центральная лимфаденэктомия (VI уровень, ипси- или билатеральная) рекомендована при распространенной форме первичной опухоли (T3–4) или дооперационно верифицированных метастазах в лимфатических узлах боковой клетчатки шеи (cN1b) с целью повышения эффективности лечения [6, 8]:
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий: профилактическая центральная лимфаденэктомия при размере опухоли <2 см увеличивает частоту осложнений, не оказывая влияния на летальность, однако снижает число рецидивов и повторных вмешательств (частота микрометастазирования в центральной клетчатке составляет 25–30 %). Большинство экспертов высказываются против этой процедуры. Часть экспертов высказываются за проведение аблационной РЙТ пациентам моложе 50 лет с учетом высокой частоты микрометастазирования. Однако, с другой стороны, лечебная необходимость РЙТ при Т1N0M0 сомнительна, и в большинстве случаев применение радиоактивного йода не показано [34, 35].
Существует проблема неточности послеоперационного определения стадии N в условиях невыполненной центральной лимфаденэктомии. В данной ситуации решение о проведении РЙТ в аблационном режиме или при вираже ТГ может быть принято индивидуально [1].
- Удаление клетчатки II–V уровней фасциально-клетчаточного пространства шеи рекомендуется только при доказанном метастатическом поражении лимфатических узлов этих зон по результатам ТАБ с целью повышения качества жизни пациентов [8].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии: Селективное удаление метастатических лимфатических узлов вне футлярно-фасциального блока нецелесообразно.
Послеоперационная стратификация риска рецидива ВДРЩЖ
Введение: Стадирование послеоперационного риска необходимо для определения оптимальной тактики послеоперационного ведения пациента.
Современные принципы стадирования послеоперационного риска основаны на рекомендациях Американской тиреоидологической ассоциации (American Thyroid Association, АТА) 2015 г. Выделяют 3 группы: высокого, промежуточного и низкого риска [10, 36].
Группа низкого риска:
папиллярный РЩЖ со всеми перечисленными ниже признаками:
- без локорегионарных или отдаленных метастазов;
- удалена макроскопически вся опухолевая ткань;
- отсутствие экстратиреоидной инвазии;
- отсутствие сосудистой инвазии;
- неагрессивный гистологический вариант;
- отсутствие метастатических очагов по данным 1-й сцинтиграфии с I.
c N0 или p N1 при поражении не более 5 лимфатических узлов, микрометастазы (размером <0,2 см в наибольшем измерении); интратиреоидный фолликулярный ВДРЩЖ с капсулярной инвазией или без нее и минимальной сосудистой инвазией (<4 очагов); интратиреоидный папиллярный рак размером <4 см при отсутствии мутации BRAF V600E; интратиреоидная папиллярная микрокарцинома, унифокальная или мультифокальная, независимо от наличия мутации BRAF V600E.
Группа промежуточного риска:
агрессивный гистологический вариант ; интратиреоидный папиллярный рак размером <4 см при наличии мутации BRAF V600E; cN 1 или p N1 при поражении >5 лимфатических узлов, макрометастазы (размером <3 см в наибольшем измерении); микроскопическая экстратиреоидная инвазия ; папиллярный рак с сосудистой инвазией; мультифокальная папиллярная микрокарцинома с микроскопической экстратиреоидной инвазией и мутацией BRAF V600E; наличие метастатических очагов на шее, накапливающих радиоактивный йод по данным 1-й сцинтиграфии с I .
Группа высокого риска:
резидуальная опухоль ; опухоль при сочетании индуцирующих агрессивное течение мутаций (TERT ± BRA F ); pN1 с любым метастатическим лимфатическим узлом размером >3 см в наибольшем изменении; макроскопическая экстратиреоидная инвазия ; широко инвазивный фолликулярный рак (>4 очагов); доказанные отдаленные метастазы ; высокая концентрация ТГ в крови, характерная для отдаленных метастазов.
- После выполнения органосохраняющих операций в случаях, когда по результатам стратификации риска рецидива пациент относится к группе промежуточного или высокого риска, рекомендуется выполнение окончательной тиреоидэктомии для последующего лечения радиоактивным йодом [6, 37].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Лечение радиоактивным йодом
- С целью подготовки к РЙТ всем пациентам рекомендуется отменить левотироксин натрия** за 4 недели до процедуры [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Радиойодтерапия проводится на фоне 2-недельной диеты с низким содержанием йода. Для РЙТ требуется высокая концентрация ТТГ крови (>30 мЕд/л). Последний может достигаться путем эндогенной стимуляции при отмене левотироксина натрия** на 4 нед (у детей – на 3 нед) или введения тиротропина альфа [6, 38].
- Применение тиротропина альфа для подготовки к РЙТ рекомендуется:
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: РЙТ позволяет уничтожить остатки тиреоидной ткани и накапливающие радиоактивный йод очаги опухоли. Оказывает положительное влияние на общую и безрецидивную выживаемость в группе пациентов промежуточного и высокого риска. Сцинтиграфия всего тела (СВТ), проведенная после РЙТ, позволяет выявлять метастазы ВДРЩЖ.
- В связи с отсутствием влияния на показатели смертности РЙТ в группе пациентов низкого риска не рекомендуется [34].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3)
- Радиойодтерапия рекомендована больным группы промежуточного и высокого риска, поскольку достоверно уменьшает вероятность прогрессирования заболевания и увеличивает выживаемость [1, 40, 41].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии: В группе пациентов промежуточного риска выполняется РЙТ по индивидуальным показаниям активностью от 30 мКи (1,1 ГБк) до 100 мКи (3,7 ГБк). В группе пациентов высокого риска выполняется радиойодаблация активностью от 30 до 150 мКи (1,1–5,5 ГБк). Терапия радиоактивным йодом (после радиойодаблации) проводится активностями от 100 до 200 мКи (3,7–7,4 МБк), при наличии клинических показаний – до 300 МБк (11,1 ГБк). При планировании РЙТ активностью 120 мКи (4,4 ГБк) и выше необходимо применение биодозиметрии крови с целью индивидуального контроля лучевой нагрузки на кровь/костный мозг.
Терапия левотироксином натрия
Заместительная терапия левотироксином натрия** направлена на коррекцию послеоперационного гипотиреоза, супрессивная – на подавление ТТГ-зависимого роста остаточных опухолевых клеток.
- В группе пациентов низкого риска и биохимической ремиссии проведение супрессивной терапии левотироксином натрия** не рекомендуется ввиду отсутствия увеличения выживаемости и ухудшения качества жизни, вместо этого рекомендуется проведение заместительной терапии [42].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
- В группах пациентов промежуточного риска, биохимического рецидива и неопределенного опухолевого статуса рекомендуется супрессивная терапия с целью повышения показателей выживаемости пациентов [42]:
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии : мягкая супрессия целесообразна при тахикардии и менопаузе; заместительная терапия – в возрасте старше 60 лет, при наличии фибрилляции предсердий, остеопороза.
- В группе пациентов высокого риска и структурного рецидива с целью повышения показателей выживаемости рекомендуется супрессивная терапия, кроме пациентов с фибрилляцией предсердий, которым проводится мягкая супрессия [42].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии: Целевые диапазоны уровня ТТГ в различных режимах [1, 6, 8]: c упрессивная терапия: уровень ТТГ <0,1 мЕд/л, уровень свободного тироксина не превышает верхнюю границу нормы; мягкая супрессия: уровень ТТГ 0,1–0,5 мЕд/л; заместительная терапия: уровень ТТГ 0,5–2,0 мЕд/л.
Таргетная терапия
- Системная таргетная терапия препаратами, зарегистрированными в РФ по данным медицинским показаниям (сорафениб** и ленватиниб**), рекомендуется при неэффективности РЙТ и доказанном прогрессировании опухоли в течение 3–12 мес согласно критериям RECIST 1.1 с целью увеличения выживаемости пациентов [6, 30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: РЙТ считается неэффективной в следующих случаях:
отсутствия накопления 131I хотя бы в 1 опухолевом очаге; прогрессирования опухоли на фоне РЙТ; отсутствия положительного эффекта РЙТ при суммарной терапевтической активности >600 мКи
- Рекомендуется индивидуальный подбор препарата для системной таргетной терапии на основе прогноза эффективности и безопасности для каждого конкретного пациента с целью улучшения выживаемости пациентов и переносимости лечения [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- В случае прогрессирования опухоли или развития угрожающей жизни токсичности на фоне применения одного препарата рекомендуется перевод пациента на прием другого препарата [6, 8].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Дистанционная лучевая терапия
- Дистанционная лучевая терапия в отдельных случаях рекомендуется пациентам с солитарными опухолевыми метастазами РЩЖ, не накапливающими радиоактивный йод и хирургически нерезектабельными, а также в качестве паллиативного лечения при болевом или компрессионном синдроме (например, при сдавлении трахеи, спинного мозга) [43, 44].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4)
Комментарий: Применение дистанционной лучевой терапии ограничено в связи с низкой чувствительности ВДРЩЖ к данному виду лечения.
Лечение анапластического рака щитовидной железы
- После постановки диагноза анапластичского РЩЖ рекомендуется в короткие сроки определить возможность радикального удаления опухоли и в случае операбельности выполнить радикальную тиреоидэктомию с избирательной резекцией всех пораженных локальных или регионарных структур и лимфатических узлов с целью увеличения показателей выживаемости пациентов [45].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарии: Способов радикального лечения анапластической карциномы практически не существует. Медиана выживаемости с момента постановки диагноза составляет от 3 до 7 мес, 1- и 5-летняя выживаемость – 17 и 8 % соответственно. В течение всего лечения необходимо обращать внимание на проходимость дыхательных путей и пищевода у пациента [46, 47].
- При анапластическом РЩЖ с паллиативной целью рекомендуется применять следующие режимы химиотерапии: паклитаксел** 50 мг / м 2 + карбоплатин** AUC 2 в/в еженедельно или паклитаксел** 30-60 мг/м2 в/в кап, еженедельно или #доцетаксел** 60 мг/м2 + доксорубицин** 60 мг / м 2 в/в раз в 3-4 недели до неприемлемой токсичности или #доцетаксел** 20 мг/м2 + доксорубицин** 20 мг / м 2 в/в еженедельно или #цисплатин** 25 мг/м2 в/в кап, еженедельно до неприемлемой токсичности или доксорубицин** 60 мг / м 2 в/в раз в 3 недели или доксорубицин** 20 мг / м 2 в/в еженедельно [48].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: С учетом неутешительных результатов существующего стандартного лечения рекомендуется всех пациентов независимо включать в клинические исследования. Необходимо рассматривать различные варианты таргетной терапии ингибиторами протеинкиназы как один из самых перспективных методов лечения [8].
Обезболивание
Порядок и рекомендации по обезболиванию при дифференцированном РЩЖ соответствуют рекомендациям «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи», представленным в рубрикаторе клинических рекомендаций Минздрава России.
Не применяется.
Медицинская реабилитация
Реабилитация
Общие принципы реабилитации пациентов после проведенных хирургических вмешательств, РЙТ, лучевой терапии и/или химиотерапии соответствуют таковым при злокачественных новообразованиях головы и шеи, представленным в клинических рекомендациях «Злокачественные новообразования полости рта».
Профилактика
Динамическая стратификация риска и диспансерное наблюдение пациентов
Принадлежность пациента к определенной группе риска не является постоянной и должна подлежать динамической переоценке в зависимости от ответа на проведенное лечение. Это позволяет индивидуализировать динамическое наблюдение, снизить финансовые затраты и своевременно выявить структурный рецидив заболевания, тем самым оказав положительное влияние на прогноз заболевания.
Динамическая стратификация риска позволяет разделить пациентов на следующие 4 основные группы по результатам проведенного лечения [6].
1. Биохимическая ремиссия (вероятность рецидива составляет 1–4 %): отрицательные данные УЗИ, СВТ, КТ; концентрация нестимулированного TГ <0,2 нг/мл; концентрация стимулированного TГ <1 нг/мл.
2. Биохимический рецидив:
отрицательные данные УЗИ, СВТ, КТ; концентрация нестимулированного TГ >1 нг/мл; концентрация стимулированного TГ >10 нг/мл; вираж антител к ТГ. В данной группе примерно у 30 % больных происходит спонтанное снижение биохимических показателей, у 20 % – ремиссия после дополнительного лечения (РЙТ), у 20 % – структурный рецидив. Смертность, связанная с РЩЖ, составляет <1 %.
При сохранении стабильной концентрации ТГ или ее снижении в большинстве случаев проводят наблюдение, при отсутствии специфических противопоказаний предпочтительна супрессия уровня ТТГ. При росте уровня ТГ или вираже антител к ТГ рекомендуется активное обследование и проведение дополнительных лечебных опций (РЙТ).
В качестве промежуточной группы между пациентами с биохимической ремиссией и с биохимическим рецидивом выделена группа больных с неопределенным опухолевым статусом.
3. Неопределенный опухолевый статус:
отрицательные или неспецифические данные УЗИ, СВТ, КТ; концентрация TГ без стимуляции составляет более 0,2, но менее 1 нг/мл; концентрация TГ после стимуляции составляет более 1, но менее 10 нг/мл; титр антител к ТГ стабильный или снижается.
Неспецифические изменения могут быть стабильны или исчезнуть, вероятность структурного рецидива оценивается несколько меньше, чем в группе биохимического рецидива (15–20 %), специфическая смертность составляет <1 %.
В большинстве случаев необходимо продолжить наблюдение (визуализация, определение уровня ТГ). При подозрительных изменениях следует прибегнуть к дополнительной визуализации и биопсии.
4. Структурный рецидив: структурные или функциональные признаки опухоли при любой концентрации ТГ и/или антител к ТГ.
Прогноз: около 50–60 % пациентов сохраняют персистенцию, несмотря на дополнительное лечение. Смертность, связанная с РЩЖ, при шейных метастазах составляет 11 %, при отдаленных – 50 %. Выбор лечебной тактики зависит от размера, локализации, объема поражения, скорости роста, захвата I или флудезоксиглюкозы [18F], гистологического варианта опухоли.
Определение тиреоглобулина и антител к тиреоглобулину
Наиболее высокочувствительным методом динамического наблюдения является определение ТГ – специфического высокочувствительного маркера тиреоцитов, а также клеток папиллярного и фолликулярного РЩЖ.
Присутствие в крови антител к ТГ может стать причиной ложноотрицательного результата исследования уровня ТГ. Определение ТГ должно осуществляться с помощью чувствительного иммунорадиометрического анализа (функциональная чувствительность – 0,2 нг/мл).
После первичного лечения ТГ может обнаруживаться в крови пациентов в течение нескольких месяцев, поэтому его определение целесообразно выполнять не ранее чем через 3 мес после проведения последнего лечебного этапа [1, 6, 8].
- Послеоперационное определение ТГ и антител к ТГ на фоне терапии левотироксином натрия** рекомендовано всем пациентам каждые 6–12 мес с целью исключения рецидива заболевания [49, 50].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
- В группе биохимической ремиссии интервал определения ТГ и антител к ТГ на фоне терапии левотироксином натрия** рекомендуется изменить до 12–24 мес с целью повышения качества жизни пациентов и снижения экономических затрат [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Интервал определения ТТГ рекомендуется не более 12 мес для всех пациентов на фоне терапии левотироксином натрия** с целью своевременного выявления рецидива заболевания [6].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
- Динамическое определение ТГ не реже 6–12 мес рекомендуется в группах пациентов высокого риска, структурного рецидива, биохимического рецидива, неопределенного опухолевого статуса с целью повышения выживаемости пациентов [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Повторное определение стимулированного ТГ рекомендовано в группах пациентов [51]:
высокого риска; структурного рецидива; биохимического или неопределенного статуса рецидива; при снижении концентрации ТГ, спонтанном или последовавшем за проведенным лечением (контроль терапевтического эффекта).
- Повторное определение стимулированного ТГ не рекомендовано в группах пациентов низкого риска и биохимической ремиссии ввиду низкой диагностической эффективности [6]:
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Послеоперационное ультразвуковое исследование
- После оперативного лечения УЗИ шеи рекомендуется через 6–12 мес в зависимости от группы риска и динамики концентрации ТГ с целью выявления структурного рецидива [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При выявлении при УЗИ подозрительных лимфатических узлов максимальным размером >0,8–1,0 см рекомендуется прицельная ТАБ, которая дополняется определением ТГ в смыве из иглы с целью морфологической или биохимической верификации рецидива заболевания [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: При меньшем размере лимфатического узла возможно динамическое наблюдение (если размеры узла остаются стабильными и нет угрозы прорастания жизненно важных структур.
Сцинтиграфия всего тела
- У пациентов с биохимической ремиссией после РЙТ проведение плановой сцинтиграфии костей всего тела не рекомендуется ввиду низкой диагностической ценности [52].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- Сцинтиграфия костей всего тела рекомендуется через 6–12 мес после РЙТ у пациентов групп высокого и промежуточного риска без достижения биохимической ремиссии и с персистенцией заболевания с целью оценки прогрессии заболевания [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Компьютерная, магнитно-резонансная и позитронно-эмиссионная томография
- Компьютерная томография мягких тканей шеи и органов грудной клетки рекомендуется при сомнениях в адекватной оценке распространенности заболевания при УЗИ, подозрении на прорастание трахеи, гортани, глотки, пищевода, выявления метастазов в легкие и лимфатические узлы средостения у пациентов группы высокого риска с повышенной концентрацией ТГ (как правило, >10 нг/мл) или с виражом антител к ТГ независимо от результатов сцинтиграфии всего тела с целью адекватной оценки распространенности заболевания [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Магнитно-резонансная томография головного мозга, скелета, брюшной полости рекомендуется пациентам группы высокого риска с повышенной концентрацией ТГ (как правило, >10 нг/мл) при отсутствии метастазов в легкие, лимфатические узлы шеи и средостения или наличии характерных симптомов метастатического поражения органов вышеуказанных локализаций с целью адекватной оценки распространенности заболевания и выявления структурного рецидива [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Позитронно-эмиссионная томография всего тела рекомендуется пациентам группы высокого риска при высокой концентрации ТГ (>10 нг/мл) и отрицательных данных сцинтиграфии всего тела с целью исключения структурного прогрессирования болезни, начального стадирования при низкодифференцированном или широко инвазивном фолликулярном РЩЖ или оценки результатов лечения при радиойодрезистентных формах ВДРЩЖ [6]:
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Рак щитовидной железы и беременность
Высокодифференцированный РЩЖ в большинстве случаев является опухолью с латентной прогрессией, и его выявление во время беременности не является показанием к ее прерыванию. Беременность не является фактором, способствующим прогрессированию ВДРЩЖ. Большинство исследований свидетельствуют о том, что отдаленный прогноз ВДРЩЖ, диагностированного во время беременности, ничем не отличается от прогноза РЩЖ, выявленного в других ситуациях. Нет никаких различий в показателях летальности и персистенции ВДРЩЖ у беременных, оперированных во II триместре до 24-й недели, и у женщин, оперированных после родов. Более того, по данным ретроспективных исследований, прогноз не ухудшается даже при проведении оперативного лечения спустя год после первичной диагностики ВДРЩЖ во время беременности.
Если при пункционной биопсии и цитологическом исследовании у беременной поставлен диагноз ВДРЩЖ, ей показано оперативное лечение, однако решение о сроках проведения операции должно быть индивидуализировано.
Существуют исследования, в которых сообщается о более высокой частоте специфических и неспецифических осложнений у женщин, перенесших операцию в период беременности, по отношению к небеременным женщинам, что потребовало более длительного пребывания в стационаре и повышенных затрат на лечение. Объем комплексного лечения пациенток с ВДРЩЖ может быть индивидуализирован исходя из факта планирования беременности (терапия радиоактивным йодом может быть в ряде случаев отложена) [6].
- Прерывание беременности не рекомендовано при выявлении ВДРЩЖ [53].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При выявлении ВДРЩЖ во время беременности рекомендовано оперативное лечение с целью повышения контроля над заболеванием [54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: сроки хирургического лечения определяются индивидуально, при этом в большинстве случаев оно может быть отложено до послеродового периода. При ВДРЩЖ, диагностированном цитологически на ранних сроках беременности, показано динамическое УЗИ с частотой 1 раз в месяц.
- При прогрессирующем увеличении опухоли или появлении измененных регионарных лимфатических узлов рекомендовано оперативное лечение во II триместре беременности в сроке до 24-й недели с целью повышения выживаемости [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Планирование беременности женщинами, получившими лечение по поводу ВДРЩЖ, рекомендовано спустя 6-12 мес после РЙТ с целью снижения риска невынашивания беременности [54].
Уровень убедительности рекомендаций – С (уровень достоверности
доказательств – 5)
Комментарии: Мужчинам, прошедшим лечение радиоактивным йодом, не рекомендуют участвовать в планировании беременности в течение 120 дней (период жизни сперматозоида) [6]
- При планировании беременности после оперативного вмешательства на ЩЖ рекомендуется поддержание стойкого эутиреоза с целью снижения риска рецидива и нормального развития плода [10].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Целесообразно назначение заместительной терапии левотироксином натрия** (в дозе около 2 мкг/кг массы тела) с целевым показателем концентрации ТТГ 0,1–2,5 мЕд/л. Контролировать содержание ТТГ в крови во время беременности необходимо 1 раз в 6–8 нед. Женщинам, которые получили лечение по поводу ВДРЩЖ, не противопоказано грудное вскармливание [6].
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
-
Клинические рекомендации Ассоциации эндокринных хирургов
-
Клинические рекомендации Российского общества специалистов по опухолям головы и шеи
-
Клинические рекомендации Российской ассоциации эндокринологов
- 1. Румянцев П.О., Ильин А.А., Румянцева У.В., Саенко В.А. Рак щитовидной
железы: современные подходы к диагностике и лечению. М.: ГЭОТАР-Медиа,
2009. 448 с.
2. Каприн А.Д., Старинский В.В. Злокачественные новообразования в России в 2015
году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена — филиал ФГБУ
НМИРЦ Минздрава России, 2017. C. 33, 151.
3. Allelein, S., Ehlers, M., Morneau, C., Schwartz, K., Goretzki, P., Seppel, T., … Schott,
M. (2017). Measurement of Basal Serum Calcitonin for the Diagnosis of Medullary
Thyroid Cancer. Hormone and Metabolic Research, 50(01), 23–28.
4. Матякин Е.Г., Подвязников С.О. Опухоли щитовидной железы. Онкология:
справочник практикующего врача. Под ред. чл.-корр. РАН И.В. Поддубной. М.:
МЕДпресс-информ, 2009. C. 177–185.
5. Бржезовский В.Ж. Опухоли щитовидной железы. Опухоли головы и шеи. 5-е
изд., доп. и перераб. М.: Практическая медицина, 2013. С. 339–359.
6. Бельцевич Д.Г., Ванушко В.Э., Румянцев П.О. и др. Российские клинические
рекомендации по диагностике и лечению высокодифференцированного рака
щитовидной железы у взрослых. Эндокринная хирургия 2017;1(11):6–27.
7. Алиева С.Б., Алымов Ю.В., Кропотов М.А. и др. Рак щитовидной железы.
Онкология. Клинические рекомендации. Под ред. М.И. Давыдова. М.:
Издательская группа РОНЦ, 2015. C. 538–547.
8. Злокачественные опухоли головы и шеи. Под ред. Подвязникова С.О., Мудунова
А.М., Болотина М.В. и др. Клинические рекомендации по лечению опухолей
головы и шеи Общенациональной онкологической сети (США). М.: ООО «АБВ-
пресс», 2019.
9. Онкология. Клинические рекомендации. Под ред. В.И. Чиссова. М.: ГЭОТАР-
Медиа, 2006. C. 125–139.
10. Cooper D.S., Doherty G.M., Haugen B.R. et al. Management guidelines for patients
with thyroid nodules and differentiated thyroid cancer. Thyroid 2006;16:109–42.
11. McLeod D.S., Watters K.F., Carpenter A.D. et al. Thyrotropin and thyroid cancer
diagnosis: a systematic review and dose-response meta-analysis. J Clin Endocrinol
Metab 2012;97:2682–92. Available at: http://www.ncbi.nlm.nih.
gov/pubmed/22622023.
12. Rinaldi S., Plummer M., Biessy C. et al. Thyroid-stimulating hormone, thyroglobulin,
and thyroid hormones and risk of differentiated thyroid carcinoma: the EPIC study. J
Natl Cancer Inst 2014;106:dju097. Available at:
http://www.ncbi.nlm.nih.gov/pubmed/24824312.
(http://www.ncbi.nlm.nih.gov/pubmed/24824312)
13. Bonavita J.A., Mayo J., Babb J. et al. Pattern recognition of benign nodules at
ultrasound of the thyroid: which nodules can be left alone? AJR Am J Roentgenol
2009;193:207–13. Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/24824312)http://www.ncbi.nlm.nih.gov/pubmed/19542415.
(http://www.ncbi.nlm.nih.gov/pubmed/19542415)
14. Alexander E.K., Cooper D. The importance, and important limitations, of ultrasound
imaging for evaluating thyroid nodules. JAMA Intern Med 2013;173:1796–7. Available
at: http://www.ncbi.nlm.nih.gov/pubmed/23979653.
(http://www.ncbi.nlm.nih.gov/pubmed/19542415)
15. Friedrich-Rust M., Meyer G., Dauth N. et al. Interobserver agreement of Thyroid
Imaging Reporting and Data System (TIRADS) and strain elastography for the
assessment of thyroid nodules. PLoS One 2013;8:e77927. Available at: http://
(http://www.ncbi.nlm.nih.gov/pubmed/19542415)www.ncbi.nlm.nih.gov/pubmed/24205031.
(http://www.ncbi.nlm.nih.gov/pubmed/24205031)
16. Kamran S.C., Marqusee E., Kim M.I. et al. Thyroid nodule size and prediction of
cancer. J Clin Endocrinol Metab 2013;98:564–70. Available at: http://www.ncbi.
nlm.nih.gov/pubmed/23275525. (http://www.ncbi.nlm.nih.gov/pubmed/24205031)
17. Yang J., Schnadig V., Logrono R., Wasserman P.G. Fine-needle aspiration of thyroid
nodules: a study of 4703 patients with histologic and clinical correlations. Cancer
2007;111:306–15. Available at: http://www.ncbi.nlm.nih.gov/ pubmed/17680588.
(http://www.ncbi.nlm.nih.gov/pubmed/24205031)
18. DANESE, D., SCIACCHITANO, S., FARSETTI, A., ANDREOLI, M., & PONTECORVI, A.
(1998). Diagnostic Accuracy of Conventional Versus Sonography-Guided Fine-Needle
Aspiration Biopsy of Thyroid Nodules. Thyroid, 8(1), 15–21.
(http://www.ncbi.nlm.nih.gov/pubmed/24205031)
19. Trimboli, P., D’Aurizio, F., Tozzoli, R., & Giovanella, L. (2017). Measurement of
thyroglobulin, calcitonin, and PTH in FNA washout fluids. Clinical Chemistry and
Laboratory Medicine (CCLM), 55(7).
(http://www.ncbi.nlm.nih.gov/pubmed/24205031)
20. Cibas E.S., Ali S.Z. The 2017 Bethesda System For Reporting Thyroid Cytopathology.
Thyroid 2017;27:1341–6. Available at:
http://www.ncbi.nlm.nih.gov/pubmed/29091573.
(http://www.ncbi.nlm.nih.gov/pubmed/24205031)
21. Giordano T.J., Beaudenon-Huibregtse S., Shinde R. et al. Molecular testing for
oncogenic gene mutations in thyroid lesions: a case-control validation study in 413
postsurgical specimens. Hum Pathol 2014;45:1339–47. Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/24205031)http://www.ncbi.nlm.nih.gov/pubmed/24830619.
(http://www.ncbi.nlm.nih.gov/pubmed/24830619)
22. Nikiforov Y.E., Ohori N.P., Hodak S.P. et al. Impact of mutational testing on the
diagnosis and management of patients with cytologically indeterminate thyroid
nodules: a prospective analysis of 1056 FNA samples. J Clin Endocrinol Metab
2011;96:3390–7. Available at: http://www.ncbi.nlm.nih.gov/pubmed/21880806.
(http://www.ncbi.nlm.nih.gov/pubmed/24830619)
23. Musholt T.J., Fottner C., Weber M.M. et al. Detection of papillary thyroid carcinoma
by analysis of BRAF and RET/PTC1 mutations in fine-needle aspiration biopsies of
thyroid nodules. World J Surg 2010;34:2595–603. Available at:
http://www.ncbi.nlm.nih.gov/pubmed/20652698.
(http://www.ncbi.nlm.nih.gov/pubmed/24830619)
24. Liu R., Bishop J., Zhu G. et al. Mortality Risk Stratification by Combining BRAF V600E
and TERT Promoter Mutations in Papillary Thyroid Cancer: Genetic Duet of BRAF and
TERT Promoter Mutations in Thyroid Cancer Mortality. JAMA Oncol 2017;3(2):202–8.
Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/24830619)https://www.ncbi.nlm.nih.gov/pubmed/27581851.
(https://www.ncbi.nlm.nih.gov/pubmed/27581851)
25. Vuong H.G., Altibi A.M.A., Duong U.N.P., Hassell L. Prognostic implication of BRAF
and TERT promoter mutation combination in papillary thyroid carcinoma-A metaanalysis.
Clin Endocrinol (Oxf) 2017;87:411–7. Available at:
https://www.ncbi.nlm.nih.gov/pubmed/28666074.
(https://www.ncbi.nlm.nih.gov/pubmed/27581851)
26. Pacini F., Capezzone M., Elisei R. et al. Diagnostic 131-iodine whole-body scan may
be avoided in thyroid cancer patients who have undetectable stimulated serum Tg
levels after initial treatment. J Clin Endocrinol Metab 2002;87:1499–501.
(https://www.ncbi.nlm.nih.gov/pubmed/27581851)
27. Bilimoria K.Y., Zanocco K., Sturgeon C. Impact of surgical treatment on outcomes for
papillary thyroid cancer. Adv Surg 2008;42:1–12. Available at: http://www.
ncbi.nlm.nih.gov/pubmed/18953806.
(https://www.ncbi.nlm.nih.gov/pubmed/27581851)
28. Hay I.D., Grant C.S., Bergstralh E.J. et al. Unilateral total lobectomy: is it sufficient
surgical treatment for patients with AMES low-risk papillary thyroid carcinoma?
Surgery 1998;124:958–64; discussion 964–56. Available at:
http://www.ncbi.nlm.nih.gov/pubmed/9854569.
(https://www.ncbi.nlm.nih.gov/pubmed/27581851)
29. Dackiw A.P., Zeiger M. Extent of surgery for differentiated thyroid cancer. Surg Clin
North Am 2004;84:817–32. Available at:
http://www.ncbi.nlm.nih.gov/pubmed/15145237.
(https://www.ncbi.nlm.nih.gov/pubmed/27581851)
30. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Thyroid
Carcinoma. Version 3.2019. (https://www.ncbi.nlm.nih.gov/pubmed/27581851)
31. Cady B. Hayes Martin Lecture. Our AMES is true: how an old concept still hits the
mark: or, risk group assignment points the arrow to rational therapy selection in
differentiated thyroid cancer. Am J Surg 1997;174:462–8. Available at: http://
(https://www.ncbi.nlm.nih.gov/pubmed/27581851)www.ncbi.nlm.nih.gov/pubmed/9374215.
(http://www.ncbi.nlm.nih.gov/pubmed/9374215)
32. Matsuzu K., Sugino K., Masudo K. et al. Thyroid lobectomy for papillary thyroid
cancer: long-term follow-up study of 1,088 cases. World J Surg 2014;38:68–79.
Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/9374215)http://www.ncbi.nlm.nih.gov/pubmed/24081532.
(http://www.ncbi.nlm.nih.gov/pubmed/24081532)
33. Udelsman R., Lakatos E., Ladenson P. Optimal surgery for papillary thyroid
carcinoma. World J Surg 1996;20:88-93. Available at:
http://www.ncbi.nlm.nih.gov/pubmed/8588420
(http://www.ncbi.nlm.nih.gov/pubmed/24081532)
34. Sacks, W., Fung, C. H., Chang, J. T., Waxman, A., & Braunstein, G. D. (2010). The
Effectiveness of Radioactive Iodine for Treatment of Low-Risk Thyroid Cancer: A
Systematic Analysis of the Peer-Reviewed Literature from 1966 to April 2008. Thyroid,
20(11), 1235–1245. (http://www.ncbi.nlm.nih.gov/pubmed/24081532)
35. Iyer N.G., Morris L.G., Tuttle R.M. et al. Rising incidence of second cancers in patients
with low-risk (T1N0) thyroid cancer who receive radioactive iodine therapy. Cancer
2011;117:4439–46. Available at: http://www.ncbi.nlm.nih.gov/pubmed/21432843.
(http://www.ncbi.nlm.nih.gov/pubmed/24081532)
36. Shaha A.R. Implications of prognostic factors and risk groups in the management of
differentiated thyroid cancer. Laryngoscope 2004;114:393–402. Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/24081532)http://www.ncbi.nlm.nih.gov/pubmed/15091208.
(http://www.ncbi.nlm.nih.gov/pubmed/15091208)
37. Scheumann G.F., Seeliger H., Musholt T.J. et al. Completion thyroidectomy in 131
patients with differentiated thyroid carcinoma. Eur J Surg 1996;162:677–84. Available
at:
(http://www.ncbi.nlm.nih.gov/pubmed/15091208)http://www.ncbi.nlm.nih.gov/pubmed/8908447.
(http://www.ncbi.nlm.nih.gov/pubmed/8908447)
131
38. Mazzaferri E.L. Thyroid remnant I ablation for papillary and follicular thyroid
carcinoma. Thyroid 1997;7:265–71. Available at:
http://www.ncbi.nlm.nih.gov/pubmed/9133698.
(http://www.ncbi.nlm.nih.gov/pubmed/8908447)
39. McDougall, I. R., & Weigel, R. J. (2001). Recombinant human thyrotropin in the
management of thyroid cancer. Current Opinion in Oncology, 13(1), 39–43.
(http://www.ncbi.nlm.nih.gov/pubmed/8908447)
40. Buffet, C., Ghander, C., le Marois, E., & Leenhardt, L. (2015). Indications for
radioiodine administration in follicular-derived thyroid cancer. Annales
d’Endocrinologie, 76(1), 1S2–1S7. doi:10.1016/s0003-4266(16)30008-7 .
(http://www.ncbi.nlm.nih.gov/pubmed/8908447)
41. Castagna, M. G., Cantara, S., & Pacini, F. (2016). Reappraisal of the indication for
radioiodine thyroid ablation in differentiated thyroid cancer patients. Journal of
Endocrinological Investigation, 39(10), 1087–1094.
(http://www.ncbi.nlm.nih.gov/pubmed/8908447)
42. Biondi B., Cooper D.S. Benefits of thyrotropin suppression versus the risks of adverse
effects in differentiated thyroid cancer. Thyroid 2010;20:135–46. Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/8908447)http://www.ncbi.nlm.nih.gov/pubmed/20151821.
(http://www.ncbi.nlm.nih.gov/pubmed/20151821)
43. Chiu A.C., Delpassand E.S., Sherman S.I. Prognosis and treatment of brain metastases
in thyroid carcinoma. J Clin Endocrinol Metab 1997;82:3637–42. Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/20151821)http://www.ncbi.nlm.nih.gov/pubmed/9360519.
(http://www.ncbi.nlm.nih.gov/pubmed/9360519)
44. Expert Panel on Radiation Oncology-Bone Metastases, Lo S.S., Lutz S.T. et al. ACR
Appropriateness Criteria (R) spinal bone metastases. J Palliat Med 2013;16:9–19.
Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/9360519)http://www.ncbi.nlm.nih.gov/pubmed/23167547.
(http://www.ncbi.nlm.nih.gov/pubmed/23167547)
45. Kebebew E., Greenspan F.S., Clark O.H. et al. Anaplastic thyroid carcinoma.
Treatment outcome and prognostic factors. Cancer 2005;103:1330–5. Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/23167547)http://www.ncbi.nlm.nih.gov/pubmed/15739211.
(http://www.ncbi.nlm.nih.gov/pubmed/15739211)
46. Shaha A.R. Airway management in anaplastic thyroid carcinoma. Laryngoscope
2008;118:1195–8. Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/15739211)http://www.ncbi.nlm.nih.gov/pubmed/18438260.
(http://www.ncbi.nlm.nih.gov/pubmed/18438260)
47. Junor E.J., Paul J., Reed N.S. Anaplastic thyroid carcinoma: 91 patients treated by
surgery and radiotherapy. Eur J Surg Oncol 1992;18:83–8. Available at:
http://www.ncbi.nlm.nih.gov/pubmed/1582515.
(http://www.ncbi.nlm.nih.gov/pubmed/18438260)
48. Smallridge R.C., Ain K.B., Asa S.L. et al. American Thyroid Association guidelines for
management of patients with anaplastic thyroid cancer. Thyroid 2012;22:1104–39.
Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/18438260)http://www.ncbi.nlm.nih.gov/pubmed/23130564.
(http://www.ncbi.nlm.nih.gov/pubmed/23130564)
49. Ernaga-Lorea, A., Hernández-Morhain, M. C., Anda-Apiñániz, E., Pineda-Arribas, J. J.,
Migueliz-Bermejo, I., Eguílaz-Esparza, N., & Irigaray-Echarri, A. (2017). Prognostic
value of change in anti-thyroglobulin antibodies after thyroidectomy in patients with
papillary thyroid carcinoma. Clinical and Translational Oncology, 20(6), 740–744.
(http://www.ncbi.nlm.nih.gov/pubmed/23130564)
131
50. Pacini F., Lari R., Mazzeo S. et al. Diagnostic value of a single serum thyroglobulin
determination on and off thyroid suppressive therapy in the follow-up of patients
with differentiated thyroid cancer. Clin Endocrinol (Oxf) 1985;23:405–11. Available
at:
(http://www.ncbi.nlm.nih.gov/pubmed/23130564)http://www.ncbi.nlm.nih.gov/pubmed/4064348.
(http://www.ncbi.nlm.nih.gov/pubmed/4064348)
51. Kloos R.T., Mazzaferri E.L. A single recombinant human thyrotropin-stimulated
serum thyroglobulin measurement predicts differentiated thyroid carcinoma
metastases three to five years later. J Clin Endocrinol Metab 2005;90:5047–57.
Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/4064348)http://www.ncbi.nlm.nih.gov/pubmed/15972576.
(http://www.ncbi.nlm.nih.gov/pubmed/15972576)
52. Sherman S.I., Tielens E.T., Sostre S. et al. Clinical utility of posttreatment radioiodine
scans in the management of patients with thyroid carcinoma. J Clin Endocrinol Metab
1994;78:629–34. Available at:
(http://www.ncbi.nlm.nih.gov/pubmed/15972576)http://www.ncbi.nlm.nih.gov/pubmed/8126134.
(http://www.ncbi.nlm.nih.gov/pubmed/8126134)
53. OʼCONNELL, T. B., & OʼDOHERTY, M. J. (2000). Differentiated thyroid cancer and
pregnancy. Nuclear Medicine Communications, 21(2), 127–128.
(http://www.ncbi.nlm.nih.gov/pubmed/8126134)
54. Gibelli B1, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Gibelli B[Author]&cauthor=true&cauthor_uid=22323846)Zamperini
P, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Zamperini P[Author]&cauthor=true&cauthor_uid=22323846)Proh
M, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Proh M[Author]&cauthor=true&cauthor_uid=22323846)Giugliano G.
Management and follow-up of thyroid cancer in pregnant women.
(https://www.ncbi.nlm.nih.gov/pubmed/?
term=Giugliano G[Author]&cauthor=true&cauthor_uid=22323846)Acta
Otorhinolaryngol Ital. 2011 Dec;31(6):358-65
(https://www.ncbi.nlm.nih.gov/pubmed/22323846)
- 1. Румянцев П.О., Ильин А.А., Румянцева У.В., Саенко В.А. Рак щитовидной
Информация
Список сокращений
ВДРЩЖ – высокодифференцированный рак щитовидной железы
КТ – компьютерная томография
МКБ-10 – Международная классификация болезней 10-го пересмотра
РЙТ – радиойодтерапия
РЩЖ – рак щитовидной железы
СВТ – сцинтиграфия всего тела
ТАБ – тонкоигольная аспирационная биопсия
ТГ – тиреоглобулин
ТТГ – тиреотропный гормон
УЗИ – ультразвуковое исследование
ЩЖ – щитовидная железа
Термины и определения
Bethesda Thyroid Classifcation, 2009, 2017 – стандартизированная система описания протокола цитологического исследования пунктатов щитовидной железы.
EU-TIRADS (European Thyroid Imaging Reporting and Data System) – стандартизированная система описания протокола ультразвукового исследования щитовидной железы.
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на РЩЖ или выявлении его у пациента врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют больного на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи – врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь больным с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований ЩЖ, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении на РЩЖ или выявлении его в ходе оказания скорой медицинской помощи больного переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет больного в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования ЩЖ или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования ЩЖ (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, которые требуют использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию больного.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т. д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия, РЙТ и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ больного или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. несоблюдение пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4. необходимость перевода больного в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или после предварительного осмотра больного врачами-специалистами медицинской организации, в которую планируется перевод.
Дополнительная информация, влияющая на течение и исход заболевания
Факторы, влияющие на исход РЩЖ:
- распространенность опухолевого процесса;
- локализация метастатических очагов;
- способность опухоли и метастазов накапливать радиоактивный йод;
- развитие нежелательных явлений препаратов для таргетной терапии.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы
1. Бельцевич Дмитрий Германович, д.м.н., профессор, главный научный сотрудник отдела хирургии ФГБУ «НМИЦ эндокринологии» Минздрава России; ORCID: http://orcid.org/0000-0001-7098-4584, eLibrary SPIN: 4475-6327, e-mail: belts67@gmail.com.
2. Мудунов Али Мурадович, д.м.н., профессор, заведующий отделом опухолей головы и шеи НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: http://orcid.org/0000-0002-0918-3857, eLibrary SPIN: 3516-6616, e-mail: ali.mudunov@info.ru.
3. Ванушко Владимир Эдуардович, д.м.н., главный научный сотрудник отдела хирургии эндокринных органов ФГБУ «НМИЦ эндокринологии» Минздрава России; ORCID: http://orcid.org/0000-0001-6338-7490, eLibrary SPIN: 6097-8990, email: vanushko@gmail.com.
4. Румянцев Павел Олегович, д.м.н., заведующий отделом радионуклидной диагностики и терапии ФГБУ «НМИЦ эндокринологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: http://orcid.org/0000-0002-7721-634X, eLibrary SPIN: 7085-7976, e-mail: pavelrum@gmail.com.
5. Мельниченко Галина Афанасьевна, д.м.н., профессор, академик РАН, директор Института клинической эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России; ORCID: http://orcid.org/0000-0002-5634-7877, eLibrary SPIN: 8615-0038, e-mail: teofrast2000@mail.ru.
6. Кузнецов Николай Сергеевич, д.м.н., профессор, заведующий отделом эндокринной хирургии ФГБУ «НМИЦ эндокринологии» Минздрава России; eLibrary SPIN: 8412-1098, e-mail: kuznetsovnikolays@yandex.ru.
7. Подвязников Сергей Олегович, д.м.н., профессор ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, вице-президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: http://orcid.org/0000-0003-1341-0765, eLibrary SPIN: 7353-1895, e-mail: podvs@inbox.ru.
8. Алымов Юрий Владимирович, к.м.н., врач-онколог хирургического отделения опухолей головы и шеи НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: https://orcid.org/0000-0002-6851-9867, e-mail: (https://orcid.org/0000-0002-6851-9867)allmedperevod@gmail.com. (mailto:allmedperevod@gmail.com)
9. Поляков Андрей Павлович, д.м.н., руководитель отделения микрохирургии МНИОИ им. Герцена, (mailto:allmedperevod@gmail.com)член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: http://orcid.org/0000-0002-5894-1917, e-mail: appolyakov@mail.ru.
10. Фадеев Валентин Викторович, д.м.н., профессор, член-корреспондент РАН, заведующий кафедрой эндокринологии; ORCID: http://orcid.org/0000-0002-3026- 6315, eLibrary SPIN: 6825-8417, e-mail: walfad@mail.ru.
11. Болотин Михаил Викторович, к.м.н., старший научный сотрудник хирургического отделения опухолей головы и шеи НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
12. Севрюков Феликс Евгеньевич, заведующий отделом лучевого и хирургического лечения заболеваний головы и шеи МРНЦ им. А.Ф. Цыба-филиал ФГБУ «НМИЦ радиологии» Минздрава России
13. Крылов Валерий Васильевич, д.м.н, Заведующий отделением радиохирургического лечения открытыми нуклидами МРНЦ им. А.Ф. Цыба-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
14. Феденко Александр Александрович, заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
15. Болотина Лариса Владимировна, заведующий Отделения химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
16. Жаров Андрей Александрович, патологоанатом ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
17. Фалалеева Наталья Александровна, Заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
18. Филоненко Елена Вячеславовна, заведующий Центра лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
19. Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
20. Иванов Сергей Анатольевич, д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
21. Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
22. Геворкян Тигран Гагикович, заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. Врачи-онкологи;
2. Врачи-хирурги;
3. Врачи-эндокринологи;
4. Врачи-радиологи;
5. Врачи общей практики.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных, по ключевым словам, связанным с РЩЖ и соответствующими разделами клинических рекомендаций, оценка качества и релевантности найденных источников.
Базы данных, использованные для сбора/селекции доказательств. Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных Embase и MedLine. Глубина поиска составляла до 40 лет.
Методы, использованные для определения качества и силы доказательств:
- консенсус экспертов;
- оценка значимости в соответствии с уровнями доказательности (табл. 1‒3).
Таблица 1. Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
Таблица 2. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровень достоверности доказательств |
Расшифровка |
| 1 |
Систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 |
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай–контроль» |
| 5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций. Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию –
не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3. Связанные документы
1. Бельцевич Д.Г., Ванушко В.Э., Мельниченко Г.А. и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечению (много)узлового зоба у взрослых (2015 г.). Эндокринная хирургия 2016; (1):5–12.
2. Бельцевич Д.Г., Ванушко В.Э., Румянцев П.О. и др. Российские клинические рекомендации по диагностике и лечению высокодифференцированного РЩЖ у взрослых, 2017 г. Эндокринная хирургия 2017;11(1):6–27. DOI: 10.14341/serg201716-27.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
1. Послеоперационный прием препаратов левотироксина натрия** в качестве заместительной терапии не оказывает отрицательного виляния на качество жизни.
2. Беременность не приводит к прогрессированию РЩЖ.
3. РЩЖ не является показанием для прерывания беременности.
4. После лечения радиоактивным йодом беременность не рекомендуется планировать в течение 6 мес.
5. Мужчинам не рекомендуется участвовать в планировании беременности в течение 120 дней после лечения радиоактивным йодом.
6. Пациенткам, получившим комплексное лечение по поводу РЩЖ, не противопоказано грудное вскармливание.
7. Подготовку к диагностике или послеоперационной терапии радиоактивным йодом можно проводить как с помощью 4-недельной отмены левотироксина натрия**, так и с помощью инъекций рекомбинантного человеческого ТТГ.
Приложение Г.
Не предусмотрено.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
1. Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid.2015;26(1):1-133. doi: 10.1089/thy.2015.0020.
2. Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid.2009;19(11):1167-1214. doi: 10.1089/thy.2009.0110.
3. Charkes ND. On the prevalence of familial nonmedullary thyroid cancer in multiply affected kindreds. Thyroid. 2006;16:181-186. doi: 10.1089/thy.2006.16.181.
4. Capezzone M, Marchisotta S, Cantara S, et al. Familial non-medullary thyroid carcinoma displays the features of clinical anticipation suggestive of a distinct biological entity. Endocr Relat Cancer. 2008;15(4):1075-1081. doi: 10.1677/ERC-08-0080.
5. Moses W, Weng J, Kebebew E. Prevalence, clinicopathologic features, and somatic genetic mutation profile in familial versus sporadic nonmedullary thyroid cancer. Thyroid. 2011;21(4):367-371. doi: 10.1089/thy.2010.0256.
6. Ito Y, Kakudo K, Hirokawa M, et al. Biological behavior and prognosis of familial papillary thyroid carcinoma. Surgery. 2009;145(1):100-105. doi: 10.1016/j.surg.2008.08.004.
7. Park YJ, Ahn HY, Choi HS, et al. The long-term outcomes of the second generation of familial nonmedullary thyroid carcinoma are more aggressive than sporadic cases. Thyroid. 2012;22(4):356-362. doi: 10.1089/thy.2011.0163.
8. Mazeh H, Benavidez J, Poehls JL, et al. In patients with thyroid cancer of follicular cell origin, a family history of nonmedullary thyroid cancer in one first-degree relative is associated with more aggressive disease. Thyroid. 2012;22(1):3-8. doi: 10.1089/thy.2011.0192.
9. Robenshtok E, Tzvetov G, Grozinsky-Glasberg S, et al. Clinical characteristics and outcome of familial nonmedullary thyroid cancer: a retrospective controlled study. Thyroid. 2011;21(1):43-48. doi: 10.1089/thy.2009.0406.
10. Richards ML. Familial syndromes associated with thyroid cancer in the era of personalized medicine. Thyroid. 2010;20(7):707-713. doi: 10.1089/thy.2010.1641.
11. Elisei R, Bottici V, Luchetti F, et al. Impact of routine measurement of serum calcitonin on the diagnosis and outcome of medullary thyroid cancer: experience in 10,864 patients with nodular thyroid disorders. J Clin Endocrinol Metab. 2004;89(1):163-168. doi: 10.1210/jc.2003-030550.
12. Hahm JR, Lee MS, Min YK, et al. Routine measurement of serum calcitonin is useful for early detection of medullary thyroid carcinoma in patients with nodular thyroid diseases. Thyroid. 2001;11(1):73-80. doi: 10.1089/10507250150500694.
13. Niccoli P, Wion-Barbot N, Caron P, et al. Interest of routine measurement of serum calcitonin: study in a large series of thyroidectomized patients. The French Medullary Study Group. J Clin Endocrinol Metab. 1997;82:338-341. doi: 10.1210/jcem.82.2.3737.
14. Costante G, Meringolo D, Durante C, et al. Predictive value of serum calcitonin levels for preoperative diagnosis of medullary thyroid carcinoma in a cohort of 5817 consecutive patients with thyroid nodules. J Clin Endocrinol Metab. 2007;92(2):450-455. doi: 10.1210/jc.2006-1590.
15. Chambon G, Alovisetti C, Idoux-Louche C, et al. The use of preoperative routine measurement of basal serum thyrocalcitonin in candidates for thyroidectomy due to nodular thyroid disorders: results from 2733 consecutive patients. J Clin Endocrinol Metab. 2011;96(1):75-81. doi: 10.1210/jc.2010-0162.
16. Абдулхабирова Ф.М., Бельцевич Д.Г., Ванушко В.Э., и др. Диагностика и лечение медуллярного рака щитовидной железы (проект национальных клинических рекомендаций). // Эндокринная хирургия. – 2012. – Т. 6. – №1 – С. 5–17. [Abdulkhabirova FM, Bel’tsevich DG, Vanushko VE, et al. Medullary Thyroid Cancer: Management Guidelines. Endocrine Surgery. 2012;6(1):5-17. (in Russ.)] doi: 10.14341/2306-3513-2012-1-5-17.
17. Repplinger D, Bargren A, Zhang YW, et al. Is Hashimoto’s thyroiditis a risk factor for papillary thyroid cancer? J Surg Res. 2008;150(1):49-52. doi: 10.1016/j.jss.2007.09.020.
18. Suh I, Vriens MR, Guerrero MA, et al. Serum thyroglobulin is a poor diagnostic biomarker of malignancy in follicular and Hurthle-cell neoplasms of the thyroid. Am J Surg. 2010;200(1):41-46. doi: 10.1016/j.amjsurg.2009.08.030.
19. Lee EK, Chung KW, Min HS, et al. Preoperative serum thyroglobulin as a useful predictive marker to differentiate follicular thyroid cancer from benign nodules in indeterminate nodules. J Korean Med Sci. 2012;27(9):1014-1018. doi: 10.3346/jkms.2012.27.9.1014.
20. Smith-Bindman R, Lebda P, Feldstein VA, et al. Risk of thyroid cancer based on thyroid ultrasound imaging characteristics: results of a population-based study. JAMA Intern Med. 2013;173(19):1788-1796. doi: 10.1001/jamainternmed.2013.9245.
21. Brito JP, Gionfriddo MR, Al Nofal A, et al. The accuracy of thyroid nodule ultrasound to predict thyroid cancer: systematic review and meta-analysis. J Clin Endocrinol Metab. 2014;99(4):1253-1263. doi: 10.1210/jc.2013-2928.
22. Langer JE, Agarwal R, Zhuang H, et al. Correlation of findings from iodine 123 scan and ultrasonography in the recommendation for thyroid fine needle aspiration biopsy. Endocr Pract. 2011;17(5):699-706. doi: 10.4158/EP10382.OR.
23. Kwak JY, Han KH, Yoon JH, et al. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk. Radiology. 2011;260(3):892-899. doi: 10.1148/radiol.11110206.
24. Moon WJ, Jung SL, Lee JH, et al. Benign and malignant thyroid nodules: US differentiation –multicenter retrospective study. Radiology. 2008;247(3):762-770. doi: 10.1148/radiol.2473070944.
25. Moon HJ, Kwak JY, Kim MJ, et al. Can vascularity at power Doppler US help predict thyroid malignancy? Radiology. 2010;255(1):260-269. doi: 10.1148/radiol.09091284.
26. Salmaslioglu A, Erbil Y, Dural C, et al. Predictive value of sonographic features in preoperative evaluation of malignant thyroid nodules in a multinodular goiter. World J Surg. 2008;32(9):1948-1954. doi: 10.1007/s00268-008-9600-2.
27. Papini E, Guglielmi R, Bianchini A, et al. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab. 2002;87(5):1941-1946. doi: 10.1210/jcem.87.5.8504.
28. Gul K, Ersoy R, Dirikoc A, et al. Ultrasonographic evaluation of thyroid nodules: comparison of ultrasonographic, cytological, and histopathological findings. Endocrine. 2009;36(3):464-472. doi: 10.1007/s12020-009-9262-3.
29. Cappelli C, Pirola I, Cumetti D, et al. Is the anteroposterior and transverse diameter ratio of nonpalpable thyroid nodules a sonographic criteria for recommending fine-needle aspiration cytology? Clin Endocrinol (Oxf). 2005;63(6):689-693. doi: 10.1111/j.1365-2265.2005.02406.x.
30. Frates MC, Benson CB, Doubilet PM, et al. Prevalence and distribution of carcinoma in patients with solitary and multiple thyroid nodules on sonography. J Clin Endocrinol Metab. 2006;91(9):3411-3417. doi: 10.1210/jc.2006-0690.
31. Horvath E, Majlis S, Rossi R, et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab. 2009;94(5):1748-1751. doi: 10.1210/c.2008-1724.
32. Tae HJ, Lim DJ, Baek KH, et al. Diagnostic value of ultrasonography to distinguish between benign and malignant lesions in the management of thyroid nodules. Thyroid. 2007;17(5):461-466. doi: 10.1089/thy.2006.0337.
33. Shimura H, Haraguchi K, Hiejima Y, et al. Distinct diagnostic criteria for ultrasonographic examination of papillary thyroid carcinoma: a multicenter study. Thyroid. 2005;15(3):251-258. doi: 10.1089/thy.2005.15.251.
34. Russ G, Royer B, Bigorgne C, et al. Prospective evaluation of thyroid imaging reporting and data system on 4550 nodules with and without elastography. Eur J Endocrinol. 2013;168(5):649-655. doi: 10.1530/EJE-12-0936.
35. Cheng SP, Lee JJ, Lin JL, et al. Characterization of thyroid nodules using the proposed thyroid imaging reporting and data system (TIRADS). Head Neck. 2013;35(4):541-547. doi: 10.1002/hed.22985.
36. Ito Y, Amino N, Yokozawa T, et al. Ultrasonographic evaluation of thyroid nodules in 900 patients: comparison among ultrasonographic, cytological, and histological findings. Thyroid. 2007;17(12):1269-1276. doi: 10.1089/thy.2007.0014.
37. Ito Y, Miyauchi A, Kihara M, et al. 2014 Patient age is significantly related to the progression of papillary microcarcinoma of the thyroid under observation. Thyroid. 2014;24(1):27-34. doi: 10.1089/thy.2013.0367.
38. Baloch ZW, LiVolsi VA, Asa SL, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: a synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference. Diagn Cytopathol. 2008;36(6):425-437. doi: 10.1002/dc.20830.
39. Crippa S, Mazzucchelli L, Cibas ES, et al. The Bethesda System for reporting thyroid fine-needle aspiration specimens. Am J Clin Pathol. 2010;134(2):343-344. doi: 10.1309/ajcpxm9wirq8jzbj.
40. Na DG, Kim JH, Sung JY, et al. Core-needle biopsy is more useful than repeat fine-needle aspiration in thyroid nodules read as nondiagnostic or atypia of undetermined significance by the Bethesda System for reporting thyroid cytopathology. Thyroid. 2012;22(5):468-475. doi: 10.1089/thy.2011.0185.
41. Nam SY, Han BK, Ko EY, et al. BRAFV600E mutation analysis of thyroid nodules needle aspirates in relation to their ultrasongraphic classification: a potential guide for selection of samples for molecular analysis. Thyroid. 2010;20(3):273-279. doi: 10.1089/thy.2009.0226.
42. Yip L, Nikiforova MN, Carty SE, et al. Optimizing surgical treatment of papillary thyroid carcinoma associated with BRAF mutation. Surgery. 2009;146(6):1215-1223. doi: 10.1016/j.surg.2009.09.011.
43. Cantara S, Capezzone M, Marchisotta S, et al. Impact of proto-oncogene mutation detection in cytological specimens from thyroid nodules improves the diagnostic accuracy of cytology. J Clin Endocrinol Metab. 2010;95(3):1365-1369. doi: 10.1210/jc.2009-2103.
44. Renshaw AA, Pinnar N. Comparison of thyroid fine-needle aspiration and core needle biopsy. Am J Clin Pathol. 2007;128(3):370-374. doi: 10.1309/07TL3V58337TXHMC.
45. Yeon JS, Baek JH, Lim HK, et al. Thyroid nodules with initially nondiagnostic cytologic results: the role of core-needle biopsy. Radiology. 2013;268(1):274-280. doi: 10.1148/radiol.13122247.
46. Ahn JE, Lee JH, Yi JS, et al. Diagnostic accuracy of CT and ultrasonography for evaluating metastatic cervical lymph nodes in patients with thyroid cancer. World J Surg. 2008;32(7):1552-1558. doi: 10.1007/s00268-008-9588-7.
47. Choi JS, Kim J, Kwak JY, et al. Preoperative staging of papillary thyroid carcinoma: comparison of ultrasound imaging and CT. AJR Am J Roentgenol. 2009;193(3):871-878. doi: 10.2214/AJR.09.2386.
48. Lesnik D, Cunnane ME, Zurakowski D, et al. Papillary thyroid carcinoma nodal surgery directed by a preoperative radiographic map utilizing CT scan and ultrasound in all primary and reoperative patients. Head Neck. 2014;36(2):191-202. doi: 10.1002/hed.23277.
49. Jeong HS, Baek CH, Son YI, et al. Integrated 18F-FDG PET/CT for the initial evaluation of cervical node level of patients with papillary thyroid carcinoma: comparison with ultrasound and contrast-enhanced CT. Clin Endocrinol (Oxf). 2006;65(3):402-407. doi: 10.1111/j.1365-2265.2006.02612.x.
50. Kaplan SL, Mandel SJ, Muller R, et al. The role of MR imaging in detecting nodal disease in thyroidectomy patients with rising thyroglobulin levels. AJNR Am J Neuroradiol. 2009;30(3):608-661. doi: 10.3174/ajnr.A1405.
51. Andersen PE, Kinsella J, Loree TR, et al. Differentiated carcinoma of the thyroid with extrathyroidal extension. Am J Surg. 1995;170(5):467-470. doi: 10.1016/S0002-9610(99)80331-6.
52. Kim E, Park JS, Son KR, et al. Preoperative diagnosis of cervical metastatic lymph nodes in papillary thyroid carcinoma: comparison of ultrasound, computed tomography, and combined ultrasound with computed tomography. Thyroid. 2008;18(4):411-418. doi: 10.1089/thy.2007.0269.
53. Yeh MW, Bauer AJ, Bernet VA, et al. American Thyroid Association statement on preoperative imaging for thyroid cancer surgery. Thyroid. 2015;25(1):3-14. doi: 10.1089/thy.2014.0096.
54. Sosa JA, Bowman HM, Tielsch JM, et al. The importance of surgeon experience for clinical and economic outcomes from thyroidectomy. Ann Surg. 1998;228(3):320-330. doi: 10.1097/00000658-199809000-00005.
55. Loyo M, Tufano RP, Gourin CG. National trends in thyroid surgery and the effect of volume on short-term outcomes. Laryngoscope. 2013;123(8):2056-2063. doi: 10.1002/lary.23923.
56. Gourin CG, Tufano RP, Forastiere AA, et al. Volume-based trends in thyroid surgery. Arch Otolaryngol Head Neck Surg. 2010;136(12):1191-1198. doi: 10.1001/archoto.2010.212.
57. Stavrakis AI, Ituarte PH, Ko CY, et al. Surgeon volume as a predictor of outcomes in inpatient and outpatient endocrine surgery. Surgery. 2007;142(6):887-899. doi: 10.1016/j.surg.2007.09.003.
58. Bilimoria KY, Bentrem DJ, Ko CY, et al. Extent of surgery affects survival for papillary thyroid cancer. Ann Surg. 2007;246(3):375-381. doi: 10.1097/SLA.0b013e31814697d9.
59. Grant CS, Hay ID, Gough IR, et al. Local recurrence in papillary thyroid carcinoma: is extent of surgical resection important? Surgery. 1988;104(6):954-962.
60. Hay ID, Grant CS, Bergstralh EJ, et al. Unilateral total lobectomy: is it sufficient surgical treatment for patients with AMES low-risk papillary thyroid carcinoma? Surgery. 1998;124(6):958-964. doi: 10.1016/S0039-6060(98)70035-2.
61. Mazzaferri EL, Kloos RT. Clinical review 128: Current approaches to primary therapy for papillary and follicular thyroid cancer. J Clin Endocrinol Metab. 2001;86(4):1447-1463. doi: 10.1210/jcem.86.4.7407.
62. Matsuzu K, Sugino K, Masudo K, et al. Thyroid lobectomy for papillary thyroid cancer: long-term follow-up study of 1,088 cases. World J Surg. 2014;38(1):68-79. doi: 10.1007/s00268-013-2224-1.
63. Barney BM, Hitchcock YJ, Sharma P, et al. Overall and cause-specific survival for patients undergoing lobectomy, near-total, or total thyroidectomy for differentiated thyroid cancer. Head Neck. 2011;33(5):645-649. doi: 10.1002/hed.21504.
64. Mendelsohn AH, Elashoff DA, Abemayor E, et al. Surgery for papillary thyroid carcinoma: is lobectomy enough? Arch Otolaryngol Head Neck Surg. 2010;136(11):1055-1061. doi: 10.1001/archoto.2010.181.
65. Haigh PI, Urbach DR, Rotstein LE. Extent of thyroidectomy is not a major determinant of survival in lowor high-risk papillary thyroid cancer. Ann Surg Oncol. 2005;12(1):81-89. doi: 10.1007/s10434-004-1165-1.
66. Nixon IJ, Ganly I, Patel SG, et al. Thyroid lobectomy for treatment of well differentiated intrathyroid malignancy. Surgery. 2012;151(4):571-579. doi: 10.1016/j.surg.2011.08.016.
67. Adam MA, Pura J, Gu L et al. Extent of surgery for papillary thyroid cancer is not associated with survival: an analysis of 61,775 patients. Ann Surg. 2014;260(4):601-605. doi: 10.1097/SLA.0000000000000925.
68. Vaisman F, Shaha A, Fish S, et al. Initial therapy with either thyroid lobectomy or total thyroidectomy without radioactive iodine remnant ablation is associated with very low rates of structural disease recurrence in properly selected patients with differentiated thyroid cancer. Clin Endocrinol (Oxf).2011;75(1):112-119. doi: 10.1111/j.1365-2265.2011.04002.x.
69. Stulak JM, Grant CS, Farley DR, et al. Value of preoperative ultrasonography in the surgical management of initial and reoperative papillary thyroid cancer. Arch Surg. 2006;141(5):489-494. doi: 10.1001/archsurg.141.5.489.
70. Kouvaraki MA, Shapiro SE, Fornage BD, et al. Role of preoperative ultrasonography in the surgical management of patients with thyroid cancer. Surgery. 2003;134(6):946-954. doi: 10.1016/S0039-6060(03)00424-0.
71. Hughes DT, White ML, Miller BS, et al. Influence of prophylactic central lymph node dissection on postoperative thyroglobulin levels and radioiodine treatment in papillary thyroid cancer. Surgery. 2010;48(6):1100-1106. doi: 10.1016/j.surg.2010.09.019.
72. Randolph GW, Duh QY, Heller KS, et al. The prognostic significance of nodal metastases from papillary thyroid carcinoma can be stratified based on the size and number of metastatic lymph nodes, as well as the presence of extranodal extension. Thyroid. 2012;22(11):1144-1152. doi: 10.1089/thy.2012.0043.
73. Zaydfudim V, Feurer ID, Griffin MR, et al. The impact of lymph node involvement on survival in patients with papillary and follicular thyroid carcinoma. Surgery. 2008;144(6):1070-1077. doi: 10.1016/j.surg.2008.08.034.
74. Leboulleux S, Rubino C, Baudin E, et al. Prognostic factors for persistent or recurrent disease of papillary thyroid carcinoma with neck lymph node metastases and/or tumor extension beyond the thyroid capsule at initial diagnosis. J Clin Endocrinol Metab. 2005;90(10):5723-5729. doi: 10.1210/jc.2005-0285.
75. Sugitani I, Kasai N, Fujimoto Y, et al. A novel classification system for patients with PTC: addition of the new variables of large (3 cm or greater) nodal metastases and reclassification during the follow-up period. Surgery. 2004;135(2):139-148. doi: 10.1016/S0039-6060(03)00384-2.
76. Robbins KT, Shaha AR, Medina JE, et al. Consensus statement on the classification and terminology of neck dissection. Arch Otolaryngol Head Neck Surg. 2008;134(5):536-538. doi: 10.1001/archotol.134.5.536.
77. Hwang HS, Orloff LA. Efficacy of preoperative neck ultrasound in the detection of cervical lymph node metastasis from thyroid cancer. Laryngoscope. 2011;121(3):487-491. doi: 10.1002/lary.21227.
78. Mulla M, Schulte KM. Central cervical lymph node metastases in papillary thyroid cancer: a systematic review of imaging-guided and prophylactic removal of the central compartment. Clin Endocrinol (Oxf). 2012;76(1):131-136. doi: 10.1111/j.1365-2265.2011.04162.x.
79. Hartl DM, Leboulleux S, Al Ghuzlan A, et al. Optimization of staging of the neck with prophylactic central and lateral neck dissection for papillary thyroid carcinoma. Ann Surg. 2012;255(4):777-783. doi: 10.1097/SLA.0b013e31824b7b68.
80. Popadich A, Levin O, Lee JC, et al. A multicenter cohort study of total thyroidectomy and routine central lymph node dissection for cN0 papillary thyroid cancer. Surgery. 2011;150(6):1048-1057. doi: 10.1016/j.surg.2011.09.003.
81. Chisholm EJ, Kulinskaya E, Tolley NS. Systematic review and meta-analysis of the adverse effects of thyroidectomy combined with central neck dissection as compared with thyroidectomy alone. Laryngoscope. 2009;119(6):1135-1139. doi: 10.1002/lary.20236.
82. Bonnet S, Hartl D, Leboulleux S, et al. Prophylactic lymph node dissection for papillary thyroid cancer less than 2 cm: implications for radioiodine treatment. J Clin Endocrinol Metab. 2009;94(4):1162-1167. doi: 10.1210/jc.2008-1931.
83. Sancho JJ, Lennard TW, Paunovic I, et al. Prophylactic central neck disection in papillary thyroid cancer: a consensus report of the European Society of Endocrine Surgeons (ESES). Langenbecks Arch Surg. 2014;399(2):155-163. doi: 10.1007/s00423-013-1152-8.
84. Zetoune T, Keutgen X, Buitrago D, et al. Prophylactic central neck dissection and local recurrence in papillary thyroid cancer: a meta-analysis. Ann Surg Oncol. 2010;17(12):3287-3293. doi: 10.1245/s10434-010-1137-6.
85. Barczynski M, Konturek A, Stopa M, et al. Prophylactic central neck dissection for papillary thyroid cancer. Br J Surg. 2013;100(3):410-418. doi: 10.1002/bjs.8985.
86. Hartl DM, Mamelle E, Borget I, et al. Influence of prophylactic neck dissection on rate of retreatment for papillary thyroid carcinoma. World J Surg. 2013;37(8):1951-1958. doi: 10.1007/s00268-013-2089-3.
87. Sywak M, Cornford L, Roach P, et al. Routine ipsilateral level VI lymphadenectomy reduces postoperative thyroglobulin levels in papillary thyroid cancer. Surgery. 2006;140(6):1000-1005. doi: 10.1016/j.surg.2006.08.001.
88. Laird AM, Gauger PG, Miller BS, et al. Evaluation of postoperative radioactive iodine scans in patients who underwent prophylactic central lymph node dissection. World J Surg. 2012;36(6):1268-1273. doi: 10.1007/s00268-012-1431-5.
89. Costa S, Giugliano G, Santoro L, et al. Role of prophylactic central neck dissection in cN0 papillary thyroid cancer. Acta Otorhinolaryngol Ital. 2009;29(2):61-69.
90. Ryu IS, Song CI, Choi SH, et al. Lymph node ratio of the central compartment is a significant predictor for locoregional recurrence after prophylactic central neck dissection in patients with thyroid papillary carcinoma. Ann Surg Oncol. 2014;21(1):277-283. doi: 10.1245/s10434-013-3258-1.
91. Moreno MA, Edeiken-Monroe BS, Siegel ER, et al. In papillary thyroid cancer, preoperative central neck ultrasound detects only macroscopic surgical disease, but negative findings predict excellent long-term regional control and survival. Thyroid. 2012;22(4):347-355. doi: 10.1089/thy.2011.0121.
92. Yoo D, Ajmal S, Gowda S, et al. Level VI lymph node dissection does not decrease radioiodine uptake in patients undergoing radioiodine ablation for differentiated thyroid cancer. World J Surg. 2012;36(6):1255-1261. doi: 10.1007/s00268-012-1507-2.
93. Roh JL, Park JY, Park CI. Total thyroidectomy plus neck dissection in differentiated papillary thyroid carcinoma patients: pattern of nodal metastasis, morbidity, recurrence, and postoperative levels of serum parathyroid hormone. Ann Surg. 2007;245(4):604-610. doi: 10.1097/01.sla.0000250451.59685.67.
94. Cavicchi O, Piccin O, Caliceti U, et al. Transient hypoparathyroidism following thyroidectomy: a prospective study and multivariate analysis of 604 consecutive patients. Otolaryngol Head Neck Surg. 2007;137(4):654-658. doi: 10.1016/j.otohns.2007.03.001.
95. Raffaelli M, De Crea C, Sessa L, et al. Prospective evaluation of total thyroidectomy versus ipsilateral versus bilateral central neck dissection in patients with clinically node-negative papillary thyroid carcinoma. Surgery. 2012;152(6):957-964. doi: 10.1016/j.surg.2012.08.053.
96. Viola D, Materazzi G, Valerio L, et al. Prophylactic central compartment lymph node dissection in papillary thyroid carcinoma: clinical implications derived from the first prospective randomized controlled single institution study. J Clin Endocrinol Metab. 2015;100(4):1316-1324. doi: 10.1210/jc.2014-3825.
97. Nikiforova MN, Kimura ET, Gandhi M, et al. BRAF mutations in thyroid tumors are restricted to papillary carcinomas and anaplastic or poorly differentiated carcinomas arising from papillary carcinomas. J Clin Endocrinol Metab. 2003;88(11):5399-5404. doi: 10.1210/jc.2003-030838.
98. Hawk WA, Hazard JB. The many appearances of papillary carcinoma of the thyroid. Cleve Clin Q. 1976;43(4):207-215.
99. Leung AK, Chow SM, Law SC. Clinical features and outcome of the tall cell variant of papillary thyroid carcinoma. Laryngoscope. 2008;118(1):32-38. doi: 10.1097/MLG.0b013e318156f6c3.
100. Moreno EA, Rodriguez Gonzalez JM, Sola PJ, et al. Prognostic value of the tall cell variety of papillary cancer of the thyroid. Eur J Surg Oncol. 1993;19(6):517-521.
101. Johnson TL, Lloyd RV, Thompson NW, et al. Prognostic implications of the tall cell variant of papillary thyroid carcinoma. Am J Surg Pathol. 1988;12(1):22-27.
102. Michels JJ, Jacques M, Henry-Amar M, et al. Prevalence and prognostic significance of tall cell variant of papillary thyroid carcinoma. Hum Pathol. 2007;38(2):212-219. doi: 10.1016/j.humpath.2006.08.001.
103. Asioli S, Erickson LA, Sebo TJ, et al. Papillary thyroid carcinoma with prominent hobnail features: a new aggressive variant of moderately differentiated papillary carcinoma. A clinicopathologic, immunohistochemical, and molecular study of eight cases. Am J Surg Pathol. 2010;34(1):44-52. doi: 10.1097/PAS.0b013e3181c46677.
104. Motosugi U, Murata S, Nagata K, et al. Thyroid papillary carcinoma with micropapillary and hobnail growth pattern: a histological variant with intermediate malignancy? Thyroid. 2009;19(5):535-537. doi: 10.1089/thy.2008.0271.
105. Lubitz CC, Economopoulos KP, Pawlak AC, et al. Hobnail variant of papillary thyroid carcinoma: an institutional case series and molecular profile. Thyroid. 2014;24(6):958-965. doi: 10.1089/thy.2013.0573.
106. Sherman SI. Toward a standard clinicopathologic staging approach for differentiated thyroid carcinoma. Semin Surg Oncol. 1999;16(1):12-15.
107. Onitilo AA, Engel JM, Lundgren CI, et al. Simplifying the TNM system for clinical use in differentiated thyroid cancer. J Clin Oncol. 2009;27(11):1872-1878. doi: 10.1200/JCO.2008.20.2382.
108. Mankarios D, Baade P, Youl P, et al. Validation of the QTNM staging system for cancer-specific survival in patients with differentiated thyroid cancer. Endocrine. 2014;46(2):300-308. doi: 10.1007/s12020-013-0078-9.
109. Edmonds CJ, Hayes S, Kermode JC, et al. Measurement of serum TSH and thyroid hormones in the management of treatment of thyroid carcinoma with radioiodine. Br J Radiol. 1977;50(599):799-807. doi: 10.1259/0007-1285-50-599-799.
110. Leboeuf R, Perron P, Carpentier AC, et al. L-T3 preparation for whole-body scintigraphy: a randomized-controlled trial. Clin Endocrinol (Oxf). 2007;67(6):839-844. doi: 10.1111/j.1365-2265.2007.02972.x.
111. Lee J, Yun MJ, Nam KH, et al. Quality of life and effectiveness comparisons of thyroxine withdrawal, triiodothyronine withdrawal, and recombinant thyroid-stimulating hormone administration for low-dose radioiodine remnant ablation of differentiated thyroid carcinoma. Thyroid. 2010;20(2):173-179. doi: 10.1089/thy.2009.0187.
112. Fallahi B, Beiki D, Takavar A, et al. Low versus high radioiodine dose in postoperative ablation of residual thyroid tissue in patients with differentiated thyroid carcinoma: a large randomized clinical trial. Nucl Med Commun. 2012;33(3):275-282. doi: 10.1097/MNM.0b013e32834e306a.
113. Robbins RJ, Driedger A, Magner J. Recombinant human thyrotropin-assisted radioiodine therapy for patients with metastatic thyroid cancer who could not elevate endogenous thyrotropin or be withdrawn from thyroxine. Thyroid. 2006;16(11):1121-1130. doi: 10.1089/thy.2006.16.1121.
114. Chianelli M, Todino V, Graziano FM, et al. Low-activity (2.0 GBq; 54 mCi) radioiodine post-surgical remnant ablation in thyroid cancer: comparison between hormone withdrawal and use of rhTSH in low-risk patients. Eur J Endocrinol. 2009;160(3):431-436. doi: 10.1530/EJE-08-0669.
115. Mallick U, Harmer C, Yap B, et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. N Engl J Med. 2012;366(18):1674-1685. doi: 10.1056/NEJMoa1109589.
116. Pacini F, Ladenson PW, Schlumberger M, et al. Radioiodine ablation of thyroid remnants after preparation with recombinant human thyrotropin in differentiated thyroid carcinoma: results of an international, randomized, controlled study. J Clin Endocrinol Metab. 2006;91(3):926-932. doi: 10.1210/jc.2005-1651.
117. Schlumberger M, Catargi B, Borget I, et al. Strategies of radioiodine ablation in patients with low-risk thyroid cancer. N Engl J Med. 2012;366:1663-1673. doi: 10.1056/NEJMoa1108586.
118. Taieb D, Sebag F, Cherenko M, et al. Quality of life changes and clinical outcomes in thyroid cancer patients undergoing radioiodine remnant ablation (RRA) with recombinant human TSH (rhTSH): a randomized controlled study. Clin Endocrinol (Oxf). 2009;71(1):115-123. doi: 10.1111/j.1365-2265.2008.03424.x.
119. Emmanouilidis N, Muller JA, Jager MD, et al. Surgery and radioablation therapy combined: introducing a 1-week condensed procedure bonding total thyroidectomy and radioablation therapy with recombinant human TSH. Eur J Endocrinol. 2009;161(5):763-769. doi: 10.1530/EJE-08-0641.
120. Tu J, Wang S, Huo Z, et al. Recombinant human thyrotropin-aided versus thyroid hormone withdrawal-aided radioiodine treatment for differentiated thyroid cancer after total thyroidectomy: a meta-analysis. Radiother Oncol. 2014;110(1):25-30. doi: 10.1016/j.radonc.2013.12.018.
121. Pak K, Cheon GJ, Kang KW, et al. The effectiveness of recombinant human thyroid-stimulating hormone versus thyroid hormone withdrawal prior to radioiodine remnant ablation in thyroid cancer: a meta-analysis of randomized controlled trials. J Korean Med Sci. 2014;29(6):811-817. doi: 10.3346/jkms.2014.29.6.811.
122. Elisei R, Schlumberger M, Driedger A, et al. Follow-up of low-risk differentiated thyroid cancer patients who underwent radioiodine ablation of postsurgical thyroid remnants after either recombinant human thyrotropin or thyroid hormone withdrawal. J Clin Endocrinol Metab. 2009;94(11):4171-4179. doi: 10.1210/jc.2009-0869.
123. Emmanouilidis N, Schrem H, Winkler M, et al. Long-term results after treatment of very low-, low-, and high-risk thyroid cancers in a combined setting of thyroidectomy and radio ablation therapy in euthyroidism. Int J Endocrinol. 2013:769473. doi: 10.1155/2013/769473.
124. Hugo J, Robenshtok E, Grewal R, et al. Recombinant human thyroid stimulating hormoneassisted radioactive iodine remnant ablation in thyroid cancer patients at intermediate to high risk of recurrence. Thyroid. 2012;22(10):1007-1015. doi: 10.1089/thy.2012.0183.
125. Rosario PW, Mineiro Filho AF, Lacerda RX, et al. Long-term follow-up of at least five years after recombinant human thyrotropin compared to levothyroxine withdrawal for thyroid remnant ablation with radioactive iodine. Thyroid. 2012;22(3):332-323. doi: 10.1089/thy.2011.0242.
126. Maenpaa HO, Heikkonen J, Vaalavirta L, et al. Low vs. high radioiodine activity to ablate the thyroid after thyroidectomy for cancer: a randomized study. PLoS One. 2008;3(4):e1885. doi: 10.1371/journal.pone.0001885.
127. Pilli T, Brianzoni E, Capoccetti F, et al. A comparison of 1850 (50 mCi) and 3700MBq (100 mCi) 131-iodine administered doses for recombinant thyrotropin-stimulated postoperative thyroid remnant ablation in differentiated thyroid cancer. J Clin Endocrinol Metab. 2007;92(9):3542-6. doi: 10.1210/jc.2007-0225.
128. Zaman M, Toor R, Kamal S, et al. A randomized clinical trial comparing 50mCi and 100mCi of iodine-131 for ablation of differentiated thyroid cancers. J Pak Med Assoc. 2006;56(8):353-356.
129. Kukulska A, Krajewska J, Gawkowska-Suwinska M, et al. Radioiodine thyroid remnant ablation in patients with differentiated thyroid carcinoma (DTC): prospective comparison of long-term outcomes of treatment with 30, 60 and 100 mCi. Thyroid Res. 2010;3(1):9. doi: 10.1186/1756-6614-3-9.
130. Castagna MG, Cevenini G, Theodoropoulou A, et al. Post-surgical thyroid ablation with low or high radioiodine activities results in similar outcomes in intermediate risk differentiated thyroid cancer patients. Eur J Endocrinol. 2013;169(1):23-29. doi: 10.1530/EJE-12-0954.
131. Han JM, Kim WG, Kim TY, et al. Effects of low-dose and high-dose postoperative radioiodine therapy on the clinical outcome in patients with small differentiated thyroid cancer having microscopic extrathyroidal extension. Thyroid. 2014;24(5):820-825. doi: 10.1089/thy.2013.0362.
132. Kruijff S, Aniss AM, Chen P, et al. Decreasing the dose of radioiodine for remnant ablation does not increase structural recurrence rates in papillary thyroid carcinoma. Surgery. 2013;154(6):1337-1344. doi: 10.1016/j.surg.2013.06.034.
133. Sabra M, Grewal R, Ghossein RM, et al. Higher administered activities of radioactive iodine are associated with less structural persistent response in older, but not younger, papillary thyroid cancer patients with lateral neck lymph node metastases. Thyroid. 2014;24(7):1088-1095. doi: 10.1089/thy.2013.0465.
134. Tuttle RM, Tala H, Shah J, et al. Estimating risk of recurrence in differentiated thyroid cancer after total thyroidectomy and radioactive iodine remnant ablation: using response to therapy variables to modify the initial risk estimates predicted by the new American Thyroid Association staging system. Thyroid.2010;20(12):1341-1349. doi: 10.1089/thy.2010.0178.
135. Vaisman F, Momesso D, Bulzico DA, et al. Spontaneous remission in thyroid cancer patients after biochemical incomplete response to initial therapy. Clin Endocrinol (Oxf). 2012;77(1):132-138. doi: 10.1111/j.1365-2265.2012.04342.x.
136. Tuttle RM, Leboeuf R. Follow up approaches in thyroid cancer: a risk adapted paradigm. Endocrinol Metab Clin North Am. 2008;37(2):419-435. doi: 10.1016/j.ecl.2008.02.008.
137. Momesso DP, Tuttle RM. Update on differentiated thyroid cancer staging. Endocrinol Metab Clin North Am. 2014;43(2):401-421. doi: 10.1016/j.ecl.2014.02.010.
138. Cooper DS, Specker B, Ho M, et al. Thyrotropin suppression and disease progression in patients with differentiated thyroid cancer: results from the National Thyroid Cancer Treatment Cooperative Registry. Thyroid. 1998;8(9):737-744. doi: 10.1089/thy.1998.8.737.
139. Bilimoria KY, Bentrem DJ, Ko CY, et al. Extent of surgery affects survival for papillary thyroid cancer. Ann Urg. 2007;246(3):375-384. doi: 10.1097/SLA.0b013e31814697d9.
140. Barney BM, Hitchcock YJ, Sharma P, et al. Overall and cause-specific survival for patients undergoing lobectomy, near-total, or total thyroidectomy for differentiated thyroid cancer. Head Neck. 2011;33(5):645-649. doi: 10.1002/hed.21504.
141. Mendelsohn AH, Elashoff DA, Abemayor E, et al. Surgery for papillary thyroid carcinoma: is lobectomy enough? Arch Otolaryngol Head Neck Surg. 2010;136(11):1055-1061. doi: 10.1001/archoto.2010.181.
142. Haigh PI, Urbach DR, Rotstein LE. Extent of thyroidectomy is not a major determinant of survival in lowor high-risk papillary thyroid cancer. Ann Surg Oncol. 2005;12(5):81-89. doi: 10.1007/s10434-004-1165-1.
143. Nixon IJ, Ganly I, Patel SG, et al. Thyroid lobectomy for treatment of well differentiated intrathyroid malignancy. Surgery. 2012;151(4):571-579. doi: 10.1016/j.surg.2011.08.016.
144. Adam MA, Pura J, Gu L, et al. Extent of surgery for papillary thyroid cancer is not associated with survival: an analysis of 61,775 patients. Ann Surg. 2014;260(4):601-605. doi: 10.1097/SLA.0000000000000925.
145. Jonklaas J, Sarlis NJ, Litofsky D, et al. Outcomes of patients with differentiated thyroid carcinoma following initial therapy. Thyroid. 2006;16(12):1229-1242. doi: 10.1089/thy.2006.16.1229.
146. McGriff NJ, Csako G, Gourgiotis L, et al. Effects of thyroid hormone suppression therapy on adverse clinical outcomes in thyroid cancer. Ann Med. 2002;34(7-8):554-564. doi: 10.1080/078538902321117760.
147. Diessl S, Holzberger B, Mader U, et al. Impact of moderate vs stringent TSH suppression on survival in advanced differentiated thyroid carcinoma. Clin Endocrinol (Oxf). 2012;76(4):586-592. doi: 10.1111/j.1365-2265.2011.04272.x.
148. Biondi B, Cooper DS. Benefits of thyrotropin suppression versus the risks of adverse effects in differentiated thyroid cancer. Thyroid. 2010;20(2):135-146. doi: 10.1089/thy.2009.0311.
149. Sugitani I, Fujimoto Y. Effect of postoperative thyrotropin suppressive therapy on bone mineral density in patients with papillary thyroid carcinoma: a prospective controlled study. Surgery. 2011;150(6):1250-1257. doi: 10.1016/j.surg.2011.09.013.
150. Hovens GC, Stokkel MP, Kievit J, et al. Associations of serum thyrotropin concentrations with recurrence and death in differentiated thyroid cancer. J Clin Endocrinol Metab. 2007;92(7):2610-2615. doi: 10.1210/jc.2006-2566.
151. Sawin CT, Geller A, Wolf PA, et al. Low serum thyrotropin concentrations as a risk factor for atrial fibrillation in older persons. N Engl J Med. 1994;331(19):1249-1252. doi: 10.1056/NEJM199411103311901.
152. Ebina A, Sugitani I, Fujimoto Y, et al. Risk-adapted management of papillary thyroid carcinoma according to our own risk group classification system: is thyroid lobectomy the treatment of choice for low-risk patients? Surgery. 2014;156(6):1579-1588. doi: 10.1016/j.surg.2014.08.060.
153. Frasoldati A, Pesenti M, Gallo M, et al. Diagnosis of neck recurrences in patients with differentiated thyroid carcinoma. Cancer. 2003;97(1):90-96. doi: 10.1002/cncr.1103.
154. Spencer CA, Bergoglio LM, Kazarosyan M, et al. Clinical impact of thyroglobulin (Tg) and Tg autoantibody method differences on the management of patients with differentiated thyroid carcinomas. J Clin Endocrinol Metab. 2005;90(10):5566-5575. doi: 10.1210/jc.2005-0671.
155. Schlumberger M, Berg G, Cohen O, et al. Follow-up of low-risk patients with differentiated thyroid carcinoma: a European perspective. Eur J Endocrinol. 2004;150(2):105-112. doi: 10.1530/eje.0.1500105.
156. Castagna MG, Brilli L, Pilli T, et al. Limited value of repeat recombinant human thyrotropin (rhTSH)-stimulated thyroglobulin testing in differentiated thyroid carcinoma patients with previous negative rhTSHstimulated thyroglobulin and undetectable basal serum thyroglobulin levels. J Clin Endocrinol Metab.2008;93(1):76-81. doi: 10.1210/jc.2007-1404.
157. Kloos RT, Mazzaferri EL. A single recombinant human thyrotropin-stimulated serum thyroglobulin measurement predicts differentiated thyroid carcinoma metastases three to five years later. J Clin Endocrinol Metab. 2005;90(9):5047-5057. doi: 10.1210/jc.2005-0492.
158. Han JM, Kim WB, Yim JH, et al. Long-term clinical outcome of differentiated thyroid cancer patients with undetectable stimulated thyroglobulin level one year after initial treatment. Thyroid. 2012;22(8):784-790. doi: 10.1089/thy.2011.0322.
159. Klubo-Gwiezdzinska J, Burman KD, Van Nostrand D, et al. Does an undetectable rhTSH-stimulated Tg level 12 months after initial treatment of thyroid cancer indicate remission? Clin Endocrinol (Oxf). 2011;74(1):111-117. doi: 10.1111/j.1365-2265.2010.03898.x.
160. Nascimento C, Borget I, Al Ghuzlan A, et al. Persistent disease and recurrence in differentiated thyroid cancer patients with undetectable postoperative stimulated thyroglobulin level. Endocr Relat Cancer. 2011;18(2):R29-40. doi: 10.1677/ERC-10-0292.
161. Verburg FA, Luster M, Cupini C, et al. Implications of thyroglobulin antibody positivity in patients with differentiated thyroid cancer: a clinical position statement. Thyroid. 2013;23(10):1211-1225. doi: 10.1089/thy.2012.0606.
162. Castagna MG, Tala Jury HP, Cipri C, et al. The use of ultrasensitive thyroglobulin assays reduces but does not abolish the need for TSH stimulation in patients with differentiated thyroid carcinoma. J Endocrinol Invest. 2011;34(8):e219-223. doi: 10.3275/7571.
163. Baudin E, Do Cao C, Cailleux AF, et al. Positive predictive value of serum thyroglobulin levels, measured during the first year of follow-up after thyroid hormone withdrawal, in thyroid cancer patients. J Clin Endocrinol Metab. 2003;88(3):1107-1111. doi: 10.1210/jc.2002-021365.
164. Pineda JD, Lee T, Ain K, et al. Iodine-131 therapy for thyroid cancer patients with elevated thyroglobulin and negative diagnostic scan. J Clin Endocrinol Metab. 1995;80(5):1488-1492. doi: 10.1210/jcem.80.5.7744991.
165. Alzahrani AS, Mohamed G, Al Shammary A, et al. Long-term course and predictive factors of elevated serum thyroglobulin and negative diagnostic radioiodine whole body scan in differentiated thyroid cancer. J Endocrinol Invest. 2005;28(6):540-546.
166. Valadao MM, Rosario PW, Borges MA, et al. Pоsitive predictive value of detectable stimulated tg during the first year after therapy of thyroid cancer and the value of comparison with Tg-ablation and Tg measured after 24 months. Thyroid. 2006;16(11):1145-1149. doi: 10.1089/thy.2006.16.1145.
167. Miyauchi A, Kudo T, Miya A, et al. Prognostic impact of serum thyroglobulin doubling-time under thyrotropin suppression in patients with papillary thyroid carcinoma who underwent total thyroidectomy. Thyroid. 2011;21(7):707-716. doi: 10.1089/thy.2010.0355.
168. Wong H, Wong KP, Yau T, et al. Is there a role for unstimulated thyroglobulin velocity in predicting recurrence in papillary thyroid carcinoma patients with detectable thyroglobulin after radioiodine ablation? Ann Surg Oncol. 2012;19(11):3479-3485. doi: 10.1245/s10434-012-2391-6.
169. Padovani RP, Robenshtok E, Brokhin M, et al. Even without additional therapy, serum thyroglobulin concentrations often decline for years after total thyroidectomy and radioactive remnant ablation in patients with differentiated thyroid cancer. Thyroid. 2012;22(8):778-783. doi: 10.1089/thy.2011.0522.
170. Diaz-Soto G, Puig-Domingo M, Martinez-Pino I, et al. Do thyroid cancer patients with basal undetectable Tg measured by current immunoassays require rhTSH testing? Exp Clin Endocrinol Diabetes. 2011;119(6):348-352. doi: 10.1055/s-0030-1269881.
171. Schlumberger M, Hitzel A, Toubert ME, et al. Comparison of seven serum thyroglobulin assays in the follow-up of papillary and follicular thyroid cancer patients. J Clin Endocrinol Metab. 2007;92(7):2487-2495. doi: 10.1210/jc.2006-0723.
172. Spencer CA. Clinical review: Clinical utility of thyroglobulin antibody (TgAb) measurements for patients with differentiated thyroid cancers (DTC). J Clin Endocrinol Metab. 2011;96(12):3615-3627. doi: 10.1210/jc.2011-1740.
173. Taylor KP, Parkington D, Bradbury S, et al. Concordance between thyroglobulin antibody assays. Ann Clin Biochem. 2011;48(Pt 4):367-369. doi: 10.1258/acb.2011.010248.
174. Giovanella L, Keller F, Ceriani L, et al. Heterophile antibodies may falsely increase or decrease thyroglobulin measurement in patients with differentiated thyroid carcinoma. Clin Chem Lab Med. 2009;47(8):952-954. doi: 10.1515/CCLM.2009.230.
175. Verburg FA, Waschle K, Reiners C, et al. Heterophile antibodies rarely influence the measurement of thyroglobulin and thyroglobulin antibodies in differentiated thyroid cancer patients. Horm Metab Res. 2010;42(10):736-739. doi: 10.1055/s-0030-1254132.
176. Latrofa F, Ricci D, Montanelli L, et al. Lymphocytic thyroiditis on histology correlates with serum thyroglobulin autoantibodies in patients with papillary thyroid carcinoma: impact on detection of serum thyroglobulin. J Clin Endocrinol Metab. 2012;97(7):2380-2387. doi: 10.1210/jc.2011-2812.
177. Giovanella L, Ceriani L. Comparison of thyroglobulin antibody interference in first- and second generation thyroglobulin immunoassays. Clin Chem Lab Med. 2011;49(6):1025-1027. doi: 10.1515/CCLM.2011.155.
178. Stanojevic M, Savin S, Cvejic D, et al. Comparison of the influence of thyroglobulin antibodies on serum thyroglobulin values from two different immunoassays in post surgical differentiated thyroid carcinoma patients. J Clin Lab Anal. 2009;23(5):341-346. doi: 10.1002/jcla.20339.
179. Stanojevic M, Savin S, Cvejic D, et al. Correlation of thyroglobulin concentrations measured by radioimmunoassay and immunoradiometric assay and the influence of thyroglobulin antibody. J Immunoassay Immunochem. 2009;30(2):197-207. doi: 10.1080/15321810902782897.
180. Eustatia-Rutten CF, Smit JW, Romijn JA, et al. Diagnostic value of serum thyroglobulin measurements in the follow-up of differentiated thyroid carcinoma, a structured meta-analysis. Clin Endocrinol (Oxf). 2004;61(1):61-74. doi: 10.1111/j.1365-2265.2004.02060.x.
181. Bachelot A, Leboulleux S, Baudin E, et al. Neck recurrence from thyroid carcinoma: serum thyroglobulin and highdose total body scan are not reliable criteria for cure after radioiodine treatment. Clin Endocrinol (Oxf). 2005;62(3):376-379. doi: 10.1111/j.1365-2265.2005.02228.x.
182. Cherk MH, Francis P, Topliss DJ, et al. Incidence and implications of negative serum thyroglobulin but positive I-131 whole-body scans in patients with well-differentiated thyroid cancer prepared with rhTSH or thyroid hormone withdrawal. Clin Endocrinol (Oxf). 2012;76(5):734-740. doi: 10.1111/j.1365-2265.2011.04278.x.
183. Pacini F, Agate L, Elisei R, et al. Outcome of differentiated thyroid cancer with detectable serum Tg and negative diagnostic (131)I whole body scan: comparison of patients treated with high (131)I activities versus untreated patients. J Clin Endocrinol Metab. 2001;86(9):4092-4097. doi: 10.1210/jcem.86.9.7831.
184. Torlontano M, Crocetti U, Augello G, et al. Comparative evaluation of recombinant human thyrotropin-stimulated thyroglobulin levels, 131I wholebody scintigraphy, and neck ultrasonography in the follow-up of patients with papillary thyroid microcarcinoma who have not undergone radioiodine therapy. J Clin Endocrinol Metab. 2006;91(1):60-63. doi: 10.1210/jc.2005-1185.
185. Robbins RJ, Srivastava S, Shaha A, et al. Factors influencing the basal and recombinant human thyrotropin-stimulated serum thyroglobulin in patients with metastatic thyroid carcinoma. J Clin Endocrinol Metab. 2004;89(12):6010-6016. doi: 10.1210/jc.2003-031573.
186. Mazzaferri EL, Robbins RJ, Spencer CA, et al. A consensus report of the role of serum thyroglobulin as a monitoring method for low-risk patients with papillary thyroid carcinoma. J Clin Endocrinol Metab. 2003;88(4):1433-1441. doi: 10.1210/jc.2002-021702.
187. Hollowell JG, Staehling NW, Flanders WD, et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab. 2002;87(2):489-499. doi: 10.1210/jcem.87.2.8182.
188. Spencer CA 2004 Challenges of serum thyroglobulin (Tg) measurement in the presence of Tg autoantibodies. J Clin Endocrinol Metab. 2004;89(8):3702-3704. doi: 10.1210/jc.2004-0986.
189. Bachelot A, Cailleux AF, Klain M, et al. Relationship between tumor burden and serum thyroglobulin level in patients with papillary and follicular thyroid carcinoma. Thyroid. 2002;12(8):707-711. doi: 10.1089/105072502760258686.
190. Spencer C, Fatemi S. Thyroglobulin antibody (TgAb) methods – strengths, pitfalls and clinical utility for monitoring TgAb-positive patients with differentiated thyroid cancer. Best Pract Res Clin Endocrinol Metab. 2013;27(5):701-712. doi: 10.1016/j.beem.2013.07.003.
191. Nygaard B, Bentzen J, Laurberg P, et al. Large discrepancy in the results of sensitive measurements of thyroglobulin antibodies in the follow-up on thyroid cancer: a diagnostic dilemma. Eur Thyroid J. 2012;1(3):193-197. doi: 10.1159/000341362.
192. Hoofnagle AN, Becker JO, Wener MH, et al. Quantification of thyroglobulin, a low-abundance serum protein, by immunoaffinity peptide enrichment and tandem mass spectrometry. Clin Chem. 2008;54(11):1796-1804. doi: 10.1373/clinchem.2008.109652.
193. Clarke NJ, Zhang Y, Reitz RE. A novel mass spectrometry-based assay for the accurate measurement of thyroglobulin from patient samples containing antithyroglobulin autoantibodies. J Investig Med. 2012;60(8):1157-1163. doi: 10.2310/JIM.0b013e318276deb4.
194. Kushnir MM, Rockwood AL, Roberts WL, et al. Measurement of thyroglobulin by liquid chromatography-tandem mass spectrometry in serum and plasma in the presence of antithyroglobulin autoantibodies. Clin Chem. 2013;59(6):982-990. doi: 10.1373/clinchem.2012.195594.
195. Hoofnagle AN, Roth MY. Clinical review: improving the measurement of serum thyroglobulin with mass spectrometry. J Clin Endocrinol Metab. 2013;98(4):1343-1352. doi: 10.1210/jc.2012-4172.
196. Snozek CL, Chambers EP, Reading CC, et al. Serum thyroglobulin, high-resolution ultrasound, and lymph node thyroglobulin in diagnosis of differentiated thyroid carcinoma nodal metastases. J Clin Endocrinol Metab. 2007;92(11):4278-4281. doi: 10.1210/jc.2007-1075.
197. Boi F, Baghino G, Atzeni F, et al. The diagnostic value for differentiated thyroid carcinoma metastases of thyroglobulin (Tg) measurement in washout fluid from fine-needle aspiration biopsy of neck lymph nodes is maintained in the presence of circulating anti-Tg antibodies. J Clin Endocrinol Metab.2006;91(4):1364-1369. doi: 10.1210/jc.2005-1705.
198. Grani G, Fumarola A. Thyroglobulin in lymph node fine-needle aspiration wash-out: a systematic review and meta-analysis of diagnostic accuracy. J Clin Endocrinol Metab. 2014;99(6):1970-1982. doi: 10.1210/jc.2014-1098.
199. Pacini F, Fugazzola L, Lippi F, et al. Detection of thyroglobulin in fine needle aspirates of nonthyroidal neck masses: a clue to the diagnosis of metastatic differentiated thyroid cancer. J Clin Endocrinol Metab. 1992;74(6):1401-1404. doi: 10.1210/jcem.74.6.1592886.
200. Spencer C, Fatemi S, Singer P, et al. Serum basal thyroglobulin measured by a second generation assay correlates with the recombinant human thyrotropin-stimulated thyroglobulin response in patients treated for differentiated thyroid cancer. Thyroid. 2010;20(6):587-595. doi: 10.1089/thy.2009.0338.
201. Pacini F, Molinaro E, Castagna MG, et al. Recombinant human thyrotropin-stimulated serum thyroglobulin combined with neck ultrasonography has the highest sensitivity in monitoring differentiated thyroid carcinoma. J Clin Endocrinol Metab. 2003;88(8):3668-3673. doi: 10.1210/jc.2002-021925.
202. Torres MR, Nobrega Neto SH, Rosas RJ, et al. Thyroglobulin in the washout fluid of lymph-node biopsy: what is its role in the follow-up of differentiated thyroid carcinoma? Thyroid. 2014;24(1):7-18. doi: 10.1089/thy.2013.0244.
203. Frasoldati A, Toschi E, Zini M, et al. Role of thyroglobulin measurement in fine-needle aspiration biopsies of cervical lymph nodes in patients with differentiated thyroid cancer. Thyroid. 1999;9:105-111. doi: 10.1089/thy.1999.9.105.
204. Baloch ZW, Barroeta JE, Walsh J, et al. Utility of thyroglobulin measurement in fine-needle aspiration biopsy specimens of lymph nodes in the diagnosis of recurrent thyroid carcinoma. Cytojournal. 2008;5:1. doi: 10.1186/1742-6413-5-1.
205. Avram AM, Fig LM, Frey KA, et al. Preablation 131-I scans with SPECT/CT in postoperative thyroid cancer patients: what is the impact on staging? J Clin Endocrinol Metab. 2013;98(3):1163-1171. doi: 10.1210/jc.2012-3630.
206. Sherman SI, Tielens ET, Sostre S, et al. Clinical utility of posttreatment radioiodine scans in the management of patients with thyroid carcinoma. J Clin Endocrinol Metab. 1994;78(3):629-634. doi: 10.1210/jcem.78.3.8126134.
207. Fatourechi V, Hay ID, Mullan BP, et al. Are posttherapy radioiodine scans informative and do they influence subsequent therapy of patients with differentiated thyroid cancer? Thyroid. 2000;10(7):573-577. doi: 10.1089/thy.2000.10.573.
208. Souza Rosario PW, Barroso AL, Rezende LL, et al. Post I-131 therapy scanning in patients with thyroid carcinoma metastases: an unnecessary cost or a relevant contribution? Clin Nucl Med. 2004;29(12):795-798.
209. Spies WG, Wojtowicz CH, Spies SM, et al. Value of post-therapy whole-body I-131 imaging in the evaluation of patients with thyroid carcinoma having undergone high-dose I-131 therapy. Clin Nucl Med. 1989;14(11):793-800.
210. Ciappuccini R, Heutte N, Trzepla G, et al. Postablation (131)I scintigraphy with neck and thorax SPECT-CT and stimulated serum thyroglobulin level predict the outcome of patients with differentiated thyroid cancer. Eur J Endocrinol. 2011;164(6):961-969. doi: 10.1530/EJE-11-0156.
211. Salvatori M, Perotti G, Villani MF, et al. Determining the appropriate time of execution of an I-131 post-therapy whole-body scan: comparison between early and late imaging. Nucl Med Commun. 2013;34(9):900-908. doi: 10.1097/MNM.0b013e328363cc5c.
212. Kohlfuerst S, Igerc I, Lobnig M, et al. Posttherapeutic (131)I SPECTCT offers high diagnostic accuracy when the findings on conventional planar imaging are inconclusive and allows a tailored patient treatment regimen. Eur J Nucl Med Mol Imaging. 2009;36(6):886-893. doi: 10.1007/s00259-008-1044-2.
213. Chen L, Luo Q, Shen Y, et al. Incremental value of 131I SPECT/CT in the management of patients with differentiated thyroid carcinoma. J Nucl Med. 2008;49(12):1952-1957. doi: 10.2967/jnumed.108.052399.
214. Schmidt D, Linke R, Uder M, et al. Five months’ follow-up of patients with and without iodinepositive lymph node metastases of thyroid carcinoma as disclosed by (131)I-SPECT/CT at the first radioablation Eur J Nucl Med Mol Imaging. 2010;37(4):699-705. doi: 10.1007/s00259-009-1299-2.
215. Maruoka Y, Abe K, Baba S, et al. Incremental diagnostic value of SPECT/CT with 131I scintigraphy after radioiodine therapy in patients with well-differentiated thyroid carcinoma. Radiology. 2012;265(3):902-909. doi: 10.1148/radiol.12112108.
216. Grewal RK, Tuttle RM, Fox J, et al. The effect of posttherapy 131I SPECT/CT on risk classification and management of patients with differentiated thyroid cancer. J Nucl Med. 2010;51(9):1361-1367. doi: 10.2967/jnumed.110.075960.
217. Padovani RP, Kasamatsu TS, Nakabashi CC, et al. One month is sufficient for urinary iodine to return to its baseline value after the use of water-soluble iodinated contrast agents in postthyroidectomy patients requiring radioiodine therapy. Thyroid. 2012;22(9):926-930. doi: 10.1089/thy.2012.0099.
218. Leboulleux S, Schroeder PR, Schlumberger M, et al. The role of PET in follow-up of patients treated for differentiated epithelial thyroid cancers. Nat Clin Pract Endocrinol Metab. 2007;3(2):112-121. doi: 10.1038/ncpendmet0402.
219. Robbins RJ, Wan Q, Grewal RK, et al. Real-time prognosis for metastatic thyroid carcinoma based on 2-[18F]fluoro-2-deoxy-D-glucose-positron emission tomography scanning. J Clin Endocrinol Metab. 2006;91(2):498-505. doi: 10.1210/jc.2005-1534.
220. Deandreis D, Al Ghuzlan A, Leboulleux S, et al. Do histological, immunohistochemical, and metabolic (radioiodine and fluorodeoxyglucose uptakes) patterns of metastatic thyroid cancer correlate with patient outcome? Endocr Relat Cancer. 2011;18(1):159-169. doi: 10.1677/ERC-10-0233.
221. Leboulleux S, Schroeder PR, Busaidy NL, et al. Assessment of the incremental value of recombinant thyrotropin stimulation before 2-[18F]-fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography imaging to localize residual differentiated thyroid cancer. J Clin Endocrinol Metab.2009;94(4):1310-1316. doi: 10.1210/jc.2008-1747.
222. Takashima S, Sone S, Takayama F, et al. Papillary thyroid carcinoma: MR diagnosis of lymph node metastasis. AJNR Am J Neuroradiol. 1998;19(3):509-513.
223. Gross ND, Weissman JL, Talbot JM, et al. MRI detection of cervical metastasis from differentiated thyroid carcinoma. Laryngoscope. 2001;111(11 Pt 1):1905-1909. doi: 10.1097/00005537-200111000-00006.
224. Toubert ME, Cyna-Gorse F, Zagdanski AM, et al. Cervicomediastinal magnetic resonance imaging in persistent or recurrent papillary thyroid carcinoma: clinical use and limits. Thyroid. 1999;9(6):591-597. doi: 10.1089/thy.1999.9.591.
225. Wang JC, Takashima S, Takayama F, et al. Tracheal invasion by thyroid carcinoma: prediction using MR imaging. AJR Am J Roentgenol. 2001;177(4):929-936.
226. Wang J, Takashima S, Matsushita T, et al. Esophageal invasion by thyroid carcinomas: prediction using magnetic resonance imaging. J Comput Assist Tomogr. 2003;27(1):18-25. doi: 10.1097/00004728-200301000-00004.
227. Lee DH, Kang WJ, Seo HS, et al. Detection of metastatic cervical lymph nodes in recurrent papillary thyroid carcinoma: computed tomography versus positron emission tomography-computed tomography. J Comput Assist Tomogr. 2009;33(5):805-810. doi: 10.1097/RCT.0b013e31818fb3f1.
228. Rosario PW, Mourao GF, dos Santos JB, et al. Is empirical radioactive iodine therapy still a valid approach to patients with thyroid cancer and elevated thyroglobulin? Thyroid. 2014;24(3):533-536. doi: 10.1089/thy.2013.0427.
229. Brose MS, Nutting CM, Jarzab B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet. 2014;384(9940):319-328. doi: 10.1016/S0140-6736(14)60421-9.
230. Anderson RT, Linnehan JE, Tongbram V, et al. Clinical, safety, and economic evidence in radioactive iodine-refractory differentiated thyroid cancer: a systematic literature review. Thyroid. 2013;23(4):392-407. doi: 10.1089/thy.2012.0520.
231. Leboulleux S, Bastholt L, Krause T, et al. Vandetanib in locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 2 trial. Lancet Oncol. 2012;13(9):897-905. doi: 10.1016/S1470-2045(12)70335-2.
232. Schlumberger M, Tahara M, Wirth LJ, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med. 2015;372:621-630. doi: 10.1056/NEJMoa1406470.
233. Cohen EE, Rosen LS, Vokes EE, et al. Axitinib is an active treatment for all histologic subtypes of advanced thyroid cancer: results from a phase II study. J Clin Oncol. 2008;26(29):4708-4713. doi: 10.1200/JCO.2007.
234. Bible KC, Suman VJ, Molina JR, et al. Efficacy of pazopanib in progressive, radioiodinerefractory, metastatic differentiated thyroid cancers: results of a phase 2 consortium study. Lancet Oncol. 2010;11(10):962-972. doi: 10.1016/S1470-2045(10)70203-5.
235. Carr LL, Mankoff DA, Goulart BH, et al. Phase II study of daily sunitinib in FDG-PET-positive, iodinerefractory differentiated thyroid cancer and metastatic medullary carcinoma of the thyroid with functional imaging correlation. Clin Cancer Res. 2010;16(21):5260-5268. doi: 10.1158/1078-0432.
236. Droz JP, Schlumberger M, Rougier P, et al. Chemotherapy in metastatic nonanaplastic thyroid cancer: experience at the Institut Gustave-Roussy. Tumori. 1990;76(5):480-483.
237. Schutz FA, Je Y, Richards CJ, et al. Metaanalysis of randomized controlled trials for the incidence and risk of treatment-related mortality in patients with cancer treated with vascular endothelial growth factor tyrosine kinase inhibitors. J Clin Oncol. 2012;30(8):871-877. doi: 10.1200/JCO.2011.37.1195.
238. Loh JA, Wartofsky L, Jonklaas J, et al. The magnitude of increased levothyroxine requirements in hypothyroid pregnant women depends upon the etiology of the hypothyroidism. Thyroid. 2009;19(3):269-275. doi: 10.1089/thy.2008.0413.
239. Pacini F, Schlumberger M, Dralle H, et al. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol. 2006;154(6):787-803. doi: 10.1530/eje.1.02158.
240. Sawka AM, Lakra DC, Lea J, et al. A systematic review examining the effects of therapeutic radioactive iodine on ovarian function and future pregnancy in female thyroid cancer survivors. Clin Endocrinol (Oxf). 2008;69(3):479-490. doi: 10.1111/j.1365-2265.2008.03222.x.
241. Garsi JP, Schlumberger M, Rubino C, et al. Therapeutic administration of 131I for differentiated thyroid cancer: radiation dose to ovaries and outcome of pregnancies. J Nucl Med. 2008;49(5):845-852. doi: 10.2967/jnumed.107.046599.
242. Pacini F, Gasperi M, Fugazzola L, et al. Testicular function in patients with differentiated thyroid carcinoma treated with radioiodine. J Nucl Med. 1994;35(9):1418-1422.
Дата публикации 10 апреля 2019Обновлено 17 июня 2021
Определение болезни. Причины заболевания
Рак щитовидной железы — это злокачественное образование, которое возникает за счёт появления фолликулярных, медуллярных или папиллярных клеток в тканях щитовидной железы.
Эпидемиология рака щитовидной железы
Совсем недавно данное заболевание считалась достаточно редкой онкопатологией. Но в последние 10-15 лет всё больше и больше людей стали обращаться в медицинские учреждения по поводу этого нарушения, примечая у себя его опасные и тревожные черты. В связи с этим количество случаев диагностированного рака щитовидной железы за прошедшие 12-18 лет увеличилось на 7%. Эксперты выдвигают теории, что это связано с применением ультразвуковых методов диагностики, позволяющих на ранних сроках выявить злокачественные образования щитовидной железы, которые раньше оставались незамеченными.[1]
Сейчас заболеваемость раком щитовидной железы составляет 2-3% от всех злокачественных новообразований других локализаций.
Факторы риска
Раком щитовидной железы чаще болеют женщины в возрасте 40-65 лет. У мужчин же данная патология встречается в четыре раза реже, чем у женщин. У детей данный вид рака встречается редко.
После Чернобыльской катастрофы количество случаев возникновения рака щитовидной железы увеличилось во много раз, особенно среди детей, так как их щитовидная железа намного больше предрасположена к накоплению вредных химических соединений, а именно радиоактивного йода.
Профилактика для людей, проживающих вблизи атомных электростанций, не требуется. На случай аварии на АЭС желательно иметь в домашней аптечке таблетки йодида калия. При работе станции в штатном режиме опасности для здоровья жителей нет.
При отсутствии воздействия радиоактивных веществ частота появления рака щитовидной железы растёт за счёт увеличения возраста.[2]
В группу риска входят люди с диффузно-токсическим зобом. Так, по результатам исследований различных медицинских учреждений, эта патология становится причиной 86% всех случаев онкологии щитовидной железы.
Уделять больше внимания своему здоровью следует не только пациентам с диффузно-токсическим зобом, но и людям со следующими особенностями:
- симптомы различных хронических воспалительных процессов в щитовидной железе;
- опухоли (в том числе и доброкачественные) или долгий воспалительный процесс в половой системе и молочных железах у женщин;
- аденома или цистаденома щитовидной железы, которую считают предраковым состоянием железы;
- наследственная предрасположенность к раку, опухолям внутренней секреции или дисфункциям;
- различные наследственные генетические изменения щитовидной железы;
- гормональная перестройка организма в связи с беременностью, лактацией, гормональным сбоем или климаксом;
- наличие вредных привычек, особенно курения.[4]
Отдельно стоит отметить, что к причинам рака щитовидной железы относят воздействие рентгеновского или радиоактивного излучения на весь организм человека или область головы и шеи. В особенности это касается детей и подростков.
Также к отрицательным факторам, увеличивающим уровень риска возникновения рака щитовидной железы, относятся условия труда, связанные с тяжёлыми металлами и испарениями. Но наибольшая опасность развития злокачественной опухоли железы возникает тогда, когда все перечисленные факторы сочетаются вместе, тем самым влияя на организм человека максимально негативно.[5][6]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы рака щитовидной железы
Основными критериями течения рака щитовидной железы являются размытость клинической картины, отсутствие болезненности узлов при пальпации, раннее распространение метастазов в лимфоузлы и другие органы и ткани (не при всех формах данной патологии).
На начальном этапе болезни пациенты отмечают появление узловых образований на шее в области проекции щитовидной железы или увеличение шейных лимфоузлов. С течением времени происходит увеличение опухоли железы, в результате чего начинают появляться и другие симптомы заболевания.
Первоначальные симптомы рака практически невозможно обнаружить. Как у мужчин, так и у женщин они сходны с признаками простудных заболеваний. К таковым можно отнести следующие проявления:
- наличие отёка на шеи в области железы;
- болезненные ощущения, локализация которых распространяется снизу вверх;
- затруднение при глотании, а также нарушения при дыхании в виде приступов удушья, возникновения одышки и появления приступообразного кашля;
- осиплость и охриплость голоса, возникающие из-за того, что большой узел железы сдавливает гортань;
- ощущение инородного тела в глотке.
У женщин при раке щитовидной железы возникают следующие характерные симптомы:
- быстрая прибавка или снижение веса;
- неожиданное появление плохого настроения без видимых причин;
- ломкость и выпадение волос;
- повышенная сухость кожи;
- болезненные ощущения в областях различных суставов;
- нестабильность артериального давления;
- изменение голоса;
- приступы жара;
- снижение либидо;
- появление на шее увеличенных лимфоузлов;
- возникновение небольшого уплотнения в области шеи;
- рассеянность и расстройства памяти;
- бессонница;
- повышенная утомляемость.
У мужчин при раке щитовидной железы тоже возникают свои специфические симптомы:
- быстрая смена настроения;
- плохой сон;
- повышение артериальное давление;
- раздражительность;
- тремор рук;
- эректильная дисфункция;
- одышка;
- более частое мочеиспускание;
- обнаружение плотных узлов в области шеи при пальпации;
- воспаление шейных лимфоузлов.[7]
Наибольшая доля подобных симптомов связана с наличием узла щитовидной железы, который в 90% случаев оказывается доброкачественным. Чтобы исключить рак железы, при обнаружении узелков в её области следует обратиться к специалисту.[3][8]
Патогенез рака щитовидной железы
Причины, ведущие к развитию рака щитовидной железы, до конца не выяснены, но ведущую роль в возникновении этой патологии отдают влиянию ионизирующего излучения (при внешнем облучении или приёме радиоактивного йода), нарушению иммунно-нейро-эндокринного аппарата и недостаточности йода в организме.
Ионизирующее излучение сильно влияет на превращение здоровых тканей щитовидной железы в злокачественные двумя способами:
- первичное изменение ДНК — является важным аспектом в образовании злокачественных тканей;
- уменьшение функции щитовидной железы из-за её облучения, прогрессирование её недостаточности и постоянная стимуляция тиреотропного гормона — приводят к самопроизвольной гиперплазии тканей железы, образованию узла и его превращению в раковую опухоль.[9]
Специалисты предполагают, что злокачественные опухоли щитовидной железы возникают вследствие дисгормонального превращения. Так, сбой образования гормонов в железе ведёт к увеличению секреции тиреотропного гормона. Он повышает стимуляцию щитовидной железы, что приводит к появлению в ней злокачественного новообразования. Проведённые наблюдения и исследования подтверждают, что длительный приём тиреотропного гормона может вызывать трансформацию здоровых тканей железы в злокачественные.[9][10]
В целом новообразования щитовидной железы имеют свои особенности развития и определённые законы роста. Так как они не являются ступенями единого процесса, их появление предположительно связано с клетками, обладающими высоким потенциалом роста, которые находятся в тиреоидных фолликулах. Именно эти клетки формируют локально-доминантные очаги, которые предположительно имеют папиллярную структуру. Они либо остаются бессимптомными в течение всей жизни человека, либо вследствие определённых факторов превращаются в опухоль. Совсем недавно стала появляться информация о высокой частоте скрытого рака щитовидной железы.[11]
Единым критерием для образования опухолей любого органа, в том числе и щитовидной железы, является изменение процессов нормальной клеточной пролиферации — разрастания ткани при помощи деления клеток.
Доказано, что под влиянием внутренних факторов происходит активизация и рост тиреоидных клеток. Так, тиреотропный гормон запускает рост тиреоцитов через аденилатциклазный путь передачи гормональных сигналов. Совместно с тиреотропным гормоном действуют инсулин и ИФР-1 (инсулиноподобный фактор роста). Так, в тиреоидной ткани, взятой при операции у пациентов с раком щитовидной железы, обнаружили значительно высокие показатели ИФР-1. Предположительно это связано с тем, что тиреотропный гормон увеличивает инсулининдуцированное аутофосфорилирование рецепторов ИФР-1 в тиреоцитах, активируя не только аденилатциклазный, но и фосфорилазный С-путь. Включение фосфорилазы С даёт начало возникновению диацилглицерина и инозитолтрифосфата, что приводит к увеличению концентрации внутриклеточного кальция, пробуждая тем самым клеточную пролиферацию. Не поддающийся контролю клеточный рост приводит к озлокачествлению, что проявляется снижением уровня стабильного йода в ткани опухоли щитовидной железы.[10][11][12]
В последнее время стали появляться данные об участии онкогенов и опухоль-супрессорных генов в механизмах развития рака. Онкогены — это часть генома, которая обычно находится в «спящем» или «тихом» состоянии. Их включение может произойти из-за мутации, что приводит к неконтролируемому росту клеток.[13]
Классификация и стадии развития рака щитовидной железы
Гистологические виды рака щитовидной железы:
- Папиллярный рак. Эта форма возникает в 60-70% случаев. Она включает варианты с микрофокусами (включениями) фолликулярного рака. Прогрессирует медленно и практически бессимптомно. Метастазирование в другие органы и ткани происходит редко. Рак данного типа хорошо поддаётся лечению при его обнаружении на ранних стадиях. Летальность имеет довольно низкие показатели. Из-за патологического роста клеток в ткани других органов развивается опухоль или киста.
- Фолликулярный рак. Иначе его называют «Хюртль-клеточный рак». Такой тип заболевания составляет 20-30% случаев. По статистике, он обнаруживается у одного из 10 пациентов. Причём чаще фолликулярным раком болеют пожилые люди. Важной чертой данного типа болезни является прорастание злокачественной опухоли в кровеносный сосуд.
Фолликулы превращаются в злокачественные клетки и дают начало возникновению рака и появлению первых клинических признаков. Их довольно сложно распознать как у женщин, так и у мужчин за счёт медленного течения болезни. Увеличенная щитовидная железа при пальпации хорошо прощупывается, появляются боли и неприятные ощущения.
Результаты прогноза являются не такими оптимистичными, как при папиллярной форме рака щитовидной железы. Количество смертельных случаев зависит от того, с какой скоростью прогрессирует рак. Метастазирование имеет агрессивный характер и может проникать в различные органы и ткани.[11][12][13][14]
- Медуллярный рак. Встречается в 5% случаев. Характеризуется агрессивным течением. Патология начинается в С-клетках, которые контролируют синтез кальцитонина. Метастазирование происходит в лимфоузлы шеи. Летальность будет зависеть от того, как агрессивно протекает болезнь. Данный тип рака трудно дифференцировать, также трудно подобрать правильное лечение. Это связанно со сложным течением болезни.
- Недифференцированный (анапластический) рак. Возникает в 5-10% случаев и обнаруживается очень редко. Характеризуется высокими темпами роста, тяжело поддаётся лечению. показатели смертности — высокие. При микробиологическом исследовании злокачественные формы клеток сильно отличаются от здоровых клеток. Этот тип рака начинается из дифференцированной формы, реже — из зоба. Процесс роста опухоли обладает быстрым темпом.
Также рак щитовидной железы делят на четыре стадии:
- I стадия — опухоль развивается внутри железы, наружная капсула железы никак не изменена, клинические признаки практически отсутствуют;
- II стадия — опухоль растёт и проникает через капсулу железы, изменяя её форму, злокачественные клетки попадают в лимфоузлы, возможно возникновение припухлости в области железы и охриплости голоса.
- III стадия — метастазы опухоли выходят за границы капсулы, появляются болевые ощущения в области железы;
- IV стадия — метастазы опухоли проникают в другие органы и ткани, возникают различные клинические проявления в зависимости от того, в какой орган попали злокачественные клетки.[13][14][15][16]
Осложнения рака щитовидной железы
Ведущим методом лечения рака щитовидной железы является операция, в ходе которой нельзя исключать возникновение осложнений. Их делят на две группы — специфические и неспецифические осложнения.
К неспецифическим относят кровотечения, нагноения, иногда возникновение отёков. Даже если эти проблемы возникают, то они хорошо устраняются.
Последствия операции
К специфическим послеоперационным осложнениям относят:
- Гипопаратиреоз. Из-за возникшей недостаточности околощитовидных желёз, которые участвуют в поддержании нормального состояния кальций-фосфорного обмена, происходит сбой метаболизма кальция и фосфора. Это приводит к нехватке кальция, вследствие чего у пациентов возникают так называемые «мурашки» или гусиная кожа. Такое осложнение развивается в 50% случаев и напрямую зависит от техники выполнения операционного вмешательства.
- Травма возвратного нерва гортани. При ранении нерва во время операции в дальнейшем могут возникнуть изменения в голосе, вплоть до его полного исчезновения. Такое осложнение появляется в 20% случаев. Повреждение нерва можно обнаружить с помощью ларингоскопии. Более опасным осложнением считается двустороннее повреждение возвратных нервов, в результате которого может произойти нарушение функции дыхания.
- Отёк или травма голосовых связок. Такие осложнения приводят к изменению голоса, восстановление которого наступает спустя 3-5 месяцев.
- Ранение добавочного нерва. Нередко это повреждение возникает при выполнении радикальной лимфаденэктомии. Такая травма возникает примерно в 17% случаев[17] и приводит к атрофии трапециевидной мышцы, вследствие чего появляются нарушения двигательной активности плечевого сустава. В самых сложных случаях данное осложнение может привести к инвалидизации пациента.
- Гипотиреоз. Это осложнение возникает из-за назначения заместительной гормонотерапии, включающую в себя приём тиреоидных гормонов. В результате этого происходит угнетение роста остаточных патологических клеток, что ведёт к предотвращению развития признаков гипотиреоидизма — недостаточности функции щитовидной железы.
Ещё одним методом лечения рака щитовидной железы является применение радиоактивного йода, при котором могут возникнуть острые и отдалённые осложнения.
К острым осложнениям относят:
- аллергические реакции на йод и интоксикация пациента;
- атрофия яичек с развитием аспермогении — наблюдается у 50% больных, получивших большие дозы йода-131;
- отёк головного и спинного мозга — возможен, если процесс метастазирования успевает попасть в мозг;
- аменорея и дисменорея у женщин (отсутствие менструаций или возникновение боли перед и во время месячных);
- возможное наступление тиреоидного криза через две недели после выполнения операции за счёт выброса гормонов из злокачественных клеток;
- проникновение метастазов в лёгкие с последующим возникновением травматической пневмонии;
- послелучевой цистит (встречается редко);
- паротит.
Отдалённые осложнения в настоящее время до конца не ясны. Но точно известно, что терапия радиоактивным йодом не оказывает отрицательного воздействия на потомство людей с раком щитовидной железы.[18]
Диагностика рака щитовидной железы
Когда необходимо обратиться к врачу
Первые симптомы рака щитовидной железы схожи с признаками простудных заболеваний. К ним относятся: боль и отёк на шее в области железы, затруднение при глотании, приступы удушья, одышка, приступообразный кашель, ощущение инородного тела в глотке, осиплость и охриплость голоса. При появлении этих симптомов следует немедленно посетить врача.
Рак щитовидной железы относится к тем опухолям, которые хорошо поддаются лечению: при своевременной постановке диагноза выживаемость составляет почти 100%.
Главная задача специалистов — отличить доброкачественные новообразования от злокачественных.
Методы диагностики рака щитовидной железы:
- Пальпация щитовидной железы. Это исследование является самым простым и доступным методом определения опухоли. С его помощью удаётся обнаружить образования размером от 1 см. Также ощупывание области щитовидной железы даёт возможность судить о консистенции образования и позволяет распознать увеличенные лимфоузлы.
- Лабораторные исследования. Диагностика рака щитовидной железы по показателям общего анализа крови проводится очень редко, так как это исследование на протяжении долгого времени не даёт никаких результатов, свидетельствующих о наличии опухоли. Определение уровня кальцитонина и присутствия онкомаркеров позволяет судить о медуллярном типе рака железы. Анализ на тиреоглобулин необходим для оценки результатов проведённой терапии. После оперативного лечения следят за уровнем тиреотропного гормона (ТТГ), трийодтиронина (Т3) и тироксина (Т4).
- Ультразвуковое исследование. Данный метод является одним из основных при определении опухоли. Он позволяет определить локализацию новообразования, его форму, размеры и другие параметры.
- Биопсия щитовидной железы. Забор клеток из «подозрительного» участка железы по праву считается самым точным методом установления диагноза. По данным этого исследования можно судить о том, какой тип рака возник у пациента и какой вариант лечения будет оптимальным.
- Магнитно-резонансная томография. Визуализация щитовидной железы при помощи электромагнитного поля в полном объёме позволяет судить о состоянии органа. Плюс данного метода в том, что пациент не подвергается вредному воздействию ионизирующего излучения.
- Компьютерная томография. Послойные изображения области щитовидной железы позволяют в большом объёме получить данные о заболевании и дают картину метастазирования (если этот процесс запущен).[11][12][13][14][15][16][17][18]
Лечение рака щитовидной железы
На сегодняшний день существует несколько методов лечения рака щитовидной железы:
- выполнение хирургического вмешательства;
- применение препаратов радиоактивного йода;
- назначение гормонотерапии;
- прохождение курса химио- и лучевой терапии.
Причём применение комбинационных схем лечения, включающих в себя два и более методов, во много раз повышают процент излечения пациентов с данным заболеванием.[18][19]
Прежде чем принимать решение в пользу того или иного метода лечения, необходимо учесть тип новообразования, его стадию и оценку общего состояния пациента.
Хирургическое лечение рака щитовидной железы
Чаще всего в борьбе с раком щитовидной железы прибегают к операции по удалению щитовидной железы — тиреоидэктомии. Он может быть тотальной и субтотальной (частичной).
При обнаружения рака 1-2 степени, когда опухоль находится в одной доле железы и не выходит за её пределы, выполняют удаление поражённой доли вместе с перешейком и подозрительными участками другой доли, если такие имеются.
При 3-4 стадии заболевания прибегают к тотальной тиреоидэктомии с обязательным удалением регионарных лимфоузлов и подкожно-жировой клетчатки.
Питание после операции: первые дни рекомендуется соблюдать щадящую диету, чтобы избежать раздражения слизистой полости рта и глотки. В дальнейшем можно придерживаться стандартных принципов рационального питания.
Гормональная терапия
После удаления щитовидной железы пациентам назначается гормонозаместительная терапия.
Радиойодтерапия
Совместно с хирургическим вмешательством проводится курс терапии радиоактивным йодом I-131, под действием которого происходит разрушение раковых клеток. Такая процедура позволяет остановить процесс метастазирования в лёгкие и может привести к их полному исчезновению.
Лучевая терапия
Лучевая терапия также помогает ликвидировать злокачественную опухоль, воздействуя на неё бета-, гамма- и рентгеновскими излучениями. Такой метод лечения применяют после частичного или полного удаления щитовидной железы для уничтожения злокачественных клеток, оставшихся в организме после операции. Иногда лучевую терапию применяют, чтобы уменьшить размеры образования и замедлить его рост. Обычно это делают пациентам с неоперабельным видом рака для облегчения его состояния.
Химиотерапия
Химиотерапия в борьбе с раком щитовидной железы не всегда оказывается эффективной, поэтому данным видом терапии пользуются редко. Химиотерапию проводят в случае невосприимчивости опухоли к другим методам лечения и при обширном процессе метастазирования.[12][13][14][15][16][17][18][19]
Таргетная терапия
Таргетную терапию применяют достаточно редко. Её назначают в следующих случаях:
- высокодифференцированные формы рака щитовидной железы, нечувствительные к радиойодтерапии;
- метастатические высокодифференцированные формы;
- низко- и недифференцированные формы рака щитовидной железы (анапластический рак).
Для лечения применяют:
- ингибиторы факторов роста кровеносных сосудов («Пазопаниб», «Мотезаниб»);
- ингибиторы рецепторов тирозинкиназы («Вандетаниб», «Акситиниб»);
- мультикиназные ингибиторы («Левантиниб»).
Хорошие результаты продемонстрировал «Сорафениб» — мощный ингибитор киназы RET. В России препарат также применяется. Его назначают индивидуально после рассмотрения каждого конкретного случая.
Поддерживающая (паллиативная) помощь
Облегчить состояние и улучшить качество жизни пациентов позволяет симптоматическое лечение.
Народные средства лечения
Лечение рака щитовидной железы народными средствами бесполезно. Без адекватной терапии пациент погибнет. Поэтому при появлении первых признаков заболевания, перечисленных выше, нужно обязательно обратиться к врачу.
Рак щитовидной железы и беременность
Высокодифференцированные формы рака щитовидной железы (папиллярный и фолликулярный) у беременных диагностируют и лечат по стандартным протоколам, но без радиоизотопного сканирования и радиойодтерапии. Для диагностики выполняют тонкоигольную биопсию узлов и определяют уровень тиреотропного гормона (ТТГ) и тиреоглобулина (ТГ). Если диагноз подтвердился, то щитовидную железу удаляют и назначают гормонозаместительную терапиею.
Беременность не ухудшает прогноз рака щитовидной железы, опухоль развивается так же, как и у других пациентов. Однако при назначении гормонозаместительной терапии после тиреоидэктомии нужен тщательный контроль.
Низкодифференцированные формы рака крайне агрессивны. При их развитии рекомендуется прервать беременность и провести полноценное лечение.
Прогноз. Профилактика
Наиболее точно оценить прогноз можно только после определения стадии заболевания, получения сведений о том, как протекало начало терапии, а также по результатам гистологического исследования новообразования. Если рак удаётся диагностировать на ранних стадиях развития, а характер злокачественности опухоли невыраженный, то процент выздоровления таких пациентов достигает 80-90%.
Неблагоприятный прогноз отмечается при постановки диагноза «Анапластическая форма тиреоидного рака». В таких случаях смертность пациентов в течение полугода от начала болезни близка к 100%. Медулярный рак также обладает большой степенью злокачественности, особенностью которого является усиленный процесс метастазирования в различные системы органов и тканей, что тоже крайне неблагоприятно.
Фолликулярный рак щитовидной железы характеризуется более благоприятным прогнозом в сравнении с медулярной формой. Самым благоприятный сценарий развития и лечения онкопатологии щитовидной железы возможен при папиллярной раке и раке смешанной формы.
Прогноз заболевания также зависит и от возраста пациента: у людей зрелого возраста с диагнозом рак щитовидной железы он будет более благоприятным, чем у лиц старше 65 и младше 25 лет.
Рецидивы рака щитовидной железы
Выделяют:
- местные рецидивы — развиваются в оставшейся ткани щитовидной железы при её неполном удалении, например после органосохраняющей операции;
- регионарные — метастазы в лимфоузлах шеи;
- отдалённые — метастазы в костях, головном мозге и лёгких.
При лечении высокодифференцированных форм рака щитовидной железы у 90 % пациентов в течение 10 лет не возникают рецидивы. У 10 % рецидивы чаще всего происходят на 3–5 год после окончания лечения. Однако они могут развиться даже спустя 20–30 лет. При агрессивных формах рака щитовидной железы рецидивы возникают всегда.
Продолжительность жизни после операции
Дифференцированные злокачественные новообразования щитовидной железы зачастую вылечиваются полностью. Продолжительность жизни таких пациентов превышает 15 лет.
При своевременном лечении медуллярного рака пятилетней выживаемости удаётся достичь у 98 % пациентов. Анапластические формы рака считаются самыми агрессивными, средняя продолжительность жизни составляет несколько месяцев.
Жизнь после лечения рака щитовидной железы
Удаление щитовидной железы зачастую не приводит к инвалидизации, потере трудоспособности или невозможности жить полноценной жизнью. После лечения пациенты принимают гормон L-тироксин, который полностью заменяет функцию утраченного органа.
Подбор дозы препарата может занять несколько месяцев. Пациентам рекомендуется временно ограничить физические и эмоциональные нагрузки, больше отдыхать и полноценно питаться. В этот период многие из них отмечают подавленное настроение, вплоть до депрессии. Но со временем состояние улучшается и всё налаживается.
Профилактика
Профилактика рака щитовидной железы предполагает устранение недостатка йода в организме за счёт употребления йодированной соли и морепродуктов.
Весомым аспектом профилактики болезни является своевременное и постоянное наблюдение у врачей эндокринологов. В особенности это необходимо людям с патологией щитовидной железы и тем, кто входит в группу риска:
- люди, живущие на территории, где наблюдается нехватка йода;
- пострадавшие от различных облучений;
- люди, в семье которых были случаи заболевания раком щитовидной железы.[20]
За дополнение статьи благодарим Андрея Пылёва — онколога, химиотерапевта, научного редактора портала «ПроБолезни».
Рак щитовидной железы – злокачественная опухоль, которая развивается из ткани щитовидной железы, фолликулярных клеток или C-клеток (парафолликулярных). Обычно первыми симптомами заболевания являются отечность, узлы на шее. В зависимости от гистологического строения, выделяют разные типы рака щитовидной железы, они отличаются разной степенью агрессивности и требуют различных подходов к лечению. [1]
Обычно узлы в щитовидной железе выявляются во время осмотра эндокринолога или УЗИ, иногда их обнаруживают сами пациенты. Узлы могут иметь разные размеры, бывают одиночными и множественными, «горячими» (сопровождаются повышенным уровнем гормонов) и «холодными». У многих пациентов сразу возникает паника: наверное, это рак?
По статистике злокачественным оказывается примерно каждый двадцатый узел. В большинстве же случаев это не рак, а такие состояния, как подострый тиреоидит (например, на фоне гриппа или эпидемического паротита), тиреоидит Хашимото (аутоиммунное воспаление в железе), нехватка йода.
- Симптомы
- Виды рака щитовидной железы
- Диагностика на ранних стадиях
- Стадии рака щитовидной железы
- Факторы риска
- Лечение
- Профилактика
- Реабилитационная терапия
- Продолжительность жизни после операции
- Последствия после операции
- Жизнь после лечения рака щитовидной железы
- Читайте также:
В ходе скрининга узлы в щитовидной железе обнаруживают примерно у 3–5% людей, причем, у женщин в 4–8 раз чаще, чем у мужчин. Паниковать не нужно, но и игнорировать узел не стоит. Для того чтобы убедиться, что это не рак, необходимо пройти обследование.[2,3]
Если узел быстро растет, либо появились узлы на шее в других местах, нужно срочно посетить врача.
Интеллектуальная собственность https://www.euroonco.ru
Симптомы
Помимо узлов в щитовидной железе, нужно обращать внимание на такие симптомы, как:
- припухлость и боль в шее;
- хриплый голос более трёх недель;
- кашель и боль в горле;
- затруднение во время глотания;
- увеличение лимфоузла на шее;
- расстройство со стороны кишечника, покраснение лица (при медуллярном раке).
На ранних стадиях рак щитовидной железы часто не имеет симптомов. Вовремя его диагностировать помогают регулярные осмотры врача-эндокринолога, ультразвуковое исследование.
Нередко злокачественная опухоль развивается на фоне других патологических процессов в щитовидной железе, таких как узловой зоб, аденома, аутоиммунный тиреоидит. Уже существующие узлы постепенно увеличиваются в размерах, появляются новые, нарастает их плотность. По мере распространения метастазов в регионарные лимфоузлы, они также увеличиваются. Со временем щитовидная железа становится настолько большой, что деформируется шея.
Часто первым симптомом заболевания становится увеличение пораженного лимфоузла. Опухоль в щитовидной железе обнаруживают только по результатам биопсии после ее удаления. Такой рак щитовидной железы называется скрытым.
На поздних стадиях, когда опухоль прорастает в пищевод, трахею, сдавливает возвратный гортанный нерв, возникает охриплость голоса, затруднение дыхания, кашель, во время которого выделяется мокрота с кровью. В таких случаях прогноз ухудшается.[1,4,5]
Рак щитовидной железы в фактах и цифрах:
- В целом заболевание встречается довольно редко: диагностируется не более 10–20 случаев на 100 000 населения в год, хотя, в разных странах показатели могут сильно различаться.
- Рак щитовидной железы составляет примерно 0,5–3% от всех онкологических заболеваний.
- Женщины болеют примерно в 2–3 раза чаще, чем мужчины. Но у мужчин обычно хуже прогноз.
- В отличие от многих других типов рака, опухоли щитовидной железы часто встречаются в молодом возрасте. Например, это самый распространенный тип рака среди женщин 20–35 лет. Каждый пятидесятый больной — ребенок или подросток.
- По данным американских экспертов, в последние годы распространенность заболевания растет примерно на 5% в год. Считается, что это во многом связано с улучшением диагностики. Врачи стали чаще обнаруживать заболевание.
- Рак щитовидной железы относительно хорошо поддается лечению. В среднем пятилетняя выживаемость составляет 98%. На поздних стадиях и при отсутствии адекватного лечения прогноз сильно ухудшается.[1,2,6]
Виды рака щитовидной железы
Выделяют следующие виды:
- Наиболее распространены дифференцированные опухоли. Под микроскопом такой рак похож на нормальную ткань щитовидной железы. В 8 из 10 случаев встречается папиллярный рак. Такие опухоли, как правило, затрагивают только одну долю органа, растут медленно, но часто распространяются в шейные лимфатические узлы. Они хорошо поддаются лечению. На долю фолликулярного рака приходится 1 случай из 10. Он чаще встречается среди людей, у которых имеется дефицит йода. Фолликулярный рак реже распространяется на шейные лимфоузлы, но чаще дает отдаленные метастазы. Около 3% приходится на оксифильную карциному. Она наиболее сложна в плане диагностики и лечения.
- Медуллярный рак составляет примерно 4% от всех случаев. Он образуется из клеток, которые производят гормон кальцитонин. Его сложно вовремя диагностировать, он плохо поддается лечению.
- Реже всего — примерно в 2% случаев — встречается анапластический, или недифференцированный рак. Он получил свое название за то, что опухолевая ткань под микроскопом совсем не похожа на нормальную. Такие опухоли ведут себя очень агрессивно, быстро растут и метастазируют, их сложно лечить.[4,7]
Диагностика на ранних стадиях
Чем раньше установлен диагноз, тем выше шансы на успешное лечение — это утверждение справедливо для любого онкологического заболевания. Если опухоль находится в пределах одного органа, вероятность ремиссии после хирургического лечения наиболее высока. С появлением отдаленных метастазов прогноз резко ухудшается.
Чтобы диагностировать рак на ранних стадиях, проводят скрининговые исследования – регулярные осмотры эндокринолога. Зачастую врач может вовремя обнаружить узел и направить пациента на обследование. Новообразования в щитовидной железе хорошо выявляет УЗИ, но врачи не рекомендуют проходить это исследование всем подряд.
Отдельную группу риска составляют носители аномального протоонкогена RET, который повышает риск медуллярного рака. Если этот тип рака был диагностирован у одного из ваших родственников, вам стоит посетить врача-генетика. При необходимости он назначит генетический анализ.
Если у человека обнаружен аномальный протоонкоген RET, врач может предложить одну из следующих тактик:
- Регулярные УЗИ щитовидной железы: это поможет диагностировать опухоль максимально рано.
- Регулярные анализы крови на уровень гормона кальцитонина.
- Профилактическое удаление железы.[8]
Диагностика рака щитовидной железы сегодня не представляет большой проблемы. Однако остается крайне важным своевременность обращения пациентов. При наличии любых проблем со щитовидной железой, необходимо регулярно наблюдаться у специалиста
Методы диагностики
Обычно, если врач во время осмотра обнаружил в щитовидной железе узлы, обследование начинают с ультразвукового исследования. Оно помогает оценить размеры, количество, расположение новообразований, изучить их внутреннюю структуру, выяснить, является ли новообразование плотным узлом или кистой.
Обнаружить раковые клетки и установить точный диагноз помогает биопсия щитовидной железы. Она может быть проведена, если узел имеет размеры не менее 1 см. Чаще всего ткань железы получают с помощью тонкой иглы, которую вводят под контролем УЗИ. Для точной диагностики нужно получить несколько образцов. Их отправляют в лабораторию для гистологического, цитологического и молекулярно-генетического анализа.[9]
По статистике, на 20 тонкоигольных биопсий диагностируют один случай рака щитовидной железы.
Иногда точный диагноз установить не удается, лаборатория описывает результат как «подозрительный» или «неопределенный». В таких случаях врач может принять следующие решения:
- Повторить тонкоигольную биопсию.
- Провести биопсию другими, более инвазивными, методами. Например, использовать более толстую иглу или удалить часть щитовидной железы.
- Провести генетические анализы, чтобы обнаружить аномальные гены, которые могли бы свидетельствовать в пользу онкологического заболевания.
Обнаруживать раковые клетки помогает радиоизотопное исследование. Его применяют для диагностики первичной опухоли и поиска метастазов. Перед процедурой в организм пациента вводят безопасный радиоактивный йод-131, внутривенно, либо дают принять в виде таблеток. Раковые клетки накапливают это вещество и дают изображение на специальных снимках. При медуллярном раке клетки не накапливают йод, поэтому радиоизотопное сканирование будет неэффективно.
По показаниям проводят рентгенографию грудной клетки, КТ, МРТ, позитронно-эмиссионную томографию (ПЭТ). Это помогает лучше изучить первичную опухоль и найти метастазы.
Так как щитовидная железа — эндокринный орган, в диагностике ее злокачественных опухолей важное значение зачастую имеют анализы крови на некоторые гормоны:
- Тиреотропный гормон вырабатывается гипофизом и стимулирует продукцию гормонов клетками щитовидной железы. Если его уровень в крови повышен, это может говорить о том, что щитовидная железа работает недостаточно активно.
- Тироксин и трийодтиронин. При раке щитовидной железы их уровни в крови чаще всего остаются нормальными.
- Тиреоглобулин — белок, который помогает судить об эффективности лечения. После тиреоидэктомии и радиойодтерапии уровень тиреоглобулина в крови должен оставаться низким. Если он растет, это может свидетельствовать о рецидиве.
- Кальцитонин вырабатывается C-клетками и участвует в регуляции обмена кальция. Определение его уровня имеет диагностическое значение при подозрении на медуллярный рак.
При медуллярном раке может быть назначен анализ на онкомаркер — раковоэмбриональный антиген. [1,3,8]
Стадии рака щитовидной железы
Стадию рака щитовидной железы определяют, опираясь на общепринятую международную классификацию TNM. Буква T обозначает размеры и другие характеристики первичной опухоли в щитовидной железе:.
- Tx – оценить характеристики первичной опухоли не удается.
- T0 – первичная опухоль во время обследования не выявлена.
- T1 – наибольший диаметр опухоли составляет 1 см и менее (T1a) или 1–2 см (T1b), и она не распространяется за пределы щитовидной железы.
- T2 – наибольший диаметр опухоли составляет от 2 до 4 см, и она не распространяется за пределы щитовидной железы.
- T3 – наибольший диаметр опухоли составляет более 4 см, либо она распространяется за пределы щитовидной железы.
- T4 – опухоль распространяется на органы и ткани, расположенные за пределами щитовидной железы. В зависимости от того, как далеко она проросла, выделяют подстадии T4a и T4b.
При анапластическом раке классификация несколько отличается. Все такие опухоли автоматически относят к четвертой стадии. При этом подстадия T4a означает, что рак находится в пределах щитовидной железы, T4b – распространился на соседние структуры.
Буква N характеризует наличие опухолевых очагов в регионарных, то есть близлежащих по отношению к щитовидной железе, лимфоузлах:
- Nx – не получается проверить, поражены ли лимфатические узлы.
- N0 – метастазы в лимфоузлах не обнаружены.
- N1 – имеются метастазы в регионарных лимфоузлах. В зависимости от того, какие группы лимфатических узлов поражены, выделяют подстадии N1a и N1b.
Буква M обозначает отдаленные метастазы:
- M0 – отдаленные метастазы не обнаружены.
- M1 – отдаленные метастазы имеются.
В зависимости от сочетания значений T, N и M, при разных типах рака щитовидной железы выделяют следующие стадии:
| Фолликулярный и папиллярный рак | |
| Стадия I | T1N0M0 |
| Стадия II | T2N0M0 |
| Стадия III | T3N0M0 или T1—3N1aM0 |
| Стадия IVA | T1—3N1bMo или T4aN0—1M0 |
| Стадия IVB | T4bN(любая)M0 |
| Стадия IVC | T(любая)N(любая)M1 |
| Медуллярный рак | |
| Стадия I | T1N0M0 |
| Стадия II | T2—3N0M0 |
| Стадия III | T1—3N1aM0 |
| Стадия IVA | T1—3N1bM0 или T4aN0—1M0 |
| Стадия IVB | T4bN(любая)M0 |
| Стадия IVC | T(любая)N(любая)M1 |
| Анапластический (недифференцированный) рак | |
| Стадия IVA | T4aN(любая)M0 |
| Стадия IVB | T4bN(любая)M0 |
| Стадия IVC | T(любая)N(любая)M1 |
Классификация папиллярного и фолликулярного рака у людей младше 45 лет несколько отличается. Если нет метастазов, всегда диагностируют стадию I, а если есть – стадию II. [1,5]
Факторы риска
Для большинства онкологических заболеваний невозможно назвать однозначную причину. Очень сложно понять, что именно привело к мутации, из-за которой нормальная клетка стала опухолевой. Известны лишь факторы риска — условия, которые в той или иной степени повышают вероятность развития заболевания.
Факторы риска:
- Пол. По неустановленным причинам женщины страдают раком щитовидной железы примерно в 3 раза чаще, чем мужчины.
- Возраст. У женщин риск повышается после 40–50 лет, у мужчин — после 60–70 лет.
- Семейная история. Риск повышен у людей, у которых есть родственники первой линии (родители, родные братья и сестры), страдающие раком щитовидной железы. Какие гены и каким образом в этом замешаны — неизвестно.
- Наследственность. Этот фактор особенно сильно связан с медуллярным раком: в 20% случаев он обусловлен мутацией предшественника гена RET.
- Недостаток йода. Люди, в организме которых не хватает этого микроэлемента, чаще страдают фолликулярным раком.
- Ионизирующие излучения. Развитию рака щитовидной железы способствует лучевая терапия головы и шеи, особенно в детском возрасте. В группе риска находятся люди, которые проживали в зоне радиоактивного заражения во время аварий на АЭС и применения ядерного оружия. Неизвестно, насколько опасна в этом плане рентгенография.
- Детям рекомендуется проводить исследование только при явной необходимости и с применением низких доз излучения. [2]
Лечение
При раке щитовидной железы прибегают к хирургическим вмешательствам, применяют лечение радиоактивным йодом, гормонотерапию, химиотерапию, лучевую, таргетную терапию. Лечебную тактику выбирают исходя из типа и стадии рака, состояния пациента.
Сегодня мы говорим о том, что применение современных методов лечения делают рак щитовидной железы в абсолютном большинстве случаев полностью излечимым заболеванием.
Хирургическое лечение рака щитовидной железы
Хирургия — основной, радикальный метод лечения РЩЖ. Если по результатам тонкоигольной биопсии в образце обнаружены опухолевые клетки, первым делом рассматривается один из вариантов хирургического лечения, за исключением некоторых случаев анапластического рака.
Если при дифференцированных формах рака (папиллярныйая или фолликулярныйая) опухоль имеет небольшие размеры и не распространяется за пределы щитовидной железы, обычно выполняют лобэктомию (гемитиреоидэктомию): удаляют пораженную долю вместе с перешейком. Это помогает сохранить выработку тиреоидных гормонов. Иногда такую операцию проводят в диагностических целях, если после тонкоигольной биопсии не удалось установить точный диагноз.
Однако, чаще всего приходится прибегать к удалению всей железы — тиреоидэктомии, или ее большей части – субтотальной резекции. После этого придется пожизненно принимать синтетический аналог тиреоидных гормонов — левотироксин.
Если есть подозрение, что, раковые клетки распространились в шейные лимфоузлы, последние также удаляют. Операции по удалению рака щитовидной железы проводят экстрафасциально, при этом важно тщательно осмотреть всю щитовидную железу и все зоны, где могут быть регионарные метастазы. При регионарных метастазах на стороне поражения на шее иссекают клетчатку в пределах фасциальных футляров. Особое внимание необходимо уделить клетчатке в области паратрахеальной зоны и передне-верхнего средостения. После хирургического вмешательства для уничтожения оставшихся опухолевых клеток и профилактики рецидива назначают терапию радиоактивным йодом. [1]
Радиойодтерапия
Практически весь йод, который поступает в организм человека, идет на нужды щитовидной железы. Если ввести пациенту радиоактивный йод, он проникнет в ткань железы и будет уничтожать раковые клетки, не оказывая влияния на другие органы. Для радиойодтерапии применяют радиоактивный изотоп йода I-131, тот же, что и для радиоизотопного исследования, только доза радиоактивности будет намного выше.
К терапии радиоактивным йодом чувствителен папиллярный и фолликулярный рак, нечувствительны медуллярные и анапластические опухоли. Обычно этот вид лечения назначают в следующих случаях:
- При неоперабельных опухолях.
- После операции, когда были поражены лимфоузлы, чтобы предотвратить рецидив.
- >Если есть отдаленные метастазы.
Для того чтобы радиойодтерапия принесла максимальный эффект, в организме пациента должен быть достаточно высок уровень тиреотропного гормона (ТТГ). Повысить его можно двумя способами:
- Ввести препарат ТТГ.
- После удаления щитовидной железы — прекратить принимать левотироксин на несколько недель. Уровень гормона в крови снизится, и гипофиз начнет активно вырабатывать ТТГ, чтобы стимулировать уже несуществующую щитовидную железу. В это время пациенту придется потерпеть некоторые симптомы, вызванные отсутствием тиреоидных гормонов: повышенную утомляемость, запоры, депрессию, ухудшение концентрации внимания, боли в мышцах.
Перед началом лечения нужно уменьшить количество йода в организме. Врач даст некоторые рекомендации по поводу диеты: на 1–2 недели придется отказаться от йодированной соли, сои, морепродуктов, яиц, молочных продуктов. [1,2]
Гормональная терапия
После удаления щитовидной железы в организме человека резко падает уровень тиреоидных гормонов. Это приводит к некоторым серьезным нарушениям, тяжелым симптомам. Активируется гипофиз и начинает вырабатывать ТТГ, чтобы стимулировать рост и активировать работу щитовидной железы, но он стимулирует лишь рост раковых клеток. Решить обе проблемы помогают препараты тиреоидных гормонов. После тиреоидэктомии их придется принимать пожизненно. [1]
Лучевая терапия
Помимо терапии радиоактивным йодом, РЩЖ можно лечить облучением из внешних источников, то есть применять лучевую терапию в классическом виде. Ее назначают при медуллярном и анапластическом раке, которые не реагируют на йод. Обычно процедуры проводят 5 дней в неделю в течение нескольких недель. [1]
Химиотерапия
Химиотерапия очень слабо работает против опухолей щитовидной железы, но чаще всего она и не нужна. Врач может рассмотреть возможность применения химиопрепаратов в двух случаях:
- При анапластическом раке в сочетании с лучевой терапии.
- При запущенном раке, который не реагирует на другие виды лечения.
Таргетная терапия при раке щитовидной железы
Таргетные препараты наиболее широко применяются при медуллярных опухолях, которые плохо реагируют на терапию радиоактивным йодом. Назначают вандетаниб или кабозантиниб. Оба препарата выпускаются в таблетках, их нужно принимать раз в день. Они помогают остановить рост рака, но неизвестно, насколько способны продлевать жизнь пациентов.
При дифференцированном раке, который не реагирует на другие виды лечения, применяют сорафениб и ленватиниб. Эти препараты блокируют рост питающих опухоль сосудов и некоторые белки, которые способствуют размножению раковых клеток. [1,13]
Профилактика
У многих заболевших людей нет никаких факторов риска, поэтому неизвестно, как можно предотвратить рак щитовидной железы.
Так как риски повышает облучение в детском возрасте, нужно с большой осторожностью относиться к любым методам лучевой диагностики и терапии у детей, применять их только при явной необходимости. В рационе любого человека должно присутствовать достаточное количество йода.
Если у человека диагностирован медуллярный рак, связанный с генетической мутацией, его родственникам нужно посетить врача-генетика и сдать анализы. И вообще, если у кого-либо из ваших близких родственников было обнаружено онкологическое заболевание, нужно уделять больше внимания своему здоровью, спросить у врача, какие виды скрининга и через какие промежутки времени вам стоит проходить.
Реабилитационная терапия
Гормоны щитовидной железы выполняют в организме важные функции, поэтому после ее удаления назначают заместительную гормональную терапию. Применяют препарат левотироксин.
После лечения сохраняется риск рецидива, поэтому врач назначит программу обследования:
- При папиллярном и фолликулярном раке щитовидной железы с высоким риском рецидива спустя 6–12 месяцев назначают исследование с радиоактивным йодом. Если оно показало отрицательный результат, дальнейших обследований не требуется. Также будут назначены анализы на уровни ТТГ и тиреоглобулина. Если уровень последнего растет, это может говорить о рецидиве. В таких случаях назначают позитронно-эмиссионную томографию (ПЭТ).
- При папиллярном и фолликулярном раке с низким риском рецидива назначают периодические осмотры врача, ультразвуковое исследование щитовидной железы и рентгенографию грудной клетки.
- При медуллярном раке назначают анализы крови на кальцитонин и раково-эмбриональный антиген. Если их уровни станут повышаться, для поиска метастазов врач назначит УЗИ шеи, КТ, МРТ.
Продолжительность жизни после операции
Прогноз при онкологических заболеваниях оценивают по показателю пятилетней выживаемости — доле пациентов, которые остались живы в течение пяти лет после того, как у них была диагностирована злокачественная опухоль. Прогнозы после операции при раке щитовидной железы (пятилетняя выживаемость) в зависимости от типа и стадии опухоли представлены в таблице:
| 1 ст. | 2 ст. | 3 ст. | 4 ст. | |
| Прогноз после операции при папиллярном раке щитовидной железы | 100% | 100% | 93% | 51% |
| Прогноз после операции при фолликулярном раке щитовидной железы | 100% | 100% | 71% | 50% |
| Прогноз после операции при медуллярном раке щитовидной железы | 100% | 98% | 81% | 28% |
В первую очередь выживаемость при РЩЖ зависит от стадии и типа опухоли. В то время как дифференцированные опухоли относительно хорошо поддаются лечению, медуллярный и анапластический рак зачастую диагностируются на более поздних стадиях, ведут себя агрессивно. Имеет значение и возраст пациента, состояние его здоровья. Выживаемость выше среди молодых мужчин и женщин, у которых нет сопутствующих заболеваний.
Лечение рака щитовидной железы может сопровождаться некоторыми осложнениями и побочными эффектами. Одни из них носят временный характер, другие сохраняются в течение длительного времени или даже на всю жизнь. В большинстве случаев их удается держать под контролем. [10,11]
Последствия после операции
Основное осложнение после операции при раке щитовидной железы (если была удалена вся железа или ее значительная часть) — гипотиреоз. Это состояние вызывает серьезные симптомы, так как тиреоидные гормоны выполняют важные функции. Однако, гипотиреоз успешно поддается коррекции гормональными препаратами. Принимать их придется пожизненно.
Другие возможные осложнения после операции:
- Охриплость или потеря голоса. Этот симптом может быть временным или стойким. Зачастую он возникает из-за раздражения гортани интубационной трубкой. Более серьезная причина — случайное повреждение гортанного нерва во время операции.
- Повреждение паращитовидных желез. Они представляют собой небольшие железы, которые находятся на задней поверхности щитовидной железы, попарно сверху и снизу. Паращитовидные железы вырабатывают гормоны, регулирующие уровень кальция в крови. При их повреждении уровень кальция в крови падает, это проявляется мышечными спазмами, покалыванием и онемением в руках, ногах.
- Крупная гематома может формироваться в области шеи при интенсивном кровотечении.
Как и после всякого хирургического вмешательства, возможно инфицирование, нагноение. Для профилактики такого осложнения применяют антибактериальные препараты. [1]
Жизнь после лечения рака щитовидной железы
Нет специальных рекомендаций по поводу того, как снизить риск рецидива рака щитовидной железы после наступления ремиссии и завершения лечения. Обычно врачи дают общие рекомендации, советуют правильно питаться, выполнять физические упражнения, отказаться от вредных привычек.
Нужно следить за своим здоровьем, вовремя проходить исследования и сдавать анализы, которые входят в реабилитационную программу. При любых непонятных симптомах, которые сохраняются в течение длительного времени, нужно обратиться к врачу.
Обычно узлы в щитовидной железе выявляются во время осмотра эндокринолога или УЗИ, иногда их обнаруживают сами пациенты. Узлы могут иметь разные размеры, бывают одиночными и множественными, «горячими» (сопровождаются повышенным уровнем гормонов) и «холодными». У многих пациентов сразу возникает паника: наверное, это рак?
По статистике злокачественным оказывается примерно каждый двадцатый узел. В большинстве же случаев это не рак, а такие состояния, как подострый тиреоидит (например, на фоне гриппа или эпидемического паротита), тиреоидит Хашимото (аутоиммунное воспаление в железе), нехватка йода. [2]
| Подробнее о лечении рака щитовидной железы в Евроонко: |
|
| Консультация онколога-эндокринолога | 6 900 руб |
| Биопсия щитовидной железы | 26 700 руб |
| Приём химиотерапевта | 6 900 руб |
| Консультация радиолога | 11 500 руб |
Список литературы:
- Клинические рекомендации: Рак щитовидной железы. — Министерство здравоохранения РФ, 2018.
- Макарьин В.А. Рак щитовидной железы. Пособие для пациентов. — М., 2016. — 168 с.
- Н.В. Шидловская, В.А. Петрухин, Ф.Ф. Бурумкулова — Рак щитовидной железы и беременность. Особенности течения и перинатальные исходы / Российский вестник акушера-гинеколога 6, 2017.
- Т.В. Павлова, И.Д. Павлов. — Клинико-морфологические аспекты рака щитовидной железы / Фармация. — 2011, №4(99). Выпуск 13.
- Клинические рекомендации: Медуллярный рак щитовидной железы. — Министерство здравоохранения РФ, 2020.
- Г.А. Червякова, Д.З. Каменский, Е.Н. Томилова / Рак щитовидной железы. — Лечебное дело,4. — 2005г.
- А.В. Гостимский, А.Ф. Романчишен, М.В. Гавщук. – Недифференцированный рак щитовидной железы. – Вестник хирургии, 2016.
- Л.С. Шаталова, Ю.Г. Козлова, Д.М. Гафланова. – Диагностика раннего рака щитовидной железы. – Бюллетень медицинских интернет-конференций, 2020. Том 10, №2.
- В.А. Белобородов, О.С. Олифирова, С.П. Шевченко. – Морфологическая верификация рака щитовидной железы. – Сибирский онкологический журнал, 2007, №2(22).
- Ванушко В.Э., Кузнецов Н.С., Гарбузов П.И., Фадеев В.В. Рак щитовидной железы. Проблемы Эндокринологии. 2005;51(4):43-53.
- Я.Д. Хэй. Папиллярный рак щитовидной железы: клинические проявления, рецидивы и прогноз. Вестник хирургии. Том 165, №1, 2006.
- S. Filetti, C. Durante, D. Hartl. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. doi.org/10.1093/annonc/mdz400
- Maria E, Cabanillas, Mabel Ryder, Camilo Jimenez. Endocr Rev. 2019 Dec 1;40(6):1573-1604. doi: 10.1210/er.2019-00007. Targeted Therapy for Advanced Thyroid Cancer: Kinase Inhibitors and Beyond. DOI: 10.1210/er.2019-00007