Состав
1 шприц (1 мл) включает 60 мг деносумаба.
Дополнительно: 47 мг сорбитола, 0.1 мг полисорбата 20, 1 мг ледяной уксусной кислоты, до 1 мл воды д/ин, до рН 5.0-5.5 гидроксида натрия.
Форма выпуска
Пролиа выпускается в форме инъекционного раствора для п/к (подкожного) введения, в шприцах по 1мл №1 во вторичной упаковке.
Фармакологическое действие
Ингибирующее (угнетающее) костную резорбцию.
Фармакодинамика и фармакокинетика
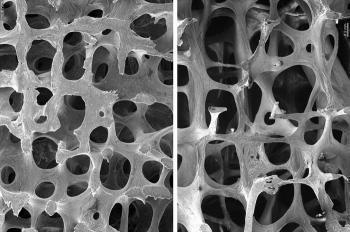
Активный ингредиент препарата Пролиа – деносумаб – полностью является моноклональным антителом человека и принадлежит к иммуноглобулиновому подклассу IgG2. Данное вещество характеризуется высокой специфичностью и сродством к рецепторному лиганду κВ (RANKL) – активатору нуклеарного фактора и, связываясь с ним, блокирует активизацию единственного находящегося на поверхности остеокластов, а также их предшественников RANK-рецептора – активатора нуклеарного фактора κВ (RANK). Вследствие этого, взаимодействия RANKL/RANK не происходит, что приводит к подавлению образования, активизации и продолжительности функционирования остеокластов и в свою очередь снижает костную резорбцию (разрушение), а также увеличивает прочность и массу трабекулярного и кортикального слоев кости.
При подкожном (п/к) введении 60 мг деносумаба наблюдалось быстрое снижение плазменных концентраций 1С-телопептида (СТХ), являющегося маркером резорбции костной ткани, примерно на 70% на протяжении 6-ти часов после инъекции и на 85% в течение следующих 3-х суток. Стабильно пониженный уровень СТХ сохранялся на протяжении полугода. При снижении плазменной концентрации деносумаба скорость понижения сывороточного содержания СТХ в некоторой степени уменьшалась, что свидетельствует об обратимости воздействия деносумаба на костное ремоделирование. Такие эффекты отмечались в течение всего терапевтического курса.
В процессе ремоделирования костной ткани в соответствии с физиологической взаимосвязью между ее образованием и резорбцией, после первой инъекции деносумаба в течение первого месяца отмечалось снижение количества маркеров костного образования (например, P1NP и костноспецифической ЩФ). Маркеры костного ремоделирования (образования кости и ее резорбции) обычно приходили к уровню, наблюдаемому до начала терапии, по прошествии не более 9-ти месяцев после введения последней дозы деносумаба. При возобновлении введения деносумаба уровень снижения СТХ соответствовал таковому в начале лечебного курса.
В проведенных исследованиях замены терапии с приема алендроновой кислоты (продолжительность лечения в среднем – 3 года) на введение деносумаба, проходившие с привлечением женщин с малой костной массой в постменопаузе доказали дополнительное уменьшение сывороточного уровня СТХ при применении деносумаба в сравнении с приемом алендроновой кислоты. При этом плазменные концентрации кальция в обеих исследуемых группах были аналогичными.
Также при проведении данных исследований, подавление взаимодействия RANK/RANKL параллельно со связыванием Fc-фрагмента (OPG-Fc) с остеопротегерином приводило к торможению костного роста и замедлению прорезывания зубов. Вследствие этого применение деносумаба у детей может негативно влиять на прорезывание зубов и развитие костей, обладающих открытыми ростовыми зонами.
В связи с тем, что деносумаб является человеческим моноклональным антителом, его применение, как и прочих препаратов белковой природы, теоретически может привести к иммуногенности. Используя иммунологический анализ в сочетании с методом чувствительной электрохемилюминесценции, были произведены обследования более 13000 больных на предмет формирования у них связывающих антител. Менее чем в 1% случаев применение деносумаба на протяжении 5-ти лет приводило к определению антител (включая растущие, транзиторные и существовавшие ранее). Серопозитивные пациенты в дальнейшем прошли обследования с целью выявления нейтрализующих антител. В культуре клеток in vitro методом хемилюминисцентного анализа таких антител обнаружено не было. Также не наблюдалось изменений клинического ответа, фармакокинетического и токсического профиля, зависимых от образования антител.
У женщин с диагностированным постменопаузальным остеопорозом применение Пролиа усиливало минеральную костную плотность, тем самым снижая частоту невертебральных и вертебральных переломов, а также переломов шейки бедра. Профили безопасности и эффективности деносумаба при терапии постменопаузального остеопороза полностью доказаны в ходе исследований, проведенных на протяжении 3-х лет. По результатам данных исследований применение Пролиа по сравнению с введением «плацебо» существенно снижает риск любых переломов, возникающих в постменопаузе у женщин с остеопорозом. В исследовании принимали участие 7808 женщин, у 23,6% из них ранее часто отмечались переломы позвонков. Все три заключительные точки эффективности касательно переломов приходили к статистически значимым показателям, которые оценивали по предварительно разработанному последовательному плану тестирования.
Применение Пролиа на протяжении более 3-х лет показало значимое и стабильное уменьшение риска появления вертебральных переломов. Снижение такого риска наблюдалось в независимости от 10-летней вероятности образования остеопоротических крупных переломов, ранее происходящих частых переломов позвонков, возраста пациентов, невертебральных переломов, минеральной плотности костей, степени костного ремоделирования и предыдущего лечения остеопороза.
У пациенток в постменопаузе в возрасте 75-ти лет и старше применение Пролиа приводило к снижению частоты новых эпизодов вертебральных переломов, а также по данным проведения post hoc анализа сокращало частоту случаев переломов бедренной шейки.
Снижение частоты появления невертебральных переломов также не зависело от 10-летней вероятности образования остеопоротических крупных переломов. Лекарство Пролиа в сравнении с применением «плацебо» существенно повышало минеральную костную плотность, определяемую каждый год проведения 3-х летнего лечения во всех без исключения анатомических областях. Схожее воздействие препарата на минерализацию костей было выявлено в поясничном районе позвоночника и не зависело от расовой принадлежности пациента, его возраста, ИМТ (индекс массы тела), значений минеральной костной плотности и ремоделирования кости. Проведенные гистологические исследования доказали нормальную структуру костей и, в сравнении с «плацебо«, понижение их ремоделирования. Патологических изменений, в том числе остеомаляции, фиброза и нарушений костной структуры отмечено не было.
Безопасность и эффективность препарата Пролиа, назначаемого для терапии снижения костной массы по причине уменьшения содержания андрогенов, также были обоснованы в ходе 3-х летнего исследования с привлечением 1468 больных, страдающих неметастатическим раком простаты. Значимое повышение костной минеральной плотности выявляли в поясничном отделе, бедренной кости ее вертеле и шейке спустя 30 суток после первой инъекции препарата. Увеличение минеральной костной плотности в поясничном отделе возникало в независимости от расовой принадлежности, возраста, ИМТ, географического региона, начальных показателей минеральной костной плотности и костного ремоделирования, а также наличия предшествующих вертебральных переломов и длительности гормондепривационной терапии.
На протяжении 3-х летнего применения Пролиа наблюдалось существенное уменьшение риска образования свежих вертебральных переломов, оцениваемое через 12 и 24 месяца после назначения препарата. Также введение Пролиа уменьшало риск появления свыше одного перелома остеопоротического характера любой локализации.
Безопасность и эффективность Пролиа при терапии потери костной массы, по причине проведения адъювантной терапии с использованием ингибитора ароматазы, определялась в ходе 2-х летнего исследовании с привлечением 252 женщин с диагностированным раком молочной железы (неметастатическим). Применение Пролиа, в сравнении с введением «плацебо«, значительно повышало минеральную костную плотность во всех исследуемых анатомических областях на протяжении 2-х лет. В поясничном отделе наращивание минеральной костной плотности было отмечено спустя 30 суток после введения первой дозы и сохранялось на протяжении всего лечения независимо от возраста пациентки, ИМТ, продолжительности применения ингибитора ароматазы, предыдущей химиотерапии и применения СМРЭ, а также времени, прошедшего от наступления менопаузы.
Фармакокинетика деносумаба при его п/к введении нелинейная и дозозависимая в широком дозировочном диапазоне, характеризующаяся повышением экспозиции препарата в дозировках 60 мг (или 1 мг/кг) и более. При введении 60 мг препарата через 10 суток (с вариабельностью 2-28 дней) его биодоступность была 61%, плазменная Cmax составляла 6 мкг/мл (с вариабельностью 1-17 мкг/мл). По достижению Cmax сывороточная концентрация уменьшалась с T1/2 26 суток (с вариабельностью 6-52 дня) и в дальнейшем на протяжении 3-х месяцев (с вариабельностью 1,5-4,5 месяца). Через 6 месяцев после введения последней дозы Пролиа у 53% пациентов деносумаба в плазме уже не обнаруживалось. При многократном введении 60 мг деносумаба через каждые полгода не отмечалось его кумуляции и изменений фармакокинетики.
Как и обыкновенный иммуноглобулин, деносумаб состоит из углеводов и аминокислот. По результатам проведенных доклинических исследований предполагается, что его метаболические преобразования и дальнейшее выведение будут проходить по пути обычного клиренса и выведения иммуноглобулинов, с распадом на отдельные аминокислоты и короткие пептидные цепи.
Фармакокинетика деносумаба при его применении пациентами в возрасте 28-87 лет не подвергается значимым изменениям. Расовая принадлежность больных также не влияет на фармакокинетику препарата.
Наличие у пациентов патологий почек, по данным исследований с привлечением 55-ти больных с различной степенью тяжести почечной недостаточности, в том числе находящихся на гемодиализе, не приводило к изменениям фармакодинамики и фармакокинетики деносумаба, что говорит об отсутствии необходимости корректировки дозировочного режима.
Влияние печеночных патологий на фармакокинетические параметры деносумаба не изучалось.
Показания к применению
Назначение Пролиа показано для терапии постменопаузального остеопороза, а также потери массы костной ткани у женщин с раком молочной железы, проходящих лечение с применением ингибиторов ароматазы и у мужчин с раком простаты, находящихся на гормондепривационной терапии.
Противопоказания
Применение Пролиа противопоказано при наличествующей гипокальциемии и персональной гиперчувствительности к деносумабу и/или прочим ингредиентам ЛС.
Побочные действия
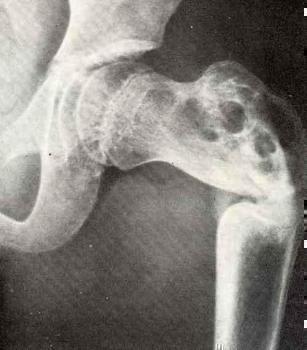
При проведении контролируемых клинических исследований наблюдали следующие негативные реакции: часто – формирование катаракты у пациентов мужского пола с раком простаты, проходящих андрогендепривационную терапию, болевые ощущения в конечностях; нечасто – развитие экзем (в том числе, включая аллергические, контактные и атопические дерматиты), воспалительные процессы в подкожной клетчатке; редко – челюстной остеонекроз; эпизодически – возникновение гипокальциемии.
Пролиа, инструкция по применению (Способ и дозировка)
Проведение п/к инъекций препаратом Пролиа рекомендуют проводить дважды в год (1 раз в 6 месяцев) в дозе 60 мг. На протяжении всего курса лечения советуют параллельно принимать витамин D и препараты кальция.
К самостоятельному введению Пролиа можно приступить только после предварительной консультации у лечащего врача, в ходе которой он должен подробно объяснить пациенту все нюансы техники проведения инъекций.
С целью снижения риска случайных уколов каждый уже заполненный шприц оснащен защитным предохранителем для иглы, активирующимся автоматически для ее закрытия сразу после выполнения инъекции.
Не следует пытаться разобрать шприц или активизировать защитный предохранитель. Нельзя использовать шприцы с отсутствующим колпачком или активизированным предохранителем иглы.
Для проведения инъекции препаратом Пролиа самостоятельно вам понадобится новый заполненный шприц и спиртовые салфетки.
Непосредственно перед самим введением следует достать из холодильника шприц, при этом, не беря его за защитный колпачок или поршень, так как это может привести к повреждению устройства.
Для комфортного введения необходимо оставить на некоторое время шприц при комнатной температуре, но не под воздействием солнечных лучей (не следует подогревать шприц в горячей воде, микроволновой печи и т.д.). Не нужно встряхивать шприц и удалять защитный колпачок до начала инъекции.
Далее необходимо убедиться в соответствии срока годности препарата Пролиа, указанного на упаковке, и визуально проверить инъекционный раствор на посторонние включения и изменения цвета (допускается введение только прозрачного, бесцветного или светло-желтого раствора). Разрешено введение раствора с небольшими пузырьками воздуха.
Выбрать хорошо освещенное, комфортное место с близко расположенной чистой поверхностью, на которой разместить необходимые для инъекции материалы и тщательно вымыть руки.
Инъекции лучше всего проводить в верхнюю область бедра или живота. В случае проведения процедуры другим лицом может быть использована тыльная поверхность рук. При отечности или покраснении предполагаемой области введения следует выбрать иное место для инъекции.
Продезинфицировать выбранное место спиртовой салфеткой.
Аккуратно снять защитный колпачок, не вращая его, а просто потянув вверх. Следует избегать касания к игле и нажима на поршень.
Взять шприц в удобную руку и, не сдавливая, зажать кожу между указательным и большим пальцами другой руки. Ввести иглу в основание складки кожи под углом 45° на глубину около 15 мм.
Удерживая кожную складку плавно и медленно, надавить на поршень до полного введения раствора. Защитный предохранитель иглы закроется только тогда, когда шприц полностью опустеет.
Не меняя давления на поршень, следует удалить иглу из кожной складки, после чего отпустить поршень и позволить защитному предохранителю целиком закрыть иглу.
В случае несрабатывания предохранителя возможно неполное введение дозы препарата, что потребует дополнительной консультации у врача.
При появлении крови в месте введения нужно аккуратно удалить ее ватной салфеткой. Не следует растирать кожу в районе инъекции. Место прокола можно заклеить пластырем.
Один шприц предназначен для проведения только одной инъекции. Оставшийся препарат повторно применять запрещено.
Использованный шприц закрывать колпачком не следует. Утилизировать все его части нужно в соответствии с рекомендуемыми врачом правилами.
Передозировка
В ходе проведенных клинических исследований введение ежемесячной дозы Пролиа 180 мг на протяжении полугода (в сумме 1080 мг за 6 месяцев) не выявило каких-либо негативных симптомов.
Взаимодействие
Направленных изысканий взаимодействия деносумаба с прочими ЛС не проводилось. Не стоит смешивать препарат с другими растворами.
Условия продажи
Купить Пролиа возможно только по рецепту.
Условия хранения
Длительная сохранность препарата требует температуры 2-8°С. Хранить шприцы следует в упаковке завода-производителя, в холодильнике, не замораживая. После изъятия Пролиа из холодильника срок его хранения при температуре до 25°С ограничен 30-ю сутками.
Срок годности
При условии соблюдения температуры 2-8°С препарат можно использовать на протяжении 3-х лет.
Особые указания
Пожилые пациенты и больные с патологиями почек не требуют корректировки дозировочного режима деносумаба.
Влияние патологий печени на безопасность и эффективность Пролиа не изучалось.
Во время терапии препаратом Пролиа рекомендуют параллельно принимать витамин D и препараты кальция, в особенности пациентам с патологиями почек.
Перед началом лечения корректировка наличествующей гипокальциемии может быть произведена приемом адекватных доз витамина D и препаратов кальция. У пациентов с повышенным риском формирования гипокальциемии следует следить за содержанием кальция.
В некоторых случаях применение Пролиа приводило к развитию кожных инфекций и ее придатков (как правило, наблюдаются воспалительные процессы в подкожной клетчатке), которые иногда могут потребовать госпитализации. В проведенных исследованиях возникновение таких реакций чаще наблюдалось в группе применения деносумаба (0,4%) в сравнении с группой введения «плацебо» (0,1%). В случае возникновения кожных инфекций пациенты должны незамедлительно сообщить об этом своему врачу.
У больных с распространенным раком, которые проходили лечение с ежемесячным введением 120 мг деносумаба, изредка наблюдали развитие остеонекроза челюсти. Также существуют отдельные сообщения о формировании данной патологии при применении схемы терапии деносумабом – 60 мг дважды в 12 месяцев.
При наличии у пациента аллергии на латекс следует избегать касаний к колпачку иглы.
Аналоги
Совпадения по коду АТХ 4-го уровня:
Аналоги Пролиа представлены препаратами: Бивалос, Остеохель С, Остеогенон, Стромос, Остеокеа, Остеолат.
Детям
Безопасность и эффективность Пролиа в педиатрии не изучались, в связи с чем его не назначают в детской возрастной группе.
При беременности и лактации
Каких-либо достоверных данных о применении Пролиа во время беременности не существует, из-за чего его назначение в этот период не рекомендуется.
Возможность проникновения деносумаба в молоко кормящей матери до конца не изучено, однако есть свидетельства его негативного влияния на грудных детей. По этой причине при кормлении грудью применять препарат Пролиа не рекомендуют.
Отзывы
Отзывы о Пролиа относительно эффективности укрепления и наращивания плотности костной ткани при остеопорозе немногочисленные и неоднозначные. Некоторые пациенты, все-таки решившиеся приобрести этот препарат и прошедшие всего одну инъекцию, уже через полгода на очередной денситометрии отмечали положительную динамику своего болезненного состояния, при этом все они строго придерживались предписаний врача на протяжении этого времени и дополнительно принимали витамин D и препараты кальция. Другие больные не ощутили у себя положительных изменений или остались недовольны их значимостью.
Сами врачи, ссылаясь на результаты исследований деносумаба, рекомендуют Пролиа к применению, но предупреждают, что абсолютной гарантии значимого положительного эффекта по отношению ко всем пациентам быть не может. Несмотря на это стоит заметить, что объективно отрицательных отзывов о препарате Пролиа у применявших его пациентов, кроме его стоимости, очень немного.
Цена, где купить
Цена на Пролиа 60 мг/1 мл №1 варьируется в районе 21000-23000 рублей.
- Интернет-аптеки РоссииРоссия
Аптека Диалог
-
Пролиа (р-р д/под/введ, 60 мг/мл,шприц с защ.устр.1 мл №1)Amgen Europe/Добролек
показать еще
Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора каппа В (RANKL) и тем самым препятствует активации единственного рецептора RANKL — активатора ядерного фактора кВ (RANK), расположенного на поверхности остеокластов и их предшественников. Таким образом, предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и продолжительность существования остеокластов. В результате деносумаб уменьшает костную резорбцию и увеличивает массу и прочность кортикального и трабекулярного слоев кости.
Фармакодинамические эффекты
Назначение деносумаба в дозе 60 мг приводило к быстрому уменьшению сывороточных концентраций маркера резорбции костной ткани — 1С-телопептида (СТХ) — приблизительно на 70% в течение 6 ч после п/к введения и приблизительно на 85% в течение последующих 3 дней. Уменьшение концентрации СТХ оставалось стабильным в 6-месячном интервале между дозированием. Скорость снижения концентрации СТХ в сыворотке крови частично уменьшалась при снижении концентрации деносумаба в сыворотке крови, что отражает обратимость влияния деносумаба на ремоделирование кости. Данные эффекты наблюдались на протяжении всего курса лечения. Соответственно физиологической взаимосвязи процессов образования и резорбции при ремоделировании костной ткани наблюдалось уменьшение содержания маркеров образования кости (например, костноспецифической щелочной фосфатазы и сывороточного N-концевого пропептида коллагена 1 типа) с первого месяца после введения первой дозы деносумаба. Маркеры ремоделирования кости (маркеры образования кости и резорбции кости), как правило, достигали концентраций периода до начала лечения не позднее, чем через 9 месяцев после приема последней дозы препарата. После возобновления лечения деносумабом степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Было показано, что перевод с лечения алендроновой кислотой (средняя продолжительность применения — 3 года) на деносумаб приводит к дополнительному снижению концентрации СТХ в сыворотке по сравнению с группой женщин в постменопаузе с низкой костной массой, продолжавших лечение алендроновой кислотой. В то же время изменения содержания кальция в сыворотке были одинаковыми в обеих группах.
В экспериментальных исследованиях ингибирование RANK/RANKL одновременно со связыванием остеопротегерина с Fc-фрагментом (OPG-Fc), приводило к замедлению роста кости и нарушению прорезывания зубов. Поэтому, лечение деносумабом может тормозить рост костей с открытыми зонами роста у детей и приводить к нарушениям прорезывания зубов.
Иммуногенность
Деносумаб — человеческое моноклональное антитело, поэтому, как и для других лекарственных средств белковой природы существует теоретический риск иммуногенности. Более чем 13 000 пациентов были обследованы на предмет образования, связывающих антител с использованием метода чувствительной электрохемилюминесценции в сочетании с иммунологическим анализом. Менее чем у 1% пациентов, принимавших деносумаб в течение 5 лет, определялись антитела (включая существовавшие ранее, транзиторные и растущие). Серопозитивные пациенты были далее обследованы на предмет образования нейтрализующих антител, используя хемилюминесцентный анализ в культуре клеток in vitro, нейтрализующих антител не обнаружено. Не было выявлено изменений фармакокинетического профиля, токсического профиля или клинического ответа, обусловленных образованием антител.
Клиническая эффективность
Лечение остеопороза в постменопаузе
У женщин с постменопаузным остеопорозом Пролиа увеличивает минеральную плотность кости (МПК), уменьшает частоту переломов шейки бедра, вертебральных и невертебральных переломов. Эффективность и безопасность деносумаба в лечении постменопаузного остеопороза была доказана в исследовании, длительностью 3 года. Результаты исследования показывают, что деносумаб существенно, в сравнении с плацебо снижает риск возникновения вертебральных и невертебральных переломов, переломов шейки бедра у женщин с остеопорозом в постменопаузе. В исследование было включено 7808 женщин, из которых у 23% отмечались часто встречающиеся переломы позвонков. Все три конечные точки эффективности в отношений переломов достигали статистически значимых значений, оцениваемых по предварительно заданной последовательной схеме тестирования.
Снижение риска возникновения новых вертебральных переломов при применении деносумаба в течение более чем 3 лет оставалось стабильным и значимым. Риск снижался независимо от 10-летней вероятности возникновения крупных остеопоротических переломов. На снижение риска также не влияли наличие часто встречающихся переломов позвонков в анамнезе, невертебральные переломы, возраст, пациентов, МПК, уровень ремоделирования кости и предшествующая терапия по поводу остеопороза.
У женщин старше 75 лет в постменопаузе деносумаб уменьшал частоту возникновения новых вертебральных переломов, и, по данным post hoc анализа, уменьшал частоту переломов шейки бедра.
Уменьшение частоты возникновения невертебральных переломов наблюдалось независимо от 10-летней вероятности возникновения крупных остеопоротических переломов.
Деносумаб существенно, по сравнению с плацебо, увеличивал МПК во всех анатомических областях. МПК определяли через 1 год, 2 и 3 года после начала терапии. Сходное влияние на МПК отмечено в поясничном отделе позвоночника независимо от возраста, расовой принадлежности, индекса массы тела (ИМТ), МПК и ремоделирования кости.
Гистологические исследования подтвердили нормальную архитектонику кости и, как и ожидалось, снижение костного ремоделирования по сравнению с плацебо. Не отмечено патологических изменений, включая фиброз, остеомаляцию и нарушение архитектоники костной ткани.
Клиническая эффективность при лечении потери костной массы, вызванной гормондепривационной терапией или терапией ингибиторами ароматазы
Лечение потери костной массы, вызванной депривацией андрогенов
Эффективность и безопасность деносумаба при лечении потери костной массы, ассоциированной со снижением концентрации андрогенов, были доказаны в 3-х летнем исследовании включавшем 1 468 пациентов с неметастатическим раком предстательной железы.
Существенное увеличение МПК определяли в поясничном отделе позвоночника, всей бедренной кости, шейке бедренной кости, вертеле бедренной кости спустя 1 месяц после приема первой дозы. Увеличение МПК в поясничном отделе позвоночника не зависело от возраста, расовой принадлежности, географического региона, ИМТ, начальных значений МПК, ремоделирования кости; продолжительности проведения гормондепривационной терапии и наличия вертебрального перелома в анамнезе.
Деносумаб значительно уменьшал риск возникновения новых вертебральных переломов на протяжении 3 лет применения. Уменьшение риска наблюдалось через 1 год и через 2 года после начала терапии. Деносумаб также снижал риск возникновения более чем одного остеопоротического перелома любой локализации.
Лечение потери костной массы, у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы
Эффективность и безопасность деносумаба в лечении потери костной массы, вызванной адъювантной терапией ингибитором ароматазы, оценивалась в 2-летнем исследовании, включавшем 252 пациентки с неметастатическим раком молочной железы. Деносумаб значительно увеличивал МПК во всех анатомических областях, по сравнению с плацебо, в течение 2 лет. Увеличение МПК наблюдалось в поясничном отделе позвоночника спустя месяц после приема первой дозы. Положительное влияние на МПК в люмбальном отделе позвоночника отмечали вне зависимости от возраста, продолжительности терапии ингибитором ароматазы, ИМТ, предшествующей химиотерапии, предшествующего использования селективного модулятора рецепторов эстрогена (СМРЭ) и времени, прошедшего от начала менопаузы.
Пролиа — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер: ЛП-000850
Международное непатентованное название: деносумаб
Лекарственная форма: раствор для подкожного введения.
Состав
Каждый предварительно заполненный шприц содержит:
Активное вещество: 60 мг деносумаба в 1 мл раствора (60 мг/мл).
Вспомогательные вещества: сорбитол (Е420) – 47 мг, уксусная кислота ледяная – 1 мг, полисорбат 20 – 0,1 мг, натрия гидроксид – до рН 5,0 – 5,5, вода для инъекций – до 1 мл.
Описание
Прозрачная жидкость, от бесцветного до светло-желтого цвета, практически свободная от видимых включений.
Фармакотерапевтическая группа
Препараты для лечения заболеваний костей – другие препараты, влияющие на структуру и минерализацию кости. Моноклональные антитела.
Код АТХ: M05BX04
Фармакологические свойства
Фармакодинамика
Механизм действия
Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора каппа B (RANKL) и тем самым препятствует активации единственного рецептора RANKL – активатора ядерного фактора κB (RANK), расположенного на поверхности остеокластов и их предшественников. Таким образом, предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и продолжительность существования остеокластов. В результате деносумаб уменьшает костную резорбцию и увеличивает массу и прочность кортикального и трабекулярного слоёв кости.
Фармакодинамические эффекты
Применение деносумаба в дозе 60 мг приводило к быстрому уменьшению сывороточных концентраций маркера резорбции костной ткани – 1С-телопептида (СТХ) – приблизительно на 70% в течение 6 часов после подкожного введения и приблизительно на 85% в течение последующих 3 дней. Уменьшение концентрации СТХ оставалось стабильным в 6-месячном интервале между введениями. Скорость снижения концентрации CTX в сыворотке крови частично уменьшалась при снижении концентрации деносумаба в сыворотке крови, что отражает обратимость влияния деносумаба на ремоделирование кости. Данные эффекты наблюдались на протяжении всего курса лечения. Соответственно физиологической взаимосвязи процессов образования и резорбции при ремоделировании костной ткани наблюдалось уменьшение содержания маркеров образования кости (например, костноспецифической щелочной фосфатазы и сывороточного N-концевого пропептида коллагена I типа) с первого месяца после введения первой дозы деносумаба.
Маркеры ремоделирования кости (маркеры образования кости и резорбции кости), как правило, достигали концентраций периода до начала лечения не позднее, чем через 9 месяцев после введения последней дозы препарата. После возобновления лечения деносумабом степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Было показано, что перевод с лечения алендроновой кислотой (средняя продолжительность применения – 3 года) на деносумаб приводит к дополнительному снижению концентрации СТХ в сыворотке по сравнению с группой женщин в постменопаузе с низкой костной массой, продолжавших лечение алендроновой кислотой. В то же время изменения содержания кальция в сыворотке были одинаковыми в обеих группах.
В экспериментальных исследованиях ингибирование RANK/RANKL одновременно со связыванием остеопротегерина с Fc-фрагментом (OPG-Fc), приводило к замедлению роста кости и нарушению прорезывания зубов. Поэтому, лечение деносумабом может тормозить рост костей с открытыми зонами роста у детей и приводить к нарушениям прорезывания зубов.
Иммуногенность
Деносумаб – человеческое моноклональное антитело, поэтому, как и для других лекарственных средств белковой природы существует теоретический риск иммуногенности.
Более чем 13000 пациентов были обследованы на предмет образования связывающих антител с использованием метода чувствительной электрохемилюминесценции в сочетании с иммунологическим анализом. Менее чем у 1% пациентов, принимавших деносумаб в течение 5 лет, определялись антитела (включая существовавшие ранее, транзиторные и растущие).
Серопозитивные пациенты были далее обследованы на предмет образования нейтрализующих антител, используя хемилюминисцентный анализ в культуре клеток in vitro, нейтрализующих антител не обнаружено. Не было выявлено изменений фармакокинетического профиля, токсического профиля или клинического ответа, обусловленных образованием антител.
Клиническая эффективность
Лечение остеопороза в постменопаузе
У женщин с постменопаузальным остеопорозом Пролиа® увеличивает минеральную плотность кости (МПК), уменьшает частоту переломов шейки бедра, вертебральных и невертебральных переломов. Эффективность и безопасность деносумаба в лечении постменопаузального остеопороза была доказана в исследовании, длительностью 3 года.
Результаты исследования показывают, что деносумаб существенно, в сравнении с плацебо, снижает риск возникновения вертебральных и невертебральных переломов, переломов шейки бедра у женщин с остеопорозом в постменопаузе. В исследование было включено 7808 женщин, из которых у 23,6% отмечались часто встречающиеся переломы позвонков. Все три конечные точки эффективности в отношении переломов достигали статистически значимых значений, оцениваемых по предварительно заданной последовательной схеме тестирования.
Снижение риска возникновения новых вертебральных переломов при применении деносумаба в течение более чем 3 лет оставалось стабильным и значимым. Риск снижался независимо от 10-летней вероятности возникновения крупных остеопоротических переломов.
На снижение риска также не влияли наличие часто встречающихся переломов позвонков в анамнезе, невертебральные переломы, возраст пациентов, МПК, уровень ремоделирования кости и предшествующая терапия по поводу остеопороза.
У женщин старше 75 лет в постменопаузе деносумаб уменьшал частоту возникновения новых вертебральных переломов, и, по данным post hoc анализа, уменьшал частоту переломов шейки бедра.
Уменьшение частоты возникновения невертебральных переломов наблюдалось независимо от 10-летней вероятности возникновения крупных остеопоротических переломов.
Деносумаб существенно, по сравнению с плацебо, увеличивал МПК во всех анатомических областях. МПК определяли через 1 год, 2 и 3 года после начала терапии. Сходное влияние на МПК отмечено в поясничном отделе позвоночника независимо от возраста, расовой принадлежности, индекса массы тела (ИМТ), МПК и ремоделирования кости.
Влияние лечения препаратом Пролиа® на случаи возникновения новых вертебральных и невертебральных переломов в течение года оценивались в рамках 5-ти летнего расширенного исследования общей продолжительностью 8 лет. При лечении препатом Пролиа® сохраняется низкий риск возникновения новых вертебральных и невертебральных переломов, а также продолжает увеличиваться МПК по сравнению с иходным уровнем в поясничном отделе позвоночника, всей бедренной кости, шейки бедра и вертеле бедренной кости на протяжении 5 лет.
Гистологические исследования лечения препаратом Пролиа® продолжительностью 5 лет, подтвердили нормальную архитектонику и, как и ожидалось, снижение костного ремоделирования по сравнению с плацебо. Не отмечено патологических изменений, включая фиброз, остеомаляцию и нарушение архитектоники костной ткани.
Клиническая эффективность при лечении потери костной массы, вызванной гормон-депривационной терапией или терапией ингибиторами ароматазы.
Лечение потери костной массы, вызванной депривацией андрогенов Эффективность и безопасность деносумаба при лечении потери костной массы, ассоциированной со снижением концентрации андрогенов, были доказаны в 3-х летнем исследовании, включавшем 1468 пациентов с неметастатическим раком предстательной железы.
Существенное увеличение МПК определяли в поясничном отделе позвоночника, всей бедренной кости, шейке бедренной кости, вертеле бедренной кости спустя 1 месяц после введения первой дозы. Увеличение МПК в поясничном отделе позвоночника не зависело от возраста, расовой принадлежности, географического региона, ИМТ, начальных значений МПК, ремоделирования кости; продолжительности проведения гормон-депривационной терапии и наличия вертебрального перелома в анамнезе.
Деносумаб значительно уменьшал риск возникновения новых вертебральных переломов на протяжении 3 лет применения. Уменьшение риска наблюдалось через 1 год и через 2 года после начала терапии. Деносумаб также снижал риск возникновения более чем одного остеопоротического перелома любой локализации.
Лечение потери костной массы, у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы
Эффективность и безопасность деносумаба в лечении потери костной массы, вызванной адъювантной терапией ингибитором ароматазы, оценивалась в 2-х летнем исследовании, включавшем 252 пациентки с неметастатическим раком молочной железы.
Деносумаб значительно увеличивал МПК во всех анатомических областях, по сравнению с плацебо, в течение 2 лет. Увеличение МПК наблюдалось в поясничном отделе позвоночника спустя месяц после введения первой дозы. Положительное влияние на МПК в люмбальном отделе позвоночника отмечали вне зависимости от возраста, продолжительности терапии ингибитором ароматазы, ИМТ, предшествующей химиотерапии, предшествующего использования селективного модулятора рецепторов эстрогена (СМРЭ) и времени, прошедшего от начала менопаузы.
Лечение остеопороза у мужчин
Эффективность и безопасность Пролиа® в лечении остеопороза у мужчин была продемонстрирована в исследовании, продолжительностью 12 месяцев, включавшем 242 пациента со сниженной костной массой, с базовым уровнем Т-показателя МПК между -2,0 и -3,5 в поясничном отделе позвоночника или шейки бедра. Также включались мужчины с Т-показателем МПК между -1,0 и -3,5 для поясничного отдела позвоночника или шейки бедра и переломами в анамнезе. Мужчины с другими заболеваниями (такими как ревматоидный артрит, остеогенез и болезнь Педжета) или лечением, которое может оказывать влияние на кость, были исключены из исследования.
Лечение препаратом Пролиа® в течение 1 года значительно увеличивало МПК по сравнению базовыми значениями в поясничном отделе позвоночника и всех отделах скелета (проксимальный отдел бедра, дистальный отдел лучевой кости). Пролиа® увеличивала МПК поясничного отдела позвоночника до 4,8%, МПК бедра до 2,0%, МПК вертела бедренной кости до 2,3%, МПК шейки бедренной кости до 2,2%, периферический 1/3 радиус МПК до 0,9%, в сравнении с плацебо.
Увеличение в МПК поясничного отдела позвоночника, бедра и вертела бедренной кости наблюдались через 6 месяцев.
Устойчивые эффекты на МПК поясничного отдела позвоночника наблюдались независимо от возраста, расы, массы тела/индекса массы тела (ИМТ), МПК и уровня резорбции кости.
Гистология кости и гистоморфометрия
Качественные гистологические оценки показывали нормальную архитектонику и качество кости, без каких-либо дефектов минерализации костной ткани или фиброза костного мозга у пациентов, получавших Пролиа®.
Фармакокинетика
При подкожном введении деносумаб характеризуется нелинейной фармакокинетикой, дозозависимой в широком диапазоне доз, и дозозависимым увеличением экспозиции для дозы в 60 мг (или 1 мг/кг) и выше.
Всасывание
После подкожного введения деносумаба в дозе 60 мг биодоступность составила 61 % и максимальная концентрация деносумаба (Cmax) – 6 мкг/мл (диапазон 1-17 мкг/мл), данные параметры наблюдались через 10 дней (диапазон 2-28 дней). После достижения Cmax содержание препарата в сыворотке крови снижалось с периодом полувыведения 26 дней (диапазон 6-52 дня) и далее в течение 3 месяцев (диапазон 1,5 -4,5 месяцев). У 53% пациентов деносумаб не обнаруживался в сыворотке крови после 6 месяцев от последнего введения препарата.
Распределение
Не наблюдалось изменений фармакокинетических параметров деносумаба, а также кумуляции за всё время введения многократных доз препарата по 60 мг каждые 6 месяцев.
Метаболизм
Деносумаб состоит из аминокислот и углеводов, как обычный иммуноглобулин. На основании данных доклинических исследований, ожидается, что метаболизм деносумаба будет происходить по пути клиренса иммуноглобулинов, результатом которого будет распад на небольшие пептидные цепи и отдельные аминокислоты.
В исследовании, 17 женщин с постменопаузальным остеопорозом получали мидазолам (2 мг внутрь) через две недели после однократной инъекции деносумаба (60 мг подкожно), что соответствует времени достижения максимальных фармакодинамических эффектов деносумаба. Деносумаб не влиял на фармакокинетику мидазолама, метаболизирующегося изоферментом CYP3A4 цитохрома P450. Следовательно, деносумаб не должен изменять фармакоконетику препаратов, метаболизирующихся изоферментом CYP3A4.
Выведение
На основании доклинических данных, выведение деносумаба будет происходить по пути выведения всех иммуноглобулинов, результатом которого будет распад на небольшие пептидные цепи и отдельные аминокислоты.
Отдельные группы пациентов
Пациенты пожилого возраста (возраст 65 лет или старше)
Возраст не оказывает значимого влияния на фармакокинетику деносумаба по данным фармакокинетического анализа в популяции пациентов от 28 лет до 87 лет.
Дети и подростки (до 18 лет)
Фармакокинетика у детей не изучалась.
Расовая принадлежность
Фармакокинетика деносумаба не зависит от расовой принадлежности.
Пациенты с почечной недостаточностью
В исследовании на 55 пациентах с различной степенью почечной недостаточности, включая пациентов, находящихся на диализе, степень почечной недостаточности не оказывала влияния на фармакокинетику и фармакодинамику деносумаба; поэтому не требуется коррекции режима дозирования деносумаба при хронической почечной недостаточности.
Хроническая печеночная недостаточность
Исследований влияния недостаточности функции печени на фармакокинетику деносумаба не проводилось.
Показания для применения
- Лечение постменопаузального остеопороза.
- Лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы и у мужчин, с раком предстательной железы, получающим гормон-депривационную терапию.
- Лечение сенильного остеопороза у мужчин.
Противопоказания
Повышенная чувствительность к любому из компонентов препарата.
Гипокальциемия.
Применение в период беременности и грудного вскармливания
Беременность
Нет каких-либо данных по применению препарата во время беременности. Пролиа® не рекомендуется для применения у беременных женщин.
Деносумаб не вызывал снижения фертильности у яванских макак при экспозиции к препарату в 100 раз выше экспозиции у человека (60 мг раз в 6 месяцев).
В исследовании на яванских макаках не отмечено негативного воздействия на организм матери или плод в течение периода, эквивалентного первому триместру экспозиции к деносумабу на дозах, в 99 раз превышающих дозу у человека (60 мг раз в 6 месяцев). В этом исследовании не оценивалось формирование лимфатических узлов плода.
В другом исследовании на яванских макаках, получавших деносумаб в течение беременности, при экспозиции, в 119 раз превышающей таковую у человека (60 мг раз в 6 месяцев), наблюдалось увеличение частоты рождения мертвого плода и постнатальной смертности; аномальный рост костей при сниженной прочности кости, сниженный гемопоэз и нарушение формирования зубов; отсутствие периферических лимфатических узлов; и снижение роста новорожденного. Не отмечено негативного воздействия на организм матери до родов; редко у матери наблюдались нежелательные реакции во время родов. Развитие молочной железы матери было нормальным.
Эксперименты на мышах с выключенным геном показали, что отсутствие RANKL может влиять на созревание молочной железы, что может приводить к ослаблению лактации.
Грудное вскармливание
Неизвестно, выводится ли деносумаб в грудное молоко. Поскольку известно, что потенциально деносумаб может вызывать нежелательные реакции у детей грудного возраста, необходимо или прекратить грудное вскармливание, или отменить препарат.
Способ применения и дозы
Введение
Проведение инъекции препарата требует предварительного обучения – см. рекомендации по введению препарата, приведенные в конце настоящей инструкции.
Доза
Рекомендуемая доза препарата Пролиа® – одна подкожная инъекция 60 мг каждые 6 месяцев.
В течение курса лечения рекомендуется дополнительно принимать препараты кальция и витамин D.
Применение у отдельных групп пациентов
Дети
Препарат Пролиа® не рекомендован к применению в педиатрии, так как эффективность и безопасность данного препарата не изучались в этой возрастной группе.
Пациенты пожилого возраста
Основываясь на имеющихся данных об эффективности и безопасности препарата в данной возрастной группе, не требуется коррекции режима дозирования препарата (см. раздел «Фармакокинетика», подраздел «Отдельные группы пациентов»).
Почечная недостаточность
Основываясь на имеющихся данных об эффективности и безопасности препарата в данной группе пациентов, не требуется коррекции режима дозирования препарата (см. раздел «Фармакокинетика», подраздел «Отдельные группы пациентов»).
У пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин) или находящихся на диализе существует большой риск развития гипокальциемии. Таким пациентам необходимо дополнительно принимать препараты кальция и витамин D.
Печеночная недостаточность
Эффективность и безопасность не изучались.
Инструкция по использованию
Следует оценить раствор перед введением на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении или изменении цвета.
Не встряхивать.
Чтобы избежать дискомфорта в месте введения, следует согреть раствор до комнатной температуры (до 25°C) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца. Шприц с остатками препарата выбросить.
Подробные рекомендации по самостоятельному подкожному введению препарата включены в данную инструкцию по медицинскому применению.
Любые количества неиспользованного препарата или неиспользованные материалы должны быть уничтожены в соответствии с местными требованиями.
Побочное действие
Заключение по профилю безопасности препарата
По результатам четырех плацебо-контролируемых исследований третьей фазы профиль безопасности препарата Пролиа® сходен при применении у женщин в постменопаузальном периоде и у пациентов со злокачественными новообразованиями молочных желез или предстательной железы, получавших гормон-депривационную терапию.
При применении препарата Пролиа® нечасто сообщалось о развитии целлюлита, редких случаях гипокальциемии, гиперчувствительности и остеонекроза челюсти, и редких случаях развития атипичных переломов бедренной кости (см. раздел «Особые указания» и описание отдельных нежелательных реакций данного раздела).
Нежелательные реакции, зарегистрированные в исследованиях фаз 2 и 3, включавших пациенток в постменопаузе и получавших гормон-депривационную терапию, а также спонтанные сообщения, полученные в пострегистрационный период, приведены в таблице ниже.
Частота возникновения определена следующим образом: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000), на основании общего коэффициента встречаемости. В каждой группе систем органов и частоты сообщений, нежелательные реакции приводятся по убыванию степени серьезности.
| Класс системы органов | Частота | Нежелательная реакция |
| Инфекции и инвазии | Часто | Инфекции мочевыводящих путей |
| Часто | Респираторные инфекции | |
| Нечасто | Дивертикулит1 | |
| Нечасто | Воспаление подкожной клетчатки1 | |
| Нечасто | Инфекции уха | |
| Со стороны иммунной системы | Редко | Реакции гиперчувствительности1 |
| Со стороны метаболизма и электролитного обмена | Редко | Гипокальциемия1 |
| Со стороны нервной системы | Часто | Ишиалгия |
| Со стороны органа зрения | Часто | Катаракта1 |
| Со стороны системы пищеварения | Часто | Запор |
| Со стороны кожи и подкожно-жировой клетчатки | Часто | Сыпь |
| Часто | Экзема | |
| Со стороны костно-мышечной системы и соединительной ткани | Очень часто | Боль в конечностях |
| Редко | Остеонекроз челюсти1 | |
| Редко | Атипичный перелом бедренной кости1 |
1 см. описание отдельных нежелательных реакций.
В обобщенном анализе данных, из всех плацебо-контролируемых исследований II и III фазы, о развитии гриппоподобного синдрома сообщалось с общим коэффициентом встречаемости 1,2% для деносумаба и 0,7% для плацебо. Этот дисбаланс был установлен в обобщенном анализе данных и не обнаружен при стратифицированном анализе.
Описание отдельных нежелательных реакций
Гипокальциемия
В двух плацебо-контролируемых исследованиях третьей фазы, включавших женщин в постменопаузальном периоде, у приблизительно 0,05% пациентов (2 из 4050) уменьшались концентрации кальции в сыворотке крови (менее 1,88 ммоль/л) после введения препарата. Не сообщалось о снижении концентраций кальция в сыворотке крови (ниже 1,88 ммоль/л) в двух плацебо-контролируемых исследованиях, включавших пациентов, получавших гормон-депривационную терапию.
При применении в рутинной клинической практике сообщалось о редких случаях тяжелой симптоматической гипокальциемии у пациентов с повышенным риском гипокальциемии, получающих препарат Пролиа®.
Инфекции кожи
Частота сообщений о развитии инфекций кожи была сравнима для групп препарата Пролиа® (1,5%, 59 из 4050]) и плацебо [1,2%, 50 из 4041] в контролируемых исследованиях третьей фазы у женщин с постменопаузальным остеопорозом и у пациентов, получающих гормон-депривационную терапию по поводу рака молочной железы или предстательной железы (плацебо [1,7%, 14 из 845] в сравнении с группой препарата Пролиа® [1,4%, 12 из 860]).
Кожные инфекции, потребовавшие госпитализации развивались у 0,1% (3 из 4041) пациенток с постменопаузальным остеопорозом в группе плацебо и у 0,4% (16 из 4050) пациенток группы препарата Пролиа®. Это преимущественно были случаи целлюлита. О серьезных случаях инфекций кожи сообщалось со сходной частотой в группах плацебо (0,6%, 5 из 845) и препарата Пролиа® (0,6%, 5 из 860) в исследованиях с гормон-депривационной терапией.
Остеонекроз челюсти
В клинических исследованиях остеопороза (пролечено 9768 пациентов более одного года), зарегистрированы редкие сообщения о развитии остеонекроза челюсти в группе препарата Пролиа® (см. раздел «Особые указания»).
Атипичные переломы бедренной кости
В клинических исследованиях остеопороза зарегистрированы редкие случаи атипичных переломов бедренной кости у пациентов в группе, получавшей препарат Пролиа® (см. раздел «Особые указания»).
Катаракта
В одном из плацебо-контролируемых исследований III фазы у пациентов с раком предстательной железы, получавших гормон-депривационную терапию, отмечен дисбаланс сообщений о развитии катаракты (4,7% в группе деносумаба, 1,2% в группе плацебо).
Подобного дисбаланса не зарегистрировано в исследованиях, включавших женщин в постменопаузе или у женщин, получавших терапию ингибиторами ароматазы по поводу рака молочной железы.
Дивертикулит
В одном из плацебо-контролируемых исследований III фазы у пациентов с раком предстательной железы, получавших гормон-депривационную терапию, отмечен дисбаланс сообщений о развитии дивертикулита (1,2% в группе деносумаба, 0% в группе плацебо).
Частота развития дивертикулита была сравнимой в группах исследований, включавших женщин в постменопаузе или у женщин, получавших терапию ингибиторами ароматазы по поводу рака молочной железы.
Реакции гиперчувствительности
У пациентов, получающих препарат Пролиа® в пострегистрационном периоде, редко сообщалось о реакциях гиперчувствительности, связанных с вводимым препаратом, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Костно-мышечная боль
У пациентов, получающих препарат Пролиа®, сообщалось о костно-мышечной боли, включая тяжелой степени.
Другие отдельные группы пациентов
В клинических исследованиях, включавших пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мл) или диализных пациентов, отмечался более высокий риск развития гипокальциемии при отсутствии добавок кальция.
Пациентам этой группы важно принимать препараты кальция и витамина D (см. раздел «Особые указания»).
Передозировка
В клинических исследованиях не отмечено случаев передозировки препарата.
В клинических исследованиях вводили дозы деносумаба до 180 мг каждые 4 недели (кумулятивная доза до 1080 мг в 6 месяцев).
Взаимодействие с другими лекарственными препаратами
Пролиа® (60 мг подкожно) не влияет на фармакокинетику мидазолама, метаболизирующегося изоферментом CYP3A4 цитохрома P450, что показывает отсутствие влияния на фармакокинетику препаратов, метаболизирующихся по этому пути (см. раздел «Фармакокинетика»).
Фармацевтическая несовместимость
Препарат не следует смешивать с другими лекарственными средствами.
Особые указания и меры предосторожности при применении
Рекомендуется прием препаратов кальция и витамина D во время применения препарата Пролиа®.
Гипокальциемия может быть скорректирована приемом препаратов кальция и витамина D в адекватных дозах перед началом терапии деносумабом. Рекомендуется мониторинг концентрации кальция во время терапии у пациентов, предрасположенных к гипокальциемии, особенно в первые недели после начала терапии (см. раздел «Побочное действие»).
У пациентов, получающих препарат Пролиа®, могут развиться инфекции кожи и ее придатков (преимущественно воспаление подкожной клетчатки), в отдельных случаях требующие госпитализации. О таких реакциях чаще сообщалось для группы деносумаба (0.4%) чем группы плацебо (0.1%) (см. раздел «Побочное действие»). При этом общая частота возникновения кожных инфекций сравнима в группах деносумаба и плацебо.
Пациентов следует проинструктировать незамедлительно обратиться за врачебной помощью в случае развития симптомов и признаков воспаления подкожной клетчатки.
У пациентов с распространенным раком, получавших 120 мг деносумаба каждые 4 недели сообщалось о развитии случаев остеонекроза челюсти. Имеются отдельные сообщения о развитии остеонекроза челюсти на дозе 60 мг каждые 6 месяцев (см. раздел «Побочное действие»).
Недостаточная гигиена полости рта и инвазивные стоматологические процедуры (например, удаление зубов), являлись факторами риска развития ОНЧ у пациентов, получающих препарат Пролиа® в клинических исследованиях.
Перед началом терапии важно оценить пациентов в отношении факторов риска развития ОНЧ. При выявлении факторов риска, перед терапией препаратом Пролиа® рекомендуется провести обследование полости рта и зубов с проведением соответствующих профилактических стоматологических мероприятий. Во время лечения препаратом Пролиа® следует поддерживать адекватную гигиену полости рота.
Во время лечения препаратом Пролиа® следует избегать инвазивных стоматологических процедур. При необходимости таких процедур, решение по плану лечения каждого пациента должно приниматься совместно с лечащим врачом на основании индивидуальной оценки соотношения польза/риск.
Пациенты с подозрением на развитие ОНЧ, или у которых ОНЧ развился во время лечения препаратом Пролиа®, должны находиться под наблюдением стоматолога или челюстно-лицевого хирурга. У пациентов с ОНЧ, развившимся во время применения препарата Пролиа®, может быть принято решение о временном прекращении лечения до разрешения состояния, на основании индивидуальной оценки соотношения риск/польза.
Атипичные переломы бедренной кости отмечались у пациенток в группе препарата Пролиа®.
Атипичные переломы бедренной кости – подвертельные или диафизарные переломы проксимальной части бедренной кости – могут появляться при минимальной травме или без травмы и могут быть билатеральными. На снимках эти переломы обычно имеют характерный внешний вид. Об атипичных переломах бедренной кости также сообщалось у пациентов с сопутствующими заболеваниями и состояниями (например, недостаток витаминов, ревматоидный артрит, гипофосфатазия), и у пациентов, получающих некоторые виды терапии (например, бисфосфонаты, глюкокортикостероиды, ингибиторы протонного насоса).
Эти случаи также наблюдались и в отсутствии антирезорбтивной терапии. Следует проинструктировать пациентов, получающих препарат Пролиа®, о необходимости сообщать о возникновении новой или необычной боли в бедре, тазобедренном суставе или паху.
Пациенты, у которых возникают такие симптомы, должны быть обследованы на наличие трещины бедренной кости и также должно быть исследовано контралатеральное бедро.
Лица с аллергией на латекс не должны касаться резинового колпачка иглы (производное латекса).
Пролиа® содержит такое же активное вещество (деносумаб), как и Эксджива™. Пациенты, получающие Пролиа®, не должны принимать препарат Эксджива™.
Влияние на способность к вождению автотранспорта и к обращению с техникой
Исследований влияния на способность к вождению автотранспортных средств и управлению механизмами не проводилось.
Форма выпуска
Раствор для подкожного введения 60 мг/мл в одноразовом предварительно заполненном шприце (ПЗШ) 1 мл из стекла I гидролитического класса c иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него). Маркированный шприц помещают в пачку картонную, вместе с инструкцией по применению.
ПЗШ может быть дополнительно помещен в контурную ячейковую упаковку с термоэтикеткой.
Каждую контурную ячейковую упаковку помещают в пачку картонную вместе с инструкцией по применению и карточкой для пациента с описанием техники инъекции (для ПЗШ с защитным устройством для иглы).
Пачка картонная снабжена отрывной карточкой-напоминанием с двумя напоминающими наклейками.
На каждую пачку наклеивают прозрачные защитные этикетки – контроль первого вскрытия, имеющие продольную цветную полосу.
Пролиа® представляет собой стерильный продукт и не содержит консервантов.
Условия хранения
Хранить при температуре 2-8°C. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Не встряхивать.
Хранить в недоступном для детей месте!
После изъятия из холодильника Пролиа® может храниться при комнатной температуре не выше 25°C в оригинальной упаковке не более 30 дней.
Срок годности
3 года. Не использовать по окончании срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту.
Производитель
Амджен Европа Б.В.
Минервум 7061
NL-4817 ZK Бреда
Нидерланды
В случае упаковки на Российской производственной площадке
Производитель
Амджен Европа Б.В.
Минервум 7061
NL-4817 ZK Бреда
Нидерланды
Упаковано: ООО «Добролек»,115446, Москва, Коломенский проезд, 13А.
Представитель в России
ООО «Амджен»
123317, Москва, Пресненская набережная, д.8, строение 1, 7ой этаж
Инструкции по введению препарата Пролиа® в предварительно заполненном шприце с защитным устройством для иглы
Купить Пролиа в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Инструкция по применению
Фармакологические свойства
Пролиа – медикаментозное средство на основе деносумаба, которое является полным аналогом человеческих антител, вырабатываемых иммунными клетками. Медикамент используется для лечения хронически прогрессирующего системного, обменного заболевания скелета, характеризующегося повышенной ломкостью костей, убыли костной ткани, связанной с приемом медикаментов, риска распространения опухолевых клеток из места возникновения в кости и остеобластокластомы.
Препарат эффективно используется для терапии женщин в период климакса, которые страдают от хрупкости и ослабленности костной ткани, защищая их от переломов и травм костей.
Эффективность и полезные действия препарата доказаны многочисленными исследованиями, а также отзывами пациентов, которые начали использование медикамента и продолжали курс терапии продолжительное время.
Состав и форма выпуска
Медикаментозное средство продается в виде раствора, который используется для инъекций. Раствор практически не обладает цветом, может иметь небольшой светло-желтый оттенок. Раствор не должен иметь никаких примесей и осадков. Средство упаковано в шприц-тюбик, что способствует более удобному использованию.
В состав препарата входят следующие компоненты:
• деносумаб;
• глюцит;
• твин 20;
• безводная этановая кислота;
• каустическая сода;
Показания к применению
Медикаментозное средство необходимо начать принимать при возникновении следующих проблем со здоровьем:
• терапия хронически прогрессирующего системного, обменного заболевания скелета, характеризующегося повышенной ломкостью костей, у женщин в период климакса;
• терапия убыли костной ткани у женщин, которые начали лечение злокачественной опухоли железистой ткани молочной железы с использованием блокаторов ароматазы;
• терапия убыли костной ткани у мужчин, которые проходят лечение рака простаты с использованием андрогенных депривационных препаратов;
Международная классификация болезней (МКБ-10)
М.81.0. Постменопаузный остеопороз;
М.81.4. Лекарственный остеопороз.
Побочные эффекты
Применение медикаментозного средства может стать причиной проявления побочных эффектов, таких как:
• понижение содержания кальция в плазме крови;
• «синдром мертвой челюсти»;
• нарушение зрения;
• помутнение хрусталика глаза у мужчин;
• изменения гиподермы и дермы;
• кожная болезнь, сопровождающаяся зудом и появлением пузырьков, гнойничков, чешуек;
• воспалительное поражение кожи;
• боли в конечностях;
• аллергия.
При проявлении побочных признаков пациенту необходимо сообщить об этом лечащему врачу, который примет решение об отмене или корректировке дозировки препарата и окажет соответствующую терапевтическую помощь.
Противопоказания
Медикаментозное средство запрещено принимать при:
• патологическом состоянии, при котором содержание общего кальция в плазме крови ниже нормы;
• повышенной восприимчивости к компонентам препарата.
Применение при беременности
Нет данных и показаний об использовании медикамента Пролиа женщинами, вынашивающими ребенка, а значит, нет научного подтверждения о безопасности средства для развивающегося в утробе женщины плода. Для безопасности мамы и ребенка принимать медикамент беременным женщинам запрещено.
Нет сведений о проникновении компонентов препарата в организм младенца с молоком матери, поэтому рекомендуется прекратить грудное вскармливание в период использования медикамента.
Способ и особенности применения
Медикаментозное средство используется в виде раствора для инъекций под кожу. Рекомендуемая дозировка медикамента составляет 60 мг раз в полгода. Одновременно с использованием препарата Пролиа необходимо употреблять медикаменты, содержащие кальций и кальциферолы.
Курс и дозировка определяются индивидуально лечащим врачом после проведения обследования пациента, сбора анализов и определения точной клинической картины заболевания.
Перед использованием медикаментозного средства необходимо проверить упаковку с раствором на целостность, отсутствие примесей и осадка, наличие помутнений и изменения цвета. При каких-либо нарушениях медикамент становится непригодным для использования, и его необходимо утилизировать в соответствии с санитарными нормами. Нельзя взбалтывать или трясти флакон перед инъекцией.
Медикамент должен быть комнатной температуры, нельзя замораживать раствор. Используется каждый шприц-ампула единоразово, остатки средства в шприце выбрасываются.
В период использования препарата пациентам рекомендуется принимать медикаменты, содержащие кальций и кальциферолы, а также обогащенную минералом пищу. Во время использования медикамента необходимо следить за содержанием кальция в крови пациента, во избежание проявления признаков гипокальциемии.
У ряда пациентов могут наблюдаться дерматологические реакции в виде покраснения кожи, зуда, высыпаний, экземы и других воспалительных проявлений. В случае возникновения подобных проблем, пациенту следует сообщить об этом квалифицированному медицинскому персоналу, который примет нужное решение и назначит симптоматическое лечение.
При продолжительной терапии медикаментом при заболевании раком молочной железы или простаты, ряд пациентов может столкнуться с аваскулярным некрозом, характеризующимся угасанием жизни костной ткани в результате плохого притока крови.
Нет сведений и клинических показаний о действии компонентов препарата на возможность управлять транспортными средствами, а также на проявление признаков снижения скорости реакции, поэтому рекомендуется с осторожностью садиться за руль или выполнять работу, требующую повышенной концентрации внимания или быстроты операций во избежание травмоопасных и угрожающих жизни последствий.
Подробная информация о рекомендуемых дозировках, сроках использования и индивидуальных рекомендациях содержится в инструкции.
Терапия детей, не достигших 18-летнего возраста
Медикаментозное средство не рекомендуется применять на детях, так как действие компонентов препарата на растущий и развивающийся организм не выявлено.
Терапия пожилых пациентов, возраст которых превышает 65-летний рубеж
При назначении медикаментозного средства Пролиа пожилым пациентам, лечащему врачу не нужно корректировать дозировку в большую или меньшую сторону.
Терапия пациентов, страдающих заболеваниями почек
Пациентам с заболеваниями почек не требуется дополнительная корректировка дозировки или продолжительности терапии. При нарушениях работы почек в тяжелой форме, есть риск понижения содержания кальция в плазме крови пациента.
При почечных заболеваниях необходимо принимать параллельно препараты, содержащие кальций и витамин D.
Терапия пациентов, страдающих заболеваниями печени
Нет данных и сведений о функционировании медикамента Пролиа и его компонентов на организм пациентов с заболеваниями печени, поэтому назначать препарат следует с особой осторожностью и только под контролем лечащего врача.
Взаимодействие с другими лекарствами
Нет проведенных исследований о взаимодействии препарата Пролиа с другими лекарственными средствами. Не рекомендуется принимать медикамент в сочетании с другими препаратами.
Решение о совмещенной терапии может принимать только лечащий врач, учитывая все риски и последствия.
Передозировка
Нет данных и сведений о передозировке препаратом Пролиа. При проявлении побочных эффектов, а также любых других неприятных симптомов, пациенту необходимо незамедлительно обратиться к лечащему врачу для получения своевременной терапевтической помощи и принятия решения о коррекции дозировки или отмене терапии препаратом.
Аналоги
Аналогичными по составу и фармакологическому воздействию препарату Пролиа, являются лекарства Denosumab и Xgeva. Действия и эффекты этих средств полностью соответствуют медикаменту Пролиа. Решение о замене препарата на аналог принимает исключительно лечащий врач.
Условия продажи
Медикаментозное средство Пролиа продается в аптечных пунктах только по назначению лечащего врача и при наличии рецептурного листа из медицинского учреждения.
Условия хранения
Медикаментозное средство Пролиа необходимо хранить в недосягаемом детьми и защищенном от проникновения любых источников света месте при температуре от 2 до 8 °С. Нельзя замораживать препарат во избежание риска потери фармакологических свойств и появления осадка. Нельзя встряхивать и взбалтывать флакон с препаратом. Подробную информацию о сроках и нормах хранения, а также данные о сроке годности медикамента в открытом и запечатанном виде, содержит инструкция по применению.
Цены на Пролиа в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Выгодные цены