Домашняя реабилитация при спастическом парезе по программе iGSC «I-CAN»
Автор статьи: к.м.н. Мокиенко О.А., Мендалиева А.С.
Основной проблемой амбулаторного этапа двигательной реабилитации является сложность обеспечения пациентов непрерывной, комплексной и интенсивной программой восстановительного лечения. Необходимость инвалидизированному пациенту преодолевать расстояние до медицинского учреждения и отсутствие постоянного контроля со стороны медперсонала снижают его мотивацию либо увеличивают риск самостоятельного подбора неэффективных или даже опасных упражнений и техник массажа. Также следует выделить проблему обеспечения пациента адекватной двигательной реабилитацией после инъекции ботулинического токсина, то есть проблему недостаточного использования «терапевтического окна», предоставляемого ботулинотерапией в течение 3-4 месяцев.
Применение французской программы домашней реабилитации iGSC «I-CAN» («Я МОГУ») решает многие проблемы внестационарного этапа реабилитации, способствует увеличению мотивации и вовлечённости пациента в интенсивный восстановительный процесс и, тем самым, повышает эффективность его реабилитации.
Программа разработана французским профессором Жаном Мишелем Грасье при поддержке компании Ипсен, производителя ботулинического токсина Диспорт.
Суть домашней реабилитации по программе «iGSC I-CAN»
Программа создана для двигательной реабилитации после инсульта, травмы головного мозга (черепномозговой травмы), после операции на головном мозге, при рассеянном склерозе: при наличии в клинической картине спастического пареза одной или нескольких конечностей.
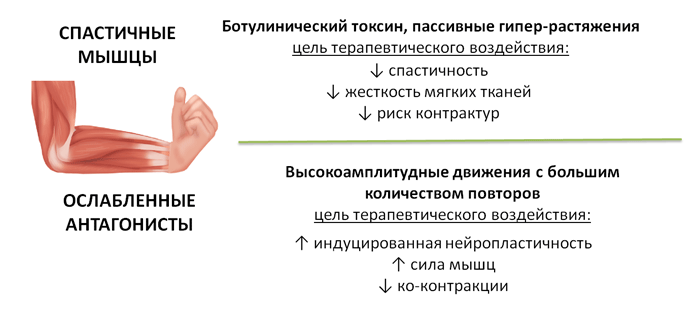
У программы две точки приложения: на мышцы со спастикой и на их ослабленные антагонисты (мышцы с парезом). Гиперактивность спастических мышц снижается или блокируется на фоне упражнений на пассивное гипер-растяжение и/или за счёт эффекта ботулинического токсина, что делает возможным включать в программу интенсивный тренинг с высокоамплитудными движениями для ослабленных паретичных мышц (Рис. 1).
Рис. 1. Две точки приложения программы iGSC «I-CAN»
Условиями программы являются ежедневное выполнение упражнений, выбранных специалистом по двигательной реабилитации, и ведение дневника по данной программе.
- Всего программа включает:
- 24 вида упражнений на пассивное растяжение различных групп мышц (со спастичностью) верхней и нижней конечности;
- 23 вида активных упражнений для различных групп мышц верхней и нижней конечности;
- 3 вида функциональных упражнений для нижних конечностей.
Специалист по двигательной реабилитации подбирает наиболее подходящие для конкретного пациента упражнения и их интенсивность. Изначально пациент выполняет упражнения под контролем специалиста, а затем самостоятельно с возможным дистанционным контролем. В помощь пациенту: видеоинструкции, электронный или бумажный дневник, печатный иллюстрированный материал.
Данные по эффективности программы домашней реабилитации iGSC «I-CAN»
Результаты двух проспективных кинических исследований программы свидетельствуют о её эффективности даже в резидуальном восстановительном периоде (то есть, когда с момента инсульта прошло более года).
В исследовании с участием 14 пациентов с хроническим гемипарезом (в среднем 52 мес после инсульта) после 9 месяцев ежедневных тренировок в рамках программы наблюдалось увеличение комфортной скорости ходьбы на 49% и максимальной скорости ходьбы на 65% [1].
В другом исследовании было показано, что у пациентов с хроническим гемипарезом (n=16, более 1 года после инсульта) через 1, 2 и 3 года тренировок в рамках программы наблюдалось значительное увеличение угла разгибания в суставах (р < 0,05) и снижение спастичности [2].
Ниже на видео представлены результаты работы по программе направленной самореабилитации пациента клиники Ренейро. Благодаря его высокой мотивации, правильно подобранному комплексу упражнений и ежедневной работе по программе iGSC I-CAN он смог увеличить не только длину шага, улучшить баланс своего тела, но и увеличить скорость ходьбы.
Видео 1. Восстановление ходьбы после инсульта с помощью программы I-CAN у пациента клиники Ренейро (врач — Мендалиева А.С.). 3 видео в динамике
Пояснения к видео. На первой консультации мы столкнулись со следующими проблемами: укорочение длины шага, ходьба осуществлялась приставными шагами, нарушение баланса (вес всего тела он переносил на здоровую сторону). В результате этих нарушений скорость ходьбы была достаточно ниже нормы. Через месяц после занятий по программе I-CAN, подобранных врачом ЛФК клиники Ренейро, мы отметили у него увеличение длины шага, а также улучшение баланса тела. Скорость ходьбы незначительно, но увеличилась. Через 6 месяцев занятий пациент продемонстрировал значительное увеличение длины шага и скорости ходьбы, улучшение баланса тела. Это позволило ему стать более свободным от помощи окружающих, самостоятельным в ежедневных делах и активным в его социальной жизни.
Организация реабилитации по программе
Врач индивидуально подбирает упражнения и устанавливает их интенсивность (количество повторов, длительность в день), а также обучает пациента правильной технике их выполнения. На это, по опыту клиники Ренейро, требуется всего 2-4 занятия. Затем пациент выполняет упражнения самостоятельно в домашних условиях. Поэтому программа также имеет название «Программа направленной самореабилитации». Немаловажно, что подобная организация процесса реабилитации значительно снижает её стоимость.
В руководстве к программе подробно описана методика упражнений для каждой мышцы/группы мышц и их обоснование. Выбор упражнений может меняться со временем. Авторы программы разъясняют для пациента: «Каждое упражнение должно быть сложным. Если упражнение со временем становится лёгким – это, с одной стороны, означает, что заметен прогресс в тренировках, с другой – что данное упражнение стало малоэффективным для тренировки мозга. Лечащему врачу в таком случае следует увеличить уровень сложности, подобрав другие упражнения».
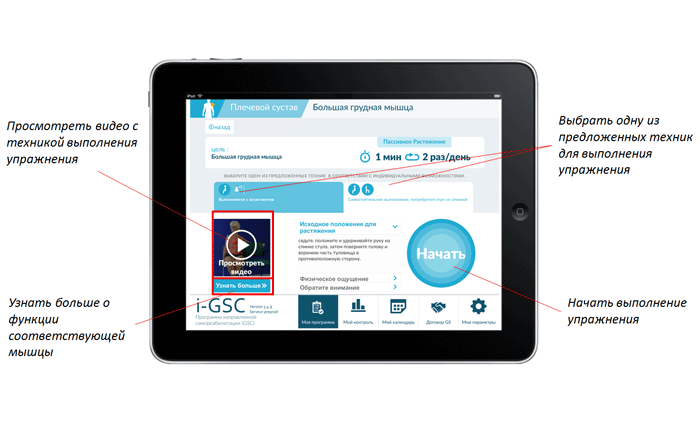
Для удобства разработаны специальное мобильное приложение (Рис. 2) и печатное изданиес описанием концепции программы и упражнений на простом, понятном для пациентов языке. В материалах описан смысл каждого упражнения, то есть, когда в повседневной жизни необходимо каждое тренируемое в рамках программы движение.
Пациент может вести дневник реабилитации с помощью приложения или используя шаблон дневника в печатном издании.
Рис. 2. Мобильное приложение для пациента.
Специалисты по двигательной реабилитации клиники Ренейро придерживаются следующих общих принципов работы с программой iGSC «I-CAN»:
- первые занятия должны проходить под контролем специалиста, контрольные встречи необходимо проводить через 1-2 недели;
- для поддержания мотивации и вовлеченности пациента необходимо подбирать те упражнения, от проведения которых можно в первую очередь ожидать результат;
- необходимо соблюдение цикла «пассивное растяжение – активное движение – пассивное растяжение»;
- необходимо постепенное увеличение продолжительности занятий;
- обязательно ведение дневника занятий;
- направление пациента к специалисту по ботулинотерапии при наличии показаний.
Показаниями к применению ботулинического токсина (БТА) в двигательной реабилитации являются: спастичность от 2 баллов по модифицированной шкале Эшворта, ограничивающая функционирование, уход и самообслуживание; вызванный спастичностью болевой синдром.
Безусловно, при спастическом парезе программа будет более эффективна, если применяется в комплексе с ботулинотерапией. Но так как, по тем или иным причинам, не всегда ботулинотерапия проводится своевременно, мы рекомендуем начинать применение программы I-CAN уже до инъекции: необходимо с первых дней приучить пациента к ежедневным занятиям, ведению дневника, все это повышает его дисциплину и мотивацию.
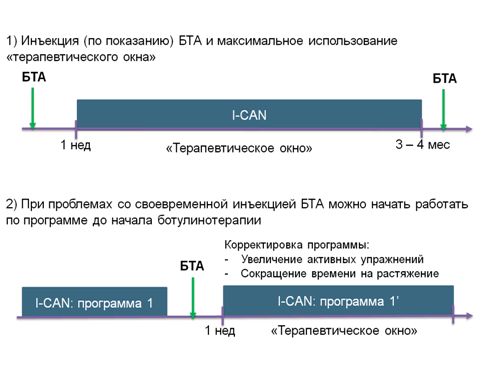
С течением времени программа может претерпевать ряд изменений, в зависимости от прогресса в занятиях. И если пациент получает инъекцию ботулинического токсина, программа также изменяется (Рис.3): сокращается время, затрачиваемое на растяжения спазмированных мышц, увеличивается время для активных упражнений, и в целом само время общей нагрузки.
Рис. 3. Два варианта выстраивания программы I-CAN, в зависимости от своевременности начала ботулинотерапии.
Ошибки при работе с программой I-CAN
Хотя программа разработана для самостоятельного выполнения, несколько занятий в начале работы с программой должны проводиться строго под контролем специалиста. Это условие описано в руководстве к данной программе, а также подкреплено нашим личным опытом.
По нашим наблюдениям, 100% пациентов, которые начинали заниматься по программе самостоятельно, неверно выбирают интенсивность и очередность упражнений. При этом 60-80% выбранных ими упражнений проводятся с неверной техникой выполнения.
Ниже приведены примеры ошибок и их корректировка врачом клиники Ренейро.
Видео 2. Выполнение на первый взгляд простого упражнения «сесть-встать» (упражнение № 18): неправильная опора на больную ногу, неправильный перенос веса тела.
Видео 3. Для более эффективного выполнением упражнения на пассивное растяжение большой грудной мышцы (упражнение №21) необходимо сперва достичь максимального разгибания в локтевом суставе.
Видео 4. При выполнении упражнения №22 для тернировки б. грудной мышцы пациент вовлекает корпус тела. Упражнение необходимо делать,
выполняя только активное отведение плеча.
После корректировки интенсивности, набора упражнений и техники, эффективность программы заметно улучшается. Как правило, достаточно 2-4 занятий со специалистом для подбора индивидуальной программы тренировок по iGSC I-CAN и обучения пациента правильной технике. Далее пациенты вполне самостоятельно выполняют упражнения дома в течение нескольких месяцев, а затем приезжают для фиксации достигнутых успехов.
Мнение специалиста клиники Ренейро
Мендалиева А.С.
Врач – невролог, врач ЛФК и спортивной медицины
«У меня только положительный опыт работы с программой I-CAN.
Я рекомендую сначала оценивать двигательный дефицит пациента с помощью теста Френчай, 10-метрового теста ходьбы и качественной оценки ходьбы, с записью на видеокамеру. Затем на основании проведённого тестирования оценивать необходимость ботулинотерапии и составлять индивидуальную программу упражнений.
Программа разработана очень грамотно и значительно повышает вовлеченность пациентов в реабилитацию и их мотивацию, что сказывается на эффективности восстановительного лечения! Это легко отследить, повторно записав выполнение теста Френчай и ходьбу пациента на камеру через несколько месяцев тренировок».
27.08.2017


Источники:
1. S.Alkandari. P042-EN Annals of Physical and Rehabilitation Medicine 54 S (2011) e228-e244
2. M. Pradines. Congress on NeuroRehabilitation and Neural Repair 21 and 22 May 2015 in Maastricht, The Netherlands
Двигательные нарушения вследствие поражения головного или спинного мозга представляют одну из наиболее частых причин инвалидности у больных с заболеваниями центральной нервной системы. Среди двигательных нарушений преобладают центральные парезы и параличи конечностей, которые обычно сопровождаются повышением мышечного тонуса по типу спастичности. При реабилитации больных с центральными парезами и параличами спастичность нередко представляет трудноразрешимую проблему, что обусловливает актуальность рассмотрения вопросов патогенеза и лечения спастичности [1,2,6,7].
Спастичность
Спастичность выявляется при исследовании пассивных движений в конечности как повышенное сопротивление (сокращение) мышцы при ее быстром растяжении. Помимо спастичности, центральные парезы характеризуются снижением мышечной силы, потерей произвольного контроля движений до полного их отсутствия в конечности (паралича), повышением сухожильных рефлексов, патологическими симптомами (симптомами Бабинского, Россолимо и другими).
Развитие спастичности при центральном парезе конечности связывается со снижением тормозных влияний на спинальные мотонейроны и интернейроны, что приводит к увеличению числа импульсов, достигающих a–мотонейроны в ответ на растяжение мышцы. Снижение тормозных влияний на спинальные мотонейроны и интернейроны объясняется комбинированным поражением пирамидных и экстрапирамидных путей внутри головного или спинного мозга, при этом важную роль в развитии спастичности отводят повреждению кортико–ретикуло–спинального тракта.
В развитии спастичности при поражении головного мозга (церебральной спастичности) большую роль играет ослабление тормозных влияний преимущественно на ?–мотонейроны, обеспечивающие движение антигравитационных мышцах, что объясняет появление характерных проявлений постинсультного спастического гемипареза: приведение плеча, сгибание в локтевом и лучезапястном суставе, приведение бедра, разгибание колена и подошвенное сгибание в голеностопном суставе. В патогенезе спастичности при поражении спинного мозга (спинальной спастичности) важная роль отводится ослаблению тормозных влияний на спинальные интернейроны, что приводит к распространению поступающего в спинной мозг возбуждения по афферентным волокнам на другие уровни и появлению выраженных патологических синкинезий.
Если центральный парез сохраняется в течение длительного времени (несколько месяцев и более), то могут возникнуть структурные изменения сегментарного аппарата спинного мозга (укорочение дендритов a–мотонейронов и коллатеральный спрутинг афферентных волокон, входящих в состав задних корешков), которые способствуют прогрессированию спастичности. Также развиваются вторичные изменения в паретичных мышцах, сухожилиях и суставах, которые усиливают двигательные расстройства и усиливают сопротивление, возникающее в мышце при ее растяжении, что необходимо учитывать при оценке мышечного тонуса в паретичных или парализованных конечностях.
Для оценки степени спастичности применяются различные шкалы, среди которых наиболее часто используется шкала Эшуорта (Ashworth, 1964). Согласно этой шкале спастичность 1 балл – легкое повышение мышечного тонуса, проявляющееся в начальном напряжении и быстром последующем облегчении, 1–а балл – легкое повышение мышечного тонуса, проявляющееся напряжением мышцы менее чем в половине всего объема пассивных движений, 2 балла – умеренное повышение мышечного тонуса в течение всего объема движений (при этом пассивные движения легко осуществляются), 3 балла – значительное повышение мышечного тонуса (пассивные движения затруднительны), 4 балла – нельзя полностью согнуть или разогнуть паретичную часть конечности (сгибательная или разгибательная контрактура).
Лечение спастичности
Основная цель лечения спастичности состоит в улучшении функциональных возможностей паретичных конечностей. К сожалению, в значительной части случаев возможности лечения спастичности ограничиваются только уменьшением боли и дискомфорта, связанного с высоким мышечным тонусом, облегчением ухода за парализованным больным или устранением имеющегося косметического дефекта, вызванного спастичностью [1,2,6,7].
Один из наиболее важных вопросов, который приходится решать при ведении больного со спастическим парезом сводится к следующему: ухудшает или нет высокий мышечный тонус функциональные возможности больного? В целом больные с центральными парезами конечностей, имеющие выраженную спастичность, имеют более плохую функциональную активность конечности, чем больные с легкой спастичностью. Вместе с тем у части больных при выраженной степени пареза спастичность в мышцах ноги может облегчать стояние и ходьбу, а ее снижение способно привести к ухудшению двигательной функции.
Перед началом лечения необходимо определить возможности лечения в данном случае (улучшение двигательных функций, уменьшение болезненных спазмов, облегчение ухода за больным и др.) и обсудить их с больным и (или) его родственниками. Возможности лечения во многом определяются сроками с момента заболевания и степенью пареза. Чем меньше сроки с момента заболевания, вызвавшего спастический парез, тем более вероятно улучшение от лечения спастичности, потому что оно может привести к существенному улучшению двигательных функций, предотвратив формирование контрактур и повысив эффективность реабилитации в период максимальной пластичности центральной нервной системы. При длительном сроке заболевания менее вероятно существенное улучшение двигательных функций, однако можно значительно облегчить уход за больным и снять дискомфорт, вызванный спастичностью. Чем меньше степень пареза в конечности, тем более вероятно, что лечение спастичности способно улучшить двигательные функции.
Физиотерапия (особенно лечебная гимнастика) представляет наиболее эффективное направление ведения больных со спастичностью, она направлена на тренировку движений в паретичных конечностях и предотвращение контрактур. В качестве методов физиотерапии используется лечение положением, обучение пациентов стоянию, сидению, ходьбе (с помощью дополнительных средств и самостоятельно), бинтование конечности, применение ортопедических аппаратов, тепловые воздействия на спастичные мышцы, а также электрическая стимуляция определенных мышечных групп, например разгибателей пальцев кисти или передней большеберцовой мышцы.
В качестве дополнения к физиотерапии используются миорелаксанты, местное введение ботулинического токсина, и хирургические методы лечения. Местное введение фенола и этанола для снятия спастичности из–за существенных побочных эффектов используется реже.
Из лекарственных препаратов для лечения спастичности наиболее часто используют пероральный прием центральных миорелаксантов. Эти лекарственные средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным больным, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры и вследствие этого предупредить развитие контрактур. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых часто вызывает нежелательные побочные эффекты [2,7].
Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта. Антиспастические средства обычно не комбинируют. В качестве лекарственных препаратов для лечения спастичности в России применяются преимущественно Сирдалуд, баклофен и толперизон. Для снятия болезненных мышечных спазмов можно также использовать диазепам в индивидульно подобранной дозе.
Сирдалуд (тизанидин) – миорелаксант центрального действия, агонист a2–адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Сирдалуд обладает также умеренным центральным анальгезирующим действием. Препарат эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. При приеме внутрь максимальная концентрация Сирдалуда в крови достигается через час, прием пищи не влияет на его фармакокинетику. Начальная доза препарата составляет 6 мг в сутки в три приема, средняя терапевтическая доза – 12–24 мг в сутки, максимальная доза – 36 мг в сутки. В качестве побочных эффектов могут отмечаться сонливость, головокружение и незначительное снижение артериального давления.
Баклофен оказывает антиспастическое действие преимущественно на спинальном уровне. Препарат представляет аналог g–аминомасляной кислоты (ГАМК); он связывается с пресинаптическими ГАМК–рецепторами, приводя к уменьшению выделению возбуждающих аминокислот (глутамата, аспратата) и подавлению моно– и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности. Препарат оказывает также умеренное центральное аналгезирующее действие. Он хорошо всасывается из желудочно–кишечного тракта, максимальная концентрация в крови достигается через 2–3 часа после приема. Баклофен используется при спинальной спастичности (спинальная травма, рассеянный склероз), реже при церебральной спастичности; он эффективен при болезненных мышечных спазмах. Начальная доза составляет 15 мг в сутки (в три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта, препарат принимают во время еды. Максимальная доза баклофена для взрослых составляет 60–75 мг в сутки. Побочные эффекты чаще проявляются сонливостью, головокружением в начале лечения, хотя в дальнейшем могут ослабевать. Из побочных эффектов следует отметить тошноту, запор, диарею, артериальную гипотонию; требуется осторожность при лечении больных пожилого возраста.
Толперизон оказывает преимущественно центральное миорелаксирующее действие. Снижение спастичности при приеме препарата связывается с угнетающим влиянием на каудальную часть ретикулярной формации, подавлением спинномозговой рефлекторной активности, центральным н–холинолитическим действием. Препарат обладает умеренным центральным анальгезирующим действием и легким сосудорасширяющим влиянием. Прием толперизона начинают с 150 мг в сутки в три приема и постепенно увеличивают дозу до получения эффекта, у взрослых обычно до 300–450 мг в сутки. Толперизон применяется для лечения как церебральной, так и спинальной спастичности, а также для уменьшения болезненных мышечных спазмов. Побочные эффекты проявляются сонливостью, мышечной слабостью, артериальной гипотонией.
При лечении церебральной спастичности наиболее часто применяют Сирдалуд, а при спинальной спастичности – Сирдалуд и баклофен. Сравнительное изучение этих двух наиболее распространенных препаратов показывает преимущество Сирдалуда как по выраженности антиспастического действия, так и по меньшей выраженности побочных эффектов [3,5]. Баклофен может использоваться интратекально с помощью специальной помпы, но это в нашей стране используется редко (в определенной степени в связи с высокой стоимостью лечения), хотя при выраженной спастичности в нижних конечностях этот метод иногда дает значительный положительный эффект.
Для уменьшения локальной спастичности применяется ботулинический токсин типа А. Использование ботулинического токсина показано, если имеется мышца с повышенной мышечной активностью, нет контрактуры, отмечаются боль, мышечные спазмы, снижение объема движений и нарушение двигательной функции, связанное со спастичностью этой мышцы [1,6]. Действие ботулинического токсина при внутримышечном введении вызвано блокированием нервно–мышечной передачи, обусловленным подавлением высвобождения нейромедиатора ацетилхолина в синаптическую щель.
Клинический эффект после инъекции ботулинического токсина отмечается спустя несколько дней и сохраняется в течение 2–6 месяцев, после чего может потребоваться повторная инъекция. Длительность действия зависит от дозы введенного препарата и неврологического заболевания, при котором проводится лечение. Восстановление способности мышцы к сокращению происходит вследствие восстановления белков, разрушенных ботулиническим токсином, и разрастаниий окончаний нерва (спрутинга), приводящих к образованию новых нервно–мышечных синапсов.
В качестве побочных эффектов от использования ботулинического токсина могут быть кожные изменения и боли в месте инъекции. Они обычно самостоятельно регрессируют в течение нескольких дней после инъекции. Возможна значительная слабость мышцы, в которую введен ботулинический токсин, а также слабость в мышцах, расположенных близко к месту инъекции, локальная вегетативная дисфункция. Однако мышечная слабость обычно компенсируется деятельностью агонистов и не приводит к ослаблению двигательной функции. Повторные инъекции ботулинического токсина у части больных дают менее значительный эффект, что связывается с образованием антител к ботулиническому токсину и блокированием его действия.
Хирургические операции для уменьшения спастичности возможны на четырех уровнях – на головном мозге, спинном мозге, периферических нервах и мышцах [1,2,7].
Хирургические операции на головном мозге включают электрокоагуляцию бледного шара, вентролатерального ядра таламуса или мозжечка и имплантацию стимулятора на поверхность мозжечка. Эти операции используются редко и имеют определенный риск осложнений.
На спинном мозге может быть проведено продольное рассечение конуса (продольная миелотомия) с целью разрыва рефлекторной дуги между передними и задними рогами спинного мозга. Операция применяется при спастичности нижних конечностей, она технически сложна и связана с высоким риском осложнений, поэтому используется редко. Шейная задняя ризотомия может привести к снижению спастичности не только в верхних конечностях, но и в нижних, однако из–за риска осложнений выполняется редко. Селективная задняя ризотомия представляет наиболее частое вмешательства среди операций на спинном мозге и его корешках, она обычно используется при спастичности в нижних конечностях на уровне от второго поясничного до второго крестцового корешка.
Рассечение периферических нервов может устранить спастичность, однако эта операция нередко осложняется развитием болей, дизестезий и нередко требует дополнительной ортопедической операции, поэтому используется редко.
Значительная часть хирургических операций у больных спастичностью проводится на мышцах или их сухожилиях. Удлинение сухожилия мышцы или перемещение мышцы уменьшает активность интрафузальных мышечных волокон, снижая тем самым спастичность. Эффект от операции сложно прогнозировать, иногда требуется несколько операций. При развитии контрактуры хирургическое вмешательство на мышцах или их сухожилиях нередко представляет единственный метод лечения спастичности.
Наиболее частыми причинами спастического пареза конечностей являются инсульт и черепно–мозговая травма, а также рассеянный склероз и спинальная (позвоночно–спинномозговая) травма.
Спастичность вследствие инсульта или черепно–мозговой травмы
У большинства больных, имеющих центральные парезы конечностей после перенесенного церебрального инсульта или черепно–мозговой травмы, обнаруживается спастичность. Во многих случаях спастичность ухудшает двигательные функции, потому что расстройство движения вызвано не только слабостью мышц, но и их повышенным тонусом. Кроме того, спастичность способствует развитию контрактуры и деформации конечности, затрудняет уход за обездвиженным больным и иногда сопровождается болезненными мышечными спазмами.
Ведущую роль в лечении спастичности имеет лечебная гимнастика, которая должна начинаться уже с первых дней заболевания и направлена на тренировку утраченных движений, самостоятельное стояние и ходьбу, а также профилактику развития контрактур в паретичных конечностей.
В качестве лекарственной терапии из миорелаксантов наиболее часто используется Сирдалуд, который способен уменьшить повышенный тонус, облегчить физиотерапевтические занятия, а также уход за парализованным больным. В части случаев прием Сирдалуда приводит и к улучшению двигательных функции паретичных конечностей. Лечение начинают с минимальной дозы препарата и постепенно повышают до получения клинического эффекта. Необходимо помнить, что увеличение дозы препарата может привести к мышечной слабости и седативному эффекту, поэтому у ходячих больных требуется длительное время (недели или месяцы) для постепенного подбора оптимальной дозы препарата.
В тех случаях, когда имеется локальная спастичность, вызывающая ухудшение двигательных функций, можно использовать локальное введение препаратов ботулинического токсина. Лучшие результаты отмечаются при использовании ботулинического токсина в ранние сроки (до года) с момента заболевания и легкой степени пареза конечности. Применение ботулинического токсина может быть особенно эффективно в тех случаях, когда имеется эквино–варусная деформация стопы, вызванная спастичностью задней группы мышц голени, или высокий тонус мышц сгибателей запястья и пальцев, ухудшающий двигательную функцию паретичной руки [1,6].
При ведении больных с постинсультной спастичностью необходимо проводить профилактику повторного инсульта и других сердечно–сосудистых заболеваний: контролировать уровень артериального давления и при показаниях использовать антигипертензивные средства, антиагреганты, антикоагулянты и другие лекарственные средства.
Спастичность вследствие рассеянного склероза или спинальной травмы
Спастичность часто обнаруживается у больных с рассеянным склерозом, обычно она вызвана поражением спинного мозга (спинальная спастичность) и преобладает в нижних конечностях. Примерно у четверти больных рассеянным склерозом спастичность ухудшает двигательные функции, а ее лечение может привести к их улучшению.
В качестве лечения спастичности наиболее часто используют Сирдалуд или баклофен, а для снятия болезненных мышечных спазмов и диазепам. Лечение начинают с минимальной дозы (4–6 мг Сирдалуда, 10–25 мг баклофена), которую постепенно (на протяжении нескольких дней или недель) доводят до терапевтической, стараясь избежать нежелательных побочных эффектов (мышечной слабости и седативного эффекта), которые нередко ограничивают применение миорелаксантов. У больных рассеянным склерозом Сирдалуд лучше переносится и имеет меньше осложнений, чем баклофен [3,5].
У больных со спинальной травмой для уменьшения спастичности также наиболее часто используются Сирдалуд и баклофен. Баклофен эффективен преимущественно при интратекальном введении, при пероральном приеме Сирдалуд дает более выраженный положительный эффект и лучше переносится больными, чем баклофен [4].
Хирургические вмешательства на спинном мозге часто используются у больных, перенесших спинальную травму, как для уменьшения спастичности, так и с целью улучшения функции тазовых органов. В части случаев удается существенно уменьшить мышечный тонус и избавить больного от болезненных мышечных спазмов в парализованных конечностях.
В тех случаях, когда имеется локальная спастичность в нижних конечностях, возможно введение ботулинического токсина как в мышцы бедра (приводящие мышцы бедра, двуглавую мышцу), так и голени (икроножную и камбаловидную мышцы). При этом наиболее выражен эффект в виде уменьшения боли, связанной со спастичностью, и облегчения ухода за обездвиженными больными.
Одним из основных принципов ведения больных со спастичностью является приоритет физиотерапии. При легкой генерализованной спастичности снижение мышечного тонуса можно достигнуть пероральным приемом Сирдалуда, при локальной спастичности – инъекцией ботулинического токсина, при выраженной спастичности и контрактурах иногда помогают только хирургические методы лечения. Использование этих методов лечения во всех случаях должно сочетаться с лечебной гимнастикой, которая составляет основу реабилитации больного со спастическими парезами или параличами конечностей.
Литература:
1. Парфенов В.А.. Спастичность // Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей / Под ред. О.Р. Орловой, Н.Н. Яхно. – М. : Каталог, 2001 – С. 91–122.
2. Barnes M.P. Management of spasticity // Age and Ageing . – 1998. – Vol. 27. – P. 239–245.
3. Hoogstraten M.C., Van der Ploeg R.J.O., Vreeling A. et al. Tizanidine versus baclofen in the treatment of spasticity in multiple sclerosis patients // Acta Neurol. Scand. – 1988. – Vol. 77. – P. 224–230.
4. Taricco M., Adine R., Pagliacci C., Telaro E. Pharmacological interventions for spasticity following spinal cord injury // Cochrane Library, Issue 1, 2004, UK; John Willey & Sons, Ltd.
5. United Kingdom Tizanidine Trial Group. A double–blind, placebo–controlled trial of Tizanidine in the treatment spasticity caused by multiple sclerosis // Neurology – 1994. –Vol. 44. – Suppl.9. – P. 70–78.
6. Ward A.B. A summary of spasticity management – a treatment algorithm // Eur. J. Neurol. – 2002. – Vol. 9. – Suppl.1. – P. 48–52.
7. Young R.R. Spasticity: a review // Neurology – 1994. –Vol. 44. – Suppl.9. – P. 512–520.
Мендалиева А.С.
Клиника «Ренейро», Москва, Россия
Программа домашней реабилитации GSC «I-CAN» в сочетании с ботулинотерапией в двигательной реабилитации пациентов со спастическим парезом
Авторы:
Мокиенко О.А., Мендалиева А.С.
Показать как цитировать
Мокиенко О.А., Мендалиева А.С. Программа домашней реабилитации GSC «I-CAN» в сочетании с ботулинотерапией в двигательной реабилитации пациентов со спастическим парезом. Журнал неврологии и психиатрии им. С.С. Корсакова.
2019;119(3):127‑132.
Mendalieva AS, The GSC I-CAN home rehabilitation program in combination with botulinotherapy in motor rehabilitation of patients with spastic paresis. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2019;119(3):127‑132. (In Russ.).
https://doi.org/10.17116/jnevro2019119031127
Основными, или базовыми, методами двигательной реабилитации пациентов со спастическим парезом в результате инсульта или черепно-мозговой травмы являются лечебная физкультура (ЛФК, физическая терапия) и локальная антиспастическая терапия [1, 2].
Физические упражнения в рамках ЛФК направлены прежде всего на стимуляцию процессов нейропластичности, т. е. реорганизации коры головного мозга путем обеспечения повторяющегося, адекватного и интенсивного модулирующего воздействия. Упражнения в рамках ЛФК-комплекса, применяющиеся в двигательной реабилитации, основаны на понимании физиологии нервной системы, механизмов индуцированной нейропластичности, принципов моторного контроля и двигательного обучения. Некоторые дополнительные подходы в рамках ЛФК-комплекса, такие как пассивная гимнастика, лечение положением, пассивное растяжение, силовые тренировки, предназначены в основном для модулирования процессов в тканях паретичной конечности — в качестве профилактики вторичных осложнений, сохранения функции и физических свойств мышц и суставов [1—3].
Применение локальной антиспастической терапии в виде инъекций препарата ботулинического токсина типа, А (БТА) нацелено на уменьшение степени спастичности для восстановления пассивной или активной функции конечности, облегчения ухода и самообслуживания, снижения ассоциированного со спастичностью болевого синдрома. Период действия БТА составляет в среднем 3—4 мес. Данное «терапевтическое окно» следует использовать для реализации интенсивных методов физической реабилитации на фоне снижения спастичности [2, 4, 5].
Однако большую часть времени пациент со спастическим парезом проводит вне стационара. Большая часть «терапевтического окна» ботулинотерапии также приходится на внестационарный этап двигательной реабилитации. Сложность обеспечения пациентов непрерывной комплексной и интенсивной программой восстановительного лечения на амбулаторном этапе на настоящее время остается существенной проблемой организации двигательной реабилитации. Применение программы «I-CAN» («Я МОГУ») решает многие проблемы внестационарного этапа реабилитации и способствует соблюдению таких ее ключевых принципов, как регулярность и адекватная интенсивность занятий, постепенное увеличение сложности, а также активное вовлечение пациента в восстановительный процесс.
Состав программы GSC «I-CAN»
В состав программы «I-CAN» (Ипсен Комплексная прогрАмма для лечения пациеНтов со спастическим парезом) входят 3 основных компонента: 1) качественная клиническая оценка состояния пациента и постановка индивидуальных целей лечения в соответствии с ожиданиями пациента; 2) эффективное введение необходимой дозы препарата БТА (диспорт) в таргетные группы мышцы, исходя из целей лечения и с соблюдением необходимой частоты инъекционных сессий; 3) программа направленной самореабилитации GSC (Guided Self-Rehabilitation Contracts), которая позволяет обеспечивать партнерство между мультидисциплинарной командой специалистов и пациентами. Таким образом, программа «I-CAN» представляет собой комплексный пациент-ориентированный подход в лечении пациентов со спастичностью.
Особый интерес в рамках «I-CAN» представляет программа направленной самореабилитации GSC. В основе программы лежит систематический подход, направленный на дифференцированную работу с мышцами-антагонистами. Для мышц со спастичностью, находящихся в укороченном состоянии и подверженных риску развития контрактур, предусмотрены упражнения длительного растяжения, которые при наличии показаний должны сочетаться с инъекциями локальных антиспастических препаратов БТА. Для мышц-антагонистов спастичным предусмотрена интенсивная программа упражнений с совершением широко-амплитудных быстрых движений без посторонней помощи или же попытки совершать такие движения, когда они невозможны. В общей сложности программа GSC «I-CAN» включает 24 упражнения на пассивное растяжение и 23 активных упражнения для различных групп мышц верхней и нижней конечностей, а также 3 функциональных упражнения: приседание на стул, ходьба широкими шагами и быстрая ходьба [6]. Интенсивность и состав программы для каждого пациента подбирается индивидуально и меняется с течением времени. Программу разработали специалисты университетской клиники им. Анри Мондора (Франция) во главе с проф. Ж.-М. Грасье [7, 8].
Упражнения на растяжение основаны на пассивном придании конечности определенного положения, при котором происходит максимальное растяжение спастичных мышц. Регулярные упражнения на пассивное растяжение спастических мышц используются для профилактики развития контрактур, сохранения длины мягких тканей, кратковременного снижения степени спастичности. Поддержание длины мягких тканей также обеспечивает основу для применения активных методов двигательной реабилитации [6, 9, 10]. Было показано, что упражнения на самостоятельное растяжение спастических мышц в течение 30 мин в день способствуют постепенному удлинению мышц, уменьшению их жесткости и чувствительности мышечных веретен [11]. Программа составлена таким образом, что за пассивным растяжением отдельной мышцы со спастичностью следует активное упражнение для ее антагониста.
Активные упражнения в рамках программы направлены на стимуляцию процессов нейропластичности за счет совершения повторных высокоамплитудных движений [6]. В исследованиях на животных было показано, что для реорганизации первичной моторной коры необходимо совершать конечностью 400 повторов функционального движения в день, а также, что 60 повторов в день для этого недостаточно [12, 13]. В то же время опытным путем исследователи из США и Канады установили, что в реальной клинической практике как стационарной, так и амбулаторной двигательной реабилитации не более 51% пациентов отрабатывают функциональные движения, и в среднем за одну тренировку совершается всего лишь 32 повтора таких движений [14, 15]. Программа GSC позволяет приблизить интенсивность ежедневных тренировок к той, что согласно вышеприведенным работам необходима для индуцированной нейропластичности и восстановления моторного контроля. По нашему опыту, пациенты в среднем достигают 200—300 повторов каждого из рекомендованных движений в рамках программы при условии адекватного лечения спастичности со своевременным применением препарата БТА при наличии показаний.
Также считается, что за счет восстановления реципрокного торможения активные упражнения с быстрыми высокоамплитудными движениями способствуют устранению феномена ко-контракции, т. е. непроизвольного сокращения антагонистов при попытке выполнить движение [6, 16—18].
Кроме того, оригинальная программа предусматривает некий психологический компонент — условный договор между специалистом и пациентом, в соответствии с которым пациент обязуется ежедневно заниматься и вести дневник реабилитации. Этот принцип отражен в названии программы: «GSC», или «Guided self-rehabilitation contract» — «Договор о направленной самореабилитации» [7]. Автором также разработано подробное руководство для пациентов с описанием концепции программы и техники упражнений на простом, понятном для пациентов языке, существует мобильное приложение, содержащее видеоинструкции для каждого упражнения и позволяющее программировать план занятий, контролировать их исполнение [6].
Таким образом, упражнения программы GSC направлены на основные компоненты патологического процесса: парез, спастичность и мышечную контрактуру (на этапе спастической миопатии), а подробное руководство и мобильное приложение с видеоинструкциями позволяют пациенту выполнять упражнения самостоятельно в домашних условиях.
Данные об эффективности программы
Так как программа «I-CAN» была разработана в начале 2000-х годов, а международное распространение получила лишь в 2016 г., применяясь до этого лишь во Франции, на настоящее время опубликованы данные нескольких клинических исследований на ограниченном числе пациентов. В настоящее время проводится слепое рандомизированное контролируемое сравнительное исследование эффективности программы GSC и стандартной клинической практики ведения пациентов на внестационарном этапе, а также завершено международное, с участием России, клиническое исследование эффекта совместного применения абоботулотоксина (препарат диспорт) и программы GSC. Во всех исследованиях, проведенных и текущих, эффективность метода оценивается у пациентов в резидуальном восстановительном периоде (при давности спастического пареза более 12 мес).
Первая опубликованная работа была посвящена оценке изменения скорости ходьбы на фоне ботулинотерапии и применения программы GSC [19]. В исследовании с участием 14 пациентов (средняя давность инсульта 52 мес) после 9 мес ежедневных тренировок в рамках программы GSC на фоне 3 последовательных циклов инъекций ботулотоксина в нижние конечности наблюдали увеличение комфортной скорости ходьбы на 49% и максимальной скорости ходьбы на 65% (p<0,01). Авторы сделали вывод, что вопреки распространенному мнению, пациенты с хроническим гемипарезом после инсульта могут значительно увеличить скорость ходьбы при совместном применении ботулотоксина и программы GSC.
В другом сравнительном проспективном исследовании 12 пациентов с гемипарезом (средняя давность инсульта 77 мес) и без выраженных нарушений когнитивной функции были обследованы дважды с интервалом в 8 нед, в течение которых не назначали ботулинотерапию [20]. При этом 6 пациентов в дополнение к стандартной физической терапии в среднем 2 ч в неделю самостоятельно выполняли упражнения в рамках GSC не менее 3 ч в неделю. В течение 8 нед среднее значение комфортной скорости ходьбы увеличилось в группе GSC с 0,77 до 0,88 м/с (+14%), а в группе стандартной терапии с 0,68 до 0,69 м/с (+1,4%); p<0,01 между группами. В группе GSC диапазон пассивной дорсифлексии (тыльное сгибание в голеностопном суставе, XV1 по шкале Тардье) увеличился на 3,3° при согнутом и на 5,5° при разогнутом коленном суставе, в группе стандартной терапии данные показатели уменьшились на 0,6° и 4,6° соответственно (статистически незначимо). Диапазон активной дорсифлексии при разогнутом коленном суставе в группе GSC увеличился на 8,2%, а в группе сравнения уменьшился на 8% (статистически незначимо). Авторы сделали вывод, что в резидуальном восстановительном периоде после инсульта самостоятельное выполнение упражнений программы GSC в дополнение к стандартной физической терапии может увеличить скорость ходьбы.
В недавно опубликованной работе M. Pradines и соавт. [21] представили результаты ретроспективного исследования эффективности годового курса упражнений, направленных на самостоятельное растяжение мышц нижних конечностей, в рамках GSC. За год наблюдения было проведено 6 клинических оценок, включающих объем пассивного движения (показатель XV1 по шкале Тардье), коэффициент укорочения, 10-метровый тест ходьбы, а также скорость передвижения в естественной среде. За коэффициент укорочения было принято отношение разницы между выявляемой и нормальной амплитудой пассивного движения к нормальной амплитуде пассивного движения (C=(Xn—XV1)/Xn, где XV1 = объем пассивного движения у пациента; Xn = объем движения в норме). За значимое изменение объема пассивного движения применяли увеличение угла более чем на 5° для подошвенных сгибателей и более чем на 10° для более проксимальных мышц. Авторы оценили изменения коэффициента укорочения и пассивного движения в мышцах, подверженных и не подверженных растяжению, а также оценили корреляцию между средним значением объема пассивного движения для 6 мышц и скоростью передвижения.
В наблюдение вошло 27 клинических случаев: 18 пациентов с гемипарезом и 9 — с парапарезом, давность пареза на момент начала наблюдения у всех пациентов составляла более 1 года. Через 1 год регулярных самостоятельных занятий в рамках программы GSC для 47% мышц, подвергшихся растяжению, наблюдали значимое увеличение объема пассивного движения по сравнению с 14% мышц, не подвергшихся регулярному растяжению (p<0,0001). Коэффициент укорочения C уменьшился на 31% в мышцах, включенных в программу растяжения, по сравнению с уменьшением данного показателя на 7% в мышцах сравнения (p<0,0001). Средняя скорость ходьбы увеличилась на 41% (p<0,0001): с 0,81 м/с до 1,15 м/с. Из 12 пациентов 8 (67%), которые были изначально сильно ограничены в передвижении или не могли самостоятельно выходить из дома, перешли в категорию более высокой функциональной независимости и мобильности. У пациентов с гемипарезом наблюдали тенденцию к корреляции между значениями объема пассивного движения и скоростью передвижения (r=0,44; p=0,09). Авторы сделали вывод о целесообразности назначения и мониторинга выполнения упражнений на самостоятельное пассивное растяжение мышц нижних конечностей по программе GSC, так как это может увеличить растяжимость мышц при давности спастического пареза более 1 года.
В недавно завершенном международном клиническом исследовании (протокол «ENGAGE», ClinicalTrials.gov ID: NCT02969356) оценивали эффект совместного применения ботулинотерапии (диспорт, 1500 ЕД) и программы GSC в отношении восстановления активной функции верхней или нижней конечности. Доза препарата была разделена между верхней и нижней конечностью, причем в случае необходимости инъекции в верхнюю конечность максимальная доза составляла не более 1000 Е.Д. Исследование проводили в 20 клинических центрах Франции, России, Чехии и США. В исследование были включены 157 взрослых пациентов с давностью очагового повреждения головного мозга более 12 мес, оценкой по модифицированной шкале Френчай от 2 до 7 баллов (при первичной цели лечения, связанной с верхней конечностью) или максимальной скоростью ходьбы от 0,2 до 1,4 м/с (при первичной цели лечения, связанной с нижней конечностью). Результаты исследования будут опубликованы в скором времени и дадут клиницистам ответы на вопросы, могут ли индивидуальные программы самореабилитации, такие как GSC, в сочетании с ботулинотерапией обеспечить улучшение активной функции в резидуальном восстановительном периоде и насколько пациенты готовы придерживаться подобной программы [22].
В настоящее время во Франции проводится многоцентровое рандомизированное слепое контролируемое исследование, в котором сравнивается эффективность программы GSC с эффективностью стандартной клинической практики ведения пациентов на внестационарном этапе в течение двухлетнего периода наблюдения (протокол «Neurorestore», ClinicalTrials.gov ID: NCT02202954) [23]. Протокол исследования подразумевает участие 124 пациентов, перенесших инсульт и находящихся в резидуальном восстановительном периоде. Первичные конечные точки исследования: скорость ходьбы (10-метровый тест) и балл по модифицированной шкале Френчай.
Общие принципы организации работы с программой
Первые несколько занятий по программе проводятся под контролем специалиста. При подборе индивидуальной программы упражнений и режима их дозирования специалист учитывает степень двигательного дефицита, выраженность спастичности, утомляемость, психологические особенности пациента и др. Для поддержания мотивации и вовлеченности пациента сначала рекомендуется подбирать те упражнения, от проведения которых в первую очередь можно ожидать результат. Далее продолжительность занятий по программе увеличивается. Автор программы разъясняет пациенту: «Каждое упражнение должно быть сложным. Если упражнение со временем становится легким — это, с одной стороны, означает, что заметен прогресс в тренировках, с другой — что данное упражнение стало малоэффективным для тренировки мозга. Лечащему врачу в таком случае следует увеличить уровень сложности, подобрав другие упражнения» [6]. После того, как пациент обучился правильной технике выполнения упражнений (по нашему опыту, для этого достаточно 3—4 очно контролируемых занятий), пациент может выполнять упражнения полностью самостоятельно с периодическим контролем 1 раз в несколько месяцев.
Также возможно проведение групповых занятий. С. Gault-Colas и соавт. [24] описывают опыт проведения 69 групповых занятий по программе GSC, отдельно по верхней конечности и отдельно по нижней. Во время таких занятий в группах пациентов по 4—5 человек отрабатывалась прежде всего техника упражнений под контролем специалиста, поэтому длительность каждого упражнения была сокращена в 3—5 раз по сравнению с режимом выполнения упражнений самостоятельно в домашних условиях. На занятиях также присутствовали родственники и ухаживающие лица. Группы, как правило, были гомогенны в отношении возраста, диагноза, приверженности занятиям. Авторы показали, что благодаря периодическому проведению таких групповых занятий увеличилась мотивация пациентов, их приверженность программе, а также улучшилась техника выполнения упражнений и динамика восстановления. Согласно опросникам подавляющее большинство пациентов (94%) выразили удовлетворенность таким форматом и желание приходить на занятия повторно, осознали преимущества качественной и интенсивной работы, а также отметили увеличение вовлеченности родственников и ухаживающих лиц в их восстановительный процесс.
Важно отметить, что ботулинотерапия является неотъемлемым компонентом программы при наличии спастичности от 2 баллов по модифицированной шкале Эшворта, ограничивающей функционирование, уход и самообслуживание, при ассоциированном со спастичностью болевым синдром [2, 4, 25]. Широкий спектр зарегистрированных таргетных мышц верхней и нижней конечностей у препарата диспорт позволяет официально проводить инъекции для достижения разнообразных целей лечения взрослых пациентов. Однако в реальной клинической практике инъекция БТА не всегда предшествует началу работы по программе GSC. В таких случаях не стоит откладывать занятия по программе, так как необходимо с первых дней акцентировать внимание пациента на необходимости проведения ежедневных занятий. Кроме этого, ведение дневника и регулярной отчетности приводит к повышению самодисциплины и мотивации пациента. И если пациент позже получает инъекцию БТА, программа, как правило, изменяется: за счет действия ботулотоксина сокращается время растяжения тех мышц, которые находились в гипертонусе, увеличивается время для активных упражнений, и в целом само время общей нагрузки.
Данная форма самореабилитации подразумевает участие пациентов в программе GSC в домашних условиях с возможностью контроля регулярности занятий врачом (тренером, консультантом), следовательно, стоит также отметить снижение «нагрузки» на специалистов амбулаторного звена, а также, возможно, и прямых затрат на годовое лечение и реабилитацию пациента с синдромом постинсультной спастичности. Для более детального анализа эффективности программы с экономической позиции требуется проведение дополнительных исследований.
Собственный опыт применения программы «I-CAN»
В клинике амбулаторной и домашней двигательной реабилитации «Ренейро» мы предлагаем программу пациентам со спастическим парезом в результате очагового повреждения головного мозга без выраженного когнитивного дефицита, суставных контрактур, мотивированных и намеренных самостоятельно выполнять упражнения в домашних условиях. Зачастую такие пациенты и так самостоятельно выполняют определенные упражнения, найденные в открытых источниках или подобранные самостоятельно. Но многие из этих упражнений, не назначенных и не контролируемых специалистом, способствуют усилению синдрома спастичности, развитию компенсаторных движений или закреплению патологических двигательных стереотипов, либо просто оказываются неэффективными.
Рассмотрим клинический случай ведения пациента по программе GSC «I-CAN» в течение 12 мес.
Мужчина, 55 лет, перенес геморрагический инсульт в базальных ядрах справа со смещением влево срединных структур с прорывом крови в желудочковую систему. Давность инсульта на момент обращения — 10 мес. В острейшем периоде сформировалась левосторонняя гемиплегия, в раннем восстановительном периоде — левосторонний спастический гемипарез. В прошлом работал резчиком по стеклу, женат. При первом визите в клинику отмечена высокая степень мотивации, пациент активно участвует в процессе воспитания внуков. Пациенту проведена комплексная диагностическая оценка с использованием шкалы Фугл—Мейера (раздел для оценки двигательной функции руки), модифицированной шкалы Френчай, с измерением объема активного движения в суставах, качественным и количественным анализом ходьбы. Ввиду проживания в 100 км от Москвы изначально пациент посещал клинику 1 раз в месяц для контроля техники выполнения упражнений и корректировки интенсивности программы, затем очные визиты требовались 1 раз в полгода. Первый цикл инъекций ботулотоксина пациент получил спустя 1,5 года после инсульта, к этому времени он ежедневно занимался по программе GSC «I-CAN» в течение 8 мес. Всего на момент последнего визита пациент получил 2 цикла инъекций в мышцы верхней конечности (инъекции проводились в стационаре). Динамика восстановления двигательной функции за период наблюдения 12 мес представлена на рисунке.
За период наблюдения у пациента отмечено улучшение функции верхней конечности, что отражает увеличение общего балла по соответствующему разделу шкалы Фугл—Мейера на 63%. При этом в течение первых 6 мес на фоне регулярных занятий по программе GSC значение данного показателя увеличилось с 30 до 42 баллов, а после проведения двух циклов инъекции БТА — до 49 баллов.
Значительное увеличение активного разгибания в локтевом суставе, с 100˚ до 170˚, произошло только после двух циклов БТА в соответствующие мышцы.
Также на фоне регулярных занятий по программе GSC отмечено увеличение скорости ходьбы. Время, затрачиваемое на перемещение с комфортной скоростью зала ЛФК с возвращением в исходную точку (2 длины зала), за 12 мес наблюдения уменьшилось с 48 до 20 мин, т. е. на 58%. Время, затрачиваемое на перемещение в естественной среде на фиксированное расстояние, снизилось на 55%, с 60 до 27 мин.
Таким образом, пациенты со спастическим парезом проводят основную часть времени вне стационара. Большая часть «терапевтического окна» ботулинотерапии также приходится на амбулаторный этап двигательной реабилитации. Поэтому организация процесса реабилитации на данном этапе играет ключевую роль в восстановлении. Программа домашней самореабилитации GSC «I-CAN» способна решить основные проблемы двигательной реабилитации для пациентов со спастическим парезом. В программе GSC могут принять участие пациенты без грубых когнитивных нарушений, намеренных самостоятельно выполнять упражнения в домашних условиях, даже в резидуальном восстановительном периоде. Ботулинотерапия является неотъемлемым компонентом программы при наличии спастичности от 2 баллов по модифицированной шкале Эшворта, ограничивающей функционирование, уход и самообслуживание, при ассоциированном со спастичностью болевым синдром.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Мокиенко Олеся Александровна — e-mail: lesya.md@yandex.ru; https://orcid.org/0000-0002-7826-5135
Мендалиева Айнагуль Сансысбаевна — https://orcid.org/0000-0003-4943-4486
*e-mail: lesya_md@yandex.ru
Лечение постинсультной спастичности
Статьи
Парфенов В.А.
Московская медицинская академия им. И.М. Сеченова
Актуальность проблемы
В России ежегодно регистрируется 300-400 тысяч инсультов, что приводит к наличию более одного миллиона больных, перенесших инсульт. Более чем у половины из них остаются двигательные нарушения, вследствие которых существенно снижается качество жизни и нередко развивается стойкая инвалидность (1).
Двигательные нарушения после перенесенного инсульта чаще всего проявляются гемипарезом или монопарезом конечности с повышением мышечного тонуса по типу спастичности (1,2,9). У больных инсультом спастичность обычно нарастает в паретичных конечностях в течение нескольких недель и месяцев, сравнительно редко (чаще всего при восстановлении двигательных) функций наблюдается спонтанное уменьшение спастичности. Во многих случаях у больных инсультом спастичность ухудшает двигательные функции, способствует развитию контрактуры и деформации конечности, затрудняет уход за обездвиженным больным и иногда сопровождается болезненными мышечными спазмами (2,5,6,9,14).
Восстановление утраченных двигательных функций максимально в течение двух-трёх месяцев с момента инсульта, в дальнейшем темпы восстановления снижаются значительно. Через год после развития инсульта мало вероятно уменьшение степени пареза, однако возможно улучшение двигательных функций и уменьшение инвалидности путём тренировки равновесия и ходьбы, использования специальных приспособлений для передвижения и снижения спастичности в паретичных конечностях (1,2,6,9,14)
Основная цель лечения постинсультной спастичности состоит в улучшении функциональных возможностей паретичных конечностей, ходьбы, самообслуживания больных. К сожалению, в значительной части случаев возможности лечения спастичности ограничиваются только уменьшением боли и дискомфорта, связанного с высоким мышечным тонусом, облегчением ухода за парализованным пациентом или устранением имеющегося косметического дефекта, вызванного спастичностью (2,6,14).
Один из наиболее важных вопросов, который приходится решать при ведении больного с постинсультной спастичностью сводится к следующему: ухудшает или нет спастичность функциональные возможности больного? В целом, функциональные возможности конечности у больного с постинсультным парезом конечности хуже при наличии выраженной спастичности, чем при её лёгкой степени. Вместе с тем у части больных при выраженной степени пареза спастичность в мышцах ноги может облегчать стояние и ходьбу, а её снижение привести к ухудшению двигательной функции и даже к падениям (2,6,14).
Перед тем, как начать лечить постинсультную спастичность, необходимо определить возможности лечения у конкретного больного (улучшение двигательных функций, уменьшение болезненных спазмов, облегчение ухода за пациентом и др.) и обсудить их с больным и (или) его родственниками. Возможности лечения во многом определяются сроками с момента заболевания и степенью пареза, наличием когнитивных расстройств (2,6,14). Чем меньше сроки с момента развития инсульта, вызвавшего спастический парез, тем более вероятно улучшение от лечения спастичности, потому что оно может привести к существенному улучшению двигательных функций, предотвратив формирование контрактур и повысив эффективность реабилитации в период максимальной пластичности центральной нервной системы. При длительном сроке заболевания менее вероятно существенное улучшение двигательных функций, однако можно значительно облегчить уход за больным и снять дискомфорт, вызванный спастичностью. Чем меньше степень пареза в конечности, тем более вероятно, что лечение спастичности улучшит двигательные функции (14).
Лечебная гимнастика
Лечебная гимнастика представляет наиболее эффективное направление ведения больного с постинсультным спастическим гемипарезом, она направлена на тренировку движений в паретичных конечностях и предотвращение контрактур (2,14).
В качестве методов физиотерапии используются лечение положением, обучение пациентов стоянию, сидению, ходьбе (с помощью дополнительных средств и самостоятельно), бинтование конечности, применение ортопедических аппаратов, тепловые воздействия на спастичные мышцы, а также электрическая стимуляция определенных мышечных групп, например разгибателей пальцев кисти или передней большеберцовой мышцы (4).
Больным, имеющим выраженную спастичность в сгибателях верхних конечностей, не следует рекомендовать интенсивные упражнения, которые могут значительно усилить мышечный тонус, например, сжимание резинового кольца или мяча, использование экспандера для развития сгибательных движений в локтевом суставе.
Массаж мышц паретичных конечностей, имеющих высокий мышечный тонус, возможен только в виде легкого поглаживания, напротив, в мышцах антогонистах, можно использовать растирание и неглубокое разминание в более быстром темпе.
Иглорефлексотерапия относительно часто используется в нашей стране в комплексной терапии больных, имеющих постинсультный спастический гемипарез, однако контролируемые исследования, проведенные за рубежом, не показывают существенной эффективности этого метода лечения (10).
Миорелаксанты
В качестве лекарственных средств, принимаемых внутрь для лечения постинсультной спастичности, в клинической практике используются преимущественно баклофен и тизанидин (5-7). Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры и вследствие этого предупредить развитие контрактур. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты (2,5-7,14). Лечение миорелаксантами начинают с минимальной дозы, затем её медленно повышают для достижения эффекта. Антиспастические средства обычно не комбинируют.
Баклофен (Баклосан) оказывает антиспастическое действие преимущественно на спинальном уровне.
Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК); он связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделению возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности.
За свою долгую историю остается препаратом выбора в лечении спастичности спинального и церебрального происхождения.
Баклофен оказывает также центральное анальгезирующее действие и оказывает противотревожный эффект. Он хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови достигается через 2-3 часа после приёма. Баклофен (баклосан) используется при спинальной (спинальная травма, рассеянный склероз) и церебральной спастичности; он эффективен при болезненных мышечных спазмах различного генеза. Баклофен (Баклосан) Начальная доза составляет 5-15 мг в сутки (в один или три приёма), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта, препарат принимают во время еды. Максимальная доза баклофена (баклосана) для взрослых составляет 60-75 мг в сутки. Побочные эффекты проявляются сонливостью, головокружением в начале лечения, хотя они имеют четко дозозависимый характер и в дальнейшем могут ослабевать. Иногда возникают тошнота, запор, диарея, артериальная гипотония.
Баклофен можно использоваться интратекально с помощью специальной помпы при спастичности, вызванной различными неврологическими заболеваниями, включая последствия инсульта (8,11,13). Использование баклофеновой помпы в сочетании с лечебной гимнастикой, физиотерапией может улучшить скорость и качество ходьбы у больных с постинсультной спастичностью, способных к самостоятельному передвижению (8). Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств (13). Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт (11). Тизанидин – миорелаксант центрального действия, агонист альфа-2 адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Препарат обладает также умеренным центральным анальгезирующим действием, эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. Начальная доза препарата составляет 2-6 мг в сутки в один или три приёма, средняя терапевтическая доза – 12-24 мг в сутки, максимальная доза – 36 мг в сутки. В качестве побочных эффектов могут отмечаться выраженная сонливость, сухость во рту, головокружение и незначительное снижение артериального давления.
Ботулинический токсин
У больных, перенесших инсульт и имеющих локальную спастичность в паретичных мышцах, можно использовать ботулинический токсин типа А или ботулотоксин (ботокс, диспорт). Использование ботулинического токсина показано, если у больного, перенесшего инсульт, имеется мышца с повышенным тонусом без контрактуры, а также отмечаются боль, мышечные спазмы, снижение объёма движений и нарушение двигательной функции, связанные со спастичностью этой мышцы (2-4,12,14). Действие ботулинического токсина при внутримышечном введении вызвано блокированием нервно-мышечной передачи, обусловленным подавлением высвобождения нейромедиатора ацетилхолина в синаптическую щель.
Клинический эффект после инъекции ботулинического токсина отмечается спустя несколько дней и сохраняется в течение 2-6 месяцев, после чего может потребоваться повторная инъекция. Лучшие результаты отмечаются при использовании ботулинического токсина в ранние сроки (до года) с момента заболевания и легкой степени пареза конечности. Применение ботулинического токсина может быть особенно эффективно в тех случаях, когда имеется эквино-варусная деформация стопы, вызванная спастичностью задней группы мышц голени, или высокий тонус мышц сгибателей запястья и пальцев, ухудшающий двигательную функцию паретичной руки (14). В контролированных исследованиях доказана эффективность диспорта при лечении постинсультной спастичности в руке (3).
В качестве побочных эффектов от использования ботулотоксина могут быть кожные изменения и боли в месте инъекции. Они обычно самостоятельно регрессируют в течение нескольких дней после инъекции. Возможна значительная слабость мышцы, в которую введён ботулотоксин, а также слабость в мышцах, расположенных близко к месту инъекции, локальная вегетативная дисфункция. Однако мышечная слабость обычно компенсируется деятельностью агонистов и не приводит к ослаблению двигательной функции. Повторные инъекции ботулотоксина у части больных дают менее значительный эффект, что связывается с образованием антител к ботулотоксину и блокированием его действия. Ограничение широкого применения ботулинического токсина в клинической практике во многом вызвано его высокой стоимостью.
Хирургические методы лечения
Хирургические операции для уменьшения спастичности возможны на четырёх уровнях — на головном мозге, спинном мозге, периферических нервах и мышцах (2,14). У больных с постинсультной спастичностью они используются редко. Эти методы чаще применяются при детском церебральном параличе и спинальной спастичности, вызванной спинальной травмой.
Хирургические операции на головном мозге включают электрокоагуляцию бледного шара, вентролатерального ядра таламуса или мозжечка и имплантацию стимулятора на поверхность мозжечка. Эти операции используются редко и имеют определённый риск осложнений.
На спинном мозге может быть проведено продольное рассечение конуса (продольная миелотомия) с целью разрыва рефлекторной дуги между передними и задними рогами спинного мозга. Операция применяется при спастичности нижних конечностей, она технически сложна и связана с высоким риском осложнений, поэтому используется редко. Шейная задняя ризотомия может привести к снижению спастичности не только в верхних конечностях, но и в нижних, однако выполняется редко из-за риска осложнений. Селективная задняя ризотомия представляет наиболее частое вмешательства среди операций на спинном мозге и его корешках, она обычно используется при спастичности в нижних конечностях на уровне от второго поясничного до второго крестцового корешка.
Рассечение периферических нервов может устранить спастичность, однако эта операция нередко осложняется развитием болей, дизестезий и нередко требует дополнительной ортопедической операции, поэтому используется редко.
Значительная часть хирургических операций у пациентов со спастичностью различного генеза проводится на мышцах или их сухожилиях. Удлинение сухожилия мышцы или перемещение мышцы уменьшает активность интрафузальных мышечных волокон, снижая тем самым спастичность. Эффект от операции сложно прогнозировать, иногда требуется несколько операций. При развитии контрактуры хирургическое вмешательство на мышцах или их сухожилиях нередко представляет единственный метод лечения спастичности.
Заключение
Лечение постинсультной спастичности представляет актуальную проблему современной неврологии. Ведущую роль в лечении постинсультной спастичности имеет лечебная гимнастика, которая должна начинаться уже с первых дней развития инсульта и быть направлена на тренировку утраченных движений, самостоятельное стояние и ходьбу, а также профилактику развития контрактур в паретичных конечностей.
В тех случаях, когда у больного с постинсультным парезом конечности имеется локальная спастичность, вызывающая ухудшение двигательных функций, можно использовать локальное введение препаратов ботулинического токсина.
В качестве лекарственных антиспастических средств, применяемых внутрь, рекомендуются Баклофен (Баклосан) и тизанидин, которые способны уменьшить повышенный тонус, облегчить физиотерапевтические занятия, а также уход за парализованным больным. Одним из перспективных методов лечения посинсультной спастичности является введение баклофена интратекально с помощью специальной помпы, эффективность которого активно изучается в последние годы.
ЛИТЕРАТУРА
1. Дамулин И.В., Парфенов В.А., Скоромец А.А., Яхно Н.Н. Нарушения кровообращения в головном и спинном мозге. В кн.: Болезни нервной системы. Руководство для врачей. Под ред. Н.Н. Яхно. М.: Медицина, 2005, Т.1., С. 232-303.
2. Парфенов В.А.. Спастичность В кн.: Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей / Под ред. О.Р. Орловой, Н.Н. Яхно. – М.: Каталог, 2001 – С. 91-122.
3. Bakheit A.M., Thilmann A.F., Ward A.B. et al. A randomized, double-blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke // Stroke. – 2000. – Vol. 31. – P. 2402-2406.
4. Bayram S., Sivrioglu K., Karli N. Et al. Low-dose botulinum toxin with short-term electrical stimulation in poststroke spastic drop foot: a preliminary study // Am J Phys Med Rehabil. – 2006. — Vol. 85. – P. 75-81.
5. Chou R., Peterson K., Helfand M. Comparative efficacy and safety of skeletal muscle relaxants for spasticity and musculoskeletal conditions: a systematic review. // J Pain Symptom Manage. – 2004. – Vol. 28. – P.140–175.
6. Gallichio J.E. Pharmacologic management of spasticity following stroke. // Phys Ther 2004. – Vol. 84. – P. 973–981.
7. Gelber D. A., Good D. C., Dromerick A. et al. Open-Label Dose-Titration Safety and Efficacy Study of Tizanidine Hydrochloride in the Treatment of Spasticity Associated With Chronic Stroke // Stroke. – 2001. — Vol.32. – P. 1841-1846.
8. Francisco G.F., Boake C. Improvement in walking speed in poststroke spastic hemiplegia after intrathecal baclofen therapy: a preliminary study // Arch Phys Med Rehabil. – 2003. – Vol. 84. – P. 1194-1199.
9. Formisano R., Pantano P., Buzzi M.G. et al. Late motor recovery is influenced by muscle tone changes after stroke // Arch Phys Med Rehabil. – 2005. – Vol. 86. – P.308-311.
10. Fink M., Rollnik J.D., Bijak M. Et al. Needle acupuncture in chronic poststroke leg spasticity // Arch Phys Med Rehabil. — 2004. – Vol. 85. – P.667-672.
11. Ivanhoe C.B., Francisco G.E., McGuire J.R. et al. Intrathecal baclofen management of poststroke spastic hypertonia: implications for function and quality of life // Arch Phys Med Rehabil. – 2006. – Vol. 87. – P. 1509-1515.
12. Ozcakir S., Sivrioglu K. Botulinum toxin in poststroke spasticity // Clin Med Res. – 2007. – Vol. 5. – P.132-138.
13. Taira T., Hori T. Intrathecal baclofen in the treatment of post-stroke central pain, dystonia, and persistent vegetative state // Acta Neurochir Suppl. – 2007. – Vol.97. – P. 227-229.
14. Ward A.B. A summary of spasticity management – a treatment algorithm // Eur. J. Neurol. – 2002. – Vol. 9. – Suppl.1. – P. 48-52.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Резюме
Двигательные нарушения в виде спастического пареза верхней конечности являются одним из наиболее частых последствий инсульта. При этом в конечности формируется моторный дефицит (слабость мышц/парез), отмечаются повышение мышечного тонуса, проприоцептивные нарушения и изменения в мышцах, суставах и окружающих тканях, что делает процесс ее функционального восстановления сложным, длительным и трудоемким.
В статье представлены факторы, оказывающие непосредственное влияние на восстановление функции верхней конечности после инсульта; показана важность своевременной диагностики всех развивающихся в ней изменений с применением необходимых оценочных шкал и создания оптимальных программ реабилитации с включением методик по восстановлению чувствительности, коррекции мышечного тонуса, современных методов реабилитации с биологической обратной связью (БОС) и т. д. Это помогает адаптировать пациентов в социуме и в быту, снизить уровень инвалидизации, что особенно важно для молодого и трудоспособного населения.
Анализ клинического наблюдения пациента Б. 22 лет с последствием инфаркта головного мозга в правой височно-теменной доле с хорошим функциональным исходом, благодаря использованию необходимых диагностических методов и индивидуально разработанной программе реабилитации, подчеркивает ценность и актуальность применения описанных в статье методик в процессе двигательного восстановления пациентов со спастическим парезом верхней конечности и проприоцептивными нарушениями после очагового поражения ЦНС.
Система БОС «Колибри» комплексная
Беспроводная технология передачи данных позволяет считать датчики Колибри лучшим решением для проведения БОС-тренингов разных модальностей для детей.
Подробнее
Введение
В настоящее время инсульт остается второй ведущей причиной смертности и инвалидности во всем мире [1]. Наиболее частым последствием инсульта являются двигательные нарушения в виде спастического пареза верхней конечности различной степени выраженности [2]. Целый комплекс проблем, возникающих в верхней конечности после инсульта: моторный дефицит (слабость мышц/парез), повышение мышечного тонуса, проприоцептивные нарушения и неизбежно возникающие изменения в мышцах, суставах и окружающих тканях, делают процесс ее функционального восстановления сложным, длительным и трудоемким.
В связи с этим крайне актуальна своевременная диагностика всего комплекса изменений, развивающихся в верхней конечности, знание и использование необходимых оценочных шкал, а также создание оптимальных программ реабилитации с включением в них наиболее эффективных методов [3]. Восстановление функции верхней конечности является одной из ключевых задач реабилитации после инсульта, выполнение которой необходимо для социально-бытовой адаптации пациентов и снижения уровня инвалидизации, особенно у трудоспособной категории пациентов. В настоящей статье обсуждаются современные методы диагностики и реабилитации проприоцептивных нарушений и спастичности, поскольку их наличие у пациентов после инсульта приводит к неиспользованию конечности и напрямую влияет на ее двигательное восстановление [4].
Кроме того, демонстрируется эффективность имплементации в индивидуальные реабилитационные программы новых методик коррекции нарушений чувствительности, мышечного тонуса и методов реабилитации с биологической
обратной связью (БОС) на примере клинического наблюдения с хорошим функциональным исходом.
Факторы, влияющие на двигательное восстановление конечности после инсульта
Восстановление функции верхней конечности после инсульта является клинически значимой проблемой. Понимание факторов, которые влияют на этот процесс, необходимо для построения индивидуально адаптированных стратегий реабилитации [5]. Пациенты, перенесшие инсульт, демонстрируют различные модели восстановления движений в верхней конечности, поскольку инсульт является гетерогенным заболеванием [4].
В настоящее время показано, что по ряду клинических и нейровизуализационных факторов, таких как возраст, наличие движений в конечности сразу после инсульта, объем поражения головного мозга, сохранность кортикоспинального тракта, количество баллов по шкале инсульта Национального института здоровья (NIHSS) и выраженности межполушарной асимметрии, можно с большой степенью вероятности спрогнозировать восстановление конечности [5]. Негативными предикторами функционального восстановления конечности наряду с размерами и локализацией очага поражения (левополушарное поражение) являются выраженность пареза и спастичности, наличие нарушений проприоцептивной чувствительности (ПЧ), а также мужской пол и степень снижения повседневной активности (по шкале Бартела) [6]. Сохранность сенсорной системы (кожных механорецепторов, проприорецепторов суставов и мышц, а также органа зрения) очень важна для планирования (система прямой связи) и управления движением (система с обратной связью), а также для последующего моторного обучения. При наличии у пациента после инсульта проприоцептивных нарушений в верхней конечности изменяется существующая в норме связь с моторной функцией, что негативно влияет на управление двигательным актом и становится фактором, снижающим реабилитационный потенциал пациента [7].
В связи с этим актуально их своевременное выявление и включение в программу реабилитации методов для ее восстановления. Наряду с проприоцептивными нарушениями и выраженностью пареза в верхней конечности избыточное повышение мышечного тонуса (более 2 баллов по шкале Эшворта) уже в ранние сроки после инсульта также является предиктором ее плохого двигательного восстановления. Поэтому своевременные диагностика и начало антиспастического лечения могут помочь в достижении лучшего результата реабилитации, предотвратить развитие осложнений (контрактур, боли и др.) и повысить качество жизни пациентов после инсульта [8].
Проприоцептивные нарушения
Проприоцептивная чувствительность – ощущение взаимного положения и движения конечностей и тела. Она играет решающую роль в управлении движениями и двигательном обучении [9, 10]. Нарушение ПЧ наблюдается у многих пациентов, перенесших инсульт. У 50–80% пациентов двигательные нарушения в конечностях сочетаются с полной или частичной утратой способности ощущать движения в сегментах конечностей [9]. У пациентов с центральными парезами состояние ПЧ рассматривается как важный прогностический показатель возможности восстановления двигательных функций [5, 8–10].
Своевременная диагностика ПЧ и последующее составление индивидуального плана реабилитационных мероприятий, включающего методики по восстановлению чувствительности, позволяют значительно увеличить эффективность реабилитации. В клинической практике для оценки ПЧ чаще всего используют шкалы Фугл-Мейера (FMA) и Ноттингемскую. Шкала FMA является наиболее изученным и известным инструментом для оценки степени сенсомоторных нарушений после инсульта. Она содержит 5 доменов по оценке двигательной функции, чувствительности (тактильной и глубокой), равновесия, амплитуды движений в суставах, болевой чувствительности. В верхней конечности ПЧ оценивается по отдельным сегментам. Пациенту с закрытыми глазами врач производит пассивное движение в тестируемом суставе, после чего тот должен описать это движение вербально. Оценка осуществляется по 3-балльной шкале [11]. По Ноттингемской шкале оценивают нарушения тактильной чувствительности, стереогнозиса и кинестезии.
При оценке кинестезии по 4-балльной шкале в одном тесте оцениваются: распознавание самого факта движения, его направление и точность восприятия изменения суставного угла [12]. Тестирование каждого сегмента конечности повторяют по 3 раза. Процедура тестирования аналогична описанной выше (для FMA), но пациент воспроизводит ощущение движения вербально или движением другой конечности. Недостатками обоих методов являются низкая детализация описания нарушений и сложность тестирования пациентов с речевыми и когнитивными нарушениями. Кроме того, отставленное во времени воспроизведение движений, в некоторых случаях используемое при тестировании, задействует кинестетическую память, которая может быть нарушена у пациентов с поражением ЦНС. В последние годы для оценки ПЧ применяется новый метод, основанный на одновременном копировании серии циклических односуставных движений, позволяющий более точно судить о пространственно-временных характеристиках проприоцептивного восприятия [13, 14].
Метод позволяет определять у пациента наличие и степень нарушений ПЧ в отдельных сегментах конечностей и отслеживать динамику их изменений в ходе реабилитации [13]. Пациенту с закрытыми глазами врач проводит серию тестирующих пассивных циклических движений исследуемого сегмента конечности (3–4 цикла за 12–20 с) с варьирующимися амплитудой и скоростью. Пациент, согласно полученной инструкции, во время выполнения тестирующих движений должен копировать их противоположной конечностью. Перед началом тестирования необходимо убедиться, что пациент понимает задание и способен выполнить копирование противоположной, условно здоровой, конечностью. Для этого его просят выполнить процедуру копирования под зрительным контролем. Во время исследования с помощью беспроводных инерционно-магнитометрических датчиков регистрируются углы (рис. 1) в тестируемом суставе и одноименном суставе другой конечности.
Рис. 1. Положение датчиков во время тестирования движений в локтевом суставе
На основе анализа зарегистрированных суставных углов оценивают схожесть пассивных и копирующих активных движений по качественным показателям, характеризующим наличие грубых нарушений при копировании, и по 4 количественным показателям:
- коэффициенту амплитуды (Камп);
- коэффициенту формы (Кфор);
- латентности начала копирования (Кнлат);
- средней в пределах теста латентности повторных циклических копирующих движений (Кцлат) [13].
Оценку степени сохранности проприоцептивного восприятия разных тест-движений проводят с использованием условного критерия нормы, разработанного при исследовании представительной выборки здоровых испытуемых. ПЧ признается сохранной, если копирование выполняется без качественных ошибок и значения не более 2 количественных показателей выходят за границы нормы [13, 14].
У здоровых испытуемых копирование происходит без качественных ошибок, с высокой точностью и практически без задержки. Таким способом можно объективно оценивать состояние ПЧ в любых сегментах конечности пациента в положении сидя или лежа, что дает возможность обследовать пациентов даже с самыми тяжелыми двигательными нарушениями. Метод позволяет проводить оценку состояния ПЧ даже без использования технических средств для регистрации суставных углов при копировании тест-движений. В этом случае оценка качества копирования может проводиться врачом визуально на основе только качественных показателей.
Для количественного выражения оценки состояния ПЧ может использоваться балльная шкала:
- 4 балла – пациент копирует все движения правильно и достаточно точно (ПЧ сохранна или близка к норме);
- 3 балла – копирует все движения правильно, но неточно, с видимой задержкой или искажением по амплитуде или форме движений (ПЧ ослаблена);
- 2 балла – правильно копирует только часть циклических тест-движений или выполняет дополнительные движения (среднее нарушение ПЧ);
- 1 балл – воспроизводит одиночное движение в том же суставе, но оно не совпадает ни с одним из пассивных тест-движений (сильное нарушение ПЧ);
- 0 баллов – копирующие движения вообще отсутствуют (полная потеря ПЧ) [9].
Спастичность
Умение выявлять спастичность уже в ранние сроки после инсульта важно для назначения адекватного лечения и составления соответствующей программы реабилитации с целью сохранения функции конечности. Для этого большинство специалистов используют 5-балльную модифицированную шкалу Эшворта (modified Ashworth Scale, mAS) [15]. В последние годы в клинической практике с этой целью также применяется модифицированная шкала Тардье (Modified Tardieu Scale – MTS), которая позволяет более точно определить и количественно измерить спастичность (угол, степень) [16]. Помимо выявления собственно спастичности, в реабилитационной практике с помощью ряда шкал оценивается степень ее влияния на активную и пассивную функцию конечности. Так, для оценки степени нарушения активной функции верхней конечности наиболее часто используют модифицированный тест Френчай (Modified Frenchay Test – MFT), шкалу оценки движений в руке (Action Research Arm Test – ARAT). Степень активности в повседневной жизни оценивают по шкале ограничения возможностей (Disability Assessment Scale – DAS), индексу Бартела (Barthel Index – BI) и др. [17, 18].
Ботулинотерапия спастичности
Уже несколько десятилетий препараты ботулинического токсина типа А (БТА) используются в реабилитации пациентов с поражениями ЦНС с фокальной и мультифокальной спастичностью для снижения мышечного тонуса и улучшения пассивной и активной функции верхней конечности [19]. Ботулинотерапия – эффективный и без опасный метод лечения спастичности с высоким уровнем убедительности рекомендаций [20–24]. Накоплен значительный клинический опыт использования препаратов БТА различных производителей, разработаны оптимальные терапевтические стратегии, отраженные в национальных и международных консенсусах разных стран и опубликованные в клинических рекомендациях национального и международного уровня [15, 19, 20]. В последнее десятилетие в России ботулинотерапия все более активно имплементируется в реабилитационный процесс в свете активно развивающейся доктрины 3-этапной системы реабилитации [15, 17, 18]. На российском рынке в начале 2000-х годов появились отечественные препараты БТА, один из которых – Релатокс® (АО «НПО «Микроген») с 2016 г. используется во многих реабилитационных центрах для лечения постинсультной спастичности верхней конечности после проведения многоцентрового простого слепого рандомизированного российского исследования «Оценка безопасности и эффективности препарата Релатокс® при спастичности руки после ишемического инсульта» [25]. За прошедшие с момента регистрации препарата 5 лет он доказал свою эффективность не только в снижении мышечного тонуса, увеличении объема активных и пассивных движений, но и в уменьшении уровня инвалидизации и боли, улучшении качества жизни пациентов [25].
БОС-технологии в реабилитации спастического пареза верхней конечности
Отсутствие поступления информации от конечности в соответствующие структуры головного мозга из-за пареза и проприоцептивных нарушений и ее неиспользование вследствие этого создает эффект «корковой деафферентации».
Для функционального восстановления конечности необходимо активирование путей «моторной адаптации». Это можно сделать с помощью метода БОС-тренировочного метода обучения сознательному контролю различных функций организма, прежде всего координации движений посредством принципа «обратной связи». С ее помощью можно частично заместить или усилить сенсорное восприятие производимых действий, моментально проанализировать и оценить результат. Посредством специальной аппаратуры пациенту через определенные стимулы (звуковые и визуальные образы) подается информация о функциональном состоянии мышц (или других органов) в реальном времени.
Пациент может изменять уровень активности конкретной группы мышц. Современные технологии позволяют формировать и другие каналы сенсорного восприятия (тактильные, вибропроприоцептивные и т. п.). Таким образом, у пациента формируются новые каналы связи между активностью его мышц и пониманием двигательного акта. Эти каналы в процессе тренировки частично, а иногда и полностью заменяют утраченную афферентацию. В настоящее время существует много различных современных устройств с БОС, используемых для восстановления верхней конечности (робототехника, экзоскелеты, виртуальная реальность и др.) [26].
Тренажеры с БОС вошли в стандарт оснащения центров и отделений медицинской реабилитации пациентов с соматическими заболеваниями, нарушениями функций опорно-двигательного аппарата, центральной и периферической нервной системы [27].
Одним из таких устройств, уже несколько лет успешно применяющихся в реабилитации пациентов со спастическими парезами верхней конечности, является отечественный комплекс коррекции движений «Колибри» – система, объединяющая в себе возможности корректора движений, электростимулятора и БОС-тренажера, с помощью которого можно стимулировать нужные мышцы, исправлять патологический двигательный стереотип и формировать новый, максимально приближенный к физиологическому [28].
Мультифункциональность комплекса, удобный и современный интерфейс, наличие беспроводных датчиков, «подстраивание» системы под индивидуальные возможности пациента и поэтапное усложнение программы, возможность дистанционного контроля выполнения сеансов и отслеживание эффективности медперсоналом, а также проведение тренинга в домашних условиях позволяют применять его не только на втором, но и на третьем этапе реабилитации, активно вовлекая пациента в процесс реабилитации, мотивируя его, что является крайне важным аспектом реабилитации.
Клиническое наблюдение
В качестве примера приводим результаты реабилитации пациента Б. 22 лет, находившегося в отделении медицинской реабилитации для взрослых с нарушениями центральной и периферической нервной системы ФГАУ «НМИЦ ЛРЦ» Минздрава России в марте-апреле и июне 2021 г. с диагнозом: цереброваскулярная болезнь, последствия инфаркта головного мозга от 09.06.2020 в правой височно-теменной доле с левосторонним спастическим гемипарезом, гемигипестезией, псевдобульбарной дизартрией, спастико-паретической формой.
При поступлении 22.03.2021 пациент отмечал снижение чувствительности в левой верхней конечности, невозможность ее использования в быту, ограничение сгибания кисти и пальцев, невозможность захвата предметов, участия руки в гигиенических и бытовых процедурах, а также подворот левой стопы во время ходьбы и сложности при произнесении слов. При физикальном осмотре значимых отклонений не было выявлено.
В неврологическом статусе: неравномерный спастический левосторонний гемипарез.
По шкале количественной оценки мышечной силы (Medical Research Council Weakness Scale – MRC)
- в руке: разгибание и сгибание в локтевом суставе – 3 балла, отведение и сгибание в плечевом суставе – 3 балла, сгибание и разгибание кисти – 2 балла, сгибание пальцев – 3 балла, разгибание – 1 балл;
- в ноге: разгибание и сгибание в тазобедренном суставе – 4 балла, разгибание в коленном суставе – 4 балла, сгибание – 3 балла, подошвенное сгибание стопы – 4 балла, тыльное сгибание стопы – 3 балла.
Мышечный тонус повышен по спастическому типу в мышцах: круглом пронаторе, сгибателях кисти и пальцев, в сгибателях локтевого сустава – 3 балла, сгибателях плечевого сустава – 1 балл, разгибателях коленного сустава и подошвенных сгибателях стопы – 3 балла.
Повышение сухожильных и периостальных рефлексов в левых конечностях и патологические стопные знаки (симптом Бабинского). Левосторонняя поверхностная и глубокая гемигипестезия в левых конечностях, более выраженная в руке. Координаторные пробы слева выполняет с мимопопаданием и неточностью. В пробе Ромберга неустойчив. Функции тазовых органов контролирует. Ходит с опорой на трость, используя зрительный контроль. Псевдобульбарная дизартрия, спастико-паретическая форма. Когнитивная и психическая сфера – норма: тест MoCA – 28 баллов, госпитальная шкала HADS – Т7, Д5. Общий балл по шкале FMA – 181 (норма – 226). Двигательная функция – 63 балла (верхняя конечность – 34 + нижняя конечность – 29) (норма – 66 + 34 балла соответственно). Равновесие – 11 баллов (норма – 14). Чувствительность – 19 баллов (норма – 24): поверхностная – 5 баллов (норма – 8), глубокая – 14 баллов (норма – 14). Объем движений и болевая чувствительность в суставах в норме – 44 + 44 балла. Ноттингемская шкала – 16 баллов: плечевой сустав, локтевой сустав, пронация/супинация предплечья – по 3 балла, лучезапястный сустав, пальцы кисти – 2 балла; тазобедренный, коленный, голеностопный суставы – 3 балла, палец стопы – 2 балла. Индекс Бартела – 90 баллов. Оценка по шкале реабилитационной маршрутизации (ШРМ) – 3 балла. При составлении реабилитационной программы у пациента со спастическим парезом верхней конечностии проприоцептивными нарушениями мультидисциплинарной реабилитационной командой (МДРК) в составе врача по физической и реабилитационной медицине, врача ЛФК, врача-физиотерапевта, логопеда и нейропсихолога были выбраны следующие домены по МКФ [26]: b260.3 проприоцептивная функция (тяжелые нарушения), b7301.3 сила мышц одной конечности (тяжелые нарушения), b7351.2 тонус мышц одной конечности (умеренные нарушения), b398.2 функции голоса и речи (умеренные нарушения), b144.0 функции памяти (норма), b160.0 функции мышления (норма). Определена цель лечения: обучение использованию руки в бытовых действиях (гигиена, одевание, употребление пищи и др.).
Поставлены задачи:
- уменьшение проприоцептивных нарушений и вовлечение руки в бытовые действия;
- снижение тонуса на 1 балл в мышцах: круглом пронаторе, сгибателях кисти и пальцев, в сгибателях локтевого сустава и увеличение объема движений в локтевом, лучезапястном суставах и пальцах кисти в левой руке с целью улучшения движений: пронации/супинации, сгибания/разгибания в локтевом суставе, кисти, пальцах;
- увеличение скорости ходьбы;
- улучшение произнесения слов, фазовой речи.
С целью восстановления ПЧ проведена ее инструментальная оценка с помощью регистрации суставных углов пассивных и копирующих активных движений в 8 тестах для руки: плечевой сустав – сгибание/разгибание (ПСР), отведение/приведение (ПОП), локтевой сустав – сгибание/разгибание (ЛСР), пронация/супинация предплечья (ПС), кисть – сгибание/разгибание (КСР), отведение/приведение (КОП). Все тесты проводили под зрительным контролем и с закрытыми глазами. Предварительное тестирование показало, что имеются грубые нарушения ПЧ в дистальных сегментах паретичной верхней конечности (рис. 2).

С учетом полученных данных для пациента был разработан индивидуальный план реабилитационных мероприятий. В качестве тренировочных упражнений, направленных на восстановление ПЧ движений предплечья и кисти, выполнялись упражнения по одновременному копированию с закрытыми глазами пассивных движений паретичной конечностью.
Эффективность их применения оценивали на основе мониторинга сенсомоторных показателей отдельных сегментов руки, в том числе ПЧ. Реабилитационная программа также включала:
- занятия по восстановлению моторной функции руки на роботизированном оборудовании с БОС «Армео», «Амадео» и комплексе «Колибри» (3 × 30 мин) по № 10;
- занятия по восстановлению мелкой моторики (30 мин) № 20;
- ЛФК индивидуально (2 р/сут по 30 мин) № 20;
- занятия на комплексе для анализа и коррекции нарушений ходьбы и координации движений с помощью расширенной виртуальной реальности С-Mill VR+ (30 мин) № 20;
- занятия с логопедом.
Пациент прошел 2 курса реабилитации в стационаре (22.03–12.04.2021 и 19.04–03.05.2021), между которыми проводилась амбулаторная реабилитация с идентичной программой.
В начале второго курса реабилитации в круглосуточном стационаре (19.04.2021) в связи со спастичностью в мышцах верхней конечности, затрудняющей процесс двигательного восстановления, под ультразвуковым контролем проведена инъекция БТА (Релатокс® в дозе 200 Ед: в лучевой и локтевой сгибатели кисти по 30 ЕД (суммарно60 ЕД), мышцы поверхностный и глубокий сгибатели пальцев по 50 ЕД, мышцу круглый пронатор 40 ЕД. Повторные тестирования ПЧ всех сегментов руки, проведенные через 10 дней, 1 мес. и 3 мес. от начала тренировки, показали улучшение копирования по количественным пространственно-временным показателям, но с отличающейся динамикой в различных сегментах конечности (рис. 3).

Метод диагностики ПЧ в сочетании с тренировками подтверждает важную роль обучения в восстановлении проприоцепции у пациентов с парезами в верхней конечности центрального генеза [9].
Через 3 мес. (после 2 курсов реабилитации в круглосуточном стационаре и активных (по 4–5 ч в день) амбулаторных занятий самореабилитацией с упражнениями по восстановлению ПЧ и использованием БОС-тренажера комплекса «Колибри) была отмечена значимая положительная динамика и достигнуты цели: расширились функциональные возможности верхней конечности, пациент стал использовать руку в быту (открывать/закрывать дверь, держать телефон, книгу, нажимать кнопки в лифте, использовать ее во время приема пищи, проведения гигиенических процедур и др.) и задачи реабилитации:
- уменьшилась выраженность чувствительных нарушений: отмечено восстановление поверхностной и глубокой чувствительности в мышцах предплечья и кисти (Ноттингемская шкала – 22 балла, по шкале FMA отмечено расширение функциональных возможностей руки с 34 до 37 баллов (общий балл – 190));
- снизился мышечный тонус на 1 балл через 1 мес. в мышцах-сгибателях кисти и пальцев (с 3 до 2 баллов). Нормализовался мышечный тонус в мышцах-сгибателях плечевого сустава. На фоне снижения мышечного тонуса произошло увеличение объема движений во всех суставах конечности. Наросла сила в мышцах-сгибателях и мышцах-разгибателях кисти и пальцев на 2 балла; в мышцах-сгибателях плечевого, локтевого, лучезапястного суставах, в мышцах-разгибателях плечевого сустава на 1 балл. Кроме того, значимо увеличилась скорость ходьбы и улучшилась речь. Все эти изменения позитивно сказались на уровне независимости пациента: ШРМ – 2 при выписке, индекс Бартела – 95 баллов.
Таким образом, положительный эффект проведенной реабилитации у пациента со спастическим парезом верхней конечности с грубым моторным и проприоцептивным дефицитом и целым спектром сопутствующих неврологических проблем – даже спустя 9 мес. после инсульта – был достигнут благодаря правильной оценке МДРК всех составляющих неврологического дефицита с применением МКФ, использованию как давно известных диагностических шкал, так и новых, апробируемых инструментов оценки; адекватно составленной реабилитационной программе с применением как традиционно используемых, так и инновационных методов, включая ботулинотерапию; проведению интенсивной и непрерывной самореабилитации с использованием упражнений по восстановлению ПЧ и БОС-технологий. Возможно, что появляющиеся в последние годы отечественные разработки: методы диагностики и реабилитации (оценка ПЧ и упражнения по ее восстановлению), реабилитационное оборудование (комплекс с БОС «Колибри») и медикаменты (препарат Релатокс®) внесут значимый вклад в реализацию программы 3-этапной реабилитации на территории нашей страны. Безусловно, эффективность их применения еще требует подтверждения и проведения исследований, однако не менее важен анализ отдельных клинических ситуаций, что и представлено в настоящей публикации.
Литература
- Katan M., Luft A. Global Burden of Stroke. Semin Neurol. 2018;38(2):208–211. DOI: 10.1055/s-0038-1649503.
- Gracies J.M., Bayle N., Vinti M. et al. Five-step clinical assessment in spastic paresis. Eur J Phys Rehabil Med. 2010;46(3):411–421. PMID: 20927007.
- Stinear C.M., Lang C.E., Zeiler S., Byblow W.D. Advances and challenges in stroke rehabilitation. Lancet Neurol. 2020;19(4):348–360. DOI: 10.1016/S1474-4422(19)30415-6.
- Langhorne P., Bernhardt J., Kwakkel G. Stroke rehabili-tation. Lancet. 2011;377:1693–1702. DOI: 10.1016/S0140-6736(11)60325-5.
- Lee J., Kim H., Kim J. et al. Differential early predictive factors for upper and lower extremity motor recovery after ischaemic stroke. Eur J Neurol. 2021;28(1):132–140. DOI: 10.1111/ene.14494.
- Левин О.С. Постинсультные двигательные нарушения. Современная терапия в психиатрии и неврологии. 2016;(3):25–32.
- Schabrun S.M., Hillier S. Evidence for the retraining of sensation after stroke: a systematic review. Clin Rehabil. 2009;(23):27–39. DOI: 10.1177/0269215508098897.
- Glaess-Leistner S., Song J.R., Audebert H.J., Wissel J. Early clinical predictors of post stroke spasticity. Top Stroke Rehabil. 2021;28(7):508–518. DOI: 10.1080/10749357.2020.1843845.
- Ostry D.J., Gribble P.L. Sensory plasticity in human motor learning. Trends Neurosci. 2016;39(2):114–123. DOI: 10.1016/j.tins.2015.12.006.
- Coupar F., Pollock A., Rowe P. et al. Predictors of upper limb recovery after stroke: a systematic review and meta-analysis. Clin Rehabil. 2009;(260):291–313. DOI: 10.1177/0269215511420305.
- Fugl-Meyer A.R., Jääskö L., Leyman I. et al. The post-stroke hemiplegic patient. 1. a method for evaluation of physical performance. Scand J Rehabil Med. 1975;7(1):13–31.
- Semrau J.A., Herter T.M., Scott S.H., Dukelow S.P. Robotic identification of kinesthetic deficits after stroke. Stroke. 2013:(44):3414–3421. DOI: 0.1161/STROKEAHA.113.002058.
- Павлова О.Г., Рощин В.Ю., Сидорова М.В. и др. Метод качественной и количественной оценки восприятия движений в отдельных суставах руки. Физиология человека. 2018;44(4):84–95. DOI: 10.1134/S0131164618040124.
- Рощин В.Ю., Павлова О.Г., Селионов В.А. и др. Сравнение объективных показателей проприоцептивного восприятия односуставных движений руки в положениях сидя и лежа у здоровых испытуемых и постинсультных больных. Физиология человека. 2019;45(4):62–70. DOI: 10.1134/S0131164619040131.
- Gracies J.M. Coefficients of impairment in deforming spastic paresis. Ann Phys Rehabil Med. 2015;58(3):173–178. DOI: 10.1016/j.rehab.2015.04.004.
- Хатькова С.Е. Современные тенденции в лечении постинсультной спастичности с использованием ботулинотерапии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(8):92–99.
- Хатькова С.Е., Орлова О.Р., Боцина А.Ю. и др. Основные принципы ведения пациентов с нарушением мышечного тонуса после очагового повреждения головного мозга. Consilium Medicum. 2016;18(2–1):25–33.
- Varvarousis D.N., Dimopoulos D., Vasileiadis G.I. et al. Do gait parameters improve after botulinum toxin injections in post stroke patients? A prospective
study. Toxicon. 2021;200:189–197. DOI: 10.1016/j.toxicon.2021.08.001. - Hoare B.J., Wallen M.A., Imms C. et al. Botulinum toxin A as an adjunct to treatment in the management of the upper limb in children with spastic cerebral palsy (UPDATE). Cochrane Database Syst Rev. 2010;2010(1):CD003469. DOI: 0.1002/14651858.CD003469.pub4.
- McIntyre A., Lee T., Janzen S. et al. Systematic review of the effectiveness of pharmacological interventions in the treatment of spasticity of the hemiparetic lower extremity more than six months post stroke. Top Stroke Rehabil. 2012;19(6):479–490. DOI: 10.1310/tsr1906-479.
- Ng Y., Chew E., Samuel G. et al. Advances in rehabilitation medicine, Singapore Med. J. 2013;54:538–551.
- Schramm A., Ndayisaba J.P., Auf dem Brinke M. et al. Spasticity treatment with onabotulinumtoxin A: data from a prospective Germanreal -life patient registry. J Neural Transm (Vienna). 2014;121(5):521–530. DOI: 10.1007/s00702-013-1145-3.
- Simpson D.M., Hallett M., Ashman E.J. et al. Practice guideline update summary: Botulinum neurotoxin for the treatment of blepharospasm, cervical dystonia, adult spasticity, and headache: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016;86(19):1818–1826. DOI: 10.1212/WNL.0000000000002560.
- Wu J., Cheng H., Zhang J. et al. Robot-Assisted Therapy for Upper Extremity Motor Impairment After Stroke: A Systematic Review and MetaAnalysis. Phys Ther. 2021;101(4):pzab010. DOI: 10.1093/ptj/pzab010.
- Хатькова С.Е., Костенко Е.В., Похабов Д.В. и др. Оценка безопасности и эффективности российского препарата ботулотоксина А Релатокс® в сравнении с Ботоксом® при спастичности руки после ишемического инсульта (мультицентровое рандомизированное исследование). Неврология, нейропсихиатрия, психосоматика. 2017;9(1):71–77.26.
- International Classification of Functioning, Disability and Health (ICF) (Electronic resource.) URL (access date: 08.17.2021).
- Приказ МЗ РФ №1705н от 29 декабря 2012 г. (Электронный ресурс.) URL (дата обращения: 29.12.2012).
- Система БОС «Колибри» комплексная — Нейротех. (Электронный ресурс.) URL (дата обращения: 17.08.2021).
Сведения об авторах
- Хатькова Светлана Евгеньевна – д.м.н., профессор, заведующая отделением медицинской реабилитации взрослых с нарушениями функции центральной и периферической нервной системы ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0002-3071-4712.
- Николаев Евгений Андреевич – врач-невролог ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0000-0003-0443-3201.
- Погорельцева Оксана Александровна – к.м.н., заведующая неврологическим отделением ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0003-1141-0091.
- Павлова Ольга Геннадьевна – д.биол.н., ведущий научный сотрудник ИВНД и НФ РАН; 117485, Россия, г. Москва, ул. Бутлерова, д. 5а; ORСID iD 0000-0001-5238-8383.
- Рощин Вадим Юрьевич – ведущий инженер ИВНД и НФ РАН; 117485, Россия, г. Москва, ул. Бутлерова, д. 5а; ORСID iD 0000-0003-4994-2376.
- Котляров Валерий Викторович – к.м.н., врач-невролог, врач функциональной диагностики, ООО «Поликлиника»; 357500, Россия, г. Пятигорск, ул. Широкая, д. 9.
Очаговое повреждение головного мозга у взрослых: синдром спастичности
Версия: Клинические рекомендации РФ 2013-2017 (Россия)
Категории МКБ:
Внутримозговое кровоизлияние (I61), Внутричерепная травма (S06), Другие уточненные травмы головы (S09.8), Другое нетравматическое внутричерепное кровоизлияние (I62), Инсульт, не уточненный как кровоизлияние или инфаркт (I64), Инфаркт мозга (I63), Множественные травмы головы (S09.7), Открытая рана головы (S01), Последствия внутричерепной травмы (T90.5), Последствия других уточненных травм головы (T90.8), Последствия неуточненной травмы головы (T90.9), Последствия открытого ранения головы (T90.1), Последствия цереброваскулярных болезней (I69), Субарахноидальное кровоизлияние (I60), Травма головы неуточненная (S09.9)
Разделы медицины:
Медицинская реабилитация, Неврология
Общая информация
Краткое описание
Профессиональные ассоциации:
• МООСБТ
• Союз реабилитологов РФ
• Ассоциация нейрохирургов России
• Общество неврологов
Клинические рекомендации
Очаговое повреждение головного мозга у взрослых: синдром спастичности
МКБ10:
I60/I61/I62/I63/I64/I69; S01/S06/S09.7/S09.8/S09.9; T90.1/T90.5/T90.8/T90.9
2016 (пересмотр каждые 5 лет)
Термины и определения
Нейропластичность – способность нервной ткани к структурно-функциональной перестройке, наступающей после еѐ повреждения [1].
Синдром верхнего мотонейрона – сборный термин, объединяющий симптомы поражения мотонейронов, располагающихся в головном мозге и/или кортико-спинальном тракте на шейном и грудном уровнях спинного мозга.
Спастичность – нарушение сенсомоторного контроля из-за повреждения верхнего мотонейрона, проявляющееся в перемежающейся или длительной непроизвольной активации мышц [2].
Парез – снижение мышечной силы, обусловленное поражением пирамидных и экстрапирамидных путей центральной нервной системы.
Медицинская реабилитация – комплекс мероприятий медицинского и психологического характера, направленных на полное или частичное восстановление нарушенных и (или) компенсацию утраченных функций пораженного органа либо системы организма, поддержание функций организма в процессе завершения остро развившегося патологического или обострения хронического патологического процесса в организме, а также на предупреждение, раннюю диагностику и коррекцию возможных нарушений функций поврежденных органов либо систем организма, предупреждение и снижение степени возможной инвалидности, улучшение качества жизни, сохранение работоспособности пациента и его социальную интеграцию в общество (Статья 40 Федерального закона N 323-ФЗ).
Краткая информация
После очагового поражения в ЦНС развивается целый комплекс нарушений моторного и не моторного характера, формируются биомеханические изменения в мышцах и окружающих структурах. Спастический парез является частым последствием повреждения ЦНС [3]. Парез, мышечная гиперактивность (в виде спастичности, спастической дистонии, ко-контракции), контрактура – три главные его составляющие, требующие особого внимания и своевременного лечения. Фокальная или мультифокальная спастичность может быть причиной нарушения активной и пассивной функции конечности, развития болевого синдрома, возникновения контрактур и гетеротопических оссификатов, сложностей в ношении ортезов, она может ухудшать прогноз функционального восстановления пациентов, снижать эффективность реабилитации, отрицательно влиять на мотивацию пациентов и ограничивать их социальную активность и адаптацию, что указывает на необходимость адекватных мер профилактики и лечения спастичности на всех этапах медицинской реабилитации пациентов с очаговым повреждением ЦНС [1, 4].
Своевременное выявление и правильное лечение больных со спастичностью представляется крайне важным и социально значимым, а также и фармако-экономически выгодным для общества, поскольку доказанным является тот факт, что прямые затраты на лечение пациентов с высоким мышечным тонусом после перенесенного инсульта в 4 раза превышают затраты, необходимые для лечения пациентов без такового [5].
Определение
Классическое определение Lance J.W. 1980 г., в котором спастичность определяется как моторное расстройство, характеризующееся зависимым от скорости повышением тонических рефлексов растяжения – мышечного тонуса – с повышенными сухожильными рефлексами вследствие гипервозбудимости рефлекса растяжения как компонента синдрома верхнего мотонейрона, в настоящее время пересмотрено, поскольку не достаточно полно отражает те сложные патофизиологические механизмы, лежащие в основе еѐ формирования и многообразие клинических характеристик этого симптомокомплекса [6].
Согласно же современному определению, спастичность – это нарушение сенсомоторного контроля из-за повреждения верхнего мотонейрона, проявляющееся в перемежающейся или длительной непроизвольной активации мышц (Группа EU-SPASM, 2006) [2].
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Кодирование по МКБ 10 и МКФ
В Клинических рекомендациях рассматриваются диагностика и лечение синдрома спастичности верхней конечности как компонента СВМТ при следующих заболеваниях по МКБ10:
Цереброваскулярные болезни (I60-I69)
I60 Субарахноидальное кровоизлияние
I61 Внутримозговое кровоизлияние
I62 Другое нетравматическое внутричерепное кровоизлияние
I63 Инфаркт мозга
I64 Инсульт, не уточненный как кровоизлияние или инфаркт
I69 Последствия цереброваскулярных болезней
Травмы головы (S00-S09)
S01 Открытая рана головы
S06 Внутричерепная травма
S09.7 Множественные травмы головы
S09.8 Другие уточненные травмы головы
S09.9 Травма головы неуточненная Последствия травм головы (T90)
T90.1 Последствия открытого ранения головы
T90.5 Последствия внутричерепной травмы
T90.8 Последствия других уточненных травм головы
T90.8 Последствия других уточненных травм головы
T90.9 Последствия неуточненной травмы головы
Согласно МКФ, в данных Клинических рекомендациях рассматриваются ограничения жизнедеятельности, связанные с нарушением следующих доменов здоровья и доменов, связанными со здоровьем:
s110 Структуры головного мозга
b730 Функции мышечной силы
b749 Функции мышц, другие уточненные и не уточненные
b760 Контроль произвольных двигательных функций
b798 Нейромышечные, скелетные и связанные с движением функции, другие уточненные
d430 Поднятие и перенос предметов
d440 Использование точных движений кисти
d445 Использование кисти и руки
d449 Перенос, перемещение и манипулирование объектами, другое уточненное и не уточненное
Классификация состояния: характерные клинические паттерны спастичности верхней и нижней конечности
По степени распространения спастичности выделяют [4, 23]:
— фокальную спастичность (например, сгибание кисти и пальцев кисти);
— мультифокальную спастичность (например, вовлечение нескольких суставов верхней или нижней конечностей или спастический гемипарез);
— региональную спастичность (например, спастический парапарез);
— генерализованную спастичность (например, спастический тетрапарез, диффузное повышение мышечного тонуса).
Наиболее часто при очаговых поражениях ЦНС формирование спастичности наблюдается в так называемых антигравитационных мышцах: сгибателях верхней и разгибателях нижней конечности. Правильное определение индивидуального мышечного паттерна, знание анатомии мышц являются одними из ключевых факторов при составлении алгоритма лечения, в формировании реабилитационных программ и очень значимым моментом для успешного проведения ботулинотерапии. В таблице 2 представлены наиболее характерные паттерны спастичности верхней и нижней конечности.
Таблица 1. Наиболее часто встречающиеся паттерны спастичности верхней и нижней конечности
| Паттерн | Вовлеченные мышцы* | Клинические проявления, осложнения |
| Верхняя конечность | ||
| Приведение и внутренняя ротация плеча |
Pectoralis major Subscapularis Teres major Latissimus dorsi Anterior deltoid |
ограничение объема пассивного и/или активного отведения и наружной ротации в плечевом суставе; боль при выполнении пассивного и/или активного отведения, наружной ротации в плечевом суставе; мацерация кожи подмышечной впадины; неприятный запах; трудности при осуществлении гигиенических процедур в подмышечной области; трудности в уходе, одевании, проведении реабилитационных мероприятий; формирование мышечной/суставной контрактур |
| Сгибание в локтевом суставе |
Brachialis Biceps brachii Brachioradialis |
ограничение объема пассивного и/или активного разгибания в локтевом суставе боль при выполнении пассивного и/или активного разгибания в локтевом суставе мацерация кожи в области локтевого сгиба трудности при одевании /например, при продевании руки в рукав/ изменение эстетического облика больного формирование мышечной/суставной контрактуры локтевого сустава |
| Пронированное предплечье |
Pronator teres Pronator quadratus |
ограничение объема пассивной и/или активной супинации предплечья болезненность при выполнении пассивной и/или активной супинации предплечья ограничение в выполнении многих бытовых манипуляций и при проведении реабилитации формирование мышечной/суставной контрактуры в суставе |
| Согнутая кисть |
Flexor carpi radialis Flexor carpi ulnaris Palmaris longus |
ограничение объема пассивного и/или активного разгибания в лучезапястном суставе боль при выполнении пассивного и/или активного разгибания в лучезапястном суставе трудности во время одевания /например, при продевании руки в рукав/ ограничения в выполнении многих бытовых манипуляций и при проведении реабилитации формирование мышечной/суставной контрактуры в лучезапястном суставе |
| Согнутые пальцы |
Flexor digitorum superficialis
Flexor digitorum profundus Interossei Lumbricales |
ограничение объема пассивного и/или активного разгибания пальцев
боль при выполнении пассивного и/или активного разгибания пальцев мацерация кожи ладони, неприятный запах трудности во время одевания /например, при надевании перчатки, варежки/ ограничения в выполнении многих бытовых манипуляций снижение или потеря функционального использования пальцев формирование мышечной/суставной контрактур |
| Деформация кисти «большой палец в ладони» |
Flexor pollicis longus Adductor pollicis Flexor pollicis brevis Opponens pollicis |
ограничение отведения большого пальца и затруднение в осуществлении захвата предметов пальцами кисти снижение манипулятивной способности пальцев невозможность или ограничение выполнения многих бытовых функций формирование мышечной/суставной контрактур |
| Нижняя конечность | ||
| Сгибание в бедре |
Iliopsoas Rectus femoris Adductors longus et brevis |
нарушение позы в положении сидя; нарушение паттерна ходьбы ходьба с паттерном «присаживания» и компенсаторным сгибанием колена для поддержания баланса влияние на сексуальную функцию |
| Приведение бедра |
Adductor longus et brevis Adductor magnus Gracilis Medial hamstrings |
cкрещенные бедра – поза «ножницы» — затруднение ухода за областью промежности сексуальные нарушения нарушение позы нарушение ходьбы — трудности отрыва и переноса конечности во время ходьбы |
| «Замороженное» колено |
Rectus femoris Vastus intermedius Vastus medialis Vastus lateralis |
нарушение паттерна ходьбы с сохранением разогнутого колена снижение скорости ходьбы функциональное удлинение ноги во время ходьбы |
| Сгибание в коленном суставе |
Medial hamstrings Lateral hamstrings |
нарушение походки: снижение скорости ходьбы, устойчивости во время ходьбы изменение позы в положении сидя ограничение выноса ноги вперед из-за сгибания ноги в коленном суставе разгибания колена во время окончания фазы переноса тела |
| Эквиноварусная деформация стопы, сгибание пальцев |
Gastrocnemius Soleus Tibialis posterior Tibialis anterior Flexor digitorum longus Flexor hallucis longus Flexor digitorum brevis |
изменение походки вследствие нарушения опорной функции стопы – «подворота» стопы при ходьбе с опорой на латеральный край стопы снижение скорости ходьбы нарушение баланса при ходьбе ограничение объема пассивного и/или активного тыльного сгибания стопы сгибание пальцев при ходьбе сгибание большого пальца при ходьбе трудности надевания и ношения обуви |
|
Переразгибание большого пальца стопы |
Extensor hallicis longus |
изменение походки: нарушение устойчивости вследствие переразгибания большого пальца при ходьбе трудности в надевании и ношении обуви повреждение целостности кожи и образование мозолей боль в пальце, стопе |
* Примечание: выделенным шрифтом обозначены мышцы, наиболее часто вовлекаемые в формирование паттерна
Этиология и патогенез
Спастичность является частью синдрома верхнего мотонейрона (СВМН), который возникает при поражении мотонейронов, располагающихся в головном мозге и при повреждении кортикоспинального тракта на шейном и грудном уровнях спинного мозга. СВМН – это сборный термин, объединяющий моторные и не моторные симптомы. К моторным проявлениям СВМН относят позитивные (различные формы непроизвольной мышечной гиперактивности) и негативные («симптомы выпадения») симптомы, а к не моторным: сенсорные (различные типы боли) и нейропсихологические нарушения [7-10]. Клиническая картина у пациентов с наличием СВМН характеризуется сочетанием негативных симптомов в виде мышечной слабости (пареза или плегии), потери ловкости и контроля за движениями и позитивных симптомов в виде спастичности и/или спастической дистонии, ко-контракции, патологических синергий и синкинезий, повышения сухожильных и периостальных рефлексов, патологическими рефлексами (Россолимо, Бабинского) и клонусами, то есть развитием спастического пареза. Выраженность клинических проявлений СВМН зависит от локализации и объема очага поражения.
Механизмы повышения мышечного тонуса не конца раскрыты. В основе нарушения мышечного тонуса при поражении ВМН лежит сложный и не до конца изученный комплекс изменений как в ЦНС так и на периферии – в мышцах, сухожилиях и других структурах: поражение не только пирамидных, но и экстрапирамидных путей, в частности ретикулоспинального тракта, приводящая к снижению тормозного влияния на альфа-мотонейроны спинного мозга; патологические изменения синапсов альфа-мотонейронов и вставочных нейронов, вызывающие их повышенную возбудимость; развивающаяся достаточно быстро реорганизация в мышцах, выражающаяся в изменении их состава и контрактильных свойств, генных изменениях и т.д., следствием чего является возникновение спастичности, гиперрефлексии, появление патологических рефлексов, первоочередная утрата наиболее тонких произвольных движений, а также биомеханические изменения в мышцах и пр. [11-14].
Эпидемиология
В Российской Федерации в 2015 году было зарегистрировано 418 602 случаев инсульта, что составило 535 случаев на 100 тыс. взрослого населения (из них 82% инфарктов г.м. и 18% кровоизлияний различного генеза) [15]. Частота возникновения инфарктов г.м. у лиц в возрасте до 45 лет, среди инсультов составляет в российской популяции 14% [16]. Также в России ежегодно около 600 тыс человек получает черепно-мозговые травмы (ЧМТ) различной степени тяжести. Количество пострадавших с тяжелой ЧМТ составляет 10 – 25 % от всех черепно-мозговых повреждений. Наибольший уровень травматизма отмечается в наиболее социально-активной возрастной группе от 20 до 40 лет [17, 18].
Спастичность развивается в среднем у 19–38% пациентов, выживших после инсульта [19, 20]. По данным ряда исследований фокальный мышечный гипертонус наблюдается уже в первые недели после инсульта у 21-24,5% пациентов [19, 20]. Среди пациентов, перенесших ЧМТ (независимо от еѐ тяжести), спастичность развивается примерно у 18%, причем риск еѐ возникновения коррелирует с длительностью нарушения сознания в остром периоде после травмы [21]. Распространенность спастичности у перенесших тяжелую ЧМТ пациентов (≤8 баллов по шкале комы Глазго в первые сутки после травмы) составляет 70-75% [22, 23]. В раннем периоде тяжелой ЧМТ повышенный мышечный тонус развивается у 57% и коррелирует со снижением их функциональной независимости через 1 год после травмы [24].
Диагностика
Диагностика
Для правильной постановки целей лечения пациента с синдромом спастичности, а также для разработки индивидуальной программы реабилитации с дальнейшей оценкой еѐ эффективности необходимо правильно уметь определять спастичность и степень еѐ выраженности, дифференцировать еѐ от других форм патологического изменения мышечного тонуса (ригидности, пластичности, контрактур), а также оценивать еѐ влияние на активную и пассивную функцию конечности, ежедневную жизнедеятельность и качество жизни пациента.
Жалобы и анамнез
Сбор жалоб и анамнеза проводится согласно общим правилам неврологического осмотра пациента. Требуется уделять внимание сведениям, получаемым от пациентов и родственников например, о наличии боли и о других факторах, способствующих усилению спастичности. Важны также сведения о преморбидном статусе пациента: его образовании, профессиональных навыках, опыте работы, предпочтениях в организации досуга, бытовых привычках и т.п. Необходимо подробно расспросить пациента чему именно мешает спастичность в повседневной жизни. Кроме того, важно учитывать, что спастичность может в ряде случаев облегчать выполнение ряда бытовых действий (удерживать предметы и т.д.). Все эти сведения требуются для обсуждения целей лечения с пациентом и его родственниками и реабилитационной командой и построения тактики лечения. В табл. 2 представлены возможные цели лечения пациента со спастичностью.
Физикальное обследование
Физикальное обследование подразумевает собой неврологический осмотр. Необходима оценка степени выраженности моторного повреждения: мышечной силы, изменения мышечного тонуса, объѐма пассивных и активных движений, поверхностной и глубокой чувствительности и пр. Отдельное внимание следует уделять выраженности когнитивных и речевых нарушений (в том числе синдромам апраксии и игнорирования), что важно учитывать при составлении реабилитационной программы.
Инструментальная диагностика
Для измерения объема движений в суставах конечностей используется гониометр. Гониометрия позволяет оценить объем пассивных и активных движений, угол возникновения остановки движения — «захвата» (catch). Также проверяется симметричность движений в правых и левых конечностях.
Таблица 2. Цели лечения спастичности [23]
| Ключевые домены | Ожидаемые результаты |
| Улучшение пассивной функции | увеличение объема пассивных движений с целью облегчения ухода за конечностью: гигиена, одевание и пр. |
| Снижение нагрузки на ухаживающих лиц | облегчение ежедневного ухода за пациентом |
| Улучшение активной функции конечности |
увеличение объема активных движений; улучшение манипулятивных способностей конечности; облегчение самообслуживания: гигиены, одевания, приема пищи, питья; а также перемещения (напр., с кровати в кресло и обратно); улучшение мобильности, скорости, качества ходьбы и т.д. |
| Устранение симптомов и нарушений |
облегчение боли; уменьшение частоты и выраженности мышечных спазмов; снижение выраженности непроизвольных ассоциативных движений (патологических синергий и синкинезий) |
| Предотвращение прогрессирования спастичности |
профилактика возникновения контрактур и деформаций конечностей; оптимизация позы лежа и сидя с целью профилактики трофических нарушений |
| Эстетические цели | эстетика позы |
| Оптимизация эффективности терапии | уменьшение количества применяемых других препаратов (антиспастических, обезболивающих, антидепрессантов и других) |
Диагностика с использованием шкал
Для определения спастичности и оценки ее влияния на разные аспекты социально-бытовой жизни, а также эффективности лечения, используются унифицированные шкалы.
Для первичной оценки спастичности широко используется пятибалльная модифицированная шкала Эшворта (modified Ashworth Scale, mAS), которая достаточно проста в использовании (Приложение Г 1) [25] .
Модифицированная шкала Эшворта широко используется в клинической практике благодаря еѐ простоте и небольшому количеству времени, затрачиваемому на еѐ применение. Однако данная шкала имеет ряд ограничений. Так, при еѐ использовании оценивается только само наличие сопротивления пассивному движению и не учитывается основная характеристика спастичности, а именно зависимость степени повышения тонического рефлекса на растяжение от скорости совершаемого пассивного движения. Таким образом, использование шкалы не позволяет абсолютно достоверно дифференцировать спастичность от других форм нарушения мышечного тонуса и наличия суставных контрактур.
Использование в клинической практике модифицированной шкалы Тардье (Tardieu Scale) позволяет достоверно определить причину повышения мышечного тонуса, например, наличие или отсутствие гиперактивности, в том числе и спастичности. Диагностика по данной шкале состоит из двух этапов: оценки длины и растяжимости мышцы и определения наличия и степени мышечного укорочения (определение угла возникновения сопротивления при разной скорости совершаемого пассивного движения и расчет угла спастичности) и определения степени спастичности [19, 26-28]. Использование данной шкалы хотя и требует больших временных затрат и определенного опыта, но дает врачу гораздо больше информации о спастичности и потому имеет большую диагностическую ценность, нежели модифицированная шкала Эшворта.
Динамику изменения степени спастичности должен оценивать один и тот же специалист у одного и того же пациента в одинаковых условиях, так как выраженность мышечного тонуса у пациентов с синдромом спастичности может меняться в течение суток и зависеть от разных внешних и внутренних факторов. Кроме того, для каждой шкалы характерна вариабельность при ее применении.
Помимо определения собственно спастичности, необходимо оценивать степень еѐ влияния на активную и пассивную функцию конечности, боль, социально-бытовую активность, эстетический вид и др. С этой целью применяется целый ряд шкал, апробированных в исследованиях. Так, для оценки степени нарушения активной функции верхней конечности наиболее часто используют модифицированный Френчай тест (Modified Frenchay Test, MFT), шкалу оценки движения в руке (Action Research Arm Test, ARAT); для оценки степени нарушения активной функции нижней конечности – десятиметровый тест ходьбы (10 Meters Walk Test) и пр. Оценку степени активности в повседневной жизни проводят по шкале степени ограничения возможностей (Disability Assessment Scale, DAS), индексу Бартел (Barthel Index, BI). Для оценки интенсивности боли, ассоциированной со спастичностью, применяют такие инструменты, как визуальная аналоговая шкала (Visual Analogue Scale, VAS); шкала интенсивности боли (Scale of Pain INtensity, SPIN), числовая шкала боли (Numeric Pain Scale, NPS). Степень вовлеченности в уход за больным родственников и других лиц можно определять по специальной шкале Caregiver Burden Scale и т.д. Однако не все шкалы на настоящий момент валидированы в России. Некоторые шкалы представлены в соответствующих клинических рекомендациях [29-31].
Рекомендации по диагностике спастичности
• Спастичность рекомендуется оценивать с помощью модифицированной шкалы Эшворта и/или модифицированной шкалы Тардье.
Уровень убедительности рекомендации A (уровень достоверности доказательств – 1b) [32, 33].
Комментарии: Использование модифицированной шкалы Тардье более предпочтительно для оценки спастичности, по сравнению с модифицированной шкалой Эшворта. Шкала Тардье в настоящее время не валидирована в России, но рекомендована к валидации на основе настоящих клинических рекомендаций.
• Для постановки индивидуальных целей реабилитации пациента рекомендовано использовать шкалу достижения индивидуальных целей GAS (Goal Attainment Scale).
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1b) [34, 35].
Комментарии: Шкала GAS имеет высокую ценность в условиях большого разнообразия ожиданий от лечения у пациентов и их семей [34, 35]. Постановка целей по шкале GAS формируется исходя из принципа SMART (Specific – индивидуальные; Measurable – измеряемые; Achievable – достижимые; Realistic – реалистичные; Timed – рассчитанные по времени). При использовании данного метода исходное функциональное нарушение каждого пациента необходимо описывать в соответствии с МКФ.
• Необходимо оценивать влияние спастичности на активную и пассивную функции конечности, общую активность в повседневной жизни, формирование и выраженность болевого синдрома.
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1а) [32, 33, 36].
Комментарии: Выбор конкретной шкалы (для оценки двигательной функции, качества жизни, боли и т.п.) определяется клинической картиной и целями реабилитации у конкретного пациента [32, 33, 36].
Лечение
Лечение синдрома спастичности
Лечебно-профилактические мероприятия пациентам с синдромом спастичности или с риском его формирования являются частью комплексной программы медицинской реабилитации больных после ОНМК или черепно-мозговой травмы. Крайне важным является максимально раннее определение алгоритма профилактических мероприятий уже в первые дни и недели после очагового поражения ЦНС, а также составление плана дальнейшего лечения и комплекса реабилитационных мероприятий в зависимости от клинического варианта спастичности (см. Приложение Б).
При ведении пациентов с синдромом спастичности необходимо в первую очередь выявить и постараться устранить внешние и внутренние факторы, которые дополнительно могут повышать мышечный тонус. К внешним факторам относятся неудобная тесная одежда, неправильно наложенные бандажи и ортезы, наличие постоянного мочевого катетера и др. К внутренним факторам относятся состояния, ухудшающие течение основного заболевания, такие как запоры, задержка мочи, пролежни, зоны гетеротопической оссификации, переломы и вывихи, инфекционные осложнения [37]. В ряде случаев одно лишь устранение данных факторов приводит к значительному снижению мышечного тонуса.
Фармакотерапия
Основным лечебным средством у больных со спастическим парезом являются миорелаксанты. Существуют 2 группы миорелаксантов: системного (пероральные миорелаксанты центрального или периферического действия) и фокального действия (препараты ботулинического токсина типа А — БТА) [38].
Ботулинический токсин
Ботулинический токсин – нейротоксин, вырабатываемый бактерией Clostridium botulinum, основной механизм действия которого заключается в блокировании холинергической передачи – высвобождения ацетилхолина в нейромышечном синапсе за счет блокады транспортного белка SNAP-25. Эффект от его внутримышечного применения проявляется локальным снижением мышечного тонуса в иньецируемых мышцах в течение нескольких месяцев после инъекции [39].
Согласно рекомендациям Американской академии неврологии 2016 года несколько препаратов БТА — абоботулотоксин, онаботулотоксин и инкоботулотоксин — имеют высочайший уровень рекомендаций А как эффективные препараты для снижения мышечного тонуса и улучшения пассивной функции конечности, а также один из них — абоботулотоксин — имеет еще уровень рекомендации В для улучшения активной функции конечности [40].
На сегодняшний день в России существует несколько препаратов БТА, использующихся с целью коррекции фокальной спастичности (Таблица 3). У каждого препарата имеется свой спектр показаний к лечению, в то время как противопоказания для проведения ботулинотерапии являются общими: беременность и период грудного вскармливания, острые инфекционные или неинфекционные заболевания, индивидуальная непереносимость компонентов препарата, воспалительный процесс в области предполагаемой инъекции, миастения, синдром Ламберта-Итона и болезни, вызывающие нарушение холинергической передачи.
Таблица 3. Препараты БТА, зарегистрированные в Российской Федерации для лечения спастичности (включены в перечень ЖНВЛП)
| Препарат | ЕД/флакон* | Вспомогательные вещества | Показания для лечения спастичности |
|
Абоботулотоксин А (Ботулинический токсин типа A-гемагглютинин комплекс), Франция |
500 или 300 |
Альбумин человека — 125 мкг; Лактоза 2,5 мг |
Фокальная спастичность верхней конечности у взрослых пациентов |
|
Онаботулотоксин А (Ботулинический токсин типа A-гемагглютинин комплекс), Ирландия |
100 |
Альбумин человека 500 мкг; Натрия хлорид 0,9 мг |
Фокальная спастичность: запястья и кисти, мышц голени у взрослых пациентов, перенесших инсульт |
| Инкоботулотоксин А (Ботулинический токсин типа А), Германия | 100 или 50 |
Альбумин человека 1000 мкг; Сахароза 4,7 мг |
Спастичность руки после инсульта |
| Ботулинический нейротоксин типа А, Китай | 100 или 50 |
Желатин (бычий) 5 мг; Декстран 25мг; Сахароза 25 мг |
Спастичность мышц верхней конечности: а) в области кисти, б) в области локтевого сустава, в) в области плеча Спастичность мышц нижней конечности: а) в области стопы, б) в области колена, в) в области бедра |
| Токсин ботулинический типа А в комплексе с гемагглютинином, Россия | 100 или 50 |
Желатин – 6 мг; Мальтоза – 12 мг |
Локальный мышечный спазм у взрослых и детей старше 2 лет (в т.ч. спастичность) |
Примечание: *единицы действия каждого препарата являются специфическими и не могут быть сравнимы или взаимозаменяемы.
Начало действия препарата отмечается уже через 5-7 дней, а при повторных инъекциях возможно и раньше, пик эффекта, выражающийся в снижении мышечного тонуса, наблюдается в среднем через 4-6 недель, а длительность действия составляет 3-4 месяца, что потенциально дает возможность в этот период «терапевтического окна» функционального восстановления [23, 39].
В качестве методов контроля инъекций, для обеспечения точного попадания в таргетные мышцы, возможно применение ЭМГ, электростимуляции или ультразвуковой метод контроля инъекций [6, 41, 42]. На территории РФ инъекции БТА могут проводиться только обученным специалистом, имеющим соответствующий сертификат.
Рекомендации по применению препаратов БТА
• Пациентам со спастичностью мышц верхней конечности ≥2 балла по mAS на любом реабилитационным периоде рекомендованы локальные инъекции БТА с целью уменьшения степени выраженности спастичности, улучшения пассивной функции конечности, улучшения самообслуживания и снижения болевого синдрома, связанного со спастичностью.
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1а) [40, 43].
Комментарии: Эффективность применения БТА при постинсультной спастичности верхней конечности показана в клинических исследованиях высокого класса доказательности с участием в общей сложности более 1500 пациентов [40, 43, 44]. Ботулинотерапию можно назначать уже через 1-2 недели после инсульта [43].
• Пациентам со спастичностью мышц верхней конечности ≥2 балла по mAS и с целями лечения, связанными с восстановлением активной функции верхней конечности, в период действия БТА рекомендованы высокоинтенсивные методики физической реабилитации.
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1b) [39, 40, 45].
Комментарии: Период действия БТА, составляющий 12-24 недели [39, 40, 43], следует использовать как «терапевтическое окно» для реализации интенсивных методов физической реабилитации на фоне снижения спастичности. Кроме того, в отдельном РКИ было показано преимущество назначения БТА (Абоботулинотоксина А в дозировке 1000 ЕД на верхнюю конечность) в отношении степени восстановления активных движений [39].
• Пациентам со спастичностью мышц нижней конечности ≥2 балла по mAS в любом реабилитационным периоде рекомендованы локальные инъекции БТА с целью уменьшения степени выраженности спастичности.
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1a) [40, 46].
Комментарии: Эффективность БТА в отношении снижения степени спастичности нижней конечности показана в нескольких РКИ высокого качества. В ряде работ также отмечается улучшение функции ходьбы на фоне снижения спастичности мышц ноги при терапии БТА [46].
Пероральные миорелаксанты
Из-за частых побочных эффектов и доказанной большей эффективности БТА, пероральные миорелаксанты не рекомендованы для снижения мышечного тонуса при мультифокальной/фокальной спастичности в качестве терапии первой линии. Сферой применения пероральных миорелаксантов является снижение мышечного тонуса с целью облегчения ухода у пациентов с генерализованной спастичностью, имеющих низкий реабилитационный потенциал [6, 40, 47-49].
Долгосрочное лечение пероральными миорелаксантами должно строго контролироваться, поскольку состояние пациента может меняться (например, повышение мышечного тонуса или, наоборот, уменьшение благодаря хирургическим вмешательствам или инъекциям БТА). Пациенты могут демонстрировать привыкание к лечению, однако следует учитывать, что увеличение суточных дозировок пероральных миорелаксантов сопровождается повышением их гепатотоксичности и требует дополнительного контроля за показателями функции печени [23, 50].
На Российском рынке представлены следующие пероральные миорелаксанты центрального действия.
Баклофен – миорелаксант центрального действия, производное гамма-аминомасляной кислоты (ГАМК), стимулирует ГАМК В-тормозные рецепторы, тормозит высвобождение возбуждающих медиаторов, угнетает моно– и полисинаптические рефлексы. Назначают лечение с небольших доз 0,01-0,015 г в день (по 0,005 г 2-3 раза в день) и постепенно повышают дозу каждые 3 дня по 0,005-0,015 в день в зависимости от степени выраженности спастичности, возраста больного и индивидуальной реакции на препарат. Средняя суточная доза при спастических парезах составляет 0,03-0,06 г, в отдельных случаях 0,075 г [1]. Возможно также назначение комбинации баклофена и диазепама, что обеспечивает больший терапевтический эффект при меньших дозах препаратов. В связи с тем, что баклофен снижает интенсивность рефлекса на растяжение, препарат уменьшает клонусы и болезненные непроизвольные мышечные спазмы. Побочные явления в виде общей слабости, ощущения тяжести в паретичной ноге наблюдаются почти у половины больных, но могут исчезнуть при уменьшении дозы препарата. При отмене препарата необходимо постепенное уменьшение дозы для предупреждения галлюцинаций и судорог.
Тизанидин – еще один миорелаксант центрального действия, оказывает возбуждающее действие на a2–адренергические рецепторы, в основном на уровне спинного мозга, снижает выброс возбуждающих аминокислот из промежуточных нейронов спинного мозга, избирательно подавляет полисинаптические механизмы, отвечающие за мышечный гипертонус. Тизанидин также снижает рефлексы на растяжение и болезненные мышечные спазмы. Он снижает сопротивление пассивным движениям, уменьшает спазмы и клонические судороги, а также повышает силу произвольных сокращений скелетных мышц. В дополнение к миорелаксирующим свойствам тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект. Препарат начинают применять по 0,001 – 0,002 г (в 1 или 2 приема), при необходимости суточную дозу повышают. Оптимальная индивидуальная суточная доза колеблется в пределах от 0,002 до 0,014 г в 2-3 приема [1].
Побочные эффекты различной степени выраженности в процессе увеличения дозы тизанидина возникают более чем у 60% больных, но могут регрессировать после снижения дозы препарата. Наиболее часто встречаются жалобы на слабость, сонливость, сухость во рту, у ряда больных отмечается снижение артериального давления, иногда сопровождающееся полуобморочным состоянием. В рандомизированном контролируемом исследовании было показано превосходство ботулинотерапии перед тизанидином в отношении степени снижения мышечного тонуса и профиля безопасности [51].
Толперизон – миорелаксант центрального действия — хорошо переносится больными, но, обладает слабым миорелаксирующим действием. Средняя суточная доза мидокалма составляет 0,15-0,45 г (по 1-3 драже 3 раза в день) [1].
Рекомендации по применению пероральных миорелаксантов
• Использование пероральных миорелаксантов показано с целью лечения генерализованной спастичности.
Уровень убедительности рекомендации B (уровень достоверности доказательств – 1b) [46].
Комментарии: Не ожидается выраженного эффекта в отношении снижения спастичности. Возможно возникновение дозо-зависимых седативных и других побочных эффектов, что необходимо контролировать.
• НЕ рекомендовано назначать пероральные миорелаксанты (баклофен, тизанидин и др) при постинсультной фокальной/мультифокальной спастичности.
Уровень убедительности рекомендации A (уровень достоверности доказательств – 1b) [38, 46, 51].
Комментарии: В РКИ было показано значимое преимущество БТА перед пероральным миорелаксантом в отношении снижения мышечного тонуса в верхней конечности у пациентов после инсульта [51]. При этом эффект применения перорального миорелаксанта не превосходил плацебо и ассоциировался со значимо большим количеством нежелательных явлений. Использование пероральных миорелаксантов показано в случае генерализованной спастичности, однако при этом также ожидаются дозо-зависимые седативные и другие побочные эффекты [38, 46].
Интратекальное введение баклофена
Интратекальное введение баклофена подразумевает прямое воздействие ГАМК-агонистов на спинной мозг с целью снижения спастичности при минимальных побочных эффектах. Эффективность метода доказана у больных с региональной спастичностью (спастической параплегией или парапарезом) вследствие спинномозговой травмы, рассеянного склероза, но пока не очевидна в отношении уменьшения постинсультной спастичности [52, 53], хотя в ряде работ был продемонстрирован положительный эффект [54-58].
Возможные побочные эффекты: бессонница, расстройства дыхания в случае передозировки, утечка цереброспинальной жидкости с головной болью, смещение, разобщение и блокада катетера, присоединение инфекции [59].
Рекомендации по интратекальному введению баклофена
• Интратекальное введение баклофена рекомендовано при региональной или генерализованной спастичности, не снижающейся на фоне лечения другими нехирургическими методами лечения.
Уровень убедительности рекомендации B (уровень достоверности доказательств – 2a) [46].
• Интратекальное введение баклофена рекомендовано пациентам со спастическим гемипарезом при неэффективности или непереносимости других нехирургических методов лечения
Уровень убедительности рекомендации B (уровень достоверности доказательств – 2b) [46, 60].
Комментарии: Метод может рассматриваться уже с 3 — 6 месяца после инсульта у пациентов, нечувствительных к другим методам [60].
Методы физической реабилитации
К подходам физической реабилитации, применяемым для снижения степени спастичности, можно отнести специальные лечебно-гимнастические приемы направленные на расслабление мышц, находящихся в состоянии повышенного тонуса, избирательные методики медицинского массажа и лечение положением. Хотя данные методики не являются основными в лечении и профилактике спастичности, однако используются для временного снижения степени еѐ выраженности при подготовке конечности к проведению ЛФК.
Методики ЛФК-комплекса
С помощью пассивных движений производится растяжение укороченных мышц. Пассивные движения осуществляются без активного мышечного содействия больного. Пассивные движения следует начинать с проксимальных отделов конечностей постепенно переходя к дистальным, при этом их темп должен быть медленным, плавным, без рывков. Пассивные движения проводят по возможности в полном объеме, изолированно в каждом суставе, обращая особое внимание на вращательные движения [1]. Объем и темп движений постепенно увеличиваются, число их для каждого сустава может быть от 5 до 10. Рекомендуемые интервалы между пассивными упражнениями – от 30 минут до 6 часов [61, 62].
Под влиянием пассивных движений паретичных конечностей отмечается активация соответствующих зон коры, причем эта активация по величине сравнима с активацией, вызываемой произвольными движениями [63].
Пассивные растяжения – это специальные лечебно-гимнастические упражнения на растяжение мышц, находящихся в повышенном тонусе, основанные на пассивном изменении длины мышцы в определенных положениях паретичной конечности, при которых происходит максимальное растяжение этих мышц («гипер-растяжение») [1, 64].
В рандомизированном контролируемом исследовании было показано, что 30-минутные ежедневные максимальные растяжения мышц, находящихся в состоянии повышенного тонуса значительно замедляют развития контрактур в конечности [64]. Пассивное растяжение также можно быть использоваться и самим пациентам в домашних условиях в рамках программ направленной самореабилитации [45].
Существуют и другие упражнения в рамках ЛФК-комплексов, направленные на снижение тонуса в целевых мышцах. Для расслабления мышц применяют также различные висы и потряхивания конечностей.
Рекомендации по применению методик ЛФК-комплекса
• Специальные лечебно-гимнастические приемы на расслабление, в частности пассивные растяжения мышц, рекомендованы для временного снижения степени выраженности спастичности, а также с целью профилактики формирования контрактур.
Уровень убедительности рекомендации B (уровень достоверности доказательств – 2b) [64].
Комментарии: Отдельные лечебно-гимнастические приемы на расслабление мышц обладают ограниченной доказательной базой [64], но их применение в рамках проведения ЛФК при повышенном мышечном тонусе является стандартом [1]. Данные методики могут применяться в дополнение к основной (медикаментозной) коррекции спастичности.
Методики медицинского массажа
Проведение массажа при спастическом парезе требует определенной осторожности и умения. Неадекватная стимуляция спастических мышц может привести к резкому повышению мышечного тонуса.
При массаже паретичных конечностей рекомендуется руководствоваться следующими правилами [1]: массаж верхней конечности следует начинать с проксимальных отделов – мышц плечевого пояса, массаж нижней конечности — с ягодичных мышц и мышц бедра, затем переходят к массажу более дистальных участков конечностей; при массаже мышц, в которых тонус повышен, следует применять лишь легкое поглаживание, темп массажных движений должен быть медленным; при массаже мышц-антагонистов, в которых тонус не повышен, можно использовать и другие массажные приемы: растирание и неглубокое разминание, эти мышцы можно массировать более энергично и в более быстром темпе.
При спастическом парезе используется также точечный массаж, который способствует выравниванию процессов возбуждения и торможения, нормализации реципрокных взаимоотношений мышц-антагонистов [1].
Рекомендации по применению методик медицинского массажа
• Специальные методы медицинского массажа могут применяться для временного снижения повышенного мышечного тонуса в дополнении к другим видам реабилитации.
Уровень убедительности рекомендации D (уровень достоверности доказательств – 5) [1].
Комментарии: Массаж как отдельный метод лечения спастичности не обладает доказательной базой, но является компонентом комплексной реабилитационной программы [1].
Лечение положением (позиционирование конечности)
Специальные укладки паретичных конечностей проводятся с помощью специальных лонгет, валиков и устройств в положении, противоположном позе Вернике-Манна, при этом растягиваются те мышцы, в которых мышечный тонус повышен более всего [1]. Для лечения положением также можно использовать специальные ортезы для стоп, кистей и пальцев, локтевого сустава. Чередуют укладку паретичных конечностей в положении больного на спине (1,5- 2 часа) и здоровом боку (40-50 минут).
У больных с черепно-мозговой травмой может быть использована укладка на животе с помощью лечебно-гимнастических матов со скатом. У больных со спастической параплегией в положении на спине используется растяжение приводящих и разгибательных мышц бедра с помощью Т-образного валика и подушек реклинаторов [1].
Лечение положением не производится во время приема пищи, ночного сна, проведения других лечебных мероприятий.
Рекомендации по позиционированию конечности
• Правильное позиционирование конечности (лечение положением) рекомендовано в дополнении к другим видам реабилитации с целью замедления прогрессирования спастичности и формирования контрактур.
Уровень убедительности рекомендации D (уровень достоверности доказательств – 5) [1, 65].
Комментарии: В клинических исследованиях не показано преимущества лечения положением по сравнению с традиционными методами физической реабилитации или отсутствием терапии в отношении спастичности, объема пассивного движения или активного использования руки в быту [44]. Однако специальные укладки могут применяться в качестве профилактических мер в дополнение к основной антиспастической терапии.
Физиотерапия
Методы физиотерапии не обладают высоким уровнем доказательности в отношении снижения мышечного тонуса и их эффект, как правило, очень непродолжителен. Чрескожная электронейростимуляция мышц (ЧЭНС) в сочетании другими видами лечения может временно снижать тонус. Предположительно, эффект связан с продукцией эндорфинов, которые снижают возбудимость мотонейронов, а также влияют и на ноцицептивную афферентацию, регулируя передачу болевых импульсов. Кроме того, предполагается, что ЧЭНС вызывает корковую синаптическую реорганизацию за счет повышения сенсорного входа, путем стимуляции толстых миелинизированных волокон типа А. Эффективность метода нуждается в подтверждении в рандомизированных контролируемых исследованиях [66-73].
Тонус мышц также может снижаться за счет вибрационного воздействия на мышцы, находящиеся в состоянии гипертонуса. Однако данный метод неэффективен для долгосрочного снижения спастичности [66].
Воздействие парафином (озокеритом) осуществляется с помощью аппликаций (чаще всего по кюветно-аппликационной методике) в виде широких полос, которые накладываются, прежде всего, на спастичные мышечные группы при температуре аппликаций 48-50 градусов и длительности воздействия 15-20 минут. Курс лечения включает 10-15 процедур, которые проводят ежедневно. Данные процедуры оказывают положительное воздействие (улучшение трофики), прежде всего на укороченные структуры мягких тканей [1].
Еще одним физиотерапевтическим методом лечения спастичности является магнитотерапия. При повышенном тонусе в верхней конечности можно использовать бегущее магнитное поле. Время процедуры составляет 15 мин. Курс лечения включает 10-15 процедур, которые желательно проводить ежедневно [1].
Рекомендации по применению методов физиотерапии
• ЧЭНС или вибрационное воздействие на мышцы рекомендованы для временного снижения повышенного мышечного тонуса и профилактики контрактур в дополнение к другим видам реабилитации при отсутствии противопоказаний.
Уровень убедительности рекомендации B (уровень достоверности доказательств – 2b) [46].
Комментарии: Согласно клиническим исследованиям, применение данных методик не способствует длительному снижение спастичности [46].
• Тепловое воздействие парафина, магнитотерапия на мышцы могут быть рекомендованы в комплексной реабилитации пациентов со спастичностью с целью улучшения трофики мягких тканей и профилактики формирования контрактур.
Уровень убедительности рекомендации D (уровень достоверности доказательств – 5) [1].
Комментарии: Данные методики не обладают доказательной базой.
Транскраниальная магнитная стимуляция (ТМС)
Транскраниальная магнитная стимуляция – это неинвазивный способ активации коры головного мозга, основанный на принципе электро-магнитной индукции. Активация нисходящего коркового влияния на спинальную рефлекторную активность усиливает тормозное влияние на чрезмерно возбужденные альфа-мотонейроны и, в конечном итоге, происходит снижение рефлекса растяжения и мышечного тонуса [74]. Эффективность метода в лечении синдрома спастичности показана в ряде работ, однако необходимо проведение дополнительных исследований [66, 75-77].
Также показана эффективность комбинированного лечения спастичности – ТМС и ботулинотерапии [78]. Однако в настоящее время доступность методики ограничена.
Рекомендации по применению ритмичной ТМС
• Пациентам с постинсультной спастичностью может быть назначена ритмичная ТМС при отсутствии противопоказаний к данной методике, еѐ доступности и наличии обученного персонала.
Уровень убедительности рекомендации D (уровень достоверности доказательств – 5) [79].
Комментарии: В настоящее время нет убедительных доказательств о влиянии ритмичной ТМС на симптомы постинсультной спастичности. Требуется проведение дополнительных исследований [80].
Хирургические методы
Хирургические методы лечения спастичности подразделяются на две основные группы: деструктивные и нейромодуляционные. Деструктивные нейрохирургические операции предполагают разрушение участков нервной системы, ответственных за проведение и поддержание патологической активности, лежащей в основе формирования повышения мышечного тонуса. К ним относятся задняя селективная ризотомия и селективная невротомия. Селективная дорсальная ризотомия используется в большей степени для купирования болевого синдрома, резистентного к фармакотерапии, чем для снижения спастичности.
При выраженном мышечном укорочении возможно применение хирургических вмешательств, дающих возможность функционального улучшения. К ним относятся: перемещение или удлинение сухожилий, невротомия. Так, при грубой мышечной варусной, эквиноварусной деформациях, сгибательной контрактуре пальцев стопы рассечение большеберцового нерва значительно улучшает баланс и функцию ходьбы [81]. Операции по удлинению сухожилий сгибателей локтя и мышц плеча эффективны у пациентов с постинсультной и постравматической спастичностью в отношении активной функции руки, боли в плече и снижения степени спастичности [82, 83]. В основе нейромодуляционных операций лежит установка устройств, подавляющих патологическую активность участков нервной системы за счет воздействия электрического тока [84, 85]. Хроническая электростимуляция спинного мозга является наиболее предпочтительным методом лечения, поскольку она позволяет регулировать мышечный тонус в зависимости от нужд реабилитационной программы. Это особенно актуально в группе больных, использующих повышенный тонус в нижней конечности в ходьбе [86].
Рекомендации по применению хирургических методов лечения
• Пациентам с фокальной или мультифокальной спастичностью в случае неэффективности ботулинотерапии могут быть показаны хирургические методы лечения спастичности.
Уровень убедительности рекомендации B (уровень достоверности доказательств – 2с) [4, 23].
• Пациентам с региональной спастичностью в случае неэффективности интратекального введения баклофена могут быть показаны хирургические методы лечения спастичности.
Уровень убедительности рекомендации B (уровень достоверности доказательств – 2с) [4, 23].
Критерии оценки качества медицинской помощи
Критерии качества специализированной медицинской помощи взрослым при спастичности в результате инсульта или ЧМТ представлены в Таблице 4.
Таблица 4. Критерии качества медицинской помощи
| N п/п | Критерии качества | Оценка выполнения |
| 1 | Медицинская реабилитация начата не позднее 48 часов от момента поступления в стационар | Да/Нет |
| 2 | Проводилась оценка мышечного тонуса пациента с применением модифицированной шкалы спастичности Ashworth | Да/Нет |
| 3 | Постановка индивидуальных целей реабилитации в соответствии c принципом SMART | Да/Нет |
| 4 | Оценка степени важности индивидуальных потребностей пациента | Да/Нет |
| 5 | Проведение инструктажа родственников больного по уходу, самостоятельным занятиям в течение госпитализации | Да/Нет |
| 6 | Оценка необходимости и возможности проведения ботулинотерапии для лечения спастичности | Да/Нет |
| 7 | Применялся комплекс реабилитационных мероприятий, направленных на восстановление двигательной активности в период снижения мышечного тонуса на фоне терапии спастичности | Да/Нет |
Информация
Источники и литература
-
Клинические рекомендации Ассоциации нейрохирургов России
-
Клинические рекомендации Всероссийского общества неврологов
-
Клинические рекомендации Союза реабилитологов России
- 1. Кадыков, А.С., Л.А. Черникова, Н.В. Шахпаронова, Реабилитация неврологических больных2008, Москва: МЕДпресс-информ. 564.
2. (SPASM), E.T.N.t.D.S.M.o.S. 2006. Centre for Rehabilitation and Engineering Studies University of Newcastle Stephenson Building Claremont Road Newcastle upon Tyne NE1 7RU UK.
3. Gracies, J.M., N. Bayle, M. Vinti, S. Alkandari, P. Vu, C.M. Loche, C. Colas, Five-step clinical assessment in spastic paresis. Eur J Phys Rehabil Med, 2010. 46(3): p. 411-21.
4. Brashear, A., Spasticity: diagnosis and management. 2nd ed2016, New York: Demos Medical Publishing, LLC.
5. Lundstrom, E., A. Smits, J. Borg, A. Terent, Four-fold increase in direct costs of stroke survivors with spasticity compared with stroke survivors without spasticity: the first year after the event. Stroke; a journal of cerebral circulation, 2010. 41(2): p. 319-24.
6. Хатькова, С.Е., О.Р. Орлова, А.Ю. Боцина, Р.К. Шихкеримов, К.А. П., Основные принципы ведения пациентов с нарушением мышечного тонуса после очагового повреждения головного мозга. CONSILIUM MEDICUM, 2016. 18(2.1): p. 25-33.
7. Gracies, J.M., Pathophysiology of spastic paresis. II: Emergence of muscle overactivity. Muscle Nerve, 2005. 31(5): p. 552-71.
8. Mayer, N.H., Clinicophysiologic concepts of spasticity and motor dysfunction in adults with an upper motoneuron lesion. Muscle Nerve Suppl, 1997. 6: p. S1-13.
9. Lance, J., Symposium synopsis in spasticity., in Disordered motor control., R. Feldman, R. Young, and W. Koella, Editors. 1980, IL: Year Book Medical Publishers: Chicago. p. 487–489.
10. Sheean, G., The neurophysiology of spasticity., in Upper Motor Neurone Syndrome and Spasticity., M.P. Barnes and G.R. Johnson, Editors. 2008, NY: Cambridge University Press: New York. p. 9–63.
11. Sheean, G., The pathophysiology of spasticity. Eur J Neurol, 2002. 9 Suppl 1: p. 3-9; dicussion 53-61.
12. Sherrington, C.S., The Integrative Action of the Nervous System.1947, New Haven: CT: Yale University Press.
13. Whitlock, J.A., Neurophysiology of spasticity., in The Practical Management of Spasticity in Children and Adults. , M.B. Glen and J. Whyte, Editors. 1990, PA: Lea & Febiger: Philadelphia. p. 8–33.
14. Burke, D., J. Wissel, G.A. Donnan, Pathophysiology of spasticity in stroke. Neurology, 2013. 80(3 Suppl 2): p. S20-6.
15. Министерство здравоохранения Российской Федерации Департамент мониторинга анализа и стратегического развития здравоохранения, ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России, Заболеваемость взрослого населения России в 2015 году. Статистические материалы. Часть III 2016, Москва
16. Добрынина, Л.А., Ишемический инсульт в молодом возрасте: причины, клиника, диагностика, прогноз восстановления двигательных функций, 2013: Москва. p. 48.
17. Овсянников, Д.М., А.А. Чехонацкий, В.Н. Колесов, А.И. Бубашвили, Социальные и эпидемиологические аспекты черепно-мозговой травмы (обзор). Саратовский научно-медицинский журнал, 2012. 8(3): p. 777–785.
18. Пошатаев, К.Е., Эпидемиологические и клинические аспекты черепно-мозговой травмы. Дальневосточный медицинский журнал, 2010(4): p. 125-8.
19. Tardieu, G., P. Lacert, Le tonus et ses troubles en clinique. Encyclopédie médico-chirurgicale.1977, Paris: Neurologie
20. Wissel, J., A. Manack, M. Brainin, Toward an epidemiology of poststroke spasticity. Neurology, 2013. 80(3 Suppl 2): p. S13-9.
21. Sendroy-Terrill, M., G.G. Whiteneck, C.A. Brooks, Aging with traumatic brain injury: cross-sectional follow-up of people receiving inpatient rehabilitation over more than 3 decades. Archives of physical medicine and rehabilitation, 2010. 91(3): p. 489-97.
22. Nakase-Richardson, R., S. McNamee, L.L. Howe, J. Massengale, M. Peterson, S.D. Barnett, O. Harris, M. McCarthy, J. Tran, S. Scott, D.X. Cifu, Descriptive characteristics and rehabilitation outcomes in active duty military personnel and veterans with disorders of consciousness with combat- and noncombat-related brain injury. Archives of physical medicine and rehabilitation, 2013. 94(10): p. 1861-9.
23. Royal College of Physicians, British Society of Rehabilitation Medicine, Chartered Society of Physiotherapy, A.o.C.P.I.i. Neurology, Spasticity in adults: management using botulinum toxin. National guidelines.2009, London: RCP.
24. Ganesh, S., A. Guernon, L. Chalcraft, B. Harton, B. Smith, T. Louise-Bender Pape, Medical comorbidities in disorders of consciousness patients and their association with functional outcomes. Archives of physical medicine and rehabilitation, 2013. 94(10): p. 1899-907.
25. Bohannon, R.W., M.B. Smith, Interrater reliability of a modified Ashworth scale of muscle spasticity. Physical therapy, 1987. 67(2): p. 206-7.
26. Tardieu, C., E. Huet de la Tour, M.D. Bret, G. Tardieu, Muscle hypoextensibility in children with cerebral palsy: I. Clinical and experimental observations. Arch Phys Med Rehabil, 1982. 63(3): p. 97-102.
27. Tardieu, G., S. Shentoub, R. Delarue, A la recherche d’une technique de mesure de la spasticite. Rev Neurol (Paris), 1954. 91(2): p. 143-4.
28. Tardieu, G., Les feuillets de l’infirmité motrice cérébrale., in Evaluation et caractères distinctifs des diverses raideurs d’origine cérébrale.1966, Association Nationale des IMC Ed.: Paris p. 1-28.
29. Союз Реабилитологов России, Ассоциация Психологов России. Клинико-психологическая диагностика и реабилитация пациентов с апраксиями при повреждениях головного мозга. 2016; Available from: https://rehabrus.ru/materialyi/normativnaya-baza-i-klinicheskie-rekomendaczii/ (дата обращения — 15.03.2017).
30. Союз Реабилитологов России, Российская ассоциация по спортивной медицине и реабилитации больных и инвалидов, Объединение нейроанестезиологов и нейрореаниматологов, Объективная оценка функции ходьбы, 2016. p. 30.
31. Союз Реабилитологов России, Ассоциация Психологов России, Инсульт у взрослых: центральный парез верхней конечности., 2017.
32. Rehabilitation Measures Database. Available from: http://www.rehabmeasures.org.
33. Canadian Partnership for Stroke Recovery. Available from: http://www.strokengine.ca/assess/.
34. Wissel, J., A.B. Ward, P. Erztgaard, D. Bensmail, M.J. Hecht, T.M. Lejeune, P. Schnider, M.C. Altavista, S. Cavazza, T. Deltombe, E. Duarte, A.C. Geurts, J.M. Gracies, N.H. Haboubi, F.J. Juan, H. Kasch, C. Katterer, Y. Kirazli, P. Manganotti, Y. Parman, T. Paternostro-Sluga, K. Petropoulou, R. Prempeh, M. Rousseaux, J. Slawek, N. Tieranta, European consensus table on the use of botulinum toxin type A in adult spasticity. J Rehabil Med, 2009. 41(1): p. 13-25.
35. Ashford, S., D. Jackson, L. Turner-Stokes, Goal setting, using goal attainment scaling, as a method to identify patient selected items for measuring arm function. Physiotherapy, 2015. 101(1): p. 88-94.
36. Кадыков, А.С., Л.С. Манвелова, Тесты и шкалы в неврологии: руководство для врачей2015, M: МЕДпресс – информ. 224.
37. Barnes, M.P., G.R. Johnson, UMN syndrome and spasticity. 2008, Cambridge Cambridge University Press.
38. Союз Реабилитологов России, Диагностика и лечение синдрома спастичности у взрослых пациентов с очаговыми поражениями центральной нервной системы и их последствиями в рамках оказания стационарной и амбулаторно-поликлинической медицинской помощи, 2016: Москва.
39. Gracies, J.M., A. Brashear, R. Jech, P. McAllister, M. Banach, P. Valkovic, H. Walker, C. Marciniak, T. Deltombe, A. Skoromets, S. Khatkova, S. Edgley, F. Gul, F. Catus, B.B. De Fer, C. Vilain, P. Picaut, Safety and efficacy of abobotulinumtoxinA for hemiparesis in adults with upper limb spasticity after stroke or traumatic brain injury: a double-blind randomised controlled trial. The Lancet. Neurology, 2015. 14(10): p. 992-1001.
40. Simpson, D.M., M. Hallett, E.J. Ashman, C.L. Comella, M.W. Green, G.S. Gronseth, M.J. Armstrong, D. Gloss, S. Potrebic, J. Jankovic, B.P. Karp, M. Naumann, Y.T. So, S.A. Yablon, Practice guideline update summary: Botulinum neurotoxin for the treatment of blepharospasm, cervical dystonia, adult spasticity, and headache: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology, 2016. 86(19): p. 1818-26.
41. Акулов, М.А., О.Р. Орлова, С.Е. Хатькова, Д.Ю. Усачев, В.О. Захаров, А.А. Томский, А.С. Орлова, Электромиографический контроль при проведении инъекций ботулотоксина типа А в мышцы верхней конечности при спастичности различной этиологии. ВОПРОСЫ НЕЙРОХИРУРГИИ, 2015(6): p. 38-45.
42. Walter, U., D. Dressler, Ultrasound-guided botulinum toxin injections in neurology: technique, indications and future perspectives. Expert review of neurotherapeutics, 2014. 14(8): p. 923-36.
43. Rosales, R.L., F. Efendy, E.S. Teleg, M.M. Delos Santos, M.C. Rosales, M. Ostrea, M.J. Tanglao, A.R. Ng, Botulinum toxin as early intervention for spasticity after stroke or non-progressive brain lesion: A meta-analysis. Journal of the neurological sciences, 2016. 371: p. 6-14.
44. Hatem, S.M., G. Saussez, M. Della Faille, V. Prist, X. Zhang, D. Dispa, Y. Bleyenheuft, Rehabilitation of Motor Function after Stroke: A Multiple Systematic Review Focused on Techniques to Stimulate Upper Extremity Recovery. Frontiers in human neuroscience, 2016. 10: p. 442.
45. Gracies, J., The Concept of Guided Self-Rehabilitation Contracts in the Treatment of Deforming Spastic Paresis. Physikalische Medizin, Rehabilitationsmedizin, Kurortmedizin, 2015. 25(03): p. IS26.
46. Winstein, C.J., J. Stein, R. Arena, B. Bates, L.R. Cherney, S.C. Cramer, F. Deruyter, J.J. Eng, B. Fisher, R.L. Harvey, C.E. Lang, M. MacKay-Lyons, K.J. Ottenbacher, S. Pugh, M.J. Reeves, L.G. Richards, W. Stiers, R.D. Zorowitz, Guidelines for Adult Stroke Rehabilitation and Recovery: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke, 2016. 47(6): p. e98-e169.
47. Hulme, A., W.J. MacLennan, R.T. Ritchie, V.A. John, P.A. Shotton, Baclofen in the elderly stroke patient its side-effects and pharmacokinetics. European journal of clinical pharmacology, 1985. 29(4): p. 467-9.
48. Jamous, A., P. Kennedy, C. Psychol, N. Grey, Psychological and emotional effects of the use of oral baclofen: a preliminary study. Paraplegia, 1994. 32(5): p. 349-53.
49. Goldstein, E.M., Spasticity management: an overview. Journal of child neurology, 2001. 16(1): p. 16-23.
50. Graham, L.A., Management of spasticity revisited. Age Ageing, 2013. 42(4): p. 435-41.
51. Simpson, D.M., J.M. Gracies, S.A. Yablon, R. Barbano, A. Brashear, Botulinum neurotoxin versus tizanidine in upper limb spasticity: a placebo-controlled study. Journal of neurology, neurosurgery, and psychiatry, 2009. 80(4): p. 380-5.
52. Penn, R.D., Intrathecal baclofen for spasticity of spinal origin: seven years of experience. Journal of neurosurgery, 1992. 77(2): p. 236-40.
53. Van Schaeybroeck, P., B. Nuttin, L. Lagae, E. Schrijvers, C. Borghgraef, P. Feys, Intrathecal baclofen for intractable cerebral spasticity: a prospective placebo-controlled, double-blind study. Neurosurgery, 2000. 46(3): p. 603-9; discussion 609-12.
54. Francisco, G.E., C. Boake, Improvement in walking speed in poststroke spastic hemiplegia after intrathecal baclofen therapy: a preliminary study. Arch Phys Med Rehabil, 2003. 84(8): p. 1194-9.
55. Horn, T.S., S.A. Yablon, D.S. Stokic, Effect of intrathecal baclofen bolus injection on temporospatial gait characteristics in patients with acquired brain injury. Arch Phys Med Rehabil, 2005. 86(6): p. 1127-33.
56. Ivanhoe, C.B., G.E. Francisco, J.R. McGuire, T. Subramanian, S.P. Grissom, Intrathecal baclofen management of poststroke spastic hypertonia: implications for function and quality of life. Arch Phys Med Rehabil, 2006. 87(11): p. 1509-15.
57. Meythaler, J.M., M.J. DeVivo, M. Hadley, Prospective study on the use of bolus intrathecal baclofen for spastic hypertonia due to acquired brain injury. Arch Phys Med Rehabil, 1996. 77(5): p. 461-6.
58. Remy-Neris, O., V. Tiffreau, S. Bouilland, B. Bussel, Intrathecal baclofen in subjects with spastic hemiplegia: assessment of the antispastic effect during gait. Arch Phys Med Rehabil, 2003. 84(5): p. 643-50.
59. Stempien, L., T. Tsai, Intrathecal baclofen pump use for spasticity: a clinical survey. American journal of physical medicine & rehabilitation / Association of Academic Physiatrists, 2000. 79(6): p. 536-41.
60. Francisco, G.E., S.A. Yablon, M.C. Schiess, L. Wiggs, S. Cavalier, S. Grissom, Consensus panel guidelines for the use of intrathecal baclofen therapy in poststroke spastic hypertonia. Top Stroke Rehabil, 2006. 13(4): p. 74-85.
61. Williams, P.E., Use of intermittent stretch in the prevention of serial sarcomere loss in immobilised muscle. Annals of the rheumatic diseases, 1990. 49(5): p. 316-7.
62. Tardieu, C., A. Lespargot, C. Tabary, M.D. Bret, For how long must the soleus muscle be stretched each day to prevent contracture? Developmental medicine and child neurology, 1988. 30(1): p. 3-10.
63. Nelles, G., W. Jentzen, M. Jueptner, S. Muller, H.C. Diener, Arm training induced brain plasticity in stroke studied with serial positron emission tomography. NeuroImage, 2001. 13(6 Pt 1): p. 1146-54.
64. Ada, L., E. Goddard, J. McCully, T. Stavrinos, J. Bampton, Thirty minutes of positioning reduces the development of shoulder external rotation contracture after stroke: a randomized controlled trial. Archives of physical medicine and rehabilitation, 2005. 86(2): p. 230-4.
65. Белова, А.Н., Нейрореабилитация: руководство для врачей2000 М.: Антидор. 568с.
66. Winstein, C.J., J. Stein, R. Arena, B. Bates, L.R. Cherney, S.C. Cramer, F. Deruyter, J.J. Eng, B. Fisher, R.L. Harvey, C.E. Lang, M. MacKay-Lyons, K.J. Ottenbacher, S. Pugh, M.J. Reeves, L.G. Richards, W. Stiers, R.D. Zorowitz, Guidelines for Adult Stroke Rehabilitation and Recovery: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke; a journal of cerebral circulation, 2016. 47(6): p. e98-e169.
67. Gracies, J.M., Physical modalities other than stretch in spastic hypertonia. Physical medicine and rehabilitation clinics of North America, 2001. 12(4): p. 769-92, vi.
68. Alabdulwahab, S.S., M. Al-Gabbani, Transcutaneous electrical nerve stimulation of hip adductors improves gait parameters of children with spastic diplegic cerebral palsy. NeuroRehabilitation, 2010. 26(2): p. 115-22.
69. Ring, H., H. Weingarden, Neuromodulation by functional electrical stimulation (FES) of limb paralysis after stroke. Acta neurochirurgica. Supplement, 2007. 97(Pt 1): p. 375-80.
70. Sahin, N., H. Ugurlu, I. Albayrak, The efficacy of electrical stimulation in reducing the post-stroke spasticity: a randomized controlled study. Disability and rehabilitation, 2012. 34(2): p. 151-6.
71. Lin, Z., T. Yan, Long-term effectiveness of neuromuscular electrical stimulation for promoting motor recovery of the upper extremity after stroke. Journal of rehabilitation medicine, 2011. 43(6): p. 506-10.
72. Yan, T., C.W. Hui-Chan, Transcutaneous electrical stimulation on acupuncture points improves muscle function in subjects after acute stroke: a randomized controlled trial. Journal of rehabilitation medicine, 2009. 41(5): p. 312-6.
73. Levin, M.F., C.W. Hui-Chan, Relief of hemiparetic spasticity by TENS is associated with improvement in reflex and voluntary motor functions. Electroencephalography and clinical neurophysiology, 1992. 85(2): p. 131-42.
74. Коржова, Ю.Е., А.В. Червяков, А.Г. Пойдашева, А.В. Переследова, Л.А. Черникова, Н.А. Супонева, М.А. Пирадов, Транскраниальная магнитная стимуляция в лечении спастичности. Вестник восстановительной медицины, 2014(1): p. 80-7.
75. Червяков, А.В., А.Г. Пойдашева, Ю.Е. Коржова, Н.А. Супонева, Л.А. Черникова, М.А. Пирадов, Современные терапевтические возможности ритмической транскраниальной магнитной стимуляции в лечении заболеваний нервной системы. Русский медицинский журнал, 2014. 22(22): p. 1567-72.
76. Chervyakov, A.V., A.V. Peresedova, A.G. Poidasheva, Y.E. Korzhova, N.G. Savitskaya, L.A. Chernikova, V.V. Gnezditsky, I.A. Zavalishin, M.A. Piradov, Intermittent theta burst stimulation in treatment of pharmacoresistant spasticity. Clinical Neurophysiology, 2014. 125(S1): p. 203.
77. Коржова, Ю.Е., А.В. Червяков, А.Г. Пойдашева, И.А. Кочергин, А.В. Переседова, М.Н. Захарова, Н.А. Супонева, Ч. Л.А., П. М.А., Применение транскраниальной магнитной стимуляции в лечении синдрома спастичности при вторично-прогредиентном рассеянном склерозе. ВОПРОСЫ КУРОРТОЛОГИИ, ФИЗИОТЕРАПИИ И ЛЕЧЕБНОЙ ФИЗИЧЕСКОЙ КУЛЬТУРЫ, 2016. 5: p. 8-13.
78. Yamada, N., W. Kakuda, T. Kondo, S. Mitani, M. Shimizu, M. Abo, Local muscle injection of botulinum toxin type a synergistically improves the beneficial effects of repetitive transcranial magnetic stimulation and intensive occupational therapy in post-stroke patients with spastic upper limb hemiparesis. European neurology, 2014. 72(5-6): p. 290-8.
79. Barros Galvao, S.C., R. Borba Costa dos Santos, P. Borba dos Santos, M.E. Cabral, K. Monte-Silva, Efficacy of coupling repetitive transcranial magnetic stimulation and physical therapy to reduce upper-limb spasticity in patients with stroke: a randomized controlled trial. Arch Phys Med Rehabil, 2014. 95(2): p. 222-9.
80. Черникова, Л.А., Инновационные технологии в нейрореабилитации.2016, М.: МИА. 344.
81. Rousseaux, M., N. Buisset, W. Daveluy, O. Kozlowski, S. Blond, Long-term effect of tibial nerve neurotomy in stroke patients with lower limb spasticity. J Neurol Sci, 2009. 278(1-2): p. 71-6.
82. Anakwenze, O.A., S. Namdari, J.E. Hsu, J. Benham, M.A. Keenan, Myotendinous lengthening of the elbow flexor muscles to improve active motion in patients with elbow spasticity following brain injury. J Shoulder Elbow Surg, 2013. 22(3): p. 318-22.
83. Namdari, S., H. Alosh, K. Baldwin, S. Mehta, M.A. Keenan, Outcomes of tendon fractional lengthenings to improve shoulder function in patients with spastic hemiparesis. J Shoulder Elbow Surg, 2012. 21(5): p. 691-8.
84. Peacock, W.J., L.A. Staudt, Functional outcomes following selective posterior rhizotomy in children with cerebral palsy. J Neurosurg, 1991. 74(3): p. 380-5.
85. Шабалов, В.А., А.В. Декопов, А.А. Томский, Е.М. Салова, Задняя селективная ризотомия в лечении тяжелого спастического синдрома при ДЦП. Вопросы нейрохирургии им. Бурденко, 2010. 74(2): p. 14-18.
86. Dimitrijevic, M.M., M.R. Dimitrijevic, L.S. Illis, K. Nakajima, P.C. Sharkey, A.M. Sherwood, Spinal cord stimulation for the control of spasticity in patients with chronic spinal cord injury: I. Clinical observations. Cent Nerv Syst Trauma, 1986. 3(2): p. 129-44.
87. Essential Evidence Plus. Available from: http://www.essentialevidenceplus.com/product/ebm_loe.cfm?show=oxford.
88. The selection and use of essential medicines. Report of the WHO Expert Committee, 2002 (including the 12th Model list of essential medicines). World Health Organization technical report series, 2003. 914: p. i-vi, 1-126.
- 1. Кадыков, А.С., Л.А. Черникова, Н.В. Шахпаронова, Реабилитация неврологических больных2008, Москва: МЕДпресс-информ. 564.
Информация
Ключевые слова
Центральный парез, спастичность, двигательная реабилитация
Список сокращений
БТА – ботулинический токсин типа А
ЛФК – лечебная физкультура
МКБ10 – международная классификация болезней 10-го пересмотра
МКФ – международная классификация функционирования
МООСБТ – Межрегиональная общественная организация специалистов ботулинотерапии
РКИ – рандомизированное контролируемое исследование
СВМН – синдром верхнего мотонейрона
ТМС – транскраниальная магнитная стимуляция
ТЭС – терапевтическая электростимуляция
УЗ – ультразвук
ФЭС – функциональная электростимуляция
ЦНС – центральная нервная система
ЧМТ – черепно-мозговая травма
ЧЭНС – чрескожная электронейростимуляция
ЭМГ – электромиография
ARAT – Action Research Arm Test, шкала оценки движения в руке
BI – Barthel Index, индекс Бартел
DAS – Disability Assessment Scale, шкала степени ограничения возможностей
GAS – Goal Attainment Scale, шкала достижения индивидуальных целей
mAS – modified Ashworth Scale, модифицированная шкала Эшворта
MFT – Modified Frenchay Test, модифицированный Френчай тест
NPS – Numeric Pain Scale, числовая шкала боли
SPIN – Scale of Pain Intensity, шкала интенсивности боли
VAS – Visual Analogue Scale, визуальная аналоговая шкала
Приложение А1. Состав Рабочей группы
Акулов М. А. – научный сотрудник отделения клинической реабилитации нейрохирургических больных ФГБНУ НИИ нейрохирургии им. акад. Н.Н. Бурденко. Представитель МООСБТ.
Боцина А. Ю. – к.м.н., заведующая отделением для больных с острым нарушением мозгового кровообращения. Представитель МООСБТ.
Воронов Д. Б. – врач-невролог первой категории, руководитель кабинета диагностики и лечения заболеваний экстрапирамидной системы и ботулинотерапии при неврологической патологии Областного консультативного центра, г. Ростов-на-Дону, не является представителем профессиональных ассоциаций.
Даминов В. Д. – д.м.н., заведующий отделением восстановительного лечения ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России. Представитель Общероссийской общественной организации «Союз Реабилитологов России».
Завалий Л. Б. – к.м.н., врач-невролог НИИ скорой помощи им. Н. В. Склифосовского. Представитель МООСБТ.
Иванова Н. Е. – д.м.н., профессор, член правления Ассоциации нейрохирургов России, заместитель директора НИИ неврологии и нейрохирургии им. Н.Н.Поленова имени профессора А. Л. Поленова. Представитель Ассоциации нейрохирургов России.
Каракулова Ю. В. – д.м.н., профессор кафедры неврологии им. В.П. Первушина, ГОУ ВПО «ПГМА им.ак.Е.А. Вагнера Росздрава». Представитель МООСБТ, Всероссийского общества неврологов.
Костенко Е. В. – д.м.н., заведующая филиалом №7 ГАУЗ МНПЦ «Московский научно-практический центр медицинской реабилитации, восстановительной и спортивной медицины Департамента здравоохранения города Москвы». Представитель МООСБТ, Всероссийского общества неврологов.
Можейко Е. Ю. – д.м.н., доцент Кафедры нервных болезней с курсом медицинской реабилитации КрасГМУ. Представитель регионального отделения общероссийской общественной организации «Союз Реабилитологов России» и член красноярского общества неврологов.
Мокиенко О. А. – к.м.н., научный сотрудник Отделения нейрореабилитации и физиотерапии ФГБНУ Научный центр неврологии и НИИ Трансляционной медицины ГБОУ ВПО РНИМУ им. Н.И. Пирогова, Москва. Представитель Общероссийской общественной организации «Союз Реабилитологов России».
Орлова О. Р. – д.м.н., профессор, Первый МГМУ им. И.М. Сеченова. Президент МООСБТ.
Прокопенко С. В. – д.м.н., профессор, главный внештатный специалист по реабилитации СФО, заведующий Кафедрой нервных болезней с курсом медицинской реабилитации КрасГМУ, Красноярск. Представитель Общероссийской общественной организации «Союз Реабилитологов России».
Хасанова Д. Р. – д.м.н., профессор, главный ангионевролог РТ, руководитель Республиканского Головного сосудистого центра, член правления Всероссийского общества неврологов Татарстана, член правления Национальной Ассоциации по Борьбе с Инсультом (НАБИ), руководитель клинического направления «Неврология» МКДЦ, Представитель Общероссийской общественной организации «Союз Реабилитологов России»
Хатькова С. Е. – д.м.н., профессор, заведующая Отделением неврологии для больных с острым нарушением мозгового кровообращения ФГАУ ЛРЦ МЗ РФ. Представитель МООСБТ.
Шихкеримов Р. К. – д.м.н., главный невролог ЮАО г. Москвы, заведующий неврологическим отделением ГБУЗ «ГП № 166 ДЗМ», Москва. Представитель МООСБТ.
Профессиональные организации, принимавшие участие в подготовке клинических рекомендаций:
• МООСБТ
• Союз реабилитологов России
• Ассоциация нейрохирургов России
• Общество неврологов
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. врач мануальной терапии;
2. врач-невролог;
3. врач-нейрохирург;
4. врач-остеопат;
5. врач-травматолог-ортопед;
6. врач по лечебной физкультуре;
7. врач по медицинской реабилитации;
8. врач-физиотерапевт;
9. инструктор-методист по лечебной физкультуре;
10. инструктор по лечебной физкультуре;
11. инструктор по трудовой терапии;
12. медицинская сестра по массажу;
13. медицинская сестра по реабилитации;
14. медицинская сестра по физиотерапии.
Для определения уровня достоверности доказательств использовалась шкала оценки уровня доказательности методов терапии Центра доказательной медицины, Оксфорд (Таблица П1) [87].
Уровни убедительности рекомендаций обозначены в соответствии со шкалой GRADE (Grading оf Recommendations Assessment, Development and Evaluation) (Таблица П2) [88].
Производить обновление клинических рекомендаций необходимо не реже чем один раз в пять лет с учетом появляющейся новой информации о тактике лечения синдрома спастичности. Решение об обновлении принимает Минздрав РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки изменений в доказательной базе, результаты проведенных исследований и клинических апробаций, а также вновь появившихся медицинских технологий, новых лекарственных препаратов, методов реабилитации.
Таблица П1. Шкала оценки уровня достоверности доказательств Центра доказательной медицины, Оксфорд [87]
| I. Для методов лечения и реабилитации | |
| Уровень доказательности | Пояснение |
| 1a | Гомогенные систематические обзоры, включающие РКИ |
| 1b | Отдельные РКИ с узким доверительным интервалом |
| 1c | Требующие уточнения РКИ |
| 2a | Гомогенные систематические обзоры или когортные исследования |
| 2b | Индивидуальные когортные исследования или РКИ низкого качества |
| 2c | Исследования исходов, экологические исследования |
| 3a | Гомогенный систематический обзор контролируемых исследований |
| 3b | Отдельное контролируемое исследование |
| 4 | Серия случаев, или когортные исследования низкого качества, или контролируемые исследования низкого качества |
| 5 | Экспертное мнение, не подверженное явной критике, либо основанное на понимании физиологии, данных доклинических исследований или основных принципах терапии |
| II. Для методов диагностики | |
| 1a | Гомогенный систематический обзор диагностических исследований Уровня 1; клиническое правило из исследований Уровня 1b, проведенными в различных клинических центрах |
| 1b | Валидирующее когортное исследование с хорошими референтными стандартами или клиническое правило, протестированное в одном центре |
| 1c | Метод обладает абсолютной чувствительностью или специфичностью |
| 2a | Гомогенный систематический обзор диагностических диагностических исследований Уровня 2 или 3a |
| 2b | Поисковые когортные исследования с хорошими референтными стандартами; клиническое правило на основе вывода из исследования или валидированное по базе данных |
| 3a | Гомогенный систематический обзор диагностических диагностических исследований Уровня 3b и ниже |
| 3b | Непоследовательное исследование; или неправильно применѐнный референтный тест |
| 4 | Серия случаев, низкокачественный или сомнительный стандарт |
| 5 | Экспертное мнение, не подверженное явной критике, либо основанное на понимании физиологии, данных доклинических исследований или основных принципах диагностики |
Таблица П2. Шкала оценки уровня убедительности рекомендаций GRADE [88]
| Уровень рекомендации | Пояснение |
| А |
Дальнейшие исследования вряд ли изменят мнение об оценке эффекта. Доказательность основана на нескольких исследованиях высокого качества с согласующимися результатами или, в определенных случаях, на одном исследовании высокого качества. |
| В |
Дальнейшие исследования могут оказать значимое влияние на мнение в отношении эффекта и даже изменить его. Доказательность основана на одном исследовании высокого качества или нескольких исследованиях с определенными ограничениями. |
| С |
Дальнейшие исследования, скорее всего, существенно повлияют на мнение относительно эффекта и, возможно, его изменят. Доказательность основана на одном или нескольких исследованиях с серьезными ограничениями. |
| D |
Достоверность суждения не установлена. Доказательность основана на экспертном мнении или нескольких исследованиях с очень серьезными ограничениями. |
Приложение А3. Связанные документы
Данные клинические рекомендации разработаны с учѐтом следующих нормативно-правовых документов:
— Приказ №1705н от 29.12.2012 «Об утверждении Порядка организации медицинской реабилитации» (зарегистрирован в Минюсте России 22.02.2013 №21276);
— Приказ Минздрава России от 15.11.2012 №928Н «Об утверждении Порядка оказания медицинской помощи больным с острыми нарушениями мозгового кровообращения» (зарегистрирован в Минюсте России 27.02.2013 №27353);
— Приказ Минздрава России от 15.11.2012 №926н «Об утверждении Порядка оказания медицинской помощи взрослому населению при заболеваниях нервной системы» (зарегистрирован в Минюсте России 23.01.2013 №26692);
— Приказ №801н от 25.07.2011 в редакции Приказа Минздрава России от 30.03.2012 №302н (зарегистрировано в Минюсте России 07.09.2011 №21754) «Об утверждении Номенклатуры должностей медицинского и фармацевтического персонала и специалистов с высшим и средним профессиональным образованием учреждений здравоохранения»;
— Приказ от 06.08.2013 №529 «Об утверждении номенклатуры медицинских организаций» (зарегистрирован в Минюсте России 13.09.2013 №29950);
— порядки оказания медицинской помощи (больным с ОНМК, взрослому населению по профилю «нейрохирургия»);
— стандарты медицинской помощи (специализированной и амбулаторно-поликлинической);
— Клинические рекомендации Союза реабилитологов России «Клинико-психологическая диагностика и реабилитация пациентов с апраксиями при повреждениях головного мозга», 2016 г.
— Проект Клинических рекомендации Союза реабилитологов России «Инсульт у взрослых: центральный парез верхней конечности».
— Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. N 520н «Об утверждении критериев оценки качества медицинской помощи.
Приложение Б. Алгоритмы ведения пациента
Алгоритм 1 в клинических рекомендациях «Очаговое повреждение головного мозга у взрослых: синдром спастичности»: 1. Алгоритм ведения пациентов с фокальной или мультифокальной спастичностью.
Примечание: подробное описание принципов назначения каждого вида терапии спастичности представлено в тексте Клинических рекомендаций
Аббревиатуры: mAS – модифицированная шкала Ashworth, БТА: ботулинический токсин типа А
Алгоритм 2 в клинических рекомендациях «Очаговое повреждение головного мозга у взрослых: синдром спастичности»: 2. Алгоритм ведения пациентов с регионарной спастичностью.
Примечание: подробное описание принципов назначения каждого вида терапии спастичности представлено в тексте Клинических рекомендаций
Аббревиатуры: mAS – модифицированная шкала Ashworth, БТА: ботулинический токсин типа А
Алгоритм 3 в клинических рекомендациях «Очаговое повреждение головного мозга у взрослых: синдром спастичности»: 3. Алгоритм ведения пациентов с генерализованной спастичностью.
Примечание: подробное описание принципов назначения каждого вида терапии спастичности представлено в тексте Клинических рекомендаций
Аббревиатуры: mAS – модифицированная шкала Ashworth, БТА: ботулинический токсин типа А
Приложение В. Информация для пациента
Спастичность – один из симптомов поражения центральной нервной системы. В результате инсульта или тяжелой травмы головного мозга нарушается контроль нервной системы над тонусом мышц, что приводит к их гиперактивности. Спастичность является ведущей причиной физических ограничений после инсульта. Спастичность нередко сопровождается болью.
Спастичность существенно влияет на качество жизни пациента и ограничивает возможности ухода. Прижатая к туловищу, согнутая в локте, запястье и пальцах, вследствие спастичности рука особенно мешает реабилитации, затрудняет процессы одевания, мытья и другую повседневную деятельность. Спастичность нижней конечности может затруднять ходьбу и гигиенические процедуры. Эффективное управление спастичностью нередко является сложной задачей для специалистов. Цели лечения спастичности включают в себя повышение мобильности и увеличение амплитуды движений, улучшение внешнего вида, облегчение самообслуживания, препятствование формированию необратимой деформации суставов. Современная медицина обладает определенным арсеналом средств для лечения спастичности: определенные методики лечебной физкультуры и массажа, препараты, принимаемые внутрь, локальное введение антиспастического препарата, интратекальное введение баклофена, хирургические методы лечения. Какой метод или комбинация методов лучше всего подходит лично для Вас, подскажет врач. Как правило, для пациентов со спастичностью руки наиболее рациональным является применением локальной антиспастической терапии в сочетании лечебной физкультуры.
Локальная антиспастическая терапия представляет собой инъекции ботулинического токсина. Препарат вводят в небольших количествах в напряженную мышцу. Действие препарата происходит локально и основано на временном местном блокировании передачи нервного импульса от нерва к мышце, что и приводит к снятию спазма. Прежде чем ботулинический токсин заблокирует передачу сигнала должно пройти время, как правило, 7-10 дней. С этого момента начинается лечебный эффект, который обычно продолжается 3-6 месяцев. С течением времени передача импульса от нерва к мышце постепенно восстанавливается.
Когда на фоне терапии спастичность уменьшается, открывается больше возможностей для восстановительного лечения. В этот период, реабилитация, направленная на увеличение амплитуды движений в суставах, активизацию собственных движений и формирования бытовых навыков становятся более эффективной.
Приложение Г1. Инструкции по использованию модифицированной шкалы Ashworth (mAS)*
Общая информация (по Bohannon, Smith, 1987):
— Уложите пациента на спину
— При исследовании мышцы-сгибателя придайте конечности положение наибольшего сгибания и максимально разогните ее за 1 секунду (скажите про себя «одна тысяча один»)
— При исследовании мышцы-разгибателя придайте конечности положение наибольшего разгибания и максимально согните за 1 секунду (скажите про себя «одна тысяча один»)
— Подсчѐт баллов основан на приведѐнных ниже правилах
Подсчет баллов (по Bohannon, Smith, 1987):
0 Нет повышения мышечного тонуса
1 Легкое повышение тонуса в виде кратковременного напряжения и быстрого расслабления мышцы или минимального сопротивления в конце пассивного сгибания или разгибания
1+ Легкое повышение тонуса в виде кратковременного напряжения мышцы с минимальным сопротивлением при продолжении пассивного движения (менее половины амплитуды)
2 Более выраженное повышение мышечного тонуса, ощущаемое в течение почти всего пассивного движения, но при этом пораженный(е) сегмент(ы) конечности легко поддается движению
3 Значительное повышение мышечного тонуса, пассивные движения затруднены
4 Пораженный(е) сегмент(ы) неподвижны в положении сгибания или разгибания
Инструкции для пациента
Перед началом тестирования пациенту дается инструкция расслабиться
Страница 1
Бланк для результатов тестирования по модифицированной шкале Ashworth
ФИО: ________________________________ Дата: __________
Bohannon, R. and Smith, M. (1987). «Interrater reliability of a modified Ashworth scale of muscle spasticity.» Physical Therapy 67(2): 206.
* Примечание: представлена официальная русскоязычная версия шкалы, прошедшая процедуру валидации (ФГБНУ Научный центр неврологии).
Страница 2
Приложение Д. Таргетные мышцы верхней конечности и дозировки БТА**
| Мышцы |
Абоботулотоксин А (Франция) |
Онаботулитоксин А (Ирландия) |
Инкоботулинотоксин А (Германия) |
Комплекс БТА – гемагглютинин (Китай) |
| Мышцы плеча | ||||
| M. subscapularis | 150-300 ЕД | Не зарегистрировано согласно действующей ин | 25 ЕД | |
| M. triceps Brachii | 150-300 ЕД | |||
| M. pectoralis Major | 150-300 ЕД | 75 ЕД | ||
| M. latissimus Dorsi | 150-300 ЕД | 25-50 ЕД | ||
| M. teres major | 75 ЕД | |||
| Сгибатели локтевого сустава и пронаторы | ||||
| M. brachioradialis | 100-200 ЕД | Не зарегистрировано согласно действующей инструкции по медицинскому применению | 60 ЕД | 25 ЕД |
| M. biceps brachii | 200-400 ЕД | 80 ЕД | 50-100 ЕД | |
| M. brachialis | 200-400 ЕД | 50 ЕД | 25 ЕД | |
| M. pronator teres | 100-200 ЕД | 40 ЕД | ||
| M. pronator quadratus | 25 ЕД | |||
| Сгибатели запястья | ||||
| M. flexor carpi radialis | 100-200 ЕД | 15-60 ЕД | 50 ЕД | 20-40 ЕД |
| M. flexor Capri Ulnaris | 100-200 ЕД | 10-50 ЕД | 40 ЕД | 20-40 ЕД |
| Сгибатели пальцев | ||||
| M. flexor digitorum superficialis | 100-200 ЕД | 15-50 ЕД | 40 ЕД | 20-40 ЕД |
| M. flexor digitorum profundus | 100-200 ЕД | 15-50 ЕД | 40 ЕД | 30-60 ЕД |
| M. adductor pollicis | 25-50 ЕД | 20 ЕД | 10 ЕД | Не зарегистрировано согласно действующей инструкции по медицинскому применению |
| M. flexor pollicis longus | 100-200 ЕД | 20 ЕД | 20 ЕД | |
| M. flexor pollicis brevis | Не зарегистрировано согласно действующей инструкции по медицинскому применению | 10 ЕД | ||
| ** Примечание. Инструкции по медицинскому применению, действующие на момент написания настоящих рекомендаций: Инструкция по медицинскому применению лекарственного препарата Диспорт® 500 ЕД П N011520/01 – 17/06/2016 и 300 ЕД ЛП001486 — 14/06/2016; Инструкция по медицинскому применению препарата Ботокс® ЛП – 002949; Инструкция по медицинскому применению препарата Ксеомин ЛСР-004746/08; Инструкция по медицинскому применению препарата Лантокс ЛСР-001587/08 |
Таргетные мышцы нижней конечности и дозировки БТА**
| Мышцы | Онаботулотоксин А |
Комплекс ботулинический токсин типа А – гемагглютинин (Ланчжоусский институт биологической продукции) |
| Спастичность в области стопы | ||
|
M. gastrocnemius Medial head of the Gastrocnemius Lateral head of the Gastrocnemius |
75 ЕД; 75 ЕД; |
100–150 ЕД |
| M. soleus | 75 ЕД | 50–100 ЕД |
| M. tibialis posterior | 75 ЕД | 50–100 ЕД |
| Спастичность в области колена | ||
| M. semitendinosus | Не зарегистрировано, согласно действующей инструкции по медицинскому применению | 50–100 ЕД |
| M. semimembranosus | Не зарегистрировано, согласно действующей инструкции по медицинскому применению | 50–100 ЕД |
| M. quadriceps femoris | Не зарегистрировано, согласно действующей инструкции по медицинскому применению | 100–150 ЕД |
| Спастичность в области бедра | ||
| M. iliopsoas | Не зарегистрировано, согласно действующей инструкции по медицинскому применению | 100–150 ЕД |
| M. rectus femoris | Не зарегистрировано, согласно действующей инструкции по медицинскому применению | 50–100 ЕД |
| Примечание. Инструкции по медицинскому применению, действующие на момент написания настоящих рекомендаций: Инструкция по медицинскому применению препарата Ботокс® ЛП – 002949; Инструкция по медицинскому применению препарата Лантокс ЛСР-001587/08 |
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Резюме
Двигательные нарушения в виде спастического пареза верхней конечности являются одним из наиболее частых последствий инсульта. При этом в конечности формируется моторный дефицит (слабость мышц/парез), отмечаются повышение мышечного тонуса, проприоцептивные нарушения и изменения в мышцах, суставах и окружающих тканях, что делает процесс ее функционального восстановления сложным, длительным и трудоемким.
В статье представлены факторы, оказывающие непосредственное влияние на восстановление функции верхней конечности после инсульта; показана важность своевременной диагностики всех развивающихся в ней изменений с применением необходимых оценочных шкал и создания оптимальных программ реабилитации с включением методик по восстановлению чувствительности, коррекции мышечного тонуса, современных методов реабилитации с биологической обратной связью (БОС) и т. д. Это помогает адаптировать пациентов в социуме и в быту, снизить уровень инвалидизации, что особенно важно для молодого и трудоспособного населения.
Анализ клинического наблюдения пациента Б. 22 лет с последствием инфаркта головного мозга в правой височно-теменной доле с хорошим функциональным исходом, благодаря использованию необходимых диагностических методов и индивидуально разработанной программе реабилитации, подчеркивает ценность и актуальность применения описанных в статье методик в процессе двигательного восстановления пациентов со спастическим парезом верхней конечности и проприоцептивными нарушениями после очагового поражения ЦНС.
Система БОС «Колибри» Комплексный
Беспроводная технология передачи данных позволяет считать датчики Колибри лучшим решением для проведения БОС-тренингов разных модальностей для детей.
Подробнее
Введение
В настоящее время инсульт остается второй ведущей причиной смертности и инвалидности во всем мире [1]. Наиболее частым последствием инсульта являются двигательные нарушения в виде спастического пареза верхней конечности различной степени выраженности [2]. Целый комплекс проблем, возникающих в верхней конечности после инсульта: моторный дефицит (слабость мышц/парез), повышение мышечного тонуса, проприоцептивные нарушения и неизбежно возникающие изменения в мышцах, суставах и окружающих тканях, делают процесс ее функционального восстановления сложным, длительным и трудоемким.
В связи с этим крайне актуальна своевременная диагностика всего комплекса изменений, развивающихся в верхней конечности, знание и использование необходимых оценочных шкал, а также создание оптимальных программ реабилитации с включением в них наиболее эффективных методов [3]. Восстановление функции верхней конечности является одной из ключевых задач реабилитации после инсульта, выполнение которой необходимо для социально-бытовой адаптации пациентов и снижения уровня инвалидизации, особенно у трудоспособной категории пациентов. В настоящей статье обсуждаются современные методы диагностики и реабилитации проприоцептивных нарушений и спастичности, поскольку их наличие у пациентов после инсульта приводит к неиспользованию конечности и напрямую влияет на ее двигательное восстановление [4].
Кроме того, демонстрируется эффективность имплементации в индивидуальные реабилитационные программы новых методик коррекции нарушений чувствительности, мышечного тонуса и методов реабилитации с биологической
обратной связью (БОС) на примере клинического наблюдения с хорошим функциональным исходом.
Факторы, влияющие на двигательное восстановление конечности после инсульта
Восстановление функции верхней конечности после инсульта является клинически значимой проблемой. Понимание факторов, которые влияют на этот процесс, необходимо для построения индивидуально адаптированных стратегий реабилитации [5]. Пациенты, перенесшие инсульт, демонстрируют различные модели восстановления движений в верхней конечности, поскольку инсульт является гетерогенным заболеванием [4].
В настоящее время показано, что по ряду клинических и нейровизуализационных факторов, таких как возраст, наличие движений в конечности сразу после инсульта, объем поражения головного мозга, сохранность кортикоспинального тракта, количество баллов по шкале инсульта Национального института здоровья (NIHSS) и выраженности межполушарной асимметрии, можно с большой степенью вероятности спрогнозировать восстановление конечности [5]. Негативными предикторами функционального восстановления конечности наряду с размерами и локализацией очага поражения (левополушарное поражение) являются выраженность пареза и спастичности, наличие нарушений проприоцептивной чувствительности (ПЧ), а также мужской пол и степень снижения повседневной активности (по шкале Бартела) [6]. Сохранность сенсорной системы (кожных механорецепторов, проприорецепторов суставов и мышц, а также органа зрения) очень важна для планирования (система прямой связи) и управления движением (система с обратной связью), а также для последующего моторного обучения. При наличии у пациента после инсульта проприоцептивных нарушений в верхней конечности изменяется существующая в норме связь с моторной функцией, что негативно влияет на управление двигательным актом и становится фактором, снижающим реабилитационный потенциал пациента [7].
В связи с этим актуально их своевременное выявление и включение в программу реабилитации методов для ее восстановления. Наряду с проприоцептивными нарушениями и выраженностью пареза в верхней конечности избыточное повышение мышечного тонуса (более 2 баллов по шкале Эшворта) уже в ранние сроки после инсульта также является предиктором ее плохого двигательного восстановления. Поэтому своевременные диагностика и начало антиспастического лечения могут помочь в достижении лучшего результата реабилитации, предотвратить развитие осложнений (контрактур, боли и др.) и повысить качество жизни пациентов после инсульта [8].
Проприоцептивные нарушения
Проприоцептивная чувствительность – ощущение взаимного положения и движения конечностей и тела. Она играет решающую роль в управлении движениями и двигательном обучении [9, 10]. Нарушение ПЧ наблюдается у многих пациентов, перенесших инсульт. У 50–80% пациентов двигательные нарушения в конечностях сочетаются с полной или частичной утратой способности ощущать движения в сегментах конечностей [9]. У пациентов с центральными парезами состояние ПЧ рассматривается как важный прогностический показатель возможности восстановления двигательных функций [5, 8–10].
Своевременная диагностика ПЧ и последующее составление индивидуального плана реабилитационных мероприятий, включающего методики по восстановлению чувствительности, позволяют значительно увеличить эффективность реабилитации. В клинической практике для оценки ПЧ чаще всего используют шкалы Фугл-Мейера (FMA) и Ноттингемскую. Шкала FMA является наиболее изученным и известным инструментом для оценки степени сенсомоторных нарушений после инсульта. Она содержит 5 доменов по оценке двигательной функции, чувствительности (тактильной и глубокой), равновесия, амплитуды движений в суставах, болевой чувствительности. В верхней конечности ПЧ оценивается по отдельным сегментам. Пациенту с закрытыми глазами врач производит пассивное движение в тестируемом суставе, после чего тот должен описать это движение вербально. Оценка осуществляется по 3-балльной шкале [11]. По Ноттингемской шкале оценивают нарушения тактильной чувствительности, стереогнозиса и кинестезии.
При оценке кинестезии по 4-балльной шкале в одном тесте оцениваются: распознавание самого факта движения, его направление и точность восприятия изменения суставного угла [12]. Тестирование каждого сегмента конечности повторяют по 3 раза. Процедура тестирования аналогична описанной выше (для FMA), но пациент воспроизводит ощущение движения вербально или движением другой конечности. Недостатками обоих методов являются низкая детализация описания нарушений и сложность тестирования пациентов с речевыми и когнитивными нарушениями. Кроме того, отставленное во времени воспроизведение движений, в некоторых случаях используемое при тестировании, задействует кинестетическую память, которая может быть нарушена у пациентов с поражением ЦНС. В последние годы для оценки ПЧ применяется новый метод, основанный на одновременном копировании серии циклических односуставных движений, позволяющий более точно судить о пространственно-временных характеристиках проприоцептивного восприятия [13, 14].
Метод позволяет определять у пациента наличие и степень нарушений ПЧ в отдельных сегментах конечностей и отслеживать динамику их изменений в ходе реабилитации [13]. Пациенту с закрытыми глазами врач проводит серию тестирующих пассивных циклических движений исследуемого сегмента конечности (3–4 цикла за 12–20 с) с варьирующимися амплитудой и скоростью. Пациент, согласно полученной инструкции, во время выполнения тестирующих движений должен копировать их противоположной конечностью. Перед началом тестирования необходимо убедиться, что пациент понимает задание и способен выполнить копирование противоположной, условно здоровой, конечностью. Для этого его просят выполнить процедуру копирования под зрительным контролем. Во время исследования с помощью беспроводных инерционно-магнитометрических датчиков регистрируются углы (рис. 1) в тестируемом суставе и одноименном суставе другой конечности.
Рис. 1. Положение датчиков во время тестирования движений в локтевом суставе
На основе анализа зарегистрированных суставных углов оценивают схожесть пассивных и копирующих активных движений по качественным показателям, характеризующим наличие грубых нарушений при копировании, и по 4 количественным показателям:
- коэффициенту амплитуды (Камп);
- коэффициенту формы (Кфор);
- латентности начала копирования (Кнлат);
- средней в пределах теста латентности повторных циклических копирующих движений (Кцлат) [13].
Оценку степени сохранности проприоцептивного восприятия разных тест-движений проводят с использованием условного критерия нормы, разработанного при исследовании представительной выборки здоровых испытуемых. ПЧ признается сохранной, если копирование выполняется без качественных ошибок и значения не более 2 количественных показателей выходят за границы нормы [13, 14].
У здоровых испытуемых копирование происходит без качественных ошибок, с высокой точностью и практически без задержки. Таким способом можно объективно оценивать состояние ПЧ в любых сегментах конечности пациента в положении сидя или лежа, что дает возможность обследовать пациентов даже с самыми тяжелыми двигательными нарушениями. Метод позволяет проводить оценку состояния ПЧ даже без использования технических средств для регистрации суставных углов при копировании тест-движений. В этом случае оценка качества копирования может проводиться врачом визуально на основе только качественных показателей.
Для количественного выражения оценки состояния ПЧ может использоваться балльная шкала:
- 4 балла – пациент копирует все движения правильно и достаточно точно (ПЧ сохранна или близка к норме);
- 3 балла – копирует все движения правильно, но неточно, с видимой задержкой или искажением по амплитуде или форме движений (ПЧ ослаблена);
- 2 балла – правильно копирует только часть циклических тест-движений или выполняет дополнительные движения (среднее нарушение ПЧ);
- 1 балл – воспроизводит одиночное движение в том же суставе, но оно не совпадает ни с одним из пассивных тест-движений (сильное нарушение ПЧ);
- 0 баллов – копирующие движения вообще отсутствуют (полная потеря ПЧ) [9].
Спастичность
Умение выявлять спастичность уже в ранние сроки после инсульта важно для назначения адекватного лечения и составления соответствующей программы реабилитации с целью сохранения функции конечности. Для этого большинство специалистов используют 5-балльную модифицированную шкалу Эшворта (modified Ashworth Scale, mAS) [15]. В последние годы в клинической практике с этой целью также применяется модифицированная шкала Тардье (Modified Tardieu Scale – MTS), которая позволяет более точно определить и количественно измерить спастичность (угол, степень) [16]. Помимо выявления собственно спастичности, в реабилитационной практике с помощью ряда шкал оценивается степень ее влияния на активную и пассивную функцию конечности. Так, для оценки степени нарушения активной функции верхней конечности наиболее часто используют модифицированный тест Френчай (Modified Frenchay Test – MFT), шкалу оценки движений в руке (Action Research Arm Test – ARAT). Степень активности в повседневной жизни оценивают по шкале ограничения возможностей (Disability Assessment Scale – DAS), индексу Бартела (Barthel Index – BI) и др. [17, 18].
Ботулинотерапия спастичности
Уже несколько десятилетий препараты ботулинического токсина типа А (БТА) используются в реабилитации пациентов с поражениями ЦНС с фокальной и мультифокальной спастичностью для снижения мышечного тонуса и улучшения пассивной и активной функции верхней конечности [19]. Ботулинотерапия – эффективный и без опасный метод лечения спастичности с высоким уровнем убедительности рекомендаций [20–24]. Накоплен значительный клинический опыт использования препаратов БТА различных производителей, разработаны оптимальные терапевтические стратегии, отраженные в национальных и международных консенсусах разных стран и опубликованные в клинических рекомендациях национального и международного уровня [15, 19, 20]. В последнее десятилетие в России ботулинотерапия все более активно имплементируется в реабилитационный процесс в свете активно развивающейся доктрины 3-этапной системы реабилитации [15, 17, 18]. На российском рынке в начале 2000-х годов появились отечественные препараты БТА, один из которых – Релатокс® (АО «НПО «Микроген») с 2016 г. используется во многих реабилитационных центрах для лечения постинсультной спастичности верхней конечности после проведения многоцентрового простого слепого рандомизированного российского исследования «Оценка безопасности и эффективности препарата Релатокс® при спастичности руки после ишемического инсульта» [25]. За прошедшие с момента регистрации препарата 5 лет он доказал свою эффективность не только в снижении мышечного тонуса, увеличении объема активных и пассивных движений, но и в уменьшении уровня инвалидизации и боли, улучшении качества жизни пациентов [25].
БОС-технологии в реабилитации спастического пареза верхней конечности
Отсутствие поступления информации от конечности в соответствующие структуры головного мозга из-за пареза и проприоцептивных нарушений и ее неиспользование вследствие этого создает эффект «корковой деафферентации».
Для функционального восстановления конечности необходимо активирование путей «моторной адаптации». Это можно сделать с помощью метода БОС-тренировочного метода обучения сознательному контролю различных функций организма, прежде всего координации движений посредством принципа «обратной связи». С ее помощью можно частично заместить или усилить сенсорное восприятие производимых действий, моментально проанализировать и оценить результат. Посредством специальной аппаратуры пациенту через определенные стимулы (звуковые и визуальные образы) подается информация о функциональном состоянии мышц (или других органов) в реальном времени.
Пациент может изменять уровень активности конкретной группы мышц. Современные технологии позволяют формировать и другие каналы сенсорного восприятия (тактильные, вибропроприоцептивные и т. п.). Таким образом, у пациента формируются новые каналы связи между активностью его мышц и пониманием двигательного акта. Эти каналы в процессе тренировки частично, а иногда и полностью заменяют утраченную афферентацию. В настоящее время существует много различных современных устройств с БОС, используемых для восстановления верхней конечности (робототехника, экзоскелеты, виртуальная реальность и др.) [26].
Тренажеры с БОС вошли в стандарт оснащения центров и отделений медицинской реабилитации пациентов с соматическими заболеваниями, нарушениями функций опорно-двигательного аппарата, центральной и периферической нервной системы [27].
Одним из таких устройств, уже несколько лет успешно применяющихся в реабилитации пациентов со спастическими парезами верхней конечности, является отечественный комплекс коррекции движений «Колибри» – система, объединяющая в себе возможности корректора движений, электростимулятора и БОС-тренажера, с помощью которого можно стимулировать нужные мышцы, исправлять патологический двигательный стереотип и формировать новый, максимально приближенный к физиологическому [28].
Мультифункциональность комплекса, удобный и современный интерфейс, наличие беспроводных датчиков, «подстраивание» системы под индивидуальные возможности пациента и поэтапное усложнение программы, возможность дистанционного контроля выполнения сеансов и отслеживание эффективности медперсоналом, а также проведение тренинга в домашних условиях позволяют применять его не только на втором, но и на третьем этапе реабилитации, активно вовлекая пациента в процесс реабилитации, мотивируя его, что является крайне важным аспектом реабилитации.
Клиническое наблюдение
В качестве примера приводим результаты реабилитации пациента Б. 22 лет, находившегося в отделении медицинской реабилитации для взрослых с нарушениями центральной и периферической нервной системы ФГАУ «НМИЦ ЛРЦ» Минздрава России в марте-апреле и июне 2021 г. с диагнозом: цереброваскулярная болезнь, последствия инфаркта головного мозга от 09.06.2020 в правой височно-теменной доле с левосторонним спастическим гемипарезом, гемигипестезией, псевдобульбарной дизартрией, спастико-паретической формой.
При поступлении 22.03.2021 пациент отмечал снижение чувствительности в левой верхней конечности, невозможность ее использования в быту, ограничение сгибания кисти и пальцев, невозможность захвата предметов, участия руки в гигиенических и бытовых процедурах, а также подворот левой стопы во время ходьбы и сложности при произнесении слов. При физикальном осмотре значимых отклонений не было выявлено.
В неврологическом статусе: неравномерный спастический левосторонний гемипарез.
По шкале количественной оценки мышечной силы (Medical Research Council Weakness Scale – MRC)
- в руке: разгибание и сгибание в локтевом суставе – 3 балла, отведение и сгибание в плечевом суставе – 3 балла, сгибание и разгибание кисти – 2 балла, сгибание пальцев – 3 балла, разгибание – 1 балл;
- в ноге: разгибание и сгибание в тазобедренном суставе – 4 балла, разгибание в коленном суставе – 4 балла, сгибание – 3 балла, подошвенное сгибание стопы – 4 балла, тыльное сгибание стопы – 3 балла.
Мышечный тонус повышен по спастическому типу в мышцах: круглом пронаторе, сгибателях кисти и пальцев, в сгибателях локтевого сустава – 3 балла, сгибателях плечевого сустава – 1 балл, разгибателях коленного сустава и подошвенных сгибателях стопы – 3 балла.
Повышение сухожильных и периостальных рефлексов в левых конечностях и патологические стопные знаки (симптом Бабинского). Левосторонняя поверхностная и глубокая гемигипестезия в левых конечностях, более выраженная в руке. Координаторные пробы слева выполняет с мимопопаданием и неточностью. В пробе Ромберга неустойчив. Функции тазовых органов контролирует. Ходит с опорой на трость, используя зрительный контроль. Псевдобульбарная дизартрия, спастико-паретическая форма. Когнитивная и психическая сфера – норма: тест MoCA – 28 баллов, госпитальная шкала HADS – Т7, Д5. Общий балл по шкале FMA – 181 (норма – 226). Двигательная функция – 63 балла (верхняя конечность – 34 + нижняя конечность – 29) (норма – 66 + 34 балла соответственно). Равновесие – 11 баллов (норма – 14). Чувствительность – 19 баллов (норма – 24): поверхностная – 5 баллов (норма – 8), глубокая – 14 баллов (норма – 14). Объем движений и болевая чувствительность в суставах в норме – 44 + 44 балла. Ноттингемская шкала – 16 баллов: плечевой сустав, локтевой сустав, пронация/супинация предплечья – по 3 балла, лучезапястный сустав, пальцы кисти – 2 балла; тазобедренный, коленный, голеностопный суставы – 3 балла, палец стопы – 2 балла. Индекс Бартела – 90 баллов. Оценка по шкале реабилитационной маршрутизации (ШРМ) – 3 балла. При составлении реабилитационной программы у пациента со спастическим парезом верхней конечностии проприоцептивными нарушениями мультидисциплинарной реабилитационной командой (МДРК) в составе врача по физической и реабилитационной медицине, врача ЛФК, врача-физиотерапевта, логопеда и нейропсихолога были выбраны следующие домены по МКФ [26]: b260.3 проприоцептивная функция (тяжелые нарушения), b7301.3 сила мышц одной конечности (тяжелые нарушения), b7351.2 тонус мышц одной конечности (умеренные нарушения), b398.2 функции голоса и речи (умеренные нарушения), b144.0 функции памяти (норма), b160.0 функции мышления (норма). Определена цель лечения: обучение использованию руки в бытовых действиях (гигиена, одевание, употребление пищи и др.).
Поставлены задачи:
- уменьшение проприоцептивных нарушений и вовлечение руки в бытовые действия;
- снижение тонуса на 1 балл в мышцах: круглом пронаторе, сгибателях кисти и пальцев, в сгибателях локтевого сустава и увеличение объема движений в локтевом, лучезапястном суставах и пальцах кисти в левой руке с целью улучшения движений: пронации/супинации, сгибания/разгибания в локтевом суставе, кисти, пальцах;
- увеличение скорости ходьбы;
- улучшение произнесения слов, фазовой речи.
С целью восстановления ПЧ проведена ее инструментальная оценка с помощью регистрации суставных углов пассивных и копирующих активных движений в 8 тестах для руки: плечевой сустав – сгибание/разгибание (ПСР), отведение/приведение (ПОП), локтевой сустав – сгибание/разгибание (ЛСР), пронация/супинация предплечья (ПС), кисть – сгибание/разгибание (КСР), отведение/приведение (КОП). Все тесты проводили под зрительным контролем и с закрытыми глазами. Предварительное тестирование показало, что имеются грубые нарушения ПЧ в дистальных сегментах паретичной верхней конечности (рис. 2).

С учетом полученных данных для пациента был разработан индивидуальный план реабилитационных мероприятий. В качестве тренировочных упражнений, направленных на восстановление ПЧ движений предплечья и кисти, выполнялись упражнения по одновременному копированию с закрытыми глазами пассивных движений паретичной конечностью.
Эффективность их применения оценивали на основе мониторинга сенсомоторных показателей отдельных сегментов руки, в том числе ПЧ. Реабилитационная программа также включала:
- занятия по восстановлению моторной функции руки на роботизированном оборудовании с БОС «Армео», «Амадео» и комплексе «Колибри» (3 × 30 мин) по № 10;
- занятия по восстановлению мелкой моторики (30 мин) № 20;
- ЛФК индивидуально (2 р/сут по 30 мин) № 20;
- занятия на комплексе для анализа и коррекции нарушений ходьбы и координации движений с помощью расширенной виртуальной реальности С-Mill VR+ (30 мин) № 20;
- занятия с логопедом.
Пациент прошел 2 курса реабилитации в стационаре (22.03–12.04.2021 и 19.04–03.05.2021), между которыми проводилась амбулаторная реабилитация с идентичной программой.
В начале второго курса реабилитации в круглосуточном стационаре (19.04.2021) в связи со спастичностью в мышцах верхней конечности, затрудняющей процесс двигательного восстановления, под ультразвуковым контролем проведена инъекция БТА (Релатокс® в дозе 200 Ед: в лучевой и локтевой сгибатели кисти по 30 ЕД (суммарно60 ЕД), мышцы поверхностный и глубокий сгибатели пальцев по 50 ЕД, мышцу круглый пронатор 40 ЕД. Повторные тестирования ПЧ всех сегментов руки, проведенные через 10 дней, 1 мес. и 3 мес. от начала тренировки, показали улучшение копирования по количественным пространственно-временным показателям, но с отличающейся динамикой в различных сегментах конечности (рис. 3).

Метод диагностики ПЧ в сочетании с тренировками подтверждает важную роль обучения в восстановлении проприоцепции у пациентов с парезами в верхней конечности центрального генеза [9].
Через 3 мес. (после 2 курсов реабилитации в круглосуточном стационаре и активных (по 4–5 ч в день) амбулаторных занятий самореабилитацией с упражнениями по восстановлению ПЧ и использованием БОС-тренажера комплекса «Колибри) была отмечена значимая положительная динамика и достигнуты цели: расширились функциональные возможности верхней конечности, пациент стал использовать руку в быту (открывать/закрывать дверь, держать телефон, книгу, нажимать кнопки в лифте, использовать ее во время приема пищи, проведения гигиенических процедур и др.) и задачи реабилитации:
- уменьшилась выраженность чувствительных нарушений: отмечено восстановление поверхностной и глубокой чувствительности в мышцах предплечья и кисти (Ноттингемская шкала – 22 балла, по шкале FMA отмечено расширение функциональных возможностей руки с 34 до 37 баллов (общий балл – 190));
- снизился мышечный тонус на 1 балл через 1 мес. в мышцах-сгибателях кисти и пальцев (с 3 до 2 баллов). Нормализовался мышечный тонус в мышцах-сгибателях плечевого сустава. На фоне снижения мышечного тонуса произошло увеличение объема движений во всех суставах конечности. Наросла сила в мышцах-сгибателях и мышцах-разгибателях кисти и пальцев на 2 балла; в мышцах-сгибателях плечевого, локтевого, лучезапястного суставах, в мышцах-разгибателях плечевого сустава на 1 балл. Кроме того, значимо увеличилась скорость ходьбы и улучшилась речь. Все эти изменения позитивно сказались на уровне независимости пациента: ШРМ – 2 при выписке, индекс Бартела – 95 баллов.
Таким образом, положительный эффект проведенной реабилитации у пациента со спастическим парезом верхней конечности с грубым моторным и проприоцептивным дефицитом и целым спектром сопутствующих неврологических проблем – даже спустя 9 мес. после инсульта – был достигнут благодаря правильной оценке МДРК всех составляющих неврологического дефицита с применением МКФ, использованию как давно известных диагностических шкал, так и новых, апробируемых инструментов оценки; адекватно составленной реабилитационной программе с применением как традиционно используемых, так и инновационных методов, включая ботулинотерапию; проведению интенсивной и непрерывной самореабилитации с использованием упражнений по восстановлению ПЧ и БОС-технологий. Возможно, что появляющиеся в последние годы отечественные разработки: методы диагностики и реабилитации (оценка ПЧ и упражнения по ее восстановлению), реабилитационное оборудование (комплекс с БОС «Колибри») и медикаменты (препарат Релатокс®) внесут значимый вклад в реализацию программы 3-этапной реабилитации на территории нашей страны. Безусловно, эффективность их применения еще требует подтверждения и проведения исследований, однако не менее важен анализ отдельных клинических ситуаций, что и представлено в настоящей публикации.
Литература
- Katan M., Luft A. Global Burden of Stroke. Semin Neurol. 2018;38(2):208–211. DOI: 10.1055/s-0038-1649503.
- Gracies J.M., Bayle N., Vinti M. et al. Five-step clinical assessment in spastic paresis. Eur J Phys Rehabil Med. 2010;46(3):411–421. PMID: 20927007.
- Stinear C.M., Lang C.E., Zeiler S., Byblow W.D. Advances and challenges in stroke rehabilitation. Lancet Neurol. 2020;19(4):348–360. DOI: 10.1016/S1474-4422(19)30415-6.
- Langhorne P., Bernhardt J., Kwakkel G. Stroke rehabili-tation. Lancet. 2011;377:1693–1702. DOI: 10.1016/S0140-6736(11)60325-5.
- Lee J., Kim H., Kim J. et al. Differential early predictive factors for upper and lower extremity motor recovery after ischaemic stroke. Eur J Neurol. 2021;28(1):132–140. DOI: 10.1111/ene.14494.
- Левин О.С. Постинсультные двигательные нарушения. Современная терапия в психиатрии и неврологии. 2016;(3):25–32.
- Schabrun S.M., Hillier S. Evidence for the retraining of sensation after stroke: a systematic review. Clin Rehabil. 2009;(23):27–39. DOI: 10.1177/0269215508098897.
- Glaess-Leistner S., Song J.R., Audebert H.J., Wissel J. Early clinical predictors of post stroke spasticity. Top Stroke Rehabil. 2021;28(7):508–518. DOI: 10.1080/10749357.2020.1843845.
- Ostry D.J., Gribble P.L. Sensory plasticity in human motor learning. Trends Neurosci. 2016;39(2):114–123. DOI: 10.1016/j.tins.2015.12.006.
- Coupar F., Pollock A., Rowe P. et al. Predictors of upper limb recovery after stroke: a systematic review and meta-analysis. Clin Rehabil. 2009;(260):291–313. DOI: 10.1177/0269215511420305.
- Fugl-Meyer A.R., Jääskö L., Leyman I. et al. The post-stroke hemiplegic patient. 1. a method for evaluation of physical performance. Scand J Rehabil Med. 1975;7(1):13–31.
- Semrau J.A., Herter T.M., Scott S.H., Dukelow S.P. Robotic identification of kinesthetic deficits after stroke. Stroke. 2013:(44):3414–3421. DOI: 0.1161/STROKEAHA.113.002058.
- Павлова О.Г., Рощин В.Ю., Сидорова М.В. и др. Метод качественной и количественной оценки восприятия движений в отдельных суставах руки. Физиология человека. 2018;44(4):84–95. DOI: 10.1134/S0131164618040124.
- Рощин В.Ю., Павлова О.Г., Селионов В.А. и др. Сравнение объективных показателей проприоцептивного восприятия односуставных движений руки в положениях сидя и лежа у здоровых испытуемых и постинсультных больных. Физиология человека. 2019;45(4):62–70. DOI: 10.1134/S0131164619040131.
- Gracies J.M. Coefficients of impairment in deforming spastic paresis. Ann Phys Rehabil Med. 2015;58(3):173–178. DOI: 10.1016/j.rehab.2015.04.004.
- Хатькова С.Е. Современные тенденции в лечении постинсультной спастичности с использованием ботулинотерапии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(8):92–99.
- Хатькова С.Е., Орлова О.Р., Боцина А.Ю. и др. Основные принципы ведения пациентов с нарушением мышечного тонуса после очагового повреждения головного мозга. Consilium Medicum. 2016;18(2–1):25–33.
- Varvarousis D.N., Dimopoulos D., Vasileiadis G.I. et al. Do gait parameters improve after botulinum toxin injections in post stroke patients? A prospective
study. Toxicon. 2021;200:189–197. DOI: 10.1016/j.toxicon.2021.08.001. - Hoare B.J., Wallen M.A., Imms C. et al. Botulinum toxin A as an adjunct to treatment in the management of the upper limb in children with spastic cerebral palsy (UPDATE). Cochrane Database Syst Rev. 2010;2010(1):CD003469. DOI: 0.1002/14651858.CD003469.pub4.
- McIntyre A., Lee T., Janzen S. et al. Systematic review of the effectiveness of pharmacological interventions in the treatment of spasticity of the hemiparetic lower extremity more than six months post stroke. Top Stroke Rehabil. 2012;19(6):479–490. DOI: 10.1310/tsr1906-479.
- Ng Y., Chew E., Samuel G. et al. Advances in rehabilitation medicine, Singapore Med. J. 2013;54:538–551.
- Schramm A., Ndayisaba J.P., Auf dem Brinke M. et al. Spasticity treatment with onabotulinumtoxin A: data from a prospective Germanreal -life patient registry. J Neural Transm (Vienna). 2014;121(5):521–530. DOI: 10.1007/s00702-013-1145-3.
- Simpson D.M., Hallett M., Ashman E.J. et al. Practice guideline update summary: Botulinum neurotoxin for the treatment of blepharospasm, cervical dystonia, adult spasticity, and headache: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016;86(19):1818–1826. DOI: 10.1212/WNL.0000000000002560.
- Wu J., Cheng H., Zhang J. et al. Robot-Assisted Therapy for Upper Extremity Motor Impairment After Stroke: A Systematic Review and MetaAnalysis. Phys Ther. 2021;101(4):pzab010. DOI: 10.1093/ptj/pzab010.
- Хатькова С.Е., Костенко Е.В., Похабов Д.В. и др. Оценка безопасности и эффективности российского препарата ботулотоксина А Релатокс® в сравнении с Ботоксом® при спастичности руки после ишемического инсульта (мультицентровое рандомизированное исследование). Неврология, нейропсихиатрия, психосоматика. 2017;9(1):71–77.26.
- International Classification of Functioning, Disability and Health (ICF) (Electronic resource.) URL (access date: 08.17.2021).
- Приказ МЗ РФ №1705н от 29 декабря 2012 г. (Электронный ресурс.) URL (дата обращения: 29.12.2012).
- Система БОС «Колибри» комплексная — Нейротех. (Электронный ресурс.) URL (дата обращения: 17.08.2021).
Сведения об авторах
- Хатькова Светлана Евгеньевна – д.м.н., профессор, заведующая отделением медицинской реабилитации взрослых с нарушениями функции центральной и периферической нервной системы ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0002-3071-4712.
- Николаев Евгений Андреевич – врач-невролог ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0000-0003-0443-3201.
- Погорельцева Оксана Александровна – к.м.н., заведующая неврологическим отделением ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0003-1141-0091.
- Павлова Ольга Геннадьевна – д.биол.н., ведущий научный сотрудник ИВНД и НФ РАН; 117485, Россия, г. Москва, ул. Бутлерова, д. 5а; ORСID iD 0000-0001-5238-8383.
- Рощин Вадим Юрьевич – ведущий инженер ИВНД и НФ РАН; 117485, Россия, г. Москва, ул. Бутлерова, д. 5а; ORСID iD 0000-0003-4994-2376.
- Котляров Валерий Викторович – к.м.н., врач-невролог, врач функциональной диагностики, ООО «Поликлиника»; 357500, Россия, г. Пятигорск, ул. Широкая, д. 9.
Мендалиева А.С.
Клиника «Ренейро», Москва, Россия
Программа домашней реабилитации GSC «I-CAN» в сочетании с ботулинотерапией в двигательной реабилитации пациентов со спастическим парезом
Авторы:
Мокиенко О.А., Мендалиева А.С.
Как цитировать:
Мокиенко О.А., Мендалиева А.С. Программа домашней реабилитации GSC «I-CAN» в сочетании с ботулинотерапией в двигательной реабилитации пациентов со спастическим парезом. Журнал неврологии и психиатрии им. С.С. Корсакова.
2019;119(3):127‑132.
Mendalieva AS, The GSC I-CAN home rehabilitation program in combination with botulinotherapy in motor rehabilitation of patients with spastic paresis. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2019;119(3):127‑132. (In Russ.)
https://doi.org/10.17116/jnevro2019119031127

Основными, или базовыми, методами двигательной реабилитации пациентов со спастическим парезом в результате инсульта или черепно-мозговой травмы являются лечебная физкультура (ЛФК, физическая терапия) и локальная антиспастическая терапия [1, 2].
Физические упражнения в рамках ЛФК направлены прежде всего на стимуляцию процессов нейропластичности, т. е. реорганизации коры головного мозга путем обеспечения повторяющегося, адекватного и интенсивного модулирующего воздействия. Упражнения в рамках ЛФК-комплекса, применяющиеся в двигательной реабилитации, основаны на понимании физиологии нервной системы, механизмов индуцированной нейропластичности, принципов моторного контроля и двигательного обучения. Некоторые дополнительные подходы в рамках ЛФК-комплекса, такие как пассивная гимнастика, лечение положением, пассивное растяжение, силовые тренировки, предназначены в основном для модулирования процессов в тканях паретичной конечности — в качестве профилактики вторичных осложнений, сохранения функции и физических свойств мышц и суставов [1—3].
Применение локальной антиспастической терапии в виде инъекций препарата ботулинического токсина типа, А (БТА) нацелено на уменьшение степени спастичности для восстановления пассивной или активной функции конечности, облегчения ухода и самообслуживания, снижения ассоциированного со спастичностью болевого синдрома. Период действия БТА составляет в среднем 3—4 мес. Данное «терапевтическое окно» следует использовать для реализации интенсивных методов физической реабилитации на фоне снижения спастичности [2, 4, 5].
Однако большую часть времени пациент со спастическим парезом проводит вне стационара. Большая часть «терапевтического окна» ботулинотерапии также приходится на внестационарный этап двигательной реабилитации. Сложность обеспечения пациентов непрерывной комплексной и интенсивной программой восстановительного лечения на амбулаторном этапе на настоящее время остается существенной проблемой организации двигательной реабилитации. Применение программы «I-CAN» («Я МОГУ») решает многие проблемы внестационарного этапа реабилитации и способствует соблюдению таких ее ключевых принципов, как регулярность и адекватная интенсивность занятий, постепенное увеличение сложности, а также активное вовлечение пациента в восстановительный процесс.
Состав программы GSC «I-CAN»
В состав программы «I-CAN» (Ипсен Комплексная прогрАмма для лечения пациеНтов со спастическим парезом) входят 3 основных компонента: 1) качественная клиническая оценка состояния пациента и постановка индивидуальных целей лечения в соответствии с ожиданиями пациента; 2) эффективное введение необходимой дозы препарата БТА (диспорт) в таргетные группы мышцы, исходя из целей лечения и с соблюдением необходимой частоты инъекционных сессий; 3) программа направленной самореабилитации GSC (Guided Self-Rehabilitation Contracts), которая позволяет обеспечивать партнерство между мультидисциплинарной командой специалистов и пациентами. Таким образом, программа «I-CAN» представляет собой комплексный пациент-ориентированный подход в лечении пациентов со спастичностью.
Особый интерес в рамках «I-CAN» представляет программа направленной самореабилитации GSC. В основе программы лежит систематический подход, направленный на дифференцированную работу с мышцами-антагонистами. Для мышц со спастичностью, находящихся в укороченном состоянии и подверженных риску развития контрактур, предусмотрены упражнения длительного растяжения, которые при наличии показаний должны сочетаться с инъекциями локальных антиспастических препаратов БТА. Для мышц-антагонистов спастичным предусмотрена интенсивная программа упражнений с совершением широко-амплитудных быстрых движений без посторонней помощи или же попытки совершать такие движения, когда они невозможны. В общей сложности программа GSC «I-CAN» включает 24 упражнения на пассивное растяжение и 23 активных упражнения для различных групп мышц верхней и нижней конечностей, а также 3 функциональных упражнения: приседание на стул, ходьба широкими шагами и быстрая ходьба [6]. Интенсивность и состав программы для каждого пациента подбирается индивидуально и меняется с течением времени. Программу разработали специалисты университетской клиники им. Анри Мондора (Франция) во главе с проф. Ж.-М. Грасье [7, 8].
Упражнения на растяжение основаны на пассивном придании конечности определенного положения, при котором происходит максимальное растяжение спастичных мышц. Регулярные упражнения на пассивное растяжение спастических мышц используются для профилактики развития контрактур, сохранения длины мягких тканей, кратковременного снижения степени спастичности. Поддержание длины мягких тканей также обеспечивает основу для применения активных методов двигательной реабилитации [6, 9, 10]. Было показано, что упражнения на самостоятельное растяжение спастических мышц в течение 30 мин в день способствуют постепенному удлинению мышц, уменьшению их жесткости и чувствительности мышечных веретен [11]. Программа составлена таким образом, что за пассивным растяжением отдельной мышцы со спастичностью следует активное упражнение для ее антагониста.
Активные упражнения в рамках программы направлены на стимуляцию процессов нейропластичности за счет совершения повторных высокоамплитудных движений [6]. В исследованиях на животных было показано, что для реорганизации первичной моторной коры необходимо совершать конечностью 400 повторов функционального движения в день, а также, что 60 повторов в день для этого недостаточно [12, 13]. В то же время опытным путем исследователи из США и Канады установили, что в реальной клинической практике как стационарной, так и амбулаторной двигательной реабилитации не более 51% пациентов отрабатывают функциональные движения, и в среднем за одну тренировку совершается всего лишь 32 повтора таких движений [14, 15]. Программа GSC позволяет приблизить интенсивность ежедневных тренировок к той, что согласно вышеприведенным работам необходима для индуцированной нейропластичности и восстановления моторного контроля. По нашему опыту, пациенты в среднем достигают 200—300 повторов каждого из рекомендованных движений в рамках программы при условии адекватного лечения спастичности со своевременным применением препарата БТА при наличии показаний.
Также считается, что за счет восстановления реципрокного торможения активные упражнения с быстрыми высокоамплитудными движениями способствуют устранению феномена ко-контракции, т. е. непроизвольного сокращения антагонистов при попытке выполнить движение [6, 16—18].
Кроме того, оригинальная программа предусматривает некий психологический компонент — условный договор между специалистом и пациентом, в соответствии с которым пациент обязуется ежедневно заниматься и вести дневник реабилитации. Этот принцип отражен в названии программы: «GSC», или «Guided self-rehabilitation contract» — «Договор о направленной самореабилитации» [7]. Автором также разработано подробное руководство для пациентов с описанием концепции программы и техники упражнений на простом, понятном для пациентов языке, существует мобильное приложение, содержащее видеоинструкции для каждого упражнения и позволяющее программировать план занятий, контролировать их исполнение [6].
Таким образом, упражнения программы GSC направлены на основные компоненты патологического процесса: парез, спастичность и мышечную контрактуру (на этапе спастической миопатии), а подробное руководство и мобильное приложение с видеоинструкциями позволяют пациенту выполнять упражнения самостоятельно в домашних условиях.
Данные об эффективности программы
Так как программа «I-CAN» была разработана в начале 2000-х годов, а международное распространение получила лишь в 2016 г., применяясь до этого лишь во Франции, на настоящее время опубликованы данные нескольких клинических исследований на ограниченном числе пациентов. В настоящее время проводится слепое рандомизированное контролируемое сравнительное исследование эффективности программы GSC и стандартной клинической практики ведения пациентов на внестационарном этапе, а также завершено международное, с участием России, клиническое исследование эффекта совместного применения абоботулотоксина (препарат диспорт) и программы GSC. Во всех исследованиях, проведенных и текущих, эффективность метода оценивается у пациентов в резидуальном восстановительном периоде (при давности спастического пареза более 12 мес).
Первая опубликованная работа была посвящена оценке изменения скорости ходьбы на фоне ботулинотерапии и применения программы GSC [19]. В исследовании с участием 14 пациентов (средняя давность инсульта 52 мес) после 9 мес ежедневных тренировок в рамках программы GSC на фоне 3 последовательных циклов инъекций ботулотоксина в нижние конечности наблюдали увеличение комфортной скорости ходьбы на 49% и максимальной скорости ходьбы на 65% (p<0,01). Авторы сделали вывод, что вопреки распространенному мнению, пациенты с хроническим гемипарезом после инсульта могут значительно увеличить скорость ходьбы при совместном применении ботулотоксина и программы GSC.
В другом сравнительном проспективном исследовании 12 пациентов с гемипарезом (средняя давность инсульта 77 мес) и без выраженных нарушений когнитивной функции были обследованы дважды с интервалом в 8 нед, в течение которых не назначали ботулинотерапию [20]. При этом 6 пациентов в дополнение к стандартной физической терапии в среднем 2 ч в неделю самостоятельно выполняли упражнения в рамках GSC не менее 3 ч в неделю. В течение 8 нед среднее значение комфортной скорости ходьбы увеличилось в группе GSC с 0,77 до 0,88 м/с (+14%), а в группе стандартной терапии с 0,68 до 0,69 м/с (+1,4%); p<0,01 между группами. В группе GSC диапазон пассивной дорсифлексии (тыльное сгибание в голеностопном суставе, XV1 по шкале Тардье) увеличился на 3,3° при согнутом и на 5,5° при разогнутом коленном суставе, в группе стандартной терапии данные показатели уменьшились на 0,6° и 4,6° соответственно (статистически незначимо). Диапазон активной дорсифлексии при разогнутом коленном суставе в группе GSC увеличился на 8,2%, а в группе сравнения уменьшился на 8% (статистически незначимо). Авторы сделали вывод, что в резидуальном восстановительном периоде после инсульта самостоятельное выполнение упражнений программы GSC в дополнение к стандартной физической терапии может увеличить скорость ходьбы.
В недавно опубликованной работе M. Pradines и соавт. [21] представили результаты ретроспективного исследования эффективности годового курса упражнений, направленных на самостоятельное растяжение мышц нижних конечностей, в рамках GSC. За год наблюдения было проведено 6 клинических оценок, включающих объем пассивного движения (показатель XV1 по шкале Тардье), коэффициент укорочения, 10-метровый тест ходьбы, а также скорость передвижения в естественной среде. За коэффициент укорочения было принято отношение разницы между выявляемой и нормальной амплитудой пассивного движения к нормальной амплитуде пассивного движения (C=(Xn—XV1)/Xn, где XV1 = объем пассивного движения у пациента; Xn = объем движения в норме). За значимое изменение объема пассивного движения применяли увеличение угла более чем на 5° для подошвенных сгибателей и более чем на 10° для более проксимальных мышц. Авторы оценили изменения коэффициента укорочения и пассивного движения в мышцах, подверженных и не подверженных растяжению, а также оценили корреляцию между средним значением объема пассивного движения для 6 мышц и скоростью передвижения.
В наблюдение вошло 27 клинических случаев: 18 пациентов с гемипарезом и 9 — с парапарезом, давность пареза на момент начала наблюдения у всех пациентов составляла более 1 года. Через 1 год регулярных самостоятельных занятий в рамках программы GSC для 47% мышц, подвергшихся растяжению, наблюдали значимое увеличение объема пассивного движения по сравнению с 14% мышц, не подвергшихся регулярному растяжению (p<0,0001). Коэффициент укорочения C уменьшился на 31% в мышцах, включенных в программу растяжения, по сравнению с уменьшением данного показателя на 7% в мышцах сравнения (p<0,0001). Средняя скорость ходьбы увеличилась на 41% (p<0,0001): с 0,81 м/с до 1,15 м/с. Из 12 пациентов 8 (67%), которые были изначально сильно ограничены в передвижении или не могли самостоятельно выходить из дома, перешли в категорию более высокой функциональной независимости и мобильности. У пациентов с гемипарезом наблюдали тенденцию к корреляции между значениями объема пассивного движения и скоростью передвижения (r=0,44; p=0,09). Авторы сделали вывод о целесообразности назначения и мониторинга выполнения упражнений на самостоятельное пассивное растяжение мышц нижних конечностей по программе GSC, так как это может увеличить растяжимость мышц при давности спастического пареза более 1 года.
В недавно завершенном международном клиническом исследовании (протокол «ENGAGE», ClinicalTrials.gov ID: NCT02969356) оценивали эффект совместного применения ботулинотерапии (диспорт, 1500 ЕД) и программы GSC в отношении восстановления активной функции верхней или нижней конечности. Доза препарата была разделена между верхней и нижней конечностью, причем в случае необходимости инъекции в верхнюю конечность максимальная доза составляла не более 1000 Е.Д. Исследование проводили в 20 клинических центрах Франции, России, Чехии и США. В исследование были включены 157 взрослых пациентов с давностью очагового повреждения головного мозга более 12 мес, оценкой по модифицированной шкале Френчай от 2 до 7 баллов (при первичной цели лечения, связанной с верхней конечностью) или максимальной скоростью ходьбы от 0,2 до 1,4 м/с (при первичной цели лечения, связанной с нижней конечностью). Результаты исследования будут опубликованы в скором времени и дадут клиницистам ответы на вопросы, могут ли индивидуальные программы самореабилитации, такие как GSC, в сочетании с ботулинотерапией обеспечить улучшение активной функции в резидуальном восстановительном периоде и насколько пациенты готовы придерживаться подобной программы [22].
В настоящее время во Франции проводится многоцентровое рандомизированное слепое контролируемое исследование, в котором сравнивается эффективность программы GSC с эффективностью стандартной клинической практики ведения пациентов на внестационарном этапе в течение двухлетнего периода наблюдения (протокол «Neurorestore», ClinicalTrials.gov ID: NCT02202954) [23]. Протокол исследования подразумевает участие 124 пациентов, перенесших инсульт и находящихся в резидуальном восстановительном периоде. Первичные конечные точки исследования: скорость ходьбы (10-метровый тест) и балл по модифицированной шкале Френчай.
Общие принципы организации работы с программой
Первые несколько занятий по программе проводятся под контролем специалиста. При подборе индивидуальной программы упражнений и режима их дозирования специалист учитывает степень двигательного дефицита, выраженность спастичности, утомляемость, психологические особенности пациента и др. Для поддержания мотивации и вовлеченности пациента сначала рекомендуется подбирать те упражнения, от проведения которых в первую очередь можно ожидать результат. Далее продолжительность занятий по программе увеличивается. Автор программы разъясняет пациенту: «Каждое упражнение должно быть сложным. Если упражнение со временем становится легким — это, с одной стороны, означает, что заметен прогресс в тренировках, с другой — что данное упражнение стало малоэффективным для тренировки мозга. Лечащему врачу в таком случае следует увеличить уровень сложности, подобрав другие упражнения» [6]. После того, как пациент обучился правильной технике выполнения упражнений (по нашему опыту, для этого достаточно 3—4 очно контролируемых занятий), пациент может выполнять упражнения полностью самостоятельно с периодическим контролем 1 раз в несколько месяцев.
Также возможно проведение групповых занятий. С. Gault-Colas и соавт. [24] описывают опыт проведения 69 групповых занятий по программе GSC, отдельно по верхней конечности и отдельно по нижней. Во время таких занятий в группах пациентов по 4—5 человек отрабатывалась прежде всего техника упражнений под контролем специалиста, поэтому длительность каждого упражнения была сокращена в 3—5 раз по сравнению с режимом выполнения упражнений самостоятельно в домашних условиях. На занятиях также присутствовали родственники и ухаживающие лица. Группы, как правило, были гомогенны в отношении возраста, диагноза, приверженности занятиям. Авторы показали, что благодаря периодическому проведению таких групповых занятий увеличилась мотивация пациентов, их приверженность программе, а также улучшилась техника выполнения упражнений и динамика восстановления. Согласно опросникам подавляющее большинство пациентов (94%) выразили удовлетворенность таким форматом и желание приходить на занятия повторно, осознали преимущества качественной и интенсивной работы, а также отметили увеличение вовлеченности родственников и ухаживающих лиц в их восстановительный процесс.
Важно отметить, что ботулинотерапия является неотъемлемым компонентом программы при наличии спастичности от 2 баллов по модифицированной шкале Эшворта, ограничивающей функционирование, уход и самообслуживание, при ассоциированном со спастичностью болевым синдром [2, 4, 25]. Широкий спектр зарегистрированных таргетных мышц верхней и нижней конечностей у препарата диспорт позволяет официально проводить инъекции для достижения разнообразных целей лечения взрослых пациентов. Однако в реальной клинической практике инъекция БТА не всегда предшествует началу работы по программе GSC. В таких случаях не стоит откладывать занятия по программе, так как необходимо с первых дней акцентировать внимание пациента на необходимости проведения ежедневных занятий. Кроме этого, ведение дневника и регулярной отчетности приводит к повышению самодисциплины и мотивации пациента. И если пациент позже получает инъекцию БТА, программа, как правило, изменяется: за счет действия ботулотоксина сокращается время растяжения тех мышц, которые находились в гипертонусе, увеличивается время для активных упражнений, и в целом само время общей нагрузки.
Данная форма самореабилитации подразумевает участие пациентов в программе GSC в домашних условиях с возможностью контроля регулярности занятий врачом (тренером, консультантом), следовательно, стоит также отметить снижение «нагрузки» на специалистов амбулаторного звена, а также, возможно, и прямых затрат на годовое лечение и реабилитацию пациента с синдромом постинсультной спастичности. Для более детального анализа эффективности программы с экономической позиции требуется проведение дополнительных исследований.
Собственный опыт применения программы «I-CAN»
В клинике амбулаторной и домашней двигательной реабилитации «Ренейро» мы предлагаем программу пациентам со спастическим парезом в результате очагового повреждения головного мозга без выраженного когнитивного дефицита, суставных контрактур, мотивированных и намеренных самостоятельно выполнять упражнения в домашних условиях. Зачастую такие пациенты и так самостоятельно выполняют определенные упражнения, найденные в открытых источниках или подобранные самостоятельно. Но многие из этих упражнений, не назначенных и не контролируемых специалистом, способствуют усилению синдрома спастичности, развитию компенсаторных движений или закреплению патологических двигательных стереотипов, либо просто оказываются неэффективными.
Рассмотрим клинический случай ведения пациента по программе GSC «I-CAN» в течение 12 мес.
Мужчина, 55 лет, перенес геморрагический инсульт в базальных ядрах справа со смещением влево срединных структур с прорывом крови в желудочковую систему. Давность инсульта на момент обращения — 10 мес. В острейшем периоде сформировалась левосторонняя гемиплегия, в раннем восстановительном периоде — левосторонний спастический гемипарез. В прошлом работал резчиком по стеклу, женат. При первом визите в клинику отмечена высокая степень мотивации, пациент активно участвует в процессе воспитания внуков. Пациенту проведена комплексная диагностическая оценка с использованием шкалы Фугл—Мейера (раздел для оценки двигательной функции руки), модифицированной шкалы Френчай, с измерением объема активного движения в суставах, качественным и количественным анализом ходьбы. Ввиду проживания в 100 км от Москвы изначально пациент посещал клинику 1 раз в месяц для контроля техники выполнения упражнений и корректировки интенсивности программы, затем очные визиты требовались 1 раз в полгода. Первый цикл инъекций ботулотоксина пациент получил спустя 1,5 года после инсульта, к этому времени он ежедневно занимался по программе GSC «I-CAN» в течение 8 мес. Всего на момент последнего визита пациент получил 2 цикла инъекций в мышцы верхней конечности (инъекции проводились в стационаре). Динамика восстановления двигательной функции за период наблюдения 12 мес представлена на рисунке.
За период наблюдения у пациента отмечено улучшение функции верхней конечности, что отражает увеличение общего балла по соответствующему разделу шкалы Фугл—Мейера на 63%. При этом в течение первых 6 мес на фоне регулярных занятий по программе GSC значение данного показателя увеличилось с 30 до 42 баллов, а после проведения двух циклов инъекции БТА — до 49 баллов.
Значительное увеличение активного разгибания в локтевом суставе, с 100˚ до 170˚, произошло только после двух циклов БТА в соответствующие мышцы.
Также на фоне регулярных занятий по программе GSC отмечено увеличение скорости ходьбы. Время, затрачиваемое на перемещение с комфортной скоростью зала ЛФК с возвращением в исходную точку (2 длины зала), за 12 мес наблюдения уменьшилось с 48 до 20 мин, т. е. на 58%. Время, затрачиваемое на перемещение в естественной среде на фиксированное расстояние, снизилось на 55%, с 60 до 27 мин.
Таким образом, пациенты со спастическим парезом проводят основную часть времени вне стационара. Большая часть «терапевтического окна» ботулинотерапии также приходится на амбулаторный этап двигательной реабилитации. Поэтому организация процесса реабилитации на данном этапе играет ключевую роль в восстановлении. Программа домашней самореабилитации GSC «I-CAN» способна решить основные проблемы двигательной реабилитации для пациентов со спастическим парезом. В программе GSC могут принять участие пациенты без грубых когнитивных нарушений, намеренных самостоятельно выполнять упражнения в домашних условиях, даже в резидуальном восстановительном периоде. Ботулинотерапия является неотъемлемым компонентом программы при наличии спастичности от 2 баллов по модифицированной шкале Эшворта, ограничивающей функционирование, уход и самообслуживание, при ассоциированном со спастичностью болевым синдром.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Мокиенко Олеся Александровна — e-mail: lesya.md@yandex.ru; https://orcid.org/0000-0002-7826-5135
Мендалиева Айнагуль Сансысбаевна — https://orcid.org/0000-0003-4943-4486
*e-mail: lesya_md@yandex.ru
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями
использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании
файлов cookie, нажмите здесь.
Выбор фармакологической терапии при спастическом мышечном гипертонусе
Основными препаратами, применяемыми для снижения мышечного тонуса, являются миорелаксанты. Рассмотрены вопросы выбора терапии с применением антиспастических препаратов в зависимости от течения заболевания, выраженности мышечной спастичности и побочных эффектов
Миорелаксанты являются основными препаратами, применяемыми для снижения мышечного тонуса. Рассмотрены вопросы подбора терапии антиспастическими препаратами в зависимости от заболевания, выраженности мышечной спастичности, побочных эффектов и особенностей действия препарата.
Основными препаратами, применяемыми для снижения мышечного тонуса, являются миорелаксанты. По механизму действия различают миорелаксанты центрального действия (влияют на синаптическую передачу возбуждения в ЦНС) и периферического действия (угнетают непосредственную возбудимость поперечнополосатых мышц). При применении миорелаксантов могут возникать достаточно значительные побочные эффекты, которые необходимо тщательно оценивать при выборе препарата [1, 2].
При выборе антиспастических средств учитывают их способность угнетать полисинаптические рефлексы (уменьшение спастичности), при этом они в наименьшей степени влияют на моносинаптические рефлексы (мышечную силу). Антиспастический препарат должен уменьшать мышечную спастичность с минимальной потерей мышечной силы [3, 4].
Медикаментозная терапия основана на использовании таблеток и инъекционных форм. Пероральные антиспастические средства за счет снижения мышечного тонуса позволяют улучшить двигательные функции, облегчить уход за иммобилизованным больным, снять болезненные мышечные спазмы, усилить эффект лечебной физкультуры, предотвратить развитие контрактур [5]. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту; однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых часто вызывает нежелательные побочные эффекты. Лечение миорелаксантами начинают с минимальной дозы, затем медленно увеличивают до достижения эффекта [6].
К наиболее широко применяемым в России миорелаксантам центрального действия для лечения спастического гипертонуса мышц относятся баклофен, тизанидин, толперизон и диазепам [7, 8].
Баклофен (Баклозан, Лиорезал) оказывает антиспастическое действие преимущественно на спинальном уровне. Препарат является аналогом гамма-аминомасляной кислоты (ГАМК), которая связывается с пресинаптическими ГАМК-рецепторами, в результате чего снижается высвобождение возбуждающих аминокислот (глутамат, аспартат) и подавляется моно – и полисинаптическая активность на синаптическом уровне спинного мозга, который вызывает снижение спастичности. Препарат также проявляет умеренное центральное обезболивающее действие. Баклофен применяют при церебральном и спинальном спастическом гипертонусе мышц различного генеза. Начальная доза составляет 5-15 мг/сут (в один или три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта. Препарат принимают во время еды. Максимальная доза баклофена для взрослых составляет от 60 до 75 мг/сут. Побочные эффекты чаще всего проявляются седативным эффектом, сонливостью, снижением концентрации внимания, головокружением, нередко слабостью во время лечения. Возможно появление тошноты, запоров и диареи, артериальной гипертензии, усиление атаксии, появление парестезий. Осторожность требуется при лечении больных пожилого возраста, больных, перенесших инсульт, больных с язвенной болезнью желудка и двенадцатиперстной кишки. Баклофен противопоказан при эпилепсии и судорогах в анамнезе [9, 10], больным с язвенной болезнью желудка и двенадцатиперстной кишки. Баклофен противопоказан при эпилепсии и судорогах в анамнезе [9, 10], больным с язвенной болезнью желудка и двенадцатиперстной кишки. Баклофен противопоказан при эпилепсии и припадках в анамнезе [9, 10].
При выраженной спастичности, когда обычное пероральное введение антиспастических средств неэффективно, показано интратекальное введение баклофена, впервые предложенное в 1984 г. R. Penn. Для достижения необходимой концентрации препарата в спинномозговой жидкости необходимо принимать достаточно значительные дозы баклофена, что может привести к нарушению сознания, сонливости и слабости. В связи с этим были разработаны системы, в которых баклофен доставляется непосредственно в интратекальное пространство спинного мозга с помощью интратекальной баклофеновой насосной системы. При этом клинический эффект достигается при значительно меньших дозах баклофена, чем при применении таблеток [11, 12].
Эта система состоит из резервуара, содержащего баклофен или аналогичный препарат, помпы (помпы), с помощью которой препарат дозируется в интратекальное пространство спинного мозга через люмбальный катетер, и блока питания. Из депо баклофен поступает непосредственно в спинномозговую жидкость, а его дозировку контролируют с помощью специального радиотелеметрического прибора. Количество препарата, попадающего в спинномозговую жидкость, может изменяться в зависимости от клинической картины. Баклофен добавляют в резервуар через 2–3 месяца путем чрескожной пункции [13].
Использование баклофеновой помпы повышает скорость и качество ходьбы у больных с нефиксированными рефлекторными контрактурами за счет высокой спастичности мышц-синергистов и дисбаланса мышц-антагонистов. Имеющийся клинический опыт 15-летнего интратекального применения баклофена у больных с инсультом свидетельствует о высокой эффективности этого метода в снижении не только степени спастичности, но и болевых синдромов и дистонических расстройств. Отмечено положительное влияние баклофеновой помпы на качество жизни пациентов с инсультом [14].
Тизанидин (Сирдалуд) — миорелаксант центрального действия, агонист альфа-2-адренорецепторов. Препарат уменьшает спастичность за счет подавления полисинаптических рефлексов на уровне спинного мозга, что может быть обусловлено торможением выброса возбуждающих аминокислот L-глутамата и L-аспартата и активацией глицина, что снижает возбудимость интернейронов спинного мозга. Тизанидин также оказывает умеренное центральное обезболивающее действие. Препарат эффективен при церебральной и спинальной спастичности, а также болезненных мышечных спазмах. Начальная доза препарата составляет 2-6 мг/сут в один или три приема, при индивидуальном подборе дозу увеличивают на 2 мг в течение 3-4 дней. При приеме внутрь, действие препарата проявляется через 30-45 мин, максимальный эффект наступает через 1-2 ч. Средняя терапевтическая доза составляет 12-24 мг/сут, максимальная доза – 36 мг/сут. В качестве побочных эффектов могут возникать сонливость, сухость во рту, головокружение и снижение артериального давления, что ограничивает применение препарата при постинсультной спастичности. Антиспастическое действие тизанидина сравнимо с действием баклофена, однако тизанидин при правильном подборе дозы переносится лучше, так как не вызывает общей мышечной слабости и не усиливает мышечную слабость в парализованной конечности [15, 16]. Могут возникать сонливость, сухость во рту, головокружение и снижение артериального давления, что ограничивает применение препарата при постинсультной спастичности. Антиспастическое действие тизанидина сравнимо с действием баклофена, однако тизанидин при правильном подборе дозы переносится лучше, так как не вызывает общей мышечной слабости и не усиливает мышечную слабость в парализованной конечности [15, 16]. Могут возникать сонливость, сухость во рту, головокружение и снижение артериального давления, что ограничивает применение препарата при постинсультной спастичности. Антиспастическое действие тизанидина сравнимо с действием баклофена, однако тизанидин при правильном подборе дозы переносится лучше, так как не вызывает общей мышечной слабости и не усиливает мышечную слабость в парализованной конечности [15, 16].
Толперизон (Мидокалм) — антиспастический препарат центрального действия, угнетает каудальную часть ретикулярной формации, обладает N-холиноблокирующими свойствами. Толперизон снижает активность спинномозговых нейронов, участвующих в формировании спастичности, путем ограничения потока натрия через мембрану нервных клеток. Наиболее часто используемая доза составляет от 300 до 450 мг/сут в два или три приема. Снижение мышечного тонуса при назначении толперизона иногда сопровождается сосудорасширяющим эффектом, что необходимо учитывать при назначении препарата больным со склонностью к артериальной гипотензии. Кроме того, препарат может вызывать или усиливать недержание мочи у пациентов [17].
Основным побочным эффектом баклофена, тизанидина и толперизона является быстрое появление мышечной слабости, и в каждом случае врач должен найти баланс между снижением тонуса и усилением слабости. Кривая равновесия между снижением спастического тонуса и нарастанием мышечной слабости у больных с повышенной дозой Мидокалма, Сирдалуда или Баклофена показывает, что наиболее быстрое нарастание слабости происходит при приеме Баклофена, а препарат А более щадящий, что позволяет для эффективного подбора индивидуальной дозы является Мидокалм. Во всех случаях, учитывая наличие узкого терапевтического окна, курс лечения начинают с небольшой дозы препарата, постепенно увеличивая ее до достижения выраженного антиспастического эффекта, но не до появления слабости [18].
Диазепам (реаланиум, релиум, сибазон) является миорелаксантом, так как обладает способностью стимулировать сниженное пресинаптическое торможение на спинальном уровне. Он не обладает прямыми ГАМКергическими свойствами, увеличивает концентрацию ацетилхолина в головном мозге и ингибирует обратный захват норадреналина и дофамина в синапсах. Это приводит к усилению пресинаптического торможения и проявляется снижением сопротивления растяжению, увеличением объема движений. Диазепам также обладает способностью уменьшать боль, вызванную мышечным спазмом. Наряду со снижением мышечного тонуса из-за токсического воздействия на центральную нервную систему развиваются вялость, головокружение, проблемы с вниманием и координацией. Это существенно ограничивает использование диазепама в качестве миорелаксанта. В основном применяется для лечения спастичности спинального генеза, при необходимости кратковременного снижения мышечного тонуса. Для лечения спастичности назначают в дозе 5 мг однократно или по 2 мг 2 раза в сутки. Максимальная суточная доза может составлять 60 мг. При высоких дозах возможны нарушения сознания, преходящие нарушения функции печени, изменения крови. Продолжительность лечения ограничена из-за возможного развития лекарственной зависимости [20] преходящая дисфункция печени и изменения крови. Продолжительность лечения ограничена из-за возможного развития лекарственной зависимости [20] преходящая дисфункция печени и изменения крови. Продолжительность лечения ограничена из-за возможного развития лекарственной зависимости [20].
Клоназепам является производным бензодиазепинов. Клоназепам оказывает седативное, центральное миорелаксирующее и анксиолитическое действие. Миорелаксирующий эффект достигается за счет усиления тормозящего действия ГАМК на передачу нервных импульсов, стимуляции бензодиазепиновых рецепторов, расположенных в аллостерическом центре постсинаптических ГАМК-рецепторов восходящей активирующей ретикулярной формации ствола мозга и вставочных нейронов латеральной рогов спинного мозга, кроме снижения возбудимости подкорковых структур головного мозга и торможения полисинаптических спинномозговых рефлексов.
Быстрое появление сонливости, головокружения и привыкания ограничивает применение этого препарата. Для уменьшения проявления возможных побочных реакций необходимо достижение терапевтической дозы путем медленного титрования в течение двух недель. Для перорального применения у взрослых рекомендуется начальная доза не более 1 мг/сут. Поддерживающая доза – 4-8 мг/сут. Возможно назначение малых доз в сочетании с другими миорелаксантами. Клоназепам эффективен при пароксизмальном повышении мышечного тонуса. Противопоказан при острых заболеваниях печени, почек, миастении [21].
Дикалия клоразепат (Транксен) — аналог бензодиазепина, превращается в основной метаболит диазепама, обладает большей активностью и продолжительностью антиспастического действия, чем диазепам. Отмечен его хороший эффект при лечении в виде снижения фазовых стретч-рефлексов, он оказывает легкое седативное действие. Начальная доза составляет 5 мг 4 раза в сутки, затем снижается до 5 мг 2 раза в сутки [22].
Дантролен — производное имидазолина, действующее вне центральной нервной системы, преимущественно на уровне мышечных волокон. Механизм действия дантролена заключается в блокаде высвобождения кальция из саркоплазматического ретикулума, что приводит к снижению степени сократимости скелетных мышц, снижению мышечного тонуса и фазовых рефлексов, увеличению амплитуды пассивных движений. Важным преимуществом дантролена по отношению к другим миорелаксантам является его доказанная эффективность в отношении спастичности не только спинного, но и церебрального генеза. Начальная доза составляет 25 мг/сут, при хорошей переносимости дозу увеличивают в течение 4 нед до 400 мг/сут. Побочные действия: сонливость, головокружение, тошнота, диарея, снижение скорости клубочковой фильтрации. Серьезную опасность, особенно у пациентов пожилого возраста, в дозах выше 200 мг/сут представляет гепатотоксическое действие, поэтому в период лечения необходимо регулярно контролировать функцию печени. Элиминация дантролена на 50% происходит за счет печеночного метаболизма, поэтому он противопоказан при заболеваниях печени. Осторожность следует также использовать при тяжелых заболеваниях сердца или легких.
Катапресан – применяется преимущественно при травмах позвоночника, действует на мозговые альфа-2 агонисты, оказывает пресинаптическое торможение. Побочные эффекты включают низкое кровяное давление и депрессию. Начальная доза — 0,05 мг 2 раза в сутки, максимальная — 0,1 мг 4 раза в сутки.
Темазепам – взаимодействует с бензодиазепиновыми рецепторами аллостерического центра постсинаптических ГАМК-рецепторов, расположенных в лимбической системе, ретикулярной формации восходящей активации, гиппокампе, вставочных нейронах боковых рогов спинного мозга. В результате открываются каналы для входящих токов ионов хлора и, таким образом, усиливается действие эндогенного тормозного медиатора ГАМК. Рекомендуемая доза составляет 10 мг 3 раза в сутки. Эффективна его комбинация с баклофеном [23, 24].
Основные препараты, применяемые для лечения спастического мышечного гипертонуса, представлены в таблице.
Поэтому выбор препарата определяется основным заболеванием, выраженностью мышечной спастичности, а также побочными эффектами и особенностями действия того или иного препарата.
Так, например, тизанидин и баклофен оказывают большее влияние на тонус мышц-разгибателей, поэтому при значительном гипертонусе мышц-сгибателей руки, легкой спастичности мышц голени не показано его назначение, т. к незначительное повышение тонуса мышц-разгибателей голени компенсирует мышечную слабость в ноге и стабилизирует походку больного. При этом средствами выбора являются методы физического воздействия на мышцы верхней конечности.
При лечении церебральной спастичности чаще всего применяют Сирдалуд, а при спинальной спастичности — Сирдалуд и Баклофен. Важным преимуществом Мидокалма перед другими миорелаксантами является отсутствие седативного действия и благоприятный спектр переносимости, что делает его препаратом выбора для амбулаторного лечения и лечения пациентов пожилого возраста.
Допустима комбинация нескольких препаратов, что позволяет эффективно снизить тонус при более низких дозах каждого из препаратов. Комбинация препаратов с разными точками приложения, начиная от мозговых центров и заканчивая мышцами, может привести к суммированию терапевтического эффекта.
Эффективность пероральных антиспастических препаратов снижается при их длительном применении, часто возникает необходимость увеличения дозы для поддержания исходного клинического эффекта, что сопровождается увеличением частоты и выраженности побочных реакций [25-27].
В ситуации, когда спастичность носит локальный характер и нежелательно системное действие пероральных миорелаксантов, предпочтительны местные методы воздействия, одним из которых является местное введение ботулотоксина [28, 29].
- Скоромец А. А., Амелин А. В., Пчелинцев М. В. Руководство по выписке для невролога. Санкт-Петербург: Политехнический. 2000. 342 стр.
- Шток В. Н. Фармакотерапия в неврологии: практическое руководство. 4-е изд., перераб и доп. М.: ООО «Агентство медицинской информации», 2006. 480 с.
- Руководство по организации неврологической помощи больным с инсультом в Санкт-Петербурге / Под ред. В. А. Сорокоумова. СПб: СПб, 2009. 88 с.
- Леманн-Хорн Ф., Людольф А. Лечение заболеваний нервной системы. Москва: МЕДпресс-информ. 2005. 528 стр.
- О’Дуайер Н., Ада Л., Нейлсон П. Спастичность и контрактура мышц при инсульте // Мозг. 2006 том. 119. Страницы 1737-1749.
- Дамулин И. В. Синдром спастичности и основные направления его лечения // Журнал неврологии и психиатрии. СС Корсаков. 2003. № 12. С. 4–9.
- Завалишин И. А., Бархатова В. П., Шитикова И. Е. Спастические парезы // В кн. Рассеянный склероз. Избранные вопросы теории и практики под ред. И. А. Завалишина, В. И. Головкина. ООО “Эльф ДПИ”. 2000, с. 436–455.
- Левин О. С. Основные лекарственные средства, применяемые в неврологии: учебное пособие. М.: МЕДпресс-информ, 2007. 336 с.
- Бойко А. Н., Лащ Н. Ю., Батышева Т. Т. Повышение мышечного тонуса: этиология, патогенез, коррекция // Руководство врача поликлиники. 2004. Т. 4. № 1. С. 28–30.
- Дамулин И. В. Синдром спастичности и основные направления его лечения // Журнал неврологии и психиатрии. СС Корсаков. 2003. № 12. С. 4–9.
- Избранные лекции по неврологии: Под ред. ВЛ Голубева. М.: ЭйдосМедиа, 2006. 624 с.
- Parziale J., Akelman E., Herz D. Спастичность: патофизиология и лечение // Ортопедия. 2003 том. 16 стр. 801–811.
- Кац Р., Раймер З. Спастическая гипертония: механизмы и измерения // Arch Physical Medicine Rehabilitation 2009 Vol. 70 страниц 144-155.
- Барнс М. Обзор клинического лечения спастичности // В: Синдром верхних двигательных нейронов и спастичность. Издательство Кембриджского университета. 2001 стр. 5–11.
- Парфенов В. А. Патогенез и лечение спастичности // Русский медицинский журнал. 2011. Т. 9. № 25. С. 16–18.
- Кадыков А. С., Шахпаранова Н. В. Медицинская реабилитация больных со спастическими парезами. В: Синдром верхнего моторного нейрона под ред. И. А. Завалишина, А. И. Осадчих, Я. В. Влашова. Самара: Самарский филиал. Литфонда, 2005, с. 304–315.
- Кадыков А. С., Черникова Л. А., Сашина М. Б. Реабилитация больных с постинсультным центральным болевым синдромом // Реабилитация. Сборник научных статей (годовое издание), № 1. М.: Изд-во РГМУ, 2003. С. 357–359.
- Сашина М. Б., Кадыков А. С., Черникова Л. А. Постинсультные болевые синдромы // Атмосфера нервные заболевания. 2004. № 3. С. 25–27.
- Камчатнов П. Р. Спастичность: современные подходы к терапии // Русский медицинский журнал. 2004. Т. 12. № 14. С. 849–854.
- Гусев Е. И., Скворцова В. И., Платинова И. А. Терапия ишемического инсульта // Consilium medicum. 2003 г., спецвыпуск стр. 18–25.
- Кадыков А. С., Черникова Л. А., Сашина М. Б. Постинсультные болевые синдромы // Неврологический журнал. 2003. № 3. Статьи 34–37.
- Мусаева Л. С., Завалишин И. А. Лечение спастичности при рассеянном склерозе // Материалы 9-го симпозиума «Рассеянный склероз: лечение и выздоровление». Санкт-Петербург: Лица России. 2000, с. 59 и 60.
- Раса. Принципы диагностики, лечения и профилактики / Под ред. Н.В. Верещагина, М. А.Пирадова, З. А.Суслина. Москва: Интермедика, 2002. 208 с.
- Sommerfeld DK, Eek EU-B., Svensson A.-K et al. Спастичность после инсульта: ее возникновение и связь с двигательными нарушениями и ограничением активности // Инсульт. 2004 том. 35 страниц 134-140.
- Бахейт А., Закине Б., Майсонобе П. Профиль пациента и современная практика лечения спастичности мышц верхних конечностей ботулотоксином типа А // Международная реабилитация. Рез. 2010, том. 33 страницы 199–204.
- Малахов В. А. Мышечная спастичность при органических заболеваниях нервной системы и ее коррекция // Международный неврологический журнал. 2010. № 5. Ст.67–70.
- Дэвис Т., Бродский М., Картер В. Консенсус по применению ботулинического нейротоксина для лечения спастичности у взрослых // Фармация и терапия. 2006 том. 31 стр. 666–682.
- Чайлдерс М., Брашер А., Йозефчик П. Дозозависимый ответ на внутримышечное введение ботулинического токсина типа А при спастичности верхних конечностей после инсульта // Арх физической медицины, реабилитация, 2004, том. 85 стр. 1063–1069.
- Кадыков А. С. Миорелаксанты в реабилитации больных с постинсультными двигательными нарушениями // Журнал неврологии и психиатрии. СС Корсаков. 1997. № 9. С. 53–55.
Королев А. А., кандидат медицинских наук
ФГБУ Всероссийский центр медицины катастроф и радиации имени ВИАМ Никифорова “МЧС России, Санкт-Петербург
Лечение постинсультной спастичности
В России ежегодно регистрируется от 300 до 400 тысяч инсультов, что обусловливает наличие более одного миллиона пациентов, перенесших инсульт. Более чем у половины из них сохраняются двигательные расстройства, которые значительно снижают качество жизни и нередко приводят к стойкой инвалидности (1).
Двигательные нарушения после инсульта чаще всего проявляются гемипарезом или монопарезом конечности с повышением мышечного тонуса в зависимости от вида спастичности (1,2,9). У больных с инсультом спастичность часто нарастает в паретичных конечностях в течение нескольких недель или месяцев; относительно редко (чаще при восстановлении двигательных функций) наблюдается спонтанное уменьшение спастичности. Во многих случаях у больных с инсультом спастичность влияет на двигательные функции, способствует развитию контрактур и деформаций конечностей, затрудняет уход за иммобилизованным больным, иногда сопровождается болезненными мышечными спазмами (2,5,6). ,9,14).
Восстановление утраченных двигательных функций максимально в течение двух-трех месяцев с момента инсульта; в дальнейшем скорость восстановления значительно снижается. Через год после начала инсульта степень пареза вряд ли уменьшится, но возможно улучшение двигательных функций и снижение инвалидности путем тренировки равновесия и походки, использования специальных приспособлений для движения, снижения спастичности в ногах. (1,2,6,9,14)
Основной целью лечения постинсультной спастичности является улучшение функциональных возможностей паретичных конечностей, походки и самообслуживания больных. К сожалению, в значительной части случаев возможности лечения спастичности ограничиваются лишь уменьшением боли и дискомфорта, связанных с высоким мышечным тонусом, облегчением ухода за парализованным больным или устранением имеющегося косметического дефекта, вызванного спастичностью (2.6). ,14).
Одним из важнейших вопросов, который необходимо решить при ведении больного со спастичностью после инсульта, является следующий: ухудшает ли спастичность функциональные возможности больного или нет? В целом функция конечности у больного с постинсультным парезом конечностей хуже при выраженной спастичности, чем при легкой спастичности. В то же время у части больных с выраженной степенью пареза спастичность в мышцах голени может облегчить стояние и ходьбу, а ее уменьшение может привести к нарушению двигательной функции и даже к падениям (2,6, 14).
Прежде чем приступить к лечению постинсультной спастичности, необходимо определить возможности лечения для конкретного больного (улучшение двигательных функций, уменьшение болевых спазмов, облегчение ухода за больным и др.) и обсудить их с больным и (или) его родственники. Возможности лечения во многом определяются временем, прошедшим от начала заболевания и степенью пареза, наличием когнитивных расстройств (2,6,14). Чем короче время, прошедшее с начала инсульта, вызвавшего спастический парез, тем больше вероятность улучшения лечения спастичности, так как это может привести к значительному улучшению двигательных функций, предотвращение образования контрактур и повышение эффективности реабилитации в период максимальной пластичности ЦНС. При длительном течении заболевания значимое улучшение двигательных функций маловероятно, однако можно значительно облегчить уход и снять дискомфорт, вызванный спастичностью. Чем ниже степень пареза конечности, тем более вероятно, что лечение спастичности улучшит двигательную функцию (14).
Лечебная гимнастика — наиболее эффективный способ ведения больного с постинсультным спастическим гемипарезом, направленный на тренировку движений в паретичных конечностях и профилактику контрактур (2,14).
Методы физиотерапии включают постановку, обучение больных стоять, сидеть, ходить (с помощью дополнительных средств и самостоятельно), бинтование конечности, ношение ортопедических приспособлений, тепловое воздействие на спастические мышцы, а также электростимуляцию отдельных групп мышц, таких как как разгибатели пальцев или передняя большеберцовая мышца (4).
Больным с выраженной спастичностью сгибателей верхних конечностей не следует рекомендовать интенсивные упражнения, способные значительно повысить мышечный тонус, например, сжимание резинового кольца или мяча, использование эспандера для развития сгибательных движений в локтевом суставе.
Массаж мышц паретичных конечностей при высоком мышечном тонусе возможен только в виде легких поглаживаний, напротив, на мышцах-антагонистах можно применять поверхностное растирание и разминание в более быстром темпе.
Иглорефлексотерапия сравнительно часто применяется в нашей стране в комплексной терапии больных спастическим гемипарезом после инсульта, однако контролируемые исследования, проведенные за рубежом, не показывают значительной эффективности этого метода лечения (10).
Баклофен и тизанидин преимущественно используются в качестве пероральных препаратов для лечения постинсультной спастичности в клинической практике (5-7). Пероральные антиспастические средства за счет снижения мышечного тонуса позволяют улучшить двигательные функции, облегчить уход за иммобилизованным больным, снять болезненные мышечные спазмы, усилить эффект физиотерапевтических процедур и, как следствие, предупредить развитие контрактур. При легкой степени спастичности значительный положительный эффект может дать применение миорелаксантов; однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых часто вызывает нежелательные побочные эффекты (2,5-7,14). Лечение миорелаксантами начинают с минимальной дозы.
Баклофен (Баклозан) оказывает антиспастическое действие преимущественно на спинальном уровне.
Препарат является аналогом гамма-аминомасляной кислоты (ГАМК); связывается с пресинаптическими ГАМК-рецепторами, что приводит к уменьшению выброса возбуждающих аминокислот (глутамата, аспартата) и подавлению моно – и полисинаптической активности на спинальном уровне, что вызывает уменьшение спастичности.
Благодаря своей долгой истории он продолжает оставаться препаратом выбора при лечении спастичности спинного и церебрального генеза.
Баклофен также оказывает центральное анальгезирующее и анксиолитическое действие. Хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови достигается через 2-3 часа после приема внутрь. Баклофен (баклозан) применяют при спинальной (спинномозговая травма, рассеянный склероз) и спастичности головного мозга; эффективен при болезненных мышечных спазмах различного генеза. Баклофен (Баклозан) Начальная доза составляет 5-15 мг в сутки (в один или три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта, препарат принимают во время еды. Максимальная доза баклофена (баклозана) для взрослых составляет 60-75 мг в сутки. Побочные эффекты проявляются сонливостью, головокружением в начале лечения, хотя они явно дозозависимы и в дальнейшем могут стихать.
Баклофен можно применять интратекально специальной помпой при спастичности, вызванной различными неврологическими заболеваниями, в том числе последствиями инсульта (8,11,13). Использование баклофеновой помпы в сочетании с лечебной физкультурой, лечебной физкультурой позволяет улучшить скорость и качество ходьбы у пациентов с постинсультной спастичностью, способных передвигаться самостоятельно (8). Имеющийся 15-летний клинический опыт интратекального применения баклофена у больных с инсультом свидетельствует о высокой эффективности этого метода в снижении не только степени спастичности, но и болевых синдромов и дистонических расстройств (13). Наблюдалось положительное влияние баклофеновой помпы на качество жизни пациентов с инсультом (11). Тизанидин — миорелаксант центрального действия, агонист альфа-2-адренорецепторов. Препарат уменьшает спастичность за счет подавления полисинаптических рефлексов на уровне спинного мозга, что может быть обусловлено торможением выброса возбуждающих аминокислот и активацией глицина, что снижает возбудимость интернейронов спинного мозга, спинной мозг. Препарат также оказывает умеренное центральное обезболивающее действие, эффективен при церебральной и спинальной спастичности, а также болезненных мышечных спазмах. Начальная доза препарата составляет 2-6 мг в сутки в один или три приема, средняя терапевтическая доза составляет 12-24 мг в сутки максимальная доза составляет 36 мг в сутки. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное падение АД, что может быть обусловлено торможением выброса возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинной мозг. Препарат также оказывает умеренное центральное обезболивающее действие, эффективен при церебральной и спинальной спастичности, а также болезненных мышечных спазмах. Начальная доза препарата составляет 2–6 мг в сутки в один или три приема, средняя терапевтическая доза — 12–24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов сильная сонливость, сухость во рту, головокружение и незначительное снижение АД, что может быть обусловлено торможением выброса возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Препарат также оказывает умеренное центральное обезболивающее действие, эффективен при церебральной и спинальной спастичности, а также болезненных мышечных спазмах. Начальная доза препарата составляет 2–6 мг в сутки в один или три приема, средняя терапевтическая доза — 12–24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное снижение артериального давления, эффективное при мозговой и спинальной спастичности, а также болезненные мышечные спазмы. Начальная доза препарата составляет 2–6 мг в сутки в один или три приема, средняя терапевтическая доза — 12–24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное снижение артериального давления, эффективное при мозговой и спинальной спастичности, а также болезненные мышечные спазмы. Начальная доза препарата составляет 2–6 мг в сутки в один или три приема, средняя терапевтическая доза — 12–24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное падение артериального давления. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное снижение артериального давления, эффективное при мозговой и спинальной спастичности, а также болезненные мышечные спазмы. Начальная доза препарата составляет 2–6 мг в сутки в один или три приема, средняя терапевтическая доза — 12–24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное падение артериального давления. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное снижение артериального давления, эффективное при мозговой и спинальной спастичности, а также болезненные мышечные спазмы. Начальная доза препарата составляет 2–6 мг в сутки в один или три приема, средняя терапевтическая доза — 12–24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное падение артериального давления средняя терапевтическая доза составляет от 12 до 24 мг в сутки, максимальная доза – 36 мг в сутки. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное падение артериального давления средняя терапевтическая доза составляет от 12 до 24 мг в сутки, максимальная доза – 36 мг в сутки. В качестве побочных эффектов могут наблюдаться сильная сонливость, сухость во рту, головокружение и незначительное падение артериального давления.
У больных, перенесших инсульт, с локальной спастичностью паретичных мышц можно использовать ботулотоксин типа А или ботулотоксин (Ботокс, Диспорт). Применение ботулотоксина показано при наличии у больного с инсультом мышцы с повышенным тонусом без контрактуры, а также при болях, мышечных спазмах, снижении объема движений и нарушении двигательной функции, связанных со спастичностью этой мышцы (2-4,12,14).).). Действие ботулотоксина при внутримышечном введении обусловлено блокадой нервно-мышечной передачи за счет подавления выброса нейромедиатора ацетилхолина в синаптическую щель.
Клинический эффект после инъекции ботулотоксина проявляется через несколько дней и сохраняется в течение 2-6 месяцев, после чего может потребоваться повторная инъекция. Наилучшие результаты отмечаются при применении ботулотоксина в ранние сроки (до года) с момента заболевания и легкого пареза конечности. Использование ботулотоксина может быть особенно эффективным в тех случаях, когда имеется косолапость, обусловленная спастичностью мышц задней поверхности голени, или повышенным тонусом сгибателей запястья и пальцев, что изменяет двигательную функцию паретичной кисти (14). В контролируемых исследованиях было показано, что диспорт эффективен при лечении спастичности руки после инсульта (3).
В качестве побочных эффектов применения ботулотоксина могут возникать изменения кожи и болезненность в месте инъекции. Обычно они регрессируют сами по себе через несколько дней после инъекции. Возможна значительная слабость мышцы, в которую вводят ботулотоксин, а также слабость в мышцах, расположенных вблизи места инъекции, локальная вегетативная дисфункция. Однако мышечная слабость обычно компенсируется активностью агонистов и не приводит к снижению двигательной функции. Повторные инъекции ботулотоксина у некоторых больных дают менее выраженный эффект, что связано с образованием антител против ботулотоксина и блокированием его действия.
Операция по уменьшению спастичности возможна на четырех уровнях: в головном мозге, спинном мозге, периферических нервах и мышцах (2,14). Они редко используются у пациентов с постинсультной спастичностью. Эти методы чаще всего используются при церебральном параличе и спастичности позвоночника, вызванной травмой позвоночника.
Хирургия головного мозга включает электрокоагуляцию бледного шара, вентролатерального ядра таламуса или мозжечка и имплантацию стимулятора на поверхность мозжечка. Эти операции используются редко и имеют некоторый риск осложнений.
Продольный конусный разрез (продольная миелотомия) может быть выполнен в спинном мозге для разрыва рефлекторной дуги между передними и задними рогами спинного мозга. Операция применяется при спастичности нижних конечностей, технически сложна и связана с высоким риском осложнений, поэтому применяется редко. Задняя шейная ризотомия позволяет уменьшить спастичность не только верхних, но и нижних конечностей, но выполняется редко из-за риска осложнений. Селективная задняя ризотомия — наиболее частое вмешательство на спинном мозге и его корешках, как правило, применяется при спастичности нижних конечностей на уровне от второго поясничного до второго крестцового.
Диссекция периферических нервов позволяет устранить спастичность, но эта операция часто осложняется развитием болей, дизестезии, нередко требует дополнительных ортопедических операций, поэтому применяется редко.
Значительная часть оперативных вмешательств у больных со спастичностью различного генеза выполняется на мышцах или их сухожилиях. Удлинение сухожилия мышцы или перемещение мышцы снижает активность интрафузальных мышечных волокон, тем самым уменьшая спастичность. Эффект от операции сложно предсказать, иногда требуется несколько операций. При развитии контрактур оперативное вмешательство на мышцах или их сухожилиях обычно является единственным методом лечения спастичности.
Лечение постинсультной спастичности является актуальной проблемой современной неврологии. Основную роль в лечении постинсультной спастичности играет лечебная физкультура, которая должна начинаться с первых дней инсульта и быть направлена на тренировку утраченных движений, самостоятельного стояния и ходьбы, а также предупреждение развития контрактур в паретические конечности.
В случаях, когда у больного с постинсультным парезом конечностей отмечается локальная спастичность, вызывающая нарушение двигательных функций, возможно применение местного введения препаратов ботулотоксина.
Баклофен (баклозан) и тизанидин рекомендуются в качестве пероральных антиспастических средств, которые могут снизить повышенный тонус, облегчить физиотерапию и уход за парализованным больным. Одним из перспективных методов лечения постинсультной спастичности является интратекальное введение баклофена с помощью специальной помпы, эффективность которой активно изучается в последние годы.
ЛИТЕРАТУРА 1. Дамулин И. В., Парфенов В. А., Скоромец А. А., Яхно Н. Н. Нарушения кровообращения в головном и спинном мозге. В: Болезни нервной системы. Руководство для врачей изд. НН Яхно. М.: Медицина, 2005, Т.1., С. 232-303. 2. Парфенов В. А. Спастичность В кн.: Применение ботокса (ботулотоксина типа А) в клинической практике: руководство для врачей / Под ред. О.Орлова, Н. Н.Яхно. – М.: Каталог, 2001 – С. 91-122. 3. Бахейт А. М., Тильманн А. Ф., Уорд А. Б и соавт. Рандомизированное двойное слепое плацебо-контролируемое исследование с ранжированием доз для сравнения эффективности и безопасности трех доз ботулинического токсина типа А (Диспорт) с плацебо при спастичности верхних конечностей после инсульта // Несчастный случай. – 2000. – Вып. 31.- С. 2402-2406. 4. Байрам С., Сивриоглу К., Карли Н и др. низкие дозы ботулинического токсина с кратковременной электростимуляцией при постинсультной спастической отвисшей стопе: предварительное исследование // Am J Phys Med Rehabil. – 2006. – Вып. 85. – С. 75-81. 5. Чоу Р., Петерсон К., Хельфанд М. Сравнительная эффективность и безопасность релаксантов скелетных мышц при спастичности и нарушениях опорно-двигательного аппарата: систематический обзор. // J Управление болевыми симптомами. – 2004. – Вып. 28. – С. 140–175. 6. Gallichio JE Фармакологическое лечение спастичности после инсульта. // ФизТер 2004. – Вып. 84. – Страницы 973–981. 7. Гелбер Д. А., Гуд Д. К., Дромерик А и соавт. Открытое исследование титрования дозы и эффективности тизанидина гидрохлорида при лечении спастичности, связанной с хроническим инсультом // Инсульт. – 2001. – Т.32. – Стр. 1841-1846. 8. Francisco GF, Boake C. Улучшение скорости ходьбы при постинсультной спастической гемиплегии после интратекальной терапии баклофеном: предварительное исследование // Arch Phys Med Rehabil. – 2003. – Вып. 84. – С. 1194-1199. 9. Formisano R., Pantano P., Buzzi MG et al. На позднее восстановление моторики влияют изменения мышечного тонуса после инсульта // Arch Phys Med Rehabil. – 2005. – Вып. 86. – С.308-311. 10. Fink M, Rollnik JD, Bijak M et al. Иглоукалывание при хронической спастичности ног после инсульта // Arch Phys Med Rehabil. – 2004. – Вып. 85. – С. 667-672. 11. Ivanhoe CB, Francis GE, McGuire JR et al. Интратекальное лечение баклофеном постинсультной спастической гипертонии: влияние на функцию и качество жизни // Arch Phys Med Rehabil. – 2006. – Вып. 87. – С. 1509-1515. 12. Озкакир С., Сивриоглу К. Ботулинический токсин при постинсультной спастичности // Clin Med Res.- 2007. – vol. 5.- С.132-138. 13. Тайра Т., Хори Т. Баклофен интратекально в лечении постинсультной центральной боли, дистонии и персистирующего вегетативного состояния // Acta Neurochir Suppl. – 2007. – Т.97. – Страницы 227-229. 14. Уорд А. Б. Обзор лечения спастичности: алгоритм лечения // Eur J. Neurol. – 2002. – Вып. 9. – Приложение 1. – С. 48-52.

Главный врач Поликлиники №19 (ГП 19 ДЗМ)
Приём населения:
пн. 15:00-20:00
чт. 09:00-12:00
ГБУЗ ЦЛО ДЗМ Аптечный пункт № 40-3
«Горячая линия» ГП №19: 8 (977) 851-57-76
109451, г. Москва, ул. Верхние поля, д. 34, корп. 4