Описание препарата Прадакса® (капсулы, 110 мг) основано на официальной инструкции, утверждено компанией-производителем в 2021 году
Дата согласования: 24.09.2021
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Прадакса®
- Заказ в аптеках Москвы
Фотографии упаковок
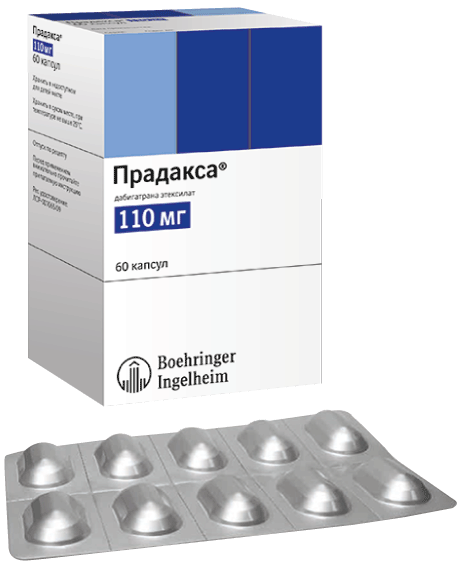
24.09.2021

24.09.2021
Действующее вещество
ATX
Фармакологическая группа
Состав
| Капсулы | 1 капсула |
| действующее вещество: | |
| дабигатрана этексилата мезилат | 86,48/126,83 мг |
| что соответствует дабигатрана этексилату — 75/110 мг | |
| вспомогательные вещества | |
| содержимое капсул: акации камедь; винная кислота, крупнозернистая; винная кислота, порошок; винная кислота, кристаллическая; гипромеллоза; диметикон; тальк; гипролоза (гидроксипропилцеллюлоза) | |
| состав капсульной оболочки: капсула из гипромеллозы (ГПМЦ) с надпечаткой черными чернилами | |
| состав ГПМЦ капсул: каррагинан (Е407); калия хлорид; титана диоксид (Е171); индигокармин (Е132) (только для дозировки 110 мг); гипромеллоза (гидроксипропилцеллюлоза); вода очищенная | |
| состав чернил черных: шеллак; бутанол; изопропанол; краситель железа оксид черный (Е172); вода очищенная; пропиленгликоль; этанол; аммиак водный; калия гидроксид |
Описание лекарственной формы
Капсулы 75 мг: продолговатые капсулы, размер 2. Крышка и корпус — непрозрачные, белого цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R75». Цвет надпечатки — черный.
Капсулы 110 мг: продолговатые капсулы, размер 1. Крышка и корпус — непрозрачные светло-синего цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R110». Цвет надпечатки — черный.
Содержимое капсул — желтоватые пеллеты.
Фармакологическое действие
Фармакологическое действие
—
ингибирующее тромбин.
Фармакодинамика
Дабигатрана этексилат является низкомолекулярным не обладающим фармакологической активностью предшественником активной формы дабигатрана. После приема внутрь дабигатрана этексилат быстро всасывается в желудочно-кишечном тракте (ЖКТ) и, путем гидролиза, катализируемого эстеразами, в печени и плазме крови, превращается в дабигатран. Дабигатран является мощным конкурентным обратимым прямым ингибитором тромбина и основным активным веществом в плазме крови.
Так как тромбин (сериновая протеаза) в процессе коагуляции превращает фибриноген в фибрин, угнетение активности тромбина препятствует образованию тромба. Дабигатран оказывает ингибирующее воздействие на свободный тромбин, тромбин, связанный с фибриновым сгустком, и вызванную тромбином агрегацию тромбоцитов.
В экспериментальных исследованиях на различных моделях тромбоза in vivo и ex vivo подтверждено антитромботическое действие и антикоагулянтная активность дабигатрана после внутривенного введения и дабигатрана этексилата — после приема внутрь.
Установлена прямая корреляция между концентрацией дабигатрана в плазме крови и выраженностью антикоагулянтного эффекта. Дабигатран удлиняет активированное частичное тромбопластиновое время (АЧТВ), экариновое время свертывания (ЭВС) и тромбиновое время (ТВ).
Профилактика венозных тромбоэмболий (ВТЭ) после эндопротезирования крупных суставов
Результаты клинических исследований у пациентов, перенесших ортопедические операции — эндопротезирование коленного и тазобедренного суставов, — подтвердили сохранение параметров гемостаза и эквивалентность применения 75 мг или 110 мг дабигатрана этексилата через 1–4 ч после операции и последующей поддерживающей дозы 150 мг или 220 мг 1 раз в сутки в течение 6–10 дней (при операции на коленном суставе) и 28–35 дней (на тазобедренном суставе), по сравнению с эноксапарином в дозе 40 мг 1 раз в сутки, который применяли накануне и после операции.
Показана эквивалентность антитромботического эффекта дабигатрана этексилата при применении 150 мг или 220 мг по сравнению с эноксапарином в дозе 40 мг в сутки при оценке основной конечной точки, которая включает все случаи венозных тромбоэмболий и смертность от любых причин.
Профилактика инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий
При длительном, в среднем около 20 месяцев, применении у пациентов с фибрилляцией предсердий и умеренным или высоким риском инсульта или системных тромбоэмболий было показано, что дабигатрана этексилат в дозе 110 мг, назначенный 2 раза в сутки, не уступал варфарину по эффективности предотвращения инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий; также в группе дабигатрана было отмечено снижение риска внутричерепных кровоизлияний и общей частоты кровотечений. Применение более высокой дозы препарата (150 мг 2 раза в день) достоверно снижало риск ишемического и геморрагического инсультов, сердечно-сосудистой смертности, внутричерепных кровоизлияний и общей частоты кровотечений по сравнению с варфарином. Меньшая доза дабигатрана характеризовалась существенно более низким риском больших кровотечений по сравнению с варфарином.
Чистый клинический эффект оценивался путем определения комбинированной конечной точки, включавшей частоту инсульта, системных тромбоэмболий, легочных тромбоэмболий, острого инфаркта миокарда, сердечно-сосудистой смертности и больших кровотечений.
Ежегодная частота перечисленных событий у пациентов, получавших дабигатрана этексилат, была ниже, чем у пациентов, получавших варфарин.
Изменения в лабораторных показателях функции печени у пациентов, получавших дабигатрана этексилат, отмечались со сравнимой или меньшей частотой по сравнению с пациентами, получавшими варфарин.
Дополнительное изучение дабигатрана этексилата в наблюдательных исследованиях у пациентов с фибрилляцией предсердий свидетельствует, что показатели эффективности и безопасности препарата в клинической практике соответствуют результатам рандомизированных исследований.
Результаты проспективного рандомизированного исследования RE-CIRCUIT продемонстрировали, что выполнение катетерной аблации у пациентов с пароксизмальной или персистирующей фибрилляцией предсердий, получающих непрерывный курс дабигатрана этексилата в дозе 150 мг (1 капсула) 2 раза в сутки, характеризуется меньшим риском больших кровотечений в сравнении с пациентами, у которых процедура выполнялась на фоне непрерывного курса варфарина. Различий между группами сравнения в отношении частоты комбинированной конечной точки, включающей инсульты, системные эмболии или транзиторные ишемические атаки, выявлено не было.
Результаты открытого рандомизированного исследования RE-DUAL PCI продемонстрировали, что применение дабигатрана этексилата в дозе 150 мг 2 раза в сутки, либо в дозе 110 мг 2 раза в сутки в комбинации с клопидогрелом или тикагрелором у пациентов с неклапанной фибрилляцией предсердий, перенесших чрескожное коронарное вмешательство со стентированием, характеризуется меньшим риском развития первичной конечной точки (большие и клинически значимые кровотечения по классификации ISTH) в сравнении с комбинированной терапией, включающей в себя варфарин в сочетании с клопидогрелом или тикагрелором и ацетилсалициловую кислоту (АСК). При этом в отношении комбинированной конечной точки эффективности, включавшей в себя смерть, тромбоэмболические события (инфаркт миокарда, инсульт или системные эмболии), либо незапланированную реваскуляризацию, объединенная группа пациентов, получавших дабигатрана этексилат (обе дозы препарата) в комбинации с клопидогрелом или тикагрелором, не уступала по эффективности группе пациентов, получавших комбинированную терапию варфарином в сочетании с клопидогрелом или тикагрелором и АСК.
Профилактика тромбоэмболий у пациентов с протезированными клапанами сердца
В ходе клинических исследований фазы II применения дабигатрана и варфарина у пациентов, перенесших операцию по замене клапана сердца механическим протезом (недавно проведенные операции и операции, проведенные более 3 месяцев назад), было выявлено повышение частоты тромбоэмболий и общего числа кровотечений (преимущественно за счет малых кровотечений) у пациентов, получавших дабигатрана этексилат. В раннем послеоперационном периоде большие кровотечения в основном характеризовались геморрагическим выпотом в перикард, особенно у пациентов, которым дабигатран этексилат был назначен в раннем периоде (на 3-й день) после хирургической замены клапанов сердца.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями
Результаты клинических исследований у пациентов с наличием острого ТГВ и/или ТЭЛА, которые первоначально получали парентеральную терапию в течение, как минимум, 5 дней, подтвердили, что дабигатрана этексилат в дозе 150 мг, назначенный 2 раза в сутки, не уступал варфарину по эффективности в отношении снижения частоты рецидивирующего симптоматического ТГВ и/или ТЭЛА и случаев смерти, обусловленных этими заболеваниями, на протяжении 6-месячного периода лечения. У пациентов, получавших дабигатрана этексилат, кровотечения отмечались значительно реже, чем у пациентов, получавших варфарин.
Частота развития инфаркта миокарда во всех проводимых исследованиях при ВТЭ, во всех лечебных группах была низкой.
Показатели функции печени
В исследованиях с применением активных препаратов сравнения возможные изменения показателей функции печени возникали у пациентов, получавших дабигатрана этексилат, со сравнимой или меньшей частотой, чем у пациентов, получавших варфарин. В исследовании с плацебо существенного различия в отношении изменений показателей функции печени, возможно имеющих клиническое значение, между группами с применением дабигатрана и плацебо не отмечалось.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями
Результаты клинического исследования у пациентов с рецидивирующим ТГВ и ТЭЛА, уже получавших в течение от 3 до 12 месяцев антикоагулянтную терапию и нуждавшихся в ее продолжении, подтвердили, что лечение дабигатрана этексилатом в дозе 150 мг 2 раза в сутки не уступало лечебному эффекту варфарина (p=0,0135). У пациентов, получавших дабигатрана этексилат, кровотечения отмечались значительно реже, чем у пациентов, получавших варфарин.
В исследовании сравнения дабигатрана этексилата с плацебо у пациентов, уже получавших в течение от 6 до 18 месяцев антагонисты витамина К, было установлено, что дабигатран превосходил плацебо в отношении профилактики рецидивирующего симптоматического ТГВ/ТЭЛА, включая случаи смерти от неустановленной причины; снижение риска за период лечения составило 92% (p<0,0001).
Частота развития инфаркта миокарда во всех проводимых исследованиях при ВТЭ во всех лечебных группах была низкой.
Показатели функции печени
В исследованиях с применением активных препаратов сравнения возможные изменения показателей функции печени возникали у пациентов, получавших дабигатрана этексилат, со сравнимой или меньшей частотой, чем у пациентов, получавших варфарин. В исследовании с плацебо существенного различия в отношении изменений показателей функции печени, возможно имеющих клиническое значение, между группами с применением дабигатрана и плацебо не отмечалось.
Фармакокинетика
После приема внутрь дабигатрана этексилат быстро и полностью превращается в дабигатран, который является активной формой в плазме крови. Расщепление пролекарства дабигатрана этексилата с помощью катализируемого эстеразой гидролиза до действующего вещества дабигатрана является преобладающей метаболической реакцией. Абсолютная биодоступность дабигатрана после приема внутрь препарата ПРАДАКСА составляла приблизительно 6,5%.
После приема внутрь препарата ПРАДАКСА у здоровых добровольцев фармакокинетический профиль дабигатрана в плазме крови характеризуется быстрым увеличением плазменных концентраций с достижением Cmax в течение 0,5 и 2,0 часов после приема препарата.
Всасывание
Исследование, в котором оценивали всасывание дабигатрана этексилата в послеоперационном периоде через 1–3 часа после хирургического вмешательства, показало относительно низкую скорость всасывания по сравнению с всасыванием у здоровых добровольцев, AUC характеризуется постепенным повышением амплитуды без появления высокого пика концентрации в плазме.
Сmax в плазме крови достигается через 6 часов после применения препарата в послеоперационном периоде за счет влияния таких сопутствующих факторов, как анестезия, парез ЖКТ и выполнение хирургического вмешательства независимо от лекарственной формы препарата. Дальнейшее исследование показало, что медленное и отсроченное всасывание обычно наблюдается только в день хирургического вмешательства. В последующие дни всасывание дабигатрана происходит быстро, с достижением Сmax в плазме крови через 2 часа после приема препарата.
Прием пищи не влияет на биодоступность дабигатрана этексилата, но задерживает время достижения Сmax в плазме крови на 2 часа.
Cmax и AUC были пропорциональны дозе.
При пероральном приеме пеллет без гидроксипропилметилцеллюлозной (ГПМЦ) оболочки капсулы, биодоступность может возрастать на 75% после однократного приема и на 37% в равновесном состоянии по сравнению с биодоступностью при применении референсной капсульной лекарственной формы. Поэтому следует всегда сохранять целостность капсул из ГПМЦ при клиническом применении для предотвращения случайного повышения биодоступности дабигатрана этексилата (см. «Способ применения и дозы»).
Распределение
Наблюдалась низкая (34–35%), независимая от концентрации степень связывания дабигатрана с белками плазмы крови. Объем распределения дабигатрана составляет 60–70 л и превосходит объем общего содержания воды в организме, что указывает на умеренное распределение дабигатрана в тканях.
Метаболизм
Метаболизм и экскреция дабигатрана были изучены после однократного внутривенного введения меченого радиоактивным изотопом дабигатрана здоровым добровольцам мужского пола. После внутривенного введения меченный радиоактивным изотопом дабигатран выводился главным образом почками (85%). Экскреция через ЖКТ составила 6% введенной дозы. Установлено, что через 168 часов после введения меченого радиоактивного препарата 88–94% его дозы выводится из организма.
Дабигатран подвергается конъюгированию с образованием фармакологически активных ацилглюкуронидов. Существуют четыре позиционных изомера: 1-O-, 2-O-, 3-O-, 4-O-ацилглюкуронид, каждый из которых составляет менее 10% общего содержания дабигатрана в плазме крови. Следы других метаболитов можно было обнаружить только с помощью высокочувствительных аналитических методов. Дабигатран выводится в основном в неизмененном виде с мочой со скоростью приблизительно 100 мл/мин, что соответствует скорости клубочковой фильтрации.
Выведение
Концентрация дабигатрана в плазме снижается биэкспоненциально со средним терминальным перниодом полувыведения 11 часов у здоровых добровольцев пожилого возраста. После многократного применения терминальный период полувыведения составлял около 12–14 часов. Период полувыведения не зависел от дозы. Период полувыведения удлиняется при нарушении функции почек (см. Нарушение функции почек).
Особые группы пациентов
Нарушение функции почек
В исследованиях I фазы экспозиция (AUC) дабигатрана после перорального приема препарата ПРАДАКСА была приблизительно в 2,7 раза выше у добровольцев с умеренной почечной недостаточностью (клиренс креатинина 30–50 мл/мин) по сравнению с экспозицией дабигатрана у добровольцев без почечной недостаточности.
У небольшого количества добровольцев с тяжелой степенью почечной недостаточности (клиренс креатинина 10–30 мл/мин) экспозиция (AUC) дабигатрана была приблизительно в 6 раз выше, а период полувыведения — приблизительно в 2 раза длиннее по сравнению с популяцией пациентов без почечной недостаточности (см. «Способ применения и дозы», «Противопоказания» и «Особые указания»).
Период полувыведения общего дабигатрана у здоровых пациентов и у пациентов с нарушением функции почек см. таблицу 1.
Таблица 1
Период полувыведения общего дабигатрана у здоровых пациентов и у пациентов с нарушением функции почек
| Скорость клубочковой фильтрации (клиренс креатинина), мл/мин | Геометрическое среднее значение (gCV%; диапазон) периода полувыведения, ч |
| ≥80 | 13,4 (25,7%; 11,0–21,6) |
| ≥50–<80 | 15,3 (42,7%; 11,7–34,1) |
| ≥30–<50 | 18,4 (18,5%; 13,3–23,0) |
| <30 | 27,2 (15,3%; 21,6-35,0) |
Кроме того, экспозиция дабигатрана (в момент достижения минимальной концентрации препарата в крови и в момент достижения максимальной концентрации препарата в крови) была оценена в проспективном открытом рандомизированном фармакокинетическом исследовании у пациентов с неклапанной фибрилляцией предсердий (ФП) с тяжелым нарушением функции почек (определяемым как клиренс креатинина 15–30 мл/мин), которые получали дабигатрана этексилат 75 мг 2 раза в сутки. Этот режим дозирования обеспечивал геометрическое среднее значение концентрации в момент достижения минимальной концентрации препарата в крови 155 нг/мл (gCV 76,9%) при измерении непосредственно перед приемом следующей дозы и геометрическое среднее значение максимальлной концентрации 202 нг/мл (gCV 70,6%) при измерении через 2 часа после приема последней дозы.
Клиренс дабигатрана при гемодиализе исследовался у 7 пациентов с терминальной хронической почечной недостаточностью (ТХПН) без фибрилляции предсердий. Диализ проводили со скоростью потока диализата 700 мл/мин, с продолжительностью 4 часа и скоростью кровотока 200 мл/мин или 350–390 мл/мин. Это приводило к снижению концентрации дабигатрана на 50% — 60% соответственно. Количество лекарственного средства, которое выводится с помощью диализа, пропорционально скорости кровотока при скорости кровотока до 300 мл/мин. Антикоагулянтная активность дабигатрана снижалась при уменьшении его концентрации в плазме крови, и процедура не влияла на фармакодинамические/фармакокинетические взаимосвязи.
Медиана клиренса креатинина в исследовании RE-LY составляла 68,4 мл/мин. Практически у половины (45,8%) пациентов в исследовании RE-LY Cl креатинина составлял >50 — <80 мл/мин. У пациентов с умеренным нарушением функции почек (клиренс креатинина 30–50 мл/мин) концентрации дабигатрана в плазме крови до и после приема дозы были в среднем соответственно в 2,29 раза и 1,81 раза выше по сравнению с пациентами без нарушения функции почек (клиренс креатинина ≥80 мл/мин).
Медиана клиренса креатинина в исследовании RE-COVER составляла 100,4 мл/мин. У 21,7% пациентов было легкое нарушение функции почек (клиренс креатинина >50 — <80 мл/мин), и у 4,5% пациентов было умеренное нарушение функции почек (клиренс креатинина 30–50 мл/мин). У пациентов с легким и умеренным нарушением функции почек концентрации дабигатрана в плазме крови в равновесном состоянии перед приемом очередной дозы были в среднем соответственно в 1,8 раза и 3,6 раза выше по сравнению с пациентами с клиренсом креатинина >80 мл/мин. Аналогичные значения для клиренса креатинина были обнаружены в исследовании RE-COVER II.
Медиана клиренса креатинина в исследованиях RE-MEDY и RE-SONATE составляла 99,0 и 99,7 мл/мин соответственно. У 22,9% и 22,5% пациентов в исследованиях RE-MEDY и RE-SONATE клиренс креатинина составлял >50 — <80 мл/мин и у 4,1% и 4,8% пациентов клиренс креатинина составлял от 30 до 50 мл/мин.
Пожилые пациенты
В специальных фармакокинетических исследованиях I фазы у пациентов пожилого возраста наблюдалось увеличение AUC на 40%–60% и Cmax более чем на 25% по сравнению с молодыми пациентами.
Влияние возраста на экспозицию дабигатрана было подтверждено в исследовании RE-LY: с увеличением минимальной концентрации препарата в крови (перед приемом очередной дозы) примерно на 31% у пациентов в возрасте ≥75 лет и снижением примерно на 22% у пациентов в возрасте <65 лет по сравнению с минимальной концентрацией препарата в крови (перед приемом очередной дозы) у пациентов в возрасте от 65 до 75 лет (см. «Способ применения и дозы» и «Особые указания»).
Нарушение функции печени
Не наблюдалось изменений в концентрации дабигатрана у 12 пациентов с умеренной печеночной недостаточностью (класс В по Чайлд-Пью) по сравнению с 12 пациентами из группы контроля (см. «Способ применения и дозы» и «Особые указания»).
Масса тела
Концентрации дабигатрана в момент достиженияминимальной концентрации препарата в крови были примерно на 20% ниже у пациентов с массой тела >100 кг по сравнению с пациентами с массой тела 50–100 кг. Большинство (80,8%) пациентов были в категории массы тела ≥50 кг и <100 кг, в пределах этого диапазона явных различий концентраций дабигатрана не установлено (см. «Способ применения и дозы» и «Особые указания»). Клинические данные в отношении пациентов с массой тела <50 кг ограничены.
Пол
Экспозиция действующего вещества в исследованиях первичной профилактики ВТЭ была примерно на 40–50% выше у пациентов женского пола; корректировки дозы не требуется.
Пациенты женского пола с фибрилляцией предсердий имели минимальную концентрацию препарата в крови и концентрацию препарата в крови после приема очередной дозы в среднем на 30% выше. Корректировки дозы не требуется (см. «Способ применения и дозы»).
Этнические группы
Не выявлено клинически значимых этнических различий в фармакокинетике и фармакодинамике дабигатрана среди пациентов европеоидной расы, афроамериканцев, латиноамериканцев, японцев или китайцев.
Фармакокинетические взаимодействия
Исследования взаимодействия in vitro не показали ингибирования или индукции основных изоферментов цитохрома Р450. Это было подтверждено исследованиями in vivo с участием здоровых добровольцев, у которых не наблюдалось никаких взаимодействий между этим препаратом и следующими действующими веществами: аторвастатином (CYP3A4), дигоксином (взаимодействие с белком-переносчиком Р-гликопротеина) и диклофенаком (CYP2С9).
Показания
- первичная профилактика венозных тромбоэмболических осложнений у взрослых пациентов, перенесших плановое тотальное эндопротезирование тазобедренного сустава или тотальное эндопротезирование коленного сустава;
- профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у взрослых пациентов с неклапанной фибрилляцией предсердий и одним или более факторами риска, такими как перенесенный инсульт или транзиторная ишемическая атака (ТИА), возраст ≥75 лет, хроническая сердечная недостаточность (≥II функционального класса по классификации NYHA), сахарный диабет, артериальная гипертензия, сосудистое заболевание (перенесенный инфаркт миокарда, заболевание периферических артерий или атеросклеротическая бляшка в аорте);
- лечение и профилактика рецидивов острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями.
Противопоказания
- известная гиперчувствительность к дабигатрану, дабигатрана этексилату или к любому из вспомогательных веществ;
- тяжелая степень почечной недостаточности (клиренс креатинина <30 мл/мин);
- активное клинически значимое кровотечение;
- поражение органов в результате клинически значимого кровотечения, включая геморрагический инсульт в течение 6 месяцев до начала терапии;
- наличие состояний, при которых повышен риск развития больших кровотечений, в том числе имеющиеся или недавние изъязвления ЖКТ, наличие злокачественных образований с высоким риском кровотечения, недавнее повреждение головного или спинного мозга, недавняя операция на головном или спинном мозге или офтальмологическая операция, недавнее внутричерепное кровоизлияние, наличие или подозрение на варикозно-расширенные вены пищевода, врожденные артериовенозные дефекты, сосудистые аневризмы или большие внутрипозвоночные или внутримозговые сосудистые аномалии;
- одновременное назначение любых других антикоагулянтов, в том числе, нефракционированного гепарина, низкомолекулярных гепаринов (НМГ) (эноксапарин, далтепарин и др.), производных гепарина (фондапаринукс и др.), пероральных антикоагулянтов (варфарин, ривароксабан, апиксабан и др.), за исключением случаев перехода лечения с или на препарат ПРАДАКСА или в случае применения нефракционированного гепарина в дозах, необходимых для поддержания центрального венозного или артериального катетера или при выполнении катетерной аблации при фибрилляции предсердий;
- одновременное назначение мощных ингибиторов Р-гликопротеина: кетоконазола для системного применения, циклоспорина, итраконазола, такролимуса и дронедарона;
- нарушения функции печени и заболевания печени, которые могут повлиять на выживаемость;
- наличие протезированного клапана сердца, требующего назначения антикоагулянтной терапии;
- беременность и периодл грудного вскармливания;
- возраст до 18 лет.
С осторожностью
Таблица 2
Факторы риска, которые могут повышать вероятность кровотечения
| Фармакодинамические и фармакокинетические факторы | Возраст ≥75 лет |
| Факторы, повышающие концентрацию дабигатрана в плазме крови | Большие: — умеренное нарушение функции почек (Cl креатинина 30–50 мл/мин); — мощные ингибиторы P-gp (за исключением указанных в разделе «Противопоказания») — см. «Взаимодействие») — cлабые и умеренные ингибиторы P-gp (например, амиодарон, верапамил, хинидин и тикагрелор — см. «Взаимодействие») Малые: — низкая масса тела (<50 кг) |
| Фармакодинамические взаимодействия (см. «Взаимодействие») | Одновременное применение: — АСК и других ингибиторов агрегации тромбоцитов, таких как клопидогрел; — НПВП; — селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотониа и норадреналина; — других лекарственных препаратов, которые могут нарушать гемостаз |
| Заболевания/процедуры с особыми геморрагическими рисками | — врожденные или приобретенные нарушения свертываемости крови; — тромбоцитопения или функциональные дефекты тромбоцитов; — недавно проведенная биопсия или перенесенная обширная травма; — бактериальный эндокардит; — эзофагит, гастрит или гастроэзофагеальная рефлюксная болезнь |
Применение при беременности и кормлении грудью
Данные о применении дабигатрана этексилата во время беременности отсутствуют. Потенциальный риск у человека неизвестен.
В экспериментальных исследованиях не установлено неблагоприятного воздействия на фертильность или постнатальное развитие новорожденных.
Женщинам репродуктивного возраста следует избегать наступления беременности при лечении препаратом ПРАДАКСА. При наступлении беременности применение препарата не рекомендуется, за исключением случаев, когда ожидаемая польза превышает возможный риск.
При необходимости применения препарата в период грудного вскармливания, в связи с отсутствием клинических данных, грудное вскармливание рекомендуется прекратить (в качестве меры предосторожности).
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Внутрь, независимо от времени приема пищи, запивая стаканом воды для облегчения прохождения препарата в желудок, 1 или 2 раза в сутки. Не следует вскрывать капсулу.
Особые указания при изъятии капсул из блистера:
— оторвите один индивидуальный блистер от блистер-упаковки по линии перфорации;
— выньте капсулу из блистера, отслаивая фольгу;
— не выдавливайте капсулы через фольгу.
Препарат ПРАДАКСА выпускается в капсулах 75 мг, 110 мг, 150 мг.
Первичная профилактика венозных тромбоэмболических осложнений у взрослых пациентов, перенесших плановое тотальное эндопротезирование тазобедренного сустава или тотальное эндопротезирование коленного сустава
Рекомендуемые дозы препарата ПРАДАКСА и продолжительность терапии для первичной профилактики венозных тромбоэмболий при ортопедических операциях приведены в таблице 3.
Таблица 3
Рекомендуемые дозы и продолжительность терапии для первичной профилактики венозных тромбоэмболий при ортопедических операциях
| Начало лечения в день операции через 1–4 часа после завершения операции | Начало приема поддерживающей дозы в первый день после операции | Продолжительность приема поддерживающей дозы | |
| Пациенты после планового тотального эндопротезирования коленного сустава | 1 капсула по 110 мг | 220 мг 1 раз в сутки (2 капсулы по 110 мг) | 10 дней |
| Пациенты после планового тотального эндопротезирования тазобедренного сустава | 28–35 дней | ||
| Рекомендовано снижение дозы | |||
| Пациенты с умеренным нарушением функции почек (клиренс креатинина 30–50 мл/мин) | 1 капсула по 75 мг | 150 мг 1 раз в сутки (2 капсулы по 75 мг) | 10 дней (эндопротезирование коленного сустава) или 28–35 дней (эндопротезирование тазобедренного сустава) |
| Пациенты, которые одновременно принимают верапамил*, амиодарон, хинидин | |||
| Пациенты в возрасте 75 лет или старше |
*Для пациентов с умеренным нарушением функции почек, которые одновременно принимают верапамил, см. Применение в особых группах пациентов.
Для обеих хирургических операций: если гемостаз не достигнут, начало лечения следует отложить. Если лечение не начато в день операции, то лечение следует начать с 2 капсул 1 раз в сутки.
Оценка функции почек до и во время терапии препаратом ПРАДАКСА
Для всех пациентов, особенно у пожилых (>75 лет), поскольку почечная недостаточность может быть частой в этой возрастной группе:
— перед терапией, во избежание назначения препарата пациентам с тяжелыми нарушениями функции почек (клиренс креатинина <30 мл/мин), необходимо предварительно оценить клиренс креатинина;
— функция почек должна оцениваться в процессе лечения, когда возникает подозрение о возможном снижении или ухудшении функции почек (например, при гиповолемии, дегидратации, одновременном применении определенных лекарственных препаратов и т.п.).
В качестве метода оценки функции почек используется расчет клиренса креатинина по формуле Кокрофта-Голта (Cockcroft-Gault method).
Пропущенная доза
Рекомендуется принять обычную суточную дозу препарата ПРАДАКСА в обычное время на следующий день. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Отмена препарата ПРАДАКСА
Лечение препаратом ПРАДАКСА не должно быть прекращено без медицинской консультации. Пациенты должны быть проинструктированы о необходимости обращаться к лечащему врачу, если у них развиваются желудочно-кишечные симптомы, такие как диспепсия.
Изменение антикоагулянтной терапии
Переход от применения препарата ПРАДАКСА к парентеральному применению антикоагулянтов
Парентеральное применение антикоагулянтов следует начинать через 24 часа после приема последней дозы препарата ПРАДАКСА (см. «Взаимодействие»).
Переход от парентерального применения антикоагулянтов к применению препарата ПРАДАКСА
Первая доза препарата ПРАДАКСА назначается вместо отменяемого антикоагулянта в интервале 0–2 часа перед временем введения его очередной дозы или одновременно с прекращением в случае непрерывного введения (например, внутривенного применения нефракционированного гепарина, НФГ).
Применение в особых группах пациентов
Нарушение функции почек
Терапия препаратом ПРАДАКСА у пациентов с тяжелым нарушением функции почек (клиренс креатинина <30 мл/мин) противопоказана (см. «Противопоказания»).
Рекомендуется коррекция дозы у пациентов с умеренным нарушением функции почек (клиренс креатинина 30–50 мл/мин) (см. таблицу 3 и «Особые указания» и «Фармакодинамика»).
Одновременное применение препарата ПРАДАКСА со слабыми или умеренными ингибиторами P-гликопротеина например, с амиодароном, хинидином или верапамилом
Следует снизить дозу, как указано в таблице 3 (см. также «Взаимодействие» и «Особые указания»). В этой ситуации препарат ПРАДАКСА и указанные лекарственные препараты следует принимать одновременно.
У пациентов с умеренным нарушением функции почек, которые одновременно принимают верапамил, следует рассмотреть вопрос о снижении дозы препарата ПРАДАКСА до 75 мг в сутки (см. «Особые указания» и «Взаимодействие»).
Применение у пожилых пациентов
Рекомендуется снижение дозы препарата у пациентов старше 75 лет (см. таблицу 3 и «Особые указания» и «Фармакодинамика»).
Влияние массы тела
Клинический опыт применения у пациентов с массой тела <50 или >110 кг в рекомендуемых дозах крайне ограничен. Учитывая имеющиеся клинические и кинетические данные, коррекции дозы не требуется (см. «Фармакокинетика»), но рекомендуется тщательное клиническое наблюдение (см. «Особые указания»).
Педиатрическая популяция
Отсутствует обоснование применения препарата ПРАДАКСА в педиатрической популяции для первичной профилактики венозных тромбоэмболических осложнений у пациентов, которым выполнено плановое тотальное эндопротезирование тазобедренного сустава или плановое тотальное эндопротезирование коленного сустава.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у взрослых пациентов с неклапанной фибрилляцией предсердий и одним или более факторами риска
Лечение и профилактика рецидивов острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями
Рекомендуемые дозы приведены в таблице 4.
Таблица 4
Рекомендуемые дозы
| Рекомендуемая доза | |
| Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у взрослых пациентов с неклапанной фибрилляцией предсердий и одним или более факторами риска | Суточная доза 300 мг (1 капсулапо 150 мг 2 раза в сутки В некоторых клинических ситуациях может быть рассмотрено использование сниженной дозы — 220 мг (1 капсула по 110 мг 2 раза в сутки) — см. таблицу 4 ниже и Применение в особых группах пациентов |
| Лечение и профилактика рецидивов острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями | Суточная доза 300 мг (1 капсула по 150 мг 2 раза в сутки) после парентерального лечения антикоагулянтом, проводящегося в течение как минимум 5 дней. В некоторых клинических ситуациях может быть рассмотрено использование сниженной дозы — 220 мг (1 капсула по 110 мг 2 раза в сутки) — см. таблицу 4 ниже и Применение в особых группах пациентов |
| Рекомендовано снижение дозы | |
| Пациенты старше 80 лет | Суточная доза 220 мг (1 капсула по 110 мг 2 раза в сутки) |
| Пациенты, получающие верапамил | |
| Снижение дозы по усмотрению врача | |
| Пациенты 75–80 лет | Суточная доза 300 мг или 220 мг должна выбираться на основе индивидуальной оценки риска тромбоэмболии и риска кровотечения |
| Пациенты с умеренным нарушением функции почек (клиренс креатинина 30–50 мл/мин) | |
| Пациенты с эзофагитом, гастритом или гастроэзофагеальной рефлюксной болезнью | |
| Другие пациенты с повышенным риском кровотечения |
Для показания Лечение и профилактика рецидивов острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями — рекомендация по использованию дозы препарата ПРАДАКСА 220 мг (1 капсула по 110 мг 2 раза в сутки) основана на фармакокинетических и фармакодинамических данных, данные клинических исследований отсутствуют.
Оценка функции почек до и во время терапии препаратом ПРАДАКСА. Для всех пациентов, особенно пожилых (>75 лет), поскольку почечная недостаточность может быть частой в этой возрастной группе:
— перед терапией, во избежание назначения препарата пациентам с тяжелыми нарушениями функции почек (клиренс креатинина <30 мл/мин), необходимо предварительно оценить клиренс креатинина;
— функция почек должна оцениваться в процессе лечения, когда возникает подозрение о возможном снижении или ухудшении функции почек (например, при гиповолемии, дегидратации, одновременном применении определенных лекарственных препаратов и т.п.).
Дополнительные требования для пациентов с легкой и умеренной почечной недостаточностью и пациентов старше 75 лет:
1. При терапии препаратом ПРАДАКСА почечная функция должна оцениваться как минимум 1 раз в год или чаще, в зависимости от клинической ситуации, когда возникает подозрение о возможном снижении или ухудшении функции почек (например, при гиповолемии, дегидратации, одновременном применении определенных лекарственных препаратов и т.п.).
В качестве метода оценки функции почек используется расчет клиренса креатинина по формуле Кокрофта-Голта (Cockcroft-Gault method).
Длительность применения
Длительность применения препарата ПРАДАКСА для профилактики инсульта при фибрилляции предсердий, ТГВ и ТЭЛА приведена в таблице 5.
Таблица 5
Длительность применения для профилактики инсульта при фибрилляции предсердий и ТГВ/ТЭЛА
| Показание | Длительность применения |
| Профилактика инсульта при фибрилляции предсердий | Терапия должна продолжаться пожизненно |
| ТГВ/ТЭЛА | Продолжительность терапии должна быть определена индивидуально после тщательной оценки эффективности лечения и риска кровотечения (см. «Особые указания»). Короткая продолжительность терапии (по крайней мере 3 месяца) должна рассматриваться при наличии транзиторных факторов риска (например, недавняя операция, травма, иммобилизация), а более длительная продолжительность терапии — при наличии постоянных факторов риска или при идиопатическом ТГВ или ТЭЛА |
Пропущенная доза
Пропущенную дозу препарата ПРАДАКСА можно принять в том случае, если до приема очередной дозы препарата остается 6 часов и более; если срок составил менее 6 часов, пропущенную дозу принимать не следует.
В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Отмена препарата ПРАДАКСА
Лечение препаратом ПРАДАКСА не должно быть прекращено без медицинской консультации. Пациенты должны быть проинструктированы о необходимости обращаться к лечащему врачу, если у них развиваются желудочно-кишечные симптомы, такие как диспепсия.
Изменение антикоагулянтной терапии
Переход от применения препарата ПРАДАКСА к парентеральному применению антикоагулянтов
Парентеральное применение антикоагулянтов следует начинать через 12 часов после приема последней дозы препарата ПРАДАКСА (см. «Взаимодействие»).
Переход от парентерального применения антикоагулянтов к применению препарата ПРАДАКСА
Первая доза препарата ПРАДАКСА назначается вместо отменяемого антикоагулянта в интервале 0–2 часа перед временем введения его очередной дозы или одновременно с прекращением в случае непрерывного введения (например, внутривенного применения нефракционированного гепарина, НФГ).
Переход от применения препарата ПРАДАКСА к применению антагонистов витамина К
При клиренсе креатинина ≥50 мл/мин прием антагонистов витамина К может быть начат за 3 дня, а при клиренсе креатинина ≥30–50 мл/мин — за 2 дня до отмены препарата ПРАДАКСА.
Поскольку препарат ПРАДАКСА может влиять на МНО, МНО будет лучше отражать эффект антагонистов витамина К только спустя не менее 2 дней после отмены препарата ПРАДАКСА. До этого значения МНО должны быть интерпретированы с осторожностью.
Переход от применения антагонистов витамина К к применению препарата ПРАДАКСА
Применение антагонистов витамина К прекращают, применение препарата ПРАДАКСА возможно при МНО <2,0.
Кардиоверсия
Проведение плановой или экстренной кардиоверсии не требует отмены терапии препаратом ПРАДАКСА.
Катетерная аблация при фибрилляции предсердий
Данные о лечении препаратом ПРАДАКСА (1 капсула по 110 мг 2 раза в сутки) отсутствуют.
Чрескожные коронарные вмешательства (ЧКВ) со стентированием коронарных артерий
У пациентов с неклапанной фибрилляцией предсердий, которым выполнено ЧКВ со стентированием коронарных артерий, дабигатрана этексилат может применяться в комбинации с антитромбоцитарными препаратами. Лечение дабигатрана этексилатом может быть начато после достижения гемостаза (см. «Фармакодинамика»).
Применение в особых группах пациентов
Применение у пожилых пациентов
Принципы выбора дозы препарата у пожилых пациентов указаны в таблице 4.
Применение у пациентов с повышенным риском кровотечений
Пациентам с повышенным риском кровотечения показано тщательное клиническое наблюдение (на предмет выявления признаков кровотечений или анемии) (см. «Особые указания», «Взаимодействие», «Фармакодинамика»). Решение о выборе дозы препарата принимается по усмотрению врача на основании оценки потенциальной пользы и риска для пациентов (см. таблицу 4). Оценка параметров коагуляции (см. «Особые указания») может помочь выявить пациентов с повышенным риском кровотечения, вызванным чрезмерным воздействием дабигатрана. Если у пациентов с высоким риском кровотечения выявлено чрезмерное воздействие дабигатрана, рекомендуется уменьшить дозу до 220 мг (1 капсула по 110 мг 2 раза в сутки). Когда возникает клинически значимое кровотечение, лечение следует прервать.
У пациентов с гастритом, эзофагитом или гастроэзофагеальной рефлюксной болезнью может быть рассмотрено снижение дозы из-за повышенного риска желудочно-кишечного кровотечения (см. таблицу 4 и «Особые указания»).
Нарушение функции почек
Терапия препаратом ПРАДАКСА у пациентов с тяжелым нарушением функции почек (клиренс креатинина <30) противопоказана (см. «Противопоказания»).
Коррекции дозы не требуется у пациентов с легким нарушением функции почек (клиренс креатинина 50 — ≤80 мл/мин). Для пациентов с умеренным нарушением функции почек (клиренс креатинина 30–50 мл/мин) рекомендуемая доза препарата ПРАДАКСА также составляет 300 мг (1 капсула по 150 мг 2 раза в сутки). Тем не менее для пациентов с высоким риском кровотечения может быть рассмотрена возможность снижения дозы препарата ПРАДАКСА до 220 мг (1 капсула по 110 мг 2 раза в сутки) (см. «Особые указания» и «Фармакокинетика»). У пациентов с нарушением функции почек рекомендуется тщательное клиническое наблюдение.
Одновременное применение препарата ПРАДАКСА с активными ингибиторами P-гликопротеина (такими как амиодарон, хинидин, верапамил)
При одновременном применении амиодарона или хинидина коррекции дозы не требуется (см. «Особые указания», «Взаимодействие» и «Фармакокинетика»). Снижение дозы рекомендуется для пациентов, которые одновременно получают верапамил (см. таблицу 4 и «Особые указания», «Взаимодействие»). В этой ситуации препарат ПРАДАКСА и верапамил следует принимать одновременно.
Влияние массы тела
В соответствии с фармакокинетическими и клиническими данными коррекции дозы не требуется. Однако за пациентами с массой тела менее 50 кг рекомендуется клиническое наблюдение.
Побочные действия
Частота побочных реакций, которые могут возникать во время терапии, приведена в виде следующей градации: очень часто (≥1/10); часто ( ≥1/100, <1/10); нечасто (≥ 1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); неизвестно (частота не может быть оценена по доступным данным).
Таблица 6
Побочные реакции
| Системно-органный класс/Побочный эффект | Частота возникновения | ||
| Первичная профилактика венозных тромбоэмболических осложнений у взрослых пациентов, перенесших плановое тотальное эндопротезирование тазобедренного сустава или тотальное эндопротезирование коленного сустава | Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у взрослых пациентов с неклапанной фибрилляцией предсердий и одним или более факторами риска | Лечение и профилактика рецидивов острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями | |
| Нарушения со стороны кроветворной и лимфатической системы | |||
| анемия | нечасто | часто | нечасто |
| снижение уровня гемоглобина | часто | нечасто | неизвестно |
| тромбоцитопения | редко | нечасто | редко |
| снижение гематокрита | нечасто | редко | неизвестно |
| нейтропения* | неизвестно | неизвестно | неизвестно |
| агранулоцитоз* | неизвестно | неизвестно | неизвестно |
| Нарушения со стороны иммунной системы | |||
| реакции гиперчувствительности | нечасто | нечасто | нечасто |
| кожная сыпь | редко | нечасто | нечасто |
| кожный зуд | редко | нечасто | нечасто |
| анафилактическая реакция | редко | редко | редко |
| ангионевротический отек | редко | редко | редко |
| крапивница | редко | редко | редко |
| бронхоспазм | неизвестно | неизвестно | неизвестно |
| Нарушения со стороны нервной системы | |||
| внутричерепное кровоизлияние | редко | нечасто | редко |
| Нарушения со стороны сосудов | |||
| гематома | нечасто | нечасто | нечасто |
| кровотечение | редко | нечасто | нечасто |
| кровотечение из раны | нечасто | — | — |
| Нарушения со стороны органов дыхания, грудной клетки и средостения | |||
| носовое кровотечение | нечасто | часто | часто |
| кровохарканье | редко | нечасто | нечасто |
| Нарушения со стороны ЖКТ | |||
| желудочно-кишечные кровотечения | нечасто | часто | часто |
| боль в животе | редко | часто | нечасто |
| диарея | нечасто | часто | нечасто |
| диспепсия | редко | часто | часто |
| тошнота | нечасто | часто | нечасто |
| ректальные кровотечения | нечасто | нечасто | часто |
| геморроидальные кровотечения | нечасто | нечасто | нечасто |
| изъязвление слизистой оболочки ЖКТ, в т.ч. язва пищевода | редко | нечасто | нечасто |
| гастроэзофагит | редко | нечасто | нечасто |
| гастроэзофагеальная рефлюксная болезнь | редко | нечасто | нечасто |
| рвота | нечасто | нечасто | нечасто |
| дисфагия | редко | нечасто | редко |
| Нарушения со стороны гепатобилиарной системы | |||
| нарушение функции печени/отклонение от нормы показателя функциональной пробы печени | часто | нечасто | нечасто |
| повышение активности аланинаминотрансферазы | нечасто | нечасто | нечасто |
| повышение активности аспартатаминотрансферазы | нечасто | нечасто | нечасто |
| повышение активности печеночных трансаминаз | нечасто | редко | нечасто |
| гипербилирубинемия | нечасто | редко | неизвестно |
| Изменения со стороны кожи и подкожных тканей | |||
| кожный геморрагический синдром | нечасто | часто | часто |
| алопеция* | неизвестно | неизвестно | неизвестно |
| Скелетно-мышечные нарушения, нарушения со стороны соединительной ткани и костей | |||
| гемартроз | нечасто | редко | нечасто |
| Изменения со стороны почек и мочевыводящих путей | |||
| урогенитальные кровотечения, в т.ч. гематурия | нечасто | часто | часто |
| Нарушения общего характера и изменения в месте проведения инъекций | |||
| кровотечения из места инъекции | редко | редко | редко |
| кровотечения из места введения катетера | редко | редко | редко |
| кровянистое отделяемое | редко | — | — |
| Повреждения, токсичность и осложнения процедур | |||
| посттравматическое кровотечение | нечасто | редко | нечасто |
| кровотечения из места операционного доступа | редко | редко | редко |
| гематома после выполнения процедуры | нечасто | — | — |
| кровотечение после выполнения процедуры | нечасто | — | — |
| анемия послеоперационная | редко | — | — |
| отделяемое после выполнения процедуры | нечасто | — | — |
| секреция из раны | нечасто | — | — |
| Хирургические операции и медицинские процедуры | |||
| дренаж раны | редко | — | — |
| дренаж после выполнения процедуры | редко | — | — |
*Данные побочные эффекты не были зарегистрированы в клинических испытаниях как побочные действия (только побочные эффекты); следовательно, частота не может быть рассчитана.
Расчет частоты побочных эффектов основан на постмаркетинговом опыте.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Взаимодействия с белками-переносчиками
Дабигатрана этексилат является субстратом эффлюксного белка-переносчика Р-гликопротеина. Ожидается, что одновременное назначение ингибиторов Р-гликопротеина приводит к повышению концентраций дабигатрана в плазме крови.
Если не указано иное, при одновременном применении дабигатрана и мощных ингибиторов Р-гликопротеина необходимо тщательное клиническое наблюдение (в отношении признаков кровотечения или анемии). При одновременном применении дабигатрана с некоторыми ингибиторами Р-гликопротеина может потребоваться снижение дозы (см. «Способ применения и дозы», «Противопоказания», «Особые указания» и «Фармакодинамика»).
Таблица 7
Взаимодействия с белками-переносчиками
| Ингибиторы Р-гликопротеина | |
| Одновременное применение противопоказано (см. «Противопоказания») | |
| Кетоконазол | Кетоконазол увеличивал общие значения AUC0–∞ и Cmax дабигатрана в 2,38 раза и в 2,35 раза соответственно, после однократного приема внутрь дозы 400 мг, и в 2,53 раза и 2,49 раза соответственно, после многократного приема внутрь дозы 400 мг кетоконазола 1 раз в сутки |
| Дронедарон | При одновременном применении дабигатрана этексилата и дронедарона общие значения AUC0–∞ и Cmax дабигатрана увеличивались примерно в 2,4 раза и 2,3 раза соответственно, после многократного приема 400 мг дронедарона 2 раза в сутки, и примерно в 2,1 раза и 1,9 раза соответственно, после однократного приема дозы 400 мг |
| Итраконазол, циклоспорин | На основании результатов исследований in vitro можно ожидать эффект, сходный с кетоконазолом |
| Одновременное применение не рекомендуется | |
| Такролимус | В исследованиях in vitro обнаружено, что такролимус имеет такой же уровень ингибирующего эффекта на Р-гликопротеин, как итраконазол и циклоспорин. Применение дабигатрана этексилата вместе с такролимусом не было изучено в клинических исследованиях. Однако ограниченные клинические данные о применении вместе с другим субстратом Р-гликопротеина (эверолимусом) позволяют предположить, что ингибирование Р-гликопротеина такролимусом слабее, чем при применении мощных ингибиторов Р-гликопротеина |
| Глекапревир/пибрентасвир | Одновременное использование комбинации фиксированных доз ингибиторов Р-гликопротеина глекапревира/пибрентасвира приводит к увеличению концентрации дабигатрана в плазме крови и может повысить риск кровотечений |
| Следует соблюдать осторожность в случае одновременного применения (см. «Способ применения и дозы» и «Особые указания») | |
| Верапамил | При одновременном применении дабигатрана этексилата (150 мг) и верапамила для приема внутрь Cmax и AUC дабигатрана увеличивались, но степень этого увеличения различалась в зависимости от времени приема и лекарственной формы верапамила (см. «Способ применения и дозы» и «Особые указания»). Максимальное увеличение экспозиции дабигатрана наблюдалось при приеме первой дозы лекарственной формы верапамила с немедленным высвобождением за один час до приема дабигатрана этексилата (увеличение Cmax примерно в 2,8 раза и увеличение AUC примерно в 2,5 раза). Эффект постепенно уменьшался при приеме лекарственной формы верапамила с длительным высвобождением (увеличение Cmax примерно в 1,9 раза и увеличение AUC примерно в 1,7 раза) или при приеме многократных доз верапамила (увеличение Cmax примерно в 1,6 раза и увеличение AUC примерно в 1,5 раза). Не наблюдалось значимых взаимодействий при приеме верапамила через 2 часа после приема дабигатрана этексилата (увеличение Cmax примерно в 1,1 раза и увеличение AUC примерно в 1,2 раза). Это объясняется полным всасыванием дабигатрана через 2 часа |
| Амиодарон | При одновременном применении препарата ПРАДАКСА с однократной пероральной дозой 600 мг амиодарона степень и скорость всасывания амиодарона и его активного метаболита дезэтиламиодарона существенно не изменялись. Значения AUC и Cmax дабигатрана возрастали примерно в 1,6 раза и 1,5 раза соответственно. Учитывая длительный период полувыведения амиодарона, возможность взаимодействия может сохраняться в течение нескольких недель после отмены амиодарона (см. «Способ применения и дозы» и «Особые указания») |
| Хинидин | Хинидин назначали в дозе 200 мг каждые 2 часа до достижения общей дозы 1000 мг. Дабигатрана этексилат назначали 2 раза в сутки в течение 3 дней подряд, на 3-й день – с хинидином или без хинидина. Значения AUCτ,ss и Cmax,ss дабигатрана увеличивались в среднем в 1,53 раза и 1,56 раза соответственно, при одновременном применении с хинидином (см. «Способ применения и дозы» и «Особые указания») |
| Кларитромицин | При одновременном применении кларитромицина (500 мг 2 раза в сутки) с дабигатрана этексилатом у здоровых добровольцев наблюдалось увеличение AUC примерно в 1,19 раза и увеличение Cmax примерно в 1,15 раза |
| Тикагрелор | При одновременном применении однократной дозы 75 мг дабигатрана этексилата с нагрузочной дозой 180 мг тикагрелора значения AUC и Cmax дабигатрана увеличивались в 1,73 раза и 1,95 раза соответственно. После многократного приема тикагрелора 90 мг 2 раза в сутки увеличение экспозиции дабигатрана составляло 1,56 раза и 1,46 раза для Cmax и AUC соответственно. Одновременное назначение нагрузочной дозы 180 мг тикагрелора и 110 мг дабигатрана этексилата (в равновесном состоянии) увеличивало значения AUCτ,ss и Cmax,ss дабигатрана в 1,49 раза и 1,65 раза соответственно, по сравнению с приемом одного дабигатрана этексилата. При назначении нагрузочной дозы 180 мг тикагрелора через 2 часа после приема 110 мг дабигатрана этексилата (в равновесном состоянии) степень увеличения AUCτ,ss и Cmax,ss дабигатрана снижалась до 1,27 раза и 1,23 раза соответственно, по сравнению с приемом одного дабигатрана этексилата. Такой раздельный прием рекомендуется для начала терапии тикагрелором с нагрузочной дозы. Одновременное назначение 90 мг тикагрелора 2 раза в сутки (поддерживающая доза) с 110 мг дабигатрана этексилата увеличивало скорректированные значения AUCτ,ss и Cmax,ss дабигатрана в 1,26 раза и 1,29 раза соответственно, по сравнению с приемом только дабигатрана этексилата |
| Позаконазол | Позаконазол также в определенной степени ингибирует P-гликопротеин, но он не был изучен в клинических исследованиях. Следует соблюдать осторожность, когда препарат ПРАДАКСА назначается одновременно с позаконазолом |
| Индукторы Р-гликопротеина | |
| Следует избегать одновременного применения | |
| Например, рифампицин, зверобой продырявленный (Hypericum perforatum), карбамазепин или фенитоин | Ожидается, что одновременное назначение приводит к снижению концентраций дабигатрана. Предварительный прием индуктора P-гликопротеина рифампицина в дозе 600 мг 1 раз в сутки в течение 7 дней уменьшал максимальную и общую экспозицию дабигатрана и общий уровень воздействия на 65,5% и 67% соответственно. Индуцирующий эффект уменьшался, что приводило к экспозиции дабигатрана, близкой к референсному значению, к 7-му дню после прекращения лечения рифампицином. Дальнейшего увеличения биодоступности еще через 7 дней не наблюдалось |
| Ингибиторы протеазы, такие как ритонавир | |
| Одновременное применение не рекомендуется | |
| Например, ритонавир и его комбинации с другими ингибиторами протеазы | Эти препараты влияют на P-гликопротеин (либо в качестве ингибитора, либо в качестве индуктора). Они не изучались и поэтому не рекомендуются для одновременного назначения с препаратом ПРАДАКСА |
| Субстрат Р-гликопротеина | |
| Дигоксин | В ходе исследования, проведенного с участием 24 здоровых добровольцев, при одновременном применении препарата ПРАДАКСА и дигоксина не наблюдалось никаких изменений экспозиции дигоксина и клинически значимых изменений в экспозиции дабигатрана |
Антикоагулянты и лекарственные средства, которые ингибируют агрегацию тромбоцитов
Лекарственные средства, терапия которыми не исследовалась или опыт применения которых ограничен, и которые могут повысить риск кровотечений при одновременном применении с препаратом ПРАДАКСА: антикоагулянты, такие как нефракционированный гепарин (НФГ), низкомолекулярные гкпарины (НМГ) и производные гепарина (фондапаринукс, дезирудин), тромболитические лекарственные препараты и антагонисты витамина К, ривароксабан или другие пероральные антикоагулянты (см. «Противопоказания»), а также лекарственные средства, которые ингибируют агрегацию тромбоцитов, такие как антагонисты рецепторов GPIIb/IIIa, тиклопидин, прасугрел, тикагрелор, декстран и сульфинпиразон (см. «Особые указания»).
На основании данных, собранных в исследовании III фазы RE-LY (см. «Фармакодинамика»), было отмечено, что сопутствующее использование других пероральных или парентеральных антикоагулянтов увеличивает частоту больших кровотечений при лечении как дабигатрана этексилатом, так и варфарином приблизительно в 2,5 раза, главным образом при переводе с одного антикоагулянта на другой (см. «Противопоказания»). Кроме того, сопутствующее применение антиагрегантов, АСК или клопидогрела приблизительно удваивало частоту больших кровотечений при лечении как дабигатрана этексилатом, так и варфарином (см. «Особые указания»).
НФГ можно применять в дозах, необходимых для поддержания проходимости центрального венозного или артериального катетера (см. «Противопоказания»).
Таблица 8
Взаимодействия с антикоагулянтами и лекарственными средствами, которые ингибируют агрегацию тромбоцитов
| НПВП | Показано, что применение НПВП для кратковременной анальгезии не было связано с повышением риска кровотечения при одновременном применении с дабигатрана этексилатом. При длительном применении в ходе исследования RE-LY НПВП повышали риск кровотечения приблизительно на 50% для дабигатрана этексилата и варфарина |
| Клопидогрел | У здоровых молодых добровольцев мужского пола одновременное назначение дабигатрана этексилата и клопидогрела не вызывало дополнительного увеличения времени капиллярного кровотечения по сравнению с монотерапией клопидогрелом. К тому же значения AUCτ,ss и Cmax,ss дабигатрана и показатели коагуляции, использующиеся для оценки влияния дабигатрана, или показатели влияния клопидогрела на подавление агрегации тромбоцитов оставались неизменными при сравнении комбинированной терапии и соответствующей монотерапии. При приеме нагрузочной дозы клопидогрела 300 мг или 600 мг значения AUCτ,ss и Cmax,ss дабигатрана увеличивались примерно на 30–40% (см. «Особые указания») |
| АСК | Одновременное применение с дабигатрана этексилатом в дозе 150 мг 2 раза в сутки может повысить риск любых кровотечений с 12% до 18% и 24% при дозах АСК 81 мг и 325 мг соответственно (см. «Особые указания») |
| НМГ | Одновременное применение НМГ, таких как эноксапарин, и дабигатрана этексилата, специально не исследовалось. После перевода с трехдневной терапии эноксапарином 40 мг 1 раз в сутки п/к, через 24 часа после введения последней дозы эноксапарина экспозиция дабигатрана была несколько ниже, чем после применения только дабигатрана этексилата (однократная доза 220 мг). Наблюдалось повышение анти-FXa/FIIa активности после применения дабигатрана этексилата с предварительным назначением эноксапарина по сравнению с анти-FXa/FIIa активностью при лечении только дабигатрана этексилатом. Считается, что это обусловлено остаточным эффектом лечения эноксапарином и не является клинически значимым. Предварительное назначение эноксапарина существенно не влияло на другие антикоагуляционные показатели дабигатрана |
Другие взаимодействия
Таблица 9
Другие взаимодействия
| Селективные ингибиторы обратного захвата серотонина (СИОЗС) или селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) | |
| СИОЗС, СИОЗСН | СИОЗС и СИОЗСН повышали риск кровотечения в исследовании RE-LY во всех группах лечения |
| Вещества, влияющие на pH желудочного содержимого | |
| Пантопразол | При одновременном применении препарата ПРАДАКСА с пантопразолом наблюдалось уменьшение AUC дабигатрана приблизительно на 30%. В клинических исследованиях пантопразол и другие ингибиторы протонного насоса (ИПН) назначались одновременно с препаратом ПРАДАКСА, и одновременное применение ИПН не снижало эффективности препарата ПРАДАКСА |
| Ранитидин | Одновременное применение ранитидина с препаратом ПРАДАКСА не оказывало клинически значимого влияния на степень всасывания дабигатрана |
Взаимодействия, связанные с метаболическим профилем дабигатрана этексилата и дабигатрана
Дабигатрана этексилат и дабигатран не метаболизируются системой цитохрома P450 и не оказывают in vitro никакого влияния на ферменты цитохрома P450. Поэтому взаимодействия дабигатрана с соответствующими лекарственными средствами не ожидается.
Передозировка
Дозы препарата ПРАДАКСА, превышающие рекомендуемые, приводят к повышению риска кровотечения у пациента.
В случае подозрения на передозировку коагуляционные тесты могут помочь определить риск кровотечения (см. «Особые указания» и «Фармакодинамика»). Калиброванный количественный тест (рТВ) или повторные измерения рТВ дают возможность прогнозировать время, когда будут достигнуты определенные уровни дабигатрана (см. «Фармакодинамика»), также в качестве дополнительной меры можно начать диализ.
Чрезмерная антикоагуляция может потребовать временного прекращения лечения препаратом ПРАДАКСА. Поскольку дабигатран в основном выводится почками, следует поддерживать адекватный диурез. В связи с тем, что степень связывания с белками плазмы крови низкая, дабигатран может выводиться с помощью диализа; клинический опыт, демонстрирующий пользу применения диализа в клинических исследованиях, ограничен (см. «Фармакокинетика»).
Лечение кровотечений. В случае геморрагических осложнений лечение препаратом ПРАДАКСА следует прекратить и установить источник кровотечения. В зависимости от клинической ситуации следует использовать соответствующие поддерживающие методы лечения, например, хирургический гемостаз или восстановление ОЦК, по решению врача.
Для ситуаций, когда требуется быстрое устранение антикоагулянтной активности, существует специфический антагонист фармакодинамического действия дабигатрана, препарат ПРАКСБАЙНД® (идаруцизумаб), введение которого позволяет нейтрализовать антикоагулянтный эффект препарата ПРАДАКСА.
Можно рассмотреть целесообразность применения концентратов факторов свертывания крови (активированных или не активированных) или рекомбинантного фактора VIIa. Имеются некоторые экспериментальные данные, свидетельствующие о возможности их применения для прекращения антикоагулянтного эффекта дабигатрана, но данные относительно их пользы в клинических ситуациях, а также относительно возможного риска рикошетной тромбоэмболии очень ограничены. Результаты коагуляционных тестов могут стать недостоверными после применения предлагаемых концентратов факторов свертывания крови. Следует соблюдать осторожность при интерпретации этих тестов. Также следует соблюдать осторожность при применении концентратов тромбоцитов при наличии тромбоцитопении или применении антиагрегантных лекарственных средств длительного действия. Все симптоматическое лечение проводят по решению врача.
В случае значительного кровотечения следует рассмотреть вопрос о консультации специалиста по гемостазу (при наличии данного специалиста).
Особые указания
Риск развития кровотечений
Применение препарата ПРАДАКСА, также как и других антикоагулянтов, рекомендуется с осторожностью при состояниях, характеризующихся повышенным риском кровотечений. Во время терапии препаратом ПРАДАКСА возможно развитие кровотечений различной локализации. Снижение уровня гемоглобина и/или гематокрита по невыясненным причинам или снижение АД, является основанием для поиска источника кровотечения.
В ситуациях опасного для жизни или неконтролируемого кровотечения, когда требуется быстрое прекращение антикоагулянтного эффекта дабигатрана, доступен специфический антагонист ПРАКСБАЙНД® (идаруцизумаб) (см. «Передозировка»).
В клинических исследованиях применение препарата ПРАДАКСА было связано с повышением частоты больших ЖК кровотечений. Повышенный риск наблюдался у пациентов пожилого возраста (≥75 лет) при применении препарата ПРАДАКСА в дозе 150 мг 2 раза в сутки. Дополнительные факторы риска включают одновременное применение ингибиторов агрегации тромбоцитов, например клопидогрела и АСК или НПВП, а также наличие эзофагита, гастрита или гастроэзофагеальной рефлюксной болезни.
Тщательное клиническое наблюдение
Тщательное наблюдение в отношении признаков кровотечения или анемии рекомендуется на протяжении всего периода лечения, особенно если присутствуют сразу несколько факторов риска (см. С осторожностью). Особую осторожность следует соблюдать, когда препарат ПРАДАКСА назначается одновременно с верапамилом, амиодароном, хинидином или кларитромицином (ингибиторы P-гликопротеина) и в частности при возникновении кровотечения, особенно у пациентов, имеющих легкое или умеренное нарушение функции почек (см. «Взаимодействие»).
Тщательное наблюдение в отношении признаков кровотечения рекомендуется у пациентов, одновременно получающих НПВП (см. «Взаимодействие»).
Прекращение приема препарата
При развитии острой почечной недостаточности прием препарата ПРАДАКСА необходимо прекратить (см. также «Противопоказания»).
При развитии тяжелого кровотечения лечение необходимо прекратить, начать поиск источника кровотечения и рассмотреть возможность применения специфического антагониста — препарата ПРАКСБАЙНД® (идаруцизумаб) (см. «Передозировка»).
Снижение дозы
Снижение дозы должно рассматриваться или рекомендоваться, как описано в разделе «Способ применения и дозы».
Применение ингибиторов протонного насоса (ИПН)
Возможно назначение ингибиторов протонного насоса (ИПН) для профилактики ЖК кровотечений.
Лабораторные показатели свертывания крови
Несмотря на то что препарат ПРАДАКСА в целом не требует регулярного антикоагулянтного мониторинга, измерение антикоагулянтного эффекта, связанного с дабигатраном, может быть полезным для обнаружения чрезмерно высокой экспозиции дабигатрана при наличии дополнительных факторов риска.
Разведенное тромбиновой время (рТВ), экариновое время свертывания (ЭВС), и активированное частичное тромбопластиновое время (АЧТВ) могут предоставить полезную информацию, но их значения следует интерпретировать с осторожностью из-за вариабельности результатов, полученных разными методами анализа. Значение международного нормализованного отношения (МНО) является недостоверным у пациентов, принимающих препарат ПРАДАКСА, и были описаны случаи ложноположительного повышения МНО. Поэтому измерение МНО проводить не следует.
Таблица 10
Пороговые значения коагуляционных тестов в момент достижения минимальной концентрации препарата в крови, которые могут быть ассоциированы с повышенным риском кровотечений
| Показатель (в момент достижения минимальной концентрации препарата в крови) | Показание | |
| Профилактика венозных тромбоэмболий у пациентов после ортопедических операций | ФП и ТГВ/ТЭЛА рТВ, нг/мл | |
| рТВ, нг/мл | >67 | >200 |
| ЭВС (кратность превышения верхней границы нормы) | Данные отсутствуют | >3 |
| АЧТВ (кратность превышения верхней границы нормы) | >1,3 | >2 |
| МНО | Не следует выполнять | Не следует выполнять |
Применение фибринолитических препаратов для лечения острого ишемического инсульта
Применение фибринолитических препаратов для лечения острого ишемического инсульта может быть рассмотрено, если результаты измерения рТВ, ЭВС или АЧТВ у пациента не превышают верхней границы нормы (ВГН) в соответствии с местным референсным диапазоном.
Хирургические вмешательства и инвазивные процедуры
Пациенты, которые принимают препарат ПРАДАКСА, имеют повышенный риск кровотечения при выполнении хирургических или инвазивных процедур. Выполнение хирургического вмешательства может потребовать временного прекращения приема препарата ПРАДАКСА.
Проведение кардиоверсии не требует перерыва в приеме препарата ПРАДАКСА.
Данные о применении препарата ПРАДАКСА (1 капсула по 110 мг 2 раза в сутки) у пациентов, которым выполняется катетерная аблация при фибрилляции предсердий, отсутствуют (см. «Способ применения и дозы»). Выполнение катетерной аблации при фибрилляции предсердий у пациентов, получающих препарат ПРАДАКСА в дозе 150 мг (1 капсула) 2 раза в сутки, не требует перерыва в приеме препарата (см. «Способ применения и дозы»).
Следует проявлять осторожность при временном прекращении лечения для выполнения хирургического вмешательства и обеспечить мониторинг антикоагуляции. Выведение дабигатрана из организма у пациентов с почечной недостаточностью может происходить дольше (см. «Фармакокинетика»). Это следует учитывать при выполнении любых процедур. В таких случаях коагуляционные тесты (см. «Фармакодинамика») могут помочь определить, сохраняются ли нарушения гемостаза.
Экстренные хирургические вмешательства и процедуры
Препарат ПРАДАКСА следует временно отменить. Если для выполнения вмешательства/процедуры требуется быстрое прекращение антикоагулянтного эффекта, следует рассмотреть возможность введения специфического антагониста к препарату ПРАДАКСА, препарата ПРАКСБАЙНД® (идаруцизумаб).
Прекращение терапии дабигатрана этексилатом подвергает пациентов тромботическому риску, связанному с их основным заболеванием. Прием препарата ПРАДАКСА может быть возобновлен через 24 часа после введения специфического антагониста к дабигатрану ПРАКСБАЙНД® (идаруцизумаб) при условии достижения полного гемостаза и стабильного состояния пациента.
Срочные хирургические вмешательства/процедуры\
Препарат ПРАДАКСА следует временно отменить. Срочное хирургическое вмешательство или процедуру, при наличии такой возможности, целесообразно выполнять не ранее чем через 12 часа в после последнего приема препарата ПРАДАКСА. Если операция или процедура не может быть отложена, ее выполнение у пациента, получающего дабигатран, может быть ассоциировано с повышенным риском кровотечения. Этот риск кровотечения следует сопоставить со срочностью вмешательства.
Плановые хирургические вмешательства
Если возможно, препарат ПРАДАКСА следует отменить по крайней мере за 24 часа до выполнения инвазивных или хирургических процедур. У пациентов с повышенным риском кровотечения или при обширном хирургическом вмешательстве, где может потребоваться полный гемостаз, следует рассмотреть возможность отмены препарата ПРАДАКСА за 2–4 дня до хирургического вмешательства.
Таблица 11
Правила отмены препарата ПРАДАКСА перед инвазивными или хирургическими процедурами
| Функция почек (клиренс креатинина, мл/мин) | T1/2 | Прекращение приема препарата перед плановой хирургической операцией | |
| Высокий риск кровотечения или проведение большой операции | Стандартный риск | ||
| ≥80 | ≈13 | За 2 дня | За 24 часа |
| ≥50-<80 | ≈15 | За 2–3дня | За 1–2 дня |
| ≥30-<50 | ≈18 | За 4 дня | За 2–3 дня (>48 часов) |
Спинальная анестезия/эпидуральная анестезия/люмбальная пункция
Такие процедуры, как спинномозговая анестезия, могут потребовать полного восстановления гемостаза.
В случае травматичной или повторной спинномозговой пункции и длительного использования эпидурального катетера может повышаться риск развития спинномозгового кровотечения или эпидуральной гематомы. Первую дозу препарата ПРАДАКСА следует принимать не ранее, чем через 2 часа после удаления катетера. Необходим контроль состояния пациентов для исключения неврологических симптомов, которые могут быть обусловлены спинномозговым кровотечением или эпидуральной гематомой.
Послеоперационная фаза
После инвазивной процедуры/хирургического вмешательства прием препарата ПРАДАКСА следует возобновить/начать как можно быстрее, если это позволяет клиническая ситуация и достигнут адекватный гемостаз.
У пациентов с риском кровотечения или имеющих риск чрезмерной экспозиции препарата, особенно у пациентов с умеренным нарушением функции почек (клиренс креатинина 30–50 мл/мин), терапию следует проводить с осторожностью (см. «Фармакодинамика»).
Пациенты с высоким риском хирургической смертности и внутренними факторами риска тромбоэмболических осложнений. Данные по эффективности и безопасности препарата ПРАДАКСА в данной группе пациентов ограничены, поэтому терапию следует проводить с осторожностью.
Хирургическое вмешательство при переломе шейки бедренной кости. Данные об использовании препарата ПРАДАКСА у пациентов, которым проводится хирургическое вмешательство при переломе шейки бедренной кости, отсутствуют. Терапия не рекомендуется.
Нарушение функции печени. Пациенты с повышением активности печеночных ферментов >2 ВГН были исключены из основных клинических исследований. Опыта применения препарата ПРАДАКСА в этой подгруппе пациентов нет. Нарушение функции печени или заболевание печени, которое, как ожидается, может повлиять на выживаемость, является противопоказанием для применения препарата ПРАДАКСА (см. «Противопоказания»).
Взаимодействие с индукторами P-гликопротеина. Ожидается, что одновременное назначение индукторов P-гликопротеина приведет к снижению концентраций дабигатрана в плазме крови, и их одновременного применения следует избегать (см. «Фармакокинетика» и «Взаимодействие»).
Пациенты с антифосфолипидным синдромом. У пациентов с антифосфолипидным синдромом (особенно при тройном положительном результате на антифосфолипидные антитела) повышен риск тромбоэмболических событий. Несмотря на то, что эффективность препарата ПРАДАКСА установлена для лечения и профилактики венозной тромбоэмболии, она не была изучена конкретно в подгруппе пациентов с антифосфолипидным синдромом. Поэтому перед применением препарата ПРАДАКСА у пациентов с антифосфолипидным синдромом рекомендуется тщательно рассмотреть все возможные варианты лечения (включая стандартное лечение, такое как антагонистами витамина К).
Пациенты с активными злокачественными новообразованиями (ТГВ/ТЭЛА). Эффективность и безопасность применения препарата ПРАДАКСА для лечения ТГВ/ТЭЛА у пациентов с активными злокачественными новообразованиями не установлены.
Влияние на способность к управлению транспортными средствами и механизмами. Влияние препарата ПРАДАКСА на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не изучалось, но учитывая, что применение препарата ПРАДАКСА может сопровождаться повышенным риском кровотечений, следует соблюдать осторожность при выполнении таких видов деятельности.
Форма выпуска
Капсулы, 75 мг, 110 мг. По 10 капсул в блистер с перфорацией из Al-Al фольги. 1, 3 или 6 блистеров в пачку картонную с инструкцией по применению.
Мультиупаковка (для дозировки 110 мг): по 10 капсул в блистер с перфорацией из Al-Al фольги. 6 блистеров в пачку картонную с инструкцией по применению.
По 3 пачки картонные в пленку из полипропилена.
Производитель
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ Бингер Штрассе, 173, 55216, Ингельхайм-на-Рейне, Германия.
Владелец регистрационного удостоверения/Организация, принимающая претензии от потребителей
Владелец регистрационного удостоверения: Берингер Ингельхайм Интернешнл ГмбХ. Бингер Штрассе, 173, 55216, Ингельхайм-на-Рейне, Германия.
Организация, принимающая претензии от потребителей: ООО «Берингер Ингельхайм» 125171, Москва, Ленинградское ш., 16А, стр. 3.
Тел.: (495) 544-50-44; факс: (495) 544-56-20.
Условия отпуска из аптек
По рецепту.
PC-RU-102094 09.2021
Условия хранения
В защищенном от влаги месте, при температуре не выше 25 °C, в оригинальной упаковке.
Не помещать капсулы в таблетницы и органайзеры для лекарств, за исключением тех, в которых они могут оставаться в оригинальной упаковке (блистере).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Прадакса — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛСР-007065/09
Торговое наименование препарата
Прадакса®
Международное непатентованное наименование
Дабигатрана этексилат
Лекарственная форма
к
Состав
Одна капсула содержит 86,48 мг, 126,83 мг или 172,95 мг дабигатрана этексилата мезилата, что соответствует 75 мг, 110 мг или 150 мг дабигатрана этексилата.
Вспомогательные вещества:
Содержимое капсул: акации камедь 4,43 мг, 6,50 мг или 8.86 мг: винная кислота, крупнозернистая 22,14 мг, 32,48 мг или 44,28 мг; винная кислота, порошок 29,52 мг, 43,30 мг или 59,05 мг: винная кислота, кристаллическая 36,90 мг, 54,12 мг или 73,81 мг; гипромеллоза 2,23 мг, 3,27 мг или 4,46 мг; диметикон 0,04 мг, 0,06 мг или 0,08 мг; тальк 17,16 мг, 25,16 мг или 34,31 мг; гипролоза (гидроксипропилцеллюлоза) 17,30 мг, 25,37 мг или 34,59 мг.
Состав капсульной оболочки: капсула из гипромеллозы (НРМС) с надпечаткой черными чернилами 60* мг, 70* мг или 90* мг.
Состав НРМС капсул: каррагинан (Е407) 0,2 мг. 0.22 мг или 0.285 мг: калия хлорид 0,27 мг, 0,31 мг или 0,4 мг; титана диоксид (Е171) 3,6 мг, 4,2 мг или 5,4 мг; индигокармин (Е132) 0.036 мг. 0,042 мг или 0.054 мг; краситель солнечный закат желтый (Е110) 0,002 мг, 0.003 мг или 0.004 мг: гипромеллоза (гидроксипропилметилцеллюлоза) 52,9 мг, 61.71 мг или 79,35 мг, вода очищенная 3,0 мг, 3,5 мг или 4,5 мг.
Состав чернил черных (%, масс.): шеллак 24 — 27%, бутанол 1 — 3%, изопропанол 1 — 3%, краситель железа оксид черный (Е172) 24 — 28%, вода очищенная 15 — 18%, пропиленгликоль 3 — 7%, этанол 23 — 26%, аммиак водный 1 — 2%, калия гидроксид 0,05 — 0,1%.
*Приблизительная масса капсулы составляет 60, 70 или 90 мг.
Описание
Капсулы 75 мг
Продолговатые капсулы из гипромеллозы (гидроксипропилметилцеллюлозы). Крышка — непрозрачная, светло-синего цвета, корпус — непрозрачный кремового цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R 75». Цвет надпечатки — черный.
Капсулы 110 мг
Продолговатые капсулы из гипромеллозы (гидроксипропилметилцеллюлозы). Крышка — непрозрачная светло-синего цвета, корпус — непрозрачный кремового цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R 110». Цвет надпечатки — черный.
Капсулы 150 мг
Продолговатые капсулы из гипромеллозы (гидроксипропилметилцеллюлозы), размер 0. Крышка — непрозрачная светло-синего цвета, корпус — непрозрачный кремового цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R 150». Цвет надпечатки — черный.
Содержимое капсул — желтоватые пеллеты.
Фармакотерапевтическая группа
Тромбина ингибитор прямой
Код АТХ
B01AE07
Фармакодинамика:
Дабигатрана этексилат является низкомолекулярным, не обладающим фармакологической активностью предшественником активной формы дабигатрана. После приема внутрь дабигатрана этексилат быстро всасывается в желудочно-кишечном тракте (ЖКТ) и, путем гидролиза, катализируемого эстеразами, в печени и плазме крови превращается в дабигатран. Дабигатран является мощным конкурентным обратимым прямым ингибитором тромбина и основным активным веществом в плазме крови.
Так как тромбин (сериновая протеаза) в процессе коагуляции превращает фибриноген в фибрин, угнетение активности тромбина препятствует образованию тромба. Дабигатран оказывает ингибирующее воздействие на свободный тромбин, тромбин, связанный с фибриновым сгустком, и вызванную тромбином агрегацию тромбоцитов.
В экспериментальных исследованиях на различных моделях тромбоза in vivo и ex vivo подтверждено антитромботическое действие и антикоагулянтная активность дабигатрана после внутривенного введения и дабигатрана этексилата — после приема внутрь. Установлена прямая корреляция между концентрацией дабигатрана в плазме крови и выраженностью антикоагулянтного эффекта. Дабигатран удлиняет активированное частичное тромбопластиновое время (АЧТВ), экариновое время свертывания (ЭВС) и тромбиновое время (ТВ).
Профилактика венозных тромбоэмболии (ВТЭ) после эндопротезирования крупных суставов
Результаты клинических исследований у пациентов, перенесших ортопедические операции — эндопротезирование коленного и тазобедренного суставов, — подтвердили сохранение параметров гемостаза и эквивалентность применения 75 мг или 110 мг дабигатрана этексилата через 1-4 часа после операции и последующей поддерживающей дозы 150 или 220 мг один раз в сутки в течение 6-10 дней (при операции на коленном суставе) и 28-35 дней (на тазобедренном суставе), по сравнению с эноксапарином в дозе 40 мг 1 раз в сутки, который применяли накануне и после операции.
Показана эквивалентность антитромботического эффекта дабигатрана этексилата при применении 150 мг или 220 мг по сравнению с эноксапарином в дозе 40 мг в сутки при оценке основной конечной точки, которая включает все случаи венозных тромбоэмболий и смертность от любых причин.
Профилактика инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий
При длительном, в среднем около 20 месяцев, применении у пациентов с фибрилляцией предсердий и с умеренным или высоким риском инсульта или системных тромбоэмболий было показано, что дабигатрана этексилат в дозе 110 мг, назначенный 2 раза в день, не уступал варфарину по эффективности предотвращения инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий; так же в группе дабигатрана было отмечено снижение риска внутричерепных кровотечений и общей частоты кровотечений.
Применение более высокой дозы препарата (150 мг 2 раза в день) достоверно снижало риск ишемического и геморрагического инсультов, сердечно-сосудистой смертности, внутричерепных кровотечений и общей частоты кровотечений по сравнению с варфарином. Меньшая доза дабигатрана характеризовалась существенно более низким риском больших кровотечений по сравнению с варфарином.
Чистый клинический эффект оценивался путем определения комбинированной конечной точки, включавшей частоту инсульта, системных тромбоэмболий, легочных тромбоэмболий, острого инфаркта миокарда, сердечно-сосудистой смертности и больших кровотечений.
Ежегодная частота перечисленных событий у пациентов, получавших дабигатрана этексилат, была ниже, чем у пациентов, получавших варфарин.
Изменения в лабораторных показателях функции печени у пациентов, получавших дабигатрана этексилат, отмечались со сравнимой или меньшей частотой по сравнению с пациентами, получавшими варфарин.
Профилактика тромбоэмболии у пациентов с протезированными клапанами сердца
В ходе клинических исследований фазы II применения дабигатрана и варфарина у пациентов, перенесших операцию по замене клапана сердца механическим протезом (недавно проведенные операции и операции, проведенные более 3-х месяцев назад), было выявлено повышение частоты тромбоэмболий и общего числа кровотечений (преимущественно за счет малых кровотечений) у пациентов, получавших дабигатрана этексилат. В раннем послеоперационном периоде большие кровотечения в основном характеризовались геморрагическим выпотом в перикард, особенно у пациентов, которым дабигатран этексилат был назначен в раннем периоде (на 3 день) после хирургической замены клапанов сердца.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями
Результаты клинических исследований у пациентов с наличием острого ТГВ и/или ТЭЛА, которые первоначально получали парентеральную терапию в течение, как минимум, 5 дней, подтвердили, что дабигатрана этексилат в дозе 150 мг, назначенный 2 раза в день, не уступал варфарину по эффективности в отношении снижения частоты рецидивирующего симптоматического ТГВ и/или ТЭЛА и случаев смерти, обусловленных этими заболеваниями, на протяжении 6-месячного периода лечения. У пациентов, получавших дабигатрана этексилат. кровотечения отмечались значительно реже, чем у пациентов, получавших варфарин.
Частота развития инфаркта миокарда во всех проводимых исследованиях при ВТЭ, во всех лечебных группах была низкой.
Показатели функции печени
В исследованиях с применением активных препаратов сравнения возможные изменения показателей функции печени возникали у пациентов, получавших дабигатрана этексилат, со сравнимой или меньшей частотой, чем у пациентов, получавших варфарин. В исследовании с плацебо существенного различия в отношении изменений показателей функции печени, возможно имеющих клиническое значение, между группами с применением дабигатрана и плацебо не отмечалось.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями
Результаты клинического исследования у пациентов с рецидивирующим ТГВ и ТЭЛА, уже получавших в течение от 3 до 12 месяцев антикоагулянтную терапию и нуждавшихся в ее продолжении, подтвердили, что лечение дабигатрана этексилатом в дозе 150 мг два раза в день не уступало лечебному эффекту варфарина (р=0,0135). У пациентов, получавших дабигатрана этексилат, кровотечения отмечались значительно реже, чем у пациентов, получавших варфарин.
В исследовании сравнения дабигатрана этексилата с плацебо у пациентов, уже получавших в течение от 6 до 18 месяцев антагонисты витамина К, было установлено, что дабигатран превосходил плацебо в отношении профилактики рецидивирующего симптоматического ТГВ/ТЭЛА. включая случаи смерти от неустановленной причины; снижение риска за период лечения составило 92% (р<0,0001).
Частота развития инфаркта миокарда во всех проводимых исследованиях при ВТЭ во всех лечебных группах была низкой.
Показатели функции печени
В исследованиях с применением активных препаратов сравнения возможные изменения показателей функции печени возникали у пациентов, получавших дабигатрана этексилат. со сравнимой или меньшей частотой, чем у пациентов, получавших варфарин. В исследовании с плацебо существенного различия в отношении изменений показателей функции печени, возможно имеющих клиническое значение, между группами с применением дабигатрана и плацебо не отмечалось.
Фармакокинетика:
После перорального введения дабигатрана этексилата отмечается быстрое дозозависимое увеличение его концентрации в плазме крови и площади под кривой «концентрация-время» (AUC). Максимальная концентрация дабигатрана этексилата (Сmах) достигается в течение 0,5-2 ч.
После достижения Cmax плазменные концентрации дабигатрана снижаются биэкспоненциально, конечный период полувыведения (Т1/2) в среднем составляет около 11 ч (у людей пожилого возраста). Конечный Т1/2 после многократного применения препарата составлял около 12-14 ч. Т1/2 не зависит от дозы. Однако в случае нарушений функции почек Т1/2 удлиняется.
Абсолютная биодоступность дабигатрана после приема дабигатрана этексилата внутрь в капсулах, покрытых оболочкой из гипромеллозы, составляет около 6,5%.
Прием пищи не влияет на биодоступность дабигатрана этексилата, однако время достижения Сmax возрастает на 2 ч.
При использовании дабигатрана этексилата без специальной капсульной оболочки, изготовленной из гипромеллозы, биодоступность дабигатрана при применении без капсульной оболочки по сравнению с лекарственной формой в капсулах может увеличиваться примерно на 75% (в 1,8 раза) при однократном приеме и примерно на 37% (в 1,4 раза) в равновесном состоянии. Поэтому следует сохранять целостность капсул, изготовленных из гипромеллозы, учитывая риск повышения биодоступности дабигатрана этексилата, и не рекомендуется вскрывать капсулы и применять их содержимое в чистом виде (например, добавляя в пищу или напитки) (см. раздел «Способ применения и дозы»).
При применении дабигатрана этексилата через 1-3 ч у пациентов после оперативного лечения отмечается снижение скорости всасывания препарата по сравнению со здоровыми добровольцами. AUCхарактеризуется постепенным повышением амплитуды без появления высокого пика концентрации в плазме. Сmах в плазме крови отмечается через 6 ч после применения дабигатрана этексилата или через 7-9 ч после операции.
Следует отметить, что такие факторы, как анестезия, парез ЖКТ и хирургическая операция могут иметь значение в замедлении всасывания, независимо от лекарственной формы препарата. Снижение скорости всасывания препарата отмечается обычно только в день операции. В последующие дни всасывание дабигатрана происходит быстро, с достижением Сmах через 2 ч после его приема внутрь.
Метаболизм
После приема внутрь в процессе гидролиза под влиянием эстеразы дабигатрана этексилат быстро и полностью превращается в дабигатран, который является основным активным метаболитом в плазме крови. При конъюгации дабигатрана образуется 4 изомера фармакологически активных ацилглюкуронидов: 1-О, 2-О, 3-О, 4-О, каждый из которых составляет менее 10% от общего содержания дабигатрана в плазме крови. Следы других метаболитов обнаруживаются только при использовании высокочувствительных аналитических методов.
Распределение
Объем распределения дабигатрана составляет 60-70 л и превосходит объем общего содержания воды в организме, что указывает на умеренное распределение дабигатрана в тканях.
Выведение
Дабигатран выводится в неизмененном виде, преимущественно почками (85%), и только 6% — через ЖКТ. Установлено, что через 168 ч после введения меченного радиоактивного препарата 88-94% его дозы выводится из организма.
Дабигатран обладает низкой способностью связывания с белками плазмы крови (34-35%), она не зависит от концентрации препарата.
Особые группы пациентов
Пожилые пациенты
У лиц пожилого возраста значение AUC выше, чем у молодых лиц, в 1,4-1,6 раза (на 40- 60%), а Сmах — более чем в 1,25 раза (на 25%).
Наблюдаемые изменения коррелировали с возрастным снижением клиренса креатинина (КК).
У женщин пожилого возраста (старше 65 лет) величины AUCt,ss иCmax,ss были примерно в 1,9 раза и в 1,6 раза выше, чем у женщин молодого возраста (18-40 лет), а у мужчин пожилого возраста — в 2,2 и 2,0 раза выше, чем у мужчин молодого возраста.
В исследовании у пациентов с фибрилляцией предсердий подтверждено влияние возраста на экспозицию дабигатрана: исходные концентрации дабигатрана у пациентов в возрасте >75 лет были примерно в 1,3 раза (на 31%) выше, а у пациентов в возрасте <65 лет — примерно на 22% ниже, чем у пациентов в возрасте 65-75 лет.
Нарушение функции почек
У добровольцев с умеренным нарушением функции почек (КК — 30-50 мл/мин) значение AUC дабигатрана после приема внутрь было приблизительно в 3 раза больше, чем у лиц с неизмененной функцией почек.
У пациентов с тяжелыми нарушениями функции почек (КК — 10-30 мл/мин) значения AUC дабигатрана этексилата и Т1/2 возрастали соответственно в 6 и 2 раза, по сравнению с аналогичными показателями у лиц без нарушений функции почек.
У пациентов с фибрилляцией предсердий и умеренной почечной недостаточностью (КК 30-50 мл/мин) концентрации дабигатрана до и после применения препарата были в среднем в 2,29 и в 1,81 раза выше, чем у пациентов без нарушений функции почек. При лечении острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактики смертельных исходов, вызываемых этими заболеваниями у пациентов с легкой и умеренной степенью почечной недостаточности (КК 30-50 мл/мин), базальная концентрация дабигатрана в период устойчивого состояния фармакокинетики были в среднем в 1,7 и в 3,4 раза выше, чем у пациентов с КК > 80 мл/мин.
При использовании гемодиализа у пациентов без фибрилляции предсердий было установлено, что количество выводившегося препарата пропорционально скорости тока крови. Длительность диализа, со скоростью тока диализата 700 мл/мин, составляла 4 часа, а скорость тока крови — 200 мл/мин или 350-390 мл/мин. Это приводило к удалению соответственно 50% и 60% концентраций свободного и общего дабигатрана. Антикоагулянтная активность дабигатрана снижалась по мере уменьшения концентраций в плазме, взаимосвязь ФК и ФД не менялась.
Нарушение функции печени
У пациентов с умеренным нарушением функции печени (7-9 баллов по шкале Чайлд-Пью) не было выявлено изменений концентрации дабигатрана в плазме крови по сравнению с пациентами без нарушения функции печени.
Масса тела
В исследованиях базальные концентрации дабигатрана у пациентов с массой тела >100 кг были примерно на 20% ниже, чем у пациентов с массой тела 50-100 кг. Масса тела у большинства (80,8%) пациентов составляла >50 — <100 кг, в пределах этого диапазона явных различий концентраций дабигатрана не установлено. Данные в отношении пациентов с массой тела <50 кг ограничены.
Пол
В основных исследованиях по профилактике развития ВТЭ установлено, что воздействие препарата у женщин было примерно в 1,4-1,5 раза (на 40-50%) выше. У пациенток с фибрилляцией предсердий базальные концентрации и концентрации после применения препарата были в среднем в 1,3 (на 30%) выше. Установленные различия не имели клинического значения.
Этнические группы
В сравнительном исследовании фармакокинетики дабигатрана у европейцев и японцев после однократного и повторного приема препарата в исследуемых этнических группах не было выявлено клинически значимых различий. Фармакокинетические исследования у пациентов негроидной расы ограничены, однако имеющиеся данные указывают на отсутствие значимых различий.
Показания:
— Профилактика венозных тромбоэмболий у пациентов после ортопедических операций;
— профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий;
— лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями;
— профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями.
Противопоказания:
— Известная гиперчувствительность к дабигатрану, дабигатрана этексилату или к любому из вспомогательных веществ;
— тяжелая степень почечной недостаточности (КК менее 30 мл/мин);
— активное клинически значимое кровотечение, геморрагический диатез, спонтанное или фармакологически индуцированное нарушение гемостаза;
— поражение органов в результате клинически значимого кровотечения, включая геморрагический инсульт в течение 6 месяцев до начала терапии;
— существенный риск развития большого кровотечения из имеющегося или недавнего изъязвления ЖКТ, наличие злокачественных образований с высоким риском кровотечения, недавнее повреждение головного или спинного мозга, недавняя операция на головном или спинном мозге или офтальмологическая операция, недавнее внутричерепное кровоизлияние, наличие или подозрение на варикозно-расширенные вены пищевода, врожденные артериовенозные дефекты, сосудистые аневризмы или большие внутрипозвоночные или внутримозговые сосудистые нарушения;
— одновременное назначение любых других антикоагулянтов, в том числе, нефракционированного гепарина, низкомолекулярных гепаринов (НМГ) (эноксапарин, дальтепарин и др.), производные гепарина (фондапаринукс и др.), пероральные антикоагулянты (варфарин, ривароксабан, апиксабан и др.), за исключением случаев перехода лечения с или на препарат ПРАДАКСА® или в случае применения нефракционированного гепарина в дозах, необходимых для поддержания центрального венозного или артериального катетера;
— одновременное назначение кетоконазола для системного применения, циклоспорина, итраконазола, такролимуса и дронедарона;
— нарушения функции печени и заболевания печени, которые могут повлиять на выживаемость;
— наличие протезированного клапана сердца;
— возраст до 18 лет (клинические данные отсутствуют).
С осторожностью:
При состояниях, повышающих риск кровотечения:
— возраст 75 лет и старше;
— умеренное снижение функции почек (КК 30-50 мл/мин);
— одновременное применение ингибиторов Р-гликопротеина (за исключением указанных в разделе «Противопоказания»);
— масса тела меньше 50 кг;
— одновременный прием ацетилсалициловой кислоты, НПВП, клопидогрела, селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата норадреналина, а также других препаратов, применение которых может нарушать гемостаз;
— врожденные или приобретенные заболевания свертывающей системы крови;
— тромбоцитопения или функциональные дефекты тромбоцитов;
— недавно проведенная биопсия или перенесенная обширная травма;
— бактериальный эндокардит;
— эзофагит, гастрит или гастроэзофагеальная рефлюксная болезнь.
Беременность и лактация:
Данные о применении дабигатрана этексилата во время беременности отсутствуют. Потенциальный риск у человека неизвестен.
В экспериментальных исследованиях не установлено неблагоприятного воздействия на фертильность или постнатальное развитие новорождённых.
Женщинам репродуктивного возраста следует избегать наступления беременности при лечении препаратом ПРАДАКСА®. При наступлении беременности применение препарата не рекомендуется, за исключением случаев, когда ожидаемая польза превышает возможный риск.
При необходимости применения препарата в период грудного вскармливания, в связи с отсутствием клинических данных, грудное вскармливание рекомендуется прекратить (в качестве меры предосторожности).
Способ применения и дозы:
Капсулы следует принимать внутрь, 1 или 2 раза в день независимо от времени приема пищи, запивая стаканом воды для облегчения прохождения препарата в желудок. Не следует вскрывать капсулу.
Особые указания при изъятии капсул из блистера:
— оторвите один индивидуальный блистер от блистер-упаковки по линии перфорации;
— выньте капсулу из блистера, отслаивая фольгу;
— не выдавливайте капсулы через фольгу.
Применение у взрослых:
Профилактика венозных тромбоэмболий (ВТЭ) у пациентов после ортопедических операций: рекомендованная доза составляет 220 мг 1 раз в сутки (2 капсулы по 110 мг).
У пациентов с умеренным нарушением функции почек в связи с риском кровотечений рекомендованная доза составляет 150 мг 1 раз в сутки (2 капсулы по 75 мг).
Профилактика ВТЭ после эндопротезирования коленного сустава: применение препарата ПРАДАКСА следует начинать через 1-4 ч после завершения операции с приема 1 капсулы (110 мг) с последующим увеличением дозы до 2 капсул (220 мг) однократно в сутки в течение последующих 10 дней. Если гемостаз не достигнут, лечение следует отложить. Если лечение не началось в день операции, терапию следует начинать с приема 2 капсул (220 мг) однократно в сутки.
Профилактика ВТЭ после эндопротезирования тазобедренного сустава: применение препарата ПРАДАКСА следует начинать через 1-4 ч после завершения операции с приема 1 капсулы (110 мг) с последующим увеличением дозы до 2 капсул (220 мг) однократно в сутки в течение последующих 28-35 дней. Если гемостаз не достигнут, лечение следует отложить. Если лечение не началось в день операции, терапию следует начинать с приема 2 капсул (220 мг) однократно в сутки.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: рекомендуется применение препарата ПРАДАКСА в суточной дозе 300 мг (1 капсула по 150 мг 2 раза в день). Терапия должна продолжаться пожизненно.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: рекомендуется применение препарата ПРАДАКСА в суточной дозе 300 мг (1 капсула по 150 мг 2 раза в день) после парентерального лечения антикоагулянтом, проводящимся в течение как минимум 5 дней. Терапия должна продолжаться до 6 месяцев.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: рекомендуется применение препарата ПРАДАКСА в суточной дозе 300 мг (1 капсула по 150 мг 2 раза в день). Терапия может продолжаться пожизненно, в зависимости от индивидуальных факторов риска.
Применение в особых группах пациентов
Применение у детей
У пациентов до 18 лет эффективность и безопасность препарата ПРАДАКСА не изучали, поэтому применение у детей не рекомендуется (см. раздел «Противопоказания»).
Нарушение функции почек
Перед терапией, во избежание назначения препарата пациентам с тяжелыми нарушениями функции почек (КК менее 30 мл/мин), необходимо предварительно оценить клиренс креатинина. В связи с отсутствием данных по применению препарата у пациентов с тяжелыминарушениями функции почек (КК менее 30 мл/мин) применение препарата ПРАДАКСА противопоказано (см. раздел «Противопоказания»).
Функция почек должна оцениваться в процессе лечения, когда возникает подозрение о возможном снижении или ухудшении функции почек (например, при гиповолемии, дегидратации, одновременном применении определенных лекарственных препаратов и т.п.).
В ходе клинической разработки препарата ПРАДАКСА в качестве метода оценки функции почек использовался расчет клиренса креатинина по формуле Кокрофта-Голта (Cocroft-Gault method).
Дабигатран выводится при гемодиализе; однако клинический опыт применения у пациентов, которым проводится гемодиализ, ограничен.
При применении препарата ПРАДАКСА с целью профилактики венозных тромбоэмболий у пациентов после ортопедических операций при умеренных нарушениях функции почек (КК 30-50 мл/мин) суточная доза препарата должна быть снижена до 150 мг (2 капсулы по 75 мг 1 раз в день).
При применении препарата ПРАДАКСА с целью профилактики инсульта, системных тромбоэмболий и снижения сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий при умеренных нарушениях функции почек (КК 30-50 мл/мин) коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день). Функция почек должна оцениваться как минимум один раз в год.
При применении препарата ПРАДАКСА с целью лечения острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактики смертельных исходов, вызываемых этими заболеваниями при КК >30 мл/мин коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
При применении препарата ПРАДАКСА с целью профилактики рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями, при умеренных нарушениях функции почек (КК 30-50 мл/мин) коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день). Функция почек должна оцениваться как минимум один раз в год.
Применение у пожилых пациентов
В связи с тем, что повышение экспозиции препарата у пожилых пациентов (старше 75 лет) часто обусловлено снижением функции почек, перед назначением препарата необходимо оценить функцию почек. Почечная функция должна оцениваться как минимум один раз в год или чаще, в зависимости от клинической ситуации. Коррекцию дозы препарата следует проводить в зависимости от тяжести нарушений функции почек (см. «Нарушение функции почек»).
Профилактика венозных тромбоэмболий у пожилых пациентов (старше 75 лет) после ортопедических операции: опыт применения ограничен. Рекомендуемая доза — 150 мг (2 капсулы по 75 мг однократно).
При применении препарата ПРАДАКСА у пожилых пациентов старше 80 лет с целью профилактики инсульта, системных тромбоэмболий и снижения сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий препарат ПРАДАКСА следует принимать в суточной дозе 220 мг (1 капсула по 110 мг 2 раза в сутки).
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями, у пациентов старше 75 лет: коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов,вызываемых этими заболеваниями, у пациентов старше 75 лет: коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
Влияние массы тела
Профилактика венозных тромбоэмболий (ВТЭ) у пациентов после ортопедических операций: у пациентов с массой тела менее 50 кг и более 110 кг опыт применения ограничен. В соответствии с фармакокинетическими и клиническими данными коррекции дозы не требуется. Однако за такими пациентами рекомендуется наблюдать.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: в соответствии с фармакокинетическими и клиническими данными коррекции дозы не требуется. Однако за пациентами с массой тела менее 50 кг рекомендуется наблюдать.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: не требуется коррекции дозы в зависимости от массы тела.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов,вызываемых этими заболеваниями: не требуется коррекции дозы в зависимости от массы тела.
Одновременное применение препарата ПРАДАКСА с активными ингибиторами Р-гликопротеина (амиодарон, хинидин, верапамил) с целью профилактики венозных тромбоэмболии у пациентов после ортопедических операций:
При одновременном применении с амиодароном, хинидином или верапамилом, дозу препарата ПРАДАКСА следует уменьшить до 150 мг 1 раз в день (2 капсулы по 75 мг) (см. раздел «Взаимодействие с другими лекарственными средствами»).
Пациентам, принимающим препарат ПРАДАКСА после ортопедических операций, не рекомендуется одновременно начинать применение верапамила и подключать его к терапии в дальнейшем.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: коррекции дозы не требуется, пациентам рекомендуется применение препарата в суточной дозе 300 мг (1 капсула по 150 мг 2 раза в день).
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов,вызываемых этими заболеваниями: коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
Применение у пациентов с повышенным риском кровотечений
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: присутствие таких факторов как возраст 75 лет или старше, умеренное снижение функции почек (КК 30-50 мл/мин), одновременное применение ингибиторов Р-гликопротеина, антиагрегантов или указание на желудочно-кишечное кровотечение в анамнезе могут повышать риск кровотечения (см. «Особые указания»). У пациентов с одним или более указанных факторов риска, по усмотрению врача, возможно снижение суточной дозы препарата ПРАДАКСА® до 220 мг (прием 1 капсулы 110 мг 2 раза в сутки).
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: присутствие таких факторов как возраст 75 лет или старше, умеренное снижение функции почек (КК 30-50 мл/мин) или указание на желудочно-кишечное кровотечение в анамнезе могут повышать риск кровотечения (см. «Особые указания»).
У пациентов с одним фактором риска коррекции дозы не требуется. Для пациентов с несколькими факторами риска клинические данные ограничены. У таких пациентов препарат должен применяться только в случаях, когда ожидаемая польза превышает риск кровотечения.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: присутствие таких факторов как возраст 75 лет или старше, умеренное снижение функции почек (КК 30-50 мл/мин) или указание на желудочно-кишечное кровотечение в анамнезе могут повышать риск кровотечения (см. «Особые указания»).
У пациентов с одним фактором риска коррекции дозы не требуется. Для пациентов с несколькими факторами риска клинические данные ограничены. У таких пациентов препарат должен применяться только в случаях, когда ожидаемая польза превышает риск кровотечения.
Переход от применения препарата ПРАДАКСА к парентеральному применению антикоагулянтов
Профилактика венозных тромбоэмболий у пациентов после ортопедических операций: парентеральное введение антикоагулянтов следует начинать через 24 ч после приема последней дозы препарата ПРАДАКСА.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: парентеральное применение антикоагулянтов следует начинать через 12 ч после приема последней дозы препарата ПРАДАКСА.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: парентеральное применение антикоагулянтов следует начинать через 12 ч после приема последней дозы препарата ПРАДАКСА.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: парентеральное применение антикоагулянтов следует начинать через 12 ч после приема последней дозы препарата ПРАДАКСА.
Переход от парентерального применения антикоагулянтов к применению препарата ПРАДАКСА
Первая доза препарата ПРАДАКСА назначается вместо отменяемого антикоагулянта в интервале 0-2 ч перед сроком очередной инъекции альтернативной терапии или одновременно с прекращением постоянной инфузии (например, внутривенного применения нефракционированного гепарина, НФГ).
Переход от применения антагонистов витамина К к применению препарата ПРАДАКСА
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: применение антагонистов витамина К прекращают, применение препарата ПРАДАКСА возможно при МНО <2,0.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: применение антагонистов витамина К прекращают, применение препарата ПРАДАКСА возможно при МНО <2,0.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: применение антагонистов витамина К прекращают, применение препарата ПРАДАКСА возможно при МНО <2,0.
Переход от применения препарата ПРАДАКСА к применению антагонистов витамина К
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: при клиренсе креатинина >50 мл/мин применение антагонистов витамина К возможно за 3 дня, а при клиренсе креатинина 30-50 мл/мин — за 2 дня до отмены препарата ПРАДАКСА.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: при клиренсе креатинина >50 мл/мин применение антагонистов витамина К возможно за 3 дня, а при клиренсе креатинина 30-50 мл/мин — за 2 дня до отмены препарата ПРАДАКСА.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: при клиренсе креатинина >50 мл/мин применение антагонистов витамина К возможно за 3 дня, а при клиренсе креатинина 30-50 мл/мин — за 2 дня до отмены препарата ПРАДАКСА.
Кардиоверсия
Профилактика инсульта, системных тромбоэмболии и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий
Проведение плановой или экстренной кардиоверсии не требует отмены терапии препарата ПРАДАКСА.
Пропущенная доза
Профилактика венозных тромбоэмболий у пациентов после ортопедических операций: рекомендуется принять обычную суточную дозу ПРАДАКСА в обычное время на следующий день. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: пропущенную дозу препарата ПРАДАКСА можно принять в том случае, если до приема очередной дозы препарата остается 6 ч и более; если срок составил менее 6 ч, пропущенную дозу принимать не следует. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: пропущенную дозу препарата ПРАДАКСА можно принять в том случае, если до приема очередной дозы препарата остается 6 ч и более; если срок составил менее 6 ч, пропущенную дозу принимать не следует. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: пропущенную дозу препарата ПРАДАКСА можно принять в том случае, если до приема очередной дозы препарата остается 6 ч и более; если срок составил менее 6 ч, пропущенную дозу принимать не следует. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Побочные эффекты:
Побочные эффекты, выявленные при применении препарата
— с целью профилактики ВТЭ после ортопедических операций;
— для профилактики инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий;
— для лечения острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями;
— для профилактики рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями.
Классификация побочных реакций по частоте развития (количество зарегистрированных случаев/количество пациентов): очень часто — до 1/10 случаев; часто — от 1/100 до 1/10 случаев; редко — от 1/1000 до 1/100 случаев; неизвестно — побочные эффекты из опыта использования не могут быть оценены на основе имеющихся данных; не применимо — побочный эффект не выявлен при применении по данному показанию.
|
Системно-органный класс/ Побочный эффект |
Показание |
|||
|
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий |
Профилактика венозных тромбоэмболий у пациентов после ортопедических операций |
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями |
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями |
|
|
Частота возникновения |
||||
|
Нарушения со стороны кроветворной и лимфатической системы: |
||||
|
анемия |
часто |
нечасто |
нечасто |
редко |
|
тромбоцитопения |
нечасто |
редко |
редко |
редко |
|
Нарушения со стороны иммунной системы: |
||||
|
реакции гиперчувствительности |
нечасто |
нечасто |
нечасто |
нечасто |
|
— крапивница |
редко |
редко |
редко |
редко |
|
— кожная сыпь |
нечасто |
редко |
нечасто |
нечасто |
|
— кожный зуд |
нечасто |
редко |
редко |
редко |
|
бронхоспазм |
неизвестно |
неизвестно |
неизвестно |
неизвестно |
|
ангионевротический отек |
редко |
редко |
редко |
редко |
|
анафилактические реакции |
неизвестно |
неизвестно |
неизвестно |
неизвестно |
|
Нарушения со стороны нервной системы: |
||||
|
внутричерепное кровотечение |
нечасто |
редко |
редко |
редко |
|
Нарушения со стороны сосудов: |
||||
|
гематома |
нечасто |
нечасто |
нечасто |
нечасто |
|
кровотечение |
нечасто |
редко |
нечасто |
нечасто |
|
Нарушения со стороны органов дыхания, грудной клетки и средостения: |
||||
|
носовое кровотечение |
часто |
нечасто |
часто |
часто |
|
кровохарканье |
нечасто |
редко |
нечасто |
нечасто |
|
Нарушения со стороны ЖКТ: |
||||
|
желудочно-кишечные кровотечения |
часто |
нечасто |
часто |
часто |
|
ректальные кровотечения |
нечасто |
нечасто |
часто |
часто |
|
геморроидальные кровотечения |
нечасто |
нечасто |
редко |
нечасто |
|
боль в животе |
часто |
редко |
нечасто |
нечасто |
|
диарея |
часто |
нечасто |
нечасто |
нечасто |
|
диспепсия |
часто |
редко |
часто |
часто |
|
тошнота |
часто |
нечасто |
нечасто |
нечасто |
|
изъязвление слизистой оболочки ЖКТ, в том числе язва пищевода |
нечасто |
редко |
нечасто |
редко |
|
гастроэзофагит |
нечасто |
редко |
нечасто |
нечасто |
|
гастроэзофагеальная рефлюксная болезнь |
нечасто |
редко |
нечасто |
нечасто |
|
рвота |
нечасто |
нечасто |
нечасто |
нечасто |
|
дисфагия |
нечасто |
редко |
редко |
редко |
|
Нарушения со стороны гепатобилиарной системы: |
||||
|
повышение активности «печеночных» трансаминаз |
редко |
нечасто |
нечасто |
нечасто |
|
нарушение функции печени |
нечасто |
часто |
нечасто |
нечасто |
|
гипербилирубинемия |
редко |
нечасто |
неизвестно |
неизвестно |
|
Изменения со стороны кожи и подкожных тканей: |
||||
|
кожный геморрагический синдром |
часто |
нечасто |
часто |
часто |
|
Скелетно-мышечные нарушения, нарушения со стороны соединительной ткани и костей: |
||||
|
гемартроз |
редко |
нечасто |
нечасто |
редко |
|
Изменения со стороны почек и мочевыводящих путей: |
||||
|
урогенитальные кровотечения |
часто |
нечасто |
часто |
часто |
|
гематурия |
часто |
нечасто |
часто |
часто |
|
Нарушения общего характера и изменения в месте проведения инъекций: |
||||
|
кровотечения из места инъекции |
редко |
редко |
редко |
редко |
|
кровотечения из места введения катетера |
редко |
редко |
редко |
редко |
|
Повреждения, токсичность и осложнения от процедур: |
||||
|
посттравматическое кровотечение |
редко |
нечасто |
нечасто |
редко |
|
кровотечения из места операционного доступа |
редко |
редко |
редко |
редко |
|
Дополнительные специфичные побочные эффекты, выявленные при профилактике венозных тромбоэмболий у пациентов, которым проведены ортопедические операции Нарушения со стороны сосудов: |
||||
|
кровотечение из операционной раны |
не применимо |
нечасто |
не применимо |
не применимо |
|
Общие расстройства и нарушения в месте введения: |
||||
|
Кровянистые выделения |
не применимо |
редко |
не применимо |
не применимо |
|
Повреждения, токсичность и осложнения послеоперационной обработки: |
||||
|
гематома после проведения обработки раны |
не применимо |
нечасто |
не применимо |
не применимо |
|
кровотечение после проведения обработки раны |
не применимо |
нечасто |
не применимо |
не применимо |
|
анемия в послеоперационном периоде |
не применимо |
редко |
не применимо |
не применимо |
|
выделения из раны после проведения процедур |
не применимо |
нечасто |
не применимо |
не применимо |
|
секреция из раны |
не применимо |
нечасто |
не применимо |
не применимо |
|
Хирургические и терапевтические процедуры: |
||||
|
дренаж раны |
не применимо |
редко |
не применимо |
не применимо |
|
дренаж после обработки раны |
не применимо |
редко |
не применимо |
не применимо |
Передозировка:
Передозировка при применении препарата ПРАДАКСАможет сопровождаться геморрагическими осложнениями, что обусловлено фармакодинамическими особенностями препарата. При возникновении кровотечения применение препарата прекращают.
Показано симптоматическое лечение.
Специфического антидота нет.
Учитывая основной путь выведения дабигатрана (почками), рекомендуется обеспечить адекватный диурез.
Проводят хирургический гемостаз и восполнение объема циркулирующей крови (ОЦК).
Возможно использование свежей цельной крови или переливание свежезамороженной плазмы.
Поскольку дабигатран обладает низкой способностью к связыванию с белками плазмы крови, препарат может выводиться при гемодиализе, однако клинический опыт по использованию диализа в этих ситуациях ограничен (см. раздел «Фармакокинетика»).
При передозировке препарата ПРАДАКСА возможно использование концентратов факторов свертывания (активированных или неактивированных) или рекомбинантного фактора VIIa. Существуют экспериментальные данные, подтверждающие эффективность этих средств в противодействие антикоагулянтному эффекту дабигатрана, однако специальных клинических исследований не проводилось.
В случае развития тромбоцитопении, или при применении антиагрегантов длительного действия, может быть рассмотрен вопрос о применении тромбоцитарной массы.
Для ситуаций, когда требуется быстрое устранение активности, существует специфический антидот дабигатрана (МНН: идаруцизумаб), являющийся антагонистом по отношению к фармакодинамическому действию препарата ПРАДАКСА.
Взаимодействие:
Совместное применение препарата ПРАДАКСА с лекарственными средствами, влияющими на гемостаз или систему коагуляции, включая нефракционированый гепарин, низкомолекулярный гепарин, ацетилсалициловую кислоту, нестероидные противовоспалительные препараты, антагонисты витамина К, может существенно повысить риск развития кровотечений.
Фармакокинетические взаимодействия
Дабигатрана этексилат и дабигатран не метаболизируются ферментами микросомального окисления печени, и не являются ни индукторами, ни ингибиторами активности изоферментами цитохрома Р450. Поэтому предполагается, что у дабигатрана отсутствуют клинически значимые фармакокинетические лекарственные взаимодействия с препаратами, метаболизм которых осуществляется изоферментами цитохрома Р450. В клинических исследованиях у здоровых добровольцев не выявлены какие-либо взаимодействия дабигатрана с аторвастатином (субстратCYP3A4) и диклофенаком (субстрат CYP2C9).
Взаимодействия с ингибиторами/индукторами Р-гликопротеина: субстратом для транспортной молекулы Р-гликопротеина является пролекарство дабигатрана этексилат, но не дабигатран. Поэтому проводилось изучение совместного применения с ингибиторами и индукторами транспортера Р-гликопротеина. Одновременное использование ингибиторов Р-гликопротеина (амиодарона, верапамила, хинидина, кетоконазола для системного применения, дронедарона, тикагрелора и кларитромицина) приводит к увеличению концентрации дабигатрана в плазме крови.
Одновременное применение с ингибиторами Р-гликопротеина: одновременное применение с такими ингибиторами Р-гликопротеина, как кетоконазол для системного применения, циклоспорин, итраконазол, такролимус и дронедарон противопоказано. Следует соблюдать осторожность при одновременном назначении с ингибиторами Р-гликопротеина (напр.: амиодарон, хинидин, верапамил и тикагрелор).
Амиодарон. При одновременном применении дабигатрана этексилата с однократной дозой амиодарона (600 мг), принимавшегося внутрь, степень и скорость всасывания амиодарона и активного его метаболита, дезэтиламиодарона, не изменялись. Значения AUC и Сmах дабигатрана увеличивались примерно в 1,6 и 1,5 раз (на 60% и 50%) соответственно.
В исследовании у пациентов с фибрилляцией предсердий концентрация дабигатрана увеличивалась не более чем на 14%, повышение риска кровотечений не было зарегистрировано. Рекомендуется наблюдение за пациентами, применяющими одновременно амиодарон и дабигатрана этексилат в отношении риска кровотечения, в особенности, при наличии почечной недостаточности (от слабой до умеренно выраженной).
Дронедарон. После одновременного применения дабигатрана этексилата и дронедарона в дозе 400 мг однократно, AUC0-∞ и Сmах дабигатрана увеличиваются в 2,1 и 1,9 раз (на 114% и 87%) соответственно, а после многократного применения дронедарона в дозе 400 мг в день — в 2,4 и 2,3 (на 136% и 125%) соответственно. После однократного и многократного применения дронедарона через 2 часа после приема дабигатрана этексилата AUC0-∞ возрастала в 1,3 и 1,6 раз, соответственно. Дронедарон не влиял на конечный Т1/2 и почечный клиренс дабигатрана. Одновременное применение препарата ПРАДАКСА® и дронедарона противопоказано.
Тикагрелор. После одновременного применения однократной дозы (75 мг) дабигатрана этексилата с нагрузочной дозой тикагрелора (180 мг) значения AUC0-∞ и Сmах дабигатрана увеличиваются в 1,73 и 1,95 раз (на 73% и 95%) соответственно. После многократного приема тикагрелора (90 мг два раза в день) это повышение воздействия дабигатрана (в отношении AUC0-∞ и Сmах) уменьшалось, соответственно, до 1,56 раза (до 56%) и до 1,46 раза (до 46%). Концентрация дабигатрана у здоровых добровольцев повышалась в 1,26 раз (до 26%) при совместном применении с тикагрелором в стационарном состоянии или в 1,49 раз (до 49%) при применении нагрузочной дозы тикагрелора с совместным применением дабигатрана этексилата, принимавшегося в дозе 110 мг два раза в сутки. Повышение концентрации было менее выраженным, если нагрузочная доза (180 мг) тикагрелора принималась через два часа после приема дабигатрана (до 27%). Совместное назначение нагрузочной дозы (180 мг) тикагрелора и 110 мг дабигатрана этексилата (в стационарном состоянии) увеличивало показатели AUCt,ss и Cmax,ss дабигатрана в 1,49 раз и 1,65 раз (+49% и 65%), соответственно, по сравнению с приемом только дабигатрана этексилата. Если нагрузочная доза 180 мг тикагрелора давалась через 2 часа после приема 110 мг дабигатрана этексилата (в стационарном состоянии), степень повышения AUCt,ss и Cmax,ss дабигатрана уменьшалась до 1,27-кратной и 1,24-кратной (+27% и 24%) соответственно, по сравнению с приемом только дабигатрана этексилата. Совместное назначение 90 мг тикагрелора х 2 раза в сутки (поддерживающая доза) со 100 мг дабигатрана этексилата повышала корректированные показатели AUCt,ss и Cmax,ss в 1,26 раз и в 1,29 раз соответственно по сравнению с приемом только дабигатрана этексилата.
Верапамил. При одновременном применении дабигатрана этексилата с верапамилом, назначавшимся перорально, значения Сmах и AUCдабигатрана увеличивались в зависимости от времени применения и лекарственной формы верапамила.
Наибольшее повышение эффекта дабигатрана наблюдалось при использовании первой дозы верапамила в лекарственной форме с немедленным высвобождением, которая применялась за 1 ч до приема дабигатрана этексилата (Сmах повысилась на 180%, a AUC — на 150%). При использовании лекарственной формы верапамила с замедленным высвобождением этот эффект прогрессивно снижался (Сmах повысилась на 90%, a AUC — на 70%), также как при использовании многократных доз верапамила (Сmах повысилась на 60%, a AUC — на 50%), что может объясняться индукцией Р-гликопротеина в ЖКТ при длительном применении верапамила.
При использовании верапамила через 2 ч после приема дабигатрана этексилата клинически значимых взаимодействий не наблюдалось (Сmах повышалась на 10%, a AUC — на 20%), поскольку через 2 ч дабигатран полностью всасывается (см. раздел «Способ применения и дозы»).
В исследовании у пациентов с фибрилляцией предсердий концентрация дабигатрана увеличивалась не более чем на 21%, повышение риска кровотечений не было зарегистрировано.
Данные о взаимодействии дабигатрана этексилата с верапамилом, введенным парентерально, отсутствуют; клинически значимого взаимодействия не ожидается.
Кетоконазол. Кетоконазол для системного применения после однократного назначения в дозе 400 мг увеличивает AUC0-∞ и дабигатрана примерно в 2,4 раза (на 138% и 135%) соответственно, а после многократного назначения кетоконазола в дозе 400 мг в день — примерно в 2,5 раза (на 153% и 149%) соответственно. Кетоконазол не влиял на Тmaх и конечный Т1/2. Одновременное применение препарата ПРАДАКСА® и кетоконазола для системного применения противопоказано.
Кларитромицин. При одновременном применении кларитромицина в дозе 500 мг 2 раза в день с дабигатрана этексилатом клинически значимого фармакокинетического взаимодействия не наблюдалось (Сmах повысилась на 15%, a AUC — на 19%).
Хинидин. Значения AUCt,ss и Cmax,ss дабигатрана при применении 2 раза в сутки в случае одновременного назначения с хинидином в дозе 200 мг каждые 2 ч до достижения суммарной дозы 1000 мг повышались в среднем, соответственно, на 53% и на 56%. Взаимодействие с итраконазолом, такролимусом и циклоспорином не изучалось, однако из данных in vitro можно ожидать схожего эффекта, как и от взаимодействия с кетоконазолом. Одновременное применение этих ингибиторов Р-гликопротеина противопоказано.
Одновременное применение с субстратами для Р-гликопротеина
Дигоксин. В исследовании, проведенном с участием 24 здоровых испытуемых, при одновременном назначении препарата ПРАДАКСА® с дигоксином не наблюдалось изменений концентрации дигоксина и клинически значимых изменений концентрации дабигатрана. При одновременном применении дабигатрана этексилата с дигоксином, являющимся субстратом Р-гликопротеина, фармакокинетического взаимодействия не наблюдалось. Ни дабигатран, ни пролекарство дабигатрана этексилат не являются клинически значимыми ингибиторами Р-гликопротеина.
Одновременное применение с индукторами Р-гликопротеина
Следует избегать одновременного назначения препарата ПРАДАКСА и индукторов Р-гликопротеина, поскольку совместное применение приводит к снижению воздействия дабигатрана (см. раздел «Особые указания»).
Рифампицин. Предварительное применение тест-индуктора рифампицина в дозе 600 мг в день в течение 7 дней приводило к снижению воздействия дабигатрана. После отмены рифампицина этот индуктивный эффект снижался, на 7 день эффект дабигатрана был близок к исходному уровню. В течение последующих 7 дней дальнейшего увеличения биодоступности дабигатрана не наблюдалось.
Через 7 дней лечения рифампицином в дозе 600 мг ежедневно ППК0-∞ и Сmах общего дабигатрана были снижены на 67% и 66% по сравнению с референсным лечением, соответственно.
Предполагается, что другие индукторы Р-гликопротеина, такие, как зверобой продырявленный или карбамазепин, могут также снижать концентрацию дабигатрана в плазме крови и должны применяться с осторожностью.
Одновременное применение с антиагрегантами
Совместное применение препарата ПРАДАКСА с лекарственными средствами, влияющими на гемостаз или систему коагуляции, включая нефракционированый гепарин, низкомолекулярный гепарин, ацетилсалициловую кислоту, нестероидные противовоспалительные препараты, антагонисты витамина К, может существенно повысить риск развития кровотечений.
Нефракционированный гепарин: можно применять в дозах, необходимых для поддержания проходимости центрального венозного или артериального катетера.
Ацетилсалициловая кислота (АСК). Эффект одновременного применения дабигатрана этексилата и АСК на риск развития кровотечений был изучен у пациентов с фибрилляцией предсердий в рандомизированном исследовании II фазы совместного применения с АСК.
При изучении одновременного применения дабигатрана этексилата в дозе 150 мг 2 раза в день и АСК у пациентов с фибрилляцией предсердий установлено, что риск кровотечений может повышаться с 12% до 18% (при использовании АСК в дозе 81 мг) и до 24% (при использовании АСК в дозе 325 мг).
НПВП. Применявшиеся НПВП (нестероидные противовоспалительные препараты) для краткосрочной анальгезии после операций не повышали риск кровотечений при одновременном использовании с дабигатрана этексилатом. Длительное применение НПВП увеличивало риск кровотечения примерно на 50%, как при совместном применении дабигатрана этексилата. так и варфарина.
Необходим тщательный контроль за признаками кровотечения, в связи с риском развития при совместном применении с НПВП (Т1/2 более 12 ч).
Низкомолекулярный гепарин: специальных исследований по одновременному применению дабигатрана этексилата и низкомолекулярных гепаринов, таких как эноксапарин, не проводилось.
Через 24 часа после 3-х дневного лечения (40 мг один раз в день) эноксапарином экспозиция дабигатрана была ниже, чем после приема разовой дозы 220 мг дабигатрана этексилата.
Высокая активность анти-FXa/FII наблюдалась после применения дабигатрана этексилата с эноксапарином по сравнению с лечением только дабигатрана этексилатом.
Считается, что это связано с действием эноксапарина и не имеет клинического значения. Другие тесты, связанные с антикоагулянтным действием дабигатрана, значительно не изменялись при предшествующем лечении эноксапарином.
Клопидогрел. Установлено, что одновременное применение дабигатрана этексилата и клопидогрела не приводит к дополнительному увеличению времени капиллярного кровотечения в сравнении с монотерапией клопидогрелом. Кроме того, показано, что значения AUCt,ss и Cmax,ss дабигатрана, а также параметры свертывания крови, которые контролировались для оценки эффекта дабигатрана (АЧТВ, экариновое время свертывания или тромбиновое время (анти FIIa), а также степень ингибирования агрегации тромбоцитов (основной показатель эффекта клопидогрела) во время комбинированной терапии не изменялись по сравнению с соответствующими показателями в монотерапии. При использовании «нагрузочной» дозы клопидогрела (300 или 600 мг) значения AUCt,ss и Cmax,ss дабигатрана повышались на 30-40%.
Одновременное применение с препаратами, повышающими pH содержимого желудка
Выявленные в ходе популяционного анализа изменения фармакокинетических параметров дабигатрана под влиянием ингибиторов протонной помпы и антацидных препаратов оказались клинически незначимыми, поскольку степень выраженности этих изменений была небольшой (снижение биодоступности не было значимым для антацидов, а для ингибиторов протонной помпы составляло 14,6%).
Установлено, что одновременное применение ингибиторов протонной помпы не сопровождается снижением концентрации дабигатрана и в среднем лишь незначительно снижает концентрацию препарата в плазме крови (на 11%). Поэтому одновременное применение ингибиторов протонной помпы, по-видимому, не ведет к повышению частоты инсульта или системных тромбоэмболий, особенно в сравнении с варфарином, и, следовательно, снижение биодоступности дабигатрана. вызываемое одновременным применением пантопразола, вероятно, не имеет клинической значимости.
Пантопразол. При совместном применении дабигатрана этексилата и пантопразола наблюдалось снижение AUC дабигатрана на 30%. Пантопразол и другие ингибиторы протонной помпы применялись совместно с дабигатрана этексилатом в клинических исследованиях, влияние на риск кровотечения или эффективность не наблюдалось.
Ранитидин. Ранитидин при применении одновременно с дабигатрана этексилатом, не оказывал значимого влияния на степень всасывания дабигатрана.
Особые указания:
Риск развития кровотечения
Применение препарата ПРАДАКСА, также как и других антикоагулянтов, рекомендуется с осторожностью при состояниях, характеризующихся повышенным риском кровотечений. Во время терапии препаратом ПРАДАКСА® возможно развитие кровотечений различной локализации. Снижение концентрации гемоглобина и/или гематокрита в крови, сопровождающееся снижением АД, является основанием для поиска источника кровотечения.
Лечение препаратом ПРАДАКСА не требует контроля антикоагулянтной активности. Тест для определения МНО применяться не должен, поскольку есть данные о ложном завышении уровня МНО.
Для выявления чрезмерной антикоагулянтной активности дабигатрана следует использовать тесты для определения тромбинового или экаринового времени свертывания. В случае, когда эти тесты не доступны, следует использовать тест для определения АЧТВ.
В исследовании RE-LY у пациентов с фибрилляцией предсердий превышение уровня АЧТВ в 2-3 раза выше границы нормы перед приемом очередной дозы препарата было ассоциировано с повышенным риском кровотечения.
В фармакокинетических исследованиях ПРАДАКСА показано, что у пациентов со сниженной функцией почек (в том числе у пожилых пациентов) наблюдается повышение экспозиции препарата. Применение препарата ПРАДАКСА противопоказано в случае выраженных нарушений функции почек (КК <30 мл/мин).
В случае развития острой почечной недостаточности препарат ПРАДАКСА следует отменить.
К повышению концентрации дагибатрана в плазме могут приводить следующие факторы: снижение функции почек (КК 30-50 мл/мин), возраст >75 лет, одновременное применение ингибитора Р-гликопротеина. Наличие одного или нескольких таких факторов может повышать риск кровотечения (см. раздел «Способ применения и дозы»).
Совместное применение препарата ПРАДАКСА с лекарственными средствами, влияющими на гемостаз или систему коагуляции, включая нефракционированый гепарин, низкомолекулярный гепарин, ацетилсалициловую кислоту, нестероидные противовоспалительные препараты, антагонисты витамина К, может существенно повысить риск развития кровотечений.
Не изучалось, но может повышать риск кровотечений одновременное применение препарата ПРАДАКСА со следующими препаратами: фондапаринукс натрия, тромболитические препараты, блокаторы гликопротеиновых GP IIb/IIIа рецепторов тромбоцитов, тиклопидин, декстран, ривароксабан и ингибиторы Р-гликопротеина (итраконазол, такролимус, циклоспорин, ритонавир, нелфинавир и саквинавир). Риск кровотечений может повышаться за счет фармакологического взаимодействия у пациентов, одновременно принимающих селективные ингибиторы обратного захвата серотонина или селективные ингибиторы обратного захвата норадреналина. Также риск кровотечений может повышаться при одновременном применении антиагрегантов и других антикоагулянтов.
Совместное применение дронедарона и дабигатрана противопоказано (см. раздел «Противопоказания»).
Одновременное применение тикагрелора может увеличивать воздействие дабигатрана и может приводить к фармакодинамическому взаимодействию, результатом которого может стать повышение риска кровотечений.
Профилактика венозных тромбоэмболий у пациентов после ортопедических операций
Установлено, что применение НПВП для кратковременной анестезии при хирургических вмешательствах одновременно с препаратом ПРАДАКСА не сопровождается повышенным риском кровотечений. Имеются ограниченные данные о регулярном применении НПВП (имеющих Т1/2 менее 12 ч) на фоне лечения препаратом ПРАДАКСА, данных о повышении риска кровотечений не получено.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий
Одновременное применение препарата ПРАДАКСА, антиагрегантов (включая АСК и клопидогрел) и НПВП увеличивает риск кровотечения. В особенности одновременное применение антиагрегантов или сильных ингибиторов Р-гликопротеина увеличивает риск больших кровотечений, в том числе желудочно-кишечных кровотечений, у пациентов в возрасте >75 лет. Если возникают клинические подозрения на кровотечение, рекомендуется проведение соответствующих исследований, таких как анализ кала на скрытую кровь или определения уровня гемоглобина (на предмет его снижения).
Применение фибринолитических препаратов может рассматриваться только в случае, если показатели ТВ, ЭВС или АЧТВ у пациента не превышают верхнюю границу нормы местного референсного диапазона.
При повышении риска кровотечений (например, при недавно проведенной биопсии или перенесенной обширной травме, бактериальном эндокардите) требуется контроль состояния пациента с целью своевременного обнаружения признаков кровотечения.
Взаимодействие с индукторами Р-гликопротеина
Применение внутрь совместно с ПРАДАКСА индуктора Р-гликопротеина рифампицина снижало концентрацию дабигатрана в плазме. Предполагается, что другие индукторы Р-гликопротеина, такие, как зверобой продырявленный или карбамазепин, могут также снижать концентрацию дабигатрана в плазме крови и должны применяться с осторожностью (см. раздел «Взаимодействие с другими лекарственными средствами»).
Хирургические операции и вмешательства
У пациентов, применяющих препарат ПРАДАКСА при проведении хирургических операций или инвазивных процедур, повышается риск кровотечений. Поэтому при проведении хирургических вмешательств следует отменить препарат ПРАДАКСА (см. также раздел «Фармакокинетика»).
Предоперационный период
Перед проведением инвазивных процедур или хирургических операций препарат ПРАДАКСА отменяют, по крайней мере, за 24 ч до их проведения. У пациентов с повышенным риском кровотечений или перед проведением обширных операций, требующих полного гемостаза, следует прекратить применение препарата ПРАДАКСА за 2-4 дня до операции. У пациентов с почечной недостаточностью клиренс дабигатрана может удлиняться.
При отмене препарата следует учитывать следующую информацию:
|
КК (мл/мин) |
Т1/2 |
Прекращение приема препарата перед плановой хирургической операцией |
|
|
Высокий риск кровотечения или проведение большой операции |
Стандартный риск |
||
|
≥80 |
~ 13 |
За 2 дня |
За 24 ч |
|
≥50 |
~ 15 |
За 2-3 дня |
За 1 -2 дня |
|
<80 |
|||
|
≥30 |
~ 18 |
За 4 дня |
За 2-3 дня |
|
<50 |
(>48 ч) |
Это следует принимать во внимание перед проведением любых процедур (см. также раздел «Фармакокинетика»).
Препарат ПРАДАКСА противопоказан пациентам с тяжелыми нарушениями функции почек (КК <30 мл/мин), но если препарат все же применяют, отменять его следует не менее чем за 5 дней до операции.
В случае необходимости проведения экстренного хирургического вмешательства прием препарата ПРАДАКСА необходимо временно прекратить. Хирургическое вмешательство, при наличии такой возможности, целесообразно выполнять не ранее, чем через 12 ч после последнего приема ПРАДАКСА. Если операция не может быть отложена, риск кровотечения может повышаться (в случае кардиоверсии см. «Способ применения и дозы»). В таком случае следует оценить соотношение риска кровотечения и необходимости экстренного проведения вмешательства.
Спинальная анестезия/эпидуральная анестезия/люмбальная пункция
Такие процедуры, как спинномозговая анестезия, могут потребовать полного восстановления гемостаза.
В случае травматичной или повторной спинномозговой пункции и длительного использования эпидурального катетера может повышаться риск развития спинномозгового кровотечения или эпидуральной гематомы. Первую дозу препарата ПРАДАКСА следует принимать не ранее, чем через 2 ч после удаления катетера. Необходим контроль состояния пациентов для исключения неврологических симптомов, которые могут быть обусловлены спинномозговым кровотечением или эпидуральной гематомой.
Период после проведения процедуры
Применение препарата ПРАДАКСА можно продолжить по достижении полного гемостаза.
В случае появления желудочно-кишечных симптомов рекомендуется принимать препарат ПРАДАКСА с пищей и/или с ингибитором протонной помпы типа пантопразола.
Влияние на способность управлять транспортными средствами и механизмами:
Влияние препарата ПРАДАКСА на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций не изучалось, но, учитывая, что применение препарата ПРАДАКСА может сопровождаться повышенным риском кровотечений, следует соблюдать осторожность при выполнении таких видов деятельности.
Форма выпуска/дозировка:
Капсулы, 75 мг, 110 мг и 150 мг.
Упаковка:
По 10 капсул в блистер с перфорацией из Аl/Аl фольги. 1, 3, 6 блистеров в пачку картонную с инструкцией по применению.
По 60 капсул во флакон из полипропилена, укупоренный пластиковой завинчивающейся крышкой с контролем вскрытия от детей, с влагопоглотителем.
Один флакон в пачку картонную с инструкцией по применению.
Мультиупаковка (для дозировок 110 мг, 150 мг): по 10 капсул в блистер с перфорацией из Аl/Аl. 6 блистеров в пачку картонную с инструкцией по применению.
По 3 пачки картонные в пленку из полипропилена.
Условия хранения:
Флакон: при температуре не выше 25°С.
Хранить флакон плотно укупоренным, для защиты от влаги.
После вскрытия флакона препарат использовать в течение 4 месяцев.
Блистеры: в сухом месте, при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности:
3 года.
Не использовать после истечения срока годности.
Условия отпуска
По рецепту
Производитель
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ, Binger Strasse 173, 55216 Ingelheim am Rhein, Germany, Германия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Берингер Ингельхайм Интернешнл ГмбХ
Купить Прадакса в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Прадакса® (Pradaxa®) инструкция по применению
📜 Инструкция по применению Прадакса®
💊 Состав препарата Прадакса®
✅ Применение препарата Прадакса®
📅 Условия хранения Прадакса®
⏳ Срок годности Прадакса®
Описание лекарственного препарата
Прадакса®
(Pradaxa®)
Основано на листке-вкладыше препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2021 года.
Дата обновления: 2023.09.05
Код ATX:
B01AE07
(Дабигатран этексилат)
Лекарственная форма
| Прадакса® |
Капс. 150 мг: 10, 30, 60 или 180 шт. рег. №: ЛП-(001907)-(РГ-RU) Предыдущий рег. №: ЛП-000872 |
Форма выпуска, упаковка и состав
препарата Прадакса®
Капсулы продолговатые, размер 0, крышка — непрозрачная, светло-синего цвета, корпус — непрозрачный, белого цвета; на крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R150»; цвет надпечатки — черный; содержимое капсул — желтоватые пеллеты.
Вспомогательные вещества: акации камедь, винная кислота крупнозернистая, винная кислота порошок, винная кислота кристаллическая, гипромеллоза 2910, диметикон, тальк, гипролоза (гидроксипропилцеллюлоза).
Состав капсульной оболочки: капсула из гидроксипропилметилцеллюлозы (ГПМЦ) с надпечаткой черными чернилами.
Состав ГПМЦ капсул: каррагинан (E407), калия хлорид, титана диоксид (E171), индигокармин (Е132), гипромеллоза (гидроксипропилметилцеллюлоза), вода очищенная.
Состав чернил черных: шеллак, бутанол, изопропанол, краситель железа оксид черный (E172), вода очищенная, пропиленгликоль, этанол безводный, аммиак водный, калия гидроксид.
10 шт. — блистеры с перфорацией (1) — пачки картонныех.
10 шт. — блистеры с перфорацией (3) — пачки картонныех.
10 шт. — блистеры с перфорацией (6) — пачки картонныех.
Мультиупаковка:
10 шт. — блистеры с перфорацией (6) — пачки картонныех (3) — пленка полипропиленовая.
х допускается наличие контроля первого вскрытия
Фармакологическое действие
Дабигатрана этексилат является низкомолекулярным, не обладающим фармакологической активностью предшественником активной формы дабигатрана. После приема внутрь дабигатрана этексилат быстро всасывается в ЖКТ и, путем гидролиза, катализируемого эстеразами, в печени и плазме крови превращается в дабигатран. Дабигатран является мощным конкурентным обратимым прямым ингибитором тромбина и основным активным веществом в плазме крови.
Т.к. тромбин (сериновая протеаза) в процессе коагуляции превращает фибриноген в фибрин, угнетение активности тромбина препятствует образованию тромба. Дабигатран оказывает ингибирующее воздействие на свободный тромбин, тромбин, связанный с фибриновым сгустком, и вызванную тромбином агрегацию тромбоцитов.
В экспериментальных исследованиях на различных моделях тромбоза in vivo и ex vivo подтверждено антитромботическое действие и антикоагулянтная активность дабигатрана после в/в введения и дабигатрана этексилата — после приема внутрь.
Установлена прямая корреляция между концентрацией дабигатрана в плазме крови и выраженностью антикоагулянтного эффекта. Дабигатран удлиняет АЧТВ, экариновое время свертывания (ЭВС) и тромбиновое время (ТВ).
Профилактика венозной тромбоэмболии (ВТЭ) после эндопротезирования крупных суставов
Результаты клинических исследований у пациентов, перенесших ортопедические операции — эндопротезирование коленного и тазобедренного суставов — подтвердили сохранение параметров гемостаза и эквивалентность применения дабигатрана этексилата в дозах 75 мг или 110 мг через 1-4 ч после операции и последующей поддерживающей дозы 150 мг или 220 мг 1 раз/сут в течение 6-10 дней (при операции на коленном суставе) и 28-35 дней (на тазобедренном суставе) по сравнению с эноксапарином в дозе 40 мг 1 раз/сут, который применяли накануне и после операции.
Показана эквивалентность антитромботического эффекта дабигатрана этексилата при применении в дозах 150 мг или 220 мг по сравнению с эноксапарином в дозе 40 мг/сут при оценке основной конечной точки, которая включает все случаи венозных тромбоэмболий и смертность от любых причин.
Профилактика инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий
При длительном, в среднем около 20 месяцев, применении у пациентов с фибрилляцией предсердий и с умеренным или высоким риском инсульта или системных тромбоэмболий было показано, что дабигатрана этексилат в дозе 110 мг, назначенный 2 раза/сут, не уступал варфарину по эффективности предотвращения инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий; также в группе дабигатрана было отмечено снижение риска внутричерепных кровотечений и общей частоты кровотечений. Применение препарата в более высокой дозе (150 мг 2 раза/сут) достоверно снижало риск ишемического и геморрагического инсультов, сердечно-сосудистой смертности, внутричерепных кровотечений и общей частоты кровотечений, по сравнению с варфарином. Меньшая доза дабигатрана характеризовалась существенно более низким риском больших кровотечений по сравнению с варфарином.
Чистый клинический эффект оценивался путем определения комбинированной конечной точки, включавшей частоту инсульта, системных тромбоэмболий, легочных тромбоэмболий, острого инфаркта миокарда, сердечно-сосудистой смертности и больших кровотечений.
Ежегодная частота перечисленных событий у пациентов, получавших дабигатрана этексилат, была ниже, чем у пациентов, получавших варфарин.
Изменения в лабораторных показателях функции печени у пациентов, получавших дабигатрана этексилат, отмечались со сравнимой или меньшей частотой по сравнению с пациентами, получавшими варфарин.
Дополнительное изучение дабигатрана этексилата в наблюдательных исследованиях у пациентов с фибрилляцией предсердий свидетельствует, что показатели эффективности и безопасности препарата в клинической практике соответствуют результатам рандомизированных исследований.
Результаты проспективного рандомизированного исследования RE-CIRCUIT продемонстрировали, что выполнение катетерной аблации у пациентов с пароксизмальной или персистирующей фибрилляцией предсердий, получающих непрерывный курс дабигатрана этексилата в дозе 150 мг (1 капсула) 2 раза/сут, характеризуется меньшим риском больших кровотечений в сравнении с пациентами, у которых процедура выполнялась на фоне непрерывного курса варфарина. Различий между группами сравнения в отношении частоты комбинированной конечной точки, включающей инсульты, системные эмболии или транзиторные ишемические атаки, выявлено не было.
Результаты открытого рандомизированного исследования RE-DUAL PCI продемонстрировали, что применение дабигатрана этексилата в дозе 150 мг 2 раза в сутки, либо в дозе 110 мг 2 раза в сутки в комбинации с клопидогрелом или тикагрелором у пациентов с неклапанной фибрилляцией предсердий, перенесших чрескожное коронарное вмешательство со стентированием, характеризуется меньшим риском развития первичной конечной точки (большие и клинически значимые кровотечения по классификации ISTH) в сравнении с комбинированной терапией, включающей в себя варфарин в сочетании с клопидогрелом или тикагрелором и АСК. При этом в отношении комбинированной конечной точки эффективности, включавшей в себя смерть, тромбоэмболические события (инфаркт миокарда, инсульт или системные эмболии), либо незапланированную реваскуляризацию, объединенная группа пациентов, получавших дабигатрана этексилат (обе дозы препарата) в комбинации с клопидогрелом или тикагрелором, не уступала по эффективности группе пациентов, получавших комбинированную терапию варфарином в сочетании с клопидогрелом или тикагрелором и АСК.
Профилактика тромбоэмболий у пациентов с протезированными клапанами сердца
В ходе клинических исследований фазы II применения дабигатрана и варфарина у пациентов, перенесших операцию по замене клапана сердца механическим протезом (недавно проведенные операции и операции, проведенные более 3 месяцев назад), было выявлено повышение частоты тромбоэмболий и общего числа кровотечений (преимущественно за счет малых кровотечений) у пациентов, получавших дабигатрана этексилат. В раннем послеоперационном периоде большие кровотечения в основном характеризовались геморрагическим выпотом в перикард, особенно у пациентов, которым дабигатрана этексилат был назначен в раннем периоде (на 3 день) после хирургической замены клапанов сердца
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями
Результаты клинических исследований у пациентов с наличием острого ТГВ и/или ТЭЛА, которые первоначально получали парентеральную терапию в течение, как минимум, 5 дней, подтвердили, что дабигатрана этексилат в дозе 150 мг, применяемый 2 раза/сут, не уступал варфарину по эффективности в отношении снижения частоты рецидивирующего симптоматического ТГВ и/или ТЭЛА и случаев смерти, обусловленных этими заболеваниями, на протяжении 6-месячного периода лечения. У пациентов, получавших дабигатрана этексилат, кровотечения отмечались значительно реже, чем у пациентов, получавших варфарин.
Частота развития инфаркта миокарда во всех проводимых исследованиях при ВТЭ во всех лечебных группах была низкой.
Показатели функции печени. В исследованиях с применением активных препаратов сравнения возможные изменения показателей функции печени возникали у пациентов, получавших дабигатрана этексилат, со сравнимой или меньшей частотой, чем у пациентов, получавших варфарин. В исследовании с плацебо существенного различия в отношении изменений показателей функции печени, возможно имеющих клиническое значение, между группами с применением дабигатрана этексилата и плацебо не отмечалось.
Профилактика рецидивирующего ТГВ и/или ТЭЛА и смертельных исходов, вызываемых этими заболеваниями
Результаты клинического исследования у пациентов с рецидивирующим ТГВ и ТЭЛА, уже получавших в течение от 3 до 12 месяцев антикоагулянтную терапию и нуждавшихся в ее продолжении, подтвердили, что лечение дабигатрана этексилатом в дозе 150 мг 2 раза/сут не уступало лечебному эффекту варфарина (р=0.0135). У пациентов, получавших дабигатрана этексилат, кровотечения отмечались значительно реже, чем у пациентов, получавших варфарин.
В исследовании сравнения дабигатрана этексилата с плацебо у пациентов, уже получавших в течение от 6 до 18 месяцев антагонисты витамина К, было установлено, что дабигатран превосходил плацебо в отношении профилактики рецидивирующего симптоматического ТГВ/ТЭЛА, включая случаи смерти от неустановленной причины; снижение риска за период лечения составило 92% (р<0.0001).
Частота развития инфаркта миокарда во всех проводимых исследованиях при ВТЭ во всех лечебных группах была низкой.
Показатели функции печени. В исследованиях с применением активных препаратов сравнения возможные изменения показателей функции печени возникали у пациентов, получавших дабигатрана этексилат, со сравнимой или меньшей частотой, чем у пациентов, получавших варфарин. В исследовании с плацебо существенного различия в отношении изменений показателей функции печени, возможно имеющих клиническое значение, между группами с применением дабигатрана этексилата и плацебо не отмечалось.
Фармакокинетика
После приема внутрь дабигатрана этексилат быстро и полностью превращается в дабигатран, который является активной формой в плазме крови. Расщепление пролекарства дабигатрана этексилата с помощью катализируемого эстеразой гидролиза до действующего вещества дабигатрана является преобладающей метаболической реакцией. Абсолютная биодоступность дабигатрана после приема внутрь препарата Прадакса® составляла приблизительно 6.5%.
После приема внутрь препарата Прадакса® у здоровых добровольцев фармакокинетический профиль дабигатрана в плазме крови характеризуется быстрым увеличением плазменных концентраций с достижением Cmax в течение 0.5 и 2.0 ч после приема препарата.
Всасывание
Исследование, в котором оценивали всасывание дабигатрана этексилата в послеоперационном периоде через 1-3 ч после хирургического вмешательства, показало относительно низкую скорость всасывания по сравнению с всасыванием у здоровых добровольцев, AUC характеризуется постепенным повышением амплитуды без появления высокого пика концентрации в плазме. Cmax в плазме крови достигается через 6 ч после применения препарата в послеоперационном периоде за счет влияния таких сопутствующих факторов, как анестезия, парез ЖКТ и выполнение хирургического вмешательства независимо от лекарственной формы препарата. Дальнейшее исследование показало, что медленное и отсроченное всасывание обычно наблюдается только в день хирургического вмешательства. В последующие дни всасывание дабигатрана происходит быстро, с достижением Cmax в плазме крови через 2 ч после приема препарата.
Прием пищи не влияет на биодоступность дабигатрана этексилата, но задерживает время достижения Cmax в плазме крови на 2 ч.
Cmax и AUC были пропорциональны дозе.
При пероральном приеме пеллет без гидроксипропилметилцеллюлозной (ГПМЦ) оболочки капсулы, биодоступность может возрастать на 75% после однократного приема и на 37% в равновесном состоянии по сравнению с биодоступностью при применении референсной капсульной лекарственной формы. Поэтому следует всегда сохранять целостность капсул из ГПМЦ при клиническом применении для предотвращения случайного повышения биодоступности дабигатрана этексилата (см. раздел «Режим дозирования»).
Распределение
Наблюдалась низкая (34-35%), независимая от концентрации степень связывания дабигатрана с белками плазмы крови. Vd дабигатрана составляет 60-70 л и превосходит объем общего содержания воды в организме, что указывает на умеренное распределение дабигатрана в тканях.
Метаболизм
Метаболизм и экскреция дабигатрана были изучены после однократного в/в введения меченого радиоактивным изотопом дабигатрана здоровым добровольцам мужского пола. После в/в введения меченый радиоактивным изотопом дабигатран выводился главным образом почками (85%). Экскреция через ЖКТ составила 6% введенной дозы. Установлено, что через 168 ч после введения меченого радиоактивного препарата 88-94% его дозы выводится из организма.
Дабигатран подвергается конъюгированию с образованием фармакологически активных ацилглюкуронидов. Существуют четыре позиционных изомера, 1-О, 2-О, 3-О, 4-О-ацилглюкуронид, каждый из которых составляет менее 10% общего содержания дабигатрана в плазме крови. Следы других метаболитов можно было обнаружить только с помощью высокочувствительных аналитических методов. Дабигатран выводится в основном в неизмененном виде с мочой со скоростью приблизительно 100 мл/мин, что соответствует скорости клубочковой фильтрации.
Выведение
Концентрация дабигатрана в плазме снижается биэкспоненциально со средним терминальным T1/2 11 ч у здоровых добровольцев пожилого возраста. После многократного применения терминальный T1/2 составлял около 12-14 ч. T1/2 не зависел от дозы. T1/2 удлиняется при нарушении функции почек.
Особые группы пациентов
Нарушение функции почек. В исследованиях I фазы экспозиция (AUC) дабигатрана после перорального приема препарата Прадакса® была приблизительно в 2.7 раза выше у добровольцев с умеренной почечной недостаточностью (КК 30-50 мл/мин) по сравнению с экспозицией дабигатрана у добровольцев без почечной недостаточности.
У небольшого количества добровольцев с тяжелой степенью почечной недостаточности (КК 10-30 мл/мин) экспозиция (AUC) дабигатрана была приблизительно в 6 раз выше, а T1/2 — приблизительно в 2 раза длиннее по сравнению с популяцией пациентов без почечной недостаточности.
Таблица 1. T1/2 общего дабигатрана у здоровых пациентов и у пациентов с нарушением функции почек
Кроме того, экспозиция дабигатрана (в момент достижения минимальной концентрации препарата в крови и в момент достижения Cmax препарата в крови) была оценена в проспективном открытом рандомизированном фармакокинетическом исследовании у пациентов с неклапанной ФП с тяжелым нарушением функции почек (определяемым как КК 15-30 мл/мин), которые получали дабигатрана этексилат 75 мг 2 раза/сут. Этот режим дозирования обеспечивал геометрическое среднее значение концентрации в момент достижения минимальной концентрации препарата в крови 155 нг/мл (gCV 76.9%) при измерении непосредственно перед приемом следующей дозы и геометрическое среднее значение Cmax 202 нг/мл (gCV 70.6%) при измерении через 2 ч после приема последней дозы.
Клиренс дабигатрана при гемодиализе исследовался у 7 пациентов с терминальной хронической почечной недостаточностью (ТХПН) без фибрилляции предсердий. Диализ проводили со скоростью потока диализата 700 мл/мин, с продолжительностью 4 часа и скоростью кровотока 200 мл/мин или 350-390 мл/мин. Это приводило к снижению концентрации дабигатрана на 50%-60% соответственно. Количество лекарственного средства, которое выводится с помощью диализа, пропорционально скорости кровотока при скорости кровотока до 300 мл/мин. Антикоагулянтная активность дабигатрана снижалась при уменьшении его концентрации в плазме крови, и процедура не влияла на фармакодинамические/фармакокинетические взаимосвязи.
Медиана КК в исследовании RE-LY составляла 68.4 мл/мин. Практически у половины (45.8%) пациентов в исследовании RE-LY КК составлял >50-<80 мл/мин. У пациентов с умеренным нарушением функции почек (КК 30-50 мл/мин) концентрации дабигатрана в плазме крови до и после приема дозы были в среднем соответственно в 2.29 раза и 1.81 раза выше по сравнению с пациентами без нарушения функции почек (КК ≥80 мл/мин).
Медиана КК в исследовании RE-COVER составляла 100.4 мл/мин. У 21.7% пациентов было легкое нарушение функции почек (КК >50-<80 мл/мин), и у 4.5% пациентов было умеренное нарушение функции почек (КК 30-50 мл/мин). У пациентов с легким и умеренным нарушением функции почек концентрации дабигатрана в плазме крови в равновесном состоянии перед приемом очередной дозы были в среднем соответственно в 1.8 раза и 3.6 раза выше по сравнению с пациентами с КК >80 мл/мин. Аналогичные значения для КК были обнаружены в исследовании RE-COVER II.
Медиана КК в исследованиях RE-MEDY и RE-SONATE составляла 99.0 мл/мин и 99.7 мл/мин соответственно. У 22.9% и 22/5% пациентов в исследованиях RE-MEDY и RE-SONATE КК составлял >50-<80 мл/мин, и у 4.1% и 4.8% пациентов КК составлял от 30 до 50 мл/мин.
Пожилые пациенты. В специальных фармакокинетических исследованиях I фазы у пациентов пожилого возраста наблюдалось увеличение AUC на 40%-60% и Cmax более чем на 25% по сравнению с молодыми пациентами.
Влияние возраста на экспозицию дабигатрана было подтверждено в исследовании RE-LY: с увеличением минимальной концентрации препарата в крови (перед приемом очередной дозы) примерно на 31% у пациентов в возрасте ≥75 лет и снижением примерно на 22% у пациентов в возрасте <65 лет по сравнению с минимальной концентрацией препарата в крови (перед приемом очередной дозы) у пациентов в возрасте от 65 до 75 лет.
Нарушение функции печени. Не наблюдалось изменений в концентрации дабигатрана у 12 пациентов с умеренной печеночной недостаточностью (класс В по Чайлд-Пью) по сравнению с 12 пациентами из группы контроля.
Масса тела. Концентрации дабигатрана в момент достижения минимальной концентрации препарата в крови были примерно на 20% ниже у пациентов с массой тела >100 кг по сравнению с пациентами с массой тела 50-100 кг. Большинство (80.8%) пациентов были в категории массы тела ≥50 кг и <100 кг, в пределах этого диапазона явных различий концентраций дабигатрана не установлено. Клинические данные в отношении пациентов с массой тела <50 кг ограничены.
Пол. Пациенты женского пола с фибрилляцией предсердий имели минимальную концентрацию препарата в крови и концентрацию препарата в крови после приема очередной дозы в среднем на 30% выше. Коррекция дозы не требуется.
Этнические группы. Не выявлено клинически значимых этнических различий в фармакокинетике и фармакодинамике дабигатрана среди пациентов европеоидной расы, афроамериканцев, латиноамериканцев, японцев или китайцев.
Фармакокинетическое взаимодействие
Исследования взаимодействия in vitro не показали ингибирования или индукции основных изоферментов цитохрома Р450. Это было подтверждено исследованиями in vivo с участием здоровых добровольцев, у которых не наблюдалось никакого взаимодействия между этим препаратом и следующими действующими веществами: аторвастатином (CYP3A4), дигоксином (взаимодействие с белком-переносчиком P-гликопротеина) и диклофенаком (CYP2C9).
Показания препарата
Прадакса®
- профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у взрослых пациентов с неклапанной фибрилляцией предсердий и одним или более факторами риска, такими как перенесенный инсульт или транзиторная ишемическая атака (ТИА), возраст ≥75 лет, хроническая сердечная недостаточность (≥II функционального класса по классификации NYHA), сахарный диабет, артериальная гипертензия, сосудистое заболевание (перенесенный инфаркт миокарда, заболевание периферических артерий или атеросклеротическая бляшка в аорте);
- лечение и профилактика рецидивов острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями.
Режим дозирования
Капсулы следует принимать внутрь, 1 или 2 раза/сут, независимо от времени приема пищи, запивая стаканом воды для облегчения прохождения препарата в желудок. Не следует вскрывать капсулу.
Для изъятия капсул из блистера:
- оторвать один индивидуальный блистер от блистер-упаковки по линии перфорации;
- вынуть капсулу из блистера, отслаивая фольгу;
- не выдавливать капсулы через фольгу.
Препарат назначают взрослым.
Препарат Прадакса® выпускается в капсулах 75 мг, 110 мг и 150 мг.
Таблица 2. Рекомендуемые дозы
Для показания лечение и профилактика рецидивов острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями — рекомендация по использованию дозы препарата 220 мг (1 капсула по 110 мг 2 раза/сут) основана на фармакокинетических и фармакодинамических данных, данные клинических исследований отсутствуют.
Оценка функции почек до и во время терапии препаратом Прадакса®
Для всех пациентов, особенно у пожилых (>75 лет), поскольку почечная недостаточность может быть частой в этой возрастной группе:
- перед терапией, во избежание назначения препарата пациентам с тяжелыми нарушениями функции почек (КК <30 мл/мин), необходимо предварительно оценить КК;
- функцию почек следует оценивать в процессе лечения, когда возникает подозрение о возможном снижении или ухудшении функции почек (например, при гиповолемии, дегидратации, одновременном применении определенных лекарственных препаратов).
Дополнительные требования для пациентов с легкой и умеренной почечной недостаточностью и у пациентов старше 75 лет. При терапии препаратом Прадакса® функцию почек следует оценивать как минимум 1 раз в год или чаще, в зависимости от клинической ситуации, когда возникает подозрение о возможном снижении или ухудшении функции почек (например, при гиповолемии, дегидратации, одновременном применении определенных лекарственных препаратов).
В качестве метода оценки функции почек используется расчет КК по формуле Кокрофта-Голта (Cockroft-Gault method).
Длительность применения
Длительность применения препарата Прадакса® для профилактики инсульта при ФП, ТГВ и ТЭЛА приведена в таблице 3.
Таблица 3. Длительность применения для профилактики инсульта при ФП и ТГВ/ТЭЛА
Пропущенная доза
Пропущенную дозу препарата Прадакса® можно принять в том случае, если до приема очередной дозы препарата остается 6 ч и более; если срок составил менее 6 ч, пропущенную дозу принимать не следует. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Отмена препарата Прадакса®
Лечение препаратом Прадакса® не должно быть прекращено без медицинской консультации. Пациенты должны быть проинструктированы обращаться к лечащему врачу, если у них развиваются желудочно-кишечные симптомы, такие как диспепсия.
Изменение антикоагулянтной терапии
Переход от применения препарата Прадакса® к парентеральному применению антикоагулянтов. Парентеральное применение антикоагулянтов следует начинать через 12 ч после приема последней дозы препарата Прадакса® (см. раздел «Лекарственное взаимодействие»).
Переход от парентерального применения антикоагулянтов к применению препарата Прадакса®. Первая доза препарата Прадакса® назначается вместо отменяемого антикоагулянта в интервале 0-2 ч перед временем введения его очередной дозы или одновременно с прекращением в случае непрерывного введения (например, в/в введения нефракционированного гепарина, НФГ).
Переход от применения препарата Прадакса® к применению антагонистов витамина К. При КК≥ 50 мл/мин прием антагонистов витамина К может быть начат за 3 дня, а при КК ≥30-<50 мл/мин — за 2 дня до отмены препарата Прадакса®. Поскольку препарат Прадакса® может влиять на МНО, МНО будет лучше отражать эффект антагонистов витамина К только спустя не менее 2 дней после отмены препарата Прадакса®. До этого значения МНО должны быть интерпретированы с осторожностью
Переход от применения антагонистов витамина К к применению препарата Прадакса®. Применение антагонистов витамина К прекращают, применение препарата Прадакса® возможно при МНО <2.0.
Кардиоверсия
Проведение плановой или экстренной кардиоверсии не требует отмены терапии препаратом Прадакса®.
Катетерная аблация при фибрилляции предсердий
Катетерная аблация может быть проведена у пациентов, применяющих препарат Прадакса® по 150 мг (1 капсула) 2 раза/сут. Выполнение катетерной аблации не требует перерыва в приеме препарата Прадакса®.
Чрескожные коронарные вмешательства (ЧКВ) со стентированием коронарных артерий
У пациентов с неклапанной фибрилляцией предсердий, которым выполнено ЧКВ со стентированием коронарных артерий, дабигатрана этексилат может применяться в комбинации с антитромбоцитарными препаратами. Лечение дабигатрана этексилатом может быть начато после достижения гемостаза.
Применение в особых группах пациентов
Применение у пожилых пациентов. Принципы выбора дозы препарата у пожилых пациентов указаны в таблице 2.
Применение у пациентов с повышенным риском кровотечений. Пациентам с повышенным риском кровотечения показано тщательное клиническое наблюдение (на предмет выявления признаков кровотечений или анемии). Решение о выборе дозы препарата принимается по усмотрению врача на основании оценки потенциальной пользы и риска для пациентов (см. таблицу 2). Оценка параметров коагуляции (см. раздел «Особые указания») может помочь выявить пациентов с повышенным риском кровотечения, вызванным чрезмерным воздействием дабигатрана. Если у пациентов с высоким риском кровотечения выявлено чрезмерное воздействие дабигатрана, рекомендуется уменьшить дозу до 220 мг (1 капсула по 110 мг 2 раза/сут). Когда возникает клинически значимое кровотечение, лечение следует прервать
У пациентов с гастритом, эзофагитом или гастроэзофагеальной рефлюксной болезнью может быть рассмотрено снижение дозы из-за повышенного риска желудочно-кишечного кровотечения (см. таблицу 2 и раздел «Особые указания»).
Нарушение функции почек. Терапия препаратом Прадакса® у пациентов с тяжелым нарушением функции почек (КК <30 мл/мин) противопоказана.
Коррекции дозы не требуется у пациентов с легким нарушением функции почек (КК 50-<80 мл/мин). Для пациентов с умеренным нарушением функции почек (КК 30-50 мл/мин) рекомендуемая доза препарата Прадакса® также составляет 300 мг (1 капсула по 150 мг 2 раза/сут). Тем не менее, для пациентов с высоким риском кровотечения может быть рассмотрена возможность снижения дозы препарата Прадакса® до 220 мг (1 капсула по 110 мг 2 раза/сут). У пациентов с нарушением функции почек рекомендуется тщательное клиническое наблюдение.
Одновременное применение препарата Прадакса® с активными ингибиторами Р-гликопротеина (такими как амиодарон, хинидин, верапамил). При одновременном применении амиодарона или хинидина коррекции дозы не требуется. Снижение дозы рекомендуется для пациентов, которые одновременно получают верапамил (см. Таблицу 2 и разделы «Особые указания», «Лекарственное взаимодействие»). В этой ситуации препарат Прадакса® и верапамил следует принимать одновременно.
Влияние массы тела. В соответствии с фармакокинетическими и клиническими данными коррекции дозы не требуется. Однако за пациентами с массой тела менее 50 кг рекомендуется клиническое наблюдение.
Применение у детей. У пациентов в возрасте до 18 лет эффективность и безопасность препарата Прадакса® не изучались, поэтому применение у детей не рекомендуется.
Побочное действие
Побочные эффекты, выявленные при применении препарата:
- с целью профилактики ВТЭ после ортопедических операций;
- для профилактики инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий;
- для лечения острого ТГВ и/или ТЭЛА и профилактика смертельных исходов, вызываемых этими заболеваниями;
- для профилактики рецидивирующего ТГВ и/или ТЭЛА и смертельных исходов, вызываемых этими заболеваниями.
Классификация побочных реакций по частоте развития (количество зарегистрированных случаев/количество пациентов): очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10 000, <1/1000), очень редко (<1/10 000), неизвестно (побочные эффекты не могут быть оценены на основании имеющихся данных), не применимо (побочный эффект не выявлен при применении по данному показанию).
Таблица 4.
Противопоказания к применению
- известная чувствительность к дабигатрану или дабигатрану этексилату или к любому из вспомогательных веществ;
- почечная недостаточность тяжелой степени (КК <30 мл/мин);
- активное клинически значимое кровотечение;
- поражение органов в результате клинически значимого кровотечения, включая геморрагический инсульт в течение предыдущих 6 мес до начала терапии;
- наличие состояний, при которых повышен риск больших кровотечений, в т.ч. имеющиеся или недавние изъязвления ЖКТ, наличие злокачественных образований с высоким риском кровотечения, недавнее повреждение головного или спинного мозга, недавняя операция на головном или спинном мозге или офтальмологическая операция, недавнее внутричерепное кровоизлияние, наличие или подозрение на варикозно-расширенные вены пищевода, врожденные артериовенозные дефекты, сосудистые аневризмы или большие внутрипозвоночные или внутримозговые сосудистые аномалии;
- одновременное назначение любых других антикоагулянтов, в т.ч. нефракционированного гепарина, низкомолекулярных гепаринов (включая эноксапарин, далтепарину), производные гепарина(включая фондапаринукс), пероральных антикоагулянтов (включая варфарин, ривароксабан, апиксабан), за исключением случаев перехода лечения с или на препарат Прадакса® или в случае применения нефракционированного гепарина в дозах, необходимых для поддержания центрального венозного или артериального катетера или при выполнении катетерной аблации при фибрилляции предсердий;
- одновременное назначение мощных ингибиторов P-гликопротеина: кетоконазола для системного применения, циклоспорина, итраконазола, такролимуса и дронедарона;
- нарушения функции печени и заболевания печени, которые могут повлиять на выживаемость;
- наличие протезированного клапана сердца при необходимости антикоагулянтной терапии;
- возраст до 18 лет (клинические данные отсутствуют).
С осторожностью
Таблица 5. Факторы риска, которые могут повышать риск кровотечения
Применение при беременности и кормлении грудью
Данные о применении дабигатрана этексилата при беременности отсутствуют. Потенциальный риск у человека неизвестен.
В экспериментальных исследованиях не установлено неблагоприятного воздействия на фертильность или постнатальное развитие новорожденных.
Женщинам репродуктивного возраста следует избегать наступления беременности при лечении препаратом Прадакса®. При наступлении беременности применение препарата не рекомендуется, за исключением случаев, когда ожидаемая польза превышает возможный риск.
При необходимости применения препарата в период грудного вскармливания, в связи с отсутствием клинических данных, грудное вскармливание рекомендуется прекратить (в качестве меры предосторожности).
Применение при нарушениях функции печени
Противопоказано применение препарата при нарушениях функции печени и заболеваниях печени, которые могут повлиять на выживаемость.
Применение при нарушениях функции почек
Применение препарата при почечной недостаточности тяжелой степени (КК <30 мл/мин) противопоказано.
С осторожностью следует назначать препарат при умеренном снижении функции почек (КК 30-50 мл/мин).
Применение у детей
У пациентов в возрасте до 18 лет эффективность и безопасность препарата Прадакса® не изучали, поэтому применение у детей не рекомендуется.
Применение у пожилых пациентов
С осторожностью следует назначать препарат пациентам в возрасте старше 75 лет.
В связи с тем, что повышение экспозиции препарата у пожилых больных (старше 75 лет) часто обусловлено снижением функции почек, перед назначением препарата необходимо оценить функцию почек. Почечная функция должна оцениваться как минимум 1 раз в год или чаще, в зависимости от клинической ситуации. Коррекцию дозы препарата следует проводить в зависимости от тяжести нарушений функции почек.
Особые указания
Риск развития кровотечений
Применение препарата Прадакса®, также как и других антикоагулянтов, рекомендуется с осторожностью при состояниях, характеризующихся повышенным риском кровотечений. Во время терапии препаратом Прадакса® возможно развитие кровотечений различной локализации. Снижение уровня гемоглобина и/или гематокрита по невыясненным причинам, или снижение АД является основанием для поиска источника кровотечения.
В ситуациях опасного для жизни или неконтролируемого кровотечения, когда требуется быстрое прекращение антикоагулянтного эффекта дабигатрана, доступен специфический антагонист Праксбайнд® (идаруцизумаб) (см. раздел «Передозировка»).
В клинических исследованиях применение препарата Прадакса® было связано с повышением частоты больших желудочно-кишечных кровотечений. Повышенный риск наблюдался у пациентов пожилого возраста (≥75 лет) при применении препарата Прадакса® в дозе 150 мг 2 раза/сут. Дополнительные факторы риска включают одновременное применение ингибиторов агрегации тромбоцитов, например, клопидогрела и АСК или НПВП, а также наличие эзофагита, гастрита или гастроэзофагеальной рефлюксной болезни.
Тщательное клиническое наблюдение
Тщательное наблюдение в отношении признаков кровотечения или анемии рекомендуется на протяжении всего периода лечения, особенно если присутствуют сразу несколько факторов риска. Особую осторожность следует соблюдать, когда препарат Прадакса® назначается одновременно с верапамилом, амиодароном, хинидином или кларитромицином (ингибиторы Р-гликопротеина) и в частности при возникновении кровотечения, особенно у пациентов, имеющих легкое или умеренное нарушение функции почек.
Тщательное наблюдение в отношении признаков кровотечения рекомендуется у пациентов, одновременно получающих НПВП.
Прекращение приема препарата
При развитии острой почечной недостаточности прием препарата Прадакса® необходимо прекратить.
При развитии тяжелого кровотечения лечение необходимо прекратить, начать поиск источника кровотечения и рассмотреть возможность применения специфического антагониста — препарата Праксбайнд® (идаруцизумаб).
Снижение дозы
Снижение дозы должно рассматриваться или рекомендоваться, как описано в разделе «Режим дозирования».
Применение ингибиторов протонового насоса
Возможно назначение ингибиторов протонового насоса (ИПН) для профилактики желудочно-кишечных кровотечений.
Лабораторные показатели свертывания крови
Несмотря на то, что препарат Прадакса® в целом не требует регулярного антикоагулянтного мониторинга, измерение антикоагулянтного эффекта, связанного с дабигатраном, может быть полезным для обнаружения чрезмерно высокой экспозиции дабигатрана при наличии дополнительных факторов риска.
Разведенное тромбиновое время (рТВ), экариновое время свертывания (ЭВС) и активированное частичное тромбопластиновое время (АЧТВ) могут предоставить полезную информацию, но их значения следует интерпретировать с осторожностью из-за вариабельности результатов, полученных разными методами анализа. Значение МНО является недостоверным у пациентов, принимающих препарат Прадакса®, и были описаны случаи ложноположительного повышения МНО. Поэтому измерение МНО проводить не следует.
Таблица 6. Пороговые значения коагуляционных тестов в момент достижения минимальной концентрации препарата в крови, которые могут быть ассоциированы с повышенным риском кровотечений
Применение фибринолитических препаратов для лечения острого ишемического инсульта
Применение фибринолитических препаратов для лечения острого ишемического инсульта может быть рассмотрено, если результаты измерения рТВ, ЭВС или АЧТВ у пациента не превышают ВГН в соответствии с местным референсным диапазоном.
Хирургические вмешательства и инвазивные процедуры
Пациенты, которые принимают препарат Прадакса®, имеют повышенный риск кровотечения при выполнении хирургических или инвазивных процедур. Выполнение хирургического вмешательства может потребовать временного прекращения приема препарата Прадакса®.
Проведение кардиоверсии не требует перерыва в приеме препарата Прадакса®.
Выполнение катетерной аблации при фибрилляции предсердий у пациентов, получающих препарат Прадакса® в дозе 150 мг (1 капсула) 2 раза/сут, не требует перерыва в приеме препарата (см. раздел «Режим дозирования»).
Следует проявлять осторожность при временном прекращении лечения для выполнения хирургического вмешательства и обеспечить мониторинг антикоагуляции. Выведение дабигатрана из организма у пациентов с почечной недостаточностью может быть более длительным (см. раздел «Фармакокинетика»). Это следует учитывать при выполнении любых процедур. В таких случаях коагуляционные тесты могут помочь определить, сохраняются ли нарушения гемостаза.
Экстренные хирургические вмешательства и процедуры
Препарат Прадакса® следует временно отменить. Если для выполнения вмешательства/процедуры требуется быстрое прекращение антикоагулянтного эффекта, следует рассмотреть возможность введения специфического антагониста к препарату Прадакса®, препарата Праксбайнд® (идаруцизумаб).
Прекращение терапии дабигатраном подвергает пациентов тромботическому риску, связанному с их основным заболеванием. Прием препарата Прадакса® может быть возобновлен через 24 ч после введения специфического антагониста к дабигатрану Праксбайнд® (идаруцизумаб) при условии достижения полного гемостаза и стабильного состояния пациента.
Срочные хирургические вмешательства/процедуры
Препарат Прадакса® следует временно отменить. Срочное хирургическое вмешательство или процедуру, при наличии такой возможности, целесообразно выполнять не ранее, чем через 12 ч после последнего приема препарата Прадакса®. Если операция или процедура не может быть отложена, ее выполнение у пациента, получающего дабигатран, может быть ассоциировано с повышенным риском кровотечения. Этот риск кровотечения следует сопоставить со срочностью вмешательства.
Плановые хирургические вмешательства
Если возможно, препарат Прадакса® следует отменить по крайней мере за 24 ч до выполнения инвазивных или хирургических процедур. У пациентов с повышенным риском кровотечения или при обширном хирургическом вмешательстве, где может потребоваться полный гемостаз, следует рассмотреть возможность отмены препарата Прадакса® за 2-4 дня до хирургического вмешательства.
Таблица 7. Правила отмены препарата Прадакса® перед инвазивными или хирургическими процедурами
Спинальная анестезия/эпидуральная анестезия/люмбальная пункция
Такие процедуры, как спинномозговая анестезия, могут потребовать полного восстановления гемостаза.
В случае травматичной или повторной спинномозговой пункции и длительного использования эпидурального катетера может повышаться риск развития спинномозгового кровотечения или эпидуральной гематомы. Первую дозу препарата Прадакса® следует принимать не ранее, чем через 2 ч после удаления катетера. Необходим контроль состояния пациентов для исключения неврологических симптомов, которые могут быть обусловлены спинномозговым кровотечением или эпидуральной гематомой.
Послеоперационная фаза
После инвазивной процедуры/хирургического вмешательства прием препарата Прадакса® следует возобновить/начать как можно быстрее, если это позволяет клиническая ситуация и достигнут адекватный гемостаз.
У пациентов с риском кровотечения или имеющих риск чрезмерной экспозиции препарата, особенно у пациентов с умеренным нарушением функции почек (КК 30-50 мл/мин), терапию следует проводить с осторожностью.
Пациенты с высоким риском хирургической смертности и внутренними факторами риска тромбоэмболических осложнений
Данные по эффективности и безопасности препарата Прадакса® в данной группе пациентов ограничены, поэтому терапию следует проводить с осторожностью.
Нарушение функции печени
Пациенты с повышением активности печеночных ферментов >2 ВГН были исключены из основных клинических исследований. Опыта применения препарата Прадакса® в этой подгруппе пациентов нет. Нарушение функции печени или заболевание печени, которое, как ожидается, может повлиять на выживаемость, является противопоказанием для применения препарата Прадакса® (см. раздел «Противопоказания»).
Взаимодействие с индукторами Р-гликопротеина
Ожидается, что одновременное назначение индукторов Р-гликопротеина приведет к снижению концентраций дабигатрана в плазме крови, и их одновременного применения следует избегать.
Пациенты с антифосфолипидным синдромом
У пациентов с антифосфолипидным синдромом (особенно при тройном положительном результате на антифосфолипидные антитела) повышен риск тромбоэмболических событий. Несмотря на то, что эффективность препарата Прадакса® установлена для лечения и профилактики венозной тромбоэмболии, она не была изучена конкретно в подгруппе пациентов с антифосфолипидным синдромом. Поэтому перед применением препарата Прадакса® у пациентов с антифосфолипидным синдромом рекомендуется тщательно рассмотреть все возможные варианты лечения (включая стандартное лечение, такое как антагонистами витамина К).
Пациенты с активными злокачественными новообразованиями (ТГВ/ТЭЛА)
Эффективность и безопасность применения препарата Прадакса® для лечения ТГВ/ТЭЛА у пациентов с активными злокачественными новообразованиями не установлены.
Влияние на способность к управлению транспортными средствами и механизмами
Влияние препарата Прадакса® на способность к управлению транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не изучалось, но учитывая, что применение препарата Прадакса® может сопровождаться повышенным риском кровотечений, следует соблюдать осторожность при таких видах деятельности.
Передозировка
Дозы препарата Прадакса®, превышающие рекомендуемые, приводят к повышению риска кровотечения у пациента.
В случае подозрения на передозировку коагуляционные тесты могут помочь определить риск кровотечения. Калиброванный количественный тест (рТВ) или повторные измерения рТВ дают возможность прогнозировать время, когда будут достигнуты определенные уровни дабигатрана, также в качестве дополнительной меры можно начать диализ.
Чрезмерная антикоагуляция может потребовать временного прекращения лечения препаратом Прадакса®. Поскольку дабигатран в основном выводится почками, следует поддерживать адекватный диурез. В связи с тем, что степень связывания с белками плазмы крови низкая, дабигатран может выводиться с помощью диализа; клинический опыт, демонстрирующий пользу применения диализа в клинических исследованиях, ограничен (см. раздел «Фармакокинетика»).
Лечение кровотечений
В случае геморрагических осложнений лечение препаратом Прадакса® следует прекратить и установить источник кровотечения. В зависимости от клинической ситуации следует использовать соответствующие поддерживающие методы лечения, например, хирургический гемостаз или восстановление ОЦК, по решению врача.
Для ситуаций, когда требуется быстрое устранение антикоагулянтной активности, существует специфический антагонист фармакодинамического действия дабигатрана, препарат Праксбайнд® (идаруцизумаб), введение которого позволяет нейтрализовать антикоагулянтный эффект препарата Прадакса®.
Можно рассмотреть целесообразность применения концентратов факторов свертывания крови (активированных или не активированных) или рекомбинантного фактора VIIa. Имеются некоторые экспериментальные данные, свидетельствующие о возможности их применения для прекращения антикоагулянтного эффекта дабигатрана, но данные относительно их пользы в клинических ситуациях, а также относительно возможного риска рикошетной тромбоэмболии очень ограничены. Результаты коагуляционных тестов могут стать недостоверными после применения предлагаемых концентратов факторов свертывания крови. Следует соблюдать осторожность при интерпретации этих тестов. Также следует соблюдать осторожность при применении концентратов тромбоцитов при наличии тромбоцитопении или применении антиагрегантных лекарственных средств длительного действия. Все симптоматическое лечение проводят по решению врача.
В случае значительного кровотечения следует рассмотреть вопрос о консультации специалиста по гемостазу (при наличии данного специалиста).
Лекарственное взаимодействие
Взаимодействие с белками-переносчиками
Дабигатрана этексилат является субстратом эффлюксного белка-переносчика Р-гликопротеина. Ожидается, что одновременное назначение ингибиторов Р-гликопротеина приводит к повышению концентраций дабигатрана в плазме крови.
Если не указано иное, при одновременном применении дабигатрана и мощных ингибиторов Р-гликопротеина необходимо тщательное клиническое наблюдение (в отношении признаков кровотечения или анемии). При одновременном применении дабигатрана с некоторыми ингибиторами Р-гликопротеина может потребоваться снижение дозы.
Таблица 8. Взаимодействие с белками-переносчиками
Антикоагулянты и лекарственные средства, которые ингибируют агрегацию тромбоцитов
Лекарственные средства, терапия которыми не исследовалась или опыт применения которых ограничен, и которые могут повысить риск кровотечений при одновременном применении с препаратом Прадакса®: антикоагулянты, такие как нефракционированный гепарин (НФГ), низкомолекулярные гепарины (НМГ) и производные гепарина (фондапаринукс, дезирудин), тромболитические лекарственные препараты и антагонисты витамина К, ривароксабан или другие пероральные антикоагулянты (см. раздел «Противопоказания»), а также лекарственные средства, которые ингибируют агрегацию тромбоцитов, такие как антагонисты рецепторов GPIIb/IIIa, тиклопидин, прасугрел, тикагрелор, декстран и сульфинпиразон (см. раздел «Особые указания»).
На основании данных, собранных в исследовании III фазы RE-LY, было отмечено, что сопутствующее использование других пероральных или парентеральных антикоагулянтов увеличивает частоту больших кровотечений при лечении как дабигатрана этексилатом, так и варфарином приблизительно в 2.5 раза, главным образом, при переводе с одного антикоагулянта на другой (см. раздел «Противопоказания»). Кроме того, сопутствующее применение антиагрегантов, АСК или клопидогрела приблизительно удваивало частоту больших кровотечений при лечении как дабигатрана этексилатом, так и варфарином (см. раздел «Особые указания»).
НФГ можно применять в дозах, необходимых для поддержания проходимости центрального венозного или артериального катетера (см. раздел «Противопоказания»).
Таблица 9. Взаимодействия с антикоагулянтами и лекарственными средствами, которые ингибируют агрегацию тромбоцитов
Другое взаимодействие
Таблица 10. Другое взаимодействие
Взаимодействие, связанное с метаболическим профилем дабигатрана этексилата и дабигатрана
Дабигатрана этексилат и дабигатран не метаболизируются системой цитохрома Р450 и не оказывают in vitro никакого влияния на ферменты цитохрома Р450. Поэтому взаимодействие дабигатрана с соответствующими лекарственными средствами не ожидается.
Условия хранения препарата Прадакса®
Препарат следует хранить в оригинальной упаковке для защиты от влаги, при температуре не выше 25°С.
Срок годности препарата Прадакса®
Срок годности — 3 года. Не использовать после истечения срока годности.
Не помещать капсулы в таблетницы и органайзеры для лекарств, за исключением тех, в которых они могут оставаться в оригинальной упаковке (блистере).
Препарат следует хранить в недоступном для детей месте.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЕШНЛ ГМБХ
(Германия)
|
|
ООО «Берингер Ингельхайм» |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Каждая капсула содержит 86,48 мг или 126,83 мг дабигатрана этексилата мезилата, что соответствует 75 мг или 110 мг дабигатрана этексилата.
Вспомогательные вещества
Содержимое капсул: акации камедь, винная кислота крупнозернистая, винная кислота порошок, винная кислота кристаллическая, гипромеллоза, диметикон, тальк, гидроксипропилцеллюлоза.
Капсульная оболочка: капсула из гипромеллозы с надпечаткой черными чернилами.
Состав капсульной оболочки (капсулы 75 мг): каррагинан (Е407), калия хлорид, титана диоксид (Е171), гипромеллоза, вода очищенная.
Состав капсульной оболочки (капсулы 110 мг): каррагинан (Е407), калия хлорид, титана диоксид (Е171), индигокармин (Е132), гипромеллоза, вода очищенная.
Состав чернил черных: шеллак, бутанол, изопропанол, железа оксид черный (Е172), вода очищенная, пропиленгликоль, этанол безводный, концентрированный раствор аммиака, калия гидроксид.
Капсулы 75 мг
Продолговатые капсулы из гипромеллозы (размер 2) с непрозрачной крышкой белого цвета и непрозрачным корпусом белого цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе – «R75». Цвет надпечатки – черный.
Капсулы 110 мг
Продолговатые капсулы из гипромеллозы (размер 1) с непрозрачной крышкой светло-синего цвета и непрозрачным корпусом светло-синего цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе – «R110». Цвет надпечатки – черный.
Содержимое капсул обеих дозировок – желтоватые гранулы.
Прямые ингибиторы тромбина.
Код ATX: В01АЕ07.
Фармакодинамика
Дабигатрана этексилат является низкомолекулярным пролекарством, не обладающим фармакологической активностью. После приема внутрь быстро всасывается и путем катализируемого эстеразами гидролиза в плазме крови и в печени превращается в дабигатран. Дабигатран является активным, конкурентным, обратимым прямым ингибитором тромбина, который действует в основном в плазме крови.
Поскольку тромбин (сериновая протеаза) активирует превращение в процессе каскада коагуляции фибриногена в фибрин, то угнетение активности тромбина препятствует образованию тромба. Дабигатран ингибирует свободный тромбин, фибрин-связывающий тромбин и вызванную тромбином агрегацию тромбоцитов.
В испытаниях на животных in vivo и ex vivo с использованием различных моделей тромбоза была продемонстрирована антитромботическая эффективность и антикоагулянтная активность дабигатрана после внутривенного применения и дабигатрана этексилата после приема внутрь.
Согласно испытаниям фазы II, существует очевидная корреляция между концентрацией дабигатрана в плазме крови и выраженностью антикоагулянтного эффекта. Дабигатран удлиняет активированное частичное тромбопластиновое время (АЧТВ), экариновое время свертывания (ЭВС) и тромбиновое время (ТВ).
У пациентов с повышенным риском кровотечения для контроля действия Прадакса возможно определение концентраций дабигатрана в плазме крови.
Стандартизированный количественный анализ разбавленного ТВ предоставляет оценку концентрации дабигатрана в плазме крови, которую можно сравнить с ожидаемыми концентрациями дабигатрана в плазме крови. Если стандартизированный анализ разбавленного ТВ показывает концентрации дабигатрана в плазме крови на уровне или ниже границы количественного определения, следует рассмотреть применение дополнительных анализов коагуляции, таких как ТВ, ЭВС или АЧТВ.
ЭВС может обеспечить прямое определение активности прямых ингибиторов тромбина.
Анализ АЧТВ широко доступен и предоставляет приблизительное определение интенсивности антикоагуляции, вызванной дабигатраном. Однако анализ АЧТВ является недостаточно чувствительным и не подходит для точного количественного определения антикоагулянтного эффекта, особенно при высокой концентрации дабигатрана в плазме крови. Высокие результаты анализа АЧТВ следует интерпретировать с осторожностью, при этом высокий результат анализа АЧТВ указывает на то, что у пациента достигнут антикоагулянтный эффект.
Таким образом, можно предположить, что эти анализы антикоагулянтной активности могут отражать концентрацию дабигатрана и предоставлять направление для оценки риска кровотечения, т.е. превышение 90-й процентили минимальной концентрации дабигатрана или определение антикоагулянтной активности, например, анализ АЧТВ при минимальной концентрации, ассоциируются с повышенным риском кровотечения.
Первичная профилактика венозных тромбоэмболий (ВТЭ) после ортопедических операций
Среднее геометрическое максимальной концентрации дабигатрана в плазме крови в равновесном состоянии (через 3 дня) при определении через приблизительно 2 часа после приема 220 мг дабигатрана этексилата составило 70,8 нг/мл с диапазоном 35,2-162 нг/мл (25-я – 75-я процентили). Среднее геометрическое минимальной концентрации дабигатрана при определении в конце интервала дозирования (т.е. через 24 часа после приема 220 мг дабигатрана) составило в среднем 22,0 нг/мл с диапазоном 13,0-35,7 нг/мл (25-я – 75-я процентили).
В специальном исследовании у пациентов с умеренными нарушениями функции почек (клиренс креатинина, КК, 30-50 мл/мин.) при приеме дабигатрана этексилата 150 мг один раз в сутки среднее геометрическое минимальной концентрации дабигатрана при определении в конце интервала дозирования составляло в среднем 47,5 нг/мл с диапазоном 29,6-72,2 нг/мл (25-я – 75-я процентили).
У пациентов, принимавших дабигатрана этексилат для профилактики ВТЭ после эндопротезирования тазобедренного или коленного сустава в дозе 220 мг однократно в сутки,
• 90-я процентиль минимальной концентрации дабигатрана в плазме крови (20-28 часов после принятой дозы) составляла около 67 нг/мл,
• 90-я процентиль АЧТВ при минимальной концентрации (20-28 часов после принятой дозы) составляла 51 секунду, что в 1,3 раза выше верхнего предела нормы.
ЭВС не определялось у пациентов, принимавших дабигатрана этексилат для профилактики ВТЭ после эндопротезирования тазобедренного или коленного сустава в дозе 220 мг однократно в сутки.
Профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска
Среднее геометрическое максимальной концентрации дабигатрана в плазме крови в равновесном состоянии при определении через приблизительно 2 часа после приема 150 мг дабигатрана этексилата два раза в сутки составило 175 нг/мл с диапазоном 117-275 нг/мл (25-я – 75-я процентили). Среднее геометрическое минимальной концентрации дабигатрана при определении в конце интервала дозирования (т.е. через 12 часов после вечернего приема 150 мг дабигатрана) составило в среднем 91,0 нг/мл с диапазоном 61,0- 143 нг/мл (25-я – 75-я процентили).
У пациентов с неклапанной фибрилляцией предсердий, принимающих дабигатрана этексилат 150 мг два раза в сутки для профилактики инсульта и системной эмболии,
• 90-я процентиль минимальной концентрации дабигатрана в плазме крови (10-16 часов после принятой дозы) составляла около 200 нг/мл,
• ЭВС при минимальной концентрации (10-16 часов после принятой дозы) приблизительно в 3 раза выше верхней границы нормы и соотносится с наблюдаемой 90-й процентилью увеличения ЭВС на 103 секунды,
• отношение АЧТВ в 2 раза выше верхней границы нормы (увеличение АЧТВ приблизительно на 80 секунд) при минимальной концентрации (10-16 часов после принятой дозы) отражает 90-ю процентиль результатов.
Лечение тромбоза глубоких вен и легочной эмболии; профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых
У пациентов, принимавших дабигатрана этексилат 150 мг два раза в сутки для лечения тромбоза глубоких вен и легочной эмболии, среднее геометрическое минимальной концентрации дабигатрана в плазме крови при определении через 10-16 часов после приема дозы лекарственного средства в конце интервала дозирования (т.е. через 12 часов после вечерней дозы дабигатрана 150 мг) составило 59,7 нг/мл с диапазоном 38,6-94,5 нг/мл (25-я – 75-я процентили). При приеме дабигатрана этексилата 150 мг два раза в сутки для лечения тромбоза глубоких вен и легочной эмболии
• 90-я процентиль минимальной концентрации дабигатрана в плазме крови (10-16 часов после принятой дозы) составляла около 146 нг/мл,
• ЭВС при минимальной концентрации (10-16 часов после принятой дозы) увеличивалось приблизительно в 2,3 раза по сравнению с исходным значением и соотносится с наблюдаемой 90-й процентилью увеличения ЭВС на 74 секунды,
• 90-я процентиль АЧТВ при минимальной концентрации (10-16 часов после принятой дозы) составляла приблизительно 62 секунды, т.е. в 1,8 раз выше по сравнению с исходным значением.
Для пациентов, принимавших дабигатрана этексилат 150 мг два раза в сутки для профилактики рецидивирующих тромбоза глубоких вен и легочной эмболии, фармакокинетические данные отсутствуют.
Профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска
Клиническое подтверждение эффективности дабигатрана этексилата было получено в испытании RE-LY (рандомизированная оценка длительной антикоагулянтной терапии) — многоцентровом, многонациональном, рандомизированном с параллельными группами испытании двух доз дабигатрана этексилата (110 мг два раза в сутки и 150 мг два раза в сутки) в сравнении с варфарином с участием пациентов с фибрилляцией предсердий и риском (от среднего до высокого) развития инсульта или системной эмболии. Основная цель данного испытания заключалась в определении, уступает ли дабигатран варфарину в снижении частоты составной конечной точки, инсульта и системной эмболии. Кроме того, было проанализировано статистическое превосходство.
В испытании RE-LY было рандомизировано 18113 пациентов, средний возраст составлял 71,5 лет, среднее по шкале CHADS2 составляло 2,1. В число участников входили: 64% мужчин, 70% европейцев и 16% азиатов.
У пациентов, принимавших варфарин, среднее значение в процентах времени в терапевтическом диапазоне (TTR) (МНО 2-3) составило 64,4% (срединное TTR 67%).
Испытание RE-LY продемонстрировало, что дабигатрана этексилат в дозе 110 мг два раза в сутки не уступает варфарину в профилактике инсульта и системной эмболии у пациентов с фибрилляцией предсердий, при этом риск интракраниального кровоизлияния и общего количества кровотечений и больших кровотечений снижается. Доза 150 мг два раза в сутки значительно снижает риск ишемического и геморрагического инсульта, смерти от сердечно-сосудистых заболеваний, интракраниального кровоизлияния и общего числа кровотечений в сравнении с варфарином. Количество случаев инфаркта миокарда было немного больше при приеме дабигатрана этексилата 110 мг два раза в сутки и 150 мг два раза в сутки по сравнению с варфарином (относительный риск 1,29; р=0,0929, относительный риск 1,27; р=0,1240 соответственно). С улучшением контроля МНО преимущество дабигатрана этексилата перед варфарином уменьшилось.
RELY-ABLE (длительное многоцентровое продолжение испытания RE-LY с участием пациентов с фибрилляцией предсердий, принимавших дабигатран после окончания испытания RE-LY)
Продолжение испытания RE-LY (RELY-ABLE) предоставило дополнительную информацию по группе пациентов, продолжившей прием дабигатрана этексилата в той же дозе, что и в испытании RE-LY. Пациенты соответствовали критериям включения в испытание RELY-ABLE, если они не прекращали прием испытуемого лекарственного средства на постоянной основе со времени своего последнего визита в испытании RE-L Y. Включенные в испытание пациенты продолжали принимать дабигатрана этексилат согласно той же двойной слепой модели, что и в испытании RE-LY, в течение до 43 месяцев периода наблюдения после RE-LY (общий средний период наблюдения RE-LY + RELY-ABLE составил 4,5 года). Было включено 5897 пациентов, что составило 49% пациентов первоначально рандомизированно определенных для приема дабигатрана этексилата в испытании RE-LY и 86% пациентов, соответствующих критериям включения в RELY-ABLE.
Во время дополнительных 2,5 лет терапии в испытании RELY-ABLE с максимальной экспозицией более 6 лет (суммарная экспозиция в испытаниях RELY + RELY-ABLE) профиль безопасности при длительном применении дабигатрана этексилата был подтвержден для обеих испытуемых дозировок: 110 мг два раза в сутки и 150 мг два раза в сутки. Новые данные по безопасности выявлены не были.
Частота конечных точек, включая большое кровотечение и другие кровотечения, соответствовала наблюдаемой в испытании RE-LY.
Данные, полученные в неинтервенционном испытании GLORIA-AF
В неинтервенционном испытании (GLORIA-AF) проспективно собрались (в его второй фазе) данные по безопасности и эффективности терапии дабигатрана этексилатом у пациентов с недавно диагностированной неклапанной фибрилляцией предсердий в реальных условиях. Испытание включало 4859 пациентов, принимающих дабигатрана этексилат (55% принимали 150 мг два раза в сутки, 43% принимали 110 мг два раза в сутки, 2% принимали 75 мг два раза в сутки). Пациенты наблюдались в течение 2-х лет. Средние оценки по шкале CHADS2 и HAS-BLED составили 1,9 и 1,2 соответственно.Среднее время наблюдения за терапией составило 18,3 месяца. Большое кровотечение развивалось у 0,97 на 100 пациенто-лет. Жизнеугрожающее кровотечение сообщалось у 0,46 на 100 пациенто-лет, интраканиальное кровоизлияние у 0,17 на 100 пациенто-лет и желудочно-кишечное кровотечение у 0,60 на 100 пациенто-лет.
Результаты наблюдения, полученные в реальных условиях, согласуются с установленным в испытании RE-LY профилем безопасности и эффективности дабигатрана этексилата по данному показанию.
Пациенты, подвергавшиеся чрескожному коронарному вмешательству (ЧКВ) со стентированием
У 2725 пациентов с неклапанной фибрилляцией предсердий, подвергшихся чрескожному коронарному вмешательству со стентированием (RE-DUAL PCI), было проведено проспективное рандомизированное открытое испытание с маскированием критериев оценки (PROBE) (фаза IIIb) для оценки двойной терапии с дабигатрана этексилатом (110 мг или 150 мг два раза в сутки) плюс клопидогрел или тикагрелор (антагонист P2Y12) в сравнении с тройной терапией с варфарином (откорректированное МНО 2,0 -3,0) плюс клопидогрел или тикагрелор и ацетилсалициловая кислота. Пациенты были рандомизированы: группа двойной терапии с дабигатрана этексилатом 110 мг два раза в сутки, группа двойной терапии с дабигатрана этексилатом 150 мг два раза в сутки или группа тройной терапии с варфарином. Пожилые пациенты, находящиеся за пределами США (≥80 лет для всех стран, ≥70 лет для Японии), были рандомизировано разделены на группу двойной терапии с дабигатрана этексилатом 110 мг или на группу тройной терапии с варфарином. Первичной конечной точкой являлась комбинированная конечная точка большие кровотечения по определению ISTH (Международное общество по изучению тромбозов и гемостазов) или клинически существенный случай небольшого кровотечения.
Частота первичной конечной точки составила 15,4% (151 пациент) в группе двойной терапии с дабигатрана этексилатом 110 мг по сравнению с 26,9% (264 пациента) в группе тройной терапии с варфарином (ОР 0,52; 95% ДИ 0,42,0,63; Р <0,0001 для не меньшей эффективности и Р <0,0001 для превосходства) и 20,2% (154 пациента) в группе двойной терапии с дабигатрана этексилатом 150 мг по сравнению с 25,7% (196 пациентов) в соответствующей группе тройной терапии с варфарином (ОР 0,72; 95% ДИ 0,58, 0,88; Р <0,0001 для не меньшей эффективности и Р =0,002 для превосходства). В контексте описательного анализа TIMI (тромболизис при инфаркте миокарда) количество случаев большого кровотечения было ниже в обеих группах двойной терапии с дабигатрана этексилатом по сравнению с группой тройной терапии с варфарином: 14 случаев (1,4%) в группе двойной терапии с дабигатрана этексилатом 110 мг в сравнении с 37 случаями (3,8%) в группе тройной терапии с варфарином (ОР 0,37; 95% ДИ 0,20, 0,68; Р =0,002) и 16 случаев (2,1%) в группе двойной терапии с дабигатрана этексилатом 150 мг в сравнении с 30 случаями (3,9%) в соответствующей группе тройной терапии с варфарином (ОР 0,51; 95% ДИ 0,28, 0,93; Р =0,03). В обеих группах двойной терапии с дабигатрана этексилатом наблюдался более низкий уровень интракраниального кровоизлияния по сравнению с соответствующей группой тройной терапии с варфарином: 3 случая (0,3%) в группе двойной терапии с дабигатрана этексилатом 110 мг в сравнении с 10 случаями (1,0%) в группе тройной терапии с варфарином (ОР 0,30; 95% ДИ 0,08,1,07; Р =0,06) и 1 случай (0,1%) в группе двойной терапии с дабигатрана этексилатом 150 мг в сравнении с 8 случаями (1,0%) в соответствующей группе тройной терапии с варфарином (ОР 0,12; 95% ДИ 0,02, 0,98; Р =0,047). Частота комбинированной конечной точки эффективности смерть, тромботические явления (инфаркт миокарда, инсульт или системная эмболия) или неплановая реваскуляризация в двух комбинированных группах двойной терапии с дабигатрана этексилатом не превышала результаты в группе тройной терапии с варфарином (13,7% в сравнении с 13,4% соответственно; ОР 1,04; 95% ДИ 0,84,1,29; Р =0,0047 для не меньшей эффективности).
Между группами двойной терапии с дабигатрана этексилатом и группой тройной терапии с варфарином не выявлено статистических различий по отдельным компонентам конечных точек эффективности.
Данное испытание продемонстрировало, что двойная терапия с дабигатрана этексилатом и антагонистами P2Y12 существенно снижает риск кровотечений в сравнении с тройной терапией с варфарином, не превышая составную конечную точку тромбоэмболические явления у пациентов с фибрилляцией предсердий, перенесших чрескожное коронарное вмешательство со стентированием.
Лечение тромбоза глубоких вен и легочной эмболии у взрослых
Эффективность и безопасность изучалась в двух многоцентровых рандомизированных двойных слепых с параллельными группами испытаниях с повторяющимся дизайном RE-COVER и RE-COVER II. В данных испытаниях дабигатрана этексилат (150 мг два раза в сутки) сравнивался с варфарином (целевое значение МНО 2,0-3,0) при применении у пациентов с острым тромбозом глубоких вен и/или легочной эмболией. Основная цель этих испытаний заключалась в том, чтобы определить, не уступает ли дабигатрана этексилат варфарину в снижении частоты комбинированной первичной конечной точки рецидивирующий симптоматический тромбоз глубоких вен и/или легочная эмболия и связанные с ними смертельные случаи в течение периода лечения 6 месяцев.
В объединенных испытаниях RE-COVER и RE-COVER II всего было рандомизировано 5153 пациента, получали лечение – 5107 пациентов.
Продолжительность применения фиксированных доз дабигатрана составляла 174,0 дня без контроля коагуляции. У пациентов, принимавших варфарин, медиана времени в терапевтическом диапазоне (МНО 2,0-3,0) составляла 60,6%.
Испытания продемонстрировали, что дабигатрана этексилат 150 мг два раза в сутки не уступал варфарину (предел не меньшей эффективности в испытаниях RE-COVER и RE-COVER II: 3,6 для разности рисков и 2,75 для отношения рисков).
Профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых
Два рандомизированных с параллельными группами двойных слепых испытания проводились с участием пациентов ранее проходивших антикоагулянтную терапию. В испытание RE-MEDY с контролем варфарином включались пациенты, проходившие лечение в течение 3-12 месяцев, которым была необходима дальнейшая антикоагулянтная терапия. В плацебо-контролируемое испытание RE-SONATE включались пациенты, принимавшие ингибиторы витамина К в течение 6-18 месяцев. Цель испытания RE-MEDY заключалась в том, чтобы сравнить безопасность и эффективность при пероральном приеме дабигатрана этексилата (150 мг два раза в сутки) и варфарина (целевое МНО 2,0-3,0) при длительном лечении для профилактики рецидивирующих симптоматических тромбоза глубоких вен и/или легочной эмболии. Всего было рандомизировано 2866 пациентов, проходили лечение — 2856 пациентов. Продолжительность приема дабигатрана этексилата варьировалась от 6 до 36 месяцев (срединное значение 534,0 дня). У пациентов, принимавших варфарин, срединное время в терапевтическом диапазоне (МНО 2,0-3,0) составляло 64,9%.
Испытание RE-MEDY продемонстрировало, что дабигатрана этексилат 150 мг два раза в сутки не уступал варфарину (предел не меньшей эффективности: 2,85 для отношения рисков и 2,8 для разности рисков).
Цель испытания RE-SONATE заключалась в оценке преимущества дабигатрана этексилата по сравнению с плацебо при профилактике рецидивирующих симптоматических тромбоза глубоких вен и/или легочной эмболии у пациентов, завершивших период лечения антагонистами витамина К продолжительностью 6-18 месяцев. Запланированная терапия состояла в приеме дабигатрана этексилата 150 мг два раза в сутки в течение 6 месяцев без контроля коагуляции.
Испытание RE-SONATE продемонстрировало, что дабигатрана этексилат превосходил плацебо в профилактике рецидивирующих симптоматических тромбоза глубоких вен/легочной эмболии, включая необъяснимые смертельные случаи, риск снижался с 5,6% до 0,4% (относительное снижение риска 92% на основании отношения рисков) во время периода лечения (р<0,0001). Вторичный анализ и анализ чувствительности первичной конечной точки и всех вторичных конечных точек показали превосходство дабигатрана этексилата над плацебо.
Испытание включало наблюдательный период в течение 12 месяцев после окончания лечения. После завершения испытания эффект лекарственного средства сохранялся до конца периода наблюдения, что указывает на то, что первоначальный эффект применения дабигатрана этексилата поддерживался. Эффект рикошета не наблюдался. В конце периода наблюдения количество случаев ВТЭ у пациентов, принимавших дабигатрана этексилат, составило 6,9% в сравнении с 10,7% в группе плацебо (отношение рисков 0,61 (95% ДИ 0,42,0,88); р=0,0082).
Клинические испытания по профилактике тромбоэмболии у пациентов с протезированными клапанами сердца
В клиническом испытании фазы II, в которое суммарно было включено 252 пациента, изучалось применение дабигатрана этексилата и варфарина у пациентов, недавно перенесших хирургическую операцию по замене клапана сердца на механический (находящихся на госпитализации после операции), и у пациентов, которым подобная операция была проведена более трех месяцев назад. В группе пациентов, принимавших дабигатрана этексилат, наблюдалось большее количество случаев развития тромбоэмболических осложнений (в основном инсульты и тромбозы искусственного клапана сердца, сопровождающиеся и несопровождающиеся клинической симптоматикой) и кровотечений по сравнению с группой пациентов, принимавших варфарин. У недавно прооперированных пациентов большие кровотечения, в основном, проявлялись как послеоперационный геморрагический перикардиальный выпот, особенно у тех пациентов, которые после операции по замене сердечного клапана начали принимать дабигатрана этексилат рано (т.е. на 3-й день) после протезирования.
Дети
Фармакокинетика и фармакодинамика дабигатрана этексилата при приеме два раза в сутки в течение последующих трех дней (всего 6 доз) в конце стандартной антикоагулянтной терапии оценивались в открытом испытании по безопасности и переносимости у 9 стабильных подростков (12-<18 лет). Все пациенты принимали перорально начальную дозу 1,71 (±10%) мг/кг дабигатрана этексилата (80% дозы для взрослых 150 мг/70 кг, откорректированной в зависимости от массы тела пациента). На основании концентрации дабигатрана и клинической оценки доза впоследствии была изменена до целевой дозы 2,14 (±10%) мг/кг дабигатрана этексилата (100% дозы для взрослых, откорректированной в зависимости от массы тела пациента). Переносимость дабигатрана этексилат капсул у этой небольшой группы подростков была удовлетворительная, зарегистрировано только три случая легких и транзиторных побочных реакций у двух пациентов. В связи с относительно низкой экспозицией, в показателях коагуляции через 72 часа (предполагается минимальная концентрация дабигатрана в стационарном состоянии или в условиях, близких к стационарному состоянию) наблюдалось незначительное увеличение АЧТВ максимально в 1,60 раз, ЭВС в 1,86 раза, Hemoclot® ТТ (Anti-FIIa) в 1,36 раза соответственно. Концентрации дабигатрана в плазме крови через 72 часа были относительно низкими и составляли 32,9- 97,2 нг/мл при конечных дозах 100-150 мг (среднее геометрическое дозы корректировало концентрацию дабигатрана в плазме крови 0,493 нг/мл/мг).
Фармакокинетика
После приема внутрь дабигатрана этексилат быстро и полностью превращается в дабигатран, являющийся активной формой в плазме крови. Преобразование пролекарства дабигатрана этексилата путем катализируемого эстеразами гидролиза в активный дабигатран является основной метаболической реакцией. Абсолютная биодоступность дабигатрана после приема внутрь Прадакса составляет около 6,5%.
После приема внутрь Прадакса фармакокинетический профиль дабигатрана в плазме крови здоровых добровольцев характеризуется быстрым увеличением концентрации в плазме с достижением Cmax в течение 0,5-2 часов.
Всасывание
В испытании по изучению всасывания дабигатрана этексилата через 1-3 часа после операции продемонстрировано замедление всасывания по сравнению со здоровыми добровольцами. Выявлено плавное нарастание кривой концентрация-время без появления пика концентрации в плазме крови. Пик плазменной концентрации достигался через 6 часов после приема. Следует отметить, что такие факторы как анестезия, парез ЖКТ и хирургическая операция могут замедлять всасывание независимо от лекарственной формы лекарственного средства. В другом испытании было показано, что медленное всасывание или его задержка наблюдается обычно только в день операции. В последующие дни всасывание дабигатрана происходит быстро с достижением пика концентрации через 2 часа после приема.
Прием пищи не влияет на биодоступность дабигатрана этексилата, однако время достижения пика плазменной концентрации замедляется на 2 часа.
Сmax и площадь под кривой концентрация-время (AUC) были пропорциональны дозе.
Биодоступность при приеме внутрь может увеличиваться приблизительно на 75% после однократной дозы и на 37% в равновесном состоянии по сравнению со стандартными капсулами при приеме гранул без капсульной оболочки из гидроксипропилметилцеллюлозы. Следовательно, целостность капсулы при применении должна сохраняться, чтобы избежать случайного увеличения биодоступности дабигатрана этексилата.
Распределение
Установлена низкая способность (34-35%) связывания дабигатрана с белками плазмы крови человека вне зависимости от концентрации препарата. Объем распределения дабигатрана составляет 60-70 л и превосходит объем общего содержания воды в организме, что указывает на умеренное распределение дабигатрана в тканях.
Биотрансформация
Метаболизм и экскреция дабигатрана изучались у здоровых добровольцев (мужчины) после однократного внутривенного введения радиоактивно-меченного дабигатрана. Выделение препарата происходило в основном через почки (85%). Экскреция с калом составляла около 6% от введенной дозы. В течение 168 часов после введения препарата выведение общей радиоактивности составляло 88-94% от введенной дозы.
Дабигатран подвергается конъюгации с образованием фармакологически активных ацилглюкуронидов. Существует 4 позиционных изомера: 1-О, 2-О, 3-О, 4-О-ацилглюкуронид, каждый из которых составляет менее 10% от общего содержания дабигатрана в плазме крови. Следы других метаболитов обнаружены только при использовании высокочувствительных аналитических методов. Дабигатран выводится в основном через почки в неизмененном виде. Скорость выведения составляет приблизительно 100 мл/мин., что соответствует скорости гломерулярной фильтрации.
Выведение
Плазменные концентрации дабигатрана снижаются биэкспоненциально, конечный период полувыведения в среднем составляет около 11 часов у здоровых пожилых пациентов. После приема многократных доз период полувыведения составлял около 12-14 часов. Период полувыведения не зависел от дозы. Однако период полувыведения увеличивается, если функция почек снижена, как показано в таблице 1.
Фармакокинетика в особых группах пациентов
Нарушение функции почек
У добровольцев с нарушением функции почек средней степени тяжести (клиренс креатинина 30-50 мл/мин.) в испытаниях фазы I экспозиция (AUC) дабигатрана после приема внутрь была в 2,7 раза выше по сравнению с добровольцами с нормальной функцией почек.
В группе, включавшей небольшое число добровольцев с тяжелой почечной недостаточностью (клиренс креатинина 10-30 мл/мин.), экспозиция (AUC) дабигатрана и период полувыведения возрастали соответственно в 6 и 2 раза по сравнению с группой добровольцев с нормальной функцией почек.
Таблица 1 Период полувыведения общего дабигатрана у здоровых добровольцев и пациентов со сниженной функцией почек
|
Скорость клубочковой фильтрации (клиренс креатинина) (мл/мин.) |
Среднее геометрическое периода полу выведения (gCV%; диапазон) (часы) |
| ≥80 | 13,4 (25,7%; 11,0-21,6) |
| ≥50-<80 | 15,3 (42,7%; 11,7-34,1) |
| ≥30-<50 | 18,4 (18,5%; 13,3-23,0) |
| <30 | 27,2 (15,3%; 21,6-35,0) |
Дополнительно экспозиция дабигатрана (при минимальной и максимальной концентрации) оценивалась в проспективном открытом рандомизированном фармакокинетическом испытании у пациентов с неклапанной фибрилляцией предсердий и тяжелым нарушением функции почек (клиренс креатинина 15-30 мл/мин.), принимавших дабигатрана эстексилат 75 мг два раза в сутки. Данный режим дозирования приводил к средней геометрической минимальной концентрации 155 нг/мл (gCV 76,9%), которая определялась непосредственно перед приемом следующей дозы, и к средней геометрической максимальной концентрации 202 нг/мл (gCV 70,6%), которая определялась в течение двух часов после приема последней дозы.
Клиренс дабигатрана исследовался у 7 пациентов без фибрилляции предсердий с терминальной стадией почечной недостаточности, находящихся на гемодиализе. Диализ проводился в течение 4 часов при скорости диализата 700 мл/мин., кровотока — 200 мл/мин. или 350-390 мл/мин., что привело к уменьшению концентрации дабигатрана на 50%-60% соответственно. Количество вещества, удаляемого при диализе, пропорционально скорости кровотока до скорости кровотока 300 мл/мин.
Антикоагулянтное действие дабигатрана уменьшалось при снижении его концентрации в плазме крови, однако на фармакокинетику/фармакодинамику диализ влияния не оказывал.
Срединное значение клиренса креатинина (КК) в RE-LY составляло 68,4 мл/мин. Почти у половины (45,8%) пациентов в RE-LY КК был >50-<80 мл/мин. У пациентов с нарушением функции почек средней степени тяжести (КК 30-50 мл/мин.) концентрация дабигатрана в плазме крови до приема дозы и после была в среднем в 2,29 и 1,81 раз выше соответственно по сравнению с пациентами с нормальной функцией почек (КК ≥80 мл/мин.).
Срединное значение КК в испытании RE-COVER составило 100,4 мл/мин. 21,7% пациентов были с нарушением функции почек легкой степени тяжести (КК >50-<80 мл/мин.), у 4,5% пациентов нарушение функции почек было средней степени тяжести (КК между 30 и 50 мл/мин.). У пациентов с нарушением функции почек легкой и средней степени тяжести равновесная концентрация была в среднем в 1,8 раз и 3,6 раз выше концентрации дабигатрана в плазме крови до приема очередной дозы по сравнению с пациентами с КК >80 мл/мин. соответственно. В испытании RE-COVER II были получены схожие значения КК.
Срединное значение КК в испытаниях RE-MEDY и RE-SONATE составило 99,0 мл/мин. и 99,7 мл/мин. соответственно. У 22,9% и 22,5% пациентов КК был >50-<80 мл/мин., у 4,1% и 4,8% КК был между 30 и 50 мл/мин.
Пожилые пациенты
Специальные фармакокинетические испытания с участием пожилых пациентов в испытании фазы I показали увеличение AUC на 40-60%, а Сmax более чем на 25% по сравнению с молодыми добровольцами.
Зависимость экспозиции дабигатрана от возраста подтвердилась в испытании RE-LY: у пациентов в возрасте 75 лет и старше минимальная концентрация была на 31% выше, а у пациентов младше 65 лет минимальная концентрация была на 22% ниже по сравнению с пациентами в возрасте от 65 до 75 лет.
Нарушение функции печени
У 12 пациентов со средним нарушением печеночной функции (степень В по Чайлд- Пью) не было выявлено изменений экспозиции дабигатрана по сравнению с контрольной группой.
Масса тела
Минимальная концентрация дабигатрана была примерно на 20% ниже у пациентов с массой тела более 100 кг по сравнению с пациентами с массой тела от 50 до 100 кг. Большинство (80,8%) пациентов имели массу тела от 50 до 100 кг, четких различий выявлено не было. Данные о пациентах с массой тела менее 50 кг ограничены.
Пол
Экспозиция действующего вещества в испытаниях по первичной профилактике ВТЭ у женщин была приблизительно на 40%-50% выше.
У женщин с фибрилляцией предсердий минимальные и после приема дозы концентрации были выше на 30%.
Коррекция режима дозирования не требуется.
Фармакокинетическое взаимодействие
Испытания по определению взаимодействия in vitro не продемонстрировали ингибирования или индукции цитохрома Р450. Это также было подтверждено при проведении исследований in vivo на здоровых добровольцах, для которых не было получено данных о каком-либо взаимодействии между дабигатрана этексилатом и следующими лекарственными средствами: аторвастатин (CYP3A4), дигоксин (субстрат Р-гликопротеина) и диклофенак (CYP2C9).
Прадакса капсулы 75 мг и 110 мг
Первичная профилактика венозных тромбоэмболий у взрослых пациентов после операций тотального эндопротезирования тазобедренного сустава или тотального эндопротезирования коленного сустава.
Прадакса капсулы 110 мг
Профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими из следующих факторов риска: инсульт или транзиторная ишемическая атака в анамнезе, возраст ≥75 лет, сердечная недостаточность (≥ класса II согласно классификации Нью-Йоркской кардиологической ассоциации (NYHA)), сахарный диабет, артериальная гипертензия.
Лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых.
Режим дозирования
ПРАДАКСА капсулы 75 мг и 110 мг: первичная профилактика венозных тромбоэмболий (ВТЭ) после ортопедических операций
Рекомендованная доза ПРАДАКСА и продолжительность лечения при первичной профилактике венозных тромбоэмболий после ортопедических операций представлены в таблице 2.
Таблица 2 Рекомендованная доза и продолжительность лечения при первичной профилактике венозных тромбоэмболий после ортопедических операций
|
Начало лечения в день операции через 1-4 часа после завершения операции |
Поддерживающая доза, начиная с первого дня после операции |
Продолжительность поддерживающей дозы |
|
|
Пациенты после эндопротезирования коленного сустава |
Одна капсула ПРАДАКСА 110 мг |
ПРАДАКСА 220 мг однократно в сутки (2 капсулы по 110 мг) |
10 дней |
|
Пациенты после эндопротезирования тазобедренного сустава |
28-35 дней |
||
|
Рекомендации по снижению дозы |
|||
|
Пациенты с нарушением функции почек средней степени тяжести (клиренс креатинина 30-50 мл/мин.) |
Одна капсула ПРАДАКСА 75 мг |
ПРАДАКСА 150 мг однократно в сутки (2 капсулы по 75 мг) |
10 дней (эндопротезирование коленного сустава) или 28-35 дней (эндопротезирование тазобедренного сустава) |
|
Пациенты, одновременно принимающие верапамил*, амиодарон, хинидин |
|||
|
Пациенты в возрасте 75 лет и старше |
*Дополнительную информацию для пациентов с нарушением функции почек средней степени тяжести, одновременно принимающих верапамил, см. в подразделе «Особые группы пациентов».
Для обоих видов оперативных вмешательств, если гемостаз не достигнут, начало терапии следует отложить. Если лекарственное средство не принималось в день операции, терапию следует начинать с приема 2 капсул однократно в сутки.
Оценка функции почек до и во время лечения ПРАДАКСА
Все пациенты и особенно пожилые пациенты (старше 75 лет), поскольку нарушения функции почек могут часто развиваться в данной возрастной группе:
• До начала приема ПРАДАКСА следует оценить функцию почек, рассчитав клиренс креатинина, чтобы не допустить назначение лекарственного средства пациентам с тяжелым нарушением функции почек (т.е. с клиренсом креатинина <30 мл/мин.).
• Необходимо проводить оценку функции почек во время лечения при подозрении на развитие почечной недостаточности (например, гиповолемия, дегидратация, одновременный прием некоторых лекарственных средств).
Для оценки функции почек (клиренс креатинина в мл/мин.) должен использоваться метод Кокрофта-Голта:
Клиренс креатинина (мкмоль/л) =
1,23 × (140 — возраст (в годах)) × масса тела (кг) (× 0,85 для женщин)
сывороточный креатинин (мкмоль/л)
Клиренс креатинина (мг/дл) =
(140 — возраст (в годах)) × масса тела (кг) (× 0,85 для женщин)
72 × сывороточный креатинин (мг/дл)
Пропущенная доза
Пропущенную дозу ПРАДАКСА принимают на следующий день в обычное время. Нельзя принимать двойную дозу, чтобы компенсировать пропущенную дозу.
Прекращение приема ПРАДАКСА
Не следует прекращать лечение ПРАДАКСА без рекомендации врача. Следует проинформировать пациентов, что нужно обратиться к лечащему врачу если развиваются желудочно-кишечные симптомы, такие как диспепсия.
Изменение лечения
Переход от лечения ПРАДАКСА к парентеральному введению антикоагулянтов
Перед переходом от приема ПРАДАКСА на парентеральный антикоагулянт рекомендуется подождать 24 часа после приема последней дозы ПРАДАКСА (см. раздел «Взаимодействие с другими лекарственными средствами»).
Переход от лечения парентеральными антикоагулянтами к приему ПРАДАКСА
Прекращают введение парентерального антикоагулянта и начинают прием ПРАДАКСА за 0-2 часа до введения очередной дозы заменяемого парентерального антикоагулянта или во время его отмены в случае продолжительного лечения (например, при применении нефракционированного гепарина внутривенно).
Особые группы пациентов
Нарушение функции почек
ПРАДАКСА противопоказано пациентам с тяжелым нарушением функции почек (клиренс креатинина менее 30 мл/мин.).
У пациентов с нарушением функции почек средней степени тяжести (клиренс креатинина 30-50 мл/мин.) рекомендуется снизить дозу, как указано в таблице 2.
Одновременное применение ПРАДАКСА и ингибиторов Р-гликопротеина от легких до умеренных, например, амиодарона, хинидина или верапамила
Пациентам следует снизить дозу, как указано в таблице 2. В этом случае ПРАДАКСА и вышеуказанные лекарственные средства должны приниматься одновременно.
Пациентам с нарушением функции почек средней степени тяжести, одновременно принимающим верапамил, может потребоваться снижение дозы ПРАДАКСА до 75 мг/сутки.
Пожилые пациенты
Для пожилых пациентов старше 75 лет рекомендуется снизить дозу, как указано в таблице 2.
Масса тела
Опыт клинического применения пациентами с массой тела менее 50 или более 110 кг ограничен. Согласно имеющимся клиническим и кинетическим данным корректировка режима дозирования не требуется, однако рекомендуется тщательное клиническое наблюдение таких пациентов.
Пол
Корректировка режима дозирования не требуется.
Дети
Опыт применения у детей ПРАДАКСА по показанию «Первичная профилактика венозных тромбоэмболий у взрослых пациентов после операций тотального эндопротезирования тазобедренного сустава или тотального эндопротезирования коленного сустава» отсутствует.
ПРАДАКСА капсулы 110 мг: профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска, лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых
Рекомендуемые дозы ПРАДАКСА для показаний: профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска, лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых приведены в таблице 3.
Таблица 3 Рекомендуемые дозы для профилактики инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска, лечения тромбоза глубоких вен и легочной эмболии, профилактики рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых
|
Рекомендуемые дозы |
|
|
Профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска |
300 мг ПРАДАКСА (по одной капсуле 150 мг два раза в сутки) |
|
Лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых |
300 мг ПРАДАКСА (по одной капсуле 150 мг два раза в сутки) назначается после применения парентеральных антикоагулянтов минимально в течение 5 дней |
|
Рекомендовано снижение дозы |
|
| Пациенты в возрасте 80 лет и старше |
Суточная доза ПРАДАКСА составляет 220 мг (по одной капсуле 110 мг два раза в сутки) |
| Пациенты, одновременно принимающие верапамил | |
|
Следует рассмотреть снижение дозы |
|
| Пациенты в возрасте 75-80 лет |
Суточная доза ПРАДАКСА 300 мг или 220 мг должна подбираться на основании индивидуальной оценки риска тромбоэмболии и риска кровотечения |
|
Пациенты с нарушением функции почек средней степени тяжести (КК 30-50 мл/мин.) |
|
|
Пациенты с гастритом, эзофагитом или гастроэзофагеальным рефлюксом |
|
|
Другие пациенты с повышенным риском развития кровотечения |
Для лечения и профилактики тромбоза глубоких вен/легочной эмболии рекомендации по применению ПРАДАКСА в дозе 220 мг (по одной капсуле 110 мг два раза в сутки) основываются на анализе фармакокинетики и фармакодинамики лекарственного средства и не изучались в данных клинических условиях.
В случае непереносимости ПРАД АКСА пациентам следует немедленно обратиться к врачу с тем, чтобы была назначена альтернативная терапия по профилактике инсульта и системной эмболии, ассоциированных с фибрилляцией предсердий, или для лечения и профилактики тромбоза глубоких вен/легочной эмболии.
Оценка функции почек до и во время лечения ПРАДАКСА
Все пациенты и особенно пожилые пациенты (старше 75 лет), поскольку нарушения функции почек могут часто развиваться в данной возрастной группе:
• До начала приема ПРАДАКСА следует оценить функцию почек, рассчитав клиренс креатинина, чтобы не допустить назначение лекарственного средства пациентам с тяжелым нарушением функции почек (т.е. с клиренсом креатинина <30 мл/мин.). Необходимо проводить оценку функции почек во время лечения при подозрении развития почечной недостаточности (например, гиповолемия, дегидратация, одновременный прием некоторых лекарственных средств).
Дополнительное требование для пациентов с нарушением функции почек средней или легкой степени тяжести, а также пациентов старше 75 лет:
• В процессе лечения ПРАДАКСА функция почек должна контролироваться, по меньшей мере, один раз в год или чаще в определенных клинических ситуациях при подозрении на снижение функции почек (например, гиповолемия, дегидратация, одновременный прием некоторых лекарственных средств).
Для оценки функции почек (клиренс креатинина в мл/мин.) должен использоваться метод Кокрофта-Голта.
Длительность применения
Длительность применения ПРАДАКСА для показаний: профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска, лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых приведена в таблице 4.
гастроэзофагеальным рефлюксом
Другие пациенты с повышенным риском развития кровотечения
Таблица 4 Длительность применения ПРАДАКСА для профилактики инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска, лечения тромбоза глубоких вен и легочной эмболии, профилактики рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых пациентов
|
Показание |
Длительность применения |
|
Профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска |
Лечение должно быть длительным. |
|
Лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых пациентов |
Длительность терапии определяется индивидуально после тщательной оценки пользы лечения и риска кровотечения. Наличие транзиторных факторов риска (например, недавнее хирургическое вмешательство, травма, иммобилизация) предполагает короткий курс терапии (минимально 3 месяца), а при постоянном риске идиопатического тромбоза глубоких вен или легочной эмболии продолжительность лечения увеличивается. |
Пропущенная доза
Пропущенную дозу ПРАДАКСА можно принять, если осталось 6 часов до следующего приема лекарственного средства. Если до следующего приема капсулы осталось менее 6 часов, пропущенную дозу принимать не следует.
Нельзя принимать двойную дозу, чтобы компенсировать пропущенную дозу.
Прекращение приема ПРАДАКСА
Не следует прекращать лечение ПРАДАКСА без рекомендации врача. Следует проинформировать пациентов, что нужно обратиться к лечащему врачу если развиваются желудочно-кишечные симптомы, такие как диспепсия.
Изменение лечения
Переход от лечения ПРАДАКСА к парентеральному введению антикоагулянтов
Перед переходом от приема ПРАДАКСА на парентеральный антикоагулянт рекомендуется подождать 12 часов после приема последней дозы ПРАДАКСА (см. раздел «Взаимодействие с другими лекарственными средствами»).
Переход от лечения парентеральными антикоагулянтами к приему ПРАДАКСА
Прекращают введение парентерального антикоагулянта и начинают прием ПРАДАКСА за 0-2 часа до введения очередной дозы заменяемого парентерального антикоагулянта или во время его отмены в случае продолжительного лечения (например, при применении нефракционированного гепарина внутривенно).
Переход от лечения ПРАДАКСА к приему антагонистов витамина К
Начало приема антагонистов витамина К должно быть скорректировано с учетом клиренса креатинина пациента следующим образом:
• Если КК ≥50 мл/мин., то прием антагонистов витамина К следует начинать за 3 дня до прекращения приема ПРАДАКСА.
• Если КК ≥30-<50 мл/мин., то прием антагонистов витамина К следует начинать за 2 дня до прекращения приема ПРАДАКСА.
Поскольку ПРАДАКСА может увеличивать МНО (международное нормализированное отношение), МНО будет достоверно отражать эффект антагонистов витамина К после прекращения приема ПРАДАКСА как минимум на 2 дня. До этого МНО следует интерпретировать с осторожностью.
Переход от лечения антагонистами витамина К к приему ПРАДАКСА
Прием антагонистов витамина К должен быть прекращен. ПРАДАКСА может применяться, как только МНО будет меньше 2,0.
Кардиоверсия (профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска)
Пациенты могут продолжать прием ПРАДАКСА при проведении кардиоверсии.
Катетерная абляция при фибрилляции предсердий (профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска)
Для режима дозирования ПРАДАКСА 110 мг два раза в сутки данные отсутствуют.
Чрескожное коронарное вмешательство (ЧКВ) со стентированием (профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска)
Пациенты с неклапанной фибрилляцией предсердий, которые подвергаются чрескожному коронарному вмешательству (ЧКВ) со стентированием, могут принимать ПРАДАКСА в комбинации с антиагрегантами после достижения гемостаза.
Особые группы пациентов
Пожилые пациенты
Для изменения режима дозирования у пожилых пациентов см. таблицу 3.
Пациенты с риском развития кровотечения
Пациенты с повышенным риском развития кровотечения должны тщательно клинически наблюдаться для определения признаков кровотечения или анемии. Доза может быть скорректирована по усмотрению врача после оценки потенциальной пользы и риска для каждого отдельного пациента (см. таблицу 3). Тест на коагуляцию (см. раздел «Меры предосторожности») может помочь выявить пациентов с повышенным риском кровотечения, вызванным чрезмерной экспозицией дабигатрана. Если обнаружена чрезмерная экспозиция дабигатрана у пациентов с высоким риском кровотечения, рекомендуется уменьшение суточной дозы до 220 мг (по одной капсуле 110 мг два раза в сутки). При возникновении клинически значимого кровотечения, лечение должно быть прервано.
Для пациентов с гастритом, эзофагитом или гастроэзофагеальным рефлюксом следует рассмотреть уменьшение дозы ПРАДАКСА в связи с возможным увеличением риска большого желудочно-кишечного кровотечения, как указано в таблице 3.
Нарушение функции почек
ПРАДАКСА противопоказано пациентам с тяжелым нарушением функции почек (клиренс креатинина менее 30 мл/мин.).
Пациентам с нарушением функции почек легкой степени тяжести (клиренс креатинина 50-≤80 мл/мин.) корректировка режима дозирования не требуется. Пациентам с нарушением функции почек средней степени тяжести (клиренс креатинина 30-50 мл/мин.) ПРАДАКСА так же следует принимать внутрь в суточной дозе 300 мг (по одной капсуле 150 мг два раза в сутки). Однако для пациентов с высоким риском кровотечения следует рассмотреть снижение суточной дозы до 220 мг (по одной капсуле 110 мг два раза в сутки). Рекомендуется тщательное клиническое наблюдение пациентов с нарушением функции почек.
Одновременное применение ПРАДАКСА и ингибиторов Р-гликопротеина от легких до умеренных, например, амиодарона, хинидина или верапамила
Корректировка режима дозирования при одновременном применении с амиодароном или хинидином не требуется.
Рекомендуется уменьшение дозы для пациентов, одновременно принимающих верапамил, как указано в таблице 3. В этом случае ПРАДАКСА и верапамил должны приниматься одновременно.
Масса тела
Корректировка режима дозирования не требуется. Рекомендуется тщательное клиническое наблюдение пациентов с массой тела менее 50 кг.
Пол
Корректировка режима дозирования не требуется
Дети
Опыт применения ПРАДАКСА у детей по показанию «Профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий» отсутствует.
Безопасность и эффективность применения ПРАДАКСА у детей от рождения до 18 лет по показанию «Лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых» не установлены. Имеющиеся в настоящее время данные приводятся в разделах «Фармакодинамика» и «Побочное действие», однако рекомендации по режиму дозирования лекарственного средства отсутствуют.
Способ применения
ПРАДАКСА следует принимать внутрь.
Капсулы могут приниматься независимо от приема пищи. ПРАДАКСА следует проглатывать целиком и запивать стаканом воды, чтобы облегчить попадание лекарственного средства в желудок.
Пациенты должны быть проинструктированы о том, что капсулу нельзя вскрывать, т.к. это может увеличить риск кровотечения.
Рекомендации по извлечению капсул из блистера
— Оторвите одну ячейку с капсулой от блистера по перфорированной линии.
— Выньте капсулу из блистера, отслаивая фольгу.
— Не выдавливайте капсулу через фольгу.
— Удаляйте фольгу настолько, чтобы было удобно извлечь капсулу.
Была проведена оценка безопасности ПРАДАКСА в десяти испытаниях фазы III, включавших 23393 пациента, принимавших ПРАДАКСА (см. таблицу 5).
Таблица 5 Количество испытуемых пациентов, максимальная суточная доза в испытаниях фазы III
|
Показание |
Количество испытуемых пациентов, принимавших ПРАДАКСА |
Максимальная суточная доза |
|
Первичная профилактика венозных тромбоэмболий при ортопедических операциях |
6684 | 220 мг |
|
Профилактика инсульта и системной эмболии у пациентов с фибрилляцией предсердий |
6059 5983 |
300 мг 220 мг |
| Лечение тромбоза глубоких вен/легочной эмболии (RE-COVER, RE-COVER II) | 2553 | 300 мг |
|
Профилактика тромбоза глубоких вен/легочной эмболии (RE-MEDY, RE-SONATE) |
2114 | 300 мг |
Нежелательные реакции наблюдались у около 9% пациентов после операции эндопротезирования тазобедренного или коленного суставов (краткосрочное лечение в течение до 42 дней), 22% пациентов с фибрилляцией предсердий, проходивших лечение по профилактике инсульта и системной эмболии (долговременное лечение в течение до 3 лет), 14% пациентов, принимавших лекарственное средство для лечения тромбоза глубоких вен/легочной эмболии, и 15% пациентов, проходивших лечение с целью профилактики тромбоза глубоких вен/легочной эмболии.
Кровотечение – наиболее часто сообщаемое нежелательное явление, которое наблюдалось приблизительно у 14% пациентов, проходящих краткосрочное лечение после плановой операции эндопротезирования тазобедренного или коленного суставов, 16,6% пациентов с фибрилляцией предсердий, принимавших лекарственное средство для профилактики инсульта и системной эмболии и 14,4% пациентов, принимавших лекарственное средство для лечения тромбоза глубоких вен/легочной эмболии. Кроме того, кровотечение развивалось у 19,4% пациентов в испытании RE-MEDY по профилактике тромбоза глубоких вен/легочной эмболии и у 10,5% пациентов в испытании RE-SONATE по профилактике тромбоза глубоких вен/легочной эмболии.
В связи с тем, что популяции пациентов, принимавших лекарственное средство по каким-либо из трех показаний, не сопоставимы, а случаи кровотечений распространяются на несколько системно-органных классов (СОК), сведения о больших и других кровотечениях приводятся в таблицах 6-11 в зависимости от показания к применению. Редко случающиеся в ходе клинических испытаний серьезные или тяжелые кровотечения вне зависимости от локализации могут привести к потере трудоспособности, могут быть угрожающими жизни или даже привести к летальному исходу.
Резюме в форме таблицы нежелательных реакций
В таблице 6 представлены нежелательные реакции, выявленные в испытаниях по первичной профилактике ВТЭ после операции эндопротезирования тазобедренного или коленного суставов, испытании по профилактике тромбоэмболического инсульта и системной эмболии у пациентов с фибрилляцией предсердий и испытаниях по лечению и профилактике тромбоза глубоких вен/легочной эмболии. Нежелательные реакции классифицированы по системно-органным классам (СОК) и частоте, указанной как: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000), частота неизвестна (на основании имеющихся данных оценить невозможно).
Таблица 6 Нежелательные реакции
| Частота | |||
| Системно-органный класс (СОК)/ предпочитаемый термин |
Первичная профилактика венозных тромбоэмболий после операций эндопротезирования тазобедренного или коленного суставов |
Профилактика инсульта и системной эмболии у пациентов с фибрилляцией предсердий |
Лечение тромбоза глубоких вен/легочной эмболии и профилактика тромбоза глубоких вен/легочной эмболии |
| Нарушения со стороны крови и лимфатической системы |
|||
| анемия | нечасто | часто | нечасто |
| снижение гемоглобина | часто | нечасто | частота неизвестна |
| тромбоцитопения | редко | нечасто | редко |
| снижение гематокрита | нечасто | редко | частота неизвестна |
| Нарушения со стороны иммунной системы | |||
| повышенная чувствительность |
нечасто | нечасто | нечасто |
| сыпь | редко | нечасто | нечасто |
| зуд | редко | нечасто | нечасто |
| анафилактическая реакция | редко | редко | редко |
| ангионевротический отек | редко | редко | редко |
| крапивница | редко | редко | редко |
| бронхоспазм | частота неизвестна |
частота неизвестна |
частота неизвестна |
| Нарушения со стороны нервной системы |
|||
| интракраниальное кровоизлияние |
редко | нечасто | редко |
| Нарушения со стороны сосудов |
|||
| гематома | нечасто | нечасто | нечасто |
| кровотечение | редко | нечасто | нечасто |
| кровотечение из раны | нечасто | — | — |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|||
| носовое кровотечение | нечасто | часто | часто |
| кровохарканье | редко | нечасто | нечасто |
| Желудочно-кишечные нарушения |
|||
| желудочно-кишечное кровотечение |
нечасто | часто | часто |
| боль в животе | редко | часто | нечасто |
| диарея | нечасто | часто | нечасто |
| диспепсия | редко | часто | часто |
| тошнота | нечасто | часто | нечасто |
| ректальное кровотечение | нечасто | нечасто | часто |
| геморроидальное кровотечение | нечасто | нечасто | нечасто |
| язва желудка и двенадцатиперстной кишки, включая эзофагит |
редко | нечасто | нечасто |
| гастроэзофагит | редко | нечасто | нечасто |
| гастроэзофагеальный рефлюкс | редко | нечасто | нечасто |
| рвота | нечасто | нечасто | нечасто |
| дисфагия | редко | нечасто | редко |
| Нарушения со стороны печени и желчевыводящих путей |
|||
| нарушение функции печени/ отклонения функциональных проб печени |
часто | нечасто | нечасто |
| повышение АЛТ (аланинаминотрансфераза) | нечасто | нечасто | нечасто |
| повышение ACT (аспартатаминотрансфераза) | нечасто | нечасто | нечасто |
| повышение печеночных ферментов |
нечасто | редко | нечасто |
| гипербилирубинемия | нечасто | редко | частота неизвестна |
| Нарушения со стороны кожи и подкожных тканей |
|||
| кожные геморрагии | нечасто | часто | часто |
| Нарушения со стороны мышечной, скелетной и соединительной ткани |
|||
| гемартроз | нечасто | редко | нечасто |
| Нарушения со стороны почек и мочевыводящих путей |
|||
| кровотечение из мочеполовой системы, включая гематурию |
нечасто | часто | часто |
| Общие нарушения и реакции в месте введения |
|||
| кровотечение в месте введения |
редко | редко | редко |
| кровотечение в месте катетеризации | редко | редко | редко |
| кровянистые выделения | редко | — | — |
| Травмы, интоксикации и осложнения процедур |
|||
| травматическое кровотечение |
нечасто | редко | нечасто |
| кровотечение из места разреза | редко | редко | редко |
| послеоперационная гематома | нечасто | — | — |
| послеоперационное кровотечение | нечасто | — | — |
| послеоперационная анемия | редко | — | — |
| послеоперационные выделения | нечасто | — | — |
| выделения из раны | нечасто | — | — |
| Хирургические и медицинские процедуры |
|||
| дренирование раны | редко | — | — |
| послеоперационный дренаж | редко | — | — |
Описание отдельных нежелательных реакций
Кровотечение
Вследствие фармакологического механизма действия, прием ПРАДАКСА может ассоциироваться с повышением риска скрытого или явного кровотечения в любых органах и тканях. Признаки, симптомы и тяжесть (включая летальный исход) могут варьироваться в зависимости от места, степени или выраженности кровотечения и/или анемии. В клинических испытаниях кровотечения из слизистых (например, желудочно-кишечные, мочеполовые) наблюдались чаще во время длительного лечения ПРАДАКСА по сравнению с лечением антагонистом витамина К. Таким образом, для обнаружения скрытых кровотечений дополнительно к адекватному клиническому наблюдению могут быть рекомендованы лабораторные исследования гемоглобина/гематокрита. Риск кровотечений может повышаться в некоторых группах пациентов, например, у пациентов со средним нарушением функции почек и/или при одновременном приеме препаратов, влияющих на гемостаз, или сильных ингибиторов Р-гликопротеина. Геморрагические осложнения могут проявляться как слабость, бледность, головокружение, головная боль или необъяснимый отек, одышка и необъяснимый шок.
При приеме ПРАДАКСА были зарегистрированы известные осложнения кровотечений, такие как синдром сдавления и острая почечная недостаточность в связи с гипоперфузией. Таким образом, следует учитывать возможность кровотечения при оценке состояния принимающего любые антикоагулянты пациента. В случае неконтролируемого кровотечения может применяться специфический агент обратного действия для дабигатрана (идаруцизумаб).
Первичная профилактика венозных тромбоэмболий после ортопедических операций
В таблице 7 представлено количество пациентов (%) со случаями кровотечения во время приема лекарственного средства для профилактики ВТЭ в двух базовых клинических испытаниях в зависимости от дозы.
Таблица 7 Количество пациентов (%) со случаями кровотечения
| ПРАДАКСА 150 мг однократно в сутки N (%) | ПРАДАКСА 220 мг однократно в сутки N (%) | Эноксапарин N (%) | |
| Количество пациентов | 1866 (100,0) | 1825 (100,0) | 1848 (100,0) |
| Большие кровотечения | 24 (1,3) | 33 (1,8) | 27 (1,5) |
| Другие кровотечения | 258 (13,8) | 251 (13,8) | 247 (13,4) |
Профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска
В таблице 8 представлены данные по случаям кровотечений, подразделенным на большие кровотечения и другие кровотечения, полученные в базовом испытании по профилактике инсульта и системной эмболии у пациентов с фибрилляцией предсердий.
Таблица 8 Данные по случаям кровотечений, подразделенным на большие кровотечения и другие кровотечения, полученные в базовом испытании по профилактике инсульта и системной эмболии у пациентов с фибрилляцией предсердий
| ПРАДАКСА 110 мг два раза в сутки | ПРАДАКСА 150 мг два раза в сутки | Варфарин | |
| Количество пациентов | 6015 | 6076 | 6022 |
| Большие кровотечения | 347 (2,92%) | 409 (3,40%) | 426 (3,61%) |
| Интракраниальное кровотечение | 27 (0,23%) | 39 (0,32%) | 91 (0,77%) |
| Желудочно-кишечное кровотечение | 134 (1,13%) | 192 (1,60%) | 128 (1,09%) |
| Летальное кровотечение | 26 (0,22%) | 30 (0,25%) | 42 (0,36%) |
| Незначительное кровотечение | 1566 (13,16%) | 1787 (14,85%) | 1931 (16,37%) |
| Другие кровотечения | 1759 (14,78%) | 1997 (16,60%) | 2169 (18,39%) |
У пациентов, рандомизированных в группы ПРАДАКСА, принимавших по 110 мг два. раза в сутки или 150 мг два раза в сутки, риск развития угрожающих жизни кровотечений и интракраниального кровотечения был значительно ниже по сравнению с пациентами, принимавшими варфарин (р <0,05). Обе дозировки ПРАДАКСА статистически значительно реже приводили к развитию кровотечений. У пациентов, принимавших ПРАДАКСА по 110 мг два раза в сутки, риск возникновения серьезных кровотечений значительно ниже по сравнению с пациентами, принимавшими варфарин (относительный риск 0,81; р=0,0027). У пациентов, принимавших ПРАДАКСА по 150 мг два раза в сутки, риск развития большого желудочно-кишечного кровотечения был существенно выше по сравнению с варфарином (относительный риск 1,48; р=0,0005). Данный эффект в основном наблюдался у пациентов ≥75 лет.
Клиническое преимущество дабигатрана в отношении профилактики инсульта и системной эмболии и сниженный риск интракраниальных кровоизлияний в сравнении с варфарином наблюдались во всех индивидуальных подгруппах, например, нарушения функции почек, возраст, одновременный прием антиагрегантов или ингибиторов Р-гликопротеина. При том, что в определенных подгруппах пациентов повышен риск развития больших кровотечений при приеме антикоагулянтов, превышение риска кровотечения для дабигатрана связан с желудочно-кишечными кровотечениями, которые в основном наблюдались в течение первых 3-6 месяцев после начала терапии ПРАДАКСА.
Лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых
В таблице 9 представлены сводные данные по случаям кровотечений, полученные в объединенных базовых испытаниях RE-COVER и RE-COVER II по изучению лечения тромбоза глубоких вен и легочной эмболии. При объединении результатов данных испытаний первичные конечные точки безопасности (большое кровотечение, большое или клинически значимое кровотечение и другое кровотечение) отмечались существенно реже, чем у варфарина при номинальном уровне значимости 5%.
Таблица 9 Данные по случаям кровотечений, полученные в испытаниях RE-COVER и RE-COVER II по изучению лечения тромбоза глубоких вен и легочной эмболии
| ПРАДАКСА 150 мг два раза в сутки | Варфарин |
Отношение рисков в сравнении с варфарином (95% доверительный интервал) |
|
| Количество пациентов, включенных в анализ безопасности | 2456 | 2462 | |
| Большие кровотечения | 24 (1,0%) | 40 (1,6%) | 0,60 (0,36, 0,99) |
| Интракраниальное кровотечение | 2 (0,1%) | 4 (0,2%) | 0,50 (0,09, 2,74) |
| Большое желудочно-кишечное кровотечение | 10 (0,4%) | 12 (0,5%) | 0,83 (0,36, 1,93) |
| Кровотечение, угрожающее жизни | 4 (0,2%) | 6 (0,2%) | 0,66 (0,19, 2,36) |
|
Большие кровотечения/клинически значимые кровотечения |
109 (4,4%) | 189 (7,7%) | 0,56 (0,45, 0,71) |
| Другие кровотечения | 354 (14,4%) | 503 (20,4%) | 0,67 (0,59, 0,77) |
| Другое желудочно-кишечное кровотечение | 70 (2,9%) | 55 (2,2%) | 1,27 (0,90, 1,82) |
Учитывались случаи кровотечений при применении обоих лекарственных средств (ПРАДАКСА и варфарин), начиная с первого приема дабигатрана этексилат или варфарина после прекращения парентеральной терапии (только период пероральной терапии). Таким образом, рассматривались все случаи кровотечений, возникавшие во время терапии ПРАДАКСА, а также во время применения варфарина, за исключением кровотечений, наблюдавшихся в период перехода с терапии варфарином на терапию парентеральными средствами.
В таблице 10 представлены данные по случаям кровотечений, полученные в базовом испытании RE-MEDY по профилактике тромбоза глубоких вен и легочной эмболии. Некоторые кровотечения (большое или клинически значимое кровотечение, другое кровотечение) отмечались существенно реже при номинальном уровне значимости 5% у пациентов, принимавших ПРАДАКСА, в сравнении с пациентами, принимавшими варфарин.
Таблица 10 Данные по случаям кровотечений, полученные в RE-MEDY по профилактике тромбоза глубоких вен и легочной эмболии
| ПРАДАКСА 150 мг два раза в сутки | Варфарин |
Отношение рисков в сравнении с варфарином (95% доверительный интервал) |
|
|
Количество пациентов, включенных в анализ безопасности |
1430 | 1426 | |
| Большие кровотечения | 13 (0,9%) | 25 (1,8%) | 0,54 (0,25, 1,16) |
| Интракраниальное кровотечение | 2 (0,1%) | 4 (0,3%) | Не рассчитывается* |
| Большое желудочно-кишечное кровотечение | 4 (0,3%) | 8 (0,5%) | Не рассчитывается* |
| Кровотечение, угрожающее жизни | 1 (0,1%) | 3 (0,2%) | Не рассчитывается* |
|
Большие кровотечения/клинически значимые кровотечения |
80 (5,6%) | 145 (10,2%) | 0,55 (0,41, 0,72) |
| Другие кровотечения | 278 (19,4%) | 373 (26,2%) | 0,71 (0,61, 0,83) |
| Другое желудочно-кишечное кровотечение | 45 (3,1%) | 32 (2,2%) | 1,39 (0,87, 2,20) |
* Отношение рисков не может быть оценено, т.к. нет случая в какой-либо из групп лечения.
В таблице 11 представлены данные по случаям кровотечений, полученные в базовом испытании RE-SONATE по профилактике тромбоза глубоких вен и легочной эмболии. Некоторые кровотечения (большое или клинически значимое кровотечение, другое кровотечение) отмечались существенно реже при номинальном уровне значимости 5% у пациентов, принимавших ПРАДАКСА, в сравнении с пациентами, принимавшими плацебо.
Таблица 11 Данные по случаям кровотечений, полученный в испытании RE-SONATE по профилактике тромбоза глубоких вен и легочной эмболии
| ПРАДАКСА 150 мг два раза в сутки | Плацебо |
Отношение рисков в сравнении с плацебо (95% доверительный интервал) |
|
|
Количество пациентов, включенных в анализ безопасности |
684 | 659 | |
| Большие кровотечения | 2 (0,3%) | 0 | Не рассчитывается* |
| Интракраниальное кровотечение | 0 | 0 | Не рассчитывается* |
| Большое желудочно-кишечное кровотечение | 2 (0,3%) | 0 | Не рассчитывается* |
| Кровотечение, угрожающее жизни | 0 | 0 | Не рассчитывается* |
|
Большие кровотечения/клинически значимые кровотечения |
36 (5,3%) | 13 (2,0%) | 2,69 (1,43, 5,07) |
| Другие кровотечения | 72 (10,5%) | 40 (6,1%) | 1,77 (1,20, 2,61) |
| Другое желудочно-кишечное кровотечение | 5 (0,7%) | 2 (0,3%) | 2,38 (0,46, 12,27) |
* Отношение рисков не может быть оценено, т.к. нет случая в какой-либо из групп лечения.
Дети (лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых)
В клиническом испытании 1160.88 перорально начальную дозу дабигатрана этексилата 1,71 (±10%) мг/кг массы тела получили всего 9 подростков (возраст от 12 до <18 лет) с диагнозом первичная ВТЭ.
Исходя из концентраций дабигатрана, полученных с помощью определения разбавленного тромбинового времени, и клинической оценки, доза была скорректирована до целевой дозы дабигатрана этексилата 2,14 (±10%) мг/кг массы тела. Во время терапии у 2 (22,1%) пациентов наблюдались легкие, связанные с дабигатрана этексилатом, нежелательные явления (гастроэзафагеальный рефлюкс/боль в животе; дискомфорт в желудке), у 1 (11,1%) пациента через более 3 дней после отмены дабигатрана этексилата сообщалось о серьезном нежелательном явлении, не связанном с лечением (рецидив венозной тромбоэмболии вен ноги).
• Повышенная чувствительность к действующему веществу или к какому-либо из вспомогательных веществ.
• Тяжелое нарушение функции почек (клиренс креатинина <30 мл/мин.).
• Активное клинически значимое кровотечение.
• Нарушения или состояния, которые рассматриваются как существенный фактор риска большого кровотечения. Данные нарушения или состояния могут включать следующие расстройства: имеющаяся или недавняя язва желудочно-кишечного тракта, злокачественные новообразования с высоким риском кровотечения, недавнее повреждение головного или спинного мозга, недавняя операция на головном мозге, позвоночнике, офтальмологическая операция, недавнее интракраниальное кровоизлияние, диагностированный или подозреваемый варикоз вен пищевода, артериовенозная мальформация, аневризмы сосудов или серьезные интраспинальные или интрацеребральные сосудистые нарушения.
• Одновременный прием с каким-либо антикоагулянтом, например, нефракционированным гепарином (НФГ), низкомолекулярными гепаринами (эноксапарин, дальтепарин и др.), производными гепарина (фондапаринукс и др.), пероральными антикоагулянтами (варфарин, ривароксабан, апиксабан и др.) за исключением особых случаев: это изменение антикоагулянтной терапии, при применении НФГ в дозах, необходимых для поддержания функционирования центрального венозного или артериального катетера, или при применении НФГ во время катетерной абляции при фибрилляции предсердий.
• Нарушение функции печени или заболевание печени, которое может оказать влияние на выживаемость.
• Сопутствующее системное лечение следующими сильными ингибиторами Р-гликопротеина: кетоконазолом, циклоспорином, итраконазолом и дронедароном.
• Протезированные клапаны сердца при необходимости антикоагулянтного лечения.
Применение ПРАДАКСА в дозах, превышающих рекомендованные, подвергает пациента повышенному риску кровотечения.
При подозрении передозировки для установления риска кровотечения может помочь определение антикоагулянтной активности. Стандартизированный количественный анализ разбавленного ТВ или повторные определения разбавленного ТВ позволяют предположить время достижения определенной концентрации дабигатрана, кроме того, можно предпринять дополнительные меры, например, можно провести диализ.
Чрезмерная антикоагуляция может потребовать прекращение приема ПРАДАКСА. Учитывая, что основной путь выведения дабигатрана через почки, рекомендуется поддерживать адекватный диурез. В связи с низкой способностью связываться с белками плазмы крови, дабигатран выводится при диализе, однако в клинических испытаниях имеется ограниченный опыт использования диализа в такой ситуации (см. раздел «Фармакокинетика).
Меры при осложнениях кровотечения
В случае развития осложнений кровотечения лечение ПРАДАКСА должно быть прекращено для выяснения источника кровотечения. В зависимости от клинической ситуации должно быть проведено соответствующее поддерживающее лечение, например, хирургический гемостаз и восполнение объема циркулирующей крови по усмотрению врача.
В ситуациях, когда требуется быстрое ингибирование антикоагулянтного эффекта ПРАДАКСА возможно использование специфического агента обратного действия (ПРАКСБАЙНД, идаруцизумаб), являющегося антагонистом фармакодинамического эффекта ПРАДАКСА (см. раздел «Меры предосторожности»).
Может быть рассмотрена возможность применения концентратов факторов свертывания (активированных или неактивированных) или рекомбинантного фактора VIIa.
Существуют некоторые экспериментальные доказательства в поддержку роли этих средств в обратимости антикоагулянтного эффекта дабигатрана, но данные о пользе их назначения в клинических условиях, а также о возможном риске тромбоэмболии существенно ограничены. При назначении указанных лекарственных средств результаты
тестов по оценке системы свертывания могут быть недостоверными. Следует проявлять осторожность при их интерпретации. Также следует соблюдать осторожность при рассмотрении возможности назначения концентратов тромбоцитов в случаях, когда присутствует тромбоцитопения, или были использованы антитромбоцитарные лекарственные средства пролонгированного действия. Все симптоматическое лечение должно назначаться врачом.
В зависимости от доступности в конкретном регионе следует рассмотреть возможность консультации эксперта гематолога в случае развития большого кровотечения.
Риск развития кровотечения
ПРАДАКСА следует применять с осторожностью при повышенном риске развития кровотечения, или при одновременном применении лекарственных средств, влияющих на гемостаз посредством ингибирования агрегации тромбоцитов. Во время лечения ПРАДАКСА кровотечения могут возникать в любом месте. При снижении уровня гемоглобина и/или гематокрита или снижении артериального давления по неизвестной причине необходимо начать поиск места кровотечения.
В ситуациях с жизнеугрожающим или неконтролируемым кровотечением, когда требуется быстрое блокирование антикоагулянтного эффекта дабигатрана, может применяться специфический агент обратного действия (ПРАКСБАЙНД, идаруцизумаб).
В клинических испытаниях ПРАДАКСА ассоциировалось с более частыми большими желудочно-кишечными кровотечениями. Повышенный риск наблюдался при приеме ПРАДАКСА 150 мг два раза в сутки пожилыми пациентами (≥75 лет). К другим факторам риска (см. также таблицу 12) относится сопутствующее лечение ингибиторами агрегации тромбоцитов, таких как клопидогрел, ацетилсалициловая кислота или нестероидные противовоспалительные средства (НПВС), а также наличие эзофагита, гастрита или гастроэзофагеального рефлюкса.
Факторы риска
В таблице 12 приводятся факторы, способствующие повышению риска кровотечения.
Таблица 12 Факторы, способствующие повышению риска кровотечения
| Фармакодинамические и кинетические факторы |
Возраст ≥75 лет |
| Факторы, повышающие концентрацию дабигатрана в плазме крови |
Существенные: • Нарушение функции почек средней степени тяжести (клиренс креатинина 30-50 мл/мин.) • Сильные ингибиторы Р-гликопротеина (см. разделы «Противопоказания» и «Взаимодействие с другими лекарственными средствами») • Одновременное применение ингибиторов Р-гликопротеина от легких до умеренных (например, амиодарон, верапамил, хинидин и тикагрелор; см. раздел «Взаимодействие с другими лекарственными средствами») Менее существенные: • Масса тела менее 50 кг |
| Фармакодинамическое взаимодействие (см. раздел «Взаимодействие с другими лекарственными средствами») |
• Ацетилсалициловая кислота и другие ингибиторы агрегации тромбоцитов, например, клопидогрел • НПВС • СИОЗС или СИОЗСиН • Другие лекарственные средства, влияющие на гемостаз |
| Заболевания/процедуры с особым риском кровотечения |
• Врожденные или приобретенные нарушения свертываемости крови • Тромбоцитопения или функциональные дефекты тромбоцитов • Недавняя биопсия или серьезная травма • Бактериальный эндокардит • Эзофагит, гастрит или гастроэзофагеальный рефлюкс |
Имеются ограниченные данные применения у пациентов с массой тела менее 50 кг.
Меры предосторожности и управление риском кровотечения
Меры при осложнениях кровотечений см. также в разделе «Передозировка».
Оценка польза/риск
При наличии повреждений, состояний, процедур и/или фармакологического лечения (НПВС, антиагреганты, СИОЗС и СИОЗСиН), существенно повышающих риск большого кровотечения, требуется тщательная оценка соотношения польза/риск. ПРАДАКСА следует назначать, если польза от применения лекарственного средства превышает риск кровотечения.
Тщательное клиническое наблюдение
Рекомендуется тщательное наблюдение за признаками кровотечения или анемии в течение всего периода лечения, особенно при сочетании факторов риска (см. таблицу 12). Особую осторожность следует проявлять при приеме ПРАДАКСА совместно с верапамилом, амиодароном, хинидином или кларитромицином (ингибиторы Р-гликопротеина), прежде всего при возникновении кровотечений в частности у пациентов с легким или средним нарушением функции почек.
Рекомендуется тщательное наблюдение за признаками кровотечения у пациентов, одновременно получающих НПВС.
Прекращение приема ПРАДАКСА
Пациенты, у которых развивается острая почечная недостаточность, должны прекратить прием ПРАДАКСА.
При развитии тяжелых кровотечений лечение должно быть прекращено и обнаружен источник кровотечения. Можно рассмотреть использование специфического агента обратного действия для ПРАДАКСА (идаруцизумаб) (см. подраздел «Комплекс мероприятий при осложнении кровотечений»).
Снижение дозы
Снижение дозы рекомендуется, как указано в разделе «Способ применения и дозы».
Использование ингибиторов протонной помпы
Для предотвращения желудочно-кишечного кровотечения следует рассмотреть применение ингибиторов протонной помпы.
Лабораторные параметры свертываемости крови
Несмотря на то, что применение ПPАДАКСА не требует рутинного мониторинга антикоагулянтного лечения, определение антикоагулянтной активности, связанной с дабигатраном, может помочь обнаружить повышенную экспозицию дабигатрана при наличии дополнительных факторов риска.
Разбавленное тромбиновое время (разбавленное ТВ), экариновое время свертывания (ЭВС) и активированное частичное тромбопластиновое время (АЧТВ) могут предоставить полезную информацию, однако результаты следует интерпретировать с осторожностью в связи с вариабельностью между тестами. Тест МНО (международное нормализованное отношение) недостоверен у пациентов, принимающих ПРАДАКСА, имеются сообщения о ложном увеличении МНО. Поэтому выполнять тест МНО не нужно.
В таблице 13 приводятся пороговые значения результатов определения антикоагулянтной активности при минимальной концентрации лекарственного средства, которые могут ассоциироваться с повышенным риском развития кровотечения.
Таблица 13 Результаты определения антикоагулянтной активности при минимальной концентрации препарата, которые могут ассоциироваться с повышенным риском кровотечения
| Тест (минимальное значение) | Показание к применению | |
|
Первичная профилактика венозной тромбоэмболии после ортопедических операций |
Профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска, лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых |
|
| Разбавленное ТВ (нг/мл) | >67 | >200 |
| ЭВС (превышение верхней границы нормы, раз) | Данных нет | >3 |
| АЧТВ (превышение верхней границы нормы, раз) | >1,3 | >2 |
| МНО | Не нужно проводить | Не нужно проводить |
Применение фибринолитических средств для лечения острого ишемического инсульта
Применение фибринолитических средств для лечения острого ишемического инсульта можно рассматривать, если у пациента показатели разбавленного тромбинового времени, экаринового времени свертывания или активированного частичного тромбопластинового времени не превышают верхнюю границу нормы в соответствии с локальной системой измерения результатов.
Хирургические операции и вмешательства
У пациентов, принимающих ПРАДАКСА после хирургической операции или инвазивных процедур, повышен риск развития кровотечения. В связи с этим может потребоваться временное прекращение приема ПРАДАКСА.
Пациенты могут продолжать прием ПРАДАКСА при проведении кардиоверсии. Данные о проведении катетерной абляции при фибрилляции предсердий у пациентов при режиме дозирования ПРАДАКСА 110 мг два раза в сутки отсутствуют.
Следует соблюдать осторожность при временном прекращении лечения в связи с оперативными вмешательствами, в таких случаях рекомендуется мониторинг антикоагулянтного лечения. Клиренс дабигатрана у пациентов с почечной недостаточностью может увеличиваться. Это следует заранее учитывать при назначении любых процедур. В таких случаях тест на коагуляцию (см. разделы «Фармакодинамика» и «Меры предосторожности») может помочь определить, есть ли нарушение гемостаза.
Экстренная хирургия или процедуры
Применение ПРАДАКСА должно быть временно прекращено. При необходимости быстрого прекращения эффекта антикоагулянта для ПРАДАКСА существует специфический агент обратного действия (ПРАКСБАЙНД, идаруцизумаб).
Терапия, направленная на блокирование действия дабигатрана, подвергает пациентов тромботическому риску в связи с основным заболеванием.
Лечение ПРАДАКСА можно возобновить через 24 часа после введения ПРАКСБАЙНД (идаруцизумаб), если пациент клинически стабилен, и был достигнут адекватный гемостаз.
Неотложная хирургия/вмешательства
Применение ПРАДАКСА должно быть временно прекращено. Операция/вмешательство должно быть, по возможности, отложено минимально на 12 часов после приема последней дозы. Если оперативное вмешательство не может быть отложено, риск кровотечения может повышаться. Данный риск кровотечения следует соизмерять со срочностью вмешательства.
Плановая хирургия
По возможности, необходимо отменить ПРАДАКСА как минимум за 24 часа до инвазивной или хирургической процедуры. У пациентов с повышенным риском кровотечения или при серьезной операции, когда может потребоваться полный гемостаз, следует рассмотреть возможность прекращения приема ПРАДАКСА за 2-4 дня до операции.
Рекомендации по отмене приема ПРАДАКСА до инвазивных и хирургических процедур представлены в таблице 14.
Таблица 14 Рекомендации по отмене приема ПРАДАКСА до инвазивных и хирургических процедур
| Почечная функция (КК в мл/мин.) | Предполагаемый период полувыведения (часы) |
Прием ПРАДАКСА следует прекратить до плановой операции |
|
| Высокий риск кровотечения или серьезная операция | Стандартный риск | ||
| ≥80 | ~13 | за 2 дня | за 24 часа |
| ≥50 — <80 | ~15 | за 2-3 дня | за 1-2 дня |
| ≥30 — <50 | ~18 | за 4 дня | за 2-3 дня (>48 часов) |
Спинальная анестезия/эпидуралъная анестезия/люмбальная пункция
Такая процедура, как спинальная анестезия, может потребовать адекватного гемостаза. Риск спинальной или эпидуральной гематомы может повышаться в случаях травматичной или повторной пункции, а также при длительном использовании эпидуральных катетеров. После удаления катетера прием первой дозы ПРАДАКСА следует отложить минимум на два часа. Такие пациенты требуют регулярного контроля неврологических симптомов возможного развития спинальной или эпидуральной гематомы.
Послеоперационный период
После инвазивной процедуры или хирургического вмешательства следует как можно быстрее возобновить или начать прием ПРАДАКСА, если позволяет клиническая ситуация, и был достигнут адекватный гемостаз.
Назначать лекарственное средство пациентам с риском развития кровотечения или пациентам с риском повышенного эффекта дабигатрана, в особенности пациентам с нарушением функции почек средней степени тяжести (клиренс креатинина 30-50 мл/мин.) следует с осторожностью.
Пациенты с высоким риском летального исхода во время операции и наличием факторов риска тромбоэмболических осложнений
Данные по эффективности и безопасности ПРАДАКСА для таких пациентов ограничены, лекарственное средство следует назначать с осторожностью.
Операции при переломе бедра
Данные по применению ПРАДАКСА у пациентов, подвергшихся операции при переломе бедра, отсутствуют. Применение ПРАДАКСА не рекомендуется.
Нарушение функции печени
Пациенты с уровнем печеночных ферментов, превышавшем в 2 раза верхнюю границу нормы, исключались из основных испытаний. Опыт клинического применения лекарственного средства у данных пациентов отсутствует. ПРАДАКСА не рекомендуется для применения у данной популяции пациентов. Нарушение функции печени или заболевание печени, которое может оказать влияние на выживаемость, — являются противопоказанием.
Взаимодействие с индукторами Р-гликопротеина
Одновременное применение с индукторами Р-гликопротеина следует избегать, т.к. данные комбинации могут привести к снижению концентрации дабигатрана в плазме крови.
Инфаркт миокарда
В испытании фазы III RE-LY (профилактика инсульта и системной эмболии у взрослых пациентов с неклапанной фибрилляцией предсердий с одним или несколькими факторами риска) частота встречаемости инфаркта миокарда составила 0,82, 0,81 и 0,64%/год в группе дабигатрана этексилата 110 мг два раза в сутки, дабигатрана этексилата 150 мг два раза в сутки и варфарина соответственно; относительный риск для дабигатрана увеличивался на 29% и 27% по сравнению с варфарином. Независимо от терапии наибольший абсолютный риск инфаркта миокарда наблюдался в следующих подгруппах со схожим относительным риском: пациенты с предшествующим инфарктом миокарда, пациенты ≥65 лет с сахарным диабетом или ишемической болезнью сердца, пациенты с фракцией выброса левого желудочка <40%, а также пациенты с нарушением функции почек средней степени тяжести. Кроме того, более высокий риск инфаркта миокарда был выявлен у пациентов одновременно принимающих ацетилсалициловую кислоту и клопидогрел или только клопидогрел.
В трех испытаниях с активным контролем фазы III (лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной
эмболии у взрослых) у пациентов, принимавших дабигатрана этексилат, был выявлен более высокий риск инфаркта миокарда по сравнению с пациентами, принимавшими варфарин: 0,4% в сравнении с 0,2% в непродолжительных испытаниях RE-COVER и RE-COVER II и 0,8% в сравнении с 0,1% в длительном испытании RE-MEDY. В данном испытании увеличение было статистически значимым (р=0,022).
В испытании RE-SONATE, в котором проводилось сравнение дабигатрана этекссилата и плацебо, риск ИМ составил 0,1% у пациентов, принимавших дабигатрана этексилат и 0,2% у пациентов, принимавших плацебо.
Пациенты с раком в активной форме (лечение тромбоза глубоких вен и легочной эмболии, профилактика рецидивирующих тромбоза глубоких вен и легочной эмболии у взрослых)
Эффективность и безопасность лекарственного средства при лечении тромбоза глубоких вен/легочной эмболии у пациентов с раком в активной форме не установлены.
Женщинам репродуктивного возраста следует избегать беременности при приеме ПРАДАКСА.
Беременность
Данные о применении ПРАДАКСА во время беременности ограничены. Испытания на животных продемонстрировали репродуктивную токсичность. Потенциальный риск для человека не установлен.
ПРАДАКСА не следует применять во время беременности, за исключением случаев крайней необходимости.
Лактация
Клинические данные об эффекте дабигатрана на новорожденных при грудном вскармливании отсутствуют.
Грудное вскармливание во время применения ПРАДАКСА следует прекратить.
Фертильность
Клинические данные отсутствуют.
В испытаниях на животных влияние на фертильность самок проявлялось в форме уменьшения имплантаций и увеличения доимплантационной потери при введении дозы 70 мг/кг (что в 5 раз выше концентрации в плазме крови у пациентов). Других эффектов на фертильность самок не наблюдалось. Влияние на фертильность самцов не обнаружено. При токсичных дозах для самок (в 5-10 раз выше концентрации в плазме крови у пациентов) у крыс и кроликов наблюдалось уменьшение массы тела плода и снижение эмбриофетальной выживаемости, а также увеличение изменчивости плодов. В испытании в пренатальный и постнатальный периоды наблюдалось увеличение смертности плодов при дозах, которые были токсичны для самок (доза в 4 раза выше концентрации в плазме крови у пациентов).
ПРАДАКСА не оказывает или оказывает незначительное воздействие на способность управлять транспортными средствами и работать с механизмами.
Взаимодействие с транспортерами
Дабигатрана этексилат является субстратом для эффлюкс-транспортеров Р-гликопротеина. Одновременное применение ингибиторов Р-гликопротеина (см. таблицу 15) может привести к повышению концентрации дабигатрана в плазме крови.
Если не указано иначе, требуется тщательное клиническое наблюдение (симптомов кровотечения или анемии) при одновременном применении дабигатрана и сильных ингибиторов Р-гликопротеина. При одновременном приеме с некоторыми ингибиторами Р-гликопротеина, может потребоваться снижение дозы (см. разделы «Фармакодинамика», «Способ применения и дозы», «Противопоказания» и «Меры предосторожности»»).
Таблица 15 Взаимодействие с транспортерами
| Ингибиторы Р-гликопротеина | |
| Одновременное применение противопоказано |
|
| Кетоконазол | Кетоконазол после приема однократной дозы в 400 мг увеличивал значения AUC0-∞ и Сmax общего дабигатрана в 2,38 и 2,35 раз соответственно, а после многократного приема кетоконазола в дозе 400 мг один раз в сутки – в 2,53 и 2,49 раз соответственно. |
| Дронедарон | При одновременном приеме дабигатрана этексилата и дронедарона многократно по 400 мг два раза в сутки значения AUC0-∞ и Сmax дабигатрана увеличивались в 2,4 и 2,3 раза соответственно; после однократного приема 400 мг дронедарона – в 2,1 и 1,9 раз соответственно. |
| Итраконазол, циклоспорин | Согласно результатам, полученным in vitro, может ожидаться эффект, схожий с кетоконазолом. |
| Одновременное применение не рекомендовано |
|
| Такролимус | Такролимус in vitro оказывает схожее ингибирующее действие на Р-гликопротеин, как и итраконазол и циклоспорин. Применение дабигатрана этексилата с такролимусом клинически не изучалось. Однако ограниченные клинические данные об опыте применения с другим субстратом Р-гликопротеина (эверолимусом) позволяют предположить, что ингибирование Р-гликопротеина такролимусом слабее по сравнению с мощными ингибиторами Р-гликопротеина. |
| Меры предосторожности при одновременном применении |
|
| Верапамил | При одновременном применении дабигатрана этексилата (150 мг) и верапамила перорально Сmax и AUC дабигатрана увеличивались, однако степень данного изменения зависела от времени введения и лекарственной формы верапамила. Наибольшее увеличение экспозиции дабигатрана наблюдалось при приеме первой дозы верапамила с немедленным высвобождением за час до приема дабигатрана этексилата (Сmax и AUC дабигатрана увеличивались в 2,8 и 2,5 раз соответственно). Эффект постепенно уменьшался при приеме лекарственной формы пролонгированного действия (Сmax и AUC дабигатрана увеличивались в 1,9 и 1,7 раз соответственно) или приеме многократных доз верапамила (Сmax и AUC дабигатрана увеличивались в 1,6 и 1,5 раз соответственно). Значимого взаимодействия не наблюдалось при приеме верапамила через 2 часа после дабигатрана этексилата (Сmax и AUC дабигатрана увеличивались в 1,1 и 1,2 раза соответственно) Это объясняется тем, что всасывание дабигатрана завершается через 2 часа. |
| Амиодарон | При одновременном применении ПРАДАКСА и амиодарона однократно перорально в дозе 600 мг степень и скорость всасывания амиодарона и его активного метаболита DEA существенно не изменялись. AUC и Сmax дабигатрана увеличивались в 1,6 и 1,5 раз соответственно. В связи с продолжительным периодом полувыведения амиодарона возможность взаимодействия может сохраняться в течение нескольких недель после прекращения приема амиодарона. |
| Хинидин | Хинидин принимался в дозе 200 мг каждые 2 часа до общей дозы в 1000 мг. Дабигатрана этексилат принимался два раза в сутки в течение 3 дней, на третий день с или без хинидина. При одновременном приеме с хинидином AUCτ,ss и Cmax,ss дабигатрана увеличивались в 1,53 и 1,56 раза соответственно. |
| Кларитромицин | При одновременном применении кларитромицина в дозе 500 мг два раза в сутки и дабигатрана этексилата здоровыми добровольцами Сmax увеличивалась примерно в 1,15 раз, AUC увеличивалась примерно в 1,19 раз. |
| Тикагрелор | При одновременном применении дабигатрана этексилата однократно в дозе 75 мг и ударной дозы тикагрелора 180 мг, AUC и Сmax дабигатрана увеличивались в 1,73 и 1,95 раз соответственно. После многократного приема тикагрелора 90 мг два раза в сутки, Сmax и AUC дабигатрана увеличивались в 1,56 и 1,46 раз соответственно. При одновременном применении ударной дозы тикагрелора 180 мг и дабигатрана этексилата 110 мг (в стационарном состоянии) AUCτ,ss и Cmax,ss дабигатрана увеличивались в 1,49 и 1,65 раз соответственно по сравнению с монотерапией дабигатрана этексилатом. При приеме ударной дозы тикагрелора 180 мг через 2 часа после дабигатрана этексилата 110 мг (в стационарном состоянии), AUCτ,ss и Cmax,ss дабигатрана снижались в 1,27 раза и 1,23 раза соответственно по сравнению с монотерапией дабигатрана этексилатом. Рекомендуется такой отсроченный начальный прием ударной дозы тикагрелора. Одновременный прием тикагрелора 90 мг два раза в день (поддерживающая доза) и дабигатрана этексилата 110 мг увеличивал AUCτ,ss и Cmax,ss дабигатрана в 1,26 и 1,29 раза соответственно по сравнению с монотерапией дабигатрана этексилатом. |
| Позаконазол | Позаконазол также в некоторой степени ингибирует Р-гликопротеин, однако его действие клинически не изучалось. Применять ПРАДАКСА одновременно с позаконазолом следует с осторожностью. |
| Индукторы Р-гликопротеина |
|
| Одновременного применения следует избегать |
|
| Например, рифампицин, препараты зверобоя (Hypericum perforatum), карбамазепин или фенитоин |
Одновременное применение приводит к снижению концентрации дабигатрана. Предварительный прием рифампицина в дозе 600 мг один раз в сутки в течение 7 дней уменьшал общий пик дабигатрана и общую экспозицию на 65,5% и 67% соответственно. На 7-й день после прекращения лечения рифампицином эффект индуктора уменьшался, а экспозиция дабигатрана восстанавливалась. Дальнейшее увеличение биодоступности после 7 дней не наблюдалось. |
| Ингибиторы протеазы, такие как ритонавир |
|
| Одновременное применение не рекомендовано |
|
| Например, ритонавир и его комбинации с другими ингибиторами протеазы |
Они оказывают воздействие на Р-гликопротеин (либо как ингибиторы, либо как индукторы). В связи с недостаточностью данных, их одновременное назначение с ПРАДАКСА не рекомендуется. |
| Субстрат Р-гликопротеина |
|
| Дигоксин | В испытании с участием 24 здоровых добровольцев при одновременном приеме ПРАДАКСА с дигоксином фармакокинетического взаимодействия не наблюдалось. |
Антикоагулянты и антиагреганты
Опыт применения ПРАДАКСА со следующими лекарственными средствами, повышающими риск кровотечения при одновременном применении с ПРАДАКСА, либо ограничен, либо отсутствует: антикоагулянты – несанкционированный гепарин (НФГ), низкомолекулярные гепарины, производные гепарина (фондапаринукс, дезирудин), тромболитики, антагонисты витамина К, ривароксабан или другие пероральные антикоагулянты; антиагреганты – антагонисты рецепторов гликопротеина IIb/IIIa, тиклопидин, прасугрел, тикагрелор, декстран и сульфинпиразон.
Согласно данным, полученным в испытании фазы III RE-LY, было установлено, что одновременное применение других пероральных или парентеральных антикоагулянтов с дабигатрана этексилатом и с варфарином увеличивает количество клинически значимых кровотечений приблизительно в 2,5 раза. В основном это имеет отношение к случаям перехода от применения одного антикоагулянта к другому. Кроме того, наблюдалось увеличение количества случаев кровотечений почти в два раза при одновременном применении антиагрегантов, ацетилсалициловой кислоты или клопидогрела и дабигатрана этексилата или варфарина.
НФГ может применяться в дозах, необходимых для поддержания функционирования центрального венозного или артериального катетера, или во время катетерной абляции при фибрилляции предсердий.
Таблица 16 Взаимодействие с антикоагулянтами и антиагрегантами
| НПВС |
НПВС, принимавшиеся для кратковременного обезболивания, не приводят к увеличению риска развития кровотечения при приеме в сочетании с дабигатрана этексилатом. При длительном применении в испытании RE-LY НПВС повышали риск кровотечения примерно на 50% при одновременном приеме как с дабигатраном, так и с варфарином. |
| Клопидогрел |
У молодых здоровых мужчин добровольцев совместный прием дабигатрана этексилата и клопидогрела не приводил к дальнейшему увеличению времени капиллярного кровотечения по сравнению с монотерапией клопидогрелом. Кроме того, AUCτ,ss и Cmax,ss дабигатрана, параметры свертываемости крови в связи с эффектом дабигатрана, или ингибирование агрегации тромбоцйтов как степень действия клопидогрела, оставались практически неизменными при сравнении комбинированного лечения с соответствующей монотерапией. При приеме ударных доз клопидогрела 300 или 600 мг AUCτ,ss и Cmax,ss дабигатрана увеличивались примерно на 30-40%. |
| Ацетилсалициловая кислота |
Совместное введение ацетилсалициловой кислоты и 150 мг дабигатрана этексилата два раза в сутки может увеличить риск любого кровотечения с 12% до 18% и 24% при приеме 81 мг и 325 мг ацетилсалициловой кислоты соответственно. |
| Низкомолекулярные гепарины |
Одновременное применение низкомолекулярных гепаринов, например, эноксапарина и дабигатрана этексилата специально не изучалось. При переходе с 3-дневного применения 40 мг эноксапарина один раз в сутки подкожно, через 24 часа после последней дозы эноксапарина экспозиция дабигатрана была немного ниже, чем после приема только дабигатрана этексилата (однократно 220 мг). После применения дабигатрана этексилата с предварительным введением эноксапарина наблюдалась более высокая анти-FXa/FIIa активность по сравнению с монотерапией дабигатрана этексилата. Это может объясняться эффектом последействия применения эноксапарина и не является клинически значимым. Другие связанные с применением дабигатрана антикоагуляционные тесты существенно не изменялись при предварительном введении эноксапарина. |
Другие взаимодействия
Таблица 17 Другие взаимодействия
|
Селективные ингибиторы обратного захвата серотонина (СИОЗС) или селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН) |
|
| СИОЗС, СИОЗСиН |
СИОЗС и СИОЗСиН повышали риск кровотечения во всех терапевтических группах клинического испытания фазы III (RELY) по сравнению дабигатрана и варфарина для профилактики инсульта у пациентов с фибрилляцией предсердий. |
|
Лекарственные средства, влияющие на pH в желудке |
|
| Пантопразол |
При совместном приеме ПРАДАКСА с пантопразолом наблюдалось снижение AUC дабигатрана приблизительно на 30%. В клинических испытаниях пантопразол и другие ингибиторы протонной помпы вводились совместно с ПРАДАКСА, при этом влияния на эффективность ПРАДАКСА не наблюдалось. |
| Ранитидин |
При одновременном приеме с ПРАДАКСА ранитидин не оказывал значимого влияния на степень всасывания дабигатрана. |
Взаимодействия, связанные с метаболическим профилелем дабигатрана этексилата и дабигатрана
Дабигатрана этексилат и дабигатран не метаболизируются с участием системы цитохрома Р450 и не влияют in vitro на ферменты цитохрома Р450 у человека. Поэтому при одновременном применении с дабигатраном лекарственного взаимодействия с соответствующими препаратами не ожидается.
Капсулы 75 мг
По 10 капсул в алюминиевую блистерную упаковку с перфорацией. 1 блистер с инструкцией по применению в картонную пачку.
Капсулы 110 мг
По 10 капсул в алюминиевую блистерную упаковку с перфорацией. 3 блистера с инструкцией по применению в картонную пачку.
Хранить при температуре не выше 25 °C в защищенном от влаги месте. Хранить в недоступном для детей месте.
3 года.
Не использовать после истечения срока годности.
По рецепту.
Производитель
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ
Бингер штрассе 173, D-55216, Ингельхайм-на-Рейне, Германия.
Агентство в РБ
г. Минск, ул. В. Хоружей, 22-1402.
Тел.: (+375 17) 242 16 33, факс: (+375 17) 242 16 40.
Совместное применение препарата Прадакса® с ЛС, влияющими на гемостаз или систему коагуляции, включая нефракционированный гепарин, низкомолекулярный гепарин, ацетилсалициловую кислоту, НПВП, антагонисты витамина К, может существенно повысить риск развития кровотечений.
Фармакокинетические взаимодействия
Дабигатрана этексилат и дабигатран не метаболизируются ферментами микросомального окисления печени, и не являются ни индукторами, ни ингибиторами активности изоферментами цитохрома P450. Поэтому предполагается, что у дабигатрана отсутствуют клинически значимые фармакокинетические лекарственные взаимодействия с препаратами, метаболизм которых осуществляется изоферментами цитохрома P450. В клинических исследованиях у здоровых добровольцев не выявлены какие-либо взаимодействия дабигатрана с аторвастатином (субстрат CYP3A4) и диклофенаком (субстрат CYP2C9).
Взаимодействия с ингибиторами/индукторами P-gp
Субстратом для транспортной молекулы P-gp является пролекарство дабигатрана этексилат, но не дабигатран. Поэтому проводилось изучение совместного применения с ингибиторами и индукторами транспортера P-gp.
Одновременное применение с ингибиторами P-gp. Одновременное использование ингибиторов P-gp (амиодарон, верапамил, хинидин, кетоконазол для системного применения, дронедарон, тикагрелор и кларитромицин) приводит к увеличению концентрации дабигатрана в плазме крови. Одновременное применение с такими ингибиторами P-gp, как кетоконазол для системного применения, циклоспорин, итраконазол, такролимус и дронедарон противопоказано. Следует соблюдать осторожность при одновременном назначении с ингибиторами P-gp (такие, как амиодарон, хинидин, верапамил и тикагрелор).
Амиодарон. При одновременном применении дабигатрана этексилата с однократной дозой амиодарона (600 мг), принимавшегося внутрь, степень и скорость всасывания амиодарона и активного его метаболита, дезэтиламиодарона, не изменялись. Значения AUC и Cmax дабигатрана увеличивались примерно в 1,6 и 1,5 раз (на 60 и 50%) соответственно.
В исследовании у пациентов с фибрилляцией предсердий концентрация дабигатрана увеличивалась не более чем на 14%, повышение риска кровотечений не было зарегистрировано. Рекомендуется наблюдение за пациентами, применяющими одновременно амиодарон и дабигатрана этексилат в отношении риска кровотечения, в особенности, при наличии почечной недостаточности (от слабой до умеренно выраженной).
Дронедарон. После одновременного применения дабигатрана этексилата и дронедарона в дозе 400 мг однократно, AUC0–∞ и Cmax дабигатрана увеличиваются в 2,1 и 1,9 раз (на 114 и 87%) соответственно, а после многократного применения дронедарона в дозе 400 мг в день — в 2,4 и 2,3 (на 136 и 125%) соответственно. После однократного и многократного применения дронедарона через 2 часа после приема дабигатрана этексилата AUC0–∞ возрастала в 1,3 и 1,6 раз, соответственно. Дронедарон не влиял на конечный T1/2 и почечный клиренс дабигатрана. Одновременное применение препарата Прадакса® и дронедарона противопоказано.
Тикагрелор. После одновременного применения однократной дозы (75 мг) дабигатрана этексилата с нагрузочной дозой тикагрелора (180 мг) значения AUC0–∞ и Cmax дабигатрана увеличиваются в 1,73 и 1,95 раз (на 73 и 95%) соответственно. После многократного приема тикагрелора (90 мг 2 раза в день) это повышение воздействия дабигатрана (в отношении AUC0–∞ и Cmax) уменьшалось, соответственно, до 1,56 раза (до 56%) и до 1,46 раза (до 46%).
Концентрация дабигатрана у здоровых добровольцев повышалась в 1,26 раз (до 26%) при совместном применении с тикагрелором в стационарном состоянии или в 1,49 раз (до 49%) при применении нагрузочной дозы тикагрелора с совместным применением дабигатрана этексилата, принимавшегося в дозе 110 мг 2 раза в сутки. Повышение концентрации было менее выраженным, если нагрузочная доза (180 мг) тикагрелора принималась через 2 ч после приема дабигатрана (до 27%). Совместное назначение нагрузочной дозы (180 мг) тикагрелора и 110 мг дабигатрана этексилата (в стационарном состоянии) увеличивало показатели AUCτ,ss и Cmax,ss дабигатрана в 1,49 раз и 1,65 раз (+49 и 65%), соответственно, по сравнению с приемом только дабигатрана этексилата. Если нагрузочная доза 180 мг тикагрелора назначалась через 2 ч после приема 110 мг дабигатрана этексилата (в стационарном состоянии), степень повышения AUCτ,ss и Cmax,ss дабигатрана уменьшалась до 1,27- и 1,24-кратной (+27 и 24%), соответственно, по сравнению с приемом только дабигатрана этексилата. Совместное назначение 90 мг тикагрелора 2 раза в сутки (поддерживающая доза) со 110 мг дабигатрана этексилата повышало корректированные показатели AUCτ,ss и Cmax,ss в 1,26 раз и 1,29 раз, соответственно, по сравнению с приемом только дабигатрана этексилата.
Верапамил. При одновременном применении дабигатрана этексилата с верапамилом, назначавшимся перорально, значения Cmax и AUC дабигатрана увеличивались в зависимости от времени применения и лекарственной формы верапамила.
Наибольшее повышение эффекта дабигатрана наблюдалось при использовании первой дозы верапамила в лекарственной форме с немедленным высвобождением, которая применялась за 1 ч до приема дабигатрана этексилата (Cmax повысилась на 180%, а AUC — на 150%). При использовании лекарственной формы верапамила с замедленным высвобождением этот эффект прогрессивно снижался (Cmax повысилась на 90%, а AUC — на 70%), также как при использовании многократных доз верапамила (Cmax повысилась на 60%, а AUC — на 50%), что может объясняться индукцией P-gp в ЖКТ при длительном применении верапамила.
При использовании верапамила через 2 ч после приема дабигатрана этексилата клинически значимых взаимодействий не наблюдалось (Cmax повышалась на 10%, а AUC — на 20%), поскольку через 2 ч дабигатран полностью всасывается (см. «Способ применения и дозы»).
В исследовании у пациентов с фибрилляцией предсердий концентрация дабигатрана увеличивалась не более чем на 21%, повышение риска кровотечений не было зарегистрировано.
Данные о взаимодействии дабигатрана этексилата с верапамилом, введенным парентерально, отсутствуют; клинически значимое взаимодействие не ожидается.
Кетоконазол. Кетоконазол для системного применения после однократного назначения в дозе 400 мг увеличивает AUC0–∞ и Cmax дабигатрана примерно в 2,4 раза (на 138 и 135%) соответственно, а после многократного назначения кетоконазола в дозе 400 мг в день — примерно в 2,5 раза (на 153 и 149%) соответственно. Кетоконазол не влиял на Tmax и конечный T1/2. Одновременное применение препарата Прадакса® и кетоконазола для системного применения противопоказано.
Кларитромицин. При одновременном применении кларитромицина в дозе 500 мг 2 раза в день с дабигатрана этексилатом клинически значимое фармакокинетическое взаимодействие не наблюдалось (Cmax повысилась на 15%, а AUC — на 19%).
Хинидин. Значения AUCτ,ss и Cmax,ss дабигатрана при применении 2 раза в сутки в случае одновременного назначения с хинидином в дозе 200 мг каждые 2 ч до достижения суммарной дозы 1000 мг повышались в среднем, соответственно, на 53 и 56%.
Взаимодействие с итраконазолом, такролимусом и циклоспорином не изучалось, однако из данных in vitro можно ожидать схожего эффекта, как и от взаимодействия с кетоконазолом. Одновременное применение этих ингибиторов P-gp противопоказано.
Одновременное применение с субстратами P-gp
Дигоксин. В исследовании, проведенном с участием 24 здоровых испытуемых, при одновременном назначении препарата Прадакса® с дигоксином не наблюдалось изменений концентрации дигоксина и клинически значимых изменений концентрации дабигатрана. При одновременном применении дабигатрана этексилата с дигоксином, являющимся субстратом P-gp, фармакокинетическое взаимодействие не наблюдалось.
Ни дабигатран, ни пролекарство дабигатрана этексилат не являются клинически значимыми ингибиторами P-gp.
Одновременное применение с индукторами P-gp
Следует избегать одновременного назначения препарата Прадакса® и индукторов P-gp, поскольку совместное применение приводит к снижению воздействия дабигатрана (см. «Особые указания»).
Рифампицин. Предварительное применение тест-индуктора рифампицина в дозе 600 мг в день в течение 7 дней приводило к снижению воздействия дабигатрана. После отмены рифампицина этот индуктивный эффект снижался, на 7-й день эффект дабигатрана был близок к исходному уровню. В течение последующих 7 дней дальнейшее увеличение биодоступности дабигатрана не наблюдалось.
Через 7 дней лечения рифампицином в дозе 600 мг ежедневно AUC0–∞ и Cmax общего дабигатрана были снижены на 67 и 66% по сравнению с референсным лечением, соответственно.
Предполагается, что другие индукторы P-gp, такие, как зверобой продырявленный или карбамазепин, могут также снижать концентрацию дабигатрана в плазме крови и должны применяться с осторожностью.
Одновременное применение с антиагрегантами
Совместное применение препарата Прадакса® с ЛС, влияющими на гемостаз или систему коагуляции, включая нефракционированный гепарин, низкомолекулярный гепарин, ацетилсалициловую кислоту (AСК), НПВП, антагонисты витамина К, может существенно повысить риск развития кровотечений.
Нефракционированный гепарин. Можно применять в дозах, необходимых для поддержания проходимости центрального венозного или артериального катетера.
AСК. Эффект одновременного применения дабигатрана этексилата и АСК на риск развития кровотечений был изучен у пациентов с фибрилляцией предсердий в рандомизированном исследовании II фазы совместного применения с АСК.
При изучении одновременного применения дабигатрана этексилата в дозе 150 мг 2 раза в день и AСК у пациентов с фибрилляцией предсердий установлено, что риск кровотечений может повышаться с 12 до 18% (при использовании АСК в дозе 81 мг) и до 24% (при использовании АСК в дозе 325 мг).
НПВП. Применявшиеся НПВП для краткосрочной анальгезии после операций не повышали риск кровотечений при одновременном использовании с дабигатрана этексилатом. Длительное применение НПВП увеличивало риск кровотечения примерно на 50%, как при совместном применении дабигатрана этексилата, так и варфарина.
Необходим тщательный контроль за признаками кровотечения, в связи с риском развития при совместном применении с НПВП (T1/2 более 12 ч).
Низкомолекулярный гепарин. Специальных исследований по одновременному применению дабигатрана этексилата и низкомолекулярных гепаринов, таких как эноксапарин, не проводилось. Через 24 ч после 3-дневного лечения (40 мг 1 раз в день) эноксапарином экспозиция дабигатрана была ниже, чем после приема разовой дозы 220 мг дабигатрана этексилата. Высокая активность анти-FXa/FII наблюдалась после применения дабигатрана этексилата с эноксапарином по сравнению с лечением только дабигатрана этексилатом. Считается, что это связано с действием эноксапарина и не имеет клинического значения. Другие тесты, связанные с антикоагулянтным действием дабигатрана, значительно не изменялись при предшествующем лечении эноксапарином.
Клопидогрел. Установлено, что одновременное применение дабигатрана этексилата и клопидогрела не приводит к дополнительному увеличению времени капиллярного кровотечения в сравнении с монотерапией клопидогрелом. Кроме того, показано, что значения AUCτ,ss и Cmax,ss дабигатрана, а также параметры свертывания крови, которые контролировались для оценки эффекта дабигатрана (АЧТВ, экариновое время свертывания или тромбиновое время (анти-FIIa), а также степень ингибирования агрегации тромбоцитов (основной показатель эффекта клопидогрела) во время комбинированной терапии не изменялись по сравнению с соответствующими показателями в монотерапии. При использовании нагрузочной дозы клопидогрела (300 или 600 мг) значения AUCτ,ss и Cmax,ss дабигатрана повышались на 30–40%.
Одновременное применение с препаратами, повышающими pH содержимого желудка
Выявленные в ходе популяционного анализа изменения фармакокинетических параметров дабигатрана под влиянием ингибиторов протонной помпы и антацидных препаратов оказались клинически незначимыми, поскольку степень выраженности этих изменений была небольшой (снижение биодоступности не было значимым для антацидов, а для ингибиторов протонной помпы составляло 14,6%). Установлено, что одновременное применение ингибиторов протонной помпы не сопровождается снижением концентрации дабигатрана и в среднем лишь незначительно снижает концентрацию препарата в плазме крови (на 11%). Поэтому одновременное применение ингибиторов протонной помпы, по-видимому, не ведет к повышению частоты инсульта или системных тромбоэмболий, особенно в сравнении с варфарином, и, следовательно, снижение биодоступности дабигатрана, вызываемое одновременным применением пантопразола, вероятно, не имеет клинической значимости.
Пантопразол. При совместном применении дабигатрана этексилата и пантопразола наблюдалось снижение AUC дабигатрана на 30%. Пантопразол и другие ингибиторы протонной помпы применялись совместно с дабигатрана этексилатом в клинических исследованиях, влияние на риск кровотечения или эффективность не наблюдалось.
Ранитидин. Ранитидин при применении одновременно с дабигатрана этексилатом, не оказывал значимое влияние на степень всасывания дабигатрана.

