Железодефицитная анемия
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Анемия, осложняющая беременность, деторождение и послеродовой период (O99.0), Железодефицитная анемия (D50), Недостаточность железа (E61.1)
Разделы медицины:
Гематология, Гематология детская
Общая информация
Краткое описание
Разработчик клинической рекомендации
Национальное гематологическое общество
Национальное общество детских гематологов, онкологов
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации
Железодефицитная анемия
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые, Дети
Год окончания действия: 2023
ID:669
Определение заболевания или состояния (группы заболеваний или состояний)
ЖДА — полиэтиологичное заболевание, развитие которого связано с дефицитом железа в организме из-за нарушения поступления, усвоения или повышенных потерь данного микроэлемента, характеризующееся микроцитозом и гипохромной анемией.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Рубрики, присвоенные различным железодефицитным состояниям в Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (МКБ-10), представлены в табл. 2. [8].
Таблица 2. Рубрики в МКБ-10, присвоенные железодефицитным состояниям [6].
Облачная МИС «МедЭлемент»
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
В соответствии с преобладающим механизмом развития железодефицита, выделяют анемии связанные с кровопотерей, нарушением всасывания, повышенной потребностью в железе и особенностями диеты (Табл. 3) [1–3,9].
Таблица 3. Классификация ЖДА
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Основными причинами развития ЖДА у женщин служат обильные менструальные кровотечения, беременность, роды (особенно повторные) и лактация. Для женщин в постменопаузе и у мужчин основной причиной развития железодефицита является кровопотеря из желудочно-кишечного тракта. Дефицит железа может развиться и без кровопотери, например, в период интенсивного роста детей, при растительной диете, вследствие резекции желудка или кишечника, а также в результате нарушения всасывания железа у лиц с воспалительными заболеваниями кишечника. Развитие ЖДА возможно у доноров крови, постоянно сдающих кровь в течение многих лет, а также у пациентов с хронической почечной недостаточностью, находящихся на программном гемодиализе (еженедельные потери 30-40 мл крови в контуре диализатора) [1–3].
Основными причинами развития ЖДА в детской практике являются:
- дефицит железа при рождении ребенка;
- алиментарный дефицит железа вследствие несбалансированного питания;
- повышенные потребности организма в железе вследствие бурного роста ребенка;
- потери железа из организма, превышающие физиологические.
Алиментарно-зависимыми факторами в развитии дефицита железа у детей являются:
- недостаточное поступление железа с пищей;
- сниженное всасывание железа;
- увеличенные потери железа из-за микрокровотечений из кишечника (обусловленные ранним введением кефира и цельного коровьего молока в рацион детей раннего возраста; глистные инвазии, инфекционно-воспалительные заболевания кишечника) [4].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Железодефицитная анемия (ЖДА) является одним из самых распространенных заболеваний в мире и стоит на первом месте по частоте встречаемости у женщин детородного возраста [3,5]. Распространенность анемии, в том числе ЖДА, зависит от многих причин: социально-экономических условий проживания, питания, кровотечений различной локализации, поражения паразитарными заболеваниями и др. Экспертами ВОЗ было показано, что анемия чаще встречается в развивающихся странах и наиболее подвержены анемии две группы населения – дети раннего возраста и беременные женщины [6] (табл. 1).
Таблица 1. Распространенность анемии в мире в зависимости от возраста, пола и социально-экономических условий (цит. по [6])
Известно, что ЖДА составляют 90% от всех анемий в детском возрасте [7] и 80% от всех анемий у взрослых [1].
По мнению экспертов ВОЗ, распространенность ЖДА в популяции может быть умеренной – от 5 до 19,9%, средней – от 20 до 39,9% и высокой – 40% и более [6].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Основными клиническими проявлениями ЖДА являются гипоксический и сидеропенический синдромы. Гипоксический синдром включает общие для всех анемий симптомы: бледность, усиленное сердцебиение, шум в ушах, головная боль, слабость. К проявлениям сидеропенического синдрома относятся извращения вкуса, сухость кожи, изменение ногтей, выпадение волос, ангулярный стоматит, жжение языка, диспептический синдром. Многообразие клинических симптомов железодефицита объясняется широким спектром метаболических нарушений, к которым приводит дисфунк ция железосодержащих и железозависимых ферментов [1,2,9,10]
К менее известным клиническим проявлениям железодефицита следует отнести невротические реакции и неврастению, снижение работоспособности мышц и общей толерантности к физической нагрузке, нарушения метаболических процессов в миокарде, нарушения периферического крово обращения (снижение периферического сопротивления и венозного тонуса, уменьшение функциональных резервов артериол) и микроциркуляции. При длительном течении ЖДА у пациентов постепенно нарастают явления миокар диодистрофии и симпатикотонии в вегетативной регуляции сердечной дея тельности [2,3].
При ЖДА наблюдаются поражения желудочно-кишечного тракта, прояв ляющиеся в виде хронических гастритов и синдромов нарушения всасывания в кишечнике. При этом снижение секреции и кислотообразования при хро нических гастритах рассматривается как следствие, а не причина железодефицита и объясняется дисрегенераторными процессами в слизистой желудка. Предполагается, что дефицит железа в кишечной стенке может вызвать повышенную абсорбцию и накопление в организме токсических концентраций металлов-антагонистов железа, например, кадмия [2,9].
Нарушения противоинфекционного иммунитета у пациентов с ЖДА имеют сложный характер. С одной стороны, железо дефицит препятствует развитию патогенных микроорганизмов, нуждающихся в железе для собственного роста и размножения. С другой стороны, железодефицит опосредованно приводит к нару шению клеточных механизмов резистентности к инфекциям (снижение микробицидной активности гранулоцитов, нарушение пролиферации лимфоци тов). В целом, предрасположенность пациентов с ЖДА к развитию инфекционных заболеваний не столь велика, как это предполагалось ранее. Напротив, лечение железодефицитных состояний парентеральными препара тами железа значительно увеличивает риск раз вития инфекций, вероятно, вследствие доступности вводимого железа для использования микроорганизмами и их быстрого роста [2].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз ЖДА основывается на характерной клинико-гематологической картине заболевания и наличии лабораторных доказательств абсолютного дефицита железа.
Жалобы и анамнез
См. раздел «клиническая картина»
Физикальное обследование
- Рекомендуется всем пациентам проведение физикального обследования при подозрении на ЖДА, необходимо обращать внимание на характерные признаки сидеропенического и анемического синдромов для верификации диагноза [1,2,4,9,10].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: основными проявлениями сидеропенического синдрома являются [1,2,4,9,10]:
— изменения кожи (пигментации цвета кофе с молоком) и слизистых оболочек (заеды в углу рта);
— изменения ногтей (ломкость, мягкость, поперечная исчерченность, вогнутость);
— изменения волос (ломкость, тусклость, раздваивание кончиков, алопеция);
— гипотония (мышечная, артериальная);
— изменения обоняния (пристрастие к запахам лака, красок, ацетона, выхлопных газов автомобиля);
— изменения вкуса (пристрастие к мелу, глине, сырым продуктам).
Основные проявления анемического синдрома, обусловленного развитием анемической гипоксии, включают [1,2,10]:
— слабость, головную боль, головокружение;
— плохую переносимость физических нагрузок;
— снижение аппетита;
— снижение работоспособности, внимания, обучаемости;
— бледность кожных покровов и видимых слизистых оболочек;
— тахикардию, систолический шум.
Несмотря на четко очерченную клиническую картину ЖДА, симптомы анемии и сидеропении обладают низкой диагностической ценностью и не позволяют уверенно диагностировать ЖДА [1,3,9]. Решающее значение в диагностике ЖДА имеют лабораторные исследования.
Лабораторные диагностические исследования
- Рекомендуется выполнение общего (клинического) анализа крови, оценка гематокрита (Hct), исследование уровня эритроцитов в крови и исследование уровня ретикулоцитов в крови с определением среднего содержания и средней концентрации Hb в эритроцитах, определение размеров эритроцитов у пациентов с анемическим синдромом с целью диагностики ЖДА [11].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: при ЖДА отмечается снижение уровня гемоглобина, гематокрита, среднего содержания и средней концентрации гемоглобина в эритроцитах (МСН и МСНС, соответственно), среднего объема эритроцитов (МСV). Количество эритроцитов обычно находится в пределах нормы. Ретикулоцитоз — не характерен, но может присутствовать у пациентов с кровотечениями. Морфологическим признаком ЖДА является гипохромия эритроцитов и анизоцитоз со склонностью к микроцитозу [1,2,10,12,13]. Перечисленные морфологические характеристики не позволяют отличить железодефицитную анемию от, так называемой, «анемии хронических заболеваний», в основе которой лежит перераспределительный дефицит железа, связанный с наличием в организме очага воспаления, инфекции или опухоли.
- Рекомендуется всем пациентам с подозрением на ЖДА исследовать сывороточные показатели обмена железа — уровня ферритина в крови, уровня трансферрина сыворотки крови, железосвязывающую способность сыворотки (ОЖСС), исследование уровня железа сыворотки крови и коэффициент насыщения трансферрина железом (НТЖ), для верификации наличия абсолютного дефицита железа [11,14,15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: отличительными признаками истинной ЖДА являются низкий уровень сывороточного ферритина, отражающий истощение тканевых запасов железа, и повышенные показатели ОЖСС и трансферрина (Табл.2.). Показатели сывороточного железа и коэффициент НТЖ в типичных случаях снижены, однако наличие нормальных и даже повышенных показателей не исключает диагноз ЖДА, поскольку прием пациентом накануне исследования железосодержащих препаратов, мясная диета или предшествующая (за 10-14 дней) трансфузия эритроцитной массы могут сильно исказить показатель сывороточного железа и, соответственно, коэффициент НТЖ, что необходимо учитывать при оценке результатов исследования. Развитию ЖДА предшествует период латентного железодефицита, лабораторными критериями которого служат низкие показатели сывороточного железа и ферритина на фоне нормального уровня гемоглобина.
Микроцитарная гипохромная анемия является характерным морфологическим признаком β-талассемии, тяжелые формы которой ассоциируются с глубокой анемией и выраженными признаками перегрузки железом (повышенные показатели сывороточного ферритина и НТЖ, сниженные – трансферрина и ОЖСС). Однако легкие субклинические формы талассемии, протекающие с легкой микроцитарной гипохромной анемией, зачастую расцениваются как железодефицитные без исследования сывороточных показателей метаболизма железа, что влечет за собой назначение неадекватной ферротерапии, способной привести к ускоренному развитию тканевой перегрузки железом.
Таблица 2. Дифференциальная диагностика железодефицитной анемии и анемии хронических заболеваний (АХЗ)
N – нормальное значение показателя; ↓ – снижение показателя; ↑ – повышение показателя.
- Рекомендуется: у всех пациентов с ЖДА проводить комплекс исследований для выяснения причины развития ЖДА и диагностики сопутствующей патологии [3,16,17]:
— анализ крови биохимический общетерапевтический (общий белок, альбумин, общий билирубин, прямой билирубин, АСТ, АЛТ, креатинин, мочевина, щелочная фосфатаза, гамма-глютаминтранспептидаза);
— анализ мочи общий
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: результаты перечисленных базовых исследований могут указывать направление дальнейшего диагностического поиска. Оценка биохимических показателей функции печени необходима для правильной интерпретации параметров обмена железа, так как нарушение белково-синтетической функции печени может приводить к нарушению продукции трансферрина [16]. Нарушение функции почек может приводить к развитию как относительного, так и абсолютного железодефицита [17]. Оценка других биохимических показателей используется при дифференциальной диагностике с анемиями иной этиологии.
- Не рекомендуется проводить исследования костного мозга для подтверждения диагноза ЖДА за исключением отдельных случаев [18].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: необходимость в проведении пункции и трепанобиопсии костного мозга может возникнуть в случаях упорной, резистентной к лечению анемии и/или при наличии других цитопений (лейко- или тромбоцитопении). При ЖДА в костном мозге какие-либо патологические признаки не определяются, клеточность, как правило, нормальная, реже отмечается умеренная гиперплазия. Характерной особенностью костного мозга при ЖДА является уменьшение количества сидеробластов – эритрокариоцитов, содержащих гранулы железа (в норме 20-40%).
ЖДА необходимо дифференцировать с анемиями, осложняющими течение хронических воспалительных и опухолевых заболеваний («анемия хронических заболеваний»), а также с гипохромными анемиями, протекающими с перегрузкой железом: α- и β-талассемии, порфирии, свинцовая интоксикация.
Инструментальные диагностические исследования
Выявление ЖДА требует проведения стандартного комплекса инструментальных исследований для выяснения причины развития анемии.
- Рекомендуется: всем пациентам с впервые установленным диагнозом ЖДА проведение следующих инструментальных исследований для поиска возможного источника кровотечения и выявления сопутствующей патологии [3,4,10,19,20]:
— рентгенография или КТ органов грудной клетки;
— УЗИ органов брюшной полости, забрюшинного пространства и малого таза;
— УЗИ щитовидной железы;
— ЭКГ (электрокардиография).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется: всем пациентам с впервые установленным диагнозом ЖДА мужского пола, а также женщинам в постменопаузе либо в репродуктивном возрасте, у которых ЖДА не коррелирует с ежемесячной потерей менструальной крови или родами, проведение эзофагогастродуоденоскопии (ЭГДС), колоноскопии и интестиноскопии в указанном порядке, до момента обнаружения достоверного источника кровопотери в ЖКТ, либо его исключения [20–22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: исследование верхнего (ЭГДС) и нижнего (колоноскопия или КТ-колоноскопия) отделов ЖКТ проводится у всех взрослых пациентов с впервые установленным диагнозом железодефицитной анемии мужского пола и у женщин в постменопаузе либо в репродуктивном возрасте, у которых ЖДА не коррелирует с ежемесячной потерей менструальной крови или родами. Выявление по данным ЭГДС эзофагита, эрозий или язв не должно рассматриваться в качестве основной причины ЖДА до момента исследования нижних отделов ЖКТ. При недоступности или наличии противопоказаний к колоноскопии, а также при незавершенной колоноскопии возможно выполнение КТ-колоноскопии или видеокапсульной колоноскопии (код медицинской услуги А03.18.001.006). Превосходство видеокапсульной колоноскопии по сравнению с КТ-колоноскопией описано в исследовании C. Spada и соавт., 2015 г. [23].
В случаях, когда источник кровопотери в верхнем и нижнем отделах желудочно-кишечного тракта найти не удается, необходимо провести эндоскопическое исследование тонкой кишки (интестиноскопию). Это исследование целесообразно провести с использованием метода видеокапсульной интестиноскопии (код медицинской услуги А03.17.002.002). Впоследствии, в случае обнаружения при видеокапсульной интестиноскопии патологии, требующей морфологической верификации диагноза и/или элиминации источника кровотечения, может быть применен метод баллонно-ассистированной интестиноскопии (А03.17.002.001).
Наиболее трудными для диагностики являются кровопотери в замкнутые полости, которые наиболее часто встречаются при эндометриозе — эктопическом разрастании эндометрия, чаще всего в мышечном и подслизистом слоях матки, реже — экстрагенитально. При этом излившееся с кровью железо повторно не используется для эритропоэза, что приводит к развитию железодефицита. Аналогичная ситуация в виде кровопотерь в замкнутые полости наблюдается при изолированном легочном сидерозе, а также гломических опухолях, возникающих в замыкающихся артериях и встречающихся в некоторых артерио-венозных анастомозах, например, в легких, плевре. Эти опухоли, особенно при изъязвлении, могут приводить к кровопотерям и развитию ЖДА.
Другими источниками кровопотерь могут быть носовые кровотечения, главным образом, у пациентов с геморрагическими диатезами (наследственная телеангиэктазия иммунная тромбоцитопения и др.), гематурии различного происхождения (хронический гематурический нефрит, IgА-нефропатии, мочекаменная болезнь, перманентный внутрисосудистый гемолиз), ятрогенные кровопотери (частые повторные заборы крови для исследований), кровопускания (при эритремии).
Иные диагностические исследования
- Рекомендуется: у пациентов детского возраста с ЖДА определять содержание антител к тканевой трансглютаминазе или содержание антител к эндомизию в крови для исключения целиакии [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: целиакия может приводить к нарушению всасывания железа в ЖКТ вследствие аутоиммунного повреждения слизистой кишечника, а также вследствие хронического скрытого кровотечения.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
Целью лечения ЖДА является введение железа в количестве, необходимом для нормализации уровня гемоглобина (у женщин 120-140 г/л, у мужчин 130-160 г/л) и восполнения тканевых запасов железа (ферритин сыворотки> 40-60 мкг/л). Для лечения и профилактики используют пероральные препараты двухвалентного железа (код В03АА по АТХ классификации) или пероральные препараты трехвалентного железа (код В03АВ по АТХ классификации), наиболее часто – железа сульфат. Количественный и качественный состав лекарственных препаратов железа сильно варьирует: высоко- и низкодозированные, односоставные и комбинированные. В соответствии с рекомендацией ВОЗ оптимальная доза железа для лечения ЖДА составляет 120 мг в день, для профилактики железодефицита – 60 мг в день. У детей доза солевых препаратов железа зависит от возраста и составляет 3 мг/кг в сутки у детей до трех лет, у детей старше трех лет − 45−60 мг в сутки, у подростков – до 120 мг в сутки. Примерно у 20% пациентов на фоне лечения развиваются понос или запор, которые купируют симптоматической терапией. Признаки раздражения желудка, такие как тошнота и ощущение дискомфорта в эпигастральной области, минимизируют, принимая препараты железа во время еды или снижая их дозу. Применение высокодозированных препаратов железа сопровождается увеличением частоты побочных эффектов со стороны желудочно-кишечного тракта. Длительность лечения определяется глубиной исходного железодефицита и может варьировать от 1 до 3 месяцев. Лечение целесообразно сочетать с назначением по ливитаминов для полноценного обеспечения пластических процессов.
Таблица 5. Нормальная концентрация Hb у детей разного возраста (цит. по [24–26])
1.1 Лечение пероральными препаратами железа
- Рекомендуется всем пациентам с ЖДА назначение препаратов железа в лекарственной форме для перорального применения с целью возмещения дефицита железа в организме. Дозы препаратов железа и длительность лечения рассчитывают индивидуально с учетом возраста, массы тела пациента и терапевтического плана лечения (Приложение А3) [2,3,9,25,27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: в настоящее время накапливаются доказательства того, что применение препаратов железа в низких дозах короткими курсами (2 недели в месяц) или альтернирующими режимами (через день в течение месяца) имеет более высокую эффективность и меньшую частоту побочных эффектов, чем применявшиеся ранее препараты железа в высоких дозах, в том числе в виде повторных (2-3 раза в день) приемов [3].
АТХ классификация разделяет препараты железа в лекарственной форме для перорального применения для лечения ЖДА на пероральные препараты двухвалентного железа (В03АА) и пероральные препараты трехвалентного железа (В03АВ) Рандомизированные исследования последних лет доказали, что эффективность пероральных препаратов двухвалентного и трехвалентного железа одинакова [3,25,28,29].
Лечение ЖДА у детей имеет некоторые особенности, которые следует учитывать в лечебном протоколе [25,29–31].
1) В процессе лечения ЖДА пероральными препаратами двухвалентного железа у детей могут возникать следующие проблемы:
— передозировка и даже отравление вследствие неконтролируемого организмом всасывания;
— взаимодействие с другими лекарственными препаратами и пищей;
— выраженный металлический привкус; окрашивание эмали зубов и десен;
— частый отказ пациентов от лечения (до 30—35% приступивших к лечению), что свидетельствует о низкой комплаентности детей к лечению ЖДА пероральными препаратами двухвалентного железа.
Большинства перечисленных проблем можно избежать при использовании пероральных препаратов трехвалентного железа, имеющих следующие свойства и преимущества:
— высокую безопасность, отсутствие риска передозировки, интоксикации и отравлений; отличная переносимость;
— отсутствие пигментации десен и зубов, приятный вкус;
— отсутствие взаимодействия с другими лекарственными средствами и продуктами питания; наличие антиоксидантных свойств.
Перечисленные свойства пероральных препаратов трехвалентного железа обеспечивают высокую комплаентность детей к лечению ЖДА [29,30].
2) Прием 100% дозы перорального препарата трехвалентного железа в течение всего периода лечения пациентов-детей ассоциируется с 100% приверженностью к лечению, незначительным количеством (6,3%) нежелательных явлений и высокой эффективностью лечения. Таким образом, пероральные препараты трехвалентного железа являются оптимальными лекарственными препаратами для терапии ЖДА у детей и подростков [29]. Важным является наличие на рынке препаратов железа в различных лекарственных формах для перорального применения (капли, сироп, таблетки), что делает возможным их применение у детей разного возраста и подростков.
1.2 Лечение парентеральными препаратами железа
- Рекомендуется назначение парентеральных препаратов трехвалентного железа (группа В03АС по классификации АТХ) пациентам с ЖДА в случаях неэффективности, плохой переносимости или наличия противопоказаний к применению препаратов железа в лекарственной форме для перорального применения для достижения излечения (Приложение А3). Длительность терапии рассчитывается индивидуально с учетом возраста, массы тела пациента и степени дефицита железа. [2,3,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: применение парентеральных препаратов трехвалентного железа показано пациентам с расстройствами всасывания вследствие предшествующей обширной резекции кишечника, пациентам с воспалительными заболеваниями кишечника (язвенный колит, болезнь Крона) и синдромом мальабсорбции, пациентам с ХБП в преддиализном и диализном периодах, а также в случае необходимости получить быстрый эффект в виде восполнения запасов железа и повышения эффективности эритропоэза (например, перед большими оперативными вмешательствами) [3].
Внутривенные инфузии препаратов железа сопряжены с опасностью анафилактического шока (1% пациентов), развитием перегрузки железом и токсических реакций, связанных с активацией ионами железа свободнорадикальных реакций биологического окисления (перекисное окисление липидов).
Внутримышечное введение препаратов железа не используется из-за низкой эффективности, развития местного гемосидероза и опасности развития инфильтратов, абсцессов и даже миосаркомы в месте введения.
1.3 Гемотрансфузионная терапия
- Рекомендуется проведение гемотрансфузионной терапии по индивидуальным показаниям пациентам с ЖДА тяжелой степени и пациентам с сопутствующей сердечно-сосудистой патологией, если есть риск декомпенсации состояния на фоне анемии [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: показания для начала гемотрансфузионной терапии должны определяться лечащим врачом в индивидуальном порядке. При определении показаний к трансфузии следует принимать во внимание наличие у пациента сопутствующей патологии, например, ишемической болезни сердца, что может потребовать проведения гемотрансфузионной терапии даже при умеренном снижении гемоглобина.
1.4 Мониторинг эффективности лечения препаратами железа на этапе лечения
- Рекомендуется проводить контроль эффективности лечения ЖДА путем мониторинга показателей гемограммы и сывороточных показателей обмена железа (ферритин, ОЖСС и трансферрин) у всех пациентов, получающих лечение препаратами железа [3,4,32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: эффективность лечения пациентов с ЖДА определяется по динамике клинических и лабораторных показателей. Самочувствие пациентов начинает улучшаться через 5-6 дней после начала ферротерапии, содержание ретикулоцитов повышается через 8-12 дней, содержание гемоглобина возрастает через 2,5-3 недели и нормализуется в большинстве случаев через месяц или позже. По окончании курса лечения препаратами железа необходимо контролировать показатели гемоглобина ежемесячно в течение года для определения необходимости поддерживающей ферротерапии.
2. Хирургическое лечение
Не применяется
Не применяется
Обезболивание не применяется
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Критериями эффективности лечения ЖДА пероральными препаратами железа являются:
- железа количество ретикулоцитов повышается (обычно на 2–3% или 20–30‰) по сравнению с их количеством до начала лечения;
- повышение концентрации Hb к концу 4-й недели лечения препаратами железа на 10 г/л и Hсt на 3% по отношению к изначальным значениям до лечения [19];
- исчезновение клинических проявлений заболевания через 1−1,5 мес. от начала лечения препаратами железа;
- преодоление тканевой сидеропении и восполнение железа в депо через 3−6 мес. от начала лечения (в зависимости от степени тяжести анемии), что контролируется по нормализации концентрации СФ (более 30 мкг/л).
Рефрактерность ЖДА к лечению препаратами железа чаще всего обусловлена неадекватностью назначенной терапии или анемией, не связанной с дефицитом железа. Отсутствие положительного ответа на адекватную ферротерапию может указывать на наличие у пациента, так называемой, «рефрактерной к ферротерапии железодефицитной анемии» (iron-refractory iron deficiency anemia – IRIDA) [33–35].
IRIDA – это наследуемое по аутосомно-рецессивному типу заболевание, описаны семейные случаи. Известно, что лечение этой разновидности ЖДА пероральными препаратами железа неэффективно, частичный эффект можно получить при использовании парентеральных препаратов железа. Причиной IRIDA является врожденный генетический дефект — мутация гена, кодирующего трансмембранную сериновую протеазу 6 (ТМРRSS6). Следствием данного генетического дефекта является гиперпродукция гепсидина, который подавляет всасывание железа в кишечнике, рециркуляцию и высвобождение железа из тканевых запасов [34,35].
ЖДА при своевременной диагностике, выявлении причин возникновения, правильном лечении подлежит излечению в 100% случаев. Так называемые, «рецидивы» ЖДА чаще всего свидетельствуют о невыявленной (неустраненной) причине развития заболевания или неправильных диагностике и лечении.
Для того чтобы терапия парентеральными препаратами железа была эффективной и безопасной для пациента необходимо строгое выполнение следующих принципов лечения:
- применение современных парентеральных препаратов железа с меньшей токсичностью и без анафилактоидных реакций, опасных для жизни пациента;
- прекращение терапии после восполнения дефицита железа во избежание развития перегрузки железом. По этим же соображениям желательно проводить терапию парентеральными препаратами железа под контролем НТЖ;
- соблюдение техники проведения внутривенной инфузии препаратов железа;
- обязательное выполнение требования инструкции по применению парентерального препарата железа, если предусмотрено введение пробной дозы перед началом лечения;
- лечение рекомендуется проводить в диапазоне безопасных доз, так как нежелательные явления парентеральных препаратов железа являются дозозависимыми.
Проведение профилактических прививок детям с ЖДА не противопоказано, не требует нормализации концентрации Hb и должно проводиться у пациентов с нетяжелой анемией в обычные сроки, поскольку количество иммунокомпетентных клеток у пациентов достаточное. В нашей стране издан официальный документ «Вакцинопрофилактика. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок. Методические указания» [36]. Согласно этому документу анемии, в том числе и ЖДА, не должны быть противопоказанием к проведению вакцинации. В разделе 13.4. этого документа написано: «Анемия нетяжелая, алиментарного генеза не должна быть причиной отвода от прививки, после которой ребенку назначают соответствующее лечение. Тяжелая анемия требует выяснения причины с последующим решением вопроса о времени вакцинации».
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Не требуется.
Госпитализация
Организация оказания медицинской помощи
Показания для экстренной госпитализации в медицинскую организацию:
1. Развитие симптомов декомпенсации ЖДА.
Показания для плановой госпитализации в медицинскую организацию:
1. диспансерное обследование, в том числе при первичной постановке диагноза ЖДА умеренной или тяжелой степени.
Показания к выписке пациента из медицинской организации
1. регресс симптомов декомпенсации ЖДА, окончание обследования для выявления причины ЖДА.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Проблема дефицита железа – это прежде всего проблема питания, поэтому первичная профилактика ЖДА и латентного дефицита железа – это адекватное, сбалансированное питание человека в любом возрасте. Ежедневная потребность взрослого человека в железе составляет около 1–2 мг, ребенка – 0,5–1,2 мг. Обычная диета обеспечивает поступление от 5 до 15 мг элементарного железа в день. В ЖКТ (двенадцатиперстной кишке и верхнем отделе тощей кишки) всасывается лишь 10–15% железа, содержащегося в пище.
- Рекомендуется дополнительное назначение профилактических доз лекарственных препаратов железа лицам из группы риска развития латентного железодефицита и ЖДА [3,25,27,31]:
— детям, находящимся на грудном и смешанном вскармливании, начиная с 4-месячного возраста и до введения прикорма (1 мг железа на 1 кг массы тела в сутки);
— детям, родившимся недоношенными, находящимся на грудном вскармливании, начиная с 1-го месяца жизни и до перехода на искусственное вскармливание молочными смесями, обогащенными железом, или до введения прикорма (2 мг железа на 1 кг массы тела в сутки);
— детям и взрослым, у которых невозможно устранить причину развития железодефицитного состояния (хроническая кровопотеря при менометроррагиях, заболевания желудочно–кишечного тракта, сопровождающиеся нарушениями всасывания (мальабсорбция, целиакия и др.) или рецидивирующими кровотечениями (болезнь Крона, НЯК, грыжа пищеводного отверстия диафрагмы и др.); пациенты на программном гемодиализе; пациенты с неоперабельными опухолями любой локализации, сопровождающимися рецидивирующими кровотечениями;
— взрослым лицам, соблюдающим вегетарианскую или веганскую диету;
— донорам, регулярно осуществляющим донации крови.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: доношенные здоровые дети имеют достаточные запасы железа в первые 4 мес. жизни. В связи с небольшим содержанием железа в грудном молоке детям, находящимся на грудном и смешанном вскармливании, показано дополнительное назначение железа с 4-месячного возраста до введения прикорма. Дети, находящиеся на искусственном вскармливании, получают достаточное количество железа из молочных смесей или прикорма. Дети в возрасте 6–12 мес. должны получать 11 мг железа в сутки. В качестве блюд прикорма следует назначать красное мясо и овощи с высоким содержанием железа. В случае недостаточного поступления железа с молочными смесями или прикормом следует дополнительно назначить железо в виде капель или сиропа. Дети в возрасте 1–3 лет должны получать 7 мг железа в сутки, лучше в виде пищи, содержащей достаточное количество красного мяса, овощей с высоким содержанием железа и фруктов с большим содержанием витамина С, который усиливает всасывание железа.Также возможно дополнительное назначение жидких форм препаратов железа или поливитаминов.
- Рекомендуется проводить вторичную профилактику дефицита железа при каждом обращении пациента к врачу, проведении диспансеризации, медицинских осмотров. Профилактика железодефицита подразумевает проведения скрининговых исследований для выявления ЖДА или латентного железодефицита. При проведении скрининга следует ориентироваться на изменения лабораторных показателей общего анализа крови: Hb, Ht, MCV и MCH. Сывороточные показатели метаболизма железа (СЖ, ОЖСС, СФ, НТЖ), обладающие высокой специфичностью в выявлении дефицита железа, следует использовать для подтверждения диагноза ЖДА или латентного дефицита железа [3,25,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: у детей в возрасте 2–5 лет, не имеющих факторов риска, обследование на предмет выявления ЖДА проводится ежегодно. Среди детей школьного возраста и мальчиков подросткового возраста скрининговому обследованию для выявления анемии подлежат дети, имеющие ЖДА в анамнезе или особые потребности, обусловленные состоянием здоровья или низким поступлением железа с пищей.
Начиная с подросткового возраста, скрининг для выявления анемии проводят у всех небеременных женщин каждые 5–10 лет в течение всего детородного возраста. Ежегодному скринингу подлежат женщины с факторами риска развития ЖДА (обильная кровопотеря при менструации или иной природы, недостаточное потребление железа и предшествующий диагноз ЖДА).
Диспансерное наблюдение за детьми и подростками с ЖДА проводится в нашей стране в течение одного года с момента установления диагноза. Контролируются самочувствие и общее состояние пациента. Перед снятием пациента с диспансерного наблюдения выполняется общий (клинический) анализ крови, все показатели которого должны быть в пределах нормы.
Информация
Источники и литература
-
Клинические рекомендации Национального гематологического общества
- 1. Идельсон ЛИ, Воробьев ПА. Железодефицитные анемии. Руководство по
гематологии. Под ред. В.И. Воробьева, Москва, Ньюдиамед; 2005, p. 171–90.
2. Воробьев А.И., Рациональная фармакотерапия заболеваний системы крови /
Воробьев А.И., Аль-Ради Л.С., Андреева Н.Е. и др.; Под общей ред. А.И. Воробьева — М.:
Литтерра 2009. — 688 с. No Title n.d.
3. Camaschella C. Iron deficiency. Blood 2019;133:30–9. https://doi.org/10.1182/blood-
2018-05-815944.
4. Диагностика и лечение железодефицитной анемии у детей: Пособие для врачей.
Под ред. акад. РАН проф. А.Г. Румянцева и проф. И.Н. Захаровой. М.: ООО “КОНТИ
ПРИНТ”; 2015.
5. Vos T, Abajobir AA, Abate KH, Abbafati C, Abbas KM, Abd-Allah F, et al. Global,
regional, and national incidence, prevalence, and years lived with disability for 328 diseases
and injuries for 195 countries, 1990–2016: a systematic analysis for the Global Burden of
Disease Study 2016. Lancet 2017;390:1211–59. https://doi.org/10.1016/S0140-
6736(17)32154-2.
6. United Nations Children’s Fund, United Nations University, World Health
Organization. Iron deficiency anemia: assessment, prevention and control. A guide for
programme managers 2011:114.
7. Хертд М. Дифференциальная диагностика в педиатрии. Пер. с нем. Том 2. М.:
Медицина; 1990.
8. World Health Organization. ICD-10: international statistical classification of diseases
and related health problems: tenth revision. 2nd ed. Geneva PP — Geneva: World Health
Organization; n.d.
9. Cappellini MD, Musallam KM, Taher AT. Iron deficiency anaemia revisited. J Intern
Med 2019:joim.13004. https://doi.org/10.1111/joim.13004.
10. Дворецкий Л.И. Анемии: стратегия и тактика диагностического поиска.
Справочник поликлинического врача. 2002. №6, с. 5-10 n.d.
11. Bermejo F, García-López S. A guide to diagnosis of iron deficiency and iron deficiency
anemia in digestive diseases. World J Gastroenterol 2009;15:4638.
https://doi.org/10.3748/wjg.15.4638.
12. Погорелов В.М., Козинец Г.И., Ковалева Л.Г. Лабораторно-клиническая
диагностика анемий. Москва. Медицинское Информационное Агентство – 2004 с. 172
n.d.
13. Долгов ВВ, Луговская СА, Морозова ВТ, Почтарь МЕ. Лабораторная диагностика
анемий. Тверь. ООО Губернская медицина. 2001; 84 с. 2001.
14. Cook JD, Baynes RD, Skikne BS. Iron Deficiency and the Measurement of Iron Status.
Nutr Res Rev 1992;5:198–202. https://doi.org/10.1079/NRR19920014.
15. Guyatt GH, Oxman AD, Ali M, Willan A, McIlroy W, Patterson C. Laboratory diagnosis
of iron-deficiency anemia. J Gen Intern Med 1992;7:145–53.
https://doi.org/10.1007/BF02598003.
16. Лукина Е.А., Деженкова А.В. Метаболизм железа в норме и при патологии //
Клиническая онкогематология. 2015. №4. n.d.
17. Gafter-Gvili A, Schechter A, Rozen-Zvi B. Iron Deficiency Anemia in Chronic Kidney
Disease. Acta Haematol 2019;142:44–50. https://doi.org/10.1159/000496492.
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet
2016;387:907–16. https://doi.org/10.1016/S0140-6736(15)60865-0.
19. Тарасова И.С., Чернов В.М., Лаврухин Д.Б., Румянцев А.Г. Оценка
чувствительности и специфичности симптомов анемии и сидеропении // Гематология
и трансфузиология. — 2011. — Т. 56, №5. — С. 6-13. n.d.
20. Goddard AF, James MW, McIntyre AS, Scott BB. Guidelines for the management of iron
deficiency anaemia. Gut 2011;60:1309 LP – 1316. https://doi.org/10.1136/gut.2010.228874.
21. Enns RA, Hookey L, Armstrong D, Bernstein CN, Heitman SJ, Teshima C, et al. Clinical
Practice Guidelines for the Use of Video Capsule Endoscopy. Gastroenterology
2017;152:497–514. https://doi.org/10.1053/j.gastro.2016.12.032.
22. Pennazio M, Spada C, Eliakim R, Keuchel M, May A, Mulder CJ, et al. Small-bowel
capsule endoscopy and device-assisted enteroscopy for diagnosis and treatment of smallbowel
disorders: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline.
Endoscopy 2015;47:352–76. https://doi.org/10.1055/s-0034-1391855.
23. Spada C, Hassan C, Barbaro B, Iafrate F, Cesaro P, Petruzziello L, et al. Colon capsule
versus CT colonography in patients with incomplete colonoscopy: A prospective,
comparative trial. Gut 2015;64:272–81. https://doi.org/10.1136/gutjnl-2013-306550.
24. Шабалов НП. Неонатология. Том 2. С-Пб.: Специальная литература; 1996.
25. Baker RD, Greer FR. Diagnosis and Prevention of Iron Deficiency and Iron-Deficiency
Anemia in Infants and Young Children (0-3 Years of Age). Pediatrics 2010;126:1040–50.
https://doi.org/10.1542/peds.2010-2576.
26. Recommendations to prevent and control iron deficiency in the United States. Centers
for Disease Control and Prevention. MMWR Recomm Reports 1998;47:1–29.
27. Jouet JP. Iron deficiency anaemia. Rev Du Prat 1989;39:1255–9.
28. Toblli J, Brignoli R. Iron (III)-hydroxide Polymaltose Complex in Iron Deficiency
Anemia. Arzneimittelforschung 2011;57:431–8. https://doi.org/10.1055/s-0031-1296692.
29. Ожегов Е.А., Тарасова И.С., Ожегов А.М. и др. Сравнительная эффективность двух
терапевтических планов лечения железодефицитной анемии у детей и подростков //
Вопр. гематологии/онкологии и иммунопатологии в педиатрии. — 2005. — Т. 4, №1. — С.
14-19. n.d.
30. Ожегов ЕА. Оптимизация лечения железодефицитной анемии у детей и
подростков: Автореф. дис. канд. мед. наук. 2005.
31. Тарасова И.С., Чернов В.М. Факторы, определяющие эффективность лечения
детей с железодефицитной анемией // Вопр. практ. педиатрии. — 2011. —Т. 3, №6. — С.
49-52. n.d.
32. Румянцев АГ, Масчан АА, Жуковская ЕВ, editors. Детская гематология.
Клинические рекомендации. М.: ГЭОТАР-Медиа; 2015.
33. Means RT, Krantz SB. Progress in understanding the pathogenesis of the anemia of
chronic disease. Blood 1992;80:1639–47.
https://doi.org/10.1182/blood.v80.7.1639.bloodjournal8071639.
34. De Falco L, Sanchez M, Silvestri L, Kannengiesser C, Muckenthaler MU, Iolascon A, et
al. Iron refractory iron deficiency anemia. Haematologica 2013;98:845–53.
https://doi.org/10.3324/haematol.2012.075515.
35. Tchou I, Diepold M, Pilotto P-A, Swinkels D, Neerman-Arbez M, Beris P. Haematologic
data, iron parameters and molecular findings in two new cases of iron-refractory iron
deficiency anaemia. Eur J Haematol 2009;83:595–602. https://doi.org/10.1111/j.1600-
0609.2009.01340.x.
36. МУ 3.3.1.1095-02. 3.3.1. Вакцинопрофилактика. Медицинские противопоказания
к проведению профилактических прививок препаратами национального календаря
прививок. Методические указания» (утв. Главным государственным санитарным
врачом РФ 09.01.2002). n.d.
- 1. Идельсон ЛИ, Воробьев ПА. Железодефицитные анемии. Руководство по
-
Клинические рекомендации Национального общества детских гематологов, онкологов
Информация
Список сокращений
ЖДА – железодефицитная анемия
ХПА – хроническая постгеморрагическая анемия
ОЖСС – общая железосвязывающая способность сыворотки
НТЖ – насыщение трансферрина железом
СЖ – сывороточное железо
СФ – сывороточный ферритин
АХЗ – анемия хронических заболеваний
ХБП – хроническая болезнь почек
ЖКТ – желудочно-кишечный тракт
УЗИ – ультразвуковое исследование
MCV – средний объем эритроцита
MCH – среднее содержание гемоглобина в эритроците
MCHC – средняя концентрация гемоглобина в эритроциты
IRIDA — рефрактерная к ферротерапии железодефицитная анемия
Термины и определения
Железодефицитная анемия (ЖДА) – это приобретенное заболевание, характеризующееся снижением содержания железа в сыворотке крови, костном мозге и тканевых депо, в результате чего нарушается образование гемоглобина и эритроцитов, развивается гипохромная анемия и трофические расстройства в тканях.
Латентный железодефицит – это состояние, характеризующееся истощением запасов железа в организме при нормальном уровне гемоглобина.
Ферротерапия – лечение лекарственными препаратами железа.
Ретикулоцитарный криз или ретикулоцитарная реакция – повышение количества ретикулоцитов более, чем на 20-25% от исходного.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Члены Национального гематологического общества:
1. Лукина Е.А., д.м.н., профессор, зав. научно-клиническим отделением орфанных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России
2. Цветаева Н.В., к.м.н., старший научный сотрудник отделения орфанных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России
3. Двирнык В.Н., к.м.н., зав. централизованной клинико-диагностической лабораторией ФГБУ «НМИЦ гематологии» Минздрава России
Члены Национального общества детских гематологов и онкологов:
4. Румянцев А.Г., академик РАН, д.м.н., профессор, президент ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
5. Масчан А.А., д.м.н., профессор, заведующий отделением детской гематологии/онкологии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
6. Чернов В.М.2, д.м.н., профессор, заведующий научно-аналитическим отделом ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
7. Тарасова И.С. 2, д.м.н., ученый секретарь Института гематологии, иммунологии и клеточных технологий ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
Члены Федерации лабораторной медицины:
8. Луговская С.А.3 , д.м.н., профессор кафедры клинической лабораторной диагностики ФГБОУ ДПО РМАНПО Минздрава России
Члены эндоскопического общества РФ РЭНДО:
9. Иванова Е.В.4,5, д.м.н., главный научный сотрудник НИЛ хирургической гастроэнтерологии и эндоскопии ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, зав. отделением эндоскопии Медицинского центра «Покровские ворота».
10. Фёдоров Е.Д.4,6 , д.м.н., проф., главный научный сотрудник и руководитель отдела эндоскопии кафедры госпитальной хирургии № 2 с НИЛ хирургической гастроэнтерологии и эндоскопии ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
Конфликт интересов: авторы не имеют конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Врачи- гематологи
Врачи- терапевты
Врачи- педиатры
Врачи- хирурги
Врачи-акушеры-гинекологи
Врачи- онкологи
Врачи- гастроэнтерологи
Методология сбора доказательств
Методы, использованные для сбора / селекции доказательств:
- Поиск публикаций в специализированных периодических печатных изданиях
- Поиск в электронных базах данных.
Методы, использованные для качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости доказательств проводилась в соответствии со шкалой оценки уровней достоверности доказательств (УДД) для методов диагностики (Табл. А1) и для методов профилактики, лечения и реабилитации (Табл. А2).
Таблица А1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица А2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Описание методики анализа доказательств и разработки рекомендаций:
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучалась для того, чтобы убедиться в соответствии ее принципам доказательной медицины. Результат изучения влиял на уровень доказательности, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Методологическое изучение фокусировалось на особенностях дизайна исследования, которые оказывали существенное влияние на качество результатов и выводов.
С целью исключения влияния субъективных факторов каждое исследование оценивалось независимо, как минимум двумя независимыми членами авторского коллектива. Различия в оценке обсуждались на совещаниях рабочей группы авторского коллектива данных рекомендаций.
На основании анализа доказательств последовательно были разработаны разделы клинических рекомендаций с оценкой силы в соответствии с рейтинговой схемой рекомендаций (табл.3).
Методы, использованные для формулирования рекомендаций:
- Консенсус экспертов;
- Оценка значимости рекомендаций в соответствии с рейтинговой схемой (табл. А3).
Таблица А3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Окончательная редакция
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Таблица 1. Основные пероральные препараты, применяемые для лечения железодефицитной анемии, и содержание в них элементарного железа
Таблица 2. Некоторые современные препараты железа для парентерального введения
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
1. ЖДА — заболевание излечимое в 100% случаев. Основные задачи лечения: найти причину снижения гемоглобина и провести лечение препаратами железа. Лечение, как правило, длительное и составляет от 3 до 6 месяцев в зависимости от степени тяжести анемии.
2. Необходимо получить у лечащего врача рекомендации по питанию.
3. Плохая переносимоть препаратов железа (боли в животе, тошнота, рвота, запор, понос) является поводом обратиться к лечащему врачу за консультацией. Возможны смена препарата или кратковеременное уменьшение дозы препарата.
4. Излечением от ЖДА является не достижение нормальной концентрации Hb, а восполнение запасов железа в организме, что может быть доказано с помощью биохимического исследования – определения концентрации СФ.
5. Прекращение приема препаратов железа после достижения нормальной концентрации Hb является ошибкой и создает предпосылки к рецидиву заболевания.
6. Родители детей с ЖДА должны получить рекомендации педиатра по проведению профилактических прививок. У детей с нетяжелой ЖДА профилактические прививки проводятся в соответствии с календарем прививок.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Нет.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
ММА имени И.М. Сеченова
Широкий спектр самых разнообразных заболеваний, приводящих к анемии наряду с различными механизмами развития анемического синдрома позволяет считать целесообразным осуществление диагностического поиска в определенной последовательности с решением конкретной диагностической задачи на каждом из этапов поиска.
На начальном этапе диагностического поиска основной целью является определение так называемого патогенетического варианта анемии (АН), т.е. основного механизма, обусловливающего снижение уровня гемоглобина у конкретного пациента.
На основании преобладающего механизма (не причины!) формирования различных видов анемий можно условно выделить несколько патогенетических вариантов:
– железодефицитные АН
– сидероахрестические (железонасыщенные) АН
– железоперераспределительные АН
– В12– дефицитные и фолиеводефицитные АН
– гемолитические АН
– анемии при костно–мозговой недостаточности
– анемии при уменьшении объема циркулирующей крови
– анемии со смешанным механизмом развития.
На данном этапе фактически речь идет о синдромной диагностике, так как каждый из патогенетических вариантов представляет собой лишь отдельный анемический синдром (синдром железодефицитной, синдром гемолитической анемии и т.д.). Указанные варианты отражают лишь ведущий патогенетический механизм, в то время как причины развития АН при каждом патогенетическом варианте могут быть различными. Например, причиной железодефицитной анемии могут быть хронические кровопотери из ЖКТ, патология кишечника с нарушением всасывания, алиментарная недостаточность и др. Сидероахрестические анемии могут развиваться у больных хронической свинцовой интоксикацией, на фоне лечения некоторыми лекарственными препаратами (изониазид и др.).
На следующем этапе диагностического поиска после определения патогенетического варианта анемии задачей врача является распознавание заболевания или патологического процесса, лежащего в основе имеющегося анемического синдрома, т.е. выявление причины анемии у конкретного больного. Данный этап диагностического поиска может быть условно обозначен, как нозологическая диагностика. Последняя приобретает важное значение, поскольку позволяет во многих случаях проводить не только патогенетическую терапию анемии, например, препаратами железа, но и воздействовать на основное заболевание (устранение хронической кровопотери при железодефицитной анемии, купирование инфекционно–воспалительного процесса и т.д.).
Железодефицитные анемии
Основным патогенетическим механизмом развития железодефицитной анемии (ЖДА) является недостаток в организме железа – главного строительного материала для построения молекулы гемоглобина, в частности, его железосодержащей части – гема. Основными критериями ЖДА являются следующие:
– низкий цветовой показатель
– гипохромия эритроцитов, микроцитоз
– снижение уровня сывороточного железа
– повышение общей железосвязывающей способности сыворотки
– снижение содержания ферритина в сыворотке.
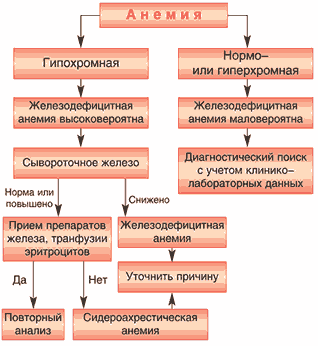
На этапе нозологической диагностики поиск причины ЖДА должен проводиться с использованием наиболее информативных методов исследования для конкретной клинической ситуации (данные анамнеза, объективного обследования, дополнительные методы и т.д.) (рис. 1).
Рис. 1. Алгоритм диагностического поиска при гипохромной и нормо-/гиперхромной анемии
Основные причины развития ЖДА:
1. Хронические кровопотери различной локализации:
1. Хронические кровопотери различной локализации:
– желудочно–кишечные (гастроэзофагальная рефлюксная болезнь, эрозивно–язвенные поражения желудка, опухоли желудка и толстой кишки, терминальный илеит, неспецифический язвенный колит, дивертикулиты, кровоточащий геморрой и др.);
– маточные (меноррагии различной этиологии, миома, эндометриоз, внутриматочные контрацептивы;
– носовые (наследственная геморрагическая телеангиэктазия и другие геморрагические диатезы);
– почечные (IgA–нефропатия, геморрагический нефрит, опухоли почек, перманентный внутрисосудистый гемолиз);
– ятрогенные и искусственные кровопотери (частые кровопускания и заборы крови для исследований, лечение гемодиализом, донорство и др.).
2. Нарушение всасывания железа (энтериты различного генеза, синдром недостаточности всасывания, резекции тонкой кишки, резекция желудка с выключением 12–перстной кишки).
3. Повышенная потребность в железе (беременность, лактация, интенсивный рост и пубертатный период, В12 –дефицитная анемия, леченная цианокобаламином).
4. Нарушение транспорта железа (гипопротеинемии различного генеза).
5. Алиментарная недостаточность.
Лечение. При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). В целом ряде случаев (меноррагии и др.) основное значение приобретает патогенетическая терапия лекарственными препаратами железа (ПЖ).
В клинической практике ПЖ применяются внутрь или парентерально. Путь введения препарата у больных ЖДА определяется конкретной клинической ситуацией. В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. На российском фармацевтическом рынке имеется широкий выбор ПЖ для приема внутрь. Они различаются количеством содержащихся в них солей железа, в том числе двухвалентного железа, наличием дополнительных компонентов (аскорбиновая и янтарная кислоты, витамины, фруктоза и др.), лекарственными формами (таблетки, драже, сиропы, растворы), переносимостью, стоимостью (табл. 1)
Клинические рекомендации лечения ПЖ для приема внутрь:
– назначение ПЖ в виде солей внутрь с достаточным содержанием двухвалентного железа;
– назначение ПЖ в виде солей внутрь с достаточным содержанием двухвалентного железа;
– назначение ПЖ, содержащих вещества, усиливающие всасывание железа;
– нежелательность одновременного приема пищевых веществ и лекарственных препаратов, уменьшающих всасывание железа;
– целесообразность назначения препаратов железа, содержащих фолиевую кислоту, цианокобаламин при наличии смешанного характера анемии;
– назначение препаратов железа парентерально при нарушении кишечного всасывания;
– достаточная продолжительность насыщающего курса терапии (не менее 1–1,5 мес);
– необходимость проведения поддерживающей терапии ПЖ в соответствующих ситуациях.
При выборе лекарственного ПЖ следует ориентироваться на содержание в нем двухвалентного железа, которое только и всасывается в кишечнике. Входящие в состав многих лекарственных форм ПЖ аскорбиновая кислота, цистеин, фруктоза усиливают всасывание железа. Назначение препаратов железа в высоких дозах (300 мг в сутки) не приводит к увеличению всасывания ионов железа, однако вызывает значительное увеличение числа побочных эффектов. С учетом этого комбинированные препараты, содержащие в своем составе фолиевую кислоту, как необходимый компонент для нормального синтеза и созревания эритроцитов, и цианокобаламин, необходимый для нормального обмена фолиевой кислоты, являющийся основным фактором образования из нее активной формы, приводят к значительному увеличению скорости синтеза гемоглобина и повышают эффективность терапии железодефицитной анемии. Всем этим критериям удовлетворяет комплексный антианемический препарат Ферро–фольгамма, содержащий в своем составе, кроме сульфата железа, 100 мг аскорбиновой кислоты, 10 мкг цианокобаламина, 5 мг фолиевой кислоты. Так, например, при назначении препарата с низким содержанием двухвалентного железа количество принимаемых таблеток должно быть не менее 8–10 в сутки, в то время как препараты с высоким содержанием двухвалентного железа (Ферро–фольгамма) можно принимать в количестве 1–2 таблеток в сутки. Необходимо учитывать, что всасывание железа может уменьшаться под влиянием некоторых содержащихся в пище веществ (фосфорная кислота, соли кальция и др.), а также при одновременном применении ряда медикаментов (тетрациклины, соли магния). Во избежание этого в препарате Ферро–фольгамма все активные компоненты находятся в специальной нейтральной оболочке, обеспечивающей их всасывание главным образом в верхнем отделе тонкой кишки. Отсутствие местного раздражающего действия на слизистую желудка способствует хорошей переносимости.
Среди побочных проявлений на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический привкус во рту, запоры, реже – поносы.
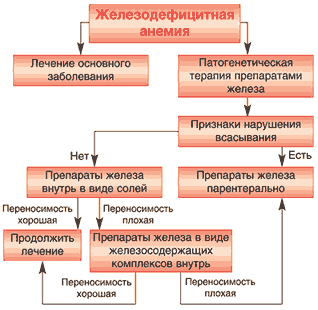
Показаниями для применения ПЖ парентерально могут быть следующие клинические ситуации:
– нарушение всасывания;
– непереносимость ПЖ для приема внутрь, не позволяющая дальнейшее продолжение лечения;
– необходимость более быстрого насыщения организма железом, например, перед оперативным вмешательством (миома матки, геморрой и др.).
Алгоритм ведения больших ЖДА представлен на рисунке 2.
Рис. 2. Алгоритм ведения больных железодефицитной анемией
Сидероахрестические анемии
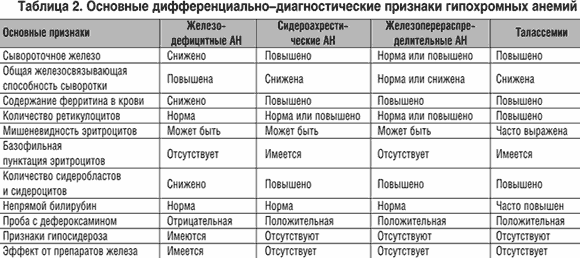
Существует группа гипохромных анемий, при которых содержание железа в организме и его запасы в депо находятся в пределах нормы или даже повышены, однако включение железа в молекулу гемоглобина (в силу различных причин) нарушено, в связи с чем железо не используется для синтеза гема. Такие анемии обозначаются, как сидероахрестические («ахрезия» – неиспользование). Их удельный вес в структуре гипохромных анемий невелик. Тем не менее верификация сидероахрестической («железонасыщенной») анемии и ее дифференциальная диагностика с ЖДА имеют важное практическое значение. Ошибочная диагностика ЖДА у больных с сидероахрестическими анемиями обычно влечет за собой неоправданное назначение препаратов железа, которые в данной ситуации не только не оказывают эффекта, но еще больше «перегружают» запасы железа в депо. Критериями сидероахрестических анемий являются следующие:
Существует группа гипохромных анемий, при которых содержание железа в организме и его запасы в депо находятся в пределах нормы или даже повышены, однако включение железа в молекулу гемоглобина (в силу различных причин) нарушено, в связи с чем железо не используется для синтеза гема. Такие анемии обозначаются, как сидероахрестические («ахрезия» – неиспользование). Их удельный вес в структуре гипохромных анемий невелик. Тем не менее верификация сидероахрестической («железонасыщенной») анемии и ее дифференциальная диагностика с ЖДА имеют важное практическое значение. Ошибочная диагностика ЖДА у больных с сидероахрестическими анемиями обычно влечет за собой неоправданное назначение препаратов железа, которые в данной ситуации не только не оказывают эффекта, но еще больше «перегружают» запасы железа в депо. следующие:
– низкий цветовой показатель;
– гипохромия эритроцитов;
– повышенное (реже нормальное) содержание железа в сыворотке;
– нормальная или сниженная железосвязывающая способность сыворотки;
– нормальное или повышенное содержание ферритина в сыворотке;
– повышенное количество сидеробластов в костном мозге;
– повышенная экскреция железа с мочой после введения десферала;
– отсутствие эффекта от препаратов железа.
Сидероахрестические анемии представляют собой гетерогенную группу и возникают в результате различных причин. Поэтому нозологический этап диагностического поиска при сидероахрестических анемиях должен проводиться с учетом как клинической ситуации, так и знания основных заболеваний и патологических процессов, сопровождающихся развитием данного анемического синдрома. Известны несколько форм сидероахрестических анемий:
– наследственные формы (аутосомные и рецессивные, чувствительные и рефрактерные к применению пиридоксина);
– связанные с дефицитом фермента гемсинтетазы (обеспечивающей включение железа в молекулу гема);
– связанные с нарушением синтеза гемоглобина из–за патологии его глобиновой части (талассемия). Это заболевание рассматривается обычно в группе гемолитических анемий;
– приобретенные формы (алкогольная интоксикация, хроническая свинцовая интоксикация, воздействие некоторых медикаментов, миелопролиферативные заболевания, кожная порфирия, идиопатические формы).
Клинические рекомендации ведения больных сидероахрестическими анемиями:
– коррекция основного патологического процесса (отмена подозреваемого медикамента, ЭДТА при свинцовой интоксикации и др.);
– назначение пиридоксина при некоторых формах (наследственных);
– назначение десфериоксиамина при высоком уровне сывороточного железа;
– трансфузии эритроцитов по строгим показаниям (выраженная анемия у больных с сопутствующей патологией);
– противопоказание к назначению препаратов железа.
Железоперераспределительные анемии
Среди гипохромных анемий определенное место занимают анемии при различных воспалительных заболеваниях как инфекционного, так и неинфекционного происхождения. При всем многообразии патогенетических механизмов анемий в данных ситуациях одним из основных считается перераспределение железа в клетки макрофагальной системы, активирующейся при различных воспалительных (инфекционных и неинфекционных) или опухолевых процессах. Поскольку истинного дефицита железа при этих анемиях не наблюдается, более оправданно говорить о железоперераспределительных анемиях.
Критерии железоперераспределительных АН:
- умеренно гипохромный характер анемии;
- нормальное или умеренно сниженное содержание сывороточного железа;
- нормальная или сниженная железосвязывающая способность сыворотки;
- повышение содержания ферритина в сыворотке;
- повышение количества сидеробластов в костном мозге;
- клинико–лабораторные признаки активного процесса (воспалительного, опухолевого);
- отсутствие эффекта от препаратов железа.
Выделение данного патогенетического варианта и осведомленность о нем практических врачей имеет важное значение ввиду сходства железоперераспределительных анемий с ЖДА и некоторыми сидероахрестическими анемиями (табл. 2), хотя сущность и терапевтические подходы при этих анемиях различны.
Наиболее частыми инфекционно–воспалительными заболеваниями, при которых возникают железоперераспределительные анемии, являются активный туберкулез различной локализации, инфекционный эндокардит, нагноительные заболевания (абсцессы брюшной полости, легких, почек, эмпиема и др.), инфекции мочевыводящих путей, холангит. Среди неинфекционных заболеваний подобный вариант анемий может развиваться при ревматических заболеваниях (ревматоидный артрит и инфекционные артриты с высокой активностью), хронических гепатитах, опухолях различной локализации при отсутствии хронических и острых кровопотерь. Назначение препаратов железа, цианокобаламина в этих ситуациях обычно неэффективно и лишь затягивает своевременное выявление основной причины анемии и соответствующую терапию. Основным способом коррекции анемии у данной категории пациентов является лечение активного воспалительного процесса.
В12 – дефицитные и фолиеводефицитные анемии
В основе данного патогенетического варианта лежит дефицит витамина В12, реже – фолиевой кислоты, возникающий вследствие различных причин. В результате дефицита происходит нарушение синтеза ДНК в кроветворных клетках, развивается неэффективный мегалобластический эритропоэз (в норме существует только у плода) с продукцией нестойких мегалоцитов и макроцитов.
Критерии В12– дефицитной АН:
– высокий цветовой показатель;
– макроцитоз, мегалоцитоз;
– эритроциты с остатками ядер (тельца Жолли, кольца Кэбота);
– ретикулоцитопения;
– гиперсегментация нейтрофилов;
– лейкопения (нейтропения);
– тромбоцитопения;
– повышение содержания железа в сыворотке;
– мегалобластическое кроветворение в костном мозге;
– неврологические нарушения и психические расстройства.
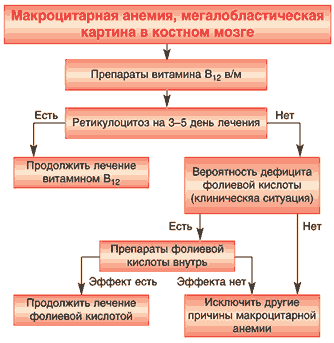
На этапе синдромной диагностики основным методом является исследование костного мозга, при котором выявляется мегалобластический эритропоэз. Данное исследование должно проводиться до назначения цианокобаламина, который широко и часто необоснованно назначается по поводу неясных АН или различной неврологической симптоматики. При невозможности выполнить диагностическое исследование костного мозга (отказ больных и др.) допустимо пробное назначение цианокобаламина с последующим обязательным исследованием количества ретикулоцитов через 3–5 дней (не позже), приобретающим диагностическое значение. Если АН связана с дефицитом витамина В12, то под влиянием нескольких инъекций препарата происходит трансформация мегалобластического кроветворения в нормобластическое, что отражается в периферической крови значительным увеличением количества ретикулоцитов по сравнению с исходным (ретикулоцитарный криз).
Основными причинами развития В12–дефицитной анемии, на исключение которых должен ориентироваться врач на этапе нозологической диагностики, являются следующие:
– нарушение всасывания витамина В12 (атрофический гастрит, рак желудка, операция гастрэктомии, резекция тонкой кишки, наложение кишечных анастомозов с формированием «слепой петли», энтериты с нарушением всасывания, спру, целиакия, селективный дефект (аутосомно–рецессивный) всасывания в сочетании с протеинурией, проявляющийся в раннем детском возрасте (синдром Имерслунд);
– повышенная потребность в витамине В12 (инвазия широким лентецом, дивертикулез толстой кишки, дисбактериоз кишечника, быстрый рост у детей, гипертиреоз, хронические заболевания печени);
– нарушение транспорта витамина В12 (дефицит транскобаламина II (аутосомно–рециссивно наследуемый дефект, проявляющийся в раннем детском возрасте);
– нарушение использования при приеме некоторых медикаментов (ПАСК, неомицин, метформин);
– алиментарная недостаточность (редкая причина) главным образом в детском возрасте, при длительном парентеральном питании без дополнительного введения витаминов.
Фолиево–дефицитные АН по своим гематологическим признакам (макроцитоз, мегалобластический эритропоэз) напоминают В12– дефицитные АН, но встречаются значительно реже и имеют несколько иной спектр вызывающих эти АН заболеваний. Среди причин фолиеводефицитных анемий основными следует считать:
– алиментарную недостаточность (частая причина у пожилых);
– энтериты с нарушением всасывания;
– прием некоторых медикаментов, угнетающих синтез фолиевой кислоты (метотрексат, триамтерен, противосудорожные, барбитураты, метформин);
– хроническую алкогольную интоксикацию;
– повышенную потребность в фолиевой кислоте (злокачественные опухоли, гемолиз, эксфолиативный дерматит, беременность).
Алгоритм ведения больных с макроцитарной анемией неясного происхождения представлен на рисунке 3.
Рис. 3. Алгоритм ведения больных макроцитарной анемией неустановленной причины
Гемолитические анемии
Основным патогенетическим механизмом развития гемолитической АН (ГАН) является укорочение продолжительности жизни эритроцитов (в норме 100–120 дней) и их преждевременный распад под воздействием различных причин.
Основным патогенетическим механизмом развития гемолитической АН (ГАН) является укорочение продолжительности жизни эритроцитов (в норме 100–120 дней) и их преждевременный распад под воздействием различных причин.
Критериями ГАН являются следующие:
– нормальный цветовой показатель (низкий при талассемии);
– ретикулоцитоз;
– наличие в крови ядросодержащих эритроидных клеток (эритрокариоцитов);
– увеличение числа эритрокариоцитов в костном мозге (свыше 25%);
– повышение содержания непрямого билирубина в сыворотке с наличием желтухи или без таковой;
– повышение содержания железа в сыворотке;
– наличие в моче гемосидерина (при некоторых формах с внутрисосудистым гемолизом);
– повышение содержания свободного гемоглобина в плазме (при внутрисосудистом гемолизе);
– увеличение селезенки (при некоторых формах).
Большинство ГАН являются нормо– или гиперхромными за исключением ГАН, связанной с нарушением синтеза глобина (талассемия), которая является гипохромной.
Направление диагностического поиска на назологическом этапе определяется особенностями клинической ситуации (возраст больного, наличие и характер фоновой патологии, прием медикаментов, семейные случаи, острый или хронически протекающий гемолиз и т.д.). Следует различать наследственные и приобретенные ГАН.
Наследственные ГАН связаны с различными генетическими дефектами, в частности, с дефектом мембраны эритроцитов (наследственный микросфероцитоз, овалоцитоз), дефицитом некоторых ферментов в эритроцитах (глюкозо–6–фосфат–дегидрогеназа, пируваткиназа и др.), нарушением синтеза цепей глобина (талассемия), наличием нестабильных гемоглобинов.
Талассемию следует заподозрить у больных гипохромной анемией с нормальным или высоким содержанием сывороточного железа в сочетании с признаками гемолиза, а также при отсутствии эффекта от препаратов железа, нередко по ошибке назначаемых таким больным. Для подтверждения диагноза и определения формы талассемии необходимо электрофоретическое исследование гемоглобина.
Среди приобретенных ГАН наиболее распространенными являются аутоиммунные ГАН (симптоматические и идиопатические). Симптоматические аутоиммуные ГАН возникают на фоне лимфопролиферативных заболеваний (хронический лимфолейкоз, лимфогранулематоз и др.), системных васкулитов (системная красная волчанка, ревматоидный артрит), хронического активного гепатита, некоторых инфекций, в частности; вирусных, при приеме ряда медикаментов. Если причина аутоиммунного гемолиза не выявляется, то говорят об идиопатических ГАН. К приобретенным ГАН относятся болезнь Маркиафавы (перманентный внутрисосудистый гемолиз), микроангиопатические ГАН (гемолиз вследствие ДВС–синдрома на фоне различных заболеваний), механический гемолиз при протезированных сосудах и клапанах сердца, маршевой гемоглобинурии, ГАН при воздействии различных токсических веществ (уксусная кислота, мышьяк и др.).
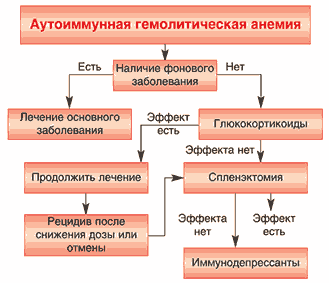
Ведение больных аутоиммунными ГАН определяется вариантом ГАН (симптоматический или идиопатический) На рисунке 4 представлен алгоритм ведения больных аутоиммунной ГАН.
Рис. 4. Алгоритм лечения аутоиммунной гемолитической анемии
Анемии при костно–мозговой недостаточности
В основе данного патогенетического варианта АН лежит нарушение нормальной продукции эритроидных клеток в костном мозге. При этом часто одновременно с угнетением эритропоэза имеет место нарушение продукции клеток гранулоцитарного и тромбоцитарного ростков, что отражается на составе периферической крови (панцитопения) и служит ориентиром в распознавании возможного механизма развития АН.
В основе данного патогенетического варианта АН лежит нарушение нормальной продукции эритроидных клеток в костном мозге. При этом часто одновременно с угнетением эритропоэза имеет место нарушение продукции клеток гранулоцитарного и тромбоцитарного ростков, что отражается на составе периферической крови (панцитопения) и служит ориентиром в распознавании возможного механизма развития АН.
Критерии АН при костно–мозговой недостаточности:
– нормохромная (реже гиперхромная) АН;
– ретикулоцитопения (вплоть до полного отсутствия ретикулоцитов при некоторых формах);
– лейкопения за счет снижения содержания нейтрофильных гранулоцитов (гранулоцитопения);
– тромбоцитопения различной степени выраженности;
– лихорадка, инфекционные осложнения, язвенно–некротические поражения слизистых;
– геморрагический синдром;
– изменения картины костно–мозгового кроветворения в соответствии с характером основного патологического процесса (замещение жировой тканью, инфильтрация бластными клетками и др.).
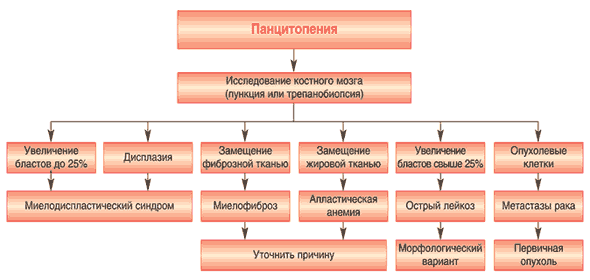
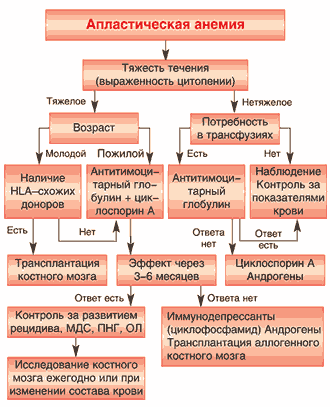
На рисунке 5. представлен диагностическаий алгоритм у больных с различными вариантами цитопенического синдрома (панцитопения, бицитопения). На рисунке 6 представлен алгоритм ведения больных с апластической анемией.
Рис. 5. Алгоритм диагностического поиска у больных панцитопенией
Рис. 6. Алгоритм ведения больных апластической анемией
Клинические рекомендации ведения больных апластической анемией:
- устранение выявленной причины (отмена лекарственного препарата, удаление тимомы, лечение вирусных инфекций и т.д.);
- HLA–типирование родных братьев и сестер больных с целью подбора донора костного мозга;
- трансфузии тромбоцитов при количестве тромбоцитов ниже 10х109/л или при менее глубокой тромбоцитопении, но выраженном геморрагическом синдроме;
- трансфузии тромбоцитов от HLA–совместимых доноров при профузных кровотечениях;
- трансфузии эритроцитов при снижении Нв ниже 70 г/л или при менее глубокой анемии у пожилых и стариков;
- нецелесообразны трансфузии компонентов крови от родственников–потенциальных доноров костного мозга;
- эффективность антитимоцитарного глобулина и циклоспорина оценивается через 3–6 месяцев;
- назначение глюкокортикоидов в качестве монотерапии нецелесообразно;
- недоказанная эффективность рекомбинантных препаратов ростковых факторов (Г–КСФ, ГМ–КСФ, ИЛ–1, ИЛ–3);
- обеспечение условий, предупреждающих инфекционные осложнения.
Анемии с сочетанными патогенетическими механизмами
В клинической практике нередко встречаются АН, в развитии которых могут иметь значение два или более патогенетических механизма. Сочетанный патогенетический вариант может встречаться у больных пожилого и старческого возраста (например, железодефицитная анемия в сочетании с фолиеводефицитной анемией). В таких ситуациях оправдано назначение препаратов, содержащих железо и фолиевую кислоту.
Название: Гематология. Национальное руководство
Автор: Рукавицын О.А.
Год издания: 2017
Размер: 17.63 МБ
Формат: pdf
Язык: Русский
Национальное руководство «Гематология» под ред., Рукавицына О.А., рассматривает огромный спектр практических и теоретических вопросов связанных с оказанием гематологической помощи. Освещены вопросы организации службы гематологической помощи в стране, ее особенности. Изложены принципы обследования пациента с патологией систем ы крови. Описаны современные данные о гемопоэтических факторах роста, гемопоэзе. Книга содержит большое количество материала о современных методах диагностики, дифференциальной диагностики и принципах лечения основных заболеваний крови. Освещены определенные особенности тактики ведения пациента с заболеванием крови в амбулаторных условиях. Представлены современные принципы фармакотерапии лимфом, анемий, цитостатической болезни, тромбоцитопений и так далее. Отдельно коллектив авторов клинического руководства выделяет главу неотложных состояний в гематологии. Для гематологов, терапевтов, педиатров, онкологов. Хирургов, анестезиологов-реаниматологов.
Эта книга удалена по требованию правообладателя

Также рекомендуем скачать
Название: Инфузионно-трансфузионная терапия. 2-е издание
Автор: Рагимов А.А., Щербакова Г.Н.
Год издания: 2019
Размер: 2.48 МБ
Формат: pdf
Язык: Русский
Описание: Практическое руководство «Инфузионно-трансфузионная терапия» под ред., А.А. Рагимова и соавт., является вторым дополненным изданием, которое является настольной книгой для большого количества врачей р… Скачать книгу бесплатно
Название: Анемии. Краткое руководство для практических врачей всех специальностей
Автор: Рукавицын О.А.
Год издания: 2018
Размер: 2.6 МБ
Формат: pdf
Язык: Русский
Описание: Практическое руководство «Анемии. Краткое руководство для практических врачей всех специальностей» под ред., Рукавицына О.А., рассматривает общую характеристику эритропоэза. обмена железа в организме … Скачать книгу бесплатно
Название: Физиология и патология гемостаза
Автор: Стуклов Н.И.
Год издания: 2016
Размер: 2.69 МБ
Формат: docx
Язык: Русский
Описание: В книге «Физиология и патология гемостаза» под ред., Стуклова Н.И., рассматриваются вопросы клинической физиологии системы гемостаза и ее нарушений. Описаны особенности системы свертывания крови (перв… Скачать книгу бесплатно
Название: ДВС-синдром
Автор: Алексеева Л.А., Рагимов А.А.
Год издания: 2010
Размер: 1.68 МБ
Формат: docx
Язык: Русский
Описание: В представленной книге «ДВС-синдром» под ред., Алексеевой Л.А., и соавт., рассматриваются вопросы клинической физиологии системы гемостаза, патогенеза развития ДВС и ДВС-синдрома. Изложены клинические… Скачать книгу бесплатно
Название: Группы крови человека. Руководство по иммуносерологии.
Автор: Донсков С.И., Мороков В.А.
Год издания: 2011
Размер: 11.48 МБ
Формат: pdf
Язык: Русский
Описание: Представленное руководство по иммуносерологии «Группы крови человека» детально рассматривает имеющиеся сведения по 38 антигенным групповым системам, что имеет особое значение при гемокомпонентно терап… Скачать книгу бесплатно
Название: Геморрагические заболевания и синдромы. 2-е издание.
Автор: Баркаган З.С.
Год издания: 1988
Размер: 14.34 МБ
Формат: djvu
Язык: Русский
Описание: Представленное руководство «Геморрагические заболевания и синдромы» рассматривает такие актуальные вопросы, как основные механизмы гемостаза, приведена методология диагностики нарушений свертывающей с… Скачать книгу бесплатно
Название: Атлас по гематологии. Практическое пособие по морфологической и клинической диагностике
Автор: Тэмпл Х., Диан Х., Хаферлах Т.
Год издания: 2010
Размер: 31.46 МБ
Формат: pdf
Язык: Русский
Описание: Практическое руководство «Атлас по гематологии. Практическое пособие по морфологической и клинической диагностике» под ред., Тэмпл Х., и соавт., рассматривает морфологию клеток крови в норме и патолог… Скачать книгу бесплатно
Название: Анемический синдром в клинической практике
Автор: Воробьев П.А.
Год издания: 2001
Размер: 2.7 МБ
Формат: pdf
Язык: Русский
Описание: Практическое руководство «Анемический синдром в клинической практике» под ред., Воробьева П.А., рассматривает характеристики анемий различного генеза. Изложена железодефицитная анемия, хроническая ане… Скачать книгу бесплатно
Название: Железодефицитные анемии у детей
Автор: Коровина Н.А., Заплатников А.Л., Захарова И.Н.
Год издания: 1998
Размер: 1.33 МБ
Формат: pdf
Язык: Русский
Описание: Учебное руководство «Железодефицитные анемии у детей» под ред., Коровина Н.А., и соавт., рассматривает принципы обмена железа в организме ребенка, его патологические состояния. Изложена этиология разв… Скачать книгу бесплатно
Название: Анемия. Руководство для практических врачей
Автор: Верткин А.Л., Ховасова Н.О., Ларюшкина Е.Д., Шамаева К.И.
Год издания: 2014
Размер: 3.06 МБ
Формат: pdf
Язык: Русский
Описание: Практическое пособие «Анемия. Руководство для практических врачей» под ред., Верткина А.Л., и соавт., рассматривает нарушение гемостаза как одного из основополагающих факторов развития сердечно-сосуди… Скачать книгу бесплатно