- Новости
- Наши услуги
- О компании
- VIDAL BOX
- Парафармацевтика
-
Ветеринария
- МКБ-11
USP
Фармакопея США
Оглавление
- Фармакологическое действие
- Показания препарата
- Режим дозирования
- Побочное действие
- Противопоказания к применению
- Особые указания
- Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Антисептическое средство из группы оксидантов. Представляет собой комплексное соединение перекиси водорода с мочевиной. При контакте перекиси водорода с поврежденной кожей и слизистыми оболочками высвобождается активный кислород, при этом происходит механическое очищение и инактивация органических веществ (протеины, кровь, гной).
Показания активного вещества
МОЧЕВИНЫ ПЕРОКСИД
Стоматит, ангина, гинекологические заболевания (для промываний и полосканий); небольшие поверхностные раны, мелкие капиллярные кровотечения из поверхностных ран, носовые кровотечения.
Режим дозирования
Применяют наружно и местно в виде водного раствора.
Мочевины пероксид следует применять согласно тем показаниям, тому способу применения и в тех дозах, которые указаны в инструкции по медицинскому применению конкретного препарата мочевины пероксида.
Побочное действие
Возможно: ощущение жжения при обработке поврежденной поверхности кожи и слизистых оболочек; гипертрофия сосочков языка (при длительном применении для полоскания полости рта).
В отдельных случаях: аллергические реакции.
Противопоказания к применению
Повышенная чувствительность к мочевины пероксиду.
Применение при беременности и кормлении грудью
Возможно применение при беременности и в период грудного вскармливания по рекомендации врача.
Особые указания
Не применять для орошения полостей; избегать попадания в глаза.
Следует иметь в виду, что действие мочевины пероксида не является стерилизующим, при его применении происходит временное уменьшение количества микроорганизмов.
Не следует применять окклюзионные повязки.
Лекарственное взаимодействие
Нестабилен в щелочной среде, в присутствии солей металлов, сложных радикалов некоторых оксидантов, а также на свету и в тепле.
Реклама. ООО Векторфарм, ОГРН 1127746033458
Реклама. АО «Видаль Рус»
Информация о препаратах, отпускаемых по рецепту, размещенная на сайте, предназначена только для специалистов.
Информация, содержащаяся на сайте, не должна использоваться пациентами для принятия самостоятельного
решения о применении представленных лекарственных препаратов и не может служить заменой очной
консультации врача.
Свидетельство о регистрации средства массовой информации Эл № ФС77-79153 выдано Федеральной службой по надзору в
сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) 15 сентября 2020 года.
Copyright © Справочник Видаль «Лекарственные препараты в России»
Кокина О.А.
ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России
Ведлер А.А.
ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России
Кожевникова П.Е.
ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России
Возможности применения мочевины в дерматологии
Авторы:
Ковалева Ю.С., Кокина О.А., Ведлер А.А., Кожевникова П.Е.
Как цитировать:
Ковалева Ю.С., Кокина О.А., Ведлер А.А., Кожевникова П.Е. Возможности применения мочевины в дерматологии. Клиническая дерматология и венерология.
2020;19(5):685‑689.
Kovaleva JuS, Kokina OA, Vedler AA, Kozhevnikova PE. Urea applications in dermatology. Klinicheskaya Dermatologiya i Venerologiya. 2020;19(5):685‑689. (In Russ.)
https://doi.org/10.17116/klinderma202019051685

Роговой слой эпидермиса защищает организм от внешних факторов воздействия и контролирует обменные процессы с окружающей средой, в частности, трансэпидермальную потерю воды [1]. Сохранение эпидермиса увлажненным и эластичным обусловлено возможностью рогового слоя удерживать воду благодаря структурной организации рогового слоя, наличию гигроскопических молекул, в совокупности — натурального увлажняющего фактора (natural moisturizing factor — NMF) [2]. В роговом слое устанавливается тонкий баланс между влажностью окружающей среды и глубжележащих слоев эпидермиса, благодаря чему контролируется трансэпидермальный обмен воды. Как известно, вода играет важную роль в поддержании нормальной функции эпидермального барьера, который, в свою очередь, чутко реагирует на изменения концентрации воды в роговом слое и в глубоких слоях эпидермиса. Снижение гидратированности тканей до менее 10–15% в роговом слое и менее 60% глубже, в эпидермисе, приводит к развитию нарушений барьерной функции и сухости кожных покровов [3].
Существует множество тесно взаимосвязанных механизмов защиты рогового слоя от дегидратации, в частности, синтез в коже компонентов NMF, причем большинство компонентов NMF являются продуктами распада белка филаггрина. Предшественником филаггрина является синтезируемый клетками зернистого слоя эпидермиса большой полипротеин профилаггрин (profilaggrin) с молекулярной массой менее 400 кДа. При протеолитическом распаде филагрина образуются вещества, которые связывают и сохраняют воду в корнеоцитах: поликарбоксиловые кислоты, гигроскопичные аминокислоты, мочевина, лактатные соединения и ионы металлов [4].
Мочевина — основной аминосодержащий компонент NMF, органическое вещество, которое содержится в тканях человека, крови и моче. Количество мочевины в организме человека в норме достигает 2%.
Учеными различных стран изучены мочевина и ее свойства. Так, впервые ее выделил из мочи французский химик Г. Руэл в 1773 г. В 1779 г. выдающиеся химики мира А. Фуркруа и Л. Воклен изучили это вещество, и дали ему современное название «карбамид» — амид угольной кислоты. В чистом виде карбамид в 1808 г. получил шведский химик Й. Берцелиус. В 1828 г. немецкий химик Ф. Велер впервые синтезировал мочевину из цианата аммония. Это одно из первых синтезируемых органических веществ [5].
Мочевина — конечный продукт азотистого обмена (полный амид угольной кислоты (H2N)2CO). Образуется в организме человека и млекопитающих животных как конечный продукт превращений аминокислот и белков, в значительных количествах выводится с мочой (отсюда и происходит ее название). Мочевина хорошо растворяется в воде с частичным образованием карбоната аммония. При нагревании водных растворов мочевины выше 80°C начинается ее гидролиз и превращение в карбамат аммония. Известно, что мочевина может выступать безопасным консервантом и стабилизатором в топических средствах [6]. Мочевина легко проникает не только в роговой слой, но и глубоко в эпидермис благодаря малой молекулярной массе. В составе косметических продуктов она сохраняет влагу и является проводником биологически активных веществ. Для синтеза 1 молекулы мочевины расходуется 4 высокоэнергетические фосфатные группы. Две молекулы АТФ требуются для образования карбомоилфосфата и 1 — для образования аргиносукцината. Однако в последней реакции АТФ претерпевает нитрофосфатное расщепление, продуктами которого является АМФ и пирофосфат, гидролизирующийся затем с образованием 2 молекул ортофосфата. Отсюда следует, что в общей сложности на образование 1 молекулы мочевины расходуется 4 молекулы АТФ [7]. Стоит отметить, что функции конечного продукта азотистого метаболизма у уреотелических организмов не единственная биологическая роль мочевины. Есть данные об участии мочевины в целом ряде биологически важных процессов [2].
К фармакологическим свойствам мочевины относят кератолитическое и увлажняющее. Кератолитический эффект объясняется ее протеолитическими свойствами: мочевина нарушает строение десмосом, которые соединяют кератиноциты, нарушает водородные связи, способствующие целостности рогового слоя, снижает пролиферативную активность кератиноцитов; повышает проницаемость эпителиального слоя кожи. Увлажняющий эффект достигается благодаря гигроскопичности молекул мочевины: она притягивает воду в эпидермис из дермы, ослабляет трансэпидермальные потери воды, делает кожу мягче и эластичнее [8]. Кроме того, мочевина длительно сохраняет абсорбирующие и антисептические свойства, предотвращая возникновение инфицирования. Есть данные, что мочевина может выступать безопасным консервантом и стабилизатором в топических средствах [6]. Малая молекулярная масса мочевины позволяет легко проникать не только в роговой, но и в более глубокие слои эпидермиса. При этом мочевина сохраняет влагу и служит проводником биологически активных веществ, включенных в состав косметического продукта [9].
С середины XX века мочевину активно применяют в медицине с различными целями. Так, ее использовали в нейрохирургической, офтальмологической, а также в хирургической практике в качестве антисептического средства. Применение мочевины в высоких концентрациях способствовало отторжению некротического струпа при ожогах.
Уже более столетия препараты, содержащие мочевину, используют в зависимости от концентрации для восстановления гидратации кожи, гиперкератоза, устранения дистрофии ногтей и усиления проникновения местных препаратов [10].
С 1940-х гг. западные дерматологи изучают действие мочевины в своей практике. Так, в 1943 г. H. Rattner впервые описал положительный эффект применения крема, содержащего 3% мочевины, при экземе кистей. В последующем мочевина нашла широкое применение в дерматовенерологии и косметологии и является важной составляющей терапии различных дерматозов [11]. Так, в состав лекарственных средств наружного действия и косметических продуктов мочевина входит в концентрациях от 0,1 до 50%. Подобный разброс связан с широким диапазоном ее фармакологических дерматотропных эффектов, и прежде всего кератолитического, влагоудерживающего и усиливающего проницаемость кожи [12]. В кремах для косметического эффекта мочевина содержится в низких концентрациях от 0,1 до 1%. Мочевина в концентрации от 1 до 5% может служить проводником для проникновения основной субстанции [12, 13]. Самой распространенной концентрацией мочевины является 10%. Кремы, содержащие 10–20% мочевины, увлажняют и смягчают кожу, улучшают ее эластичность, уменьшают проявления гиперкератоза. Кремы, в составе которых присутствует 50% мочевины, используют для лечения гиперкератоза, применяются в комплексном лечении заболеваний ногтей [13].
В последние десятилетия мази с мочевиной находят применение в лечении онихомикоза в сочетании с противогрибковыми средствами [14]. В исследованиях российских ученых зафиксировано, что мочевина обладает не только выраженными хумектантными свойствами, но и высокоэффективным соединением, которое активно воздействует на формирование и функционирование эпидермального барьера, а именно:
— стимулирует эпидермальную дифференцировку, воздействуя на экспрессию мРНК некоторых генов, которые отвечают за синтез белков инволюкрина, лорикрина, филаггрина;
— усиливает синтез липидов кератиноцитами, увеличивая при этом активность ферментов сфинголипидного метаболизма, таких как палмитолтрансфераза, холестеролсинтетаза, сфингомиелиназа и др.;
— оказывают влияние на выработку антимикробных пептидов — кателицидина и b-дефензина-2 кератиноцитами [15].
У пациентов с хроническими дерматозами, такими как атопический дерматит (АД), псориаз, экзема и др., сопровождаемыми выраженной сухостью кожи, во время комплексного лечения появляется потребность в ускорении реабилитации кожного покрова, также важно отметить необходимость в возобновлении естественного водного баланса и уровня липидов кожного покрова, эластичности, смягчении и увлажнении кожи, долгосрочной защите кожного покрова. Участки кожи с тонким кожным барьером и сниженной барьерной функцией (кожа задней поверхности ушной раковины, лицо, сгибательные поверхности суставов) требуют особой защиты [9].
У пациентов с АД на фоне ксероза кожи отмечается значительное снижение содержания мочевины в роговом слое. Так, в ряде исследований установлено, что на 4–5-й день наружной терапии больных АД, в частности, кремом, в состав которого входит 5% мочевина, происходило заметное уменьшение зуда, гиперемии и инфильтрации [16]. Зарубежными коллегами отмечены положительные результаты применения препаратов с мочевиной для терапии пациентов с экземой, дерматитами, кератозом, псориазом, ихтиозом, АД [17—23]. В частности, I. Hagemann и E. Proksch определили снижение гиперпролиферации эпидермиса при псориазе в результате топической терапии препаратами с мочевиной. Авторы доказали протеолитический, гидратирующий, противозудный эффекты при воздействии мочевины на кожу [24].
В российском исследовании установлено, что мазь с 30% мочевиной оказывает кератолитическое действие, смягчает и увлажняет кожу и может применяться при заболеваниях кожи, сопровождаемых избыточным гиперкератозом (ихтиоз, псориаз, болезнь Девержи), и также может использоваться для размягчения кожи и удаления роговых наслоений при бородавках перед удалением, грибковых заболеваниях для размягчения ногтевых пластинок с целью облегчения их подрезания [25].
Увлажняющие кремы являются полезными вспомогательными средствами при воспалительных дерматозах и благоприятно воздействуют при лечении сухой, шелушащейся кожи. В ряде исследований установлено, что топические глюкокортикостероиды для наружной терапии в дерматологии эффективнее использовать в комбинации с мочевиной в концентрации 2–7% для пролонгирования эффекта и исключения осложнений [26].
В Италии G. Micali, A. Verzì и соавт. (2019) провели исследование с целью оценки эффективности и переносимости 50% безводной мочевины. В исследование вошли 25 пациентов (12 мужчин и 13 женщин в возрасте 35–75 лет) с бляшечным псориазом и выраженным гиперкератотическим компонентом. Испытанный продукт оказался эффективным кератолитическим средством при наличии псориатических бляшек, что подтвердилось с помощью УЗИ пораженных участков кожи [27].
Наиболее эффективны наружные средства с мочевиной в виде эмульсионных мягких лекарственных форм (кремов), что широко используется в косметологии. Это объясняется тем, что липидная фаза косметического средства способствует сохранению естественного поверхностного эпидермального барьерного слоя, в результате чего уменьшается трансэпидермальная потеря влаги [28].
Мочевина также входит в состав комбинированных наружных средств и успешно применяется при различных дерматозах. Одной из распространенных комбинаций 2% мочевины в дерматологии является ее сочетание с 0,1% метилпреднизолоном ацепонатом (МПА) в форме крема. Мочевина в такой комбинации обеспечивает гидратирующий эффект — увлажняет, устраняет зуд и сухость кожи, а также улучшает проникновение МПА в очаг воспаления и восстанавливает защитные свойства кожи [29, 30].
В результате одного из открытых наблюдательных исследований получены данные о высокой эффективности терапии с применением препарата МПА 0,1% и 2% мочевиной при лечении стероидчувствительных дерматозов кожи лица. Это позволяет с высокой терапевтической эффективностью и безопасностью проводить местную терапию у данной категории пациентов [31].
Эффективность применения комбинированного наружного средства МПА 0,1% + мочевина 2% в терапии больных различными стероидчувствительными дерматозами оценена в дерматологической клинике Уральского научно-исследовательского института дерматовенерологии и иммунопатологии. Зафиксировано снижение активности воспалительного процесса, уменьшение сухости и шелушения кожи. В ходе лечения у пациентов побочных явлений не отмечено [25].
Помимо комбинированных лекарственных препаратов на российском рынке представлено большое количество косметических средств, в составе которых присутствует мочевина в концентрации от 2 до 20% и более, предназначенных для ухода за кожей у детей с рождения, и средств для профессионального использования для размягчения гиперкератоза, обработки мозолей, снятия усталости и чувства тяжести в ногах
С целью повышения эффективности лечения стероидочувствительных дерматозов за счет комбинации топических глюкокортикостероидов с увлажняющим компонентом — 2% мочевиной компанией АО «Акрихин» в рамках программы импортозамещения создан крем Комфодерм М2: – уникальная комбинация МПА и 2% мочевины. Сочетанное применение МПА и 2% мочевины более эффективно, чем раздельное действие этих лекарственных средств, что значительно расширяет спектр применения и позволяет проводить терапию стероидчувствительных дерматозов даже на участках с тонкой чувствительной кожей (лицо, шея, складки) [25]. Практикующим врачам также будет интересна новая инновационная косметическая линия эмолентной дерматологической косметики Сенсадерм на основе физиологических липидов омега-3, -6, -9, которые позволяют полноценно восстанавливать эпидермальный барьер и способствуют питанию и смягчению кожи в течение длительного времени. Специальный крем Сенсадерм содержит мочевину 5% и может применяться для увлажнения сухой и атопичной кожи взрослых и детей с рождения.
Таким образом, мочевина сама по себе является важным органическим веществом и участвует в различных процессах организма. Доказана ее роль в поддержании эпидермального барьера кожи. В дерматологии и косметологии мочевина широко применяется благодаря кератолитическому и увлажняющему действию при различных дерматозах, причем в комбинации с другими веществами.
Авторы заявляют об отсутствии конфликта интересов.
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями
использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании
файлов cookie, нажмите здесь.
Леонардо Челлено, Католический университет Святого Сердца, Рим, Италия, WILEY Дерматологическая терапия, 19 июля 2018 г., DOI: 10.1111/dth.12690
Аннотация
Нарушения барьерной функции связывают с рядом кожных заболеваний, включая ксероз, атопический дерматит и псориаз. Мочевина, компонент естественного увлажняющего фактора кожи, играет важную роль в сохранении гидратации и целостности кожи. Несколько исследований изучали влияние мочевины в клинических условиях. В настоящей статье мы обобщаем доступные клинические данные о влиянии мочевины на поддержание здоровья кожи и лечение кожных заболеваний. В более низких дозах (≤10%) препараты местного применения, содержащие мочевину, действуют как увлажнитель кожи, в то время как при более высоких концентрациях (>10% мочевины) препараты на основе мочевины оказывают кератолитическое действие. (например, Аквапилинг (aquapiling.net)) Мочевина также полезна при комбинированной терапии противовоспалительными и противогрибковыми препаратами в силу своей активности в качестве усилителя проникновения.
КЛЮЧЕВЫЕ СЛОВА
атопический дерматит, вульгарный ихтиоз, кератолитическое средство, увлажняющее средство, онихомикоз, псориаз, мочевина местного применения, ксероз
ВВЕДЕНИЕ
Роль кожи заключается в защите тела от вредного воздействия окружающей среды при сохранении соответствующих механических свойств, в том числе эластичности. Здоровая кожа характеризуется эффективным контролем потери воды, что позволяет поддерживать хороший уровень увлажнения и, следовательно, прочный физический и химический барьер (Verdier-Sévrain & Bonté, 2007).
Мочевина – это полярная гигроскопическая молекула, эндогенно вырабатываемая человеческим организмом и естественным образом обнаруживаемая в коже. Мочевина образуется в результате метаболизма белков и других органических соединений азота и выделяется с мочой и потом (Kapuscinska & Nowak, 2014; Mosher, 1933). Как один из компонентов натурального увлажняющего фактора (NMF), мочевина способствует сохранению здорового уровня увлажнения кожи. Несмотря на постоянное открытие новых ингредиентов и новых составов для ухода за кожей, мочевина по-прежнему остается одной из самых полезных молекул, доступных дерматологам из-за ее молекулярных и функциональных характеристик. В настоящей статье мы представляем обзор клинических данных, подтверждающих использование мочевины для поддержания целостности кожи и лечения заболеваний, связанных с дисфункцией кожного барьера.
МОЧЕВИНА И КОЖА
Роговой слой (SC) — самый внешний слой кожи, защищает организм от внешних агентов и контролирует обмены с окружающей средой, особенно трансэпителиальную потерю воды (TEWL). Структурная организация рогового слоя и присутствие гигроскопичных молекул, вместе называемых NMF, позволяют роговому слою удерживать воду, таким образом сохраняя эпидермис увлажненным и эластичным. Роговой слой состоит из окончательно дифференцированных кератиноцитов, называемых корнеоцитами, которые расположены в плотными слоями и объединены корнеодесмосомами. Корнеоциты встроены в гидрофобный липидный внеклеточный матрикс, ороговевшую клеточную оболочку (Pouillot, Dayan, Polla, Polla, & Polla, 2008). Хотя барьер, создаваемый роговым слоем, по своей структуре напоминает кирпичную стену, он имеет более динамичный и сложный характер (Elias, 1983). Фактически, ороговевшая клеточная оболочка, окружающая неделящиеся заполненные кератином корнеоциты, представляет собой активную среду, состоящую из ферментов, участвующих в дифференцировке эпидермиса и формировании NMF (Pouillot et al., 2008).
Соответствующий уровень гидратации необходим для поддержания механических свойств кожи, таких как прочность, гибкость и эластичность (Mojumdar, Pham, Topgaard, & Sparr, 2017). In vivo нормальный уровень гидратации находится в диапазоне 30–50% от сухого веса рогового слоя (Caspers, Lucassen, Carter, Bruining, & Puppels, 2001). Вода, обнаруживаемая в роговом слое, в основном поглощается корнеоцитами, способными увеличивать свой вес при набухании до 50% (Richter, Müller, Schwarz, Wepf, & Wiesendanger, 2001; Mojumdar et al., 2017). В условиях низкой относительной влажности (RH) роговой слой является хрупким и ломким, становясь более эластичным по мере увеличения относительной влажности (Mojumdar et al., 2017). Изменения относительной влажности также изменяют подвижность кератиновых нитей, присутствующих в корнеоцитах, подтверждая тем самым роль воды в пластификации кератина (Mojumdar et al., 2017).
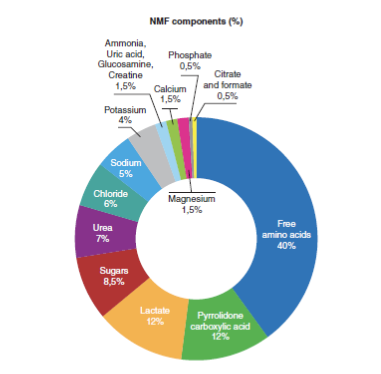
NMF имеет решающее значение для поддержания здорового рогового слоя, поскольку играет важную роль в увлажнении кожи (Robinson, Visscher, Laruffa, & Wickett, 2010). Снижение уровня NMF вызывает потерю воды в роговом слое и снижает эластичность эпидермиса (Verdier-Sévrain & Bonté, 2007). NMF состоит из молекул, которые образуются в результате распада белков или секретируются сальными и потовыми железами. Подробный состав NMF изображен на рисунке 1. Разложение филаггрина, кератин-агрегирующего белка оболочки ороговевших клеток, который образуется во время дифференцировки кератиноцитов (Simon et al., 1996; Kezic, Kammeyer, Calkoen, Fluhr, & Bos, 2009), приводит к образованию гигроскопичных аминокислот и других побочных продуктов, включая мочевину (Björklund et al., 2014). В здоровом роговом слое мочевине соответствует 7% NMF, процент, который снижается с возрастом (Verdier-Sévrain & Bonté, 2007).
Компоненты NMF (%)
По часовой стрелке: свободные аминокислоты; пирролидонкарбоновая кислота; лактат; сахара; мочевина; хлориды; натрий; калий; аммиак, мочевая кислота, глюкозамин, креатинин; кальций; фосфаты; цитрат и формиат.
РИСУНОК 1 Химический состав NMF. Данные из (Verdier-Sévrain & Bonté, 2007 г.)
МОЧЕВИНА И ФУНКЦИОНАЛЬНАЯ ЦЕЛОСТНОСТЬ МОЗОЛИСТОГО СЛОЯ
На протяжении многих лет увлажняющее действие мочевины исследовалось in vivo (Serup, 1992; Bettinger, Gloor, Gehring, & Wolf, 1995; Treffel & Gabard, 1995; Loden, 1996, 1997; Kuzmina, Hagströmer, & Emtestam, 2002); Grether-Beck, Mühlberg, Brenden, & Krutmann, 2008; Borelli, Bielfeldt, Borelli, Schaller, & Korting, 2011). Пан и его коллеги проанализировали эти клинические данные в 2013 году (Pan, Heinecke, Bernardo, Tsui, & Levitt, 2013). Было отмечено, что мочевина снижает трансэпидермальную потерю воды (Loden, 1996, 1997; Borelli et al., 2011), улучшает гидратацию (Borelli et al., 2011) и удерживает воду (Treffel & Gabard, 1995). Кроме того, мочевина способна увеличивать количество свободной воды в условиях высокой влажности (Bettinger et al., 1995) и действовать как мощный увлажнитель кожи и отшелушивающее средство (Serup, 1992).
Следует отметить тот факт, что во всех указанных клинических исследованиях использовались составы для местного применения в виде крема, эмульсии или пены с концентрацией мочевины 10% или меньше. О нежелательных явлениях не сообщалось, что подтверждает безопасность применения препаратов на основе мочевины для местного применения.
Мочевина увеличивает содержание воды в роговом слое, действуя как увлажнитель, но также за счет сохранения текучести рогового слоя (Albèr et al., 2014; Mojumdar et al., 2017). Путём измерения корнеометрии, Albèr et al. обнаружили, что мочевина способствует увлажнению кожи даже при применении в составе с пониженной водной активностью (Albèr et al., 2014). В последующем исследовании изучались молекулярные характеристики кератина и макроскопические свойства рогового слоя (SC) после добавления мочевины к дегидратированным SC и корнеоцитам, и было обнаружено, что изменения были аналогичны изменениям, происходящим при увеличении относительной влажности в отсутствие мочевины (Mojumdar et al., 2017). Эти данные подтверждают гипотезу о том, что мочевина действует как естественный эндогенный увлажнитель, заменяя воду в условиях низкой влажности и поддерживая уровень жидкости в составе рогового слоя (Mojumdar et al., 2017). В более высоких концентрациях (>10%) (например, Аквапилинг (aquapiling.net)) мочевина оказывает смягчающее/кератолитическое действие. Первые доказательства были получены в исследованиях Суонбека в 60-х годах. Эти исследования показали, что препараты с высокой концентрацией мочевины можно использовать для лечения ихтиоза и других гиперкератозных состояний (Swanbeck, 1968a, 1968b; Swanbeck & Rajka, 1970). Суонбек предположил, что при высоких концентрациях мочевина способна растворять кератин, способствуя разрушению водородных связей. Дальнейшие исследования показали, что мочевина способна вызывать конформационные изменения кератина, вызывающие денатурацию белковой структуры (Pan et al., 2013).
Помимо свойств увлажнения, сохранения текучести SK и активизации денатурации кератина, мочевина также способна участвовать в регуляции экспрессии генов (Friedman, von Grote, & Meckfessel, 2016). В исследовании Grether-Beck et al. указывается на, что мочевина индуцирует экспрессию эпидермальных генов (Grether-Beck et al., 2012). Хотя необходимы дополнительные исследования для лучшего понимания участия мочевины в регуляции экспрессии генов в SK, активная роль мочевины как индуктора экспрессии эпидермальных генов может объяснить положительные эффекты мочевины в сохранении функции кожного барьера.
МОЧЕВИНА И ЛЕЧЕНИЕ ДЕРМАТОЛОГИЧЕСКИХ СОСТОЯНИЙ
Нарушения кератинизации характеризуются качественными или количественными изменениями структуры рогового слоя. Мочевина, используемая отдельно или в комбинированной терапии, улучшает лечение таких патологических состояний, включая ксероз, атопический дерматит, вульгарный ихтиоз, псориаз и онихомикоз (Pan et al., 2013).
Ксероз или сухость кожи может быть результатом обезвоживания или изменения выработки липидов. Обезвоженная кожа, типичная для пожилых людей, в тканях которых отсутствует вода – тонкая, слабая и хрупкая. Низкое количество кожного сала и аномальные уровни липидов в эпидермисе (как при атопическом дерматите) делают кожу нежной, непрозрачной, красной и гиперчувствительной к внешним агентам. В обоих случаях составы для местного применения, содержащие мочевину, играют важную роль в лечении заболеваний. При использовании в низких дозах (в основном <10%, в одном исследовании использовалось 40% мочевины) мочевина регулирует трансэпидермальную потерю воды (TEWL) и восстанавливает способность рогового слоя мобилизовать и поддерживать гидратацию (Pan et al., 2013; Danby et al., 2016). Увлажняющие средства, содержащие мочевину, улучшают заживление трещин у пациентов с диабетом (Federici, Federici, & Milani, 2015; Gin et al., 2017). Открытые пяточные трещины позволяют бактериям проникать внутрь и могут привести к инфекциям и дальнейшим осложнениям. Кроме того, процедура ухода за кожей, включающая этап увлажнения, останавливает прогрессирование заболеваний сухой кожи, включая гиперпролиферацию эпидермиса и воспаление (Friedman, von Grote, & Meckfessel, 2016).
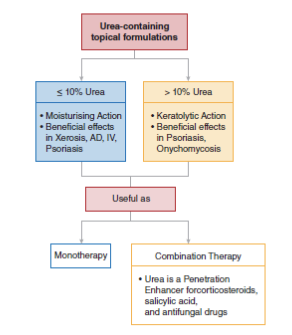
Сверху вниз, слева направо: составы с мочевиной для местного применения; ≤10% мочевины, увлажняющее действие, положительное действие при ксерозе, AД, IV, псориазе; ≥10% мочевины, кератолитическое действие, положительное действие при псориазе, онихомикозе; полезна в качестве; монотерапия; комбинированная терапия, мочевина – усилитель проникновения кортикостероидов, салициловой кислоты и противогрибковых препаратов.
РИСУНОК 2 Обзор известных эффектов препаратов для местного применения, содержащих мочевину, в клинических условиях. AД, топический дерматит; IV, вульгарный ихтиоз
Дисфункцию кожного барьера связывают с повышенным риском развития атопического дерматита (АД) (Egawa & Kabashima, 2018). Ослабленный кожный барьер облегчает проникновение аллергенов и других внешних агентов и предрасполагает организм к воспалению. Если воспаление кожи не проходит, барьерная функция нарушается еще больше (Egawa & Kabashima, 2018). АД является наиболее распространенным воспалительным заболеванием кожи, которым страдают до 30% детей во всем мире (Bieber, 2008). АД является кожным проявлением генетической предрасположенности к аллергии и характеризуется очень зудящими и рецидивирующими кожными поражениями на сухой коже (Egawa & Kabashima, 2018). Соответствующая гидратация рогового слоя кажется крайне важной при предотвращении АД, поскольку применение увлажняющих кремов у новорожденных снижает распространенность заболевания (Horimukai et al., 2014; Simpson et al., 2014).
В нескольких клинических испытаниях изучались клинические эффекты содержащих мочевину препаратов для местного применения при АД (Pan et al., 2013). Было установлено, что при концентрации 10% мочевина улучшает гидратацию кожи и снижает трансэпидермальную потерю воды (TEWL) у пациентов с АД (Sasaki, Tadaki, & Tagami, 1989). При этом в двух недавних исследованиях утверждается, что мочевина усиливает гидратацию кожи при АД без снижения TEWL (Hoppe et al., 2015; Ahmad Nasrollahi et al., 2018). Данные противоречивые результаты можно объяснить низкой концентрацией мочевины, используемой в применяемых составах (всего 5%).
Клиническое преимущество мочевины при АД наблюдалось при использовании отдельно и в комбинации с гидрокортизоном или валератом бетаметазона-17 (Bohnsack, Tausch, Gassmuller, & Rippke, 1997; Wilhelm, Scholermann, & Bohnsack, 1998; Loden et al., 2002; Wirén. et al., 2009; Pan et al., 2013). Следует отметить, что комбинированная терапия с мочевиной оказалась более эффективной, чем лечение только гидрокортизоном или бетаметазон-17-валератом (Pan et al., 2013). Недавний Кокрановский обзор подтвердил, что при АД лечение увлажняющими средствами и местными кортикостероидами более эффективно, чем лечение только местными кортикостероидами (Van Zuuren, Fedorowicz, & Arents, 2017). Систематический обзор подтвердил положительный эффект увлажняющих средств при АД, но предупредил о необходимости проведения более узко специализированных исследований, которые позволили бы проводить прямые сравнения увлажняющих средств (Lindh & Bradley, 2015). Между тем, имеющиеся данные подтверждают использование увлажняющих средств, содержащих мочевину, в качестве терапии первой линии при АД (Lindh & Bradley, 2015).
Вульгарный ихтиоз (IV) – это генетическое заболевание с распространенностью 1:300, вызванное мутациями с потерей функции в гене филаггрина (FLG) (Brown & McLean, 2012). IV характеризуется шелушащейся сухой кожей с симметричными белыми или серыми чешуйками. Шелушение происходит из-за отсутствия белка филаггрина в роговом слое, что вызывает низкую клеточную регенерацию рогового слоя и хроническое накопление кератина. В недавнем систематическом обзоре сделан вывод о том, что препараты, содержащие мочевину, следует использовать в качестве терапии первой линии при вульгарном ихтиозе (Lindh & Bradley, 2015). Поддерживающая терапия с использованием 10% мочевины ничем не хуже терапии, содержащей 1% гидрокортизон, 2% салициловую кислоту или парафиновые увлажнители (Pan et al., 2013).
Псориаз – хроническое воспалительное заболевание кожи, распространенность которого во всем мире составляет 2% (Parisi, Symmons, Griffiths, & Ashcroft, 2013). Псориаз характеризуется развитием эритематозных шелушащихся бляшек, которые возникают в результате усиленной пролиферации кератиноцитов и измененной дифференцировки эпидермиса (Zhang et al., 2009). Были проведены клинические испытания для изучения влияния мочевины на псориатическую кожу (Pan et al., 2013). В одном из исследований было установлено, что при использовании в концентрации 10% мочевина снижает трансэпидермальную потерю воды (TEWL) и усиливает гидратацию рогового слоя (Sasaki, Tadaki, & Tagami, 1989). Впоследствии Хагеманн и Прокш также обнаружили, что мочевина вызывает дифференцировку эпидермиса (Hagemann & Proksch, 1996). При использовании в концентрации от 10 до 40%, отдельно или в комбинации с бифоназолом или дитранолом, в большинстве исследований сообщалось об улучшении отшелушивания и клинического состояния у пациентов с псориазом (Pan et al., 2013). (например, Аквапилинг (aquapiling.net))
В концентрации 40% мочевина демонстрирует клиническое действие при лечении грибковых инфекций ногтей, таких как онихомикоз (Pan et al., 2013). Местное лечение флуконазолом 1% и мочевиной 40% более эффективно, чем одним флуконазолом при лечении онихомикоза (Bassiri-Jahromi, Ehsani, Mirshams-Shahshahani, & Jamshidi, 2012). Мочевина усиливает проникновение противогрибкового агента и, таким образом, усиливает лечебный эффект (Pan et al., 2013). (например, Крем-паста от натоптышей Аквапилинг (aquapiling.net))
Мочевина может считаться усилителем проникновения в силу своей способности облегчать транспорт потока молекул через ноготь и кожу (Trommer & Neubert, 2006). Данные молекулы включают вышеупомянутые противогрибковые препараты, а также другие соединения, используемые при лечении кожных заболеваний, такие как кортикостероиды (Trommer & Neubert, 2006). В более раннем исследовании Эйреса и Хупера изучалось усиливающее действие мочевины при проникновении кортизола через кожу (Ayres & Hooper, 1978). Авторы заметили, что препарат для местного применения, содержащий 1,0% кортизола и 10% мочевины, доставлял в кожу в восемь раз больше кортизола, чем крем для местного применения, использованный в качестве контроля (1,0% кортизола в креме, смешиваемым с водой). Последующие исследования показали, что мочевина усиливает проникновение гидрокортизона, прогестерона и лейпролида через подкожную клетчатку (Trommer & Neubert, 2006). Следует отметить, что в исследовании in vitro, в котором изучалась чрескожная диффузия прогестерона, мочевина увеличивала проникновение прогестерона в 2,5 раза (Valenta & Wedenig, 1997).
Механизм, с помощью которого мочевина увеличивает проницаемость рогового слоя, полностью не изучен, но считается, что он связан со способностью увеличивать содержание воды, абсорбированной корнеоцитами, что является прямым следствием высокой способности связывать воду (Mueller et al., 2016). В более высоких дозах кератолитическое действие мочевины также может играть роль в усилении проникновения лекарственных средств (Trommer & Neubert, 2006). Вследствие признанного действия в качестве химического усилителя проникновения мочевину следует использовать вместе с местными кортикостероидами, салициловой кислотой или противогрибковыми препаратами для улучшения доставки лекарств и результатов лечения.
ВЫВОД
Мочевина – хорошо известное увлажняющее и кератолитическое средство. Мочевина уже более века безопасно используется для поддержания здоровья кожи и лечения ряда кожных заболеваний. Клинические исследования подтвердили положительное действие мочевины при заболеваниях, связанных с дисфункцией кожного барьера. При использовании в разных концентрациях мочевина оказывает разное действие (рис. 2). Более низкую концентрацию мочевины (≤10%) связывают с увлажняющим эффектом, тогда как более высокая концентрация (>10%) оказывает смягчающее/кератолитическое действие. Как усилитель проникновения через кожу мочевина облегчает пересечение кожного барьера другими молекулами и, таким образом, улучшает действие лекарств, используемых в комбинированной терапии. Составы для местного применения, содержащие мочевину, доступны в различных концентрациях и предоставляют врачам широкий спектр альтернатив для повышения эффективности лечения кожных заболеваний и улучшения самочувствия пациента.
БЛАГОДАРНОСТЬ
Поддержка по составлению и редактированию медицинских текстов была предоставлена Ракель Карвалхоса, доктором философии, и компанией «ЭРА МС СРЛ (ERA MS SRL)». Финансовую поддержку при составлении и редактировании медицинских текстов оказала компания «РЕЛАЙФ СРЛ (RELIFE SRL)».
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
ORCID Леонардо Челлено https://orcid.org/0000-0002-7129-198X
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
Ahmad Nasrollahi, S., Ayatollahi, A., Yazdanparast, T., Samadi, A., Hosseini, H., Shamsipour, M., … Firooz, A. (2018). Comparison of linoleic acid-containing water-in-oil emulsion with urea-containing water-in-oil emulsion in the treatment of atopic dermatitis: A randomized clinical trial. Clinical Cosmetic and Investigational Dermatology, 11, 21–28. https://doi.org/10.2147/CCID.S145561 Albèr, C., Buraczewska-Norin, I., Kocherbitov, V., Saleem, S., Lodén, M., & Engblom, J. (2014). Effects of water activity and low molecular weight humectants on skin permeability and hydration dynamics — a double-blind, randomized and controlled study. International Journal of Cosmetic Science, 36(5), 412–418. https://doi.org/10.1111/ics.12136 Ayres, P. J., & Hooper, G. (1978). Assessment of the skin penetration properties of different carrier vehicles for topically applied cortisol. British Journal of Dermatology, 99(3), 307–317. https://doi.org/10.1111/j. 1365-2133.1978.tb02002.x Bassiri-Jahromi, S., Ehsani, A. H., Mirshams-Shahshahani, M., & Jamshidi, B. (2012). A comparative evaluation of combination therapy of fluconazole 1% and urea 40% compared with fluconazole 1% alone in a nail lacquer for treatment of onychomycosis: Therapeutic trial. Journal of Dermatological Treatment, 23(6), 453–456. https://doi. org/10.3109/09546634.2011.588191 Bettinger, J., Gloor, M., Gehring, W., & Wolf, W. (1995). Influence of emulsions with and without urea on water-binding capacity of the stratum corneum. Journal of the Society of Cosmetic Chemists, 46(5), 247–254. Bieber, T. (2008). Atopic dermatitis. New England Journal of Medicine, 358(14), 1483–1494. https://doi.org/10.1056/NEJMra074081 Björklund, S., Andersson, J. M., Pham, Q. D., Nowacka, A., Topgaard, D., & Sparr, E. (2014). Stratum corneum molecular mobility in the presence of natural moisturizers. Soft Matter, 10(25), 4535–4546. https://doi. org/10.1039/C4SM00137K Bohnsack, K., Tausch, I., Gassmuller, J., & Rippke, F. (1997). Efficacy on the symptom “dry skin” and long-term dermal tolerance of Laceran lotion 10% urea in patients with atopic dermatitis. Zeitschrift für Hautkrankheiten, 72, 34–39. Borelli, C., Bielfeldt, S., Borelli, S., Schaller, M., & Korting, H. C. (2011). Cream or foam in pedal skin care: Towards the ideal vehicle for urea used against dry skin. International Journal of Cosmetic Science, 33(1), 37–43. https://doi.org/10.1111/j.1468-2494.2010.00576.x Brown, S. J., & McLean, W. H. I. (2012). One remarkable molecule: filaggrin. The Journal of Investigative Dermatology, 132(3 Pt 2), 751–762. https://doi.org/10.1038/jid.2011.393 Caspers, P. J., Lucassen, G. W., Carter, E. A., Bruining, H. A., & Puppels, G. J. (2001). In vivo confocal Raman microspectroscopy of the skin: Noninvasive determination of molecular concentration profiles. The Journal of Investigative Dermatology, 116(3), 434–442. https://doi. org/10.1046/j.1523-1747.2001.01258.x Danby, S. G., Brown, K., Higgs-Bayliss, T., Chittock, J., Albenali, L., & Cork, M. J. (2016). The effect of an emollient containing urea, ceramide NP, and lactate on skin barrier structure and function in older people with dry skin. Skin Pharmacology and Physiology, 29(3), 135–147. https://doi.org/10.1159/000445955 Egawa, G., & Kabashima, K. (2018). Barrier dysfunction in the skin allergy. Allergology International, 67(1), 3–11. https://doi.org/10.1016/j.alit. 2017.10.002 Elias, P. M. (1983). Epidermal lipids, barrier function, and desquamation. The Journal of Investigative Dermatology, 80(Suppl), 44s–49s. Federici, A., Federici, G., & Milani, M. (2015). Use of a urea, arginine and carnosine cream versus a standard emollient glycerol cream for treatment of severe xerosis of the feet in patients with type 2 diabetes: A randomized, 8 month, assessor-blinded, controlled trial. Current Medical Research and Opinion, 31(6), 1063–1069. https://doi.org/10. 1185/03007995.2015.1037731 Friedman, A. J., von Grote, E. C., & Meckfessel, M. H. (2016). Urea: A clinically oriented overview from bench to bedside. Journal of Drugs in Dermatology: JDD, 15(5), 633–639. Gin, H., Rorive, M., Gautier, S., Condomines, M., Saint Aroman, M., & Garrigue, E. (2017). Treatment by a moisturizer of xerosis and cracks of the feet in men and women with diabetes: A randomized, double-blind, placebo-controlled study. Diabetic Medicine, 34(9), 1309–1317. https://doi.org/10.1111/dme.13402 Grether-Beck, S., Felsner, I., Brenden, H., Kohne, Z., Majora, M., Marini, A., … Krutmann, J. (2012). Urea uptake enhances barrier function and antimicrobial defense in humans by regulating epidermal gene expression. Journal of Investigative Dermatology, 132(6), 1561–1572. https://doi. org/10.1038/jid.2012.42 Grether-Beck, S., Mühlberg, K., Brenden, H., & Krutmann, J. (2008). Urea plus ceramides and vitamins: Improving the efficacy of a topical urea preparation by addition of ceramides and vitamins. Der Hautarzt; Zeitschrift Fur Dermatologie, Venerologie, Und Verwandte Gebiete, 59(9), 717–718, 720–723. https://doi.org/10.1007/s00105-008-1594-z Hagemann, I., & Proksch, E. (1996). Topical treatment by urea reduces epidermal hyperproliferation and induces differentiation in psoriasis. Acta Dermato-Venereologica, 76(5), 353–356. Hoppe, T., Winge, M. C. G., Bradley, M., Nordenskjöld, M., Vahlquist, A., Törmä, H., & Berne, B. (2015). Moisturizing treatment of patients with atopic dermatitis and ichthyosis vulgaris improves dry skin, but has a modest effect on gene expression regardless of FLG genotype. Journal of the European Academy of Dermatology and Venereology, 29(1), 174–177. https://doi.org/10.1111/jdv.12333 Horimukai, K., Morita, K., Narita, M., Kondo, M., Kitazawa, H., Nozaki, M., … Ohya, Y. (2014). Application of moisturizer to neonates prevents development of atopic dermatitis. The Journal of Allergy and Clinical Immunology, 134(4), 824–830.e6. https://doi.org/10.1016/j.jaci.2014.07.060 Kapuscinska, A., & Nowak, I. (2014). The use of urea and its derivatives in the cosmetics industry. CHEMIK, 68(2), 91–98. Kezic, S., Kammeyer, A., Calkoen, F., Fluhr, J. W., & Bos, J. D. (2009). Natural moisturizing factor components in the stratum corneum as biomarkers of filaggrin genotype: Evaluation of minimally invasive methods. British Journal of Dermatology, 161(5), 1098–1104. https:// doi.org/10.1111/j.1365-2133.2009.09342.x Kuzmina, N., Hagströmer, L., & Emtestam, L. (2002). Urea and sodium chloride in moisturisers for skin of the elderly—a comparative, double-blind, randomised study. Skin Pharmacology and Applied Skin Physiology, 15(3), 166–174. https://doi.org/10.1159/000063545 Lindh, J. D., & Bradley, M. (2015). Clinical effectiveness of moisturizers in atopic dermatitis and related disorders: A systematic review. American Journal of Clinical Dermatology, 16(5), 341–359. https://doi.org/10. 1007/s40257-015-0146-4 Loden, M. (1996). Urea-containing moisturizers influence barrier properties of normal skin. Archives of Dermatological Research, 288(2), 103–107. Loden, M. (1997). Barrier recovery and influence of irritant stimuli in skin treated with a moisturizing cream. Contact Dermatitis, 36(5), 256–260. Loden, M., Andersson, A.-C., Anderson, C., Bergbrant, I.-M., Frödin, T., Ohman, H., … Lindberg, M. (2002). A double-blind study comparing the effect of glycerin and urea on dry, eczematous skin in atopic patients. Acta Dermato-Venereologica, 82(1), 45–47. Mojumdar, E. H., Pham, Q. D., Topgaard, D., & Sparr, E. (2017). Skin hydration: Interplay between molecular dynamics, structure and water uptake in the stratum corneum. Scientific Reports, 7(1), 15712. https:// doi.org/10.1038/s41598-017-15921-5 Mosher, H. H. (1933). Simultaneous study of constituents of urine and perspiration. Journal of Biological Chemistry, 99, 781. Mueller, J., Oliveira, J. S. L., Barker, R., Trapp, M., Schroeter, A., Brezesinski, G., & Neubert, R. H. H. (2016). The effect of urea and taurine as hydrophilic penetration enhancers on stratum corneum lipid models. Biochimica et Biophysica Acta (BBA) — Biomembranes, 1858(9), 2006–2018. https://doi.org/10.1016/j.bbamem.2016.05.010 Pan, M., Heinecke, G., Bernardo, S., Tsui, C., & Levitt, J. (2013). Urea: A comprehensive review of the clinical literature. Dermatology Online Journal, 19(11), 20392. Parisi, R., Symmons, D. P. M., Griffiths, C. E. M., & Ashcroft, D. M. (2013). Global epidemiology of psoriasis: A systematic review of incidence and prevalence. Journal of Investigative Dermatology, 133(2), 377–385. https://doi.org/10.1038/jid.2012.339 Pouillot, A., Dayan, N., Polla, A. S., Polla, L. L., & Polla, B. S. (2008). The stratum corneum: A double paradox. Journal of Cosmetic Dermatology, 7(2), 143–148. https://doi.org/10.1111/j.1473-2165.2008.00379.x Richter, T., Müller, J. H., Schwarz, U. D., Wepf, R., & Wiesendanger, R. (2001). Investigation of the swelling of human skin cells in liquid media by tapping mode scanning force microscopy. Applied Physics A, 72(S1), S125–S128. https://doi.org/10.1007/s003390100750 Robinson, M., Visscher, M., Laruffa, A., & Wickett, R. (2010). Natural moisturizing factors (NMF) in the stratum corneum (SC). I. Effects of lipid extraction and soaking. Journal of Cosmetic Science, 61(1), 13–22. Sasaki, Y., Tadaki, T., & Tagami, H. (1989). The effects of topical application of urea cream on the function of pathological stratum corneum. Acta Dermatol-Kyoto, 84(4), 581–586. Serup, J. (1992). A three-hour test for rapid comparison of effects of moisturizers and active constituents (urea). Measurement of hydration, scaling and skin surface lipidization by noninvasive techniques. Acta Dermato-Venereologica. Supplementum, 177, 29–33. Simon, M., Haftek, M., Sebbag, M., MontéZin, M., Girbal-Neuhauser, E., Schmitt, D., & Serre, G. (1996). Evidence that filaggrin is a component of cornified cell envelopes in human plantar epidermis. Biochemical Journal, 317(1), 173–177. https://doi.org/10.1042/bj3170173 Simpson, E. L., Chalmers, J. R., Hanifin, J. M., Thomas, K. S., Cork, M. J., McLean, W. H. I., … Williams, H. C. (2014). Emollient enhancement of the skin barrier from birth offers effective atopic dermatitis prevention. Journal of Allergy and Clinical Immunology, 134(4), 818–823. https:// doi.org/10.1016/j.jaci.2014.08.005 Swanbeck, G. (1968a). A new treatment of ichthyosis and other hyperkeratotic conditions. Acta Dermato-Venereologica, 48(2), 123–127. Swanbeck, G. (1968b). Carbamide cream for dry and hyperkeratotic skin. Läkartidningen, 65(22), 2286–2290. Swanbeck, G., & Rajka, G. (1970). Antipruritic effect of urea solutions. An experimental and clinical study. Acta Dermato-Venereologica, 50(3), 225–227. Treffel, P., & Gabard, B. (1995). Stratum corneum dynamic function measurements after moisturizer or irritant application. Archives of Dermatological Research, 287(5), 474–479. Trommer, H., & Neubert, R. H. (2006). Overcoming the stratum corneum: The modulation of skin penetration. A review. Skin Pharmacology and Physiology, 19(2), 106–121. https://doi.org/10.1159/000091978 Valenta, C., & Wedenig, S. (1997). Effects of penetration enhancers on the in-vitro percutaneous absorption of progesterone. Journal of Pharmacy and Pharmacology, 49(10), 955–959. https://doi.org/10.1111/j.2042-7158. 1997.tb06023.x Van Zuuren, E. J., Fedorowicz, Z., & Arents, B. W. M. (2017). Emollients and moisturizers for eczema: Abridged Cochrane systematic review including GRADE assessments. British Journal of Dermatology, 177(5), 1256–1271. https://doi.org/10.1111/bjd.15602 Verdier-Sévrain, S., & Bonté, F. (2007). Skin hydration: A review on its molecular mechanisms. Journal of Cosmetic Dermatology, 6(2), 75–82. https://doi.org/10.1111/j.1473-2165.2007.00300.x Wilhelm, K. P., Scholermann, A., & Bohnsack, K. (1998). Efficacy and tolerability of a topical preparation containing 10% urea in patients with atopic dermatitis. Aktuelle Dermatologie, 24, 26–30. Wirén, K., Nohlgård, C., Nyberg, F., Holm, L., Svensson, M., Johannesson, A., … Lodén, M. (2009). Treatment with a barrier-strengthening moisturizing cream delays relapse of atopic dermatitis: A prospective and randomized controlled clinical trial. Journal of the European Academy of Dermatology and Venereology, 23(11), 1267–1272. https://doi.org/10. 1111/j.1468-3083.2009.03303.x Zhang, X.-J., Huang, W., Yang, S., Sun, L.-D., Zhang, F.-Y., Zhu, Q.-X., … Liu, J.-J. (2009). Psoriasis genome-wide association study identifies susceptibility variants within LCE gene cluster at 1q21. Nature Genetics, 41(2), 205–210. https://doi.org/10.1038/ng.31
Уродерм — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-001277
Торговое наименование препарата
Уродерм
Международное непатентованное наименование
Мочевина
Лекарственная форма
Мазь для наружного применения
Состав
Активное вещество: мочевина (карбамид) (в пересчете на 100%) — 0,3 г.
Вспомогательные вещества: воск эмульсионный — 0,06 г, парафин жидкий (вазелиновое масло) — 0,06 г, глицерол (глицерин) (в пересчете на 100%) — 0,1 г, глицин (кислота аминоуксусная) — 0,002 г, этанол (спирт этиловый) 95% — 0,1 г, вода очищенная до 1 г.
Описание
Однородная мазь белого цвета, возможен слабый запах аммиака.
Фармакотерапевтическая группа
кератолитическое средство
Фармакодинамика:
Обладает кератолитическим действием, смягчает и увлажняет кожу, повышает ее эластичность.
Показания:
В комплексной терапии заболеваний кожи, сопровождающегося избыточным ороговением: ихтиоз и ихтиозиформные дерматозы, кератодермии, псориаз, хроническая экзема, болезнь Девержи, фолликулярный кератоз, гиперкератотические формы грибковых заболеваний; омозолелости, сухость кожи.
Используется для размягчения кожи и удаления роговых наслоений при бородавках (перед удалением) и для размягчения ногтевых пластинок с целью облегчения их подрезания и обработки при вросшем ногте, онихомикозах, онихогрифозе, ониходистрофии, твердых ногтях.
Противопоказания:
Гиперчувствительность к компонентам препарата.
Не следует наносить на обширные поверхности при почечной, печеночной и сердечно-сосудистой недостаточности.
Беременность и лактация:
Рекомендуется соблюдать осторожность, использовать после консультации с врачом. Не рекомендуется наносить на обширные поверхности.
Применение возможно, если потенциальная польза для матери превышает потенциальный риск для плода или ребенка.
Способ применения и дозы:
Наружно.
При заболеваниях кожи, сопровождающихся избыточным ороговением (ихтиозе, ихтиозиформных дерматозах, кератодермиях, псориазе, хронической экземе, болезни Девержи, фолликулярном кератозе, омозолелостях, сухости кожи мазь наносят на участки скопления роговых наслоений тонким слоем 2 раза в день.
При сильном шелушении возможно использование окклюзионной повязки.
Перед нанесением мази поверхностные раны, эрозии, трещины, корочки, ссадины обрабатывают антисептиками.
Лечение прекращают после устранения роговых наслоений.
При гиперкератотических формах грибковых заболеваний мазь наносят за 20-30 минут до противогрибковых, наружных средств.
При бородавках мазь наносят на 2-8 часов под лейкопластырь, затем размягченную часть бородавки срезают, после чего возможно ее удаление.
Для облегчения подрезания и обработки ногтей при вросшем ногте, онихомикозах, онихогрифозе, ониходистрофии, твердых ногтях мазь наносят на ногти на 20-30 минут, затем их подрезают. При значительном утолщении ногтей мазь наносят 2 раза в день, заклеивая лейкопластырем, обрабатывают после размягчения.
Длительность лечения при кожных заболеваниях зависит от локализации и тяжести процесса и может составлять несколько недель. Для облегчения подрезания и обработки ногтей мазь может использоваться 2-3 раза в месяц, длительность использования ее в таких случаях не ограничена.
Побочные эффекты:
При использовании в остром периоде кожного заболевания в отдельных случаях возможно усиление зуда и покраснения кожи в местах нанесения препарата, что требует его временной отмены до снижения остроты процесса.
Возможны аллергические реакции.
Передозировка:
Не выявлена.
Взаимодействие:
Способность мочевины разрыхлять роговой слой кожи создает условия для повышения резорбции других наружных средств, что усиливает их действие.
Мазь можно чередовать (утро-вечер) с любыми другими наружными средствами, кроме кератолитических (мазь салициловая).
Особые указания:
Не наносить на слизистые оболочки.
Влияние на способность управлять транспортными средствами и механизмами:
Препарат не влияет на способность управлять автомобилем и выполнять работы, требующие повышенной концентрации внимания.
Форма выпуска/дозировка:
Мазь для наружного применения, 30%.
Упаковка:
Алюминиевые тубы по 10, 15, 20 и 35 г.
Каждую тубу вместе с инструкцией по применению помещают в пачку из картона.
Условия хранения:
При температуре от 2 до 8 °С.
Хранить в недоступном для детей месте. Замораживания не допускать.
Срок годности:
3 года.
Не использовать по истечении срока годности.
Условия отпуска
Без рецепта
Производитель
АО «Фармацевтическое научно-производственное предприятие «Ретиноиды» (АО «Ретиноиды»), 111123, г. Москва, ул. Плеханова, д. 2/46, стр. 5, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
АО «Ретиноиды»
Купить Уродерм в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Диуретическое (мочегонное) и дегидратируюшее (обезвоживающее) средство. Предупреждает и уменьшает отек мозга, токсический отек легких, понижает внутриглазное давление.
Назначают в нейрохирургической практике, главным образом на ранних стадиях отека мозга, в офтальмологии при глаукоме (повышенном внутриглазном давлении), особенно во время острых приступов. Лечение онихомикоза (поражения ногтей, вызванного паразитическими грибками), ихтиоза (чешуйчатого утолщения обширных участков кожи), гиперкератоза (чрезмерного утолщения наружного слоя кожи), гнойных ран.
Раствор мочевины для внутривенного введения готовят непосредственно перед введением в асептических (стерильных) условиях. Использование заранее приготовленных растворов, при стоянии разлагающихся, может вызвать гемолиз (разрушение эритроцитов). Применяют 30% раствор, приготовленный на 10% растворе глюкозы. Растворение происходит с поглощением тепла (раствор охлаждается). Раствор выдерживают, пока его температура не достигнет комнатной. Вводят раствор капельно со скоростью 40-60-80 капель в минуту. Только при необходимости получить быстрый и максимальный эффект увеличивают скорость введения до 80-120 капель в минуту. Общая доза — 0,5-1,5 г (в среднем 1 г) мочевины на 1 кг массы тела больного. Эффект наступает обычно через 15-30 мин, достигает масимума через 1-11/2 ч от начала введения раствора и длится 5-6 ч и более (до 14 ч). При необходимости можно вводить повторно (не более 2-3 раз) с промежутком 12-24 ч. При отеке мозга отмечаются снижение внутричерепного давления, уменьшение напряжения твердой мозговой оболочки, появление пульсации; при глаукоме — снижение внутриглазного давления.
Внутрь назначают мочевину в виде 50% или 30% раствора в сахарном сиропе в дозе 0,75-1,5 г/кг. Имеются данные о том, что при глаукоме гипотензивный (снижающий внутриглазное давление) эффект после перорального (через рот) применения мочевины наступает в те же сроки (30-45 мин), что и при внутривенном капельном введении. Однако дегидратируюшее (снимающее отек) влияние на мозговую ткань проявляется при пероральном введении только через несколько часов.
В связи с обезвоживанием организма больные испытывают жажду и сухость во рту. Для предупреждения нарушения водного баланса в первые сутки после применения препарата следует вводить внутривенно капельно изотонический раствор глюкозы или натрия хлорида (500-800 мл) с добавлением аскорбиновой кислоты (0,2-0,3 г) и витамина Bi (0,1-0,15 г). Недопустимо назначать больным другие мочегонные средства. При вливании раствора мочевины больным, находящимся в бессознательном состоянии или под наркозом, для отведения мочи следует ввести в мочевой пузырь катетер (полую трубку).
При внутривенном введении нельзя допускать попадания раствора под кожу во избежание раздражения и некроза (омертвения) тканей.
Для лечения онихомикозов (грибкового заболевания ногтей) в качестве кератолитического (размягчающего роговой /поверхностный/ слой кожи) средства применяют 30% мазь мочевины, для лечения ихтиоза и гиперкератоза используют 10% крем. Мазь и крем наносят на пораженные участки. Для очистки гнойных ран от некротических масс (омертвевших участков ткани) в виде орошений и влажных повязок используют 10% раствор мочевины.
Тошнота, рвота, сухость во рту, жажда, изжога, анорексия (отсутствие аппетита), тромбоз (нарушение проходимости) вен, флебит (воспаление вен) в месте введения.
Внутричерепное кровотечение, выраженная почечная, печеночная, сердечная недостаточность. Нельзя применять вместе с другими мочегонными средствами.
В комплекте с растворителем (10% раствор глюкозы) по 30 г, 45 г, 60 г и 90 г; 30% мазь; 10% крем.
В хорошо укупоренной таре в сухом месте.
Карбамид, Уреафил, Уреверд.
Инструкция составлена коллективом авторов и редакторов сайта Piluli. Список авторов справочника лекарств представлен на странице редакции сайта: Редакция сайта.
Описание препарата «Мочевина» на данной странице является упрощённой и дополненной версией официальной инструкции по применению. Перед приобретением или использованием препарата вы должны проконсультироваться с врачом и ознакомиться с утверждённой производителем аннотацией.
Информация о препарате предоставлена исключительно с ознакомительной целью и не должна быть использована как руководство к самолечению. Только врач может принять решение о назначении препарата, а также определить дозы и способы его применения.
Количество просмотров: 25351.