Rec.INN
зарегистрированное ВОЗ
Входит в состав препаратов:
список
Фармакологическое действие
Рекомбинантное человеческое моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6). Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ-6Р). Блокада обеих форм рецептора позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в т.ч. препятствует активации антиген-представляющих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 — единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: СРБ, фибриногена, сывороточного амилоидного белка А — SАА, гепсидина, лептина.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток.
На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 7 недель) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того, ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию, включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
При однократном п/к введении левилимаба пациентам с ревматоидным артритом активное вещество обнаруживается в сыворотке крови в течение 2-24 ч, и его концентрация нарастает, достигая Cmax через 96 ч, с последующим снижением. Cmax левилимаба в сыворотке крови после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168.5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC(0-168 ч) составляли 1866231 [1297632-3719014] (нг/мл)×ч для группы пациентов с еженедельным введением и 2152996.5 [1323711-3081436] (нг/мл)×ч для группы с введением 1 раз в 2 недели. При многократном введении левилимаба значения AUC(0-2016 ч) составили 189580779 [134794695; 230680771] (нг/мл)×ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл)×ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (Cmax-mult) нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом Тmax) составляло 1848 [1512; 2016] ч и 1848 [1512; 1848] ч при еженедельном введении и введении 1 раз в 2 недели соответственно.
Vd в равновесном состоянии составлял 7871.029 [4226.795; 13363.547] мл при введении 1 раз в неделю и 7130.453 [5532.978; 11387.959] мл при введении 1 раз в 2 недели.
О накоплении левилимаба при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10.932 [6.446; 14.178] для еженедельного введения, 2.593 [1.902; 4.164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление левилимаба, с ростом Cmax в 6.5-14.2 раза при еженедельном введении и в 1.9-4.2 раза при введении 1 раз в 2 недели. Таким образом, п/к введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Значения показателей, характеризующих период элиминации, зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2.2 мг/кг составлял 35.288 мл/ч.
Показания активного вещества
ЛЕВИЛИМАБ
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Режим дозирования
Применяется под наблюдением врача.
Вводят п/к. Рекомендуемая доза — 324 мг однократно в виде двух инъекций по 162 мг каждая.
Побочное действие
Инфекции и инвазии: нечасто — вирусные инфекции верхних дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулез.
Со стороны крови и лимфатической системы: очень часто — нейтропения; часто — лейкопения, лимфопения; нечасто — тромбоцитопения.
Со стороны сердечно-сосудистой системы: нечасто — повышение АД.
Общие реакции: часто — реакции в месте введения.
Лабораторные данные: часто — повышение активности АЛТ, АСТ, повышение концентрации холестерина и триглицеридов в крови, положительный результат анализа высвобождения интерферона гамма с антигеном Mycobacterium tuberculosis, положительный результат внутрикожного диагностического теста на туберкулез.
Противопоказания к применению
Повышенная чувствительность к левилимабу; клинически значимые бактериальные инфекции в острой фазе, включая туберкулез; детский и подростковый возраст до 18 лет; беременность, грудное вскармливание; печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью; почечная недостаточность тяжелой и терминальной степени тяжести (СКФ<30 мл/мин).
С осторожностью
Следует соблюдать осторожность при назначении левилимаба пациентам с хроническими и рецидивирующими инфекциями или с указаниями в анамнезе на них; сопутствующими заболеваниями, предрасполагающими к развитию инфекций; в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний; после недавно проведенной вакцинации живыми вакцинами; при назначении пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью), пациентам с почечной недостаточностью средней степени тяжести (СКФ 30 мл/мин). В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность с целью раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Противопоказание: печеночная недостаточность тяжелой степени (класс С по классификации Чайлд-Пью).
Применение при нарушениях функции почек
Противопоказание: почечная недостаточность тяжелой степени и в терминальной стадии (СКФ<30 мл/мин).
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Особые указания
Применение препарата, содержащего левилимаб, возможно только в условиях стационарной медицинской помощи.
До начала приема препарата, содержащего левилимаб, необходимо предоставить письменную информацию пациенту об эффективности левилимаба и рисках, связанных с его применением (в т.ч. о риске влияния на эмбрион и плод), и получить письменное согласие на применение препарата.
Учитывая иммуносупрессивное действие левилимаба, терапия потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. При реактивации гепатита В терапию левилимабом следует прекратить и назначить соответствующую противовирусную терапию.
Перед применением левилимаба и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии левилимабом.
С осторожностью применять левилимаб у пациентов с АЧН <2×109/л. При снижении АЧН <0.5×109/л терапию левилимабом следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической ситуацией.
С осторожностью применять левилимаб при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Следует оценивать показатели активности печеночных трансаминаз (АЛТ и АСТ) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что в свою очередь может привести к снижению эффективности терапии. Необходимо более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
При возникновении анафилактических или других серьезных аллергических реакций применение левилимаба следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Влияние на способность к управлению транспортными средствами и механизмами
Пациентам, испытывающим головокружение при применении левилимаба не следует управлять транспортными средствами и работать с механизмами до тех пор, пока головокружение не прекратится.
Лекарственное взаимодействие
Не следует проводить иммунизацию живыми вакцинами в ходе лечения левилимабом, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии левилимабом, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Илсира — инструкция по применению
Синонимы, аналоги
Статьи
Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях стационарной медицинской помощи.
Регистрационный номер:
ЛП-006244
Торговое наименование:
ИЛСИРА®
Международное непатентованное или группировочное наименование:
левилимаб
Лекарственная форма:
раствор для подкожного введения
Состав
| Ингредиент: | В 1,0 мл | В предварительно наполненном шприце 0,9 мл |
| Действующее вещество: | ||
| Левилимаб | 180,0 мг | 162,0 мг |
| Вспомогательные вещества: | ||
| Натрия ацетата тригидрат | 0,436 мг | 0,392 мг |
| Глицин | 7,5 мг | 6,8 мг |
| Маннитол | 23,0 мг | 20,7 мг |
| Уксусная кислота ледяная | до pH 5,0 | до pH 5,0 |
| Вода для инъекций | до 1,0 мл | до 0,9 мл |
Описание
Прозрачный, желто-коричневого цвета раствор. Возможно наличие лёгкой опалесценции.
Фармакотерапевтическая группа
Иммунодепрессанты, ингибиторы интерлейкина.
Код по ATX:
L04AC
Фармакологические свойства
Фармакодинамика
Левилимаб – рекомбинантное человеческое моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6). Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в том числе препятствует активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза – эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 – единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: СРБ, фибриногена, сывороточного амилоидного белка А – SAA, гипсидина, лептина.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген-индуцированного артрита у яванских макак (Масаса fascicularis) многократное (один раз в неделю в течение 7-ми недель) подкожное введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжелых инфекционных заболеваниях, в том числе у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
Всасывание/распределение
При однократном подкожном введении левилимаба пациентам с ревматоидным артритом, препарат обнаруживается в сыворотке крови пациентов в течение 2-24 часов, и его концентрация нарастает, достигая максимальных значений через 96 часов, с последующим снижением. Максимальная концентрация левилимаба в сыворотке крови (Сmax) после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168,5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC(0-168) составляли 1866231 [1297632-3719014] (нг/мл)·ч, для группы пациентов с еженедельным введением препарата и 2152996,5 [1323711-3081436] (нг/мл)·ч, для группы с введением препарата 1 раз в 2 недели. При многократном введении левилимаба значения суммарной площади под кривой концентрация – время рассчитанной в период 0-2016 ч после введения (AUC (0-2016)) составили 189580779 [134794695; 230680771] (нг/мл)·ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл)·ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (Cmax-mult) нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении препарата и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом время достижения максимальной концентрации (Тmax) составляло 1848 [1512; 2016] часов и 1848 [1512; 1848] часов при еженедельном введении препарата и введении 1 раз в 2 недели соответственно.
Стационарный объем распределения составляя 7871,029 [4226,795; 13363,547] мл при введении препарата 1 раз в неделю и 7130,453 [5532,978; 11387,959] мл при введении 1 раз в 2 недели.
О накоплении препарата при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10,932 [6,446; 14,178] для еженедельного введения препарата, 2,593 [1,902; 4,164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом максимальной концентрации в 6,5-14,2 раза при еженедельном введении и в 1,9-4,2 раза при выведении препарат 1 раз в 2 недели. Таким образом, подкожное введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Выведение
Значения показателей, характеризующих период элиминации (Kel, С1 и период полувыведения препарата), зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2,2 мг/кг составлял 35,288 мл/час.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания к применению
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Противопоказания
- Гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата.
- Клинически значимые бактериальные инфекции в острой фазе, включая туберкулез.
- Детский и подростковый возраст до 18 лет.
- Беременность, грудное вскармливание.
- Печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью. Почечная недостаточность тяжелой и терминальной степени тяжести (СКФ <30 мл/мин).
С осторожностью
Следует соблюдать осторожность при назначении левилимаба пациентам с хроническими и рецидивирующими инфекциями или с анамнестическими указаниями на них; сопутствующими заболеваниями, предрасполагающими к развитию инфекций; в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний; после недавно проведенной вакцинации живыми вакцинами; при назначении пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью), пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин). В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность с целю раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и в период грудного вскармливания
Применение при беременности
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат ИЛСИРА® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Применение в период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат ИЛСИРА® противопоказан к применению в период грудного вскармливания.
Влияние на фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата ИЛСИРА® должно осуществляться под наблюдением врачей. Рекомендуемая доза препарат ИЛСИРА® составляет 324 мг однократно в виде двух подкожных инъекций по 162 мг каждая.
Указания по применению
Подготовка к проведению подкожной инъекции
На данном этапе не следует снимать колпачок шприца
Техника выполнения подкожной инъекции препарата ИЛСИРА® в преднаполненном шприце
- Выберите место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
- Места инъекций и стороны следует менять с каждой последующей процедурой инъекции.
- Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции.
- Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
- Шприц не встряхивать.
- Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям;
- Одной рукой возьмите в складку обработанную кожу.
- В другую руку возьмите шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1,5 см допустимо введение под углом 90 градусов).
- Одним быстрым движением полностью введите иглу в кожную складку.
- После введения иглы отпустите складку кожи.
- Введите весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 секунд.
- Когда шприц будет пустым, выньте иглу из кожи под тем же углом.
- Кусочком марли слегка прижмите область инъекции в течение 10 секунд, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
- После инъекции шприц повторно не использовать.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла. Не допускайте хранения использованных шприцев в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у пациентов с ревматоидным артритом препарат ИЛСИРА® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были нейтропения, повышение активности АЛТ и повышение уровня холестерина крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата ИЛСИРА®, был ожидаемым для класса ингибиторов ИЛ6Р. Летальных исходов, связанных с терапией препаратом ИЛСИРА®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
| Системно-органный класс | Частота | Наименование реакции |
| Инфекции и инвазии | Нечасто | вирусные инфекции верхних дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулез. |
| Нарушения со стороны крови и лимфатической системы | Очень часто | нейтропения |
| Часто | лейкопения, лимфопения | |
| Нечасто | тромбоцитопения | |
| Нарушения со стороны сосудов | Нечасто | повышение артериального давления |
| Общие нарушения и реакции в месте введения | Часто | реакции в месте введения* |
| Лабораторные и инструментальные данные | Часто | повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), повышение уровня холестерина и триглицеридов крови, повышение уровня билирубина крови, положительный результат анализа высвобождения интерферона гамма с антигеном Mycobacterium tuberculosis, положительный результат внутрикожного диагностического теста на туберкулез. |
| *В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда. |
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, анемия, лимфаденит, лимфоцитоз, повышение уровня глюкозы крови, отклонение от нормы процедуры визуализации легких.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях при подкожном введении левилимаба в максимальной дозе 2,9 мг/кг (около 217 мг при массе тела 75 килограммов) явлений дозолимитирующей токсичности не зарегистрировано.
Специфический антидот отсутствует. Лечение симптоматическое.
Взаимодействие с другими лекарственными препаратами
Сведений о наличии неблагоприятных лекарственных взаимодействий левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Особые указания
Применение препарата возможно только в условиях стационарной медицинской помощи.
При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятии по фармаконадзору. До начала приема препарата ИЛСИРА® необходимо предоставить письменную информацию пациенту об эффективности препарата и рисках, связанных с его применением (в том числе о риске влияния на эмбрион и плод) и получить письменное согласие на применение препарата.
Серьезные инфекции
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В и (или) С, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В терапия левилимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Туберкулез
Пациентам с активным туберкулезом терапия препаратом ИЛСИРА® противопоказана. Перед назначением препарата ИЛСИРА® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом ИЛСИРА®.
Лабораторные показатели
Нейтропения
В клинических исследованиях препарата ИЛСИРА® отмечалось снижении числа нейтрофилов. Снижение абсолютного числа нейтрофилов (АЧН) не сопровождалось более высокой частотой развития инфекций, в том числе серьезных. Следует соблюдать осторожность при лечении препаратом ИЛСИРА® пациентов с АЧН <2×109/л. При снижении АЧН <0,5×109/л терапию препаратом ИЛСИРА® следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения
В клинических исследованиях препарата ИЛСИРА® отмечалось снижении числа тромбоцитов. Снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени
В клинических исследованиях препарата ИЛСИРА® отмечалось повышение активности «печеночных» трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом). Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® у пациентов с показателями аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT), превышающими верхнюю границу нормы (ВГН) более чем в 1,5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и ACT) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена
В клинических исследованиях препарата ИЛСИРА® отмечалось повышение концентрации липидов (холестерин и(или) триглицериды). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований препарата ИЛСИРА® анафилактических реакций и реакций гиперчувствительности не зарегистрировано. Однако при использовании других ингибиторов ИЛ6Р регистрировались крапивница и другие реакции гиперчувствительности, в том числе анафилаксия. При возникновении анафилактических или других серьёзных аллергических реакций применение препарата ИЛСИРА® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата ИЛСИРА® при лечении ревматоидного артрита выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом ИЛСИРА®, так как клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом ИЛСИРА®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Влияние на способность управлять транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата ИЛСИРА® на способность управлять транспортными средствами и работать с машинами и (или) механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата ИЛСИРА®, рекомендуется не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Форма выпуска
Раствор для подкожного введения 180 мг/мл.
По 0,9 мл в трехкомпонентные стерильные шприцы из бесцветного нейтрального стекла I гидролитического класса. Шприц, с одной стороны, имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена пластмассовым колпачком с бутил каучуковым уплотнителем. Шприц укупорен эластичным уплотнителем на поршень и поршнем.
На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу помещают в контурную ячейковую упаковку из пленки ПВХ.
По 2 и 4 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона.
Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 или 4 шт.
Условия хранения
При температуре от 2 до 8 °С в защищенном от света месте. Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, п. Стрельна, ул. Связи, д. 34, лит. А.
Производитель
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, п. Стрельна, ул. Связи, д. 38, стр. 1.
Организация, принимающая претензии потребителей
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, п. Стрельна, ул. Связи, д. 34, лит. А.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Статья подготовлена специалистом исключительно в ознакомительных целях. Мы настоятельно призываем вас не заниматься самолечением. При появлении первых симптомов — обращайтесь к врачу.
Володина Светлана Игоревна
Кардиолог, терапевт. Кандидат медицинских наук. Стаж 11 лет. Место работы: ГКБ №63, ДКЦ №1
Задать вопрос
Левилимаб — новый зарегистрированный препарат от коронавируса. Относится к группе противовоспалительных средств и иммунодепрессантов. Будет использован для лечения осложнений коронавирусной инфекции. Полная инструкция по применению пока не опубликована, но некоторые сведения уже доступны. Торговое название лекарства, Илсира, принадлежит компании Биокад. Ожидается скорое поступление лекарственного вещества в больницы.
Это обзорная статья о новом препарате, а не инструкция. Описанная ниже информация не должна быть использована для самолечения с помощью лекарства. Все сведения предварительные. Для получения точных данных нужно дождаться официального выпуска.
Терапевтическое действие Левилимаба
По своей лекарственной активности действующий компонент относится к иммунодепрессантам. Это рекомбинантное человеческое моноклональное антитело к рецепторной структуре интерлейкина-6. Химическое соединение соединяется и подавляет разные формы ИЛ-6, включая те, что расположены на клеточных мембранах. Этот механизм действия помогает предотвратить развитие воспалительного процесса, обуславливающего усиление активности иммунокомпетентных клеток. Блокирование обеих форм рецепторной структуры значительно улучшает результаты противовоспалительной терапии. Нарушается формирование протеинов острой фазы в клетках печени.
Лекарственная активность иммуноглобулина к ИЛ-6, направленная на устранение воспаления, помогает предотвратить активацию клеток, презентирующих антиген. Также химическое соединение подавляет активацию лимфоцитов, фибробластов, макрофагов и других клеточных элементов, участвующих в воспалительной реакции. Снижается выработка цитокинов. Использование левилимаба при ревматоидном артрите понижает формирование клеток, разрушающих костную и хрящевую ткани.
Дополнительные свойства
- Разные методы исследования подтвердили наличие описанных лекарственных свойств у действующего компонента. Вещество подавляет деление некоторых иммунокомпетентных клеток, участвующих в воспалительной реакции. Это терапевтическое действие зависит от используемой дозы.
- Применение препарата на животных продемонстрировало улучшение состояние суставов при наличии воспалительных процессов в этих анатомических структурах. Улучшалось состояние костной и хрящевой ткани. Дегенерация суставных элементов подавляется.
- Снижается вероятность развития тяжелого иммунопатологического осложнения, называемого цитокиновым штормом. Механизм действия связан с блокированием рецепторных структур ИЛ-6. Этот цитокин способен вызывать подобные реакции при различных заболеваниях, включая коронавирусную инфекцию.
- Лабораторные тесты подтверждают высокую эффективность лекарственного вещества. Результаты показывают, что медикаментозная терапия блокирует большинство рецепторных структур к цитокину.
- Уровень С-реактивный белка в организме падает. Этот результат показывает высокую противовоспалительную эффективность препарата Илсира.
Лекарственное вещество относится к наиболее эффективным иммунодепрессантам. Блокируется действие цитокина, отвечающего за поражение суставных структур и других органов при иммунопатологических заболеваниях. Снижается риск развития гиперцитокинемии у пациентов. При ревматоидном артрите улучшается общее состояние суставов. Замедляются дегенеративные процессы, затрагивающие кости и хрящи. Повышается двигательная активность. Качество жизни пациента нормализуется.
Левилимаб от коронавируса
Изготовители были нацелены на создание препарата для эффективного лечения ревматоидного артрита. По своим свойствам химическое соединение не должно было уступать другим ингибиторам интерлейкина 6. Во время пандемии коронавируса медикаменты этой группы в исследованиях и на практике продемонстрировали эффективность. Результаты показали, что применение таких средств у тяжелых больных снижает вероятность летального исхода на фоне цитокинового шторма и других аутоиммунных реакций. Производители включили свое лекарство в группу исследования. Была подтверждена результативность применения вещества. В июне левилимаб был зарегистрирован в качестве лекарства для лечения осложнений коронавирусной инфекции.
Механизм действия при COVID19 связан с подавлением работы цитокина, ИЛ-6. Этот иммунный компонент обуславливает формирование тяжелых иммунопатологических реакций у некоторых пациентов. Защитная система организма из-за повышенной активации начинает атаковать здоровые ткани. В первую очередь это осложнение затрагивает легкие при коронавирусной пневмонии. Возникает цитокиновый шторм. Летальный исход связан с респираторным дистресс-синдромом. Химическое соединение эффективно блокирует различные рецепторы к этому веществу, благодаря чему риск смерти снижается.
Действие химического соединения было доказано на практике. Теперь ожидается поступление медикаментов в больницы для лечения пациентов. Только врачи могут правильно подбирать дозу. Самолечение этим средством или другими медикаментами при наличии коронавирусной инфекции запрещено.
Фармакокинетические особенности
При разовой подкожной инъекции левилимаба уровень химического соединения в кровотоке выявляется в течение двадцати четырех часов. Наивысший уровень действующего компонента возникает через девяносто шесть часов с момента введения. Дальше концентрация постепенно снижается. Самый высокий уровень компонента в кровотоке после разовой инъекции, введении один или два раза за четырнадцать суток отличается незначительно. Дополнительные инъекции приводят к увеличению уровня химического соединения.
Вещество накапливается в организме при регулярном введении. Разовая инъекция в неделю дает оптимальную концентрацию химического соединения с учетом накопления в организме. Особенности удаляется лекарства из организма зависят от используемой дозы. Нет информации об особенностях выведения у людей с нарушением почечной или печеночной деятельности. Нет информации об изменениях выведения вещества у пожилых людей.
Показания для Левилимаба
Препарат будет использован для предотвращения развития жизнеугрожающего респираторного дистресс-синдрома, связанного с усилением выработки цитокинов. Это показание предполагает применение лекарства у пациентов с тяжелым течением коронавирусной инфекции. Врачи смогут назначать лекарство для предупреждения опасных осложнений болезни.
Официальная инструкция пока отсутствует, поэтому нет точной информации о показаниях к применению Илсира. С учетом первых исследования не исключен выпуск медикаментов для лечения ревматоидного артрита с этим действующим компонентом.
Противопоказания
- Непереносимость действующих или вспомогательных компонентов.
- Возраст до восемнадцати лет.
- Вынашивание ребенка.
- Кормление грудью.
- Активный инфекционный процесс, вызванный бактериями.
- Тяжелое нарушение деятельности печени.
- Тяжелое нарушение деятельности почек с показателем клиренса креатинина ниже 30 миллилитров в минуту.
Применение с осторожностью
Осторожное лечение с применением левилимаба предусмотрено для больных с инфекционными процессами в организме, включая рецидивы, хронические патологии и анамнестические факторы с повышенным риском появления такой проблемы. Врач осторожно проводит лекарственную терапию в период раннего выздоровления после инфекционных заболеваний бактериальной, вирусной, паразитарной или грибковой природы. Аналогично после использования живой вакцины, у пациентов с умеренным нарушением печеночной или почечной деятельности.
Активное вещество способно предотвращать острый воспалительный процесс на фоне раннего протекания инфекции. На эту особенность следует обратить внимание с точки зрения своевременной диагностики инфекционных патологий во время медикаментозного лечения. Нет достаточной информации о безопасности медикаментов для больных старше шестидесяти пяти лет. Нужно оценивать состояние таких людей во время лечения.
Все факторы риска возникновения осложнений терапии учитываются лечащим врачом. Специалист изучает анамнез перед назначением препарата. Если у пациента есть предрасположенность к негативным последствиям лечения, врач периодически проводит обследования. Особое внимание уделяется раннему обнаружению инфекций на фоне лекарственного снижения иммунитета.
Инструкция по применению Левилимаба
Жидкая лекарственная форма для проведения подкожных инъекций. Процедура введения химического соединения не отличается от правил проведения инъекций других медикаментов этой группы. Все правила будут описаны в официальной инструкции после выпуска медикаментов. Лечение проводится только под врачебным контролем. Специалист подбирает правильную дозу и частоту введения лекарства.
Побочные эффекты
Изучение особенностей левилимаба у людей с ревматоидным артритом продемонстрировало общую безопасность. К самым распространенным побочным эффектам специалисты отнесли снижение нейтрофилов, увеличение уровня ферментных веществ печеночного происхождения и повышение концентрации холестерола. Обнаруженные нежелательные реакции применения средства соответствуют побочным действиям других медикаментов из группы ингибиторов интерлейкина-6. Смерти на фоне применения действующего компонента в ходе изучены не были зарегистрированы.
Средство обладает отличным профилем безопасности. Особенности побочных эффектов у пациентов старше шестидесяти пяти лет и у больных с умеренным нарушением почечной или печеночной деятельности не изучены, поэтому этим категориям пациентам нужно больше врачебного внимания во время лечения.
Обнаруженные нежелательные реакции
- Инфекционные осложнения: воспаление верхнего респираторного тракта при инвазии вирусов, воспаление легких, обострение хронической формы тонзиллита, скрытое туберкулезное течение.
- Сосудистые расстройства: увеличение давления крови.
- Кроветворная система: понижение уровня нейтрофилов, снижение численности лейкоцитов, понижение лимфоцитов, уменьшение количества тромбоцитов.
- Результаты анализов: увеличение уровня ферментных веществ печеночного происхождения, увеличение холестерола и триглицеридов, положительный кожный анализ на туберкулезную инфекцию, гипербилирубинемия, положительный антигенный тест интерферона гамма на туберкулезную инфекцию.
- В области инъекции: воспаление, покраснение, инфицирования, болезненность, эритема, зудение и другие негативные последствия инъекционного подкожного введения.
- Побочные эффекты, связь появления которых с действием лекарства пока не подтвердилась: лимфаденит, увеличение концентрации сахара в кровотоке, изменение результатов визуального обследования легких, повышение уровня лимфоцитов, воспалительный процесс в коже и анемия.
Врач объяснит пациенту риски использования медикаментов этого типа. Наблюдение специалиста за состоянием пациента и диагностическими данными помогает предотвратить развитие опасных осложнений. При любых жалобах во время лечения следует обратиться к доктору. Иногда требуется временная или постоянная отмена терапии.
Дополнительные сведения
- Нет информации о негативных последствиях передозировки. Во время исследования не обнаружена наивысшая безопасная дозировка. Использование повышенных концентраций не показало появления токсического эффекта Следует соблюдать правила применения, включая рекомендованные дозы. При случайной передозировке проводится специфическая терапия для устранения осложнений.
- Относится к классу N по особенностям применения медикаментов с точки зрения FDA. Специальное изучение особенности влияния левилимаба на зародыш не осуществлялось. Поскольку медикаменты этой группы могут преодолевать гистологический барьер и проникать в ткани развивающегося организма, использование средства во время вынашивания ребенка запрещено. Пациенты во время курса проведения инъекции должны предотвращать зачатие. При случайном зачатии нужно обратиться к врачу.
- Химические соединения, относящиеся к антителам IgG, способны выделяться с секретом молочных желез у женщин. Отдельное изучение этого активного вещества с точки зрения возможности попадания в материнское молоко не осуществлялось. Проводить инъекции в период кормления грудью запрещено.
- Производитель не опубликовал информацию о нежелательных и допустимых комбинация препарата с другими медикаментами. Точные данные будут в официальной инструкции. Применение любого лекарства совместно с левилимабом возможно только с разрешения лечащего врача.
- Нет информации о способности химического соединения влиять на фертильность у пациентов.
Выпуск официальной инструкции дополнит или изменит информацию.
Меры осторожного применения
- Медикаментозная терапия проводится в больнице под наблюдением медицинского персонала. Появление нежелательных реакций контролируется врачом. Проводится запрос к службам, ответственным за фармакологический надзор. До терапии больного тщательно информируют о механизме действия, нежелательных реакциях и других особенностях действующего компонента. Нужно получить согласие на проведения курса инъекций.
- Лечение с применением инъекций этого вещества никогда не проводится, если пациент страдает от тяжелого инфекционного заболевания, вроде ВИЧ-инфекции, синдрома приобретенного иммунодефицита в качестве осложнения, туберкулеза, сифилиса, гепатита B или C. Перед терапией проводят анализы. Врач оценивает возможные риски. Не следует проводить инъекции при обнаружении местных инфекционных процессов в активной форме. Иммунодепрессант способен вызвать рецидив инфекционной патологии или облегчить инфицирование. Обострение любого инфекционного процесса требует прекращения терапии.
- Активную форму туберкулезной инфекции относится к категорическим противопоказаниям. Для начала лечения врач проводит диагностику для исключения этого заболевания. Из-за повышенного риска инфицирования и скрытого течения туберкулеза во время терапии нужны периодические обследования. Если заболевание обнаружено, терапия отменяется для проведения соответствующего лечения.
Исследования во время курса инъекций помогают снизить вероятность развития тяжелых осложнений, связанных с деятельностью инфекционных агентов.
Результаты анализов
К распространенным нежелательным реакциям производитель отнес умеренное снижение численности нейтрофилов, не влияющее на риск развития инфекции. Нужен особый контроль, если у больного до начала лечения обнаружено снижение уровня этих клеток. Если выявлена выраженная нейтропения, лекарственная терапия отменяется. Соответствующие анализы специалисты рекомендуют проводить через четыре-восемь недель и позже. Также производитель выявлял понижение тромбоцитов, не вызывающее повышенного риска кровоизлияния. Врачу следует оценить уровень этих клеточных элементов перед началом терапии и проводить контроль позже. Если чисто тромбоцитов значительно снижено, инъекции не проводятся.
Отдельные ферментные вещества печеночной ткани, трансаминазы, повышаются в ходе введения левилимаба в организм, однако при этом не обнаруживается повреждение органа. Вероятность появления нежелательной реакции повышается, если совместно используются медикаменты, негативно влияющие на печень. Если у больного изначально уровень АЛТ и ACT выше нормы в полтора и более раза, нужно проводить терапию осторожно. Рекомендуются регулярные обследования.
Отдельно производитель отметил повышение уровня холестерола и триглицеридов. Эти изменения нужно определять с помощью анализов через четыре-восемь недель и далее. Если у больного в анамнезе есть нарушение липидного профиля, лечение проводится с указанием врачебных рекомендаций.
Иммунные реакции и вакцины
Применение левилимаба сопряжено с потенциальным риском развития повышенной иммунной чувствительности или аллергии. Изучение действующего компонента со стороны производителя не показало случаев появления анафилаксии и аллергии. Прочие медикаменты этой группы на практике вызывали разные формы аллергии, включая кожные высыпания и анафилактическую реакцию. Если развивается иммунопатологическая реакция во время терапии, следует остановить введение средства и оказать пациенту соответствующую помощь. Исследование активного вещества на пациентах не продемонстрировало образования иммуноглобулинов к лекарству.
Использовать живые вакцины во время курса проведения инъекции не следует, поскольку нет достоверной информации о возможных последствиях такого действия от производителя. Есть потенциальный риск развития инфекционных осложнений на фоне медикаментозного снижения иммунной функции у пациента. Врач учитывает промежуток между проведением вакцинации живым препаратом и началом введения левилимаба. Есть соответствующие рекомендации, на которые специалист обращает внимание.
Особые категории пациентов
- Если у больного присутствует пристрастие к наркотическим веществам или алкогольным напиткам, результативность самостоятельной терапии может быть сниженной из-за нарушения правил и сроков инъекций. Такой фактор приводит к недостаточному результату применения лекарства. Рекомендуется проводить достаточный врачебный контроль курса лечения в больнице. Есть повышенная вероятность осложнений со стороны почек и печени, поэтому такие особенности учитываются специалистом.
- Мало информации об результативности и безопасности использования средства у мужчин и женщин в возрасте от шестидесяти пяти лет. Нет повода предполагать, что выведение и действие химического соединения у таких пациентов будет значительно отличаться.
- Не исследованы особенности применения средства при нарушении печеночной и почечной деятельности. Аналогично с использованием лекарственного вещества у пациентов до восемнадцати лет.
Изготовитель не предоставил информацию о возможном воздействии левилимаба на скорость психомоторных реакций. Прочие медикаменты из этой группы иногда обуславливают вертиго. Если такой побочный эффект наблюдается, нужно перестать заниматься опасной деятельностью, включая вождение, вплоть до исчезновения нежелательных реакций со стороны нервной системы и психики.
Аналоги левилимаба
Это недавно разработанное российское лекарство от коронавирусной инфекции. Ожидается выпуск лекарственного вещества под торговым названием «Илсира». Нет аналогов с таким же действующим компонентом. Можно найти отдаленные аналоги из группы блокаторов интерлейкина 6. Таковым является тоцилизумаб.
Принимать это средство или его аналог без разрешения врача запрещено.
Отзывы и цены
Медикаменты еще не поступили в больницы, поэтому большинство инфекционистов и врачей других профилей не оценило эффективность и безопасность действующего вещества. Отдельный опыт применения под контролем производителя продемонстрировал отличный профиль безопасности. Другие блокаторы интерлейкина 6 на практике иногда вызывали повышенную чувствительность иммунитета, в том числе в виде анафилаксии, однако это лекарственное вещество во время исследования не сформировало такую нежелательную реакцию. Ученые заявили о том, что это средство значительно снижает риск летального исхода у пациентов с тяжелым течением коронавирусной инфекции.
Информации о стоимости еще нет.
Купить Левилимаб
Сейчас приобрести это средство невозможно. Официального выпуска еще не было. Ожидается поступление медикаментов в больничные учреждения в течение двух месяцев. Нет информации о возможном поступлении лекарства в аптечные сети.
Видео
Новое зарегистрированное средство от коронавируса, разработанное российскими учеными. Полностью оригинальное химическое соединение.
Состав Илсиры
В состав раствора входит (на 1 мл раствора) 180 мг действующего вещества левилимаба и вспомогательные вещества: натрия ацетат тригидрат 0,436 мг, глицин 7,5 мг, маннитол 23,0 мг, уксусная кислота ледяная до повышения рН 5,0, вода для инъекций 1,0 мл.
Расчет компонентов на предварительно наполненный шприц 0,9 мл:
- 162,0 мг левилимаба;
- натрия ацетата тригидрата — 0,392 мг;
- глицина — 6,8 мг;
- маннитола — 20,7 мг;
- уксусной кислоты ледяной — до повышения рН 5,0;
- вода для инъекций — 0,9 мл.
Форма выпуска
Препарат Илсира — это желто-коричневый раствор, прозрачный, склонный к легкой опалесценции. Выпускается в форме раствора для подкожного введения, 180 мг/мл. Препарат расфасован в трехкомпонентные стерильные шприцы из стекла. С одной стороны шприца расположена впаянная игла для инъекций с пластмассовым колпачком. Шприц закупорен эластичным колпачком-уплотнителем на поршень и поршнем. На каждом шприце самоклеющаяся этикетка. Шприцы расположены в контурной ячейковой упаковке из ПВХ-пленки. В картонных пачках по 2/4 контурных упаковок.
Фармакологическое действие
Иммунодепрессивное, ингибитор интерлейкина.
Фармакодинамика и фармакокинетика
Лекарство Илсира — рекомбинантное человеческое моноклональное антитело к специфическим рецепторам интерлейкина-6 (сокращенной ИЛ-6). Действующее вещество обладает способностью блокировать и связывать мембранные рецепторы мИЛ6Р и растворимые рецепторы ИЛР. Способность препарата блокировать обе формы рецепторов не дает развиться провоспалительному каскаду специфических медиаторов воспаления, препятствует активации Т- и В-лимфоцитов, макрофагов, моноцитов, фибробластов и эндотелиальных клеток.
Специфические противовоспалительные свойства препарата Илсира были проверены в тестах на живых организмах и в пробирке. Средство обладает способность оказывать антипролиферативное действие на клетки DS-1, приводя к дозозависимому ингибированию роста клеток. Противовоспалительные свойства вещества левилимаб были проверены на модели коллаген-индуицрованного артрита у макак. При введении средства один раз в 7 дней в течение 7 недель наблюдалось снижение выраженности воспалительных реакций в суставах, также эти данные были подтверждены во время гистологических исследований. Происходило значительное снижение выраженности воспалительного процесса и замедлялось разрушение хрящевой ткани.
Как известно, ИЛ-6 — это ключевой цитокин, принимающий участие при развитии цитокинового шторма у больных, получающих иммуносупрессивную терапию, и при формировании острого респираторного дистресс-синдрома во время тяжелых инфекционных заболеваний, к которым относится и новая инфекция COVID-19.
Фармакодинамические показатели рИЛ6Р, мИЛ6Р, ИЛ-6 и СРБ указываются на то, что препарат активно нейтрализует рецепторы ИЛ-6, быстро и эффективно снижает сывороточную концентрацию медиаторов воспаления. Это подтверждается эффективным лечением активного ревматоидного артрита у мартышек с помощью данного средства.
После однократного подкожного введения средства больным ревматоидным артритом, действующее вещество можно обнаружить в плазме крови от 2 часов до суток, при этом со временем его концентрация увеличивается. Максимальные значения наблюдаются через 96 часов, а затем постепенно снижаются. При многократном введении препарата Илсира он накапливается, коэффициент кумуляции составляет порядка 10 для еженедельного введения и порядка 2,5 при введении 1 раз в 14 дней. Также специалисты отмечаются накопление вещества после повторных инъекций и рост максимальной его концентрации в крови в 6-14 раз при приеме каждые 7 дней и в 1,9-4 раза — каждые 14 дней. Можно сделать вывод, что подкожное введение средства раз в 7 дней обеспечит более высокую концентрацию в сыворотке крови. После однократного введения подкожно левилимаба в дозировке 2,2 мг на кг общий клиренс составляет 35,3 мл в час.
Показания к применению
Используют препарат Илсира от коронавируса для купирования угрожающего жизни дистресс-синдрома, сопровождающегося цитокиновым штормом.
Противопоказания
Левилимаб (Биокад) не рекомендуется к применению:
- при аллергии на вещество или любые вспомогательные компоненты в составе;
- при наличии у больного любых клинически значимых бактериальных инфекций в фазе обострения, в том числе при туберкулезе;
- у детей и подростков до 18 лет;
- при кормлении грудью и беременности;
- пациентам с печеночной недостаточностью тяжелой степени, в терминальной стадии, когда СКФ составляет менее 30 мл в минуту.
Рекомендуют соблюдать осторожность при назначении препарата следующим группам пациентов:
- с хроническими заболеваниями, которые предрасполагают к развитию инфекций;
- при рецидивирующих инфекционных заболеваниях или таковыми в анамнезе;
- недавно перенесшим тяжелые и средней тяжести инфекционные заболевания;
- после вакцинации живой вакциной;
- при заболеваниях печени легкой и средней тяжести;
- при почечной недостаточности средней тяжести;
- пожилые пациенты.
Побочные действия
У лекарственного средства Илсира мало побочных реакций и проявляются она нечасто. Наиболее вероятно возникновение нейтропении, рост активность АЛТ и общего холестерина крови. В ходе клинических исследований препарата при лечении артрита летальных исходов выявлено не было.
Также наблюдались следующие эффекты от приема препарата:
- лейкопения и лимфопения, местные реакции на участке введения препарата, зуд и эритема кожи;
- рост активности аланинаминотрансферазы, аспартатаминотрансферазы, холестерина, триглицеридов крови, билирубина;
- вирусные поражения верхних дыхательных путей, пневмония, обострение тонзиллита, латентный туберкулез;
- рост артериального давления, анемия, лимфоцитоз, повышенный сахар в крови.
Также при лечении средством могут наблюдаться ложно положительные результаты внутрикожного диагностического теста на туберкулез, анализа высвобождения интерферона гамма с антигеном бактерии туберкулеза.
Илсира, инструкция по применению (Способ и дозировка)
Лекарство от коронавируса должно применяться под наблюдением врача. Рекомендуют дозировку 324 мг для однократного введения. Две подкожные инъекции производят по 162 мг.
Инъекционное средство левилимаб, инструкция по применению:
- Необходимо тщательно вымыть руки.
- Извлечь упаковку со шприцем из холодильника, извлечь шприц из картонной упаковки.
- Осмотреть внимательно шприц и лекарство в нем на предмет помутнения раствора, примеси посторонних частиц, изменения цвета, любых повреждений, истечения срока годности.
- Шприц рекомендуется нагреть при комнатной температуре 25-30 минут.
- Инъекции рекомендуется проводить в переднюю и боковую поверхность бедра, среднюю треть наружной части плеча, в переднюю брюшную стенку (более 5 см отступить от пупка). Нельзя делать уколы в одно и то же место, в места, где есть покраснение, болезненность, кровоподтеки и уплотнения.
- Место укола обрабатывают спиртовой салфеткой круговыми движениями.
- Снять колпачек с иглы, не прикасаясь к ней руками и не прислоняя к любым поверхностям.
- Одной рукой взять в руку обработанный участок кожи и сформировать складку.
- Другой рукой взять шприц, градуированным рисунком вверх.
- Ввести иглу под углом 45 или 90 градусов (если есть достаточная жировая прослойка, не менее 1,5 см) один быстрым движением.
- Отпустить складку кожи.
- Медленно ввести раствор в течение 2-5 секунд.
- Вынуть иглу из кожи под тем же углом.
- Прижмите чистым куском марки область инъекции в течение 10 секунд.
- Не трите поверхность кожи.
Частота применения препарата определяется лечащим врачом.
Передозировка
Нет клинических данных о передозировке препаратом. Не удалось установить максимально переносимую дозировку для человека. При проведении клинических исследований при подкожном введении 2,9 мг на кг веса проявления токсичности не наблюдалось. У препарата нет антидота. Рекомендуется симптоматическое лечение.
Взаимодействие
На текущем этапе не обнаружено неблагоприятных лекарственных взаимодействий препарата с прочими средствами. Нельзя смешивать вещество с другими лекарствами.
Условия продажи
Препарат отпускают строго о рецепту. Применение лекарство возможно только в условиях стационарной мед. помощи.
Детям
Нет данных об эффективности и безопасности применения препарата у пациентов младше 18 лет.
При беременности и лактации
Исследования влияния препарата Илсира на плод во время беременности не проводилось. Моноклональные антитела проникают сквозь плацентарный барьер. Женщины и мужчины, которые проходят лечение средством должны использовать эффективные методы контрацепции.
Нет данных о том, проникает ли действующее вещество препарата в грудное молоко. Есть данные о том, что иммуноглобулины класса G способные выделяться с молоком женщины. Поэтому применение препарат в период грудного вскармливания не рекомендуется.
Аналоги Илсиры
Совпадения по коду АТХ 4-го уровня:
Аналог левилимаба — препарат под МНН Илсира. Это торговое название вещества, зарегистрированное на территории РФ.
Групповые аналоги средства представлены препаратами тоцилизумаба.
Отзывы об Илсире
Изначально планировали и разрабатывали лекарство левилимаб от артрита. Однако, на данный момент средство хорошо себя зарекомендовало при лечении тяжелых форм коронавируса COVID-19, особенно при гиперреакции иммунной системы на вирус. Тестировать вещество начали с августа 2019 года (в качестве препарата от артрита), а в апреле 2020 года его уже одобрило Министерство Здравоохранения России. Окончательно завершить все клинические испытания средства планируют к 2024 году. Исследования проводят на базе Инфекционной больницы им. Боткина, в Мед. центре им Алмазова в Санкт-Перебредете, на территории Чечни, Москвы и Дагестана.
Позитивно о препарате левилимаба от коронавируса отзывается и ген. директор компании Biocad. Судя по данным исследований из 60 больных, получавших данный препарат только 2 оказалось в реанимации, 13 человек были выписаны, а у остальных наблюдалась стойкая положительная динамика. Наиболее эффективным препарат оказался при лечении средней и тяжелой формы болезни.
Лекарство не просто купирует, но и предотвращает развитие цитокинового шторма, который порой бывает опаснее самого вируса. Специалисты рекомендуют назначать Илсиру на начальных этапах заболевания, пока не произошло присоединения бактериальной флоры. При длительной иммобилизации больного применять средство становится опасно, это может привести к развитию септического шока.
В целом лекарство признано эффективным и перспективным, несмотря на то, что оно еще находится на стадии дополнительных исследований.
Цена Илсиры, купить Илсиру в Москве
Указать актуальную цену левилимаба в форме препарата Илсира на данный момент невозможно. Средство нельзя найти в свободной продаже в аптеках, оно выдается непосредственно для лечения в клинике. Указать стоимость препарата в Спб также нельзя.
- Новиков П.И.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
- Бровко М.Ю.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
,
- Акулкина Л.А.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
- Надточеева В.Б.
- Факультет фундамен- тальной медицины, МГУ им. М.В. Ломоносова
,
- Моисеев С.В.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
- DOI
- 10.32756/0869-5490-2021-3-67-75
- Количество просмотров
- 1810
Скачать статью в PDF
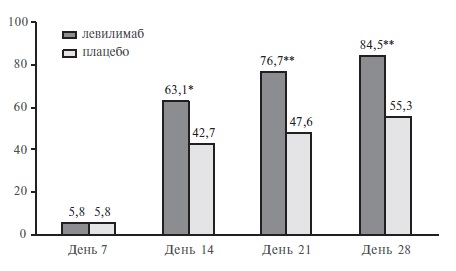
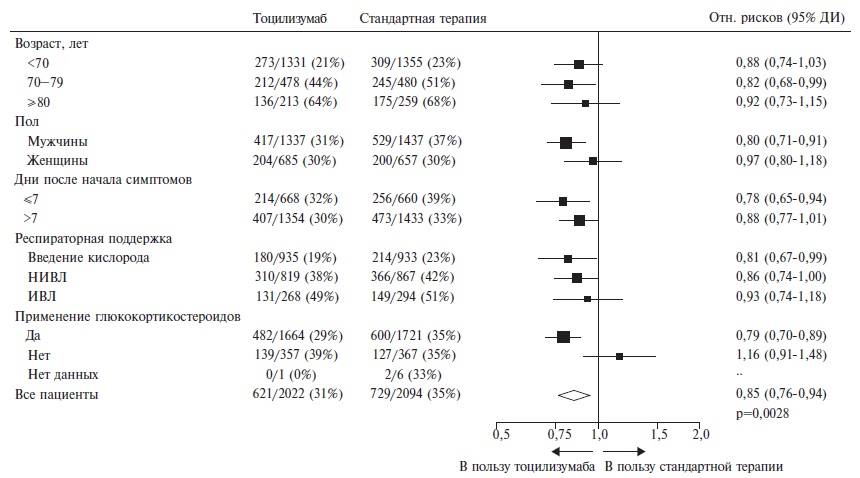
Левилимаб – это новый ингибитор интерлейкина (ИЛ)-6, разработанный фармацевтической компанией ЗАО “БИОКАД” и недавно зарегистрированный для патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении COVID-19. Препарат представляет собой моноклональное антитело, блокирующее как растворимые, так и мембранные рецепторы ИЛ-6. Эффективность и безопасность левилимаба были установлены в рандомизированном, двойном слепом исследовании CORONA, в которое были включены 206 пациентов с COVID-19 ассоциированной пневмонией, у которых имелся по крайней мере один критерий тяжести заболевания, такой как увеличение частоты дыханий более 30 в минуту, снижение SpO2≤93% или PaO2/FiO2≤300 мм рт. ст., увеличение распространенности поражения легких более чем на 50% в течение 24-48 ч и др. Первичным критерием эффективности в этом исследовании была доля пациентов, состояние которых стабильно улучшилось по шкале ВОЗ (без дополнительных инъекций левилимаба открытым методом) на 14-й день после введения исследуемого препарата. По этому показателю левилимаб достоверно превосходил плацебо (63,1% и 42,7%,
соответственно; р=0,0017), а разница между группами сохранялась до конца 30-дневного наблюдения. Эффективность левилимаба подтверждалась и результатами анализа ряда вторичных показателей эффективности, таких как потребность в дополнительном введении ингибитора ИЛ-6 открытым методом и частота перевода в отделение реанимации и интенсивной терапии. Увеличения риска развития оппортунистических инфекций при введении левилимаба отмечено не было. В статье на основании случая успешного применения левилимаба у пациента с COVID-19 разбираются практические аспекты использования ингибиторов ИЛ-6 при этом заболевании.
С.В. Моисеев. Несмотря на ограничительные меры, которые принимаются по всему миру, и продолжающуюся вакцинацию число больных с COVID-19 продолжает увеличиваться, а во многих странах, включая Россию, периодически регистрируются подъемы заболеваемости, которые связывают с появлением мутировавших штаммов вируса и/или недостаточным охватом населения вакцинацией. Очевидно, что последняя не позволяет исключить возможность COVID-19, хотя значительно снижает риск развития инфекции и тяжесть ее течения [1]. В клинических исследованиях изучаются многочисленные лекарственные средства, которые обладают потенциальной активностью в отношении SARS-CoV-2, однако противовирусные препараты, характеризующиеся доказанной эффективностью в профилактике неблагоприятных исходов COVID-19, по-прежнему отсутствуют. В нашей стране для лечения SARS-CoV-2 инфекции широко используется фавипиравир, который в рандомизированном клиническом исследовании вызывал более быстрое улучшение состояния пациентов по сравнению со стандартной терапией [2], однако остается неясным, снижает ли этот препарат риск прогрессирования COVID-19 и, соответственно, частоту перевода на искусственную вентиляцию легких и смерти больных. При оценке перспектив лечения SARS-CoV2 инфекции необходимо учитывать, что эффекта от противовирусной терапии следует ждать только в случае раннего ее назначения (например, в первые 1-3 дня), когда у пациента продолжается репликация вируса и еще нет признаков чрезмерного воспалительного ответа, который определяет тяжесть течения заболевания. Следует отметить, что распространенная в нашей стране практика назначения антибиотиков пациентам с COVID-19 с первых дней инфекции не имеет какого-либо обоснования и смысла, так как антибактериальные средства не обладают противовирусной активностью, а риск вторичных бактериальных инфекций при COVID-19 не так велик, особенно при легком течении заболевания. При этом широкое применение антибиотиков сопровождается распространением резистентности среди бактериальных возбудителей, может привести к различным побочным эффектам, включая диарею и псевдомембранозный колит, и вынуждает чаще использовать резервные антибиотики на госпитальном этапе в случае присоединения бактериальной инфекции. Для подавления гипериммунного воспалительного ответа, вызванного SARS-CoV-2, в настоящее время применяют глюкокортикостероиды, прежде всего дексаметазон, и “антицитокиновые» препараты, в частности ингибиторы интерлейкина (ИЛ)-6, первые сообщения об эффективности которых при COVID-19 были опубликованы уже вскоре после начала пандемии в Китае и Италии, а затем и в других странах. Препараты этой группы представляют собой моноклональные антитела, которые взаимодействуют с рецепторами ИЛ-6 (тоцилизумаб и сарилумаб) или непосредственно с цитокином (олокизумаб). Российской компанией ЗАО “БИОКАД» разработан еще один ингибитор ИЛ-6 – левилимаб (Илсира), который блокирует как растворимые, так и мембранные рецепторы ИЛ-6. Эффективность и безопасность левилимаба изучаются у пациентов с ревматоидном артритом, а в Российской Федерации он был недавно одобрен для патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении COVID-19. Что послужило основанием для регистрации левилимаба по этому показанию?
П.И. Новиков. Эффективность и безопасность левилимаба у госпитализированных пациентов с COVID-19 изучались в рандомизированном (1:1), двойном слепом, плацебо-контролируемом исследовании CORONA, которое проводилось в 12 российских центрах, включая перепрофилированные клиники Первого МГМУ им. И.М. Сеченова [3]. В исследование включали взрослых пациентов (18 лет и старше) с SARS-CoV-2 инфекцией, подтвержденной с помощью полимеразной цепной реакции, у которых имелись признаки пневмонии на компьютерной томограмме (КТ) органов грудной клетки и по крайней мере один показатель тяжести заболевания, в том числе увеличение частоты дыханий более 30 в минуту, снижение SpO2 ≤93% или PaO2/FiO2 ≤300 мм рт. ст., увеличение распространенности поражения легких более чем на 50% в течение 24-48 ч и др. Необходимость в искусственной вентиляции легких (ИВЛ) была критерием исключения из исследования, т.е. в него не включали пациентов, находившихся в критическом состоянии. Протокол исследования не допускал применение других моноклональных антител для лечения COVID-19. Пациентам основной группы в дополнение к стандартной терапии вводили подкожно левилимаб в дозе 324 мг (две инъекции по 162 мг одновременно), в то время как больные контрольной группы получали плацебо и стандартное лечение. В случае ухудшения состояния больных в обеих группах разрешалось дополнительное введение левилимаба в дозе 324 мг открытым методом. Исследование не обладало статистической мощностью, достаточной для сравнительного анализа летальности пациентов, поэтому первичным критерием эффективности было стойкое улучшение по шкале ВОЗ на 14-й день после введения исследуемого препарата. Эта шкала предполагает распределение больных с COVID-19 на 7 категорий: 1 – не госпитализировался/выписан, 2 – госпитализирован, но не требуются введение кислорода или другая медицинская помощь, 3 – госпитализирован, введение кислорода не требуется, но проводится другая терапия, 4 – госпитализирован, требуется введение кислорода, 5 – госпитализирован, требуются высокопоточная кислородотерапия или неинвазивная вентиляция легких (НИВЛ), 6 – госпитализирован, требуются ИВЛ или экстракорпоральная мембранная оксигенация (ЭКМО), 7 – смерть. Критерием стойкого улучшения было снижение категории по шкале по крайней мере на 2 (например, перевод пациента с ИВЛ на введение увлажненного кислорода через канюли или отсутствие необходимости в респираторной поддержке у больного, находившегося на НИВЛ) или достижение категорий 1 или 2 (выписка из стационара или отсутствие необходимости в кислородотерапии и другой медицинской помощи). Кроме того, изучались различные вторичные критерии эффективности, в том числе частота других исходов по указанной шкале, частота перевода в отделение реанимации и интенсивной терапии (ОРИТ), длительность лихорадки и госпитализации, изменения лабораторных признаков воспаления.
С апреля по август 2020 г. были рандомизированы 206 пациентов с COVID-19 ассоциированной пневмонией. Группы левилимаба и плацебо были сопоставимы по среднему возрасту (58,5 и 58,2 года, соответственно), хотя доля пациентов в возрасте ≥75 лет была достоверно выше в группе левилимаба (11,7% и 3,9%). Доля мужчин в двух группах составляла 56,3% и 49,5%, соответственно. В обеих группах практически все пациенты относились к категории 4 (58,3% и 61,2%, соответственно) или 3 (38,8% и 37,9%), т.е. получали увлажненный кислород или не нуждались в какой-либо респираторной поддержке. Доля пациентов, принимавших глюкокортикостероиды в обеих группах была очень низкой (4,9% и 8,7%, соответственно), так как исследование проводилось в начале пандемии, когда польза назначения препаратов этой группы вызывала сомнение. Увеличение содержания С-реактивного белка (СРБ), которое в настоящее время является одним из основных показаний к назначению ингибиторов ИЛ-6, не учитывалось при отборе пациентов в исследование CORONA, однако медиана этого показателя была высокой как в группе левилимаба, так и плацебо (39,8 и 46,0 мг/л, соответственно). При интерпретации результатов исследования необходимо учитывать тот факт, что 13 (12,6%) и 42 (40,8%) больным двух групп, соответственно, вводился левилимаб открытым методом в связи с ухудшением состояния в качестве “терапии спасения». Пациентов, получивших повторное введение левилимаба, считали не ответившими на терапию, а для оценки эффективности проводили анализ “non-responder imputation». Таким образом, значительная часть пациентов группы плацебо также получили инъекцию ингибитора ИЛ-6, что могло способствовать улучшению результатов терапии в контрольной группе и несколько нивелировать эффективность исследуемого препарата.
*p=0,0017, ** p<0,0001
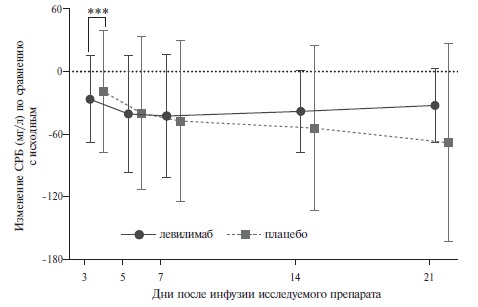
На 14-й день доля пациентов, состояние которых стабильно улучшилось (без дополнительных инъекций левилимаба открытым методом), в группе левилимаба достоверно превосходила таковую в группе плацебо (63,1% и 42,7%, соответственно; р=0,0017). Таким образом, исследование CORONA подтвердило преимущество ингибитора ИЛ-6 перед контролем по первичному критерию эффективности. Выявленные различия между группами сохранялись на 21-й и 28-й дни наблюдения (рис. 1). Эффективность левилимаба подтверждалась и трехкратным снижением потребности в дополнительном введении исследуемого препарата открытым методом, а также результатами анализа ряда вторичных показателей эффективности. Например, на 5-й день доля пациентов, не нуждавшихся в оксигенотерапии, в основной группе была значительно выше, чем в группе плацебо (41,8% и 26,2%, соответственно; р=0,0186), а на 30-й день в группе левилимаба было выявлено значительное увеличение доли выписанных пациентов (84,5% и 55,3%, p<0,0001). При этом частота перевода пациентов в ОРИТ в основной группе была достоверно ниже, чем в группе плацебо (2,9% и 9,7%, соответственно; р=0,0449). Летальность в обеих группах была низкой и достоверно не отличалась между ними (1,9% и 1,0%, соответственно). Лабораторные признаки воспаления, в частности СОЭ и уровень СРБ, постепенно уменьшились в обеих группах, однако после введения левилимаба их динамика была более быстрой (рис. 2). Лечение ингибитором ИЛ-6 было относительно безопасным, в частности системные/оппортунистические инфекции в обеих группах встречались в единичных случаях, а тяжелая нейтропения или реакции гиперчувствительности зарегистрированы не были.
*** достоверные различия
С.В. Моисеев. Таким образом, клиническое исследование CORONA подтвердило, что введение левилимаба в дополнение к стандартной терапии по эффективности превосходит плацебо и вызывает улучшение клинического состояния у части больных COVID-19 ассоциированной пневмонией. Благоприятный эффект препарата проявлялся в течение первой недели после его введения и сохранялся до конца 30-дневного периода наблюдения. Примером успешного применения левилимуба у пациента с тяжелым течением COVID-19 может служить следующее наблюдение.
В.Б. Надточеева. Пациентка С., 56 лет, страдающая сахарным диабетом 2 типа, госпитализирована в отделение для лечения больных коронавирусной инфекцией клиники им. Е.М. Тареева 2 июля 2021 г. на седьмой день болезни с подтвержденной SARS-CoV-2 инфекцией (в мазке из носа и ротоглотки выявлена РНК вируса методом полимеразной цепной реакции). Заболела остро: повышение температуры тела до 39,1оС, резкая слабость, аносмия, малопродуктивный кашель. Амбу латорно получала фавипиравир, апиксабан (в дозе 2,5 мг два раза в сутки) и парацетамол, однако лихорадка и другие симптомы заболевания сохранялись. На 6-й день болезни появилась нарастающая одышка, в связи с чем пациентка была доставлена в клинику машиной скорой помощи.
При поступлении состояние средней тяжести. Тем пе ратура тела 38,8оС. SpO2 в покое 91%. После незначительной физической нагрузки SpO2 снижалась до 86-88%. При компьютерной томографии в обоих легких определялись множественные участки уплотнения легочной ткани от степени “матового стекла» до консолидации, ретикулярные изменения, утолщение междолькового интерстиция по типу “булыжной мостовой» (высокая вероятность COVID-19; КТ-3 степени). В отделении проводилось введение увлажненного кислорода через носовые канюли (10-12 л/мин). Начата терапия дексаметазоном в дозе 20 мг/сут внутривенно капельно, продолжен прием апиксабана. На второй день госпитализации температура тела 38,5оС. В общем анализе крови лейкоцитоз (12100 в мл), снижение количества лимфоцитов (450 в мл) и повышение СОЭ (37 мм/ч). Кроме того, выявлено увеличение содержания СРБ (337 мг/л) и ферритина (949 мкг/л) и активности ЛДГ (707 ед/л).
Учитывая нарастание дыхательной недостаточности, наличие высокой воспалительной активности и неэффективность глюкокортикостероидов в высокой дозе, пациентке однократно введен левилимаб в дозе 324 мг подкожно. В течение суток температура тела нормализовалась, а содержание СРБ снизилось до 260 мг/л, ферритина до 846 мкг/л. В течение последующих 3-5 дней отмечено нарастание SpO2 до 96% на воздухе, увеличение толерантности к физическим нагрузкам, а также нормализация содержания СРБ (1,6 мг/л), снижение активности ЛДГ (365 ед/л), концентрации ферритина (336 мкг/л), числа лейкоцитов (9600 в мл) и увеличение количества лимфоцитов (1400 в мл). Через неделю выявлена положительная динамика при компьютерной томографии органов грудной клетки в виде уменьшения зон “матового стекла» (до КТ-2 степени) (рис. 3). Пациентка выписана через 10 дней.
С.В. Моисеев. У пациентов, включенных в исследование CORONA, летальность в группах сравнения оказалась низкой. Это не позволило изучить эффективность препарата в профилактике смерти пациентов с COVID-19 от прогрессирующего поражения легких. Что известно о влиянии других ингибиторов ИЛ-6 на риск неблагоприятных исходов SARS-CoV-2 инфекции?
М.Ю. Бровко. Первые случаи успешного применения тоцилизумаба у пациентов с тяжелым течением COVID-19 были описаны в начале пандемии и послужили основанием для проведения большого числа неконтролируемых и контролируемых исследований препаратов этой группы. Хотя польза назначения ингибиторов ИЛ-6 представлялась очевидной, тем не менее, результаты клинических исследований оказались противоречивыми. Нерандомизированные исследования в основном демонстрировали эффективность тоцилизумаба [4,5]. Например, в ретроспективном американском исследовании STOP-COVID эффективность тоцилизумаба изучали у 3924 пациентов с COVID-19, поступивших в ОРИТ (62,8% мужчин, медиана возраста 62 года) [6]. 433 (11,0%) из них получили тоцилизумаб в течение первых 2 дней после госпитализации в ОРИТ. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти на 29% по сравнению с контролем (отношение рисков 0,71, 95% ДИ 0,56-0,92). В то же время эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 ассоциированной пневмонии не была подтверждена в нескольких рандомизированных контролируемых исследованиях [7-9]. Так, в двойном слепом, рандомизированном, плацебоконтролируемом исследовании, проводившемся в США, эффективность тоцилизумаба изучали у 243 больных средне-тяжелой COVID-19 пневмонией (медиана возраста 59,8 лет) [9]. 84% из них получали оксигенотерапию. В течение 28 дней частота перевода на ИВЛ или смерти достоверно не отличалась между группами тоцилизумаба и плацебо (10,6% и 12,5%, соответственно). Лечение тоцилизумабом не привело также к уменьшению риска ухудшения состояния больных или сокращению длительности оксигенотерапии.
Тем не менее, опубликованы результаты нескольких крупных рандомизированных исследований, которые показали эффективность ингибиторов ИЛ-6 у пациентов с COVID-19 на основании анализа “твердых» конечных точек, таких как необходимость в ИВЛ и летальность. В исследовании EMPACTA у 389 рандомизированных госпитализированных больных с COVID-19 лечение тоцилизумабом привело к достоверному снижению риска интубации или смерти на 44% по сравнению с плацебо (отношение рисков 0,56; 95% ДИ 0,330,97) [10]. В исследовании REMAP-CAP у 803 больных с COVID-19, находившихся в ОРИТ в критическом состоянии, лечение тоцилизумабом или сарилумабом сопровождалось достоверным увеличением выживаемости в течение 90 дней по сравнению со стандартной терапией [11]. И, наконец, в самое крупное рандомизированное исследование RECOVERY, проводившееся в Великобритании, были включены 4116 пациентов с COVID-19 ассоциированной пневмонией, сопровождавшейся гипоксией и увеличением содержания СРБ ≥75 мг/л, которые получали тоцилизумаб (n=2022) или только стандартную терапию (n=2094) [12]. Частота применения глюкокортикостероидов составила в целом 82%, т.е. протокол стандартной терапии в этом исследовании соответствовал сложившейся к настоящему времени практике лечения госпитализированных пациентов с COVID-19. На момент рандомизации у 14% больных проводилась ИВЛ, у 41% – неинвазивная респираторная поддержка, включая высокопоточную оксигенотерапию и НИВЛ, а 45% пациентов нуждались только во введении кислорода. Во всей выборке лечение тоцилизумабом привело к достоверному снижению летальности пациентов на 15% (р=0,0028; рис. 4). Среди больных, которые исходно не нуждались в ИВЛ, в группе тоцилизумаба было выявлено достоверное снижение риска интубации или смерти на 16% по сравнению с контролем (p<0,0001). Результаты лечения были в целом сходными в различных выборках пациентов, выделенных в зависимости от демографических и клинических показателей (рис. 5), однако обращает на себя внимание достоверное снижение риска смерти при лечении тоцилизумабом на 21% у пациентов, получавших глюкокортикостероиды, и отсутствие подобного эффекта у больных, которым не проводилась терапия препаратами этой группы. Приведенные данные могут указывать на более высокую эффективность комбинированной терапии ингибиторами ИЛ-6 и глюкокортикостероидами, хотя протокол исследования RECOVERY не предполагал изучение этого вопроса.
С.В. Моисеев. Применение ингибиторов ИЛ-6, включая левилимаб, предусмотрено во временных методических рекомендациях по профилактике, диагностике и лечению новой коронаровирусной инфекции, которые постоянно обновляются Минздравом Российской Федерации на протяжении пандемии. В июне 2021 г. назначение тоцилизумаба для лечения COVID-19 было одобрено Американской администрацией по контролю за пищевыми продуктами и лекарствами (FDA) у взрослых пациентов и детей, получающих системные глюкокортикостероиды и нуждающихся в оксигенотерапии, НИВЛ, ИВЛ или ЭКМО. В каких случаях и когда следует применять левилимаб или другие ингибиторы ИЛ-6 у пациентов с COVID-19?
Л.А. Акулкина. В последнее время увеличилось количество пациентов с COVID-19, которые самостоятельно или по рекомендации врача начинают прием иммуносупрессивных препаратов, прежде всего глюкокортикостероидов, уже с первых дней инфекции. Подобная практика опасна, так как подавление иммунного ответа при продолжающейся репликации вируса может привести к прогрессированию заболевания. Данную гипотезу подтверждают результаты исследования RECOVERY, в котором изучались различные препараты, в том числе дексаметазон, у пациентов с COVID-19. В этом исследовании лечение дексаметазоном привело к достоверному снижению 28-дневной летальности (р<0,001) госпитализированных пациентов [13]. Благоприятный эффект препарата на выживаемость наблюдался у пациентов, находившихся на ИВЛ или получавших оксигенотерапию, но отсутствовал у больных, не нуждавшихся в респираторной поддержке, а также у пациентов, у которых симптомы инфекции сохранялись менее 7 дней. Таким образом, слишком раннее введение дексаметазона в этом исследовании не улучшало прогноз у пациентов с COVID-19. Это объясняется тем, что воспаление, в том числе вызванное увеличением выброса провоспалительных цитокинов, таких как ИЛ-1, ИЛ-6 и фактор некроза опухоли альфа, является нормальным ответом хозяина на вирусную инфекцию, который необходим для элиминации вируса. Однако у части больных, инфицированных SARS-CoV-2, вирус вызывает чрезмерный воспалительный ответ, который напоминает синдром выделения цитокинов, или “цитокиновый шторм», описанный при первичном и вторичном гемофагоцитарном лимфогистиоцитозе и синдроме активации макрофагов, а также при CAR-Tклеточной терапии онкологических заболеваний [14]. Следует отметить, что при тяжелом течении COVID-19 концентрации циркулирующих цитокинов могут быть значительно ниже, чем при “классическом» синдроме выделения цитокинов или остром респираторном дистресс синдроме другой этиологии [15]. Предложенные ранее критерии диагностики синдрома выделения цитокинов не вполне пригодны для диагностики этого состояния при COVID-19. Например, к числу критериев, включенных в HScore, отнесены двухили трехростковые цитопении (снижение содержания гемоглобина <9,2 г/дл, числа лейкоцитов ≤5000 в мл и/или тромбоцитов ≤110000 в мл) [16], которые при SARS-CoV-2 инфекции встречаются относительно редко [17,18], хотя лимфопения является одним из ключевых проявлений заболевания. Более того, при COVID-19 часто отмечается нейтрофильный лейкоцитоз, который ассоциировался с более тяжелым течением инфекции [19]. Соответственно, увеличение числа нейтрофилов при этом заболевании далеко не всегда является признаком присоединения бактериальной инфекции и основанием для назначения антибиотиков.
К настоящему времени различными группами авторов разработаны более специфичные для COVID-19 критерии диагностики синдрома выброса цитокинов, хотя общепринятые критерии по-прежнему отсутствуют. R. Caricchio и соавт. предложили использовать три группы критериев, отражающих (1) воспаление (увеличение содержания ферритина, СРБ, нейтрофилов) (2) гибель клеток и повреждение ткани (повышение активности печеночных аминотрансфераз, ЛДГ, D-димера, тропонина) и (3) преренальные электролитные нарушения (снижение анионного разрыва, увеличение содержания хлоридов, калия, креатинина) [20]. Использование указанных критериев позволило выделить пациентов с более тяжелым течением COVID-19, которое характеризовалось необходимостью в более длительной госпитализации и более высоким риском смерти. Кстати, увеличение абсолютного количества нейтрофилов более 11400 в мл авторы расценили как один из критериев диагностики синдрома выделения цитокинов при COVID-19.
B. Webb и соавт. при обследовании 299 госпитализированных пациентов с COVID-19 разработали шкалу cHIS, предназначенную для диагностики гипервоспалительного синдрома на основании анализа 6 критериев: лихорадка, активация макрофагов (гиперферритинемия), гематологические нарушения (увеличение отношения количества нейтрофилов и лимфоцитов), повреждение печени (активность ЛДГ или АСТ), коагулопатия (D-димер) и цитокинемия (СРБ, ИЛ-6 или триглицериды) [21]. Наличие по крайней мере двух из перечисленных критериев ассоциировалось с увеличением риска смерти или интубации.
На практике оценить целесообразность введения ингибиторов ИЛ-6 пациентам с COVID-19 часто несложно и без использования каких-либо шкал. Необходимость в назначении антицитокиновых препаратов обычно наблюдается на 6-9-й день болезни, если у пациента с КТ-признаками COVID-19 ассоциированной пневмонии сохраняется лихорадка и/или отмечается нарастание лабораторных признаков воспаления, в том числе содержания С-реактивного белка (до 100-400 мг/л и более), ферритина, фибриногена, ИЛ-6, а также D-димера, особенно в сочетании со снижением SpO2≤93%. Дополнительным доводом в пользу назначения ингибитора ИЛ-6 в подобных случаях может служить наличие факторов риска неблагоприятного течения COVID-19, таких как пожилой возраст, сахарный диабет, ожирение, ишемическая болезнь сердца [22,23].
В.Б. Надточеева. Показания к введению ингибиторов ИЛ-6 иллюстрирует приведенное выше наблюдение. У 56-летней пациентки в конце первой недели болезни выявлена COVID-19 ассоциированная пневмония (КТ3), сопровождавшаяся гипоксией (снижением SpO2 до 91% на воздухе), выраженной лимфопенией и высокой воспалительной активностью, в частности содержание СРБ увеличилось до 337 мг/л. Сохранение лихорадки после введения дексаметазона в дозе 20 мг/сут указывало на недостаточную эффективность глюкокортикостероида. На повышенный риск дальнейшего прогрессирования поражения легких при COVID-19 указывало наличие сахарного диабета 2 типа. Однократное подкожное введение левилимаба в дозе 324 мг уже в течение суток привело к нормализации температуры тела и улучшению состояния пациентки, а в течение последующих нескольких дней увеличилось SpO2, восстановилось количество лимфоцитов в крови и снизились лабораторные признаки воспаления. Умеренный лейкоцитоз мы расценивали как признак не бактериальной инфекции, а воспаления, поэтому лечение антибиотиками не проводилось. Снижение количества лейкоцитов на фоне противовоспалительной терапии подтверждало правильность выбранной тактики лечения.
С.В. Моисеев.. В настоящее время во всем мире для лечения COVID-19 широко применяют глюкокортикостероиды. Какова должна быть тактика назначения препаратов этой группы и ингибиторов ИЛ-6? С чего лучше начинать лечение?
В.И. Шоломова. В рандомизированных клинических исследованиях возможные варианты стратегии применения противовоспалительных препаратов у пациентов с COVID-19 не сравнивали. Данных о сравнительной эффективности глюкокортикостероидов и ингибиторов ИЛ-6 в профилактике неблагоприятных исходов заболевания также нет. Тем не менее, не вызывает сомнения, что глюкокортикостероиды обладают широким спектром противовоспалительной активности и дают необходимый эффект у значительной части пациентов с признаками синдрома выделения цитокинов. Глюкокортикостероиды подавляют экспрессию различных провоспалительных цитокинов и повышают выделение цитокинов, обладающих противовоспалительной активностью [24], поэтому их также можно считать антицитокиновыми препаратами, как и генно-инженерные биологические препараты или ингибиторы янускиназ. Основным недостатком глюкокортикостероидов являются различные побочные эффекты, однако они чаще встречаются при длительном лечении препаратами этой группы и не представляют особой проблемы при кратковременном применении глюкокортикостероидов, особенно в небольших дозах, у пациентов с COVID-19. Лечение дексаметазоном или другими глюкокортикостероидами может привести к декомпенсации сахарного диабета, однако гликемический профиль обычно улучшается после снижения дозы или отмены этих препаратов. Соответственно, с этих препаратов обычно и начинают лечение. Кстати, в исследовании RECOVERY, в котором изучался тоцилизумаб, практически все пациенты на момент рандомизации уже получали дексаметазон или другие глюкокортикостероиды. Введение ингибитора ИЛ-6 необходимо при отсутствии быстрого ответа на введение глюкокортикостероида и, тем более, при продолжающемся нарастании воспалительного ответа и/или появлении признаков гипоксии. У пациентов со сниженной SpO2, а также у больных, относящихся к группе риска, как в нашем наблюдении, лучше не ждать ответа на глюкокортикостероиды, а одновременно с ними сразу вводить ингибитор ИЛ-6.
М.Ю. Бровко. Если исходить из концепции “цитокинового шторма» как основы прогрессирования COVID19, то блокада действия различных цитокинов выглядит оправданной, хотя эффективность такого подхода в контролируемых исследованиях не изучалась и, соответственно, не доказана. При ревматических заболеваниях, таких как ревматоидный артрит, опыта комбинированной терапии различными генно-инженерными биологическими препаратами и/или ингибиторами янус-киназ также нет. Речь, конечно, не идет о глюкокортикостероидах, которые, как указано выше, сегодня являются компонентом терапии у большинства госпитализированных пациентов со средне-тяжелым и тяжелым течением COVID-19. Иногда комбинированная терапия является вынужденной мерой, например, в случае ухудшения состояния пациента, не ответившего на пероральный прием ингибитора янус-киназ, необходимо вводить ингибитор ИЛ-6. Различия механизмов действия ингибиторов ИЛ-6, по-видимому, не имеют большого значения, поэтому комбинированное применение разных препаратов этой группы, вряд ли, приведет к усилению эффекта по сравнению с таковым при введении одного и того же препарата. В исследовании CORONA, как и в других исследованиях ингибиторов ИЛ-6, допускалось повторное введение левилимаба открытым методом в случае отсутствия ответа на первую инъекцию исследуемого препарата двойным слепым методом. Как указано выше, доля пациентов, которым потребовалось повторное введение левилимаба, в основной группе составила около 12% и была в 3 раза меньше, чем в группе плацебо. Таким образом, почти в 90% случаев исследователи были удовлетворены результатами однократного введения ингибитора ИЛ-6. Конечно, этот показатель в достаточной мере условный и может существенно отличаться в разных выборках, так как результаты лечения любыми противовоспалительными препаратами в значительной степени зависят от тяжести течения COVID-19.
С.В. Моисеев. Необходимо ли измерять содержание ИЛ-6 при оценке показаний к введению ингибиторов этого цитокина?
М.Ю. Бровко. ИЛ-6 – это один из основных медиаторов воспаления. По данным нескольких мета-анализов, повышение концентрации этого цитокина ассоциировалось с более тяжелым течением и неблагоприятными исходами COVID-19, такими как госпитализация в ОРИТ и смерть [25-27]. Например, в одном из таких исследований у пациентов с осложненным течением COVID-19 содержание ИЛ-6 было почти в 3 раза выше, чем у больных с неосложненными формами заболевания [25]. По нашему опыту, увеличение содержания ИЛ-6 может предшествовать росту других лабораторных признаков воспаления, таких как СРБ, но на короткое время. Однако возможность планового определения концентрации ИЛ-6 имеется не во всех лечебных учреждениях, особенно при наличии большого потока пациентов с COVID-19. Да и измерение содержания этого цитокина не является обязательным, так как оценить необходимость во введении ингибиторов ИЛ-6 можно на основании клинической картины и изменений более доступных лабораторных маркеров, таких как СРБ и количество лимфоцитов в периферической крови. Как и другие лабораторные показатели, уровень ИЛ-6 является неспецифичным и повышается при воспалении любой природы, т.е. он не позволяет дифференцировать синдром выделения цитокинов при COVID-19 от бактериальной инфекции. Измерение содержания ИЛ-6 после введения левилимаба не имеет смысла, так как этот препарат блокирует рецепторы цитокина и не влияет на его содержание, которое обычно остается повышенным несмотря на положительную динамику других маркеров воспаления, в частности содержания СРБ или ферритина.
С.В. Моисеев. Тоцилизумаб выпускается в виде двух лекарственных форм – для внутривенного и подкожного введения, в то время как все остальные ингибиторы ИЛ-6 предназначены только для подкожного применения. Имеет ли значение путь введения этих препаратов при COVID-19?
П.И. Новиков. Однозначно ответить на этот вопрос сложно. С одной стороны, среди ингибиторов ИЛ-6 у пациентов с COVID-19 лучше всего изучен тоцилизумаб внутривенно, который применялся в большинстве рандомизированных и нерандомизированных клинических исследований. С другой стороны, всем больным с COVID-19, нуждающимся в ингибиторах ИЛ-6, вводить тоцилизумаб внутривенно нереально, учитывая дефицит этого препарата, который неизбежно усиливается во время подъемов заболеваемости, когда число госпитализированных пациентов быстро увеличивается. К настоящему времени накоплен опыт внутривенного введения подкожных форм ингибиторов ИЛ-6, хотя мы в своей практике чаще вводили их в соответствии с инструкцией по применению. В рандомизированных контролируемых исследованиях эффективность внутривенного и подкожного введения тоцилизумаба не сравнивали, а результаты нерандомизированных исследований оказались противоречивыми [4,28]. С.С. Боб кова и соавт. сопоставили результаты внутривенного (n=114) и подкожного (n=86) введения тоцилизумаба и подкожного применения левилимаба (n=100) и олокизумаба (n=100) у 400 пациентов с COVID-19 [29]. Все изученные ингибиторы ИЛ-6 вызывали сопоставимое снижение содержания СРБ через 24 ч после введения, а достоверных различий летальности между группами не выявили. Таким образом, в этом исследовании тоцилизумаб не имел преимуществ перед ингибиторами ИЛ-6 для подкожного применения. Доводом в пользу возможности подкожного введения левилимаба служат и результаты рандомизированного исследования CORONA, которое подтвердило преимущество препарата перед плацебо у пациентов с COVID-19. При выборе пути введения необходимо учитывать состояние больного. В более тяжелых случаях, особенно при быстром нарастании гипоксии, вероятно, имеет смысл отдать предпочтение внутривенному введению.
С.В. Моисеев. Тактика медикаментозного лечения средне-тяжелых и тяжелых форм COVID-19 по-прежнему вызывает много вопросов, однако все же в этом направлении удалось достичь существенного прогресса, который прежде всего связан с применением глюкокортикостероидов и ингибиторов ИЛ-6. Потребность в последних в российских лечебных учреждениях остается высокой, поэтому расширение арсенала ингибиторов ИЛ-6 благодаря появлению левилимаба, разработанного российской фармацевтической компанией, имеет очень важное значение. Необходимо подчеркнуть, что эффективность левилимаба в лечении COVID-19 была установлена в рандомизированном, плацебо-контролируемом исследовании, в то время как многие лекарственные средства, которые в свое время использовали или пытались использовать при SARS-CoV-2 инфекции (гидроксихлорохин, лопинавир/ритонавир и др.), не выдержали этого испытания.
Используемые источники
- Nogrady B. Mounting evidence suggests Sputnik COVID vaccine is safe andeffective. Nature 2021 Jul 6. doi: 10.1038/d41586-021-01813-2. Epub ahead of print. PMID: 34230663.
- Руженцова Т.А., Чухляев П.В., Хавкина Д.А. и др.. Эффективность и безопасность применения фавипиравира в комплексной терапии COVID-19 легкого и среднетяжелого течения. Инфекционные болезни: новости, мнения, обучение 2020;9(4):26-38 [Ruzhentsova TA, Chukhlyaev PV, Khavkina DA, et al. Efficacy and safety of favipiravir in a complex therapy of mild to moderate COVID-19. Infektsionnye bolezni: novosti, mneniya, obuchenie 2020;9(4): 26-38 (In Russ.)].
- Clinicaltriles.gov: https://clinicaltrials.gov/ct2/show/NCT04397562?term=levilimab&draw=2&rank=1.
- Guaraldi G, Meschiari M, Cozzi-Lepri A, et al. Tocilizumab in patients with severe COVID-19: a retrospective cohort study. Lancet Rheumatol 2020;2:e474–8.
- Menzella F, Fontana M, Salvarani C, et al. Efficacy of tocilizumab in patients with COVID-19 ARDS undergoing noninvasive ventilation. Crit Care
2020;24:589. - Gupta S, Wang W, Hayek SS, et al. Association between early treatment with tocilizumab and mortality among critically ill patients with COVID-19. JAMA Intern Med 2021;181(1):41-51.
- Salvarani C, Dolci G, Massari M, et al; for the RCT-TCZ-COVID-19 Study Group. Effect of tocilizumab vs standard of care on clinical worsening in patients hospitalized with COVID-19 pneumonia: a randomized clinical trial. JAMA Intern Med 2021;181(1):24-31
- Hermine O, Mariette X, Tharaux P-L, et al; for the CORIMUNO-19 Collaborative Group. Effect of tocilizumab vs usual care in adults hospitalized
with COVID-19 and moderate or severe pneumonia: a randomized clinical trial. JAMA Intern Med; 2021;181(1):32-40. - Stone JH, Frigault MJ, Serling-Boyd NJ, et al. Efficacy of tocilizumab in patients hospitalized with Covid-19. N Engl J Med 2020;10.1056/NEJMoa2028836. doi:10.1056/NEJMoa2028836.
- Salama C, Han J, Yau L, et al. Tocilizumab in patients hospitalized with Covid19 pneumonia. N Engl J Med 2021;384(1):20-30.
- REMAP-CAP Investigators, Gordon AC, Mouncey PR, Al-Beidh F, et al. Interleukin-6 receptor antagonists in critically ill patients with Covid-19. N Engl J Med. 2021;384(16):1491-502.
- RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet. 2021;397(10285):1637-45.
- RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med 2021; 384(8):693-704.
- Fajgenbaum DC, June CH. Cytokine Storm. N Engl J Med 2020;383(23):2255- 73.
- Sinha P, Matthay MA, Calfee CS. Is a “cytokine storm” relevant to COVID-19? JAMA Intern Med 2020;383(23):2255-73.
- Fardet L, Galicier L, Lambotte O. Development and validation of the HScore, a score for the diagnosis of reactive hemophagocytic syndrome. Arthritis Rheumatol 2014;66:2613–2620.
- Agbuduwe C, Basu S. Haematological manifestations of COVID-19: From cytopenia to coagulopathy. Eur J Haematol 2020;105(5):540-6.
- Cheung CKM, Law MF, Lui GCY, Wong SH, Wong RSM. Coronavirus Disease 2019 (COVID-19): A haematologist’s perspective. Acta Haematol 2021;144(1):10-23.
- Huang G, Kovalic AJ, Graber CJ. Prognostic value of leukocytosis and lymphopenia for Coronavirus Disease severity. Emerg Infect Dis 2020;26(8):1839-41.
- Caricchio R, Gallucci M, Dass C, et al. Preliminary predictive criteria for COVID-19 cytokine storm. Ann Rheum Dis 2021; 80(1):88-95.
- Webb BJ, Peltan ID, Jensen P, et al. Clinical criteria for COVID-19-associated hyperinflammatory syndrome: a cohort study. Lancet Rheumatol 2020;2:e754–6.
- Глыбочко П.В., Фомин В.В., Авдеев С.Н. и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке. Клин фармакол тер 2020;29(2):21-9 [Glybochko P, Fomin V, Avdeev S, et al. Clinical characteristics of 1007 intensive care unit patients with SARS-CoV-2 pneumonia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(2):21-9 (In Russ.)].
- Глыбочко П.В., Фомин В.В., Моисеев С.В. и др. Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии. Клин фармаколтер 2020;29(3):25-36 [Glybochko P, Fomin V, Moiseev S, et al. Clinical outcomes of patients with COVID-19 admitted for respiratory support to the intensive care units in Russia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020; 29(3):25-36 (In Russ.)].
- Hardy RS, Raza K, Cooper MS. Therapeutic glucocorticoids: mechanisms of actions in rheumatic diseases. Nature Rev Rheumatol 2020;16(3):133-44.
- Coomes EA, Haghbayan H. Interleukin-6 in Covid-19: A systematic review and meta-analysis. Rev Med Virol 2020;30(6):1-9.
- Zhu J, Pang J, Ji P, et al. Elevated interleukin-6 is associated with severity of COVID-19: a meta-analysis. J Med Virol 2021;93(1):35-7.
- Aziz M, Fatima R, Assaly R. Elevated interleukin-6 and severe COVID-19: A meta-analysis. J Med Virol 2020;92(11):2283-5.
- Kaminski MA, Sunny S, Balabayova K, et al. Tocilizumab therapy for COVID19: A comparison of subcutaneous and intravenous therapies. Int J Infect Dis. 2020;101:59-64.
- Бобкова С.С., Жуков А.А., Проценко Д.Н. и др. Сравнительная эффективность и безопасность применения препаратов моноклональных антител к ИЛ-6 у пациентов с новой коронавирусной инфекцией COVID-19 тяжелого течения. Ретроспективное когортное исследование. Вестник интенсивной терапии им. А.И. Салтанова 2021;1:69–76 [Bobkova SS, Zhukov AA, Protsenko DN, et al. Comparative study of monoclonal anti-IL6 antibodies in severe new coronavirus disease COVID-19 patients. Annals of Critical Care 2021;1:69–76 (In Russ.)].
Версия на английском языке