«Heart bypass» redirects here. For the technique to take over the function of the heart and lungs during surgery, see Cardiopulmonary bypass.
| Coronary artery bypass surgery | |
|---|---|

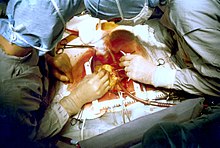
Early in a coronary artery bypass operation, during vein harvesting from the legs (left of image) and the establishment of cardiopulmonary bypass by placement of an aortic cannula (bottom of image). The perfusionist and heart-lung machine are on the upper right. The patient’s head (not seen) is at the bottom. |
|
| Other names | Coronary artery bypass graft |
| ICD-10-PCS | 021209W |
| ICD-9-CM | 36.1 |
| MeSH | D001026 |
| MedlinePlus | 002946 |
|
[edit on Wikidata] |
Coronary artery bypass surgery, also known as coronary artery bypass graft (CABG, pronounced «cabbage»), is a surgical procedure to treat coronary artery disease (CAD), the buildup of plaques in the arteries of the heart. It can relieve chest pain caused by CAD, slow the progression of CAD, and increase life expectancy. It aims to bypass narrowings in heart arteries by using arteries or veins harvested from other parts of the body, thus restoring adequate blood supply to the previously ischemic (deprived of blood) heart.
There are two main approaches. The first uses a cardiopulmonary bypass machine, a machine which takes over the functions of the heart and lungs during surgery by circulating blood and oxygen. With the heart in arrest, harvested arteries and veins are used to connect across problematic regions—a construction known as surgical anastomosis. In the second approach, called the off-pump coronary artery bypass graft (OPCABG), these anastomoses are constructed while the heart is still beating. The anastomosis supplying the left anterior descending branch is the most significant one and usually, the left internal mammary artery is harvested for use. Other commonly employed sources are the right internal mammary artery, the radial artery, and the great saphenous vein.
Effective ways to treat chest pain (specifically, angina, a common symptom of CAD) have been sought since the beginning of the 20th century. In the 1960s, CABG was introduced in its modern form and has since become the main treatment for significant CAD. Significant complications of the operation include bleeding, heart problems (heart attack, arrhythmias), stroke, infections (often pneumonia) and injury to the kidneys.
Uses[edit]
Coronary artery bypass surgery aims to prevent death from coronary artery disease and improve quality of life by relieving angina, the associated feeling of chest pain.[1] The decision to perform surgery is informed by studies of CABG’s efficacy in different patient subgroups, based on the lesions’ anatomy or how well the heart is functioning. These results are compared with that of other strategies, most importantly percutaneous coronary intervention (PCI).[2][3]
Coronary artery disease[edit]
Coronary artery disease is caused when coronary arteries of the heart accumulate atheromatous plaques, causing stenosis (narrowing) in one or more arteries and risking myocardial infarction, the interruption of blood supply to the heart. CAD can occur in any of the major vessels of coronary circulation: the left main stem, left ascending artery, circumflex artery, and right coronary artery, and branches thereof. CAD symptoms vary from none, to chest pain only when exercising (stable angina), to chest pain even at rest (unstable angina). It can even manifest as a myocardial infarction; if blood flow to the heart is not restored within a few hours, whether spontaneously or by medical intervention, the blood-deprived part of the heart becomes necrotic (dies) and is scarred. It may lead to other complications such as arrhythmias, rupture of the papillary muscles of the heart, or sudden death.[4]
There are various methods of detecting and assessing CAD. Apart from history and clinical examination, noninvasive methods include electrocardiography (ECG) at rest or during exercise, and X-ray of the chest. Echocardiography can quantify heart functioning by measuring, for example, enlargement of the left ventricle, the ejection fraction, and the situation of the heart valves. The most accurate ways to detect CAD are the coronary angiogram and the coronary CT angiography.[4] An angiogram can provide detailed anatomy of coronary circulation and lesions. The significance of each lesion is determined by the diameter loss. A diameter loss of 50% translates to a 75% cross-sectional area loss, considered moderate by most groups. Severe stenosis constitutes a diameter loss of 2/3 or more—a greater-than-90% loss of cross-sectional area.[5] To more accurately determine the severity of stenosis, interventional cardiologists may also employ intravascular ultrasound, which can determine the severity and provide information on the composition of the atheromatous plaque. With the technique of fractional flow reserve, the pressure after the stenosis is compared to mean aortic pressure. If the ratio is less than 0.80, then the stenosis is deemed significant.[5]
Indications for CABG[edit]
Stable patients[edit]
People with angina during exercise are usually first treated with medical therapy. Noninvasive tests help estimate which patients might benefit from undergoing coronary angiography. Generally, if portions of cardiac wall are receiving less blood than normal, coronary angiography is indicated; then, lesions are identified and inform a decision to undergo PCI or CABG.[6]
CABG is generally preferred over PCI when there is a significant burden of plaque on the coronary arteries, that is extensive and complex, due to survival benefit. Other indicators that a patient will benefit more from CABG rather than PCI include: decreased left-ventricle function; left main disease; diabetes; and complex triple system disease (including LAD, Cx and RCA), especially when the lesion in the LAD is at its proximal part.[2][3]
Acute coronary syndrome[edit]
During an acute heart event, known as acute coronary syndrome, it is paramount to quickly restore blood flow to heart tissue. Typically, patients arrive at the hospital with chest pain. They are first treated with drugs, particularly the strongest drugs that prevent clots within vessels (dual anti-platelet therapy: aspirin and clopidogrel). Patients at risk of ongoing ischemia undergo PCI to restore blood flow and thus oxygen delivery to the struggling heart.[7] If PCI failed to restore blood flow because of anatomical considerations or other technical problems, urgent CABG is indicated to save heart tissue. The timing of the operation plays a role in survival: It is preferable to delay the surgery if possible (three days if the infarction affecting the total thickness of the cardiac muscle, and six hours if it does not).[2]
CABG is also indicated when there are mechanical complications of an infarction (ventricular septal defect, papillary muscle rupture or myocardial rupture).[8] There are no absolute contraindications of CABG, but severe disease of other organs such as the liver or brain, limited life expectancy, and patient fragility are considered.[8]
Other cardiac surgery[edit]
CABG is also performed when a patient is to undergo another cardiac surgical procedure, most commonly for valve disease, and angiography reveals a significant lesion of the coronary arteries.[9] CABG can also address dissection of coronary arteries, where a rupture of the coronary layers creates a pseudo-lumen (cavity) and diminishes blood delivery to the heart. Such a dissection may be caused by pregnancy, tissue diseases like Enhler–Danlos syndromes and Marfan syndrome, cocaine abuse, or PCI. A coronary aneurysm may also indicate CABG: A blood clot might develop within the vessel and travel downstream.[10]
CABG versus PCI[edit]
CABG and percutaneous coronary intervention (PCI) are the two methods to restore blood flow caused by stenotic lesions of the coronary arteries. The choice of method is still a matter of debate, but it is clear that in the presence of complex lesions, significant left main disease, or diabetes, CABG yields better long-term survival and outcomes.[11][10] Strong indications for CABG also include symptomatic patients and impaired left ventricle function.[10] CABG offers better results than PCI in left main disease and in CAD that affects multiple vessels, because of the protection arterial conduits offer to the native arteries of the heart, by producing vasodilator factors and preventing the advancement of plaques. Studies published in 2023 show that CABG in patients with left main disease is associated with lower mortality and fewer adverse events compared to PCI.[12][13]
Patients with unprotected left main disease—when the runoff of the left main artery is not protected by a patent graft since a previous CABG operation—have been studied as a group. A 2016 European study found that in these patients, CABG outperforms PCI in the long run (5 years). Another 2016 study found that PCI has similar results to CABG at 3 years, but that CABG becomes better than PCI after 4 years.[14][15]
A 2012 trial and followup in diabetic patients demonstrated a significant advantage to CABG over PCI. The relative advantage remained evident at 3.8-year and 7.5-year follow ups, which found particular benefits in smokers and younger patients.[16] A 2015 trial compared CABG and the latest technological advancement of PCI, second-generation drug-eluting stents in multivessel disease. Their results indicated that CABG is a better option for CAD patients.[17] A trial published in 2021, comparing results after one year, also concluded that CABG is a safer option than PCI.[18] A large study published in 2023 showed that PCI patients had higher mortality than CABG patients with left main coronary artery disease.[19]
Procedure[edit]
Preoperative examination and strategy[edit]
Routine preoperative examination aims to check the status of systems and organs besides the heart. The examination typically includes a chest X-ray to check the lungs, a complete blood count, and kidney and liver function tests. Physical examination to determine the quality of the grafts or the safety of removing them, such as varicosities in the legs, or the Allen test in the arm is performed to be sure that blood supply to the arm will not be critically disturbed.[20]
A patient taking anticoagulants—aspirin, clopidogrel, ticagrelol and others—will stop taking them several days before, to prevent excessive bleeding during and after the operation. Warfarin is also stopped for the same reason and the patient starts taking heparin products after the INR falls below 2.0.[20][21]
After the angiogram is reviewed by the surgical team, targets are selected (that is, which native arteries will be bypassed and where the anastomosis should be placed). Ideally, all major lesions in significant vessels should be addressed. Most commonly, the left internal thoracic artery (LITA; formerly, left internal mammary artery, LIMA) is anastomosed to the left anterior descending artery (LAD) because the LAD is the most significant artery of the heart and supplies blood to a larger portion of myocardium than other arteries.[21]
A conduit can be used to graft one or more native arteries. In the latter case, an end-to-side anastomosis is performed. In the former, using a sequential anastomosis, a graft can then deliver blood to two or more native vessels of the heart.[21] Also, the proximal part of a conduit can be anastomosed to the side of another conduit. It is preferred not to harvest too much conduit because it might necessitate re-operation.[21]
With cardiopulmonary bypass machine (on-pump)[edit]
The intubated patient is brought to the operating theater. Lines (e.g., peripheral IV cannulae, central lines such as internal jugular cannulae) are inserted for drug administration and monitoring. A description of a traditional CABG follows.
- Harvesting
An incision in the sternum is made while conduits are being harvested, either from the arm or the leg. The LITA is harvested through the sternotomy. There are two common ways of mobilizing the LITA: the pedicle (i.e., a pedicle consisting of the artery plus surrounding fat and veins) and the skeletonized (i.e., freed of other tissues). Before the LITA is divided in its more distal part, the anticoagulant heparin is administered to the patient via a peripheral line, to prevent clots.[21]
- Catheterization and establishment of cardiopulmonary bypass
After harvesting, the pericardium—the sac that surrounds the heart—is opened and stay sutures are placed to keep it open. Purse string sutures are placed in the aorta to prepare the insertions of the cannula into the aorta, and a catheter which temporarily arrests the heart using a solution high in potassium. Another purse string is placed in the right atrium for the venous cannula. Once the cannulas and the catheter are placed, cardiopulmonary bypass (CBP) is commenced. Deoxygenated blood arriving to the heart from veins is forwarded to the CBP machine to get oxygenated, then delivered to the aorta to keep the rest of the body saturated. The blood is often cooled to 32–34 °C (90–93 °F) to slow metabolism and minimize the demand for oxygen. A clamp is placed on the aorta between the cardioplegic catheter and aortic cannula, so that the flow of cardioplegic solution may be controlled by adjusting the clamp. Within minutes, the heart stops beating.[21][22]
- Anastomosis (grafting)
With the heart still, the tip of the heart is taken out of pericardium so that native arteries lying on the posterior side of the heart are accessible. Usually, distal anastomoses are constructed first (first to the right coronary system, then to the circumflex) and then the sequential anastomosis if necessary. Surgeons check the anastomosis for patency (whether it is sufficiently open) or leaking. They then insert the graft within the pericardium, sometimes attached to the cardioplegic catheter. The anastomosis of the LIMA to the LAD is usually the last distal anastomosis to be constructed; while it is being constructed the blood rewarming process starts (by the CPB).[21] After the anastomosis is completed and checked for leaks, the proximal anastomoses of the conduits, if any, are next. They can be done either with the clamp still on, or after removing the aortic clamp and isolating a small segment of the aorta by placing a partial clamp. That said, aortas burdened by plaques might be damaged or release atheromatous debris by being overhandled.[21][23]
- Weaning from cardiopulmonary bypass and closure
After the proximal anastomoses are done, the clamp is removed and the aorta and conduits de-aired. Pacing wires, which supply a current to assist the heartbeat, might be placed. If the heart and other systems are functioning, CBP is discontinued and cannulae are removed. Protamine is administered to reverse the effect of the anticoagulant heparin. After possible bleeding sites are checked, chest tubes are placed and the sternum is closed.[21][23]
Off-pump (OPCABG)[edit]
Off-pump coronary artery bypass graft (OPCABG) surgery avoids using the CPB machine by stabilizing small segments of the heart at a time. The surgical team and anesthesiologists must coordinate and take great care to not manipulate the heart too much, lest they compromise the stability of blood flow. Compromise should be detected immediately and appropriate action taken.
Keeping a healthy heartbeat may involve maneuvers like placing atrial wires to protect from bradycardia, or by placing stitches or incisions into the pericardium to help exposure. Snares and tapes are used to facilitate exposure. The aim is to avoid distal ischemia caused by blockage of the vessel supplying distal portions of the left ventricle, so usually LITA to LAD is the first to be anastomosed and others follow. For the anastomosis, a fine tube blowing humidified CO2 keeps the surgical field clean of blood. Also, a shunt might be used so the blood can travel past the site of anastomosis. After the distal anastomoses are completed, proximal anastomoses to the aorta are constructed with a partially closed aortic clamp. The rest of the process is similar to on-pump CABG.[24]
Alternative approaches and special situations[edit]
When CABG is performed as an emergency because of a myocardial infarction, the highest priority is to salvage the struggling myocardium. Before operation, an intra-aortic balloon pump (IABP) might be inserted to relieve some of the burden of pumping blood, effectively reducing the amount of oxygen needed by myocardium. During operation, the standard practice is to place the patient on CPB as soon as possible and revascularize the heart with three saphenous veins. A calcified aorta also poses a problem because it is very dangerous to clamp. In this case, the operation can be done as an off-pump CAB using both inferior mesenteric arteries (IMA) or Y, T and sequential grafts. Deep arrest may be induced with hypothermia, lowering the temperature of the body to slightly above 20 °C (68 °F).[25] In cases where a significant artery is totally blocked, it may be possible to remove the plaque and use the same hole in the artery to perform an anastomosis.·This technique is called endarterectomy and is usually performed at the right coronary system.[26]
Re-operations of CABG (another CABG operation after a previous one) pose difficulties. The heart may be positioned too close to the sternum and thus at risk when cutting the sternum again, so an oscillating saw is used. The heart may be covered with strong adhesions to adjusting structures. Doctors must decide whether aging grafts should be replaced. Manipulation of vein grafts is avoided because it risks dislodgement of plaque.[27]
The technique of «minimally invasive revascularization» (commonly, «MIDCAB»: minimally invasive direct coronary artery bypass) strives to avoid a large incision in the sternum. It utilizes off-pump techniques to place a graft, usually of the LIMA at the LAD. The LIMA is freed through an incision between the left ribs (thoractomy), or even using an endoscope placed in the left chest.[28] Robot-assisted coronary revascularization, which is not yet widely used, avoids the sternum incision to prevent infections and bleeding. Both conduit harvesting and the anastomosis are performed with the aid of a robot, through a thoracotomy. Usually, the procedure is combined with hybrid coronary revascularization, in which methods of CABG and PCI are both employed. Anastomosis of the LIMA to the LAD is performed in the operating theater and other lesions are treated with PCI—either at the operating room immediately following the anastomosis, or several days later.[29]
-
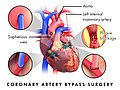
Coronary artery bypass graft
-
Coronary artery bypass graft, single bypass
-
Coronary artery bypass graft, double bypass.
-
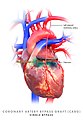
Coronary artery bypass graft, triple bypass
-
Coronary artery bypass graft, quadruple bypass
Post-operative care[edit]
After the procedure, the patient is usually transferred to the intensive care unit (ICU), where intubations are removed if not already done in the operating theater. They usually exit the ICU by the following day, and four days later, if no complications occur, the patient is discharged from the hospital.[30]
A series of drugs are commonly used in early post-operative care. Dobutamine, a beta agent, can increase the cardiac output and is administered some hours after the operation. Beta blockers are used to prevent atrial fibrillation and other supraventricular arrhythmias. Pacing wires attached to both atria, inserted during the operation, may help prevent atrial fibrillation. Aspirin (80 mg) is used to prevent graft failure.[30] Angiotensin-converting enzyme (ACE) inhibitors and angiotensin receptor blockers (ARBs) are used to control blood pressure, especially in patients with low cardiac function (<40%). Amlodipine, a calcium channel blocker, is used for patients whose radial artery was used as a graft.[2]
After the discharge, patients may experience insomnia, low appetite, decreased sex drive, and memory problems. This effect is usually transient and lasts 6 to 8 weeks.[30] A tailored exercise plan is usually beneficial.[30]
Results[edit]
CABG is the best procedure to reduce mortality from severe CAD and improve quality of life.[31] Operative mortality strongly relates to the patient’s age. According to a study by Eagle et al., patients 50–59 years old have an operative mortality rate of 1.8%, while patients older than 80 have a rate of 8.3%.[32] Other factors that increase mortality are being female, re-operation, dysfunction of the left ventricle, and left main disease.[32] CABG usually relieves angina, but in some patients it reoccurs. Around 60% of patients will be angina-free 10 years after their operation.[32] Myocardial infarction is rare five years after a CABG, but its risk increases with time.[33] The risk of sudden death for CABG patients is low.[33] Quality of life is also high for at least five years, then can slowly start to decline.[34] However, the use of bilateral mammary artery in patients of younger age and those without specific comorbidities (diabetes, obesity, steroid use) can provide excellent long-term survival and quality of life. [35]
The beneficial effects of CABG are clear at the cardiac level. Left-ventricle function is improved and malfunctioning segments of the heart—dyskinetic (moving inefficiently) or even akinetic (not moving)—can show signs of improvement. Both systolic and diastolic functions are improved and keep improving for up to five years in some cases.[36] Left-ventricle function and myocardial perfusion during exercise also improves after CABG. When the left ventricle is severely impaired before operation (ejection fraction below 30%), however, benefits are less impressive in terms of segmental wall movement but still significant because other parameters might improve as LV function improves; the pulmonary hypertension might be relieved and lengthen survival.[36][37]
Determining the total risk of the procedure is difficult because of the diversity of patients undergoing CABG; different subgroups have different risk, but younger patients see better results than older ones. A CABG using two, rather than one, internal mammary arteries (IMAs) may offer greater protection from CAD, but results are not yet conclusive.[32][38]
Grafts[edit]
Conduits that can be used for CABG may be arteries or veins. Arteries have a superior long-term patency (expandedness), but veins are more commonly used due to their practicality.[39]
Arterial grafts originate from the part of the internal thoracic artery (ITA) that runs near the edge of sternum, and can easily be mobilized and anastomosed to the native target vessel of the heart. The left artery is most often used because it is closer to the heart, but the right artery is sometimes used, depending on patient and surgeon preferences. The ITAs are advantageous because of their endothelial cells, which produce endothelium-derived relaxing factor and prostacyclin, protecting the artery from atherosclerosis and thus stenosis or occlusion. Disadvantages include a high rate of complications, such as deep sternal wound infections, in some subgroups of patients—mainly obese and diabetic ones. The left radial artery and left gastroepiploic artery can be also used. Long-term patency is influenced by the type of artery used and intrinsic factors of the cardiac arterial circulation.[40]
Veins used are mostly great saphenous veins and, in some cases, the lesser saphenous vein. Their patency rate is lower than that of arteries. Aspirin protects grafts from occlusion; adding clopidogrel does not improve rates.[40]
Compared to PCI[edit]
CABG and PCI are the two methods to revascularize stenotic lesions of the cardiac arteries. The preferences for each patient is still a matter of debate but in the presence of complex lesions and significant Left Main Disease, and in diabetic patients, CABG seems to offer better results in patients than PCI.[11][10] Strong indications for CABG also include symptomatic patients and those with impaired LV function.[10]
Complications[edit]
The most common complications of CABG are postoperative bleeding, heart failure, atrial fibrillation (a form of arrhythmia), stroke, kidney dysfunction, and infection of the wound near the sternum.[37]
Postoperative bleeding occurs in 2–5% of cases and may require returning to the operating room;[41] the most common indicator is the amount of blood being drained by chest tubes, which are inserted during the operation to drain fluid or air from the chest. Bleeding may originate from the aorta, the anastomosis, an insufficiently sealed branch of the conduit, or from the sternum. Other causes include platelet abnormalities or their failure to clot—perhaps due to the bypass or to the rebound heparin effect, which occurs when the anti-coagulant heparin is administered at the beginning of surgery and reappears in the blood after its neutralization by protamine.[42]
Low cardiac output syndrome (LCOS) can occur in up to 14% of CABG patients. According to its severity, LCOS is treated with inotropes, an intra-aortic balloon pump (IABP), optimization of pre-load and afterload, or correction of blood gauzes and electrolytes. The aim is to maintain a systolic blood pressure above 90 mmHg and a cardiac index of more than 2.2 L/min/m2.[37] LCOS is often transient.[41] Myocardial infarction can occur after the operation because of either technical or patient-specific factors. Its incidence is difficult to estimate due to varying definitions, but most studies place its occurrence at between 2% and 5%. The incidence is also dependent on whether it is isolated CABG (average, 4%, range, 0.3%–10%) or a combined operation (average, 2.0%, range, 0.7%–12%).[43] New electrocardiogram features, such as Q waves or ultrasound-documented alternation of cardiac wall motions, are indicative. Ongoing ischemia might prompt emergency angiography and PCI or re-operation.[44][41] Immediate coronary angiography offers the most expeditious modality not only for diagnosis but also for potential reintervention.[45] Echocardiography is less valuable for the detection or confirmation of postoperative myocardial ischemia.[46] Arrhythmias can also occur, most-commonly atrial fibrillation (incidence of 20–40%) that is treated with correcting electrolyte balance, and rate and rhythm control.[41][37] However, arrhythmia such as ventricular tachycardia or fibrillation can be a sign of postoperative myocardial ischemia that is treated depending on the cause.[47]
Adverse neurological effects occur after CABG in about 1.5% of patients.[41] They can manifest as type-1 deficits—focal deficits such as stroke or coma—or type-2 global deficits such as delirium caused by CPB, hypoperfusion, or cerebral embolism.[37] Cognitive impairment has been reported in up to 80% cases after CABG at discharge and lasts for a year in up to 40% of cases. The cause remains unclear; CPB is an unlikely cause because even in CABG patients without CPB, as in off-pump CABG, and PCI patients, the incidence is the same.[37][38]
Infections, such as wound infections in the sternum (superficial or deep) are most commonly caused by Staphylococcus aureus, and may complicate the post-operation process. The harvesting of both two thoracic arteries is a risk factor because it significantly impairs the perfusion of blood through the sternum.[37] Pneumonia can also occur.[41] Complications in the gastrointestinal tract have been described and are most commonly due to medications administered during the operation.[38]
History[edit]
Pre-CABG[edit]
In the early 20th century, surgical interventions aiming to relieve angina and prevent death were either sympathectomy — a cut on the sympathetic chain that supplies the heart—or pericardial abrasion, with the hope adhesions would create significant collateral circulation. Sympathectomy produced disappointing and inconsistent results.[49] French surgeon Alexis Carrel was the first to anastomose a vessel—a branch of the carotid artery—to a native artery in the heart of a dog, but the experiment could not be reproduced.[50] In the mid-20th century, revascularization efforts continued. Beck C. S. used a carotid conduit to connect the descending aorta to the coronary sinus, the biggest vein of the heart. In the «Vineberg Procedure», Arthur Vineberg used skeletonized LITA, placing it in a small tunnel he created next to the LAD and hoping spontaneous collateral circulation would form. This occurred in canine experiments but not in humans. Goetz RH was the first to perform an anastomosis of the ITA to LAD in the 1960 using a sutureless technique.[49]
The development of coronary angiography in 1962 by Mason Sones helped medical doctors to identify patients in need of operation, and which native heart vessels should be bypassed.[51] In 1964, Soviet cardiac surgeon Vasilii Kolesov performed the first successful internal thoracic artery–coronary artery anastomosis, followed by Michael DeBakey in the United States. Argentine surgeon René Favaloro standardized the procedure. Their advances made CABG the standard of care of CAD patients.[52]
The CABG era[edit]
The modern era of the CABG began in 1964 when Soviet cardiac surgeon Vasilii Kolesov performed the first successful internal thoracic artery–coronary artery anastomosis. The same year, Michael DeBakey used a saphenous vein to create an aorta-coronary artery bypass. Argentinean surgeon Rene Favaloro advanced and standardized the CABG technique using the patient’s saphenous vein.[52]
The introduction of arresting the heart during operation (cardioplegia) made CABG much less risky. A major obstacle of CABG was ischemia and infarction occurring while the heart was stopped to allow surgeons to construct the distal anastomosis. In the 1970s, potassium-based cardioplegia was used. Cardioplegia minimized the oxygen demands of the heart, thus reducing the effects of ischemia. Refinement of cardioplegia in the 1980s made CABG less risky, lowering mortality during operation.[53]
In the late 1960s, after the work of René Favaloro, the operation was performed in only a few centers, but was anticipated to more broadly change the outcome of coronary artery disease. By 1979, there were 114,000 procedures per year in the US. The introduction of PCI did not obsolesce CABG; rates of both procedures continued to increase, but PCIs grew more rapidly. In the following decades, CABG was extensively studied and compared to PCI. The absence of a clear advantage of CABG over PCI led to a small decrease in numbers of CABGs in some countries (like the US) by 2000. In Europe—mainly Germany—CABG was increasingly performed. As of 2023, research comparing the two techniques is continuing.[54] Meta-analysis published in 2023 suggests that CABG provides a consistent survival benefit over PCI with drug-eluting stents (DES). [55]
Favaloro’s work is fundamental to the history of graft selection. He established the use of bilateral ITAs as superior to vein grafts. Surgeons examined the use of other arterial grafts—splenic, gastroepiploic mesenteric, subscapular and others—but none matched the patency rates of ITA. In 1971, Carpentier introduced the use of the radial artery, which was initially prone to failure, but the development of harvesting techniques in the following 20 years significantly improved patency.[56]
Other animals[edit]
Pigs, sheeps, and dogs have been used as experimental models, for the development of CABG.[57] Performing CABG to treat a sick animal though is extremely rare. [58]
See also[edit]
- Angioplasty
- Cardiothoracic surgery
- Cleveland Clinic
- Dressler’s syndrome
- Hybrid coronary revascularization
- Totally endoscopic coronary artery bypass surgery
- Chest tube
References[edit]
- ^ Al-Atassi et al. 2016, pp. 1553–1554.
- ^ a b c d Al-Atassi et al. 2016, p. 1554.
- ^ a b Kouchoukos et al. 2013, p. 405.
- ^ a b Kouchoukos et al. 2013, p. 356.
- ^ a b Kouchoukos et al. 2013, p. 357.
- ^ Bojar 2021, pp. 4–9.
- ^ Bojar 2021, pp. 7–10.
- ^ a b Smith & Schroder 2016, p. 549.
- ^ Al-Atassi et al. 2016, p. 1556.
- ^ a b c d e Kouchoukos et al. 2013, p. 409.
- ^ a b Welt 2022, pp. 185–186.
- ^
- ^ Farina, Gaudino & Taggart 2020, pp. 1 & 6.
- ^ Farina, Gaudino & Taggart 2020, pp. 1–2.
- ^ Ngu, Sun & Ruel 2018, pp. 527–531.
- ^ Farina, Gaudino & Taggart 2020, pp. 4–5.
- ^ Ngu, Sun & Ruel 2018, pp. 529.
- ^ Fearon et al. 2022, pp. 128–129.
- ^
- ^ a b Al-Atassi et al. 2016, Surgical Technique.
- ^ a b c d e f g h i Kouchoukos et al. 2013, p. 367.
- ^ Al-Atassi et al. 2016, p. 1562.
- ^ a b Al-Atassi et al. 2016, p. 1564.
- ^ Kouchoukos et al. 2013, pp. 374–376.
- ^ Al-Atassi et al. 2016, p. 1563.
- ^ Kouchoukos et al. 2013, p. 348.
- ^ Kouchoukos et al. 2013, p. 386.
- ^ Mick et al. 2016, pp. 1603–1605.
- ^ Mick et al. 2016, pp. 1606–1608.
- ^ a b c d Kouchoukos et al. 2013, p. 387.
- ^ Kouchoukos et al. 2013, pp. 404–405.
- ^ a b c d Kouchoukos et al. 2013, p. 388.
- ^ a b Kouchoukos et al. 2013, p. 397.
- ^ Kouchoukos et al. 2013, p. 399.
- ^ Sef, D; Raja, SG (February 2021). «Bilateral internal thoracic artery use in coronary artery bypass grafting in the post-ART era – Perspective». International Journal of Surgery (London, England). 86: 1–4. doi:10.1016/j.ijsu.2020.12.007. PMID 33388437. S2CID 230488630.
- ^ a b Kouchoukos et al. 2013, p. 401.
- ^ a b c d e f g Al-Atassi et al. 2016, Results.
- ^ a b c Smith & Schroder 2016, p. 566.
- ^ Al-Atassi et al. 2016, pp. 1561.
- ^ a b Kouchoukos et al. 2013, p. 403.
- ^ a b c d e f Smith & Schroder 2016, p. 565.
- ^ Al-Atassi et al. 2016, 1569.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (February 2023). «Postcardiac surgery myocardial ischemia: Why, when, and how to intervene». The Journal of Thoracic and Cardiovascular Surgery. 165 (2): 687–695. doi:10.1016/j.jtcvs.2021.05.052. PMID 34556355. S2CID 237616162.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (February 2023). «Postcardiac surgery myocardial ischemia: Why, when, and how to intervene». The Journal of Thoracic and Cardiovascular Surgery. 165 (2): 687–695. doi:10.1016/j.jtcvs.2021.05.052. PMID 34556355. S2CID 237616162.
- ^ Robinson, NB; Sef, D; Gaudino, M; Taggart, DP (February 2023). «Postcardiac surgery myocardial ischemia: Why, when, and how to intervene». The Journal of Thoracic and Cardiovascular Surgery. 165 (2): 687–695. doi:10.1016/j.jtcvs.2021.05.052. PMID 34556355. S2CID 237616162.
- ^ Laflamme, M; DeMey, N; Bouchard, D; Carrier, M; Demers, P; Pellerin, M; Couture, P; Perrault, LP (April 2012). «Management of early postoperative coronary artery bypass graft failure». Interactive Cardiovascular and Thoracic Surgery. 14 (4): 452–6. doi:10.1093/icvts/ivr127. PMC 3309816. PMID 22223760.
- ^ Sef, D; Szavits-Nossan, J; Predrijevac, M; Golubic, R; Sipic, T; Stambuk, K; Korda, Z; Meier, P; Turina, MI (2019). «Management of perioperative myocardial ischaemia after isolated coronary artery bypass graft surgery». Open Heart. 6 (1): e001027. doi:10.1136/openhrt-2019-001027. PMC 6519404. PMID 31168389.
- ^ Al-Atassi et al. 2016, p. 1552.
- ^ a b Head et al. 2013, pp. 2862–2863.
- ^ Al-Atassi et al. 2016, p. 1551.
- ^ Head et al. 2013, p. 2862.
- ^ a b Head et al. 2013, p. 2863.
- ^ Head et al. 2013, p. 2865.
- ^ Head et al. 2013, pp. 2863–2865.
- ^ Urso, S; Sadaba, R; González-Martín, JM; Dayan, V; Nogales, E; Tena, MÁ; Abad, C; Portela, F (30 March 2023). «Coronary surgery provides better survival than drug-eluting stent: A pooled meta-analysis of Kaplan- Meier-derived individual patient data». The Journal of Thoracic and Cardiovascular Surgery. doi:10.1016/j.jtcvs.2023.03.020. PMID 37001801. S2CID 257868518.
- ^ Head et al. 2013, p. 2868.
- ^ Connolly 2001, p. 1.
- ^ Cordova 2020.
Sources[edit]
- Al-Atassi, Talal; Toeg, Hadi D.; Chan, Vincent; Ruel, Marc (2016). «Coronary Artery Bypass Grafting». In Frank Sellke; Pedro J. del Nido (eds.). Sabiston and Spencer Surgery of the Chest. ISBN 978-0-323-24126-7.
- Bojar, R.M. (2021). Manual of Perioperative Care in Adult Cardiac Surgery. Wiley. ISBN 978-1-119-58255-7. Retrieved 2022-10-26.
- Connolly, John E. (2001-03-25). «The Development of Coronary Artery Surgery: Personal Recollections». Texas Heart Institute Journal. 29 (1): 10–14. PMC 101261. PMID 11995842.
- Cordova, Melanie Greaver (2020-05-05). «Veterinarians, MDs team up for canine open-heart surgery». Cornell Chronicle. Retrieved 2023-08-24.
- Farina, Piero; Gaudino, Mario Fulvio Luigi; Taggart, David Paul (2020). «The Eternal Debate With a Consistent Answer: CABG vs PCI». Seminars in Thoracic and Cardiovascular Surgery. Elsevier BV. 32 (1): 14–20. doi:10.1053/j.semtcvs.2019.08.009. ISSN 1043-0679. PMID 31442489. S2CID 201632303.
- Fearon, William F.; Zimmermann, Frederik M.; De Bruyne, Bernard; Piroth, Zsolt; van Straten, Albert H.M.; Szekely, Laszlo; Davidavičius, Giedrius; Kalinauskas, Gintaras; Mansour, Samer; Kharbanda, Rajesh; Östlund-Papadogeorgos, Nikolaos; Aminian, Adel; Oldroyd, Keith G.; Al-Attar, Nawwar; Jagic, Nikola; Dambrink, Jan-Henk E.; Kala, Petr; Angerås, Oskar; MacCarthy, Philip; Wendler, Olaf; Casselman, Filip; Witt, Nils; Mavromatis, Kreton; Miner, Steven E.S.; Sarma, Jaydeep; Engstrøm, Thomas; Christiansen, Evald H.; Tonino, Pim A.L.; Reardon, Michael J.; Lu, Di; Ding, Victoria Y.; Kobayashi, Yuhei; Hlatky, Mark A.; Mahaffey, Kenneth W.; Desai, Manisha; Woo, Y. Joseph; Yeung, Alan C.; Pijls, Nico H.J. (2022-01-13). «Fractional Flow Reserve–Guided PCI as Compared with Coronary Bypass Surgery». New England Journal of Medicine. Massachusetts Medical Society. 386 (2): 128–137. doi:10.1056/nejmoa2112299. ISSN 0028-4793. PMID 34735046. S2CID 242940936.
- Head, S. J.; Kieser, T. M.; Falk, V.; Huysmans, H. A.; Kappetein, A. P. (2013-10-01). «Coronary artery bypass grafting: Part 1—the evolution over the first 50 years». European Heart Journal. Oxford University Press (OUP). 34 (37): 2862–2872. doi:10.1093/eurheartj/eht330. ISSN 0195-668X. PMID 24086085.
- Smith, Peter K.; Schroder, Jacob N. (2016). «On-Pump Coronary Artery Bypass Grafting». In Josef E. Fischer (ed.). Master Techniques in Surgery CARDIAC SURGERY. Wolters Kluwer. ISBN 9781451193534.
- Kouchoukos, Nicholas; Blackstone, E. H.; Hanley, F. L.; Kirklin, J. K. (2013). Kirklin/Barratt-Boyes Cardiac Surgery E-Book (4th ed.). Elsevier. ISBN 978-1-4160-6391-9.
- Mick, Stephanie; Keshavamurthy, Suresh; Mihaljevicl, Tomislav; Bonatti, Johannes (2016). «Robotic and Alternative Approaches to Coronary Artery Bypass Grafting». In Frank Sellke; Pedro J. del Nido (eds.). Sabiston and Spencer Surgery of the Chest. pp. 1603–1615. ISBN 978-0-323-24126-7.
- Ngu, Janet M. C.; Sun, Louise Y.; Ruel, Marc (2018). «Pivotal contemporary trials of percutaneous coronary intervention vs. coronary artery bypass grafting: a surgical perspective». Annals of Cardiothoracic Surgery. AME Publishing Company. 7 (4): 527–532. doi:10.21037/acs.2018.05.12. ISSN 2225-319X. PMC 6082775. PMID 30094218.
- Welt, Frederick G.P. (2022-01-13). «CABG versus PCI — End of the Debate?». New England Journal of Medicine. Massachusetts Medical Society. 386 (2): 185–187. doi:10.1056/nejme2117325. ISSN 0028-4793. PMID 35020989.
External links[edit]
- Lawton JS, Tamis-Holland JE, Bangalore S, Bates ER, Beckie TM, Bischoff JM, Bittl JA, Cohen MG, DiMaio JM, Don CW, Fremes SE, Gaudino MF, Goldberger ZD, Grant MC, Jaswal JB, Kurlansky PA, Mehran R, Metkus TS Jr, Nnacheta LC, Rao SV, Sellke FW, Sharma G, Yong CM, Zwischenberger BA. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022;79:e21-e129
Традиционное аортокоронарное шунтирование включает торакотомию с применением срединной стернотомии. Аппарат искусственного кровообращения (АИК) используется для обеспечения кардиопульмонарного шунтирования, которое позволяет остановить сердце и отвести из него кровь. Это дает возможность располагать большим временем во время проведения оперативного вмешательства и облегчает применение сосудистых анастомозов; остановка сердца также заметно снижает потребность миокарда в кислороде.
Перед началом выполнения АКШ пациент получает очень высокую дозу гепарина для предотвращения тромбообразования в обходном кровотоке. Затем аорта пережимается, а сердце останавливается инъекцией кардиоплегического раствора (кристаллоидного или, более часто, созданного на основе крови), который также содержит вещества, помогающие клеткам миокарда переносить ишемию и реперфузию. Кардиоплегический раствор и сердце иногда подвергают легкому охлаждению, для увеличения переносимости ишемии; тело пациента также охлаждают аппаратом искусственного кровообращения с той же целью.
В типичных случаях в качестве трансплантата для левой передней нисходящей артерии используют левую внутреннюю грудную артерию. В других ситуациях можно применить трансплантат, состоящий из сегментов большой подкожной вены. В редких случаях можно использовать правую внутреннюю грудную артерию или лучевую артерию, взятую с недоминирующей руки.
После завершения создания сосудистого анастомоза с аорты снимают зажим, начинают перфузию коронарных артерий оксигенированной кровью, что обычно приводит к восстановлению активности сердца. Гемостаз, подавленный гепарином, нормализуют протамином. Несмотря на все меры предосторожности, остановка сердца не проходит без последствий. В течение периода реперфузиичасто возникает дисфункция миокарда, которая может вести к брадикардии, аритмий (например, фибрилляции желудочков), и низкого сердечного выброса. При данных осложнениях применяются стандартные меры, такие как стимуляция, дефибрилляция и инотропные препараты.
Обычно длительность госпитализации составляет 4–5 дней, однако при развитии осложнений или сопутствующих заболеваниях длительность стационарного лечения увеличивается.
Осложнения и недостатки традиционной техники шунтирования коронарных артерий преимущественно связаны с:
-
Стернотомией
-
Экстракорпоральным кровообращением
Срединная стернотомия обычно хорошо переносится пациентами, однако период восстановления занимает от 4 до 6 недель. Кроме того, при инфицировании послеоперационной раны возникают медиастинит и остеомиелит, лечение которых может быть нетривиальным.
Искусственное кровообращение (ИК) является причиной некоторых серьезных осложнений, среди которых:
-
Кровотечение
-
Органная дисфункция, включая нейропсихиатрические эффекты
-
Инсульт
Кровотечение, связанное с искусственным кровообращением, является частой проблемой, обусловленной различными факторами, включая гемодилюцию, применение гепарина, дисфункцию тромбоцитов из-за прохождения через насос АИК, диссеминированное внутрисосудистое свертывание крови и индуцированную гипотермию.
Дисфункция органа может возникать вследствие системной воспалительной реакции в ответ на использование аппарата ИК (вероятно, вследствие контакта крови с чужеродными материалами системы), что может вызвать нарушение функции любого органа (например, легких, почек, мозга, желудочно-кишечного тракта). Катетеризация аорты, ее пережатие и снятие зажима может спровоцировать появление эмболов, которые приблизительно в 1,5% случаев обуславливают возникновение инсульта; с микроэмболизацией могут быть связаны постоперационные психоневрологические нарушения, которые наблюдаются в 5–10% случаев.
Другие распространённые осложнения АКШ включают:
-
Дизритмии
-
Очаговая ишемия миокарда
-
Тотальная ишемия миокарда
Периоперационный инфаркт миокарда встречается у 1% пациентов. Фибрилляция предсердий – в 15–40% случаев, как правило на 2–4-й день после операции. Бета-блокаторы (включая соталол) и амиодарон способны уменьшать вероятность развития предсердных аритмий после операции на сердце. Неустойчивая ЖТ возникает почти у 50% больных.
Смертность преимущественно зависит от состояния пациентов перед оперативным вмешательством; также важен опыт хирургов и специализация лечебного учреждения (т.е., количество операций, выполняемых за год). В специализированных центрах периоперационная летальность среди пациентов с неотягощенным анамнезом по заболеваниям других систем и органов обычно составляет < 1–3%.
Простой калькулятор может классифицировать риск при АКШ на три группы (низкий, средний, высокий). Более продвинутый калькулятор (online cardiac surgery risk calculator) опубликован Обществом торакальных хирургов (STS).
Более новые техники направлены на ограничение осложнений от традиционного аортокоронарного шунтирования путём
-
Избежание сердечно-легочного шунтирования (шунтирование коронарных артерий без использования аппарата искусственного кровообращения)
-
Избегания срединной стернотомии (минимально инвазивное коронарное шунтирование)
-
Комбинирования обеих техник
Избежать сердечно-легочного шунтирования в случае некоторых пациентов позволяет техника операции, позволяющая хирургу реваскуляризировать сокращающееся сердце. Специальные инструменты и методы удерживают часть миокарда, обеспечивая относительную неподвижность операционного поля.
АКШ на работающем сердце чаще проводят путём парастернального или межреберного доступа (малоинвазивное АКШ), иногда с использованием эндоскопической аппаратуры и даже роботизированной поддержки, однако оно также выполняется в сочетании с традиционной срединной стернотомией, которая обеспечивает лучший операционный доступ.
Биение сердца во время операции означает, что миокард требует больше кислорода, чем при использовании АИК. Таким образом, сердце оказывается чувствительным к прекращению коронарного кровотока, устраиваемому во время наложения сосудистого анастомоза; это прекращение может вызвать ишемию или инфаркт зоны миокарда, снабжаемой оперируемым сосудом. Некоторые хирурги накладывают временный коронарный шунт для обеспечения перфузии дистальных сегментов.
АКШ на работающем сердце технически более сложное, но может оказаться целесообразным у пациентов с выраженной кальцификацией аорты, что приводит к более высокому риску манипуляций на аорте. По сравнению с перфузионным шунтированием, бесперфузионное АКШ (без насоса) ассоциировано с повышенной потребностью в реваскуляризации в течение одного года.
Малоинвазивная техника АКШ более сложна в исполнении, а также неудобна при наложении нескольких шунтов, особенно на задней поверхности сердца. Объем переливаемой крови, продолжительность асистолии и стоимость вмешательства при выполнении АКШ на работающем сердце обычно меньше, чем при шунтировании с использованием АИК, а также несколько клинических исследований показали, что частота развития серьезных осложнений, таких как смерть, инфаркт миокарда и инсульт, сопоставима при обеих техниках. Таким образом, представляется, что теоретические преимущества избежания искусственного кровообращения на практике полностью не реализуются.
Минимально инвазивное коронарное шунтирование обычно сочетается с off-pump-техникой, однако также может проводиться с использованием АИК. В этих случаях искусственное кровообращение налаживается эндоваскулярно с использованием специальных катетеров, вставляемых в артериальное и венозное русло. Просвет аорты чаще перекрывается баллоном, расположенным на конце аортального катетера, чем наружным зажимом. Несмотря на избежание осложнений, связанных со срединной стернотомией, эта техника ассоциирована с таким же риском смерти и развития больших операционных осложнений, как и стандартные подходы.

Авторское право © 2023 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.

Аортокоронарное шунтирование — это хирургическая операция, при которой создаются обходные пути для крови вокруг заблокированных сосудов, позволяющие обеспечить питание сердечной мышцы и предотвратить развитие инфаркта. Узнайте о преимуществах и особенностях проведения АКШ на сайте Формула Здоровья.
Аортокоронарное шунтирование (АКШ) является одним из самых распространенных хирургических методов лечения коронарной недостаточности сердца, который предназначен для восстановления кровоснабжения сердца. Данная операция выполняется путем создания обходного пути для крови, который обходит заболевшую артерию и восстанавливает нормальный кровоток в сосудах сердца.
Несмотря на то, что АКШ считается относительно безопасной и эффективной процедурой, она может иметь ограниченные противопоказания, как, например, возраст, сердечная недостаточность и т.д. Тем не менее, для многих пациентов АКШ является последней надеждой на восстановление нормального кровотока в сердце и улучшение качества жизни.
«АКШ – это безопасные и эффективные метод лечения коронарной недостаточности сердца, который может быть рекомендован пациентам с заболеванием коронарных артерий, которые не могут получить должного улучшения с помощью лекарственной терапии и альтернативных методов лечения.»
В данной статье мы поговорим более детально о том, как происходит операция АКШ, какие показания и ограничения у нее есть, а также какие последствия и осложнения могут возникнуть после процедуры.
Аортокоронарное шунтирование (АКШ) — это хирургическая процедура, которая позволяет обойти суженные участки коронарных артерий, обеспечивая достаточный кровоток к сердцу.
АКШ проводят пациентам, страдающим от коронарных заболеваний, чтобы восстановить нормальный кровоток к сердцу и уменьшить риск сердечных приступов.
Аортокоронарное шунтирование (АКШ) является хирургическим вмешательством, которое выполняется пациентам с коронарной болезнью сердца (КБС) и обструкцией артерий, по которым кровь должна поступать в сердце.
Показания для АКШ могут включать стенокардию, ишемическую болезнь сердца, инфаркт миокарда и другие заболевания, которые могут быть связаны с обструкцией коронарных артерий. Пациенты, у которых неэффективно лечение медикаментозными препаратами или ангиопластикой, могут быть кандидатами на проведение АКШ.
В целом, АКШ обычно рекомендуется пациентам, которые имеют серьезное повреждение коронарных артерий или высокий риск развития сердечно-сосудистых заболеваний. Однако решение о проведении АКШ должно быть принято индивидуально с учетом всех факторов, связанных с заболеванием и состоянием пациента.
Если у вас есть подозрение на КБС, вы должны незамедлительно проконсультироваться с квалифицированным кардиологом, чтобы оценить ваше состояние и риск развития сердечно-сосудистых заболеваний.
Вопрос-ответ:
Что такое аортокоронарное шунтирование?
Аортокоронарное шунтирование – это хирургическая процедура, которая проводится для обеспечения кровоснабжения сердца при наличии сужения коронарных артерий. В рамках операции создаются дополнительные магистральные артерии, которые обходят сужения и обеспечивают нормальное кровообращение в миокарде. Таким образом, процедура предотвращает развитие инфаркта миокарда и повышает качество жизни пациента.
Когда необходимо проведение аортокоронарного шунтирования?
Аортокоронарное шунтирование проводится при наличии сужения одной или нескольких коронарных артерий, когда имеются клинические симптомы исхемии миокарда, такие как боли в груди, одышка, утомляемость. Процедура может быть рекомендована, если консервативное лечение неэффективно и коронарные стенозы слишком выражены.
Как проводится аортокоронарное шунтирование?
Аортокоронарное шунтирование проводится в условиях операционной, при общей анестезии. Хирург делает небольшой разрез в грудной клетке, взаимодействует с сердцем через открытые артерии и производит шунтирование (прохождение пластической опухоли между имеющимися магистральными артериями). После того, как шунт создан, коронарные артерии становятся проходимыми для крови и обеспечивают правильное кровообращение в миокарде.
Какова продолжительность аортокоронарного шунтирования?
Продолжительность аортокоронарного шунтирования зависит от сложности пациента и количества артерий, в которых имеются стенозы. В среднем, процедура длится от 3 до 5 часов, но может занять и более длительное время, если требуются дополнительные манипуляции.
Как долго длится реабилитация после аортокоронарного шунтирования?
Реабилитация после аортокоронарного шунтирования может занять от 6 недель до нескольких месяцев. Пациенты обычно выписываются из больницы через 5-7 дней после операции. Затем им назначаются лекарства, которые помогают восстановиться после процедуры и предотвратить развитие осложнений. Также пациентам предписывается следить за своим здоровьем, регулярно посещать врача, проводить регулярное физическое обследование и следить за своим питанием.
Какие осложнения могут возникнуть после аортокоронарного шунтирования?
Осложнения после аортокоронарного шунтирования могут быть различными, но, в целом, они довольно редки. К ним относятся: инфекции раны, кровотечения, повреждения сердца, нарушение ритма сердца, инсульт, повреждения почек и другие. Важно следить за своим здоровьем в течение периода реабилитации и обращаться за медицинской помощью в случае необходимости.
Можно ли обойтись без аортокоронарного шунтирования?
Не всегда аортокоронарное шунтирование является единственным возможным способом лечения ишемической болезни сердца. В некоторых случаях возможно проведение баллонной ангиопластики, при которой сужение коронарной артерии расширяют с помощью специального баллона. Однако, этот метод эффективен только при наличии небольших участков сужения. Врач принимает решение о необходимости проведения той или иной процедуры после тщательного обследования пациента.
Какие результаты позволяет достичь аортокоронарное шунтирование?
Аортокоронарное шунтирование позволяет увеличить длительность и качество жизни пациента с ишемической болезнью сердца, предотвратить инфаркт миокарда и другие серьезные осложнения. Процедура помогает устранить существующее сужение коронарных артерий и обеспечивает нормальное кровообращение в миокарде. Результаты аортокоронарного шунтирования могут быть долгосрочными, при условии соблюдения рекомендаций врачей по периоду реабилитации и контролю своего здоровья.
Подготовка к операции аортокоронарного шунтирования
Общая информация
Аортокоронарное шунтирование является серьезной операцией на сердце, поэтому необходима хорошая подготовка к ее проведению. Эта процедура позволяет повысить качество жизни пациента с заболеваниями сердца, такими как стенокардия или инфаркт миокарда.
Перед операцией
Перед проведением операции аортокоронарного шунтирования пациент должен пройти необходимые обследования, которые включают в себя ЭКГ, эхокардиографию, общий анализ крови и мочи, а также другие исследования, которые может назначить врач.
Подготовка к операционной
Перед операцией пациент должен быть натощак в течение 6-8 часов. Одежда должна быть легкой и комфортной. Пациент должен быть готов к переносу в операционную, где будет проведена процедура анестезии.
Постоперационный период
После проведения операции пациент должен находиться в больнице в течение нескольких дней для наблюдения. Ему будут назначены противовоспалительные и противоотечные лекарства, а также физиотерапевтические процедуры для быстрого восстановления.
- При необходимости пациент должен соблюдать диету и контролировать свой вес
- Для восстановления после операции можно использовать лечебные упражнения и тренировки
- Пациент должен вести здоровый образ жизни, не курить и заниматься физическими упражнениями
Таким образом, правильная подготовка к операции аортокоронарного шунтирования позволяет уменьшить риск возможных осложнений и способствует быстрому восстановлению пациента после процедуры.
Проведение операции аортокоронарного шунтирования
Хирургический доступ
Перед проведением операции аортокоронарного шунтирования необходимо создать хирургический доступ. Для этого выделяются головная артерия и вены, а также другие анатомические структуры в грудной полости. Доступ может быть открытым или минимально инвазивным.
Замена сосудов
В процессе операции аортокоронарного шунтирования хирург заменяет поврежденные или заболевшие сосуды, которые питают сердце. Обычно используется жилка от ноги, которая вшивается между аортой и легочной артерией. Это позволяет более эффективно обеспечивать кровью область сердца, которая была повреждена.
Риски и осложнения
Операция аортокоронарного шунтирования, как и любая другая хирургическая процедура, сопряжена с рисками и осложнениями. Среди них могут быть остановка сердца, потеря крови, инфекция и т.д. Тем не менее, современные методы операции значительно снижают вероятность возникновения этих осложнений.
Восстановительный период
После выполнения операции аортокоронарного шунтирования пациенты обычно проводят в отделении интенсивной терапии примерно сутки. Затем они переводятся в обычную палату и начинают проходить реабилитационную программу, которая включает в себя лекарства и физические упражнения. Восстановительный период требует от пациента терпения и сотрудничества с медицинскими работниками.
Восстановительный период после операции
Первые дни
После операции пациент обычно проводит несколько дней в отделении реанимации, где ему оказывают все необходимые меры поддерживающей терапии. В это время врачи мониторят его состояние и убеждаются в том, что все системы организма функционируют должным образом.
Кроме того, пациент начинает восстанавливать дыхательные функции и прогрессивно увеличивает физическую активность. Команда медицинских профессионалов обязательно проводит дополнительные исследования, чтобы подтвердить успешность операции.
Несколько недель
В течение следующих нескольких недель после операции пациенту следует соблюдать определенный режим. Хотя большинство людей возвращается к своей обычной жизни за 4-6 недель, но есть и случаи, когда это занимает больше времени.
Врачи рекомендуют последовательно увеличивать физические нагрузки и не переусердствовать, придерживаться здоровой диеты и уделять достаточно времени отдыху, так как восстановление требует сил и энергии организма.
Долгосрочный период
Для достижения максимально положительных результатов после операции пациенту необходимо следить за своим здоровьем на протяжении всей жизни. Врачи могут рекомендовать изменить стиль жизни, например, перейти на более здоровую диету, бросить курить, регулярно заниматься физическими упражнениями.
Также пациент должен регулярно посещать врача, следить за своими привычками и принимать лекарства, если таковые назначены. Соблюдение всех рекомендаций врача поможет предотвратить возможные осложнения и сохранить долгие годы качество жизни.
Возможные осложнения после операции
Ишемический инсульт
Одним из наиболее серьезных осложнений аортокоронарного шунтирования является ишемический инсульт. Он может возникнуть из-за образования тромба в сосудах головного мозга во время операции.
Почечная недостаточность
При проведении операции аортокоронарного шунтирования может нарушиться кровоснабжение почек. Это может привести к почечной недостаточности, которая проявляется понижением уровня мочевины и креатинина в крови.
Инфекция раны после операции
После операции аортокоронарного шунтирования может возникнуть инфекция раны. Это может произойти, если в рану попали бактерии во время операции. Симптомы инфекции раны включают красноту, отёк, боль и выделение гноя.
Образование рубца на грудной клетке
После операции аортокоронарного шунтирования может произойти образование рубца на грудной клетке. Рубец может стать заметным и оставаться на всю жизнь. Он может также вызывать зуд, болезненность и ограничение движений.
Во избежание этих осложнений, необходимо тщательно соблюдать инструкции врача в период после операции, которые включают ограничение физической активности и приведение в соответствие режима питания и лекарственного лечения.
Диета после аортокоронарного шунтирования
Рекомендации по питанию
После аортокоронарного протезирования важно следить за своим питанием. Рацион должен включать в себя достаточное количество белков, жиров и углеводов, а также витаминов и минералов.
Рекомендуется употреблять пищу маленькими порциями, но часто — пять-шесть раз в день. При этом можно включать все виды продуктов, в том числе молочные продукты, мясо, рыбу, овощи и фрукты. Однако следует избегать жирных и тяжелых блюд, алкогольных напитков, крепкого кофе и чая.
Ограничения и запрещенные продукты
После операции не рекомендуется употреблять копченое мясо, жареную пищу, соленые продукты и маринады. Также нужно ограничить потребление сахара и сахаросодержащих продуктов.
Если вы страдаете от диабета, то после операции необходимо контролировать уровень сахара в крови и при необходимости регулировать его за счет диеты и принимаемых лекарств.
Рекомендации по питьевому режиму
Принимайте достаточное количество жидкости. Рекомендуется пить негазированную воду, зеленый чай, свежевыжатые соки и отвары. Избегайте крепкого чая, кофе и алкоголя, которые могут вызвать сердечные приступы.
Следуйте этим простым рекомендациям и вы быстрее восстановитесь после операции аортокоронарного шунтирования и вернетесь к обычному образу жизни.
Физические упражнения после операции аортокоронарного шунтирования
Важность физических упражнений
Физические упражнения являются важным компонентом восстановления после операции аортокоронарного шунтирования. Они помогают укрепить сердечно-сосудистую систему, улучшить кровообращение, насытить ткани кислородом и уменьшить риск развития сердечно-сосудистых заболеваний. Важно начать заниматься физическими упражнениями под руководством врача-реабилитолога.
Виды физических упражнений
В период реабилитации после операции аортокоронарного шунтирования рекомендуется начинать с легких физических упражнений, таких как ходьба и медленное бегание. Затем можно добавлять упражнения на силу и гибкость. Важно избегать сильных нагрузок и длительных тренировок. При выполнении упражнений нужно следить за своими ощущениями и не переутомляться.
Рекомендации по тренировкам
- Начинать с легких физических упражнений под руководством врача-реабилитолога;
- Постепенно увеличивать нагрузки и продолжительность тренировок;
- Избегать сильных нагрузок и длительных тренировок;
- Не переутомляться и следить за своими ощущениями;
- Давать своему организму время на восстановление после тренировок.
Последствия недостатка физических упражнений
Недостаток физических упражнений может привести к обратному эффекту и негативно повлиять на состояние сердца и сосудов, увеличить риск развития сердечно-сосудистых заболеваний и снизить качество жизни. Поэтому важно регулярно заниматься физическими упражнениями и следить за своим здоровьем.
Продолжительность реабилитации после аортокоронарного шунтирования
Реабилитация после аортокоронарного шунтирования является важным этапом в восстановлении пациента. Продолжительность этого процесса зависит от многих факторов: общего состояния пациента перед операцией, количества и места наложения шунтов, а также адекватности проведения реабилитационных мероприятий.
Продолжительность реабилитационного периода может быть разной для разных пациентов. В среднем, полный курс реабилитации может занять около 3-6 месяцев. В этот период пациенту необходимо следовать определенным принципам: контролировать свой рацион питания, выполнять упражнения, рекомендованные врачом, принимать лекарства, а также следить за изменением своего состояния и своевременно обращаться к врачу.
При правильном проведении реабилитационных мероприятий пациент сможет вернуться к обычной жизнедеятельности. Важно понимать, что реабилитационный период — это не только время восстановления тела, но и время для изменения образа жизни и привычек, например, бросить курить и начать регулярно заниматься спортом.
- Советы для ускорения восстановления:
- Слушайте свое тело: При выполнении упражнений и на протяжении всего реабилитационного периода важно внимательно следить за своим состоянием и не допускать переутомления.
- Следуйте рекомендациям врача: Рекомендации врача по питанию, физической активности и приему лекарств должны быть выполнены в точности.
- Поддерживайте позитивное мышление: Стремление к позитивным результатам и наличие целей помогут преодолеть сложности реабилитации и быстрее достигнуть успеха.
Эффективность аортокоронарного шунтирования
Успешность операции
Аортокоронарное шунтирование является эффективной методикой лечения ишемической болезни сердца. Согласно исследованиям, проведенным последние годы, более 90% операций проходят успешно. Хотя некоторые пациенты могут испытывать некоторые осложнения на ранней стадии, большинство из них улучшают свое состояние и жизненный прогноз после месяца.
Улучшения в качестве жизни
Пациенты, прошедшие аортокоронарное шунтирование, часто замечают значительные изменения в их здоровье и качестве жизни. Существенное улучшение в функции сердечно-сосудистой системы может привести к более легкому осуществлению повседневных действий и уменьшению боль в груди. Большинство пациентов отмечают улучшение настроения и жизненного оптимизма после операции.
Продолжительность и эффективность результата
Аортокоронарное шунтирование имеет высокую продолжительность действия, позволяя пациентам жить более долгую и здоровую жизнь. Средний срок службы байпаса составляет от 10 до 15 лет. Однако, в некоторых случаях, этот период может продлиться и до 20 лет и более при хорошем уходе. В целом, аортокоронарное шунтирование имеет высокую эффективность, улучшая качество жизни пациентов и продлевая их жизнь.
Прогноз после операции
После аортокоронарного шунтирования прогноз зависит от нескольких факторов. Важным является текущее состояние сердца пациента, наличие сопутствующих заболеваний, таких как диабет или хроническая обструктивная болезнь легких, а также возраст и общее состояние здоровья.
Однако, в целом, результаты операции обычно являются благоприятными. Облегчение симптомов и уменьшение риска повторного инфаркта миокарда являются главными достижениями аортокоронарного шунтирования. Многие пациенты сообщают о значительном улучшении своего качества жизни после операции.
Важно понимать, что аортокоронарное шунтирование может предотвратить повторный инфаркт, но не может решить основную причину заболевания — коронарную артериальную болезнь. Поэтому важно следить за состоянием сердца и продолжать принимать меры по профилактике заболеваний сердечно-сосудистой системы, включая здоровый образ жизни, правильное питание и регулярные медицинские осмотры.
В целом, прогноз после аортокоронарного шунтирования обычно является положительным, позволяя пациентам вернуться к своей повседневной жизни и избежать серьезных последствий заболевания сердца.
Сравнение эффективности аортокоронарного шунтирования с другими видами операций на сердце
Аортокоронарное шунтирование (АКШ) — это один из самых распространенных методов лечения ишемической болезни сердца (ИБС), которая вызывается зажимом или блокированием артерий, которые питают сердечную мышцу. Однако есть и другие виды лечения ИБС, такие как перкутанная коронарная интервенция (ПКИ) и медикаментозная терапия.
Наиболее успешным и долгосрочным методом лечения ИБС является АКШ, поскольку этот метод не только устраняет зажимы и блокировки артерий, но и обеспечивает нормальное кровоснабжение сердечной мышцы. В отличие от ПКИ, где используется эндоваскулярная процедура, при АКШ проводится операция, которая более радикально и эффективно лечит ИБС.
По сравнению с медикаментозной терапией, АКШ не только обеспечивает более надежный результат, но и снижает риск развития других сердечно-сосудистых заболеваний, таких как инфаркт миокарда или мерцательная аритмия.
- Хотя АКШ — это инвазивный метод лечения, он является наиболее эффективным и безопасным среди имеющихся вариантов для лечения ИБС.
- В общем, эта процедура имеет высокий успех и ожидаемое улучшение со стороны пациентов.
Однако, как и со всеми медицинскими процедурами, АКШ может иметь свои ограничения и осложнения. Пациенты, которые страдают от ужасающих проблем сердечно-сосудистой системы, должны тщательно обсуждать все аспекты этой процедуры со своим кардиологом и хирургом, чтобы принять самое правильное решение для своего здоровья.
Стоимость операции aortocoronary bypass и возможности оплаты
Стандартная стоимость операции
Стоимость аортокоронарного шунтирования может изменяться в зависимости от места проведения операции и имеющихся дополнительных услуг. Ориентировочная стоимость в среднем составляет от 150 000 до 500 000 рублей.
Возможности оплаты
Многие частные клиники и государственные медицинские учреждения предоставляют различные программы финансирования. Кроме того, в некоторых случаях возможна оплата по ОМС.
Также стоит учитывать, что стоимость операции может быть частично или полностью возмещена по договору обязательного медицинского страхования.
Дополнительные расходы
Дополнительные расходы могут возникнуть в случае необходимости проведения дополнительных исследований и процедур, которые могут быть связаны с аортокоронарным шунтированием.
В некоторых случаях могут потребоваться дополнительные постоянные расходы на лекарственные препараты и реабилитационную терапию, что также следует учитывать при планировании финансовых затрат.
Преимущества и недостатки аортокоронарного шунтирования
Преимущества
Аортокоронарное шунтирование (АКШ) является эффективной операцией для лечения коронарной болезни сердца (КБС). Ее главным преимуществом является возможность восстановить нормальное кровоснабжение сердца, что помогает предотвратить инфаркт миокарда. Кроме того, АКШ снижает риск развития сердечной недостаточности и улучшает качество жизни пациентов.
Также АКШ обладает высокой успешностью и обычно производится безопасно. Операция может проводиться как в открытом, так и в минимально инвазивном режиме. Восстановление кровоснабжения обычно происходит незамедлительно после операции, что обеспечивает быстрое улучшение состояния пациента.
Недостатки
Одним из недостатков АКШ является высокая стоимость операции и необходимость продолжительного отдыха после нее. Также АКШ не гарантирует полного излечения КБС и не предотвращает ее возможное развитие в других сосудах.
Кроме того, АКШ может повлечь за собой некоторые риски, включая инфекцию, кровотечение и формирование тромбов. При этом, как и при любой другой операции, существует также риск осложнений во время операции и в период после нее.
Иногда АКШ не может быть выполнено из-за возраста пациента, ухудшения общего состояния здоровья или наличия других противопоказаний. Поэтому решение об АКШ должно быть принято индивидуально для каждого пациента после тщательного обследования и оценки показаний и противопоказаний.
Как найти лучшего специалиста для аортокоронарного шунтирования?
Операция аортокоронарного шунтирования является сложной и серьезной процедурой, поэтому очень важно найти квалифицированного кардиохирурга. Существует несколько способов поиска подходящего специалиста:
- Обратиться к рекомендациям врача — консультация с кардиологом может помочь определить, какой хирург является лучшим выбором для Вас. Врач может рекомендовать конкретного специалиста, с которым работал раньше или знает о его опыте и квалификации.
- Проанализировать отзывы пациентов — сегодня многие медицинские центры имеют сайты с отзывами пациентов, которые проходили аортокоронарное шунтирование. Просмотр отзывов можно сделать в интернете или в офисе выбранного медицинского центра. Это поможет понять, какие результаты можно ожидать от операции при работе с тем или иным хирургом.
- Сравнить опыт и статистику — важно просмотреть квалификацию кардиохирурга и его опыт в проведении операций аортокоронарного шунтирования. Сведения об их статистике и процентах успешных выполнения операций могут легко быть найдены в интернете или получены от медицинского центра.
Поиск хорошего кардиохирурга для проведения операции аортокоронарного шунтирования является основной составляющей, которая напрямую влияет на успешность операции и на последующие результаты лечения. Не забывайте, что выбор хирурга должен быть основан на личных критериях, включая опыт, квалификацию и отзывы других пациентов.
Отзывы пациентов после аортокоронарного шунтирования
Положительные отзывы
Иван, 55 лет: Хотелось бы выразить благодарность всему медицинскому персоналу, побывавшему на моем операционном столе. Они настолько профессионально и заботливо отнеслись к моему здоровью, что я сразу почувствовал себя более легким и спокойным после операции. Теперь, спустя несколько недель после операции, я могу заметить явные изменения к лучшему в моем самочувствии и здоровье. Определенно рекомендую данную процедуру.
Отрицательные отзывы
- Ольга, 43 года: К сожалению, после этой операции я чувствовала себя очень плохо в течение нескольких месяцев. Конечно, мне сделали все, что было необходимо, и врачи были заботливыми и внимательными. Но мне было трудно преодолеть долгое время в больнице и сложные ощущения после операции.
- Владимир, 60 лет: Для меня операция стала неудачной. После нескольких месяцев ухудшения состояния мне пришлось вернуться в больницу. Несмотря на все усилия врачей, они не смогли помочь мне достаточно, и мое самочувствие так и не вернулось.
- Марина, 52 года: Я сразу после операции почувствовала себя лучше, но буквально через пару недель мои проблемы вновь начались. Пока ожидаю результатов анализов, но очень беспокоюсь о будущем.
Частые вопросы об аортокоронарном шунтировании
Какое время восстановления нужно после операции?
Время восстановления после аортокоронарного шунтирования может варьироваться в зависимости от общего состояния пациента и количества проведенных операций.
Однако, большинство пациентов могут возвращаться к обычной жизни через несколько недель после операции. Некоторые люди могут нуждаться в реабилитации и физической терапии для полного восстановления.
Может ли операция решить проблемы с сердечно-сосудистой системой навсегда?
Аортокоронарное шунтирование может помочь улучшить кровообращение и лечить коронарную болезнь сердца.
Однако, хотя операция может улучшить состояние сердечно-сосудистой системы, сама по себе она не может обеспечить полное излечение или предотвратить возможные последствия в дальнейшем.
В каких случаях может потребоваться повторное оперативное вмешательство?
В некоторых случаях, после аортокоронарного шунтирования, может потребоваться дополнительное хирургическое вмешательство. Это может произойти, например, если прежние раневые швы расходятся или если происходит обострение коронарной болезни сердца.
В таких случаях, хирург должен обсудить возможные риски и пользу повторного операционного пособия с пациентом, чтобы решить, какой путь действия будет наилучшим для них в тот или иной момент.
Можно ли продолжать заниматься спортом или заниматься физическими упражнениями после операции?
Многие пациенты возобновляют свои ежедневные физические упражнения или спортивные занятия после операции по их собственному усмотрению и на совете лечащего врача.
Однако, важно помнить, что каждый случай индивидуальный, и следует получить консультацию лечащего врача относительно ожидаемого времени восстановления и уровня причастности любых физических нагрузок или спортивных занятий.
Коронарное шунтирование больных ишемической болезнью сердца: реабилитация и вторичная профилактика: Российские клинические рекомендации

Цена: 250 Р
Год:
2017
Количество страниц:
188
ISBN:
978-5-7982-0374-1
УДК:
616.12-008.46
Копирайт:
© ННПЦССХ им. А.Н. Бакулева, 2017
Аннотация:
РАБОЧАЯ ГРУППА ПО ПОДГОТОВКЕ ТЕКСТА РЕКОМЕНДАЦИЙ
Сопредседатели: Л.А. Бокерия, академик РАН, профессор,
Д.М. Аронов, профессор
Члены рабочей группы:
- О.Л. Барбараш, чл.-корр. РАН, профессор (Кемерово),
- М.Г. Бубнова, профессор (Москва),
- Т.А. Князева, профессор (Москва),
- Н.П. Лямина, профессор (Саратов),
- В.Е. Маликов, профессор (Москва),
- Н.К. Новикова, к.п.н. (Москва),
- Л.В. Петрунина, к.м.н. (Москва),
- М.А. Арзуманян, к.м.н. (Москва),
- А.Н.Сумин, профессор (Кемерово),
- Г.А. Чумакова, профессор (Барнаул)
Комитет экспертов:
- Р.С. Акчурин, академик РАН, профессор (Москва),
- М.М. Алшибая, профессор (Москва),
- Д.М. Аронов, профессор (Москва),
- Л.С. Барбараш, академик РАН, профессор (Кемерово),
- О.Л. Барбараш, чл.-корр. РАН, профессор (Кемерово),
- С.А. Бойцов, чл.-корр. РАН, профессор (Москва),
- Л.А. Бокерия, академик РАН, профессор (Москва),
- С.А. Болдуева, профессор (Санкт-Петербург),
- М.Г. Бубнова, профессор (Москва),
- Ю.И. Бузиашвили, академик РАН, профессор (Москва),
- А.С. Галявич, профессор (Казань),
- М.Г. Глезер, профессор (Москва),
- М.Л. Гордеев, профессор (Санкт-Петербург),
- В.П. Зайцев, профессор (Москва),
- Г.Е. Иванова, профессор (Москва),
- Д.Г. Иоселиани, академик РАН, профессор (Москва),
- Р.С. Карпов, академик РАН, профессор (Томск),
- Т.А. Князева, профессор (Москва),
- Н.П. Лямина, профессор (Саратов),
- В.П. Мазаев, профессор (Москва),
- В.Е. Маликов, профессор (Москва),
- А.И. Мартынов, академик РАН, профессор (Москва),
- В.Ю. Мерзляков, д.м.н. (Москва),
- О.Ф. Мисюра, к.м.н. (Санкт-Петербург),
- Н.Б. Перепеч, профессор (Санкт-Петербург),
- А.Н. Репин, профессор (Томск),
- М.Я. Руда, профессор (Москва),
- И.Ю. Сигаев, профессор (Москва),
- А.Б. Смулевич, академик РАН, профессор (Москва),
- А.Л. Сыркин, профессор (Москва),
- Е.И. Чазов, академик РАН, профессор (Москва),
- И.Е. Чазова, академик РАН, профессор (Москва),
- Г.А. Чумакова, профессор (Барнаул),
- Е.В. Шляхто, академик РАН, профессор (Санкт-Петербург),
- С.С. Якушин, профессор (Рязань)
Как купить
Содержание:
Список сокращений
1. Введение
1.1. Кардиологическая реабилитация: определение, значение в улучшении течения ишемической
болезни сердца и снижении летальности
1.2. Краткий обзор прежней государственной системы поэтапной реабилитации больных с острым
инфарктом миокарда и перенесших коронарное шунтирование
1.3. Организационные принципы современной системы кардиологической реабилитации в России
1.3.1. Этапность кардиореабилитации
1.3.2. Мультидисциплинарность реабилитационного процесса
1.3.3. Реабилитационный потенциал
1.4. Критерии доказательности предлагаемых утверждений
2. Реабилитация больных ишемической болезнью сердца после коронарного шунтирования
2.1. Коронарное шунтирование: актуальность и основные цели
2.2. Реабилитация при коронарном шунтировании: эффективность и нерешенные проблемы
3. Методология поэтапной реабилитации после коронарного шунтирования
3.1. Физический аспект реабилитации
3.2. Преабилитация
3.2.1. Информационная и психологическая подготовка больного ишемической болезнью сердца
к операции коронарного шунтирования
3.2.2. Возможности предоперационной физической тренировки больного
3.2.3. Рекомендации по предоперационной подготовке респираторной системы и предоперационной
тренировке больных ишемической болезнью сердца перед проведением коронарного
шунтирования
3.2.3.1. Задачи предоперационной тренировки больных
3.2.3.2. Применение побудительной спирометрии для тренировки дыхательной мускулатуры
3.2.3.3. Тренажеры для тренировки дыхательной мускулатуры
3.2.4. Применение лечебной физкультуры для тренировок дыхательной мускулатуры
3.2.4.1. Применение статических дыхательных упражнений
3.2.4.2. Применение динамических дыхательных упражнений
3.2.4.3. Методика диафрагмального дыхания
3.2.4.4. Методика продуктивного кашля
3.2.5. Методика вибрационного массажа грудной клетки
3.2.5.1. Мануальные методики вибромассажа
3.2.5.2. Методика проведения вибротерапии с использованием вибромассажера
3.3. Классификация больных по тяжести клинического состояния
4. Этапы реабилитации после коронарного шунтирования и система двигательной активности
4.1. Первый этап реабилитации (в отделении кардиохирургии)
4.1.1. Первая ступень двигательной активности первого этапа
4.1.2. Вторая ступень двигательной активности первого этапа
4.1.3. Выписка больного из кардиохирургического стационара
4.2. Второй этап кардиореабилитации после коронарного шунтирования в стационаре центра кардиореабилитации
4.2.1. Общие вопросы второго этапа
4.2.2. Третья ступень двигательной активности второго этапа
4.2.3. Четвертая ступень двигательной активности второго этапа
4.2.4. Пятая ступень двигательной активности второго этапа
4.3. Третий, амбулаторный (поликлинический), этап кардиореабилитации после коронарного шунтирования
4.3.1. Ранний подэтап амбулаторной кардиореабилитации
4.3.2. Поздний подэтап амбулаторной кардиореабилитации
4.3.3. Функциональные пробы
4.3.4. Программы физических тренировок в реабилитации больных после коронарного шунтирования
4.3.4.1. Роль лечебной гимнастики
4.3.4.2. Тренировка на велотренажере
4.3.4.3. Дозированная ходьба
4.3.4.4. Статические нагрузки
4.3.4.5. Резистивные тренировки
4.4. Инструкция в связи с наличием стернальной раны
5. Образовательная программа для больных, перенесших коронарное шунтирование
5.1. Задачи образовательной «Школы для больных ИБС, перенесших КШ, и их родственников»
5.2. Методы работы в образовательной «Школе для больных ИБС, перенесших КШ, и их родственников»
6. Медикаментозная терапия при коронарном шунтировании: пред-, послеоперационная и во вторичной профилактике
6.1. Антиагрегационная терапия
6.1.1. Предоперационная антиагрегационная терапия
6.1.2. Послеоперационная антиагрегационная терапия
6.1.3. Пероральные антикоагулянты
6.2. Гиполипидемическая терапия
6.3. Бета-адреноблокаторы
6.4. Ингибиторы АПФ/БРА
6.5. Другие средства
6.5.1. Антагонисты кальция
6.5.2. Метаболические миокардиальные цитопротекторы
6.5.3. Ингибиторы If-каналов синусного узла
6.5.4. Антагонисты минералокортикоидных рецепторов
6.6. Профилактика послеоперационной фибрилляции предсердий
7. Общие аспекты вторичной профилактики
7.1. Курение
7.2. Питание
7.3. Контроль массы тела
7.4. Контроль артериального давления
7.5. Контроль гликемии
<8. Психологический аспект реабилитации
8.1. Влияние эмоциональных расстройств на результаты коронарного шунтирования
8.2. Послеоперационный делирий
8.3. Послеоперационные когнитивные нарушения
9. Методы физио- и бальнеотерапии в реабилитации после коронарного шунтирования
9.1. Усиленная наружная контрпульсация
9.2. Аппаратная физиотерапия
9.2.1. Низкоинтенсивное лазерное излучение
9.2.2. Синусоидальные модулированные токи
9.2.3. Низкочастотное магнитное поле
9.3. Бальнеотерапия
9.3.1. «Суховоздушные» углекислые ванны
9.3.2. Воздушно-радоновые ванны
9.4. Лечебный массаж
10. Санаторно-курортное лечение после коронарного шунтирования
11. Восстановление сексуальной активности после перенесенного коронарного шунтирования
11.1. Влияние коронарного шунтирования на сексуальную активность
11.2. Сексуальная активность и риск сердечно-сосудистых осложнений
11.3. Сексуальная активность и обучение пациента
11.4. Сексуальная активность и психологический аспект
11.5. Фармакотерапия при сексуальной дисфункции
12. Оценка трудоспособности и трудоустройство пациентов после коронарного шунтирования
12.1. Нормативно-правовая база и медико-социальная экспертиза
12.2. Степень нарушения трудоспособности
12.3. Сроки возобновления трудовой деятельности и длительность инвалидности в зависимости от группы
физической активности
13. Приложение. Сокращенный вариант пособия для инструктажа больного перед операцией коронарного шунтирования
14. Приложения. Комплексы ЛФК и схемы физических тренировок
14.1. Примерный комплекс ЛФК № 1 (строгий постельный режим)
14.2. Примерный комплекс ЛФК № 2 (расширенный постельный режим)
14.3. Примерный комплекс ЛФК № 3 (палатный и свободный режимы)
14.4. Примерный комплекс ЛФК № 4
14.5. Примерный комплекс ЛФК № 5
14.6. Примерная схема физических тренировок больных после коронарного шунтирования в
подготовительном периоде поликлинического этапа
14.7. Примерная схема физических тренировок больных после коронарного шунтирования в основном
периоде поликлинического этапа
14.8. Примерная схема физических тренировок больных после коронарного шунтирования в
поддерживающем периоде поликлинического этапа
Литература
Не знаете, с чего начать? Оставьте нам заявку, сотрудники Booking Health организуют для вас поездку для лечения в Германии, цель которой — улучшение качества жизни и укрепление здоровья
Обратиться в Booking Health
В настоящее время, в связи со сложностями, связанными с организацией лечения в Турции, Швейцарии, Южной Корее и Индии, мы приостановили обработку заявок по этим направлениям.
Если вас интересует организация лечения в Германии, оставьте, пожалуйста, заявку, и наши специалисты свяжутся с вами в ближайшее время.
Аортокоронарное шунтирование (АКШ) – операция на сердце, направленная на восстановление нормального кровоснабжения сердца путем создания «новых сосудов» в обход поврежденных, не способных обеспечивать достаточную перфузию артериальной крови.
Благодаря современному оборудованию и высокой квалификации врачей, ведущие позиции в проведении аорто-коронарного шунтирования (АКШ) занимают такие клиники:
- Университетская клиника Ольденбург, отделение кардиохирургии.
- Клиника кардиохирургии Карлсруэ, отделение кардиохирургии.
- Университетская клиника Ульма, отделение кардиоторакальной хирургии.
Стоимость медицинской программы будет зависеть от объема предварительного обследования и выбранной тактики лечения. Средгие цены на АКШ представлены ниже:
- Лечение ИБС, стенокардии методом аортокоронарного шунтирования – 38 040 €
- Коронарография и аортокоронарное шунтирование (АКШ) – 38 370 €
- Аортокоронарное шунтирование (АКШ) с заменой сердечного клапана – 58 700 €
Операция АКШ позволяет устранить симптомы ишемической болезни сердца и предотвратить инфаркт миокарда. Поговорим о том, что такое АКШ в кардиологии.
Содержание
- Показания
- Противопоказания
- Как проводится операция?
- Восстановление после АКШ на сердце
- Жизнь после АКШ на сердце
- Где лучше делать АКШ?
Показания
АКШ – операция, которая требуется в первую очередь пациентам с тяжелой стенокардией, резистентной к медикаментозной терапии. Кроме того, хирургическое лечение может быть рекомендовано и при отсутствии симптомов. Существует безболевая ишемия миокарда, которая не менее опасна. Она не ощущается пациентом, но может быть диагностирована с помощью ЭКГ и холтеровского мониторирования.
Показания к АКШ могут быть определены и при помощи коронарографии. Это рентгенологическое исследование, при котором в артерии сердца вводится контраст. Основной причиной смертности от ишемической болезни является атеросклероз и нарушение целостности атеросклеротической бляшки. Кровеносный сосуд надрывается, в месте повреждения формируется тромб. Он закупоривает венечную артерию, результатом чего становится инфаркт миокарда.
Коронарография позволяет определить больших размеров препятствия на пути кровотока (атеросклеротические бляшки) и оценить риск острых сердечно-сосудистых событий. Высокая степень поражения коронарных артерий требует проведения АКШ сердца.
По итогам коронарографии основные показания к АКШ это:
- Сужение просвета любой коронарной артерии на 75% и более
- Уменьшение просвета ствола левой коронарной артерии на 50% и более
Оценивается также расположение стеноза (нарушения проходимости) коронарных артерий. Чем оно проксимальнее (ближе к сердцу), тем хуже кровоснабжение миокарда. Наиболее успешной будет операция АКШ на сердце, если дальше сужения наблюдается нормальная циркуляция крови.
Подобрать профильную клинику и лечение
Противопоказания
Аортокоронарное шунтирование (АКШ) может не проводиться пациентам даже в случае, когда к хирургическому вмешательству имеются показания. Виной тому может стать наличие противопоказаний. Это заболевания и состояния организма, которые делают операцию слишком опасной или безрезультатной.
Основные противопоказания к АКШ на сердце:
- Снижение фракции выброса левого желудочка до 30%
- Застойная сердечная недостаточность
- Нарушение кровотока во всех коронарных артериях
- Тяжелые сопутствующие заболевания
В случае нарушения кровообращения во всех коронарных артериях предпочтение отдают лазерной реваскуляризации миокарда или клеточной терапии.
Как проводится операция?
Операция может проводиться с использованием аппарата искусственного кровообращения. Кроме того, в развитых странах, включая Германию, все чаще применяется АКШ на работающем сердце.
Суть хирургического вмешательства состоит в том, чтобы создать для движения крови обходной путь. Для этого создаются шунты – дополнительные сосуды, которые выходят из аорты и впадают в коронарные артерии – дальше уровня сужения. В качестве протезов используются собственные вены или артерии человека. Это может быть большая подкожная вена или лучевая артерия.
Обычно создается 3 шунта – для наиболее крупных коронарных артерий:
- Передней межжелудочковой
- Огибающей
- Правой
У 20% пациентов устанавливается 4-8 анастомозов. Более предпочтительной является АКШ (аортокоронарное шунтирование) на работающем сердце.
Преимущества следующие:
- Не повреждаются клетки крови
- Реабилитация после АКШ проходит быстрее
- Операция имеет меньшую продолжительность
В этом случае осложнения после АКШ на сердце встречаются реже. Потому что отсутствует риск тех из них, что напрямую связаны с применением аппарата искусственного кровообращения. Это отёк лёгких, эмболические поражения сосудов головного мозга или почек, гипоксия (кислородное голодание) внутренних органов.
Восстановление после АКШ на сердце
Непосредственно после хирургического вмешательства пациент определенное время находится на искусственной вентиляции легких. А после восстановления естественного дыхания требуется профилактика застойных явлений. Для этого пациенту предлагается несколько десятков раз за день надувать резиновые шарики. В результате лёгкие расправляются.
Восстановление после АКШ на открытом сердце предполагает уход за послеоперационной раной. Разрез проходит посередине грудины. Кроме того, имеется повреждение на нижних конечностях – там, где врач брал материал для шунтирования (большую подкожную вену). Раны кожи заживают через 1-2 недели. После этого человеку разрешают мыться в душе.
Бандаж после АКШ является не обязательной, но предпочтительной мерой, позволяющей снизить риск расхождения швов грудины. В то время как кожа заживает в среднем за 10 дней, кость срастается несколько месяцев. Часто пациенты спрашивают, сколько носить бандаж после АКШ. Обычно его используют в течение 4-6 месяцев.
Аритмия после АКШ должна отсутствовать. Если она возникает, то не является следствием операции. Аритмий существует большое количество. Некоторые могут быть вызваны ишемией миокарда, другие – самостоятельными патологиями, третьи – перенесенным инфарктом миокарда. Обычно ритм сердца нормализуется после операции за счет улучшения кровоснабжения сердечной мышцы.
Последствия операция АКШ оценивают через 2-3 месяца после её проведения. К этому времени стенокардия уже не должна беспокоить пациента. Человеку назначают нагрузочный тест и снимают ЭКО, чтобы понять, насколько улучшилось кровоснабжение миокарда. Если боли после АКШ при физической нагрузке отсутствуют, операция считается успешной.
Восстановление после АКШ можно проводить в клинике, в санатории или дома. Естественно, наиболее успешной реабилитация будет под руководством специалиста. Но некоторые пациенты проходят реабилитацию после АКШ в домашних условиях, что обычно связано с желанием сэкономить. Если на качественное восстановление денег нет, нужно заниматься собой самостоятельно. Очень важны упражнения после АКШ. Начать нужно с ходьбы – хотя бы по 1 километру в сутки. Затем – постепенно увеличивать нагрузку.
Часто пациенты спрашивают, когда можно спать на боку после АКШ. Ложиться на бок можно практически сразу, если вам так удобно. Большинство врачей не запрещают это своим пациентам, так как на результатах операции сон на боку не сказывается.
Подобрать профильную клинику и лечение
Жизнь после АКШ на сердце
После АКШ жизнь человека меняется только в лучшую сторону. Полное восстановление занимает около 6 месяцев. За это время срастается грудина и повышается толерантность к физическим нагрузкам. Инвалидность после АКШ сердца не выдается. Более того, инвалидность после АКШ могут снять, если вы снова стали трудоспособным человеком. А в случае успеха операции и отсутствия сопутствующей патологии, это так и случится.
Несколько важных вопросов, которыми часто интересуются пациенты относительно образа жизни после операции:
- Душ – разрешен через 10 дней после операции (плюс-минус 2 дня), если зажила кожная рана
- Баня после АКШ сердца – разрешена через 2-3 месяца, когда вы пройдете контрольное обследование (потому что перепады температур могут спровоцировать спазм коронарных артерий и приступ стенокардии)
- Алкоголь после АКШ разрешен умеренных количествах после периода раннего послеоперационного восстановления
- Курение – запрещено, потому что ведет к сужению коронарных сосудов и повышает риск их атеросклеротического поражения
- Гимнастика после АКШ – проводится под руководством специалиста по лечебной физкультуре, требуется для укрепления сердечной мышцы и улучшения толерантности к физическим нагрузкам
- Диета после АКШ сосудов сердца – является желательной, но не обязательной (можно снизить потребление животных жиров, чтобы уменьшить риск возникновения атеросклеротических бляшек в местах, где их ещё нет)
Проведенная хирургическая операция не дает вам гарантии отсутствия стенокардии или инфаркта миокарда в будущем. Потому что АКШ лишь позволяет обойти суженные участки сосудов. Но через несколько лет могут появиться новые атеросклеротические бляшки. Поэтому важно придерживаться здорового образа жизни и принимать назначенные врачом препараты.
Где лучше делать АКШ?
Аортокоронарное шунтирование делают во всем мире. Многие жители СНГ делают АКШ в Москве. Часто жители развивающихся стран стремятся выехать за границу для проведения операции. Потому что она весьма опасна, требует длительного восстановления. А более качественная операция обеспечивает лучшие результаты лечения и менее болезненный реабилитационный период.
Жители многих стран отправляются на операцию АКШ в Штаты. Там медицина действительно качественная, но очень дорогая. Дешевле делать АКШ в Израиле. Мы же рекомендуем Германию. Это «золотая середина» – немецкие клиники способны обеспечить столь же высокое качество медицинских услуг, что и США, но приехать сюда на лечение проще, да и услуги врачей обходятся дешевле.
Основные преимущества проведения аортокоронарного шунтирования в Германии:
- Хирургическая операция проводится на работающем сердце, если это возможно с учетом клинической ситуации
- В Германии работают лучшие врачи – они съезжаются сюда со всего мира, чтобы получить медицинскую практику. А при выполнении АКШ немалую роль играет квалификация кардиохирурга
- Немецкие клиники оборудованы по последнему слову техники
- После операции человеку обеспечивается качественный уход и медикаментозная поддержка, что улучшает переносимость раннего послеоперационного периода
- Возможность прохождения качественной реабилитации, которая вернет человеку прежний образ жизни и восстановит трудоспособность
Безопасную и эффективную операцию на аорте можно пройти в Клинике Гелиос Крефельд – медицинском центре максимального обеспечения, непрерывно сотрудничающем с ведущими университетами и научно-исследовательскими центрами мира. Отделение взрослой и детской кардиохирургии под руководством профессора, доктора медицины Юргена Эннкера имеет ряд собственных разработок в сфере хирургических вмешательств на грудном и брюшном отделах аорты. Это аортокоронарное шунтирование с применением минимизированного экстракорпорального кровообращения (используется специальный аппарат искусственного кровообращения), аортокоронарное шунтирование на работающем сердце и минимально инвазивное прямое шунтирование коронарных артерий. Также в отделении применяются гибридные эндопротезы грудного и брюшного отделов аорты, проводятся классические реконструктивные вмешательства с установкой саморасширяющихся стентов. При этом специалисты отделения проводят как первичные, так и более сложные ревизионные вмешательства у пациентов всех возрастов.
Лечение в Германии для вас может организовать компания Booking Health. Мы давно работаем на рынке медицинского туризма, поэтому сможем подобрать для вас лучшую клинику. Вы будете лечиться у самых авторитетных немецких специалистов.
Благодаря нашей помощи вы сможете сэкономить до 70% от общих расходов на лечение и его организацию. У нас заключены прямые договора со всеми крупными клиниками Германии. Для лечения вам не придется оформлять страховку для иностранных пациентов. Вы получите страховку Booking Health, которая покроет все непредвиденные медицинские расходы в период лечения и в течение 4 лет после него.
Обратиться в Booking Health
Выбирайте лечение за рубежом и Вы, несомненно, получите отличный результат!
Авторы:
Статья составлена под редакцией экспертов в области медицины, врачей-специалистов Доктор Надежда Иванисова, Доктор Вадим Жилюк. Для лечения состояний, о которых идет речь в статье, необходимо обратиться к врачу; информация в статье не предназначена для самолечения!
Источники:
National Center for Biotechnology
American Heart Association
American College of Cardiology
Читайте:
Почему Booking Health – Вопросы и ответы
Как не ошибиться в выборе клиники и специалиста
7 причин доверять рейтингу клиник на сайте Booking Health
Уникальные методики по лечению псориаза в мировых клиниках
Отправить запрос на лечение