Содержание
- Что такое итраконазол для собак?
- Использование итраконазола у собак
- Дозировка итраконазола для собак
- Противопоказания итраконазола для собак
- Побочные эффекты итраконазола для собак
Итраконазол — это противогрибковый препарат, который поэтому используется для лечения различных заболеваний, вызванных грибками и дрожжами. Но итраконазол для собак может назначать только ветеринар, который является профессионалом, отвечающим за оценку, диагностику и назначение наиболее подходящего лечения.
В этой статье Better-Pets.net мы объясним использование итраконазола у собак, а также его инструкцию по применению и противопоказания, которые следует учитывать. Продолжай читать!
Что такое итраконазол для собак?
Итраконазол — это системный противогрибковый, что означает, что он действует против грибков, вводимых перорально. Это производное триазола, которое начали использовать недавно, в 1990-х годах. В частности, оно действует, прерывая синтез грибковой мембраны. Это полезно против Malassezia, Candida, Histoplasma capsulatum, Криптококк, Бластомицеты, Sporothrix или Кокцидиоды.
Он считается эффективным лекарством, потому что до сих пор резистентность грибов к азолам развивается медленно. Кроме того, итраконазол хорошо усваивается организмом, и после перорального приема его максимальная концентрация достигается через несколько часов. В значительном количестве он достигает кожи и ногтей и сохраняется в тканях в течение нескольких недель. Он всасывается в тонком кишечнике, метаболизируется в печени и выводится с мочой и желчью. Итраконазол для собак можно найти в таблетках или суспензии. Наконец, обратите внимание, что дрожжи — это разновидности грибов, поэтому их можно лечить такими лекарствами, как итраконазол.
Использование итраконазола у собак
Итраконазол используется для лечения грибковые заболевания. Они также известны под именем дерматофития когда они поражают кожу. Дерматофиты — это грибы, которые располагаются на коже, волосах или ногтях и питаются кератином. Стригущий лишай — хорошо известный пример дерматофитии. Дрожжевые инфекции Malassezia они также поддаются лечению итраконазолом. С другой стороны, грибки могут вызывать заболевания легких, горла, рта и т. Д.
Системное введение итраконазола, в данном случае перорально, увеличивает скорость выздоровления по сравнению с местным лечением, которое может быть назначено в некоторых случаях. К тому же оба варианта можно комбинировать по усмотрению ветеринара. То есть можно назначить итраконазол внутрь вместе с шампунем с противогрибковым действием для местного применения.
Имейте в виду, что некоторые грибы могут передаваться другим животным, включая человека. По этой причине, когда мы подозреваем появление болезни грибкового происхождения, мы должны обратиться к ветеринару. Хотя более легкие случаи могут разрешиться сами собой в течение нескольких месяцев, хорошая диагностика и раннее лечение позволяют избежать осложнений и передачи инфекции. Необходимые гигиенические меры также должны быть выполнены как можно скорее. Таким образом не только излечивается пораженная собака, но и предотвращается распространение грибка и потенциальные инвазии среди других членов семьи. В некоторых случаях необходимо заботиться не только о собаке, но и об окружающей среде.
Дозировка итраконазола для собак
Чтобы определить дозу, ветеринарный врач, поскольку только этот профессионал может назначать собакам итраконазол, будет учитывать болезнь собаки и ее вес, а также товарный вид препарата. Например, для борьбы Malassezia Итраконазол в дозе 5 мг на кг массы тела можно вводить перорально один раз в день или дозу, разделенную на каждые 12 часов.
Как правило, эти процедуры являются продолжительными, превышая Продолжительность 3-4 недели, в зависимости от эволюции. Введение может быть прерывистым, через несколько недель, то есть давать его несколько дней подряд, давать отдых другим и возобновлять лечение. Конечно, всегда в соответствии с критериями и под контролем ветеринара. Только этот специалист может решить, когда закончить лечение и выписать нас. Что касается приема, то таблетки выдаются просто после еды или с ней для лучшего впитывания.
В этой другой статье мы объясним, как дать собаке таблетки.
Противопоказания итраконазола для собак
В качестве меры предосторожности итраконазол не следует назначать беременным сукХотя побочные эффекты для щенков на дрессировке были продемонстрированы только на мышах и при очень высоких дозах. Также не рекомендуется в период кормления грудью.
С другой стороны, итраконазол не рекомендуется при собаки с печеночной недостаточностью. Если собака уже лечится каким-либо другим препаратом, и ветеринар не знает об этом, об этом необходимо сообщить в случае возникновения нежелательных взаимодействий между ними. Конечно, собакам, у которых ранее наблюдалась побочная реакция на итраконазол, не следует использовать его повторно.
Побочные эффекты итраконазола для собак
Итраконазол считается препаратом с большим запасом прочности. Это значит, что не вызывает побочных эффектовдаже если рекомендованная доза превышена. Фактически, это лекарство начали назначать, потому что оно достигло эффективности с большей безопасностью, поскольку остальные наиболее часто назначаемые противогрибковые средства вызывали расстройства пищеварения, особенно при более длительном лечении.
Введенная доза и продолжительность лечения считаются определяющими при появлении побочных эффектов. Таким образом, до сих пор не сообщалось об умеренном зуде и тошноте. Однако следует отметить, что относительно недавнее использование итраконазола может повлиять на текущие знания о его возможных эффектах.
Эта статья носит чисто информативный характер, у нас на Better-Pets.net нет полномочий назначать ветеринарное лечение или ставить какой-либо диагноз. Мы приглашаем вас отвезти вашего питомца к ветеринару в случае, если у него есть какие-либо заболевания или дискомфорт.
Если вы хотите прочитать больше статей, похожих на Итраконазол для собак — дозировка, применение и побочные эффекты, рекомендуем вам зайти в наш раздел «Лекарства».
Список используемой литературы
- ЭСККАП. (2015). Контроль поверхностных микозов у собак и кошек. Руководство № 2.
- Факультет ветеринарии и животноводства. (2000). Дерматомикоз Фармакологические и терапевтические аспекты. Монографии по ветеринарной медицине, т. 20. №1.
- Фернандес, Хесус. (2000). Оценка применения итраконазола при лечении дерматофитозов собак и кошек. Мадридский университет Комплутенсе.
Инструкция по применению итраконазола в ветеринарной медицине. Рассчитайте оптимальную дозу препарата. Изучите широту антимикотического эффекта итраконазола для кошек и собак. Улучшите эффективность терапии животных на 200% с помощью Интраконазола
Торговые названия, бренды и дженерики. Препарат можно купить в гуманных аптеках
- Итразол
- Румикоз
- Ирунин
- Орунгал
- Орунгамин
- Итраконазол
- Интраконазол-ратиофарм
- Текназол
- Кандитрал
- Орунит
- Итрамикол
- Миконихо
- Интраконазол пеллеты
Физикохимические свойства итраконазола
Физико-химические свойства синтетический противогрибковый препарат из группы производных триазола; по структуре близок к флуконазолу ,широко используется в ветеринарии.
Молекулярная масса равна 706.
Фармакология итраконазола у животных
Фармакологическое действие — итраконазол является фунгистатическим веществом из группы производных триазола , которые, как и имидазолы (клотримазол, кетоконазол и др.), действуют главным образом путем изменения структуры клеточных мембран чувствительных к препарату грибов, что повышает проницаемость мембран и позволяет содержимому клетки просачиваться из нее, а также препятствует поглощению предшественников производных пурина и пиримидина.
Итраконазол обладает активностью в отношении ряда патогенных грибов, включая дрожжевые грибки и дерматофиты, вызывающих патологии у собак, кошек и других видов животных. Исследования, проведенные in vivo с использованием лабораторных моделей, показали, что итраконазол оказывает фунгистатическое действие в отношении многих штаммов патогенных грибов:
- Candida
- Aspergillus
- Cryptococcus
- Histoplasma
- Trypanosoma cruzi
- Blastomyces
Применение итраконазола в ветеринарной медицине
Итраконазол применяют для лечения системных микозов животных, включая аспергиллез, менингит, вызванный криптококковой инфекцией, бластомикоз и гистоплазмоз. Итраконазол (в отличие от кетоконазола) не оказывает существенного воздействия на синтез гормонов и у мелких видов животных вызывает меньше побочных эффектов, чем кетоконазол.
Лошадям итраконазол можно рекомендовать для лечения споротрихозов и остеомиелитов, вызванных Coccidioides immitis.
Фармокинетика препарата
Фармакокинетика. У кошек, собак и других животных абсорбция итраконазола в высокой степени зависит от pH содержимого желудка у животного и от наличия в нем корма. При поступлении препарата натощак биодоступность составляет лишь 50% или даже меньше, тогда как в присутствии корма достигает 100%.
Интраконазол в организме животных обладает очень высокой способностью к связыванию с белками, в значительной степени распределяется по всему организму, особенно в ткани, богатые липидами (препарат очень липофилен).
Концентрация итраконазола в коже, женской репродуктивной системе и гное у собак, кошек и других видов животных выше его концентрации в сыворотке крови. В цереброспинальной, внутриглазной жидкости и в секрете слюнных желез у животных итраконазол обнаруживается в минимальной конвентрации.
Итраконазол у кошек и собак метаболизируется в печени до многих метаболитов, в том числе гидроксиитраконазола, являющегося активным. У человека период полувыведения из сыворотки крови составляет 21—64 ч. Элиминация у животных, вероятно, характеризуется насыщением.
Противопоказания к применению интаконазола у домашних животных
Влияние на репродукцию. Согласно инструкции по применению, итраконазол не следует применять животным, имеющим повышенную чувствительность к нему или к другим азольным противогрибковым препаратам; животным с нарушением функции печени или ахлоргидрией (гипохлоргидрией) итраконазол назначают только в том случае, если эффективность лечения превалирует над риском возникновения побочных явлений.
У лабораторных животных интраконазол в высоких дозах (в 5—20 раз выше рекомендованных) оказывал дозозависимые токсические эффекты у самок, проявлял фетотоксичность и тератогенность. Безопасность применения препарата во время беременности не установлена, поэтому назначать его в этом случае можно, только если эффективность лечения превалирует над вероятным риском. Итраконазол проникает в материнское молоко, но значение этого факта не выяснено.
Побочные эффекты итраконазола у кошек, собак и других видов животных
Предупреждения у собак, вероятно, наиболее серьезным побочным действием препарата является его гепатотоксичность. Примерно у 10% собак, получавших итраконазол в дозе 10 мг/кг/день, и у 5% собак, получавших по 5 мг/кг/день, была выявлена значительная гепатотоксичность, требующая немедленного прекращения введения препарата (по меньшей мере, временного). Повреждение печени сопровождаются значительным усилением активности АЛТ. Симптоматическим показателем токсичности также часто является анорексия, появляющаяся обычно на втором месяце лечения препаратом. У некоторых собак, получающих итраконазол в высоких дозах (по 10 мг/кг/день), могут развиться поражения кожи в виде изъязвлений/васкулит, отек в области конечностей, требующие снижения дозы.
У кошек, вероятно, побочные эффекты дозозависимы. Описаны нарушения со стороны желудочно-кишечного тракта (анорексия, потеря массы тела, рвота), гепатотоксичность (повышение уровня АЛТ, желтушность) и угнетение.
При появлении побочных эффектов и повышении уровня АЛТ у животных применение препарата следует прекратить. Как только уровень АЛТ восстанавливается до нормы и исчезают другие побочные эффекты, при необходимости препарат вновь назначают в более низкой дозе или с удлинением интервала между его введением и обеспечением интенсивного мониторинга.
Передозировка и острая токсичность итраконазола у кошек, собак и других видов животных
Информация, касающаяся острого токсического эффекта при применении итраконазола, очень ограничена. Согласно иснтрукции, пероральное введение антацидов поможет уменьшить абсорбцию. При значительных передозировках следует провести очищение кишечника и при необходимости назначить поддерживающее лечение. Путем диализа итраконазол вывести нельзя.
В результате проведенных исследований на собаках, которым ежедневно в течение 3 месяцев перорально давали итраконазол в дозе 40 мг/кг, никаких явных признаков токсичности выявлено не было.
Лекарственные взаимодействия для наилучшей абсорции итраконазола требуется кислая среда, поэтому антациды, Н2-блокаторы (циметвдин, ранитидин и др.) или диданозин могут вызвать заметное снижение всасывания итраконазола. Диданозин не следует назначать одновременно с итраконазолом, остальные препараты, перечисленные выше, при необходимости можно давать через 2 ч после введения итраконазола.
Итраконазол может увеличить протромбиновое время у кошек, собак и других видов домашних животных , получающих варфарин или другие кумариновые антикоагулянты. Рифампин (рифампицин) может усилить скорость метаболизма итраконазола, поэтому рекомендуется коррекция дозы последнего.
Согласно интсрукции по применению, итраконазол может снизить метаболизм фенитоина или циклоспорина. Ветеринарное значение этого взаимодействия неясно.
Интраконазол при одновременном его назначении с терфенади- ном или ястемизолом может увеличить вероятность возникновения нарушений со стороны сердечно-сосудистой системы, поэтому при необходимости применения итраконазола лучшим вариантом будет использовать другой антигистаминный препарат.
Интраконазол может увеличить концентрацию дигоксина в сыворотке крови животных; рекомендуется мониторинг уровня дигоксина в сыворотке крови.
Согласно инструкции, итраконазол увеличивает концентрацию пероральных антидиабетических препаратов в сыворотке крови у собак и кошек (например, хлорпропамида, глипизида), что может привести к гипогликемии.
Одновременное назначение кетоконазола, итраконазола, внутривенного введения миконазола или тролеандомицина с цизапридом может привести к повышению концентрации последнего с последующей вентрикулярной аритмией. На сегодняшний день производитель утверждает, что цизаприд не следует одновременно назначать с этими препаратами.
Влияние на лабораторные показатели итраконазол может вызвать гипокалиемию или у небольшого процента пациентов повышение результатов при проведении тестов, определяющих функциональное состояние печени.
Дозы интраконазола разным видам животных
Собакам при системных микозах, итраконазол назначают:
- в дозе 5 мг/кг per os 1 -2 раза в день; при быстро прогрессирующих, угрожающих жизни животного заболеваниях следует рассмотреть возможность добавления амфотерицина В;
- в дозе 5 мг/кг per os 1—2 раза в день; автор обычно рекомендует назначение более высокихдоз, но при развитии токсичности дозу необходимо уменьшить.
Дозы итраконазола кошкам при системных микозах , вызванных чувствительными к препарату грибками:
- в дозе 5 мг/кг per os 1-2 раза в день; обычно рекомендуется назначение более высоких доз, но при развитии токсичности дозу необходимо снизить.
При генерализованной дерматофитии у кошек итраконазол применяют в дозе:
- в дозе 10 мг/кг per os 1 раз в день
При системных микозах кошек интраконазол назначают в дозе:
- в дозе 5 мг/кг per os 1-2 раза вдень; при быстро прогрессирующих, угрожающих жизни животного заболеваниях следует рассмотреть возможность добавления амфотерицина.
При системных микозах, генерализованной дерматофитии, поражениях Dematiaceous у кошек применяют итраконазол в дозах:
- в дозах 5-10 мг/кг per os каждые 12-24 часов
Лошадям широко используют препараты итраконазола
При аспергиллезе лошадей итраконазол дают в дозах:
- в дозе 3 мг/кг 2 раза в день.
Метод приготовления суспензии итраконазола предоставлен производителем со следующими предупреждениями в инструкции по применению:
- данные по биодоступности не приводятся;
- применять препарат только в том случае, если других вариантов не имеется.
Содержимое 24 капсул по 100 мг высыпать в стеклянную ступку. Добавить 4—5 мл 95% этилового спирта USP и оставить на 3-4 мин для размягчения. Растереть до густой пасты, после того как спирт испарится, останется порошок. Медленно смешать с 15 мл простого сиропа. Полученную массу перенести в бутылку 60 мл из стекла янтарного цвета и, ополаскивая ступку простым сиропом, довести до 60 мл. Хорошо перемешать и поместить в холодильник. Оставшуюся после использования суспензию через 35 дней выбрасывают.
Узнайте о основных противомикробных препаратах у животных
- Трихопол (Trichopol) для животных
- Инструкция по применению байтрила в ветеринарии
- Метронид (Metronid) для животных (инструкция по применению, дозы, показания и противопоказания)
- Инструкция по применению цефтриаксона в ветеринарии (Ceftriaxone). Изучите широту антибактериального эффекта цефтриаксона у животных
- Изучите широту антибактериального эффекта метрогила у животных
- Инструкция по применению доксициклина у животных. Изучите широту антибактериального эффекта доксициклина у животных. Расчитайте оптимальную дозу препарата ж-ым разных видов. Улучшите эффективность терапии на 140%
- Метронидазол (Metronidazole) для животных (инструкция по применению в ветеринарии, дозы, показания и противопоказания)
- Атоваквон (ATOVAQUONE) для животных
- Азитромицин (Azithromycin) для животных
Параметры для мониторинга лечения животных с помощью препаратов итраконазола
- клиническая эффективность;
- при длительной терапии рекомендовано проведение тестов, определяющих функциональное состояние печени (АЛТ ежемесячно);
- аппетит;
- внешний осмотр при поражениях на коже с изъязвлениями у собак.
Информация для владельца владельцы должны понимать важность соблюдения лечебных рекомендаций ветеринарного врача и при появлении каких-либо побочных эффектов ставить специалиста в известность. Давать препарат с кормом.
Форма выпуска
Медицинские препараты: Итраконазол в капсулах для перорального применения по 100 мг; Sporanot.
Торговые названия, бренды и дженерики
- Ирунин
- Итразол
- Итраконазол
- Итрамикол
- Кандитрал
- Миконихо
- Орунгал
- Орунгамин
- Орунит
- Румикоз
- Текназол
^Наверх
Полезно знать
- Лечение собак с пироплазмозом
- ХартМедин у собак
- Дигоксин у собак и кошек — инструкция к применению в ветеринарной медицине
Итраконазол (Itraconazole) инструкция по применению
📜 Инструкция по применению Итраконазол
💊 Состав препарата Итраконазол
✅ Применение препарата Итраконазол
📅 Условия хранения Итраконазол
⏳ Срок годности Итраконазол
⚠️ Регистрационное удостоверение данного продукта заменено
⚠️ Внимание! Название данного продукта изменилось, новый продукт:
Итраконазол-АКОС
Описание лекарственного препарата
Итраконазол
(Itraconazole)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2011 года, дата обновления: 2022.05.16
Владелец регистрационного удостоверения:
Код ATX:
J02AC02
(Итраконазол)
Лекарственная форма
| Итраконазол |
Капс. 100 мг: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 15, 16, 18, 20, 21, 24, 25, 28, 30, 35, 36 или 42 шт. рег. №: ЛП-000018 |
Форма выпуска, упаковка и состав
препарата Итраконазол
1 шт. — упаковки ячейковые контурные (1) — пачки картонные.
1 шт. — упаковки ячейковые контурные (2) — пачки картонные.
1 шт. — упаковки ячейковые контурные (3) — пачки картонные.
1 шт. — упаковки ячейковые контурные (4) — пачки картонные.
1 шт. — упаковки ячейковые контурные (5) — пачки картонные.
3 шт. — упаковки ячейковые контурные (1) — пачки картонные.
3 шт. — упаковки ячейковые контурные (2) — пачки картонные.
3 шт. — упаковки ячейковые контурные (3) — пачки картонные.
3 шт. — упаковки ячейковые контурные (4) — пачки картонные.
3 шт. — упаковки ячейковые контурные (5) — пачки картонные.
4 шт. — упаковки ячейковые контурные (1) — пачки картонные.
4 шт. — упаковки ячейковые контурные (2) — пачки картонные.
4 шт. — упаковки ячейковые контурные (3) — пачки картонные.
4 шт. — упаковки ячейковые контурные (4) — пачки картонные.
4 шт. — упаковки ячейковые контурные (5) — пачки картонные.
5 шт. — упаковки ячейковые контурные (1) — пачки картонные.
5 шт. — упаковки ячейковые контурные (2) — пачки картонные.
5 шт. — упаковки ячейковые контурные (3) — пачки картонные.
5 шт. — упаковки ячейковые контурные (4) — пачки картонные.
5 шт. — упаковки ячейковые контурные (5) — пачки картонные.
6 шт. — упаковки ячейковые контурные (1) — пачки картонные.
6 шт. — упаковки ячейковые контурные (2) — пачки картонные.
6 шт. — упаковки ячейковые контурные (3) — пачки картонные.
6 шт. — упаковки ячейковые контурные (4) — пачки картонные.
6 шт. — упаковки ячейковые контурные (5) — пачки картонные.
7 шт. — упаковки ячейковые контурные (1) — пачки картонные.
7 шт. — упаковки ячейковые контурные (2) — пачки картонные.
7 шт. — упаковки ячейковые контурные (3) — пачки картонные.
7 шт. — упаковки ячейковые контурные (4) — пачки картонные.
7 шт. — упаковки ячейковые контурные (5) — пачки картонные.
Фармакологическое действие
Синтетическое противогрибковое средство широкого спектра действия. Производное триазола. Подавляет синтез эргостерола клеточной мембраны грибов. Активен в отношении дерматофитов (Trichophyton spp., Microsporum spp., Epidermophyton floccosum), дрожжевых грибов Candida spp. (включая Candida albicans, Candida parapsilosis), плесневых грибов (Cryptococcus neoformans, Aspergillus spp., Trichosporon spp., Geotrichum spp., Penicillium marneffei, Pseudallescheria boydii, Histoplasma spp., Coccidioides immitis, Paracoccidioides braziliensis. Sporothrix schenckii, Fonsecaea spp.. Cladosporium spp., Blastomyces dermatidis), Stalassezia spp.
Некоторые штаммы могут быть устойчивы: Candida glabrata, Candida krusei, Candida tropicalis, Absidia spp., Fusarium spp., Mucor spp., Rhizomucor spp., Rhizopus spp., Scedosporium proliferans, Scopulariopsis spp.
Эффективность лечения оценивается через 2-4 недели после прекращения терапии (при микозах), через 6-9 месяцев — при онихомикозах (по мере смены ногтей).
Фармакокинетика
Всасывается из желудочно-кишечного тракта (ЖКТ) достаточно полно. Прием итраконазола в капсулах сразу после еды увеличивает биодоступность. Прием его в виде раствора натощак приводит к более высокой скорости достижения Cmax и большей величине концентрации равновесной фазы (Css) по сравнению с приемом после еды (на 25%).
Время достижения Cmax при приеме капсул — около 3-4 ч. Css при приеме 100 мг препарата 1 раз в сут – 0.4 мкг/мл; при приеме 200 мг 1 раз в сут -1.1 мкг/мл, 200 мг 2 раза в сут — 2 мкг/мл.
Время достижения Cmax при приеме раствора — около 2 ч при приеме натощак и 5 ч — после еды. Время наступления Css в плазме при длительном применении — 1-2 недели. Связь с белками плазмы — 99.8%.
Хорошо проникает в ткани и органы (в т.ч. в слизистую оболочку влагалища), содержится в секрете сальных и потовых желез. Концентрация итраконазола в легких, почках, печени, костях, желудке, селезенке, скелетных мышцах в 2-3 раза превышает его концентрацию в плазме; в тканях, содержащих кератин, — в 4 раза. Терапевтическая концентрация итраконазола в коже сохраняется в течение 2-4 недель после прекращения 4 недельного курса лечения. Терапевтическая концентрация в кератине ногтей достигается через 1 неделю после начала лечения и сохраняется в течение 6 месяцев после завершения 3 месячного курса лечения. Низкие концентрации определяются в сальных и потовых железах кожи. Метаболизируется в печени с образованием активных метаболитов, в т. ч. гидроксиитраконазола. Является ингибитором изоферментов CYP3A4, CYP3A5 и CYP3A7.
Выведение из плазмы — двухфазное: почками в течение 1 недели (35% в виде метаболитов, 0.03%— в неизмененном виде) и через кишечник (3-18% в неизмененном виде). T1/2 — 1-1.5 дня. Не удаляется при проведении диализа.
Показания препарата
Итраконазол
Вульвовагинальный кандидоз; дерматомикоз, разноцветный лишай, кандидоз слизистой оболочки полости рта, кератомикоз; онихомикоз, вызванный дерматофитами или дрожжеподобным грибами; системные микозы — системный аспергиллез или кандидоз, криптококкоз (в т.ч. криптококковый менингит) у иммунокомпрометированных лиц и криптококкоз центральной нервной системы независимо от иммунного статуса при неэффективности терапии 1-й линии; гистоплазмоз, бластомикоз, споротрихоз, паракокцидиоидоз; прочие редко встречающиеся системные и тропические микозы.
Режим дозирования
Внутрь. Сразу после еды. Капсулы проглатывают целиком.
Выведение препарата итраконазол из кожи и ногтевой ткани осуществляется медленнее, чем из плазмы. Таким образом, оптимальные клинические и микологические эффекты достигаются через 2-4 недели после окончания лечения при инфекциях кожи и через 6-9 месяцев после окончания лечения ногтевых инфекций. Продолжительность лечения может быть скорректирована в зависимости от клинической картины лечения:
- при вульвовагинальном кандидозе — 200 мг 2 раза в сут в течение 1 дня или 200 мг 1 раз в сут в течение 3 дней;
- при дерматомикозах — 200 мг 1 раз в сут в течение 7 дней или 100 мг 1 раз в сут в течение 15 дней;
- поражения высококератинизированных участков кожи (дерматофития стоп и кистей) -200 мг 2 раза в сут в течение 7 дней или 100 мг 1 раз в сут в течение 30 дней;
- при отрубевидном лишае — 200 мг 1 раз сут в течение 7 дней;
- при кандидозе слизистой оболочки полости рта — 100 мг 1 раз в сут в течение 15 дней (в некоторых случаях у иммунокомпрометированных лиц биодоступность итраконазола может снижаться, что иногда требует удвоения дозы);
- при кератомикозах — 200 мг 1 раз в сут в течение 21 дня (длительность лечения зависит от клинического ответа);
- при онихомикозе — 200 мг 1 раз в сут в течение 3 месяцев или 200 мг 2 раза в сут в течение 1 недели на курс;
- при поражении ногтей на ногах (независимо от наличия поражения ногтей на руках) проводят 3 курса с интервалом 3 недели. При поражении ногтей только на руках проводят 2 курса с интервалом 3 недели;
- элиминация итраконазола из кожи и ногтей медленная; оптимальный клинический ответ при дерматомикозах достигается через 2-4 месяца после завершения лечения, при онихомикозах — 6-9 месяцев;
- при системном аспергиллезе — 200 мг/сут в течение 2-5 месяцев; при прогрессировании и диссеминации заболевания дозу увеличивают до 200 мг 2 раза в сут;
- при системном кандидозе — 100-200 мг 1 раз в сут в течение 3 недель — 7 месяцев, при прогрессировании и диссеминации заболевания дозу увеличивают до 200 мг 2 раза в сут;
- при системном криптококкозе без признаков менингита — 200 мг 1 раз в сут в течение 2-12 месяцев. При криптококковом менингите — 200 мг 2 раза в сут в течение 2-12 месяцев;
- лечение гистоплазмоза начинают с 200 мг 1 раз в сут, поддерживающая доза — 200 мг 2 раза в сут в течение 8 месяцев;
- при бластомикозе — 100 мг 1 раз в сут, поддерживающая доза — 200 мг 2 раза в сут в течение 6 месяцев;
- при споротрихозе — 100 мг 1 раз в сут в течение 3 месяцев;
- при паракокцидиоидозе — 100 мг 1 раз в сут в течение 6 месяцев;
- при хромомикозе -100-200 мг 1 раз в сут в течение 6 месяцев;
- детям назначают, если ожидаемая польза превышает потенциальный риск.
Побочное действие
Со стороны желудочно-кишечного тракта: диспепсия (тошнота, рвота, диарея, запор, снижение аппетита), боль в животе.
Со стороны гепатобилиарной системы: обратимое повышение «печеночных» ферментов, гепатит, в очень редких случаях при применении Итраконазола развивалось тяжелое токсическое поражение печени, в том числе случаи острой печеночной недостаточности с летальным исходом.
Со стороны нервной системы: головная боль, головокружение, периферическая нейропатия.
Со стороны иммунной системы: анафилактические, анафилактоидные и аллергические реакции.
Со стороны кожных покровов: в очень редких случаях — мультиформная экссудативная эритема (синдром Стивенса-Джонсона) кожная сыпь, кожный зуд, крапивница, ангионевротический отек, алопеция, светочувствительность.
Прочие: нарушения менструального цикла, гипокалиемия, отечный синдром, хроническая сердечная недостаточность и отек легких.
Противопоказания к применению
Гиперчувствительность, хроническая сердечная недостаточность, в т.ч. в анамнезе (за исключением терапии жизнеугрожающих состояний); одновременный прием субстратов изофермента CYP3A4, удлиняющих интервал QT(астемизол, бепридил, цизаприд, дофетилид, левацетилметадол, мизоластин, пимозид, хинидин, сертиндол, терфенадин); ингибиторы ГМГ-КоА-редуктазы, метаболизирующиеся изоферментом CYP3A4 (ловастатин, симвастатин); одновременный пероральный прием триазолама и мидазолама, алкалоидов спорыньи (дигидроэрготамин, эргометрин, эрготамин, метилэрготамин), нисолдипина, элетриптана; беременность, период лактации.
С осторожностью. Почечная и печеночная недостаточность, периферическая нейропатия, факторы риска: хроническая сердечная недостаточность (ишемическая болезнь сердца, поражение сердечных клапанов, тяжелые заболевания легких, в т.ч. хроническая обструктивная болезнь легких, состояния, сопровождающиеся отечным синдромом), нарушение слуха, одновременный прием блокаторов медленных кальциевых каналов, детский и пожилой возраст.
Применение при беременности и кормлении грудью
Противопоказан во время беременности и в период лактации.
Применение при нарушениях функции печени
С осторожностью: печеночная недостаточность.
При нарушении функции печени полный период полувыведения итраконазола несколько увеличен, поэтому рекомендуется осуществлять контроль концентрации итраконазола в плазме и при необходимости корректировать дозу препарата.
В очень редких случаях при применении Итраконазола развивалось тяжелое токсическое поражение печени, включая случаи острой печеночной недостаточности с летальным исходом. В большинстве случаев это отмечалось у пациентов, уже имевших заболевания печени, у пациентов, с другими тяжелыми заболеваниями, получавших терапию итраконазолом по системным показаниям, а также у пациентов, получавших другие лекарственные средства, обладающие гепатотоксическим действием. У некоторых пациентов не выявлялись очевидные факторы риска в отношении поражения печени. Несколько таких случаев возникли в первый месяц терапии, а некоторые — в первую неделю лечения. В связи с этим рекомендуется регулярно контролировать функцию печени у пациентов, получающих терапию итраконазолом. Пациентов следует предупредить о необходимости немедленно связаться со своим врачом в случае возникновения симптомов, предполагающих возникновение гепатита, а именно: анорексии, тошноты, рвоты, слабости, боли в животе и потемнения мочи. В случае появлении таких симптомов необходимо немедленно прекратить терапию и провести исследование функции печени. Пациентам с повышенной концентрацией «печеночных» ферментов или заболеванием печени в активной фазе, или при перенесенном токсическом поражении печени при приеме других препаратов не следует назначать лечение Итраконазолом за исключением тех случаев, когда ожидаемая польза оправдывает риск поражения печени. В этих случаях необходимо во время лечения контролировать концентрация «печеночных» ферментов.
Применение при нарушениях функции почек
С осторожностью: почечная недостаточность.
При нарушении функции почек полный период полувыведения итраконазола несколько увеличен, поэтому рекомендуется осуществлять контроль концентрации итраконазола в плазме и при необходимости корректировать дозу препарата.
Применение у детей
С осторожностью: детский возраст. Детям назначают, если ожидаемая польза превышает потенциальный риск.
Применение у пожилых пациентов
С осторожностью: пожилой возраст.
Особые указания
- Женщинам детородного возраста, принимающим Итраконазол, необходимо использовать надежные методы контрацепции на протяжении всего курса лечения вплоть до наступления первой менструации после его завершения.
- Обнаружено, что итраконазол обладает отрицательным инотропным эффектом. При одновременном приеме итраконазола и блокаторов кальциевых каналов, которые могут оказывать тот же эффект, необходимо соблюдать осторожность. Сообщалось о случаях хронической сердечной недостаточности, связанных с приемом Итраконазола. Итраконазол не следует принимать пациентам с хронической сердечной недостаточностью или с наличием этого заболевания в анамнезе за исключением случаев, когда возможная польза значительно превосходит потенциальный риск. При индивидуальной оценке соотношения пользы и риска следует принимать во внимание такие факторы как серьезность показаний, режим дозирования и индивидуальные факторы риска возникновения хронической сердечной недостаточности. Факторы риска включают в себя наличие заболеваний сердце, таких как ишемическая болезнь сердца или поражения клапанов; серьезные заболевания легких, такие как обструктивные поражения легких; почечная недостаточность или другие заболевания, сопровождающиеся отеками. Таких пациентов необходимо проинформировать о признаках и симптомах застойной сердечной недостаточности. Лечение должно проводиться с осторожностью, при этом необходимо мониторировать больного на предмет возникновения симптомов застойной сердечной недостаточности. При их появлении прием Итраконазола необходимо прекратить.
- При пониженной кислотности желудка: при этом состоянии абсорбция итраконазола из капсул нарушается. Пациентам, принимающим антацидные препараты (например, алюминия гидроксид), рекомендуется их использовать не ранее, чем через 2 ч после приема капсул Итраконазола. Пациентам с ахлоргидрией или применяющим блокаторы Н1 гистаминовых рецепторов и ингибиторы протонной помпы, рекомендуется принимать капсулы Итраконазола с напитками, содержащими колу.
- В очень редких случаях при применении Итраконазола развивалось тяжелое токсическое поражение печени, включая случаи острой печеночной недостаточности с летальным исходом. В большинстве случаев это отмечалось у пациентов, уже имевших заболевания печени, у пациентов, с другими тяжелыми заболеваниями, получавших терапию итраконазолом по системным показаниям, а также у пациентов, получавших другие лекарственные средства, обладающие гепатотоксическим действием. У некоторых пациентов не выявлялись очевидные факторы риска в отношении поражения печени. Несколько таких случаев возникли в первый месяц терапии, а некоторые — в первую неделю лечения. В связи с этим рекомендуется регулярно контролировать функцию печени у пациентов, получающих терапию итраконазолом. Пациентов следует предупредить о необходимости немедленно связаться со своим врачом в случае возникновения симптомов, предполагающих возникновение гепатита, а именно: анорексии, тошноты, рвоты, слабости, боли в животе и потемнения мочи. В случае появлении таких симптомов необходимо немедленно прекратить терапию и провести исследование функции печени. Пациентам с повышенной концентрацией «печеночных» ферментов или заболеванием печени в активной фазе, или при перенесенном токсическом поражении печени при приеме других препаратов не следует назначать лечение Итраконазолом за исключением тех случаев, когда ожидаемая польза оправдывает риск поражения печени. В этих случаях необходимо во время лечения контролировать концентрация «печеночных» ферментов.
- Нарушения функции печени: итраконазол метаболизируется преимущественно в печени. Поскольку у пациентов с нарушениями функции печени полный период полувыведения итраконазола несколько увеличен, рекомендуется осуществлять контроль концентрации итраконазола в плазме и при необходимости корректировать дозу препарата.
- Нарушения функции почек: Поскольку у пациентов с почечной недостаточностью полный период полувыведения итраконазола несколько увеличен, рекомендуется осуществлять контроль концентрации итраконазола в плазме и при необходимости корректировать дозу препарата.
- Пациенты с иммунодефицитом: биодоступность итраконазола при пероральным приеме может быть снижена у некоторых пациентов с нарушенным иммунитетом, например, у больных с нейтропенией, больных СПИДом или перенесших операцию по трансплантации органов.
- Пациенты с системными грибковыми инфекциями, представляющими угрозу жизни: вследствие фармакокинетических характеристик Итраконазол в виде капсул не рекомендуется для начала лечения системных микозов, представляющих угрозу для жизни пациентов.
- Больные СПИДом.
- Лечащий врач должен оценить необходимость назначения поддерживающей терапии больным СПИДом, ранее получавшим лечение по поводу системных грибковых инфекций, например, споротрихоза, бластомикоза, гистоплазмоза или криптококкоза (как менингеального, так и неменингеального), у которых существует риск рецидива.
- Клинические данные о применении капсул Итраконазол в педиатрической практике ограничены. Капсулы Итраконазол не следует назначать детям, за исключением случаев, когда ожидаемая польза превышает возможный риск.
- Лечение следует прекратить при возникновении периферической нейропатии, которая может быть связана с приемом капсул Итраконазола.
- Нет данных о перекрестной гиперчувствительности к итраконазолу и другим азоловым противогрибковым препаратам.
Воздействие на способность водить автомобиль и работать с техникой. Итраконазол может вызвать головокружение и другие побочные эффекты, которые могут повлиять на способность управлять транспортными средствами и другой техникой, требующей повышенного внимания при работе.
Передозировка
Данные отсутствуют. При случайной передозировке следует применять поддерживающие меры. В течение первого часа провести промывание желудка и, если это необходимо, назначить активированный уголь. Итраконазол не выводится при гемодиализе. Какого-либо специфического антидота не существует.
Лекарственное взаимодействие
- Лекарственные средства, оказывающие влияние на абсорбцию итраконазола Лекарственные средства, уменьшающие кислотность желудка, снижают абсорбцию итраконазола, что связано с растворимостью оболочек капсул.
- Лекарственные средства, оказывающие влияние на метаболизм итраконазола. Итраконазол в основном метаболизируется изоферментом CYP3A4. Было изучено взаимодействие итраконазола с рифампицином, рифабутином и фенитоином, являющимися мощными индукторами изофермента CYP3A4. Исследованием было установлено, что в этих случаях биодоступность итраконазола и гидроксиитроконазола значительно снижается, что приводит к существенному уменьшению эффективности препарата. Одновременное применение итраконазола с данными препаратами, являющимися потенциальными индукторами микросомальных ферментов печени, не рекомендуется. Исследования взаимодействия с другими индукторами микросомальных ферментов печени, такими как карбамазепин, фенобарбитал и изониазид, не проводились, однако, аналогичные результаты можно предположить.
Мощные ингибиторы изофермента CYP3A4, такие как ритонавир, индинавир, кларитромицин и эритромицин, могут увеличивать биодоступность итраконазола.
- Влияние итраконазола на метаболизм других лекарственных средств. Итраконазол может ингибировать метаболизм препаратов, расщепляемых изоферментом CYP3A4. Результатом этого может быть усиление или пролонгирование их действия, в том числе и побочных эффектов. Перед началом приема сопутствующих лекарственных препаратов, необходимо проконсультироваться с лечащим врачом по поводу путей метаболизма данного препарата, указанных в инструкции по медицинскому применению. После прекращения лечения концентрации итраконазола в плазме снижаются постепенно в зависимости от дозы и длительности. Это необходимо принимать во внимание при обсуждении мигрирующего эффекта итраконазола на сопутствующие лекарственные средства.
Примерами таких лекарств являются:
Препараты, которые нельзя назначать одновременно с итраконазолом:
- терфенадин, астемизол, мизоластин, цизаприд, дофетилид, хинидин, пимозид, левацетилметадол, сертиндол — совместное применение данных лекарственных средств с итраконазолом может вызывать повышение концентрации этих веществ в плазме и увеличивать риск удлинения интервала QT и в редких случаях — возникновение мерцательной аритмии желудочков (torsade des pointes);
- метаболизируемые изоферментом CYP3A4 ингибиторы редуктазы ГМГ- КоА такие, как симвастатин и ловастатин;
- мидазолам для приема внутрь и триазолам;
- алкалоиды спорыньи такие как дигидроэрготамин, эргометрин, эрготамин и метилэргометрин;
- блокаторы «медленных» кальциевых каналов — в дополнение к возможному фармакокинетическому взаимодействию, связанному с общим путем метаболизма с участием изофермента CYP3A4, блокаторы «медленных» кальциевых каналов могут оказывать отрицательный инотропный эффект, который усиливается при одновременном приеме с итраконазолом.
Препараты, при назначении которых необходимо следить за их концентрациями в плазме, действием, побочными эффектами. В случае одновременного назначения с итраконазолом дозу этих препаратов, если необходимо, следует уменьшать.
- непрямые антикоагулянты;
- ингибиторы ВИЧ-протеазы, такие как ритонавир, индинавир, саквинавир;
- некоторые противоопухолевые препараты, такие как алкалоиды барвинка розового, бусульфан, доцетаксел, триметрексат;
- метаболизируемые изоферментом CYP3A4 блокаторы «медленных» кальциевых каналов, такие как верапамил и производные дигидропиридина;
- некоторые иммуносупрессивные средства: циклоспорин, такролимус, сиролимус (также известный как рапамицин);
- некоторые метаболизируемые изоферментом CYP3A4 ингибиторы редуктазы ГМГ- КоА такие, как аторвастатин;
- некоторые глюкокортикостероиды, такие как будесонид, дексаметазон и метилпреднизолон;
- другие препараты: дигоксин, карбамазепин, буспирон алфентанил, алпразолам, бротизолам, мидазолам для внутривенного введения, рифабутин, эбастин, ребоксетин, цилостазол, дизопирамид, элетриптан, галофантрин, репаглинид.
Взаимодействия между итраконазолом и зидовудином и флувастатином не обнаружено. Не отмечалось влияния итраконазола на метаболизм этинилэстрадиола и норэтистерона.
- Влияние на связь белками плазмы.
Исследования in vitro продемонстрировали отсутствие взаимодействия между итраконазолом и такими препаратами, как имипрамин, пропранолол, диазепам, циметидин, индометацин, толбутамид и сульфаметазин при связывании с белками плазмы.
Условия хранения препарата Итраконазол
В сухом, защищенном от света месте, при температуре не выше 25°С. Хранить в недоступном для детей месте.
Срок годности препарата Итраконазол
Срок годности. 3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Ирунин®
(ВЕРОФАРМ, Россия)
Итразол®
(ВЕРТЕКС, Россия)
Итраконазол
(ДЕВЕЛОПМЕНТ МК, Россия)
Итраконазол
(ПРОИЗВОДСТВО МЕДИКАМЕНТОВ, Россия)
Итраконазол
(RUSAN PHARMA, Индия)
Итраконазол
(АТОЛЛ, Россия)
Итраконазол
(ФОРМУЛА-ФР, Россия)
Итраконазол
(АВВА РУС, Россия)
Итраконазол
(AVVA PHARMACEUTICALS, Кипр)
Итраконазол-АКОС
(БИОКОМ, Россия)
Все аналоги
- Case Report
- Open Access
- Published:
- Tomasz Jagielski2,
- Gustavo Baldasso1,
- Louise Helene Bacher1,
- Márcio Garcia Ribeiro3 &
- …
- Marconi Rodrigues de Farias1
Acta Veterinaria Scandinavica
volume 65, Article number: 7 (2023)
Cite this article
-
2034 Accesses
-
3 Citations
-
10 Altmetric
-
Metrics details
A Correction to this article was published on 22 June 2023
This article has been updated
Abstract
Background
Protothecosis is a rare infectious disease caused by unicellular, achlorophyllous, microalgae of the genus Prototheca, ubiquitously distributed in nature. The algae are emerging pathogens, whose incidence is increasing in both human and animal populations and serious systemic infections related to this pathogen have been increasingly described in humans in recent years. After mastitis in dairy cows, canine protothecosis is the second most prevalent form of the protothecal disease in animals. Here, we report the first case of chronic cutaneous protothecosis due to P. wickerhamii in a dog in Brazil, successfully treated with a long-term therapy with itraconazole in pulse.
Case presentation
Upon clinical examination, exudative nasolabial plaque, ulcered, and painful lesions in central and digital pads and lymphadenitis were observed in a 2-year-old mixed-breed dog, with a 4-month history of cutaneous lesions and contact with sewage water. Histopathological examination revealed intense inflammatory reaction, with numerous spherical to oval, encapsulated structures stained with Periodic Acid Schiff, compatible with Prototheca morphology. Tissue culture on Sabouraud agar revealed yeast-like, greyish-white colonies after 48 h of incubation. The isolate was subjected to mass spectrometry profiling and PCR-sequencing of the mitochondrial cytochrome b (CYTB) gene marker, leading to identification of the pathogen as P. wickerhamii. The dog was initially treated with oral itraconazole at a dosage of 10 mg/kg once daily. After six months, the lesions resolved completely, yet recurred shortly after cessation of therapy. The dog was then treated with terbinafine at a dose of 30 mg/kg, once daily for 3 months, with no success. The resolution of clinical signs, with no recurrence over a 36-months follow-up period, was achieved after 3 months of treatment with itraconazole (20 mg/kg) in pulse intermittently on two consecutive days a week.
Conclusions
This report highlights the refractoriness of skin infections by Prototheca wickerhamii with therapies proposed in the literature and suggests a new treatment option with oral itraconazole in pulse dosing for long-term disease control successfully performed in a dog with skin lesions.
Background
Protothecosis refers to a localized or disseminated disease of humans and animals caused by unicellular, colourless, yeast-like microalgae of the genus Prototheca. These microorganisms are normally saprophytic and ubiquitous in nature with a predilection for wet and organic-rich areas [1, 2]. The current Prototheca taxonomy, based on the mitochondrially-encoded CYTB gene marker, accepts fourteen species of which those exhibiting pathogenic potential are Prototheca wickerhamii, P. bovis (formerly P. zopfii genotype 2), P. ciferrii (formerly P. zopfii genotype 1), P. cutis, P. miyajii and P. blaschkeae [3]. In humans, protothecosis has often been associated with underlying medical conditions and immunosuppression [4,5,6]. The most prevalent form of the protothecal disease in animals is bovine mastitis, typically manifested as chronic and drug-resistant infections resulting in significant reductions in milk production and premature culling [7]. After dairy cattle, dogs are the second animal species most usually affected. The infection usually starts following ingestion of contaminated water or feed or at a site of minor trauma or injury to the skin [7,8,9,10,11]. The algae may spread from the intestinal tract or other primary sites of infection, to other organs, including the brain, eye, kidneys, liver, and heart producing a systemic disease with high mortality (up to 75% in disseminated cases) [7, 12,13,14]. Clinically, canine protothecosis presents with intermittent hematochezia, anorexia, and emaciation. Skin lesions can occur as the sole clinical sign of disease or be accompanied by gastrointestinal, neurological, or ophthalmic signs. Canine protothecosis has mainly been caused by P. bovis [11, 12, 15]. Infections due to P. wickerhamii seems to be more rare [13].
Prototheca species have been tested against a wide range of antimicrobial agents demonstrating a very diverse susceptibility in vitro [17,18,19]. Furthermore, the lack of correlation between in vitro and in vivo drug activities has become a hallmark of protothecosis. In dogs, despite using a plethora of antimicrobial agents, the disease often leads to a poor outcome, especially if developed as a disseminated infection, and if proper diagnosis and treatment have been delayed [7, 15].
There are few reports of protothecosis in dogs. The largest study on canine protothecosis was carried out in Australia. Of the 17 reported cases, only two were P. wickerhamii [15]. In a recent study of 11 documented cases of protothecosis, three dogs had a molecular diagnosis of P. wickerhamii causing skin lesions, one in Australia and two in Italy [16]. In Brazil, only two well-documented reports of canine protothecosis have been published, both caused by P. bovis [11, 21].
This report describes an uncommon case of cutaneous infection caused by P. wickerhamii in a dog, underlining the refractoriness of the algae to conventional therapy and stressing the relevance of the condition to human health, owing to the zoonotic potential of the pathogen.
Case presentation
An 18-month-old, intact female dog of mixed breed, was admitted to the veterinary clinic of the Pontifícia Universidade Católica do Paraná (PUC-PR), Curitiba, Brazil, with a 2-month history of cutaneous lesions. No other clinical signs were reported. The owner told that the dog had access to an outside area, and contact with humid environment, including leaf mold, and effluent from a sewage disposal plant.
Upon clinical examination, eroded, ulcerated, exudative, and painful lesions on nasal planum and foot pads (Fig. 1), associated with sneezing and bilateral sanguinopurulent nasal discharge were observed, as well as mandibular and prescapular lymphadenomegaly, detected on palpation.
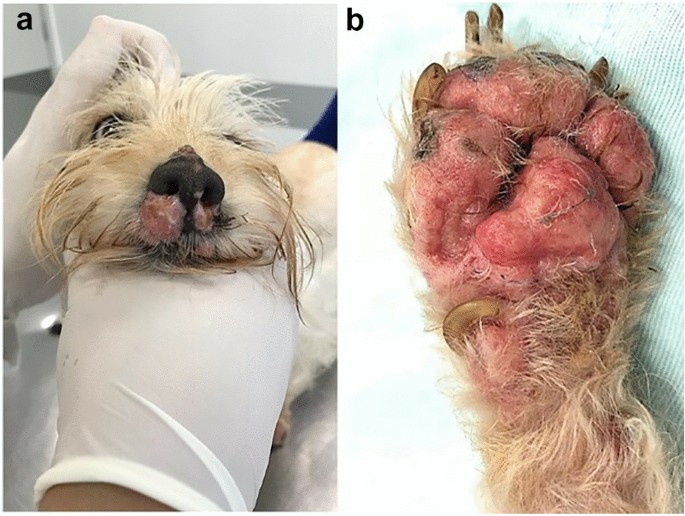
Cutaneous lesions caused by Prototheca wickerhamii in a dog. Dog, female, 18 months old with cutaneous protothecosis: a eroded-ulcerative and exudative nasolabial plaques; b erythematous, ulcerative and painful lesions on foot pad
Full size image
The dog was subjected to standard blood and urine analysis, abdominal ultrasound and chest radiograph and neurological and ophthalmic examinations. Material collected by fine-needle aspiration from the nasal lesion and prescapular lymph nodes were submitted for Gram and Diff-Quick cytology staining. Biopsy fragments of foot pads and nasal planum regions were collected aseptically, and subjected to histopathological examination and microbiological culture. Tissue homogenates and urine were inoculated onto sheep blood agar medium (5%) and MacConkey agar medium (Oxoid™, Sao Paulo, Brazil), and incubated under aerobic conditions for 3 days at 37 ºC. Tissue specimens were also plated on Sabouraud agar medium (Oxoid™, Sao Paulo, Brazil) and incubated aerobically for 15 days at 37 °C.
The yeast-like colonies grown in culture were initially identified as Prototheca, based on conventional, phenotype-based methods (macro- and micromorphology and biochemical, carbohydrate assimilation tests) [22]. Confirmatory identification was performed by using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF MS, Bruker and DaltonicsTM, Bremen, Germany) at 337 nm laser wavelength. Spectra were analysed between 2000 and 20,000 m/z using FlexControl 3.3 software. Genus- and species-level identification was evaluated at threshold scores of ≥ 1.7 and ≥ 2.0, respectively [20]. Finally, the isolated strain was subjected to molecular speciation with a newly proposed PCR-based method targeting the mitochondrially-encoded cytochrome b (CYTB) gene marker [3].
Results of the haematological evaluation, serum biochemistry, and urine analyses were within normal range.
Cytopathological examination (400 and 1000 × magnification) of prescapular lymph nodes and impression smear of the nasal lesion, revealed a pyogranulomatous infiltrate, although no infectious agent was observed. Upon histopathological examination at 1000 × magnification, oedema and intense inflammatory reaction with a diffuse distribution throughout the dermis were noted, with abundance of neutrophils, macrophages, lymphocytes, and plasma cells, containing numerous Periodic Acid Schiff -positive, encapsulated, spherical or oval structures, with a cartwheel-like appearance, ranging from 3.5 to 20 µm, thus morphologically compatible with Prototheca algae (Fig. 2).
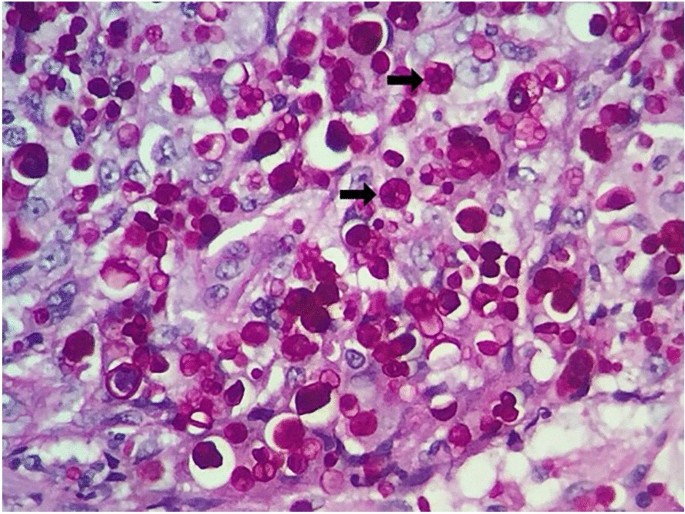
Histopathological presentation of cutaneous protothecosis. Dermatohistopathological examination of a dog, with cutaneous protothecosis, showing numerous encapsulated structures, rounded to oval (arrows), in the middle of the inflammatory infiltrate (PAS 100X)
Full size image
Post 48 h incubation, on either Sabouraud or blood agar, greyish-white and opaque colonies, attaining a diameter of 1 mm were seen. Microscopically, single cells and endosporulating cells (moruloid sporangia aspect) were clearly visible, suggestive of Prototheca wickerhamii. The species identity was confirmed by both MALDI-TOF MS profiling and CYTB-based genotyping (PCR-sequencing).
Once the diagnosis was made, treatment with oral itraconazole was started at a dose of 10 mg/kg, once daily. Although itraconazole alone presents a poor response, the literature presents it as a possible option as a single agent in the treatment of protothecosis in some cases [7]. The response was slow yet progressive and, after 60 days of treatment, lesion regression was observed (Fig. 3). Treatment was continued for six months with clinical and blood follow-ups.
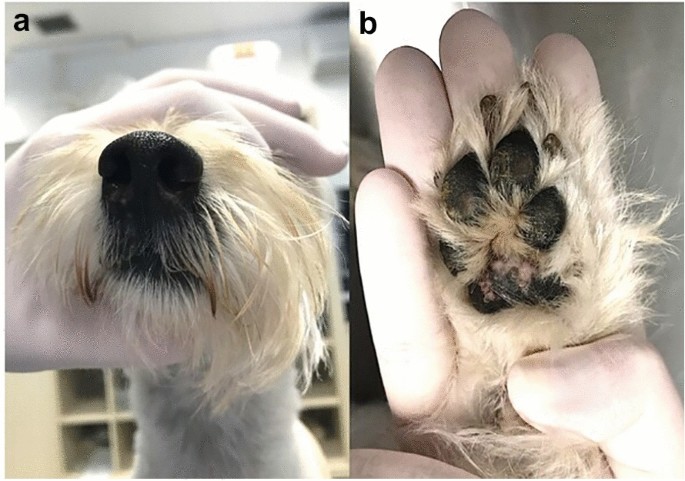
Cutaneous protothecosis after treatment. Involution of nasolabial plaques a and foot pad lesions b after initial treatment with itraconazole 10 mg/kg orally once daily after 60 days
Full size image
Six months after starting treatment with itraconazole, the dog presented hyporexia and an increase in hepatic alanine aminotransferase enzymes (from 65 U/L to 189 U/L, laboratory reference indicates normality up to 88 U/L). Due to the apparent improvement in the condition and the observed side effects, itraconazole (human generic) was then discontinued. Values normalized after 30 days of therapy with S-adenosyl-methionine (at a dose of 20 mg/kg once a day orally. After 30 days of discontinuation of itraconazole), however, the clinical signs in the nasal planum and foot pad recurred. Consequently, treatment with oral terbinafine (human generic) at a dosage of 30 mg/kg, once daily, and topical clotrimazole (Canesten®, Bayer, 10 mg/g) on the foot pad lesions were instituted. The dog remained on treatment with terbinafine for three months, with partial regression of the lesions, which prompted the interruption of the drug. Thence, oral itraconazole was again prescribed in a pulse regimen (i.e., intermittent administration of a drug at the recommended dose with a longer-than-accepted interval between doses) at a dose of 20 mg/kg/day for two consecutive days a week. This pulse regimen led to clinical improvement, with complete resolution of cutaneous lesions after 3 months and no side effects were observed. The dog remains under 3-month follow-up monitoring with clinical examination, blood count, serum biochemistry and remains without skin lesions. Attempts to discontinue itraconazole in pulse twice a week were not successful with relapse within a few days of disuse. Figure 4 shows the treatment timeline.
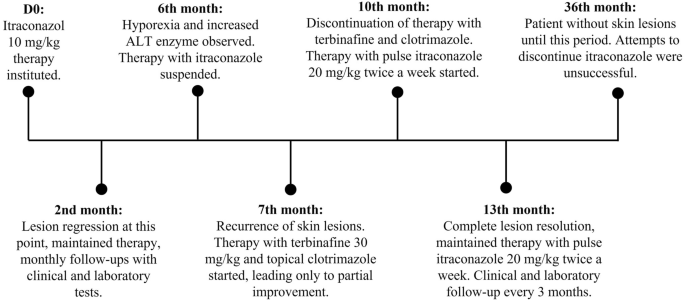
Treatment timeline. Treatment instituted according to elapsed time. D0 (day zero) = diagnosis and start of treatment and other times presented in months
Full size image
Discussion and conclusions
The common failure of treatment of canine protothecosis relates to several factors, with the immunological impairment of the host, delayed diagnosis, and drug resistance of the pathogen being the most widely recognized [11].
A number of antibacterial, antifungal, and algaecidal compounds have been evaluated in vitro [17,18,19] and in vivo [7, 15] with the aim of treating protothecosis in domestic animals. However, none of the compounds tested so far, have produced an efficient and consistent clinical response. In the present report, the initial treatment with oral itraconazole resulted in regression, albeit very slow, of the lesions. However, even the drug was maintained for 6 months since the lesions cleared, they reappeared shortly after discontinuation of therapy. The complete clinical cure, with no recurrence over 30 months follow-up, was obtained only after a long-term (3 months) treatment with itraconazole at twice higher dose (20 mg/kg) in pulse intermittently. It thus seems that itraconazole exerts algaestatic rather than algaecidal effect on Prototheca cells, when applied in suboptimal dosage. The increased dosage of itraconazole might have promoted therapeutic concentration, augmenting its algaecidal effect on the algae in the target tissue.
The high cutaneous concentrations achieved by itraconazole after oral administration and its pharmacokinetic profile suggest pulse administration. This has been proven successful in the treatment of Malassezia pachydermatis and dermatophytosis skin infections in dogs [23, 24]. The present case is the first that used pulsed itraconazole for the treatment of cutaneous protothecosis in dogs.
The benefits of pulse administration, when compared to daily administration, include a lower potential for side effects and adverse reactions, increased owner compliance, and reduced cost of treatment [23].
The present report describes the failure of terbinafine to cure the protothecal infection. Administration of terbinafine has been advocated as a treatment for human protothecosis of the skin, when patients do not respond to azole therapies [5]. It should be noted that in the only report that used terbinafine for the treatment of canine protothecosis, despite its in vitro activity, the drug partially controlled the lesions but failed to contain the infection, leading to the animal’s death [13].
The prognosis of cutaneous protothecosis in dogs is much better than that of systemic disease. Also, P. wickerhamii is generally more susceptible to treatment than P. bovis [2, 15]. Still, as demonstrated in our case, P. wickerhamii may resist conventional treatment regimens and persist in animal tissues for weeks to months. This is the first time that cutaneous lesions in dogs inflicted by P. wickerhamii have been cured successfully by using pulse regimen itraconazole treatment.
Protothecosis in both dogs and humans has often been associated with immunosuppressive conditions [7]. In the present case, blood and urine analyses, abdominal ultrasound and chest radiograph showed no changes, reinforcing the evidence that neither local nor systemic immunosuppression was present and indicating that protothecal cutaneous lesions may develop in healthy animals. This is in line with previous findings that dogs with cutaneous infection, as the sole clinical manifestation, did not display any immunological defects whatsoever [8, 10].
Whereas, certain inadequacies in farm management, such as poor hygiene of housing, feeding, and milking have long been considered as predisposing factors to protothecosis in dairy cattle [11], those favoring the disease development in dogs and cats, are yet to be disclosed.
The main route of protothecal infections in dogs is probably by ingestion of contaminated water or food [11, 12, 15]. Alternatively, the pathogen may infect the animal through skin or mucosal abrasions or other minor trauma [1, 2]. In our report, given the presence of nasolabial plane and foot pad lesions, it is possible that the dog may have developed the infection through a direct contact with Prototheca-infested outdoor environment, especially that it included sources conducive for the protothecal growth (e.g., untreated sewage effluent).
Cutaneous protothecosis, with no clinical signs originating from other organs is uncommon in dogs [9]. Our case was such a case with clinical signs restricted exclusively to the nasal plane and foot pads of the animal. Macro-and microscopic aspects of the skin lesions were similar to those observed in other dogs with cutaneous involvement [8, 13].
A wide spectrum of molecular methods that have become available, over the last decade, provide a powerful complement to conventional measures used for fast and reliable identification of Prototheca species. Currently, the only diagnostic tool, used also in this study, allowing for an accurate differentiation between all Prototheca species is PCR-sequencing of the partial CYTB gene [3].
This report highlights the refractoriness of skin infections by Prototheca wickerhamii with therapies proposed in the literature and suggests a new treatment option with oral itraconazole in pulse dosing for long-term disease control successfully performed in a dog with skin lesions.
Availability of data and materials
The datasets used and analyzed in the current study are available from the corresponding author on reasonable request.
Change history
-
22 June 2023
A Correction to this paper has been published: https://doi.org/10.1186/s13028-023-00682-1
Abbreviations
- CYTB:
-
Cytochrome B
- MALDI-TOF:
-
Matrix-assisted laser desorption-ionisation-time of flight mass
- MS:
-
Spectrometry
- PAS:
-
Periodic acid schiff
References
-
Pal M, Abraha A, Rahman MT, Dave P. Protothecosis: an emerging algal disease of humans and animals. Int J Life Sci Biotechnol Pharma Res. 2014;3:1–13.
Google Scholar
-
Masuda M, Jagielski T, Danesi P, Falcaro C, Bertola M, Krockenberger M, et al. Protothecosis in dogs and cats—new research directions. Mycopathologia. 2021;186:143–52. https://doi.org/10.1007/s11046-020-00508-y.
Article
PubMedGoogle Scholar
-
Jagielski T, Gawor J, Bakuła Z, Decewicz P, Maciszewski K, Karnkowska A. Cytb as a new genetic marker for differentiation of Prototheca species. J Clin Microbiol. 2018. https://doi.org/10.1128/JCM.00584-18.
Article
PubMed
PubMed CentralGoogle Scholar
-
Chou DW, Chung KM, Lee CT. Prototheca wickerhamii cutaneous and systemic infections. Am J Trop Med Hyg. 2014;91:664–5. https://doi.org/10.4269/ajtmh.14-0082.
Article
PubMed
PubMed CentralGoogle Scholar
-
Lass-Flörl C, Mayr A. Human protothecosis. Clin Microbiol Rev. 2007;20:230–42.
Article
PubMed
PubMed CentralGoogle Scholar
-
Zhao F, Chen M, Fu Y. Multiple cutaneous infections caused by Prototheca wickerhamii. J Clin Lab Anal. 2020;34:1–4. https://doi.org/10.1002/jcla.23492.
Article
CASGoogle Scholar
-
Pressler BM. Protothecosis and chlorellosis. In: Greene CE, editor. Infect Dis Dog Cat. fourth. Philadelphia: Saunders; 2013. p. 696–701.
Google Scholar
-
Ginel PJ, Pérez J, Molleda JM, Lucena R, Mozos E. Cutaneous protothecosis in a dog. Vet Rec. 1997;140:651–3. https://doi.org/10.1136/vr.140.25.651.
Article
CAS
PubMedGoogle Scholar
-
Miller WH, Griffin CC, Campbell KL. Protothecosis. In: Miller W, Griffin C, Campell K, editors. Small Anim Dermatology. seventh. Philadelphia: Saunders; 2012. p. 272–3.
Google Scholar
-
Papadogiannakis EI, Velonakis EN, Spanakos GK, Koutinas AF. Cutaneous disease as sole clinical manifestation of protothecosis in a boxer dog. Case Rep Vet Med. 2016. https://doi.org/10.1155/2016/2878751.
Article
PubMed
PubMed CentralGoogle Scholar
-
Ribeiro MG, Rodrigues de Farias M, Roesler U, Roth K, Rodigheri SM, Ostrowsky MA, et al. Phenotypic and genotypic characterization of Prototheca zopfii in a dog with enteric signs. Res Vet Sci. 2009;87:479–81. https://doi.org/10.1016/j.rvsc.2009.04.015.
Article
CAS
PubMedGoogle Scholar
-
Carfora V, Noris G, Caprioli A, Iurescia M, Stravino F, Franco A. Evidence of a Prototheca Zopfii genotype 2 disseminated infection in a dog with cutaneous lesions. Mycopathologia. 2017;182:603–8. https://doi.org/10.1007/s11046-016-0108-2.
Article
PubMedGoogle Scholar
-
Milley CD, Labelle P, Tolar E, Griffin J, Reeder C. Prototheca wickerhamii in a dog with cutaneous, ocular and systemic manifestations and treatment with terbinafine. Vet Rec Case Rep. 2017. https://doi.org/10.1136/vetreccr-2015-000225.
Article
Google Scholar
-
Bottero E, Mercuriali E, Abramo F, Dedola B, Martella V, Zini E. Fatal protothecosis in four dogs with large bowel disease in Italy. Vet Med Austria. 2016;103:17–21. https://doi.org/10.1080/13693780601187158.
Article
Google Scholar
-
Stenner VJ, MacKay B, King T, Barrs VRD, Irwin P, Abraham L, et al. Protothecosis in 17 Australian dogs and a review of the canine literature. Med Mycol. 2007;45:249–66. https://doi.org/10.1080/13693780601187158.
Article
CAS
PubMedGoogle Scholar
-
Falcaro C, Furlanello T, Binanti D, Fondati A, Bonfanti U, Krockenberger M, Malik R, Danesi P. Molecular characterization of Prototheca in 11 symptomatic dogs. J Vet Diagn Invest. 2021;33(1):156–61. https://doi.org/10.1177/1040638720976423.
Article
CAS
PubMedGoogle Scholar
-
Alves AC, Capra E, Morandi S, Cremonesi P, Pantoja JCF, Langoni H, et al. In vitro algicidal effect of guanidine on Prototheca zopfii genotype 2 strains isolated from clinical and subclinical bovine mastitis. Lett Appl Microbiol. 2017;64:419–23. https://doi.org/10.1111/lam.12737.
Article
CAS
PubMedGoogle Scholar
-
Morandi S, Cremonesi P, Capra E, Silvetti T, Decimo M, Bianchini V, et al. Molecular typing and differences in biofilm formation and antibiotic susceptibilities among Prototheca strains isolated in Italy and Brazil. J Dairy Sci. 2016;99:6436–45. https://doi.org/10.3168/jds.2016-10900.
Article
CAS
PubMedGoogle Scholar
-
Salerno T, Ribeiro MG, Langoni H, Siqueira AK, da Costa EO, Melville PA, et al. In vitro algaecide effect of sodium hypochlorite and iodine based antiseptics on Prototheca zopfii strains isolated from bovine milk. Res Vet Sci. 2010;88:211–3. https://doi.org/10.1016/j.rvsc.2009.08.001.
Article
CAS
PubMedGoogle Scholar
-
Gonçalves JL, Tomazi T, Barreiro JR, de Braga PAC, Ferreira CR, Araújo Junior JP, et al. Identification of Corynebacterium spp. isolated from bovine intramammary infections by matrix-assisted laser desorption ionization-time of flight mass spectrometry. Vet Microbiol. 2014;173:147–51. https://doi.org/10.1016/j.vetmic.2014.06.028.
Article
CAS
PubMedGoogle Scholar
-
Sonne L, de Oliveira EC, Argenta FF, Monteggia RS, Ferreiro L, Rösler U, et al. Prototheca zopfii genotype 2 disseminated infection in a dog with neurological signs. Ciência Rural. 2017. https://doi.org/10.1590/0103-8478cr20160877.
Article
Google Scholar
-
Jagielski T, Bakula Z, Gawor J, Maciszewskic K, Kusberd WH, Dyląg M. The genus Prototheca (Trebouxiophyceae, Chlorophyta) revisited: implications from molecular taxonomic studies. Algal Res. 2019;43:101639. https://doi.org/10.1016/j.algal.2019.101639.
Article
Google Scholar
-
Pinchbeck LR, Hillier A, Kowalski JJ, Kwochka KW. Comparison of pulse administration versus once daily administration of itraconazole for the treatment of Malassezia pachydermatis dermatitis and otitis in dogs. J Am Vet Med Assoc. 2002;220:1807–12. https://doi.org/10.2460/javma.2002.220.1807.
Article
CAS
PubMedGoogle Scholar
-
Colombo S, Cornegliani L, Vercelli A. Efficacy of itraconazole as a combined continuous/pulse therapy in feline dermatophytosis: preliminary results in nine cases. Vet Dermatol. 2001;12:347–50. https://doi.org/10.1046/j.0959-4493.2001.00274.x.
Article
CAS
PubMedGoogle Scholar
Download references
Acknowledgements
Not applicable
Prior publication
Data included in abstract of this article have previously been published in the “Abstracts from the 9th World Congress of Veterinary Dermatology, October 2020–April 2021, Sydney, Australia. Veterinary Dermatology, Volume 31, Supplement 1, October 2020”
Funding
The authors received no financial support for the research, authorship, and publication of this article.
Author information
Authors and Affiliations
-
Department of Veterinary Medicine, School of Life and Sciences, Pontifícia Universidade Católica do Paraná, 1155 Imaculada Conceição Street, Curitiba, PR, 80215-901, Brazil
Vanessa Cunningham Gmyterco, Gustavo Baldasso, Louise Helene Bacher & Marconi Rodrigues de Farias
-
Department of Medical Microbiology, Institute of Microbiology, Faculty of Biology, University of Warsaw, I. Miecznikowa 1, 02-096, Warsaw, Poland
Tomasz Jagielski
-
Department of Animal Production and Preventive Veterinary Medicine, School of Veterinary Medicine and Animal Sciences, Sao Paulo State University-UNESP, Botucatu, SP, 18618-681, Brazil
Márcio Garcia Ribeiro
Authors
- Vanessa Cunningham Gmyterco
You can also search for this author in
PubMed Google Scholar - Tomasz Jagielski
You can also search for this author in
PubMed Google Scholar - Gustavo Baldasso
You can also search for this author in
PubMed Google Scholar - Louise Helene Bacher
You can also search for this author in
PubMed Google Scholar - Márcio Garcia Ribeiro
You can also search for this author in
PubMed Google Scholar - Marconi Rodrigues de Farias
You can also search for this author in
PubMed Google Scholar
Contributions
VCG performed the clinical examination, recorded and documented the case and was a major contributor in writing the manuscript. TJ performed the genetic and molecular analysis and was a major contributor in writing the manuscript. GB performed the clinical examination, formatted and wrote the article, LHB formatted and wrote the article. MGR aided in diagnosis and mycological culture, performed the analysis of the data and wrote the manuscript. MRF performed the clinical examination, collection of samples and supervised the clinical part of the case, performed analysis of the data and wrote the manuscript. All authors have read and approved the final version of the manuscript. All authors read and approved the final manuscript.
Corresponding authors
Correspondence to
Vanessa Cunningham Gmyterco or Tomasz Jagielski.
Ethics declarations
Ethics approval and consent to participate
This study did not require official or institutional ethical approval. The animals were handled according to high ethical standards and national legislation.
Consent for publication
There was obtained a written consent from the owner of the dog used with the agreement for this publication.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
The original version of this article was revised: There were typos in Aff. 2 and in the caption of Fig. 1.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Gmyterco, V.C., Jagielski, T., Baldasso, G. et al. Cutaneous protothecosis in a dog successfully treated with oral itraconazole in pulse dosing.
Acta Vet Scand 65, 7 (2023). https://doi.org/10.1186/s13028-022-00662-x
Download citation
-
Received:
-
Accepted:
-
Published:
-
DOI: https://doi.org/10.1186/s13028-022-00662-x
Keywords
- CYTB gene
- Genetic identification
- MALDI-TOF MS
Prototheca sp.
Prototheca wickerhamii



