Интерферон бета-1b (Interferon beta-1b) инструкция по применению
📜 Инструкция по применению Интерферон бета-1b
💊 Состав препарата Интерферон бета-1b
✅ Применение препарата Интерферон бета-1b
📅 Условия хранения Интерферон бета-1b
⏳ Срок годности Интерферон бета-1b
Описание лекарственного препарата
Интерферон бета-1b
(Interferon beta-1b)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2021 года.
Дата обновления: 2020.11.17
Владелец регистрационного удостоверения:
Контакты для обращений:
БИОКАД АО
(Россия)
Код ATX:
L03AB08
(Интерферон бета-1b)
Лекарственные формы
| Интерферон бета-1b |
Р-р д/п/к введения 8 млн.МЕ/0.5 мл: шприцы 1, 5 или 15 шт. рег. №: ЛСР-007366/09 |
|
|
Р-р д/п/к введения 8 млн.МЕ/1 мл: фл. 5, 10, 15 или 30 шт. рег. №: ЛСР-007366/09 |
Раствор для п/к введения прозрачный, бесцветный или желтоватого оттенка.
Вспомогательные вещества: натрия ацетата тригидрат — 0.408 мг, уксусная кислота ледяная — до pH 4.0, декстран 50-70 тыс. — 15 мг, полисорбат 80 — 0.04 мг, маннитол — 50 мг, динатрия эдетата дигидрат — 0.0555 мг, вода д/и — до 1 мл.
1 мл — флаконы бесцветного стекла (5) — упаковки контурные пластиковые (1) — пачки картонные×.
1 мл — флаконы бесцветного стекла (5) — упаковки контурные пластиковые (2) — пачки картонные×.
1 мл — флаконы бесцветного стекла (5) — упаковки контурные пластиковые (3) — пачки картонные×.
1 мл — флаконы бесцветного стекла (5) — упаковки контурные пластиковые (6) — пачки картонные×.
Раствор для п/к введения прозрачный, бесцветный или желтоватого оттенка.
Вспомогательные вещества: натрия ацетата тригидрат — 0.408 мг, уксусная кислота ледяная — до pH 4.0, декстран 50-70 тыс. — 15 мг, полисорбат 80 — 0.04 мг, маннитол — 50 мг, динатрия эдетата дигидрат — 0.0555 мг, вода д/и — до 1 мл.
0.5 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (1) — пачки картонные××.
0.5 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (5) — пачки картонные××.
0.5 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (15) — пачки картонные××.
× Пачка с флаконами дополнительно может комплектоваться:
Комплектность №1:
шприцами одноразовыми инъекционными с иглой (5, 10, 15 и 30 шт., соответственно);
иглами медицинскими инъекционными (5, 10, 15 и 30 шт., соответственно);
салфетками спиртовыми (10, 20, 30 и 60 шт., соответственно).
Комплектность №2:
шприцами одноразовыми инъекционными с иглой (5, 10, 15 и 30 шт., соответственно);
иглами медицинскими инъекционными двух видов (5, 10, 15 и 30 шт., соответственно);
салфетками спиртовыми (10, 20, 30 и 60 шт., соответственно).
×× Пачка со шприцами дополнительно может комплектоваться:
салфетками спиртовыми (10, 20, 30 и 60 шт., соответственно).
Фармакологическое действие
Рекомбинантный интерферон бета-1b выделяют из клеток Escherichia coli, в геном которых внедрен ген человеческого интерферона бета, кодирующий аминокислоту серин в 17-й позиции. Интерферон бета-1b представляет собой негликозилированный белок молекулярной массы 18500 дальтон, состоящий из 165 аминокислот.
Фармакодинамика
Интерфероны по своей структуре являются белками и принадлежат к семейству цитокинов. Молекулярная масса интерферонов находится в диапазоне от 15000 до 21000 дальтон. Выделяют три основных класса интерферонов: альфа, бета и гамма. Интерфероны альфа, бета и гамма имеют схожий механизм действия, однако различные биологические эффекты. Активность интерферонов видоспецифична, и, следовательно, изучить их эффекты возможно только на культурах клеток человека или in vivo на человеке.
Интерферон бета-1b обладает противовирусной и иммуномодулирующей активностями. Механизм действия интерферона бета-1b при рассеянном склерозе до конца не установлен. Однако известно, что биологический эффект интерферона бета-1b опосредуется его взаимодействием со специфическими рецепторами, которые обнаружены на поверхности клеток человека. Связывание интерферона бета-1b с этими рецепторами индуцирует экспрессию ряда веществ, которые рассматриваются в качестве медиаторов биологических эффектов интерферона бета-1b. Содержание некоторых из этих веществ определяли в сыворотке и фракциях клеток крови больных, получавших интерферон бета-1b. Интерферон бета-1b снижает связывающую способность рецептора интерферона гамма и повышает его интернализацию и деградацию. Кроме того, интерферон бета-1b повышает супрессорную активность мононуклеарных клеток периферической крови.
Не проводилось целенаправленных исследований с целью определения воздействия интерферона бета-1b на функцию сердечно-сосудистой системы, дыхательной и эндокринной систем.
Результаты клинических исследований
Ремиттирующий рассеянный склероз
В рамках контролируемого клинического исследования пациентов с ремиттирующей формой рассеянного склероза, способных к самостоятельной ходьбе (EDSS от 0 до 5.5), получавших препарат интерферона бета-1b, получены данные, о том, что препарат снижает частоту обострений на 30%, уменьшает тяжесть обострений и число госпитализаций по причине основного заболевания. В дальнейшем были показаны увеличение интервала между обострениями и тенденция к замедлению прогрессирования ремиттирующего рассеянного склероза.
Вторично-прогрессирующий рассеянный склероз
Было проведено два контролируемых клинических исследования, включивших 1657 пациентов с вторично прогрессирующей формой рассеянного склероза. В исследованиях приняли участие пациенты с исходным значением EDSS от 3 до 6.5 баллов, т.е. пациенты были способны самостоятельно ходить. При оценке главной конечной точки исследования «время до подтвержденной прогрессии», т.е. способности замедлять прогрессирование заболевания в исследованиях, были получены противоречивые данные.
Одно из двух исследований показало статистически значимое замедление скорости прогрессирования инвалидизации (отношение рисков = 0.69 при 95% доверительном интервале (0.55, 0.86), р=0.0010, снижение рисков составило 31% в группе терапии интерфероном бега-1b) и увеличение времени до момента утраты возможности передвигаться самостоятельно, т.е. использования инвалидного кресла или EDSS 7.0 (отношение рисков = 0.61 при 95% доверительном интервале (0.44, 0.85), р=0.0036, снижение рисков составило 39% в группе терапии интерфероном бета-1b) среди пациентов, принимавших интерферон бета-1b. Терапевтический эффект препарата сохранялся и в последующем периоде наблюдения вне зависимости от частоты обострений.
Во втором исследовании препарата интерферона бета-1b у пациентов с вторично прогрессирующей формой рассеянного склероза не показано замедления скорости прогрессирования. Однако пациенты, включенные в это исследование, имели меньшую активность заболевания, нежели пациенты в других исследованиях при вторично-прогрессирующем течении рассеянного склероза. При проведении ретроспективного мета-анализа данных обоих исследований показан статистически значимый эффект (р=0.0076, при сравнении групп пациентов, получавших интерферон бета-1b 8 млн. ME, и группы плацебо).
Ретроспективный анализ по субгруппам показал, что влияние на скорость прогрессирования более выражено в группе пациентов с высокой активностью заболевания до начала терапии (отношение рисков = 0.72 при 95% доверительном интервале (0.59, 0.88), р=0.0011, снижение рисков составило 28% в группе пациентов с обострениями или быстрой прогрессией EDSS, получавших интерферон бета-1b, в сравнении с группой плацебо). По результатам проведенного анализа можно заключить, что анализ частоты рецидивов и быстрой прогрессии EDSS (EDSS >1 балла или >0.5 при базовой EDSS ≥6 баллов за предшествующие терапии 2 года) может способствовать выявлению пациентов с активным течением заболевания. В данных исследованиях было также показано снижение частоты обострений (30%). Не было показано, что интерферон бета-1b оказывает влияние на продолжительность обострений.
Клинически изолированный синдром
Одно контролируемое клиническое исследование интерферона бета-1b провели у пациентов с клинически изолированным синдромом (КИС). КИС предполагает наличие единственного клинического эпизода демиелинизации и/или, по крайней мере, двух клинически не проявляющих себя очагов на Т2-взвешенных изображениях МРТ, которых недостаточно для постановки диагноза клинически достоверного рассеянного склероза. Установлено, что КИС с большой вероятностью в дальнейшем приводит к развитию рассеянного склероза.
В исследование включались пациенты с одним клиническим очагом или двумя и более очагами на МРТ, при условии, что все альтернативные заболевания, которые могли бы служить наиболее вероятной причиной имеющихся симптомов, кроме рассеянного склероза, были исключены.
Это исследование состояло из 2 фаз, плацебо-контролируемой фазы и фазы последующего наблюдения. Плацебо-контролируемая фаза имела продолжительность 2 года или до момента перехода пациента в клинически достоверный рассеянный склероз (КДРС). После завершения плацебо-контролируемой фазы пациент переводился в фазу последующего наблюдения на фоне терапии интерфероном бета-1b. С целью оценки раннего и отсроченного эффекта назначения интерферона бета-1b сравнивались группы пациентов, первоначально рандомизированных на интерферон бета-1b (группа немедленного лечения) и плацебо (группа отсроченного лечения). В ходе исследования пациенты и исследователи оставались заслеплены относительно распределения пациентов в группы терапии.
Таблица 1. Эффективность интерферона бета-1b в рамках клинических исследований BENEFIT и продленного наблюдения пациентов исследования BENEFIT
В плацебо-контролируемой фазе исследования интерферон бета-1b статистически достоверно предотвращал переход КИС в КДРС. В группе пациентов, получавших интерферон бета-1b, показана задержка трансформации в достоверный рассеянный склероз по критериям МакДональда (см. таблицу 1).
Анализ подгрупп в зависимости от исходных факторов продемонстрировал эффективность интерферона бета-1b в отношении предотвращения трансформации в КДРС во всех подгруппах. Риск трансформации в КДРС в течение 2 лет был выше в группе пациентов с монофокальным КИС с 9 и более очагами на Т2-взвешенных изображениях или с наличием очагов, накапливающих контраст, по данным МРТ в начале исследования. Эффективность интерферона бета-1b в группе пациентов с мультифокальными клиническими проявлениями не зависела от исходных показателей МРТ, что свидетельствует о высоком риске трансформации КИС в КДРС у пациентов данной группы.
В настоящее время нет общепринятого определения высокого риска, однако к группе высокого риска развития КДРС можно отнести пациентов с моноочаговым КИС (клиническим проявлением 1 очага в ЦНС) и, по крайней мере, 9 очагами на МРТ в Т2-режиме и/или накапливающим контрастное вещество. Пациенты с многоочаговым КИС (клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска развития КДРС независимо от количества очагов на МРТ. В любом случае, решение о назначении интерферона бета-1b должно быть принято, исходя из заключения о высоком риске развития КДРС у пациента.
Терапия с интерфероном бета-1b хорошо переносилась пациентами, на что указывает низкий процент выбывших пациентов (93% завершили исследование).
Для улучшения переносимости проводилось титрование дозы интерферона бета-1b, применялись НПВП в начале терапии. Кроме того, применялся автоинжектор у большинства пациентов на протяжении всего исследования.
В дальнейшем интерферон бета-1b сохранял высокую эффективность по способности предотвращать развитие КДРС после 3 и 5 лет наблюдения (табл.1), несмотря на то, что большинство пациентов, получавших плацебо, начали терапию интерфероном бета-1b через 2 года после начала исследования. Подтвержденная прогрессия EDSS (увеличение EDSS, по крайней мере, на одном визите в сравнении с исходным значением) была ниже в группе немедленного лечения (табл.1, значительный эффект выявлен на 3-м году терапии, но на 5-м эффект отсутствует). У большинства пациентов в обеих группах не было прогрессирования инвалидности за 5-летний период. Не получено убедительных доказательств в пользу влияния на данный исход немедленного назначения интерферона бета-1b. Не показано влияния немедленного лечения интерфероном бета-1b на качество жизни пациентов.
Ремиттирующий, вторично-прогрессирующий рассеянный склероз и клинически изолированный синдром
Эффективность интерферона бета-1b показана во всех клинических исследованиях по способности уменьшать активность заболевания (острое воспаление в ЦНС и стойкое повреждение ткани), оцененную по показателям МРТ. Соотношение клинической активности рассеянного склероза и активности заболевания по МРТ-показателям в настоящее время до конца не установлено.
Фармакокинетика
После п/к введения интерферона бета-1b в рекомендуемой дозе 8 млн. ME его сывороточные концентрации низкие или вообще не определяются. В связи с этим, сведений о фармакокинетике препарата у больных рассеянным склерозом, получающих интерферон бета-1b в рекомендуемой дозе, нет. После п/к введения 16 млн. ME интерферона бета-1b максимальные уровни в плазме составляют около 40 МЕ/мл через 1-8 ч после инъекции.
По результатам многочисленных клинических исследований клиренс интерферона бета-1b и T1/2 препарата из сыворотки составляет в среднем 30 мл/мин/кг и 5 ч соответственно. Абсолютная биодоступность интерферона бета-1b при п/к введении равняется примерно 50%.
Введение интерферона бета-1b через день не приводит к повышению уровня препарата в плазме крови, а его фармакокинетика в течение курса терапии, по-видимому, не меняется.
При п/к применении интерферона бета-1b в дозе 0.25 мг через день уровни маркеров биологического ответа (неоптерин, бета2-микроглобулин и иммуносупрессивный цитокин интерлейкин-10) значительно повышались по сравнению с исходными показателями через 6-12 ч после введения первой дозы препарата, достигали пика через 40-124 ч и оставались повышенными на протяжении 7-дневного (168 ч) периода исследования. Связь между уровнями в плазме интерферона бета-1b или уровнями индуцированных им маркеров и механизмом действия интерферона бета-1b при рассеянном склерозе не установлена.
Показания препарата
Интерферон бета-1b
- клинически изолированный синдром (единственный клинический эпизод демиелинизации, позволяющий предположить рассеянный склероз, при условии исключения альтернативных диагнозов) с достаточной выраженностью воспалительного процесса для назначения в/в кортикостероидов — для замедления перехода в КДРС у пациентов с высоким риском* развития КДРС;
- ремиттирующий рассеянный склероз — для уменьшения частоты и тяжести обострений рассеянного склероза у пациентов способных ходить без посторонней помощи, при наличии в анамнезе не менее 2 обострений заболевания за последние 2 года с последующим полным или неполным восстановлением неврологического дефицита;
- вторично-прогрессирующий рассеянный склероз с активным течением заболевания, характеризующийся обострениями или выраженным ухудшением неврологических функций в течение последних 2 лет — для уменьшения частоты и тяжести клинических обострений болезни, а также для замедления темпов прогрессировать заболевания.
* Общепринятого определения высокого риска нет. По данным исследования к группе высокого риска развития КДРС относятся пациенты с моноочаговым КИС (клиническими проявлениями 1 очага в ЦНС) и ≥Т2-очагами на МРТ и/или накапливающим контрастное вещество очагами. Пациенты с многоочаговым КИС (клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска развития КДРС независимо от количества очагов на МРТ.
Режим дозирования
Лечение препаратом интерферона бета-1b следует начинать под наблюдением врача, имеющего опыт лечения рассеянного склероза.
Взрослые
Рекомендуемую дозу интерферона бета-1b 8 млн. MЕ вводят п/к через день.
Дети
Не проводилось формальных клинических и фармакокинетических исследований в детской и подростковой популяции. Ограниченные опубликованные данные свидетельствует о сопоставимом профиле безопасности препарата интерферона бета-1b в дозе 8 млн. MЕ п/к через день в группе пациентов от 12 до 16 лет, в сравнении с взрослой популяцией. Отсутствует информация о применении препарата интерферона бета-1b у лиц младше 12 лет, препарат не может применяться в указанной группе пациентов.
В начале лечения обычно рекомендуется провести титрование дозы. Лечение следует начинать с введения 2 млн. ME п/к через день, постепенно увеличивая дозу до 8 млн. ME, вводимую также через день. Период титрования дозы может варьировать в зависимости от индивидуальной переносимости препарата.
Таблица 2. Схема титрования дозы*
* Период титрования может быть увеличен при развитии нежелательных реакций.
Длительность лечения в настоящее время не установлена. Имеются результаты клинических исследований, в которых длительность лечения у больных ремиттирующим и вторично-прогрессирующим рассеянным склерозом достигала 5 и 3 лет соответственно. В группе пациентов с рецидивирующим течением рассеянного склероза высокая эффективность показана в течение первых 2 лет. Дальнейшее трехлетнее наблюдение показало сохранение показателей эффективности в течение всего периода лечения. У пациентов с клинически изолированным синдромом наблюдалась значительная задержка трансформации в достоверный рассеянный склероз на протяжении более чем 5 лет.
Терапия интерфероном бета-1b не показана пациентам с рецидивирующе-ремиттирующей формой рассеянного склероза, у которых за прошедшие 2 года произошло менее 2 обострений, или пациентам с вторично-прогрессирующим рассеянным склерозом, у которых в течение прошедших 2 лет не выявлено прогрессии.
Пациентам, у которых не наблюдается стабилизации течения заболевания (например, стойкое прогрессирование заболевания по шкале EDSS в течение 6 месяцев или необходимость проведения 3 и более курсов терапии кортикотропином или ГКС) в течение 1 года, лечение препаратом интерферона бета-1b рекомендуется прекратить.
Рекомендации по применению для пациентов
- Выбрать удобное время проведения инъекции. Инъекции желательно делать вечером перед сном.
- Перед введением препарата тщательно вымыть руки водой с мылом.
- Взять одну контурную ячейковую упаковку с заполненным шприцем/флаконом из картонной пачки, которая должна храниться в холодильнике, и выдержать ее при комнатной температуре в течение нескольких минут для того, чтобы температура препарата сравнялась с температурой окружающего воздуха. В случае появления конденсата на поверхности шприца/флакона следует подождать еще несколько минут до тех пор, пока конденсат не испарится.
- Перед использованием следует осмотреть раствор в шприце/флаконе. При наличии взвешенных частиц или изменении цвета раствора, или повреждении шприца/флакона препарат не следует применять. Если появилась пена, что бывает, когда шприц/флакон встряхивают или сильно покачивают, следует подождать, пока осядет пена.
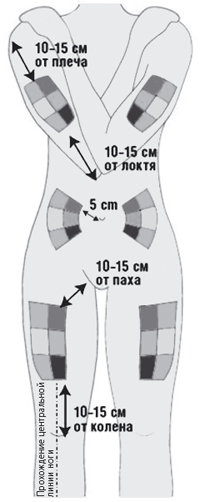
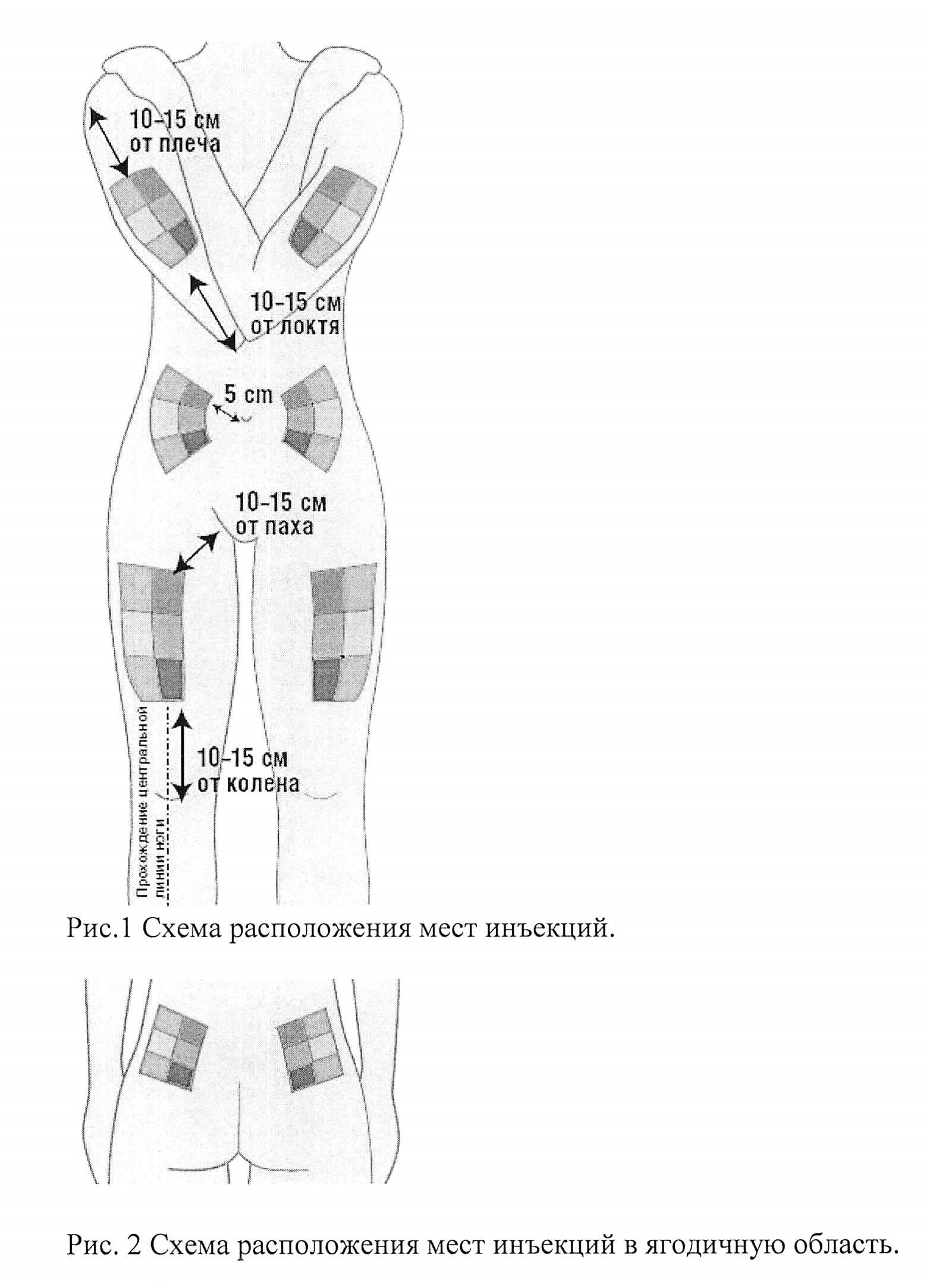
- Выбрать область тела для инъекции. Интерферон бета-1b вводится в подкожную жировую клетчатку (жировой слой между кожей и мышечной тканью), поэтому следует выбирать места с рыхлой клетчаткой вдали от мест растяжения кожи, нервов, суставов и сосудов:
- бедра (передняя поверхность бедер кроме паха и колена);
- живот (кроме срединной линии и околопупочной области);
- наружная поверхность плеч;
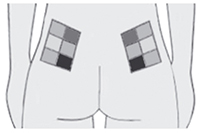
- ягодицы (верхний наружный квадрант).
Рис. 1. Схема расположения мест инъекций.
Рис. 2. Схема расположения мест инъекций в ягодичную область.
Не следует использовать для инъекции болезненные точки, обесцвеченные, покрасневшие участки кожи или области с уплотнениями и узелками.
Каждый раз следует выбирать новое место для укола, так можно уменьшить неприятные ощущения и боль на участке кожи в месте инъекции. Внутри каждой инъекционной области есть много точек для укола. Следует постоянно менять точки инъекций внутри конкретной области.
- Подготовка к инъекции.
Если пациент применяет препарат интерферона бета-1b в шприцах
Взять подготовленный шприц в рабочую руку. Снять защитный колпачок с иглы.
Если пациент применяет препарат интерферона бета-1b во флаконах
Взять флакон с препаратом интерферона бета-1b и осторожно поставить флакон на ровную поверхность (стол). Пинцетом (или другим удобным приспособлением) снять крышку флакона. Продезинфицировать верхнюю часть флакона. Взять стерильный шприц в рабочую руку, снять защитный колпачок с иглы и, не нарушая стерильность, осторожно ввести иглу через резиновый колпачок флакона так, чтобы конец иглы (3-4 мм) был виден через стекло флакона. Перевернуть флакон, чтобы его горлышко было направлено вниз.
- Количество раствора препарата интерферон бета-1b, которое нужно ввести при проведении инъекции, зависит от рекомендованной врачом дозы. Не следует хранить излишки препарата, оставшиеся в шприце/флаконе, для повторного использования.
Если пациент применяет препарат интерферон бета-1b в шприцах
В зависимости от дозы, которую прописал врач, может потребоваться удалить лишний объем раствора препарата из шприца. В случае такой необходимости следует медленно и аккуратно нажимать на поршень шприца для удаления лишнего количества раствора. Необходимо давить на поршень до тех пор, пока поршень не дойдет до необходимой метки на этикетке шприца.
Если пациент применяет препарат интерферон бета-1b во флаконах
Медленно оттянуть поршень назад и набрать в шприц из флакона необходимый объем раствора, соответствующий дозе препарата интерферон бета-1b, которую прописал врач. Затем, не нарушая стерильность, удалить флакон с иглы, придерживая иглу у основания (необходимо следить, чтобы игла не соскочила со шприца). Перевернув шприц вверх иглой, и, двигая поршень, удалить пузырьки воздуха осторожным постукиванием по шприцу и надавливанием на поршень. Заменить иглу на шприце и снять с нее колпачок.
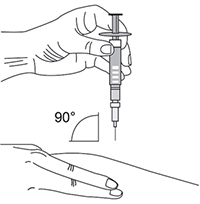
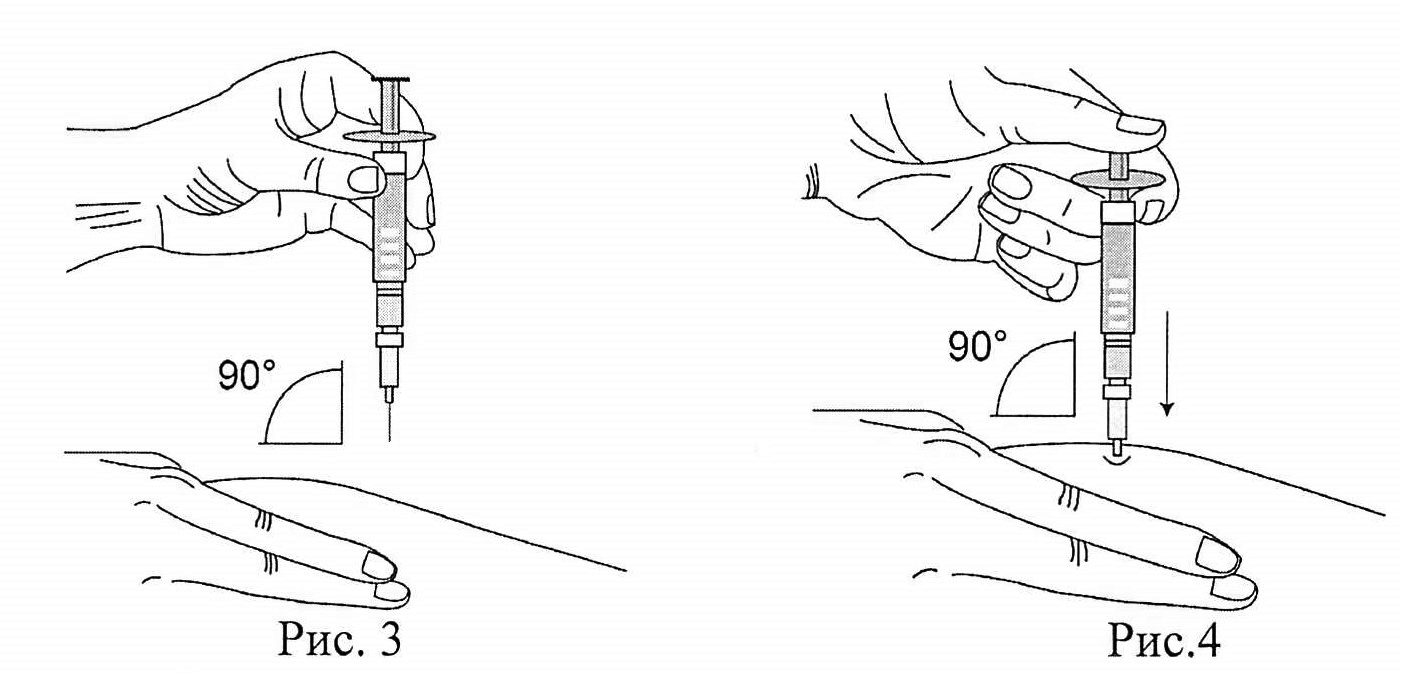
- Предварительно продезинфицировать участок кожи, куда будет введен препарат интерферон бета-1b. Когда кожа обсохнет, слегка собрать кожу в складку большим и указательным пальцами (рис. 3).
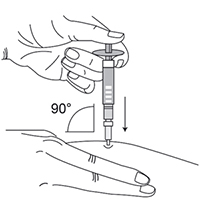
- Располагая шприц перпендикулярно месту инъекции, ввести иглу в кожу под углом 90° (рис. 4). Рекомендуемая глубина введения иглы составляет 6 мм от поверхности кожи. Глубина подбирается в зависимости от типа телосложения и толщины подкожной жировой клетчатки. Препарат следует вводить, равномерно нажимая на поршень шприца вниз до конца (до его полного опустошения).
Рис. 3
Рис. 4
- Удалить шприц с иглой движением вертикально вверх.
- Использованные шприцы/флаконы следует выбрасывать только в специально отведенное место, недоступное для детей.
- Если пациент забыл ввести препарат интерферон бета-1b, необходимо сделать инъекцию немедленно, как только он вспомнит об этом. Следующую инъекцию производят через 48 ч. Не допускается вводить двойную дозу препарата.
Не следует прекращать применение препарата интерферон бета-1b без консультации с врачом.
Побочное действие
Нежелательные реакции часто возникают на начальных этапах лечения, однако в ходе последующего лечения их частота и интенсивность уменьшаются. Наиболее частыми реакциями являются гриппоподобный симптомокомплекс (лихорадка, озноб, боль в суставах, недомогание, потливость, головная боль или боль в мышцах) и реакции в месте введения, которые во многом обусловлены фармакологическими свойствами интерферона бета-1b. Реакции в месте введения часто встречаются после применения интерферона бета-1b: покраснение, отек, деколорация, воспаление, боль, гиперчувствительность, некроз, неспецифические реакции. Для улучшения переносимости рекомендуется начинать терапию интерфероном бета-1b с титрования (см. схему титрования дозы в разделе «Режим дозирования»), гриппоподобный синдром так же может быть скорректирован назначением НПВП. Распространенность реакций в месте введения может быть снижена при применении автоинжектора.
Ниже представлены перечни нежелательных явлений, выявленных в рамках клинических исследований (табл. 3) и по данным пострегистрационного применения интерферона бета-1b (табл. 4).
Таблица 3. Нежелательные явления и отклонения лабораторных показателей с частотой возникновения ≥10% в сравнении частотой соответствующего явления на плацебо; значимые побочные эффекты, связанные с препаратом <10%
1 Отклонение лабораторного показателя.
2 Достоверно связан с терапией интерфероном бета-1b у пациентов с КИС, р<0.05.
3 Достоверно связан с терапией интерфероном бета-1b у пациентов с РРС, р<0.05.
4 Достоверно связан с терапией интерфероном бета-1b у пациентов с ВПРС, р<0.05.
5 Реакции в месте введения могут включать любые неблагоприятные проявления, возникающие в месте инъекции, например: кровотечение в месте инъекции, гиперчувствительность, воспаление в месте инъекции, припухлость в месте введения, некроз в месте инъекции, боль в месте инъекции, отек в месте инъекций и атрофия в месте инъекции; «Гриппоподобный синдром» обозначает комбинацию, по крайней мере, двух из приведенных ниже симптомов: лихорадка, озноб, миалгия, недомогание, потливость.
Таблица 4. Неблагоприятные реакции, выявленные в процессе пострегистрационных наблюдений, и для которых частота встречаемости установлена (определены на основе объединенных данных клинических исследований (N=1093))
Частота встречаемости определена как: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000). Для HP, выявленных в процессе пострегистрационных наблюдений, и для которых частота встречаемости не установлена, указано «частота неизвестна». Внутри каждой группы, сформированной по частоте встречаемости, симптомы представлены в порядке уменьшения серьезности.
* Данные ЗАО Биокад.
1 Неблагоприятные реакции, выявленные только в процессе пострегистрационных наблюдений.
2 Относится ко всем препаратам, содержащим интерферон бета.
Противопоказания к применению
- гиперчувствительность к рекомбинантному интерферону бета или другим компонентам препарата;
- заболевания печени в стадии декомпенсации;
- тяжелые депрессивные заболевания и/или суицидальные мысли в анамнезе;
- эпилепсия (адекватно не контролируемая);
- беременность;
- период грудного вскармливания;
- детский и подростковый возраст до 18 лет (информация по эффективности и безопасности применения интерферона бета-1b у детей ограничена; эффективность применения у детей не доказана).
С осторожностью
Пациентам, в анамнезе которых имеется указание на депрессию или судороги, а также пациентам, получающим противосудорожные средства, интерферон бета-1b следует применять с осторожностью. Препарат следует применять с осторожностью у пациентов с сердечной недостаточностью III-IV стадии по классификации NYHA и у больных с кардиомиопатией. Необходимо соблюдать осторожность при лечении препаратом интерферон бета-1b больных с нарушениями функции костного мозга, анемией, тромбоцитопенией или лейкопенией, моноклональной гаммапатией, тяжелой почечной недостаточностью.
Применение при беременности и кормлении грудью
Неизвестно, способен ли интерферон бета-1b вызывать повреждения плода при лечении беременных женщин или влиять на репродуктивную функцию человека. В контролируемых клинических исследованиях у больных рассеянным склерозом отмечались случаи самопроизвольного аборта. В исследованиях у макак-резус человеческий интерферон бета-1b оказывал эмбриотоксическое действие и в более высоких дозах вызывал увеличение частоты абортов. Следовательно, интерферон бета-1b противопоказан во время беременности. Женщинам репродуктивного возраста при лечении этим препаратом следует пользоваться адекватными методами контрацепции. В случае наступления беременности во время лечения интерфероном бета-1b или планировании беременности, женщину следует информировать о потенциальном риске и рекомендовать прекращение лечения. У пациенток с высокой частотой рецидивов в анамнезе до начала лечения необходимо тщательно оценить риск развития серьезного рецидива после прекращения лечения препаратом при наступлении беременности против возможного повышенного риска развития спонтанного аборта.
Неизвестно, экскретируется ли интерферон бета-1b с грудным молоком. Учитывая потенциальную возможность развития серьезных нежелательных реакций на интерферон бета-1b у младенцев, находящихся на грудном вскармливании, необходимо прекратить кормление грудью или отменить препарат.
Применение при нарушениях функции печени
Применение препарата противопоказано при заболеваниях печени в стадии декомпенсации.
Применение при нарушениях функции почек
Необходимо соблюдать осторожность при лечении препаратом больных с тяжелой почечной недостаточностью.
Применение у детей
Противопоказано применение препарата в детском и подростковом возрасте до 18 лет.
Особые указания
Патология иммунной системы
Применение цитокинов у больных с моноклональной гаммапатией иногда сопровождалось развитием синдрома системного повышения проницаемости капилляров с шокоподобными симптомами и летальным исходом.
Патология ЖКТ
В редких случаях на фоне применения препарата интерферона бета-1b наблюдалось развитие панкреатита, в большинстве случаев связанного с наличием гипертриглицеридемии.
Поражение нервной системы
Больных необходимо информировать о том, что побочным эффектом препарата интерферона бета-1b могут быть депрессия и суицидальные мысли, при появлении которых следует немедленно обратиться к врачу.
В двух контролируемых клинических исследованиях с участием 1657 пациентов с вторично-прогрессирующим рассеянным склерозом не было выявлено достоверных различий частоты развития депрессии и суицидальных мыслей при применении интерферона бета-1b или плацебо. Тем не менее, следует проявлять осторожность при назначении препарата интерферона бета-1b больным с депрессивными расстройствами и суицидальными мыслями в анамнезе.
При возникновении подобных явлений на фоне лечения, следует рассмотреть вопрос о целесообразности отмены препарата интерферона бета-1b.
Препарат интерферона бета-1b необходимо применять с осторожностью у больных с судорогами в анамнезе, в т.ч. получающих терапию противоэпилептическими препаратами, особенно если приступы у этих пациентов не контролируются адекватно на фоне терапии противоэпилептическим препаратами.
Изменения лабораторных показателей
Пациентам с дисфункцией щитовидной железы рекомендуется проверять функцию щитовидной железы (гормоны щитовидной железы, ТТГ) регулярно, а в остальных случаях — по клиническим показаниям.
Кроме стандартных лабораторных анализов, назначаемых при ведении пациентов с рассеянным склерозом, перед началом терапии препаратом интерферона бета-1b, а также регулярно в период лечения, рекомендуется проводить развернутый анализ крови, включая определение лейкоцитарной формулы, и числа тромбоцитов и биохимический анализ крови, а также проверять функцию печени (например, активность ACT, АЛТ и ГГТ).
При ведении пациентов с анемией, тромбоцитопенией, лейкопенией (по отдельности или в комбинации) может потребоваться более тщательный мониторинг развернутого анализа крови, включая определение количества эритроцитов, лейкоцитов, тромбоцитов и лейкоцитарной формулы.
Нарушения со стороны печени и желчевыводящих путей
Клинические исследования показали, что терапия интерфероном бета-1b часто может приводить к бессимптомному повышению активности печеночных трансаминаз, которое, в большинстве случаев, выражено незначительно и носит преходящий характер. Как и при лечении другими интерферонами бета тяжелые поражения печени (включая печеночную недостаточность) при применении препарата интерферона бета-1b наблюдаются редко. Наиболее тяжелые случаи отмечались у пациентов, подвергшихся воздействию гепатотоксичных лекарственных препаратов или веществ, а также при некоторых сопутствующих заболеваниях (например, злокачественные новообразования с метастазированием, тяжелые инфекции и сепсис, алкоголизм).
При лечении препаратом интерферона бета-1b необходимо осуществлять мониторинг функции печени (включая оценку клинической картины). Повышение активности трансаминаз в сыворотке крови требует тщательного наблюдения и обследования. При значительном повышении активности трансаминаз в сыворотке крови или появлении признаков поражения печени (например, желтухи) следует отменить препарат. При отсутствии клинических признаков поражения печени или после нормализации активности печеночных ферментов возможно возобновление терапии препаратом интерферона бета-1b с наблюдением за функцией печени.
Нарушения со стороны почек и мочевыводящих путей
При назначении препарата пациентам с тяжелой почечной недостаточностью следует соблюдать осторожность.
Случаи нефротического синдрома, обусловленного различными исходными нефропатиями (включая фокальносегментарный гломерулосклероз (ФСГС), болезнь минимальных изменений, мембранопролиферативный гломерулонефрит (МПГН) и мембранозную гломерулопатию), были зарегистрированы во время лечения препаратами интерферона бета. Подобные случаи были зарегистрированы в различные моменты времени в процессе терапии и могут возникать после нескольких лет применения интерферона бета. Рекомендуется периодический мониторинг ранних признаков и симптомов, например, отеков, протеинурии и нарушения функции почек, особенно у пациентов с высоким риском поражения почек. В случае развития нефротического синдрома требуется его немедленное лечение, следует рассмотреть необходимость отмены препарата интерферона бета-1b.
Заболевания сердечно-сосудистой системы
Препарат интерферона бета-1b необходимо применять с осторожностью у больных с заболеваниями сердца, в частности, при ИБС, нарушениях ритма и сердечной недостаточности. Должен проводиться мониторинг функции сердечно-сосудистой системы, особенно в начале лечения.
Отсутствуют свидетельства в пользу прямого кардиотоксического эффекта интерферона бета-1b, однако связанный с применением интерферона бета-1b гриппоподобный синдром может стать значимым стрессовым фактором для пациентов с имеющейся значимой патологией сердечно-сосудистой системы. В ходе постмаркетингового наблюдения очень редко наступало ухудшение состояния деятельности сердечно-сосудистой системы у пациентов с имеющейся значимой патологией сердечно-сосудистой системы, которое по времени возникновения было связано с началом лечения интерфероном бета-1b.
Имеются редкие сообщения о возникновении кардиомиопатии на фоне лечения препаратом интерферона бета-1b. При развитии кардиомиопатии, в случае, если предполагается, что это связано с применением препарата, то лечение препаратом интерферона бета-1b следует прекратить.
Тромботическая микроангиопатия (ТМАП)
Были зарегистрированы случаи тромботической микроангиопатии, проявляющейся в виде тромботической тромбоцитопенической пурпуры (ТТП) или гемолитического уремического синдрома (ГУС), в т.ч. с летальным исходом. Подобные случаи были зарегистрированы в различные моменты времени в процессе терапии и могут возникать как через несколько недель, так и через несколько лет применения интерферона бета. Ранние клинические признаки включают тромбоцитопению, новый эпизод артериальной гипертензии, лихорадку, симптомы со стороны ЦНС (например, спутанность сознания, парез) и нарушение функции почек. По результатам лабораторных исследований признаками вероятной ТМАП являются снижение количества тромбоцитов, повышение ЛДГ в плазме в связи с активацией гемолиза и обнаружение шизоцитов (фрагменты эритроцитов) в мазке крови. При наличии клинических признаков ТМАП рекомендуется продолжать оценку количества тромбоцитов, активность ЛДГ в сыворотке крови, мазков крови и функции почек. При диагностировании ТМАП необходимо начать раннее лечение (включая плазмаферез, при необходимости). Рекомендовано немедленное прекращение терапии препаратом интерферон бета-1b.
Общие нарушения и реакции в месте инъекции
Могут наблюдаться серьезные аллергические реакции (редкие, но проявляющиеся в острой и тяжелой форме, такие как бронхоспазм, анафилаксия и крапивница). У пациентов, получавших препарат интерферона бета-1b, наблюдались случаи некроза в месте инъекции (см. раздел «Побочное действие»). Некроз может быть обширным и распространяться на мышечные фасции, а также жировую ткань и, как следствие, приводить к образованию рубцов. В некоторых случаях необходимо удаление омертвевших участков или, реже, пересадка кожи. Процесс заживления при этом может занимать до 6 месяцев.
При появлении признаков повреждения целостности кожи (например, истечения жидкости из места инъекции) пациенту следует обратиться к врачу прежде, чем он продолжит выполнение инъекций препарата интерферона бета-1b.
При появлении множественных очагов некроза лечение препаратом интерферона бета-1b следует прекратить до полного заживления поврежденных участков. При наличии одного очага, если некроз не слишком обширен, применение препарата интерферона бета-1b может быть продолжено, поскольку у некоторых пациентов заживление омертвевшего участка в месте инъекции происходило на фоне применения препарата интерферона бета-1b.
С целью снижения риска развития реакции и некроза в месте инъекции, больным следует рекомендовать:
- проводить инъекции, строго соблюдая правила асептики;
- каждый раз менять место инъекции;
- вводить препарат строго п/к.
Периодически следует контролировать правильность выполнения самостоятельных инъекций, особенно при появлении местных реакций.
Иммуногенность
Как и при лечении любыми другими препаратами, содержащими белки, при применении препарата интерферона бета-1b существует возможность образования антител. В ряде контролируемых клинических исследований производился анализ сыворотки крови каждые 3 месяца для выявления образования антител к интерферону бета-1b. В этих исследованиях было показано, что нейтрализующие антитела к интерферону бета-1b развивались у 23-41% пациентов, что подтверждалось как минимум двумя последующими позитивными результатами лабораторных тестов. У 43-55% из этих пациентов в последующих лабораторных исследованиях было выявлено стабильное отсутствие антител к интерферону бета-1b.
В исследовании с участием пациентов с клинически изолированным синдромом, позволяющим предположить рассеянный склероз, нейтрализующая активность, которая измерялась каждые 6 месяцев, во время соответствующих визитов отмечалась у 16.5-25.2% пациентов, получавших интерферон бета-1b. Нейтрализующая активность обнаруживалась, по крайней мере, один раз у 30% (75) пациентов, получавших интерферон бета-1b; у 23% (17) из них до того, как исследование завершилось, статус антител вновь стал отрицательным.
В ходе двухлетнего периода исследования развитие нейтрализующей активности не связывалось со снижением клинической эффективности (в том, что касалось времени до наступления клинически достоверного рассеянного склероза).
Не было доказано, что наличие нейтрализующих антител сколько-нибудь значительно влияет на клинические результаты. С развитием нейтрализующей активности не связывалось появление каких-либо побочных реакций.
Решение о продолжении или прекращении терапии должно основываться на показателях клинической активности заболевания, а не на статусе нейтрализующей активности.
Влияние на способность к управлению транспортными средствами и механизмами
Специальные исследования не проводились. Нежелательные явления со стороны ЦНС могут влиять на способность управлять автомобилем и работать с механизмами. В связи с этим необходимо соблюдать осторожность при занятии потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. При появлении описанных побочных действий следует воздержаться от выполнения указанных видов деятельности.
Передозировка
Интерферон бета-1b в дозах до 176 млн. ME в/в 3 раза в неделю у взрослых больных злокачественными опухолями не вызывал серьезных нежелательных явлений.
Лекарственное взаимодействие
Специальные исследования взаимодействия интерферона бета-1b с другими препаратами не проводились.
Эффект применения интерферона бета-1b в дозе 8 млн. ME через день на метаболизм лекарственных средств у больных рассеянным склерозом неизвестен.
На фоне применения интерферона бета-1b ГКС и АКТГ, назначаемые на срок до 28 дней при лечении обострений, переносятся хорошо. Применение интерферона бета-1b одновременно с другими иммуномодуляторами (кроме ГКС или АКТГ) не изучалось.
Интерфероны снижают активность микросомальных печеночных ферментов системы цитохрома Р450 у человека и животных. Необходимо соблюдать осторожность при назначении интерферона бета-1b в комбинации с препаратами, имеющими узкий терапевтический индекс, клиренс которых в значительной степени зависит от активности этих ферментов (в т.ч. противоэпилептическими средствами, антидепрессантами).
Необходимо также соблюдать осторожность при одновременном применении любых препаратов, влияющих на систему кроветворения.
Не проводилось исследований на совместимость с противоэпилептическими препаратами.
Условия хранения препарата Интерферон бета-1b
Препарат следует хранить в недоступном для детей месте при температуре от 2° до 8°С.
Срок годности препарата Интерферон бета-1b
Срок годности — 2 года. Не применять по истечении срока годности, указанного на упаковке.
В пределах установленного срока годности допустимо хранение пациентом невскрытого флакона/шприца в течение одного месяца при температуре не выше 25°С.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
БИОКАД АО
(Россия)

|
|
198515 Санкт-Петербург, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
0,5 мл раствора содержит:
действующее вещество: интерферон бета 1-b человеческий
рекомбинантный (рчИФН-бета) — 8 млн ME.
вспомогательные
вещества: натрия ацетата тригидрат — 0,204 мг,
уксусная кислота ледяная — до pH 4,0, декстран-50-70 тыс. — 7,5 мг,
полисорбат-80 — 0,02 мг, маннитол — 25 мг, динатрия эдетата дигидрат — 0,02775
мг, вода для инъекций — до 0,5 мл.
Прозрачная, бесцветная или желтоватого оттенка жидкость.
Иммуностимуляторы. Интерфероны.
Код ATX: L03AB08
Рекомбинантный интерферон
бета-1b выделяют из клеток Escherichia coli, в геном которых внедрен ген человеческого интерферона бета, кодирующий
аминокислоту серин в 17-й позиции. Интерферон бета-1b представляет собой негликозилированный белок
молекулярной массы 18500 дальтон, состоящий из 165 аминокислот.
Фармакодинамика
Интерфероны по своей структуре являются белками и принадлежат к
семейству цитокинов. Молекулярная масса интерферонов находится в диапазоне от
15000 до 21000 Дальтон. Выделяют три основных класса интерферонов: альфа, бета
и гамма. Интерфероны альфа, бета и гамма имеют схожий механизм действия, однако
раз биологические эффекты. Активность интерферонов видоспецифична, и,
следовательно, изучить их эффекты возможно только на культурах клеток человека
или in vivo на человеке.
Интерферон бета-1b обладает противовирусной и иммуномодулирующей активностями. Механизм
действия интерферона бета-1b при рассеянном склерозе до конца не установлен. Однако известно, что
биологический эффект интерферона бета-1b опосредуется его
взаимодействием со специфическими рецепторами, которые обнаружены на
поверхности клеток человека. Связывание интерферона бета-1b с этими рецепторами
индуцирует экспрессию ряда веществ, которые рассматриваются в качестве
медиаторов биологических эффектов интерферона бета-1b. Содержание некоторых из
этих веществ определяли в сыворотке и фракциях клеток крови больных, получавших
интерферон бета-1b. Интерферон бета-1b снижает связывающую способность рецептора интерферона гамма и повышает
его интернализацию и деградацию. Кроме того, интерферон бета-1b повышает супрессорную
активность мононуклеарных клеток периферической крови.
Не проводилось
целенаправленных исследований с целью определения воздействия интерферона бета-1b на функцию
сердечно-сосудистой системы, дыхательной и эндокринной систем.
Результаты
клинических исследований (приведена информация,
полученная в ходе клинических исследований оригинального препарата интерферона
бета-1b Бетаферон®).
Ремиттирующий
рассеянный склероз:
В рамках контролируемого
клинического исследования пациентов с ремиттирующей формой рассеянного
склероза, способных к самостоятельной ходьбе (EDSS от 0 до 5,5), получавших
препарат интерферона бета-1b, получены данные, о том, что препарат снижает частоту обострений на 30%,
уменьшает тяжесть обострений и число госпитализаций по причине основного
заболевания. В дальнейшем были показаны увеличение интервала между обострениями
и тенденция к замедлению прогрессирования ремиттирующего рассеянного склероза.
Вторично-прогрессирующий рассеянный склероз:
Было
проведено два контролируемых клинических исследования, включивших 1657
пациентов с вторично прогрессирующей формой рассеянного склероза. В
исследованиях приняли участие пациенты с исходным значением EDSS от 3 до 6,5 баллов, т.е.
пациенты были способны самостоятельно ходить. При оценке главной конечной точки
исследования “время до подтвержденной прогрессии”, т.е. способности замедлять
прогрессирование заболевания в исследованиях, были получены противоречивые
данные.
Одно
из двух исследований показало статистически значимое замедление скорости прогрессирования
инвалидизации (отношение рисков=0.69 при 95% доверительном интервале (0.55,
0.86), р=0.0010, снижение рисков составило 31% в группе терапии интерфероном
бета-1b) и увеличение времени до
момента утраты возможности передвигаться самостоятельно, т.е. использования
инвалидного кресла или EDSS 7,0 (отношение рисков=0.61 при 95% доверительном. интервале (0.44,
0.85), р=0.0036, снижение рисков составило 39% в группе терапии интерфероном
бета-1b) среди пациентов, принимавших
интерферон бета-1b. Терапевтический эффект препарата сохранялся и в последующем периоде
наблюдения вне зависимости от частоты обострений.
Во втором исследовании
препарата интерферона бета-1b у пациентов с вторично прогрессирующей формой рассеянного склероза не
показано замедления скорости прогрессирования. Однако, пациенты, включенные в
это исследование, имели меньшую активность заболевания, нежели пациенты в
других исследованиях при вторично-прогрессирующем течении рассеянного склероза.
При проведении ретроспективного мета-анализа данных обоих исследований показан
статистически значимый эффект (р=0,0076, при сравнении групп пациентов,
получавших интерферон бета-1b 8 млн ME, и группы плацебо).
Ретроспективный анализ по
субгруппам показал, что влияние на скорость прогрессирования более выражено в
группе пациентов с высокой активностью заболевания до начала терапии (отношение
рисков=0.72 при 95% доверительном интервале (0.59, 0.88), р=0.0011, снижение
рисков составило 28% в группе пациентов с обострениями или быстрой прогрессией EDSS, получавших интерферон
бета-1b, в сравнении с группой
плацебо). По результатам проведенного анализа можно заключить, что анализ
частоты рецидивов и быстрой прогрессии EDSS (EDSS> 1 балла или >0,5
при базовой EDSS≥6 баллов за предшествующие
терапии два года) может способствовать выявлению пациентов с активным течением
заболевания. В данных исследованиях было также показано снижение частоты
обострений (30%). Не было показано, что интерферон бета-1b оказывает влияние на
продолжительность обострений.
Клинически-изолированный
синдром:
Одно
контролируемое клиническое исследование интерферона бета-1b провели у пациентов с
клинически изолированным синдромом (КИС). КИС предполагает наличие
единственного клинического эпизода демиелинизации и/или, по крайней мере, двух
клинически не проявляющих себя очагов на Т2-взвешенных изображениях МРТ,
которых недостаточно для постановки диагноза клинически достоверного РС.
Установлено, что КИС с большой вероятностью в дальнейшем приводит к развитию
рассеянного склероза.
В
исследование включались пациенты с одним клиническим очагом или двумя и более
очагами на МРТ, при условии, что все альтернативные заболевания, которые могли
бы служить наиболее вероятной причиной имеющихся симптомов, кроме рассеянного
склероза, были исключены.
Это исследование состояло из двух фаз, плацебо-контролируемой фазы и
фазы последующего наблюдения. Плацебо-контролируемая фаза имела
продолжительность 2 года или до момента перехода пациента в клинически
достоверный рассеянный склероз (КДРС). После завершения плацебо-контролируемой
фазы пациент переводился в фазу последующего наблюдения на фоне терапии
интерфероном бета-1b. С целью оценки раннего и отсроченного эффекта назначения интерферона
бета-1b сравнивались группы
пациентов, первоначально рандомизированных на интерферон бета-1b (группа немедленного
лечения) и плацебо (группа отсроченного лечения). В ходе исследования пациенты
и исследователи оставались заслеплены относительно распределения пациентов в
группы терапии.
Таблица 1. Эффективность интерферона бета-1b в рамках клинических
исследований
BENEFIT и продленного наблюдения
пациентов исследования BENEFIT.
|
Результаты 2 летней терапии Плацебо-контролируемая фаза |
Результаты 3-го года терапии Последующая фаза открытой терапии |
Результаты по итогам 5-го года терапии Последующая фаза открытой терапии |
||||
|
Интерферон бета-1b 8 млн МЕ |
Плацебо |
Группа немедленного лечения интерфероном бета-1b 8 млн МЕ |
Группа отсроченного лечения интерфероном бета-1b 8 млн МЕ |
Группа немедленного лечения интерфероном бета-1b 8 млн МЕ |
Группа отсроченного лечения интерфероном бета-1b 8 млн МЕ |
|
| n=292 | n=176 | n=292 | n=176 | n=292 | n=176 | |
|
Число пациентов завершивших данную фазу |
271 (93%) |
166 (94%) |
249 (85%) |
143 (81%) |
235 (80%) |
123 (70%) |
|
Основные показатели эффективности |
||||||
|
Время до развития клинически достоверного рассеянного склероза (КДРС) |
||||||
|
По Каплан-Майеру |
28% | 45% | 37% | 51% | 46% | 57% |
|
Уменьшение риска |
47% в сравнении с плацебо |
41% в сравнении с группой отсроченного лечения интерфероном бета-1b |
37% в сравнении с группой отсроченного лечения интерфероном бета-1b |
|||
|
отношение рисков при 95% ДИ |
HR=0.53[0.39, 0.73] |
HR=0.59[0.42, 0.83] |
HR=0.63[0.48, 0.83] |
|||
|
Лог-ранговый тест |
p<0.0001 интерферон бета-1b продлил время до наступления КДРС на 363 дня, от 255 дней в группе плацебо (до 618 дней в группе интерферона бета-1b) |
Р=0.0011 | Р=0.0027 | |||
|
Время до трансформации РС по критериям Мак-Дональда |
||||||
| По Каплан-Майеру | 69% | 85% |
Не является главной конечной точкой |
Не является главной конечной точкой |
||
|
Уменьшение риска |
43% в сравнении с группой плацебо |
|||||
|
отношение рисков при 95% ДИ |
HR=0.57[0.46, 0.71] | |||||
|
Лог-ранговый тест |
р <0.0001 |
|||||
|
Время до прогрессии EDSS |
||||||
|
По Каплан-Майеру |
Не является главной конечной точкой |
16% | 24% | 25% | 29% | |
|
Уменьшение риска |
40% в сравнении с группой отсроченного лечения интерфероном бета-1b |
24% в сравнении с группой отсроченного лечения интерфероном бета-1b |
||||
|
отношение рисков при 95% ДИ |
HR=0.60[0.39, 0.92] | HR=0.76[0.52, 1.11] | ||||
|
Лог-ранговый тест |
Р=0.022 | Р=0.177 |
В плацебо-контролируемой
фазе исследования интерферон бета-1b статистически достоверно предотвращал переход КИС в КДРС, В группе
пациентов, получавших интерферон бета-1b, показана задержка трансформации в достоверный рассеянный склероз по
критериям Мак-Дональда (см. таблицу 1).
Анализ подгрупп в
зависимости от исходных факторов продемонстрировал эффективность интерферона
бета-1b в отношении предотвращения
трансформации в КДРС во всех подгруппах. Риск трансформации в КДРС в течение 2
лет был выше в группе пациентов с монофокальным КИС с 9 и более очагами на
Т2-взвешенных изображениях или с наличием очагов, накапливающих контраст, по
данным МРТ в начале исследования. Эффективность интерферона бета-1b в группе пациентов с мультифокальными
клиническими проявлениями не зависела от исходных показателей МРТ, что
свидетельствует о высоком риске трансформации КИС в КДРС у пациентов данной
группы.
В настоящее время нет
общепринятого определения высокого риска, однако к группе высокого риска
развития КДРС можно отнести пациентов с моноочаговым КИС (клиническим
проявлением 1 очага в ЦИС) и по крайней мере 9 очагами на МРТ в Т2- режиме
и/или накапливающим контрастное вещество. Пациенты с многоочаговым КИС
(клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска
развития КДРС независимо от количества очагов на МРТ. В любом случае, решение о
назначении интерферона бета-1b должно быть принято, исходя из заключения о высоком риске развития КДРС
у пациента.
Терапия с интерфероном
бета-1b хорошо переносилась
пациентами, на что указывает низкий процент выбывших пациентов (93% завершили
исследование).
Для
улучшения переносимости проводилось титрование дозы интерферона бета-1b, применялись
нестероидные противовоспалительные препараты в начале терапии. Кроме того,
применялся автоинжектор у большинства пациентов на протяжении всего
исследования.
В
дальнейшем интерферон бета-1b сохранял высокую эффективность по способности предотвращать развитие
КДРС после 3 и 5 лет наблюдения (табл. 1), несмотря на то, что большинство
пациентов, получавших плацебо, начали терапию интерфероном бета-1b через два
года после начала исследования. Подтвержденная прогрессия EDSS (увеличение EDSS, по крайней мере, на одном
визите в сравнении с исходным значением) была ниже в группе немедленного
лечения (табл. 1, значительный эффект выявлен на 3-м году терапии, но на 5-м
эффект отсутствует). У большинства пациентов в обеих группах не было
прогрессирования инвалидности за 5-летний период. Не получено убедительных
доказательств в пользу влияния на данный исход немедленного назначения
интерферона бета-1b. Не показано влияния немедленного лечения интерфероном бета-1b на качество жизни
пациентов.
Ремиттирующий,
вторично-прогрессирующий рассеянный склероз и клинически- изолированный синдром:
Эффективность интерферона
бета-1b показана во всех
клинических исследованиях по способности уменьшать активность заболевания
(острое воспаление в ЦНС и стойкое повреждение ткани), оцененную по показателям
магнитно-резонансной томографии (МРТ). Соотношение клинической активности
рассеянного склероза и активности заболевания по МРТ — показателям в настоящее
время до конца не установлено.
Фармакокинетика (самостоятельных исследований фармакокинетики Интерферон бета-1б ЗАО
«БИОКАД» Россия не проводилось, приведены фармакокинетические характеристики по
литературным данным).
После подкожного введения
интерферона бета-1b в рекомендуемой дозе 8 млн ME его сывороточные концентрации низкие или вообще не определяются. В
связи с этим, сведений о фармакокинетике препарата у больных рассеянным
склерозом, получающих интерферон бета-1b в рекомендуемой дозе, нет. После подкожного введения 16 млн ME интерферона бета-1b максимальные уровни в
плазме составляют около 40 МЕ/мл через 1-8 ч после инъекции.
По результатам
многочисленных клинических исследований клиренс интерферона бета-1b и период
полувыведения препарата из сыворотки составляет в среднем 30 мл/мин/кг и 5
часов соответственно. Абсолютная биодоступность интерферона бета-1b при подкожном введении
равняется примерно 50%.
Введение интерферона бета-1b через день не приводит к
повышению уровня препарата в плазме крови, а его фармакокинетика в течение
курса терапии, по-видимому, не меняется. При подкожном применении интерферона
бета-1b в дозе 0,25 мг через день
уровни маркеров биологического ответа (неоптерин, бета2-микроглобулин и иммуносупрессивный
цитокин интерлейкин-10) значительно повышались по сравнению с исходными
показателями через 6-12 ч после введения ,первой дозы препарата. Они достигали
пика через 40-124 ч и оставались повышенными на протяжении 7-дневного (168 ч)
периода исследования. Связь между уровнями в плазме интерферона бета-1b или уровнями
индуцированных им маркеров и механизмом действия интерферона бета-1b при рассеянном склерозе не
установлена.
• Клинически изолированный синдром
(КИС) (единственный клинический эпизод демиелинизации, позволяющий предположить
рассеянный склероз, при условии исключения альтернативных диагнозов) с
достаточной выраженностью воспалительного процесса для назначения внутривенных
кортикостероидов — для замедления перехода в клинически достоверный рассеянный
склероз (КДРС) у пациентов с высоким риском развития КДРС.
Общепринятого определения высокого риска нет. По данным исследования к
группе высокого риска развития КДРС относятся пациенты с моноочаговым КИС
(клиническими проявлениями 1 очага в ЦНС) и ≥Т2-очагами на МРТ и/или
накапливающим контрастное вещество очагами. Пациенты с многоочаговым КИС
(клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска
развития КДРС независимо от количества очагов на МРТ;
• Ремиттирующий рассеянный склероз —
для уменьшения частоты и тяжести обострений рассеянного склероза у пациентов
способных ходить без посторонней помощи, при наличии в анамнезе не менее 2-х
обострений заболевания за последние 2 года с последующим полным или неполным
восстановлением неврологического дефицита;
• Вторично-прогрессирующий
рассеянный склероз с активным течением заболевания, характеризующийся
обострениями или выраженным ухудшением неврологических функций в течение
последних двух лет — для уменьшения частоты и тяжести клинических обострений
болезни, а также для замедления темпов прогрессирования заболевания.
Применять
строго по назначению врача.
• Гиперчувствительность к
рекомбинантному интерферону-бета или другим компонентам препарата.
• Заболевания печени в стадии
декомпенсации.
• Тяжелая депрессия и/или
суицидальные мысли.
• Эпилепсия (адекватно не
контролируемая).
• Беременность и период грудного
вскармливания.
• Детский возраст до 18 лет
(информация по эффективности и безопасности применения интерферона бета-1b у детей ограничена).
С осторожностью
Пациентам, в анамнезе
которых имеется указание на депрессию или судороги, а также пациентам,
получающим противосудорожные средства, интерферон бета-1b следует применять с
осторожностью. Препарат следует применять с осторожностью у пациентов с
сердечной недостаточностью III-IV стадии по классификации NYHA и у больных с кардиомиопатией. Необходимо соблюдать осторожность при
лечении препаратом интерферон бета-1b больных с нарушениями функции костного мозга, анемией, тромбоцитопенией
или лейкопенией, моноклональной гаммапатией, тяжелой почечной недостаточностью.
Неизвестно, способен ли интерферон бета-1b вызывать повреждения плода
при лечении беременных женщин или влиять на репродуктивную функцию человека. В
контролируемых клинических исследованиях у больных рассеянным склерозом
отмечались случаи самопроизвольного аборта. В исследованиях у макак-резус
человеческий интерферон бета-1b оказывал эмбриотоксическое действие и в более высоких дозах вызывал увеличение
частоты абортов. Следовательно, интерферон бета-1b противопоказан во время беременности. Женщинам
репродуктивного возраста при лечении этим препаратом следует пользоваться
адекватными методами контрацепции. В случае наступления беременности во время
лечения интерфероном бета-1b или планировании беременности, женщину следует информировать о
потенциальном риске и рекомендовать прекращение лечения. У пациенток с высокой
частотой рецидивов в анамнезе до начала лечения необходимо тщательно оценить
риск развития серьезного рецидива после прекращения лечения препаратом при
наступлении беременности против возможного повышенного риска развития
спонтанного аборта. Неизвестно, экскретируется ли интерферон бета-1b с грудным молоком.
Учитывая потенциальную возможность развития серьезных нежелательных реакций на
интерферон бета-1b у
младенцев, находящихся на грудном вскармливании, необходимо прекратить грудное вскармливание или отменить препарат.
Лечение
препаратом интерферона бета-1b следует начинать под наблюдением врача, имеющего опыт лечения
рассеянного склероза.
Взрослые:
Рекомендуемую
дозу интерферона бета-1b 8 млн ME вводят подкожно через день.
Дети:
Не проводилось формальных клинических и фармакокинетических
исследований в детской и подростковой популяции. Ограниченные опубликованные
данные свидетельствует о сопоставимом профиле безопасности препарата
интерферона бета-1b в дозе 8 млн ME подкожно через день в группе пациентов от 12 до 16 лет, в сравнении с
взрослой популяцией. Отсутствует информация о применении препарата интерферона
бета-1b у лиц младше 12 лет,
препарат не может применяться в указанной группе пациентов.
В начале лечения обычно рекомендуется провести титрование дозы. Лечение
следует начинать с введения 2 млн ME подкожно через день, постепенно увеличивая дозу до 8 млн ME, вводимую также через
день. Период титрования дозы может варьировать в зависимости от индивидуальной
переносимости препарата.
Таблица 2. Схема
титрования дозы*
| День лечения | Доза, млн МЕ |
Объем препарата, мл в зависимости от применяемой формы выпуска |
| 8 млн МЕ/0,5 мл | ||
| 1, 3, 5 | 2 | 0,125 |
| 7, 9, 11 | 4 | 0,25 |
| 13, 15, 17 | 6 | 0,375 |
| ≥19 | 8 | 0,5 |
⃰ Период титрования может
быть увеличен при развитии нежелательных реакций.
Длительность
лечения в настоящее время не установлена. Имеются результаты клинических
исследований, в которых длительность лечения у больных ремиттирующим и вторично-прогрессирующим
рассеянным склерозом достигала 5 и 3 лет соответственно.
В группе пациентов с рецидивирующим течением рассеянного склероза
высокая эффективность показана в течение первых двух лет. Дальнейшее трехлетнее
наблюдение показало сохранение показателей эффективности в течение всего
периода лечения. У пациентов с клинически изолированным синдромом наблюдалась
значительная задержка трансформации в достоверный рассеянный склероз на
протяжении более чем пяти лет.
Терапия интерфероном бета-1b не показана пациентам с
рецидивирующе-ремиттирующей формой рассеянного склероза, у которых за прошедшие
2 года произошло менее двух обострений, или пациентам с
вторично-прогрессирующим рассеянным склерозом, у которых в течение прошедших
двух лет не выявлено прогрессии.
Пациентам, у которых не
наблюдается стабилизации течения заболевания (например, стойкое
прогрессирование заболевания по шкале EDSS в течение 6 месяцев или необходимость проведения трех и более курсов
терапии кортикотропином или глюкокортикостероидами) в течение 1 года, лечение
препаратом интерферона бета-1b рекомендуется прекратить.
Рекомендации по применению для пациентов:
1) Выберите удобное для Вас время
проведения инъекции. Инъекции желательно делать вечером перед сном.
2) Перед введением препарата
тщательно вымойте руки водой с мылом.
3) Возьмите одну контурную ячейковую
упаковку с заполненным шприцем из картонной пачки, которая должна храниться в
холодильнике, и выдержите ее при комнатной температуре в течение нескольких
минут для того, чтобы температура препарата сравнялась с температурой окружающего
воздуха. В случае появления конденсата на поверхности шприца подождите еще
несколько минут до тех пор, пока конденсат не испарится.
4) Перед использованием следует
осмотреть раствор в шприце. При наличии взвешенных частиц или изменении цвета раствора
или повреждении шприца препарат не следует применять. Если появилась пена, что
бывает, когда шприц встряхивают или сильно покачивают, подождите, пока осядет
пена.
5) Выберите область тела для
инъекции. Интерферон бета-1b вводится в подкожную жировую клетчатку (жировой слой между кожей и
мышечной тканью), поэтому используйте места с рыхлой клетчаткой вдали от мест
растяжения кожи, нервов, суставов и сосудов (на рис. 1 и 2. указаны
рекомендованные области для инъекций):
• Бедра (передняя поверхность бедер
кроме паха и колена);
• Живот (кроме срединной линии и
околопупочной области);
• Наружная поверхность плеч;
• Ягодицы (верхний наружный
квадрант).
Не следует использовать для инъекции болезненные
точки, обесцвеченные, покрасневшие участки кожи или области с уплотнениями и
узелками.
Каждый раз выбирайте новое место для укола, так вы сможете уменьшить
неприятные ощущения и боль на участке кожи в месте инъекции. Внутри каждой
инъекционной области есть много точек для укола. Постоянно меняйте точки
инъекций внутри конкретной области.
6) Подготовка к инъекции.
Если
пациент применяет препарат интерферона бета-1b в шприцах
Возьмите подготовленный шприц в руку, которой вы пишете. Снимите
защитный колпачок с иглы.
7) Количество раствора препарата
интерферон бета-1b, которое нужно ввести при проведении инъекции, зависит от
рекомендованной Вашим врачом дозы. Не храните остатки препарата, оставшиеся в
шприце, для повторного использования.
Если пациент применяет
препарат интерферон бета-1b в шприцах
В
зависимости от дозы, которую Вам прописал врач, Вам может потребоваться удалить
лишний объем раствора препарата из шприца. В случае такой необходимости
медленно и аккуратно нажимайте на поршень шприца для удаления лишнего
количества раствора. Давите на поршень до тех пор, пока поршень не дойдет до
необходимой метки на этикетке шприца.

препарат интерферон бета-1b. Когда кожа обсохнет, слегка соберите кожу в складку большим и
указательным пальцами (рис.3).
9) Располагая шприц перпендикулярно месту инъекции, введите иглу в кожу
под углом 90° (рис.4). Рекомендуемая глубина введения иглы составляет 6 мм от
поверхности кожи. Глубина подбирается в зависимости от типа телосложения и
толщины подкожной жировой клетчатки. Вводите препарат, равномерно нажимая на
поршень шприца вниз до конца (до его полного опустошения).
10) Удалите шприц с иглой движением вертикально
вверх.
11) Использованные шприцы выбрасывайте
только в специально отведенное место, недоступное для детей.
12) Если Вы забыли ввести препарат
интерферон бета-1b, сделайте инъекцию немедленно, как только вспомнили об этом. Следующую
инъекцию производят через 48 ч. Не допускается вводить двойную дозу препарата.
Не прекращайте применение препарата интерферон бета-1b без консультации с врачом.
Нежелательные
реакции часто возникают на начальных этапах лечения, однако, в ходе последующего
лечения их частота и интенсивность уменьшаются. Наиболее частыми реакциями
являются гриппоподобный симптомокомплекс (лихорадка, озноб, боль в суставах,
недомогание, потливость, головная боль или боль в мышцах) и реакции в месте
введения, которые во многом обусловлены фармакологическими свойствами
интерферона бета-1b. Реакции в месте введения часто встречаются после применения интерферона
бета-1b: покраснение, отек,
деколорация, воспаление, боль, гиперчувствительность, некроз, неспецифические
реакции. Для улучшения переносимости рекомендуется начинать терапию
интерфероном бета-1b с титрования (см. схему титрования дозы в разделе “Способ применения и
дозы”), гриппоподобный синдром так же может быть скорректирован назначением
нестероидных противовоспалительных препаратов. Распространённость реакций в
месте введения может быть снижена при применении автоинжектора.
Ниже представлены перечни нежелательных явлений, выявленных в рамках
клинических исследований (Таблица 3. нежелательные явления и отклонения
лабораторных показателей), и по данным пострегистрационного применения
интерферона бета-1b (табл. 4, частоты рассчитаны исходя из объединенных данных клинических
исследований (очень часто (≥10 %), часто (<10 % — >1 %), нечасто (<1%
— ≥0,1 %), редко (<0,1 % — ≥0,01 %) и очень редко (<0,01 %)). Опыт
применения интерферона бета-1b у пациентов с рассеянным склерозом ограничен, нежелательные реакции,
возникающие очень редко, могут быть еще не выявлены.
Таблица 3.
Нежелательные явления и отклонения лабораторных показателей с частотой
возникновения ≥10% в сравнении частотой соответствующего явления на плацебо;
значимые побочные эффекты, связанные с препаратом <10%.
|
Система органов Нежелательные явления и отклонения лабораторных показателей |
Клинически изолированный синдром (BENEFIT) |
Вторично прогрессирующий рассеянный склероз (Европейское исследование) |
Вторично прогрессирующий рассеянный склероз (Североамериканское исследование) |
Рецидивирующий рассеянный склероз |
Интерферон бета-1b 250 мкг (плацебо) n=292 (n=176) |
Интерферон бета-1b 250 мкг (плацебо) n=360 (n=358) |
Интерферон бета-1b 250 мкг (плацебо) n=317 (n=308) |
Интерферон бета-1b 250 мкг (плацебо) n=124 (n=123) |
|
| Инфекции | ||||
| Инфекции | 6% (3%) | 13% (11%) | 11% (10%) | 14% (13%) |
| Абсцесс | 0% (1%) | 4% (2%) | 4% (5%) | 1% (6%) |
|
Кровь и лимфатическая система |
||||
| Лимфопения (<1500/мм3)×˄ ο | 79% (45%) | 53% (28%) | 88% (68%) | 82% (67%) |
| Нейропения (<1500/мм3)×˄*ο | 11% (2%) | 18% (5%) | 4% (10%) | 18% (5%) |
| Лейкопения (<3000/мм3)×˄ *ο | 11% (2%) | 13% (4%) | 13% (4%) | 16% (4%) |
| Лимфаденопатия | 1% (1%) | 3% (1%) | 11% (5%) | 14% (11%) |
|
Метаболические нарушения |
||||
|
Гипогликемия (<55 мг/дл) × |
3% (5%) | 27% (27%) | 5% (3%) | 15% (13%) |
| Психические нарушения | ||||
| Депрессия | 10% (11%) | 24% (31%) | 44% (41%) | 25% (24%) |
| Тревога | 3% (5%) | 6% (5%) | 10% (11%) | 15% (13%) |
| Нервная система | ||||
| Головная боль ˄ | 27% (17%) | 47% (41%) | 55% (46%) | 84% (77%) |
| Головокружение | 3% (4%) | 14% (14%) | 28% (26%) | 35% (28%) |
| Бессонница | 8% (4%) | 12% (8%) | 26% (25%) | 31% (33%) |
| Мигрень | 2% (2%) | 4% (3%) | 5% (4%) | 12% (7%) |
| Парестезии | 16% (17%) | 35% (39%) | 40% (43%) | 19% (21%) |
| Органы зрения | ||||
| Конъюктивит | 1% (1%) | 2% (3%) | 6% (6%) | 12% (10%) |
| Нарушение зрения ˄ | 3% (1%) | 11% (15%) | 11% (11%) | 7% (4%) |
| Органы слуха | ||||
| Боль в ушах | 0% (1%) | <1% (1%) | 6% (8%) | 16% (15%) |
|
Заболевания со стороны сердца |
||||
| Ощущение сердцебиения * | 1% (1%) | 2% (3%) | 5% (2%) | 8% (2%) |
| Сосудистая система | ||||
| Вазодилатация | 0% (0%) | 6% (4%) | 13% (8%) | 18% (17%) |
| Артериальная гипертензия ο | 2% (0%) | 4% (2%) | 9% (8%) | 7% (2%) |
| Органы дыхания | ||||
|
Инфекции верхних дыхательных путей |
18% (19%) | 3% (2%) | ||
| Синусит | 4% (6%) | 6% (6%) | 16% (18%) | 36% (26%) |
| Усиление кашля | 2% (2%) | 5% (10%) | 11% (15%) | 31% (23%) |
| Одышка * | 0% (0%) | 3% (2%) | 8% (6%) | 8% (2%) |
|
Желудочно-кишечный тракт |
||||
| Диарея | 4% (2%) | 7% (10%) | 21% (19%) | 35% (29%) |
| Запор | 1% (1%) | 12% (12%) | 22% (24%) | 24% (18%) |
| Тошнота | 3% (4%) | 13% (13%) | 32% (30%) | 48% (49%) |
| Рвота ˄ | 5% (1%) | 4% (6%) | 10% (12%) | 21% (19%) |
| Боли в животе ͦ | 5% (3%) | 11% (6%) | 18% (16%) | 32% (24%) |
|
Печень и желчевыводящие пути |
||||
|
Повышение АЛТ (<5 раз в сравнении с исходным)× ˄ * ο |
18% (5%) | 14% (5%) | 4% (2%) | 19% (6%) |
|
Повышение АСТ (>5 раз в сравнении с исходным)× ˄ * ο |
6% (1%) | 4% (1%) | 2% (1%) | 4% (0%) |
|
Кожа и подкожно-жировая клетчатка |
||||
| Кожные реакции | 1% (0%) | 4% (4%) | 19% (17%) | 6% (8%) |
| Сыпь ˄ ο | 11% (3%) | 20% (12%) | 26% (20%) | 27% (32%) |
|
Нарушения со стороны опорно-двигательной системы |
||||
| Гипертонусο | 2% (1%) | 41% (31%) | 57% (57%) | 26% (24%) |
| Миалгия * ο | 8% (8%) | 23% (9%) | 19% (29%) | 44% (28%) |
| Миалгия | 2% (2%) | 39% (40%) | 57% (6%) | 13% (10%) |
| Боль в спине | 10% (7%) | 26% (24%) | 31% (32%) | 36% (37%) |
| Боль в конечностях | 6% (3%) | 14% (12%) | 0% (0%) | |
|
Мочевыделительная система |
||||
| Задержка мочи | 1% (1%) | 4% (6%) | 15% (13%) | |
| Протеинурия (>1+) × | 25% (26%) | 14% (11%) | 5% (5%) | 5% (3%) |
| Учащенное мочеиспускание | 1% (1%) | 6% (5%) | 12% (11%) | 3% (5%) |
| Недержание мочи | 1% (1%) | 8% (15%) | 20% (19%) | 2% (1%) |
| Императивные порывы | 1% (1%) | 8% (7%) | 21% (17%) | 4% (2%) |
| Репродуктивная система | ||||
| Дисменорея | 2% (0%) | <1% (<1%) | 6% (5%) | 18% (11%) |
|
Нарушение менструального цикла * |
1% (2%) | 9% (13%) | 10% (8%) | 17% (8%) |
|
Метроррагия (ациклические маточные кровотечения) |
2% (0%) | 12% (6%) | 10% (10%) | 15% (8%) |
| Импотенция | 1% (0%) | 7% (4%) | 10% (11%) | 2% (1%) |
|
Общие реакции и реакции в месте введения |
||||
|
Реакции в месте введения (различных типов) ˄ *о § |
52% (11%) | 78% (20%) | 89% (37%) | 85% (37%) |
| Некроз в месте введения * о | 1% (0%) | 5% (0%) | 6% (0%) | 5% (0%) |
|
Гриппоподобный синдром § ˄ * о |
44% (18%) | 61% (40%) | 43% (33%) | 52% (48%) |
| Лихорадка ˄ * о | 13% (5%) | 40% (13%) | 29% (24%) | 59% (41%) |
| Боль | 4% (4%) | 31% (25%) | 59% (59%) | 52% (48%) |
| Боль в груди о | 1% (0%) | 5% (4%) | 15% (8%) | 15% (15%) |
| Периферический отек | 0% (0%) | 7% (7%) | 21% (18%) | 7% (8%) |
| Астения * | 22% (17%) | 63% (58%) | 64% (58%) | 49% (35%) |
| Озноб ˄ *о | 5% (1%) | 23% (7%) | 22% (12%) | 46% (19%) |
| Потливость * | 2% (1%) | 6% (6%) | 10% (10%) | 23% (11%) |
| Недомогание * | 0% (1%) | 8% (5%) | 6% (2%) | 15% (3%) |
|
× отклонение лабораторного показателя ˄ Достоверно связан с терапией интерфероном бета-1b у пациентов с КИС, р <0.05 * Достоверно связан с терапией интерфероном бета-1b у пациентов с РРС, р <0.05 о Достоверно связан с терапией интерфероном бета-1b у пациентов с ВПРС, р <0.05 § Реакции в месте введения могут включать в себя любые неблагоприятные проявления, возникающие в месте инъекции, например: кровотечение в месте инъекции, гиперчувствительность, воспаление в месте инъекции, припухлость в месте введения, некроз в месте инъекции, боль в месте инъекции, отек в месте инъекции и атрофия в месте инъекции; «Гриппоподобный синдром» означает комбинацию по крайней мере, двух из приведенных ниже симптомов: лихорадка, озноб, миалгии, недомогание, потливость. |
Таблица
4. Неблагоприятные реакции, выявленные в процессе
пострегистрационных наблюдений и для которых частота встречаемости установлена,
определены на основе объединенных данных клинических исследований (N=1093). Частота
встречаемости определена как: «очень часто» (≥1/10) и «часто» (от ≥1/100 до
<1/10), «нечасто» (от ≥1/1000 до <1/100), «редко» (от ≥1/10000 до
<1/1000). Для HP, выявленных в процессе пострегистрационных наблюдений, и для которых
частота встречаемости не установлена, указано «частота
неизвестна».
|
Класс системы органов |
Очень часто ≥1/10 |
Часто ≥1/100 до <1/10 |
Не часто ≥1/1000 до <1/100 |
Редко ≥1/10000 до <1/1000 |
Частота неизвестна |
|
Кровь и лимфатическая система |
Анемия | Тромбоцитопения |
Кровоточивость * Тромботическая микроангиопатия, включая тромботическую тромбоцитопеническую пурпуру/гемолитический синдром2 |
||
|
Нарушения со стороны иммунной системы |
Анафилактические реакции |
Синдром повышенной проницаемости капилляров при наличии моноклональной гаммапатии1 |
|||
| Эндокринные нарушения | Гипотиреоз |
Гипертиреоз, патология щитовидной железы |
|||
| Метаболические нарушения |
Увеличение веса Снижение веса |
Повышение уровня триглицеридов крови |
Анорексия1 | ||
| Психические нарушения | Спутанное сознание |
Эмоциональная лабильность, суицидальные попытки |
|||
|
Нарушения со стороны нервной системы |
Судороги | ||||
| Нарушения со стороны сердца | Тахикардия | Кардиомиопатия1 | |||
| Сосудистые нарушения | Гипертензия |
Снижение артериального давления ** |
|||
|
Нарушения со стороны дыхательной системы, грудной клетки и средостения |
Бронхоспазм1 |
Легочная артериальная гипертензия |
|||
|
Нарушения со стороны желудочно-кишечного тракта |
Панкреатит | ||||
|
Нарушения со стороны гепатобилиарного тракта |
Повышение уровня билирубина крови |
Повышение уровня гамма- глутамилтранспептидазы Гепатит |
Нарушения функции печени, включая гепатит, печеночная недостаточность1 |
||
|
Кожа и подкожно-жировая клетчатка |
Крапивница Зуд Алопеция |
Изменение цвета кожи | |||
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
Артралгия |
Лекарственно-индуцированная индуцированная красная волчанка |
|||
|
Нарушения со стороны почек и мочевыводящих путей |
Нефротический синдром, гломерулосклероз1 |
||||
|
Нарушения со стороны репродуктивной системы и молочных желез |
Меноррагия | ||||
|
* Данные ЗАО «БИОКАД» 1 -неблагоприятные реакции, выявленные только в процессе пострегистрационных наблюдений; 2 -относится ко всем препаратам, содержащим интерферон бета |
Внутри каждой группы, сформированной по частоте
встречаемости, симптомы представлены в порядке уменьшения серьезности.
Интерферон бета-1b в дозах до 176 млн МЕ внутривенно три раза в неделю у взрослых больных
злокачественными опухолями не вызывал серьезных нежелательных явлений.
Специальные исследования
взаимодействия интерферона бета-1b с другими препаратами не проводились.
Эффект применения
интерферона бета-1b в дозе 8 млн ME через день на метаболизм лекарственных средств у больных рассеянным
склерозом неизвестен.
На фоне применения
интерферона бета-1b глюкокортикостероиды и АКТГ, назначаемые на срок до 28 дней при лечении
обострений, переносятся хорошо, Применение интерферона бета-1b одновременно с другими
иммуномодуляторами (кроме глюкокортикостероидов или АКТГ) не изучалось.
Интерфероны снижают
активность микросомальных печеночных ферментов системы цитохрома Р450 у
человека и животных. Необходимо соблюдать осторожность при назначении
интерферона бета-1b в комбинации с препаратами, имеющими узкий терапевтический индекс, клиренс
которых в значительной степени зависит от активности этих ферментов (в т.ч.
противоэпилептическими средствами, антидепрессантами).
Необходимо также соблюдать
осторожность при одновременном применении любых препаратов, влияющих на систему
кроветворения.
Не проводилось
исследований на совместимость с противоэпилептическими препаратами.
Патология иммунной
системы
Применение
цитокинов у больных с моноклональной гаммапатией иногда сопровождалось
развитием синдрома системного повышения проницаемости капилляров с
шокоподобными симптомами и летальным исходом.
Патология
желудочно-кишечного тракта
В редких
случаях на фоне применения препарата интерферона бета-1b наблюдалось развитие
панкреатита, в большинстве случаев связанного с наличием гипертриглицеридемии.
Поражение
нервной системы
Больных необходимо информировать о том, что побочным эффектом препарата
интерферона бета-1b могут быть депрессия и суицидальные мысли, при появлении которых
следует немедленно обратиться к врачу.
В двух контролируемых клинических исследованиях с участием 1657 пациентов
с вторично-прогрессирующим PC не было выявлено достоверных различий частоты развития депрессии и
суицидальных мыслей при применении интерферона бета-1b или плацебо. Тем не менее,
следует проявлять осторожность при назначении препарата интерферона бета-1b больным с депрессивными
расстройствами и суицидальными мыслями в анамнезе.
При
возникновении подобных явлений на фоне лечения, следует рассмотреть вопрос о
целесообразности отмены препарата интерферона бета-1b.
Препарат
интерферона бета-1b необходимо применять с осторожностью у больных с судорогами в анамнезе,
в т. ч. получающих терапию противоэпилептическими препаратами, особенно если
приступы у этих пациентов не контролируются адекватно на фоне терапии
противоэпилептическим препаратами.
Изменения
лабораторных показателей
Пациентам
с дисфункцией щитовидной железы рекомендуется проверять функцию щитовидной
железы (гормоны щитовидной железы, тиреотропный гормон) регулярно, а в
остальных случаях — по клиническим показаниям.
Кроме
стандартных лабораторных анализов, назначаемых при ведении пациентов с
рассеянным склерозом, перед началом терапии препаратом интерферона бета-1b, а также регулярно в
период лечения, рекомендуется проводить развернутый анализ крови, включая
определение лейкоцитарной формулы, и числа тромбоцитов и биохимический анализ
крови, а также проверять функцию печени (например, активность
аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ) и g-глутамилтрансферазы (g-ГT)),
При
ведении пациентов с анемией, тромбоцитопенией, лейкопенией (по отдельности или
в комбинации) может потребоваться более тщательный мониторинг развернутого
анализа крови, включая определение количества эритроцитов, лейкоцитов,
тромбоцитов и лейкоцитарной формулы.
Нарушения
со стороны печени и желчевыводящих путей
Клинические исследования показали, что терапия интерфероном бета-1b часто может приводить к
бессимптомному повышению активности «печеночных» трансаминаз, которое, в
большинстве случаев, выражено незначительно и носит преходящий характер. Как и
при лечении другими интерферонами бета тяжелые поражения печени (включая
печеночную недостаточность) при применении препарата интерферона бета-1b наблюдаются
редко. Наиболее тяжелые случаи отмечались у пациентов, подвергшихся воздействию
гепатотоксичных лекарственных препаратов или веществ, а также при некоторых
сопутствующих заболеваниях (например, злокачественные новообразования с метастазированием,
тяжелые инфекции и сепсис, алкоголизм).
При лечении препаратом
интерферона бета-1b необходимо осуществлять мониторинг функции печени (включая оценку
клинической картины). Повышение активности трансаминаз в сыворотке крови
требует тщательного наблюдения и обследования. При значительном повышении
активности трансаминаз в сыворотке крови или появлении признаков поражения
печени (например, желтухи) следует отменить препарат. При отсутствии
клинических признаков поражения печени или после нормализации активности
«печеночных» ферментов возможно возобновление терапии препаратом интерферона
бета-1b с наблюдением за функцией
печени.
Нарушение со стороны
почек и мочевыводящих путей
При назначении препарата
пациентам с тяжелой почечной недостаточностью следует соблюдать осторожность.
Нефротический
синдром.
Случаи нефротического
синдрома, обусловленного различными исходными нефропатиями, (включая
фокально-сегментарный гломерулосклероз (ФСГС), болезнь минимальных изменений,
мембранопролиферативный гломерулонефрит (МПГН) и мембранозную гломерулопатию)
были зарегистрированы во время лечение препаратами интерферона бета. Подобные
случаи были зарегистрированы в различные моменты времени в процессе терапии и
могут возникать после нескольких лет применения интерферона бета. Рекомендуется
периодический мониторинг ранних признаков и симптомов, например, отеков,
протеинурии и нарушения функции почек, особенно у пациентов с высоким риском
поражения почек. Требуется немедленное лечение нефротического синдрома, следует
рассмотреть необходимость отмены препарата интерферон бета 1б.
Заболевания
сердечно-сосудистой системы
Препарат интерферона бета-1b необходимо применять с
осторожностью у больных с заболеваниями сердца, в частности, при ишемической
болезни сердца, нарушениях ритма и сердечной недостаточности. Должен
проводиться мониторинг функции сердечно-сосудистой системы, особенно в начале
лечения.
Отсутствуют свидетельства
в пользу прямого кардиотоксического эффекта интерферона бета-1b, однако, связанный с
применением интерферона бета-1b гриппоподобный синдром, может стать значимым стрессовым фактором для
пациентов с имеющейся значимой патологией сердечно-сосудистой системы. В ходе
постмаркетингового наблюдения очень редко наступало ухудшение состояния
деятельности сердечно-сосудистой системы у пациентов с имеющейся значимой патологией
сердечно-сосудистой системы, которое по времени возникновения было связано с
началом лечения интерфероном бета-1b.
Имеются редкие сообщения о
возникновении кардиомиопатии на фоне лечения препаратом интерферона бета-1b. При развитии
кардиомиопатии, в случае, если предполагается, что это связано с применением
препарата, то лечение препаратом интерферона бета-1b следует прекратить.
Тромботическая
микроангиопатия.
Были зарегистрированы
случаи тромботической микроангиопатии (ТМА), проявляющейся как тромботическая
тромбоцитопеническая пурпура (ТТП) или гемолитико-уремического синдрома, в том
числе со смертельным исходом. Подобные случаи были зарегистрированы в различные
моменты времени в процессе терапии и могут возникать как через несколько
недель, так и через несколько лет применения интерферона бета. Ранние
клинические признаки включают тромбоцитопению, впервые выявленную гипертонию,
лихорадку, симптомы со стороны центральной нервной системы (например,
дезориентация, парезы) и нарушение функции почек. По результатам лабораторных
исследований признаками вероятной ТМА являются снижение числа тромбоцитов,
повышение сывороточной лактатдегидрогеназы (ЛДГ) вследствие гемолиза и
шизоцитоз (фрагментации эритроцитов) в мазке крови. При наличии клинических
признаков ТМА рекомендуется оценить число тромбоцитов, активность ЛДГ в
сыворотке крови, мазок крови и функцию почек. Если ТМА диагностирована,
необходимо назначение терапии (включая плазмаферез, при необходимости).
Рекомендовано немедленное прекращение терапии препаратом интерферон бета 1б.
Общие нарушения и
нарушения в месте инъекции
Могут наблюдаться
серьезные аллергические реакции (редкие, но проявляющиеся в острой и тяжелой
форме, такие как бронхоспазм, анафилаксия и крапивница).
У пациентов, получавших
препарат интерферона бета-1b, наблюдались случаи некроза в месте инъекции (см. раздел «Побочные
эффекты»). Некроз может быть обширным и распространяться на мышечные фасции, а
также жировую ткань и, как следствие, приводить к образованию рубцов. В
некоторых случаях необходимо удаление омертвевших участков или, реже, пересадка
кожи. Процесс заживления при этом может занимать до 6 месяцев.
При
появлении признаков повреждения целостности кожи (например, истечения жидкости
из места инъекции) пациенту следует обратиться к врачу прежде, чем он продолжит
выполнение инъекций препарата интерферона бета-1b.
При
появлении множественных очагов некроза лечение препаратом интерферона бета-1b следует прекратить до полного заживления поврежденных участков. При
наличии одного очага, если некроз не слишком обширен, применение препарата
интерферона бета-1b может быть продолжено, поскольку у некоторых пациентов заживление
омертвевшего участка в месте инъекции происходило на фоне применения препарата
интерферона бета- 1b.
С целью снижения риска развития реакции и некроза в месте инъекции,
больным следует рекомендовать:
— проводить инъекции, строго соблюдая правила асептики;
— каждый раз менять место инъекции;
— вводить препарат строго
подкожно.
Периодически следует контролировать
правильность выполнения самостоятельных инъекций, особенно при появлении
местных реакций.
Иммуногенность
Исследования
иммуногенности лекарственного препарата интерферона бета-1b производства
ЗАО «БИОКАД», Россия, не проводились. Как и при лечении любыми другими
препаратами, содержащими белки, при применении препарата интерферона бета- 1b существует возможность
образования антител. В ряде контролируемых клинических исследований
производился анализ сыворотки крови каждые 3 месяца для выявления образования
антител- к интерферону бета-1b. В этих исследованиях было показано, что нейтрализующие антитела к
интерферону бета-1b развивались у 23-41% пациентов, что подтверждалось как минимум двумя
последующими позитивными результатами лабораторных тестов. У 43-55% из этих
пациентов в последующих лабораторных исследованиях было выявлено стабильное
отсутствие антител к интерферону бета-1b.
В исследовании с участием
пациентов с клинически изолированным синдромом, позволяющим предположить
рассеянный склероз, нейтрализующая активность, которая измерялась каждые 6
месяцев, во время соответствующих визитов отмечалась у 16,5- 25,2% пациентов,
получавших интерферон бета-1b. Нейтрализующая активность обнаруживалась, по крайней мере, один раз у
30% (75) пациентов, получавших интерферон бета-1b; у 23% (17) из них до
того, как исследование завершилось, статус антител вновь стал отрицательным.
В ходе двухлетнего периода исследования развитие нейтрализующей
активности не связывалось со снижением клинической эффективности (в том, что
касалось времени до наступления клинически достоверного рассеянного склероза).
Не было доказано, что
наличие нейтрализующих антител сколько-нибудь значительно влияет на клинические
результаты. С развитием нейтрализующей активности не связывалось появление
каких-либо побочных реакций.
Решение
о продолжении или прекращении терапии должно основываться на показателях
клинической активности заболевания, а не на статусе нейтрализующей активности.
Специальные
исследования не проводились. Нежелательные явления со стороны ЦНС могут влиять
на способность управлять автомобилем и работать с механизмами. В связи с этим
необходимо соблюдать осторожность при занятии потенциально опасными видами
деятельности, требующими повышенной концентрации внимания и быстроты
психомоторных реакций. При появлении описанных побочных действий следует
воздержаться от выполнения указанных видов деятельности.
Раствор для подкожного
введения 8 млн МЕ/0,5 мл.
По 0,5 мл (8 млн МЕ/0,5 мл)
в трехкомпонентные стерильные шприцы из бесцветного нейтрального стекла I
гидролитического класса. На каждый шприц наклеивают этикетку. По 1 шприцу в
контурную ячейковую упаковку из пленки ПВХ.
По 1, 5 или 15 контурных ячейковых
упаковок с инструкцией по применению помещают в пачку из картона.
Пачка со шприцами
дополнительно может комплектоваться:
— салфетками спиртовыми по 1, 5 и 15 шт. соответственно.
Хранить при температуре от 2
до 8 °C.
В пределах указанного срока
годности допустимо хранение пациентом невскрытого шприца в течение одного
месяца при температуре не выше 25 °C.
Хранить
в недоступном для детей месте.
2
года.
Не
применять по истечении срока годности, указанного на упаковке.
Отпускают
по рецепту.
Владелец регистрационного
удостоверения
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург,
Петродворцовый район, п. Стрельна, ул. Связи, д. 34, литер А.
Производитель
ЗАО «БИОКАД», Россия,
143422, Московская обл., Красногорский р-н, с. Петрово- Дальнее.
Организация, принимающая претензии потребителей
ЗАО «БИОКАД», 198515, г. Санкт-Петербург,
Петродворцовый район, п. Стрельна, ул. Связи, д. 34, лит. А.
Тел,: +7 (812) 380 49 33, Факс: +7 (812) 380 49 34, e-mail: biocad@biocad.ru
Информацию о развитии нежелательных реакций направлять по адресу: safetv@biocad.ru
Бетаферон — инструкция по применению
Синонимы, аналоги
Статьи
В настоящее время препарат не числится в Государственном реестре лекарственных средств или указанный регистрационный номер исключен из реестра.
РЕГИСТРАЦИОННЫЙ НОМЕР:
П N012097/01
ТОРГОВОЕ НАИМЕНОВАНИЕ ПРЕПАРАТА:
Бетаферон
МЕЖДУНАРОДНОЕ НЕПАТЕНТОВАННОЕ НАИМЕНОВАНИЕ:
Интерферон бета-1b
ЛЕКАРСТВЕННАЯ ФОРМА:
Лиофилизат для приготовления раствора для подкожного введения
СОСТАВ
Каждый флакон с активным компонентом содержит: Интерферон бета -1b (IFN- бета -1b) — 0,30 мг (соответствует 9,6 млн. МЕ), альбумин человеческий – 15,00 мг, маннитол – 15,00 мг.
В 1 мл приготовленного раствора содержится 0,25 мг (8,0 млн. МЕ) рекомбинантного интерферона бета-1b.
В 1 мл водного растворителя для приготовления раствора для инъекций содержится 5,4 мг натрия хлорида.
ОПИСАНИЕ
Лиофилизат: Лиофилизированная масса белого цвета.
Растворитель: Прозрачный практически бесцветный раствор.
Восстановленный раствор: Раствор от слегка опалесцирующего до опалесцирующего, бесцветный или светло-желтого цвета.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА
Цитокин. Средство для лечения рассеянного склероза.
КОД АТХ: L03AB08
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Интерфероны — белки, принадлежащие к семейству цитокинов и имеющие молекулярную массу от 15000 до 21000 дальтон. Существует три класса интерферонов: интерферон альфа, интерферон бета и интерферон гамма, имеющих различную, но частично совпадающую биологическую активность. Активность интерферона бета-1b является видоспецифичной, поэтому наиболее значимую фармакологическую информацию по интерферону бета-1b можно получить из исследований с культивируемыми человеческими клетками или в исследованиях in vivo у человека.
Активное вещество препарата Бетаферон (интерферон бета-1b) обладает противовирусной и иммуномодулирующей активностью. Механизмы действия интерферона бета-1b при рассеянном склерозе (РС) окончательно не установлены. Однако известно, что биологический эффект интерферона бета-1b опосредуется его взаимодействием со специфическими рецепторами, которые обнаружены на поверхности клеток человека. Связывание интерферона бета-1b с этими рецепторами индуцирует экспрессию ряда веществ, которые рассматриваются в качестве медиаторов биологических эффектов интерферона бета-1b. Содержание некоторых из этих веществ определяли в сыворотке и фракциях клеток крови больных, получавших интерферон бета-1b. Интерферон бета-1b снижает связывающую способность, а также усиливает интернализацию и деградацию рецепторов к гамма-интерферону. Кроме того, интерферон бета-1b повышает супрессорную активность мононуклеарных клеток периферической крови. Отдельные исследования по влиянию препарата Бетаферон на сердечно-сосудистую, дыхательную и эндокринную систему не проводились.
Клинические исследования:
Рецидивирующе-ремиттирующий рассеянный склероз
В клиническом исследовании, проводившемся у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом и способных передвигаться без посторонней помощи (базовое значение EDSS от 0 до 5,5), было показано, что лечение препаратом Бетаферон снижает частоту (на 30 %) и тяжесть клинических обострений болезни, число госпитализаций вследствие заболевания, а также удлиняет продолжительность ремиссии. Информация о влиянии терапии препаратом Бетаферон на продолжительность рецидива или появление симптомов между обострениями, а также на прогрессирование заболевания при рецидивирующе-ремиттирующем рассеянном склерозе отсутствует.
Вторично-прогрессирующий рассеянный склероз:
Было проведено два контролируемых клинических исследования с участием 1657 пациентов с вторично-прогрессирующим РС (базовое значение EDSS от 3 до 6,5, т.е. пациенты способны ходить). Пациенты с легкой степенью заболевания, а также пациенты, не способные передвигаться, в исследования включены не были. Результаты обоих исследований продемонстрировали противоречивые результаты по первичной конечной точке — времени до подтвержденного прогрессирования заболевания – в виде отсрочки прогрессирования нетрудоспособности.
В одном из двух исследований на фоне лечения препаратом Бетаферон была продемонстрирована статистически значимая отсрочка прогрессирования нетрудоспособности (соотношение рисков=0,69, 95 % доверительный интервал (0,55; 0,86), р=0,0010 соответствуют снижению риска на 31 % в результате терапии препаратом Бетаферон) и тяжелой инвалидности (т.е. когда больные вынуждены постоянно пользоваться инвалидным креслом) (соотношение рисков = 0,61, 95 % доверительный интервал (0,44; 0,85), р=0,0036 соответствуют снижению риска на 39 % в результате терапии препаратом Бетаферон). Этот эффект наблюдался на протяжении 33 месяцев у больных с любым индексом инвалидизации независимо от частоты рецидивов. Во втором исследовании с участием пациентов с вторично-прогрессирующим РС не отмечалось отсрочки наступления инвалидности в результате лечения препаратом Бетаферон. Существуют данные, свидетельствующие о том, что пациенты, включенные в данное исследование, находились на менее активной стадии заболевания по сравнению с пациентами, принимавшими участие в первом исследовании.
Данные ретроспективного мета-анализа обоих исследований показали общий статистически значимый эффект терапии (р=0,0076; 8 млн. МЕ препарата Бетаферон в сравнении с пациентами, получавшими плацебо).
Ретроспективный анализ, проведенный в подгруппах, показал, что лечение препаратом Бетаферон с большей вероятностью оказывает влияние на время наступления инвалидности у пациентов, имевших заболевание в активной форме до начала терапии (соотношение рисков 0,72, 95 % доверительный интервал (0,59; 0,88), р=0,0011 соответствуют снижению риска на 28 % в результате терапии препаратом Бетаферон у пациентов с рецидивами или выраженной прогрессией EDSS, 8 млн. МЕ препарата Бетаферон в сравнении с пациентами, получавшими плацебо). Данные ретроспективного анализа позволяют предположить, что рецидивы, а также выраженное прогрессирование по шкале EDSS (EDSS>1 балла или EDSS >0,5 балла для EDSS >6 в предыдущие два года) могут помочь выявить пациентов с активной формой заболевания.
В обоих исследованиях с участием пациентов с вторично-прогрессирующим рассеянным склерозом лечение препаратом Бетаферон снижало частоту клинических обострений на 30 %. Данных о влиянии терапии на продолжительность рецидивов отмечено не было.
Клинически изолированный синдром, позволяющий предположить рассеянный склероз
Было проведено одно контролируемое клиническое исследование у пациентов с клинически изолированным синдромом и результатами магнитно-резонансной томографии головного мозга (МРТ), позволяющими предположить наличие рассеянного склероза (по крайней мере, два очага, не проявляющихся клинически на Т2-взвешенных изображениях МРТ). В исследование включались пациенты с моноочаговым или многоочаговым началом заболевания (т.е. пациенты с клиническими проявлениями одного или, по меньшей мере, двух очагов поражения центральной нервной системы). Пациенты, имеющие симптомы любого заболевания, схожие с симптомами рассеянного склероза, исключались из исследования.
Данное исследование включало 2 фазы: плацебо-контролируемую фазу (плацебо в сравнении с препаратом Бетаферон) и следовавшую за ней заранее запланированную фазу наблюдения. Плацебо-контролируемая фаза продолжалась 2 года или до момента развития клинически достоверного рассеянного склероза (КДРС), в зависимости от того, что наступит раньше. После завершения плацебо-контролируемой фазы исследования пациенты переходили в фазу последующего заранее запланированного наблюдения, чтобы сравнить эффекты от раннего и позднего начала терапии препаратом Бетаферон. Сравнение проводилось у пациентов, первоначально рандомизированных в группу препарата Бетаферон («группа раннего начала терапии препаратом Бетаферон») и в группу плацебо («группа позднего начала терапии»).
Таблица 1.
Результаты первичной эффективности по данным исследования BENEFIT и результаты последующего наблюдения по данным исследования BENEFIT Follow—up.
В плацебо-контролируемой фазе исследования препарат Бетаферон замедлял прогрессирование заболевания от первого клинического проявления до клинически достоверного рассеянного склероза. Терапия препаратом Бетаферон вызывала стабильну отсрочку прогрессирования рассеянного склероза по критериям Макдональда (Таблица 1).
Лечение препаратом Бетаферон оказывало эффект в отношении прогрессирования заболевания до КДРС во всех анализируемых подгруппах. У пациентов с моноочаговой формой и, как минимум, девятью очагами на Т2-взвешенных изображениях или Gd-усилением на исходной МРТ головного мозга риск прогрессирования заболевания до КДРС в течение 2-х лет был выше. У пациентов с многоочаговой формой сроки развития заболевания до КДРС не зависели от исходных показателей МРТ, что на осноосновании
клинических наблюдений указывало на высокий риск КДРС вследствие
прогрессирования заболевания. На данный момент не существует четкого определе
ния понятия «высокий риск». Более консервативный подход предполагает выявление, по крайней мере, девяти гиперинтенсивных очагов на Т2-взвешенных изображениях при первоначальном сканировании и, по крайней мере, одного нового очага на Т2-взвешенных изображениях или одного нового очага с Gd-усилением не менее чем через месяц после первоначального сканирования. В любом случае лечение должно назначаться только пациентам с высоким риском.
Высокий процент пациентов, завершивших исследование (93% из группы препарата Бетаферон), указывал на хорошую переносимость лечения препаратом Бетаферон. Для повышения переносимости препарата в начале терапии проводили титрование доз и введение нестероидных противовоспалительных препаратов. Более того, в течение всего исследования большинству пациентов введение препарата осуществлялось с помощью автоинжектора.
В последующей фазе открытого наблюдения было очевидно влияние терапии через 3 и 5 лет лечения (Таблица 1) даже при условии, что большинство пациентов группы плацебо получали лечение препаратом Бетаферон по крайней мере, начиная со второго года заболевания. В группе с ранним началом терапии препаратом Бетаферон (Таблица 1, выраженный эффект через 3 года, отсутствие значительного эффекта через 5 лет) прогрессирование заболевания по шкале EDSS (подтвержденное увеличение EDSS, как минимум на один бал по сравнению с исходным состоянием) было ниже. У большинства пациентов в обеих группах не наблюдалось прогрессирования нетрудоспособности в течение 5 лет. Для «раннего начала терапии» не было продемонстрировано устойчивого влияния на этот исходный параметр. Не было выявлено никаких преимуществ в отношении качества жизни, определяемого в соответствии с FAMS (Functional Assessment of MS – функциональная оценка рассеянного склероза: индекс лечение, исход), вследствие раннего начала терапии препаратом Бетафероном.
Рецидивирующе-ремиттирующий рассеянный склероз, вторично-прогрессирующий рассеянный склероз и клинически изолированный синдром, позволяющий предположить рассеянный склероз.
Результаты МРТ у пациентов с рассеянным склерозом продемонстрировали эффективность препарата Бетаферон и замедление течения болезни во всех исследованиях. По результатам оценки МРТ взаимосвязь течения рассеянного склероза и клинического исхода в настоящее время не выяснена.
Токсикологическая характеристика
Исследования острой токсичности не проводились. Поскольку грызуны нечувствительны к действию человеческого интерферона бета, оценка риска проводилась на основании исследований токсичности при повторных дозах у макак-резус. Наблюдалась транзиторная гипертермия, наряду с выраженным преходящим повышением концентрации лимфоцитов и преходящим снижением тромбоцитов и сегментоядерных нейтрофилов.
Длительные исследования токсичности не проводились. Исследования репродуктивной токсичности у макак-резус выявили токсичность для матери и увеличение частоты спонтанных абортов. У живого потомства не наблюдалось каких-либо пороков развития. Исследования влияния на фертильность не проводились. Не наблюдалось какого-либо влияния на эстральный цикл обезьян.
В одном отдельном исследовании генотоксичности (тест Амеса), не наблюдалось каких-либо мутагенных эффектов. Исследования канцерогенности не проводились. Тест клеточной трансформации in vitro не выявил какого-либо канцерогенного потенциала.
Фармакокинетика
Концентрацию интерферона бета-1b в плазме у пациентов и добровольцев определяли с помощью специфичного биологического анализа.
После подкожного введения 0,5 мг (16,0 млн. МЕ) интерферона бета-1b максимальная концентрация в плазме достигается через 1-8 часов после инъекции и составляет около 40 МЕ/мл. По данным различных исследований при внутривенном введении интерферона бета-1b клиренс и период его полувыведения из плазмы составляют в среднем 30 мл/мин/кг и 5 часов соответственно.
Введение препарата Бетаферон через день не приводит к повышению концентрации интерферона бета-1b в плазме крови, а его фармакокинетика в течение курса терапии не меняется.
При подкожном введении интерферона бета-1b абсолютная биодоступность составляет приблизительно 50%.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
• Клинически изолированный синдром (КИС) (единственный клинический эпизод демиелинизации, позволяющий предположить рассеянный склероз, при условии исключения альтернативных диагнозов) с достаточной выраженностью воспалительного процесса для назначения внутривенных кортикостероидов – для
замедления перехода в клинически достоверный рассеянный склероз (КДРС) у пациентов с высоким риском развития КДРС.
Общепринятого определения высокого риска нет. По данным исследования к группе высокого риска развития КДРС относятся пациенты с моноочаговым КИС (клиническими проявлениями 1 очага в ЦНС) и ≥ 9 очагов на Т2-взвешенных изображениях на МРТ и/или накапливающим контрастное вещество очагами. Пациенты с многоочаговым КИС (клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска развития КДРС независимо от количества очагов на МРТ.
• Рецидивируще-ремиттирующий рассеянный склероз (РРС) – для уменьшения частоты и тяжести обострений у амбулаторных больных (т.е. пациентов, способных ходить без посторонней помощи) при наличии в анамнезе не менее 2-х обострений за последние два года с последующим полным или неполным восстановлением неврологического дефицита.
• Вторично-прогрессирующий рассеянный склероз с активным течением заболевания, характеризующимся обострениями или выраженным ухудшением неврологических функций в течение последних двух лет – для уменьшения частоты и степени тяжести клинических обострений болезни, а также для замедления темпов прогрессирования заболевания.
ПРОТИВОПОКАЗАНИЯ
- Беременность.
- Грудное вскармливание.
- Реакции гиперчувствительности на природный или рекомбинантный интерферон бета в анамнезе и компоненты, входящие в состав препарата.
- Тяжелая депрессия и/или суицидальные мысли.
- Заболевания печени в стадии декомпенсации.
- Детский возраст до 18 лет (информация об эффективности и безопасности применения интерферона бета-1b у детей ограничена).
С ОСТОРОЖНОСТЬЮ
Препарат Бетаферон следует применять с осторожностью у пациентов со следующими заболеваниями:
- заболевания сердца, в частности, сердечная недостаточность III-IV функционального класса по классификации Нью-Йоркской Кардиологической Ассоциации (NYHA), кардиомиопатия;
- эпилептические припадки в анамнезе;
- моноклональная гаммапатия;
- анемия, тромбоцитопения, лейкопения;
- тяжелая почечная недостаточность.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ
Беременность
Информация о способности препарата Бетаферон вызывать повреждения плода при лечении беременных женщин или влиять на репродуктивную функцию человека ограничена. В контролируемых клинических исследованиях у больных рассеянным склерозом отмечались случаи самопроизвольного аборта. Применение препарата Бетаферон при беременности противопоказано.
Женщинам репродуктивного возраста во время терапии препаратом Бетаферон следует пользоваться надежными методами контрацепции. В случае наступления беременности во время лечения или при планировании беременности пациентка должна быть проинформирована о потенциальном риске для плода. В этом случае рекомендуется отменить применение препарата Бетаферон.
У пациенток с высокой частотой рецидивов в анамнезе перед началом терапии необходимо оценивать риск развития серьезного рецидива после прекращения лечения препаратом при наступлении беременности против возможного риска развития спонтанного аборта.
Период грудного вскармливания
Неизвестно, выделяется ли интерферон бета-1b с грудным молоком. Учитывая теоретическую возможность развития нежелательных реакций на препарат Бетаферон у младенцев, находящихся на грудном вскармливании, необходимо прекратить кормление грудью или отменить препарат.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Терапию препаратом Бетаферон следует начинать под наблюдением врача, имеющего опыт лечения рассеянного склероза.
Рекомендуемую дозу препарата Бетаферон 0,25 мг (8 млн. МЕ), которая содержится в 1 мл приготовленного раствора, вводят подкожно через день.
В начале лечения обычно рекомендуется провести титрование дозы. Лечение следует начинать с введения 0,0625 мг (0,25 мл) подкожно через день, постепенно увеличивая дозу до 0,250 мг (1,0 мл), вводимую также через день. Период титрования дозы может быть изменен в случае возникновения любой значимой нежелательной реакции. Для достижения достаточной эффективности терапии необходимо дозу 0,250 мг (1,0 мл) вводить через день.
Таблица для титрования дозы:
|
День лечения |
Доза в мг |
Объем препарата в мл |
|
1, 3, 5 |
0,0625 |
0,25 |
|
7, 9, 11 |
0,125 |
0,5 |
|
13, 15, 17 |
0,1875 |
0,75 |
|
≥ 19, 21, 23 и далее |
0,250 |
1,0 |
В клинических исследованиях длительность лечения у больных рецидивирующе-ремиттирующим и вторично-прогрессирующим рассеянным склерозом достигала 5 лет и 3 года соответственно.
При рецидивирующе-ремиттирующем рассеянном склерозе эффективность лечения препаратом Бетаферон была продемонстрирована на протяжении первых двух лет терапии. Имеющиеся данные по дополнительному 3-х летнему периоду терапии согласуются с данными по эффективности лечения препаратом Бетаферон на протяжении всего периода лечения.
У пациентов с клинически изолированным синдромом, позволяющим предположить рассеянный склероз, прогрессирование заболевания до КДРС было замедлено на период 5 лет.
Не рекомендуется проводить терапию препаратом Бетаферон у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом, имевшим менее двух рецидивов в течение последних 2-х лет, и у пациентов с вторично-прогрессирующим рассеянным склерозом, у которых не наблюдалось активной фазы заболевания за последние 2 года.
Лечение препаратом Бетаферон следует прекратить, если пациент не отвечает на терапию, например, наблюдается устойчивое прогрессирование заболевания в течение 6 месяцев по шкале EDSS (расширенная шкала инвалидизации) или, несмотря на лечение препаратом Бетаферон, требуется не менее трех курсов терапии АКТГ (адренокортикотропный гормон) или кортикостероидами в течение 1 года.
Приготовление инъекционного раствора
A. Упаковка препарата, содержащая флаконы и предварительно наполненные шприцы:
Для растворения лиофилизированного порошка интерферона бета-1b для инъекций используют прилагаемые готовый шприц с растворителем и иглу.
Б. Упаковка препарата, содержащая флаконы, предварительно наполненные шприцы, адаптер для флакона с иглой и спиртовые салфетки:
Для растворения лиофилизированного порошка интерферона бета-1b для инъекций используют прилагаемые готовый шприц с растворителем и адаптер для флакона с иглой.
Во флакон с препаратом Бетаферон вводят 1,2 мл растворителя (раствор натрия хлорида 0,54 %). Порошок должен раствориться полностью без встряхивания. Перед применением следует осмотреть готовый раствор, который должен быть от слегка опалесцирующего до опалесцирующего, бесцветного или светло-желтого цвета. При наличии частиц или изменении цвета раствора его нельзя применять.
Неиспользованный раствор следует выбросить.
В 1 мл готового раствора содержится 0,25 мг (8 млн. МЕ) интерферона бета-1b.
Необходимое в соответствии с титрованной дозой количество препарата набирают в шприц после приготовления раствора.
Техника самостоятельных инъекций для пациентов
Чтобы самостоятельно приготовить раствор препарата Бетаферон для инъекции и сделать укол, пожалуйста, внимательно прочитайте инструкции и выполняйте их поэтапно. Врач или медсестра ознакомят Вас с процедурой и техникой самостоятельных инъекций и помогут Вам в обучении. Не пытайтесь самостоятельно делать уколы до тех пор, пока Вы не будете уверены в том, что правильно поняли требования по приготовлению раствора, а также технику самостоятельных инъекций.
А. Упаковка препарата, содержащая флаконы и предварительно наполненные шприцы.
- Подготовка к инъекции.
- Введение необходимого объема растворителя (1,2 мл) во флакон с препаратом Бетаферон.
- Набор необходимого объема раствора для инъекции (1,0 мл) в шприц.
Подготовка к инъекции
1. Перед тем как сделать укол, соберите все необходимое для инъекции.
Для этого Вам потребуются:
- заполненный шприц с растворителем препарата Бетаферон (0,54% раствор натрия хлорида)
- флакон с препаратом Бетаферон
- игла 21G
- игла 30G
- спиртовые салфетки
- контейнер для использованных шприцов и игл
2. Тщательно вымойте руки с мылом.
3. Снимите защитный колпачок с флакона с препаратом Бетаферон.
4. Протрите спиртовой салфеткой крышку флакона с препаратом Бетаферон (протирайте в одном направлении и используйте одну салфетку).
ПРИМЕЧАНИЕ: оставьте спиртовую салфетку на крышке флакона и не снимайте ее до тех пор, пока не будете готовы использовать флакон.
Введение необходимого объема растворителя (1,2 мл) во флакон с препаратом Бетаферон
ПРИМЕЧАНИЕ: возьмите флакон с препаратом Бетаферон и выбросьте находящуюся сверху спиртовую салфетку.
1. Держа руки на устойчивой поверхности, выньте шприц с растворителем из упаковки. Потянув за крышку, снимите ее с основания шприца. Не дотрагивайтесь до открытого кончика шприца. Не надавливайте на поршень.
2. Выньте иглу 21G из упаковки и плотно насадите ее на кончик шприца. Снимите с иглы защитный колпачок. Не дотрагивайтесь до иглы.
3. Установив флакон с препаратом Бетаферон на устойчивой поверхности, медленно введите иглу шприца (содержащего 1,2 мл растворителя) до конца через пробку флакона.
4. Медленно надавливайте на поршень. Игла должна быть направлена в сторону так,
чтобы жидкость стекала по стенке флакона (если ввести растворитель прямо в
порошок, то образуется много пены).
5. Следите за тем, чтобы игла не соприкасалась с порошком или образующимся
раствором.
6. Когда Вы введете все содержимое шприца во флакон с препаратом Бетаферон, удерживайте флакон между большим, указательным и средним пальцами так, чтобы игла и шприц находились на руке.
7. Осторожно повертите флакон в руке для полного растворения порошка препарата Бетаферон. НЕ ВСТРЯХИВАЙТЕ!
8. Внимательно осмотрите раствор (он должен быть прозрачным).
ПРИМЕЧАНИЕ: если смесь содержит частицы или поменяла цвет, вылейте ее и начните всю процедуру с начала.
Набор необходимого объема раствора для инъекций (1,0 мл) в шприц
ПРИМЕЧАНИЕ: перед набором приготовленного раствора полностью выжмите поршень шприца, чтобы удалить воздух, который, возможно, остался внутри шприца.
1. Слегка наклоните флакон с раствором препарата Бетаферон и установите кончик иглы в
самой нижней точке флакона.
ПРИМЕЧАНИЕ: следите за тем, чтобы кончик иглы все время находился в растворе.
2. Потяните поршень и наберите в шприц 1,0 мл жидкости до метки.
3. Переверните флакон вверх дном и держите шприц иглой вверх.
4. Осторожно постучите по шприцу, чтобы пузырьки воздуха переместились в верхнюю часть цилиндра.
5. Осторожно надавите на поршень, чтобы из шприца вышел ТОЛЬКО ВОЗДУХ.
6. Отделите шприц от иглы. Иглу оставьте во флаконе.
7. Положите шприц (без иглы) на ровную поверхность. Следите за тем, чтобы кончик шприца не касался поверхности.
8. Возьмите иглу 30G, выньте ее из упаковки и плотно насадите на кончик шприца.
9. Флакон с остатками раствора и иглой выбросьте.
ПРИМЕЧАНИЕ: Препарат следует вводить подкожно сразу после приготовления раствора. Если инъекция откладывается, то раствор следует хранить в холодильнике и использовать в течение 3 ч. Раствор нельзя замораживать. Теперь Вы готовы сделать инъекцию.
Б. Упаковка препарата, содержащая флаконы, предварительно наполненные шприцы адаптер для флакона с иглой и спиртовые салфетки.
Этапы приготовления раствора:
1 — Перед началом процедуры тщательно вымойте руки с мылом.
2 — Откройте флакон с препаратом Бетаферон — лучше не ногтем, поскольку он может сломаться, а большим пальцем — и поставьте на стол.
3 — Протрите спиртовой салфеткой крышку флакона. Передвигайте салфетку только в одном направлении, а затем оставьте ее на крышке флакона.
4 – Откройте блистерную упаковку, в которой находится адаптер для флакона, но адаптер оставьте внутри.
Не вынимайте адаптер для флакона из блистерной упаковки.
Кроме того, следите за тем, чтобы не прикасаться к адаптеру для флакона. Важно, чтобы он оставался стерильным.
5 – В процессе присоединения адаптера держите флакон на ровной поверхности.
6 — Снимите спиртовую салфетку с крышки флакона препарата Бетаферон. Поместите на крышку флакона блистерную упаковку, в которой содержится приспособление для переноса раствора с адаптером для флакона. Надавите на блистер большим и указательным пальцами или ладонью до щелчка.
7 — Взяв за края блистерной упаковки, снимите ее с адаптера флакона. Теперь Вы готовы к тому, чтобы присоединить предварительно заполненный шприц с растворителем к приспособлению для переноса раствора.
8 — Возьмите шприц. Перекрутите оранжевый колпачок на кончике шприца и, потянув за него, снимите со шприца. Выбросьте колпачок.
9 — Присоедините шприц к отверстию на боковой стороне адаптера, введя в него кончик шприца и осторожно закрепив путем нажатия с одновременным поворотом по часовой стрелке (как показано стрелкой), чтобы получилась сборная конструкция со шприцем.
10 — Удерживайте конструкцию со шприцем за дно флакона. Медленно надавите до отказа на поршень шприца, чтобы переместить весь растворитель во флакон. Отпустите поршень. При этом поршень может вернуться в свое первоначальное положение.
11 — Сделайте несколько острожных вращательных движений флаконом, чтобы сухой порошок препарата Бетаферон полностью растворился. При этом конструкция со шприцем остается все еще присоединенной к флакону.
Не встряхивайте флакон.
12 — Внимательно осмотрите раствор. Он должен быть прозрачным и не содержать никаких частиц. Если
раствор поменял цвет или содержит частицы, вылейте его и начните всю процедуру с начала, взяв новую упаковку принадлежностей. Если появилась пена – что может случиться, если флакон встряхивать или
слишком сильно вращать – дайте флакону постоять, пока пена не осядет.
Подготовка шприца
13 — Если поршень вернулся в свое первоначальное положение, снова протолкните его внутрь и зафиксируйте. Для подготовки инъекции переверните конструкцию, так чтобы флакон находился сверху, а крышка флакона была направлена вниз. Это позволит раствору стечь в шприц.
Держите шприц горизонтально.
Медленно оттяните поршень, чтобы набрать весь раствор из флакона в шприц.
14 — Поверните конструкцию со шприцем таким образом, чтобы игла была направлена вверх. Это заставит пузырьки воздуха подняться к поверхности раствора.
15 — Удалите пузырьки воздуха, осторожно постучав по шприцу и переместив поршень к отметке 1 мл или того
объема, который был назначен врачом.
Если вместе с пузырьками воздуха во флакон было вытеснено слишком много раствора, немного оттяните поршень назад, чтобы вновь набрать раствор из флакона обратно в шприц. Делайте это до тех пор, пока весь воздух не будет удален, и в шприце не будет содержаться 1 мл приготовленного раствора.
Важное замечание: Набирая раствор повторно, верните конструкцию со шприцем в горизонтальное положение, при котором флакон находится сверху.
16 — После этого возьмитесь за синий адаптер флакона вместе с присоединенным к нему флаконом,
поверните адаптер на себя, а затем отделите его от шприца.
Отделяя адаптер с флаконом от шприца, беритесь только за синий пластиковый адаптер. Держите шприц в горизонтальном положении; флакон должен находиться под шприцем.

17 — В результате отсоединения флакона и адаптера от шприца обеспечивается вытекание раствора из иглы во время инъекции.
18 — Теперь Вы готовы сделать инъекцию.
ПРИМЕЧАНИЕ: Препарат следует вводить подкожно сразу после приготовления раствора. Если инъекция откладывается, то раствор следует хранить в холодильнике и использовать в течение 3 ч. Раствор нельзя замораживать.
19 — Флакон и оставшийся неиспользованный раствор выбросьте в контейнер для
отходов.
Краткое описание подготовки препарата к инъекции
1. Достаньте содержимое из упаковки.
2. Прикрепите к флакону адаптер для флакона.
3. Присоедините шприц к адаптеру флакона.
4. Надавите на поршень, чтобы переместить растворитель во флакон.
5. Переверните сборную конструкцию со шприцем, затем оттяните поршень.
6. Отделите флакон от шприца – теперь Вы готовы сделать инъекцию.
ПРИМЕЧАНИЕ: Препарат следует вводить подкожно сразу после приготовления раствора. Если инъекция откладывается, то раствор следует хранить в холодильнике и использовать в течение 3 ч. Раствор нельзя замораживать.
Выбор и подготовка места для инъекции и введение раствора препарата
Бетаферон (1,0 мл) подкожно
- Выбор места инъекции
Препарат Бетаферон (интерферон бета-1b) следует вводить подкожно. Для этого лучше всего подходят мягкие места, расположенные вдали от суставов и нервов.
Места инъекции можно выбирать с помощью рисунка. Лучше всего сначала определить место инъекции, а затем готовить шприц.
Если Вам трудно дотянуться до какого-либо места, попросите помощи у человека, который умеет делать уколы.
1 — Выберите место инъекции (см. рисунок «Схема чередования выполненных инъекций» в конце инструкции).
ВАЖНОЕ ПРИМЕЧАНИЕ: Не делайте инъекцию в те места, где присутствуют бугорки, припухлости, твердые узлы или болезненные ощущения. Кроме того, не следует вводить раствор в те участки, где имеются изменения цвета кожи, углубления, корочки, или нарушена целостность кожи. Если Вы обнаружите у себя эти или другие необычные состояния, обратитесь к своему лечащему врачу.
2 — Протрите кожу в месте инъекции спиртовой салфеткой и дождитесь, пока кожа высохнет под воздействием воздуха. Выбросьте салфетку.
Для дезинфекции кожи используйте подходящее дезинфицирующее средство.
3 — Снимите с иглы защитный колпачок. Потяните за колпачок, а не перекручивайте его.
4 — Осторожно защипните кожу вокруг продезинфицированного участка (чтобы немного приподнять ее).
5 — Резким уверенным движением вонзите иглу прямо в кожу под углом 90°. Держите шприц как карандаш или
дротик.
6 — Медленно введите раствор, плавно и непрерывно надавливая на поршень. (Надавливайте на поршень до упора, пока шприц не опустеет).
7- Выбросьте шприц в контейнер для отходов.
- Чередование мест инъекции
Каждый раз необходимо выбирать новое место для инъекции, так как чередование мест инъекции позволяет коже восстановиться, а также помогает предотвратить попадание инфекции. Лучше заранее выбирать место инъекции и только затем готовить шприц. Схема, приведенная на рисунке, поможет Вам правильно чередовать места инъекции. Например, если первую инъекцию Вы сделали в правую половину живота, то вторую сделайте в левую половину, третью – в правое бедро и т.д. в соответствии со схемой до тех пор, пока Вы не используете все возможные участки для инъекций. Записывайте, куда и когда Вы сделали последнюю инъекцию.
Следуя предложенной схеме, после 8-ой инъекций (через 16 дней) Вы вновь вернетесь к месту первой инъекции (например, правой половине живота). Это называется «циклом чередования». В схеме, приводимой нами в качестве примера, каждая зона в свою очередь разделена на 6 участков для инъекций (что в целом составляет 48 участков для инъекций): левая и правая, верхняя, центральная и нижняя части соответствующей зоны. Когда после одного цикла чередования Вы вернетесь к одной из зон, выбирайте как можно более отдаленный участок для инъекции в этой зоне. Если какая-либо зона стала болезненной, то обсудите с врачом другие возможные места инъекций.
Схема чередования:
С целью помочь себе правильно чередовать места инъекций, рекомендуется записывать, когда и в какой участок была сделана инъекция. Для этого Вы можете использовать следующую схему чередования:
1-ый цикл чередования Первые 8 инъекций делают последовательно с 1-ой зоны по 8-ю зону, используя только верхний левый сегмент каждой зоны.
2-ой цикл чередования Следующие 8 инъекций начинают снова с 1-ой зоны, но делать их нужно в нижний правый сегмент каждой зоны.
3-ий цикл чередования Следующие 8 инъекций в этом цикле начинают с 1-ой зоны и выполняют по очереди в центральные левые сегменты каждой зоны.
При соблюдении этой последовательности у каждой зоны будет возможность полностью восстановиться перед следующей инъекцией.
Регистрация выполненных инъекций
Инструкция по учету мест и дат выполненных инъекций
Выберите место инъекции. Если Вы уже пользуетесь препаратом Бетаферон, то начните с той зоны, которая не использовалась в течение последнего цикла чередования, т.е. в течение последних 16 дней.
Сделав инъекцию, запишите использованный участок и дату выполненной инъекции (см. рисунок «Пример регистрации выполненных инъекций» в конце инструкции по применению).
ПОБОЧНОЕ ДЕЙСТВИЕ
Возникновение нежелательных реакций обычно сопутствует началу терапии. Частота их возникновения снижается с течением времени.
Наиболее часто может возникать комплекс гриппоподобных симптомов (лихорадка, озноб, артралгия, общее недомогание, потливость, головная боль или миалгия), обусловленный фармакологическим действием препарата Бетаферон. Рекомендуется проводить титрование дозы в начале лечения. Выраженность гриппоподобных симптомов можно ослабить, применяя нестероидные противовоспалительные препараты.
Часто у пациентов после введения препарата Бетаферон в дозе 0,25 мг (8 млн. МЕ) возникают реакции в месте введения (например, покраснение, отек, изменение цвета кожи, воспаление, боль, гиперчувствительность, некроз и неспецифические реакции).
Частота реакций в месте введения может быть снижена при использовании устройства для автоматического введения препарата.
Неблагоприятные реакции (НР) при применении препарата Бетаферон, наблюдавшиеся в ходе клинических исследований и выявленные в процессе пострегистрационного наблюдения, и частота их встречаемости представлены ниже.
Для описания конкретной реакции, ее синонимов и связанных с нею состояний используется наиболее подходящий термин из Медицинского словаря для регуляторной деятельности (MedDRA).
Таблица 1: Неблагоприятные явления и отклонения лабораторных показателей, наблюдавшиеся в ходе клинических испытаний с коэффициентом возникновения ≥ 10% и с соответствующим процентным показателем для группы плацебо. Побочные эффекты с коэффициентом возникновения < 10%, появление которых очевидно связано с применением препарата.

Примечания:
1— все нежелательные явления, возникающие в месте инъекции: кровоподтек,
гиперчувствительность, воспаление, уплотнение в месте инъекции, некроз, боль, реакция
в месте инъекции, отек, атрофия тканей;
2— комплекс гриппоподобных симптомов, обозначенный как гриппоподобный
синдром, включающий, по меньшей мере, два из следующих нежелательных явлений:
лихорадка, озноб, миалгия, недомогание и потливость;
3 — отклонение от нормы лабораторных показателей;
4 — нежелательные явления, в значительной мере связанные с применением препарата
Бетаферон у пациентов с клинически изолированным синдромом, позволяющим
предположить рассеянный склероз, p < 0,05;
5 — нежелательные явления, в значительной мере связанные с применением препарата
Бетаферон у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом,
p < 0,05;
6 — нежелательные явления, в значительной мере связанные с применением препарата
Бетаферон у пациентов с вторично-прогрессирующим рассеянным склерозом, p < 0,05;
7 — в ходе клинического исследования BENEFIT не наблюдалось изменений в профиле
безопасности препарата Бетаферон.
Таблица 2:
Неблагоприятные реакции, выявленные в процессе пострегистрационных наблюдений, и для которых частота встречаемости установлена, определены на основе объединенных данных клинических исследований (N = 1093). Частота встречаемости определена как: «очень часто» (> 1/10) и «часто» (от > 1/100 до < 1/10), «нечасто» (от > 1/1000 до < 1/100), «редко» (от > 1/10000 до < 1/1000). Для НР, выявленных в процессе пострегистрационных наблюдений, и для которых частота встречаемости не установлена, указано «частота неизвестна».




Примечания:
1– неблагоприятные реакции, выявленные только в процессе пострегистрационных
наблюдений;
2 – относится ко всем препаратам, содержащим интерферон бета;
3 – относится ко всем препаратам, содержащим интерферон (см. последующий
комментарий).
Легочная артериальная гипертензия
Имеются сообщения о случаях возникновения легочной артериальной гипертензии (ЛАГ) при применении препаратов с содержанием интерферона бета. Возникновение заболевания отмечалось в различные периоды лечения, в том числе через несколько лет после начала терапии интерфероном бета.
Пациентам и врачам необходимо информировать представительство компании-производителя о подозрении на нежелательные реакции, связанные с применением препарата Бетаферон, с целью отслеживания соотношения пользы и риска.
ПЕРЕДОЗИРОВКА
При введении препарата Бетаферон внутривенно в дозе до 5,5 мг (176 млн. МЕ) три раза в неделю взрослым пациентам с онкологическими заболеваниями не было выявлено серьёзных нежелательных явлений.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ И ДРУГИЕ ФОРМЫ ВЗАИМОДЕЙСТВИЯ
Специальные исследования взаимодействия препарата Бетаферон с другими препаратами не проводились.
Влияние препарата Бетаферон в дозе 0,25 мг (8 млн. МЕ) через день на метаболизм лекарственных средств у больных рассеянным склерозом неизвестен.
На фоне применения препарата Бетаферон глюкокортикостероиды и АКТГ, назначаемыена срок до 28 дней при лечении обострений, переносятся хорошо. Применение препарата Бетаферон одновременно с другими иммуномодуляторами, помимо кортикостероидов или АКТГ, не изучалось и, следовательно, не рекомендуется.
Интерфероны снижают активность печеночных цитохром Р450-зависимых ферментов у человека и животных. Необходимо соблюдать осторожность при назначении препарата Бетаферон в комбинации с лекарственными препаратами, имеющими узкий терапевтический индекс, клиренс которых в значительной степени зависит от печеночной системы цитохрома Р450 (например, противоэпилептические средства). Специальные исследования на совместимость препарата Бетаферон с противоэпилептическими средствами не проводились. Необходимо также соблюдать осторожность при одновременном применении любых препаратов, влияющих на систему кроветворения. Ввиду отсутствия исследований на совместимость данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
ОСОБЫЕ УКАЗАНИЯ
Иммунные нарушения
Применение цитокинов у больных с моноклональной гаммапатией иногда сопровождалось системным повышением проницаемости капилляров с развитием шока и летальным исходом.
Желудочно-кишечные нарушения
В редких случаях на фоне применения препарата Бетаферон наблюдалось развитие панкреатита, в большинстве случаев связанное с наличием гипертриглицеридемии.
Заболевания нервной системы
Следует проявлять осторожность при назначении препарата Бетаферон больным с депрессивными расстройствами в настоящее время или в анамнезе, в особенности пациентам с суицидальными мыслями в анамнезе. Депрессии и суицидальные мысли чаще встречаются у пациентов с рассеянным склерозом, чем в общей популяции, и связаны с применением интерферона.
Пациенты должны быть проинформированы о том, что в случае возникновения депрессии и суицидальных мыслей они должны сообщать об этом лечащему врачу немедленно.
Пациенты, проявляющие депрессию должны находиться под тщательным наблюдением, а терапию препаратом Бетаферон следует соответствующим образом корректировать.
Необходимость продолжения лечения препаратом Бетаферон должна быть пересмотрена. Препарат Бетаферон необходимо применять с осторожностью у пациентов с судорогами в анамнезе и у пациентов, принимающих противосудорожные препараты, в особенности, если контролировать эпилепсию данными препаратами не удается (см. разделы «Побочное действие», «Взаимодействие с другими лекарственными препаратами и другие формы взаимодействия»).
Данный препарат содержит человеческий альбумин, и по этой причине существует весьма незначительный риск передачи вирусных заболеваний. Нельзя исключить риск передачи болезни Крейтцфельдта-Якоба.
Изменения лабораторных показателей
Пациентам с дисфункцией щитовидной железы рекомендуется проверять функцию щитовидной железы регулярно, а в остальных случаях – по клиническим показаниям.
Кроме стандартных лабораторных анализов, назначаемых при ведении пациентов с рассеянным склерозом, перед началом терапии препаратом Бетаферон, а также регулярно во время проведения лечения рекомендуется проводить развернутый анализ крови, включая определение лейкоцитарной формулы, числа тромбоцитов и биохимического анализа крови, а также проверять функцию печени (например, активность аспартат-аминотрансферазы (АСТ), аланин-аминотрансферазы (АЛТ) и гамма-глутамилтрансферазы (γ-ГТ)).
При ведении пациентов с анемией, тромбоцитопенией, лейкопенией (по отдельности или в комбинации) может потребоваться более тщательный мониторинг развернутого анализа крови, включая определение количества эритроцитов, лейкоцитов, тромбоцитов и лейкоцитарной формулы. Пациенты с нейтропенией должны находиться под тщательным наблюдением на предмет повышения температуры или развития инфекции. Имеются сообщения о случаях тромбоцитопении с выраженным снижением числа тромбоцитов.
Нарушения функции печени и желчевыводящих путей
Клинические исследования показали, что терапия препаратом Бетаферон часто может приводить к бессимптомному повышению активности печеночных трансаминаз, которое в большинстве случаев выражено незначительно и носит преходящий характер. Имеются редкие сообщения о случаях тяжелого поражения печени, включая печеночную недостаточность при применении интерферонов бета. Наиболее тяжелые случаи отмечались у пациентов, подвергшихся воздействию гепатотоксичных лекарственных препаратов или веществ, а также при некоторых сопутствующих заболеваниях (например, злокачественные новообразования с метастазированием, тяжелые инфекции и сепсис, злоупотребление алкоголем).
При лечении препаратом Бетаферон необходимо осуществлять мониторинг функции печени (включая оценку клинической картины). Повышение активности трансаминаз в сыворотке крови требует тщательного наблюдения и обследования. При значительном повышении активности трансаминаз в плазме крови или появлении признаков поражения печени (например, желтухи) следует отменить препарат. При отсутствии клинических признаков поражения печени или после нормализации активности «печеночных» ферментов возможно возобновление терапии препаратом Бетаферон с наблюдением за функцией печени.
Нарушения функции почек и мочевыводящих путей
Препарат Бетаферон необходимо применять с осторожностью у больных с тяжелой почечной недостаточностью под тщательным наблюдением.
Нефротический синдром
Имеются сообщения о случаях возникновения нефротического синдрома с различными нефропатиями, включая фокальный сегментарный гломерулосклероз (ФСГС), болезнь минимальных изменений (БМИ), мембранопролиферативный гломерулонефрит (МПГН) и мембранозную нефропатию (МН), при лечении препаратами, содержащими интерферон бета. Возникновение заболевания отмечалось как в различные периоды во время лечения, так и через несколько лет после начала терапии интерфероном бета. Рекомендуется регулярно проверять появление ранних симптомов, таких как отечность, протеинурия и нарушение функции почек, особенно у пациентов, имеющих высокий риск развития заболевания почек. Лечение нефротического синдрома следует назначать на раннем этапе, а необходимость продолжения лечения препаратом Бетаферон должна быть пересмотрена.
Заболевания сердечно-сосудистой системы
Препарат Бетаферон необходимо применять с осторожностью у больных с заболеваниями сердца. Пациенты с тяжелыми заболеваниями сердца, в частности, с клинически выраженной хронической сердечной недостаточностью с отчетливой симптоматикой застоя жидкости, ишемической болезнью сердца или аритмией, должны находиться под контролем врача для своевременного выявления возможного ухудшения состояния, особенно в начале лечения.
Хотя доказательства прямого кардиотоксического действия препарата Бетаферон отсутствуют, гриппоподобные симптомы, обычно возникающие при введении интерферонов бета, могут быть провоцирующим фактором у пациентов с тяжелыми заболеваниями сердца.
В период пострегистрационного применения очень редко сообщалось об ухудшении кардиального статуса у пациентов с тяжелыми заболеваниями сердца, связанном с началом применения препарата Бетаферон. Поступали редкие сообщения о случаях развития кардиомиопатии. Если предполагается, что развитие кардиомиопатии связано с применением препарата, то лечение препаратом Бетаферон следует прекратить.
Тромботическая микроангиопатия (ТМАП)
Имеются сообщения о случаях тромботической микроангиопатии, которая проявлялась в виде тромботической тромбоцитопенической пурпуры (ТТП) или гемолитического уремического синдрома (ГУС), в том числе с летальным исходом, при лечении препаратами с содержанием интерферона бета. Возникновение заболевания отмечалось как в различные периоды лечения, так и через несколько недель и даже лет после начала терапии интерфероном бета. К первым клиническим признакам относятся тромбоцитопения, новый эпизод артериальной гипертензии, лихорадка, симптомы со стороны центральной нервной системы (например, спутанность сознания, парез) и нарушение функции почек. Лабораторные показатели, такие, как снижение количества тромбоцитов, повышение лактатдегидрогеназы (ЛДГ) в плазме позволяют предположить возникновение тромботической микроангиопатии (ТМАП) в связи с активацией гемолиза и обнаружение шизоцитов (фрагменты эритроцитов) в мазке крови. При появлении клинических признаков ТМАП необходимо продолжать тестирование уровня тромбоцитов, лактатдегидрогеназы (ЛДГ) в плазме, мазков крови и функции почек. При диагностировании тромботической микроангиопатии (ТМАП) необходимо начать раннее лечение (в том числе плазмаферез). Терапию препаратом Бетаферон рекомендуется прекратить.
Общие нарушения и нарушения в месте инъекции
Могут наблюдаться серьезные аллергические реакции (редкие, но проявляющиеся в острой и тяжелой форме, такие как бронхоспазм, анафилаксия и крапивница). В случае возникновения тяжелой реакции препарат Бетаферон следует отменить и назначить соответствующее лечение.
У пациентов, получавших препарат Бетаферон, наблюдались случаи некроза в месте инъекции (см. раздел «Побочное действие»). Некроз может быть обширным и
распространяться на мышечные фасции, а также жировую ткань и, как следствие, приводить к образованию рубцов. В некоторых случаях необходимо удаление омертвевших участков или, реже, пересадка кожи. Процесс заживления при этом может занимать до 6 месяцев.
При появлении признаков повреждения целостности кожи (например, истечения жидкости из места инъекции) пациенту следует обратиться к врачу прежде, чем он продолжит выполнение инъекций препарата Бетаферон.
При появлении множественных очагов некроза лечение препаратом Бетаферон следует прекратить до полного заживления поврежденных участков. При наличии одного очага, если некроз не слишком обширен, применение препарата Бетаферон может быть продолжено, поскольку у некоторых пациентов заживление омертвевшего участка в месте инъекции происходило на фоне применения препарата Бетаферон.
С целью снижения риска развития реакции и некроза в месте инъекции, больным следует рекомендовать:
– проводить инъекции, строго соблюдая правила асептики;
– каждый раз менять место инъекции.
Применение автоинжектора способствует снижению распространенности реакций в месте инъекции. В базовом исследовании, во время которого автоинжектор применяли у большинства пациентов с клинически изолированным синдромом, позволяющим предположить рассеянный склероз, случаи возникновения некроза в месте введения отмечались реже, чем в ходе других базовых исследований. Периодически следует контролировать правильность выполнения самостоятельных инъекций, особенно при появлении местных реакций.
Иммуногенность
Как и при лечении любыми другими белковыми препаратами, при применении препарата Бетаферон существует возможность иммуногенности. В ряде контролируемых клинических исследований производился анализ сыворотки крови каждые 3 месяца для выявления антител к препарату Бетаферон.
Было показано, что нейтрализующие антитела к интерферону бета-1b развивались у 23%-41% пациентов с рецидивирующе-ремиттирующим рассеянным склерозом и вторично-прогрессирующим рассеянным склерозом, что подтверждалось как минимум двумя последующими позитивными результатами лабораторных тестов. У 43%-55% из этих пациентов в последующих лабораторных исследованиях было выявлено стабильное отсутствие антител к интерферону бета-1b, что подтверждалось как минимум двумя последующими отрицательными результатами лабораторных тестов.
В этих исследованиях появление нейтрализующей активности было связано со снижением клинической эффективности только в отношении частоты возникновения рецидивов. Результаты некоторых анализов позволяют предположить большую выраженность данного эффекта у пациентов с более высоким титром нейтрализующих антител. В исследовании с участием пациентов с клинически изолированным синдромом, позволяющим предположить рассеянный склероз, нейтрализующая активность, которая измерялась каждые 6 месяцев, обнаруживалась, по крайней мере, один раз у 32% (89) получавших препарат Бетаферон пациентов. На основании лабораторных исследований, проведенных в конце 5-летнего периода, у 60% (53) этих пациентов было выявлено стабильное отсутствие антител к интерферону бета-1b. В ходе данного исследования развитие нейтрализующей активности связывалось со значительным увеличением количества вновь обнаруженных очагов и увеличением объема очагов на Т2-вхвешенных изображениях при магнитно-резонансном исследовании. Маловероятно, что развитие нейтрализующей активности связано со снижением клинической эффективности относительно времени до наступления клинически достоверного рассеянного склероза или прогрессирования по шкале EDSS.
С развитием нейтрализующей активности не связано появление каких-либо новых побочных реакций.
В исследованиях in vitro препарат Бетаферон продемонстрировал перекрестную реактивность с нативным интерфероном бета. Однако ввиду отсутствия исследований in vivo, клиническое значение данного факта не подтверждено.
Существуют малочисленные неубедительные данные о пациентах с развившейся нейтрализующей активностью, которые завершили лечение препаратом Бетаферон. Решение о продолжении или прекращении терапии должно основываться на всех аспектах статуса заболевания, а не только на статусе нейтрализующей активности.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Специальные исследования не проводились. Нежелательные явления со стороны центральной нервной системы (ЦНС) могут влиять на способность управлять автомобилем и работать с механизмами. В связи с этим необходимо соблюдать осторожность при занятии потенциально опасными видами деятельности, требующими повышенного внимания.
ФОРМА ВЫПУСКА
Лиофилизат для приготовления раствора для подкожного введения по 9,6 млн. МЕ препарата во флаконе из стекла типа I (Евр.Фарм.) с пробкой, обкатанной алюминиевым колпачком, с отщелкивающейся крышкой бирюзового цвета.
1) Растворитель (раствор натрия хлорида 0,54 %) по 1,2 мл в шприце из стекла типа I
(Евр.Фарм.) в ячейковой упаковке ПВХ/бумага (блистер).
5 флаконов в пластиковом поддоне и 5 шприцев (каждый в блистере) вместе с инструкцией по применению в картонной коробке или
15 флаконов в пластиковом поддоне и 15 шприцев (каждый в блистере) вместе с
инструкцией по применению в картонной коробке
2) Растворитель (раствор натрия хлорида 0,54 %) по 1,2 мл в шприце из стекла типа I
(Евр.Фарм.).
1 флакон, 1 шприц, 1 адаптер с иглой для флакона и 2 спиртовые салфетки помещают в разовую картонную упаковку, имеющую картонную вклейку и контроль первого вскрытия (перфорация или стикер).
По 5 или по 15 разовых упаковок вместе с инструкцией по применению в картонную коробку, имеющую контроль первого вскрытия (перфорация или стикер).
УСЛОВИЯ ХРАНЕНИЯ
При температуре не выше 25°С. Не замораживать. Хранить в недоступном для детей месте.
СРОК ГОДНОСТИ
Лиофилизат – 2 года. Растворитель – 3 года. Не использовать по истечении срока годности.
УСЛОВИЯ ОТПУСКА
Отпускается по рецепту.
НАИМЕНОВАНИЕ И АДРЕС ЮРИДИЧЕСКОГО ЛИЦА, НА ИМЯ КОТОРОГО ВЫДАНО РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
Байер Фарма АГ, Мюллерштрассе 178, 13353, Берлин, Германия Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany
ПРОИЗВОДИТЕЛЬ
1. Байер Фарма АГ, Мюллерштрассе 178, 13353, Берлин, Германия Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany
2. ЗАО «ФармФирма «Сотекс» 141345, Россия, Московская область, Сергиево-Посадский муниципальный район, сельское поселение Березняковское, пос. Беликово, д.11
За дополнительной информацией и с претензиями обращаться по адресу:
107113 Москва, 3-я Рыбинская ул., д.18, стр.2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Фармакологическая группа вещества Интерферон бета-1a
-
Нозологическая классификация
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Интерферон бета-1a
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Интерферон бета-1a
-
Взаимодействие
-
Способ применения и дозы
-
Меры предосторожности
-
Особые указания
-
Торговые названия с действующим веществом Интерферон бета-1a
Русское название
Интерферон бета-1a
Английское название
Interferon beta-1a
Латинское название
Interferonum beta-1a (род. Interferoni beta-1a)
Нозологическая классификация
Фармакологическое действие
—
антипролиферативное, иммуномодулирующее, противовирусное.
Характеристика
Рекомбинантный человеческий интерферон бета−1a, вырабатываемый клетками млекопитающих (культура клеток яичника китайского хомячка). Специфическая противовирусная активность — более 200 млн МЕ/мг (1 мл раствора содержит 30 мкг интерферона бета−1а, обладающих 6 млн МЕ антивирусной активности). Существует в гликозилированном виде, содержит 166 аминокислотных остатков и комплексный углеводный фрагмент, связанный с атомом азота. По аминокислотной последовательности идентичен натуральному (естественному) человеческому интерферону бета.
Фармакология
Связывается со специфическими рецепторами на поверхности клеток организма человека и запускает сложный каскад межклеточных взаимодействий, приводящий к интерферон-обусловленной экспрессии многочисленных генных продуктов и маркеров, в т.ч. комплекса гистосовместимости I класса, белка Мх, 2′,5′-олигоаденилатсинтетазы, бета2-микроглобулина и неоптерина.
Маркеры биологической активности (неоптерин, бета2-микроглобулин и др.) определяются у здоровых доноров и пациентов после парентерального введения доз 15–75 мкг. Концентрация этих маркеров нарастает в течение 12 ч после введения и сохраняется повышенной на протяжении 4–7 дней. Пик биологической активности в типичных случаях отмечается через 48 ч после введения. Точные соотношения между плазменными уровнями интерферона бета−1а и концентрацией белков-маркеров, синтез которых он индуцирует, пока неизвестны.
Стимулирует активность супрессорных клеток, усиливает продукцию интерлейкина−10 и трансформирующего ростового фактора бета, оказывающих при рассеянном склерозе противовоспалительное и иммуносупрессорное действие. Интерферон бета−1а достоверно уменьшает частоту обострений и скорость прогрессирования необратимых неврологических нарушений при ремиттирующем типе течения рассеянного склероза (замедляется прирост числа и площади очагового поражения мозга по данным МРТ). Лечение может сопровождаться появлением антител к интерферону бета−1а. Они понижают его активность in vitro (нейтрализующие антитела) и биологические эффекты (клиническую эффективность) in vivo. При продолжительности лечения 2 года антитела обнаруживаются у 8% больных. По другим данным, спустя 12 мес лечения антитела появляются в сыворотке у 15% пациентов.
Мутагенного действия не обнаружено. Данные по изучению канцерогенности у животных и человека отсутствуют. При исследовании репродуктивной функции у макак-резус, получавших интерферон бета−1а в дозах, в 100 раз превышающих МРДЧ, у некоторых животных наблюдалось прекращение овуляции и понижение уровня прогестерона в сыворотке (эффекты имели обратимый характер). У обезьян, получавших дозы, в 2 раза превышающие недельные рекомендованные, этих изменений выявлено не было.
Введение беременным обезьянам доз, в 100 раз превышающих МРДЧ, не сопровождалось проявлениями тератогенного действия и негативным влиянием на развитие плода. Однако дозы, в 3–5 раз превышающие недельную рекомендованную, вызывали выкидыш (при 2-кратном превышении недельной дозы выкидыша не было). Информация о влиянии на репродуктивную функцию у человека отсутствует.
Фармакокинетические исследования интерферона бета−1а у больных рассеянным склерозом не проводились.
У здоровых добровольцев фармакокинетические параметры зависели от пути введения: при в/м введении в дозе 60 мкг Сmax составляла 45 МЕ/мл и достигалась через 3–15 ч, T1/2 — 10 ч; при п/к введении Сmax — 30 МЕ/мл, время ее достижения — 3–18 ч, T1/2 — 8,6 ч. Биодоступность при в/м введении составляла 40%, при п/к — в 3 раза ниже. Данные, свидетельствующие о возможном проникновении в грудное молоко, отсутствуют.
Применение вещества Интерферон бета-1a
Рецидивирующий рассеянный склероз (при наличии не менее 2 рецидивов неврологической дисфункции в течение 3 лет и отсутствии признаков непрерывного прогрессирования заболевания между рецидивами).
Противопоказания
Гиперчувствительность (в т.ч. к природному или рекомбинантному бета-интерферону, сывороточному альбумину человека), выраженная депрессия и/или наличие суицидальных мыслей, эпилепсия (при недостаточной эффективности противоэпилептических средств), беременность, кормление грудью.
Ограничения к применению
Возраст до 16 лет (безопасность и эффективность применения не определены).
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — C.
Побочные действия вещества Интерферон бета-1a
По данным плацебо-контролируемого исследования при в/м введении в дозе 30 мкг 1 раз в неделю, если наблюдалось в 2% случаев и более (в скобках указан % встречаемости в группе плацебо).
Гриппоподобный синдром — 61%(40%), как правило в начале лечения, в т.ч. головная боль 67%(57%), миалгия 34%(15%), лихорадка 23%(13%), озноб 21%(7%), астения 21%(13%).
Со стороны нервной системы и органов чувств: бессонница 19%(16%), головокружение 15%(13%), недомогание 4%(3%), обморок (обычно однократный в начале лечения) 4%(2%), суицидальные тенденции 4%(1%), судороги 3%(0%), нарушение речи 3%(0%), понижение слуха 3%(0%), атаксия 2%(0%).
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): анемия 8%(3%), эозинофилия 5%(4%), вазодилатация 4%(1%), уменьшение гематокрита 3%(1%), аритмия.
Со стороны респираторной системы: развитие инфекций верхних дыхательных путей 31%(28%), синусит 18%(17%), одышка 6%(5%), отит 6%(3%).
Со стороны органов ЖКТ: тошнота 33%(23%), диарея 16%(10%), диспепсия 11%(7%), анорексия 7%(6%).
Аллергические реакции: крапивница 5%(2%), реакции гиперчувствительности 3%(0%).
Прочие: болевой синдром 24%(20%), в т.ч. артралгия 9%(5%), боль в животе 9%(6%), боль в груди 6%(4%); развитие инфекций 11%(6%)в т.ч. Herpes zoster 3%(2%), Herpes simplex 2%(1%); спазм мышц 7%(6%); местные реакции в области введения 4%(1%), в т.ч. воспаление 3%(0%), экхимоз 2%(1%); алопеция 4%(1%); вагинит 4%(2%), повышение уровня АСТ 3%(1%), киста яичника 3%(0%), невус 3%(0%).
Взаимодействие
Совместим с кортикостероидами и АКТГ. Не рекомендуется одновременное применение с миелосупрессивными препаратами, в т.ч. цитостатиками (возможен аддитивный эффект). С осторожностью сочетать со средствами, клиренс которых в значительной степени зависит от системы цитохрома Р450 (противоэпилептические препараты, некоторые антидепрессанты и др.).
Способ применения и дозы
В/м, по 30 мкг 1 раз в неделю под контролем врача (по возможности в одно и то же время суток и один и тот же день недели, меняя место инъекции еженедельно). Продолжительность курса лечения определяется врачом.
Меры предосторожности
С осторожностью назначают больным с нетяжелым депрессивным состоянием, судорожным синдромом, выраженной почечной и печеночной недостаточностью, тяжелой миелосупрессией. Необходимо тщательное наблюдение за состоянием больных с заболеваниями сердца, в т.ч. стенокардией, застойной сердечной недостаточностью, аритмией. В ходе лечения рекомендуется контролировать клеточный состав крови, в т.ч. число тромбоцитов и лейкоцитарную формулу, а также проводить биохимический анализ крови (включая определение ферментов печени). При наличии признаков угнетения костного мозга необходим более тщательный контроль показателей крови.
Женщин детородного возраста следует информировать о способности интерферона бета−1 вызывать выкидыш и необходимости использовать адекватные меры контрацепции. С осторожностью применять во время работы водителям транспортных средств и людям, профессия которых связана с повышенной концентрацией внимания. Для уменьшения выраженности гриппоподобного синдрома до инъекции и в течение 24 ч после нее возможно использование анальгетиков-антипиретиков.
В случае развития прогрессирующей формы рассеянного склероза лечение следует прекратить.
Особые указания
Продолжительность лечения не определена (опыт более, чем 2-месячного применения отсутствует). Раствор готовят с использованием прилагаемого шприца с растворителем.
Торговые названия с действующим веществом Интерферон бета-1a
Регистрационный номер
Торговое наименование
Интерферон бета-1b
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
1 мл раствора содержит:
действующее вещество: интерферон бета-1b человеческий рекомбинантный (рчИФН-бета) — 8 млн МЕ или 16 млн МЕ
вспомогательные вещества: натрия ацетата тригидрат — 0,408 мг, уксусная кислота ледяная — до pH 4,0, декстран-50-70 тыс. — 15 мг, полисорбат-80 — 0,04 мг, маннитол — 50 мг, динатрия эдетата дигидрат — 0,0555 мг, вода для инъекций — до 1 мл.
Описание
Прозрачная, бесцветная или желтоватого оттенка жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Рекомбинантный интерферон бета-1b выделяют из клеток Escherichia coli, в геном которых внедрён ген человеческого интерферона бета, кодирующий аминокислоту серии в 17-й позиции. Интерферон бета-1b представляет собой негликозилированный белок молекулярной массы 18500 дальтон, состоящий из 165 аминокислот.
Фармакодинамика
Интерфероны по своей структуре являются белками и принадлежат к семейству цитокинов. Молекулярная масса интерферонов находится в диапазоне от 15000 до 21000 Дальтон. Выделяют три основных класса интерферонов: альфа, бета и гамма. Интерфероны альфа, бета и гамма имеют схожий механизм действия, однако различные биологические эффекты. Активность интерферонов видоспецифична, и, следовательно, изучить их эффекты возможно только на культурах клеток человека или in vivo на человеке.
Интерферон бета-1b обладает противовирусной и иммуномодулирующей активностями. Механизм действия интерферона бета-1b при рассеянном склерозе до конца не установлен. Однако известно, что биологический эффект интерферона бета-1b опосредуется его взаимодействием со специфическими рецепторами, которые обнаружены на поверхности клеток человека. Связывание интерферона бета-1b с этими рецепторами индуцирует экспрессию ряда веществ, которые рассматриваются в качестве медиаторов биологических эффектов интерферона бета-1b. Содержание некоторых из этих веществ определяли в сыворотке и фракциях клеток крови больных, получавших интерферон бета-1b. Интерферон бета-1b снижает связывающую способность рецептора интерферона гамма и повышает его интернализацию и деградацию. Кроме того, интерферон бета-1b повышает супрессорную активность мононуклеарных клеток периферической крови.
Не проводилось целенаправленных исследований с целью определения воздействия интерферона бета-1b на функцию сердечно-сосудистой системы, дыхательной и эндокринной систем.
Результаты клинических исследований
Ремиттирующий рассеянный склероз:
В рамках контролируемого клинического исследования пациентов с ремиттирующей формой рассеянного склероза, способных к самостоятельной ходьбе (EDSS от 0 до 5,5), получавших препарат интерферона бета-1b, получены данные, о том, что препарат снижает частоту обострений на 30 %, уменьшает тяжесть обострений и число госпитализаций по причине основного заболевания. В дальнейшем были показаны увеличение интервала между обострениями и тенденция к замедлению прогрессирования ремиттирующего рассеянного склероза.
Вторично-прогрессирующий рассеянный склероз:
Было проведено два контролируемых клинических исследования, включивших 1657 пациентов с вторично прогрессирующей формой рассеянного склероза. В исследованиях приняли участие пациенты с исходным значением EDSS от 3 до 6,5 баллов, то есть пациенты были способны самостоятельно ходить. При оценке главной конечной точки исследования «время до подтверждённой прогрессии», то есть способности замедлять прогрессирование заболевания в исследованиях, были получены противоречивые данные. Одно из двух исследований показало статистически значимое замедление скорости прогрессирования инвалидизации (отношение рисков = 0.69 при 95 % доверительном интервале (0.55, 0.86), p = 0.0010, снижение рисков составило 31 % в группе терапии интерфероном бета-1b) и увеличение времени до момента утраты возможности передвигаться самостоятельно, то есть использования инвалидного кресла или EDSS 7,0 (отношение рисков = 0.61 при 95 % доверительном интервале (0.44, 0.85), p = 0.0036, снижение рисков составило 39 % в группе терапии интерфероном бета-1b) среди пациентов, принимавших интерферон бета-1b. Терапевтический эффект препарата сохранялся и в последующем периоде наблюдения вне зависимости от частоты обострений.
Во втором исследовании препарата интерферона бета-1b у пациентов с вторично прогрессирующей формой рассеянного склероза не показано замедления скорости прогрессирования. Однако, пациенты, включённые в это исследование, имели меньшую активность заболевания, нежели пациенты в других исследованиях при вторично- прогрессирующем течении рассеянного склероза. При проведении ретроспективного мета-анализа данных обоих исследований показан статистически значимый эффект (p = 0,0076, при сравнении групп пациентов, получавших интерферон бета-1b 8 млн МЕ, и группы плацебо).
Ретроспективный анализ по субгруппам показал, что влияние на скорость прогрессирования более выражено в группе пациентов с высокой активностью заболевания до начала терапии (отношение рисков = 0.72 при 95 % доверительном интервале (0.59, 0.88), p = 0.0011, снижение рисков составило 28 % в группе пациентов с обострениями или быстрой прогрессией EDSS, получавших интерферон бета-1b, в сравнении с группой плацебо). По результатам проведённого анализа можно заключить, что анализ частоты рецидивов и быстрой прогрессии EDSS (EDSS >1 балла или >0,5 при базовой EDSS >6 баллов за предшествующие терапии два года) может способствовать выявлению пациентов с активным течением заболевания. В данных исследованиях было также показано снижение частоты обострений (30 %). Не было показано, что интерферон бета-1b оказывает влияние на продолжительность обострений.
Клинически-изолированный синдром:
Одно контролируемое клиническое исследование интерферона бета-1b провели у пациентов с клинически изолированным синдромом (КИС). КИС предполагает наличие единственного клинического эпизода демиелинизации и/или, по крайней мере, двух клинически не проявляющих себя очагов на T2-взвешенных изображениях МРТ, которых недостаточно для постановки диагноза клинически достоверного PC. Установлено, что КИС с большой вероятностью в дальнейшем приводит к развитию рассеянного склероза. В исследование включались пациенты с одним клиническим очагом или двумя и более очагами на МРТ, при условии, что все альтернативные заболевания, которые могли бы служить наиболее вероятной причиной имеющихся симптомов, кроме рассеянного склероза, были исключены.
Это исследование состояло из двух фаз, плацебо-контролируемой фазы и фазы последующего наблюдения. Плацебо-контролируемая фаза имела продолжительность 2 года или до момента перехода пациента в клинически достоверный рассеянный склероз (КДРС). После завершения плацебо-контролируемой фазы пациент переводился в фазу последующего наблюдения на фоне терапии интерфероном бета-1b. С целью оценки раннего и отсроченного эффекта назначения интерферона бета-1b сравнивались группы пациентов, первоначально рандомизированных на интерферон бета-1b (группа немедленного лечения) и плацебо (группа отсроченного лечения). В ходе исследования пациенты и исследователи оставались заслеплены относительно распределения пациентов в группы терапии.
|
Результаты 2 летней терапии Плацебо-контролируемая фаза |
Результаты 3-го года терапии Последующая фаза открытой терапии |
Результаты по итогам 5-го года наблюдения Последующая фаза открытой терапии |
||||
|
Интерферон бета-1b 8 млн МЕ n = 292 |
Плацебо n = 176 |
Группа немедленного лечения интерфероном бета-1b 8 млн МЕ n = 292 |
Группа отсроченного лечения интерфероном бета-1b 8 млн МЕ n = 176 |
Группа немедленного лечения интерфероном бета-1b 8 млн МЕ n=292 |
Группа отсроченного лечения интерфероном бета-1b 8 млн МЕ n = 176 |
|
|
Число пациентов завершивших данную фазу |
271 (93 %) |
166 (94 %) |
249 (85 %) |
143 (81 %) |
235 (80 %) |
123 (70 %) |
|
Основные показатели эффективности |
||||||
|
Время до развития клинически достоверного рассеянного склероза (КДРС) |
||||||
|
По Каплан-Майеру |
28% |
45% |
37 % |
51% |
46 % |
57 % |
|
Уменьшение риска |
47 % в сравнении с плацебо |
41 % в сравнении с группой отсроченного лечения интерфероном бета-1b |
37 % в сравнении с группой отсроченного лечения интерфероном бета-1b |
|||
|
отношение рисков при 95 % ДИ |
HR = 0.53[0.39,0.73] |
HR = 0.59[0.42,0.83] |
HR = 0.63[0.48,0.83] |
|||
|
Лог-ранговый тест |
p < 0.0001 интерферон бета-1b продлил время до наступления КДРС на 363 дня, от 255 дней в группе плацебо (до 618 дней в группе интерферона бета-1b) |
P = 0.0011 |
P = 0.0027 |
|||
|
Время до трансформации в РС по критериям Мак-Дональда |
||||||
|
По Каплан-Майеру |
69 % |
85% |
Не являлся главной конечной точкой |
Не являлся главной конечной точкой |
||
|
Уменьшение риска |
43 % в сравнении с группой плацебо |
|||||
|
отношение рисков при 95 % ДИ |
HR = 0.57[0.46,0.71] |
|||||
|
Лог-ранговый тест |
p < 0.0001 |
|||||
|
Время до прогрессии EDSS |
||||||
|
По Каплан-Майеру |
Не являлся главной конечной точкой |
16 % |
24 % |
25 % |
29 % |
|
|
Уменьшение риска |
40 % в сравнении с группой отсроченного лечения интерфероном бета-1b |
24 % в сравнении с группой отсроченного лечения интерфероном бета-1b |
||||
|
отношение рисков при 95 % ДИ |
HR = 0.60[0.39,0.92] |
HR=0.76[0.52,1.11] |
||||
|
Лог-ранговый тест |
P = 0.022 |
P = 0.177 |
В плацебо-контролируемой фазе исследования интерферон бета-1b статистически достоверно предотвращал переход КИС в КДРС. В группе пациентов, получавших интерферон бета-1b, показана задержка трансформации в достоверный рассеянный склероз по критериям Мак-Дональда (см. таблицу 1).
Анализ подгрупп в зависимости от исходных факторов продемонстрировал эффективность интерферона бета-1b в отношении предотвращения трансформации в КДРС во всех подгруппах. Риск трансформации в КДРС в течение 2 лет был выше в группе пациентов с монофокальным КИС с 9 и более очагами на Т2-взвешенных изображениях или с наличием очагов, накапливающих контраст, по данным МРТ в начале исследования. Эффективность интерферона бета-1b в группе пациентов с мультифокальными клиническими проявлениями не зависела от исходных показателей МРТ, что свидетельствует о высоком риске трансформации КИС в КДРС у пациентов данной группы.
В настоящее время нет общепринятого определения высокого риска, однако к группе высокого риска развития КДРС можно отнести пациентов с моноочаговым КИС (клиническим проявлением 1 очага в ЦНС) и по крайней мере 9 очагами на МРТ в Т2-режиме и/или накапливающим контрастное вещество. Пациенты с многоочаговым КИС (клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска развития КДРС независимо от количества очагов на МРТ. В любом случае, решение о назначении интерферона бета-lb должно быть принято, исходя из заключения о высоком риске развития КДРС у пациента.
Терапия с интерфероном бета-1b хорошо переносилась пациентами, на что указывает низкий процент выбывших пациентов (93 % завершили исследование).
Для улучшения переносимости проводилось титрование дозы интерферона бета-lb, применялись нестероидные противовоспалительные препараты в начале терапии. Кроме того, применялся автоинжектор у большинства пациентов на протяжении всего исследования.
В дальнейшем интерферон бета-1b сохранял высокую эффективность по способности предотвращать развитие КДРС после 3 и 5 лет наблюдения (табл. 1), несмотря на то, что большинство пациентов, получавших плацебо, начали терапию интерфероном бета-1b через два года после начала исследования. Подтверждённая прогрессия EDSS (увеличение EDSS, по крайней мере, на одном визите в сравнении с исходным значением) была ниже в группе немедленного лечения (табл. 1, значительный эффект выявлен на 3-м году терапии, но на 5-м эффект отсутствует). У большинства пациентов в обеих группах не было прогрессирования инвалидности за 5-летний период. Не получено убедительных доказательств в пользу влияния на данный исход немедленного назначения интерферона бета-1b. Не показано влияния немедленного лечения интерфероном бета-lb на качество жизни пациентов.
Ремиттирующий, вторично-прогрессирующий рассеянный склероз и клинически- изолированный синдром:
Эффективность интерферона бета-1b показана во всех клинических исследованиях по способности уменьшать активность заболевания (острое воспаление в ЦНС и стойкое повреждение ткани), оценённую по показателям магнитно-резонансной томографии (МРТ). Соотношение клинической активности рассеянного склероза и активности заболевания по МРТ — показателям в настоящее время до конца не установлено.
Фармакокинетика
После подкожного введения интерферона бета-1b в рекомендуемой дозе 8 млн МЕ его сывороточные концентрации низкие или вообще не определяются. В связи с этим, сведений о фармакокинетике препарата у больных рассеянным склерозом, получающих интерферон бета-1b в рекомендуемой дозе, нет. После подкожного введения 16 млн МЕ интерферона бета-1b максимальные уровни в плазме составляют около 40 МЕ/мл через 1–8 ч после инъекции.
По результатам многочисленных клинических исследований клиренс интерферона бета-1b и период полувыведения препарата из сыворотки составляет в среднем 30 мл/мин/кг и 5 часов соответственно. Абсолютная биодоступность интерферона бета-1b при подкожном введении равняется примерно 50 %.
Введение интерферона бета-1b через день не приводит к повышению уровня препарата в плазме крови, а его фармакокинетика в течение курса терапии, по-видимому, не меняется.
При подкожном применении интерферона бета-1b в дозе 0,25 мг через день уровни маркеров биологического ответа (неоптерин, бета2-микроглобулин и иммуносупрессивный цитокин интерлейкин-10) значительно повышались по сравнению с исходными показателями через 6-12 ч после введения первой дозы препарата. Они достигали пика через 40–124 ч и оставались повышенными на протяжении 7-дневного (168 ч) периода исследования. Связь между уровнями в плазме интерферона бета-1b или уровнями индуцированных им маркеров и механизмом действия интерферона бета-1b при рассеянном склерозе не установлена.
Показания
-
Клинически изолированный синдром (КИС) (единственный клинический эпизод демиелинизации, позволяющий предположить рассеянный склероз, при условии исключения альтернативных диагнозов) с достаточной выраженностью воспалительного процесса для назначения внутривенных кортикостероидов — для замедления перехода в клинически достоверный рассеянный склероз (КДРС) у пациентов с высоким риском развития КДРС.
Общепринятого определения высокого риска нет. По данным исследования к группе высокого риска развития КДРС относятся пациенты с моноочаговым КИС (клиническими проявлениями 1 очага в ЦНС) и ≥Т2-очагами на МРТ и/или накапливающим контрастное вещество очагами. Пациенты с многоочаговым КИС (клиническими проявлениями >1 очага в ЦНС) относятся к группе высокого риска развития КДРС независимо от количества очагов на МРТ;
- Ремиттирующий рассеянный склероз — для уменьшения частоты и тяжести обострений рассеянного склероза у пациентов способных ходить без посторонней помощи, при наличии в анамнезе не менее 2-х обострений заболевания за последние 2 года с последующим полным или неполным восстановлением неврологического дефицита;
- Вторично-прогрессирующий рассеянный склероз с активным течением заболевания, характеризующийся обострениями или выраженным ухудшением неврологических функций в течение последних двух лет — для уменьшения частоты и тяжести клинических обострений болезни, а также для замедления темпов прогрессирования заболевания.
Применять строго по назначению врача.
Противопоказания
- Гиперчувствительность к рекомбинантному интерферону-бета или другим компонентам препарата.
- Заболевания печени в стадии декомпенсации.
- Тяжёлые депрессивные заболевания и/или суицидальные мысли в анамнезе.
- Эпилепсия (адекватно не контролируемая).
- Беременность.
- Детский возраст до 18 лет (Информация по эффективности и безопасности применения интерферона бета-1b у детей ограничена. Эффективность применения у детей не доказана).
С осторожностью
Пациентам, в анамнезе которых имеется указание на депрессию или судороги, а также пациентам, получающим противосудорожные средства, интерферон бета-1b следует применять с осторожностью. Препарат следует применять с осторожностью у пациентов с сердечной недостаточностью Ⅲ–Ⅳ стадии по классификации NYHA и у больных с кардиомиопатией. Необходимо соблюдать осторожность при лечении препаратом интерферон бета-1b больных с нарушениями функции костного мозга, анемией или тромбоцитопенией.
Применение при беременности и в период грудного вскармливания
Неизвестно, способен ли интерферон бета-1b вызывать повреждения плода при лечении беременных женщин или влиять на репродуктивную функцию человека. В контролируемых клинических исследованиях у больных рассеянным склерозом отмечались случаи самопроизвольного аборта. В исследованиях у макак-резус человеческий интерферон бета-1b оказывал эмбриотоксическое действие и в более высоких дозах вызывал увеличение частоты абортов. Следовательно, интерферон бета-1b противопоказан во время беременности. Женщинам репродуктивного возраста при лечении этим препаратом следует пользоваться адекватными методами контрацепции. В случае наступления беременности во время лечения интерфероном бета-1b или планировании беременности, женщину следует информировать о потенциальном риске и рекомендовать прекращение лечения. Неизвестно, экскретируется ли интерферон бета-1b с грудным молоком. Учитывая потенциальную возможность развития серьёзных нежелательных реакций на интерферон бета-1b у младенцев, находящихся на грудном вскармливании, необходимо прекратить кормление грудью или отменить препарат.
Способ применения и дозы
Лечение препаратом интерферона бета-1b следует начинать под наблюдением врача, имеющего опыт лечения рассеянного склероза.
Взрослые:
Рекомендуемую дозу интерферона бета-1b 8 млн МЕ вводят подкожно через день. Дети:
Не проводилось формальных клинических и фармакокинетических исследований в детской и подростковой популяции. Ограниченные опубликованные данные свидетельствует о сопоставимом профиле безопасности препарата интерферона бета-1b в дозе 8 млн МЕ подкожно через день в группе пациентов от 12 до 16 лет, в сравнении с взрослой популяцией. Отсутствует информация о применении препарата интерферона бета-1b у лиц младше 12 лет, препарат не может применяться в указанной группе пациентов.
В начале лечения обычно рекомендуется провести титрование дозы. Лечение следует начинать с введения 2 млн МЕ подкожно через день, постепенно увеличивая дозу до 8 млн МЕ, вводимую также через день. Период титрования дозы может варьировать в зависимости от индивидуальной переносимости препарата.
|
Объём препарата, мл в зависимости от |
|||
|
День лечения |
Доза, млн ME |
применяемой формы выпуска |
|
|
8 млн МЕ/0,5 мл |
8 млн МЕ/1 мл |
||
|
1,3,5 |
2 |
0,125 |
0,25 |
|
7, 9,11 |
4 |
0,25 |
0,5 |
|
13, 15, 17 |
6 |
0,375 |
0,75 |
|
>19 |
8 |
0,5 |
1,0 |
* Период титрования может быть увеличен при развитии нежелательных реакций.
Длительность лечения в настоящее время не установлена. Имеются результаты клинических исследований, в которых длительность лечения у больных ремиттирующим и вторично-прогрессирующим рассеянным склерозом достигала 5 и 3 лет соответственно. В группе пациентов с рецидивирующим течением рассеянного склероза высокая эффективность показана в течение первых двух лет. Дальнейшее трёхлетнее наблюдение показало сохранение показателей эффективности в течение всего периода лечения. У пациентов с клинически изолированным синдромом наблюдалась значительная задержка трансформации в достоверный рассеянный склероз на протяжении более чем пяти лет.
Терапия интерфероном бета-1b не показана пациентам с рецидивирующе-ремиттирующей формой рассеянного склероза, у которых за прошедшие 2 года произошло менее двух обострений, или пациентам с вторично-прогрессирующим рассеянным склерозом, у которых в течение прошедших двух лет не выявлено прогрессии.
Пациентам, у которых не наблюдается стабилизации течения заболевания (например, стойкое прогрессирование заболевания по шкале EDSS в течение 6 месяцев или необходимость проведения трёх и более курсов терапии кортикотропином или глюкокортикостероидами) в течение 1 года, лечение препаратом интерферона бета-1b рекомендуется прекратить.
Рекомендации по применению для пациентов:
1) Выберите удобное для Вас время проведения инъекции. Инъекции желательно делать вечером перед сном.
2) Перед введением препарата тщательно вымойте руки водой с мылом.
3) Возьмите одну контурную ячейковую упаковку с заполненным шприцем/ флаконом из картонной пачки, которая должна храниться в холодильнике, и выдержите её при комнатной температуре в течение нескольких минут для того, чтобы температура препарата сравнялась с температурой окружающего воздуха. В случае появления конденсата на поверхности шприца/флакона подождите ещё несколько минут до тех пор, пока конденсат не испарится.
4) Перед использованием следует осмотреть раствор в шприце/флаконе. При наличии взвешенных частиц или изменении цвета раствора или повреждении шприца/флакона препарат не следует применять. Если появилась пена, что бывает, когда шприц/флакон встряхивают или сильно покачивают, подождите, пока осядет пена.
5) Выберите область тела для инъекции. Интерферон бета-1b вводится в подкожную жировую клетчатку (жировой слой между кожей и мышечной тканью), поэтому используйте места с рыхлой клетчаткой вдали от мест растяжения кожи, нервов, суставов и сосудов (на рис. 1 и 2. указаны рекомендованные области для инъекций):
— Бедра (передняя поверхность бёдер кроме паха и колена);
— Живот (кроме срединной линии и околопупочной области);
— Наружная поверхность плеч;
— Ягодицы (верхний наружный квадрант).
Не следует использовать для инъекции болезненные точки, обесцвеченные, покрасневшие участки кожи или области с уплотнениями и узелками. Каждый раз выбирайте новое место для укола, так вы сможете уменьшить неприятные ощущения и боль на участке кожи в месте инъекции. Внутри каждой инъекционной области есть много точек для укола. Постоянно меняйте точки инъекций внутри конкретной области.
6) Подготовка к инъекции.
Если пациент применяет препарат интерферона бета-1b в шприцах
Возьмите подготовленный шприц в руку, которой вы пишете. Снимите защитный колпачок с иглы.
Если пациент применяет препарат интерферона бета-1b во флаконах
Возьмите флакон с препаратом интерферона бета-1b и осторожно поставьте флакон на ровную поверхность (стол). Пинцетом (или другим удобным приспособлением) снимите крышку флакона. Продезинфицируйте верхнюю часть флакона. Возьмите стерильный шприц в руку, которой вы пишете, снимите защитный колпачок с иглы и, не нарушая стерильность, осторожно введите иглу через резиновый колпачок флакона так, чтобы конец иглы (3–4 мм) был виден через стекло флакона. Переверните флакон, чтобы его горлышко было направлено вниз.
7) Количество раствора препарата интерферон бета-1b, которое нужно ввести при проведении инъекции, зависит от рекомендованной Вашим врачом дозы. Не храните остатки препарата, оставшиеся в шприце/флаконе, для повторного использования.
Если пациент применяет препарат интерферон бета-1b в шприцах
В зависимости от дозы, которую Вам прописал врач, Вам может потребоваться удалить лишний объём раствора препарата из шприца. В случае такой необходимости медленно и аккуратно нажимайте на поршень шприца для удаления лишнего количества раствора. Давите на поршень до тех пор, пока поршень не дойдёт до необходимой метки на этикетке шприца.
Если пациент применяет препарат интерферон бета-1b во флаконах
Медленно оттяните поршень назад и наберите в шприц из флакона необходимый объём раствора, соответствующий дозе препарата интерферон бета-1b, которую Вам прописал врач. Затем, не нарушая стерильность, удалите флакон с иглы, придерживая иглу у основания (следите, чтобы игла не соскочила со шприца). Перевернув шприц вверх иглой, и, двигая поршень, удалите пузырьки воздуха осторожным постукиванием по шприцу и надавливанием на поршень. Замените иглу на шприце и снимите с неё колпачок.

9) Располагая шприц перпендикулярно месту инъекции, введите иглу в кожу под углом 90° (рис. 4).
Рекомендуемая глубина введения иглы составляет 6 мм от поверхности кожи. Глубина подбирается в зависимости от типа телосложения и толщины подкожной жировой клетчатки. Вводите препарат, равномерно нажимая на поршень шприца вниз до конца (до его полного опустошения).
10) Удалите шприц с иглой движением вертикально вверх.
11) Использованные шприцы/флаконы выбрасывайте только в специально отведённое место, недоступное для детей.
12) Если Вы забыли ввести препарат интерферон бета-1b, сделайте инъекцию немедленно, как только вспомнили об этом. Следующую инъекцию производят через 48 ч. Не допускается вводить двойную дозу препарата.
Не прекращайте применение препарата интерферон бета-1b без консультации с врачом.
Побочное действие
Нежелательные реакции часто возникают на начальных этапах лечения, однако, в ходе последующего лечения их частота и интенсивность уменьшаются. Наиболее частыми реакциями являются гриппоподобный симптомокомплекс (лихорадка, озноб, боль в суставах, недомогание, потливость, головная боль или боль в мышцах) и реакции в месте введения, которые во многом обусловлены фармакологическими свойствами интерферона бета-1b. Реакции в месте введения часто встречаются после применения интерферона бета-1b: покраснение, отёк, деколорация, воспаление, боль, гиперчувствительность, некроз, неспецифические реакции. Для улучшения переносимости рекомендуется начинать терапию интерфероном бета-1b с титрования (см. схему титрования дозы в разделе «Способ применения и дозы»), гриппоподобный синдром так же может быть скорректирован назначением нестероидных противовоспалительных препаратов. Распространённость реакций в месте введения может быть снижена при применении автоинжектора.
Ниже представлены перечни нежелательных явлений, выявленных в рамках клинических исследований (Таблица 3. нежелательные явления и отклонения лабораторных показателей), и по данным пострегистрационного применения интерферона бета-1b (табл. 4, частоты рассчитаны исходя из объединённых данных клинических исследований (очень часто (≥ 10 %), часто (< 10 % — ≥ 1 %), нечасто (< 1% — ≥ 0,1 %), редко (< 0,1 % — ≥ 0,01 %) и очень редко (< 0,01 %)). Опыт применения интерферона бета-1b у пациентов с рассеянным склерозом ограничен, нежелательные реакции, возникающие очень редко, могут быть ещё не выявлены.
|
Система органов Нежелательные явления и отклонения лабораторных показателей |
Клинически изолированный синдром (BENEFIT) |
Вторично прогрессирующий рассеянный склероз (Европейское исследование) |
Вторично прогрессирующий рассеянный склероз (Североамериканское исследование) |
Рецидивирующий рассеянный склероз |
|
Интерферон бета-1b 250 мкг (плацебо) n=292 (n=176) |
Интерферон бета-1b 250 мкг (плацебо) n=360 (n=358) |
Интерферон бета-1b 250 мкг (плацебо) n=317 (n=308) |
Интерферон бета-1b 250 мкг (плацебо) n=124 (n=123) |
|
|
Инфекции |
||||
|
Инфекции |
6% (3%) |
13% (11%) |
11% (10%) |
14% (13%) |
|
Абсцесс |
0% (1%) |
4% (2 %) |
4% (5%) |
1 % (6 %) |
|
Кровь и лимфатическая система |
||||
|
Лимфопения (<1500/мм3) ×Λ° |
79% (45%) |
53% (28%) |
88% (68%) |
82 % (67 %) |
|
Нейтропения (<1500/мм3) ×Λ * ° |
11% (2%) |
18% (5%) |
4% (10%) |
18 % (5 %) |
|
Лейкопения (<3000/мм3) ×Λ * ° |
11% (2%) |
13% (4%) |
13% (4%) |
16 % (4) % |
|
Лимфаденопатия |
1% (1%) |
3% (1 %) |
11% (5%) |
14 % (11 %) |
|
Метаболические нарушения |
||||
|
Гипогликемия (<55 мг/дл) × |
3% (5%) |
27% (27%) |
5% (3%) |
15 % (13 %) |
|
Психические нарушения |
||||
|
Депрессия |
10% (11%) |
24% (31%) |
44% (41%) |
25% (24%) |
|
Тревога |
3% (5%) |
6% (5 %) |
10% (11%) |
15 % (13 %) |
|
Нервная система |
||||
|
Головная боль Λ |
27% (17%) |
47% (41 %) |
55% (46%) |
84 % (77 %) |
|
Головокружение |
3% (4%) |
14% (14 %) |
28% (26%) |
35 % (28 %) |
|
Бессонница |
8% (4%) |
12% (8 %) |
26% (25%) |
31 % (33 %) |
|
Мигрень |
2% (2%) |
4% (3 %) |
5% (4%) |
12 % (7 %) |
|
Парестезии |
16% (17%) |
35% (39%) |
40% (43%) |
19% (21%) |
|
Органы зрения |
||||
|
Конъюнктивит |
1% (1%) |
2% (3 %) |
6% (6%) |
12 % (10 %) |
|
Нарушение зрения Λ |
3% (1%) |
11% (15%) |
11% (11%) |
7% (4%) |
|
Органы слуха |
||||
|
Боль в ушах |
0% (1%) |
<1% (1 %) |
6% (8%) |
16 % (15 %) |
|
Заболевания со стороны сердца |
||||
|
Ощущение сердцебиения* |
1% (1%) |
2% (3 %) |
5% (2%) |
8 % (2 %) |
|
Сосудистая система |
||||
|
Вазодилатация |
0% (0%) |
6% (4%) |
13% (8%) |
18% (17%) |
|
Артериальная гипертензия° |
2% (0%) |
4% (2 %) |
9% (8%) |
7 % (2 %) |
|
Органы дыхания |
||||
|
Инфекции верхних дыхательных путей |
18% (19%) |
3% (2%) |
||
|
Синусит |
4% (6%) |
6 % (6%) |
16% (18%) |
36 % (26 %) |
|
Кашель |
2% (2%) |
5% (10%) |
11% (15%) |
31% (23%) |
|
Одышка * |
0% (0%) |
3% (2 %) |
8% (6%) |
8 % (2 %) |
|
Желудочно-кишечный тракт |
||||
|
Диарея |
4% (2%) |
7% (10 %) |
21% (19%) |
35 % (29 %) |
|
Запор |
1% (1%) |
12% (12 %) |
22% (24%) |
24 % (18 %) |
|
Тошнота |
3% (4%) |
13% (13%) |
32% (30%) |
48% (49%) |
|
Рвота Λ |
5% (1%) |
4% (6 %) |
10% (12%) |
21 % (19 %) |
|
Боли в животе ° |
5% (3%) |
11% (6 %) |
18% (16%) |
32 % (24 %) |
|
Печень и желчевыводящие пути |
||||
|
Повышение АЛТ (>5 раз в сравнении с исходным) ×Λ * ° |
18% (5%) |
14% (5%) |
4% (2%) |
19 % (6 %) |
|
Повышение АСТ (>5 раз в сравнении с исходным) × L * ° |
6% (1%) |
4% (1%) |
2% (1%) |
4 % (0 %) |
|
Кожа и подкожно-жировая клетчатка |
||||
|
Кожные реакции |
1% (0%) |
4% (4%) |
19% (17%) |
6% (8%) |
|
Сыпь Λ° |
11% (3%) |
20% (12%) |
26% (20%) |
27% (32 %) |
|
Нарушения со стороны опорно-двигательной системы |
||||
|
Гипертонус° |
2% (1%) |
41% (31 %) |
57% (57%) |
26 % (24 %) |
|
Миалгия * ° |
8% (8%) |
23% (9 %) |
19% (29%) |
44% (28 %) |
|
Миастения |
2% (2%) |
39% (40 %) |
57% (60%) |
13% (10 %) |
|
Боль в спине |
10% (7%) |
26% (24%) |
31% (32%) |
36% (37%) |
|
Боль в конечностях |
6% (3%) |
14% (12 %) |
0 % (0 %) |
|
|
Мочевыделительная система |
||||
|
Задержка мочи |
1% (1%) |
4% (6%) |
15% (13%) |
|
|
Протеинурия (> 1+)× |
25% (26%) |
14% (11%) |
5% (5%) |
5 % (3 %) |
|
Учащенное мочеиспускание |
1% (1%) |
6% (5%) |
12% (11%) |
3% (5%) |
|
Недержание мочи |
1% (1%) |
8% (15%) |
20% (19%) |
2% (1%) |
|
Императивные позывы |
1% (1%) |
8% (7%) |
21% (17%) |
4% (2 %) |
|
Репродуктивная система |
||||
|
Дисменорея |
2% (0%) |
<1% (<1%) |
6% (5%) |
18% (11 %) |
|
Нарушение менструального цикла * |
1% (2%) |
9% (13%) |
10% (8%) |
17% (8 %) |
|
Метрорагия |
2% (0%) |
12% (6%) |
10% (10%) |
15% (8 %) |
|
Импотенция |
1% (0%) |
7% (4%) |
10% (11%) |
2% (1%) |
|
Общие реакции и реакции в месте введения |
||||
|
Реакции в месте введения (различных типов) Λ * °§ |
52% (11%) |
78% (20 %) |
89% (37%) |
85% (37 %) |
|
Некроз в месте введения * ° |
1% (0%) |
5% (0 %) |
6% (0%) |
5% (0 %) |
|
Гриппоподобный синдром & Λ *° |
44% (18%) |
61% (40 %) |
43% (33%) |
52 % (48 %) |
|
Лихорадка Λ * ° |
13% (5%) |
40% (13 %) |
29% (24%) |
59 % (41 %) |
|
Боль |
4% (4%) |
31% (25 %) |
59% (59%) |
52 % (48 %) |
|
Боль в груди ° |
1% (0%) |
5% (4%) |
15% (8%) |
15% (15%) |
|
Периферический отек |
0% (0%) |
7% (7%) |
21% (18%) |
7% (8%) |
|
Астения * |
22% (17%) |
63% (58 %) |
64% (58%) |
49 % (35 %) |
|
ОзнобΛ * ° |
5% (1%) |
23% (7 %) |
22% (12%) |
46 % (19 %) |
|
Потливость * |
2% (1%) |
6% (6%) |
10% (10%) |
23% (11 %) |
|
Недомогание * |
0% (1%) |
8% (5 %) |
6% (2%) |
15 % (3 %) |
|
× отклонение лабораторного показателя Λ Достоверно связан с терапией интерфероном бета-1b у пациентов с КИС, p < 0.05 * Достоверно связан с терапией интерфероном бета-1b у пациентов с РРС, p < 0.05 ° Достоверно связан с терапией интерфероном бета-1b у пациентов с ВПРС, p < 0.05 § Реакции в месте введения могут включать в себя любые неблагоприятные проявления, возникающие в месте инъекции, например: кровотечение в месте инъекции, гиперчувствительность, воспаление в месте инъекции, припухлость в месте введения, некроз в месте инъекции, боль в месте инъекции, отёк в месте инъекции, и атрофия в месте инъекции; «Гриппоподобный синдром» обозначает комбинацию по крайней мере, двух из приведённых ниже симптомов: лихорадка, озноб, миалгии, недомогание, потливость. |
|
Класс системы органов |
Очень часто ≥ 1/10 |
Часто ≥1/100 до < 1/10 |
Не часто ≥1/1,000 до < 1/100 |
Редко ≥1/10,000 до < 1/1,000 |
Очень редко < 0,01 % |
|
Кровь и лимфатическая система |
Анемия |
Тромбоцитопения |
Кровоточивость** |
||
|
Нарушения со стороны иммунной системы |
Анафилактические реакции |
Синдром повышенной проницаемости капилляров при наличии моноклональной гаммапатии |
|||
|
Эндокринные нарушения |
Гипотиреоз |
Гипертиреоз Патология щитовидной железы |
|||
|
Метаболические нарушения |
Увеличение веса Снижение веса |
Повышение уровня триглицеридов крови |
Анорексия |
||
|
Психические нарушения |
Спутанное сознание |
Эмоциональная лабильность Суицидальные попытки |
|||
|
Нарушения со стороны нервной системы |
Судороги |
||||
|
Нарушения со стороны сердца |
Тахикардия |
Кардиомиопатия, |
|||
|
Сосудистые нарушения |
Гипертензия |
Снижение артериального давления** |
|||
|
Нарушения со стороны дыхательной системы, грудной клетки и средостения |
Бронхоспазм |
||||
|
Нарушения со стороны желудочно-кишечного тракта |
Панкреатит |
||||
|
Нарушения со стороны гепатобилиарного тракта |
Повышение уровня билирубина крови |
Повышение уровня гамма-глутаминтранспептидазы гепатит |
Нарушения печени, включая гепатит Печёночная недостаточность |
||
|
Кожа и подкожно-жировая клетчатка |
Крапивница Зуд Алопеция |
Изменение цвета кожи |
|||
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
Артралгия |
||||
|
Нарушения со стороны репродуктивной системы и молочных желез |
Меноррагия |
||||
|
* частота установлена в клинических исследованиях ** Данные ЗАО «БИОКАД» |
Внутри каждой группы, сформированной по частоте встречаемости, симптомы представлены в порядке уменьшения серьёзности.
Передозировка
Интерферон бета-1b в дозах до 176 млн МЕ внутривенно три раза в неделю у взрослых больных злокачественными опухолями не вызывал серьёзных нежелательных явлений.
Взаимодействие с другими лекарственными средствами
Специальные исследования взаимодействия интерферона бета-lb с другими препаратами не проводились.
Эффект применения интерферона бета-lb в дозе 8 млн МЕ через день на метаболизм лекарственных средств у больных рассеянным склерозом неизвестен. На фоне применения интерферона бета-lb глюкокортикостероиды и АКТЕ, назначаемые на срок до 28 дней при лечении обострений, переносятся хорошо. Применение интерферона бета-lb одновременно с другими иммуномодуляторами (кроме глюкокортикостероидов или АКТГ) не изучалось.
Интерфероны снижают активность микросомальных печёночных ферментов системы цитохрома P450 у человека и животных. Необходимо соблюдать осторожность при назначении интерферона бета-lb в комбинации с препаратами, имеющими узкий терапевтический индекс, клиренс которых в значительной степени зависит от активности этих ферментов (в том числе противоэпилептическими средствами, антидепрессантами). Необходимо также соблюдать осторожность при одновременном применении любых препаратов, влияющих на систему кроветворения.
Не проводилось исследований на совместимость с противоэпилептическими препаратами.
Особые указания
Патология иммунной системы
Применение цитокинов у больных с моноклональной гаммапатией иногда сопровождалось развитием синдрома системного повышения проницаемости капилляров с шокоподобными симптомами и летальным исходом.
Патология желудочно-кишечного тракта
В редких случаях на фоне применения препарата интерферона бета-1b наблюдалось развитие панкреатита, в большинстве случаев связанного с наличием гипертриглицеридемии.
Поражение нервной системы
Больных необходимо информировать о том, что побочным эффектом препарата интерферона бета-1b могут быть депрессия и суицидальные мысли, при появлении которых следует немедленно обратиться к врачу.
В двух контролируемых клинических исследованиях с участием 1657 пациентов с вторично-прогрессирующим PC не было выявлено достоверных различий частоты развития депрессии и суицидальных мыслей при применении интерферона бета-1b или плацебо. Тем не менее, следует проявлять осторожность при назначении препарата интерферона бета-1b больным с депрессивными расстройствами и суицидальными мыслями в анамнезе.
При возникновении подобных явлений на фоне лечения, следует рассмотреть вопрос о целесообразности отмены препарата интерферона бета-1b.
Препарат интерферона бета-1b необходимо применять с осторожностью у больных с судорогами в анамнезе, в том числе получающих терапию противоэпилептическими препаратами, особенно если приступы у этих пациентов не контролируются адекватно на фоне терапии противоэпилептическим препаратами.
Изменения лабораторных показателей
Пациентам с дисфункцией щитовидной железы рекомендуется проверять функцию щитовидной железы (гормоны щитовидной железы, тиреотропный гормон) регулярно, а в остальных случаях — по клиническим показаниям.
Кроме стандартных лабораторных анализов, назначаемых при ведении пациентов с рассеянным склерозом, перед началом терапии препаратом интерферона бета-1b, а также регулярно в период лечения, рекомендуется проводить развёрнутый анализ крови, включая определение лейкоцитарной формулы, и числа тромбоцитов и биохимический анализ крови, а также проверять функцию печени (например, активность аспартатаминотрансферазы (ACT), аланинаминотрансферазы (AЛT) и g- глутамилтрансферазы (g-ГТ)).
При ведении пациентов с анемией, тромбоцитопенией, лейкопенией (по отдельности или в комбинации) может потребоваться более тщательный мониторинг развернутого анализа крови, включая определение количества эритроцитов, лейкоцитов, тромбоцитов и лейкоцитарной формулы.
Нарушения со стороны печени и желчевыводящих путей
Клинические исследования показали, что терапия интерфероном бета-1b часто может приводить к бессимптомному повышению активности «печёночных» трансаминаз, которое, в большинстве случаев, выражено незначительно и носит преходящий характер. Как и при лечении другими интерферонами бета тяжёлые поражения печени (включая печёночную недостаточность) при применении препарата интерферона бета-1b наблюдаются редко. Наиболее тяжёлые случаи отмечались у пациентов, подвергшихся воздействию гепатотоксичных лекарственных препаратов или веществ, а также при некоторых сопутствующих заболеваниях (например, злокачественные новообразования с метастазированием, тяжёлые инфекции и сепсис, алкоголизм).
При лечении препаратом интерферона бета-1b необходимо осуществлять мониторинг функции печени (включая оценку клинической картины). Повышение активности трансаминаз в сыворотке крови требует тщательного наблюдения и обследования. При значительном повышении активности трансаминаз в сыворотке крови или появлении признаков поражения печени (например, желтухи) следует отменить препарат. При отсутствии клинических признаков поражения печени или после нормализации активности «печёночных» ферментов возможно возобновление терапии препаратом интерферона бета-1b с наблюдением за функцией печени.
Нарушение со стороны почек и мочевыводящих путей
При назначении препарата пациентам с тяжёлой почечной недостаточностью следует
соблюдать осторожность.
Заболевания сердечно-сосудистой системы
Препарат интерферона бета-1b необходимо применять с осторожностью у больных с заболеваниями сердца, в частности, при ишемической болезни сердца, нарушениях ритма и сердечной недостаточности. Должен проводиться мониторинг функции сердечно-сосудистой системы, особенно в начале лечения.
Отсутствуют свидетельства в пользу прямого кардиотоксического эффекта интерферона бета-1b, однако, связанный с применением интерферона бета-1b гриппоподобный синдром, может стать значимым стрессовым фактором для пациентов с имеющейся значимой патологией сердечно-сосудистой системы. В ходе постмаркетингового наблюдения очень редко наступало ухудшение состояния деятельности сердечно-сосудистой системы у пациентов с имеющейся значимой патологией сердечно-сосудистой системы, которое по времени возникновения было связано с началом лечения интерфероном бета-1b.
Имеются редкие сообщения о возникновении кардиомиопатии на фоне лечения препаратом интерферона бета-1b. При развитии кардиомиопатии, в случае, если предполагается, что это связано с применением препарата, то лечение препаратом интерферона бета-1b следует прекратить.
Общие нарушения и нарушения в месте инъекции
Могут наблюдаться серьёзные аллергические реакции (редкие, но проявляющиеся в острой и тяжёлой форме, такие как бронхоспазм, анафилаксия и крапивница). У пациентов, получавших препарат интерферона бета-1b, наблюдались случаи некроза в месте инъекции (см. раздел «Побочные эффекты»). Некроз может быть обширным и распространяться на мышечные фасции, а также жировую ткань и, как следствие, приводить к образованию рубцов. В некоторых случаях необходимо удаление омертвевших участков или, реже, пересадка кожи. Процесс заживления при этом может занимать до 6 месяцев.
При появлении признаков повреждения целостности кожи (например, истечения жидкости из места инъекции) пациенту следует обратиться к врачу прежде, чем он продолжит выполнение инъекций препарата интерферона бета-1b.
При появлении множественных очагов некроза лечение препаратом интерферона бета-1b следует прекратить до полного заживления повреждённых участков. При наличии одного очага, если некроз не слишком обширен, применение препарата интерферона бета-1b может быть продолжено, поскольку у некоторых пациентов заживление омертвевшего участка в месте инъекции происходило на фоне применения препарата интерферона бета-1b.
С целью снижения риска развития реакции и некроза в месте инъекции, больным следует рекомендовать:
- проводить инъекции, строго соблюдая правила асептики;
- каждый раз менять место инъекции;
- вводить препарат строго подкожно.
Периодически следует контролировать правильность выполнения самостоятельных инъекций, особенно при появлении местных реакций.
Иммуногенность
Как и при лечении любыми другими препаратами, содержащими белки, при применении препарата интерферона бета-1b существует возможность образования антител. В ряде контролируемых клинических исследований производился анализ сыворотки крови каждые 3 месяца для выявления образования антител к интерферону бета-1b. В этих исследованиях было показано, что нейтрализующие антитела к интерферону бета-1b развивались у 23–41 % пациентов, что подтверждалось как минимум двумя последующими позитивными результатами лабораторных тестов. У 43–55 % из этих пациентов в последующих лабораторных исследованиях было выявлено стабильное отсутствие антител к интерферону бета-1b.
В исследовании с участием пациентов с клинически изолированным синдромом, позволяющим предположить рассеянный склероз, нейтрализующая активность, которая измерялась каждые 6 месяцев, во время соответствующих визитов отмечалась у 16,5–25,2 % пациентов, получавших интерферон бета-1b. Нейтрализующая активность обнаруживалась, по крайней мере, один раз у 30 % (75) пациентов, получавших интерферон бета-1b; у 23 % (17) из них до того, как исследование завершилось, статус антител вновь стал отрицательным.
В ходе двухлетнего периода исследования развитие нейтрализующей активности не связывалось со снижением клинической эффективности (в том, что касалось времени до наступления клинически достоверного рассеянного склероза).
Не было доказано, что наличие нейтрализующих антител сколько-нибудь значительно влияет на клинические результаты. С развитием нейтрализующей активности не связывалось появление каких-либо побочных реакций.
Решение о продолжении или прекращении терапии должно основываться на показателях клинической активности заболевания, а не на статусе нейтрализующей активности.
Влияние на способность управлять транспортными средствами, механизмами
Специальные исследования не проводились. Нежелательные явления со стороны ЦНС могут влиять на способность управлять автомобилем и работать с механизмами. В связи с этим необходимо соблюдать осторожность при занятии потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. При появлении описанных побочных действий следует воздержаться от выполнения указанных видов деятельности.
Форма выпуска
Раствор для подкожного введения, 8 млн МЕ/мл, 8 млн МЕ/0,5 мл.
По 1 мл (8 млн МЕ/мл) во флаконы бесцветного нейтрального стекла I гидролитического класса, укупоренные пробками, с обкаткой алюминиевыми колпачками. На каждый флакон наклеивают этикетку.
По 5 флаконов в контурную ячейковую упаковку из плёнки ПВХ.
По 1, 2, 3 или 6 контурных ячейковых упаковок с инструкцией по применению помещают в пачку из картона.
По 0,5 мл (8 млн МЕ/0,5 мл) в трёхкомпонентные стерильные шприцы из бесцветного нейтрального стекла I гидролитического класса. На каждый шприц наклеивают этикетку. По 1 шприцу в контурную ячейковую упаковку из плёнки ПВХ.
По 1, 5 или 15 контурных ячейковых упаковок с инструкцией по применению помещают в пачку из картона.
Пачка с флаконами дополнительно может комплектоваться:
Комплектность № 1:
- шприцами одноразовыми инъекционными с иглой по 5, 10, 15 и 30 шт соответственно;
- иглами медицинскими инъекционными по 5, 10, 15 и 30 шт соответственно;
- салфетками спиртовыми по 10, 20, 30 и 60 шт соответственно.
Комплектность № 2:
- шприцами одноразовыми инъекционными с иглой по 5, 10, 15 и 30 шт соответственно;
- иглами медицинскими инъекционными двух видов по 5, 10, 15 и 30 шт соответственно;
- салфетками спиртовыми по 10, 20, 30 и 60 шт соответственно.
Пачка со шприцами дополнительно может комплектоваться:
- салфетками спиртовыми по 1, 5 и 15 шт соответственно.
Хранение
Хранить при температуре от 2 до 8 °C.
В пределах указанного срока годности допустимо хранение пациентом невскрытого флакона/шприца в течение одного месяца при температуре не выше 25 °C. Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту