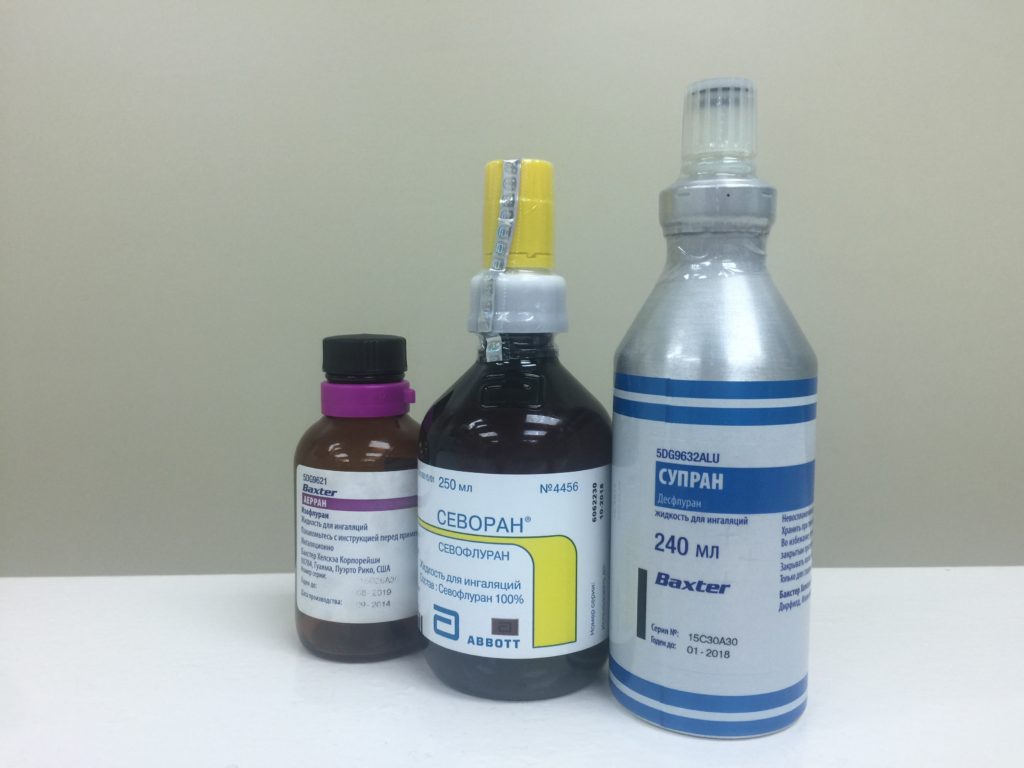
Введение
Ингаляционная анестезия может использоваться для животных большинства видов и разного возраста. Ее преимуществами являются быстрая индукция и хорошее восстановление после наркоза, оптимальный контроль наркоза и стабильные физиологические эффекты по сравнению с большинством инъекционных анестетиков. Ввиду минимального метаболизма большинства современных ингаляционных средств для наркоза они с меньшей вероятностью оказывают влияние на показатели, оцениваемые в исследовании [1, 2].
Недостатки ингаляционной анестезии – высокая стоимость и необходимость в очистных системах вентиляции, а также необходимость высокой технической компетентности персонала. Самый безопасный способ введения средств для наркоза – использование наркозного аппарата. С помощью испарителя средство для наркоза поступает в организм животных в точно заданной концентрации. Для процедур, которые занимают незначительное время, у мелких лабораторных животных можно использовать простую ингаляционную камеру, но в этом случае требуется осторожность, поскольку при открытии камеры может создаваться высокая концентрация паров анестетика в зоне дыхания оператора.
Анестезирующие средства доставляются к животному с помощью газа-носителя. В качестве такого газа-носителя может выступать медицинский кислород, но результатом этого будет высокий уровень кислорода в артериальной крови. Кислород в смеси с воздухом или закисью азота (N2O) поддерживает в организме животных физиологический уровень артериального кислорода. Закись азота также способствует развитию аналгезирующего действия без угнетения дыхания и позволяет снизить расход анестетика на 20–50%. При этом угнетение сердечно-сосудистой системы, характерное для применения ингаляционных средств для наркоза, резко снижается.
Поступление средств для наркоза может быть достигнуто с помощью ингаляционной камеры или маски, подобранной по размеру животного. Ингаляционная камера чаще применяется для грызунов и других мелких животных, которые слабо приучены к взаимодействию с человеком. Маска должна использоваться только для животных, которые привыкли к манипуляциям и оператору. Анестезию осуществляют, удерживая маску на животном, или газ вводят через эндотрахеальную трубку.
В данном обзоре предпринята попытка систематизировать основные механизмы действия ингаляционных анестетиков и закиси азота и рассмотреть их применение в исследованиях на лабораторных животных.
Расчет расхода анестетика
Расход препаратов для ингаляционной анестезии, таких как севофлуран, десфлуран и изофлуран, зависит от продолжительности анестезии, потока свежего газа и концентрации препарата в дыхательном контуре. Упрощенная формула для расчета расхода анестетика, предложенная J. Ehrenwerth и J. Eisenkraft в 1993 г., выглядит следующим образом [3]:
3 • FGF • об.% = расход анестетика (мл/ч),
где: 3 – коэффициент, FGF – fresh gas flow (поток свежего газа), л/мин, об.% – объемный процент на испарителе.
Эта формула расхода анестетика подходит для быстрого и приблизительного расчета.
Примеры среднего расхода анестетика при общей анестезии для:
- севофлурана — 3 • 1 • 4 = 12 мл/ч;
- десфлурана — 3 • 1 • 8 = 24 мл/ч;
- изофлурана — 3 • 1 • 2= 6 мл/ч.
Существует более сложная формула расхода анестетика, но при этом и наиболее точная:
расход анестетика (в мл) = (FGF • С • T) / (const • 100),
где: FGF – средний поток свежего газа, мл/мин; С – средняя концентрация анестетика, об.%; T – продолжительность анестезии, мин; const – константа анестетика (объем пара): севофлуран 184 мл, десфлуран 210 мл, изофлуран 195 мл.
Минимальная альвеолярная концентрация
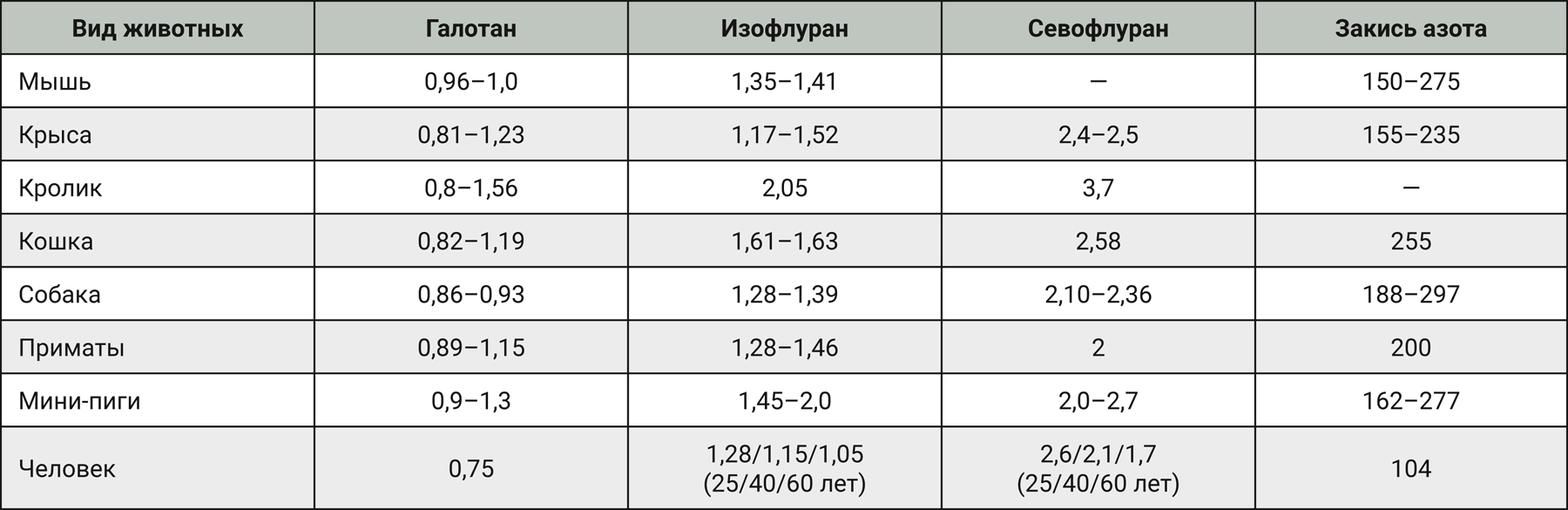
Минимальная альвеолярная концентрация (МАК) используется как показатель эффективности ингаляционного анестетика и представляет собой концентрацию анестетика, которая вызывает неподвижность у 50% животных одного вида и соответствует легкой степени анестезии.
МАК одинакова для животных одного вида и колеблется в диапазоне от 10 до 20% между разными видами животных [4]. Чтобы достоверно достичь адекватной/средней глубины анестезии у 95% животных необходимо использовать 1,5 МАК. Для достижения глубокого наркоза используют 2,0 МАК, однако такая же доза может вызвать и передозировку [5]. При этом МАК снижается с возрастом животного, а самые высокие значения обнаруживаются у новорожденных. Премедикация опиоидами, α2-агонистами или транквилизаторами снижает МАК. Высокое значение МАК для N2O у животных указывает на то, что анестезию нельзя поддерживать одним N2O. Закись азота более эффективна для человека (МАК 104%) (табл. 1).
Механизм действия ингаляционных средств для анестезии
Закись азота. Закись азота (N2O) была открыта в 1793 г. английским ученым Джозефом Пристли. Закись азота нашла научное применение в качестве анестетика в клинической стоматологии и медицине в начале 1840-х годов. Горацию Уэллсу, американскому дантисту, удалили один зуб после вдыхания N2O – и это была первая демонстрация клинической анестезии. Затем последовал период широкого клинического использования N2O для стоматологической анестезии, за которым, к сожалению, – период отказа, когда было признано, что высокие концентрации, необходимые для анестезии, часто подвергали пациента риску тяжелой гипоксии и даже приводили к смерти от асфиксии. Хотя за последние 150 лет конкретный способ использования N2O значительно изменился, все же он по прежнему чаще других анестетиков применяется в стоматологии.
Сегодня медицинское применение N2O включает сбалансированную анестезию во время операции, при которой N2O часто сочетается с другими препаратами и в экстренных ситуациях. Закись азота также используется для подготовки водолазов к глубоким погружениям, потому что состояние имитирует дезориентацию и поведенческие изменения при декомпрессионной болезни.
Низкие концентрации N2O вызывают только анальгетический и анксиолитический эффекты без потери сознания. Как анальгетическое средство N2O давно используется в акушерстве для облегчения боли при родах. Закись азота также применяется для самостоятельного обезболивания онкологическими больными с целью облегчения боли и дискомфорта, связанных с рядом медицинских процедур, включая внутрисуставные инъекции, ректороманоскопию, колоноскопию, офтальмологические процедуры и взятие материала для биопсии. В Европе смесь 50% N2O : 50% О2 широко используется при неотложной медицинской помощи пациентам в местах происшествий и при их транспортировке.
Механизм анальгетического действия закиси азота. Механизм аналгезии N2O рассматривается как антиноцицептивное действие N2O на животных. Поскольку животные не могут сообщать об уменьшении болевых ощущений, обезболивание более точно определяется у животных как антиноцицепция или снижение реакции на раздражитель.
Опиоидная гипотеза антиноцицептивного действия N2O. Еще в 1943 г. полагали, что обезболивающий эффект N2O был сопоставимым с анальгетическим действием опиоидных анальгетиков, примерно 30% N2O считался столь же эффективным, как и 10–15 мг морфина. В середине 1970-х годов впервые продемонстрирована индуцированная N2O антиноцицепция у мышей и крыс, чувствительная к блокаде наркотическим антагонистом налоксоном [7, 8].
Индуцированная N2O аналгезия у людей также блокировалась налоксоном [9, 10]. Эта гипотеза была дополнительно подтверждена сообщениями о животных, нечувствительных к морфину, имеющих перекрестную толерантность к N2O [8, 11].
Факт, что перекрестная толерантность была односторонней (устойчивые к N2O животные не были перекрестно толерантными к морфину), привел B.A. Berkowitz и соавт. [11] к мысли, что N2O может оказывать фармакологическое действие через стимуляцию нейронного высвобождения эндогенных опиоидных пептидов. Опиоидный пептид, высвобождаемый N2O, идентифицирован как динорфин [12, 13].
Длительное лечение морфином приводит к десенситизации опиоидных рецепторов и/или механизмов передачи сигнала, что способствует перекрестной толерантности к N2O и зависит от тех же опиоидных рецепторов. При постоянном лечении с использованием N2O развивается толерантность, связанная с чрезмерным истощением запасов эндогенных опиоидных пептидов, так что последующее воздействие N2O не может высвободить достаточные количества опиоидных пептидов, чтобы вызвать антиноцицепцию [14].
Участие оксида азота в антиноцицепции N2O. Оксид азота (NO) – эндогенный биологический регулятор. Антиноцицепция N2O вызывает дозозависимый антагонизм с помощью ряда аналогов L-аргинина, которые конкурентно ингибируют NO-синтазу (NOS). Оксид азота также играет ключевую роль в высвобождении опиоидного пептида. В экспериментах показано, что NO вызывает высвобождение эндогенных опиатов (динорфин), играющих посредническую роль в антиноцицептивном эффекте N2O. Расположение нервных окончаний, из которых высвобождается динорфин, и опиоидных рецепторов не определено [14]. Схема участия NO в антиноцицепции N2O представлена на рис. 1.
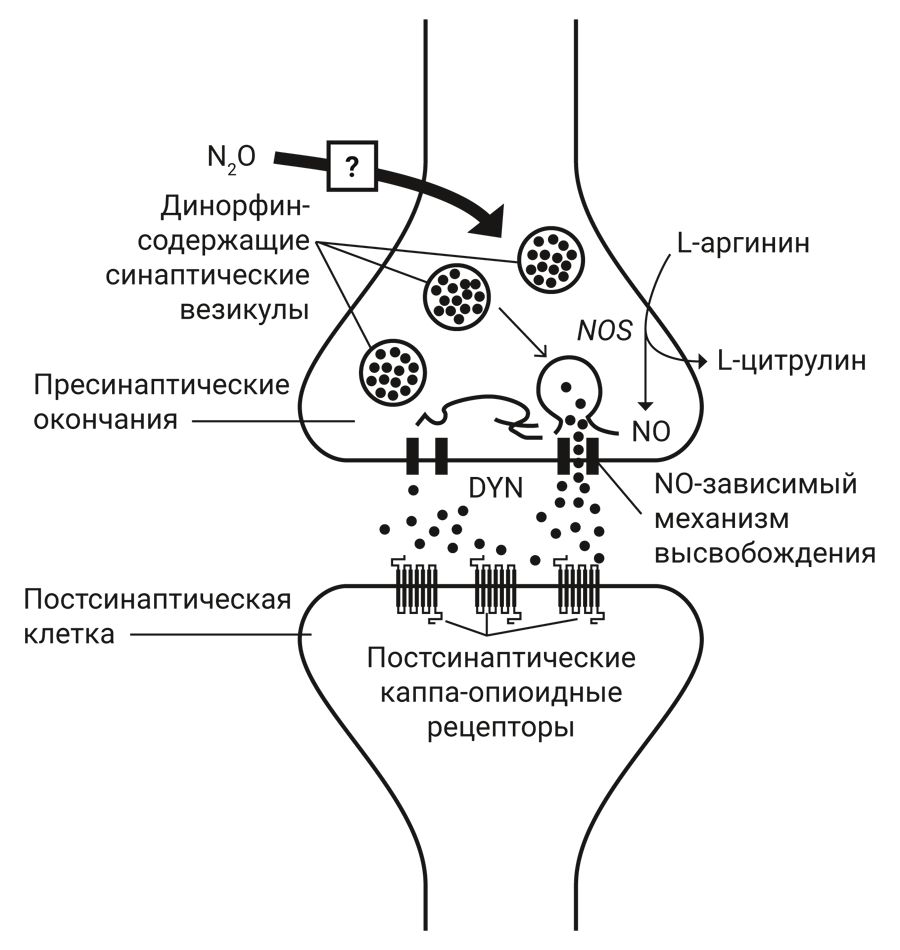
Примечание. DYN – динорфин, NOS – синтаза оксида азота, NO – оксид азота
Считается, что N2O стимулирует высвобождение нейронами эндогенных опиоидных пептидов динорфинов (DYNs); молекулярные аспекты того, как N2O инициирует этот процесс, пока неизвестны. Пресинаптическое нервное окончание за счет фермента синтазы оксида азота (NOS) участвует в образовании NO. Оксид азота, по-видимому, участвует в высвобождении DYN. Динорфин пересекает синаптическую щель и активирует постсинаптические опиоидные рецепторы.
Нисходящие пути, активируемые N2O. М. Fujinaga и М. Maze [15] предположили, что высвобождение эндогенных опиоидных пептидов и последующая стимуляция опиоидных рецепторов активируют нисходящие пути, которые модулируют ноцицептивную обработку в спинном мозге.
Норадренергический путь – самый важный нисходящий путь, тем не менее он находится под тоническим ингибированием γ-аминомасляной кислотой – ГАМКергическим путем. Стимуляция опиоидных рецепторов опиоидными пептидами, высвобождаемыми N2O, ингибирует ГАМКергический путь, вызывая таким образом растормаживание нисходящего норадренергического пути. Расторможенный норадренергический путь, по-видимому, модулирует ноцицептивную обработку спинного мозга. Закись азота индуцирует высвобождение эндогенных опиоидных пептидов, которые активируют опиоидные рецепторы на γ-аминомасляной кислоте – ГАМКергических ядрах моста. Этот путь в свою очередь активирует нисходящую норадренергическую систему в заднем роге спинного мозга, которая прямо или косвенно подавляет ноцицептивную обработку на уровне первичных афферентных нейронов и нейронов второго порядка, передающих сенсорные сигналы вверх – восходящий ноцицептивный путь.
Толерантность к антиноцицепции N2O. Как и в случае со многими центрально-опосредованными эффектами лекарств, непрерывное введение N2O приводит к развитию толерантности к антиноцицептивному эффекту N2O у экспериментальных животных [16] и к анальгетическому эффекту N2O у людей [17].
Исследование развития толерантности к N2O на различных линиях крыс показало, что линия крыс Fischer демонстрирует стойкий антиноцицептивный ответ на использование N2O, но не проявляет острой толерантности, тогда как линия крыс Lewis плохо реагирует на индуцированную N2O антиноцицепцию [18]. Помимо отличающейся чувствительности к N2O, у крыс Fisher и Lewis также различные нейрохимические и поведенческие реакции на другие препараты центрального действия [19, 20]. По сравнению с крысами Fisher слабореагирующая линия Lewis имеет более низкие базальные уровни эндогенных опиоидных пептидов, поэтому у крыс этой линии уровень опиоидных пептидов не повышается после введения морфина [20]. Это также согласуется с выводами о том, что поддержание высоких уровней опиоидного пептида за счет ингибирования фермента энкефалиназы может предотвратить развитие острой толерантности к N2O у крыс [21].
Механизм анксиолитического действия закиси азота. Имеются данные, что снижение беспокойства при вдыхании N2O является специфическим анксиолитическим действием, не зависящим от анальгетического эффекта N2O. При этом задействованные механизмы еще полностью не изучены.
Установлено, что N2O вызывает паттерны поведенческой реакции, напоминающие эффекты бензодиазепинов [14]. Рецепторы ГАМК опосредуют анксиолитическое действие, вызываемое хлордиазепоксидом и активацией N2O бензодиазепиновых рецепторов.
Исследования в приподнятом крестообразном лабиринте показали, что повышенная активность в открытом рукаве, вызываемая N2O и хлордиазепоксидом, блокируется неселективным ингибитором NOS, и это антагонистическое действие прекращается под влиянием L-аргинина [22, 23]. Также в экспериментах анксиолитическое действие N2O блокируется ингибитором гуанилилциклазы [24].
Известно, что цГМФ действует на несколько различных мишеней: цГМФ-зависимые протеинкиназы (PKG), цГМФ-зависимые катионные каналы или цГМФ-регулируемая фосфодиэстераза [25]. Анксиолитическое действие, индуцированное N2O, значительно ослабляется ингибиторами PKG [24] (рис. 2).
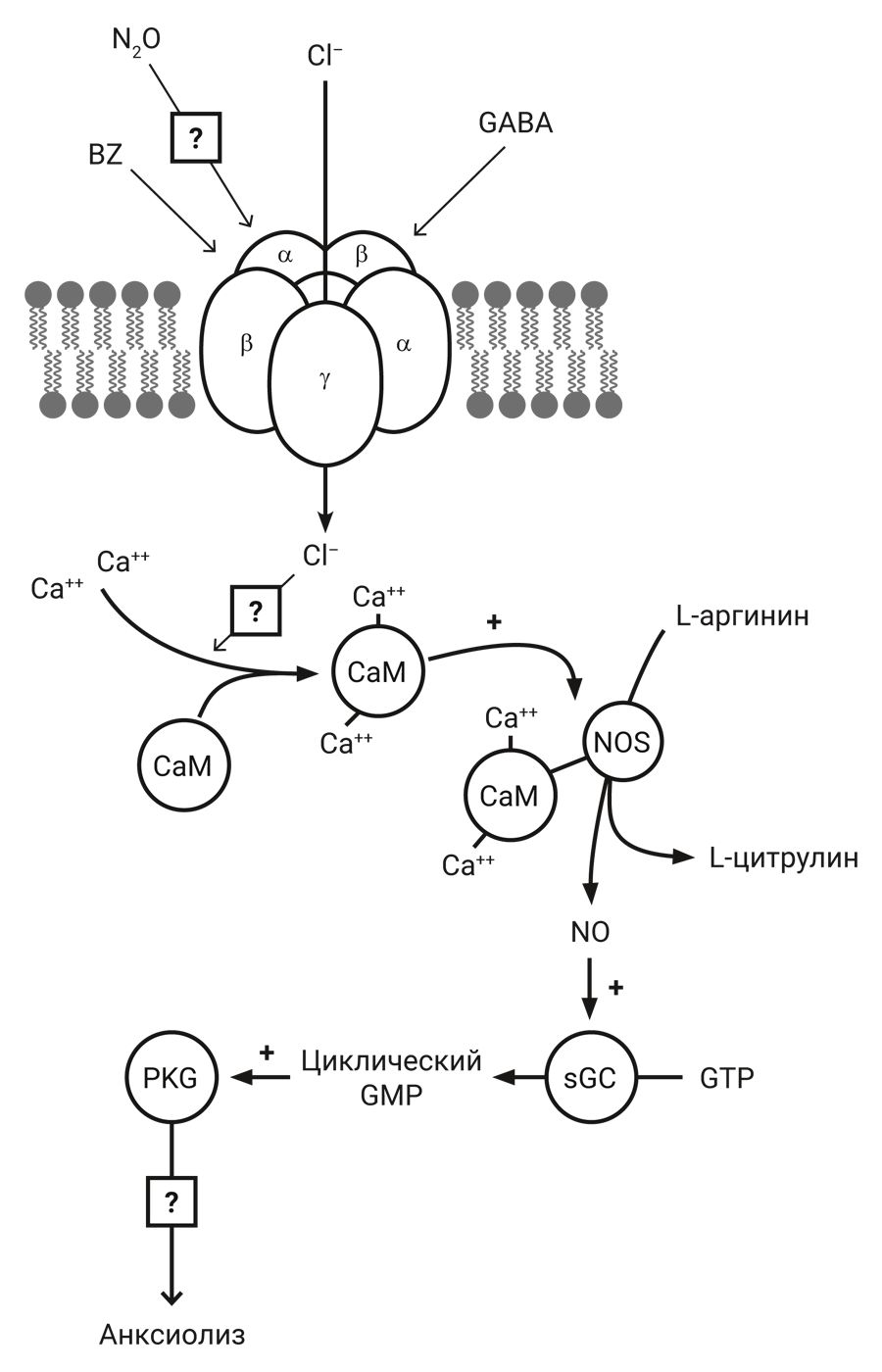
Примечание. BZ – бензодиазепин, GABA – γ-аминомасляная кислота, CaM – кальмодулин, NOS – синтаза оксида азота, PKG – GMP-зависимая протеинкиназа
Считается, что N2O вызывает активацию сайта связывания бензодиазепина (BZ). Это действие способствует активации сайта связывания γ-аминомасляной кислоты (ГАМК, GABA), что приводит к притоку хлорид-ионов в нейрон. Повышенная концентрация хлорид-иона в нейроне может вызвать активацию кальмодулина (CaM), который затем активирует фермент синтазу оксида азота (NOS). NOS обеспечивает образование NO, который стимулирует гуанилилциклазу, продуцирующую вторичный мессенджер циклический гуанозинмонофосфат (циклический GMP). Циклический GMP, в свою очередь, стимулирует циклическую GMP-зависимую протеинкиназу (PKG), которая приводит к анксиолитическому эффекту закиси азота.
Механизм анестезии при применении закиси азота. Из-за низкой активности в клинической практике N2O обычно используется для снижения минимальной альвеолярной концентрации второго ингаляционного агента для анестезии и увеличения скорости индукции (т.е. эффект второго газа [26]), а также для обеспечения или усиления обезболивающего компонента общей анестезии.
Долгое время предполагалось, что общие анестетики (например, N2O) действуют неспецифическим образом на мембраны нейронов, изменяют текучесть мембран и/или влияют на ионные каналы. Однако в дальнейшем было высказано предположение, что общие анестетики могут действовать на одно или несколько суперсемейств ионных каналов, управляемых лигандами, которые включают ГАМК, рецепторы глицина, никотинового ацетилхолина, 5-гидрокситриптамина и глутамата [27].
Рецепторы глутамата N-метил-D-аспартата (NMDA) также являются возможной мишенью для ингаляционных анестетиков. Подобно другим антагонистам NMDA, нейротоксический эффект N2O зависит от возраста и чувствителен к аттенуации ГАМКергическими препаратами [28, 29].
Предполагается, что общее свойство антагонизма рецептора NMDA может лежать в основе схожих фармакологических профилей N2O и кетамина. Фактически при совместном применении эти два препарата вызывают синергетическую нейротоксичность [30].
Механизмы действия ингаляционных анестетиков
Современные ингаляционные анестетики – это галогенированные углеводороды (галотан), галогенированные простые эфиры (изо-, дез-, эн-, севофлуран). Химические формулы представлены на рис. 3.
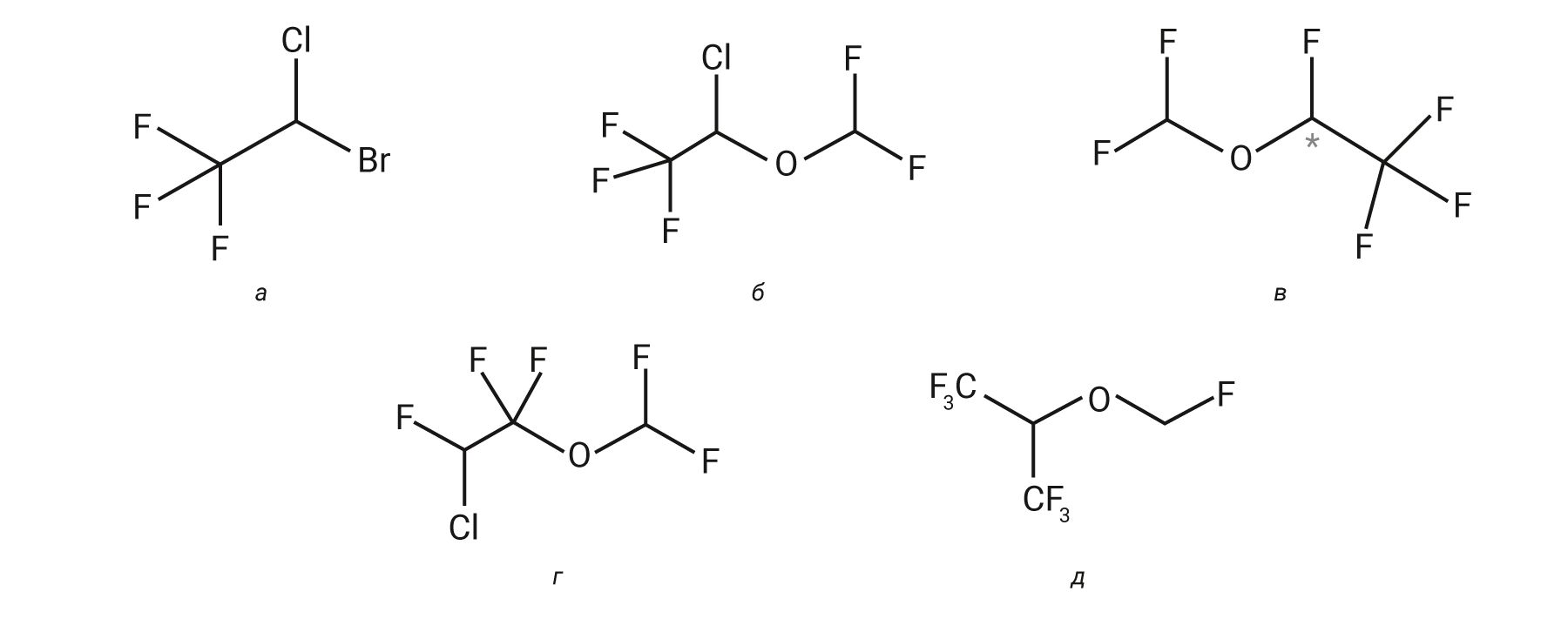
Все современные ингаляционные анестетики (галотан, изофлуран, энфлуран и др.) схожи по структуре и имеют идентичный механизм действия. Основной механизм их действия – усиление ингибирующего эффекта ГАМК путем взаимодействия с рецепторами ГАМК центральной нервной системы [31–35].
Полагают, что ингаляционные анестетики влияют на аллостерические центры ряда рецепторов, сопряженных с ионными каналами (рис. 4).
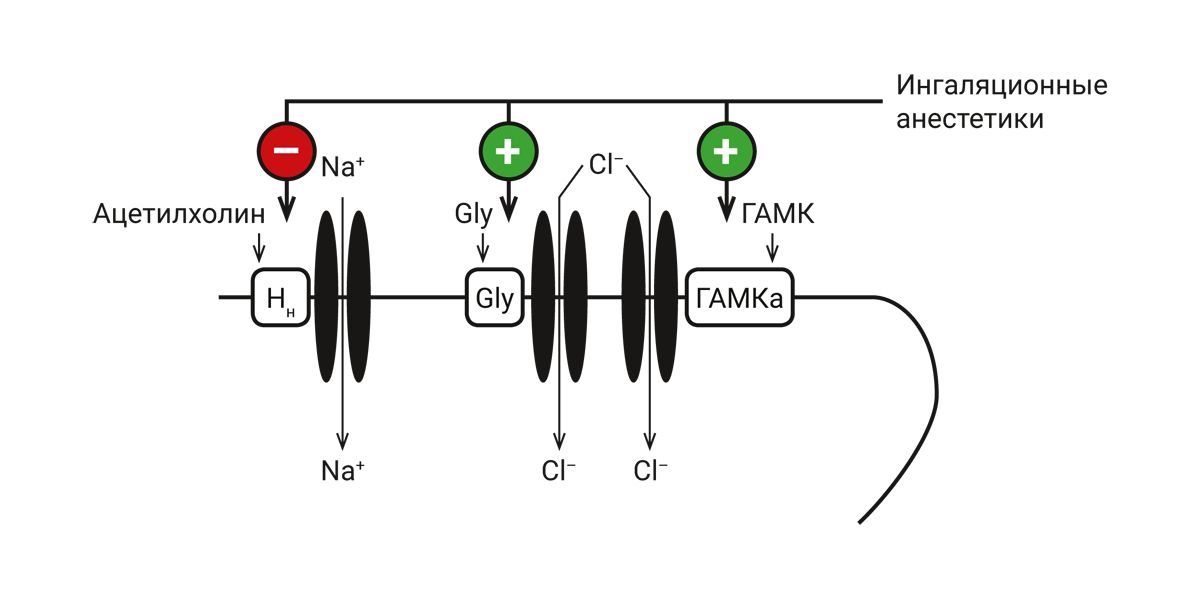
Примечание. Gly – глутаминовая кислота; Нн – холинорецепторы; ГАМК – γ-аминомасляная кислота; красный круг – тормозящие, зеленые – активирующие влияния анестетиков.
Ингаляционные анестетики блокируют аллостерические центры Нн-холинорецепторов, сопряженных с натриевыми каналами. При этом снижается сродство холинорецептора к ацетилхолину и обычная концентрация ацетилхолина не способна активировать рецептор и открыть канал. Нарушение тока ионов натрия в клетку приводит к прекращению генерации потенциалов действия.
Ингаляционные анестетики, так же, как и N2O, активируют аллостерические центры ГАМК- и глициновых рецепторов, сопряженных с хлоридными каналами. На фоне ингаляционных анестетиков чувствительность ГАМК- и глицинового рецептора к эндогенным лигандам многократно возрастает и даже ничтожно малые концентрации лигандов способны активировать рецептор и открыть канал. Поступление ионов хлора в клетку вызывает гиперполяризацию постсинаптической мембраны [31, 32].
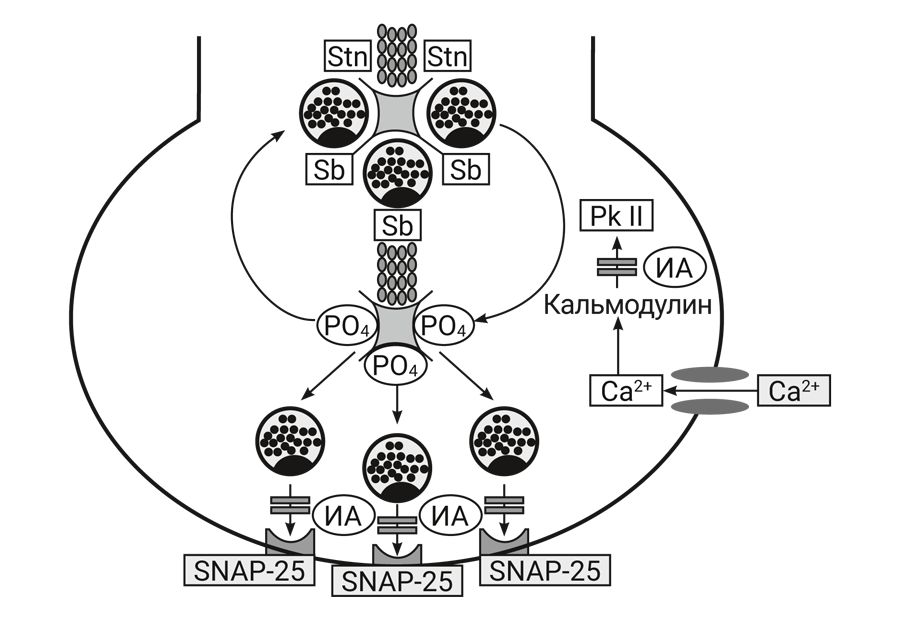
В последнее время показано, что ингаляционные анестетики нарушают процессы взаимодействия белков, ответственных за выброс медиатора из везикул пресинаптического окончания (рис. 5). В обычных условиях везикулы с медиатором, подобно гроздьям винограда, фиксированы на микротрубочках особым белком синтаксином. Под влиянием потенциала действия открываются кальциевые каналы пресинаптической мембраны, при этом в клетку поступают ионы кальция, которые активируют кальмодулин и зависимую от него протеинкиназу II типа, которая фосфорилирует синтаксин. В фосфорилированном состоянии синтаксин не способен фиксировать везикулы, и они отрываются от микротрубочек. В мембранах везикул находится белок синаптобревин, который легко связывается с белком SNAP-25, расположенным в пресинаптической мембране. Поэтому везикулы быстро «заякориваются» в мембране и выбрасывают медиатор в синаптическую щель. Ингаляционные анестетики нарушают процесс фосфорилирования синтаксина и везикулы не способны оторваться от микротрубочек, кроме того, ингаляционные анестетики инактивируют синаптобревин и везикулы не могут фиксироваться в пресинаптической мембране [36–40].
Таким образом, совместный механизм действия закиси азота и ингаляционных анестетиков во многом синергичен, что и обеспечивает их фармакологическую эффективность (рис. 6).
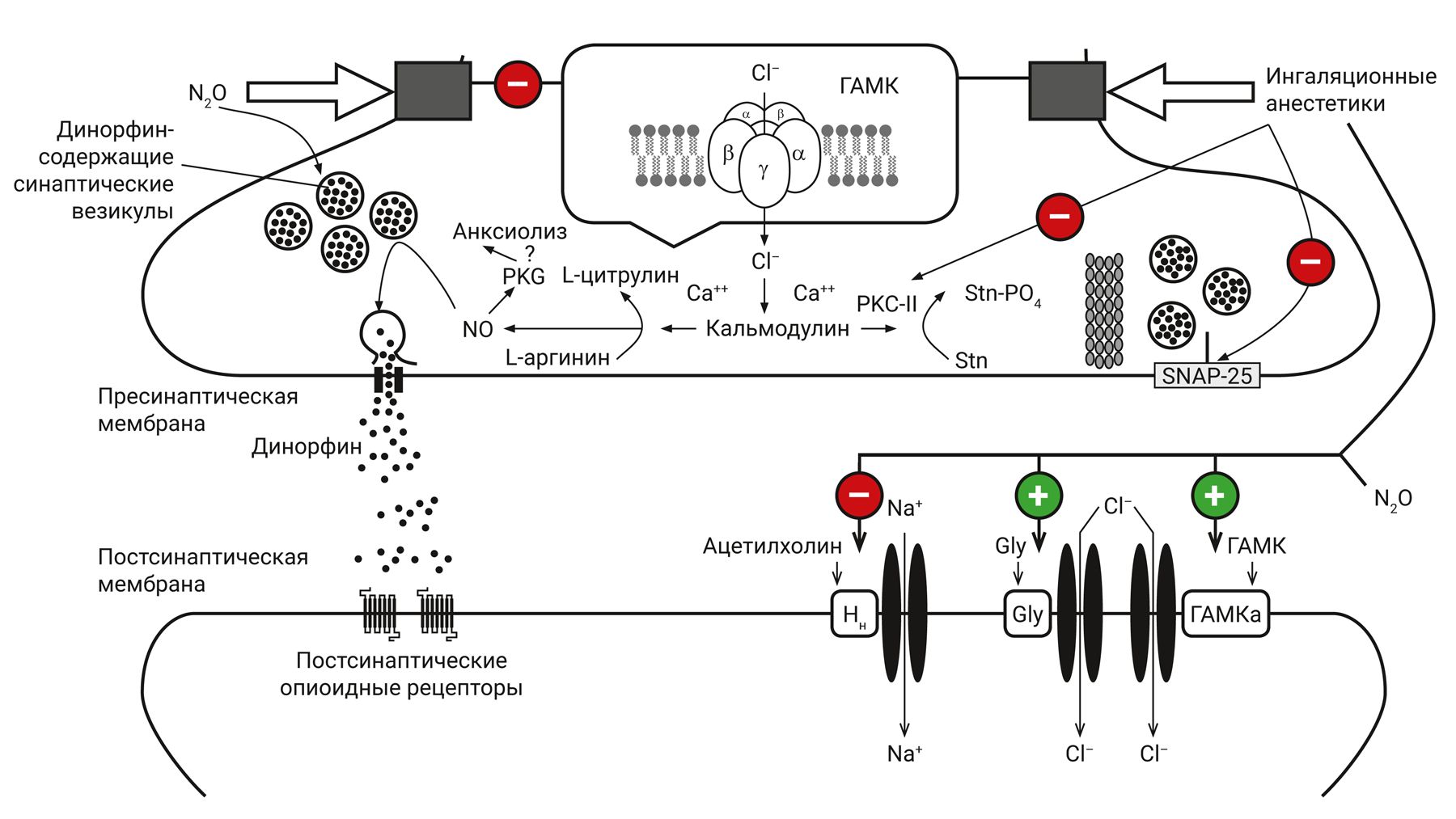
Примечание. Gly – глутаминовая кислота, Нн – холинорецепторы, ГАМК – γ-аминомасляная кислота, PKC-II – кальмодулин-зависимая протеинкиназа II типа; Stn – белок синтаксин; SNAP-25 – мембранный белок, компонент белкового комплекса SNARE; PKG – GMP-зависимая протеинкиназа; NO – оксид азота; красные круги – тормозящие, зеленые – активирующие влияния анестетиков
Фармакологическое действие ингаляционных анестетиков и закиси азота
Закись азота. Фармакокинетика: закись азота плохо растворяется в крови и липидах, поэтому при ингаляции обеспечивается быстрое введение в наркоз, а после прекращения подачи происходит такой же быстрый выход из него (в течение 4–5 мин). В организме закись азота практически не метаболизируется [31, 41–43].
Фармакодинамика:
- Анестезирующий эффект (способность вводить в наркоз) – закись азота оказывает слабое анестезирующее действие, т.е. хирургической стадии наркоза можно добиться при ингаляции чистой закиси азота под избыточным давлением. Поскольку для нормального газообмена уровень кислорода в воздухе не должен быть ниже 20% обычно применяют смесь 70–80% закиси азота и 20% кислорода. Такая смесь обеспечивает лишь поверхностный наркоз и может быть использована только для создания вводного наркоза и поддержания наркоза на фоне других анестетиков.
- В расчете на анальгетический эффект иногда используют ингаляции 45% смеси с закисью азота для обезболивания при инфаркте миокарда, родах (так как закись азота не влияет на тонус матки), при снятии швов, экстракции зубов. Аналгезию под влиянием анестезирующих газов, которая возникает без выключения сознания, называют рауш-наркоз.
- Миорелаксирующее действие у закиси азота не выражено, стадия возбуждения чрезвычайно короткая, проявляется в виде эйфории, «опьянения».
Эффект второго газа. Под эффектом «второго газа» понимают увеличение альвеолярной концентрации летучего анестетика, когда с вдыхаемым газом одновременно подается закись азота. Более быстрое поступление закиси азота в кровь вызывает уменьшение объема легких, в результате которого концентрация летучего анестетика в остаточном объеме увеличивается, что повышает альвеолярно-капилярный градиент парциального давления.
Закись азота (60–70% во вдыхаемой смеси) при сочетанном применении с другими анестетиками увеличивает их скорость поглощения, МАК галотана или изофлурана уменьшается примерно на 20–25% и, следовательно, снижается подавление сердечно-легочной функции [2]. Наименьшее соотношение O2: N2O должно быть 1:2, так, чтобы концентрация кислорода составляла не менее 33% [44].
Нежелательные эффекты закиси азота:
- Закись азота окисляет атом кобальта в составе цианокобаламина и нарушает активность зависимого от него фермента метионинсинтетазы, который участвует в процессе переноса метильных групп при синтезе ДНК в костном мозге. Поэтому при длительной ингаляции возможно возникновение анемии и нейтропении. Согласно данным Международного общества по изучению боли, в связи с угрозой этого осложнения максимальная длительность анестезии закисью азота не должна превышать 6 ч.
- После прекращения наркоза возможно развитие диффузионной гипоксии. Плохо растворимая в крови закись азота начинает интенсивно выделяться из крови в альвеолы и вытесняет из них кислород. Поскольку альвеолы лишаются кислорода, газообмен прекращается. Во избежание гипоксии после прекращения наркоза закисью азота в течение 4–5 мин проводят ингаляцию кислородом.
- Несмотря на то, что закись азота плохо растворяется в крови, ее растворимость в 15 раз выше, чем у кислорода, и в 30 раз лучше, чем у азота, поэтому при прекращении ингаляции она начинает выделяться в полости организма в количествах, значительно превышающих объемы газов атмосферного воздуха. Выделение закиси азота в кишечник приводит к развитию метеоризма, в придаточные пазухи носа – к чувству распирания и головной боли, в барабанную полость среднего уха – к боли и заложенности в ушах.
Эти нежелательные эффекты надо учитывать в период клинического наблюдения за животными после наркоза.
Галотан. Фармакокинетика: галотан лучше, чем закись азота, растворяется в крови и липидах, поэтому при его ингаляции введение в наркоз наступает относительно медленно (через 4–7 мин), а выход из наркоза продолжается 15–20 мин.
Фармакодинамика:
- Галотан высокоактивен, вызывает глубокий наркоз с достаточно выраженной аналгезией и миорелаксацией, поэтому применяется для введения в наркоз и поддержания наркоза при различных видах хирургических операций.
- При галотановом наркозе практически не выражена стадия возбуждения.
- Ганглиоблокирующее действие и снижение вагусного влияния на бронхи дают бронходилатирующий эффект.
- Галотан несколько снижает артериальное давление за счет блокады Нн-холинорецепторов вегетативных ганглиев и каротидных клубочков, а также вследствие угнетения сосудодвигательного центра продолговатого мозга и стимуляции продукции оксида азота в эндотелиальных клетках сосудов.
- Галотан снижает силу сердечных сокращений и сердечный выброс за счет нарушения процесса поступления ионов кальция в миокард. Также при использовании галотана возможно развитие брадикардии, так как он угнетает синусовый узел.
Нежелательные эффекты галотана:
- Галотан повышает внутричерепное давление, усиливая кровоток в сосудах головного мозга.
- Под влиянием галотана происходит угнетение сократительной активности миокарда и дыхательного центра.
- 20% галотан подвергается метаболизму с образованием фторэтанола, фторацетальдегида, трифторуксусной кислоты, которые накапливаются в мембранах гепатоцитов и могут привести к фатальному некрозу печени (частота развития у людей 1 случай на 10 000), поэтому повторное применение галотана допускаются не ранее чем через 6 мес после первой ингаляции.
- Введение на фоне галотана адреналина или норадреналина с целью повышения артериального давления может привести к развитию фибрилляции желудочков. Если необходимо поддержать артериальное давление во время галотанового наркоза, следует использовать фенилэфрин или метоксамин.
Изофлуран. Фармакокинетика: изофлуран несколько хуже галотана растворяется в системе газ–кровь–липиды, поэтому быстрее, чем галотан, обеспечивает ввод в наркоз и выход из него (в пределах 3–5 мин).
Фармакодинамика:
- Изофлуран обеспечивает глубокий наркоз с выраженной миорелаксацией.
- В отличие от галотана изофлуран не снижает сократительную функцию миокарда и не ухудшает кровоток во внутренних органах.
- Изофлуран практически не влияет на уровень внутричерепного давления.
Нежелательные эффекты:
- Изофлуран оказывает раздражающее действие на слизистые оболочки бронхов и усиливает секрецию бронхиальных желез. Скопление слизи в дыхательных путях может привести к их обтурации и развитию ателектаза. Для предупреждения этого при изофлурановом наркозе проводят премедикацию атропином (он снижает секрецию желез).
- Изофлуран практически не метаболизируется, поэтому не оказывает гепатотоксического действия.
Энфлуран. По основным характеристикам энфлуран близок к изофлурану (фактически он является его изомером). Однако энфлуран имеет ряд особенностей:
- По растворимости в крови и липидах он занимает промежуточное положение между галотаном и изофлураном, поэтому по скорости наступления наркоза и выхода из него он также находится между этими средствами.
- Может вызывать тоникоклонические судороги.
- В большей степени, чем галотан, повышает внутричерепное давление и мозговой кровоток.
Эффекты ингаляционных анестетиков на различные органы и системы
Влияние на дыхательную систему. Современные ингаляционные анестетики воздействуют на все звенья физиологии дыхания. Они оказывают бронходилатирующее действие за счет снижения внутриклеточной концентрации кальция и снижения чувствительности к нему, причем эффект более выражен в дистальных отделах дыхательных путей. Ингаляционные анестетики уменьшают скорость мукоцилиарного клиренса вследствие снижения частоты биения ресничек, нарушения синхронизма их работы или изменения свойств слизи, а также вызывают уменьшение количества сурфактанта в ткани. На фоне их применения снижаются дыхательный объем и минутная вентиляция легких, угнетается дыхательный ответ на гиперкапнию и гипоксию за счет центральных и периферических хеморецепторных механизмов [31, 41–43].
Влияние на сердечно-сосудистую систему. Ингаляционные анестетики снижают сократимость левого и правого желудочка, левого предсердия, диастолической функции левого желудочка и угнетают рефлекторный контроль артериального давления, опосредованный барорецепторами. Они по-разному влияют на нормальный и поврежденный миокард, в различной степени изменяя показатели постнагрузки левого желудочка. Системные гемодинамические эффекты ингаляционных анестетиков складываются из миокардиальных эффектов, прямого воздействия на артериальную и венозную сосудистую сеть и нарушений активности вегетативной нервной системы. При их применении повышается чувствительность миокарда к аритмогенным эффектам эпинефрина и в зависимости от концентрации последнего, степени и локализации повреждения внутри проводящих путей могут либо предотвратить, либо способствовать развитию предсердных или желудочковых аритмий при ишемии или инфаркте миокарда [31, 41–43].
Влияние на центральную нервную систему. Все современные ингаляционные анестетики могут снижать мозговой метаболизм до 60%. Влияние ингаляционных анестетиков на мозговой кровоток зависит от дозы. При использовании концентрации ниже MAК мозговой кровоток существенно не меняется. В концентрации выше 1 МАК мозговые сосуды расширяются, что приводит к увеличению мозгового кровотока и внутричерепного объема крови.
Анестезия также может влиять на уровень глюкозы в крови и концентрацию липидов, которые могут косвенно воздействовать на метаболизм мозга [45].
На церебральный метаболизм также действуют изменения температуры тела, в частности, переохлаждение часто встречается при длительной анестезии у маленьких животных. Например, гипергликемия значительно повышает риск глобальной ишемии головного мозга [46], модулируя механизмы и нейропротекторные свойства гематоэнцефалического барьера [47, 48].
Особенности наркотизации разных видов лабораторных животных
У крыс и мышей кислород можно использовать в качестве единственного газа-носителя, за исключением очень длительных процедур. При отсутствии механической вентиляции легких уровень углекислого газа CO2 во время анестезии в артериальной крови будет повышен. Для коротких процедур, где используются мыши, анестезию можно вызвать ингаляционным анестетиком в стеклянной банке. При стандартных условиях температуры и давления 1 мл жидкого изофлурана дает 182 мл газа. В сосуде емкостью 500 мл 0,11 мл жидкого изофлурана быстро испаряется, достигая концентрации 4%, при этом мышь, помещенная в банку, подвергнется анестезии в течение нескольких минут и проснется через 30–60 с после извлечения из банки. Животное никогда не должно контактировать с жидким анестетиком, в противном случае возникнет местное раздражение [2].
Если несколько мышей подвергают анестезии друг за другом в банке, необходимо принять меры для предотвращения недостатка кислорода. Для защиты персонала этот метод можно использовать, только применяя вытяжной шкаф с вентиляцией.
Все ингаляционные анестетики достаточно безопасны для кроликов, кошек, собак и хорьков [49, 50–52]. Анестезия с использованием суфентанила в сочетании с закисью азота описана у собак [53].
Для хорьков рекомендованы следующие режимы дозирования: 4–5% изофлуран для введения в наркоз и 1,5–3% для поддержания наркоза, 3–3,5% галотан для введения в наркоз и 0,5–2,5% для поддержания наркоза [54].
Закись азота наиболее востребована для животных массой тела >2 кг, так как для более мелких животных ингаляционные анестетики быстро поглощаются и без N2O [2]. Закись азота не рекомендуется использовать у травоядных, поскольку она легко диффундирует в наполненные газом сегменты кишечника.
Анестезию средствами для наркоза не следует проводить у кроликов без седативных препаратов, поскольку они неохотно вдыхают пары и могут длительно задерживать дыхание и сопротивляться [55, 56]. Вместо этого для премедикации можно использовать инъекционный анестетик короткого действия с последующим применением ингаляционной анестезии.
Для мини-пигов также используют N2O, но только в качестве дополнения к другим анестетикам. Это не сильнодействующий анестетик и поэтому его можно вводить в высоких концентрациях, но не рекомендуется применять N2O в концентрациях выше 75%. При этом N2O снижает дозу более сильнодействующих анестетиков (примерно на 50% уменьшает дозу изофлурана).
Изофлуран широко используется для обезболивания мини-пигов, он предпочтительнее галотана, поскольку его применение безопаснее, с его помощью легче регулировать глубину анестезии и он обеспечивает более быстрое введение в наркоз и выход из него [6].
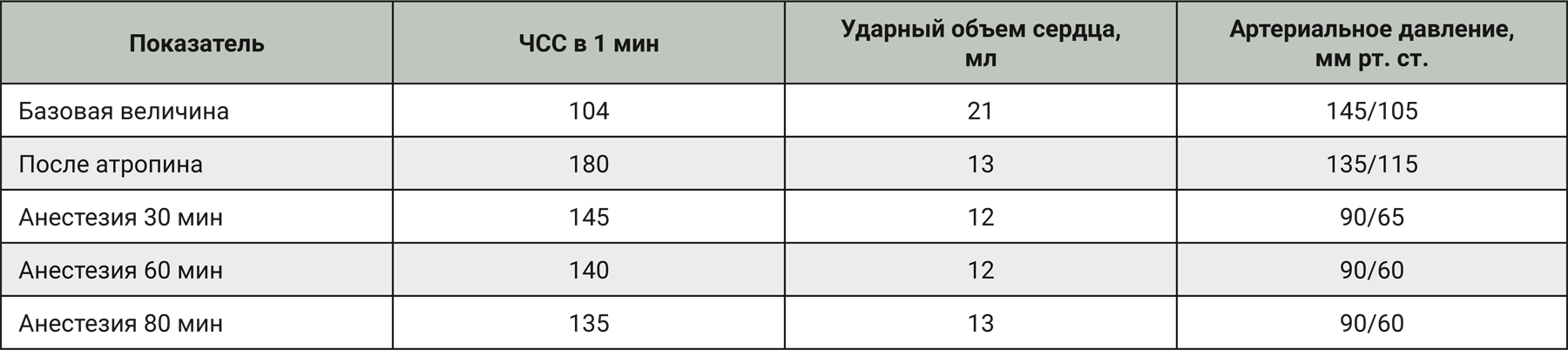
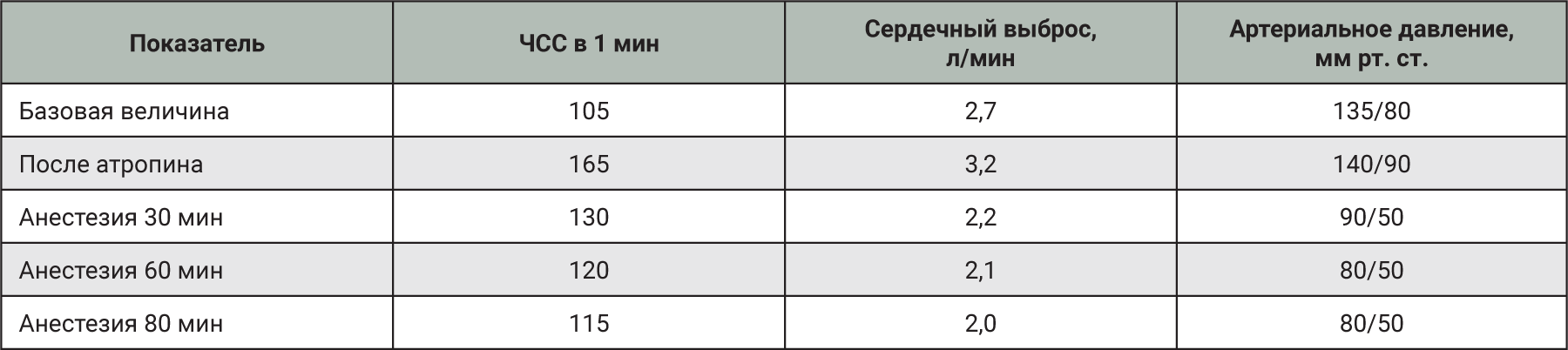
Также изофлуран хорошо сочетается с сильными анальгетиками, поскольку он обеспечивает только минимальный обезболивающий эффект, а в комбинации с анальгетиками его доза может быть существенно снижена [6]. Комбинация изофлурана и N2O была испытана на самках мини-пигов. Влияние на физиологические параметры мини-пигов при использовании комбинации 1,75–2,00% изофлурана со смесью N2O : О2 (1:3) представлено в табл. 2. Также в этом исследовании наблюдалось снижение артериального давления и увеличение частоты сердечных сокращений (ЧСС) в первый час анестезии. В целом комбинация изофлурана и N2O оказалась эффективна при применении у мини-пигов [6].
Десфлуран, севофлуран и энфлуран являются изомерами изофлурана, они также применяются для анестезии мини-пигов.
Поскольку десфлуран имеет низкую растворимость в крови, наступление наркоза и выход их него происходят очень быстро, поэтому можно легко регулировать глубину анестезии. Он более летуч, чем галотан и изофлуран, для него необходимы специальные испарители. Высокая цена десфлурана часто ограничивает его использование у мини-пигов.
Севофлуран широко используется у мини-пигов, он может быть препаратом выбора при повышенном риске, когда мини-пиги особи молодые или больные, поскольку он обеспечивает быстрый вывод из наркоза. В целом изофлуран и севофлуран (с закисью азота или без нее) являются универсальными агентами для анестезии свиней [6].
При применении энфлурана необходима соответствующая премедикация. Высокие концентрации энфлурана могут вызывать у свиней реакцию, напоминающую судороги, в связи с чем энфлуран постепенно исчезает с рынка.
Как и изофлуран, энфлуран можно комбинировать с N2O для обезболивания мини-пигов.
Комбинацию энфлурана и N2O исследовали на мини-пигах A.K.O. Alstrup и соавт. [6]. В отличие от других ингаляционных анестетиков энфлуран практически не метаболизируется, и это особенно важно в случае проведения повторной анестезии мини-пигов. Физиологические параметры, наблюдаемые у мини-пигов в возрасте 5 мес, при анестезии энфлураном и N2O представлены в табл. 3. Наблюдалось снижение артериального давления и увеличение ЧСС в течение первого часа анестезии. При таком типе анестезии у спонтанно дышащих мини-пигов может развиваться респираторный ацидоз, поэтому для длительных исследований рекомендуется искусственная вентиляция легких.
Далее приведены некоторые факторы, увеличивающие или уменьшающие МАК ингаляционных анестетиков у мини-пигов и других видов животных [6]:
- увеличивают – гипертермия, стимуляторы, ЦНС, амфетамин, эфедрин, физостигмин;
- уменьшают – гипотермия, премедикация, ацепромазин, мидазолам, ксилазин, другие анестетики, закись азота, кетамин, возраст, беременность.
Безопасность оператора при проведении анестезии
Обеспечение безопасности оператора при проведении анестезии касается воздействия анестезирующих газов, обращения с газовыми баллонами и возможного злоупотребления лекарственными препаратами.
Воздействие анестезирующих газов. Хроническое влияние ингаляционных анестетиков может приводить к заболеваниям печени и почек, абортам, бесплодию, врожденным дефектам и новообразованиям у людей [57]. Закись азота может подавлять функцию костного мозга и вызвать аборт. В большинстве стран есть правила, касающиеся использования анестезирующих газов. Правила включают оценку рисков, предотвращение и контроль воздействия, установку и обслуживание, меры контроля, мониторинг влияния, наблюдение за здоровьем персонала, информирование и обучение персонала.
Установлены пределы действия анестезирующих газов и рекомендации по ограничению воздействия. Обеспечение качественной работы вентиляционных систем сводят к минимуму влияние следовых газов.
Если невозможно избежать воздействия, рекомендуется использовать более безопасные анестетики, например, более безопасный, чем галотан, изофлуран. Системы поглощения анестетиков с активированным углем имеют ограниченное применение и поглощают галогенированные летучие вещества, но не закись азота.
Газовые баллоны. Газовые баллоны находятся под высоким давлением, а при их механическом повреждении (падение) или нагревании могут взорваться.
Баллоны нельзя хранить рядом с источниками тепла или горючего материала. Клапаны кислородного баллона и связанное с ними оборудование нельзя смазывать, не должны использоваться масла и смазки на углеродной основе. Их сочетание с высоким давлением кислородного баллона может вызвать взрыв.
Запрещается курение в непосредственной близости от баллона или подводящих трубок или попадание на них прямых солнечных лучей.
Анестезия галогенсодержащими ингаляционными анестетиками нового поколения характеризуется быстрым восстановлением сознания и когнитивных функций пациентов. Севофлуран и десфлуран отличают низкая токсичность, незначительное влияние на состояние и функции внутренних органов, хорошая управляемость. В рамках сателлитного симпозиума ООО «ЭббВи» ведущие отечественные и зарубежные специалисты в области анестезиологии и реаниматологии представили свой опыт применения ингаляционных галогенсодержащих анестетиков в клинической практике.
Профессор Ян Фердинанд ХЕНДРИКС (Госпиталь Св. Богоматери, г. Аалст, Бельгия, доцент-консультант кафедры анестезиологии медицинского факультета Стенфордского университета, Калифорния) сравнил физико-химические свойства и клинические характеристики галогенсодержащих ингаляционных анестетиков. Десфлуран и севофлуран относятся к последнему поколению галогенсодержащих анестетиков. Несмотря на некоторую схожесть по химической структуре и физико-химическим свойствам, они имеют различия в фармакотерапевтическом действии.
Длительность индукции анестезии, или вводного наркоза, определяется скоростью подъема альвеолярной концентрации. Поскольку процесс поглощения ингаляционного анестетика начинается в альвеолах, возникает разница между вдыхаемым и альвеолярным парциальным давлением. Другими словами, длительность индукции зависит от скорости наступления равновесия между альвеолярной концентрацией анестетика в конце выдоха (FА) и вдыхаемой концентрацией (Fi). Чем быстрее анестетик поглощается кровью, тем медленнее возрастает фракционная альвеолярная концентрация и ниже отношение FА/Fi (рис. 1). Период наиболее интенсивного поглощения анестетика зависит от его физико-химических свойств. У десфлурана одна минимальная альвеолярная концентрация равна 6%, у севофлурана – 2%. Иначе говоря, градиент/напор подаваемого десфлурана выше, чем у всех других ингаляционных анестетиков. Следовательно, десфлуран обладает самой высокой степенью поглощения1. Однако сравнение севофлурана и десфлурана не должно ограничиваться кривыми FА/Fi. Прежде всего важна фактическая концентрация, а она зависит от Fi .
Концентрация газа прямо пропорциональна его парциальному давлению, поэтому альвеолярное парциальное давление анестетика будет возрастать медленно. Следовательно, чем выше скорость поступления анестетика из альвеол в кровь, тем существеннее разница между Fi и FА и медленнее индукция анестезии.
Индукция анестезии десфлураном наступает раньше, чем индукция анестезии севофлураном. «Однако, – отметил докладчик, – увеличения концентрации десфлурана при индукции допускать не следует, поскольку могут развиться осложнения, такие как раздражение дыхательных путей, гипертензия, тахикардия». В свою очередь у севофлурана есть несколько особенностей, которые делают его достойным препаратом для индукционной анестезии даже у взрослых: низкий коэффициент растворимости кровь/газ (быстрый рост FA) и незначительное раздражающее действие (возможность применения избыточного давления).
Время восстановления сознания пациента – еще одна важная характеристика анестетика. Сравнительный анализ профиля восстановления сознания по окончании анестезии разными анестетиками в амбулаторных условиях показал, что время пробуждения при использовании десфлурана незначительно отличается от такового при применении севофлурана (на две-три минуты). Однако надо понимать, что важнее: промежуточные или значимые конечные результаты? Во многих исследованиях изучалось влияние летучего анестетика на продолжительность пребывания пациента в больнице и интенсивность послеоперационной боли. Как показал ретроспективный анализ результатов анестезии за 2005–2009 гг., среди 42 352 пациентов, получавших изофлуран, десфлуран и севофлуран, продолжительность пребывания в стационаре при использовании изофлурана составила 2,85 дня (2,78–2,93), десфлурана – 2,64 дня (2,57–2,72), севофлурана – 2,55 дня (2,48–2,62)2. Таким образом, несмотря на более быстрое восстановление сознания после применения десфлурана, достоверно быстрее (р = 0,009) выписываются пациенты, получавшие анестезию севофлураном (рис. 2).
При назначении анестетиков следует учитывать их фармакодинамический профиль. Существует мнение, что у пациентов с ожирением, у которых нарушены функции многих органов, по сравнению с пациентами без ожирения пробуждение после прекращения подачи севофлурана (в отличие от десфлурана) происходит медленнее. Однако в клинической практике время насыщения тканей и время элиминации препарата после прекращения его подачи у больных с ожирением и пациентов с нормальной массой тела практически идентичны. Следовательно, препарат может с успехом применяться и у больных с ожирением. В клиническом исследовании было подтверждено, что в рутинной клинической практике морбидное ожирение не оказывает клинически значимого влияния на поглощение ингаляционных анестетиков (изофлуран, севофлуран, десфлуран)3.
Профессор Я. Хендрикс отметил, что технологии подачи ингаляционных анестетиков в настоящее время активно и успешно развиваются. Сегодня внимание специалистов приковано к системам автоматизированной низкопоточной анестезии, предназначенным для достижения и поддержания итоговой концентрации препарата. Новейшее программное обеспечение оборудования позволяет автоматизировать подачу ингаляционного анестетика и обеспечить работу на низком потоке. Недавно специалистам-анестезиологам были представлены новые системы автоматизированной низкопоточной анестезии, которые независимо от степени растворимости ингаляционного анестетика позволяют поддерживать необходимый уровень концентрации препарата.
Еще один вопрос, волнующий мировую общественность, – влияние ингаляционных анестетиков на окружающую среду. Докладчик отметил, что в отличие от N2O десфлуран и севофлуран не содержат опасных для озонового слоя веществ. Однако ингаляционные анестетики, содержащие галогенизированные органические соединения – сильные парниковые газы, задерживают инфракрасное излучение в атмосфере и тем самым представляют угрозу в плане глобального потепления. В исследовании, посвященном воздействию анестетиков на окружающую среду и изменение климата, показано, что галогенизированные органические соединения ответственны за парниковый эффект приблизительно на 10–15% от общего антропогенного радиационного воздействия на климат, измеренного относительно начала индустриальной эпохи4. Вклад же самих ингаляционных анестетиков в парниковый эффект, по мнению профессора Хендрикса, равен примерно действию одной угольной электростанции или одного миллиона легковых автомобилей.
В заключение профессор Хендрикс отметил, что научные исследования принципов действия и свойств ингаляционных анестетиков продолжаются.
Ингаляционные анестетики третьего поколения: аспекты практического применения
Заведующий отделением реаниматологии МОНИКИ им. М.Ф. Владимирского, д.м.н., профессор Валерий Владимирович ЛИХВАНЦЕВ рассмотрел механизм действия галогенсодержащих анестетиков, который реализуется через взаимодействие с эндогенными рецепторами.
Ингаляционные анестетики подразделяются на три группы. Первая группа – «чистые» сенситизаторы гамма-аминомасляной кислоты (ГАМК). Это препараты, которые оказывают хороший гипнотический эффект и у которых практически полностью отсутствует анальгетический эффект (пропофол, этомидат, барбитурат). Вторую группу составляют препараты, активные в отношении ионотропного рецептора глутамата, селективно связывающего N-метил-D-аспартат (NMDA-рецепторов): циклопропан, закись азота, ксенон и кетамин. В третью группу входят соединения, активные в отношении не только ГАМК, но и ацетилхолиновых рецепторов в центре и на периферии: десфлуран, севофлуран, изофлуран. Это препараты, обладающие гипнотическим и анальгетическим эффектами, однако соотношение выраженности этих компонентов у препаратов обсуждаемой группы не одинаково5.
Как известно, минимальная альвеолярная концентрация, при которой у 50% пациентов отсутствует двигательная реакция на болевой раздражитель, является показателем силы действия ингаляционного анестетика. Показатели минимальной альвеолярной концентрации у галогенсодержащих анестетиков существенно различаются, причем у десфлурана уровень минимальной альвеолярной концентрации выше (6,00%), чем у севофлурана (1,58–2,05%) и изофлурана (1,15%), а значит, анестетический потенциал ниже. Уровень минимальной альвеолярной концентрации летучих анестетиков зависит от состояния пациента и уменьшается с возрастом, а также при использовании ряда лекарственных средств, в частности опиатов, N2O.
Степень раздражающего действия ингаляционных галогенсодержащих анестетиков также различна. Десфлуран не рекомендуется использовать для индукции анестезии, хотя отдельные работы демонстрируют возможность индукции анестезии десфлураном на фоне премедикации опиоидами. Однако в отличие от севофлурана десфлуран оказывает раздражающее воздействие на верхние дыхательные пути и бронхи, обладает резким запахом, вызывающим саливацию, задержку дыхания, кашель и ларингоспазм. В связи с этим десфлуран противопоказан больным бронхиальной астмой и курильщикам. Севофлуран в свою очередь может без оговорок использоваться для ингаляционной индукции у детей и взрослых.
Скорость поглощения анестетика тканями определяется величиной альвеолярно-венозного градиента парциальных давлений. Если анестетик перестает поглощаться тканями, венозное и альвеолярное парциальное давление выравнивается. Равновесное состояние у десфлурана и севофлурана достигается быстро. В связи с этим оба препарата можно использовать через ларингеальную маску. Ингаляционная индукция анестезии в нашей стране пока не распространена. Между тем, по мнению докладчика, поддержание анестезии с помощью ингаляционных препаратов возможно благодаря их свойствам. Так, период насыщения при анестезии десфлураном занимает три-четыре минуты, севофлураном – пять – семь минут. Препараты позволяют легко управлять глубиной анестезии.
Периоды поддержания анестезии с применением десфлурана и севофлурана существенно различаются. Если моноанестезия севофлураном при ряде амбулаторных малотравматичных вмешательств все-таки возможна, то для десфлурана по ряду причин вряд ли оправданна. При поддержании анестезии следует использовать фентанил при анестезии десфлураном в дозе не менее 3 мкг/кг/ч, что позволит избежать побочных эффектов, при анестезии севофлураном – не более 3 мкг/кг/ч. Севофлуран способен потенцировать эффекты миорелаксантов, что не свойственно десфлурану.
С появлением галогенсодержащих анестетиков возросла тенденция к применению низкопоточной анестезии на наркозных аппаратах. Ингаляционная анестезия считается низкопоточной, если общий поток свежего газа по ротаметрам наркозного аппарата составляет 0,5–1 л/мин. Для анестезии с потоком свежих газов менее 0,5 л/мин лучше использовать анестезию десфлураном и севофлураном. Пропускная способность испарителей исключает использование галотана и энфлурана уже при потоке свежих газов менее 0,5 л/мин, следовательно, для закрытой системы циркуляции подходят только десфлуран и севофлуран.
Высокий уровень доставки при малом газотоке (разрешенные высокие установки на испарителе) в сочетании с низкой индивидуальной поглощаемостью приводит к низкой постоянной времени при использовании севофлурана и десфлурана. Это важная характеристика ингаляционных анестетиков, поскольку чем ниже постоянная времени, тем быстрее можно достичь необходимой концентрации препарата, то есть углубить анестезию или, наоборот, сделать ее более поверхностной.
Профессор В.В. Лихванцев отметил, что существуют разные мнения по поводу отрицательного влияния ингаляционных анестетиков на функцию печени. Проблема гепатотоксичности связана с использованием первого галогенсодержащего анестетика – галотана, который вызывает два вида поражения печени – острый некроз (галотановый гепатит) и легкую субклиническую гепатотоксичность. Острый некроз печени – это аутоиммунный процесс, который инициируется перекисным окислением галогенсодержащего анестетика с образованием трифторацетата. Метаболизм севофлурана исключает образование трифторацетата, а десфлуран, хотя образует его в процессе биодеградации, подвергается биотрансформации в малой степени. Уровень трифторацетата у десфлурана в 1000 раз меньше, чем у галотана, поэтому десфлуран отличается низкой гепатотоксичностью, что подтверждено клинически. Однако при анализе данных специальной литературы разных стран за 1999–2010 гг. было установлено пять случаев, когда токсический гепатит, ставший следствием анестезии десфлураном, привел к летальному исходу.
Прямое нефротоксическое действие галогенсодержащих анестетиков доказано только для метоксифлурана, который может вызывать полиурию, гипернатриемию, дегидратацию и другие нарушения. Нефротоксичность метоксифлурана прямо пропорциональна метаболизму анестетика. Действующим агентом считается фторид-ион, образующийся в процессе биотрансформации. Именно поэтому ингаляционные анестетики проходят тестирование на количество фторид-иона, образующегося в процессе их биодеградации.
Как показали результаты исследований, благодаря незначительной биодеградации десфлуран не оказывает негативного влияния на работу почек. Севофлуран имеет ограниченную доступность для биотрансформации в почках, поэтому при использовании в клинических концентрациях не вызывает острого некроза почек.
Важным аспектом при рассмотрении проблем ингаляционной анестезии является кардиопротективный эффект галогенсодержащих анестетиков. Метаанализ 38 рандомизированных исследований с участием 3996 пациентов был посвящен сравнению кардиопротективного эффекта ингаляционных анестетиков – десфлурана, севофлурана, изофлурана6. Результаты метаанализа продемонстрировали кардиопротективный эффект всех исследуемых галогенсодержащих анестетиков. Применение анестезии севофлураном и десфлураном ассоциируется со снижением общей летальности, частоты случаев инфаркта миокарда.
Профессор В.В. Лихванцев назвал вопрос о скорости пробуждения после анестезии десфлураном и севофлураном спорным. Низкая растворимость в крови и тканях делает пробуждение после прекращения подачи десфлурана более быстрым по сравнению с севофлураном, но результаты исследований подтверждают, что в ряде случаев показатели темпа пробуждения после анестезии этими препаратами примерно равны.
Докладчик рассказал о результатах собственного рандомизированного исследования темпов пробуждения пациентов после анестезии севофлураном и десфлураном в реальных условиях. Всего в исследование был включен 131 пациент: у 44 пациентов анестезию проводили пропофолом, у 43 – десфлураном, у 44 – севофлураном.
Для наблюдения выделили две группы анестезиологов с большим стажем работы с ингаляционными анестетиками: так называемые наблюдатели (фиксировали готовность пациента к экстубации трахеи, переводу из операционной, но не вмешивались в процесс проведения анестезии) и собственно анестезиологи, проводящие анестезию. В ходе исследования наблюдатель фиксировал «теоретическую» скорость пробуждения, а анестезиолог – реальную клиническую значимость различий между сравниваемыми группами анестезий. Результаты исследования показали, что темпы пробуждения от анестезии десфлураном по сравнению с анестезией севофлураном были выше, но незначительно (две-три минуты). При этом докладчик обратил внимание аудитории на один важный момент. Только специалисты в стационарах должны решать, имеет клиническое значение разница в скорости пробуждения после анестезии или нет.
Завершая выступление, профессор В.В. Лихванцев отметил, что ингаляционные анестетики третьего поколения севофлуран и десфлуран на сегодняшний день являются препаратами выбора в анестезиологии. Они характеризуются уникальными свойствами, подтвержденными многочисленными исследованиями, и предназначены для широкого клинического применения.
Ингаляционные анестетики третьего поколения: шаг к детям
Применению ингаляционной анестезии в педиатрии был посвящен доклад заведующего отделением анестезиологии и реанимации Российской детской клинической больницы, к.м.н. Владимира Станиславовича КОЧКИНА.
В нашей стране ингаляционные анестетики третьего поколения в педиатрической практике используются уже несколько лет. Применение севофлурана без ограничений в педиатрии разрешено в России с 2005 г., десфлурана с ограничениями – с 2013 г. Третья фаза клинических исследований отечественного препарата ксенон завершена в 2011 г., но он разрешен к применению только у лиц старше 18 лет.
Севофлуран показан для вводной и поддерживающей анестезии у взрослых и детей при хирургических операциях в стационарных и амбулаторных условиях. Противопоказаниями к применению препарата являются повышенная чувствительность, подтвержденная или предполагаемая генетическая восприимчивость к развитию злокачественной гипертермии, грудное вскармливание.
Показания к применению десфлурана: для вводной и поддерживающей анестезии у взрослых, а также для поддерживающей анестезии у детей при проведении хирургических вмешательств как в стационаре, так и в амбулаторных условиях. Среди противопоказаний, в частности, проведение вводной анестезии у детей в возрасте до
12 лет, поддерживающей анестезии у детей в возрасте до шести лет, если не применяется интубация.
Севофлуран обладает относительно приятным запахом и не раздражает слизистые оболочки дыхательных путей, что отличает его от десфлурана. Данное свойство позволяет достаточно комфортно проводить аппаратно-масочную индукцию у пациентов детского возраста.
Десфлуран и севофлуран обладают схожими клиническими характеристиками. Они одинаково действуют на мозговой кровоток и внутричерепное давление, не провоцируют судорожную активность, не влияют на почечный кровоток, уменьшают кровоток в печени. Различия наблюдаются в уровне СО2 в покое и при нагрузке. Но если сравнивать анестетическую силу десфлурана и севофлурана, у последнего она выше.
Индукция с предварительным заполнением контура наркозного аппарата смесью, содержащей 6–8% севофлурана, может быть инициирована быстрым насыщением жизненной емкости легких смесью или проводится при спокойном дыхании пациента. При использовании десфлурана индукция может быть только последовательной, с начальной концентрацией 3% и последующим повышением на 0,5–1% через каждые два-три вдоха до 11%. Однако, по словам докладчика, в педиатрии она неприемлема, поскольку вызывает осложнения (таблица).
Сравнительный анализ осложнений индукции показал, что более чем у 1% пациентов в возрасте от двух до 16 лет во время индукции анестезии десфлураном с использованием лицевой или ларингеальной маски возникают проблемы респираторного характера. Распространенное осложнение при использовании галогенсодержащих анестетиков, в том числе севофлурана, у детей – злокачественная гипертермия. Она проявляется повышенным потреблением кислорода, накоплением лактата и продукцией большого количества углекислого газа и тепла. Специфическим антидотом злокачественной гипертермии служит дантролен. При применении десфлурана также может развиться гиперкалиемия – резкое повышение в сыворотке крови уровня калия и креатинина, а также миоглобинурия у пациентов с нейромышечными дистрофиями. При этом у пациентов не наблюдаются симптомы ригидности или гиперметаболизма. Для лечения такого состояния используют экстракорпоральные методы.
Как показали результаты исследований, одновременное применение фентанила 2,5 мкг/кг у детей, получавших анестезию на основе десфлурана или севофлурана, значительно уменьшало частоту развития ажитации. При использовании десфлурана у детей быстрее восстанавливалось сознание7.
В рандомизированном исследовании изучали особенности экстубации у детей, находившихся под наркозом с использованием десфлурана или севофлурана. Серьезных осложнений не выявлено. Проблемы респираторного характера (кашель) были зафиксированы в группе десфлурана. В ходе исследования было выявлено, что применение мидазолама в премедикацию на длительность пробуждения влияло значительнее, чем выбор ингаляционного анестетика. Частота возникновения ажитации пробуждения также не зависела от анестетика8.
Возникновение кашля в ответ на стимуляцию трахеи при интубации, раздувании манжеты и глубоком вдохе – надежная и клинически значимая оценка реактивности дыхательных путей. Исследования показали, что при 1,0 минимальной альвеолярной концентрации севофлуран значительно превосходит десфлуран в подавлении умеренного и тяжелого ответа на эту стимуляцию9.
Докладчик подчеркнул, что поддержание анестезии через ларингеальную маску неприемлемо для детей до шести лет. Для поддержания анестезии через ларингеальную маску при небольших концентрациях не отмечалось значимой разницы на раздражение дыхательных путей между десфлураном и севофлураном10.
В нейрохирургии севофлуран и десфлуран могут быть в равной степени использованы у детей, поскольку не влияют на мозговой кровоток. Применение этих препаратов способствует раннему выведению из наркоза нейрохирургических больных.
В.С. Кочкин отметил, что результаты собственного клинического опыта по использованию галогенсодержащих анестетиков показали преимущество севофлурана перед десфлураном.
Севофлуран считается препаратом выбора у пациентов с поливалентной аллергией, при прогнозируемой трудной интубации, критическом состоянии. Десфлуран в педиатрической практике используют только после интубации для поддержания анестезии, поскольку имеются серьезные ограничения по его использованию.
Подводя итог, В.С. Кочкин подчеркнул, что для дальнейшего расширения возможности использования ингаляционных анестетиков в детской клинической практике необходимы многосторонние исследования их эффективности и безопасности. Совершенствование хирургических и анестезиологических технологий позволит улучшить качество оказываемой помощи детям в стационаре.
Современные ингаляционные анестетики
Современные ингаляционные анестетики — галогенсодержащие препараты для проведения ингаляционной анестезии: севофлуран (севоран, sevoflurane), десфлуран (супран, desflurane) и изофлуран (форан, isoflurane). Все анестетики данной группы отличаются высокой эффективностью, управляемостью и, следовательно, высокой безопасностью. Кроме этого, современные ингаляционные анестетики обладают органопротекторными свойствами вместо органотокстичности: прекондиционирование миокарда, бронходилатация, нейропротекция. Применяются как при вводной анестезии (севофлуран), так и на этапе поддержания общей анестезии (севофлуран, десфлуран, изофлуран), а так же для ингаляционной седации при помощи устройства AnaConDa (изофлуран и севофлуран).
Ксенон и закись азота так же относятся к ингаляционным анестетикам, однако назвать их современными и часто используемыми в мире нельзя подробнее читайте здесь.
Фармакология севофлурана и десфлурана здесь
Характеристика современных ингаляционных анестетиков
Современные ингаляционные анестетики имеют несомненные преимущества перед средствами для внутривенной анестезии и прежними ингаляционными анестетиками (фторотан, этран). Их фармакокинетика зависит от концентрации препарата, потока свежего газа, альвеолярной вентиляции и сердечного выброса. При этом концентрацию ингаляционных анестетиков всегда можно измерить (в испарителе и в выдыхаемом воздухе), а концентрацию внутривенных анестетиков можно измерить только в шприце. Стоимость ингаляционной анестезии сопоставима с тотальной внутривенной анестезией на основе пропофола. Для рассчета расхода ингаляционных анестетиков во время общей анестезии существуют формулы и калькулятор.
История химического синтеза ингаляционных анестетиков здесь
Во время индукции и поддержания анестезии вентиляция, первый из пяти факторов, которые определяют концентрацию ингаляционного анестетика в легких, доставляет анестетик в легкие и тем самым увеличивает его альвеолярную концентрацию. Поглощение анестетика кровью в легких противодействует эффекту вентиляции путем удаления анестетика из легких с током крови. Метаболизм анестетиков может усилить их поглощение. Три фактора определяют поглощение кровью: растворимость (коэффициент распределения кровь-газ), легочный кровоток (сердечный выброс) и разница между парциальным давлением анестетика в легких и в поступающей в легкие венозной крови. Растворимость определяет отличие ингаляционных анестетиков друг от друга— более низкая растворимость обеспечивает более быстрый выход из анестезии (изофлуран>севофлуран>десфлуран), т.е. наиболее короткий период пробуждения у десфлурана.
Механизм действия ингаляционных анестетиков
Механизм действия ингаляционных анестетиков до конца не изучен и на сегодняшний день остается загадкой. Общая анестезия представляет собой совокупность отдельных и независимых компонентов, каждый из которых включает в себя определенные, возможно, в чем-то пересекающиеся друг с другом механизмы воздействия на различные участки центральной нервной системы. Сила действия общих анестетиков коррелирует с их жирорастворимостью, в связи с чем становится важным аспект их взаимодействия с гидрофобными мишенями. Не существует единого молекулярного механизма, объясняющего действие ингаляционных анестетиков. Вероятно, многочисленные мишени способствуют развитию разных эффектов для каждого препарата. Обездвиживающий эффект ингаляционных анестетиков связан с воздействием на структуры спинного мозга, тогда как развитие седации/сна и амнезии обусловлено супраспинальными механизмами. Ингаляционные анестетики постсинаптически усиливают ингибирующую синаптическую передачу, потенцируя лиганд-управляемые ионные каналы, активированные гамма-аминомасляной кислотой (ГАМК) и глицином; действуют экстрасинаптически, активируя ГАМК-рецепторы и трансмембранные ионные токи; и пресинаптически – усиливая базальное высвобождение ГАМК. Ингаляционные анестетики пресинаптически подавляют передачу возбуждения в синапсах, уменьшая высвобождение глутамата (ингаляционные анестетики), и постсинаптически – ингибируя ионотропные рецепторы возбуждения, активируемые глутаматом (газообразные анестетики). В настоящее время не существует исчерпывающей теории анестезии, описывающей последовательность событий от момента взаимодействия молекулы анестетика с его мишенью до развития клинической картины анестезии.
И хотя благодаря методам молекулярной генетики уже сделан большой шаг вперед в понимании фармакологии внутривенных анестетиков, действие ингаляционных анестетиков на молекулярном и клеточном уровнях все еще представляет множество загадок. До сих пор нет возможности установить четкую последовательность событий, от начала взаимодействия ингаляционного анестетика с мишенью, через каскад сложных биологических процессов к вариабельным поведенческим проявлениям, характеризующим совокупное состояние клинической анестезии у человека. Однако продолжающиеся научные исследования, затрагивающие основные элементы этого процесса, уже привели к созданию системы взглядов, трактующих действие анестетиков на различных анатомо-функциональных уровнях.
Минимальная альвеолярная концентрация (МАК) ингаляционных анестетиков
Введение концепции минимальной альвеолярной концентрации (МАK) как универсальной меры силы ингаляционных анестетиков в 1960-е гг. сыграло огромную роль в развитии как прикладной анестезиологии, так и анестезиологической науки. Анестетическая сила ингаляционных агентов была установлена в классических работах Eger и его коллег, давших определение минимальной альвеолярной концентрации ингаляционного анестетика при атмосферном давлении, необходимой для предотвращения двигательной реакции в ответ на болевой стимул у 50% пациентов. Поскольку альвеолярные концентрации ингаляционных анестетиков соответствуют их концентрациям в других органах после наступления равновесия, которое наиболее быстро достигается в органах с богатой перфузией, таких как мозг и сердце, МАK является аналогом плазменной ЕС50 (концентрация, эффективная в 50%) для внутривенных анестетиков. В клиническом применении МАK обычно выражают в объемных процентах, которые могут значительно варьировать с температурой, из-за изменений водорастворимости, тогда как эквивалентные молярные концентрации жидкой фазы не зависят от температуры. Концепция МАK —универсальный клинический стандарт в практике анестезиолога реаниматолога.
МАК севофлурана, изофлурана и десфлурана в зависимости от возраста
| Возраст | МАК севофлурана | МАК десфлурана | МАК изофлурана |
| 25 | 2,6% | 7,3% | 1,28% |
| 40 | 2,1% | 6,0% | 1,15% |
| 60 | 1,7% | 5,2% | 1,05% |
Кроме классического представления МАК, существуют и другие виды, ориентированные на клиническую практику.
- МАК пробуждения (МАСAWAKE) — минимальная альвеолярная концентрация при которой прекращается продуктивный контакт с 50% пациентов. Она характеризует седативный эффект анестетика. Данная величина для севорана равна 0,7%.
- МАКБАР ( MACBAR — anesthetic dose blocking adrenergic stress and cardiovascular responses to incision, МАК блокирования адренэргического ответа) — минимальная альвеолярная концентрация, достаточная для блокады адренергической реакции на любой болевой стимул у 50% пациентов. Эта константа характеризует анальгетический эффект и для севофлурана равна 4,2%.
- МАКИЛМ (MACLMI — laryngeal mask installation, МАК инсталляции ларингеальной маски) — минимальная альвеолярная концентрация, необходимая для мягкой инсталляции ларингеальной маски у 50% пациентов, которая для севофлурана равна 2,0%.
- МАКИТ (MACTI — tracheal intubation, МАК интубации трахеи) — минимальная альвеолярная концентрация, необходимая для интубации трахеи, т.е. концентрация анестетика в конце выдоха, которая у 50% пациентов предотвращает движение на раздувание манжеты эндотрахеальной трубки Данная величина для севофлурана равна 3,6%.
- МАКЗЭТ/ЛМ (MACTT/LMA — tracheal tube/laryngeal mask airway, МАК замены эндотрахеальной трубки на ларингеальную маску) — минимальная альвеолярная концентрация, достаточная для замены эндотрахеальной трубки на ларингеальную маску, которая предотвращает реакцию у 50% пациентов Данная константа для севофлурана равна 2,6%.
- МАКЭ (MACEX extubation, МАК экстубации) — минимальная альвеолярная концентрация, которая предотвращает реакцию у 50% пациентов при экстубации трахеи. Данная величина для севофлурана равна 1,1%.
Влияние на дыхательную систему
Современные ингаляционные анестетики воздействуют на все звенья физиологии дыхания, от различных сил, контролирующих вентиляцию и легочный кровоток, до поверхностного натяжения, секреции слизи, тонуса гладкой мускулатуры дыхательных путей и развития воспалительной реакции. Бронходилатирующее действие ингаляционных анестетиков осуществляется посредством различных сложных механизмов, которые включают в себя как снижение внутриклеточной концентрации кальция, так и снижение чувствительности к кальцию. Ингаляционные анестетики повышают базисный легочный динамический комплайнс, но эти вещества более эффективно снижают возрастающее легочное сопротивление, если оно вызвано химическими или механическими раздражителями. Ингаляционные анестетики преимущественно расширяют дистальные отделы дыхательных путей в большей степени, чем проксимальные. Ингаляционные анестетики уменьшают скорость мукоцилиарного клиренса за счет снижения частоты биения ресничек, нарушения синхронизма их работы или изменения свойств слизи. Легочный сурфактант уменьшает работу дыхания посредством снижения альвеолярного поверхностного натяжения. Ингаляционные анестетики вызывают постепенное, обратимое уменьшение фосфатидилхолина, основного липидного компонента сурфактанта. Действие ингаляционных анестетиков на паренхиму легких и легочный кровоток многогранно, и это осложняет непосредственную оценку изменений в сосудистом сопротивлении легких, возникших в результате применения анестетиков. Ингаляционные анестетики вызывают двухфазный ответ гладкой мускулатуры сосудов легких в виде сокращения и расслабления, регулируемый различными способами через кальций-опосредованные сигнальные пути. В целом конечный эффект изменений легочного сосудистого сопротивления, индуцированных ингаляционными анестетиками, относительно мал. Гипоксическая легочная вазоконстрикция – это важный механизм, посредством которого происходит перераспределение легочного кровотока из плохо вентилируемых областей легких в области с адекватной альвеолярной вентиляцией.
Ингаляционные анестетики дозозависимым образом снижают дыхательный объем и минутную вентиляцию и становятся причиной тахипноэ. Относительная способность ингаляционных анестетиков повышать напряжение диоксида углерода в артериальной крови (как индекс депрессии дыхания) распределяется следующим образом: десфлуран = изофлуран > севофлуран. Ингаляционные анестетики воздействуют на инспираторную и экспираторную мускулатуру в различной степени, что, возможно, является результатом изменения чувствительности бульбоспинальных инспираторных и экспираторных нейронов.
Ингаляционные анестетики дозозависимым образом угнетают дыхательный ответ на гиперкапнию и гипоксию посредством различных центральных и периферических хеморецепторных механизмов. Эффект субанестетической концентрации ингаляционных анестетиков на гиперкапническую реакцию весьма спорен. Подавление гипоксической реакции путем применения субанестетической концентрации летучих анестетиков зависит от используемого вещества и, возможно, от исходного уровня возбуждения ЦНС.
Ингаляционные анестетики могут проявлять провоспалительное влияние и усугублять острое повреждение легких. В то же время, напротив, было продемонстрировано, что ингаляционные анестетики могут уменьшать воспаление и улучшать как химическую, так и физиологическую функцию легких при остром повреждении легких.
Влияние на сердечно-сосудистую систему
Ингаляционные анестетики вызывают дозозависимое снижение сократимости левого и правого желудочка, левого предсердия, диастолической функции левого желудочка. Отрицательные инотропные эффекты ингаляционных анестетиков связаны с нарушением внутриклеточного баланса кальция в кардиомиоцитах. Ингаляционные анестетики по-разному влияют на нормальный и скомпрометированный миокард, в разной степени изменяя показатели постнагрузки левого желудочка. Системные гемодинамические эффекты ингаляционных анестетиков сложны и складываются из миокардиальных эффектов, прямого воздействия на артериальную и венозную сосудистую сеть и нарушений активности вегетативной нервной системы. Ингаляционные анестетики в различной степени повышают чувствительность миокарда к аритмогенным эффектам эпинефрина и, в зависимости от концентрации последнего, степени и локализации повреждения внутри проводящих путей, могут предотвратить либо способствовать развитию предсердных или желудочковых аритмий при ишемии или инфаркте миокарда. Ингаляционные анестетики – относительно слабые коронарные вазодилататоры, и не вызывают феномен «обкрадывания» при использовании в рекомендуемых дозировках даже у пациентов, анатомия коронарных артерий которых предрасполагает к развитию данного синдрома. При использовании до, во время или немедленно после окклюзии коронарной артерии и реперфузии ингаляционные анестетики приводят к развитию важных кардиопротекторных эффектов против обратимой и необратимой ишемии миокарда у экспериментальных животных и людей. Ингаляционные анестетики в различной степени угнетают рефлекторный контроль артериального давления, опосредованный барорецепторами.
Таким образом, ингаляционные анестетики оказывают глубокое воздействие на сердечно-сосудистую систему, изменяя инотропное, хронотропное, дромотропное состояние сердца. Эти анестетики также оказывают значительное действие на преднагрузку и постнагрузку сердечно-сосудистой системы. Данные фармакологические эффекты приводят к нежелательным изменениям гемодинамики, которые могут усиливаться у пациентов с сердечно-сосудистыми заболеваниями. Ингаляционные анестетики обладают кардиопротективными эффектами и непосредственно уменьшают последствия ишемического и реперфузионного повреждения. Работа с ингаляционными анестетиками требует ясного понимания их комплексного фармакологического влияния на сердечно-сосудистую систему.
Влияние на центральную нервную систему
Все современные ингаляционные анестетики снижают мозговой метаболизм. Препараты этой группы вызывают эффект «burst suppression» на ЭЭГ. При этом мозговой метаболизм снижается примерно до 60%. Влияние ингаляционных анестетиков на мозговой кровоток зависит от дозы. При использовании концентрации ниже минимальной альвеолярной концентрации (MAК) мозговой кровоток существенно не меняется. В концентрации выше 1 МАК мозговые сосуды расширяются, что приводит к увеличению мозгового кровотока и внутричерепного объема крови.
Метаболизм и токсичность
Изофлуран и десфлуран метаболизируются до печеночных трифторацилированных белковых соединений, которые вызывают повреждение печени у восприимчивых пациентов. Предрасположенность к возникновению повреждения печени обнаруживается, если провести параллель в метаболизме родственных препаратов, соотвественно, изофлуран (0,2%) > десфлуран (0,02%).
Севофлуран не продуцирует ацилированных белковых соединений. Токсичность и поражение печени были зарегистрированы после повторного использования при последующих эпизодах применения различных фторсодержащих анестетиков. О таком феномене перекрестной сенсибилизации сообщалось также при использовании гидрохлорфторуглеродов, препаратов замещения хлорфторуглеродов. Севофлуран метаболизируется до гексафторизопропанола (HFIP), формальдегида, неорганического фтора и двуокиси углерода. Несмотря на то, что после анестезии севофлураном отмечался высокий уровень фтора, о фтор-ассоциированном повреждении почек не сообщалось. Основным продуктом распада севофлурана под действием оснований является соединение А. Соединение А – это нефротоксичный виниловый эфир, который индуцирует дозо- и времязависимое повреждение почек. Пороговый уровень для повреждения почек и у крыс, и у людей – около 150 ppm/ч. Взаимодействие обезвоженного адсорбента углекислого газа и ингаляционных анестетиков может привести к образованию монооксида углерода СО (угарного газа) в дыхательном контуре (десфлуран >>> изофлуран). Ничтожно малое количество монооксида углерода образуется из севофлурана.
Нет риска, связанного с краткосрочными периодами незначительных профессиональных контактов с отходами ингаляционных анестетиков (операционная, палата пробуждения, отделение интенсивной терапии). С профессиональной экспозицией высоких концентраций (103 ppm) может быть связано увеличение числа выкидышей и снижение фертильности. Фторсодержащий ингаляционный анестетик изофлуран разрушает озоновый слой и вносит свой вклад в развитие парникового эффекта и глобальное потепление.
Препараты современной ингаляционной анестезии
Основными препаратами для проведения современной ингаляционной анестезии являются Севофлуран и Десфлуран, которые имеют несомненные преимущества перед изофлураном. Поэтому, изофлуран может быть использован для проведения общей анестезии, но в отсутствии севофлурана и десфлурана! Характеристика современных ингаляционных анестетиков представлена ниже.
СЕВОФЛУРАН
Севофлуран — современный ингаляционный анестетик третьего поколения. Минимальная альвеолярная концентрация (МАК) севорана 2,01% (подробную характеристику в зависимости от возраста пациента см. выше). Вврдная анестезия сопровождается минимальным возбуждением и раздражением верхних дыхательных путей. Севофлуран вызывает незначительную депрессию миокарда, угнетение дыхания и снижение ОПСС и артериального давления. Севофлуран не вызывает судорог, повышает мозговой кровоток, усиливает действие недеполяризующих мышечных релаксантов.
Применение
У взрослых используется быстрая индукция, предусматривающая подачу анестетика в концентрации 8 об%, без предварительного заполнения дыхательного контура. Поддержание общей анестезии севофлураном: 0,5 — 4,0 об.% при использовании воздушно-кислородной смеси 40:60%. Кроме этого, Севофлуран используется для седации со средней скоростью 5 мл/час при помощи устройства AnaConDa.
Учебные фильмы по анестезиологии
Вводная анестезия севофлураном
Седация севофлураном при гастроскопии
Ингаляционная анестезия севофлураном с сохраненным спонтанным дыханием
ДЕСФЛУРАН
Десфлуран — современный ингаляционный анестетик третьего поколения. Минимальная альвеолярная концентрация (МАК) десфлурана 6,0 об%. (подробную характеристику в зависимости от возраста пациента см. выше). Анестетическая сила десфлурана в 4 раза ниже, чем у других галогенсодержащих анестетиков, но в 17 раз выше, чем у закиси азота.
Высокое давление насыщенного пара требует специального испарителя с термокомпенсацией.
Главное отличие десфлурана от севофлурана и изофлурана — наиболее короткий период пробуждения.
Десфлуран не рекомендуется для вводной анестезии из-за раздражающего действия на дыхательные пути.
ИЗОФЛУРАН
Изофлуран — ингаляционный анестетик второго поколения. По анестетической силе превосходит севофлуран. Изофлуран выраженно угнетает дыхание, может вызывать умеренную тахикардию, артериальную гипотонию (уменьшает общее периферическое сосудистое сопротивление). Изофлуран потенцирует действие недеполяризующих мышечных релаксантов. Гепатотоксичность и нефротоксичность не характерны. МАК изофлурана 1,15%. Характеристика МАК изофлурана в зависимости от возраста пациента см. выше.
Применение
При вводной анестезии используют возрастающие концентрации изофлурана от 0,5 до 3 об.% в кислородно-воздушной смеси. Поддержание анестезии 1 — 2,5 об.%. Изофлуран используется для седации со средней скоростью 3 мл/час при помощи устройства AnaConDa.
Источник
- Лихванцев В.В. Практическое руководство по анестезиологии. М.: ООО «Медицинское информационное агентство», 2011.
- Лихванцев В.В. Опасности и осложнения общей анестезии. М.: ООО «Медицинское информационное агентство», 2014.
- Миллер Р. Анестезия Рональда Миллера. Издательство «Человек», 2015.
- Edmond I Eger II. The pharmacology of inhaled anesthetics, 2010.
Многие подходы в хирургии (схемы операций, оперативная техника, принципы периоперационного ведения больных) сформировались еще в доантибиотиковую эру. Однако становление доказательной медицины привело к тщательной ревизии многих положений. Мощным орудием развенчания мифов, переходивших из одного хирургического руководства в другое, стало Кокрановское сотрудничество — общество, основанное в 1992 г. и поставившее своей целью обобщение итогов рандомизированных контролируемых клинических исследований. В результате его работы было установлено, что многие методы ведения больных в периоперационном периоде неэффективны, например: голодание перед операцией, длительная предоперационная подготовка кишечника, рутинное применение назогастральных зондов и дренирование послеоперационных ран, продолжительный постельный режим. Осмысление этих положений привело к созданию концепции Fast-Track-хирургии, или программы ускоренного восстановления после хирургических вмешательств, эффективность методов которой подтверждена доказательной медициной[21]. Целью программы является раннее восстановление функций организма после хирургических вмешательств для достижения оптимальных результатов лечения на основе мультимодального подхода.
Новая концепция была предложена в 90-х годах XX века датским врачом анестезиологом-реаниматологом профессором Henrik Kehlet, который провел системный анализ патофизиологических механизмов возникновения осложнений после плановых хирургических вмешательств. В итоге была выработана многокомпонентная система мер, направленных на снижение стрессовой реакции организма на хирургическую агрессию. Именно нивелирование последствий стресса с целью воздействия на все этапы периоперационного периода — до операции, во время и после ее проведения — для уменьшения числа осложнений и сокращения сроков пребывания пациентов на больничной койке стало краеугольным камнем этой концепции [15]. Причем на процесс восстановления больного качественное влияние может оказать появление новых методик лечения и новых лекарственных препаратов. Так, введение в практику короткодействующих седатиков (пропофол, мидазолам) и синтетических опиоидов (ремифентанил) позволило сделать анестезию более управляемой, сократить время восстановления после наркоза.
Отечественные концепции общей анестезии традиционно формировались с явным креном в пользу применения внутривенных средств (барбитураты, бензодиазепины, кетамин, пропофол и т. д.). Причинами тому были, с одной стороны, недофинансирование и консерватизм, а с другой — необходимость специального вентиляционного обустройства операционных блоков и наличия наркозно-дыхательных аппаратов с соответствующими типу ингаляционного анестетика испарителями. Ингаляционные анестетики имели малый «вес» в структуре общих анестезий. Из них чаще всего применялась закись азота (N2O), способная потенцировать эффекты внутривенных средств.
В последнее время по ряду причин, в том числе экономических, возрождается интерес к ингаляционной анестезии (ИА), давно получившей в мире наибольшее распространение. Первым препаратом для ИА, зарегистрированным в России после длительного перерыва (т. е. исключая изофлуран, который используется с 80-х годов ХХ века), стал севофлуран (2004). По применению этого анестетика в нашей стране накоплен значительный опыт и опубликовано большое количество работ[2, 3].
В настоящий момент в России появился галогенсодержащий анестетик десфлуран (торговое наименование — Супран, производитель — компания Baxter, США). Препарат является новым для нашего отечества, но за рубежом он используется более 15 лет[19]. Десфлуран обращает на себя внимание самым низким показателем растворимости среди современных ингаляционных анестетиков. В сравнении с препаратами иных физико-химических свойств, а также изофлураном и севофлураном, десфлуран обеспечивает более короткие сроки выхода пациента из анестезии, более быстрое восстановление защитных рефлексов дыхательных путей и сознания. Эти качества могут быть особенно важны в Fast-Track-хирургии.
Фармакологическая промышленность последовательно выпускала все более безопасные и эффективные препараты для ИА: энфлуран, изофлуран (2-е поколение галогенсодержащих анестетиков), севофлуран и, наконец, десфлуран (3-е поколение). К признанным преимуществам современной ИА относят хорошую управляемость и безопасность, быстроту наступления эффекта и прекращения действия анестетика, точность дозировки на основании минимальной альвеолярной концентрации (МАК). Глубина анестезии изменяется поворотом ручки испарителя на наркозном аппарате, а воспроизводимым ориентиром глубины служит МАК.
Обсуждая ингаляционные анестетики в аспекте Fast-Track-оптимизации, нужно упомянуть о двух препаратах, позиционирование которых относительно фармакологического мейнстрима до конца не определено: старом — N2O и новом — ксеноне. Отношение к первому анестетику за последнее десятилетие кардинально изменилось, пройдя путь от обязательного включения в большинство сбалансированных (комбинированных) анестезий до полного отказа от применения в некоторых клиниках. Это связано прежде всего с целым рядом побочных эффектов N2O: нейротоксичностью, отрицательным влиянием на гемопоэз, проэмическим эффектом, накоплением в брюшной и плевральной полостях[3]. Применение ксенона значительно ограничивается ценовым фактором. Энфлуран с его высокой степенью метаболизации замыкает тройку препаратов, не обладающих свойствами, необходимыми для Fast-Track-хирургии.
Таким образом, в последнее десятилетие на соответствие «золотому стандарту» ИА претендовали изофлуран и севофлуран, теперь в этот спор включился и десфлуран. Выбор между претендентами должен быть максимально обоснованным, базирующимся на результатах комплексного анализа фармакологических свойств.
По химическому строению десфлуран — фторсодержащий эфир, относящийся к 3-му поколению галогенсодержащих препаратов. Десфлуран структурно напоминает изофлуран (рис.), однако незначительное отличие (атом хлора заменен фтором) существенно изменяет его физические свойства, определяющие фармакокинетический профиль (табл. 1). Ключевой особенностью оказывается низкая растворимость десфлурана в крови и тканях, обеспечивающая наиболее быструю, в ряду ингаляционных анестетиков, индукцию в анестезию, лабильное течение анестезии и скорый выход из нее. Низкий коэффициент распределения кровь/газ для десфлурана (0,42), почти как у N2O, способствует скорейшей реакции организма пациента на изменение концентрации анестетика в газовой смеси. Это в значительной мере определяет выдающуюся анестетическую управляемость и применимость десфлурана в Fast-Track-хирургии.
Рис. Химическое строение десфлурана и изофлурана
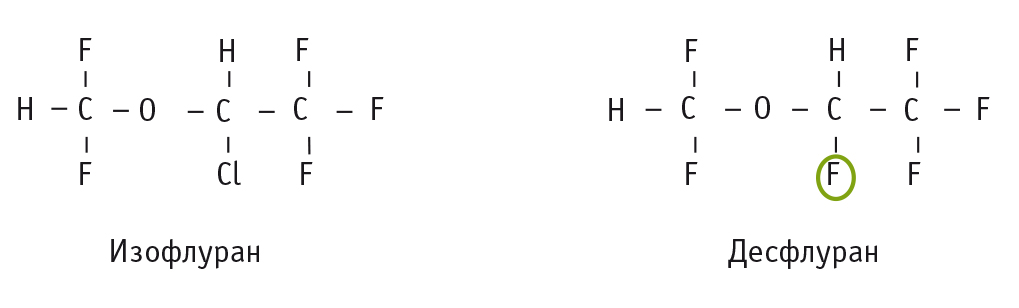
Таблица 1
Некоторые физические и фармакокинетические характеристики ингаляционных анестетиков
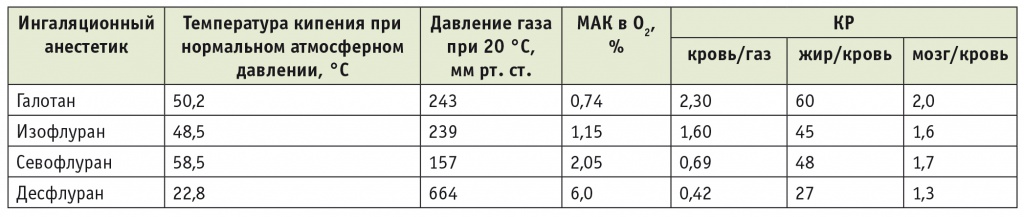
Примечание. КР — коэффициент нормализованного распределения ингаляционных анестетиков; МАК — минимальная альвеолярная концентрация для людей зрелого возраста при 37 °С, Ратм.
= 760 мм рт. ст.
Молекулярные механизмы действия ингаляционных анестетиков пока неизвестны. Динамичность процессов индукции и выхода из анестезии вряд ли связана со степенью ковалентного замещения в заинтересованных структурах ЦНС. В ряду теорий наркоза «липидная» теория Meyer — Overton — лишь одна из нескольких конкурирующих концепций, но именно она служит методологической основой для сравнительной оценки эффективности анестетиков с учетом их липофильности.
В соответствии с теорией Meyer — Overton МАК характеризует силу действия ингаляционного анестетика. Мощность анестетика оказывается пропорциональной его растворимости в жирах в цифровом выражении коэффициента распределения масло/газ. МАК прямолинейно зависит от значения коэффициента распределения масло/газ при 37 °С, что делает этот показатель важным критерием оценки мощности ингаляционного анестетика и глубины анестезии. Приведенные в таблице 1 общепризнанные цифры МАК для десфлурана являются усредненными и могут снижаться при гипотермии, у больных преклонного возраста и в результате медикаментозного потенцирования. Зависимость МАК десфлурана от возраста, а также эффект второго газа представлены в таблице 2.
Таблица 2
Изменение минимальной альвеолярной концентрации десфлурана в зависимости от возраста и при комбинации с N2O, %
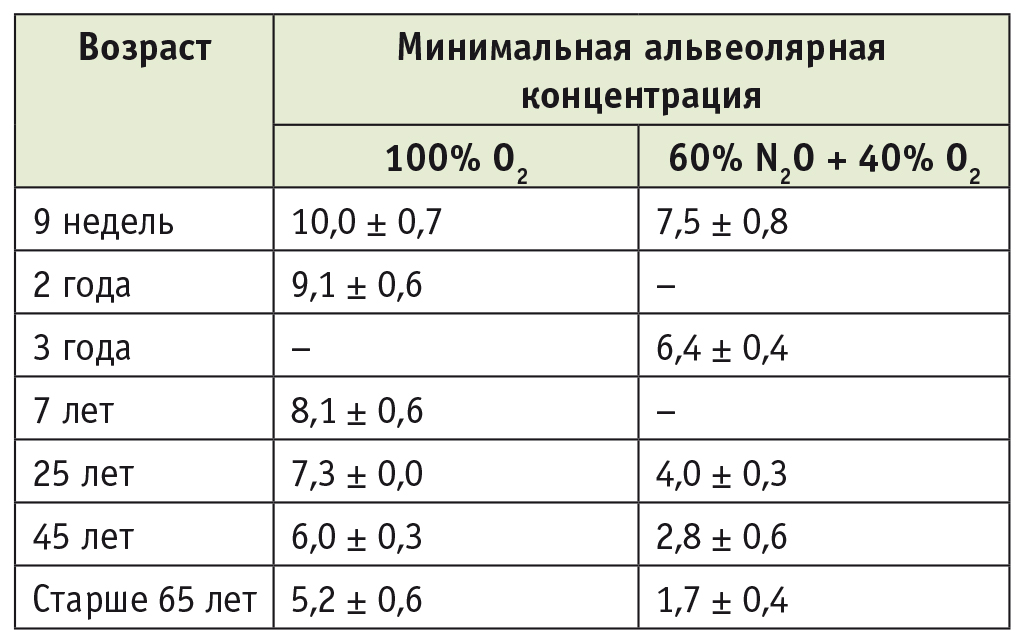
Примечание. Прочерки означают отсутствие данных.
Гипертермия, тиреотоксикоз, гипернатриемия, алкогольная и наркотическая зависимость и ряд других факторов приводят к росту МАК[14]. По этому показателю мощность десфлурана меньше мощности изофлурана и севофлурана. Такая относительно слабая анальгетическая активность десфлурана при его феноменальной управляемости легко корригируется использованием фентанила в минимальных дозах с учетом травматичности и хронологии оперативного вмешательства. Это не накладывает каких-либо ограничений на его назначение, так как применение сбалансированной (комбинированной) анестезии уже полвека считают приоритетным по отношению к моноанестезии в большинстве клинических ситуаций.
Побочные действия ингаляционных анестетиков связаны с их метаболизацией. Уровень печеночной метаболизации десфлурана ничтожно мал: он не превышает 0,02%, препарат в основном выводится из организма через легкие[14, 19]. Соответственно использование десфлурана не сопряжено с появлением признаков повреждения печени после анестезии, что подтверждается сравнительной стабильностью функциональных печеночных проб, и сопровождается наименьшим числом побочных эффектов в обсуждаемом фармакологическом ряду. Минимальное значение метаболизации в ряду галогенсодержащих анестетиков определяет медикаментозный выбор десфлурана в Fast-Track-хирургии.
Как в случаях с изофлураном и севофлураном, распад десфлурана при контакте с натронной известью может приводить к образованию монооксида углерода, т. е. угарного газа, сопровождающемуся повышением содержания карбоксигемоглобина у некоторых пациентов. Продукция монооксида углерода прямо пропорциональна концентрации анестетика, температуре сорбента и степени его сухости, а также зависит от типа извести. Однако это больше проблема не медикаментозная, а организационная — связанная с оборудованием операционного зала и планированием графика использования и профилактики наркозно-дыхательной аппаратуры[6, 8].
Цереброваскулярные эффекты десфлурана, равно как и других ингаляционных анестетиков, формируются из двух разнонаправленных тенденций: в результате прямого дилатирующего воздействия на гладкомышечные элементы сосудистой стенки мозговой кровоток увеличивается, чему противостоит торможение процессов внутримозгового метаболизма, индуцированное тем же препаратом. Во время анестезии 1–2 МАК десфлурана и севофлурана снижается уровень церебральной утилизации глюкозы[4, 16]. Использование десфлурана в количествах 0,5–1,5 МАК при нейрохирургических операциях не влияет на величину внутричерепного давления[9]. Десфлуран и севофлуран сходны по действию на мозговой кровоток и СО2-реактивность церебральных сосудов. Изменения мозгового кровотока и метаболизма при анестезии этими двумя препаратами в большей или меньшей степени ассоциированы и имеют позитивную направленность.
Десфлуран, как и другие галогенсодержащие анестетики, вызывает дозозависимое снижение артериального давления, в основном посредством уменьшения общего периферического сопротивления. При этом терапевтическая широта препарата обеспечивает стабильность сердечного выброса за счет хронотропной компенсаторной реакции в пределах 1–2 МАК. Поэтому увеличение ЧСС при концентрации десфлурана, превышающей 1 МАК, не должно расцениваться как признак неадекватной анестезии[23]. Снижение общего периферического сопротивления при адекватном приросте производительности сердца обеспечивает необходимый уровень доставки кислорода к тканям важнейших органов. Сравнительная оценка результатов применения внутривенных анестетиков и десфлурана у пациентов с ИБС не выявила увеличения риска развития ишемии миокарда при использовании последнего[11]. Однако способность десфлурана вызывать прирост ЧСС требует взвешенного подхода к его применению в качестве единственного препарата для вводного наркоза у больных с нарушениями коронарного кровотока.
В подавляющем большинстве клинических ситуаций практикующие врачи предпочитают проводить индукцию внутривенными препаратами. Ингаляционная индукция чаще обсуждается в литературе и на конференциях, чем применяется на практике. Даже педиатрическая концепция ингаляционной моноанестезии VIMA (Volatile Induction and Maintenance of Anesthesia) допускает возможность использования наркотических анальгетиков. В клинической медицине и Fast-Track-хирургии превалирует мнение, что индукцию анестезии удобнее осуществлять препаратами для внутривенной анестезии, а поддержание — галогенсодержащими анестетиками.
В отличие, например, от севофлурана, десфлуран практически лишен аритмогенного действия, так как он не вызывает повышения чувствительности миокарда к адреналину и не провоцирует вентрикулярных нарушений ритма, и способен предупреждать аритмогенные последствия ишемии[13]. К профилактическим эффектам десфлурана можно отнести также «эффект анестезиологического прекондиционирования», т. е. способность защищать органы и ткани от гипоксии. Важно, что кардиопротективное действие, выраженное у ингаляционных анестетиков, не наблюдается у распространенных внутривенных препаратов, например у пропофола[6]. В метаанализе данных почти 3 тысяч операций аортокоронарного шунтирования показано, что ИА десфлураном и севофлураном ассоциируется со снижением общей летальности в сравнении с результатами тотальной внутривенной анестезии и приводит к снижению уровня тропонина I через 6, 12 и 24 часа после операции[24].
Подобно другим ингаляционным анестетикам, десфлуран может вызывать дозозависимую респираторную депрессию: частота дыхания увеличивается при снижении дыхательного объема и чувствительности к СО2. Заметный запах и раздражение слизистой оболочки во время индукции анестезии могут вызвать усиленное слюноотделение, задержку дыхания, кашель и ларингоспазм, особенно у курильщиков. Однако взаимное потенцирование десфлурана и внутривенных препаратов для индукции нивелирует указанные явления.
К фармакологическим особенностям галогенсодержащих анестетиков относят их супрессирующее влияние на нейромышечную передачу. Так, миорелаксирующее действие десфлурана потенцируется наркотическими анальгетиками и, естественно, миорелаксантами, преимущественно недеполяризующими[14]. Поэтому в период поддержания анестезии галогенсодержащими анестетиками дозы используемых релаксантов следует корригировать в соответствии с параметрами нейромышечного мониторирования.
Десфлуран не рекомендуется для индукции анестезии у новорожденных и детей до 12 лет в связи с риском развития последствий раздражения верхних дыхательных путей. После проведения индукции анестезии другими анестетиками и интубации трахеи десфлуран используют для поддержания анестезии в качестве моноанестетика или в комбинации с другими средствами для наркоза.
Основные характеристики десфлурана и особенности его действия на организм человека позволяют утверждать, что этот новый для России препарат применим в большинстве ситуаций, когда требуется защита организма больного от хирургического стресса, в том числе в рамках концепции Fast Track. Из видимых ограничений можно отметить высококонцентрационную индукцию вообще и моноиндукцию у детей в частности.
Заявленные физико-химические свойства обеспечивают управляемость наркоза десфлураном, более высокую скорость индукции и выхода из наркоза, чем у препаратов сравнения. К основным фармакологическим воздействиям галогенсодержащих анестетиков относят угнетение сознания, сердечно-сосудистой системы, дыхания, рефлекторной и двигательной активности, зависящее от концентрации анестетика. При выходе из наркоза на фоне снижения концентрации десфлурана происходит восстановление временно утраченных функций, в том числе защитных рефлексов дыхательных путей. Скорость элиминации десфлурана превосходит таковую у других галогенсодержащих анестетиков, и восстановление сознания при его использовании происходит быстрее. Однако это не всегда сопровождается одновременным восстановлением защитных рефлексов дыхательных путей[1]. В сравнительном исследовании десфлурана и севофлурана установлено, что защитные рефлексы при использовании десфлурана восстанавливаются быстрее. Были обследованы 64 пациента, рандомизированных по характеру оперативного вмешательства и длительности анестезии, составившей около 60 минут. Поддержание анестезии осуществляли десфлураном или севофлураном со средним значением МАС 0,62, релаксанты не применялись, больные находились на самостоятельном дыхании. Для обеспечения проходимости дыхательных путей использовали ларингеальную маску. У участников группы десфлурана сознание восстановилось через 3,4 ± 1,9 минуты после окончания операции, а еще через 2 минуты все пациенты смогли выпить тестовый объем жидкости (20 мл) без признаков дисфагии и кашля. В группе, где анестезию проводили севофлураном, через 2 минуты после восстановления сознания пробу с водой выполнили лишь 45% пациентов и через 6 минут около 18% испытуемых еще не могли выпить воду ввиду дисфагии[16].
В метаанализе рандомизированных клинических исследований, проведенном F. Dexter и соавт., показано, что после операций с использованием миорелаксантов время от окончания операции до экстубации в группе десфлурана статистически значимо меньше, чем в группе севофлурана, кроме того, при применении десфлурана значимо уменьшалась вариабельность времени до экстубации, обретавшей более регламентированный характер[7]. Эти результаты свидетельствуют о большей управляемости анестезии десфлураном и прогнозируемости восстановления после наркоза, что также облегчает выбор анестетика.
Таким образом, более быстрый выход из наркоза и статистически значимо более раннее восстановление защитных рефлексов дыхательных путей, позволяющие снизить риск послеоперационных осложнений (аспирация, гиповентиляция, обструкция дыхательных путей), являются важными аспектами безопасности десфлурана, определяющими его преимущества перед другими ингаляционными анестетиками, особенно при реализации хирургической Fast-Track-концепции. Десфлуран также имеет хорошие перспективы применения в амбулаторной хирургии, препарат способствует ранней активизации пациентов, что увеличивает пропускную способность операционной.
Меньшая, чем у других анестетиков, растворимость в жировой ткани (см. табл. 1) может обеспечить заметные преимущества десфлурана у больных с избыточным весом. Известно, что анестетики способны накапливаться в жировом депо, продлевая постнаркозную депрессию у тучных пациентов. Многие исследователи подтверждают преимущества десфлурана у больных с ожирением: после анестезии десфлураном при длительных операциях сознание у них восстанавливалось быстрее, чем при использовании севофлурана. После перевода в послеоперационную палату показатели восстановления по шкале Aldrete и степень насыщения крови кислородом были выше в группе десфлурана[22]. Преимущества десфлурана особенно наглядно реализуются при росте длительности анестезии. Показано, что каждый дополнительный час анестезии севофлураном приводит к увеличению времени восстановления защитных рефлексов дыхательных путей на 4,5 минуты, а при анестезии десфлураном — лишь на 16 секунд. Таким образом, анестезия десфлураном может рассматриваться как метод выбора у больных с избыточным весом[18].
Показания к выбору и использованию ингаляционных анестетиков у геронтологических больных, по нашему мнению, должны формироваться с учетом исследований по изучению частоты послеоперационной когнитивной дисфункции и методов ее профилактики. Очевидно, что заявленные фармакологические свойства десфлурана при анестезиологическом обеспечении хирургических операций у пожилых людей позволяют реализовать преимущества десфлурана перед анестетиками сравнения. Десфлуран имеет хорошие перспективы применения у больных пожилого и старческого возраста. Вопрос скорейшего послеоперационного восстановления физического и психического статуса для пожилых людей является приоритетным и напрямую связан с возможным развитием когнитивных нарушений. Относительно быстрая элиминация десфлурана способствует снижению рисков когнитивной дисфункции. В исследовании, проведенном J. E. Heavner и соавт., время восстановления больных пожилого возраста после длительной (более 2 часов) анестезии в группе десфлурана было меньше, чем при использовании севофлурана[10]. Похожие данные получены при анализе анестезий на малых абдоминальных операциях с продолжительностью менее одного часа[12]. D. Rortgen и соавт. изучили частоту возникновения когнитивных нарушений при использовании десфлурана и севофлурана в группе больных старше 65 лет. Изменение стандартных психометрических тестов было более выраженным в группе севофлурана. Эти пациенты в послеоперационном периоде чаще отмечали нарушения памяти и скорости реакции[20].
ЗАКЛЮЧЕНИЕ
Десфлуран является ингаляционным анестетиком уже 3-го поколения галогенсодержащих препаратов. Физико-химической особенностью и главным преимуществом десфлурана является наиболее быстрое, в ряду галогенсодержащих анестетиков, восстановление после анестезии; причем время выхода из наркоза не зависит от длительности анестезии. Кроме того, относительно низкая липотропность позволяет использовать десфлуран у людей с избыточным весом и при этом добиваться предсказуемого окончания анестезии без учета задержки препарата в жировом депо. Постнаркозное восстановление сознания приближено по времени к быстрому появлению защитных рефлексов, что способствует уменьшению количества осложнений и повышает оборот операционного оборудования. У больных пожилого и старческого возраста показания к применению десфлурана формируют не только с учетом соматического статуса, но и с целью профилактики послеоперационной когнитивной дисфункции.
Таким образом, использование десфлурана позволяет проводить наиболее управляемую анестезию. Его свойства свидетельствуют о том, что, возможно, скоро появятся новые стандарты ингаляционной анестезии, проводимой галогенсодержащими анестетиками.