Rec.INN
зарегистрированное ВОЗ
Входит в состав препаратов:
список
Фармакологическое действие
Гипогликемическое средство.
Семаглутид является агонистом рецепторов ГИП-1 (ГИП-1Р), произведенным методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae с последующей очисткой.
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который селективно связывается и активирует ГИП-1Р. ГПП-1Р служит мишенью для нативного ГИП-1.
ГИП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на CCC. Влияние на концентрацию глюкозы и аппетит специфически опосредовано ГИП-1Р, а расположенными в поджелудочной железе и головном мозге. Фармакологические концентрации семаглутида снижают концентрацию глюкозы крови и массу тела посредством сочетания эффектов, описанных ниже. ГИЙ-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек, где их активация может оказывать сердечно-сосудистые и микроциркуляторные эффекты.
В отличие от нативного ГПП-1, продленный T1/2 семаглутида (около 1 недели) позволяет применять его п/к 1 раз в неделю. Связывание с альбумином является основным механизмом длительного действия семаглутида, что приводит к снижению выведения его почками и защищает от метаболического распада. Кроме того, семаглутид стабилен в отношении расщепления ферментом дипептидилпептидазой-4. Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляции секреции инсулина и подавления секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не снижает секрецию глюкагона.
Семаглутид снижает общую массу тела и массу жировой ткани, уменьшая потребление энергии. Данный механизм затрагивает общее снижение аппетита, включая усиление сигналов насыщения и ослабление сигналов голода, а также улучшение контроля потребления пищи и снижение тяги к пище. Снижается также инсулинорезистентность, возможно, за счет уменьшения массы тела. Помимо этого, семаглутид снижает предпочтение к приему пищи с высоким содержанием жиров. В исследованиях на животных было показано, что семаглутид поглощается специфическими областями головного мозга и усиливает ключевые сигналы насыщения и ослабляет ключевые сигналы голода. Воздействуя на изолированные участки тканей головного мозга семаглутид активирует нейроны, связанные с чувством сытости, и подавляет нейроны, связанные с чувством голода.
В клинических исследованиях семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое АД и уменьшал воспаление.
В исследованиях на животных семаглутид подавляет развитие атеросклероза, предупреждая дальнейшее развитие аортальных бляшек и уменьшая воспаление в бляшках.
Фармакокинетика
T1/2 семаглутида равен приблизительно 1 неделе. Tmax в плазме составило от 1 до 3 дней после введения дозы лекарственного средства. AUC достигалась спустя 4-5 недель однократного еженедельного применения. После п/к введения семаглутида в дозах 0.5 мг и 1 мг средние показатели его равновесной концентрации у пациентов с СД2 составили около 16 нмоль/л и 30 нмоль/л, соответственно. Экспозиция для доз семаглутида 0.5 мг и 1 мг увеличивается пропорционально введенной дозе. При п/к введении семаглутида в переднюю брюшную стенку, бедро или плечо достигается сходная экспозиция. Абсолютная биодоступность семаглутида после п/к введения составила 89%. Средний объем распределения семаглутида в тканях после п/к введения пациентам с СД2 составил приблизительно 12.5 л. Семаглутид в значительной степени связывался с альбумином плазмы крови (> 99%). Семаглутид метаболизируется посредством протеолитического расщепления пептидной основы белка и последующего бета-окисления жирной кислоты боковой цепи. ЖКТ и почки являются основными путями выведения семаглутида и его метаболитов. 2/3 введенной дозы семаглутида выводится почками, 1/3- через кишечник. Приблизительно 3% от введенной дозы выводится почками в виде неизмененного семаглутида. У пациентов с СД2 клиренс семаглутида составил около 0.05 л/ч. С элиминационным T1/2 примерно 1 неделя семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 недель после введения последней дозы лекарственного средства.
Показания активного вещества
СЕМАГЛУТИД
Сахарный диабет 2 типа на фоне диеты и физических упражнений для улучшения гликемического контроля в качестве: монотерапии; комбинированной терапии с другими пероральными гипогликемическими препаратами (ПГГП)-метформином, метформином и производным сульфонилмочевины, метформином и/или тиазолидиндионом, у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии; комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии данным лекарственным средством и метформином.
Режим дозирования
П/к в живот, бедро или плечо. Применяют 1 раз в неделю в любое время, независимо от приема пищи. При необходимости день еженедельного введения можно менять при условии, что интервал времени между двумя инъекциями составляет не менее 3-х дней (> 72 часов). Начальная доза составляет 0.25 мг 1 раз в неделю. После 4 недель применения дозу следует увеличить до 0.5 мг 1 раз в неделю.
Побочное действие
Со стороны иммунной системы: редко — анафилактические реакции.
Со стороны обмена веществ и питания: очень часто — гипогликемия при совместном применении с инсулином или производным сульфонилмочевины; часто — гипогликемия при совместном применении с другими ПГГП, снижение аппетита.
Со стороны нервной системы: часто — головокружение, нечасто — дисгевзия.
Со стороны органа зрения: часто — осложнения диабетической ретинопатии.
Со стороны сердечно-сосудистой системы: увеличение ЧСС.
Со стороны ЖКТ: очень часто — тошнота, диарея; часто — рвота, боль в животе, вздутие живота, запор, диспепсия, гастрит, гастроэзофагеальная рефлюксная болезнь, отрыжка, метеоризм.
Со стороны печени и желчевыводящих путей: часто — холелитиаз.
Местные реакции: реакции в месте введения.
Системные реакции: утомляемость.
Лабораторные и инструментальные данные: часто — повышение активности липазы, повышение активности амилазы, снижение массы тела.
Противопоказания к применению
Медуллярный рак щитовидной железы в анамнезе, в т.ч. в семейном; множественная эндокринная неоплазия 2 типа; сахарный диабет 1 типа; диабетический кетоацидоз; беременность и период грудного вскармливания; возраст до 18 лет; печеночная недостаточность тяжелой степени; терминальная стадия почечной недостаточности (КК <15 мл/мин); хроническая сердечная недостаточность IV ФК (в соответствии с классификаций NYHA).
С осторожностью
У пациентов с почечной недостаточностью и у пациентов с наличием панкреатита в анамнезе.
Применение при беременности и кормлении грудью
Применение противопоказано при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Препарат противопоказан для применения при нарушении функции печени
Применение при нарушениях функции почек
Препарат противопоказан для применения при нарушении функции почек
Применение у детей
Применение противопоказано в детском возрасте до 18 лет.
Особые указания
Применение противопоказано у пациентов с СД1 или для лечения диабетического кетоацидоза. Лекарственное средство не заменяет инсулин.
Применение агонистов ГПП-1Р может быть ассоциировано с НР со стороны ЖКТ. Это следует учитывать при лечении пациентов с почечной недостаточностью, так как тошнота, рвота и диарея могут привести к дегидратации и ухудшению функции почек.
При применении агонистов ГИ-1Р наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
Пациенты, получающие лекарственное средство в комбинации с производным сульфонилмочевины или инсулином, могут иметь повышенный риск развития гипогликемии.
Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией, получающих инсулинотерапию. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями. .
В пострегистрационном периоде применения другого аналога ГТИП-1, лираглутида, были отмечены случаи медуллярного рака щитовидной железы (МРЩЖ). Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения МРЩЖ с применением аналогов ГГП-1. Необходимо проинформировать пациента о риске МРЩЖ и о симптомах опухоли щитовидной железы (появления уплотнения в области шеи, дисфагии, одышки, непроходящей охриплости голоса). Значительное повышение концентрации кальцитонина в плазме крови может указывать на МРЖЩ (у пациентов с МРЖЩ значения концентрации кальцитонина в плазме крови обычно >50 нг/л). При выявлении повышения концентрации кальцитонина в плазме крови следует провести дальнейшее обследование пациента. Пациенты с узлами в щитовидной железе, выявленными при медицинском осмотре или при проведении УЗИ щитовидной железы, также должны быть дополнительно обследованы. Применение семаглутида у пациентов с личным или семейным анамнезом МРЩЖ или с синдромом МЭН типа 2 противопоказано.
Влияние на способность к управлению транспортными средствами и механизмами
Лекарственное средство не влияет или незначительно влияет на способность управлять транспортными средствами или работу с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно в комбинации с производным сульфонилмочевины или инсулином.
Лекарственное взаимодействие
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных средств. Семаглутид следует применять с осторожностью у пациентов, получающих пероральные лекарственные средства, для которых необходима быстрая абсорбция в ЖКТ.
Вещества, добавленные к лекарственному средству, могут вызвать деградацию семаглутида. Нельзя смешивать с другими лекарственными средствами, в том числе с инфузионными растворами.
Ребелсас — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-006910
Торговое наименование:
Ребелсас®
Международное непатентованное наименование:
семаглутид
Лекарственная форма:
таблетки
Состав
1 таблетка препарата содержит:
действующее вещество: семаглутид* 3 мг; 7 мг или 14 мг
вспомогательные вещества: натрия салкапрозат, повидон К90, целлюлозу микрокристаллическую, магния стеарат.
*аналог глюкагоноподобного пептида-1 человека (ГПП-1), произведенный методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae.
Описание
Таблетки, 3 мг:
Овальные двояковыпуклые таблетки от белого до светло-желтого цвета с гравировкой «3» на одной стороне и «novo» на другой.
Таблетки, 7 мг:
Овальные двояковыпуклые таблетки от белого до светло-желтого цвета с гравировкой «7» на одной стороне и «novo» на другой.
Таблетки, 14 мг:
Овальные двояковыпуклые таблетки от белого до светло-желтого цвета с гравировкой «14» на одной стороне и «novo» на другой.
Фармакотерапевтическая группа
Гипогликемическое средство – аналог глюкагоноподобного пептида-1 (ГПП-1).
Код ATX:
A10BJ06
Фармакологические свойства
Механизм действия
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист рецептора ГПП-1 (рГПП-1), который селективно связывается с рГПП-1 (мишенью нативного ГПП-1) и активирует его.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на сердечно-сосудистую систему (ССС). Влияние на концентрацию глюкозы и аппетит специфически опосредовано рГПП-1, расположенными в поджелудочной железе и головном мозге. Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляции секреции инсулина и подавления секреции глюкагона при высокой концентрации глюкозы крови. Механизм снижения концентрации глюкозы крови также связан с небольшой задержкой опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не препятствует секреции глюкагона. Механизм действия семаглутида не зависит от способа применения.
Семаглутид снижает массу тела и массу жировой ткани, уменьшая потребление энергии, в том числе в целом снижая аппетит. Кроме того, семаглутид снижает предпочтение к приему пищи с высоким содержанием жиров.
рГПП-1 представлены в специфических областях сердца, сосудов, иммунной системы и почек. В клинических исследованиях (КИ) семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое артериальное давление (АД) и уменьшал воспаление. В исследованиях на животных семаглутид замедлял развитие атеросклероза, предупреждая прогрессирование развития аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамика
Результаты фармакодинамики семаглутида для приема внутрь оценивались после 12 недель применения.
Гликемия натощак и постпрандиальная гликемия
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. У пациентов с сахарным диабетом 2 типа (СД2) терапия семаглутидом привела к снижению концентрации глюкозы натощак на 22% и постпрандиальной концентрации глюкозы на 29% по сравнению с плацебо.
Секреция глюкагона
Семаглутид снижает постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к снижению концентрации глюкагона по сравнению с плацебо, а именно, к снижению постпрандиального глюкагонового ответа на 29%.
Опорожнение желудка
Семаглутид вызывает небольшую задержку раннего постпрандиального опорожнения желудка (экспозиция парацетамола (AUC0-1ч) снижается на 31% в первый час после приема пищи), тем самым снижая скорость поступления постпрандиальной глюкозы в кровь.
Концентрация липидов натощак и после приема пищи
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и холестерина липопротеинов очень низкой плотности (ЛПОНП) натощак на 19% и 20%, соответственно. Постпрандиальное увеличение концентрации триглицеридов и холестерина ЛПОНП в ответ на прием пищи с высоким содержанием жиров снизилось на 24% и 21%, соответственно. Концентрация АпоВ48 снижалась как натощак, так и после приема пищи на 25% и 30%, соответственно.
Клиническая эффективность и безопасность
Эффективность и безопасность препарата Ребелсас® оценивались в восьми глобальных рандомизированных контролируемых клинических исследованиях (КИ) фазы IIIа. Из них семь КИ в качестве основной цели оценивали эффективность гликемического контроля, в то время как одно КИ оценивало в качестве основной цели сердечно-сосудистый (СС) исход.
В КИ были включены 8842 рандомизированных пациента с СД2 (5169 человек получали семаглутид), в том числе 1165 пациентов с умеренным нарушением функции почек. Средний возраст пациентов составил 61 год (от 18 до 92 лет), причем 40% пациентов были в возрасте 65 лет и старше, а 8% – 75 лет и старше. Эффективность семаглутида сравнивали с плацебо или активным контролем (ситаглиптин, эмпаглифлозин и лираглутид).
Возраст, пол, раса, этническая принадлежность, масса тела, индекс массы тела (ИМТ), длительность сахарного диабета (СД), заболевания верхних отделов желудочно-кишечного тракта и почечная недостаточность не повлияли на эффективность семаглутида.
Монотерапия
В 26-недельном двойном слепом исследовании 703 пациента с СД2, недостаточно контролируемым диетой и физическими нагрузками, были рандомизированы в группы терапии препаратом Ребелсас® в дозах 3 мг, 7 мг, 14 мг или плацебо один раз в сутки.
По результатам исследования (анализ данных 703 пациентов) монотерапия препаратом Ребелсас® в дозах 3 мг, 7 мг и 14 мг раз в сутки в течение 26 недель привела к статистически значимому снижению показателей HbA1c на 0,9%, 1,2% и 1,4% по сравнению с 0,3% в группе плацебо (р <0,001 для всех дозировок).
Показатель глюкозы плазмы натощак (ГПН) на фоне монотерапии препаратом Ребелсас® в дозах 3 мг, 7 мг и 14 мг раз в сутки в течение 26 недель снизился на 0,9 ммоль/л, 1,5 ммоль/л и на 1,8 ммоль/л, соответственно, по сравнению с 0,2 ммоль/л в группе плацебо (р=0,003, р<0,001, р<0,001 соответственно дозам).
На терапии препаратом Ребелсас® 14 мг было получено статистически значимое снижение массы тела на 3,7 кг против снижения на 1,4 кг в группе плацебо (р<0,001). Доля пациентов, достигших целевого значения HbA1c <7%, составила 55%, 69%, 77% и 31% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с эмпаглифлозином, оба в комбинации с метформином
В 52-недельном открытом КИ 822 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® 14 мг один раз в сутки или эмпаглифлозином 25 мг один раз в сутки, оба в комбинации с метформином.
На 26 неделе (первичная конечная точка – анализ данных 822 пациентов) терапия препаратом Ребелсас® 14 мг один раз в сутки по сравнению с эмпаглифлозином 25 мг один раз в сутки привела к статистически значимому снижению показателя HbA1c на 1,3% против снижения на 0,9%, соответственно (р <0,0001).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе, составила 67% и 40% для препарата Ребелсас® 14 мг и эмпаглифлозина 25 мг, соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 52 неделе, сохранялась примерно в том же соотношении 66% и 43% для препарата Ребелсас® 14 мг и эмпаглифлозина 25 мг, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с ситаглиптином, оба в комбинации с метформином, или метформином совместно с производными сульфонилмочевины
В 78-недельном двойном слепом исследовании с двойным маскированием 1864 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® в дозе 3 мг, 7 мг, 14 мг или ситаглиптином в дозе 100 мг один раз в сутки (оба в комбинации с метформином или метформином совместно с производными сульфонилмочевины).
На 26 неделе (первичная конечная точка – анализ данных 1397 пациентов) терапия препаратом Ребелсас® 7 мг и 14 мг один раз в сутки привела к статистически значимому снижению показателя HbA1c на 1,0% и на 1,3% по сравнению со снижением на 0,8% на терапии ситаглиптином 100 мг один раз в сутки (р<0,001 для обеих доз, соответственно).
Показатель ГПН на фоне терапии препаратом Ребелсас® в дозах 7 мг и 14 мг раз в сутки в течение 26 недель снизился на 1,2 ммоль/л и на 1,7 ммоль/л, соответственно, по сравнению с 0,9 ммоль/л в группе терапии ситаглиптином 100 мг один раз в сутки (р<0,05, р<0,001 соответственно дозам).
На терапии препаратом Ребелсас® 7 мг и 14 мг в течение 26 недель было получено статистически значимое снижение массы тела на 2,2 кг и на 3,1 кг против снижения на 0,6 кг в группе терапии ситаглиптином 100 мг один раз в сутки (р<0,001 для обеих доз).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе исследования, составила 44%, 56% и 32% для препарата Ребелсас® 7 мг, 14 мг и ситаглиптина 100 мг, соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 78 неделе, сохранялась примерно в том же соотношении 39%, 45% и 29% для препарата Ребелсас® 7 мг, 14 мг и ситаглиптина 100 мг, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с лираглутидом и плацебо, все в комбинации с метформином или метформином с ингибитором натрийзависимого переносчика глюкозы 2 типа (SGLT2)
В 52-недельном двойном слепом исследовании с двойным маскированием 711 пациентов с СД2 были рандомизированы в группы терапии препаратом Ребелсас® 14 мг, лираглутидом 1,8 мг в виде подкожной инъекции или плацебо один раз в сутки (все в комбинации с метформином или метформином с ингибитором SGLT2).
На 26 неделе (первичная конечная точка – анализ данных 711 пациентов) терапия препаратом Ребелсас® 14 мг один раз в сутки привела к статистически значимому снижению показателя НbА1c на 1,2% по сравнению со снижением на 1,1% в группе терапии лираглутидом 1,8 мг в виде подкожной инъекции один раз в сутки (р<0,0001 в отношении не меньшей эффективности) и по сравнению со снижением на 0,2% в группе плацебо (р<0,0001).
Показатель ГПН на фоне терапии препаратом Ребелсас® 14 мг раз в сутки в течение 26 недель снизился на 2,0 ммоль/л по сравнению с 0,4 ммоль/л в группе плацебо (р<0,0001).
На терапии препаратом Ребелсас® 14 мг в течении 26 недель было получено статистически значимое снижение массы тела на 4,4 кг против снижения на 3,1 кг в группе терапии лираглутидом 1,8 мг в виде подкожной инъекции один раз в сутки (р=0,0003) и по сравнению со снижением на 0,5 кг в группе плацебо (р<0,0001).
Доля пациентов, достигших HbA1c <7% на 26 неделе исследования, составила 68%, 62% и 14% для препарата Ребелсас® 14 мг, лираглутида 1,8 мг и плацебо, соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к завершению исследования на 52 неделе, составила 61%, 55% и 15% для препарата Ребелсас® 14 мг, лираглутида 1,8 мг и плацебо, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с плацебо, оба в комбинации с монотерапией базальным инсулином или метформином, или производными сульфонилмочевины, или с комбинацией метформина и базального инсулина или с комбинацией метформина и производных сульфонилмочевины у пациентов с умеренным нарушением функции почек
В 26-недельном двойном слепом исследовании 324 пациента с СД2 и умеренным нарушением функции почек (рСКФ 30-59 мл/мин/1,73 м²) были рандомизированы в группы терапии препаратом Ребелсас® 14 мг или плацебо один раз в сутки. Препарат исследования был добавлен к стабильному режиму гипогликемической терапии.
На 26 неделе (первичная конечная точка – анализ данных 324 пациентов) терапия препаратом Ребелсас® 14 мг один раз в сутки по сравнению с плацебо привела к статистически значимому снижению показателей HbA1c на 1,0% по сравнению с 0,2% в группе плацебо (р<0,0001). Показатель ГПН на фоне терапии препаратом Ребелсас® 14 мг раз в сутки в течение 26 недель снизился на 1,5 ммоль/л по сравнению с 0,4 ммоль/л в группе плацебо (р<0,05).
На терапии препаратом Ребелсас® 14 мг было получено статистически значимое снижение массы тела на 3,4 кг по сравнению со снижением на 0,9 кг в группе плацебо (р<0,0001).
Доля пациентов, достигших HbA1c <7%, составила 58% и 23% для препарата Ребелсас® 14 мг и плацебо, соответственно.
Семаглутид (препарат Ребелсас®) по сравнению с ситаглиптином, оба в комбинации с метформином, ингибиторами SGLT2, производными сульфонилмочевины или тиазолидиндионами. Исследование гибкой коррекции дозы
В 52-недельном открытом исследовании 504 пациента с СД2 были рандомизированы в группы терапии препаратом Ребелсас® (гибкая коррекция дозы 3 мг, 7 мг и 14 мг один раз в сутки) или ситаглиптином в дозе 100 мг один раз в сутки, оба в комбинации с 1-2 пероральными гипогликемическими лекарственными препаратами (метформин, ингибиторы SGLT2, производные сульфонилмочевины или тиазолидиндионы). Дозу препарата Ребелсас® корректировали каждые 8 недель в зависимости от гликемического ответа пациента и его переносимости. Доза ситаглиптина 100 мг была фиксированной.
На 52 неделе (первичная конечная точка – анализ данных 504 пациентов) количество пациентов, получающих терапию семаглутидом в дозах 3 мг, 7 мг и 14 мг, составило примерно 10%, 30% и 60%, соответственно. Доля пациентов, достигших целевого значения HbA1c < 7%, составила 58% и 25% для гибкой дозы препарата Ребелсас® один раз в сутки и ситаглиптина в фиксированной дозе 100 мг, соответственно (р<0,001). Шанс достижения целевого значения HbA1c < 7% для гибкой дозы препарата Ребелсас® один раз в сутки был в 4,4 больше в сравнении с шансом на терапии ситаглиптином в фиксированной дозе 100 мг (р<0,0001).
Терапия гибкой дозой препарата Ребелсас® один раз в день привела к статистически значимому снижению показателя массы тела на 2,6 кг в сравнении со снижением на 0,7 кг в группе терапии ситаглиптином в фиксированной дозе 100 мг (р<0,001).
Семаглутид (препарат Ребелсас®) по сравнению с плацебо в комбинации с инсулином
В 52-недельном двойном слепом исследовании (основной конечный показатель на 26 неделе) 731 пациент с СД2, недостаточно контролируемым на терапии инсулином (базальным, базальным/болюсным или двухфазным) с метформином или без него, был рандомизирован в группы терапии препаратом Ребелсас® в дозах 3 мг, 7 мг, 14 мг или плацебо один раз в сутки.
На 26 неделе (первичная конечная точка – анализ данных 731 пациента) терапия препаратом Ребелсас® 3 мг, 7 мг и 14 мг привела к статистически значимому снижению показателя HbA1c на 0,6%, на 0,9% и на 1,3% по сравнению с 0,1% в группе плацебо (р<0,0001 для всех доз).
Показатель ГПН в группе терапии препаратом Ребелсас® в дозах 7 мг и 14 мг раз в сутки в течение 26 недель снизился на 1,1 ммоль/л и на 1,3 ммоль/л, соответственно, по сравнению с увеличением на 0,3 ммоль/л в группе плацебо (р<0,0001 для обеих доз).
На терапии препаратом Ребелсас® 3 мг, 7 мг, 14 мг в течении 26 недель было получено статистически значимое снижение массы тела на 1,4 кг, на 2,4 кг и на 3,7 кг против снижения на 0,4 кг в группе плацебо (р<0,05, р<0,001, р<0,001 соответственно дозе).
Доля пациентов, достигших целевого значения HbA1c <7% на 26 неделе исследования, составила 28%, 43%, 58% и 7% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо, соответственно. Доля пациентов, достигших целевого значения HbA1c <7% к окончанию исследования на 52 неделе, сохранялась примерно в том же соотношении 29%, 40%, 54% и 9% для препарата Ребелсас® 3 мг, 7 мг, 14 мг и плацебо, соответственно.
Оценка влияния на сердечно-сосудистую систему
3183 пациента с СД2 и высоким сердечно-сосудистым (СС) риском были рандомизированы в двойное слепое КИ в группы терапии препаратом Ребелсас® 14 мг один раз в сутки или плацебо в дополнение к стандартному лечению. С учетом ранее проведенного исследования по влиянию на сердечно-сосудистую систему (ССС) в отношении инъекционной формы семаглутида, протокол исследования был нацелен на подтверждение безопасности терапии препаратом Ребелсас® 14 мг, в связи с чем исследование было ограничено по времени: медиана периода наблюдения составляла 16 месяцев.
Первичная конечная точка представляла собой время от рандомизации до первого большого сердечно-сосудистого события (БССС), такого как смерть по причине СС патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Пациенты, подходящие для включения в исследование, были в возрасте 50 лет или старше и с установленным сердечно-сосудистым заболеванием (ССЗ) и/или хронической болезнью почек, или в возрасте 60 лет или старше только с факторами риска развития ССЗ. В общей сложности 1797 пациентов (56,5%) имели ССЗ без хронической болезни почек, 354 (11,1%) имели только хроническую болезнь почек и 544 (17,1%) имели как ССЗ, так и болезни почек. 488 пациентов (15,3%) имели только факторы риска развития ССЗ. Средний возраст на момент включения в исследование составил 66 лет, 68% пациентов были мужчинами. Средний стаж СД составлял 14,9 лет, средний ИМТ составлял 32,3 кг/м². Инсульт или инфаркт миокарда был в анамнезе у 11,7% и 36,1% пациентов, соответственно.
Общее количество первых БССС было 137: 61 (3,8%) при применении семаглутида и 76 (4,8%) при применении плацебо, тем самым у пациентов в группе терапии препаратом Ребелсас® продемонстрировано численное снижение на 21% частоты БССС в сравнении с пациентами в группе плацебо, отношение рисков 0,79 (0,57, 1,11), что достигало исходной цели исследования – продемонстрировать отсутствие повышения сердечно-сосудистого риска на терапии Ребелсас® (р<0,001).
Результаты анализа в отношении компонентов первичной конечной точки были следующими: смерть по причине СС патологии – 0,9% случаев при применении семаглутида и 1,9% случаев при применении плацебо (снижение частоты событий на 51%); инфаркт миокарда без смертельного исхода – 2,3% случаев при применении семаглутида и 1,9% случаев при применении плацебо (нет различий в пользу семаглутида); инсульт без смертельного исхода – 0,8% случаев при применении семаглутида и 1,0% случаев при применении плацебо (численное уменьшение частоты событий на 26%). Смерть по любым причинам возникла у 1,4% пациентов в группе семаглутида и у 2,8% пациентов в группе плацебо (снижение частоты событий на 49%).
Масса тела
На терапии семаглутидом к окончанию исследования у 27-45% пациентов было достигнуто снижение массы тела на ≥5%, а у 6-16% было достигнуто снижение массы тела на ≥10% при применении семаглутида, по сравнению с 12-39% и 2-8%, соответственно, при применении активных препаратов сравнения.
Артериальное давление
Терапия препаратом Ребелсас® привела к снижению систолического АД на 2-7 мм рт. ст.
Дети и подростки
Безопасность и эффективность применения препарата Ребелсас® у детей и подростков (младше 18 лет) не установлены.
Фармакокинетика
Абсорбция
Семаглутид для перорального применения обладает низкой абсолютной биодоступностью и вариабельным всасыванием. Ежедневное применение препарата в соответствии с рекомендуемым режимом дозирования в комбинации с длительным периодом полувыведения уменьшает суточные колебания экспозиции.
Фармакокинетические свойства семаглутида были всесторонне изучены на здоровых добровольцах и пациентах с СД2. Максимальная концентрация семаглутида в плазме крови после приема внутрь достигалась через 1 час после применения препарата. Равновесная концентрация препарата была достигнута спустя 4-5 недель применения препарата один раз в сутки. У пациентов с СД2 средние равновесные концентрации составляли приблизительно 6,7 нмоль/л и 14,6 нмоль/л при применении семаглутида 7 мг и 14 мг, соответственно; при этом 90% пациентов, получавших терапию семаглутидом в дозе 7 мг, имели среднюю концентрацию между 1,7 и 22,7 нмоль/л, а 90% пациентов, получавших терапию семаглутидом в дозе 14 мг, имели среднюю концентрацию между 3,7 и 41,3 нмоль/л. Системная экспозиция семаглутида увеличивалась пропорционально введённой дозе.
Основываясь на данных, полученных в условиях in vitro, натрия салкапрозат облегчает всасывание семаглутида. Всасывание семаглутида преимущественно происходит в желудке. Расчетная биодоступность семаглутида после приема внутрь составляет приблизительно 1%. Межиндивидуальная вариабельность абсорбции была высокой (коэффициент вариации составлял примерно 100%). Оценка внутрииндивидуальной вариабельности биодоступности не была достоверной.
Абсорбция семаглутида снижается, если препарат принимается вместе с пищей или с большим количеством воды. Более длительный интервал между приемом препарата и приемом пищи приводит к увеличению всасывания.
Распределение
У пациентов с СД2 расчетный абсолютный объем распределения составляет приблизительно 8 л. Семаглутид в значительной степени связывается с белками плазмы крови (>99%).
Метаболизм
Семаглутид метаболизируется посредством протеолитического расщепления пептидной структуры с последующим бета-окислением жирной кислоты боковой цепи. В метаболизме семаглутида, по-видимому, участвует фермент нейтральная эндопептидаза (НЭП).
Выведение
Основными путями выведения производных семаглутида является выведение с мочой и калом. Приблизительно 3% от принятой дозы выводится с мочой в виде неизмененного семаглутида. С периодом полувыведения примерно 1 неделя семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 недель после того, как пациент примет последнюю дозу. У пациентов с СД2 клиренс семаглутида составляет примерно 0,04 л/ч.
Переход между пероральным применением и подкожным (п/к) введением.
Влияние перехода между пероральным применением и п/к введением семаглутида трудно прогнозировать из-за высокой фармакокинетической вариабельности перорального семаглутида. Экспозиция после перорального применения семаглутида 14 мг один раз в сутки сравнима с таковой при применении семаглутида в дозе 0,5 мг для п/к введения один раз в неделю. Пероральная доза, эквивалентная 1,0 мг семаглутида для п/к введения, не была установлена.
Особые группы пациентов
Пациенты пожилого возраста
На основании данных, полученных в ходе КИ, включавших пациентов в возрасте до 92 лет, возраст не оказывал влияния на фармакокинетику.
Пол
Пол не оказывал клинически значимого влияния на фармакокинетику семаглутида.
Расовая и этническая принадлежность
Расовая группа (европеоидная, негроидная или афроамериканская, монголоидная) и этническая принадлежность (испанцы или латиноамериканцы, не испанцы и не латиноамериканцы) не влияли на фармакокинетику семаглутида.
Масса тела
Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Семаглутид обеспечивал надлежащую системную экспозицию в диапазоне массы тела от 40 до 188 кг по данным КИ.
Почечная недостаточность
Почечная недостаточность не оказывала клинически значимого эффекта на фармакокинетику семаглутида. Фармакокинетические свойства семаглутида оценивали у пациентов с легкой, средней или тяжелой почечной недостаточностью и пациентов с терминальной стадией почечной недостаточности, находящихся на диализе, по сравнению с пациентами с нормальной функцией почек, получавших в течение 10 дней подряд семаглутид один раз в сутки. Это также было показано для пациентов с СД2 и нарушением функции почек на основании данных исследований фазы IIIа.
Печёночная недостаточность
Печёночная недостаточность не оказывала клинически значимого эффекта на фармакокинетику семаглутида. Фармакокинетические свойства семаглутида оценивали у пациентов с легкой, средней или тяжелой печёночной недостаточностью по сравнению с пациентами с нормальной функцией печени, получавших в течение 10 дней подряд семаглутид один раз в сутки.
Заболевание верхних отделов ЖКТ
Заболевания верхних отделов желудочно-кишечного тракта (хронический гастрит и/или гастроэзофагеальная рефлюксная болезнь) не оказывали клинически значимого эффекта на фармакокинетику семаглутида. Фармакокинетические свойства оценивали у пациентов с СД2 с заболеваниями верхних отделов желудочно-кишечного тракта или без них, получавших в течение 10 дней подряд семаглутид один раз в сутки. Это также было показано для пациентов с СД2 и заболеванием верхних отделов ЖКТ на основании данных исследований фазы IIIа.
Дети и подростки
Исследований семаглутида у детей и подростков до 18 лет не проводили.
Показания к применению
Препарат Ребелсас® показан для применения у взрослых пациентов с неудовлетворительным контролем СД2 в дополнение к диете и физической нагрузке для улучшения контроля гликемии:
- в качестве монотерапии, когда применение метформина невозможно по причине непереносимости или наличия противопоказаний;
- в комбинированном применении с другими гипогликемическими лекарственными препаратами.
Противопоказания
- Гиперчувствительность к семаглутиду или к любому из вспомогательных веществ препарата;
- сахарный диабет 1 типа (СД1);
- диабетический кетоацидоз;
- медуллярный рак щитовидной железы в анамнезе, в том числе семейном;
- множественная эндокринная неоплазия (МЭН) 2 типа;
Противопоказано применение препарата Ребелсас® у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности и/или из-за ограниченного опыта:
- беременность и период грудного вскармливания;
- возраст до 18 лет;
- печёночная недостаточность тяжёлой степени;
- терминальная стадия почечной недостаточности (клиренс креатинина (КК) < 15 мл/мин);
- хроническая сердечная недостаточность IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация))
С осторожностью
Препарат Ребелсас® рекомендуется применять с осторожностью у пациентов с панкреатитом в анамнезе (см. раздел «Способ применения и дозы»).
Применение при беременности и в период грудного вскармливания
Беременность
Исследования на животных продемонстрировали репродуктивную токсичность препарата. Данные по применению семаглутида у беременных женщин ограничены. В связи с этим применение семаглутида во время беременности противопоказано. Если пациентка готовится к беременности, либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Лечение семаглутидом следует прекратить, как минимум, за 2 месяца до планируемой беременности по причине длительного периода полувыведения (см. раздел «Фармакокинетика»).
Период грудного вскармливания
У лактирующих крыс семаглутид, натрия салкапрозат и/или его метаболиты проникали в молоко. Нельзя исключить риск для ребенка, находящегося на грудном вскармливании.
Противопоказано применять препарат Ребелсас® в период грудного вскармливания.
Способ применения и дозы
Способ применения
Препарат Ребелсас® представляет собой таблетки для приема внутрь один раз в сутки.
Препарат следует принимать натощак в любое время суток.
Таблетку необходимо проглатывать целиком, запивая водой (половина стакана воды, что эквивалентно 120 мл). Таблетки не следует делить, измельчать или разжевывать, так как неизвестно, влияет ли это на всасывание семаглутида.
Пациенты должны подождать не менее 30 минут перед приемом пищи или напитков, или приемом других пероральных лекарственных препаратов. Несоблюдение данного условия приведет к снижению всасывания семаглутида (см. разделы «Взаимодействие с другими лекарственными средствами» и «Фармакокинетические свойства»).
Дозы
Начальная доза препарата Ребелсас® составляет 3 мг один раз в сутки в течение одного месяца. Через 1 месяц применения дозу следует увеличить до 7 мг один раз в сутки. Для дальнейшего улучшения гликемического контроля после, как минимум, 1 месяца применения в дозе 7 мг один раз в сутки, дозу можно увеличить до поддерживающей дозы 14 мг один раз в сутки.
Максимальная рекомендуемая доза препарата Ребелсас® для приема один раз в сутки составляет 14 мг. Прием двух таблеток по 7 мг для достижения эффекта дозировки 14 мг не изучался и поэтому не рекомендуется.
Информация о переходе между семаглутидом для перорального применения и для подкожного (п/к) введения представлена в разделе «Фармакокинетические свойства».
При применении препарата Ребелсас® в комбинации с метформином и/или ингибитором SGLT2 или тиазолидиндионом терапию метформином и/или ингибитором SGLT2 или тиазолидиндионом можно продолжить в прежних дозах.
При применении семаглутида в комбинации с производным сульфонилмочевины или инсулином следует предусмотреть снижение дозы производного сульфонилмочевины или инсулина с целью снижения риска возникновения гипогликемии (см. разделы «Особые указания» и «Побочное действие»).
Для коррекции дозы препарата Ребелсас® не требуется самостоятельный мониторинг концентрации глюкозы в крови. Самостоятельный мониторинг концентрации глюкозы в крови необходим для коррекции дозы сульфонилмочевины и инсулина, особенно в начале лечения семаглутидом и при снижении дозы инсулина. Рекомендуется использовать поэтапный подход к снижению дозы инсулина.
Пропуск дозы
В случае пропуска дозы препарата, пропущенную дозу дополнительно принимать не нужно, следует продолжить прием препарата в обычном режиме на следующий день.
Применение в особых группах пациентов
Пациенты пожилого возраста
Не требуется коррекции дозы в зависимости от возраста. Опыт применения препарата Ребелсас® у пациентов в возрасте 75 лет и старше ограничен (см. раздел «Фармакокинетические свойства»).
Пациенты с почечной недостаточностью
Не требуется коррекция дозы у пациентов с легкой, средней или тяжелой почечной недостаточностью. Опыт применения препарата у пациентов с тяжелой стадией почечной недостаточности ограничен. Препарат противопоказан пациентам с терминальной стадией почечной недостаточности (см. раздел «Фармакокинетические свойства»).
Пациенты с печёночной недостаточностью
Не требуется коррекции дозы у пациентов с печёночной недостаточностью. Опыт применения семаглутида у пациентов с печёночной недостаточностью тяжёлой степени ограничен; применение препарата Ребелсас® у таких пациентов противопоказано (см. раздел «Фармакокинетика»).
Дети и подростки
Применение препарата Ребелсас® у детей и подростков в возрасте до 18 лет противопоказано в связи с отсутствием данных по безопасности и эффективности.
Побочное действие
Краткий отчет по профилю безопасности
В 10 КИ IIIа фазы 5707 пациентов получали семаглутид (препарат Ребелсас®) в качестве монотерапии или в комбинации с другими гипогликемическими препаратами. Продолжительность лечения варьировалась от 26 недель до 78 недель. Наиболее часто регистрируемыми нежелательными реакциями (HP) во время КИ являлись нарушения со стороны ЖКТ, включая тошноту (очень часто), диарею (очень часто) и рвоту (часто).
Список нежелательных реакций в виде таблицы
В Таблице 1 приведены HP, выявленные во всех исследованиях IIIа фазы у пациентов с СД2 (описаны в разделе «Фармакодинамические свойства»). Частота встречаемости данных HP основана на объединенных исследованиях фазы IIIа, за исключением исследования СС исходов.
HP распределены по системно-органным классам в соответствии с MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1 000 до <1/100); редко (от ≥1/10 000 до <1/1 000) и очень редко (<1/10 000). В каждой группе частота развития HP представлена по снижению степени тяжести.
Таблица 1 Нежелательные реакции из контролируемых исследований фазы IIIа
| Система органов MedDRA | Очень часто | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | Анафилактические реакции | |||
| Нарушения со стороны обмена веществ и питания | Гипогликемия при совместном применении с инсулином или производными сульфонилмочевиныa | Гипогликемия при совместном применении с другими ПГГПa Снижение аппетита |
||
| Нарушения со стороны органа зрения | Осложнения диабетической ретинопатииb | |||
| Нарушения со стороны сердца | Увеличение частоты сердечных сокращений (ЧСС) | |||
| Нарушения со стороны желудочно-кишечного тракта | Тошнота Диарея |
Рвота Боль в животе Вздутие живота Запор Диспепсия Гастрит Гастроэзофагеальная рефлюксная болезнь Метеоризм |
Отрыжка | Острый панкреатит |
| Нарушения со стороны печени и желчевыводящих путей | Холелитиаз | |||
| Общие расстройства и нарушения в месте введения | Утомляемость | |||
| Лабораторные и инструментальные данные | Повышение активности липазы Повышение активности амилазы |
Снижение массы тела |
а) Гипогликемия, определяемая как концентрация глюкозы крови <3,0 ммоль/л или <54 г/дл
b) Осложнения диабетической ретинопатии, включающие: необходимость в фотокоагуляции сетчатки глаза, необходимость в интравитреальном введении препаратов, кровоизлияние в стекловидное тело, развитие слепоты (нечасто), связанной с СД. Частота основана на исследовании СС исходов с применением семаглутида для п/к введения, но нельзя исключать, что риск выявленных осложнений диабетической ретинопатии также относится к препарату Ребелсас®.
Описание отдельных HP
Гипогликемия
Тяжелая гипогликемия, в основном, наблюдалась при применении семаглутида в комбинации с производными сульфонилмочевины (<0,1% пациентов, <0,001 явлений/пациенто-год) или с инсулином (1,1% пациентов, 0,013 явлений/пациенто-год). Всего несколько эпизодов (0,1% пациентов, 0,001 явлений/пациенто-год) наблюдались при применении семаглутида в комбинации с ПГГП, за исключением производных сульфонилмочевины.
HP со стороны ЖКТ
Во время терапии препаратом Ребелсас® у пациентов отмечалась тошнота (15%), диарея (10%) и рвота (7%). Большинство реакций были от лёгкой до средней степени тяжести и краткосрочными. HP стали причиной преждевременного выбывания из КИ у 4% пациентов. Чаще всего о HP сообщалось в первые месяцы терапии.
Острый панкреатит, подтвержденный по результатам экспертной оценки, был зарегистрирован в исследованиях IIIа фазы при применении семаглутида (<0,1%) и препарата сравнения (0,2%). В исследовании СС исходов частота развития острого панкреатита, подтвержденная по результатам экспертной оценки, составила 0,1% при применении семаглутида и 0,2% при применении плацебо (см. раздел «Особые указания».)
Осложнения диабетической ретинопатии
В 2-летнем КИ с применением семаглутида для п/к введения были изучены 3297 пациентов с СД2 и высоким СС риском, длительным стажем СД и неадекватным контролем гликемии. В данном КИ подтвержденные случаи диабетической ретинопатии развились у большего количества пациентов, получавших терапию семаглутидом для п/к введения (3,0%), по сравнению с пациентами, получавшими плацебо (1,8%). Развитие событий наблюдалось у пациентов с уже выявленной диабетической ретинопатией, получавших терапию инсулином. Различия между видами терапии появлялись рано и сохранялись на протяжении всего исследования. Систематическая оценка осложнения диабетической ретинопатии была проведена только в исследовании СС исходов с применением семаглутида для п/к введения. В КИ препарата Ребелсас® длительностью до 18 месяцев с участием 6352 пациентов с СД2 частота HP, связанных с диабетической ретинопатией, была сходной в группе препарата Ребелсас® и препаратов сравнения (4,2% и 3,8%, соответственно).
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к препарату Ребелсас®. В конце КИ доля пациентов, у которых были обнаружены антитела к препарату Ребелсас® в любой момент времени, была низкой (0,5%), и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГГ1П-1 эффектом.
Увеличение частоты сердечных сокращений.
На фоне применения агонистов рецепторов ГПП-1 отмечалось увеличение частоты сердечных сокращений (ЧСС). В исследованиях препарата Ребелсас® фазы IIIа наблюдались средние изменения ЧСС от 0 до 4 ударов в минуту (уд/мин) относительно исходного уровня, равного 69-76 уд/мин.
Передозировка
В ходе КИ передозировка препаратом Ребелсас® могла быть связана с нарушениями со стороны ЖКТ. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии в зависимости от клинических проявлений и симптомов у пациента. Учитывая длительный период полувыведения семаглутида (примерно 1 неделя), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки (см. раздел «Фармакокинетические свойства»). Специфического антидота при передозировке препарата Ребелсас® не существует.
Взаимодействие с другими лекарственными средствами
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов.
Влияние семаглутида на другие лекарственные препараты
Левотироксин натрия
Общая экспозиция (AUC) тироксина (с поправкой на эндогенные уровни) повышалась на 33% после применения однократной дозы левотироксина натрия. Максимальная экспозиция (Сmax) не изменялась. Необходимо рассмотреть возможность проведения мониторинга показателей функции щитовидной железы при применении совместной терапии препаратом Ребелсас® с левотироксином натрия.
Варфарин
Препарат Ребелсас® не изменял общую экспозицию AUC или Cmax R- и S-изомеров варфарина после однократной дозы варфарина, и фармакодинамическое действие варфарина согласно измерению с использованием международного нормализованного отношения (МНО) не подвергалось клинически значимому воздействию. Однако после начала терапии семаглутидом у пациентов, принимающих варфарин или другие производные кумарина, рекомендуется проводить частый мониторинг МНО.
Розувастатин
AUC розувастатина увеличивалась на 41% [90% ДИ: 24; 60] при одновременном применении препарата Ребелсас®. В связи с широким терапевтическим окном розувастатина величина изменений экспозиции признана клинически не значимой.
Дигоксин, пероральные контрацептивы, метформин, фуросемид
При одновременном применении с семаглутидом не наблюдалось клинически значимых изменений AUC или Сmax дигоксина, пероральных гормональных контрацептивных средств (содержащих этинилэстрадиол и левоноргестрел), метформина или фуросемида.
Взаимодействие с лекарственными препаратами с очень низкой биодоступностью (F: 1%) не оценивалось.
Влияние других лекарственных препаратов на семаглутид
Омепразол
При приеме с омепразолом не наблюдалось клинически значимого изменения AUC или Сmax семаглутида.
В исследовании фармакокинетики препарата Ребелсас®, применяемого вместе с пятью другими таблетками, AUC семаглутида снизилась на 34%, а Сmax – на 32%. Это говорит о том, что наличие нескольких таблеток в желудке влияет на всасывание семаглутида при одновременном применении. После приема препарата Ребелсас® пациентам следует подождать 30 минут, прежде чем принимать другие пероральные лекарственные препараты (см. раздел «Способ применения и дозы»).
Особые указания
Общие положения
Семаглутид противопоказан пациентам с СД1 или для лечения диабетического кетоацидоза. Диабетический кетоацидоз был зарегистрирован у инсулинозависимых пациентов, у которых отмечалось быстрое прекращение лечения или снижение дозы инсулина при начале лечения агонистом рГПП-1 (см. раздел «Способ применения и дозы»).
Опыт лечения пациентов с хронической сердечной недостаточностью IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация) отсутствует, поэтому семаглутид противопоказан у этих пациентов. Терапевтический опыт применения семаглутида у пациентов, перенесших бариатрическую операцию, отсутствует.
Реакции со стороны ЖКТ
Применение агонистов рГПГ1-1 может быть ассоциировано с HP со стороны ЖКТ, которые могут вызвать обезвоживание, что в редких случаях может привести к ухудшению функции почек (см. раздел «Побочное действие»). Пациентов, получающих терапию препаратом Ребелсас®, необходимо проинформировать о потенциальном риске обезвоживания вследствие нежелательных реакций со стороны желудочно-кишечного тракта и о необходимости принятия мер предосторожности во избежание потери жидкости.
Острый панкреатит
При применении агонистов рГПП-1 наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапию семаглутидом необходимо прекратить. При подтверждении острого панкреатита терапию семаглутидом возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
Гипогликемия
Пациенты на терапии семаглутидом в комбинации с производными сульфонилмочевины или инсулином могут иметь повышенный риск развития гипогликемии (см. раздел «Побочное действие»). В начале лечения семаглутидом риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина (см. раздел «Способ применения и дозы»).
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов, получающих терапию инсулином и семаглутид для п/к применения. Данный риск нельзя исключить при лечении пероральным семаглутидом (см. раздел «Побочное действие»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациям. Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением диабетической ретинопатии, однако при этом нельзя исключать другие причины. Длительный контроль гликемии снижает риск развития диабетической ретинопатии.
Ответ на терапию
Для достижения оптимального эффекта препарата Ребелсас® рекомендуется соблюдение режима дозирования. Если ответ на лечение семаглутидом менее выражен, чем ожидалось, лечащий врач должен быть проинформирован о том, что всасывание семаглутида очень вариабельно и может быть минимальным (у 2-4% пациентов вовсе не будет наблюдаться экспозиции), а также что абсолютная биодоступность семаглутида низка.
Женщины с репродуктивным потенциалом
Женщинам с репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В 2-летних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключён.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Влияние на способность управлять транспортными средствами, механизмами
Семаглутид не влияет или незначительно влияет на способность управлять транспортными средствами или работу с механизмами. При применении семаглутида в комбинации с производными сульфонилмочевины и/или инсулином пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами (см. раздел «Особые указания»).
Форма выпуска
Таблетки 3 мг:
10 таблеток в блистер из формованной алюминиевой фольги зеленого цвета, ламинированной полипропиленом, и покровной алюминиевой фольги, ламинированной полипропиленом.
3 блистера с инструкцией по применению в картонную пачку.
Таблетки 7 мг:
10 таблеток в блистер из формованной алюминиевой фольги красного цвета, ламинированной полипропиленом, и покровной алюминиевой фольги, ламинированной полипропиленом.
3 блистера с инструкцией по применению в картонную пачку.
Таблетки 14 мг:
10 таблеток в блистер из формованной алюминиевой фольги синего цвета, ламинированной полипропиленом, и покровной алюминиевой фольги, ламинированной полипропиленом.
3 блистера с инструкцией по применению в картонную пачку.
Срок годности
30 месяцев. Не применять по истечении срока годности.
Условия хранения
Хранить при температуре не выше 25°С в оригинальной упаковке (блистер) для защиты от влаги и света.
Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту
Держатель регистрационного удостоверения
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Производитель:
Ново Нордиск А/С, Дания;
Юридический адрес: Ново Алле, DK-2880 Багсваерд, Дания
Адрес места производства: Ново Нордиск Парк, DK-2760 Малов, Дания
Организация, принимающая претензии от потребителей:
ООО «Ново Нордиск»
121614, г. Москва, Крылатская улица, д. 15, офис 41
Купить Ребелсас в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Оземпик — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005726
Торговое наименование:
Оземпик®
Международное непатентованное наименование:
семаглутид
Лекарственная форма:
раствор для подкожного введения
Состав
В 1 мл препарата содержится:
действующее вещество: семаглутид 1,34 мг;
вспомогательные вещества: динатрия гидрофосфат дигидрат, пропиленгликоль, фенол, хлористоводородная кислота (для коррекции pH), натрия гидроксид (для коррекции pH), вода для инъекций.
Для шприц-ручки Оземпик® 0,25 мг/доза или 0,5 мг/доза:
В одной предварительно заполненной шприц-ручке объёмом 1,5 мл содержится 2 мг семаглутида.
Для шприц-ручки Оземпик® 1 мг/доза:
В одной предварительно заполненной шприц-ручке объёмом 3 мл содержится 4 мг семаглутида.
Описание
Прозрачный бесцветный или почти бесцветный раствор.
Фармакотерапевтическая группа
Гипогликемическое средство – аналог глюкагоноподобного пептида-1 (ГПП-1).
Код ATX:
A10BJ06.
Фармакологические свойства
Семаглутид является агонистом рецепторов ГПП-1 (ГПП-1Р), произведённым методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae с последующей очисткой.
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который селективно связывается и активирует ГПП-1Р. ГПП-1Р служит мишенью для нативного ГПП-1.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на сердечно-сосудистую систему (ССС). Влияние на концентрацию глюкозы и аппетит специфически опосредовано ГПП-1Р, расположенными в поджелудочной железе и головном мозге. Фармакологические концентрации семаглутида снижают концентрацию глюкозы крови и массу тела посредством сочетания эффектов, описанных ниже. ГПП-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек, где их активация может оказывать сердечно-сосудистые (СС) и микроциркуляторные эффекты.
В отличие от нативного ГПП-1, продлённый период полувыведения семаглутида (около 1 недели) позволяет применять его подкожно (п/к) 1 раз в неделю. Связывание с альбумином является основным механизмом длительного действия семаглутида, что приводит к снижению выведения его почками и защищает от метаболического распада. Кроме того, семаглутид стабилен в отношении расщепления ферментом дипептидилпептидазой-4.
Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляции секреции инсулина и подавления секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не снижает секрецию глюкагона.
Семаглутид снижает общую массу тела и массу жировой ткани, уменьшая потребление энергии. Данный механизм затрагивает общее снижение аппетита, включая усиление сигналов насыщения и ослабление сигналов голода, а также улучшение контроля потребления пищи и снижение тяги к пище. Снижается также инсулинорезистентность, возможно, за счёт уменьшения массы тела. Помимо этого, семаглутид снижает предпочтение к приёму пищи с высоким содержанием жиров. В исследованиях на животных было показано, что семаглутид поглощается специфическими областями головного мозга и усиливает ключевые сигналы насыщения и ослабляет ключевые сигналы голода. Воздействуя на изолированные участки тканей головного мозга семаглутид активирует нейроны, связанные с чувством сытости, и подавляет нейроны, связанные с чувством голода.
В клинических исследованиях (КИ) семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое артериальное давление (АД) и уменьшал воспаление.
В исследованиях на животных семаглутид подавляет развитие атеросклероза, предупреждая дальнейшее развитие аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамика
Все фармакодинамические исследования были проведены после 12 недель терапии (включая период увеличения дозы) в равновесной концентрации семаглутида 1 мг 1 раз в неделю.
Уровень гликемии натощак и постпрандиальный уровень гликемии
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. По сравнению с плацебо терапия семаглутидом 1 мг у пациентов с сахарным диабетом 2 типа (СД2) привела к снижению концентрации глюкозы с точки зрения абсолютного изменения от исходного значения (ммоль/л) и относительного снижения по сравнению с плацебо (%) в отношении: концентрации глюкозы натощак (1,6 ммоль/л; 22%); концентрации глюкозы через 2 часа после приёма пищи (4,1 ммоль/л; 37%); средней суточной концентрации глюкозы (1,7 ммоль/л; 22%) и постпрандиальных пиков концентрации глюкозы за 3 приёма пищи (0,6-1,1 ммоль/л). Семаглутид снижал концентрацию глюкозы натощак после введения первой дозы.
Функция бета-клеток поджелудочной железы и секреция инсулина
Семаглутид улучшает функцию бета-клеток поджелудочной железы. После внутривенного струйного введения глюкозы пациентам с СД2 семаглутид по сравнению с плацебо улучшал первую и вторую фазу инсулинового ответа с трёхкратным и двукратным повышением, соответственно, и увеличивал максимальную секреторную активность бета-клеток поджелудочной железы после теста стимуляции аргинином. Кроме того, по сравнению с плацебо терапия семаглутидом увеличивает концентрации инсулина натощак.
Секреция глюкагона
Семаглутид снижает концентрацию глюкагона натощак и постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к относительному снижению концентрации глюкагона по сравнению с плацебо: концентрации глюкагона натощак (8-21%), постпрандиальной) глюкагонового ответа (14-15%) и средней суточной концентрации глюкагона (12%).
Глюкозозависимая секреция инсулина и глюкозозависимая секреция глюкагона
Семаглутид снижал высокую концентрацию глюкозы в крови, стимулируя секрецию инсулина и снижая секрецию глюкагона глюкозозависимым способом. Скорость секреции инсулина после введения семаглутида пациентам с СД2 была сопоставима с таковой у здоровых добровольцев.
Во время индуцированной гипогликемии семаглутид по сравнению с плацебо не изменял контррегуляторный ответ повышения концентрации глюкагона, а также не усугублял снижение концентрации С-пептида у пациентов с СД2.
Опорожнение желудка
Семаглутид вызывал небольшую задержку раннего постпрандиальной) опорожнения желудка, тем самым снижая скорость поступления постпрандиальной глюкозы в кровь.
Масса тела и состав тела
Наблюдалось большее снижение массы тела при применении семаглутида по сравнению с изученными препаратами сравнения (плацебо, ситаглиптином, эксенатидом замедленного высвобождения (ЗВ), дулаглутидом и инсулином гларгин) (см. раздел «Клиническая эффективность и безопасность»). Потеря массы тела при применении семаглутида происходила преимущественно за счёт потери жировой ткани, превышающей потерю мышечной массы в 3 раза.
Аппетит, потребление калорий и выбор продуктов питания
По сравнению с плацебо семаглутид снизил потребление калорий на 18-35 % во время трёх последовательных приёмов пищи ad libitum. Этому способствовали стимулированные семаглутидом подавление аппетита как натощак, так и после приёма пищи, улучшенный контроль потребления пищи, ослабление тяги к еде, особенно с высоким содержанием жиров.
Липиды натощак и постпрандиальные липиды
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и холестерина липопротеинов очень низкой плотности (ЛПОНП) натощак на 12% и 21%, соответственно. Постпрандиальное увеличение концентрации триглицеридов и холестерина ЛПОНП в ответ на приём пищи с высоким содержанием жиров снизилось более чем на 40%.
Электрофизиология сердца (ЭФс)
Действие семаглутида на процесс реполяризации в сердце было протестировано в исследовании ЭФс. Применение семаглутида в дозах, превышающих терапевтические (в равновесной концентрации до 1,5 мг), не приводило к удлинению скорректированного интервала QT.
Клиническая эффективность и безопасность
Как улучшение гликемического контроля, так и снижение СС заболеваемости и смертности являются неотъемлемой частью лечения СД2.
Эффективность и безопасность препарата Оземпик® в дозах 0,5 мг и 1 мг оценивались в шести рандомизированных контролируемых КИ 3а фазы. Из них пять КИ в качестве основной цели оценивали эффективность гликемического контроля, в то время как одно КИ оценивало в качество основной цели СС исход. В дополнение были проведены два КИ препарата Оземпик® 3 фазы с участием японских пациентов.
Терапия препаратом Оземпик® продемонстрировала устойчивые, статистически превосходящие и клинически значимые улучшение показателя HbA1с и снижение массы тела на срок до 2 лет по сравнению с плацебо и лечением с активным контролем (ситаглиптином, инсулином гларгин, эксенатидом ЗВ и дулаглутидом).
Возраст, пол, раса, этническая принадлежность, исходные значения индекса массы тела (ИМТ) и массы тела (кг), длительность сахарного диабета (СД) и почечная недостаточность не повлияли на эффективность препарата Оземпик®.
Монотерапия
Монотерапия препаратом Оземпик® в дозах 0,5 мг и 1 мг 1 раз в неделю в течение 30 недель по сравнению с плацебо привела к статистически более значимому снижению показателей HbA1с (-1,5%, -1,6% против 0%, соответственно), глюкозы плазмы натощак (ГПН) (-2,5 ммоль/л, -2,3 ммоль/л против -0,6 ммоль/л, соответственно) и массы тела (-3,7 кг, -4,5 кг против -1,0 кг, соответственно).
Препарат Оземпик® по сравнению с ситаглиптином, оба в комбинации с 1-2 пероральными гипогликемическими препаратами (ПГГП) (метформином и/или препаратами группы тиазолидиндиона)
Терапия препаратом Оземпик® 0,5 мг и 1 мг 1 раз в неделю в течение 56 недель по сравнению с ситаглиптином привела к устойчивому и статистически более значимому снижению показателей HbA1с (-1,3%, -1,6% против -0,5%, соответственно), ГПН (-2,1 ммоль/л, -2,6 ммоль/л против -1,1 ммоль/л, соответственно) и массы тела (-4,3 кг, -6,1 кг против -1,9 кг, соответственно). Терапия препаратом Оземпик® 0,5 мг и 1 мг по сравнению с ситаглиптином значительно снижала систолическое АД от исходного значения в 132,6 мм рт.ст. (-5,1 мм рт.ст., -5,6 мм рт.ст, против -2,3 мм рт.ст., соответственно). Изменений диастолического АД не происходило.
Препарат Оземпик® по сравнению с дулаглутидом, оба в комбинации с метформином
Терапия препаратом Оземпик® 0,5 мг по сравнению с дулаглутидом 0,75 мг, оба 1 раз в неделю на протяжении 40 недель, привела к устойчивому и статистически превосходящему снижению показателей HbA1с (-1,5% против -1,1%), ГПН (-2,2 ммоль/л против -1,9 ммоль/л) и массы тела (-4,6 кг против -2,3 кг), соответственно.
Терапия препаратом Оземпик® 1 мг по сравнению с дулаглутидом 1,5 мг оба 1 раз в неделю на протяжении 40 недель, привела к устойчивому и статистически превосходящему снижению показателей HbA1с (-l,8% против -1,4%), ГПН (-2,8 ммоль/л против -2,2 ммоль/л) и массы тела (-6,5 кг против -3,0 кг), соответственно.
Препарат Оземпик® по сравнению с эксенатидом ЗВ, оба в комбинации с метформином или метформином совместно с производным сульфонилмочевины
Терапия препаратом Оземпик® 1 мг 1 раз; в неделю на протяжении 56 недель по сравнению с эксенатидом ТВ 2,0 мг привела к устойчивому и статистически более значимому снижению показателей HbA1с (-U5% против -0,9%), ГПН (-2,8 ммоль/л против -2,0 ммоль/л) и массы тела (-5,6 кг против -1,9 кг), соответственно.
Препарат Оземпик® по сравнению с инсулином гларгин, оба в комбинации с 1-2 ПГГП (монотерапия метформином или метформин с производным сульфонилмочевины)
Терапия препаратом Оземпик® в дозах 0,5 мг и 1 мг 1 раз в неделю по сравнению с инсулином гларгин в течение 30 недель привела к статистически более значимому снижению показателей HbA1с (-1,2%, -1,6% против -0,8%, соответственно) и массы тела (-3,5 кг, -5,2 кг против +1,2 кг, соответственно).
Снижение показателя ГПН было статистически более значимым для препарата Оземпик® 1 мг по сравнению с инсулином гларгин (-2,7 ммоль/л против -2,1 ммоль/л). Не наблюдалось статистически более значимое снижение показателя ГПН для препарата Оземпик® 0,5 мг (-2,0 ммоль/л против -2,1 ммоль/л).
Доля пациентов, у которых наблюдались тяжёлые или подтверждённые (<3,1 ммоль/л) эпизоды гипогликемии, была ниже при применении препарата Оземпик® 0,5 мг (4,4%) и Оземпик® 1 мг (5,6%) по сравнению с инсулином гларгин (10,6%).
Больше пациентов достигли показателя HbA1с <7% без тяжёлых или подтверждённых эпизодов гипогликемии и без набора веса при применении препарата Оземпик® 0,5 мг (47%) и Оземпик® 1 мг (64%) по сравнению с инсулином гларгин (16%).
Препарат Оземпик® по сравнению с плацебо, оба в комбинации с базальным инсулином
Терапия препаратом Оземпик® в дозах 0,5 мг и 1 мг по сравнению с плацебо в течение 30 недель привела к статистически более значимому снижению показателей HbA1с (-1,4%, -1,8% против -0,1%, соответственно), ГПН (-1,6 ммоль/л, -2,4 ммоль/л против -0,5 ммоль/л, соответственно) и массы тела (-3,7 кг, -6,4 кг против -1,4 кг, соответственно). Частота тяжёлых или подтверждённых эпизодов гипогликемии существенно не различалась при применении препарата Оземпик® и плацебо. Доля пациентов с показателем HbA1с ≤8% на скрининге, сообщивших о тяжёлых или подтверждённых (<3,1 ммоль/л) эпизодах гипогликемии, была выше при применении препарата Оземпик® по сравнению с плацебо и сопоставима у пациентов с показателем HbA1с >8% на скрининге.
Комбинация с монотерапией производным сульфонилмочевины
На 30-й неделе КИ (см. подраздел «Оценка влияния на ССС») была произведена оценка подгруппы из 123 пациентов, находящихся на монотерапии производным сульфонилмочевины. На 30-й неделе показатель HbA1с снизился на 1,6% и на 1,5% при применении препарата Оземпик® в дозах 0,5 мг и 1 мг, соответственно, и увеличился на 0,1% при применении плацебо.
Комбинация с предварительно смешанным инсулином ± 1-2 ПГГП
На 30-й неделе КИ (см. подраздел «Оценка влияния на ССС») была произведена оценка подгруппы из 867 пациентов, находящихся на терапии предварительно смешанным инсулином (в комбинации или без 2-х ПГГП). На 30-й неделе показатель HbA1с снизился на 1,3% и на 1,8% при применении препарата Оземпик® в дозах 0,5 мг и 1 мг, соответственно, и снизился на 0,4% при применении плацебо.
Соотношение пациентов, достигших целевого снижения показателя HbA1с
До 79% пациентов достигли целей лечения в отношении снижения показателя HbA1с <7%, и доля таких пациентов была значительно больше при применении препарата Оземпик® по сравнению с пациентами, получавшими ситаглиптин, эксенатид ЗВ, инсулин гларгин, дулаглутид и плацебо.
Доля пациентов, достигших показателя HbA1с менее 7% без тяжёлых или подтверждённых эпизодов гипогликемии и без набора веса, была значительно больше при применении препарата Оземпик® в дозах 0,5 мг и 1 мг (до 66% и 74%, соответственно) по сравнению с пациентами, получавшими ситаглиптин (27%), эксенатид ЗВ (29%), инсулин гларгин (16%), дулаглутид 0,75 мг (44%) и дулаглутид 1,5 мг (58%).
Масса тела
Монотерапия препаратом Оземпик® 1 мг или терапия в комбинации с 1-2 лекарственными препаратами приводила к статистически большему снижению массы тела (потеря составляла до 6,5 кг) по сравнению с терапией плацебо, ситаглиптином, эксенатидом ЗВ, инсулином гларгин или дулаглутидом. Снижение массы тела было устойчивым на срок до 2-х лет.
После одного года терапии потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0,5 мг (46% и 13%) и 1 мг (до 62% и 24%), по сравнению с пациентами, находившимися на терапии активными препаратами сравнения ситаглиптином и эксенатидом ЗВ (до 18% и до 4%).
В КИ длительностью 40 недель потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0,5 мг (44% и 14%), по сравнению с пациентами, получавшими дулаглутид 0,75 мг (23% и 3%). Потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 1 мг (до 63% и 27%), по сравнению с пациентами, получавшими дулаглутид 1,5 мг (30% и 8%).
В СС КИ потери массы тела ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0,5 мг (36% и 13%) и 1 мг (47% и 20%), по сравнению с пациентами, получавшими плацебо 0,5 мг (18% и 6%) и 1 мг (19% и 7%).
ГПН и постпрандиальное увеличение концентрации глюкозы
Во время всех трёх ежедневных приёмов пищи препарат Оземпик® 0,5 мг и 1 мг показал значительное снижение концентрации ГПН до 2,8 ммоль/л и снижение постпрандиального прироста концентрации глюкозы до 1,2 ммоль/л (разница между значениями до и после еды, полученная после трёх приёмов пищи) (в дополнение см. раздел «Фармакодинамика»).
Функция бета-клеток поджелудочной железы и инсулинорезистентность
В ходе терапии препаратом Оземпик® 0,5 мг и 1 мг произошло улучшение функции бета-клеток поджелудочной железы и уменьшение инсулинорезистентности, что подтверждается оценкой гомеостатических моделей функции бета-клеток поджелудочной железы (НОМА-IR) и инсулинорезистентности (HOMA-IR) (в дополнение см. раздел «Фармакодинамика»).
Липиды
Во время КИ препарата Оземпик® наблюдалось улучшение профиля липидов крови натощак, преимущественно в группе, получавшей дозу 1 мг (в дополнение см. раздел «Фармакодинамика»).
Оценка влияния на ССС
3297 пациентов с СД2 и высоким СС риском были рандомизированы в двойное слепое КИ длительностью 104 недели на получение препарата Оземпик® 0,5 мг или 1 мг 1 раз в неделю либо плацебо 0,5 мг или 1 мг в дополнение к стандартной терапии СС заболеваний в течение последующих двух лет.
Терапия препаратом Оземпик® привела к снижению на 26% риска первичного комбинированного исхода, включающего смерть по причине СС патологии, инфаркт миокарда (ИМ) без смертельного исхода и инсульт без смертельного исхода. В первую очередь это было обусловлено значительным уменьшением частоты инсульта без смертельного исхода (39%) и незначительным уменьшением частоты ИМ без смертельного исхода (26%), но без изменений в частоте смерти по причине СС патологии.
Значительно снизился риск реваскуляризации миокарда или периферических артерий, в то время как риск нестабильной стенокардии, требующей госпитализации, и риск госпитализации по причине сердечной недостаточности снизились незначительно.
Микроциркуляторные исходы включали в себя 158 новых или ухудшившихся случаев нефропатии. Относительный риск в отношении времени до возникновения нефропатии (новые случаи развития персистирующей макроальбуминурии, персистирующее удвоение сывороточной концентрации креатинина, необходимость в постоянной заместительной почечной терапии и смерть по причине болезни почек) составил 0,64.
В дополнение к стандартной терапии СС заболеваний терапия препаратом Оземпик® в дозах 0,5 мг и 1 мг по сравнению с плацебо 0,5 мг и 1 мг в течение 104 недель привела к значительному и устойчивому снижению от исходных значений показателя HbA1с (-1,1% и -1,4% против -0,4% и -0,4%, соответственно).
Артериальное давление
Наблюдалось значительное снижение среднего систолического АД при применении препарата Оземпик® 0,5 мг (3,5-5,1 мм рт.ст.) и Оземпик® 1 мг (5,4-7,3 мм рт.ст.) в комбинации с ПГГП или базальным инсулином. Не отмечалось значительной разницы по показателям диастолического АД между препаратом Оземпик® и препаратами сравнения.
Фармакокинетика
Препарат подходит для введения 1 раз в неделю, так как период полувыведения семаглутида равен приблизительно 1 неделе.
Абсорбция
Время достижения максимальной концентрации (Сmax) в плазме составило от 1 до 3 дней после введения дозы препарата.
Равновесная концентрация препарата (AUCτ/24) достигалась спустя 4-5 недель однократного еженедельного применения препарата. После п/к введения семаглутида в дозах 0,5 мг и 1 мг средние показатели его равновесной концентрации у пациентов с СД2 составили около 16 нмоль/л и 30 нмоль/л, соответственно.
Экспозиция для доз семаглутида 0,5 мг и 1 мг увеличивается пропорционально введённой дозе.
При п/к введении семаглутида в переднюю брюшную стенку, бедро или плечо достигается сходная экспозиция.
Абсолютная биодоступность семаглутида после п/к введения составила 89%.
Распределение
Средний объём распределения семаглутида в тканях после п/к введения пациентам с СД2 составил приблизительно 12,5 л. Семаглутид в значительной степени связывался с альбумином плазмы крови (>99%).
Метаболизм
Семаглутид метаболизируется посредством протеолитического расщепления пептидной основы белка и последующего бета-окисления жирной кислоты боковой цепи.
Выведение
Желудочно-кишечный тракт (ЖКТ) и почки являются основными путями выведения семаглутида и его метаболитов, 2/3 введённой дозы семаглутида выводится почками, 1/3 – через кишечник.
Приблизительно 3% от введённой дозы выводится почками в виде неизменённого семаглутида.
У пациентов с СД2 клиренс семаглутида составил около 0,05 л/ч. С элиминационным периодом полувыведения примерно 1 неделя семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 недель после введения последней дозы препарата.
Особые группы пациентов
Не требуется коррекции дозы семаглутида в зависимости от возраста, пола, расовой и этнической принадлежности, массы тела, наличия почечной или печёночной недостаточности.
Возраст
На основании данных, полученных в ходе КИ 3а фазы, включавших пациентов в возрасте от 20 до 86 лет, показано, что возраст не влиял на фармакокинетику семаглутида.
Пол
Пол не влиял на фармакокинетику семаглутида.
Раса
Расовая группа (белая, чёрная или афроамериканская, азиатская) не влияла на фармакокинетику семаглутида.
Этническая принадлежность
Этническая принадлежность (латиноамериканская) не влияла на фармакокинетику семаглутида.
Масса тела
Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Дозы семаглутида равные 0,5 мг и 1 мг обеспечивают достаточную экспозицию препарата в диапазоне массы тела от 40 до 198 кг.
Почечная недостаточность
Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику семаглутида. Это было показано у пациентов с различной степенью почечной недостаточности (лёгкой, средней, тяжёлой или у пациентов, находящихся на диализе) по сравнению с пациентами с нормальной функцией почек в исследовании однократной дозы семаглутида равной 0,5 мг. Это также было показано на основании данных КИ 3а фазы для пациентов с СД2 и почечной недостаточностью, хотя опыт применения у пациентов с терминальной стадией заболевания почек был ограничен.
Печёночная недостаточность
Печёночная недостаточность не влияла на экспозицию семаглутида. Фармакокинетические свойства семаглутида оценивались в ходе исследования однократной дозы семаглутида равной 0,5 мг у пациентов с различной степенью печёночной недостаточности (лёгкой, средней, тяжёлой) по сравнению с пациентами с нормальной функцией печени.
Дети и подростки
Исследований семаглутида у детей и подростков до 18 лет не проводили.
Показания к применению
Препарат Оземпик® показан для применения у взрослых пациентов с сахарным диабетом 2 типа на фоне диеты и физических упражнений для улучшения гликемического контроля в качестве:
• монотерапии;
• комбинированной терапии с другими пероральными гипогликемическими препаратами (ПГГП) – метформином, метформином и производным сульфонилмочевины, метформином и/или тиазолидиндионом, у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии;
• комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом Оземпик® и метформином.
Препарат Оземпик® показан для снижения риска развития больших сердечно-сосудистых событий* у пациентов с сахарным диабетом 2 типа и высоким сердечно-сосудистым риском в качестве дополнения к стандартному лечению сердечно-сосудистых заболеваний (на основании анализа времени наступления первого большого сердечно-сосудистого события – см. раздел «Фармакологические свойства», подраздел «Оценка влияния на ССС»).
* большие сердечно-сосудистые события включают: смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Противопоказания
- Гиперчувствительность к семаглутиду или любому из вспомогательных веществ препарата;
- медуллярный рак щитовидной железы в анамнезе, в том числе в семейном;
- множественная эндокринная неоплазия (МЭН) 2 типа;
- сахарный диабет 1 типа (СД 1); диабетический кетоацидоз.
Противопоказано применение препарата Оземпик® у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности иди ограниченным опытом применения:
- беременность и период грудного вскармливания:
- возраст до 18 лет;
- печёночная недостаточность тяжёлой степени;
- терминальная стадия почечной недостаточности (клиренс креатинина (КК) <15 мл/мин);
- хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация)).
С осторожностью
Препарат Оземпик® рекомендуется применять с осторожностью у пациентов с почечной недостаточностью и у пациентов с наличием панкреатита в анамнезе (см. раздел «Особые указания»).
Применение при беременности и в период грудного вскармливания
Беременность
Исследования на животных продемонстрировали репродуктивную токсичность препарата (см. раздел «Доклинические данные по безопасности»).
Данные по применению семаглутида у беременных женщин ограничены. Противопоказано применять семаглутид во время беременности. Женщинам с сохранённым репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом. Если пациентка готовится к беременности, либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Из-за длительного периода полувыведения терапию семаглутидом необходимо прекратить как минимум за 2 месяца до планируемого наступления беременности (см. раздел «Фармакокинетика»).
Период грудного вскармливания
У лактирующих крыс семаглутид проникал в молоко. Нельзя исключить риск для ребёнка, находящегося на грудном вскармливании. Противопоказано применять семаглутид в период грудного вскармливания.
Способ применения и дозы
Способ применения
Препарат Оземпик® применяют 1 раз в неделю в любое время, независимо от приёма пищи. Препарат Оземпик® вводят п/к в живот, бедро или плечо. Место инъекции может изменяться без коррекции дозы. Препарат Оземпик® нельзя вводить внутривенно и внутримышечно. Дальнейшая информация по способу применения содержится в разделе «Руководство по использованию».
При необходимости день еженедельного введения можно менять при условии, что интервал времени между двумя инъекциями составляет не менее 3-х дней (>72 часов).
Дозы
Начальная доза препарата Оземпик® составляет 0,25 мг 1 раз в неделю. После 4 недель применения дозу следует увеличить до 0,5 мг 1 раз в неделю. Для дальнейшего улучшения гликемического контроля после как минимум 4 недель применения препарата в дозе 0,5 мг 1 раз в неделю, дозу можно увеличить до 1 мг 1 раз в неделю.
Доза препарата Оземпик® 0,25 мг не является терапевтической.
Препарат Оземпик® может применяться в виде монотерапии или в комбинации с одним или более гипогликемическими препаратами (см. раздел «Клиническая эффективность и безопасность»).
При добавлении препарата Оземпик® к предшествующей терапии метформином и/или тиазолидиндионом терапию метформином и/или тиазолидиндионом можно продолжить в прежних дозах.
При добавлении препарата Оземпик® к проводимой терапии производным сульфонилмочевины или инсулином следует предусмотреть снижение дозы производного сульфонилмочевины или инсулина с целью снижения риска возникновения гипогликемий (см. раздел «Особые указания»).
Применение препарата Оземпик® не требует проведения самоконтроля концентрации глюкозы крови. При применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином, такой самоконтроль концентрации глюкозы крови может потребоваться для коррекции дозы производного сульфонилмочевины или инсулина.
Пропущенная доза
В случае пропуска дозы препарат Оземпик® следует ввести как можно быстрее в течение 5 дней с момента запланированного введения дозы. Если продолжительность пропуска составляет более 5 дней, пропущенную дозу не нужно вводить. Следующую дозу препарата Оземпик® следует ввести в обычный запланированный день. В каждом случае пациенты могут возобновить их обычный однократный еженедельный график введения.
Применение препарата в особых клинических группах пациентов
Пациенты пожилого возраста (≥65 лет)
Не требуется коррекции дозы в зависимости от возраста. Опыт применения семаглутида у пациентов в возрасте 75 лет и старше ограничен.
Пациенты с печёночной недостаточностью
Не требуется коррекции дозы у пациентов с печёночной недостаточностью (см. раздел «Фармакокинетика»). Опыт применения семаглутида у пациентов с печёночной недостаточностью тяжёлой степени ограничен; применение препарата Оземпик® у таких пациентов противопоказано.
Пациенты с почечной недостаточностью
Не требуется коррекции дозы у пациентов с почечной недостаточностью. Опыт применения препарата у пациентов с терминальной стадией почечной недостаточности отсутствует; применение препарата Оземпик® у таких пациентов противопоказано.
Дети и подростки
Применение препарата Оземпик® у детей и подростков в возрасте до 18 лет противопоказано в связи с отсутствием данных по безопасности и эффективности.
Побочное действие
Наиболее часто регистрируемыми нежелательными реакциями (HP) во время КИ являлись нарушения со стороны ЖКТ, включая тошноту, диарею и рвоту. В целом, данные реакции были лёгкой или средней степени тяжести и краткосрочными.
HP распределены по системно-органным классам в соответствии с MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000) и очень редко (<1/10000). В каждой группе частоты развития HP представлены по снижению степени серьёзности.
Таблица 1 HP, выявленные при проведении КИ 3 фазы
| Система органов MedDRA | Очень часто | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | Анафилактические реакции | |||
| Нарушения со стороны обмена веществ и питания | Гипогликемияa при совместном применении с инсулином или производным сульфонилмочевины | Гипогликемияa при совместном применении с другими ПГГП Снижение аппетита |
||
| Нарушения со стороны нервной системы | Головокружение | Дисгевзия | ||
| Нарушения со стороны органа зрения | Осложнения диабетической ретинопатииb | |||
| Нарушения со стороны сердца | Увеличение частоты сердечных сокращений (ЧСС) | |||
| Нарушения со стороны ЖКТ | Тошнота Диарея |
Рвота Боль в животе Вздутие живота Запор Диспепсия Гастрит Гастроэзофагеальная рефлюксная болезнь Отрыжка Метеоризм |
||
| Нарушения со стороны печени и желчевыводящих путей | Холелитиаз | |||
| Общие расстройства и нарушения в месте введения | Утомляемость | Реакции в месте введения | ||
| Лабораторные и инструментальные данные | Повышение активности липазы Повышение активности амилазы Снижение массы тела |
a Гипогликемия, определенная как тяжёлая (требующая помощи другого человека) или симптоматическая в сочетании с концентрацией глюкозы в плазме крови <3,1 ммоль/л
b Осложнения диабетической ретинопатии – это сочетание из: необходимости в фотокоагуляции сетчатки глаза, необходимости в интравитреальном введении препаратов, кровоизлияния в стекловидное тело, развития слепоты, связанной с СД.
Частота основана на исследовании СС исходов.
2-летнее исследование СС исходов и безопасности
В популяции пациентов с высоким риском развития СС заболеваний профиль HP был аналогичным таковому в других КИ 3а фазы (описаны в разделе «Клиническая эффективность и безопасность»).
Описание отдельных HP
Гипогликемия
Во время монотерапии препаратом Оземпик® не наблюдалось эпизодов тяжёлой гипогликемии. Гипогликемия тяжёлой степени, в основном, наблюдалась при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином. Наблюдалось несколько эпизодов тяжёлой гипогликемии при применении препарата Оземпик® в комбинации с другими, за исключением производного сульфонилмочевины, ПГГП.
HP со стороны ЖКТ
Во время терапии препаратом Оземпик® в дозах 0,5 мг и 1 мг у пациентов отмечалась тошнота, диарея и рвота. Большинство реакций были от лёгкой до средней степени тяжести и краткосрочными. HP стали причиной преждевременного выбывания из КИ 3,9% и 5,9% пациентов, соответственно. Чаще всего о HP сообщалось в первые месяцы терапии.
Осложнения диабетической ретинопатии
В 2-летнем КИ, в котором участвовали пациенты с СД2 и высоким СС риском, длительным течением СД и неадекватным контролем гликемии, подтверждённые случаи осложнений диабетической ретинопатии развивались у большего количества пациентов, получавших препарат Оземпик® (3,0%), по сравнению с пациентами, получавшими плацебо (1,8%). У пациентов с анамнезом диабетической ретинопатии в начале КИ возрастание абсолютного риска развития осложнений было выше. У пациентов с отсутствием подтверждённого анамнеза диабетической ретинопатии количество событий было одинаковым при применении препарата Оземпик® и плацебо.
В КИ продолжительностью до 1 года частота HP, связанных с диабетической ретинопатией, была одинаковой в группе препарата Оземпик® и препаратов сравнения.
Прекращение лечения по причине HP
Частота прекращения лечения по причине HP составила 8,7% для пациентов, получавших препарат Оземпик® 1 мг. Наиболее частыми HP, приводившими к прекращению лечения, были нарушения со стороны ЖКТ.
Реакции в месте введения
Сообщалось о реакциях в месте введения (таких как, сыпь в месте введения, покраснение) у 0,6 % и 0,5 % пациентов, получавших семаглутид 0,5 мг и 1 мг, соответственно. Эти реакции носили, как правило, лёгкий характер.
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к семаглутиду после терапии препаратом Оземпик®. В конце КИ доля пациентов, у которых были обнаружены антитела к семаглутиду в любой момент времени, была низкой (1-2%) и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГПП-1 эффектом.
Передозировка
В ходе КИ сообщалось о передозировках до 4 мг в однократной дозе и до 4 мг в неделю. Наиболее частой HP, о которой сообщалось, была тошнота. Все пациенты выздоровели без осложнений.
Специфического антидота при передозировке препарата Оземпик® не существует. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии. Учитывая длительный период выведения препарата (примерно 1 неделя), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки.
Взаимодействие с другими лекарственными средствами
Исследования семаглутида in vitro показали очень небольшую вероятность ингибирования или индукции ферментов системы цитохрома Р450 (CYP) и ингибирования транспортёров лекарственных препаратов.
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов. Семаглутид следует применять с осторожностью у пациентов, получающих пероральные лекарственные препараты, для которых необходима быстрая абсорбция в ЖКТ.
Парацетамол
При оценке фармакокинетики парацетамола во время теста стандартизированного приёма пищи было выявлено, что семаглутид задерживает опорожнение желудка. При одновременном применении семаглутида в дозе 1 мг AUC0-60мин и Сmax парацетамола снизились на 27% и 23%, соответственно. Общая экспозиция парацетамола (AUC0-5ч) при этом не изменялась. При одновременном приёме семаглутида и парацетамола коррекция дозы последнего не требуется.
Пероральные гормональные контрацептивные средства
Не предполагается, что семаглутид снижает эффективность пероральных гормональных контрацептивных средств. При одновременном применении комбинированного перорального гормонального контрацептивного препарата (0,03 мг этинилэстрадиола/0,15 мг левоноргестрела) и семаглутида последний не оказывал клинически значимого влияния на общую экспозицию этинилэстрадиола и левоноргестрела. Экспозиция этинилэстрадиола не была затронута; наблюдалось увеличение на 20% экспозиции левоноргестрела в равновесном состоянии. Сmax не изменилась ни для одного из компонентов.
Аторвастатин
Семаглутид не изменял системную экспозицию аторвастатина после применения однократной дозы аторвастатина (40 мг). Сmax аторвастатина снизилась на 38%. Это изменение было расценено как клинически незначимое.
Дигоксин
Семаглутид не изменял системную экспозицию или Сmax дигоксина после применения однократной дозы дигоксина (0,5 мг).
Метформин
Семаглутид не изменял системную экспозицию или Сmax метформина после применения метформина в дозе 500 мг 2 раза в день в течение 3,5 дней.
Варфарин
Семаглутид не изменял системную экспозицию или Сmax R- и S-изомеров варфарина после применения однократной дозы варфарина (25 мг). На основании определения международного нормализованного отношения (МНО) клинически значимых изменений фармакодинамических эффектов варфарина также не наблюдалось.
Несовместимость
Вещества, добавленные к препарату Оземпик®, могут вызвать деградацию семаглутида. Препарат Оземпик® нельзя смешивать с другими лекарственными средствами, в том числе с инфузионными растворами.
Особые указания
Применение препарата Оземпик® противопоказано у пациентов с СД1 или для лечения диабетического кетоацидоза.
Препарат Оземпик® не заменяет инсулин.
Реакции со стороны ЖКТ
Применение агонистов ГПП-1Р может быть ассоциировано с HP со стороны ЖКТ. Это следует учитывать при лечении пациентов с почечной недостаточностью, так как тошнота, рвота и диарея могут привести к дегидратации и ухудшению функции почек.
Острый панкреатит
При применении агонистов ГПП-1Р наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия препаратом Оземпик® должна быть прекращена; в случае подтверждения острого панкреатита терапию препаратом Оземпик® возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором развития острого панкреатита.
Гипогликемия
Пациенты, получающие препарат Оземпик® в комбинации с производным сульфонилмочевины или инсулином, могут иметь повышенный риск развития гипогликемии. В начале лечения препаратом Оземпик® риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина.
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов с наличием диабетической ретинопатии, получающих терапию инсулином и семаглутидом (см. раздел «Побочное действие»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией, получающих инсулинотерапию. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями. Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением состояния диабетической ретинопатии, однако при этом нельзя исключать и другие причины.
Сердечная недостаточность
Отсутствует опыт применения препарата Оземпик® у пациентов с ХСН IV функционального класса в соответствии с классификацией NYHA. Применение препарата у таких пациентов противопоказано.
Заболевания щитовидной железы
В пострегистрационном периоде применения другого аналога ГПП-1, лираглутида, были отмечены случаи медуллярного рака щитовидной железы (МРЩЖ). Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения МРЩЖ с применением аналогов ГПП-1. Необходимо проинформировать пациента о риске МРЩЖ и о симптомах опухоли щитовидной железы (появления уплотнения в области шеи, дисфагии, одышки, непроходящей охриплости голоса).
Значительное повышение концентрации кальцитонина в плазме крови может указывать на МРЖЩ (у пациентов с МРЖЩ значения концентрации кальцитонина в плазме крови обычно >50 нг/л). При выявлении повышения концентрации кальцитонина в плазме крови следует провести дальнейшее обследование пациента. Пациенты с узлами в щитовидной железе, выявленными при медицинском осмотре или при проведении УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Применение семаглутида у пациентов с личным или семейным анамнезом МРЩЖ или с синдромом МЭН типа 2 противопоказано.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В 2-летних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для группы аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключён.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Влияние на способность управлять транспортными средствами и работу с механизмами
Препарат Оземпик® не влияет или незначительно влияет на способность управлять транспортными средствами или работу с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином.
Руководство по использованию
Предварительно заполненная шприц-ручка Оземпик® поставляется в двух видах:
Оземпик® 0,25 мг/доза или 0,5 мг/доза раствор для подкожного введения в предварительно заполненной шприц-ручке позволяет вводить дозы 0,25 мг или 0,5 мг. Данная шприц-ручка предназначена для повышения дозы и поддержания терапевтической дозы 0,5 мг. Одна шприц-ручка содержит 1,5 мл раствора.
Оземпик® 1 мг/доза раствор для подкожного введения в предварительно заполненной шприц-ручке позволяет вводить дозы только 1 мг. Данная шприц-ручка предназначена только для поддержания терапевтической дозы 1 мг. Одна шприц-ручка содержит 3 мл раствора.
В упаковку препарата Оземпик® включены иглы НовоФайн® Плюс.
Пациенту следует рекомендовать выбрасывать инъекционную иглу после каждой инъекции в соответствии с местными требованиями.
Шприц-ручка Оземпик® предназначена только для индивидуального использования. Препарат Оземпик® нельзя применять, если он выглядит иначе, чем прозрачный бесцветный или почти бесцветный раствор.
Препарат Оземпик® нельзя применять, если он был заморожен.
Препарат Оземпик® можно вводить при помощи игл длиной до 8 мм. Шприц-ручка предназначена для использования с одноразовыми инъекционными иглами НовоФайн®.
Всегда после каждой инъекции удаляйте иглу и храните шприц-ручку Оземпик® с отсоединённой иглой. Это поможет предотвратить закупорку игл, загрязнение, заражение, вытекание раствора и введение неправильной дозы препарата.
Форма выпуска
Раствор для подкожного введения, 1,34 мг/мл.
1) Шприц-ручка Оземпик® 0,25 мг/доза или 0,5 мг/доза.
По 1,5 мл препарата в картриджи из стекла, укупоренные поршнями из хлорбутиловой резины с одной стороны и алюминиевыми колпачками с дисками из бромбутиловой резины/полиизопрена, с другой стороны. Картридж встроен в мультидозовую одноразовую шприц-ручку для многократных инъекций из полипропилена, полиоксиметилена, поликарбоната и акрилонитрил бутадиен стирола. 1 шприц-ручка вместе с инструкцией по применению и 6 одноразовыми иглами НовоФайн® Плюс в картонную пачку.
2) Шприц-ручка Оземпик® 1 мг/доза.
По 3 мл препарата в картриджи из стекла, укупоренные поршнями из хлорбутиловой резины с одной стороны и алюминиевыми колпачками с дисками из бромбутиловой резины/полиизопрена, с другой стороны. Картридж встроен в мультидозовую одноразовую шприц-ручку для многократных инъекций из полипропилена, полиоксиметилена, поликарбоната и акрилонитрил бутадиен стирола. 1 шприц-ручка вместе с инструкцией по применению и 4 одноразовыми иглами НовоФайн® Плюс в картонную пачку.
Срок годности
3 года. Не применять по истечении срока, указанного на этикетке шприц-ручки и упаковке.
Условия хранения
Хранить при температуре от 2 °С до 8 °С (в холодильнике), но не рядом с морозильной камерой. Защищать от света. Не замораживать.
Используемую или переносимую в качестве запасной шприц-ручку с препаратом хранить при температуре не выше 30 °С или при температуре от 2 °С до 8 °С (в холодильнике) в течение 6 недель. Не замораживать. После использования закрывать шприц-ручку колпачком для защиты от света.
Препарат Оземпик® следует предохранять от воздействия избыточного тепла и света. Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту.
Производитель и владелец регистрационного удостоверения:
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Производство готовой лекарственной формы:
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Первичная упаковка:
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Вторичная/потребительская упаковка:
Ново Нордиск А/С, Бреннум Парк, DK-3400 Хиллерод, Дания
Производитель (Выпускающий контроль качества):
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Организация, принимающая претензии от потребителей:
ООО «Ново Нордиск», 121614, Москва, ул. Крылатская, д. 15, офис 41
Оземпик® и НовоФайн® – зарегистрированные торговые марки, принадлежащие компании Ново Нордиск А/С, Дания
Инструкция для пациентов по применению препарата Оземпик® 0,25 мг/доза или 0,5 мг/доза раствор для подкожного введения в предварительно заполненной шприц-ручке.
Внимательно прочитайте данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Используйте шприц-ручку только после того, как Вы научитесь ею пользоваться под руководством врача или медсестры.
Начните с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0,25 мг/доза или 0,5 мг/доза, затем посмотрите на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если Вы слабовидящий или у Вас имеются серьёзные проблемы со зрением, и Вы не можете различить цифры на счётчике дозы, не используйте шприц-ручку без посторонней помощи. Помочь вам может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 2 мг семаглутида и позволяет выбрать дозы 0,25 мг или 0,5 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм.
Иглы НовоФайн® Плюс включены в упаковку.
Важная информация

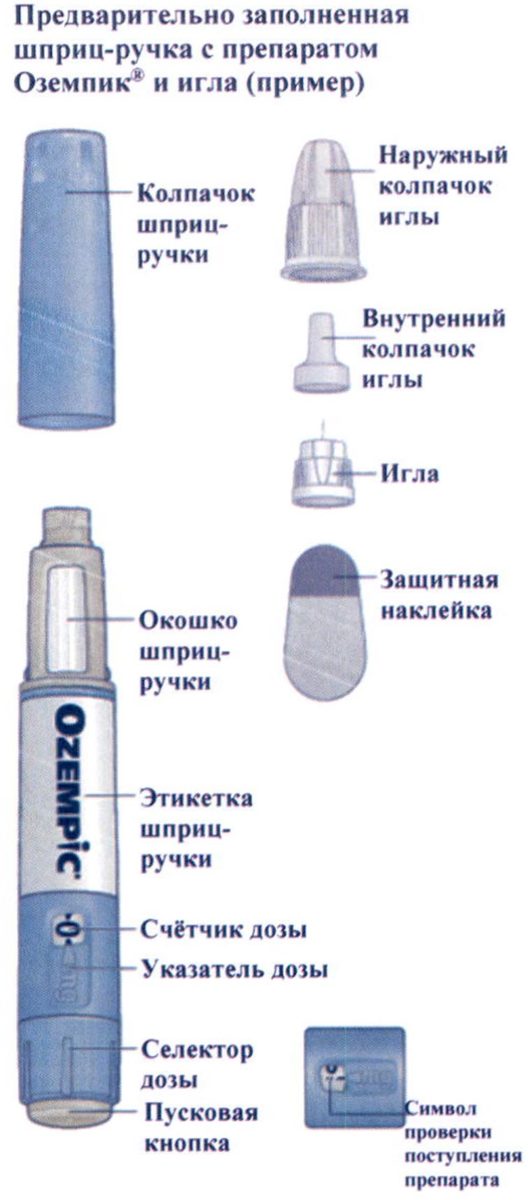
- Подготовка шприц-ручки с новой иглой к использованию
- Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0,25 мг/доза или 0,5 мг/доза. Это особенно важно, если Вы применяете более одного инъекционного препарата.
- Снимите колпачок со шприц-ручки (рис. А).
- Убедитесь, что раствор в шприц-ручке прозрачный и бесцветный (рис. В).
Посмотрите в окошко шприц-ручки. Если раствор мутный и не бесцветный, не используйте шприц ручку. - Возьмите новую иглу и удалите защитную наклейку (рис. С).
Если защитная наклейка повреждена, не используйте иглу, так как в этом случае стерильность не гарантируется. - Наденьте иглу на шприц-ручку и поверните её, чтобы игла плотно держалась на шприц-ручке (рис. D).
- Снимите наружный колпачок иглы, но не выбрасывайте его (рис. Е). Он понадобится Вам после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
- Снимите и выбросьте внутренний колпачок иглы (рис. F). Если Вы попытаетесь надеть внутренний колпачок обратно на иглу, Вы можете случайно уколоться иглой. На конце иглы может появиться капля раствора. Это нормальное явление, однако. Вы всё равно должны проверить поступление препарата, если Вы используете новую шприц-ручку в первый раз.
Не присоединяйте новую иглу до тех пор, пока Вы не будете готовы сделать инъекцию.
Всегда для каждой инъекции используйте новую иглу.
Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата. Никогда не используйте иглу, если она погнута или повреждена. - Проверка поступления препарата
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции.
Если капля раствора на конце иглы не появилась, повторите операцию «2» «Проверка поступления препарата», но не более 6 раз. Если капля раствора так и не появилась, поменяйте иглу и повторите операцию «2» «Проверка поступления препарата» ещё раз.
Если капля раствора так и не появилась, утилизируйте шприц-ручку и используйте новую.Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введён, даже если счётчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если Вы не проверите поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки. Вы можете не ввести необходимую дозу и ожидаемый эффект препарата Оземпик® не будет достигнут. - Установка дозы
- Поворачивайте селектор дозы до тех пор, пока он не покажет необходимую Вам дозу (0,25 мг или 0,5 мг) (рис. А).
Если доза была выбрана неправильно, Вы можете поворачивать селектор дозы вперёд или назад, пока не будет установлена правильная доза.
Максимальная доза, которую можно установить, составляет 0,5 мг.
Селектор дозы изменяет дозу. Только счётчик дозы и указатель дозы покажут количество мг препарата в выбранной Вами дозе.
Вы можете выбрать до 0,5 мг препарата на дозу. Если в шприц-ручке содержится менее 0,5 мг, счётчик дозы остановится прежде, чем появится «0,5».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперёд, назад или, если набранная доза превышает количество мг препарата, оставшихся в шприц-ручке. Не считайте щелчки шприц-ручки.
Всегда перед каждой инъекцией проверяйте какое количество мг препарата Вы набрали по счётчику дозы и указателю дозы.
Не считайте щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозы 0,25 мг или 0,5 мг.
Выбранная доза должна находится точно напротив указателя дозы – такое положение гарантирует, что Вы получите правильную дозу препарата. Сколько препарата осталось- Чтобы определить, сколько препарата осталось, используйте счётчик дозы (рис. А): Поворачивайте селектор дозы до остановки счётчика дозы.
Если он показывает «0,5», в шприц-ручке осталось не менее 0,5 мг препарата.
Если счётчик дозы остановился до того, как появилось «0,5», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 0,5 мг.
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
- Поворачивайте селектор дозы до тех пор, пока он не покажет необходимую Вам дозу (0,25 мг или 0,5 мг) (рис. А).
- Введение препарата
Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
- Если после долгого нажатия на пусковую кнопку на счётчике дозы не появляется «0», это может означать закупорку или повреждение иглы.
- В этом случае Вы не получили препарат, даже если счётчик дозы изменил положение с исходной дозы, которую Вы установили.
Что делать с закупоренной иглой
Замените иглу как описано в операции 5 «После завершения инъекции» и повторите все шаги, начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедитесь, что установили полную необходимую Вам дозу.
Никогда не дотрагивайтесь до счётчика дозы во время введения препарата. Это может прервать иъекцию. - После завершения инъекции
Всегда после каждой инъекции выбрасывайте иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, Вы не введёте себе препарат. Выбрасывайте пустую шприц-ручку с отсоединённой иглой в соответствии с рекомендациями данными врачом, медсестрой, фармацевтом или в соответствии с местными требованиями.Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
После каждой инъекции всегда сразу удаляйте иглу со шприц-ручки.
Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата. Дополнительная важная информация- Всегда храните шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
- Никогда не передавайте свою шприц-ручку и иглы к ней другим лицам.
- Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрёстное инфицирование.
Уход за шприц-ручкой
Аккуратно обращайтесь со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы крови или дискомфорт в области живота (тошнота или рвота).
- Не оставляйте шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур.
- Не применяйте препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы крови может стать слишком высокой или Вы можете почувствовать дискомфорт в области живота такой, как тошнота или рвота.
- Не применяйте препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы крови может стать слишком высокой.
- Предохраняйте шприц-ручку от попадания на неё пыли, загрязнений и жидкости.
- Не мойте шприц-ручку, не погружайте её в жидкость и не смазывайте её. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством.
- Нельзя ронять или ударять шприц-ручку о твёрдую поверхность. Если Вы уронили шприц-ручку или сомневаетесь в её исправности, присоедините новую иглу и проверьте поступление препарата перед тем, как сделать инъекцию.
- Не пытайтесь повторно заполнить шприц-ручку Пустую шприц-ручку необходимо выбросить.
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать её на части.
Инструкция для пациентов по применению препарата Оземпик® 1 мг/доза раствор для подкожного введения в предварительно заполненной шприц-ручке.
Внимательно прочитайте данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Используйте шприц-ручку только после того, как Вы научитесь ею пользоваться под руководством врача или медсестры.
Начните с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза, затем посмотрите на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если Вы слабовидящий или у Вас имеются серьёзные проблемы со зрением, и Вы не можете различить цифры на счётчике дозы, не используйте шприц-ручку без посторонней помощи. Помочь вам может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 4 мг семаглутида и позволяет выбрать только дозу 1 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм.
Иглы НовоФайн® Плюс включены в упаковку. 
Обратите особое внимание на информацию, отмеченную такими значками, это очень важно для безопасного использования шприц-ручки.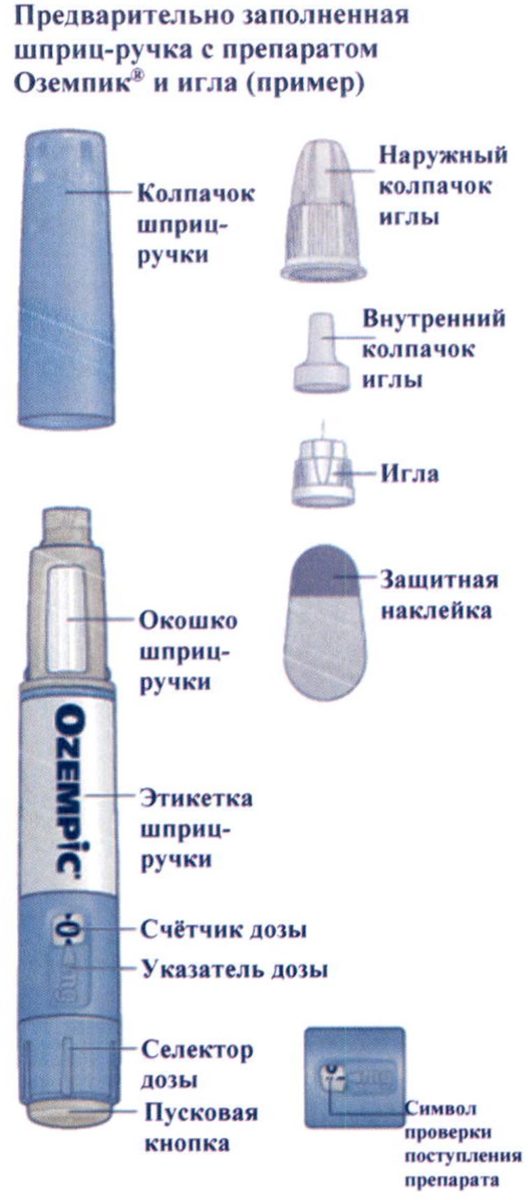
- Подготовка шприц-ручки с новой иглой к использованию
- Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза. Это особенно важно, если Вы применяете более одного инъекционного препарата.
Снимите колпачок со шприц-ручки (рис. А). - Убедитесь, что раствор в шприц-ручке прозрачный и бесцветный (рис. В).
Посмотрите в окошко шприц-ручки. Если раствор мутный и не бесцветный, не используйте шприц ручку. - Возьмите новую иглу и удалите защитную наклейку (рис. С).
Если защитная наклейка повреждена, не используйте иглу, так как в этом случае стерильность не гарантируется. - Наденьте иглу на шприц-ручку и поверните её, чтобы игла плотно держалась на шприц-ручке (рис. D).
- Снимите наружный колпачок иглы, но не выбрасывайте его (рис. Е). Он понадобится Вам после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
- Снимите и выбросьте внутренний колпачок иглы (рис. F). Если Вы попытаетесь надеть внутренний колпачок обратно на иглу, Вы можете случайно уколоться иглой.
На конце иглы может появиться капля раствора. Это нормальное явление, однако. Вы всё равно должны проверить поступление препарата, если Вы используете новую шприц-ручку в первый раз.
Не присоединяйте новую иглу до тех пор, пока Вы не будете готовы сделать инъекцию.
Всегда для каждой инъекции используйте новую иглу.
Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Никогда не используйте иглу, если она погнута или повреждена. - Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза. Это особенно важно, если Вы применяете более одного инъекционного препарата.
- Проверка поступления препарата
Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введён, даже если счётчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если Вы не проверите поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, Вы можете не ввести необходимую дозу и ожидаемый эффект препарата Оземпик® не будет достигнут. - Установка дозы
- Поверните селектор дозы, чтобы выбрать дозу 1 мг (рис. А).
Продолжайте поворачивать до тех пор, пока счётчик дозы не остановится и не покажет «1».
Только счётчик дозы и указатель дозы покажут, что был выбран 1 мг.
Вы можете выбрать только 1 мг препарата на дозу. Если в шприц-ручке содержится менее 1 мг, счётчик дозы остановится прежде, чем появится «1».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперёд, назад или, если Вы пытаетесь набрать дозу больше 1 мг. Не считайте щелчки шприц-ручки.
Всегда перед каждой инъекцией но счётчику дозы и указателю дозы проверяйте, что был набран 1 мг.
Не считайте щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозу 1 мг. Доза 1 мг должна находится точно напротив указателя дозы – такое положение гарантирует, что Вы получите правильную дозу препарата.Сколько препарата осталось
- Чтобы определить, сколько препарата осталось, используйте счётчик дозы (рис. А): Поворачивайте селектор дозы до остановки счётчика дозы.
Если он показывает «1», в шприц-ручке осталось не менее 1 мг препарата. Если счётчик дозы остановился до того, как появилась цифра «1», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 1 мг.
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
- Поверните селектор дозы, чтобы выбрать дозу 1 мг (рис. А).
- Введение препарата
- Введите иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. А).
- Убедитесь, что счётчик дозы находится в поле Вашего зрения. Не дотрагивайтесь до счётчика дозы пальцами – это может прервать инъекцию.
- Нажмите пусковую кнопку до упора и удерживайте её в этом положении, пока счётчик дозы не покажет «0» (рис. В). «0» должен находится точно напротив указателя дозы. При этом Вы можете услышать или ощутить щелчок.
- Удерживайте иглу под кожей, после того, как счётчик дозы вернулся к «0» и медленно считайте до 6 (рис. С).
- Если Вы извлечёте иглу из-под кожи раньше, Вы можете увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
- Извлеките иглу из-под кожи (рис. D). Если в месте инъекции появилась кровь, слегка прижмите к месту укола ватный тампон. Не массируйте место укола.
После завершения инъекции Вы можете увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которую Вы ввели.
Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
- Если после долгого нажатия на пусковую кнопку на счётчике дозы не появляется «0», это может означать закупорку или повреждение иглы.
- В этом случае Вы не получили препарат, даже если счётчик дозы изменил положение с исходной дозы, которую Вы установили.
Что делать с закупоренной иглой
Замените иглу как описано в операции 5 «После завершения инъекции» и повторите все шаги, начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедитесь, что установили полную необходимую Вам дозу.
Никогда не дотрагивайтесь до счётчика дозы во время введения препарата. Это может прервать иъекцию. - После завершения инъекции
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
После каждой инъекции всегда сразу удаляйте иглу со шприц-ручки.
Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Дополнительная важная информация- Всегда храните шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
- Никогда не передавайте свою шприц-ручку и иглы к ней другим лицам.
- Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрёстное инфицирование.
Уход за шприц-ручкой
Аккуратно обращайтесь со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы крови или дискомфорт в области живота (тошнота или рвота).
- Не оставляйте шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур.
- Не применяйте препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы крови может стать слишком высокой или Вы можете почувствовать дискомфорт в области живота такой, как тошнота или рвота.
- Не применяйте препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы крови может стать слишком высокой.
- Предохраняйте шприц-ручку от попадания на неё пыли, загрязнений и жидкости.
- Не мойте шприц-ручку, не погружайте её в жидкость и не смазывайте её. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством.
- Нельзя ронять или ударять шприц-ручку о твёрдую поверхность. Если Вы уронили шприц-ручку или сомневаетесь в её исправности, присоедините новую иглу и проверьте поступление препарата перед тем, как сделать инъекцию.
- Не пытайтесь повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить.
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать её на части.
Купить Оземпик в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Семаглутид
Semaglutide
Фармакологическое действие
Семаглутид является агонистом рецепторов ГПП-1 (ГПП-1Р), произведённым методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae с последующей очисткой.
Семаглутид представляет собой аналог ГПП-1, имеющий 94 % гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который селективно связывается и активирует ГПП-1Р. ГПП-1Р служит мишенью для нативного ГПП-1.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на сердечно-сосудистую систему. Влияние на концентрацию глюкозы и аппетит специфически опосредовано ГПП-1Р, расположенными в поджелудочной железе и головном мозге. Фармакологические концентрации семаглутида снижают концентрацию глюкозы крови и массу тела посредством сочетания эффектов, описанных ниже. ГПП-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек, где их активация может оказывать сердечно-сосудистые и микроциркуляторные эффекты.
В отличие от нативного ГПП-1, продлённый период полувыведения семаглутида (около 1 недели) позволяет применять его подкожно 1 раз в неделю. Связывание с альбумином является основным механизмом длительного действия семаглутида, что приводит к снижению выведения его почками и защищает от метаболического распада. Кроме того, семаглутид стабилен в отношении расщепления ферментом дипептидилпептидазой-4.
Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляции секреции инсулина и подавления секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не снижает секрецию глюкагона.
Семаглутид снижает общую массу тела и массу жировой ткани, уменьшая потребление энергии. Данный механизм затрагивает общее снижение аппетита, включая усиление сигналов насыщения и ослабление сигналов голода, а также улучшение контроля потребления пищи и снижение тяги к пище. Снижается также инсулинорезистентность, возможно, за счёт уменьшения массы тела. Помимо этого, семаглутид снижает предпочтение к приёму пищи с высоким содержанием жиров. В исследованиях на животных было показано, что семаглутид поглощается специфическими областями головного мозга и усиливает ключевые сигналы насыщения и ослабляет ключевые сигналы голода. Воздействуя на изолированные участки тканей головного мозга семаглутид активирует нейроны, связанные с чувством сытости, и подавляет нейроны, связанные с чувством голода.
В клинических исследованиях семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое артериальное давление и уменьшал воспаление.
В исследованиях на животных семаглутид подавляет развитие атеросклероза, предупреждая дальнейшее развитие аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамика
Все фармакодинамические исследования были проведены после 12 недель терапии (включая период увеличения дозы) в равновесной концентрации семаглутида 1 мг 1 раз в неделю.
Уровень гликемии натощак и постпрандиальный уровень гликемии
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. По сравнению с плацебо терапия семаглутидом 1 мг у пациентов с сахарным диабетом 2 типа (СД2) привела к снижению концентрации глюкозы с точки зрения абсолютного изменения от исходного значения (ммоль/л) и относительного снижения по сравнению с плацебо (%) в отношении: концентрации глюкозы натощак (1,6 ммоль/л; 22 %); концентрации глюкозы через 2 часа после приёма пищи (4,1 ммоль/л; 37 %); средней суточной концентрации глюкозы (1,7 ммоль/л; 22 %) и постпрандиальных пиков концентрации глюкозы за 3 приёма пищи (0,6–1,1 ммоль/л). Семаглутид снижал концентрацию глюкозы натощак после введения первой дозы.
Функция бета-клеток поджелудочной железы и секреция инсулина
Семаглутид улучшает функцию бета-клеток поджелудочной железы. После внутривенного струйного введения глюкозы пациентам с СД2 семаглутид по сравнению с плацебо улучшал первую и вторую фазу инсулинового ответа с трёхкратным и двукратным повышением, соответственно, и увеличивал максимальную секреторную активность бета-клеток поджелудочной железы после теста стимуляции аргинином. Кроме того, по сравнению с плацебо терапия семаглутидом увеличивает концентрации инсулина натощак.
Секреция глюкагона
Семаглутид снижает концентрацию глюкагона натощак и постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к относительному снижению концентрации глюкагона по сравнению с плацебо: концентрации глюкагона натощак (8–21 %), постпрандиальной) глюкагонового ответа (14–15 %) и средней суточной концентрации глюкагона (12 %).
Глюкозозависимая секреция инсулина и глюкозозависимая секреция глюкагона
Семаглутид снижал высокую концентрацию глюкозы в крови, стимулируя секрецию инсулина и снижая секрецию глюкагона глюкозозависимым способом. Скорость секреции инсулина после введения семаглутида пациентам с СД2 была сопоставима с таковой у здоровых добровольцев.
Во время индуцированной гипогликемии семаглутид по сравнению с плацебо не изменял контррегуляторный ответ повышения концентрации глюкагона, а также не усугублял снижение концентрации С-пептида у пациентов с СД2.
Опорожнение желудка
Семаглутид вызывал небольшую задержку раннего постпрандиальной) опорожнения желудка, тем самым снижая скорость поступления постпрандиальной глюкозы в кровь.
Масса тела и состав тела
Наблюдалось большее снижение массы тела при применении семаглутида по сравнению с изученными препаратами сравнения (плацебо, ситаглиптином, эксенатидом замедленного высвобождения (ЗВ), дулаглутидом и инсулином гларгин) (см. раздел «Клиническая эффективность и безопасность»). Потеря массы тела при применении семаглутида происходила преимущественно за счёт потери жировой ткани, превышающей потерю мышечной массы в 3 раза.
Аппетит, потребление калорий и выбор продуктов питания
По сравнению с плацебо семаглутид снизил потребление калорий на 18–35 % во время трёх последовательных приёмов пищи ad libitum. Этому способствовали стимулированные семаглутидом подавление аппетита как натощак, так и после приёма пищи, улучшенный контроль потребления пищи, ослабление тяги к еде, особенно с высоким содержанием жиров.
Липиды натощак и постпрандиальные липиды
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и холестерина липопротеинов очень низкой плотности (ЛПОНП) натощак на 12 % и 21 %, соответственно. Постпрандиальное увеличение концентрации триглицеридов и холестерина ЛПОНП в ответ на приём пищи с высоким содержанием жиров снизилось более чем на 40 %.
Электрофизиология сердца (ЭФс)
Действие семаглутида на процесс реполяризации в сердце было протестировано в исследовании ЭФс. Применение семаглутида в дозах, превышающих терапевтические (в равновесной концентрации до 1,5 мг), не приводило к удлинению скорректированного интервала QT.
Клиническая эффективность и безопасность
Как улучшение гликемического контроля, так и снижение сердечно-сосудистой заболеваемости и смертности являются неотъемлемой частью лечения СД2.
Эффективность и безопасность препарата в дозах 0,5 мг и 1 мг оценивались в шести рандомизированных контролируемых клинических исследовани 3a фазы. Из них пять клинических исследований в качестве основной цели оценивали эффективность гликемического контроля, в то время как одно клиническое исследование оценивало в качество основной цели сердечно-сосудистый исход. В дополнение были проведены два клинических исследования препарата 3 фазы с участием японских пациентов.
Терапия препаратом продемонстрировала устойчивые, статистически превосходящие и клинически значимые улучшение показателя HbA1с и снижение массы тела на срок до 2-х лет по сравнению с плацебо и лечением с активным контролем (ситаглиптином, инсулином гларгин, эксенатидом ЗВ и дулаглутидом).
Возраст, пол, раса, этническая принадлежность, исходные значения индекса массы тела (ИМТ) и массы тела (кг), длительность сахарного диабета (СД) и почечная недостаточность не повлияли на эффективность семаглутида.
Монотерапия
Монотерапия семаглутидом в дозах 0,5 мг и 1 мг 1 раз в неделю в течение 30 недель по сравнению с плацебо привела к статистически более значимому снижению показателей HbA1с (-1,5 %, -1,6 % против 0 %, соответственно), глюкозы плазмы натощак (ГПН) (-2,5 ммоль/л, -2,3 ммоль/л против -0,6 ммоль/л, соответственно) и массы тела (-3,7 кг, -4,5 кг против -1,0 кг, соответственно).
Семаглутид по сравнению с ситаглиптином, оба в комбинации с 1–2 пероральными гипогликемическими препаратами (ПГГП) (метформином и/или препаратами группы тиазолидиндиона)
Терапия семаглутидом 0,5 мг и 1 мг 1 раз в неделю в течение 56 недель по сравнению с ситаглиптином привела к устойчивому и статистически более значимому снижению показателей HbA1с (-1,3 %, -1,6 % против -0,5 %, соответственно), ГПН (-2,1 ммоль/л, -2,6 ммоль/л против -1,1 ммоль/л, соответственно) и массы тела (-4,3 кг, -6,1 кг против -1,9 кг, соответственно). Терапия препаратом 0,5 мг и 1 мг по сравнению с ситаглиптином значительно снижала систолическое АД от исходного значения в 132,6 мм рт. ст. (-5,1 мм рт. ст., -5,6 мм рт. ст, против -2,3 мм рт. ст., соответственно). Изменений диастолического АД не происходило.
Семаглутид по сравнению с дулаглутидом, оба в комбинации с метформином
Терапия семаглутидом 0,5 мг по сравнению с дулаглутидом 0,75 мг, оба 1 раз в неделю на протяжении 40 недель, привела к устойчивому и статистически превосходящему снижению показателей HbA1с (-1,5 % против -1,1 %), ГПН (-2,2 ммоль/л против -1,9 ммоль/л) и массы тела (-4,6 кг против -2,3 кг), соответственно.
Терапия семаглутидом 1 мг по сравнению с дулаглутидом 1,5 мг оба 1 раз в неделю на протяжении 40 недель, привела к устойчивому и статистически превосходящему снижению показателей HbA1с (-1,8 % против -1,4 %), ГПН (-2,8 ммоль/л против -2,2 ммоль/л) и массы тела (-6,5 кг против -3,0 кг), соответственно.
Семаглутид по сравнению с эксенатидом ЗВ, оба в комбинации с метформином или метформином совместно с производным сульфонилмочевины
Терапия семаглутидом 1 мг 1 раз; в неделю на протяжении 56 недель по сравнению с эксенатидом ТВ 2,0 мг привела к устойчивому и статистически более значимому снижению показателей HbA1с (-U5 % против -0,9 %), ГПН (-2,8 ммоль/л против -2,0 ммоль/л) и массы тела (-5,6 кг против -1,9 кг), соответственно.
Семаглутид по сравнению с инсулином гларгин, оба в комбинации с 1-2 ПГГП (монотерапия метформином или метформин с производным сульфонилмочевины)
Терапия семаглутидом в дозах 0,5 мг и 1 мг 1 раз в неделю по сравнению с инсулином гларгин в течение 30 недель привела к статистически более значимому снижению показателей HbA1с (-1,2 %, -1,6 % против -0,8 %, соответственно) и массы тела (-3,5 кг, -5,2 кг против +1,2 кг, соответственно).
Снижение показателя ГПН было статистически более значимым для семаглутида 1 мг по сравнению с инсулином гларгин (-2,7 ммоль/л против -2,1 ммоль/л). Не наблюдалось статистически более значимое снижение показателя ГПН для семаглутида 0,5 мг (-2,0 ммоль/л против -2,1 ммоль/л).
Доля пациентов, у которых наблюдались тяжёлые или подтверждённые (<3,1 ммоль/л) эпизоды гипогликемии, была ниже при применении семаглутида 0,5 мг (4,4 %) и семаглутида 1 мг (5,6 %) по сравнению с инсулином гларгин (10,6 %).
Больше пациентов достигли показателя HbA1с <7 % без тяжёлых или подтверждённых эпизодов гипогликемии и без набора веса при применении семаглутида 0,5 мг (47 %) и семаглутида 1 мг (64 %) по сравнению с инсулином гларгин (16 %).
Семаглутид по сравнению с плацебо, оба в комбинации с базальным инсулином
Терапия семаглутидом в дозах 0,5 мг и 1 мг по сравнению с плацебо в течение 30 недель привела к статистически более значимому снижению показателей HbA1с (-1,4%, -1,8% против -0,1%, соответственно), ГПН (-1,6 ммоль/л, -2,4 ммоль/л против -0,5 ммоль/л, соответственно) и массы тела (-3,7 кг, -6,4 кг против -1,4 кг, соответственно). Частота тяжёлых или подтверждённых эпизодов гипогликемии существенно не различалась при применении семаглутида и плацебо. Доля пациентов с показателем HbA1с ≤8 % на скрининге, сообщивших о тяжёлых или подтверждённых (<3,1 ммоль/л) эпизодах гипогликемии, была выше при применении семаглутида по сравнению с плацебо и сопоставима у пациентов с показателем HbA1с >8 % на скрининге.
Комбинация с монотерапией производным сульфонилмочевины
На 30-й неделе клинических исследований (см. подраздел «Оценка влияния на сердечно-сосудистую систему») была произведена оценка подгруппы из 123 пациентов, находящихся на монотерапии производным сульфонилмочевины. На 30-й неделе показатель HbA1с снизился на 1,6 % и на 1,5 % при применении препарата в дозах 0,5 мг и 1 мг, соответственно, и увеличился на 0,1 % при применении плацебо.
Комбинация с предварительно смешанным инсулином ± 1–2 ПГГП
На 30-й неделе клинических исследований (см. подраздел «Оценка влияния на сердечно-сосудистую систему») была произведена оценка подгруппы из 867 пациентов, находящихся на терапии предварительно смешанным инсулином (в комбинации или без 2-х ПГГП). На 30-й неделе показатель HbA1с снизился на 1,3 % и на 1,8 % при применении препарата в дозах 0,5 мг и 1 мг, соответственно, и снизился на 0,4 % при применении плацебо.
Соотношение пациентов, достигших целевого снижения показателя HbA1с
До 79 % пациентов достигли целей лечения в отношении снижения показателя HbA1с <7 %, и доля таких пациентов была значительно больше при применении семаглутида по сравнению с пациентами, получавшими ситаглиптин, эксенатид ЗВ, инсулин гларгин, дулаглутид и плацебо.
Доля пациентов, достигших показателя HbA1с менее 7% без тяжёлых или подтверждённых эпизодов гипогликемии и без набора веса, была значительно больше при применении семаглутида в дозах 0,5 мг и 1 мг (до 66 % и 74 %, соответственно) по сравнению с пациентами, получавшими ситаглиптин (27 %), эксенатид ЗВ (29 %), инсулин гларгин (16 %), дулаглутид 0,75 мг (44 %) и дулаглутид 1,5 мг (58 %).
Масса тела
Монотерапия семаглутидом 1 мг или терапия в комбинации с 1–2 лекарственными препаратами приводила к статистически большему снижению массы тела (потеря составляла до 6,5 кг) по сравнению с терапией плацебо, ситаглиптином, эксенатидом ЗВ, инсулином гларгин или дулаглутидом. Снижение массы тела было устойчивым на срок до 2-х лет.
После одного года терапии потери массы ≥5 % и ≥10 % достигло большее количество пациентов, получавших семаглутид 0,5 мг (46 % и 13 %) и 1 мг (до 62 % и 24 %), по сравнению с пациентами, находившимися на терапии активными препаратами сравнения ситаглиптином и эксенатидом ЗВ (до 18 % и до 4 %).
В клиническом исследовании длительностью 40 недель потери массы ≥5 % и ≥10 % достигло большее количество пациентов, получавших семаглутид 0,5 мг (44% и 14%), по сравнению с пациентами, получавшими дулаглутид 0,75 мг (23 % и 3 %). Потери массы ≥5 % и ≥10 % достигло большее количество пациентов, получавших семаглутид 1 мг (до 63 % и 27 %), по сравнению с пациентами, получавшими дулаглутид 1,5 мг (30 % и 8 %).
В сердечно-сосудистом клиническом исследовании потери массы тела ≥5 % и ≥10 % достигло большее количество пациентов, получавших семаглутид 0,5 мг (36 % и 13 %) и 1 мг (47 % и 20 %), по сравнению с пациентами, получавшими плацебо 0,5 мг (18 % и 6 %) и 1 мг (19 % и 7 %).
ГПН и постпрандиальное увеличение концентрации глюкозы
Во время всех трёх ежедневных приёмов пищи семаглутид 0,5 мг и 1 мг показал значительное снижение концентрации ГПН до 2,8 ммоль/л и снижение постпрандиального прироста концентрации глюкозы до 1,2 ммоль/л (разница между значениями до и после еды, полученная после трёх приёмов пищи) (в дополнение см. раздел «Фармакодинамика»).
Функция бета-клеток поджелудочной железы и инсулинорезистентность
В ходе терапии семаглутидом 0,5 мг и 1 мг произошло улучшение функции бета-клеток поджелудочной железы и уменьшение инсулинорезистентности, что подтверждается оценкой гомеостатических моделей функции бета-клеток поджелудочной железы (НОМА-IR) и инсулинорезистентности (HOMA-IR) (в дополнение см. раздел «Фармакодинамика»).
Липиды
Во время клинических исследований семаглутида наблюдалось улучшение профиля липидов крови натощак, преимущественно в группе, получавшей дозу 1 мг (в дополнение см. раздел «Фармакодинамика»).
Оценка влияния на сердечно-сосудистую систему
3297 пациентов с СД2 и высоким сердечно-сосудистым риском были рандомизированы в двойное слепое клиническое исследование длительностью 104 недели на получение семаглутида 0,5 мг или 1 мг 1 раз в неделю либо плацебо 0,5 мг или 1 мг в дополнение к стандартной терапии сердечно-сосудистых заболеваний в течение последующих 2-х лет.
Терапия семаглутидом привела к снижению на 26 % риска первичного комбинированного исхода, включающего смерть по причине сердечно-сосудистой патологии, инфаркт миокарда (ИМ) без смертельного исхода и инсульт без смертельного исхода. В первую очередь это было обусловлено значительным уменьшением частоты инсульта без смертельного исхода (39 %) и незначительным уменьшением частоты ИМ без смертельного исхода (26 %), но без изменений в частоте смерти по причине сердечно-сосудистой патологии.
Значительно снизился риск реваскуляризации миокарда или периферических артерий, в то время как риск нестабильной стенокардии, требующей госпитализации, и риск госпитализации по причине сердечной недостаточности снизились незначительно.
Микроциркуляторные исходы включали в себя 158 новых или ухудшившихся случаев нефропатии. Относительный риск в отношении времени до возникновения нефропатии (новые случаи развития персистирующей макроальбуминурии, персистирующее удвоение сывороточной концентрации креатинина, необходимость в постоянной заместительной почечной терапии и смерть по причине болезни почек) составил 0,64.
В дополнение к стандартной терапии сердечно-сосудистых заболеваний терапия семаглутидом в дозах 0,5 мг и 1 мг по сравнению с плацебо 0,5 мг и 1 мг в течение 104 недель привела к значительному и устойчивому снижению от исходных значений показателя HbA1с (-1,1 % и -1,4 % против -0,4 % и -0,4 %, соответственно).
Артериальное давление
Наблюдалось значительное снижение среднего систолического АД при применении семаглутида 0,5 мг (3,5–5,1 мм рт. ст.) и семаглутида 1 мг (5,4–7,3 мм рт.ст.) в комбинации с ПГГП или базальным инсулином. Не отмечалось значительной разницы по показателям диастолического АД между семаглутидом и препаратами сравнения.
Фармакокинетика
Препарат подходит для введения 1 раз в неделю, так как период полувыведения семаглутида равен приблизительно 1 неделе.
Всасывание
Время достижения максимальной плазменной концентрации (Cmax) составило от 1 до 3 дней после введения дозы препарата.
Равновесная концентрация препарата (AUCτ/24) достигалась спустя 4–5 недель однократного еженедельного применения препарата. После подкоржного введения семаглутида в дозах 0,5 мг и 1 мг средние показатели его равновесной концентрации у пациентов с СД2 составили около 16 нмоль/л и 30 нмоль/л, соответственно.
Экспозиция для доз семаглутида 0,5 мг и 1 мг увеличивается пропорционально введённой дозе.
При подкожном введении семаглутида в переднюю брюшную стенку, бедро или плечо достигается сходная экспозиция.
Абсолютная биодоступность семаглутида после п/к введения составила 89 %.
Распределение
Средний объём распределения (Vd) семаглутида в тканях после подкожного введения пациентам с СД2 составил приблизительно 12,5 л. Семаглутид в значительной степени связывался с альбумином плазмы крови (>99 %).
Биотрансформация
Семаглутид метаболизируется посредством протеолитического расщепления пептидной основы белка и последующего бета-окисления жирной кислоты боковой цепи.
Элиминация
Желудочно-кишечный тракт и почки являются основными путями выведения семаглутида и его метаболитов, ⅔ введённой дозы семаглутида выводится почками, ⅓ – через кишечник.
Приблизительно 3 % от введённой дозы выводится почками в виде неизменённого семаглутида.
У пациентов с СД2 клиренс семаглутида составил около 0,05 л/ч. С элиминационным периодом полувыведения примерно 1 неделя семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 недель после введения последней дозы препарата.
Особые группы пациентов
Не требуется коррекции дозы семаглутида в зависимости от возраста, пола, расовой и этнической принадлежности, массы тела, наличия почечной или печёночной недостаточности.
Возраст
На основании данных, полученных в ходе клинических иссследований 3a фазы, включавших пациентов в возрасте от 20 до 86 лет, показано, что возраст не влиял на фармакокинетику семаглутида.
Пол
Пол не влиял на фармакокинетику семаглутида.
Раса
Расовая группа (белая, чёрная или афроамериканская, азиатская) не влияла на фармакокинетику семаглутида.
Этническая принадлежность
Этническая принадлежность (латиноамериканская) не влияла на фармакокинетику семаглутида.
Масса тела
Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Дозы семаглутида равные 0,5 мг и 1 мг обеспечивают достаточную экспозицию препарата в диапазоне массы тела от 40 до 198 кг.
Почечная недостаточность
Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику семаглутида. Это было показано у пациентов с различной степенью почечной недостаточности (лёгкой, средней, тяжёлой или у пациентов, находящихся на диализе) по сравнению с пациентами с нормальной функцией почек в исследовании однократной дозы семаглутида равной 0,5 мг. Это также было показано на основании данных клинического исследования 3a фазы для пациентов с СД2 и почечной недостаточностью, хотя опыт применения у пациентов с терминальной стадией заболевания почек был ограничен.
Печёночная недостаточность
Печёночная недостаточность не влияла на экспозицию семаглутида. Фармакокинетические свойства семаглутида оценивались в ходе исследования однократной дозы семаглутида равной 0,5 мг у пациентов с различной степенью печёночной недостаточности (лёгкой, средней, тяжёлой) по сравнению с пациентами с нормальной функцией печени.
Дети и подростки
Исследований семаглутида у детей и подростков до 18 лет не проводили.
Показания
Препарат показан для применения у взрослых пациентов с сахарным диабетом 2 типа на фоне диеты и физических упражнений для улучшения гликемического контроля в качестве:
- монотерапии;
- комбинированной терапии с другими пероральными гипогликемическими препаратами (ПГГП) — метформином, метформином и производным сульфонилмочевины, метформином и/или тиазолидиндионом, у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии;
- комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом и метформином.
Препарат показан для снижения риска развития больших сердечно-сосудистых событий* у пациентов с сахарным диабетом 2 типа и высоким сердечно-сосудистым риском в качестве дополнения к стандартному лечению сердечно-сосудистых заболеваний (на основании анализа времени наступления первого большого сердечно-сосудистого события – см. раздел «Фармакологические свойства», подраздел «Оценка влияния на сердечно-сосудистую систему»).
* большие сердечно-сосудистые события включают: смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Противопоказания
- Гиперчувствительность к семаглутиду;
- медуллярный рак щитовидной железы в анамнезе, в том числе в семейном;
- множественная эндокринная неоплазия (МЭН) 2 типа;
- сахарный диабет 1 типа (СД 1);
- диабетический кетоацидоз.
Противопоказано применение препарата у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности иди ограниченным опытом применения:
- беременность и период грудного вскармливания;
- возраст до 18 лет;
- печёночная недостаточность тяжёлой степени;
- терминальная стадия почечной недостаточности (клиренс креатинина (КК) <15 мл/мин);
- хроническая сердечная недостаточность (ХСН) Ⅳ функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация)).
С осторожностью
Рекомендуется применять с осторожностью у пациентов с почечной недостаточностью и у пациентов с наличием панкреатита в анамнезе (см. раздел «Меры предосторожности»).
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и строго контролируемых исследований по безопасности применения семаглутида при беременности у человека не проведено.
Исследования на животных продемонстрировали репродуктивную токсичность препарата (см. раздел «Доклинические данные по безопасности»).
Противопоказано применять семаглутид во время беременности. Женщинам с сохранённым репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом. Если пациентка готовится к беременности, либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Из-за длительного периода полувыведения терапию семаглутидом необходимо прекратить как минимум за 2 месяца до планируемого наступления беременности (см. раздел «Фармакокинетика»).
Применение в период грудного вскармливания
У лактирующих крыс семаглутид проникал в молоко. Нельзя исключить риск для ребёнка, находящегося на грудном вскармливании. Противопоказано применять семаглутид в период грудного вскармливания.
Способ применения и дозы
Начальная дозировка семаглутида — 0,25 мг подкожно один раз в неделю в течение 4 недель. Доза 0,25 мг предназначена для инициации лечения и не эффективна для контроля над гликемией.
Через 4 недели дозу семаглутида необходимо увеличить до 0,5 мг 1 раз в неделю. Максимальная рекомендуемая доза семаглутида составляет 1 мг 1 раз в неделю.
Следует строго соблюдать соответствие используемой лекарственной формы показаниям к применению.
Побочные действия
Наиболее часто регистрируемыми нежелательными реакциями (HP) во время КИ являлись нарушения со стороны желудочно-кишечного тракта, включая тошноту, диарею и рвоту. В целом, данные реакции были лёгкой или средней степени тяжести и краткосрочными.
Определение частоты побочных эффектов: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1 000 и <1/100); редко (≥1 /10 000 и <1/1 000); очень редко (<1/10 000, включая отдельные случаи). В каждой группе частоты развития HP представлены по снижению степени серьёзности.
| Система органов MedDRA | Очень часто | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | Анафилактические реакции | |||
| Нарушения со стороны обмена веществ и питания | Гипогликемияa при совместном применении с инсулином или производным сульфонилмочевины | Гипогликемияa при совместном применении с другими ПГГП Снижение аппетита |
||
| Нарушения со стороны нервной системы | Головокружение | Дисгевзия | ||
| Нарушения со стороны органа зрения | Осложнения диабетической ретинопатииb | |||
| Нарушения со стороны сердца | Увеличение частоты сердечных сокращений (ЧСС) | |||
| Нарушения со стороны желудочно-кишечного тракта | Тошнота Диарея |
Рвота Боль в животе Вздутие живота Запор Диспепсия Гастрит Гастроэзофагеальная рефлюксная болезнь Отрыжка Метеоризм |
||
| Нарушения со стороны печени и желчевыводящих путей | Холелитиаз | |||
| Общие расстройства и нарушения в месте введения | Утомляемость | Реакции в месте введения | ||
| Лабораторные и инструментальные данные | Повышение активности липазы Повышение активности амилазы Снижение массы тела |
a Гипогликемия, определенная как тяжёлая (требующая помощи другого человека) или симптоматическая в сочетании с концентрацией глюкозы в плазме крови <3,1 ммоль/л.
b Осложнения диабетической ретинопатии – это сочетание из: необходимости в фотокоагуляции сетчатки глаза, необходимости в интравитреальном введении препаратов, кровоизлияния в стекловидное тело, развития слепоты, связанной с СД.
Частота основана на исследовании сердечно-сосудистых исходов.
2-летнее исследование сердечно-сосудистых исходов и безопасности
В популяции пациентов с высоким риском развития сердечно-сосудистых заболеваний профиль HP был аналогичным таковому в других клинических исследованиях 3a фазы (описаны в разделе «Клиническая эффективность и безопасность»).
Описание отдельных HP
Гипогликемия
Во время монотерапии семаглутидом не наблюдалось эпизодов тяжёлой гипогликемии. Гипогликемия тяжёлой степени, в основном, наблюдалась при применении семаглутида в комбинации с производным сульфонилмочевины или инсулином. Наблюдалось несколько эпизодов тяжёлой гипогликемии при применении семаглутида в комбинации с другими, за исключением производного сульфонилмочевины, ПГГП.
HP со стороны желудочно-кишечного тракта
Во время терапии семаглутидом в дозах 0,5 мг и 1 мг у пациентов отмечалась тошнота, диарея и рвота. Большинство реакций были от лёгкой до средней степени тяжести и краткосрочными. HP стали причиной преждевременного выбывания из клинических исследований 3,9 % и 5,9 % пациентов, соответственно. Чаще всего о HP сообщалось в первые месяцы терапии.
Осложнения диабетической ретинопатии
В 2-летнем клиническом исследовании, в котором участвовали пациенты с СД2 и высоким сердечно-сосудистым риском, длительным течением СД и неадекватным контролем гликемии, подтверждённые случаи осложнений диабетической ретинопатии развивались у большего количества пациентов, получавших семаглутид (3,0 %), по сравнению с пациентами, получавшими плацебо (1,8 %). У пациентов с анамнезом диабетической ретинопатии в начале КИ возрастание абсолютного риска развития осложнений было выше. У пациентов с отсутствием подтверждённого анамнеза диабетической ретинопатии количество событий было одинаковым при применении семаглутида и плацебо.
В клиническом исследовании продолжительностью до 1 года частота HP, связанных с диабетической ретинопатией, была одинаковой в группе семаглутида и препаратов сравнения.
Прекращение лечения по причине HP
Частота прекращения лечения по причине HP составила 8,7 % для пациентов, получавших семаглутид 1 мг. Наиболее частыми HP, приводившими к прекращению лечения, были нарушения со стороны желудочно-кишечного тракта.
Реакции в месте введения
Сообщалось о реакциях в месте введения (таких как, сыпь в месте введения, покраснение) у 0,6 % и 0,5 % пациентов, получавших семаглутид 0,5 мг и 1 мг, соответственно. Эти реакции носили, как правило, лёгкий характер.
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к семаглутиду после терапии препаратом. В конце клинического исследования доля пациентов, у которых были обнаружены антитела к семаглутиду в любой момент времени, была низкой (1–2 %) и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГПП-1 эффектом.
Передозировка
В ходе клинических исследований сообщалось о передозировках до 4 мг в однократной дозе и до 4 мг в неделю. Наиболее частой HP, о которой сообщалось, была тошнота. Все пациенты выздоровели без осложнений.
Специфического антидота при передозировке семаглутида не существует. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии. Учитывая длительный период выведения препарата (примерно 1 неделя), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки.
Взаимодействие
Исследования семаглутида in vitro показали очень небольшую вероятность ингибирования или индукции ферментов системы цитохрома Р450 (CYP) и ингибирования транспортёров лекарственных препаратов.
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов. Семаглутид следует применять с осторожностью у пациентов, получающих пероральные лекарственные препараты, для которых необходима быстрая абсорбция в желудочно-кишечном тракте.
Парацетамол
При оценке фармакокинетики парацетамола во время теста стандартизированного приёма пищи было выявлено, что семаглутид задерживает опорожнение желудка. При одновременном применении семаглутида в дозе 1 мг AUC0–60 мин и Cmax парацетамола снизились на 27 % и 23 %, соответственно. Общая экспозиция парацетамола (AUC0–5 ч) при этом не изменялась. При одновременном приёме семаглутида и парацетамола коррекция дозы последнего не требуется.
Пероральные гормональные контрацептивные средства
Не предполагается, что семаглутид снижает эффективность пероральных гормональных контрацептивных средств. При одновременном применении комбинированного перорального гормонального контрацептивного препарата (0,03 мг этинилэстрадиола/0,15 мг левоноргестрела) и семаглутида последний не оказывал клинически значимого влияния на общую экспозицию этинилэстрадиола и левоноргестрела. Экспозиция этинилэстрадиола не была затронута; наблюдалось увеличение на 20 % экспозиции левоноргестрела в равновесном состоянии. Cmax не изменилась ни для одного из компонентов.
Аторвастатин
Семаглутид не изменял системную экспозицию аторвастатина после применения однократной дозы аторвастатина (40 мг). Cmax аторвастатина снизилась на 38 %. Это изменение было расценено как клинически незначимое.
Дигоксин
Семаглутид не изменял системную экспозицию или Cmax дигоксина после применения однократной дозы дигоксина (0,5 мг).
Метформин
Семаглутид не изменял системную экспозицию или Cmax метформина после применения метформина в дозе 500 мг 2 раза в день в течение 3,5 дней.
Варфарин
Семаглутид не изменял системную экспозицию или Cmax R- и S-изомеров варфарина после применения однократной дозы варфарина (25 мг). На основании определения международного нормализованного отношения (МНО) клинически значимых изменений фармакодинамических эффектов варфарина также не наблюдалось.
Несовместимость
Вещества, добавленные к препарату, могут вызвать деградацию семаглутида. Препарат нельзя смешивать с другими лекарственными средствами, в том числе с инфузионными растворами.
Меры предосторожности
Применение семаглутида противопоказано у пациентов с СД1 или для лечения диабетического кетоацидоза.
Семаглутид не заменяет инсулин.
Реакции со стороны желудочно-кишечного тракта
Применение агонистов ГПП-1Р может быть ассоциировано с HP со стороны желудочно-кишечного тракта. Это следует учитывать при лечении пациентов с почечной недостаточностью, так как тошнота, рвота и диарея могут привести к дегидратации и ухудшению функции почек.
Острый панкреатит
При применении агонистов ГПП-1Р наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия семаглутидом должна быть прекращена; в случае подтверждения острого панкреатита терапию семаглутидом возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором развития острого панкреатита.
Гипогликемия
Пациенты, получающие семаглутид в комбинации с производным сульфонилмочевины или инсулином, могут иметь повышенный риск развития гипогликемии. В начале лечения семаглутидом риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина.
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов с наличием диабетической ретинопатии, получающих терапию инсулином и семаглутидом (см. раздел «Побочное действие»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией, получающих инсулинотерапию. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями. Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением состояния диабетической ретинопатии, однако при этом нельзя исключать и другие причины.
Сердечная недостаточность
Отсутствует опыт применения семаглутида у пациентов с ХСН Ⅳ функционального класса в соответствии с классификацией NYHA. Применение препарата у таких пациентов противопоказано.
Заболевания щитовидной железы
В пострегистрационном периоде применения другого аналога ГПП-1, лираглутида, были отмечены случаи медуллярного рака щитовидной железы (МРЩЖ). Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения МРЩЖ с применением аналогов ГПП-1. Необходимо проинформировать пациента о риске МРЩЖ и о симптомах опухоли щитовидной железы (появления уплотнения в области шеи, дисфагии, одышки, непроходящей охриплости голоса).
Значительное повышение концентрации кальцитонина в плазме крови может указывать на МРЖЩ (у пациентов с МРЖЩ значения концентрации кальцитонина в плазме крови обычно >50 нг/л). При выявлении повышения концентрации кальцитонина в плазме крови следует провести дальнейшее обследование пациента. Пациенты с узлами в щитовидной железе, выявленными при медицинском осмотре или при проведении УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Применение семаглутида у пациентов с личным или семейным анамнезом МРЩЖ или с синдромом МЭН типа 2 противопоказано.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В 2-летних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для группы аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключён.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Влияние на способность к вождению автотранспорта и управлению механизмами
Семаглутид не влияет или незначительно влияет на способность управлять транспортными средствами или работу с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно при применении семаглутида в комбинации с производным сульфонилмочевины или инсулином.
Классификация
-
АТХ
A10BJ06
-
Фармакологическая группа
-
Код МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Семаглутид предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Семаглутид, содержатся в инструкции производителя, прилагаемой к упаковке.
Начиная с 2005 г. агонисты рецепторов глюкагоноподобного пептида-1 (арГПП-1) стали признанным классом препаратов в терапии сахарного диабета 2-го типа (СД2) [1]. Представители этого класса препаратов зарекомендовали себя в качестве эффективной патогенетической опции с позиции значимого сахароснижающего действия, благоприятного влияния на вес и низкого риска развития гипогликемических событий [2].
Помимо этого, российские и зарубежные рекомендации выделяют класс арГПП-1 наряду с классом ингибиторов натрий-глюкозного котранспортера-2 (иНГЛТ-2) как предпочтительные препараты второй линии после метформина у пациентов, имеющих анамнез или высокий риск развития сердечно-сосудистых заболеваний (ССЗ) [3][4]. Дополнительно в руководстве Американского Колледжа Кардиологов совместно с Американской Ассоциацией Сердца в отношении профилактики риска сердечно-сосудистых событий у пациентов с СД2 выделяется преимущественное действие арГПП-1 в отношении атеросклеротических событий, в то время как иНГЛТ-2 влияют на хроническую сердечную недостаточность [5].
Метаанализ и результаты крупномасштабного проспективного наблюдательного исследования CAPTURE показали, что в структуре широкой популяции пациентов с СД2 около одной трети уже имеют в истории болезни данные о сердечно-сосудистых катастрофах и неблагоприятных событиях атеросклеротического генеза [6][7]. При этом известно, что с позиции гликемического контроля заболевания во всем мире только около половины пациентов с СД2 достигают целевых значений уровня гликированного гемоглобина (HbA1c) [8 –10].
Несмотря на значительную потребность в назначении представителей современных классов сахароснижающих препаратов, как международные, так и российские данные свидетельствуют о низкой частоте их применения. Так, по анализу базы данных США только 5,4% пациентов с СД2 без ССЗ и 4,1% с ССЗ были назначены арГПП-1 [11]. В структуре сахароснижающей терапии, по данным Российского федерального регистра пациентов с СД2, назначение арГПП-1 не превышает 0,3% [12]. Более того, отсутствуют заметные различия по назначению кардиопротективных классов препаратов в зависимости от степени сердечно-сосудистого риска пациентов.
Низкую частоту назначений арГПП-1 частично связывают с тем, что до настоящего времени все представители класса были доступны для применения в форме подкожных инъекций — путь введения, который, вероятно, менее предпочтителен для пациентов, особенно на ранних этапах заболевания. В 2019 г. в США был одобрен к применению уже зарекомендовавший себя представитель класса арГПП-1 — семаглутид, но уже в таблетированной форме для перорального приема [13]. Затем препарат был одобрен в Европе и Японии, а в апреле 2021 г. препарат прошел регистрацию на территории Российской Федерации [14].
В данном обзоре будут освещены ключевые особенности фармакологического профиля перорального семаглутида, а также данные, полученные в ходе исследований клинической программы препарата (PIONEER), совокупно включившей в себя около 9500 пациентов с СД2.
ФАРМАКОЛОГИЧЕСКИЙ ПРОФИЛЬ ПЕРОРАЛЬНОГО СЕМАГЛУТИДА
Семаглутид является высокогомологичным (94% гомологии) рекомбинантным, длительно действующим аналогом человеческого ГПП-1. Возможность перорального применения данного арГПП-1 была достигнута за счет коформуляции с фармацевтически неактивным усилителем абсорбции — SNAC (соль натрия аминокаприловой кислоты). Усилитель абсорбции за счет изменения локальной кислотности в желудке, а также увеличения проницаемости его слизистой защищает молекулы препарата от деградации пищеварительными ферментами и обеспечивает всасывание мономеров семаглутида через стенку желудка в системный кровоток [15][16].
Ранние исследования второй фазы клинической программы показали, что, несмотря на длительный период полувыведения семаглутида (около недели), в связи с низкой биодоступностью пероральной формы (≈1%) принимать препарат необходимо один раз в день. Более того, с учетом очевидной чувствительности препарата к любым факторам, оказывающим влияние на абсорбцию, было показано, что необходимо соблюдение определенных условий приема, чтобы обеспечить наименьшее влияние этих факторов [15].
Так, необходимо исключить наличие любых посторонних субстратов при применении перорального семаглутида — будь то еда, напитки или другие препараты. Таблетку семаглутида рекомендуют принимать натощак минимум за 30 мин до еды, запивая чистой водой в объеме не более 120 мл (полстакана), так как в противном случае будет разбавляться его концентрация и нарушаться взаимоотношение активного и вспомогательного компонентов [15]. Концентрация вспомогательного компонента SNAC в составе также была подобрана для оптимизации биодоступности препарата. Было показано, что концентрация SNAC 300 мг обеспечивает наилучшее всасывание семаглутида, а повышение более 300 мг даже несколько снижает конечную концентрацию препарата в кровотоке. В этой связи не рекомендуют применение более одной таблетки перорального семаглутида, так как это может негативно сказаться на абсорбции препарата [17].
Несмотря на возможную вариабельность концентрации препарата, было продемонстрировано, что равновесная концентрация после ежедневного приема перорального семаглутида достигалась к концу первого месяца терапии [17]. В исследовании второй фазы по определению оптимальной дозы семаглутида в составе таблетки было показано, что хотя пероральное применение характеризуется низкой биодоступностью, с позиции клинической эффективности, безопасности и переносимости были достигнуты сопоставимые результаты между инъекционной и пероральной формой препарата [18].
КЛИНИЧЕСКАЯ ПРОГРАММА
На основании исследований второй фазы в клиническую программу третьей фазы (PIONEER) были отобраны дозы 3 мг (инициирующая), 7 мг, 14 мг (терапевтические) перорального семаглутида для возможности поэтапной эскалации дозы препарата с целью нивелирования характерных для арГПП-1 диспептических явлений и достижения максимальной клинической эффективности. Применение перорального семаглутида у пациентов в рамках клинической программы осуществлялось в соответствии с вышеописанными условиями приема [18].
Данные клинической программы анализировались в соответствии с руководством международного совета по гармонизации технических требований к регистрации лекарств для медицинского применения (ICN) с кодовым номером Е9. Для расчета результатов были использованы две оценки эффектов, достигнутых в исследовании: оценка по стратегии терапии и оценка по эффективности препарата. Первая оценивала результат в каждой группе всех рандомизированных пациентов исследования независимо от того, назначались ли пациентам дополнительные препараты или они прекращали прием исследуемого препарата. В данном обзоре представлены результаты в соответствии со вторым способом оценки эффективности препарата, поскольку так результаты не скомпрометированы дополнительными терапевтическими интервенциями для лечения СД2 у пациентов, включенных в программу исследований (рис. 1 ) [19][20].
Рис. 1. Результаты анализа оценки эффективности препарата в исследованиях клинической программы PIONEER.
А — эффективность по влиянию на HbA1c; В — влияние препаратов на вес.
Клиническая программа разработки перорального семаглутида состояла из 8 исследований третьей фазы и включила 9543 пациента. Было проведено исследование семаглутида в сравнении с плацебо в качестве монотерапии (PIONEER 1), в дополнение к инсулину (PIONEER 
Основные характеристика пациентов представлены в таблице 1.
Таблица 1. Основные характеристики пациентов, включенных в программу PIONEER
|
Особенность / группа сравнения |
Плацебо-контролируемые исследования |
Исследования с активным контролем |
|||||
|
PIONEER 1 |
PIONEER 5 |
PIONEER 8 |
PIONEER 4 |
PIONEER 2 |
PIONEER 3 |
PIONEER 7 |
|
|
моно- |
ХБП |
инсулин |
лира- |
эмпа- |
сита- |
сита- |
|
|
Пациенты, n |
703 |
324 |
731 |
711 |
822 |
1864 |
504 |
|
Возраст, лет |
55 (11) |
70 (8) |
61 (10) |
56 (10) |
58 (10) |
58 |
57 (9,9) |
|
Длительность СД2, лет |
3,5 (4,9) |
14 (8,0) |
15 (8,1) |
7,6 (5,5) |
7,5 (6,1) |
8,6 |
8,8 (6,2) |
|
HbA1c, % |
8,0 |
8,0 |
8,2 |
8,0 |
8,1 |
8,3 |
8,3 |
|
Вес, кг |
88,1 |
90,8 |
85,9 |
94,0 |
91,6 |
91,2 |
88,6 |
МОНОТЕРАПИЯ ПЕРОРАЛЬНЫМ СЕМАГЛУТИДОМ
В исследовании PIONEER 1 оценивались эффективность и безопасность монотерапии пероральным семаглутидом в сравнении с плацебо у пациентов с СД2, находящихся только на диете в сочетании с физическими упражнениями. Совокупно в исследовании участвовали 703 пациента с некомпенсированным СД2 (HbA1c 7–9%). Пациенты были распределены в 4 группы: 3 группы находились на терапии пероральным семаглутидом в дозах 3 мг, 7 мг, 14 мг соответственно; в 4-й группе пациенты принимали плацебо. По результатам 26 недель терапии скорректированная по плацебо разница снижения HbA1c в группе семаглутида варьировала от -0,7% до -1,4% (p<0,001 для всех доз). На фоне терапии семаглутидом 14 мг было продемонстрировано наиболее значимое снижение веса (на -2,3 кг большее снижение в сравнении с плацебо). Наиболее частыми нежелательными явлениями были транзиторные диспептические явления средней и легкой степени тяжести — характерное явление для представителей класса арГПП-1 [21].
ИНТЕНСИФИКАЦИЯ САХАРОСНИЖАЮЩЕЙ ТЕРАПИИ
В исследовании PIONEER 2 применение перорального семаглутида в дозе 14 мг сравнивалось с применением иНГЛТ-2 — эмпаглифлозином 25 мг. Исследование длилось 52 недел,и и в нем принял участие 821 пациент. Средняя длительность СД2 составила примерно 7 лет, а исходный уровень HbA1c около 8%, средний вес пациентов был 92 кг. На 26-й неделе терапии на фоне приема перорального семаглутида было отмечено значимое снижение HbA1c (-1,4% против -0,9%, p<0,0001). Что более существенно, значимая разница удерживалась и до завершения исследования на 52-й неделе (-1,3% против -0,8%, p<0,0001). Около 72% пациентов в группе семаглутида достигли цели терапии по снижению HbA1c<7% против 48% на терапии эмпаглифлозином. На фоне применения обоих препаратов было продемонстрировано снижение веса: на 26-й неделе снижение составило -4,2 кг и -3,8 кг на фоне терапии семаглутидом и эмпаглифлозином соответственно. Однако на терапии эмпаглифлозином дальнейшего снижения веса в ходе исследования не наблюдалось, в то время как у пациентов на фоне применения перорального семаглутида продолжалась дальнейшая коррекция массы тела (-4,7 кг против -3,8 кг, p=0,01) [22].
В исследовании PIONEER 4 сравнение эффективности и безопасности перорального семаглутида 14 мг оценивалось против терапии инъекционным арГПП-1 — лираглутидом 1,8 мг. Исследование имело двойное заслепление с позиции приема препаратов: пациенты принимали препарат исследования и плацебо в соответствующей форме выпуска, а для целей полного контроля эффекта была введена группа полного плацебо. По завершении исследования в группе терапии семаглутидом было отмечено значимое превосходство как по снижению HbA1c, так и по снижению веса в сравнении с лираглутидом и плацебо (снижение HbA1c: -1,2%, -0,9% и 0,2% соответственно; веса: -5,0 кг, -3,1 кг и -1,2 кг соответственно). Как было отмечено ранее, частота нежелательных явлений на фоне терапии семаглутидом сопоставима с классом арГПП-1. В исследовании PIONEER 4 у пациентов на фоне терапии пероральным семаглутидом 14 мг был сходный профиль нежелательных явлений в сравнении с лираглутидом 1,8 мг с наиболее частым проявлением гастроинтестинальных реакций в виде тошноты, диареи или рвоты. Все явления имели среднюю или легкую степень тяжести и носили транзиторный характер, пик развития эпизодов тошноты приходился на 8-ю неделю с дальнейшим затуханием частоты этого явления [23].
В исследованиях PIONEER 3 и PIONEER 7 пероральный семаглутид в дозах 3, 7 и 14 мг сравнивался с терапией ситаглиптином 100 мг у пациентов, находящихся на терапии 1–2 сахароснижающими препаратами. Длительность СД2 составила около 9 лет, средний HbA1c 8,3%, а масса тела — 90 кг.
Исследование PIONEER 3 длилось 78 недель и продемонстрировало, что к 26-й неделе уже была достигнута первичная конечная точка в отношении превосходства по снижению HbA1c на фоне терапевтических доз семаглутида 7 мг (-1,1%) и 14 мг (-1,4%) в сравнении с ситаглиптином 100 мг. По завершении исследования к 78-й неделе преимущество терапевтических доз семаглутида над ситаглиптином сохранялось. К 78-й неделе также было продемонстрировано значимое снижение веса в группе семаглутида 3, 7 и 14 мг по сравнению с ситаглиптином 100 мг: -1,9, -2,2, -3,4 кг и -1,1 кг соответственно [24].
Другое исследование сравнения перорального семаглутида с ситаглиптином — PIONEER 7 — имело свои особенности. Хоть оно и было рандомизированным, но было приближено к реальной практике: исследование было открытым, дозу семаглутида пациентам повышали в зависимости от компенсации гликемии или переносимости препарата. Основной конечной точкой было достижение целей терапии — HbA1c <7,0%. Исследование также состояло из двух фаз по 52 нед. В первой фазе пациенты (n=504) принимали препараты в соответствии с рандомизацией, во второй пациенты, находившиеся на терапии пероральным семаглутидом, продолжали прием, а пациенты из группы ситаглиптина были перерандомизированы в группу продолжающих прием ситаглиптина или переключающихся на терапию семаглутидом.
По завершении первой фазы исследования PIONEER 7 структура распределения доз семаглутида 3, 7 и 14 мг составила 10, 30 и 60% соответственно, что позволило 63% пациентов достигнуть HbA1c <7% в сравнении с 23% на терапии ситаглиптином 100 мг. Средняя межгрупповая разница снижения HbA1c составила -0,7%. Во второй фазе пациенты, находившиеся исходно на терапии семаглутидом, поддерживали устойчивый гликемический контроль вплоть до завершения исследования на 104-й неделе, к тому же демонстрировали дальнейшее снижение веса (-2,8 кг на 52-й неделе и -3,7 кг на 104-й неделе). Пациенты, которые оставались на терапии ситаглиптином 100 мг в период 52–104-й недели, демонстрировали повышение HbA1c на +0,1%, в то время как у пациентов, переключившихся на семаглутид при распределении доз 13, 20 и 66 соответственно, была продемонстрирована тенденция на дальнейшее снижение HbA1c -0,3%, притом большее число пациентов имели уровень HbA1c<7,0% (53% против 29%) (рис. 2) [25][26].
Рис. 2. Снижение уровня гликированного гемоглобина от исходного в исследовании PIONEER 7 при гибкой коррекции дозы семаглутида.
Представлены обе фазы исследования с соответствующим распределением дозы семаглутида по завершении каждой из фаз.
ИССЛЕДОВАНИЯ У ПАЦИЕНТОВ С ДЛИТЕЛЬНЫМ САХАРНЫМ ДИАБЕТОМ 2 ТИПА И В ОСОБЫХ КЛИНИЧЕСКИХ СИТУАЦИЯХ
В исследовании PIONEER 8 участвовали пациенты, находившиеся на инсулинотерапии. Они были несколько старше пациентов вышеупомянутых исследований, и средняя длительность СД2 составляла 15 лет. В исследовании оценивали эффективность терапии семаглутидом в дозах 3, 7 и 14 мг на фоне продолжающейся инсулинотерапии (с метформином или без него), также в исследовании была группа плацебо. В исследование был рандомизирован 731 пациент в соотношении 1:1:1:1. Средняя исходная доза инсулина составляла около 60 Ед.
По результатам исследования было показано, что во всех группах терапии семаглутидом наблюдалось значимое изменение HbA1c: -0,5, -1,0, -1,4% соответственно дозе. У большой доли пациентов удалось достичь целей терапии к окончанию исследования, в частности, достижение HbA1c <6,5% было отмечено у 11,6, 19,5, 38,7 и 2,3% для 3, 7, 14 мг и плацебо соответственно. Также было продемонстрировано значимое снижение веса в группе терапии семаглутидом от -1,0 кг до -4,3 кг в сравнении с плацебо [27]. Эффективность терапии семаглутидом не зависела от исходного типа применяемого режима инсулина, будь то базальный, базис-болюсный или двухфазный режим [28].
Более того, дополнительная сахароснижающая терапия требовалась меньшей доле пациентов в группе семаглутида: 29,3, 18,1, 17,1 и 36,4% для 3, 7, 14 мг и плацебо соответственно. Аналогичная ситуация наблюдалась и с позиции интенсификации инсулина, она потребовалась 27,2, 17,6, 13,8 и 32,6 пациентов для 3, 7, 14 мг и плацебо соответственно [27]. Дополнительно на фоне терапии семаглутидом было отмечено в среднем снижение требуемой дозы инсулина на 2–9 Ед, в то время как среднее повышение дозы в группе плацебо составило 7–9 Ед [28].
Возможность применения перорального семаглутида оценивалась и у пациентов с различными коморбидными состояниями. В ранних фармакокинетических исследованиях не было продемонстрировано значимого влияния на концентрацию семаглутида при нарушениях функции почек и печени [17][29]. В этой связи коррекция дозы семаглутида при данных нарушениях не требуется.
Клиническая эффективность семаглутида при нарушении функции почек оценивалась в исследовании PIONEER 5. В это исследование были рандомизированы 324 пациента в возрасте 70 лет, с длительностью СД 2 14 лет и со средней расчётной скоростью клубочковой фильтрации 48 мл/мин/1,73 м2. Пациенты находились на сопутствующей терапии метформином и/или производными сульфонилмочевины, на терапии базальным инсулином (с или без метформина). По результатам исследования на терапии семаглутидом в дозе 14 мг у пациентов с нарушением функции почек наблюдалось значимое снижение HbA1c на -1,1% и снижение веса на -3,7 кг в сравнении с плацебо (-0,1% и -1,1 кг). Эффект терапии не зависел от исходной скорости клубочковой фильтрации. Также в исследовании отметили отсутствие негативного влияния семаглутида на фильтрационную способность почки и тенденцию по снижению показателя отношения альбумина к креатинину на фоне терапии [30].
Потенциальные особенности действия препарата на фоне коморбидных состояний могут определяться наличием заболеваний верхних отделов желудочно-кишечного тракта и приёмом дополнительных препаратов. Было продемонстрировано, что наличие таких заболеваний, как хронических гастрит или гастроэзофагеальная рефлюксная болезнь не оказывает влияния на эффективную концентрацию семаглутида, соответственно, коррекции дозы у данной группы пациентов не требуется [31]. Дополнительно отдельно было отмечено отсутствие влияния приема ингибиторов протонной помпы (омепразола) на параметры концентрации перорального семаглутида. Однако в этом же анализе обратили внимание на некоторое повышение экспозиции левотироксина при одновременном приеме с пероральным семаглутидом. Соответственно, исследователи рекомендуют производить мониторинг параметров щитовидной железы в подобных клинических ситуациях [32].
ДОПОЛНИТЕЛЬНЫЕ АНАЛИЗЫ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ПЕРОРАЛЬНОГО СЕМАГЛУТИДА
По завершении клинической программы был проведен обобщающий метаанализ общей клинической эффективности и безопасности семаглутида для приема внутрь в терапевтических дозах 7 мг и 14 мг. По результатам анализа по всем исследованиям PIONEER было получено, что в сравнении с плацебо семаглутид в среднем снижал HbA1c на 1,04% (-1,26%, -0,83%), а в сравнении с любыми препаратами сравнения значимо превосходил их по эффекту на HbA1c на дополнительные -0,33% (-0,46%, -0,21%). При этом по сравнению с любыми активными препаратами почти в 1,5 раза была выше вероятность достичь HbA1c<7,0%. Влияние на вес также было более значимым как по сравнению с плацебо, так и по сравнению с активными препаратами (-2,52 кг (-3,37 кг, -1,67 кг)). Риск любых нежелательных явлений (общий профиль безопасности, серьёзные нежелательные явления, гипогликемии, панкреатит) в целом не отличался на фоне терапии семаглутидом, плацебо или активным контролем. Однако, как отмечено ранее, на фоне терапии семаглутидом была отмечена более высокая частота диспептических расстройств (тошнота примерно в 3 раза чаще, чем в группах сравнения) [33].
В других анализах оценивали влияние разных факторов на продемонстрированную эффективность семаглутида в клинической программе PIONEER. Было показано, что клиническая эффективность препарата дозозависимая, но не зависит от исходного профиля пациента, будь то раса [34], возраст [34], длительность СД 2 [36] или фоновая сахароснижающая терапия (метформин, производные сульфонилмочевины, иНГЛТ-2, инсулин или другие и их комбинации) [23].
СЕРДЕЧНО-СОСУДИСТАЯ БЕЗОПАСНОСТЬ
Ранее семаглутид изучался на предмет сердечно-сосудистой безопасности в форме препарата для подкожного введения в исследовании SUSTAIN 6. Исследование продолжалось более 2 лет и обладало достаточной базой для демонстрации сердечно-сосудистого преимущества препарата. По результатам исследования SUSTAIN 6 было установлено, что добавление инъекционного семаглутида к стандарту терапии пациентов с СД2 и высоким сердечно-сосудистым риском приводило к снижению относительного риска наступления неблагоприятного исхода (MACE) на четверть по сравнению с плацебо [отношение рисков (ОР) 95% ДИ 0,74 (0,58– 0,95)] [25]. Притом при последующих анализах было показано, что этот эффект был стабилен на протяжении всего исследования и не зависел ни от исходного сердечно-сосудистого риска или наличия микрососудистых осложнений в анамнезе, ни от длительности СД2, ни от других антроподемографических характеристик включенных пациентов [28–31].
Несмотря на упомянутые результаты исследования SUSTAIN 6, в отношении семаглутида для перорального применения, как для всех новых препаратов, также должно было быть удовлетворено требование подтвердить отсутствие негативного действия препарата на сердечно-сосудистую систему [32]. Таким образом, в клинической программе перорального семаглутида отдельное место заняло исследование сердечно-сосудистых исходов — PIONEER 6. Исследование имело сходный дизайн с SUSTAIN 6, но преследовало своей целью подтвердить безопасность препарата, поэтому было непродолжительным (меньше 16 мес) и не стремилось набрать достаточную мощность для доказательства преимущества. В исследование вошли 3183 пациента, около 85% пациентов высокого сердечно-сосудистого риска, средний возраст составил 66 лет, а длительность СД2 — около 15 лет.
По результатам исследования PIONEER 6 было продемонстрировано, что пероральный семаглутид в дозе 14 мг был безопасен и численно снижал риск крупных сердечно-сосудистых катастроф на 21% [ОР 95% ДИ 0,79 (0,57–1,11), p=0,2]. В отношении вторичной конечной точки обращает на себя внимание то, что на фоне терапии пероральным семаглутидом снижался риск сердечно-сосудистой смерти [снижение на 51%; ОР 95% ДИ 0,49 (0,27–0,92), p=0,03]; а также соразмерно был ниже относительный риск смерти по любым причинам [снижение на 49%; ОР 95% ДИ 0,51 (0,51–0,84), p=0,008] (рис. 3) [33].
Рис. 3. Время до первого комбинированного исхода крупных сердечно-сосудистых событий.
А — кривые Каплана-Мейера по времени наступления MACE [комбинированного крупного сердечно-сосудистого события — сердечно-сосудистой смерти, инсульта без смертельного исхода, инфаркта без смертельного исхода]. В — частота сердечно-сосудистой смерти и смерти по любой причине. ОР — относительный риск, ДИ — доверительный интервал.
В дальнейшем, с учетом сходного дизайна SUSTAIN 6 и PIONEER 6, сопоставимости и однонаправленности полученных результатов, был проведен ряд совокупных анализов, включивших популяцию обоих исследований. Совокупная популяция объединенных данных составила 6480 участников. Было получено, что совокупный эффект семаглутида остается примерно в тех же рамках — на 24% снижение относительного риска MACE [ОР 95% ДИ 0,76 (0,62–0,92)]. При этом эффект опять же был однороден по подгруппам исходного сердечно-сосудистого риска [34].
Дополнительно, устойчивость результатов по совокупной популяции пациентов в исследованиях сердечно-сосудистой безопасности семаглутида проанализировали с позиции классификации исходного риска в исследовании REWIND, в котором исследовалась безопасность дулаглутида у пациентов с множественными сердечно-сосудистыми факторами риска. По результатам данного анализа в исследованиях с семаглутидом 2170 пациентов характеризовались как пациенты с факторами риска, а 4130 — с анамнезом ССЗ. Полученные данные свидетельствовали об однородном эффекте семаглутида у обеих групп пациентов [35].
Это было подтверждено в недавнем анализе, который также включал популяцию исследований SUSTAIN 6 и PIONEER 6. В этом анализе полностью сопоставили исходный профиль пациентов на терапии семаглутидом с исходным профилем пациентов на терапии дулаглутидом в исследовании REWIND. По результатам проведенного сбалансированного непрямого анализа было получено, что 2633 пациента на терапии семаглутидом для подкожного применения и 2491 пациент на терапии пероральным семаглутидом удовлетворяли исходному профилю сердечно-сосудистого анамнеза пациентов в исследовании REWIND. Было показано, что в подобной популяции пациентов на терапии семаглутидом в сравнении с плацебо снижался риск MACE на 33% (p<0,001), а в сравнении с дулаглутидом — на 24% [ОР 95% ДИ 0,76 (0,58–0,99), p=0,04] [36].
Дальнейшее исследование сердечно-сосудистых преимуществ перорального семаглутида изучается в крупномасштабном исследовании SOUL: совокупная популяция — 9650 пациентов, продолжительность 5 лет (NCT03914326). Результаты исследования будут представлены ближе к 2025 г. [37].
ЗАКЛЮЧЕНИЕ
С учетом нарастающего числа пациентов с СД2 и бремени, которое ложится как на пациентов, так и на врачебное сообщество, необходимо шире внедрять терапевтические опции, отраженные в клинических рекомендациях всего мира. Появление перорального семаглутида знаменует собой новый этап, так как предоставляет возможность более раннего назначения арГПП-1, доказавших свою значимую клиническую эффективность.
Данные клинической программы PIONEER подтверждают значимое преимущество перорального семаглутида перед другими сахароснижающими препаратами, влияние препарата на вес, а также его профиль безопасности.
Вероятно, семаглутид в форме таблеток позволит преодолеть барьер инъекционного назначения арГПП-1. Однако стоит помнить об особенностях как самого препарата, так и класса в целом, и настраивать пациентов в отношении соблюдения режима применения перорального семаглутида как с позиции достижения максимальной клинической эффективности, так и с учетом скорости титрации дозы для определения ее переносимости.
Важно помнить, что это первый арГПП-1, доступный в форме таблеток, и для корректного полного всасывания препарат необходимо принимать натощак, запивая половиной стакана воды за 30 мин до еды или приема других препаратов. Пациентам необходимо разъяснять, что ожидаемые эффекты тошноты могут возникать при инициации и эскалации терапии и что эти явления носят временный характер.
С учетом современных рекомендаций расширения использования арГПП-1 у разных профилей пациентов, наличие пероральной формы семаглутида при соблюдении вышеописанных условий поможет расширить успешную практику применения этих препаратов (или препаратов этого класса) на ранних этапах заболевания.
Список литературы
1. Rodbard HW. The Clinical Impact of GLP-1 Receptor Agonists in Type 2 Diabetes: Focus on the Long-Acting Analogs. Diabetes Technol Ther. 2018;20(S2):S2-33-S2-41. doi: https://doi.org/10.1089/dia.2018.0103
2. Nauck MA, Meier JJ. Management of endocrine disease: Are all GLP-1 agonists equal in the treatment of type 2 diabetes? Eur J Endocrinol. 2019;181(6):R211-R234. doi: https://doi.org/10.1530/EJE-19-0566
3. American Diabetes Association. 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes—2020. Diabetes Care. 2020;43(S1):S98-S110. doi: https://doi.org/10.2337/dc20-S009
4. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — №S1. — С. 1-144. doi: https://doi.org/10.14341/DM221S1
5. Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease. J Am Coll Cardiol. 2019;74(10):e177-e232. doi: https://doi.org/10.1016/j.jacc.2019.03.010
6. Einarson TR, Acs A, Ludwig C, Panton UH. Prevalence of cardiovascular disease in type 2 diabetes: a systematic literature review of scientific evidence from across the world in 2007–2017. Cardiovasc Diabetol. 2018;17(1):83. doi: https://doi.org/10.1186/s12933-018-0728-6
7. Mosenzon O, et al. CAPTURE: a cross-sectional study of the contemporary (2019) prevalence of cardiovascular disease in adults with type 2 diabetes across 13 countries. Abstract # 158 (Conference proceedigs). 56th Annual Meeting of the European-Association-for-the-Study-of-Diabetes (EASD), ELECTR NETWORK. 2020.
8. Lipska KJ, Yao X, Herrin J, et al. Trends in Drug Utilization, Glycemic Control, and Rates of Severe Hypoglycemia, 2006–2013. Diabetes Care. 2017;40(4):468-475. doi: https://doi.org/10.2337/dc16-0985
9. Gagliardino JJ, Atanasov PK, Chan JCN, et al. Resource use associated with type 2 diabetes in Africa, the Middle East, South Asia, Eurasia and Turkey: results from the International Diabetes Management Practice Study (IDMPS). BMJ Open Diabetes Res Care. 2017;5(1):1-10. doi: https://doi.org/10.1136/bmjdrc-2016-000297
10. Shestakova M, et al. Epidemiology of diabetes in Russian Federation: What has changed over 2007-2019 yr? Abstract #339 (Conference proceedigs). 56th Annual Meeting of the European-Association-for-the-Study-of-Diabetes (EASD), ELECTR NETWORK. 2020.
11. Pantalone KM, Misra-Hebert AD, Hobbs TM, et al. Antidiabetic treatment patterns and specialty care utilization among patients with type 2 diabetes and cardiovascular disease. Cardiovasc Diabetol. 2018;17(1):54. doi: https://doi.org/10.1186/s12933-018-0699-7
12. Vikulova O, et al. Glucose lowering medications use according to cardiac complications in patients with type 2 diabetes in real clinical practice. Abstract # 890. (Conference proceedigs) 56th Annual Meeting of the European-Association-for-the-Study-of-Diabetes (EASD, ELECTR NETWORK. 2020.
13. Rybelsus. Prescribing information. Novo Nordisk Inc; 2020. [Internet]. Accessed April 20, 2020. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/209637s003lbl.pdf
14. Ребелсас®. ЛП-006910. [Internet]. Available from: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=5906891a-6bf5-4eda-9ddf-982fe3d32f4b&t=
15. Buckley ST, Bækdal TA, Vegge A, et al. Transcellular stomach absorption of a derivatized glucagon-like peptide-1 receptor agonist. Sci Transl Med. 2018;10(467):eaar7047. doi: https://doi.org/10.1126/scitranslmed.aar7047
16. Brayden DJ, Gleeson J, Walsh EG. A head-to-head multi-parametric high content analysis of a series of medium chain fatty acid intestinal permeation enhancers in Caco-2 cells. Eur J Pharm Biopharm. 2014;88(3):830-839. doi: https://doi.org/10.1016/j.ejpb.2014.10.008
17. Granhall C, Donsmark M, Blicher TM, et al. Safety and Pharmacokinetics of Single and Multiple Ascending Doses of the Novel Oral Human GLP-1 Analogue, Oral Semaglutide, in Healthy Subjects and Subjects with Type 2 Diabetes. Clin Pharmacokinet. 2019;58(6):781-791. doi: https://doi.org/10.1007/s40262-018-0728-4
18. Davies M, Pieber TR, Hartoft-Nielsen M-L, Hansen OKH, Jabbour S, Rosenstock J. Effect of Oral Semaglutide Compared With Placebo and Subcutaneous Semaglutide on Glycemic Control in Patients With Type 2 Diabetes. JAMA. 2017;318(15):1460. doi: https://doi.org/10.1001/jama.2017.14752
19. fda.gov [Internet]. E9(R1) Statistical Principles for Clinical Trials: Addendum: Estimands and Sensitivity Analysis in Clinical Trials. [cited 2021 May 18]. Available from: https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM582738.pdf. (Ссылка активна на июнь 2021 года).
20. Aroda VR, Saugstrup T, Buse JB, et al. Incorporating and interpreting regulatory guidance on estimands in diabetes clinical trials: The PIONEER 1 randomized clinical trial as an example. Diabetes, Obes Metab. 2019;21(10):2203-2210. doi: https://doi.org/10.1111/dom.13804
21. Aroda VR, Rosenstock J, Terauchi Y, et al. PIONEER 1: Randomized Clinical Trial of the Efficacy and Safety of Oral Semaglutide Monotherapy in Comparison With Placebo in Patients With Type 2 Diabetes. Diabetes Care. 2019;42(9):1724-1732. doi: https://doi.org/10.2337/dc19-0749
22. Rodbard HW, Rosenstock J, Canani LH, et al. Oral Semaglutide Versus Empagliflozin in Patients With Type 2 Diabetes Uncontrolled on Metformin: The PIONEER 2 Trial. Diabetes Care. 2019;42(12):2272-2281. doi: https://doi.org/10.2337/dc19-0883
23. Pratley R, Amod A, Hoff ST, et al. Oral semaglutide versus subcutaneous liraglutide and placebo in type 2 diabetes (PIONEER 4): a randomised, double-blind, phase 3a trial. Lancet. 2019;394(10192):39-50. doi: https://doi.org/10.1016/S0140-6736(19)31271-1
24. Rosenstock J, Allison D, Birkenfeld AL, et al. Effect of Additional Oral Semaglutide vs Sitagliptin on Glycated Hemoglobin in Adults With Type 2 Diabetes Uncontrolled With Metformin Alone or With Sulfonylurea. JAMA. 2019;321(15):1466-1480. doi: https://doi.org/10.1001/jama.2019.2942
25. Pieber TR, Bode B, Mertens A, et al. Efficacy and safety of oral semaglutide with flexible dose adjustment versus sitagliptin in type 2 diabetes (PIONEER 7): a multicentre, open-label, randomised, phase 3a trial. Lancet Diabetes Endocrinol. 2019;7(7):528-539. doi: https://doi.org/10.1016/S2213-8587(19)30194-9
26. Buse JB, Bode BW, Mertens A, et al. Long-term efficacy and safety of oral semaglutide and the effect of switching from sitagliptin to oral semaglutide in patients with type 2 diabetes: a 52-week, randomized, open-label extension of the PIONEER 7 trial. BMJ Open Diab Res Care. 2020;8:e001649. doi: https://doi.org/10.1136/bmjdrc-2020-001649
27. Zinman B, Aroda VR, Buse JB, et al. Efficacy, Safety, and Tolerability of Oral Semaglutide Versus Placebo Added to Insulin With or Without Metformin in Patients With Type 2 Diabetes: The PIONEER 8 Trial. Diabetes Care. 2019;42(12):2262-2271. doi: https://doi.org/10.2337/dc19-0898
28. Pratley RE, Crowley MJ, Gislum M, et al. Oral Semaglutide Reduces HbA1c and Body Weight in Patients with Type 2 Diabetes Regardless of Background Glucose-Lowering Medication: PIONEER Subgroup Analyses. Diabetes Ther. 2021;12(4):1099-1116. doi: https://doi.org/10.1007/s13300-020-00994-9
29. Baekdal TA, Thomsen M, Kupčová V, Hansen CW, Anderson TW. Pharmacokinetics, Safety, and Tolerability of Oral Semaglutide in Subjects With Hepatic Impairment. J Clin Pharmacol. 2018;58(10):1314-1323. doi: https://doi.org/10.1002/jcph.1131
30. Mosenzon O, Blicher TM, Rosenlund S, et al. Efficacy and safety of oral semaglutide in patients with type 2 diabetes and moderate renal impairment (PIONEER 5): a placebo-controlled, randomised, phase 3a trial. Lancet Diabetes Endocrinol. 2019;7(7):515-527. doi: https://doi.org/10.1016/S2213-8587(19)30192-5.
31. Meier JJ, Granhall C, Hoevelmann U, et al. 1013-P: Effect of Upper Gastrointestinal Disease on the Pharmacokinetics of Oral Semaglutide in Subjects with Type 2 Diabetes. Diabetes. 2019;68(S1):1013-P. doi: https://doi.org/10.2337/db19-1013-P
32. Bækdal TA, Breitschaft A, Navarria A, Hansen CW. A randomized study investigating the effect of omeprazole on the pharmacokinetics of oral semaglutide. Expert Opin Drug Metab Toxicol. 2018;14(8):869-877. doi: https://doi.org/10.1080/17425255.2018.1488965
33. Li J, He K, Ge J, Li C, Jing Z. Efficacy and safety of the glucagon-like peptide-1 receptor agonist oral semaglutide in patients with type 2 diabetes mellitus: A systematic review and meta-analysis. Diabetes Res Clin Pract. 2021;172:108656. doi: https://doi.org/10.1016/j.diabres.2021.108656
34. Desouza C, Amod A, Kallenbach K, et al. 930-P: Efficacy of Oral Semaglutide According to Race: An Exploratory Subgroup Analysis of the PIONEER Trial Program. Diabetes. 2020;69(S1):930-P. doi: https://doi.org/10.2337/db20-930-P
35. Aroda VR, Bauer R, Hertz CL, et al. 932-P: Efficacy and Safety of Oral Semaglutide by Baseline Age in the PIONEER Clinical Trial Program. Diabetes. 2020;69(S1):932-P. doi: https://doi.org/10.2337/db20-932-P
36. Haluzik M, et al. Efficacy of oral semaglutide according to diabetes duration: an exploratory subgroup analysis of the PIONEER trial programme. (Conference proceedigs). Abstract # 890. EASD 2019. Barcelona.
37. Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016;375(19):1834-1844. doi: https://doi.org/10.1056/NEJMoa1607141.
38. Jodar E, Seufert J, Damgaard LH, et al. SUSTAIN 6: a post-hoc analysis of the effect of semaglutide on cardiovascular outcomes over time in subjects with type 2 diabetes, European Heart Journal/ 2017;38(1):3910. doi: https://doi.org/10.1093/eurheartj/ehx504.3910
39. Verma S, Bain SC, Honoré JB, et al. Impact of microvascular disease on cardiovascular outcomes in type 2 diabetes: Results from the LEADER and SUSTAIN 6 clinical trials. Diabetes, Obes Metab. 2020;22(11):2193-2198. doi: https://doi.org/10.1111/dom.14140.
40. Verma S, Bain SC, Monk Fries T, et al. Duration of diabetes and cardiorenal efficacy of liraglutide and semaglutide: A post hoc analysis of the LEADER and SUSTAIN 6 clinical trials. Diabetes, Obes Metab. 2019;21(7):1745-1751. doi: https://doi.org/10.1111/dom.13698
41. Leiter LA, Bain SC, Hramiak I, et al. Cardiovascular risk reduction with once-weekly semaglutide in subjects with type 2 diabetes: a post hoc analysis of gender, age, and baseline CV risk profile in the SUSTAIN 6 trial. Cardiovasc Diabetol. 2019;18(1):73. doi: https://doi.org/10.1186/s12933-019-0871-8.
42. fda.gov [Internet]. Guidance for Industry. Diabetes Mellitus — Evaluating Cardiovascular Risk in New Antidiabetic Therapies to Treat Type 2 Diabetes. [cited 2021 May 18]. Available from: https://www.fda.gov/media/71297/download.
43. Husain M, Birkenfeld AL, Donsmark M, et al. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2019;381(9):841-851. doi: https://doi.org/10.1056/NEJMoa1901118
44. Husain M, Bain SC, Jeppesen OK, et al. Semaglutide (SUSTAIN and PIONEER) reduces cardiovascular events in type 2 diabetes across varying cardiovascular risk. Diabetes, Obes Metab. 2020;22(3):442-451. doi: https://doi.org/10.1111/dom.13955
45. Verma S, Fainberg U, Husain M, et al. Applying rewind cvd criteria to SUSTAIN 6 and PIONEER 6: an exploratory analysis of CV outcomes with semaglutide. J Am Coll Cardiol. 2020;75(11):1922. doi: https://doi.org/10.1016/S0735-1097(20)32549-3
46. Evans LM, Mellbin L, Johansen P, Lawson J, Paine A, Sandberg A. A population‐adjusted indirect comparison of cardiovascular benefits of once‐weekly subcutaneous semaglutide and dulaglutide in the treatment of patients with type 2 diabetes, with or without established cardiovascular disease. Endocrinol Diabetes Metab. 2021;4(3). doi: https://doi.org/10.1002/edm2.259
47. clinicaltrials.gov [Internet]. A Heart Disease Study of Semaglutide in Patients With Type 2 Diabetes (SOUL). [cited 2021 May 18]. Available from: https://clinicaltrials.gov/ct2/show/NCT03914326.

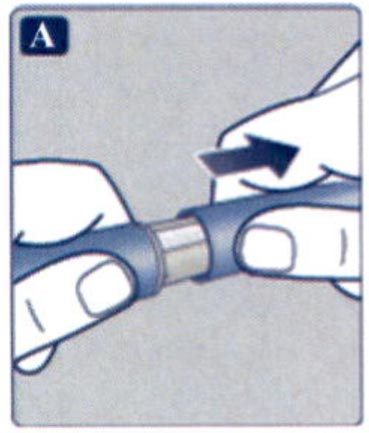

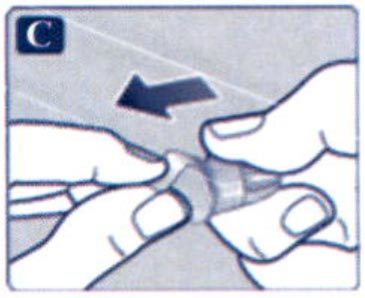
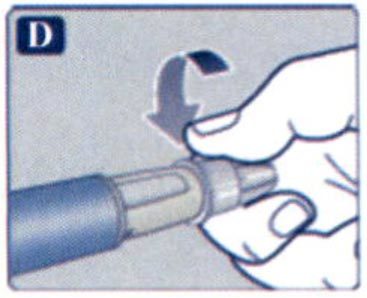
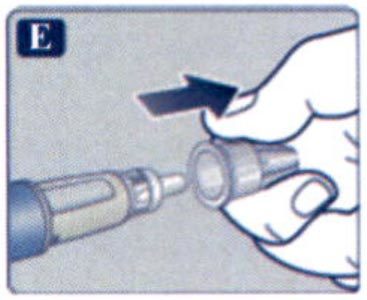
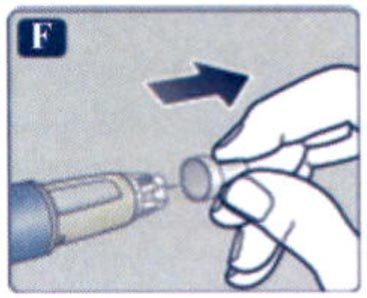
 Всегда для каждой инъекции используйте новую иглу.
Всегда для каждой инъекции используйте новую иглу. Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата. 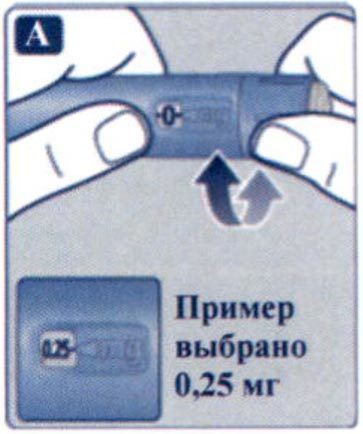
 Всегда перед каждой инъекцией проверяйте какое количество мг препарата Вы набрали по счётчику дозы и указателю дозы.
Всегда перед каждой инъекцией проверяйте какое количество мг препарата Вы набрали по счётчику дозы и указателю дозы.
 Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®. Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
 Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться. 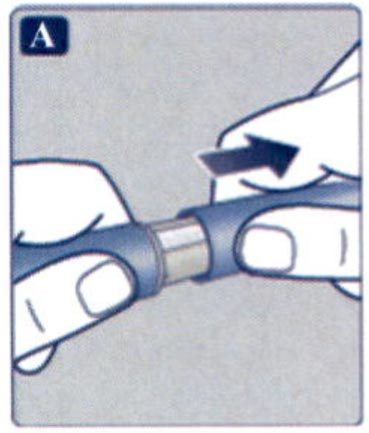
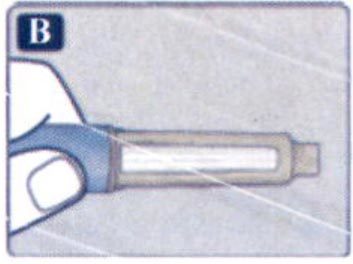
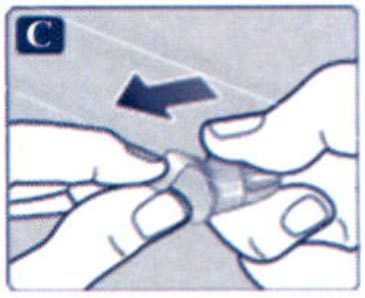
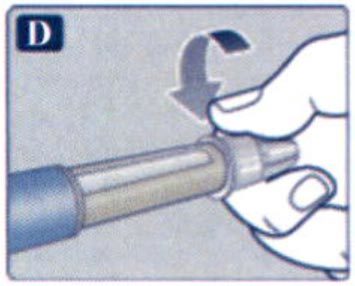
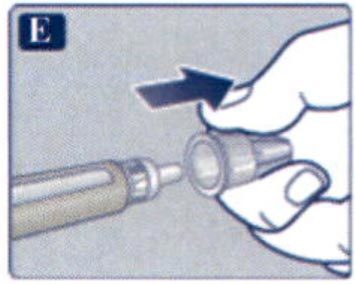
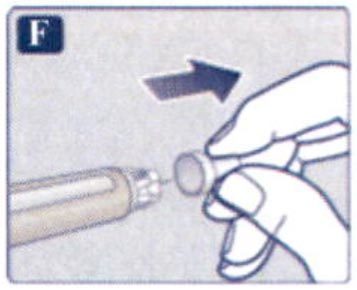
 Всегда для каждой инъекции используйте новую иглу.
Всегда для каждой инъекции используйте новую иглу. Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата. 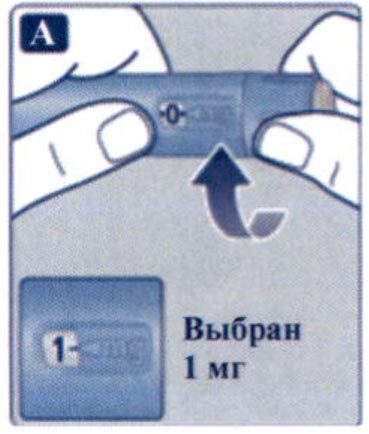
 Всегда перед каждой инъекцией но счётчику дозы и указателю дозы проверяйте, что был набран 1 мг.
Всегда перед каждой инъекцией но счётчику дозы и указателю дозы проверяйте, что был набран 1 мг.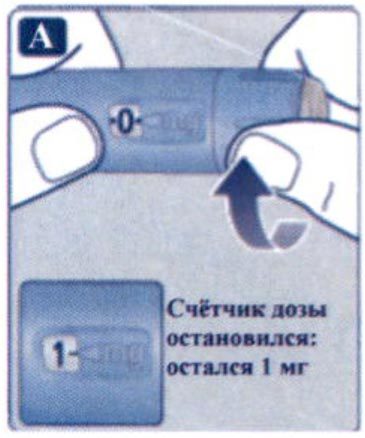
 Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®. 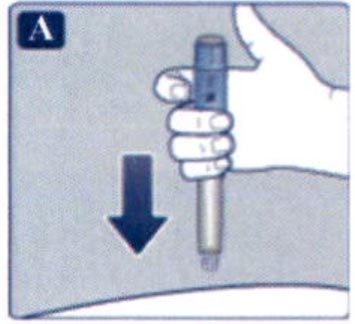
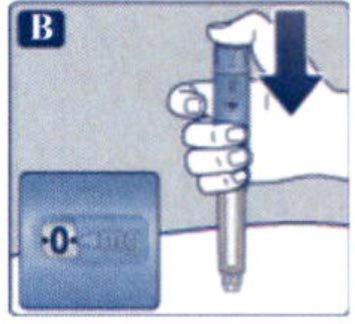
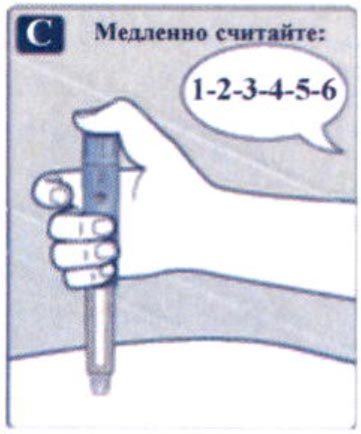
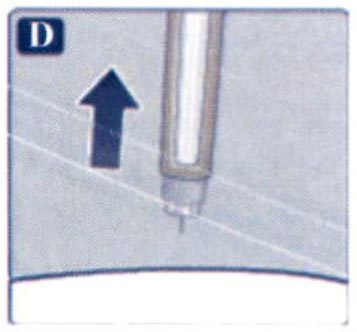
 Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться. 

