NatraBio, Hot Flashes Menopause, 60 Tablets: описание, полная инструкция на русском языке
NatraBio, Hot Flashes Menopause, 60 Tablets:
Описание
- Natural гомеопатическое Лекарство
обеспечивая естественный рельеф для симптомов:
- Menstrual нарушений
- Irritability
- Hot мигает
- Breast нежность
- Melancholy
Over
NatraBio с гордостью представляет вам новую эру в облегчению симптомов. Научно разработан для обеспечения быстрой, эффективной помощи в быстрой и удобной таблетке, продукты natrabio достаточно сильная для острые симптомы, но достаточно мягкий для детей.
For более 20 лет natrabio является лидером в области инноваций и науки для гомеопатических препаратов с глубокой приверженностью к качеству и удовлетворенности клиентов.
- Advanced составов
- All натуральные ингредиенты
- No сонливость
- Non-формирование привычки
- Fast, эффективный сброс симптома
- Convenient быстрорастворимых таблеток
NatraBio занимается выпуском передовых, натуральных товаров для здоровья, разрабатываемых и изготавливаемых по фармацевтическим стандартам.
использует для того чтобы облегчить симптомы менопаузы:
- Menstrual нарушений
- Irritability
- Hot мигает
- Breast нежность
- Melancholy и усталость
Over
NatraBio, Hot Flashes Menopause, 60 Tablets:
Рекомендации по Применению
- Women, жевать одну таблетку и дать раствориться во рту каждые 2 часа до улучшения симптомов
- Then принимать по 4 таблетки ежедневно или по мере необходимости для дальнейшего облегчения
- For достижения наилучших результатов принимать в чистом рот.
NatraBio, Hot Flashes Menopause, 60 Tablets:
Другие Ингредиенты
материалы
Активные ингредиенты
цель
материалы
Цимицифуга гасетоза 4х
симптомы менопаузы
материалы
Sanguinaria сера 4х
жара
материалы
ignatia амара 6х, 12х, 30х
усталость, капризность
материалы
helonias соединение двудомная 6х
усталость
материалы
сепия 6х, 12х, 30х
приливы, климакс, усталость
материалы
Oophorinum 12х
нарушения менструального цикла, приливы
материалы
Лахесис 12х
приливы, симптомы менопаузы
материалы
вспомогательные вещества: целлюлоза, декстроза, лактоза, магния стеарат
NatraBio, Hot Flashes Menopause, 60 Tablets:
Предупреждения
- Do не использовать при печати блистерной фольги разрывается или отсутствует
Stop использование и попросить врача если
- Symptoms ухудшаются или сохраняются в течение более 2 недель
- New симптомы
If вы беременны или грудного вскармливания, попросите медицинских специалистов перед использованием.
Keep это вне досягаемости детей. В случае передозировки, получить медицинскую помощь или обратитесь в Центр управления яд прямо сейчас.
- Store при комнатной температуре (65-80&град;Ф).
Купить NatraBio, Hot Flashes Menopause, 60 Tablets на iHerb (айхерб)
NatraBio, Hot Flashes Menopause, 60 Tablets
Отзывы NatraBio, Hot Flashes Menopause, 60 Tablets
Когда я купил этот продукт, я хотел, чтобы мои приливы ушли. Я не ожидал, что эти таблетки работают очень хорошо, и даже не на всех. К моему удивлению, я’ВЭ был на них в течение двух недель, и большинство моих приливов, которые происходят как днем, так и ночью ушли. Я’м 58 лет и были постменопаузального в течение ряда лет. У меня были интенсивные приливы с каплями пота по всему телу. Я бы вам более 10 сбрасывает в день. Мой план был, чтобы попытаться найти решение для себя безопасным препаратом, и поэтому тратить много денег и времени я не был успешным до сих пор. Теперь я могу функционировать намного лучше, и я чувствую себя прекрасно и без помощи лекарств, которые могут быть опасны для организма, на длительный срок.Спасибо.
Это’ы помочь мне и дать спать лучше тоже!Не более горячие вспышки!
отлично работает. Я могу спать намного лучше после приема одной таблетки в течение дня. приятные цены, отличный результат.
У меня все еще есть приливы на 66 и хотел что-то естественное, чтобы получить облегчение. Я использовал эти недели и приливы уменьшились и не так часто. Для меня, я не мог’т продолжать ввиду что-то похожее на мяту как ингредиент, какое воздействие моя почка’ов.
Эти работы, но не для меня.
Я бросил курить в 1992 г., чай с мятой, чтобы очистить мои легкие, прекрасно работают. Теперь я могу’т-нибудь выпить или съесть что-нибудь с мятой.
Я бы порекомендовал эти горячие облегчение вспышка для тех, кто предпочитает натуральные.
Ванда
Серьезно я не могу перестать принимать его.Кроме того, хорошие привычки в еде, он работает мягко и правильно.
Сначала я оценил его negativly, но это было горячее время, теперь зимний сезон, и это мне помогает хорошо, особенно от ночного sweatings.
Это один из немногих продуктов, который помогает моей жене’ы приливы и помочь избавить меня от жалоб на них.Хорошо для нас,лол
Лучший продукт я до сих пор пробовал. Спасибо.
Ничего не сделал для меня. Не был доволен этим продуктом на всех. Кроме того, нет маркировки, где продукт сделан, несколько расплывчато о других ингредиентов.
Приливы, по мнению пациенток и медицинских специалистов, являются наиболее характерным и неприятным климактерическим симптомом [1, 2]. В зависимости от степени тяжести, приливы в течение 5-7 лет могут отрицательно сказываться на качестве жизни женщин [3, 4].
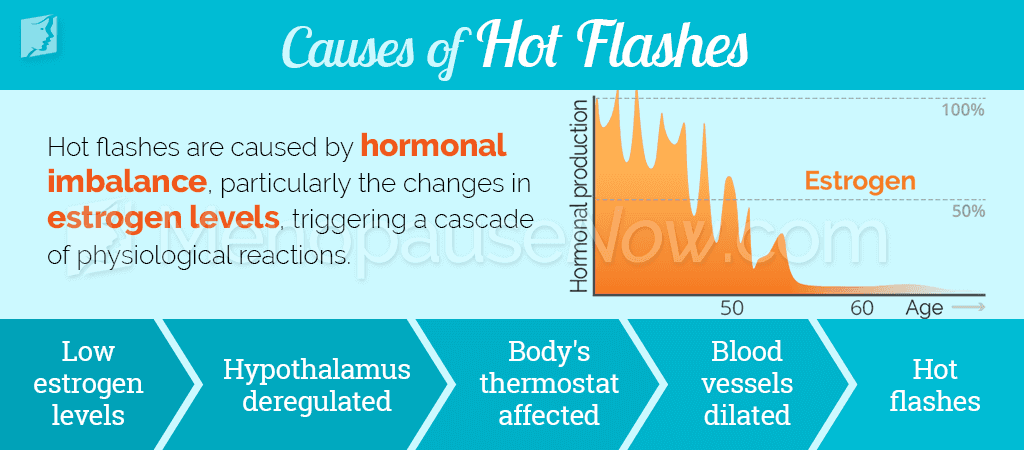
Приливы, как вазомоторный симптом, сопровождаются повышенной сосудистой реактивностью и характеризуются первоначальным значительным расширением кровеносных сосудов и последующим их сужением. Патогенетические механизмы приливов до сих пор изучаются. Предположительно симптом является результатом нарушения механизма регулирования температуры в гипоталамусе из-за снижения уровня эстрогена после предварительной сенсибилизации к нему.
Первой линией терапии приливов сегодня являются гормонально-заместительные средства (ГЗТ), которые доказали свою эффективность и положительное влияние на качество жизни для многих женщин [5, 6]. Однако последние исследования, включая данные лаборатории «Инициатива по охране здоровья женщин» (Women’s Health Initiative, WHI) [7, 8] показывают небезопасность ГЗТ в отдельных случаях. Селективные модуляторы рецепторов эстрогена (СМРЭ), имеющие антиэстрогенное действие, такие как тамоксифен и ралоксифен, также могут вызывать приливы, особенно тяжелые у женщин, проходящих лечение от рака груди [9].
В связи с высокой необходимостью в негормональных средствах лечения вазомоторных симптомов, сегодня активно изучаются возможности применения нефармацевтических методов и препаратов из других групп. В частности, обзор литературы показывает, что лечение селективными ингибиторами обратного захвата серотонина (СИОЗС) или серотонина и норадреналина (СИОЗСН) снижает частоту и тяжесть приливов у женщин в менопаузе и постменопаузе. Исследования продемонстрировали высокую эффективность таких СИОЗС, как пароксетин, циталопрам и эсцитолапрам, а также СИОЗСН венлафаксина.
Две работы, «Приливы и ночная потливость при менопаузе: современное состояние вопроса» Д. Ф. Арчер и соавт. [10], и «Действительно ли СИОЗС и СИОЗСН снижают частоту и/или выраженность приливов в менопаузе» Криса Стаббса и соавт.[11] комплексно рассматривают особенности патогенеза вазомоторных симптомов, ограничения классической терапии и возможности применения других методов в качестве ее альтернативы.
Распространенность и общие характеристики приливов
Как отмечается в работе Криса Стаббса, приливы перименопаузе и менопаузе испытывают от 80% до 90% женщин. Арчер и соавт. также утверждают, что вазомоторные симптомы при климаксе регистрируются во всех регионах мира. Однако распространение симптомов и потребность в лечении значительно варьируются у женщин различного этнического происхождения и из различной культурной среды [12, 13]. Вазомоторные симптомы являются многомерным явлением и отражают сочетание наследственности, рациона питания, физических изменений, применения лекарственных средств, культурного влияния и индивидуальных ощущений и ожиданий. [13]
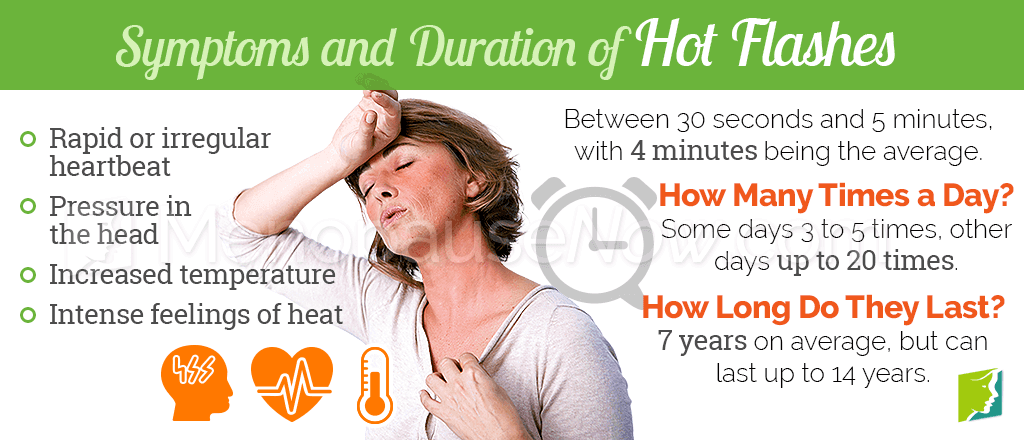
Приливы могут возникать в любое время суток, они бывают спонтанными или вызываются разнообразными распространенными факторами, такими как смущение, резкое изменение температуры окружающей среды, стресс, алкоголь, кофеин или любой теплый напиток. Приливы обычно начинаются с внезапного ощущения жара или тепла, часто сопровождаются потливостью, некоторым покраснением кожи и иногда ощущением сердцебиения. Длительность варьируется от 30 секунд до 60 минут, в среднем — от 3 до 4 минут [10].
У большинства женщин приливы продолжаются более 1 года и в среднем длятся около 4 лет. Некоторые женщины продолжают испытывать приливы в течение 20 и более лет после последней менструации [2]. Приливы могут мешать работе и повседневной деятельности, а также сну, вызывая последующую усталость, потерю концентрации и симптомы депрессии, что в совокупности мешает семейной жизни, а также нарушает сексуальную функцию и отношения между партнерами.
Механизмы возникновения приливов
Доктор Арчер и соавт. в своей работе рассматривают современную теорию патогенеза приливов.
Вазомоторные симптомы возникают в результате нарушения терморегуляторной функции, при котором обычные механизмы отвода тепла активируются ненадлежащим образом. Принято считать, что наиболее важной для терморегуляторного баланса областью головного мозга является преоптическая область гипоталамуса [14]. Внутренняя температура тела обычно поддерживается в пределах термонейтральной зоны. Когда температура тела превышает определенный предел, в преоптической зоне активируются афферентные пути, расширяющие сосуды и усиливающие потоотделение [14-16]. Когда температура тела падает ниже определенного предела, происходит сокращение потока периферической крови и возникает дрожь [17]. Согласно существующей гипотезе, у женщин, имеющих вазомоторные симптомы, значительно сокращается термонейтральная зона, и афферентные пути активируются даже при незначительных изменениях внутренней температуры тела.
Наиболее эффективным способом лечения вазомоторных симптомов является терапия эстрогенами. Считается, что эстроген корректирует нарушение терморегуляторной функции, возникающее в результате колебания и снижения эндогенного эстрогена при переходе в менопаузу. Эстроген повышает предел потоотделения и расширяет термонейтральную зону [18].
Научные данные позволяют предполагать, что в патогенезе вазомоторных симптомов большую роль играют серотонин и норэпинефрин. Колебания уровня эстрогена изменяют уровень задействованных при нейропередаче норэпинефрина и/или серотонина, что приводит к неадекватному потоотделению и приливам, характерным для вазомоторных симптомов [19-21]. Введение эстрадиола приводит к общему повышению синтеза и доступности норэпинефрина и серотонина, а также снижает количество, плотность или чувствительность рецепторов в экспериментальных моделях на животных. Доклинические исследования показали, что изменения в моноаминовой нейропередаче могут изменить пределы потоотделения и дрожи и сузить термонейтральную зону.
Гормонозаместительная терапия (ГЗТ)
Как отмечают авторы работы «Приливы и ночная потливость при менопаузе: современное состояние вопроса», гормональная терапия позволяет эффективно контролировать приливы и многие другие распространенные симптомы, вызванные менопаузой [22, 23]. Двойные слепые рандомизированные контролируемые исследования показывают, что ни один другой медицинский или альтернативный способ лечения не дает более значительного облегчения вазомоторных симптомов, чем ГЗТ. Эффект развивается в течение месяца, и в течение 3 месяцев терапия устраняет до 90% всех вазомоторных симптомов [24]. Обычной клинической практикой является корректировка дозы ГЗТ с целью достижения большего эффекта и минимизации побочных эффектов, таких как боль в молочных железах или маточное кровотечение.
При оральной ГЗТ повышается риск тромбоэмболии, но пока не выявлено, сопряжены ли с повышенным риском непероральные способы введения, такие как пластыри и гели. Тип прогестина также может оказывать влияние на риск [25]. Однако для тех пациенток, у которых присутствуют факторы риска (например, ожирение или тромбоэмболия в анамнезе), следует рассмотреть применение непероральной ГЗТ [6, 25].
Обширное исследование долгосрочной безопасности и эффективности так называемых «биоидентичных» или «натуральных» стероидных гормонов не проводилось, поэтому их следует избегать [6]. «Биоидентичные» гормоны местного изготовления во многих странах не подвергаются изучению фармацевтическими регулирующими органами, и производители могут уклоняться от необходимости проверять свою продукцию на предмет качества, безопасности и эффективности.
Селективные модуляторы рецепторов эстрогена
Селективные модуляторы рецепторов эстрогена (СМРЭ) имеют широкий спектр действия в качестве агонистов или антагонистов рецепторов эстрогена, в зависимости от уровня экспрессии протеинов корегуляторов, присутствующих в целевой ткани. Свойством всех последних СМРЭ как класса является неспособность подавлять вазомоторные симптомы, они даже могут усиливать их по сравнению с плацебо. По данным недавнего отчета, большее число пациентов лечившихся базедоксифеном (23%), испытывали приливы по сравнению с плацебо (6,6%). В большинстве случаев приливы были слабыми или умеренной тяжести и не приводили к прекращению исследования [26]. Эти результаты ограничивают использование СМРЭ пациентками с выраженными вазомоторными симптомами.
Базедоксифен обеспечивает большую защиту эндометрия по сравнению с другими СМРЭ. Это позволяет использовать этот препарат в паре с ККЭ во избежание негативного воздействия эстрогена на эндометрий и молочные железы, в то же время подавляя вазомоторные симптомы и поддерживая нормальное состояние влагалища и нормальную минеральную плотность костной ткани [27].
Негормональная терапия приливов
Несмотря на то, что заместительная гормональная терапия считается золотым стандартом лечения приливов, она связана с повышенным риском развития эстроген-зависимых патологий, включая рак груди, рак эндометрия, сердечно-сосудистые заболевания и тромбоэмболию, отмечает в своей работе доктор Стаббс [11].
Пациентки с приливами, которые либо не могут, либо не хотят принимать ГЗТ, обращаются к негормональным методам лечения. К негормональной терапии можно отнести нефармацевтические и фармацевтические средства.
Нефармацевтические методы лечения
- Когнитивно-поведенческая терапия. Психологические вмешательства при менопаузе нацелены на облегчение симптомов посредством воздействия на поведение, понимание, когнитивные процессы (память, убеждения) или эмоции [28]. Приемы поведенческого вмешательства включают дыхание с заданным ритмом (медленное, глубокое дыхание), мышечную релаксацию и биологическую обратную связь. Сравнительное исследование показало, что дыхание с заданным ритмом значительно снижает частоту приливов, но мышечная релаксация и биологическая обратная связь такого воздействия не оказывали [29]. Такой эффект дыхания с заданным ритмом был подтвержден теми же исследователями в плацебо-контролируемом исследовании.
- Иглоукалывание. Воздействия метода на вазомоторные симптомы было многократно изучено, но качество исследований варьируется. Рандомизированные контролируемые исследования не выявили доказательств эффективности [30]. Многоцентровое рандомизированное контролируемое исследование с участием 267 женщин показало значительное улучшение вазомоторных, соматических симптомов и симптомов сна у женщин, лечившихся иглоукалыванием наряду с консультациями по самопомощи, по сравнению с применением только самопомощи [31]. Таким образом, иглоукалывание, возможно, снижает климактерические симптомы, но необходимы достоверные клинические исследования.
- Блокада звездчатого ганглия. Звездчатый ганглий представляет собой симпатический ганглий, находящийся непосредственно под подключичной артерией, и его интервенция имеет различные клинические применения. Ганглий непосредственно связан с островковой областью мозга, которая имеет высокую активность во время приливов [32]. Экспериментальное исследование продолжительностью 12 недель с участием 13 пациенток с раком груди, испытывающих тяжелые приливы, показало значительное и быстрое снижение частоты приливов, очень тяжелые приливы были сведены практически к нулю. Осложнения, связанные с блокадой ЗГ, включают окулосимпатический паралич (синдром Горнера), необходимость артериальной или венозной инъекции анестетика, пневмоторакс и паралич голосовых связок. Импульсное радиочастотное воздействие может обеспечить более постоянное повреждение звездного ганглия и не связано с синдромом Горнера [33]. Блокада ЗГ может быть полезна для лечения приливов в крайних случаях, когда гормональная терапия противопоказана.
- Йога. Систематическое изучение йоги [34] применительно к менопаузальным симптомам показало, что фактических данных для того, чтобы полагать, что занятия являются эффективным средством при менопаузе недостаточно.
- Фитоэстрогены. Крупные рандомизированные контролируемые исследования не подтвердили, что фитоэстрогены, изофлавон красного клевера и черный стеблелист превосходят плацебо в снижении приливов [35]. Все основные научные, клинические учреждения и регулятивные органы в области женского здоровья не рекомендуют назначение и применение этих гормонов.
Арчер и соавт. в своей работе резюмируют, что имеется мало сведений о том, что изменения в рационе питания, иглоукалывание или физические упражнения снижают приливы, однако они могут улучшить настроение и качество жизни. Регулярные физические нагрузки, снижение веса, устранение факторов, способствующих возникновению приливов (таких как кофеин или прямое воздействие тепла), могут помочь минимизировать приливы и их влияние [36]. Медитация, релаксация, управляемое дыхание и когнитивно-поведенческая терапия показывают многообещающие результаты в снижении приливов. Недавние данные первого уровня показывают, что терапия на основе техники внимательности может быть эффективным и хорошо переносимым средством от приливов [37].
Стаббс и соавт. подтверждают, что, несмотря на потенциальную эффективность, нефармацевтические методы могут быть не лучшим вариантом для женщин с тяжелыми приливами или тех, кто ищет немедленного облегчения.
Плацебо
Интересно, что применение плацебо при менопаузальных приливах имеет достаточно высокую субъективную эффективность. В работе Арчера и соавт. рассказывается о результатах различных исследований, согласно которым эффект плацебо составляет от 10 до 63% [35]. Однако исследования, в которых использовались амбулаторные датчики электропроводимости кожи для объективного измерения физиологических приливов, показывают, что в амбулаторных условиях женщины занижали истинное число приливов на 50% [38, 39]. Этот результат ставит под вопрос достоверность приливов по сообщениям пациентов в качестве показателя частоты физиологических приливов. Хотя субъективные приливы можно рассматривать как клинически более значимые, чем объективные приливы, в одном клиническом исследовании сообщалось об улучшении качества жизни, сна и снижении утомляемости только у женщин, у которых наблюдалось снижение объективных приливов минимум на 50% [40].
Фармацевтические негормональные методы терапии приливов
Многие женщины отказываются применять ГЗТ при приливах или имеют противопоказания к ГЗТ. Недостаточное понимание механизмов, лежащих в основе менопаузальных вазомоторных симптомов, ограничивает разработку новых направленных способов лечения. Существующие негормональные средства оказались на вооружении клиницистов благодаря случайным наблюдениям снижения выраженности приливов как «побочного» эффекта препарата, прописанного по другим показаниям.
Проспективные рандомизированные контролируемые исследования показали, что ряд препаратов превосходит плацебо в лечении вазомоторных симптомов. В целом, эти препараты снижают частоту и тяжесть приливов на 50–60%. Такая эффективность является приемлемой для большинства женщин, которые не хотят использовать гормоны. Для сравнения, стандартная доза эстрогена уменьшает приливы на 80–90% [10].
Как сообщают Стаббс и соавт., для лечения приливов были рассмотрены несколько неэстрогенных фармацевтических или рецептурных препаратов. К ним относятся клонидин, агонист альфа-адренорецепторов, противосудорожный габапентин, селективные ингибиторы обратного захвата серотонина (СИОЗС) и ингибиторы обратного захвата серотонина-норэпинефрина (ИОЗСН). Клонидин и габапентин продемонстрировали некоторую эффективность, однако каждый из них имеет серьезные побочные эффекты, которые могут сделать их непрактичными для многих женщин. Габапентин вызывает головокружение, сонливость, периферические отеки, потерю равновесия и суицидальные мысли. Побочные эффекты от клонидина аналогичны и включают головокружение, седацию, головную боль. СИОЗС и ИОЗСН продемонстрировали перспективность снижения как частоты, так и тяжести приливов без серьезных рисков, свойственных ГЗТ, или более серьезных побочных эффектов других изученных рецептурных лекарств.
Клиническая эффективность СИОЗС и CИОЗНС в терапии вазомоторных симптомов
В работе «Приливы и ночная потливость при менопаузе: современное состояние вопроса» Д. Ф. Арчер и соавт. приводят результаты недавних исследований применения СИОЗС, ИОЗНС и габапентина для снижения частоты и тяжести вазомоторных симптомов [41].
- В ходе проспективных рандомизированных плацебо-контролируемых исследований проводилась оценка эффективности ИОЗСН десвенлафаксина, и результаты были переданы для одобрения регулирующими органами [42-44]. При применении десвенлафаксина в дозе 100 мг/день наблюдалось сокращение частоты вазомоторных симптомов через 12 недель на 65%. Из 75% пациенток, достигших ремиссии и улучшения состояния, 50% приходится на десвенлафаксин по сравнению с 29% при применении плацебо, что является статистически значимым [43].
- Небольшое сравнительное исследование габапентина и эстрадиола подкожного введения показало, что оба препарата снижали частоту приливов при отсутствии разницы между двумя группами исследования [45]. Габапентин (300 мг три раза в сутки) был настолько же эффективен, как и эстроген в низких дозах для снижения частоты и тяжести вазомоторных симптомов. Венлафаксин замедленного высвобождении (75 мг) не сравнивался напрямую с эстрогеном, но был настолько же эффективен при лечении вазомоторных симптомов, как и габапентин, и лучше переносился, согласно данным одного перекрестного исследования [46].
- По данным одного проспективного исследования [47], флуоксетин и циталопрам не уменьшали выраженность приливов по сравнению с плацебо, в то время как согласно данным другого исследования [48] пароксетин, венлафаксин, флуоксетин и сертралин оказались более эффективными, чем плацебо.
Препараты, влияющие на содержание серотонина и норэпинефрина в мозге, продемонстрировали умеренный эффект в отношении вазомоторных симптомов. Десвенлафаксин, который одобрен в Мексике и Таиланде для лечения вазомоторных симптомов в дозе 100 мг/сутки, рекомендуется титровать с постепенным повышением дозы для минимизации нежелательных явлений (тошноты, рвоты, головокружения) в первую неделю после начала терапии и с понижением дозы для минимизации симптомов отмены (тревожность, депрессия и резкая смена настроения).
Авторы работы «Действительно ли СИОЗС и СИОЗСН снижают частоту и/или выраженность приливов в менопаузе» Криса Стаббса приводят результаты нескольких масштабных обзоров:
В 2013 году Shams et al. опубликовали систематический обзор и метаанализ, оценивающий эффективность пяти СИОЗС – эсциталопрама, пароксетина, сертралина, циталопрама и флуоксетина – для уменьшения вазомоторных симптомов (приливов) у здоровых женщин в перименопаузе. Анализ 11 рандомизированных контролируемых испытаний (РКИ), включивших группу из 2069 женщин в возрасте от 36 до 76 лет, показал, что лечение СИОЗС привело к значительному снижению среднего количества ежедневных приливов в течение 4-8 недель с 10 в день до 9 по сравнению с плацебо. В этом исследовании эсцитолапрам был наиболее эффективным СИОЗС для снижения ежедневной частоты приливов. Исследователи пришли к выводу, что СИОЗС являются разумной заменой ГЗТ. [49]
В систематическом обзоре 2015 года, проведенном Хэндли и Уильямсом, было проанализировано 18 РКИ, изучавших эффективность СИОЗС/ИОЗСН по сравнению с плацебо. Участниками были здоровые женщины в возрасте от 27 до 78 лет, которые сообщали, что испытывали в среднем от 46 до 76 приливов в неделю. СИОЗС/СИОЗС уменьшали симптомы приливов на 65% по сравнению с плацебо. Потенциальными СИОЗС первой линии были пароксетин, пароксетин пролонгированного действия, циталопрам и эсциталопрам). Венлафаксин был идентифицирован как потенциальный ИОЗСН первой линии. Пароксетин пролонгированного действия продемонстрировал наибольшее статистически значимое снижение частоты приливов. Венлафаксин обеспечивал более быстрое облегчение симптомов, чем СИОЗС, но имел более высокую частоту побочных эффектов, в первую очередь тошноты и запоров. [50]
В 2015 году Североамериканское общество менопаузы (NAMS) опубликовало заявление о негормональном ведении вазомоторных симптомов, связанных с менопаузой [23]. Члены группы провели поиск в пяти базах данных статей с высоким уровнем доказательств (РКИ или систематические обзоры), посвященных негормональной терапии приливов. В одном из таких исследований сообщалось, что ИОЗСН венлафаксин в пролонгированной форме продемонстрировал эффективность в уменьшении вазомоторных симптомов, аналогичную низким дозам эстрадиола. После оценки доказательств группа NAMS пришла к выводу, что негормональные методы лечения являются подходящими средствами лечения приливов в менопаузе и постменопаузе.
Рекомендации NAMS включают следующие СИОЗС и СИОЗСН: соль пароксетина 7,5 мг/день; пароксетин или пароксетин замедленного действия 10-25 мг/день; эсциталопрам 10-20 мг/день; циталопрам 10-20 мг/день; десвенлафаксин 50-150 мг/день; и венлафаксин в пролонгированной форме 37,5–150 мг/день. Соль пароксетина доступна только в дозировке 7,5 мг и в настоящее время является единственным лекарством от приливов, одобренным FDA [23].
Женщины с раком груди в анамнезе, принимающие тамоксифен, должны избегать СИОЗС. Исследования показали, что некоторые СИОЗС подавляют активность фермента CYP2D6, что может привести к снижению терапевтических уровней тамоксифена. ИОЗСН венлафаксин и десвенлафаксин, по-видимому, практически не влияют на активность тамоксифена и должны рассматриваться в качестве терапии первой линии для этих пациентов. [11]
Вывод
Вазомоторные симптомы встречаются у всех женщин независимо от их культурной и этнической принадлежности и часто негативно влияют на качество жизни пациенток.
ГЗТ по-прежнему считается наиболее эффективным средством уменьшения приливов у женщин в менопаузе и постменопаузе. Однако опасения, что гормональная терапия может увеличить риск эстроген-зависимых патологий, привели к исследованиям возможности применения других средств для лечения этой патологии. Нефармацевтические методы и некоторые фармацевтический препараты, в частности группы СМРЭ, недостаточно убедительно демонстрируют свою эффективность.
СИОЗС и ИОЗСН снижают частоту и тяжесть вазомоторных симптомов, связанных с менопаузой, на 10–64%, в зависимости от исследования. Побочные эффекты от СИОЗС и СИОЗСН, включающие тошноту, запор и сухость во рту, не отличались серьезностью и часто исчезали в течение первой недели. [4, 23]
Из группы СИОЗС наибольшую активность проявляет эсциталопрам и пароксетин пролонгированного действия, из группы ИОЗСН – венлафаксин в пролонгированной форме.
Несмотря на то, что СИОЗС и ИОЗСН менее эффективны, чем ГЗТ, они существенно уменьшают частоту и выраженность приливов и могут быть рекомендованы женщинам, не готовым принять риски гормональной терапии. Для более детальной оценки преимуществ, безопасности и дозировок необходимы дополнительные плацебо-контролируемые исследования.
Литература:
- Voda AM. Climacteric hot flash. Maturitas 1981;3:73–90
- Politi MC, Schleinitz MD, Col NF. Revisiting the duration of vasomotor symptoms of menopause: a meta-analysis. J Gen Intern Med 2008; 23:1507-13
- Freedman RR. Menopausal hot flashes: mechanisms, endocrinology, treatment. J Steroid Biochem Mol Biol. 2014; 142:115–20. [PubMed: 24012626]
- Imai A, Matsunami K, Takagi H, Ichigo S. New generation nonhormonal management for hot flashes. Gynecol Endocrinol. 2013; 29(1):63–6. [PubMed: 22809093]
- Santen RJ, Allred DC, Ardoin SP, et al. Postmenopausal hormone therapy: an Endocrine Society scientific statement. J Clin Endocrinol Metab 2010;95:s1–66
- Sturdee DW, Pines A, on behalf of the International Menopause Society Writing Group. Updated IMS recommendations on postmenopausal hormone therapy and preventive strategies for midlife health. Climacteric 2011;14:302–20
- LaCroix AZ, Chlebowski RT, Manson JE, et al. Health outcomes after stopping conjugated equine estrogens among postmenopausal women with prior hysterectomy: a randomized controlled trial. JAMA 2011;305:1305–14
- Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002;288:321–33
- Gupta P, Sturdee DW, Palin SL, et al. Menopausal symptoms in women treated for breast cancer: the prevalence and severity of symptoms and their perceived effects on quality of life. Climacteric 2006;9:49–58
- Archer DF, Sturdee DW, Baber R, et al. Menopausal hot flushes and night sweats: where are we now?. Climacteric. 2011;14(5):515-528. doi:10.3109/13697137.2011.608596
- Stubbs, Chris & Mattingly, Lisa & Crawford, Steven & Wickersham, Elizabeth & Brockhaus, Jessica & Mccarthy, Laine. (2017). Do SSRIs and SNRIs reduce the frequency and/or severity of hot flashes in menopausal women. The Journal of the Oklahoma State Medical Association. 110. 272-274.
- Freeman EW, Sherif K. Prevalence of hot flushes and night sweats around the world: a systematic review. Climacteric 2007;10:197–214
- Palacios S, Henderson VW, Siseles N, Tan D, Villaseca P. Age of menopause and impact of climacteric symptoms by geographical region. Climacteric 2010;13:419–28
- Romanovsky AA. Thermoregulation: some concepts have changed. Functional architecture of the thermoregulatory system. Am J Physiol Regul Integr Comp Physiol 2007;292:R37–46
- Boulant JA. Role of the preoptic-anterior hypothalamus in thermoregulation and fever. Clin Infect Dis 2000;31(Suppl 5):S157–61
- Zhang YH, Yamada K, Hosono T, Chen XM, Shiosaka S, Kanosue K. Efferent neuronal organization of thermoregulatory vasomotor control. Ann NY Acad Sci 1997;813:117–22
- Charkoudian N. Skin blood flow in adult human thermoregulation: how it works, when it does not, and why. Mayo Clin Proc 2003;78:603–12
- Freedman RR, Blacker CM. Estrogen raises the sweating threshold in postmenopausal women with hot flashes. Fertil Steril 2002;77:487–90
- Berendsen HH. The role of serotonin in hot flushes. Maturitas 2000;36:155–64
- Quan N, Xin L, Blatteis CM. Microdialysis of norepinephrine into preoptic area of guinea pigs: characteristics of hypothermic effect. Am J Physiol 1991;261:R378–85
- Freedman RR. Pathophysiology and treatment of menopausal hot flashes. Semin Reprod Med 2005;23:117–25
- MacLennan AH. Evidence-based review of therapies at the menopause. Int J Evid Based Healthc 2009;7:112–23
- Nonhormonal management of menopause-associated vasomotor symptoms: 2015 position statement of The North American Menopause Society. Menopause. 2015; 22(11):1–18. [PubMed: 25490113]
- MacLennan AH, Broadbent JL, Lester S, Moore V. Oral oestrogen and combined oestrogen/progestogen therapy versus placebo for hot flushes. Cochrane Database of Systematic Reviews (Online) 2004:CD002978
- Olié V, Canonico M, Scarabin PY. Postmenopausal hormone therapy and venous thromboembolism. Thromb Res 2011;127(Suppl 3):S26–9
- de Villiers TJ, Chines AA, Palacios S, et al. Safety and tolerability of bazedoxifene in postmenopausal women with osteoporosis: results of a 5-year, randomized, placebocontrolled phase 3 trial. Osteoporos Int 2011;22:567–76
- Lobo RA, Pinkerton JV, Gass ML, et al. Evaluation of bazedoxifene/conjugated estrogens for the treatment of menopausal symptoms and effects on metabolic parameters and overall safety profile. Fertil Steril 2009;92:1025–38
- Towey M, Bundy C, Cordingley L. Psychological and social interventions in the menopause. Curr Opin Obstet Gynecol 2006;18:413–17
- Freedman RR, Woodward S. Behavioral treatment of menopausal hot flushes: evaluation by ambulatory monitoring. Am J Obstet Gynecol 1992;167:436–9
- Lee MS, Shin BC, Ernst E. Acupuncture for treating menopausal hot flushes: a systematic review. Climacteric 2009;12:16–25
- Borud EK, Alraek T, White A, et al. The acupuncture on hot flushes among menopausal women (ACUFLASH) study, a randomized controlled trial. Menopause 2009;16:484–93
- Freedman RR, Benton MD, Genik RJ, et al. Cortical activation during menopausal hot flashes. Fertil Steril 2006;85:674–678
- van Boxem K, van Eerd M, Brinkhuize T, et al. Radiofrequency and pulsed radiofrequency treatment of chronic pain syndromes: the available evidence. Pain Pract 2008;8:385–93
- Lee MS, Kim JI, Ha JY, Boddy K, Ernst E. Yoga for menopausal symptoms: a systematic review. Menopause 2009;16:602–8
- Geller SE, Shulman LP, van Breemen RB, et al. Safety and efficacy of black cohosh and red clover for the management of vasomotor symptoms: a randomized controlled trial. Menopause 2009;16:1156–66
- Borrelli F, Ernst E. Alternative and complementary therapies for the menopause. Maturitas 2010;66:333–43
- Carmody JF, Crawford S, Salmoirago-Blotcher E, Leung K, Churchill L, Olendzki N. Mindfulness training for coping with hot flashes: results of a randomized trial. Menopause 2011;18:611–20
- Carpenter JS, Elam JL, Ridner SH, Carney PH, Cherry GJ, Cucullu HL. Sleep, fatigue, and depressive symptoms in breast cancer survivors and matched healthy women experiencing hot flashes. Oncol Nurs Forum 2004;31:591–8
- Carpenter J, Azzouz F, Monahan P, Storniolo A, Ridner S. Is sternal skin conductance monitoring a valid measure of hot flash intensity or distress? Menopause 2005;12:512–19
- Carpenter JS, Storniolo AM, Johns S, et al. Randomized, double-blind, placebocontrolled crossover trials of venlafaxine for hot flashes after breast cancer. Oncologist 2007;12:124–35
- Albertazzi P. Non-estrogenic approaches for the treatment of climacteric symptoms. Climacteric 2007;10(Suppl 2):115–20
- Archer DF, Seidman L, Constantine GD, Pickar JH, Olivier S. A double-blind, randomly assigned, placebo-controlled study of desvenlafaxine efficacy and safety for the treatment of vasomotor symptoms associated with menopause. Am J Obstet Gynecol 2009;200:172 e1–10
- Speroff L, Gass M, Constantine G, Olivier S. Efficacy and tolerability of desvenlafaxine succinate treatment for menopausal vasomotor symptoms: a randomized controlled trial. Obstet Gynecol 2008;111:77–87
- Archer DF, Dupont CM, Constantine GD, Pickar JH, Olivier S. Desvenlafaxine for the treatment of vasomotor symptoms associated with menopause: a double-blind, 35 randomized, placebo-controlled trial of efficacy and safety. Am J Obstet Gynecol 2009;200:238 e1–10
- Aguirre W, Chedraui P, Mendoza J, Ruilova I. Gabapentin vs. low-dose transdermal estradiol for treating post-menopausal women with moderate to very severe hot flushes. Gynecol Endocrinol 2010;26:333–7
- Loprinzi CL, Sloan J, Stearns V, et al. Newer antidepressants and gabapentin for hot flashes: an individual patient pooled analysis. J Clin Oncol 2009;27:2831–7
- Suvanto-Luukkonen E, Koivunen R, Sundstrom H, et al. Citalopram and fluoxetine in the treatment of postmenopausal symptoms: a prospective, randomized, 9-month, placebocontrolled, double-blind study. Menopause 2005;12:18–26
- Loprinzi CL, Sloan J, Stearns V, Iyengar M, et al. Newer antidepressants and gabapentin for hot flashes: an individual patient pooled analysis. J Clin Oncol 2009;27:2831– 7
- Shams T, Firwana B, Habib F, et al. SSRIs for hot flashes: a systematic review and meta analysis of randomized trials. J Gen Intern Med. 2013; 29(1):204–13. [PubMed: 23888328]
- Handley A, Williams M. The efficacy and tolerability of SSRI/SNRIs in the treatment of vasomotor symptoms in menopausal women: a systematic review. J Am Assoc Nurse Pract. 2015; 27(1):54–61. [PubMed: 24944075]
Менопауза и климактерическое состояние у женщины
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Другие уточненные нарушения менопаузного и перименопаузного периода (N95.8), Менопауза и климактерическое состояние у женщины (N95.1), Менопаузные и перименопаузные нарушения неуточненные (N95.9), Постменопаузный атрофический вагинит (N95.2), Состояния, связанные с искусственно вызванной менопаузой (N95.3)
Разделы медицины:
Акушерство и гинекология
Общая информация
Краткое описание
Российское общество акушеров-гинекологов
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации
Менопауза и климактерическое состояние у женщины
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые
Год окончания действия: 2023
ID:117
Определение заболевания или состояния (группы заболеваний или состояний)
Менопауза определяется как последняя самостоятельная менструация (ПМ) [1].
Естественная менопауза отражает окончательное прекращение менструальных циклов вследствие потери фолликулярной активности яичников [2]. Является ретроспективным клиническим диагнозом, устанавливается после 12 последовательных месяцев отсутствия менструаций (аменореи).
Климактерический синдром — комплекс вегетативно-сосудистых, психических и обменно-эндокринных нарушений, возникающих у женщин на фоне угасания (или резкой потери) гормональной функции яичников и общего старения организма [3].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
N95 Нарушения менопаузы и другие нарушения в околоменопаузном периоде:
N95.1 – Менопауза и климактерическое состояние у женщины
N95.2 – Постменопаузальный атрофический вагинит
N95.3 – Состояние, связанное с искусственно вызванной менопаузой
N95.8 — Другие уточненные нарушения менопаузного и перименопаузного периода
N95.9- Менопаузные и перименопаузные нарушения неуточненные
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Выделяют следующие типы менопаузы:
- самопроизвольная (естественная) менопауза;
- ятрогенная (вторичная) менопауза, наступившая в результате двухсторонней овариоэктомии (хирургическая менопауза), химио- или лучевой терапии.
- преждевременная (преждевременная недостаточность яичников) (до 40 лет);
- ранняя (40–44 года);
- своевременная (45–55 лет);
- поздняя (старше 55 лет).
В 2001 г. впервые была разработана клинико-гормональная характеристика этапов старения репродуктивной системы (Stages of Reproductive Aging Workshop — STRAW), пересмотренная в 2011 г. с учетом результатов крупных когортных исследований, проведенных в течение последующих 10 лет (STRAW+10) (рис. 1).
Период менопаузального перехода характеризуется вариабельностью циклов, начинается в 40–45 лет и заканчивается с наступлением менопаузы. Отмечаются различные уровни ФСГ, Е2 и снижение ингибина В и антимюллерова гормона (АМГ). На фоне задержек менструаций могут появляться вазомоторные, психологические, урогенитальные симптомы дефицита эстрогенов.
Менопауза — стойкое прекращение менструаций, это последняя самостоятельная менструация, обусловленная возрастным снижением гормональной и «выключением» репродуктивной функции яичников. Дата наступления менопаузы оценивается ретроспективно: спустя 12 мес. отсутствия менструации. Выделяют преждевременную менопаузу (до 40 лет), раннюю (40–44 лет), своевременную (45–55 лет) и позднюю (старше 55 лет).
Перименопауза включает период менопаузального перехода + 12 мес. после последней самостоятельной менструации.
Постменопауза — период после наступления менопаузы.
Различают фазы раннего постменопаузального периода: +1а, +1b, +1c. Характерно прогрессирующее повышение уровней ФСГ, снижение Е2, АМГ и ингибина В. Эта фаза продолжается 5–8 лет, чаще персистируют симптомы климактерического синдрома.
Поздняя постменопаузальная фаза (+2) — Вазомоторные симптомы менее выражены, но могут персистировать в 15 % случаев длительное время. На первый план выходит соматическое старение.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Период менопаузы характеризуется постепенным снижением, а затем и «выключением» функции яичников. Развившееся в результате этого состояние гипергонадотропного гипогонадизма характеризуется изменением функции лимбической системы, нарушением секреции нейрогормонов, развитием инволютивных и атрофических процессов в репродуктивных и нерепродуктивных органах-мишенях [4].
Несмотря на универсальность эндокринных сдвигов в ходе репродуктивного старения, у разных женщин отдельные стадии этого процесса могут отличаться по своей продолжительности и сопровождаться различными специфическими симптомами (вазомоторными, психо-эмоциональными, вагинальными, сексуальными и др.) и системными нарушениями: потерей костной массы, формированием неблагоприятного профиля сердечно-сосудистого риска вследствие развития висцерального ожирения, дислипидемии, эндотелиальной дисфункции, нарушения толерантности к глюкозе и др. [4]–[7].
Большинство симптомов менопаузы непосредственно связаны с дефицитом эстрогенов, как основных гормонов, вырабатываемых в фолликулах яичников. Наиболее частыми и ранними проявлениями менопаузы являются вазомоторные симптомы: приливы жара и гипергидроз, ознобы. В настоящее время вазомоторные симптомы рассматриваются как часть единого патофизиологического процесса нейроэндокринной и сосудистой дисрегуляции в период климактерия [8]. Возникновение вазомоторных симптомов в условиях эстрогенного дефицита связано с центральными механизмами при участии гипоталамических KNDy-нейронов, продуцирующих нейропептиды кисспептин, нейрокинин, динорфин, норадренергической и серотонинергической систем, влияющих на терморегуляторные процессы в организме [9].
Недостаток эстрогенов приводит к существенным изменениям костного метаболизма с преобладанием костной резорбции над процессами ее формирования. Уменьшение с возрастом абсорбции кальция в кишечнике, дефицит витамина D и нарушение образования в почках активного 1,25‑дигидроксивитамина D3 способствует развитию вторичного гиперпаратиреоза, что также усиливает костную резорбцию. Все эти изменения приводят к снижению прочности костной ткани, переломам при минимальной нагрузке на скелет (низкоэнергетические переломы) [10]–[12].
Все структуры мочеполового тракта являются эстроген-зависимыми, поэтому в ответ на снижение уровня половых стероидов в слизистой влагалища, вульвы, мочевого тракта, соединительной ткани и мышцах малого таза развиваются ишемия и атрофические изменения. Вследствие этого развиваются симптомы сухости, зуда, дискомфортных и иногда болезненных ощущений во влагалище, происходит резкое ощелачивание влагалищной среды, могут возникать дисбиотические процессы в мочеполовом тракте и различные нарушения мочеиспускания, формирующие ГУМС [13], [14].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Средний возраст наступления менопаузы во всем мире составляет 48,8 лет (95% ДИ 48,3–49,2) со значительными колебаниями этого показателя в зависимости от географического региона проживания женщин [15], в РФ он колеблется от 49 до 51 года [3].
Около 75% женщин в возрасте от 45 до 55 лет предъявляют жалобы на приливы, при этом в 28,5% случаев ─ средней или тяжелой степени выраженности [16].
Вазомоторные симптомы чаще возникают в позднем периоде менопаузального перехода и особенно выражены в первые годы постменопаузы [17].
Распространенность нарушений сна у женщин в перименопаузе колеблется от 39% до 47%, у женщин в постменопаузе — от 35% до 60% [18].
Среди лиц в возрасте 50 лет и старше в РФ остеопороз выявляется у 34% женщин, а частота остеопении составляет 43% [19].
У 15% женщин в перименопаузе и до 80% женщин в постменопаузе отмечаются симптомы ГУМС или ВВА [20]–[22]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВВА. Распространенность нарушений мочеиспускания (внезапное и непреодолимое желание помочиться, которое невозможно отсрочить, недержание мочи) у женщин зависит от длительности постменопаузы и увеличивается с 15.5% при постменопаузе до 5 лет и до 41.4 % при длительности менопаузы более 20 лет [23].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические признаки, возникающие в период пери- и постменопаузы ввиду недостатка эстрогенов, складываются в климактерический (менопаузальный) синдром. Установлена четкая взаимосвязь менопаузы и вазомоторных симптомов, нарушений сна/ бессонницы, сухости влагалища, диспареунии, лабильности настроения, депрессии, а также расстройства когнитивной функции [18], [24]. Существующие данные о связи сексуальных дисфункции с дефицитом эстрогенов в настоящее время неоднозначны.
Вазомоторные симптомы (приливы жара, потливость, ознобы) являются наиболее частыми проявлениями периода пери- и ранней постменопаузы. Субъективно приливы жара воспринимаются как внезапное ощущение жара или тепла, возникающее в верхней части туловища, часто сопровождающееся покраснением кожи, потоотделением, иногда сердцебиением. Продолжительность прилива в среднем от 3 до 4 минут с различными колебаниями (от 30 секунд до 60 мин) [8], [18]. Как показывают данные исследований, начало приливов жара зачастую предшествует прекращению менструального цикла. Средняя продолжительность приливов составляет 7,4 года, однако в последнее время появляется все больше данных проспективных исследований о том, что у значительного числа женщин они могут продолжаться ≥10 лет [2], [25].
Наиболее типичная жалоба пациенток с нарушениями сна — частые пробуждения (фрагментация сна). Другими проявлениями являются бессонница, трудности засыпания и ранние пробуждения. Нередко нарушения сна сочетаются с вазомоторными симптомами (являясь по отношению к ним первичными или вторичными), а также с повышенной тревожностью, лабильность настроения. В возникновении нарушений сна в период менопаузы немаловажную роль играют психосоциальные факторы, стресс и сопутствующие заболевания [26].
Сухость влагалища, зуд и диспареуния (болезненность при половом акте) являются симптомами, связанными с ВВА. В основе развития ВВА лежит дефицит половых гормонов (в первую очередь эстрогенов), вызывающий ряд инволютивных (атрофических) процессов в урогенитальном тракте и сопровождается изменением состава микробиоты. Симптомы ВВА нередко сочетаются с расстройствами мочеиспускания (поллакиурией, никтурией, цисталгией, императивными позывами к мочеиспусканию). Симптомокомплекс, возникающий у женщин на фоне дефицита эстрогенов, включающий физиологические и анатомические изменения во влагалище, уретре, мочевом пузыре и наружных половых органах получил название ГУМС [27].
Возникновение депрессии в период менопаузы связано с недостатком эстрогенов в организме женщины, часто сочетается с вазомоторными симптомами и ночной потливостью, что ведет к нарушению сна и бессоннице, и является результатом нарушения регуляции норадренергической и серотонинергической систем [18]. Эти же процессы имеют отношение к нарушениям когнитивной функции (как правило, снижение концентрации внимания и памяти), которые в большей степени наблюдаются у пациенток в период перименопаузы, однако связь когнитивных нарушений и дефицита эстрогенов носят более сложный характер [28]. Следует отметить, что данные проявления нередко коррелируют с вазомоторными симптомами, депрессией и тревожными состояниями у менопаузальных женщин [29].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
В диагностике менопаузы важным является сбор анамнестических данных, включающий информацию о менструации, наличии менопаузальных симптомов. Данные лабораторных и инструментальных обследований необходимы в случае затруднений при установлении диагноза, а также для выявления ассоциированных с менопаузой состояний.
Критерии установления диагноза/состояния на основании патогномоничных данных:
1. анамнестических данных
2. физикального обследования
3. лабораторных исследований
4. инструментального обследования.
Жалобы и анамнез
- Рекомендуется при опросе пациентки обращать внимание на наличие следующих жалоб и признаков для диагностики климактерических симптомов [2], [3], [33], [34], [18], [20], [22], [26], [29]–[32]:
— вазомоторные — приливы, повышенная ночная потливость, ознобы;
— психоэмоциональные — депрессия, раздражительность, возбудимость, расстройство сна, слабость, снижение памяти и концентрации внимания;
— урогенитальные и сексуальные — зуд, жжение, сухость во влагалище, диспареуния, дизурия;
— скелетно-мышечные — миалгии, артралгии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3).
Комментарии: Большинство эпидемиологических и клинических исследований показывают, что многие женщины испытывают более одного из этой группы симптомов в течение отдельных стадий старения репродуктивной системы. Следует подчеркнуть большую индивидуальную вариабельность менопаузальных проявлений среди пациенток как по времени их появления, так и по длительности и интенсивности. Наиболее часто первыми симптомами являются вазомоторные (приливы жара, ночная потливость, ознобы) и психоэмоциональные симптомы. Со временем отмечается появление урогенитальных и других симптомов.
- Рекомендуется всем пациенткам на этапе постановки диагноза использовать терминологияю и систему критериев STRAW +10 для определения стадии репродуктивного старения [20], [35].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Терминология и система критериев STRAW +10 применимы у большинства женщин, поскольку процесс старения репродуктивной системы универсален. Классификация стадии репродуктивного старения по STRAW +10 неприменима у пациенток с СПЯ, ПНЯ, после гистерэктомии, аблации эндометрия, или использующих в настоящее время ВМС-ЛНГ, КОК. У этих групп пациенток необходимо обращать внимание на возникновение вазомоторных и психоэмоциональных симптомов как ранних признаков приближающейся менопаузы.
- Рекомендуется пациенткам с наличием менопаузальных симптомов проводить анкетирование (Шкала Грина) (приложение Г) для определения степени их тяжести [36].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам проводить тщательный сбор анамнестических данных для выявления факторов риска онкологических заболеваний органов репродуктивной системы и молочной железы, сердечно-сосудистых заболеваний, остеопороза и других коморбидных состояний для определения плана обследования и лечения [18], [37].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: сбор анамнеза подразумевает опрос пациентки относительно жалоб, наследственной патологии (наличие онкологических заболеваний: рак молочной железы, эндометрия, яичников, кишечника; тромбоэмболические события; сахарный диабет; сердечно-сосудистые заболевания — инсульты, инфаркты до 60 лет; остеопороз, включая переломы), акушерского анамнеза (гестационный сахарный диабет, преэклампсия, артериальная гипертензия), вредных привычек, сопутствующих соматических, эндокринных и системных заболеваний, хирургических вмешательств, гинекологической патологии, текущей или проводимой ранее лекарственной терапии.
Физикальное обследование
- Рекомендуется всем пациенткам проведение визуального осмотра наружных половых органов и бимануального влагалищного исследования для диагностики патологии вульвы, влагалища, шейки матки и органов малого таза [38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам визуальное исследование и пальпация молочных желез для диагностики патологии молочной железы [39], [40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам измерение окружности талии (ОТ), как ключевого показателя абдоминального/висцерального ожирения [37], [41]–[44].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам определение массы тела, роста и вычисление индекса массы тела (ИМТ) для диагностики избыточной массы тела и ожирения [2], [37], [41]–[43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Лабораторные диагностические исследования
- Рекомендуется проводить гормональное обследование пациенткам в случае наличия затруднений при определении стадии репродуктивного старения [36], [37], [41], [45], [46]:
— исследование уровня ФСГ в сыворотке крови у женщин до 45 лет с менопаузальными симптомами, включая аменорею или нерегулярные менструации (цикл более 38 дней или менее 24 дней, вариабельность цикла более 7 дней для женщин моложе 42 лет, более 9 дней для женщин 42-45 лет [47]), у женщин до 45 лет с синдромом поликистозных яичников, аблацией эндометрия или у женщин, нуждающихся в дифференциальной диагностике аменореи; у женщин до 45 лет после гистерэктомии без придатков;
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: исследование уровня ФСГ в сыворотке крови проводится дважды на 2-4 день менструального цикла в двух последующих менструальных циклах при наличии менструаций, в случае аменореи — в любой день дважды с перерывом 4-6 недель.
— исследование уровня тиреотропного гормона (ТТГ) в крови для дифференциальной диагностики причин олигоменореи/аменореи, атипичных вазомоторных симптомов, нарушений сна, быстрой утомляемости, колебаний веса [48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5);
— исследование уровня пролактина в крови у женщин для дифференциальной диагностики причин олигоменореи/аменореи, галактореи [48];
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется определение концентрации водородных ионов (рН) отделяемого слизистой оболочки влагалища для уточнения диагноза ВВА в сомнительных случаях [48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: тест-полоски для определения pH вагинального секрета.
- Рекомендуется при наличии жалоб и клинических признаков ГУМС проводить молекулярно-биологическое исследование влагалищного отделяемого на микроорганизмы-маркеры бактериального вагиноза или микробиологическое (культуральное) исследование отделяемого женских половых органов на аэробные и факультативно-анаэробные микроорганизмы для оценки микробиоты влагалища [14], [27], [38], [42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется при наличии факторов риска остеопороза, низкоэнергетических переломов в анамнезе, при ожирении исследование уровня 25-ОН витамина D крови для выявления недостаточности/дефицита [49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациенткам проводить цитологическое исследование микропрепарата шейки матки (ПАП-тест) и определение ДНК вирусов папилломы человека (Papilloma virus) высокого канцерогенного риска в отделяемом (соскобе) из цервикального канала методом ПЦР, количественное исследование для скрининга поражений шейки матки [50], [51], [52].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: необходимо придерживаться следующего подхода к цервикальному скринингу:
— 21-29 лет — цитологическое исследование микропрепарата шейки матки- 1 раз в 3 года.
— 30-65 лет — ко-тестирование (цитологическое исследование микропрепарата шейки матки и определение ДНК вирусов папилломы человека (Papilloma virus) высокого канцерогенного риска в отделяемом (соскобе) из цервикального канала методом ПЦР):
- раз в 5 лет у ВПЧ негативных женщин и Цитологическое исследование микропрепарата шейки матки (ПАП-тест) <ASCUS
- 1 раз в 3 года у ВПЧ негативных женщин и Цитологическое исследование микропрепарата шейки матки (ПАП-тест) =ASCUS ежегодно у ВПЧ позитивных женщин Цитологическое исследование микропрепарата шейки матки (ПАП-тест) <ASCUS
Инструментальные диагностические исследования
- Рекомендуется при наличии низкоэнергетических переломов в анамнезе/факторов риска остеопороза проведение рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости с использованием двухэнергетической рентгеновской абсорбциометрии (ДЭРА) с целью оценки минеральной плотности кости (МПК) [19], [53]–[55], [56], [57].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: Для оценки МПК используются критерии ВОЗ по интерпретации результатов ДЭРА у женщин:
— норма — показатели Т-критерия от +2,5 до –1 стандартных отклонений от пиковой костной массы;
— остеопения — показатели Т-критерия от –1 до –2,5 стандартных отклонений;
— остеопороз — показатели Т-критерия – 2,5 стандартных отклонений и ниже;
— тяжелый остеопороз — показатели Т-критерия –2,5 стандартных отклонений и ниже с наличием в анамнезе одного и более переломов.
- Рекомендуется всем женщинам с диагнозом ПНЯ базовое проведение рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости с использованием ДЭРА с целью оценки МПК [56], [57], [58], [59].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: Женщины с диагнозом ПНЯ имеют как общеизвестные факторы риска развития остеопороза, так и специфические (такие как выключение функции яичников до накопления пиковой костной массы, отсутствие лечения более 1 года из-за задержки постановки диагноза, неадекватная терапия и несоблюдение рекомендаций).
Рекомендуется интерпретировать результаты ДЭРА у женщин с ПНЯ [58], [60]:
МПК в пределах возрастной нормы — показатели Z-критерия > -2 стандартных отклонений;
низкая МПК — показатели Z-критерия < -2 стандартных отклонений;
остеопороз — показатели Т-критерия < -2,5 стандартных отклонений и ниже и / или наличие низкоэнергетического перелома (особенно вертебрального)
- Рекомендуется женщинам в постменопаузе при наличии факторов риска остеопороза проводить оценку индивидуальной 10-летней вероятности переломов (опросник FRAX) [19], [61], [62].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: См. соответствующие клинические рекомендации «Остеопороз».
- Рекомендуется всем пациенткам проведение ультразвукового (трансвагинального/трансабдоминального + трансвагинального) исследования органов малого таза для выявления патологии органов малого таза [39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется проведение рентгеновской маммографии в двух проекциях для выявления патологии молочных желез у женщин в возрасте от 40 до 75 лет включительно 1 раз в 2 года; проведение ультразвукового исследования — по показаниям [39], [40], [63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: рентгеновская маммография и ультразвуковое исследование (УЗИ) молочных желез не альтернативные, а взаимодополняющие методики, использующиеся в диагностическом алгоритме заболеваний молочных желез.
УЗИ молочных желез является основным скрининговым методом для женщин до 40 лет и широко используется в качестве дополнительного метода уточняющей диагностики у женщин после 40 лет.
Для адекватной трактовки результатов инструментальной диагностики, в том числе на этапе принятия решения о назначении МГТ, а также правильной маршрутизации пациенток проводится оценка молочных желез по классификации ACR и шкале BI-RADS (Breast Imaging Reporting and Data System).
- Рекомендуется назначение ежегодной рентгеновской маммографии в двух проекциях, начиная с возраста 40 лет, и ежегодного УЗИ молочных желез в возрасте до 40 лет с оценкой по шкале BI-RADS и классификации ACR при приеме менопаузальной (заместительной) гормональной терапии для выявления патологии молочных желез [20], [39], [40], [63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Группа авторов данных клинических рекомендаций, основываясь на действующих приказах МЗ РФ, а также проанализировав положения отечественных и зарубежных клинических рекомендаций, формулирует данную позицию с целью гармонизации ведения пациенток, получающих МГТ, а также минимизации рисков невыявления интервальных раков молочной железы.
Иные диагностические исследования
- Рекомендуется проведение комплексного обследования женщинам перед назначением МГТ для выявления противопоказаний и/или риска возможных нежелательных явлений, которое включает [3], [20], [36]–[38], [42], [64]–[66]:
— ультразвуковое исследование органов малого таза;
Комментарии: при толщине эндометрия до 4 мм у женщин в пери- и постменопаузе МГТ не противопоказана; ≥ 5 мм — в фазе менопаузального перехода назначаются прогестагены в течение 12–14 дней и проводится контрольное УЗИ органов малого таза на 5-7й день менструальноподобного кровотечения или на фоне его отсутствия через 7 дней после окончания приема гестагенов; > 5 мм в постменопаузе— рекомендовано проводить гистероскопию и раздельное диагностическое выскабливание полости матки и цервикального канала для уточнения состояния эндометрия.
— обследование молочных желез: визуальный осмотр, пальпация, рентгеновская маммография в двух проекциях, УЗИ молочных желез
Комментарии: Обследование молочных желез, согласно возрасту (маммография, начиная с возраста 40 лет, и УЗИ молочных желез в возрасте до 40 лет с оценкой по шкале BIRADS и классификацией маммографической плотности по ACR), перед назначением МГТ рекомендуется проводить дополнительно, если после предыдущего обследования молочных желез прошло более полугода или если ранее обследование молочных желез не проводилось.
При наличии узловых образований молочных желез, и/ или категории по шкале BI-RADS, отличной от 1 или 2 и/или высокой маммографической плотности (ACR: D) и/или других значимых факторов риска РМЖ рекомендована консультация врача-маммолога (врача-онколога) для определения наличия или отсутствия противопоказаний для приема МГТ (ЗГТ половыми стероидами) со стороны молочных желез.
— измерение АД
— общий (клинический) анализ крови
-анализ крови биохимический общетерапевтический (уровень глюкозы/ гликированного гемоглобина в крови натощак; общий белок; билирубин, креатинин) и анализ крови по оценке нарушений липидного обмена биохимический (уровень общего холестерина крови, ЛПНП-ХС, ЛПВП-ХС, триглицериды);
Комментарий: при подозрении на наличие метаболического синдрома или нарушений углеводного обмена (НГТ, СД 2 типа) рекомендуется проведение перорального 2-часового глюкозотолерантного теста, как надежного индикатора нарушения толерантности к глюкозе.
— Цитологическое исследование микропрепарата шейки матки — ПАП-тест;
Комментарий: в случае выявления патологии по данным цитологического исследования микропрепарата шейки матки перед назначением МГТ показано дополнительное обследование и лечение.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1).
— Оценку риска венозных тромбоэмболических осложнений (ВТЭО).
Комментарий: для оценки риска и определения необходимости профилактики ВТЭ следует использовать шкалу PADUA (см. Приложение Г). О высоком риске и необходимости профилактики ВТЭ свидетельствует сумма баллов от 4 и более. В этом случае требуется консультация смежных специалистов, а назначение МГТ не целесообразно.
- Рекомендуется проведение ряда дополнительных обследований перед назначением МГТ женщинам при соответствующих данных анамнеза и показаниях [3], [20], [36], [37], [45], [65]–[68]:
-УЗИ печени и анализ крови биохимический общетерапевтический (определение активности АЛТ, АСТ, ГГТ в крови); колоноскопия; коагулограмма (ориентировочное исследование системы гемостаза) и определение концентрации Д-димера в крови; определение полиморфизма G20210A протромбина в гене фактора II свертывания крови; молекулярно-генетическое исследование мутации G1691A в гене фактора V (мутация Лейдена в V факторе свертывания).
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1).
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
Индивидуальный подход к каждой пациентке является приоритетным при выборе тактики лечения климактерических расстройств. Учитывая современную концепцию персонализации менопаузальной гормональной терапии, врач при выборе терапии должен соблюдать следующие принципы:
1. Безопасность составляющих компонентов используемого препарата.
2. Персонификация МГТ с учетом факторов риска сердечно-сосудистых заболеваний (ССЗ), рака молочной железы (РМЖ) и постменопаузального остеопороза (ПМО), наличия коморбидных состояний у женщины:
- Подбор минимальной эффективной дозировки
- Определение лекарственной формы препаратов МГТ
- Использование режима терапии с учетом возраста, стадии репродуктивного старения (STRAW +10) и потребности пациентки
Применение МГТ требует периодической коррекции дозировок в зависимости от стадии репродуктивного старения, возраста, эффективности и переносимости лечения, что позволяет:
1. Эффективно купировать симптомы климактерического синдрома.
2. Уменьшить / отсрочить развитие отдаленных последствий дефицита эстрогенов.
- Рекомендуется назначение менопаузальной гормональной терапии (МГТ) женщинам в перименопаузе и постменопаузе для лечения:
— Вазомоторных симптомов умеренной и тяжелой степени, существенно снижающих качество жизни,
— Симптомов ГУМС, сексуальной дисфункции [3], [13], [65], [69]–[72], [20], [34], [36], [41], [42], [45], [46], [64], [73].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарий: Цель МГТ у женщин в перименопаузе и постменопаузе — частично восполнить дефицит половых гормонов, используя минимально-оптимальные дозы гормональных препаратов, способные улучшить общее состояние больных, купировать климактерические симптомы, обеспечить профилактику поздних обменных нарушений.
Следует придерживаться так называемой «временной гипотезы терапевтического окна»: начинать МГТ в возрасте моложе 60 лет и при длительности постменопаузы менее 10 лет. По мере увеличения возраста пациентки и длительности постменопаузы целесообразно снижение дозы назначаемой МГТ.
- Рекомендуется назначение менопаузальной гормональной терапии (МГТ) женщинам в перименопаузе и постменопаузе для профилактики постменопаузального остеопороза [3], [19], [20], [36], [42], [53], [66], [67], [71]–[73], [73], [76]:
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1).
Комментарий: Назначение МГТ для профилактики остеопороза показано женщинам в перименопаузе, а также женщинам в постменопаузе моложе 60 лет и длительностью менопаузы не более 10 лет.
МГТ является эффективным методом предотвращения потери костной массы, которая наиболее выражена в первые 3–5 лет постменопаузы, а также способствует сохранению качества кости и межпозвонковых дисков у женщин в постменопаузе. Эффективность МГТ доказана в отношении снижения риска перелома в популяции постменопаузальных женщин.
Снижение риска остеопоротических переломов зависит от длительности приема и возраста начала МГТ и сохраняется в течение продолжительного времени после прекращения лечения.
Доказательства профилактики переломов при назначении МГТ ограничены данными по пероральному применению стандартных доз эстрогенов и медроксипрогестерона (по анатомо-терапевтическо-химической классификации (АТХ)- Прогестагены и эстрогены (для последовательного «календарного» приема). Имеются фактические данные о предотвращении потери МПК при пероральном (эстрадиол, эстрадиола валерат) и трансдермальном (эстрадиол) применении доз эстрогенов в составе МГТ (по АТХ-Прогестагены и эстрогены в комбинации; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированные сочетания)), ниже стандартных, а также о предотвращении переломов позвонков и других локализаций при применении тиболона (по АТХ – прочие эстрогены).
Мониторинг эффективности терапии осуществляется с помощью ДЭРА — 1 раз в 1-2 года.
- Рекомендуется назначение менопаузальной/заместительной гормональной терапии (МГТ/ЗГТ) женщинам для восполнения дефицита эстрогенов при:
— Преждевременной недостаточности яичников и ранней менопаузе;
— Двусторонней овариэктомии [36], [46], [58], [66], [72], [73],[78],[79].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарий: Целью гормональной терапии у женщин с преждевременной недостаточностью яичников и после двусторонней овариоэктомии является достижение средних значений концентрации эстрадиола в плазме крови, характерных для женщин с сохраненным, регулярным менструальным циклом. Показаниями к назначению ЗГТ половыми стероидами являются лечение симптомов эстрогендефицита, а также первичная профилактика остеопороза. Начинать заместительную гормональную терапию следует как можно раньше после постановки диагноза ПНЯ при отсутствии противопоказаний.
- Не рекомендуется назначать МГТ женщинам при отсутствии четких показаний для ее применения, т.е. значимых симптомов или физических последствий дефицита эстрогенов [3], [20], [37], [41], [65].
Уровень убедительности рекомендаций С, уровень достоверности доказательств 5).
- Рекомендуется врачу-акушеру-гинекологу учитывать наличие относительных противопоказаний к МГТ с целью оценки рисков лечения для решения вопроса о возможности ее назначения, а также для индивидуального подбора типа, режима, дозы и пути введения МГТ:
Возраст пациентки; стадию репродуктивного старения по STRAW +10; длительность постменопаузы; ожирение (ИМТ> 30 кг/м2); резистентность к инсулину, сахарный диабет; наличие в анамнезе холелитиаза, холецистита, холецистэктомии; хронические заболевания печени; мигрень; дислипидемия; неконтролируемая гипертония; курение; наличие миомы матки, эндометриоза; отягощенный семейный анамнез по венозным тромбоэмболиям (ВТЭ); отягощенный акушерский анамнез (наличие артериальной гипертензии, преэклампсии, гестационного сахарного диабета); повышенный риск рака молочной железы; коллагенозы; эпилепсия [73].
Уровень убедительности рекомендаций А, уровень достоверности доказательств 1).
Комментарии: назначение МГТ возможно при наличии миомы матки не более 2-3 узлов (с межмышечным или субсерозным расположением) диаметром не более 3 см при условии проведения ультразвукового исследования матки и придатков не реже 1 раза в 6 месяцев на фоне МГТ. При обнаружении роста/увеличения количества или изменения структуры миоматозных узлов МГТ необходимо отменить[79].
- Не рекомендуется назначение МГТ пациенткам при наличии у них следующих заболеваний/состояний (абсолютные противопоказания):
Кровотечение из половых путей неясного генеза; рак молочной железы (диагностированный, подозреваемый или в анамнезе); диагностированные или подозреваемые эстрогензависимые злокачественные новообразования (эндометрия, яичников, матки); острые и хронические заболевания печени в настоящее время или в анамнезе (до нормализации функциональных проб печени), в том числе злокачественные опухоли печени; тромбозы (артериальные и венозные) и тромбоэмболии в настоящее время или в анамнезе (в том числе тромбоз глубоких вен; тромбоэмболия легочной артерии, инфаркт миокарда, ишемические или геморрагические цереброваскулярные нарушения); наличие миомы матки с субмукозным расположением узла; наличие полипа эндометрия; аллергия к компонентам МГТ; кожная порфирия; прогестагензависимые новообразования (например, менингиома) (для гестагенов) [3], [20], [81], [82], [36], [45]–[48], [64], [65], [80].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: При наличии у пациентки миомы матки с субмукозным расположением узла или при наличии полипа эндометрия рекомендовано оперативное лечение (в случае миомы матки с субмукозным расположением узла — гистерорезектоскопия, миомэктомия; в случае полипа эндометрия – гистероскопия, раздельное диагностическое выскабливанием или гистерорезектоскопия, полипэктомия). После получения результатов патолого-анатомического исследования рассмотреть вопрос о назначении МГТ.
1.1. Режимы и характеристики МГТ
- Рекомендуется индивидуальный подбор режима и пути введения препаратов МГТ пациенткам с учетом выраженности симптомов, персонального и семейного анамнеза, стадии репродуктивного старения (по STRAW+10), результатов соответствующих исследований, наличия коморбидных состояний, предпочтений и ожиданий женщины для обеспечения высокой эффективности, безопасности терапии и приверженности к ней [2], [3], [20], [31], [36], [37], [41], [42], [45], [46], [48], [66], [67], [72], [73], [85]–[88].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1).
Комментарий: Препараты МГТ имеют широкий спектр лекарственных форм, путей и способов их введения, которые определяют различные преимущества и риски при использовании.
При инициации МГТ целесообразно подбирать минимальную эффективную дозу препарата. По мере увеличения возраста женщины и длительности постменопаузы рекомендуется рассмотреть возможность снижения дозировки. В перименопаузе используются стандартные и низкие дозы эстрогенов (по АТХ — Эстрогены) в составе МГТ. В постменопаузе используются низкие и ультранизкие дозы эстрогенов в составе МГТ.
У женщин в постменопаузе старше 45 лет низкодозированные и ультранизкодозированные пероральные эстрогены в составе комбинированной монофазной МГТ эффективны для лечения вазомоторных симптомов, при этом имеют более благоприятный профиль безопасности и переносимости в сравнении со стандартными дозами эстрогенов. Низкодозированная МГТ продемонстрировала большую эффективность в отношении снижения приливов у женщин в возрасте менее 55 лет, при длительности менопаузы менее 5 лет и при ИМТ ≥30 кг/м² в сравнении с ультранизкодозированной МГТ [87].
В РФ зарегистрированы пероральные препараты МГТ с включением стандартных (2 мг), низких (1 мг) и ультранизких (0,5 мг) доз эстрогенного компонента в форме эстрадиола или эстрадиола валерата (по АТХ- Прогестагены и эстрогены в комбинации; Антиандрогены и эстрогены; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированные сочетания)).
В РФ зарегистрированы трансдермальные формы эстрогенов для МГТ – эстрадиол (по АТХ — Эстрадиол) 0,06% — накожный гель с включением максимальной суточной дозы 3 мг эстрадиола (5,0 г геля), стандартной суточной дозы 1,5 мг эстрадиола (2,5 г геля), низкой суточной дозы #0,75 мг эстрадиола (1,25 г геля) [88]; Эстрадиол (по АТХ — Эстрадиол) 0,1% накожный гель с включением максимальной суточной дозы 1,5 мг эстрадиола (1,5 г геля), стандартной суточной дозы 1 мг эстрадиола (1,0 г геля), низкой суточной дозы 0,5 мг эстрадиола (0,5 г геля); эстрадиола (по АТХ — Эстрадиол) трансдермальная терапевтическая система (накожный пластырь) с включением стандартной суточной дозы эстрадиола 50 мкг/сут.
Трансдермальные формы эстрогенов вследствие отсутствия первичной стадии печеночного метаболизма в отличие от пероральных форм эстрогенов имеют более благоприятный профиль безопасности — не повышают риск ВТЭО и ЖКБ. Использование трансдермальных форм эстрогенов ассоциировано с меньшим риском больших сердечно-сосудистых событий (инфаркта, инсульта) и ВТЭО, чем использование эквивалентных доз пероральных форм эстрогенов [68], [89]–[91].
Важно учитывать свойства прогестагена в составе МГТ. Микронизированный прогестерон**, дидрогестерон** и ряд других прогестагенов (по АТХ — Гестагены), кроме защитного влияния на эндометрий могут обладать и другими эффектами. Например, дроспиренон в составе комбинации с эстрадиолом (по АТХ – Прогестагены и эстрогены) обладает подтвержденной способностью снижать уровень АД, препятствовать задержке жидкости, улучшать ряд метаболических параметров [83]–[85]. Микронизированный прогестерон** и дидрогестерон** в наименьшей степени ассоциированы с повышением риска РМЖ в сравнении с другими гестагенами в составе МГТ [92]–[94]. Микронизировнный прогестерон и дидрогестерон обладают более благоприятным профилем безопасности в отношении риска ВТЭ в сравнении с норэтистероном и медроксипрогестероном [20], [89], [95].
В качестве МГТ в ряде стран (в том числе в РФ) также используется синтетический стероид тиболон (по АТХ – другие эстрогены). При пероральном приеме препарат метаболизируется с образованием трех активных метаболитов, из которых два обладают эстрогеноподобной активностью, в то время как третий метаболит обладает слабой гестагеноподобной и андрогеноподобной активностью. Эффективность его применения для купирования климактерических симптомов сопоставима с эстрадиолом в составе МГТ (2,5 мг тиболона эквивалентно по действию 1–1,5 мг эстрадиола). Препарат используется для лечения симптомов эстрогенной недостаточности у женщин в постменопаузе (но не ранее чем через 12 месяцев после последней менструации) или сразу после двусторонней овариэктомии, для профилактики и лечения остеопороза у женщин с высоким риском переломов при непереносимости ли противопоказаниях к применению других лекарственных средств, используемых для профилактики остеопороза, а также может быть эффективным средством для терапии сексуальной дисфункции у женщин в постменопаузе. Дополнительным преимуществом препарата является отсутствие пролиферативной активности в отношении эндометрия и молочных желез, а также отсутствие значимого влияния на рост миоматозных узлов [20], [86], [96].
- Рекомендуется назначение монотерапии эстрогенами (по АТХ- Эстрогены) в непрерывном режиме женщинам с удаленной маткой, вне зависимости от фазы климактерия, для лечения климактерических симптомов и/или профилактики остеопороза [3], [34], [45], [47], [65], [97], [98].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: необходимо учитывать показания к гистерэктомии и объем операции (тотальная или субтотальная). Монотерапия эстрогенами показана только при тотальной гистерэктомии. В случае высокой надвлагалищной ампутации матки, а также пациенткам после гистерэктомии с распространенным наружным генитальным эндометриозом в анамнезе, показано назначение комбинированной эстроген-гестагенной терапии или тиболона (алгоритмы).[20], [99]
Используются препараты, содержащие эстрадиол и эстрадиол валерат. Пути введения: пероральный (таблетки) и парентеральный (накожный — гели, пластыри) в непрерывном режиме.
- Рекомендуется назначение монотерапии прогестагенами (по АТХ — Гестагены) женщинам в периоде менопаузального перехода для профилактики гиперпластических процессов эндометрия и регуляции менструального цикла [3], [35], [45]–[47], [65], [100].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарий: используется прогестерон** в дозе 200 — 400 мг в сутки; #дидрогестерон** 10-20 мг в сутки [101]. Прогестерон и его производные назначаются на срок не менее 10-14 дней.
#Левоноргестрел в форме внутриматочной терапевтической системы (по АТХ – Пластиковые спирали с гестагенами) имеет показание к использованию в качестве гестагенного компонента МГТ. Применение #левоноргестрела в форме внутриматочной терапевтической системы (по АТХ – Пластиковые спирали с гестагенами) в период менопаузального перехода имеет преимущества для использования у женщин, нуждающихся в контрацепции, а также при наличии обильных маточных кровотечений, не связанных с органической патологией матки.
- Рекомендуется назначение комбинированной эстроген-гестагенной терапии (по АТХ – Прогестагены и эстрогены в комбинации; Антиандрогены и эстрогены; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированные сочетания)) в циклическом режиме женщинам с интактной маткой в перименопаузе, но не ранее 6 месяцев после последней менструации, для лечения климактерических симптомов и профилактики постменопаузального остеопороза [27], [34]–[36], [42], [45]–[48], [102].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий: следует информировать женщину о том, что препараты МГТ не обладают контрацептивным эффектом.
В перименопаузе используются стандартные и низкие дозы эстрогенов в составе МГТ. В РФ зарегистрированы комбинированные формы пероральных препаратов, содержащие стандартную дозу (2 мг) и низкую дозу (1 мг) эстрадиола в сочетании с гестагеном.
Для трансдермальной МГТ используется стандартная доза — 1,5 мг эстрадиола 0,06% накожного геля (2,5 г геля); 1,0 мг эстрадиола 0,1% накожного геля (1,0 г геля) ежедневно в непрерывном режиме, 50 мкг/сут эстрадиола — трандермальная терапевтическая система (накожный пластырь) 1 раз в 7 дней. При назначении трансдермального пути введения эстрогенов в качестве гестагенного компонента используются микронизированный прогестерон** (по АТХ – Гестагены) (перорально или вагинально) в дозе 200-300 мг в сутки; дидрогестерон** (по АТХ – Гестагены) перорально 10-20 мг в сутки в зависимости от ИМТ. Прогестерон и его производные назначаются на срок не менее 10-14 дней.
- Рекомендуется назначение комбинированной эстроген-гестагенной терапии (по АТХ – Прогестагены и эстрогены в комбинации; Антиандрогены и эстрогены; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированные сочетания)) в циклическом режиме женщинам с ПНЯ (спонтанной или ятрогенного генеза, в том числе хирургической) с интактной маткой для лечения климактерических симптомов и профилактики остеопороза [2], [20], [46], [58], [71], [77], [103]–[106].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий: При назначении терапии пациенткам с ПНЯ учитывают предпочтения пациентки относительно пути и способа введения препарата, а также необходимость контрацепции. Рекомендуется назначение эстроген-гестагенной терапии в циклическом режиме женщинам с ПНЯ для лечения климактерических симптомов, улучшения качества жизни, профилактики остеопороза и других возраст-ассоциированных заболеваний по крайней мере до возраста естественной менопаузы – 50-51 года. При длительном применении ЗГТ при ПНЯ есть возможность перехода на непрерывную монофазную терапию при необходимости.
Пациенткам с ПНЯ могут потребоваться более высокие дозы эстрадиола в составе ЗГТ для купирования менопаузальных симптомов и профилактики постменопаузального остеопороза (2-4 мг/сут в составе пероральных препаратов, 1,5-3 мг/сут эстрадиола гемигидрата в составе 0,06% накожного геля (2,5-5,0г), 1-1,5 мг/сут эстрадиола гемигидрата в составе 0,1% накожного геля (1,0-1,5 г), 50-100 мкг/сут эстрадиола трандермальная терапевтическая система (накожный пластырь) 1 раз в неделю для купирования менопаузальных симптомов и профилактики постменопаузального остеопороза. Учитывая благоприятный профиль безопасности трансдермальных эстрогенов и необходимость длительного лечения, следует отдавать предпочтение парентеральному пути введения эстрогенов в составе ЗГТ [58].
- Рекомендуется назначение монофазной комбинированной низкодозированной эстроген-гестагенной терапии (по АТХ – Прогестагены и эстрогены в комбинации; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированные сочетания)) в непрерывном режиме женщинам с интактной маткой в постменопаузе для лечения климактерических симптомов и профилактики постменопаузального остеопороза [3], [20], [66], [70], [83], [102], [107], [108], [36], [37], [41], [42], [45], [46], [48], [65]
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий: Непрерывный монофазный режим МГТ назначается не ранее чем через 12 месяцев после последней менструации. Для пероральной МГТ используется низкая доза эстрогена — 1 мг эстрадиола. В РФ зарегистрированы следующие комбинированные формы пероральных препаратов: эстрадиол 1мг/дидрогестерон 5 мг; эстрадиола 1мг/дроспиренон 2мг.
Для трансдермальной МГТ, используется низкая доза – #0,75 мг эстрадиола 0,06% накожного геля (1,25 г геля) [88]; 0,5 мг эстрадиола 0,1% накожного геля (0,5 г геля). При недостаточном клиническом эффекте через 1-2 месяца после начала лечения, учитывая благоприятный профиль безопасности трансдермальных форм эстрогенов, индивидуально доза может быть увеличена до стандартной 1,5 мг эстрадиола 0,06% накожного геля (2,5 г геля); 1,0 мг эстрадиола 0,1% накожного геля (1,0 г геля), 50 мкг/сут эстрадиола — трандермальная терапевтическая система (накожный пластырь) 1 раз в 7 дней.
При назначении трансдермального пути введения эстрогенов в качестве гестагенного компонента дополнительно используются прогестерон** (перорально или вагинально) в дозе 100 мг в сутки; дидрогестерон** 10 мг в сутки; внутриматочная система с левоноргестрелом (ЛНГ-ВМС) (по АТХ – Пластиковые спирали с гестагенами).
- Рекомендуется назначение монофазной комбинированной ультранизкодозированной эстроген-гестагенной терапии (по АТХ – Прогестагены и эстрогены в комбинации; Прогестагены и эстрогены (для последовательного «календарного» приема); Прогестагены и эстрогены (фиксированные сочетания)) в непрерывном режиме женщинам с интактной маткой в постменопаузе для лечения климактерических симптомов [3], [20], [70], [107], [109], [36], [37], [41], [42], [45], [46], [48], [65].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: Для пероральной МГТ женщинам в постменопаузе используется ультранизкая доза эстрогена – 0,5 мг эстрадиола в составе препарата. В РФ зарегистрированы следующие комбинированные формы пероральных препаратов: эстрадиол 0,5 мг/дидрогестерон 2,5 мг; эстрадиола 0,5мг/дроспиренон 0,25мг.
Для трансдермальной МГТ используется низкая доза — #0,75 мг/сут эстрадиола 0,06% в составе накожного геля (1,25 г геля) [88]; 0,5 мг/cут эстрадиола 0,1% в составе накожного геля (0,5 г геля).
При назначении трансдермального пути введения эстрогенов в качестве гестагенного компонента дополнительно используются микронизированный прогестерон** (перорально или вагинально) в дозе 100 мг в сутки; дидрогестерон** 10 мг в сутки; внутриматочная система с левоноргестрелом (ЛНГ-ВМС) (по АТХ – Пластиковые спирали с гестагенами).
- Рекомендуется отдавать предпочтение трансдермальному пути введения препаратов эстрогенов у женщин с климактерическими симптомами и наличием коморбидных состояний [3], [20], [66]–[68], [70], [83], [84], [36], [37], [41], [42], [45], [46], [48], [65]:
Болезни печени, поджелудочной железы, нарушенной всасываемости в желудочно-кишечном тракте; расстройства коагуляции, повышенный риск венозного тромбоза; гипертриглицеридемия до и на фоне пероральных препаратов; артериальная гипертензия (> 170/100 мм рт. ст.); гиперинсулинемия; повышенный риск образования/ наличие камней в желчных путях; мигрень; ожирение; курение.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется назначение локальной/системной МГТ женщинам для купирования проявлений ГУМС [2], [3], [65], [110]–[113], [13], [20], [21], [27], [36], [38], [42], [49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: Локальная (вагинальная) терапия эстрогенами в низких дозах предпочтительна для женщин пери- и постменопаузального периода с жалобами только на симптомы ГУМС: сухость влагалища, диспареунию или дискомфорт при половой жизни, связанные с этим состоянием [22], [114]. Симптомы ГУМС и выраженность атрофических изменений мочеполового тракта имеют прогрессирующее течение и возобновляются через 1 -3 месяца после прекращения гормональной терапии [115].
Длительные наблюдения (6–24 мес.) показывают отсутствие влияния локальных эстрогенов на эндометрий, поэтому не требуется дополнительного использования прогестагенов. Локальные эстрогены не повышают риск ВТЭО, РМЖ, ССЗ, гиперплазии и рака эндометрия по данным наблюдательных исследований [116].
Эстриол (по АТХ – Эстриол) интравагинально не имеет возрастных ограничений и может быть назначен женщинам старше 60 лет. В начале лечения препараты назначают ежедневно в терапевтической дозе в течение 2-4 недель (терапия насыщения), по мере улучшения — 2 раза в неделю длительно (поддерживающая терапия) (см. таблицу 1 приложения А3). Лечение ГУМС рассматриваться как долговременная терапия так как ограничений для перерывов и возобновления приема этих препаратов нет. В зависимости от тяжести симптомов гормональные препараты могут использоваться совместно с лубрикантами.
Следует учесть для пациенток, принимающих системную МГТ, что она может быть недостаточно эффективна для купирования симптомов ГУМС, и это может потребовать дополнительного назначения локальной терапии эстрогенами.
В РФ для локального (вагинального) применения зарегистрированы препараты эстриола (по АТХ – Эстриол) в различных дозах — от 0,5 до 0,03 мг как в виде монотерапии, так и в сочетании с лактобактериями, а также комбинации лиофилизированной культуры лактобактерий, 0,2 мг эстриола и 2,0 мг прогестерона (по АТХ- Прочие препараты, применяемые в гинекологии). Синергическое действие компонентов комбинированных локальных препаратов может быть эффективным для профилактики рецидивирующих инфекций мочевыводящих путей, возникающих в постменопаузе на фоне атрофических изменений микрофлоры влагалища [111], [117], [118], [112], [119], [120].
- Не рекомендуется назначать препараты тестостерона (по АТХ — Производные 3-оксоандростена) для лечения женщин с когнитивными, сердечно-сосудистыми, метаболическими нарушениями и сексуальной дисфункцией [3], [20], [121].
Уровень убедительности рекомендаций B (уровень достоверности доказательств –1).
Комментарий: В РФ препараты тестостерона для лечения климактерических симптомов не зарегистрированы. Согласно данным систематического обзора и мета-анализа РКИ 2019 года препараты тестостерона могут быть эффективны для лечения женщин в постменопаузе, у которых после биопсихосоциальной оценки диагностировано снижение сексуального влечения. Эффективность в отношении улучшения общего самочувствия, скелетно-мышечного и когнитивного здоровья, а также показатели безопасности требуют дальнейшего изучения [121].
- Рекомендуется проведение мониторинга терапии пациенток на фоне МГТ с целью оценки эффективности, переносимости и безопасности, а также необходимости ее продолжения [2], [3], [20], [36], [37], [41], [65], [70].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5).
Комментарии: после назначения МГТ пациенткам оценка эффективности и переносимости терапии проводится через 1-2 месяца после начала лечения, далее каждые 6 месяцев в течение первого года терапии, затем 1 раз в год на фоне приема МГТ.
Решение о продолжении МГТ принимается совместно пациенткой (хорошо информированной) и ее врачом, с учетом конкретных целей лечения и объективной оценки текущих индивидуальных преимуществ и рисков терапии.
Нет никаких причин накладывать жесткие ограничения на продолжительность МГТ. Данные наиболее важных РКИ свидетельствуют в поддержку безопасности терапии, по крайней мере, в течение 5 лет у здоровых женщин, начавших ее до возраста 60 лет [93].
Эксперты NAMS в 2015 г. опубликовали заявление о возможном продолжении использования МГТ в минимальной эффективной дозе у женщин в возрасте ˃ 65 лет для лечения персистирующих приливов при условии, что пациентка получила подробную информацию о возможных рисках и находится под тщательным врачебным наблюдением [122].
Нет окончательного решения, каким образом лучше прекращать прием МГТ: постепенно или резко. У некоторых женщин ультранизкая доза гормонального препарата способна поддерживать общее благополучие и адекватное купирование симптомов, поэтому они предпочитают получать такое лечение до момента их полного завершения.
2. Негормональное лечение
- Рекомендуется применение альтернативных негормональных методов лечения женщинам, имеющих противопоказания к МГТ (включая пациенток с гормонально–зависимыми онкологическими заболеваниями) или не желающих использовать МГТ для купирования климактерических расстройств [1], [2], [128]–[137], [3], [138]– [143], [20], [121], [123]–[127].
Уровень убедительности рекомендаций A (уровень достоверности доказательств –1)
Комментарии: Снижение массы тела ассоциировано со снижением степени тяжести и количества вазомоторных симптомов [131].
Использование когнитивно-поведенческой терапии способствует снижению тяжести вазомоторных симптомов, но не их количества [132]–[135].
Клинический гипноз снижает частоту и степень тяжести вазомоторных симптомов, улучшает сон и настроение [136], [144].
Акупунктура является эффективным средством коррекции вазомоторных симптомов [137].
Согласно Кокрановскому систематическому обзору 2014 года, недостаточно данных об эффективности физических упражнений с целью коррекции вазомоторных симптомов, что подтверждается и в других РКИ [143]. Однако умеренные физические нагрузки у женщин в пери- и постменопаузе были связаны с улучшением качества жизни, когнитивных и физических функций и значительным снижением смертности [142], [143]. Йога, медитация, релаксация и управляемое дыхания по данным различных РКИ не оказывали значимого эффекта на вазомоторные симптомы [140], [141].
- Рекомендуется применение селективных ингибиторов обратного захвата серотонина (СИОЗС) и селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) женщинам с климактерическим синдромом, имеющих противопоказания к МГТ, в том числе пациенткам с гормон-зависимыми злокачественными новообразованиями, или не желающих использовать МГТ, с целью купирования вазомоторных и психоэмоциональных симптомов и улучшения сна [1], [36], [145]–[154], [41], [155]–[158], [45], [46], [123], [125], [126], [129], [130].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарий: к препаратам, которые достоверно облегчают вазомоторные симптомы и улучшают сон, относятся СИОЗС и СИОЗСН. Однако, В РФ СИОЗС и СИОЗСН не имеют зарегистрированных показаний к применению при климактерическом синдроме.
К СИОЗС относятся препараты #пароксетин** (используемые дозы 10-20 мг/сут)[154], #циталопрам (используемые дозы 10 мг/сут)[146], #эсциталопрам (используемые дозы 10-20 мг/сут)[150] и #флуоксетин** (используемые дозы 10 мг/сут [159]). К СИОЗСН — #венлафаксин (используемые дозы 37,5-150 мг/сут) [130]. Длительность терапии СИОЗС и СИОЗСН составляет 3-6 месяцев. Вопрос о продолжении терапии решается индивидуально.
В начале лечения обычно требуется постепенно увеличивать дозу препарата с целью минимизации побочных эффектов. Отмена препарата также должна проводиться с постепенным снижением дозы в течение не менее чем 2 недель во избежание появления симптомов отмены [158].
- Рекомендуется женщинам, имеющим противопоказания к применению МГТ или отказе от ее проведения, назначение полипептидов эпифиза [шишковидной железы] крупного рогатого скота (по АТХ- Прочие препараты, применяемые в гинекологии) для лечения климактерических симптомов [138], [139], [160].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий: Полипептиды эпифиза [шишковидной железы] крупного рогатого скота стимулируют продукцию пептидов, блокирующих структуры гипоталамуса, участвующих в возникновении вазомоторных симптомов. Препарат не оказывает влияния на уровень эстрадиола, уровни гонадотропинов в плазме крови и толщину эндометрия у женщин в период постменопаузы. В настоящее время имеются публикации результатов двух РКИ по изучению эффективности и безопасности препарата на основе полипептидов эпифиза у женщин с климактерическим синдромом в постменопаузе и одного открытого сравнительного наблюдательного исследования по изучению эффективности препарата полипептидов эпифиза и низкодозированной комбинированной МГТ, где препарат продемонстрировал высокую эффективность в купировании климактерических симптомов тяжелой степени в комбинации с МГТ без необходимости повышения дозы гормональных препаратов. Требуются дальнейшие долгосрочные большие по объему исследования по изучению эффективности и безопасности терапии полипептидами эпифиза климактерического синдрома у женщин в постменопаузе [138], [139].
- Рекомендуется лекарственных препаратов цимицифуги кистевидной корневищ экстракт (по АТХ — Прочие препараты, применяемые в гинекологии) женщинам при наличии у них противопоказаний к МГТ или иных факторов, препятствующих ее назначению, для терапии вазомоторных симптомов легкой и средней степени тяжести [34], [161], [162].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Цимицифуги кистевидной корневищ экстракт не является фитоэстрогеном в классическом его понимании и действует через рецепторы серотонина, дофамина и норадреналина в головном мозге [1], [162].
Согласно данным систематического обзора и мета-анализа экстракт корневищ цимицифуги более эффективен в лечении вазомоторных симптомов, чем плацебо, хотя эффект менее выражен, чем у МГТ [34], [161].
- Рекомендуется назначение лекарственных препаратов бета-аланина (по АТХ- Прочие препараты, применяемые в гинекологии) женщинам при наличии у них противопоказаний к МГТ или иных факторов, препятствующих назначению МГТ для терапии вазомоторных симптомов легкой и средней степени тяжести [163]–[166]
Уровень убедительности рекомендаций C (уровень достоверности доказательств –2).
- Рекомендуется использование негормональных любрикантов, ведение половой жизни, а также регулярное использование увлажнителей пролонгированного действия женщинам для терапии симптомов ГУМС [13], [22], [27], [36], [45], [46], [167]–[170], [171].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Неприменимо
Госпитализация
Организация оказания медицинской помощи
Стационарное лечение не предусмотрено.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Специфических профилактических мероприятий в отношении пациенток в пери- и постменопаузе не разработано. Неспецифическая профилактика подразумевает физическую активность, правильное питание и ведение здорового образа жизни.
- Рекомендуются регулярные физические занятия женщинам в пери- и постменопаузе для улучшения качества жизни, снижения смертности от сердечно-сосудистых заболеваний и общей смертности [172], [173].
Уровень убедительности рекомендаций А, уровень достоверности доказательств – 2)
Комментарий: Оптимальные физические нагрузки составляют как минимум 150 минут аэробных упражнений средней интенсивности или 75 минут высокой интенсивности в неделю, возможно сочетание упражнение средней и высокой интенсивности. При выборе интенсивности аэробной активности необходимо учитывать физическое состояние и возраст женщины. Кроме того, рекомендовано прохождение не менее 10 000 шагов в сутки. У физически активных лиц улучшается метаболический профиль, сохраняются мышечная масса (профилактика саркопении) и сила, когнитивные способности и качество жизни. Заболевания сердца, инсульт, переломы и некоторые онкологические заболевания, например, рак молочной железы и рак толстой кишки, встречаются гораздо реже.[174]
- Рекомендуется снижение массы тела женщинам в пери- и постменопаузе при наличии избыточной массы тела или ожирения для снижения смертности от сердечно-сосудистых заболеваний и общей смертности [172], [173], [175].
Уровень убедительности рекомендаций А, уровень достоверности доказательств – 2)
Комментарий: у женщин вазомоторные симптомы увеличиваются по частоте и интенсивности параллельно повышению ИМТ. Снижение массы тела приводит к облегчению вазомоторных симптомов. У женщин, начиная с периода менопаузального перехода, происходит прибавка массы тела и перераспределение жировой ткани с преимущественным накоплением висцерального жира, что приводит к возникновению инсулинорезистентности и развитию метаболического синдрома. Снижение массы тела лишь на 5–10 % достаточно для коррекции многих нарушений, ассоциированных с нарушениями углеводного обмена (НТГ, СД 2 типа).
- Рекомендуется следовать принципам здорового питания женщинам в пери- и постменопаузе для снижения смертности от сердечно-сосудистых заболеваний и общей смертности[37], [173], [176].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Комментарий: Основные компоненты здорового питания: несколько порций в день фруктов и овощей, цельных злаков, рыба дважды в неделю и низкое общее потребление жиров, рекомендуется отдавать предпочтение оливковому маслу. Потребление соли должно быть ограничено, а дневное количество алкоголя не должно превышать 20 г.
- Рекомендуется отказаться от курения женщинам в пери- и постменопаузе для снижения смертности от сердечно-сосудистых заболеваний и общей смертности [172], [177]
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарий: Доказано более раннее наступление менопаузы у курящих женщин. Результаты крупномасштабных исследований показывают, что даже незначительное / умеренное, но длительное курение, значимо коррелирует с внезапной кардиальной смертью у женщин (в 2 раза выше по сравнению с некурящими сверстницами); риск внезапной кардиальной смерти возрастает на 8% в течение каждых 5-ти лет курения).
- Рекомендуется следовать принципам, способствующим сохранению когнитивной функции в старшем возрасте [178], [179].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: Существует три главных подхода для сохранения когнитивной функции: — улучшение состояния головного мозга за счет профилактики и лечения артериальной гипертензии, сахарного диабета 2 типа, дислипидемии, ожирения и отказа от курения; — повышение когнитивного резерва с помощью различных видов досуга, стимулирующих познавательную деятельность, и высокой социальной активности; — профилактика патологических изменений, характерных для болезни Альцгеймера, которая включает регулярные физические занятия, применение методик по формированию стрессоустойчивости.
МГТ, начатая в среднем возрасте, способствует снижению риска болезни Альцгеймера и деменции. Необходим новый стиль взаимоотношений врач — пациент, при котором врач становится советчиком, а пациентка должна взять ответственность за свое собственное здоровье.
- Рекомендуется мониторирование эффективности лечения и выявление нежелательных эффектов на фоне МГТ через 1-2 месяца после начала лечения. Далее каждые 6 месяцев в течение первого года терапии, затем 1 раз в год [2], [3].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: Наблюдение за пациентками, принимающими МГТ, включает: ультразвуковое исследование матки и придатков (не реже 1 раза в год; для пациенток с миомой матки не реже 1 раза в 6 месяцев); рентгеновскую маммографию в двух проекциях в возрасте после 40 лет и УЗИ молочных желез в возрасте до 40 лет с оценкой по шкале BI-RADS ежегодно; анализ крови биохимический общетерапевтический: глюкоза, гликированный гемоглобин, креатинин, общий белок, билирубин, липидограмма (уровень общего холестерина крови, ЛПНП-ХС, ЛПВП-ХС, триглицериды); общий (клинический) анализ крови; ТТГ (по показаниям); коагулограмму (ориентировочное исследование системы гемостаза) и определение концентрации Д-димера в крови (по показаниям); исследование уровня 25-ОН витамина D в крови (по показаниям); определение полиморфизма G20210A протромбина в гене фактора II свертывания крови; молекулярно-генетическое исследование мутации G1691A в гене фактора V (мутация Лейдена в V факторе свертывания)(по показаниям); рентгеноденситометрию поясничного отдела позвоночника и проксимального отдела бедренной кости с использованием двухэнергетической рентгеновской абсорбциометрии (ДЭРА) (по показаниям)
- Рекомендуется женщинам, принимающим МГТ, ежегодно оценивать соотношение польза/риск для решения вопроса о продолжении МГТ [20], [180], [181], [73].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарий: Потенциальная связь между использованием МГТ и раком молочной железы является спорной. Данные, полученные в исследовании WHI (Womens Health Initiative) не показали повышения риска РМЖ у женщин, впервые применяющих МГТ в течение 5-7 лет после начала терапии. Согласно результатам WHI, повышенный риск РМЖ существует в случае применении определенной комбинации эстрогенов с синтетическим прогестагеном (КЭЭ и МПА) более 5 лет. При этом скорректированный относительный риск (на другие факторы риска) не является статистически значимым.
Фактический риск РМЖ на фоне МГТ низок и оценивается как в менее чем 0,1% в год или <1 случая на 1000 женщин-лет среди пользователей МГТ, что ниже, чем риск, связанный с эндогенными факторами, такими как повышенная плотность молочных желез или таких факторов, как ожирение, гиподинамия и потребление алкоголя. Согласно данным исследований, МГТ, содержащее микронизированный прогестерон или дидрогестерон не повышает риски РМЖ [20], [92]–[94], [182]
Информация
Источники и литература
-
Клинические рекомендации Российского общества акушеров-гинекологов
- [1] J. Drewe, K. A. Bucher, and C. Zahner, “A systematic review of non-hormonal
treatments of vasomotor symptoms in climacteric and cancer patients,” pp. 1–29, 2015, doi:
10.1186/s40064-015-0808-y.
[2] P. F. Schnatz, A. Romegialli, J. Abrantes, K. Marakovits, D. Cunningham, and D. M.
O’Sullivan, “The North American Menopause Society: From abstract to publication,”
Menopause, vol. 15, no. 5, pp. 996–1001, 2008, doi: 10.1097/gme.0b013e318166f026.
[3] Ю. С. В. Сухих Г.Т., Сметник В.П., Андреева Е.Н., Балан В.Е., Гависова А.А.,
Григорян О.Р., Ермакова Е.И., Зайдиева Я.З., Ильина Л.М., Касян В.Н., Марченко Л.А.,
Подзолкова Н.М., Роговская С.И., Сметник А.А., Чернуха Г.Е., Менопаузальная
гормонотерапия и сохранение здоровья женщин в зрелом возрасте. Клинические
рекомендации. 2015, pp. 8–9.
[4] T. Muka et al., “Association of Vasomotor and Other Menopausal Symptoms with Risk
of Cardiovascular Disease: A Systematic Review and Meta-Analysis,” PLoS One, vol. 11, p.
e0157417, Jun. 2016, doi: 10.1371/journal.pone.0157417.
[5] J. L. Gordon, D. R. Rubinow, R. C. Thurston, J. Paulson, P. J. Schmidt, and S. S. Girdler,
“Cardiovascular, hemodynamic, neuroendocrine, and inflammatory markers in women with
and without vasomotor symptoms,” Menopause, vol. 23, no. 11, pp. 1189–1198, Nov. 2016,
doi: 10.1097/GME.0000000000000689.
[6] R. C. Thurston et al., “Physiologically assessed hot flashes and endothelial function
among midlife women,” Menopause, vol. 24, no. 8, pp. 886–893, Aug. 2017, doi:
10.1097/GME.0000000000000857.
[7] G. M. van Dijk et al., “The association between vasomotor symptoms and metabolic
health in peri- and postmenopausal women: A systematic review,” Maturitas, vol. 80, no. 2,
pp. 140–147, Feb. 2015, doi: 10.1016/j.maturitas.2014.11.016.
[8] V. M. Miller et al., “What’s in a name: are menopausal ‘hot flashes’ a symptom of
menopause or a manifestation of neurovascular dysregulation?,” Menopause, vol. 25, no. 6,
pp. 700–703, 2018, doi: 10.1097/gme.0000000000001065.
[9] S. V. Yureneva and V. G. Averkova, “Menopausal vasomotor symptoms: central triggers,
effectors, and new possibilities of pathogenetic therapy,” Ross. Vestn. akushera-ginekologa,
vol. 18, no. 5, p. 43, 2018, doi: 10.17116/rosakush20181805143.
[10] G. A. Greendale et al., “Bone mineral density loss in relation to the final menstrual
period in a multiethnic cohort: results from the Study of Women’s Health Across the Nation
(SWAN),” J. Bone Miner. Res., vol. 27, no. 1, pp. 111–118, Jan. 2012, doi: 10.1002/jbmr.534.
[11] F. Trémollieres, “Assessment and hormonal management of osteoporosis,” Climacteric,
vol. 22, no. 2, pp. 122–126, Mar. 2019, doi: 10.1080/13697137.2018.1555582.
[12] R. Sapir-Koren and G. Livshits, “Is interaction between age-dependent decline in
mechanical stimulation and osteocyte–estrogen receptor levels the culprit for
postmenopausal-impaired bone formation?,” Osteoporos. Int., vol. 24, no. 6, pp. 1771–1789,
2013, doi: 10.1007/s00198-012-2208-2.
[13] “The 2020 genitourinary syndrome of menopause position statement of The North
American Menopause Society,” Menopause, vol. 27, no. 9, pp. 976–992, 2020, doi: DOI:
10.1097/GME.0000000000001609.
[14] D. J. Portman, M. L. S. Gass, and on behalf of the V. A. T. C. C. Panel, “Genitourinary
syndrome of menopause: new terminology for vulvovaginal atrophy from the International
Society for the Study of Women’s Sexual Health and The North American Menopause
Society,” Menopause, vol. 21, no. 10, 2014, [Online]. Available:
https://journals.lww.com/menopausejournal/Fulltext/2014/10000/Genitourinary_syndrome_o
[15] D. A. J. M. Schoenaker, C. A. Jackson, J. V Rowlands, and G. D. Mishra, “Socioeconomic
position, lifestyle factors and age at natural menopause: a systematic review and metaanalyses
of studies across six continents,” Int. J. Epidemiol., vol. 43, no. 5, pp. 1542–1562, Oct.
2014, doi: 10.1093/ije/dyu094.
[16] E. W. Freeman, M. D. Sammel, and R. J. Sanders, “Risk of long-term hot flashes after
natural menopause: evidence from the Penn Ovarian Aging Study cohort,” Menopause, vol.
21, no. 9, pp. 924–932, Sep. 2014, doi: 10.1097/GME.0000000000000196.
[17] C. Costanian, S. Zangiabadi, S. A. Bahous, R. Deonandan, and H. Tamim, “Reviewing the
evidence on vasomotor symptoms: the role of traditional and non-traditional factors,”
Climacteric, vol. 23, no. 3, pp. 213–223, May 2020, doi: 10.1080/13697137.2019.1711051.
[18] N. Santoro, C. N. Epperson, and S. B. Mathews, “Menopausal Symptoms and Their
Management,” Endocrinol. Metab. Clin. North Am., vol. 44, no. 3, pp. 497–515, 2015, doi:
10.1016/j.ecl.2015.05.001.
[19] G. A. Mel’Nichenko et al., “Russian federal clinical guidelines on the diagnostics,
treatment, and prevention of osteoporosis,” Probl. Endokrinol. (Mosk)., vol. 63, no. 6, pp. 392–
426, 2017, doi: 10.14341/probl2017636392-426.
[20] R. J. Baber, N. Panay, and A. Fenton, “2016 IMS Recommendations on women’s midlife
health and menopause hormone therapy,” Climacteric, vol. 19, no. 2, pp. 109–150, Mar. 2016,
doi: 10.3109/13697137.2015.1129166.
[21] F. Palma, A. Volpe, P. Villa, and A. Cagnacci, “Vaginal atrophy of women in
postmenopause. Results from a multicentric observational study: The AGATA study,”
Maturitas, vol. 83, pp. 40–44, Jan. 2016, doi: 10.1016/j.maturitas.2015.09.001.
[22] Y. S. V. Yureneva, E. E. I. Ermakova, and G. A. V. Glazunova, “Genitourinary syndrome of
menopause in peri- and postmenopausal patients: Diagnosis and therapy (short clinical
guideline),” Akush. Ginekol. (Sofiia)., vol. 5_2016, pp. 138–144, May 2016, doi:
10.18565/aig.2016.5.138-144.
[23] L. N. Wood and J. T. Anger, “Urinary incontinence in women,” BMJ Br. Med. J., vol. 349,
p. g4531, Sep. 2014, doi: 10.1136/bmj.g4531.
[24] W. H. Natcher, “NIH State-of-the-Science Conference on Management of Menopause-
Related Symptoms Sponsored by : National Institutes of Health,” Heal. (San Fr., vol. 3, pp.
118(suppl 2):1–172, 2005.
[25] N. E. Avis et al., “Duration of Menopausal Vasomotor Symptoms Over the Menopause
Transition,” JAMA Intern Med, vol. 175, no. 4, pp. 531–539, 2015, doi:
10.1001/jamainternmed.2014.8063.
[26] P. Monteleone, G. Mascagni, A. Giannini, A. R. Genazzani, and T. Simoncini, “Symptoms
of menopause — global prevalence, physiology and implications,” Nat. Rev. Endocrinol., vol.
14, no. 4, pp. 199–215, 2018, doi: 10.1038/nrendo.2017.180.
[27] P. Briggs, “Genitourinary syndrome of menopause,” Post Reprod. Heal., vol. 26, no. 2,
pp. 111–114, 2020, doi: 10.1177/2053369119884144.
[28] P. M. Maki et al., “Guidelines for the evaluation and treatment of perimenopausal
depression: Summary and recommendations,” J. Women’s Heal., vol. 28, no. 2, pp. 117–134,
2019, doi: 10.1089/jwh.2018.27099.mensocrec.
[29] E. S. Mitchell and N. F. Woods, “Cognitive symptoms during the menopausal transition
and early postmenopause,” Climacteric, vol. 14, no. 2, pp. 252–261, Apr. 2011, doi:
10.3109/13697137.2010.516848.
[30] H. M. Kravitz and H. Joffe, “Sleep During the Perimenopause: A SWAN Story,”
Obstetrics and Gynecology Clinics of North America, vol. 38, no. 3. Elsevier, pp. 567–586, Sep.
01, 2011, doi: 10.1016/j.ogc.2011.06.002.
[31] S. M. Mallhi TH, Khan YH, Khan AH, Mahmood Q, Khalid SH, “Managing Hot Flushes in
Menopausal Women: A Review,” J Coll Physicians Surg Pak., vol. Jun;28(6), pp. 460–465, 2018,
doi: doi: 10.29271/jcpsp.2018.06.460.
[32] M. R. Islam, P. Gartoulla, R. J. Bell, P. Fradkin, and S. R. Davis, “Prevalence of
menopausal symptoms in Asian midlife women: a systematic review,” Climacteric, vol. 18, no.
2, pp. 157–176, Mar. 2015, doi: 10.3109/13697137.2014.937689.
[33] S. Chaikittisilpa, K. Soimongkol, and U. Jaisamrarn, “Efficacy of oral estrogen plus
testosterone gel to improve sexual function in postmenopausal women,” Climacteric, vol. 22,
no. 5, pp. 460–465, Sep. 2019, doi: 10.1080/13697137.2019.1577378.
[34] G. Sarri, H. Pedder, S. Dias, Y. Guo, and M. A. Lumsden, “Vasomotor symptoms resulting
from natural menopause: a systematic review and network meta-analysis of treatment
effects from the National Institute for Health and Care Excellence guideline on menopause,”
BJOG An Int. J. Obstet. Gynaecol., vol. 124, no. 10, pp. 1514–1523, Sep. 2017, doi:
https://doi.org/10.1111/1471-0528.14619.
[35] D. Harlow, P. Maki, R. W. Rebar, and E. Director, “President, International Menopause
Society (South Africa),” Climacteric, vol. 15, no. 2, pp. 105–114, 2012, doi:
10.3109/13697137.2011.650656.
[36] O. Ortmann, M. Beckermann, E. Inwald, T. Strowitzki, E. Windler, and C. Tempfer, “Periand
postmenopause—diagnosis and interventions interdisciplinary S3 guideline of the
association of the scientific medical societies in Germany (AWMF 015/062): short version,”
Arch. Gynecol. Obstet., vol. 302, Jul. 2020, doi: 10.1007/s00404-020-05682-4.
[37] E. Armeni et al., “Maintaining postreproductive health: A care pathway from the
European Menopause and Andropause Society (EMAS).,” Maturitas, vol. 89, pp. 63–72, Jul.
2016, doi: 10.1016/j.maturitas.2016.04.013.
[38] R. J. Santen et al., “Treatment of urogenital atrophy with low-dose estradiol:
Preliminary results,” Menopause, vol. 9, no. 3, pp. 179–187, 2002, doi: 10.1097/00042192-
200205000-00006.
[39] “Приказ Министерства здравоохранения Российской Федерации от 20.10.2020 №
1130н «Об утверждении Порядка оказания медицинской помощи по профилю
‘акушерство и гинекология,’” 2020.
[40] “Доброкачественная дисплазия молочной железы.Клинические
рекомендации.Министерство здравоохранения Россиской Федерации.,” p. 77, 2020.
[41] M. A. Lumsden, “The NICE Guideline – Menopause: diagnosis and management,”
Climacteric, vol. 19, no. 5, pp. 426–429, Sep. 2016, doi: 10.1080/13697137.2016.1222483.
[42] П. С. В. и соавт. Юренева С. В. Ермакова, Ведение женщин с менопаузальными
расстройствами. Учебное пособие. 2016.
[43] Е. Е. И. Юренева С.В., “Менопауза и климактерическое состояние у женщины,”
Акушерство и гинекология., vol. 7, pp. 17–21, 2018.
[44] Y. S. V. Yureneva, K. V. I. Komedina, and K. S. Y. Kuznetsov, “Weight gain in
perimenopausal women: methods for assessing the body composition and maintenance
tactics,” Akush. Ginekol. (Sofiia)., vol. 2_2020, pp. 56–61, Mar. 2020, doi:
10.18565/aig.2020.2.56-61.
[45] C. A. Stuenkel et al., “Treatment of Symptoms of the Menopause: An Endocrine Society
Clinical Practice Guideline,” J. Clin. Endocrinol. Metab., vol. 100, no. 11, pp. 3975–4011, Nov.
2015, doi: 10.1210/jc.2015-2236.
[46] National Collaborating Centre for Women’s and Children’s Health (UK). Menopause: Full
Guideline. London: National Institute for Health and Care Excellence. London, 2015.
[47] M. G. Munro, H. O. D. Critchley, and I. S. Fraser, “The two FIGO systems for normal and
abnormal uterine bleeding symptoms and classification of causes of abnormal uterine
bleeding in the reproductive years: 2018 revisions.,” Int. J. Gynaecol. Obstet. Off. organ Int.
Fed. Gynaecol. Obstet., vol. 143, no. 3, pp. 393–408, Dec. 2018, doi: 10.1002/ijgo.12666.
[48] Menopause Practice (5th Edition) : A Clinician’s Guide.The North American Menopause
Society. 2014.
[49] E. A. Pigarova et al., “Russian Association of Endocrinologists recommendations for
diagnosis, treatment and prevention of Vitamin D deficiency in adults,” Probl. Endokrinol.
(Mosk)., vol. 62, no. 4, pp. 60–84, 2016, doi: 10.14341/probl201662460-84.
[50] Fahey M. T., Irwig L., Macaskill P. Meta-analysis of Pap test accuracy //American journal of
epidemiology. – 1995. – Т. 141. – №. 7. – С. 680-689. .
[51] Meggiolaro A., Unim B., Semyonov L., Miccoli S., Maffongelli E., La Torre G. The role of
Pap test screening against cervical cancer: a systematic review and meta-analysis. Clin Ter.
167(4):124–39. .
[52] Wang J. Analysis of the application values of different combination schemes of liquid-based
cytology and high-risk human papilloma virus test in the screening of high-grade cervical lesions
//Brazilian Journal of Medical and Biological Research. – 2019. .
[53] J. A. Kanis, C. Cooper, & R. Rizzoli, and J.-Y. Reginster, “European guidance for the
diagnosis and management of osteoporosis in postmenopausal women,” doi:
10.1007/s00198-018-4704-5.
[54] W. D. Leslie, S. Morin, L. M. Lix, and H. Johansson, “Fracture risk assessment without
bone density measurement in routine clinical practice,” 2011, doi: 10.1007/s00198-011-
1747-2.
[55] W. D. Leslie et al., “High fracture probability with FRAX® usually indicates
densitometric osteoporosis: implications for clinical practice,” Osteoporos. Int., vol. 23, no. 1,
pp. 391–397, 2012, doi: 10.1007/s00198-011-1592-3.
[56] Assessment of fracture risk and its application to screening for postmenopausal
osteoporosis. World Health Organization, Geneva. World Health Organ Tech Rep Ser.
1994;843:1-129. .
[57] Nelson HD, Haney EM. Screening for Osteoporosis: Systematic Review to Update the 2002
US Preventive Services Task Force Recommendation. Rockville (MD): Agency for Healthcare
Research and Quality (US); 2010 Jul. Report No.: 10-05145-EF-1. .
[58] N. Panay et al., “Premature ovarian insufficiency: an International Menopause Society
White Paper.,” Climacteric, vol. 23, no. 5, pp. 426–446, Oct. 2020, doi:
10.1080/13697137.2020.1804547.
[59] X. Xu, M. Jones, and G. D. Mishra, “Age at natural menopause and development of
chronic conditions and multimorbidity: results from an Australian prospective cohort.,”
Hum. Reprod., vol. 35, no. 1, pp. 203–211, Jan. 2020, doi: 10.1093/humrep/dez259.
[60] “International Society for Clinical Densitometry position statement 2019.”
https://www.iscd.org/official-positions/2019-iscd-official-positions-adult.
[61] L. Shepstone et al., “Screening in the community to reduce fractures in older women
(SCOOP): a randomised controlled trial.,” Lancet (London, England), vol. 391, no. 10122, pp.
741–747, Feb. 2018, doi: 10.1016/S0140-6736(17)32640-5.
[62] Jiang X, Gruner M. Diagnostic accuracy of FRAX in predicting the 10-year risk of
osteoporotic fractures using the USA treatment thresholds: A systematic review and metaanalysis.
Bone. 2017 Jun;99:20-25. .
[63] T. B. Bevers et al., “Breast Cancer Screening and Diagnosis, Version 3.2018, NCCN
Clinical Practice Guidelines in Oncology.,” J. Natl. Compr. Canc. Netw., vol. 16, no. 11, pp.
1362–1389, Nov. 2018, doi: 10.6004/jnccn.2018.0083.
[64] R. H. Cobin and N. F. Goodman, “American Association of Clinical Endocrinologists and
American College of Endocrinology Position Statement on Menopause–2017 Update,”
Endocr. Pract., vol. 23, no. 7, pp. 869–881, Jul. 2017, doi: 10.4158/EP171828.PS.
[65] H. Okano et al., “Japan Society of Obstetrics and Gynecology and Japan Society for
Menopause and Women’s Health 2017 guidelines for hormone replacement therapy,” J.
Obstet. Gynaecol. Res., vol. 44, no. 8, pp. 1355–1368, Aug. 2018, doi:
https://doi.org/10.1111/jog.13684.
[66] G. Casanova, R. Bossardi Ramos, P. Ziegelmann, and P. M. Spritzer, “Effects of Low-
Dose Versus Placebo or Conventional-Dose Postmenopausal Hormone Therapy on Variables
Related to Cardiovascular Risk: A Systematic Review and Meta-Analyses of Randomized
Clinical Trials,” J. Clin. Endocrinol. Metab., vol. 100, no. 3, pp. 1028–1037, Mar. 2015, doi:
10.1210/jc.2014-3301.
[67] S. R. Salpeter, J. M. E. Walsh, T. M. Ormiston, E. Greyber, N. S. Buckley, and E. E.
Salpeter, “Meta-analysis: effect of hormone-replacement therapy on components of the
metabolic syndrome in postmenopausal women.,” Diabetes. Obes. Metab., vol. 8, no. 5, pp.
538–554, Sep. 2006, doi: 10.1111/j.1463-1326.2005.00545.x.
- [1] J. Drewe, K. A. Bucher, and C. Zahner, “A systematic review of non-hormonal
Информация
Список сокращений
АМГ — антимюллеровый гормон
АЛТ— аланинаминотрансфераза
АСТ— аспартатаминотрансфераза
АД — артериальное давление
ВА — вагинальная атрофия
ВВА – вульвовагинальная атрофия
ВМС — вазомоторные симптомы
ВОЗ — Всемирная организация здравоохранения
ВПЧ – вирус паппиломы человека
ВТЭ — венозная тромбоэмболия
ГЭ — гиперплазия эндометрия
ГГТ — гамма-глютамилтрансфераза
ГУМС — генитоуринарный менопаузальный синдром
ДЭРА — двухэнергетическая рентгеновская абсорбциометрия
Е2 — эстрадиол
Е2В — эстрадиола валерат
ЖКБ- желчекаменная болезнь
ЗГТ – заместительная гормональная терапия
ИБС — ишемическая болезнь сердца
ИМТ — индекс массы тела
КЭЭ – конъюгированные эквин эстрогены
КОК — комбинированные оральные контрацептивы
ВМС-ЛНГ — внутриматочная система с левоноргестрелом
ЛПВП-ХС — липопротеины высокой плотности холестерин
ЛПНП-ХС — липопротеины низкой плотности холестерин
МПК – минеральная плотность кости
МГТ — менопаузальная гормональная терапия
МПА — медроксипрогестерона ацетат
МЗ РФ – министерство здравоохранения Российской Федерации
ОТ — объем талии
ПМ — последняя менструация
ПТГ – паратиреоидный гормон
ПНЯ — преждевременная недостаточность яичников
ПЦР – полимеразная цепная реакция
РКИ — рандомизированное контролируемое исследование
РМЖ — рак молочной железы
РФ – Российская Федерация
РЯ – рак яичников
СИОЗС — селективные ингибиторы обратного захвата серотонина
СИОЗСН — селективные ингибиторы обратного захвата серотонина и норадреналина
СПЯ- синдром поликистозных яичников
УЗИ – ультразвуковое исследование
ФСГ — фолликулостимулирующий гормон
ХС — холестерин
EMA (European Medical Agency) — комитет Европейского агентства по надзору в сфере лекарственных средств
FRAX – шкала оценки 10-летнего риска переломов
NAMS (North American Menopause Society) – Cеверо-американское общество по Менопаузе
STRAW (Stages of Reptoductive Ageing Workshop) – классификация стадий репродуктивного старения
SCORE (Systematic COronary Risk Evaluation) – шкала оценки сердечно-сосудистого риска смерти от сердечно-сосудистого заболевания
WHI ( Womens Health Initiative) – рандомизированное контролируемое исследование «Во имя здоровья женщин»
Термины и определения
Этапы репродуктивного старения женщин — клинико-гормональная характеристика этапов старения репродуктивной системы (Stages of Reproductive Aging Workshop — STRAW) разработаны в 2001 г. и пересмотрены в 2011 г. с учетом результатов крупных когортных исследований, проведенных в течение последующих 10 лет (STRAW+10)
Вазомоторные нарушения — проявление всех форм нарушений вегетативной регуляции (приливы, лабильность АД и пульса, расстройства дыхания, повышенная потливость, ознобы и т.д.).
Приливы жара — резкий приток тепла к лицу и к верхней половине тела (шея, руки, грудь), который может сопровождаться кратковременным подъемом центральной температуры тела, испариной, потоотделением и заканчиваться ознобом.
Психоэмоциональные менопаузальные расстройства включают различные лабильность настроения, депрессивное состояние, тревожность, плаксивость, повышенную возбудимость, агрессию, панические атаки.
Генитоуринарный менопаузальный синдром (ГУМС) — симптомокомплекс, ассоциированный со снижением эстрогенов и других половых стероидов, включающий в себя изменения, возникающие в наружных половых органах, промежности, влагалище, уретре и мочевом пузыре.
Вульвовагинальная атрофия (ВВА) часто сопровождает ГУМС. Наиболее распространенными симптомами ВВА является сухость влагалища, диспареуния, жжение и зуд.
Недержание мочи — непроизвольное выделение мочи, являющееся социальной или гигиенической проблемой, при наличии объективных проявлений неконтролируемого мочеиспускания
Постменопаузальный остеопороз — системное заболевание скелета, характеризующееся нарушением архитектоники костной ткани и прогрессивным уменьшением минеральной плотности костной ткани, что приводит к снижению прочности кости и повышению риска переломов.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Адамян Лейла Владимировна — Академик РАН, доктор медицинских наук, профессор, заместитель директора ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, Заслуженный деятель науки России, заведующая кафедрой репродуктивной медицины и хирургии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, главный специалист Минздрава России по акушерству и гинекологии, является Президентом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов-эндоскопистов, Российской ассоциации по эндометриозу, членом Российского общества акушеров-гинекологов.
Андреева Елена Николаевна — доктор медицинских наук, профессор, директор Института репродуктивной медицины, зав. отделением эндокринной гинекологии, профессор кафедры эндокринологии ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, профессор кафедры репродуктивной медицины и хирургии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, является членом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов эндоскопистов, Российской ассоциации по эндометриозу, Российского общества акушеров гинекологов, международной ассоциации акушеров-гинекологов и эндокринологов.
Аполихина Инна Анатольевна — д.м.н., профессор, руководитель отделения эстетической гинекологии и реабилитации ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, профессор кафедры акушерства, гинекологии, перинатологии и репродуктологии ИПО ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России, профессор кафедры акушерства и гинекологии департамента профессионального образования ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Артымук Наталья Владимировна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии имени профессора Г.А. Ушаковой ФГБОУ ВО «Кемеровский государственный медицинский университет» Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в Сибирском федеральном округе (г. Кемерово), является членом президиума правления Российского общества акушеров-гинекологов, президент Кемеровской региональной общественной организации «Ассоциация акушеров-гинекологов».
Ашрафян Л.А., академик РАН, д.м.н., профессор, директор института онкогинекологии и маммологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, президент Российского общества специалистов по профилактике и лечению опухолей репродуктивной системы.
Балан Вера Ефимовна, д.м.н., проф., руководитель поликлинического отделения ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии», президент Российской ассоциации по менопаузе.
Ермакова Елена Ивановна, к.м.н., старший научный сотрудник отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ.
Кузнецов Сергей Юрьевич, к.м.н., врач-рентгенолог, врач акушер-гинеколог отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ.
Родионов Валерий Витальевич – заведующий отделением патологии молочной железы института онкогинекологии и маммологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации, д.м.н., является членом Российского общества маммологов, Российского общества специалистов по профилактике и лечению опухолей репродуктивной системы.
Сметник Антонина Александровна — зав. отделением гинекологической эндокринологии, к.м.н., является членом Российского общества акушеров-гинекологов, вице-президент Российской ассоциации по менопаузе.
Филиппов Олег Семенович – д.м.н., профессор, заместитель директора Департамента медицинской помощи детям и службы родовспоможения Министерства здравоохранения Российской Федерации, профессор кафедры акушерства и гинекологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России (г. Москва).
Чернуха Галина Евгеньевна — доктор медицинских наук, профессор, главный научный сотрудник отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, является президентом Межрегиональной ассоциации гинекологов – эндокринологов, членом Российского общества акушеров-гинекологов.
Юренева Светлана Владимировна, д.м.н., ведущий научный сотрудник отделения гинекологической эндокринологии, профессор кафедры акушерства и гинекологии ФГБУ НМИЦ АГП им. академика В.И. Кулакова МЗ РФ, является членом Российской ассоциации акушеров-гинекологов, вице-президентом Межрегиональной ассоциации гинекологов-эндокринологов, членом президиума Российской ассоциации по остеопорозу, РОСОРС.
Ярмолинская Мария Игоревна — руководитель отдела гинекологии и эндокринологии ФГБНУ «НИИ АГиР им.Д.О.Отта», заведующий отделением гинекологии № 2, руководитель центра «Диагностики и лечение эндометриоза», профессор кафедры акушерства и гинекологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, профессор РАН, д.м.н., профессор, член Российского общества акушеров-гинекологов.
Якушевская Оксана Владимировна, к.м.н., научный сотрудник отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ.
Конфликт интересов: отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Клинические рекомендации по оказанию медицинской помощи пациенткам в периоды пери- и постменопаузы, а также пациенткам с раннее и преждевременной менопаузой составлены в соответствии с требованиями о разработке клинических рекомендаций медицинскими профессиональными некоммерческими организациями, часть 2 статьи 76 Федерального закона от 21.11.2011г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», приказом Министерства здравоохранения Российской Федерации № 103н от 28.02.2019г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
Целевая аудитория данных клинических рекомендаций:
1.врачи акушеры-гинекологи
2.врачи эндокринологи
3. врачи урологи
4. врачи терапевты
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Рис. 1. STRAW+10: стадии старения репродуктивной системы женщин [1].
Заключение по системе BI-RADS:
0 категория – неуточненное и требует дообследования
1 категория – результат отрицательный (без изменений)
2 категория – доброкачественные изменения
3 категория – вероятно доброкачественные изменения
4, 5 категории — высокая вероятность малигнизации
6 категория – малигнизация, подтвержденная морфологически с помощью биопсии.
Маршрутизация пациенток в зависимости от заключения по системе BI-RADS:
0 категория – направляется на консультацию врача-онколога для дальнейшего обследования
1, 2 категория – наблюдение врачом акушером-гинекологом
3 – направляется в онкологический диспансер для верификации диагноза
4, 5,6 категории – наблюдение врачом онкологом
1. Монотерапия эстрогенами
Проводится в непрерывном режиме женщинам с удаленной маткой, вне зависимости от фазы климактерия, для лечения климактерических симптомов и/или профилактики остеопороза. Терапия локальной/системной МГТ у женщин для купирования проявлений ГУМС.
Таблица 4 Схемы лечения эстрогенами
2. Терапия гестагенами
Проводится женщинам в период менопаузального перехода для профилактики гиперпластических процессов эндометрия и регуляции менструального цикла, в постменопаузе в составе МГТ.
Таблица 5 Схемы лечения гестагенами.
3. Комбинированная эстроген-гестагенная терапия
Проводится женщинам с интактной маткой в перименопаузе, но не ранее, чем через 6 месяцев после последней менструации и в постменопаузе для лечения климактерических симптомов и профилактики остеопороза в циклическом и непрерывном режимах.
Таблица 6 Схемы лечения комбинированными эстроген-гестагенными препаратами.
Таблица 7 Негормональные методы терапии вазомоторных симптомов
Приложение Б. Алгоритмы действий врача
рисунок 2
рисунок 3
рисунок 4
рисунок 5
рисунок 6
рисунок 7
Приложение В. Информация для пациента
Менопауза ─ стойкое прекращение менструальных циклов вследствие потери фолликулярной активности яичников. Менопауза может быть самопроизвольной (естественная менопауза) или ятрогенной (вторичная менопауза), наступающей в результате двухсторонней овариоэктомии (удаления яичников), химио- или лучевой терапии. Менопауза возникает раньше у курильщиц. Самый драматичный период «перестройки» женского организма включает два года до менопаузы плюс первые два года постменопаузы. Ранняя стадия перехода в менопаузу характеризуется нарастанием вариабельности продолжительности менструальных циклов. Менструальный цикл может колебаться в пределах 7 и более дней при сравнении последовательных циклов – как в сторону укорочения, так и удлинения. Поздняя стадия перехода в менопаузу характеризуется задержками менструаций от 30 дней и более. Отсутствие менструации в течение 12 месяцев и более говорит о наступлении постменопаузы.
Изменение уровня гормонов и характеристик менструального цикла может сопровождаться возникновением комплекса симптомов, именуемых «климактерическим синдром». Период менопаузального перехода зачастую сопровождается классическими климактерическими симптомами, что всегда свидетельствует о дезадаптации женского организма к нормальному, естественному ходу событий. В переходный период женщины могут предъявлять разнообразные жалобы: приливы «жара», потливость, усталость, раздражительность, тревогу, напряжение, частые ночные пробуждения, нарушения сна, нарушение концентрации внимания, перепады настроения, потеря кратковременной памяти и затруднения мышления и запоминания новой информации, боли в суставах/пояснице, сухость влагалища, дискомфорт и боль при половых контактах, недержание мочи, увеличение веса и/или изменение пропорций тела, женщина отмечает увеличение жировой ткани в области живота, сексуальные нарушения, сухость кожи, ухудшение состояния волос и ногтей, происходит снижение минеральной плотности костной ткани и др. Наиболее частыми симптомами у женщин в пери- и ранней постменопаузе являются вазомоторные проявления: приливы жара и повышенная потливость. При наличии тех или иных менопаузальных симптомов женщине необходимо обратиться к гинекологу – эндокринологу для прохождения медицинского обследования и получения рекомендаций по применению гормональной или негормональной терапии, образу жизни, питанию и т.д. Наиболее благоприятное терапевтическое окно воздействия – менопаузальный переход и ранняя постменопауза. Именно период менопаузального перехода при выраженном климактерическом синдроме является отправной точкой для начала менопаузальной гормональной терапии, позволяющей корректировать климактерические симптомы, предупреждать и лечить проявления урогенитальной атрофии, профилактировать развитие остеопороза.
Наступление менопаузы можно предположить, если возраст женщины на момент появления вазомоторных симптомов старше 45 лет и если в течение 12 месяцев у нее отсутствуют менструации. Для постановки диагноза нужно провести гормональное обследование крови и ультразвуковое исследование органов малого таза.
Общая стратегия поддержания здоровья женщин в пери- и постменопаузе, наряду с обязательным соблюдением здорового образа жизни, диетой, адекватной физической активностью, включает менопаузальную гормональную терапию (МГТ). Восполнение сниженной функции яичников при дефиците половых гормонов с помощью минимально- оптимальных доз гормональных препаратов позволит купировать вазомоторные симптомы, улучшит общее состояние женщин и обеспечит профилактику поздних обменных нарушений.
Препараты эстрогенов выпускаются в различных дозах. Дозы гормонов, путь их введения подбирается индивидуально, с учетом предпочтений и ожиданий самой женщины, возраста пациентки, а также в зависимости от имеющихся симптомов и необходимости профилактики заболеваний, риск развития которых выявляется при анализе данных личного и семейного анамнеза, результатов обследования. Очень важно, что менопаузальная гормональная терапия позволяет не только купировать проявления климактерического синдрома, но и обладает свойством тормозить процессы старения (англ. anti-age effect), а также способствует увеличению продолжительности жизни и повышению ее качества.
При наличии симптомов сухости и дискомфорта во влагалище первой линией выбора являются негормональные вагинальные смазки и увлажняющие кремы наряду с регулярной половой жизнью. В случае неэффективности смазок и увлажняющих кремов, терапия эстрогенами в низкой дозе вагинально остается терапевтическим стандартом лечения вагинальных симптомов.
МГТ является «золотым стандартом» для лечения менопаузальных симптомов, однако некоторые женщины имеют противопоказания для такой терапии (рак молочной железы в анамнезе, семейный риск тромбоэмболии и др. Для них могут быть предложены альтернативные методы: когнитивная поведенческая терапия, регулярные физические занятия, снижение веса и избегание факторов, способствующих возникновению приливов (потребление кофе, прямое воздействие высокой температуры) или применение негормональных растительных препаратов («цимицифуга» (black cohosh)), альтернативных препаратов (полипептиды шишковидной железы, бета-аланин) и антидепрессантов (СИОЗС и СИОЗСН), которые достаточно широко используются для лечения менопаузальных симптомов. Следует всячески пропагандировать отказ от курения и злоупотребления алкоголем.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Паспорт таблицы:
Название на русском языке: Оценка тяжести климактерического синдрома по шкале Грина.
Оригинальное название: The Greene Climacteric Scale
Источник (официальный сайт разработчиков, публикация с валидацией): Greene Climacteric Scale (GCS). Greene J.G. Constructing a standard climacteric scale. Maturitas, 1998. Vol.29, 25-31
— индекс
— вопросник
— другое (уточнить):
Пояснение: Необходимо выбрать в каждой строке один вариант ответа, наиболее подходящий состоянию на момент осмотра и поставить рядом с ним знак V или X в окошке. После чего, проводится подсчет суммы баллов.
Ключ (интерпретация): 0 — нет симптома.
1 — слабое проявление симптома.
2 — умеренное проявление симптома.
3 — тяжелое проявление симптома.
Степень выраженности климактерического синдрома по результатам тестирования:
1-11 — слабая.
12-19 – средняя.
20 и выше – тяжелая.
Паспорт таблицы:
Название на русском языке: Шкала оценки риска ВТЭО у нехирургических больных (шкала Падуа)
Оригинальное название: Assessment of venous thromboembolism risk
Источник (официальный сайт разработчиков, публикация с валидацией): Geerts W.H., Pineo G.F., Heit J.A., et al. Prevention of Venous Thromboembolism. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126: 338S–400S.
— индекс
— вопросник
— другое (уточнить):
Пояснение: Проводится оценка имеющихся факторов риска и подсчет суммы баллов.
Ключ (интерпретация): 0-3 балла – низкий риск, ≥4 баллов – высокий риск развития ВТЭО
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
В последние десятилетия во всем мире отмечается тенденция к увеличению средней продолжительности жизни, что сопровождается неуклонным постарением населения, прежде всего женского[5, 9]. По данным Росстата, доля лиц старше трудоспособного возраста в общей структуре населения страны к началу 2014 г. достигла 23,1%, средний возраст мужчин составил 36,64 года, а средний возраст женщин — 41,73 года. При этом еще в 2010 г. россиянки были на полгода моложе (41,1 года)[11]. С учетом сложившихся как в России, так и в большинстве стран мира стойких негативных демографических тенденций это объясняет глобальный интерес медицинской науки к феномену женского репродуктивного старения[5, 22].
Старение женского организма — длительный и весьма разнородный процесс, который по-особому протекает у различных индивидуумов, но в то же время имеет ряд общих принципиальных характеристик, выявленных в ходе крупных когортных проспективных исследований здоровья женщин среднего возраста (35–60 лет), проведенных в последние 10 лет. Эти характеристики в 2011 г. были обобщены группой экспертов, усовершенствовавших критерии этапов репродуктивного старения женщин STRAW (Stages of Reproductive Aging Workshop), опубликованные в 2001 г., и предложивших шкалу STRAW+10 (десять лет спустя)[22].
Ключевым моментом новых положений послужил факт, что основным признаком, позволяющим разграничить периоды жизни женщины, ассоциированные с «этапами репродуктивного старения», является характер менструального цикла. Его типичные нарушения с последующим полным прекращением менструаций (аменорея в течение года — менопауза) позволяют выделить у женщин среднего возраста период менопаузального перехода, перименопаузу, раннюю постменопаузу и позднюю постменопаузу, впоследствии переходящую в старость. В STRAW+10 были упрощены критерии для ранней и поздней стадий переходного периода, основанные на оценке менструальных кровотечений; внесены корректирующие изменения в критерии для позднего этапа репродуктивного периода (стадия –3), а также для ранней постменопаузы (стадия +1); представлена информация о продолжительности поздней переходной стадии (стадия –1) и ранней постменопаузы (стадия +1), которую теперь разделяют на три фазы (+1a, +1b и +1c). Термин «перименопауза» остается правомочным, этот период начинается на стадии –2 и завершается через 12 месяцев с момента последней менструации, однако ранняя постменопауза, согласно критериям STRAW+10, продолжается в течение 6–8 лет[22].
Изменения, развивающиеся в организме женщины на фоне прогрессирующего дефицита эстрогенов в связи с генетически детерминированным процессом выключения функции репродуктивной системы, объединяют в понятие «менопаузальный синдром». Цель практического врача в контексте менопаузального синдрома — предупреждение и лечение заболеваний, сохранение и укрепление здоровья женщин среднего возраста, в том числе устранение симптомов менопаузальных расстройств, снижение риска болезней, ассоциированных с наступлением старости[5, 14].
Основной лечебно-профилактической технологией, имеющей патогенетическую направленность, служит менопаузальная гормонотерапия — предмет споров и опасений гормонофобов[5, 9, 13].
Различные проявления менопаузального синдрома (раздел МКБ-10: N95 — «Нарушения менопаузы и другие нарушения в околоменопаузном периоде») в случае наступления естественной менопаузы имеют определенную закономерность: вначале, как правило в период менопаузального перехода, возникают ранневременные расстройства (обусловленные утратой обратной связи за счет снижения продукции эстрадиола яичниками), затем, как правило в период ранней постменопаузы, — средневременные расстройства (следствие утраты влияния эстриола). В большинстве клинических ситуаций можно купировать эти симптомы и даже на определенное время предупредить их прогрессирование, суть которого состоит в развитии со временем необратимых органических изменений в органах-мишенях, их «износе» на фоне существования без привычной поддержки эстрогенов — универсального фактора биологической пролиферации. Эти изменения — субстрат поздневременных нарушений, появление которых знаменует начало конца бесперебойного функционирования репродуктивно значимых органов и систем: ЦНС (нарушения когнитивной функции, памяти, болезнь Альцгеймера), сердечно-сосудистой (ИБС, атеросклероз, гипертензия, метаболический синдром) и костно-мышечной (остеопороз, остеоартроз) систем, слизистых оболочек[5, 12] (для мочевыделительной системы и половых путей предложены термины «урогенитальный синдром менопаузы», «генитоуринарный синдром»)[13].
Вместе с тем у конкретной пациентки не обязательны все проявления — иногда это какой-то один синдром, иногда несколько; последовательность появления симптомов и их интенсивность также могут варьировать, особенно в случае искусственной менопаузы, когда шкалой STRAW пользоваться затруднительно ввиду невозможности оценить характер менструального цикла[22].
Наиболее распространенным проявлением климактерического синдрома являются «горячие приливы» (hot flashes) — приступообразно возникающий симптомокомплекс, в основе которого лежит дисфункция высшей вегетативной регуляции с развитием кардиоваскулярных, респираторных и температурных сдвигов[5, 13, 23]. Клинически значимые приливы наблюдаются у 75% женщин климактерического возраста, причем у 25% они не прекращаются на протяжении всей ранней постменопаузы. Порой приливы настолько выраженны, что резко снижают качество жизни[13, 14]. Особую остроту проблеме придают ситуации, когда в силу ряда причин женщина не может или отказывается использовать классическую терапию эстрогенсодержащими препаратами, эффективность которых в настоящее время безоговорочно доказана, а прием ограничен четко определенными относительными или абсолютными противопоказаниями. На долю таких страдалиц остаются немедикаментозная терапия (коррекция рациона, психотерапия, физиолечение, рефлексотерапия) либо медикаментозная негормональная терапия и/или симптоматическое лечение (тофизопам, клонидин, метаболические и гомеопатические средства), посиндромная терапия (направленная на коррекцию метаболического, остеопенического, астенического синдромов, депрессии). Промежуточную нишу между медикаментозной негормональной терапией и классической менопаузальной гормонотерапией традиционно занимают фитоэстрогены (ФЭ), обладающие активностью по отношению к эстрогеновым рецепторам органов-мишеней[5, 7, 8].
Цель обзора:
обобщение существующей доказательной базы терапевтической эффективности и безопасности ФЭ при их использовании для коррекции менопаузальных расстройств.
К основным классам ФЭ относят:
- изофлавоны (генистеин, дайдзеин, биоханин, формононетин), которые содержатся в соевых бобах и клевере. Они наиболее близки по структуре и оказываемому действию к эстрогенам (особенно генистеин и дайдзеин);
- лигнаны (энтеролактон, энтеродиол) — содержатся в зерновых и овощах, частично в масличных;
- куместаны (куместрол) — содержатся в клевере и люцерне[6, 25].
В течение длительного периода мнение об эффективности ФЭ оставалось разноречивым, что неоднократно подчеркивалось в международных консенсусах по менопаузе[13, 14]. Существовавшие до недавнего времени представления о низкой — сопоставимой с плацебо (33–38%) — эффективности фитогормонов, применяемых для коррекции климактерических расстройств, были сформированы на основе довольно многочисленных клинических исследований разного уровня доказательности, выполненных с использованием лекарственных препаратов и биологически активных добавок, технология изготовления которых оставляла желать лучшего[6, 8]. Вместе с тем уже в прошлом десятилетии были подтверждены такие эффекты ФЭ, как коррекция вазомоторных расстройств, терапия проявлений урогенитального синдрома менопаузы, ангиопротективное и антиатерогенное действие, благоприятное влияние на липидный спектр крови и костный метаболизм[3, 21, 35]. Исследования последних лет позволили некоторым препаратам получить доказательную базу и в отношении эффективности и безопасности лечения широкого спектра менопаузальных расстройств.
Приливы. В 2013 г. в 12-м выпуске Кокрановской библиотеки были опубликованы результаты систематического обзора, включавшего 43 рандомизированных контролируемых исследования продолжительностью не менее 12 недель, посвященных использованию ФЭ для лечения менопаузальных вазомоторных расстройств. В этих исследованиях приняли участие 4084 женщины с приливами в менопаузе, перименопаузе или постменопаузе. Не было получено убедительных данных о снижении любыми ФЭ частоты и тяжести приливов. Вместе с тем в рамках мультицентрового рандомизированного плацебо-контролируемого исследования было доказано влияние синтетического генистеина на частоту приливов (частота приливов в сутки снизилась вдвое, в среднем с 9,4 до 4,7, в то время как на фоне приема плацебо — лишь на 28,3%, с 9,9 до 7,1)[18]. Авторы систематического обзора отметили терапевтическую эффективность генистеина в дозах 30 мг/сут и выше в отношении снижения частоты приливов и не исключили наличия у него дозозависимого эффекта в плане влияния на их тяжесть[25]. Интересна информационная составляющая обзора, объясняющая причину низкой терапевтической эффективности многих ФЭ. Будучи по строению гликозидами, молекулы связываются с глюкозой в кишечнике при активном участии кишечной микробиоты и в результате становятся неактивными. Однако технологический прорыв, обеспечивший гарантированное качество сырья и высокую степень очистки синтетического генистеина, позволил получить агликолевую форму, благодаря чему молекула генистеина остается активной в результате метаболизма в кишечнике. В России агликолевый генистеин содержится в Менориле (30 мг в одной капсуле с режимом дозирования 1–3 раза в день).
Согласно метаанализу, проведенному K. Taku и соавт. (2012), назначение изофлавонов (в среднем 54 мг) на срок от 6 недель до 12 месяцев значимо снижает частоту приливов по сравнению с плацебо. Эффективными оказались дозы генистеина 18,8 мг и более (они в 2 раза более действенны, чем меньшие дозы)[33].
Результатам исследований с высоким уровнем доказательности не противоречат данные отечественного многоцентрового клинического исследования, в которое были включены 23 женщины с климактерическим синдромом различной степени тяжести, средний исходный показатель модифицированного менопаузального индекса (ММИ) составил 37,39 ± 0,99, средний индекс вегетативных расстройств — 41,39 ± 2,13[4]. Все пациентки принимали синтетический активный генистеин (Менорил) в суточной дозе 60 мг в течение 6 месяцев. Установлена его высокая эффективность в коррекции менопаузальных расстройств легкой и средней степени тяжести: через 6 месяцев терапии было получено значимое снижение ММИ до 6,96 ± 0,67 (р < 0,005). Одновременно были отмечены снижение среднего индекса вегетативных расстройств до 9,65 ± 0,47 (р < 0,005) и положительная динамика самочувствия пациенток по данным анкеты MOS SF-36.
Дозозависимый эффект изофлавонов отметили также исследователи группы S. L. Crawford и соавт. (2013). По их данным, наилучшие результаты были достигнуты у женщин, получавших самые высокие дозы препарата (100–200 мг) и наиболее часто (2–3 раза в день), причем, хотя в этом исследовании были задействованы препараты разных производителей, результаты оказались идентичными[16]. Тем не менее одно из последних исследований китайских ученых не выявило значимого улучшения в отношении менопаузальных симптомов при назначении 40 г соевой муки, 40 г обезжиренного молока и 63 мг чистого дайдзеина или 40 г обезжиренного молока (плацебо)[26].
В последние годы опубликован ряд исследований эффективности препаратов, содержащих экстракт тритерпеновых гликозидов Cimicifuga racemosa (черный змеиный корень, клопогон кистевидный). В работе T. S. Shams и соавт. (2010) экстракт цимицифуги азиатской (черный змеиный корень) показал низкую эффективность в отношении менопаузальных симптомов (всего 26%), зато был признан безопасным[32]. Закономерно, что влияние азиатской цимицифуги на приливы и качество жизни женщин в перименопаузе особенно много изучают ученые Китая[36]. Но вопрос о реальной безопасности экстракта до сегодняшнего дня остается дискуссионным, так как были получены сведения о гепатотоксическом действии некоторых его метаболитов, вызывающих изменения печени, аналогичные повреждениям при аутоиммунном гепатите[17]. Тем не менее метаанализ, опубликованный в апреле 2011 г., опровергает предположение о гепатотоксичности препаратов черного змеиного корня[30]. Есть данные о более высокой эффективности экстракта красного клевера в отношении проявлений климактерических расстройств: по результатам одного из рандомизированных исследований его эффективность составила 57%, в то время как черного змеиного корня — лишь 36%[36].
Следует различать препараты цимицифуги в зависимости от сырья, обработки и технологии получения молекулы действующего вещества. Так, экстракт цимицифуги BNO 1055 (клопогон кистевидный), в отличие от своего азиатского собрата, имеет доказательную базу и высокий уровень безопасности, подтвержденный рандомизированными клиническими плацебо-контролируемыми исследованиями[1, 10]. По данным Д. В. Ельчанинова (2012), экстракт цимицифуги BNO 1055 снижает частоту приливов на 58% и благотворно влияет на психоэмоциональное состояние пациенток[2]. Заслуживают внимания данные отечественного рандомизированного плацебо-контролируемого исследования с участием 105 пациенток, страдавших климактерическим синдромом средней степени тяжести, которые в течение года получали экстракты красного клевера и цимицифуги BNO 1055[10]. Автором показано, что эффективность экстрактов красного клевера и цимицифуги BNO 1055 значимо превышает плацебо, а их терапевтическое воздействие обусловлено влиянием на нейромедиаторный обмен (статистически значимое повышение содержания серотонина, дофамина, снижение уровня норадреналина) и сохраняется у 59% женщин в течение 6 месяцев, у 27,5% пациенток — в течение года.
Урогенитальный синдром менопаузы. В настоящее время доказано, что при лечении урогенитальной атрофии локальные формы эстрогенов имеют преимущества перед системной терапией[13]. В исследовании О. В. Карпович (2007) показано, что генистеин более эффективен в отношении сухости влагалища по сравнению с системной менопаузальной гормональной терапией (МГТ), выявлено снижение сухости влагалища в 5,8 раза (р < 0,05). Установлено, что его эффект проявляется через 2–3 недели терапии с дальнейшим снижением тяжести климактерического синдрома: на протяжении первых 6 месяцев — в 1,5 раза, в течение года — в 2 раза[3]. В рамках двойного слепого плацебо-контролируемого и контролируемого конъюгированными эстрогенами исследования положительное эстрогеноподобное влияние на слизистую оболочку влагалища продемонстрировал и экстракт цимицифуги BNO 1055[1]. P. Fanti и соавт. (1998) в своем исследовании показали, что при атрофии слизистой влагалища на фоне постовариоэктомического синдрома эффективна доза генистеина 25 мкг, отметив дозозависимый эффект препарата[19].
Ангиопротективное и антиатерогенное действие. В ряде исследований установлено положительное влияние генистеина на сосудистую стенку, в эксперименте он подавлял клеточную пролиферацию, а также ангиогенез и рост опухолевых клеток[20, 35]. Способность к расширению просвета сосудов показали генистеин и эквимолар, в отличие от дайдзеина[35].
Влияние на костный метаболизм. В двойном слепом плацебо-контролируемом и контролируемом конъюгированными эстрогенами исследовании доказано, что экстракт цимицифуги BNO 1055 может препятствовать развитию остеопороза, о чем свидетельствуют значения суррогатных сывороточных маркеров метаболизма костной ткани (щелочной фосфатазы костной ткани и др.). Полученные данные о стабильной концентрации печеночных ферментов и показателей факторов свертывающей системы крови подтверждают отсутствие у экстракта цимицифуги BNO 1055 гепатотоксического действия[1].
В ряде работ были доказаны такие эффекты генистеина, как ингибирование костной резорбции и стимуляция остеогенеза. Исследовательской группой P. Fanti и соавт. (1998) обнаружено, что у женщин после овариоэктомии со сниженным исходным уровнем минеральной плотности костной ткани при приеме 5 и 25 мкг генистеина статистически значимо снижается степень деминерализации костной ткани[19]. В то же время в рамках двойного слепого плацебо-контролируемого исследования N. Morabito и соавт. (2002) отмечена статистически сходная эффективность МГТ и ФЭ, что подтверждено путем оценки минеральной плотности костной ткани, а также определения уровней пиридинолина и деоксипиридинолина в моче и др.[28]. Эффективность лечения генистеином нарушений минерального обмена костной ткани по сравнению с группой плацебо по данным лабораторных исследований (выделение пиридинолина и диоксипиридинолина в моче, увеличение уровня костно-специфической алкалин-фосфатазы, инсулиноподобного фактора роста 1) в рамках двойного слепого плацебо-контролируемого исследования была установлена также H. Marini и соавт. (2007)[27].
M. Yamaguchi (2012) показано, что генистеин в синергизме с цинком стимулирует синтез белка и образование остеобластов костной ткани. Таким образом, он подавляет остеокластогенез из стволовых клеток костного мозга и индуцирует апоптоз зрелых остеокластов, приводя к увеличению костной массы. Генистеин регулирует костный гомеостаз через воздействие на эстрогеновые рецепторы и влияние на экспрессию генов многих белков, связанных с метаболизмом костной ткани[37].
Заслуживают внимания данные рандомизированного плацебо-контролируемого исследования о положительном влиянии комбинации генистеина, полиненасыщенных жирных кислот и витаминов D3 и K1 на минеральную плотность костной ткани у женщин в постменопаузе. В этом шестимесячном двойном слепом исследовании 70 пациенток были рандомизированы и получали ежедневно либо только кальций, либо комбинацию генистеина (30 мг/сут), витамина D3 (800 МЕ/день), витамина K1 (150 мкг/день) и полиненасыщенных жирных кислот (1 г полиненасыщенных жирных кислот: соотношение эйкозапентаеновая кислота/докозагексаеновая кислота ≈ 2/1). Оценивались маркеры костной резорбции и минеральная плотность кости (в шейке бедра, поясничном отделе позвоночника, треугольнике Уорда)[24].
В настоящее время на российском рынке доступно комплексное средство Менорил плюс, которое содержит в одной капсуле генистеин в дозе 15 мг, ресвератрол 15 мг (активный антиоксидантный компонент с противоопухолевым, противовоспалительным, кардиопротекторным, сахаропонижающим и гиполипидемическим действием), витамин D3
0,005 мг и витамин К1 0,06 мг. Рекомендованный режим дозирования — 2 капсулы в день. Такой состав активных веществ обусловливает комплексное действие: эстрогеноподобное, выраженное антиоксидантное с позитивным влиянием на кожу, сердечно-сосудистую систему, а также протективное в отношении костной ткани.
Влияние на углеводный и жировой обмен. В рамках исследования K. Vedavanam (1999) обнаружено свойство изофлавонов сои оказывать антиоксидантное воздействие, влияя на уровень ЛПНП[34]. D. Goodman-Gruen, D. Kritz-Silverstein (2003) выявили статистически значимую обратную связь между приемом генистеина и показателями массы тела и ИМТ[21]. В 2014 г. C. Moser и соавт. опубликовали работу, в которой была доказана положительная роль тритерпеновых гликозидов (Cimicifuga racemosa extract Ze 450) в лечении диабета 2 типа в эксперименте на животных[29].
Антипролиферативный эффект, отсутствие риска развития эстрогензависимых опухолей. В рамках исследования E. J. Choi, G. H. Kim (2014) продемонстрировано значительное антипролиферативное действие дайдзеина и генистеина против трех линий клеток. В эксперименте антипролиферативные эффекты были более выраженными у генистеина, чем у дайдзеина, что могло быть связано с большей выраженностью его эстрогенной активности, более сильным сродством генистеина к эстрогеновым рецепторам[15].
Интересны данные двойного слепого плацебо-контролируемого исследования, в рамках которого 401 пациентка (у каждой из них по меньшей мере одна из близких родственниц страдала раком молочной железы) в течение 3 лет принимала экстракт красного клевера или плацебо. Каждые 6 месяцев всем участницам проводили полный анализ биохимических показателей, ежегодно — маммографию, определение минеральной плотности костной ткани, а также УЗИ малого таза. Значимых межгрупповых различий обнаружено не было, но в группе, принимавшей ФЭ, наблюдали небольшое улучшение показателей денситометрии. Авторами сделан вывод, что экстракт красного клевера не повышает риск развития эстрогензависимых опухолей[31]. Этому выводу созвучны результаты рандомизированного плацебо-контролируемого исследования И. В. Рафаэлян (2015), в котором показано, что экстракты красного клевера и цимицифуги BNO 1055 при их использовании 105 женщинами с климактерическим синдромом средней тяжести в течение года не оказывали негативного влияния на маммографическую плотность и состояние эндометрия[10].
ЗАКЛЮЧЕНИЕ
Проблема оказания лечебно-профилактической помощи женскому населению в пери- и постменопаузе сохраняет свою остроту и далека от окончательного решения. Клиффорд Саймак однажды сказал: «Ученый должен продвигаться вперед, прикладывая один кусочек знания к другому, и только тогда делать выводы». Данные последних лет в определенной степени носят новационный характер, открывая горизонты эры высоких технологий в изготовлении фитопрепаратов, в том числе фитогормонов[6]. Помимо высокого уровня доказательности, результаты многочисленных исследований свидетельствуют о значительном нереализованном пока еще лечебно-профилактическом потенциале различных фитоэстрогенов последнего поколения. Учитывая тот факт, что старт классической менопаузальной гормонотерапии допустим лишь в пределах «окна терапевтических возможностей» — не позже 10 лет после наступления менопаузы, — особенно ценно для клинициста то, что терапия фитоэстрогенами возможна в разные периоды жизни женщины. К тому же при их применении, помимо уменьшения частоты приливов, можно добиться нормализации у пациентки артериального давления и либидо, купирования связанных с приливами астенических проявлений и цефалгий, улучшения настроения, получить эффект позитивного влияния на костную ткань и кожу.
Индивидуальный выбор средств и технологий (или их сочетаний) для терапии менопаузальных расстройств, наряду со знаниями и умениями, требует от врача искусства работы с конкретной пациенткой, «чувства меры», «соблюдения пропорций». В клинической практике это в значительной степени достигается путем применения препарата в соответствии с инструкцией. Тогда лечение будет безопасным не только для пациентки, но и для врача.
Описание товара Source Naturals, Hot Flash, 180 таблеток
- Не содержит генетически модифицированной со膆
- Помогает снизить частоту приливов, связанных с менопаузой
- Пищевая добавка
Source Naturals Eternal Woman™ — это революционная линия, разработанная для того, чтобы женщины в период менопаузы могли ощутить Freedom to Change™ естественным образом. Формула Source Naturals Hot Flash® может помочь минимизировать резкую реакцию организма на снижение уровня эстрогена. Формула Hot Flash включает изофлавоны сои, не содержащие ГМО, которые, как показали клинические исследования, могут снизить частоту и тяжесть приливов.
†† Не является генетически модифицированным продуктом.
Способ приема
Принимать по 3 таблетки в день. Для достижения наилучших результатов используйте этот продукт не менее 4 недель.
Предупреждения
Не подходит для женщин детородного возраста. Не следует принимать при планировании беременности, в период беременности или грудного вскармливания.
Хранить в сухом и прохладном месте.
Не следует использовать данный продукт, если любая из защитных пленок повреждена или отсутствует. Хранить в недоступном для детей месте.
Производитель оставляет за собой право изменить внешний вид упаковки, состав продукта, вкусовые добавки и его консистенцию. Мы стараемся следить за изменениями, но, если вы заметили какое-либо несоответствие, пожалуйста, сообщите нам об этом в письме или в комментарии к товару. Спасибо!
Компоненты товара
| Пищевая ценность | ||
| Размер порции: 3 таблетки | ||
| Порций в упаковке: 60 | ||
| Количество в 1 порции | % от суточной нормы | |
| Калории | 10 | |
| Всего углеводов | 1 г | < 1%* |
| Пищевая клетчатка | 1 г | 4%* |
| Белки | 1 г | 2%* |
| Кальций (в виде двузамещенного фосфата кальция, природного происхождения) | 98 мг | 8% |
| Натрий | 8 мг | < 1% |
| Комплекс изофлавонов без ГМО SoyLife® (из сои) | 2,1 г | † |
| Содержит 42 мг общих изофлавонов | ||
| Стандартизированный экстракт женьшеня (корень) (3:1) | 160 мг | † |
| Содержит 4 мг тритерпеновых гликозидов | ||
| Экстракт корня дягиля лекарственного (Dong Quai) | 150 мг | † |
| Порошок из экстракта корня солодки | 150 мг | † |
| Экстракт ягод витекса | 100 мг | † |
| † Процент от суточной нормы при условии потребления 2000 калорий в день. † Суточная норма не определена. |
Другие Ингредиенты
Двузамещенный фосфат кальция, сорбитол, стеариновая кислота, диоксид кремния, модифицированная целлюлозная камедь, и стеарат магния.
Содержит сою.
Подходит для вегетарианцев. Не содержит дрожжей, молочных продуктов, яиц, глютена и пшеницы. Не содержит консервантов, искусственных красителей, ароматизаторов и отдушек.
Directions
Take 1 tablet in the morning and 1 tablet in the evening. This will help maintain sufficient levels of S-equol, giving you relief during the day and night.
Ingredients
Key Ingredient: S-equol
Inactive Ingredients: Dicalcium Phosphate, Fermented Soy Germ, Silicon Dioxide, Croscarmellose Sodium, Magnesium Stearate, Coating (Hypromellose, Glycerin, Hydroxypropyl Cellulose), Microcrystalline Cellulose. Contains Soy
See Supplement Facts
How does Equelle work?
During menopause, estrogen levels decrease causing symptoms like hot flashes, sleep difficulties and vaginal irritation. Equelle’s active ingredient, S-equol, has a similar structure as estrogen and can mimic some of its actions, helping to ease menopause symptoms.
Is Equelle right for me?
If you’re experiencing menopause symptoms like hot flashes, sleep disturbances, vaginal discomfort, and more, Equelle is right for you whether you are in perimenopause, menopause, or postmenopause.
S-equol is the active ingredient in Equelle. It is a naturally derived compound produced through the fermentation of soy germ and is naturally produced by women in the gut in small amounts. The S-equol used in Equelle is developed using a patented fermentation process that simulates the specific gut conditions needed for certain bacteria to produce S-equol.
Equelle and its active ingredient, S-equol, have undergone decades of clinical research and development. It has been shown to be safe and is not associated with changes in sex or thyroid hormones, negative effects on endometrial health or breast cancer. In general, taking botanicals or plant-based supplements may result in possible gastrointestinal upset. If you are experiencing any adverse effects, we recommend discontinuing product use and consulting your physician or healthcare professional.
Equelle is safe to take with other foods, supplements, and over-the-counter or prescription medications and will not negatively interact with them. However, Equelle should not be taken if you have a soy allergy or sensitivity. If you are pregnant, nursing, taking any medications and/or hormone therapy (HT), you should consult your healthcare professional before taking this product.
Equelle contains calcium, which may interfere with the absorption of thyroid medications. To prevent this interference, space the dosing of Equelle at least 4 hours apart from your thyroid medication. As always talk with your doctor if you have concerns.
Only trace amounts of soy compounds remain in the final Equelle product. These amounts are significantly less than those present in a single serving of most common soy foods.
No. During our fermentation process, only small trace amounts of soy compounds remain in the final Equelle product. These amounts are significantly less than those present in a single serving of most common soy foods. However, since there are still small trace amounts of soy compounds, Equelle should not be taken if you have a soy allergy or sensitivity.
TRUST & SAFETY
20 years of research for proven safety.
Equelle’s active ingredient, S-equol, is a plant-based compound, derived from soy and proven safe by scientific experts with:
No association with breast cancer or other cancers
No changes in sex or thyroid hormones
No negative effects on endometrial health


OUR PROMISE
We are with you every step of the way.
We know it’s important to try Equelle to make sure it works for you. That’s why we have a 90 day money-back guarantee. If Equelle doesn’t work for you, we’ll make it easy and refund you in full.
FROM OUR COMMUNITY
Real reviews from
real women.
This area allows women like you to express their own opinions and comments about Equelle. We stay out of it! These reviews are unfiltered and uncurated.
Hot flashes are one of the most common symptoms experienced by women around the time of menopause. In fact, approximately half of all perimenopausal women and 75 — 85% of all postmenopausal women experience hot flashes.
While the onset, duration, frequency, and severity of hot flashes varies greatly between women, hot flashes often begin in the years before a woman’s last period and can last anywhere from six months to fifteen years.
Hot flashes are caused by hormonal fluctuations that occur during the menopausal transition. Fortunately, treating this underlying hormonal imbalance naturally and making simple lifestyle changes is all that most women need to manage this symptom. Continue reading to learn more about hot flashes, their symptoms, causes, management, and treatments.

What Are Hot Flashes?
Hot flashes, also called «hot flushes», are a vasomotor symptom of menopause. This means that hot flashes can disrupt the normal regulation of blood vessels, resulting in intense heat, perspiration, and other symptoms that can range from mild to severe.
The duration and frequency of hot flashes varies from woman to woman. Hot flashes can occur at any time of the day or night, though they are often called night sweats when they happen during sleeping hours.
Women with menopause-related hot flashes will usually experience a consistent and unique pattern of symptoms. Some women experience mild symptoms of hot flashes infrequently, while others experience more severe symptoms multiple times each day.
Signs and Symptoms of Hot Flashes
The following are the most common signs and symptoms of hot flashes:
- Sudden, intense feelings of heat. This can appear in the face, neck, arms, torso, and sometimes the whole body.
- Rapid or irregular heartbeat and pulse. Heart palpitations may occur.
- Flushing. This symptom is particularly prevalent in lighter-skinned women.
- Perspiration. Sweating can range from mild to profuse.
- Cold chills. This often follow hot flashes, though sometimes women experience only the chill.
- Sleep disturbances. Night sweats can disrupt sleep and lead to fatigue or insomnia.
- Other symptoms. Nausea, dizziness, anxiety, and headaches are other possible symptoms associated with hot flashes.
While each woman will experience the symptoms of hot flashes in a pattern that is unique to her, some women are at a greater risk for more severe and prolonged hot flashes. Women taking the breast cancer treatment drug tamoxifen may experience more severe and prolonged hot flashes. Additionally, women who have total hysterectomies will often experience hot flashes more severely and for a longer duration.
Click on the following link to read more information about hot flashes, or continue reading below to learn more about the causes of hot flashes.
 Signs of Hot Flashes
Signs of Hot Flashes
Generally, tests aren’t needed in order to diagnose hot flashes, as they are characteristic of causing a rapid heartbeat, perspiration, flushed, blotchy skin, and a sudden feeling of warmth across the upper body and face. Nevertheless, read about signs of hot flashes to pinpoint the condition here.
 What Every Women Should Know about Hot Flashes
What Every Women Should Know about Hot Flashes
The most important thing that women need to know about hot flashes is that they are in control. Find out more about this frustrating symptom of menopause as far as causes, symptoms, and triggers. Once you have a greater understanding you will be much more prepared to prevent and cope with unruly heat.
Hormonal Causes
The most common cause of hot flashes in menopausal women is changing levels of estrogen in the body. Estrogen has a direct effect on the hypothalamus, the part of the brain responsible for controlling appetite, sleep, and body temperature.
Lowered levels of estrogen confuse the hypothalamus, causing it to inaccurately sense that the body is overheating. This provokes an internal chain of reactions that women experience as «hot flashes».
In addition to these completely normal hormonal causes of hot flashes, other medical conditions can also cause hot flashes.
Other Causes of Hot Flashes
Certain medical conditions and medications can sometimes cause a person to experience hot flashes. For this reason, women for whom menopause is unlikely or women with other unexplained symptoms should consult a doctor to rule out these other potential causes of hot flashes.
Diseases That Can Cause Hot Flashes
- Panic disorder
- Infection
- Obesity
- Diabetes
- Hyperhidrosis
- Thyroid disease
- Cancer
Medications That Can Cause Hot Flashes
- Raloxifene (osteoporosis drug)
- Tamoxifen (breast cancer drug)
- Gonadotropin analogues (e.g., nafarelin)
Click on the following link to read more information about the causes of hot flashes, or keep reading to learn about managing hot flashes through simple measures, including the avoidance of common hot flash triggers.
 What Causes Postmenopausal Hot Flashes?
What Causes Postmenopausal Hot Flashes?
You may be discouraged and confused if you are still experiencing hot flashes after menopause. Though many symptoms were thought to disappear once your menstrual cycle halts for good, the surges are still coming. This article explores further potential causes for this and how to knock them out.
 6 Habits That Trigger a Hot Flash Episode
6 Habits That Trigger a Hot Flash Episode
Certain lifestyle choices can be making your hot flashes much worse than they have to be. Increased heart rate, shallow breathing, sweating, and redness are made much more severe by these six triggers. Find out what to avoid if you’re worried about when your next outburst will take over.
Thankfully, women who experience hot flashes during menopause have several ways to manage them in order to reduce their frequency and severity. In many cases, simple steps can be taken throughout the day to reduce hot flashes or prevent them altogether. Also, avoiding the common triggers of hot flashes is another important way to combat them.
Simple daily changes that can greatly help a menopausal woman manage hot flashes include:
- Considering air conditioning, ceiling and floor fans, and even small personal handheld fans
- Avoiding being rushed, since it can quickly raise the body’s temperature and trigger a hot flash
- Keeping ice water or another cold beverage on hand during the day and night
- Taking a cool shower before bed
- Using cotton sheets and avoiding silk or synthetics
- Keeping a cold pack under or near the pillow and turning the pillow often to keep cool
In addition to making these simple changes, avoiding hot flash triggers can significantly help a woman manage hot flashes.
Common Triggers:
- Warm environments (i.e., hot weather, saunas)
- Devices that give off heat (e.g., fireplaces, hair dryers, heaters)
- Stress
- Anxiety
- Hot and spicy foods and drinks
- Smoking cigarettes
- Overconsumption of caffeine, alcohol, and sugar
- Diet pills
Making minor daily changes and avoiding triggers can make a huge difference for many menopausal women who are trying to manage hot flashes. While these measures often help to reduce the frequency and intensity of hot flashes, they are unable to treat the root of the problem, which is a hormonal imbalance.
Click on the following link to read more information on managing hot flashes, or continue reading below to learn more about the treatments for hot flashes.
 5 Must-Have Products for Hot Flashes
5 Must-Have Products for Hot Flashes
While hot flashes are most commonly a symptom of menopause or another hormonal disturbance, in a few rare cases, they may be a sign of something worse, like a rare form of cancer. Talk to a doctor if you experience hot flashes as well as symptoms like fatigue, weakness, or weight loss.
 Best Things to Do or to Take for Hot Flashes
Best Things to Do or to Take for Hot Flashes
Hot flashes are likely to be the most common symptom of menopause. According to recent studies, around 4 out of every 5 women — or 80% of women — will experience hot flashes at some point in their life, usually close to the times of transition related to menopause.
If the simple management techniques outlined above are not bringing about relief, there are other treatment measures that can be followed.
Health Tips for Fighting Hot Flashes:
- Practice slow, diaphragmatic breathing
- Eat a balanced diet
- Aim for a vitamin E intake of 800mg/day
- Consider B vitamin levels
- Increase soy protein intake
- Exercise regularly
- Consider meditation or yoga
Daily behaviors can have a significant impact on a woman’s experience of hot flashes. For example, eating a spicy dinner or having too many glasses of wine can trigger hot flashes. Increased stress due to work pressure or family obligations can also set a hot flash into motion. Lifestyle adjustments are two-pronged: some strategies focus on avoiding triggers, while others concentrate on increasing overall health — some overlap exists between these two.
It is most logical, as well as safest, to begin with the least invasive lifestyle changes first, and then progress on to other measures if these are not working. Given the fact that at heart, hot flashes are a hormonal issue, it is most effective to address the problem at the source. Natural and alternative remedies are a safe and easy way to balance hormone levels, particularly in conjunction with lifestyle changes to promote overall health.
In more drastic cases, it may be advisable to seek surgical or pharmaceutical treatments, though these are more risky in terms of side effects and should be approached with caution. In addition to hormone replacement therapy (HRT), several other pharmaceutical drugs may be effective hot flash treatment options. These drugs include:
- Selective serotonin reuptake inhibitors (SSRIs)
- Blood pressure medications
- Mild sedatives
- Seizure medications
It is important to keep in mind that while all of these drugs have the potential to assist in hot flash relief, they all carry a risk of side effects, some of which may outweigh any potential benefits. Click on the following link to read and learn more specifics about the different options for the treatment of hot flashes.
 What to Take for Hot Flashes
What to Take for Hot Flashes
As one of the most infamous menopause symptoms, hot flashes can bring misery to women’s lives for months on end if they don’t find an effective treatment options. Read about what you can take for hot flashes to finally find relief from these life-disrupting episodes here.
 Supplements for Hot Flashes: Safe and Cost-Effective
Supplements for Hot Flashes: Safe and Cost-Effective
Many women will go to great lengths and spend anything just to find ultimate relief from hot flashes. However, their wallets don’t have to suffer as well. Click here to learn more about safe and cost-effective supplements for hot flashes, and finally find the relief you’ve been dreaming of today.
- «Hot flashes … in January». Canadian Medical Association Journal. 2004: 170 (1).
- National Health Service UK. (2015). Hot flushes: how to cope. Retrieved March 15, 2016, from http://www.nhs.uk/Livewell/menopause/Pages/hot-flushes.aspx
- National Institute on Aging. (2015). What Can You Do for Hot Flashes and Other Menopausal Symptoms. Retrieved March 15, 2016, from https://www.nia.nih.gov/health/publication/menopause-time-change/what-can-you-do-hot-flashes-and-other-menopausal-symptoms
- Sikon, Andrea and Holly Thacker M.D. «Treatment for Menopausal Hot Flashes». Cleveland Clinic Journal of Medicine. July 2004: 71 (7).
- Thurston, R.C. & Joffe, H. (2011). Vasomotor Symptoms and Menopause: Findings from the Study of Women’s Health Across the Nation. Obstetrics and Gynecology Clinics of North America, 38(3), 489-501. doi: 10.1016/j.ogc.2011.05.006