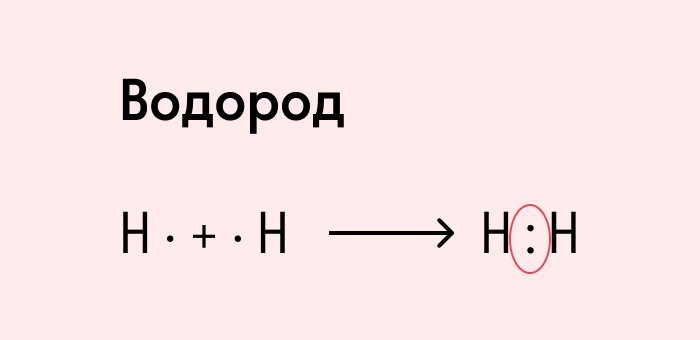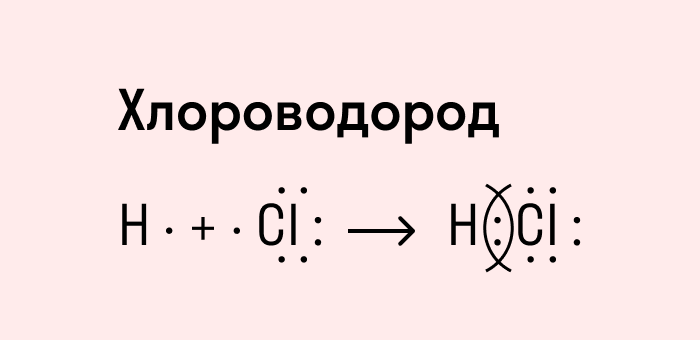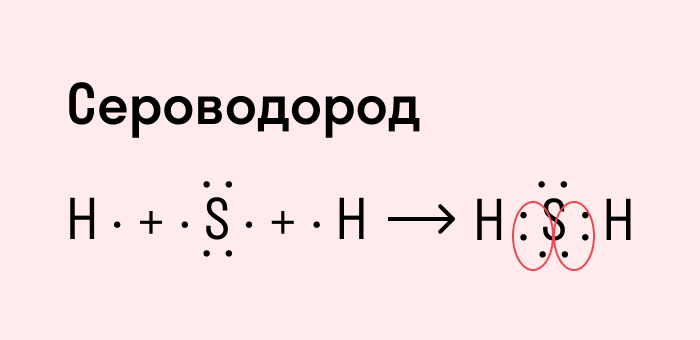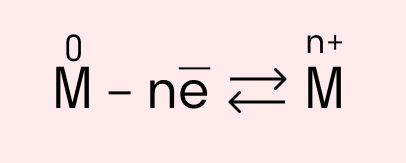Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому.
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Узнай, какие профессии будущего тебе подойдут
10 минут — и ты разберёшься, как стать тем, кем захочешь
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
-
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
-
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва.
Также на прочность влияют следующие показатели:
-
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
-
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
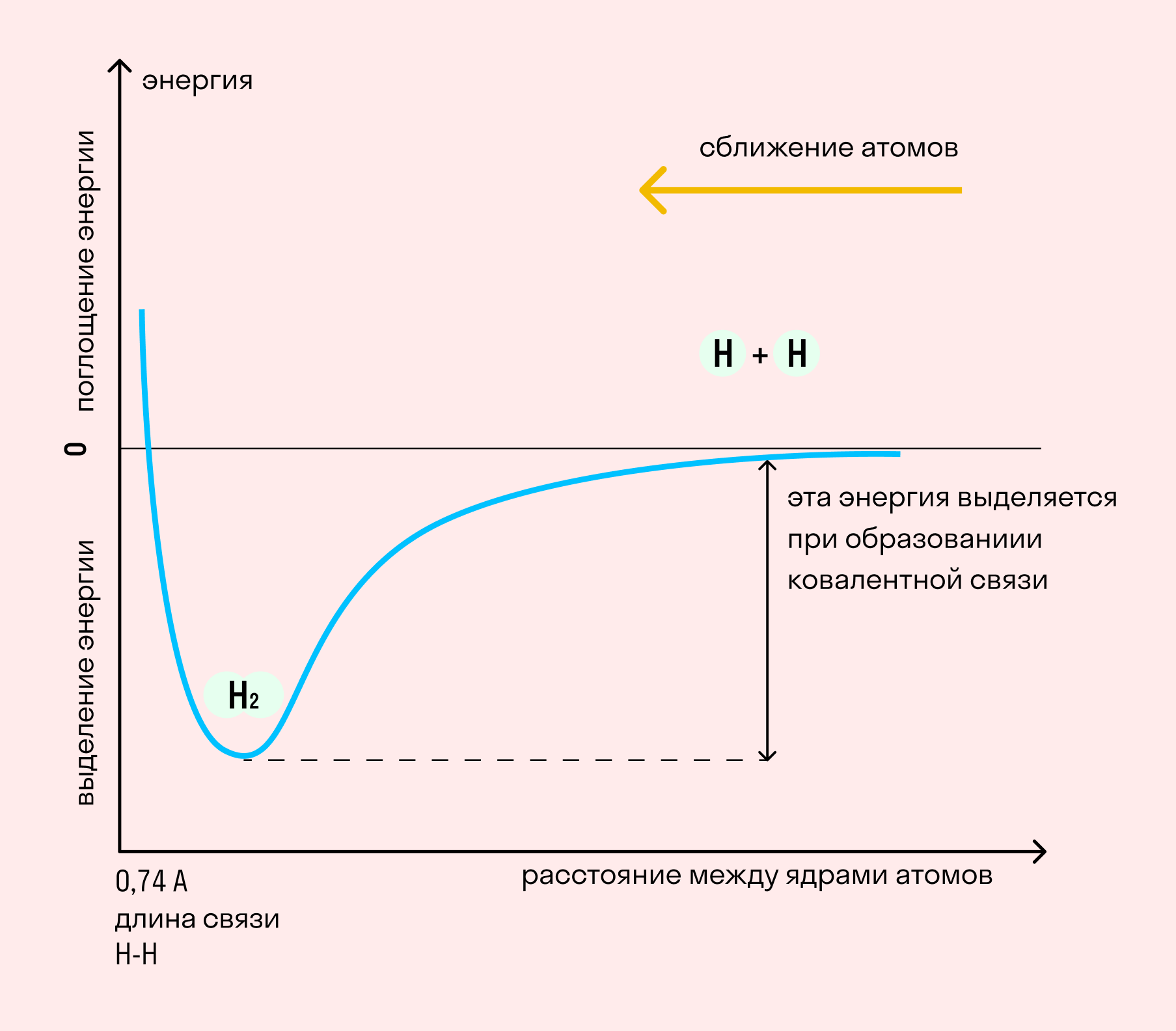
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Выберите идеального репетитора по химии
15 000+ проверенных преподавателей со средним рейтингом 4,8. Учтём ваш график и цель обучения
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
-
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
-
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
-
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
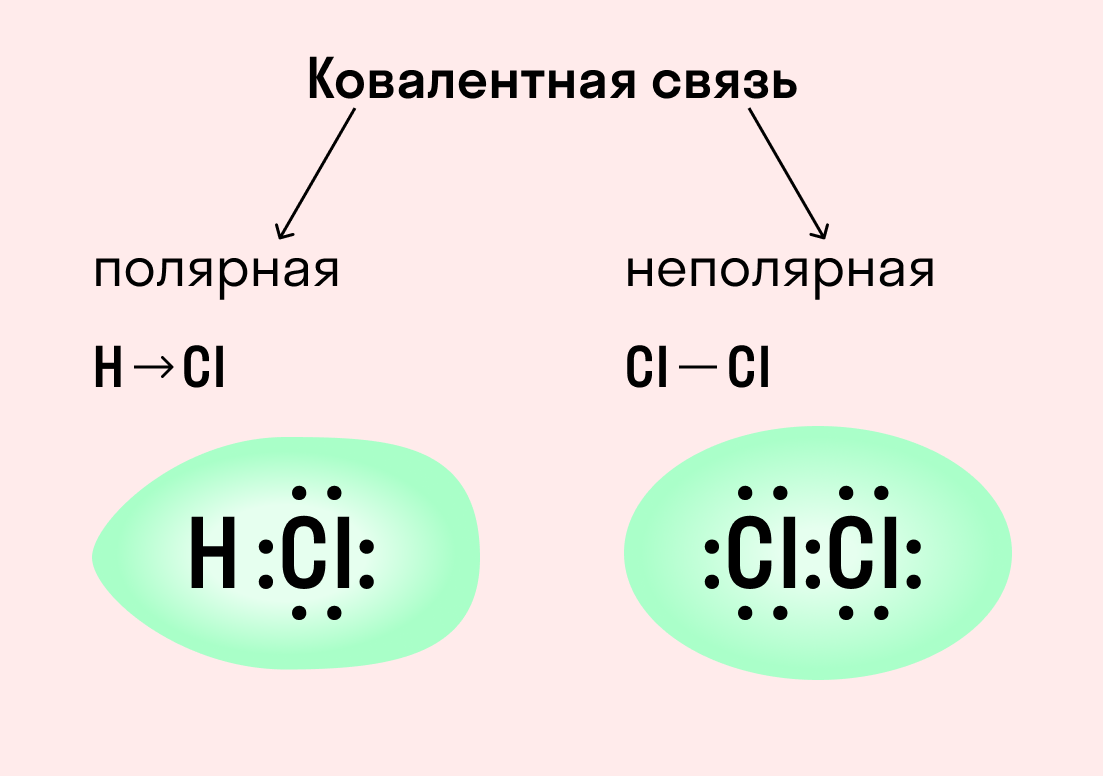
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь.
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Важно!
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
Ионная связь
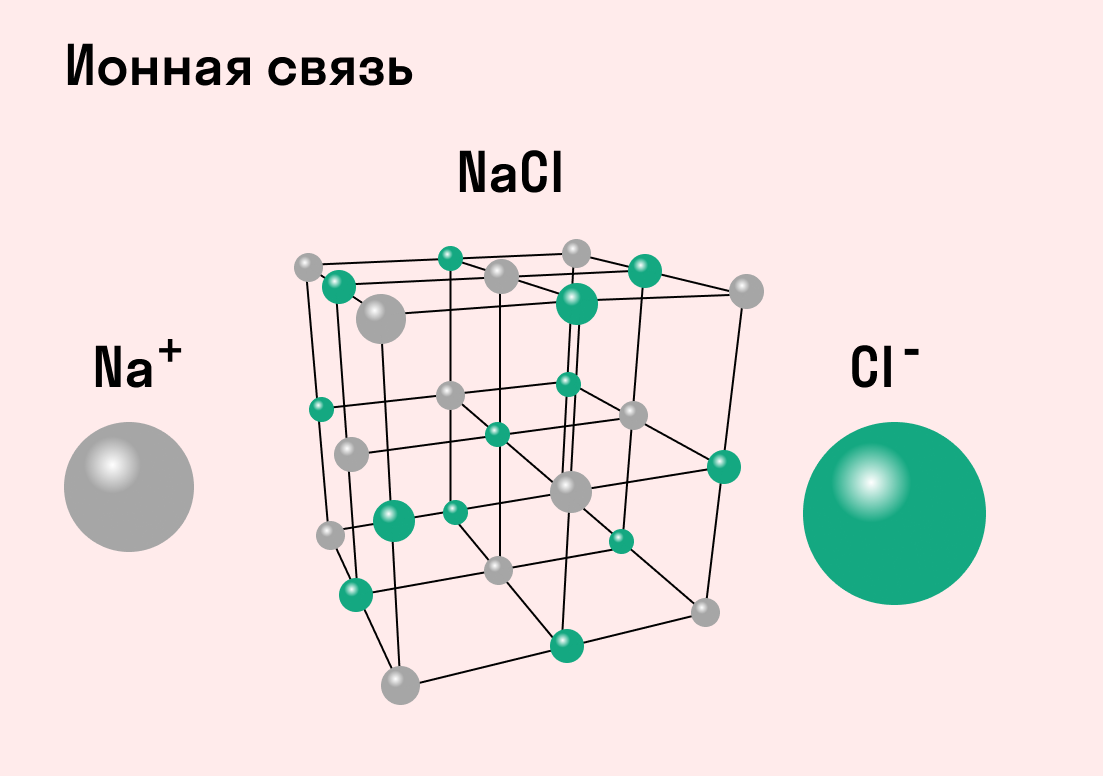
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов.
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Важно!
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
-
ненасыщенна,
-
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
|
Ковалентная связь |
Ионная связь |
|---|---|
|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. |
Характеризуется появлением и взаимным притяжением ионов. |
|
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. |
Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
|
Имеет направленность и насыщенность. |
Ненасыщенна и не имеет направленности. |
|
Количество связей, образуемых атомом, называется валентностью. |
Количество ближайших соседей атома называется координационным числом. |
|
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. |
Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
Металлическая связь
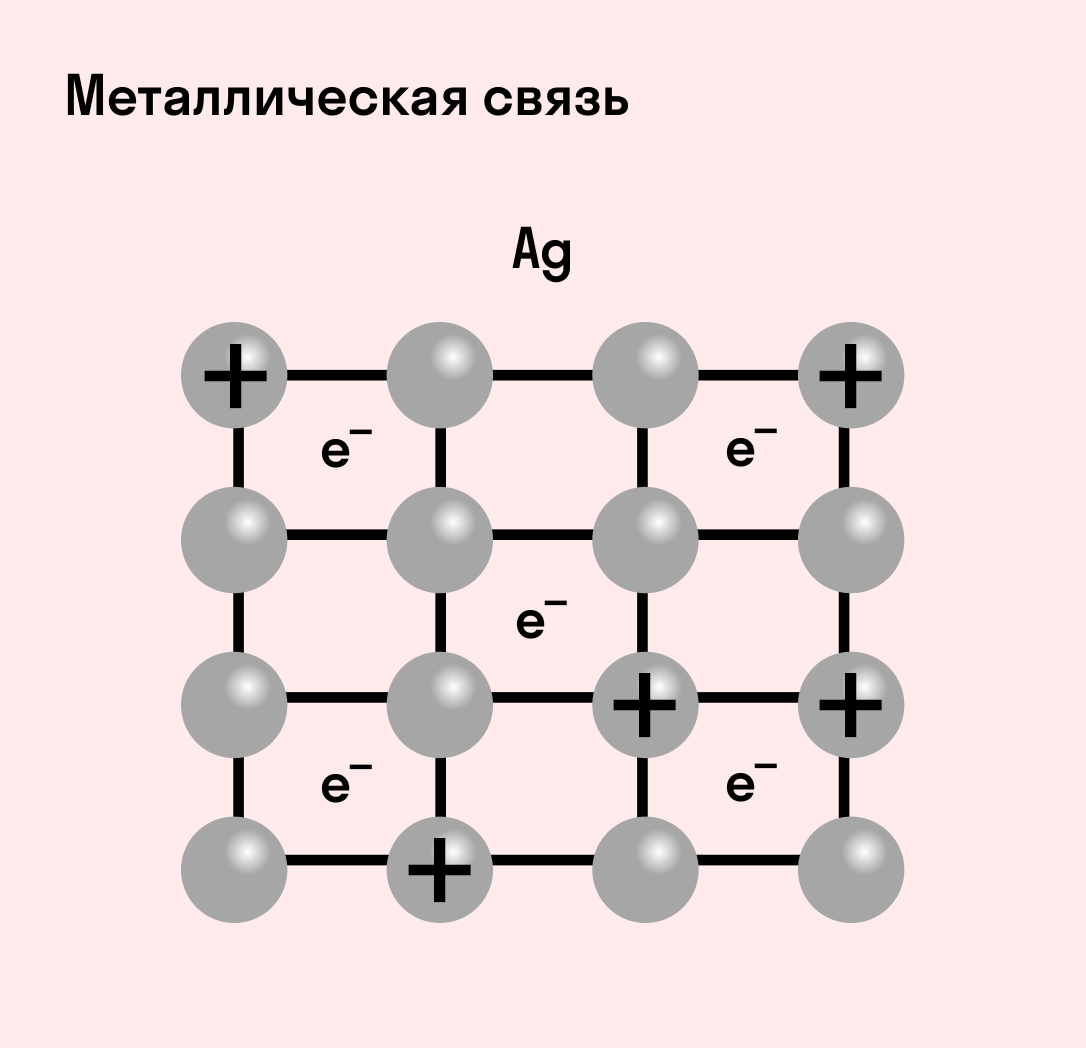
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества.
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
-
ненаправленность,
-
делокализованный характер,
-
многоэлектронность.
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
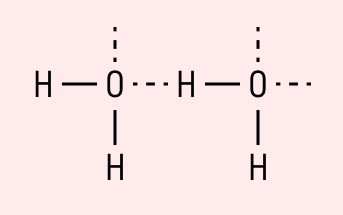
Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества.
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Важно!
В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т. д.
Характеристики водородной связи:
-
насыщенная,
-
направленная.
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
-
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
-
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
-
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
-
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
-
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Содержание
Введение……………………………………………………………………………………………….3
1. Химическая связь: основные понятия…………………………………………………4
2. Ковалентная химическая связь…………………………………………………………..7
3. Ионная химическая связь и ее свойства………………………………………………9
4. Металлическая связь………………………………………………………………………..11
5. Водородная связь……………………………………………………………………………..13
Заключение………………………………………………………………………………………….15
Список использованной литературы…………………………………………………….16
Введение
Молекулы химических веществ представляют собой сложную систему атомных ядер и электронов. Атомы в молекуле удерживаются преимущественно силами электростатического характера. В этом случае говорят, что они связаны химической связью. Химическая связь осуществляется s- и p-электронами внешнего и d-электронами предвнешнего слоя.
Возникновение химических связей – это самопроизвольный процесс, а причиной тому является уменьшение энергии системы.
Образование любой химической связи обязательно сопровождается выделением энергии, в то время как разрыв – требует ее поглощения.
Выделяют внутримолекулярные и межмолекулярные связи, которые отличаются друг от друга по энергии в десятки раз. Образование внутримолекулярных химических связей связано со сближением атомов за счет неспаренных электронов с антипараллельными спинами. Результатом такого сильного обменного взаимодействия приводи является образование общей электронной пары. В то же время, возрастает электронная плотность в межъядерном пространстве, что способствует стягиванию ядер двух атомов. При этом энергия системы уменьшается, а между атомами возникает химическая связь и образуется молекула.
Учение о химической связи является одной из центральных проблем современной химии. Число химических соединений непрерывно возрастает. Ежегодно описывается около двадцати тысяч новых соединений. Число возможных реакций между этими соединениями невероятно велико. Не зная природу воздействия атомов в веществе, невозможно понять причины многообразия соединений, представить их строение, состав, механизм образования и т.д.
Актуальность выбранной темы связана с колоссальным количеством новых химических соединений, нуждающихся в изучении, в молекулах которых сосредоточены различного рода химические связи.
Целью работы является рассмотрение основных понятий и типов химической связи.1
Возникновение химических связей – процесс самопроизвольный и причина этого процесса –
1. Химическая связь: основные понятия
Как правило, взаимодействие атомов обусловливает возникновение химических связей, приводящих к образованию устойчивых многоатомных систем: молекулы, молекулярного иона, кристалла.
Условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов.
Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла.
Химическая связь характеризуется несколькими основными параметрами, представленных в таблице 1.
Таблица 1 – Параметры химической связи
Таким образом, химической связью называют совокупность сил, под действием которых атомы, ионы или молекулы связываются друг с другом в новые устойчивые образования: молекулы, сложные ионы, ассоциаты.2
В зависимости от характера взаимодействия общей электронной пары с ядрами атомов, можно выделить несколько типов химической связи (рисунок 1).
Рисунок 1 – Типы химической связи
В зависимости от симметрии электронных облаков, в результате перекрывания которых образуется химическая связь, суммарное электронное облако будет иметь различную симметрию, в соответствии с которой они распадаются на три вида: σ-, π- и δ- связи.
σ-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов, при этом максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов. Как видно из рисунка 2, в образовании σ-связи в силу своей шаровой симметрии всегда принимают участие s-электроны.
Рисунок 2 – Образование σ-связи
π-связи возникают при перекрывании электронных облаков над и под линией, соединяющей центры атомов. Суммарные электронные облака также симметрично расположены относительно этой оси, но они не имеют цилиндрической симметрии, как в случае σ-связи (рисунок 3).
Рисунок 3 – Образование π-связи
δ-связь образуют только d-электроны. Это происходит за счет перекрывания всех четырех своих лепестков электронных облаков, которые расположены в параллельных плоскостях.
Выше была рассмотрена классификация химических связей, исходившая из симметрии электронных облаков. Существует и другой подход к классификации химической связи, основанный на характере распределения электронной плотности между атомами в молекуле, т. е. химическая связь рассматривается с точки зрения принадлежности электронной пары тому или иному атому. При этом, возможны три случая.
В первом случае, электронная пара связывает в молекуле два одинаковых атома и в равной мере принадлежит им обоим. В молекуле нет разделения центров тяжести положительного и отрицательного зарядов, так как они совпадаю. Такая связь называется ковалентной неполярной.
Если электронная пара связывает два различных атома, то она смещается в сторону более электроотрицательного атома. Центры тяжести положительного и отрицательного зарядов разделяются, связь становится полярной и носит название ковалентной полярной связи.
Третий случай связан с полной передачей электронной пары во владение одного из атомов. Это происходит при взаимодействии двух атомов, резко отличающихся по электроотрицательности, т. е. способности удерживать электронную пару в своем электрическом поле. При этом атом, отдавший электроны, становится положительно заряженным ионом, а атом, принявший их, – отрицательным. В этом случае связь носит название ионной.3
2. Ковалентная химическая связь
Ковалентной связью называют связь атомов в молекуле с помощью общих электронных пар. Общая электронная пара образуется в результате перекрывания электронных облаков.
Существует два механизма образования общих электронных пар: из неспаренных электронов и по донорно-акцепторному механизму.
По первому механизму неспаренные электроны каждого из атомов образуют общую пару электронов. По этому механизму образование молекул H2, Cl2 и HCl изображено на рисунке 4.
Рисунок 4 – Образование ковалентной связи
По второму механизму свободная пара электронов одного атома переходит на свободную орбиталь другого атома.
Например, при взаимодействии аммиака NH3 и иона водорода Н+ неподеленная пара электронов атома азота переходит на свободную орбиталь иона водорода Н+ и образуется ион аммония NH4+ (рисунок 5).
Рисунок 5 – Донорно-акцепторный механизм образования ковалентной связи
Ковалентная связь может быть полярной или неполярной.
Неполярная ковалентная связь образуется между атомами элементов с одинаковым значением электроотрицательности. В этом случае общая электронная пара располагается на одинаковом расстоянии от ядер обоих атомов. Например, неполярная ковалентная связь имеется у молекул H2, Cl2, O2.
Поляpная ковалентная связь образуется между атомами элементов с разной электроотрицательностью. В данном случае общая электронная пара смещается в сторону атома с большим значением электроотрицательности. Такая связь есть в молекулах хлористого водорода (HCl), воды (Н2О).
Основные характеристики ковалентной связи представлены в таблице 2.
Таблица 2 – Характеристики ковалентной связи4
3. Ионная химическая связь и ее свойства
Ионная связь – химическая связь между ионами, осуществляемая электростатическим притяжением.
Ионных соединений сравнительно немного. В случае если разница электроотрицательностей элементов будет велика, произойдет не просто смещение электронной плотности, а полная передача электрона от одного атома к другому. Рассмотрим это на примере фторида натрия NaF (рисунок 6).
Рисунок 6 – Образование ионной связи
Атом натрия стремится отдать один электрон, а атом фтора готов его принять. Это легко осуществляется при их взаимодействии, которое сопровождается переходом электрона. При этом атом натрия полностью передает свой электрон атому фтору: натрий лишается электрона и становится заряженным положительно, а хлор приобретает электрон и становится заряженным отрицательно. Например: NaF – фторид натрия; КCl – хлорид калия и др.
Свойства ионной химической связи представлены на рисунке 7.
Рисунок 7 – Свойства ионной химической связи
Свойства, описанные выше, вытекают из электростатической природы ионной связи. Силовые линии из точечного заряда имеют сферическое строение (рисунок 8).
Рисунок 8 – Электростатическая природа ионной связи
Вследствие ненаправленности и ненасыщаемости ионной связи энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Однако из- за отталкивания одноименных ионов друг от друга устойчивость системы достигается лишь при определенной взаимной координации ионов. В отличие от ковалентных соединений координационное число в «чисто» ионных соединениях не зависит от специфики электронной структуры элементов, а определяется соотношением размеров ионов.
Таким образом, в обычных условиях ионные соединения представляют собой кристаллические вещества. Поэтому для них понятие «простые двухионные молекулы» типа NaCl теряет смысл, а весь кристалл можно рассматривать как единую гигантскую молекулу.5
4. Металлическая связь
Металлы обладают высокой тепло- и электропроводностью. Данный аспект заставляет предположить, что валентные электроны их атомов металлов способны свободно перемещаться внутри его кристаллической решетки.
На рисунке 9 изображена одна из моделей строения металлов, согласно которой электроны образуют газ из отрицательных зарядов, который прочно скрепляет положительные ионы металла в одно целое. На рисунке 9 изображены положительно заряженные ионы, которые остаются после отрыва от атомов валентных электронов. Эти ионы содержат атомное ядро и внутреннюю замкнутую электронную оболочку атома. Каждый обрамленный кружком положительный заряд соответствует атомному ядру с заполненными электронными оболочками.
Рисунок 9 – Сечение металлического кристалла в атомной плоскости со схематическим изображением электронного газа
Данная модель металлической связи, основанная на представлении об «электронном газе», обусловливает и два других характерных свойств металлов – пластичность и ковкость.
Ковкое вещество легко поддается расплющиванию в тонкие листы; пластичное вещество можно вытягивать в тонкую проволоку. Для того чтобы такая обработка металлов с изменением формы происходила без разрушения, атомные плоскости кристалла должны легко скользить одна по другой. Такое смещение атомов не вызывает появления больших сил отталкивания в металлах, потому что подвижный электронный газ постоянно смягчает перемещение положительных ионов, экранируя их друг от друга.
Иначе обстоит дело в ионных кристаллах, где химическая связь практически полностью обусловлена электростатическим притяжением между противоположно заряженными ионами. В ионном кристалле валентные электроны прочно связаны с ядром атома. Сдвиг ионных слоев в таком кристалле приводит к сближению ионов одинакового заряда и вызывает сильное отталкивание между ними, в результате чего происходит разрушение кристалла (рисунок 10).
Рисунок 10 – Силы, возникающие при сдвиговой деформации кристаллов: а — сдвиг слоев металлического кристалла вдоль атомной плоскости;
б — сдвиг слоев ионного кристалла вдоль атомной плоскости
За более совершенную модель связи в металлах отвечает теория молекулярных орбиталей. Согласно этой модели, весь кристалл металла следует рассматривать как одну гигантскую молекулу. Все атомные орбитали определенного типа взаимодействуют в кристалле, образуя совокупность делокализованных орбиталей, простирающихся по всему кристаллу.6
5. Водородная связь
Водородная связь является специфической разновидностью межмолекулярного и внутримолекулярного взаимодействия.
Водородная связь – это дополнительная химическая связь между положительно поляризованным атомом водорода и отрицательно поляризованным атомом элемента с высокой электроотрицательностью (чаще всего фтора, кислорода или азота) в составе одной или разных молекул.
Схематично водородную связь обозначают тремя точками (рисунок 11).
Рисунок 11 – Образование водородной связи
Водородную связь, которая осуществляется между атомами одной молекулы, называют внутримолекулярной, а если связь возникает между разным молекулами, то межмолекулярной (рисунок 12).
Рисунок 12 – Типы водородной связи
Образование водородной связи напрямую связано с уникальными свойствами положительно поляризованного атома водорода. Его единственный электрон смещен в направлении атома, с которым атом водорода образует ковалентную связь. Поэтому другой стороной, на которой «оголяется» положительно заряженное ядро, атом водорода способен сближаться с электроотрицательными атомами до расстояний, близких к длине химической связи.
Длина водородной связи в 1.5-2 раза больше длины ковалентной связи, она в 5-6 раз слабее её, но в несколько раз прочнее вандерваальсовых сил.
Водородная связь между молекулами H2O является причиной проявления водой некоторых аномальных свойств. Плотность воды при переходе из твердого состояния в жидкое не уменьшается, как у большинства веществ, а возрастает. Это обусловлено тем, что в твердом состоянии молекулы воды соединены водородными связями, образуя ажурную структуру с множеством пустот. При плавлении льда примерно 15% водородных связей разрываются, что способствует сокращению объема, занимаемого водой. При дальнейшем нагревании противодействуют две тенденции: дальнейший разрыв водородных связей, способствующий увеличению плотности, и рост кинетической энергии молекул воды, приводящий к снижению плотности. При 4°С действия этих двух эффектов уравниваются, а при дальнейшем нагревании уже преобладает эффект увеличения кинетической энергии, что приводит к снижению плотности воды. Таким образом, при 4°С плотность воды максимальна.
Если бы максимум плотности воды приходился на 0°С, то поверхностные слои воды при охлаждении сверху опускались бы на дно, уступая место менее холодным слоям, и водоемы быстро замерзали бы на всю глубину. При этом многие формы жизни в воде были бы невозможны. В действительности замерзший слой воды является более легким и остается на поверхности, значительно замедляя дальнейшую кристаллизацию. Поэтому большинство водоемов зимой не промерзает до дна. Вода кипит при аномально высокой температуре. На разрыв водородных связей при переходе из жидкого в газообразное состояние необходимо затратить значительную энергию. При отсутствии водородных связей точка кипения воды лежала бы не при 100°С, а при –80°С. Тогда бы на Земле не было водоемов, а значит, и многих форм жизни.7
Заключение
На всех этапах развития химии вопросам химической связи уделялось много внимания и создавались теории в соответствии с общими представлениями в науке своего времени.
В начале XIX века была известна только одна количественная характеристика атома – масса, возникла гравитационная теория Бертолле (образование химической связи объяснялось взаимодействием масс атомов).
Главным вкладом в развитие представлений о строении молекул явилась теория химического строения органических соединений.
Вопрос о природе химической связи был решен после открытия электронного строения атомов, так как это позволило установить фундаментальную роль электронов в образовании химической связи.
Сегодня, не представляется возможным изучения свойств, строения химических соединений и их превращений без знания теории химической связи.
Не имея представлений о теории строения молекул и теории химической связи, практически невозможно понять элементарный химический процесс, построить его схему и на основании этого предвидеть кинетические характеристики. Помимо прочего, без использования данных теорий сегодня не обходится создание новейших веществ и материалов с заданными свойствами, например таких как полупроводниковые материалы, специальные керамические материалы, стали, стекла и прочее.8
Список использованной литературы
1. Сечкарев, Б.А. Химическая связь: учебное пособие / Б.А. Сечкарев, Ф.В. Титов; ГОУ ВПО «Кемеровский университет». – Кемерово: Кузбасвузиздат, 2006. – 169 с.
2. Громаков, Н.С. Химическая связь: Учебное пособие по химии для студентов дневной, заочной и дистанционной форм обучения, Казань: КГАСУ, 2011. – 132 с.
3. Коренев, Ю.М. Общая и неорганическая химия / Ю.М. Корнев, В.П. Овчаренко. – М.: Школа имени А. Н. Колмогорова, Издательство Московского университета, 2000. – 384 с.
4. Загурская, И.Н. Неорганическая химия: учебное пособие / И.Н.
Загурская, Д.В. Цымай, И.Н. Загурский. – Орел: ОрелГТУ, 2008 – 180 с.
5. Ткачев, С.В. Основы общей и неорганической химии: учеб.-метод. пособие / С. В. Ткачев. – 11-е изд. – Минск: БГМУ, 2013. – 211 с.
6. Павлов, Н.Н. Общая и неорганическая химия: Учебник / Н.Н. Павлов. – СПб.: Лань, 2011. – 422 с.
7. Минкин, В.И. Теория строения молекул / В.И. Минкин, Б. Я. Симкин, Р.М. Миняев. – Ростов на/Д: Феникс, 1997. – 236 с.
8. Хрущева, И.В. Общая и неорганическая химия: Учебник / И.В. Хрущева, В.И. Щербаков, Д.С. Леванова. — СПб.: Лань П, 2016. – 496 с.
1 Сечкарев, Б.А. Химическая связь: учебное пособие / Б.А. Сечкарев, Ф.В. Титов; ГОУ ВПО «Кемеровский университет». – Кемерово: Кузбасвузиздат, 2006. С. 8.
2 Громаков, Н.С. Химическая связь: Учебное пособие по химии для студентов дневной, заочной и дистанционной форм обучения, Казань: КГАСУ, 2011. С. 13-15.
3 Коренев, Ю.М. Общая и неорганическая химия / Ю.М. Корнев, В.П. Овчаренко. – М.: Школа имени А. Н. Колмогорова, Издательство Московского университета, 2000. – С. 27-28.
4 Загурская, И.Н. Неорганическая химия: учебное пособие / И.Н. Загурская, Д.В. Цымай, И.Н. Загурский. – Орел: ОрелГТУ, 2008 – С. 51.
5 Ткачев, С.В. Основы общей и неорганической химии: учеб.-метод. пособие / С. В. Ткачев. – 11-е изд. – Минск: БГМУ, 2013. С. 47.
6 Павлов, Н.Н. Общая и неорганическая химия: Учебник / Н.Н. Павлов. – СПб.: Лань, 2011. С. 265.
7 Минкин, В.И. Теория строения молекул / В.И. Минкин, Б. Я. Симкин, Р.М. Миняев. – Ростов на/Д: Феникс, 1997. С. 49.
8 Хрущева, И.В. Общая и неорганическая химия: Учебник / И.В. Хрущева, В.И. Щербаков, Д.С. Леванова. — СПб.: Лань П, 2016. С. 147.
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная.
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2), то один из электронов практически полностью переходит к другому атому, с образованием ионов. Такая связь называется ионная.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – это химическая связь, образованная за счет образования общей электронной пары А:В. При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 109о28′.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ.
Пример. Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H. + .H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры: H2 (H-H), O2 (O=O), S8.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент. Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO2, NH3.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А. + .В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH3+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: Н–I, H–Br, H–Cl длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na+, с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na )2)8)1 — 1e = +11Na+ )2)8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl )2 )8 )7 + 1e = +17Cl— )2 )8 )8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4+, сульфат-ион SO42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na+Cl—, Na2+ SO42-.
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимодействия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
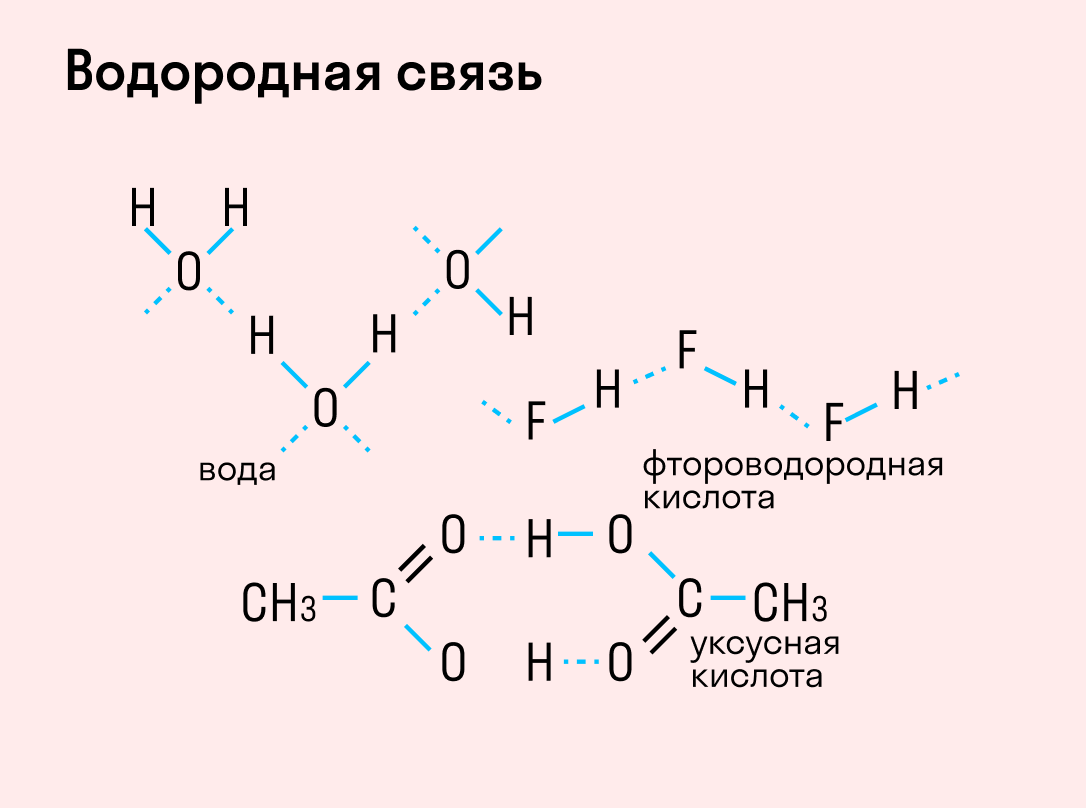
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Тренировочный тест по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.
695
Создан на
От Admin
Тренировочный тест «Химические связи»
1 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) оксид кремния
2) оксид бария
3) бромид бария
4) нитрат бария
5) белый фосфор
2 / 10
Из предложенного перечня выберите два вещества, между молекулами которых существует водородная связь.
1) фтороводород
2) ацетон
3) иодоводород
4) пропанол-2
5) силан
3 / 10
Из предложенного перечня выберите два соединения, между молекулами которых образуется водородная связь.
1) C2H4
2) NH3
3) SiH4
4) CH3OH
5) CH3COOCH3
4 / 10
Из предложенного перечня выберите два вещества, в которых есть связи, образованные по донорно-акцепторному механизму.
1) СО
2) PH3
3) CaO
4) CH3COONH4
5) KHS
Запишите номера выбранных ответов.
5 / 10
Из предложенного перечня веществ выберите два соединения, в которых присутствует ионная связь.
1) хлороводород
2) хлорид натрия
3) оксид серый(IV)
4) аммиак
5) оксид натрия
6 / 10
Из предложенного перечня веществ выберите два вещества, которые имеют атомную кристаллическую решётку.
1) белый фосфор
2) сера
3) графит
4) кремний
5) натрий
7 / 10
Из предложенного перечня выберите два вещества немолекулярного строения.
1) Al4C3
2) C3H8O3
3) CH3ONa
4) H2SO4
5) P4
8 / 10
Из предложенного перечня выберите два вещества, которые в состоянии имеют молекулярное строение.
1) глюкоза
2) алмаз
3) оксид цинка
4) аммиак
5) гидроксид натрия
9 / 10
Из предложенного перечня выберите два вещества, которые имеют ионную кристаллическую решётку.
1) Na2CO3
2) HBr
3) SO2
4) PCl3
5) (NH4)2SО4
10 / 10
Из предложенного перечня выберите два вещества, которые имеют атомную кристаллическую решётку.
1) оксид углерода(IV)
2) оксид кремния
3) карбид кремния
4) оксид калия
5) карбид кальция
Запишите в поле ответа номера выбранных веществ.
Ваша оценка
The average score is 40%