| Регистрационное удостоверение |
| 1 |
|
|||||||||||||||||||||||||||||||||||||||||
| 2 | Наименование держателя или владельца регистрационного удостоверения лекарственного препарата |
|
||||||||||||||||||||||||||||||||||||||||
| 3 |
Торговое наименование лекарственного препарата |
|||||||||||||||||||||||||||||||||||||||||
| 4 | Международное непатентованное или группировочное или химическое наименование |
|||||||||||||||||||||||||||||||||||||||||
| 5 | Формы выпуска |
|
||||||||||||||||||||||||||||||||||||||||
| 6 | Сведения о стадиях производства |
|
||||||||||||||||||||||||||||||||||||||||
| 7 | Инструкция по применению лекарственного препарата | |||||||||||||||||||||||||||||||||||||||||
| 8 | Нормативная документация |
|
||||||||||||||||||||||||||||||||||||||||
| 9 | Фармако-терапевтическая группа |
|
||||||||||||||||||||||||||||||||||||||||
| 10 | Анатомо-терапевтическая химическая классификация |
|
||||||||||||||||||||||||||||||||||||||||
| 11 | Фармацевтическая субстанция |
|
||||||||||||||||||||||||||||||||||||||||
| 12 | Особые отметки |
|
Как пользоваться сайтом ГРЛС
Обласова Антонина t.me/ninavaccinaИнструкция как искать действующие официальные инструкции к лекарственным препаратам, в т.ч. к вакцинам.
Сразу совет: лучше это делать с компьютера, а не с мобильного
1.Заходим на сайт ГРЛС по прямой ссылке https://grls.rosminzdrav.ru/ или просто гуглим
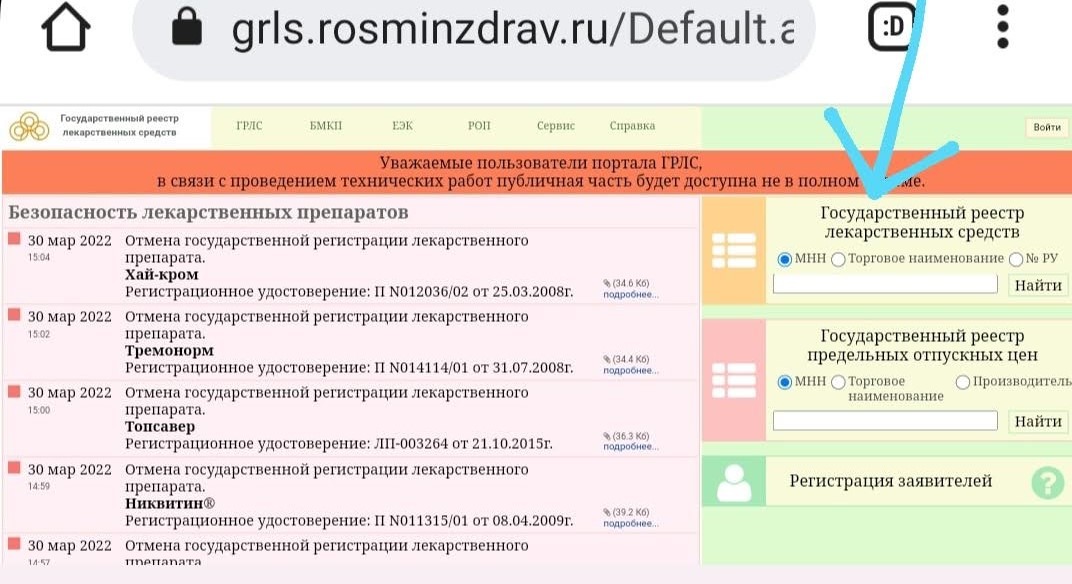
2. На открывшемся сайте нажимаете на надпись, отмеченную стрелкой
3. Попадаете в Н̶а̶р̶н̶и̶ю̶ вот на такую страницу
4. Воспользуйтесь нужными вам фильтрами
- Например, можно ввести торговое наименование вакцины,
- или в строке МНН набрать название инфекции
- и нажать кнопку «найти«
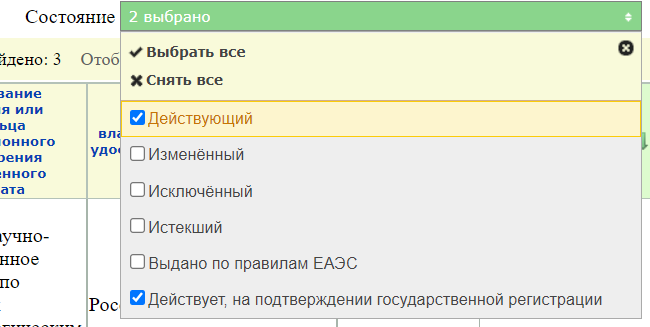
По умолчанию стоит фильтр на действующие записи
но можно найти и старые, которые уже не действуют.
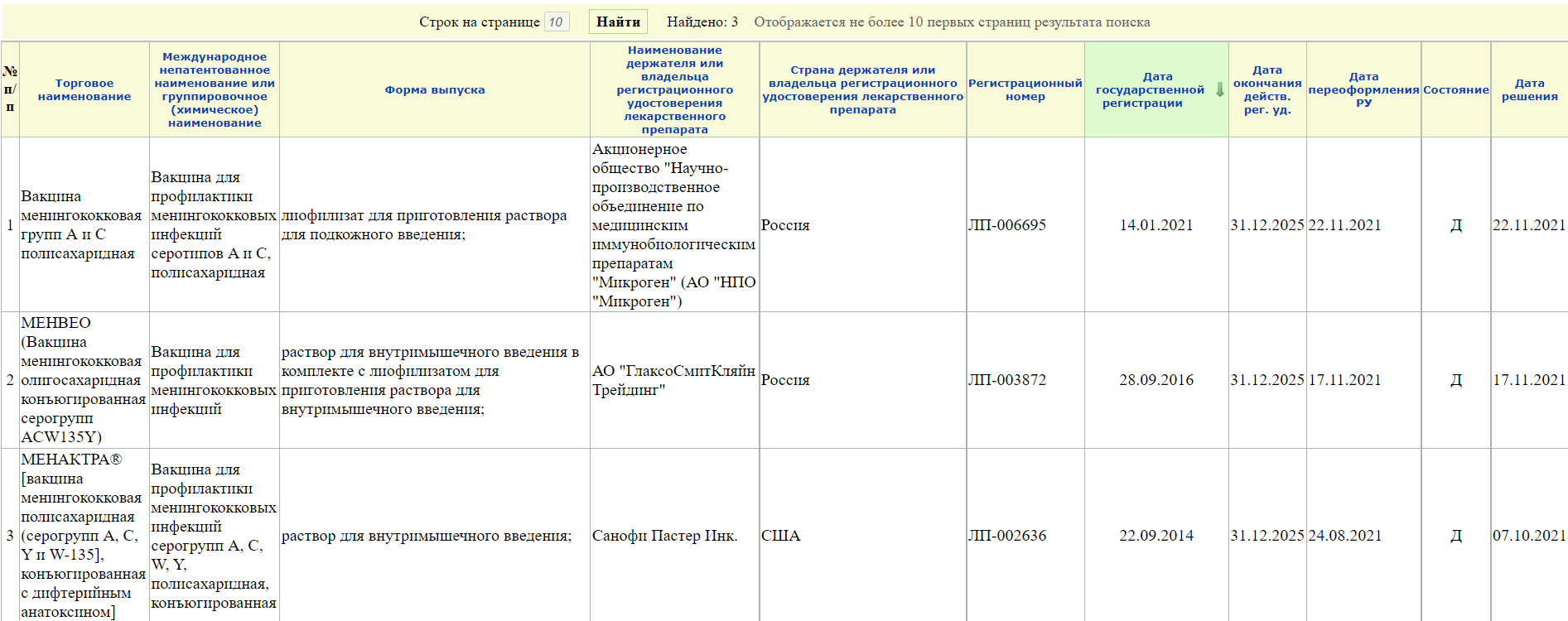
5. Вам откроется перечень имеющихся препаратов
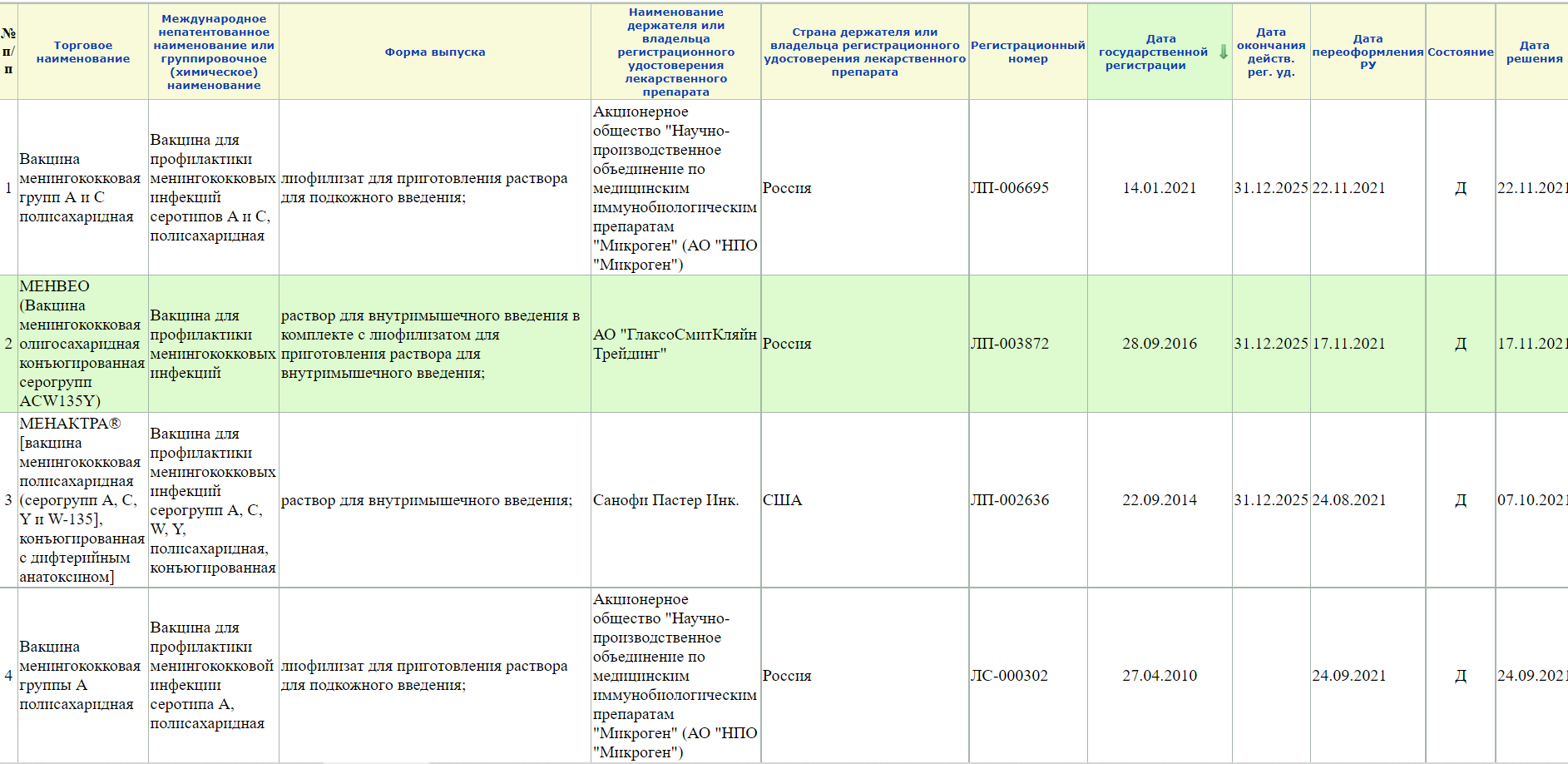
Кстати! Лучше все-таки вводить неполный запрос, а что-то типа «менингококк» или «коклюш», так как если выбирать из подсказок системы, то может отображаться не все (или вообще ничего). Так, например при запросе Вакцина для профилактики менингококковых инфекций» сайт не выдает вот эту карточку на вакцину против менингококка серогруппы А.
А при запросе «менингококк» открывается 4 записи
Хотя, иногда, это усложняет поиск, так как могут отображаться препараты, которые просто имеют в названии однокоренные слова.
6. Идете в карточку препарата (нажимаете на запись)
Вы попадаете на страницу с информацией, где есть данные о производителе, фасовках, и др.
7. Пролистываете эту страницу вниз и ищете там вот такую кнопку, жмете на нее
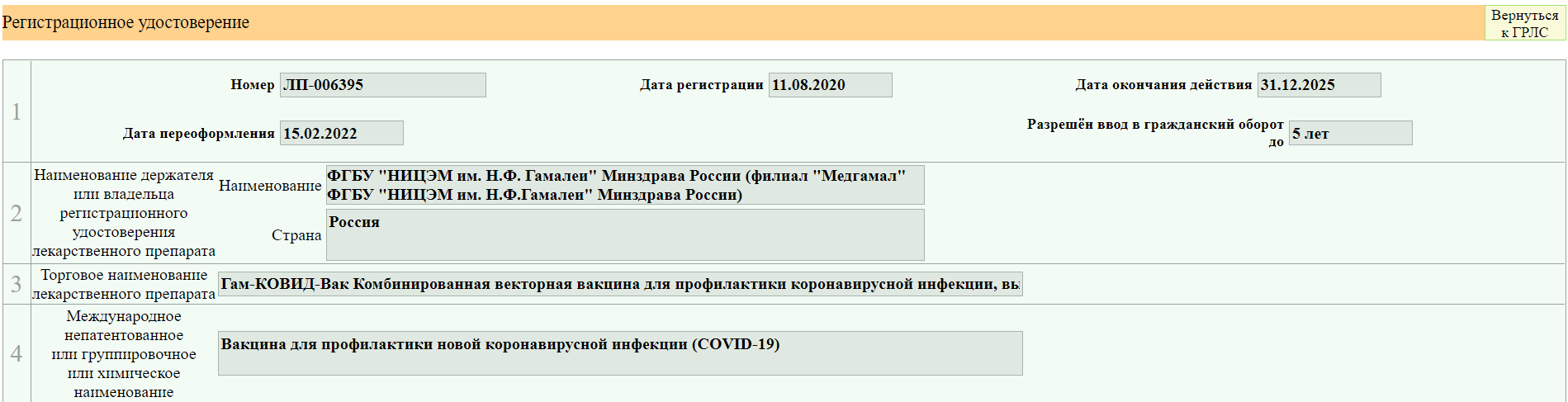
8. Вам открывается вот такая страница.
Я взяла для примера вакцину от ковида, так как там много изменений вносилось
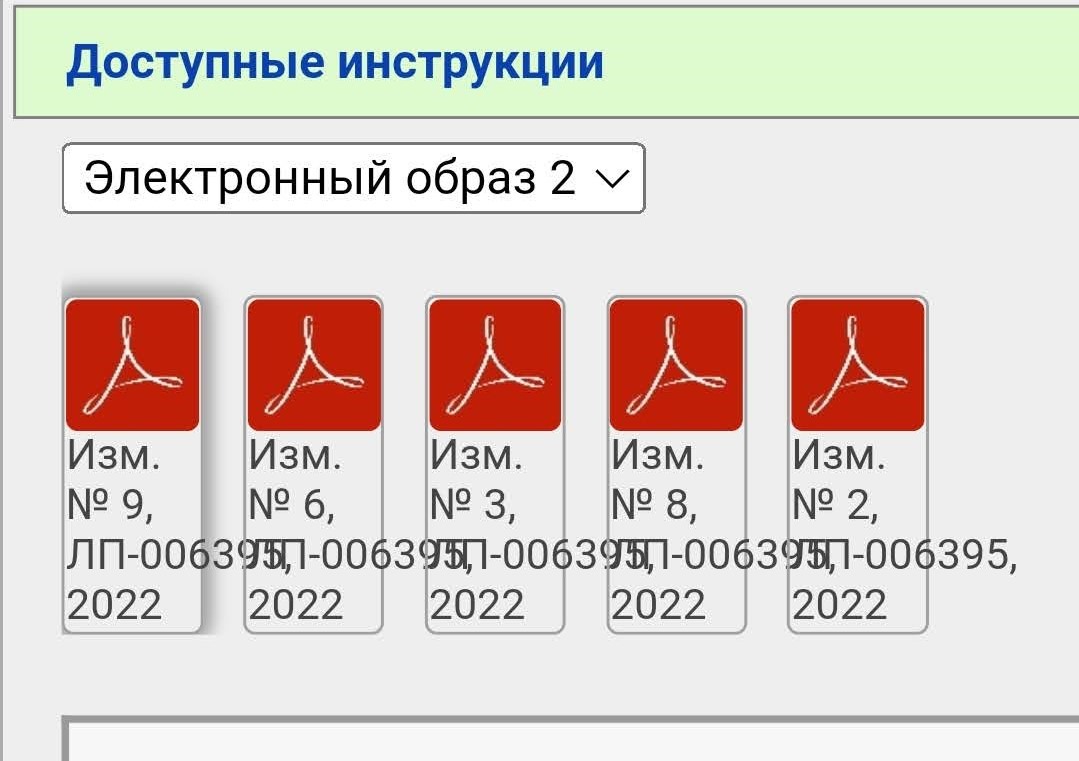
Вы видите несколько PDF файлов, но не спешите их открывать. Вначале нажимаем сюда
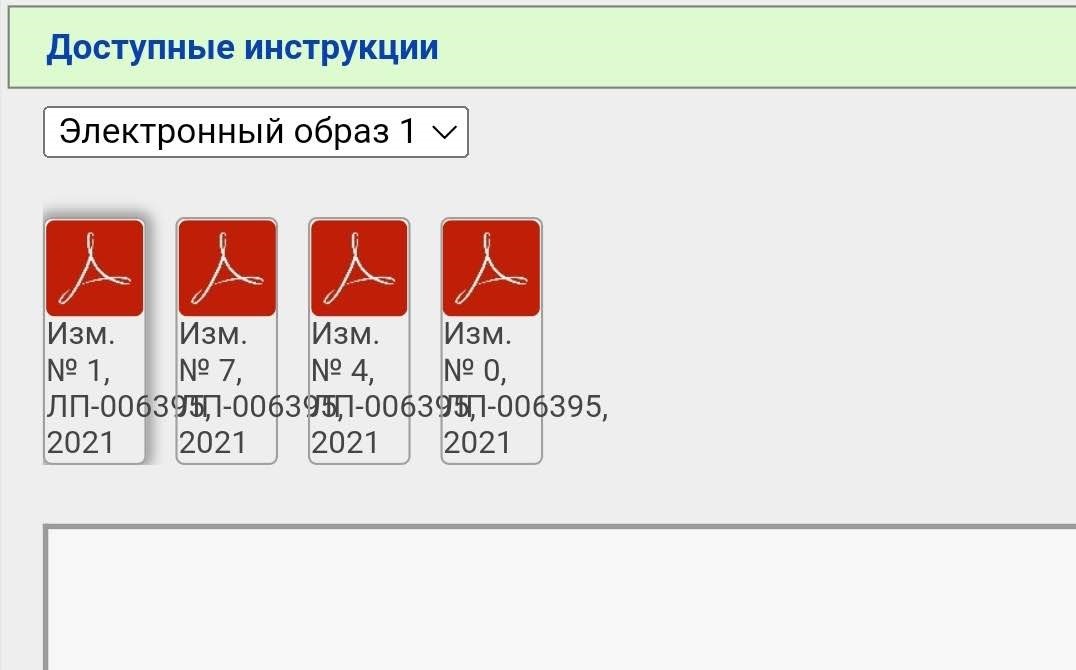
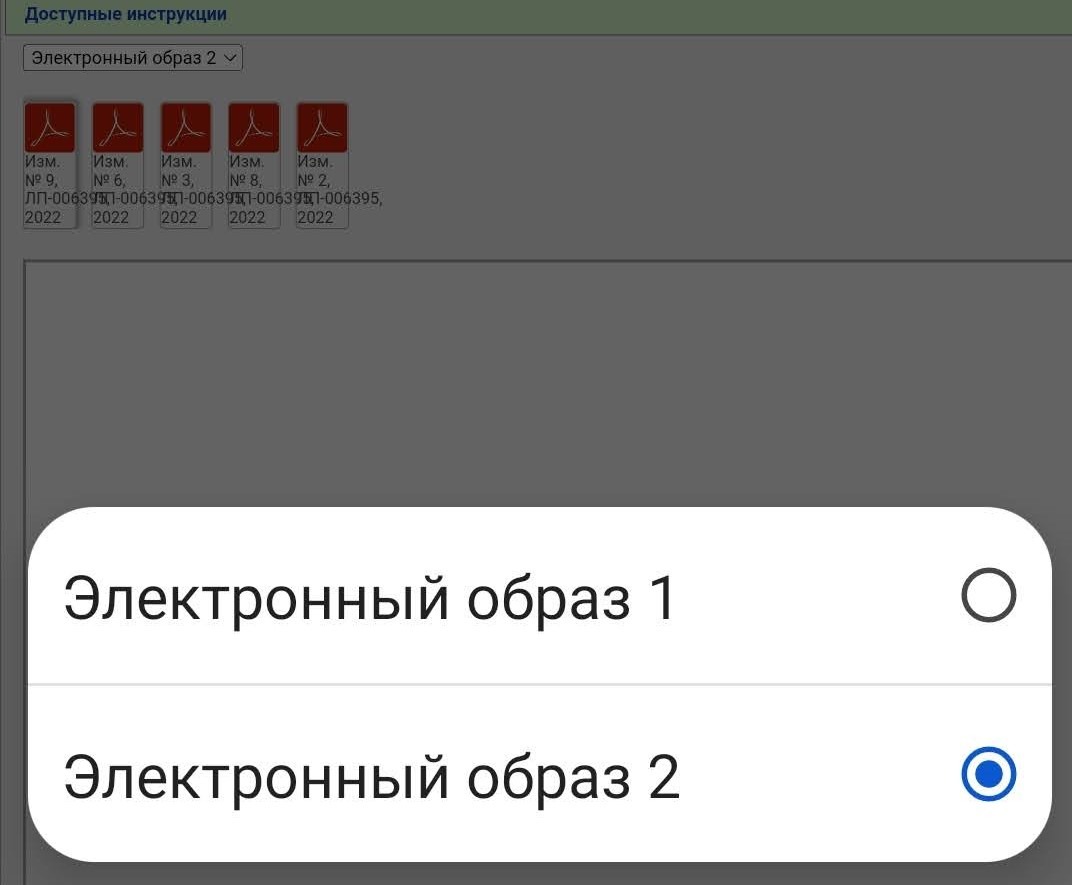
В случае с Гам-Ковид-Ваком электронный образ — это как бы «полная инструкция», которая изначально выкладывается. В данном примере исходный документ — это «Имз. № О». Когда появляются какие-то изменения/дополнения, то публикуется не новая полная инструкция, а только изменение в формате было/стало. Когда изменений накапливается много их наконец могут собрать в кучу и опубликовать новый электронный образ. Но это не общее правило. Изменения и дополнения тоже могут публиковаться отдельными образами (короче, бардак).
В нашем примере электронных образов два, мы выбираем более новый (второй). Тут тоже уже появился ряд правок.
Чтобы «собрать» в голове полную инструкцию нужно скачать все документы. Почему в данном случае есть изменения 2, 3, 6, 8 и 9, но нет 1, 4, 5 и 7 — не знаю.
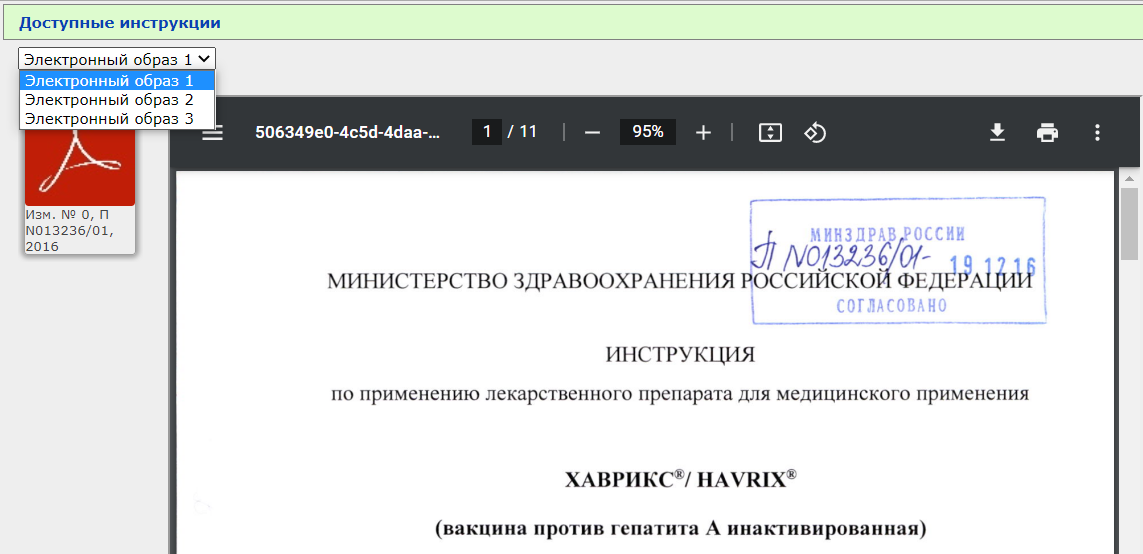
Обычно изменений не так много. Вот, например, для препарата Хаврикс (вакцина против гепатита А) добавлено 3 электронных образа:
- Полная инструкция
- Два дополнения
- еще одно дополнение
Очень не рекомендую пользоваться другими ресурсами с инструкциями. Они могут содержать ошибки, неполные или неактуальные данные. Тут хоть и через жо, но хотя бы точно актуально.
M
Sur.ly
Home
How it Works
Downloads
Help
X
Powered
by SUR.LY
!
Report this website
We got your feedback. Thank you!
Report this website
Adult content
Suspicious activity or malware
Spam or abuse
Other
Share your thoughts with us:
G
T
F
Trust
70
Privacy
70
Child safety
N/A
grls.rosminzdrav.ru
Site Rating
Trust
Privacy
Child safety
N/A
Site Advisor
0 /
0
Alexa Rank
N/A
Daily visitors
3 962
Daily pageviews
19 022
D
U
Recent posts: Sur.ly for WordPress
Sur.ly for WordPress
Sur.ly plugin for WordPress is free of charge.
Sur.ly for Joomla
Sur.ly plugin for Joomla 2.5/3.0 is free of charge.
Sur.ly for Drupal
Sur.ly extension for both major Drupal version is free of charge.
Sur.ly for any website
In case your platform is not in the list yet, we provide Sur.ly Development Kit (SDK) for free, which allows you to implement Sur.ly on any website using PHP 4.3 and newer.
Безопасность лекарственных препаратов
Отмена государственной регистрации лекарственного препарата.
Эритромицин
Регистрационное удостоверение: ЛСР-007901/08 от 07.10.2008г.
Отмена государственной регистрации лекарственного препарата.
Ультоп®
Регистрационное удостоверение: ЛСР-002262/07 от 17.08.2007г.
Отмена государственной регистрации лекарственного препарата.
Рибоксин
Регистрационное удостоверение: ЛП-000240 от 16.02.2011г.
Отмена государственной регистрации лекарственного препарата.
Пирацетам
Регистрационное удостоверение: Р N003484/01 от 21.05.2009г.
Отмена государственной регистрации лекарственного препарата.
Пилокарпин
Регистрационное удостоверение: ЛСР-010622/08 от 26.12.2008г.
Отмена государственной регистрации лекарственного препарата.
Нафтизин
Регистрационное удостоверение: ЛСР-001477/09 от 03.03.2009г.
Отмена государственной регистрации лекарственного препарата.
Левомицетин
Регистрационное удостоверение: ЛС-002068 от 01.11.2011г.
Отмена государственной регистрации лекарственного препарата.
Лазикс®
Регистрационное удостоверение: П N014865/02 от 16.05.2008г.
Все публикации раздела «Безопасность ЛП»
Новости
Информация о результатах проведения аттестации уполномоченных лиц производителей биомедицинских клеточных продуктов

ИНФОРМАЦИЯ
В соответствии с Порядком аттестации уполномоченного лица производителя биомедицинского клеточного продукта, требования к уровню образования и квалификации указанного уполномоченного лица и его полномочий по обеспечению качества биомедицинского клеточного продукта, вводимого в обращение, утвержденного приказом Минздрава России от 29 сентября 2017 г. № 694н «Об утверждении порядка аттестации уполномоченного лица производителя биомедицинского клеточного продукта, требований к уровню образования и квалификации указанного уполномоченного лица и его полномочий по обеспечению качества биомедицинского клеточного продукта, вводимого в обращение», 18 января 2023 года с 10.00 по московскому времени планируется проведение аттестации уполномоченного лица производителя биомедицинского клеточного продукта.
Аттестация будет проводиться Аттестационной комиссией Министерства здравоохранения Российской Федерации по аттестации уполномоченного лица производителя биомедицинского клеточного продукта в помещении Минздрава России, расположенном по адресу: Москва, Успенский переулок, д.10, стр. 1.
Заявителям регистрации и производителям лекарственных препаратов для медицинского применения
Федеральным законом от 29 ноября 2021 г. № 382-ФЗ «О внесении изменений в часть вторую Налогового кодекса Российской Федерации» (далее соответственно – Налоговый Кодекс Российской Федерации в реакции № 382-ФЗ) внесены изменения в Налоговый Кодекс Российской Федерации, в том числе в части увеличения размеров государственной пошлины за совершение действий уполномоченным федеральным органом исполнительной власти при осуществлении государственной регистрации лекарственных препаратов и регистрации лекарственных препаратов для медицинского применения в целях формирования общего рынка лекарственных средств в рамках Евразийского
экономического союза, а также в отношении регистрации медицинских изделий.
Так, согласно частям 1 и 2 статьи 333.32.1 за совершение Минздравом России действий, связанных с осуществлением государственной регистрации лекарственных препаратов в соответствии с Федеральным законом от 12 апреля 2010 года № 61-ФЗ «Об обращении лекарственных средств» осуществлением регистрации лекарственных препаратов для медицинского применения в целях формирования общего рынка лекарственных средств в рамках Евразийского экономического союза в соответствии с правом Евразийского экономического
союза уплачиваются пошлины в различных размерах в зависимости от видов осуществляемых действий.
Наиболее значительная государственная пошлина уплачивается за внесение в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, изменений, требующих проведения экспертизы лекарственных средств в части экспертизы качества лекарственного средства и (или) экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, — 490 000 рублей.
В условиях применения ограничительных экономических мер в отношении Российской Федерации, с учетом оперативного реагирования производителей лекарственных средств на конъюнктуру рынка и изменение логистических цепочек и в целях оптимизации затрат заявителей и минимизации повторной оплаты государственной пошлины Минздрав России рекомендует вносить различные точечные виды изменений в регистрационную документацию на лекарственное средство, объединяя их в единую подачу в рамках отдельного определенного вида регистрационного действия.
Изменения, вносимые в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, требующие проведения экспертизы предложенных методов контроля качества лекарственного средства и качества представленных образцов лекарственного средства с использованием этих методов и (или) экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата, указаны в разделе II классификации изменений, вносимых в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для медицинского применения, утвержденной приказом Минздрава России от 13 декабря 2016 г. № 959н.


Проведение аттестации экспертов ФГБУ «НЦЭСМП» Минздрава России в соответствии с Порядком определения уровня профессиональной подготовки экспертов федерального государственного бюджетного учреждения по проведению экспертизы лекарственных средств для медицинского применения и аттестации их на право проведения экспертизы лекарственных средств для медицинского применения, утвержденного приказом Минздрава России от 26 августа 2010 г. № 755н, назначено на 15.11.2022 (тестирование) и на 17.11.2022 (собеседование) в 10:00 по московскому времени.
Субъектам обращения лекарственных средств
Министерство здравоохранения Российской Федерации в связи с техническими
работами в Государственном реестре предельных отпускных цен производителей
на лекарственные препараты, включенные в перечень жизненно необходимых
и важнейших лекарственных препаратов, который размещен на официальном сайте
в сети Интернет (http://grls.rosminzdrav.ru), сообщает, что в соответствии с пунктом
16 Особенностей государственного регулирования предельных отпускных цен
производителей на лекарственные препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных препаратов, утвержденных
Постановлением Правительства Российской Федерации от 31.10.2020 № 1771,
и решения Федеральной антимонопольной службы (далее – ФАС России) от
09.09.2022 № ТН/84479/22 о снижении перерегистрированных предельных
отпускных цен производителей на лекарственные препараты, включенные в перечень
жизненно необходимых и важнейших лекарственных препаратов, (копия
прилагается) размещает актуальные сведения о предельных отпускных ценах
на лекарственные препараты, соответствующие Международному непатентованному
наименованию или группировочному (химическому) наименованию Эноксапарин
натрия.

Информация о результатах проведения аттестации уполномоченных лиц производителей биомедицинских клеточных продуктов

Субъектам обращения лекарственных средств
Департамент регулирования обращения лекарственных средств и медицинских изделий Министерства здравоохранения Российской Федерации информирует, что с 01.09.2022 на Едином портале государственных и муниципальных услуг (функций) доступно предоставление следующих государственных услуг:
- по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения в Российской Федерации или на общем рынке лекарственных средств в рамках Евразийского экономического союза, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией;
- по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию и вывоз из Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения.
Для получения заключений (разрешительных документов) в форме электронного документа представление документов и сведений заявителем осуществляется в форме электронного документа (пакета электронных документов), подписанного усиленной неквалифицированной электронной подписью.
Услуга оказывается на основании оптимизированного стандарта, разработанного в соответствии с постановлением Правительства Российской Федерации от 30 июля 2021 г. № 1279. Утвержденные оптимизированные стандарты прилагаются.
Письмо о размещённых услугах на ЕПГУ
ОС по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию и вывоз из Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения
ОС по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения в Российской Федерации или на общем рынке лекарственных средств в рамках Евразийского экономического союза, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией
ИНФОРМАЦИЯ
В соответствии с Порядком аттестации уполномоченного лица производителя биомедицинского клеточного продукта, требования к уровню образования и квалификации указанного уполномоченного лица и его полномочий по обеспечению качества биомедицинского клеточного продукта, вводимого в обращение, утвержденного приказом Минздрава России
от 29 сентября 2017 г. № 694н «Об утверждении порядка аттестации уполномоченного лица производителя биомедицинского клеточного продукта, требований к уровню образования и квалификации указанного уполномоченного лица и его полномочий по обеспечению качества биомедицинского клеточного продукта, вводимого в обращение»,
14 сентября 2022 года с 10.00 по московскому времени планируется проведение аттестации уполномоченного лица производителя биомедицинского клеточного продукта.
Аттестация будет проводиться Аттестационной комиссией Министерства здравоохранения Российской Федерации по аттестации уполномоченного лица производителя биомедицинского клеточного продукта в помещении Минздрава России, расположенном по адресу: Москва, Успенский переулок, д.10, стр. 1.
Субъектам обращения лекарственных средств
Департамент регулирования обращения лекарственных средств и медицинских изделий Минздрава России сообщает, что 25 августа 2022 года официально опубликовано распоряжение Правительства Российской Федерации от 24 августа 2022 г. № 2419-р, которым внесены изменения в перечень ЖНВЛП, в том числе в части корректировки лекарственных форм, являющихся эквивалентными по отношению к уже включенным лекарственным формам (http://publication.pravo.gov.ru/Document/View/0001202208250043).
Обращаем внимание на необходимость оперативной подачи документов для государственной регистрации предельных отпускных цен производителей на лекарственные препараты, лекарственные формы которых были включены в данное распоряжение.
В отношении лекарственных препаратов, по которым внесены изменения в части написания лекарственных форм или группировочных наименований необходимо подать заявление о внесении изменений в Государственный реестр предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов.
Департамент регулирования обращения лекарственных средств и медицинских изделий направляет для сведений и учета в работе письмо ФГБУ «НЦЭСМП» Минздрава России от 16.03.2021 №5761.

Департамент регулирования обращения лекарственных средств
и медицинских изделий Министерства здравоохранения Российской Федерации
в связи с вступлением в силу постановления Правительства Российской Федерации
от 17.11.2021 №1961 «О внесении изменений в постановление Правительства
Российской Федерации от 3 апреля 2020 г. № 441» (далее – Постановление № 1961),
продлевающего срок действия постановления Правительства Российской Федерации
от 3 апреля 2020 г. № 441 «Об особенностях обращения лекарственных препаратов
для медицинского применения, которые предназначены для применения в условиях
угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и для
организации оказания медицинской помощи лицам, пострадавшим в результате
чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики
и лечения заболеваний, представляющих опасность для окружающих, заболеваний
и поражений, полученных в результате воздействия неблагоприятных химических,
биологических, радиационных факторов» до 01.01.2023, сообщает следующее.
В соответствии с п.2 Постановления №1961 разрешения на временное обращение
серии (партии) лекарственного препарата, не зарегистрированного в Российской
Федерации и разрешенного для медицинского применения на территории
иностранных государств уполномоченными органами соответствующих
иностранных государств, выданные в соответствии с постановлением Правительства
Российской Федерации от 3 апреля 2020г. №441 до дня вступления в силу настоящего
постановления, действительны до 1 января 2023 г. и подлежат замене до 1 января
2022 г. по заявлению юридического лица, действующего в собственных интересах
или уполномоченного представлять интересы другого юридического лица, на имя
которого выдано соответствующее разрешение, представленному в Министерство
здравоохранения Российской Федерации в срок до 20 декабря 2021 г.
В связи с изложенным информируем, что в случае необходимости продления
разрешения на временное обращение необходимо предоставить заявление в форме
письменного обращения в Министерство здравоохранения Российской Федерации
в срок до 20.12.2021.

Все публикации раздела «Новости»
В государственный реестр лекарственных средств, включены как иностранные, так и русские препараты, профилактические и диагностические лекарства, которые зарегистрированы Минздравом России.
Госреестр выпускается официально Министерством здравоохранения Росссийской Федерации. Публикуется и ведется строго в соответствии с Законом о лекарственных средствах на сайт http://grls.rosminzdrav.ru.
Официальные документы Минздрава России, в соответствии с которыми составляется Реестр следующие:
- — регистрационные удостоверения;
- — нормативные документы на зарубежные лекарственные средства;
- — приказы о разрешении медицинского применения;
- — фармокопейные и временные фармокопейные статьи;
- — удостоверение регистрации уникального номера.
Как работать с реестром лекарственных средств?
Давайте попробуем разобраться, как же работать с реестром и как найти нужный медикамент, если никогда не открывали этот сайт. Заходим на сайт через поисковую строку вашего браузера. Набираем: Государственный реестр лекарственных средств. Сразу попадаем на главную страницу, на которой первым делом высвечивается информация о безопасности лекарственных средств.
Безопасность лекарственных средств, это те медикаменты, у которых изменилась государственная регистрация: либо отменилась, либо возобновилась, либо приостановлена. Если необходимо распечатать подробную информацию о государственной регистрации какого либо препарата, она представлена в формате пдф файла. Там же, при открытии файла, можно узнать причину изменений в регистрации.
Далее на странице открываются актуальные новости и документы, в которых можно ознакомиться с приказами об аттестации уполномоченных лиц производителей лекарственных препаратов для медицинского применения. Так же все приказы читаемы, прозрачны и представлены в пдф файлах для распечатки.
Приступим непосредственно к самому реестру лекарственных средств. Поиск находится в правом верхнем углу страницы. Щелкаем на сам текст и открывается расширенный поиск. Первой строкой идет номер регистрационного удостоверения.
Этот поиск больше нужен аптечным и медицинским организациям, которые работают с поставщиками и могут запросить нужное удостоверение.
А гражданам, которые хотят просто проверить зарегистрирован ли препарат, который они приобрели в аптеке, понадобиться поиск по Торговому наименованию. Это то название, которое крупными буквами написано на коробочке, бутылочке, тюбике и т.д., в зависимости от формы выпуска приобретенного препарата. Вводим наименование и сразу внизу высвечиваются варианты, выбираем нужный.
Дальше можно просто нажать кнопку Найти. Но если препаратов много, то слишком долго придется пересматривать найденные варианты. Поэтому лучше ввести лекарственную форму- это самое легкое для человека без знаний фармации. Лекарственная форма это то, в чем выпускается препарат: таблетки, раствор, порошки, аэрозоль и т.д. Тогда варианты поиска уменьшатся.
МНН группированное( химическое) наименование- это химическое название самой субстанции. Оно написано, в основном, мелким шрифтом под торговым наименованием, либо в составе. Это само действующее вещество, название которого может совпадать с торговым названием.
Так, с этим разобрались. Следующий пункт в поиске : Наименование держателя регистрационного удостоверения. Этот пункт тоже для аптек и больниц, которые работают с оптовыми поставщиками, и эти документы им предоставляются вместе с медикаментами. Далее следуют пункты: Производитель и Страна. Их так же можно прочитать на упаковке, которую купили и вбить в строку. Можно пропустить.
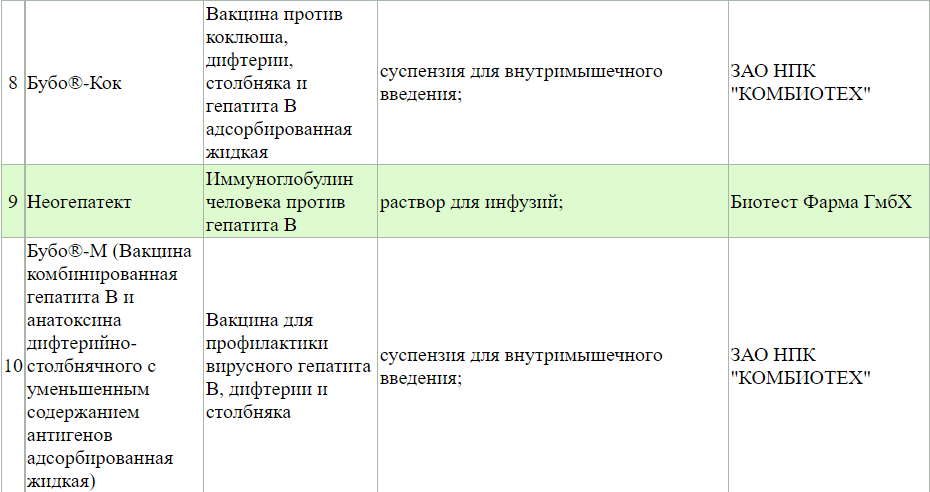
Когда вся информацию, которая найдена на упаковке, была занесена в графы поиска, можно нажать кнопку Найти. Сразу высвечивается сколько найдено строк с препаратами. Чем больше было вбито информации, тем меньше и точнее будет список. Ищем графу: Дата государственной регистрации (она выделена бледно-зеленым цветом) и через графу от нее Дату переоформления РУ. Смотрим даты и смотрим графу Состояние. Буква Д- значит препарат имеет действующее регистрационное удостоверение и прошел все необходимые проверки.
Если препарат не найден, значит он не зарегистрирован в государственном реестре и это повод задуматься о целесообразности его приема.
Все фирмы, которые занимаются продажей фармакологических препаратов в своей работе всегда опираются на Государственный реестр. Следовательно, если продукция в соответствии с регистрационным удостоверением отнесена к лекарственным средствам или препаратам, для осуществления оптовой торговли данной продукцией получение лицензии на фармацевтическую деятельность является обязательным.
Списки А и В, перечень жизненно важных лекарственных препаратов, списки ПККН, списки льготного и безрецептурного отпуска лекарств, все составляются опираясь на информацию, представленную в Реестре. Так как в Реестре содержится информация о торговых и МНН препаратов, их формах выпуска, дозировке, упаковке, фармакологических группах, он служит для представления лекарственного средства, для полного его описания. Реестр так же используется при сборе заявок от регионов на поставку, при оценке производства на предприятиях, при продаже за рубеж, при составлении государственного равновесия спроса и предложения на лекарственные средства.
Разобравшись более подробно в работе с государственным реестром лекарственных средств видно, что информация в нем доступна, понятна и прозрачна для любого пользователя. Даже человек без специального образования может найти полезную информацию о актуальности регистрационного удостоверения интересующего препарата и не сомневаться в его приеме.
( 2 оценки, среднее 4 из 5 )