Фармакологические (биологические) свойства и эффекты
Противогельминтное средство группы бензимидазола. Фенбендазол (5-фенил-тио-2-бензимидазол карбамат) обладает широким спектром нематодоцидного и цестодоцидного действия, активен в отношении взрослых форм, личинок и яиц нематод ЖКТ и легких, а также цестод, паразитирующих у животных.
Механизм действия фенбендазола заключается в разрушении микроканальцев в клетках кишечника гельминтов и нарушении энергетических процессов, что приводит к гибели паразитов.
При пероральном введении фенбендазол легко всасывается в кишечнике и распределяется в органах и тканях животного; выделяется из организма в неизменной форме и в виде метаболитов, в основном с желчью и частично с мочой, у лактирующих животных также с молоком.
По степени воздействия на организм относятся к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007-76), в рекомендуемых дозах хорошо переносится животными.
Показания к применению препарата ФЕНБЕНДАЗОЛ
Назначают молодняку крупного рогатого скота, овцам, козам, жеребятам, поросятам, собакам и кошкам с лечебной и профилактической целью при:
- нематодозах;
- цестодозах.
Порядок применения
Вводят животным однократно, принудительно на корень языка в следующих дозах.
Молодняку крупного рогатого скота при мониезиозе — 150 мг на 15 кг массы животного; при диктиокаулезе, гемонхозе, буностомозе, эзофагостомозе, нематодирозе, остертагиозе, хабертиозе, коопериозе и стронгилоидозе — 150 мг на 20 кг массы животного.
Овцам и козам при мониезиозе — 150 мг на 15 кг массы животного; при диктиокаулезе, гемонхозе, буностомозе, эзофагостомозе, нематодирозе, остертагиозе, трихостронгилоидозе, хабертиозе, коопериозе, стронгилоидозе — 150 мг на 30 кг массы животного.
Жеребятам при параскаридозе и стронгилятозах — 150 мг на 15 кг массы животного.
Поросятам при аскаридозе, эзофагостомозе, стронгилоидозе, трихоцефалезе, метастронгилоидозе — 150 мг на 30 кг массы животного.
Взрослым собакам и кошкам при токсокарозе, токсаскаридозе, анкилостомозе, унцинариозе, дипилидиозе, тениидозах — 150 мг на 1.5 кг массы животного.
Щенкам и котятам (в возрасте старше 3 недель) при токсокарозе, токсаскаридозе, анкилостомозе, унцинариозе, дипилидиозе и тениидозах 1 раз/сут 3 дня подряд в разовой дозе 150 мг на 3 кг массы животного.
Специальной диеты и применения слабительных средств перед дегельминтизацией не требуется.
Побочные эффекты
Побочных явлений и осложнений при применении фенбендазола в соответствии с показаниями и режимом дозирования, как правило, не наблюдается.
При повышенной индивидуальной чувствительности животного к фенбендазолу и появлении аллергических реакций использование лекарственного средства прекращают.
Симптомы передозировки у животных не выявлены.
Противопоказания к применению препарата ФЕНБЕНДАЗОЛ
- индивидуальная повышенная чувствительность животного к фенбендазолу.
Не следует применять препарат:
- истощенным и больным инфекционными болезнями животным;
- щенкам и котятам моложе 3-недельного возраста.
Особые указания и меры личной профилактики
Не рекомендуется одновременное применение с бромсаланфлукицидами, т.к. у крупного рогатого скота при данном взаимодействии отмечались случаи абортов и гибель у овец.
Убой животных на мясо разрешают не ранее, чем через 14 суток после дегельминтизации. При вынужденном убое ранее установленного срока, мясо может быть использовано в корм плотоядным животным или для производства мясо-костной муки.
Молоко дойных животных запрещается использовать для пищевых целей в течение 3 суток после дегельминтизации. Молоко, полученное ранее установленного срока, может быть использовано после термической обработки в корм животным.
Во время работы с лекарственным средством запрещается курить пить и принимать пищу. По окончании работы следует вымыть руки теплой водой с мылом.
📖 5 mins.
Используемый в качестве средства для лечения паразитарных глистных инвазий у собак, фенбендазол является антгельминтиком, который находится в обращении с начала 1970-х годов. (Source)
Однако в последние годы появилось множество опубликованных и рецензируемых работ с описанием конкретных случаев, доказывающих, что фенбендазол также очень эффективен при лечении некоторых агрессивных видов рака у людей. Считается, что это объясняется следующими сильными сторонами, которые отличают фенбендазол от других противораковых препаратов:
- Как мы уже упоминали выше, существует значительное количество научных публикаций, которые поддерживают и обосновывают его эффективное применение в лечении некоторых агрессивных видов рака у людей. (Source)
Например, сообщалось, что только фенбендазол является эффективным средством, вызывающим регрессию опухолей у пациентов с диффузной крупноклеточной В-клеточной лимфомой, метастатическим раком, почечно-клеточной карциномой и раком мочевого пузыря. (Source)
- Фенбендазол имеет очень мало побочных эффектов и очень безопасен для применения людьми.
- Во многих странах его можно приобрести без рецепта.
- Его производство обходится очень недорого.
Более того, в нашей статье «Как работает фенбендазол?» мы сообщали, что противораковое действие фенбендазола очень похоже на группу растительных алкалоидов химиотерапии, к которой относится противораковый препарат Таксол. Кроме того, благодаря уникальному принципу действия и исключительному профилю безопасности, уровень токсичности фенбендазола намного ниже, чем у обычных химиотерапевтических препаратов.
В результате многочисленных наблюдений и выводов стало очевидно (с появлением определенных закономерностей), что происхождение некоторых видов рака может быть связано с вирусами, паразитами и т.п. и вызываться ими.
На самом деле, возможно, это происходит в гораздо большем количестве случаев, чем нам известно, особенно если раковые клетки попадают на «благодатную почву», представленную ослабленным иммунитетом в сочетании с особыми генетическими склонностями.
Поэтому мы серьезно рассматриваем применение противопаразитарных, противоглистных, антилактационных и других препаратов как часть комплексного подхода к лечению рака, который также может включать использование традиционных методов лечения рака.

Фенбендазол для людей
Фенбендазол не является препаратом, который обычно используется для лечения людей, как мебендазол.
Обычно фенбендазол используется для лечения животных (включая млекопитающих, птиц и рыб), зараженных паразитами, и известен тем, что уничтожает множество паразитических червей, таких как глисты, анкилостомы, некоторые ленточные черви и круглые черви.
Впервые фенбендазол был обнаружен под такими торговыми названиями, как Panacur или Safe-Guard, в связи с лечением рака много лет назад благодаря нашим собственным исследованиям. Однако совсем недавно он снова привлек наше внимание благодаря известной истории человека, который успешно вылечил свой мелкоклеточный рак легких с помощью этого препарата против глистов.
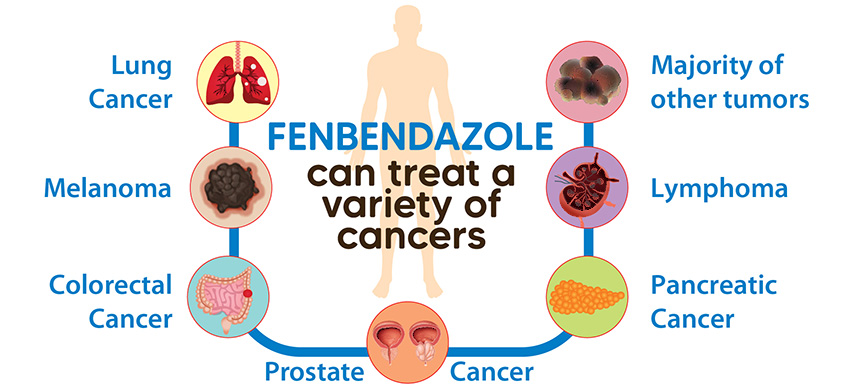
С тех пор специальный веб-сайт и группа в Facebook служат платформой для хроники его собственного опыта, а также опыта других пациентов, которые испытывают преимущества использования фенбендазола при лечении таких видов рака, как немелкоклеточный рак легких, меланома, колоректальный рак, рак простаты, рак поджелудочной железы четвертой стадии и другие виды.
Эти последние сообщения лишь подтверждают существующие и растущие научные данные, демонстрирующие противораковый потенциал многочисленных препаратов класса бензимидазолов. В связи с этим мы считаем, что, как и мебендазол, фенбендазол для людей демонстрирует значительный противораковый потенциал.
В некоторых исследованиях фенбендазол оказался более эффективным, чем мебендазол. Например, в одном из таких исследований фенбендазол оказался намного успешнее мебендазола и других препаратов в борьбе с Cryptococcus neoformans — оппортунистическим грибком, который встречается в любой точке мира и может вызывать криптококковый менингит у некоторых людей. (Source)
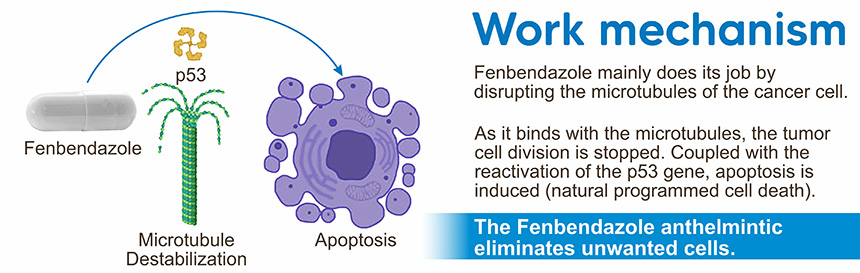
Более того, из множества опубликованных научных статей, в которых предполагалось, что фенбендазол демонстрирует противораковые свойства, в данной работе «Фенбендазол действует как умеренный дестабилизатор микротрубочек и вызывает гибель раковых клеток путем модуляции многочисленных клеточных путей» было установлено, что:
- «Полученные результаты, в сочетании с нашими предыдущими данными, позволяют предположить, что фенбендазол является новым агентом, вмешивающимся в микротрубочки, который проявляет антинеопластическую активность и может быть оценен как потенциальный терапевтический агент благодаря своему воздействию на многочисленные клеточные пути, ведущие к эффективному уничтожению раковых клеток».
Авторы этой работы пришли к выводу, что механизмы борьбы фенбендазола с раком не только нарушают протеасомное вмешательство и функцию микротрубочек раковых клеток, но и демонстрируют способность блокировать поглощение глюкозы, по сути, голодая раковые клетки. Фенбендазол снижал экспрессию изоформы 4 транспортера глюкозы (GLUT4). Стимуляция поглощения глюкозы в клетках с помощью инсулина перемещает GLUT4 через внутриклеточные везикулы к плазматической мембране, готовой поглощать глюкозу. Нарушая его линейное движение по микротрубочкам с помощью фенбендазола, движение GLUT4 ингибируется, что значительно снижает стимулированное инсулином поглощение сахара. (Source)
Более того, поскольку фенбендазол действует аналогично колхицину (взаимодействуя с участком на тубулине), но при этом заметно отличается от других алкалоидов винки, он не будет конкурировать с ними или другими химиотерапевтическими препаратами. Вместо этого, как и в случае с другими бензимидазольными соединениями, фенбендазол будет усиливать противораковое действие других методов лечения рака, таких как хирургия, радиотерапия, дихлорацетат натрия (DCA), берберин и т.д. (Source)
Кроме того, в недавно опубликованной научной статье говорится о том, что фенбендазол (и аналогичные препараты) потенциально может реактивировать геном р53. Функционируя как опухолевый супрессор, р53 известен как «страж генома». Однако его способность к подавлению может быть подавлена в некоторых видах рака. (Source)
Более того, в статье Nature далее говорится о том, что фенбендазол был очень эффективен в сочетании с DCA.
Фенбендазол для людей — пригоден ли он для употребления человеком?
Хотя фенбендазол обычно и изначально используется для лечения паразитических червей у животных, в отчете Европейского медицинского агентства говорится: «Фенбендазол, похоже, хорошо переносится людьми после перорального воздействия (разовая пероральная доза до 2000 мг на человека: 500 мг на человека в течение 10 дней подряд)». (Source)
Однако длительное воздействие пока научно не подтверждено. Скорее всего, это связано с природой действия препарата — паразитарные инфекции обычно уничтожаются не более чем за 1-2 недели.
Несмотря на это, многие люди принимают фенбендазол ежедневно в течение многих лет в качестве профилактики для предотвращения рецидивов рака или в качестве активного лечения опухоли. Лечение представляется безопасным, и оно редко, если вообще когда-либо, вызывает какие-либо побочные эффекты.
Заключительная заметка
Спасибо, что посетили нас и нашли время прочитать эту статью. Если вы ищете больше ценных идей и информации о фенбендазоле, пожалуйста, ознакомьтесь с остальной информацией, которую мы предлагаем на нашем сайте.
Если вы ищете другие варианты, совместимые с протоколом фенбендазола, вы можете ознакомиться с DCA, метаболической стратегией противоракового лечения, которая может использоваться отдельно или в сочетании с фенбендазолом: https://www.dcaguide.org/.
Содержание
- Состав и форма выпуска
- Фармакологические свойства
- Механизм действия
- Показания к применению
- Дозировка и схема лечения
- Побочные действия
- Противопоказания
- Взаимодействие с другими препаратами
- Особые указания
- Торговые названия и цены
- Аналоги

Фенбендазол (Fenbendazole) − это противогельминтное средство широкого спектра действия, применяемое в ветеринарии и воздействующее на многих кишечных паразитов: лямблий, нематод и цестод, в частности цепней из рода Taenia (но не эффективен против огуречного цепня) и некоторых трематод.
Воздействует на взрослых особей, а также паразитов в личиночной стадии и их яйца. Преимущество состоит в отсутствии побочных эффектов или их незначительных проявлениях.
Содержание
Состав и форма выпуска
Лекарства на основе фенбендазола выпускаются в форме порошка, таблеток, суспензии, пасты. В составе препаратов, кроме фенбендазола, содержатся вспомогательные компоненты (лактоза, тальк и другие), а также иногда другие действующие вещества (пирантел, празиквантел).
Фармакологические свойства
Фенбендазол предназначен для орального использования. Он плохо всасывается из ЖКТ, что делает его менее токсичным. Большая часть его выводится с калом в неизмененном виде, незначительное количество покидает организм с мочой (около 1%). Поступление средства в тонкую кишку с желчью способствует более длительному воздействию на паразитов.
Фенбендазол полностью выводится из организма за 48 часов, но нередко его остатки выявляются в тканях и органах на протяжении 10−25 дней.
Механизм действия
Фенбендазол активно воздействует на нематод и цестод. Механизм действия состоит в разрушении клеточных микроканальцев кишечника гельминтов, а также изменении энергетических процессов. В результате гельминты погибают и выводятся с калом.
Показания к применению
Фенбендазол используется для избавления от большинства нематод, многих ленточных червей и некоторых других кишечных паразитов у собак, кошек, крупного рогатого скота, овец и коз, свиней, кроликов, птицы. Фенбендазол может также приводить к гибели нематод и других кишечных паразитов у животных меньших размеров, включая крыс, мышей и хомячков. Это средство может быть использовано против кишечных паразитов даже у многих амфибий и рептилий.
Дозировка и схема лечения
При лечении фенбендазолом не требуется прием слабительного средства. По поводу дозировок желательно посоветоваться с ветеринаром или изучать инструкцию конкретного препарата. Средние рекомендованные дозы для различных животных приведены ниже.
Упрощенная схема профилактики и лечения
Ниже приведены средние дозы и рекомендации для случаев, когда точный диагноз не поставлен либо проводится профилактика. При выраженных симптомах лечение по такой схеме может быть недостаточно эффективным, но все же может быть полезным, когда по каким-либо причинам нет возможности точно установить возбудителя гельминтоза у животного.
Для сельскохозяйственных животных и птиц
Дозировки для профилактики и для лечения самых распространенных нематод следующие:
- КРС – 7,5 мг/кг массы тела (назначается индивидуально);
- овцы и козы – 5 мг/кг веса (групповым способом либо индивидуально);
При использовании фенбендазола групповым способом для лечения овец и коз препарат смешивается с 50−100 г корма. В расчет берется группа до 150 голов.
- лошади – 7,5 мг/кг веса (индивидуально);
- свиньи – 5 мг/кг массы тела (групповым либо индивидуальным способом);
Если планируется дегельминтизация более 50 животных, средство смешивается с кормом, рассчитанным на половину нормы.
- куры – 7,5 мг/кг массы (используется для группового лечения);
Фенбендазол смешивается с комбикормом, приготовленным для утреннего кормления. Дозировка рассчитывается, исходя из общей массы тела птиц.
Несмотря на низкую токсичность и отсутствие побочных эффектов, рекомендуется испытать препарат на нескольких животных, прежде чем приступить к массовому лечению. За ними следует наблюдать 3 дня. Если осложнения не проявились, можно проводить дегельминтизацию всего стада.
Для собак
Терапия собак фенбендазолом проводится в дозировке 50 мг/кг веса. Для избавления от нематод препарат назначается 1 раз в день курсом, составляющим трое суток. При лечении цестодозов терапия длится 10−14 дней.
Собака во время беременности должна пройти терапевтический курс, начиная с 40-го дня вынашивания. Щенкам проводится дегельминтизация через три недели от рождения.
Для кошек
Схема лечения гельминтозов у кошек не отличается от терапии собак. Дозировка составляет 40− мг/кг массы тела. Лечение котят проводится, начиная с трехнедельного возраста. Лекарство смешивается с небольшим объемом корма.
Существует две разновидности препаратов: для взрослых собак и кошек, а также для щенков и котят. Они отличаются составом – разным количеством активного компонента. Это делает применение более удобным.
Большая таблица с точной дозировкой фенбендазола для собак, котов, крупного рогатого скота, овец, коз, лошадей и птицы.
|
КРУПНЫЙ РОГАТЫЙ СКОТ |
|
|
Паразиты |
Дозировка и схема лечения |
| Кишечные нематоды | 1) 5-7,5 мг/кг
2) 1 мг/кг / день x 5-10 дней, смешивая с кормом |
| Dictyocaulus viviparus (легочная нематода) | 5-7,5 мг/кг, повторить через 4 недели при необходимости |
| Печёночная Двуустка (взрослые черви) | 15 мг/кг / день x 6 дней |
| Moniezia SPP | 10 мг/кг |
| Ostertagia ostertagi (подавляет развитие личинок) | 10 мг/кг |
| Лямблии | 10 мг/кг 2р. в день x 3 дня |
|
ОВЦЫ |
|
|
Паразиты |
Дозировка и схема лечения |
| Кишечные нематоды | 5-10 мг/кг |
| Dictyocaulus viviparus (легочная нематода) | 1)100-150 мг/кг
2) 25 мг/кг / день x 5 дней |
| Печёночная Двуустка (взрослые черви) | 1) 150 мг/кг
2) 10-30 мг/кг/день x 5 дней |
| Род Moniezia (при монелиозе) | 5-15 мг/кг |
| Muellerius capillaris (легочная нематода) | 1) 20-40 мг/кг;
2) 5 мг/кг x 6-14 дней |
|
КОЗЫ |
|
|
Паразиты |
Дозировка и схема лечения |
| Кишечные нематоды | 1) 5 мг/кг
2) 5 мг/кг x 5 дней, смешивая с кормом |
| Dictyocaulus viviparus (легочная нематода) | 1) 100 мг/кг
2) 25 мг/кг x 5 дней 3) 10 мг/кг x 10 дней |
| Печёночная Двуустка (взрослые черви) | 1) 150 мг/кг
2) 30 мг /кг/день x 5 дней |
| Род Moniezia (при монелиозе) | 5-15 мг/кг |
| Muellerius capillaris (легочная нематода) | 15 мг/кг x 2 дня, повторить через 35 дней |
|
СВИНЬИ |
|
| Паразиты | Дозировка и схема лечения |
| Кишечные нематоды | 1) 3-6 мг/кг
2) 20 ppm в корм x 5 дней; свиноматки – 100 ppm 3) 10 ppm в корм x 10 дней; свиноматки – 50 ppm |
| Аскарда свиная | 10 мг/кг |
| Аскариды (миграция личинок) | 3 мг/кг/день x 3 дня |
| Род Metastrongylus (легочные нематоды, при метастронгилезе) | 25 мг/кг |
| Stephanurus Dentatus («почечные» нематоды) | 3 мг/кг/день x 3 дня |
| Strongyloides SPP | 5 мг/кг/день x 3 дня |
| Trichuris suis (свиной власоглав) | 25 мг/кг |
|
ЛОШАДИ |
|
| Паразиты | Дозировка и схема лечения |
| Кишечные нематоды | 5-7,5 мг/кг |
| Аскариды | 10 мг/кг |
| Личинки аскаирид (фаза миграции) | 10 мг/кг/день x 5 дней |
| Dictyocaulus arnfieldi (легочная нематода) | 7,5-10 мг/кг |
| Род Habronema (личинка могут поражать кожу, глаза) | 10 мг/кг/день x 5 дней |
| Oxyuris equ (незрелые черви в кишечнике) | 10 мг/кг |
| Cyathostomins (осумкованные личинки в слизистой толстой кишки) | 7,5 мг/кг/день x 5 дней |
| Strongyloides westeri | 50 мг/кг |
| Род Strongylus (миграция личинок) | 1) 10 мг дней/кг/день x 5 дней
2) 50 мг/кг / сутки x 3 дня 3) 60 мг/кг. |
| Thelazia lacrimalis (глазные нематоды) | 10 мг/кг / день x5 дней |
| Род Trichostrongylus | 50 мг/кг |
| СОБАКИ | |
| Паразиты | Дозировка и схема лечения |
| Кишечные нематоды | 50 мг/кг/день x 3 дня |
| Собачья токсокара (Toxocara Canis) и Toxascaris leonina | 50 мг/кг/день x 3 дня |
| Токсокары (предотвращение дородовой передачи или с молоком) | 5 мг/кг/день с 40-го дня беременности до 2-х дня после щенения (родов) |
| Angiostrongylus vasorum (серечно-легочная нематода) | 20-50 мг/кг/ сутки x 5 дней |
| Capillaria aerophila (легочная нематода) | 50 мг/кг 2р. в день x10-14 дней |
| Capillaria plica (нематода мочеполвой системы) | 50 мг/кг/день x 3 дня, повторить 3 недели в виде разового приема |
| Crenosoma vulpis (легочная нематода) | 50 мг/кг/день x 3 дня |
| Filaroides hirthi (легочная нематода) | 50 мг/кг/день x 14 дней |
| Filaroides osleri (легочная нематода) | 50 мг/кг/день x 10 дней |
| Paragonimus kellicotti | 20-50 мг/кг/день x 5 дней |
| Род Taenia (цепни) | 50 мг/кг/день x 3 дня |
| Trichinella spiralis (в мышцах) | 25 мг/кг 2р. в день x 5 дней |
| Trichuris vulpis (собачий власоглав) | 50 мг/кг/день x 3 дня, повторить через 2-3 недели и после 2-х месяцев |
| КОТЫ | |
| Паразиты | Дозировка и схема лечения |
| Кишечные нематоды | 50 мг/кг/день x 3-5 дней |
| Aelurostrongylus abstrusus (легочная нематода) | 50 мг/кг/день x 3-4 дней |
| Capillaria aerophila (легочная нематода) | 50 мг/кг/день x 10 дней |
| Capillaria feliscati (нематода мочеполвой системы) | 35 мг/кг/ 2р. в день x 3-10 дней |
| Paragonimus kellicotti (легочная трематода) | 50 мг/кг/день x 10-14 дней |
| ПТИЦА | |
| Паразиты | Дозировка и схема лечения |
| Аскариды у кур | 15-25 мг/кг / сутки x 3 дня |
| Аскариды у фазанов и куропаток | 1) 120 ppm в корма x 3 дней
2) 60 ppm в корм x 6 дней |
| Аскариды у остальной птицы | 10-50 мг/кг, повторить через 10 дней |
| Род Capillaria (очень опасные кишечные нематоды) | 10-50 мг/кг x 5 дней |
| Род Heterakis (нематоды, вызывающие распространение простейших паразитов) в фазанов и куропаток | 60 ppm в кормов x 6 дней |
| Syngamus trachea (нематода в трахее) у фазанов и куропаток | 1) 120 ppm корма x 3 дня
2) 60 ppm в кормов x 6 дней |
Побочные действия
Обычно нежелательные эффекты после приема фенбендазола у животных не наблюдаются. В редких случаях появляется рвота или аллергические реакции в виде крапивницы, отеков, побледнения десен, похолодание конечностей. У птиц иногда наблюдается низкий уровень красных и белых кровяных телец. Как правило, это связано с непереносимостью препарата организмом животного.
При передозировке возможны кишечные расстройства.
Противопоказания
Не рекомендуется использовать фенбендазол для лечения животных, ослабленных инфекциями, которые привели к воспалительным процессам в организме.
Взаимодействие с другими препаратами
Фенбендазол нежелательно принимать одновременно с пиперазином и лекарствами, которые ингибируют холинэстеразу.
Особые указания
После лечения фенбендазолом убой животных разрешен спустя две недели. Если необходимость в этом возникла раньше, мясо скармливается пушным зверям либо используется для изготовления мясо-костной муки. Не рекомендуется пить молоко коров и коз на протяжении трех суток после дегельминтизации. При добавлении препарата в корм животных, человеку следует использовать средства индивидуальной защиты (перчатки, марлевые маски, головной убор, халат). После проведения работ руки тщательно моются с мылом. Пустые банки из-под лекарства утилизируются.
Торговые названия и цены
Торговые названия – Фебтал, Цестал, Бровадазол, Дирофен, Панакур, Оксилур и другие. Препараты в виде порошка (20%, 100 г) и таблеток (упаковка из 30 штук) стоят около 2,5 дол. Приблизительно такую же цену придется заплатить за 10 мл суспензии. Лекарство в форме пасты (24 г) – от 3 дол.
Аналоги
К основным аналогам относятся другие препараты с группы бензимидазолов: альбендазол, мебендазол, тиабендазол. Они обладают также широким спектром действия. Предпочтительней в плане соотношения токсичности и эффективности является первый из них – альбендазол.
Большинство других антигельминтных средства (пиперазин, пирантел и др.), часто применяемых в ветеринарии, не эффективны против такого количества разнообразных паразитов, поэтому обычно используются в комплексе.
From Wikipedia, the free encyclopedia
 |
|
| Clinical data | |
|---|---|
| AHFS/Drugs.com | International Drug Names |
| License data |
|
| ATC code |
|
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.051.024 |
| Chemical and physical data | |
| Formula | C15H13N3O2S |
| Molar mass | 299.35 g·mol−1 |
| 3D model (JSmol) |
|
|
SMILES
|
|
|
InChI
|
|
| |
Fenbendazole is a broad spectrum benzimidazole anthelmintic used against gastrointestinal parasites including: giardia, roundworms, hookworms, whipworms, the tapeworm genus Taenia (but not effective against Dipylidium caninum, a common dog tapeworm), pinworms, aelurostrongylus, paragonimiasis, strongyles, and strongyloides that can be administered to sheep, cattle, horses, fish, dogs, cats, rabbits, most reptiles, freshwater shrimp tanks as planaria and hydra treatments, as well as seals.
Drug interactions[edit]
Drug interactions may occur if salicylanilides such as dibromsalan and niclosamide are co-administered. Abortions in cattle and death in sheep have been reported after using these medications together.[1] Abortions in domestic ruminants have been associated with concurrent use of anti-trematode therapeutic agents.[citation needed]
Toxicity[edit]
Fenbendazole is poorly absorbed from the gastrointestinal tract in most species. The LD50 in laboratory animals exceeds 10 g/kg when administered orally.[1] Given its low toxicity and high tolerability among different species, the possibility of repurposing it as a drug to treat cancer in humans has been proposed.[2]
Metabolism[edit]
Fenbendazole is metabolized in the liver to oxfendazole, which is anthelmintic too; oxfendazole partially gets reduced back to fenbendazole in the liver and rumen.[3][4] Also, fenbendazole itself is an active metabolite of another anthelmintic drug, febantel.[5]
See also[edit]
- Oxfendazole
- Nocodazole
- Praziquantel
References[edit]
- ^ a b Plumb DC (2005). Plumb’s veterinary drug handbook (Fifth ed.). Stockholm, Wis.: PhrmaVet. ISBN 978-0-8138-0518-4.
- ^ Dogra N, Kumar A, Mukhopadhyay T (August 2018). «Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways». Scientific Reports. 8 (1): 11926. Bibcode:2018NatSR…811926D. doi:10.1038/s41598-018-30158-6. PMC 6085345. PMID 30093705.
Fenbendazole is known to have a high safety margin and most species tolerate it very well. It has very low degree of toxicity and high degree of safety in experimental animals. In this study, we show that fenbendazole (FZ) exhibits a moderate microtubule depolymerizing activity towards human cancer cells, but possesses a potent antitumor effect as evident from in vitro and in vivo experiments.
- ^ Junquera P (2015-07-26). «Fenbendazole, Anthelmintic for Veterinary Use on Cattle, Sheep, Goats, Pig, Poultry, Horses, Dogs and Cats Against Roundworms and Tapeworms». PARASITIPEDIA. Retrieved 2015-09-08.
- ^ Junquera P (2015-07-26). «Oxfendazole, Anthelmintic for Veterinary Use on Cattle, Sheep, Goats, Horses, Dogs and Cats Against Roundworms and Tapeworms». PARASITIPEDIA. Retrieved 2015-09-08.
- ^ Junquera P (2015-07-26). «Febantel for Veterinary Use on Dogs, Cats, Cattle, Sheep, Goats, Pig and Poultry Against Roundworms and Tapeworms». PARASITIPEDIA. Retrieved 2015-09-08.
Паразитарные болезни, в том числе гельминтозы животных, повсеместно распространены
в РФ и в мире. В некоторых регионах России от 40 до 90% овец и крупного рогатого скота
инвазированы гельминтами (Радионов, Архипов, 2010; Шамхалов и др., 2015), что причиняет
большой экономический ущерб вследствие значительного снижения роста и развития молодняка,
уменьшения мясной, молочной, шерстной продуктивности и качества получаемой продукции.
Установлено, что прирост массы тела телят, зараженных Dictyocaulus viviparus и желудочно-кишечными стронгилятами, снижается в среднем на 34–35 кг в год (Сафиуллин,
1997).
К наиболее часто применяемым средствам борьбы с гельминтозами животных относится фенбендазол
(ФБЗ), который обладает широким спектром действия, безопасен в применении и нетоксичен
для организма животных, за исключением редких случаев диареи и рвоты (Goosens et al., 2005; Архипов, 2009; Riviere, Papich, 2009; Tramboo et al., 2017; Bushra, 2019). Механизм действия препарата обусловлен изменением микротубул
гельминтов и нарушением потребления глюкозы у нематод, что вызывает снижение запасов
энергии и гибель гельминта. Известно, что ФБЗ обладает низкой растворимостью, а следовательно,
слабой биодоступностью (Campbell, Rew, 1986; Душкин и др., 2013), и поэтому при терапии
некоторых гельминтозов требуется повышение его дозировок. Так, для повышения водорастворимости
современных препаратов используют различные методики модификации лекарственных субстанций
с помощью циклодекстринов, полисахаридов, липосом, мицелл и наноразмерных неорганических
частиц (Marchessault et al., 2006; Krishnaian, 2010; Yanghuan et al., 2015). Повышение фармакологического эффекта достигается за счет увеличения растворимости,
мембранной проницаемости и лучшей доставки молекул препарата к месту их действия (Loftsson
et al., 2007; Kong et al., 2017). Кроме того, могут быть использованы различные физико-химические методы для
повышения растворимости препаратов: изменение и уменьшение размеров частиц, изменение
кристаллической структуры, приготовление твердых дисперсий субстанций с полимерами
и др. (Boldyrev, 2004; Vemula et al., 2010; Wagh, Wagh, 2015).
Большой интерес к повышению эффективности действия ФБЗ вызван использованием механохимической
технологии для улучшения показателей растворимости, абсорбции и биодоступности (Душкин
и др., 2013). В предыдущие годы нами была определена активность супрамолекулярного
фенбендазола (СФБЗ) с арабиногалактаном и поливинилпирролидоном при нематодозах овец
и крупного рогатого скота (Варламова, 2017; Arkhipov et al., 2019).
В наших исследованиях использовался новый полимерный компонент – экстракт солодки
(ЭС), который содержит до 25% глицирризиновой кислоты (ГК). Ранее было установлено,
что производные ГК могут встраиваться в клеточные мембраны, обеспечивая подвижность
липидов (Селютина и др., 2015). Благодаря амфифильным свойствам ГК способна к образованию
мицелл с гидрофобными веществами и их переносу через биологические мембраны (Dushkin
et al., 2012; Graebin, 2016; Selutina et al., 2016). Кроме того, нами был установлен тот факт, что добавление известного эмульгатора
– натрия диоктилсульфосукцината (НДОСС) (Hetenyi et al., 2017), использующегося в пищевой промышленности, – увеличивает антигельминтную активность
действующего вещества (ДВ) (Варламова и др., 2019).
Цель работы – изучение физико-химических свойств и биологической активности СФБЗ,
полученного по механохимической технологии при гельминтозах.
МАТЕРИАЛЫ И МЕТОДЫ
СФБЗ получали при совместной механообработке компонентов, взятых в весовом соотношении
1 : 8.9 : 0.1 в металлическом барабане (объем 800 мл) валковой шаровой мельницы типа
LE-101 (Венгрия) при скорости вращения барабана 60 об./мин и модуле процесса 1 : 16
в среде с металлическими шарами (диаметр 23 мм). Полученные при варьировании времени
активации (от 1 до 24 ч) образцы композиций представляли собой твердые дисперсии (ТД)
в виде легкосыпучих порошков. Эти ТД в среде растворителей образовывали супрамолекулярные
комплексы.
В работе были использованы:
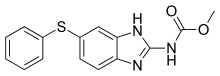
ФБЗ, который в химическом отношении представляет собой 5-(фенилтио)-2-бензимидазолкарбамат
(99.0%) производства Changzhou Yabang Pharmaceuticals Co. Ltd (Цзянсу, Китай);
ЭС – сухой мелкодисперсный порошок от светло- до темно-коричневого цвета с содержанием
24.9% ГК производства ООО “Вистерра”, Алтайский край (Декларация соответствия TCN
RU Д–RU.AF96.B.00958);
НДОСС с содержанием основного вещества 96% (Acras Organics, Нью-Джерси, США) – мелкодисперсный,
гигроскопичный порошок со слегка горьким, мыльным вкусом и запахом октанола. В РФ
разрешено его использование в качестве эмульгатора и детергента.
Физико-химические свойства исходных компонентов и их изменения в полученных ТД изучали
методами ИК-спектроскопии и рентгенофазового анализа (РФА). Основной параметр, определяющий
образование комплексов из их ТД, – изменение растворимости ФБЗ. Для определения концентрации
ФБЗ в анализируемых образцах использовали метод высокоэффективной жидкостной хроматографии
(ВЭЖХ). Анализ проводили на жидкостном хроматографе Agilent 1100 (Германия) с диодной
матрицей с использованием аналитической колонки Hypersil C18 (5 мкм, 150 × 4.6 мм).
Элюент состава ацетонитрил–ацетатный буфер, рН 3.4, в соотношении 1 : 1 подавали в
изократическом режиме со скоростью 1 мл/мин. Температура термостата колонки была 30°С,
УФ-детектирование проводили при длине волны 290 нм. Объем вводимой пробы – 1 мкл.
Прием и обработку данных осуществляли с помощью программно-аппаратного комплекса Chemstation.
При рентгенофазовом анализе дифрактограммы регистрировали при вращении образца методом
съемки “на просвет” в диапазоне углов рассеяния 20:5–100° на дифрактометре Brucker
D8 (Advance, Германия) с фокусирующим германиевым кристаллом-монохроматором на первичном
пучке (CuKa-излучение, длина волны 0.1542 нм). Первичную обработку дифрактограмм проводили методом
Aлександера с учетом собственного рассеяния кюветы, внесением поправки на поглощение
и поляризацию излучения (Alexander, 1969). Для определения степени кристалличности
образцов, подвергнутых механообработке с различным временем воздействия, использовали
метод Руланда, отличительная особенность которого – возможность одновременного учета
влияния искажений в кристаллической решетке ФБЗ при вычислении степени его кристалличности
(Ruland, 1961; Могилевская и др., 2006).
ИК-спектры измеряли методом нарушенного полного внутреннего отражения (НПВО) на инфракрасном
фурье-спектрометре VERTEX 70v (Bruker Optik GmbH, Германия) с использованием приставки
НПВО GladyATR 50 (PIKE, США) с алмазным рабочим элементом в области 4000–400 см–1 со спектральным разрешением 4 см–1. Измеренные спектры НПВО корректировали с использованием входящей в состав программного
обеспечения OPUS 7 программы для учета зависимости глубины проникновения излучения
в образец от длины волны (Khalikov et al., 2019).
Исследование антигельминтной активности проводили в соответствии с Руководством по
экспериментальному изучению новых фармакологических веществ субстанций (Хабриев, 2005),
Правилами, адаптированными Европейской конвенцией по защите позвоночных животных,
используемых для экспериментальных научных целей (Страсбург, 1986), и Правилами надлежащей
клинической практики РФ (Приказ МЗ РФ № 199н от 01.04.2016 г.).
Особенности фармакокинетики СФБЗ изучали в организме овец методом ВЭЖХ. В опытах использовали
две группы овец (по пять голов в каждой), которым давали СФБЗ и субстанцию ФБЗ в дозе
2 мг/кг однократно перорально. Пробы крови брали до и через 1, 2, 4, 6, 8, 12, 24,
33, 48, 72 и 144 ч после введения супрамолекулярного и базового препаратов. Для определения
наличия ФБЗ и его метаболитов (сульфоксида и сульфона) в сыворотке крови овец применяли
методику, описанную нами ранее (Кочетков и др., 2016; ГОСТ 32834-2014). В работе использовали
жидкостной хроматограф высокого давления Agilent 1290 с масс-спектрометрическим детектором
Agilent 6430 (QQQ), управляемым с помощью программы Mass Hunter Workstation Software
LC/MS Data Acquisition Triple Quadrupole Version B.06.00. Хроматографическое разделение
проводили на колонке Kromasil Eternity XT-2.5-C18 (Швеция) длиной 100 мм, с внутренним
диаметром 2.1 мм, с размером зерна сорбента 2.5 мкм и предколонке Kromasil Eternity
2.1 × 10 мм. Детектирование аналитов и внутреннего стандарта осуществляли с помощью
метода тандемной масс-спектрометрии (МС/МС) в режиме записи сигналов выбранных ионных
реакций (MRM) для отрицательно заряженных ионов при температуре ионизации 350°C, потоке
газа 10 л/мин и давлении небулайзера 40 psi.
Изучение эффективности действия СФБЗ против Trichinella spiralis на лабораторной модели проводили на 70 инбредных белых мышах BALB/c (генотип – b,
c, H-2d) обоих полов (16–18 г) возраста 1.5–2 мес., полученных из питомника “Столбовая”
(ФГБУН НЦБМТ ФМБА России). Мыши находились на карантине в течение 7 сут до опыта в
условиях свободного доступа к корму и воде в соответствии с ежедневными нормами кормления
РФ (Приказ МЗ СССР № 1179 от 10.10.1983 г. “Об утверждении нормативов затрат кормов
для лабораторных животных в учреждениях здравоохранения”). Мышей содержали в виварии
при 22оС и влажности 60–70% с естественным и искусственным освещением. Животных распределяли
на группы случайным образом с одинаковой массой тела.
Инвазионные личинки T. spiralis были выделены методом переваривания мышечной ткани крыс. Пробы выдерживали в переваривающей
жидкости (20 мл концентрированной HCl, 1000 мл физиологического раствора и 20 г пепсина)
при 37°С в течение 12 ч в условиях постоянного встряхивания в механическом встряхивателе.
Затем после двойной седиментации при 1000 об./2 мин при добавлении 1.5% желатина в
физиологический раствор получили суспензию личинок. Для подсчета числа выделенных
личинок использовали хемоцитометр. После 12-часового голодания мышам в желудок вводили
с помощью атравматического зонда 200 личинок T. spiralis на мышь (Астафьев и др., 1989). На 3-и сут после заражения животных разделили на
группы (6 экспериментальных и одну контрольную) по 10 мышей в каждой. Животным 1,
2 и 3-й группы вводили СФБЗ в дозах соответственно 3.0, 2.0 и 1.0 мг/кг по ДВ в крахмальном
геле. Мыши 4-й и 5-й групп получали субстанцию ФБЗ (без механохимической обработки)
в дозах 5 и 1.0 мг/кг в крахмальном геле соответственно. Физическую смесь того же
состава (ФБЗ/ ЭС/НДОСС в соотношении 1.0 : 8.9 : 0.1) назначали животным 6-й группы
в дозе 1.0 мг/кг. Мыши контрольной группы получали 1%-ный крахмальный гель в соответствующем
объеме. На 3-и сут после введения препаратов провели декапитацию мышей всех групп.
Гельминтологическое вскрытие тонкого кишечника мышей проводили на 3-и сут после введения
препаратов. Тонкий кишечник мышей вскрывали ножницами по всей длине, помещали в физиологическом
растворе в аппарат Бермана, затем термостатировали при 37–39оС в течение 2 ч, после чего исследовали седимент под бинокулярной лупой и подсчитывали
число обнаруженных T. spiralis (Астафьев и др., 1989; Архипов и др., 2019).
Антигельминтную эффективность СФБЗ изучали в овцеводческой ферме в Самарской обл.
(ООО “Измайлов”). Опыты проводили в период максимального подъема зараженности в 2019
г. Всего в опыте были использованы 284 головы молодняка овец различных пород с массой
тела от 16 до 37 кг, включая спонтанно зараженных Nematodirus spp. (60 овец) и другими видами желудочно-кишечных стронгилят (55 овец). Овец содержали
в станках (без выпаса), и кормили согласно соответствующим нормам, обеспечивали водой
вдоволь и распределяли на группы с равным числом яиц в 1 г фекалий на основании количественного
учета яиц гельминтов методом McMaster (MAFF, 1986). В расчетах использовали среднее
геометрическое число яиц гельминтов в 1 г фекалий (Wood et al., 1995). По результатам исследований проб фекалий овец разделили на 6 равных групп
по 7–10 голов в каждой (MAFF, 1986). Животные 1, 2 и 3-й групп получали СФБЗ в форме
10%—ного порошка однократно в дозах 1.0, 2.0 и 3.0 мг/кг по ДВ соответственно. Животным
4-й и 5-й групп назначали субстанцию ФБЗ в дозах 1.0 и 5.0 мг/кг соответственно. Овцы
контрольной группы препарат не получали. Эффективность применения СФБЗ при нематодозах
овец определяли по результатам исследования проб фекалий методом McMaster до и через
15–18 сут после лечения. Идентификацию нематод проводили на основании их морфологии
в фекалиях. Эффективность препаратов подсчитывали по снижению среднего геометрического
числа яиц нематод до и после лечения (MAFF, 1986; Wood et al., 1995).
Статистическую обработку полученных данных проводили с помощью компьютерной программы
SAS №9.4 SoftwareforWindows. Microsoft Excel PK Solver 2.0 использовали для обсчета
данных фармакокинетических кривых с использованием однокамерной модели (Zhang et al., 2010). Математический анализ проводили по среднему числу гельминтов с помощью параметрического
t-теста для сравнения разницы между лечеными и контрольными группами (Р ≤ 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Метод механохимической модификации ФБЗ с ЭС и НДОСС использовали для получения СФБЗ.
Подтверждением образования комплекса служит повышение растворимости, что подтверждено
данными ВЭЖХ-анализа. При этом в количественном выражении данные растворимости представлены
в табл. 1, из которой видно повышение растворимости до 27 раз. При этом растворимость физической
смеси (без механохимической обработки) повысилась незначительно, в 2.6 раза.
Таблица 1.
Растворимость субстанции фенбендазола (ФБЗ) и его твердой дисперсии с экстрактом солодки
(ЭС) и натрия диоктилсульфосукцинатом (НДОСС)
| Название образца и соотношение компонентов |
Время механообработки, мин |
Растворимость | |
|---|---|---|---|
| абсолютная, мг/л | увеличение, раз | ||
| ФБЗ – исходный образец | – | 1.0 | – |
| ФБЗ : ЭС : НДОСС – 1 : 8.9 : 0.1 | 30 | 7.4 | 7 |
| То же | 150 | 14.8 | 15 |
| » | 240 | 25.3 | 25 |
| » | 420 | 26.9 | 27 |
| ФБЗ : ЭС : НДОСС – 1 : 8.9 : 0.1 – физическая смесь | – | 2.6 | 3 |
РФА использовали для выявления разницы в композициях ФБЗ и ЭС, при этом наличие НДОСС
не учитывали из-за его незначительного содержания в твердой дисперсии (не более 1%).
Сопоставление дифрактограмм исходного ФБЗ и его измельченной композиции (2 ч механообработки
LE-101 при модуле 1 : 25) указывает на то, что при такой механообработке кристалличность
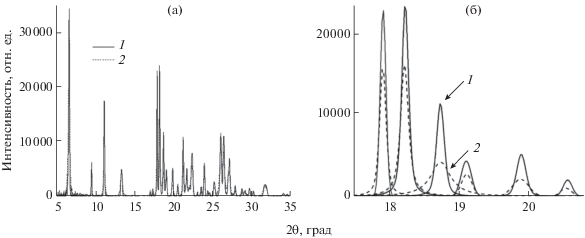
исходного ФБЗ не изменяется (рис. 1), несмотря на снижение интенсивности рефлексов, что наглядно отображается на рис. 1б. Сделан вывод лишь о микронизации образца ФБЗ с сохранением исходной кристалличности.
Однако добавление к кристаллическому ФБЗ аморфно-кристаллического образца полимера
ЭС (кристалличность 20% из-за наличия в ЭС до 25% ГК) и проведение совместной механообработки
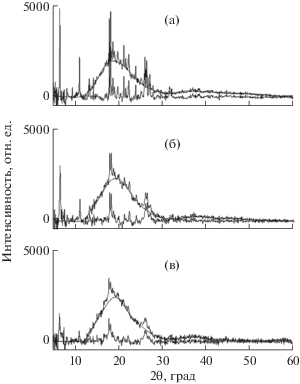
позволили снизить кристалличность ФБЗ до 20% (рис. 2).
Рис. 1.
Рефлексы отражения исходного (1) и измельченного (2) образцов фенбендазола. а – общий вид дифрактограммы; б – увеличенный размер фрагмента
дифрактограммы.
Рис. 2.
Рефлексы отражения твердой дисперсии состава ФБЗ : ЭС (1 : 9) в виде физической смеси
(а) и после механообработки: 120 (б) и 420 мин (в).
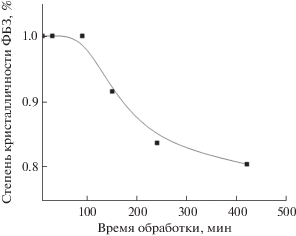
Обработка результатов РФА показывает, что степень аморфизации ФБЗ в ТД состава ФБЗ
: ЭС (1 : 9) достигает оптимального значения (10%) уже при механообработке в течение
150 мин и дальнейшая обработка (вплоть до 420 мин) не позволяет существенно снизить
кристалличность ФБЗ (рис. 3).
Рис. 3.
Влияние времени механообработки на снижение степени кристалличности фенбендазола (ФБЗ)
в твердой дисперсии после механообработки до 420 мин.
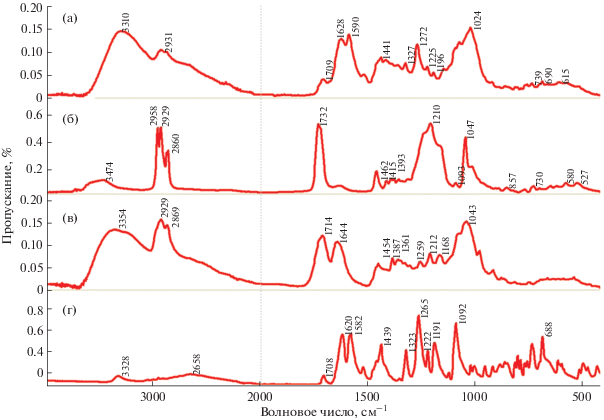
При анализе ИК-спектров (рис. 4) было установлено, что в процессе совместной механообработки субстанции ФБЗ с ЭС
и НДОСС не происходит механодеструкции лекарственного вещества. Кроме этого в твердой
дисперсии содержатся частоты поглощения исходного ФБЗ с незначительным смещением в
область повышения частот на 1–7 см–1. И лишь полосы 3310 и 1092 см–1, характерные для исходного ФБЗ, смещаются в область снижения частот до 8 см–1. Эти данные позволяют предполагать образование межмолекулярного комплекса ФБЗ с компонентами
твердой дисперсии. Сравнение ИК-спектров СФБЗ с ИК-спектром ГК (действующего вещества
ЭС) показывает, что чаще всего наблюдается смещение основных характеристичных полос
ГК в область повышения частот 5–19 см–1, что свидетельствует об участии групп ГК в образовании комплексов включения и было
отмечено ранее (Khalikov et al., 2019).
Рис. 4.
ИК-спектры твердой дисперсии фенбендазола (ФБЗ) с экстрактом солодки (ЭС) и натрия
диоктилсульфосукцинатом (НДОСС) (а), ИК-спектры НДОСС (б), ЭС (в) и ФБЗ (г).
При изучении физико-химических свойств было установлено, что повышается растворимость
СФБЗ, уменьшаются размеры частиц ФБЗ, происходят потеря кристалличности ФБЗ и его
аморфизация, однако деструктивных изменений молекулы ФБЗ в условиях механообработки
отмечено не было. Вероятно, ФБЗ локализуется на поверхности и в порах молекул ЭС и
НДОСС, что изменяет особенности и свойства действующего вещества, и носители транспортируют
его через клеточные мембраны.
Результаты исследований, полученные нами при изучении особенностей фармакокинетики
ФБЗ и его метаболитов в организме овец, показали существенную разницу в метаболизме
ФБЗ после введения базового препарата и супрамолекулярного комплекса в равной дозе
(по 2.0 мг/кг по ДВ). ФБЗ и его метаболиты (сульфоксид и сульфон) начали обнаруживать
в сыворотке крови овец через 2 ч после однократного перорального введения супрамолекулярной
формы и только через 5–6 ч после применения базового препарата – ФБЗ. Максимальное
содержание ФБЗ и его метаболитов было отмечено в сыворотке крови овец через 28–42
ч после введения СФБЗ и составило соответственно 50.2, 41.2 и 43.2 против 19.1, 16.4
и 18.8 нг/мл после применения базового ФБЗ, что почти в 2.5 раза ниже показателей
СФБЗ.
Фармакокинетические параметры ФБЗ и его метаболитов, представленные в табл. 2, свидетельствуют о значительном повышении скорости абсорбции и времени поступления
их в кровь. Так, скорость абсорбции ФБЗ после введения базового препарата составила
0.032 ч–1, а после введения супрамолекулярной формы – 0.060 ч–1. Время всасывания в кровь половины введенной дозы было равно соответственно 25.60
и 13.88 ч, т.е. ФБЗ в супрамолекулярной форме всасывается почти в 2 раза быстрее.
Отмечали значительную разницу в показателях клиренса базового и супрамолекулярного
фенбендазола. Максимальная концентрация ФБЗ в сыворотке крови овец составила после
введения супрамолекулярной формы 50.62 нг/мл, что в 2.5 раза выше максимальной концентрации
базового препарата (19.84 нг/мл). Значительное повышение было отмечено и в концентрации
метаболитов в крови овец, которым вводили супрамолекулярную форму. Период полувыведения
ФБЗ был в 3.5 раза больше после применения СФБЗ. Время удерживания ФБЗ в системном
кровотоке овец составило 61.60 и 364.22 ч соответственно после введения базового и
СФБЗ.
Таблица 2.
Фармакокинетические параметры фенбендазола и его метаболитов в организме овец после
введения базового и супрамолекулярного фенбендазола в дозе 2.0 мг/кг по действующему
веществу
| Показатель | Фенбендазол | Сульфоксид | Сульфон | |||
|---|---|---|---|---|---|---|
| М | RSD | М | RSD | М | RSD | |
| Базовый фенбендазол | ||||||
| ka, ч–1 | 0.032 | 6.6 | 0.038 | 1.6 | 0.031 | 3.0 |
| t1/2ka, ч | 25.60 | 6.4 | 18.30 | 1.7 | 19.10 | 3.0 |
| CL, л/ч | 0.94 | 6.4 | 1.58 | 3.0 | 1.34 | 3.2 |
| Cmax, нг/мл | 19.84 | 1.8 | 16.70 | 1.6 | 18.20 | 1.8 |
| Tmax, ч | 40.42 | 6.0 | 27.60 | 2.2 | 27.82 | 2.8 |
| T1/2, ч | 28.82 | 6.4 | 20.10 | 2.8 | 21.56 | 3.0 |
| AUC0 – t, нг/(мл ч) | 1154.16 | 6.8 | 928.12 | 2.4 | 1014.12 | 3.4 |
| МRТ, ч | 61.60 | 7.44 | 54.18 | 2.6 | 55.36 | 3.0 |
| Супрамолекулярный фенбендазол | ||||||
| ka, ч–1 | 0.060 | 5.4 | 0.034 | 2.0 | 0.028 | 4.0 |
| t1/2ka, ч | 13.88 | 8.2 | 21.50 | 1.8 | 26.42 | 4.2 |
| CL, л/ч | 0.22 | 7.0 | 0.50 | 5.2 | 0.40 | 6.2 |
| Cmax, нг/мл | 50.62 | 4.0 | 41.74 | 4.4 | 42.14 | 4.6 |
| Tmax, ч | 42.82 | 9.0 | 31.68 | 2.6 | 40.18 | 4.0 |
| T1/2, ч | 102.22 | 11.2 | 24.58 | 3.4 | 28.60 | 3.4 |
| AUC0 – t, нг/(мл ч) | 3044.68 | 3.8 | 2482.64 | 4.2 | 2466.20 | 4.8 |
| МRТ, ч | 364.22 | 9.4 | 69.08 | 2.6 | 88.40 | 4.0 |
Значения показателей фармакокинетики ФБЗ и его метаболитов в организме овец значительно
различаются при применении базового и супрамолекулярного фенбендазола в равной дозе
2 мг/кг по ДВ и свидетельствуют о большем уровне абсорбции СФБЗ, что может приводить
к изменению его биологической активности.
Испытания СФБЗ на белых мышах, зараженных T. spiralis, показали его высокую нематодоцидную активность (табл. 3). В ходе проведенных опытов было установлено, что СФБЗ в дозах 3.0, 2.0 и 1.0 мг/кг
по ДВ показал соответственно 100, 99.73 и 96.27%-ную эффективность. При этом в тонком
кишечнике животных обнаруживали соответственно 0, 0.230 и 3.163 экз. T. spiralis. Субстанция ФБЗ (базовый препарат) показала в дозе 5 мг/кг 95.97%-ный эффект, а в
дозе 1 мг/кг – 13.7%-ную эффективность против T. spiralis. Физическая смесь ФБЗ : ЭС : ДССН в соотношении 1 : 8.9 : 0.1 показала в дозе 2 мг/кг
по ДВ 24.17%-ную антигельминтную активность. У животных контрольной группы обнаруживали
в среднем по 84.726 экз. T. spiralis.
Таблица 3.
Эффективность использования супрамолекулярного фенбендазола (СФБЗ) против Trichinella spiralis
| Группа мышей | Препарат | Доза, мг/кг по ДВ | Геометрическое среднее число нематод, экз. | Эффективность*, % |
|---|---|---|---|---|
| Контроль | Плацебо | – | 84.72 | – |
| Опытная | СФБЗ | 3.0 | 0 | 100** |
| » | » | 2.0 | 0.230 | 99.73** |
| » | » | 1.0 | 3.163 | 96.27** |
| » | ФБЗ-субстанция | 5.0 | 3.417 | 95.97** |
| » | » | 1.0 | 73.125 | 13.70 |
| » | ФБЗ : ЭС : НДОСС физическая смесь | 2.0 | 64.247 | 24.17 |
Полученные результаты испытания СФБЗ при гельминтозах овец показали различную степень
эффективности использования препарата в разных дозах (табл. 4). СФБЗ продемонстрировал в дозах 3.0, 2.0 и 1.0 мг/кг по ДВ соответственно 100, 98.21
и 95.64%-ную эффективность против Nematodirus spp. по результатам копроовоскопических исследований методом McMaster. После введения
комплекса в дозе 2.0 мг/кг по ДВ 8 из 10 леченых овец освободились от гельминтов,
и число яиц нематодирусов снизилось на 98.21%. Эффективность введения комплекса в
дозе 1 мг/кг составила 95.64%, и 6 из 10 животных освободились от инвазии. Значения
эффективности введения базового препарата – субстанции ФБЗ в дозах 5 и 1 мг/кг по
ДВ – составили соответственно 95.58 и 16.22%.
Таблица 4.
Эффективность супрамолекулярного фенбендазола (СФБЗ) при желудочно-кишечных стронгилятозах
овец
| Препарат | Доза по ДВ, мг/кг | Число овец в группе |
Число овец, освободившихся от инвазии | Среднее число яиц гельминтов в 1 г фекалий |
Снижение числа яиц гельминтов в фекалиях, % |
|
|---|---|---|---|---|---|---|
| до лечения | после лечения | |||||
| Нематодироз | ||||||
| СФБЗ | 3.0 | 10 | 10 | 174.5 ± 7.1 | 0 | 100* |
| » | 2.0 | 10 | 8 | 178.6 ± 6.8 | 3.2 | 98.21* |
| » | 1.0 | 10 | 6 | 180.2 ± 7.2 | 7.8 ± 1.2 | 95.64* |
| ФБЗ | 1.0 | 10 | 0 | 177.0 ± 6.9 | 149.8 ± 5.7 | 16.22 |
| » | 5.0 | 10 | 5 | 171.6 ± 6,8 | 7.9 ± 1.2 | 95.58* |
| Контроль | – | 10 | 0 | 173.7 ± 6.9 | 178.8 ± 7.7 | – |
| Другие стронгилятозы пищеварительного тракта | ||||||
| СФБЗ | 3.0 | 10 | 10 | 193.4 ± 7.2 | 0 | 100* |
| » | 2.0 | 9 | 7 | 191.6 ± 6.9 | 4.1 ± 1.0 | 97.94* |
| » | 1.0 | 9 | 4 | 198.2 ± 7.0 | 9.0 ± 1.2 | 95.47* |
| ФБЗ | 1.0 | 9 | 0 | 189.6 ± 7.1 | 158.4 ± 5.6 | 20.25 |
| » | 5.0 | 9 | 5 | 195.3 ± 7.2 | 8.6 ± 1.4 | 95.67* |
| Контроль | – | 9 | 0 | 192.6 ± 7.3 | 198.6 ± 7.4 | – |
СФБЗ показал 100, 97.94 и 95.47%-ную эффективность против других желудочно-кишечных
стронгилят овец в дозах соответственно 3.0, 2.0 и 1.0 мг/кг по ДВ. Субстанция ФБЗ
в дозах 5 и 1 мг/кг по ДВ проявила 95.67 и 20.25%-ную антигельминтную активность при
обнаружении в 1 г фекалий овец контрольной группы 192.6 ± 7.3 и 198.6 ± 7.4 экз. до
и в конце опыта. Следовательно, эффективность введения СФБЗ была в 4.7–5.8 раза выше
эффективности введения субстанции ФБЗ.
Повышение антигельминтной эффективности комплекса, по нашему мнению, обусловлено ролью
механохимической технологии и применением для адресной доставки НДОСС и ЭС, что позволило
увеличить растворимость препарата в воде. Значительное повышение биологической активности
СФБЗ связано также с повышением биодоступности и изменением метаболизма ФБЗ в форме
супрамолекулярного комплекса.
Таким образом, проведенные исследования подтвердили повышение биологической активности
СФБЗ, полученного по механохимической технологии с добавлением ЭС и НДОСС в опытах
на лабораторной модели трихинеллеза белых мышей и на овцах, спонтанно инвазированных
стронгилятами пищеварительного тракта в дозе, которая была в 2.5 раза меньше дозы
базового препарата ФБЗ, рекомендованной согласно инструкции. Увеличение антигельминтного
действия, по нашему мнению, связано с уменьшением размеров частиц ФБЗ, потерей его
кристалличности и аморфизации, включением его молекул на поверхность и в поры ЭС и
НДОСС и, как следствие, повышением растворимости и проницаемости через биологические
мембраны.
Авторы выражают благодарность А.Н. Озерину (ИСПМ РАН) за помощь при изучении дифрактограмм
образцов СМКФ и их анализа, а также К.М. Садову и специалистам овцеводческих хозяйств
за помощь в проведении полевых опытов.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования
РФ.
Список литературы
-
Архипов И.А. Антигельминтики: фармакология и применение. М.: РАСХН, 2009. 406 с.
-
Архипов И.А., Варламова А.И., Одоевская И.М. Методические рекомендации по испытанию и оценке эффективности препаратов при трихинеллезе
и гименолепидозе на лабораторной модели // Рос. паразитол. журн. 2019. № 13. С. 58–63. -
Астафьев Б.А., Яроцкий Л.С., Лебедева М.Н. Экспериментальные модели паразитозов в биологии и медицине. М.: Наука, 1989. 278
с. -
Варламова А.И. Спектр антигельминтной активности супрамолекулярного комплекса фенбендазола с арабиногалактаном
// Рос. паразитол. журн. 2017. № 1. С. 78–83. -
Варламова А.И., Архипов И.А., Халиков С.С., Садов К.М. Эффективность фенбендазола на основе наноразмерной супрамолекулярной системы доставки
с поливинилпирролидоном и диоктилсульфосукцинатом натрия при гельминтозах // Рос.
паразитол. журн. 2019. № 1. С. 56–63. -
ГОСТ 32834-2014. Продукты пищевые, продовольственное сырье. Метод определения остаточного
содержания антгельминтиков с помощью высокоэффективной жидкостной хроматографии с
масс-спектрометрическим детектором. Дата введения 01.01.2016. М.: Стандартинформ,
2015. 20 с. -
Душкин А.В., Сунцова Л.П., Халиков С.С. Механохимическая технология для повышения растворимости лекарственных веществ //
Фармацевт. исследования. 2013. № 1. С. 448–457. -
Кочетков П.П., Варламова А.И., Абрамов В.Е., Мисюра И.А., Абрамова Е.В., Абрамов С.В.,
Кошеваров Н.И., Архипов И.А. Определение фенбендазола и его метаболитов в молоке коров методом жидкостной хроматографии
с масс-спектрометрическим детектированием // Рос. паразитол. журн. 2016. № 4. С. 554–562. -
Могилевская Е.Л., Акопова Т.А., Зеленецкий А.Н., Озерин А.Н. О кристаллической структуре хитина и хитозана // Высокомолек. соединения. 2006. №2.
С. 216–226. -
Радионов А.В., Архипов И.А. Распространение нематодозов крупного рогатого скота при разной технологии содержания
в России // Рос. паразитол. журн. 2010. № 4. С. 89–93. -
Сафиуллин Р.Т. Распространение и экономический ущерб от основных гельминтозов жвачных // Ветеринария.
1997. № 6. С. 28–32. -
Селютина О.Ю., Апанасенко И.Е., Поляков Н.Э. Исследование мембраномодифицирующей активности глицирризиновой кислоты // Изв. РАН.
Сер. хим. 2015. № 7. С. 1555–1559. -
Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических
субстанций. М.: Медицина, 2005. 832 с. -
Шамхалов В.М., Магомедов О.А., Шамхалов М.В., Гюльахмедова Н.Х., Бакриева Р.М. Распространение кишечных гельминтозов овец в Дагестане // Рос. паразитол. журн. 2015.
№ 2. С. 61–64. -
Alexander L.E. X-ray diffraction methods in polymer science. N.Y.: Intersci.-John Wiley, 1969. 119
p. -
Arkhipov I.A., Khalikov S.S., Sadov K.M., Dushkin A.V., Meteleva E.S., Varlamova A.I.,
Odoevskaya I.M., Danilevskaya N.V. Influence of mechanochemical technology on anthelmintic efficacy of the supramolecular
complex of fenbendazole with polyvinylpyrrolidone // J. Adv. Vet. Anim. Res. 2019.
V. 6(1). P. 133–141. -
Boldyrev V.V. Mechanochemical modification and synthesis of drugs // J. Mater. Sci. 2004. V. 39.
P. 5117–5120. -
Bushra M., Shahardar R.A., Allaie I.M., Wani Z.A. Efficacy of closantel, fenbendazole and ivermectin against GI helminths of cattle
in central Kashmir // J. Parasit. Dis. 2019, V. 43(2). P. 289–293. -
Campbell W.C., Rew R.S. Chemotherapy of parasitic diseases. New York; London: Plenum Press, 1986. 655 p.
-
Dushkin A.V., Tolstikova T.G., Khvostov M.V., Tolstikov G.A. Complexes of polysaccharides and glycyrrhizic acid with drug molecules. Mechanochemical
synthesis and pharmacological activity / Ed. Karunaratn D.N. // The complex world
of polysaccharides. Croatia: InTech, 2012. P. 573–602. -
Goossens E., Dorny P., Vercammen F., Vercruysse J. Field evaluation of the efficacy of fenbendazole in captive wild ruminants // Vet.
Rec. 2005. V. 157(19). P. 582–586. -
Graebin C.S. The pharmacological activities of glycyrrhizinic acid (“Glycyrrhizin”) and glycyrrhetinic
Acid / Eds Merillon J.M., Ramawat K. Sweeteners. Reference Series in Phytochemistry.
Cham.: Springer, 2016. -
Hetenyi G., Griesser J., Moser M., Demarne F., Jannin V., Bernkop-Schnurch A. Comparison of the protective effect of self-emulsifying peptide drug delivery systems
towards intestinal proteases and glutathione // Inter. J. Pharm. 2017. V. 523 (1).
P. 357–365. -
Khalikov S.S., Lokshin B.V., Ilyin M.M., Varlamova A.I., Musaev M.B., Arkhipov I.A. Methods for obtaining solid dispersions of drugs and their properties // Russ. Chem.
Bull. 2019. V. 68. P. 1924–1932. -
Kong R., Zhu X., Meteleva E.S., Chistyachenko Y.S., Suntsova L.P., Polyakov N.E.,
Khvostov M.V., Baev D.S., Tolstikova T.G., Yu J., Dushkin A.V., Su W. Enhanced solubility and bioavailability of simvastatin by mechanochemically obtained
complexes // Inter. J. Pharm. 2017. V. 534. P. 108–118. -
Krishnaian Y.S. Pharmaceutical technologies for enhancing oral bioavailability of poorly soluble
drugs // J. Bioequival. Bioavailab. 2010. V. 2(2). P. 28–36. -
Loftsson T., Vogensen S., Brewster M.E., Konraosdottir F. Effects of cyclodextrins on drug delivery through biological membranes // J. Pharm. Sci. 2007. V. 10. P. 2532–2546.
-
Marchessault R.H., Ravenelle F., Zhu X.X. Polysaccharides for drug delivery and pharmaceutical applications. Washington D.C.:
Am. Chem. Soc., 2006. 365 p. -
Ministry of Agriculture Fisheries and Food. Manual of veterinary parasitological laboratory
techniques. Reference Book 418. London: Her Majesty’s Stationery Office, 1986. 160
p. -
Riviere J.E., Papich M.G. Veterinary pharmacology & therapeutics. 9thed. Hoboken: Willey-Blackwell, 2009. 1541 p.
-
Ruland W. X-ray determination of crystallinity and diffuse disorder scattering // Acta Cryst.
1961. V. 14. P. 1180–1185. -
Selutina O.Yu., Polyakov N.E., Korneev D.V., Zaitsev B.N. Influence of glycyrrhizin on permeability and elasticity of cell membrane: perspectives
for drugs delivery // Drug Deliv. 2016. V. 23 (3). P. 848–855. -
Tramboo S.R., Shahardar R.A., Allaie I.M., Wani Z.A., Abbas M. Efficacy of ivermectin, closantel and fenbendazole against gastrointestinal nematodes
of sheep in Kashmir valley // J. Parasit. Dis. 2017. V. 41. P. 380. -
Vemula V.R., Lagishetty V., Lingala S. Solubility enhancement techniques // Inter. J. Pharm. Sci. Rev. Res. 2010. V. 5(1).
P. 41–51. -
Wagh V.T., Wagh R.D. Solid dispersion techniques for enhancement of solubilization and biovailability
of poorly water soluble drugs – a review // Inter. J. Pharm. Technol. 2015. V. 6 (4).
P. 3027–3045. -
Wood I.B., Amaral N.K., Bairden K., Dunkan J.L., Kassai T., Malone J.B., Pancavich J.A., Reinecke R.K., Slocombe O., Taylor S.M., Vercruysse J. World Association for the Advancement of Veterinary Parasitology (WAAVP) second edition
of guidelines for evaluating the effectiveness of anthelmintics in ruminants (bovine,
ovine, caprine) // Vet. Parasitol. 1995. V. 58. P. 181–213. -
Yanghuan Ye., Zhang X., Zhang T., Wang H., Wu B. Design and evaluation of injectable niclosamide nanocrystals prepared by wet media
milling technique // J. Drug Dev. Ind. Pharm. 2015. V. 41 (9). P. 1416–1424. -
Zhang Y., Huo M., Zhou J., Xie S. PK Solver: An add-in program for pharmacokinetic and pharmacodynamic data analysis
in Microsoft Excel // Comp. Meth. Programs Biomed. 2010. V. 99(3). P. 306–314.
Дополнительные материалы отсутствуют.