-
E-Pard — покупки за рубежом
- —
-
Каталог товаров eBay.de
- —
- Красота и здоровье
- —
- Природные и альтернативные средства правовой защиты
- —
- Средства самопомощи-Средства массовой информации
- —
- Energy Pak Neu Magnetfolie mit Wärmespeicher Bio-aktiv bei Schmer…
Этот товар недоступен — товар распродан
Категория товара Средства самопомощи-Средства массовой информации
ID товара 153213690248
Продавец fruzel_frunkel, 100.0 %
Цена 4.00 EUR ~ 357.40 руб.
- Описание
-
Основные состояние: новый, продажа: фиксированная цена
Товар из страны DE, Landshut
Окончание продажи 02.02.2019 16:50:56
-
- Доставка
-
Доставка в страны
Россия, Украина, Белоруссия, Казахстан, Грузия, Молдова, Армения и др.Доставка до адреса со склада E-Pard. Стоимость доставки из Германии рассчитывается после проверки заказа.
-
- Оплата
-
Способы
Банковская карта, PayPal, Электронные деньги, переводКомиссия
От 0% до 5% от стоимости заказа
-
Характеристики Energy Pak Neu Magnetfolie mit Wärmespeicher Bio-aktiv bei Schmerzen Wärmepads
Купить Energy Pak Neu Magnetfolie mit Wärmespeicher Bio-aktiv bei Schmerzen Wärmepads из категории Средства самопомощи-Средства массовой информации в разделе Природные и альтернативные средства правовой защиты из каталога Красота и здоровье с доставкой в Россию, Казахстан, Беларусь, Украину, Молдову, Армению, Азербайджан, Грузию и другие страны на уникальных условиях сервиса E-Pard: гарантия доставки, страхование посылки, единый тариф, никаких скрытых расходов. Сравните цены в европейских магазинах и выберите лучший вариант. Сэкономьте деньги — купите нужный товар у иностранного продавца, сделайте это с доставкой в любой город и населённый пункт.
Описание Energy Pak Neu Magnetfolie mit Wärmespeicher Bio-aktiv bei Schmerzen Wärmepads
Disclaimer: Все торговые марки, зарегистрированные товарные знаки, названия продуктов, названия компаний или их логотипы указаны только для идентификационных целей и являются собственностью их соответствующих владельцев. Информационные материалы используются на основе партнёрских соглашений и из верифицированных источников. Если вы считаете, что ваши права нарушаются — свяжитесь с нами.
Витамины – низкомолекулярные органические соединения различной химической природы, необходимые для осуществления жизненно важных биохимических и физиологических процессов в живых организмах.
Организм человека и животных не синтезирует витамины или синтезирует в недостаточном количестве, поэтому он должен получать их в готовом виде с пищей.
Кроме витаминов, в рационе человека в малых дозах должны присутствовать другие незаменимые вещества — макро- и микроэлементы. Они участвуют во многих жизненно важных обменных реакциях, некоторые из них необходимы для обеспечения должного уровня активности соответствующих витаминов.
Усталость, упадок сил, слабость, нервное перенапряжение — часто это следствие неудовлетворения текущих потребностей организма в энергии. Вредное воздействие окружающей среды, недостаток полезных компонентов в пище, интенсивный уровень жизни, постоянные стрессы способствуют дефициту необходимых организму витаминов, а также минеральных элементов.
Прием пероральных контрацептивов также нарушает статус многих микроэлементов в организме: фолиевой кислоты, витаминов группы В, витамина С, цинка, магния.
Недостаток микроэлементов в питании может нарушить способность к запоминанию и мыслительной деятельности, способствовать развитию депрессии. Дефицит витаминов группы В (особенно тиамина В1, ниацина В3, фолиевой кислоты и витамина В12) может нарушить ментальные функции, ухудшить память, снизить концентрацию внимания.
Витаминно-минеральный комплекс Витрум Энерджи содержит 13 витаминов и 8 минералов, а также коэнзим Q10 — необходимые компоненты, которые работают для поддержания энергии и тонуса.
На работоспособность и энергичность ключевое влияние оказывают витамины группы В: витамины В1, В2, В3, В5 регулируют функциональное состояние ЦНС, обмен веществ и трофику тканей, поэтому их применяют для повышения общей реактивности организма.
Витамины группы В и железо участвуют в формировании гемоглобина, улучшают циркуляцию крови, осуществляют транспорт питательных веществ, ускоряют процессы регенерации, усиливают сопротивляемость организма к различным стрессовым ситуациям, участвуют в синтезе нейротрансмиттеров.
Магний контролирует баланс внутриклеточного калия, регулирует функции сердечно-сосудистой и нервной систем, участвует в энергетических процессах организма, устраняет судороги в мышцах, помогает снять стресс, способствует восстановлению сил после физических нагрузок.
Витамин С — антиоксидант, участвует в сопротивляемости организма к различным стрессовым ситуациям, способствует синтезу коллагена, поддержанию нормального тонуса, укреплению сосудистой стенки.
Витамин D ответственен за поддержание функций скелета, регулирует обмен кальция, тонус нервной системы, нормальное соотношение сна и бодрствования, способствует поддержанию нормального тонуса мышц и сердечно-сосудистой системы.
Йод способствует поддержанию физических и умственных функций организма, при его дефиците наблюдается снижение иммунитета.
Коэнзим Q10 (убихинон) является витаминоподобным веществом, которое улучшает выработку энергии в клетках, оказывает благоприятное воздействие на сердечно-сосудистую систему, способствует повышению работоспособности, физической выносливости, а также обладает антиоксидантным эффектом. Расход убихинона прогрессивно возрастает при физических и эмоциональных нагрузках, при частых простудных заболеваниях и при хроническом стрессе, обусловливая высокую вероятность развития его дефицита.
Описание препарата Оземпик® (раствор для подкожного введения, 1.34 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2021 году
Дата согласования: 04.08.2021
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Фотографии упаковок

04.08.2021
04.08.2021
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для подкожного введения | 1 мл |
| действующее вещество: | |
| семаглутид | 1,34 мг |
| вспомогательные вещества: динатрия гидрофосфат дигидрат; пропиленгликоль; фенол; хлористоводородная кислота (для коррекции pH); натрия гидроксид (для коррекции pH); вода для инъекций | |
| для шприц-ручки Оземпик® 0,25 или 0,5 мг/доза: в 1 предварительно заполненной шприц-ручке объемом 1,5 мл содержится 2 мг семаглутида | |
| для шприц-ручки Оземпик® 1 мг/доза: в 1 предварительно заполненной шприц-ручке объемом 3 мл содержится 4 мг семаглутида |
Описание лекарственной формы
Прозрачный бесцветный или почти бесцветный раствор.
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
Семаглутид является агонистом рецепторов ГПП-1 (ГПП-1Р), произведенным методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae с последующей очисткой.
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который селективно связывается и активирует ГПП-1Р. ГПП-1Р служит мишенью для нативного ГПП-1.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на ССС. Влияние на концентрацию глюкозы и аппетит специфически опосредовано ГПП-1Р, расположенными в поджелудочной железе и головном мозге. Фармакологические концентрации семаглутида снижают концентрацию глюкозы крови и массу тела посредством сочетания эффектов, описанных ниже. ГПП-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек, где их активация может оказывать сердечно-сосудистые (СС) и микроциркуляторные эффекты.
В отличие от нативного ГПП-1, продленный T1/2 семаглутида (около 1 нед) позволяет применять его п/к 1 раз в неделю. Связывание с альбумином является основным механизмом длительного действия семаглутида, что приводит к снижению выведения его почками и защищает от метаболического распада. Кроме того, семаглутид стабилен в отношении расщепления ферментом ДПП-4. Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляций секреции инсулина и подавления секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не снижает секрецию глюкагона.
Семаглутид снижает общую массу тела и массу жировой ткани, уменьшая потребление энергии. Данный механизм затрагивает общее снижение аппетита, включая усиление сигналов насыщения и ослабление сигналов голода, а также улучшение контроля потребления пищи и снижение тяги к пище. Снижается также инсулинорезистентность, возможно, за счет уменьшения массы тела. Помимо этого, семаглутид снижает предпочтение к приему пищи с высоким содержанием жиров. В исследованиях на животных было показано, что семаглутид поглощается специфическими областями головного мозга и усиливает ключевые сигналы насыщения и ослабляет ключевые сигналы голода. Воздействуя на изолированные участки тканей головного мозга семаглутид активирует нейроны, связанные с чувством сытости, и подавляет нейроны, связанные с чувством голода.
В клинических исследованиях (КИ) семаглутид оказывал положительное влияние на липиды плазмы крови, снижал сАД и уменьшал воспаление.
В исследованиях на животных семаглутид подавляет развитие атеросклероза, предупреждая дальнейшее развитие аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамические исследования
Все фармакодинамические исследования были проведены после 12 нед терапии (включая период увеличения дозы) при Css семаглутида в дозе 1 мг 1 раз в неделю.
Уровень гликемии натощак и постпрандиальный уровень гликемии
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. По сравнению с плацебо, терапия семаглутидом (1 мг) у пациентов с сахарным диабетом типа 2 (СД2) привела к снижению концентрации глюкозы с точки зрения абсолютного изменения от исходного значения (ммоль/л) и относительного снижения по сравнению с плацебо (%) в отношении концентрации глюкозы натощак (1,6 ммоль/л; 22%), концентрации глюкозы через 2 ч после приема пищи (4,1 ммоль/л; 37%), средней суточной концентрации глюкозы (1,7 ммоль/л; 22%) и постпрандиальных пиков концентрации глюкозы за 3 приема пищи (0,6–1,1 ммоль/л). Семаглутид снижал концентрацию глюкозы натощак после введения первой дозы.
Функция бета-клеток поджелудочной железы и секреция инсулина
Семаглутид улучшает функцию бета-клеток поджелудочной железы. После в/в струйного введения глюкозы пациентам с СД2 семаглутид по сравнению с плацебо улучшал первую и вторую фазу инсулинового ответа с трехкратным и двукратным повышением, соответственно, и увеличивал максимальную секреторную активность бета-клеток поджелудочной железы после теста стимуляции аргинином. Кроме того, по сравнению с плацебо, терапия семаглутидом увеличивает концентрации инсулина натощак.
Секреция глюкагона
Семаглутид снижает концентрацию глюкагона натощак и постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к относительному снижению концентрации глюкагона по сравнению с плацебо: концентрации глюкагона натощак (8–21%), постпрандиального глюкагонового ответа (14–15%) и средней суточной концентрации глюкагона (12%).
Глюкозозависимая секреция инсулина и глюкозозависимая секреция глюкагона
Семаглутид снижал высокую концентрацию глюкозы в крови, стимулируя секрецию инсулина и снижая секрецию глюкагона глюкозозависимым способом. Скорость секреции инсулина после введения семаглутида пациентам с СД2 была сопоставима с таковой у здоровых добровольцев.
Во время индуцированной гипогликемии семаглутид по сравнению с плацебо не изменял контррегуляторный ответ повышения концентрации глюкагона, а также не усугублял снижение концентрации С-пептида у пациентов с СД2.
Опорожнение желудка
Семаглутид вызывал небольшую задержку раннего постпрандиального опорожнения желудка, тем самым снижая скорость поступления постапрандиальной глюкозы в кровь.
Масса тела и состав тела
Наблюдалось большее снижение массы тела при применении семаглутида по сравнению с изученными препаратами сравнения (плацебо, ситаглиптин, эксенатид замедленного высвобождения (ЗВ), дулаглутид и инсулин гларгин) (см. Клиническая эффективность и безопасность). Потеря массы тела при применении семаглутида происходила преимущественно за счет потери жировой ткани, превышающей потерю мышечной массы в 3 раза.
Аппетит, потребление калорий и выбор продуктов питания
По сравнению с плацебо семаглутид снизил потребление калорий на 18–35% во время трех последовательных приемов пищи ad libitum. Этому способствовали стимулированные семаглутидом подавление аппетита как натощак, так и после приема пищи, улучшенный контроль потребления пищи, ослабление тяги к еде, особенно с высоким содержанием жиров.
Липиды натощак и постпрандиальные липиды
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и Хс-ЛПОНП натощак на 12 и 21%, соответственно. Постпрандиальное увеличение концентрации триглицеридов и Хс-ЛПОНП в ответ на прием пищи с высоким содержанием жиров снизилось более чем на 40%.
Электрофизиология сердца (ЭФс)
Действие семаглутида на процесс реполяризации в сердце было протестировано в исследовании ЭФс. Применение семаглутида в дозах, превышающих терапевтические (при Css до 1,5 мг), не приводило к удлинению скорректированного интервала QT.
Клиническая эффективность и безопасность
Как улучшение гликемического контроля, так и снижение СС-заболеваемости и смертности являются неотъемлемой частью лечения СД2.
Эффективность и безопасность препарата Оземпик® в дозах 0,5 и 1 мг оценивались в 6 рандомизированных контролируемых КИ 3а фазы. Из них 5 КИ в качестве основной цели оценивали эффективность гликемического контроля, в то время как 1 КИ оценивало в качество основной цели СС-исход. В дополнение были проведены 2 КИ препарата Оземпик® 3-й фазы с участием японских пациентов.
Терапия препаратом Оземпик® продемонстрировала устойчивые, статистически превосходящие и клинически значимые улучшения показателя HbA1c и снижение массы тела на срок до 2 лет по сравнению с плацебо и лечением с активным контролем (ситаглиптин, инсулин гларгин, эксенатид ЗВ и дулаглутид).
Возраст, пол, раса, этническая принадлежность, исходные значения ИМТ и массы тела (кг), длительность сахарного диабета (СД) и почечная недостаточность не повлияли на эффективность препарата Оземпик®.
Монотерапия
Монотерапия препаратом Оземпик® в дозах 0,5 и 1 мг 1 раз в неделю в течение 30 нед по сравнению с плацебо привела к статистически более значимому снижению показателей HbA1c (−1,5; −1,6% против 0%, соответственно), глюкозы плазмы натощак (ГПН) (−2,5; −2,3 ммоль/л против −0,6 ммоль/л, соответственно) и массы тела (−3,7; −4,5 кг против −1 кг, соответственно).
Препарат Оземпик® по сравнению с ситаглиптином, оба в комбинации с 1–2 пероральными гипогликемическими препаратами (ПГГП) (метформин и/или препараты группы тиазолидиндиона).
Терапия препаратом Оземпик® в дозах 0,5 и 1 мг 1 раз в неделю в течение 56 нед по сравнению с ситаглиптином привела к устойчивому и статистически более значимому снижению показателей HbA1c (−1,3; −1,6% против −0,5%, соответственно), ГПН (−2,1; −2,6 ммоль/л против −1,1 ммоль/л, соответственно) и массы тела (−4,3; −6,1 кг против −1,9 кг, соответственно). Терапия препаратом Оземпик® в дозах 0,5 и 1 мг по сравнению с ситаглиптином значительно снижала сАД от исходного значения в 132,6 мм рт.ст. (−5,1; −5,6 мм рт.ст. против −2,3 мм рт.ст., соответственно). Изменений дАД не происходило.
Препарат Оземпик® по сравнению с дулаглутидом, оба в комбинации с метформином
Терапия препаратом Оземпик® в дозе 0,5 мг по сравнению с дулаглутидом в дозе 0,75 мг, оба 1 раз в неделю на протяжении 40 нед, привела к устойчивому и статистически превосходящему снижению показателей HbA1c(−1,5 против −1,1%), ГПН (−2,2 против −1,9 ммоль/л) и массы тела (−4,6 против −2,3 кг), соответственно.
Терапия препаратом Оземпик® в дозе 1 мг по сравнению с дулаглутидом в дозе 1,5 мг оба 1 раз в неделю на протяжении 40 нед, привела к устойчивому и статистически превосходящему снижению показателей HbA1c(−1,8 против −1,4%), ГПН (−2,8 против −2,2 ммоль/л) и массы тела (−6,5 против −3,0 кг), соответственно.
Препарат Оземпик® по сравнению с эксенатидом ЗВ, оба в комбинации с метформином или метформином совместно с производным сульфонилмочевины
Терапия препаратом Оземпик® в дозе 1 мг 1 раз в неделю на протяжении 56 нед по сравнению с эксенатидом ЗВ в дозе 2,0 мг привела к устойчивому и статистически более значимому снижению показателей HbA1c(−l,5 против −0,9%), ГПН (−2,8 против −2,0 ммоль/л) и массы тела (−5,6 против −1,9 кг), соответственно.
Препарат Оземпик® по сравнению с инсулином гларгин, оба в комбинации с 1–2 ПГГП (монотерапия метформином или метформин с производным сульфонилмочевины)
Терапия препаратом Оземпик® в дозах 0,5 и 1 мг 1 раз в неделю по сравнению с инсулином гларгин в течение 30 нед привела к статистически более значимому снижению показателей HbA1c(−l,2; −1,6% против −0,8%, соответственно) и массы тела (−3,5; −5,2 кг против 1,2 кг, соответственно).
Снижение показателя ГПН было статистически более значимым для препарата Оземпик® 1 мг по сравнению с инсулином гларгин (−2,7 против −2,1 ммоль/л). Не наблюдалось статистически более значимое снижение показателя ГПН для препарата Оземпик® 0,5 мг (−2,0 против −2,1 ммоль/л).
Доля пациентов, у которых наблюдались тяжелые или подтвержденные (<3,1 ммоль/л) эпизоды гипогликемии, была ниже при применении препарата Оземпик® в дозе 0,5 мг (4,4%) и Оземпик® в дозе 1 мг (5,6%) по сравнению с инсулином гларгин (10,6%).
Больше пациентов достигли показателя HbA1c <7% без тяжелых или подтвержденных эпизодов гипогликемии и без набора веса при применении препарата Оземпик® в дозе 0,5 мг (47%) и Оземпик® в дозе 1 мг (64%) по сравнению с инсулином гларгин (16%).
Препарат Оземпик® по сравнению с плацебо, оба в комбинации с базальным инсулином
Терапия препаратом Оземпик® в дозах 0,5 и 1 мг по сравнению с плацебо в течение 30 нед привела к статистически более значимому снижению показателей HbA1c(−l,4; −1,8% против −0,1%, соответственно), ГПН (−1,6; −2,4 ммоль/л против −0,5 ммоль/л, соответственно) и массы тела (−3,7; −6,4 кг против −1,4 кг, соответственно). Частота тяжелых или подтвержденных эпизодов гипогликемии существенно не различалась при применении препарата Оземпик® и плацебо. Доля пациентов с показателем HbA1c ≤8% на скрининге, сообщивших о тяжелых или подтвержденных (<3,1 ммоль/л) эпизодах гипогликемии, была выше при применении препарата Оземпик® по сравнению с плацебо и сопоставима у пациентов с показателем HbA1c>8% на скрининге.
Комбинация с монотерапией производным сульфонилмочевины
На 30-й нед КИ (см. «Оценка влияния на ССС») была произведена оценка подгруппы из 123 пациентов, находящихся на монотерапии производным сульфонилмочевины. На 30-й нед показатель НЬА1с снизился на 1,6 и 1,5% при применении препарата Оземпик® в дозах 0,5 и 1 мг, соответственно, и увеличился на 0,1% при применении плацебо.
Комбинация с предварительно смешанным инсулином ±1–2 ПГГП
На 30-й нед КИ (см. подраздел «Оценка влияния на ССС») была произведена оценка подгруппы из 867 пациентов, находящихся на терапии предварительно смешанным инсулином (в комбинации или без 2 ПГГП). На 30-й нед показатель HbА1c снизился на 1,3 и 1,8% при применении препарата Оземпик® в дозах 0,5 и 1 мг, соответственно, и снизился на 0,4% при применении плацебо.
Соотношение пациентов, достигших целевого снижения показателя HbА1c
До 79% пациентов достигли целей лечения в отношении снижения показателя HbA1c<7%, и доля таких пациентов была значительно больше при применении препарата Оземпик® по сравнению с пациентами, получавшими ситаглиптин, эксенатид ЗВ, инсулин гларгин, дулаглутид и плацебо.
Доля пациентов, достигших показателя HbA1c менее 7% без тяжелых или подтвержденных эпизодов гипогликемии и без набора веса, была значительно больше при применении препарата Оземпик® в дозах 0,5 и 1 мг (до 66 и 74% соответственно) по сравнению с пациентами, получавшими ситаглиптин (27%), эксенатид ЗВ (29%), инсулин гларгин (16%), дулаглутид 0,75 мг (44%) и дулаглутид 1,5 мг (58%).
Масса тела
Монотерапия препаратом Оземпик® 1 мг или терапия в комбинации с 1–2 лекарственными препаратами приводила к статистически большему снижению массы тела (потеря составляла до 6,5 кг) по сравнению с терапией плацебо, ситаглиптином, эксенатидом ЗВ, инсулином гларгин или дулаглутидом. Снижение массы тела было устойчивым на срок до 2 лет.
После одного года терапии потери массы ≥5 и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® в дозах 0,5 мг (46 и 13%) и 1 мг (до 62 и 24%), по сравнению с пациентами, находившимися на терапии активными препаратами сравнения ситаглиптином и эксенатидом ЗВ (до 18 и до 4%).
В КИ длительностью 40 нед потери массы ≥5 и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® в дозе 0,5 мг (44 и 14%), по сравнению с пациентами, получавшими дулаглутид в дозе 0,75 мг (23 и 3%). Потери массы ≥5 и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 1 мг (до 63 и 27%), по сравнению с пациентами, получавшими дулаглутид 1,5 мг (30 и 8%).
В СС КИ потери массы тела ≥5 и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® в дозах 0,5 мг (36 и 13%) и 1 мг (47 и 20%) по сравнению с пациентами, подучавшими плацебо 0,5 мг (18 и 6%) и 1 мг (19 и 7%).
ГПН и постпрандиальное увеличение концентрации глюкозы
Во время всех 3 ежедневных приемов пищи препарат Оземпик® 0,5 и 1 мг показал значительное снижение концентрации ГПН до 2,8 ммоль/л и снижение постпрандиального прироста концентрации глюкозы до 1,2 ммоль/л (разница между значениями до и после еды, полученная после 3 приемов пищи) (в дополнение см. «Фармакодинамические исследования»).
Функция бета-клеток поджелудочной железы и инсулинорезистентность
В ходе терапии препаратом Оземпик® 0,5 и 1 мг произошло улучшение функции бета-клеток поджелудочной железы и уменьшение инсулинорезистентности, что подтверждается оценкой гомеостатических моделей функции бета-клеток поджелудочной железы (НОМА-В) и инсулинорезистентности (HOMA-IR) (в дополнение см. «Фармакодинамические исследования»).
Липиды
Во время КИ препарата Оземпик® наблюдалось улучшение профиля липидов крови натощак, преимущественно в группе, получавшей дозу 1 мг (в дополнение см. «Фармакодинамические исследования»).
Оценка влияния на ССС
3297 пациентов с СД2 и высоким СС-риском были рандомизированы в двойное слепое КИ длительностью 104 нед на получение препарата Оземпик® 0,5 или 1 мг 1 раз в неделю либо плацебо 0,5 или 1 мг в дополнение к стандартной терапии СС-заболеваний в течение последующих 2 лет.
Терапия препаратом Оземпик® привела к снижению на 26% риска первичного комбинированного исхода, включающего смерть по причине СС-патологии, инфаркт миокарда (ИМ) без смертельного исхода и инсульт без смертельного исхода. В первую очередь это было обусловлено значительным уменьшением частоты инсульта без смертельного исхода (39%) и незначительным уменьшением частоты ИМ без смертельного исхода (26%), но без изменений в частоте смерти по причине СС-патологии.
Значительно снизился риск реваскуляризации миокарда или периферических артерий, в то время как риск развития нестабильной стенокардии, требующей госпитализации, и риск госпитализации по причине сердечной недостаточности снизились незначительно. Микроциркуляторные исходы включали в себя 158 новых или ухудшившихся случаев нефропатии. ОР в отношении времени до возникновения нефропатии (новые случаи развития персистирующей макроальбуминурии, персистирующее удвоение сывороточной концентрации креатинина, необходимость в постоянной заместительной почечной терапии и смерть по причине болезни почек) составил 0,64.
В дополнение к стандартной терапии СС-заболеваний терапия препаратом Оземпик® в дозах 0,5 и 1 мг по сравнению с плацебо 0,5 и 1 мг в течение 104 нед привела к значительному и устойчивому снижению от исходных значений показателя НЬА1c(−1,1 и −1,4% против −0,4 и −0,4%, соответственно).
АД
Наблюдалось значительное снижение среднего сАД при применении препарата Оземпик® в дозе 0,5 мг (3,5–5,1 мм рт.ст.) и Оземпик® в дозе 1 мг (5,4–7,3 мм рт.ст.) в комбинации с ПГГП или базальным инсулином. Не отмечалось значительной разницы по показателям дАД между препаратом Оземпик® и препаратами сравнения.
Фармакокинетика
Препарат подходит для введения 1 раз в неделю, т.к. T1/2 семаглутида равен приблизительно 1 нед.
Абсорбция. Время достижения Cmax в плазме составило от 1 до 3 дней после введения дозы препарата.
Равновесная концентрация препарата (AUCt/24) достигалась спустя 4–5 нед однократного еженедельного применения препарата. После п/к введения семаглутида в дозах 0,5 и 1 мг средние показатели его Css у пациентов с СД2 составили около 16 и 30 нмоль/л соответственно. Экспозиция для доз семаглутида 0,5 и 1 мг увеличивается пропорционально введенной дозе. При п/к введении семаглутида в переднюю брюшную стенку, бедро или плечо достигается сходная экспозиция. Абсолютная биодоступность семаглутида после п/к введения составила 89%.
Распределение. Средний Vd семаглутида в тканях после п/к введения пациентам с СД2 составил приблизительно 12,5 л. Семаглутид в значительной степени связывался с альбумином плазмы крови (>99%).
Метаболизм. Семаглутид метаболизируется посредством протеолитического расщепления пептидной основы белка и последующего бета-окисления жирной кислоты боковой цепи.
Выведение. ЖКТ и почки являются основными путями выведения семаглутида и его метаболитов. 2/3 введенной дозы семаглутида выводится почками; 1/3 — через кишечник. Приблизительно 3% от введенной дозы выводится почками в виде неизмененного семаглутида. У пациентов с СД2 клиренс семаглутида составил около 0,05 л/ч. С элиминационным T1/2 примерно 1 нед семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 нед после введения последней дозы препарата.
Особые группы пациентов
Не требуется коррекции дозы семаглутида в зависимости от возраста, пола, расовой и этнической принадлежности, массы тела, наличия почечной или печеночной недостаточности.
Возраст. На основании данных, полученных в ходе КИ 3а фазы, включавших пациентов в возрасте от 20 до 86 лет, показано, что возраст не влиял на фармакокинетику семаглутида.
Пол. Пол не влиял на фармакокинетику семаглутида.
Раса. Расовая группа (белая, черная или афроамериканская, азиатская) не влияла на фармакокинетику семаглутида.
Этническая принадлежность. Этническая принадлежность (латиноамериканская) не влияла на фармакокинетику семаглутида.
Масса тела. Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Дозы семаглутида, равные 0,5 и 1 мг, обеспечивают достаточную экспозицию препарата в диапазоне массы тела от 40 до 198 кг.
Почечная недостаточность. Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику семаглутида. Это было показано у пациентов с различной степенью почечной недостаточности (легкой, средней, тяжелой или у пациентов, находящихся на диализе) по сравнению с пациентами с нормальной функцией почек в исследовании однократной дозы семаглутида равной 0,5 мг. Это также было показано на основании данных КИ 3а фазы для пациентов с СД2 и почечной недостаточностью, хотя опыт применения у пациентов с терминальной стадией заболевания почек был ограничен.
Печеночная недостаточность. Печеночная недостаточность не влияла на экспозицию семаглутида.
Фармакокинетические свойства семаглутида оценивались в ходе исследования однократной дозы семаглутида, равной 0,5 мг, у пациентов с различной степенью печеночной недостаточности (легкой, средней, тяжелой) и пациентов с нормальной функцией печени.
Дети и подростки. Исследований семаглутида у детей и подростков до 18 лет не проводили.
Показания
Препарат Оземпик® показан для применения у взрослых пациентов с сахарным диабетом типа 2 на фоне диеты и физических упражнений для улучшения гликемического контроля в качестве:
— монотерапии;
— комбинированной терапии с другими пероральными гипогликемическими препаратами (ПГГП) — метформином, метформином и производным сульфонилмочевины, метформином и/или тиазолидиндионом, у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии;
— комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом Оземпик® и метформином.
Препарат Оземпик® показан для снижения риска развития больших сердечно-сосудистых событий (включают смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода) у пациентов с сахарным диабетом типа 2 и высоким сердечно-сосудистым риском в качестве дополнения к стандартному лечению сердечно-сосудистых заболеваний (на основании анализа времени наступления первого большого сердечно-сосудистого события (см. «Фармакодинамические исследования», подраздел Оценка влияния на ССС).
Противопоказания
гиперчувствительность к семаглутиду или любому из вспомогательных веществ препарата;
медуллярный рак щитовидной железы в анамнезе, в том числе в семейном;
множественная эндокринная неоплазия (МЭН) 2 типа;
сахарный диабет типа 1 (СД1);
диабетический кетоацидоз.
Противопоказано применение препарата Оземпик® у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности или ограниченным опытом применения:
— беременность и период грудного вскармливания;
— возраст до 18 лет;
— печеночная недостаточность тяжелой степени;
— терминальная стадия почечной недостаточности (Cl креатинина <15 мл/мин);
— хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация).
С осторожностью: препарат Оземпик® рекомендуется применять с осторожностью у пациентов с почечной недостаточностью и пациентов с наличием панкреатита в анамнезе (см. «Особые указания»).
Применение при беременности и кормлении грудью
Беременность. Исследования на животных продемонстрировали репродуктивную токсичность препарата (см. Доклинические данные по безопасности). Данные по применению семаглутида у беременных женщин ограничены.
Противопоказано применять семаглутид во время беременности. Женщинам с сохраненным репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом.
Если пациентка готовится к беременности либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Из-за длительного T1/2 терапию семаглутидом необходимо прекратить как минимум за 2 мес до планируемого наступления беременности (см. «Фармакокинетика»).
Период грудного вскармливания. У лактирующих крыс семаглутид проникал в молоко. Нельзя исключить риск для ребенка, находящегося на грудном вскармливании. Противопоказано применять семаглутид в период грудного вскармливания.
Способ применения и дозы
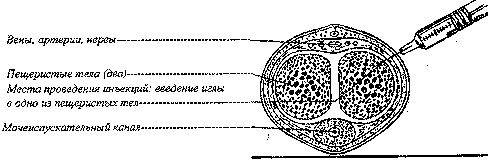
П/к, в живот, бедро или плечо, 1 раз в неделю в любое время, независимо от приема пищи. Место инъекции может изменяться без коррекции дозы. Препарат Оземпик® нельзя вводить в/в и в/м.
Дальнейшая информация по способу применения — Руководство по использованию.
При необходимости день еженедельного введения можно менять при условии, что интервал времени между двумя инъекциями составляет не менее 3 дней (>72 ч).
Дозы. Начальная доза препарата Оземпик® составляет 0,25 мг 1 раз в неделю. После 4 нед применения дозу следует увеличить до 0,5 мг 1 раз в неделю. Для дальнейшего улучшения гликемического контроля после как минимум 4 нед применения препарата в дозе 0,5 мг 1 раз в неделю дозу можно увеличить до 1 мг 1 раз в неделю. Доза препарата Оземпик® 0,25 мг не является терапевтической.
Препарат Оземпик® может применяться в виде монотерапии или в комбинации с одним или более гипогликемическими препаратами (см. Клиническая эффективность и безопасность).
При добавлении препарата Оземпик® к предшествующей терапии метформином и/или тиазолидиндионом терапию метформином и/или тиазолидиндионом можно продолжить в прежних дозах. При добавлении препарата Оземпик® к проводимой терапии производным сульфонилмочевины или инсулином следует предусмотреть снижение дозы производного сульфонилмочевины или инсулина с целью снижения риска возникновения гипогликемий (см. «Особые указания»).
Применение препарата Оземпик® не требует проведения самоконтроля концентрации глюкозы крови. Самостоятельный мониторинг концентрации глюкозы в крови необходим для коррекции дозы сульфонилмочевины и инсулина, особенно в начале лечения препаратом Оземпик® и при снижении дозы инсулина. Рекомендуется использовать поэтапный подход к снижению дозы инсулина.
Пропущенная доза. В случае пропуска дозы препарат Оземпик® следует ввести как можно быстрее в течение 5 дней с момента запланированного введения дозы. Если продолжительность пропуска составляет более 5 дней, пропущенную дозу не нужно вводить. Следующую дозу препарата Оземпик® следует ввести в обычный запланированный день. В каждом случае пациенты могут возобновить их обычный однократный еженедельный график введения.
Особые клинические группы пациентов
Пожилой возраст (≥65 лет). Не требуется коррекции дозы в зависимости от возраста. Опыт применения семаглутида у пациентов в возрасте 75 лет и старше ограничен.
Печеночная недостаточность. Не требуется коррекции дозы у пациентов с печеночной недостаточностью (см. «Фармакокинетика»).
Опыт применения семаглутида у пациентов с печеночной недостаточностью тяжелой степени ограничен; применение препарата Оземпик® у таких пациентов противопоказано.
Почечная недостаточность. Не требуется коррекции дозы у пациентов с почечной недостаточностью. Опыт применения препарата у пациентов с терминальной стадией почечной недостаточности отсутствует; применение препарата Оземпик® у таких пациентов противопоказано.
Дети и подростки. Применение препарата Оземпик® у детей и подростков в возрасте до 18 лет противопоказано в связи с отсутствием данных по безопасности и эффективности.
Руководство по использованию
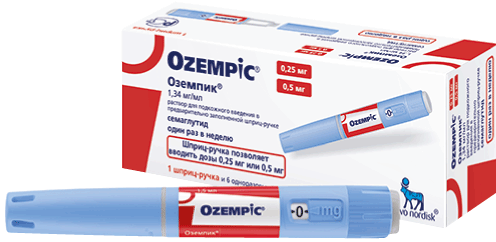
Предварительно заполненная шприц-ручка Оземпик® поставляется в двух видах:
— Оземпик® 0,25 или 0,5 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке позволяет вводить дозы 0,25 или 0,5 мг. Данная шприц-ручка предназначена для повышения дозы и поддержания терапевтической дозы 0,5 мг. 1 шприц-ручка содержит 1,5 мл раствора.
— Оземпик® 1 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке позволяет вводить дозу только 1 мг. Данная шприц-ручка предназначена только для поддержания терапевтической дозы 1 мг. 1 шприц-ручка содержит 3 мл раствора.
В упаковку препарата Оземпик® включены иглы НовоФайн® Плюс.
Пациенту следует рекомендовать выбрасывать инъекционную иглу после каждой инъекции в соответствии с местными требованиями.
Шприц-ручка Оземпик® предназначена только для индивидуального использования. Препарат Оземпик® нельзя применять, если он выглядит иначе, чем прозрачный бесцветный или почти бесцветный раствор.
Препарат Оземпик® нельзя применять, если он был заморожен.
Препарат Оземпик® можно вводить при помощи игл длиной до 8 мм. Шприц-ручка предназначена для использования с одноразовыми инъекционными иглами НовоФайн®. Всегда после каждой инъекции удаляйте иглу и храните шприц-ручку Оземпик® с отсоединенной иглой. Это поможет предотвратить закупорку игл, загрязнение, заражение, вытекание раствора и введение неправильной дозы препарата.
Инструкция для пациентов по применению препарата Оземпик® 0,25 или 0,5 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке
Следует внимательно прочитать данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Необходимо использовать шприц-ручку только после того, как пациент научится ею пользоваться под руководством врача или медсестры.
Начать следует с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0,25 или 0,5 мг/доза, затем посмотреть на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если пациент слабовидящий или у него имеются серьезные проблемы со зрением и он не может различить цифры на счетчике дозы, не следует использовать шприц-ручку без посторонней помощи. Помочь может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 2 мг семаглутида и позволяет выбрать дозы 0,25 или 0,5 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм. Иглы НовоФайн® Плюс включены в упаковку.
Важная информация
Следует обратить особое внимание на информацию, размещенную под этим заголовком, это очень важно для безопасного использования шприц-ручки.
Рисунок (внешний вид)
1. Подготовка шприц-ручки с новой иглой к использованию
— Проверить название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0,25 или 0,5 мг/доза. Это особенно важно, если пациент применяет более одного инъекционного препарата.
— Снять колпачок со шприц-ручки (рис. 1А).
Убедиться, что раствор в шприц-ручке прозрачный и бесцветный (рис. 1В). Посмотреть в окошко шприц-ручки. Если раствор мутный и не бесцветный, не использовать шприц-ручку.
Взять новую иглу и удалить защитную наклейку (рис. 1С). Если защитная наклейка повреждена, не использовать иглу, т.к. в этом случае стерильность не гарантируется.
Надеть иглу на шприц-ручку и повернуть ее, чтобы игла плотно держалась на шприц-ручке (рис. 1D).
Снять наружный колпачок иглы, но не выбрасывать его (рис. 1Е). Он понадобится после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
Снять и выбросить внутренний колпачок иглы (рис. 1F). Если пациент попытается надеть внутренний колпачок обратно на иглу, он может случайно уколоться иглой. На конце иглы может появиться капля раствора, это нормальное явление, однако все равно необходимо проверить поступление препарата, если пациент использует новую шприц-ручку в первый раз. Не присоединять новую иглу до тех пор, пока пациент не будет готов сделать инъекцию.
Важная информация
Всегда для каждой инъекции использовать новую иглу. Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Никогда не использовать иглу, если она погнута или повреждена.
2. Проверка поступления препарата
Перед первой инъекцией с помощью каждой новой шприц-ручки проверить поступление препарата. Если шприц-ручка уже находится в использовании, то перейти к операции 3. «Установка дозы».
Поворачивать селектор дозы, пока счетчик дозы не поравняется с символом проверки поступления препарата (vvw) (рис. 2А).
Держать шприц-ручку иглой вверх.
Нажать пусковую кнопку и удерживать ее в этом положении, пока счетчик дозы не возвратится к «0» (рис. 2B). «0» должен стоять напротив указателя дозы. На конце иглы должна появиться капля раствора.
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции. Если капля раствора на конце иглы не появилась, повторить операцию «2» «Проверка поступления препарата», но не более 6 раз. Если капля раствора так и не появилась, поменять иглу и повторить операцию «2» «Проверка поступления препарата» еще раз. Если капля раствора так и не появилась, утилизировать шприц-ручку и использовать новую.
Важная информация
Всегда перед использованием новой шприц-ручки в первый раз следует убедиться в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата. Если капля раствора не появилась, препарат не будет введен, даже если счетчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена. Если не будет проверено поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, пациент может не ввести необходимую дозу, и ожидаемый эффект препарата Оземпик® не будет достигнут.
3. Установка дозы
Поворачивать селектор дозы до тех пор, пока он не покажет необходимую дозу (0,25 или 0,5 мг) (рис. 3A).
Если доза была выбрана неправильно, пациент может поворачивать селектор дозы вперед или назад, пока не будет установлена правильная доза. Максимальная доза, которую можно установить, составляет 0,5 мг. Селектор дозы изменяет дозу. Только счетчик дозы и указатель дозы покажут количество мг препарата в выбранной пациентом дозе.
Пациент может выбрать до 0,5 мг препарата на дозу. Если в шприц-ручке содержится менее 0,5 мг, счетчик дозы остановится прежде, чем появится «0,5».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперед, назад или если набранная доза превышает количество мг препарата, оставшегося в шприц-ручке.
Не следует считать щелчки шприц-ручки.
Важная информация
Всегда перед каждой инъекцией проверять какое количество (мг) препарата пациент набрал по счетчику дозы и указателю дозы.
Не следует считать щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозы 0,25 или 0,5 мг. Выбранная доза должна находиться точно напротив указателя дозы — такое положение гарантирует, что пациент получит правильную дозу препарата.
Сколько препарата осталось. Чтобы определить, сколько препарата осталось, следует использовать счетчик дозы (рис. 3B): поворачивать селектор дозы до остановки счетчика дозы. Если он показывает «0,5», в шприц-ручке осталось не менее 0,5 мг препарата. Если счетчик дозы остановился до того, как появилось «0,5», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 0,5 мг.
Важная информация
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не использовать шприц-ручку. Использовать новую шприц-ручку Оземпик®.
4. Введение препарата
— Ввести иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. 4A).
— Убедиться, что счетчик дозы находится в поле зрения человека, проводящего инъекцию. Не дотрагиваться до счетчика дозы пальцами — это может прервать инъекцию.
— Нажать пусковую кнопку до упора и удерживать ее в этом положении, пока счетчик дозы не покажет «0» (рис. 4B). «0» должен находиться точно напротив указателя дозы. При этом пациент может услышать или ощутить щелчок.
— Удерживать иглу под кожей, после того, как счетчик дозы вернулся к «0» и медленно считать до 6 (рис. 4C). Если извлечь иглу из-под кожи раньше, пациент может увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
Извлечь иглу из-под кожи (рис. 4D). Если в месте инъекции появилась кровь, необходимо слегка прижать к месту укола ватный тампон. Не массировать место укола. После завершения инъекции пациент может увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которая введена.
Важная информация
Всегда следует сверяться с показаниями счетчика дозы, чтобы знать, какое количество препарата введено. Удерживать пусковую кнопку до тех пор, пока счетчик дозы не покажет «0».
Как выявить закупорку или повреждение иглы. Если после долгого нажатия на пусковую кнопку на счетчике дозы не появляется «0», это может означать закупорку или повреждение иглы. В этом случае пациент не получил препарат, даже если счетчик дозы изменил положение с исходной дозы, которая установлена.
Что делать с закупоренной иглой. Заменить иглу как описано в операции 5 «После завершения инъекции» и повторить все шаги, начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедиться, что установлена полная необходимая пациенту доза.
Никогда не следует дотрагиваться до счетчика дозы во время введения препарата. Это может прервать инъекцию.
5. После завершения инъекции
Положив наружный колпачок иглы на плоскую поверхность, ввести конец иглы внутрь колпачка, не касаясь его или иглы (рис. 5A).
Когда игла войдет в колпачок, осторожно надеть наружный колпачок на иглу (рис. 5B).
Отвинтить иглу и выбросить ее, соблюдая меры предосторожности.
После каждого использования надевать на шприц-ручку колпачок, чтобы защитить содержащийся в ней раствор от воздействия света (рис. 5C).
Всегда после каждой инъекции выбрасывать иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, пациент не введет себе препарат.
Выбрасывать пустую шприц-ручку с отсоединенной иглой необходимо в соответствии с рекомендациями, данными врачом, медсестрой, фармацевтом или местными требованиями.
Важная информация
Никогда не пытаться надеть внутренний колпачок обратно на иглу (можно уколоться).
После каждой инъекции всегда сразу удалять иглу со шприц-ручки. Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Дополнительная важная информация
Всегда хранить шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
Никогда не передавать свою шприц-ручку и иглы к ней другим лицам.
Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрестное инфицирование.
Уход за шприц-ручкой
Следует аккуратно обращаться со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы крови или дискомфорт в области живота (тошнота или рвота). Не оставлять шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур. Не применять препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы крови может стать слишком высокой или пациент может почувствовать дискомфорт в области живота, такой, как тошнота или рвота. Не применять препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы крови может стать слишком высокой. Предохранять шприц-ручку от попадания на нее пыли, загрязнений и жидкости. Не мыть шприц-ручку, не погружать ее в жидкость и не смазывать ее. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством. Нельзя ронять или ударять шприц-ручку о твердую поверхность. Если пациент уронил шприц-ручку или сомневается в ее исправности, необходимо присоединить новую иглу и проверить поступление препарата перед тем, как сделать инъекцию. Не пытайтесь повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить. Не следует пытаться самостоятельно починить шприц-ручку или разобрать ее на части.
Инструкция для пациентов по применению препарата Оземпик® 1 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке
Следует внимательно прочитать данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Необходимо использовать шприц-ручку только после того, как пациент научится ею пользоваться под руководством врача или медсестры.
Начать следует с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза, затем посмотреть на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если пациент слабовидящий или у него имеются серьезные проблемы со зрением, и он не может различить цифры на счетчике дозы, не использовать шприц-ручку без посторонней помощи. Помочь может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 4 мг семаглутида и позволяет выбрать только дозу 1 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм. Иглы НовоФайн® Плюс включены в упаковку.
Важная информация
Следует обратить особое внимание на информацию, размещенную под заголовком «Важная информация», это очень важно для безопасного использования шприц-ручки.
Рисунок (внешний вид)
1. Подготовка шприц-ручки с новой иглой к использованию
Проверить название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза. Это особенно важно, если пациент применяет более одного инъекционного препарата.
Снять колпачок со шприц-ручки (рис. 1А).
Убедиться, что раствор в шприц-ручке прозрачный и бесцветный (рис. 1В). Посмотреть в окошко шприц-ручки. Если раствор мутный и не бесцветный, не использовать шприц-ручку.
Взять новую иглу и удалить защитную наклейку (рис.1С). Если защитная наклейка повреждена, не использовать иглу, т.к. в этом случае стерильность не гарантируется.
Надеть иглу на шприц-ручку и повернуть ее, чтобы игла плотно держалась на шприц-ручке (рис. 1D).
Снять наружный колпачок иглы, но не выбрасывать его (рис. 1Е). Он понадобится после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
Снять и выбросить внутренний колпачок иглы (рис. 1F). Если пациент попытается надеть внутренний колпачок обратно на иглу, он может случайно уколоться иглой. На конце иглы может появиться капля раствора, это нормальное явление, однако все равно необходимо проверить поступление препарата, если пациент использует новую шприц-ручку в первый раз. Не присоединять новую иглу до тех пор, пока пациент не будет готов сделать инъекцию.
Важная информация.
Всегда для каждой инъекции использовать новую иглу. Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Никогда не использовать иглу, если она погнута или повреждена.
2. Проверка поступления препарата
Перед первой инъекцией с помощью каждой новой шприц-ручки проверить поступление препарата. Если шприц-ручка уже находится в использовании, то перейти к операции 3. «Установка дозы».
Поворачивать селектор дозы, пока счетчик дозы не поравняется с символом проверки поступления препарата (vvw) (рис. 2A).
Держать шприц-ручку иглой вверх.
Нажать пусковую кнопку и удерживать ее в этом положении, пока счетчик дозы не возвратится к «0» (рис. 2B). «0» должен стоять напротив указателя дозы. На конце иглы должна появиться капля раствора.
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции. Если капля раствора на конце иглы не появилась, повторить операцию «2» «Проверка поступления препарата», но не более 6 раз. Если капля раствора так и не появилась, поменять иглу и повторить операцию «2» «Проверка поступления препарата» еще раз. Если капля раствора так и не появилась, утилизировать шприц-ручку и использовать новую.
Важная информация
Всегда перед использованием новой шприц-ручки в первый раз следует убедиться в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введен, даже если счетчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если не будет проверено поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, пациент может не ввести необходимую дозу и ожидаемый эффект препарата Оземпик® не будет достигнут.
3. Установка дозы
Повернуть селектор дозы, чтобы выбрать дозу 1 мг (рис.3A).
Продолжать поворачивать селектор дозы до тех пор, пока он не покажет необходимую дозу (1 мг).
Только счетчик дозы и указатель дозы покажут, что был выбран 1 мг.
Пациент может выбрать только 1 мг препарата на дозу. Если в шприц-ручке содержится менее 1 мг, счетчик дозы остановится прежде, чем появится «1».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперед, назад или если набранная доза превышает количество мг препарата, оставшихся в шприц-ручке.
Не следует считать щелчки шприц-ручки.
Важная информация
Всегда перед каждой инъекцией проверять по счетчику и указателю дозы, что был набран 1 мг.
Не следует считать щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозу 1 мг. Доза 1 мг должна находиться точно напротив указателя дозы — такое положение гарантирует, что пациент получит правильную дозу препарата.
Сколько препарата осталось. Чтобы определить, сколько препарата осталось, следует использовать счетчик дозы (рис. 3B): поворачивать селектор дозы до остановки счетчика дозы. Если он показывает «1», в шприц-ручке осталось не менее 1 мг препарата. Если счетчик дозы остановился до того, как появилось «1», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 1 мг.
Важная информация
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не использовать шприц-ручку. Использовать новую шприц-ручку Оземпик®.
4. Введение препарата
Ввести иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. 4A).
Убедиться, что счетчик дозы находится в поле зрения человека, проводящего инъекцию. Не дотрагиваться до счетчика дозы пальцами — это может прервать инъекцию.
Нажать пусковую кнопку до упора и удерживать ее в этом положении, пока счетчик дозы не покажет «0» (рис. 4B). «0» должен находиться точно напротив указателя дозы. При этом пациент может услышать или ощутить щелчок.
Удерживать иглу под кожей, после того как счетчик дозы вернулся к «0», и медленно считать до 6 (рис. 4C). Если извлечь иглу из-под кожи раньше, пациент может увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
Извлечь иглу из-под кожи (рис. 4D). Если в месте инъекции появилась кровь, необходимо слегка прижать к месту укола ватный тампон. Не массировать место укола. После завершения инъекции пациент может увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которая введена.
Важная информация
Всегда необходимо сверяться с показаниями счетчика дозы, чтобы знать, какое количество препарата введено. Удерживать пусковую кнопку до тех пор, пока счетчик дозы не покажет «0».
Как выявить закупорку или повреждение иглы. Если после долгого нажатия на пусковую кнопку на счетчике дозы не появляется «0», это может означать закупорку или повреждение иглы. В этом случае пациент не получил препарат, даже если счетчик дозы изменил положение с исходной дозы, которая установлена.
Что делать с закупоренной иглой. Заменить иглу, как описано в операции 5 «После завершения инъекции», и повторить все шаги начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедиться, что установлена полная необходимая пациенту доза.
Никогда не следует дотрагиваться до счетчика дозы во время введения препарата. Это может прервать инъекцию.
5. После завершения инъекции
Положив наружный колпачок иглы на плоскую поверхность, ввести конец иглы внутрь колпачка, не касаясь его или иглы (рис. 5A).
Когда игла войдет в колпачок, осторожно надеть наружный колпачок на иглу (рис. 5B).
Отвинтить иглу и выбросить ее, соблюдая меры предосторожности.
После каждого использования надевать на шприц-ручку колпачок, чтобы защитить содержащийся в ней раствор от воздействия света (рис. 5C).
Всегда после каждой инъекции выбрасывать иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, пациент не введет себе препарат.
Выбрасывать пустую шприц-ручку с отсоединенной иглой необходимо в соответствии с рекомендациями, данными врачом, медсестрой, фармацевтом или местными требованиями.
Важная информация
Никогда не пытаться надеть внутренний колпачок обратно на иглу (можно уколоться).
После каждой инъекции всегда сразу удалять иглу со шприц-ручки. Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Дополнительная важная информация
Всегда хранить шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
Никогда не передавать свою шприц-ручку и иглы к ней другим лицам.
Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрестное инфицирование.
Уход за шприц-ручкой
Следует аккуратно обращаться со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы в крови или дискомфорт в области живота (тошнота или рвота). Не оставлять шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур. Не применять препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы в крови может стать слишком высокой или пациент может почувствовать дискомфорт в области живота (тошнота или рвота). Не применять препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы в крови может стать слишком высокой. Предохранять шприц-ручку от попадания на нее пыли, загрязнений и жидкости. Не мыть шприц-ручку, не погружать ее в жидкость и не смазывать ее. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством. Нельзя ронять или ударять шприц-ручку о твердую поверхность. Если пациент уронил шприц-ручку или сомневается в ее исправности, необходимо присоединить новую иглу и проверить поступление препарата перед тем, как сделать инъекцию. Не пытаться повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить. Не следует пытаться самостоятельно починить шприц-ручку или разобрать ее на части.
Побочные действия
Наиболее часто регистрируемыми нежелательными реакциями (HP) во время КИ являлись нарушения со стороны ЖКТ, включая тошноту, диарею и рвоту. В целом, данные реакции были легкой или средней степени тяжести и краткосрочными. HP распределены по системно-органным классам в соответствии с MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000); очень редко (<1/10000). В каждой группе частоты развития HP представлены по снижению степени серьезности.
Таблица 1
HP, выявленные при проведении КИ 3-й фазы
| Система органов MedDRA | Очень часто | Часто | Нечасто | Редко |
| Со стороны иммунной системы | Анафилактические реакции | |||
| Со стороны обмена веществ и питания | Гипогликемияа при совместном применении с инсулином и производным сульфонилмочевины | Гипогликемияа при совместном применении с другими ПГГП, снижение аппетита | ||
| Со стороны нервной системы | Головокружение | Дисгевзия | ||
| Со стороны органа зрения | Осложнения диабетической ретинопатииb | |||
| Со стороны сердца | Увеличение ЧСС | |||
| Нарушения со стороны ЖКТ | Тошнота, диарея | Рвота, боль в животе, вздутие живота, запор, диспепсия, гастрит, ГЭРБ, отрыжка, метеоризм | Острый панкреатит | |
| Со стороны печени и желчевыводящих путей | Холелитиаз | |||
| Общие расстройства и нарушения в месте введения | Утомляемость | Реакции в месте введения | ||
| Лабораторные и инструментальные данные | Повышение активности липазы, повышение активности амилазы, снижение массы тела |
aГипогликемия, определенная как тяжелая (требующая помощи другого человека) или симптоматическая, в сочетании с концентрацией глюкозы в плазме крови <3,1 ммоль/л.
bОсложнения диабетической ретинопатии — это сочетание из необходимости в фотокоагуляции сетчатки глаза, необходимости в интравитреальном введении препаратов, кровоизлияния в стекловидное тело, развития слепоты, связанной с СД. Частота основана на исследовании СС-исходов.
2-летнее исследование СС-исходов и безопасности. В популяции пациентов с высоким риском развития СС-заболеваний профиль HP был аналогичным таковому в других КИ 3а фазы (описаны в разделе Клиническая эффективность и безопасность).
Описание отдельных HP
Гипогликемия. Во время монотерапии препаратом Оземпик® не наблюдалось эпизодов тяжелой гипогликемии. Гипогликемия тяжелой степени, в основном, наблюдалась при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином. Наблюдалось несколько эпизодов тяжелой гипогликемии при применении препарата Оземпик® в комбинации с другими, за исключением производного сульфонилмочевины, ПГГП.
HP со стороны ЖКТ. Во время терапии препаратом Оземпик® в дозах 0,5 и 1 мг у пациентов отмечалась тошнота, диарея и рвота. Большинство реакций были от легкой до средней степени тяжести и краткосрочными. HP стали причиной преждевременного выбывания из КИ 3,9 и 5,9% пациентов, соответственно. Чаще всего о HP сообщалось в первые месяцы терапии.
Острый панкреатит. Частота развития острого панкреатита, подтвержденного по результатам экспертной оценки, в исследованиях 3а фазы составила 0,3% при применении семаглутида и 0,2% при применении препарата сравнения. В 2-летнем исследовании сердечно-сосудистых исходов частота развития острого панкреатита, подтвержденная по результатам экспертной оценки, составила 0,5% при применении семаглутида и 0,6% при применении плацебо (см. «Особые указания».)
Осложнения диабетической ретинопатии. В 2-летнем КИ, в котором участвовали пациенты с СД2 и высоким СС-риском, длительным течением СД и неадекватным контролем гликемии, подтвержденные случаи осложнений диабетической ретинопатии развивались у большего количества пациентов, получавших препарат Оземпик® (3,0%), по сравнению с пациентами, получавшими плацебо (1,8%). У пациентов с анамнезом диабетической ретинопатии в начале КИ возрастание абсолютного риска развития осложнений было выше. У пациентов с отсутствием подтвержденного анамнеза диабетической ретинопатии количество событий было одинаковым при применении препарата Оземпик® и плацебо. В КИ продолжительностью до 1 года частота HP, связанных с диабетической ретинопатией, была одинаковой в группе препарата Оземпик® и препаратов сравнения.
Прекращение лечения по причине HP. Частота прекращения лечения по причине HP составила 8,7% для пациентов, получавших препарат Оземпик® 1 мг. Наиболее частыми HP, приводившими к прекращению лечения, были нарушения со стороны ЖКТ.
Реакции в месте введения. Сообщалось о реакциях в месте введения (таких как сыпь в месте введения, покраснение) у 0,6 и 0,5% пациентов, получавших семаглутид 0,5 и 1 мг, соответственно. Эти реакции носили, как правило, легкий характер.
Иммуногенность. Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов у пациентов могут появиться антитела к семаглутиду после терапии препаратом Оземпик®. В конце КИ доля пациентов, у которых были обнаружены антитела к семаглутиду в любой момент времени, была низкой (1–2%), и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГПП-1 эффектом.
Взаимодействие
Исследования семаглутида in vitro показали очень небольшую вероятность ингибирования или индукции ферментов системы цитохрома Р450 (CYP) и ингибирования транспортеров лекарственных препаратов.
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов. Семаглутид следует применять с осторожностью у пациентов, получающих пероральные лекарственные препараты, для которых необходима быстрая абсорбция в ЖКТ.
Парацетамол. При оценке фармакокинетики парацетамола во время теста стандартизированного приема пищи было выявлено, что семаглутид задерживает опорожнение желудка. При одновременном применении семаглутида в дозе 1 мг AUC0–60 мин и Cmax парацетамола снизились на 27 и 23%, соответственно. Общая экспозиция парацетамола (AUC0–5 ч) при этом не изменялась. При одновременном приеме семаглутида и парацетамола коррекция дозы последнего не требуется.
Пероральные гормональные контрацептивные средства. Не предполагается, что семаглутид снижает эффективность пероральных гормональных контрацептивных средств. При одновременном применении комбинированного перорального гормонального контрацептивного препарата (0,03 мг этинилэстрадиола/0,15 мг левоноргестрела) и семаглутида последний не оказывал клинически значимого влияния на общую экспозицию этинилэстрадиола и левоноргестрела. Экспозиция этинилэстрадиола не была затронута; наблюдалось увеличение на 20% экспозиции левоноргестрела в равновесном состоянии. Cmax не изменилась ни для одного из компонентов.
Аторвастатин. Семаглутид не изменял системную экспозицию аторвастатина после применения однократной дозы аторвастатина (40 мг). Cmax аторвастатина снизилась на 38%. Это изменение было расценено как клинически незначимое.
Дигоксин. Семаглутид не изменял системную экспозицию или Cmax дигоксина после применения однократной дозы дигоксина (0,5 мг).
Метформин. Семаглутид не изменял системную экспозицию или Cmax метформина после применения метформина в дозе 500 мг 2 раза в день в течение 3,5 дней.
Варфарин. Семаглутид не изменял системную экспозицию или Cmax R- и S-изомеров варфарина после применения однократной дозы варфарина (25 мг). На основании определения МНО клинически значимых изменений фармакодинамических эффектов варфарина также не наблюдалось.
Несовместимость. Вещества, добавленные к препарату Оземпик®, могут вызвать деградацию семаглутида. Препарат Оземпик® нельзя смешивать с другими ЛС, в т.ч. с инфузионными растворами.
Передозировка
В ходе КИ сообщалось о передозировках до 4 мг в однократной дозе и до 4 мг/нед.
Симптомы: наиболее частой HP, о которой сообщалось, была тошнота. Все пациенты выздоровели без осложнений.
Лечение: специфического антидота при передозировке препарата Оземпик® не существует. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии. Учитывая длительный T1/2 препарата (примерно 1 нед), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки.
Особые указания
Применение препарата Оземпик® противопоказано у пациентов с СД1 или для лечения диабетического кетоацидоза.
Препарат Оземпик® не заменяет инсулин. Диабетический кетоацидоз был зарегистрирован у инсулинозависимых пациентов, у которых отмечалось быстрое прекращение лечения или снижение дозы инсулина при начале лечения агонистом ГПП-1P (см. «Способ применения и дозы»).
Реакции со стороны ЖКТ
Применение агонистов ГПП-1Р может быть ассоциировано с HP со стороны ЖКТ. Это следует учитывать при лечении пациентов с почечной недостаточностью, т.к. тошнота, рвота и диарея могут привести к дегидратации и ухудшению функции почек.
Острый панкреатит
При применении агонистов ГПП-1Р наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия препаратом Оземпик® должна быть прекращена; в случае подтверждения острого панкреатита терапию препаратом Оземпик® возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором развития острого панкреатита.
Гипогликемия
Пациенты, получающие препарат Оземпик® в комбинации с производным сульфонилмочевины или инсулином, могут иметь повышенный риск развития гипогликемии. В начале лечения препаратом Оземпик® риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина.
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов с наличием диабетической ретинопатии, получающих терапию инсулином и семаглутидом (см. «Побочные действия»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией, получающих инсулинотерапию. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями.
Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением состояния диабетической ретинопатии, однако при этом нельзя исключать и другие причины.
Сердечная недостаточность
Отсутствует опыт применения препарата Оземпик® у пациентов с ХСН IV функционального класса в соответствии с классификацией NYHA. Применение препарата у таких пациентов противопоказано.
Заболевания щитовидной железы
В пострегистрационном периоде применения другого аналога ГПП-1, лираглутида, были отмечены случаи медуллярного рака щитовидной железы (МРЩЖ). Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения МРЩЖ с применением аналогов ГПП-1. Необходимо проинформировать пациента о риске развития МРЩЖ и симптомах опухоли щитовидной железы (появление уплотнения в области шеи, дисфагии, одышки, непроходящей охриплости голоса).
Значительное повышение концентрации кальцитонина в плазме крови может указывать на МРЩЖ (у пациентов с МРЩЖ значения концентрации кальцитонина в плазме крови обычно >50 нг/л). При выявлении повышения концентрации кальцитонина в плазме крови следует провести дальнейшее обследование пациента. Пациенты с узлами в щитовидной железе, выявленными при медицинском осмотре или при проведении УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Применение семаглутида у пациентов с личным или семейным анамнезом МРЩЖ или с синдромом МЭН типа 2 противопоказано.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В 2-летних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для группы аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключен.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Влияние на способность управлять транспортными средствами и работать с механизмами. Препарат Оземпик® не влияет или незначительно влияет на способность управлять транспортными средствами или работать с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином.
Форма выпуска
Раствор для подкожного введения, 1,34 мг/мл.
1. Шприц-ручка Оземпик® 0,25 или 0,5 мг/доза. По 1,5 мл препарата в картриджах из стекла, укупоренных поршнями из хлорбутиловой резины с одной стороны и алюминиевыми колпачками с дисками из бромбутиловой резины/полиизопрена с другой стороны. Картридж встроен в мультидозовую одноразовую шприц-ручку для многократных инъекций из полипропилена, полиоксиметилена, поликарбоната и акрилонитрил бутадиен стирола. 1 шприц-ручку и 6 одноразовых игл НовоФайн® Плюс помещают в картонную пачку.
2. Шприц-ручка Оземпик® 1 мг/доза. По 3 мл препарата в картриджах из стекла, укупоренных поршнями из хлорбутиловой резины с одной стороны и алюминиевыми колпачками с дисками из бромбутиловой резины/полиизопрена с другой стороны. Картридж встроен в мультидозовую одноразовую шприц-ручку для многократных инъекций из полипропилена, полиоксиметилена, поликарбоната и акрилонитрил бутадиен стирола. 1 шприц-ручку и 4 одноразовых иглы НовоФайн® Плюс помещают в картонную пачку.
Производитель
Производитель и владелец регистрационного удостоверения:
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания.
www.novonordisk.com
Производство готовой лекарственной формы. Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания.
Первичная упаковка. Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания.
Вторичная/потребительская упаковка. Ново Нордиск А/С, Бреннум Парк, DK-3400 Хиллерод, Дания.
Производитель (выпускающий контроль качества). Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания.
Организация, принимающая претензии от потребителей. ООО «Ново Нордиск», 121614, Москва, ул. Крылатская, 15, оф. 41.
Тел.: (495) 956-11-32; факс: (495) 956-50-13.
www.novonordisk.ru
Оземпик® и НовоФайн® — зарегистрированные торговые марки, принадлежащие компании Ново Нордиск А/С, Дания.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (в холодильнике, но не рядом с морозильной камерой, не замораживать).
Используемую или переносимую в качестве запасной шприц-ручку, закрытую колпачком, при t не выше 30 °C или при t 2–8 °C. Использовать в течение 6 нед. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Кальций (кальция карбонат), антислеживающий агент целлюлоза, магний (магния оксид), экстракт бурых водорослей (Fucus vesiculosus), оболочка таблетки (AquaPolish® F оранжевый 034.17 (стабилизатор гидроксипропилметилцеллюлоза, стабилизатор гидроксипропилцеллюлоза, загуститель глицерин, антислеживающий агент тальк, краситель титана диоксид, краситель оксиды и гидроксиды железа), триглицериды среднецепочечные), витамин С (L-аскорбиновая кислота), железо (железа фумарат), витамин E (D-альфа-токоферола ацетат), цинк (цинка цитрат), селен (обогащенные селеном дрожжи), марганец (марганца глюконат), витамин В3 (никотинамид), стабилизатор кроскармеллоза, коэнзим Q10, антислеживающий агент магниевая соль стеариновой кислоты, витамин К1(фитоменадион), медь (меди глюконат), антислеживающий агент кремния диоксид, витамин В5 (D-пантотенат кальция), витамин A (ретинола ацетат), биотин, витамин D3
(холекальциферол), витамин B6
(пиридоксина гидрохлорид), витамин B1
(тиамина гидрохлорид), витамин В2
(рибофлавин), витамин В12 (цианокобаламин), фолиевая кислота.
| Активный компонент | Содержание в суточной норме потребления (1 таблетка, покрытая оболочкой, массой 1400 мг) | % от рекомендуемого уровня суточного потребления или адекватного* уровня потребления |
| Витамин А | 0,8 мг | 100 |
| Витамин С | 80 мг | 133** |
| Витамин B1 | 1,1 мг | 79 |
| Витамин B2 | 1,4 мг | 88 |
| Витамин B3(PP) | 16 мг | 89 |
| Витамин В5 | 6 мг | 100 |
| Витамин B6 | 1,4 мг | 70 |
| Витамин В12 | 2,5 мкг | 250** |
|
Витамин D3 (200 МЕ) |
5 мкг | 100 |
| Витамин E | 12 мг | 120** |
| Витамин К1 | 75 мкг | 63* |
| Биотин | 50 мкг | 100 |
| Фолиевая кислота | 200 мкг | 100 |
| Цинк | 10 мг | 67 |
| Магний | 100 мг | 25 |
| Марганец | 2 мг | 100* |
| Медь | 1 мг | 100* |
| Селен | 55 мкг | 79 |
| Йод (экстракт Fucus vesiculosus (150 мг), содержащий 0,1% йода) | 150 мкг | 100 |
| Железо | 14 мг | 100 |
| Кальций | 120 мг | 12 |
| Коэнзим Q10 | 10 мг | 33* |
** не превышает верхний допустимый уровень потребления
В качестве биологически активной добавки к пище — дополнительного источника магния, цинка, марганца, меди, селена, йода, железа, витаминов А, С, B1, B2, В3 (РР), В5, В6, В12, D3, Е, К1, биотина, фолиевой кислоты, источника коэнзима Q10, содержащей кальций.
Витамины (от лат. Vita — жизнь) — низкомолекулярные органические соединения различной химической природы, необходимые для осуществления жизненно важных биохимических и физиологических процессов в живых организмах.
Организм человека и животных не синтезирует витамины или синтезирует в недостаточном количестве, поэтому он должен получать их в готовом виде с пищей.
Кроме витаминов, в рационе человека в малых дозах должны присутствовать другие незаменимые вещества — макро- и микроэлементы. Они участвуют во многих жизненно важных обменных реакциях, некоторые из них необходимы для обеспечения должного уровня активности соответствующих витаминов.
Усталость, упадок сил, слабость, нервное перенапряжение — часто это следствие неудовлетворения текущих потребностей организма в энергии. Вредное воздействие окружающей среды, недостаток полезных компонентов в пище, интенсивный уровень жизни, постоянные стрессы способствуют дефициту необходимых организму витаминов, а также минеральных элементов.
Прием оральных контрацептивов так же нарушает статус многих микроэлементов в организме: фолиевой кислоты, витаминов группы В, витамина С, цинка, магния.
Недостаток микроэлементов в питании может нарушить способность к запоминанию и мыслительной деятельности, способствовать развитию депрессии. Дефицит витаминов группы В (особенно тиамина В1, ниацина В3, фолиевой кислоты и витамина В12) может нарушить ментальные функции, ухудшить память, снизить концентрацию внимания.
Витаминно-минеральный комплекс ВИТРУМ ЭНЕРДЖИ VITRUM ENERGY содержит 13 витаминов и 8 минералов, а также коэнзим Q10 — необходимые компоненты, которые работают для поддержания энергии и тонуса:
✓ На работоспособность и энергичность ключевое влияние оказывают витамины группы В:
витамины В1, В2, В3, В5
регулируют функциональное состояние центральной нервной системы, обмен веществ и трофику тканей, поэтому их применяют для повышения общей реактивности организма.
✓ Витамины группы В и железо участвуют в формировании гемоглобина, улучшают циркуляцию крови, осуществляют транспорт питательных веществ, ускоряют процессы регенерации, усиливают сопротивляемость организма к различным стрессовым ситуациям, участвуют в синтезе нейротрансмиттеров.
✓ Магний контролирует баланс внутриклеточного калия, регулирует функции сердечно-сосудистой и нервной систем, участвует в энергетических процессах организма, устраняет судороги в мышцах, помогает снять стресс, способствует восстановлению сил после физических нагрузок.
✓ Витамин С — антиоксидант, участвует в сопротивляемости организма к различным стрессовым ситуациям, способствует синтезу коллагена, поддержанию нормального тонуса, укреплению сосудистой стенки.
✓ Витамин Д ответственен за поддержание функций скелета, регулирует обмен кальция, тонус нервной системы, нормальное соотношение сна и бодрствования, способствует поддержанию нормального тонуса мышц и сердечно-сосудистой системы.
✓ Йод способствует поддержанию физических и умственных функций организма, при его дефиците наблюдается снижение иммунитета.
✓ Коэнзим Q10
(убихинон) является витаминоподобным веществом, которое улучшает выработку энергии в клетках, оказывает благоприятное воздействие на сердечно-сосудистую систему, способствует повышению работоспособности, физической выносливости, а также обладает антиоксидантным эффектом. Расход убихинона прогрессивно возрастает при физических и эмоциональных нагрузках, при частых простудных заболеваниях и при хроническом стрессе, обусловливая высокую вероятность развития его дефицита.
Взрослым принимать по 1 таблетке в день во время приема пищи. Продолжительность приема — 1 месяц. При необходимости прием можно повторить.
Перед применением рекомендуется проконсультироваться с врачом.
Индивидуальная непереносимость компонентов, беременность, кормление грудью, повышенная склонность к тромбообразованию.
Таблетки, покрытые оболочкой, массой 1400 мг. По 30 таблеток во флаконе, 1 флакон в картонной пачке.
Населению. Места реализации определяются национальным законодательством государств-членов Евразийского экономического союза.
В сухом, защищенном от попадания прямых солнечных лучей и недоступном для детей месте, при температуре не выше 25 °С.
3 года.
Не является лекарством.
Наименование и место нахождения изготовителя:
«Walmark a.s.», Oldrichovice 44, 739 61 Trinec, (адрес производства: Polni 836, 739 61 Trinec), Чешская Республика.
Организация, уполномоченная принимать претензии от потребителей / импортер:
АО «Нижфарм», Россия, 603105, г. Нижний Новгород, ул. Салганская, д.7.
Тел.: +7 (831) 278-80-88, факс: +7 (831) 430-72-28, е-mail: med@stada.ru.
Торговое название: КАВЕРДЖЕКТ®
Международное непатентованное название:
алпростадил / alprostadil
Состав
Состав препарата: активного вещества алпростадила 10 мкг, или 20 мкг; вспомогательные вещества: лактоза, натрия цитрат.
Состав растворителя: бензилового спирта 9 мг, воды для инъекций q.s. 1 мл.
Лекарственная форма:
лиофилизат для приготовления раствора для внутрикавернозного введения.
Описание: лиофилизированный порошок или пористая масса белого или почти белого цвета; растворитель — прозрачный бесцветный раствор.
Фармакотерапевтическая группа:
вазодилатирующее средство, препарат ПГЕ1.
Код ATX: G04BE01.
Фармакологические свойства
Фармакодинамика.
Алпростадил, встречающаяся в естественных условиях форма простагландина Е1 обладает широким спектром фармакологического действия. Среди наиболее значимых его эффектов следует отметить вазодилатацию и подавление агрегации тромбоцитов.
При интракавернозном введении (в половой член) алпростадил ингибирует α1-адренорецепторы в тканях, расслабляет мускулатуру кавернозных тел, увеличивает кровоток и улучшает микроциркуляцию. Алпростадил вызывает эрекцию путем релаксации трабекулярной гладкой мускулатуры пещеристых тел и дилатации кавернозных артерий, что ведет к расширению лакунарных пространств и перекрытию кровотока за счет прижатия венул к белковой оболочке (окклюзия вен полового члена).
Начало действия — 5-10 мин, продолжительность — 1-3 часа.
Фармакокинетика.
Абсорбция: Для лечения эректильной дисфункции алпростадил инъецируют в пещеристые тела полового члена. Абсолютная биодоступность алпростадила не определена.
Распределение: После внутрикавернозного введения 20 мкг алпростадила средние периферические плазменные концентрации спустя 30 и 60 мин после инъекции (89 и 102 пикограмм/мл, соответственно) не были существенно выше, чем уровни эндогенного алпростадила (96 пикограмм/мл). Алпростадил связывается с плазматическими белками, прежде всего с альбумином (81%) и в меньшей степени с фракцией IV-4 α-глобулина (55%). Существенного связывания с эритроцитами или лейкоцитами не отмечено.
Метаболизм: Алпростадил быстро превращается в соединения, которые в свою очередь метаболизируются перед выведением из организма. Около 80% циркулирующего алпростадила метаболизируется при первом прохождении через легкие, преимущественно за счет бета- и омега-окисления. Первичные метаболиты алпростадила — 15-кето-ПГЕ1 13,14-дигидро-15-оксо-ПГЕ1 и 13,14-дигидро-ПГЕ1. В отличие от 15-кето-ПГЕ1 и 13,14-дигидро-15-оксо-ПГЕ1 которые почти полностью лишены биологической активности, 13,14-дигидро-ПГЕ1 снижает кровяное давление и подавляет агрегацию тромбоцитов. После внутрикавернозного введения алпростадила уровни этого метаболита того же порядка, что и уровни ПГЕ1 в то же время уровни 13,14-дигидро-15-оксо-ПГЕ1 основного циркулирующего метаболита, более чем в 10 раз выше. 15-кето-ПГЕ1 не обнаруживается в плазме на протяжении всего периода наблюдения. После внутрикавернозного введения 20 мкг алпростадила содержание основного циркулирующего метаболита 13,14-дигидро-15-оксо-ПГЕ1 в периферическом кровотоке увеличивается и достигает максимума спустя 30 мин, а затем возвращается к исходному уровню спустя 60 мин после введения, в то время как уровни алпростадила в периферическом кровотоке остаются незначительно выше исходных. Концентрация 13,14-диги дро-ПГЕ1 в плазме не определяется.
Выведение: Метаболиты алпростадила выводятся преимущественно почками, почти 90% введенной внутривенно дозы выводится с мочой в течение 24 часов. Остальная часть выводится с фекалиями.
Влияние возраста или расы: Возможное влияние возраста или расы на фармакокинетику алпростадила после внутрикавернозного введения не оценивалось.
Продолжительных исследований канцерогенности алпростадила не проводилось. Не выявлено потенциальной мутагенности алпростадила.
Алпростадил в дозе до 2 мг/кг/день, вводимый подкожно, не влияет на репродуктивную функцию и не вызывает изменений сперматогенеза.
Показания к применению
- нарушения эрекции нейрогенной, сосудистой, психогенной или смешанной этиологии;
- диагностика нарушений эрекции в дополнение к другим диагностическим тестам.
Противопоказания
- установленная повышенная чувствительность к компонентам препарата;
- заболевания, которые могут предрасполагать к возникновению приапизма, такие как серповидноклеточная анемия, миеломная болезнь, лейкоз;
- анатомические деформации полового члена (ангуляция полового члена, кавернозный фиброз, болезнь Пейрони);
- наличие имплантанта полового члена;
- мужчинам, которым противопоказана или не рекомендуется половая жизнь;
С осторожностью
У лиц моложе 18 лет безопасность и эффективность препарата не изучена.
Способ применения и дозы
Прямое внутрикавернозное введение. Рекомендуется применение иглы размером 27 — 30 G, длиной 13 мм. Место введения — дорсо-латеральная часть проксимальной трети полового члена.
Подбор начальной дозы в кабинете врача
Доза подбирается индивидуально у каждого больного осторожным титрованием под наблюдением врача. Следует придерживаться приводимой ниже схемы с учетом эректильного ответа до тех пор, пока не будет достигнута доза, вызывающая эрекцию длительностью, достаточной для полового акта, но не более 60 мин. Если на определенную дозу реакция отсутствует, то следующая более высокая доза может быть введена через 1 час. При наличии ответа интервал между дозами должен быть не менее 1 дня. Больной должен находиться в кабинете врача до тех пор, пока не наступит полная детумесценция.
| НЕЙРОГЕННАЯ ЭТИОЛОГИЯ (Повреждение спинного мозга) | СОСУДИСТАЯ, ПСИХОГЕННАЯ И СМЕШАННАЯ ЭТИОЛОГИЯ | |
| Начальная инъекция | 1,25 мкг | 2,5 мкг |
| Вторая инъекция | 2,5 мкг | При частичном ответе на первую инъекцию: 5 мкг При отсутствии ответа: 7,5 мкг |
| Третья инъекция | 5 мкг | |
| Величина пошагового повышения дозы до достижения оптимальной дозы | 5 мкг | 5 -10 мкг |
Поддерживающая терапия
Доза, выбранная для самоинъекций, должна вызывать у пациента эрекцию, достаточную для полового акта, длительностью не более 1 часа. Если длительность эрекции превышает 1 час, то дозу следует уменьшить. Самостоятельное лечение в домашних условиях должно начинаться с дозы, установленной в кабинете врача. При необходимости изменение дозы должно проводиться только после консультации с врачом и в соответствии с указаниями по подбору дозы. Следует вводить наименьшую эффективную дозу. Рекомендуемая частота проведения инъекций — не более трех раз в неделю, но не чаще одного раза в сутки. Эрекция обычно наступает через 5-20 мин после инъекции.
Средняя доза алпростадила к концу 6 месяца терапии была 20,7 мкг. У большинства больных поддерживающая доза составляла 5-20 мкг. Применение доз свыше 60 мкг не рекомендуется. ДОПОЛНИТЕЛЬНОЕ СРЕДСТВО ДИАГНОСТИКИ НАРУШЕНИЯ ЭРЕКЦИИ В самой простой пробе при нарушении эрекции (фармакологическая проба) после внутрикавернозного введения препарата КАВЕРДЖЕКТ у больного наблюдают развитие эрекции. КАВЕРДЖЕКТ используют также в дополнение к лабораторным исследованиям, таким как дуплексное или допплеровское ультразвуковое исследование, проба на вымывание ксенона-133, радиоизотопная фаллография и артериография полового члена, что позволяет визуализировать и оценить состояние сосудов полового члена. В любом случае следует использовать однократную дозу препарата КАВЕРДЖЕКТ, которая вызывает нормальную эрекцию.
Разведение и процедура самовведения
Для разведения использовать только прилагающийся растворитель или воду для инъекций с бензиловым спиртом 0,9 %. После разведения в 1 мл растворителя объем полученного раствора равен 1,13 мл. В 1 мл данного раствора будет содержаться 10,5 мкг или 20,5 мкг алпростадила, соответственно, однако после инъекции в организм попадет 10 мкг или 20 мкг алпростадила, соответственно, поскольку 0,5 мкг теряется из-за адсорбции на стенках шприца и флакона. После разведения препарата не следует добавлять во флакон какие-либо вещества. Перед введением раствор необходимо проверить визуально на наличие частиц или изменение цвета.
- Вымойте руки водой с мылом.
- Снимите с флакона пластиковую защитную крышечку.
- С помощью одной из прилагаемых пропитанных спиртом салфеток протрите резиновую пробку флакона (вторая салфетка понадобится позднее). Использованную салфетку следует выбросить.
- Распакуйте большую иглу с маркировкой 22G1 ½, не снимая с нее при этом пластмассового защитного колпачка. Соедините иглу со шприцем, надев основание иглы на шейку шприца и крепко прижав.
- Аккуратно снимите с иглы защитный колпачок.
- Держа шприц кончиком иглы вверх, подведите поршень шприца к отметке «1 мл» (для удаления избытка воды из шприца.)
- Проткните иглой резиновую пробку флакона в ее центральной части и надавите на поршень вниз, чтобы ввести воду во флакон.
- Аккуратно держа шприц и флакон как одно целое, легкими круговыми движениями добейтесь полного растворения порошка. НЕЛЬЗЯ использовать препарат, если полученный раствор мутный, или приобрел окраску, или содержит какие-либо частицы.
- Переверните флакон вверх дном, не вынимая шприц. Убедившись в том, что кончик иглы расположен ниже уровня жидкости, медленно потяните поршень шприца на себя до тех пор, пока уровень раствора не достигнет нужной отметки на шприце.
- Для удаления пузырьков воздуха следует слегка постучать по шприцу, или ввести раствор обратно во флакон, а затем вновь медленно набрать его в шприц.
- Извлеките иглу из флакона и аккуратно наденьте на нее защитный колпачок.
- Вскройте упаковку с иглой меньшего размера (27G ½), но не доставайте иглу, а отложите упаковку в сторону.
- Снимите со шприца иглу большего размера вместе с защитным колпачком и отложите, чтобы затем выбросить.
- Держа в одной руке шприц, возьмите иглу меньшего размера из вскрытой упаковки, не снимая с нее при этом пластмассовый защитный колпачок, и соедините ее со шприцем, как соединяли иглу большего размера.
Диаграмма А: На поперечном разрезе полового члена показаны места проведения инъекций.Диаграмма Б: Половой член, вид сверху; места проведения инъекций заштрихованы.
Препарат следует вводить в одну из двух областей полового члена, которые называются пещеристыми телами.
- Проводить процедуру самовведения препарата следует в положении сидя, стоя или полулежа.
- Инъекции проводите только в места, указанные на диаграммах А и Б. Следует избегать попадания в видимые вены. Повторные инъекции следует проводить попеременно с одной и с другой стороны полового члена. Каждый раз следует выбирать для инъекции новую точку на соответствующей стороне.
- Возьмите головку полового члена большим и указательным пальцами. Оттяните половой член и крепко держите его пальцами, чтобы во время процедуры он не выскользнул. Мужчины, которым не проводилось обрезание (иссечение крайней плоти) должны отвести крайнюю плоть, чтобы точно определить место проведения инъекции.
- Тщательно обработайте кожу в месте проведения инъекции неиспользованной салфеткой, пропитанной спиртом. Отложите эту салфетку в сторону.
- Возьмите шприц большим и указательным пальцами, не помещая большой палец на поршень. Уверенным движением введите иглу под углом 90 градусов в место для инъекции, указанное врачом.
Рис.1: Введение иглы в место проведения инъекции - Большим или указательным пальцем надавите на поршень. Медленным уверенным движением введите все содержимое шприца.
- Извлеките иглу из полового члена. Придерживая половой член с двух сторон, прижмите салфетку, пропитанную спиртом, к месту проведения инъекции и подержите так около 3 мин. Если появилась кровь, то следует прижимать салфетку до тех пор, пока кровотечение не остановится.
- После использования содержимого этой упаковки все материалы следует выбросить, придерживаясь соответствующих правил безопасности. Можно использовать пластиковую упаковку препарата КАВЕРДЖЕКТ следующим образом: поместите использованный шприц, иглы и флакон в пластиковый контейнер. Достаньте из контейнера красное пластиковое запирающее устройство и отложите в сторону. Затем плотно закройте контейнер, при этом должен раздаться щелчок. Удалите надрезанную центральную часть этикетки (там, где нарисован красный замок), чтобы обнажился паз. Чтобы запереть контейнер, полностью протолкните красное запирающее устройство в паз. Когда запирающее устройство встанет на свое место, контейнер надежно заперт, и его можно выбросить. Контейнер, содержащий использованные шприц, иглы и флакон не может быть включен в процесс рециркуляции отходов.
Побочные действия
Местные (наиболее часто): боль и жжение в половом члене, пролонгированная эрекция (длительность 4-6 час), фиброз полового члена, гематома и экхимоз в месте инъекции. Фиброз полового члена, включая ангуляцию полового члена, образование фиброзных узелков и болезнь Пейрони отмечаются у 3 — 8% пациентов. Гематома в месте инъекции (3% пациентов) и экхимоз в месте инъекции (2% пациентов), связаны скорее с техникой инъекции, а не с действием алпростадила. Частота пролонгированной эрекции (4-6 час) составляла 4%.
Местные (менее 1%): приапизм (длительность эрекции более 6 час), баланит, геморрагии в месте инъекции, воспаление, зуд и отек в месте инъекции, кровотечения из мочеиспускательного канала, ощущение теплоты в половом члене, онемение, грибковая инфекция, раздражение, повышенная чувствительность кожи (гиперестезия), фимоз, зуд, эритема, «венозный сброс» из кавернозных тел, болезненная эрекция, нарушение эякуляции.
Частота приапизма составляла 0,4%. В большинстве случаев наблюдалось самопроизвольное расслабление полового члена.
Системные эффекты (наиболее часто): повышение АД, головокружение, головная боль, боль в спине, инфекции верхних дыхательных путей, гриппоподобный синдром, синусит, заложенность носа, кашель, простатит, боли не в месте инъекции.
Системные эффекты (менее 1%): боль в яичках, отек яичек, ощущение теплоты в яичках, утолщение яичек, покраснение мошонки, боль в мошонке, сперматоцеле, отек мошонки, гематурия, нарушение мочеиспускания, учащение мочеиспускания, императивные позывы к мочеиспусканию, боль в области таза, снижение АД, тахикардия, вазодилатация, периферические сосудистые нарушения, суправентрикулярная экстрасистолия, вазовагальные реакции, гипестезия, мышечная слабость, гипергидроз, сыпь, зуд не в месте инъекции, тошнота, сухость во рту, увеличение уровня креатинина в сыворотке крови, судороги икроножных мышц, расширение зрачков.
Снижение АД и учащение пульса, наблюдались при дозах препарата более 20 и 30 мкг, соответственно и, по-видимому, были дозозависимыми. Однако эти изменения не имели клинического значения; только 3 пациента прекратили лечение из-за симптоматической гипотонии.
КАВЕРДЖЕКТ не оказывал клинически значимого действия на результаты лабораторного исследования крови и мочи.
Передозировка
Симптомы: боль в половом члене, длительная эрекция и/или приапизм, необратимое ухудшение эректильной функции. Лечение: если эрекция длится менее 6 ч, необходимо врачебное наблюдение, поскольку часто происходит спонтанная детумесценция (прекращение эрекции, уменьшение размеров половых органов вследствие оттока крови), если более 6ч — следует провести интракавернозную инъекцию α-адреномиметиков (например, эфедрина, эпинефрина, фенилэфрина, этилэфрина) или выполнить аспирацию крови из кавернозных тел или провести хирургическое лечение. Пациент должен находиться под медицинским наблюдением до исчезновения системных явлений и/или до наступления полной детумесценции полового члена.
Взаимодействие с другими лекарственными средствами
КАВЕРДЖЕКТ не предназначен для смешивания или одновременного введения с другими препаратами, а также для совместного применения с другими лекарственными средствами для лечения нарушения эрекции. Возможность фармакокинетических взаимодействий с другими лекарственными средствами не исследовалась. Совместное применение с гипотензивными препаратами, диуретиками, антидиабетическими препаратами (включая инсулин), или нестероидными противовоспалительными средствами не оказывает какого-либо влияния на безопасность или эффективность препарата КАВЕРДЖЕКТ. Безопасность и эффективность совместного применения препарата КАВЕРДЖЕКТ с другими вазоактивными препаратами не изучена.
Присутствие бензилового спирта в растворителе снижает степень связывания со стенками флакона. В связи с этим при использовании воды для инъекций, содержащей бензиловый спирт, получается более устойчивый раствор и обеспечивается более полное введение препарата.
Особые указания
- До начала терапии препаратом КАВЕРДЖЕКТ должна быть проведена диагностика поддающихся лечению причин нарушения эрекции.
- Первые инъекции препарата должны проводиться в кабинете врача специально подготовленным медицинским персоналом. Самоинъекции можно начинать только после проведения подробного инструктажа больного и освоения им техники самоинъекций. Врач должен тщательно оценить навыки больного и его способность к проведению данной процедуры. Внутрикавернозное введение следует проводить с соблюдением правил асептики.
- Следует осуществлять постоянное наблюдение за состоянием больного, проводящего самостоятельное лечение, особенно в начальный период, когда может потребоваться изменение дозы. Каждые 3 месяца больному рекомендуется посещать лечащего врача для оценки эффективности и безопасности лечения и коррекции дозы (при необходимости).
- Флакон с разведенным препаратом предназначен для однократного применения и после использования выбрасывается. Следует проинструктировать больного о правилах уничтожения иглы, шприца и флакона.
- Известно, что после внутрикавернозного введения вазоактивных препаратов, включая КАВЕРДЖЕКТ, может развиться приапизм (эрекция, длительностью более 6 часов). Чтобы снизить риск развития приапизма следует вводить наименьшую эффективную дозу. Пациент должен немедленно сообщать врачу обо всех случаях эрекции длительностью более 4 часов. Лечение приапизма проводится в соответствии со сложившейся медицинской практикой.
- После внутрикавернозного введения препарата может развиться фиброз полового члена, включая ангуляцию полового члена, образование фиброзных узелков и болезнь Пейрони. Частота возникновения фиброза может увеличиваться с увеличением продолжительности использования препарата. Для выявления признаков фиброза полового члена или болезни Пейрони настоятельно рекомендуется регулярное обследование больных с внимательным осмотром полового члена. У больных с развитием ангуляции полового члена, кавернозного фиброза или болезни Пейрони лечение препаратом должно быть прекращено.
- Поскольку при внутрикавернозном введении возможно небольшое кровотечение, больные, применяющие КАВЕРДЖЕКТ, должны быть осведомлены о мерах защиты от инфекций, передаваемых половым путем, а также через кровь, включая вирус иммунодефицита человека (ВИЧ). Больные, получающие лечение антикоагулянтами типа варфарина или гепарина, имеют повышенную склонность к кровотечению после внутрикавернозной инъекции.
- Особый контроль необходим у пациентов, получающих ингибиторы МАО, и в случае затянувшейся эрекции у пролеченных α-адреномиметиками (может развиться гипертонический криз); а также у пациентов с ИБС, хронической сердечной недостаточностью или легочным заболеванием (сексуальная стимуляция и половые сношения могут привести к обострению заболевания).
- Следует строго соблюдать соответствие используемой лекарственной формы алпростадила конкретным показаниям для его применения.
Форма выпуска
Лиофилизат для приготовления раствора для внутрикавернозного введения 10, 20 мкг (флаконы) / в комплекте с растворителем — вода для инъекций с бензиловым спиртом 9 мг/мл шприц одноразовый) 1 мл, игла для инъекций — 2 шт. и салфетки — 2 штуки с инструкцией по применению в пластмассовой коробке.
Срок годности
Срок годности лиофилизата: 2 года.
Срок годности растворителя: 3 года.
Не применять по истечении срока годности!
Условия хранения
Список Б. При температуре не выше 25°С. Не замораживать! Разведенный раствор хранить в оригинальном флаконе при температуре не вышё 25°С в течение не более 24 часов. Не замораживать и не охлаждать! Хранить в недоступном для детей месте!
Отпуск из аптек: по рецепту.
Производитель
Пфайзер МФГ. Бельгия Н.В., Бельгия Юридический адрес: Рийксвег 12, 2870 Пюре, Бельгия. Претензии потребителей направлять по адресу представительства «Пфайзер Интернэшнл ЭлЭлСи: 109147 Москва, ул. Таганская, 21
-
E-Pard — покупки за рубежом
- —
-
Каталог товаров eBay.de
- —
- Красота и здоровье
- —
- Природные и альтернативные средства правовой защиты
- —
- Средства самопомощи-Средства массовой информации
- —
- Energy Pak Neu Magnetfolie mit Wärmespeicher Bio-aktiv bei Schmer…
Этот товар недоступен — товар распродан
Категория товара Средства самопомощи-Средства массовой информации
ID товара 153213690248
Продавец fruzel_frunkel, 100.0 %
Цена 4.00 EUR ~ 408.99 руб.
- Описание
-
Основные состояние: новый, продажа: фиксированная цена
Товар из страны DE, Landshut
Окончание продажи 02.02.2019 16:50:56
-
- Доставка
-
Доставка в страны
Россия, Украина, Белоруссия, Казахстан, Грузия, Молдова, Армения и др.Доставка до адреса со склада E-Pard. Стоимость доставки из Германии рассчитывается после проверки заказа.
-
- Оплата
-
Способы
Банковская карта, PayPal, Электронные деньги, переводКомиссия
От 0% до 5% от стоимости заказа
-
Характеристики Energy Pak Neu Magnetfolie mit Wärmespeicher Bio-aktiv bei Schmerzen Wärmepads
Купить Energy Pak Neu Magnetfolie mit Wärmespeicher Bio-aktiv bei Schmerzen Wärmepads из категории Средства самопомощи-Средства массовой информации в разделе Природные и альтернативные средства правовой защиты из каталога Красота и здоровье с доставкой в Россию, Казахстан, Беларусь, Украину, Молдову, Армению, Азербайджан, Грузию и другие страны на уникальных условиях сервиса E-Pard: гарантия доставки, страхование посылки, единый тариф, никаких скрытых расходов. Сравните цены в европейских магазинах и выберите лучший вариант. Сэкономьте деньги — купите нужный товар у иностранного продавца, сделайте это с доставкой в любой город и населённый пункт.
Описание Energy Pak Neu Magnetfolie mit Wärmespeicher Bio-aktiv bei Schmerzen Wärmepads
Disclaimer: Все торговые марки, зарегистрированные товарные знаки, названия продуктов, названия компаний или их логотипы указаны только для идентификационных целей и являются собственностью их соответствующих владельцев. Информационные материалы используются на основе партнёрских соглашений и из верифицированных источников. Если вы считаете, что ваши права нарушаются — свяжитесь с нами.
-
Contents
-
Table of Contents
-
Troubleshooting
-
Bookmarks
Quick Links
Energy Pak user manual
High Power
Lithium Ferrous
Phosphate (LFP)
Battery
3kWh / 6kWh / 12kWh Models
MICROGREEN SOLAR CORP.
1-888-684-8868
info@microgreen.ca
Microgreen.ca
Summary of Contents for Microgreen Energy Pak 3
-
Page 1
Energy Pak user manual High Power Lithium Ferrous Phosphate (LFP) Battery 3kWh / 6kWh / 12kWh Models MICROGREEN SOLAR CORP. 1-888-684-8868 info@microgreen.ca Microgreen.ca… -
Page 3: Table Of Contents
Table of Contents HOW TO USE THIS MANUAL ………………………………3 ENERGY PAK MODELS ………………………………..4 ENERGY PAK OVERVIEW ……………………………….. 6 IMPORTANT SAFETY INFORMATION…………………………..12 INSTALLATION ……………………………………13 NORMAL OPERATION ………………………………..16 MAINTENANCE / PROTECTIONS AND STORAGE ………………………19 Maintenance / Protections …………………………….19 Off-season Storage Procedure …………………………..19 EMERGENCY BYPASS MODE ……………………………..
-
Page 4: How To Use This Manual
Energy Pak, damage to surrounding property, and/or potential risk of injury or death. These warnings must be heeded when installing or operating the Energy Pak. For the latest documents on Energy Pak, visit microgreen.ca…
-
Page 5: Energy Pak Models
Also the Energy Pak 12 comes with a multi-function LED display, whereas the Energy Pak 3 and Energy Pak 6 come with a voltage display only. The LED display is optional for the Energy Pak 3 and Energy Pak 6 models.
-
Page 6
Energy Pak 6 • Lithium battery ideal for typical cottage, cabin or modular home • 6 kWh capacity • 12/24 V output Energy Pak 12 • Lithium battery ideal for home off-grid system, transit vehicle emissions reduction system • 12 kWh capacity •… -
Page 7: Energy Pak Overview
Available Models of Energy Pak Energy Pak Energy Storage Nominal Voltage Model Capacity (approximate) Energy Pak 3 – EP 12240 3 kWh 12 V Energy Pak 6 – EP 12280 6 kWh 12 V Energy Pak 6– EP 24240 6 kWh 24 V Energy Pak 12 –…
-
Page 8
The Energy Pak can be operated using the buttons and switches located directly on the front panel (see Figure below), or using the LED Display / Remote Controller. For the Energy Pak 3 and Energy Pak 6 this is an optional component that plugs into it (see Figure 3e below). -
Page 9
Figure 3b: Front Panel components of the 12 kWh Energy Pak… -
Page 10
Figure 3c: Left Panel components of the 12 kWh Energy Pak Figure 3d: Right Panel components of the 12 kWh Energy Pak… -
Page 11
This comes with the Energy Pak 12 ONLY, replacing the voltage display of the Energy Pak 3 and Energy Pak 6 models. The Display is available on the Energy Pak 3 and Energy Pak 6 as an optional wired component. -
Page 12
The picture below shows the default mode of the LED display. The LED display is included in the Energy Pak 12, and is optional for the Energy Pak 3 and Energy Pak 6 via a wired connection (see Section 9 for more details). -
Page 13: Important Safety Information
4 Important Safety Information WARNING This manual contains important instructions for all Energy Pak models that must be followed during installation, and operation. Failure to follow these instructions may result in damage, fire, injury or death. Do not attempt to use the Energy Pak if it appears damaged.
-
Page 14: Installation
Secure the Energy Pak with fasteners after installation, especially if it is being used in a moving vehicle such as a boat or RV. This is especially applicable to the Energy Pak 3 and Energy Pak 6; note that the casing contains holes which enable them to be fastened down with screws;…
-
Page 15
3. Wiring: Whenever making any connection to the battery terminals, DOUBLE-CHECK that the polarity is correct. Do not connect more than one pair of electrical cables to the battery terminals of the Energy Pak. If you want to power multiple loads, use two bus bars that each make a single connection to one of the battery terminals of the Energy Pak, and then connect all of your loads to the bus bars. -
Page 16
Figure 5b: Incorrect connection for multiple loads (multiple wires directly connected to the battery terminal) 4. Use power cables with proper gauge Users are advised to select the proper length and specifications of power cables to fit the power rating of their applications. -
Page 17: Normal Operation
6 Normal Operation Once installed, you can operate the Energy Pak simply by turning it on/off. It must be turned on to supply power or to charge. The Energy Pak should be turned off during installation, when connecting/disconnecting wires, and for long-term storage. To turn ON the Energy Pak for charge &…
-
Page 18
Maintain the SOC level above 20% to avoid auto-shutdown The built-in BMS has been programmed to shut off the Energy Pak when the SOC (State of Charge) falls below approximately 20%. This prevents over-discharging the battery cells and improves the operating lifetime of your Energy Pak. -
Page 19
In addition, if you have an LED display, the SOC indicator may not be accurate until 1 full charge-discharge cycle has occurred. Furthermore, the SOC may become inaccurate over time; again, a full charge-discharge cycle will restore the accuracy of the indicator. Low Temperature Operation Due to the inherent nature of lithium ion battery cells, their performance is reduced at low temperatures. -
Page 20: Maintenance / Protections And Storage
7 Maintenance / Protections and Storage 7.1 Maintenance / Protections Unlike traditional AGM batteries, the Energy Pak can be operated safely with little maintenance. The Energy Pak features a BMS (Battery Management System) which is a protective circuitry that continuously monitors and protects the battery from being overcharged, overdrained, or overheated.
-
Page 21: Emergency Bypass Mode
8 Emergency Bypass Mode 8.1 Why have a Bypass Mode? As previously mentioned, the Energy Pak is equipped with a BMS that shuts down the system when a potentially unsafe condition is detected. The BMS thus maximizes the operational safety (as well as prolonging the lifetime of the battery).
-
Page 22
While running in Emergency Bypass Mode, the operating voltage is still measured accurately and is the most reliable parameter. It is advisable to monitor the voltage to ensure that the Energy Pak is operating in the appropriate voltage range: 12.0 — 14.0 V for 12V models ●… -
Page 23: Using The Led Display / Remote Controller
The LED Display provides more detailed information about the Energy Pak. It is a standard component built-in the Energy Pak 12 front panel. For the Energy Pak 3 and Energy Pak 6, it is an optional component. The LED display is a wired connection that also serves as a remote controller.
-
Page 24
• The Energy Pak 6 model contains 8 battery cells, therefore 8 valid voltage readings are shown on the Display. The Energy Pak 3 contains 4 cells; so only 4 voltage readings are valid. • The Energy Pak 12 model contains 16 battery cells, so… -
Page 25
Cell Temperatures • The Energy Pak includes two temperature sensors to monitor the temperature of the battery cells • The two numbers on this page show the temperature at two specific locations inside the Energy Pak • Temperatures in the range of -20 to 68 C are considered acceptable for connecting a load (the Energy Pak will automatically shut down outside this range) -
Page 26
Settings This page can be used to configure the alarm sound, ● screen saver time and display language This page can also be used to change the parameter ● settings — it is strongly recommended that users do not change any parameter settings Info This page displays general information about the ●… -
Page 27: How To Deal With An Emergency
10 How to Deal with an Emergency If your health or safety is threatened, please always start with the following two steps before dealing with the other suggestions. STEPS: Contact the fire department or other first responders immediately. Inform all people who may be affected to ensure that they can evacuate the area. WARNING: Only perform the actions suggested below if safe to do so.
-
Page 28: Troubleshooting
Incorrect current reading displayed By frequently monitoring the LED Display Screen (optional on the Energy Pak 3 and Energy Pak 6, standard on the Energy Pak 12), you will develop a good feel for how your electrical loads affect the displayed electrical current.
-
Page 29
Display giving inaccurate reading for SOC SOC is a measure of the energy actually contained in the Energy Pak, expressed as a percentage of the nominal (perfect) capacity of Energy Pak. The Energy Pak may initially display an inaccurate SOC, or the reading may become inaccurate over time –… -
Page 30: Warranty & Technical Support
12 Warranty & Technical Support WARRANTY Energy Pak comes with a 3-year warranty period under normal usage. TECHNICAL SUPPORT If you need further assistance, please contact Microgreen. When contacting us, please provide the following information: Name of owner ● Your preferred method of contact (phone, mobile phone or email) ●…
-
Page 31: Energy Pak Specs Sheet
13 Energy Pak Specs Sheet Energy Pak 3 Energy Pak 6 Energy Pak 12 NOTE MODEL NAME EP12240 EP 12480 EP 24240 EP 24480 EP 48240 MODEL NUMBER Lithium Iron LiFePO BATTERY CHEMISTRY Phosphate 12.8 V 12.8 V 25.6 V 25.6 V…
-
Page 32: How To Contact Us
14 How to Contact Us Microgreen Solar Corporation 860 Denison Street, Unit 10-11 Markham, ON Canada L3R 4H1 1-888-684-8868 Tel: Email: info@microgreen.ca Website: https://www.microgreen.ca Scan this QR code to find out more on Energy Pak…
Abbildung ähnlich
- VK2
- Ihr PreisVK2
- Ersparnis3
-
Leider führen wir diesen Artikel nicht
-
- PZN
- 03327173Produktkennzeichnung
-
- Darreichung
- Folie
Produktdetails & Pflichtangaben
1 Energy-Pak Magnetstreifen (95×55 mm) zur mehrmaligen Anwendung + 5 Befästigungs-Pflaster
Weitere Produktinformationen
Inhalt:
1 Energy-Pak Magnetstreifen (95×55 mm) zur mehrmaligen Anwendung + 5 Befästigungs-Pflaster
Zur bio-aktiven Anwendung bei
- Muskel- und Gelenkschmerzen
- Zerrungen
- Prellung
- Bandscheiben-Beschwerden
- Hexenschuss
- Ischias
- rheumatischen Schmerzen
Produktbewertungen zu Energy Pak Magnetfolie mit Wärmespeicher
0
Bewertungen
-
5 von 5
0Produktbewertungen
-
4 von 5
0Produktbewertungen
-
3 von 5
0Produktbewertungen
-
2 von 5
0Produktbewertungen
-
1 von 5
0Produktbewertungen
Für jede von Ihnen verfasste Premium-Bewertung schenken wir Ihnen einen Gutschein für Ihren nächsten Einkauf!
2 Energy Pak Models
This manual covers the 3 available Energy Pak models. The features and functionalities are largely the same,
the main difference is the output voltage and the capacity.
Also the Energy Pak 12 comes with a multi-function LED display, whereas the Energy Pak 3 and Energy Pak 6
come with a voltage display only. The LED display is optional for the Energy Pak 3 and Energy Pak 6 models.
Energy Pak 3
•
Lithium battery ideal for RV or boat power
•
3 kWh capacity
•
12 V output
4