Эмплисити — инструкция по применению
Синонимы, аналоги
Статьи
РЕГИСТРАЦИОННЫЙ НОМЕР:
ЛП-004241 — 120417
ТОРГОВОЕ НАЗВАНИЕ:
Эмплисити® (Empliciti®)
МЕЖДУНАРОДНОЕ НЕПАТЕНТОВАННОЕ НАЗВАНИЕ:
элотузумаб
ЛЕКАРСТВЕННАЯ ФОРМА:
лиофилизат для приготовления концентрата для приготовления раствора для инфузий
СОСТАВ:
1 флакон содержит*:
активное вещество: элотузумаб 340 мг или 440 мг,
вспомогательные вещества: натрия цитрата дигидрат 16,6 мг или 21,5 мг; лимонная кислота моногидрат 2,44 мг или 3,17 мг; сахароза 510 мг или 660 мг; полисорбат 80 3,40 мг или 4,40 мг.
* Фасовка производится с учетом перезакладки в 40 мг (13,3%) для 300 мг и 40 мг (10%) для 400 мг, что необходимо для гарантии полного извлечения заявленной дозировки. Извлекаемое количество элотузумаба в одном флаконе — 300 мг и 400 мг соответственно.
ОПИСАНИЕ
Пористая масса или порошок от белого до почти белого цвета.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА:
противоопухолевое средство, антитела моноклональные
Код ATX: L01XC23
ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
Фармакодинамика
Элотузумаб является человеческим иммуностимулирующим моноклональным IgGl антителом, которые специфически связывается с белком SLAMF7 (7 представитель в семействе сигнальных молекул активации лимфоцитов). SLAMF7 в большом количестве экснрессируется на миеломных клетках независимо от типа цитогенетических аномалий. SLAMF7 также экспрессируется на натуральных киллерах, нормальных плазматических клетках и других иммунных клетках, в том числе на некоторых Т-клетках, моноцитах, В-клетках и дендритных клетках. SLAMF7 не обнаруживается на клетках здоровых тканей и гемопоэтических стволовых клетках.
Элотузумаб напрямую активирует натуральные киллеры через SLAMF7 и Fc-рецепторы и тем самым усиливает их противомиеломную активность in vitro. Элотузумаб также связывается с SLAMF7 на миеломных клетках, что способствует их взаимодействию с натуральными киллерами и уничтожению миеломных клеток посредством антитело-зависимой клеточной цитотоксичности (АЗКЦ). В доклинических исследованиях элотузумаб показал синергетическую активность при совместном применении с леналидомидом.
Отсутствуют данные по канцерогенности или мутагенности препарата у животных и человека.
Фармакокинетика
Фармакокинетику элотузумаба изучали у пациентов с множественной миеломой, получавших препарат в дозах от 0,5 до 20 мг/кг. Элотузумаб обладает нелинейной фармакокинетикой, клиренс препарата снижается с 17,5 до 5,8 мл/день/кг при повышении дозы с 0,5 до 20 мг/кг. Это позволяет предположить, что клиренс зависит от взаимодействия с мишенью, что приводит к более чем пропорциональному увеличению площади под кривой концентрация-время (AUC). Объем распределения элотузумаба приближается к объему внутрисосудистого пространства и не зависит от дозы препарата. По результатам популяционного фармакокинетического анализа типичное значение объёма центрального распределения составляет 4,04 л. При введении элотузумаба в дозе 10 мг/кг, концентрация препарата в крови снижается приблизительно до 3% от ранее достигнутой максимальной равновесной концентрации. На мышиных моделях ксенотрансплантата было установлено, что максимальная терапевтическая эффективность препарата наблюдается при концентрации элотузумаба в плазме крови 70 мкг/мл. У человека применение элотузумаба в дозе 10 мг/кг обеспечивает достижение равновесной концентрации более 70 мкг/мл в плазме крови.
Метаболизм элотузумаба не охарактеризован. Как ожидается, в процессе катаболизма моноклональные антитела будут деградировать на небольшие пептиды и аминокислоты.
Особые группы пациентов
Клиренс элотузумаба возрастает с увеличением массы тела, что является основанием для расчета дозы препарата на массу тела пациента. Популяционный фармакокинетический анализ показал отсутствие зависимости клиренса элотузумаба от возраста (от 37 до 88 лет), пола, расы, исходной активностилактатдегидрогеназы (ЛДГ), концентрации альбумина, нарушения функции почек, а также наличия нарушения функции почек (от легкой степени до тяжелой, с необходимостью гемодиализа или без таковой) или нарушения функции печени легкой степени.
Нарушение функции почек
Фармакокинетические свойства элотузумаба были изучены при назначении комбинированной терапии с ленолидамидом и дексаметазоном у пациентов с множественной миеломой и нормальной функцией почек (клиренс креатинина более 90 мл/мин), тяжелым нарушением функции почек, не требующим проведения диализа (клиренс креатинина менее 30 мл/мин) или терминальной стадией нарушения функции почек, требующей проведения диализа (клиренс креатинина менее 30 мл/мин). Не было отмечено клинически значимых различий в клиренсе препарата у пациентов с тяжелыми нарушениями функции почек (с и без диализа) и пациентами с нормальной функцией почек.
Нарушение функции печени
Фармакокинетические свойства элотузумаба были изучены у пациентов с легкой степенью печеночной недостаточности (общий билирубин менее или равен верхней границе нормы (ВГН) и ACT выше ВГН; или общий билирубин в 1,0-1,5 раза выше ВГН или любое значение ACT) в сравнении с пациентами с нормальной функцией печени (общий билирубин и ACT в пределах нормы). Различий в клиренсе элотузумаба между вышеуказанными группами пациентов не обнаружено. Фармакокинетика препарата не изучалась у пациентов со средней степенью печеночной недостаточности (повышение общего билирубина от 1,5 до 3,0 ВГН, любое значение ACT) и тяжёлой степенью печеночной недостаточности (общий билирубин более 3,0 ВГН, любое значение ACT).
Нарушения ЭКГ
Возможное влияние элотузумаба на удлинения интервала QTc изучали у пациентов при использовании дозировок 10 и 20 мг/кг как в виде монотерапии, так и в комбинации с леналидомидом и дексаметазоном. Изменений средних значений интервала QT обнаружено не было. Анализ клинических показателей ЭКГ и концентрации элотузумаба в сыворотке крови не выявил значимого влияния препарата на реполяризацию. В клинических исследованиях не были отмечены какие-либо клинически значимые изменения частоты сердечных сокращений, длительности интервала PR, длительности комплекса QRS, атрио-вентрикулярной проводимости или деполяризация, а также случаи желудочковой тахикардии типа «пируэт».
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Элотузумаб в комбинации с леналидомидом и дексаметазоном показан для лечения пациентов с множественной миеломой, получивших один или несколько предшествующих курсов терапии.
ПРОТИВОПОКАЗАНИЯ
- Гиперчувствительность к любому компоненту препарата.
- Детский возраст до 18 лет в связи с отсутствием данных по эффективности и безопасности.
- Беременность и период грудного вскармливания в связи с отсутствием данных по эффективности и безопасности.
- Нарушение функции печени средней степени и тяжёлой степени тяжести.
- При наличии противопоказаний к применению препаратов комбинированной терапии — см. инструкции по применению соответствующих препаратов.
ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ
Применение при беременности
Исследований влияния элотузумаба на репродуктивную функцию у животных не проводилось. Исследований применения Эмплисити® у беременных женщин не проводилось. Применение элотузумаба при беременности противопоказано. Во время лечения женщинам детородного возраста рекомендуется применение контрацепции.
Комбинированная терапия
Применение препарата в комбинации с леналидомидом может вызывать тяжелые, угрожающие жизни врожденные дефекты, поэтому необходимо придерживаться требований, связанных с предохранением от беременности, включая тестирование и контрацепцию. Леналидомид проникает как в кровь, так и в сперму пациентов, поэтому во время лечения как мужчинам, так и женщинам необходимо использовать надежные методы контрацепции. Перед применением комбинированной терапии с леналидамидом необходимо ознакомиться с инструкцией по медицинскому применению препарата леналидомид.
Применение в период грудного вскармливания
Исследований касательно проникновения в грудное молоко женщин в период лактации не проводилось. Согласно общим сведениям попадание антител в грудное молоко возможно, поэтому нельзя исключить риск для новорожденного при применении препарата в период грудного вскармливания. Ввиду потенциальной опасности развития серьезных побочных реакций у ребенка, применение Эмплисити® в период грудного вскармливания противопоказано.
Влияние на фертильность
Исследований касательно влияния элотузумаба на фертильность не проводилось.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Препарат должен вводиться под руководством врача, имеющего опыт лечения множественной миеломы.
Перед введением каждой дозы Эмплисти* пациенты должны получать премедикацию.
Режим дозирования
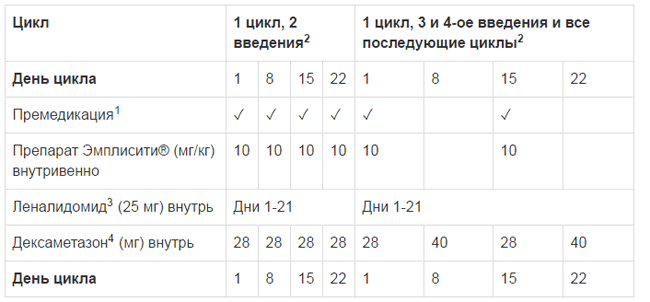
Рекомендуемая доза Эмплисити® в комбинации с дексаметазоном составляет 10 мг/кг в виде внутривенной инфузии в дни 1, 8, 15, 22 в течение первых двух 28-дневных циклов и каждые две недели в последующих циклах в дни 1 и 15. Лечение должно продолжаться до прогрессирования заболевания или до появления признаков непереносимой токсичности. Дексаметазон следует применять следующим образом:
- В дни введения Эмплисити®, дексаметазон следует принимать по 28 мг внутрь за 3-24 часа до введения Эмплисити®, а также 8 мг внутривенно за 45 — 90 минут до введения Эмплисити .
- В дни, когда Эмплисити® не вводят, но назначена доза дексаметазона, его следует принимать в дозе 40 мг внутрь.
- Рекомендуемая доза леналидомида составляет 25 мг внутрь один раз в день в дни 1 -21 каждого 28 дневного цикла, по крайней мере, за 2 часа после введения элотузумаба.
Схема введения доз представлено в Таблице 1.
Таблица 1: Рекомендованная схема введения Эмплисити® в комбинации с леналидомидом и дексаметазоном
1Премедикация следующими препаратами проводится за 45-90 минут до введения Эмплисити®: 8 мг дексаметазона внутривенно, блокатор Н1-гистаминовых рецепторов: дифенгидрамин (25-50 мг внутрь или внутривенно) или аналогичный препарат; блокатор Н2-гистаминовых рецепторов: ранитидин (50 мг внутривенно или 150 мг внутрь) или аналогичный препарат; парацетамол (650-1000 мг внутрь).
2 Цикл 28 дней
3 Не ранее чем через 2 часа после введения Эмплисити®.
4 Внутрь дексаметазон (28 мг) за 3-24 часа до введения Эмплисити®.
Инструкции по введению препарата
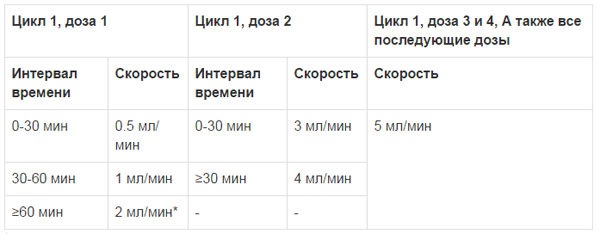
Введение Эмплисити® следует начинать со скоростью 0,5 мл в минуту. При хорошей переносимости скорость ведения можно пошагово увеличивать, как описано в Таблице 2. Максимальная скорость введения не должна превышать 5 мл в минуту.
Таблица 2: Скорость введения Эмплисити®
* Поддерживать эту скорость до завершения введения, около 1 часа, в зависимости от массы тела пациента.
Изменение режима введения
Если введение одного из препаратов приостановлено, прервано или прекращено, терапию остальными препаратами можно продолжать по расписанию. Однако, если приостановлено или прекращено применение дексаметазона, то применение Эмплисити® должно быть основано на клинической оценке риска развития реакций гиперчувствительности. При развитии инфузионных реакций 2 степени и выше, введение Эмплисити® необходимо приостановить и назначить соответствующее лечение. После снижения тяжести инфузионной реакции до 1 степени и ниже, введение Эмплисити® следует возобновить со скоростью 0.5 мл в минуту и, при хорошей переносимости, постепенно повышать на 0.5 мл в минуту каждые 30 минут до той скорости, на которой развилась инфузионная реакция. Если повторного развития инфузионных реакций не происходит, можно продолжить увеличение скорости введения по схеме (см. Таблицу 2 Скорость введения Эмплисити®).
У пациентов, у которых ранее развивались инфузионные реакции, показатели жизненно важных функций необходимо контролировать каждые 30 минут в течение 2 часов после окончания введения Эмплисити®. Если инфузионная реакция развивается снова, введение препарата следует прекратить и не возобновлять в этот день. Очень тяжелые инфузионные реакции могут потребовать отмены терапии препаратом Эмплисити и проведения неотложной терапии.
Приостановление терапии и изменение схемы терапии дексаметазоном и леналидомидом следует проводить по клиническим показаниям.
Пациенты с инфузионными реакциями легкой степени тяжести могут получать препарат Эмплисити® со сниженной скоростью введения и под тщательным наблюдением врача.
Правила приготовления раствора
Концентрат и раствор для инфузии готовят в асептических условиях.
Препарат Эмплисити® совместим со следующими типами оборудования для инфузии:
- Стеклянные флаконы, поливинилхлоридные (PVC) и полиолефиновые мешки для инфузии;
- Поливинилхлоридные (PVC) системы для внутривенного введения с автоматическим инфузионным насосом;
- Полиэфирсульфоновые (размер пор: 0,2 — 1,2 мкм) и нейлоновые (размер пор: 0,2 мкм) проточные фильтры для инфузионных систем.
Частично использованные флаконы с препаратом должны быть утилизированы, согласно местным рекомендациям.
Правила приготовления раствора
- Дозировка препарата определяется с учетом веса пациента — 10 мг/кг. На основании дозы, выписанной пациенту, определяют количество флаконов препарата, необходимых для введения. Для приготовления разовой дозы для введения на одного пациента может потребоваться более 1 флакона.
- Удаляют защитную пластиковую крышку с флакона. Пробку флакона протирают стерильной ватой, смоченной в спирте.
- Содержимое каждого флакона растворяют в воде для инъекций как указано в Таблице 3, используя шприц соответствующего объема (размер иглы 18 или меньше).
Таблица 3: Инструкции по разведению растворению Эмплисити®

- Для уменьшения пенообразования воду добавляют медленно, придерживая поршень шприца пальцами. Струю растворителя направляют строго на стенку флакона (а не на лиофилизат).
- Осторожно перемешивают круговыми движениями, держа флакон вертикально. Затем переворачивают флакон, чтобы растворить весь порошок, который может находиться в верхней части флакона или на пробке. НЕ ВСТРЯХИВАТЬ.
- Лиофилизат должен раствориться в течение 10 минут. После полного растворения, оставьте полученный раствор еще на 5-10 минут перед дальнейшим разведением.
- Полученный концентрат представляет собой прозрачную или сильно опалесцирующую жидкость от бесцветного до светло-желтого цвета. Нельзя использовать раствор другого цвета или содержащий инородные частицы. Флаконы с измененной окраской или частицами выбрасывают.
- После растворения отбирают необходимый объем концентрата из каждого флакона для рассчитанной дозы, но не более максимального -16 мл из флакона 400 мг и 12 мл из 300 мг флакона. Дальнейшее разведение проводят во флаконе стерильной инфузионной системы с помощью 230 мл 0,9 % раствора натрия хлорида для инфузий или стерильного 5 % раствора декстрозы для инфузий. Объем 0,9 % раствора натрия хлорида для инфузий или стерильного 5 % раствора декстрозы для инфузий подбирается таким образом, чтобы концентрация элотузумаба в растворе была не более чем 5 мл/кг массы тела пациента при любой вводимой дозе препарата.
- Приготовленный раствор перемешивают путем осторожного переворачивания емкости для инфузий. Не встряхивать флакон перед использованием! Приготовленный раствор нельзя замораживать.
- Перед введением необходимо провести визуальный контроль приготовленного раствора препарата на наличие механических включений и изменение цвета. Раствор Эмплисити® представляет собой прозрачный или сильно опалесцирующий раствор, от бесцветного до светло-желтого цвета.
- Препарат должен вводиться через стерильную инфузионную систему с низкой
- способностью связывания белков со стерильным, апирогенным проточным
- фильтром (размер пор 0,2 — 1,2 мкм) и автоматическим инфузионным насосом.
- Введение Эмплисити® следует начинать со скорости 0,5 мл в минуту. Если введение переносится хорошо, скорость инфузии можно постепенно повышать, как указано в Таблице 2. Максимальная скорость инфузии не должна превышать 5 мл в минуту.
- Препарат нельзя вводить в виде быстрой внутривенной инъекции или в виде болюсной инъекции.
- Не смешивать препарат Эмплисити® с другими лекарственными препаратами в одном флаконе или системе для инфузии и не вводить его одновременно с другими препаратами для инфузии.
- После введения каждой дозы Эмплисити® необходимо промыть инфузионную систему стерильным 0,9 % изотоническим раствором натрия хлорида для инфузии или стерильным 5 % раствором декстрозы для инфузии. С точки зрения микробиологической чистоты, приготовленный раствор должен использоваться немедленно. В противном случае приготовленный раствор можно хранить в защищенном от света месте до 24 часов при температуре 2 — 8 °С (Из указанных 24 часов раствор препарата может находится при комнатной температуре (20-25 °С) и дневном освещении в течение не более чем 8 часов, включая время, необходимое для введения препарата). Приготовленный раствор нельзя замораживать!
- Неиспользованный остаток Эмплисити® во флаконе и пустой флакон необходимо уничтожить.
Пациенты пожилого возраста
В клинических исследованиях различий по безопасности и эффективности между пациентами 65 лет и более и пациентами более молодого возраста (менее 65 лет) отмечено не было. Данные об эффективности и безопасности препарата у больных старше 85 лет ограничены.
Нарушение функции почек
В клинических исследованиях фармакокинетика элотузумаба в комбинированной терапии существенным образом не отличалась у пациентов с нормальной функцией почек, у пациентов с тяжелым нарушением функции почек, которое не требовало проведения диализа, и у пациентов с терминальной стадией нарушения функции почек, которое требовало проведения диализа. У пациентов с нарушениями функции почек разной степени тяжести, а также у пациентов, нуждающихся в проведении диализа, коррекция дозы Эмплитисити® не требуется.
Нарушение функции печени
У пациентов с легкой степенью тяжести печеночной недостаточности коррекция дозы Эмплисити® не требуется. У пациентов с нарушением функции печени средней или тяжелой степени клинические исследования не проводились.
ПОБОЧНОЕ ДЕЙСТВИЕ
Ниже приведены побочные реакции, отмечавшиеся у пациентов с множественной миеломой, получающих комбинированную терапию препаратом Эмплисити8. Большинство нежелательных реакций были легкими или умеренными (1 или 2 степени). Эти реакции представлены по системно-органным классам и по частоте. Частота встречаемости определяется как: очень часто (>1/10); часто (>1/100, <1/10); нечасто (>1/1000, <1/100); редко (>1/10000, <1/1000); очень редко (<1/10000).
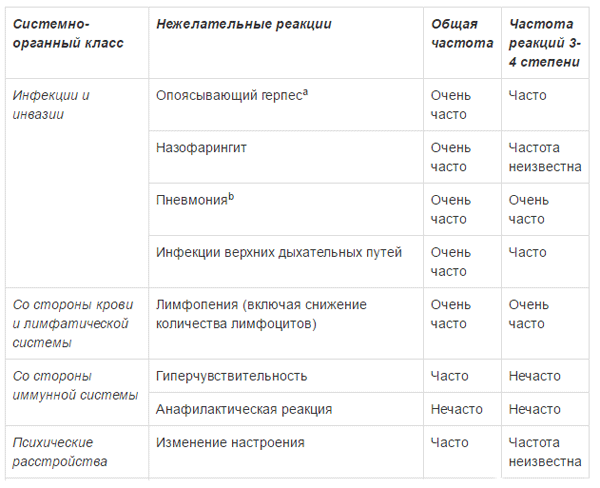
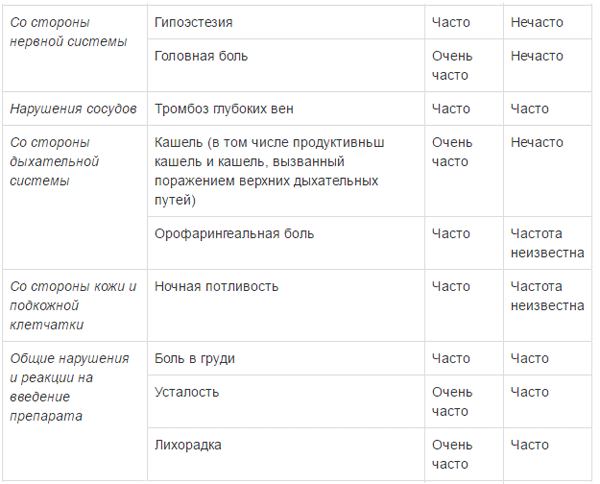
a опоясывающий герпес объединяет группу терминов: герпес Зостера, оральный герпес, герпетические вирусные инфекции b пневмония объединяет группу терминов: пневмония, атипичная пневмония, бронхопневмония, долевая пневмония, бактериальная пневмония, грибковая пневмония, гриппозная пневмония и пневмококковая пневмония
Инфузионные реакции
В клиническом исследовании с участием пациентов с множественной миеломой инфузионные реакции были отмечены примерно у 10% пациентов, которые прошли премедикацию и получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном (N=318). Частота возникновения инфузионных реакций от легкой до средней степени тяжести составила > 50% среди пациентов, которые не прошли премедикацию. Все отчеты по инфузионным реакциям относились к реакции 3 степени и ниже. Инфузионные реакции 3 степени отмечались у 1% пациентов. К наиболее часто отмечаемым симптомам инфузионной реакции относились: жар, озноб, гипертензия. 5% пациентов требовалось прерывание введения Эмплисити в среднем в течение 25 минут ввиду инфузионной реакции, а 1% пациентов прекратил лечение ввиду появления инфузионных реакций. Среди пациентов, у которых была отмечена инфузионная реакция, у 70% (23/33) отмечалось развитие реакции во время получения первой дозы.
Инфекции
Частота возникновения инфекций, включая пневмонию, была выше в группе терапии препаратом Эмплисити®, чем в контрольной группе. В клиническом исследовании с участием пациентов с множественной миеломой инфекции были отмечены у 81,4% пациентов, (К) получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном (N=318), и у 74,4% пациентов, получавших терапию леналидомидом и дексаметазоном (N=317). Инфекции 3-4 степени были отмечены у 28% пациентов, получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном, и у 24,3% пациентов, получавших терапию леналидомидом и дексаметазоном. Смертельные инфекции встречались редко и отмечались у 2,5% пациентов, получавших терапию препаратом Эмплисити® в сочетании с леналидомидом и дексаметазоном, и у 2,2% пациентов, получавших терапию леналидомидом и дексаметазоном. Частота развития пневмонии была выше в группе терапии препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном по сравнению с группой терапии леналидомидом и дексаметазоном: 15,1% и 11,7% пациентов, с летальным исходом 0,6% и 0%, соответственно.
Вторичные злокачественные новообразования
Частота развития вторичных злокачественных новообразований была выше у пациентов, (К) получавших терапию препаратом Эмплисити , чем в контрольной группе. В рамках клинического исследования с участием пациентов с множественной миеломой, инвазивные вторичные злокачественные новообразования отмечались у 6,9% пациентов, получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном (N=318), и у 4,1% пациентов, получавших терапию леналидомидом и дексаметазоном (N=317). Известно, что вторичные злокачественные новообразования связаны с воздействием леналидомида, которое отмечалось в течение более длительного периода времени у пациентов, получавших (К) комбинированную терапию препаратом Эмплисити , леналидомидом и дексаметазоном, чем среди пациентов, получавших терапию леналидомидом и дексаметазоном. Частота возникновения гематологических опухолей была одинаковой в двух группах терапии (1,6%). Солидные опухоли отмечались у 2,5% пациентов, получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном и у 1,9% пациентов, получавших терапию леналидомидом и дексаметазоном. Рак кожи (не меланома) был отмечен у 3,1% пациентов, получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном, и у 1,6% пациентов, получавших терапию леналидомидом и дексаметазоном.
Тромбоз глубоких вен
В клиническом исследовании с участием пациентов с множественной миеломой тромбозы глубоких вен были отмечены у 7,2% пациентов, получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном (N=318), и у 3,8% пациентов, получавших терапию леналидомидом и дексаметазоном (N=317). Среди пациентов, принимавших аспирин, тромбоз глубоких вен был отмечен у 4,1% пациентов, получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном, и у 1,4% пациентов, получавших терапию леналидомидом и дексаметазоном. Частота развития тромбоза глубоких вен, отмеченная среди групп терапии, была сходной для пациентов, получавших профилактическую терапию с применением низкомолекулярного гепарина (2,2% в обеих группах лечения), и для пациентов, получавших антагонисты витамина К, и показатели составили 0% для пациентов, получавших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном, и 6,7% для пациентов, получавших терапию леналидомидом и дексаметазоном.
Иммуногенность
Препарат Эмплисити*, как и другие белковые препараты, обладает иммуногенностью. У 18,5 % пациентов (получавших терапию препаратом Эмплисити , и у которых измеряли уровень соответствующих антител) наблюдалось образование антител к препарату. Нейтрализующие антитела определялись у 6,4 %. У большинства пациентов иммуногенность препарата была преходящей и наблюдалась только в начале терапии, и исчезала через 2-4 месяца. Не выявлено зависимости между наличием антител к препарату в плазме крови и изменений фармакокинетических параметров, эффективности и безопасности препарата.
ПЕРЕДОЗИРОВКА
Отмечен один случай передозировки препаратом при использовании 23,3 мг/кг элотузумаба в комбинации с леналидомидом и дексаметазоном. При этом у пациента не наблюдалось инфузионных реакций и других симптомов, и не потребовалось какое-либо дополнительное лечение, связанное с передозировкой. Пациент продолжил терапию препаратом Эмплисити®.
Максимально переносимая доза не установлена. В клинических исследованиях примерно 78 пациентов получали элотузумаб в дозе 20 мг/кг без развития токсических эффектов. При передозировке лечение должно заключаться в симптоматической лекарственной терапии в соответствии с возникающими побочными реакциями при тщательном наблюдении за пациентом.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
Фармакокинетических исследований по изучению лекарственных взаимодействий с препаратом Эмплисити* проведено не было. Препарат представляет собой человеческое моноклональное антитело. Ввиду того, что антитела не подвергаются метаболизму при участии изоферментов цитохрома Р450 и других изоферментов, ингибирование или индукция этих изоферментов не оказывают влияние на фармакокинетику элотузумаба при совместном применении с другими лекарственными препаратами. Однако, ввиду того что препарат Эмплисити® применяется в комбинации с ленолидамидом и дексаметазоном, необходимо ознакомиться с информацией о взаимодействии в инструкциях этих препаратов.
ОСОБЫЕ УКАЗАНИЯ
Инфузионные реакции
Эмплисити® может вызывать развитие инфузионных реакций. Инфузионные реакции были отмечены в клинических исследованиях приблизительно у 10% пациентов, получавших терапию препаратом Эмплисити®, леналидомидом и дексаметазоном.
Все отмеченные инфузионные реакции были не выше 3-ей степени тяжести. В клинических исследованиях при комбинированной терапии с леналидомидом и дексаметазоном инфузионные реакции 3 степени возникли у 1% пациентов. Наиболее частыми побочными реакциями были лихорадка, озноб и гипертензия. В исследовании комбинированной терапии с леналидомидом и дексаметазоном у 5% пациентов потребовалось прерывание введения препарата Эмплисити® из-за развития инфузионных реакций в среднем на 25 минуте, а у 1% пациентов препарат пришлось отменить из-за инфузионных реакций. Среди пациентов, у которых возникли инфузионные реакции, у 70% (в случае комбинации с леналидомидом и дексаметазоном) они возникали во время введения первой дозы.
Комбинированная терапия с использованием препарата
Препарат Эмплисити1 применяется в комбинации с другими препаратами; таким образом,предостережения и меры предосторожности, применяемые к этим препаратам, также будут актуальны и для комбинированной терапии, включающей элотузумаб. В том числе он потенциальный риск для плода, наличие и передачу препарата/антител со спермой и кровью и запрет на донорство крови и/или спермы. Перед началом лечения необходимо учесть указания по применению всех препаратов, применяемых в комбинации с препаратом Эмплисити®.
Инфекции
В клинических исследованиях с участием пациентов с множественной миеломой частота возникновения инфекций, включая пневмонию, была выше среди пациентов, получавших терапию препаратом Эмплисити®. Необходимо следить за состоянием пациентов и применять терапию для лечения инфекционных заболеваний.
Вторичные злокачественные новообразования
В клиническом исследовании с участием пациентов с множественной миеломой, в котором проводилось сравнение терапии препаратом Эмплисити» в сочетании с леналидомидом и дексаметазоном и терапии леналидомидом и дексаметазоном, частота появления вторичных злокачественных новообразований, а в частности солидных опухолей и рака кожи (не меланома), была выше среди пациентов, проходивших терапию препаратом Эмплисити . Известно, что вторичные злокачественные новообразования связаны с воздействием леналидомида, которое было в течение более длительного периода времени у пациентов, проходивших терапию препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном, чем среди пациентов, получавших леналидомид и дексаметазон. Частота возникновения гематологических опухолей была одинаковой в двух группах терапии. Необходимо контролировать пациентов на предмет развития вторичных злокачественных новообразований.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Исследований влияния применения препарата на способность управлять транспортными средствами и работать с механизмами не проводилось.
ФОРМА ВЫПУСКА
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий 300 мг, 400 мг.
По 340 мг или 440 мг активного вещества во флакон прозрачного бесцветного стекла типа I, укупоренный бутилрезиновой пробкой и алюминиевым колпачком с защитной пластиковой крышкой.
По 1 флакону вместе с инструкцией по применению помещают в пачку картонную. Места вскрытия картонной пачки заклеены двумя защитными прозрачными бесцветными стикерами; на среднюю часть каждого стикера, ограниченную линиями отрыва, нанесен рисунок в виде желтой сетки.
УСЛОВИЯ ХРАНЕНИЯ
Хранить при температуре от 2 до 8 °С в защищенном от света месте.
Не замораживать.
Хранить в недоступном для детей месте!
СРОК ГОДНОСТИ
3 года.
Не применять по истечении срока годности.
УСЛОВИЯ ОТПУСКА
Отпускают по рецепту.
ЮРИДИЧЕСКОЕ ЛИЦО, НА ИМЯ КОТОРОГО ВЫДАНО РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
Бристол-Майерс Сквибб Компани, США
345, Парк-авеню, г. Нью-Йорк, штат Нью-Йорк, США
Bristol-Myers Squibb Company, USA
345, Park Avenue, New York, New York, USA
ПРОИЗВОДИТЕЛЬ/ ФАСОВЩИК (ПЕРВИЧНАЯ УПАКОВКА)
Бристол-Майерс Сквибб Холдинге Фарма, Лтд. Лиабилити Компани
Роуд 686 Км 2,3 Бо. Тиеррас Нуевас, Манати, Пуэрто-Рико, 00674, США
Bristol-Myers Squibb Holdings Pharma, Ltd. Liability Company,
Road 686 Km 2.3 Bo. Tierras Nuevas, Manati, Puerto Rico, 00674, USA
УПАКОВЩИК (ВТОРИЧНАЯ УПАКОВКА)/ВЫПУСКАЮЩИЙ КОНТРОЛЬ КАЧЕСТВА
Бристол-Майерс Сквибб С.р.Л., Италия
Локалита Фонтана дель Черазо, 03012, Ананьи (ФР), Италия
Bristol-Myers Squibb S.r.L., Italy
Localita Fontana del Ceraso, 03012, Anagni (FR), Italy
Претензии потребителей направлять по адресу Представительства в РФ:
ООО «Бристол-Майерс Сквибб», 105064, г. Москва, Земляной вал, д.9
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Эмплисити® (Empliciti)
💊 Состав препарата Эмплисити®
✅ Применение препарата Эмплисити®
Описание активных компонентов препарата
Эмплисити®
(Empliciti)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.03.16
Владелец регистрационного удостоверения:
Код ATX:
L01FX08
(Элотузумаб)
Лекарственные формы
| Эмплисити® |
Лиофилизат д/пригот. концентрата д/пригот. р-ра д/инфузий 300 мг: фл. 1 шт. рег. №: ЛП-(000275)-(РГ-RU) |
|
|
Лиофилизат д/пригот. концентрата д/пригот. р-ра д/инфузий 400 мг: фл. 1 шт. рег. №: ЛП-(000275)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Эмплисити®
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий в виде пористой массы или порошка от белого до почти белого цвета.
* фасовка производится с учетом перезакладки в 40 мг (13.3%), что необходимо для гарантии полного извлечения заявленной дозировки.
Извлекаемое количество элотузумаба в 1 флаконе — 300 мг.
Вспомогательные вещества: натрия цитрата дигидрат — 16.6 мг, лимонной кислоты моногидрат — 2.44 мг, сахароза — 510 мг, полисорбат 80 — 3.4 мг.
Флаконы бесцветного стекла (1) — пачки картонные со стикерами первого вскрытия.
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий в виде пористой массы или порошка от белого до почти белого цвета.
* фасовка производится с учетом перезакладки в 40 мг (10%), что необходимо для гарантии полного извлечения заявленной дозировки.
Извлекаемое количество элотузумаба в 1 флаконе — 400 мг.
Вспомогательные вещества: натрия цитрата дигидрат — 21.5 мг, лимонной кислоты моногидрат — 3.17 мг, сахароза — 660 мг, полисорбат 80 — 4.4 мг.
Флаконы бесцветного стекла (1) — пачки картонные со стикерами первого вскрытия.
Фармакологическое действие
Элотузумаб — человеческое иммуностимулирующее моноклональное IgG1 антитело, которое специфически связывается с белком SLAMF7 (7 представитель в семействе сигнальных молекул активации лимфоцитов). SLAMF7 в большом количестве экспрессируется на миеломных клетках независимо от типа цитогенетических аномалий. SLAMF7 также экспрессируется на натуральных киллерах, нормальных плазматических клетках и других иммунных клетках, в т.ч. на некоторых Т-клетках, моноцитах, В-клетках и дендритных клетках. SLAMF7 не обнаруживается на клетках здоровых тканей и гемопоэтических стволовых клетках.
Элотузумаб напрямую активирует натуральные киллеры через SLAMF7 и Fc-рецепторы и тем самым усиливает их противомиеломную активность in vitro. Элотузумаб также связывается с SLAMF7 на миеломных клетках, что способствует их взаимодействию с натуральными киллерами и уничтожению миеломных клеток посредством антитело-зависимой клеточной цитотоксичности. В доклинических исследованиях элотузумаб показал синергетическую активность при совместном применении с леналидомидом.
Фармакокинетика
Элотузумаб обладает нелинейной фармакокинетикой, клиренс препарата снижается с 17.5 до 5.8 мл/сут/кг при повышении дозы с 0.5 до 20 мг/кг. Это позволяет предположить, что клиренс зависит от взаимодействия с мишенью, что приводит к более чем пропорциональному увеличению AUC. Vd элотузумаба приближается к объему внутрисосудистого пространства и не зависит от дозы препарата. По результатам популяционного фармакокинетического анализа типичное значение объема центрального распределения составляет 4.04 л. При введении элотузумаба в дозе 10 мг/кг концентрация препарата в крови снижается приблизительно до 3% от ранее достигнутой максимальной Css.
На мышиных моделях ксенотрансплантата было установлено, что максимальная терапевтическая эффективность препарата наблюдается при концентрации элотузумаба в плазме крови 70 мкг/мл. У человека применение элотузумаба в дозе 10 мг/кг обеспечивает достижение Css более 70 мкг/мл в плазме крови.
Метаболизм элотузумаба не охарактеризован. Как ожидается, в процессе катаболизма моноклональные антитела будут деградировать на небольшие пептиды и аминокислоты.
Клиренс элотузумаба возрастает с увеличением массы тела, что является основанием для расчета дозы на массу тела пациента.
Показания активных веществ препарата
Эмплисити®
В комбинации с леналидомидом и дексаметазоном для лечения пациентов с множественной миеломой, получивших один или несколько предшествующих курсов терапии.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Применяют в/в в виде инфузии.
Рекомендуемая доза в комбинации с дексаметазоном составляет 10 мг/кг. Схему и длительность лечения устанавливают в зависимости от клинической ситуации.
Побочное действие
Инфекции и инвазии: очень часто — опоясывающий герпес, инфекции верхних дыхательных путей.
Со стороны системы кроветворения: очень часто — лимфопения.
Аллергические реакции: часто — реакции гиперчувствительности; нечасто — анафилактическая реакция.
Психические нарушения: часто — изменение настроения.
Со стороны нервной системы: очень часто — головная боль; часто — гипестезия.
Со стороны сердечно-сосудистой системы: часто — тромбоз глубоких вен.
Со стороны дыхательной системы: очень часто — назофарингит, кашель (в т.ч. продуктивный кашель и кашель, вызванный поражением верхних дыхательных путей), пневмония; часто — орофарингеальная боль.
Со стороны пищеварительной системы: очень часто — диарея.
Со стороны кожи и подкожных тканей: часто — повышенное потоотделение по ночам.
Прочие: очень часто — усталость, лихорадка, снижение массы тела; часто — инфузионные реакции, боль в груди.
Противопоказания к применению
Повышенная чувствительность к элотузумабу; нарушение функции печени средней и тяжелой степени; наличие противопоказаний к применению препаратов комбинированной терапии; беременность, период грудного вскармливания; возраст до 18 лет.
Применение при беременности и кормлении грудью
Применение элотузумаба при беременности противопоказано.
Во время лечения женщинам детородного возраста рекомендуется применение контрацепции.
Ввиду потенциальной опасности развития серьезных побочных реакций у ребенка применение элотузумаба в период грудного вскармливания противопоказано.
Применение при нарушениях функции печени
У пациентов с легкой степенью тяжести печеночной недостаточности коррекция дозы не требуется.
При нарушении функции печени средней и тяжелой степени применение элотузумаба противопоказано.
Применение при нарушениях функции почек
У пациентов с нарушениями функции почек разной степени тяжести, а также у пациентов, нуждающихся в проведении диализа, коррекция дозы не требуется.
Применение у детей
Противопоказано применение у пациентов в возрасте до 18 лет.
Применение у пожилых пациентов
Нет данных.
Особые указания
Элотузумаб может вызывать развитие инфузионных реакций. Инфузионные реакции были отмечены в клинических исследованиях приблизительно у 10% пациентов, получавших терапию элотузумабом, леналидомидом и дексаметазоном. Наиболее частыми побочными реакциями были лихорадка, озноб и артериальная гипертензия.
В клинических исследованиях с участием пациентов с множественной миеломой частота возникновения инфекций, включая пневмонию, была выше среди пациентов, получавших терапию элотузумабом. Необходимо следить за состоянием пациентов и применять стандартную терапию для лечения инфекционных заболеваний.
Частота развития вторичных злокачественных новообразований была выше у пациентов, получавших терапию элотузумабом, чем в контрольной группе. Известно, что вторичные злокачественные новообразования связаны с воздействием леналидомида, которое отмечалось в течение более длительного периода времени у пациентов, получавших комбинированную терапию элотузумабом, леналидомидом и дексаметазоном, чем среди пациентов, получавших терапию леналидомидом и дексаметазоном. Необходимо контролировать пациентов на предмет развития вторичных злокачественных новообразований.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Инструкция по применению Эмплисити
- Состав
- Показания к применению
- Противопоказания к применению
- Рекомендации по применению
- Фармакологическое действие
- Особые указания
- Условия отпуска
Состав
Активное вещество: элотузумаб.
Вспомогательные вещества: натрия цитрата дигидрат — 21.5 мг, лимонной кислоты моногидрат — 3.17 мг, сахароза — 660 мг, полисорбат 80 — 4.4 мг.
Показания к применению Эмплисити
Элотузумаб в комбинации с леналидомидом и дексаметазоном показан для лечения пациентов с множественной миеломой, получивших один или несколько предшествующих курсов терапии.
Противопоказания к применению Эмплисити
- Гиперчувствительность к любому компоненту препарата.
- Детский возраст до 18 лет в связи с отсутствием данных по эффективности и безопасности.
- Беременность и период грудного вскармливания в связи с отсутствием данных по эффективности и безопасности.
- Нарушение функции печени средней степени и тяжёлой степени тяжести.
- При наличии противопоказаний к применению препаратов комбинированной терапии — см. инструкции по применению соответствующих препаратов.
Рекомендации по применению
Препарат должен вводиться под руководством врача, имеющего опыт лечения множественной миеломы.
Перед введением каждой дозы Эмплисити пациенты должны получать премедикацию.
Режим дозирования
Рекомендуемая доза Эмплисити в комбинации с дексаметазоном составляет 10 мг/кг в виде внутривенной инфузии в дни 1, 8, 15, 22 в течение первых двух 28-дневных циклов и каждые две недели в последующих циклах в дни 1 и 15. Лечение должно продолжаться до прогрессирования заболевания или до появления признаков непереносимой токсичности. Дексаметазон следует применять следующим образом:
- В дни введения Эмплисити, дексаметазон следует принимать по 28 мг внутрь за 3- 24 часа до введения Эмплисити, а также 8 мг внутривенно за 45 — 90 минут до введения Эмплисити.
- В дни, когда Эмплисити не вводят, но назначена доза дексаметазона, его следует принимать в дозе 40 мг внутрь.
- Рекомендуемая доза леналидомида составляет 25 мг внутрь один раз в день в дни 1-21 каждого 28 дневного цикла, по крайней мере, за 2 часа после введения элотузумаба.
Фармакологическое действие
Элотузумаб является человеческим иммуностимулирующим моноклональным IgGl антителом, которые специфически связывается с белком SLAMF7 (7 представитель в семействе сигнальных молекул активации лимфоцитов). SLAMF7 в большом количестве экспрессируется на миеломных клетках независимо от типа цитогенетических аномалий. SLAMF7 также экспрессируется на натуральных киллерах, нормальных плазматических клетках и других иммунных клетках, в том числе на некоторых Т-клетках, моноцитах, В-клетках и дендритных клетках. SLAMF7 не обнаруживается на клетках здоровых тканей и гемопоэтических стволовых клетках.
Элотузумаб напрямую активирует натуральные киллеры через SLAMF7 и Fc-рецепторы и тем самым усиливает их противомиеломную активность in vitro. Элотузумаб также связывается с SLAMF7 на миеломных клетках, что способствует их взаимодействию с натуральными киллерами и уничтожению миеломных клеток посредством антителозависимой клеточной цитотоксичности (АЗКЦ). В доклинических исследованиях элотузумаб показал синергетическую активность при совместном применении с леналидомидом.
Особые указания
Инфузионные реакции
Эмплисити может вызывать развитие инфузионных реакций. Инфузионные реакции были отмечены в клинических исследованиях приблизительно у 10% пациентов, получавших терапию препаратом Эмплисити, леналидомидом и дексаметазоном.
Все отмеченные инфузионные реакции были не выше 3-ей степени тяжести. В клинических исследованиях при комбинированной терапии с леналидомидом и дексаметазоном инфузионные реакции 3 степени возникли у 1% пациентов. Наиболее частыми побочными реакциями были лихорадка, озноб и гипертензия. В исследовании комбинированной терапии с леналидомидом и дексаметазоном у 5% пациентов потребовалось прерывание введения препарата Эмплисити из-за развития инфузионных реакций в среднем на 25 минуте, а у 1% пациентов препарат пришлось отменить из-за инфузионных реакций. Среди пациентов, у которых возникли инфузионные реакции, у 70% (в случае комбинации с леналидомидом и дексаметазоном) они возникали во время введения первой дозы.
Комбинированная терапия с использованием препарата
Препарат Эмплисити применяется в комбинации с другими препаратами; таким образом, предостережения и меры предосторожности, применяемые к этим препаратам, также будут актуальны и для комбинированной терапии, включающей элотузумаб. В том числе он включают потенциальный риск для плода, наличие и передачу препарата/антител со спермой и кровью и запрет на донорство крови и/или спермы. Перед началом лечения необходимо учесть указания по применению всех препаратов, применяемых в комбинации с препаратом Эмплисити.
Инфекции
В клинических исследованиях с участием пациентов с множественной миеломой частота возникновения инфекций, включая пневмонию, была выше среди пациентов, получавших терапию препаратом Эмплисити. Необходимо следить за состоянием пациентов и применять стандартную терапию для лечения инфекционных заболеваний.
Вторичные злокачественные новообразования
В клиническом исследовании с участием пациентов с множественной миеломой, в котором проводилось сравнение терапии препаратом Эмплисити в сочетании с леналидомидом и дексаметазоном и терапии леналидомидом и дексаметазоном, частота появления вторичных злокачественных новообразований, а в частности солидных опухолей и рака кожи (не меланома), была выше среди пациентов, проходивших терапию препаратом Эмплисити. Известно, что вторичные злокачественные новообразования связаны с воздействием леналидомида, которое было в течение более длительного периода времени у пациентов, проходивших терапию препаратом Эмплисити® в сочетании с леналидомидом и дексаметазоном, чем среди пациентов, получавших леналидомид и дексаметазон. Частота возникновения гематологических опухолей была одинаковой в двух группах терапии. Необходимо контролировать пациентов на предмет развития вторичных злокачественных новообразований.
Условия отпуска
Отпускается по рецепту
Эмплисити 400 мг 1шт. лиофилизат
Инструкция по применению Эмплисити 400 мг 1шт. лиофилизат
Форма выпуска, упаковка и состав
Лиофилизат для приготовления концентрата для приготовления раствора для инфузий в виде пористой массы или порошка от белого до почти белого цвета.
* фасовка производится с учетом перезакладки в 40 мг (10%), что необходимо для гарантии полного извлечения заявленной дозировки.
Извлекаемое количество элотузумаба в 1 флаконе — 400 мг.
Вспомогательные вещества: натрия цитрата дигидрат — 21.5 мг, лимонной кислоты моногидрат — 3.17 мг, сахароза — 660 мг, полисорбат 80 — 4.4 мг.
Флаконы бесцветного стекла (1) — пачки картонные со стикерами первого вскрытия.
Фармакологическое действие
Элотузумаб — человеческое иммуностимулирующее моноклональное IgG1 антитело, которое специфически связывается с белком SLAMF7 (7 представитель в семействе сигнальных молекул активации лимфоцитов). SLAMF7 в большом количестве экспрессируется на миеломных клетках независимо от типа цитогенетических аномалий. SLAMF7 также экспрессируется на натуральных киллерах, нормальных плазматических клетках и других иммунных клетках, в т.ч. на некоторых Т-клетках, моноцитах, В-клетках и дендритных клетках. SLAMF7 не обнаруживается на клетках здоровых тканей и гемопоэтических стволовых клетках.
Элотузумаб напрямую активирует натуральные киллеры через SLAMF7 и Fc-рецепторы и тем самым усиливает их противомиеломную активность in vitro. Элотузумаб также связывается с SLAMF7 на миеломных клетках, что способствует их взаимодействию с натуральными киллерами и уничтожению миеломных клеток посредством антитело-зависимой клеточной цитотоксичности. В доклинических исследованиях элотузумаб показал синергетическую активность при совместном применении с леналидомидом.
Фармакокинетика
Элотузумаб обладает нелинейной фармакокинетикой, клиренс препарата снижается с 17.5 до 5.8 мл/сут/кг при повышении дозы с 0.5 до 20 мг/кг. Это позволяет предположить, что клиренс зависит от взаимодействия с мишенью, что приводит к более чем пропорциональному увеличению AUC. Vd элотузумаба приближается к объему внутрисосудистого пространства и не зависит от дозы препарата. По результатам популяционного фармакокинетического анализа типичное значение объема центрального распределения составляет 4.04 л. При введении элотузумаба в дозе 10 мг/кг концентрация препарата в крови снижается приблизительно до 3% от ранее достигнутой максимальной Css.
На мышиных моделях ксенотрансплантата было установлено, что максимальная терапевтическая эффективность препарата наблюдается при концентрации элотузумаба в плазме крови 70 мкг/мл. У человека применение элотузумаба в дозе 10 мг/кг обеспечивает достижение Css более 70 мкг/мл в плазме крови.
Метаболизм элотузумаба не охарактеризован. Как ожидается, в процессе катаболизма моноклональные антитела будут деградировать на небольшие пептиды и аминокислоты.
Клиренс элотузумаба возрастает с увеличением массы тела, что является основанием для расчета дозы на массу тела пациента.
Показания
В комбинации с леналидомидом и дексаметазоном для лечения пациентов с множественной миеломой, получивших один или несколько предшествующих курсов терапии.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Применяют в/в в виде инфузии.
Рекомендуемая доза в комбинации с дексаметазоном составляет 10 мг/кг. Схему и длительность лечения устанавливают в зависимости от клинической ситуации.
Побочное действие
Инфекции и инвазии: очень часто — опоясывающий герпес, инфекции верхних дыхательных путей.
Со стороны системы кроветворения: очень часто — лимфопения.
Аллергические реакции: часто — реакции гиперчувствительности; нечасто — анафилактическая реакция.
Психические нарушения: часто — изменение настроения.
Со стороны нервной системы: очень часто — головная боль; часто — гипестезия.
Со стороны сердечно-сосудистой системы: часто — тромбоз глубоких вен.
Со стороны дыхательной системы: очень часто — назофарингит, кашель (в т.ч. продуктивный кашель и кашель, вызванный поражением верхних дыхательных путей), пневмония; часто — орофарингеальная боль.
Со стороны пищеварительной системы: очень часто — диарея.
Со стороны кожи и подкожных тканей: часто — повышенное потоотделение по ночам.
Прочие: очень часто — усталость, лихорадка, снижение массы тела; часто — инфузионные реакции, боль в груди.
Противопоказания к применению
Повышенная чувствительность к элотузумабу; нарушение функции печени средней и тяжелой степени; наличие противопоказаний к применению препаратов комбинированной терапии; беременность, период грудного вскармливания; возраст до 18 лет.
Применение при беременности и кормлении грудью
Применение элотузумаба при беременности противопоказано.
Во время лечения женщинам детородного возраста рекомендуется применение контрацепции.
Ввиду потенциальной опасности развития серьезных побочных реакций у ребенка применение элотузумаба в период грудного вскармливания противопоказано.
Применение при нарушениях функции печени
У пациентов с легкой степенью тяжести печеночной недостаточности коррекция дозы не требуется.
При нарушении функции печени средней и тяжелой степени применение элотузумаба противопоказано.
Применение при нарушениях функции почек
У пациентов с нарушениями функции почек разной степени тяжести, а также у пациентов, нуждающихся в проведении диализа, коррекция дозы не требуется.
Применение у детей
Противопоказано применение у пациентов в возрасте до 18 лет.
Применение у пожилых пациентов
Нет данных.
Особые указания
Элотузумаб может вызывать развитие инфузионных реакций. Инфузионные реакции были отмечены в клинических исследованиях приблизительно у 10% пациентов, получавших терапию элотузумабом, леналидомидом и дексаметазоном. Наиболее частыми побочными реакциями были лихорадка, озноб и артериальная гипертензия.
В клинических исследованиях с участием пациентов с множественной миеломой частота возникновения инфекций, включая пневмонию, была выше среди пациентов, получавших терапию элотузумабом. Необходимо следить за состоянием пациентов и применять стандартную терапию для лечения инфекционных заболеваний.
Частота развития вторичных злокачественных новообразований была выше у пациентов, получавших терапию элотузумабом, чем в контрольной группе. Известно, что вторичные злокачественные новообразования связаны с воздействием леналидомида, которое отмечалось в течение более длительного периода времени у пациентов, получавших комбинированную терапию элотузумабом, леналидомидом и дексаметазоном, чем среди пациентов, получавших терапию леналидомидом и дексаметазоном. Необходимо контролировать пациентов на предмет развития вторичных злокачественных новообразований.

Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 98 890
Форма выпуска, состав и упаковка
На современном фармакологическом рынке лекарственное средство Эмплисити представлено в форме лиофилизированного порошка для приготовления инъекционного раствора. Лиофилизат помещен в стеклянный флакон, флакон выполнен из прозрачного стекла, укупорен бутилрезиновой крышкой для предотвращения попадания влаги внутрь флакона. Лиофилизат имеет белый цвет, пористую консистенцию без видимых неоднородных включений.
Активное действующее вещество лекарства – элотузумаб. В одном флаконе содержится 0,3 или 0,4 г АДВ, в качестве вспомогательных веществ выступают натрия цитрата дигидрат , лимонная кислота моногидрат, сахароза, полисорбат.
Фармакологическое действие
В 2015 году FDA одобрило применение лекарственного средтсва Эмплисити для лечения множественной миеломы в составе комбинированной терапии с Леналидомидом и глюкокортикостероидами. Медикаментозное средство – это гуманизированное моноклональное антитело, связываемое с мембранными белками, вырабатываемыми клетками миеломы.
Эмплисити относится к группе противоопухолевых средств. В ходе клинических испытаний механизм метаболизма не установлен, предполагается, что в процессе метаболизма вещество будет распадаться на аминокислоты и пептиды.
Показатель скорости очищения биологических сред зависим от массы тела пациента и возрастает с ростом ИМТ, и не зависит от возраста больного. В ходе клинических испытаний проводились исследования этого показателя в пациентов от 37 до 88 лет.
Показания
Показанием для инфузий Эмплисити является множественная миеломная болезнь I, II, и III стадии по классификации Дьюри-Сальмона. Медикаментозное средство рекомендуется использовать в комбинации, в которую помимо Эмплисити входят леналидомид и дексаметазон.
Противопоказания
Обязательно получите консультацию химиотерапевта, у препарата есть противопоказания:
-непереносимость одного из компонентов лекарства;
-беременность и лактация;
-печеночная недостаточность средней и тяжелой формы.
Из-за отсутствия клинического опыта препарат не рекомендуется применять у пациентов детского и пубертатного возраста.
Кроме того, при назначении терапии, следует учитывать противопоказания к применению дексаметазона и леналидомида.
Способ применения и дозы
Выбор индивидуальной терапевтической дозы Эмплисити – прерогатива врача. Перед введением каждой дозы Эмплисити больные должны пройти предварительную медикаментозную подготовку для снижения тревожности.
Рекомендуемая терапевтическая доза медикаментозного средства в сочетании с дексаметазоном — 10 мг/кг в форме раствора для внутривенных инфузий. Применяется в 1, 8, 15,22 день первых двух месячных циклов терапии, а в последующих циклах в первый и пятнадцатый день.
В дни, когда планируется внутривенная инфузия Эмплисити, больной должен принять Дексаметазон (28 мг) per os за 3-24 часа до введения лекарства, а затем получить внутривенную инъекцию не позже, чем за 1,5 часа до инфузии Эмплисити.
В дни, когда планируется внутривенная инфузия Эмплисити, больной должен принимать Леналидомид (25 мг) per os не позже, чем за 120 минут после инфузии Эмплисити.
Имеются специальные указания, касающиеся изменения режима введения Эмплисити. Так, если по каким-то причинам из терапевтической схемы выводится один из препаратов комплексной терапии, лечение оставшимися в схеме медикаментами необходимо продолжать по расписанию.
В случае, если приостановлен прием Дексаметазон, врач должен оценить риски возникновения иммуноаллергических реакций и потенциальную пользу введения Эмплисити.
При возникновении инфузионных осложнений введение медикаментозного средства нужно прекратить. Выраженные инфузионные осложнения требуют прекращения терапии Эмплисити и проведения мер интенсивной терапии в условиях медицинского стационара.
При возникновении слабо выраженных осложнений инфузионной терапии отмены препарата не требуется. Скорость введения медикаментозного средства должна быть снижена.
Побочные действия
Рассмотрим побочные действия медикаментозного средства. Чтобы понимать потенциальную опасность, которая может возникать как при передозировке, так и при использовании лекарства в рекомендованных вачом дозах, обозначим негативные реакции организма на лекарство как наиболее частые (более 1/10), частые (более 1/100, но менее чем 1/10), нечастые (более 1/1000 , но менее 1/100) и очень редкие (менее 1/10000):
-Наиболее частые – диспепсические растройства, пневмонии, возникновение герпевирусной инфекции, затруднение носового дыхания, назофарингит, головные боли, кашель, астения, снижение ИМТ, повышение температуры тела.
-К частым побочным явлениям можно отнести индивидуальную непереносимость одного из компонентов средства, психоэмоциональную лабильность, снижение чувствительности кожных покровов к раздражителям, тромбоз вен, повышение уровня потоотделения, особенно в ночное время суток, болевые ощущения в груди, постинфузионные осложнения.
-Нечастые – анафилактические реакции,
Передозировка
В ходе клинических исследований не получено данных о реакциях организма вследствие передозировки лекарственным средством, а max переносимая дозировка не выяснена. Зафиксирован случай применения больному множественной миеломой Эмплисити в дозе 23,3 мг/кг в сочетанной терапии с Дексаметазон и Леналидомид. У больного не выявлено инфузионных осложнений либо симптоматики побочных явлений, а терапии, связанной с передозировкой не потребовалось.
Лекарственное взаимодействие
Клинические испытания на предмет изучения лекарственных взаимодействий с медикаментозным средством Эмплисити не проводились.
Особые указания
Данных о развитии негативных реакций организма на лекарство у больных с печеночной недостаточностью не получено. В случае если лечение требуется пациентам с таким диагнозом в умеренных и легких формах, лечение должно проходить под строгим врачебным контролем.
Лекарственное средство не должно применяться в период беременности и лактации. Если вы подозреваете беременность, проинформируйте врача об этом факте до назначения препарата.
В силу ограниченности клинических данных препарат не назначается пациентам в детском и пубертатном возрасте.
Нарушения почечных функций не является противопоказанием к лечению Эмплисити.
Накопленный клинический опыт позволяет назначать медикаментозное средство больным с диагностированными нарушениями функционирования мочевыводящей системы и почек.
В ходе клинических испытаний не выявлен механизм взаимодействия АДВ препарата с алкоголем, однако от употребления спиртных напитков на период терапии рекомендуется отказаться.
Во время лечения медикаментозным средством доктор должен осуществлять контроль на предмет развития у пациента вторичных опухолей.
Медикаментозное средство может вызывать инфузионные осложнения. В ходе клинических исследований инфузионные реакции зафиксированы у 1/10 от общего количества больных, получавших рекомендованную комплексную терапию, однако тяжесть инфузионных реакций не превышала 3-ю степень.
При испытаниях на контрольной группе пациентов влияние на способность концентрации внимания не выявлено, однако, учитывая, что лекарство может способствовать возникновению таких побочных явлений, как головная боль, головокружение, пациентам, принимающим терапию, следует отказаться от занятий, требующих повышенной концентрации внимания.
Препарат обладает потенциальной способностью вызывать иммунный ответ организма вне зависимости от его иммунной специфичности. В ходе клинических испытаний нейтрализующие антитела выявлены у 6,4 % пациентов.
Скорость введение инфузионного раствора не должна превышать 0,5 мл в 60 секунд в начальном периоде терапии. В зависимости от самочувствия пациента, отсутствию негативных реакций организма на лекарственное средство последующая скорость введения инфузионного раствора может быть увеличена.
Запрещено введение препарата вне условий больничного стационара. Лиофилизат разводится исключительно стерильной водой для инъекций.
Подготовка ИР должна проводиться квалифицированным медицинским персоналом. Флакон после введения растворяющей воды для инфузий запрещено встряхивать, перемешивание должно осуществляться путем медленного переворачивания флакона. Готовить инфузионный раствор необходимо непосредственно перед манипуляцией. Перед введением приготовленного раствора его необходимо осмотреть на наличие посторонних включений, а также оценить цвет раствора: в норме он может варьироваться от полностью бесцветного до светло-желтого. Раствор должен быть прозрачным, без механических примесей.
Запрещается введение препарата в виде внутривенной инъекции, смешивание с иными медикаментозными средствами в одной инфузионной системе, одновременное введение с другими лекарствами.
Приготовленный инфузионный раствор при необходимости может храниться при T не более 8 градусов Цельсия не больше суток, замораживать раствор категорически запрещается.
Сроки и условия хранения
Лекарство не требует создания особых условий хранения. К месту хранения лекарственного препарата доступ детей должен быть ограничен. Рекомендованная T хранения не более 8 градусов Цельсия. Не применяйте лекарство после истечения срока пригодности, который составляет не более 36 месяцев. Вскрывать флакон необходимо непосредственно перед приготовлением инъекционного раствора в силу высокой гигроскопичности медикаментозного средства. Избегайте попадания на лекарство прямых солнечных лучей.
Препарат относится к группе лекарств рецептурного отпуска из аптек. Перед применением в обязательном порядке ознакомьтесь с аннотацией по использованию препарата, которая есть в упаковке с медикаментозным средством.
Купить Эмплисити в Москве и других регионах России можно в нашей интернет аптеке. Все вопросы, связанные с покупкой и доставкой препарата, можно уточнить по телефону или посредством формы обратной связи. Согласно законодательству Российской Федерации (Постановление правительства Российской федерации от 19.01.1998 № 55) лекарственные препараты как товар не подлежат возврату и обмену.
Цены на Эмплисити в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 98 890 руб.