Для оценки частоты нежелательных явлений использовалась классификация согласно рекомендациям ВОЗ: очень часто (≥ 10%), часто (≥ 1% и
Ниже приведен перечень нежелательных явлений, зарегистрированных у пациентов, получавших препарат Экстимия® после цитотоксической химиотерапии, и у здоровых добровольцев в рамках клинического исследования. Подавляющее большинство нежелательных явлений были обусловлены основным злокачественным заболеванием или цитотоксической химиотерапией и не были связаны с применением препарата Экстимия®.
Инфекционные и паразитарные заболевания
Часто: острая респираторная вирусная инфекция.
Нарушения со стороны крови и лимфатической системы
Очень часто: анемия, тромбоцитопения, лейкоцитоз, нейтрофилез, лимфоцитоз, лейкопения, нейтропения и лимфопения.
Часто: фебрильная нейтропения.
Лейкопения, нейтропения, лимфопения, и фебрильная нейтропения, по всей вероятности, связаны с использовавшимися химиопрепаратами. У здоровых добровольцев зафиксирован случай увеличения селезенки.
Нарушения со стороны нервной системы
Часто: головная боль, головокружение, парестезии, сенсорная нейропатия.
Нарушения со стороны органа зрения
Часто: слезотечение.
Нарушения со стороны сердца
Часто: тахикардия, аритмия.
Нарушения со стороны сосудов
Часто: артериальная гипо — и гипертензия, флебит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Часто: кашель, сухость слизистой оболочки носа.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: тошнота, диарея.
Часто: стоматит, рвота, боль в животе, диспепсия, запор, геморрой, отрыжка, зуд десен, потеря аппетита.
Нарушения со стороны печени и желчевыводящих путей
Очень часто: повышение общего билирубина, повышение аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы, лактатдегидрогеназы.
Часто: повышение гамма-глутамилтранспептидазы, боль в правом подреберье, гепатотоксичность.
Нарушения со стороны кожи и подкожных тканей
Очень часто: алопеция.
Часто: сухость кожи лица, гиперемия кожи лица, зуд кожи, изменение ногтей.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Очень часто: артралгия, оссалгия.
Часто: миалгия, боль в спине, боль в конечностях.
Оссалгии и артралгии являются характерными для препаратов Г-КСФ нежелательными реакциями. Как правило, они слабые или умеренные и купируются самостоятельно.
Нарушения со стороны почек и мочевыводящих путей
Очень часто: гиперкреатининемия.
Часто — повышение уровня мочевины, протеинурия, бактериурия, лейкоцитурия.
Нарушения со стороны половых органов и молочной железы
Часто: боли в области молочной железы, маточное кровотечение.
Общие расстройства и нарушения в месте введения
Очень часто: повышение температуры тела, слабость, утомляемость.
Часто: местные реакции (гиперемия кожи в месте введения), отеки, астения, гриппоподобный синдром, лимфостаз.
Лабораторные и инструментальные данные
Очень часто: гипергликемия, гиперальбуминемия, гиперкалиемия, гиперхлоремия.
Часто: гипернатриемия, гиперурикемия.
Форма выпуска, упаковка и состав
препарата Экстимия®
Раствор для п/к введения прозрачный, бесцветный.
Вспомогательные вещества: натрия ацетата тригидрат — 0.23 мг, уксусная кислота ледяная — до pH 4.0, маннитол — 50 мг, вода д/и — до 1 мл.
1 мл — шприцы бесцветного стекла (1) — упаковки ячейковые контурные из пленки ПВХ (1) — пачки картонные.
Фармакологическое действие
Ковалентный конъюгат филграстима (рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора, рчГКСФ) с одной молекулой полиэтиленгликоля с молекулярной массой 30 кДа, с пролонгированным действием в результате снижения почечного клиренса.
Эмпэгфилграстим связывается с рецептором Г-КСФ подобно филграстиму и пэгфилграстиму. Аналогично филграстиму, эмпэгфилграстим регулирует образование и высвобождение нейтрофилов из костного мозга, заметно увеличивает количество нейтрофилов с нормальной или повышенной функциональной активностью (хемотаксис и фагоцитоз) в периферической крови в течение 24 ч и вызывает небольшое увеличение количества моноцитов и/или лимфоцитов.
Фармакокинетика
У здоровых добровольцев после однократного п/к введения эмпэгфилграстима в различных дозах (3-9 мг) Cmax в крови достигалась в среднем через 36-48 ч. У больных раком молочной железы, получающих химиотерапию комбинацией доцетаксела и доксорубицина, во время первого цикла химиотерапии после однократного п/к введения эмпэгфилграстима в дозе 7.5 мг Сmax достигалась в крови в среднем через 61 ч, а Т1/2 составил 78 ч. Концентрация эмпэгфилграстима в сыворотке поддерживается в течение периода нейтропении после миелосупрессивной химиотерапии.
Выведение эмпэгфилграстима нелинейное, дозозависимое, насыщаемое. Клиренс в основном осуществляется нейтрофилами. В соответствии с саморегулирующимся механизмом клиренса, концентрация эмпэгфилграстима в сыворотке медленно снижается во время преходящего снижения числа нейтрофилов, связанного с химиотерапией, и быстро — после начала восстановления числа нейтрофилов. У больных раком молочной железы, получающих химиотерапию комбинацией доцетаксела и доксорубицина, во время первого цикла химиотерапии после однократного п/к введения эмпэгфилграстима в дозе 7.5 мг медиана клиренса составила 368.8 мл/(ч×кг).
Показания активных веществ препарата
Экстимия®
Для снижения продолжительности нейтропении, частоты возникновения фебрильной нейтропении и инфекций, проявляющихся фебрильной нейтропенией, при цитостатической терапии по поводу злокачественных новообразований.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
П/к, однократно в дозе 7.5 мг не менее чем через 24 ч после окончания введения химиопрепаратов.
Побочное действие
Инфекционные и паразитарные заболевания: часто — острая респираторная вирусная инфекция.
Со стороны системы кроветворения: очень часто — анемия, тромбоцитопения, лейкоцитоз, нейтрофилез, лимфоцитоз, лейкопения, нейтропения и лимфопения; часто — фебрильная нейтропения. У здоровых добровольцев зафиксирован случай увеличения селезенки.
Со стороны нервной системы: часто — головная боль, головокружение, парестезии, сенсорная невропатия.
Со стороны органа зрения: часто — слезотечение.
Со стороны сердечно-сосудистой системы: часто — тахикардия, аритмия, артериальная гипотензия и гипертензия, флебит.
Со стороны дыхательной системы: часто — кашель, сухость слизистой оболочки носа.
Со стороны пищеварительной системы: очень часто — тошнота, диарея, повышение общего билирубина, повышение активности АСТ, АЛТ, ЩФ, ЛДГ; часто — стоматит, рвота, боль в животе, диспепсия, запор, геморрой, отрыжка, зуд десен, потеря аппетита, повышение активности ГГТ, боль в правом подреберье, гепатотоксичность.
Со стороны кожи и подкожно-жировой клетчатки: очень часто — алопеция; часто — сухость кожи лица, гиперемия кожи лица, зуд кожи, изменение ногтей.
Со стороны костно-мышечной системы: очень часто — артралгия, оссалгия; часто — миалгия, боль в спине, боль в конечностях.
Со стороны мочевыделительной системы: очень часто — гиперкреатининемия; часто — повышение уровня мочевины, протеинурия, бактериурия, лейкоцитурия.
Со стороны половых органов и молочной железы: часто — боли в области молочной железы, маточное кровотечение.
Прочие: очень часто — повышение температуры тела, слабость, утомляемость; часто — местные реакции (гиперемия кожи в месте введения), отеки, астения, гриппоподобный синдром, лимфостаз.
Лабораторные и инструментальные данные: очень часто — гипергликемия, гиперальбуминемия, гиперкалиемия, гиперхлоремия; часто — гипернатриемия, гиперурикемия.
Противопоказания к применению
Повышенная чувствительность к эмпэгфилграстиму, филграстиму, пэгфилграстиму, пегилированным белкам, белкам, полученным с использованием Е. coli; нейтропения при хроническом миелолейкозе и миелодиспластических синдромах; острый лейкоз; для увеличения доз цитотоксической химиотерапии выше установленных в режимах дозирования; одновременное назначение с цитотоксической химио- и лучевой терапией; беременность и период грудного вскармливания; возраст до 18 лет.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации.
Применение при нарушениях функции печени
Пациенты с печеночной недостаточностью коррекции дозы не требуется.
Применение при нарушениях функции почек
Пациентам с почечной недостаточностью коррекции дозы не требуется.
Применение у детей
Противопоказано применение в возрасте до 18 лет.
Особые указания
С осторожностью следует назначать эмпэгфилграстим при злокачественных и предопухолевых заболеваниях миелоидного характера (в т.ч. острый миелолейкоз de novo и вторичный), в комбинации с высокодозной химиотерапией.
Не следует применять эмпэгфилграстим менее чем за 14 дней до, во время и менее чем через 24 ч после введения цитотоксических химиотерапевтических средств.
Необходимо отменить запланированное введение эмпэгфилграстима при повышении общего количества лейкоцитов выше 50×109/л.
Г-КСФ стимулирует эндотелиальные клетки и может ускорять рост миелоидных клеток, включая злокачественные клетки и некоторые немиелоидные клетки in vitro.
Кашель, лихорадка и одышка в сочетании с рентгенологическими инфильтративными изменениями, ухудшением функции легких и увеличением количества нейтрофилов могут служить признаками респираторного дистресс-синдрома у взрослых. В таком случае эмпэгфилграстим следует отменить и назначить соответствующее лечение.
Зарегистрированы очень редкие случаи разрыва селезенки после применения препаратов пегилированного филграстима, некоторые — с фатальным исходом, поэтому следует тщательно наблюдать за размерами селезенки с помощью УЗИ. Следует предусмотреть возможность спленомегалии или разрыва селезенки у пациентов с жалобами на боль в верхней левой части живота и/или в верхней части левого плеча.
Монотерапия эмпэгфилграстимом не исключает развития тромбоцитопении и анемии при продолжении миелосупрессивной химиотерапии в полной дозе. Рекомендуется регулярно определять число тромбоцитов и гематокрит.
Развитие серповидно-клеточного криза ассоциировалось с терапией препаратами пегилированного филграстима у пациентов с серповидно-клеточной анемией. Терапию эмпэгфилграстимом у пациентов с серповидно-клеточной анемией следует проводить с осторожностью только после тщательного определения потенциального риска и пользы.
Наблюдались единичные случаи лейкоцитоза 100×109/л или более у пациентов, получающих эмпэгфилграстим. Это явление носило временный характер и обычно наблюдалось через 24-48 ч после введения препарата в соответствии с его фармакодинамическими эффектами. Каких-либо побочных явлений, непосредственно связанных с таким лейкоцитозом, не описано.
Возросшая гемопоэтическая активность костного мозга в ответ на терапию факторами роста приводит к транзиторным положительным изменениям при визуализации костей, что следует принимать во внимание при интерпретации результатов.
Влияние на способность к управлению транспортными средствами и механизмами
Учитывая возможные побочные эффекты эмпэгфилграстима, в период лечения пациенты должны соблюдать осторожность при управлении автотранспортом и выполнении работ, требующих повышенной концентрации внимания.
Лекарственное взаимодействие
Из-за возможной чувствительности быстро делящихся миелоидных клеток к цитотоксической терапии эмпэгфилграстим следует вводить через 24 ч после введения цитотоксических химиотерапевтических средств.
Известно, что литий усиливает высвобождение нейтрофилов. Следует учитывать возможность фармакодинамического взаимодействия с литием при применении эмпэгфилграстима.
Экстимия — инструкция по применению
Синонимы, аналоги
Статьи
Внимательно прочтите эту инструкцию перед тем, как начать прием/использование этого лекарственного средства.
Сохраните инструкцию, она может потребоваться вновь.
Если у Вас возникли вопросы, обратитесь к врачу.
Это лекарственное средство назначено лично Вам, и его не следует передавать другим лицам, поскольку оно может причинить им вред даже при наличии тех же симптомов, что и у Вас.
Регистрационный номер:
ЛП-003560-170717
Торговое наименование препарата:
Экстимия®
Международное непатентованное наименование:
эмпэгфилграстим
Лекарственная форма:
раствор для подкожного введения.
Состав:
В 1 шприце содержится:
активное вещество: пегилированный рекомбинантный гранулоцитарный колониестимулирующий фактор человека (эмпэгфилграстим) — 7,5 мг;
вспомогательные вещества: натрия ацетата тригидрат — 0,23 мг, уксусная кислота ледяная — до рН 4,0, маннитол — 50,0 мг, вода для инъекций — до 1,0 мл.
Описание:
Прозрачный бесцветный раствор.
Фармакотерапевтическая группа:
Лейкопоэза стимулятор
Код АТХ:
L03AA13
Фармакологические свойства
Фармакодинамика
Эмпэгфилграстим — ковалентный конъюгат филграстима (рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора, рчГКСФ) с одной молекулой полиэтиленгликоля (ПЭГ) с молекулярной массой 30 кДа, с пролонгированным действием в результате снижения почечного клиренса.
Эмпэгфилграстим связывается с рецептором Г-КСФ подобно филграстиму и пэгфилграстиму. Аналогично филграстиму, эмпэгфилграстим регулирует образование и высвобождение нейтрофилов из костного мозга, заметно увеличивает количество нейтрофилов с нормальной или повышенной функциональной активностью (хемотаксис и фагоцитоз) в периферической крови в течение 24 ч и вызывает небольшое увеличение количества моноцитов и/или лимфоцитов.
По данным клинических исследований установлено, что однократное подкожное введение эмпэгфилграстима после каждого цикла миелосупрессивной цитотоксической терапии уменьшает продолжительность нейтропении 4 степени примерно в 2 раза, по сравнению с ежедневным введением филграстима. Частота возникновения фебрильной нейтропении была сопоставима с частотой в группе пациентов, получавших ежедневное введение филграстима. Общая частота нейтропении после химиотерапии при однократном введении эмпэгфилграстима и ежедневном введении филграстима была сопоставима на первом цикле, а на последующих циклах наблюдалась явная тенденция к уменьшению общей частоты нейтропении в группе эмпэгфилграстима с каждым циклом, по сравнению с группой филграстима.
Фармакокинетика
Всасывание:
У здоровых добровольцев после однократного подкожного введения различных доз эмпэгфилграстима (3 мг — 9 мг) максимальная концентрация (Сmаx) эмпэгфилграстима в крови достигалась в среднем через 36 — 48 часов. У больных раком молочной железы, получающих химиотерапию комбинацией доцетаксела и доксорубицина, во время первого цикла химиотерапии после однократного подкожного введения эмпэгфилграстима в дозе 7,5 мг Сmаx, составлявшая в среднем 192143,6 пг/мл, достигалась в крови в среднем через 61 час, а период полувыведения (Т½) составил 78 часов.
Распределение: Концентрация эмпэгфилграстима в сыворотке крови поддерживается в течение периода нейтропении после миелосупрессивной химиотерапии. Средняя системная экспозиция AUC(o-∞) эмпэгфилграстима после однократного подкожного введения в дозе 7,5 мг составила 27718704 (пг/мл)*ч.
Выведение:
Выведение эмпэгфилграстима нелинейное, дозозависимое, насыщаемое.
Клиренс в основном осуществляется нейтрофилами. В соответствии с саморегулирующимся механизмом клиренса, концентрация эмпэгфилграстима в сыворотке медленно снижается во время преходящего снижения числа нейтрофилов, связанного с химиотерапией, и быстро — после начала восстановления числа нейтрофилов.
У больных раком молочной железы, получающих химиотерапию комбинацией доцетаксела и доксорубицина, во время первого цикла химиотерапии после однократного подкожного введения эмпэгфилграстима в дозе 7,5 мг медиана клиренса составила 368,8 мл/ (ч*кг), а медиана константы элиминации — 0,0087 ч-1.
Фармакокинетика в особых группах пациентов:
Фармакокинетика эмпэгфилграстима у особых групп пациентов (пациенты с почечной и печеночной недостаточностью, дети и пациенты пожилого возраста) на сегодняшний день не изучалась.
Пациенты с нарушением функции печени и почек
Поскольку механизм выведения. эмпэгфилграстима не связан с почками или печенью (выведение осуществляется, главным образом, нейтрофилами), не ожидается изменений его свойств у больных с нарушениями функции этих органов.
Дети и пациенты пожилого возраста
Данные о применении эмпэгфилграстима у детей или пожилых пациентов (старше 65 лет) отсутствуют.
Показания к применению
Для снижения продолжительности нейтропении, частоты возникновения фебрильной нейтропении и инфекций, проявляющихся фебрильной нейтропенией, при цитостатической терапии по поводу злокачественных новообразований.
Противопоказания
- Нейтропения при хроническом миелолейкозе и миелодиспластических синдромах;
- Острый лейкоз;
- Для увеличения доз цитотоксической химиотерапии выше установленных в режимах дозирования;
- Одновременное назначение с цитотоксической химио- и лучевой терапией;
- Беременность и период грудного вскармливания;
- Возраст до 18 лет;
- Гиперчувствительность к белкам, полученным с использованием E.coli, филграстиму, эмпэгфилграстиму, пэгфилграстиму, пегилированным белкам, вспомогательным веществам препарата.
С осторожностью
- Злокачественные и предопухолевые заболевания миелоидного характера (в т.ч. острый миелолейкоз de novo и вторичный);
- В комбинации с высокодозной химиотерапией;
- Серповидно-клеточная анемия
Применение при беременности и в период грудного вскармливания
Беременность
Исследований у беременных женщин не проводилось. Потенциальный риск, связанный с влиянием на эмбрион или плод человека, неизвестен.
Период грудного вскармливания
Исследования у кормящих женщин не проводились, поэтому не следует применять препарат в период грудного вскармливания.
Способ применения и дозы
Взрослые (>18 лет): однократно, подкожно, в дозе 7,5 мг (один шприц), не менее чем через 24 часа после окончания введения химиопрепаратов. Препарат вводится подкожно, в область плеча, передней брюшной стенки или бедра.
Коррекция режима дозирования
Не следует применять препарат Экстимия® менее чем за 14 дней до, во время и менее чем через 24 часа после введения цитотоксических химиотерапевтических средств.
Необходимо отменить запланированное введение препарата Экстимия® при повышении общего количества лейкоцитов выше 50 х109/л.
Применение у особых групп пациентов
Дети: рекомендаций по применению препарата Экстимия® у детей и подростков в возрасте до 18 лет нет (недостаточно данных).
Пациенты с почечной / печеночной недостаточностью: коррекции дозы не требуется.
Информация для пациента по технике проведения п/к инъекции
Перед проведением инъекции необходимо пройти специальное обучение у лечащего врача или медицинской сестры.
Самостоятельное введение препарата:
- Достаньте из холодильника один блистер со шприцом. Для того, чтобы инъекция была более комфортной, следует выдержать шприц при комнатной температуре в течение 30 минут или согреть его в руке. Нельзя подогревать препарат другими способами.
- Проверьте дату истечения срока годности на этикетке. Не применяйте препарат по истечению срока годности.
- Тщательно вымойте руки.
- Подготовьте все необходимое для инъекции (салфетку, смоченную спиртом, стерильный марлевый тампон).
- Извлеките шприц с препаратом
- Проверьте внешний вид раствора. Он должен быть прозрачным, бесцветным и без видимых твердых частиц. Не используйте препарат, если раствор мутный или содержит видимые частицы.
- Осторожно, не вращая, потянув по прямой линии, не дотрагиваясь до иглы, снимите защитный колпачок с иглы.
- При наличии в шприце небольших пузырьков воздуха осторожно постучите по шприцу пальцем, держа его иглой вверх, чтобы пузырьки воздуха собрались в верхней части шприца, и медленным осторожным надавливанием на поршень удалите весь воздух из шприца. Шприц с препаратом не следует встряхивать.
- Наиболее оптимальными зонами для подкожного введения являются переднебоковая поверхность бедра и живот, за исключением области вокруг пупка (рис. 1). Можно также сделать инъекцию в наружную поверхность плеча.
- Продезинфицируйте кожу в. месте инъекции с помощью смоченной в спирте салфетки. Соберите кожу в складку большим и указательным пальцем без надавливания.
- Полностью введите иглу в основание кожной складки под углом не менее 45 градусов (рис. 2).
- Осторожно потяните за поршень шприца, чтобы убедиться, что не произошло прокола сосуда. Если в шприце появилась кровь, извлеките иглу и введите ее в другое место.
- После введения иглы начинайте вводить раствор под кожу, медленно и равномерно надавливая на поршень шприца, продолжая удерживать кожу в складке.
- Продолжайте надавливать на поршень, пока не будет введен весь раствор. После введения всей дозы извлеките иглу из места инъекции и наденьте на иглу защитный колпачок.
- На несколько секунд приложите к месту инъекции стерильный марлевый тампон.
- Используйте каждый шприц только для одной инъекции. Не вводите повторно оставшийся в шприце раствор.
При возникновении каких-либо проблем, обращайтесь за помощью к лечащему врачу или медицинской сестре.
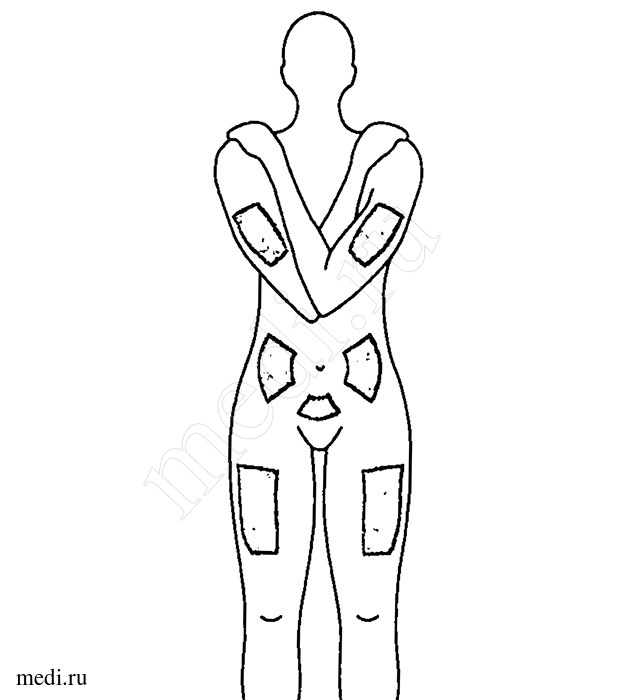
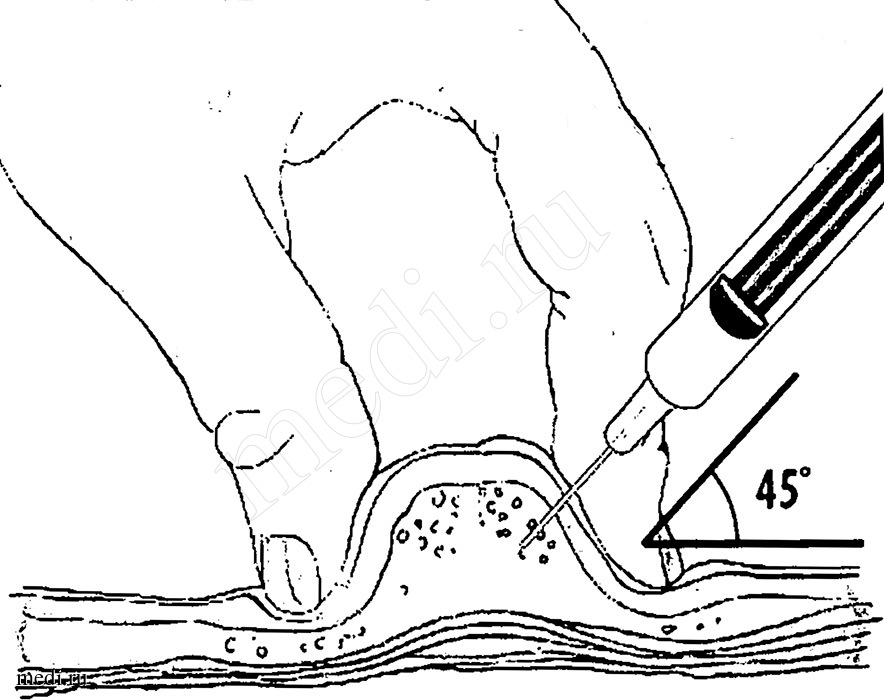
Рис.2
Побочное действие
Для оценки частоты нежелательных явлений использовалась классификация согласно рекомендациям ВОЗ: очень часто (>10%), часто (>1% и <10%), нечасто (>0,1% и <1%), редко (>0,01% и <0,1%), очень редко (<0,01%).
Ниже приведен перечень нежелательных явлений, зарегистрированных у пациентов, получавших препарат Экстимия® после цитотоксической химиотерапии, и у здоровых добровольцев в рамках клинического исследования. Подавляющее большинство нежелательных явлений были обусловлены основным злокачественным заболеванием или цитотоксической химиотерапией и не были связаны с применением препарата Экстимия®.
Инфекционные и паразитарные заболевания
Часто: острая респираторная вирусная инфекция.
Нарушения со стороны крови и лимфатической системы
Очень часто: анемия, тромбоцитопения, лейкоцитоз, нейтрофилез, лимфоцитоз, лейкопения, нейтропения и лимфопения.
Часто: фебрильная нейтропения.
Лейкопения, нейтропения, лимфопения, и фебрильная нейтропения, по всей вероятности, связаны с использовавшимися химиопрепаратами. У здоровых добровольцев зафиксирован случай увеличения селезенки.
Нарушения со стороны нервной системы
Часто: головная боль, головокружение, парестезии, сенсорная нейропатия.
Нарушения со стороны органа зрения
Часто: слезотечение.
Нарушения со стороны сердца
Часто: тахикардия, аритмия.
Нарушения со стороны сосудов
Часто: артериальная гипо — и гипертензия, флебит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Часто: кашель, сухость слизистой оболочки носа.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: тошнота, диарея.
Часто: стоматит, рвота, боль в животе, диспепсия, запор, геморрой, отрыжка, зуд десен, потеря аппетита.
Нарушения со стороны печени и желчевыводящих путей
Очень часто: повышение общего билирубина, повышение аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы, лактатдегидрогеназы.
Часто: повышение гамма-глутамилтранспептидазы, боль в правом подреберье, гепатотоксичность.
Нарушения со стороны кожи и подкожных тканей
Очень часто: алопеция.
Часто: сухость кожи лица, гиперемия кожи лица, зуд кожи, изменение ногтей.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Очень часто: артралгия, оссалгия.
Часто: миалгия, боль в спине, боль в конечностях.
Оссалгии и артралгии являются характерными для препаратов Г-КСФ нежелательными реакциями. Как правило, они слабые или умеренные и купируются самостоятельно.
Нарушения со стороны почек и мочевыводящих путей
Очень часто: гиперкреатининемия.
Часто: повышение уровня мочевины, протеинурия, бактериурия, лейкоцитурия.
Нарушения со стороны половых органов и молочной железы
Часто: боли в области молочной железы, маточное кровотечение.
Общие расстройства и нарушения в месте введения
Очень часто: повышение температуры тела, слабость, утомляемость.
Часто: местные реакции (гиперемия кожи в месте введения), отеки, астения, гриппоподобный синдром, лимфостаз.
Лабораторные и инструментальные данные
Очень часто: гипергликемия, гиперальбуминемия, гиперкалиемия, гиперхлоремия.
Часто: гипернатриемия, гиперурикемия.
Ниже приведен перечень нежелательных явлений, зарегистрированных у пациентов, получавших другие препараты пегилированного филграстима (в частности, пэгфилграстим).
Нарушения со стороны иммунной системы
Нечасто: реакции гиперчувствительности, включая кожную сыпь, крапивницу, ангионевротический отек, одышку, эритему, гиперемию, анафилаксию.
Нарушения со стороны сосудов
Нечасто: синдром повышенной проницаемости капилляров.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Нечасто: интерстициальная пневмония, отек легких, фиброз легких и инфильтраты в легких.
Нарушения со стороны кожи и подкожных тканей
Нечасто: синдром Свита, кожный васкулит.
Нарушения со стороны почек и мочевыводящих путей
Нечасто: гломерулонефрит.
Общие расстройства и нарушения в месте введения
Часто: боль в месте введения, некардиальная боль в груди.
Передозировка
Максимальная дозировка препарата Экстимия®, изучавшаяся у человека, составляет 9 мг однократно. При использовании препарата Экстимия® в дозе 9 мг у здоровых добровольцев наблюдались головная боль, миалгия, боль в спине, тромбоцитопения, гипербилирубинемия, гиперурикемия, гипергликемия, повышение ACT, ЩФ, гипонатриемия, гипохлоремия. Все нежелательные явления прошли без последствий, самостоятельно или после применения симптоматической терапии (головная боль, миалгия, артралгия, костные боли купировались применением НПВС). Таким образом, нежелательные явления при передозировке не отличаются от явлений при применении препарата в рекомендованных дозах.
Безопасность препарата Экстимия® в дозе более 9 мг не изучалась. При введении более высоких доз препарата Экстимия® можно ожидать усиления описанных нежелательных явлений, гиперлейкоцитоза и развития рикошетной нейтропении.
Взаимодействие с другими лекарственными средствами
Исследования, посвященные специфическим взаимодействиям или метаболизму, не проводились.
Поскольку эмпэгфилграстим выводится преимущественно нейтрофилами, т.е. с помощью специфического механизма, не пересекающегося с путями метаболизма большинства лекарственных средств, вероятность лекарственных взаимодействий представляется минимальной.
Цитотоксическая химиотерапия
Из-за возможной чувствительности быстро делящихся миелоидных клеток к цитотоксической терапии препарат Экстимия® следует вводить через 24 часа после введения цитотоксических химиотерапевтических средств.
Взаимодействие с другими гемопоэтическими факторами роста и цитостатиками неизвестно.
Известно, что литий усиливает высвобождение нейтрофилов. Хотя фармакодинамическое взаимодействие с литием не доказано ни для филграстима, ни для пэгфилграстима, следует учитывать его возможность при использовании препарата Экстимия®.
Оценка безопасности и эффективности препарата Экстимия® у пациентов, получающих химиотерапевтические препараты, применение которых сопровождается отсроченной миелосупрессией (например, производные нитрозомочевины), не проводились.
Признаков взаимодействия препарата Экстимия® с другими лекарственными препаратами на настоящее время не зафиксировано.
Особые указания
Лечение препаратом Экстимия® должно проводиться только под контролем врача, имеющих опыт применения Г-КСФ, при наличии необходимых диагностических возможностей.
ГКСФ стимулирует эндотелиальные клетки и может ускорять рост миелоидных клеток, включая злокачественные клетки, и некоторые немиелоидные клетки in vitro. Препарат Экстимия® не следует использовать при миелодиспластических синдромах, хроническом миелолейкозе, вторичном остром миелолейкозе, поскольку безопасность и эффективность препарата у данных групп пациентов не оценивалась. Следует особенно тщательно проводить дифференциальную диагностику между бласт-трансформацией при хроническом миелолейкозе и острым миелолейкозом.
Безопасность и эффективность препарата Экстимия® у больных с острым миелолейкозом не изучались.
Безопасность и эффективность препарата Экстимия® у больных, получавших высокодозную химиотерапию, не изучались.
Кашель, лихорадка и одышка в сочетании с рентгенологическими инфильтративными изменениями, ухудшением функции легких и увеличением количества нейтрофилов могут служить признаками респираторного дистресс-синдрома у взрослых. В таком случае на усмотрение врача препарат Экстимия® следует отменить и назначить соответствующее лечение.
Зарегистрированы очень редкие случаи разрыва селезенки после применения препаратов пегилированного филграстима, некоторые — с фатальным исходом, поэтому следует тщательно наблюдать за размерами селезенки с помощью инструментального обследования (ультразвуковое исследование). Следует предусмотрель возможность спленомегалии или разрыва селезенки у больных с жалобами на боль в верхней левой части живота и/или в верхней части левого плеча.
Монотерапия препаратом Экстимия® не исключает развития тромбоцитопении и анемии при продолжении миелосупрессивной химиотерапии в полной дозе. Рекомендуется регулярно определять число тромбоцитов и гематокрит.
Препарат Экстимия® не следует использовать для увеличения доз цитотоксической химиотерапии выше установленных в режимах дозирования.
Развитие серповидно-клеточного криза ассоциировалось с терапией препаратами пегилированного филграстима у пациентов с серповидно-клеточной анемией. Терапия препаратом Экстимия® у пациентов с серповидно-клеточной анемией должна проводиться с осторожностью только после тщательного определения потенциального риска и пользы. Наблюдались единичные случаи лейкоцитоза 100*109/л или более у больных, получающих препарат Экстимия®. Данное явление носило временный характер и обычно наблюдалось через 24-48 ч после введения препарата в соответствии с его фармакодинамическими эффектами. Каких-либо побочных явлений, непосредственно связанных с таким лейкоцитозом, не описано.
Безопасность и эффективность препарата Экстимия® при мобилизации периферических стволовых клеток крови у больных соответствующим образом не оценивались. Возросшая гемопоэтическая активность костного мозга в ответ на терапию факторами роста приводит к транзиторным положительным изменениям при визуализации костей, что следует принимать во внимание при интерпретации результатов.
Влияние на способность управлять транспортными средствами и механизмами
Учитывая возможные побочные эффекты препарата Экстимия®, в период лечения пациенты должны соблюдать осторожность при управлении автотранспортом и выполнении работ, требующих повышенной концентрации внимания.
Форма выпуска
По 1,0 мл раствора для подкожного введения с концентрацией 7,5 мг/мл эмпэгфилграстима в стерильные шприцы типа BD Нурак из бесцветного нейтрального стекла I гидролитического класса. На каждый шприц наклеивают этикетку самоклеящуюся.
По 1 шприцу в контурную ячейковую упаковку из пленки ПВХ.
По 1 контурной ячейковой упаковке с инструкцией по применению в пачку из картона.
Условия хранения
При температуре от 2 до 8°С в защищенном от света месте. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
По рецепту.
Производитель
ЗАО «БИОКАД», Россия, 198515,
г. Санкт-Петербург, Петродворцовый район, п. Стрельна, ул. Связи, д. 34, литер А.
Произведено:
ЗАО «БИОКАД», Россия, 143422,
Московская обл., Красногорский район, с. Петрово-Дальнее.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)

Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 25 000
Описание препарата
Экстимия — это продукт-новатор пэгилированного G-CSF, обозначенный для профилактики нейтропении у пациентов, получающих миелосупрессивную химиотерапию.
Состав и форма выпуска препарата
Внутриподкожный препарат бесцветный и прозрачный с составом: маннитол, эмпэгфилграстим, уксусная кислота, ацетат тригидрат натрия, вода для инъекций. Экстимию купить можно в аптеках России.
Показания
Показания Экстимии согласно указаниям производителя:
• химиотерапия новообразования;
• цистит геморрагический, вызванный цитостатиками;
• уротоксичность цитостатиков;
• периодическая нейтропения;
• синдром Итона-Ламберта;
• идиопатическая нейтропения;
• лейкопения;
• аутоиммунная нейтропения;
• метастатический асцит;
• идиопатическая и наркотическая лейкопения;
• злокачественные новообразования различной локализации;
• гранулоцитопения;
• радиационная цитопения;
• локально распространенные формы злокачественных новообразований;
• фебрильная нейтропения;
• мозжечковая дегенерация в опухолях;
• лейкопения с лучевой терапией;
• твердые опухоли;
• врожденная нейтропения;
• наследственные раковые заболевания;
• радиационная лейкопения;
• метастатический асцит;
• стойкая нейтропения;
• злокачественное новообразование;
• радиационная лейкопения;
• нейтропения циклическая;
• злокачественные опухоли;
• наследственная нейтропения;
• нейтропения у больных СПИДом.
Цена Экстимии колеблется от 27 500 руб. до 45 000 руб.
Противопоказания
Инструкция по применению Экстимии предусматривает определенные запреты на прием препарата:
• период беременности;
• лактация;
• детский возраст до 18 лет;
• острые формы лейкоза;
• индивидуальная непереносимость белков, филграстима, эмпэгфилграстима, пэгфилграстима, и другим компонентам медпрепарата;
• увеличение дозировки при цитотоксических процессах;
• лечение нейтропении во время хронического миелолейкоза и миелодиспластического синдрома.
Дозировка
Препарат Экстимия используют в разных дозировках для разных групп пациентов:
1. Взрослые.
2. Дети.
3. Больные с нарушенной функциональностью почек и печени.
Взрослым применяют единожды с помощью введения под кожу. Дозировка не более 7,5 мг. Применяется через сутки по окончанию химиотерапии. Используют несколько мест для подкожного введения:
• плечо;
• бедро;
• передняя часть живота.
Цитотоксические препараты не применяются одновременно с лекарством Экстимия. Также запрещено использование за 2 недели до курса и сутки после окончания цитотоксичекого курса лечения. Повышенный уровень лейкоцитов (50х109) является показанием для применения препарата.
В детском возрасте применение обуславливается высокой вероятностью излечения и низкой степенью риска, поскольку клинические испытания на детях до 18 лет не проводились.
Больные с нарушенной функциональностью печени и почек принимали препарат без побочных эффектов. Корректировать дозу не требовалось.
Побочные действия
В Москве Экстимию приобрести можно только по рецепту врача, поскольку существует ряд побочных эффектов:
• нейтрофилез;
• алопеция;
• гриппоподобный синдром;
• некардиальная боль в груди;
• острая респираторная вирусная инфекция;
• аритмия;
• боль в правом подреберье;
• повышение температуры тела;
• эритема;
• гломерулонефрит;
• гиперальбуминемия;
• боль в спине;
• запор;
• сенсорная нейропатия;
• тромбоцитопения;
• синдром повышенной проницаемости капилляров;
• повышение уровня мочевины;
• повышение аспартатаминотрансферазы;
• артериальная гипо — и гипертензия;
• фебрильная нейтропения;
• сухость слизистой оболочки носа;
• анемия;
• боль в месте введения;
• ангионевротический отек;
• гиперемия кожи в месте введения;
• боль в конечностях;
• повышение общего билирубина;
• парестезии;
• нейтропения;
• лейкоцитоз;
• интерстициальная пневмония;
• гиперхлоремия;
• боли в области молочной железы;
• гиперемия кожи лица;
• тошнота;
• головокружение;
• лейкопения;
• кожный васкулит;
• кожная сыпь;
• лейкоцитурия;
• сухость кожи лица;
• стоматит;
• рвота фебрильная нейтропении;
• инфильтраты в легких;
• анафилаксию;
• крапивницу;
• гипернатриемия;
• лимфостаз;
• бактериурия;
• маточное кровотечение;
• изменение ногтей;
• зуд десен;
• тахикардия;
• лимфопения;
• нейтропения;
• гиперурикемия;
• фиброз легких;
• гиперкалиемия;
• гепатотоксичность;
• утомляемость;
• потеря аппетита;
• боль в животе;
• увеличения селезенки;
• лимфоцитоз;
• синдром Свита;
• артралгия диспепсия;
• лимфопения;
• гиперкреатининемия;
• гипергликемия;
• кашель;
• головная боль;
• слезотечение;
• лейкопения;
• флебит;
• диарея;
• геморрой;
• отрыжка;
• зуд кожи;
• оссалгия;
• миалгия;
• протеинурия;
• слабость;
• отеки;
• астения;
• одышка;
• гиперемию;
• отек легких.
При любых изменениях в организме во время принятия Экстимии срочно обратиться к лечащему врачу.
Клинические испытания с применением специфических препаратов и воздействие метаболизма при них, не проводили.
Активное вещество взаимодействует с нейтрофилом. За счет этого он выводится из организма, при этом не вмешивается в биологические процессы метаболизма других лекарственных препаратов и уменьшает шанс взаимодействия.
Применение вместе с цитотоксической химиотерапией подразумевает выполнения определенных правил. Быстро делящиеся миелоедные клетки могут оказывать чувствительность к цитотоксическим лекарственным препаратам. Поэтому применение Экстимии позволяется лишь через сутки после последней дозы цитотоксических препаратов.
Одновременное использование с гемопоэтическим медпрепаратом и цитостатиком не было исследовано. Но, литиевые соединение высвобождают большое количество нейтрофильных клеток. Доказательства фармакодимамического воздействия на литиевые соединения, отсутствуют. Поэтому при использовании филграстимовых или пэгфилграстимовых препаратов необходимо ограничить, либо вести тщательное наблюдение за пациентом.
Отсроченная миелосупрессия лечащаяся химическими препаратами, не оценивалась для использования Экстримии. Безопасность и эффективность медпрепарата при таком диагнозе не исследована.
Других взаимодействий с лекарственными формами медпрепаратов не было выявлено, поскольку клинические испытания на синтез, метаболизм не проводились. Купить Экстимию можно в специализированных аптечных пунктах, по указанию лечащего врача.
Особые указания
Клинические испытания с применением специфических препаратов и воздействие метаболизма при них, не проводили.
Активное вещество взаимодействует с нейтрофилом. За счет этого он выводится из организма, при этом не вмешивается в биологические процессы метаболизма других лекарственных препаратов и уменьшает шанс взаимодействия.
Применение вместе с цитотоксической химиотерапией подразумевает выполнения определенных правил. Быстро делящиеся миелоедные клетки могут оказывать чувствительность к цитотоксическим лекарственным препаратам. Поэтому применение Экстимии позволяется лишь через сутки после последней дозы цитотоксических препаратов.
Одновременное использование с гемопоэтическим медпрепаратом и цитостатиком не было исследовано. Но, литиевые соединение высвобождают большое количество нейтрофильных клеток. Доказательства фармакодимамического воздействия на литиевые соединения, отсутствуют. Поэтому при использовании филграстимовых или пэгфилграстимовых препаратов необходимо ограничить, либо вести тщательное наблюдение за пациентом.
Отсроченная миелосупрессия лечащаяся химическими препаратами, не оценивалась для использования Экстримии. Безопасность и эффективность медпрепарата при таком диагнозе не исследована.
Других взаимодействий с лекарственными формами медпрепаратов не было выявлено, поскольку клинические испытания на синтез, метаболизм не проводились. Купить Экстимию можно в специализированных аптечных пунктах, по указанию лечащего врача.
Особые указания
Клинические испытания с применением специфических препаратов и воздействие метаболизма при них, не проводили.
Активное вещество взаимодействует с нейтрофилом. За счет этого он выводится из организма, при этом не вмешивается в биологические процессы метаболизма других лекарственных препаратов и уменьшает шанс взаимодействия.
Применение вместе с цитотоксической химиотерапией подразумевает выполнения определенных правил. Быстро делящиеся миелоедные клетки могут оказывать чувствительность к цитотоксическим лекарственным препаратам. Поэтому применение Экстимии позволяется лишь через сутки после последней дозы цитотоксических препаратов.
Одновременное использование с гемопоэтическим медпрепаратом и цитостатиком не было исследовано. Но, литиевые соединение высвобождают большое количество нейтрофильных клеток. Доказательства фармакодимамического воздействия на литиевые соединения, отсутствуют. Поэтому при использовании филграстимовых или пэгфилграстимовых препаратов необходимо ограничить, либо вести тщательное наблюдение за пациентом.
Отсроченная миелосупрессия лечащаяся химическими препаратами, не оценивалась для использования Экстримии. Безопасность и эффективность медпрепарата при таком диагнозе не исследована.
Других взаимодействий с лекарственными формами медпрепаратов не было выявлено, поскольку клинические испытания на синтез, метаболизм не проводились. Купить Экстимию можно в специализированных аптечных пунктах, по указанию лечащего врача.
Лечебный курс проводится под тщательным надзором лечащего специалиста, который имеет опыт в применении препарата. Также необходимы диагностические методики для быстрого реагирования на изменения в организме пациента.
Гранулоцитарно-макрофагальный колониестимулирующий фактор оказывает стимулирующие действие на однослойный пласт плоских клеток мезенхимного происхождения, и ускоряет интенсивность развития клеток миеломы, а том числе злокачественные опухоли. Препарат запрещается использовать при диагнозах: миелодисплатический синдром, хронические формы миелолейкоза, вторичном поражении. Безопасное и эффективное применение, при таких заболеваниях, не было доказано клиническими испытаниями. Оценочная диагностика должна проводиться на основании промежутка бласт-трансформации в хронических формах миелолейкоза и острой формы заболевания.
Пациенты с острой формой миелолейкоза и больные с высокой дозировкой химических препаратов не участвовали в клинических исследованиях. Поэтому безопасное и эффективное применение для таких групп пациентов, не доказано.
У небольшой группы пациентов наблюдалась симптоматика астмы, гриппа. Кашлевые процессы, высокая температура и задышка, появлялась на фоне ухудшения функциональности дыхательной системы, при увеличении концентрации нейтрофильных клеток в крови и выражались в виде дистресс-синдрома. В этом случае лечение было отменено.
Есть зарегистрированные случаи летального исхода, на фоне повреждения целостности селезенки. Результаты исследований дали информативность о возможности развития спленомагелии. При использовании препарата необходимы частые процедуры УЗИ, для пациентов с болями в области живота или жалобами на болевые ощущения в области сердца и левого плеча.
Одиночное использование препарата не может гарантировать исключение интенсивного развития тромбоцитопении или анемии, при длительном лечебном курсе миелосупрессии. Для предотвращения таких последствий необходимы постоянные анализы на количество клеток в крови.
Беременность и лактация
Клинические исследования применения препарата во время беременности и лактации не были проведены. Поэтому исключение рисков воздействия на плод и младенцев не производится. Из-за воздействия активного вещества, существует риск повреждения эмбриона или плода. Не рекомендуется применять препарат во время беременности и грудного вскармливания.
При нарушениях функции почек
Пациенты с почечной недостаточностью не ощущали побочных эффектов или изменений в организме, поскольку выведение препарата основывается на взаимодействии с нейтрофильными клетками. Корректировка дозы не требуется.
При нарушениях функции печени
Пациенты с печеночной недостаточностью не ощущали побочных эффектов или изменений в организме, поскольку выведение препарата основывается на взаимодействии с нейтрофильными клетками. Корректировка дозы не требуется.
Применение в пожилом возрасте
Не проводились клинические испытания с пациентами пожилого возраста.
Применение в детском возрасте
Не проводились клинические испытания с пациентами возрастной категории до 18 лет.
Хранение
Хранение Экстимии предусматривает использование оригинальной упаковки и температурного режима от 2 до 8 С. Препарат не замораживать.
Цены на Экстимия в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 25 000 руб.
Сертификаты и лицензии
Инструкция по применению Экстимия
- Состав
- Показания к применению
- Противопоказания к применению
- Рекомендации по применению
- Применение при беременности и кормлении грудью
- Фармакологическое действие
- Побочные действия
- Особые указания
- Передозировка
- Лекарственное взаимодействие
- Условия хранения
- Условия отпуска
Состав
Активное вещество: пегилированный рекомбинантный гранулоцитарный колониестимулирующий фактор человека (эмпэгфилграстим) 7,5 мг;
вспомогательные вещества: натрия ацетата тригидрат 0,23 мг, уксусная кислота ледяная до pH 4,0, полисорбат 20 0,04 мг, маннитол 50,0 мг, вода для инъекций до 1,0 мл.
Показания к применению Экстимия
Для снижения продолжительности нейтропении, частоты возникновения фебрильной нейтропении и инфекций, проявляющихся фебрильной нейтропенией, при цитостатической терапии по поводу злокачественных новообразований.
Противопоказания к применению Экстимия
— Нейтропения при хроническом миелолейкозе и миелодиспластических синдромах;
— острый лейкоз;
— для увеличения доз цитотоксической химиотерапии выше установленных в режимах дозирования;
— одновременное назначение с цитотоксической химио- и лучевой терапией;
— беременность и период грудного вскармливания;
— возраст до 18 лет;
— гиперчувствительность к белкам, полученным с использованием Е. coli, филграстиму, эмпэгфилграстиму, пэгфилграстиму, пегилированным белкам, вспомогательным веществам препарата.
С осторожностью:
— Злокачественные и предопухолевые заболевания миелоидного характера (в т.ч. острый миелолейкоз de novo и вторичный);
— в комбинации с высокодозной химиотерапией;
— серповидно-клеточная анемия.
Рекомендации по применению
Взрослые (≥ 18 лет): однократно, подкожно, в дозе 7,5 мг (один шприц), не менее чем через 24 часа после окончания введения химиопрепаратов. Препарат вводится подкожно, в область плеча, передней брюшной стенки или бедра.
Коррекция режима дозирования
Не следует применять препарат Экстимия® менее чем за 14 дней до, во время и менее чем через 24 часа после введения цитотоксических химиотерапевтических средств. Необходимо отменить запланированное введение препарата Экстимия® при повышении общего количества лейкоцитов выше 50 х 109/л.
Применение у особых групп пациентов
Дети: рекомендаций по применению препарата Экстимия® у детей и подростков в возрасте до 18 лет нет (недостаточно данных).
Пациенты с почечной /печеночной недостаточностью: коррекции дозы не требуется.
Информация для пациента по технике проведения п/к инъекции
Перед проведением инъекции необходимо пройти специальное обучение у лечащего врача или медицинской сестры.
Самостоятельное введение препарата:
1. Достаньте из холодильника один блистер со шприцом. Для того, чтобы инъекция была более комфортной, следует выдержать шприц при комнатной температуре в течение 30 минут или согреть его в руке. Нельзя подогревать препарат другими способами.
2. Проверьте дату истечения срока годности на этикетке. Не применяйте препарат по истечению срока годности.
3. Тщательно вымойте руки.
4. Подготовьте все необходимое для инъекции (салфетку, смоченную спиртом, стерильный марлевый тампон).
5. Извлеките шприц с препаратом
6. Проверьте внешний вид раствора. Он должен быть прозрачным, бесцветным и без видимых твердых частиц. Не используйте препарат, если раствор мутный или содержит видимые частицы.
7. Осторожно, не вращая, потянув по прямой линии, не дотрагиваясь до иглы, снимите защитный колпачок с иглы.
8. При наличии в шприце небольших пузырьков воздуха осторожно постучите по шприцу пальцем, держа его иглой вверх, чтобы пузырьки воздуха собрались в верхней части шприца, и медленным осторожным надавливанием на поршень удалите весь воздух из шприца. Шприц с препаратом не следует встряхивать.
9. Наиболее оптимальными зонами для подкожного введения являются переднебоковая поверхность бедра и живот, за исключением области вокруг пупка (рис. 1). Можно также сделать инъекцию в наружную поверхность плеча.
10. Продезинфицируйте кожу в месте инъекции с помощью смоченной в спирте салфетки. Соберите кожу в складку большим и указательным пальцем без надавливания.
11. Полностью введите иглу в основание кожной складки под углом не менее 45 градусов (рис. 2).
12. Осторожно потяните за поршень шприца, чтобы убедиться, что не произошло прокола сосуда. Если в шприце появилась кровь, извлеките иглу и введите ее в другое место.
13. После введения иглы начинайте вводить раствор под кожу, медленно и равномерно надавливая на поршень шприца, продолжая удерживать кожу в складке.
14. Продолжайте надавливать на поршень, пока не будет введен весь раствор. После введения всей дозы извлеките иглу из места инъекции и наденьте на иглу защитный колпачок.
15. На несколько секунд приложите к месту инъекции стерильный марлевый тампон.
16. Используйте каждый шприц только для одной инъекции. Не вводите повторно оставшийся в шприце раствор.
При возникновении каких-либо проблем, обращайтесь за помощью к лечащему врачу или медицинской сестре.
Применение Экстимия при беременности и кормлении грудью
Беременность
Исследований у беременных женщин не проводилось. Потенциальный риск, связанный с влиянием на эмбрион или плод человека, неизвестен.
Период грудного вскармливания
Исследования у кормящих женщин не проводились, поэтому не следует применять препарат в период грудного вскармливания.
Фармакологическое действие
Фармакодинамика:
Эмпэгфилграстим — ковалентный конъюгат филграстима (рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора, рчГКСФ) с одной молекулой полиэтиленгликоля (ПЭГ) с молекулярной массой 30 кДа, с пролонгированным действием в результате снижения почечного клиренса.
Эмпэгфилграстим связывается с рецептором Г-КСФ подобно филграстиму и пэгфилграстиму. Аналогично филграстиму эмпэгфилграстим регулирует образование и высвобождение нейтрофилов из костного мозга, заметно увеличивает количество нейтрофилов с нормальной или повышенной функциональной активностью (хемотаксис и фагоцитоз) в периферической крови в течение 24 ч и вызывает небольшое увеличение количества моноцитов и/или лимфоцитов.
По данным клинических исследований установлено, что однократное подкожное введение эмпэгфилграстима после каждого цикла миелосупрессивной цитотоксической терапии уменьшает продолжительность нейтропении 4 степени примерно в 2 раза, по сравнению с ежедневным введением филграстима. Частота возникновения фебрильной нейтропении была сопоставима с частотой в группе пациентов, получавших ежедневное введение филграстима. Общая частота нейтропении после химиотерапии при однократном введении эмпэгфилграстима и ежедневном введении филграстима была сопоставима на первом цикле, а на последующих циклах наблюдалась явная тенденция к уменьшению общей частоты нейтропении в группе эмпэгфилграстима с каждым циклом, по сравнению с группой филграстима.
Фармакокинетика:
Всасывание
У здоровых добровольцев после однократного подкожного введения различных доз эмпэгфилграстима (3 мг — 9 мг) максимальная концентрация (Сmах) эмпэгфилграстима в крови достигалась в среднем через 36-48 часов. У больных раком молочной железы, получающих химиотерапию комбинацией доцетаксела и доксорубицина, во время первого цикла химиотерапии после однократного подкожного введения эмпэгфилграстима в дозе 7,5 мг Сmах, составлявшая в среднем 192143,6 пг/мл, достигалась в крови в среднем через 61 час, а период полувыведения (Т1/2) составил 78 часов.
Распределение
Концентрация эмпэгфилграстима в сыворотке крови поддерживается в течение периода нейтропении после миелосупрессивной химиотерапии. Средняя системная экспозиция AUQ(0-∞) эмпэгфилграстима после однократного подкожного введения в дозе 7,5 мг составила 27718704 (пг/мл)*ч.
Выведение
Выведение эмпэгфилграстима нелинейное, дозозависимое, насыщаемое. Клиренс в основном осуществляется нейтрофилами. В соответствии с саморегулирующимся механизмом клиренса, концентрация эмпэгфилграстима в сыворотке медленно снижается во время преходящего снижения числа нейтрофилов, связанного с химиотерапией, и быстро — после начала восстановления числа нейтрофилов. У больных раком молочной железы, получающих химиотерапию комбинацией доцетаксела и доксорубицина, во время первого цикла химиотерапии после однократного подкожного введения эмпэгфилграстима в дозе 7,5 мг медиана клиренса составила 368,8 мл/ (ч*кг), а медиана константы элиминации — 0,0087 ч-1.
Фармакокинетика в особых группах пациентов
Фармакокинетика эмпэгфилграстима у особых групп пациентов (пациенты с почечной и печеночной недостаточностью, дети и пациенты пожилого возраста) на сегодняшний день не изучалась.
Пациенты с нарушением функции печени и почек
Поскольку механизм выведения эмпэгфилграстима не связан с почками или печенью (выведение осуществляется, главным образом, нейтрофилами), не ожидается изменений его свойств у больных с нарушениями функции этих органов.
Дети и пациенты пожилого возраста
Данные о применении эмпэгфилграстима у детей или пожилых пациентов (старше 65 лет) отсутствуют.
Побочные действия Экстимия
Для оценки частоты нежелательных явлений использовалась классификация согласно рекомендациям ВОЗ: очень часто (≥ 10%), часто (≥ 1% и < 10%), нечасто (≥ 0,1% и < 1%), редко (≥ 0,01% и < 0,1%), очень редко (< 0,01%).
Ниже приведен перечень нежелательных явлений, зарегистрированных у пациентов, получавших препарат Экстимия® после цитотоксической химиотерапии, и у здоровых добровольцев в рамках клинического исследования. Подавляющее большинство нежелательных явлений были обусловлены основным злокачественным заболеванием или цитотоксической химиотерапией и не были связаны с применением препарата Экстимия®.
Инфекционные и паразитарные заболевания
Часто: острая респираторная вирусная инфекция.
Нарушения со стороны крови и лимфатической системы
Очень часто: анемия, тромбоцитопения, лейкоцитоз, нейтрофилез, лимфоцитоз, лейкопения, нейтропения и лимфопения.
Часто: фебрильная нейтропения.
Лейкопения, нейтропения, лимфопения, и фебрильная нейтропения, по всей вероятности, связаны с использовавшимися химиопрепаратами. У здоровых добровольцев зафиксирован случай увеличения селезенки.
Нарушения со стороны нервной системы
Часто: головная боль, головокружение, парестезии, сенсорная нейропатия.
Нарушения со стороны органа зрения
Часто: слезотечение.
Нарушения со стороны сердца
Часто: тахикардия, аритмия.
Нарушения со стороны сосудов
Часто: артериальная гипо — и гипертензия, флебит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Часто: кашель, сухость слизистой оболочки носа.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: тошнота, диарея.
Часто: стоматит, рвота, боль в животе, диспепсия, запор, геморрой, отрыжка, зуд десен, потеря аппетита.
Нарушения со стороны печени и желчевыводящих путей
Очень часто: повышение общего билирубина, повышение аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы, лактатдегидрогеназы.
Часто: повышение гамма-глутамилтранспептидазы, боль в правом подреберье, гепатотоксичность.
Нарушения со стороны кожи и подкожных тканей
Очень часто: алопеция.
Часто: сухость кожи лица, гиперемия кожи лица, зуд кожи, изменение ногтей.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Очень часто: артралгия, оссалгия.
Часто: миалгия, боль в спине, боль в конечностях.
Оссалгии и артралгии являются характерными для препаратов Г-КСФ нежелательными реакциями. Как правило, они слабые или умеренные и купируются самостоятельно.
Нарушения со стороны почек и мочевыводящих путей
Очень часто: гиперкреатининемия.
Часто — повышение уровня мочевины, протеинурия, бактериурия, лейкоцитурия.
Нарушения со стороны половых органов и молочной железы
Часто: боли в области молочной железы, маточное кровотечение.
Общие расстройства и нарушения в месте введения
Очень часто: повышение температуры тела, слабость, утомляемость.
Часто: местные реакции (гиперемия кожи в месте введения), отеки, астения, гриппоподобный синдром, лимфостаз.
Лабораторные и инструментальные данные
Очень часто: гипергликемия, гиперальбуминемия, гиперкалиемия, гиперхлоремия.
Часто: гипернатриемия, гиперурикемия.
Особые указания
Лечение препаратом Экстимия® должно проводиться только под контролем врача, имеющих опыт применения Г-КСФ, при наличии необходимых диагностических возможностей.
ГКСФ стимулирует эндотелиальные клетки и может ускорять рост миелоидных клеток, включая злокачественные клетки, и некоторые немиелоидные клетки in vitro.
Препарат Экстимия® не следует использовать при миелодиспластических синдромах, хроническом миелолейкозе, вторичном остром миелолейкозе, поскольку безопасность и эффективность препарата у данных групп пациентов не оценивалась.
Следует особенно тщательно проводить дифференциальную диагностику между бласттрансформацией при хроническом миелолейкозе и острым миелолейкозом.
Безопасность и эффективность препарата Экстимия® у больных с острым миелолейкозом не изучались.
Безопасность и эффективность препарата Экстимия® у больных, получавших высокодозную химиотерапию, не изучались.
Кашель, лихорадка и одышка в сочетании с рентгенологическими инфильтративными изменениями, ухудшением функции легких и увеличением количества нейтрофилов могут служить признаками респираторного дистресс-синдрома у взрослых. В таком случае на усмотрение врача препарат Экстимия® следует отменить и назначить соответствующее лечение.
Зарегистрированы очень редкие случаи разрыва селезенки после применения препаратов пегилированного филграстима, некоторые — с фатальным исходом, поэтому следует тщательно наблюдать за размерами селезенки с помощью инструментального обследования (ультразвуковое исследование). Следует предусмотреть возможность спленомегалии или разрыва селезенки у больных с жалобами на боль в верхней левой части живота и/или в верхней части левого плеча.
Монотерапия препаратом Экстимия® не исключает развития тромбоцитопении и анемии при продолжении миелосупрессивной химиотерапии в полной дозе. Рекомендуется регулярно определять число тромбоцитов и гематокрит.
Препарат Экстимия® не следует использовать для увеличения доз цитотоксической химиотерапии выше установленных в режимах дозирования.
Развитие серповидно-клеточного криза ассоциировалось с терапией препаратами пегилированного филграстима у пациентов с серповидно-клеточной анемией. Терапия препаратом Экстимия® у пациентов с серповидно-клеточной анемией должна проводиться с осторожностью только после тщательного определения потенциального риска и пользы. Наблюдались единичные случаи лейкоцитоза 100 х 109/л или более у больных, получающих препарат Экстимия®. Данное явление носило временный характер и обычно наблюдалось через 24-48 ч после введения препарата в соответствии с его фармакодинамическими эффектами. Каких-либо побочных явлений, непосредственно связанных с таким лейкоцитозом, не описано.
Безопасность и эффективность препарата Экстимия® при мобилизации периферических стволовых клеток крови у больных соответствующим образом не оценивались.
Возросшая гемопоэтическая активность костного мозга в ответ на терапию факторами роста приводит к транзиторным положительным изменениям при визуализации костей, что следует принимать во внимание при интерпретации результатов.
Передозировка
Максимальная дозировка препарата Экстимия®, изучавшаяся у человека, составляет 9 мг однократно. При использовании препарата Экстимия® в дозе 9 мг у здоровых добровольцев наблюдались головная боль, миалгия, боль в спине, тромбоцитопения, гипербилирубинемия, гиперурикемия, гипергликемия, повышение ACT, ЩФ, гипонатриемия, гипохлоремия. Все нежелательные явления прошли без последствий, самостоятельно или после применения симптоматической терапии (головная боль, миалгия, артралгия, костные боли купировались применением НПВС). Таким образом, нежелательные явления при передозировке не отличаются от явлений при применении препарата в рекомендованных дозах.
Безопасность препарата Экстимия® в дозе более 9 мг не изучалась. При введении более высоких доз препарата Экстимия® можно ожидать усиления описанных нежелательных явлений, гиперлейкоцитоза и развития рикошетной нейтропении.
Лекарственное взаимодействие
Исследования, посвященные специфическим взаимодействиям или метаболизму, не проводились.
Поскольку эмпэгфилграстим выводится преимущественно нейтрофилами, т.е. с помощью специфического механизма, не пересекающегося с путями метаболизма большинства лекарственных средств, вероятность лекарственных взаимодействий представляется минимальной.
Цитотоксическая химиотерапия
Из-за возможной чувствительности быстро делящихся миелоидных клеток к цитотоксической терапии препарат Экстимия® следует вводить через 24 часа после введения цитотоксических химиотерапевтических средств.
Взаимодействие с другими гемопоэтическими факторами роста и цитостатиками неизвестно.
Известно, что литий усиливает высвобождение нейтрофилов. Хотя фармакодинамическое взаимодействие с литием не доказано ни для филграстима, ни для пэгфилграстима, следует учитывать его возможность при использовании препарата Экстимия®.
Оценка безопасности и эффективности препарата Экстимия® у пациентов, получающих химиотерапевтические препараты, применение которых сопровождается отсроченной миелосупрессией (например, производные нитрозомочевины), не проводились.
Признаков взаимодействия препарата Экстимия® с другими лекарственными препаратами на настоящее время не зафиксировано.
Условия хранения
При температуре от 2 до 8 °С, в защищенном от света месте. Не замораживать. Хранить в недоступном для детей месте. Срок годности — 3 года.
Условия отпуска
Без рецепта

