Эфлейра — инструкция по применению
Синонимы, аналоги
Статьи
Внимательно прочтите эту инструкцию перед тем, как начать прием/использование лекарственного средства.
Сохраните инструкцию, она может потребоваться вновь.
Если у Вас возникли вопросы, обратитесь к врачу.
Это лекарственное средство назначено лично Вам, и его не следует передавать другим лицам, поскольку оно может причинить им вред даже при наличии тех же симптомов, что и у Вас.
Регистрационный номер:
ЛП-005439
Торговое наименование препарата:
Эфлейра®
Международное непатентованное наименование:
нетакимаб
Лекарственная форма:
раствор для подкожного введения
Состав:
1 мл раствора содержит:
Действующее вещество: нетакимаб – 60 мг;
Вспомогательные вещества: натрия ацетата тригидрат – 1,74 мг, трегалозы дигидрат – 80 мг, полоксамер 188 – 0,5 мг, уксусная кислота ледяная – до pH 5,0, вода для инъекций – до 1,0 мл.
Описание:
Прозрачный или слегка опалесцирующий от бесцветного до светло-желтого или светло-желтого с коричневатым оттенком цвета раствор.
Фармакотерапевтическая группа:
Интерлейкина ингибитор
Код АТХ:
L04AC
Фармакологические свойства
Фармакодинамика
Нетакимаб является рекомбинантным гуманизированным моноклональным антителом, в терапевтических концентрациях специфически связывающим интерлейкин-17А (ИЛ-17А), находящийся непосредственно в тканях или в крови и других биологических жидкостях. ИЛ-17А – провоспалительный цитокин, гиперпродукция которого преимущественно обусловлена активацией Th17-лимфоцитов. В рамках врожденного иммунитета ИЛ-17А выполняет защитную роль. При хронических иммуновоспалительных заболеваниях патологическая активация Th17-лимфоцитов и гиперпродукция ИЛ-17 стимулирует Т-клеточный ответ и усиленную продукцию других медиаторов воспаления: ИЛ-1, ИЛ-6, фактора некроза опухоли альфа (ФНО-α), факторов роста (Г-КСФ, ГМ-КСФ) и различных хемокинов.
Нетакимаб обладает высокой термодинамической константой специфического связывания с ИЛ-17А человека. По данным доклинических исследований специфическое связывание нетакимаба в нормальных тканях человека ограничено тканями легкого, тимуса, лимфатического узла, миндалин, что согласуется с данными об экспрессии ИЛ-17 клетками этих тканей.
Применение нетакимаба не сопровождается статистически значимым изменением уровня Т-лимфоцитов и не влияет на уровень и соотношение иммуноглобулинов классов А, G и М.
Специфическая противовоспалительная активность нетакимаба продемонстрирована в тестах in vitro и in vivo. Нетакимаб дозозависимо ингибирует ИЛ-17 и ФНОα-зависимую продукцию интерлейкина-6 на культуре клеток при IC50 40 pM. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (один раз в неделю в течение 4-х недель) подкожное введение нетакимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (суставной хрящ остается интактным, синовиальные оболочки — без признаков поражения и воспалительной реакции, пролиферации синовиоцитов не отмечено).
У больных псориазом использование нетакимаба сопровождается угасанием явлений воспаления и гиперкератоза в коже, достоверным снижением уровня С-реактивного белка и СОЭ. У пациентов с активным анкилозирующим спондилитом и псориатическим артритом на фоне применения нетакимаба отмечается уменьшение симптомов воспаления в позвоночнике, энтезисах и суставах, а также быстрое снижение концентрации С-реактивного белка, являющегося маркером воспаления.
Фармакокинетика
Всасывание/распределение
Изменение концентрации нетакимаба после его подкожного введения является дозозависимым (значения Сmax, Cmax-mult, AUC0-t находятся в прямой зависимости от дозы). Препарат характеризуется медленной фазой абсорбции с постепенным линейным нарастанием концентрации в сыворотке крови.
При однократном подкожном введении нетакимаба в дозе 120 мг пациентам с бляшечным псориазом препарат начинал обнаруживаться в сыворотке крови в течение 0,5 — 4 часов после введения; максимальная концентрация нетакимаба (Сmax) составляла 15,1 [7,7-19,3] мкг/мл, время ее достижения – 144 [72-168] ч, AUC0-168 – 1667,8 [932,2-2270,8] (мкг/мл)*ч.
При повторных введениях отмечено накопление препарата в сыворотке крови с ростом концентрации в 1,8-3,6 раза. Максимальная концентрация при многократном введении (Cmax-mult) составляла 33,0 [23,1-44,0] мкг/мл и достигалась (Tmax-mult) через 1680 [672-2016] часов.
Выведение
Характеристики выведения нетакимаба являются типичными для препаратов на основе моноклональных антител: показатели Kel, T½, MRT, Cl не зависят от дозы вводимого препарата, период полувыведения после однократного введения составляет около 16 суток.
Средний клиренс нетакимаба при однократном введении в дозе 120 мг пациентам с бляшечным псориазом составил 1,8 л/сутки.
Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания к применению
- Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия.
- Лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию.
- Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию.
Противопоказания
- Гиперчувствительность к нетакимабу, а также к любому из вспомогательных веществ препарата.
- Клинически значимые инфекционные заболевания в острой фазе, включая туберкулез.
- Детский и подростковый возраст до 18 лет.
- Беременность, грудное вскармливание.
С осторожностью
Следует соблюдать осторожность при назначении нетакимаба пациентам с хроническими и рецидивирующими инфекциями или с анамнестическими указаниями на них, в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний, а также после недавно проведенной вакцинации живыми вакцинами.
В связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет, следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы.
В связи с отсутствием сведений о применении нетакимаба у больных воспалительными заболеваниями кишечника, следует избегать его назначения пациентам с болезнью Крона или язвенным колитом.
Применение при беременности и в период грудного вскармливания
Применение при беременности
При применении нетакимаба у животных не выявлено отрицательного влияния на репродуктивную функцию, эмбриотоксичности или тератогенных эффектов.
Исследований влияния на плод у беременных женщин не проводилось. Препарат противопоказан к применению во время беременности.
Применение при грудном вскармливании
Нет данных о проникновении нетакимаба в грудное молоко. Учитывая, что иммуноглобулины класса G, к которым относится нетакимаб, при циркуляции в крови матери могут выделяться с грудным молоком, применение в период грудного вскармливания противопоказано. Во избежание негативного воздействия на ребенка следует прекратить либо грудное вскармливание, либо терапию, учитывая соотношение риска и пользы для матери и ребенка.
Влияние на фертильность
В исследованиях у животных не обнаружено негативного воздействия нетакимаба на фертильность. Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата Эфлейра® должно осуществляться под наблюдением врачей, имеющих опыт лечения заболеваний, при которых показан препарат Эфлейра®. После соответствующего обучения возможно самостоятельное введение препарата пациентом при условии динамического наблюдения со стороны лечащего врача. Препарат Эфлейра® может применяться как в стационарных, так и в амбулаторных условиях.
Препарат Эфлейра® вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл препарата с концентрацией 60 мг/мл.
Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая вводится 1 раз в неделю на неделях 0, 1 и 2, затем 1 раз каждые 4 недели.
Лечение активного анкилозирующего спондилита при недостаточном ответе на стандартную терапию: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели.
Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели до недели 10 включительно. Далее с недели 14 препарат вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) каждая 1 раз в 4 недели.
| Показание | Разовая доза | Индукция | Поддерживающая терапия |
| Бляшечный псориаз | 120 мг | 0, 1, 2 недели |
1 раз в 4 недели, начиная с недели 6 |
| Анкилозирующий спондилит | 120 мг | 0, 1, 2 недели |
1 раз в 2 недели, начиная с недели 4 |
| Псориатический артрит | 120 мг | 0, 1, 2 недели |
1 раз в 2 недели, начиная с недели 4 по неделю 10 включительно, далее 1 раз в 4 недели с недели 14 |
При пропуске очередного введения по любой причине инъекция препарата Эфлейра® должна быть произведена как можно быстрее. Дата следующего введения рассчитывается исходя из продолжительности задержки с введением препарата: если со времени пропуска введения прошло не более 3 дней, то следующую инъекцию препарата необходимо выполнить по текущему графику, если с момента пропуска введения прошло более 3 дней, то новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Эфлейра®.
Указания по применению
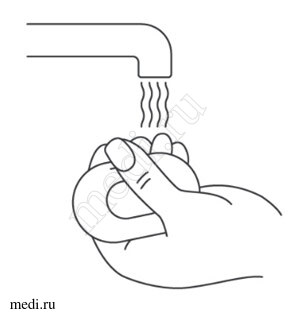
Подготовка к проведению подкожной инъекции

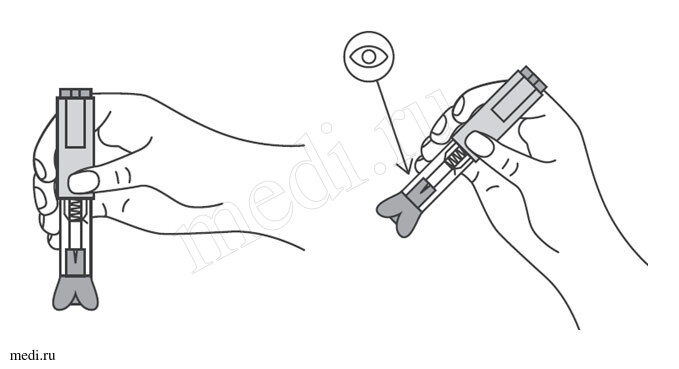
Препарат Эфлейра ® в автоинжекторе
- помутнения раствора, наличия в препарате посторонних видимых частиц;
- изменения цвета;
- повреждения любых частей шприца/автоинжектора;
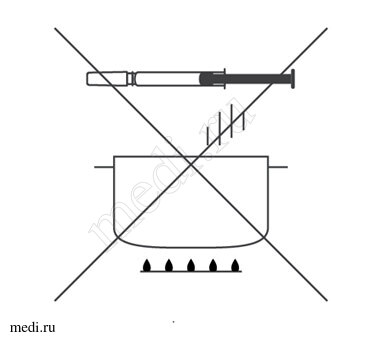
- истечения срока годности (годен до…), указанного на картонной пачке, а также на этикетке шприца/автоинжектора.
На данном этапе не следует снимать колпачок шприца/автоинжектора
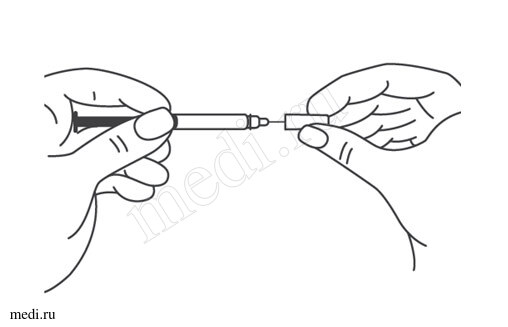
1. Техника выполнения подкожной инъекции препарата Эфлейра® в преднаполненном шприце
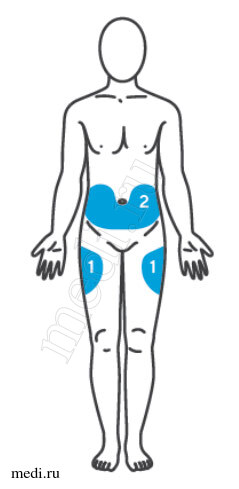
Выбор и подготовка места для инъекции



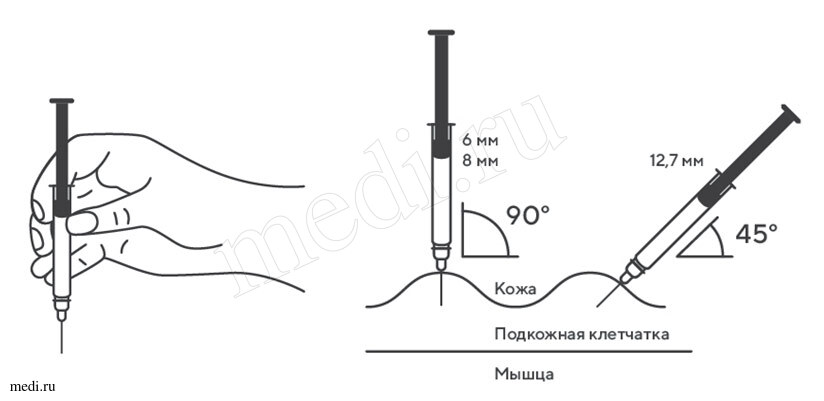
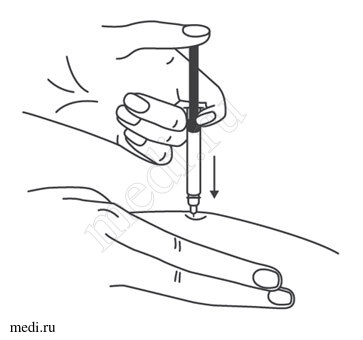
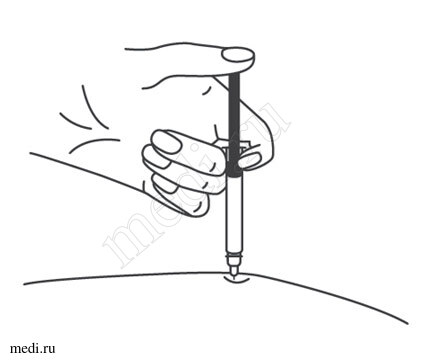
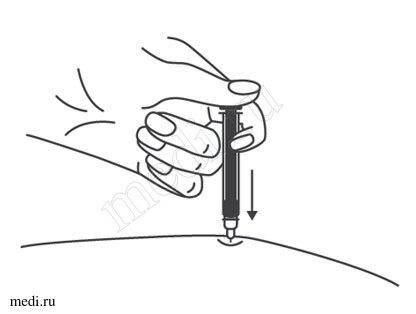
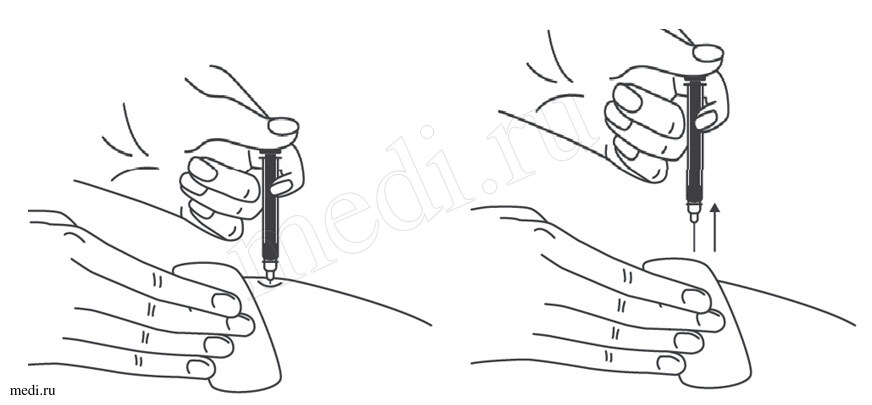
После инъекции шприц повторно не использовать
2. Техника выполнения подкожной инъекции препарата Эфлейра® в автоинжекторе
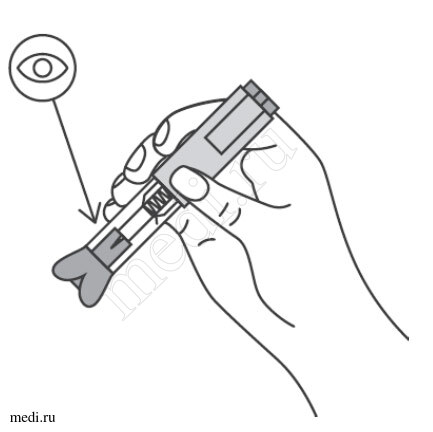



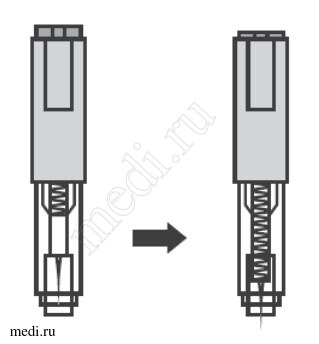
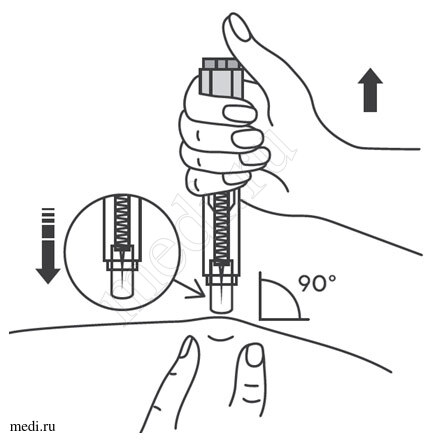
После инъекции автоинжектор повторно не использоватьУтилизация расходного материала

Побочное действие
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено.
Большинство зарегистрированных нежелательных явлений (НЯ), связанных с применением препарата Эфлейра®, имели легкую или среднюю степень тяжести и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было.
Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1000 до <1/100), редко (от >1/10000 до <1/1000), очень редко (<10000).
Инфекции и инвазии: часто – инфекции верхних дыхательных путей; нечасто – инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция.
Нарушения со стороны печени и желчевыводящих путей: нечасто – гипербилирубинемия.
Желудочно-кишечные нарушения: нечасто – боль в животе, диарея.
Нарушения со стороны кожи и подкожной клетчатки: нечасто – экзема, дерматит, сыпь, зуд, крапивница.
Нарушения со стороны крови и лимфатической системы: часто – нейтропения, лейкопения, лимфоцитоз; нечасто – тромбоцитопения, лимфопения.
Нарушения со стороны иммунной системы: нечасто – гиперчувствительность.
Нарушения со стороны органа зрения: нечасто – эписклерит.
Нарушения со стороны нервной системы: нечасто – головная боль, головокружение, парестезия, поражение лицевого нерва.
Нарушения со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса.
Нарушения со стороны сосудов: нечасто — гипертензия (в том числе изолированная систолическая/диастолическая гипертензия), гипертонический криз.
Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция**.
Нарушения метаболизма и питания: нечасто – гипергликемия.
Нарушения со стороны почек и мочевыводящих путей: нечасто – протеинурия.
Лабораторные и инструментальные данные: часто – повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто – повышение гамма-глутамилтрансферазы (ГГТ), повышение уровня холестерина в крови, увеличение веса.
Травмы, интоксикации и осложнения процедур: нечасто – головокружение во время процедуры (во время инъекции).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто – инфицированный невус.
Нарушения со стороны репродуктивной системы и молочных желез: нечасто – фиброзно-кистозная болезнь молочных желез.
* «Гриппоподобное заболевание» характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата.
** Местные реакции могут включать в себя любые неблагоприятные проявления, возникающие в месте инъекции.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях явлений дозолимитирующей токсичности не зарегистрировано: при подкожном введении нетакимаба в максимальной дозе 3 мг/кг (195 – 355 мг для взрослого человека с весом 65 – 85 кг) патологических отклонений не было выявлено.
Специфический антидот отсутствует. Лечение симптоматическое.
Взаимодействие с другими лекарственными средствами
Сведений о наличии неблагоприятных лекарственных взаимодействий нетакимаба с другими лекарственными препаратами до настоящего времени не получено. Предполагается, что нетакимаб может усиливать иммуносупрессивное действие глюкокортикоидов, метотрексата, сульфасалазина, лефлуномида и других базисных противовоспалительных препаратов.
Смешивание препарата с другими лекарственными средствами, введение в виде инфузии строго запрещено.
Особые указания
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В и/или С, сифилис, туберкулез, относится к противопоказаниям для назначения нетакимаба. Применение нетакимаба у данной группы больных не изучено. Учитывая иммуносупрессивное действие нетакимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. Необходимо проводить скрининг и оценивать соотношение риска и пользы терапии нетакимабом у этих пациентов.
Пациентам с активным туберкулезом терапия препаратом Эфлейра® противопоказана. Перед назначением препарата Эфлейра® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Эфлейра®.
При реактивации гепатита В терапия нетакимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии.
При использовании нетакимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований нетакимаба анафилактических реакций не зарегистрировано, нечасто отмечались реакции гиперчувствительности и крапивница. Однако при использовании других ингибиторов ИЛ17 крапивница и анафилактические реакции отмечались в редких и очень редких случаях. При возникновении анафилактических или других серьёзных аллергических реакций применение препарата Эфлейра® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения нетакимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательный мониторинг за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований на данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Эфлейра® при лечении псориаза, псориатического артрита и анкилозирующего спондилита выработка связывающих антител к нетакимабу была зарегистрирована менее чем в 0,5 % случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба у пациентов с псориазом, псориатическим артритом и анкилозирующим спондилитом.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Эфлейра®, так как клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом Эфлейра®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям. Иммунизация инактивированными вакцинами во время терапии нетакимабом должна выполняться с осторожностью.
Влияние на способность управлять транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Эфлейра® на способность управлять транспортными средствами и работать с машинами и (или) механизмами.
Форма выпуска
Раствор для подкожного введения 60 мг/мл.
Преднаполненные шприцы
По 1,0 мл препарата в трехкомпонентные шприцы. Цилиндр каждого шприца изготовлен из бесцветного нейтрального стекла I гидролитического класса. Шприц с одной стороны имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена жестким колпачком. С другой стороны шприц укупорен поршнем, шток которого изготовлен из полипропилена; на конце поршня имеется уплотнитель из бутилкучука, ламинированный фторполимером.
На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу помещают в контурную ячейковую упаковку из пленки ПВХ или ПЭТ.
По 2 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона. Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 шт.
Автоинжектор
По 1,0 мл препарата в трехкомпонентные шприцы. Цилиндр каждого шприца изготовлен из бесцветного нейтрального стекла I гидролитического класса.
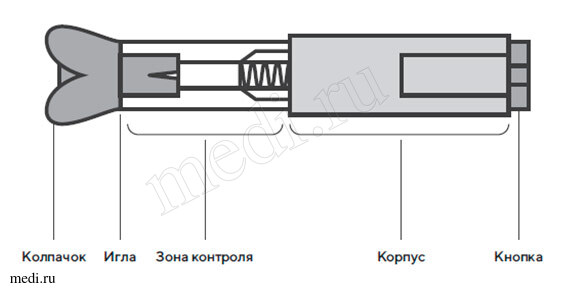
Шприц с препаратом встроен в пластиковый автоинжектор, состоящий из защитного колпачка, корпуса с прозрачной зоной контроля, верхнего корпуса и кнопки активации. Внутреннее устройство автоинжектора имеет цилиндр, защищающий иглу, и поршень, который через систему механического пуска соединен с кнопкой активации.
На каждый автоинжектор наклеивают самоклеящуюся этикетку.
По 1 автоинжектору помещают в контурную ячейковую упаковку из пленки ПВХ или ПЭТ.
По 2 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона. Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 шт.
Условия хранения
При температуре от 2 до 8°С в защищенном от света месте. Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
ЗАО «БИОКАД», Россия, 143422, Московская обл., Красногорский р-н, с. Петрово-Дальнее.
Владелец регистрационного удостоверения
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, д. 34, лит. А.
Организация, принимающая претензии потребителей
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, д. 34, лит. А.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Эйлеа® (Eylea®)
💊 Состав препарата Эйлеа®
✅ Применение препарата Эйлеа®
Описание активных компонентов препарата
Эйлеа®
(Eylea®)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2023.04.11
Владелец регистрационного удостоверения:
Вторичная упаковка и выпускающий контроль качества:
BAYER, AG
(Германия)
Код ATX:
S01LA05
(Афлиберцепт)
Лекарственная форма
| Эйлеа® |
Р-р д/внутриглазного введения 40 мг/мл: фл. 0.1 мл рег. №: ЛП-003544 |
Форма выпуска, упаковка и состав
препарата Эйлеа®
Раствор для внутриглазного введения прозрачный или слегка опалесцирующий, бесцветный или светло-желтого цвета.
Вспомогательные вещества: натрия дигидрофосфата моногидрат, натрия гидрофосфата гептагидрат, натрия хлорид, сахароза, полисорбат 20, вода д/и.
Один флакон содержит (0.1 мл) 100 мкл раствора (извлекаемый объем), что эквивалентно 4 мг афлиберцепта. Данный извлекаемый объем раствор позволяет обеспечить введение разовой дозы 2 мг афлиберцепта, что составляет 50 мкл раствора.
0.1 мл (100 мкл) извлекаемого объема* — флаконы бесцветного стекла (1) в комплекте с фильтровальной иглой — пачки картонные с контролем первого вскрытия (перфорация и/или стикер).
* Препарат производится с избытком наполнения в целях обеспечения извлекаемого объема не менее 0.1 мл (100 мкл).
Фармакологическое действие
Афлиберцепт — рекомбинантный гибридный белок, состоящий из связывающихся с VEGF (эндотелиальными факторами роста сосудов) частей внеклеточных доменов рецептора VEGF 1 и рецептора VEGF 2, соединенных с доменом Fc (фрагмента способного к кристаллизации) иммуноглобулина G1 (IgG1). Афлиберцепт производится с помощью технологии рекомбинантной ДНК с использованием экспрессионной системы клеток яичника китайского хомячка (СНО) К-1.
Афлиберцепт действует как растворимый рецептор-ловушка, который связывает VEGF-A (сосудистый эндотелиальный фактор роста А) и P1GF (плацентарный фактор роста) с более высокой аффинностью, чем их естественные рецепторы, и, таким образом, может ингибировать связывание и активацию этих родственных рецепторов VEGF.
Эндотелиальный фактор роста сосудов A (VEGF-A), эндотелиальный фактор роста сосудов В (VEGF-B) и плацентарный фактор роста (PlGF) относятся к VEGF-семейству ангиогенных факторов, которые могут действовать как сильные митогенные, хемотаксические и влияющие на сосудистую проницаемость факторы для эндотелиальных клеток. Действие VEGF осуществляется через две рецепторные тирозинкиназы — VEGFR-1 и VEGFR-2, находящиеся на поверхности эндотелиальных клеток. P1GF связывается только с VEGFR-1, которые также присутствуют на поверхности лейкоцитов. Избыточная активация VEGF-А этих рецепторов может приводить к патологической неоваскуляризации и избыточной проницаемости сосудов. В этих процессах P1GF может проявлять синергизм с VEGF-А, а также стимулирует инфильтрацию лейкоцитов и сосудистое воспаление.
Фармакокинетика
Вводят непосредственно в стекловидное тело для оказания локального воздействия. После интравитреального введения афлиберцепт медленно всасывается в системный кровоток, где обнаруживается в основном в виде неактивного стабильного комплекса с VEGF; при этом только свободный афлиберцепт может связывать эндогенный VEGF. Афлиберцепт не кумулирует в плазме крови при интравитреальном введении каждые 4 недели. Развитие системных фармакодинамических эффектов, таких как изменения АД, маловероятно. Величина средней Cmax свободного афлиберцепта в плазме согласно результатам фармакокинетических дополнительных исследований находилась в диапазоне от 0.03 до 0.05 мкг/мл, индивидуальные значения не превышали 0.14 мкг/мл. Впоследствии плазменные концентрации свободного афлиберцепта снижались до значений ниже или близких к нижнему пределу количественного определения, как правило, в течение одной недели. Ожидается, что как и другие крупные белки, и свободный, и связанный афлиберцепт будет выводиться из организма путем протеолитического катаболизма.
Показания активных веществ препарата
Эйлеа®
Для лечения неоваскулярной возрастной макулярной дегенерации («влажной» формы ВМД); снижения остроты зрения, вызванного макулярным отеком вследствие окклюзии вен сетчатки (центральной вены (ОЦВС) или ее ветвей (ОВЦВС)); снижения остроты зрения, вызванного диабетическим макулярным отеком (ДМО); снижения остроты зрения, вызванного миопической хориоидальной неоваскуляризацией (миопической ХНВ).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Средство предназначено для введения в стекловидное тело. Рекомендуемая доза афлиберцепта составляет 2 мг. Интервал между введениями должен составлять не менее одного месяца. Количество инъекций и интервалы между инъекциями устанавливают в зависимости от показаний, результатов изменения остроты зрения и/или анатомических показателей.
Побочное действие
Со стороны иммунной системы: нечасто — реакции гиперчувствительности.
Со стороны органа зрения: очень часто — снижение остроты зрения, субконъюнктивальное кровоизлияние, боль в глазу; часто — разрыв пигментного эпителия сетчатки, отслойка пигментного эпителия сетчатки, дегенерация сетчатки, кровоизлияние в стекловидное тело, катаракта, кортикальная катаракта, ядерная катаракта, субкапсулярная катаракта, эрозия роговицы, микроэрозии роговицы, повышение внутриглазного давления, затуманивание зрения, плавающие помутнения стекловидного тела, отслойка стекловидного тела, боль в месте введения, чувство инородного тела в глазу, слезотечение, отек века, кровоизлияния в месте введения, точечный кератит, инъекция конъюнктивы век, инъекция конъюнктивы глазного яблока; нечасто — эндофтальмит, отслойка сетчатки, разрыв сетчатки, ирит, увеит, иридоциклит, помутнение хрусталика, дефект эпителия роговицы, раздражение в месте введения, аномальная чувствительность тканей глаза, раздражение века, воспалительная реакция во влаге передней камеры, отек роговицы; редко — слепота, ятрогенная травматическая катаракта, воспалительная реакция со стороны стекловидного тела (витреит), гипопион.
Противопоказания к применению
Повышенная чувствительность к афлиберцепту; активная или подозреваемая интра- или периокулярная инфекция; активное тяжелое внутриглазное воспаление; беременность и период грудного вскармливания, за исключением случаев, когда потенциальная польза для матери превышает потенциальный риск для плода; возраст до 18 лет.
С осторожностью: при лечении пациентов с плохо контролируемой глаукомой (не следует вводить афлиберцепт при внутриглазном давлении >30 мм рт.ст.); у пациентов, перенесших инсульт, транзиторную ишемическую атаку или инфаркт миокарда в течение последних 6 месяцев; у пациентов с факторами риска нарушения целостности пигментного эпителия сетчатки.
Применение при беременности и кормлении грудью
Афлиберцепт не следует применять при беременности, за исключением случаев, когда потенциальная польза для матери превышает потенциальный риск для плода.
Афлиберцепт не рекомендуется применять при грудном вскармливании. Необходимо принять решение о прерывании грудного вскармливания или воздержаться от терапии афлиберцептом, принимая во внимание пользу грудного вскармливания для ребенка и пользу лечения для матери.
Женщины репродуктивного возраста должны использовать эффективные средства контрацепции в период лечения и, по крайней мере, в течение 3 месяцев после последней интравитреальной инъекции афлиберцепта.
Применение при нарушениях функции печени
Коррекции дозы у пациентов с печеночной недостаточностью не требуется.
Применение при нарушениях функции почек
Коррекции дозы у пациентов с почечной недостаточностью не требуется.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
У пациентов пожилого возраста соблюдения каких-либо специальных условий не требуется.
Особые указания
Была выявлена связь интравитреальных инъекций, включая инъекции афлиберцепта, с развитием эндофтальмита, воспалительной реакции со стороны стекловидного тела, регматогенной отслойки сетчатки, разрыва сетчатки, ятрогенной травматической катаракты. При введении афлиберцепта всегда следует строго соблюдать соответствующую технику асептического проведения инъекций. Пациенты должны находиться под наблюдением в течение 1 недели после проведенной инъекции для выявления первых признаков воспаления и своевременного назначения необходимой терапии. Следует информировать пациентов о необходимости немедленно сообщать врачу о любых симптомах, свидетельствующих о развитии эндофтальмита или любой другой реакции, указанной выше.
Наблюдались случаи повышения внутриглазного давления в первые 60 мин после интравитреальных инъекций, включая инъекции афлиберцепта. При лечении пациентов с плохо контролируемой глаукомой необходимы особые меры предосторожности (не следует вводить афлиберцепт при внутриглазном давлении >30 мм рт. ст.). Во всех случаях необходим контроль внутриглазного давления и перфузии диска зрительного нерва с назначением соответствующей состоянию терапии.
Поскольку афлиберцепт представляет собой белок с терапевтическими свойствами, существует вероятность проявления иммуногенности. Следует информировать пациентов о необходимости сообщать врачу о любых признаках или симптомах внутриглазного воспаления, таких как боль, светобоязнь или конъюнктивальная или перикорнеальная инъекция, которые могут быть клиническими проявлениями гиперчувствительности.
После интравитреальных инъекций ингибиторов VEGF были отмечены системные нежелательные явления, в т.ч. кровоизлияния вне органа зрения и тромбоэмболия артерий. Существует теоретический риск связи этих явлений с ингибированием VEGF. Имеются ограниченные данные по безопасности применения афлиберцепта пациентами с ОЦВС, ОВЦВС, ДМО или миопической ХНВ, имеющими в анамнезе инсульт, транзиторную ишемическую атаку или инфаркт миокарда за период в 6 мес до начала терапии. При лечении таких пациентов следует соблюдать осторожность.
При введении афлиберцепта одновременно в оба глаза возможно повышение его системной экспозиции, что, в свою очередь, повышает риск возникновения системных нежелательных явлений.
Факторы риска, связанные с нарушением целостности слоя пигментных клеток после анти-VEGF терапии «влажной» формы ВМД, включают обширную и/или выраженную отслойку пигментного эпителия сетчатки. В начале терапии афлиберцептом следует соблюдать осторожность при его назначении пациентам с факторами риска развития разрывов пигментного эпителия сетчатки.
Пациентам с регматогенной отслойкой сетчатки или с макулярными разрывами 3 или 4 стадии не рекомендуют терапию афлиберцептом.
В случае разрыва сетчатки инъекцию афлиберцепта следует отменить, лечение не следует возобновлять до адекватного восстановления разрыва.
От инъекции следует воздержаться до следующей запланированной по графику инъекции в случае снижения МКОЗ >30 букв по сравнению с последней оценкой остроты зрения; субретинальных кровоизлияний, затрагивающих центральную ямку, или если размер кровоизлияния составляет >50% от общей области поражения.
От инъекции следует воздержаться на период 28 дней до планируемого и 28 дней после проведенного интраокулярного хирургического вмешательства.
При наличии у пациентов клинических признаков необратимых изменений зрительных функций на фоне ишемической ОЦВС и ОВЦВС терапия афлиберцептом не рекомендована.
Влияние на способность к управлению транспортными средствами и механизмами
Применение афлиберцепта оказывает минимальное влияние на способность управлять транспортными средствами и использовать механизмы вследствие возможных временных нарушений зрения, связанных как с инъекцией, так и с процедурой обследования. Если после проведения инъекции у пациента возникли временные нарушения зрения, не рекомендуется управлять автомобилем или работать с механизмами до восстановления четкости зрительного восприятия.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
АТХ
S01LA05 Афлиберцепт
Фармакологическая группа
- Средство, препятствующие новообразованию сосудов [Офтальмологические средства]
Нозологическая классификация (МКБ-10)
- H34 Окклюзии сосудов сетчатки
- H35.3 Дегенерация макулы и заднего полюса
- H36.0 Диабетическая ретинопатия (E10-E14+ с общим четвертым знаком .3)
- H58.1 Нарушения зрения при болезнях, классифицированных в других рубриках
Состав
| Раствор для внутриглазного введения | 1 мл |
| активное вещество: | |
| афлиберцепт | 40 мг |
| вспомогательные вещества: натрия дигидрофосфата моногидрат — 1,104 мг, натрия гидрофосфата гептагидрат — 0,537 мг, натрия хлорид — 2,338 мг, сахароза — 50 мг, полисорбат 20 — 0,3 мг, вода для инъекций — до 1 мл | |
| 1 фл. содержит 100 мкл раствора, что эквивалентно 4 мг афлиберцепта |
Фармакологическое действие
Фармакологическое действие — ингибирующее неоангиогенез.
Способ применения и дозы
Интравитреально. Препарат Эйлеа® предназначен только для введения в стекловидное тело.
Содержимое флакона следует использовать только для одной инъекции.
Препарат Эйлеа® должен вводить только врач, имеющий соответствующую квалификацию и опыт интравитреальных инъекций.
Неоваскулярная («влажная» форма) возрастная макулярная дегенерация («влажная» ВМД).Рекомендованная доза препарата Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора.
Лечение препаратом Эйлеа® начинают с введения трех последовательных ежемесячных инъекций, затем выполняют по одной инъекции каждые два месяца. Контроль между инъекциями не требуется.
Через 12 мес лечения препаратом Эйлеа® интервал между инъекциями может быть увеличен на основании результатов изменения остроты зрения и анатомических показателей. В этом случае лечащий врач должен составить график контрольных обследований, которые могут быть более частыми, чем инъекции.
Макулярный отек развившийся вследствие окклюзии вен сетчатки (центральной вены (ОЦВС) или ее ветвей (ОВВС).
Рекомендованная доза препарата Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора.
После начальной инъекции лечение проводится ежемесячно. Интервал между двумя инъекциями должен быть не менее одного месяца.
Если не наблюдается улучшение остроты зрения и анатомических показателей после непрерывного лечения, лечение препаратом Эйлеа® должно быть прекращено.
Ежемесячные инъекции продолжают до достижения максимально возможной остроты зрения в отсутствие признаков активности заболевания. Для этого необходимо проведение трех и более последовательных ежемесячных инъекций.
Терапия может быть продолжена в обычном и удлиненном режиме при постепенном увеличении интервала между инъекциями для поддержания достигнутых стабильных остроты зрения и анатомических показателей, однако данных, позволяющих установить длительность интервалов, недостаточно. В случае ухудшения остроты зрения и анатомических показателей интервалы между инъекциями должны быть соответственно сокращены.
Мониторинг и выбор схемы лечения осуществляются лечащим врачом на основании индивидуального ответа пациента.
Мониторинг проявлений активности заболевания может включать в себя стандартный офтальмологический осмотр, функциональную диагностику или проведение визуальных методов исследования (оптической когерентной томографии или флюоресцентной ангиографии).
Диабетический макулярный отек (ДМО). Рекомендованная доза препарата Эйлеа®составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора.
Терапию препаратом Эйлеа® начинают с одной ежемесячной инъекции в течение первых пяти месяцев, после чего инъекции проводят каждые два месяца. Мониторинг между инъекциями не требуется.
Через 12 мес лечения препаратом Эйлеа® интервал между инъекциями может быть увеличен на основании результатов остроты зрения и анатомических показателей. График контрольных обследований составляется лечащим врачом.
Если результаты остроты зрения и анатомические показатели указывают на отсутствие эффекта от проводимого лечения, терапию препаратом Эйлеа® следует прекратить.
Особые группы пациентов
Нарушение функции печени и/или почек. Никаких специальных исследований с участием пациентов с печеночной и/или почечной недостаточностью, получающих препарат Эйлеа®, не проводилось.
На основании доступных данных, коррекция дозы у таких пациентов не требуется.
Пожилой возраст. Соблюдение каких-либо специальных условий не требуется. Опыт лечения пациентов старше 75 лет с ДМО ограничен.
Дети. Безопасность и эффективность препарата Эйлеа® не изучалась у детей и подростков. Препарат Эйлеа® не показан к применению у данной группы пациентов.
Способ введения
Интравитреальные инъекции должны проводиться в соответствии с медицинскими стандартами и действующими рекомендациями квалифицированным врачом, имеющим опыт проведения таких инъекций. В целом необходимо обеспечить адекватную анестезию и асептические условия, включая применение местных бактерицидных средств широкого спектра действия (например, наносить повидон-йод на кожу вокруг глаза, веко и поверхность глаза). Рекомендуется дезинфекция рук хирурга, применение стерильных перчаток, салфеток и стерильного расширителя век (или его эквивалента). Инъекционную иглу следует вводить на 3,5–4,0 мм кзади от лимба в полость стекловидного тела, избегая горизонтального меридиана и направляя иглу в центр глазного яблока. Объем вводимого раствора — 0,05 мл. Следующая инъекция проводится в другой участок склеры.
Сразу после интравитреальной инъекции состояние пациента необходимо контролировать на предмет повышения ВГД. Адекватный мониторинг может включать проверку перфузии диска зрительного нерва или офтальмотонометрию. При необходимости следует обеспечить доступность стерильного оборудования для парацентеза.
После проведения интравитреальной инъекции пациента следует предупредить о необходимости безотлагательно сообщать о любых симптомах, которые могут свидетельствовать о развитии эндофтальмита (например боль в глазу, конъюнктивальная или перикорнеальная инъекция, светобоязнь, затуманивание зрения). Каждый флакон следует использовать только для одной интравитреальной инъекции. Флакон содержит дозу афлиберцепта, превышающую рекомендованную дозу 2 мг. Извлекаемый объем флакона (100 мкл) не используется полностью. Избыточный объем должен быть удален до инъекции. Введение полного объема флакона может привести к передозировке. Для удаления пузырьков воздуха и избыточного объема лекарственного препарата следует медленно нажать на поршень шприца и передвинуть цилиндрическое основание купола поршня до черной метки на шприце (эквивалентно 50 мкл, т.е. 2 мг афлиберцепта).
После инъекции весь неиспользованный препарат должен быть утилизирован.
Перед применением следует внимательно осмотреть флакон. При нарушении целостности флакона, значительном изменении цвета, помутнении, обнаружении видимых частиц, препарат нельзя применять.
Инструкции по использованию флакона
1. Удаляют пластиковый колпачок и дезинфицируют внешнюю часть резиновой пробки флакона.
2. Присоединяют фильтровальную иглу 18 G, 5 мк, вложенную в картонную пачку, к стерильному шприцу на 1 мл с люэровским наконечником.
3. Фильтровальную иглу вводят в центр пробки флакона до тех пор, пока она полностью не войдет во флакон и ее конец не коснется дна или нижнего края флакона.
4. Соблюдая правила асептики, извлекают все содержимое флакона с препаратом Эйлеа® в шприц, держа флакон вертикально, немного наклоняя его для полного извлечения препарата. Для предотвращения попадания воздуха необходимо убедиться, что скошенный конец иглы погружен в жидкость. При отборе раствора продолжают наклонять флакон, следя за тем, чтобы конец иглы был погружен в жидкость.
5. Убедившись, что шток поршня достаточно оттянут назад при заборе раствора из флакона, фильтровальную иглу полностью опустошают.
6. Фильтровальную иглу снимают и утилизируют.
Примечание: фильтровальная игла не используется для интравитреальной инъекции.
7. Соблюдая правила асептики, иглу для инъекции 30 G × 1/2 дюйма плотно присоединяют к кончику шприца с люэровским наконечником.
8. Перед применением препарата Эйлеа® удаляют пластиковый колпачок с иглы.
9. Держа шприц иглой вверх, проверяют раствор на наличие пузырьков. Если они имеются, осторожно встряхивают шприц пальцем до тех пор, пока все пузырьки не поднимутся наверх.
10. Медленно надавливая на поршень так, чтобы его край достиг метки 0,05 мл на шприце, удаляют все пузырьки и избыточный объем препарата.
11. Флакон предназначен только для однократного использования. Весь неиспользованный объем лекарственного препарата или отходы должны быть утилизированы.
Форма выпуска
Раствор для внутриглазного введения, 40 мг/мл По 0,1 мл извлекаемого объема препарата во флаконе бесцветного стекла, укупоренный пробкой из бутилкаучука, с обжимным алюминиевым колпачком и полипропиленовой крышкой. По 1 фл. и 1 фильтровальной игле помещают в картонную пачку.
Производитель
Байер Фарма АГ, Мюллерштрассе 178, 13353 Берлин, Германия. Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение: Байер Фарма АГ, Мюллерштрассе 178, 13353 Берлин, Германия. Bayer Pharma AG, Mullerstrasse 178, 13353 Berlin, Germany.
Условия отпуска из аптек
По рецепту
Условия хранения препарата Эйлеа®
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности препарата Эйлеа®
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Синонимы нозологических групп
Рубрика МКБ-10Синонимы заболеваний по МКБ-10
| H34 Окклюзии сосудов сетчатки | Артериальный тромбоз сосудов глаза |
| Венозный тромбоз сосудов глаза | |
| Нарушение ретинальной циркуляции | |
| Нарушения внутриглазного кровообращения | |
| Недостаточность кровоснабжения сетчатой и сосудистой оболочки глаза | |
| Окклюзия центральных сосудов сетчатки | |
| Острая непроходимость артерий сетчатки | |
| Подострая и хроническая недостаточность кровообращения в сетчатке или в сосудистой оболочке глаза | |
| Сосудистые заболевания сетчатки глаза | |
| Сосудистые нарушения в сетчатой оболочке глаза | |
| Тромбоз сосудов сетчатки | |
| Тромбоз центральной вены сетчатки | |
| Тромбоз центральной вены сетчатки и ее ветвей | |
| Тромбоз центральной вены сетчатой оболочки глаза и ее ветвей | |
| H35.3 Дегенерация макулы и заднего полюса | Ангиосклеротическая макулодистрофия |
| Болезнь Штаргардта | |
| Возрастная макулодистрофия | |
| Дегенеративные изменения желтого пятна | |
| Дегенеративные процессы в желтом пятне | |
| Дегенерация возрастная макулярная | |
| Дегенерация желтого пятна | |
| Деградация сетчатки | |
| Дистрофия сетчатки | |
| Дистрофия сетчатой оболочки | |
| Макулярная дегенерация | |
| Макулярная дегенерация возрастная (старческая) | |
| Наследственная пигментная дегенерация сетчатки | |
| Наследственные тапеторетинальные дегенерации | |
| Нетранссудативные формы макулярных дегенераций | |
| Пигментная дегенерация сетчатки | |
| Старческая дегенерация желтого пятна | |
| H36.0 Диабетическая ретинопатия (E10-E14+ с общим четвертым знаком .3) | Геморрагическая диабетическая ретинопатия |
| Диабетическая ретинопатия | |
| Дистрофия сетчатки у больных сахарным диабетом |
Эйлеа®
МНН: Афлиберцепт
Производитель: Регенерон Фармасьютикалс, Инк.
Анатомо-терапевтическо-химическая классификация: Афлиберцепт
Номер регистрации в РК:
№ РК-ЛС-5№020045
Информация о регистрации в РК:
02.10.2018 — бессрочно
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
319 827.2 KZT
- Скачать инструкцию медикамента
Торговое название
Эйлеа®
Международное непатентованное название
Афлиберцепт
Лекарственная форма
Раствор для инъекций, 40 мг/мл
Состав
1 мл препарата содержит
активное вещество — афлиберцепта 40 мг,
вспомогательные вещества: натрия хлорид, натрия дигидрофосфат моногидрат, натрия гидрофосфат гептагидрат, сахароза, полисорбат 20, вода для инъекций.
Описание
Прозрачный, слегка опалесцирующий раствор.
Фармакотерапевтическая группа
Препараты для лечения заболеваний глаз. Средства для лечения сосудистых расстройств окологлазного пространства. Антинеоваскулярные средства. Афлиберцепт.
Код АТХ S01LA05
Фармакологические свойства
Фармакокинетика
Абсорбция / распределение
После интравитреального введения афлиберцепт медленно проникает в системный кровоток и находится, главным образом в виде неактивного стабильного комплекса с VEGF (фактор роста эндотелия сосудов), однако только «свободный афлиберцепт» может связываться с эндогенным VEGF.
Максимальная концентрация свободного афлиберцепта в плазме крови (системный Cmax) низкая и в среднем составляет приблизительно 0,02 микрограмма/мл (в диапазоне от 0 до 0,054) в течение 1-3 дней после интравитреального введения 2 мг, а через две недели после введения дозы не обнаруживается в плазме. При интравитреальном введении каждые 4 недели афлиберцепт не кумулирует в плазме.
Предполагается, что после интравитреального введения пациентам 2 мг препарата, средняя максимальная концентрация свободного афлиберцепта в плазме крови более чем в 100 раз ниже концентрации афлиберцепта, необходимой для связывания половины максимального уровня системного VEGF. Таким образом, системный фармакодинамический эффект (такой как, изменения АД) маловероятен.
Экскреция
Свободный афлиберцепт связывается с VEGF для формирования стабильного инертного комплекса. Как и в случае с другими крупными белками предполагается, что свободный и связанный афлиберцепт будет выводиться путем протеолитического катаболизма.
Фармакодинамика
Афлиберцепт представляет собой рекомбинантный гибридный белок, состоящий из фрагментов внеклеточных доменов рецепторов VEGF (фактора роста эндотелия сосудов) 1 и 2, соединенных с Fc-фрагментом человеческого IgG1.
Афлиберцепт вырабатывается в клетках K1 яичника китайского хомячка (CHO/ЯКХ) путем рекомбинантной ДНК-технологии.
Механизм действия
Эндотелиальный сосудистый фактор роста А (VEGF-A) и плацентарный фактор роста (PIGF) относятся к семейству ангиогенных факторов, которые могут действовать в качестве активного митогенного, хемотаксического фактора и фактора сосудистой проницаемости для эндотелиальных клеток. VEGF действует посредством тирозинкиназы двух рецепторов, VEGFR-1 и VEGFR-2, которые присутствуют на поверхности эндотелиальных клеток. PIGF связывается только с фактором VEGFR-1, который также присутствует на поверхности лейкоцитов. Излишняя активация рецепторов VEGF-А может привести к патологической неоваскуляризации и повышенной проницаемости сосудов.
Возможен синергизм между фактором PIGF и VEGF-A в этих процессах, также известно, что фактор PIGF способствует лейкоцитарной инфильтрации и сосудистому воспалению. Множество глазных болезней связаны с патологической неоваскуляризацией, сосудистым пропотеванием, которые могут привести к утолщению или отеку сетчатки, что, как полагают, способствует потере зрения.
Афлиберцепт действует как растворимый рецептор-«ловушка», который связывает все изоформы VEGF-A и PIGF с большей аффинностью, чем их природные рецепторы, и таким образом ингибирует связывание и активацию нативных рецепторов VEGF. Константа равновесной диссоциации (КD) для связывания афлиберцепта, с человеческим VEGF-A165 составляет 0,5 промилле, а для человеческого VEGF-A121 составляет 0,36 промилле. Константа KD для связывания с человеческим PIGF-2 составляет 39 промилле.
Исследования на животных показали, что афлиберцепт может предотвращать патологическую неоваскуляризацию и пропотевание жидкости из сосудов на ряде различных моделей глазных болезней. Например, интравитреальное введение афлиберцепта обезьянам предотвращало развитие выраженной хориоидальной неоваскуляризации ( ХНВ/CNV) после повреждения лазерным лучом, и способствовало уменьшению пропотевания жидкости через сосуды на установленных участках патологической хориоидальной неоваскуляризации.
Фармакодинамические эффекты
Неоваскулярная влажная возрастная макулярная дегенерация (влажная ВМД) характеризуется патологической хориоидальной неоваскуляризацией (ХНВ). Пропотевание крови или жидкости из участков ХНВ может вызывать отек сетчатки и/или суб- /интраретинальное кровоизлияние, приводящее к потере остроты зрения.
У пациентов, получающих препарат Эйлеа® (одна инъекция в месяц в течение трех первых месяцев, с последующей одной инъекцией каждые 2 месяца), отмечалось уменьшение толщины сетчатки вскоре после начала лечения и уменьшение среднего размера патологического участка ХНВ, что соответствует результатам, полученным у пациентов на фоне ежемесячного введения ранибизумаба в дозе 0,5 мг.
Макулярный отек вследствие окклюзии центральной вены сетчатки или ее ветвей
При окклюзии центральной вены сетчатки или ее ветвей возникает ишемия сетчатки, провоцирующая высвобождение VEGF, которые в свою очередь дестабилизируют плотные соединения и способствуют пролиферации эндотелиальных клеток. Повышение активности VEGF приводит к нарушению гематоретинального барьера, и такая повышенная сосудистая проницаемость приводит к отеку сетчатки, стимулированию роста эндотелиальных клеток и неоваскуляризации.
У пациентов, получающих лечение Эйлеа®, (одна инъекция раз в месяц на протяжении шести месяцев) наблюдалась постоянная, быстрая и устойчивая ответная реакция в отношении морфологии ( толщина центральной зоны сетчатки (ТЦЗС) по данным ОКТ (оптической когерентной томографии). Улучшение среднего показателя ТЦЗС сохранялось на протяжении 24 недель.
Диабетический макулярный отек
Диабетический макулярный отек характеризуется повышенной проницаемостью сосудов и повреждением капилляров сетчатки, что может вызвать потерю остроты зрения.
У пациентов, получавших препарат Эйлеа®, вскоре после начала лечения наблюдался быстрый и устойчивый морфологический ответ (толщина центральной зоны сетчатки [ТЦЗС]), согласно оценке данных ОКТ. Среднее изменение в ТЦЗС от исходного уровня значения к 52 неделе было статистически значимым в пользу Эйлеа®.
Миопическая хориоидальная неоваскуляризация
Миопическая хориоидальная неоваскуляризация является частой причиной потери зрения у взрослых с патологической миопией.
Она развивается как ранозаживляющий механизм вследствие разрыва мембраны Бруха и представляет собой наиболее угрожающее зрению событие при патологической миопии.
Показания к применению
— неоваскулярная (влажная) возрастная макулярная дегенерация (ВМД)
— нарушение зрения вследствие макулярного отека, обусловленного окклюзией вен сетчатки (центральной вены сетчатки (ОЦВС) и ее ветвей (ОВВС))
— нарушение зрения вследствие диабетического макулярного отека (ДМО) — нарушение зрения вследствие миопической хориоидальной неоваскуляризации (миопической ХНВ)
Способ применения и дозы
Эйлеа® предназначен только для интравитреального введения.
Препарат должен вводиться только квалифицированным врачом, имеющим опыт проведения интравитреальных инъекций.
Каждый флакон содержит 0.278 мл раствора для интравитреального введения, что предоставляет извлекаемый объем 0.1 мл.
Разовая доза препарата во флаконе составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора для инъекций.
Режим дозирования
Неоваскулярная возрастная макулярная дегенерация
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора для инъекций.
Лечение Эйлеа® начинают с трех последовательных инъекций 1 раз в месяц (каждые 4 недели в течение первых 12 недель) с дальнейшей инъекцией 1 раз каждые 2 месяца. Нет необходимости в проведении мониторинга между инъекциями.
После первых 12 месяцев лечения Эйлеа®, интервал между инъекциями может быть продлен на основании визуальных и анатомических результатов. В этом случае график обследований должен устанавливаться лечащим врачом и при этом он может быть чаще, чем график инъекций.
Макулярный отек вследствие окклюзии вен сетчатки (центральной вены сетчатки или ее ветвей)
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора для инъекций.
После начальной инъекции препарата лечение проводят каждый месяц. Интервал между двумя инъекциями не должен быть короче одного месяца.
Если визуальные и анатомические результаты не указывают на пользу проводимой непрерывной терапии, инъекции Эйлеа® следует прекратить.
Лечение продолжают до достижения максимальной остроты зрения и/или отсутствия признаков активности заболевания. Возможна необходимость в выполнении 3-х или более последовательных ежемесячных инъекций.
Лечение затем можно продолжить в режиме treat-and-extend (лечить-и-увеличивать) с постепенным увеличением интервалов между инъекциями для поддержания стабильных визуальных и/или анатомических результатов, однако имеется недостаточно данных, чтобы сделать заключение о длительности этих интервалов. Если отмечается ухудшение визуальных и/или анатомических результатов необходимо сократить интервал в лечении, соответственно.График мониторинга и лечения должен определяться лечащим врачом на основании индивидуальной реакции пациента.
Мониторинг активности заболевания включает в себя проведение клинического обследования, функциональных тестов или методов визуализации (например, оптической когерентной томографии или флуоресцентной ангиографии).
Диабетический макулярный отек
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора для инъекций.
Лечение Эйлеа® начинают с пяти последовательных инъекций 1 раз в месяц с дальнейшим интервалом лечения 1 инъекция в 2 месяца. Нет необходимости в проведении мониторинга между инъекциями.
После первых 12 месяцев лечения Эйлеа®, интервал между инъекциями может быть продлен на основании визуальных и анатомических результатов. График обследований должен устанавливаться лечащим врачом.
Если визуальные и анатомические результаты не указывают на пользу проводимой непрерывной терапии, инъекции Эйлеа® следует прекратить.
Миопическая хориоидальная неоваскуляризация
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл (0.05 мл) раствора в виде однократной интравитреальной инъекции.
Дополнительные дозы могут вводиться, если визуальные и/или анатомические результаты свидетельствуют о сохранении признаков заболевания. При развитии рецидива необходимо лечение как в случае новой манифестации заболевания.
График обследований должен устанавливаться лечащим врачом.
Интервал между двумя инъекциями не должен быть короче одного месяца.
Дополнительная информация для особых категорий пациентов
Пациенты с нарушениями функции печени и/или почек
Не проводилось каких-либо специальных исследований Эйлеа® у больных с нарушениями функции печени и почек. Доступные данные не предполагают коррекции дозы у таких пациентов.
Пожилые пациенты
Специальных предостережений не существуют. Имеется ограниченный опыт применения у больных старше 75 лет с диабетическим макулярным отеком.
Дети и подростки
Безопасность и эффективность в данной возрастной группе не установлена.
Нет обоснования для применения Эйлеа® в педиатрической популяции по показаниям ВМД, ОЦВС и ОВВС, ДМО, миопической ХНВ
Техника введения
Интравитреальные введения должны осуществляться квалифицированным врачом, имеющим опыт проведения интравитреальных инъекций в соответствии с медицинскими стандартами и действующими руководящими положениями. В целом, должна обеспечиваться адекватная анестезия и асептика, включая наружные бактерицидные средства широкого спектра (например, повидон-йод), наносимые на кожу вокруг глаза, веко и поверхность глаза. Рекомендуется применять хирургическую дезинфекцию рук, использовать стерильные перчатки, стерильные салфетки, стерильные векорасширители (или эквивалент).
Иглу для инъекций следует вводить на 3,5–4 мм кзади от лимба в полость стекловидного тела, избегая области горизонтальной меридианы и направляя иглу к центру глазного яблока. Затем следует выполнить инъекцию 0.05 мл раствора; для последующих инъекций следует использовать разные места склеры.
Сразу после интравитреальной инъекции должно быть начато наблюдение за пациентами на предмет выявления возможного повышения внутриглазного давления. Надлежащий мониторинг может состоять из проверки перфузии диска зрительного нерва или тонометрии. При необходимости следует обеспечить доступ к стерильному оборудованию для проведения парацентеза.
После интравитреальной инъекции пациентов необходимо проинструктировать о том, что они должны без промедления сообщать о каких-либо симптомах эндофтальмита (например, глазная боль, покраснение глаза, светобоязнь, нечеткость зрения).
Каждый флакон должен применяться только для лечения одного глаза.
После инъекции любой неиспользованный продукт должен быть утилизирован.
Инструкция по введению изложена в отдельном разделе.
Побочные действия
Серьезные побочные реакции, связанные с инъекцией Эйлеа® наблюдались менее чем в одной из 2200 проведенных интравитреальных инъекций, и включали слепоту, эндофтальмит, отслойку сетчатки, травматическую катаракту, кровоизлияния в стекловидное тело, катаракту, отслойку стекловидного тела, и повышение внутриглазного давления (смотрите раздел «Особые указания»).
Наиболее частыми побочными реакциями (как минимум у 5% пациентов, получивших терапию Эйлеа®) были кровоизлияние под конъюнктиву (24%), снижение остроты зрения (10%), боль в глазу (10%), повышение внутриглазного давления (7%), отслойка стекловидного тела (7%), плавающие помутнения стекловидного тела (6%) и катаракта (6%).
Перечисленные ниже данные по безопасности препарата включают в себя все побочные реакции, основанные на исследованиях фазы III, с допустимой возможностью их взаимосвязи с процедурой инъекции или с самим препаратом
Очень часто (1/10)
— снижение остроты зрения
— кровоизлияние под конъюнктиву
— боль в глазу
Часто (1/100, 1/10)
— разрыв пигментного эпителия сетчатки⃰, отслойка пигментного эпителия сетчатки, дегенерация сетчатки, кровоизлияние в стекловидное тело, катаракта, ядерная катаракта, субкапсулярная катаракта, эрозия роговицы, повреждение роговицы, повышение внутриглазного давления, нечеткость зрения, плавающие помутнения стекловидного тела, отек роговицы, отслойка стекловидного тела, боль в месте введения, ощущение инородного тела в глазах, повышенное слезоотделение, отек век, кровоизлияние в месте введения, точечный кератит, гиперемия конъюнктивы, окулярная гиперемия
Нечасто (1/1 0001/100)
— реакции гиперчувствительности
— эндофтальмит**, отслойка сетчатки, разрыв сетчатки, ирит, иридоциклит, кортикальная катаракта, помутнение хрусталика, отек роговицы, повреждение эпителия роговицы, раздражение в месте введения, ощущение дискомфорта в глазу, раздражение век, воспаление передней камеры глаза.
Редко (1/10 000, 1/1 000)
— слепота, увеит, травматическая катаракта, воспаление стекловидного тела, гипопион
*Состояния, о которых известно, что они связаны с влажной ВМД. Наблюдались только в исследованиях влажной ВМД.
**Эндофтальмит с положительной и отрицательной культурой.
Описание отдельных побочных реакций
Артериальные тромбоэмболические явления
Артериальные тромбоэмболические явления (АТЯ)– это побочные реакции, потенциально связанные с ингибированием системного эндотелиального фактора роста сосудов (VEGF). Существует теоретический риск развития АТЯ после интравитреального применения ингибиторов VEGF.
АТЯ, как это определено критериями Сотрудничества Антитромбоцитарных исследователей (АРТС), включают в себя нефатальный инфаркт миокарда, нефатальный инсульт или сосудистую смерть (включая смерть неизвестной этиологии)
Частота АТЯ у больных с ВМД в исследованиях III фазы в течение 96 недель была 3,3% (60 из 1,824) в комбинированной группе пациентов, получавших Эйлеа® по сравнению с 3,2% (19 из 595) у пациентов, получавших ранибизумаб (см. раздел «Фармакодинамические свойства»). Соответствующие цифры в исследованиях отмечались у пациентов с ДМО в течение первых 52 недель как 3,3% (19 из 578) на фоне Эйлеа® и 2,8% (8 из 287) в контрольной группе) (см. раздел «Фармакодинамические свойства»).
Частота АТЯ у больных с ОЦВС в исследованиях III фазы продолжительностью 76/100 недель была 0,6% (2 из 317) у пациентов, получавших, по крайней мере, одну дозу Эйлеа® по сравнению с 1,4% (2 из 142) в группе пациентов, получавших только имитацию инъекции (см. раздел «Фармакодинамические свойства»). Частота АТЯ у больных с ОВВС в исследованиях III фазы продолжительностью 52 недели была 0% (0 из 91) у пациентов, получавших Эйлеа® сравнению с 2,2% (2 из 92) в контрольной группе (см. раздел «Фармакодинамические свойства»).
Один из пациентов в контрольной группе получил лечение препаратом Эйлеа® в качестве «терапии спасения».
Частота АТЯ у больных с миопической ХНВ в исследовании продолжительностью 48 недель была 1,1% (1 из 91) на фоне Эйлеа® по сравнению с 0% (0 из 31) в контрольной группе).
Как и для других препаратов белковой природы существует вероятность развития иммуногенности на введение препарата Эйлеа®.
Противопоказания
— гиперчувствительность к афлиберцепту или вспомогательным компонентам препарата
— активная окулярная или периокулярная инфекция или подозрение на них
— активное тяжелое интраокулярное воспаление.
Лекарственные взаимодействия
Исследования на лекарственные взаимодействия не проводились.
Особые указания
Эндофтальмит
Побочные действия
При введении Эйлеа® всегда необходимо применять соответствующую технику проведения асептических инъекций. Кроме того, необходимо наблюдать за состоянием пациента в течение недели после проведения инъекции для обеспечения своевременного лечения при появлении признаков инфекционного процесса. Пациентов необходимо проинструктировать о том, что они должны без промедления сообщать при подозрении на какие-либо симптомы эндофтальмита или других вышеуказанных нарушений.
После проведения интравитреальных инъекций, в том числе препарата Эйлеа®, в течение первых 60 мин. наблюдается повышение внутриглазного давления (смотрите раздел «Побочные действия»). Пациенты с плохо контролируемой глаукомой нуждаются в особых мерах предосторожности. Эйлеа® не вводят когда внутриглазное давление ≥ 30 мм рт. ст. Во всех случаях необходимо проводить наблюдение за внутриглазным давлением и перфузией диска зрительного нерва и принимать соответствующие меры терапии.
Иммуногенность
Как и для других препаратов белковой природы существует вероятность развития иммуногенности на введение препарата Эйлеа®.
Пациенты должны быть проинструктированы о необходимости сообщать о любых признаках или симптомах интраокулярного воспаления, таких как боль, светобоязнь, покраснение, что может быть клиническим признаком повышенной чувствительности.
Системные эффекты
После интравитреальных инъекций ингибиторов VEGF отмечались системные побочные эффекты, включая внеглазные кровоизлияния и артериальные тромбоэмболические явления, которые теоретически могут быть обусловлены ингибированием VEGF. Данные о безопасности применения у пациентов с ДМО, ОЦВС, ОВВС, а также миопической ХНВ, имевших в анамнезе инсульт или транзиторные ишемические атаки в течение последних 6 месяцев, ограничены. Следовательно, при лечении таких пациентов следует соблюдать осторожность.
Другие
Как и при лечении другими ингибиторами VEGF для терапии ВМД, ОЦВС, ОВВС, ДМО и миопической ХНВ, следующие предостережения также применимы и к Эйлеа®.
-
Безопасность и эффективность терапии с Эйлеа® при введении в оба глаза систематически не изучалась. Если лечение проводится одновременно в оба глаза, это может привести к повышенному воздействию препарата, что может повысить риск развития системных побочных эффектов.
-
Одновременное применение с другими анти-VEGF препаратами, (ингибиторами фактора роста эндотелия сосудов).
Доступных данных об одновременном применении Эйлеа® с другими анти-VEGF препаратами (для системного или окулярного применения), нет.
-
Факторы риска, связанные с развитием разрыва пигментного эпителия сетчатки после терапии анти-VEGF препаратами для лечения влажной ВМД, включают обширную и/или высокую отслойку пигментного эпителия сетчатки. Перед началом лечения Эйлеа® следует проявлять осторожность пациентам, имеющим указанные факторы риска разрыва пигментного эпителия сетчатки.
-
Необходимо воздержаться от проведения лечения пациентам с регматогенной отслойкой сетчатки или с макулярным разрывом 3-4 степени.
-
В случае разрыва сетчатки следует воздержаться от введения дозы и не возобновлять его до тех пор, пока разрыв не будет устранен должным образом.
-
При нижеуказанных состояниях необходимо прекратить введение дозы и не возобновлять его ранее следующей запланированной инъекции препарата:
— снижение показателя наилучшей корригированной остроты зрения (НКОЗ) ≥30 букв по сравнению с показателем при последней оценке остроты зрения
— субретинальное кровоизлияние с вовлечением центра фовеа или, если размер кровоизлияния составляет ≥50% общей области поражения
-
Если проведено или запланировано хирургическое вмешательство на глазах необходимо воздержаться от введения дозы за 28 дней до и после операции.
-
Не cледует назначать Эйлеа® во время беременности, за исключением тех случаев, когда потенциальная польза от лечения превышает потенциальный риск для плода.
-
Женщинам репродуктивного возраста во время лечения препаратом необходимо использовать эффективную контрацепцию, по крайней мере в течение 3 месяцев после последней интравитреальной инъекции Эйлеа®.
-
Имеется ограниченный опыт применения препарата у пациентов с ишемической окклюзией центральной вены сетчатки и ее ветвей. Не рекомендуется применять препарат пациентам, имеющим клинические признаки необратимой потери функции зрения ишемического характера.
Популяции с ограниченными данными
Имеется ограниченный опыт применения препарата для лечения ДМО у пациентов с сахарным диабетом 1 типа или у диабетических пациентов с уровнем гликозилированного гемоглобина более 12% или с пролиферативной диабетической ретинопатией.
Эйлеа® не изучался у пациентов с активными системными инфекциями или у пациентов с сопутствующими заболеваниями глаз, такими как, отслойка сетчатки или макулярный разрыв. Также не имеется опыта применения препарата у диабетических пациентов с неконтролируемой артериальной гипертензией. Лечащий врач должен принимать во внимание недостаток данной информации при лечении таких пациентов.
Нет опыта применения препарата в лечении миопической ХНВ у лиц не азиатской популяции, пациентов, ранее получавших лечение по поводу миопической ХНВ, а также с экстрафовеальной локализацией поражения.
Беременность и период лактации
Беременность
Данные об использовании афлиберцепта у беременных женщин отсутствуют.
Доклинические исследования продемонстрировали эмбриофетальную токсичность.
Хотя системное воздействие после окулярного введения является очень низким, не cледует назначать Эйлеа® во время беременности, за исключением тех случаев, когда потенциальная польза от лечения превышает потенциальный риск для плода.
Лактация
Неизвестно, проникает ли афлиберцепт в грудное молоко. Нельзя исключить существование риска для ребенка находящегося на грудном вскармливании.
Не рекомендуется принимать Эйлеа® в период кормления грудью. Необходимо принять решение о прекращении кормления грудью или воздержании от приема препарата с учетом пользы от кормления для ребенка и пользы от терапии для женщины.
Фертильность
Результаты исследований на животных при высоком системном воздействии препарата свидетельствуют о том, что афлиберцепт может оказывать неблагоприятное влияние на фертильность у женщин и мужчин. Не ожидается подобных эффектов после окулярного введения препарата с очень низким системным воздействием.
Применение в педиатрии
Безопасность и эффективность препарата у детей и подростков не изучались.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
После инъекций Эйлеа® отмечается незначительное влияние на способность управлять транспортным средством и потенциально опасными механизмами вследствие возможных временных нарушений зрения после проведения интравитреальных инъекций препарата или сопутствующего обследования зрения.
Пациентам не следует управлять автомобилем или сложными механизмами до тех пор, пока зрительная функция не будет в достаточной степени восстановлена.
Передозировка
В клинических исследованиях дозы до 4 мг с интервалом в 1 месяц и отдельные случаи передозировки в дозе 8 мг в целом хорошо переносились.
Симптомы: передозировка в результате повышенного объема введения может привести к повышению внутриглазного давления.
Лечение: в случаях передозировки необходимо проводить наблюдение за внутриглазным давлением и при необходимости лечащий врач должен назначить адекватное лечение.
Форма выпуска и упаковка
По 0.278 мл раствора во флакон из бесцветного стекла типа I вместимостью 2 мл, укупоренный пробкой из бутилкаучука, фольгированный фторполимером; обжатый алюминиевым кольцом и полипропиленовым колпачком.
По 1 флакону, 1 фильтровальной игле вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Условия хранения
Хранить при температуре от 2°С до 8°С. Не замораживать.
Хранить в картонной пачке для предотвращения воздействия света.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Регенерон Фармасьютикалс, Инк.,
Нью-Йорк 12144, США
Владелец регистрационного удостоверения
Байер Фарма АГ, Берлин, Германия.
Упаковщик
Байер Фарма АГ, Берлин, Германия.
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукта (товара)
ТОО «Байер КАЗ»
ул. Тимирязева, 42, бизнес-центр «Экспо-Сити», пав. 15
050057 Алматы, Республика Казахстан,
тел. +7 727 258 80 40, факс: +7 727 258 80 39,
e-mail: kz.claims@bayer.com
Инструкции по введению
Флакон предназначен только для однократного использования.
Перед введением следует визуально осмотреть флакон. Нельзя использовать флакон при наличии частиц, хлопьев или изменения цвета раствора.
Перед применением неоткрытый флакон может храниться при комнатной температуре (25 °C / 77°F) в течение максимум 24 часов. Все манипуляции с открытым флаконом следует проводить в асептических условиях.
Для интравитреального введения необходимо использовать иглу для инъекций размером 30 G x ½.
-
Снимите пластиковый колпачок и продезинфицируйте наружную часть резиновой пробки флакона
| 073721241477976842_ru.doc | 323.5 кб |
| 075162901477978000_kz.doc | 351.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
1 мл лекарственного средства содержит: активное вещество — афлиберцепта 40 мг,
вспомогательные вещества: натрия хлорид, натрия дигидрофосфат моногидрат, натрия гидрофосфат гептагидрат, сахароза, полисорбат 20, вода для инъекций.
Прозрачный, слегка опалесцирующий раствор.
Препараты для лечения заболеваний глаз. Средства для лечения сосудистых расстройств окологлазного пространства. Антинеоваскулярные средства. Афлиберцепт. Код ATX S01LA05.
Фармакологические свойства
Фармакокинетика
Лекарственное средство Эйлеа® вводится непосредственно в стекловидное тело для оказания локального воздействия.
Абсорбция / распределение
После интравитреального введения афлиберцепт медленно проникает в системный кровоток, где обнаруживается в основном в виде неактивного стабильного комплекса с VEGF (фактор роста эндотелия сосудов), при этом только «свободный афлиберцепт» может связывать эндогенный VEGF.
В исследовании фармакокинетики с частым отбором проб у 6 пациентов с неоваскулярной влажной возрастной макулярной дегенерацией (влажной ВМД) максимальная концентрация свободного афлиберцепта в плазме (системная Смакс) была низкой и составляла в среднем около 0,02 мкг/мл (в диапазоне от 0 до 0.054) в течение 1-3 дней после интравитреального введения 2 мг афлиберцепта, и через две недели после введения дозы, афлиберцепт вовсе не обнаруживался практически у всех пациентов. Афлиберцепт не кумулирует в плазме крови при интравитреальном введении каждые 4 недели.
Средняя максимальная концентрация свободного афлиберцепта в плазме крови примерно в 50-500 раз ниже, чем концентрация, необходимая для ингибирования биологической активности VEGF в системном кровотоке на 50% на животных моделях, у которых изменения артериального давления наблюдались после достижения концентрации свободного афлиберцепта в системном кровотоке около 10 мкг/мл, давление возвращалось к нормальным значениям при снижении концентрации ниже приблизительно 1 мкг/мл. В исследовании на здоровых добровольцах было установлено, что после интравитреального введения 2 мг афлиберцепта пациентам, средняя максимальная концентрация в плазме крови свободного афлиберцепта более чем в 100 раз ниже концентрации, необходимой для связывания половины максимального уровня системного VEGF (2.91 мкг/мл). Таким образом, развитие системных фармакодинамических эффектов, таких как изменения артериального давления, маловероятно.
Экскреция
Поскольку Эйлеа® — белковое лекарственное средство, никаких исследований метаболизма не проводилось.
Свободный афлиберцепт связывается с VEGF с образованием стабильного инертного комплекса. Ожидается, что, как и другие крупные белки, и свободный и связанный афлиберцепт будет выводиться из организма путем протеолитического катаболизма.
Нарушение функции почек
Никаких специальных исследований лекарственного средства Эйлеа® с участием пациентов с нарушенной функцией почек не проводилось.
Фармакодинамика
Афлиберцепт представляет собой рекомбинантный гибридный белок, состоящий из фрагментов внеклеточных доменов человеческих рецепторов VEGF (фактора роста эндотелия сосудов) 1 и 2, соединенных с Fc-фрагментом человеческого IgGl.
Афлиберцепт вырабатывается в клетках К1 яичника китайского хомячка (СНО/ЯКХ) по технологии рекомбинантной ДНК.
Афлиберцепт действует как растворимый рецептор-ловушка, связывающийся с VEGF-А и P1GF с большим сродством, чем их естественные рецепторы, и, таким образом, может ингибировать связывание и активацию этих родственных VEGF рецепторов.
Механизм действия
Эндотелиальный сосудистый фактор роста А (VEGF-А) и плацентарный фактор роста (P1GF) относятся к семейству VEGF ангиогенных факторов, которые обладают мощным митогенным, хемотаксическим действием в отношении эндотелиальных клеток и повышают проницаемость сосудов. VEGF действует посредством двух типов тирозинкиназных рецепторов, VEGFR-1 и VEGFR-2, которые присутствуют на поверхности эндотелиальных клеток. P1GF связывается только с фактором VEGFR-1, который также присутствует на поверхности лейкоцитов. Избыточная активация VEGF-А этих рецепторов может привести к патологической неоваскуляризации и избыточной проницаемости сосудов. В этих процессах P1GF может проявлять синергизм с VEGF-А и стимулировать инфильтрацию лейкоцитов и сосудистое воспаление.
Фармакодинамические эффекты
Неоваскулярная влажная возрастная макулярная дегенерация (влажная ВМД)
Влажная ВМД характеризуется патологической хориоидальной неоваскуляризацией (ХНВ). Просачивание крови и жидкости из участков ХНВ может вызвать утолщение или отек сетчатки и/или суб-/интраретинальное кровоизлияние, что приводит к снижению остроты зрения.
У пациентов, получавших лекарственное средство Эйлеа® (одна инъекция в месяц в течение трех первых месяцев, с последующей одной инъекцией каждый месяц или каждые 2 месяца), отмечалось уменьшение толщины центральной зоны сетчатки (ТЦЗС) вскоре после начала лечения и уменьшение среднего размера патологического участка ХНВ, что соответствует результатам, полученным у пациентов на фоне ежемесячного введения ранибизумаба в дозе 0.5 мг.
Макулярный отек вследствие окклюзии центральной вены сетчатки (ОЦВС) или ее ветвей (ОВВС)
При ОЦВС и ОВВС развивается ишемия сетчатки, провоцирующая высвобождение VEGF, которые в свою очередь дестабилизируют плотные соединения и стимулируют пролиферацию эндотелиальных клеток. Повышение активности VEGF приводит к нарушению гематоретинального барьера, повышенной проницаемости сосудов, отеку сетчатки и неоваскуляризации.
У пациентов, получавших терапию лекарственным средством Эйлеа® (одна инъекция раз в месяц на протяжении шести месяцев), наблюдалась постоянная, быстрая и устойчивая ответная реакция в отношении морфологии (ТЦЗС по данным ОКТ). Улучшение среднего показателя ТЦЗС сохранялось на протяжении 24 недель.
Диабетический макулярный отек (ДМО)
ДМО является последствием диабетической ретинопатии и характеризуется повышенной проницаемостью сосудов и повреждением капилляров сетчатки, что может привести к потере остроты зрения.
У пациентов, получавших лекарственное средство Эйлеа®, большинство из которых страдали диабетом II типа, вскоре после начала лечения наблюдался быстрый и устойчивый морфологический ответ (ТЦЗС согласно оценке данных ОКТ).
Миопическая хориоидальная неоваскуляризация (миопическая ХНВ)
Миопическая ХНВ является частой причиной потери зрения у взрослых людей с патологической миопией. Она развивается как механизм заживления ран вследствие разрывов мембран Бруха и представляет собой наиболее опасное для зрения явление в патологической миопии.
Лекарственное средство Эйлеа® показано взрослым пациентам для лечения:
неоваскулярной (влажной) возрастной макулярной дегенерации (влажной ВМД);
снижения остроты зрения, вызванного макулярным отеком вследствие окклюзии вен сетчатки (центральной вены (ОЦВС) или ее ветвей (ОВВС));
снижения остроты зрения, вызванного диабетическим макулярным отеком (ДМО);
снижения остроты зрения, вызванного миопической хориоидальной неоваскуляризацией (миопической ХНВ).
Способ применения и дозировка
Лекарственное средство Эйлеа® предназначено только для интравитреального введения.
Лекарственное средство должно вводиться только квалифицированным врачом, имеющим опыт проведения интравитреальных инъекций.
Режим дозирования
Неоваскулярная возрастная макулярная дегенерация
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора для инъекций.
Лечение Эйлеа® начинают с трех последовательных инъекций 1 раз в месяц. Затем интервал между инъекциями увеличивают до двух месяцев.
На основании заключения врача о результатах изменения остроты зрения и/или анатомических показателей интервал между инъекциями может поддерживаться на уровне двух месяцев или впоследствии увеличиваться при лечении в режиме «лечить и увеличивать интервал», при котором интервалы между введениями доз препарата увеличиваются с шагом в 2 или 4 недели для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей. В случае ухудшения остроты зрения и/или анатомических показателей интервалы между инъекциями должны быть соответственно сокращены до минимума — два месяца в течение первых 12 месяцев лечения.
Нет необходимости в проведении мониторинга между инъекциями. На основании заключения врача контрольные обследования могут выполняться чаще, чем визиты для проведения инъекций.
Интервалы лечения больше четырех месяцев между инъекциями не изучались.
Макулярный отек, разившийся вследствие ОЦВС или ОВВС
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора для инъекций.
После начальной инъекции лекарственного средства лечение проводят каждый месяц. Интервал между двумя инъекциями должен быть не менее одного месяца.
Если не наблюдается улучшение остроты зрения и анатомических показателей после непрерывного лечения, терапия лекарственным средством Эйлеа® должна быть прекращена.
Ежемесячная терапия продолжается до достижения максимально возможной остроты зрения в отсутствие признаков активности заболевания. Для этого может потребоваться
три или более последовательных ежемесячных инъекции.
Затем лечение может быть продолжено в режиме «лечить и увеличивать интервал» при постепенном увеличении интервалов времени между инъекциями для поддержания достигнутых стабильных остроты зрения и /или анатомических показателей, однако имеющихся данных недостаточно для того, чтобы сделать вывод о продолжительности этих интервалов. В случае ухудшения остроты зрения и (или) анатомических показателей интервалы между инъекциями должны быть соответствующим образом сокращены.
График мониторинга и лечения должен определяться лечащим врачом индивидуально, на основании ответа пациента.
Мониторинг проявлений активности заболевания может включать в себя стандартный офтальмологический осмотр, функциональную диагностику или проведение визуальных методов исследования (например, оптическую когерентную томографию или флуоресцеиновую ангиографию).
ДМО
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, (эквивалентно 50 мкл раствора для инъекций) интравитреально в виде первых пяти последовательных ежемесячных инъекций, с дальнейшим интервалом лечения 1 инъекция в 2 месяца. Нет необходимости в проведении мониторинга между инъекциями.
Через 12 месяцев лечения Эйлеа® интервал между инъекциями может быть увеличен на основании результатов изменения остроты зрения и анатомических показателей; при лечении в режиме «лечить и увеличивать интервал» интервалы между введениями доз препарата постепенно увеличиваются для поддержания достигнутых стабильных остроты зрения и/или анатомических показателей, однако данных для установления длины таких интервалов недостаточно. В случае ухудшения остроты зрения и анатомических показателей интервалы между инъекциями должны быть соответственно сокращены. В этом случае лечащий врач должен составить график контрольных обследований, которые могут быть более частыми, чем инъекции.
Если результаты остроты зрения и анатомические показатели указывают на отсутствие эффекта от проводимого лечения, терапию лекарственным средством Эйлеа® следует прекратить.
Миопическая ХНВ
Рекомендованная доза Эйлеа® составляет 2 мг афлиберцепта, что эквивалентно 50 мкл раствора для инъекций.
Дополнительные дозы могут вводиться, если результаты остроты зрения и/или анатомические показатели показывают, что заболевание сохраняется. Рецидивы следует рассматривать как новое проявление заболевания.
График мониторинга определяется лечащим врачом.
Интервал между двумя инъекциями должен составлять не менее одного месяца.
Дополнительная информация для особых категорий пациентов
Пациенты с нарушениями функции печени и/или почек
Какие — либо специальные исследования Эйлеа® у больных с нарушениями функции печени и почек не проводились. На основании доступных данных, коррекции дозы у таких пациентов не требуется.
Пожилые пациенты
Особых мер предосторожности не требуется. Опыт применения у пациентов старше 75 лет с диабетическим макулярным отеком ограничен.
Применение в педиатрии
Безопасность и эффективность лекарственного средства у детей и подростков не изучалась. Лекарственное средство Эйлеа® не показано к применению у данной группы пациентов при влажной ВМД, ОЦВС, ОВВС, ДМО и миопической ХНВ.
Техника введения
Интравитреальные введения должны осуществляться квалифицированным врачом, имеющим опыт проведения интравитреальных инъекций в соответствии с медицинскими стандартами и действующими руководящими положениями. В целом должны обеспечиваться адекватная анестезия и асептические условия, включая применение наружных бактерицидных средств широкого спектра действия (например, наносить повидон-йод на кожу вокруг глаза, веко и поверхность глаза). Рекомендуется дезинфекция рук хирурга, использование стерильных перчаток и салфеток, стерильного векорасширителя (или его эквивалента).
Инъекционную иглу следует вводить в стекловидное тело на 3.5-4.0 мм кзади от лимба, избегая горизонтального меридиана и направляя ее к центру глазного яблока. Объем введенного препарата составляет 0.05 мл. Следующая инъекция лекарственного средства проводится в другой участок склеры.
Сразу после интравитреальной инъекции состояние пациента необходимо контролировать на предмет повышения внутриглазного давления. Надлежащий мониторинг может состоять из проверки перфузии диска зрительного нерва или офтальмотонометрии. При необходимости следует обеспечить доступ к стерильному оборудованию для проведения парацентеза.
После интравитреальной инъекции пациентам необходимо без промедления сообщать о каких-либо симптомах эндофтальмита (например, боль в глазу, покраснение глаза, светобоязнь, нечеткость зрения).
Каждый флакон должен применяться только для лечения одного глаза. Извлечение нескольких доз из флакона может увеличить риск загрязнения и последующего инфицирования.
Флакон содержит дозу афлиберцепта, превышающую рекомендованную дозу 2 мг. Извлекаемый из флакона объем (100 мкл) не следует использовать целиком. Избыточный объем следует выпустить из шприца до инъекции. Ввод всего объема флакона может привести к передозировке. Для удаления пузырьков воздуха и избыточного объема лекарственного средства, медленно нажимайте на поршень шприца, чтобы совместить цилиндрическое основание поршня с черной меткой дозы на шприце (эквивалентной 50 микролитрам, т.е. 2 мг афлиберцепта).
После инъекции все неиспользованное лекарственное средство должно быть утилизировано.
О любых побочных эффектах, развившихся на фоне применения лекарственного средства, в том числе и не описанных в инструкции, необходимо сообщить врачу.
Оценка безопасности применения лекарственного средства Эйлеа® осуществлялась в ходе исследований фазы III с участием 3102 пациентов. Из них 2501 пациентов получали рекомендованную дозу 2 мг.
Серьезные офтальмологические нежелательные реакции, связанные с инъекцией Эйлеа® наблюдались менее чем в одной из 1900 проведенных интравитреальных инъекций, и включали слепоту, эндофтальмит, отслойку сетчатки, травматическую катаракту, катаракту, кровоизлияние в стекловидное тело, отслойку стекловидного тела и повышение внутриглазного давления (смотрите раздел «Меры предосторожности»). Наиболее распространенными нежелательными реакциями (как минимум у 5 % пациентов, получивших терапию Эйлеа®) были субконъюнктивальное кровоизлияние (25%), снижение остроты зрения (11%), боль в глазу (10%), катаракта (8%), повышение внутриглазного давления (8 %), отслойка стекловидного тела (7 %), плавающие помутнения стекловидного тела (7 %).
Перечисленные ниже данные по безопасности лекарственного средства включают в себя все нежелательные реакции, основанные на исследованиях фазы III по показаниям влажная ВМД, ОЦВС, ОВВС, ДМО и миопическая ХНВ с указанием возможности наличия причинно-следственной связи с процедурой введения или с лекарственным средством.
Нежелательные лекарственные реакции классифицированы в соответствии с системно-органными классами: очень часто (> 1/10), часто (> 1/100, < 1/10), нечасто (> 1/1 000, < 1/100), редко (> 1/10 000, < 1/1 000). В рамках каждой группы нежелательные реакции представлены в порядке уменьшения степени тяжести.
| Системно-органные классы | Очень часто | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | реакции гиперчувствительности*** | |||
| Нарушения со стороны органа зрения | снижение остроты зрения, субконъюнктивальное кровоизлияние, боль в глазу | разрыв пигментного эпителия сетчатки*, отслойка пигментного эпителия сетчатки, дегенерация сетчатки, кровоизлияние в стекловидное тело, катаракта, кортикальная катаракта, ядерная катаракта, субкапсулярная катаракта, эрозия роговицы, повреждение роговицы, повышение внутриглазного давления, нечеткость зрения, плавающие помутнения стекловидного тела, отслойка стекловидного тела, боль в месте введения, ощущение инородного тела в глазах, повышенное слезоотделение, отек век, кровоизлияние в месте введения, точечный кератит, гиперемия конъюнктивы, окулярная гиперемия | эндофтальмит* *, отслойка сетчатки, разрыв сетчатки, ирит, увеит, иридоциклит, помутнение хрусталика, повреждение эпителия роговицы, раздражение в месте введения, аномальная чувствительность тканей глаза, покраснение век, воспаление передней камеры глаза, отек роговицы | слепота, травматическая катаракта, воспаление стекловидного тела, гипопион |
* Состояния, как известно, связанные, с влажной ВМД. Наблюдались только в исследованиях с влажной ВМД.
** Эндофтальмит с положительной и отрицательной культурой.
*** В пострегистрационном периоде сообщения о реакциях гиперчувствительности включали сыпь, зуд, крапивницу и в отдельных случаях — тяжелые анафилактические/анафилактоидные реакции.
Описание отдельных нежелательных реакций
Артериальная тромбоэмболия (АТЯ) является нежелательным явлением, потенциально связанным с системным ингибированием эндотелиального фактора роста сосудов (VEGF). Теоретически существует риск развития АТЯ после интравитреального применения ингибиторов VEGF, включая инфаркт миокарда и инсульт.
Как и все лекарственные средства белковой природы Эйлеа® обладает иммуногенным потенциалом.
повышенная чувствительность к афлиберцепту или вспомогательным компонентам лекарственного средства;
активная или подозреваемая окулярная или периокулярная инфекция;
активное тяжелое внутриглазное воспаление.
Лекарственные взаимодействия
Исследования в отношении лекарственных взаимодействий не проводились. Осуществление вспомогательной фотодинамической терапии с применением вертепорфина (PDT) и Эйлеа не изучалось, поэтому, профиль безопасности не был установлен.
Реакции, обусловленные интравитреальным введением
Интравитреальные инъекции, включая инъекции лекарственного средства Эйлеа®, могут вызвать развитие эндофтальмита, внутриглазное воспаление, регматогенную отслойку сетчатки, разрыв сетчатки и ятрогенную травматическую катаракту (см. раздел «Побочное действие»).
При введении лекарственного средства Эйлеа® всегда необходимо соблюдать соответствующую технику асептического проведения инъекций. Кроме того, необходим мониторинг пациентов в течение недели после инъекции, для выявления первых признаков воспаления и своевременного назначения необходимой терапии.
При появлении каких-либо симптомов, свидетельствующих о развитии эндофтальмита или любой другой реакции, указанной выше, необходимо немедленно сообщить врачу. Наблюдались случаи повышения внутриглазного давления в первые 60 минут после интравитреальных инъекций, включая инъекции лекарственного средства Эйлеа® (смотрите раздел «Побочное действие»). Пациенты с плохо контролируемой глаукомой нуждаются в особых мерах предосторожности. Лекарственное средство Эйлеа® не следует вводить при внутриглазном давлении > 30 мм рт. ст. Во всех случаях необходим контроль внутриглазного давления и перфузии диска зрительного нерва с назначением соответствующей состоянию терапии.
Иммуногенность
Так как Эйлеа® представляет собой белок с терапевтическими свойствами, существует вероятность проявления иммуногенности (см. раздел «Побочное действие»). При появлении признаков или симптомов внутриглазного воспаления, таких как боль, светобоязнь или покраснение, которые могут являться клиническими проявлениями гиперчувствительности к лекарственному средству, необходимо сообщить врачу.
Системные эффекты
После интравитреальных инъекций ингибиторов VEGF были отмечены системные нежелательные явления, включая кровоизлияния вне органа зрения и тромбоэмболии артерий. Существует теоретический риск связи этих явлений с ингибированием VEGF. Имеются ограниченные данные относительно безопасности применения афлиберцепта пациентами с ОЦВС, ОВВС, ДМО или миопической ХНВ с анамнестическими сведениями об инсульте, транзиторной ишемической атаке или инфаркте миокарда за период в 6 месяцев перед началом терапии. Указанным пациентам следует соблюдать осторожность при терапии лекарственным средством Эйлеа®.
Прочее
Как и в случае интравитреального введения других анти-VEGF препаратов при влажной ВМД, ОЦВС, ОВВС, ДМО и миопической ХНВ, следует принять во внимание следующее:
Безопасность и эффективность лекарственного средства Эйлеа® при введении одновременно в оба глаза систематически не изучались (см. раздел «Фармакодинамика»). Одновременное билатеральное введение может привести к повышению системной экспозиции лекарственного средства, что, в свою очередь, повышает риск системных нежелательных явлений.
Сопутствующее применение других анти-VEGF (фактор роста эндотелия сосудов). Отсутствуют данные об одновременном применении лекарственного средства Эйлеа® с другими анти-VEGF препаратами (системными или глазными).
Факторы риска, связанные с нарушением целостности слоя пигментных клеток после анти-VEGF терапии влажной ВМД, включают распространенную и/или локализованную в верхних отделах отслойку пигментного эпителия сетчатки. Пациентам с факторами риска развития разрывов пигментного эпителия сетчатки следует соблюдать осторожность в начале терапии лекарственным средством Эйлеа®.
Пациентам с регматогенной отслойкой сетчатки или макулярными разрывами 3 или 4 стадии от лечения следует воздержаться.
В случае разрыва сетчатки введение дозы следует остановить и не возобновлять лечение до достаточного восстановления места разрыва.
От инъекции следует воздержаться до следующей запланированной по графику инъекции в случае:
снижения наилучшей корригированной остроты зрения (BCVA) более чем на 30 букв, по сравнению с последней оценкой остроты зрения;
субретинальных кровоизлияний, затрагивающих центральную ямку, или в случае размера кровоизлияния >50% общей площади поражения.
Следует воздержаться от введения дозы лекарственного средства в течение предыдущих или последующих 28 дней в случае выполнения или планирования операции на глазу.
Лекарственное средство Эйлеа® не следует использовать во время беременности, за исключением случаев, когда потенциальная выгода превышает потенциальный риск для плода (см. раздел «Беременность и период лактации»).
Женщинам репродуктивного возраста следует использовать эффективные способы контрацепции в период лечения и в течение, по меньшей мере, 3 месяцев после последней интравитреальной инъекции афлиберцепта.
Имеется ограниченный опыт лечения пациентов с ишемическим макулярным отеком вследствие окклюзии ветви вены сетчатки и ишемическим макулярным отеком вследствие окклюзии центральной вены сетчатки. Пациентам с клиническими признаками необратимой ишемической потери зрительной функции терапия афлиберцептом не рекомендована.
Группы пациентов с ограниченными данными
Имеется только ограниченный опыт лечения ДМО у пациентов с сахарным диабетом типа I, у пациентов с уровнем гликированного гемоглобина более 12 %, или у пациентов с пролиферативной диабетической ретинопатией. Лекарственное средство Эйлеа® не изучалось у пациентов с активными системными инфекциями или у пациентов с сопутствующими заболеваниями глаз, такими как отслойка сетчатки или разрыв макулы. Также отсутствует опыт лечения лекарственным средством Эйлеа® пациентов с сахарным диабетом и неконтролируемой гипертензией. При лечении таких пациентов врач должен учитывать этот дефицит информации.
Отсутствует опыт лечения миопической ХНВ у пациентов не азиатской популяции, пациентов ранее проходивших лечение миопической ХНВ, и пациентов с экстрафовеальными поражениями.
Женщины репродуктивного возраста
Женщинам репродуктивного возраста во время терапии лекарственным средством Эйлеа® необходимо использовать эффективную контрацепцию, по крайней мере, в течение 3 месяцев после последней интравитреальной инъекции.
Беременность
Данные по применению афлиберцепта у беременных женщин отсутствуют.
В исследования на животных была продемонстрирована эмбрио-фетотоксичность.
Несмотря на то, что системная экспозиция после внутриглазного введения Эйлеа® очень мала, лекарственное средство не следует применять при беременности, за исключением тех случаев, когда потенциальная польза от лечения превышает потенциальный риск для плода.
Период грудного вскармливания
Неизвестно, проникает ли афлиберцепт в грудное молоко. Нельзя исключить существование риска для ребенка находящегося на грудном вскармливании.
Не рекомендуется принимать лекарственное средство Эйлеа® в период грудного вскармливания. Необходимо принять решение о прерывании грудного вскармливания или воздержании от приема лекарственного средства, принимая во внимание пользу грудного вскармливания для ребенка и пользу лечения для матери.
Фертильность
Результаты исследований на животных с высокой системной экспозицией показывают, что афлиберцепт может нарушать мужскую и женскую фертильность. Подобные эффекты маловероятны после внутриглазного введения лекарственного средства с учетом очень низкой системной экспозиции.
Влияние лекарственного средства на способность управлять транспортными средствами и потенциально опасными механизмами
У пациентов могут наблюдаться временные нарушения зрения, связанные как с инъекцией, так и с процедурой обследования.
Пациентам не следует управлять автомобилем или сложными механизмами до восстановления четкости зрительного восприятия.
В клинических исследованиях применялись дозы до 4 мг с интервалом в 1 месяц, наблюдались отдельные случаи передозировки при применении дозы 8 мг.
Симптомы: передозировка в результате введения большего объема может привести к повышению внутриглазного давления.
Лечение: в случаях передозировки следует контролировать внутриглазное давление, при необходимости лечащий врач должен назначить адекватную терапию по его коррекции.
Форма выпуска и упаковка
По 0.278 мл раствора во флакон из бесцветного стекла типа I, вместимостью 2 мл. укупоренный пробкой из бутилкаучука, фольгированный фторполимером, обжатый алюминиевым кольцом и полипропиленовым колпачком.
По 1 флакону, 1 фильтровальной игле вместе с инструкцией по медицинскому применению помещают в пачку из картона.
Хранить при температуре от 2 °C до 8 °C. Не замораживать.
Хранить в картонной пачке для предотвращения воздействия света.
Хранить в недоступном для детей месте!
Перед использованием невскрытый флакон может храниться при температуре не выше 25°С до 24 часов. После вскрытия флакона необходимо соблюдать асептические условия.
Срок хранения
2 года.
Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту
Информация о производителе
Владелец регистрационного удостоверения:
Байер АГ, Германия.
Производитель готовой лекарственной формы:
Регенерон Фармасьютикалс, Инк.,
Нью-Йорк 12144, США.
Выпускающий контроль качества/Упаковка:
Байер АГ, Германия
13353 Берлин, Мюллерштрассе 178, Германия.
Дополнительную информацию можно получить по адресу: 220089, Минск, пр-т Дзержинского 57, 14 эт.
Тел.: +375(17) 239-54-20 (30).
Факс. +375(17) 336-12-36.
Инструкции по введению
Флакон предназначен только для однократного использования (для одного глаза).
Флакон содержит 100 мкл извлекаемого объема лекарственного средства, что превышает рекомендованную дозу в 50 мкл. Извлекаемый из флакона объем (100 мкл) не следует использовать целиком, часть его должна быть отброшена перед применением.
Перед введением следует визуально осмотреть флакон. Нельзя использовать флакон при наличии посторонних частиц и/или изменения цвета раствора или при любом изменении внешнего вида раствора.
Для интравитреального введения необходимо использовать иглу для инъекций размером 30 G × 1/2.
Снимите пластиковый колпачок и продезинфицируйте наружную часть резиновой пробки флакона.
Соедините иглу 18G с 5-микронным фильтром, вложенную в картоннуюупаковку с 1-милиллитровым стерильным шприцем с замком Люэра.
Вводите фильтровальную иглу в центр пробки флакона, пока она полностью не войдет во флакон, а кончик не достигнет дна или нижнего края флакона.
В асептических условиях извлеките все содержимое флакона лекарственного средства Эйлеа® в шприц, удерживая флакон в вертикальном положении, слегка наклонив его для полного извлечения лекарственного средства. Чтобы предотвратить попадание воздуха необходимо обеспечить погружение косого края фильтровальной иглы в жидкость. Продолжайте наклонять флакон во время отбора лекарственного средства, удерживая срез фильтровальной иглы погруженным в жидкость.
Удостоверьтесь в том, что шток поршня при заборе раствора из флакона в достаточной степени поднят, и игла с фильтром пустая.
Снимите фильтровальную иглу и утилизируйте ее надлежащим образом.
Примечание: фильтровальная игла не предназначена для интравитреальных инъекций.
В условиях асептики, скручивающим движением наденьте крепко иглу для инъекций 30G × 1/2 дюйма на переходную канюлю шприца с люэровским замком.
8. Удерживая шприц с поднятой вверх иглой, проверьте его на наличие пузырьков. Если есть пузырьки, мягко постучите по шприцу пальцем до тех пор, пока все пузырьки не поднимутся вверх.
9. Устраните все пузырьки и удалите излишки лекарственного средства, медленно нажимая на поршень шприца так, чтобы его конец совпал с линией на отметке 0,05 мл на шприце.
10. Флакон предназначен только для одноразового использования.
Извлечение нескольких доз из флакона может увеличить риск загрязнения и последующего инфицирования.
Весь неиспользованный объем лекарственного препарата или отходы должны быть утилизированы.