Описание препарата Эфлейра® (раствор для подкожного введения, 60 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 20.06.2022
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Эфлейра®
Фотографии упаковок

20.06.2022
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для п/к введения | 1 мл |
| активное вещество: | |
| нетакимаб | 60 мг |
| вспомогательные вещества: натрия ацетата тригидрат — 1,74 мг; трегалозы дигидрат — 80 мг; полоксамер 188 — 0,5 мг; уксусная кислота ледяная — до pH 5; вода для инъекций — до 1 мл |
Описание лекарственной формы
Раствор для п/к введения: прозрачный или слегка опалесцирующий от бесцветного до светло-желтого или светло-желтого с коричневатым оттенком цвета.
Фармакологическое действие
Фармакологическое действие
—
дерматотропное.
Фармакодинамика
Нетакимаб является рекомбинантным гуманизированным моноклональным антителом, в терапевтических концентрациях специфически связывающим ИЛ-17А, находящийся непосредственно в тканях или крови и других биологических жидкостях. ИЛ-17А — провоспалительный цитокин, гиперпродукция которого преимущественно обусловлена активацией Th17-лимфоцитов. В рамках врожденного иммунитета ИЛ-17А выполняет защитную роль. При хронических иммуновоспалительных заболеваниях патологическая активация Th17-лимфоцитов и гиперпродукция ИЛ-17 стимулирует Т-клеточный ответ и усиленную продукцию других медиаторов воспаления: ИЛ-1, ИЛ-6, ФНО-α, факторов роста (G-CSF, GM-CSF) и различных хемокинов.
Нетакимаб обладает высокой термодинамической константой специфического связывания с ИЛ-17А человека. По данным доклинических исследований, специфическое связывание нетакимаба в нормальных тканях человека ограничено тканями легкого, тимуса, лимфатических узлов, миндалин, что согласуется с данными об экспрессии ИЛ-17 клетками этих тканей.
Применение нетакимаба не сопровождается статистически значимым изменением уровня Т-лимфоцитов и не влияет на уровень и соотношение Ig классов А, G и М.
Специфическая противовоспалительная активность нетакимаба продемонстрирована в тестах in vitro и in vivo. Нетакимаб дозозависимо ингибирует ИЛ-17 и ФНО-α-зависимую продукцию ИЛ-6 на культуре клеток при IC50 40 pM. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в нед в течение 4 нед) п/к введение нетакимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (суставной хрящ остается интактным, синовиальные оболочки — без признаков поражения и воспалительной реакции, пролиферации синовиоцитов не отмечено).
У больных псориазом использование нетакимаба сопровождается угасанием явлений воспаления и гиперкератоза в коже, достоверным снижением уровня С-реактивного белка и СОЭ.
У пациентов с активным анкилозирующим спондилитом и псориатическим артритом на фоне применения нетакимаба отмечается уменьшение симптомов воспаления в позвоночнике, энтезисах и суставах, а также быстрое снижение концентрации С-реактивного белка, являющегося маркером воспаления.
Фармакокинетика
Всасывание/распределение. Изменение концентрации нетакимаба после его п/к введения является дозозависимым (значения Сmax, Cmax–mult, AUC0–t находятся в прямой зависимости от дозы). Препарат характеризуется медленной фазой абсорбции с постепенным линейным нарастанием концентрации в сыворотке крови.
При однократном п/к введении нетакимаба в дозе 120 мг пациентам с бляшечным псориазом препарат начинал обнаруживаться в сыворотке крови в течение 0,5–4 ч после введения; Cmax нетакимаба составляла 15,1 (7,7–19,3) мкг/мл, Tmax — 144 (72–168) ч, AUC0–168 — 1667,8 (932,2–2270,8) мкг/мл·ч.
При повторных введениях отмечено накопление препарата в сыворотке крови с ростом концентрации в 1,8–3,6 раза. Cmax при многократном введении (Cmax–mult) составляла 33,0 (23,1–44) мкг/мл и достигалась (Tmax–mult) через 1680 (672–2016) ч.
Выведение. Характеристики выведения нетакимаба являются типичными для препаратов на основе моноклональных антител: показатели Kel (константа элиминации), T1/2, MRT (среднее время пребывания препарата в организме), клиренса не зависят от дозы вводимого препарата, T1/2 после однократного введения составляет около 16 сут.
Средний клиренс нетакимаба при однократном введении дозы 120 мг пациентам с бляшечным псориазом составил 1,8 л/сут.
Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом.
Особые группы пациентов
Почечная и печеночная недостаточность. Фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Возраст старше 65 лет. Фармакокинетические данные у лиц старше 65 лет отсутствуют.
Показания
- лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия;
- лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию;
- лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию.
Противопоказания
- гиперчувствительность к нетакимабу, а также к любому из вспомогательных веществ препарата;
- клинически значимые инфекционные заболевания в острой фазе, включая туберкулез;
- беременность;
- период грудного вскармливания;
- возраст до 18 лет.
С осторожностью: пациенты с хроническими и рецидивирующими инфекциями или анамнестическими указаниями на них, в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний, а также после недавно проведенной вакцинации живыми вакцинами; пациенты старше 65 лет (в связи с отсутствием данных клинических исследований о применении нетакимаба); больные с воспалительными заболеваниями кишечника, в т.ч. с болезнью Крона или язвенным колитом (в связи с отсутствием сведений о применении нетакимаба).
Применение при беременности и кормлении грудью
Беременность. При применении нетакимаба у животных не выявлено отрицательного влияния на репродуктивную функцию, эмбриотоксичности или тератогенных эффектов. Исследований влияния на плод у беременных женщин не проводилось. Препарат противопоказан к применению во время беременности.
Период грудного вскармливания. Нет данных о проникновении нетакимаба в грудное молоко. Учитывая, что IgG, к которым относится нетакимаб, при циркуляции в крови матери могут выделяться с грудным молоком, применение в период грудного вскармливания противопоказано. Во избежание негативного воздействия на ребенка следует прекратить либо грудное вскармливание, либо терапию, учитывая соотношение риска и пользы для матери и ребенка.
Фертильность. В исследованиях у животных не обнаружено негативного воздействия нетакимаба на фертильность. Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
П/к.
Применение препарата Эфлейра® должно осуществляться под наблюдением врачей, имеющих опыт лечения заболеваний, при которых показан препарат Эфлейра®. После соответствующего обучения возможно самостоятельное введение препарата пациентом при условии динамического наблюдения со стороны лечащего врача. Препарат Эфлейра® может применяться как в стационарных, так и в амбулаторных условиях.
Препарат Эфлейра® вводится в дозе 120 мг в виде 2 п/к инъекций по 1 мл препарата с концентрацией 60 мг/мл.
Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия. Рекомендуемая доза — 120 мг в виде 2 п/к инъекций по 1 мл (60 мг) препарата, каждая вводится 1 раз в нед на неделях 0, 1 и 2, затем 1 раз каждые 4 нед.
Лечение активного анкилозирующего спондилита при недостаточном ответе на стандартную терапию. Рекомендуемая доза — 120 мг в виде двух п/к инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в нед на неделях 0, 1 и 2, затем — каждые 2 нед.
Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию. Рекомендуемая доза — 120 мг в виде двух п/к инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в нед на неделях 0, 1 и 2, затем каждые 2 нед до недели 10 включительно. Далее с недели 14 препарат вводится в дозе 120 мг в виде двух п/к инъекций по 1 мл (60 мг) каждая 1 раз в 4 нед.
| Показание | Разовая доза, мг | Индукция | Поддерживающая терапия |
| Бляшечный псориаз | 120 | 0, 1, 2 недели | 1 раз в 4 нед, начиная с недели 6 |
| Анкилозирующий спондилит | 120 | 0, 1, 2 недели | 1 раз в 2 нед, начиная с недели 4 |
| Псориатический артрит | 120 | 0, 1, 2 недели | 1 раз в 2 нед, начиная с недели 4 по неделю 10 включительно, далее 1 раз в 4 нед с недели 14 |
При пропуске очередного введения по любой причине инъекция препарата Эфлейра® должна быть произведена как можно быстрее. Дата следующего введения рассчитывается исходя из продолжительности задержки с введением препарата: если со времени пропуска введения прошло не более 3 дней, то следующую инъекцию препарата необходимо выполнить по текущему графику; если с момента пропуска дозы прошло более 3 дней, то новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Эфлейра®.
Подготовка к проведению подкожной инъекции (на данном этапе не следует снимать колпачок шприца/автоинжектора)
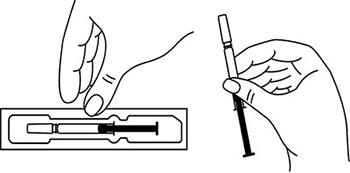
1. Тщательно вымыть руки
Рисунок 1.
2. Достать упаковку с двумя шприцами/автоинжекторами с препаратом Эфлейра® из холодильника, затем извлечь из картонной пачки и ячейковой упаковки два шприца/автоинжектора и положить на чистую поверхность. Убедиться, что срок хранения препарата, указанный на картонной пачке и шприце/автоинжекторе, не истек.
Рисунок 2. Препарат Эфлейра® в преднаполненном шприце.
Рисунок 3. Препарат Эфлейра® в автоинжекторе.
3. Осмотреть шприцы/автоинжекторы, а также лекарственный препарат, находящийся в них. Препарат Эфлейра® представляет собой прозрачный, от бесцветного до светло-желтого цвета раствор. Нельзя использовать препарат в случае помутнения раствора, наличия в препарате посторонних видимых частиц; изменения цвета; повреждения любых частей шприца/автоинжектора; истечения срока годности («годен до…»), указанного на картонной пачке, а также на этикетке шприца/автоинжектора.
4. Перед введением шприцы/автоинжекторы с препаратом Эфлейра® следует довести до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение приблизительно 25–30 мин. Не следует согревать шприц/автоинжектор каким-либо другим способом.
Рисунок 4.
5. Подготовить салфетку/ватный тампон, спиртовой раствор.
Техника выполнения п/к инъекции препарата Эфлейра® в преднаполненном шприце
Выбор и подготовка места для инъекции
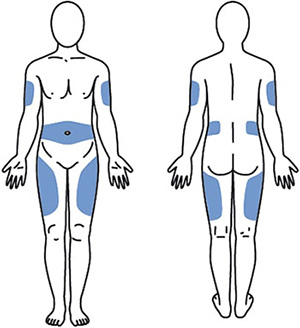
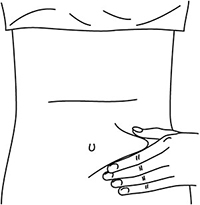
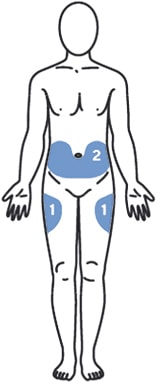
1. Выбрать место инъекции (передняя брюшная стенка, отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже).
Рисунок 5.
2. Места инъекций и стороны следует менять с каждой последующей процедурой инъекции. Расстояние между двумя введениями должно составлять как минимум 5 см.
3. Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек (эти признаки могут указывать на наличие инфекции). По возможности не следует вводить препарат в псориатическую бляшку.
4. Место для укола необходимо обработать спиртовой салфеткой/ватным тампоном круговыми движениями.
Рисунок 6.
5. Шприц не встряхивать.
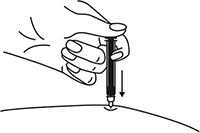
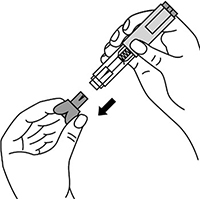
6. Снять колпачок с иглы, не дотрагиваясь до иглы и избегая ее прикосновения к другим поверхностям.
Рисунок 7.
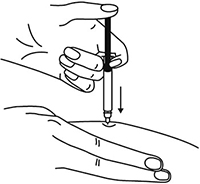
7. Большим и указательным пальцами одной руки взять в складку обработанную кожу.
Рисунок 8.
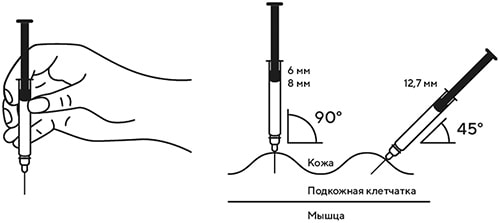
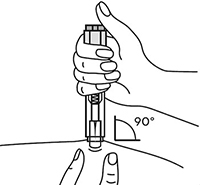
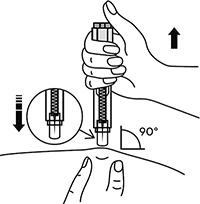
8. В другую руку взять шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90° к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45°, у пациентов с толщиной кожной складки более 1,5 см допустимо введение под углом 90°).
Рисунок 9.
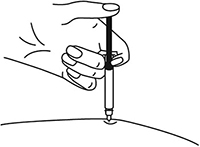
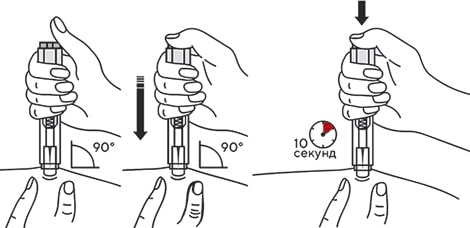
9. Одним быстрым движением полностью ввести иглу в кожную складку.
Рисунок 10.
10. После введения иглы складку кожи отпустить.
Рисунок 11.
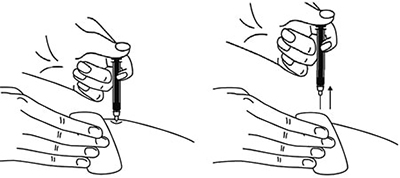
11. Ввести весь раствор медленным постоянным надавливанием на поршень шприца в течение 2–5 с.
Рисунок 12.
12. Когда шприц будет пустым, вынуть иглу из кожи под тем же углом.
Рисунок 13.
13. Сухой стерильной салфеткой/ватным шариком слегка прижать область инъекции, но не растирать область выполненной инъекции. Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем.
14. Ввести вторую дозу препарата Эфлейра® аналогичным образом предпочтительно в ту же анатомическую область при условии, что место последующей инъекции должно быть не ближе 5 см от предыдущей. Время выполнения 2 инъекций не должно превышать 10 мин.
15. После инъекции шприц повторно не использовать.
Техника выполнения подкожной инъекции препарата Эфлейра® в автоинжекторе
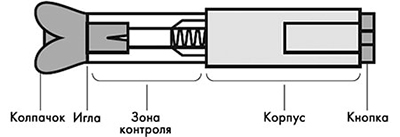
Рисунок 14. Устройство автоинжектора.
Автоинжектор не встряхивать.
Не снимать защитный колпачок с автоинжектора до выполнения инъекции.
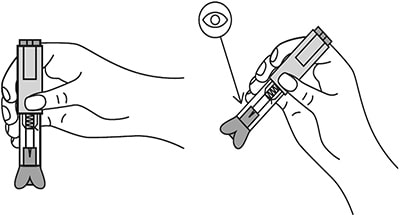
Проверить срок годности препарата по маркировке на упаковке, оценить целостность автоинжектора и состояние раствора через зону контроля автоинжектора. Не использовать автоинжектор в случае его повреждения, изменения цвета и прозрачности раствора, а также при истечении срока годности.
Рисунок 15.
1. Разместить автоинжектор на чистой горизонтальной поверхности.
2. Выбрать место введения (область брюшной стенки, отступая не менее 5 см от пупка, или передняя поверхность бедра) и обработать кожу в области введения спиртовой салфеткой.
Рисунок 16.
3. Непосредственно перед инъекцией одной рукой снять колпачок с автоинжектора, удерживая другой рукой его корпус.
Рисунок 17.
4. Одной рукой взять в складку обработанную спиртовой салфеткой кожу и удерживать в течение всей процедуры инъекции.
5. В другую руку взять автоинжектор, удерживая его за корпус. Введение препарата необходимо осуществлять, плотно прижав автоинжектор под углом 90° к поверхности кожи. Надавливание автоинжектором на поверхность кожной складки приведет к разблокированию кнопки.
Рисунок 18.
6. Удерживая автоинжектор под углом 90° к поверхности кожной складки, надавить до упора на кнопку автоинжектора. Пациент услышит щелчок, указывающий на начало инъекции. Не изменять положение автоинжектора. Необходимо удерживать кнопку в течение 10 с до окончания инъекции.
Рисунок 19.
7. Если инъекция не запустилась, следует отпустить кнопку и проверить, плотно ли прижат автоинжектор к кожной складке. Прижать плотно автоинжектор к коже и повторить процедуру инъекции, вновь нажав на кнопку.
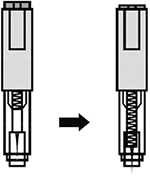
8. Удерживать автоинжектор плотно прижатым к коже еще несколько секунд для полного введения лекарственного вещества. Осмотрев зону контроля, убедиться, что вся доза препарата введена и контейнер пуст.
Рисунок 20.
9. После окончания инъекции следует извлечь автоинжектор, игла автоматически закроется защитным цилиндром.
Рисунок 21.
10. Сухой стерильной салфеткой/ватным шариком слегка прижать область инъекции, не растирая кожу. Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем.
11. Ввести вторую дозу препарата Эфлейра® аналогичным образом предпочтительно в ту же анатомическую область при условии, что место последующей инъекции должно быть не ближе 5 см от предыдущей. Время выполнения 2 инъекций не должно превышать 10 мин.
12. После инъекции автоинжектор повторно не использовать.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы/автоинжекторы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла.
Не допускать хранения использованных шприцев/автоинжекторов в местах, доступных для детей.
Рисунок 22.
Побочные действия
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено.
Большинство зарегистрированных нежелательных явлений, связанных с приемом препарата Эфлейра®, имели легкую или среднюю степень тяжести, определяемую по СТСАЕ v.4.03., и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было.
Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии.
В данной инструкции нежелательные реакции представлены в соответствии с MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000); очень редко (≤10000).
Инфекционные и инвазии: часто — инфекции верхних дыхательных путей; нечасто — инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция.
Желудочно-кишечные нарушения: нечасто — боль в животе, диарея.
Со стороны печени и желчевыводящих путей: нечасто — гипербилирубинемия.
Со стороны кожи и подкожной клетчатки: нечасто — экзема, дерматит, сыпь, зуд, крапивница.
Со стороны крови и лимфатической системы: часто — нейтропения, лейкопения, лимфоцитоз; нечасто — тромбоцитопения, лимфопения.
Со стороны иммунной системы: нечасто — гиперчувствительность.
Со стороны органа зрения: нечасто — эписклерит.
Со стороны нервной системы: нечасто — головная боль, головокружение, парестезия, поражение лицевого нерва.
Со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса.
Со стороны сосудов: нечасто — гипертензия (в т.ч. изолированная систолическая/диастолическая гипертензия), гипертонический криз.
Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция**.
Нарушения метаболизма и питания: нечасто — гипергликемия.
Со стороны почек и мочевыводящих путей: нечасто — протеинурия.
Лабораторные и инструментальные данные: часто — повышение активности АЛТ, АСТ, положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто — повышение ГГТ, повышение уровня Хс в крови, увеличение веса.
Травмы, интоксикации и осложнения процедур: нечасто — головокружение во время процедуры (во время инъекции).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто — инфицированный невус.
Со стороны репродуктивной системы и молочных желез: нечасто — фиброзно-кистозная болезнь молочных желез.
*Гриппоподобное заболевание характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата.
**Местные реакции могут включать в себя любые неблагоприятные проявления, возникающие в месте инъекции.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Сведений о наличии неблагоприятных лекарственных взаимодействий нетакимаба с другими лекарственными препаратами до настоящего времени не получено.
Предполагается, что препарат нетакимаб может усиливать иммуносупрессивное действие ГКС, метотрексата, сульфасалазина, лефлуномида и других базисных противовоспалительных препаратов.
Смешивание препарата с другими ЛС, введение в виде инфузии строго запрещено.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях явлений дозолимитирующей токсичности не зарегистрировано: при п/к введении нетакимаба в максимальной дозе 3 мг/кг (195–355 мг для взрослого человека с весом 65–85 кг) патологических отклонений не было выявлено.
Лечение: симптоматическое. Специфический антидот отсутствует.
Особые указания
Наличие таких потенциально тяжелых инфекций, как ВИЧ, активный гепатит В и/или С, сифилис, туберкулез, относится к противопоказаниям для назначения нетакимаба. Применение нетакимаба у данной группы больных не изучено. Учитывая иммуносупрессивное действие нетакимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. Необходимо проводить скрининг и оценивать соотношение риска и пользы терапии нетакимабом у этих пациентов.
Пациентам с активным туберкулезом терапия препаратом Эфлейра® противопоказана. Перед назначением препарата Эфлейра® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Эфлейра®.
При реактивации гепатита В терапия нетакимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии.
При использовании нетакимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований нетакимаба анафилактических реакций не зарегистрировано, нечасто отмечались реакции гиперчувствительности и крапивница. Однако при использовании других ингибиторов ИЛ-17 крапивница и анафилактические реакции отмечались в редких и очень редких случаях. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Эфлейра® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения нетакимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательный мониторинг за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований на данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность. В ходе клинических исследований препарата Эфлейра® при лечении псориаза, псориатического артрита и анкилозирующего спондилита выработка связывающих антител к нетакимабу была зарегистрирована менее чем в 0,5% случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба у пациентов с псориазом, псориатическим артритом и анкилозирующим спондилитом.
Возраст старше 65 лет. Данные об эффективности и безопасности препарата у пациентов старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Нарушение функций почек и печени. Эффективность и безопасность препарата у данной категории пациентов не изучались.
Дети. Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация. Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Эфлейра®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом Эфлейра®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям. Иммунизация инактивированными вакцинами во время терапии нетакимабом должна выполняться с осторожностью.
Влияние на способность управлять транспортными средствами и механизмами. Отсутствуют данные о влиянии препарата Эфлейра® на способность управлять транспортными средствами и работать с машинами и/или механизмами.
Форма выпуска
Раствор для подкожного введения, 60 мг/мл.
Преднаполненные шприцы
По 1 мл препарата в трехкомпонентные шприцы. Цилиндр каждого шприца изготовлен из бесцветного нейтрального стекла I гидролитического класса. Шприц с одной стороны имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена жестким колпачком. С другой стороны шприц укупорен поршнем, шток которого изготовлен из полипропилена; на конце поршня имеется уплотнитель из бутилкучука, ламинированный фторполимером. На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу помещают в контурную ячейковую упаковку из пленки ПВХ или ПЭТ. По 2 контурные ячейковые упаковки помещают в пачку из картона. Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 шт.
Автоинжектор
По 1 мл препарата в трехкомпонентные шприцы. Цилиндр каждого шприца изготовлен из бесцветного нейтрального стекла I гидролитического класса. Шприц с препаратом встроен в пластиковый автоинжектор, состоящий из защитного колпачка, корпуса с прозрачной зоной контроля, верхнего корпуса и кнопки активации. Внутреннее устройство автоинжектора имеет цилиндр, защищающий иглу, и поршень, который через систему механического пуска соединен с кнопкой активации. На каждый автоинжектор наклеивают самоклеящуюся этикетку.
По 1 автоинжектору помещают в контурную ячейковую упаковку из пленки ПВХ или ПЭТ. По 2 контурные ячейковые упаковки помещают в пачку из картона. Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 шт.
Производитель
АО «БИОКАД». 143422, Россия. Московская обл., Красногорский р-н, с. Петрово-Дальнее.
Владелец регистрационного удостоверения. АО «БИОКАД». 198515, Россия. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, 34, лит. А.
Организация, принимающая претензии потребителей. АО «БИОКАД». 198515, Россия. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, 34, лит. А.
Тел.: (812) 380-49-33; факс: (812) 380-49-34.
e-mail: biocad@biocad.ru
Информацию о развитии нежелательных реакций направлять по адресу: safety@biocad.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Фармакологическое действие
Нетакимаб является рекомбинантным гуманизированным моноклональным антителом, в терапевтических концентрациях специфически связывающим интерлейкин-17А (ИЛ-17А), находящийся непосредственно в тканях или в крови и других биологических жидкостях. ИЛ-17А – провоспалительный цитокин, гиперпродукция которого преимущественно обусловлена активацией Th17-лимфоцитов. В рамках врожденного иммунитета ИЛ-17А выполняет защитную роль. При хронических иммуновоспалительных заболеваниях патологическая активация Th17-лимфоцитов и гиперпродукция ИЛ-17 стимулирует Т-клеточный ответ и усиленную продукцию других медиаторов воспаления: ИЛ-1, ИЛ-6, ФНОα, факторов роста (Г-КСФ, ГМ-КСФ) и различных хемокинов.
Нетакимаб обладает высокой термодинамической константой специфического связывания с ИЛ-17А человека. По данным доклинических исследований специфическое связывание нетакимаба в нормальных тканях человека ограничено тканями легкого, тимуса, лимфатического узла, миндалин, что согласуется с данными об экспрессии ИЛ-17 клетками этих тканей.
Применение нетакимаба не сопровождается статистически значимым изменением уровня Т-лимфоцитов и не влияет на уровень и соотношение иммуноглобулинов классов А, G и М.
Специфическая противовоспалительная активность нетакимаба продемонстрирована в тестах in vitro и in vivo. Нетакимаб дозозависимо ингибирует ИЛ-17 и ФНОα-зависимую продукцию ИЛ-6 на культуре клеток при IC50 40 pM. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 4 недель) п/к введение нетакимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (суставной хрящ остается интактным, синовиальные оболочки — без признаков поражения и воспалительной реакции, пролиферации синовиоцитов не отмечено).
У больных псориазом использование нетакимаба сопровождается угасанием явлений воспаления и гиперкератоза в коже, достоверным снижением уровня С-реактивного белка и СОЭ.
У пациентов с активным анкилозирующим спондилитом и псориатическим артритом на фоне применения нетакимаба отмечается уменьшение симптомов воспаления в позвоночнике, энтезисах и суставах, а также быстрое снижение концентрации С-реактивного белка, являющегося маркером воспаления.
Фармакокинетика
Всасывание/распределение
Изменение концентрации нетакимаба после п/к введения препарата является дозозависимым (значения Сmax, Cmax—mult, AUC0-t находятся в прямой зависимости от дозы). Препарат характеризуется медленной фазой абсорбции с постепенным линейным нарастанием концентрации в сыворотке крови.
При однократном п/к введении нетакимаба в дозе 120 мг пациентам с бляшечным псориазом препарат начинал обнаруживаться в сыворотке крови в течение 0.5-4 ч после введения; Сmax составляла 15.1 (7.7-19.3) мкг/мл, Тmax – 144 (72-168) ч, AUC0-168 – 1667.8 (932.2–2270.8) (мкг/мл)×ч.
При повторных введениях отмечено накопление препарата в сыворотке крови с ростом концентрации в 1.8-3.6 раза. Максимальная концентрация при многократном введении (Cmax-mult) составляла 33.0 (23.1-44.0) мкг/мл и достигалась (Tmax—mult) через 1680 (672-2016) ч.
Выведение
Характеристики выведения нетакимаба являются типичными для препаратов на основе моноклональных антител: показатели Kel, T1/2, MRT, Cl не зависят от дозы вводимого препарата. Т1/2 после однократного введения составляет около 16 суток.
Средний клиренс нетакимаба при однократном введении в дозе 120 мг пациентам с бляшечным псориазом составил 1.8 л/сут.
Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом.
Фармакокинетика в особых клинических случаях
Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания препарата
Эфлейра®
- лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия;
- лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию;
- лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию.
Режим дозирования
Применение препарата Эфлейра® должно осуществляться под наблюдением врачей, имеющих опыт лечения заболеваний, при которых показан препарат Эфлейра®. После соответствующего обучения возможно самостоятельное введение препарата пациентом при условии динамического наблюдения со стороны лечащего врача.
Препарат Эфлейра® можно применять как в стационарных, так и в амбулаторных условиях.
Препарат вводят в дозе 120 мг в виде двух п/к инъекций по 1 мл препарата с концентрацией 60 мг/мл.
Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия
Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата, каждая вводится 1 раз в неделю на неделях 0, 1 и 2, затем 1 раз каждые 4 недели.
Лечение активного анкилозирующего спондилита при недостаточном ответе на стандартную терапию
Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели.
Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию
Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели до недели 10 включительно. Далее с недели 14 препарат вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) каждая 1 раз в 4 недели.
При пропуске очередного введения по любой причине инъекция препарата Эфлейра® должна быть произведена как можно быстрее. Дата следующего введения рассчитывается исходя из продолжительности задержки с введением препарата: если со времени пропуска введения прошло не более 3 дней, следующую инъекцию препарата необходимо выполнить по текущему графику, если с момента пропуска дозы прошло более 3 дней, то новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Эфлейра®.
Указания по применению
Подготовка к проведению п/к инъекции
Тщательно вымыть руки.
Достать упаковку с двумя шприцами/автоинжекторами с препаратом Эфлейра® из холодильника, затем извлечь из картонной пачки и ячейковой упаковки два шприца/автоинжектора и положить на чистую поверхность. Убедиться, что срок хранения препарата, указанный на картонной пачке и шприце/автоинжекторе не истек.
Препарат Эфлейра® в преднаполненном шприце
Препарат Эфлейра® в автоинжекторе
Осмотреть шприцы/автоинжекторы, а также лекарственный препарат, находящийся в них. Препарат Эфлейра® представляет собой прозрачный, от бесцветного до светло-желтого цвета раствор. Нельзя использовать препарат в случае:
- помутнения раствора, наличия в препарате посторонних видимых частиц;
- изменения цвета;
- повреждения любых частей шприца/автоинжектора;
- истечения срока годности (годен до…), указанного на картонной пачке, а также на этикетке шприца/автоинжектора.
Перед введением шприцы/автоинжекторы с препаратом Эфлейра® следует довести до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение приблизительно 25-30 мин. Не следует согревать шприц/автоинжектор каким-либо другим способом.
Подготовить салфетку/ватный тампон, спиртовой раствор.
На данном этапе не следует снимать колпачок шприца/автоинжектора.
Техника выполнения п/к инъекции препарата Эфлейра® в преднаполненном шприце
Выбор и подготовка места для инъекции
Выбрать место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
Места инъекций и стороны следует менять при каждой последующей инъекции. Расстояние между двумя введениями должно составлять как минимум 5 см.
Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек (эти признаки могут указывать на наличие инфекции). По возможности не следует вводить препарат в псориатическую бляшку.
Место для укола необходимо обработать спиртовой салфеткой/ватным тампоном круговыми движениями.
Шприц не встряхивать.
Снять колпачок с иглы, не дотрагиваясь до иглы и избегая ее прикосновения к другим поверхностям.
Большим и указательным пальцами одной руки взять в складку обработанную кожу.
В другую руку взять шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1.5 см допустимо введение под углом 90 градусов).
Одним быстрым движением полностью ввести иглу в кожную складку.
После введения иглы складку кожи следует отпустить.
Ввести весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 сек.
Когда шприц будет пустым, вынуть иглу из кожи под тем же углом.
Сухой стерильной салфеткой/ватным шариком слегка прижать область инъекции, но не растирать. Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем.
Ввести вторую дозу препарата Эфлейра® аналогичным образом предпочтительно в ту же анатомическую область при условии, что место последующей инъекции должно быть не ближе 5 см от предыдущей. Время выполнения двух инъекций не должно превышать 10 мин.
После инъекции шприц повторно не использовать.
Техника выполнения п/к инъекции препарата Эфлейра® в автоинжекторе
Устройство автоинжектора:
Автоинжектор не встряхивать.
Не следует снимать защитный колпачок с автоинжектора до выполнения инъекции.
Необходимо проверить срок годности препарата по маркировке на упаковке, оценить целостность автоинжектора и состояние раствора через зону контроля автоинжектора. Не следует использовать автоинжектор в случае его повреждения, изменения цвета и прозрачности раствора, а также при истечении срока годности.
Разместить автоинжектор на чистой горизонтальной поверхности.
Выбрать место введения (область брюшной стенки (отступая не менее 5 см от пупка) или передняя поверхность бедра) и обработать кожу в области введения спиртовой салфеткой.
Непосредственно перед инъекцией одной рукой снять колпачок с автоинжектора, удерживая другой рукой его корпус.
Одной рукой взять в складку обработанную спиртовой салфеткой кожу и удерживать в течение всей процедуры инъекции.
В другую руку взять автоинжектор, удерживая его за корпус. Введение препарата необходимо осуществлять, плотно прижав автоинжектор под углом 90 градусов к поверхности кожи. Надавливание автоинжектором на поверхность кожной складки приведет к разблокированию кнопки.
Удерживая автоинжектор под углом 90 градусов к поверхности кожной складки, надавить до упора на кнопку автоинжектора. Послышится щелчок, указывающий на начало инъекции. Не следует изменять положение автоинжектора. Необходимо удерживать кнопку в течение 10 сек до окончания инъекции.
Если инъекция не запустилась, следует отпустить кнопку и проверить, плотно ли прижат автоинжектор к кожной складке. Необходимо прижать плотно автоинжектор к коже и повторить процедуру инъекции, вновь нажав на кнопку.
Следует удерживать автоинжектор плотно прижатым к коже еще несколько секунд для полного введения лекарственного вещества. Осмотрев зону контроля, необходимо убедиться, что вся доза препарата введена и контейнер пуст.
После окончания инъекции извлечь автоинжектор, игла автоматически закроется защитным цилиндром.
Сухой стерильной салфеткой/ватным шариком слегка прижать область инъекции, но не растирать область выполненной инъекции. Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем.
Ввести вторую дозу препарата Эфлейра® аналогичным образом предпочтительно в ту же анатомическую область при условии, что место последующей инъекции должно быть не ближе 5 см от предыдущей. Время выполнения двух инъекций не должно превышать 10 мин.
После инъекции автоинжектор повторно не использовать.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы/автоинжекторы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла. Не допускать хранения использованных шприцев/автоинжекторов в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено.
Большинство зарегистрированных нежелательных явлений, связанных с приемом препарата Эфлейра®, имели легкую или среднюю степень тяжести и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было.
Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии.
В данной инструкции нежелательные реакции представлены в соответствии с MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
Инфекции и инвазии: часто – инфекции верхних дыхательных путей; нечасто – инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция.
Со стороны печени и желчевыводящих путей: часто — гипербилирубинемия.
Со стороны ЖКТ: нечасто — боль в животе, диарея.
Со стороны кожи и подкожной клетчатки: нечасто – экзема, дерматит, сыпь, зуд, крапивница.
Со стороны крови и лимфатической системы: часто — нейтропения, лейкопения, лимфоцитоз; нечасто – тромбоцитопения, лимфопения.
Со стороны иммунной системы: нечасто — гиперчувствительность.
Со стороны органа зрения: нечасто – эписклерит.
Со стороны нервной системы: нечасто — головная боль, головокружение, парестезия, поражение лицевого нерва.
Со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса.
Со стороны сосудов: нечасто — гипертензия (в т.ч. изолированная систолическая/диастолическая гипертензия), гипертонический криз.
Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция**
Со стороны метаболизма и питания: нечасто – гипергликемия.
Со стороны почек и мочевыводящих путей: нечасто — протеинурия.
Лабораторные и инструментальные данные: часто – повышение активности АЛТ, АСТ, положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто – повышение ГГТ, повышение уровня холестерина в крови, увеличение массы тела.
Травмы, интоксикации и осложнения процедур: нечасто – головокружение во время процедуры (во время инъекции).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто – инфицированный невус.
Со стороны репродуктивной системы и молочных желез: нечасто – фиброзно-кистозная болезнь молочных желез.
* Гриппоподобное заболевание характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры тела, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата.
** Местные реакции могут включать любые неблагоприятные проявления, возникающие в мете инъекции.
Противопоказания к применению
- гиперчувствительность к нетакимабу, а также к любому из вспомогательных веществ препарата;
- клинически значимые инфекционные заболевания в острой фазе, включая туберкулез;
- детский и подростковый возраст до 18 лет;
- беременность;
- период грудного вскармливания.
С осторожностью
Следует соблюдать осторожность при назначении препарата пациентам с хроническими и рецидивирующими инфекциями или с указаниями на них в анамнезе, в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний, а также после недавно проведенной вакцинации живыми вакцинами.
В связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы.
В связи с отсутствием сведений о применении нетакимаба у больных воспалительными заболеваниями кишечника следует избегать его назначения пациентам с болезнью Крона или язвенным колитом.
Применение при беременности и кормлении грудью
Беременность
При применении нетакимаба у животных не выявлено отрицательного влияния на репродуктивную функцию, эмбриотоксичности или тератогенных эффектов. Исследований влияния на плод у беременных женщин не проводилось. Препарат противопоказан к применению во время беременности.
Грудное вскармливание
Нет данных о выделении нетакимаба с грудным молоком. Учитывая, что иммуноглобулины класса G, к которым относится нетакимаб, при циркуляции в крови матери могут выделяться с грудным молоком, применение в период грудного вскармливания противопоказано. Во избежание негативного воздействия на ребенка следует прекратить либо грудное вскармливание, либо терапию, учитывая соотношение риска и пользы для матери и ребенка.
Фертильность
В исследованиях у животных не обнаружено негативного воздействия нетакимаба на фертильность. Данные о влиянии препарата на фертильность у человека отсутствуют.
Применение при нарушениях функции печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Применение при нарушениях функции почек
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Применение у детей
Противопоказано применение препарата в возрасте до 18 лет.
Применение у пожилых пациентов
В связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы.
Особые указания
Наличие таких потенциально тяжелых инфекций, как ВИЧ, активный гепатит В и/или С, сифилис, туберкулез, относится к противопоказаниям для назначения нетакимаба. Применение нетакимаба у данной группы пациентов не изучено. Учитывая иммуносупрессивное действие нетакимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. Необходимо проводить скрининг и оценивать соотношение риска и пользы терапии нетакимабом у этих пациентов.
Пациентам с активным туберкулезом терапия препаратом Эфлейра® противопоказана. Перед назначением препарата Эфлейра® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Эфлейра®.
При реактивации гепатита В лечение нетакимабом следует прекратить и назначить соответствующую противовирусную терапию.
Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии.
При применении нетакимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований нетакимаба анафилактические реакции не зарегистрированы, нечасто отмечались реакции гиперчувствительности и крапивница. Однако при применении других ингибиторов ИЛ-17 крапивница и анафилактические реакции отмечались в редких и очень редких случаях. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Эфлейра® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения нетакимабом, что, в свою очередь, может привести к снижению эффективности терапии. Необходим более тщательный мониторинг за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований на данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Эфлейра® при лечении псориаза, псориатического артрита и анкилозирующего спондилита формирование связывающих антител к нетакимабу было зарегистрировано менее чем в 0.5% случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба у пациентов с псориазом, псориатическим артритом и пациентов с анкилозирующим спондилитом.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Использование в педиатрии
Исследование эффективности и безопасности препарата у детей и подростков в возрасте до 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Эфлейра®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом Эфлейра®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям. Иммунизацию инактивированными вакцинами во время терапии нетакимабом необходимо выполнять с осторожностью.
Влияние на способность к управлению транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Эфлейра® на способность управлять транспортными средствами и работать с машинами и/или механизмами.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях явлений дозолимитирующей токсичности не зарегистрировано: при п/к введении препарата нетакимаб в максимальной дозе 3 мг/кг (195–355 мг для взрослого человека с массой тела 65–85 кг) патологических отклонений не было выявлено.
Лечение: специфический антидот отсутствует; проводят симптоматическую терапию.
Лекарственное взаимодействие
Сведений о наличии неблагоприятного лекарственного взаимодействия нетакимаба с другими лекарственными препаратами до настоящего времени не получено. Предполагается, что нетакимаб может усиливать иммуносупрессивное действие ГКС, метотрексата, сульфасалазина, лефлуномида и других базисных противовоспалительных препаратов.
Смешивание препарата с другими лекарственными средствами и введение в виде инфузии строго запрещено.
Условия хранения препарата Эфлейра®
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°С; не замораживать.
Срок годности препарата Эфлейра®
Срок годности — 2 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.
Эфлейра — инструкция по применению
Синонимы, аналоги
Статьи
Внимательно прочтите эту инструкцию перед тем, как начать прием/использование лекарственного средства.
Сохраните инструкцию, она может потребоваться вновь.
Если у Вас возникли вопросы, обратитесь к врачу.
Это лекарственное средство назначено лично Вам, и его не следует передавать другим лицам, поскольку оно может причинить им вред даже при наличии тех же симптомов, что и у Вас.
Регистрационный номер:
ЛП-005439
Торговое наименование препарата:
Эфлейра®
Международное непатентованное наименование:
нетакимаб
Лекарственная форма:
раствор для подкожного введения
Состав:
1 мл раствора содержит:
Действующее вещество: нетакимаб – 60 мг;
Вспомогательные вещества: натрия ацетата тригидрат – 1,74 мг, трегалозы дигидрат – 80 мг, полоксамер 188 – 0,5 мг, уксусная кислота ледяная – до pH 5,0, вода для инъекций – до 1,0 мл.
Описание:
Прозрачный или слегка опалесцирующий от бесцветного до светло-желтого или светло-желтого с коричневатым оттенком цвета раствор.
Фармакотерапевтическая группа:
Интерлейкина ингибитор
Код АТХ:
L04AC
Фармакологические свойства
Фармакодинамика
Нетакимаб является рекомбинантным гуманизированным моноклональным антителом, в терапевтических концентрациях специфически связывающим интерлейкин-17А (ИЛ-17А), находящийся непосредственно в тканях или в крови и других биологических жидкостях. ИЛ-17А – провоспалительный цитокин, гиперпродукция которого преимущественно обусловлена активацией Th17-лимфоцитов. В рамках врожденного иммунитета ИЛ-17А выполняет защитную роль. При хронических иммуновоспалительных заболеваниях патологическая активация Th17-лимфоцитов и гиперпродукция ИЛ-17 стимулирует Т-клеточный ответ и усиленную продукцию других медиаторов воспаления: ИЛ-1, ИЛ-6, фактора некроза опухоли альфа (ФНО-α), факторов роста (Г-КСФ, ГМ-КСФ) и различных хемокинов.
Нетакимаб обладает высокой термодинамической константой специфического связывания с ИЛ-17А человека. По данным доклинических исследований специфическое связывание нетакимаба в нормальных тканях человека ограничено тканями легкого, тимуса, лимфатического узла, миндалин, что согласуется с данными об экспрессии ИЛ-17 клетками этих тканей.
Применение нетакимаба не сопровождается статистически значимым изменением уровня Т-лимфоцитов и не влияет на уровень и соотношение иммуноглобулинов классов А, G и М.
Специфическая противовоспалительная активность нетакимаба продемонстрирована в тестах in vitro и in vivo. Нетакимаб дозозависимо ингибирует ИЛ-17 и ФНОα-зависимую продукцию интерлейкина-6 на культуре клеток при IC50 40 pM. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (один раз в неделю в течение 4-х недель) подкожное введение нетакимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (суставной хрящ остается интактным, синовиальные оболочки — без признаков поражения и воспалительной реакции, пролиферации синовиоцитов не отмечено).
У больных псориазом использование нетакимаба сопровождается угасанием явлений воспаления и гиперкератоза в коже, достоверным снижением уровня С-реактивного белка и СОЭ. У пациентов с активным анкилозирующим спондилитом и псориатическим артритом на фоне применения нетакимаба отмечается уменьшение симптомов воспаления в позвоночнике, энтезисах и суставах, а также быстрое снижение концентрации С-реактивного белка, являющегося маркером воспаления.
Фармакокинетика
Всасывание/распределение
Изменение концентрации нетакимаба после его подкожного введения является дозозависимым (значения Сmax, Cmax-mult, AUC0-t находятся в прямой зависимости от дозы). Препарат характеризуется медленной фазой абсорбции с постепенным линейным нарастанием концентрации в сыворотке крови.
При однократном подкожном введении нетакимаба в дозе 120 мг пациентам с бляшечным псориазом препарат начинал обнаруживаться в сыворотке крови в течение 0,5 — 4 часов после введения; максимальная концентрация нетакимаба (Сmax) составляла 15,1 [7,7-19,3] мкг/мл, время ее достижения – 144 [72-168] ч, AUC0-168 – 1667,8 [932,2-2270,8] (мкг/мл)*ч.
При повторных введениях отмечено накопление препарата в сыворотке крови с ростом концентрации в 1,8-3,6 раза. Максимальная концентрация при многократном введении (Cmax-mult) составляла 33,0 [23,1-44,0] мкг/мл и достигалась (Tmax-mult) через 1680 [672-2016] часов.
Выведение
Характеристики выведения нетакимаба являются типичными для препаратов на основе моноклональных антител: показатели Kel, T½, MRT, Cl не зависят от дозы вводимого препарата, период полувыведения после однократного введения составляет около 16 суток.
Средний клиренс нетакимаба при однократном введении в дозе 120 мг пациентам с бляшечным псориазом составил 1,8 л/сутки.
Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания к применению
- Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия.
- Лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию.
- Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию.
Противопоказания
- Гиперчувствительность к нетакимабу, а также к любому из вспомогательных веществ препарата.
- Клинически значимые инфекционные заболевания в острой фазе, включая туберкулез.
- Детский и подростковый возраст до 18 лет.
- Беременность, грудное вскармливание.
С осторожностью
Следует соблюдать осторожность при назначении нетакимаба пациентам с хроническими и рецидивирующими инфекциями или с анамнестическими указаниями на них, в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний, а также после недавно проведенной вакцинации живыми вакцинами.
В связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет, следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы.
В связи с отсутствием сведений о применении нетакимаба у больных воспалительными заболеваниями кишечника, следует избегать его назначения пациентам с болезнью Крона или язвенным колитом.
Применение при беременности и в период грудного вскармливания
Применение при беременности
При применении нетакимаба у животных не выявлено отрицательного влияния на репродуктивную функцию, эмбриотоксичности или тератогенных эффектов.
Исследований влияния на плод у беременных женщин не проводилось. Препарат противопоказан к применению во время беременности.
Применение при грудном вскармливании
Нет данных о проникновении нетакимаба в грудное молоко. Учитывая, что иммуноглобулины класса G, к которым относится нетакимаб, при циркуляции в крови матери могут выделяться с грудным молоком, применение в период грудного вскармливания противопоказано. Во избежание негативного воздействия на ребенка следует прекратить либо грудное вскармливание, либо терапию, учитывая соотношение риска и пользы для матери и ребенка.
Влияние на фертильность
В исследованиях у животных не обнаружено негативного воздействия нетакимаба на фертильность. Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата Эфлейра® должно осуществляться под наблюдением врачей, имеющих опыт лечения заболеваний, при которых показан препарат Эфлейра®. После соответствующего обучения возможно самостоятельное введение препарата пациентом при условии динамического наблюдения со стороны лечащего врача. Препарат Эфлейра® может применяться как в стационарных, так и в амбулаторных условиях.
Препарат Эфлейра® вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл препарата с концентрацией 60 мг/мл.
Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая вводится 1 раз в неделю на неделях 0, 1 и 2, затем 1 раз каждые 4 недели.
Лечение активного анкилозирующего спондилита при недостаточном ответе на стандартную терапию: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели.
Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели до недели 10 включительно. Далее с недели 14 препарат вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) каждая 1 раз в 4 недели.
| Показание | Разовая доза | Индукция | Поддерживающая терапия |
| Бляшечный псориаз | 120 мг | 0, 1, 2 недели |
1 раз в 4 недели, начиная с недели 6 |
| Анкилозирующий спондилит | 120 мг | 0, 1, 2 недели |
1 раз в 2 недели, начиная с недели 4 |
| Псориатический артрит | 120 мг | 0, 1, 2 недели |
1 раз в 2 недели, начиная с недели 4 по неделю 10 включительно, далее 1 раз в 4 недели с недели 14 |
При пропуске очередного введения по любой причине инъекция препарата Эфлейра® должна быть произведена как можно быстрее. Дата следующего введения рассчитывается исходя из продолжительности задержки с введением препарата: если со времени пропуска введения прошло не более 3 дней, то следующую инъекцию препарата необходимо выполнить по текущему графику, если с момента пропуска введения прошло более 3 дней, то новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Эфлейра®.
Указания по применению
Подготовка к проведению подкожной инъекции


Препарат Эфлейра ® в автоинжекторе
- помутнения раствора, наличия в препарате посторонних видимых частиц;
- изменения цвета;
- повреждения любых частей шприца/автоинжектора;
- истечения срока годности (годен до…), указанного на картонной пачке, а также на этикетке шприца/автоинжектора.

На данном этапе не следует снимать колпачок шприца/автоинжектора
1. Техника выполнения подкожной инъекции препарата Эфлейра® в преднаполненном шприце
Выбор и подготовка места для инъекции









После инъекции шприц повторно не использовать
2. Техника выполнения подкожной инъекции препарата Эфлейра® в автоинжекторе








После инъекции автоинжектор повторно не использоватьУтилизация расходного материала

Побочное действие
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено.
Большинство зарегистрированных нежелательных явлений (НЯ), связанных с применением препарата Эфлейра®, имели легкую или среднюю степень тяжести и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было.
Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1000 до <1/100), редко (от >1/10000 до <1/1000), очень редко (<10000).
Инфекции и инвазии: часто – инфекции верхних дыхательных путей; нечасто – инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция.
Нарушения со стороны печени и желчевыводящих путей: нечасто – гипербилирубинемия.
Желудочно-кишечные нарушения: нечасто – боль в животе, диарея.
Нарушения со стороны кожи и подкожной клетчатки: нечасто – экзема, дерматит, сыпь, зуд, крапивница.
Нарушения со стороны крови и лимфатической системы: часто – нейтропения, лейкопения, лимфоцитоз; нечасто – тромбоцитопения, лимфопения.
Нарушения со стороны иммунной системы: нечасто – гиперчувствительность.
Нарушения со стороны органа зрения: нечасто – эписклерит.
Нарушения со стороны нервной системы: нечасто – головная боль, головокружение, парестезия, поражение лицевого нерва.
Нарушения со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса.
Нарушения со стороны сосудов: нечасто — гипертензия (в том числе изолированная систолическая/диастолическая гипертензия), гипертонический криз.
Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция**.
Нарушения метаболизма и питания: нечасто – гипергликемия.
Нарушения со стороны почек и мочевыводящих путей: нечасто – протеинурия.
Лабораторные и инструментальные данные: часто – повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто – повышение гамма-глутамилтрансферазы (ГГТ), повышение уровня холестерина в крови, увеличение веса.
Травмы, интоксикации и осложнения процедур: нечасто – головокружение во время процедуры (во время инъекции).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто – инфицированный невус.
Нарушения со стороны репродуктивной системы и молочных желез: нечасто – фиброзно-кистозная болезнь молочных желез.
* «Гриппоподобное заболевание» характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата.
** Местные реакции могут включать в себя любые неблагоприятные проявления, возникающие в месте инъекции.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях явлений дозолимитирующей токсичности не зарегистрировано: при подкожном введении нетакимаба в максимальной дозе 3 мг/кг (195 – 355 мг для взрослого человека с весом 65 – 85 кг) патологических отклонений не было выявлено.
Специфический антидот отсутствует. Лечение симптоматическое.
Взаимодействие с другими лекарственными средствами
Сведений о наличии неблагоприятных лекарственных взаимодействий нетакимаба с другими лекарственными препаратами до настоящего времени не получено. Предполагается, что нетакимаб может усиливать иммуносупрессивное действие глюкокортикоидов, метотрексата, сульфасалазина, лефлуномида и других базисных противовоспалительных препаратов.
Смешивание препарата с другими лекарственными средствами, введение в виде инфузии строго запрещено.
Особые указания
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В и/или С, сифилис, туберкулез, относится к противопоказаниям для назначения нетакимаба. Применение нетакимаба у данной группы больных не изучено. Учитывая иммуносупрессивное действие нетакимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. Необходимо проводить скрининг и оценивать соотношение риска и пользы терапии нетакимабом у этих пациентов.
Пациентам с активным туберкулезом терапия препаратом Эфлейра® противопоказана. Перед назначением препарата Эфлейра® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Эфлейра®.
При реактивации гепатита В терапия нетакимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии.
При использовании нетакимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований нетакимаба анафилактических реакций не зарегистрировано, нечасто отмечались реакции гиперчувствительности и крапивница. Однако при использовании других ингибиторов ИЛ17 крапивница и анафилактические реакции отмечались в редких и очень редких случаях. При возникновении анафилактических или других серьёзных аллергических реакций применение препарата Эфлейра® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения нетакимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательный мониторинг за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований на данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Эфлейра® при лечении псориаза, псориатического артрита и анкилозирующего спондилита выработка связывающих антител к нетакимабу была зарегистрирована менее чем в 0,5 % случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба у пациентов с псориазом, псориатическим артритом и анкилозирующим спондилитом.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Эфлейра®, так как клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом Эфлейра®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям. Иммунизация инактивированными вакцинами во время терапии нетакимабом должна выполняться с осторожностью.
Влияние на способность управлять транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Эфлейра® на способность управлять транспортными средствами и работать с машинами и (или) механизмами.
Форма выпуска
Раствор для подкожного введения 60 мг/мл.
Преднаполненные шприцы
По 1,0 мл препарата в трехкомпонентные шприцы. Цилиндр каждого шприца изготовлен из бесцветного нейтрального стекла I гидролитического класса. Шприц с одной стороны имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена жестким колпачком. С другой стороны шприц укупорен поршнем, шток которого изготовлен из полипропилена; на конце поршня имеется уплотнитель из бутилкучука, ламинированный фторполимером.
На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу помещают в контурную ячейковую упаковку из пленки ПВХ или ПЭТ.
По 2 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона. Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 шт.
Автоинжектор
По 1,0 мл препарата в трехкомпонентные шприцы. Цилиндр каждого шприца изготовлен из бесцветного нейтрального стекла I гидролитического класса.
Шприц с препаратом встроен в пластиковый автоинжектор, состоящий из защитного колпачка, корпуса с прозрачной зоной контроля, верхнего корпуса и кнопки активации. Внутреннее устройство автоинжектора имеет цилиндр, защищающий иглу, и поршень, который через систему механического пуска соединен с кнопкой активации.
На каждый автоинжектор наклеивают самоклеящуюся этикетку.
По 1 автоинжектору помещают в контурную ячейковую упаковку из пленки ПВХ или ПЭТ.
По 2 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона. Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 шт.
Условия хранения
При температуре от 2 до 8°С в защищенном от света месте. Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
ЗАО «БИОКАД», Россия, 143422, Московская обл., Красногорский р-н, с. Петрово-Дальнее.
Владелец регистрационного удостоверения
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, д. 34, лит. А.
Организация, принимающая претензии потребителей
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, д. 34, лит. А.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено.
Большинство зарегистрированных нежелательных явлений (НЯ), связанных с применением препарата Эфлейра®, имели легкую или среднюю степень тяжести и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было.
Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
Инфекции и инвазии: часто – инфекции верхних дыхательных путей; нечасто – инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция.
Нарушения со стороны печени и желчевыводящих путей: нечасто – гипербилирубинемия.
Желудочно-кишечные нарушения: нечасто – боль в животе, диарея.
Нарушения со стороны кожи и подкожной клетчатки: нечасто – экзема, дерматит, сыпь, зуд, крапивница.
Нарушения со стороны крови и лимфатической системы: часто – нейтропения, лейкопения, лимфоцитоз; нечасто – тромбоцитопения, лимфопения.
Нарушения со стороны иммунной системы: нечасто – гиперчувствительность.
Нарушения со стороны органа зрения: нечасто – эписклерит.
Нарушения со стороны нервной системы: нечасто – головная боль, головокружение, парестезия, поражение лицевого нерва.
Нарушения со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса.
Нарушения со стороны сосудов: нечасто — гипертензия (в том числе изолированная систолическая/диастолическая гипертензия), гипертонический криз.
Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция**.
Нарушения метаболизма и питания: нечасто – гипергликемия.
Нарушения со стороны почек и мочевыводящих путей: нечасто – протеинурия.
Лабораторные и инструментальные данные: часто – повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто – повышение гамма-глутамилтрансферазы (ГГТ), повышение уровня холестерина в крови, увеличение веса.
Травмы, интоксикации и осложнения процедур: нечасто – головокружение во время процедуры (во время инъекции).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто – инфицированный невус.
Нарушения со стороны репродуктивной системы и молочных желез: нечасто – фиброзно-кистозная болезнь молочных желез.
*«Гриппоподобное заболевание» характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата.
**Местные реакции могут включать в себя любые неблагоприятные проявления, возникающие в месте инъекции.
В статье рассматриваются клинические случаи пациентов со среднетяжелым и тяжелым псориазом кожных покровов, псориазом таких сложно курабельных локализаций, как область волосистой части головы и ногтевых пластин, а также с наличием таких системных проявлений псориаза, как псориатический артрит. Целью настоящей статьи стала оценка эффективности терапии тяжелого и среднетяжелого псориаза, псориаза социально значимых локализаций, а также псориаза с сопутствующим псориатическим артритом, новым отечественным генно-инженерным биологическим препаратом нетакимаб (Эфлейра®). Опыт, полученный и изложенный в данной статье на примере 4 клинических случаев, продемонстрировал хорошие результаты терапии новым отечественным препаратом нетакимаб (Эфлейра®), не только с точки зрения оценки кожного статуса, но и с точки зрения благоприятного влияния на процессы системного воспаления при псориазе.
Введение
Псориаз – это распространенное хроническое воспалительное заболевание кожи, которым страдают 3,5% населения планеты и которое представляет собой серьезное психосоциальное бремя для пациентов [1].
Для псориаза характерна и системная, и кожная комплексная реакция, при которой идет масштабное повышение выброса провоспалительных цитокинов, продуцируемых иммунокомпетентыми клетками врожденного и адаптивного иммунитета, изменяющих пролиферацию и дифференцировку резидентных клеток кожи.
В ряде исследований показано, что ключевая эффекторная роль в патогенезе псориаза принадлежит интерлейкину-17 (ИЛ-17), провоцирующему воспаление и развитие изменений кожи, характерных для данного заболевания, а также играющему роль в развитии системного воспаления, системных проявлений псориаза и псориаз-ассоциированных сопутствующих заболеваний, таких как псориатический артрит, сердечно-сосудистые заболевания, ожирение, нарушение обмена веществ, заболевания печени и почек, артериальная гипертония и депрессия [2].
Терапия псориаза на протяжении долгого времени представляла собой сложную задачу с учетом того обстоятельства, что при среднетяжелом и тяжелом течении данного заболевания наружные средства имеют весьма ограниченный эффект и низкую приверженность терапии среди пациентов, а многие системные препараты обладают широким спектром побочных эффектов.
За последнее десятилетие были разработаны высокоэффективные таргетные методы лечения псориаза, в частности, нацеленные на ИЛ-17 и ИЛ-23. Успешность применения этих препаратов подчеркивает важность оси клеток, продуцирующих ИЛ-23/T-хелперов (Th)-17 в патогенезе псо-риаза [3].
Эфлейра® (нетакимаб) — разработанное компанией BIOCAD оригинальное высокогуманизированное моноклональное антитело, ингибитор ИЛ-17. Препарат зарегистрирован для лечения среднетяжелого и тяжелого бляшечного псориаза, анкилозирующего спондилита и псориатического артрита.
Нетакимаб – рекомбинантное моноклональное антитело, в терапевтических концентрациях специфически связывающее ИЛ-17А, находящийся непосредственно в тканях или в крови и других биологических жидкостях. ИЛ-17А – провоспалительный цитокин, гиперпродукция которого обусловлена преимущественно активацией Th17-лимфоцитов. В процессах врожденного иммунитета ИЛ-17А выполняет защитную роль. При хронических иммуновоспалительных заболеваниях патологическая активация Th17-лимфоцитов и гиперпродукция ИЛ-17 стимулируют Т-клеточный ответ и усиленную продукцию других медиаторов воспаления, таких как ИЛ-1, -6, фактор некроза опухоли-α (ФНО-α), а также факторов роста (Г-КСФ, ГМ-КСФ) и различных хемокинов.
Специфическая противовоспалительная активность нетакимаба продемонстрирована в тестах in vitro и in vivo. Нетакимаб дозозависимо ингибирует ИЛ-17- и ФНО-α-зависимую продукцию ИЛ-6 культурой клеток при IC50 равную 40 пM.
Применение нетакимаба пациентами с псориазом приводит к угасанию воспаления и гиперкератоза в коже, снижению уровней СОЭ и С-реактивного белка. Быстрое снижение концентрации С-реактивного белка, являющегося маркером воспаления, а также уменьшение симптомов воспаления в энтезисах, суставах и в позвоночнике при использовании нетакимаба наблюдаются у больных активным анкилозирующим спондилитом и псориатическим артритом [4].
Клинический случай № 1
Пациент В., мужчина 48 лет, страдает распространенным вульгарным псориазом, в т.ч. с поражением кожи области волосистой части головы и ногтевых пластин в течение 30 лет.
В 2018 г. появились болевые ощущения в суставах. Пациент неоднократно обращался в различные ЛПУ Москвы, где получал стандартную наружную терапию псориаза. Из анамнеза известно, что в связи с наличием измененных ногтевых пластин ранее прошел курс лечения системным препаратом итраконазол без положительного эффекта. Лабораторно онихомикоз подтвержден не был. В течение последнего года пациент отмечает увеличение площади поражения кожных покровов и сокращение периодов ремиссии.
В анамнезе: длительный стаж табакокурения; правосторонний тендинит пяточного (ахиллова) сухожилия; псориатическая артропатия; левосторонний сакроилеит ст. 2, ФН1.
Обратился в отделение дерматовенерологии и косметологии ФГБУ «Поликлиника № 1» УД Президента РФ в 2019 г.
Общий статус: пациент нормостенического телосложения, рост – 187 см, вес – 92 кг, индекс массы тела (ИМТ) – 26. Общее состояние удовлетворительное. Сознание ясное. Кожные покровы вне высыпаний обычной окраски и влажности. Тургор кожи нормальный. Лимфоузлы, доступные для пальпации, не увеличены, эластичные, безболезненные. Дыхание через нос свободное. Зев: слизистая оболочка обычной окраски, миндалины не увеличены, налетов нет. Над легкими перкуторно легочный звук. В легких выслушивается везикулярное дыхание, хрипов нет. SpO2 – 97%. Тоны сердца звучные, ритм правильный. Патологические шумы не выслушиваются. Перкуторно границы относительной сердечной тупости в норме. Пульсация на артериях тыла стоп сохранена. Язык влажный, налетов нет. Живот при пальпации мягкий, безболезненный во всех отделах. Печень не увеличена. Селезенка не пальпируется. Симптом поколачивания по поясничной области отрицательный с обеих сторон. Дизурии нет. Стул регулярный, оформленный. Отеков нет.
Status localis. Патологический кожный процесс носит хронический воспалительный характер, распространенный, локализован в т.ч. и в области кожи волосистой части головы в виде эритемы с выраженной инфильтрацией в основании и плотными серебристо-белыми чешуйками на поверхности. Характерно наличие «псориатической короны» в области кожи лба. На коже верхних конечностей (область локтевых суставов, предплечий) и нижних конечностей (голени) папулы и бляшки воспалительного характера размером от 5 до 15 см. Элементы округлой формы ярко-красного цвета с выраженной инфильтрацией в основании и характерным периферичес-ким венчиком роста, что говорит о прогрессирующей стадии заболевания. Ногтевые пластинки кистей рук имеют характерный симптом масляного пятна и положительный симптом наперстка. Ногти стоп изменены по нормо- и гипертрофическому типу.
Текущая оценка псориаза: BSA – 10%, PASI – 22 балла, sPGA – 4, DLQI – 18, NAPSI – 55 баллов.
Клинический диагноз: псориаз обыкновенный, среднетяжелая степень, псориатическая артропатия, левосторонний сакроилеит ст. 2, ФН1.
В связи с наличием среднетяжелого псориаза с поражением социально значимых участков кожи в области волосистой части головы и ногтевых пластин, а также диагностированным на приеме у ревматолога псориатичес-ким артритом было принято решение о назначении системной генно-инженерной биологической терапии (ГИБТ). Выбор препарата лежал в зоне блокаторов ФНО-α и блокаторов ИЛ-17. Несмотря на равную эффективность препаратов этих групп с точки зрения влияния на кожный процесс, по данным существующих исследований предпочтение было отдано блокаторам ИЛ-17. К выбору в пользу ингибиторов ИЛ-17 подводил и высокий ИМТ пациента. Пациенту был назначен препарат нетакимаб (Эфлейра®).
Пациент прошел стандартное обследование перед назначением ГИБТ, согласно которому были зафиксированы следующие отклонения в лабораторных данных: общий анализ крови (ОАК) – лимфоциты – 44; общий анализ мочи (ОАМ) – следы эритроцитов; биохимический анализ крови – в пределах нормы.
Рентгенография органов грудной клетки – легкие без очаговых и инфильтративных изменений. Диаскинтест отрицательный.
Серологические анализы крови на антитела к ВИЧ, вирусам гепатита С и В (HBS-Ag), на сифилис отрицательные.
Пациент был осмотрен терапевтом и пульмонологом – согласно соматическому статусу и результатам обследования на момент осмотра ГИБТ разрешена.
Больной получил терапию препаратом нетакимаб (Эфлейра®) с периодом инициации 120 мг подкожно еженедельно в течение 3 недель и последующими инъекциями препарата 1 раз в 4 недели в дозировке 120 мг подкожно.
Положительная динамика на фоне терапии наблюдалась уже после первой инъекции препарата в виде уменьшения болевого синдрома в суставах и отсутствия прогрессирования со стороны кожного процесса.
На фоне проводимой терапии пациент проходил лабораторный мониторинг. По результатам контрольного биохимического анализа крови после второй инъекции нетакимаба отмечалось повышение уровня АЛТ до 224,8 и АСТ до 78,1 ЕД/л. Пациент был направлен на консультацию к гастроэнтерологу. При сборе анамнеза выяснилось, что повышение уровня трансаминаз совпало с началом приема препарата Протеин RPS nutrition. Был установлен диагноз токсического гепатита, и пациенту был рекомендован прием препарата бициклол по 2 таблетке 3 раза в день в течение 2 недель с контролем биохимического анализа крови. Основываясь на клинических рекомендациях РГА от 2019 г. «Лекарственные поражения печени», терапия ГИБТ была продолжена без изменения кратности приема. Также было рекомендовано отменить прием Протеина RPS nutrition. При последующем контроле биохимического анализа крови на фоне терапии препаратом нетакимаб: АЛТ – 112,3 ЕД/л, АСТ в норме. К 12 неделям терапии препаратом нетакимаб печеночные трансаминазы в пределах нормы.
При оценке терапии препаратом Эфлейра® на протяжение 12 недель, необходимо отметить, что положительная динамика со стороны кожных покровов наметилась уже после первой инъекции препарата и неуклонно нарастала до ключевой точки терапии в 12 недель. Были достигнуты следующие показатели индексов: BSA – 5%, PASI – 1,4 балла, sPGA – 2, DLQI – 5, NAPSI – 44 балла (табл. 1). Таким образом, результатом терапии в этом периоде стало достижение ответа PASI 90, что соответствует почти чистой коже. Терапия переносилась пациентом хорошо, показатель DLQI не достигал максимального снижения в связи с сохранением болевого синдрома в суставах, что, вероятно, требует дополнительной консультации ревматолога, или пересмотра кратности применения нетамимаба, согласно инструкции по применению. Незначительная динамика по индексу NAPSI не показательна, т.к. для восстановления ногтевой пластины требуется больше времени, чем для кожи.
Сам пациент оценивает получаемую терапию как удовлетворительную с точки зрения динамики улучшения кожного процесса и показателей качества жизни, а также отмечает хорошую переносимость препарата. Терапия продолжается по сегодняшний день.
Клинический случай № 2
Пациент О., мужчина 42 лет, страдает распространенным вульгарным псориазом в течение 20 лет. Неоднократно обращался к врачам – дерматовенерологам различных ЛПУ, где получал стандартную наружную терапию и курсы таких препаратов, как эссенциале форте, супрастин, гемодез, натрия тиосульфат, без выраженного положительного эффекта со стороны кожного процесса. Пациент получал препарат метотрексат в дозировке 10 мг 1 раз в неделю без эффекта со стороны кожных покровов. В течение последнего года отмечал распространение высыпаний на кожных покровах, появление высыпаний на лице и кистях рук.
В анамнезе: со слов пациента, здоров.
Обратился за консультацией к дерматовенерологу ФГБУ «Поликлиника № 1» УД Президента РФ в 2020 г.
Общий статус: пациент гиперстенического телосложения, рост – 170 см, вес – 97 кг, ИМТ=33,56. Общее состояние удовлетворительное. Сознание ясное. Положение активное. Кожные покровы вне высыпаний обычной окраски, сухие. Тургор кожи нормальный. Лимфоузлы, доступные пальпации, не увеличены, эластичные, безболезненные. Дыхание через нос свободное. Зев: слизистая обычной окраски, миндалины не увеличены, налетов нет. Над легкими перкуторно легочный звук. В легких выслушивается везикулярное дыхание, хрипов нет. SpO2 – 96%. Тоны сердца звучные, ритм правильный. Патологические шумы не выслушиваются. Перкуторно границы относительной сердечной тупости в норме. Пульсация на артериях тыла стоп сохранена. Язык влажный, налетов нет. Живот при пальпации мягкий, безболезненный во всех отделах. Печень не увеличена. Селезенка не пальпируется. Симптом поколачивания по поясничной области отрицательный с обеих сторон. Дизурии нет. Стул регулярный, оформленный. Отеков нет.
Status localis. Патологический кожный процесс носит хронический воспалительный характер, распространенный, локализован в области кожи волосистой части головы, на лице, на коже туловища (живот, грудь, спина), в области верхних и нижних конечностей. Высыпания в области кожи волосистой части головы и лица представлены эритемой с инфильтрацией в основании, цвет ярко-красный, на поверхности чешуйки серебристого цвета. В области кожи туловища и конечностей высыпания представлены распространенной эритемой с четкими границами, с инфильтрацией в основании, ярко-красного цвета с выраженным шелушением на поверхности и лихенификацией. Ногтевые пластинки кистей и стоп с явлениями дистального и краевого онихолизиса, положителен симптом наперстка.
Текущая оценка псориаза: BSA – 75%; PASI – 29 баллов, sPGA – 3, DLQI – 22, NAPSI – 15 баллов.
Клинический диагноз: распространенный вульгарный псориаз тяжелого течения.
В связи с тяжелым течением псориаза, локализацией высыпаний в области социально значимых участков кожи (область лица, волосистой части головы, кожа кистей), с учетом факторов риска развития псориатического артрита (тяжелое течение псориаза, мужской пол, наличие псориатической онихопатии) принято решение о назначении системной ГИБТ препаратом нетакимаб (Эфлейра®).
Пациенту перед назначением ГИБТ был рекомендован диагностический скрининг, по результатам которого выявлена сопутствовавшая патология в виде неалкогольного стеатогепатита, метаболического синдрома, нарушения толерантности к глюкозе.
Таким образом, пациент попадает в группу риска по кардиоваскулярной патологии, которая коррелирует с псориазом. Назначение данному пациенту системной терапии именно ингибитором ИЛ-17 обусловлено не только с точки зрения наличия тяжелого псориаза с предикторами псориатического артрита, но и с точки зрения снижения кардиоваскулярного риска в связи с наличием выраженного системного воспаления.
Лабораторные данные, полученные при обследовании: ОАК – базофилы 1,2, ОАМ – без отклонений, биохимический анализ крови: АЛТ –102 ЕД/л, АСТ – 50 ЕД/л, ГГТ – 99 ЕД/л, мочевая кислота – 498 мкмоль/л; ЛПНП – 3,1 ммоль/л; коэффициент атерогенности – 3,5; гликированный гемоглобин – 6,1%.
По данным УЗИ органов брюшной полости – гепатомегалия, диффузные изменения печени по типу стеатогепатоза, диффузные изменения поджелудочной железы, перегиб и уплотнение стенок желчного пузыря. Застой желчи.
Рентгенография органов грудной клетки – легкие без очаговых и инфильтративных изменений. Диаскинтест отрицательный.
Серологические анализы крови на антитела к ВИЧ, вирусам гепатита С и В (HBS-Ag), на сифилис отрицательные.
Пациент был осмотрен терапевтом, пульмонологом, гастроэнтерологом и эндокринологом, по заключению которых противопоказаний к проведению терапии ингибитором ИЛ-17 не выявлено. Дополнительно получал терапию препаратом колекальциферол по 10 тыс. Ме 1 раз в день.
Пациент получил терапию препаратом нетакимаб (Эфлейра®) в отделении дерматовенерологии и косметологии с периодом инициации 120 мг подкожно еженедельно в течение 3 недель и последующими инъекциями препарата 1 раз в 4 недели в дозировке 120 мг подкожно.
Положительная динамика на фоне проводимой терапии была отмечена уже после первой инъекции препарата Эфлейра® в виде снижения интенсивности зуда, чувства стянутости кожи, отсутствия появлений новых элементов сыпи, уменьшения интенсивности окраски высыпаний.
Интересен факт снижения показателей активности печеночных ферментов (АЛТ – 68 ЕД/л, АСТ – 37, ГГТ – 75 ЕД/л) на фоне терапии препаратом нетакимаб (период инициации), что косвенно подтверждает участие ИЛ-17 в процессах системного воспаления при псориазе и его коморбидностях, говорит о положительном влиянии терапии блокатором ИЛ-17 (в данном случае препаратом Эфлейра®) на эти процессы.
При оценке терапии препаратом нетамимаб на протяжение 12 недель достигнуты следующие показатели индексов: BSA – 65%, PASI – 5,4 балла, sPGA – 1, DLQI – 5, NAPSI – 11 баллов (табл. 2). Таким образом, результатом терапии стало достижение снижения тяжести и распространенности псориаза по индексу PASI на на 98%, что соответствует практически чистой коже. Терапия переносилась пациентом хорошо, показатель DLQI к 12-й неделе терапии достиг хорошего показателя, что свидетельствует о значительном снижении негативного влияния заболевания на жизнь пациента. Незначительная динамика по NAPSI не показательна, т.к. для восстановления ногтевой пластины требуется больше времени.
Сам пациент оценивает получаемую терапию как удовлетворительную с точки зрения динамики улучшения кожного процесса и показателей качества жизни, а также отмечает хорошую переносимость препарата. К 12-й неделе терапии, согласно дерматологическому индексу качества жизни пациента, заболевание перестало значительно влиять на его жизнь.
Клинический случай № 3
Пациентка И., женщина 31 года, страдает распространенным вульгарным псориазом с 13 лет, когда после перенесенной ангины впервые отметила появление высыпаний на коже тела. Неоднократно получала амбулаторное и стационарное лечение препаратами натрия тиосульфата, реамберином, антигистаминными препаратами, топическими глюкокортикостероидами с временным положительным эффектом. С 2018 г. получала системную терапию препаратом метотрексат без выраженного положительного эффекта со стороны кожи. В дальнейшем применяла только топическую терапию препаратом Элоком® без стойкого положительного эффекта.
В анамнезе: хронический тонзиллит. Аллергоанамнез не отягощен.
В семейном анамнезе: у отца псориаз.
Обратилась за консультацией к дерматовенерологу ФГБУ «Поликлиника № 1» УД Президента РФ в 2020 г.
Общий статус: пациентка гиперстенического телосложения, рост – 167 см, вес – 76 кг, ИМТ – 27,25. Общее состояние удовлетворительное. Сознание ясное. Положение активное. Кожные покровы вне высыпаний обычной окраски, нормальной влажности. Тургор кожи сохранен. Лимфоузлы, доступные пальпации, не увеличены, эластичные, безболезненные. Дыхание через нос свободное. Зев: слизистая оболочка обычной окраски, миндалины не увеличены, налетов нет. Над легкими перкуторно легочный звук. В легких выслушивается везикулярное дыхание, хрипов нет. SpO2 – 99%. Тоны сердца звучные, ритм правильный. Патологические шумы не выслушиваются. Перкуторно границы относительной сердечной тупости в норме. Пульсация на артериях тыла стоп сохранена. Язык влажный, налетов нет. Живот при пальпации мягкий, безболезненный во всех отделах. Печень не увеличена. Селезенка не пальпируется. Симптом поколачивания по поясничной области отрицательный с обеих сторон. Дизурии нет. Стул регулярный, оформленный. Отеков нет.
Status localis. Патологический кожный процесс носит хронический воспалительный характер, распространенный, в области кожи волосистой части головы и представлен эритематозными бляшками с инфильтрацией в основании и плотными серебристо-белыми чешуйками на поверхности. Характерная «псориатическая корона» в области кожи лба. Высыпания на коже груди, живота, спины, поясницы, верхних и нижних конечностей представлены воспалительными папулами и бляшками размером от 1 до 10 см (область голеней) округлого типа, с четкими границами, с различной степенью инфильтрации в основании. На поверхности шелушение, не доходящее до края элементов с формированием зон периферического роста элементов.
Текущая оценка псориаза: BSA – 26%, PASI – 11,6 балла, sPGA – 3, DLQI – 21 балл.
Клинический диагноз: распространенный вульгарный псориаз среднетяжелого течения.
В связи с наличием среднетяжелого течения псориаза, локализацией высыпаний в области социально значимых участков кожи (область волосистой части головы), отсутствием положительного эффекта от проведенной ранее базисной противовоспалительной терапии препаратом метотрексат и наличием высокого ИМТ принято решение о назначении терапии ингибитором ИЛ-17 – нетакимаб (Эфлейра®).
Пациентке был рекомендован диагностический скрининг перед назначением ГИБТ. По результатам проведенного обследования патологии не выявлено.
Рентгенография органов грудной клетки – легкие без очаговых и инфильтративных изменений. Диаскинтест отрицательный.
Серологические анализы крови на антитела к ВИЧ, вирусам гепатита С и В (HBS-Ag), на сифилис отрицательные.
Пациентка осмотрена терапевтом – противопоказаний к терапии генно-инженерным биологическим препаратом, а именно ингибитором ИЛ-17, не выявлено.
Больная получала терапию препаратом нетакимаб (Эфлейра®) с периодом инициации в течение 3 недель и последующими инъекциями препарата 1 раз в 4 недели в дозировке 120 мг подкожно на протяжении 12 недель. Всего выполнено 4 инъекции.
Пациентка отметила улучшение со стороны кожного процесса практически после первой инъекции препарата нетакимаб, что заключалось в снижении интенсивности зуда, отсутствии появления новых элементов сыпи.
При оценке терапии препаратом нетамимаб на протяжение 3 недель достигнуты следующие показатели индксов: BSA – 21%, PASI – 3 балла, sPGA – 2, DLQI –10 баллов (табл. 3).
Терапия переносилась пациенткой хорошо, DLQI улучшился на 50% уже через месяц терапии. Лабораторный скрининг (биохимические показатели и ОАК) на фоне терапии без отклонений.
Сама пациентка намерена продолжать терапию, оценивает достигнутые результаты как отличные с точки зрения динамики улучшения кожного процесса и показателей качества жизни, а также отмечает хорошую переносимость препарата.
Клинический случай № 4
Пациент Я., мужчина 26 лет, страдает распространенным вульгарным псориазом около 15 лет. Обращался к дерматовенеролгам разных ЛПУ, получал стандартную топическую терапию с временным положительным эффектом. В течение последнего года применяет лосьон Белосалик. Отмечат вялотекущее течение заболевания с обострениями в осенне-зимний период, во время стрессов и основной локализацией высыпаний на коже волосистой части головы.
В анамнезе: артериальная гипертония 1-й степени, гиперлипидемия, нарушение толерантности к глюкозе. Начальные проявления недостаточности мозгового кровообращения. Узловой зоб до 1 см. Аллергоанамнез не отягощен. Курение – 20 лет, около пачки сигарет в день.
Обратился в отделение дерматовенерологии и косметологии ФГБУ «Поликлиника № 1» УД Президента РФ в 2020 г. в связи с появлением высыпаний помимо области кожи волосистой части головы, на коже тела и конечностей.
Общий статус: пациент нормостенического телосложения, рост – 178 см, вес – 92 кг, ИМТ=29. Общее состояние удовлетворительное. Сознание ясное. Кожные покровы вне высыпаний обычной окраски и влажности. Тургор кожи нормальный. Лимфоузлы, доступные пальпации, не увеличены, эластичные, безболезненные. Дыхание через нос свободное. Зев: слизистая оболочка обычной окраски, миндалины не увеличены, налетов нет. Над легкими перкуторно легочный звук. В легких выслушивается везикулярное дыхание, хрипов нет. SpO2 – 97%. Тоны сердца звучные, ритм правильный. Патологические шумы не выслушиваются. Перкуторно границы относительной сердечной тупости в норме. Пульсация на артериях тыла стоп сохранена. Язык влажный, налетов нет. Живот при пальпации мягкий, безболезненный во всех отделах. Печень не увеличена. Селезенка не пальпируется. Симптом поколачивания по поясничной области отрицательный с обеих сторон. Дизурии нет. Стул регулярный, оформленный. Отеков нет.
Status localis. Патологический кожный процесс носит хронический воспалительный характер, распространенный, локализован в области кожи волосистой части головы, на коже туловища, верхних и нижних конечностей. Высыпания в области кожи волосистой части головы представлены эритемой с инфильтрацией в основании, на поверхности которой плотные серебристые чешуйко-корки. Высыпания в области кожи тела, конечностей представлены папулами и бляшками размером от 5 до 20 см с различной степенью инфильтрации в основании, на поверхности элементов серебристо-белые чешуйко-корки. Псориатическая триада положительная. Ногтевые пластинки кистей рук поражены по типу «наперсток». Текущая оценка псориаза: BSA – 12%, PASI – 13,7 балла, sPGA – 2, DLQI – 10, NAPSI – 42 балла. Клинический диагноз: распространенный вульгарный псориаз среднетяжелого течения.
В связи с наличием среднетяжелого течения псориаза, локализацией высыпаний в области социально значимых участков кожи (область волосистой части головы), наличием предикторов псориатического артрита в виде поражения ногтевых платин и мужского пола пациента принято решение о назначении системной ГИБТ. Оценивая соматический статус пациента, в частности нарушение толерантности к глюкозе, артериальную гирпертонию, дислипидемию, выбор препарата для ГИБТ осуществлен в рамках блокаторов ИЛ-17 и остановлен на препарате нетакимаб (Эфлейра®).
Лабораторные данные, полученные при обследовании: гипергликемия – 6,2 ммоль/л, гиперлипидемия: холестерин общий – 8,25 ммоль/л, триглицериды – 2,43 ммоль/л, печеночные ферменты, креатинин, мочевина, С-реактивный белок в норме. ОАК и ОАМ без патологии.
Рентгенография органов грудной клетки: легкие без очаговых и инфильтративных изменений. Диаскинтест отрицательный.
Серологические анализы крови на антитела к ВИЧ, вирусам гепатита С и В (HBS-Ag), на сифилис отрицательные.
Пациент осмотрен терапевтом – противопоказаний к системной терапии генно-инженерным биологическим препаратом, а именно ингибитором ИЛ-17, не выявлено.
Пациент получил терапию препаратом нетакимаб (Эфлейра®) в отделении дерматовенерологии и косметологии с периодом инициации 120 мг подкожно еженедельно в течение 3 недель и последующими инъекциями препарата 1 раз в 4 недели в дозировке 120 мг подкожно. Пациент получал терапию на протяжении 12 недель.
При оценке терапии препаратом нетамимаб (Эфлейра®) на протяжение 12 недель отмечалось, что положительная динамика со стороны кожных покровов наметилась уже после первой инъекции препарата. Были достигнуты следующие показатели индексов: BSA – 2%, PASI – 1,2 балла, sPGA – 0,5, DLQI – 2, NAPSI – 18 баллов (табл. 4). Таким образом, результатами терапии к 12-й неделе явилось достижение PASI 90, что соответствует показателю почти чистая кожа и является хорошим показателем положительной динамики со стороны кожного процесса. Терапия переносилась пациентом хорошо. Лабораторный скрининг на фоне терапии без отклонений.
Сам пациент оценивает получаемую терапию удовлетворительно с точки зрения динамики улучшения кожного процесса, регресса кожного зуда и показателей качества жизни, а также отмечает хорошую переносимость препарата.
Заключение
Появление российского оригинального генно-инженерного биологического препарата Эфлейра® – безусловное достижение отечественной фарминдустрии. Отрадно то, что создание данного препарата базируется на самых последних достижениях в изучении иммунопатогенеза псориаза. Участие ИЛ-17 на сегодняшний день достаточно активно изучается в развитии не только псориаза, псориатического артрита и анкилозирующего спондилита, но и в процессах системного воспаления, столь характерного для псориаза. Роль данного цитокина изучается также в развитии метаболичес-кого синдрома, инсулинорезистентнос-ти, дислипидемии и атеросклероза – процессов, которые являются основой развития последующей эндотелиальной дисфункции и вытекающих из этого высоких кардиоваскулярных рисков при псориазе, так хорошо известных каждому дерматовенерологу. Таким образом, терапия псориаза на сегодняшний день накладывает на дерматовенерологов ничуть не меньшую ответственность за дальнейшую судьбу и здоровье пациентов, чем на терапевтов и кардиологов. Ранняя и адекватная оценка соматического статуса пациента, грамотный выбор терапии, основанный на глубоких знаниях природы заболевания и возможностей его лечения, могут значительно снизить риск развития острого инфаркта миокарда и ишемического инсульта, предотвратить инвалидность, и возможно, сохранить жизнь наших пациентов.
Полученный опыт, изложенный в данной статье, демонстрирует хорошие результаты терапии псориаза новым отечественным препаратом нетакимаб (Эфлейра®) не только с точки зрения оценки кожного статуса, но и с точки зрения благоприятного влияния на процессы системного воспаления.
Автор для связи: Н.А. Мерзликина, врач-дерматовенеролог, отделение дерматовенерологии и косметологии, Поликлиника № 1 УД Президента РФ, Москва, Россия; natal-ya.pryahina90@mail.ru
Адрес: 119002, Россия, Москва, пер. Сивцев Вражек, 26/28