Эфлейра — инструкция по применению
Синонимы, аналоги
Статьи
Внимательно прочтите эту инструкцию перед тем, как начать прием/использование лекарственного средства.
Сохраните инструкцию, она может потребоваться вновь.
Если у Вас возникли вопросы, обратитесь к врачу.
Это лекарственное средство назначено лично Вам, и его не следует передавать другим лицам, поскольку оно может причинить им вред даже при наличии тех же симптомов, что и у Вас.
Регистрационный номер:
ЛП-005439
Торговое наименование препарата:
Эфлейра®
Международное непатентованное наименование:
нетакимаб
Лекарственная форма:
раствор для подкожного введения
Состав:
1 мл раствора содержит:
Действующее вещество: нетакимаб – 60 мг;
Вспомогательные вещества: натрия ацетата тригидрат – 1,74 мг, трегалозы дигидрат – 80 мг, полоксамер 188 – 0,5 мг, уксусная кислота ледяная – до pH 5,0, вода для инъекций – до 1,0 мл.
Описание:
Прозрачный или слегка опалесцирующий от бесцветного до светло-желтого или светло-желтого с коричневатым оттенком цвета раствор.
Фармакотерапевтическая группа:
Интерлейкина ингибитор
Код АТХ:
L04AC
Фармакологические свойства
Фармакодинамика
Нетакимаб является рекомбинантным гуманизированным моноклональным антителом, в терапевтических концентрациях специфически связывающим интерлейкин-17А (ИЛ-17А), находящийся непосредственно в тканях или в крови и других биологических жидкостях. ИЛ-17А – провоспалительный цитокин, гиперпродукция которого преимущественно обусловлена активацией Th17-лимфоцитов. В рамках врожденного иммунитета ИЛ-17А выполняет защитную роль. При хронических иммуновоспалительных заболеваниях патологическая активация Th17-лимфоцитов и гиперпродукция ИЛ-17 стимулирует Т-клеточный ответ и усиленную продукцию других медиаторов воспаления: ИЛ-1, ИЛ-6, фактора некроза опухоли альфа (ФНО-α), факторов роста (Г-КСФ, ГМ-КСФ) и различных хемокинов.
Нетакимаб обладает высокой термодинамической константой специфического связывания с ИЛ-17А человека. По данным доклинических исследований специфическое связывание нетакимаба в нормальных тканях человека ограничено тканями легкого, тимуса, лимфатического узла, миндалин, что согласуется с данными об экспрессии ИЛ-17 клетками этих тканей.
Применение нетакимаба не сопровождается статистически значимым изменением уровня Т-лимфоцитов и не влияет на уровень и соотношение иммуноглобулинов классов А, G и М.
Специфическая противовоспалительная активность нетакимаба продемонстрирована в тестах in vitro и in vivo. Нетакимаб дозозависимо ингибирует ИЛ-17 и ФНОα-зависимую продукцию интерлейкина-6 на культуре клеток при IC50 40 pM. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (один раз в неделю в течение 4-х недель) подкожное введение нетакимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (суставной хрящ остается интактным, синовиальные оболочки — без признаков поражения и воспалительной реакции, пролиферации синовиоцитов не отмечено).
У больных псориазом использование нетакимаба сопровождается угасанием явлений воспаления и гиперкератоза в коже, достоверным снижением уровня С-реактивного белка и СОЭ. У пациентов с активным анкилозирующим спондилитом и псориатическим артритом на фоне применения нетакимаба отмечается уменьшение симптомов воспаления в позвоночнике, энтезисах и суставах, а также быстрое снижение концентрации С-реактивного белка, являющегося маркером воспаления.
Фармакокинетика
Всасывание/распределение
Изменение концентрации нетакимаба после его подкожного введения является дозозависимым (значения Сmax, Cmax-mult, AUC0-t находятся в прямой зависимости от дозы). Препарат характеризуется медленной фазой абсорбции с постепенным линейным нарастанием концентрации в сыворотке крови.
При однократном подкожном введении нетакимаба в дозе 120 мг пациентам с бляшечным псориазом препарат начинал обнаруживаться в сыворотке крови в течение 0,5 — 4 часов после введения; максимальная концентрация нетакимаба (Сmax) составляла 15,1 [7,7-19,3] мкг/мл, время ее достижения – 144 [72-168] ч, AUC0-168 – 1667,8 [932,2-2270,8] (мкг/мл)*ч.
При повторных введениях отмечено накопление препарата в сыворотке крови с ростом концентрации в 1,8-3,6 раза. Максимальная концентрация при многократном введении (Cmax-mult) составляла 33,0 [23,1-44,0] мкг/мл и достигалась (Tmax-mult) через 1680 [672-2016] часов.
Выведение
Характеристики выведения нетакимаба являются типичными для препаратов на основе моноклональных антител: показатели Kel, T½, MRT, Cl не зависят от дозы вводимого препарата, период полувыведения после однократного введения составляет около 16 суток.
Средний клиренс нетакимаба при однократном введении в дозе 120 мг пациентам с бляшечным псориазом составил 1,8 л/сутки.
Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания к применению
- Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия.
- Лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию.
- Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию.
Противопоказания
- Гиперчувствительность к нетакимабу, а также к любому из вспомогательных веществ препарата.
- Клинически значимые инфекционные заболевания в острой фазе, включая туберкулез.
- Детский и подростковый возраст до 18 лет.
- Беременность, грудное вскармливание.
С осторожностью
Следует соблюдать осторожность при назначении нетакимаба пациентам с хроническими и рецидивирующими инфекциями или с анамнестическими указаниями на них, в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний, а также после недавно проведенной вакцинации живыми вакцинами.
В связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет, следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы.
В связи с отсутствием сведений о применении нетакимаба у больных воспалительными заболеваниями кишечника, следует избегать его назначения пациентам с болезнью Крона или язвенным колитом.
Применение при беременности и в период грудного вскармливания
Применение при беременности
При применении нетакимаба у животных не выявлено отрицательного влияния на репродуктивную функцию, эмбриотоксичности или тератогенных эффектов.
Исследований влияния на плод у беременных женщин не проводилось. Препарат противопоказан к применению во время беременности.
Применение при грудном вскармливании
Нет данных о проникновении нетакимаба в грудное молоко. Учитывая, что иммуноглобулины класса G, к которым относится нетакимаб, при циркуляции в крови матери могут выделяться с грудным молоком, применение в период грудного вскармливания противопоказано. Во избежание негативного воздействия на ребенка следует прекратить либо грудное вскармливание, либо терапию, учитывая соотношение риска и пользы для матери и ребенка.
Влияние на фертильность
В исследованиях у животных не обнаружено негативного воздействия нетакимаба на фертильность. Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата Эфлейра® должно осуществляться под наблюдением врачей, имеющих опыт лечения заболеваний, при которых показан препарат Эфлейра®. После соответствующего обучения возможно самостоятельное введение препарата пациентом при условии динамического наблюдения со стороны лечащего врача. Препарат Эфлейра® может применяться как в стационарных, так и в амбулаторных условиях.
Препарат Эфлейра® вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл препарата с концентрацией 60 мг/мл.
Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая вводится 1 раз в неделю на неделях 0, 1 и 2, затем 1 раз каждые 4 недели.
Лечение активного анкилозирующего спондилита при недостаточном ответе на стандартную терапию: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели.
Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию: рекомендуемая доза 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели до недели 10 включительно. Далее с недели 14 препарат вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) каждая 1 раз в 4 недели.
| Показание | Разовая доза | Индукция | Поддерживающая терапия |
| Бляшечный псориаз | 120 мг | 0, 1, 2 недели |
1 раз в 4 недели, начиная с недели 6 |
| Анкилозирующий спондилит | 120 мг | 0, 1, 2 недели |
1 раз в 2 недели, начиная с недели 4 |
| Псориатический артрит | 120 мг | 0, 1, 2 недели |
1 раз в 2 недели, начиная с недели 4 по неделю 10 включительно, далее 1 раз в 4 недели с недели 14 |
При пропуске очередного введения по любой причине инъекция препарата Эфлейра® должна быть произведена как можно быстрее. Дата следующего введения рассчитывается исходя из продолжительности задержки с введением препарата: если со времени пропуска введения прошло не более 3 дней, то следующую инъекцию препарата необходимо выполнить по текущему графику, если с момента пропуска введения прошло более 3 дней, то новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Эфлейра®.
Указания по применению
Подготовка к проведению подкожной инъекции


Препарат Эфлейра ® в автоинжекторе
- помутнения раствора, наличия в препарате посторонних видимых частиц;
- изменения цвета;
- повреждения любых частей шприца/автоинжектора;
- истечения срока годности (годен до…), указанного на картонной пачке, а также на этикетке шприца/автоинжектора.

На данном этапе не следует снимать колпачок шприца/автоинжектора
1. Техника выполнения подкожной инъекции препарата Эфлейра® в преднаполненном шприце
Выбор и подготовка места для инъекции









После инъекции шприц повторно не использовать
2. Техника выполнения подкожной инъекции препарата Эфлейра® в автоинжекторе








После инъекции автоинжектор повторно не использоватьУтилизация расходного материала

Побочное действие
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено.
Большинство зарегистрированных нежелательных явлений (НЯ), связанных с применением препарата Эфлейра®, имели легкую или среднюю степень тяжести и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было.
Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1000 до <1/100), редко (от >1/10000 до <1/1000), очень редко (<10000).
Инфекции и инвазии: часто – инфекции верхних дыхательных путей; нечасто – инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция.
Нарушения со стороны печени и желчевыводящих путей: нечасто – гипербилирубинемия.
Желудочно-кишечные нарушения: нечасто – боль в животе, диарея.
Нарушения со стороны кожи и подкожной клетчатки: нечасто – экзема, дерматит, сыпь, зуд, крапивница.
Нарушения со стороны крови и лимфатической системы: часто – нейтропения, лейкопения, лимфоцитоз; нечасто – тромбоцитопения, лимфопения.
Нарушения со стороны иммунной системы: нечасто – гиперчувствительность.
Нарушения со стороны органа зрения: нечасто – эписклерит.
Нарушения со стороны нервной системы: нечасто – головная боль, головокружение, парестезия, поражение лицевого нерва.
Нарушения со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса.
Нарушения со стороны сосудов: нечасто — гипертензия (в том числе изолированная систолическая/диастолическая гипертензия), гипертонический криз.
Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция**.
Нарушения метаболизма и питания: нечасто – гипергликемия.
Нарушения со стороны почек и мочевыводящих путей: нечасто – протеинурия.
Лабораторные и инструментальные данные: часто – повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто – повышение гамма-глутамилтрансферазы (ГГТ), повышение уровня холестерина в крови, увеличение веса.
Травмы, интоксикации и осложнения процедур: нечасто – головокружение во время процедуры (во время инъекции).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто – инфицированный невус.
Нарушения со стороны репродуктивной системы и молочных желез: нечасто – фиброзно-кистозная болезнь молочных желез.
* «Гриппоподобное заболевание» характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата.
** Местные реакции могут включать в себя любые неблагоприятные проявления, возникающие в месте инъекции.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях явлений дозолимитирующей токсичности не зарегистрировано: при подкожном введении нетакимаба в максимальной дозе 3 мг/кг (195 – 355 мг для взрослого человека с весом 65 – 85 кг) патологических отклонений не было выявлено.
Специфический антидот отсутствует. Лечение симптоматическое.
Взаимодействие с другими лекарственными средствами
Сведений о наличии неблагоприятных лекарственных взаимодействий нетакимаба с другими лекарственными препаратами до настоящего времени не получено. Предполагается, что нетакимаб может усиливать иммуносупрессивное действие глюкокортикоидов, метотрексата, сульфасалазина, лефлуномида и других базисных противовоспалительных препаратов.
Смешивание препарата с другими лекарственными средствами, введение в виде инфузии строго запрещено.
Особые указания
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В и/или С, сифилис, туберкулез, относится к противопоказаниям для назначения нетакимаба. Применение нетакимаба у данной группы больных не изучено. Учитывая иммуносупрессивное действие нетакимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. Необходимо проводить скрининг и оценивать соотношение риска и пользы терапии нетакимабом у этих пациентов.
Пациентам с активным туберкулезом терапия препаратом Эфлейра® противопоказана. Перед назначением препарата Эфлейра® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Эфлейра®.
При реактивации гепатита В терапия нетакимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии.
При использовании нетакимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований нетакимаба анафилактических реакций не зарегистрировано, нечасто отмечались реакции гиперчувствительности и крапивница. Однако при использовании других ингибиторов ИЛ17 крапивница и анафилактические реакции отмечались в редких и очень редких случаях. При возникновении анафилактических или других серьёзных аллергических реакций применение препарата Эфлейра® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения нетакимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательный мониторинг за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований на данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Эфлейра® при лечении псориаза, псориатического артрита и анкилозирующего спондилита выработка связывающих антител к нетакимабу была зарегистрирована менее чем в 0,5 % случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба у пациентов с псориазом, псориатическим артритом и анкилозирующим спондилитом.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Эфлейра®, так как клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом Эфлейра®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям. Иммунизация инактивированными вакцинами во время терапии нетакимабом должна выполняться с осторожностью.
Влияние на способность управлять транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Эфлейра® на способность управлять транспортными средствами и работать с машинами и (или) механизмами.
Форма выпуска
Раствор для подкожного введения 60 мг/мл.
Преднаполненные шприцы
По 1,0 мл препарата в трехкомпонентные шприцы. Цилиндр каждого шприца изготовлен из бесцветного нейтрального стекла I гидролитического класса. Шприц с одной стороны имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена жестким колпачком. С другой стороны шприц укупорен поршнем, шток которого изготовлен из полипропилена; на конце поршня имеется уплотнитель из бутилкучука, ламинированный фторполимером.
На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу помещают в контурную ячейковую упаковку из пленки ПВХ или ПЭТ.
По 2 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона. Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 шт.
Автоинжектор
По 1,0 мл препарата в трехкомпонентные шприцы. Цилиндр каждого шприца изготовлен из бесцветного нейтрального стекла I гидролитического класса.
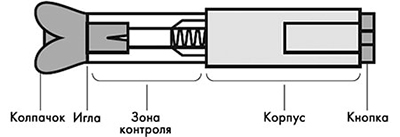
Шприц с препаратом встроен в пластиковый автоинжектор, состоящий из защитного колпачка, корпуса с прозрачной зоной контроля, верхнего корпуса и кнопки активации. Внутреннее устройство автоинжектора имеет цилиндр, защищающий иглу, и поршень, который через систему механического пуска соединен с кнопкой активации.
На каждый автоинжектор наклеивают самоклеящуюся этикетку.
По 1 автоинжектору помещают в контурную ячейковую упаковку из пленки ПВХ или ПЭТ.
По 2 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона. Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 шт.
Условия хранения
При температуре от 2 до 8°С в защищенном от света месте. Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
ЗАО «БИОКАД», Россия, 143422, Московская обл., Красногорский р-н, с. Петрово-Дальнее.
Владелец регистрационного удостоверения
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, д. 34, лит. А.
Организация, принимающая претензии потребителей
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, пос. Стрельна, ул. Связи, д. 34, лит. А.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакологическое действие
Нетакимаб является рекомбинантным гуманизированным моноклональным антителом, в терапевтических концентрациях специфически связывающим интерлейкин-17А (ИЛ-17А), находящийся непосредственно в тканях или в крови и других биологических жидкостях. ИЛ-17А – провоспалительный цитокин, гиперпродукция которого преимущественно обусловлена активацией Th17-лимфоцитов. В рамках врожденного иммунитета ИЛ-17А выполняет защитную роль. При хронических иммуновоспалительных заболеваниях патологическая активация Th17-лимфоцитов и гиперпродукция ИЛ-17 стимулирует Т-клеточный ответ и усиленную продукцию других медиаторов воспаления: ИЛ-1, ИЛ-6, ФНОα, факторов роста (Г-КСФ, ГМ-КСФ) и различных хемокинов.
Нетакимаб обладает высокой термодинамической константой специфического связывания с ИЛ-17А человека. По данным доклинических исследований специфическое связывание нетакимаба в нормальных тканях человека ограничено тканями легкого, тимуса, лимфатического узла, миндалин, что согласуется с данными об экспрессии ИЛ-17 клетками этих тканей.
Применение нетакимаба не сопровождается статистически значимым изменением уровня Т-лимфоцитов и не влияет на уровень и соотношение иммуноглобулинов классов А, G и М.
Специфическая противовоспалительная активность нетакимаба продемонстрирована в тестах in vitro и in vivo. Нетакимаб дозозависимо ингибирует ИЛ-17 и ФНОα-зависимую продукцию ИЛ-6 на культуре клеток при IC50 40 pM. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 4 недель) п/к введение нетакимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (суставной хрящ остается интактным, синовиальные оболочки — без признаков поражения и воспалительной реакции, пролиферации синовиоцитов не отмечено).
У больных псориазом использование нетакимаба сопровождается угасанием явлений воспаления и гиперкератоза в коже, достоверным снижением уровня С-реактивного белка и СОЭ.
У пациентов с активным анкилозирующим спондилитом и псориатическим артритом на фоне применения нетакимаба отмечается уменьшение симптомов воспаления в позвоночнике, энтезисах и суставах, а также быстрое снижение концентрации С-реактивного белка, являющегося маркером воспаления.
Фармакокинетика
Всасывание/распределение
Изменение концентрации нетакимаба после п/к введения препарата является дозозависимым (значения Сmax, Cmax—mult, AUC0-t находятся в прямой зависимости от дозы). Препарат характеризуется медленной фазой абсорбции с постепенным линейным нарастанием концентрации в сыворотке крови.
При однократном п/к введении нетакимаба в дозе 120 мг пациентам с бляшечным псориазом препарат начинал обнаруживаться в сыворотке крови в течение 0.5-4 ч после введения; Сmax составляла 15.1 (7.7-19.3) мкг/мл, Тmax – 144 (72-168) ч, AUC0-168 – 1667.8 (932.2–2270.8) (мкг/мл)×ч.
При повторных введениях отмечено накопление препарата в сыворотке крови с ростом концентрации в 1.8-3.6 раза. Максимальная концентрация при многократном введении (Cmax-mult) составляла 33.0 (23.1-44.0) мкг/мл и достигалась (Tmax—mult) через 1680 (672-2016) ч.
Выведение
Характеристики выведения нетакимаба являются типичными для препаратов на основе моноклональных антител: показатели Kel, T1/2, MRT, Cl не зависят от дозы вводимого препарата. Т1/2 после однократного введения составляет около 16 суток.
Средний клиренс нетакимаба при однократном введении в дозе 120 мг пациентам с бляшечным псориазом составил 1.8 л/сут.
Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом.
Фармакокинетика в особых клинических случаях
Фармакокинетические параметры нетакимаба у пациентов с анкилозирующим спондилитом схожи с таковыми у пациентов с бляшечным псориазом.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания препарата
Эфлейра®
- лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия;
- лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию;
- лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию.
Режим дозирования
Применение препарата Эфлейра® должно осуществляться под наблюдением врачей, имеющих опыт лечения заболеваний, при которых показан препарат Эфлейра®. После соответствующего обучения возможно самостоятельное введение препарата пациентом при условии динамического наблюдения со стороны лечащего врача.
Препарат Эфлейра® можно применять как в стационарных, так и в амбулаторных условиях.
Препарат вводят в дозе 120 мг в виде двух п/к инъекций по 1 мл препарата с концентрацией 60 мг/мл.
Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия
Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата, каждая вводится 1 раз в неделю на неделях 0, 1 и 2, затем 1 раз каждые 4 недели.
Лечение активного анкилозирующего спондилита при недостаточном ответе на стандартную терапию
Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели.
Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию
Рекомендуемая доза — 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. Препарат вводится 1 раз в неделю на неделях 0, 1 и 2, затем каждые 2 недели до недели 10 включительно. Далее с недели 14 препарат вводится в дозе 120 мг в виде двух подкожных инъекций по 1 мл (60 мг) каждая 1 раз в 4 недели.
При пропуске очередного введения по любой причине инъекция препарата Эфлейра® должна быть произведена как можно быстрее. Дата следующего введения рассчитывается исходя из продолжительности задержки с введением препарата: если со времени пропуска введения прошло не более 3 дней, следующую инъекцию препарата необходимо выполнить по текущему графику, если с момента пропуска дозы прошло более 3 дней, то новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Эфлейра®.
Указания по применению
Подготовка к проведению п/к инъекции
Тщательно вымыть руки.
Достать упаковку с двумя шприцами/автоинжекторами с препаратом Эфлейра® из холодильника, затем извлечь из картонной пачки и ячейковой упаковки два шприца/автоинжектора и положить на чистую поверхность. Убедиться, что срок хранения препарата, указанный на картонной пачке и шприце/автоинжекторе не истек.
Препарат Эфлейра® в преднаполненном шприце
Препарат Эфлейра® в автоинжекторе
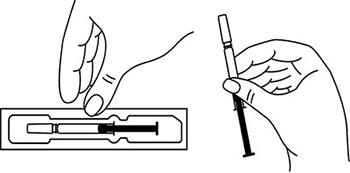
Осмотреть шприцы/автоинжекторы, а также лекарственный препарат, находящийся в них. Препарат Эфлейра® представляет собой прозрачный, от бесцветного до светло-желтого цвета раствор. Нельзя использовать препарат в случае:
- помутнения раствора, наличия в препарате посторонних видимых частиц;
- изменения цвета;
- повреждения любых частей шприца/автоинжектора;
- истечения срока годности (годен до…), указанного на картонной пачке, а также на этикетке шприца/автоинжектора.
Перед введением шприцы/автоинжекторы с препаратом Эфлейра® следует довести до комнатной температуры, для этого необходимо оставить шприц при комнатной температуре в течение приблизительно 25-30 мин. Не следует согревать шприц/автоинжектор каким-либо другим способом.
Подготовить салфетку/ватный тампон, спиртовой раствор.
На данном этапе не следует снимать колпачок шприца/автоинжектора.
Техника выполнения п/к инъекции препарата Эфлейра® в преднаполненном шприце
Выбор и подготовка места для инъекции
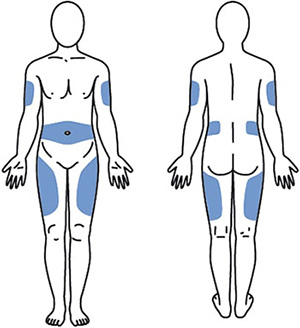
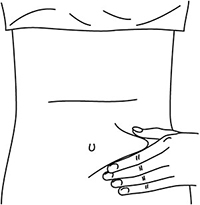
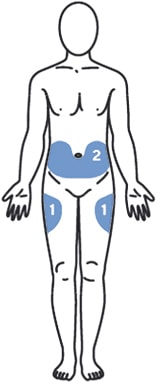
Выбрать место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
Места инъекций и стороны следует менять при каждой последующей инъекции. Расстояние между двумя введениями должно составлять как минимум 5 см.
Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек (эти признаки могут указывать на наличие инфекции). По возможности не следует вводить препарат в псориатическую бляшку.
Место для укола необходимо обработать спиртовой салфеткой/ватным тампоном круговыми движениями.
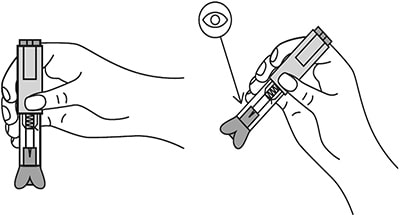
Шприц не встряхивать.
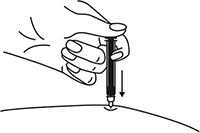
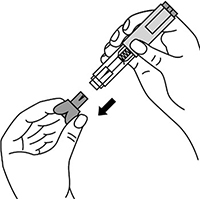
Снять колпачок с иглы, не дотрагиваясь до иглы и избегая ее прикосновения к другим поверхностям.
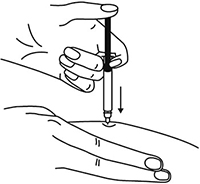
Большим и указательным пальцами одной руки взять в складку обработанную кожу.
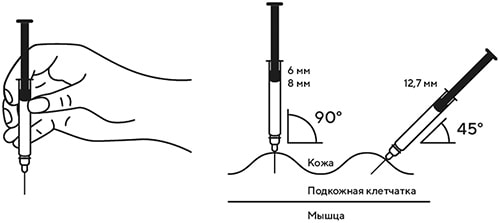
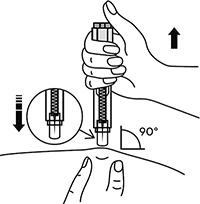
В другую руку взять шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1.5 см допустимо введение под углом 90 градусов).
Одним быстрым движением полностью ввести иглу в кожную складку.
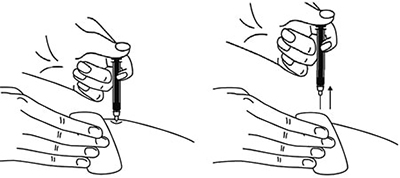
После введения иглы складку кожи следует отпустить.
Ввести весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 сек.
Когда шприц будет пустым, вынуть иглу из кожи под тем же углом.
Сухой стерильной салфеткой/ватным шариком слегка прижать область инъекции, но не растирать. Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем.
Ввести вторую дозу препарата Эфлейра® аналогичным образом предпочтительно в ту же анатомическую область при условии, что место последующей инъекции должно быть не ближе 5 см от предыдущей. Время выполнения двух инъекций не должно превышать 10 мин.
После инъекции шприц повторно не использовать.
Техника выполнения п/к инъекции препарата Эфлейра® в автоинжекторе
Устройство автоинжектора:
Автоинжектор не встряхивать.
Не следует снимать защитный колпачок с автоинжектора до выполнения инъекции.
Необходимо проверить срок годности препарата по маркировке на упаковке, оценить целостность автоинжектора и состояние раствора через зону контроля автоинжектора. Не следует использовать автоинжектор в случае его повреждения, изменения цвета и прозрачности раствора, а также при истечении срока годности.
Разместить автоинжектор на чистой горизонтальной поверхности.
Выбрать место введения (область брюшной стенки (отступая не менее 5 см от пупка) или передняя поверхность бедра) и обработать кожу в области введения спиртовой салфеткой.
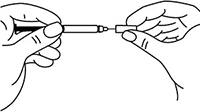
Непосредственно перед инъекцией одной рукой снять колпачок с автоинжектора, удерживая другой рукой его корпус.
Одной рукой взять в складку обработанную спиртовой салфеткой кожу и удерживать в течение всей процедуры инъекции.
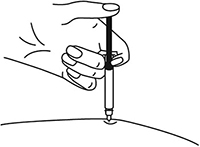
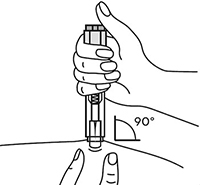
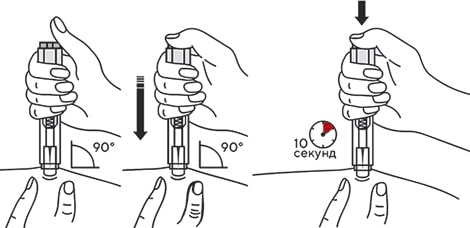
В другую руку взять автоинжектор, удерживая его за корпус. Введение препарата необходимо осуществлять, плотно прижав автоинжектор под углом 90 градусов к поверхности кожи. Надавливание автоинжектором на поверхность кожной складки приведет к разблокированию кнопки.
Удерживая автоинжектор под углом 90 градусов к поверхности кожной складки, надавить до упора на кнопку автоинжектора. Послышится щелчок, указывающий на начало инъекции. Не следует изменять положение автоинжектора. Необходимо удерживать кнопку в течение 10 сек до окончания инъекции.
Если инъекция не запустилась, следует отпустить кнопку и проверить, плотно ли прижат автоинжектор к кожной складке. Необходимо прижать плотно автоинжектор к коже и повторить процедуру инъекции, вновь нажав на кнопку.
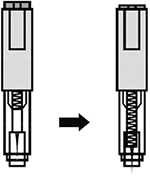
Следует удерживать автоинжектор плотно прижатым к коже еще несколько секунд для полного введения лекарственного вещества. Осмотрев зону контроля, необходимо убедиться, что вся доза препарата введена и контейнер пуст.
После окончания инъекции извлечь автоинжектор, игла автоматически закроется защитным цилиндром.
Сухой стерильной салфеткой/ватным шариком слегка прижать область инъекции, но не растирать область выполненной инъекции. Из места инъекции может выделиться небольшое количество крови. При необходимости можно воспользоваться пластырем.
Ввести вторую дозу препарата Эфлейра® аналогичным образом предпочтительно в ту же анатомическую область при условии, что место последующей инъекции должно быть не ближе 5 см от предыдущей. Время выполнения двух инъекций не должно превышать 10 мин.
После инъекции автоинжектор повторно не использовать.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы/автоинжекторы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла. Не допускать хранения использованных шприцев/автоинжекторов в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено.
Большинство зарегистрированных нежелательных явлений, связанных с приемом препарата Эфлейра®, имели легкую или среднюю степень тяжести и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было.
Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии.
В данной инструкции нежелательные реакции представлены в соответствии с MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
Инфекции и инвазии: часто – инфекции верхних дыхательных путей; нечасто – инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция.
Со стороны печени и желчевыводящих путей: часто — гипербилирубинемия.
Со стороны ЖКТ: нечасто — боль в животе, диарея.
Со стороны кожи и подкожной клетчатки: нечасто – экзема, дерматит, сыпь, зуд, крапивница.
Со стороны крови и лимфатической системы: часто — нейтропения, лейкопения, лимфоцитоз; нечасто – тромбоцитопения, лимфопения.
Со стороны иммунной системы: нечасто — гиперчувствительность.
Со стороны органа зрения: нечасто – эписклерит.
Со стороны нервной системы: нечасто — головная боль, головокружение, парестезия, поражение лицевого нерва.
Со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса.
Со стороны сосудов: нечасто — гипертензия (в т.ч. изолированная систолическая/диастолическая гипертензия), гипертонический криз.
Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция**
Со стороны метаболизма и питания: нечасто – гипергликемия.
Со стороны почек и мочевыводящих путей: нечасто — протеинурия.
Лабораторные и инструментальные данные: часто – повышение активности АЛТ, АСТ, положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто – повышение ГГТ, повышение уровня холестерина в крови, увеличение массы тела.
Травмы, интоксикации и осложнения процедур: нечасто – головокружение во время процедуры (во время инъекции).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто – инфицированный невус.
Со стороны репродуктивной системы и молочных желез: нечасто – фиброзно-кистозная болезнь молочных желез.
* Гриппоподобное заболевание характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры тела, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата.
** Местные реакции могут включать любые неблагоприятные проявления, возникающие в мете инъекции.
Противопоказания к применению
- гиперчувствительность к нетакимабу, а также к любому из вспомогательных веществ препарата;
- клинически значимые инфекционные заболевания в острой фазе, включая туберкулез;
- детский и подростковый возраст до 18 лет;
- беременность;
- период грудного вскармливания.
С осторожностью
Следует соблюдать осторожность при назначении препарата пациентам с хроническими и рецидивирующими инфекциями или с указаниями на них в анамнезе, в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний, а также после недавно проведенной вакцинации живыми вакцинами.
В связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы.
В связи с отсутствием сведений о применении нетакимаба у больных воспалительными заболеваниями кишечника следует избегать его назначения пациентам с болезнью Крона или язвенным колитом.
Применение при беременности и кормлении грудью
Беременность
При применении нетакимаба у животных не выявлено отрицательного влияния на репродуктивную функцию, эмбриотоксичности или тератогенных эффектов. Исследований влияния на плод у беременных женщин не проводилось. Препарат противопоказан к применению во время беременности.
Грудное вскармливание
Нет данных о выделении нетакимаба с грудным молоком. Учитывая, что иммуноглобулины класса G, к которым относится нетакимаб, при циркуляции в крови матери могут выделяться с грудным молоком, применение в период грудного вскармливания противопоказано. Во избежание негативного воздействия на ребенка следует прекратить либо грудное вскармливание, либо терапию, учитывая соотношение риска и пользы для матери и ребенка.
Фертильность
В исследованиях у животных не обнаружено негативного воздействия нетакимаба на фертильность. Данные о влиянии препарата на фертильность у человека отсутствуют.
Применение при нарушениях функции печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Применение при нарушениях функции почек
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Применение у детей
Противопоказано применение препарата в возрасте до 18 лет.
Применение у пожилых пациентов
В связи с ограниченными данными клинических исследований о применении нетакимаба у пациентов в возрасте старше 65 лет следует соблюдать осторожность при назначении препарата пациентам указанной возрастной группы.
Особые указания
Наличие таких потенциально тяжелых инфекций, как ВИЧ, активный гепатит В и/или С, сифилис, туберкулез, относится к противопоказаниям для назначения нетакимаба. Применение нетакимаба у данной группы пациентов не изучено. Учитывая иммуносупрессивное действие нетакимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. Необходимо проводить скрининг и оценивать соотношение риска и пользы терапии нетакимабом у этих пациентов.
Пациентам с активным туберкулезом терапия препаратом Эфлейра® противопоказана. Перед назначением препарата Эфлейра® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Эфлейра®.
При реактивации гепатита В лечение нетакимабом следует прекратить и назначить соответствующую противовирусную терапию.
Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии.
При применении нетакимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований нетакимаба анафилактические реакции не зарегистрированы, нечасто отмечались реакции гиперчувствительности и крапивница. Однако при применении других ингибиторов ИЛ-17 крапивница и анафилактические реакции отмечались в редких и очень редких случаях. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Эфлейра® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения нетакимабом, что, в свою очередь, может привести к снижению эффективности терапии. Необходим более тщательный мониторинг за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований на данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Эфлейра® при лечении псориаза, псориатического артрита и анкилозирующего спондилита формирование связывающих антител к нетакимабу было зарегистрировано менее чем в 0.5% случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба у пациентов с псориазом, псориатическим артритом и пациентов с анкилозирующим спондилитом.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Использование в педиатрии
Исследование эффективности и безопасности препарата у детей и подростков в возрасте до 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом Эфлейра®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом Эфлейра®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям. Иммунизацию инактивированными вакцинами во время терапии нетакимабом необходимо выполнять с осторожностью.
Влияние на способность к управлению транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Эфлейра® на способность управлять транспортными средствами и работать с машинами и/или механизмами.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях явлений дозолимитирующей токсичности не зарегистрировано: при п/к введении препарата нетакимаб в максимальной дозе 3 мг/кг (195–355 мг для взрослого человека с массой тела 65–85 кг) патологических отклонений не было выявлено.
Лечение: специфический антидот отсутствует; проводят симптоматическую терапию.
Лекарственное взаимодействие
Сведений о наличии неблагоприятного лекарственного взаимодействия нетакимаба с другими лекарственными препаратами до настоящего времени не получено. Предполагается, что нетакимаб может усиливать иммуносупрессивное действие ГКС, метотрексата, сульфасалазина, лефлуномида и других базисных противовоспалительных препаратов.
Смешивание препарата с другими лекарственными средствами и введение в виде инфузии строго запрещено.
Условия хранения препарата Эфлейра®
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°С; не замораживать.
Срок годности препарата Эфлейра®
Срок годности — 2 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено.
Большинство зарегистрированных нежелательных явлений (НЯ), связанных с применением препарата Эфлейра®, имели легкую или среднюю степень тяжести и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было.
Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших нетакимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную связь с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
Инфекции и инвазии: часто – инфекции верхних дыхательных путей; нечасто – инфекция дыхательных путей, пневмония, назофарингит, фарингит, синусит, инфекция мочевыводящих путей, кандидоз пищевода, конъюнктивит вирусный, простой герпес, стафилококковое импетиго, фурункул, туберкулезная инфекция.
Нарушения со стороны печени и желчевыводящих путей: нечасто – гипербилирубинемия.
Желудочно-кишечные нарушения: нечасто – боль в животе, диарея.
Нарушения со стороны кожи и подкожной клетчатки: нечасто – экзема, дерматит, сыпь, зуд, крапивница.
Нарушения со стороны крови и лимфатической системы: часто – нейтропения, лейкопения, лимфоцитоз; нечасто – тромбоцитопения, лимфопения.
Нарушения со стороны иммунной системы: нечасто – гиперчувствительность.
Нарушения со стороны органа зрения: нечасто – эписклерит.
Нарушения со стороны нервной системы: нечасто – головная боль, головокружение, парестезия, поражение лицевого нерва.
Нарушения со стороны сердца: нечасто — синусовая брадикардия, блокада левой ножки пучка Гиса.
Нарушения со стороны сосудов: нечасто — гипертензия (в том числе изолированная систолическая/диастолическая гипертензия), гипертонический криз.
Общие нарушения и реакции в месте введения: нечасто — гриппоподобное заболевание*, местная реакция**.
Нарушения метаболизма и питания: нечасто – гипергликемия.
Нарушения со стороны почек и мочевыводящих путей: нечасто – протеинурия.
Лабораторные и инструментальные данные: часто – повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), положительный результат исследования на комплекс Mycobacterium tuberculosis; нечасто – повышение гамма-глутамилтрансферазы (ГГТ), повышение уровня холестерина в крови, увеличение веса.
Травмы, интоксикации и осложнения процедур: нечасто – головокружение во время процедуры (во время инъекции).
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто – инфицированный невус.
Нарушения со стороны репродуктивной системы и молочных желез: нечасто – фиброзно-кистозная болезнь молочных желез.
*«Гриппоподобное заболевание» характеризуется появлением ряда симптомов, сходных с выявляемыми при гриппе или простуде, включая, например, но не ограничиваясь: повышение температуры, озноб, ломоту в теле, недомогание, слабость, снижение аппетита, сухой кашель, которые имеют временную связь с проведением инъекции препарата.
**Местные реакции могут включать в себя любые неблагоприятные проявления, возникающие в месте инъекции.