Дихлорацетат натрия представляет собой натриевую соль дихлоруксусной кислоты ( DCA ). Дихлоруксусная кислота имеет высокую кислотность, поэтому ее обычно хранят и продают в виде различных солей, которые снижают кислотность до приемлемого рН.
Дихлорацетат натрия это белый цвет, растворимый в кристаллическом порошке воды. Химическая формула — Cl2CHCOONa. Это простая молекула, которая имеет много применений.
Применение дихлорацетата натрия до открытия канадских ученых ограничивалось лечением детей с врожденными нарушениями метаболизма. Вещество было эффективным только при заболеваниях, вызванных нарушением функции митохондрий в клетках. Группа ученных пришла к выводу, что DCA является эффективным главным образом против раковых опухолей, которые поразили легкие, грудь и отделы головного мозга.
Дихлорацетат натрия не является ядом или химиопрепаратом, после действия которого происходит полное разрушение организма. Чтобы улучшить состояние здоровья и победить раковое заболевание, люди годами пьют препараты на основе DCA.
Преимуществом применения дихлорацетата натрия при раковой опухоли в том, что он имеет совсем другой механизм действия: он направлен на восстановление функций поврежденной митохондрии, в результате чего раковая клетка неизбежно гибнет.
DCA быстро разрушает злокачественную опухоль, а продукты ее распада проникают в кровь. Такой процесс может вызвать плохое самочувствие пациента, но симптомы интоксикации устраняются с помощью специальных капельниц, клизм и сорбентов.
Важно вовремя начать лечение DCA, если заболевание будет запущено, а внутренние органы пострадают от химиотерапии, никакие препараты уже не помогут. Иногда люди длительное время принимают дихлорацетат натрия, а состояние их здоровья остается на прежнем уровне. Тогда специалисты подбирают более высокую дозировку.
СОСТАВ
Дихлорацетат натрия (DCA).
ПОКАЗАНИЯ
- Неходжкинская лимфома;
- Острая лимфатическая лейкемия;
- Острая миелоцитическая лейкемия;
- Хроническая лимфатическая лейкемия;
- Рак груди;
- Рак яичек;
- Медуллобластома;
- Клеточная карцинома Меркеля;
- Нейробластома;
- Мелкоклетчатый рак лёгких.
- Заболевания, вызванные нарушением функции митохондрий в клетках.
Дозировка препарата должна быть назначена только специалистом, такое лечение невозможным становится при неврологических нарушениях. Побочных действий от приема дихлорацетата натрия не наблюдается, они могут возникать лишь при невропатии – дрожание пальцев рук и дрожь внутри, но через неделю после прекращения лечения побочные явления исчезают.
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
Дихлорацетат принимается из расчёта 12 — 25 мг порошка на 1 кг веса пациента — т.е. в сутки при весе 40 кг выходит около 1 гр. При весе 60 кг — 1,5 г ≈ 1/3 чай ложки. После еды. Также пьют «Нейромультивит» по 1 табл. три раза в день и 5-7 чашек чая, лучше нашего Живого Чая.
При дополнительных побочных действиях: тошнота, затруднённость дыхания, нарушения пищеварения, онемение в пальцах, тремор, головокружение, частое мочеиспускание, беспокойство, депрессия, сонливость – доза должна быть снижена до 10 мг/кг или прекращена на несколько дней, затем всё же желательно вернуться к дозе 25 мг/кг в день.
ПРОТИВОПОКАЗАНИЯ
Учеными замечено, что при других видах опухолей использование Дихлорацетата натрия приводило к ухудшению состояния. Причем, не просто вызывало побочные эффекты, а именно активизация онкологического процесса. В связи с этим существует ряд противопоказаний, а именно:
- Нарушение функций пищеварения;
- Высокая нагрузка на печень;
- Токсическое действие на нервную систему, вплоть, до появления полинейропатии, спутанности сознания, летаргии;
- Нарушение дыхания.
Хранить с плотно закрытой крышкой, в прохладном, защищенном от света месте.
Срок годности 3 года.
Мы готовы доставить Ваш заказ в любую страну и любой город, независимо от его размера.
Мы предлагаем следующие способы доставки:
- Доставка почтой России
- Курьерская доставка (до двери)
- Доставка транспортной компанией (СДЭК, Boxberry, ЦАП, Деловые Линии)
- Самовывоз по адресу г.Сочи, ул. Северная 6.
Мы рекомендуем доставку почтой России (наиболее экономный, но при этом быстрый вариант) или компанией СДЭК.
Обратите внимание, что у Почты России есть три тарифа: Обычная доставка, Ускоренная и EMS.
Ускоренная – на 80-100% дороже, в среднем посылка приходит на 2-3 дня быстрее.
EMS – доставка посылки до двери.
Вопросы по доставке вы можете задать по телефонам:
+7 (938) 467 78 06
+7 (928) 234 98 80
+7 (995) 003 74 85
Стоимость доставки
При заказе обычной доставки почты России у нас действует система скидок. Чем больше ваш заказ, тем ниже стоимость доставки. Обратите внимание, акция действует по только на территории РФ.
Сумма заказа
|
Сумма заказа |
Стоимость доставки |
|
До 800 рублей |
350 |
|
От 800 до 3500 рублей |
300 |
|
От 3500 до 6000 рублей |
250 |
|
От 6000 до 8000 рублей |
175 |
|
От 8000 до 11000 рублей |
100 |
|
От 11000 рублей |
Бесплатная доставка |
При ускоренной доставке Почты России, EMS или транспортной компании, Вы оплачиваете фактическую стоимость доставки. Она зависит от расстояния и размера заказа. Стоимость доставки рассчитает наш сотрудник, который с Вами свяжется.
Оплатить Ваш заказ можно следующими способами:
- Переводом на карту Сбербанка 4276 3000 5416 5108, владелец Геннадий Алексеевич Гарбузов. Платеж можно сделать с помощью приложения Сбербанк Online, через банкомат или в отделении Сбербанка (все варианты без комиссии). Или переводом с карты другого банка (размер комиссии уточняйте в вашем банке)
- Произвести оплату с вашей банковской карты при оформлении заказа (через сервис Robokassa)
- Произвести оплату с вашей банковской карты по выставленному счёту (через сервис Robokassa).
- Оплатить с помощью платёжных систем Золотая Корона (для жителей СНГ), Western Union и MoneyGram (для жителей дальнего зарубежья)
- Возможны иные способы оплаты по согласованию с вашим менеджером.
Обратите внимание! Заказы мы отправляем только по предоплате. Если Вам по какой-то причине это неудобно, мы готовы пойти на компромиссный вариант: Вы внесёте частичную небольшую предоплату, а остальную сумму оплатите при получении посылки.
Возврат и обмен товара
Возврат или обмен товара, который не подошел (не понравился), допускается, если с момента покупки прошло не более 7 дней (статья 26.1, пункт 4 ЗоЗПП) и он не входит в перечень товаров, не подлежащих возврату и обмену. Для проведения операции нужно позвонить по номеру +7(495)744-63-63 или отправить письмо на электронный адрес vitauct8@yandex.ru.
Обменять или вернуть товар можно в течение недели, если соблюдены условия:
- товар не использовался, не вскрывался;
- упаковка не повреждена;
- не нарушены технические, лечебные, другие свойства товара;
- сохранен товарный вид изделия;
- присутствуют ярлыки, пломбы;
- есть документация на продукцию, чек на покупку.
Обмен производится однократно на аналог такой же стоимости (без перерасчета) или на более дешевый/дорогой аналог с перерасчетом стоимости и возвратом/доплатой.
К сведению покупателей
При отказе от заказа Garbuzov.org обязуется вернуть уплаченную по договору сумму в течение 10 дней со дня предъявления требований по возврату, за исключением расходов на пересылку товара, которые оплачивает покупатель (статья 26.1). При ненадлежащем качестве продукции продавец берет на себя транспортные расходы в оба направления.
При 100 %-ной оплате заказ нужно получить до истечения срока хранения. Если заказчик не забирает посылку в установленные сроки хранения, товар возвращается отправителю. Транспортные расходы в этом случае оплачивает заказчик.
Подробную информацию можно узнать здесь.
Благодаря ученым из Университета Альберты в Канаде было изобретено средство, побеждающее раковую опухоль. Одолеть ее можно лишь активацией митохондрий, которые были подавлены болезнью. Изобретённый препарат «Дихлорацетат натрия», по утверждениям ученых, справляется с этой задачей и борется со многими типами рака.
Особую эффективность медикамента отмечают в борьбе с раком легких, отделов головного мозга и груди. Еще в 30-х годах ХХ века ученые пришли к выводу, что функциональные нарушения митохондрий клеток приводят к возникновению раковых опухолей. Митохондрии являются важнейшими органеллами живой клетки, и до недавнего времени ученые считали, что их разрушение — это не причина рака, а результат. Поэтому с 2005 года Мичелакис, который сомневался в этой гипотезе, начал тестовую работу над молекулами дихлорацетата натрия.
Лабораторные исследования препарата
Лабораторные испытания и тесты на животных показали, что лекарственное средство «Дихлорацетат натрия» является активатором фермента митохондрий, которые подавляются из-за возникших недугов независимо от типа онкологических заболеваний. Уменьшение раковых клеток достигается благодаря нормализации функций органелл. Препарат существенно отличается от химиотерапии тем, что не является токсичным и не воздействует угнетающе на здоровые клетки больного.
Профессор Мичелакис отмечает, что многопрофильность вещества, содержащегося в препарате, дает возможность бороться с большинством форм рака, за исключением сарком. Медикамент имеет влияние на онкологические образования, на которые нельзя воздействовать другими лекарствами. Вещество препарата не принадлежит ни одной из существующих фармацевтических компаний, поэтому медикамент не имеет патента. Это существенно сказывается на его ценовой доступности.
Лабораторные эксперименты показали, что препарат, оказывая уничтожающее действие на клетки злокачественной опухоли, не влияет при этом на здоровые части организма.
Когда начинать прием препарата?
Очень важно при лечении рака средство «Дихлорацетат натрия» принимать тогда, когда состояние организма еще удовлетворительное. Не стоит ждать прохождения нескольких курсов химиотерапии, которые оказывают существенные разрушения. К тому же раковые клетки имеют свойство вырабатывать иммунитет к химии. Это уже давно заметили медики. Первые несколько курсов химиотерапии действительно оказывают положительное влияние на протекание болезни, последующие же, наоборот, малоэффективны. Поэтому препарат нужно начинать принимать как можно раньше, даже совместно с курсами химии. Но дозировка должна составлять не более 15 мг на 1 кг веса.
Препарат «Дихлорацетат натрия»: состав
Состав лекарственного средства – натриевая соль дихлоруксусной кислоты. Соль находится в препарате в виде моногидрата, т. е. около 12% – кристаллизованная вода.
Ученые в настоящее время исследуют способы снижения токсичности рассматриваемого лекарственного средства и эффективность его в борьбе с раком.
Прием препарата
Это необходимо знать, если вы решили приобрести медикамент «Дихлорацетат натрия». Как принимать препарат для оказания помощи больному организму, ученые уже определили. Из расчета на 1 кг веса — по 25-50 мг в течение всего дня. Применение препарата в течение двух лет по 50 мг может вызвать периферическую невропатию, поэтому доза приема лекарственного средства была снижена до 25 мг, что способствовало прекращению неприятных явлений.
Если препарат при дозировке 25 мг на 1 кг веса вызывает нарушение пищеварения, тошноту, онемение в пальцах, затрудненность дыхания (также может спровоцировать депрессию, тремор, головокружение, сонливость, частое мочеиспускание, беспокойство), дозу необходимо снизить до 10 мг на 1 кг веса. Иногда рекомендуют вообще прекратить его прием на несколько дней. Затем снова необходимо вернуться к прежней дозировке – 25 мг на 1 кг веса в сутки. Отмечали случаи применения лимонной кислоты, которая оказывала снижение явлений периферической невропатии после приёма препарата «Дихлорацетат натрия». Инструкция по применению отмечает необходимость разбавлять рассматриваемый медикамент водой (100-150 мл). Это сделать несложно, так как лекарство имеет порошкообразную форму. Необходимо стараться избегать попадания препарата на кожу — он может вызвать раздражение.
Применение препарата при лизисе опухолей
Препарат может вызвать лизис злокачественной опухоли при острой лимфатической лейкемии, неходжкинской лимфоме, острой миелоцитической лейкемии, раке груди, клеточной карциноме, хронической лимфатической лейкемии, раке яичек, клеточной карциноме, медуллобластоме.
Лизисом злокачественной опухоли называется очень быстрый апоптоз раковых клеток (запрограммированная смерть), сопровождающийся резким ухудшением самочувствия (в исключительных случаях может вызвать летальный исход). В таких случаях необходимо сразу же прием препарата приостановить и проконсультироваться с врачом. Через несколько дней, возможно, разрешат возобновить применение препарата, при этом снизив дозу.
Данных о лекарственной несовместимости средства «Дихлорацетат натрия» с другими препаратами нет из-за его новизны (исключение – медикамент «Лазикс»).
Применение одновременно с кофеинизированными сортами чая, высокие дозы витамина В1, сочетание с лимонной кислотой, коэнзимом Q и альфа-липоидной кислотой добавляет эффективность препарату.
Эффективность препарата
Эффективность медикамента «Дихлорацетат натрия» зависит от некоторых факторов. Существенно снижает его лечебные свойства плохое состояние пациента. Например, когда у него из-за болезни затронуты жизненно важные органы, или разрушение произошло под воздействием химиотерапии. Также не рекомендуют применение средства, если больной не встает, постоянно испытывает боли, принимает наркотики.
Снижает эффективность препарата и сильное поражение недугом печени. Когда она не может справляться с погибшими раковыми клетками и продуктами распада, попадающими в кровь, ситуация усложняется.
При низкой дозировке эффективность препарата невысокая, при большой дозе результат становится заметнее. Но есть некоторые факторы риска. При большой дозировке может случиться так, что с продуктами распада опухоли печень не справится. Это вызовет интоксикацию организма, появление тошноты и рвоты. Поэтому дозировку нужно подбирать правильно.
Где приобрести?
Что делать, если кому-то необходимо приобрести препарат «Дихлорацетат натрия»? Где купить? Выпускается рассматриваемое лекарство в Канаде, поэтому можно заказать его, используя интернет-ресурсы, у производителей. Также существует возможность приобрести препарат у продавцов в России, закупающих его в Канаде. Цена на медикамент невысока, поэтому купить его могут позволить себе пациенты, принадлежащие к разным социальным слоям.
Отзывы о препарате
Положительный эффект лекарственного средства «Дихлорацетат натрия», отзывы о котором подтверждают его, прослеживается у многих больных раком. Препарат применяли одновременно и с курсом химеотерапии, и с иными лекарствами, что не снизило его эффективность.
Некоторые врачи не верили в выздоровление своих пациентов. Они были удивлены, когда больные шли на поправку. Многие отмечают отсутствие побочных эффектов при приеме препарата.
Отзывов отрицательных очень мало. Все они указывают на неэффективность медикамента «Дихлорацетат натрия». Что это? Известно, что некоторым пациентам препарат не помог избавиться от недуга. Некоторые люди отмечали появление рецидива болезни.
Как проверить подлинность препарата
На подлинность препарата «Дихлорацетат натрия» указывают некоторые факторы: он состоит из белых кристаллов, горьковатых на вкус. Если цвет кристаллов желтоватый, то медикамент имеет низкое качество, и применять его не рекомендуется. При растворении препарата в воде он не должен терять свой горьковатый вкус. Если разбавленный до кашицы порошок периодически наносить на кожу предплечья или внутреннюю поверхность плеча с интервалом в 1 минуту в течение 10 минут, то через какое-то время образуется малозаметное с окантовкой пятно. А через 5-10 часов это пятно станет более красным и четким. Спустя несколько дней на этом месте кожа может начать шелушиться.
Данный способ проверки рекомендуют использовать в крайнем случае: при добавлении в порошок серной кислоты, применяемой для аккумуляторов машин, произойдет реакция с выделением тепла и запаха дихлоруксусной кислоты. Само лекарство практически не имеет запаха. Чем выше качество препарата, тем меньше его запах. Если попробовать на вкус порошок, то он вызовет онемение, прохладу и вяжущий эффект.
Listen to this article
📖 15 mins.
Федорчук А.Г., Пясковская О.Н., Горбик Г.В., Прохорова И.В., Колесник Д.Л., Соляник Г.И
1Институтэкспериментальной патологии, онкологии и радиобиологии имениР.Е. Кавецкого НАН Украины, Киев 03022, Украина.
Корреспонденция: [email protected]
Поступила: 17 мая 2016 г
Аннотация
История вопроса: Противоопухолевое действие дихлорацетата натрия (ДХА) может быть связано с его способностью активировать окислительное фосфорилирование, что приводит к усиленной генерации реактивных форм кислорода и индукции апоптоза. С другой стороны, активация окислительного фосфорилирования может способствовать выживанию опухолевых клеток, в частности, за счет увеличения синтеза АТФ. Такие неоднозначные эффекты ДКА могут влиять на его противораковую эффективность, зависящую от биологических свойств опухоли, графика введения ДКА и его дозы. Целью исследования был анализ противоопухолевого действия ДКА против глиомы С6 у крыс в условиях различных графиков его введения и различных дозировок.
Материалы и методы: Исследование проводилось на крысах Вистар с интрацеребрально трансплантированными клетками глиомы С6. Терапия ДКА проводилась следующим образом: ежедневно в течение 6 дней, начиная со второго дня после трансплантации опухолевых клеток (график І) или 7(го) дня (график ІІ) в дозе 1,0 г/кг, или ежедневно в течение 13 дней, начиная со второго дня в дозах 1,0; 1,5 или 4,5 г/кг (график ІІІ). Влияние гипоксии на противораковый эффект ДКА изучали с помощью гипоксических камер, в которых содержание кислорода поддерживалось на уровне 12,5-13% в течение 3 ч после введения ДКА крысам с глиомой С6. Состояние компонентов электронно-транспортной цепи митохондрий в опухолевых клетках изучали с помощью электронного парамагнитного резонанса.
Результаты: Показано, что терапия ДКА по схеме I приводила к снижению продолжительности жизни животных на 15% (LS; < 0,05), в то время как применение схемы II не оказывало влияния на этот показатель. Длительное введение ДКА (график ІІІ) приводило к значительному противоопухолевому эффекту и увеличивало ДЖ крыс на 25,5% (p < 0,05). В условиях гипоксии лечение ДКА приводило к значительному увеличению СЖ животных на 15-22%. Дозировка DCA оказывала умеренный эффект противоракового действия. Максимальный эффект, увеличение СЖ на 34,5% (p < 0,05), был обнаружен при дозе 1,5 г/кг. Показано, что противораковая активность ДКА при всех изученных условиях не связана с его влиянием на функциональное состояние митохондрий опухолевых клеток.
Выводы: Противораковый эффект ДКА существенно зависит от графика его введения; будучи введенным в одинаковой общей дозе, но в зависимости от графика ДКА может вызывать неоднозначные эффекты, варьирующие от стимуляции роста опухоли до значительной противораковой активности. В гипоксических условиях противораковая эффективность ДКА против глиомы С6 значительно усиливается.
Ключевые слова: дихлорацетат натрия, глиома С6, митохондриальная электронно-транспортная цепь.
Используемые сокращения: DCA — дихлорацетат натрия; EPR — электронный парамагнитный резонанс; LS — продолжительность жизни; MtETC — митохондриальная электронно-транспортная цепь; PDH — киназа пируватдегидрогеназы; ROS — реактивные виды кислорода.
ВВЕДЕНИЕ
Согласно статистике Всемирной организации здравоохранения, средний уровень заболеваемости опухолями головного мозга составляет 10,9-12,8 на 100 000 населения [1]. Около 60% всех опухолей центральной нервной системы составляют злокачественные новообразования, среди которых глиомы составляют до 50-55%. По статистическим данным, глиомы составляют всего 1,4% от всех клинически диагностированных опухолей, но прогноз для больных глиомами самый неблагоприятный. Средняя продолжительность выживания пациентов со злокачественной глиомой после ее первичной диагностики составляет около 8 месяцев в Украине и 14 месяцев в США [2]. Именно поэтому терапия пациентов с глиомами различной степени злокачественности относится к числу наиболее важных проблем современной клинической онкологии.
Несмотря на разработку многочисленных новых противоопухолевых средств, в настоящее время основным подходом к терапии больных глиомами остается «терапия отчаяния», то есть хирургическое вмешательство, однако его эффективность недостаточно низка [3, 4]. Предполагается, что неэффективность радикального удаления глиом во многом обусловлена инвазией опухоли в нормальные окружающие ткани, при этом значительно уменьшается образование недискретных краев.
Современные протоколы радиотерапии злокачественных глиом рекомендуют фракционированное облучение с низкими суточными дозами (> 2 Гр), с общей дозой 60-90 Гр [5]. Однако даже современные методы облучения не смогли помочь преодолеть крайне низкую эффективность терапии, обусловленную высокой радиорезистентностью глиомы, вызванной развитием локальной гипоксии [6].
Химиотерапевтические препараты (в том числе таргетные) малоэффективны при глиомах из-за их плохой биодоступности [7-10]. Например, в большинстве случаев анализ биоптатов злокачественной глиомы свидетельствует о наличии дефектного, но функционального гематоэнцефалического барьера, который препятствует прохождению многих таргетных препаратов (особенно антител против факторов роста и рецепторов). Для лечения злокачественной глиомы используется только один алкилирующий цитостатический препарат — темозоломид. Следует отметить, что ответ на терапию темозоломидом может наблюдаться только у 5-8% пациентов при монотерапии и примерно у 20% пациентов при адъювантной терапии темозоломидом в сочетании с радиотерапией или хирургическим лечением [11, 12].
Известно, что в значительной части злокачественных опухолей АТФ образуется путем гликолиза даже в присутствии кислорода (эффект Варбурга). Аэробный гликолиз является малоэффективным способом генерации АТФ, но он поддерживает высокий пролиферативный потенциал опухолевых клеток и способствует их выживанию, снижая риск образования апоптотических стимулов [13, 14]. Поэтому в последние годы метаболизм опухоли, обеспечивающий эти преимущества роста, рассматривается как новая мишень для противораковой терапии, а соединения, способные ингибировать гликолиз в опухолевых клетках, изучаются как потенциально эффективные противораковые агенты [15-17]. Среди антиметаболических агентов, активных в отношении многих типов раковых клеток, можно упомянуть дихлорацетат натрия (ДХА) [18-20].
DCA ингибирует киназу пируватдегидрогеназы (PDH), что приводит к непрямой активации ферментов комплекса PDH и, следовательно, к сдвигу клеточного метаболизма от гликолиза в сторону окислительного фосфорилирования. В случае активации окислительного фосфорилирования и снижения интенсивности гликолиза при действии DCA можно ожидать торможения пролиферации опухолевых клеток, обусловленного, в частности, значительным снижением содержания метаболитов пентозофосфатного обхода и пирувата, важных для синтеза белков и нуклеиновых кислот. DCA-индуцированная активация митохондриального метаболизма может приводить к блокированию пролиферации опухолевых клеток, усилению генерации реактивных форм кислорода (ROS) и индукции апоптоза. Однако, несмотря на теоретическую очевидность противоракового действия DCA, его эффективность не гарантирована. Как было показано [21], в широком диапазоне концентраций DCA оказывает цитостатическое, но не цитотоксическое действие, что подтверждается данными об отсутствии его влияния на внутриклеточный уровень ROS, скорость образования лактата и скорость апоптоза в клетках глиомы С6.
Кроме того, необходимо отметить, что DCA-индуцированная активация окислительного фосфорилирования может приводить не только к противоопухолевому эффекту, но и способствовать выживанию опухолевых клеток за счет увеличения синтеза АТФ. Такое амбивалентное влияние на выживание опухолевых клеток предопределяет вариабельность активности DCA [22, 23]. Биологические свойства опухоли, график введения DCA и его дозы могут существенно влиять на его противоопухолевую эффективность.
Целью исследования был анализ противоопухолевой эффективности ДКА против глиомы С6 у крыс в условиях различных графиков его введения и дозирования.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на самках крыс Вистар в возрасте 2,5-3 месяцев весом 90-150 г, выращенных в животноводческом комплексе Института экспериментальной патологии, онкологии и радиобиологии имени Р.Е. Кавецкого Национальной академии наук Украины (ИЭПОР). Использование и уход за экспериментальными животными осуществлялись в соответствии со стандартными международными правилами биологической этики и были одобрены Institutional Animal Care and Use Committee. Линия клеток глиомы С6 была получена из Национального банка клеточных линий и опухолевых штаммов ИЕПОР.
Клетки глиомы С6 культивировали in vitro в культуральной среде DMEM, дополненной 10% FBS (Sigma, США), 2 мМ L-глутамина и 40 мг/мл гентамицина при 37 °С в увлажненной атмосфере с 5% СО2. Трансплантацию клеток глиомы С6 проводили под тотальной анестезией путем интрацеребральной инокуляции 0,6-106 клеток в 0,05 мл физиологического раствора в левую теменную область (передний рог левого бокового желудочка).
Водный раствор DCA (Sigma-Aldrich, США) вводили ежедневно per os через зонд в объеме 3 мл на животное. Терапия DCA проводилась по разным схемам и в разных дозах следующим образом:
- график І — DCA вводили ежедневно в течение 6 дней, начиная со второго дня после трансплантации опухолевых клеток, в общей дозе 1,0 г/кг;
- график ІІІ — DCA вводили ежедневно в течение 6 дней, начиная с7-го дня после трансплантации опухолевых клеток, в общей дозе 1,0 г/кг;
- схема ІІІ — DCA вводили ежедневно в течение 13 дней, начиная со второго дня, в общей дозе 1,0; 1,5 или 4,5 г/кг.
Все животные из соответствующих контрольных групп получали 3,0 мл воды для инъекций по графикам введения ДКА. В каждой группе было по 13-15 крыс.
На 14-й день после инокуляции опухолевых клеток 4-5 крыс из каждой группы были принесены в жертву под эфирным наркозом, была собрана кровь; ткань мозга была взята для дальнейшего исследования.
Изменение времени выживания (ВПВ) оставшихся животных служило показателем противоопухолевого эффекта лечения, который рассчитывали по формуле:
CST (%) = 100 (ST — STC)/STC,
где ST и STС — время выживания крыс из экспериментальной и контрольной групп, соответственно.
Влияние гипоксии (ингибитора окислительного фосфорилирования) на противоопухолевый эффект ДКА изучали с помощью гипоксических камер, в которых содержание кислорода поддерживалось на уровне 12,5-13% в течение 3 ч после введения ДКА крысам с глиомой С6. Содержание кислорода в гипоксических камерах контролировали с помощью оксиметра ISO2 (World Precision Instruments, США). Противораковый эффект лечения оценивали по увеличению времени выживания животных с глиомой С6.
Изменение состояния компонентов митохондриальной электронно-транспортной цепи (МТЭТЦ) в опухолевых клетках анализировали с помощью метода электронного парамагнитного резонанса. Анализ образцов методом электронного парамагнитного резонанса (ЭПР) проводили при 77 К на спектрофотометре Е-109 Varian (США). По данным ЭПР-спектроскопии определяли уровни восстановленных негемовых железо-серных (Fe-S) центров (g = 1,94) белков MtETC, нитрозильных (NO) комплексов гемового железа (gсер = 2,01) и нитрозильных комплексов Fe-S (gсер = 2,03).
Статистический анализ данных проводили описательными методами, корреляционным анализом, нелинейным регрессионным анализом, t-тестом Стьюдента и U-тестом Манна — Уитни с использованием программ Microsoft Excel, Microcal Origin и Statistica. Данные представлены в виде M ± m.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследования показали, что эффективность DCA против глиомы С6 зависит от графика введения и значительно повышается, если животные находятся в гипоксических условиях в течение 3 ч после введения препарата.
Как видно (табл. 1), терапия ДКА по схеме I привела к снижению продолжительности жизни животных на 15% (LS; р < 0,05). При применении схемы II, отличающейся от схемы I более поздними сроками начала лечения, влияния на ЖС экспериментальных животных не наблюдалось. Длительное применение ДКА (график ІІІ) привело к значительному противоопухолевому эффекту и увеличению СЖ крыс на 25,5% (р < 0,05).
Обычно в доклинических исследованиях эффективность противоопухолевых средств, введение которых начинается на фоне уже развившейся опухоли (7-10-й дни после инокуляции опухолевых клеток), ниже по сравнению с тем, если такие средства вводятся в более ранние сроки (2-й день после инокуляции опухолевых клеток). Однако наши данные продемонстрировали обратную картину: эффективность DCA выше против развитой опухоли. Известно, что для развитой опухоли характерно развитие внутриопухолевой гипоксии. Увеличение СЖ крыс с глиомой С6 после длительного введения ДКА на фоне развитой опухоли может быть связано с развитием внутриопухолевой гипоксии, поскольку ДКА-индуцированная активация окислительного фосфорилирования в условиях дефицита кислорода значительно снижает синтез АТФ и, следовательно, может привести к гибели опухолевых клеток. Это предположение согласуется с результатами исследования, в котором анализировалось влияние гипоксии на эффективность цитотоксического/цитостатического действия DCA против клеток глиомы С6 in vitro. Как было показано [21], значительное усиление цитотоксического действия ДКА на клетки глиомы С6 в условиях гипоксии (трехкратное снижение IC50 ДКА по сравнению с нормоксическими условиями культивирования) определялось высоким уровнем ДКА-индуцированного некроза клеток.
Введение DCA в гипоксических условиях приводило к значительному усилению его противоракового эффекта. В частности, при введении по схеме I ДКА в гипоксических условиях не оказывал влияния на СЖ экспериментальных животных, в то время как в отсутствие гипоксии такая терапия стимулировала опухолевый процесс и вызывала снижение СЖ на 15%. При введении ДКА по схеме II в гипоксических условиях ДКА значительно пролонгировал СЖ крыс на 22% по сравнению с животными, получавшими ДКА в условиях нормоксии (табл. 1). Однако необходимо отметить, что значительная вариабельность противоглиомного действия ДКА при различных схемах его введения наблюдалась как в условиях гипоксии, так и нормоксии.
| Вид терапии | График введения ДКА | График введения DCA | График введения ДКА | Изменение СЖ, % |
| Количество | Начало (день) | Продолжительность лечения (дни) | ||
| ДКА | І | 2-й | 6 | -15.0 |
| DCA | ІІ | 7-й | 6 | 0 |
| DCA | ІІІ | 2-й | 13 | 25.5 |
| ДКА + гипоксия | І | 2-й | 6 | 0 |
| ДКА + гипоксия | ІІ | 7-й | 6 | 22 |
Среди возможных механизмов противоракового действия ингибиторов энергетического метаболизма опухолевых клеток, в том числе ДКА, можно отметить способность этих агентов оказывать повреждающее действие на функциональное состояние МТЭЦ в опухолевых клетках через активацию окислительного фосфорилирования, гипоксию и возможную дефектность митохондриальной системы. Поэтому мы изучили влияние DCA на функциональное состояние МТЭЦ с помощью ЭПР-спектроскопии.
Высокая инвазивность глиомы затрудняет точное разделение опухолевой и нормальной тканей. Поэтому для приготовления образцов ЭПР мы использовали ткань полушария головного мозга с опухолью, а для сравнения — ткань полушария головного мозга без опухоли.
В качестве показателей функционального состояния МТЭЦ использовали уровни NO-комплексов митохондриального гемового железа (что отражает повреждающее действие РОС и азота на ЭТЦ), а также содержание Fe-S центров, непосредственно отражающих функциональное состояние этой энергетической системы.
Анализ влияния ДКА в условиях нормоксии и гипоксии на функциональное состояние МТЭЦ в клетках глиомы С6 выявил отсутствие корреляции между функциональным состоянием МТЭЦ и уровнем жизни экспериментальных животных (табл. 2).
Как видно из таблицы 2, введение ДКА по всем схемам в условиях нормоксии и гипоксии не влияло на уровни Fe-S центров в полушарии головного мозга с глиомой С6 даже на фоне значительного (более 46,7%) повышения уровня нитрозилирования белков гема, зарегистрированного после введения ДКА в нормоксических условиях. Предполагается, что снижение содержания Fe-S центров в опухолевой ткани характеризует нарушение работы МТЭТК, приводящее к гибели опухолевых клеток. Неизменное содержание Fe-S центров указывало на то, что противоопухолевое действие ДКА не связано с его влиянием на функциональное состояние митохондрий в клетках глиомы С6.
| Группа животных | Полушарие головного мозга с глиомой | ||
| Расписание І | Расписание ІІ | Расписание ІІІ | |
| Интенсивность сигнала ЭПР для комплексов NO-гема (г = 2,01; а.е.) | |||
| Контроль | 100.0 ± 2.9 | 100.0 ± 6.5 | 100.0 ± 1.4 |
| DCA | 153.1 ± 21.7* | 146.7 ± 13.0* | 152.4 ± 20.8* |
| ДКА + гипоксия | 87.4 ± 14.3 | 148.4 ± 9.8* | 103.6 ± 10.7 |
| Интенсивность сигнала ЭПР для Fe-S центров (g=1,94; а.е.) | |||
| Контроль | 100.0 ± 40.4 | 100.0 ± 19.1 | 100.0 ± 28.9 |
| DCA | 97.5 ± 17.4 | 112.4 ± 23.0 | 83.3 ± 19.2 |
| ДКА + гипоксия | 100.6 ± 37.3 | 115.1 ± 40.0 | 108.3 ± 16.0 |
Примечание: *p < 0,05, различия значимы по сравнению со значением для контроля.
В отличие от образцов ткани мозга с глиомой, содержание NO-гемовых комплексов в нормальной ткани мозга после введения ДКА по графикам І и ІІІ значительно снижалось более чем на 17% в условиях нормоксии и гипоксии (табл. 3). Однако уровень Fe-S центров в нормальной ткани мозга оставался неизменным.
| Группа животных | Полушарие головного мозга без глиомы | ||
| Расписание І | Расписание ІІ | Расписание ІІІ | |
| Интенсивность сигнала ЭПР для комплексов NO-гема (г = 2,01; а.е.) | |||
| Контроль | 100.0 ± 3.4 | 100.0 ± 4.3 | 100.0 ± 2.7 |
| DCA | 82.8 ± 3.4* | 119.6 ± 2.9* | 82.9 ± 3.6* |
| ДКА + гипоксия | 72.1 ± 9.9* | 123.0 ± 9.1 | 56.8 ± 20.4* |
| Интенсивность сигнала ЭПР для Fe-S центров (g = 1,94; а.е.) | |||
| Контроль | 100.0 ± 34.0 | 100.0 ± 5.3 | 100.0 ± 20.0 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| ДКА + гипоксия | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Примечание: *p < 0,05, различия значимы по сравнению со значением для контроля.
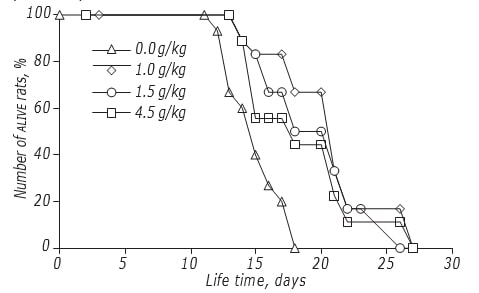
Исследование эффектов дозирования DCA на СЖ крыс проводилось по графику с наибольшей противораковой эффективностью. Было показано, что доза DCA умеренно влияла на эффективность его противоглиомного действия (рис., табл. 4). Максимальный эффект был зарегистрирован при введении DCA в дозе 1,5 г/кг: СЖ экспериментальных животных увеличилась на 34,5% (p < 0,05). Повышение дозы ДКА до 4,5 г/кг не привело к дальнейшему росту его эффективности: СЖ крыс было достоверно выше, чем у контрольных животных, не получавших ДКА, но не отличалось от такового у животных, получавших дозу 1,0 г/кг.
Анализ эффектов ДКА при его длительном применении в различных дозах не выявил существенных изменений в уровнях нитрозилирования белков гема и содержания Fe-S центров в клетках полушария головного мозга с глиомой (табл. 5) и нормальной ткани мозга (табл. 6).
| Общая доза, г/кг |
График введения | Начало (день) | Продолжительность терапии (дни) | Изменение СЖ, % |
|---|---|---|---|---|
| 1.0 | III | 2-й | 13 | +25.5 |
| 1.5 | III | 2-й | 13 | +34.5 |
.
| Группа животных | Полушарие головного мозга с глиомой | ||
| DІ | D2 | D3 | |
| Интенсивность сигнала ЭПР для комплексов NO-гема (г = 2,01; а.е.) | |||
| Контроль | 100.0 ± 1.4 | 100.0 ± 3.5 | 100.0 ± 3.5 |
| DCA | 152.4 ± 20.8* | 93.1 ± 13.0 | 103.0 ± 3.1 |
| Интенсивность сигнала ЭПР для Fe-S центров (g=1,94; а.е.) | |||
| Контроль | 100.0 ± 28.9 | 100.0 ± 5.5 | 100.0 ± 5.5 |
| DCA | 83.3 ± 19.2 | 88.1 ± 12.1 | 101.2 ± 10.6 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| ДКА + гипоксия | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Примечание: *p < 0,05, различия значительны по сравнению со значением для контроля.
.
| Группа животных | Полушарие головного мозга без глиомы | ||
| DІ | D2 | D3 | |
| Интенсивность сигнала ЭПР для комплексов NO-гема (г = 2,01; а.е.) | |||
| Контроль | 100.0 ± 2.7 | 100.0 ± 13.0 | 100.0 ± 13.0 |
| DCA | 82.9 ± 3.6* | 94.2 ± 2.7 | 79.4 ± 5.4 |
| Интенсивность сигнала ЭПР для Fe-S центров (g = 1,94; а.е.) | |||
| Контроль | 100.0 ± 20.0 | 100.0 ± 15.5 | 100.0 ± 15.5 |
| DCA | 101.3 ± 28.1 | 118.6 ± 3.6 | 102.4 ± 6.9 |
Примечание: *p < 0,05, различия значительны по сравнению со значением для контроля.
.
Отсутствие подобных изменений наряду с высокой противораковой эффективностью ДКА (особенно в дозе 1,5 г/кг) еще раз продемонстрировало, что действие ДКА против глиомы С6 не связано с функциональным состоянием митохондрий опухолевых клеток.
В заключение следует отметить, что результаты нашего исследования показали, что противораковая эффективность ДКА существенно зависит от графика его введения, при котором она варьирует от значительного снижения СЖ, прямо коррелирующего со стимуляцией роста опухоли, до значительного противоракового эффекта и увеличения СЖ крыс на 25,5%. Длительное метрономическое введение DCA обеспечивает лучшую противораковую эффективность с низкой вариабельностью между дозами. Также было продемонстрировано, что гипоксические условия содержания животных значительно повышают противоглиомную эффективность DCA. Наряду с этим, противораковая активность данного препарата не связана с его влиянием на функциональное состояние митохондрий опухолевых клеток.
ССЫЛКИ
1 Weller M, Wick W, Aldape K, et al. Glioma. Nat Rev Dis Primers 2015; 1: 15017. doi: 10.1038/nrdp.2015.17.
2 Zozulya YuA, Vasil’ev IG, Glavacky AYa, et al. Brain gliomas. Современное состояние проблемы и направления дальнейших исследований. Зозуля Ю.А., ред. Киев: ЭксОб, 2007. 631 с. (на русском языке).
3 Aghi MK, Nahed BV, Sloan AE, et al. The role of surgery in the management of patients with diffuse low grade glioma: Систематический обзор и основанное на доказательствах руководство по клинической практике. J Neurooncol 2015; 125: 503-30.
4 Hervey-Jumper SL, Berger MS. Технические нюансы хирургии опухолей мозга в бодрствующем состоянии и роль максимально безопасной резекции. J Neurosurg Sci 2015; 59: 351-60.
5 Laperriere N, Zuraw L, Cairncross G. Радиотерапия при недавно диагностированной злокачественной глиоме у взрослых: систематический обзор. Radiother Oncol 2002; 64: 259-73.
6 Ryken TC, Parney I, Buatti J, et al. The role of radiotherapy in the management of patients with diffuse low grade glioma: Систематический обзор и основанное на доказательствах руководство по клинической практике. J Neurooncol 2015; 125: 551-83.
7 Norden AD, Drappatz J, Wen PY. Novel anti-angiogenic therapies for malignant gliomas. Lancet Neurol 2008; 7: 1152-60.
8 Huang TT, Sarkaria SM, Cloughesy TF, Mischel PS. Таргетная терапия для пациентов со злокачественными глиомами: извлеченные уроки и дальнейший путь. J Neurother 2009; 6: 500-12.
9 Staedtke V, Bai RY, Laterra J. Investigational new drugs for brain cancer. Expert Opin Investig Drugs 2016; 17: 1-20.
10 Kang JH, Adamson C. Новые химиотерапевтические препараты и другие виды терапии для лечения глиомы высокой степени злокачественности. Expert Opin Investig Drugs 2015; 24: 1361-79.
11 Baritchii A, Jurj A, Soritau O, et al. Sensitizer drugs for the treatment of temozolomide-resistant glioblastoma. J BUON 2016; 21: 199-207.
12 Mallick S, Gandhi AK, Rath GK. Терапевтический подход за пределами обычного темозоломида при недавно диагностированной глиобластоме: Обзор современных доказательств и будущее направление. Indian J Med Paediatr Oncol 2015; 36: 229-37.
13 Gatenby RA, Gillies RJ. Почему у раковых опухолей высокий аэробный гликолиз? Nat Rev Cancer 2004; 4: 891-9.
14 Kim JW, Dang CV. Многогранная роль гликолитических ферментов. Trends Biochem Sci 2005; 30: 142-50.
15 Jin S, DiPaola RS, Mathew R, White E. Метаболическая катастрофа как средство для гибели раковых клеток. J Cell Sci 2007; 3: 379-83.
16 Seyfried TN, Kiebish MA, Marsh J. Metabolic management of brain cancer. Biochim Biophys Acta 2011; 6: 577-94.
17 Decollogne S, Dilda PJ, Hau E, et al. Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 2015; 34: 14.
18 Kankotia S, Stacpoole PW. Дихлорацетат и рак: новый дом для сиротского препарата? Biochim Biophys Acta 2014; 1846: 617-29.
19 Stacpoole PW. The dichloroacetate dilemma: environmental hazard versus therapeutic goldmine — both or neither? Environ Health Perspect 2011; 119: 155-8.
20 Michelakis ED, Webster L, Mackey JR. Дихлорацетат (DCA) как потенциальная метаболическая таргетная терапия рака. Br J Cancer 2008; 99: 989-94.
21 Kolesnik DL, Pyaskovskaya ON, Boichuk IV, Solyanik GI. Гипоксия усиливает противоопухолевую активность дихлорацетата. Exp Oncol 2014; 36: 231-5.
22 James MO, Stacpoole PW. Фармакогенетические соображения при дозировании дихлорацетата. Pharmacogenomics 2016; doi:10.2217/pgs-2015-0012.
23 Dunbar EM, Coats BS, Shroads AL, et al. Фаза 1 исследования дихлорацетата (DCA) у взрослых с рецидивирующими злокачественными опухолями мозга. Invest New Drugs 2014; 32: 452-64.
1. Васляева С. Н., Люсов В. А., Цыганкова О. В., Гордеев И. Г., Волов Н. А. Безболевая ишемия миокарда: патогенетические и патофизиологические механизмы. Традиционные и метаболические аспекты терапии // Российский кардиологический журнал. – 2004. – № 4(48). – С. 74-83.
2. Мануйлов А. М., Попов К. А., Цымбалюк И. Ю., Литвинова М. Г., Хубиева Ф. У. Шестопалов А. В. Биологическая активность дихлорацетата натрия: концепции и механизмы (обзор литературы) // Кубанский научный медицинский вестник. – 2016. – № 6 (161). – С. 156–163.
3. Сорокіна Л., Бiлюк А., Хижняк С. Вплив натрій дихлорацетату на перебіг проокисно- антиоксидантних процесів в організмі мишей з саркомою 37 // Бiологiя. – 2011. – Випуск 57. – С. 35–37.
4. Сорокіна Л. В., Хижняк С. В., Дiденко Г. В., Степанова Л. I., Капля О. А. Структурний стан клітинних мембран саркоми 37 в динаміці росту // Фiзика живого. – 2010. – Т. 18. № 3. – С. 83–88.
5. Archer S. L., Weir E. K., Wilkins M. R. The basic science of pulmonary arterial hypertension for clinicians: new concepts and experimental therapies // Circulation. – 2010. – Vol. 121. № 18. – P. 2045–2066.
6. Barsan W. G. Treatment of cerebral ischemia with dichloroacetate // United States Patent Number: 4,631,294. – Date of Patent: Dec. 23, 1986. – Appl. No.: 752,091. – Filed: Jul. 5, 1985.
7. Bonnet S., Archer S. L., Allalunis-Turner J., Haromy A., Beaulieu C., Thompson R. et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth // Cancer Cell. – 2007. – Vol. 11. № 1. – P. 37–51.
8. Brandsma D., Dorlo T. P., Haanen J. H., Beijnen J. H., Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate // Journal of Neurology. – 2010. – Vol. 257. № 12. – P. 2099–2100.
9. Cao W., Yacoub S., Shiverick K. T., Namiki K., Sakai Y., Porvasnik S. et al. Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation // The Prostate. – 2008. – Vol. 68. № 11. – P. 1223–1231.
10. De Stefano N., Matthews P. M., Ford B. et al. Short-term dichloroacetate treatment improves indices of cerebral metabolism in patients with mitochondrial disorders // Neurology. – 1995. – Vol.45. № 6. – P. 1193–1198.
11. Dhar S., Lippard S. J. Mitaplatin, a potent fusion of cisplatin and the orphan drug dichloroacetate // Proceedings of the National Academy of Sciences of the United States of America. – 2009. – Vol. 106. № 52. – P. 22199–22204.
12. Duncan G. E., Perkins L. A., Theriaque D. W., Neiberger R. E., Stacpoole P. W. Dichloroacetate therapy attenuates the blood lactate response to submaximal exercise in patients with defects in mitochondrial energy metabolism // The Journal of Clinical Endocrinology & Metabolism. – 2004. – Vol. 89. № 4. – P. 1733– 1738.
13. Fereidoonnezhad M., Faghih Z., Mojaddami A., Tabaei S. M. H., Rezaei Z. Novel approach synthesis, molecular docking and cytotoxic activity evaluation of N-phenyl-2,2- dichloroacetamide derivatives as anticancer agents // Journal of Sciences, Islamic Republic of Iran. – 2016. – Vol. 27. № 1. – P. 39–49.
14. Fiebiger W., Olszewski U., Ulsperger E., Geissler K., Hamilton G. In vitro cytotoxicity of novel platinum-based drugs and dichloroacetate against lung carcinoid cell lines // Clinical & translational oncology. – 2011. – Vol. 13. № 1. – P. 43–49.
15. Flavin D. Medullary thyroid carcinoma relapse reversed with dichloroacetate: a case report // Oncology Letters. – 2010. – Vol. 1. № 5. – P. 889–891.
16. Heshe D., Hoogestraat S., Brauckmann C., Karst U., Boos J., Lanvers-Kaminsky C. Dichloroacetate metabolically targeted therapy defeats cytotoxicity of standard anticancer drugs // Cancer Chemotherapy and Pharmacology. – 2011. – Vol. 67. № 3. – P. 647–655.
17. Ishiguro T., Ishiguro R., Ishiguro M., Iwai S. Co-treatment of dichloroacetate and omeprazole dramatically reduced the pain of pancreatic and bile duct cancer; possible blockade of their invasion // Abdominal Oncology. – 2013. – Vol. 1. – P. 1–4.
18. Ishiguro T., Ishiguro R., Ishiguro M., Iwai S. Co-treatment of dichloroacetate, omeprazole and tamoxifen exhibited synergistically antiproliferative effect on malignant tumors: in vivo experiments and a case report // Hepatogastroenterology. – 2012. – Vol. 59. № 116. – P. 994–996.
19. Jung G. -S., Jeon J. -H., Choi Y. -K., Jang S. Y., Park S. Y., Kim S. -W., Byun J. -K., Kim M. -K., Lee S., Shin E. -C., Lee I. -K., Kang Y. N., Park K. -G. Pyruvate dehydrogenase kinase regulates hepatitis C virus replication // Scientific Reports. – 2016. – Vol. 6. – Article number 30846.
20. Kaufmann P., Engelstad K., Wei Y., Jhung S., Sano M. C., Shungu D. C. et al. Dichloroacetate causes toxic neuropathy in MELAS: a randomized, controlled clinical trial // Neurology. – 2006. – Vol. 66. № 3. – P. 324–330.
21. Khan A. Case report of long term complete remission of metastatic renal squamous cell carcinoma after palliative radiotherapy and adjuvant dichloroacetate // Advances in Cancer: Research & Treatment. – 2012. – Vol. 2012. – Article ID 441895.
22. Khan A. Use of oral dichloroacetate for palliation of leg pain arising from metastatic poorly differentiated carcinoma: a case report // Journal of Palliative Medicine. – 2011. – Vol. 14. № 8. – P. 973–977.
23. Kinnaird A., Dromparis P., Haromy A., Bowers L., Hashimoto K., Sutendra G. et al. Dichloroacetate is a novel therapy for renal cell carcinoma // The Journal of Urology. – 2012. – Vol. 187. № 4. – P. e120–e121.
24. Kinnaird A., Dromparis P., Saleme B., Gurtu V., Watson K., Paulin R., Zervopoulos S., Stenson T., Sutendra G., Pink D. B., Carmine-Simmen K., Moore R., Lewis J. D., Michelakis E. D. Metabolic modulation of clear-cell renal cell carcinoma with dichloroacetate, an inhibitor of pyruvate dehydrogenase kinase // European Urology. – 2016. – Vol. 69. № 4. – P. 734–744.
25. Kluza J., Corazao-Rozas P., Touil Y., Jendoubi M., Maire C., Guerreschi P. et al. Inactivation of the HIF-1alpha/ PDK3 signaling axis drives melanoma toward mitochondrial oxidative metabolism and potentiates the therapeutic activity of pro-oxidants // Cancer Research. – 2012. – Vol. 72. № 19. – P. 5035–5047.
26. Kwitniewski M., Moan J., Juzeniene A. Metabolic-targeted therapy with dichloroacetate (DCA): a novel treatment strategy to improve the outcome of photodynamic therapy // Photochemical & Photobiological Sciences. – 2011. – Vol. 10. № 1. – P. 25–28.
27. Li T., Schultz I., Keys D. A., Campbell J. L., Fisher J. W. Quantitative evaluation of dichloroacetic acid kinetics in human – a physiologically based pharmacokinetic modeling investigation // Toxicology. – 2008. – Vol. 245. № 1–2. – P. 35–48.
28. Ludvik B., Peer G., Berzlanovich A., Stifter S., Graf H. Effects of dichloroacetate and bicarbonate on haemodynamic parameters in healthy volunteers // Clinical Science. – 1991. – Vol. 80. № 1. – P. 47–51.
29. Madhok B. M., Yeluri S., Perry S. L., Hughes T. A., Jayne D. G. Dichloroacetate induces apoptosis and cell-cycle arrest in colorectal cancer cells // British Journal of Cancer. – 2010. – Vol. 102. № 12. – P. 1746–1752.
30. Michelakis E. D., Sutendra G., Dromparis P., Webster L., Haromy A., Niven E. et al. Metabolic modulation of glioblastoma with dichloroacetate // Science Translational Medicine. – 2010. – Vol. 2. № 31. – P. 31ra34.
31. Michelakis E. D., Webster L., Mackey J. R. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer // British Journal of Cancer. – 2008. – Vol. 99. № 7. – P. 989–994.
32. Ohashi T., Akazawa T., Aoki M., Kuze B., Mizuta K., Ito Y., Inoue N. Dichloroacetate improves immune dysfunction caused by tumor-secreted lactic acid and increases antitumor immunoreactivity // International Journal of Cancer. – 2013. – Vol. 133. № 5. – P. 1107–1118.
33. Olszewski U., Poulsen T. T., Ulsperger E., Poulsen H. S., Geissler K., Hamilton G. In vitro cytotoxicity of combinations of dichloroacetate with anticancer platinum compounds // Clinical Pharmacology: Advances and Applications. – 2010. – Vol. 2. – P. 177–183.
34. Pfeffer G., Majamaa K., Turnbull D. M. et al. Treatment for mitochondrial disorders // Cochrane Database of Systematic Reviews. – 2012. – № 4. – CD004426.
35. Rajendran A., Bansal D., Marwaha R. K., Singhi S. C. Tumor lysis syndrome // The Indian Journal of Pediatrics. – 2013. – Vol. 80. № 1. – P. 50–54.
36. Ribes G., Valette G., Loubatieres-Mariani M. -M. Metabolic effects of sodium dichloroacetate in normal and diabetic dogs // Diabetes. – 1979. – Vol. 28. № 9. – P. 852–857.
37. Roh J. — L., Park J. Y., Kim E. H., Jang H. J., Kwon M. Activation of mitochondrial oxidation by PDK2 inhibition reverses cisplatin resistance in head and neck cancer // Cancer Letters. – 2016. – Vol. 371. № 1. – P. 20–29.
38. Rozier M. D., Zata V. J., Ellsworth M. L. Lactate interferes with ATP release from red blood cells // The American Journal of Physiology. Heart and Circulatory Physiology. – 2007. – Vol. 292. № 6. – P. H3038-H3042.
39. Saed G. M., Fletcher N. M., Jiang Z. L., Abu-Soud H. M., Diamond M. P. Dichloroacetate induces apoptosis of epithelial ovarian cancer cells through a mechanism involving modulation of oxidative stress // Reproductive Sciences. – 2011. – Vol. 18. № 12. – P. 1253–1261.
40. Shahrzad S., Lacombe K., Adamcic U., Minhas K., Coomber B. L. Sodium dichloroacetate (DCA) reduces apoptosis in colorectal tumor hypoxia // Cancer Letters. – 2010. – Vol. 297. № 1. – P. 75–83.
41. Shen H., Decollogne S., Dilda P. J., Hau E., Chung S. A., Luk P. P., Hogg P. J., McDonald K. L. Dual-targeting of aberrant glucose metabolism in glioblastoma // Journal of Experimental & Clinical Cancer Research. – 2015. – Vol. 34. № 1. – Article 14.
42. Shen Y., Fan H., Ou D., Liao S., Cheng A. et al. Dichloroacetate (DCA) enhances activities of sorafenib against hepatocellular carcinoma (HCC) via modulation of aberrant cellular metabolism of HCC cells // Molecular Cancer Therapeutics. – 2009. – Vol. 8. № 12 (Suppl.). – Abstract B97.
43. Shen Y. C., Ou D. L., Hsu C., Lin K. L., Chang C. Y., Lin C. Y. et al. Activating oxidative phosphorylation by a pyruvate dehydrogenase kinase inhibitor overcomes sorafenib resistance of hepatocellular carcinoma // British Journal of Cancer. – 2013. – Vol. 108. № 1. – P. 72–81.
44. Stacpoole P. W. Review of the pharmacologic and therapeutic effects of diisopropylammonium dichloroacetate (DIPA) // The Journal of Clinical Pharmacology. – 1969. – Vol. 9. № 5. – P. 282–291.
45. Stacpoole P. W. The pharmacology of dichloroacetate // Metabolism – Clinical and Experimental. – 1989. – Vol. 38. № 11. – P. 1124–1144.
46. Stacpoole P. W. Treatment of hyperlipoproteinemia with a dichloroacetate salt // United States Patent Number: 4,122,188. – Date of Patent: Oct. 24, 1978. – Appl. №: 828, 677. – Filed: Aug. 29, 1977.
47. Stacpoole P. W., Dunbar E. M., Shroads A. L., Coats B. S., Langaee T. Predictability of glutathione transferase zeta 1 haplotype on kinetics of dichloroacetate in human trials // Drug Metabolism Reviews. – 2011. – Vol. 43. – Suppl. 2. – P. 181–182.
48. Stacpoole P. W., Henderson G. N., Yan Z., Cornett R., James M. O. Pharmacokinetics, metabolism and toxicology of dichloroacetate // Drug Metabolism Reviews. – 1998. – Vol. 30. № 3. – P. 499–539.
49. Stacpoole P. W., Kerr D. S., Barnes C., Bunch S. T., Carney P. R., Fennell E. M. et al. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children // Pediatrics. – 2006. – Vol. 117. № 5. – P. 1519–1531.
50. Stacpoole P. W., Nagaraja N. V., Hutson A. D. Efficacy of dichloroacetate as a lactate- lowering drug // Journal of Clinical Pharmacology. – 2003. – Vol. 43. № 7. – P. 683–691.
51. Strum S. B., Adalsteinsson O., Black R. R., Segal D., Peress N. L., Waldenfels J. Case report: sodium dichloroacetate (DCA) inhibition of the «Warburg effect» in a human cancer patient: complete response in non-Hodgkin’s lymphoma after disease progression with rituximab-CHOP // Journal of Bioenergetics and Biomembranes. – 2013. – Vol. 45. № 3. – P. 307–315.
52. Sun R. C., Board P. G., Blackburn A. C. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells // Molecular Cancer. – 2011. – Vol. 10. – Article 142.
53. Sun R. C., Fadia M., Dahlstrom J. E., Parish C. R., Board P. G., Blackburn A. C. Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo // Breast Cancer Research and Treatment. – 2010. – Vol. 120. № 1. – P. 253– 260.
54. Tong J., Xie G., He J., Li J., Pan F., Liang H. Synergistic antitumor effect of dichloroacetate in combination with 5-fluorouracil in colorectal cancer // Journal of Biomedicine & Biotechnology. – 2011. – Vol. 2011. – Article ID 740564.
55. Valauri-Orton A., Bschorer F., Bernd K. K. Dichloroacetate decreases cell health and activates oxidative stress defense pathways in rat alveolar type II pneumocytes // BioMed Research International. – 2015. – Vol. 2015. – Article ID 129031.
56. Vella S., Conti M., Tasso R., Cancedda R., Pagano A. Dichloroacetate inhibits neuroblastoma growth by specifically acting against malignant undifferentiated cells // International Journal of Cancer. – 2012. – Vol. 130. № 7. – P. 1484–1493.
57. Vissing J., Gansted U., Quistorff B. Exercise intolerance in mitochondrial myopathy is not related to lactic acidosis // Annals of Neurology. – 2001. – Vol. 49. № 5. – P. 672–676.
58. Wargovich T. J., MacDonald R. G., Hill J. A., Feldman R. L., Stacpoole P. W., Pepine C. J. Myocardial metabolic and hemodynamic effects of dichloroacetate in coronary artery disease // The American Journal of Cardiology. – 1988. – Vol. 61. № 1. – P. 65–70.
59. Washington J. T., Quintyne N. J. Dichloroacetate induces different rates of cell death in cancer and noncancer cell lines in vitro // Tumori. – 2012. – Vol. 98. № 1. – P. 142–151.
60. Wong J. Y., Huggins G. S., Debidda M., Munshi N. C., De Vivo I. Dichloroacetate induces apoptosis in endometrial cancer cells // Gynecologic Oncology. – 2008. – Vol. 109. № 3. – P. 394–402.
61. Xiao H., Yan L., Zhang Y., Qi R., Li W., Wang R. et al. A dual-targeting hybrid platinum (IV) prodrug for enhancing efficacy // Chemical Communications. – 2012. – Vol. 48. № 87. – P. 10730– 10732.
62. Xiao L., Li X., Niu N., Qian J., Xie G., Wang Y. Dichloroacetate (DCA) enhances tumor cell death in combination with oncolytic adenovirus armed with MDA-7/IL-24 // Molecular and Cellular Biochemistry. – 2010. – Vol. 340. № 1. – P. 31–40.
63. Xie J., Wang B. S., Yu D. H., Lu Q., Ma J., Qi H. et al. Dichloroacetate shifts the metabolism from glycolysis to glucose oxidation and exhibits synergistic growth inhibition with cisplatin in HeLa cells // International Journal of Oncology. – 2011. – Vol. 38. № 2. – P. 409–417.
64. Xue X., You S., Zhang Q., Wu Y., Zou G. Z., Wang P. C. et al. Mitaplatin increases sensitivity of tumor cells to cisplatin by inducing mitochondrial dysfunction // Molecular Pharmaceutics. – 2012. – Vol. 9. № 3. – P. 634–644.
65. Zajac J., Kostrhunova H., Novohradsky V., Vrana O., Raveendran R., Gibson D., Kasparkova J., Brabec V. Potentiation of mitochondrial dysfunction in tumor cells by conjugates of metabolic modulator dichloroacetate with a Pt(IV) derivative of oxaliplatin // Journal of Inorganic Biochemistry. – 2016. – Vol. 156. – P. 89–97.
66. Zhang N., Palmer A. F. Development of a dichloroacetic acid-hemoglobin conjugate as a potential targeted anti-cancer therapeutic // Biotechnology and Bioengineering. – 2011. – Vol.108. № 6. – P. 1413–1420.
CAS номер: 2156-56-1
Синонимы: Дихлороуксусная натриевая соль; Натриумдихлорацетат; SDA; Натриевая соль дихлоруксусной кислоты; Sodium dichloroacetate; Dichloroacetic acid sodium salt; Sodium 2,2-dichloroacetate;
Производитель: Китай
Физико-химические свойства:
Химическая формула: C₂HCl₂NaO₂ или Cl₂CHCOONa
Молярная масса: 150,92 г/моль
Плотность: 1,57 г/см³
Температура:
— плавления 198°C (разлагается)
— кипения 194°C
— вспышки 194°C
Описание и внешний вид:
Натрий дихлорацетат является органическим химическим соединением, натриевая соль дихлоруксусной кислоты. Производное уксусной кислоты, содержащее два атома хлора, присоединенных к метильной группе. Представляет собой белое кристаллическое вещество или порошок. Легко растворяется в воде, этиловом спирте. При разбавлении кристаллов в небольшом количестве воды, раствор приобретает ярко выраженный горький вкус с небольшим привкусом пищевой соды. Дихлоруксусная кислота имеет высокую кислотность, поэтому ее обычно хранят и продают в виде различных солей, которые снижают кислотность до приемлемого рН.
Область применения:
В качестве промежуточного продукта в органическом синтезе для производства других химических реактивов.
Применяется в производстве косметических и лекарственных средств.
Меры безопасности:
Натрий дихлорацетат может оказывать негативное воздействие на организм при проглатывании и попадании внутрь, не предназначена для употребления или наружного применения. Проглатывание приводит к сильному отравлению и поражению внутренних органов.
Воздействие дихлорацетат натрия способствует возникновению серьёзного раздражения слизистых оболочек глаз, кожи и дыхательных путей. Предположительно может вызывать рак.
При горении выделяет ядовитый, едкий дым, раздражающие пары и газы оксидов углерода, хлороводорода.
Стабилен при нормальных условиях использования и хранения.
Хранить рекомендуется в плотно закрытой таре, в прохладном, сухом, хорошо проветриваемом помещении, избегая контакта с другими несовместимыми веществами, вдали от источников тепла, искр или пламени.
При работе рекомендуется использовать респиратор, спецодежду, защитные перчатки, сапоги и очки.
Необходимо соблюдать правила личной гигиены, запрещается принимать пищу, пить, курить во время работы с реактивом.
Помещение для работы должно быть оборудовано общей приточно-вытяжной вентиляцией.