АТОПИКА® инструкция по применению
📜 Инструкция по применению АТОПИКА®
💊 Состав препарата АТОПИКА®
✅ Применение препарата АТОПИКА®
📅 Условия хранения АТОПИКА®
⏳ Срок годности АТОПИКА®
Описание лекарственного препарата ветеринарного назначения АТОПИКА®
Основано на официально утвержденной инструкции по применению
препарата АТОПИКА® для специалистов
и утверждено компанией-производителем для электронного издания справочника Видаль Ветеринар
2017 года
Дата обновления: 2016.09.13
Лекарственная форма
|
|
АТОПИКА® |
Капсулы для перорального применения 25 мг рег. 826-3-12.15-2915№ПВИ-3-12.15/04677 |
Форма выпуска, состав и упаковка
Капсулы для перорального применения мягкие желатиновые, овальной формы, серо-голубого цвета с маркировкой «NVR 25 mg» на одной стороне.
Вспомогательные вещества: моно-, ди-, триглицериды кукурузного масла, этанол безводный (E1510), желатин (E441), глицерол 85% (E442), макрогола глицерина гидроксистеарат, пропиленгликоль (E1520), титана диоксид (E171), карминовая кислота (E120), краситель железа оксид черный, α-токоферол (E307).
Расфасованы по 5 капсул в блистеры из алюминиевой фольги, помещенные по 3, 6 или 12 шт. в картонные пачки вместе с инструкцией по применению.
Фармакологические (биологические) свойства и эффекты
Селективный иммунодепрессант. Циклоспорин, входящий в состав препарата, является циклическим полипептидом, состоящим из 11 аминокислот. Подавляет развитие реакций клеточного типа, включая кожную гиперчувствительность замедленного типа, а также зависимое от Т-лимфоцитов образование антител. На клеточном уровне блокирует покоящиеся лимфоциты в фазах G0 или Gi клеточного цикла и подавляет запускаемую антигеном продукцию и секрецию цитокинов (включая интерлейкин-2 (фактор роста Т-лимфоцитов)) активированными Т-лимфоцитами. Циклоспорин действует на лимфоциты обратимо, не подавляет гемопоэз и не влияет на функционирование фагоцитирующих клеток.
После перорального введения препарата максимальная концентрация циклоспорина в плазме крови отмечается через 1-2 ч; связывание с белками плазмы (преимущественно липопротеинами) составляет около 90%.
Циклоспорин в значительной степени подвергается биотрансформации в печени изоферментом CYP3A4, и, в меньшей степени, в ЖКТ и почках, с образованием примерно 15 метаболитов. Основными путями метаболизма являются моно- и дигидроксилирование в различных частях молекулы. Выводится из организма в основном с фекалиями и частично с мочой (около 10% введенной дозы) главным образом в виде метаболитов, в незначительных количествах (около 0.1%) в неизмененном виде.
Атопика® по степени воздействия на организм относится к веществам малоопасным (4 класс опасности по ГОСТ 12.1.007-76).
Показания к применению препарата АТОПИКА®
- хроническая форма атопического дерматита у собак.
Порядок применения
Препарат Атопика® применяют собакам индивидуально перорально 1-2 раза/сут за 2 ч до или после кормления в суточной дозе 5 мг циклоспорина на 1 кг массы животного.
Суточные дозы препарата в зависимости от массы животного и используемой капсулы представлены в таблице.
Продолжительность курса лечения определяет лечащий ветеринарный врач. Как правило, продолжительность курса составляет 4 недели. После клинического улучшения состояния животного препарат назначают через день, или 1 раз в 3-4 дня. Если в течение 8 недель клиническое улучшение не наступает, применение препарата прекращают.
Особенностей действия лекарственного препарата при первом применении и отмене не установлено.
Следует избегать нарушений схемы применения препарата, т.к. это может привести к снижению его эффективности. В случае пропуска очередной дозы препарат следует ввести как можно скорее в той же дозе.
Побочные эффекты
При применении препарата в соответствии с настоящей инструкцией побочных явлений и осложнений у животных, как правило, не наблюдается. В редких случаях возможны желудочно-кишечные расстройства (рвота, диарея); вялость или гиперактивность, гипертрофический гингивит легкой или умеренной степени, бородавчатые поражения кожи или изменения волосяного покрова, покраснение и отек ушных раковин, мышечная слабость, судороги. Указанные симптомы исчезают самопроизвольно после прекращения применения препарата и обычно не требуют применения лекарственных средств. В очень редких случаях, в основном у вест-хайленд-уайт терьеров, применение препарата может привести к развитию сахарного диабета. При необходимости животному назначают средства симптоматической терапии.
При передозировке препарата в течение 3 месяцев у животного может наблюдаться снижение массы тела, гиперкератоз области ушных раковин, мозолистые поражения на подушечках лап, гипертрихоз. Указанные признаки проходят в течение 2 месяцев после прекращения применения препарата и не требуют применения лекарственных средств.
Противопоказания к применению препарата АТОПИКА®
- выраженные нарушения функции почек и/или печени;
- онкологические и инфекционные болезни;
- сахарный диабет;
- повышенная индивидуальная чувствительность животного к компонентам препарата (в т.ч. в анамнезе).
Препарат не следует применять животным других видов.
Особые указания и меры личной профилактики
Не следует применять препарат беременным и лактирующим сукам, щенкам моложе 6-месячного возраста и/или собакам массой менее 2 кг.
Препарат Атопика® не следует применять одновременно с другими иммунодепрессантами, макролидами, аминогликозидами, противосудорожными и антимикробными лекарственными средствами.
Не следует проводить вакцинацию животных в период лечения препаратом, а также за 2 недели до и после периода лечения.
Препарат Атопика® не предназначен для применения продуктивным животным.
Меры личной профилактики
При применении препарата Атопика® следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными препаратами. Во время работы запрещается курить, пить и
принимать пищу, по окончании работы следует вымыть руки с мылом.
Людям с гиперчувствительностью к компонентам препарата следует избегать прямого контакта с препаратом Атопика®. При случайном контакте лекарственного препарата с кожей или слизистыми оболочками их необходимо немедленно промыть большим количеством воды. В случае появления аллергических реакций или при случайном попадании препарата в организм человека следует немедленно обратиться в медицинское учреждение (при себе иметь инструкцию по применению препарата или этикетку).
Запрещается использование пустой упаковки из-под препарата для бытовых целей, она подлежат утилизации с бытовыми отходами.
Условия хранения АТОПИКА®
Препарат следует хранить в закрытой упаковке производителя, отдельно от продуктов питания и кормов, в сухом, защищенном от света, недоступном для детей месте при температуре от 0°С до 25°С.
Срок годности АТОПИКА®
Срок годности при соблюдении условий хранения — 3 года с даты производства. Запрещается применение препарата по истечении срока годности.
Неиспользованный лекарственный препарат утилизируют в соответствии с требованиями законодательства.
Контакты для обращений
|
|
123112 Москва, Пресненская наб. 10 |
АТОПИКА® отзывы
Помогите другим с выбором, оставьте отзыв об АТОПИКА®
Оставить отзыв
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код

Оглавление
- 1 Рекомендуемые дозировки
- 2 Правила безопасности
- 3 Беременность/уход
- 4 Рекомендации по использованию
- 5 Польза
- 6 Побочные эффекты
Рекомендуемые дозировки
Лечение Циклоспорином проводится строго под контролем ветеринарного врача с подбором минимально эффективной дозы (не все препараты Циклоспорина дозируются одинаково), которая снижает риск развития побочных эффектов. Принимать препарат рекомендовано за час до или через два часа после еды.
Атопика
Атопика (Atopica) назначают собакам весом более 1,8 кг. Обычная целевая доза составляет 3,3-6,6 мг/кг. для лечения атопического дерматита. Эти дозы следует вводить один раз в день в течение 30 дней, после чего дозу следует уменьшить до минимального количества.
| Вес собаки (кг) | Дозировка (для атопического дерматита) |
|---|---|
| 1,8 – 2,3 | 1 капсула 10 мг |
| 2,3 — 4 | 2 × 10 мг капсул |
| 4 – 7,3 | 1 капсула по 25 мг |
| 7,3 – 14,9 | 1 капсула по 50 мг |
| 14,9 — 29 | 1 капсула по 100 мг |
| 29 – 35,8 | 1 капсула по 100 мг + капсула 1 х 50 мг |
| 35,8 – 54,8 | 2 капсулы по 100 мг |
После уменьшения дозы препарата до минимума рекомендуется применять атопика (Atopica) или неорал (Neoral) через день или два раза в неделю:
| Диагноз | Доза Атопика/Неорал |
|---|---|
| воспалительное заболевание кишечника (ВЗК) | 1,98 — 4,99 мг / кг два раза в день |
| пузырчатка вульгарная (Pemphigus Vulgaris) | 4,99 — 9,9 мг / кг атопика + 4,99 мг /кг кетоконазола, вводимого один раз в день |
Зачастую возможно применение альтернативных препаратов (но только после рекомендации ветеринара), таких как:
Сандиммун
Дозировка сандиммуна (Sandimmunе) не эквивалентна дозировке атопика (Atopica) или неорал (Neoral). Не используйте эти лекарства взаимозаменяемо. При использовании в качестве общего иммунодепрессанта сандиммун обычно дозируют 4,28-12,49 мг/кг каждые 12 часов.
Применяют при следующих заболеваниях.
| Диагноз | Дозировка |
|---|---|
| анальные свищи | 4,01 — 7,48мг /кг, вводимое каждые 12 часов (сужение при заживлении очагов) |
| гломерулярный нефрит (острый нефрит) | 14,96 мг /кг, вводимое каждые 24 часа |
| гемолитическая анемия (иммунно-опосредованная) — иммунная система организма атакует собственные красные кровяные клетки. | 9,9 мг / кг каждые 12-24 часа |
Оптиммун
Оптиммун (Optimmune) — актуальное офтальмологическое лекарство, которое можно использовать для лечения синдрома сухого глаза (ССГ). Рекомендуется 6,3 мм полоску мази оптиммун нанести на нижнее веко.
Правила безопасности
Побочные эффекты и осложнения при применении препарата в соответствии с инструкциями обычно не наблюдаются. В редких случаях возможны расстройства желудочно-кишечного тракта (диарея, рвота), может быть небезопасно для собак с болезнью печени или почек. Не следует применять препарат одновременно с другими лекарственными средствами.
Беременность/уход
Не рекомендуется вводить препарат беременным или кормящим животным.
Рекомендации по использованию
Использование любого лекарственного средства, в состав которого входит Циклоспорин, рекомендовано:
- принимать только по назначению врача ветеринара;
- строго придерживайтесь рекомендованной схемы лечения;
- вводите лекарство за час до или через два часа после еды;
- сообщайте ветеринару о клинических обострениях, возникающих во время лечения (если таковые имеются);
- информируйте ветеринара о любых других лекарствах или дополнениях, которые вы даете собаке.
Например, если ветеринар предписывает атопика (Atopica), не заменяйте его на сандиммун (Sandimmune), так как дозировка этих препаратов разная.
Важно не давать никаких других лекарств, пока собака принимает циклоспорин, во избежание нежелательных взаимодействий с другими лекарственными средствами.
Польза
Чаще всего препарат используется для лечения атопического дерматина.
Побочные эффекты
Наиболее распространенными побочными эффектами являются процессы, связанные с желудком (рвота, диарея). Встречались случаи воспаления десен, чрезмерный рост волос, чрезмерное выпадение волос и папилломатоз (характеризующийся образованием множественных папиллом на каком-либо участке кожи или слизистой оболочке). Передозировки могут привести к повреждению почек или печени.
Циклоспорин+преднизолон для собак-атопиков
Циклоспорин эффективный препарат для подавления воспаления кожи и зуда при атопическом дерматите (АД) у собак. Но, зачастую, его эффект достигает полной силы только через несколько недель (в среднем, 3-4) после начала применения. А есть категория пациентов-атопиков с таким сильным зудом, что даже несколько дней кажутся вечностью. В данном исследовании попытались оценить эффективность и сохранность краткосрочного (3 недели) сочетанного применения циклоспорина (5 мг/кг) и преднизолона (1 мг/кг 7 дней, затем через день еще 14 дней). Собак-атопиков разбили на 2 группы: только циклоспорин (Ц, 25 собак) и циклоспорин+преднизолон (Ц+П, 23 собаки). В группе Ц+П ответ на лечение был значительно быстрее (значительное снижение зуда уже через 3-4 дня, а через 2 недели общая ремиссия на 72,8%), чем в группе Ц (значительное снижение зуда только через 7-8 дней, общая ремиссия через 2 недели только на 24,7%). Побочные эффекты наблюдались в обеих группах, но были незначительными и не выходящими за рамки «обычных» побочных при применении циклоспорина (расстройства ЖКТ) или преднизолона (полиурия, вялость). Таким образом, короткое параллельное использование этих препаратов может быть рекомендовано в начале лечения АД. Я бы даже в большинстве случаев использовала меньшие дозы преднизолона. Внимание! Длительное сочетанное использование этих препаратов увеличивает риск побочных эффектов, особенно оппортунистических инфекций.
По материалам статьи: Concurrent short-term use of prednisolone with cyclosporine A accelerates pruritus reduction and improvement in clinical scoring in dogs with atopic dermatitis
Дерматологически Ваша, Светлана Белова
Описание препарата Циклоспорин (капсулы, 100 мг) основано на официальной инструкции, утверждено компанией-производителем в 2002 году
Дата согласования: 09.07.2002
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав и форма выпускa
- Фармакологическое действие
- Фармакологическое действие
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Меры предосторожности
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Циклоспорин
Действующее вещество
ATX
Фармакологическая группа
Состав и форма выпускa
1 капсула содержит циклоспорина 25, 50 или 100 мг; в контурной ячейковой упаковке 10 шт., в картонной пачке 5 упаковок.
Фармакологическое действие
Фармакологическое действие
—
иммунодепрессивное.
Тормозит развитие реакций иммунитета клеточного типа, в т.ч. реакцию «трансплантат против хозяина», кожную гиперчувствительность замедленного типа, аллергический энцефаломиелит, артрит, обусловленный адъювантом Фрейнда, продукцию антител, зависимую от Т-хелперов. Обладает способностью блокировать активацию лимфоцитов в фазах G0 или G1 клеточного цикла, синтез и высвобождение цитокинов, рост Т-лимфоцитов (интерлейкина-2). Оказывает избирательное действие и не обладает угнетающим эффектом на кроветворение и фагоцитарное звено иммунитета.
Тормозит развитие реакций иммунитета клеточного типа, в т.ч. реакцию «трансплантат против хозяина», кожную гиперчувствительность замедленного типа, аллергический энцефаломиелит, артрит, обусловленный адъювантом Фрейнда, продукцию антител, зависимую от Т-хелперов. Обладает способностью блокировать активацию лимфоцитов в фазах G0 или G1 клеточного цикла, синтез и высвобождение цитокинов, рост Т-лимфоцитов (интерлейкина-2). Оказывает избирательное действие и не обладает угнетающим эффектом на кроветворение и фагоцитарное звено иммунитета.
Фармакокинетика
Всасывается в кишечнике. Биодоступность — 30%, возрастает в зависимости от длительности лечения и величины дозы. Cmax в плазме достигается через 1–5 ч. Оптимальные концентрации циклоспорина А в крови находятся в интервале от 300 до 800 нг/мл. Распределяется главным образом вне кровяного русла, хотя и обнаруживается в эритроцитах, гранулоцитах, лимфоцитах. Проникает в грудное молоко. T1/2 — 19 ч у взрослых и 7 ч у детей. Метаболизируется с образованием 15 метаболитов. Выводится преимущественно с желчью, в моче обнаруживается в виде метаболитов около 6% дозы.
Показания
Профилактика и лечение реакции отторжения после пересадки костного мозга и трансплантации солидных органов (почки, печень, сердце, сердечно-легочный трансплантат, легкие или поджелудочная железа), в т.ч. у больных, ранее получавших другие иммунодепрессанты; профилактика и лечение реакции «трансплантат против хозяина»; аутоиммунные заболевания: эндогенный увеит (активный, угрожающий зрению среднего или заднего участка глаза неинфекционной этиологии при неэффективности обычной терапии или развитии тяжелых побочных эффектов при лечении; увеит Бехчета с рецидивирующими приступами воспаления, в т.ч. сетчатки); нефротический синдром у взрослых и детей, глюкокортикоидозависимый и резистентный к ним, обусловленный патологией сосудистого клубочка (нефропатия минимальных изменений, очаговый и сегментарный гломерулосклероз, мембранозный гломерулонефрит) с целью индукции ремиссии и ее поддержания, а также для поддержания ремиссии, индуцированной глюкокортикоидами, и их последующей отмены; тяжелые формы ревматоидного артрита с высокой степенью активности (в случаях, когда неэффективны классические медленно действующие противоревматические препараты или их применение невозможно); тяжелые формы псориаза, атопического дерматита (при системной терапии).
Противопоказания
Гиперчувствительность к циклоспорину или его составляющим.
Применение при беременности и кормлении грудью
Опыт применения у беременных ограничен. Данные, полученные на больных с пересаженными органами, показывают, что в сравнении с традиционными методами лечения, терапия циклоспорином не вызывает повышенного риска отрицательных воздействий на течение и исход беременности. На время лечения следует прекратить грудное вскармливание.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
Внутрь, при пересадке органов — в дозе 10–15 мг/кг за 4–12 ч до операции, затем ежедневно однократно на протяжении 1–2 нед; в дальнейшем дозу постепенно уменьшают до поддерживающей (обычно 2–6 мг/кг). При аутоиммунных заболеваниях, в т.ч. ревматоидном артрите — 3 мг/кг в 2 приема в течение первых 6 нед. В случае недостаточного эффекта суточную дозу постепенно увеличивают при условии удовлетворительной переносимости. Максимальная суточная доза — 5 мг/кг. Курс лечения — до 12 нед.
Для поддерживающей терапии дозу подбирают индивидуально в зависимости от переносимости препарата. Возможно комбинирование с малыми дозами глюкокортикоидами и/или НПВС.
При псориазе для индукции ремиссии 2,5 мг/кг/сут в 2 приема, в тяжелых случаях заболевания для быстрого достижения эффекта начальная доза 5 мг/кг (если при применении в суточной дозе 5 мг/кг в течение 6 нед нет клинического эффекта — препарат отменяют).
При атопическом дерматите начальная доза 2,5 мг/кг/сут, в тяжелых случаях увеличивают до 5 мг/кг/сут. При достижении положительного клинического результата дозу постепенно понижают до полной отмены.
Побочные действия
Со стороны нервной системы и органов чувств: чувство усталости, головная боль, парестезии, судороги; редко — мышечные спазмы, миопатия, тремор.
У больных после пересадки печени были описаны признаки энцефалопатии, нарушения зрения, сознания, нарушения координации движений.
Со стороны органов ЖКТ: гиперплазия кишечника, потеря аппетита, тошнота, рвота, диарея, боль в животе, панкреатит; возможны обратимые нарушения функции печени, повышение концентрации билирубина, печеночных ферментов в крови (выраженность этих нарушений зависит от дозы препарата).
Со стороны мочеполовой системы: нарушения функции почек, повышение концентрации креатинина и мочевины в сыворотке (наблюдаются в течение первых несколько недель лечения, имеют дозозависимый характер и уменьшаются при снижении дозы). При длительном лечении возможно развитие структурных изменений в почках (интерстициальный фиброз).
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): повышение АД (особенно у больных после пересадки сердца); анемия (слабо выраженная), лейко-, тромбопения.
Прочие: гинекомастия, дисменорея, гирсутизм, акне, гипертрихоз, гипертрофия десен, появление отеков, увеличение массы тела; гиперкалиемия, гипомагниемия, повышение концентрации мочевой кислоты в крови, редко — обратимое увеличение уровня липидов в сыворотке; развитие инфекционных, злокачественных и лимфопролиферативных заболеваний.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
При одновременном назначении с препаратами калия или калийсберегающими диуретиками повышается риск развития гиперкалиемии; с аминогликозидами, амфотерицином В, ципрофлоксацином, мелфаланом, колхицином, триметопримом, НПВС — риск развития нефротоксичности; с ловастатином — риск возникновения мышечных болей и слабости. Разные препараты могут повышать или снижать концентрации циклоспорина в плазме за счет подавления или индукции ферментов печени, принимающих участие в метаболизме и элиминации. Кетоконазол, макролиды (в т.ч. эритромицин и джозамицин), доксициклин, пероральные контрацептивы, пропафенон, БКК (в т.ч. верапамил, дилтиазем, никардипин) повышают концентрацию циклоспорина в плазме; барбитураты, карбамазепин, фенитоин, метамизол натрий, рифампицин, нафциллин, сульфадимидин, триметоприм при их в/в введении — понижают. При комбинированном применении препаратов необходимо тщательное мониторирование концентрации циклоспорина в крови и изменение дозы Веро-циклоспорина. Циклоспорин понижает клиренс преднизолона, лечение высокими дозами метилпреднизолона повышает концентрацию циклоспорина в крови.
Передозировка
Симптомы: обратимое нарушение функции почек.
Лечение: симптоматическое. Гемодиализ и гемоперфузия с использованием активированного угля неэффективны.
Меры предосторожности
Во время лечения необходим систематический контроль функции почек и печени, уровня калия в плазме (особенно у пациентов с нарушением функции почек), до начала и после 1 мес лечения определение концентрации липидов. При стойком повышении концентрации мочевины, креатинина, билирубина, печеночных ферментов следует понизить дозу препарата. При развитии артериальной гипертензии необходимо гипотензивное лечение, при повышении содержания липидов в сыворотке — понижение дозы препарата и/или ограничении поступления жиров с диетой.
Необходимо избегать чрезмерного подавления иммунитета.
В процесс лечения не следует проводить вакцинацию живыми ослабленными вакцинами против эпидемического паротита, кори, краснухи, полиомиелита.
Не рекомендуется одновременное применение с ловастатином, цитостатиками (мелфаланом).
Условия хранения
В сухом, защищенном от света месте, при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Federal (USA) Law restricts this drug to use by or on the order of a licensed veterinarian. Keep this and all drugs out of reach of children.
CYCLAVANCE™ (cyclosporine oral solution) USP MODIFIED is an oral form of cyclosporine that immediately forms a microemulsion in an aqueous environment. Cyclosporine, the active ingredient in CYCLAVANCE, is a cyclic polypeptide, immune modulating agent consisting of 11 amino acids. It is produced as a metabolite by the fungal species Beauveria nivea.
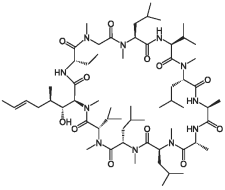
Chemically, cyclosporine A is designated Cyclo[[(E) — (2S,3R,4R) — 3 — hydroxy — 4 — methyl — 2 — (methylamino) — 6 — octenoyl] — L — 2 — aminobutyryl — N — methylglycyl — N — methyl — L — leucyl — L — valyl — N — methyl — L — leucyl — L — alanyl — D — ananyl — N — methyl — L — leucyl — N — methyl — L — leucyl — N — methyl — L — valyl].
Cyclavance (cyclosporine oral solution) USP MODIFIED Indications
CYCLAVANCE is indicated for the control of atopic dermatitis in dogs weighing at least 4 lbs (1.8 kg) body weight.
DOSAGE AND ADMINISTRATION: Always Provide the Instructions for Assembling the Dispensing System and Preparing a Dose of CYCLAVANCE and the Information for Dog Owners with the prescription. The initial dose of CYCLAVANCE is 5 mg/kg/day as a single daily dose for 30 days. Following this initial daily treatment period, the dose of CYCLAVANCE may be tapered by decreasing the frequency of dosing to every other day or twice weekly, until a minimum frequency is reached which will maintain the desired therapeutic effect. CYCLAVANCE should be given at least one hour before or two hours after a meal. If a dose is missed, the next dose should be administered (without doubling) as soon as possible but dosing should be no more frequent than once daily. The dispensing system for the 5 and 15 mL vial sizes includes a 1 mL oral dosing syringe graduated in 0.05 mL increments. To dose the dog, administer 0.05 mL of CYCLAVANCE per 2.2 lbs of body weight. The dispensing system for the 30 and 50 mL vial sizes includes both a 1 mL oral dosing syringe graduated in 0.05 mL increments, and a 3 mL oral dosing syringe graduated in 0.1 mL increments. To dose the dog, administer 0.1 mL of CYCLAVANCE per 4.4 lbs of body weight. Do not rinse or clean the oral dosing syringe between uses. (See Instructions for Assembling the Dispensing System and Preparing a Dose of CYCLAVANCE.)
Contraindications
CYCLAVANCE is contraindicated for use in dogs with a history of neoplasia. Do not use in dogs with a hypersensitivity to cyclosporine.
Warnings
CYCLAVANCE (cyclosporine oral solution) is a systemic immunosuppressant that may increase the susceptibility to infection and the development of neoplasia.
HUMAN WARNINGS: Not for human use. Keep this and all drugs out of reach of children. For use only in dogs. Special precautions to be taken when administering CYCLAVANCE in dogs: Do not eat, drink, smoke, or use smokeless tobacco while handling CYCLAVANCE. Wear gloves during administration. Wash hands after administration. In case of accidental ingestion, seek medical advice immediately and provide the package insert or the label to the physician.
People with known hypersensitivity to cyclosporine should avoid contact with CYCLAVANCE.
Precautions
The safety and effectiveness of cyclosporine has not been established in dogs less than 6 months of age or less than 4 lbs body weight. CYCLAVANCE is not for use in breeding dogs, pregnant or lactating bitches. As with any immunomodulation regimen, exacerbation of sub-clinical neoplastic and infectious conditions may occur. Gastrointestinal problems and gingival hyperplasia may occur at the initial recommended dose (See Animal Safety).
CYCLAVANCE may cause elevated levels of serum glucose, and should be used with caution in cases with diabetes mellitus. If signs of diabetes mellitus develop following the use of CYCLAVANCE, consideration should be given to tapering or discontinuing the dose.
CYCLAVANCE should be used with caution with drugs that affect the P-450 enzyme system. Simultaneous administration of CYCLAVANCE with drugs that suppress the P-450 enzyme system, such as azoles (e.g. ketoconazole), may lead to increased plasma levels of cyclosporine.
Since the effect of cyclosporine use on dogs with compromised renal function has not been studied, CYCLAVANCE should be used with caution in dogs with renal insufficiency.
There have been reports of convulsions in human adult and pediatric patients receiving cyclosporine, particularly in combination with high dose methylprednisolone (See Animal Safety).
Killed vaccines are recommended for dogs receiving CYCLAVANCE because the impact of cyclosporine on the immune response to modified live vaccines is unknown (See Animal Safety).
Adverse Reactions
A total of 265 dogs were included in the field study safety analysis. One hundred and eleven (111) dogs were treated with placebo for the first 30 days. For the remainder of the study, all dogs received cyclosporine capsules.
Fourteen dogs withdrew from the study due to adverse reactions. Four dogs withdrew from the study after vomiting. One dog each withdrew from the study after diarrhea; vomiting, diarrhea and pruritus; vomiting, depression and lethargy; lethargy, anorexia and hepatitis; gingival hyperplasia, lethargy, polyuria/polydipsia and soft stool; seizure; sebaceous cyst; pruritus; erythema; or otitis externa.
Vomiting and diarrhea were the most common adverse reactions occurring during the study. In most cases, signs spontaneously resolved with continued dosing. In other cases, temporary dose modifications (brief interruption in dosing, divided dosing, or administration with a small amount of food) were employed to resolve signs.
Persistent otitis externa, urinary tract infections, anorexia, gingival hyperplasia, lymphadenopathy and lethargy were the next most frequent adverse events observed. Gingival hyperplasia regressed with dose tapering. Owners of four dogs reported seizures while dogs were receiving cyclosporine. In one dog, seizures were the result of a brain tumor diagnosed one month into the study. Another dog experienced seizures before and after the study.
Otitis externa, allergic otitis, or pinna erythema, with or without exudates, commonly accompanies atopy. Many dogs entered the study with otitis externa, which did not resolve without otic treatment. New cases of otitis externa, allergic otitis, or pinna erythema developed while dogs were receiving cyclosporine. However, the incidence rate was lower with cyclosporine compared to placebo. A change in the dose frequency was not necessary when new cases occurred.
Number of Dogs Displaying Each Clinical Observation in the Field Study
|
Clinical sign |
% out of 265 |
|
Vomiting |
30.9% |
|
Diarrhea |
20.0% |
|
Persistent Otitis Externa |
6.8% |
|
Urinary Tract Infection |
3.8% |
|
Anorexia |
3.0% |
|
Lethargy |
2.3% |
|
Gingival Hyperplasia |
2.3% |
|
Lymphadenopathy |
2.3% |
The following clinical signs were reported in less than 2% of dogs treated with cyclosporine in the field study: constipation, flatulence, Clostridial organisms in the feces, nausea, regurgitation, polyuria/polydipsia, strong urine odor, proteinuria, pruritus, erythema/flushed appearance, pyoderma, sebaceous adenitis, crusty dermatitis, excessive shedding, coarse coat, alopecia, papillomas, histiocytoma, granulomatous mass or lesion, cutaneous cyst, epulis, benign epithelial tumor, multiple hemangioma, raised nodule on pinna, seizure, shaking/trembling, hind limb twitch, panting, depression, irritability, hyperactivity, quieter, increased light sensitivity, reluctance to go outside, weight loss, hepatitis.
The following clinical signs were observed in 1.5-4.5% of dogs while receiving the placebo: vomiting, diarrhea and urinary tract infection. The following clinical signs were observed in less than 1% of dogs receiving the placebo: anorexia, otitis externa, cutaneous cysts, corneal opacity, lymphadenopathy, erythema/flushed appearance.
Clinical Pathology Changes: During the study, some dogs experienced changes in clinical chemistry parameters while receiving cyclosporine, as described in the following table:
|
Clinical Chemistry |
% Affected (out of 265) |
|
Elevated Creatinine |
7.8% |
|
Hyperglobulinemia |
6.4% |
|
Hyperphosphatemia |
5.3% |
|
Hyperproteinemia |
3.4% |
|
Hypercholesterolemia |
2.6% |
|
Hypoalbuminemia |
2.3% |
|
Hypocalcemia |
2.3% |
|
Elevated BUN |
2.3% |
In addition, the following changes in clinical chemistry parameters were noted in less than 2% of dogs: hypernatremia; hyperkalemia, elevated ALT, elevated ALP, hypercalcemia and hyperchloremia. These clinical pathology changes were generally not associated with clinical signs.
POST-APPROVAL EXPERIENCE: The following adverse events are based on post-approval adverse drug experience reporting. Not all adverse reactions are reported to FDA CVM. It is not always possible to reliably estimate the adverse event frequency or establish a causal relationship to product exposure using this data. The following adverse events are grouped by body system and are presented in decreasing order of reporting frequency.
Gastrointestinal: Emesis, diarrhea, gingival hyperplasia, hemorrhagic diarrhea, abdominal pain, hematemesis, digestive tract hemorrhage, hypersalivation, retching, flatulence, tenesmus, intestinal stasis, digestive tract hypermotility, melena, pancreatitis, involuntary defecation
General: Lethargy, anorexia, weight loss, polydipsia, hyperthermia, pale mucous membrane, general pain, collapse, dehydration, edema
Dermatologic: Pruritus, dermatitis and eczema, alopecia, erythema, papilloma, bacterial skin infection, skin lesion, skin and/or appendage neoplasm, pigmentation disorder, hair change, hyperkeratosis, histiocytoma, fungal skin infection, dermal cyst(s), desquamation
Behavioral: Hyperactivity, behavioral changes, anxiety, vocalization, aggression, inappropriate urination, disorientation
Neurologic: Muscle tremor, convulsion, ataxia, paresis
Respiratory: Tachypnea, dyspnea, cough
Urologic: Polyuria, urine abnormalities (hematuria, urinary tract infection, proteinuria, glucosuria, decreased urine concentration) urinary incontinence, cystitis, renal failure, renal insufficiency
Immune: Urticaria, anaphylaxis, allergic edema
Blood and lymphatic: Lymphadenopathy, anemia, hypoalbuminemia, leukopenia
Hepatic: Elevated Liver Enzymes, hepatopathy, hepatomegaly, hepatitis
Musculoskeletal: Lameness, limb weakness, myositis
Ear and labyrinth: Otitis externa
Cardio-vascular: Tachycardia
Endocrine: Diabetes mellitus, hyperglycemia
In some cases, death/euthanasia has been reported as an outcome of the adverse events listed above.
Neoplasms have been reported in dogs taking cyclosporine, including reports of lymphoma/lymphosarcoma and mast cell tumor. It is unknown if these were preexisting or developed de novo while on cyclosporine.
Diabetes mellitus has been reported; West Highland White Terriers are the most frequently reported breed.
To report suspected adverse drug events, for technical assistance or to obtain a copy of the Safety Data Sheet, contact Virbac AH, Inc. at 1-888-338-3659. For additional information about adverse drug experience reporting for animal drugs, contact FDA at 1-888-FDA-VETS or http://www.fda.gov/reportanimalae.
Clinical Pharmacology
Cyclosporine is a immunosuppressive agent that has been shown to work via suppression of T-helper and T-suppressor cells and inhibition of interleukin-2. It does not depress hematopoiesis or the function of phagocytic cells. A decrease in CD4 and CD8 cells was not seen in dogs receiving 20 mg/kg/day of cyclosporine for 56 days. Cyclosporine is not a corticosteroid or an antihistamine.
METABOLISM: Cyclosporine is extensively metabolized by the cytochrome P-450 enzyme system in the liver, and to a lesser degree in the gastrointestinal tract and the kidney. The metabolism of cyclosporine can be altered by the co-administration of a variety of agents (See Precautions).
EFFECTIVENESS FIELD STUDY: A multisite, placebo controlled, double masked, field study was conducted in the United States and Canada using 16 investigators. Two hundred sixty five (265) dogs aged 1-10 years, weighing 4-121 lbs received either cyclosporine capsules at 5 mg/kg/day or placebo capsules. After 30 days, placebo dogs were switched to cyclosporine capsules.
Dogs were treated with cyclosporine capsules for a total of 4 months. No additional therapy with antihistamines, corticosteroids or medicated shampoos was permitted. Evaluations for pruritus and for skin lesions to derive a Canine Atopic Dermatitis Extent and Severity Index (CADESI) score occurred at enrollment and at monthly intervals. One hundred ninety-two (192) dogs were included in the statistical analysis of effectiveness.
At the end of the 30 day placebo controlled period, CADESI scores of dogs treated with cyclosporine capsules improved by 45% from enrollment, while CADESI scores of dogs treated with placebo worsened by 9%. Seventy-four percent (74%) of cyclosporine capsule treated dogs showed improvement in their pruritus scores over the first 30 day period, while only 24% of the placebo treated dogs showed an improvement. Owner and Veterinary Global Assessment in response to treatment also demonstrated statistically significant (p<0.0001) improvement. After 4 weeks of therapy, Owner and Veterinary Global Assessments showed approximately twice as much improvement in the cyclosporine capsule treated dogs as compared to placebo treated dogs.
Improvements in pruritus accompanied by 50% or 75% improvements in CADESI scores resulted in dose reductions to every other day or twice weekly respectively. Not all dogs were able to decrease to twice weekly dosing. Some animals required upward or downward dosage adjustments during the study. Such adjustments should be expected during therapy of this disease. Dogs unable to decrease from once daily dosing after 60 days were considered dose reduction failures for the purposes of the study.
The results of dose assignments, based on the study criteria, for each 4-week dosing period, are shown in the graph.
Analysis of blood levels of cyclosporine drawn during the study demonstrated no correlation between blood cyclosporine levels and CADESI scores or pruritus; therefore monitoring blood cyclosporine levels is not an appropriate predictor of effectiveness.
ANIMAL SAFETY: In a 52-week oral study with dose levels of 0, 1, 3, and 9 times the target initial daily dose, emesis, diarrhea and weight loss were seen in all cyclosporine treated groups with increasing frequency as the dose increased.
Multilocular papilloma-like lesions of the skin were observed in 5 out of 8 high dose animals between weeks 20 and 40. These changes regressed spontaneously after drug was withdrawn.
Other findings in the mid and high dose animals included swollen gums due to chronic gingivitis and periodontitis, lower serum albumin and higher cholesterol, triglyceride, IgA and IgG. Hematological findings consisted of anemia and decreased leukocyte counts in a few high dose animals. Erythrocyte sedimentation rates were increased at all dose levels in a dose dependent fashion. Notable histopathological findings were limited to lymphoid atrophy, hypertrophic gums (from gingivitis) and slight regenerative changes of the renal tubular epithelium in high dose animals. The findings were shown to be reversible during a 12-week recovery phase of the study.
In a 90-day study with cyclosporine, dogs were dosed in one of two patterns: either 1, 3, or 5X the maximum recommended target initial daily dose for 90 days, or 1, 3, or 5X the maximum recommended target initial daily dose for 30 days followed by tapering to mimic the recommended clinical dosing pattern. The maximum recommended dose, when administered for 90 days causes callus-like lesions on the footpads, red/swollen pinnae, mild to moderate gingival proliferation, hyperkeratotic areas on the integument, hair loss, salivation, vomiting, and diarrhea/ abnormal stools. These clinical signs lessened in severity or resolved as the drug was tapered to a lower dose. Increased erythrocyte sedimentation rate, hyperproteinemia, hyperglobulinemia, hypoalbuminemia, hypocalcemia, hypophosphatemia, and hypomagnesemia were observed at three and five times the maximum recommended dose. These resolved as the dose was tapered.
When administered at higher than the maximum recommended dose, raised skin lesions, papilloma-like areas on the integument, popliteal lymph node enlargement, and weight loss were also seen. There were no cyclosporine related changes in urinalysis, ECG, blood pressure, or ophthalmologic exams.
Gross necropsy revealed epithelial changes consistent with those seen on physical examination. Proliferation of gingiva and toe pad epithelium was seen in all cyclosporine dosed groups, and was seen in a dose dependent fashion. The degree of the proliferation was greater in dogs in the non-tapered groups as compared to the tapered groups. Similar changes were noted on histopathologic examination of the cutaneous changes seen on physical examination. These lesions were characterized by epidermal hyperplasia, chronic dermatitis and hyperkeratosis.
Methylprednisolone combination: Twenty-four dogs were administered 1 mg/kg/day methylprednisolone alone for 14 days followed by 20 mg/kg/day cyclosporine either alone or in combination with methylprednisolone, or placebo for 14 days. There was no evidence of seizures/convulsions or neurological signs.
Vaccination effect: The effect of cyclosporine administration on the immunological response to vaccination was evaluated in a study in which 16 dogs were dosed with either cyclosporine at 20 mg/kg/day (4X the initial daily dose) or placebo for 56 days. All dogs were vaccinated on Day 27 with a killed commercial rabies virus and a multivalent vaccine (DHLPP) which included a modified live virus. Antibody titers for rabies, canine distemper, canine adenovirus type 2, parainfluenza, parvovirus, Leptospira canicola, and Leptospira icterohaemorrhagiae were examined on Days 0, 27 (prior to vaccination), 42 and 56. Quantification of CD4, CD8, and CD3 T-lymphocytes was analyzed.
Clinical changes included soft stool and dermatologic changes consistent with those seen in previous studies. Antibody titers did not rise in dogs treated with cyclosporine or the placebo for any component of the multivalent vaccine which included a modified live virus while all animals demonstrated a significant increase in antibody rabies titer by Day 42 or 15 days post-revaccination. No effect was seen on T-lymphocytes.
STORAGE INFORMATION: CYCLAVANCE (cyclosporine oral solution) USP MODIFIED should be stored and dispensed in the original container at temperatures between 68-86°F (20-30°C).
Do not refrigerate because a precipitate may be observed below 68°F (20°C).
Once opened, use contents within 12 weeks.
How Supplied
CYCLAVANCE is supplied in glass amber vials of 15 and 50 mL at 100 mg/mL.
— 15 mL vials are supplied with a 1 mL Luer Lok® oral dosing syringe.
— 50 mL vials are supplied with a 1 mL and 3 mL Luer Lok® oral dosing syringes.
Instructions for Assembling the Dispensing System and Preparing a Dose of CYCLAVANCE™ (cyclosporine oral solution) USP MODIFIED.
Assembling the Dispensing System
The dispensing system consists of three parts:
1. A vial containing the medicine sealed with a rubber stopper
2. A plastic adapter (dispensing system) that you will push onto the top of the vial. The adapter must always remain on the vial after first use.
3. An oral dosing syringe that fits into the top of the plastic adapter to withdraw the prescribed dose of medicine from the vial.
(1 mL syringe with the 5 and 15 mL vial sizes; 1 and 3 mL syringes with the 30 and 50 mL vial sizes)