12.09.2022
Описание препарата Тецентрик® (концентрат для приготовления раствора для инфузий, 60 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 12.09.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Концентрат для приготовления раствора для инфузий | 1 фл. (14/20 мл) |
| действующее вещество: | |
| атезолизумаб | 840/1200 мг |
| вспомогательные вещества: L-гистидин — 43,4/62 мг; уксусная кислота ледяная — 11,5/16,5 мг; сахароза — 575,1/821,6 мг; полисорбат 20 — 5,6/8 мг; вода для инъекций — до 14/20 мл |
Описание лекарственной формы
Прозрачная или опалесцирующая жидкость от бесцветного до коричневато-желтого цвета.
Фармакологическое действие
Фармакологическое действие
—
противоопухолевое.
Фармакодинамика
Механизм действия
При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов. Данное угнетение происходит посредством ингибирования пролиферации T-лимфоцитов и продукции цитокинов. PD-L1 может экспрессироваться на опухолевых клетках и инфильтрирующих опухоль иммунных клетках и участвовать в подавлении противоопухолевого иммунного ответа в микроокружении опухоли.
Атезолизумаб — это гуманизированное моноклональное антитело из класса IgG1 с видоизмененным Fc-фрагментом, которое непосредственно связывается с PD-L1 и блокирует его взаимодействие с рецепторами PD-1 и B7.1. Таким образом, атезолизумаб способствует прекращению опосредованного PD-L1/PD-1 подавления иммунного ответа и вызывает реактивацию противоопухолевого иммунитета. Атезолизумаб не затрагивает взаимодействие рецептора PD-1 с лигандом PD-L2. Блокада рецептора PD-L1 у мышей с генетически родственными моделями опухолей приводит к уменьшению опухолевого роста.
Мутации в кодоне 600 (V600) гена BRAF (v-raf murine sarcoma viral oncogene homolog B1) вызывают гиперактивацию сигнального пути MAPK (митогенактивируемой протеинкиназы), что приводит к пролиферации опухолевых клеток, повышению их выживаемости и подавлению их распознавания иммунной системой. Двойное ингибирование MAPK-пути посредством ингибиторов BRAF и MEK (митогенактивируемая внеклеточная сигнал-регулируемая киназа) подавляет опухолевый рост и повышает иммуногенность опухоли. Это происходит за счет улучшения презентации антигена при увеличении инфильтрации Т-лимфоцитов в опухоль. В животных моделях добавление атезолизумаба к кобиметинибу и вемурафенибу в дальнейшем уменьшает опухолевый рост и приводит к более высокой клеточной инфильтрации и активации по сравнению с применением только таргетной терапии.
Иммуногенность
При применении атезолизумаба возможно развитие реакции со стороны иммунной системы. Положительные результаты анализа на возникшие после начала терапии антитела к атезолизумабу (ATA) отмечались у 13,1–36,4% пациентов. Положительные результаты анализа на нейтрализующие антитела к атезолизумабу (НАA) отмечались у 4,3–19,7% пациентов. Статус АТА и НАА не оказывал клинически значимого влияния на фармакокинетику, эффективность или безопасность атезолизумаба. Данные по иммуногенности в значительной степени зависят от различных факторов, таких как чувствительность и специфичность метода, методология проведения анализа, а также обращение с образцами и время их забора, прием сопутствующих препаратов и характер основного заболевания. Таким образом, сравнение частоты встречаемости антител к препарату Тецентрик® и частоты встречаемости антител к другим препаратам может быть некорректным.
Доклинические данные безопасности
Канцерогенность. Канцерогенный потенциал атезолизумаба не исследовался.
Генотоксичность. Мутагенный потенциал атезолизумаба не исследовался.
Влияние на фертильность. Исследования фертильности при применении атезолизумаба не проводились. Тем не менее в рамках исследования хронической токсичности у яванских макак было выявлено, что препарат Тецентрик® оказывал влияние на менструальный цикл у всех самок обезьян, получавших дозу препарата 50 мг/кг, что проявлялось нерегулярностью цикла во время фазы дозирования и коррелировало с отсутствием вновь сформированного желтого тела в яичниках при терминальной некропсии. Данный эффект был обратим после отмены препарата. Влияние на мужские репродуктивные органы не отмечалось.
Репродуктивная токсичность. Исследования тератогенности или токсичности в отношении репродуктивной системы при применении препарата Тецентрик® не проводились. Установлено, что путь передачи сигнала PD-L1/PD-1 является ключевым для установления иммунологической толерантности материнского организма к плоду, а значит, и для выживаемости плода во время беременности. Ожидается, что применение препарата Тецентрик® будет оказывать неблагоприятное влияние на течение беременности, а также подвергать плод риску и потенциально вызывать гибель эмбриона.
Фармакокинетика
Фармакокинетические параметры атезолизумаба при введении в дозе 840 мг 1 раз в 2 нед и дозе 1200 мг 1 раз в 3 нед сопоставимы.
Фармакокинетика атезолизумаба изучалась при применении доз 0,01–20 мг/кг и фиксированной дозы 1200 мг каждые 3 нед, а также фиксированной дозы 840 мг каждые 2 нед у различных пациентов. Экспозиция атезолизумаба повышалась пропорционально дозе в диапазоне доз от 1 до 20 мг/кг.
Фармакокинетика атезолизумаба описана с использованием линейной двухкамерной модели распределения с элиминацией первого порядка для диапазона доз 1–20 мг/кг. Согласно фармакокинетическому моделированию, общая экспозиция атезолизумаба была сопоставима при применении в дозе 840 мг каждые 2 нед, 1200 мг каждые 3 нед и 1680 мг каждые 4 нед. При этом равновесное состояние достигалось через 6–9 нед при многократном введении атезолизумаба. Коэффициент максимального системного накопления для различных режимов дозирования составляет 3,3.
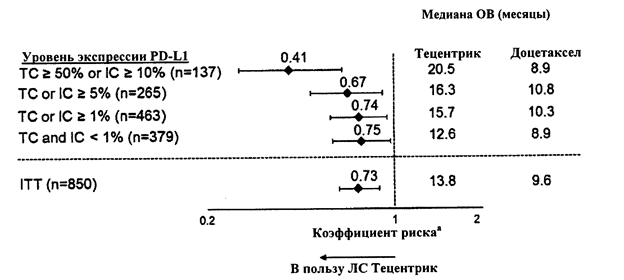
На основании анализа экспозиции, данных профиля эффективности и безопасности следующие факторы не оказывали клинически значимого эффекта: возраст 21–89 лет, масса тела, пол, наличие АТА, уровень альбумина, опухолевая нагрузка, нарушение функции почек, нарушение функции печени легкой степени тяжести, уровень экспрессии PD-L1 или статус по шкале ECOG (шкала Восточной кооперативной группы исследования рака), а также регион или этническая принадлежность пациента.
Всасывание. Препарат Тецентрик® вводится в/в. Другие пути введения препарата не изучались.
Распределение. Согласно результатам анализа популяционной фармакокинетики, Vd в центральной камере (V1) составляет 3,28 л, а Vss — 6,91 л у среднестатистического пациента.
Метаболизм. Исследований метаболизма атезолизумаба не проводилось. Как и другие антитела, атезолизумаб преимущественно подвергается катаболизму.
Выведение. Клиренс атезолизумаба составляет 0,2 л/день, а среднестатистический T1/2 — 27 дней (согласно результатам анализа популяционной фармакокинетики).
Особые группы пациентов
Пациенты пожилого возраста. У пациентов пожилого возраста отдельных исследований фармакокинетики атезолизумаба не проводилось.
Согласно результатам анализа популяционной фармакокинетики, у пациентов от 21 года до 89 лет возраст не оказывает значимого влияния на фармакокинетику атезолизумаба. Клинически значимых различий фармакокинетики атезолизумаба у пациентов младше 65 лет, 65–75 лет и пациентов старше 75 лет не наблюдалось (см. «Способ применения и дозы», Особые указания по дозированию).
Пациенты с нарушением функции почек. У пациентов с нарушением функции почек отдельных исследований фармакокинетики атезолизумаба не проводилось.
Согласно результатам анализа популяционной фармакокинетики, не наблюдалось клинически значимых различий клиренса атезолизумаба у пациентов с нарушением функции почек легкой (расчетная СКФ (рСКФ) 60–89 мл/мин/1,73 м2) или средней (рСКФ 30–59 мл/мин/1,73 м2) степеней тяжести по сравнению с этими показателями у пациентов с нормальной функцией почек (рСКФ ≥90 мл/мин/1,73 м2). Нарушение функции почек тяжелой степени (рСКФ 15–29 мл/мин/1,73 м2) отмечалось у небольшого количества пациентов в клинических исследованиях, в связи с чем неизвестно, оказывает ли тяжелая почечная недостаточность влияние на фармакокинетику атезолизумаба (см. «Способ применения и дозы», Особые указания по дозированию).
Пациенты с нарушением функции печени. Отдельных исследований фармакокинетики атезолизумаба у пациентов с нарушением функции печени не проводилось. Не наблюдалось клинически значимых различий клиренса атезолизумаба у пациентов с нарушением функции печени легкой степени тяжести (концентрация билирубина ≤ ВГН и активность АСТ > ВГН или концентрация билирубина >1,0–1,5×ВГН при любой активности АСТ) или средней степени тяжести (концентрация билирубина >1,5–3,0×ВГН при любой активности АСТ).
Данные для пациентов с нарушением функции печени тяжелой степени (концентрация билирубина >3,0×ВГН при любой активности АСТ) отсутствуют. Нарушение функции печени определялось в соответствии с критериями Национального института рака (NCI) (см. «Способ применения и дозы», Особые указания по дозированию).
Показания
- уротелиальный рак.
Монотерапия местнораспространенного или метастатического уротелиального рака у взрослых пациентов
— местнораспространенный или метастатический уротелиальный рак у пациентов, которые ранее получали платиносодержащую химиотерапию;
— местнораспространенный или метастатический уротелиальный рак с наличием экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, при невозможности лечения цисплатином;
— местнораспространенный или метастатический уротелиальный рак при невозможности проведения любой платиносодержащей химиотерапии независимо от уровня экспрессии PD-L1.
- немелкоклеточный рак легкого.
Адъювантная монотерапия немелкоклеточного рака легкого у взрослых пациентов
Немелкоклеточный рак легкого стадий II–IIIA (система стадирования UICC/AJCC, 7-я редакция) с наличием экспрессии PD-L1 ≥50% на клетках опухоли в качестве адъювантной терапии после полной хирургической резекции и последующей химиотерапии на основе препаратов платины.
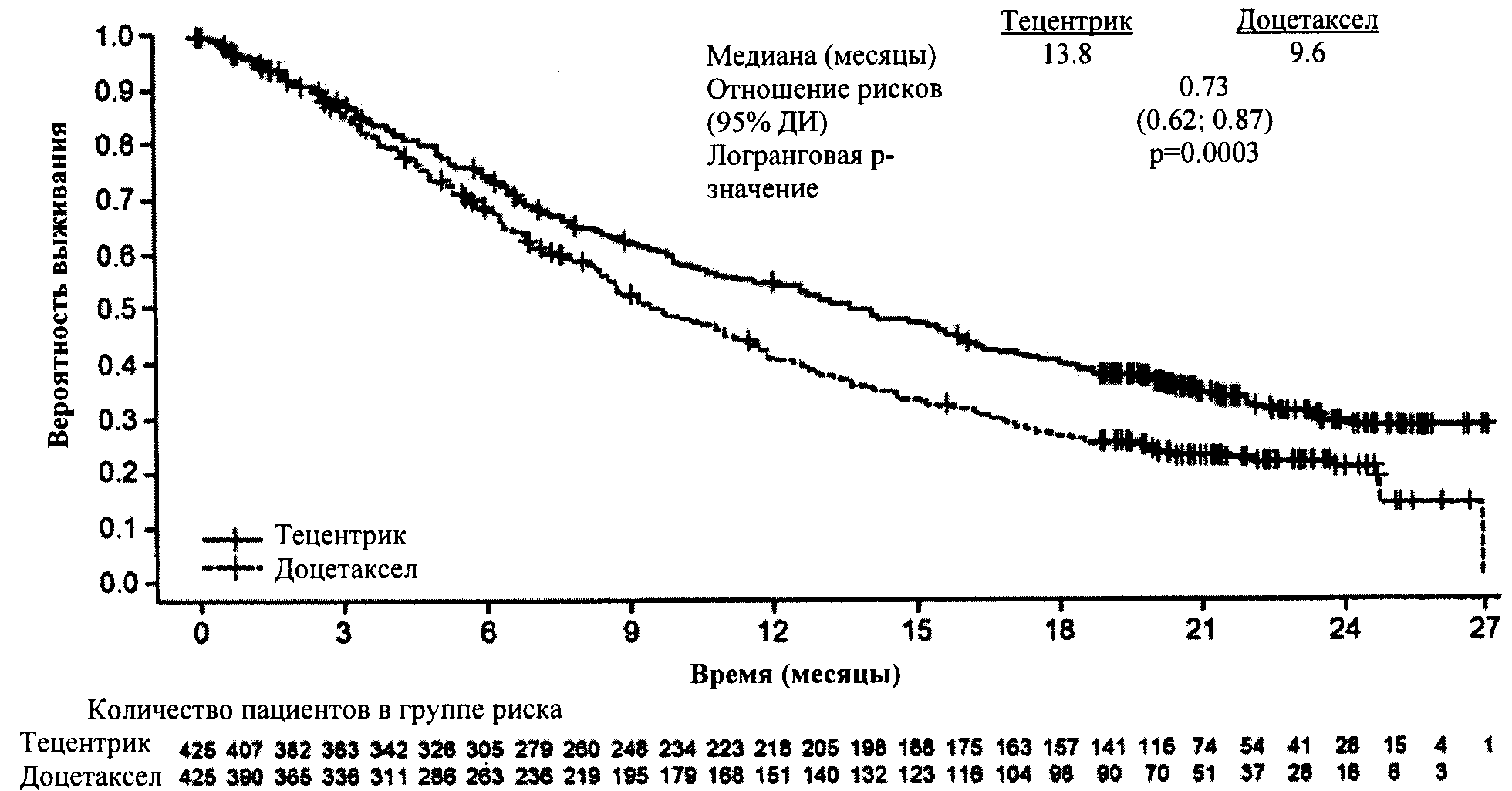
Монотерапия местнораспространенного или метастатического немелкоклеточного рака легкого у взрослых пациентов
— метастатический немелкоклеточный рак легкого с наличием экспрессии PD-L1 ≥50% на клетках опухоли или при наличии экспрессии PD-L1; ≥10% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, при отсутствии EGFR или ALK геномной опухолевой мутации, в первой линии терапии;
— местнораспространенный или метастатический немелкоклеточный рак легкого после предшествующей химиотерапии независимо от уровня экспрессии PD-L1. Пациенты с EGFR или ALK геномной опухолевой мутацией должны также получить таргетную терапию перед началом терапии препаратом Тецентрик®.
Комбинированная терапия метастатического неплоскоклеточного немелкоклеточного рака легкого у взрослых пациентов независимо от уровня экспрессии PD-L1
— метастатический неплоскоклеточный немелкоклеточный рак легкого в комбинации с бевацизумабом, паклитакселом и карбоплатином в первой линии терапии. У пациентов с немелкоклеточным раком легкого с EGFR или ALK геномной опухолевой мутацией препарат Тецентрик® в комбинации с бевацизумабом, паклитакселом и карбоплатином показан только после неэффективности соответствующей таргетной терапии;
— метастатический неплоскоклеточный немелкоклеточный рак легкого в комбинации с наб-паклитакселом и карбоплатином в первой линии терапии при отсутствии EGFR или ALK-геномной опухолевой мутации.
- мелкоклеточный рак легкого.
Комбинированная терапия мелкоклеточного рака легкого у взрослых пациентов
Распространенный мелкоклеточный рак легкого в комбинации с карбоплатином и этопозидом в 1-й линии терапии независимо от уровня экспрессии PD-L1.
- тройной негативный рак молочной железы.
Комбинированная терапия неоперабельного местнораспространенного или метастатического тройного негативного рака молочной железы у взрослых пациентов
Неоперабельный местнораспространенный или метастатический тройной негативный рак молочной железы в комбинации с наб-паклитакселом, при наличии экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, у пациентов без предшествующей химиотерапии по поводу метастатического заболевания.
- гепатоцеллюлярная карцинома.
Комбинированная терапия гепатоцеллюлярной карциномы у взрослых пациентов
Неоперабельная гепатоцеллюлярная карцинома в комбинации с бевацизумабом у пациентов без предшествующей системной терапии независимо от уровня экспрессии PD-L1.
- меланома.
Комбинированная терапия неоперабельной или метастатической меланомы у взрослых пациентов
Неоперабельная или метастатическая меланома с BRAF-V600-мутацией в комбинации с препаратами Котеллик® и Зелбораф® независимо от уровня экспрессии PD-L1.
Противопоказания
- гиперчувствительность к атезолизумабу или любому компоненту препарата в анамнезе;
- беременность;
- период грудного вскармливания;
- детский возраст до 18 лет (эффективность и безопасность применения препарата Тецентрик® у детей и подростков <18 лет не изучались).
С осторожностью: нарушение функции печени тяжелой (концентрация билирубина >3×ВГН и любая активность АСТ) степени (эффективность и безопасность применения препарата Тецентрик® не изучались); аутоиммунные заболевания (эффективность и безопасность применения препарата Тецентрик® не изучались); нарушение функции почек тяжелой степени; тяжелые или жизнеугрожающие нежелательные кожные реакции на лечение другими иммуностимулирующими противоопухолевыми средствами в анамнезе.
Применение при беременности и кормлении грудью
Фертильность. Согласно результатам исследований у животных, препарат Тецентрик® может оказывать влияние на фертильность у женщин с сохранной репродуктивной функцией.
Контрацепция. Женщины с сохранной репродуктивной функцией должны использовать высокоэффективные методы контрацепции и принимать активные меры для предотвращения беременности в период лечения препаратом Тецентрик® и в течение минимум 5 мес после последней инфузии препарата (см. «Особые указания», «Фармакодинамика», Репродуктивная токсичность).
Беременность. Применение препарата Тецентрик® может оказывать отрицательное воздействие на плод в силу механизма действия. Исследования на животных показали, что ингибирование пути PD-L1/PD-1 может приводить к повышенному риску иммуноопосредованного отторжения развивающегося плода и его гибели. Необходимо проинформировать беременную женщину о наличии риска для плода.
Клинические исследования препарата Тецентрик® у беременных женщин не проводились.
Препарат Тецентрик® не следует применять во время беременности (см. «Фармакодинамика», Репродуктивная токсичность).
Применение препарата Тецентрик® в ходе родов и родоразрешения не изучалось.
Период грудного вскармливания. Неизвестно, выводится ли атезолизумаб с грудным молоком. Влияние препарата на образование грудного молока или присутствие препарата Тецентрик® в грудном молоке не исследовались. Поскольку возможность отрицательного воздействия на ребенка, находящегося на грудном вскармливании, неизвестна, следует прекратить либо грудное вскармливание, либо применение препарата Тецентрик®.
Способ применения и дозы
Реклама: ООО «РЛС-Патент», ИНН 5044031277, erid=4CQwVszH9pUkpHxmQQo
В/в.
Общие рекомендации
Замена препарата на какой-либо другой биологический лекарственный препарат требует согласования с лечащим врачом.
Препарат Тецентрик® должен вводиться медицинским персоналом.
Препарат предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Важно. Препарат Тецентрик® необходимо вводить только в виде в/в инфузии.
Важно. Вводить препарат Тецентрик® струйно или болюсно нельзя.
Важно. Одновременно вводить другие медицинские препараты через одну инфузионную систему нельзя.
Первую дозу препарата Тецентрик® необходимо вводить в течение 60 мин.
При хорошей переносимости первой инфузии все последующие инфузии можно проводить в течение 30 мин.
Рекомендуемая доза препарата Тецентрик® составляет:
— 840 мг в виде в/в инфузии каждые 2 нед или
— 1200 мг в виде в/в инфузии каждые 3 нед или
— 1680 мг в виде в/в инфузии каждые 4 нед.
Монотерапия препаратом Тецентрик®
Для решения вопроса о целесообразности терапии препаратом Тецентрик® пациентам следует пройти валидированный тест на экспрессию PD-L1 в следующих случаях:
— до начала терапии местнораспространенного или метастатического уротелиального рака при невозможности лечения цисплатином;
— до начала адъювантной терапии немелкоклеточного рака легкого;
— до начала терапии метастатического немелкоклеточного рака легкого при отсутствии EGFR или ALK геномной опухолевой мутации, в первой линии терапии.
Монотерапия местнораспространенного или метастатического уротелиального рака и монотерапия местнораспространенного или метастатического немелкоклеточного рака легкого
Препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии, до момента утраты клинического эффекта или развития признаков неприемлемой токсичности.
Адъювантная монотерапия немелкоклеточного рака легкого
Препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии, в течение 1 года, при отсутствии рецидива заболевания или развития признаков неприемлемой токсичности.
Комбинированная терапия препаратом Тецентрик®
Рекомендации по дозированию также следует смотреть в соответствующих инструкциях по медицинскому применению. В случае применения в один день, препарат Тецентрик® следует вводить перед в/в комбинированной терапией.
Неплоскоклеточный немелкоклеточный рак легкого в первой линии терапии в комбинации с бевацизумабом, паклитакселом и карбоплатином
Начальная доза: препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии. Бевацизумаб, паклитаксел и карбоплатин применяются каждые 3 нед в течение 4 или 6 циклов.
Поддерживающая доза (следует за начальной): препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии без сопутствующего применения химиотерапии. Бевацизумаб применяется каждые 3 нед.
Препарат Тецентрик® применяется до момента утраты клинического эффекта или развития признаков неприемлемой токсичности. Бевацизумаб применяется до прогрессирования заболевания или развития признаков неприемлемой токсичности.
Неплоскоклеточный немелкоклеточный рак легкого в первой линии терапии в комбинации с наб-паклитакселом и карбоплатином
Начальная доза: препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии. Наб-паклитаксел и карбоплатин применяются каждые 3 нед в течение 4 или 6 циклов. Наб-паклитаксел и карбоплатин применяются в 1-й день каждого 21-дневного цикла. Наб-паклитаксел дополнительно применяется в 8-й и 15-й дни.
Поддерживающая доза (следует за начальной): препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии без сопутствующего применения химиотерапии. Препарат Тецентрик® применяется до момента утраты клинического эффекта или развития признаков неприемлемой токсичности.
Распространенный мелкоклеточный рак легкого в первой линии терапии в комбинации с карбоплатином и этопозидом
Начальная доза: препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии. Карбоплатин и этопозид применяются в виде в/в инфузии каждые 3 нед на протяжении 4 циклов. Карбоплатин и этопозид применяются в 1-й день каждого цикла. Далее этопозид также применяется на 2-й и 3-й дни цикла.
Поддерживающая доза (следует за начальной): препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии без сопутствующего применения химиотерапии. Препарат Тецентрик® применяется до момента утраты клинического эффекта или развития признаков неприемлемой токсичности.
Тройной негативный рак молочной железы в первой линии терапии в комбинации с наб-паклитакселом (экспрессия PD-L1 ≥1%)
Препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии. Наб-паклитаксел применяется в дозе 100 мг/м2 в 1-й, 8-й и 15-й дни каждого 28-дневного цикла. Препарат Тецентрик® применяется до прогрессирования заболевания или развития признаков неприемлемой токсичности.
При отсутствии признаков прогрессирования заболевания или развития признаков неприемлемой токсичности наб-паклитаксел применяется в течение как минимум 6 циклов. Терапия препаратом Тецентрик® может продолжаться даже в случае развития неприемлемой токсичности наб-паклитаксела.
Для решения вопроса о назначении препарата Тецентрик® в первой линии терапии пациентам с тройным негативным раком молочной железы следует пройти валидированный тест на экспрессию PD-L1.
Неоперабельная гепатоцеллюлярная карцинома в комбинации с бевацизумабом
Препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии. Бевацизумаб применяется в дозе 15 мг/кг каждые 3 нед в виде в/в инфузии. Препарат Тецентрик® в комбинации с бевацизумабом применяется до момента утраты клинического эффекта или развития признаков неприемлемой токсичности.
Неоперабельная или метастатическая меланома с BRAF-V600-мутацией в комбинации с препаратами Котеллик® и Зелбораф®
Препарат Тецентрик® применяется согласно схеме, указанной выше, в виде в/в инфузии в комбинации с препаратами Котеллик® и Зелбораф®.
Препарат Котеллик® применяется внутрь в дозе 60 мг/сут (с 1-го по 21-й дни терапии, 7 дней перерыв).
Препарат Зелбораф® применяется внутрь в дозе 720 мг 2 раза в сутки.
Перед началом терапии препаратом Тецентрик® пациенты должны завершить 28-дневный курс терапии препаратами Котеллик® (внутрь 60 мг/сут (с 1-го по 21-й дни терапии, 7 дней перерыв) и Зелбораф® (внутрь 960 мг 2 раза в сутки (с 1-го по 21-й дни) и 720 мг внутрь 2 раза в сутки (с 22-го по 28-й дни). Перед применением комбинированной терапии должен быть проведен валидированный тест на наличие BRAF-V600-мутации.
Препараты Тецентрик®, Зелбораф® и Котеллик® применяются до прогрессирования заболевания или развития признаков неприемлемой токсичности.
Пропуск в плановом введении
При пропуске в плановом введении препарата Тецентрик® необходимо в кратчайшие сроки ввести препарат в рекомендуемой дозе. График введений препарата Тецентрик® должен быть скорректирован с целью поддержания соответствующего интервала между введениями.
Коррекция дозы
Снижение дозы препарата Тецентрик® не рекомендуется.
Коррекция режима дозирования при иммуноопосредованных нежелательных реакциях (НР)
Таблица 1
Рекомендации по коррекции режима дозирования при отдельных НР
| НР | Степень тяжести | Коррекция терапии |
| Пневмонит | 2-я степень | Приостановить терапию1 препаратом Тецентрик® |
| 3-я или 4-я степень | Полностью прекратить лечение препаратом Тецентрик® | |
| Гепатит (пациенты без гепатоцеллюлярной карциномы) | 2-я степень (активность АЛТ или АСТ в 3–5 раз превышает ВГН, или билирубин в крови в 1,5–3 раза превышает ВГН) | Приостановить терапию1 препаратом Тецентрик® |
| 3-я или 4-я степень (активность АЛТ или АСТ в >5 раз превышает ВГН, или билирубин в крови в >3 раза превышает ВГН) | Полностью прекратить лечение препаратом Тецентрик® | |
| Гепатит (пациенты с гепатоцеллюлярной карциномой) | Активность АЛТ/АСТ в пределах нормы на начальном уровне с последующим увеличением в пределах >3 — ≤10 ВГН | Приостановить терапию1 препаратом Тецентрик® |
| Активность АЛТ/АСТ >1 — ≤3 ВГН на начальном уровне с последующим увеличением в переделах >5 — ≤10 ВГН | ||
| Активность АЛТ/АСТ >3 — ≤5 ВГН на начальном уровне с последующим увеличением в переделах >8 — ≤10 ВГН | ||
| Активность АЛТ/АСТ в >10 ВГН или общий билирубин >3 ВГН | Полностью прекратить лечение препаратом Тецентрик® | |
| Колит | Диарея 2-й или 3-й степени (увеличение числа дефекаций/сут ≥4 по сравнению с начальным уровнем) или симптоматический колит |
Приостановить терапию1 препаратом Тецентрик® |
| Диарея 4-й степени или колит (жизнеугрожающий, показано срочное вмешательство) | Полностью прекратить лечение препаратом Тецентрик® | |
| Гипотиреоз | Симптоматический | Приостановить терапию препаратом Тецентрик®. Терапия может быть возобновлена в случае, если симптомы контролируются с помощью заместительной терапии тиреоидным гормоном и уровень ТТГ снижается |
| Гипертиреоз | Симптоматический | Приостановить терапию препаратом Тецентрик®. Терапия может быть возобновлена в случае, если симптомы контролируются с помощью антитиреоидного препарата и функция щитовидной железы улучшается |
| Надпочечниковая недостаточность | Симптоматическая | Приостановить терапию2 препаратом Тецентрик® |
| Гипофизит | 2-я или 3-я степень | Приостановить терапию2 препаратом Тецентрик® |
| 4-я степень | Полностью прекратить лечение препаратом Тецентрик® | |
| Сахарный диабет типа 1 | Гипергликемия 3-й или 4-й степени (уровень глюкозы натощак >250 мг/дл или 13,9 ммоль/л) | Приостановить терапию препаратом Тецентрик®. Лечение может быть возобновлено, когда достигнут метаболический контроль с помощью заместительной терапии инсулином |
| Инфузионные реакции | 1-я или 2-я степень | Снизить скорость инфузии или прервать инфузию. Терапия может быть возобновлена, когда явление разрешилось |
| 3-я или 4-я степень | Полностью прекратить лечение препаратом Тецентрик® | |
| Сыпь/тяжелые кожные нежелательные реакции | 3-я степень или подозрение на синдром Стивенса-Джонсона или токсический эпидермальный некролиз (независимо от степени тяжести) | Приостановить терапию1 препаратом Тецентрик® |
| 4-я степень или подтвержденный синдром Стивенса-Джонсона или токсический эпидермальный некролиз (независимо от степени тяжести) | Полностью прекратить лечение препаратом Тецентрик® | |
| Миастенический синдром/злокачественная миастения, синдром Гийена-Барре, менингит и энцефалит | Все степени тяжести | Полностью прекратить лечение препаратом Тецентрик® |
| Панкреатит | 2-я или 3-я степень или Активность амилазы или липазы в сыворотке крови в >2 раз превышает ВГН |
Приостановить терапию1 препаратом Тецентрик® |
| 4-я степень или любая степень рецидивирующего панкреатита | Полностью прекратить лечение препаратом Тецентрик® | |
| Миокардит | 2-я степень | Приостановить терапию1 препаратом Тецентрик® |
| 3-я или 4-я степень | Полностью прекратить лечение препаратом Тецентрик® | |
| Нефрит | 2-я степень (уровень креатинина в >1,5–3,0 превышает начальный уровень или >1,5–3,0 × ВГН) | Приостановить терапию1 препаратом Тецентрик® |
| 3-я или 4-я степень (уровень креатинина в >3,0 превышает начальный уровень или >3,0 × ВГН) | Полностью прекратить лечение препаратом Тецентрик® | |
| Миозит | 2-я или 3-я степень | Приостановить терапию препаратом Тецентрик® |
| 4-я степень или 3-я степень рецидивирующего миозита | Полностью прекратить лечение препаратом Тецентрик® | |
| Другие иммуноопосредованные нежелательные реакции | 2-я или 3-я степень | Приостановить терапию1 препаратом Тецентрик® |
| 4-я степень или рецидивирующее явление 3-й степени | Полностью прекратить терапию препаратом Тецентрик® (за исключением эндокринопатий, которые контролируется с помощью ЗГТ). |
Критерии токсичности указаны в соответствии с общими критериями терминологии Национального института рака для нежелательных явлений, в. 4.0.
1Терапия может быть возобновлена после купирования или снижения тяжести явления до 0-й или 1-й степени в течение 12 нед, а также после снижения дозы ГКС (преднизолон или его эквивалент) до ≤10 мг/сут.
2Терапия может быть возобновлена после купирования или снижения тяжести явления до 0-й или 1-й степени в течение 12 нед, а также после снижения дозы ГКС (преднизолон или его эквивалент) до ≤10 мг/сут при условии, что состояние пациента стабильно при приеме заместительной терапии.
При возникновении иных иммуноопосредованных НР (в зависимости от типа и тяжести) 2-й или 3-й степеней тяжести терапию препаратом Тецентрик® необходимо приостановить и начать терапию ГКС (1–2 мг/кг/сут преднизолона или его эквивалента).
При купировании или снижении тяжести реакции до ≤1-й степени необходимо постепенно снижать дозу ГКС согласно клиническим показаниям. Терапия препаратом Тецентрик® может быть возобновлена после купирования или снижения тяжести явления до ≤1-й степени в течение 12 нед, а также после снижения дозы ГКС (преднизолон или его эквивалент) до ≤10 мг/сут перорально.
Терапию препаратом Тецентрик® необходимо полностью прекратить при возникновении иммуноопосредованных НР 4-й степени тяжести или невозможности снизить дозу ГКС (преднизолон или его эквивалент) до ≤10 мг/сут в течение 12 нед после возникновения соответствующих реакций.
Особые указания по дозированию
Дети. Препарат Тецентрик® не одобрен к применению у пациентов в возрасте <18 лет. Эффективность и безопасность применения препарата Тецентрик® у данной популяции пациентов не установлены. В ходе исследования клиническая польза препарата не была продемонстрирована (см. «Фармакокинетика», Особые группы пациентов).
Пожилой и старческий возраст. Коррекции дозы препарата Тецентрик® у пациентов в возрасте ≥65 лет не требуется (см. «Фармакокинетика», Особые группы пациентов).
Нарушение функции почек. Коррекции дозы у пациентов с нарушением функции почек легкой и средней степени тяжести не требуется (см. «Фармакокинетика», Особые группы пациентов). Применение препарата у пациентов с нарушением функции почек тяжелой степени не изучалось.
Нарушение функции печени. Коррекции дозы у пациентов с нарушением функции печени легкой и средней степени тяжести не требуется. Применение препарата Тецентрик® у пациентов с нарушением функции печени тяжелой степени не изучалось (см. «Фармакокинетика», Особые группы пациентов).
Правила приготовления и хранения раствора для инфузий
Подготовка препарата к введению должна проводиться в асептических условиях. Следует использовать стерильную иглу и шприц для приготовления раствора для инфузий препарата Тецентрик®.
Важно. Препарат не содержит консервантов, каждый флакон предназначен только для однократного использования.
Важно. Смешивать препарат Тецентрик® с другими препаратами нельзя.
Следует утилизировать любое неиспользованное количество препарата, оставшееся во флаконе.
Приготовление раствора 1680 мг
1. Отобрать 28 мл препарата Тецентрик® из двух флаконов.
2. Развести препарат в инфузионном пакете из ПВХ, ПЭ, полиолефина или полипропилена (ПП), содержащем 250 мл 0,9% стерильного раствора натрия хлорида для инъекций. После разведения препарата 1 мл полученного раствора содержит около 6 мг атезолизумаба (1680 мг/278 мл). Разбавлять необходимо только 0,9% стерильным раствором хлорида натрия для инъекций.
3. Инфузионный пакет осторожно перевернуть для перемешивания раствора, избегая при этом пенообразования. Приготовленный раствор для инфузий должен использоваться сразу после его приготовления.
4. Раствор для парентерального введения перед использованием следует визуально проверить на наличие частиц и изменение цвета. В случае обнаружения частиц или изменения цвета раствор использовать нельзя.
Приготовление раствора 1200 мг
1. Отобрать 20 мл препарата Тецентрик® из флакона.
2. Развести препарат в инфузионном пакете из ПВХ, ПЭ, полиолефина или ПП, содержащем 250 мл 0,9% стерильного раствора натрия хлорида для инъекций. После разведения препарата 1 мл полученного раствора содержит около 4,4 мг атезолизумаба (1200 мг/270 мл). Разбавлять необходимо только 0,9% стерильным раствором хлорида натрия для инъекций.
3. Инфузионный пакет осторожно перевернуть для перемешивания раствора, избегая при этом пенообразования. Приготовленный раствор для инфузий должен использоваться сразу после его приготовления.
4. Раствор для парентерального введения перед использованием следует визуально проверить на наличие частиц и изменение цвета. В случае обнаружения частиц или изменения цвета раствор использовать нельзя.
Приготовление раствора 840 мг
1. Отобрать 14 мл препарата Тецентрик® из флакона.
2. Развести препарат в инфузионном пакете из ПВХ, ПЭ, полиолефина или ПП, содержащем 250 мл 0,9% стерильного раствора натрия хлорида для инъекций. После разведения препарата 1 мл полученного раствора содержит около 3,18 мг атезолизумаба (840 мг/264 мл). Разбавлять необходимо только 0,9% стерильным раствором хлорида натрия для инъекций.
3. Инфузионный пакет осторожно перевернуть для перемешивания раствора, избегая при этом пенообразования. Приготовленный раствор для инфузий должен использоваться сразу после его приготовления.
4. Раствор для парентерального введения перед использованием следует визуально проверить на наличие частиц и изменение цвета. В случае обнаружения частиц или изменения цвета раствор использовать нельзя.
С точки зрения микробиологической чистоты раствор для инфузии должен быть использован сразу после приготовления.
В исключительных случаях готовый раствор может храниться не более 24 ч при температуре 2–8 °C или 8 ч при комнатной температуре (≤30 °С). Если препарат не используется сразу, то время и условия хранения приготовленного раствора являются ответственностью пользователя.
Совместимость
Препарат Тецентрик® совместим с инфузионными пакетами с контактирующей поверхностью из ПВХ, ПЭ или полиолефина, а также с мембранами инфузионных фильтров из полиэфирсульфона или полисульфона, инфузионными системами и другими приспособлениями для инфузий из ПВХ, ПЭ, полибутадиена или полиэфируретана.
Побочные действия
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100); редко (≥1/10000 и <1/1000); очень редко (<1/10000).
Монотерапия препаратом Тецентрик®
В таблице 2 представлены объединенные данные о НР, наблюдавшихся при монотерапии препаратом Тецентрик® у пациентов с различными типами опухолей.
Таблица 2
НР у пациентов, получавших монотерапию препаратом Тецентрик® в ходе клинических исследований
| Класс систем органов | Очень часто | Часто | Нечасто | Редко |
| Инфекционные и паразитарные заболевания | Инфекции мочевыводящего тракта16 | |||
| Со стороны крови и лимфатической системы | Тромбоцитопения14 | |||
| Со стороны иммунной системы | Реакции гиперчувствительности | |||
| Со стороны эндокринной системы | Гипотиреоз2 | Надпочечниковая недостаточность4, сахарный диабет5, гипертиреоз3 | Гипофизит25 | |
| Со стороны обмена веществ и питания | Снижение аппетита | Гипокалиемия22, гипонатриемия23, гипергликемия | ||
| Со стороны нервной системы | Головная боль | Синдром Гийена-Барре6, менингоэнцефалит7 | Миастенический синдром26 | |
| Со стороны ССС | Снижение АД | Миокардит1 | ||
| Со стороны дыхательной системы, органов грудной клетки и средостения | Одышка, кашель | Гипоксия24, пневмонит8, назофарингит28 | ||
| Со стороны ЖКТ | Диарея15, тошнота, рвота | Дисфагия, колит9, боль в животе, боль в ротоглотке17 | Панкреатит10 | |
| Со стороны печени и желчевыводящих путей | Повышение активности АЛТ, повышение активности АСТ, гепатит12 | |||
| Со стороны кожи и подкожных тканей | Сыпь13, зуд | Сухость кожи | Псориатические состояния29, тяжелые кожные нежелательные реакции30 | |
| Со стороны скелетно-мышечной системы и соединительной ткани | Артралгия, боль в спине, боль в мышцах и костях18 | Миозит20,21 | ||
| Со стороны почек и мочевыводящих путей | Повышение концентрации креатинина в крови27 | Нефрит19 | ||
| Общие расстройства и нарушения в месте введения | Повышенная утомляемость, астения, лихорадка | Озноб, гриппоподобный синдром, инфузионные реакции11 |
1Данные исследований, не вошедших в объединенную базу данных. Частота встречаемости основана на экспозиции препарата в рамках всей программы.
2Сообщения включали гипотиреоз, повышение активности ТТГ в крови, тиреоидит, снижение активности ТТГ в крови, тиреоидит, аутоиммунный гипотиреоз, эутиреоидный патологический синдром, микседему, отклонения в результатах тестов функционального состояния щитовидной железы, острый тиреоидит и снижение активности тироксина.
3Сообщения включали гипертиреоз, диффузный токсический зоб, эндокринную офтальмопатию, экзофтальм.
4Сообщения включали надпочечниковую недостаточность, первичную надпочечниковую недостаточность.
5Сообщения включали сахарный диабет, сахарный диабет типа 1, диабетический кетоацидоз и кетоацидоз.
6Сообщения включали синдром Гийена-Барре и демиелинизирующую полинейропатию.
7Сообщения включали энцефалит, менингит, светобоязнь.
8Сообщения включали пневмонит, инфильтрацию легких, бронхиолит, интерстициальную болезнь легких, лучевой пневмонит.
9Сообщения включали колит, аутоиммунный колит, ишемический колит, микроскопический колит, язвенный колит.
10Сообщения включали панкреатит, аутоиммунный панкреатит, острый панкреатит, увеличение активности липазы и амилазы.
11Сообщения включали инфузионные реакции и синдром высвобождения цитокинов.
12Сообщения включали асцит, аутоиммунный гепатит, гепатоцеллюлярное повреждение, гепатит, острый гепатит, гепатотоксичность, нарушение функции печени, лекарственноиндуцированное повреждение печени, печеночную недостаточность, жировой гепатоз, очаговое поражение печени, кровотечение из варикозных вен пищевода, варикозное расширение вен пищевода.
13Сообщения включали сыпь, макулопапулезную сыпь, эритему, зудящую сыпь, акнеиформный дерматит, экзему, дерматит, эритематозную сыпь, язву кожных покровов, папулезную сыпь, фолликулит, макулезную сыпь, шелушение кожи, пустулезную сыпь, фурункул, акне, лекарственный дерматит, синдром ладонно-подошвенной эритродизестезии, себорейный дерматит, аллергический дерматит, эритему кожи век, токсическое поражение кожи, сыпь на коже век, стойкую эритему, папулосквамозную сыпь, везикулярную сыпь, волдыри, волдыри на губах, пемфигоид и кровавый волдырь в полости рта.
14Сообщения включали тромбоцитопению и снижение числа тромбоцитов.
15Сообщения включали диарею, частую дефекацию и усиление желудочно-кишечной моторики.
16Сообщения включали инфекции мочевыводящего тракта, цистит, пиелонефрит, инфекции мочевыводящего тракта, вызванные энтеробактериями рода Escherichia, острый пиелонефрит, бактериальные инфекции мочевыводящего тракта, инфекции почек, грибковые инфекции мочевыводящего тракта, инфекции мочевыводящего тракта, вызванные бактериями рода Pseudomonas.
17Сообщения включали боль в ротоглотке, раздражение горла, дискомфорт в ротоглотке.
18Сообщения включали скелетно-мышечную боль, миалгию и боль в костях.
19Сообщения включали нефрит и нефрит с пурпурой Шенлейна-Геноха.
20Сообщения включали миозит, рабдомиолиз, ревматическую полимиалгию, дерматомиозит, абсцесс мышц, наличие миоглобина в моче.
21Фатальные случаи отмечались в клинических исследованиях, не вошедших в исследовательский пул данных.
22Сообщения включали гипокалиемию и снижение уровня калия в крови.
23Сообщения включали гипонатриемию и снижение уровня натрия в крови.
24Сообщения включали гипоксию, снижение насыщения кислородом (сатурация), снижение парциального давления кислорода (РО2).
25Сообщения включали гипофизит и нарушение температурной регуляции.
26Сообщения включали тяжелую псевдопаралитическую миастению (миастения gravis).
27Сообщения включали повышение концентрации креатинина в крови и гиперкреатининемию.
28Сообщения включали назофарингит, заложенность носа и ринорею.
29Сообщения включали псориазоформный дерматит и псориаз.
30Сообщения включали буллезный дерматит, эксфолиативную сыпь, многоформную эритему, генерализованный эксфолиативный дерматит, токсическую кожную сыпь и токсический эпидермальный некролиз.
Комбинированная терапия препаратом Тецентрик®
В таблице 3 представлены дополнительные данные о НР, наблюдавшихся в ходе клинических исследований при применении препарата Тецентрик® в составе комбинированной терапии.
В таблице 3 также представлены НР, имеющие клинически значимые отличия при комбинированной терапии по сравнению с монотерапией препаратом Тецентрик® (см. таблицу 2 выше).
Меланома. У пациентов, получавших препарат Тецентрик® в комбинации с препаратами Котеллик® и Зелбораф®, чаще отмечались отклонения функциональных показателей печени (49,6%), панкреатит (38,7%), гипотиреоз (26,1%), гипертиреоз (18,7%), пневмонит (12,6%), менингоэнцефалит (2,6%), сахарный диабет (1,7%), миозит (1,3%), нефрит (1,3%) и гипофизит (0,9%).
Таблица 3
НР у пациентов, получавших комбинированную терапию препаратом Тецентрик® в ходе клинических исследований
| Класс систем органов | Очень часто | Часто | Нечасто |
| Инфекционные и паразитарные заболевания | Инфекция легкого*,8 | Сепсис17 | |
| Со стороны крови и лимфатической системы | Анемия*, нейтропения*, 1, тромбоцитопения*, α, 2, лейкопения*9 | Лимфопения*,11 | |
| Со стороны иммунной системы | Реакции гиперчувствительности | ||
| Со стороны эндокринной системы | Гипотиреоз*, α, 3 | Гипертиреозα | Гипофизитα,5, надпочечниковая недостаточностьα,4 |
| Со стороны обмена веществ и питания | Гипомагниемия*10, снижение аппетита | Гипокалиемия18, гипонатриемия19 | |
| Со стороны нервной системы | Периферическая нейропатия*, 6 | Дисгевзия*, обморок*, головокружение* | |
| Со стороны сосудов | Повышение АД*14 | ||
| Со стороны дыхательной системы, органов грудной клетки и средостения | Назофарингит15 | Дисфония* | |
| Со стороны ЖКТ | Тошнота, диарея20, запор*, рвота | Стоматит*, дисгевзия | |
| Со стороны кожи и подкожных тканей | Сыпь21, зуд, алопеция13 | Тяжелые кожные нежелательные реакции16, псориаз | |
| Со стороны скелетно-мышечной системы и соединительной ткани | Артралгия, боль в мышцах и костях22, боль в спине | ||
| Со стороны почек и мочевыводящих путей | Протеинурия*,7, повышение концентрации креатинина в крови23 | Нефритα,12 | |
| Влияние на результаты лабораторных исследований | Повышение активности ЩФ в крови | ||
| Общие расстройства и нарушения в месте введения | Периферический отек*, гипертермия, утомляемость, астения |
*НР, встречающиеся с частотой ≥5% (все степени тяжести) или ≥2% (3–4-я степени тяжести) по сравнению с контрольной группой.
αНаблюдаемая частота в комбинированной терапии представляет клинически значимые отличия по сравнению с монотерапией препаратом Тецентрик®.
1Сообщения включали нейтропению, снижение числа нейтрофилов, фебрильную нейтропению, нейтропенический сепсис, гранулоцитопению.
2Сообщения включали тромбоцитопению и снижение числа тромбоцитов.
3Сообщения включали гипотиреоз, повышение активности ТТГ в крови, снижение активности ТТГ в крови, аутоиммунный тиреоидит, зоб, тиреоидит, снижение концентрации свободного тироксина, снижение концентрации свободного трийодтиронина, нарушение функций щитовидной железы, повышение концентрации свободного тироксина, повышение концентрации тироксина, снижение концентрации трийодтиронина, повышение концентрации свободного трийодтиронина, патологическую концентрацую ТТГ, синдром эутироидной слабости, микседематозная кома, патологические результаты при оценке функций щитовидной железы, снижение концентрации тироксина, патологическую концентрацию трийодтиронина, бессимптомный тиреоидит и хронический тиреоидит.
4Сообщения включали надпочечниковую недостаточность, снижение уровня кортизола, острую недостаточность коры надпочечников, вторичную недостаточность коры надпочечников, патологические результаты теста стимуляции АКТГ, болезнь Аддисона, воспаление надпочечника, недостаточность АКТГ.
5Сообщения включали гипофизит и нарушение температурной регуляции.
6Сообщения включали периферическую нейропатию, периферическую сенсорную нейропатию, полинейропатию, опоясывающий лишай, периферическую двигательную нейропатию, аутоиммунную нейропатию, невралгическую амиотрофию, периферическую сенсорно-моторную нейропатию, аксональную нейропатию, пояснично-крестцовую плексопатию, нейропатическую артропатию и токсическую нейропатию, инфекцию периферических нервов.
7Сообщения включали протеинурию, наличие белка в моче, гемоглобинурию и нефротический синдром, патологические изменения мочи и альбуминурию.
8Сообщения включали пневмонию, бронхит, инфекции легкого, инфекцию нижних дыхательных путей, трахеобронхит, инфекционное обострение хронической обструктивной болезни дыхательных путей, инфекционный плевральный выпот, параканкрозную пневмонию, атипичную пневмонию, абсцесс легкого, инфекцию плевры, пневмоторакс.
9Сообщения включали снижение числа лейкоцитов и лейкопению.
10Сообщения включали гипомагниемию и снижение уровня магния в крови.
11Сообщения включали лимфопению и снижение числа лимфоцитов.
12Сообщения включали нефрит, тубулоинтерстициальный нефрит, аутоиммунный нефрит, аллергический нефрит, гломерулонефрит, нефротический синдром и мезангиопролиферативный гломерулонефрит.
13Сообщения включали алопецию, мадароз, очаговую алопецию, тотальную алопецию и гипотрихоз.
14Сообщения включали гипертензию, повышение кровяного давления, гипертонический криз, повышение сАД, диастолическую гипертензию, неадекватный контроль кровяного давления и гипертоническую ретинопатию.
15Сообщения включали назофарингит, заложенность носа и ринорею.
16Сообщения включали буллезный дерматит, экфолиативную сыпь, многоформную эритему, генерализованный эксфолиативный дерматит, токсическую кожную сыпь, синдром Стивенса-Джонсона, лекарственную реакцию с эозинофилией и системными симптомами, токсический эпидермальный некролиз и кожный васкулит (случаи синдрома Стивенса-Джонсона и лекарственной реакции с эозинофилией и системными симптомами отмечались в исследованиях вне объединенных данных).
17Сообщения включали сепсис, септический шок, уросепсис, нейтропенический сепсис, легочный сепсис, бактериальный сепсис, сепсис, вызванный бактериями рода Klebsiella, абдоминальный сепсис, сепсис, вызванный грибами рода Candida, сепсис, вызванный бактериями рода Escherihia, Pseudomonas, Staphylococcus.
18Сообщения включали гипокалиемию и снижение уровня калия в крови.
19Сообщения включали гипонатриемию и снижение уровня натрия в крови.
20Сообщения включали диарею, позывы к дефекации, частую дефекацию, геморрагическую диарею и усиление желудочно-кишечной моторики.
21Сообщения включали акне, пустулезные акне, волдыри, кровавые волдыри, дерматит, акнеиформный дерматит, аллергический дерматит, эксфолиативный дерматит, лекарственный дерматит, экзему, инфицированную экзему, эритему, эритему кожи век, сыпь на коже век, стойкую эритему, фолликулит, фурункул, дерматит кожи рук, волдыри на губах, кровавые волдыри в полости рта, синдром ладонно-подошвенной эритродизестезии, сыпь, эритематозную сыпь, фолликулярную сыпь, генерализованную сыпь, макулезную сыпь, макулопапулезную сыпь, папулезную сыпь, папулосквамозную сыпь, зудящую сыпь, пустулезную сыпь, везикулярную сыпь, дерматит мошонки, себорейный дерматит, шелушение кожи, токсическое поражение кожи, язвы на коже.
22Сообщения включали боль в мышцах и костях, миалгию и боль в спине.
23Сообщения включали повышение концентрации креатинина в крови и гиперкреатининемию.
Описание отдельных НР
Указанные данные представлены для значимых НР при монотерапии препаратом Тецентрик®. Данные о важных НР представлены в случае их клинически значимого отличия при комбинированной терапии по сравнению с монотерапией препаратом Тецентрик®. Дополнительная информация по контролю перечисленных ниже состояний представлена в разделе «Особые указания».
Иммуноопосредованный пневмонит
Развитие пневмонита наблюдалось у 2,7% пациентов, получавших монотерапию препаратом Тецентрик®; у 1 пациента данная НР привела к летальному исходу. Медиана времени до начала проявления признаков пневмонита составила 3,4 мес (диапазон: 0,1–24,8 мес). Медиана длительности течения пневмонита составила 1,4 мес (диапазон: от 0 до 21,2 мес). У 12 пациентов (0,4%) пневмонит стал причиной постоянной отмены препарата Тецентрик®. Пневмонит, требующий сопутствующего применения ГКС, был зарегистрирован у 1,6% пациентов, получавших препарат.
Иммуноопосредованный гепатит
Развитие гепатита наблюдалось у 2% пациентов, получавших монотерапию препаратом Тецентрик®, два явления были фатальными. Медиана времени до начала проявления признаков гепатита составила 1,5 мес (диапазон: 0,2–18,8 мес). Медиана длительности течения гепатита составила 2,1 мес (диапазон: 0–22 мес). У 6 пациентов (0,2%) гепатит стал причиной отмены препарата Тецентрик®. Гепатит, требующий сопутствующего применения ГКС, был зарегистрирован у 0,6% пациентов, получавших препарат.
Иммуноопосредованный колит
Развитие колита наблюдалось у 1,1% пациентов, получавших препарат Тецентрик®. Медиана времени до проявления признаков колита составила 4,7 мес (диапазон: 0,5–17,2 мес). Медиана длительности течения колита составила 1,2 мес (диапазон: 0,1–17,8 мес). У 8 пациентов (0,3%) колит стал причиной отмены препарата Тецентрик®. Колит, требующий сопутствующего применения ГКС, был зарегистрирован у 0,6% пациентов, получавших препарат.
Иммуноопосредованные эндокринопатии
Нарушения функции щитовидной железы. Развитие гипотиреоза наблюдалось у 5,2% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков гипотиреоза составила 4,9 мес (диапазон: от 0 до 31,3 мес).
Развитие гипертиреоза наблюдалось у 0,9% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков гипертиреоза составила 2,1 мес (диапазон: от 0,7 до 15,7 мес). Медиана длительности течения гипертиреоза составила 2,6 мес (диапазон: от 0 до 17,1 мес).
Развитие гипертиреоза наблюдалось у 4,9% пациентов, получавших препарат Тецентрик® в комбинации с карбоплатином и наб-паклитакселом. У 1 пациента (0,2%) развитие гипертиреоза привело к отмене терапии препаратом Тецентрик®.
Надпочечниковая недостаточность. Развитие надпочечниковой недостаточности наблюдалось у 0,3% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков надпочечниковой недостаточности составила 5,5 мес (диапазон: от 0 до 19 мес). Медиана длительности течения надпочечниковой недостаточности составила 16,8 мес (диапазон: 0–16,8 мес). У 1 пациента (<0,1%) развитие надпочечниковой недостаточности привело к отмене терапии препаратом Тецентрик®. Надпочечниковая недостаточность, требующая сопутствующего применения ГКС, была зарегистрирована у 0,3% пациентов, получавших препарат.
Развитие надпочечниковой недостаточности наблюдалось у 1,5% пациентов, получавших препарат Тецентрик® в комбинации с карбоплатином и наб-паклитакселом. Надпочечниковая недостаточность, требующая сопутствующего применения ГКС, была зарегистрирована у 0,8% пациентов, получавших препарат Тецентрик® в комбинации с карбоплатином и наб-паклитакселом.
Гипофизит. Развитие гипофизита наблюдалось у <0,1% пациентов, получающих монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков гипофизита составляла 7,2 мес (диапазон: от 0,8 до 13,7 мес). Одному пациенту потребовалось применение ГКС и отмена терапии препаратом Тецентрик®.
Развитие гипофизита наблюдалось у 0,8% пациентов, получающих препарат Тецентрик® в комбинации с бевацизумабом, паклитакселом и карбоплатином. Медиана времени до проявления признаков гипофизита составила 7,7 мес (диапазон: от 5 до 8,8 мес). Всем 3 пациентам потребовалось применение ГКС.
Сахарный диабет. Развитие сахарного диабета наблюдалось у 0,3% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков сахарного диабета составила 4,2 мес (диапазон: от 0,1 до 9,9 мес). Медиана длительности течения сахарного диабета составила 1,6 мес (диапазон: 0,1–15,2 мес). У 3 пациентов (<0,1%) сахарный диабет стал причиной отмены препарата Тецентрик®.
Иммуноопосредованный менингоэнцефалит
Развитие менингоэнцефалита наблюдалось у 0,4% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков менингоэнцефалита составила 0,5 мес (диапазон: от 0 до 12,5 мес). Медиана длительности течения менингоэнцефалита составила 0,7 мес (диапазон: от 0,2 до 14,5 мес). Менингоэнцефалит, требующий сопутствующего применения ГКС, наблюдался у 0,2% пациентов, получающих препарат Тецентрик®, при этом у 4 (0,1%) пациентов терапия препаратом Тецентрик® была прекращена.
Иммуноопосредованные нейропатии
Развитие нейропатии, включая синдром Гийена-Барре и демиелинизирующую полинейропатию, наблюдалось у 0,2% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков нейропатии составила 7 мес (диапазон: от 0,6 до 8,1 мес). Медиана длительности течения нейропатии составила 7 мес (от 0,6 до 8,1 мес). Медиана длительности течения нейропатии составила 8 мес (от 0,6 до 8,3 мес). У 1 пациента (<0,1%) синдром Гийена-Барре стал причиной отмены препарата Тецентрик®. Синдром Гийена-Барре, требующий применения ГКС, был зарегистрирован у 2 пациентов (<0,1%), получающих терапию препаратом Тецентрик®.
Иммуноопосредованный панкреатит
Развитие панкреатита, включая повышение активности амилазы и липазы, наблюдалось у 0,6% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков панкреатита составила 5 мес (диапазон: от 0,3 до 16,9 мес). Медиана длительности течения панкреатита составила 0,8 мес (диапазон: от 0,1 до 12 мес). Отмена терапии препаратом Тецентрик® вследствие развития панкреатита отмечалась у 3 пациентов (<0,1%). Панкреатит, требующий сопутствующего применения ГКС, был зарегистрирован у 4 пациентов (0,1%), получавших препарат.
Иммуноопосредованный миозит
Развитие миозита наблюдалось у 0,4% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков миозита составила 5,1 мес (диапазон: от 0,7 до 11 мес). Медиана длительности течения миозита составила 5 мес (диапазон: от 0,7 до 22,6 мес). Отмена терапии препаратом Тецентрик® вследствие развития миозита отмечалась у 1 пациента (<0,1%). Миозит, требующий сопутствующего применения глюкокортикостероидов, был зарегистрирован у 7 пациентов (0,2%), получавших препарат.
Иммуноопосредованный нефрит
Развитие нефрита наблюдалось у <0,1% пациентов, получавших монотерапию препаратом Тецентрик®. Медиана времени до проявления признаков нефрита составила 13,1 мес (диапазон: от 9 до 17,5 мес). Медиана длительности течения нефрита составила 2,8 мес (диапазон: от 0,5 до 9,5 мес). Отмена терапии препаратом Тецентрик® вследствие развития нефрита отмечалась у 2 пациентов (<0,1%). Нефрит, требующий сопутствующего применения ГКС, был зарегистрирован у 1 пациента, получавшего препарат.
Иммуноопосредованные тяжелые кожные НР
Тяжелые кожные НР наблюдались у 0,7% пациентов, получавших монотерапию препаратом Тецентрик®.
Медиана времени до проявления признаков тяжелых кожных НР составила 5,9 мес (диапазон: от 0,1 до 15,5 мес).
Медиана длительности составила 1,6 мес (диапазон: от 0 до 22,1+ мес; «+» обозначает цензурированное значение).
Отмена терапии препаратом Тецентрик® вследствие развития тяжелых кожных НР отмечалась у 3 пациентов (<0,1%).
Тяжелые кожные НР, требующие сопутствующего применения ГКС, были зарегистрированы у 0,2% пациентов, получавших монотерапию препаратом Тецентрик®.
Пострегистрационное применение
В ходе пострегистрационного применения новых нежелательных явлений обнаружено не было.
Взаимодействие
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Реклама: ООО «ВЕДАНТА», ИНН 7714886235, erid 4CQwVszH9pUkKJ7jUDd
Реклама: ООО «РЛС-Библиомед» ИНН 7714758963
Отдельных фармакокинетических исследований взаимодействия атезолизумаба с другими ЛС не проводилось.
Поскольку атезолизумаб выводится посредством катаболизма, метаболического лекарственного взаимодействия не ожидается.
Перед применением атезолизумаба следует избегать использования системных ГКС или иммунодепрессантов из-за их потенциального влияния на фармакодинамическую активность и эффективность атезолизумаба. Тем не менее после начала терапии атезолизумабом системные ГКС или другие иммунодепрессанты могут использоваться для лечения иммуноопосредованных НР (см. «Особые указания» и «Способ применения и дозы»).
Передозировка
Информация о передозировке препарата Тецентрик® отсутствует.
Особые указания
В медицинской документации пациента следует указывать торговое наименование (Тецентрик®) и номер серии введенного препарата.
Иммуноопосредованный пневмонит
В ходе клинических исследований препарата Тецентрик® наблюдались случаи пневмонита, в т.ч. с летальным исходом (см. «Побочные действия»). Необходимо тщательно наблюдать за пациентами на предмет возникновения признаков и симптомов пневмонита.
Рекомендации по коррекции режима дозирования при иммуноопосредованном пневмоните указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованный гепатит
В клинических исследованиях препарата Тецентрик® наблюдались случаи гепатита, в т.ч. с летальным исходом (см. «Побочные действия»). Необходимо тщательно отслеживать возникновение признаков и симптомов гепатита.
Следует мониторировать активность АСТ, АЛТ и концентрацию билирубина до начала терапии препаратом Тецентрик® и периодически в ходе лечения.
У пациентов с отклонениями функциональных показателей печени, выявленными на исходном уровне, следует рассмотреть вопрос о проведении соответствующего лечения.
Рекомендации по коррекции режима дозирования при иммуноопосредованном гепатите указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованный колит
В клинических исследованиях препарата Тецентрик® наблюдались случаи диареи или колита (см. «Побочные действия»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков/симптомов колита.
Рекомендации по коррекции режима дозирования при иммуноопосредованном колите указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованные эндокринопатии
В ходе клинических исследований препарата Тецентрик® наблюдались случаи гипотиреоза, гипертиреоза, гипофизита, надпочечниковой недостаточности и сахарного диабета типа 1, включая диабетический кетоацидоз (см. «Побочные действия»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов эндокринопатий. Требуется наблюдение за изменениями функции щитовидной железы до начала терапии препаратом Тецентрик® и периодически в ходе лечения. У пациентов с отклонениями функциональных показателей щитовидной железы на исходном уровне следует рассмотреть вопрос о проведении соответствующего лечения.
Пациенты с бессимптомными отклонениями функциональных показателей щитовидной железы могут получать терапию препаратом Тецентрик®.
Рекомендации по коррекции режима дозирования при иммуноопосредованных эндокринопатиях указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованный менингоэнцефалит
В ходе клинических исследований препарата Тецентрик® наблюдались случаи менингоэнцефалита (см. «Побочные действия»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов менингита или энцефалита.
Рекомендации по коррекции режима дозирования при иммуноопосредованном менингоэнцефалите указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованные нейропатии
В ходе клинических исследований препарата Тецентрик® наблюдались случаи миастенического синдрома/злокачественной миастении или синдрома Гийена-Барре, которые могли иметь угрожающий жизни характер (см. «Побочные действия»). За пациентами необходимо тщательно наблюдать на предмет возникновения симптомов моторной и сенсорной нейропатии.
Рекомендации по коррекции режима дозирования при иммуноопосредованных нейропатиях указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованный панкреатит
В клинических исследованиях препарата Тецентрик® отмечались случаи панкреатита, включая повышение активности амилазы и липазы сыворотки (см. «Побочные действия»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов развития острого панкреатита.
Рекомендации по коррекции режима дозирования при иммуноопосредованном панкреатите указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованный миокардит
В клинических исследованиях препарата Тецентрик® отмечались случаи миокардита, в т.ч. 1 случай с летальным исходом (см. «Побочные действия»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов развития миокардита.
Рекомендации по коррекции режима дозирования при иммуноопосредованном миокардите указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованный миозит
В клинических исследованиях препарата Тецентрик® наблюдались случаи миозита, включая фатальные (см. «Побочные действия»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков/симптомов миозита. Рекомендации по коррекции режима дозирования при иммуноопосредованном миозите указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованный нефрит
В клинических исследованиях препарата Тецентрик® отмечались случаи нефрита (см. «Побочные действия»). Необходимо тщательно наблюдать за пациентами на предмет изменения функций почек.
Рекомендации по коррекции режима дозирования при иммуноопосредованном нефрите указаны в разделе «Способ применения и дозы», таблица 1.
Инфузионные реакции
В ходе клинических исследований препарата Тецентрик® наблюдались случаи инфузионных реакций (см. «Побочные действия»).
Рекомендации по коррекции режима дозирования при развитии инфузионных реакций указаны в разделе «Способ применения и дозы», таблица 1.
Иммуноопосредованные тяжелые кожные НР
При применении препарата Тецентрик® отмечались случаи иммуноопосредованных тяжелых кожных НР, включая случаи синдрома Стивенса-Джонсона и токсический эпидермальный некролиз.
Пациентов следует мониторировать на предмет подозреваемых тяжелых кожных реакций, следует также исключить другие причины.
Лечение препаратом Тецентрик® следует приостановить на основании тяжести НР, а именно при развитии кожной реакции 3-й степени тяжести до ее разрешения до ≤1-й степени тяжести или полностью прекратить при развитии кожной реакции 4-й степени тяжести и ввести ГКС (см. «Способ применения и дозы»).
При подозрении на тяжелые кожные НР пациентов следует направить к специалисту для дальнейшей постановки диагноза и контроля.
Лечение препаратом Тецентрик® следует приостановить у пациентов с подозрением на синдром Стивенса-Джонсона или токсический эпидермальный некролиз. В случае подтвержденного синдрома Стивенса-Джонсона или токсического эпидермального некролиза терапию препаратом Тецентрик® следует полностью прекратить.
Необходимо соблюдать осторожность при рассмотрении назначения препарата Тецентрик® пациенту с тяжелыми или жизнеугрожающими нежелательными кожными реакциями на лечение другими иммуностимулирующими противоопухолевыми средствами в анамнезе.
Меры предосторожности при определенных заболеваниях
Применение атезолизумаба в комбинации с бевацизумабом, паклитакселом и карбоплатином при метастатическом неплоскоклеточном немелкоклеточном раке легкого. Перед началом терапии лечащему врачу следует тщательно оценить комбинацию рисков при применении схемы лечения, состоящей из 4 препаратов: атезолизумаб, бевацизумаб, паклитаксел и карбоплатин (см. «Побочные действия»).
Применение атезолизумаба в комбинации с наб-паклитакселом при метастатическом тройном негативном раке молочной железы. Нейтропения и периферические нейропатии, которые отмечались при применении атезолизумаба и наб-паклитаксела, могут быть обратимыми в случае прерывания введения наб-паклитаксела. Лечащим врачам следует обратиться к инструкции по применению наб-паклитаксела в отношении отдельных мер предосторожности и противопоказаний для данного лекарственного препарата.
Применение атезолизумаба при ранее нелеченном уротелиальном раке при невозможности проведения терапии цисплатином. Исходные и прогностические характеристики заболевания в соответствующей группе пациентов в исследовании были в целом сопоставимы с таковыми у пациентов в клинической практике, которым было невозможно провести терапию цисплатином, но было возможно провести комбинированную терапию на основе карбоплатина.
Данных в подгруппе пациентов, которым было невозможно провести любую химиотерапию, недостаточно.
Таким образом, применять атезолизумаб у таких пациентов необходимо с осторожностью после тщательной оценки потенциального баланса пользы и риска на индивидуальной основе.
Применение атезолизумаба в комбинации с бевацизумабом, паклитакселом и карбоплатином. Пациенты с немелкоклеточным раком легкого и четкой инфильтрацией опухоли в торакальные магистральные сосуды или четкой кавитацией легочных очагов (которые видны на снимках) исключались из соответствующего опорного клинического исследования после сообщения о нескольких случаях легочных кровотечений с летальным исходом, что является общеизвестным фактором риска для терапии бевацизумабом.
Ввиду отсутствия данных, у таких пациентов атезолизумаб необходимо применять с осторожностью после тщательной оценки баланса пользы и риска для каждого пациента.
Применение атезолизумаба в комбинации с бевацизумабом, паклитакселом и карбоплатином у EGFR+ пациентов с немелкоклеточным раком легкого и прогрессированием заболевания при терапии эрлотинибом и бевацизумабом. В соответствующем опорном исследовании не было получено данных по эффективности атезолизумаба в комбинации с бевацизумабом, паклитакселом и карбоплатином у EGFR+ пациентов, у которых ранее отмечалось прогрессирование заболевания при применении эрлотиниба и бевацизумаба.
Применение атезолизумаба в комбинации с бевацизумабом при гепатоцеллюлярной карциноме. Данные у пациентов с гепатоцеллюлярной карциномой и заболеванием печени класса B по шкале Чайлд-Пью, которые получали атезолизумаб в комбинации с бевацизумабом, очень ограничены; данные о пациентах с гепатоцеллюлярной карциномой и заболеванием печени класса С по шкале Чайлд-Пью на сегодняшний день отсутствуют.
Риск кровотечений повышен у пациентов, получающих бевацизумаб.
Отмечались случаи тяжелых желудочно-кишечных кровотечений, включая случаи с летальным исходом, у пациентов с гепатоцеллюлярной карциномой, которые получали атезолизумаб в комбинации с бевацизумабом. Необходимо провести скрининг и последующее лечение варикоза вен пищевода в соответствии с клинической практикой у пациентов с гепатоцеллюлярной карциномой перед началом терапии атезолизумабом в комбинации с бевацизумабом. Применение бевацизумаба следует полностью прекратить у пациентов с кровотечениями 3-й или 4-й степени тяжести, которые получают комбинированную терапию (см. инструкцию по применению бевацизумаба).
При применении атезолизумаба в комбинации с бевацизумабом может развиться сахарный диабет. Лечащим врачам следует мониторировать показатели глюкозы крови перед началом и периодически во время лечения атезолизумабом в комбинации с бевацизумабом в соответствии с клиническими показаниями.
Применение атезолизумаба в виде монотерапии первой линии метастатического немелкоклеточного рака легкого. Лечащим врачам следует учесть отсроченное начало эффекта терапии атезолизумабом до начала монотерапии 1-й линии у пациентов с немелкоклеточным раком легкого.
Более высокое число летальных случаев в рамках 2,5 мес после рандомизации с последующей более длительной пользой по показателю выживаемости отмечалось при применении атезолизумаба по сравнению с химиотерапией. Специфических факторов, связанных с ранними летальными исходами, установить не удалось.
Особые группы пациентов
Пациенты с аутоиммунными заболеваниями не подлежали включению в программу клинических исследований препарата Тецентрик®, данные изучения эффективности и безопасности препарата у таких пациентов отсутствуют. У пациентов с аутоиммунными заболеваниями препарат Тецентрик® необходимо применять с осторожностью после оценки потенциального риска и пользы.
Инструкции по уничтожению неиспользованного препарата или препарата с истекшим сроком годности
Попадание лекарственного препарата Тецентрик® в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов.
Влияние на способность управлять транспортными средствами и механизмами. Влияние препарата Тецентрик® на способность управлять автомобилем и работать с механизмами не изучалось.
Форма выпуска
Концентрат для приготовления раствора для инфузий, 60 мг/мл. По 1200 мг/20 мл или 840 мг/14 мл препарата во флаконе бесцветного стекла (гидролитический класс 1 ЕФ/Ф.США/ЯФ), укупоренном пробкой из бутилкаучука, ламинированном фторполимером, обжатом алюминиевым колпачком и закрытом пластмассовой крышкой. По 1 фл. вместе с инструкцией по применению помещают в картонную пачку.
С целью контроля первого вскрытия на пачку наносится защитная голографическая наклейка.
Производитель
Производитель
Для флаконов 20 мл. Рош Диагностикс ГмбХ, Германия/Roche Diagnostics GmbH, Sandhofer Strasse 116, 68305 Mannheim, Germany.
Для флаконов 14 мл и 20 мл. Ф. Хоффманн-Ля Рош Лтд., Швейцария/F. Hoffmann-La Roche Ltd., Wurmisweg, 4303 Kaiseraugst, Switzerland.
Фасовщик (первичная упаковка)
Для флаконов 20 мл. Рош Диагностикс ГмбХ, Германия/Roche Diagnostics GmbH, Sandhofer Strasse 116, 68305 Mannheim, Germany.
Для флаконов 14 мл и 20 мл. Ф. Хоффманн-Ля Рош Лтд., Швейцария/F. Hoffmann-La Roche Ltd., Wurmisweg, 4303 Kaiseraugst, Switzerland.
Упаковщик (вторичная/потребительская упаковка)
Ф. Хоффманн-Ля Рош Лтд., Швейцария/F. Hoffmann-La Roche Ltd., Wurmisweg, 4303 Kaiseraugst, Switzerland.
Выпускающий контроль качества
Ф. Хоффманн-Ля Рош Лтд., Швейцария/F. Hoffmann-La Roche Ltd., Wurmisweg, 4303 Kaiseraugst, Switzerland.
Владелец регистрационного удостоверения. Ф. Хоффманн-Ля Рош Лтд., Швейцария/F. Hoffmann-La Roche Ltd., Grenzacherstrasse 124, 4070 Basel, Switzerland.
Организация, принимающая претензии от потребителей. АО «Рош-Москва». 107031, Россия, Москва, Трубная пл., 2, пом. 1, эт. 1-й, комн. 42.
Тел.: (495) 229-29-99; факс: (495) 229-79-99 или через форму обратной связи на сайте.
www.roche.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре 2–8 °C, в картонной пачке для защиты от света.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Тецентрик лиофилизат — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-004652
Торговое наименование
Тецентрик®
Международное непатентованное наименование
Атезолизумаб
Лекарственная форма
Концентрат для приготовления раствора для инфузий
Состав
1 флакон содержит:
действующее вещество: атезолизумаб — 1200 мг;
вспомогательные вещества: L-гистидин — 62.0 мг, уксусная кислота ледяная — 16.5 мг, сахароза — 821.6 мг, полисорбат 20 — 8.0 мг, вода для инъекций до 20 мл.
Описание
Прозрачная или слегка опалесцирующая жидкость от бесцветного до светло-желтого цвета.
Фармакотерапевтическая группа
Противоопухолевое средство — антитела моноклональные.
Код АТХ
L01XC
Фармакологические свойства
Фармакодинамика
Механизм действия
При связывании лиганда PD—L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и В7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов. Данное угнетение происходит посредством ингибирования пролиферации Т-лимфоцитов и продукции цитокинов. PD—L1 может экспрессироваться на опухолевых клетках и инфильтрирующих опухоль иммунных клетках и участвовать в подавлении противоопухолевого иммунного ответа в микроокружении опухоли.
Атезолизумаб — это гуманизированное моноклональное антитело из класса иммуноглобулинов G1 (IgGl) с видоизмененным Fc-фрагментом, которое непосредственно связывается с PD—L1 и блокирует его взаимодействие с рецепторами PD— 1 и В7.1. Таким образом, атезолизумаб способствует прекращению опосредованного PD— L1/PD-1 подавления иммунного ответа и вызывает реактивацию противоопухолевого иммунитета. Атезолизумаб не затрагивает взаимодействие рецептора PD-1 с лигандом PD— L2.
Блокада рецептора PD—L1 у мышей с генетически родственными моделями опухолей приводит к уменьшению опухолевого роста.
Иммуногенностъ
При применении атезолизумаба возможно развитие реакции со стороны иммунной системы. Положительные результаты анализа на антитела к атезолизумабу в одной или нескольких временных точках после введения препарата отмечались у 43.9% пациентов с местнораспространенным/метастатическим уротелиальным раком (МР/МУР). Частота образования антитерапевтических антител (АТА) у пациентов с местнораспространенным/ метастатическим немелкоклеточным раком легкого (МР/МНРЛ) составляла 30.4%. Наличие АТА не оказывало клинически значимого влияния на фармакокинетику, эффективность или безопасность препарата Тецентрик®.
Данные по иммуногенности в значительной степени зависят от различных факторов, таких как чувствительность и специфичность метода, методология проведения анализа, а также обращение с образцами и время их забора, прием сопутствующих препаратов и характер основного заболевания. Таким образом, сравнение частоты встречаемости антител к препарату Тецентрик» и частоты встречаемости антител к другим препаратам может быть некорректным.
Доклинические данные безопасности
Канцерогенность: канцерогенный потенциал атезолизумаба не исследовался.
Мутагенность: мутагенный потенциал атезолизумаба не исследовался.
Влияние на фертильность: исследования фертильности при применении атезолизумаба не проводились. Тем не менее, в рамках исследования хронической токсичности у яванских макак было выявлено, что препарат Тецентрик® оказывал влияние на менструальный цикл у всех самок обезьян, получавших дозу препарата 50 мг/кг. что проявлялось нерегулярностью цикла во время фазы дозирования и коррелировало с отсутствием желтого тела в яичниках при терминальной некропсии. Данный эффект был обратим после отмены препарата. Влияние на мужские репродуктивные органы не отмечалось. Тератогенность: исследования тератогенности или токсичности в отношении репродуктивной системы при применении препарата Тецентрик® не проводились. Установлено, что путь передачи сигнала PD—L1/PD-1 является ключевым для установления иммунологической толерантности материнского организма к плоду, а значит и для выживаемости плода во время беременности. Ожидается, что применение препарата Тецентрик® будет оказывать неблагоприятное влияние на течение беременности, а также подвергать плод риску и потенциально вызывать гибель эмбриона.
Фармакокинетика
Фармакокинетика атезолизумаба изучалась при применении доз 0.01 мг/кг — 20 мг/кг каждые 3 недели, включая фиксированную дозу 1200 мг у различных пациентов. Экспозиция атезолизумаба повышалась пропорционально дозе в диапазоне доз от 1 мг/кг до 20 мг/кг. Фармакокинетика атезолизумаба описана с использованием линейной двухкамерной модели распределения с элиминацией первого порядка для диапазона доз 1- 20 мг/кг. При этом равновесное состояние достигалось через 6-9 недель (2-3 цикла терапии) при многократном введении. Средний коэффициент накопления для показателей площади под кривой «концентрация-время» (AUC), максимальной концентрации (Сmax) и минимальной концентрации (Cmin) составил 1.91, 1.46 и 2.75, соответственно.
На системную экспозицию атезолизумаба не оказывали клинически значимого влияния следующие факторы: возраст 21-89 лет, масса тела, пол, наличие антитерапевтических антител (АТА), уровень альбумина, опухолевая нагрузка, нарушение функции почек, нарушение функции печени легкой степени тяжести, уровень экспрессии PD—L1 или статус по шкале ECOG (шкала Восточной Кооперативной Группы Исследования Рака), а также регион или этническая принадлежность пациента.
Всасывание
Препарат Тецентрик® вводится внутривенно. Другие пути введения препарата не изучались.
Распределение
Согласно результатам анализа популяционной фармакокинетики объем распределения в центральной камере (Vi) составляет 3.28 л, а объем распределения в равновесном состоянии (Vss) — 6.91 л у среднестатистического пациента.
Метаболизм
Исследований метаболизма атезолизумаба не проводилось. Как и другие антитела, атезолизумаб преимущественно подвергается катаболизму.
Выведение
Клиренс атезолизумаба составляет 0.200 л/день, а среднестатистический период полу выведения (t 1/2) — 27 дней (согласно результатам анализа популяционной фармакокинетики).
Фармакокинетика у особых групп пациентов
Дети
Исследований фармакокинетики атезолизумаба у детей не проводилось.
Пациенты пожилого возраста
У пациентов пожилого возраста отдельных исследований фармакокинетики атезолизумаба не проводилось.
Согласно результатам анализа популяционной фармакокинетики у пациентов в возрасте от 21 года до 89 лет возраст не оказывает значимого влияния на фармакокинетику атезолизумаба. Клинически значимых различий фармакокинетики атезолизумаба у пациентов младше 65 лет, в возрасте 65-75 лет и пациентов старше 75 лет не наблюдалось (см. подраздел «Особые указания по дозированию» раздела «Способ применения и дозы»).
Пациенты с нарушением функции почек
У пациентов с нарушением функции почек отдельных исследований фармакокинетики атезолизумаба не проводилось.
Согласно результатам анализа популяционной фармакокинетики не наблюдалось клинически значимых различий клиренса атезолизумаба у пациентов с нарушением функции почек легкой (расчетная скорость клубочковой фильтрации (рСКФ) 60-89 мл/мин/1.73 м2) или средней (рСКФ 30-59 мл/мин/1.73 м2) степеней тяжести по сравнению с пациентами с нормальной функцией почек (рСКФ более 90 мл/мин/1.73 м2). Нарушение функции почек тяжелой степени (рСКФ 15-29 мл/мин/1.73 м2) отмечалось у небольшого количества пациентов в клинических исследованиях, в связи с чем не известно оказывает ли тяжелая почечная недостаточность влияние на фармакокинетику атезолизумаба (см. подраздел «Особые указания по дозированию» раздела «Способ применения и дозы»). Пациенты с нарушением функции печени
Отдельных исследований фармакокинетики атезолизумаба у пациентов с нарушением функции печени не проводилось. Не наблюдалось клинически значимых различий клиренса атезолизумаба у пациентов с нарушением функции печени легкой степени тяжести (концентрация билирубина < верхней границы нормы (ВГН) и активность аспартатаминотрансферазы (ACT) > ВГН или концентрация билирубина <1.0-1.5 х ВГН и любая активность ACT) и нормальной функцией печени (концентрация билирубина и уровень ACT < ВГН).
Данные для пациентов с нарушением функции печени средней (концентрация билирубина >1.5-3.0 х ВГН и любая активность ACT) или тяжелой (концентрация билирубина >3.0 х ВГН и любая активность ACT) степеней тяжести отсутствуют. Нарушение функции печени определялось в соответствии с критериями Национального института рака (NCI) (см. подраздел «Особые указания по дозированию» раздела «Способ применения и дозы»).
Показания к применению
Монотерапия местнораспространенного или метастатического уротелиального рака j взрослых
Местнораспространенный или метастатический уротелиальный рак после
предшествующей химиотерапии или при невозможности лечения цисплатином. Монотерапия местнораспространенного или метастатического немелкоклеточного рака легкого у взрослых
Местнораспространенный или метастатический немелкоклеточный рак легкого после предшествующей химиотерапии.
Противопоказания
Гиперчувствительность к атезолизумабу или любому компоненту препарата в анамнезе. Беременность и период грудного вскармливания.
Детский возраст до 18 лет (эффективность и безопасность применения препарата Тецентрик® у детей и подростков <18 лет не изучались).
С осторожностью
Нарушение функции печени средней (концентрация билирубина >1.5-3.0 х ВГН и любая активность ACT) или тяжелой (концентрация билирубина >3.0 х ВГН и любая активность ACT) степеней тяжести (эффективность и безопасность применения препарата Тецентрик® не изучались).
Аутоиммунные заболевания (эффективность и безопасность применения препарата Тецентрик® не изучались).
Нарушение функции почек тяжелой степени тяжести.
Применение во время беременности и в период грудного вскармливания
Беременность
Применение препарата Тецентрик® может оказывать отрицательное воздействие на плод в силу механизма действия. Исследования на животных показали, что ингибирование пути PD—L1/PD-1 может приводить к повышенному риску иммуноопосредованного отторжения развивающегося плода и его гибели. Необходимо проинформировать беременную женщину о наличии риска для плода.
Клинические исследования препарата Тецентрик® у беременных женщин не проводились. Препарат Тецентрик® не следует применять во время беременности (см. подраздел «Тератогенность» раздела «Фармакологические свойства»).
Контрацепция
Женщины с сохранной репродуктивной функцией должны использовать эффективные методы контрацепции и принимать активные меры для предотвращения беременности в период лечения препаратом Тецентрик® и в течение минимум 5 месяцев после последней инфузии препарата (см. раздел «Особые указания» и подраздел «Тератогенность» раздела «Фармакологические свойства»).
Период грудного вскармливания
Неизвестно, выводится ли атезолизумаб с грудным молоком. Влияние препарата на образование грудного молока или присутствие препарата Тецентрик® в грудном молоке не исследовались. Поскольку возможность отрицательного воздействия на ребенка, находящегося на грудном вскармливании, неизвестна, следует прекратить либо грудное вскармливание, либо применение препарата Теценгрик®.
Способ применения и дозы
Общие рекомендации
Замена препарата на какой-либо другой биологический лекарственный препарат требует согласования с лечащим врачом.
Препарат Тецентрик необходимо вводить только в виде внутривенной (в/в) инфузии под тщательным наблюдением опытного медицинского работника.
Вводить препарат Тецентрик® струйно или болюсно нельзя.
Рекомендуемая доза препарата Тецентрик составляет 1200 мг в виде в/в инфузии каждые 3 недели.
Первую дозу препарата Тецентрик необходимо вводить в течение 60 минут.
При хорошей переносимости первой инфузии все последующие инфузии можно проводить в течение 30 минут.
Длительность терапии
Пациенты должны получать терапию препаратом Тецентрик до прогрессирования заболевания или развития признаков неприемлемой токсичности.
Пропуск в плановом введении
При пропуске в плановом введении препарата Тецентрик необходимо в кратчайшие сроки ввести препарат в рекомендуемой дозе, не дожидаясь следующего запланированного введения. График введений препарата Тецентрик» должен быть скорректирован с целью поддержания 3-х недельного интервала между введениями.
Коррекция дозы
Снижение дозы препарата Тецентрик» не рекомендуется.
Приостановка терапии или задержка введения последующих доз
Таблица 1. Рекомендации по коррекции режима дозирования при отдельных
нежелательных реакциях.
|
Нежелательная |
Степень тяжести |
Коррекция терапии |
|
Пневмонит |
2-я степень |
Приостановить терапию препаратом 1ецентрик . Терапия может быть возобновлена после снижения тяжести явления до 0-ой или Пой степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до <10 мг перорально в сутки. |
|
3-я или 4-я степень |
Полностью прекратить лечение препаратом Тецентрик». |
|
|
Гепатит |
я степень (уровень АЛТ или ACT в 5 раз превышает верхнюю границу нормы |
Приостановить терапию препаратом Тецентрик®. Терапия может быть возобновлена после снижения степени тяжести |
|
(ВГН) или билирубин в крови в 1.5-3 раза превышает ВГН) |
явления до 0-ой или 1 -ой степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов |
|
|
3-я или 4-я степень (уровень АЛТ или ACT в >5 раз превышает ВГН или билирубин в крови в >3 раза превышает ВГН) |
Полностью прекратить лечение препаратом Тецентрик. |
|
|
Колит |
Диарея 2-ой или 3-ей |
Приостановить терапию препаратом Тецентрикк. |
|
Диарея 4-ой степени или колит (жизнеугрожающее состояние; показано срочное медицинское вмешательство) |
Полностью прекратить лечение препаратом Тецентрик |
|
|
Гипотиреоз и |
Симптоматический |
Приостановить терапию препаратом Тецентрик®. Гипотиреоз |
|
Терапия может быть возобновлена после улучшения функции щитовидной железы с помощью антитиреоидных препаратов. |
||
|
Надпочечниковая недостаточность |
Симптоматический |
Приостановить терапию препаратом Тецентрик®. Терапия может быть возобновлена после снижения тяжести явления до 0-ой или 1-ой степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до <10 мг перорально в сутки; при |
|
Гипофизит |
2-я или 3-я степень |
Приостановить терапию препаратом Тецентрик®. Терапия может быть возобновлена после снижения тяжести явления до 0-ой или Пой степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до <10 мг перорально в сутки; при |
|
4-я степень |
Полностью прекратить лечение препаратом Тецентрик. |
|
|
Сахарный диабет 1-го типа |
Гипергликемия 3-ей или 4-ой степени (уровень глюкозы натощак >250 мг/дл или 13.9 ммоль/л) |
Приостановить терапию препаратом Тецентрик®. Терапия может быть возобновлена после установления контроля метаболизма при помощи |
|
заместительной терапии инсулином. |
|||||
|
Инфузионные реакции |
1-я или 2-я степень |
Снизить скорость инфузии или прервать инфузию. Терапия может быть возобновлена после разрешения явления. |
|||
|
3-я или 4-я степень |
11олностью прекратить лечение препаратом Тецентрик. |
||||
|
Сыпь (см. раздел «Побочное |
3-я степень |
Приостановить терапию препаратом Тецентрик®. Терапия может быть возобновлена после разрешения сыпи и снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до <10 мг перорально в сутки. |
|||
|
4-я степень |
Полностью прекратить лечение препаратом Тецентрик. |
||||
|
Миастенический синдром/злокачественная |
Все степени тяжести |
Полностью прекратить лечение препаратом Тецентрик. |
|||
|
Панкреатит |
Повышение уровня амилазы или липазы в сыворотке крови 3-ей или 4-ой степени (в >2 раза превышает ВГН) или |
Приостановить терапию препаратом Тецентрикк. |
|||
|
до <10 мг перорально в сутки. |
|||||
|
4-ая степень или любая степень |
Полностью прекратить лечение препаратом Тецентрик. |
||||
Критерии токсичности указаны в соответствии с общими критериями терминологии Национального Института Рака для нежелательных явлений, в. 4.0.
Терапию препаратом Тецентрик» необходимо полностью прекратить при возникновении следующих состояний: токсичность 4-ой степени тяжести за исключением эндокринопатий, которые контролируются заместительной гормональной терапией;
любое рецидивирующее явление > 3-ей степени тяжести; если степень токсичности, связанной с терапией, не уменьшается до 0-ой или 1-ой в течение 12 недель после даты возникновения явления;
если по прошествии 12 недель после даты возникновения явления для купирования токсичности, связанной с терапией, требуется применение дозы глюкокортикостероидов >10 мг (преднизолона или его эквивалента) перорально в сутки.
Особые указания по дозированию
Дети Эффективность и безопасность применения препарата Тецентрик у детей и подростков (<18 лет) не изучались.
Пожилой и старческий возраст Коррекции дозы препарата Тецентрик у пациентов в возрасте >65 лет не требуется (см. подраздел «Применение у особых групп пациентов» раздела «Фармакокинетические свойства»). Нарушение функции почек Коррекции дозы у пациентов с нарушением функции почек легкой и средней степени тяжести не требуется (см. подраздел «Применение у особых групп пациентов» раздела «Фармакокинетические свойства»). Применение препарата у пациентов с нарушением функции почек тяжелой степени тяжести не изучалось.
Нарушение функции печени Коррекции дозы у пациентов с нарушением функции печени легкой степени тяжести не требуется. Применение препарата Тецентрик у пациентов с нарушением функции печени средней и тяжелой степеней тяжести не изучалось (см. подраздел «Применение у особых групп пациентов» раздела «Фармакокинетические свойства»).
Правила приготовления и хранения раствора для инфузии
Разведение препарата Тецентрик должно проводиться медицинским персоналом в асептических условиях.
Препарат не содержит консервантов, каждый флакон предназначен только для однократного использования. Отобрать 20 мл препарата Тецентрик из флакона. Развести препарат в инфузионном пакете из поливинилхлорида (ПВХ), полиэтилена (ПЭ) или полиолефина, содержащем 250 мл 0.9% стерильного раствора натрия хлорида для инъекций. После разведения препарата 1 мл полученного раствора содержит около 4.4 мг атезолизумаба (1200 мг/270 мл).
Разбавлять необходимо только 0.9% стерильным раствором хлорида натрия для инъекции. Инфузионный пакет осторожно перевернуть для перемешивания раствора, избегая при этом ценообразования. Приготовленный раствор для инфузий должен использоваться сразу после его приготовления. Раствор для парентерального введения перед использованием следует визуально проверить на наличие частиц и изменение цвета. В случае обнаружения частиц или изменения цвета раствор использовать нельзя. С точки зрения микробиологической чистоты раствор для инфузии должен быть использован сразу после приготовления. В исключительных случаях готовый раствор может храниться не более 24 часов при температуре 2-8°С или 8 часов при комнатной температуре (<30°С). Если препарат не используется сразу, то время и условия хранения приготовленного раствора являются ответственностью пользователя. Совместимость Препарат Тецентрик» совместим с инфузионными пакетами с контактирующей поверхностью из поливинилхлорида (ПВХ), полиэтилена (ПЭ) или полиолефина, а также с мембранами инфузионных фильтров из полиэфирсульфона или полисульфона, инфузионными системами и другими приспособлениями для инфузий из ПВХ, ПЭ, полибутадиена или полиэфируретана.
Побочное действие
В Таблице 2 представлены объединенные данные о нежелательных реакциях (HP), наблюдавшихся при применении препарата Тецентрик у пациентов с МР/МУР иМР/МНРЛ, а также в клинических исследованиях у пациентов с другими типами опухолей. Для описания частоты нежелательных реакций используется следующая классификация: очень частые (^1/10), частые (^1/100 и <1/10), нечастые (>1/1000 и <1/100). редкие (>1/10000 и <1/1000) и очень редкие (<1/10000).
Таблица 2. HP у пациентов, получавших терапию препаратом Тецен грик в ходе клинических исследований.
| Класс систем органов |
Очень часто |
Часто |
Нечасто |
Редко |
| Нарушения со стороны крови и л им фатической системы | Тромбоцитопения | |||
| Нарушения со стороны иммунной системы | Реакции гиперчувствите ьности | |||
| Нарушения со стороны эндокринной системы | Гипотиреоз1, гипертиреоз2 |
Надпочечниковая недостаточность3 , сахарный диабет4 |
Гипофизит | |
| Нарушения со стороны обмена веществ | Снижение аппетита | Гипокалиемия, гипонатриемия | ||
| Нарушения со стороны нервной системы |
Синдром Гийена- Барре5, неинфекционный менингит7 |
Неинфекционн ый энцефалит6, миастенически й синдром8 | ||
| Нарушения со стороны сердечно сосудистой системы | Снижение артериального давления |
1 — сообщения включали гипотиреоз, повышение активности тиреотропного гормона в крови, снижение активности тиреотропного гормона в крови, тиреоидит, микседему, отклонения в результатах тестов функционального состояния щитовидной железы, острый тиреоидит и снижение активности тироксина. — сообщения включали гипертиреоз, повышение активности тиреотропного гормона в крови, снижение активности тиреотропного гормона в крови, тиреоидит, эндокринную офтальмопатию, экзофтальм, отклонения в результатах тестов функционального состояния щитовидной железы, острый тиреоидит и снижение активности тироксина. — сообщения включали надпочечниковую недостаточность, первичную надпочечниковую недостаточность и болезнь Аддисона. — сообщения включали сахарный диабет и сахарный диабет 1-го типа. — сообщения включали синдром Гийена-Барре и демиелинизирующую полинейропатию. — сообщения включали энцефалит. — сообщения включали менингит. — данные исследований, не вошедших в объединенную базу данных. Частота встречаемости основана на экспозиции препарата в рамках всей программы. — сообщения включали пневмонит, инфильтрацию легких, бронхиолит, интерстициальную болезнь легких, лучевой пневмонит. 10-сообщения включали колит, аутоиммунный колит, ишемический колит, микроскопический колит. — сообщения включали панкреатит и острый панкреатит.
— сообщения включали аутоиммунный гепатит, гепатит, острый гепатит. — сообщения включали макулезно-папулезную сыпь, эритему, зудящую сыпь, акнеиформный дерматит, экзему, папулезную сыпь, макулезную сыпь, дерматит, эритематозную сыпь, акне, пустулезную сыпь, шелушение кожи, язву кожных покровов, себорейный дерматит, многоформную эритему, буллезный дерматит, генерализованную сыпь, токсическое поражение кожи, эксфолиативную сыпь, аллергический дерматит, лекарственный дерматит, эксфолиативный дерматит, синдром ладонно-подошвенной эритродизестезии, папулосквамозную сыпь, токсическую кожную сыпь, эритему кожи век, сыпь на коже век, фолликулит, фурункул и сыпь.
Описание отдельных нежелательных реакций Дополнительная информация по контролю перечисленных ниже состояний представлена в разделе «Особые указания». Иммуноопосредованный пневмонит Развитие пневмонита наблюдалось у 3.1% пациентов с метастатическим уротелиальным раком (МУР) и немелкоклеточным раком легкого (НМРЛ), получавших препарат Тецентрик; у одного пациента (0.05%) данная нежелательная реакция привела к летальному исходу. Медиана времени до начала проявления признаков пневмонита составила 3.5 месяца (диапазон: 3 дня — 20.5 месяца). Медиана длительности течения пневмонита составила 1.5 месяца (диапазон: от 0 дней до 15.1 месяца). У 0.5% пациентов пневмонит стал причиной постоянной отмены препарата Тецентрик. Пневмонит, требующий сопутствующего применения глюкокортикостероидов, был зарегистрирован у 1.6% пациентов, получавших препарат. Иммуноопосредованный гепатит Развитие гепатита наблюдалось у 0.3% пациентов с МУР и НМРЛ, получавших препарат Тецентрик. Медиана времени до начала проявления признаков гепатита составила 1.1 месяца (диапазон: 9 дней — 7.9 месяца). Медиана длительности течения гепатита составила 1 месяц (диапазон: 9 дней — 1.9 месяца). У <0.1% пациентов гепатит стал причиной отмены препарата Тецентрик. Гепатит, требующий сопутствующего применения глюкокортикостероидов, был зарегистрирован у 0.2% пациентов, получавших препарат. Иммуноопосредованнын колит
Развитие колита наблюдалось у 1.1% пациентов с МУР и НМРЛ, получавших препарат Тецентрик. Медиана времени до проявления признаков колита составила 4 месяца (диапазон: 15 дней — 15.2 месяца). Медиана длительности течения колита составила 1.4 месяца (диапазон: 3 дня — 17.8 месяца). У 0.2% пациентов колит стал причиной отмены препарата Теценгрик4. Колит, требующий сопутствующего применения глюкокортикостероидов, был зарегистрирован у 0.5% пациентов, получивших препарат. Иммунооносредованные эндокринопатии Развитие гипотиреоза наблюдалось у 4.7% пациентов с МУР и НМРЛ, получавших препарат Тецентрик. Медиана времени до проявления признаков гипотиреоза составила месяца (диапазон: от 15 дней до 31.3 месяца). Развитие гипертиреоза наблюдалось у 1.7% пациентов с МУР и НМРЛ, получавших препарат Тецентрик». Медиана времени до проявления признаков гипертиреоза составила месяца (диапазон: от 21 дня до 31.3 месяца). Развитие надпочечниковой недостаточности наблюдалось у 0.3% пациентов с МУР и НМРЛ, получавших препарат Тецентрик®. Медиана времени до проявления признаков надпочечниковой недостаточности составила 5.7 месяца (диапазон: от 3 дней до 19 месяцев). Надпочечниковая недостаточность, требующая сопутствующего применения глюкокортикостероидов, была зарегистрирована у 0.3% пациентов, получавших препарат. Развитие гипофизита наблюдалось у <0.1% пациентов с МУР и НМРЛ, получающих препарат Тецентрик®. Время до проявления признаков гипофизита составляло 13.7 месяцев. Развитие сахарного диабета наблюдалось у 0.3% пациентов с МУР и НМРЛ, получавших препарат Тецентрик®. Время до проявления признаков сахарного диабета варьировало от 3 дней до 6.5 месяца. У 1 пациента (<0.1 %) сахарный диабет стал причиной отмены препарата Тецентрикк). Иммуноопосредованный менингоэнцефа.1 ит Развитие менингита наблюдалось у 3 пациентов (0.1%) с МУР и НМРЛ, получавших препарат Тецентрик\ Время до начала проявления менингита составляло от 15 до 16 дней. Всем пациентам потребовалось применение глюкокортикостероидов, и терапия препаратом Тецентрик® была прекращена. Развитие энцефалита наблюдалось у 2 пациентов (<0.1 %). Время до проявления признаков энцефалита составило 14 и 16 дней. Одному из пациентов потребовалось применение глюкокортикостероидов. У 1 пациента (<0.1 %) энцефалит стал причиной отмены препарата Тецентрик® . Иммуноопосредованные нейропатии Развитие нейропатии, включая синдром Гийена-Барре и демиелинизирующую полинейропатию, наблюдалось у 0.2% пациентов с МУР и НМРЛ, получавших препарат Тецентрик». Медиана времени до проявления признаков нейропатии составила 7 месяцев (диапазон: от 18 дней до 8.1 месяца). Медиана длительности течения нейропатии составила 4.6 месяца (от 0 дней до 8.6 месяца). У 1 пациента (<0.1 %) синдром Гийена- Барре стал причиной отмены препарата Тецентрик® . Синдром Гийена-Барре, требующий применения глюкокортикостероидов, был зарегистрирован у 2 пациентов (<0.1 %). Иммуноопосредованный панкреатит Развитие панкреатита, включая повышение активности амилазы и липазы, наблюдалось у 0.5% пациентов с МУР и НМРЛ, получавших препарат Тецентрик®. Медиана времени до проявления признаков панкреатита составила 5.5 месяца (диапазон: от 9 дней до 16.9 месяца). Медиана длительности течения панкреатита составила 18 дней (диапазон: от 3 дней до 11.2 месяца). Панкреатит, требующий сопутствующего применения глюкокортикостероидов, был зарегистрирован у 2 пациентов (<0.1 %), получавших препарат.
Передозировка
Информация о передозировке препарата Тецентрик® отсутствует.
Взаимодействие с другими лекарственными препаратами
Отдельных фармакокинетических исследований взаимодействия атезолизумаба с другими лекарственными средствами не проводилось. Поскольку атезолизумаб выводится посредством катаболизма, метаболического лекарственного взаимодействия не ожидается. Перед применением атезолизумаба следует избегать использования системных глюкокортикостероидов или иммунодепрессантов из-за их потенциального влияния на фармако динамическую активность и эффективность атезолизумаба. Тем не менее, после начала терапии атезолизумабом системные глюкокортикостероиды или другие иммунодепрессанты могут использоваться для лечения нежелательных реакций со стороны иммунной системы (см. раздел «Особые указания» и «Способ применения и дозы»).
Особые указания
В медицинской документации пациента следует указывать торговое наименование (Тецентрию) и номер серии введенного препарата.
Иммуноопосредованный пневмонит В ходе клинических исследований препарата Тецентрик наблюдались случаи пневмонита, в том числе с летальным исходом (см. раздел «Побочное действие»). Необходимо тщательно наблюдать за пациентами на предмет возникновения признаков и симптомов пневмонита. В случае развития пневмонита 2-ой (умеренной) степени тяжести следует приостановить терапию препаратом Тецентрик и начать терапию преднизолоном (или его эквивалентом) в дозе 1-2 мг/кг в сутки перорально. После того, как выраженность симптомов пневмонита уменьшилась до <1-ой (легкой) степени тяжести, следует постепенно снижать дозу глюкокортикостероидов на протяжении >1 месяца. Терапию препаратом Тецентрик можно возобновить, если выраженность пневмонита уменьшится до <1-ой (легкой) степени тяжести в течение 12 недель, а доза глюкокортикостероидов (преднизолона или его эквивалента перорально) будет снижена до <10 мг в сутки. При развитии пневмонита 3-ей (тяжелой) или 4-ой (жизнеугрожающей) степени тяжести терапию препаратом Тецентрик следует отменить и не возобновлять в дальнейшем.
Иммуноопосредованный гепатит
В клинических исследованиях препарата Тецентрик наблюдались случаи гепатита, в том числе с летальным исходом (см. раздел «Побочное действие»). Необходимо тщательно отслеживать возникновение признаков и симптомов гепатита. Следует мониторировать активность аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ) и уровень билирубина до начала терапии препаратом Тецентрик® и периодически в ходе лечения. У пациентов с отклонениями функциональных показателей печени (ФПП), выявленными на исходном уровне, следует рассмотреть вопрос о проведении соответствующего лечения. Если отклонения ФПП 2-ой степени тяжести (АЛТ или ACT >3-5 х ВГН или уровень билирубина >1.5-3 х ВГН) сохраняются более 5-7 дней, следует приостановить лечение препаратом Тецентрик и начать лечение преднизолоном или его эквивалентом в дозе 1-2 мг/кг в сутки перорально. После того, как результаты ФПП улучшатся до <1-ой степени, необходимо снижать дозу глюкокортикостероидов на протяжении >1 месяца. Терапию препаратом Тецентрик® можно возобновить, если выраженность явления уменьшится до <1-ой степени тяжести в течение 12 недель, а доза глюкокортикостероидов (преднизолона или его эквивалента перорально) будет снижена до <10 мг в сутки. В случае развития гепатита 3-ей или 4-ой степени тяжести (АЛТ или ACT >5.0 х ВТН или уровень билирубина в крови >3 х ВТН), терапию препаратом Тецентрик» следует отменить и не возобновлять в дальнейшем.
Иммуноопосредованный колит
В клинических исследованиях препарата Тецентрик” наблюдались случаи диареи, колита (см. раздел «Побочное действие»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков/симптомов колита. Следует приостановить терапию препаратом Тецентрик» в случае развития диареи 2-ой (умеренной) или 3-ей (тяжелой) степени тяжести (увеличение кратности стула >4 раз в день) или клинически выраженного колита. Если развились диарея или колит 2-ой степени тяжести, и симптомы сохраняются или проявляются волнообразно в течение >5 дней, необходимо начать терапию преднизолоном перорально или его эквивалентом в дозе 1-2 мг/кг в сутки. Диарею или колит 3-ей (тяжелой) степени тяжести следует купировать применением глюкокортикостероидов внутривенно (в/в) (метилпреднизолон или его эквивалент в дозе 1-2 мг/кг в сутки). После улучшения состояния следует применять пероральные глюкокортикостероиды (преднизолон или его эквивалент 1-2 мг/кг в сутки). При уменьшении выраженности симптомов до <1-ой степени, следует постепенно снижать дозу глюкокортикостероидов на протяжении >1 месяца. Терапию препаратом Тецентрик» можно возобновить, если выраженность явления уменьшится до <1-ой степени в течение 12 недель, а доза глюкокортикостероидов (преднизолона или его эквивалента) перорально будет снижена до <10 мг в сутки. При развитии диареи или колита 4-ой степени тяжести (жизнеугрожающей), следует оказать неотложную помощь, а терапию препаратом Тецентрик» отменить и не возобновлять в дальнейшем.
Иммунооносредованные эндокринопатии В ходе клинических исследований препарата Тецентрик» наблюдались случаи гипотиреоза, гипертиреоза, гипофизита, надпочечниковой недостаточности и сахарного диабета 1-го типа, включая диабетический кетоацидоз (см. раздел «Побочное действие»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов эндокринопатий. Требуется наблюдение за изменениями функции щитовидной железы до начала терапии препаратом Тецентрик1‘ и периодически в ходе лечения. У пациентов с отклонениями функциональных показателей щитовидной железы на исходном уровне следует рассмотреть вопрос о проведении соответствующего лечения. Пациенты с бессимптомными отклонениями функциональных показателей щитовидной железы могут получать терапию препаратом Тецентрик®. При клинически выраженном гипотиреозе следует приостановить терапию препаратом Тецентрикк и при необходимости начать заместительную терапию тиреоидным гормоном. Изолированный гипотиреоз можно контролировать с помощью заместительной терапии без применения глюкокортикостероидов. В случае клинически выраженного гипертиреоза следует приостановить терапию препаратом Тецентрик® и при необходимости начать лечение тиреостатическим препаратом (например, метимазолом). Терапию препаратом Тецентрик» можно возобновить после установления контроля над симптомами и улучшения функции щитовидной железы. При клинически выраженной надпочечниковой недостаточности следует приостановить терапию препаратом Тецентрик1* и начать лечение метилпреднизолоном в/в или его эквивалентом в дозе 1-2 мг/кг в сутки. После снижения выраженности симптомов необходимо продолжить терапию преднизолоном или его эквивалентом перорально в дозе 1-2 мг/кг в сутки. После того, как выраженность симптомов уменьшится до <1-ой степени, следует постепенно снижать дозу глюкокортикостероидов на протяжении >1 месяца. Терапию препаратом Тецентрик» можно возобновить, если выраженность явления уменьшится до <1-ой степени в течение 12 недель, а доза глюкокортикостероидов (преднизолона или его эквивалента) будет снижена до <10 мг в сутки перорально и (в случае необходимости проведения заместительной терапии) будет достигнуто стабильное состояние пациента на фоне заместительной терапии. При развитии гипофизита 2-ой или 3-ей степени тяжести терапию атезолизумабом необходимо прервать и начать лечение глюкокортикостероидами (1-2 мг/кг/сут метилпреднизолона или его аналога, внутривенно). При необходимости также следует начать заместительную гормональную терапию. После улучшения клинических симптомов следует продолжить терапию преднизолоном или его аналогами в дозе 1-2 мг/кг/сут. При снижении тяжести симптомов до < Пой степени дозу глюкокортикостероидов необходимо постепенно уменьшать на протяжении > 1 месяца. Терапия атезолизумабом может быть возобновлена после снижения тяжести явления до < Пой степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до <10 мг перорально в сутки; при этом состояние пациента должно оставаться стабильным на заместительной терапии (если она была необходима). При возникновении гипофизита 4-ой степени тяжести терапию атезолизумабом следует полностью прекратить. При развитии сахарного диабета 1-го типа следует начать лечение инсулином. При гипергликемии > 3-ей степени тяжести (уровень глюкозы натощак >250 мг/дл) следует приостановить терапию препаратом Тецентрик®. Терапия может быть возобновлена при достижении метаболического контроля на фоне заместительной терапии инсулином.
Иммунооносредованный менингоэнцефалит В ходе клинических исследований препарата Тецентрик® наблюдались случаи (менингита/энцефалита) (см. раздел «Побочное действие»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов менингита или энцефалита. Применение препарата Тецентрик® следует прекратить и не возобновлять в дальнейшем при развитии менингита или энцефалита любой степени тяжести. Следует начать лечение метилпреднизолоном в/в или его эквивалентом в дозе 1-2 мг/кг в сутки. После улучшения состояния пациента следует перейти на пероральный прием преднизолона или его эквивалента в дозе 1-2 мг/кг в сутки. Если выраженность симптомов уменьшается до <1- ой степени, следует постепенно снижать дозу глюкокортикостероидов на протяжении >1 месяца.
Иммуноопосредованные нейропатии В ходе клинических исследований препарата Тецентрик® наблюдались случаи миастенического синдрома/злокачественной миастении или синдрома Гийена-Барре, которые могли иметь угрожающий жизни характер (см. раздел «Побочное действие»). За пациентами необходимо тщательно наблюдать на предмет возникновения симптомов моторной и сенсорной нейропатии. Терапию препаратом Тецентрик® следует прекратить и не возобновлять в дальнейшем при развитии миастенического синдрома/злокачественной миастении или синдрома Гийена- Барре любой степени тяжести. Следует рассмотреть возможность терапии системными глюкокортикостероидами (преднизолоном перорально или его эквивалентом) в дозе 1-2 мг/кг в сутки.
Иммуноопосредованный панкреатит В клинических исследованиях препарата Тецентрик® отмечались случаи панкреатита, включая повышение активности амилазы и липазы сыворотки (см. раздел «Побочное действие»). За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов развития острого панкреатита.
При повышении активности сывороточной амилазы или липазы >3-ей степени тяжести (>2.0 х ВТН) или развитии панкреатита 2-ой или 3-ей степени тяжести следует приостановить лечение препаратом Тецентрик® и начать лечение метилпреднизолоном в/в или его эквивалентом в дозе 1-2 мг/кг в сутки. После уменьшения выраженности симптомов необходимо продолжать лечение преднизолоном или его эквивалентом перорально в дозе 1-2 мг/кг в сутки. Терапию препаратом Тецентрик» можно возобновить, если активность сывороточной амилазы и липазы снизится до <1 -ой степени в течение 12 недель или после разрешения симптомов панкреатита, а доза глюкокортикостероидов (преднизолона или его эквивалента перорально) будет снижена до <10 мг в сутки. При развитии панкреатита 4-ой степени или рецидива панкреатита любой степени тяжести терапию препаратом Тецентрик» следует прекратить и не возобновлять в дальнейшем.
Инфузионные реакции В ходе клинических исследований препарата Тецентрик» наблюдались случаи инфузионных реакций (ИР) (см. раздел «Побочное действие»).
У пациентов с ИР 1-ой или 2-ой степени тяжести следует уменьшить скорость инфузии или прервать введение препарата. Пациентам с ИР 3-ей или 4-ой степени тяжести терапию препаратом Тецентрик® следует прекратить и не возобновлять в дальнейшем. Пациенты с ИР 1-ой или 2-ой степени тяжести могут продолжать терапию препаратом Тецентрик® под тщательным наблюдением. Следует рассмотреть целесообразность проведения премедикации с помощью антипиретиков и антигистаминных препаратов.
Особые популяции пациентов Пациенты с аутоиммунными заболеваниями не подлежали включению в программу клинических исследований препарата Тецентрикк данные изучения эффективности и безопасности препарата у таких пациентов отсутствуют. У пациентов с аутоиммунными заболеваниями препарат Тецентрик® необходимо применять с осторожностью после оценки потенциального риска и пользы.
Инструкции по уничтожению неиспользованного препарата или препарата с истекшим сроком годности Попадание лекарственного препарата Тецентрикк в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. Уничтожение неиспользованного препарата или препарата с истекшим сроком годности должно проводиться в соответствии с требованиями лечебного учреждения. Следует строго соблюдать следующие пункты в отношении использования и утилизации шприцев и других острых медицинских предметов:
никогда не использовать повторно иглы и шприцы;
все использованные иглы и шприцы следует поместить в контейнер для острых отходов (одноразовый контейнер, устойчивый к прокалыванию).
Влияние на способность управлять транспортными средствами и механизмами
Влияние препарата Тецентрик® на способность управлять автомобилем и работать с механизмами не изучалось.
Форма выпуска
Концентрат для приготовления раствора для инфузий 60 мг/мл
По 1200 мг/20 мл препарата во флакон бесцветного стекла (гидролитический класс 1 ЕФ/Ф.США/ЯФ), укупоренный пробкой из бутилкаучука. ламинированного фторполимером, обжатый алюминиевым колпачком и закрытый пластмассовой крышкой. флакон с препаратом вместе с инструкцией по применению помещают в картонную пачку.
Срок годности
2 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия хранения
Хранить при температуре 2-8°С в картонной пачке для защиты от света. Хранить в недоступном для детей месте.
Условия отпуска
По рецепту.
Владелец Регистрационного удостоверения
Ф. Хоффманн—Ля Рош Лтд., Швейцария F. Hoffmann-La Roche Ltd. Grenzacherstrasse 124. 4070 Basel, Switzerland
Производитель
Рош
Диагностике ГмбХ, Германия Roche Diagnostics GmbH, Sandhofer Strasse 116, 68305 Mannheim, Germany
Фасовщик (первичная упаковка)
Рош
Диагностике ГмбХ, Германия Roche Diagnostics GmbH, Sandhofer Strasse 116, 68305 Mannheim, Germany
Упаковщик (вторичнаи/потребительскаи упаковка)
Ф. Хоффманн—Ля Рош Лтд., Швейцария F. Hoffrnann-La Roche Ltd, Wurmisweg, 4303 Kaiseraugst, Switzerland
Выпускающий контроль качества
Рош
Диагностике ГмбХ, Германия Roche Diagnostics GmbH, Sandhofer Strasse 116, 68305 Mannheim, Germany или Ф. Хоффманн—Ля Рош Лтд., Швейцария F. Hoffmann-La Roche Ltd, Wurmisweg, 4303 Kaiseraugst, Switzerland Претензии потребителей направлять в компанию ЗАО «Рош-Москва» по адресу: 107031, Россия, г. Москва, Трубная площадь, д. 2 тел. (495) 229 29 99, факс (495) 229 79 99 или через форму обратной связи на сайте: www.roche.ru
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакологическое действие
Противоопухолевое средство. Представляет собой гуманизированное моноклональное антитело из класса иммуноглобулинов G1 (IgG1) с видоизмененным Fc-фрагментом, которое непосредственно связывается с PD-L1 и блокирует его взаимодействие с рецепторами PD-1 и B7.1. Таким образом, атезолизумаб способствует прекращению опосредованного PD-L1/PD-1 подавления иммунного ответа и вызывает реактивацию противоопухолевого иммунитета. Атезолизумаб не затрагивает взаимодействие рецептора PD-1 с лигандом PD-L2.
Блокада рецептора PD-L1 у мышей с генетически родственными моделями опухолей приводит к уменьшению опухолевого роста.
Фармакокинетика
Фармакокинетика атезолизумаба изучалась при применении в дозах 0.01-20 мг/кг каждые 3 недели, включая фиксированную дозу 1200 мг у различных пациентов. Экспозиция атезолизумаба повышалась пропорционально дозе в диапазоне доз от 1 мг/кг до 20 мг/кг. Фармакокинетика атезолизумаба описана с использованием линейной двухкамерной модели распределения с элиминацией первого порядка для диапазона доз 1-20 мг/кг. При этом равновесное состояние достигалось через 6-9 недель (2-3 цикла терапии) при многократном введении. Средний коэффициент накопления для показателей AUC, Cmax и Cmin составил 1.91, 1.46 и 2.75 соответственно.
Согласно результатам анализа популяционной фармакокинетики объем распределения в центральной камере (V1) составляет 3.28 л, а объем распределения в равновесном состоянии (Vss) – 6.91 л у среднестатистического пациента.
Как и другие антитела, атезолизумаб преимущественно подвергается катаболизму.
Клиренс атезолизумаба составляет 0.200 л/сут, а среднестатистический Т1/2 – 27 дней (согласно результатам анализа популяционной фармакокинетики).
Показания активного вещества
АТЕЗОЛИЗУМАБ
Монотерапия местнораспространенного или метастатического уротелиального рака у взрослых после предшествующей химиотерапии или при невозможности лечения цисплатином.
Монотерапия местнораспространенного или метастатического немелкоклеточного рака легкого у взрослых после предшествующей химиотерапии.
Режим дозирования
Вводят в/в инфузии под тщательным наблюдением опытного медицинского работника.
Рекомендуемая доза составляет 1200 мг в виде в/в инфузии каждые 3 недели.
Побочное действие
Со стороны системы кроветворения: тромбоцитопения
Со стороны иммунной системы: реакции гиперчувствительности.
Со стороны эндокринной системы: гипотиреоз, гипертиреоз, надпочечниковая недостаточность, сахарный диабет, гипофизит.
Со стороны нервной системы: синдром Гийена-Барре, неинфекционный менингит, неинфекционный энцефалит, миастенический синдром.
Со стороны сердечно-сосудистой системы: снижение АД.
Со стороны дыхательной системы: одышка, гипоксия, заложенность носа, пневмонит.
Со стороны пищеварительной системы: диарея, тошнота, рвота, дисфагия, колит, боль в животе, панкреатит, увеличение концентрации липазы, увеличение концентрации амилазы, повышение активности АЛТ, повышение активности АСТ, гепатит
Со стороны кожи и подкожных тканей: сыпь, зуд.
Со стороны костно-мышечной системы: артралгия, боль в мышцах и в костях.
Общие реакции: повышенная утомляемость, астения, лихорадка, озноб, гриппоподобный синдром, инфузионные реакции.
Противопоказания к применению
Беременность; период лактации (грудного вскармливания); возраст до 18 лет; повышенная чувствительность к атезолизумабу.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Особые указания
С осторожностью: нарушение функции печени средней (концентрация билирубина >1.5-3.0×ВГН и любая активность АСТ) или тяжелой (концентрация билирубина >3.0×ВГН и любая активность АСТ) степеней тяжести; аутоиммунные заболевания ; нарушение функции почек тяжелой степени тяжести.
Необходимо тщательно наблюдать за пациентами на предмет возникновения признаков и симптомов пневмонита.
Необходимо тщательно отслеживать возникновение признаков и симптомов гепатита. Следует мониторировать активность АСТ, АЛТ и уровень билирубина до начала терапии и периодически в ходе лечения. У пациентов с отклонениями функциональных показателей печени (ФПП), выявленными на исходном уровне, следует рассмотреть вопрос о проведении соответствующего лечения. В случае развития гепатита 3-й или 4-й степени тяжести (АЛТ или АСТ >5.0×ВГН или уровень билирубина в крови >3×ВГН), терапию атезолизумабом следует отменить и не возобновлять в дальнейшем.
При развитии диареи или колита 4-й степени тяжести (жизнеугрожающей), следует оказать неотложную помощь, а терапию атезолизумабом отменить и не возобновлять в дальнейшем.
За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов эндокринопатий. Требуется наблюдение за изменениями функции щитовидной железы до начала терапии атезолизумабом и периодически в ходе лечения. У пациентов с отклонениями функциональных показателей щитовидной железы на исходном уровне следует рассмотреть вопрос о проведении соответствующего лечения.
При клинически выраженном гипотиреозе следует приостановить терапию атезолизумабом и при необходимости начать заместительную терапию тиреоидным гормоном. Изолированный гипотиреоз можно контролировать с помощью заместительной терапии без применения ГКС. В случае клинически выраженного гипертиреоза следует приостановить терапию атезолизумабом и при необходимости начать лечение тиреостатическим препаратом (например, метимазолом). Терапию атезолизумабом можно возобновить после установления контроля над симптомами и улучшения функции щитовидной железы.
При развитии сахарного диабета 1 типа следует начать лечение инсулином. При гипергликемии ≥3-й степени тяжести (уровень глюкозы натощак >250 мг/дл) следует приостановить терапию атезолизумабом. Терапия может быть возобновлена при достижении метаболического контроля на фоне заместительной терапии инсулином.
За пациентами необходимо тщательно наблюдать на предмет возникновения признаков и симптомов менингита или энцефалита, симптомов моторной и сенсорной невропатии, развития острого панкреатита.
Лекарственное взаимодействие
Перед применением атезолизумаба следует избегать использования системных ГКС или иммунодепрессантов из-за их потенциального влияния на фармакодинамическую активность и эффективность атезолизумаба. Тем не менее, после начала терапии атезолизумабом системные ГКС или другие иммунодепрессанты могут использоваться для лечения нежелательных реакций со стороны иммунной системы.
МНН: Атезолизумаб
Производитель: Ф. Хоффманн-Ля Рош Лтд.
Анатомо-терапевтическо-химическая классификация: Атезолизумаб
Номер регистрации в РК:
№ РК-ЛС-5№024868
Информация о регистрации в РК:
30.12.2020 — 30.12.2025
Номер регистрации в РБ:
10680/18
Информация о регистрации в РБ:
20.12.2018 — 20.12.2023
- Скачать инструкцию медикамента
Торговое наименование
Тецентрик®
Международное непатентованное название
Атезолизумаб
Лекарственная форма, дозировка
Концентрат для приготовления раствора
для инфузий 840 мг/14 мл
Концентрат для приготовления раствора
для инфузий 1200 мг/20 мл, 20 мл
Фармакотерапевтическая группа
Антинеопластические и
иммуномодулирующие препараты. Антинеопластические препараты.
Антинеопластические препараты другие. Моноклональные антитела.
Атезолизумаб.
Код ATХ
L01XC32
Показания к применению
Уротелиальный рак
Препарат Тецентрик®
показан к применению в качестве монотерапии для лечения
местнораспространенного или метастатического уротелиального рака у
взрослых пациентов:
• после предшествующей
химиотерапии препаратами платины или
• невозможности лечения
цисплатином, а также при наличии экспрессии PD-L1 ≥5%.
Немелкоклеточный рак легкого
Препарат Тецентрик®
в комбинации с бевацизумабом, паклитакселом и карбоплатином показан к
применению в первой линии терапии взрослых пациентов с
метастатическим неплоскоклеточным немелкоклеточным раком легкого
(НМРЛ). У пациентов с EGFR или ALK геномной опухолевой мутацией
препарат Тецентрик®
в комбинации с бевацизумабом, паклитакселом и карбоплатином показан к
применению только при отсутствии эффективности соответствующей
таргетной терапии.
Препарат Тецентрик®
в комбинации с наб-паклитакселом и карбоплатином показан к применению
в первой линии терапии взрослых пациентов с метастатическим
неплоскоклеточным НМРЛ при отсутствии EGFR или ALK геномной
опухолевой мутации.
Препарат Тецентрик®
в монорежиме показан к применению в первой линии терапии взрослых
пациентов с метастатическим НМРЛ при наличии экспрессии PD-L1 ≥50%
на опухолевых клетках или при наличии экспрессии PD-L1 ≥10% на
иммунокомпетентных клетках, инфильтрирующих ткань опухоли, при
отсутствии EGFR или ALK геномной опухолевой мутации.
Препарат Тецентрик®
показан к применению в качестве монотерапии для лечения взрослых
пациентов с местнораспространенным или метастатическим НМРЛ после
предшествующей химиотерапии. Перед началом терапии препаратом
Тецентрик®
пациенты с EGFR или ALK геномной опухолевой мутацией должны получить
таргетную терапию.
Мелкоклеточный рак легкого
Препарат Тецентрик®
в комбинации с карбоплатином и этопозидом показан к применению в
первой линии терапии взрослых пациентов с распространенным
мелкоклеточным раком легкого.
Тройной негативный рак молочной
железы
Препарат Тецентрик®
в комбинации с
наб-паклитакселом показан для лечения взрослых пациентов с
неоперабельным местно-распространённым или метастатическим тройным
негативным раком молочной железы при наличии экспрессии PD-L1 ≥1%,
не получавших предшествующую химиотерапию по поводу метастатического
заболевания.
Гепатоцеллюлярная карцинома
Препарат Тецентрик®
в комбинации с бевацизумабом показан для лечения взрослых пациентов с
распространенной или неоперабельной гепатоцеллюлярной карциномой без
предшествующей системной терапии.
Перечень сведений, необходимых до
начала применения
Противопоказания
-
гиперчувствительность к действующему
веществу или к любому из вспомогательных веществ
Необходимые меры
предосторожности при применении
Перед началом терапии препаратом
Тецентрик®
сообщите лечащему врачу
если:
-
у вас аутоиммунное заболевание
(состояние, при котором организм атакует собственные клетки) -
вам сообщили о распространении рака
в области головного мозга -
у вас когда-либо наблюдалось
воспаление легких (так называемый пневмонит) -
вы имеете или когда-либо имели
хроническое вирусное поражение печени, включая гепатит B или гепатит
C -
у вас вирус иммунодефицита человека
(ВИЧ-инфекция) или синдром приобретенного иммунодефицита (СПИД) -
у вас когда-либо наблюдались
серьезные побочные
эффекты на фоне другой терапии антителами, которые помогают вашей
иммунной системе бороться с онкологическим заболеванием -
вы принимали препараты,
стимулирующие иммунную систему -
вы принимали препараты, подавляющие
иммунную систему -
вы получили живую аттенуированную
вакцину -
в течение последних двух недель вы
получали лекарственные препараты для лечения инфекций (антибиотики)
Если что-либо из вышеперечисленного
имеет отношение к вам (или вы не уверены) перед началом терапии
препаратом Тецентрик®
проконсультируйтесь со
своим лечащим врачом.
Применение препарата Тецентрик®
может вызвать некоторые
побочные эффекты, о которых вы должны немедленно сообщить своему
лечащему врачу.
Они могут развиться через несколько недель или месяцев после приема
последней дозы. Немедленно сообщите своему врачу, если заметите
какие-либо из перечисленных симптомов:
-
воспаление легких (пневмонит):
симптомы могут включать впервые развившийся или усиливающийся
кашель, затруднение дыхания и боль в груди -
воспаление печени (гепатит):
симптомы могут включать пожелтение кожи или глаз, тошноту, рвоту,
кровотечение или кровоизлияние, потемнение цвета мочи и боль в
животе -
воспаление кишечника (колит):
симптомы могут включать диарею (водянистый, жидкий или мягкий стул),
кровь в стуле и боль в животе -
воспаление щитовидной железы,
надпочечников и гипофиза (гипотиреоз, гипертиреоз, надпочечниковая
недостаточность или гипофизит): симптомы могут включать
утомляемость, потерю веса, увеличение веса, изменение настроения,
выпадение волос, запор, головокружение, головные боли, повышенную
жажду, учащенное мочеиспускание и изменения зрения -
диабет 1 типа, включая закисление
крови, вызванное диабетом (диабетический кетоацидоз): симптомы могут
включать нехарактерное усиленное чувство голода или жажды, учащенное
мочеиспускание, потерю веса и чувство усталости -
воспаление головного мозга
(энцефалит) или воспаление оболочек спинного и головного мозга
(менингит): симптомы могут включать напряженность мышц шеи, головную
боль, повышенние температуры тела, озноб, рвоту,
светочувствительность глаз, спутанность сознания и сонливость -
воспаление или проблемы с нервами
(невропатия): симптомы могут включать мышечную слабость и онемение,
покалывание в руках и ногах -
воспаление поджелудочной железы
(панкреатит): симптомы могут включать боль в животе, тошноту и рвоту -
воспаление сердечной мышцы
(миокардит): симптомы могут включать затруднение дыхания, снижение
переносимости физических нагрузок, чувство усталости, боль в груди,
отек лодыжек или ног, нерегулярное сердцебиение и обморок -
воспаление почек (нефрит): симптомы
могут включать изменение объема и цвета мочи, боль в области таза и
отечность тела, и могут приводить к почечной недостаточности -
воспаление мышц (миозит): симптомы
могут включать мышечную слабость, утомляемость после ходьбы или
стояния, спотыкания или падения, а также проблемы с глотанием или
дыханием -
тяжелые реакции, связанные с
инфузией (события, развивающиеся во время инфузии или в течение
одного дня после инфузии): могут включать повышение температуры
тела, озноб, затруднение дыхания и приливы -
тяжелые кожные реакции, которые
могут включать сыпь, зуд, образование волдырей, шелушение или язвы
на коже, и/или язвы во рту или на слизистой оболочке носа, горла или
гениталий.
Если вы заметили развитие какого-либо
из вышеперечисленных симптомов, немедленно сообщите об этом своему
лечащему врачу.
Не пытайтесь самостоятельно лечить
симптомы, применяя другие лекарственные препараты. Ваш врач может:
-
назначить вам
другие препараты, чтобы предотвратить осложнения и уменьшить
выраженность симптомов. -
приостановить введение следующей
дозы препарата Тецентрик®. -
прекратить лечение препаратом
Тецентрик®.
Лабораторные и инструментальные
данные
Перед началом лечения ваш врач
проведет обследование общего состояния здоровья. Во время лечения у
вас также будут проводить анализы крови.
Другие препараты и препарат
Тецентрик®
Сообщите своему лечащему врачу, если
вы принимаете, недавно принимали или собираетесь принимать какие-либо
другие лекарственные препараты. К ним относятся лекарственные
препараты, отпускаемые без рецепта, в том числе лекарственные травы.
Беременность и контрацепция
Сообщите своему лечащему врачу, если
вы беременны, думаете, что беременны или планируете забеременеть.
Вам не назначат препарат Тецентрик®,
если вы беременны, если только ваш врач не сочтет это необходимым.
Это связано с тем, что влияние препарата Тецентрик®
на беременных
неизвестно — возможно, он может нанести вред вашему будущему ребенку.
Если вы можете забеременеть, вы
должны использовать эффективные методы контрацепции:
-
во время лечения препаратом
Тецентрик®
и -
в течение 5 месяцев после приема
последней дозы.
Если вы забеременели во время лечения
препаратом Тецентрик®,
сообщите об этом своему лечащему врачу.
Кормление грудью
Неизвестно, попадает ли препарат
Тецентрик®
в грудное молоко.
Спросите своего лечащего врача, следует ли вам прекратить грудное
вскармливание или лечение препаратом Тецентрик®.
Взаимодействия с другими
лекарственными препаратами
Отдельные исследования
фармакокинетического взаимодействия атезолизумаба с другими
лекарственными средствами не проводились. Поскольку атезолизумаб
подвергается катаболизму, метаболического лекарственного
взаимодействия не ожидается.
Перед началом применения
атезолизумаба следует избегать использования системных
кортикостероидов или иммуносупрессантов из-за их потенциального
влияния на фармакодинамическую активность и эффективность
атезолизумаба. Тем не менее, после начала начала терапии
атезолизумабом системные кортикостероиды или другие иммуносупрессанты
могут использоваться для лечения иммуноопосредованных нежелательных
реакций.
Специальные предупреждения
Применение в педиатрии
Препарат Тецентрик®
противопоказан у детей
и подростков младше 18 лет. Это связано с тем, что безопасность и
эффективность препарата Тецентрик®
для данной возрастной
группы не установлены.
Пациенты пожилого возраста
Коррекция дозы препарата Тецентрик®
у пациентов в возрасте
≥65 лет не требуется.
Пациенты с нарушением функции
почек
Коррекция дозы у пациентов с
нарушением функции почек легкой или умеренной степени тяжести не
требуется. Данные о применении препарата у пациентов с нарушением
функции почек тяжелой степени очень ограничены, невозможно
сформулировать выводы о применении препарата в данной популяции.
Пациенты с нарушением функции
печени
Коррекция дозы у пациентов с
нарушением функции печени легкой или умеренной степени тяжести не
требуется. Применение препарата Тецентрик®
у пациентов с нарушением функции печени тяжелой степени не изучалось.
Особенности влияния препарата на
способность управлять транспортным средством или потенциально
опасными механизмами
Препарат Тецентрик®
оказывает
несущественное влияние на способность управлять транспортными
средствами и работать с механизмами. Если вы чувствуете усталость,
воздержитесь от управления автомобилем и работы с механизмами, пока
не почувствуете себя лучше.
Рекомендации по применению
Режим дозирования
Лечение препаратом Тецентрик®
проводится опытным
врачом онкологом в
условиях стационара.
Рекомендуемая доза составляет:
-
840 миллиграммов (мг) каждые две
недели или -
1200 миллиграммов (мг) каждые три
недели или -
1680 миллиграммов (мг) каждые четыре
недели.
Метод и путь введения
Препарат Тецентрик®
вводят внутривенно
капельно (внутривенная инфузия).
Ваша первая инфузия будет длиться
более 60 минут.
-
Ваш лечащий врач будет внимательно
наблюдать за вами во время первой инфузии. -
Если во время первой инфузии у вас
не наблюдается реакции на инфузию, следующие инфузии будут
проводиться в течение 30 минут.
Длительность лечения
Ваш лечащий врач будет продолжать
лечение препаратом Тецентрик®
до тех пор, пока
препарат не перестанет приносить вам пользу. Однако лечащий врач
может прекратить лечение, если побочные эффекты станут слишком
серьезными.
Меры, необходимые при пропуске
одной или нескольких доз лекарственного препарата
Если вы пропустили очередную инфузию
препарата, проконсультируйтесь с вашим лечащим врачом. Чтобы лечение
было полностью эффективным, очень важно продолжать инфузии.
Указание на наличие риска
симптомов отмены
Не прекращайте лечение препаратом
Тецентрик®,
если вы не обсудили это со своим лечащим врачом. Прекращение терапии
может прекратить действие лекарственного препарата.
Если у вас имеются дополнительные
вопросы по применению данного препарата, обратитесь к лечащему врачу.
Рекомендации по обращению за
консультацией к медицинскому работнику для разъяснения способа
применения лекарственного препарата
При наличии вопросов по применению
препарата, обратитесь к лечащему врачу.
Описание нежелательных реакций,
которые
проявляются при стандартном применении лекарстенного препарата и
меры, которые следует принять в этом случае
Подобно всем лекарственным
препаратам, препарат Тецентрик®
может вызывать
нежелательные реакции, однако они возникают не у всех.
Немедленно сообщите своему врачу,
если вы заметите
какие-либо из следующих нежелательных
реакций или в случае их усугубления.
Они могут развиться через несколько недель или месяцев после введения
последней дозы. Не пытайтесь самостоятельно лечить симптомы, применяя
другие лекарственные препараты.
Перечень нежелательных реакций:
Следующие нежелательные реакциии
были зарегистрированы в ходе клинических испытаний при использовании
препарата Тецентрик®
в монотерапии:
Очень часто (могут возникать у
более чем 1 человека из 10)
-
инфекции мочевыводящих путей
-
снижение аппетита
-
головная боль
-
кашель, одышка
-
тошнота, рвота, диарея
-
сыпь, зуд кожи
-
артралгия, боль в спине,
мышечно-скелетная боль -
повышенная температура тела,
утомляемость, астения
Часто (могут возникать не более
чем у 1 человека из 10)
-
тромбоцитопения
-
инфузионная реакция
-
гипотериоз, гипертиреоз
-
гипокалиемия, гипонатриемия,
гипергликемия -
артериальная гипотензия
-
пневмонит, гипоксия, заложенность
носа, назофарингит -
боль в животе, колит, дисфагия,
орофарингеальная боль -
повышение активности АСТ, повышение
активности АЛТ,
гепатит -
сухость кожи
-
повышение концентрации креатинина в
крови -
гриппоподобный синдром, озноб
Нечасто (могут возникать не более
чем у 1 человека из 100)
-
сахарный диабет, надпочечниковая
недостаточность -
синдром Гийена-Барре,
менингоэнцефалит -
панкреатит
-
псориаз, тяжелые кожные
нежелательные реакции -
миозит
-
нефрит
Редко (могут возникать не более
чем у 1 человека из 1000)
-
гипофизит
-
миастенический синдром
-
увеит
-
миокардит
-
пемфигоид
Неизвестно (невозможно оценить на
основании имеющихся данных)
-
неинфекционный цистит
Следующие нежелательные реакциии
были зарегистрированы в ходе клинических испытаний при использовании
препарата Тецентрик®
в комбинации с противоопухолевыми препаратами:
Очень часто (могут возникать у
более чем 1 человека из 10)
-
инфекции легких
-
анемия, тромбоцитопения,
нейтропения, лейкопения -
гипотериоз
-
снижение аппетита
-
периферическая нейропатия, головная
боль -
артериальная гипертензия
-
одышка, кашель
-
тошнота, диарея, запор, рвота
-
сыпь, зуд кожи, алопеция
-
артралгия, мышечно-скелетная боль,
боль в спине -
повышенная температура тела,
утомляемость, астения, периферический отек
Часто (могут возникать не более
чем у 1 человека из 10)
-
сепсис
-
лимфопения
-
инфузионная реакция
-
гипертиреоз
-
гипокалиемия, гипонатриемия,
гипомагнезиемия -
обморок, головокружение
-
дисфония
-
стоматит, дисгевзия
-
повышение активности АСТ, повышение
активности АЛТ -
протеинурия, повышение концентрации
креатинина в крови -
повышение активности щелочной
фосфатазы
Нечасто (могут возникать не более
чем у 1 человека из 100)
-
псориаз, тяжелые кожные
нежелательные реакции
Редко (могут возникать не более
чем у 1 человека из 1000)
-
пемфигоид
При
развитии нежелательных лекарственных реакций следует обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов
РГП на ПХВ «Национальный центр
экспертизы лекарственных средств и медицинских изделий»
Комитета медицинского и фармацевтического контроля Министерства
здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведения
Состав лекарственного препарата
Один флакон (14 мл) содержит
активное вещество
— атезолизумаб, 840.0 мг,
вспомогательные вещества:
L-гистидин,
кислота уксусная ледяная, сахароза, полисорбат 20, вода для инъекций.
Один флакон (20 мл) содержит
активное вещество
— атезолизумаб, 1200.0 мг,
вспомогательные вещества:
L-гистидин,
кислота уксусная ледяная, сахароза, полисорбат 20, вода для инъекций.
Описание внешнего вида, запаха,
вкуса
Прозрачная или слегка опалесцирующая
жидкость от бесцветного до светло-желтого цвета.
Форма выпуска и упаковка
По 14 мл препарата помещают во
флаконы бесцветного прозрачного боросиликатного стекла типа I
вместимостью 15 мл, укупоренные резиновыми пробками с покрытием из
фтористого полимера и закатанные алюминиевыми колпачками с
пластиковой крышкой «flip-off».
По 1 флакону вместе с инструкцией по
медицинскому применению на казахском и русском языках помещают в
пачку из картона.
По 20 мл препарата помещают во
флаконы бесцветного прозрачного боросиликатного стекла типа I
вместимостью 20 мл, укупоренные резиновыми пробками с покрытием из
фтористого полимера и закатанные алюминиевыми колпачками с
пластиковой крышкой «flip—off».
По 1 флакону вместе с инструкцией по
медицинскому применению на казахском и русском языках помещают в
пачку из картона. С целью контроля первого вскрытия на пачку
наносится защитная голографическая наклейка.
Срок хранения
3 года
Не применять по истечении срока
годности.
Условия хранения
В оригинальной упаковке, при
температуре от 2 °С до 8 °С. Не замораживать! Не встряхивать!
Допустимый период нахождения
препарата при температуре от 9 °С до 30 °С — 312 часов,
включая 240 часов (10 суток) при 25 °С и 72 часа (3 суток) при 30
°С.
После разведения концентрата
допустимый период нахождения раствора для инфузий при температуре от
2 °С до 8 °С – не более 24 часов, при температуре не
выше 30 °С – 8 часов.
Хранить в недоступном для детей
месте!
Условия отпуска из аптек
По рецепту
Сведения о производителе
Ф. Хоффманн-Ля Рош Лтд., Швейцария
Wurmisweg
4303 Кайзераугст, Швейцария
Тел. + 41 61 688 11 11
Факс + 41 61 691 93 91
info@roche.com
Держатель регистрационного
удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
Grenzacherstrasse
124,
4070 Базель, Швейцария
Тел. + 41 61 688 11 11
Факс + 41 61 691 93 91
info@roche.com
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации на
территории Республики Казахстан, принимающей претензии
(предложения) по качеству лекарственных средств от потребителей
и ответственной
за пострегистрационное наблюдение за безопасностью лекарственного
средства
ТОО «Рош Казахстан»
Республика Казахстан
050020, г. Алматы, ул. Луганского, д.
137
Тел. + 7 727 321 24 24
kz.safety@roche.com,
kz.quality@roche.com
<—————————————————————————————————>
Следующая информация предназначена
только для медицинских работников:
Инструкция по приготовлению
раствора для инфузий
Для рекомендованной дозы
840 мг: отобрать
14 мл концентрата из
флакона и развести в инфузионном пакете из поливинилхлорида,
полиолефина, полиэтилена или полипропилена, содержащем 0.9%
стерильный раствор натрия хлорида для инъекций.
Для рекомендованной дозы
1200 мг: отобрать 20 мл концентрата
из флакона и
развести в инфузионном пакете из поливинилхлорида, полиолефина,
полиэтилена или полипропилена, содержащем 0.9% стерильный раствор
натрия хлорида для инъекций.
Для рекомендованной дозы 1680 мг:
отобрать 28 мл концентрата из двух флаконов препарата Тецентрик®
840 мг и развести в
инфузионном пакете из поливинилхлорида,
полиолефина, полиэтилена или полипропилена,
содержащем 0.9% стерильный раствор натрия хлорида для инъекций.
После разведения препарата
концентрация раствора должна составлять 3.2-16.8 мг/мл. Инфузионный
пакет следует осторожно перевернуть для перемешивания раствора,
избегая при этом пенообразования. Приготовленный раствор для инфузий
следует использовать немедленно.
Растворы для парентерального введения
перед использованием следует визуально проверять на наличие частиц и
изменение цвета. В случае обнаружения частиц или изменения цвета
раствор использовать нельзя.
Признаков несовместимости между
препаратом Тецентрик®
и инфузионными пакетами
с контактирующей поверхностью из поливинилхлорида, полиолефина,
полиэтилена или полипропилена не выявлено. Кроме того, не наблюдалось
признаков несовместимости с мембранами инфузионных фильтров из
полиэфирсульфона или полисульфона, инфузионными системами и другими
приспособлениями для инфузий из поливинилхлорида, полиэтилена,
полибутадиена или полиэфируретана. Использование встроенных фильтров
с мембранами опционально.
Разведенный концентрат
Химическая и физическая стабильность
готового к применению лекарственного препарата подтверждена при
хранении в течение не более 24 часов при температуре не выше 30 °С
и до 30 дней при температуре от 2 °С до 8 °С с момента
приготовления.
С микробиологической точки зрения
приготовленный раствор для инфузий подлежит немедленному применению.
Если препарат не введен немедленно, хранение готового к применению
препарата и обеспечение условий до введения является обязанностью
пользователя, в целом не должно превышать 24 часов при температуре
2-8 °C или 8 часов при комнатной температуре (≤25 °С), за
исключением случаев, когда приготовление раствора производилось в
контролируемых и валидируемых условиях асептики.
Способ применения
Препарат Тецентрик®
предназначен для
внутривенного введения. Вводить препарат струйно или болюсно нельзя.
Первую дозу препарата Тецентрик®
необходимо вводить в
течение 60 минут. Если первая инфузия хорошо переносится, все
последующие инфузии можно проводить в течение 30 минут.
Одновременно вводить другие
лекарственные препараты через одну инфузионную систему нельзя.
Утилизация
Попадание препарата Тецентрик®
в окружающую среду
должно быть сведено к минимуму. Любое неиспользованное количество
лекарственного препарата или
отходы следует уничтожить в установленном порядке.
| 10680_18_i.pdf | 3.85 кб |
| Tecentriq_1200_mg_ex_Kau_draft_PIL_26.11_.2021_rus_.docx | 0.05 кб |
| Tecentriq_8401200_mg_ex_Kau_draft_PIL_25.03_.2022_kaz_.docx | 0.05 кб |
Отправить прикрепленные файлы на почту
«Центр экспертиз и испытаний в здравоохранении» МЗ РБ. Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
1 флакон с концентратом 20 мл содержит 1200 мг атезолизумаба*.
После разведения (см. раздел «Особые меры предосторожности при обращении с препаратом и его утилизации») в 1 мл раствора содержится около 4.4 мг атезолизумаба.
* Атезолизумаб – это гуманизированное моноклональное антитело класса IgGl c модифицированным Fc-фрагментом, которое непосредственно связывается с лигандом рецептора программируемой гибели клеток (PD-L1), полученное с помощью рекомбинантной ДНК-технологии из клеток яичников китайского хомячка.
Полный список вспомогательных веществ представлен в разделе «Перечень вспомогательных веществ».
Жидкость от бесцветного до светло-желтого цвета.
В виде монотерапии препарат Тецентрик показан для лечения местно-распространенной или метастатической уротелиальной карциномы (УК) у взрослых после предшествующей химиотерапии на основе препаратов платины или при наличии противопоказаний к применению цисплатина (см. раздел «Фармакодинамические свойства»).
В виде монотерапии препарат Тецентрик показан для лечения местно-распространенного или метастатического немелкоклеточного рака легких (НМРЛ) после предшествующей химиотерапии. До начала применения препарата Тецентрик пациенты с активирующими мутациями в гене EGFR или с мутацией ALK должны получить таргетную терапию (см. раздел «Фармакодинамические свойства»).
Назначение и контроль применения препарата Тецентрик должны осуществлять врачи, имеющие опыт лечения онкологических заболеваний.
Режим дозирования
Рекомендуемая доза препарата Тецентрик составляет 1200 мг внутривенно каждые три недели.
Продолжительность терапии
Терапию препаратом Тецентрик следует продолжать до потери клинической пользы (см. раздел «Фармакодинамические свойства») или развития неприемлемой токсичности.
Несвоевременный прием или пропуск дозы
В случае пропуска плановой дозы препарата Тецентрик, пропущенную дозу следует получить как можно скорее; рекомендуется не дожидаться следующей плановой дозы. График введения препарата корректируется таким образом, чтобы сохранить 3-недельный интервал между дозами.
Изменение дозы в ходе терапии
Уменьшение дозы препарата Тецентрик не рекомендуется.
Приостановка или прерывание терапии (см. также разделы «Особые указания и меры предосторожности при применении» и «Нежелательные реакции»)
Таблица 1: Рекомендации по модификации дозы препарата Тецентрик
| Нежелательная реакция | Степень тяжести | Коррекция терапии |
|---|---|---|
| Пневмонит | 2-я степень |
Приостановить терапию препаратом Тецентрик. Терапия может быть возобновлена после снижения тяжести явления до 0-й или 1-й степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до ≤ 10 мг перорально в сутки |
| 3-я или 4-я степень |
Полностью прекратить лечение препаратом Тецентрик® |
|
| Гепатит |
2-я степень (уровень AЛT или ACT в 3-5 раз превышает верхнюю границу нормы (ВГН) или билирубин в крови в 1.5-3 раза превышает ВГН) |
Приостановить терапию препаратом Тецентрик. Терапия может быть возобновлена после снижения степени тяжести явления до 0-й или 1-й степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до ≤ 10 мг перорально в сутки |
|
3-я или 4-я степень (уровень AЛT или ACT в > 5 раз превышает ВГН или билирубин в крови в > 3 раза превышает ВГН) |
Полностью прекратить лечение препаратом Тецентрик |
|
| Колит |
Диарея 2-й или 3-й степени (увеличение кратности стула ≥ 4 раз в день или клинически выраженный колит) |
Приостановить терапию препаратом Тецентрик. Терапия может быть возобновлена после снижения тяжести явления до 0-й или 1-й степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до ≤ 10 мг перорально в сутки |
|
Диарея 4-й степени или колит (жизнеугрожающее состояние; показано срочное медицинское вмешательство) |
Полностью прекратить лечение препаратом Тецентрик |
|
|
Гипотиреоз и гипертиреоз |
Симптоматический |
Приостановить терапию препаратом Тецентрик. Гипотиреоз Терапия может быть возобновлена после снижения уровня ТТГ с помощью соответствующей заместительной терапии. Гипертиреоз Терапия может быть возобновлена после улучшения функции щитовидной железы с помощью антитиреоидных препаратов |
|
Надпочечниковая недостаточность |
Симптоматический |
Приостановить терапию препаратом Тецентрик. Терапия может быть возобновлена после снижения тяжести явления до 0-й или 1-й степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до ≤10 мг перорально в сутки; при этом состояние пациента остается стабильным на заместительной терапии |
| Гипофизит | 2-я или 3-я степень |
Приостановить терапию препаратом Тецентрик. Терапия может быть возобновлена после снижения тяжести явления до 0-й или 1-й степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до ≤ 10 мг перорально в сутки; при этом состояние пациента должно оставаться стабильным на заместительной терапии |
| 4-я степень |
Полностью прекратить лечение препаратом Тецентрик |
|
|
Сахарный диабет 1-го типа |
Гипергликемия 3-й или 4-й степени (уровень глюкозы натощак > 250 мг/дл или 13.9 ммоль/л) |
Приостановить терапию препаратом Тецентрик. Терапия может быть возобновлена после установления контроля метаболизма при помощи заместительной терапии инсулином |
|
Инфузионные реакции |
1-я или 2-я степень |
Снизить скорость инфузии или прервать инфузию. Терапия может быть возобновлена после разрешения явления |
| 3-я или 4-я степень |
Полностью прекратить лечение препаратом Тецентрик |
|
| Сыпь | 3-я степень |
Приостановить терапию препаратом Тецентрик. Терапия может быть возобновлена после разрешения сыпи и снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до ≤ 10 мг перорально в сутки |
| 4-я степень |
Полностью прекратить лечение препаратом Тецентрик |
|
|
Миастенический синдром/злокачественная миастения, синдром Гийена–Барре и менингоэнцефалит |
Все степени тяжести |
Полностью прекратить лечение препаратом Тецентрик |
| Панкреатит |
Повышение уровня амилазы или липазы в сыворотке крови 3-й или 4-й степени (в > 2 раза превышает ВГН) или панкреатит 2-й или 3-й степени |
Приостановить терапию препаратом Тецентрик. Терапия может быть возобновлена после снижения тяжести явления (повышение уровня амилазы и липазы) до 0-й или 1-й степени в течение 12 недель или купирования симптомов панкреатита и снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до ≤ 10 мг перорально в сутки |
|
4-я степень или любая степень рецидивирующего панкреатита |
Полностью прекратить лечение препаратом Тецентрик |
|
| Миокардит | 2-я степень |
Приостановить терапию препаратом Тецентрик. Терапию можно возобновить при условии улучшения симптомов до 0-й или 1-й степени в течение 12 недель, сокращения дозы кортикостероидов (преднизон или эквивалентный препарат) до ≤ 10 мг в сутки |
| 3-я или 4-я степень |
Окончательно прекратить лечение препаратом Тецентрик |
|
|
Другие иммуноопосредованные нежелательные реакции |
2-я или 3-я степень | |
|
4-я степень или рецидивирующая 3-я степень |
Окончательно прекратить лечение препаратом Тецентрик (за исключением эндокринопатий, контролируемых заместительной гормонотерапией) |
Примечание: степень токсичности определяется в соответствии с Общими терминологическими критериями Национального института онкологии США, версия 4.0 (НИО – ОТК, версия 4). Пациентам, получающим терапию препаратом Тецентрик, следует выдать Памятки для пациентов и проинформировать о рисках, связанных с применением препарата.
Особые группы пациентов
Дети
Безопасность и эффективность препарата Тецентрик у детей и подростков младше 18 лет не установлена. Данные отсутствуют.
Лица пожилого возраста
На основании данных анализа фармакокинетики в совокупности, коррекция дозы препарата Тецентрик для пациентов в возрасте ≥ 65 лет не требуется.
Применение у пациентов с нарушением функции почек
Основываясь на популяционном фармакокинетическом анализе пациентам с легкой или умеренной почечной недостаточностью, коррекция дозы не требуется (см. раздел «Фармакокинетические свойства»). Данные о пациентах с тяжелой почечной недостаточностью слишком ограничены, чтобы сделать выводы о применении препарата в данной совокупности.
Применение у пациентов с нарушением функции печени
Основываясь на популяционном фармакокинетическом анализе, корректировка дозы не требуется для пациентов с легкой печеночной недостаточностью. Применение препарата Тецентрик у пациентов с умеренной или тяжелой печеночной недостаточностью не изучалось (см. раздел «Фармакокинетические свойства»).
Общее состояние онкологического пациента по шкале Восточной объединенной онкологической группы (ECOG) ≥ 2
Пациенты с общим состоянием ≥ 2 по шкале ECOG были исключены из участия в клинических исследованиях при HMPЛ и терапии 2-й линии при УК (см. разделе «Особые указания и меры предосторожности при применении» или «Фармакодинамические свойства»).
Способ применения
Препарат Тецентрик предназначен для внутривенного введения. Инфузии не следует вводить внутривенно струйно быстро или в виде болюсных инфузий.
Начальную дозу Тецентрик необходимо вводить в течение 60 минут. Если пациент хорошо переносит первую инфузию, продолжительность последующих инфузий может составлять 30 минут.
Инструкции по разведению и обращению с лекарственным препаратом перед введением представлены в разделе «Особые меры предосторожности при обращении с препаратом и его утилизация».
Гиперчувствительность к атезолизумабу или к любому из вспомогательных веществ, перечисленных в разделе «Перечень вспомогательных веществ».
Для улучшения прослеживаемости биологических лекарственных средств следует четко указывать торговое наименование и номер серии вводимого препарата в карте пациента.
Большинство иммуноопосредованных нежелательных реакций, возникших в процессе терапии с применением атезолизумаба, носили обратимый характер при условии прерывания приема препарата и начала использования кортикостероидов и/или поддерживающей терапии. Наблюдались иммуноопосредованные нежелательные реакции, влияющие на несколько систем организма. Иммуноопосредованные нежелательные реакции могут возникать после введения последней дозы атезолизумаба.
При возникновении подозреваемых иммуноопосредованных нежелательных реакций необходимо провести тщательный анализ для подтверждения этиологии и исключения других причин. Исходя из степени тяжести нежелательной реакции следует отменить препарат и начать курс кортикостероидов. После улучшения до степени ≤ 1 доза кортикостероидов постепенно снижается в течение ≥ 1 месяца. На основании ограниченных данных клинических исследований с участием пациентов, у которых иммуноопосредованные нежелательные реакции не поддавались контролю за счет системного применения кортикостероидов, допускается применение других системных иммунодепрессантов. Атезолизумаб отменяется на постоянной основе при рецидивах иммуноопосредованных нежелательных реакций 3-й степени или возникновении иммунных HP 4-й степени, исключая эндокринопатические нарушения, поддающиеся контролю за счет гормональной заместительной терапии (см. разделы «Режим дозирования и способ применения» и «Нежелательные реакции»).
Иммуноопосредованный пневмонит
В ходе клинических исследовании с применением атезолизумаба отмечались случаи пневмонита, в том числе с летальным исходом (см. раздел «Нежелательные реакции»). Необходимо облсдовать пациентов на предмет признаков и симптомов пневмонита.
Терапию атезолизумабом следует прервать при пневмоните степени 2, после чего начинают курс преднизона или эквивалентного препарата в дозе 1-2 мг/кг в сутки. При улучшении симптомов до степени ≤ 1, доза кортикостероидов постепенно снижается в течение ≥ 1 месяца. Терапию атезолизумабом можно возобновить, если в течение 12 недель степень тяжести НЯ понижается до ≤ 1, а доза кортикостероидов (преднизона или эквивалентного препарата) составляет ≤ 10 мг в сутки. При пневмоните степени 3 или 4 лечение атезолизумабом должно быть прекращено на постоянной основе.
Иммуноопосредованный гепатит
В ходе клинических исследований с применением атезолизумаба отмечались случаи гепатита, иногда ведущего к летальному исходу (см. раздел «Нежелательные реакции»). Необходимо обследовать пациентов на предмет признаков и симптомов гепатита.
До начала терапии, периодически в процессе терапии и по показаниям на основании клинической оценки необходимо контролировать уровни аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ) и билирубина.
Терапию атезолизумабом следует прервать, если явление степени 2 (АЛТ или ACT > в 3-5 раз × ВГН, билирубин крови > 1.5-3 раза × ВГН) сохраняется более 5-7 дней, после чего начинают курс преднизона или эквивалентного препарата в дозе 1-2 мг/кг в сутки. При изменении степени тяжести НЯ до ≤ 1, доза кортикостероидов постепенно сокращается в течение ≥ 1 месяца.
Терапию атезолизумабом можно возобновить при условии, если тяжесть НЯ понижается до ≤1 в течение 12 недель, а доза кортикостероидов (преднизон или эквивалентный препарат) сокращается до ≤ 10 мг в сутки. Терапия атезолизумабом отменяется на постоянной основе при НЯ степени 3 или 4 (АЛТ или ACT > 5 раз × ВГП или билирубин крови > 3 раза × ВГП).
Иммуноопосредованный колит
В ходе клинических исследований с применением атезолизумаба отмечались случаи диареи или колита (см. раздел «Нежелательные реакции»). Необходимо обследовать пациентов на предмет признаков и симптомов колита.
Терапию атезолизумабом прерывают при диарее степени 2 или 3 (увеличение частоты стула ≥ 4 раза в сутки по сравнению с исходным уровнем) или колите (симптоматическом). При диарее степени 2 или колите, если симптомы сохраняются в течение > 5 дней или возобновляются, начинают терапию преднизоном или эквивалентным препаратом в дозе 1-2 мг/кг в сутки. При диарее или колите степени 3 необходима терапия с внутривенным введением кортикостероидов (метилпреднизолон или эквивалентный препарат в дозе 1–2 мг/кг в сутки). После улучшения симптомов начинают терапию преднизоном или эквивалентным препаратом в дозе 1-2 мг/кг в сутки. При снижении степени тяжести симптомов до ≤ 1, доза кортикостероидов постепенно понижается в течение ≥1 месяца. Терапию атезолизумабом можно возобновить, если степень тяжести симптомов понижается до ≤ 1 в течение 12 недель, а доза кортикостероидов (преднизона или эквивалента) уменьшается до ≤10 мг в сутки. Терапия атезолизумабом отменяется на постоянной основе при диарее или колите 4-й степени тяжести (представляет угрозу для жизни; показано неотложное врачебное вмешательство).
Иммуноопосредованные эндокринопатии
В клинических исследованиях с применением атезолизумаба отмечались гипотиреоз, гипертиреоз, недостаточность надпочечников, гипофизит и сахарный диабет 1-го типа, включая диабетический кетоацидоз (см. раздел «Нежелательные реакции»).
Необходимо наблюдение пациентов для выявления клинических признаков и симптомов эндокринопатий. До начала терапии, а также периодически в процессе терапии необходим контроль функции щитовидной железы. При отклонении показателей функции щитовидной железы от нормы на исходном уровне необходимо соответствующее наблюдение больных.
Пациенты с бессимптомными нарушениями функции щитовидной железы могут получать атезолизумаб. При симптоматическом гипотиреозе применение атезолизумаба следует отменить и по необходимости начать гормональную заместительную терапию щитовидной железы. Контроль изолированного гипотиреоза достигается за счет заместительной терапии и без применения кортикостероидов. При симптоматическом гипертиреозе применение атезолизумаба отменяется и, по необходимости, назначаются антитиреоидные препараты. После достижения контроля симптомов и улучшения функции щитовидной железы терапию атезолизумабом возобновляют.
При симптоматической недостаточности надпочечников, атезолизумаб отменяется, после чего назначают внутривенные кортикостероиды (метилпреднизолон или эквивалентный препарат в дозе 1-2 мг/кг в сутки). После улучшения симптомов применяют преднизолон в дозе 1-2 мг/кг в сутки или эквивалентный препарат. При улучшении симптомов до степени ≤ 1 доза кортикостероидов постепенно снижается на протяжении ≥ 1 месяца. Терапию можно возобновить, если степень тяжести симптомов понижается до ≤ 1 в течение 12 недель, а доза кортикостероидов (преднизона или эквивалентного препарата) сокращается до ≤ 10 мг в сутки, при этом состояние пациента на заместительной терапии стабильно (при необходимости).
При гипофизите степени 2 или 3 атезолизумаб отменяют, после чего начинают терапию внутривенными кортикостероидами (метилпреднизолон или эквивалентный препарат в дозе 1-2 мг/кг в сутки). Также при необходимости начинают гормональную заместительную терапию. После улучшения симптомов переходят к терапии преднизоном или эквивалентным препаратом в дозе 1-2 мг/кг в сутки. При улучшении симптомов до степени ≤ 1, доза кортикостероидов постепенно снижается на протяжении ≥ 1 месяца. Терапию можно возобновить, если в течение 12 недель степень тяжести НЯ снижается до ≤ 1, доза кортикостероидов (преднизона или эквивалентного препарата) сокращается до ≤ 10 мг в сутки, а состояние пациента на заместительной терапии (при необходимости) стабильно. При гипофизите 4-й степени терапия атезолизумабом отменяется на постоянной основе.
При сахарном диабете 1-го типа назначают инсулин. При гипергликемии ≥ степени 3 (уровень глюкозы натощак > 250 мг/дл или 13.9 ммоль/л), атезолизумаб отменяют. Терапию можно возобновить при условии достижения метаболического контроля на инсулин-заместительной терапии.
Иммуноопосредованный менингоэниефалит
В клинических исследованиях с применением атезолизумаба наблюдался менингоэнцефалит (см. раздел «Нежелательные реакции»). Необходимо обследовать пациентов на предмет признаков и симптомов менингита или энцефалита.
Терапию атезолизумабом отменяют на постоянной основе при менингите или энцефалите любой степени тяжести. Начинают терапию внутривенными кортикостероидами (метилпреднизолон или эквивалентным препаратом в дозе 1-2 мг/кг в сутки). После улучшения симптомов применяется преднизолон или эквивалентный препарат в дозе 1-2 мг/кг в сутки.
Иммуноопосредованные невропатии
У пациентов на терапии атезолизумабом наблюдались миастенический синдром, тяжелая псевдопаралитическая миастения или синдром Гийена–Барре, которые могут представлять угрозу для жизни. Необходимо обследовать пациентов на предмет симптомов моторной и сенсорной невропатии.
Терапию атезолизумабом отменяют на постоянной основе при миастеническом синдроме/тяжелой псевдопаралитической миастении или синдроме Гийена–Барре любой степени тяжести. Может потребоваться назначение системных кортикостероидов (преднизон или эквивалентный препарат в дозе 1-2 мг/кг в сутки).
Иммуноопосредованный панкреатит
В клинических исследованиях с применением атезолизумаба были случаи панкреатита, в том числе повышения уровней сывороточной амилазы и липазы (см. раздел «Нежелательные реакции»). Необходимо пристальное наблюдение пациентов на предмет признаков и симптомов острого панкреатита.
Терапию препаратом атезолизумаб прерывают при повышении уровней амилазы и липазы ≥ 3 степени (> 2 × ВГН), или при панкреатите степени 2 и 3, после чего начинают терапию внутривенными кортикостероидами (метилпреднизолон или эквивалентный препарат в дозе 1-2 мг/кг в сутки). После улучшения симптомов переходят к терапии преднизоном или эквивалентным препаратом в дозе 1-2 мг/кг в сутки. Терапию атезолизумабом можно возобновить, если в течение 12 недель уровни сывороточной амилазы и липазы понижаются до степени ≤ 1, симптомы панкреатита исчезают, а доза кортикостероидов (преднизона или эквивалентного препарата) сокращается до ≤ 10 мг в сутки. Применение атезолизумаба отменяют на постоянной основе при панкреатите 4-й степени или при рецидивирующем панкреатите.
Иммуноопосредованный миокардит
Терапию атезолизумабом следует приостановить при миокардите степени 2, после чего начинают курс преднизона либо эквивалентного препарата в дозе 1-2 мк/кг в сутки. Терапия может быть возобновлена после снижения тяжести явления до 0-й или 1-й степени в течение 12 недель, а также после снижения дозы глюкокортикостероидов (преднизолона или его эквивалента) до ≤ 10 мг перорально в сутки Лечение атезолизумабом должно быть прекращено полностью ПРИ миокардите степени 3 или 4.
Инфузионные реакции
В клинических исследованиях с применением атезолизумаба наблюдались инфузионные реакции (см. раздел «Нежелательные реакции»). У пациентов с инфузионными реакциями степени 1 или 2 необходимо уменьшить скорость инфузии или прервать терапию. Атезолизумаб отменяют на постоянной основе при возникновении инфузионных реакций степени 3 или 4. Пациенты с инфузионными реакциями 1-2-й степени могут продолжать терапию атезолизумабом при условии пристального наблюдения; возможна премедикация жаропонижающими или антигистаминными средствами.
Пациенты, исключенные из клинических исследований
Пациенты со следующими заболеваниями не допускались к участию в клинических исследованиях: аутоиммунные заболевания в анамнезе, пневмонит в анамнезе, острое метастазирование в головной мозг, ВИЧ, гепатит В или гепатит в анамнезе. Также из исследований были исключены пациенты, которым в течение 28 дней до начала набора вводилась живая ослабленная вакцина; в течение 4 недель – системные иммуностимулирующие препараты и в течение 2 недель – системные иммунодепрессанты.
Исключали пациентов с общим состоянием на исходном уровне ≥ 2 (за исключением исследования GO29293 [IMvigor210], когорта 1, куда были набраны пациенты с уротелиальной карциномой, не неподлежащие (или которым не показана) терапии цисплатином, для которых допускалось общее состояние на исходном уровне ≥ 2) (см. раздел «Фармакодинамические свойства»).
По причине отсутствия данных в указанных совокупностях атезолизумаб следует использовать с осторожностью после тщательной оценки соотношения пользы/риск для конкретного пациента.
Применение атезолизумаба при уротелиальной карциноме у ранее нелеченных пациентов, которым противопоказана терапия цисплатином
Исходные и прогностические характеристики заболевания в когорте 1 совокупности исследования IMvigor210 в целом были сопоставимы с показателями пациентов в клинике, для которых была невозможна терапия цисплатином, но допускалась комбинированная химиотерапия на основе карбоплатина. Данных о подгруппе пациентов, для которых химиотерапия невозможна в принципе, недостаточно; по этой причине у таких пациентов атезолизумаб следует применять с осторожностью, после тщательной оценки соотношения пользы и рисков на индивидуальной основе.
Памятка для пациентов
Все лица, назначающие препарат Тецентрик, должны быть ознакомлены с Информацией для врачей и Протоколом ведения больного. Врач, назначающий лечение, должен обсудить риски терапии препаратом Тецентрик с пациентом. Пациенту следует предоставить Памятку для пациента с указаниями постоянно иметь ее с собой.
Официальные фармакокинетические исследования лекарственных взаимодействий с атезолизумабом не проводились. Поскольку атезолизумаб выводится из системы кровообращения посредством катаболизма, не ожидается возникновения межлекарственных взаимодействий.
Следует избегать применения системных кортикостероидов или иммунодепрессантов до начала терапии атезолизумабом по причине возможной интерференции с фармакодинамической активностью и эффективностью атезолизумаба. Тем не менее, системные кортикостероиды и другие иммунодепрессанты могут использоваться для устранения иммуноопосредованных нежелательных реакций после того, как курс терапии атезолизумабом был начат (см. раздел «Особые указания и меры предосторожности при применении»).
Женщинам детородного возраста следует использовать эффективные средства контрацепции в ходе терапии атезолизумабом и в течение 5 месяцев после ее окончания.
Беременность
Данные об использовании атезолизумаба у беременных женщин отсутствуют. Не проводились исследования влияния атезолизумаба на развитие и репродуктивную функцию. Исследования на животных показали, что ингибирование пути PD-L1/PD-1 на мышиной модели беременности может привести к иммуноопосредованному отторжению развивающегося плода, что ведет к его гибели (см. раздел «Данные доклинической безопасности»). Данные результаты указывают на наличие потенциального риска того, что применение атезолизумаба в период беременности, исходя из механизма действия препарата, может причинить вред плоду, в том числе повышать частоту выкидышей и мертворождения.
Известно, что иммуноглобулины человека G1 (IgG1) проходят сквозь плацентарный барьер, а атезолизумаб является IgG1; таким образом, есть вероятность передачи препарата от матери к развивающемуся плоду.
Атезолизумаб не следует использовать в период беременности, если только клиническое состояние беременной женщины не требует проведения такого рода терапии.
Кормление грудью
Не известно, выделяется ли атезолизумаб с грудным молоком. Атезолизумаб является моноклональным антителом, ожидается его присутствие в молозиве и в небольшом количестве в грудном молоке. Нельзя исключать наличие риска для новорожденных/младенцев. Учитывая пользу грудного вскармливания для ребенка и преимущества терапии для матери, следует принять решение о том, прервать ли грудное вскармливание или же отменить Тецентрик.
Фертильность
Клинические данные о возможном влиянии атезолизумаба на фертильность отсутствуют. Исследования репродуктивной и эмбриональной токсичности атезолизумаба не проводились; тем не менее, на основании данных 26-недельного исследования токсичности повторной дозы установлено, что атезолизумаб влияет на менструальный цикл при расчетном значении AUC, примерно в 6 раз превышающем AUC у пациентов, принимающих рекомендованную дозу препарата, при этом данный эффект носит обратимый характер (см. раздел «Данные доклинической безопасности»). Влияние на мужскую репродуктивную функцию отсутствует.
Препарат Тецентрик оказывает незначительное влияние на способность управлять транспортными средствами и работать с механизмами. Пациентам, испытывающим утомляемость, рекомендовано воздержаться от управления транспортными средствами и работы с механизмами до исчезновения симптомов (см. раздел «Нежелательные реакции»).
Профиль безопасности препарата Тецентрик основывается на совокупных данных от 2160 пациентов с метастатической УК и HMKPЛ. Наиболее распространенными нежелательными реакциями являются утомляемость (35.4%), снижение аппетита (25.5%), тошнота (22.9%), диспноэ (21.8%), диарея (18.6%), сыпь (18.6%), гипертермия (18.3%), рвота (15.0%), боль в суставах (14.2%), слабость (13.8%) и зуд (11.3%).
Резюме в форме таблицы нежелательных реакций
Нежелательные лекарственные реакции (HЛP) перечислены по системно-органным классам Медицинского словаря регуляторной деятельности (MedDRA) и категориям частоты. Использовались следующие категории частоты: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000). В каждой категории частоты нежелательные реакции представлены в порядке уменьшения степени серьезности.
Таблица 2: Краткая информация о нежелательных реакциях, наблюдаемых у пациентов на терапии препаратом Тецентрик в клинических исследованиях
|
Нарушения со стороны крови и лимфатической системы |
|
| Часто | Тромбоцитопения |
|
Нарушения со стороны иммунной системы |
|
| Часто | Гиперчувствительность |
|
Эндокринные нарушения |
|
| Часто | Гипотиреозa, гипертиреозb |
| Нечасто | Сахарный диабетc, недостаточность надпочечниковd |
| Редко | Гипофизит |
|
Нарушения метаболизма и питания |
|
| Очень часто | Пониженный аппетит |
| Часто | Гипокалиемия, гипонатриемия |
|
Нарушения со стороны нервной системы |
|
| Нечасто | Синдром Гийена–Барреe, неинфекционный менингитf |
| Редко |
Неинфекционный энцефалитg, миастенический синдромh |
|
Нарушения со стороны сосудов |
|
| Часто | Гипотензия |
|
Нарушения со стороны сердца |
|
| Редко | Миокардитh |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
| Очень часто | Диспноэ |
| Часто | Пневмонитi, гипоксия, заложенность носа |
|
Желудочно-кишечные нарушения |
|
| Очень часто | Тошнота, рвота, диарея |
| Часто | Боль в животе, колитj, дисфагия |
| Нечасто | Панкреатинk, повышенный уровень липазы |
| Редко | Повышенный уровень амилазы |
|
Нарушения со стороны печени и желчевыводящих путей |
|
| Часто | Повышенный уровень ACT, повышенный уровень АЛТ |
| Нечасто | Гепатитl |
|
Нарушения со стороны кожи и подкожных тканей |
|
| Очень часто | Сыпьm, зуд |
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
|
| Очень часто | Боль в суставах |
| Часто | Мышечно-скелетные боли |
|
Общие нарушения и реакции в месте введения |
|
| Очень часто | Пирексия, утомляемость, слабость |
| Часто |
Инфузионные реакции, гриппоподобные заболевания, озноб |
a Включая сообщения о гипотиреозе, повышении уровня тиреотропного гормона в крови, тиреоидите, понижении уровня тиреотропного гормона в крови, отклонении от нормы функции щитовидной железы, остром тиреоидите и пониженном уровне тироксина.
b Включая сообщения о гипертиреозе, повышении уровня тиреотропного гормона в крови, тиреоидите, понижении уровня тиреотропного гормона в крови, эндокринной офтальмопатии, экзофтальме, отклонении от нормы функции щитовидной железы, остром тиреоидите и пониженном уровне тироксина.
с Включая сообщения о сахарном диабете и сахарном диабете 1-го типа.
d Включая сообщения о недостаточности надпочечников, первичной недостаточности надпочечников и болезни Аддисона.
е Включая сообщения о синдроме Гийена–Барре и демиелинизирующей полинейропатии.
f Включая сообщения о менингите.
g Включая сообщения об энцефалите.
h Сообщается в других исследованиях, кроме исследований с участием пациентов с метастатической УК и НМРЛ. Частота определяется на основании на экспозиции 8000 пациентов во всех исследованиях атезолизумаба.
i Включая сообщения о пневмоните, инфильтрации легких, бронхиолите, интерстициальном заболевании легких, лучевом пневмоните.
j Включая сообщения о колите, аутоиммунном колите, ишемическом колите и микроскопическом колите.
k Включая сообщения о панкреатите и остром панкреатите.
l Включая сообщения об аутоиммунном гепатите, гепатите и остром гепатите.
m Включая сообщения об акне, экземе, эритеме, эритеме век, мультиформной эритеме, эксфолиативной сыпи, сыпи на веках, фолликулите, фурункулах, дерматите, акнеформном дерматите, аллергическом дерматите, буллезном дерматите, эксфолиативном дерматите, лекарственной сыпи, ладонно-подошвенном синдроме, сыпи, эритематозной сыпи, генерализованной сыпи, макулезной сыпи, макуло-папулезной сыпи, папулезной сыпи, папуло-сквамозной сыпи, зудящей сыпи, пустулезной сыпи, себорейном дерматите, шелушении кожи, кожной токсичности, кожной язве, токсикодермии.
Описание отдельных нежелательных реакций
Представленные ниже данные отражают экспозицию атезолизумаба в отношении клинически значимых нежелательных реакций в клинических исследованиях (см. раздел «Фармакодинамические свойства»). Указания по ведению такого рода нежелательных реакций даны в разделах «Режим дозирования способ применения» и «Особые указания и меры предосторожности при применении».
Иммуноопосредованный пневмонит
Пневмонит развился у 3.1% (68/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. В 1 случае это закончилось летальным исходом. Среднее время до возникновения НЯ составляло 3.5 месяцев (от 3 дней до 20.5 месяцев). Средняя продолжительность равнялась 1.5 месяцам (0 дней – 15.1+ месяцев; + обозначает цензурированный показатель). Пневмонит стал причиной отмены атезолизумаба у 10 (0.5%) пациентов. Пневмонит, требующий применения кортикостероидов, возник у 1.6% (34/2160) пациентов на терапии атезолизумабом.
Иммуноопосредованный гепатит
Гепатит развился у 0.3% (7/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Среднее время до возникновения НЯ составляло 1.1 месяц (от 9 дней до 7.9 месяцев). Средняя продолжительность равнялась 1 месяцу (9 дней – 1.9+ месяцев; + обозначает цензурированный показатель). Гепатит стал причиной отмены атезолизумаба у 2 (< 0.1 %) пациентов. Гепатит, требующий применения кортикостероидов, возник у 0.2% (5/2160) пациентов на терапии атезолизумабом.
Иммуноопосредованный колит
Колит развился у 1.1% (23/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Среднее время до возникновения НЯ составляло 4 месяца (от 15 дней до 15.2 месяцев). Средняя продолжительность равнялась 1.4 месяцам (3 дня – 17.8+ месяцев; + обозначает цензурированный показатель). Колит стал причиной отмены атезолизумаба у 5 (< 0.2%) пациентов. Колит, требующий применения кортикостероидов, возник у 0.5% (10/2160) пациентов на терапии атезолизумабом.
Иммуноопосредованные эндокринопатии
Гипотиреоз развился у 4.7% (101/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Среднее время до возникновения НЯ составляло 5.5 месяцев (от 15 дней до 31.3 месяцев).
Гипертиреоз возник у 1.7% (36/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Среднее время до возникновения НЯ составляло 3.5 месяца (от 21 дня до 31.3 месяцев).
Недостаточность надпочечников возникла у 0.3% (7/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Среднее время до возникновения НЯ составляло 5.7 месяцев (от 3 дней до 19 месяцев). Недостаточность надпочечников, потребовавшая применения кортикостероидов, наблюдалась у 0.3% (6/2160) пациентов на терапии атезолизумабом. Гипофизит развился у < 0.1% (1/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Среднее время до возникновения НЯ у данного пациента составляло 13.7 месяцев.
Сахарный диабет возник у 0.3% (6/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Время до возникновения НЯ составляло от 3 дней до 6.5 месяцев. Сахарный диабет стал причиной отмены атезолизумаба у 1 (< 0.1%) пациента.
Иммуноопосредованный менингоэнцефалит
Менингит возник у 0.1% (3/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Время до возникновения НЯ составляло от 15 до 16 дней. Всем трем пациентам потребовались кортикостероиды и отмена атезолизумаба.
Энцефалит возник у < 0.1% (2/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Время до возникновения НЯ составляло от 14 до 16 дней. Энцефалит стал причиной отмены атезолизумаба у 1 (< 0.1%) пациента. Необходимость в применении кортикостероидов по причине энцефалита возникла у < 0.1% (1/2160) пациентов, принимающих атезолизумаб.
Иммуноопосредованные невропатии
Синдром Гийена–Барре и демиелинизирующая полинейропатия возникли у 0.2% (5/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Среднее время до возникновения НЯ составило 7 месяцев (от 18 дней до 8.1 месяца). Средняя продолжительность равнялась 4.6 месяцам (от 0+ до 8.3+ месяцев; + обозначает цензурированное значение). Синдром Гийена–Барре стал причиной отмены атезолизумаба у 1 (< 0.1%) пациента. Необходимость в применении кортикостероидов по причине синдрома Гийена–Барре возникла у < 0.1% (2/2160) пациентов, принимающих атезолизумаб.
Миастенический синдром
Миастения гравис возникла у < 0.1% (4/6000) пациентов во всех клинических исследованиях с применением атезолизумаба по причине различных видов опухоли. Время до возникновения НЯ составляло от 20 дней до 4 месяцев. Все четыре пациента прекратили применение атезолизумаба. Миастенический синдром/миастения гравис, требующие применения кортикостероидов, возникли у < 0.1% (3/6000) пациентов на терапии атезолизумабом.
Иммуноопосредованный панкреатит
Панкреатит, включая повышенные уровни амилазы и липазы, возник у 0.5% (10/2160) пациентов, которые получали атезолизумаб по причине метастатической УК и НМРЛ. Среднее время до возникновения НЯ составляло 5.5 месяцев (от 9 дней до 16.9 месяцев). Средняя продолжительность равнялась 19 дням (от 3 дней до 11.2+ месяцев; + обозначает цензурированное значение). Необходимость в применении кортикостероидов по причине панкреатита возникла у < 0.1% (2/2160) пациентов, принимающих атезолизумаб.
Иммуноопосредованный миокардит
Миокардит развился у < 0.1% (2/8000) пациентов, которые получали атезолизумаб во время всех клинических исследований при многочисленных типах опухолей. Время до начала проявления нежелательного явления составило 18 дней и 33 дня. Миокардит у обоих пациентов требовал применения кортикостероидов и стал причиной отмены атезолизумаба.
Иммуногенностъ
В исследовании IMvigor210 у 43.9% пациентов был получен положительный результат анализа на антитела к атезолизумабу (АТА) в один или несколько моментов времени после введения дозы. В исследовании OAK (GO28915) частота случаев АТА в ходе лечения составила 30.4%. В целом, положительный результат на АТА не имеет клинически значимого влияния на фармакокинетику, эффективность или безопасность препарата.
Отсутствуют данные, на основании которых можно было бы сделать вывод о благоприятном влиянии нейтрализующих антител.
Сообщение о подозреваемых нежелательных реакциях.
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальную систему сообщения о нежелательных реакциях.
Информация о передозировке атезолизумаба отсутствует.
В случае передозировки необходимо обеспечить пристальное наблюдение пациента на предмет признаков и симптомов нежелательных реакций, а также начать соответствующее симптоматическое лечение.
Противоопухолевые средства, моноклональные антитела.
Код АТХ: не назначен.
Фармакодинамические свойства
Механизм действия
Лиганд программируемой гибели 1 (PD-L1) может быть экспрессирован в опухолевых клетках и/или опухоль инфильтрирующих иммунных клетках может способствовать ингибированию противоопухолевого иммунного ответа в микроокружении опухоли. Связывание PD-L1 с рецепторами PD-1 и В7.1, обнаруженное на Т-клетках и антигенпредставляющих клетках, подавляет активность цитотоксических Т-клеток, пролиферацию Т-клеток и продукцию цитокинов.
Атезолизумаб представляет собой Fc-модифицированное (глико-инженерное) гуманизированное моноклональное антитело иммуноглобулина G1 (IgG1), которое непосредственно связывается с PD-L1 и обеспечивает двойную блокаду рецепторов PD-1 и В7.1, высвобождая опосредованное PD-L1/PD-1 ингибирование иммунного ответа с реактивацией противоопухолевого иммунного ответа без индуцирования зависимой от антител клеточной цитотоксичности. Атезолизумаб сохраняет интеракцию PD-L2/PD-1, что позволяет поддерживать опосредуемые ингибирующие сигналы PD-L2/PD-1.
Клиническая эффективность и безопасность
Длительность терапии
У ранее нелеченных пациентов терапия с применением Тецентрика могла продолжаться до момента прогрессирования заболевания. У ранее леченых пациентов, принявших участие в основных исследованиях, терапию продолжали до момента потери клинической пользы, определяемой по следующим критериям:
• Отсутствие симптомов и признаков (в том числе ухудшения лабораторных показателей [например, вновь возникшая, или усугубляющаяся, гиперкальциемия]), указывающих на явное прогрессирование заболевания.
• Отсутствие ухудшений в общем состоянии больного по шкале ECOG.
• Отсутствие прогрессирования опухоли в критических анатомических зонах (например, лептоменингиальная болезнь), которое невозможно легко контролировать и стабилизировать по протоколу, допускало медицинские вмешательства до введения повторной дозы.
• Доказательства клинической пользы по оценке исследователя
Уротелиальная карцинома
IMvigor211 (G029294): Рандомизированное исследование с участием пациентов с местно-распространенной или метастатической УК, ранее проходивших химиотерапию
Проведено открытое, многоцентровое, международное, рандомизированное исследование фазы III (IMvigor211), направленное на оценку эффективности и безопасности атезолизумаба в сравнении с химиотерапией (по выбору исследователя, винфлунин, доцетаксел или паклитаксел) у пациентов с местно-распространенной или метастатическои УК, у которых наблюдалось прогрессирование заболевания в ходе платиносодержащей химиотерапии или после нее.
Из участия в исследовании были исключены пациенты с аутоиммунными заболеваниями в анамнезе; активными или требующими применениями кортикостероидов метастазами в головной мозг; в случае введения живой ослабленной вакцины в течение 28 дней до начала набора; в случае введения системных иммуностимулирующих средств в течение 4 недель или системных иммунодепрессантов в течение 2 недель до набора. Опухоль оценивали каждые 9 недель в течение первых 54 недель, затем – каждые 12 недель. Образцы опухоли перспективно оценивали на предмет экспрессии PD-L1 в инфильтрирующих иммунных клетках (ИК), а на основе полученных результатов определяли подгруппы экспрессии PD-L1 для анализа, описанного далее.
Всего набрали 931 пациента. Пациентов в произвольном порядке (1:1) отнесли в группы атезолизумаба или химиотерапии. Рандомизация стратифицировалась по химиотерапии (винфлунин или таксан), статусу экспрессии PD-L1 в ИК (< 5% в сравнении с ≥ 5%), количеству прогностических факторов риска (0 или 1-3) и наличию метастазов в печень (да/нет). Прогностические факторы риска включали время, прошедшее с момента окончания предыдущего курса химиотерапии < 3 месяцев, общее состояние больного по шкале ECOG > 0 и уровень гемоглобина < 10 г/дл.
Атезолизумаб вводили в фиксированной дозе 1200 мг в виде внутривенных инфузий каждые 3 недели. Уменьшение дозы не допускалось. Терапия проводилась до момента потери клинической пользы по оценке исследователя или возникновения неприемлемой токсичности. Винфлунин вводили в дозе 320 мг/м2 в виде внутривенной инфузии в день 1 каждого 3-недельного цикла до момента прогрессирования заболевания или развития неприемлемой токсичности. Паклитаксел вводили 175 мг/м2 в виде внутривенной инфузии в течение 3 часов в день 1 каждого 3-недельного цикла до прогрессирования заболевания или неприемлемой токсичности. Доцетаксел вводили в дозе 75 мг/м2 в виде внутривенной инфузии в день 1 каждого 3-недельного цикла до момента прогрессирования заболевания или развития неприемлемой токсичности. Для всех пациентов, получавших лечение, средняя продолжительности терапии составила 2.8 месяцев в группе атезолизумаба, 2.1 месяца в группе винфлунина и паклитаксела и 1.6 месяцев в группе доцетаксела.
Демографические характеристики и исходные характеристики заболевания в популяции первичного анализа были хорошо сбалансированы по экспериментальным группам. Средний возраст равнялся 67 годам (от 31 до 88 лет), 77.1% пациентов были мужчинами. Большинство пациентов принадлежали к европеоидной расе (72.1%), при этом 53.9% пациентов в группе химиотерапии получили винфлунин, 71.4% пациентов имели хотя бы один прогностический фактор риска, а у 28.8% были обнаружены метастазы в печень на исходном уровне. Общее состояние больного по шкале ECOG на исходном уровне характеризовалось показателем 0 (45.6%) или 1 (54.4%). У 71.1% пациентов первичным очагом опухолевого процесса являлся мочевой пузырь, у 25.4% диагностировали уротелиальную карциному верхних отделов. 24.2% пациентов прошли только один курс предшествующей адъювантной или неоадъювантной химиотерапии на основе препаратов платины с прогрессированием заболевание в течение 12 месяцев.
Первичной конечной точкой эффективности исследования IMvigor211 являлась общая выживаемость (ОВ). Вторичные конечные точки эффективности, анализируемые по Критериям оценки ответа солидных опухолей (RECIST) в 1.1, включали частоту объективного ответа (ЧОО), выживаемость без прогрессирования (ВБП) и длительность ответа (ДО). Сравнения ОВ в экспериментальной и контрольной группах популяция IC2/3, 1C1/2/3 и ITT (Intention to treat, i.e. all comers полная популяция) осуществлялось в ходе иерархической процедуры с фиксированной последовательностью на основании стратифицированного логрангового критерия при двухстороннем уровне 5% следующим образом: шаг 1) совокупность IC2/3; шаг 2) совокупность 1C1/2/3; шаг 3) вся совокупность ITT. Описательная оценка статистической значимости результатов по ОВ для шагов 2 и 3 была возможна только в случае статистической значимости результата предшествующего этапа.
Средний период сбора данных по выживаемости составляет 17 месяцев. В ходе первичного анализа исследования IMvigor211 не была достигнута первичная конечная точка ОВ. Не было выявлено клинически значимого преимущества в выживаемости при применении атезолизумаба по сравнению с химиотерапией у пациентов с ранее леченной местно-распространенной или метастатической уротелиальной карциномой. По предварительно установленному иерархическому порядку проведения тестов, совокупность IC/2/3 проходила анализ первой, при этом ОВ составила 0.87 (95% ДИ% 0.63, 1.21; средняя ОВ 11.1 в сравнении с 10.6 месяцами для атезолизумаба и химиотерапии, соответственно). Стратифицированная логранговая p-величина составила 0.41, поэтому результаты в данной совокупности не считаются статистически значимыми. Как следствие, не проводились формальные тесты статистической значимости по показателям ОВ в совокупности 1C1/2/3 и общая популяция ITT, результаты данных анализов считаются поисковыми. Основные результаты в совокупной популяции приведены в таблице 3. Кривая Каплана–Мейера для ОВ в общей популяции представлена на рис. 1.
Таблица 3: Обзор данных по эффективности в общей популяции (IMvigor211)
| Первичная конечная точка эффективности | Атезолизумаб (n=467) | Химиотерапия (n=464) |
|---|---|---|
|
Первичная конечная точка эффективности |
||
| ОВ | ||
| Количество летальных исходов (%) | 324 (69.4%) | 350 (75.4%) |
| Медиана времени до наступления события (месяцы) | 8.6 | 8.0 |
| 95% ДИ | 7.8, 9.6 | 7.2, 8.6 |
|
Стратифицированное+ отношение рисков (95% ДИ) |
0.85 (0.73, 0.99) | |
| р-значение** | 0.0378 | |
| 12-месячная ОВ (%)* | 39.2% | 32.4% |
|
Вторичные и поисковые конечные точки |
||
|
ВБП по оценке исследователя (RECIST в.1.1) |
||
| Количество событий (%) | 407 (87.2%) | 410(88.4%) |
| Медиана ВБП (месяцы) | 2.1 | 4.0 |
| 95% ДИ | 2.1, 2.2 | 3.4, 4.2 |
| Стратифицированное отношение рисков (95% ДИ) | 1.10 (0.95, 1.26) | |
|
ЧОО по оценке исследователя (RECIST в.1.1) |
n=462 | n=461 |
| Количество пациентов с подтвержденным ответом (%) | 62 (13.4%) | 62 (13.4%) |
| 95% ДИ | 10.45, 16.87 | 10.47, 16.91 |
| Количество случаев полного ответа (%) | 16 (3.5%) | 16 (3.5%) |
| Количество случаев частичного ответа (%) | 46 (10.0%) | 46 (10.0%) |
| Количество случаев стабилизации заболевания (%) | 92 (19.9%) | 162 (35.1%) |
|
Длительность ответа по оценке исследователя (RECIST в.1.1) |
n=62 | n=62 |
| Средняя в месяцах*** | 21.7 | 7.4 |
| 95% ДИ | 13.0, 21.7 | 6.1, 10.3 |
ДИ = доверительный интервал; ДО = длительность ответа: ЧОО – частота объективного ответа; ОВ = общая выживаемость; ВБП = выживаемость без прогрессирования; RECIST = критерии оценки ответа при солидных опухолях, в.1.1.
* на основании оценки Каплана–Мейера.
+ Стратифицировано по химиотерапии (винфлунин или таксан), статусу ИК (< 5% или ≥ 5%), количеству прогностических факторов риска (0 или 1-3), наличию метастазов в печень (да/нет).
** На основании стратифицированного логрангового критерия; предоставлено только в описательных целях; согласно заданной иерархии, p-значение для анализа ОВ в ITT полной популяции не может считаться статистически значимой.
*** Ответ сохранялся у 63% респондентов из группы атезолизумаба и у 21% респондентов из группы химиотерапии.
Рис. 1: Кривая Каплана-Мейера для общей выживаемости (IMvigor211)
IMvigor210 (GO29293): несравнительное исследование у ранее нелеченных пациентов с уротелиальной карциномой, которым не показана терапия цисплатином, а также у пациентов с уротелиальной карциномой, ранее получавших химиотерапию.
Многоцентровое, международное, несравнительное клиническое исследование фазы II в двух когортах IMvigor210, проводилось у пациентов с местно-распространенной или метастатической УК (также известной как уротелиальный рак мочевого пузыря).
В исследование было набрано в целом 438 пациентов, которых подразделили на 2 когорты. В когорту 1 вошли ранее нелеченные пациенты с местно-распространенной или метастатической УК, для которых химиотерапия на основе цисплатина была не показана или заболевание прогрессировало не менее чем через 12 месяцев после платиносодержащей неоадъювантной или адъювантной химиотерапии. В когорту 2 включили пациентов, которые прошли не менее одного курса химиотерапии на основе препаратов платины по причине местно-распространенной или метастатической УК, или при прогрессировании заболевания в течение 12 месяцев с момента прохождения неоадъювантной или адъювантной химиотерапии на основе препаратов платины.
В когорте 1, 119 пациентов получали атезолизумаб в дозе 1200 мг в виде внутривенной инфузии каждые три недели до момента прогрессирования заболевания. Средний возраст составлял 73 года. Большинство пациентов были мужчинами (81%), а также принадлежали к европеоидной расе (91%).
В когорту 1 вошли 45 пациентов (38%) с общим состоянием по шкале ECOG 0. 50 пациентов (42%) с общим состоянием по шкале ECOG 1 и 24 пациента (20%) с общим состоянием по шкале ECOG 2. У 35 пациентов (29%) не было факторов риска Байорина (состояние по шкале ECOG ≥ 2 и метастазы во внутренние органы), 66 пациентов (56%) с одним фактором риска Байорина и 18 пациентов (15%) с двумя факторами рисками Байорина, 84 пациента (71%) с нарушениями почечной функции (скорость клубочковой фильтрации [СКФ] < 60 мл/мин) и 25 пациентов (21%) с метастазами в печень.
Первичной конечной точкой эффективности для когорты 1 являлась подтвержденная частота объективного ответа (ЧОО) по оценке независимого комитета по анализу при использовании RECIST в.1.1.
Первичный анализ осуществлялся после наблюдения пациентов в течение не менее 24 недель. Медиана продолжительности терапии составляла 15.0 недель, медиана продолжительности общей выживаемости равнялась 8.5 месяцем в общей популяции. Показаны клинически значимые результаты по ЧОО согласно RECIST в.1.1; тем не менее, по сравнению с заранее заданной исторической контрольной частотой ответа 10%, статистическая значимость для первичной конечной точки не была достигнута. Подтвержденная ЧОО согласно RECIST в.1.1 составили 21.9% (95% ДИ: 9.3, 40.0) у пациентов с экспрессией PD-L1 ≥ 5%, 18.8% (95% ДИ: 10.9, 29.0) у пациентов с экспрессией PD-L1 ≥ 1% и 19.3% (95% ДИ: 12.7, 27.6) в общей популяции. Медиана длительности ответа (ДО) не была достигнута в подгруппах по экспрессии PD-L1 и в полной популяции. ОВ носила незрелый характер, при этом соотношение «явление/пациенты» составило около 40%. Медиана ОВ во всех подгруппах пациентов (экспрессия PD-L1 ≥ 5% и ≥ 1%) и в полной популяции (популяция ITT) составила 10.6 месяцев. Обновленный анализ выживаемости проводился со средним периодом наблюдения 17.2 месяца в когорте 1. Результаты анализа обобщаются в таблице 4. Медиана ДО не была достигнута в подгруппах по экспрессии PD-L1 и в полной популяции.
Таблица 4: Обзор обновленных данных по эффективности (lMvigor210 Группа 1)
| Конечная точка эффективности | Экспрессия PD-L1 > 5% в ИК | Экспрессия PD-L1 1 > 1% в ИК | Все пациенты |
|---|---|---|---|
|
ЧОО (по оценке ННК; RECIST в.1.1) |
n=32 | n=119 | |
| Кол-во пациентов (%) | 9 (28.1%) | 19 (23.8%) | 27 (22.7%) |
| 95% ДИ | 13.8, 46.8 | 15.0, 34.6 | 15.5, 31.3 |
| Кол-во пациентов с полным ответом (%) | 4 (12.5%) | 8 (10.0%) | 11 (9.2%) |
| 95% ДИ | (3.5, 29.0) | (4.4, 18.8) | (4.7, 15.9) |
| Кол-во пациентов с частичным ответом (%) | 5 (15.6%) | 11 (13.8%) | 16 (13.4%) |
| 95% ДИ | (5.3, 32.8) | (7.1, 23.3) | (7.9, 20.9) |
|
ДО (по оценке ННК; RECIST в. 1.1) |
n=9 | n=19 | n=27 |
| Количество пациентов с наличием события (%) | 3 (33.3%) | 5 (26.3%) | 8 (29.6%) |
| Медиана (месяцы) (95% ДИ) | НО (11.1, НО) | НО (НО) | НО (14.1, НО) |
|
ВБП (по оценке ННК; RECIST в. 1.1) |
n=32 | n=80 | n=119 |
| Количество пациентов с наличием события (%) | 24 (75.0%) | 59 (73.8%) | 88 (73.9%) |
| Медиана (месяцы) (95% ДИ) | 4.1 (2.3, 11.8) | 2.9 (2.1, 5.4) | 2.7 (2.1, 4.2) |
| ОВ | n=32 | n=80 | n=119 |
| Количество пациентов с наличием события (%) | 18 (56.3%) | 42 (52.5%) | 59 (49.6%) |
| Медиана (месяцы) (95% ДИ) | 12.3 (6.0, НО) | 14.1 (9.2, НО) | 15.9 (10.4, НО) |
| Однолетняя ОВ (%) | 52.4% | 54.8% | 57.2% |
ДИ = доверительный интервал; ДО = длительность ответа; ИК = инфильтрирующие опухоль иммунные клетки; ННК = независимый наблюдательный комитет; НО = оценка невозможна; ЧОО = частота объективного ответа; ОВ = общая выживаемость; ВБП = выживаемость без прогрессирования; RECIST = критерии оценки ответа солидных опухолей, в.1.1.
В когорте 2 комбинированными первичными точками оценки эффективности были подтвержденная ЧОО по оценке ННК с использованием критерия RECIST в.1.1 и ЧОО по оценке исследователя с использованием модифицированного критерия RECIST (mRECIST). В этой когорте 310 пациентов получали атезолизумаб в дозе 1200 мг в виде внутривенных инфузий каждые 3 недели до потери клинической пользы. Первичный анализ в когорте 2 проводился после прохождения всеми пациентами последующего наблюдения не менее 24 недели. Комбинированные первичные конечные точки исследования в когорте 2 были достигнуты со статистически значимой ЧОО по оценке ННК согласно RECIST в.1.1 и по оценке исследователя согласно mRECIST по сравнению с заранее заданной исторической контрольной частотой ответа 10%.
Кроме того, провели анализ выживаемости с периодом наблюдения с медианой 21.1 месяца в когорте 2. Подтвержденные значения ЧОО согласно оценке ННК согласно RECIST в.1.1 составили 28.0% (95% ДИ: 19.5, 37.9) у пациентов с экспрессией PD-L1 ≥ 5%, 19.3% (95% ДИ: 14.2, 25.4) у пациентов с экспрессией PD-L1 ≥ 1% и 15.8% (95% ДИ: 11.9, 20.4) у всех участников исследования. Подтвержденные значения ЧОО согласно оценке исследователя по mRECIST в. 1.1 составили 29.0% (95%) ДИ: 20.4, 38.9) у пациентов с экспрессией PD-L1 ≥ 5%, 23.7% (95% ДИ: 18.1, 30.1) у пациентов с экспрессией PD-L1 ≥1% и 19.7% (95% ДИ: 15.4, 24.6) у всех пациентов. Частота полного ответа согласно оценке ННК согласно RECIST в.1.1 в полной популяции составила 6.1% (95% ДИ: 3.7, 9.4). В когорте 2 медиана длительности ответа не была достигнута ни в одной подгруппе по уровню экспрессии PD-L1, а также в полной популяции, тем не менее, она была достигнута у пациентов с экспрессией PD-L1 < 1% (13.3 месяца; 95% ДИ 4.2, НО). Показатель общей выживаемости на 12 месяце составил 37% в полной популяции.
Немелкоклеточный рак легких
OAK (GO28915): рандомизированное исследование фазы III с участием пациентов с местно-распространенным или метастатическим НМРЛ, ранее получавших химиотерапию.
ОАК – открытое, многоцентровое, международное рандомизированное исследование фазы III по оценке эффективности и безопасности применения атезолизумаба по сравнению с доцетакселом у пациентов с местно-распространенным или метастатическим НМРЛ, у которых отмечалось прогрессирование заболевания во время химиотерапии на основании препаратов платины или после нее. В данном исследовании не включались пациенты с аутоиммунными заболеваниями в анамнезе, активными или кортикостероид-зависимыми метастазами в головной мозг, пациенты, которым в течение 28 дней до начала набора вводилась живая ослабленная вакцина, в течение 4 недель – системные иммуностимулирующие препараты или в течение 2 недель до набора – системные иммунодепрессанты. Оценка опухоли выполнялась каждые 6 недель в течение первых 36 недель, а также каждые 9 недель в дальнейшем. Образцы опухоли перспективно оценивали на предмет экспрессии PD-L1 в опухолевых клетках (ОК) и инфильтрирующих опухоль иммунных клетках (ИК).
Всего было зарегестрировано 1225 пациентов. Согласно плану анализа первых 850 рандомизированных пациентов включили в первичный анализ эффективности. Рандомизацию стратифицировали по статусу экспрессии PD-L1 на ИК, по количеству предшествующих режимов химиотерапии и по гистологии. Пациенты были рандомизированы (1:1) для приема атезолизумаба или доцетаксела. Атезолизумаб вводили в фиксированной дозе 1200 мг в виде внутривенных инфузий каждые 3 недели. Уменьшение дозы не допускалось. Терапия проводилась до момента потери клинической пользы, по оценке исследователя. Доцетаксел вводили в дозе 75 мг/м2 в виде внутривенной инфузии в день 1 каждого 3-недельного цикла до прогрессирования заболевания. Для всех пациентов средняя продолжительность терапии составила 2.1 месяца в группе доцетаксела и 3.4 месяца в группе атезолизумаба.
Демографические характеристики и исходные характеристики заболевания в популяции первичного анализа были хорошо сбалансированы по экспериментальным группам. Средний возраст равнялся 64 годам (от 33 до 85 лет), 61% пациентов были мужчинами. Большинство пациентов принадлежали к европеоидной расе (70%). Примерно у трети пациентов по гистологии диагностировали неплоскоклеточный рак (74%), у 10% имелись известные мутации EGFR, у 0.2% были известные мутации ALK, у 10% имелись метастазы в ЦНС на исходном уровне, большинство пациентов являлись курильщиками или курили в прошлом (82%). Общее состояние больного по шкале ЕCOG на исходном уровне было 0 (37%) или 1 (63%). 74% пациентов прошли ранее только один курс химиотерапии на основе препаратов платины.
Первичной конечной точкой эффективности была общая выживаемость (ОВ). Основные результаты этого исследования с медианной выживаемостью в течение 21 месяца приведены в таблице 5. Кривые Каплана–Мейера для ОВ в популяции ITT представлены на рисунке 2. На рисунке 3 представлены результаты ОВ в подгруппах ITT и PD-L1, демонстрируя преимущества ОВ с атезолизумабом во всех подгруппах, в том числе с экспрессией PD-L1 < 1% в ОК и ИК.
Таблица 5: Обзор данных по эффективности в популяции для первичного анализа (вся популяция ITT)* (ОАК)
| Первичная конечная точка эффективности |
Атезолизумаб (n=425) |
Доцетаксел (n=425) |
|---|---|---|
| Первичная конечная точка эффективности | ||
| ОВ | ||
| Количество летальных исходов (%) |
271 (64%) | 298 (70%) |
| Медиана времени до события (месяцы) |
13.8 | 9.6 |
| 95% ДИ | (11.8, 15.7) | (8.6, 11.2) |
| Стратифицированное+ отношение рисков (95% ДИ) |
0.73 (0.62, 0.87) | |
| р-значение** | 0.0003 | |
| 12 месяцев OB (%)*** | 218 (55%) | 151 (41%) |
| 18 месяцев OB (%) *** | 157 (40%) | 98 (27%) |
| Вторичные конечные точки | ||
| ВБП по оценке исследователя (RECIST в.1.1) | ||
| Количество событий (%) |
380 (89%) | 375 (88%) |
| Медиана ВБП (месяцы) |
2.8 | 4.0 |
| 95% ДИ | (2.6, 3.0) | (3.3, 4.2) |
| Стратифицированное отношение рисков (95% ДИ) |
0.95 (0.82, 1.10) | |
| ЧОО по оценке исследователя (RECIST в.1.1) | ||
| Количество пациентов с ответом (%) |
58 (14%) | 57 (13 %) |
| 95% ДИ | (10.5, 17.3) | (10.3, 17.0) |
| Длительность ответа по оценке исследователя (RECIST в.1.1) |
n=58 | n=57 |
| Медиана в месяцах*** |
16.3 | 6.2 |
| 95% ДИ | (10.0, НО) | (4.9, 7.6) |
ДИ = доверительный интервал; ДО = длительность ответа: НО = невозможна оценка; ЧОО – частота объективного ответа; ВБП = выживаемость без прогрессирования; RECIST = критерии оценки ответа при солидных опухолях, в.1.1.
* Популяция первичного анализа включает первых 850 рандомизированных пациентов.
+ Стратифицировано по экспрессии PD-L1 в инфильтрирующих опухоль иммунных клетках, количеству предшествующих курсов химиотерапии и гистологии.
** На основании стратифицированного логрангового критерия.
*** На основании оценки Каплана–Мейера.
Рис. 2: Кривая Каплана–Мейера для общей выживаемости в популяции первичного анализа (все пациенты) (ОАК)
Коэффициент риска оценивается на основании стратифицированной модели Кокса; p-значение оценивается на основании стратифицированного логрангового критерия.
Рис. 3: График «форест-плот» общей выживаемости по экспрессии PD-L1 в популяции первичного анализа (ОАК)
а Стратифицированный HR (отношение рисков) для ITT при ОК или ИК ≥ 1%. Нестратифицированный HR для других исследуемых подгрупп.
ITT – полная популяция, ТС – опухолевые клетки, 1C – инфильтрирующие опухоль иммунные клетки.
Улучшение ОВ наблюдалось при применении атезолизумаба по сравнению с доцетакселом в терапии пациентов с неплоскоклеточным НМРЛ (отношение рисков [HR] 0.73, 95% ДИ: 0.60, 0.89% медиана ОВ 15.6 в сравнении с 11.2 месяцами для атезолизумаба и доцетаксела, соответственно) и плоскоклеточным НМРЛ (отношение рисков [HR] 0.73, 95% ДИ: 0.54, 0.98% медиана ОВ 8.9 в сравнении с 7.7 месяцами для атезолизумаба и доцетаксела, соответственно). Наблюдаемое улучшение ОВ было показано во всех подгруппах пациентов, в том числе у пациентов с метастазами в головной мозг на исходном уровне (HR 0.54, 95% ДИ: 0.31, 0.94; медиана ОВ 20.1 в сравнении с 11.9 месяцами для атезолизумаба и доцетаксела соответственно) и у пациентов, которые никогда не курили (HR 0.71, 95% ДИ: 0.47, 1.08; медиана ОВ 16.3 в сравнении с 12.6 месяцами для атезолизумаба и доцетаксела, соответственно). Тем не менее, у пациентов с мутациями EGFR не наблюдалось улучшения ОВ при применении атезолизумаба по сравнению с доцетакселом (HR 1.24, 95% ДИ: 0.71, 2.18; медиана ОВ 10.5 в сравнении с 16.2 месяцами для атезолизумаба и доцетаксела, соответственно).
При применении атезолизумаба по сравнению с доцетакселом наблюдалось удлиненное время до ухудшения боли в грудной клетке по оценке пациента согласно Опроснику по качеству жизни-LC113 Европейской организации по исследованию и лечению рака (HR 0.71, 95% ДИ: 0.49, 1.05; медиана не была достигнута ни в одной группе). Время до ухудшения симптомов рака легких (например, кашля, диспноэ, боль в руке/плече) по Опроснику LC13 Европейской организации по исследованию и лечению рака оказалось схожим в группах атезолизумаба и доцетаксела. К данным результатам следует подходить с осторожностью по причине открытого дизайна исследования.
POPLAR (GO28753): Рандомизированное исследование фазы II у пациентов с местно-распространенным или метастатическим НМРЛ, ранее получавших химиотерапию
POPLAR – многоцентровое, международное, рандомизированное, открытое, контролируемое исследование фазы II у пациентов с местно-распространенным или метастатическим НМРЛ, у которых наблюдалось прогрессирование заболевания на фоне химиотерапии препаратами платины или после нее, независимо от экспрессии PD-L1. Первичной конечной точкой оценки эффективности являлась общая выживаемость. 287 пациентов были рандомизированы в соотношении 1:1 в группы атезолизумаба (1200 мг в виде внутривенной инфузии каждые 3 недели до потери клинической пользы) или доцетаксела (75 мг/м2 в виде внутривенной инфузии в день 1 каждого 3-недельного цикла до прогрессирования заболевания). Рандомизацию стратифицировали по статусу экспрессии PD-L1 на ИК, по числу предшествующих линий химиотерапии и по гистологии. В результате обновленного анализа с 200 летальными исходами и средним периодом наблюдения и сбора данных по выживаемости 22 месяца было показано, что медиана ОВ составляет 12.6 месяцев в группе атезолизумаба и 9.7 месяцев в группе доцетаксела (HR 0.69, 95% ДИ: 0.52, 0.92). ЧОО составляла 15.3% в сравнении с 14.7%, а средняя ПО равнялась 18.6 месяцам в сравнении с 7.2 месяцами для атезолизумаба и доцетаксела, соответственно.
Дети
Европейское агентство по лекарственным средствам отсрочило обязательство о предоставлении результатов исследований применения лекарственного средства Тецентрик во всех подгруппах пациентов детского возраста в терапии злокачественных новообразований (за исключением опухолей центральной нервной системы, гемопоэтических опухолей и опухолей лимфоидных тканей) (см. раздел «Применение у детей»).
Фармакокинетические свойства
Экспозиция атезолизумаба повышалась пропорционально дозе в диапазоне доз от 1 мг/кг до 20 мг/кг включая фиксированную дозу 1200 мг, вводимую каждые 3 недели. Анализ популяции, который включал 472 пациента, описывал фармакокинетику атезолизумаба в диапазоне доз: от 1 до 20 мг/кг с использованием линейной двухкамерной модели распределения с элиминацией первого порядка. Данные фармакокинетического анализа позволяют предположить, что равновесное состояние достигается через 6–9 недель (2-3 цикла) при многократном введении. Средний коэффициент накопления для показателей площади под кривой «концентрация-время» (AUC), максимальной концентрации (Сmах) и минимальной концентрации (Cmin) составил 1.91, 1.46 и 2.75, соответственно.
Абсорбция
Атезолизумаб вводится в виде внутривенной инфузии. Исследования других способов введения не проводились.
Распределение
Данные фармакокинетического анализа в популяции показывают, что объем распределения в центральной камере составляет 3.28 л, а объем распределения в равновесном состоянии равняется 6.91 л у среднестатистического пациента.
Биотрансформация
Метаболизм атезолизумаба напрямую не изучался. Основным путем выведения антител является катаболизм.
Элиминация
Данные фармакокинетического анализа в популяции показывают, что клиренс атезолизумаба составляет 0.200 л/сутки, а среднестатистический период полувыведения равняется 27 дням.
Применение в особых группах пациентов
На основании результатов фармакокинетического анализа в популяции и анализа экспозиции установили, что возраст (21-89 лет), регион, этническая принадлежность, почечная недостаточность, легкая печеночная недостаточность, уровень экспрессии PD-L1 или состояние больного по шкале ECOG не влияют на фармакокинетику атезолизумаба. Масса тела, пол, положительный статус АТА (антитерапевтических антитела), уровни альбумина и опухолевая нагрузка оказывают статистически, но не клинически значимый эффект на фармакокинетику атезолизумаба. Коррекция дозы не требуется.
Применение у лиц пожилого возраста
Специальные исследования по применению атезолизумаба у лиц пожилого возраста не проводились. Влияние возраста на фармакокинетику атезолизумаба оценили в ходе популяционного фармакокинетического анализа. На основании данных о пациентах в возрасте 21-89 лет (n=472), со средним возрастом 62 года, возраст не оказывает влияния на фармакокинетику атезолизумаба. Не выявили клинически значимых отличий в фармакокинетике атезолизумаба у пациентов < 65 лет (n=274), пациентов 65-75 лет (n=152) и пациентов > 75 лет (n=46) (см. раздел «Режим дозирования и способ применения»).
Дети
Исследования фармакокинетики атезолизумаба у детей и подростков не проводились.
Применение у лиц с нарушением функции почек
Отдельные исследования применения атезолизумаба у пациентов с нарушением функции почек не проводились. В ходе популяционного фармакокинетического анализа не было выявлено клинически значимых различий клиренса атезолизумаба у пациентов с нарушением функции почек легкой (расчетная скорость клубочковой фильтрации (рСКФ) 60-89 мл/мин/1.73 м2; n=208) или средней (рСКФ 30-59 мл/мин/1.73 м2; n=116) степеней тяжести по сравнению с пациентами с нормальной функцией почек (рСКФ больше или равная 90 мл/мин/1.73 м2; n=140). Нарушение функции почек тяжелой степени было диагностировано только у нескольких пациентов (рСКФ 15-29 мл/мин/1.73 м2; n=8) (см. раздел «Режим дозирования и способ применения»). Влияние тяжелой почечной недостаточности на фармакокинетику атезолизумаба неизвестно.
Применение у лиц с нарушением функции печени
Отдельные исследования применения атезолизумаба у пациентов с нарушением функции печени не проводились. В ходе фармакокинетического анализа популяции не было выявлено клинически значимых различий клиренса атезолизумаба у пациентов с легкой печеночной недостаточностью (билирубин ≤ ВГН и АСТ > ВГН или билирубин от > 1.0 до 1.5 × ВГН и любой показатель ACT, n=71) и нормальной функцией печени (билирубин и ACT < ВГН, n =401). Данные о пациентах с умеренной или тяжелой печеночной недостаточностью отсутствуют. Печеночная недостаточность определялась по критериям дисфункции печени Национального института paкa (NCI) (см. раздел «Режим дозирования и способ применения»). Влияние умеренной или тяжелой печеночной недостаточности (билирубин от > 1.5 до 3 × ВГН при любых показателях ACT или билирубин > 3 × ВГН и любой показатель ACT) на фармакокинетику атезолизумаба неизвестно.
Данные доклинической безопасности
Канцерогенность
Исследования канцерогенности для определения канцерогенного потенциала атезолизумаба не проводились.
Мутагенность
Исследования мутагенности для определения мутагенного потенциала атезолизумаба не проводились. Тем не менее, не ожидается, что моноклональные тела будут изменять ДНК или хромосомы.
Фертильность
Исследования фертильности при применении атезолизумаба не проводились; тем не менее, в исследование хронической токсичности была включена оценка репродуктивных органов самцов и самок яванских макак. При еженедельном введении атезолизумаба самкам обезьян при расчетном значении AUC, примерно в 6 раз превышающем AUC у пациентов, принимающих препарат в рекомендованной дозе, происходило нарушение менструального цикла и коррелировало с отсутствием новых желтых тел в яичниках, что носило обратимый характер. Влияние на репродуктивные органы самцов отсутствовало.
Тератогенность
Исследований репродуктивной токсичности или тератогенности атезолизумаба на животных не проводились. Исследования на животных показали, что ингибирование пути PD-L1/PD-1 может привести к иммунному отторжению развивающегося плода, что ведет к его гибели. Введение атезолизумаба может причинить вред плоду, включая летальный исход.
L-гистидин
Уксусная кислота ледяная
Сахароза
Полисорбат 20
Вода для инъекций
Несовместимость
Данное лекарственное средство не следует смешивать с другими лекарственными препаратами, за исключением тех, которые были перечислены в разделе «Особые меры предосторожности при обращении с препаратом и его утилизации».
3 года.
Разведенный раствор
Было показано, что химическая и физическая стабильность после вскрытия упаковки составляет не более 24 часов при температуре от 2 °С до 8 °С или 24 часа при температуре ≤ 30 °С с момента приготовления.
С микробиологической точки зрения, приготовленный раствор для инфузий подлежит немедленному применению. Если препарат не введен немедленно, хранение готового к применению препарата и обеспечение условий до введения является обязанностью пользователя, в целом не должно превышать 24 часов при температуре от 2 °С до 8 °С или 8 часов при температуре окружающей среды (≤ 25 °С).
Хранить при температуре 2 °С – 8 °С. Флакон хранить в картонной пачке для защиты от света.
Не замораживать. Не встряхивать. Хранить в недоступном для детей месте.
Информация об условиях хранения после разведения лекарственного препарата представлена в разделе «Срок годности».
По 1200 мг/20 мл препарата во флакон бесцветного стекла (гидролитический класс 1 ЕФ/Ф.США/ЯФ), укупоренный пробкой из бутилкаучука, ламинированного фторполимером, обжатый алюминиевым колпачком и закрытый пластмассовой крышкой.
1 флакон с препаратом вместе с инструкцией по применению помещают в картонную пачку.
Препарат Тецентрик не содержит антимикробных консервантов и должен приготавливаться медицинским работником в асептических условиях.
Не встряхивать.
Инструкции по разведению
Концентрат лекарственного средства Тецентрик в количестве 20 мл извлекают из флакона и разводят в инфузионном пакете из поливинилхлорида ПВХ, полиэтилена ПЭ или полиолефина, содержащем 250 мл раствора для инъекций натрия хлорида 9 мг/мл (0.9%). После разведения в одном мл раствора должно содержаться около 4.4 мг препарата Тецентрик (1200 мг/270 мл). Пакет следует осторожно перевернуть, чтобы перемешать раствор во избежание ценообразования. После приготовления препарат подлежит немедленному введению (см. раздел «Срок годности»).
До введения лекарственные формы для парентерального применения подлежат тщательному осмотру на предмет наличия включений и изменения цвета. При наличии посторонних включений или изменения цвета использование раствора не допускается.
Не наблюдалось несовместимости между препаратом Тецентрик и инфузионным пакетом с контактными поверхностями из поливинилхлорида (ПВХ), полиэтилена (ПЭ) или полиолефина (ПО). Кроме того, не отмечалось несовместимости с мембранами фильтров из полиэфирсульфона или полисульфона, а также инфузионными системами и другими инфузионными принадлежностями из ПВХ, ПЭ, полибутадиена и полиэфируретана. Использование встроенных мембран фильтров является необязательным.
Утилизация
Следует минимизировать выброс препарата Тецентрик в окружающую среду. Неиспользованное лекарственное средство или отходы подлежат утилизации в соответствии с местными требованиями.
Держатель регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Производитель
Рош Диагностике ГмбХ, Германия
Roche Diagnostics GmbH, Sandhofer Strasse 116, 68305 Mannheim, Germany
В случае поставок и реализации на территории Республики Беларусь претензии потребителей направлять на адрес ИООО «Рош Продактс Лимитед»:
220073, г. Минск, 1-й Загородный пер., 20, 8-й этаж, кабинет 20.
Тел. (017) 256 23 08; факс (017) 256 23 06.
Email: belarus.safety@roche.com


.png)