Инфекции и инвазии: очень часто — инфекции верхних дыхательных путей, инфекции мочевыводящих путей, инфекции, вызванные вирусами Herpes simplex типов 1 и 2; часто — инфекции, вызванные вирусом Varicella zoster, инфекции нижних дыхательных путей, гастроэнтерит, кандидоз ротовой полости, вульвовагинальный кандидоз, грипп, ушные инфекции, пневмония, вагинальные инфекции, инфекции зубов; нечасто — онихомикоз, гингивит, микозы кожи, тонзиллит, острый синусит, целлюлит, пневмонит, туберкулез, цитомегаловирусная инфекция; частота неизвестна — листериоз/листериозный менингит.
Новообразования доброкачественные, злокачественные и неуточненные (включая кисты и полипы): часто — папиллома кожи.
Со стороны крови и лимфатической системы: очень часто — лимфопения, лейкопения, включая нейтропению; часто — лимфаденопатия, иммунная тромбоцитопеническая пурпура, тромбоцитопения, снижение гематокрита, обусловленное анемией, лейкоцитоз; нечасто — панцитопения, гемолитическая анемия; редко — гемофагоцитарный лимфогистиоцитоз.
Со стороны иммунной системы: часто — синдром высвобождения цитокинов, гиперчувствительность, включая анафилаксию.
Со стороны эндокринной системы: очень часто — диффузный токсический зоб (Базедова болезнь), гипертиреоз, гипотиреоз; часто — аутоиммунный тиреоидит, включая подострый тиреоидит, зоб, положительный тест на антитиреоидные антитела.
Со стороны обмена веществ: нечасто — снижение аппетита.
Психические расстройства: часто — бессонница, тревога, депрессия.
Со стороны нервной системы: очень часто — головная боль; часто — рецидив рассеянного склероза, головокружение, гипестезия, парестезия, тремор, дисгевзия, мигрень; нечасто — нарушение чувствительности, гиперестезия, головная боль напряжения; частота неизвестна — инсульт (ишемический и геморрагический), расслоение цервикоцефальных артерий.
Со стороны органа зрения: часто — конъюнктивит, эндокринная офтальмопатия, нечеткость зрения; нечасто — диплопия.
Со стороны органа слуха и равновесия: часто — вертиго; нечасто — боль в ухе.
Со стороны сердечно-сосудистой системы: очень часто — тахикардия, приливы; часто — брадикардия, ощущение сердцебиения; нечасто — фибрилляция предсердий; частота неизвестна — инфаркт миокарда.
Со стороны дыхательной системы: часто — одышка, кашель, носовое кровотечение, икота, орофарингеальная боль, бронхиальная астма; нечасто — чувство стеснения в глотке, раздражение глотки; частота неизвестна — легочное альвеолярное кровотечение.
Со стороны пищеварительной системы: очень часто — тошнота; часто — боль в животе, рвота, диарея, диспепсия, стоматит; нечасто — запор, гастроэзофагеальная рефлюксная болезнь, кровоточивость десен, сухость во рту, дисфагия, желудочно-кишечные расстройства, гематохезия (кровь в кале).
Со стороны печени и желчевыводящих путей: часто — повышение активности АСТ, АЛТ; нечасто — холецистит, включая некалькулезный холецистит и острый некалькулезный холецистит.
Со стороны кожи и подкожных тканей: очень часто — крапивница, сыпь, зуд, генерализованная сыпь; часто — эритема, кровоподтеки, алопеция, повышенное потоотделение, акне, поражение кожи, дерматит; нечасто — волдыри, ночная потливость, отечность лица, экзема.
Со стороны костно-мышечной системы: часто — миалгия, мышечная слабость, артралгия, боли в спине, боль в конечностях, мышечные спазмы, боль в шее, костно-мышечные боли; нечасто — костно-мышечная скованность, дискомфорт в конечностях.
Со стороны мочевыделительной системы: часто — протеинурия, гематурия; нечасто — нефролитиаз, кетонурия, нефропатии, включая анти-ГБМ (гломерулонефрит, обусловленный антителами к гломерулярной мембране) болезнь.
Со стороны половых органов и молочной железы: часто — меноррагия, нерегулярные менструации; нечасто — цервикальная дисплазия, аменорея.
Общие реакции: очень часто — повышение температуры тела, усталость, озноб; часто — дискомфорт в грудной клетке, боль, периферический отек, астения, гриппоподобное состояние, общий дискомфорт (чувство общего недомогания).
Лабораторные и инструментальные данные: часто — увеличение концентрации креатинина в крови; нечасто — снижение массы тела, увеличение массы тела, снижение количества эритроцитов, положительный бактериальный тест, повышение концентрации глюкозы в крови, увеличение объема клеток.
Прочие: часто — ушибы, инфузионные реакции.
Лемтрада — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер: ЛП-003714.
Торговое название препарата: Лемтрада®.
Международное непатентованное название: алемтузумаб.
Лекарственная форма: концентрат для приготовления раствора для инфузий.
Состав
1 мл препарата содержит:
действующее вещество: алемтузумаб — 10 мг;
вспомогательные вещества: динатрия эдетата дигидрат — 0,0187 мг, фосфатный забуференный солевой раствор pH 7,2 (калия хлорид — 0,2 мг, калия дигидрофосфат — 0,2 мг, натрия хлорид — 8 мг, динатрия гидрофосфат безводный1 — 1,15 мг, полисорбат-80 — 0,1 мг, вода для инъекций — до 1 мл).
1 соответствует 1,44 мг динатрия гидрофосфата дигидрата.
Описание
Прозрачная или опалесцирующая бесцветная или светло-желтая жидкость.
Фармакотерапевтическая группа: селективный иммунодепрессант.
Код ATX: L04AA34.
Фармакологические свойства
Механизм действия
Алемтузумаб — это гуманизированное IgGl каппа моноклональное антитело к гликопротеинам CD52 с молекулярной массой 21-28 кДа. Производится по технологии рекомбинантной ДНК с использованием суспензионной культуры клеток яичника китайского хомячка. Алемтузумаб представляет собой человеческий IgGl (вариабельные и константные участки каппа цепи) с участками, определяющими комплементарность, полученными от моноклональных антител мыши (крысы). Молекулярная масса антитела составляет примерно 150 кДа.
Алемтузумаб связывается с гликопротеинами СD52, которые присутствует в больших количествах на поверхности В- и Т-лимфоцитов, и в более низких количествах — на поверхности естественных клеток-киллеров, моноцитов и макрофагов. На поверхности нейтрофилов, плазматических клеток и стволовых клеток костного мозга гликопротеины СD52 не определяются или определяются в небольших количествах. Действие алемтузумаба реализуется путем антитело-зависимого цитолиза и комплемент-опосредованного лизиса, которые развиваются после связывания алемтузумаба с В- и Т-лимфоцитами.
Точный механизм действия алемтузумаба при рассеянном склерозе до конца не изучен, но, предположительно, может быть связан с иммуномодулирующим эффектом после истощения популяции лимфоцитов и их последующей репопуляции, включая:
- изменение количества, процентного соотношения и свойств некоторых подтипов лимфоцитов,
- увеличение уровня регуляторных Т-лимфоцитов,
- увеличение уровня В- и Т-лимфоцитов памяти,
- транзиторное влияние на врожденную иммунную систему (например, на нейтрофилы, макрофаги и естественные клетки-киллеры).
Снижение количества циркулирующих В- и Т-лимфоцитов и их последующая репопуляция уменьшает вероятность рецидива, что, в конечном счете, замедляет прогрессирование заболевания.
Фармакодинамика
Препарат Лемтрада® снижает количество циркулирующих В- и Т-лимфоцитов после каждого курса лечения, при этом наименьшее количество клеток отмечается через месяц после курса лечения. Со временем популяция лимфоцитов восстанавливается, при этом восстановление популяции В-клеток обычно завершается в течение 6 месяцев. Количество лимфоцитов с экспрессией СDЗ+ и СD4+ увеличивается до нормы гораздо медленнее и обычно не восстанавливается до исходных значений к 12 месяцу после лечения. Приблизительно у 40 % пациентов общее количество лимфоцитов достигало нижней границы нормы через 6 месяцев после каждого курса лечения, а приблизительно у 80 % пациентов общее количество лимфоцитов достигало нижней границы нормы через 12 месяцев после каждого курса лечения.
Лемтрада® оказывает транзиторное действие на нейтрофилы, моноциты, эозинофилы, базофилы и естественные клетки-киллеры.
Клиническая эффективность и безопасность
Безопасность и эффективность препарата Лемтрада® оценивались в ходе 3 рандомизированных клинических исследований с участием пациентов с рецидивирующе-ремиттирующим рассеянным склерозом (РРРС), с активным препаратом сравнения, и со скрытием выбора метода лечения от оценивающего результат специалиста.
В Таблице 1 представлена информация по дизайну/демографическим показателям пациентов Исследований 1 и 2, а в Таблице 2 — информация по результатам этих исследований.
Таблица 1:
дизайн и демографические показатели пациентов исследований 1 и 2
* Пациенты, перенесшие, по меньшей мере, 1 рецидив во время лечения интерфероном бета-1а (ИФНбета-1а) или глатирамера ацетатом при приеме препарата на протяжении минимум 6 месяцев.
Таблица 2:
Основные клинические и МРТ конечные точки Исследований 1 и 2
1 Комбинированные первичные конечные точки: СЧО и УПИ. Исследование признавалось успешным, если была достигнута, по меньшей мере, одна из двух комбинированных конечных точек.
2 Наступление события УПИ определялось как сохраняющиеся на протяжении 6 месяцев увеличение баллов по Расширенной шкале оценки состояния инвалидизации (ЕDSS), по меньшей мере, на 1 балл при исходном балле ≥ 1,0 и на 1,5 балла при исходном уровне ЕDSS 0 баллов.
Рисунок 1: Время до устойчивой (в течение ≥ 6 месяцев) прогрессии инвалидизации [УПИ] в Исследовании 2
Верхний график — алемтузумаб.
Нижний график — ИФНбета-1а (подкожно).
Percentage of Patients with SAD — процент пациентов с УПИ.
Follow-Up Month — месяцы наблюдения.
HR (hazard ratio) — отношение рисков, рассчитанное для кривых выживания,
p-value — р-значение
Тяжесть рецидива
Кроме влияния на частоту рецидивов, дополнительный анализ, проведенный в рамках Исследования 1 (CAMMS323), показал, что, по сравнению с использованием ИФНбета-1а, применение препарата Лемтрада® в дозе 12 мг в сутки приводило к значимому снижению числа пациентов с тяжелыми рецидивами (снижение на 61%, р=0,0056), а также к значимому снижению числа рецидивов, требующих назначения стероидов (снижение на 58%, р<0,0001). Дополнительный анализ, проведенный в рамках Исследования 2 (САММS32400507), показал, что, по сравнению с использованием ИФНбета-1а, применение препарата Лемтрада® в дозе 12 мг в сутки приводило к значимому снижению числа пациентов с тяжелыми рецидивами (снижение на 48%, р=0,0121), а также к значимому снижению числа рецидивов, требующих назначения стероидов (снижение на 56%, р<0,0001) или госпитализации (снижение на 55%, р=0,0045).
Устойчивое снижение инвалидизации (УСИ)
Время до начала УСИ определялось в случае сохранения на протяжении 6 месяцев уменьшения баллов по ЕDSS, по меньшей мере, на 1 балл при исходном балле ≥ 2. УСИ является мерой устойчивого улучшения с точки зрения инвалидизации. В рамках Исследования 2 УСИ достигли 29% пациентов, получавших препарат Лемтрада®, и лишь 13% пациентов, получавших ИФНбета-1а подкожно. Различие было статистически значимым (р=0,0002).
В рамках Исследования 3 (фаза 2 исследования САММS223) оценивались безопасность и эффективность препарата Лемтрада® при применении его пациентами с РРРС на протяжении 5 лет. Критериями включения в исследование были: 0-3 балла по шкале ЕDSS, по меньшей мере, 2 клинических эпизода рассеянного склероза в течение предыдущих 2 лет и ≥ 1 очага, контрастируемого гадолинием. Ранее участники не должны были получать лечение по поводу рассеянного склероза. В рамках исследования пациенты получали либо препарат Лемтрада® в дозе 12 мг в сутки (N=108) или 24 мг в сутки (N=108), который вначале (0 месяц) вводили 1 раз в сутки на протяжении 5 дней, а затем (12 месяц) — 1 раз в сутки на протяжении 3 дней, либо ИФНбета-1а в дозе 44 мкг (N=107) 3 раза в неделю на протяжении 3 лет. 46 пациентов получили третий курс препарата Лемтрада® (24 месяц) по 12 мг в сутки или 24 мг в сутки на протяжении 3 дней.
Через 3 года у пациентов, получавших препарат Лемтрада® по сравнению с пациентами, получавшими ИФНбета-1а подкожно, риск 6-месячного УПИ снизился на 76% (отношение рисков, рассчитанное для кривых выживания 0,24 [95% ДИ: 0,110; 0,545]. р<0.0006), а среднегодовая частота обострений снизилась на 67% (отношение рисков 0.33 [95% ДИ: 0,196; 0,552], р<0,0001). На протяжении 2 лет последующего наблюдения применение алемтузумаба в дозе 12 мг в сутки привело к значимому (р<0,0001) снижению баллов по шкале ЕDSS, по сравнению с применением ИФНбета-1а (сравнение выполнялось с исходным уровнем).
Через 5 лет препарат Лемтрада® снизил риск УПИ на 69 % (отношение рисков, рассчитанное для кривых выживания 031 [95% ДИ: 0,161; 0,598], р=0.0005), а среднегодовую частоту обострений — на 66% (отношение рисков 0,34 [95% ДИ: 0,202; 0.569], р<0,0001) (по сравнению с подкожным введением ИФНбета-1а).
В открытом продолжении клинических исследований препарата Лемтрада® некоторые пациенты «в случае необходимости» (при документальном подтверждении возобновления активности рассеянного склероза) получали дополнительные дозы препарата. В рамках дополнительных курсов препарат Лемтрада® в дозе 12 мг в сутки вводили на протяжении 3 дней подряд (суммарная доза 36 мг), по меньшей мере, через 12 месяцев после предыдущего курса лечения. Польза и риски > 2 курсов лечения до конца не установлены, однако полученные результаты позволяют предположить, что дополнительные курсы терапии не привели к изменению профиля безопасности. Дополнительные курсы терапии должны проводиться не ранее, чем через 12 месяцев после предыдущего курса.
Иммуногенность
Как и любые другие лекарственные препараты белкового происхождения, алемтузумаб обладает потенциальной иммуногенностью. Полученные данные отражали процент пациентов с положительными результатами на наличие антител к алемтузумабу (по данным фермент-связанного иммуносорбентного исследования (ELISA), подтвержденного анализом конкурентного связывания). Затем положительные образцы изучались на наличие признаков ингибирования in vitro методом проточной цитометрии. В рамках контролируемых клинических исследований с участием пациентов с рассеянным склерозом для выявления антител к алемтузумабу образцы сыворотки собирали через 1, 3 и 12 месяцев после каждого курса терапии. Во время исследований антитела к алемтузумабу обнаруживались приблизительно у 85 % пациентов, получавших препарат Лемтрада®, при этом у 92 % из этих пациентов были положительными результаты тестирования также и на наличие антител, ингибирующих связывание препарата Лемтрада® in vitro. Те пациенты, у которых выработались антитела к алемтузумабу, продолжали демонстрировать их наличие на протяжении 15 месяцев с момента первого введения препарата. Взаимосвязи между наличием антител к алемтузумабу или ингибирующих антител к алемтузумабу и снижением эффективности, изменением фармакодинамики или развитием нежелательных реакций, включая реакции, связанные с инфузиями. не выявлено.
Частота выявления антител в значительной степени зависит от чувствительности и специфичности используемого метода анализа. Кроме того, частота выявления антител (включая ингибирующие антитела) может зависеть от целого ряда факторов, таких как методика анализа, обработка образцов, время забора образцов, одновременный прием других препаратов и сопутствующие заболевания. По этим причинам сравнение частоты выявления антител к препарату Лемтрада® с частотой выявления антител к другим препаратам может быть ошибочным.
Фармакокинетика
Фармакокинетику алемтузумаба оценивали в исследовании с участием 216 пациентов с рецидивирующе-ремиттирующим рассеянным склерозом, получавших внутривенные инфузии препарата в дозах 12 мг или 24 мг в сутки в течение 5 дней подряд, а затем — в течение 3 дней подряд через 12 месяцев после начального курса терапии. Концентрация препарата в сыворотке крови в пределах одного курса лечения возрастала после введения каждой последующей дозы, а максимальная концентрация (Сmах) достигалась после последней инфузии курса. Введение препарата в дозе 12 мг в сутки позволяло достичь значение Сmax, равное 3014 нг/мл, на 5 сутки начального курса лечения и 2276 нг/мл — на 3 сутки второго курса лечения. Период полувыведения составлял приблизительно 4-5 дней и его значения существенно не различались в ходе начального и последующего курсов терапии; концентрации в сыворотке крови в течение приблизительно 30 дней после каждого курса лечения были низкими или неопределяемыми.
Алемтузумаб — белок, предполагаемым путем метаболизма которого является распад на небольшие пептиды и отдельные аминокислоты под действием широко распространенных протеолитических ферментов. Классические исследования биотрансформации не проводились.
Имеющиеся данные не позволяют сделать выводы о влиянии расы и пола на фармакокинетику препарата Лемтрада®. Фармакокинетика препарата не изучалась у пациентов в возрасте 55 лет и старше.
Показания к применению
Препарат Лемтрада® показан для лечения взрослых пациентов с активным рецидивирующе-ремиттирующим рассеянным склерозом (РРРС), т.е. перенесших два или более обострения в течение последних двух лет.
Противопоказания
- Повышенная чувствительность к алемтузумабу или к какому-либо из вспомогательных веществ препарата.
- ВИЧ-инфекция.
- Возраст до 18 лет (безопасность и эффективность препарата не установлены) (см. в разделе «Особые указания» подраздел «Педиатрическая популяция»).
Ограничения по применению препарата во время беременности приведены в разделе «Применение при беременности и в период грудного вскармливания».
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении препарата Лемтрада® для лечения беременных женщин с рассеянным склерозом ограничены. Препарат Лемтрада® можно применять во время беременности, только если предполагаемая польза превышает потенциальный риск для плода.
Известно, что человеческий иммуноглобулин проходит через плацентарный барьер; алемтузумаб также может проходить через плацентарный барьер, и, следовательно, потенциально представляет риск для плода. В исследованиях на животных было выявлено токсическое действие на репродуктивную функцию. Неизвестно, способен ли алемтузумаб оказывать вредное воздействие на плод при его введении беременной женщине или негативно влиять на репродуктивную функцию.
Заболевания щитовидной железы представляют особый риск для беременных женщин. При отсутствии лечения гипотиреоза во время беременности имеется повышенный риск невынашивания беременности и воздействия на плод, результатами которого могут быть задержка умственного развития и карликовость. У беременных женщин с диффузным токсическим зобом (болезнь Грейвса, Базедова болезнь) антитела к рецепторам тиреотропного гормона могут передаваться развивающемуся плоду и вызвать развитие транзиторного диффузного токсического зоба у новорожденного.
Период грудного вскармливания
Алемтузумаб был обнаружен в молоке лактирующих мышей и у их детёнышей.
Неизвестно, проникает ли алемтузумаб в грудное молоко у людей. Однако нельзя исключить наличие риска для ребенка, получающего грудное молоко. Таким образом, грудное вскармливание должно быть прекращено на протяжении всего курса лечения препаратом Лемтрада®, а также в течение 4 месяцев после выполнения последней инфузии в рамках любого курса лечения. При этом польза от передачи иммунитета через грудное молоко может превосходить риски от возможного попадания алемтузумаба в организм ребенка.
Женщины детородного возраста
После окончания каждого из курсов терапии препаратом Лемтрада® концентрация алемтузумаба в сыворотке крови была низкой или находилась на неопределяемом уровне приблизительно в течение 30 дней. Женщины детородного возраста должны использовать надёжные методы контрацепции во время лечения препаратом Лемтрада® и в течение 4 месяцев после последней инфузии препарата Лемтрада®.
Влияние на фертильность
Достоверные данные по клинической безопасности, касающиеся влияния препарата Лемтрада® на репродуктивную функцию, отсутствуют. В рамках дополнительного исследования с участием 13 мужчин, получавших алемтузумаб (в дозах 12 мг или 24 мг), не было получено никаких подтверждений развития аспермии, азооспермии, устойчивого снижения количества сперматозоидов, нарушений подвижности или увеличения числа морфологических изменений сперматозоидов.
Известно, что рецепторы СD52 присутствует в тканях репродуктивных органов человека и грызунов. Данные, полученные в исследованиях на животных, выявили наличие влияния на репродуктивную функцию у гуманизированных мышей, однако имеющиеся данные не позволяют судить о том, влияет ли применение препарата Лемтрада® на репродуктивную функцию человека.
Способ применения и дозы
Терапия алемтузумабом должна назначаться и проводиться под контролем невролога, имеющего опыт лечения пациентов с рассеянным склерозом, при доступности специалистов и оборудования для своевременной диагностики и лечения наиболее часто возникающих нежелательных реакций, особенно аутоиммунных заболеваний и инфекций. Терапия должна проводиться в условиях доступа к средствам для купирования реакций гиперчувствительности и/или анафилактических реакций.
Пациенты должны быть проинформированы о рисках, связанных с терапией алемтузумабом, а также о необходимости находиться под наблюдением в период лечения и в течение 48 месяцев после последней инфузии.
Премедикация
Пациентам необходимо проводить премедикацию кортикостероидами непосредственно перед введением препарата Лемтрада® в каждые первые 3 дня каждого курса лечения. В ходе клинических исследований премедикацию пациентам проводили с помощью 1000 мг метилпреднизолона, который вводили в каждый из первых 3 дней каждого курса лечения препаратом Лемтрада®.
Кроме того, дополнительно, можно рассмотреть вопрос о проведении перед введением препарата Лемтрада® премедикации антигистаминными средствами и/или антипиретиками (жаропонижающими средствами).
У всех пациентов необходимо применять пероральные средства для профилактики герпеса, начиная их применение в первый день каждого курса лечения и продолжая в течение как минимум 1 месяца после лечения препаратом Лемтрада®. При проведении клинических исследований пациентам вводили ацикловир в дозе 200 мг 2 в сутки или эквивалент.
Дозировка
Рекомендованная дозировка препарата Лемтрада® — 12 мг в сутки в виде внутривенной инфузии.
Проводят 2 курса терапии.
Первый курс терапии: 12 мг в сутки в течение 5 последовательных дней (общая доза — 60 мг).
Второй курс терапии: 12 мг в сутки в течение 3-х последовательных дней (общая доза — 36 мг). Проводится через 12 месяцев после первого курса терапии. Более длительный перерыв между курсами инфузий не изучался.
Пропущенные дозы не следует вводить в один и тот же день с введением запланированных
Способ применения
Содержимое флакона перед введением следует визуально проверить на наличие твердых частиц и изменение цвета. Не используйте препарат в случае наличия в растворе видимых частиц или изменения цвета.
Не встряхивайте флакон перед использованием.
Для внутривенного введения наберите 1,2 мл концентрата из флакона в стерильный шприц, соблюдая правила асептики. Введите набранный концентрат в 100 мл раствора натрия хлорида 9 мг/мл (0.9%) для инфузий или раствора глюкозы (5%) для инфузий. Нельзя разводить данный лекарственный препарат другими растворами. Осторожно переверните емкость для перемешивания раствора.
Препарат Лемтрада® не содержит антимикробных консервантов и, следовательно, необходимо соблюдать меры предосторожности, чтобы сохранить приготовленный раствор в стерильном состоянии. Рекомендуется вводить разведенный препарат немедленно. Каждый флакон предназначен только для однократного использования.
Любое количество неиспользованного лекарственного средства или отходы после его использования должны быть утилизированы в соответствии с местными нормативными требованиями.
Длительность внутривенной инфузии составляет приблизительно 4 часа. Если инфузия плохо переносится пациентом, можно уменьшить скорость введения препарата.
В случае крайней необходимости допускается хранение готового для применения раствора в защищенном от света месте при температуре 2 °- 8 °С не более 8 часов.
Побочное действие
При проведении совокупного анализа безопасности препарата Лемтрада® в выборку были включены 1188 пациентов с РРРС, получавших препарат Лемтрада® (в дозах 12 мг или 24 мг) в рамках контролируемых клинических исследований. При этом длительность последующего наблюдения в целях оценки безопасности составила 2363 пациенто-лет, а медиана последующего наблюдения — 24 месяца.
Наиболее важными нежелательными реакциями были: аутоиммунные заболевания (нарушения функции щитовидной железы, иммунная тромбоцитопеническая пурпура (ИТП), нефропатии, цитопении), инфузионные реакции и инфекционные заболевания.
Наиболее частыми нежелательными реакциями (≥20% пациентов) были сыпь, головная боль, лихорадка и инфекции дыхательных путей.
Приведенная ниже таблица основана на совокупных данных по безопасности за период 24 месяца, полученных в рамках исследований с участием пациентов с РРРС, получавших препарат Лемтрада® в дозе 12 мг в сутки в течение 5 последовательных дней в начале исследования и в течение 3 последовательных дней через 12 месяцев исследования. Нежелательные реакции, которые возникали у ≥0,5 % пациентов, указаны по системноорганным классам (СОК) согласно Медицинскому словарю регуляторной деятельности (MedDRA) и по терминам предпочтительного употребления (ТПУ). Частота оценивалась согласно следующим условным обозначениям: очень часто (≥ 1/10); часто (≥ 1/100 — < 1/10); нечасто (≥ 1/1000 — < 1/100). Внутри каждой группы частоты встречаемости нежелательные реакции представлены в порядке уменьшения их серьезности.
Нежелательные реакции, наблюдавшиеся у ≥ 0,5 % пациентов, получавших препарат Лемтрада® в дозе 12 мг в клинических исследованиях

Описание отдельных нежелательных реакций
Термины, обозначенные звёздочкой (*) в таблице, включают нежелательные реакции, которые упоминаются при описании инфузионных реакций. Инфузионные реакции могут также включать фибрилляцию предсердий и анафилаксию, которые встречаются реже чем в 0,5 % случаях.
Передозировка
В ходе контролируемых клинических исследований два пациента с рассеянным склерозом по ошибке получили почти по 60 мг препарата Лемтрада® (т.е. полную дозу начального курса лечения) в одной инфузии, что привело к развитию тяжёлых нежелательных реакций (головная боль, сыпь, гипотензия или синусовая тахикардия). Применение препарата Лемтрада® в дозах, превышающих изученные в клинических исследованиях, может увеличить интенсивность и/или продолжительность инфузионных реакций или усилить воздействие препарата на иммунную систему.
Антидот при передозировке препарата Лемтрада® неизвестен. Лечение заключается в прекращении применения препарата и проведении поддерживающей терапии.
Взаимодействие с другими лекарственными средствами
Исследования с участием пациентов с рассеянным склерозом, направленные на изучение взаимодействия препарата Лемтрада®, применяемого в рекомендованных дозах, с другими лекарственными средствами, не проводились. В контролируемом клиническом исследовании у пациентов с рассеянным склерозом, которые незадолго до этого получали лечение бета-интерфероном и глатирамера ацетатом, возникла необходимость прекращения лечения за 28 дней до начала терапии препаратом Лемтрада®.
При лечении пациентов с рассеянным склерозом препарат Лемтрада® не назначали совместно с другими антинеопластическими или иммуносупрессивными препаратами или вслед за ними. Также, как в случае с другими иммуномодуляторами, принимая решение о назначении препарата Лемтрада®, следует учитывать потенциальные сочетанные воздействия данных лекарственных средств на иммунную систему пациента. Применение препарата Лемтрада® совместно с любым из препаратов данных групп может увеличить риск иммуносупрессии. Ввиду отсутствия исследований по изучению совместимости, не следует смешивать алемтузумаб с другими лекарственными препаратами. Не следует добавлять другие лекарственные средства или одновременно вводить их по одной и той же линии для внутривенных инфузий.
Для разведения данного лекарственного препарата не следует использовать иные растворители, кроме указанных в разделе «Способ применения и дозы».
Известные случаи несовместимости алемтузумаба и поливинилхлоридных (ПВХ) инфузионных пакетов, ПВХ инфузионных систем с выстилкой из ПВХ или полиэтилена, а также фильтров с низким уровнем связывания белков отсутствуют.
Особые указания
Необходимо прекратить прием интерферонов бета и глатирамера ацетат за 28 дней до начала лечения препаратом Лемтрада®.
Применение препарата Лемтрада® не рекомендуется пациентам, у которых наблюдается неактивное или стабильное течение заболевания.
Наблюдение за пациентами
Лечение рекомендуется проводить в виде двух курсов инфузий (см. раздел «Способ применения и дозы»). При этом пациенты должны находиться под наблюдением в период лечения и в течение 48 месяцев после последней инфузии.
Премедикация
Пациентам необходимо проводить премедикацию кортикостероидами непосредственно перед введением препарата Лемтрада® в каждые первые 3 дня каждого курса лечения. В ходе клинических исследований премедикацию пациентам проводили с помощью 1000 мг метилпреднизолона, который вводили в каждый из первых 3 дней каждого курса лечения препаратом Лемтрада®.
Кроме того, дополнительно, можно рассмотреть вопрос о проведении перед введением препарата Лемтрада® премедикации антигистаминными средствами и/или антипиретиками (жаропонижающими средствами).
У всех пациентов необходимо применять пероральные средства для профилактики герпеса, начиная их применение в первый день каждого курса лечения и продолжая в течение, как минимум, 1 месяца после лечения препаратом Лемтрада®. При проведении клинических исследований пациентам вводили ацикловир в дозе 200 мг 2 в сутки или эквивалент.
Почечная или печёночная недостаточность
В клинических исследованиях препарата Лемтрада® не участвовали пациенты с почечной или печёночной недостаточностью.
Педиатрическая популяция
Безопасность и эффективность препарата Лемтрада® у детей с рассеянным склерозом в возрасте от рождения до 18 лет не установлена. Нет опыта применения алемтузумаба у детей в возрасте от рождения до 10 лет для лечения рассеянного склероза.
Пожилые пациенты
В клинических исследованиях не принимали участия пациенты старше 55 лет. Нет данных о том, отличается ли ответ на лечение данной возрастной группы от такового у более молодых пациентов.
Инфузионные реакции
В контролируемых клинических исследованиях инфузионными реакциями считались любые нежелательные реакции, отмечавшиеся во время инфузии препарата Лемтрада® или в течение 24 часов после окончания инфузии. Большая часть из них может быть вызвана высвобождением цитокинов во время инфузии. В контролируемых клинических исследованиях у большинства пациентов с рассеянным склерозом, которые получали препарат Лемтрада®, развивались инфузионные реакции легкой или умеренной степени тяжести во время и/или в течение 24 часов после введения препарата Лемтрада® в дозе 12 мг. Наиболее частыми реакциями были головная боль, сыпь, лихорадка, тошнота, крапивница, кожный зуд, бессонница, озноб, «приливы», повышенная утомляемость, одышка, дисгевзия. дискомфорт в грудной клетке, генерализованная сыпь, тахикардия, брадикардия. диспепсия, головокружение и боль. Серьёзные реакции возникали у 3 % пациентов и включали лихорадку, крапивницу, фибрилляцию предсердий, тошноту, дискомфорт в грудной клетке и гипотонию. Клинические проявления анафилаксии могут быть сходными с клиническими проявлениями инфузионных реакций, но они, как правило, являются более тяжёлыми и жизнеугрожающими. В отличие от инфузионных реакций, анафилактические реакции встречаются редко.
Для уменьшения тяжести инфузионных реакций рекомендуется проведение премедикации. В контролируемых клинических исследованиях большая часть пациентов получала антигистаминные препараты и/или антипиретики (жаропонижающие средства), по меньшей мере, перед одной инфузией препарата Лемтрада®. Проведение премедикации не исключает развитие инфузионных реакций. Рекомендуется тщательно наблюдать за состоянием пациента во время инфузии препарата Лемтрада® и в течение 2 часов после её окончания. В случае развития инфузионных реакций, при необходимости следует провести соответствующее симптоматическое лечение. Как правило, длительность инфузии составляет 4 часа. Если инфузия плохо переносится пациентом, можно снизить скорость введения препарата. При возникновении тяжёлых инфузионных реакций нужно немедленно прекратить инфузию препарата. Во время проведения клинических исследований анафилактические или иные тяжёлые реакции, требующие прерывания лечения, отмечались очень редко.
Врач должен быть информирован о сердечно-сосудистых заболеваниях пациента, так как инфузионные реакции могут вызывать осложнения со стороны сердца, например, тахикардию.
Во время проведения инфузии должны быть доступны средства для лечения анафилактических или иных тяжёлых реакций.
Аутоимунные заболевания
На фоне лечения препаратом Лемтрада® могут образовываться аутоантитела, что может привести к развитию аутоиммунных заболеваний, включая заболевания щитовидной железы, иммунную тромбоцитопеническую пурпуру (ИТП) или, редко, нефропатию (например, анти-ГМБ болезнь [гломерулонефрит, обусловленный антителами к гломерулярной базальной мембране]). Следует соблюдать осторожность при лечении пациентов, имеющих в анамнезе иные (не рассеянный склероз) аутоиммунные заболевания. В то же время имеющиеся данные позволяют предположить, что лечение алемтузумабом не утяжеляет течение уже имеющихся аутоиммунных заболеваний.
Заболевания щитовидной железы
Аутоиммунные заболевания щитовидной железы были выявлены в течение 48 месяцев после первой инфузии приблизительно у 36% пациентов с рассеянным склерозом, которые получали препарат Лемтрада® в дозе 12 мг в рамках клинических исследований. Как в группе пациентов, получавших препарат Лемтрада®, так и в группе пациентов, получавших интерферон бета-1а (ИНФбета-1а), частота выявления заболеваний щитовидной железы была выше у пациентов с такой патологией в анамнезе. Пациенты, имеющие заболевания щитовидной железы, должны получать препарат Лемтрада® только в тех случаях, когда предполагаемая польза терапии превышает предполагаемый риск. У участников исследований отмечались как гипертиреоз, так и гипотиреоз. В большинстве случаев эти нарушения были легкой или умеренной степени тяжести. Тяжёлые заболевания наблюдались менее чем у 1 % пациентов и более чем у одного пациента, и включали тяжелые случаи диффузного токсического зоба, гипертиреоза и гипотиреоза. Для лечения заболеваний щитовидной железы применялась стандартная медикаментозная терапия, однако некоторым пациентам потребовалось хирургическое вмешательство. В клинических исследованиях пациентам, у которых развивались заболевания щитовидной железы, допускалось проведение повторного курса лечения препаратом Лемтрада®. Имеются ограниченные данные о том, что у пациентов, получавших повторный курс, обычно не наблюдалось ухудшения течения заболевания щитовидной железы. Вопрос о продолжении лечения препаратом Лемтрада® следует рассматривать индивидуально, учитывая при этом клиническое состояние пациента. Исследования функции щитовидной железы, такие как контроль уровня тиреотропного гормона, следует проводить до начала лечения и затем каждые 3 месяца в течение 48 месяцев после последней инфузии. По окончании этого периода анализы выполняются на основании клинических данных, позволяющих предположить нарушение функций щитовидной железы.
В клинических исследованиях не было выявлено связи между уровнем антител к тиреоидной пероксидазе (АТ-ТПО) и развитием нежелательных явлений со стороны щитовидной железы. У половины пациентов с исходными положительными титрами АТ-ТПО и у четверти пациентов с исходными отрицательными титрами АТ-ТПО в дальнейшем отмечались заболевания щитовидной железы. Подавляющее большинство (приблизительно 80 %) пациентов, у которых после лечения развились нежелательные явления со стороны щитовидной железы, имели исходный отрицательный титр АТ-ТПО. Следовательно, нежелательные явления со стороны щитовидной железы может развиться у пациента вне зависимости от исходного результата АТ-ТПО, и пациент периодически должен проходить все обследования, как описано выше.
Иммунная тромбоцитопеническая пурпура (ИТП)
Тяжелые случаи ИТП наблюдались примерно у 1 % пациентов с рассеянным склерозом, принимавших участие в контролируемых клинических исследованиях. Один случай ИТП не был вовремя диагностирован, так как он произошел до введения требований обязательного ежемесячного контроля клинического анализа крови. Пациент скончался от геморрагического инсульта. ИТП обычно развивается в период от 14 до 36 месяцев после первой инфузии препарата. Симптомы ИТП могут включать (но не ограничиваться ими) легко возникающие кожные кровоизлияния, точечные кровоизлияния (петехии), спонтанные кожно-слизистые кровотечения (например, носовое кровотечение, кровохарканье), более обильные, чем обычно, либо нерегулярные менструальные кровотечения. Кровохарканье может также быть проявлением анти-ГМБ болезни (см. ниже), поэтому следует проводить соответствующую дифференциальную диагностику. Пациент должен быть информирован о возможности возникновения этих симптомов, и в случае любых сомнений немедленно обращаться к врачу.
Полный клинический анализ крови с подсчетом форменных элементов следует выполнить до начала лечения, и затем ежемесячно в течение 48 месяцев после последней инфузии. После окончания данного периода анализы выполняются на основании клинических данных, позволяющих предположить ИТП. При подозрении на ИТП следует немедленно выполнить полный клинический анализ крови.
При подтверждении диагноза ИТП долны быть немедленно предприняты соответствующие меры, включая срочное направление к специалисту. Данные клинических исследований по изучению рассеянного склероза показали, что соблюдение требований режима мониторинга крови, а также обучение распознаванию признаков и симптомов ИТП, привело к ранней диагностике и лечению ИТП в большинстве случаев, развившихся при применении первого курса терапии.
Потенциальный риск развития ИТП, связанный с повторным лечением препаратом Лемтрада®, неизвестен.
Нефропатии
Нефропатии, включая анти-ГМБ болезнь, наблюдались у 0,3 % пациентов с рассеянным склерозом, принимавших участие в контролируемых клинических исследованиях. Как правило, они отмечались в течение 39 месяцев после последней инфузии препарата Лемтрада®. В клинических исследованиях отмечено два случая анти-ГМБ болезни. Оба случая были тяжёлыми, однако благодаря клиническому и лабораторному мониторингу были своевременно выявлены, и их лечение было успешным.
Клинические проявления нефропатии могут включать повышение уровня креатинина в сыворотке крови, гематурию и/или протеинурию. Несмотря на отсутствие случаев альвеолярного кровотечения в ходе клинических исследований, этот вид кровотечения, проявляющийся кровохарканьем, может развиваться при анти-ГМБ болезни. Кровохарканье также может быть признаком ИТП (см. выше), поэтому следует провести надлежащую дифференциальную диагностику. Пациент должен быть информирован о необходимости внимательно относиться к возможности появления этих симптомов, а в случае их развития немедленно обратиться за медицинской помощью.
Анти-ГМБ болезнь может привести к развитию почечной недостаточности, требующей проведения диализа и/или трансплантации при несвоевременно начатой терапии. При отсутствии лечения может возникнуть угроза для жизни.
Необходимо определить уровень креатинина и провести клинический анализ мочи с микроскопией осадка до начала терапии препаратом Лемтрада®. Данные обследования необходимо проводить ежемесячно в течение курса лечения, а также в дальнейшем в течение 48 месяцев после последней инфузии препарата Лемтрада®. Выявление клинически значимых отклонений от исходного значения креатинина сыворотки крови, необъяснимой гематурии и/или протеинурии может свидетельствовать о развитии нефропатии. Пациент должен быть немедленно направлен к соответствующему специалисту. Ранняя диагностика и лечение нефропатии могут снизить риск неблагоприятного исхода. После окончания периода 48 месяцев после последней инфузии анализы выполняются на основании клинических данных, позволяющих предположить нарушение функции почек.
Потенциальный риск развития нефропатии, связанный с повторным лечением препаратом Лемтрада®, неизвестен.
Цитопении
В клинических исследованиях аутоиммунные цитопении, такие как нейтропения. гемолитическая анемия и панцитопения, отмечались нечасто. Для своевременного выявления цитопений следует ежемесячно выполнять полный клинический анализ крови (см. подраздел «Иммунная тромбоцитопеническая пурпура»). Если цитопения подтверждается, следует немедленно предпринять соответствующие меры, включая направление пациента к специалисту.
Инфекционные заболевания
В контролируемых клинических исследованиях продолжительностью до двух лет с участием пациентов с рассеянным склерозом инфекционные заболевания возникали у 71 % пациентов, получавших препарат Лемтрада® в дозе 12 мг, тогда как в группе пациентов, получавших интерферон бета-1а (ИФНбета-1а) (44 мкг 3 раза в неделю), они возникали у 53 % пациентов; большинство этих инфекционных заболеваний были легкой или умеренной степени тяжести. Инфекционные заболевания, возникавшие более часто у пациентов, получавших препарат Лемтрада®, по сравнению с группой ИФНбета-1а, включали назофарингит, инфекции мочевыводящих путей, инфекции верхних дыхательных путей, синусит, герпес ротовой полости, грипп и бронхит. В контролируемых клинических исследованиях с участием пациентов с рассеянным склерозом тяжёлые инфекционные заболевания развивались у 2,7 % пациентов, получавших препарат Лемтрада®, и у 1 % пациентов, получавших ИФНбета-1а. Тяжёлые инфекционные заболевания в группе пациентов, получавших препарат Лемтрада®, включали аппендицит, гастроэнтерит, пневмонию, опоясывающий лишай и инфекции зубов. Как правило, продолжительность заболеваний была обычной, и они разрешались после применения стандартного медикаментозного лечения.
В клинических исследованиях тяжёлые инфекции, вызванные вирусом ветряной оспы (Varicella zoster), включая первичное и повторное инфицирование, чаще отмечались у пациентов, получавших препарат Лемтрада® в дозе 12 мг (0,3%), чем у пациентов, получавших ИФНбета-1а (0 %). В группе пациентов, получавших препарат Лемтрада® в дозе 12 мг, отмечались также случаи инфицирования вирусом папилломы человека (ВПЧ) (2 %), в том числе цервикальная дисплазия. Рекомендуется проводить ежегодный осмотр пациенток на предмет выявления ВПЧ.
В контролируемых клинических исследованиях также были выявлены случаи туберкулёза, как в группе пациентов, получавших препарат Лемтрада®, так и в группе пациентов, получавших ИФНбета-1а. Активный и латентный туберкулёз был отмечен у 0.3 % пациентов, получавших препарат Лемтрада®. Чаще всего эти случаи регистрировались в эндемичных зонах. До начала лечения в соответствии с локальными требованиями необходимо провести скрининг на наличие активного или латентного туберкулёза.
У пациентов, получавших лечение препаратом Лемтрада®, отмечались случаи развития листериоза/листериозного менингита. Эти инфекции развивались, обычно, в течение одного месяца после инфузии препарата Лемтрада®. Для снижения данного риска, пациенты, получающие препарат Лемтрада®«, должны избегать употребления в пищу сырого и недостаточно термически обработанного мяса, сыров мягких сортов и непастеризованной молочной продукции в течение, как минимум, одного месяца после лечения препаратом Лемтрада®.
В контролируемых клинических исследованиях с участием пациентов с рассеянным склерозом поверхностные грибковые инфекции, особенно кандидоз полости рта и вагинальный кандидоз, чаще возникали у пациентов, получавших препарат Лемтрада®» (12 %), чем у пациентов, получавших ИФНбета-1а (3 %).
Если у пациента наблюдается активное инфекционное заболевание, врач должен отложить начало лечения препаратом Лемтрада®» до достижения полного контроля над течением заболевания.
Нет данных о влиянии препарата Лемтрада® на реактивацию вирусов гепатита В (ВГ-В) или гепатита С (ВГ-С), поскольку пациентов с признаками активных или хронических инфекционных заболеваний исключали из участия в клинических исследованиях. До начала лечения препаратом Лемтрада®» следует проводить скрининг на носительство вирусов ВГ-В и/или ВГ-С. Следует проявлять осторожность при назначении препарата Лемтрада® носителям вирусов ВГ-В и/или ВГ-С, поскольку есть риск реактивации вируса и развития необратимой печёночной недостаточности у пациентов этой группы.
Злокачественные новообразования
Так же, как и в случае с другими иммуномодуляторами, следует с осторожностью назначать препарат Лемтрада® пациентам с предшествовавшими и/или имеющимися злокачественными новообразованиями. В настоящий момент неизвестно, повышает ли алемтузумаб риск развития злокачественной опухоли щитовидной железы, поскольку аутоиммунное заболевание щитовидной железы может само по себе быть фактором риска малигнизации.
Контрацепция
Женщины детородного возраста должны использовать надёжные методы контрацепции во время лечения препаратом Лемтрада® и в течение 4 месяцев после последней инфузии препарата Лемтрада®.
Вакцинация
Пациентам рекомендуется соблюдать локальные требования к иммунизации не позднее чем за 6 недель до начала лечения препаратом Лемтрада®. Способность организма формировать иммунный ответ на какую-либо вакцину после лечения препаратом Лемтрада® не изучена.
В контролируемых клинических исследованиях с участием пациентов с рассеянным склерозом безопасность иммунизации живыми вирусными вакцинами после курса лечения препаратом Лемтрада® не изучалась. Пациентам, недавно прошедшим курс лечения препаратом Лемтрада®, не рекомендуется проводить иммунизацию живыми вирусными вакцинами.
Тестирование на антитела к вирусу ветряной оспы/вакцинация против инфекции, вызванной вирусом Varicella zoster
Как и в случае с любым другим иммуномодулирующим препаратом, до начала курса лечения препаратом Лемтрада® пациентам сотсутствием в анамнезе ветряной оспы и вакцинации против инфекции, вызванной вирусом Varicella zoster, следует пройти тестирование на антитела к вирусу Varicella zoster. Вакцинацию пациентов с отрицательным тестом антител к вирусу Varicella zoster следует проводить до начала лечения препаратом Лемтрада®. Для того, чтобы эффект вакцинации проявился полностью, лечение препаратом Лемтрада® нужно назначать не ранее, чем через 6 недель после вакцинации.
Рекомендуемые лабораторные исследования для наблюдения за пациентами
Лабораторные тесты следует выполнять с определенной периодичностью во время всего курса лечения, а также в течение 48 месяцев после последней инфузии препарата Лемтрада®, что позволит своевременно диагностировать аутоиммунные заболевания:
- Полный клинический анализ крови с подсчётом форменных элементов (до начала лечения и затем ежемесячно);
- Определение концентрации креатинина в сыворотке крови (до начала лечения и затем ежемесячно);
- Общий анализ мочи и микроскопия осадка (до начала лечения и затем ежемесячно);
- Исследование функции щитовидной железы, например, определение уровня тиреотропного гормона (ТТГ) (до начала лечения и затем каждые 3 месяца).
По окончании периода длительностью 48 месяцев после последней инфузии дополнительные обследования проводятся при появлении любых клинических признаков нефропатии или нарушения функции щитовидной железы.
Информация об использовании алемтузумаба вне рамок спонсируемых компанией исследовании до регистрации препарата Лемтрада®
Следующие нежелательные реакции были выявлены при использовании алемтузумаба для лечения В-клеточного хронического лимфоцитарного лейкоза (В-ХЛЛ), а также для лечения других заболеваний, как правило, в более высоких дозах (например. 30 мг) и с большей частотой, чем рекомендовано для лечения рассеянного склероза. Поскольку информация об этих реакциях поступала спонтанно и размер популяции, получавшей лечение, не определен, не всегда есть возможность достоверно оценить их частоту или выявить связь с приёмом алемтузумаба.
Аутоиммунные заболевания
Аутоиммунные заболевания, о развитии которых сообщалось на фоне терапии алемтузумабом, включают нейтропению, гемолитическую анемию (включая один летальный случай), приобретённую гемофилию, анти-ГМБ болезнь и заболевания щитовидной железы. Тяжёлые и иногда аутоиммунные заболевания с летальным исходом, включая аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопению, апластическую анемию, синдром Гийена-Барре и хроническую воспалительную демиелинизирующую полирадикулонейропатию, описаны у пациентов без рассеянного склероза и получавших алемтузумаб. У одного пациента со злокачественным новообразованием, получавшего алемтузумаб, была отмечена положительная реакция Кумбса. У другого пациента с онкологическим заболеванием инфузия привела к летальному исходу в связи с развитием реакции «трансплантат против хозяина».
Инфузионные реакции
Тяжёлые и иногда инфузионные реакции с летальным исходом, включая бронхоспазм, гипоксию, обморок, лёгочные инфильтраты, острый респираторный дистресс-синдром, остановку дыхания, инфаркт миокарда, аритмии, острую сердечную недостаточность и остановку сердца, наблюдались у пациентов без рассеянного склероза и получавших алемтузумаб в более высоких дозах и с большей частотой, чем рекомендовано для лечения рассеянного склероза. Как правило, эти реакции протекали тяжелее, чем у пациентов с рассеянным склерозом. Также сообщалось о тяжёлых анафилактических реакциях и других реакциях гиперчувствительности, включая анафилактический шок и отёк Квинке.
Инфекции и инвазии
Сообщалось о тяжёлых и иногда с летальным исходом вирусных, бактериальных, протозойных и грибковых инфекционных заболеваниях, включая случаи, вызванные реактивацией латентных инфекций, у пациентов без рассеянного склероза и получавших алемтузумаб в более высоких дозах и с большей частотой, чем рекомендовано для лечения РС. Как правило, эти инфекции протекали тяжелее, чем у пациентов с рассеянным склерозом. Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) наблюдалась с одинаковой частотой у пациентов с В-ХЛЛ, как получавших, так и не получавших терпию алемтузумабом.
Заболевания крови и лимфатической систем
Тяжёлые кровотечения на фоне терапии алемтузумабом наблюдались у пациентов без рассеянного склероза.
Нарушения со стороны сердца
У пациентов без рассеянного склероза и получавших потенциально кардиотоксичные препараты до начала терапии алемтузумабом, отмечались застойная сердечная недостаточность, кардиомиопатия и снижение фракции выброса.
Лимфопролиферативные заболевания, вызванные вирусом Эпштейна-Барр
В не спонсируемых компанией исследованиях наблюдались лимфопролиферативные заболевания, вызванные вирусом Эпштейна-Барр.
Влияние на способность управлять транспортными средствами и работать с механизмами
Исследований по оценке влияния препарата Лемтрада® на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности не проводилось.
У многих пациентов во время лечения препаратом Лемтрада® или в течение 24 часов после проведения инфузии развивались инфузионные реакции. Некоторые из этих реакций (например, головокружение) могут оказать временное влияние на способность пациента управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности. С учетом возможных побочных эффектов, необходимо соблюдать осторожность при управлении транспортом и работе с механизмами.
Форма выпуска
По 1,2 мл концентрата для приготовления раствора для инфузий, 10 мг/мл во флаконы из прозрачного бесцветного стекла гидролитического типа I номинальной вместимостью 2 мл, которые укупоривают серыми бутилкаучуковыми пробками и закатывают алюминиевыми колпачками, снабженными отрывными пластиковыми дисками.
По 1 флакону вместе с инструкцией по применению помещают в картонную пачку.
Условия хранения
Хранить в защищенном от света месте при температуре 2 °- 8 °С.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
Джензайм Европа БВ, Нидерланды.
Фирма-производитель (выпускающий контроль качества)
1)Джензайм Лтд., Великобритания.
Genzyme Ltd., United Kingdom.
37 Hollands Road, Haverhill, Suffolk, CB9 8PU, United Kingdom.
2)Джензайм Ирландия Лимитед, Ирландия.
Genzyme Ireland Limited, Ireland.
IDA Industrial Park, Old Kilmeaden Road, Waterford, Ireland.
Производитель готовой лекарственной формы
Берингер Ингельхайм Фарма ГмбХ и Ко. КГ. Германия.
Boehringer Ingelheim Pharma GmbH & Co. KG, Germany.
Birkendorfer Str. 65, 88397 Biberach an der Riss, Germany.
Претензии потребителей направлять по адресу в России:
АО «Санофи Россия».
125009, г. Москва, ул. Тверская, д. 22.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
In September 2013, Alemtuzumab was approved in Europe as an additional therapeutic option for active relapsing-remitting Multiple Sclerosis (RRMS). Since its synthesis in the early eighties as the first humanized monoclonal antibody, Alemtuzumab therapeutic potentials were explored for many diseases (eg. Graft versus host disease, transplantation, vasculitis, rheumatoid arthritis, immunologically mediated cytopenia) [1, 2]; it is the first depleting monoclonal antibody which was licensed for the treatment of RRMS. The mechanism of Alemtuzumab differs from immunmodulating and other immunosuppressive treatments in its fundamental approach, which consists of at least two courses of lymphocyte depletion followed by cellular repopulation. The reconstitution of lymphocytes is thought to be of particular importance not only for the beneficial clinical effects, but also for the long-term side effects [3]. Alemtuzumab is introducing a new therapeutic concept of an induction-like treatment strategy, but without the need of a maintenance treatment in the follow up in most of the treated patients. Such concepts are till now not well established in our clinical practice. Furthermore, other highly efficacious treatment options such as Natalizumab and Fingolimod are available. No clinical trials have directly compared Alemtuzumab with these medications making the clinical decision not straight forward.
Although the role of Alemtuzumab in RRMS was investigated in three active-controlled clinical studies [4–6], using it in clinical practice can be quite challenging as several questions are still to be answered: how to define patients who will most likely profit from Alemtuzumab? Where does Alemtuzumab stand in MS treatment scenario? And then if Alemtuzumab is to be given, how should we switch patients from other specific MS treatments to Alemtuzumab? What other MS medications could be given following Alemtuzumab? How could the infusion management be optimized? Which side effects can be expected and how should they be handled? What is the most applicable monitoring strategy in clinical practice?
The aim of this review is to summarize our experience with Alemtuzumab in clinical practice of the last two years following a structured approach starting with treatment selection followed by preparation and infusion management up to the longterm monitoring.
The innovative treatment concept of alemtuzumab
Alemtuzumab is a monoclonal antibody that selectively binds to CD52, which is a surface glycoprotein molecule of unknown function [7]. It is expressed on the surface of T- and B-cells and other cell populations but not on the hematological precursors [8]. Alemtuzumab infusion results in rapid depletion of the CD52 positive cells [9], leading to lymphopenia, which lasts for several years [10]. While B-cells recover relatively quickly within a range of 3–8 months, the repopulation of T cells occurs more slowly, as it needs up to 3 years and in another study up to 60 months for CD4+ and 30 months for CD8+ T cells in average [11, 12]. The experimental data using humanized CD52 mice have shown, that the depletion of lymphocytes upon anti-CD52 treatment was predominant in peripheral circulation, while the number of those cells was clearly less affected in spleen, thymus, bone marrow and lymph nodes [13, 14]. This may represent an explanation for the unexpected low rate of infections in patients receiving Alemtuzumab. As mentioned before, the depletion of CD52-positive cell is followed by a recovery phase that can vary between treated patients. However, it was shown that different repopulation kinetics among patients was not able to predict the risk of MS reactivation [14–16].
This process is considered as part of the reprogramming of the dysregulated immune system. Some authors suggest that the observed prolonged effect of Alemtuzumab lies in the slow reconstitution of T lymphocytes after the initial depletion, and not in the depletion itself [3].
The radical approach of Alemtuzumab which leads to its prolonged therapeutical effect is actually also associated with the well-described side effects. In addition to the infusion-associated reactions (IAR), which will be described in more details later, the increased incidence of antibody-mediated autoimmune diseases upon Alemtuzumab therapy is remarkable [17]. Taking into consideration the previously described mechanism of immune cells depletion and the potential side effects, the need arises to find appropriate criteria that are useful for patient selection.
No biomarker to detect predisposition for secondary autoimmunity has been found yet. IL-21 was previously described as a promising candidate but these results could not be reproduced in another following study, which was attributed to the use of different kits [18, 19].
Different treatment strategies
Alemtuzumab therapy consists of two courses with 12 months in between. In spite of this non-frequent intermittent administration of the medication, this approach guarantees a long-term stabilization of the disease activity and to achieve the therapeutic effect, keeping in mind that Alemtuzumab infusions should take place under close monitoring. Until now, all available highly-efficacious therapies as Natalizumab and Fingolimod follow a continuous treatment strategy. After stopping these drugs, disease activity is returning or even overshooting as it has been described for Natalizumab [20, 21] and also even in fewer cases for fingolimod [22–25]. On the other side, treatment switches are easier to perform if a more or less reversible treatment as Fingolimod or Natalizumab is applied. The disadvantage is that the use of other treatment approaches after Alemtuzumab is more complicated due to the effects of irreversible depletion and repopulation, on the other side patient is practically off treatment after the second Alemtuzumab infusion. The rapid onset of Alemtuzumab treatment effects can be explained by depletion of both cells of the acquired and innate immune system, including the impairment in activation as well as cytokine release [9].
Comparing side effects, Alemtuzumab has specific windows where side effects are increased specifically (IARs during infusion, infections directly after infusion, secondary autommunity with a maximum in the third year) [26, 27] which is different to risk of adverse events of eg. Natalizumab presenting an increased PML risk after a certain treatment duration [28]. In the field of MS treatment, we have for the first time different treatment strategies with different efficacy and risk profiles during the treatment duration which should be considered before treatment is selected (Fig. 1). Alemtuzumab presents with characteristics of induction treatment although strategy is not correctly defined by the term induction treatment as in the most cases no maintenance treatment is necessary at least for the 5 year window after treatment start [29].
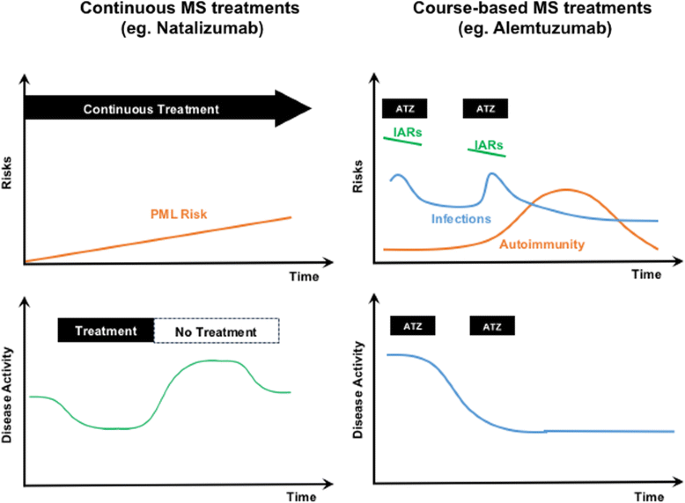
Comparison of different highly efficacious RRMS therapy strategies Alemtuzumab (right), and Natalizumab (left). The upper diagrams show the adverse effects, which happen usually within specific time windows, the lower diagrams the clinical efficacy
Full size image
Patient selection: who is the right patient for Alemtuzumab?
According to the European Medicines Agency (EMA), Alemtuzumab is approved for the treatment of patients with active RRMS [30], whereas disease activity is defined by clinical and/or imaging criteria. According to the criteria for assessment of MS activity proposed by Lublin and colleagues [31], a patient with RRMS would be considered as having an active course if a clinical relapse took place or the brain MRI showed new Gadolinium-enhancing and/or the increase in size or number of T2 lesions. MRI monitoring should be done in regular annual intervals [32]. In the clinical trials, the disease duration was limited to 5 years in treatment naïve and to 10 years in pretreated patients [4, 6] probably because Alemtuzumab was not able to cause improvement in SPMS patients in a small pivotal study [11]. So in our opinion, the benefit of the patients regarding Alemtuzumab treatment is optimal if significant inflammatory signs are present clinically and by MRI. So Alemtuzumab is not indicated for patients who do not show any disease activity, and it is also not considered as a standard alternative for patients who are stable on current therapy.
It should be emphasized that for MS patients with high disease activity, highly efficacious therapy options such as Alemtuzumab should be used early within a “window of opportunity” [33]. That implies that the optimal timing would be in the presence of significant clinical and MRI inflammatory activity without significant disability [34]. Therapeutical efficacy of Alemtuzumab is most prominent in early stages of disease by reducing inflammatory activity to counteract the development and accumulation of disability [11, 35]. Patients presenting with an EDSS value up to 3–4 still potentially have predominant inflammatory processes, while irreversible damage is increasingly assumed to be associated with higher EDSS values [36]. Accordingly, Alemtuzumab is most appropriately to be used before an EDSS score of 4 is reached. This should not be interpreted that patients with higher EDSS scores can not benefit from treatment with Alemtuzumab, as the indication should be considered based on clinical and/or radiological disease activity Actually in some patients Alemtuzumab is used as “last option” treatment as many treatments before have failed. The efficacy of Alemtuzumab as last option treatment strategy has to be investigated by defined cohort or real world studies [37, 38].
In addition to the disease activity as a determining factor in the therapeutic decision, other factors, such as patient personality and cognitive skills, should be taken into consideration. Because of necessary longterm monitoring patient’s discipline is demanded, as Alemtuzumab treatment is potentially associated with severe adverse effects which have to be identified early [39].
Keeping in mind that different forms of MS are mediated by different pathological processes, possibly implicating different therapeutical approaches, the diagnosis and classification of MS should be definitely confirmed. Neuromyelitis optica (NMO) which was long been considered as a special form of MS, is associated with different etiology. Alemtuzumab is not considered as a first line treatment option in this disease, as several case reports showed a worsening of NMO under Alemtuzumab treatment [40–42].
As no previous studies have yet compared the efficacy of Alemtuzumab directly with other highly active therapies, such as Natalizumab or Fingolimod, the clinical decision to choose one of the above mentioned medications is largely based on other factors. That would include on top of the list the potential side effects of each drug versus the expected benefit. Additionally the relative and absolute contraindications should be carefully assessed to choose the most suitable drug. For example, patients with positive anti-JCV status represent high-risk group for PML development on longterm Natalizumab treatment [43]. For female patients in child-bearing age, Alemtuzumab can be the choice, but the it should be planned 4 months after the last infusion [44].
There are relative and absolute contraindications for Alemtuzumab treatment, which should be taken into consideration (Table 1).
Full size table
Patient preparation: pretreatment
The strategy how to initiate the treatment with Alemtuzumab depends on pretreatment status of the patient (Fig. 2). In treatment-naïve MS patients, an immediate start of Alemtuzumab is possible. Moreover, Alemtuzumab treatment accompanied with high dose steroids can itself even be used as an acute relapse treatment. Direct switching from Interferon-beta or Glatiramer Acetate to Alemtuzumab is also possible without any specific washout period if no relevant laboratory abnormalities (for example lymphocytopenia) are present. In case of Teriflunomide and Dimethylfumarate, it is advised to wait at least one month before Alemtuzumab administration, as it is required that the levels of lymphocytes are within normal range (>1.5 GPt/l). It is also recommended to accelerate Teriflunomide elimination by Cholestyramine application and determine its blood concentration before the Alemtuzumab start. Patients stopping Fingolimod should have recovered to physiological absolute lymphocyte counts as well which is an important pharmacodynamics parameter considering the mechanism of action of Fingolimod [45]. In patients switching from Fingolimod, we are not as strict with a recovered absolute lymphocyte count (>1.0 GPt/l) as with Dimethylfumarate (>1.5 GPt/l) as Fingolimod is only affecting lymphocyte redistribution between lymphoid tissues and blood.

Recommended protocols for switching to Alemtuzumab, regarding different pretreatments. Special attention should be paid for patients who were previously treated with natalizumab, two different protocols are suggested depending on the individual PML risk
Full size image
Prior therapy with Natalizumab represents a special situation as the switching protocol depends on the actual PML risk which is closely linked to the JCV status and treatment duration [28]. The challenge is to find a way between returning disease activity after Natalizumab and PML risk. Because of the irreversible and acutely immunosppressive mechanism of action of Alemtuzumab, a carryover PML after natalizumab treatment which has been described occurring even up to 6 months after Natalizumab cessation has to be excluded before treatment start [46, 47]. So if there is only a low PML risk which means treatment duration with Natalizumab less than 2 years and/or negative anti-JCV antibodies, a washout period between two and three months is considered sufficient until pharmacodynamic effects of Natalizumab have disappeared. MRI and possibly CSF analysis should be performed as part of the work up as described later. For patients with higher PML risk (JCV antibody positive and treatment duration > 2 years) we recommend a stepwise approach. 3 months after last infusion first MRI should be performed to exclude PML and monitor return of disease activity. If no MRI activity is present, follow up MRI will be performed 4 weeks later which will be repeated until 6 months. If there is MRI activity (or clinical activity) present, CSF analysis with JCV DNA and cell count should be performed before Alemtuzumab is started. This procedure has been applied many times in our clinical practice and can avoid return of clinical activity and makes PML much more unlikely. This means that a strict 6 months washout period cannot be applied in all PML high risk patients on Natalizumab. It is crucial to implement an individual approach for the switch of natalizumab to Alemtuzumab. As irreversible, cell depleting therapy, a carry over of a Natalizumab-associated PML has to be avoided in potential Alemtuzumab patients. In our hands, identifying patients with MRI activity was mostly sufficient to avoid clinical rebound activity as Alemtuzumab demonstrates a rapid onset of action. After immunosuppressive therapies, such as Azathioprine, Cyclosporine A, Mitoxantrone or Cyclophosphamide, which are rarely used nowadays, wash-out period of 3–6 months is necessary in addition to physiological white blood cell counts. Nevertheless patients after immunosuppressive pretreatment are not the ideal patients although case reports have reported beneficial effects [37].
In general, it should be kept in mind that these recommendations are general. In everyday clinical practice we are confronted with special individual patient cases that may require deviation from the general recommendations. These adjustments are justified depending on the individual disease activity and progression, and it is advisable to document the reason for the different approach appropriately [48].
Patient preparation: preparatory steps
Taking into consideration the well-known side-effects and contraindications of Alemtuzumab, a detailed patient history and physical examination should be performed to exclude possible contraindications. Effective treatment should be given in case of acute infections. It is required to wait until the infection is cured before going on with the Alemtuzumab infusion. On the other hand, chronic Infections such HBV, HCV, TBC and syphilis (except HIV) do not represent absolute contraindications, but their presence demands additional carefulness. An active infection should be excluded. In case of a positive quantiferon test, active TBC has to be excluded by chest X-ray and prophylactic treatment with Isoniacid for at least half a year has to be started before Alemtuzumab treatment can begin 6–8 weeks later [49]. Neoplasms, which are considered as relative contraindication, should be cured before initiating Alemtuzumab treatment. Recommended lab tests before starting treatment with Alemtuzumab are described in Table 2. This workup should be done before every Alemtuzumab infusion later on.
Full size table
MRI of the complete neuroaxis (not older than three months) should be performed as documentation for baseline status before Alemtuzumab start. All the above-mentioned tests should be accomplished and managed before the first treatment course; and these safety investigations should be repeated prior to the commencement of the second treatment course. There are no specific requirements regarding lymphocyte or leukocyte cell counts which have to be reached before second Alemtuzumab course.
Women with childbearing potential should be informed to use an effective contraception during treatment phase and four months thereafter.
Especially for patients who have a history of neither chicken pox infection nor of previous vaccination against Varicella-Zoster virus, it is obligatory to measure its antibodies level before initiating Alemtuzumab treatment. We recommend VZV testing in all patients before Alemtuzumab application. For those who are VZV antibody negative the vaccination should be given, followed by measuring the VZV antibody titer four to six weeks after VZV vaccination. As vaccinations may be complication by the depleting-repleting mechanism of action vaccination status should be checked and necessary vaccinations should be performed before first Alemtuzumab application.
Before first Alemtuzumab treatment, patients should be informed about potential side effects and the need for regular monitoring which is mandatory for a beneficial risk-beneftit ratio of Alemtuzumab.
Alemtuzumab infusion management
Treatment with Alemtuzumab consists of at least two courses of infusion therapy with twelve months in between. During the first course (“the induction course”) the monoclonal antibody is intravenously infused over five consecutive days with the recommended dose of 12 mg/day. Out of practical reasons it is useful to start the treatment course on Monday to avoid infusions during weekends. One year later, Alemtuzumab is infused in a second course of treatment (“the maintenance course”) over three consecutive days. Between the two treatment courses no immunomodulatory treatment should be applied. Shortening the interval between these two courses is not recommended as there is no experience. To reduce the infusion-associated reactions (IAR), a specific schedule of infusion should be applied (Table 3).
Full size table
The day before Alemtuzumab infusion, H1 and H2 blockade should be initiated which could be applied beyond the infusion week if necessary [30, 50]. An anti-pyretic, given 30–60 min before infusion, may help to reduce the infusion reaction.
In addition, a short infusion of methylprednisolone (1 g) is recommended for the first three days of treatment. Cytokine release and lymphocyte activation could account for such infusion-associated reactions [51, 52]. Induction of serum cytokines could be due to cross-linking of NK cells in addition to cell lysis [52]. Pivotal studies not using standardized infusion procedure and methylprednisolone pre-treatment demonstrated higher levels of serum cytokines and significant more IARs after initial alemtuzumab infusions [51]. Pre-and concomitant methylprednisolone treatment incorporated into the standard infusion protocol may attenuate cytokine release syndrome and help reduce infusion-associated reactions to enhance patient tolerance [50]. This protocol is based on the procedure in pivotal studies. However, in deviation from this study experience, the steroid infusion may be adjusted depending on the individual situation and the patient’s response. This mean extension over 5 days or potential pretreatment one day before Alemtuzumab infusion which is actually investigated in a clinical trial. If the Alemtuzumab course could not be completed over the consecutive 5 days, if the course has to be interrupted because of eg. acute infection with fever, the remaining Alemtuzumab infusions should be performed as soon as possible in the next weeks. In this case, methylprednisolone should be applied before all remaining Alemtuzumab infusions.
Alemtuzumab infusion should be started after methylprednisolone infusion. Mixing these preparations is not allowed, as this can lead to precipitation of the drug. Alemtuzumab itself is diluted immediately before the infusion in 100 ml of 0.9 % sodium chloride solution or 5 % glucose solution (chemically stable at 2–8 °C for up to 8 h). Other infusions could be applied using the same intravenous port as Alemtuzumab, a paravenous infusion is not critical as Alemtuzumab is a monoclonal antibody and not a chemotherapy. The infusion-associated reactions (IAR) occur in up to 90 % of patients treated with Alemtuzumab [50]. Skin reactions are observed predominantly. With mild symptoms, symptomatic treatment with anti-histamergic treatments or anti-pyretics/anti-inflammatory treatments and slower infusion rate are usually sufficient. In case of severe reactions such as fever, urticaria, atrial fibrillation, nausea, chest discomfort or hypotension, the infusion should be stopped immediately. Because of these potential acute infusion-associated reactions, anaphylaxis therapy should be kept ready although the reaction to Alemtuzumab is generally not anaphylactic, so that the infusion can be further continued. The observation for two hours after the end of the infusion is necessary. In our hand, monitoring of the patient’s temperature seems to be an effective method for early detection of an infusion-associated reaction in everyday practice [30]. It is therefore recommended to monitor and document the body temperature every half hour. Heart rate and blood pressure should also be measured every one hour. In addition to this reaction, reappearance of old neurological deficits, which occurred in the context of past relapses, can also occur, which it is caused by the release of cytokines due to cell depletion in a process similar to Uhthoff effect (Cytokine Uhthoff syndrome) [51]. The highest drug level is reached after the last infusion [53]. However, even if this falls in the next few days, its effect with regard to lymphocyte depletion goes on, so that it is still possible to experience reactions related to cells depletion [9].
Post-infusion monitoring
Alemtuzumab treatment is associated with an increased risk for the development of autoimmune diseases, for this reason a regular monitoring is indicated to allow for an early recognition and thereby early treatment of these diseases [10, 17, 19, 54–57]. Most of the autoimmune phenomena have a beneficial prognosis if they are identified early and anti-inflammatory treatment is started early. So monthly check-ups should take place up to 48 months after the last infusion, including a complete differential blood count to detect the development of Alemtuzumab-induced thrombocytopenic purpura (ATP) [58, 59]. In addition, monthly monitoring of serum creatinine levels and urine tests with microscopy for an early detection of possible glomerulonephritis are necessary [59]. Thyroid function test using the TSH value should also be performed every three months. In pregnant patients with special interest in thyroid monitoring monthly TSH testing is recommended [55, 57, 60].
The monitoring does not need to be performed by the treating neurologist. Good experiences are reported in terms of the cooperation with general practitioners, who can perform or arrange for the check-ups. However, it is essential that the treating neurologist ensures that the control tests are carried out according to previous specifications and the obtained results are evaluated. Treating neurologist has to organize and supervise monitoring after Alemtuzumab treatment. Patients should be clearly informed not to wait for problems to happen, but immediately and regularly communicate with their physician. Modern communication tools as email reminders, smartphone could be nicely implemented in the patient management [61].
Collecting real world data in an alemtuzumab registry
Although the clinical experience with the agent has substantially increased since market introduction, there are only few reports yet on the long-term use of the drug in the routine of physicians and MS centers [10, 16, 44]. That is why real world data about Alemtuzumab data should be collected as the German non-interventional long-Term study foR obsErvAtion of Treatment with Alemtuzumab (TREAT-MS) which is documenting physician and patient experience in daily clinical practice for six years [62]. Data for this non-interventional study will be collected on a widely unselected patient population eligible for Alemtuzumab treatment. It is expected that compared to the clinical studies, patients with more concomitant diseases and/or more concomitant medications will be documented. Together with the high patient numbers and long follow-up period, a substantial number of patient years will be documented and the option for relevant subgroup analyses provided [48].
For this observational study, a protocol was developed based on the risk management plan for alemtuzumab. By participation in the study, physicians are reminded about the investigations and precautions. The documentation system MSDS3D has been shown to be efficient to guide physicians through the study procedures and to collect the relevant information in clinical practice and for the use in previous non-interventional studies such as PANGAEA [63]. It interactively collects data, but also assists neurologists in the execution of complex processes required for comprehensive management of MS patients (Fig. 3a, b) [64–66].
a/b The standard protocol for documentation of the different monitoring parameters as displayed on MSDS3D, which enables for monitoring laboratory, clinical, and radiological progression, as well as planning the next step in approaching patients who showed abnormalities
Full size image
Infections
As infections can be facilitated by cellular depletion of the adaptive and innate immune system together and infusion-associated reaction symptoms like fever, headache, and fatigue may mimic infectious signs, routine blood analysis is usually a suitable tool to identify infectious conditions. But laboratory monitoring during infusion therapy is not needed, and it can even be affected by cell depletion-related artifacts [9]. During the the first infusion week, rapid cellular depletion and impairment of activation of different adaptive and innate immune cell subtypes take place accompanied by marked serum cytokine increases. Nevertheless, these acute Alemtuzumab-mediated effects are assumed to lead to several effects observable by standard blood testing, such as the non-infectious increase in leukocyte count, CRP, and PCT, which are of particular importance in identification and monitoring of infectious conditions. Furthermore, transient elevation of liver enzymes, thrombocytopenia, and TSH modulation are demonstrated. So we recommend clinicians to be aware of clinical symptoms and vital data to initiate supportive analysis rather than standard laboratory testing within the first alemtuzumab treatment week [9].
In general, patients should also be advised to avoid the consumption of raw foods such as raw milk products because of possible contamination with listeria [30]. The ability of Alemtuzumab to deplete dendritic cells as well may explain cases of Listeria meningitis linked to the initial Alemtuzumab infusions [9, 67, 68]. Listeria meningitis infection may be facilitated by immune cell depletion in the adaptive as well as the innate immune system, possibly by an outburst of a pre-existing, clinically silent and CD8+ T cell controlled infection due to cellular depletion and activation blockade. These findings highlight the relevance of certain infections, which could be promoted by the depletion and blockade of innate immune subsets, that clinicians should be aware of within the first days after initial Alemtuzumab infusion.
Patients who have acute or chronic infections should not start with Alemtuzumab therapy. As mentioned above the presence of acute infections under Alemtuzumab therapy demands immediate diagnostic and therapeutic procedures. Taking into consideration that human papilloma virus infections (including cervical dysplasia) were described, it is obligatory for female patients to perform an annual HPV-screening with cervical cytology, especially when no former HPV vaccination was given.
Due to the observed increased rate of herpes infections, prophylaxis with acyclovir is recommended [69]. In the phase 3 clinical studies, this prophylactic regimen was introduced not from the beginning on [4, 6, 59]. But the patients receiving 200 mg of acyclovir twice daily or an equivalent for this purpose demonstrated less herpetic infections. Prophylaxis should begin on the first day of each treatment phase and should be maintained throughout the course of treatment for at least for 1 month. It should be noted that acyclovir can cause several immunological phenomena including rash itself, which has to be differentiated from IARs and could be improved by the transition to a newer treatments, such as Valacyclovir, as an alternative.
In the approval trials infections were moderately increased in Alemtuzumab group compared with interferon group, represented mainly by mild to moderate infections in the upper respiratory tract, gastroenteritis and urinary tract infections [70]. This is a completely different profile compared to hematological patients treated by higher doses of Alemtuzumab demonstrating specific opportunistic infections of immunosuppression [71]. In MS patients, infections were not prolonged and receded under traditional medical therapy. Serious or opportunistic infections were not noticed to be increased. Pre-existing chronic diseases, such as tuberculosis, can be reactivated. No data are available regarding reactivation of controlled chronic HBV/HCV infections. In a recent observation period of 7 years no change in the malignancy rate has been detected [44]. As the thyroid is carefully investigated because of thyroid autoimmunity by eg. ultrasound, a rise in the incidence of thyroid papillary carcinoma diagnosis may be the consequence suggesting overdiagnosis [72].
Autoimmune adverse events
In a recent study for long-term safety evaluation an incidence of 48 % for secondary autoimmune diseases was reported [44]. This is attributed to dysregulated B cells, resulting in secondary autoimmunity [17]. Because of this high incidence of secondary autoimmune diseases, determining biomarkers that can predict which patients are more susceptible to develop secondary autoimmunity is of high importance. Even though a high value of interleukin 21 at baseline could successfully predict the occurrence of autoimmune diseases in Alemtuzumab treated patients, it is inadvisable to rely on these values when taking the treatment decision, because of problems related to the confirmation of results by the currently available kits [18, 19]. An overview about the lab testing as part of the risk monitoring plan is demonstrated in Fig. 4.
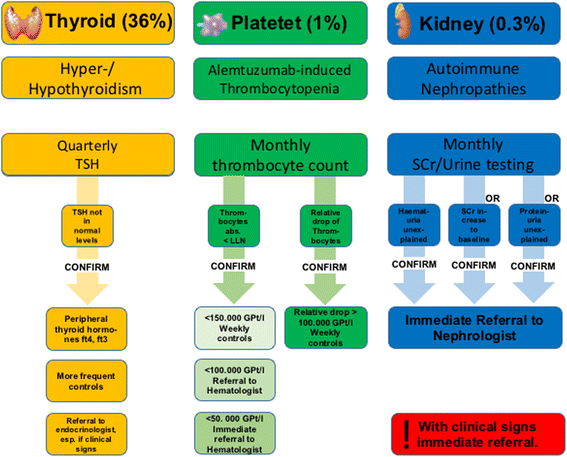
Algorithm for monitoring patients after alemtuzumab infusion regarding secondary autoimmune side effects
Full size image
Thyroid disease
The development of autoimmune thyroid diseases is of high importance as it can be detected in more than 35 % of patients treated with Alemtuzumab in the 4 years after first Alemtuzumab infusion [60]. Both hypo- and hyperthyroidism may occur, and the development of Graves’ disease was highly prevalent [55].
The peak of incidence is reported to be in the third year after the first dose of Alemtuzumab. Most events are of mild to moderate severity and can respond to conventional therapies. However, surgical intervention may be needed in less than 1 % of patients. The occurrence of thyroids side effects requires careful assessment of the clinical status of the patient and the necessity of medical and/or surgical therapies before continuing Alemtuzumab treatment. According to data derived from clinical studies, the baseline value of anti-TPO antibodies before starting alemtuzumab could not predict the development of thyroid side effects. Almost 80 % of patients who manifested with thyroidal problems after alemtuzumab therapy, showed negative anti-TPO antibody status at the beginning of the study [60].
Alemtuzumab-induced thrombocytopenia
In addition, Alemtuzumab-induced autoimmune-mediated thrombocytopenia was reported in more than 1 % of patients, which represents a form of idiopathic thrombocytopenia (ITP) [26, 58, 73].
Acute ITP has occured in ab to 2 % of the treated patients in clinical MS-studies within 14–36 months after the first exposure to alemtuzumab. ATP can manifest clinically with higher tendency to bruises, petechias, spontaneous mucosal bleedings (epistaxis, hemoptysis), severe or irregular menstrual bleeding or symptoms of anemia due to blood loss including serious hemodynamic complications. Complete blood count including platelet value should be performed monthly over at least 48 months after the last alemtuzumab infusion. The platelet control should be performed weekly in case that platelet count drops to less than 30 % of its initial value or below the normal range, and hematological consultation should be ordered when the platelet number is less than 100.000 GPt/l.
Normally the acute treatment of thrombocytopenia is usually low to high dose corticosteroids, it does not tend to develop a chronic condition. Reports about continuing alemtuzumab therapy after the development of ATP are limited and giving a new alemtuzumab infusion should be assessed on an individual basis [2].
Nephropathies
Nephropathies and individual cases of Goodpasture’s syndrome with renal and pulmonary infection were reported in 0.3 % of the patients [44, 74]. Nephropathies including anti-glomerular basement membrane (anti-GBM) disease, occured in 0.3 % of the patients in clinical MS-studies up to 39 months after the last administration of Alemtuzumab. These cases were early recognized by clinical and laboratory control, so that they could follow favorable course after effective treatment. The development of anti-glomerular basement membrane (anti-GBM) disease without suitable monitoring had led to renal failure, which in case of delayed treatment led to dialysis and/or kidney transplantation. Such side effects can be detected by laboratory monitoring through the presence of hematuria, proteinuria and/or creatinine elevation. Consequently, an urgent specialized nephrological consultation will be necessary.
Vaccinations
The efficacy of vaccines during and closely after Alemtuzumab application can be limited. That is why it is recommended to check the success of the vaccinations by determining their respective titers. The use of attenuated living vaccination should be avoided. Patients should fulfill the vaccination requirements at least six weeks before starting the Alemtuzumab therapy. It should be emphasized that for patients treated with Alemtuzumab the flu-vaccine should be delayed at least six months after the last infusion; however this vaccination can be repeated in case the first vaccination was not efficient.
One pilot study showed that for patients treated with Alemtuzumab the humoral immunological response after different vaccinations was not different from that detected in respective controls [6, 75], implying that the immune competence is restored after lymphocytes depletion induced by Alemtuzumab therapy. This is in line with the data derived from clinical studies which demonstrated low incidence of opportunistic infections following Alemtuzumab infusions. However this study was small and only 5 patients were vaccinated within the first 6 months after Alemtuzumab [16, 76, 77].
Moreover different studies suggested that the long lasting lymphopenia is neither associated with higher incidence of infections nor with higher activity of MS compared with accelerated lymphocyte reconstitution [12, 15, 78].
Pregnancy
No safety data are available till now regarding the potential influence of Alemtuzumab on male fertility. The concerns regarding potential effect on fertility remains not well investigated, as the target antigen CD52 is also found in the tissues of the reproductive system.
Alemtuzumab is contraindicated during pregnancy and lactation, as animal studies have shown reproductive toxicity because Alemtuzumab, as well as human immunoglobulins, can cross the placenta. The same applies during lactation as they can be transferred by breast milk, and the risk to the infant is unknown. Additionally, the increased incidence of autoimmune diseases such as thyroid disease, particularly by the use of Alemtuzumab in women of childbearing age represents potential concern [79].
The development of autoimmune diseases had been observed during the study period within a maximum in the third year after first infusion followed by a decrease in risk [44]. So it makes sense to plan for pregnancy either after this period has passed or before the third year which means 4 months after the second infusion, and then profit from the prolonged high efficiency without the need for additional medication.
Treatment following the 2 Alemtuzumab courses
The majority of MS patients treated with Alemtuzumab do not need additional Alemtuzumab infusions or different MS treatments in the first 5 years after Alemtuzumab treatment. In a recent analysis for ECTRIMS 2015, 68 % of CARE-MS1 and 60 % of CARE-MS2 have not received additional Alemtuzumab infusions. 22.1 % resp. 8.0 % of CARE-MS1 and 28.8 % resp. 9.9 % of CARE-MS2 patients have received one resp. two Alemtuzumab retreatments. In both clinical trials, the threshold for Alemtuzumab retreatment was quite low with one relapse activity or two new T2 lesions resp. one new Gd + lesion in the follow up MRI. If the treatment strategy of Alemtuzumab has been selected after careful consideration, this selected strategy should be generally maintained which means that retreatments should be applied at least once or twice if needed. Every retreatment should be accompanied with careful consideration about retreatment, disease activity, response to Alemtuzumab and additional treatment options. If the patient seems to be an Alemtuzumab-non-responder, alternative treatment strategies should be considered as eg. Fingolimod or B-cell depleting therapies.
In the clinical trials, 2.3 % resp. 7.6 % of the CARE-MS 1 resp. 2 patients have been treated with other MS treatments in the first 5 years after Alemtuzumab start. The majority of these 96 out of 1496 patients used baseline medication (interferon and GA), 10 % each were treated with Fingolimod and Natalizumab. Switching after Alemtuzumab to Interferon-beta or Glatiramer Acetate can be done quite quickly after the last Alemtuzumab infusion after excluding relevant lymphopenia especially for interferon treatment. There is not a lot of experience with the new oral medications Teriflunomide and Dimethylfumarate. Especially with Dimethylfurmarate, the previous immunosuppression with Alemtuzumab has to be considered. By switching to Natalizumab it should be kept in mind that Alemtuzumab leads to significant long-lasting changes in the adaptive immunity cells. As Alemtuzumab works as an immunosuppressive, changing to Natalizumab is associated with higher risk for PML development especially in patients with positive JCV antibodies. The better treatment option of highly active MS treatments which has already been used in our center is Fingolimod. Because of the individually very different prolonged effect of Alemtuzumab on the adaptive immunity, it is not possible to give a general waiting period after the last Alemtuzumab infusion. A complete immune status can be helpful including differential blood count, CD4+ T cells, CD8+ T cells, B cells, NK cells.
Alemtuzumabum (род. Alemtuzumabi)
Алемтузумаб представляет собой рекомбинантное гуманизированное IgG1 kappa (IgG1κ) моноклональное антитело по отношению к поверхностному клеточному гликопротеину CD52.
Алемтузумаб получают в суспензионной культуре клеток млекопитающих (клетки яичника китайского хомячка) в питательной среде, содержащей неомицин. Неомицин не обнаруживается в конечном продукте.
Молекулярная масса: ≈150 кДа.
Механизм действия
Точный механизм, посредством которого алемтузумаб оказывает терапевтическое действие при рассеянном склерозе, не до конца изучен, предположительно он может быть обусловлен связыванием с гликопротеинами CD52 — антигенами клеточной поверхности, присутствующими на Т- и В-лимфоцитах, а также на естественных клетках-киллерах, моноцитах и макрофагах. После связывания с клеточной поверхностью Т- и В-лимфоцитов алемтузумаб приводит к антителозависимому клеточному цитолизу и комплементопосредованному лизису.
Фармакодинамика
Влияние алемтузумаба на популяцию лимфоцитов. Применение алемтузумаба снижает количество циркулирующих Т- и В-лимфоцитов после каждого цикла терапии. В клинических исследованиях самое низкое количество клеток наблюдалось через 1 мес после цикла терапии, по результатам первого анализа крови после проведенного цикла терапии. Со временем количество лимфоцитов восстанавливалось: количество В-клеток обычно восстанавливалось в течение 6 мес; количество Т-клеток увеличивалось гораздо медленнее и обычно не восстанавливалось до исходных значений к 12-му мес после лечения. Приблизительно у 60% пациентов общее количество лимфоцитов было ниже НГН через 6 мес после каждого цикла терапии, а у 20% — ниже НГН через 12 мес.
Восстановление популяции лимфоцитов различно для лимфоцитов разных подтипов. В клинических исследованиях через 1 мес среднее количество CD4+ лимфоцитов составляло 40 клеток/мкл (мм3), а через 12 мес — 270 клеток/мкл (мм3). Через 30 мес приблизительно у половины пациентов количество CD4+ лимфоцитов оставалось ниже НГН.
Кардиоэлектрофизиология. В исследовании с участием 53 пациентов с рассеянным склерозом применение алемтузумаба в дозе 12 мг/сут в течение 5 дней не вызывало изменений интервала QTc более чем на 20 мс. Увеличение ЧСС в среднем на 22–26 уд./мин наблюдалось в течение по крайней мере 2 ч после первой, но не последующих инфузий.
Фармакокинетика
Фармакокинетику алемтузумаба оценивали у 148 пациентов с рецидивирующей формой рассеянного склероза, которые получали алемтузумаб в дозах 12 мг/сут в течение 5 последующих дней, а затем в дозе 12 мг/сут в течение 3 последующих дней через 12 мес после 1-го цикла терапии.
Всасывание. Концентрация алемтузумаба в сыворотке крови возрастала с введением каждой последующей дозы в течение цикла терапии, при этом Cmax наблюдалась после последней инфузии цикла терапии. Величина Cmax составляла 3014 нг/мл на 5-й день 1-го цикла терапии и 2276 нг/мл на 3-й день 2-го цикла терапии.
Распределение. Алемтузумаб в основном содержится в крови и интерстициальном пространстве с центральным Vd 14,1 л.
Выведение. T1/2 составлял приблизительно 2 нед, и его значения существенно не различались между первым и последующими циклами терапии. Концентрации в сыворотке крови в течение приблизительно 30 дней после каждого цикла терапии обычно были неопределяемыми (<60 нг/мл).
Особые группы пациентов
Возраст, расовая принадлежность или пол пациентов не оказывали влияния на фармакокинетику алемтузумаба.
Неклиническая токсикология
Канцерогенность, мутагенность, нарушение фертильности. Исследования по оценке канцерогенного или генотоксического потенциала алемтузумаба не проводились.
Алемтузумаб не оказывал влияния на фертильность или репродуктивную функцию при в/в введении в дозах 3 или 10 мг/кг huCD52-трансгенным самцам мышей в течение 5 последовательных дней до спаривания с нелечеными самками дикого типа. Однако неблагоприятное воздействие на параметры семенной жидкости (включая аномальную морфологию (отсоединение/отсутствие головки) и снижение общего количества и подвижности) наблюдалось при введении обеих исследуемых доз.
При в/в введении алемтузумаба в дозах 3 или 10 мг/кг huCD52-трансгенным самкам мышей в течение 5 последовательных дней до спаривания с нелечеными самцами дикого типа наблюдалось снижение среднего числа желтых тел и мест имплантации и увеличение постимплантационных потерь, приводящих к уменьшению количества жизнеспособных эмбрионов при применении более высокой исследуемой дозы.
Клинические исследования
Эффективность алемтузумаба (в дозе 12 мг) оценивалась в двух исследованиях (исследование 1 и 2), у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом (РРРС/RRMS). Алемтузумаб вводили путем в/в инфузии 1 раз в день в течение 5-дневного курса, а через 1 год — путем в/в инфузии 1 раз в день в течение 3-дневного курса. В оба исследования были включены пациенты, у которых было не менее 2 рецидивов в течение 2 лет до включения в исследования и не менее 1 рецидива в течение 1 года до включения в исследования. Неврологические осмотры проводились каждые 12 нед и при подозрении на рецидив. МРТ проводилась ежегодно.
Исследование 1. Исследование 1 представляло собой рандомизированное открытое слепое контролируемое сравнительное исследование (препарат сравнения — интерферон бета-1a в дозе 44 мкг, вводимый п/к 3 раза в неделю) продолжительностью 2 года у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом. Пациенты, принимавшие участие в исследовании 1, имели балл 5 или менее по расширенной шкале оценки состояния инвалидизации (Expanded Disability Status Scale — ЕDSS) и должны были испытать по крайней мере 1 рецидив во время терапии интерфероном бета или глатирамера ацетатом.
Пациенты были рандомизированы для получения алемтузумаба (n=426) или интерферона бета-1a (n=202). На момент начала исследования средний возраст пациентов составлял 35 лет, средняя продолжительность заболевания — 4,5 года, средний балл по EDSS — 2,7.
Критериями клинических исходов были годовая частота рецидивов (ARR — annualized relapse rate) в течение 2 лет и время до подтвержденного прогрессирования инвалидизации. Подтвержденное прогрессирование инвалидизации определялось как увеличение по крайней мере на 1 балл по сравнению с баллом на исходном уровне по EDSS (увеличение на 1,5 балла для пациентов с баллом 0 по EDSS на исходном уровне), сохраняющееся в течение 6 мес. Показателем результата МРТ было изменение объема поражения при Т2-взвешенной визуализации.
Годовая частота рецидивов была значительно ниже у пациентов, получавших алемтузумаб, по сравнению с пациентами, получавшими интерферон бета-1a. Время до наступления 6-месячного подтвержденного прогрессирования инвалидизации было значительно отсрочено при лечении алемтузумабом по сравнению с интерфероном бета-1a. По изменению объема поражения Т2 существенной разницы между группами лечения не наблюдалось. Результаты исследования 1 представлены в таблице 1.
Таблица 1
Клинические исходы (показатели) и результаты МРТ в исследовании 1
| Алемтузумаб (n = 426) | Интерферон бета-1a, 44 мкг (n = 202) | Значение p | |
| Клинические показатели | |||
| Годовая частота рецидивов | 0,26 | 0,52 | <0,0001 |
| Относительное снижение | 49% | ||
| Процент пациентов с прогрессированием инвалидизации на 2-м году | 13% | 21% | 0,0084 |
| Снижение относительного риска | 42% | ||
| Процент пациентов без рецидивов на 2-м году | 65% | 47% | <0,0001 |
| Результаты МРТ | |||
| Процентное изменение объема поражения Т2 по сравнению с исходным уровнем | −1,3 | −1,2 | 0,14 |
Исследование 2. Исследование 2 представляло собой рандомизированное открытое слепое контролируемое сравнительное исследование (препарат сравнения интерферон бета-1a в дозе 44 мкг, вводимый п/к 3 раза в неделю) продолжительностью 2 года у пациентов с рецидивирующе-ремиттирующим рассеянным склерозом. Пациенты, принимавшие участие в исследовании 2, имели балл 3 или менее по EDSS и ранее не получали лечения рассеянного склероза.
Пациенты были рандомизированы для получения алемтузумаба (n=376) или интерферона бета-1a (n=187). На момент начала исследования (исходном уровне) средний возраст пациентов составлял 33 года, средняя продолжительность заболевания — 2 года, средний балл по EDSS — 2.
Критериями (показателями) клинических исходов были годовая частота рецидивов (ARR) в течение 2 лет и время до подтвержденного прогрессирования инвалидизации, как определено в исследовании 1. Показателем результата МРТ было изменение объема поражения Т2.
Годовая частота рецидивов была значительно ниже у пациентов, получавших алемтузумаб, по сравнению с пациентами, получавшими интерферон бета-1a. Значимых различий между группами лечения по времени до подтверждения прогрессирования инвалидизации и по первичной конечной точке МРТ (изменение объема поражения Т2) не наблюдалось. Результаты исследования 2 представлены в таблице 2.
Таблица 2
Клинические показатели и результаты МРТ в исследовании 2
| Показатели | Алемтузумаб (n=376) | Интерферон бета-1a,44 мкг (n=187) | Значение p |
| Клинические исходы (показатели) | |||
| Годовая частота рецидивов | 0,18 | 0,39 | <0,0001 |
| Относительное снижение | 55% | ||
| Процент пациентов с прогрессированием инвалидизации на 2-м году | 8% | 11% | 0,22 |
| Снижение относительного риска | 30% | ||
| Процент пациентов без рецидивов на 2-м году | 78% | 59% | <0,0001 |
| Результаты МРТ | |||
| Процентное изменение объема поражения Т2 по сравнению с исходным уровнем | −9,3 | −6,5 | 0,31 |
Алемтузумаб показан для лечения рецидивирующих форм рассеянного склероза, включая рецидивирующе-ремиттирующую и активную вторично-прогрессирующую форму течения заболевания у взрослых.
Учитывая профиль безопасности, алемтузумаб следует применять только у пациентов с неадекватным ответом на терапию двумя или более ЛС, предназначенными для лечения рассеянного склероза (см. «Меры предосторожности»).
Применение алемтузумаба противопоказано пациентам:
— с подтвержденной повышенной чувствительностью или анафилактическими реакциями на алемтузумаб;
— ВИЧ-инфицированным, поскольку алемтузумаб вызывает длительное снижение количества CD4+ лимфоцитов;
— с активной инфекцией.
На основании данных профиля безопасности алемтузумаб не рекомендуется для применения у пациентов с клинически изолированным синдромом (см. «Меры предосторожности»).
Беременность
Краткий обзор рисков (обзор профиля безопасности). Адекватные данные о риске для развития эмбриона/плода, связанном с применением алемтузумаба у беременных женщин, отсутствуют. При введении алемтузумаба беременным huCD52-трансгенным мышам в период органогенеза наблюдалась эмбриолетальность (см. Данные, полученные на животных). При применении алемтузумаба могут появиться аутоантитела. Сообщалось о передаче через плаценту антител к рецептору ТТГ (антитиреоидных антител), приводящей к болезни Грейвса у новорожденных.
В общей совокупности населения США фоновый риск серьезных врожденных пороков развития и выкидыша при клинически подтвержденной беременности составляет 2–4% и 15–20% соответственно. Фоновый риск серьезных врожденных пороков развития и выкидыша для указанной популяции неизвестен.
Клиническая значимость. Применение алемтузумаба вызывает стойкие нарушения функции щитовидной железы (см. «Меры предосторожности»). При отсутствии лечения гипотиреоза у беременных женщин повышается риск невынашивания беременности (выкидыша) и негативного влияния на плод, включая задержку умственного развития и карликовость. У матерей с болезнью Грейвса материнские антитела к рецепторам ТТГ могут передаваться развивающемуся плоду и вызывать у новорожденных болезнь Грейвса. У пациентки, у которой болезнь Грейвса развилась после лечения алемтузумабом, трансплацентарная передача антител к рецепторам ТТГ привела к неонатальной болезни Грейвса с тиреотоксическим кризом у ребенка, который родился через 1 год после введения алемтузумаба (см. «Меры предосторожности»).
Данные, полученные на животных. При в/в введении алемтузумаба беременным huCD52-трансгенным мышам в период органогенеза (с 6-го по 10-й или с 11-го по 15-й день беременности ) в дозах 3 или 10 мг/кг тератогенных эффектов не наблюдалось. Однако у беременных животных, получавших алемтузумаб с 11-го по 15-й день беременности, наблюдалось повышение эмбриолетальности (увеличение постимплантационных потерь и количества самок, у которых произошла гибель или резорбция всех плодов). В отдельном исследовании, проведенном на беременных huCD52-трансгенных мышах, при в/в введении алемтузумаба в период органогенеза (с 6-го по 10-й или с 11-го по 15-й день беременности) в дозах 3 или 10 мг/кг у потомства наблюдалось снижение популяций В- и Т-лимфоцитов при применении обеих исследуемых доз.
У беременных huCD52-трансгенных мышей, которым алемтузумаб вводили в/в в дозах 3 или 10 мг/кг/сут на протяжении всего периода беременности и лактации, наблюдалось увеличение смертности детенышей (потомства) в период лактации при дозе 10 мг/кг. Снижение популяций Т- и В-лимфоцитов и гуморальный иммунный ответ (гуморальная иммунная реакция, образование антител) наблюдались у потомства при применении обеих исследуемых доз.
Период грудного вскармливания
Краткий обзор рисков. Данные о присутствии алемтузумаба в грудном молоке у женщин, воздействии на ребенка, находящегося на грудном вскармливании, или влиянии на выработку молока, отсутствуют. Алемтузумаб обнаруживался в молоке кормящих huCD52-трансгенных мышей (см. Данные, полученные на животных).
Пользу грудного вскармливания для развития и здоровья ребенка следует учитывать наряду с клинической потребностью матери в алемтузумабе и любыми потенциальными неблагоприятными воздействиями алемтузумаба или основного заболевания матери на ребенка, находящегося на грудном вскармливании.
Данные, полученные на животных. Алемтузумаб обнаруживался в молоке кормящих huCD52-трансгенных мышей, которым вещество вводили в/в в дозе 10 мг/кг с 8-го по 12-й день после родов. Концентрации алемтузумаба в сыворотке крови были сходными у кормящих мышей и потомства на 13-й день после родов и связаны с признаками фармакологической активности (снижение количества лимфоцитов) у потомства.
Женщины и мужчины с сохраненным репродуктивным потенциалом
Контрацепция. Перед началом лечения алемтузумабом женщин с сохраненным репродуктивным потенциалом следует проинформировать о возможности серьезного риска для плода. Чтобы избежать внутриутробного воздействия алемтузумаба, женщинам с сохраненным репродуктивным потенциалом следует использовать эффективные методы/средства контрацепции во время прохождения цикла терапии алемтузумабом и в течение 4 мес после его завершения.
Бесплодие. У huCD52-трансгенных мышей введение алемтузумаба до и во время периода спаривания приводило к негативному влиянию на параметры семенной жидкости у самцов и снижению числа желтых тел и имплантаций у самок (см. Неклиническая токсикология).
Следующие серьезные нежелательные явления описаны в разделе «Меры предосторожности»:
— аутоиммунные заболевания;
— инфузионные реакции;
— инсульт и расслоение церебральных артерий;
— злокачественные новообразования;
— иммунная тромбоцитопеническая пурпура;
— гломерулярная нефропатия, включая болезнь с образованием антител к базальной мембране клубочков (анти-ГМБ-болезнь — гломерулонефрит, обусловленный антителами к гломерулярной базальной мембране);
— нарушения функции щитовидной железы;
— другие аутоиммунные цитопении;
— аутоиммунный гепатит;
— гемофагоцитарный лимфогистиоцитоз;
— приобретенная гемофилия A;
— инфекционные заболевания;
— прогрессирующая мультифокальная (многоочаговая) лейкоэнцефалопатия;
— острый некалькулезный холецистит;
— пневмонит.
Данные клинических исследований
Поскольку клинические исследования проводятся в самых разных условиях, частота нежелательных явлений, наблюдаемая в клинических исследованиях одного ЛС, не может быть напрямую сопоставлена с частотой в клинических исследованиях другого ЛС и может не отражать частоту, наблюдаемую на практике.
В общей сложности 811 пациентов с рецидивирующими формами течения рассеянного склероза получали алемтузумаб в контролируемых клинических исследованиях (исследование 1 и исследование 2). Возраст пациентов составлял от 18 до 55 лет, 65% пациентов составляли женщины, 92% пациентов являлись представителями европеоидной расы. В общей сложности 811 пациентов получили 1-й цикл терапии, а 789 пациентов получили 2-й цикл терапии через 12 мес. Общий период последующего наблюдения в контролируемых исследованиях составлял 1622 пациенто-лет.
В клинических исследованиях рассеянного склероза (контролируемых и открытых расширенных) в общей сложности 1217 пациентов получали алемтузумаб. Приблизительно 60% пациентов получили в общей сложности 2 цикла терапии и приблизительно 24% пациентов получили в общей сложности 3 цикла терапии; другие пациенты получили в общей сложности 4 или более циклов терапии, хотя данные о пациентах, получивших более 3 циклов терапии, ограничены. Общий период последующего наблюдения составлял 6858 пациенто-лет. Медиана наблюдения за пациентами составляла 6 лет с момента введения первой дозы алемтузумаба, при этом приблизительно 14% пациентов наблюдались не менее 7 лет.
Наиболее распространенные побочные эффекты
В контролируемых клинических исследованиях наиболее часто возникающими побочными эффектами при применении алемтузумаба (по крайней мере у 10% пациентов и чаще, чем при применении интерферона бета-1a) были кожная сыпь, головная боль, пирексия, назофарингит, тошнота, инфекции мочевыводящих путей, повышенная утомляемость, бессонница, инфекции верхних дыхательных путей, инфекции, вызванные вирусом герпеса, крапивница, зуд, нарушения функции щитовидной железы, грибковые инфекции, артралгия, боль в конечностях, боль в спине, диарея, синусит, орофарингеальная боль, парестезия, головокружение, абдоминальная боль, приливы крови/жара к лицу и рвота.
В таблице 3 перечислены побочные эффекты, о которых сообщалось у ≥5% пациентов, получавших алемтузумаб в исследованиях 1 и 2, с той же или более высокой частотой, чем при применении интерферона бета-1a.
Таблица 3
Побочные эффекты по результатам объединенных контролируемых препаратом сравнения с активной субстанцией исследований продолжительностью 2 года у пациентов с рецидивирующе-ремиттирующей формой течения рассеянного склероза
| Побочные эффекты | Алемтузумаб (n=811)% | Интерферон бета-1a 44 мкг (n=389)% |
| Кожная сыпь | 53 | 6 |
| Головная боль | 52 | 23 |
| Пирексия | 29 | 9 |
| Назофарингит | 25 | 19 |
| Тошнота | 21 | 9 |
| Инфекции мочевыводящих путей | 19 | 8 |
| Повышенная утомляемость | 18 | 13 |
| Бессонница | 16 | 15 |
| Инфекции верхних дыхательных путей | 16 | 13 |
| Инфекции, вызванные вирусом герпеса | 16 | 3 |
| Крапивница | 16 | 2 |
| Зуд | 14 | 2 |
| Нарушения функции щитовидной железы | 13 | 3 |
| Грибковые инфекции | 13 | 4 |
| Атралгия | 12 | 9 |
| Боль в конечностях | 12 | 9 |
| Боль в спине | 12 | 8 |
| Диарея | 12 | 6 |
| Синусит | 11 | 8 |
| Орофарингеальная боль | 11 | 5 |
| Парестезия | 10 | 8 |
| Головокружение | 10 | 5 |
| Абдоминальная боль | 10 | 5 |
| Приливы крови/жара к лицу | 10 | 4 |
| Рвота | 10 | 3 |
| Кашель | 9 | 4 |
| Озноб | 9 | 3 |
| Дисгевзия | 8 | 7 |
| Грипп | 8 | 6 |
| Дерматит | 8 | 5 |
| Диспепсия | 8 | 4 |
| Наличие крови в моче | 8 | 3 |
| Одышка | 8 | 1 |
| Тахикардия | 8 | 1 |
| Тревожность | 7 | 6 |
| Мышечная слабость | 7 | 6 |
| Бронхит | 7 | 4 |
| Дискомфорт в грудной клетке | 7 | 2 |
| Мышечные спазмы | 6 | 5 |
| Миалгия | 6 | 5 |
| Снижение количества лимфоцитов CD4+ | 6 | 2 |
| Снижение количества лимфоцитов CD8+ | 6 | 2 |
| Астения | 5 | 4 |
| Снижение количества Т-лимфоцитов | 5 | 3 |
| Эритема | 5 | 2 |
| Периферические отеки | 5 | 2 |
| Носовое кровотечение | 5 | 2 |
| Боль в шее | 5 | 2 |
| Аномальное маточное кровотечение | 5 | 1 |
Лимфопения
Практически у всех (99,9%) пациентов, получавших алемтузумаб в клинических исследованиях рассеянного склероза, наблюдалась лимфопения. Самое низкое количество лимфоцитов наблюдалось приблизительно через 1 мес после каждого цикла терапии. Среднее количество лимфоцитов через 1 мес после 1-го и 2-го циклов терапии алемтузумабом составляло 0,25·109/л (диапазон: 0,02–2,30·109/л) и 0,32·109/л (диапазон: 0,02–1,81·109/л) соответственно. Общее количество лимфоцитов увеличивалось и достигало НГН через 6 мес после каждого цикла терапии алемтузумабом приблизительно у 40% пациентов и через 12 мес после каждого цикла терапии приблизительно у 80% пациентов (см. «Фармакология»).
Суицидальные мысли или суицидальное поведение
В клинических исследованиях у 0,6% пациентов в группах лечения алемтузумабом и интерфероном бета-1a наблюдались случаи возникновения суицидальных мыслей или попыток самоубийства. Ни в одной из групп лечения в клинических исследованиях не было завершенных самоубийств. Суицидальное поведение или суицидальные мысли наблюдались у пациентов как с психическими расстройствами или нарушениями функции щитовидной железы в анамнезе, так и без них. Пациентам следует немедленно сообщать лечащему врачу о любых симптомах депрессии или случаях возникновения суицидальных мыслей.
Иммуногенность
Как и любые другие ЛС белкового происхождения (белковые терапевтические ЛС), алемтузумаб обладает потенциальной иммуногенностью. Частота выявления антител в значительной степени зависит от чувствительности и специфичности используемого метода анализа. Кроме того, наблюдаемая частота положительного результата анализа на антитела (включая ингибирующие антитела) может зависеть от целого ряда факторов, включая методику анализа и обработки образцов, время забора образцов, применение сопутствующих ЛС и основное заболевание. По этим причинам сравнение частоты выявления антител к алемтузумабу с частотой выявления антител к другим ЛС может быть ошибочным.
С помощью ферментсвязанного иммуносорбентного исследования и анализа конкурентного связывания, связывающие антитела к алемтузумабу были обнаружены у 62, 67 и 29% пациентов, получавших лечение алемтузумабом, на 1, 3 и 12-м мес 1-го цикла терапии, и у 83, 83 и 75% пациентов, получавших лечение алемтузумабом, на 13, 15 и 24-м мес 2-го цикла терапии. Образцы, которые дали положительный результат на связывающие антитела, дополнительно оценивали на наличие признаков ингибирования in vitro методом проточной цитофлуориметрии (проточной цитометрии). Нейтрализующие антитела были обнаружены у 87, 46 и 5% пациентов с положительным результатом на связывающие антитела на 1, 3 и 12-м мес 1-го цикла терапии и у 94, 88 и 42% пациентов с положительным результатом на связывающие антитела на 13, 15 и 24-м мес 2-го цикла терапии. Антитела к алемтузумабу приводили к снижению концентрации алемтузумаба в течение 2-го, но не 1-го цикла терапии. По результатам 2 циклов терапии, в клинических исследованиях не было получено доказательств того, что наличие связывающих или ингибирующих антител к алемтузумабу оказывает значительное влияние на клинические результаты, общее количество лимфоцитов или возникновение побочных эффектов. Высокие титры антител к алемтузумабу, которые наблюдались у 13 пациентов, были связаны с неполным исчезновением лимфоцитов после 3-го или 4-го циклов терапии, однако явного влияния наличия антител к алемтузумабу на клиническую эффективность или профиль безопасности алемтузумаба не наблюдалось.
Данные пострегистрационного применения
В ходе пострегистрационного периода применения алемтузумаба были выявлены следующие побочные эффекты. Поскольку информация об этих побочных эффектов поступает из спонтанных сообщений от популяции неопределенного размера, нет возможности достоверно оценить частоту их возникновения или установить причинно-следственную связь с воздействием алемтузумаба.
Со стороны крови и лимфатической системы: приобретенная гемофилия A (см. «Меры предосторожности»), нейтропения, тромбоцитопения.
Со стороны мозгового кровообращения: инсульт, включая геморрагический и ишемический и расслоение церебральных артерий (см. «Меры предосторожности»).
Со стороны ЖКТ: холецистит, включая некалькулезный и острый некалькулезный (см. «Меры предосторожности»).
Со стороны печени и желчевыводящих путей: аутоиммунный гепатит, вирусный гепатит (см. «Меры предосторожности»).
Инфекции и инвазии: оппортунистические инфекции, прогрессирующая многоочаговая лейкоэнцефалопатия (см. «Меры предосторожности»).
Со стороны иммунной системы: аутоиммунный гепатит, васкулит, синдром Гийена-Барре, гемофагоцитарный лимфогистиоцитоз (см. «Меры предосторожности»), саркоидоз.
Со стороны дыхательной системы: легочно-альвеолярное кровоизлияние (см. «Меры предосторожности»).
Информация не предоставлена.
После однократной случайной инфузии алемтузумаба в дозе 60 мг у двух пациентов с рассеянным склерозом наблюдались серьезные побочные эффекты (головная боль, кожная сыпь и артериальная гипотензия или синусовая тахикардия). Дозы алемтузумаба, превышающие рекомендуемые, могут увеличить интенсивность и/или продолжительность инфузионных реакций или усилить воздействие на иммунную систему.
Антидот при передозировке алемтузумаба неизвестен.
Рекомендуемая доза алемтузумаба составляет 12 мг/сут, вводимых путем в/в инфузии.
Лечебный курс включает 2 цикла терапии.
1-й цикл терапии: 12 мг/сут в течение 5 последовательных дней (общая доза — 60 мг).
2-й цикл терапии: 12 мг/сут в течение 3 последовательных дней (общая доза — 36 мг); проводят через 12 мес после 1-го цикла терапии.
Дополнительные циклы терапии (после завершения 2-го цикла) алемтузумабом можно проводить по мере необходимости в дозе 12 мг/сут в течение 3 последовательных дней (общая доза 36 мг), но не ранее чем через 12 мес после введения последней дозы любого из предыдущих циклов терапии.
Аутоиммунные заболевания
Терапия алемтузумабом может привести к образованию аутоантител и повысить риск развития серьезных аутоиммунных опосредованных состояний, которые могут представлять опасность для жизни.
В клинических исследованиях (контролируемых и открытых расширенных) у пациентов, получавших алемтузумаб, наблюдались нарушения функции щитовидной железы (36,8%), иммунная тромбоцитопеническая пурпура (2%) и гломерулярная нефропатия (0,3%). Витилиго и аутоиммунная гемолитическая анемия наблюдались у 0,3% пациентов. Аутоиммунная панцитопения, недифференцированные заболевания соединительной ткани и диабет типа 1 возникали у 0,2% пациентов (для каждого типа заболевания). Ревматоидный артрит, пигментная эпителиопатия сетчатки и приобретенная гемофилия A (антитела к фактору VIII) наблюдались у 0,1% пациентов. В ходе пострегистрационного периода применения алемтузумаба сообщалось о случаях васкулита, аутоиммунного гепатита и синдрома Гийена-Барре (см. «Побочные действия»).
При лечении пациентов с В-клеточным хроническим лимфолейкозом, а также с другими аутоиммунными заболеваниями, сообщалось о хронической воспалительной демиелинизирующей полинейропатии, как правило, при применении алемтузумаба в более высоких и частых дозах, чем рекомендовано при рассеянном склерозе.
У онкологического пациента, получавшего алемтузумаб, развилась фатальная трансфузионноассоциированная реакция «трансплантат против хозяина».
Аутоантитела могут передаваться от матери к плоду во время беременности. После лечения беременной женщины алемтузумабом произошел случай передачи через плаценту антител к рецептору ТТГ, который привел к болезни Грейвса у новорожденного (см. «Применение при беременности и кормлении грудью»).
Применение алемтузумаба может повысить риск развития других аутоиммунных заболеваний из-за широкого спектра образования аутоантител при его применении.
Следует определять соотношение белка в моче к креатинину в сыворотке крови до начала лечения алемтузумабом. Контроль показателей общего анализа крови с подсчетом лейкоцитарной формулы, уровня креатинина в сыворотке крови и показателей клинического анализа мочи с микроскопией осадка (с подсчетом количества клеток) следует проводить до начала лечения алемтузумабом и затем ежемесячно в течение 48 мес после введения последней дозы алемтузумаба, чтобы обеспечить раннее выявление и лечение аутоиммунных нежелательных явлений. После окончания 48-месячного периода следует провести тестирование на основании клинических данных, свидетельствующих об аутоиммунных заболеваниях.
Инфузионные реакции
Применение алемтузумаба вызывает синдром высвобождения цитокинов, что приводит к инфузионным реакциям, некоторые из которых могут быть серьезными и опасными для жизни.
В клинических исследованиях у 92% пациентов, получавших алемтузумаб, наблюдались инфузионные реакции. У некоторых пациентов инфузионные реакции отмечались более чем через 24 ч после инфузии алемтузумаба. Серьезные реакции возникли у 3% пациентов и включали анафилаксию у 2 пациентов (включая анафилактический шок), ангионевротический отек, бронхоспазм, артериальную гипотензию, боль в груди, брадикардию, тахикардию (включая мерцательную аритмию), преходящие неврологические симптомы, АГ, головную боль, пирексию и кожную сыпь. Другие инфузионные реакции включали тошноту, крапивницу, зуд, бессонницу, озноб, приливы жара/крови к лицу, повышенную утомляемость, одышку, легочные инфильтраты, дисгевзию, диспепсию, головокружение и боль. В клинических исследованиях 0,6% пациентов с инфузионными реакциями получали эпинефрин или атропин.
В ходе пострегистрационного применения алемтузумаба сообщалось о случаях легочно-альвеолярного кровоизлияния (кровотечения), ишемии миокарда, инфаркта миокарда, инсульта (включая ишемический и геморрагический) и диссекции (расслоения) церебральных (например, позвоночных, сонных) артерий. Реакции могут возникать после введения любой из доз в течение цикла терапии. В большинстве случаев время до появления реакций находилось в пределах 1–3 дней после инфузии алемтузумаба. Пациентов следует проинформировать о признаках и симптомах и рекомендовать незамедлительно обращаться за медицинской помощью при появлении любого из данных симптомов.
Сообщалось о случаях развития нейтропении тяжелой степени (в т.ч. фатальной ) в течение 2 мес после инфузии алемтузумаба; некоторые случаи разрешились после проведения терапии гранулоцитарным колониестимулирующим фактором. Сообщалось о легкой или средней степени тяжести снижении количества тромбоцитов, которое начиналось во время инфузии алемтузумаба и часто разрешалось без дополнительного лечения.
Другие серьезные и иногда фатальные инфузионные реакции (например, гипоксия, обморок, острый респираторный дистресс-синдром, остановка дыхания, инфаркт миокарда, острая сердечная недостаточность, остановка сердца) были зарегистрированы при лечении пациентов с В-клеточным хроническим лимфолейкозом, а также с другими заболеваниями, как правило, при применении алемтузумаба в более высоких и частых дозах, чем рекомендовано при рассеянном склерозе.
Рекомендуется проводить премедикацию кортикостероидами непосредственно перед инфузией алемтузумаба в течение первых 3 дней каждого цикла терапии. В клинических исследованиях пациенты получали метилпреднизолон в дозе 1000 мг в течение первых 3 дней каждого цикла терапии алемтузумабом. Перед введением алемтузумаба рекомендуется проводить предварительное лечение антигистаминными и/или жаропонижающими ЛС. Однако проведение предварительного лечения не исключает развития инфузионных реакций.
Следует рассмотреть возможность дополнительного мониторинга пациентов с заболеваниями (медицинскими состояниями), предрасполагающими к сердечно-сосудистым или легочным осложнениям. Следует проинформировать пациентов о том, что инфузионная реакция может возникнуть в течение 48 ч после инфузии.
Введение алемтузумаба следует проводить только в сертифицированных медицинских учреждениях, имеющих обученный персонал и доступ к оборудованию и средствам для лечения инфузионных реакций (включая анафилаксию, цереброваскулярные, сердечные и респираторные неотложные состояния).
Инсульт и диссекция церебральных артерий
Инсульт. В ходе пострегистрационного применения сообщалось о серьезных и жизнеугрожающих инсультах (включая ишемический и геморрагический) в течение 3 дней после введения алемтузумаба, причем большинство случаев происходило в течение 1 дня.
Диссекция церебральных артерий. В ходе пострегистрационного применения сообщалось о случаях расслоения церебральных (например, позвоночных, сонных) артерий с поражением нескольких артерий в течение 3 дней после введения алемтузумаба. В одном из таких случаев был зарегистрирован ишемический инсульт.
Следует проинформировать пациентов о симптомах инсульта и диссекции церебральных (например, позвоночных, сонных) артерий и о необходимости незамедлительного обращения за медицинской помощью при появлении данных симптомов.
Злокачественные новообразования
Рак щитовидной железы. Применение алемтузумаба может повышать риск развития рака щитовидной железы. В контролируемых клинических исследованиях у 3 из 919 (0,3%) пациентов, получавших алемтузумаб, развился рак щитовидной железы, в то время как в группе лечения интерфероном бета-1a такого явления не наблюдалось. Однако скрининг на рак щитовидной железы проводился чаще в группе лечения алемтузумабом в связи с более высокой частотой развития аутоиммунных заболеваний щитовидной железы у таких пациентов. Два дополнительных случая развития рака щитовидной железы у пациентов, получавших алемтузумаб, были зарегистрированы в неконтролируемых (несравнительных) исследованиях.
Пациентам и медицинским работникам необходимо следить за симптомами рака щитовидной железы, включая новые уплотнения или припухлость на шее, боль в передней части шеи, постоянную охриплость или другие изменения голоса, затрудненное глотание или дыхание, или постоянный кашель, не связанный с инфекцией верхних дыхательных путей.
Меланома. Применение алемтузумаба может повышать риск развития меланомы. В клинических исследованиях рассеянного склероза (контролируемых и открытых расширенных) у 5 из 1486 (0,3%) пациентов, принимавших алемтузумаб, развилась меланома или меланома in situ. У одного из данных пациентов наблюдались признаки местнораспространенного заболевания.
Пациентам, получающим алемтузумаб, следует проводить осмотр кожи для мониторинга меланомы в начале и ежегодно в течение курса лечения алемтузумабом.
Лимфопролиферативные заболевания и лимфома. У пациентов с рассеянным склерозом, получавших лечение алемтузумабом, наблюдались случаи лимфопролиферативных заболеваний (нарушений) и лимфомы, включая MALT-лимфому (Mucosa-Associated Lymphoid Tissue), болезнь Кастлемана и летальный исход после лечения лимфомы Беркитта, не связанной с вирусом Эпштейна-Барра. В период пострегистрационного применения сообщалось о лимфопролиферативных заболеваниях, связанных с вирусом Эпштейна-Барра, у пациентов без рассеянного склероза.
Поскольку алемтузумаб оказывает иммуномодулирующее действие, следует также соблюдать осторожность при его назначении пациентам с предшествующими или текущими злокачественными новообразованиями.
Иммунная тромбоцитопеническая пурпура. Иммунная тромбоцитопеническая пурпура наблюдалась в клинических исследованиях рассеянного склероза (контролируемых и открытых расширенных) у 2% пациентов, получавших алемтузумаб.
В контролируемом клиническом исследовании у пациентов с рассеянным склерозом у 1 пациента, получавшего алемтузумаб, развилась иммунная тромбоцитопеническая пурпура, которая не была вовремя диагностирована, т.к. случай произошел до введения требований обязательного ежемесячного контроля клинического анализа крови; пациент умер от внутричерепного кровоизлияния. Надир количества тромбоцитов ≤20000 клеток/мкл (мм3) в результате иммунной тромбоцитопенической пурпуры наблюдался у 2% всех пациентов, получавших лечение алемтузумабом в клинических исследованиях рассеянного склероза. Наличие антитромбоцитарных антител не предшествовало возникновению иммунной тромбоцитопенической пурпуры. Случай иммунной тромбоцитопенической пурпуры был диагностирован более чем через 3 года после введения последней дозы алемтузумаба.
Симптомы иммунной тромбоцитопенической пурпуры включают легко возникающие кожные кровоизлияния, петехии, спонтанные кожно-слизистые кровотечения (например, носовое кровотечение, кровохарканье), более обильные, чем обычно, или нерегулярные менструальные кровотечения. Кровохарканье также может быть проявлением болезни с образованием антител к базальной мембране клубочков, поэтому следует проводить соответствующую дифференциальную диагностику. Пациента следует проинформировать о возможности возникновения данных симптомов и рекомендовать незамедлительно обращаться за медицинской помощью в случае любых сомнений/опасений.
Общий клинический анализ крови с подсчетом форменных элементов следует проводить до начала лечения, и затем ежемесячно в течение 48 мес после последней инфузии. После окончания данного периода анализы следует проводить на основании клинических данных, свидетельствующих о наличии иммунной тромбоцитопенической пурпуры. При подозрении на иммунную тромбоцитопеническую пурпуру следует немедленно провести расширенный клинический анализ крови. При подтверждении диагноза следует незамедлительно принять соответствующие меры.
Гломерулярная нефропатия, включая болезнь с образованием антител к базальной мембране клубочков (анти-ГМБ-болезнь — гломерулонефрит, обусловленный антителами к гломерулярной базальной мембране)
Гломерулярные нефропатии возникли у 0,3% пациентов, получавших алемтузумаб в клинических исследованиях рассеянного склероза. Было зарегистрировано 3 случая мембранозного гломерулонефрита и 2 случая анти-ГБМ-болезни.
В пострегистрационный период применения у некоторых пациентов с анти-ГБМ-болезнью, получавших алемтузумаб, сообщалось о случаях развития терминальной стадии почечной недостаточности, требующей проведения диализа или трансплантации почки. Необходимо срочное проведение обследования и лечения, поскольку своевременная диагностика и раннее лечение могут помочь сохранить функцию почек. При отсутствии лечения анти-ГБМ-болезни может возникнуть угроза для жизни. Альвеолярное кровоизлияние, проявляющееся кровохарканьем, является распространенным проявлением анти-ГБМ-болезни, о котором сообщалось в пострегистрационный период применения алемтузумаба. Случаи анти-ГБМ-болезни были диагностированы спустя 40 мес после последней инфузии алемтузумаба.
Симптомы нефропатии могут включать отеки, гематурию, изменение цвета мочи, снижение диуреза, повышенную утомляемость, одышку и кровохарканье. Пациенты и лица, осуществляющие уход, должны быть проинструктированы о необходимости обращения за медицинской помощью в случае возникновения таких симптомов.
Перед началом лечения необходимо определить уровень креатинина в сыворотке крови, провести клинический анализ мочи с микроскопией осадка (с подсчетом количества клеток) и определить соотношение белка в моче к креатинину. Определение уровня креатинина в сыворотке крови и контроль показателей клинического анализа мочи с микроскопией осадка (с подсчетом клеток) следует проводить ежемесячно в течение 48 мес после последней инфузии алемтузумаба. После окончания данного периода анализы следует проводить на основании клинических данных, свидетельствующих о наличии нефропатии.
При результатах анализа мочи, проведенного с помощью тест-полоски, с уровнем белка 1+ или более, следует определить соотношение белка в моче к креатинину. При соотношении белка в моче к креатинину более 200 мг/г, повышении уровня креатинина в сыворотке крови более чем на 30% или необъяснимой гематурии необходимо провести дальнейшее обследование на наличие нефропатий. Повышенный уровень креатинина в сыворотке крови с гематурией или признаками поражения легких при анти-ГБМ-болезни (например, кровохарканье, одышка при физической нагрузке) требуют немедленной оценки. Раннее диагностирование и лечение нефропатий может снизить риск неблагоприятных исходов.
Нарушения функции щитовидной железы
Эндокринные нарушения функции щитовидной железы, включая аутоиммунные заболевания щитовидной железы, наблюдались у 36,8% пациентов, получавших алемтузумаб в клинических исследованиях (контролируемых и открытых расширенных) рассеянного склероза. Впервые диагностированные заболевания щитовидной железы возникали на протяжении всего периода наблюдения за пациентами в неконтролируемых (несравнительных) клинических исследованиях, более чем через 7 лет после введения первой первой дозы алемтузумаба. Аутоиммунные заболевания щитовидной железы включали болезнь Грейвса, гипертиреоз, гипотиреоз, аутоиммунный тиреоидит и зоб. Эндокринная офтальмопатия (офтальмопатия Грейвса) со снижением зрения, болью в глазах и экзофтальмом наблюдалась у 2% пациентов, получавших алемтузумаб. Хирургическая декомпрессия орбиты потребовалась 7% пациентов. Серьезные нарушения со стороны щитовидной железы наблюдались приблизительно у 5,2% пациентов, получавших алемтузумаб в клинических исследованиях, и включали кардиальные события и нарушения со стороны психики, связанные с заболеванием щитовидной железы. Из всех пациентов, получавших алемтузумаб, 3,8% пациентов подверглись тиреоидэктомии.
Заболевания щитовидной железы представляют особый риск для беременных женщин (см. «Применение при беременности и кормлении грудью»).
Исследования функции щитовидной железы, такое как контроль уровня ТТГ, следует проводить до начала лечения и затем каждые 3 мес в течение 48 мес после последней инфузии алемтузумаба. По окончании этого периода анализы выполняются на основании клинических показаний или в случае беременности.
Пациентам с текущими заболеваниями щитовидной железы алемтузумаб следует назначать только в том случае, если ожидаемая польза превышает потенциальный риск.
Другие аутоиммунные цитопении
Аутоиммунные цитопении, такие как нейтропения (0,1%), гемолитическая анемия (0,3%) и панцитопения (0,2%), возникали в клинических исследованиях (контролируемых и открытых расширенных) у пациентов, получавших алемтузумаб. В случаях аутоиммунной гемолитической анемии пациенты давали положительный результат на прямые антиглобулиновые антитела, а надир уровня гемоглобина варьировал от 2,9 до 8,6 г/дл. Симптомы аутоиммунной гемолитической анемии включают слабость, боль в груди, желтуху, темную мочу и тахикардию. Один пациент с аутоиммунной панцитопенией, получавший алемтузумаб, умер от сепсиса.
В ходе пострегистрационного применения алемтузумаба сообщалось о дополнительных аутоиммунных цитопениях, включая фатальную аутоиммунную гемолитическую анемию и апластическую анемию, при лечении пациентов с В-клеточным лимфоцитарным лейкозом, а также с другими заболеваниями, как правило, при применении алемтузумаба в более высоких и частых дозах, чем рекомендовано при рассеянном склерозе.
Для мониторинга цитопении следует использовать результаты общего анализа крови. При подтверждении цитопении необходимо оперативное (немедленное) медицинское вмешательство.
Аутоиммунный гепатит
В пострегистрационный период применения сообщалось о случаях аутоиммунного гепатита, вызывающего клинически значимое поражение печени, включая острую печеночную недостаточность, требующую трансплантации, у пациентов, получавших алемтузумаб. Если у пациента появляются клинические признаки, включая необъяснимое повышение уровня печеночных ферментов или симптомы, указывающие на нарушения функции печени (например, необъяснимая тошнота, рвота, абдоминальная боль (боль в животе), повышенная утомляемость, анорексия, желтуха и/или темная моча), следует незамедлительно определить уровень сывороточных трансаминаз и общего билирубина и, в зависимости от обстоятельств, временно или окончательно прекратить лечение алемтузумабом.
Перед началом лечения алемтузумабом необходимо определить уровень трансаминаз (АЛТ и АСТ) и общего билирубина в сыворотке крови. Следует периодически контролировать уровни трансаминаз и общего билирубина в течение 48 мес после последней инфузии алемтузумаба.
Гемофагоцитарный лимфогистиоцитоз
Гемофагоцитарный лимфогистиоцитоз наблюдался у пациентов, получавших алемтузумаб. Гемофагоцитарный лимфогистиоцитоз — опасный для жизни синдром патологической иммунной активации, характеризующийся клиническими признаками и симптомами острого системного воспаления. Гемофагоцитарный лимфогистиоцитоз ассоциируется с высоким уровнем смертности, если не распознать его на ранней стадии и не начать лечение. Общие признаки включают лихорадку, гепатоспленомегалию, кожную сыпь, лимфаденопатию, неврологические симптомы (например, изменение психического статуса, атаксию или судороги), цитопению, высокий уровень ферритина в сыворотке крови, гипертриглицеридемию, нарушения функции печени и коагуляции. Гемофагоцитоз можно обнаружить при проведении гистологического исследовании костного мозга, селезенки или лимфатических узлов. В случаях гемофагоцитарного лимфогистиоцитоза, зарегистрированных при применении алемтузумаба, у большинства пациентов наблюдались лихорадка, повышение уровня ферритина в сыворотке крови, повышение активности трансаминаз (трансаминит), гипертриглицеридемия, и все пациенты нуждались в госпитализации. Хотя небольшое количество случаев ограничивает возможность делать выводы относительно среднего или диапазона латентного периода для гемофагоцитарного лимфогистиоцитоза, сообщалось, что симптомы возникают в течение приблизительно 13–33 мес после начала лечения. Пациентов, у которых развиваются ранние проявления патологической иммунной активации, следует незамедлительно обследовать и рассмотреть возможность постановки диагноза «гемофагоцитарный лимфогистиоцитоз». Терапию алемтузумабом следует прекратить, если невозможно установить альтернативную этиологию признаков или симптомов.
Приобретенная гемофилия А
Случаи приобретенной гемофилии А (антитела к фактору VIII) были зарегистрированы как в ходе клинических исследований, так и в пострегистрационный период применения. Обычно у пациентов наблюдаются спонтанные подкожные гематомы и обширные кровоподтеки, хотя могут наблюдаться гематурия, носовое кровотечение, желудочно-кишечные и другие виды кровотечений. У пациентов с подобными симптомами необходимо провести анализ на коагулопатию, включая АЧТВ. Пациентов следует проинформировать о признаках и симптомах приобретенной гемофилии A и рекомендовать незамедлительно обращаться за медицинской помощью при появлении любого из этих симптомов.
Инфекционные заболевания
В контролируемых клинических исследованиях рассеянного склероза продолжительностью до 2 лет инфекции развивались у 71% пациентов, получавших алемтузумаб, по сравнению с 53% пациентов, получавших интерферон бета-1a. Инфекции, которые чаще развивались у пациентов, получавших алемтузумаб, по сравнению с пациентами, получавшими интерферон бета-1a, включали назофарингит, инфекции мочевыводящих путей, инфекции верхних дыхательных путей, синусит, инфекции, вызванные вирусом герпеса, грипп и бронхит. Серьезные инфекции развивались у 3% пациентов, получавших алемтузумаб, по сравнению с 1% пациентов, получавших интерферон бета-1a. Серьезные инфекции в группе лечения алемтузумабом включали аппендицит, гастроэнтерит, пневмонию, опоясывающий герпес (herpes zoster) и инфекции зубов.
Не рекомендуется проводить иммунизацию живыми вирусными вакцинами после цикла терапии алемтузумабом. Пациенты, получающие лечение алемтузумабом, могут подвергаться повышенному риску инфицирования после введения живых вирусных вакцин в связи с нарушениями иммунитета.
Применение алемтузумаба противопоказано у пациентов с активной инфекцией (см. «Противопоказания»).
Одновременное применение алемтузумаба с противоопухолевыми или иммуносупрессивными ЛС может увеличить риск иммуносупрессии.
Оппортунистические инфекции. В пострегистрационный период применения алемтузумаба сообщалось о развитии у пациентов серьезных, иногда с летальным исходом, оппортунистических инфекций, включая аспергиллез, кокцидиоидомикоз, гистоплазмоз, пневмоцистную пневмонию, нокардиоз, вирус Эпштейна-Барр и ЦМВ-инфекцию.
Инфекции, вызванные Listeria Monocytogenes (листериоз). Инфекции, вызванные Listeria monocytogenes (например, менингит, энцефалит, сепсис и гастроэнтерит), включая летальные случаи листериозного менингоэнцефалита, развивались у пациентов, получавших алемтузумаб. Листериозные инфекции развивались уже через 3 дня после начала лечения и в течение 8 мес после последней инфузии алемтузумаба. Продолжительность периода повышенного риска развития листериозной инфекции (листериоза) после лечения алемтузумабом неизвестна.
Пациентам следует избегать употребления или подвергать достаточной термической обработке продукты, которые являются потенциальными источниками Listeria monocytogenes (например, мясные деликатесы, молочные продукты из непастеризованного молока, сыры мягких сортов, недостаточно термически обработанное мясо, морепродукты или птица). Данные меры предосторожности против развития листериозной инфекции (листериоза) следует предпринять до начала лечения алемтузумабом.
Инкубационный период для Listeria monocytogenes составляет от 3 до 70 дней. В большинстве случаев признаки и симптомы инвазивного листериоза проявляются в течение 1 мес после контакта с Listeria monocytogenes. Симптомы листериозной инфекции включают лихорадку, озноб, диарею, тошноту, рвоту, головную боль, боли в суставах и мышцах, ригидность затылочных мышц, затруднения при ходьбе, изменения психического статуса, кому и другие неврологические изменения. Как и в случае со многими инфекциями, лечение не всегда может предотвратить смертность и заболеваемость, связанные с листериозной инфекцией. Пациентам следует тщательно наблюдать за появлением симптомов листериозной инфекции и при их появлении незамедлительно обращаться за медицинской помощью.
Инфекции, вызванные вирусом герпеса. В контролируемых клинических исследованиях у 16% пациентов, получавших алемтузумаб, развивались герпесвирусные инфекции по сравнению с 3% пациентов, получавших интерферон бета-1a, включая герпес полости рта (8,8%), опоясывающий герпес (herpes zoster) (4,2%), простой герпес (herpes simplex) (1,8%) и герпес половых органов (генитальный герпес) (1,3%). Серьезные герпетические инфекции у пациентов, получавших алемтузумаб, включали первичное инфицирование ветряной оспой (0,1%), опоясывающий герпес (0,2%) и герпетический менингит (0,1%). Следует назначать противовирусные ЛС для профилактики герпетической инфекции в соответствующих супрессивных режимах дозирования. Противовирусную профилактическую терапию герпесвирусных инфекций следует проводить начиная с 1-го дня каждого цикла терапии и продолжать в течение по крайней мере 2 мес после окончания цикла терапии алемтузумабом или до тех пор, пока количество CD4+ лимфоцитов не достигнет ≥200 клеток/мкл (мм3), в зависимости от того, что произойдет позднее.
Вирус папилломы человека (ВПЧ). Инфицирование ВПЧ шейки матки, включая дисплазию шейки матки, наблюдалось у 2% пациентов, получавших лечение алемтузумабом. Рекомендуется проводить ежегодный осмотр пациенток на предмет выявления ВПЧ.
Туберкулез. В ходе контролируемых клинических исследований туберкулез развивался у пациентов, получавших лечение алемтузумабом и интерфероном бета-1a. Случаи возникновения активной и латентной формы туберкулеза наблюдались у 0,3% пациентов, получавших алемтузумаб; чаще всего данные случаи регистрировались в эндемичных регионах. Перед началом терапии алемтузумабом следует провести скрининг на наличие туберкулеза в соответствии с локальными требованиями. Пациентам с положительным результатом скрининга на наличие туберкулеза необходимо провести лечение в соответствии со стандартной медицинской практикой до начала терапии алемтузумабом.
Грибковые инфекции. В контролируемых клинических исследованиях рассеянного склероза грибковые инфекции, особенно кандидоз полости рта и вагинальный кандидоз, чаще возникали у пациентов, получавших алемтузумаб (12%), по сравнению с пациентами, получавшими интерферон бета-1a (3%).
Инфекции у пациентов, не страдающих рассеянным склерозом. В пострегистрационный период применения алемтузумаба сообщалось о развитии серьезных и иногда с летальным исходом вирусных, бактериальных, протозойных и грибковых инфекций, в т.ч. вызванных реактивацией латентных инфекций, при лечении пациентов с В-клеточным лимфоцитарным лейкозом, а также с другими заболеваниями, как правило, при применении алемтузумаба в более высоких и частых дозах, чем рекомендовано при рассеянном склерозе.
Гепатит. Нет данных о влиянии алемтузумаба на реактивацию вируса гепатита В или вируса гепатита C, поскольку пациентов с признаками активных или хронических инфекционных заболеваний исключали из участия в клинических исследованиях. Следует рассмотреть возможность проведения скрининга пациентов с высоким риском инфицирования вирусом гепатита B и/или гепатита C перед началом терапии алемтузумабом. Следует с осторожностью назначать терапию алемтузумабом пациентам — носителям вируса гепатита B и/или гепатита C, поскольку пациенты с таким статусом могут подвергаться риску развития необратимой печеночной недостаточности в связи с возможной реактивацией вируса.
Прогрессирующая многоочаговая лейкоэнцефалопатия. Прогрессирующая мультифокальная лейкоэнцефалопатия наблюдалась у пациента с рассеянным склерозом, получавшего лечение алемтузумабом. Прогрессирующая мультифокальная лейкоэнцефалопатия — оппортунистическая вирусная инфекция головного мозга, вызванная JC-вирусом, которая, как правило, возникает только у пациентов с ослабленным иммунитетом и обычно приводит к смерти или тяжелой форме инвалидности. Прогрессирующая мультифокальная лейкоэнцефалопатия была диагностирована у пациента через 2 мес после 2-го цикла терапии алемтузумабом. Пациент ранее получал многократную терапию рассеянного склероза, но в течение более 1 года не получал другие ЛС для лечения рассеянного склероза. Пациент не имел в анамнезе других системных заболеваний, приводящих к нарушению функции иммунной системы, и не получал ранее лечение натализумабом, который применяется для лечения прогрессирующей мультифокальной лейкоэнцефалопатии. Пациент не получал сопутствующую терапию какими-либо иммуносупрессивными или иммуномодулирующими ЛС. После диагностирования прогрессирующей мультифокальной лейкоэнцефалопатии у пациента развился воспалительный синдром восстановления иммунитета. Состояние пациента улучшилось, но при последнем осмотре сохранялись легкие остаточные неврологические нарушения (осложнения).
При первых признаках или симптомах, указывающих на прогрессирующую мультифокальную лейкоэнцефалопатию, терапию алемтузумабом следует отменить и провести соответствующее диагностическое обследование. Типичные симптомы, связанные с прогрессирующей мультифокальной лейкоэнцефалопатией, разнообразны, прогрессируют в течение нескольких дней или недель и включают прогрессирующую слабость с одной стороны тела или неуклюжесть движений (конечностями), нарушение зрения, нарушения мышления, памяти и ориентации, приводящие к спутанности сознания и изменениям личности.
Проявления заболевания могут быть заметны на результатах МРТ еще до появления клинических признаков или симптомов. Случаи прогрессирующей мультифокальной лейкоэнцефалопатии, диагностированной на основании результатов МРТ и обнаружения ДНК JC-вируса в спинномозговой жидкости при отсутствии клинических признаков или симптомов, характерных для прогрессирующей мультифокальной лейкоэнцефалопатии, были зарегистрированы у пациентов, получавших другие ЛС для лечение рассеянного склероза, ассоциированного с прогрессирующей мультифокальной лейкоэнцефалопатией. У многих из этих пациентов впоследствии появились клинические симптомы прогрессирующей мультифокальной лейкоэнцефалопатии. Таким образом, рекомендуется проводить МРТ-мониторинг для выявления признаков, которые могут быть связаны с прогрессирующей мультифокальной лейкоэнцефалопатией, а при любых сомнительных результатах следует проводить дальнейшее обследование для ранней диагностики прогрессирующей мультифокальной лейкоэнцефалопатии, если она присутствует. После прекращения применения другого ЛС для лечения рассеянного склероза, связанного с прогрессирующей мультифокальной лейкоэнцефалопатией, сообщалось о более низкой смертности и заболеваемости, связанных с прогрессирующей мультифокальной лейкоэнцефалопатией, у пациентов, у которых изначально отсутствовали симптомы на момент постановки диагноза, по сравнению с пациентами, у которых на момент постановки диагноза наблюдались характерные клинические признаки и симптомы. Неизвестно, связаны ли эти различия с ранним выявлением и прекращением лечения рассеянного склероза или с различиями в течении заболевания у таких пациентов.
Острый некалькулезный холецистит. Применение алемтузумаба может повысить риск развития острого некалькулезного холецистита. В контролируемых клинических исследованиях у 0,2% пациентов с рассеянным склерозом, получавших алемтузумаб, развивался острый некалькулезный холецистит, по сравнению с 0% пациентов, получавших интерферон бета-1a. В ходе пострегистрационного применения были зарегистрированы дополнительные случаи острого некалькулезного холецистита у пациентов, получавших алемтузумаб. Время появления симптомов варьировало от менее 24 ч до 2 мес после инфузии алемтузумаба. О типичных факторах риска или предрасполагающих факторах, таких как сопутствующее критическое заболевание (жизнеугрожающее состояние), часто не сообщалось. В некоторых случаях для подтверждения диагноза острого некалькулезного холецистита использовались отклоняющиеся от нормы результаты УЗИ или КТ. Некоторые пациенты получали консервативное лечение противомикробными ЛС (антибиотиками) и выздоравливали без хирургического вмешательства, тогда как другим проводилась холецистэктомия.
Симптомы острого некалькулезного холецистита включают абдоминальную боль, болезненность в области живота, лихорадку, тошноту и рвоту. Также часто наблюдаются лейкоцитоз и отклонения от нормы показателей печеночных ферментов. Острый некалькулезный холецистит — заболевание, которое связано с высоким уровнем заболеваемости и смертности, если его не диагностировать на ранней стадии и не начать лечение. При подозрении на острый некалькулезный холецистит необходимо провести обследование и незамедлительно начать лечение.
Пневмонит. В клинических исследованиях у 6 из 1217 (0,5%) пациентов, получавших алемтузумаб, наблюдался пневмонит различной степени тяжести. В клинических исследованиях наблюдались случаи экзогенного аллергического пневмонита и пневмонита с фиброзом. Пациентам следует рекомендовать сообщать о симптомах пневмонита, которые могут включать одышку, кашель, свистящее дыхание, боль или стеснение в груди и кровохарканье.
Применение в особых группах пациентов
Дети. Безопасность и эффективность алемтузумаба у пациентов в возрасте до 17 лет не установлены. Применение алемтузумаба у детей не рекомендуется в связи с риском развития аутоиммунных заболеваний, инфузионных реакций и инсульта, а также из-за возможного увеличения риска развития злокачественных новообразований (щитовидной железы, меланомы, лимфопролиферативных заболеваний и лимфомы).
Пожилой возраст. Клинические исследования алемтузумаба не включали достаточного количества пациентов в возрасте 65 лет и старше, чтобы определить, отличается ли их реакция от реакции более молодых пациентов.
www.rxlist. com, 2022.
Бахтиярова К.З.
Башкирский государственный медицинский университет, Уфа
Бойко А.Н.
КГБУЗ «Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями»
- Scopus AuthorID:
57224826008 - ORCID:
0000-0001-6476-6417
Власов Я.В.
Кафедра неврологии и нейрохирургии Самарского государственного медицинского университета
Давыдовская М.В.
ГБУ Москвы «Научно-практический центр клинических исследований и оценки медицинских технологий Департамента здравоохранения Москвы», Москва, Россия
- Scopus AuthorID:
14065958200 - ORCID:
0000-0002-8294-0893
Евдошенко Е.П.
Санкт-Петербургское ГБУЗ «Городская клиническая больница №31», Санкт-Петербургский городской Центр рассеянного склероза и аутоиммунных заболеваний, Санкт-Петербург
- Scopus AuthorID:
51763507000 - ORCID:
0000-0002-8006-237X
Захарова М.Н.
Научный центр неврологии РАМН, Москва
Котов С.В.
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Попова Е.В.
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
Сиверцева С.А.
Тюменский областной центр рассеянного склероза
Тотолян Н.А.
Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
Хабиров Ф.А.
Казанская государственная медицинская академия Минздравсоцразвития России;
Республиканский клинико-диагностический центр по демиелинизирующим заболеваниям Министерства здравоохранения Республики Татарстан, Казань
Обновленные рекомендации совета экспертов по применению и обеспечению безопасности терапии препаратом алемтузумаб (Лемтрада)
Авторы:
Хачанова Н.В., Бахтиярова К.З., Бойко А.Н., Власов Я.В., Давыдовская М.В., Евдошенко Е.П., Захарова М.Н., Котов С.В., Попова Е.В., Сиверцева С.А., Тотолян Н.А., Хабиров Ф.А.
Как цитировать:
Хачанова Н.В., Бахтиярова К.З., Бойко А.Н., Власов Я.В., Давыдовская М.В., Евдошенко Е.П., Захарова М.Н., Котов С.В., Попова Е.В., Сиверцева С.А., Тотолян Н.А., Хабиров Ф.А. Обновленные рекомендации совета экспертов по применению и обеспечению безопасности терапии препаратом алемтузумаб (Лемтрада). Журнал неврологии и психиатрии им. С.С. Корсакова.
2020;120(3):82‑91.
Khachanova NV, Bakhtiiarova KZ, Boĭko AN, Vlasov IaV, Davydovskaya MV, Evdoshenko EP, Zakharova MN, Kotov SV, Popova EV, Sivertseva SA, Totolian NA, Khabirov FA. Updated recommendations of the Council of Experts on the use and safety of alemtuzumab (Lemtrada). Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2020;120(3):82‑91. (In Russ.)
https://doi.org/10.17116/jnevro202012003182

Введение
Рассеянный склероз (РС) является хроническим аутоиммунным и нейродегенеративным заболеванием центральной нервной системы, при котором наблюдается прогрессирующее нарастание неврологических нарушений преимущественно у лиц молодого возраста. Клиническое течение РС отличается большой вариабельностью, что проявляется разной частотой и тяжестью обострений, клинической симптоматикой, темпами прогрессирования и накопления инвалидности. Современные рекомендации по лекарственной терапии пациентов с РС указывают на необходимость раннего применения препаратов, изменяющих течение рассеянного склероза (ПИТРС), у пациентов с активным течением заболевания [1]. При этом под активностью принято понимать не только клинические обострения, но и радиологические признаки болезни в виде появления новых Т2- или Т1-очагов с контрастным усилением при динамических магнитно-резонансных исследованиях (МРТ) головного и спинного мозга [1]. В последние 10 лет многие исследователи стали выделять пациентов с высокоактивным, или агрессивным, течением РС, при котором наблюдается высокая частота обострений (2 и более в последний год), их инвалидизирующий характер, короткая длительность ремиссий, ранее вовлечение в патологический процесс пирамидной и мозжечковой систем, достижение уровня инвалидизации по шкале EDSS 4 балла и более в течение первых 5 лет болезни, выраженная активность по данным МРТ головного и спинного мозга [2—6]. Однако единого понимания критериев высокоактивного, или агрессивного, РС в настоящее время нет. В отношении подобных пациентов нередко предлагается индукционная схема терапии, терапия иммунореконституции либо раннее переключение на более эффективные ПИТРС 2-й линии, к которым принято относить натализумаб, финголимод, алемтузумаб и окрелизумаб [7—9].
Алемтузумаб (Лемтрада) — рекомбинантное гуманизированное моноклональное антитело, разрешенное к применению в более чем 50 странах мира, включая Российскую Федерацию. Эффективность алемтузумаба обусловлена множественными механизмами действия [10, 11]. Высказываются предположения, что терапевтические свойства алемтузумаба обусловлены не только его противовоспалительным действием, но и влиянием на регенерацию тканей головного мозга и возможным нейропротективным действием за счет изменения лимфоцитарного профиля [12, 13]. Данные наблюдений в когортах ранее не леченных пациентов, которым проводили терапию алемтузумабом в качестве препарата первого выбора, а также расширенные исследования III фазы клинических испытаний препарата свидетельствуют о долгосрочной эффективности лечения (>9 лет) алемтузумабом примерно у 2/3 пациентов [14—16]. Наиболее эффективен препарат был при активном течении РС с высокой частотой обострений [17]. Проведенные исследования позволяют говорить о том, что с помощью краткосрочной иммуносупрессии удается достичь долгосрочной иммуномодуляции. Однако новые сведения в отношении безопасности терапии алемтузумабом, полученные в постмаркетинговой практике, и пересмотренные рекомендации Европейского медицинского агентства (ЕМА) позволяют рекомендовать данный вид терапии пациентам с высокоактивным течением ремиттирующего РС (РРС) [18]. Неврологические центры России принимали активное участие в проведении клинических исследований препарата, и позитивные клинические МРТ-эффекты, полученные в международных исследованиях, были подтверждены в выборке российских пациентов [19].
Методы
Для подготовки обновленной версии рекомендаций группой российских экспертов (авторы рекомендаций) обсуждены новые данные по эффективности и безопасности препарата, опубликованные после того, как были составлены первые клинические рекомендации. На основании имеющегося клинического опыта были определены соответствующие темы для обновления в рамках процесса пересмотра ранее предложенных рекомендаций по применению алемтузумаба. Координатором (Н.В. Хачанова) составлен первый проект, затем было проведено несколько этапов его рассмотрения экспертами. Наиболее существенные изменения в отношении клинического применения алемтузумаба были включены в обновленный проект, который был повторно рассмотрен всеми авторами для получения окончательного заключения.
Рекомендации к применению препарата алемтузумаб
Профиль пациентов
Алемтузумаб рекомендован для монотерапии пациентов с высокоактивным течением РРС (согласно международным критериям МакДональда, 2010) в возрасте от 18 до 55 лет (до начала терапии) и уровнем инвалидизации по шкале EDSS не более 5,5 балла (вне обострения) [18]:
1. Пациенты с высокой активностью течения РРС, несмотря на полный и адекватный курс одним препаратом ПИТРС или более (табл. 1).
2. Пациенты с быстропрогрессирующим тяжелым РРС, ранее не получавшие ПИТРС (см. табл. 1).
Отдельного внимания заслуживают пациенты с высокоактивным РРС, которым проводили терапию натализумабом, так как на фоне терапии у них в большинстве случаев нет активности заболевания, но риск развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) при продолжении терапии после 2 лет с введением препарата со стандартным интервалом дозирования (каждые 4 нед) вынуждает пересмотреть лечебную тактику и сменить терапию на другой ПИТРС 2-й линии [20]. Поэтому препарат алемтузумаб также может быть рекомендован:
3. Пациентам с высокоактивным РРС с высоким риском развития прогрессирующей ПМЛ после завершения 2 полных лет терапии натализумабом (риск ПМЛ на фоне терапии натализумабом значительно повышается у пациентов, получаюших терапию более 2 лет при значениях индекса антител к вирусу John Cunningham (JCV)>1,5) [21, 22].
Преимущества терапии алемтузумабом должны быть сопоставлены с риском побочных эффектов. Информацию о рисках необходимо представить таким образом, чтобы каждый пациент мог ее понять, используя конкретные примеры, к которым пациент может легко относиться. В большинстве случаев пациенты больше готовы принять риски, чем неврологи [23]. К примеру, пациенты придают большее значение времени прогрессирования инвалидности, чем вероятности развития ПМЛ [24]. Наконец, анализ риска/пользы лечения РРC должен учитывать риски, связанные с самим заболеванием, как в краткосрочной (контроль над активностью заболевания), так и в долгосрочной (риск прогрессирования инвалидности, снижение ожидаемой продолжительности жизни) перспективе. Риск инвалидности, вызванной РС, каждого пациента может оцениваться в зависимости от наличия или отсутствия факторов, ассоциированных с неблагоприятным прогнозом.
Противопоказания к терапии алемтузумабом
На основании обновленных данных по безопасности препарата алемтузумаб ЕМА пересмотрела перечень противопоказаний, что нашло отражение в инструкции по медицинскому применению алемтузумаба [18]:
1. Повышенная чувствительность к активному веществу или любому из вспомогательных веществ.
2. Инфекция вирусом иммунодефицита человека (ВИЧ).
3. Любые активные инфекционные процессы до их разрешения.
4. Пациенты с неконтролируемой артериальной гипертензией.
5. Пациенты с диссекцией краниоцефальных артерий в анамнезе.
6. Пациенты, перенесшие острое нарушение мозгового кровообращения в анамнезе.
7. Пациенты с приступом стенокардии в анамнезе, а также перенесшие инфаркт миокарда.
8. Пациенты с известной коагулопатией, получающие антитромбоцитарную или антикоагулянтную терапию.
9. Пациенты с другими сопутствующими аутоиммунными заболеваниями (кроме РС).
Терапия алемтузумабом не рекомендована в следующих клинических случаях [25]:
1. Иммуносупрессивная или противоопухолевая терапия, проводимая в настоящее время.
2. Латентные хронические инфекции: сифилис, туберкулез, гепатиты.
3. Активные оппортунистические инфекции по клиническим, лабораторным и инструментальным методам обследования, такие как врожденные или приобретенные иммунодефициты: трансплантация органов, лучевая терапия. Данный перечень является неполным, для каждого пациента врач индивидуально оценивает наличие повышенного риска развития оппортунистических инфекций, в том числе с учетом данных лабораторной диагностики.
4. Беременность и лактация.
5. Заболевания щитовидной железы, сопровождаемые тяжелым тиреотоксикозом и его осложнениями.
6. Заболевания крови: гемобластозы, нейтропения, лимфопролиферативные заболевания.
7. Серьезные заболевания почек и печени.
Поскольку лечение алемтузумабом связано с потенциально повышенным риском развития серьезных инфекций, пациентам с признаками инфекционного заболевания должно быть отказано в начале лечения до тех пор, пока инфекция полностью не разрешится [18]. Кроме того, учитывая, что алемтузумаб может увеличивать вероятность развития некоторых видов рака, таких как рак щитовидной железы, рак кожи (меланома), лимфопролиферативные заболевания и лимфома, следует проявлять осторожность перед началом лечения алемтузумабом у пациентов с уже существующим и/или продолжающимся онкологическим заболеванием [18, 26].
Обследования перед назначением терапии
1. Клиническое обследование пациента, включающее подробный сбор анамнеза как по заболеванию, так и по предшествующей терапии; полный неврологический осмотр.
2. Информирование пациента о характере предстоящей терапии, возможных побочных реакциях, обучение пациента и его родственников тактике поведения при возникновении новых симптомов на фоне терапии.
3. Развернутый клинический анализ крови с обязательным подсчетом тромбоцитов, лимфоцитов, нейтрофилов. Пациентам, которым ранее проводили иммуносупрессивную терапию, следует дополнительно провести фенотипирование лимфоцитов (субпопуляции Т- и В-лимфоцитов CD4+, CD8+, CD19+) с целью исключения скрытого иммунодефицита.
4. Биохимический анализ крови (АСТ, АЛТ, общий билирубин, креатинин, мочевина, скорость клубочковой фильтрации, глюкоза).
5. Коагулограмма.
6. Анализ мочи (белок, микроскопия осадка).
7. Определение антител к ВИЧ, гепатиту В, С, сифилису.
8. Рентгенография органов грудной клетки, диаскин-тест, выполненные не позднее чем за 6 мес до начала терапии, и консультация фтизиатра для исключения туберкулеза.
9. Электрокардиография (ЭКГ). При необходимости ЭКГ может быть дополнена эхокардиографическим исследованием.
10. Исследование функции щитовидной железы (ТТГ, свободные фракции тиреоидных гормонов), определение антител к рецепторам ТТГ и тиреоидной пероксидазе (АТ к ТПО). Пациентам, имеющим заболевания щитовидной железы в анамнезе, необходима консультация врача-эндокринолога с целью определения дополнительных исследований, оценки потенциальных рисков и принятия совместного решения о начале терапии.
11. Всем пациентам, даже с указанием в анамнезе на перенесенную ветряную оспу или вакцинацию против вируса Varicella Zoster (VZV), перед терапией препаратом необходимо провести серологическое исследование титра антител к данному вирусу — иммуноглобулинов класса G (IgG). При получении негативного результата рекомендуется выполнить вакцинацию против VZV в соответствии с инструкцией за 6 нед до начала терапии алемтузумабом.
12. С женщинами детородного возраста перед назначением терапии препаратом обсудить вопрос о необходимости соблюдения адекватной контрацепции на протяжении всего периода терапии и 4 мес после ее окончания.
13. МРТ головного мозга с контрастированием, выполненная не позднее чем за 3 мес до начала терапии.
Для снижения риска листериозной инфекции пациенты, которым планируется терапия алемтузумабом, должны избегать употребления в пищу сырого и недостаточно термически обработанного мяса, сыров мягких сортов и непастеризованной молочной продукции в течение как минимум 2 нед до и 1 мес после лечения алемтузумабом [18]. Также пациентам с повышенным риском развития листериозной инфекции врач может посчитать целесообразным профилактическое назначение одной из следующих схем антибиотикотерапии [27]:
1) прием ко-тримоксазола в дозировке 960 мг 3 раза в неделю в течение 1 мес после каждого курса алемтузумаба;
2) для пациентов, которые будут соблюдать рекомендуемую диету, альтернативой является прием амоксициллина в дозировке 1000 мг или ко-тримоксазола в дозировке 960 мг/сут для устранения эндогенной контаминации листерией (общая продолжительность курса составляет 8 дней). Антибактериальную терапию в таком случае следует начинать за 4 дня до первой инфузии алемтузумаба и продолжать в течение еще 4 дней на фоне его введения. После чего пациенту следует соблюдать строгую диету в течение 1 мес после инфузии алемтузумаба;
3) также, если лечение алемтузумабом возможно запланировать за несколько месяцев, то пациентам, готовым строго соблюдать диету, можно предложить начать придерживаться данной диеты за 90 дней до и в течение 1 мес после каждого курса алемтузумаба.
В течение 1 нед перед инфузией врач должен подтвердить отсутствие противопоказаний к терапии и оценить готовность пациента к инфузии: отсутствие каких-либо инфекций, статус иммунизации и сопутствующую терапию.
Вакцинация
Эффективность вакцинации во время терапии алемтузумабом и непосредственно после проведенного лечебного цикла может быть ограничена. В соответствии с инструкцией по медицинскому применению алемтузумаба любая необходимая вакцинация должна быть завершена за 6 нед до начала лечения им [18]. Пациентам, недавно прошедшим курс лечения алемтузумабом, не рекомендуется проводить иммунизацию живыми вирусными вакцинами [18]. Следует подчеркнуть, что для пациентов, получающих лечение алемтузумабом, вакцинация против гриппа должна быть отсрочена не менее чем на 6 мес после последней инфузии препарата, однако она может быть повторена, если первая вакцинация не была эффективной [11]. Пациенты, не имеющие в анамнезе перенесенной ветряной оспы или не прошедшие иммунизацию против вируса ветряной оспы (VZV), должны быть вакцинированы за 6 нед до планируемого начала терапии [18].
Способ применения и дозы
Инфузии алемтузумаба должны проводиться под постоянным контролем врачей, специализирующихся на диагностике и лечении неврологических заболеваний. Пациенты должны быть проинформированы о рисках, связанных с терапией алемтузумабом, а также о необходимости находиться под активным наблюдением в период лечения и в течение 48 мес после последней инфузии.
Рекомендованная доза препарата алемтузумаб — 12 мг/сут в виде внутривенной капельной инфузии со скоростью 25 мл/ч. Лечебный курс включает 2 цикла терапии:
— Первый цикл терапии: 12 мг/сут в течение 5 дней (желательно последовательных, общая доза 60 мг).
— Второй цикл терапии: 12 мг/сут в течение 3 дней (общая доза 36 мг). Второй цикл может проводиться не ранее чем через 48 нед после первого цикла терапии. Пропущенные инфузии не следует выполнять в один день с запланированными.
Пациенты должны находиться под наблюдением в течение всей инфузии и не менее 2 ч после ее окончания в связи с возможностью развития реакции гиперчувствительности.
Повторные лечебные циклы
Примерно у 1/2 пациентов из основных исследований (64% из CARE MS I [28] и 55% из CARE MS II [29]) во время участия в расширенном исследовании проведение дополнительного лечения алемтузумабом не потребовалось [30—32]. Однако некоторым пациентам необходимо проведение дополнительного курса терапии в связи с активностью заболевания. При необходимости может быть рассмотрено до двух дополнительных циклов лечения алемтузумабом [18]:
— Третий и четвертый циклы терапии: 12 мг/день в течение 3 дней (общая доза 36 мг). Эти циклы могут проводиться через 12 мес и более после завершения основного лечебного курса терапии.
Критериями проведения повторного лечебного цикла терапии алемтузумабом после завершения 2 циклов терапии являются:
1) развитие более 1 инвалидизирующего обострения (с увеличением значения по шкале EDSS на 1 балл и более) в период наблюдения;
2) появление более 2 новых/увеличивающихся гиперинтенсивных очагов в режиме Т2 и/или новых контрастируемых очагов (Gd+) в режиме Т1 по данным МРТ головного или спинного мозга в динамике.
Противопоказаниями к повторному лечению являются беременность, диагноз иммунной тромбоцитопении, формирование антител к гломерулярной базальной мембране (мембранозная нефропатия), наличие злокачественных новообразований в анамнезе (за исключением базально-клеточного рака), выявление нейтрализующих антител к алемтузумабу [33].
Проведение инфузии алемтузумаба
По данным клинических исследований и постмаркетингового применения алемтузумаба, у более чем 90% пациентов наблюдаются инфузионные реакции (ИР) в большинстве случаев легкой или средней степени тяжести, включающие сыпь, головные боли, тошноту, лихорадку, озноб, ощущения сердцебиения, недомогание, астению, боль в спине [31, 32, 34]. Инфузия алемтузумаба может проводиться только в стационаре/дневном стационаре при условии доступа к отделению неотложной помощи в случае развития анафилактической реакции. Для предупреждения развития ИР за 1 сут до начала инфузии пациенту следует назначить антагонисты H1-гистаминовых рецепторов (лоратадин, цитеризин) и H2-гистаминовых рецепторов (ранитидин, фамотидин). За 1 ч до начала инфузии в первые 3 дня любого курса необходимо внутривенно капельно ввести метилпреднизолон в дозе 1000 мг. Однако введение метилпреднизолона может быть продлено до 5 дней. Если первый лечебный цикл алемтузумаба не может быть завершен в течение 5 последовательных дней и должен быть прерван из-за, например, острой инфекции с лихорадкой, оставшиеся инфузии алемтузумаба должны быть выполнены как можно скорее в течение следующих недель [11]. В этом случае метилпреднизолон следует применять перед всеми оставшимися инфузиями алемтузумаба. Смешивать эти препараты нельзя, так как это может привести к выпадению препарата в осадок. Алемтузумаб разводят непосредственно перед инфузией в 100 мл 0,9% раствора хлорида натрия или 5% раствора глюкозы (химически разведенный препарат устойчив при 2—8 °С в течение до 8 ч) [18]. Алемтузумаб также должен быть защищен от света, что может быть достигнуто путем покрытия инфузионной емкости с лекарством фольгой или другим непрозрачным материалом. Длительность инфузии составляет 4 ч, при необходимости она может быть увеличена до 8 ч. Также при необходимости во время инфузии алемтузумаба применяют антигистаминные и/или жаропонижающие средства.
Для раннего выявления ИР рекомендуется контролировать и документировать температуру тела, проводить измерение уровня артериального давления и пульса каждый час. Наблюдение за состоянием пациента следует проводить на протяжении инфузии и в течение 2 ч после ее окончания. Большинство ИР, ассоциированных с инфузией алемтузумаба, можно купировать с помощью таких вмешательств, как медикаментозное лечение, и путем замедления или прерывания инфузии (табл. 2). Любые признаки и симптомы, связанные с ИР, которые реагируют на прерывание инфузии или введение антигистаминных и жаропонижающих средств, могут быть связаны с синдромом высвобождения цитокинов (СВЦ) [35]. Некоторые зарубежные эксперты [36] предлагают первоначально снизить скорость инфузии на 50% и оценить выраженность симптомов через 30 мин. При уменьшении симптомов скорость может быть снова увеличена. Если инфузию необходимо полностью прекратить, ее можно возобновить на 50% от предыдущей скорости в течение 15 мин и увеличить в дальнейшем по мере переносимости [36]. Следует помнить, что самый высокий уровень препарата в крови достигается после последней инфузии, поэтому развитие ИР и лихорадка могут сохраняться до 24 ч после завершения инфузии [11]. В экспериментальных исследованиях некоторые пациенты испытывали синдром Утхоффа во время или вскоре после завершения инфузии алемтузумаба. Возникновение феномена Утхоффа после введения алемтузумаба подобно инфузионным реакциям может быть связано с СВЦ [37]. Важно информировать пациента о возможном преходящем ухудшении симптомов РС, которые могут возникнуть во время или после инфузии. Несмотря на редкость, иммунно-опосредованная реакция гиперчувствительности может возникнуть у некоторых пациентов во время последующих инфузий алемтузумаба.
Мониторирование после инфузии алемтузумаба
Инфекционные заболевания. В течение 1-й недели после проведенного лечебного цикла алемтузумабом происходят быстрое клеточное истощение и нарушение активации различных адаптивных и врожденных иммунных подтипов клеток, сопровождающиеся выраженным повышением уровня сывороточных цитокинов. Тем не менее предполагается, что эти острые эффекты, опосредованные алемтузумабом, приводят к ряду эффектов, наблюдаемых при стандартном анализе крови, таких как не ассоциированное с инфекцией увеличение количества лейкоцитов, повышение С-реактивного белка и тромбокрита, которые имеют особое значение для идентификации и мониторинга инфекционных состояний. Кроме того, показаны преходящее повышение активности печеночных ферментов, тромбоцитопения и модуляция тиреотропного гормона (ТТГ) [38].
Инфекционные заболевания часто наблюдаются при применении алемтузумаба. Инфекции верхних и нижних дыхательных путей, мочевыводящих путей, герпетическая инфекция полости рта и случаи опоясывающего герпеса — наиболее распространенные типы инфекций [30]. Как отмечалось выше, у пациентов могут развиваться инфузионные реакции в виде повышения температуры тела и сохраняться до 24 ч после инфузии алемтузумаба. Поэтому в случае сохранения у пациента температуры выше субфебрильных цифр (>37,1 °С) в течение более 24 ч после последней инфузии, необходимо направить его на консультацию к терапевту/инфекционисту для исключения развития инфекционного заболевания и своевременного назначения антибактериальной терапии при необходимости. В связи с высокой частотой развития герпетической инфекции после завершения лечебного цикла рекомендуется проведение профилактической терапии ацикловиром 200 мг 2 раза в сутки (или терапевтически эквивалентным препаратом), начиная с 1-го дня любого цикла терапии алемтузумабом, и длительностью не менее 28 сут после 1-го дня любого цикла [18].
Активное мониторирование и особая настороженность в отношении риска развития инфекционных осложнений должны сохраняться, по крайней мере, в течение 1-го месяца после каждого цикла алемтузумаба.
Вторичные аутоиммунные заболевания. Аутоиммунные заболевания, вероятно, являются наиболее значимым риском при лечении алемтузумабом. Клинические исследования показали, что риск развития аутоиммунных заболеваний был выше через 6—60 мес после окончания инфузионного цикла [31, 32]. Аутоиммунные состояния включали нарушения функции щитовидной железы, иммунную тромбоцитопению (ИТП), нефропатии (например, мембранозная нефропатия), аутоиммунный гепатит и приобретенную гемофилию А. Согласно постмаркетинговым данным, после лечения алемтузумабом у некоторых пациентов развились множественные аутоиммунные нарушения [18].
Заболевание щитовидной железы было наиболее частым побочным эффектом у пациентов, получавших алемтузумаб. Среди пациентов с РС, получавших алемтузумаб в дозе 12 мг (n=811) в рамках клинических исследований, кумулятивная частота тиреоидных событий составила 42% в течение 6 лет [39]. Сообщалось о гипертиреозе (болезнь Грейвса), гипотиреозе и тиреоидите. Поэтому пациенты, имеющие заболевания щитовидной железы до начала лечения алемтузумабом, должны получать терапию только в тех случаях, когда предполагаемая польза терапии превышает предполагаемый риск. Согласно данным клинических исследований, исходное значение АТ к ТПО до начала терапии алемтузумабом не позволяет прогнозировать развитие побочных эффектов со стороны щитовидной железы. Почти у 80% пациентов, у которых после терапии алемтузумабом появились проблемы с функцией щитовидной железы, в начале исследования был выявлен отрицательный статус АТ к ТПО [40]. Пациенты, у которых развивается аутоиммунное заболевание после терапии алемтузумабом, должны быть обследованы на наличие других аутоиммунно-опосредованных состояний [18]. Для раннего выявления нарушений функции щитовидной железы мониторинг уровня ТТГ следует проводить каждые 3 мес на протяжении 48 мес после последнего лечебного цикла. В случае появления симптомов, предполагающих дисфункцию щитовидной железы, или отклонений уровня ТТГ пациент должен быть направлен на консультацию к эндокринологу. Пациенты и врачи должны быть осведомлены о возможном более позднем начале аутоиммунных расстройств после 48-месячного периода наблюдения.
Более редкими, но более серьезными являются аутоиммунные цитопатии в виде тромбоцитопении, мембранозных нефропатий и синдрома Гудпасчера [28, 41]. К настоящему времени понятно, что развитие ИТП нельзя предотвратить, но можно предотвратить неблагоприятные исходы за счет раннего выявления и последующего своевременного лечения. В связи с этим после проведения терапии алемтузумабом исследование уровня тромбоцитов следует выполнить сразу после инфузии на 3-й и 5-й дни первого инфузионного цикла, а также сразу после инфузии на 3-й день любого последующего цикла [18]. Клинически значимую тромбоцитопению следует наблюдать до ее разрешения. Кроме того, в течение 48 мес после последней инфузии алемтузумаба необходимо проводить ежемесячный мониторинг анализа крови с подсчетом количества тромбоцитов, а также врачам сохранять повышенную настороженность в отношении симптомов ИТП. При подозрении на развитие ИТП пациент должен быть немедленно направлен на консультацию к гематологу.
Терапия алемтузумабом может приводить к поражению клубочков почек, включая мембранозную нефропатию и синдром Гудпасчера [18]. Клинические проявления могут включать повышение креатинина сыворотки крови, гематурию и/или протеинурию. В ходе постмаркетингового применения алемтузумаба зарегистрировано 5 случаев альвеолярного легочного кровотечения [42]. У получающих лечение пациентов отмечается значительный риск заболеваемости и тяжелых осложнений, включая почечную недостаточность, кровотечения или осложнения терапии. В настоящий момент развитие нефропатий при терапии алемтузумабом нельзя предотвратить, но можно предотвратить неблагоприятные исходы за счет раннего выявления и последующего своевременного лечения. С целью исключения нарушения функции почек до начала терапии алемтузумабом необходимо исследовать уровень креатинина и выполнить клинический анализ мочи с микроскопией осадка. Данные обследования необходимо повторять ежемесячно в течение 48 мес после последней инфузии алемтузумаба. После окончания этого периода анализы выполняют на основе клинических данных, позволяющих предположить нарушение функции почек. При подозрении на развитие у пациента нефропатии, включая синдром Гудпасчера, пациент должен быть немедленно направлен на консультацию к нефрологу.
Случаи аутоиммунного гепатита (включая смертельные, а также требующие трансплантации печени) и повреждения печени, связанные с инфекциями, были зарегистрированы у пациентов, получавших алемтузумаб [18]. Биохимическое исследование крови с контролем печеночных показателей следует проводить ежемесячно, по крайней мере, до 48 мес после последней инфузии. Пациенты должны быть проинформированы о риске аутоиммунного гепатита, повреждения печени и сопутствующих симптомах.
Гемофагоцитарный лимфогистиоцитоз. Во время постмаркетингового использования алемтузумаба у пациентов, получавших инфузии, зарегистрированы случаи гемофагоцитарного лимфогистиоцитоза (ГЛГ), включая летальные случаи [18]. ГЛГ — угрожающий жизни синдром патологической иммунной активации, характеризующийся клиническими признаками и симптомами острого системного воспаления. ГЛГ характеризуется лихорадкой, гепатомегалией и цитопенией. Сообщалось, что симптомы ГЛГ появляются спустя от нескольких месяцев до 4 лет после начала лечения алемтузумабом. Пациенты должны быть проинформированы о симптомах ГЛГ и времени начала заболевания. Пациенты, у которых развиваются ранние проявления патологической иммунной активации, должны быть немедленно оценены, и диагноз ГЛГ должен быть рассмотрен.
Серьезные сердечно-сосудистые состояния. В ходе пострегистрационного применения алемтузумаба были зарегистрированы случаи инфаркта миокарда, инсульта (ишемического и геморрагического), а также диссекций позвоночной или сонной артерий, большинство из которых развились в пределах 30 дней после инфузии препарата [42, 43]. В большинстве случаев продолжительность периода до начала развития этих нежелательных реакций составляла 1—3 дня после инфузии.
Перевод с других ПИТРС на алемтузумаб
Данные, документирующие исходы у пациентов, перешедших на алемтузумаб с других ПИТРС, ограничены. Перевод пациентов с ПИТРС 1-й линии не представляет сложностей, поскольку обязательным условием безопасного начала терапии является выполнение всех необходимых исследований, рекомендованных для исключения противопоказаний. Никакого «отмывочного» периода не требуется, за исключением процедуры ускоренной элиминации терифлуномида в соответствии с инструкцией.
Однако, хотя препарат разрешен к применению у пациентов с высокоактивным РС, которым ранее проводилась терапия ПИТРС, не менее важным аспектом данных рекомендаций являются меры по минимизации риска развития оппортунистических инфекций, в частности «переходной» ПМЛ, при переводе пациентов с натализумаба на алемтузумаб.
В соответствии с программой минимизации риска натализумаб-ассоциированной ПМЛ, одобренной ЕМА, всем пациентам, завершающим терапию натализумабом, в связи с высоким риском ПМЛ должна быть выполнена МРТ головного мозга с контрастным усилением по расширенному протоколу [44]. При отсутствии подозрений на доклиническую ПМЛ пациенту рекомендовано на протяжении 3 мес находиться под наблюдением лечащего врача с ежемесячным введением метилпреднизолона в дозе 1000 мг внутривенно капельно для предупреждения возобновления клинической/радиологической активности заболевания после завершения терапии натализумабом. В сомнительных случаях необходимо выполнить люмбальную пункцию с целью проведения полимеразной цепной реакции для определения ДНК JC-вируса. При исключении ПМЛ терапия алемтузумабом может быть рекомендована и начата через 3 мес после завершения терапии натализумабом с предварительным обследованием пациента, включающим МРТ головного мозга и все необходимые исследования (см. «Обследования перед назначением терапии»). Поскольку по данным ретроспективного анализа МР-изображений 41 пациента с натализумаб-ассоциированной ПМЛ показано, что объем очага ПМЛ увеличивается на 62,8% каждый месяц «преддиагностической» фазы, то повторное МРТ головного мозга с контрастом непосредственно перед стартом терапии является обязательным [45].
При планировании перевода на алемтузумаб пациента, получающего финголимод, необходимо после прекращения терапии через 8 нед выполнить все необходимые обследования, включая МРТ головного мозга с контрастированием, для исключения противопоказаний. Для предупреждения «ребаунд-эффекта» после прекращения терапии финголимодом на усмотрение лечащего врача могут быть рекомендованы инфузии метилпреднизолона 1000 мг внутривенно капельно 1 раз в 4 нед до начала терапии алемтузумабом. Обязательными условиями являются нормализация уровня лейкоцитов и лимфоцитов, а также отсутствие активных инфекционных заболеваний.
Таким образом, предложенные рекомендации разработаны для минимизации рисков терапии алемтузумабом и достижения наилучшего соотношения польза/риск.
Авторы заявляют об отсутствии конфликта интересов.
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями
использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании
файлов cookie, нажмите здесь.




