Содержание
-
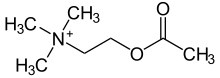
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Ацетилхолин
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Ацетилхолин
-
Противопоказания
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Ацетилхолин
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
Структурная формула
Русское название
Ацетилхолин
Английское название
Acetylcholine
Латинское название
Acetylcholinum (род. Acetylcholini)
Химическое название
2-(Ацетилокси)-N,N,N-триметилэтанаминия хлорид
Брутто формула
C7H16ClNO2
Фармакологическая группа вещества Ацетилхолин
Нозологическая классификация
Список кодов МКБ-10
-
H34.0 Преходящая ретинальная артериальная окклюзия
-
I70.2 Атеросклероз артерий конечностей
-
N31.2 Нейрогенная слабость мочевого пузыря, не классифицированная в других рубриках
-
Z100* КЛАСС XXII Хирургическая практика
Код CAS
60-31-1
Фармакологическое действие
—
холиномиметическое.
Характеристика
Ацетилхолина хлорид — бесцветные кристаллы или белая кристаллическая масса. Расплывается на воздухе. Легко растворим в воде, хлороформе и этаноле; практически нерастворим в эфире.
Фармакология
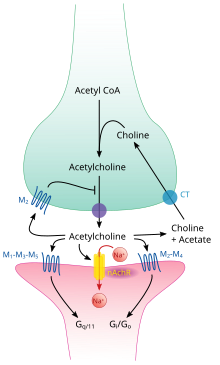
Осуществляет передачу нервных импульсов в ЦНС, вегетативных ганглиях, окончаниях парасимпатических и двигательных нервов, возбуждает постсинаптические мембраны потовых желез. Взаимодействует с м- и н-холинорецепторами, вызывает деполяризацию мембраны, повышает проницаемость для ионов натрия, выравнивая потенциал напряжения. Стимуляция м-холинорецепторов увеличивает содержание «вторичных медиаторов» (цАМФ и цГМФ). Локальный синаптический потенциал генерирует потенциал действия в нейроне следующей ступени или повышает функциональную активность клеток органов (мышцы, железы и др.).
При системном действии преобладают м-холиномиметические эффекты: брадикардия, расширение кровеносных сосудов, снижение АД, повышение тонуса и сократимости гладких мышц бронхов, ЖКТ, матки, желчного и мочевого пузыря, усиление секреции пищеварительных, бронхиальных, потовых и слезных желез, сужение зрачков (миоз), спазм аккомодации. Снижает внутриглазное давление (при сужении зрачка и уплощении радужной оболочки расширяются шлеммов канал и пространства радужно-роговичного угла, улучшается отток внутриглазной жидкости). Стимулирующее влияние на н-холинорецепторы вегетативных ганглиев (симпатических и парасимпатических) значимо проявляется только при блокаде м-холинорецепторов.
При приеме внутрь неэффективен, т.к. легко гидролизуется; в условиях парентерального введения оказывает быстрый, но кратковременный эффект. После аппликации в конъюнктивальный мешок всасывается в кровь, оказывает резорбтивное действие. Плохо проникает через ГЭБ.
Применение вещества Ацетилхолин
Операции на передней камере глаза (удаление катаракты, кератопластика, иридоэктомия) — для обеспечения миоза в течение нескольких секунд после высвобождения хрусталика; спазм артерий сетчатки; редко — эндартериит, перемежающаяся хромота, трофические расстройства в культях, атония кишечника и мочевого пузыря, рентгенодиагностика ахалазии пищевода.
Противопоказания
Гиперчувствительность, бронхиальная астма, хроническая сердечная недостаточность II–III ст., стенокардия, атеросклероз, эпилепсия, кровотечения из ЖКТ.
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — C.
Побочные действия вещества Ацетилхолин
При системном применении или системной абсорбции: сужение коронарных сосудов, брадикардия, аритмия, снижение АД, покраснение лица, затруднение дыхания, повышенное потоотделение.
При аппликации в глаза: отек, помутнение роговицы.
Взаимодействие
Проявляет антагонизм с адреномиметиками по влиянию на величину зрачка. Бета-адреноблокаторы, антихолинэстеразные препараты, адреномиметики повышают противоглаукомный эффект. Трициклические антидепрессанты, м-холиноблокаторы, фенотиазин, хлорпротиксен, клозапин снижают парасимпатическую активность. Галотан усиливает побочные проявления. При сочетании с хинидином возможно трепетание желудочков.
Передозировка
Симптомы: резкое снижение АД, брадикардия, нарушение ритма сердца, профузный пот, миоз, усиление перистальтики кишечника, бронхоспазм, остановка сердца.
Лечение: немедленное в/в, п/к или в/м введение 0,5–1 мл 0,1% раствора атропина (при необходимости повторно), при тяжелом бронхоспазме и резком падении АД — 0,1–1 мл 0,1% раствора адреналина п/к.
Способ применения и дозы
парентерально.
Местно: равномерно нанося на поверхность радужной оболочки и в направлении к углу зрачка 0,5–2 мл.
Парентерально: по 0,05–0,1 г п/к или в/м 1–3 раза в сутки. Высшие дозы п/к и в/м: разовая — 0,1 г, суточная — 0,3 г.
Меры предосторожности
Раствор готовят непосредственно перед использованием, т.к. ацетилхолин в растворе быстро разлагается.
При инъекции следует убедиться, что игла не попала в вену: в/в введение не допускается (возможно резкое понижение АД и остановка сердца).
Длительная аппликация (в течение нескольких лет) в конъюнктивальный мешок может привести к необратимому миозу и образованию задних петехий.
Для пролонгации миоза возможна предварительная инстилляция пилокарпина. При операции по поводу катаракты применяют только после выделения хрусталика.
Химическое название
N, N, N-триметил-2-аминоэтанола ацетат
Химические свойства
Ацетилхолин – основной нейромедиатор, отвечающий за нервно-мышечную передачу в парасимпатической нервной системе. Это четвертичное моноаммониевое соединение. Само по себе вещество не стойкое, в организме быстро разрушается с помощью ацетилхолинэстеразы, в результате чего образуется уксусная кислота и холин.
Средство синтезируют в виде белых кристаллов или кристаллической массы, которая имеет свойство расплываться при контакте с воздухом. Вещество хорошо растворяется в спирте и воде. Его нельзя кипятить и долго хранить, ацетилхолин разлагается.
Используется в качестве лекарства, улучшающего нервно-мышечную передачу и для проведения фармакологических исследований. Часто его синтезируют в виде соли или хлорида.
Данный нейромедиатор играет важную роль в организме, повышает работоспособность головного мозга и память. Поэтому важно, чтобы содержалось достаточно ацетилхолина в продуктах питания, входящих в ежедневный рацион.
Выпускают средство в ампулах по 5 мл, содержащих по 100-200 мг сухого препарата. Перед использованием его растворяют в воде для инъекций.
Фармакологическое действие
Холинолитическое, сосудорасширяющее, гипотензивное.
Фармакодинамика и фармакокинетика
Холиномиметическое действие Ацетилхолина на организм возникает из-за стимуляции им н- и м-холинорецепторов. Вещество замедляет сердечные сокращения, расширяет периферические кровеносные сосуды, понижает АД, усиливает перистальтику кишечника и желудка.
Средство влияет на секрецию бронхиальных и пищеварительных желез, выведение пота и слез. Также вещество производит миотический эффект, усиливает спазм аккомодации (сужение зрачка), понижает внутриглазное давление.
Малые дозы ацетилхолина стимулируют передачу нервных импульсов в различных отделах головного мозга, а большие – напротив тормозят этот процесс. Данный нейромедиатор в целом повышает работоспособность головного мозга и память. Поэтому важно, чтобы содержалось достаточно ацетилхолина в продуктах питания, входящих в ежедневный рацион. При его недостатке развиваются нарушения работы мозга (болезнь Альцгеймера).
Показания к применению
Ранее его назначали в качестве холиномиметика. Также возможно применение средства для лечения глаукомы в течение непродолжительного периода, так как при длительном использовании может развиться катаракта.
Противопоказания
Не рекомендуется к приему при бронхиальной астме, атеросклерозе, кровотечении из ЖКТ, стенокардии.
Побочные действия
Во время лечения Ацетилхолином могут развиться:
- брадикардия, понижение артериального давления, сердечная аритмия;
- тошнота, диарея, головные боли, нарушения зрения, повышенное слезотечение;
- ринорея, потливость, бронхоспазм;
- частое мочеиспускание.
Инструкция по применению (Способ и дозировка)
Ацетилхолин назначают подкожно и внутримышечно. В среднем дозировка для взрослых составляет 50-100 мг. При необходимости инъекции можно делать несколько раз подряд, до трех раз.
Нельзя допускать внутривенного введения препарата, так как это может привести к резкому понижению артериального давления, вплоть до остановки сердца.
Передозировка
Передозировка может вызвать резкое снижение АД, брадикардию, остановку сердца, нарушения ритма, миоз, диарею и так далее. Для устранения нежелательных симптомов рекомендуется как можно скорее ввести подкожно или внутривенно 1 мл 0,1% р-ра атропина или другого холинолитика (например, Метацин). При необходимости произвести повторные инъекции.
Взаимодействие
Антихолинэстеразные лекарственные средства усиливают холиномиметическое действие данного вещества.
М-холиноблокаторы, нейролептики, трициклические антидепрессанты, производные фенотиазина, Клозапин, Хлорпротиксен снижают эффективность средства.
Условия продажи
На данный момент лекарство не продается в аптеках.
Условия хранения
Хранят препарат в плотно запаянных ампулах.
Особые указания
На данный момент данное вещество в медицинской практике практически не применяется.
Средство иногда входит в состав некоторых комб. препаратов для местного использования в хирургии глаза, чтобы создать стойкий и продолжительный миоз.
Препараты, в которых содержится (Аналоги)
На данный момент препараты ацетилхолина не выпускают.
Отзывы
Отзывов о данном средстве практически нет, его сложно приобрести в аптеке и оно практически не применяется в медицине. Лекарство заменили более эффективными препаратами.
Цена, где купить
Купить Ацетилхолин в чистом виде практически невозможно. Иногда его можно приобрести в составе специфических глазных капель для проведения клинических исследований.
Фармакологическое действие
M-, н-холиномиметик. Оказывает прямое стимулирующее действие на м- и н-холинорецепторы. Проявлением м-холиномиметического действия являются брадикардия, уменьшение ОПСС, повышение тонуса и сократительной активности мышц бронхов, ЖКТ, мочевого пузыря, круговой мышцы радужки, цилиарной мышцы глаза, повышение секреции желез бронхов, желудка, кишечника, слюнных, слезных и носоглоточных желез. Вызывает расслабление сфинктеров ЖКТ и сфинктера мочевого пузыря.
Н-холиномиметическое действие связано с участием ацетилхолина в передаче нервных импульсов с преганглионарных волокон на постганглионарные в вегетативных узлах, а также с двигательных нервов на поперечно-полосатую мускулатуру. В малых дозах является физиологическим передатчиком нервного возбуждения, в больших дозах может вызывать стойкую деполяризацию в области синапсов и блокировать передачу возбуждения. Участвует в передаче нервного импульса в разных отделах мозга, при этом малых концентрациях облегчает, а в высоких — тормозит синаптическую передачу.
Показания активного вещества
АЦЕТИЛХОЛИН ХЛОРИД
Эндартериит, перемежающаяся хромота, трофические расстройства в культях, спазмы артерий сетчатки, атония кишечника и мочевого пузыря, для облегчения рентгенологической диагностики ахалазии пищевода.
Режим дозирования
Применяют п/к и в/м в дозе 50-100 мг 2-3 раза/сут. Максимальные дозы: разовая — 100 мг, суточная — 300 мг.
Побочное действие
Со стороны пищеварительной системы: тошнота, рвота, боли в животе, диарея, саливация.
Со стороны сердечно-сосудистой системы: брадикардия, артериальная гипотензия.
Со стороны ЦНС: головная боль, нарушение аккомодации, слезотечение.
Прочие: повышенное потоотделение, ринорея, бронхоспазм, учащенное мочеиспускание.
Противопоказания к применению
Бронхиальная астма, стенокардия, атеросклероз, эпилепсия, кровотечения из ЖКТ, гиперкинез при беременности, воспалительные процессы в брюшной полости до оперативного вмешательства.
Применение при беременности и кормлении грудью
Следует избегать применения ацетилхолина хлорида при беременности и в период лактации.
Применение у пожилых пациентов
Применять с осторожностью во избежание риска обострения сопутствующих заболеваний.
Особые указания
В настоящее время системное применение ацетилхолина хлорида ограничено.
Ацетилхолин хлорид входит в состав некоторых комбинированных препаратов для местного применения в глазной хирургии и необходим для создания быстрого и полного миоза.
Лекарственное взаимодействие
При одновременном применении с антихолинэстеразными средствами усиливаются холиномиметические эффекты ацетилхолина хлорида.
При одновременном применении м-холиноблокаторов, трициклических антидепрессантов, нейролептиков (производные фенотиазина, хлорпротиксен, клозапин) уменьшаются эффекты ацетилхолина хлорида.
1 капсула содержит:
активное вещество: холина альфосцерата гидрат (Глицерилфосфорилхолин гидрат), в пересчете на холина альфосцерат (L-a-глицерофосфорилхолин) 400 мг;
вспомогательные вещества: вода очищенная, макрогол (полиэтиленгликоль 400), повидон (пласдон С-15 или коллидон® 17 PF);
состав капсулы мягкой желатиновой: желатин, глицерол (глицерин), метилпарабен (метилпарагидроксибензоат), пропилпарабен (пропилпарагидроксибензоат), сорбитол (сорбит), титана диоксид, краситель железа оксид желтый, краситель железа оксид красный, краситель железа оксид черный, вода очищенная.
Капсулы мягкие желатиновые, овальной формы, от светло-коричневого до коричневого цвета. Содержимое капсул — маслянистая, прозрачная, бесцветная или слегка окрашенная жидкость.
ноотропное средство
Код ATX
[N07AX02]
Фармакологические свойства
Фармакодинамика
Ноотропное средство. Центральный холиностимулятор, в составе которого содержится 40,5% метаболически защищенного холина.
Обеспечивает синтез ацетилхолина и фосфатидилхолина в нейрональных мембранах, улучшает кровоток и усиливает метаболические процессы в центральной нервной системе, активирует ретикулярную формацию. Увеличивает линейную скорость кровотока, способствует нормализации пространственно-временных характеристик спонтанной биоэлектрической активности мозга, регрессу очаговых неврологических симптомов и восстановлению сознания; оказывает положительное влияние на познавательные и поведенческие реакции больных с сосудистыми заболеваниями головного мозга (дисциркуляторной энцефалопатией и остаточными явлениями нарушения мозгового кровообращения).
Оказывает профилактическое и корригирующее действие на патогенетические факторы инволюционного психоорганического синдрома, снижает холинергическую активность. Стимулирует дозозависимое выделение ацетилхолина в физиологических условиях; участвуя в синтезе фосфатидилхолина (мембранного фосфолипида), улучшает синаптическую передачу, пластичность нейрональных мембран. Не оказывает влияния на репродуктивный цикл и не обладает тератогенным, мутагенным действием.
Фармакокинетика
Абсорбция — 88%. Легко проникает через гематоэнцефалический барьер (при пероральном приеме концентрация в мозге — 45% от таковой в плазме). Выводится преимущественно легкими, в виде диоксида углерода (85%), а также почками и через кишечник (15%).
В комплексной терапии при:
- черепно-мозговой травме с преимущественно стволовым уровнем поражения (острый период);
- цереброваскулярной недостаточности;
- психоорганическом синдроме на фоне дегенеративных заболеваний и инволюционных процессов головного мозга;
- мультиинфарктной деменции.
Гиперчувствительность, геморрагический инсульт (острая стадия), беременность, период лактации, детский возраст до 18 лет.
Способ применения и дозировка
Внутрь, по 0,4 г 3 раза в сутки, в течение 3-6 мес.
В подостром периоде черепно-мозговой травмы по 0,8 г утром и 0,4 г днем в течение 6 мес.
Со стороны пищеварительной системы: гастрит, язвенная болезнь желудка, фарингит. Со стороны нервной системы: нервозность, ишемия головного мозга, судороги, гиперкинезия, головокружение. Прочие: аллергические реакции, учащение мочеиспускания.
Взаимодействие с другими лекарственными средствами
Лекарственное взаимодействие препарата не установлено.
В период лечения необходимо соблюдать осторожность при вождении автотранспорта и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Капсулы 400 мг.
По 10 или 14 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 1,2,3 или 4 контурных ячейковых упаковки по 10 или 14 капсул вместе с инструкцией по применению в пачку из картона.
Список Б. В сухом, защищенном от света месте при температуре не выше 25°С. Хранить в недоступном для детей месте.
2 года.
Не применять по истечении срока годности.
По рецепту.
Производитель
УП «Минскинтеркапс», республика Беларусь, 220075, г. Минск, ул. Инженерная, д. 26
В случае фасовки и/или упаковки препарата на ЗАО «Канонфарма продакшн» дополнительно указывают его наименование, адрес, телефон, факс.
Организация, принимающая претензии
ЗАО «Канонфарма продакшн»
Адрес: 141100 г. Щелково, Московская область, ул. Заречная, д. 105
 |
|
| Clinical data | |
|---|---|
| Other names | ACh |
| ATC code |
|
| Physiological data | |
| Source tissues | motor neurons, parasympathetic nervous system, brain |
| Target tissues | skeletal muscles, brain, many other organs |
| Receptors | nicotinic, muscarinic |
| Agonists | nicotine, muscarine, cholinesterase inhibitors |
| Antagonists | tubocurarine, atropine |
| Precursor | choline, acetyl-CoA |
| Biosynthesis | choline acetyltransferase |
| Metabolism | acetylcholinesterase |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| IUPHAR/BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| E number | E1001(i) (additional chemicals) |
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.000.118 |
| Chemical and physical data | |
| Formula | C7H16NO2 |
| Molar mass | 146.210 g·mol−1 |
Acetylcholine (ACh) is an organic compound that functions in the brain and body of many types of animals (including humans) as a neurotransmitter.[1] Its name is derived from its chemical structure: it is an ester of acetic acid and choline.[2] Parts in the body that use or are affected by acetylcholine are referred to as cholinergic. Substances that increase or decrease the overall activity of the cholinergic system are called cholinergics and anticholinergics, respectively.
Acetylcholine is the neurotransmitter used at the neuromuscular junction—in other words, it is the chemical that motor neurons of the nervous system release in order to activate muscles. This property means that drugs that affect cholinergic systems can have very dangerous effects ranging from paralysis to convulsions. Acetylcholine is also a neurotransmitter in the autonomic nervous system, both as an internal transmitter for the sympathetic nervous system and as the final product released by the parasympathetic nervous system.[1] Acetylcholine is the primary neurotransmitter of the parasympathetic nervous system.[2][3]
In the brain, acetylcholine functions as a neurotransmitter and as a neuromodulator. The brain contains a number of cholinergic areas, each with distinct functions; such as playing an important role in arousal, attention, memory and motivation.[4]
Acetylcholine has also been found in cells of non-neural origins as well as microbes. Recently, enzymes related to its synthesis, degradation and cellular uptake have been traced back to early origins of unicellular eukaryotes.[5] The protist pathogen Acanthamoeba spp. have shown evidence of the presence of ACh, which provides growth and proliferative signals via a membrane located M1-muscarinic receptor homolog.[6]
Partly because of its muscle-activating function, but also because of its functions in the autonomic nervous system and brain, many important drugs exert their effects by altering cholinergic transmission. Numerous venoms and toxins produced by plants, animals, and bacteria, as well as chemical nerve agents such as Sarin, cause harm by inactivating or hyperactivating muscles through their influences on the neuromuscular junction. Drugs that act on muscarinic acetylcholine receptors, such as atropine, can be poisonous in large quantities, but in smaller doses they are commonly used to treat certain heart conditions and eye problems.[citation needed] Scopolamine, or Diphenhydramine, which also act mainly on muscarinic receptors in an inhibitory fashion in the brain (especially the M1 receptor) can cause delirium, hallucinations, and amnesia through receptor antagonism at these sites. So far as of 2016, only the M1 receptor subtype has been implicated in delirium.[7] The addictive qualities of nicotine are derived from its effects on nicotinic acetylcholine receptors in the brain.
Chemistry[edit]
Acetylcholine is a choline molecule that has been acetylated at the oxygen atom. Because of the charged ammonium group, acetylcholine does not penetrate lipid membranes. Because of this, when the molecule is introduced externally, it remains in the extracellular space and at present it is considered that the molecule does not pass through the blood–brain barrier.
Biochemistry[edit]
Acetylcholine is synthesized in certain neurons by the enzyme choline acetyltransferase from the compounds choline and acetyl-CoA. Cholinergic neurons are capable of producing ACh. An example of a central cholinergic area is the nucleus basalis of Meynert in the basal forebrain.[8][9]
The enzyme acetylcholinesterase converts acetylcholine into the inactive metabolites choline and acetate. This enzyme is abundant in the synaptic cleft, and its role in rapidly clearing free acetylcholine from the synapse is essential for proper muscle function. Certain neurotoxins work by inhibiting acetylcholinesterase, thus leading to excess acetylcholine at the neuromuscular junction, causing paralysis of the muscles needed for breathing and stopping the beating of the heart.
Functions[edit]
Acetylcholine functions in both the central nervous system (CNS) and the peripheral nervous system (PNS). In the CNS, cholinergic projections from the basal forebrain to the cerebral cortex and hippocampus support the cognitive functions of those target areas. In the PNS, acetylcholine activates muscles and is a major neurotransmitter in the autonomic nervous system.[10][2]
Cellular effects[edit]
Like many other biologically active substances, acetylcholine exerts its effects by binding to and activating receptors located on the surface of cells. There are two main classes of acetylcholine receptor, nicotinic and muscarinic. They are named for chemicals that can selectively activate each type of receptor without activating the other: muscarine is a compound found in the mushroom Amanita muscaria; nicotine is found in tobacco.
Nicotinic acetylcholine receptors are ligand-gated ion channels permeable to sodium, potassium, and calcium ions. In other words, they are ion channels embedded in cell membranes, capable of switching from a closed to an open state when acetylcholine binds to them; in the open state they allow ions to pass through. Nicotinic receptors come in two main types, known as muscle-type and neuronal-type. The muscle-type can be selectively blocked by curare, the neuronal-type by hexamethonium. The main location of muscle-type receptors is on muscle cells, as described in more detail below. Neuronal-type receptors are located in autonomic ganglia (both sympathetic and parasympathetic), and in the central nervous system.
Muscarinic acetylcholine receptors have a more complex mechanism, and affect target cells over a longer time frame. In mammals, five subtypes of muscarinic receptors have been identified, labeled M1 through M5. All of them function as G protein-coupled receptors, meaning that they exert their effects via a second messenger system. The M1, M3, and M5 subtypes are Gq-coupled; they increase intracellular levels of IP3 and calcium by activating phospholipase C. Their effect on target cells is usually excitatory. The M2 and M4 subtypes are Gi/Go-coupled; they decrease intracellular levels of cAMP by inhibiting adenylate cyclase. Their effect on target cells is usually inhibitory. Muscarinic acetylcholine receptors are found in both the central nervous system and the peripheral nervous system of the heart, lungs, upper gastrointestinal tract, and sweat glands.
Neuromuscular junction[edit]
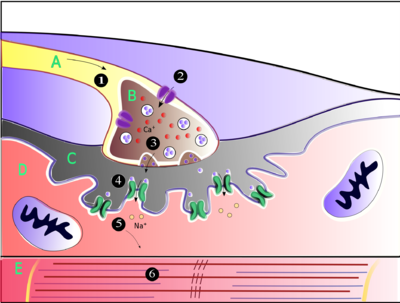
Acetylcholine is the substance the nervous system uses to activate skeletal muscles, a kind of striated muscle. These are the muscles used for all types of voluntary movement, in contrast to smooth muscle tissue, which is involved in a range of involuntary activities such as movement of food through the gastrointestinal tract and constriction of blood vessels. Skeletal muscles are directly controlled by motor neurons located in the spinal cord or, in a few cases, the brainstem. These motor neurons send their axons through motor nerves, from which they emerge to connect to muscle fibers at a special type of synapse called the neuromuscular junction.
When a motor neuron generates an action potential, it travels rapidly along the nerve until it reaches the neuromuscular junction, where it initiates an electrochemical process that causes acetylcholine to be released into the space between the presynaptic terminal and the muscle fiber. The acetylcholine molecules then bind to nicotinic ion-channel receptors on the muscle cell membrane, causing the ion channels to open. Sodium ions then flow into the muscle cell, initiating a sequence of steps that finally produce muscle contraction.
Factors that decrease release of acetylcholine (and thereby affecting P-type calcium channels):[11]
- Antibiotics (clindamycin, polymyxin)
- Magnesium: antagonizes P-type calcium channels
- Hypocalcemia
- Anticonvulsants
- Diuretics (furosemide)
- Eaton-Lambert syndrome: inhibits P-type calcium channels
- Myasthenia gravis
- Botulinum toxin: inhibits SNARE proteins
Calcium channel blockers (nifedipine, diltiazem) do not affect P-channels. These drugs affect L-type calcium channels.
Autonomic nervous system[edit]
The autonomic nervous system controls a wide range of involuntary and unconscious body functions. Its main branches are the sympathetic nervous system and parasympathetic nervous system. Broadly speaking, the function of the sympathetic nervous system is to mobilize the body for action; the phrase often invoked to describe it is fight-or-flight. The function of the parasympathetic nervous system is to put the body in a state conducive to rest, regeneration, digestion, and reproduction; the phrase often invoked to describe it is «rest and digest» or «feed and breed». Both of these aforementioned systems use acetylcholine, but in different ways.
At a schematic level, the sympathetic and parasympathetic nervous systems are both organized in essentially the same way: preganglionic neurons in the central nervous system send projections to neurons located in autonomic ganglia, which send output projections to virtually every tissue of the body. In both branches the internal connections, the projections from the central nervous system to the autonomic ganglia, use acetylcholine as a neurotransmitter to innervate (or excite) ganglia neurons. In the parasympathetic nervous system the output connections, the projections from ganglion neurons to tissues that do not belong to the nervous system, also release acetylcholine but act on muscarinic receptors. In the sympathetic nervous system the output connections mainly release noradrenaline, although acetylcholine is released at a few points, such as the sudomotor innervation of the sweat glands.
Direct vascular effects[edit]
Acetylcholine in the serum exerts a direct effect on vascular tone by binding to muscarinic receptors present on vascular endothelium. These cells respond by increasing production of nitric oxide, which signals the surrounding smooth muscle to relax, leading to vasodilation.[12]
Central nervous system[edit]
In the central nervous system, ACh has a variety of effects on plasticity, arousal and reward. ACh has an important role in the enhancement of alertness when we wake up,[13] in sustaining attention [14] and in learning and memory.[15]
Damage to the cholinergic (acetylcholine-producing) system in the brain has been shown to be associated with the memory deficits associated with Alzheimer’s disease.[16] ACh has also been shown to promote REM sleep.[17]
In the brainstem acetylcholine originates from the Pedunculopontine nucleus and laterodorsal tegmental nucleus collectively known as the mesopontine tegmentum area or pontomesencephalotegmental complex.[18][19] In the basal forebrain, it originates from the basal nucleus of Meynert and medial septal nucleus:
- The pontomesencephalotegmental complex acts mainly on M1 receptors in the brainstem, deep cerebellar nuclei, pontine nuclei, locus coeruleus, raphe nucleus, lateral reticular nucleus and inferior olive.[19] It also projects to the thalamus, tectum, basal ganglia and basal forebrain.[18]
- Basal nucleus of Meynert acts mainly on M1 receptors in the neocortex.
- Medial septal nucleus acts mainly on M1 receptors in the hippocampus and parts of the cerebral cortex.
In addition, ACh acts as an important internal transmitter in the striatum, which is part of the basal ganglia. It is released by cholinergic interneurons. In humans, non-human primates and rodents, these interneurons respond to salient environmental stimuli with responses that are temporally aligned with the responses of dopaminergic neurons of the substantia nigra.[20][21]
Memory[edit]
Acetylcholine has been implicated in learning and memory in several ways. The anticholinergic drug, scopolamine, impairs acquisition of new information in humans[22] and animals.[15] In animals, disruption of the supply of acetylcholine to the neocortex impairs the learning of simple discrimination tasks, comparable to the acquisition of factual information[23] and disruption of the supply of acetylcholine to the hippocampus and adjacent cortical areas produces forgetfulness, comparable to anterograde amnesia in humans.[24]
Diseases and disorders[edit]
Myasthenia gravis[edit]
The disease myasthenia gravis, characterized by muscle weakness and fatigue, occurs when the body inappropriately produces antibodies against acetylcholine nicotinic receptors, and thus inhibits proper acetylcholine signal transmission. Over time, the motor end plate is destroyed. Drugs that competitively inhibit acetylcholinesterase (e.g., neostigmine, physostigmine, or primarily pyridostigmine) are effective in treating the symptoms of this disorder. They allow endogenously released acetylcholine more time to interact with its respective receptor before being inactivated by acetylcholinesterase in the synaptic cleft (the space between nerve and muscle).
Pharmacology[edit]
Blocking, hindering or mimicking the action of acetylcholine has many uses in medicine. Drugs acting on the acetylcholine system are either agonists to the receptors, stimulating the system, or antagonists, inhibiting it. Acetylcholine receptor agonists and antagonists can either have an effect directly on the receptors or exert their effects indirectly, e.g., by affecting the enzyme acetylcholinesterase, which degrades the receptor ligand. Agonists increase the level of receptor activation; antagonists reduce it.
Acetylcholine itself does not have therapeutic value as a drug for intravenous administration because of its multi-faceted action (non-selective) and rapid inactivation by cholinesterase. However, it is used in the form of eye drops to cause constriction of the pupil during cataract surgery, which facilitates quick post-operational recovery.
Nicotinic receptors[edit]
Nicotine binds to and activates nicotinic acetylcholine receptors, mimicking the effect of acetylcholine at these receptors. ACh opens a Na+ channel upon binding so that Na+ flows into the cell. This causes a depolarization, and results in an excitatory post-synaptic potential. Thus, ACh is excitatory on skeletal muscle; the electrical response is fast and short-lived. Curares are arrow poisons, which act at nicotinic receptors and have been used to develop clinically useful therapies.
Muscarinic receptors[edit]
Muscarinic receptors form G protein-coupled receptor complexes in the cell membranes of neurons and other cells. Atropine is a non-selective competitive antagonist with Acetylcholine at muscarinic receptors.
Cholinesterase inhibitors[edit]
Many ACh receptor agonists work indirectly by inhibiting the enzyme acetylcholinesterase. The resulting accumulation of acetylcholine causes continuous stimulation of the muscles, glands, and central nervous system, which can result in fatal convulsions if the dose is high.
They are examples of enzyme inhibitors, and increase the action of acetylcholine by delaying its degradation; some have been used as nerve agents (Sarin and VX nerve gas) or pesticides (organophosphates and the carbamates). Many toxins and venoms produced by plants and animals also contain cholinesterase inhibitors. In clinical use, they are administered in low doses[why?] to reverse the action of muscle relaxants, to treat myasthenia gravis, and to treat symptoms of Alzheimer’s disease (rivastigmine, which increases cholinergic activity in the brain).
Synthesis inhibitors[edit]
Organic mercurial compounds, such as methylmercury, have a high affinity for sulfhydryl groups, which causes dysfunction of the enzyme choline acetyltransferase. This inhibition may lead to acetylcholine deficiency, and can have consequences on motor function.
Release inhibitors[edit]
Botulinum toxin (Botox) acts by suppressing the release of acetylcholine, whereas the venom from a black widow spider (alpha-latrotoxin) has the reverse effect. ACh inhibition causes paralysis. When bitten by a black widow spider, one experiences the wastage of ACh supplies and the muscles begin to contract. If and when the supply is depleted, paralysis occurs.
Comparative biology and evolution[edit]
Acetylcholine is used by organisms in all domains of life for a variety of purposes. It is believed that choline, a precursor to acetylcholine, was used by single celled organisms billions of years ago[citation needed] for synthesizing cell membrane phospholipids.[25] Following the evolution of choline transporters, the abundance of intracellular choline paved the way for choline to become incorporated into other synthetic pathways, including acetylcholine production. Acetylcholine is used by bacteria, fungi, and a variety of other animals. Many of the uses of acetylcholine rely on its action on ion channels via GPCRs like membrane proteins.
The two major types of acetylcholine receptors, muscarinic and nicotinic receptors, have convergently evolved to be responsive to acetylcholine. This means that rather than having evolved from a common homolog, these receptors evolved from separate receptor families. It is estimated that the nicotinic receptor family dates back longer than 2.5 billion years.[25] Likewise, muscarinic receptors are thought to have diverged from other GPCRs at least 0.5 billion years ago. Both of these receptor groups have evolved numerous subtypes with unique ligand affinities and signaling mechanisms. The diversity of the receptor types enables acetylcholine to create varying responses depending on which receptor types are activated, and allow for acetylcholine to dynamically regulate physiological processes. ACh receptors are related to 5-HT3 (serotonin), GABA, and Glycine receptors, both in sequence and structure, strongly suggesting that they have a common evolutionary origin.[26]
History[edit]
In 1867, Adolf von Baeyer resolved the structures of choline and acetylcholine and synthesized them both, referring to the latter as «acetylneurin» in the study.[27][28] Choline is a precursor for acetylcholine. This is why Frederick Walker Mott and William Dobinson Halliburton noted in 1899 that choline injections decreased the blood pressure of animals.[29][28] Acetylcholine was first noted to be biologically active in 1906, when Reid Hunt (1870–1948) and René de M. Taveau found that it decreased blood pressure in exceptionally tiny doses.[30][28][31]
In 1914, Arthur J. Ewins was the first to extract acetylcholine from nature. He identified it as the blood pressure-decreasing contaminant from some Claviceps purpurea ergot extracts, by the request of Henry Hallett Dale.[28] Later in 1914, Dale outlined the effects of acetylcholine at various types of peripheral synapses and also noted that it lowered the blood pressure of cats via subcutaneous injections even at doses of one nanogram.[32][28]
The concept of neurotransmitters was unknown until 1921, when Otto Loewi noted that the vagus nerve secreted a substance that inhibited the heart muscle whilst working as a professor in the University of Graz. He named it vagusstoff («vagus substance»), noted it to be a structural analog of choline and suspected it to be acetylcholine.[33][34] In 1926, Loewi and E. Navratil deduced that the compound is probably acetylcholine, as vagusstoff and synthetic acetylcholine lost their activity in a similar manner when in contact with tissue lysates that contained acetylcholine-degrading enzymes (now known to be cholinesterases).[35][36] This conclusion was accepted widely. Later studies confirmed the function of acetylcholine as a neurotransmitter.[34]
In 1936, H. H. Dale and O. Loewi shared the Nobel Prize in Physiology or Medicine for their studies of acetylcholine and nerve impulses.[28]
See also[edit]
- Ann Silver
- Acetylcholinesterase
- Neuromuscular junction
- Nicotinic acetylcholine receptor
- Muscarinic acetylcholine receptor
Specific references[edit]
- ^ a b Tiwari P, Dwivedi S, Singh MP, Mishra R, Chandy A (October 2012). «Basic and modern concepts on cholinergic receptor: A review». Asian Pacific Journal of Tropical Disease. 3 (5): 413–420. doi:10.1016/S2222-1808(13)60094-8. PMC 4027320.
- ^ a b c Sam C, Bordoni B (2023). «Physiology, Acetylcholine». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 32491757. Retrieved 2023-04-06.
- ^ Lott EL, Jones EB (June 2019). «Cholinergic Toxicity». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 30969605.
- ^ Kapalka GM (2010). «Substances Involved in Neurotransmission». Nutritional and Herbal Therapies for Children and Adolescents. Elsevier. pp. 71–99. doi:10.1016/b978-0-12-374927-7.00004-2. ISBN 978-0-12-374927-7.
- ^ Baig AM, Rana Z, Tariq S, Lalani S, Ahmad HR (March 2018). «Traced on the Timeline: Discovery of Acetylcholine and the Components of the Human Cholinergic System in a Primitive Unicellular Eukaryote Acanthamoeba spp». ACS Chem Neurosci. 9 (3): 494–504. doi:10.1021/acschemneuro.7b00254. PMID 29058403.
- ^ Baig AM, Ahmad HR (June 2017). «Evidence of a M1-muscarinic GPCR homolog in unicellular eukaryotes: featuring Acanthamoeba spp bioinformatics 3D-modelling and experimentations». J. Recept. Signal Transduct. Res. 37 (3): 267–275. doi:10.1080/10799893.2016.1217884. PMID 27601178. S2CID 5234123.
- ^ Dawson AH, Buckley NA (March 2016). «Pharmacological management of anticholinergic delirium — theory, evidence and practice». British Journal of Clinical Pharmacology. 81 (3): 516–524. doi:10.1111/bcp.12839. PMC 4767198. PMID 26589572.
Delirium is only associated with the antagonism of post‐synaptic M1 receptors and to date other receptor subtypes have not been implicated
- ^ Smythies J (2009). «Philosophy, perception, and neuroscience». Perception. 38 (5): 638–51. doi:10.1068/p6025. PMID 19662940. S2CID 45579740.
- ^ Smythies J, d’Oreye de Lantremange M (2016). «The Nature and Function of Digital Information Compression Mechanisms in the Brain and in Digital Television Technology». Front Syst Neurosci. 10: 40. doi:10.3389/fnsys.2016.00040. PMC 4858531. PMID 27199688.
- ^ Waxenbaum JA, Reddy V, Varacallo M (2023). «Anatomy, Autonomic Nervous System». StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 30969667. Retrieved 2023-04-06.
- ^ Miller RD, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, eds. (2009-01-01). Miller’s Anesthesia (7th ed.). Elsevier Health Sciences. pp. 343–47. ISBN 978-0-443-06959-8.
- ^ Kellogg DL, Zhao JL, Coey U, Green JV (February 2005). «Acetylcholine-induced vasodilation is mediated by nitric oxide and prostaglandins in human skin». J. Appl. Physiol. 98 (2): 629–32. doi:10.1152/japplphysiol.00728.2004. PMID 15649880. S2CID 293055.
- ^ Jones BE (November 2005). «From waking to sleeping: neuronal and chemical substrates». Trends Pharmacol. Sci. 26 (11): 578–86. doi:10.1016/j.tips.2005.09.009. PMID 16183137.
- ^ Himmelheber AM, Sarter M, Bruno JP (June 2000). «Increases in cortical acetylcholine release during sustained attention performance in rats». Brain Res Cogn Brain Res. 9 (3): 313–25. doi:10.1016/S0926-6410(00)00012-4. PMID 10808142.
- ^ a b Ridley RM, Bowes PM, Baker HF, Crow TJ (1984). «An involvement of acetylcholine in object discrimination learning and memory in the marmoset». Neuropsychologia. 22 (3): 253–63. doi:10.1016/0028-3932(84)90073-3. PMID 6431311. S2CID 7110504.
- ^ Francis PT, Palmer AM, Snape M, Wilcock GK (February 1999). «The cholinergic hypothesis of Alzheimer’s disease: a review of progress». J. Neurol. Neurosurg. Psychiatry. 66 (2): 137–47. doi:10.1136/jnnp.66.2.137. PMC 1736202. PMID 10071091.
- ^ Platt B, Riedel G (August 2011). «The cholinergic system, EEG and sleep». Behav. Brain Res. 221 (2): 499–504. doi:10.1016/j.bbr.2011.01.017. PMID 21238497. S2CID 25323695.
- ^ a b Woolf NJ, Butcher LL (May 1986). «Cholinergic systems in the rat brain: III. Projections from the pontomesencephalic tegmentum to the thalamus, tectum, basal ganglia, and basal forebrain». Brain Res. Bull. 16 (5): 603–37. doi:10.1016/0361-9230(86)90134-6. PMID 3742247. S2CID 39665815.
- ^ a b Woolf NJ, Butcher LL (December 1989). «Cholinergic systems in the rat brain: IV. Descending projections of the pontomesencephalic tegmentum». Brain Res. Bull. 23 (6): 519–40. doi:10.1016/0361-9230(89)90197-4. PMID 2611694. S2CID 4721282.
- ^ Goldberg JA, Reynolds JN (December 2011). «Spontaneous firing and evoked pauses in the tonically active cholinergic interneurons of the striatum». Neuroscience. 198: 27–43. doi:10.1016/j.neuroscience.2011.08.067. PMID 21925242. S2CID 21908514.
- ^ Morris G, Arkadir D, Nevet A, Vaadia E, Bergman H (July 2004). «Coincident but distinct messages of midbrain dopamine and striatal tonically active neurons». Neuron. 43 (1): 133–43. doi:10.1016/j.neuron.2004.06.012. PMID 15233923.
- ^ Crow TJ, Grove-White IG (October 1973). «An analysis of the learning deficit following hyoscine administration to man». Br. J. Pharmacol. 49 (2): 322–7. doi:10.1111/j.1476-5381.1973.tb08379.x. PMC 1776392. PMID 4793334.
- ^ Ridley RM, Murray TK, Johnson JA, Baker HF (June 1986). «Learning impairment following lesion of the basal nucleus of Meynert in the marmoset: modification by cholinergic drugs». Brain Res. 376 (1): 108–16. doi:10.1016/0006-8993(86)90904-2. PMID 3087582. S2CID 29182517.
- ^ Easton A, Ridley RM, Baker HF, Gaffan D (July 2002). «Unilateral lesions of the cholinergic basal forebrain and fornix in one hemisphere and inferior temporal cortex in the opposite hemisphere produce severe learning impairments in rhesus monkeys». Cereb. Cortex. 12 (7): 729–36. doi:10.1093/cercor/12.7.729. PMID 12050084.
- ^ a b Dean B (November 2009). «Evolution of the human CNS cholineric system: has this resulted in the emergence of psychiatric disease?». Aust N Z J Psychiatry. 43 (11): 1016–28. doi:10.3109/00048670903270431. PMID 20001397. S2CID 31059344.
- ^ Ortells MO, Lunt GG (March 1995). «Evolutionary history of the ligand-gated ion-channel superfamily of receptors». Trends in Neurosciences. 18 (3): 121–127. doi:10.1016/0166-2236(95)93887-4. PMID 7754520. S2CID 18062185.
- ^ Baeyer A (1867). «I. Üeber das neurin». Justus Liebigs Ann Chem (in German). 142 (3): 322–326. doi:10.1002/jlac.18671420311.
- ^ a b c d e f Kawashima K, Fujii T, Moriwaki Y, Misawa H, Horiguchi K (2015). «Non-neuronal cholinergic system in regulation of immune function with a focus on α7 nAChRs». International Immunopharmacology. 29 (1): 127–34. doi:10.1016/j.intimp.2015.04.015. PMID 25907239.
- ^ Mott FW, Halliburton WD (1899). «VII. The physiological action of choline and neurine». Philosophical Transactions of the Royal Society of London. Series B, Containing Papers of a Biological Character. 191 (2001): 211–267. doi:10.1098/rstb.1899.0007. PMC 2463419. PMID 20758460.
- ^ Hunt R, Taveau M (1906). «On the physiological action of certain choline derivatives and new methods for detecting choline». BMJ. 2: 1788–1791.
- ^ Dorkins HR (April 1982). «Suxamethonium-the development of a modern drug from 1906 to the present day». Medical History. 26 (2): 145–68. doi:10.1017/s0025727300041132. PMC 1139149. PMID 7047939.
- ^ Dale HH (1914). «The action of certain esters and ethers of choline, and their relation to muscarine». J Pharmacol Exp Ther. 6 (2): 147–190.
- ^ Loewi O (1922). «Über humorale übertragbarkeit der herznervenwirkung». Pflug Arch Ges Phys (in German). 193 (1): 201–213. doi:10.1007/BF02331588. S2CID 34861770.
- ^ a b Zeisel SH (2012). «A brief history of choline». Annals of Nutrition & Metabolism. 61 (3): 254–8. doi:10.1159/000343120. PMC 4422379. PMID 23183298.
- ^ Loewi O, Navratil E (1926). «Über humorale übertragbarkeit der herznervenwirkung». Pflug Arch Ges Phys (in German). 214 (1): 678–688. doi:10.1007/BF01741946. S2CID 43748121.
- ^ Zimmer HG (March 2006). «Otto Loewi and the chemical transmission of vagus stimulation in the heart». Clinical Cardiology. 29 (3): 135–6. doi:10.1002/clc.4960290313. PMC 6654523. PMID 16596840.
General bibliography[edit]
- Brenner GM, Stevens CW (2006). Pharmacology (2nd ed.). Philadelphia PA: W. B. Saunders. ISBN 1-4160-2984-2.
- Canadian Pharmacists Association (2000). Compendium of Pharmaceuticals and Specialties (25th ed.). Toronto ON: Webcom. ISBN 0-919115-76-4.
- Carlson NR (2001). Physiology of Behavior (7th ed.). Needham Heights MA: Allyn and Bacon. ISBN 0-205-30840-6.
- Gershon MD (1998). The Second Brain. New York NY: HarperCollins. ISBN 0-06-018252-0.
- Siegal A, Sapru HN (2006). «Ch. 15». Essential Neuroscience (Revised 1st ed.). Philadelphia: Lippincott, Williams & Wilkins. pp. 255–267.
- Hasselmo ME (February 1995). «Neuromodulation and cortical function: modeling the physiological basis of behavior». Behav. Brain Res. 67 (1): 1–27. doi:10.1016/0166-4328(94)00113-T. PMID 7748496. S2CID 17594590. as PDF
- Yu AJ, Dayan P (May 2005). «Uncertainty, neuromodulation, and attention». Neuron. 46 (4): 681–92. doi:10.1016/j.neuron.2005.04.026. PMID 15944135. S2CID 15980355. as PDF
External links[edit]
- Warning over combining common medicines for elderly